Оксимное производное циклогекс-2-ен-1-она и способ подавления роста нежелательных растений - RU2009138C1
Код документа: RU2009138C1
Чертежи











Описание
Изобретение относится к новым оксимным производным циклогекс-2-ен-1-она, которые могут найти применение в сельском хозяйстве, и к химическим способам защиты растений, а именно к способам подавления роста нежелательных растений, использующему новые оксимные производные циклогекс-2-ен-1-она.
Известны оксимные производные 5-(ацетилфенил)циклогекс-2-ен-1-она, которые используются в способе борьбы с нежелательной растительностью.
Известен способ подавления роста нежелательных растений путем
обработки почвы или растений соединением общей формулы

R2 - этил, аллил. Однако он недостаточно эффективен.
Целью изобретения является изыскание новых оксимных производных циклогекс-2-ен-1-она, обладающих высокой гербицидной активностью, и увеличение гербицидной активности способа подавления роста нежелательных растений.
Указанная цель достигается за счет оксимного производного циклогекс-2-ен-1-она общей
формулы I

R1 - С1 -С3-алкил или бензил,
R2 - этил, алкил, 3-хлораллил, 2-метилаллил, один из R3 и R4 является водородом, в то время как другой из R3 и R4 представляет собой фенил, фенил, монозамещенный фтором, хлором, метилом, метокси, трифторметилом или диметиламино сульфонил, фенил, дизамещенный хлором или метокси, или 3, 4-метилендиоксифенил.
Указанная цель достигается также путем обработки
почвы или растений оксимным производным циклогекс-2-ен-1-она общей формулы I


R1 - С1-С3-алкил или бензил,
R2 - этил, аллил, 3-хлораллил, 2-метилаллил.
Один из R3 и R4 является водородом, в то время как другой из R3 и R4 представляет собой фенил, фенил, монозамещенный фтором, хлором, меилом, трифторметилом, или диметиламиносульфонилом, фенил, дизамещенный хлором или метокси, или 3,4-метилендиоксифенил, в количестве 1-10 кг/га.
Следует отметить, что если R является водородом, то соединения по данному изобретению могут
существовать в одной из таутомерных форм, изображенных ниже


В данном описании упоминание любой из этих форм обозначает любой таутомер или таутомерную смесь, в которой составляющей является указанная форма. Что касается соединений-предшественников, то и в этом случае упоминание о любом одном таутомере означает любой таутомер или таутомерную смесь.
Соединения по изобретению могут быть получены различными способами.
Для удобства рассмотрение получения соединений по данному изобретению следует разбить на 3-4 части.
Часть А включает в себя получение 4/или 6/-(возможно замещенный фенил) циклогексан-1,3-диона формулы II. Эту реакцию удобно проводить взаимодействием соединений формул III и IV.
R3-CH2 -COOR



Как известно, исходные соединения III и IV получаются из известных соединений по стандартным методикам.
Часть В включает в себя ацилирование соединения формулы
II с получением 2-ацил-4(или 6)-необязательно замещенный винил)-3-оксициклогекс-2-ен-1-она
формулы V

Кроме того,
предпочтительно проводить ацилирование взаимодействием 4(или 6)-) возможно замещенный фенил (циклогексан-1,3-диона формулы II с
кислотой R6 СООН и/или ее солью, ангидридом или
галоидангидридом в присутствии амина-растворителя, предпочтительно триэтиламина или пиридина, получая промежуточное О-ацильное производное
формулы VI

Часть С включает в себя образование соединения формулы I, где R является водородом. Эту реакцию можно проводить взаимодействием соединения формулы V с гидроксиламином с получением промежуточного оксимного соединения формулы I, где R2 является водородом и введением указанного оксимного производного в реакцию с соединением формулы R2 - L, где R2 такой, как определено выше для формулы I, а L представляет собой отщепляемую группу, например, хлорид, бромид, иодид, сульфат, нитрат, метилсульфат, этилсульфат, тетрафторборат, гексафторфосфат, гексафторантимонат, метансульфонат, фторсульфонат, фторметансульфонат и трифторметансульфонат либо, предпочтительно, взаимодействием соединения формулы V с производным формулы H2 N-O-R2 (или его солью, например, гидрохлоридом с таким основанием, как триэтиламин), где R2 определен выше для формулы I.
Оксимацию удобно проводить при 0-50оС при комнатной температуре возможно в присутствии воды и/или органического растворителя, например в спирте, таком как метанол или этанол и возможно, если используют H2N-O-R2, в присутствии основания, например такого амина, как триэтиламин.
Необязательная стадия. Часть D, включает в себя замещение водорода (формула I, где R является водородом) другим заместителем типа, описанного выше для R в формуле I. Такое замещение можно проводить стандартным способом взаимодействием подходящего соединения R - L, где L является описанной выше отщепляемой группой, или с неорганическим или органическим основанием или солью, при температуре 0-100оС, предпочтительно 20-50оС в присутствии органического растворителя и/или воды.
Соединение формулы V можно превращать в другое соединение формулы V замещением фенильного кольца, например, сульфонированием и/или дериватизацией по стандартным методикам.
Ниже данное изобретение более подробно иллюстрируется прилагаемыми примерами. Примеры 1-38 относятся к получению соединений - предшественников, а остальные примеры касаются получения соединений формулы I. Структуры соединений подтверждаются массо-спектрометрически и ЯМР-анализом.
П р и м е р 1. Получение 5,5-диметил-4-фенилциклогексан-1,3-диона.
Смесь этилфенилацетата (34 г) и мезитилоксида (20 г) добавляют к раствору натрия (4,6 г) в этаноле (80 мл) и раствор кипятят с обратным холодильником 4 ч. Этанол выпаривают под вакуумом, к остатку прибавляют воду и водный раствор экстрагируют диэтиловым эфиром. Водную фазу подкисляют концентрированной соляной кислотой и продукт экстрагируют метиленхлоридом. Выпариванием экстракта и очисткой остатка на колонке с силикагелем с использованием в качестве элюента 5% (объем/объем) смеси метанол-метиленхлорид получают целевое соединение (24 г) и виде белого твердого соединения с т. пл. 133-135оС.
Вычислено, % : C 77,8; H 7,4.
С14Н16О2
Найдено, % : С 77,6; Н 7,2.
Способом, описанным в примере 1, получают следующие соединения - предшественники формулы VII, перечисляемые в табл. 1.
П р и м е р 15. Получение 2-бутирил-5,5-диметил-3-окси-4-фенилциклогекс-2-ен-1-она.
Триэтиламин (5,2 г) по каплям прибавляют к перемешиваемому раствору 5,5-диметил-4-фенилциклогексан-1,3-диона (10,8 г) и н-бутирилхлорида (5,3 г) в метиленхлориде (100 мл). После перемешивания при комнатной температуре в течение дополнительных 2 час реакционный раствор промывают водой и раствором соли и сушат над безводным сульфатом магния. Метиленхлорид удаляют под вакуумом с получением смеси 1-бутирилокси-5,5-диокси-4-фенилцикло- гекс-1-ен-3-она и 1-бутирилокси-5,5-диметил-6-фенилциклогекс-1-ен-3-она. Прибавляют толуол (100 мл) затем 4-(N-диметиламино)-пиридин (1 г) и смесь кипятят с обратным холодильником 3 ч. Выпариванием толуола под вакуумом получают красное масло, которое очищают на колонке с силикагелем с использованием в качестве элюента 5% (объем/объем) смеси диэтиловый эфир-метиленхлорид и получают целевое соединение (6 г) в форме бледно-желтого масла.
Вычислено, % : С 75,5; Н 7,7
С18Н22О3
Найдено, %
: С 75,7; Н 7,7
По методике, описанной в примере 15, получают перечисленные в табл. 2 соединения-предшественники формулы VIII.
П р и м е р 39. Получение 2-(1-(аллилоксиамино)-бутил)-5,5-диметил-3-окси-4-фе-нилциклогекс-2-ен-1-он .
Триэтиламин (1,2 г) прибавляют к раствору 2-бутил-5,5-диметил-3-окси-4-фенилциклогекс-2-ен-1-она (2,8 г) и гидрохлорида О-аллилгидроксиламина (1,2 нг) в этаноле (50 мл). После перемешивания в течение ночи при комнатной температуре этанол выпаривают под вакуумом, к остатку прибавляют воду и водный раствор экстрагируют метиленхлоридом. После высушивания органических экстрактов над безводным сульфатом магния метиленхлорид выпаривают под вакуумом. Остаток хроматографируют на силикагеле (через колонку) с использованием в качестве элюента 5% (объем/объем) диэтиловый эфир-метиленхлорида и получают целевое соединение (2,1 г) в форме вязкого бесцветного масла.
Вычислено, % : С
73,9; Н 7,9;
N 4,1
С21Н27NO3
Найдено, % : С 74,7; Н 7,8; N 4,3.
В табл. 3 перечислены соединения формулы IX, полученные способом, описанным в примере 39.
П р и м е р 83. Получение тетра-н-бутиламмониевой соли 2-(1-(аллилоксиминопропил)-3-окси-4-(3-метилфенил)-5,5-димети- лциклогекс-2-ен-1-она.
2-(1-(аллилоксимино)пропил)-3-окси-4-(3-метилфенил)-5,5-диметилциклогекс-2- н-1-он (2 г) в метаноле (2 мл) прибавляют к 25% -ному раствору гидроксида тетра-н-бутиламмония (20 мл). После выдерживания
в
течение ночи при комнатной температуре метанол выпаривают под вакуумом. К остатку прибавляют метиленхлорид, раствор промывают водой, сушат над безводным сульфатом магния, фильтруют, выпаривают и
получают целевое соединение в виде бесцветного масла (3 г)
Вычислено, % : С 76,3; Н 10,7; N 4,8.
С37Н62N2O3
Найдено, % :
С
71,4; H 10,1; N 4,4.
П р и м е р 84. Получение 2-(1-(аллилоксиимино)пропил)-3-ацетокси-4-(3-метил- фенил)-5,5-диметилциклогекс-2-ен-1-она.
Триэтиламин (1,1 мм) в метиленхлориде (20 мл) по каплям прибавляют к раствору 2-(1-(аллилоксиимино)пропил)-3-окси-4-(3-метилфенил)-5,5-диметилциклогекс-2 ен-1-она (2,1 г) и ацетилхлорида (0,5 мл) в метиленхлориде (100 мл). После перемешивания в течение ночи при комнатной температуре раствор промывают водой, сушат над безводным сульфатом магния, фильтруют и выпаривают. Остаток очищают на колонке с силикагелем с использованием метиленхлорида в качестве элюента и получают целевое соединение (0,8 г) в виде бесцветного масла.
Вычислено, % : C 72,1; H 7,6; N 3,7.
C23
H29O4N
Найдено, % : C 69,7; H 7,6; N 3,5.
П р и м е р 85. Получение натриевой соли 2-(1-(аллилоксиимино)пропил)-3-окси-4-(3-хлорфенил)-5, 5-диметилциклогекс-2- н-1-она. 2-(1-аллилоксиимино)пропил)-3-окси-4-(3-хлорфенил)-5,5-диметилциклогекс-2-е -1-он (1,7 г) прибавляют к раствору гидроксида натрия (0,2 г) в этаноле (30 мл) при комнатной температуре. После перемешивания в течение 30 мин этанол выпаривают и остаток растирают с диэтиловым эфиром, получая целевое соединение в виде белого твердого соединения (1,0 г) с т. пл. 160оС.
Вычислено, % : C 62,6; H 6,0; N 3,7.
C20H23O3NClNa.
Найдено, % : C 57,4; H 6,2; N 3,8.
Данные ЯМР для примеров с указанием очевидности существования смеси изомеров.
Данные ЯМР (300 мгц) значение δ , ч/млн.
П р и м е р 83. (растворитель CDCl3) 0, 67, 1,25 С , синглет, синглет), 0,96, 1,05/-CH2-CH3, триплет, триплет) 1,27-1,5/трет. бутил мультиплет/; 3,02/-CH2-CH3, мультиплет), 2, 01, 2,46, 2,23, 2,61 (кольцевые -CH2- и -CH-, дублет, дублет, мультиплет, мультиплет), 2,28 /Ar-CH3, синглет), 4,45-4,6/-OCH2-, мультиплет), 5,1-5,33/-СH2, мультиплет), 6,03 (-CH-, мультиплет), 6,9-7,16 (ароматический протон, мультиплет).
(Наличие 2-изомера следует из присутствия двух сигналов - СН2 -СН3).
П р и м е р 84. (Растворитель CDCl3 (0,78, 0,95, 1,13, 1,25) , дублет, дуб- лет), 1,0, 1,05 ( СН2СН3, триплет, триплет) 1,37, 2,20 ( , синглет, синглет); 2, 34, 2,37 (Ar-CH3, синглет, синглет), 2,2-2,75, 3,07-3,2, 3,42, 3,87)-СН2-СН3 и кольцевые -СН2- и -СН-, мультиплет, 2-х квартет, синглет, синглет), 4, 58(-ОСН2-, мультиплет); 5,12-5,34 (-С-СН2, мультиплет), 5,97 (-СН-, мультиплет) 6,87-7,24 (ароматический Н, мультиплет). (свидетельство присутствия 2- изомера, два сигнала , два сигнала Ar-CH3, два сигнала -СН2-СН3).
П р и м е р 85. (Растворитель DMCOd6), 0,56, 1,06 ( , широкий синглет, ши- рокий синглет), 0,85, 1, 03 (-СН2 -СН3, триплет, триплет); 1,6-3,5 (кольцевые -СН2- и СН-, мультиплет и -СН2-СН3, мультиплет); 4,22-4,35/-OCH2-, широкий синглет, мультиплет); 4, 4-5,25 (-СН-СН2, мультиплет), 5,7- 6,0(-СН , мультиплет, мультиплет) ; 6,8-7,45 (ароматический Н, мультиплет).
Свидетельство присутствия 2-изомера: две различные этильные группы (2х СН3, триплеты); а также два различных аллильных сигнала, особенно в области 5,7-6,0 (2-х мультиплеты).
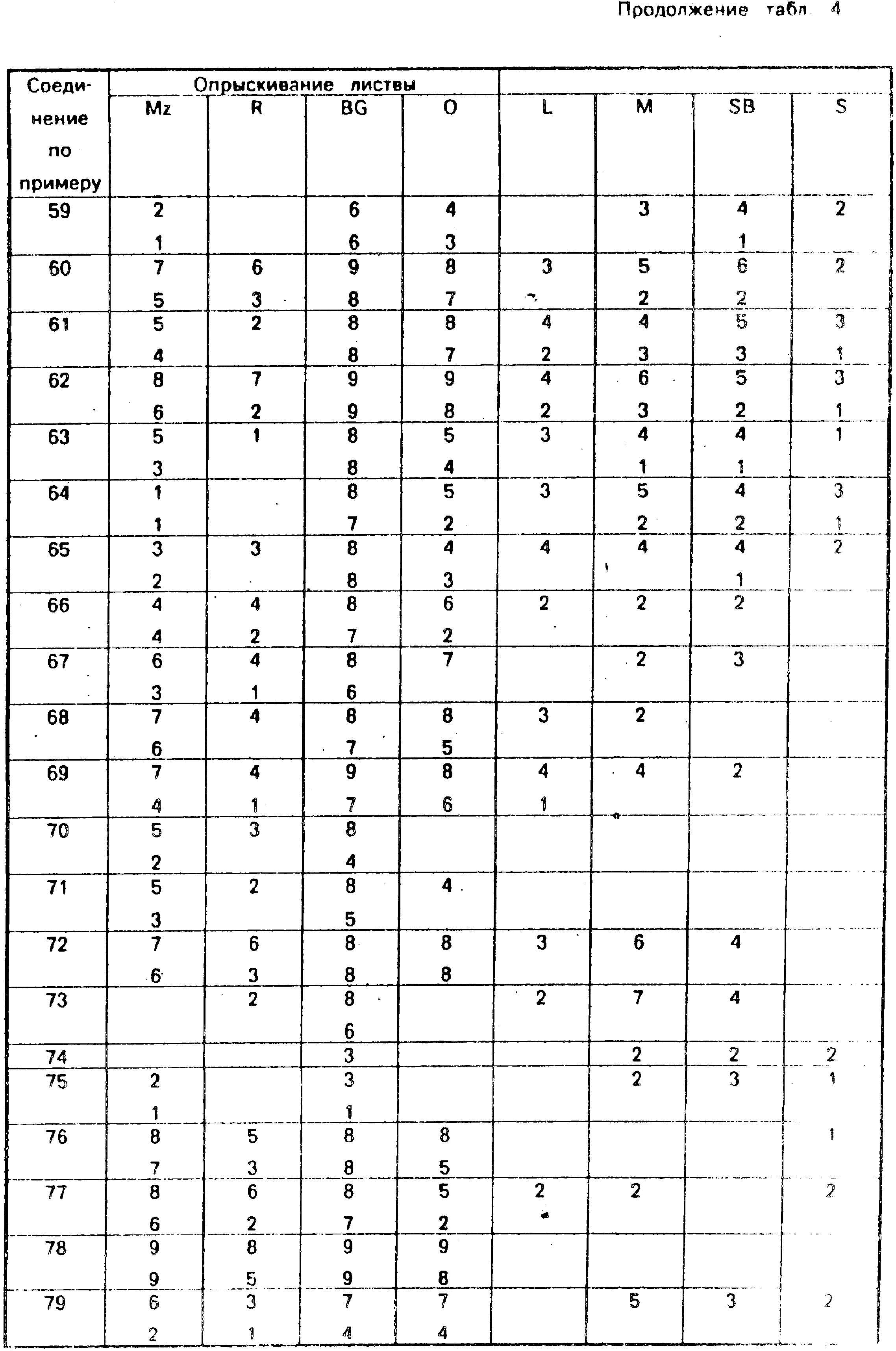
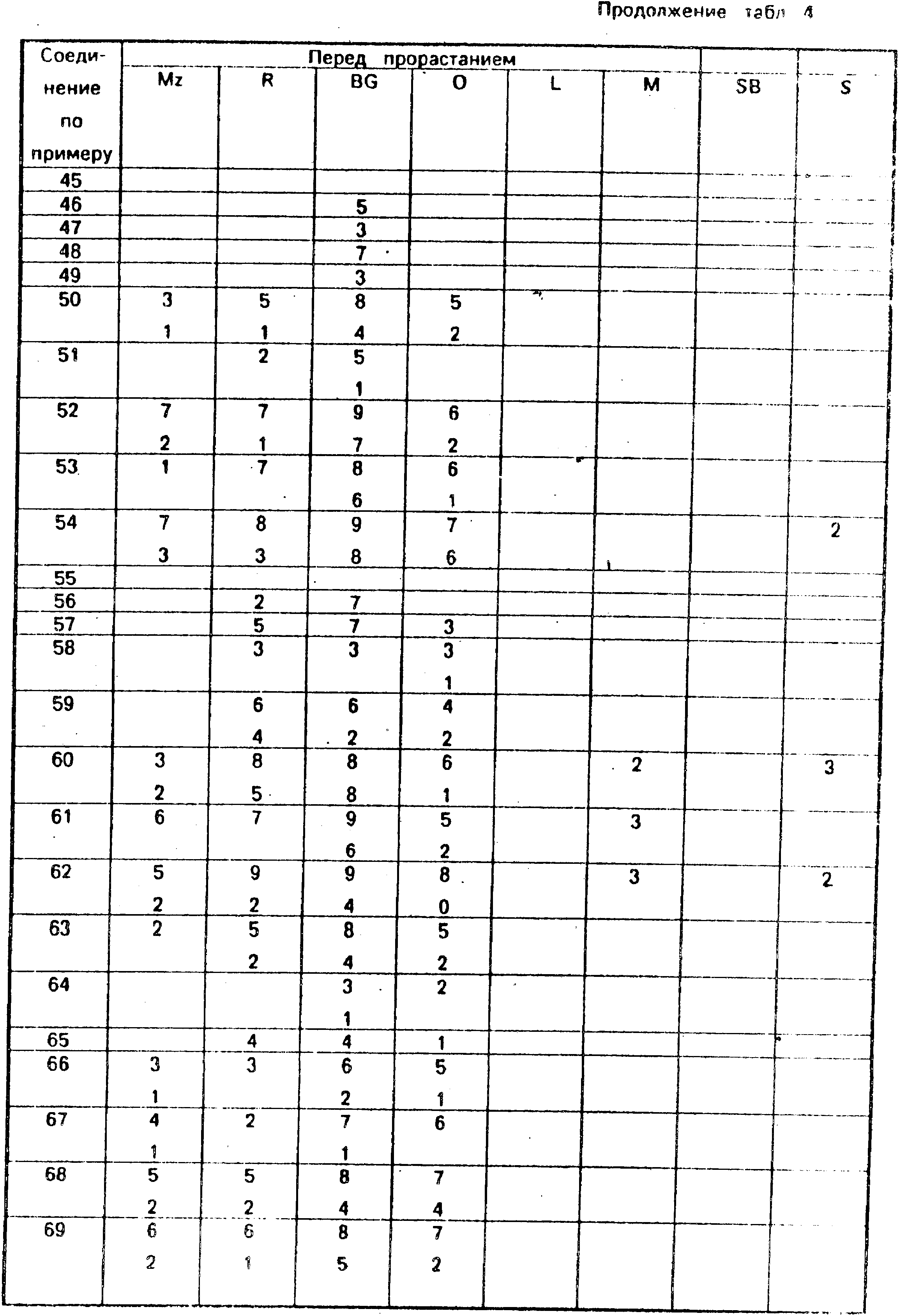
Для оценки гербицидной активности соединения испытывают с использованием следующего набора растений: кукуруза, Zea mays (Mz); рис. Oryza sativa (R), петушье просо, Echinochloa crusgalli (BG); овес посевной, Avena Sativa (O); лен, Linum usitatissunum (L); горчица, Sinapsis alba (M); сахарная свекла, Beta vulgarisz (SB) и соя, Glycine max (S).
Испытания делятся на две категории: до и после прорастания. Испытание до прорастания включает в себя опрыскивание жидкой рецептурой соединения почвы, в которую недавно были высажены семена указанных выше растений. Испытание после прорастания включают два типа испытаний: поливку почвы и опрыскивание листвы. В испытаниях поливом почвы почву, на которой растут растения указанных выше видов, поливают жидкой рецептурой, содержащей соединение по данному изобретению, а при опрыскивании листвы высаженные растения опрыскивают этой рецептурой.
Используемая в этих испытаниях почва представляла собой садовую культурную почву.
Рецептуры, используемые в испытаниях, получают из растворов испытуемых соединений в ацетоне, содержащем 0,4 вес. % конденсата алкилфенол/этиленоксид; доступного под торговым названием TRГТОN Х-155. Эти ацетоновые растворы разбавляют водой и результирующие рецептуры наносят в дозах, соответствующих 5 кг или 1 кг активного ингредиента на га, что эквивалентно 900 л/га при опрыскивании почвы и опрыскивании листвы и в дозе 10 кг активного ингредиента на га при объеме, эквивалентном приблизительно 3000 л/га в испытании на полив почвы.
В качестве контроля в испытании перед прорастанием использовали засеянную необработанную почву, а в испытании после прорастания - необработанную почву с проросшими растениями.
Гербицидный эффект испытуемых соединений оценивают визуально через 12 дней после опрыскивания листвы и почвы и через 13 дней после полива почвы, по шкале 0-9, где 0 указывает на то, что рост происходит так же, как в контроле, а 9 соответствует гибели растений. Повышение на 1 в линейной шкале соответствует приблизительно повышению уровня эффективности на 10% .
Результаты испытаний приведены в табл. 4, где соединения указаны со ссылкой на предшествующие примеры. Незаполненное белое пространство в представленной табл. 4 соответствует оценке 0. (56) Патент США 4652303, кл. A 01 N 43/40, 1987.
Заявка ФРГ N 3329017, кл. C 07 C 131/09, 1985.
Реферат
Использование: сельское хозяйство, химические способы защиты растений. Сущность изобретения: почву или растения обрабатывают соединением общей формулы

Формула

где R - водород, натрий, ацетил или тетрабутиламмоний;
R1 - C1-C3-алкил или бензил;
R2 - этил, аллил, 3-хлораллил или 2-метилаллил;
R3 и R4 - один из них водород, а другой - фенил, фенил, монозамещенный фтором, хлором, метилом, метокси, трифторметилом или диметиламиносульфонилом, фенил, дизамещенный хлором или метоксигруппой, или 3,4-метилендиоксифенил.

где R - водород, натрий, ацетил или тетрабутиламмоний;
R1 - C1 -C3-алкил или бензил,
R2 - этил, аллил, 3-хлораллил или 2-метилаллил,
R3 и R4 - один из них водород, а другой - фенил, фенил, монозамещенный фтором, хлором, метилом, метокси, трифторметил или диметиламиносульфонилом, фенил, дизамещенный хлором или метоксигруппой, или 3, 4-метилендиоксифенил,
в количестве 1-10 кг/га.

Комментарии