Производные нафтохинона, экстракт растительного материала, их использование, фунгицидная, и/или акарицидная, и/или инсектицидная композиция - RU2154382C2
Код документа: RU2154382C2
Чертежи
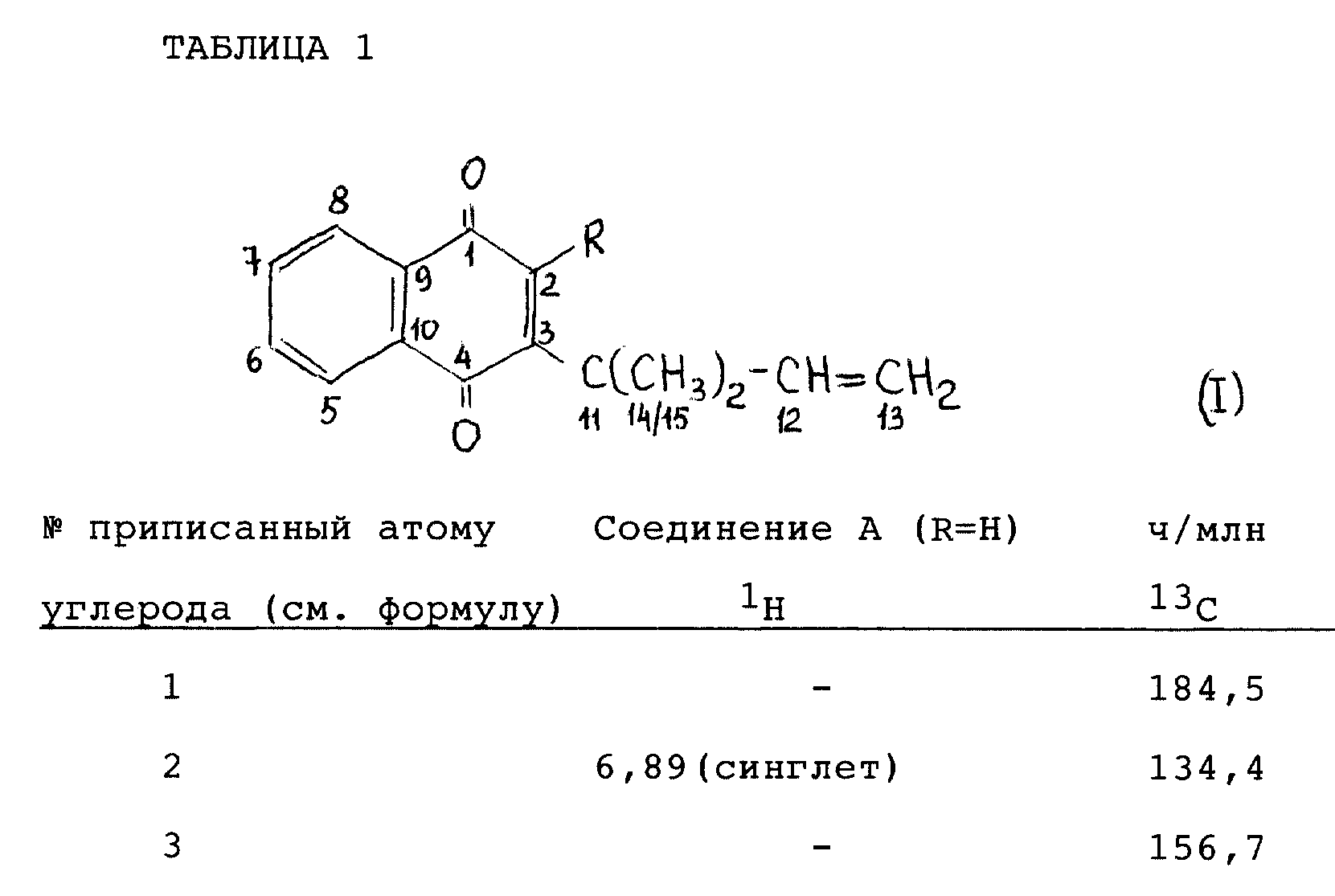






Описание
Настоящее изобретение относится к ряду производных нафтохинона, одно из которых является новым соединением, способам их получения, композициям, содержащим такие соединения, и к их применению в качестве пестицидов, таких как фунгициды и, особенно, инсектициды и акарициды.
Было установлено, что экстракты растений вида Calceolaria, особенно Calceolaria sessilis, Calceolaria andina и Calceolaria glabrata var. meyenenis, обнаруженные в Чили, проявляют пестицидную активность. В результате очистки и анализа таких экстрактов были выделены и идентифицированны некоторые производные нафтохинона, которые также обладают пестицидной активностью.
В соответствии с настоящим изобретением предлагается применение соединения общей формулы 1:

в которой R представляет собой атом водорода, этаноилоксигруппу или гидроксильную группу, или солей такого соединения в качестве пестицида, например фунгицида и/или, особенно, инсектицида и/или акарицида.
Соединение формулы 1 может находиться в чистом виде или в смеси с одним или более другими соединениями формулы 1. Особенно предпочтительно, чтобы соединение формулы 1 или, по крайней мере, одно из соединений формулы 1 представляло собой соединение, в котором R представляет собой этаноилоксигруппу.
Соединение формулы 1, в которой R представляет собой гидроксильную группу, может таутомеризоваться с образованием соответствующего 4-гидроксинафталин-1,2-диона и в связи с этим настоящее изобретение также включает такой таутомер. Кроме того, соединение формулы 1, в которой R представляет собой гидроксильную группу, может образовывать соли с такими щелочными металлами, как натрий и калий, и со щелочноземельными металлами, и такие соли также составляют часть изобретения.
Как отмечено выше, экстракты растений вида Calceolaria сами по себе обладают пестицидной активностью. Таким образом, в соответствии с другим аспектом настоящего изобретения предлагается экстракт разновидностей Calceolaria, предназначенный для использования в качестве пестицида, например фунгицида и/или, в особенности, инсектицида и/или акарицида.
Может применяться частично очищенный экстракт разновидностей Calceolaria. Предпочтительно, чтобы такой экстракт содержал, по крайней мере, одно соединение указанной выше формулы 1.
Соединения формулы 1 или экстракты, упомянутые выше, могут быть получены экстракцией измельченного растительного материала, например листьев и/или стеблей разновидностей Calceolaria, с помощью растворителя. Первоначальную экстракцию предпочтительно осуществлять с помощью такого углеводородного растворителя, как алкан, особенно гексан, причем затем экстракт концентрируют, например, путем выпаривания. Далее концентрированный экстракт может быть подвергнут хроматографической очистке, например, методом хроматографического разделения на колонке с силикагелем с последующим осуществлением процессов дополнительного разделения.
Предпочтительно, разновидности Calceolaria представляют собой Calceolаria andina, Calceolaria sessilis или Calceolaria glabrata var. meyenenis.
Соединения формулы 1 могут использоваться в качестве пестицида в форме упомянутого выше экстракта. С другой стороны, выделенные соединения формулы 1 или экстракты разновидностей Calceolaria могут быть сформулированы с инертным носителем или разбавителем с получением пестицидной композиции. Согласно другому аспекту настоящего изобретения предусматривается пестицидная, например фунгицидная и/или, особенно, инсектицидная и/или акарицидная, композиция, которая содержит носитель и в качестве активного ингредиента соединение указанной выше формулы 1 как указанной выше или экстракт разновидностей Calceolaria.
Композиции изобретения могут содержать 0,001-95 вес.% активного ингредиента формулы 1. Предпочтительно такие композиции в форме, готовой для использования, содержат 0,001-25 вес.% активного ингредиента. Однако более высокие концентрации, например до 95%, могут присутствовать в композициях, выпускаемых в продажу в виде концентратов, предназначенных для разбавления перед применением.
Композиции изобретения могут смешиваться с большим числом подходящих инертных носителей, например, растворителей, разбавителей и/или поверхностно-активных агентов с получением дустов, гранулированных твердых веществ, смачиваемых порошков, ленточных ловушек комаров или других твердых препаратов или эмульсий, эмульгируемых концентратов, спрэев, аэрозолей или других жидких препаратов.
Подходящие растворители и разбавители включают воду, алифатические и ароматические углеводороды, такие как ксилол или другие нефтяные фракции, и такие спирты, как этанол. Поверхностно-активные агенты могут относиться к анионному, катионному и неионному типам. В композиции также могут вводиться антиоксиданты или другие стабилизаторы, а также отдушки и красители. Такие инертные носители могут относиться к тем типам и использоваться в таких количествах, которые традиционно применяются в пестицидных композициях.
Кроме таких инертных носителей композиции изобретения могут также содержать один или более дополнительных активных ингредиентов. Такие дополнительные активные ингредиенты могут представлять собой другие соединения, обладающие пестицидной активностью, и такие другие соединения могут демонстрировать синергитический эффект с соединениями настоящего изобретения.
Соединения формулы 1 и экстракты разновидностей Calceolaria, как отмечалось выше, могут применяться для борьбы с заражением вредителями в домашних, садовых, сельскохозяйственных, медицинских или ветеринарных условиях. Таким образом, согласно другому аспекту настоящего изобретения предусматривается использование в качестве пестицида, например фунгицида и/или, особенно, инсектицида и/или акарицида, соединения указанной выше формулы 1, экстракта указанных выше разновидностей Calceolaria или упомянутой выше композиции.
Настоящее изобретение также предусматривает способ борьбы с вредителями, такими как грибки и/или, в особенности, насекомые и/или клещи в очаге поражения, который заключается в обработке такого очага соединением указанной выше формулы 1, экстрактом указанных выше разновидностей Calceolaria или описанной выше композицией. Предпочтительно, чтобы такой очаг представлял собой вредителей как таковых или окружающую среду, подвергаемую или подвергнутую воздействию таких вредителей. Более предпочтительно, чтобы такой очаг представлял собой вредителей как таковых, хранящиеся пищевые продукты, растения или животных, подвергаемых или подвергнутых воздействию таких вредителей, семена таких растений или среду, в которой растут такие растения или предполагается их выращивание. Более конкретно, соединения формулы 1, экстракты и композиции, упомянутые выше, могут использоваться в домашних условиях путем опрыскивания комнат для борьбы с мухами или другими насекомыми, в садовых или сельскохозяйственных условиях для обработки хранящихся культур, особенно хлебных злаков, или для опрыскивания таких растущих культур, как хлопок или рис, с целью борьбы с заражением грибками, насекомыми или другими вредителями, а также в медицинских или ветеринарных условиях, например, путем опрыскивания крупного рогатого скота для профилактики или лечения заражения насекомыми или другими вредителями.
Синтез соединения формулы 1, в котором R представляет собой гидроксильную группу, описан R.J.Cooke в Aust.J.Sei, Res. (1950), стр. 481-486, а спектр13C ЯМР такого соединения представлен I.A.McDonald, T.J.Simpson и A. F.Sierakowsky в Aust. J.Chem. (1977), 30, стр. 1727-34.
Кроме этого, выделение соединений формулы 1, в которой R представляет собой гидроксил или этаноилоксигруппу из надземных частей Calceolaria sessilis, и физические характеристики таких соединений описаны M.C.Chapy, I. Jimenez, М. Piovano, J.A.Garbarino и B.Diduk в Biol.Sec.Chil. Quim. (1993), 38, стр. 187-190.
Экстракт, полученный упомянутыми авторами, с использованием дихлорметана обладает теми же свойствами, что и полученный по изобретению (экстрагент-гексан), поскольку содержит тот же комплекс активных веществ. Однако соединения формулы 1, где R - водород, являются новыми веществами. Согласно еще одному аспекту настоящего изобретения предусматривается соединение указанной выше формулы 1, в которой R представляет собой атом водорода или этаноилоксигруппу.
Соединение формулы 1, в которой R представляет собой этаноилоксигруппу, может быть получено по реакции соединения формулы 1, в которой R представляет собой гидроксильную группу с этаноил галогенидом, особенно с этаноил хлоридом. Предпочтительно проводить такую реакцию в присутствии растворителя. Подходящими растворителями могут служить хлорированные углеводороды, такие как дихлорметан, ароматические углеводороды и такие гетероароматические соединения, как пиридин, а также их смеси. Также предпочтительно, чтобы такую реакцию проводили при температуре в интервале 0-40oC, более предпочтительно 15-30oC, причем наиболее предпочтительной является температура окружающего воздуха (около 20oC).
Соединение формулы 1, в которой R представляет собой гидроксильную группу, может быть получено кипячением с обратным холодильником 2-(3-метилбут-2-енилокси)нафталин-1,4-диона в спирте, предпочтительно в абсолютированном этаноле.
2-(3-Метилбут-2-енилокси)нафталин-1, 4-дион может быть получен по реакции 2-гидроксинафталин-1,4-диона с трифенил-фосфином и диэтил азодикарбоксилатом и далее с 3-метилбут-2-енолом в присутствии растворителя, такого как тетрагидрофуран.
2-Гидроксинафталин-1,4-дион (известный также под названием Лаусон или Генна) представляет собой известное соединение, выпускаемое промышленностью.
Далее настоящее изобретение иллюстрируется следующими примерами.
Пример 1
Методика экстракции
Измельченный материал (450 г) растения Calceolaria andina из Чили
экстрагировали гексаном (2 х 1500
мл) с использованием микроволнового излучения (Панасоник - 6452 В, 800 ватт, 3 минуты). Объединенные экстракты выпаривали досуха при пониженном давлении с получением
зеленого масла (10,8 г) (Экстракт
А).
Остаток элюировали с отсасыванием с силикагеля (Силикагель 60Н, Мерк 7736) смесью бензина и эфира (2:1) с получением двух активных фракций, которые затем объединяли (4,79 г).
Объединенные активные фракции элюировали с силикагеля (Силикагель 60, Мерк 9385) смесью бензина с эфиром (4:1). Основные компоненты объединяли и выпаривали досуха (3,81 г).
Основные компоненты (1,76 г) растворяли в эфире (50 мл) и экстрагировали насыщенным водным раствором карбоната натрия (4х50 мл).
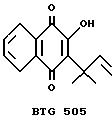
Объединенные основные фракции подкисляли до pH 5 с помощью 2 М хлористоводородной кислоты и экстрагировали эфиром (3х40 мл). Объединенные эфирные экстракты промывали водой (2х25 мл), насыщенным водным раствором хлористого натрия (25 мл) и сушили над сульфатом магния. В результате фильтрации и выпаривания растворителя при пониженном давлении получали красное твердое вещество (226 мг), т.пл. 60oC, идентифицированное методом ЯМР, как соединение формулы 1, в котором R представляет собой гидроксильную группу (Соединение В).
Оставшийся органический слой промывали насыщенным водным раствором хлористого натрия (25 мл) и сушили над сульфатом магния. В результате фильтрации и выпаривания получали красноватое твердое вещество (1,53 г).
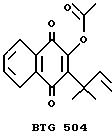
Красноватое твердое вещество (1,50 г) элюировали с силикагеля (силикагель 60, Мерк 7736) с использованием смеси бензина с эфиром (4:1) и выделяли два соединения. Менее полярное соединение (48 мг) идентифицировали как соединение формулы 1, в которой R представляет собой атом водорода (Соединение А), тогда как второе, более полярное соединение (1,14 г), т.пл. 55oC, идентифицировали как соединение формулы 1, в которой R представляет собой этаноилоксигруппу (Соединение C).
В спектрах1H ЯМР и13C ЯМР (полученных для раствора в CDCl3 с использованием тетраметилсилана в качестве внутреннего стандарта на спектрометре JEOL GX-400 при 400 МГц для1H ЯМР и 100 МГц для13C ЯМР) наблюдались пики, представленные в таблице 1.
Пример 2
Альтернативная
методика экстракции.
Измельченный материал (100 г) растения разновидности Calceolaria andina оставляли в гексане (500 мл) на 2 часа перед перемешиванием в течение 10 минут. Растворитель фильтровали и остаток экстрагировали гексаном (2х500 мл). Объединенные экстракты выпаривали досуха с получением зеленого твердого вещества (2,23 г) (Экстракт В). Этот материал разделяли в соответствии с методикой, описанной в примере 1.
Пример 3
Получение 2-(1,1-диметилпроп-2-енил)-3-гидроксинафталин- 1,
4-диона
(Соединение В. Формула 1: R=OH)
(I) Получение 2- (3-метилбут-2-енилокси) нафталин-1,4-диона.
К перемешиваемому раствору 2-гидрогсинафталин-1,4-диона (10,0 г, 57,4 ммоля) и трифенилфосфина (15,1 г, 57,4 ммоля) в сухом тетрагидрофуране (150 мл) при 0oC и в атмосфере азота добавляли диэтилазодикарбоксилат (10,0 г, 57,4 ммоля). После перемешивания еще в течение 5 минут прикапывали раствор 3-метилбут-2-енола (7,42 г, 86,1 ммоля) в сухом тетрагидрофуране (10 мл) и перемешивание продолжали в течение 2 часов. Осадок собирали, сушили на воздухе и перекристаллизовывали из водного метанола с получением целевого соединения (8,3 г) в виде желтого кристаллического твердого вещества с температурой плавления 138oC.
1H ЯМР (400 МГц) d: 1.76 (синглет, 3H, 3хH-15), 1.81 (синглет, 3H, 3хH-14), 4,59 (дублет, 2H, J=6.9 Гц, 2хH-11), 5,49 (триплет, 1H, J=6.9 Гц, H-12), 6.16 (синглет, H-3), 7.68-7.76 (мультиплет, 2H, H-6 и H-7), 8.06-8.13 (мультиплет, 2H, H-5 и H-8).
13C ЯМР (100 МГц) d: 18.4(15), 25.8(14), 66.4(11), 110.5(3), 117.2(12), 126.1a(5), 126.7a(8),
131.1b(9), 132.0b(10), 133.2c(7),
134.2c(6), 140.5(13), 159.5(2), 180.3(1) и 185.0(4),
где a, b или с представляют собой взаимозаменяемые
обозначения.
(II) Получение 2-(1, 1-диметилпроп-2-енил)-3-гидроксинафталин- 1,4-диона.
Раствор 2-(3-метилбут-2-енилокси)нафталин-1,4-диона (4,27 г, 24,8 ммоля), полученного в пункте (1) в абсолютированном этаноле (125 мл), нагревали с обратным холодильником в течение 6 часов. Смесь охлаждали и растворитель удаляли in vacuo. Остаток растворяли в диэтиловом эфире и экстрагировали 1% (вес. /об. ) водным раствором гидроксида натрия (6х25 мл). Объединенные основные фракции подкисляли до pH 5 с помощью 2 М хлористоводородной кислоты и экстрагировали диэтиловым эфиром (6х25 мл). Объединенные эфирные экстракты последовательно промывали водой (2х25 мл), насыщенным водным раствором хлористого натрия (25 мл) и сушили над безводным сульфатом магния. В результате фильтрации и выпаривания при пониженном давлении с последующей перекристаллизацией из водного метанола получали целевое соединение (4,27 г) в виде желтого кристаллического твердого вещества, т.пл. 60oC.
Пример 4
Получение 2-(1,1-диметилпроп-2-енил)-3-этаноилоксинафталин-1,4-диона
(Соединение C. Формула 1: R= -O-CO-CH3)
К перемешиваемому раствору 2-(1,
1-диметилпроп-2-енил)-3- гидроксинафталин-1,4-диона (20,0 г, 82,6 ммоля), полученного по методике, описанной выше в примере 3, в смеси сухого дихлорметана (250
мл) и пиридина (50 мл) при 0o
C медленно добавляли раствор этаноил хлорида (25,9 г, 330 ммоля) в дихлорметане (25 мл) в течение 40 минут. Перемешиваемой смеси давали медленно нагреваться до
комнатной температуры в течение 2 часов
перед последовательным промыванием водой (50 мл), 2 М хлористоводородной кислотой (2х50 мл), водой (2х50 мл), насыщенным водным раствором карбоната натрия
(2х50 мл), водой (2х50 мл), насыщенным водным
раствором хлористого натрия (50 мл) и сушкой над сульфатом магния. В результате фильтрации и выпаривания растворителя при пониженном давлении и
перекристаллизации из водного метанола получали целевое
соединение (21,6 г) в виде желтого кристаллического твердого вещества, т.пл. 55oC.
Пример 5
Пестицидная
активность
Пестицидную активность оценивали на
мухах, горчичных жучках, моли капустной, клещах и белокрылке с использованием следующих методов.
Мухи комнатные (МД) (Musca
domestica)
Самок мух по грудному отделу (тораксу)
обрабатывали одной микролитровой каплей испытуемого соединения, растворенного в ацетоне. Две дублирующие группы из 15 мух каждая
использовали для каждой нормы доз и всего 6 уровней доз применяли для
каждого испытуемого соединения. После обработки мухи выдерживались при температуре 20±1oC, и смертность
оценивали через 24 и 48 часов после обработки. Значения LD50
рассчитывали в микрограммах испытуемого соединения в расчете на муху (см. Sawicki с сотр., Bulletin of the World Health
Organisation, 35, 893, (1966) и Sawicki с сотр., Entomologia and Exp. Appli 10,
253, (1967).
Горчичные жучки (PC) (Phaedon cochleariae fab)
По одной микролитровой капле
ацетонового раствора испытуемого соединения применяли вентрально на взрослых горчичных
жучках с использованием микрокапельного апликатора. Обработанных насекомых выдерживали в течение 48 часов, после
чего оценивали смертность. При каждом уровне доз использовали по две дублирующие группы
из 20-25 горчичных жучков и в целях сравнения использовали для обработки пять уровней доз. Значения LD50 рассчитывали так же, как описано для домашних мух.
Моль капустная
(PX) (Plutella xylostella)
Личинки в пятой возрастной стадии обрабатывали 0,5 мкл каплей раствора
испытуемого соединения в ацетоне. Три дублирующие группы из 10 личинок каждая использовали
при каждой норме доз и на каждом испытуемом соединении применяли по пять уровней доз. После обработки
личинки выдерживали при 22oC и смертность оценивали по отсутствию окукливания через 5
дней. Значения LD50 расчитывали как описано для домашних мух.
Клещи (ТЦ)
(Tetranychus urticae)
25 взрослых самок клещей погружали на 30 секунд в 35 мкл раствора
испытуемого соединения в смеси ацетон-вода в соотношении 1:4. Обработанных насекомых выдерживали при
21±2oC и смертность оценивали через 72 часа после обработки. Живыми считались
клещи, осуществляющие повторяющееся (нерефлекторное) движение более чем одной двигательной конечности
после указанного промежутка времени. При каждой норме доз использовали три дублирующие группы по
25 клещей в каждой и для каждого испытуемого соединения использовали 5 или 6 уровней доз. Значения
LD50 расчитывали в ч/млн раствора испытуемого соединения в расчете на насекомое. Испытание
осуществляли с использованием трех различных штаммов клещей, один из которых восприимчив (GSS), а
два других (NYR-Bif-1000 и UK-S- Carb-600) устойчивы к действию бифентрина и карбарила соответственно.
GSS штамм был получен от компании Шеринг AG, Берлин. NYR-Bif-1000 штамм был представлен
Департаментом Энтомологии Корнуельского Университета, Нью-Йорк, причем он был подвергнут воздействию полевого
штамма с целью селекции с помощью бифентрина. UK-S-Carb-600 штамм был получен путем
селекции карбарилом штамма UK-S, представленного фирмой Шелл Рисерч Лимитед, Ситтинг-боурн. (см. T.J.Dennehy,
A.W.Farnham and I.Denholm., Pestic. Sc., 39, 47-54 (1993).
Белокрылка
(ВТ) (Bemisia tabaci)
Ацетоновые растворы (0,100 мл) испытуемых соединений помещали в 10 мл стеклянные
пробирки и выпаривали на роторном испарителе с получением пленки испытуемого
соединения. Внутрь пробирки помещали тридцать взрослых белокрылок и затем через 60 минут обработанных насекомых переносили
на необработанные диски листьев хлопка, которые выдерживали влажными на слое
акарового геля. Температуру поддерживали на уровне 25oC и через 48 часов оценивали смертность. Для каждого из
5-7 уровней доз соединения применяли по три репликата. Значения LC50
рассчитывали с использованием соответствующего компьютерного программного обеспечения ("Polo-PC", полученная от фирмы
ЛеОра Софтваэ. Беркли, Калифорния). (см. M.R.Cahill и B.Hackett в тезисах
Брайтоновской конференции по защите культур, 1992). Испытание осуществляли с использованием трех различных штаммов белокрылок,
один из которых восприимчив, а два других устойчивы к действию
пиретроидных инсектицидов. Восприимчивый штамм (SUD-S) был собран с хлопка в Судане в 1978 г., один из устойчивых штаммов (Ned 3) был
собран в Голландии с герберы в 1992 г., а другой устойчивый штамм
(USA-B) был собран с poinsettia в Южной Америке в 1985 г.
Результаты, полученные в таких испытаниях, представлены в таблицах 2 и 3. Приведенные значения представляют собой LD50 (мкг/насекомое) или LC50 (ч/млн раствора испытуемого соединения), если не указано особо.
Пример 6
Активность против белокрылок (ТV) (Trialeurodes
vaporatiorum)
Листовой диск погружали в 40% раствор Соединения C в системе ацетон:вода и затем оставляли сушиться. Затем взрослых
белокрылок в чашке Петри накрывали обработанным листом. При
каждой норме доз использовали по четыре репликатные группы из 10 взрослых белокрылок. Уничтожение насекомых оценивали через определенные
промежутки времени после обработки и с учетом коррекции по
формуле Аббота рассчитывали процент смертности.
Результаты такого испытания представлены в таблице 4.
Полученные результаты демонстрируют LC50 при применении на насекомых 10-100 ч/млн соединения C.
Проведенные испытания также показали, что соединения формулы 1 обладают афицидной активностью в отношении различных разновидностей тли, особенно Myzus persicae и Aphis gossypii.
Кроме того, проведенные испытания показали, что соединения формулы 1 обладают хорошей фунгицидной активностью против широкого спектра грибков, вызывающих заболевания как злаковых, так и широколистовых культур. Особенно хорошая активность наблюдалась в отношении грибков вида Erysiphe, особенно Erysiphe graminis, Botrytis, особенно Botrytis fabae и Botrytis cinerea, Rhizoctoria, особенно Rhizoctoria solani и Rhizoctonia cerealis, Pyricularia, особенно Pyricularia oryzae, и Aspergillus, особенно Aspergillus niger.
Результаты фунгицидных испытаний
Метод. Фунгитоксичность BTG 504 и 505 в отношении изолятов Pyricularia oryzae/=Magnaporthe grisea/ и
Rhizoctonia solani тестировали in vitro.
Каждое соединение вводили в картофельный агар с декстрозой в растворителе (50/50 этанол/ацетон) при соотношении 0,5 мл растворителя на 250 мл агара, пока автоклавированный агар находился в расплавленном состоянии, и охлаждали до 50oC. Каждое соединение испытывали при одной концентрации (максимум 100 мг•л-1) или в сериях разбавлений. Пять концентраций в сериях использовали для определения EC50 (концентрация, приводящая в результате к 50% ингибированию роста колонии).
Каждое испытание включало три контрольные обработки: стандартным фунгицидом (карбендазим с концентрацией 1 или 5 мг•л-1); только этанол/ацетон; без добавок. Фунгицид, используемый в качестве стандарта, необязательно должен представлять собой вещество, используемое коммерчески для борьбы с данным грибком; такой фунгицид может рассматриваться как представитель активных, коммерчески доступных соединений.
Каждый грибок испытывали на агаре в четырех чашках Петри для каждой обработки при трех репликатных грибковых колониях на пластине (одна колония для R. solani). R. solani инкубировали в течение 4 дней при 20-25oC, а P. oryzae - в течение 7 дней. Затем измеряли увеличение диаметра колонии и эту величину использовали для определения активности: A = 91-100% ингибирование роста; В = 76-90% ингибирование; C = 51-75% ингибирование, D = 26-50% ингибирование; E = 6-25% ингибирование; N = 0,5% ингибирование. Значение EC50 оценивали из графика зависимости диаметра колонии от логарифма концентрации.
Результаты
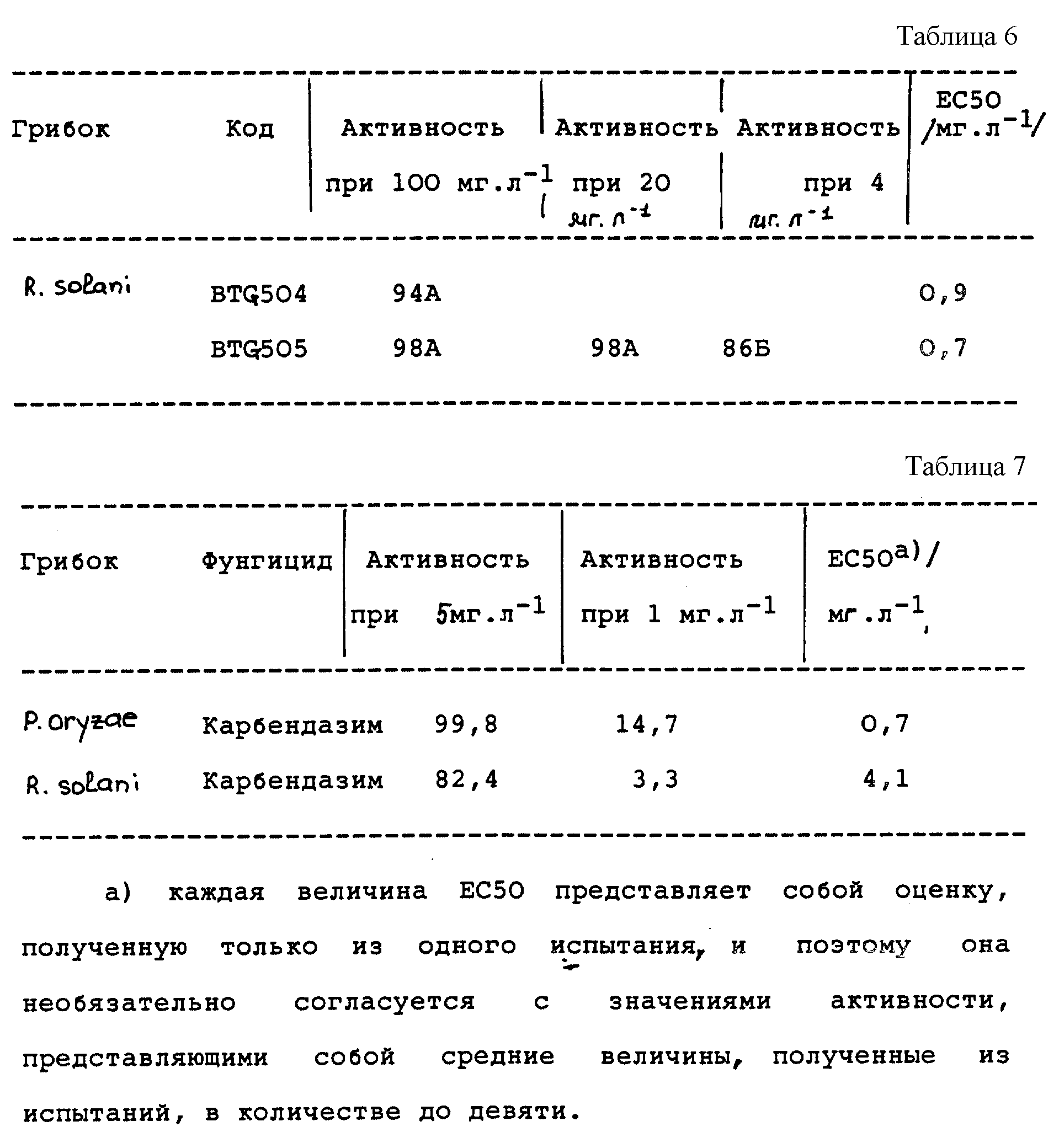
Активность испытуемых соединений (% ингибирования роста диаметра колонии) против Pyricularia oryzae на агаровых пластинах (см. таблицу 5).
Активность испытуемых соединений (% ингибирования роста диаметра колонии) против Rhiroctonia solani на агаровых пластинах (см. таблицу 6).
Средняя активность (% ингибирования роста диаметра колонии) фунгицидов, используемых в качестве стандартов в испытаниях на агаровых пластинах (см. таблицу 7).
Примеры
композиций
I.CODACIDETM1) - 90
мас.%
Соединение А - 10 мас.%м
Реферат
Изобретение относится к новому производному 1,4 - нафтохинона формулы I, где R - водород, а также к экстрактам измельченного растительного материала растений Calceolaria sessilis и Calceolaria andina, содержащим указанное выше соединение или его аналоги, где R - гидроксильная и этаноилоксигруппа. Указанные экстракты и соединение могут быть использованы для борьбы с насекомыми и/или клещами, и/или грибами как таковые или в виде композиции, содержащей соответствующие целевые добавки. Технический результат приобретения - расширение ассортимента пестицидов, которые могут быть использованы для борьбы с вредителями в домашних, садовых, сельскохозяйственных, медицинских или ветеринарных условиях. 6 с. и 1 з.п.ф-лы, 7 табл.
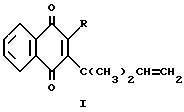
Формула
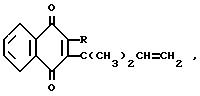
где R - этаноилокси- или оксигруппа,
в качестве фунгицида, и/или акарицида, и/или инсектицида.
