Устройство и способ солюбилизации, выделения, удаления и осуществления взаимодействия карбоновых кислот в маслах, жирах, водных или органических растворах с помощью микро- или наноэмульсификации - RU2581368C2
Код документа: RU2581368C2
Чертежи
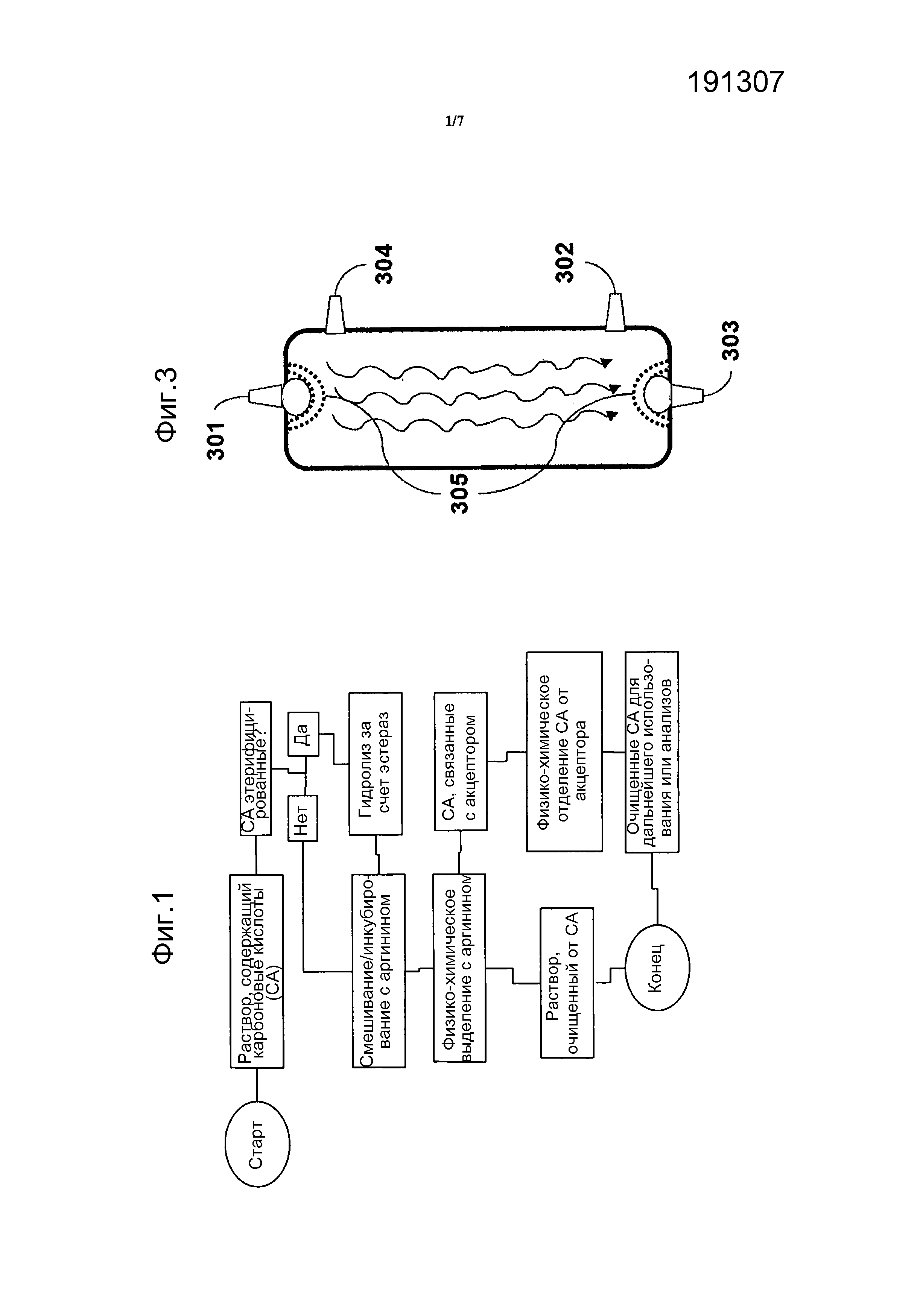
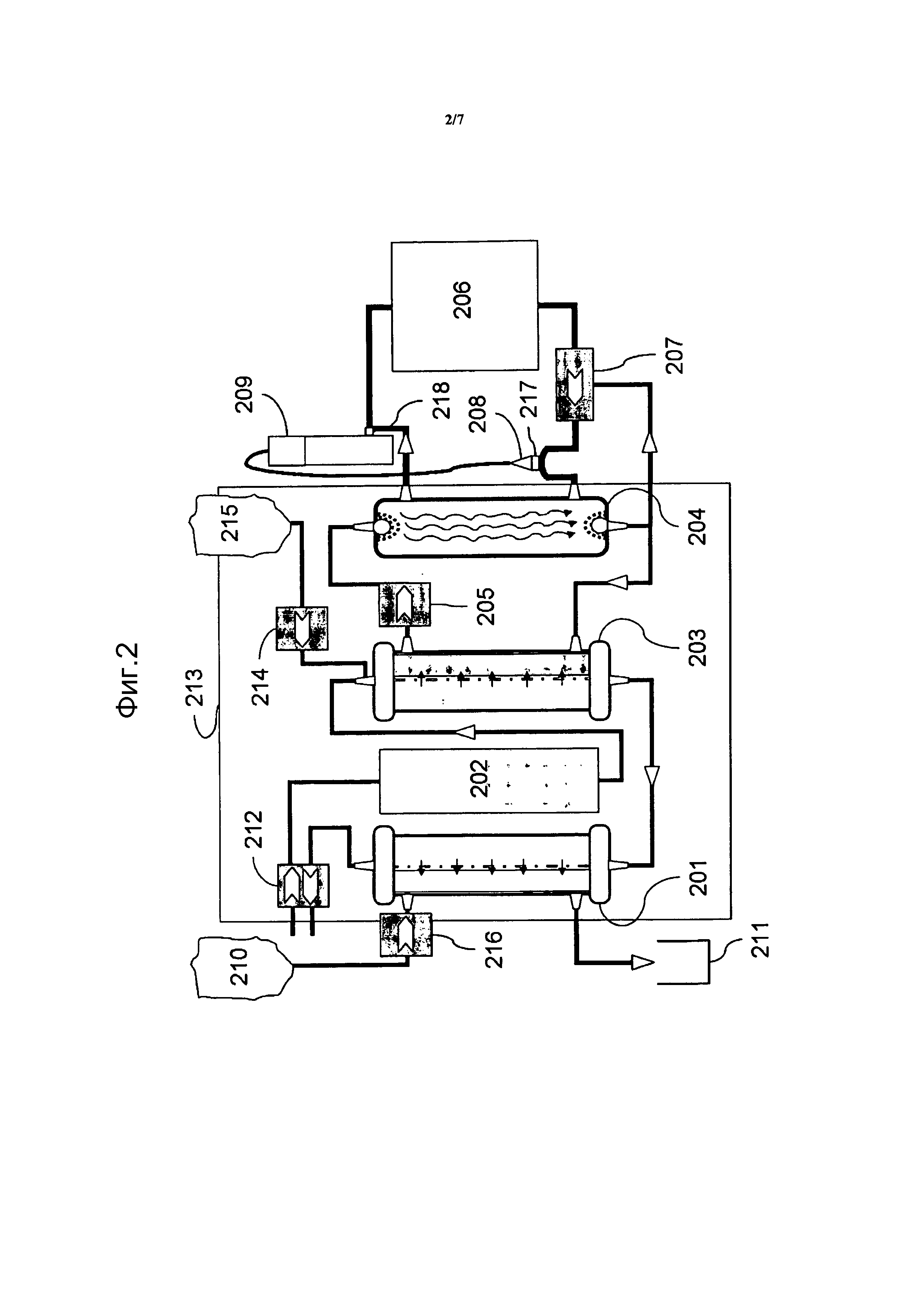

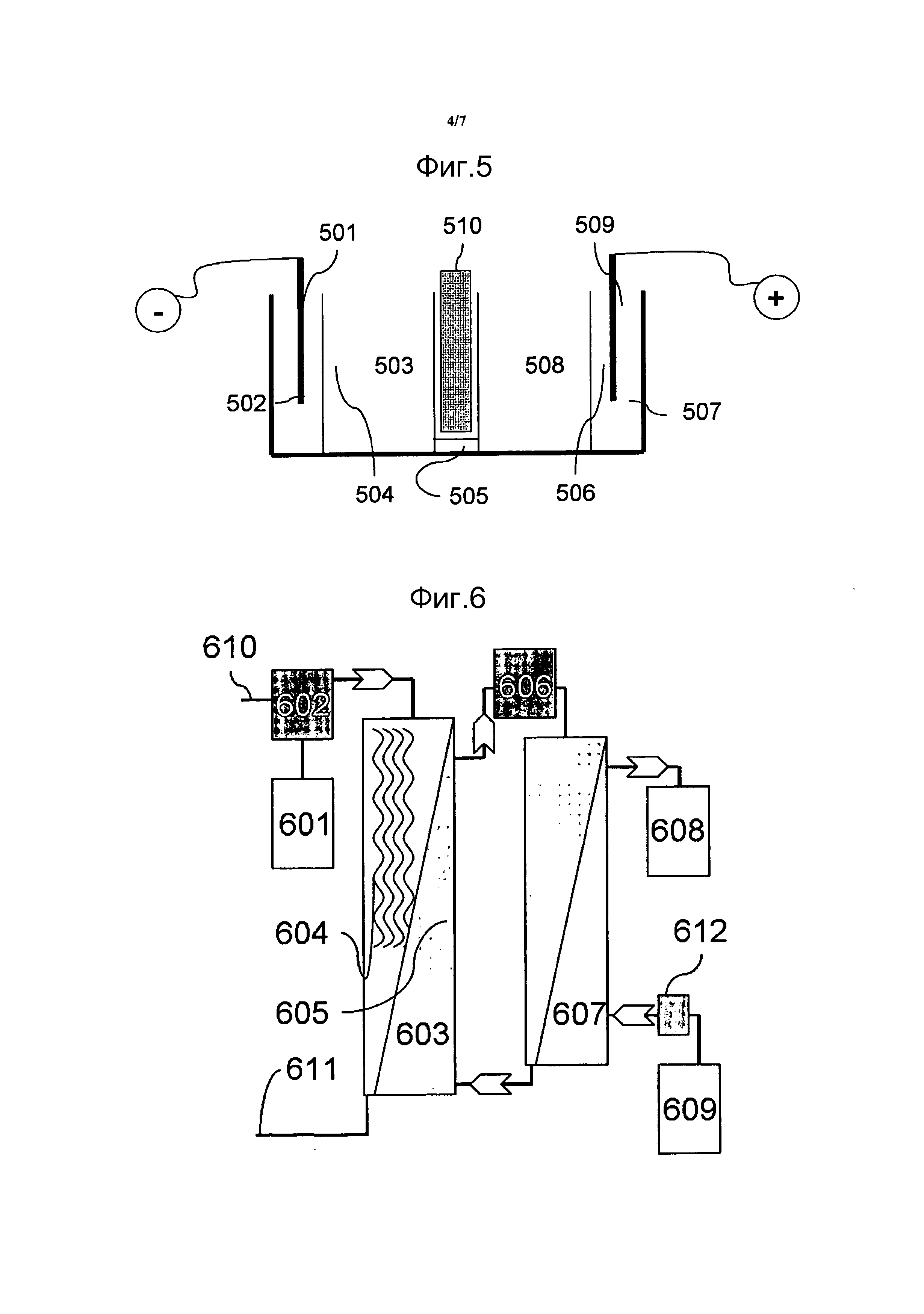



Описание
A. Известный уровень техники
Настоящее изобретение относится к солюбилизирующим соединениям, к устройству и к способу солюбилизации и удаления карбоновых кислот, и особенно жирных кислот, из масел, жиров, водных эмульсий, водных или органических растворов. Устройства, используемые в способе по изобретению, можно использовать для выделения карбоновых кислот из масел, жиров, водных эмульсий, липофильных сред, водных сред или органических растворов, соответственно, тем самым, изменяя условия их взаимодействий. Одно из применений представляет собой устройство для удаления жирных кислот из крови нуждающегося в этом субъекта. Указанное устройство можно использовать далее для аналитических, соответственно диагностических, целей, для определения концентраций жирных кислот в корпоральных жидкостях субъектов, в пище или в фармацевтических препаратах. Кроме того, указанный способ можно применять для удаления остатков карбоновых кислот в промышленных растворах, например, образующихся в пищевой или нефтеперерабатывающей промышленности.
Вообще жирные кислоты представляют собой высоко липофильные молекулы, которые плохо растворимы в водных растворах. Поэтому только небольшие концентрации жирных кислот можно солюбилизировать в водных растворах, хотя все молекулы жирных кислот, превышающие такую концентрацию, присутствуют в форме мицелл, образуют эмульсии за счет фазового разделения, или оказываются адсорбированными на стенках контейнера и/или на других липофильных или амфифильных молекулах, таких как белки в растворе. При концентрации, превышающей критическую концентрацию мицелл (CMC) этерифицированных и неэтерифицированных карбоновых кислот, концентрация свободных жирных кислот в водной среде остается неизменной.
Жирные кислоты имеют тенденцию образовывать эмульсии в водных средах. В присутствии белков или клеточных структур жирные кислоты могут ими адсорбироваться или адсорбироваться на них. Солюбилизация таких иммобилизованных жирных кислот зависит, главным образом, от критической концентрации мицелл (CMC) жирных кислот в окружающей водной среде. Эмульгаторы и детергенты способны повысить CMC гидрофобных веществ, и таким образом способствовать отделению иммобилизованных липофильных молекул. Такие эмульгаторы и детергенты могут превратить эмульсии в мини-, микро- или наноэмульсии. Таким образом, площадь контакта солюбилизированных жирных кислот с водной фазой увеличивается. Это обеспечивает лучшую способность к выделению и экстрагированию солюбилизированных жирных кислот. Это также повышает реакционную способность в отношении других молекул.
Эмульсии этерифицированных и неэтерифицированных жирных кислот с водной средой можно полностью выделить только с помощью органического растворителя. Без помощи мембраны этого можно достичь только путем переноса жирных кислот в органическую фазу, смешивая с органическим растворителем. Экстрагирование возможно также за счет адсорбции на акцептор. В присутствии адсорбирующих молекул, таких как белки, выделение жирных кислот в эмульсии или суспензии за счет разделения фаз или экстрагирования часто является неполным. Кроме того, эффективность такого способа ограничена, и обычно он не приспособлен для он-лайн (непрерывного) процесса. При фильтровании таких эмульсий водную фракцию можно отфильтровать почти полностью. Однако также гидрофильные молекулы, особенно крупные белки, удерживаются и выделяются вместе с органической фазой. Разделение молекул можно осуществить, используя хроматографические способы. Такие способы, однако, занимают много времени и ограничены по производительности.
Другим способом выделения карбоновых кислот из водных или органических сред является дистилляция. Однако такой способ требует больших энергетических затрат и может вызвать изомеризацию карбоновых кислот или денатурирование органических компонентов внутри среды. Следующим способом является омыление. Добавленные соли часто бывает трудно удалить из органики, также как из водных растворов во время дальнейшей обработки. Таким образом, существует необходимость в способе непрерывного и селективного экстрагирования жирных кислот из эмульсии водных или органических растворов. Целью настоящего изобретения является создание простого, быстрого и биосовместимого способа выделения жирных кислот из водных эмульсий или органических сред.
Неожиданно было обнаружено, что этой цели можно достичь, добавляя солюбилизирующее соединение к водным эмульсиям или к водным средам, таким как кровь, липофильные среды или органические среды, содержащие карбоновые кислоты или смеси карбоновых кислот с другими органофильными молекулами. Солюбилизирующее соединение по настоящему изобретению, обладающее определенными в описании характеристиками, способно солюбилизировать карбоновые кислоты и превратить эмульгированные карбоновые кислоты в макро- или наноэмульсии, что позволяет осуществить выделение с помощью способов разделения, таких как диализ, фильтрование и электрофорез.
Указанную задачу решают, следуя техническим указаниям независимых пунктов формулы настоящего изобретения. Дальнейшие полезные воплощения настоящего изобретения вытекают из зависимых пунктов формулы изобретения, описания и примеров.
Жирные кислоты
Обычно жирные кислоты состоят из карбоксильной концевой группы и длинной алифатической цепочки. В зависимости от присутствия двойных связей их подразделяют на насыщенные или ненасыщенные жирные кислоты. В литературе существуют различные определения жирных кислот. В одном из определений указано, что карбоновые кислоты, содержащие 4 атома углерода или больше, рассматривают как жирные кислоты. Однако природные жирные кислоты содержат по меньшей мере 8 атомов углерода. У этих атомов углерода по меньшей мере одна нитрогруппа может замещать атом (атомы) водорода и превращать их в нитро-жирные кислоты. Также нитро-жирные кислоты могут иметь другие заместители, такие как перечисленные выше.
Примерами неразветвленных насыщенных жирных кислот являются октановая кислота (каприловая кислота), декановая кислота (каприновая кислота), додекановая кислота (лауриновая кислота), тетрадекановая кислота (миристиновая кислота), гексадекановая кислота (пальмитиновая кислота), гептадекановая кислота (маргариновая кислота), октадекановая кислота (стеариновая кислота), эйкозановая кислота (арахидиновая кислота), докозановая кислота (бегеновая кислота) и тетракозановая кислота (лигноцериновая кислота).
В соответствии с настоящим изобретением предпочтительной подгруппой подлежащих выделению насыщенных жирных кислот являются миристиновая кислота, пальмитиновая кислота и стеариновая кислота.
Примерами моноолефиновых жирных кислот являются цис-9-тетрадеценовая кислота (миристолеиновая кислота), цис-9-гексадеценовая кислота (пальмитолеиновая кислота), цис-6-гексадеценовая кислота (сальпеновая кислота), цис-6-октадеценовая кислота (петроселиновая кислота), цис-9-октадеценовая кислота (олеиновая кислота), цис-11-октадеценовая кислота (вакценовая кислота), 12-гидрокси-9-цис-октадеценовая кислота (рицинолеиновая кислота), цис-9-эйкозеновая кислота (гадолеиновая кислота), цис-11-эйкозеновая кислота (гондоевая кислота), цис-13-докозеновая кислота (эруковая кислота), цис-15-тетракозеновая кислота (нервоновая кислота), t9-октадеценовая кислота (элаидиновая кислота), t11-октадеценовая кислота (t-вакценовая кислота) и t3-гексадеценовая кислота. В соответствии с настоящим изобретением предпочтительной подгруппой подлежащих выделению ненасыщенных жирных кислот являются транс-изомеры t9-октадеценовой кислоты, t11-октадеценовой кислоты, и t3-гексадеценовой кислоты.
Примерами полиолефиновых жирных кислот являются 9,12-октадекадиеновая кислота (линолевая кислота), 6,9,12-октадекатриеновая кислота (γ-линолевая кислота), 8,11,14-эйкозатриеновая кислота (дигомо-γ-линолевая кислота), 5,8,11,14-эйкозатриеновая кислота (арахидоновая кислота), 7,10,13,16-докозатетраеновая кислота, 4,7,10,13,16-докозапентаеновая кислота, 9,12,15-октадекатриеновая кислота (α-линоленовая кислота), 6,9,12,15-октадекатетраеновая кислота (стеаридоновая кислота), 8,11,14,17-эйкозатетраеновая кислота, 5,8,11,14,17-эйкозапентаеновая кислота (EPA), 7,10,13,16,19-докозапентаеновая кислота (DPA), 4,7,10,13,16,19-докозагексаеновая кислота (DHA), 5,8,11-эйкозатриеновая кислота (медовая кислота), 9c 11t 13t элеостеариновая кислота, 8t 10t 12c календовая кислота, 9c 11t 13c катальповая кислота, 4,7,9,11,13,16,19 докозагептадекановая кислота (стеллагептаеновая кислота), таксолевая кислота, пиноленовая кислота и сциадоновая кислота.
В соответствии с настоящим изобретением предпочтительной подгруппой подлежащих выделению ненасыщенных жирных кислот являются транс-изомеры линоленовой кислоты, γ-линолевой кислоты, EPA и DPA.
Примерами ацетиленовых жирных кислот являются 6-октадециновая кислота (тарировая кислота), t11-октадецен-9-иновая кислота (санталбовая или ксименовая кислота), 9-октадециновая кислота (стеароловая кислота), 6-октадецен-9-иновая кислота (6,9-октадецениновая кислота), t10-гептадецен-8-иновая кислота (пировиноградная кислота), 9-октадецен-12-иновая кислота (крепениновая кислота), t7,t11-октадекадиен-9-иновая кислота (хайстеровая кислота), t8,t10-октадекадиен-12-иновая кислота, 5,8,11,14-эйкозатетраиновая кислота (ETYA).
Следует отметить, что в соответствии с настоящим изобретением также и основания, соответственно и соли, вышеуказанных жирных кислот должны относиться к группе под общим названием жирные кислоты или свободные жирные кислоты.
Примерами подходящих органических и неорганических оснований для образования солей являются основания, полученные из ионов металлов, например, алюминия, ионов щелочных металлов, таких как натрий или калий, ионов щелочноземельных металлов, таких как кальций или магний, или ионов солей амина или гидроксидов щелочных или щелочноземельных металлов, -карбонатов или -бикарбонатов. Примеры включают водный гидроксид натрия, гидроксид лития, карбонат кали, аммиак и бикарбонат натрия, соли аммония, первичные, вторичные и третичные амины, такие как, например, низшие алкиламины, такие как метиламин, трет-бутиламин, прокаин, этаноламин, арилалкиламины, такие как дибензиламин и N,N-дибензилэтилендиамин, низшие алкилпиперидины, такие как N-этилпиперидин, циклоалкиламины, такие как циклогексиламин или дициклогексиламин, морфолин, глюкамин, N-метил- и Ν,Ν-диметилглюкамин, 1-адамантиламин, бензатин, или соли, полученные из аминокислот, таких как лизин, орнитин, или амиды органических нейтральных или кислотных аминокислот или тому подобное.
Следующие карбоновые кислоты являются предпочтительныеми примерами жирных кислот:
октановая кислота (каприловая кислота), декановая кислота (каприновая кислота), додекановая кислота (лауриновая кислота), тетрадекановая кислота (миристиновая кислота), гексадекановая кислота (пальмитиновая кислота), гептадекановая кислота (маргариновая кислота), октадекановая кислота (стеариновая кислота), эйкозановая кислота (арахидиновая кислота), докозановая кислота (бегеновая кислота), тетракозановая кислота (лигноцериновая кислота), цис-9-тетрадеценовая кислота (миристолеиновая кислота), цис-9-гексадеценовая кислота (пальмитолеиновая кислота), цис-6-октадеценовая кислота (петроселиновая кислота), цис-9-октадеценовая кислота (олеиновая кислота), цис-11-октадеценовая кислота (вакценовая кислота), цис-9-эйкозеновая кислота (гадолеиновая кислота), цис-11-эйкозеновая кислота (гондоевая кислота), цис-13-докозеновая кислота (эруковая кислота), цис-15-тетракозеновая кислота (ацетэруковая кислота), t9-октадеценовая кислота (элаидиновая кислота), t11-октадеценовая кислота (t-вакценовая кислота), t3-гексадеценовая кислота, 9,12-октадекадиеновая кислота (линолевая кислота), 6,9,12-октадекатриеновая кислота (γ-линолевая кислота), 8,11,14-эйкозатриеновая кислота (дигомо-y-линолевая кислота), 5,8,11,14-эйкозатетраеновая кислота (арахидоновая кислота), 7,10,13,16-докозатетраеновая кислота, 4,7,10,13,16-докозапентаеновая кислота, 9,12,15-октадекатриеновая кислота (α-линоленовая кислота), 6,9,12,15-октадекатетраеновая кислота (стеаридоновая кислота), 8,11,14,17-эйкозатетраеновая кислота, 5,8,11,14,17-эйкозапентаеновая кислота (EPA), 7,10,13,16,19-докозапентаеновая кислота (DPA), 4,7,10,13,16,19-докозагексаеновая кислота (DHA), 5,8,11-эйкозатриеновая кислота (медовая кислота), 9c 11t 13t элеостеариновая кислота, 8t 10t 12c календовая кислота, 9c 11t 13c катальповая кислота, 4,7,9,11,13,16,19 докозагептадекановая кислота (стеллагептаеновая кислота), таксолевая кислота, пиноленовая кислота, сциадоновая кислота, 6-октадециновая кислота (тарировая кислота), t11-октадецен-9-иновая кислота (санталбовая или ксименовая кислота), 9-октадециновая кислота (стеароловая кислота), 6-октадецен-9-иновая кислота (6,9-октадецениновая кислота), t10-гептадецен-8-иновая кислота (пуриловая кислота), 9-октадецен-12-иновая кислота (крепеновая кислота), t7,t11-октадекадиен-9-иновая кислота (хайстеровая кислота), t8,t10-октадекадиен-12-иновая кислота, 5,8,11,14-эйкозатетраиновая кислота (ETYA), элеоостеариновая кислота, календовая кислота, катальповая кислота, стеллагептаеновая кислота, таксолеиновая кислота, ретиноевая кислота, изопальмитиновая кислота, пристановая кислота, фитановая кислота, 11,12-метиленоктадекановая кислота, 9,10-метиленгексадекановая кислота, коронаровая кислота, (R,S)-липоевая кислота, (S)-липоевая кислота, (R)-липоевая кислота, 6,8-бис(метилсульфанил)октановая кислота, 4,6-бис(метилсульфанил)гексановая кислота, 2,4-бис(метилсульфанил)бутановая кислота, 1,2-дитиоланкарбоновая кислота, (R,S)-6,8-дитианоктановая кислота, (R)-6,8-дитианоктановая кислота, (S)-6,8-дитианоктановая кислота, цереброновая кислота, гидроксиацетэруковая кислота, рицинолеиновая кислота, лесквероловая кислота, брассиловая кислота и тапсоновая кислота.
Жирные кислоты в крови
У млекопитающих жирные кислоты служат физиологически важными энергетическими веществами и играют ключевую роль в энергетическом метаболизме. Кроме того, они являются важными субстратами для синтеза мембранных фосфолипидов и биологически активных агентов, таких как эйкозаноиды и лейкотриены. Организм млекопитающих в значительной степени зависит от жирных кислот, как поставщиков химически аккумулированной энергии, строительных блоков клеточных мембран и для передачи сигналов. Основным источником жирных кислот являются пищевые липиды, переваренные в желудочно-кишечном тракте благодаря каталитическому действию гидролитических ферментов поджелудочной железы. Часть жирных кислот вырабатывается печенью, запасающей углеводы в качестве субстрата. Однако большой процент жирных кислот хранится в жировых клетках (адипоцитах), включающих адипозную ткань в форме триацилглицерина.
Концентрация этерифицированных и неэтерифицированных жирных кислот в крови зависит от нескольких факторов, таких как усвоение пищи или выделение из адипозной ткани. Жирные кислоты могут быть связаны с другими молекулами или присоединены к другим молекулам, таким как триглицериды или фосфолипиды, или к небольшому проценту жирных кислот, оставшихся несвязанными. В любом случае жирные кислоты нерастворимы в воде и должны быть связаны с растворимым в воде компонентом для транспорта в организме. Транспорт жирных кислот в организме осуществляется за счет лимфатической и сосудистой систем. В основном существуют две транспортные формы: жирные кислоты могут переноситься как триацилглицерины, которые представляют собой основной компонент циркулирующих липобелков, таких как хиломикроны и липобелки очень низкой плотности, или как неэтерифицированные жирные кислоты, которые связаны с белками плазмы, в частности, с альбумином плазмы. Свободные жирные кислоты, которые ни с чем не связаны, обладают очень низкой растворимостью и присутствуют только в очень низких концентрациях.
Состав, распределение и концентрации жирных кислот в крови человека могут сильно отличаться и состоят из суммы различных фракций плазмы: эфиры холестерина, фосфолипиды и триацилглицерины, также как связанные с альбумином жирные кислоты. Насыщенные жирные кислоты в крови человека представлены в основном миристиновой кислотой (14:0), пальмитиновой кислотой (16:0) и стеариновой кислотой (18:0). Основной тип мононенасыщенных жирных кислот принадлежит к группе, состоящей из олеиновой кислоты (18:1) и пальмитолеиновой кислоты (16:1). Полиненасыщенные омега-3 жирные кислоты включают линоленовую кислоту (18:3), эйкозапентаеновую кислоту (20:5), докозапентаеновую кислоту (22:5) и докозагексаеновую кислоту (22:6). Полиненасыщенные омега-6 жирные кислоты включают в основном линолевую кислоту (18:2), эйкозадиеновую кислоту (20:2), дигомогаммалиноленовую кислоту (20:3), арахидоновую кислоту (20:4), адреновую кислоту (22:4) и докозапентаеновую кислоту (22:5). Концентрации других жирных кислот обычно очень низки в цельной крови, но могут меняться в зависимости от генетики, питания и образа жизни.
Концентрации жирных кислот в крови повышены у страдающих ожирением пациентов и вносят вклад в диабет 2 типа, гепатический стеатоз и некоторые сердечно-сосудистые нарушения, такие как атеросклероз. Была выяснена патогенетическая роль жирных кислот в развитии атеросклероза и связанных с ним таких заболеваний, как церебральные, миокардиальные, почечные, эректильные дисфункции. Без претензий на полноту, далее будут исследованы некоторые аспекты. Было обнаружено, что повышение содержания жирных кислот отвечает за увеличение образования реакционноспособных кислородных радикалов, что вызывает эндотелиальную дисфункцию, которую можно ослабить, используя антиоксидант (Pleiner et al., FFA-induced endothelial dysfunction can be corrected by vitamin C. J Clin Endocrinol Metab 2002, 87, 2913-7). Указанный эффект усиливается за счет транс-жирных кислот, которые, как предполагают, обладают дополнительными вредными эффектами (Lopez Garcia et al., Consumption of trans-fatty acids is related to plasma biomarkers of inflammation and endothelial dysfunction. J Nutr 2005, 135, 562-566; Mozaffarian et al., Health effects of trans-fatty acids: experimental and observational evidence. Eur J Clin Nutr 2009, 63 Suppl 2, S5-21). Их обвиняют в повышении кровяного давления, и было обнаружено, что они являются патогенетическим фактором возникновения артериальной гипертонии (Zheng et al., Plasma fatty acid composition and 6-year incidence of hypertension in middle-aged adults: the Atherosclerosis Risk in Communities (ARIC) Study. Am J Epidemiol 1999, 150, 492-500). Было обнаружено, что транс-жирные кислоты повышают риск инфаркта миокарда и неожиданной остановки сердца (Ascherio et al., Trans-fatty acids intake and risk of myocardial infarction. Circulation 1994, 89, 94-101; Baylin et al, High 18:2 Trans-fatty acids in adipose tissue are associated with increased risk of nonfatal acute myocardial infarction in Costa Rican adults. J Nutr 2003, 133, 1186-1191). Наряду с постоянным увеличением концентрации жирных кислот в крови, они ответственны за резистентность к инсулину и развитие сахарного диабета (Krachler et al., Fatty acid profile of the erythrocyte membrane preceding development of type 2 diabetes mellitus. Nutr Metab Cardiovasc Dis 2008, 18, 503-510; Lionetti et al, From chronic overnutrition to insulin resistance: the role of fat-storing capacity and inflammation. Nutr Metab Cardiovasc Dis 2009, 19, 146-152; Yu et al., Mechanism by which fatty acids inhibit insulin activation of insulin receptor substrate-1 (IRS-l)-associated phosphatidylinositol 3-kinase activity in muscle. J Biol Chem 2002, 277, 50230-50236). В настоящее время считают, что повышенный оборот жирных кислот, как результат хронического переедания, является наиболее важным патологическим механизмом в развитии большинства обычных заболеваний в промышленных странах (Bays, "Sick fat," metabolic disease, and atherosclerosis. Am J Med 2009, 122, S26-37). Медицинского лечения для эффективного снижения избыточного веса не существует (Aronne et al., When prevention fails: obesity treatment strategies. Am J Med 2009, 122, S24-32). Однако можно найти полных людей, которым удалось снизить массу тела и таким образом значительно уменьшить возможность заболеваний, вызываемых жирными кислотами (Lien et a, The STEDMAN project: biophysical, biochemical and metabolic effects of a behavioral weight loss intervention during weight loss, maintenance, and regain. Omics 2009, 13, 21-35; Schenk et a, Improved insulin sensitivity after weight loss and exercise training is mediated by a reduction in plasma fatty acids mobilization, not enhanced oxidative capacity. J Physiol 2009, 587, 4949-4961). Поэтому желательно создать устройство для эффективного снижения полного количества жирных кислот и предпочтительно кислот с повышенной патогеничностью.
Было обнаружено, что хирургическое удаление подкожной адипозной ткани является неэффективным в отношении уменьшения концентрации или количественного содержания циркулирующих жирных кислот. Удаление фракции липопротеинов с высокой концентрацией холестерина путем непосредственной адсорбции из крови можно осуществить, используя адсорбцию или фильтрацию указанных частиц. Такие процедуры для он-лайн очистки крови называют LDL аферезом. Хотя они созданы для снижения содержания LDL холестерина, они также адсорбируют триглицериды. Однако количество экстрагируемых триглицеридов недостаточно для снижения содержания жирных кислот в организме.
Содержание жирных кислот в крови является низким в голодном состоянии в покое. Однако наблюдается значительное повышение во время липолиза (см. далее). Из-за нерастворимости в водной среде транспорт неэтерифицированных жирных кислот осуществляется белками и клеточными структурами (Spector et al., Utilization of long-chain free fatty acids by human platelets. J Clin Invest 1970, 49, 1489-1496). Основным транспортным белком крови является альбумин. Было документально установлено наличие по меньшей мере 10 специфических сайтов связывания жирных кислот. Однако связывающая способность может резко возрасти за счет образования мицеллярных структур с жирными кислотами в условиях избытка жирных кислот или других липидов (Schubiger et al., Mixed micelles: a new problem-free solution for omega-123I-heptadecanoic acid in comparison. Nuklearmedizin 1984, 23, 27-28). При молярности альбумина около 600 мкмоль/л будет наблюдаться связывающая способность по меньшей мере 0,006 моль/л для жирных кислот, что соответствует примерно 0,0035 кг/л (Berk and Stump, Mechanisms of cellular uptake of long chain free fatty acids. Mol Cell Biochem 1999, 192, 17-31).
Кроме того, жирные кислоты переносятся в этерифицированной форме, как моно-, ди- или триацилглицерины. Концентрация в сыворотке в голодном состоянии значительно изменяется. Однако общепризнанные нормальные значения должны быть ниже 150 мг/дл (1,7 моль/л). После приема пищи или во время тренировки концентрация может возрасти в несколько раз и даже может превысить 1000 мг/дл (11,3 ммоль/л).
Существуют лишь скудные сообщения, в которых исследуют различия в содержании липидов в различных сайтах внутри циркуляции. В указанных исследованиях было обнаружено, что значительно более высокие значения для жирных кислот и триглицеридов существуют в центральной венозной системе (Vena cava) по сравнению с другими изученными сайтами (Wiese et al., Lipid composition of the vascular system during infancy, childhood, and young adulthood, J. Lipid Res. 1967, 8, 312-320; Zauner et al., Pulmonary arterial-venous differences in lipids and lipid metabolites. Respiration 1985, 47, 214-219). Отсутствуют сообщения об изменениях содержания липидов в центральной венозной системе во время тренировок и при индуцированном липолизе.
В настоящее время было обнаружено, что во время физических тренировок содержание липидов резко возрастает в центральных абдоминальных венах, демонстрируя увеличивающуюся разницу в содержании липидов в центральном и периферическом сайте доступа, как раскрыто далее. Таким образом, уменьшение содержания жирных кислот в крови с использованием раскрытых в описании способов и устройств и солюбилизирующих соединений можно использовать для лечения указанных выше заболеваний, связанных с повышенным уровнем содержания жирных кислот в крови или в организме.
Таким образом, настоящее изобретение относится к лечению и профилактике заболеваний, вызванных жирными кислотами, таких как диабет 2 типа, печеночный стеатоз, сердечно-сосудистые заболевания, такие как артериальная гипертония, инфаркт миокарда, удар, неожиданная смерть от инфаркта, атеросклероз, заболевания, связанные с атеросклерозом, такие как церебральная, миокардиальная, почечная и эректильная дисфункции, также как к снижению веса и к снижению содержания холестерина и также к профилактике резистентности к инсулину и профилактике развития сахарного диабета, за счет использования раскрытых в изобретении солюбилизирующих соединений для удаления жирных кислот из крови.
Липолиз
Плазменные жирные кислоты представляют собой важный энергетический субстрат. Доступность жирных кислот определяют преимущественно по их мобилизации из хранилищ триацилглицерина в адипозной ткани в процессе липолиза. У человека липолиз адипозной ткани регулируется рядом гормональных, паракринных и/или автокринных сигналов. Основные гормональные сигналы могут быть представлены катехоламинами, инсулином, гормоном роста, натрийуретическими пептидами, тироксином и некоторыми адипоцитокинами (Stich and Berlan, Phisiological regulation of NEFA availability: lypolysis pathway. Proc Nutr Soc 2004, 63, 369-374). Абсолютные уровни и относительные важность и вклад указанных сигналов меняются в различных физиологических ситуациях, причем питание и физические упражнения являются основными физиологическими переменными, которые влияют на систему гормональных сигналов. Семейство ферментов, называемых липазами, с различными функциями отвечает за разрушение триглицеридов, находящихся внутри жировых клеток для хранения энергии. Углеводороды и жирные кислоты представляют собой основные энергоресурсы для мышечных сокращений. Во время упражнений липолиз высвобождает 7,1+/-1,2 макромоль×мин(-1)×кг(-1) веса тела, что приводит к выделению жирных кислот порядка 420Ό мкмоль в час у человека весом 100 кг, что эквивалентно 0,15 кг жирных кислот (Coggan et al., Fat metabolism during high-intensity exercise in endurance-trained и untrained men. Metabolism 2000, 49, 122-128). Однако стимуляция липолиза фармакологическим вмешательством и/или локальными физическими мерами может далее повысить липолитическую способность. Липолиз повышается вплоть до троекратного за счет систематического применения природных рецепторных агонистов или лекарственных средств (Riis et al., Elevated regional lypolysis in hyperthyroidism. J Clin Endocrinol Metab 2002, 87, 4747-4753; Barbe et al., In situ assessment of the role of the beta 1-, beta 2- и beta 3-adrenoceptors in the control of lypolysis and nutritive blood flow in human subcutaneous adipose tissue. Br J Pharmacol 1996, 117, 907-913). Агонисты адренорецепторов, демонстрирующие стимулирование липолиза: адреналин, норадреналин, изопреналин, эфедрин, изопротериол, салбутамол, теофиллин, фенотерол или ципреналин и др.
Липолитические эффекты были также описаны для физических изменений жировой ткани. Исследователи обнаружили, что ультразвук обладает ожижающим эффектом в отношении адипозной ткани, что приводит к уменьшению содержания жировой ткани, если это осуществляется по время голодания (Faga et al., Ultra sound-assisted lypolysis of the omentum in dwarf pigs. Aesthetic Plast Surg 2002, 26, 193-196; Miwa et al., Effect of Ultra sound application on fat mobilization. Pathophysiology 2002, 9, 13).
Хотя для всех вышеизложенных измерений усиление липолиза было документировано, измеряемое влияние на концентрации неэтерифицированных жирных кислот было маленьким. В пилотном исследовании было обнаружено, что после стимуляции липолиза содержание жирных кислот существенно повышается, если его измеряют, используя способ по настоящему изобретению для солюбилизации жирных кислот. Кроме того, было обнаружено, что содержание жирных кислот гораздо выше в абдоминальной венозной системе, чем в периферической циркуляции. Этот факт оказался неожиданным, так как он не наблюдался в исследованиях на животных, при измерении образцов крови из различных участков, взятых одновременно.
Поэтому стимуляция липолиза по время осуществления очистки крови от жирных кислот способом по настоящему изобретению и использование центральной абдоминальной вены в качестве сайта доступа является предпочтительным вариантом настоящего изобретения.
Экстрагируемую часть можно увеличить, если содержание этерифицированных и неэтерифицированных жирных кислот транспортируемых в крови можно повысить, осуществляя указанный способ. Неожиданно оказалось, что задачу можно решить, усиливая липолиз способом по настоящему изобретению.
Сольватация и адгезия жирных кислот в водной среде
Растворимость карбоновых кислот в воде минимальна, если длина углеродной цепочки превышает 4 атома углерода и в отсутствие гидроксильных (-OH) групп, карбоксильных (-COOH) групп или других полярных гидрофильных или заряженных групп и/или при введении алкильных заместителей или других липофильных групп.
Растворимость можно повысить, используя детергенты, которые проникают в мицеллы жирных кислот, снижая тем самым их стабильность, уменьшая их размеры и увеличивая число свободных молекул жирных кислот в водной среде. Как свободные жирные кислоты, так и мицеллы имеют тенденцию связываться с липотропными структурами. Среди них можно указать углерод, металлы, керамику, природные и синтетические полимеры. Кроме того, органические структуры содержат липофильные участки, причем некоторые из них сконструированы специально для того, чтобы связывать жирные кислоты, которые образуют мембранные или липидные транспортные белки. Пространственные сайты связывания представлены главным образом гидрофобными аминокислотами.
В крови липиды электростатически связаны со специализированными транспортными белками. Жирные кислоты, главным образом, переносятся альбумином. Связывание жирных кислот с молекулами альбумина основано также на силах электростатического взаимодействия, которые локализованы в гидрофобных карманах. Энергия связывания таких карманов меняется, однако pKa для всех из них существенно выше, чем CMC жирных кислот. Поэтому жирные кислоты остаются в окружающей среде даже после полного удаления свободных жирных кислот. Было обнаружено, что отделение жирных кислот от альбумина является почти полным, если используют органические растворители для их высвобождения, из-за их лучшего растворения в органических растворителях. Однако такие растворители изменяют структуру белков, делая их непригодными для дальнейшего процесса или использования в живом организме. Для использования альбумина для медицинских или других целей необходимо уменьшить содержание в них жирных кислот, не изменяя при этом структуры и функциональности альбумина. Указанную задачу можно решить путем активирования частиц углерода, которые обладают более высокой связывающей способностью с жирными кислотами, чем с альбумином. Однако указанный процесс нуждается в дополнительной стадии для очистки альбумина. Поэтому вплоть до настоящего времени не существовало способа, который позволил бы быстро освободить и солюбилизировать все содержащиеся в молекулах альбумина жирные кислоты в водной среде, который не изменяет ультраструктуру и функции молекул альбумина.
Карбоновые кислоты также переносятся в пузырьках фосфолипидов. Электростатические взаимодействия между углеводородной цепочкой карбоновых кислот и цепочкой фосфолипидов удерживают карбоновые кислоты от диффузии в окружающую водную среду. С необходимыми поправками это применимо также к другим органическим растворам, биомассам или органическим сточным водам. В органических растворах, предназначенных для дальнейшей модификации, очистки или использования, где желательно не использовать органический растворитель, желателен альтернативный биосовместимый способ. До сих пор такой способ отсутствует.
Неожиданно оказалось, что этой цели можно достичь путем использования по меньшей мере одного солюбилизирующего соединения, как раскрыто в описании, включающего по меньшей мере один амидинофрагмент и/или по меньшей мере один гуанидинофрагмент, и особенно солюбилизирующего соединения общей формулы (I), (II) и (III) и наиболее предпочтительно аргинина и его производных.
Подлежащие удалению карбоновые кислоты обычно содержатся в водной среде или в водных растворах, таких как кровь или плазма крови, или в водных эмульсиях, таких как молоко, или в органической среде, такой как топливо, газ, биодизельное топливо, газолин, бензин и тому подобные, или в маслах, таких как растительные масла, такие как льняное масло, ореховое масло, олифа, масло энотеры, масло подсолнечника, масло семян подсолнечника, соевое масло, рапсовое масло, оливковое масло, оливковое масло первого отжима, пальмовое масло, масло пальмовых косточек, арахисовое масло, хлопковое масло, кокосовое масло, кукурузное масло, масло виноградных косточек, масло фундука, рисовое масло, сафлоровое масло, кунжутное масло, также как животные масла, такие как рыбий жир, или содержащиеся в жирах, таких как сливочное масло, олеомаргарин или маргарин.
В случае, если карбоновые кислоты находятся в воде, водной среде, водной эмульсии или в водной суспензии, по меньшей мере одно солюбилизирующее соединение можно непосредственно добавить к водной среде, эмульсии или суспензии, или по меньшей мере одно солюбилизирующее соединение можно растворить в воде, и полученный водный раствор можно добавить к водной среде, эмульсии или суспензии, содержащим карбоновые кислоты. После такого добавления происходит образование наноэмульсий и/или микроэмульсий.
В случае, если карбоновые кислоты находятся в органической среде или липофильной органической среде, солюбилизирующее соединение растворяют в воде, и полученный раствор солюбилизирующего соединения в воде добавляют к органической среде. Образуется двухфазная смесь, и карбоновые кислоты переходят в водную фазу. Считают, что образуется комплекс или агрегат одной молекулы карбоновой кислоты с одной молекулой солюбилизирующего соединения или их димер или тример, что делает карбоновую кислоту растворимой в воде. Таким образом, предпочтительно, перемешивать или встряхивать двухфазные смеси, состоящие из органического и водного слоя, для обеспечения интенсивного перемешивания указанных двух слоев. Карбоновые кислоты, содержащиеся в водной фазе, можно удалить, используя фазовое разделение. При желании, способ экстрагирования можно повторить. В случае если карбоновые кислоты находятся в масле или жире, солюбилизирующее соединение растворяют в воде и полученный раствор солюбилизирующего соединения в воде добавляют к маслу или жиру. При желании, органический растворитель можно добавлять в масло или жир для уменьшения вязкости масла или жира, чтобы обеспечить лучшую перемешиваемость масла или жира. Смесь масла или жира и водного раствора солюбилизирующего соединения перемешивают. Карбоновые кислоты переходят в водную фазу, и водную фазу можно удалить, используя декантирование или фазовое разделение. При желании, процесс экстрагирования можно повторять несколько раз.
Таким образом, настоящее изобретение также относится к водной микроэмульсии и/или водной наноэмульсии, содержащей по меньшей мере одно солюбилизирующее соединение и по меньшей мере одну карбоновую кислоту в микроэмульгированной или в наноэмульгированной форме.
Если солюбилизирующее соединение используют в избытке порядка 1,2-2,8, предпочтительно 1,5-2,5 и более предпочтительно в избытке 1,7-2,3 молярных эквивалентов, оказывается возможным удалить более чем 90% карбоновых кислот за одну стадию экстрагирования. Если стадию экстрагирования повторяют дважды, можно удалить вплоть до 99% карбоновых кислот.
Карбоновые кислоты, которые можно удалить, представляют собой карбоновые кислоты, содержащие более чем 5 атомов углерода, более предпочтительно более чем 7 атомов углерода, и особенно предпочтительно более чем 9 атомов углерода. Предпочтительно, чтобы указанные карбоновые кислоты представляли собой жирные кислоты, как раскрыто в описании, хотя способом настоящего изобретения можно также удалять другие липофильные соединения, содержащие карбоксильную группу или группу карбоновой кислоты, такие как лекарственные средства или токсины. Одной из карбоновых кислот, которая однозначно исключена из настоящего изобретения, является напроксен. Кроме того, целью настоящего изобретения не является создание способов и соединений или устройств для солюбилизации лекарственных препаратов с целью получения галеновых композиций. Особенно предпочтительны удаление и солюбилизация нафтеновых кислот из масел, бензина, газа и топлива. Из карбоновых кислот наиболее предпочтительны такие карбоновые кислоты, которые содержат двойные и/или тройные связи, такие как ненасыщенные и полиненасыщенные жирные кислоты. Еще более предпочтительны физиологические карбоновые кислоты, и особенно такие физиологические карбоновые кислоты, которые находятся в организмах людей. Для промышленных целей ненасыщенные жирные кислоты предпочтительно удаляют и солюбилизируют из исходных материалов, таких как масла и жиры, тогда как для медицинских целей указанные насыщенные жирные кислоты предпочтительно удаляют из крови пациента. Кроме того, предпочтительны такие карбоновые кислоты, которые встречаются в маслах и жирах вышеуказанных источников, особенно животных, таких как рыбы, в кукурузе, оливках, зерне, сельскохозяйственных продуктах, рисе, сое и тому подобных. В случае, если карбоновые кислоты, которые необходимо удалить из органических сред, таких как жиры, воски, масла, топливо, бензин и тому подобные, находятся в этерифицированной форме (т.е. связаны в эфирах), стадию омыления можно осуществить до осуществления стадии удаления и солюбилизации по настоящему изобретению. Такое омыление предпочтительно осуществляют в смеси растворителей, состоящей из воды и по меньшей мере второго растворителя, смешивающегося с водой. Другими предпочтительными карбоновыми кислотами являются перфторкарбоновые кислоты, такие как перфторпропионовая кислота, перфтороктановая кислота (PFOA), перфтордекановая кислота, перфтордодекановая кислота, перфторгексадекановая кислота, также как другие перфторкарбоновые кислоты и профириновая кислота.
Настоящее изобретение также относится к солюбилизации, соответственно к удалению, ароматических карбоновых кислот, принадлежащих к вышеуказанным целевым группам, таких как бензойная кислота, 4-аминобензойная кислота, антраниловая кислота, бензиловая кислота, коричная кислота, салициловая кислота, фенилуксусная кислота, 4-метоксифенилуксусная кислота, галловая кислота, фталевая кислота, терефталевая кислота, абиетиновая кислота, бицинхониновая кислота, хинная кислота, хоризмовая кислота, клавулановая кислота, фузаровая кислота, фузидовая кислота, мочевая кислота, гиппуровая кислота, иботеновая кислота, индол-3-уксусная кислота, миндальная кислота, стифниновая кислота, усниновая кислота, абсцизовая кислота, троповая кислота, бензохинонтетракарбоновая кислота, босвеллевая кислота, кофеиновая кислота, карминовая кислота, хенодеоксихолевая кислота, кумариновая кислота, кромоглициновая кислота, цинарин, меклофенамовая кислота, 2,4-дихлорфеноксиуксусная кислота, домоевая кислота, пипемидовая кислота, феруловая кислота, 5-гидроксиферуловая кислота, изофталевая кислота, мефенамовая кислота, мета-хлорпероксибензойная кислота, пероксибензойная кислота, протокатеховая кислота, налидиксовая кислота, синаповая кислота, сукрононовая кислота.
Особенно предпочтительны удаление и солюбилизация из крови карбоновых кислот, которые приводят к различным заболеваниям, вызываемым и/или связанным с повышенным и/или опасным уровнем таких карбоновых кислот, и особенно жирных кислот.
Карбоновые кислоты являются предпочтительно липофильными и предпочтительно имеют коэффициент разделения н-октанол-вода (также известный как log KOW или коэффициент разделения октанол-вода) >2,0, предпочтительно >3,0 и более предпочтительно >4,0. (Например: log KOW уксусной кислоты равен -0,17, масляной кислоты равен 0,79, октановой кислоы равен 3,05 и декановой кислоты равен 4,09).
Предпочтительно также, чтобы подлежащие удалению карбоновые кислоты имели значение pKs>4,85, предпочтительно >4,87. (например: уксусная кислота имеет pKs 4,76, масляная кислота 4,82, пентановая кислота 4,84 и октановая кислота 4,89).
Таким образом в настоящем изобретении предложен способ выделения карбоновых кислот, которые вовсе не растворяются в воде или плохо растворяются в воде, и которые можно солюбилизировать в воде с помощью раскрытых в изобретении солюбилизирующих соединений, предпочтительно в форме нано- или микроэмульсий. После перехода в водную фазу жирные кислоты можно удалить различными раскрытыми в описании способами.
Таким образом, настоящее изобретение относится к использованию солюбилизирующих соединений для солюбилизации карбоновых кислот в водных или органических средах, где указанное солюбилизирующее соединение содержит по меньшей мере одну амидиногруппу и/или по меньшей мере одну гуанидиногруппу, и где указанное соединение имеет коэффициент разделения н-октанол-вода KOW <6,30.
Термин "солюбилизация карбоновых кислот в водной или органической среде" следует понимать следующим образом: подлежащие солюбилизации карбоновые кислоты содержатся в органической среде, такой как масла или топливо, или в водной среде, такой как кровь или молоко, и солюбилизированы за счет использования солюбилизирующего соединения в водной фазе.
Таким образом, можно утверждать, что настоящее изобретение относится к использованию солюбилизирующих соединений для солюбилизации карбоновых кислот из водной или органической среды в водную фазу, где указанное солюбилизирующее соединение содержит по меньшей мере одну амидиногруппу и/или по меньшей мере одну гуанидиногруппу, и где указанное соединение имеет коэффициент разделения н-октанол-вода Kow<6,30.
Кроме того, настоящее изобретение относится к использованию солюбилизирующих соединений для солюбилизации липофильных карбоновых кислот в водной среде, где указанные солюбилизирующие соединения содержат по меньшей мере одну амидиногруппу и/или по меньшей мере одну гуанидиногруппу, и где указанные соединения имеют коэффициент разделения н-октанол-вода Kow <6,30.
В том случае, если карбоновые кислоты содержатся в водной фазе, такой как кровь, только очень маленькие количества свободных карбоновых кислот присутствуют в крови, так как указанные карбоновые кислоты, и особенно жирные кислоты, плохо растворяются в воде. Большая часть подлежащих удалению из крови карбоновых кислот связана с другими соединениями, такими как альбумин, и уже не являются свободными карбоновыми кислотами. Однако существует равновесие между очень небольшим количеством свободных карбоновых кислот в крови и тем или иным способом связанных или депонированных карбоновых кислот, которые рассматривают как больше не свободные кислоты. Если теперь, используя способ по настоящему изобретению, осуществить образование комплексов карбоновых кислот с солюбилизирующим соединением, указанные свободные карбоновые кислоты нарушат равновесие и связанные с альбумином карбоновые кислоты поступят в кровь, причем затем их снова можно удалить, используя способ по настоящему изобретению, так что в итоге можно удалить почти все карбоновые кислоты, содержавшиеся в крови в свободной или в связанной форме. Для такого непрерывного процесса удаления из крови карбоновых кислот, и особенно жирных кислот, наиболее подходит способ диализа.
Солюбилизирующие соединения, раскрытые в настоящем описании, включают по меньшей мере одну амидиногруппу или по меньшей мере одну гуанидиногруппу, или по меньшей мере одну амидиногруппу и по меньшей мере одну гуанидиногруппу. Если амидиногруппа является незамещенной, ее можно представить следующей формулой H2N-C(NH)-. Но существует возможность того, что все три атома водорода заменены заместителями R, R' и R", что представлено следующей общей формулой (R)(R')N-C(NR")-. Предпочтительно, чтобы два из трех атомов водорода были заменены на заместители, что представлено следующей общей формулой: (R')NH-C(NR")- или (R)(R')N-C(NH)-. Предпочтительны амидиногруппы, содержащие по меньшей мере один водород. Если гуанидиногруппа является незамещенной, ее можно представить следующей формулой: H2N-C(NH)-NH-. Но возможно также, что все четыре атома водорода заменены заместителями R, R', R" и R'", как представлено следующей формулой (R)(R')N-C(NR")-N(R"")-. Предпочтительно, чтобы три из четырех атомов водорода были заменены заместителями, как представлено следующими формулами: (R')NH-C(NR")-N(R"")- или (R)(R')N-C(NH)-N(R"")- или (R)(R')N-C(NR")-NH-. Таким образом, предпочтительны гуанидиногруппы с по меньшей мере одним атомом водорода и, предпочтительно, с двумя атомами водорода.
Солюбилизирующее соединение включает или содержит по меньшей мере одну амидиногруппу и/или по меньшей мере одну гуанидиногруппу, причем предпочтительны гуанидиногруппы. Кроме того, солюбилизирующее соединение включает или содержит предпочтительно не более чем 15 атомов углерода, более предпочтительно не более чем 14, более предпочтительно не более чем 13, более предпочтительно не более чем 12, более предпочтительно не более чем 11, более предпочтительно не более чем 10, более предпочтительно не более чем 9, и более предпочтительно не более чем 8 атомов углерода, и наиболее предпочтительно, чтобы солюбилизирующее соединение было производным аргинина. В случае полимерных или олигомерных солюбилизирующих соединений предпочтительно, чтобы на амидинофрагмент или на гуанидинофрагмент приходилось не более чем 10 атомов углерода, и более предпочтительно, чтобы присутствовало не более чем 8 атомов углерода.
Кроме того, солюбилизирующее соединение является гидрофильным и может предпочтительно содержать один или более из следующих заместителей:
-NH2, -OH, -PO3H2, -PO3H-, -PO32-, -OPO3H2, -OPO3H-, -OPO32-, -COOH, -COO-, -CO-NH2, -NH3+, -NH-CO-NH2, -N(CH3)3+, -N(C2H5)3+, -N(C3H7)3+, -NH(CH3)2+, -NH(C2H5)2+, -NH(C3H7)2+, -NHCH3, -NHC2H5, -NHC3H7, -NH2CH3+, -NH2C2H5+, -NH2C3H7+, -SO3H, -SO3-, -SO2NH2, -CO-COOH, -O-CO-NH2, -C(NH)-NH2, -NH-C(NH)-NH2, -NH-CS-NH2, -NH-COOH.
Предпочтительны также солюбилизирующие соединения, которые представляют собой производные аргинина или которые представляют собой дипептиды или трипептиды или полипептиды, содержащие аминокислоту аргинин или производное аргинина.
Возможно также, что амидиногруппа или гуанидиногруппа представляют собой часть гетероциклической системы, такой как в имидазоле, гистидине, клотианидине или 4-(4,5-дигидро-1H-имидазол-2-иламино)масляной кислоте.
Солюбилизирующие соединения представляют собой гидрофилы и характеризуются коэффициентом распределения н-октанол-вода (также известным как KOW или коэффициент распределения октанол-вода) порядка KOW<6,30 (log KOW<0,80), предпочтительно KOW<1,80 (log KOW<0,26), более предпочтительно KOW<0,63 (log KOW<-0,20) и наиболее предпочтительно KOW<0,40 (log KOW<-0,40).
Предпочтительными солюбилизирующими соединениями являются:
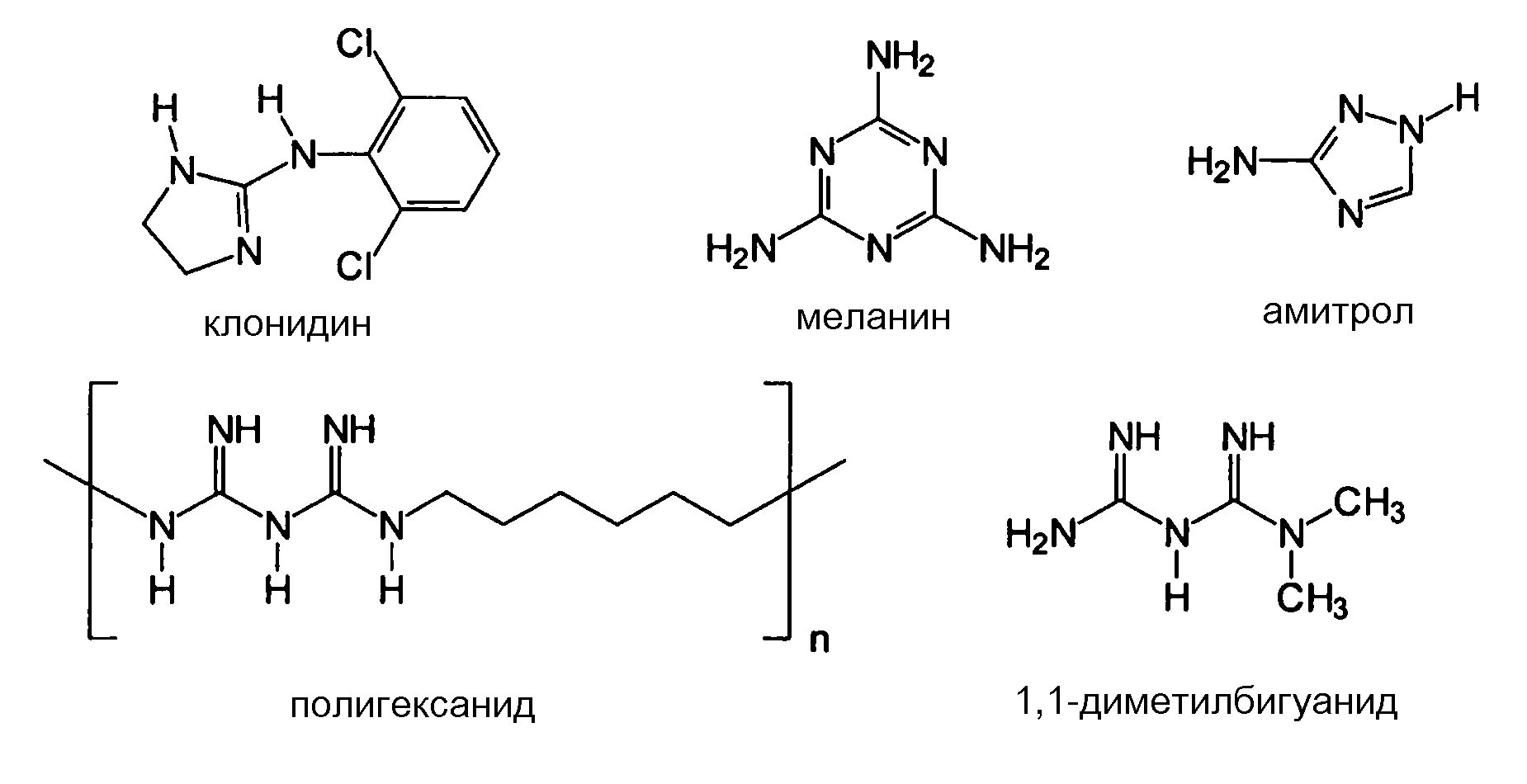
L-2-амино-3-гуанидинопропионовая кислота, L-аргинин, L-NIL, H-гомоарг-OH, гистидин, Νω-нитро-L-аргинин, Ν-ω-гидрокси-L-нораргинин, метиловый эфир D-аргинина, Nω-монометил-L-аргинин, NG,NG-диметиларгинин, D-(+)-октопин, аргининоянтарная кислота, свободное основание L-канаванина, креатин, гуанидиноуксусная кислота, 3-гуанидинопропионовая кислота, 4-гуанидиномасляная кислота, 4-(4,5-дигидро-1H-имидазол-2-иламино)масляная кислота, (S)-(-)-2-гуанидиноглутаровая кислота, 6-гуанидиногексановая кислота, гуанидино, сульфгуанидин, агматинсульфат, 4-гуанидинобензойная кислота, 1,3-ди-o-толилгуанидин, клотианидин, L-орнитин, N-гуанилмочевина, циметидин, 1-(o-толил)бигуанид, хлоргексидин, 1,1-диметилбигуанид, прогуанил, полигексанид, поли-L-аргинин (70000-150000 MW (МВ)), диминазен, меланин, 4-(4,6-диамино-2,2-диметил-2H-[1,3,5]триазин-1-ил, имидазол, метилимидазол, Tyr-Arg (киотрофин), Arg-Gln, Gly-Arg, Arg-Phe, Arg-Glu, Lys-Arg ацетат, His-Arg, Arg-Gly-Asp (RGD), Arg-Phe-Ala, Thr-Lys-Pro-Arg (Tuftsin), Gly-Gly-Tyr-Arg, Gly-His, аргатробан, L-NMMA (L-NG-монометиларгинин), L-NAME (L-нитро-аргинин-метилэфир), цитрат L-гидроксиаргинина, диметиларгинин (ADMA), D-гомоаргинин, нораргинин, L-канаванин (2-амино-4-(гуанидиноокси)масляная кислота), 4-гуанидино-фенилаланин, 3-гуанидинофенилаланин, O-α-гиппурил-L-аргининовая кислота, H-Arg-AMC (L-аргинин-7-амидо-4-метилкумарин), L-TAME (P-тозил-L-аргининметилэфир), дифенилацетил-D-Arg-4-гидроксибензиламид, агматин (аргамин; 1-амино-4-гуанидинобутансульфат), L-аргинин-этилэфир, L-аргининметилэфир, гуанидин, гуанидинацетат, гуанидинкарбонат, гуанидиннитрат, гуанидинтиоцианат, гуанилмочевина, фосфат гуанилмочевины, динитрамид гуанилмочевины, 2-гуанидиноацетальдегид-диэтилацеталь, дициандиамид, 2-гуанидинобензимидазол, S-((2-гуанидино-4-триазолил)метил)изотиомочевина, гуанидинобутилальдегид, 4-гуанидинобензойная кислота, леонурин (4-гуанидино-н-бутилсирингат), амбазон ([4-(2-(диаминометилиден)гидразинил)фенил]иминотиомочевина), амилорид (3,5-диамино-N-карбамимидоил-6-хлорпиразин-2-карбамид), аминогуанидин, амитрол (3-амино-1,2,4-триазол), нитрогуанидин, аргининосукцинат, бареттин ((2S,5Z)-цикло-[(6-бром-8-ентриптофан)аргинин]), лизин, хлоргексидин (1,1'-гексаметиленбис[5-(4-хлорфенил)бигуанид]), циметидин (2-циан-1-метил-3-[2-(5-метилимидазол-4-илметилсульфанил)этил]гуанидин, клонидин (2-[(2,6-дихлорфенил)имино]имидазолидин), клотианидин ((E)-1-(2-хлор-1,3-тиазол-5-илметил)-3-метил-2-нитрогуанидин), 2,4-диаминопиридин, Ν,Ν'-ди-o-толилгуанидин, гуанетидин, креатин, креатинин, киотрофин (L-тирозил-L-аргинин), лугдунам, (N-(4-цианофенил)-N-(2,3-метилендиоксибензил)гуанидинуксусная кислота, метформин (1,1-диметилбигуанид), октопин, (Na-(l-карбоксиэтил)аргинин), полигексанид (полигексаметиленбигуанид (PHMB)), прогуанил (1-(4-хлорфенил)-5-изопропилбигуанид), сульфагуанидин (4-амино-N-(диаминометилен)бензолсульфонамид), тетразен (4-амидино-1-(нитрозаминоамидино)-1-тетразена), L-аргинин-4-метокси-β-нафтиламид, L-аргинин-ß-нафтиламид, L-аргинин-гидроксамат, L-аргинин-p-нитроанилид, N-α-бензоил-DL-аргинин, Nω-нитро-L-аргинин, робенидин, (1,3-бис[(4-хлорбензилиден)амино]гуанидин, 1-(2,2-диэтоксиэтил)гуанидин, нитрат 1-(P-толил)гуанидин.
Настоящее изобретение можно эффективно использовать в широком интервале отношений концентраций солюбилизирующего соединения и подлежащих солюбилизации жирных кислот. Часто содержание жирной кислоты в растворе точно неизвестно. Поэтому оказывается необходимым определить количество солюбилизирующего соединения, которое необходимо добавить. Солюбилизацию карбоновых кислот по настоящему изобретению, и особенно жирных кислот, можно обеспечить, если молярное отношение солюбилизирующего соединения к жирным кислотам (свободным и связанным) находится в интервале значений от 1:1000 до 1000:1. Предпочтителен интервал от 1:100 до 100:1. Более предпочтителен интервал от 1:10 до 10:1. Другим предпочтительным интервалом является интервал от 1:2 до 2:1. Наиболее предпочтительно отношение в интервале от 1:1 до 2:1. Предпочтительно использовать солюбилизирующее соединение в молярном избытке 3%, или 5%, или 7%, или 8%, или 10%, или 12%, или 15%, или 20%, или 25%, или 30%, или 35%, или 40%, или 45%, или 50%, или 55%, или 60%, или 70%, или 80%, или 90%, или 100%, или 120%, или 140%, или 160%, или 180%, или 200%. Кроме того, предпочтительно, чтобы молярное отношение жирных кислот к солюбилизирующему соединению составляло от 1:1 до 1:200. Более предпочтительно молярное отношение жирных кислот к солюбилизирующему соединению в интервале от 1:1 до 1:100, более предпочтительно от 1:1 до 1:50, еще более предпочтительно 1:1 до 1:30, еще более предпочтительно от 1:1 до 1:25, еще более предпочтительно от 1:1 до 1:20, еще более предпочтительно от 1:1 до 1:15, еще более предпочтительно от 1:1 до 1:10, еще более предпочтительно от 1:1 до 1:9, еще более предпочтительно от 1:1 до 1:8, еще более предпочтительно от 1:1 до 1:7, еще более предпочтительно от 1:1 до 1:6, еще более предпочтительно от 1:1 до 1:5, еще более предпочтительно от 1:1 до 1:4, еще более предпочтительно от 1:1 до 1:3, еще более предпочтительно от 1:1 до 1:2, еще более предпочтительно от 1:1 до 1:1,8, еще более предпочтительно от 1:1 до 1:1,6, еще более предпочтительно от 1:1 до 1:1,5, еще более предпочтительно от 1:1 до 1:1,4, также предпочтительно отношение от 1:1 до 1:1,3, также предпочтительно отношение от 1:1 до 1:1,2, также предпочтительно отношение от 1:1 до 1:1,1, также предпочтительно отношение от 1:1 до 1:1,05, также предпочтительно отношение от 1:1,2 до 1:2,8, также предпочтительно отношение от 1:1,4 до 1:2,6, также предпочтительно отношение от 1:1,6 до 1:2,4, также предпочтительно отношение от 1:1,8 до 1:2,2, более предпочтительно отношение от 1:1,9 до 1:2,1 и наиболее предпочтительно молярное отношение жирных кислот к солюбилизирующему соединению в интервале 1,0:2,0. Указанные молярные отношения являются предпочтительными для солюбилизирующих соединений с одной амидиногруппой или одной гуанидиногруппой. Если солюбилизирующее соединение содержит две амидиногруппы или две гуанидиногруппы или одну амидиногруппу и одну гуанидиногруппу, используют предпочтительно только половину количества солюбилизирующего соединения. Так, в таком случае молярное отношение жирных кислот к солюбилизирующему соединению составляет от 1:0,5 до 1:25, предпочтительно от 1:0,6 до 1:1,4, также предпочтительно от 1:0,7 до 1:1,3, также предпочтительно от 1:0,8 до 1:1,2, также предпочтительно от 1:0,9 до 1:1,1, более предпочтительно от 1:0,95 до 1:1,05 и наиболее предпочтительно молярное отношение жирных кислот к солюбилизирующему соединению в интервале значений 1,0:1,0.
Солюбилизацию предпочтительно осуществляют при значениях pH>7,0 и более предпочтительно в интервале значений pH от 7,0 до 9,0. Однако в зависимости от среды, из которой необходимо удалить карбоновые кислоты, можно использовать значения pH вплоть до 14, причем предпочтительно использовать значения pH в интервале между 7,0 и 8,0, если карбоновые кислоты необходимо удалить из крови. Однако, если не удается достичь полной солюбилизации, можно добавить более эффективное солюбилизирующее соединение, или можно повысить значение pH, или можно выделить водный слой и повторить процесс экстрагирования, или использовать комбинацию указанных трех возможностей.
Некоторые из солюбилизирующих соединений по настоящему изобретению можно представить следующей общей формулой (I) и формулой (II):

где
R', R", R'" и R"" каждый независимо друг от друга представляет собой -H, -OH, -CH=CH2, -CH2-CH=CH2, -C(CH3)=CH2, -CH=CH-CH3> -C2H4-CH=CH2, -CH3, -C2H5, -C3H7, -CH(CH3)2, -C4H9, -CH2-CH(CH3)2, -CH(CH3)-C2H5, -C(CH3)3, -C5H11, -CH(CH3)-C3H7, -CH2-CH(CH3)-C2H5, -CH(CH3)-CH(CH3)2, -C(CH3)2-C2H5, -CH2-C(CH3)3, -CH(C2H5)2, -C2H4-CH(CH3)2, -C6H13, -C7H15, цикло-C3H5, цикло-C4H7, цикло-C5H9, цикло-C6H11, -PO3H2, -PO3H-, -PO32-, -NO2, -C≡CH, -C≡C-CH3, -CH2-C≡CH, -C2H4-C≡CH, -CH2-C≡C-CH3,
или R' и R" вместе образуют остаток -CH2-CH2-, -CO-CH2-, -CH2-CO-, -CH=CH-, -CO-CH=CH-, -CH=CH-CO-, -CO-CH2-CH2-, -CH2-CH2-CO-, -CH2-CO-CH2- или -CH2-CH2-CH2-;
X представляет собой -NH-, -NR""-, -O-, -S- или -CH2- или замещенный атом углерода; и
L представляет собой гидрофильный заместитель, выбранный из группы, включающей или состоящей из -NH2, -OH, -PO3H2, -PO3H-, -PO32-, -OPO3H2, -OPO3H-, -OPO32-, -COOH, -COO-, -CO-NH2, -NH3+, -NH-CO-NH2, -N(CH3)3+, -N(C2H5)3+, -N(C3H7)3+, -NH(CH3)2+, -NH(C2H5)2+, -NH(C3H7)2+, -NHCH3, -NHC2H5, -NHC3H7, -NH2CH3+, -NH2C2H5+, -NH2C3H7+, -SO3H, -SO3-, -SO2NH2, -CO-COOH, -O-CO-NH2, -C(NH)-NH2, -NH-C(NH)-NH2, -NH-CS-NH2, -NH-COOH, или

или
L представляет собой C1-C8 неразветвленную или разветвленную и насыщенную или ненасыщенную углеродную цепочку содержащую по меньшей мере один заместитель, выбранный из группы, включающей или состоящей из -NH2, -OH, -PO3H2, -PO3H-, -PO32-, -OPO3H2, -OPO3H-, -OPO32-, -COOH, -COO-, -CO-NH2, -NH3+, -NH-CO-NH2) -N(CH3)3+, -N(C2H5)3+, -N(C3H7)3+, -NH(CH3)2+, -NH(C2H5)2+, -NH(C3H7)2+, -NHCH3, -NHC2H5, -NHC3H7, -NH2CH3+, -NH2C2H5+, -NH2C3H7+, -SO3H, -SO3-, -SO2NH2, -CO-COOH, -O-CO-NH2, -C(NH)-NH2, -NH-C(NH)-NH2, -NH-CS-NH2, -NH-COOH, или
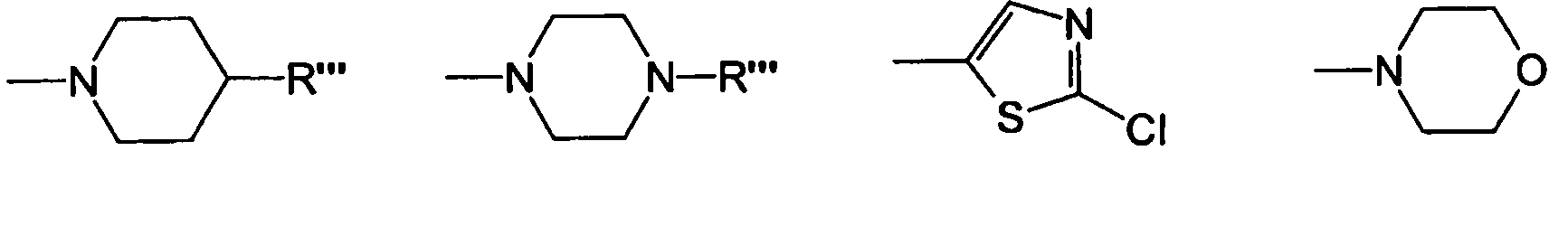
или
L представляет собой бензольное кольцо и, предпочтительно, паразамещенное бензольное кольцо, с по меньшей мере одним заместителем, выбранным из группы, включающей или состоящей из -NH2, -OH, -PO3H2, -PO3H-, -PO32-, -OPO3H2, -OPO3H-, -OPO32-, -COOH, -COO-, -CO-NH2, -NH3+, -NH-CO-NH2, -N(CH3)3+, -N(C2H5)3+, -N(C3H7)3+, -NH(CH3)2+, -NH(C2H5)2+, -NH(C3H7)2+, -NHCH3, -NHC2H5, -NHC3H7, -NH2CH3+, -NH2C2H5+, -NH2C3H7+, -SO3H, -SO3-, -SO2NH2, -CO-COOH, -O-CO-NH2, -C(NH)-NH2, -NH-C(NH)-NH2, -NH-CS-NH2, -NH-COOH, или

Однако такие соединения не являются предпочтительными и их можно исключить из рассматриваемой заявки, где X представляет собой -O- или -S- и L представляет собой -NH2, -OH, -OPO3H2, -OPO3H-, -OPO32-, -NH3+, -NH-CO-NH2, -N(CH3)3+, -N(C2H5)3+, -N(C3H7)3+, -NH(CH3)2+, -NH(C2H5)2+, -NH(C3H7)2+, -NHCH3, -NHC2H5, -NHC3H7, -NH2CH3+, -NH2C2H5+, -NH2C3H7+, -SO3H, -SO3-, -SO2NH2, -CO-COOH, -O-CO-NH2, -NH-C(NH)-NH2, -NH-CS-NH2, -NH-COOH,

Также исключаются соединения, в которых X представляет собой -NH- или -NR""- и L представляет собой -OPO3H2, -OPO3H-, -OPO32-, -NH-CO-NH2, -CO-COOH, -O-CO-NH2, -NH-C(NH)-NH2, -NH-CS-NH2 или -NH-COOH.
Указанный остаток L может быть далее замещен заместителями, определенными как R1-R13. Указанный остаток L состоит предпочтительно из 1-10 атомов углерода, более предпочтительно из 1-6 атомов углерода и наиболее предпочтительно из 2-4 атомов углерода. Атомы углерода любых заместителей, таких как -COOH, присутствующих на указанном остатке L, включены в вышеуказанное число атомов углерода. Таким образом, указанный остаток L содержит неразветвленную или разветвленную цепочку атомов углерода или фенильное кольцо, которое может быть замещено одним или более из насыщенных или ненасыщенных и неразветвленных или разветвленных алкильных заместителей и/или заместителей, определенных как R1-R13.
Предпочтительно, чтобы углеродная цепочка L была в интервале C1-C7, более предпочтительно в интервале C1-C6 и наиболее предпочтительно в интервале C1-C5.
Соединения общей формулы (I) или (II), которые можно использовать для солюбилизации жирных кислот в водной среде или в воде представлены следующими формулами (I) или (II):

где
каждый R, R", R'" и R"" независимо друг от друга представляют собой -H, -OH, -CH=CH2, -CH2-CH=CH2, -C(CH3)=CH2, -CH=CH-CH3, -C2H4-CH=CH2, -CH3, -C2H5, -C3H7, -CH(CH3)2, -C4H9, -CH2-CH(CH3)2, -СΗ(СΗ3)-С2Η5, -C(CH3)3, -C5H11, -CH(CH3)-C3H7, -CH2-CH(CH3)-C2H5, -CH(CH3)-CH(CH3)2, -C(CH3)2-C2H5, -CH2-C(CH3)3, -CH(C2H5)2, -C2H4-CH(CH3)2, -C6H13, -C7H15, цикло-C3H5, цикло-C4H7, цикло-C5H9, цикло-C6H11, -PO3H2, -PO3H-, -PO32-, -NO2, -C≡CH, -C≡C-CH3, -CH2-C≡CH, -C2H4-C≡CH, -CH2-C≡C-CH3,
или R' и R" вместе образуют указанный остаток -CH2-CH2-, -CH=CH- или -CH2-CH2-CH2-;
X представляет собой -NH-, -NR""-, -O-, -S- или -CH2- или замещенный атом углерода; и
L представляет собой -CR1R2R3, -CR4R5-CR1R2R3, -CR6R7-CR4R5-CR1R2R3, -CR8R9-CR6R7-CR4R5-CR1R2R3, -CR10R11-CR8R9-CR6R7-CR4R5-CR1R2R3, -CR12R13-C10R11-CR8R9-CR6R7-CR4R5-CR1R2R3;

R*, R#, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 независимо друг от друга представляют собой следующие заместители:
-NH2, -OH, -PO3H2, -PO3H-, -PO32-, -OPO3H2, -OPO3H-, -OPO32-, -COOH, -COO-, -CO-NH2, -NH3+, -NH-CO-NH2, -N(CH3)3+, -N(C2H5)3+, -N(C3H7)3+, -NH(CH3)2+, -NH(C2H5)2+, -NH(C3H7)2+, -NHCH3, -NHC2H5, -NHC3H7, -NH2CH3+, -NH2C2H5+, -NH2C3H7+, -SO3H, -SO3-, -SO2NH2, -CO-COOH, -O-CO-NH2, -C(NH)-NH2, -NH-C(NH)-NH2, -NH-CS-NH2, -NH-COOH, -H, -OCH3, -OC2H5, -OC3H7, -O-цикло-C3H5, -OCH(CH3)2, -P(O)(OCH3)2, -Si(CH3)2(C(CH3)3), -OC(CH3)3, -OC4H9, -OPh, -OCH2-Ph, -OCPh3, -SH, -SCH3, -SC2H5, -SC3H7, -S-цикло-C3H5, -SCH(CH3)2, -SC(CH3)3, -NO2, -F, -Cl, -Br, -I, -P(O)(OC2H5)2, -P(O)(OCH(CH3)2)2, -C(OH)[P(O)(OH)2]2, -Si(C2H5)3, -Si(CH3)3, -N3, -CN, -OCN, -NCO, -SCN, -NCS, -CHO, -COCH3, -COC2H5, -COC3H7, -CO-цикло-C3H5, -COCH(CH3)2, -COC(CH3)3, -COCN, -COOCH3, -COOC2H5, -COOC3H7, -COO-цикло-C3H5, -COOCH(CH3)2, -COOC(CH3)3, -OOC-CH3, -OOC-C2H5, -OOC-C3H7, -OOC-цикло-C3H5, -OOC-CH(CH3)2, -OOC-C(CH3)3, -CONHCH3, -CONHC2H5, -CONHC3H7, -CONH-цикло-C3H5, -CONH[CH(CH3)2], -CONH[C(CH3)3], -CON(CH3)2, -CON(C2H5)2, -CON(C3H7)2, -CON(цикло-C3H5)2, -CON[CH(CH3)2]2, -CON[C(CH3)3]2, -NHCOCH3, -NHCOC2H5, -NHCOC3H7, -NHCO-цикло-C3H5, -NHCO-CH(CH3)2, -NHCO-C(CH3)3, -NHCO-OCH3, -NHCO-OC2H5, -NHCO-OC3H7, -NHCO-O-цикло-C3H5, -NHCO-OCH(CH3)2, -NHCO-OC(CH3)3, -NH-цикло-C3H5, -NHCH(CH3)2, -NHC(CH3)3, -N(CH3)2, -N(C2H5)2, -N(C3H7)2, -N(цикло-C3H5)2, -N[CH(CH3)2]2, -N[C(CH3)3]2, -SOCH3, -SOC2H5, -SOC3H7, -SO-цикло-C3H5, -SOCH(CH3)2, -SOC(CH3)3, -SO2CH3, -SO2C2H5, -SO2C3H7, -SO2-цикло-C3H5, -SO2CH(CH3)2, -SO2C(CH3)3, -SO3CH3, -SO3C2H5, -SO3C3H7, -SO3-цикло-C3H5, -SO3CH(CH3)2, -SO3C(CH3)3, -SO2NH2, -OCF3, -OC2F5, -О-COOCH3, -О-COOC2H5, -O-COOC3H7, -О-COO-цикло-C3H5, -О-COOCH(CH3)2, -O-COOC(CH3)3, -NH-CO-NHCH3, -NH-CO-NHC2H5, -NH-CS-N(C3H7)2, -NH-CO-NHC3H7, -NH-CO-N(C3H7)2, -NH-CO-NH[CH(CH3)2], -NH-CO-NH[C(CH3)3], -NH-CO-N(CH3)2, -NH-CO-N(C2H5)2, -NH-CO-NH-цикло-C3H5, -NH-CO-N(цикло-C3H5)2, -NH-CO-N[CH(CH3)2]2, -NH-CS-N(C2H5)2, -NH-CO-N[C(CH3)3]2, -NH-CS-NH2, -NH-CS-NHCH3, -NH-CS-N(CH3)2, -NH-CS-NHC2H5, -NH-CS-NHC3H7, -NH-CS-NH-цикло-C3H5, -NH-CS-NH[CH(CH3)2], -NH-CS-NH[C(CH3)3], -NH-CS-N(цикло-C3H5)2, -NH-CS-N[CH(CH3)2]2, -NH-CS-N[C(CH3)3]2, -NH-C(=NH)-NH2, -NH-C(=NH)-NHCH3, -NH-C(=NH)-NHC2H5, -NH-C(=NH)-NHC3H7, -O-CO-NH-цикло-C3H5, -NH-C(=NH)-NH-цикло-C3H5, -NH-C(=NH)-NH[CH(CH3)2], -О-CO-NH[CH(CH3)2], -NH-C(=NH)-NH[C(CH3)3], -NH-C(=NH)-N(CH3)2, -NH-C(=NH)-N(C2H5)2, -NH-C(=NH)-N(C3H7)2, -NH-C(=NH)-N(цикло-C3H5)2, -O-CO-NHC3H7, -NH-C(=NH)-N[CH(CH3)2]2, -NH-C(=NH)-N[C(CH3)3]2, -O-CO-NHCH3, -O-CO-NHC2H5, -О-CO-NH[C(CH3)3], -О-CO-N(CH3)2, -О-CO-N(C2H5)2, -O-CO-N(C3H7)2, -О-CO-N(цикло-C3H5)2, -O-CO-N[CH(CH3)2]2, -O-CO-N[C(CH3)3]2) -O-CO-OCH3, -О-CO-OC2H5, -О-CO-OC3H7, -O-CO-О-цикло-C3H5, -О-CO-OCH(CH3)2, -О-CO-OC(CH3)3, -CH2F, -CHF2, -CF3, -CH2Cl, -CH2Br, -CH2I, -CH2-CH2F, -CH2-CHF2, -CH2-CF3, -CH2-CH2Cl, -CH2-CH2Br, -CH2-CH2I, цикло-C3H5, цикло-C4H7, цикло-C5H9, цикло-C6H11, цикло-C7H13, цикло-C8H15, -Ph, -CH2-Ph, -CPh3, -CH3, -C2H5, -C3H7, -CH(CH3)2, -C4H9, -CH2-CH(CH3)2, -CH(CH3)-C2H5, -C(CH3)3, -C5H11, -CH(CH3)-C3H7, -CH2-CH(CH3)-C2H5, -CH(CH3)-CH(CH3)2, -C(CH3)2-C2H5, -CH2-C(CH3)3, -CH(C2H5)2, -C2H4-CH(CH3)2, -C6H13, -C7H15, -C8H17, -C3H6-CH(CH3)2, -C2H4-CH(CH3)-C2H5, -CH(CH3)-C4H9, -CH2-CH(CH3)-C3H7, -CH(CH3)-CH2-CH(CH3)2, -CH(CH3)-CH(CH3)-C2H5, -CH2-CH(CH3)-CH(CH3)2, -CH2-C(CH3)2-C2H5, -C(CH3)2-C3H7, -C(CH3)2-CH(CH3)2, -C2H4-C(CH3)3, -CH(CH3)-C(CH3)3, -CH=CH2, -CH2-CH=CH2, -C(CH3)=CH2, -CH=CH-CH3, -C2H4-CH=CH2, -CH2-CH=CH-CH3, -CH=CH-C2H5, -CH2-C(CH3)=CH2, -CH(CH3)-CH=CH, -CH=C(CH3)2, -C(CH3)=CH-CH3, -CH=CH-CH=CH2, -C3H6-CH=CH2, -C2H4-CH=CH-CH3, -CH2-CH=CH-C2H5) -CH=CH-C3H7, -CH2-CH=CH-CH=CH2, -CH=CH-CH=CH-CH3, -CH=CH-CH2-CH=CH2, -C(CH3)=CH-CH=CH2, -CH=C(CH3)-CH=CH2, -CH=CH-C(CH3)=CH2, -C2H4-C(CH3)=CH2, -CH2-CH(CH3)-CH=CH2) -CH(CH3)-CH2-CH=CH2, -CH2-CH=C(CH3)2, -CH2-C(CH3)=CH-CH3, -CH(CH3)-CH=CH-CH3, -CH=CH-CH(CH3)2, -CH=C(CH3)-C2H5, -C(CH3)=CH-C2H5, -C(CH3)=C(CH3)2, -C(CH3)2-CH=CH2, -CH(CH3)-C(CH3)=CH2, -C(CH3)=CH-CH=CH2, -CH=C(CH3)-CH=CH2, -CH=CH-C(CH3)=CH2, -C4H8-CH=CH2, -C3H6-CH=CH-CH3, -C2H4-CH=CH-C2H5, -CH2-CH=CH-C3H7, -CH=CH-C4H9, -C3H6-C(CH3)=CH2, -C2H4-CH(CH3)-CH=CH2, -CH2-CH(CH3)-CH2-CH=CH2, -C2H4-CH=C(CH3)2, -CH(CH3)-C2H4-CH=CH2, -C2H4-C(CH3)=CH-CH3, -CH2-CH(CH3)-CH=CH-CH3, -CH(CH3)-CH2-CH=CH-CH3, -CH2-CH=CH-CH(CH3)2, -CH2-CH=C(CH3)-C2H5, -CH2-C(CH3)=CH-C2H5, -CH(CH3)-CH=CH-C2H5, -CH=CH-CH2-CH(CH3)2, -CH=CH-CH(CH3)-C2H5, -CH=C(CH3)-C3H7, -C(CH3)=CH-C3H7, -CH2-CH(CH3)-C(CH3)=CH2, -C[C(CH3)3]=CH2, -CH(CH3)-CH2-C(CH3)=CH2, -CH(CH3)-CH(CH3)-CH=CH2, -CH=CH-C2H4-CH=CH2, -CH2-C(CH3)2-CH=CH2, -C(CH3)2-CH2-CH=CH2, -CH2-C(CH3)=C(CH3)2, -CH(CH3)-CH=C(CH3)2, -C(CH3)2-CH=CH-CH3, -CH=CH-CH2-CH=CH-CH3, -CH(CH3)-C(CH3)=CH-CH3, -CH=C(CH3)-CH(CH3)2, -C(CH3)=CH-CH(CH3)2, -C(CH3)=C(CH3)-C2H5, -CH=CH-C(CH3)3, -C(CH3)2-C(CH3)=CH2, -CH(C2H5)-C(CH3)=CH2, -C(CH3)(C2H5)-CH=CH2, -CH(CH3)-C(C2H5)=CH2, -CH2-C(C3H7)=CH2, -CH2-C(C2H5)=CH-CH3, -CH(C2H5)-CH=CH-CH3, -C(C4H9)=CH2, -C(C3H7)=CH-CH3, -C(C2H5)=CH-C2H5, -C(C2H5)=C(CH3)2, -C[CH(CH3)(C2H5)]=CH2, -C[CH2-CH(CH3)2]=CH2, -C2H4-CH=CH-CH=CH2, -CH2-CH=CH-CH2-CH=CH2, -C3H6-C≡C-CH3, -CH2-CH=CH-CH=CH-CH3, -CH=CH-CH=CH-C2H5, -CH2-CH=CH-C(CH3)=CH2, -CH2-CH=C(CH3)-CH=CH2, -CH2-C(CH3)=CH-CH=CH2, -CH(CH3)-CH2-C≡CH, -CH(CH3)-CH=CH-CH=CH2, -CH=CH-CH2-C(CH3)=CH2, -CH(CH3)-C≡C-CH3, -CH=CH-CH(CH3)-CH=CH2, -CH=C(CH3)-CH2-CH=CH2, -C2H4-CH(CH3)-C≡CH, -C(CH3)=CH-CH2-CH=CH2, -CH=CH-CH=C(CH3)2, -CH2-CH(CH3)-CH2-C≡CH, -CH=CH-C(CH3)=CH-CH3, -CH=C(CH3)-CH=CH-CH3, -CH2-CH(CH3)-C≡CH, -C(CH3)=CH-CH=CH-CH3, -CH=C(CH3)-C(CH3)=CH2, -C(CH3)=CH-C(CH3)=CH2, -C(CH3)=C(CH3)-CH=CH2, -CH=CH-CH=CH-CH=CH2, -C≡CH, -C≡C-CH3, -CH2-C≡CH, -C2H4-C≡CH, -CH2-C≡C-CH3, -C≡C-C2H5, -C3H6-C≡CH, -C2H4-C≡C- CH3, -CH2-C≡C-C2H5, -C≡C-C3H7, -CH(CH3)-C≡CH, -C4H8-C≡CH, -C2H4-C≡C-C2H5, -CH2-C≡C-C3H7, -C≡C-C4H9, -C≡C-C(CH3)3, -CH(CH3)-C2H4-C≡CH, -CH2-CH(CH3)-C≡C-CH3, -CH(CH3)-CH2-C≡C-CH3, -CH(CH3)-C≡C-C2H5, -CH2-C≡C-CH(CH3)2, -C≡C-CH(CH3)-C2H5, -C≡C-CH2-CH(CH3)2, -CH(C2H5)-C≡C-CH3, -C(CH3)2-C≡C-CH3, -CH(C2H5)-CH2-C≡CH, -CH2-CH(C2H5)-C≡CH, -C(CH3)2-CH2-C≡CH, -CH2-C(CH3)2-C≡CH, -CH(CH3)-CH(CH3)-C≡CH, -CH(C3H7)-C≡CH, -C(CH3)(C2H5)-C≡CH, -CH2-CH(C≡CH)2, -C≡C-C≡CH, -CH2-C≡C-C≡CH, -C≡C-C≡C-CH3, -CH(C≡CH)2, -C2H4-C≡C-C≡CH, -CH2-C≡C-CH2-C≡CH, -C≡C-C2H4-C≡CH, -CH2-C≡C-C≡C-CH3, -C≡C-CH2-C≡C-CH3, -C≡C-C≡C-C2H5, -C(C≡CH)2-CH3, -C≡C-CH(CH3)-C≡CH, -CH(CH3)-C≡C-C≡CH, -CH(C≡CH)-CH2-C≡CH, -CH(C≡CH)-C≡C-CH3, -CH=CH-Ph, -NH-CO-CH2-COOH, -NH-CO-C2H4-COOH, -NH-CO-CH2-NH2, -NH-CO-C2H4-NH2, -NH-CH(COOH)-CH2-COOH, -NH-CH2-COOH, -NH-C2H4-COOH, -NH-CH(COOH)-C2H4-COOH, -NH-CH(CH3)-COOH;
где предпочтительно по меньшей мере один из заместителей R*, R#, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 выбирают из следующих заместителей:
-NH2, -OH, -PO3H2, -PO3H-, -PO32-, -OPO3H2, -OPO3H-, -OPO32-, -COOH, -COO-, -CO-NH2, -NH3+, -NH-CO-NH2, -N(CH3)3+, -N(C2H5)3+, -N(C3H7)3+, -NH(CH3)2+, -NH(C2H5)2+, -NH(C3H7)2+, -NHCH3, -NHC2H5, -NHC3H7, -NH2CH3+, -NH2C2H5+, -NH2C3H7+, -SO3H, -SO3-, -SO2NH2, -CO-COOH, -O-CO-NH2, -C(NH)-NH2, -NH-C(NH)-NH2, -NH-CS-NH2, -NH-COOH.
Предпочтительными также являются соединения представленной далее общей формулы (III):
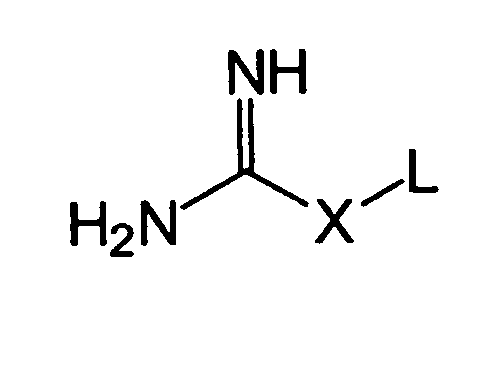
где остатки X и L имеют указанные в описании значения.
Предпочтительно, чтобы соединения общей формулы (I), (II) и (III) имели коэффициент разделения н-октанол-вода (известный также как KOW или коэффициент разделения октанол-вода) KOW<6,30 (log KOW<0,80), предпочтительно KOW<1,80 (log KOW<0,26), более предпочтительно KOW<0,63 (log KOW<-0,20) и наиболее предпочтительно KOW<0,40 (log KOW<-0,40).
Кроме того, соединения общей формулы (I), (II) и (III) имеют одинаковое предпочтительное число атомов углерода, как раскрыто выше, одинаковый предпочтительный интервал pH для реакции солюбилизации, одинаковое предпочтительное молярное отношение количества карбоновой кислоты к количеству солюбилизирующего соединения и одинаковые предпочтительные условия взаимодействий, как раскрыто выше для солюбилизации соединений в общем.
Коэффициент разделения представляет собой отношение концентраций неионизированного соединения между двумя растворами. Для измерения коэффициента разделения ионизируемых растворенных веществ, величину pH водной фазы устанавливают таким образом, чтобы преобладающая форма соединения оказалась неионизированной. Логарифм отношения концентраций неионизированного растворенного вещества в растворителях называют log P:

Коэффициент распределения представляет собой отношение суммы концентраций всех форм соединений (ионизированные плюс неионизированные) в каждой из двух фаз. Для измерений коэффициента распределения, величину pH водной фазы доводят с помощью буфера до конкретного значения, такого, чтобы величина pH заметно не изменялась при введении соединения. Логарифм отношения суммы концентраций различных форм растворенного вещества в одном растворителе к сумме концентраций его форм в другом растворителе обозначают как log D:
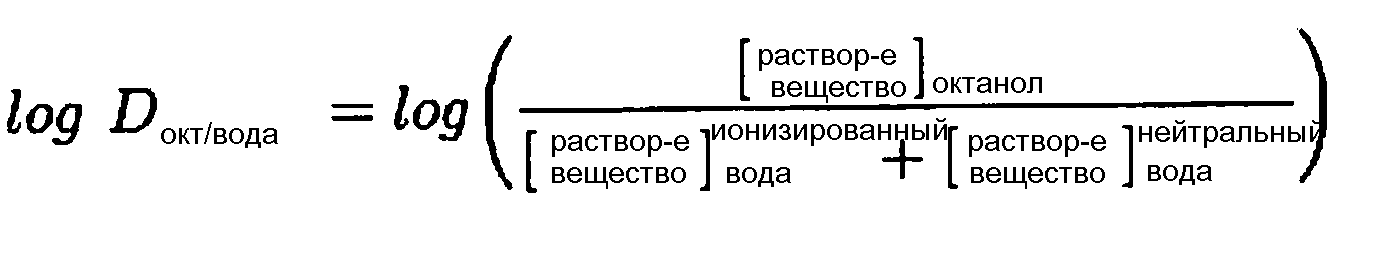
Кроме того, log D зависит от величины pH, следовательно, необходимо конкретно указывать значение pH, при котором определяют log D. Особый интерес представляет log D при pH=7,4 (физиологическое значение pH сыворотки крови). Для неионизируемых соединений logP=logD при любых значениях pH.
Аргинин
Аргинин (2-амино-5-гуанидинопентановая кислота) представляет собой α-аминокислоту. Боковая цепочка аминокислоты аргинина состоит из алифатической неразветвленной цепочки из 3 атомов углерода, дистальный конец которой заканчивается сложной группой гуанидиния. В соответствии с настоящим изобретением можно использовать L-аргинин, D-аргинин, также как их рацематы.
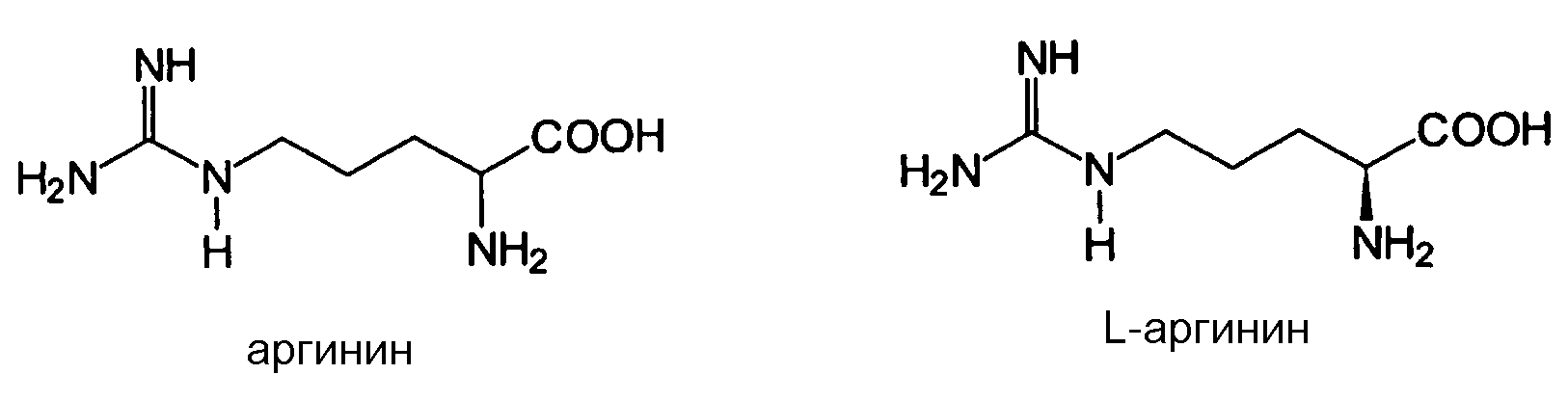
При pKa 12,48, группа гуанидиния положительно заряжена в нейтральном, кислотном и даже в основном окружении, и таким образом придает основные химические свойства аргинину. Из-за конъюгирования между двойной связью и неподеленной парой электронов азота положительный заряд делокализован, что обеспечивает образование множества H-связей. Аргинин может быть протонирован и может нести три дополнительных заряда, расположенных на боковых цепочках (pKa 12,48), у аминогруппы (pKa 8,99) и у карбоксигруппы (pKa 1,82).
L-форма представляет собой одну из 20 наиболее общих природных аминокислот. У млекопитающих аргинин классифицируют как полузаменимую или условно незаменимую аминокислоту, в зависимости от стадии развития и состояния здоровья индивидуума. Дети неспособны отвечать их требованиям, и поэтому аргинин является незаменимым для питания детей.
Аргинин представляет собой амфифильную молекулу с реакционноспособной карбоксигруппой.
Литературное значение log POW(см. выше) для аргинина составляет -4,20. Для аргинина коэффициент распределения приблизительно равен коэффициенту разделения, так как при pH=7 аргинин почти эксклюзивно присутствует в ионной форме. Libby с сотрудниками (Mol Pharmacol 1981, 20, 602-608) определил log DOW=-4,08.
При исследовании способности солюбилизации жирных кислот водными аминокислотными системами было обнаружено, что аргинин полностью растворяет олеиновую кислоту за счет образования микро- и наноэмульсий, когда превышают молярное отношение 1:1 (аргинин:жирная кислота). Интересно, что для солюбилизации карбоновых кислот не требуется сорастворителя. Спонтанное образование наноэмульсий наблюдают при комнатной температуре. Величина pH после самоорганизации 1:1 микроэмульсии составляет около 9,8. Было обнаружено, что размер частиц в наноэмульсии составляет около 2 нм в диаметре, и не было обнаружено агрегатов крупнее, чем 25 нм. Такая самоассоциация наночастиц является центральной характеристикой наноэмульсий. Наноэмульсии полностью прозрачны и стабильны в течение более 6 месяцев при температурах между -20 и 100°C. Снижение значения pH за счет добавления кислоты (HCl) уменьшает сольватационную способность, что можно преодолеть, добавляя аргинин. Однако значение pH раствора является критическим для наноэмульсификационной способности аргинина, которая снижается при значениях pH ниже 8.
Неожиданно было обнаружено, что аргинин проявляет свои солюбилизационные способности также в органических растворах. Исследовали альбумин и олеиновую кислоту при различных концентрациях в водном растворе, добавляя аргинин. Избыток жирных кислот приводит к затуманиванию раствора. Добавляя аргинин, этот эффект можно полностью обратить. Равновесный диализ осуществляют с аргинином и без него. Можно показать, что перенос жирных кислот через 5000D целлюлозную мембрану вплоть до 10 раз выше, если в модельном растворе присутствует аргинин. Аналогичные исследования, осуществленные с человеческой плазмой, демонстрируют сравнимые результаты (пример 1). Способность аргинина высвобождать связанные с альбумином жирные кислоты исследовали, используя3H-меченную олеиновую кислоту. Без аргинина около 40% жирных кислот с радиоактивными метками остается в органической фазе после экстрагирования н-гексаном. Добавление аргинина высвобождает жирные кислоты. Однако более высокая молярная концентрация аргинина, чем концентрация жирных кислот, необходима для достижения максимального эффекта. Можно достичь уменьшения концентрации остаточных жирных кислот ниже 2%. Эффективность возрастает, если температуру повышают до 38°C, по сравнению с эффективностью при комнатной температуре. Другие гидрофильные аминокислоты (лизин, аспарагин, аспарагиновая кислота, глутамин, глутаминовая кислота, гистидин) также как гидрофобные аминокислоты, исследованные идентичным способом, также привели к уменьшению содержания остаточных жирных кислот. Однако они были менее исследованы по сравнению с аргинином.
Производные аргинина в качестве солюбилизирующих соединений
Термин ”производные аргинина" относится к соединениям содержащим карбоксигруппу (-COOH) и амидиногруппу (H2N-C(NH)-) или замещенную амидиногруппу, разделенные по меньшей мере одним атомом углерода, или к содержащим карбоксигруппу (-COOH) и гуанидиногруппу (H2N-C(NH)-NH-) или замещенную гуанидиногруппу, разделенные по меньшей мере одним атомом углерода. Вышеуказанные соединения общей формулы (I) также являются производными аргинина.
Примерами производных аргинина являются, например, амидиноуксусная кислота, амидинопропионовая кислота, амидиномасляная кислота, гуанидинопропионовая кислота, гуанидиномасляная кислота, олигоаргинин, полиаргинин, также как


Взаимодействие карбоновых кислот и солюбилизирующего соединения
В соответствии с настоящим изобретением предпочтительный способ удаления карбоновых кислот из водных или органических растворов включает следующие ключевые стадии:
a) добавление солюбилизирующего соединения к раствору, содержащему жирные кислоты;
b) пропускание раствора вдоль поверхности, на которой имеются иммобилизованные липазы или катализаторы, способные выделить жирные кислоты из их этерифицированных форм, и которая воплощена в микро- или нанофлюидной капиллярной системе для достижения полного взаимодействия с этерифицированными жирными кислотами;
c) пропускание раствора вдоль поверхности раздела фаз, состоящей из разделительной мембраны, геля или блока полых капилляров;
d) создание градиента через поверхность раздела фаз, используя концентрационный градиент, осмотический градиент, физико-химический градиент, pH градиент, пневматический градиент, температурный градиент, электрический градиент или их комбинации;
e) выделение фракции жирной кислоты, связанной с солюбилизирующим соединением;
f) растворение жирных кислот в акцепторной среде; и
g) необязательное удаление солюбилизирующего соединения из раствора.
Таким образом, способность солюбилизирующего соединения создавать микро- и наноэмульсии из карбоновых кислот в водной или органической среде составляет основу настоящего изобретения. Этот фундаментальный принцип можно использовать в различных медицинских, фармацевтических, биохимических, промышленных и экологических применениях, которые будут раскрыты далее.
Получение солюбилизирующих соединений
Солюбилизирующее соединение можно использовать в виде чистого раствора, раствора с установленным значением рН или комплексного раствора. Оно может быть связано электростатически или ковалентно с пептидом или белком, также как с отрицательно заряженным органическим или неорганическим полимером или поверхностью. Эффект солюбилизации можно усилить, уменьшая ионную силу подлежащего обработке или анализу раствора, эмульсии или масла, например, с помощью комплексообразования, диализа или электродиализа для уменьшения концентрации катионов. Кроме того, может оказаться полезным изменить энергию связывания электростатического взаимодействия карбоновой кислоты с белком, подлежащей очистке карбоновой кислоты за счет изменения энергии поверхности белка или за счет тиолизации сульфидных связей, тем самым изменяя пространственную конфигурацию белка. Как раскрыто в примерах, можно показать, что для солюбилизирующих соединений, таких как аргинин, существует спонтанное и стехиометрическое образование аддукта аргинина и ионизированных гидрофобных субстанций, в частности, жирных кислот в подходящих условиях. В результате образуются мини-, микро- или наноэмульсии.
В соответствии с настоящим изобретением указанные мини-, микро- или наноэмульгированные карбоновые кислоты можно выделить, соответственно экстрагировать из водных или органических сред путем
1) адсорбирования подлежащего выделению вещества на поверхностях, таких как аэролиты, сферы, микрошарики или цеолиты, особенно, если они демонстрируют поверхностные характеристики, обеспечивающие им способность образовывать электростатические или ковалентные связи с подлежащими выделению веществами;
2) комплексообразования, т.е. образования солей;
3) диффузии подлежащего выделению вещества в акцепторную среду (особенно органогели);
4) диализа подлежащего выделению вещества за счет создания термического, электрического или физико-химического градиента;
5) фильтрования подлежащего выделению вещества за счет создания термического, электрического или физико-химического градиента;
6) дистилляционных методов;
7) сверхкритического жидкостного экстрагирования;
8) методик разделения нанофлюидов.
Гемодиализ
Гемодиализ представляет собой процедуру очистки крови и представляет собой способ лечения пациентов, страдающих почечной недостаточностью. Принцип диализа состоит в диффузии растворенных веществ через полупроницаемую мембрану (осмос), когда кровь/плазма с водорастворимыми токсинами, электролитами, мочевиной и другими веществами находится с одной стороны мембраны (пермеат) и диализный раствор, состоящий из воды и ряда важных электролитов в физиологической концентрации, с другой стороны (диализат). Небольшие молекулы, такие как вода, электролиты, мочевина и ураты, диффундируют через маленькие отверстия в мембране в соответствии с концентрационным градиентом, но не белки и клетки крови. При гемодиализе кровь пациента откачивают, пропускают через мембрану диализатора, и очищенную кровь (ретинат) перекачивают обратно в организм пациента. Противоток крови и диализата максимизирует концентрационный градиент растворенных веществ между кровью и диализатом.
Раствор для диализа приготавливают путем смешивания концентрата раствора электролитов и буферной системы со стерильной деионизированной водой (диализат). Полученный диализат нагревают и освобождают от газа. Существуют в основном две системы смешивания. В волюметрической системе смешивания два фиксировано настроенных насоса смешивают концентрат и воду таким образом, что количество потока и концентрация диализного раствора не изменяются. Проводимость представляет собой меру концентрации электролитов в растворе. После смешивания измеряют проводимость раствора, и насосы настраивают вручную при необходимости изменения количества воды или концентрата.
Диализная установка обычно обеспечивает следующие функции:
- аспирация крови у пациента с помощью перистальтических насосов,
- антикоагуляция,
- процесс транспорта через диализатор (диализаторы),
- контроль скорости потока диализата и фильтрата,
- контроль за градиентами давления между диализатом и фильтратом,
- контроль за проводимостью,
- регулировкя ионной силы и pH,
- удаление захваченного воздуха и частиц,
- кондиционирование рециркулирующей крови,
- возвращение крови пациенту с помощью перистальтических насосов.
Электролиты, мочевина, креатинин, фосфат, аминокислоты, фармакологически активные вещества и вода способны проходить через полупроницаемые мембраны, как это происходит при гемодиализе.
B. Определения
Термин "диализатор" означает устройство, содержащее поверхность раздела фаз, обеспечивающую диффузию и проникновение карбоновых кислот в растворе с одной стороны поверхности раздела на другую сторону, в другой раствор за счет физического и/или химического градиента.
Термин "экстрактор" означает устройство, содержащее материалы, которые обеспечивают физическое и/или химическое взаимодействие карбоновых кислот с межфазной поверхностью, тем самым адсорбируя и/или адсорбируя и/или осуществляя комплексообразование и/или их выделение.
"Капиллярные пустоты" представляют собой непрерывные, линейные, трубчатые открытые пространства внутри материала.
Термин "поры" относится к характеристикам материала, содержащего поры, отверстия или полости, которые позволяют проходить молекулам из одного отделения в другое отделение по направлению градиента. Указанные поры, отверстия или полости могут быть одинакового или различного размера, формы и могут по-разному распределяться в материале, предпочтительно материале мембраны.
Термин "кровь", как здесь использован, относится к крови, цельной крови, плазме крови и к сыворотке.
Следует также отметить, что термин "кровь" может также в описании относиться к компонентам крови и кровезаменителям.
Термин "компоненты крови", в том смысле, как использован в описании, представляет собой клеточные и бесклеточные компоненты, включающие эритроциты, лейкоциты, тромбоциты, белки и пептиды, также как липидные фракции.
Термин "кровезаменители", в том смысле, как использован в описании, относится к кровезаменителям, которые могут, по меньшей мере, частично переносить кислород и вещества, которые увеличивают объем крови, которые поддерживают циркуляцию крови, но не могут обеспечить физиологическую функцию крови.
Термин "субъект" относится к любым млекопитающим, включая людей. Люди предпочтительны.
Термин "первое входное отверстие", "второе входное отверстие", "третье входное отверстие", "четвертое входное отверстие" и т.д. следует понимать как количество входных отверстий устройства, но не как количество входных отверстий частей устройства, таких как одна из камер устройства. Таким образом, выражение "четвертое входное отверстие второй камеры" не означает, что вторая камера имеет четыре входных отверстия, но что во второй камере имеется входное отверстие No. 4 указанного устройства.
Термин "микроэмульсия", в том смысле, как использован в описании, относится к характеристикам эмульсии солюбилизирующего соединения по настоящему изобретению и карбоновой кислоты, которые включают по меньшей мере два из следующего:
спонтанная самоассоциация, оптическая прозрачность, помутнение <1,1 см-1, причем >80% мицелл имеют размеры <200 нм при 25°C, стабильность оптической прозрачности в температурном интервале между -40 и 99°C, стабильность оптической прозрачности в течение по меньшей мере 12 месяцев, поверхностное натяжение <60 дин/с.
Термин "наноэмульсия", в том смысле, как использован в описании, относится к характеристикам эмульсии солюбилизирующего соединения по настоящему изобретению и карбоновой кислоты, которая включает по меньшей мере два из следующего:
спонтанная самоассоциация, оптическая прозрачность, помутнение <0,4 см-1, >80% мицелл имеют размеры <100 нм при 25°C, стабильность оптической прозрачности в интервале температур между -40 и 99°C, стабильность оптической прозрачности в течение по меньшей мере 12 месяцев, поверхностное натяжение <50 дин/с.
C. Способы выделения и взаимодействия свободных карбоновых кислот из водных или органических сред
Выделение свободных карбоновых кислот можно осуществить, используя физические или химические способы, известные специалистам в данной области. Такие способы включают, но ими не ограничиваются, один или комбинацию следующих способов: адсорбция, комплексообразование, фильтрация, диализ, выпаривание, разделение за счет сил гравитации, электрофорез, электролитический способ, электроосмотический способ, электрокинетический способ, осмотический способ, термический способ, за счет концентрационного градиента или в результате химического взаимодействия.
Предпочтительно, чтобы выделение осуществляли, используя адсорбцию, фильтрацию, диализ, электролиз, также как комплексообразование и разделение под действием сил гравитации.
Способы использования наноэмульгирующего эффекта
Наноэмульгирующий эффект солюбилизирующего соединения в отношении карбоновых кислот обеспечивает их сольватацию и очистку в водных средах, обеспечивает их использование в качестве электролитов, обеспечивает химические взаимодействия в водных средах, обеспечивает химическую реакционную способность, повышает растворяющую способность карбоновых кислот для гидрофобных и липофильных веществ. Наноэмульсификация обеспечивает, соответственно повышает, растворимость и проникновение карбоновых кислот в молекулярные комплексы, и органические или неорганические твердые вещества. Кроме того, ее можно использовать для растворения комплексов карбоновых кислот с аполярными или амфифильными молекулами в органических средах или эмульсиях.
Наноэмульсификация
Термин "наноэмульсификация" относится к образованию наноэмульсий. Их можно использовать для широкого круга применений. Оптимальная растворимость двух фаз в водных средах, большая площадь поверхности между обеими фазами, также как размеры и геометрические структуры указанных фаз в интервале нанометров делают их многофункциональными носителями для растворения реагентов, химикалий или лекарственных препаратов. В ряде коммуникационных сообщений относительно наноэмульсий было показано, что солюбилизирующие соединения, такие как аргинин или производные аргинина, оказываются ценными добавками. Однако до сих пор не было документировано ни одного случая использования таких солюбилизирующих соединений для получения наноэмульсий.
Способы комплексообразования и адсорбции
Карбоновые кислоты, которые были солюбилизированы в водных средах, можно далее подвергнуть обработке, выделяя их за счет комплексообразования или адсорбции. В водных средах материалы, необходимые для комплексообразования, должны быть донорами протонов, обладающими способностью образовывать соли с карбоновыми кислотами. Предпочтительным вариантом является использование солей кальция.
Адсорбенты, которые можно использовать в гидрофильных или гидрофобных средах, могут обладать гидрофильными или гидрофобными свойствами и могут присутствовать в растворенном виде или могут быть иммобилизованы на материале подложки. Материалы, которые можно использовать, перечислены далее (5. Акцептор/адсорбент молекулы/материалы). В предпочтительном варианте используют углерод, иммобилизованный аргинин или кальций. Для адсорбции или комплексообразования жирных кислот может оказаться необходимым протонизировать их в органической водной среде или депротонизировать их в органическом растворителе. При осуществлении такого процесса они могут легко адсорбироваться в органическую водную среду или растворитель. Предпочтительным вариантом является использование н-гексана, триглицеридов или холестерина.
Способы использования процедур жидкость-жидкостного разделения
Эффект солюбилизации по настоящему изобретению можно далее использовать для выделения карбоновых кислот из органических сред с помощью известной специалистам в данной области методики жидкость-жидкостного экстрагирования. Принцип указанного способа состоит в спонтанном или направляемом разделении водной и органической фаз. Для выделения или удаления растворенных в органической фазе карбоновых кислот, водный раствор, содержащий солюбилизирующее соединение, смешивают с органической фазой. Такое перемешивание можно осуществить, используя различные физические способы, такие как встряхивание, перемешивание, вибрация, обработка ультразвуком, нагревание, барботирование, выпаривание, также как с помощью ламинарной или турбулентной динамики жидкостей. Солюбилизированные карбоновые кислоты уносятся с водной средой, после чего происходит выделение и концентрирование в водном растворе. Фазовое разделение можно осуществить, используя гравитацию, которую можно усилить, используя физические способы, такие как центрифугирование или обработка ультразвуком. Для экстрагирования выделенных таким образом карбоновых кислот, водный или органический раствор удаляют стандартными способами. Растворенные карбоновые кислоты можно выделить, подкисляя раствор и экстрагируя органическим растворителем. Наоборот, карбоновые кислоты, растворенные в органическом растворителе, можно перенести или выделить в водную среду путем экстрагирования, используя солюбилизирующее соединение (соединения) по настоящему изобретению. Указанный способ можно использовать для получении и для аналитических целей или применять на крупномасштабных промышленных предприятиях.
Электрокинетический и электрофоретический способы
Предпочтительным вариантом является электрофоретическое выделение карбоновых кислот. Карбоновые кислоты представляет собой слабые электролиты. Их ионная сила соответствует их CMC в водной системе из-за их низкого разделения. Было показано, что ионные и анионные детергенты повышают разделение, снижая CMC. Однако более высокого значения ионной силы достигают, используя ионные поверхностно-активные агенты или только в присутствии противоионов. Теоретически, противоион, который затрудняет образование мицелл, должен привести в то же самое время к оптимальному разделению и даже к лучшему разделению, если константа диссоциации связанной ионной пары высока. Подробный анализ разделения карбоновых кислот в наноэмульсиях отсутствует. Неожиданно было обнаружено, что солюбилизирующие соединения проявляют указанные свойства. Кроме того, они солюбилизируют карбоновые кислоты и обеспечивают неожиданно высокую электрофоретическую подвижность карбоновых кислот. По-видимому, низкая степень сцепления между углеродными цепочками карбоновых кислот в процессе взаимодействия с такими молекулами и отвечает за наблюдаемую подвижность. Таким образом, наноэмульгирование солюбилизирующих соединений и карбоновых кислот обеспечивает их электрофорез в водных средах или органических средах. Кроме того, такие солюбилизирующие соединения делают карбоновые кислоты пригодными для электрофоретических исследований и процедур разделения, как известно специалистам в данной области. Предпочтительным вариантом является использование в гель-электрофорезе. Пригодны гидро- или органогели. Детектирование электрофоретически разделенных карбоновых кислот можно осуществить, используя неорганические хромофоры, например, хромат (254 нм), молибдат (230 нм), или ароматические кислоты с сильными УФ-хромофорами, т.е. фталевую, тримеллитовую, пиромеллитовую, бензойную, пиридиндикарбоновую кислоту, ацетат меди-пиридин и 4-аминобензоат, способами, известными специалистам в данной области.
Другим предпочтительным вариантом является использование электроосмоса, электродиализа и электрофильтрации. Карбоновые кислоты проявляют тенденцию к образованию мицелл в водных средах, как было указано раньше. В органических растворителях они перемещаются свободно. Однако, так как они протонированы в органических растворителях, электрокинетическое движение невозможно. Если они присутствуют в виде соли в водной среде, электрофоретическая подвижность слаба. Кроме того, хотя карбоновые кислоты обычно представляют собой небольшие молекулы, за счет образования мицелл они попадают в фильтрационную среду только в незначительной степени. Это явление усугубляется тем фактом, что доступные материалы фильтров являются или гидрофильными, или гидрофобными. Однако указанные свойства не являются идеальными для выделения карбоновых кислот. Поэтому электроосмос, электродиализ и электрофильтрация не эффективны для указанной цели.
Неожиданно оказалось, что использование солюбилизирующего соединения по настоящему изобретению приводит к микро- или наноэмульгированию карбоновых кислот и позволяет выделять их способами осмоса, диализа, фильтрации, дистилляции или суперкритического жидкостного экстрагирования, используя концентрационный градиент, термический градиент, электрический градиент, физико-химический градиент или их комбинации. В предпочтительном варианте используют органофильную разделительную мембрану. Указанные мембраны должны содержать значительную часть органических молекул, если их используют для осмоса или диализа, или поверхность канальцев фильтра должна демонстрировать высокое содержание липофильных молекул.
Однако разделительных сред, которые проявляли бы такие свойства, не существует. Неожиданно автор обнаружил, что транспортную способность и селективность для карбоновых кислот можно повысить за счет выбора молекул на поверхности разделительной среды, уменьшая при этом размеры пор/канальцев.
Считают, что механизм способа по настоящему изобретению является комбинацией указанных эффектов: т.е., высокой степени разделения карбоновых кислот и высокой степени диссоциации аргинина или других солюбилизирующих соединений, обеспечивая быстрое перемещение в электрическом поле. Существующий в наноканальцах электрокинетический поток может далее повысить электрофоретическую транспортную способность.
Способы нанофильтрации
Карбоновые кислоты имеют низкий молекулярный вес и маленькие размеры. Поэтому они преимущественно пригодны для нанофильтрации. Однако низкая концентрация свободных карбоновых кислот в водной среде делает нанофильтрацию неэффективной. Кроме того, мембраны, селективные для гидрофобных или липофильных веществ, непригодны или недостаточны. Солюбилизация жирных кислот по настоящему изобретению повышает долю свободных карбоновых кислот и обеспечивает их нанофильтрацию. В последние годы нанофильтрационные мембраны стали коммерчески доступными. Однако их поверхности являются гидрофильными, что делает их неподходящими для использования с карбоновыми кислотами. Гидрофобизация поверхностей канальцев оказывает только незначительное влияние на их скорости фильтрации. Так как нанофильтрация должна предлагать ощутимые преимущества по сравнению с использованием микро- или ультрафильтрационных мембран, такие как высокая специфичность субстрата или усиленный поток, были предприняты попытки усовершенствовать выделение карбоновых кислот в наноканальцах. Поэтому было желательно функционализировать поверхности наноканальцев, чтобы придать им свойства липофильности. Указанной цели можно достичь, используя несколько классов молекул: аминокислоты, полипептиды и карбоновые кислоты (см. глава E, 4. Вещества для функционализации поверхности).
Поэтому предпочтительным вариантом является использование нанофильтрационных мембран с функционализированными поверхностями, обладающими характеристиками низкой гидрофильности (контактный угол для воды >100° при 25°C) и высокой липофильности (контактный угол для олеиновой кислоты <10° при 25°C). Средняя ширина канальцев должна быть в интервале от 5 до 100 нм, более предпочтительно между 10 и 50 нм. Длина канальцев должна быть в интервале от 0,1 до 10 мкм, более предпочтительно между 2 и 5 мкм. Материалы, которые можно использовать, перечислены далее (глава E, 3.3 Материалы разделительных мембран).
Предпочтительными материалами являются оксид алюминия, оксид титана, углерод, поликарбонат, полиэтилен, силикаты.
В предпочтительном варианте функционализации поверхности должно предшествовать монослойное покрытие поверхности канальцев полимером, подходящим для взаимодействия с молекулами, которые используют при функционализации, называемое соединительным слоем, и молекулы, которые должны присоединиться к указанному слою, определяющему свойства поверхности, называют функционализационным слоем.
1. Соединительный слой
Этот слой действует как поверхность раздела между данным материалом подложки и функционализационным слоем. Может оказаться необходимым вначале ввести или активировать молекулярные структуры на материале подложки. Указанный соединительный слой должен полностью покрывать поверхность, которая должна быть ровной после обработки. На поверхности должно быть большое количество реакционноспособных групп, подходящих для взаимодействия с молекулами функционализационного слоя. Однако может оказаться желательным многослойное покрытие для формирования структур канальцев. Этого можно достичь, используя полимеры, как представлено далее (глава E, 3.3 Материалы для разделительных мембран).
Предпочтительным вариантом является использование полимеров, таких как APTS, пентафторфенилакрилат (PFA), пентафторфенилметакрилат (PFMA), поли-N-триметил-аминоэтилметакрилат (PTMAEMA) и поли(2-диметиламино)этилметакрилат (PDMAEMA).
2. Функционализация слоя
Указанный слой служит для создания определенных условий поверхности.
Предпочтительные условия поверхности, возникающие за счет суммы межмолекулярных сил взаимодействия Коломба, Ван-дер-Ваальса, водородных связей и гидрофобных взаимодействий, функционализированной поверхности по настоящему изобретению, включают сетку, обеспечивающую липофильные эффекты, обеспечивающие разделение карбоновых кислот. Интерпозицию заряженных групп, создающих поверхностный заряд, который может быть положительным или отрицательным, используют в предпочтительном варианте. Следующим предпочтительным вариантом является создание липофильной или гидрофобной поверхности с силой в интервале 2-20 нм, при этом имеющей нейтральный или положительный заряд. Подходящими молекулами могут быть карбоновые кислоты, аминокислоты, пептиды, белки, третичные или четвертичные амиды, ароматические углеводороды или циклодекстрины. (см. глава E, 4. Материалы для функционализации поверхности).
В предпочтительном варианте жирные кислоты, аланин, фенилаланин, аргинин, лизин, амидин или гуанидин используют в качестве центральной функциональной группы внутри молекулярной структуры.
Таким образом, настоящее изобретение относится также к ультра- или нанофильтрационной разделительной панели для осуществления диализа, фильтрования или нанофильтрования карбоновых кислот, которая функционализирована одним или более из веществ общей формулы (I) или (II), включающей по меньшей мере функционализированный слой и необязательно соединительный слой.
D. Применения способа солюбилизации по настоящему изобретению
Диализ жирных кислот крови
Диализ представляет собой стандартную процедуру в медицине, в аналитике и в химической или фармацевтической промышленности. Указанную процедуру используют для уменьшения количества или полного удаления веществ из подаваемого раствора под действием градиентного прохождения через поверхность раздела. Указанная поверхность чаще всего состоит из пористой мембраны, которая пропускает молекулы до определенного размера. Доступные мембраны отличаются по своим гидрофильным и гидрофобным свойствам. Однако прохождение свободных карбоновых кислот возможно только в незначительных количествах. Одной из причин этого является то, что количество свободных жирных кислот мало даже в присутствии высоких концентраций детергентов, так как мицеллы все еще присутствуют, что приводит к таким размерам частиц, которые не могут пройти через поры мембран. Указанную проблему можно преодолеть за счет создания микро- или наноэмульсий по настоящему изобретению. Способ по настоящему изобретению можно осуществить путем модификации обычного способа диализа крови, например, соединяя кровеносную систему субъекта с диализатором через трубки. Альтернативно, некоторое количество крови отбирают в качестве образца, обрабатывают в модифицированном диализаторе способом по настоящему изобретению, после чего снова вводят пациенту. В последнем случае объем образца забираемой крови находится в интервале от 10 мл до 0,5 л, предпочтительно между 100 и 500 мл, более предпочтительно между 300 и 500 мл.
Необходимо подчеркнуть, что все способы, раскрытые в настоящем изобретении, можно осуществить in-vivo, т.е. в организме человека и животного, и in-vitro, т.е. вне организма человека и животного.
В предпочтительном варианте способ по настоящему изобретению используют для удаления свободных жирных кислот из крови нуждающегося в этом субъекта. Поэтому существуют медицинские и научные применения указанного способа. В соответствии с настоящим изобретением предложен диализатор, соответственно экстрактор, который применяет раскрытые выше принципы настоящего изобретения к крови субъекта. С этой целью устройство по настоящему изобретению присоединяют к венозной или артериальной системе кровообращения млекопитающего, предпочтительно человека, используя канюли, катетеры и трубки. В некоторых вариантах здесь можно использовать коммерчески доступное устройство для диализа, например, Plasmat futura® (BBraun Melsungen, Germany). Кровь аспирируют указанным устройством через венозную или артериальную трубку или полученный образец крови можно перекачать в устройство для диализа (см. схему Фиг.2: 213), используя перистальтический насос (212), или после или без геморазделения. Устройство для диализа состоит из двух подэлементов, которые соединены между собой соответствующими трубками (например, Fresenius, Lifeline® Бета SN Set SRBL-R, Germany). Первый подэлемент состоит из диализатора, как раскрыто далее (для подробного описания см. раздел Процедуры диализа/экстрагирования). Кровь, отобранную в диализное устройство, можно предварительно обработать с помощью диализа и/или осуществить цитратную антикоагуляцию (202) способом, известным специалистам в данной области, или подвергнуть процедуре геморазделения, или осуществить последовательность указанных процедурных стадий. Подготовленную кровь (плазму) закачивают с помощью диализного устройства во входное отверстие диализатора (203) наряду с постоянным вливанием инфузионного раствора аргинина или любого другого раствора солюбилизирующего соединения с помощью инфузионного насоса (214) из контейнера для хранения (215), содержащего стерильный раствор солюбилизирующего соединения, такого как аргинин. Конечную концентрацию солюбилизирующего соединения в диализате можно рассчитать, используя поток протекающей крови (плазмы) и концентрацию указанного соединения в инфузионном растворе. В случае аргинина следует стремиться к конечной концентрации от 100 до 300 ммоль/л. Если его растворяют в распределительной камере диализатора (для подробного описания см. раздел Процедуры диализа/экстрагирования) раствор смеси солюбилизирующее соединение-кровь (плазма) проходит через полые волокна мембраны, создающей микро- или нанофлюидные условия. В предпочтительном варианте используют комплект полых капилляров в камере с типичным диаметром 200 мкм и длиной 30 см. Объем крови (плазмы) внутри разделительной среды составляет 40-80 мл, предпочтительно 50-60 мл. Материал их может быть органическим, неорганическим или их комбинацией. Материалы, которые можно использовать, суммированы в списке материалов для поверхности раздела (см. главу E, 3.4 Полые пористые капилляры). Мембранная поверхность раздела имеет микро- или нанопоры, которые молекулярно функционализированы. Функционализация и свойства поверхностей, пор и канальцев раскрыты далее (см. главу E, 4. Материалы для функционализации поверхности). Длительность прохождения подаваемого раствора должна быть предпочтительно между 20 и 60 с, более предпочтительно между 30 и 40 с. Длительность возникающего контакта между подаваемым раствором и поверхностью раздела должна гарантировать полное удаление солюбилизированных жирных кислот. Блок таких фильтровальных картриджей известен специалистам в данной области. Диализную жидкость пропускают через входное отверстие диализатора. Она заполняет пространство между внешней поверхностью полых волокон и внутренней стенкой картриджа. Направление перфузии противоположно направлению подаваемого потока, и специалисты называют это перекрестным потоком. Типичная скорость перфузии подвергающейся диализу жидкости находится в том же интервале значений, что и скорость подаваемой жидкости. Однако может оказаться необходимым изменять отношения скоростей потоков, что может быть обычно между 1:2, 1:1, 2:1 или 3:1, в зависимости от концентрации липидов в подаваемом растворе. Диализная жидкость покидает картридж через выходной конус и ее направляют во вторичную циркуляционную секцию, которая раскрыта далее.
Кровь (плазма) покидает диализатор, собираясь в сборной камере, и ее передают через адекватные трубки во вторую секцию. Вторая секция состоит из стандартного диализатора, используемого для гемодиализа (201). Кровь (плазму) подают через полые капилляры камеры внутри диализатора, позволяя установиться концентрационному равновесию между низкомолекулярными гидрофильными молекулами и электролитами против диализного раствора (210), который прокачивают, используя перистальтический насос (216), и поступает в пространство между внешней поверхностью волокон и внутренней поверхностью картриджа. Диализат покидает стандартный диализатор через выходное отверстие, и его собирают в резервуар для отходов (211). Концентрацию, соответственно ионную силу, диализата и величину pH регулируют, используя устройство для диализа. Очищенную плазму соединяют с клетками крови, которые были выделены (не изображено на Фиг.2). Очищенную кровь закачивают с помощью перистальтического насоса (212) обратно пациенту через вышеуказанную катетерную систему.
Вторичная циркуляционная система
Как было указано ранее, раствор внутри вторичной циркуляционной системы, именуемый здесь акцепторным раствором, должен обладать высокой способностью связываться с жирными кислотами, которые прошли через поверхность раздела диализатора (203), и направить их в следующее, вторичное экстракционное устройство (204), именуемое здесь модулем обмена жирных кислот. Акцепторный раствор (см. глава E, 7. Акцепторные растворы) внутри вторичного контура может быть водным раствором с органическим или неорганическим акцептором (см. глава E, 5. Акцепторные/адсорбентные молекулы/материалы). Акцепторные молекулы могут быть растворены в свободной форме или могут быть иммобилизованы на цеолитах или адсорбирующих поверхностях (см. глава E, 4. Материалы для функционализации поверхности). Предпочтительно использовать в качестве акцептора для жирных кислот во вторичной циркуляции раствор белков, связывающих очищенные жирные кислоты, полученных из человеческого материала или из синтетических продуктов. Акцепторный раствор вторичного контура циркуляции перекачивают, используя насос (205), предпочтительно перистальтический насос. Акцепторный раствор, содержащий жирные кислоты, покидает диализатор через отверстие для выхода фильтрата за счет аспирации перистальтическим насосом (205) и направляется во входное отверстие обменного модуля жирной кислоты (204) через соответствующие трубки и протекает через обычную обменную камеру, заполненную экстрагирующим гранулятом. Акцепторный раствор очищается, пока проходит через экстрагирующий гранулят, затем покидает модуль обмена через выходное отверстие и попадает в трубку, которая соединена с диализатором у входного отверстия фильтрационной камеры.
Обменный модуль карбоновой кислоты (см. Фиг.3) состоит из картриджа, который имеет два входных отверстия и два выходных отверстия, расположенных на противоположных сторонах цилиндрического картриджа. Входное отверстие (301) и выходное отверстие (303) вторичного циркуляционного контура закрыты фильтр-воронкой (305) с порами, размеры которых меньше нижнего значения интервала размеров экстрагирующего гранулята в обменной камере. Входное отверстие (302) и выходное отверстие (304) для третичного циркуляционного контура достаточно велики, чтобы обеспечить низкое давление поступающего и выходящего потока гранулированного экстракционного материала. Внутри обменного модуля обменный раствор вторичного контура находится в тесном контакте с экстрагирующим гранулятом третичного контура циркуляции. Перфузия обменного модуля с раствором вторичной циркуляции и с гранулятом из третичной циркуляции направляются в противоположном направлении относительно друг друга. Обновленный акцепторный раствор вторичного контура выходит через выходное отверстие (303) обменного модуля и направляется в фильтратное соединение на входе диализатора через трубку.
Третичный контур циркуляции
Третичная циркуляция экстрагирования осуществляется насосом (см. Фиг.2: 205), подходящим для использования гранулированного экстрагирующего материала. Предпочтительно можно использовать насос с двойным цилиндром (207). Попадание воздуха в циркуляционную систему уменьшается за счет одновременного заполнения системы небольшими количествами очищенного акцепторного раствора через соединение через трубку, которая соединяет насос с выходным отверстием обменного модуля. Байпасный канал насоса обеспечивает одновременное заполнение системы. Экстрагируемый материал, растворенный в акцепторном растворе, направляют через трубку, которая соединена с выходным отверстием обменного модуля жирной кислоты. Остаточный воздух, попавший в указанный сегмент, удаляют, используя воздушную ловушку (208), установленную на верхней части отверстия для удаления воздуха (217). Указанное отверстие уплотнено фильтровальной пластиной, которая не позволяет проходить экстрагированному материалу. После прохождения обменного модуля экстракционный материал покидает картридж через выходное отверстие третичного циркуляционного контура. Указанное выходное отверстие соединено с трубкой, которая может быть фиксирована в вертикальном положении, расположенном выше обменного модуля и резервуара для отходов для акцепторного раствора (209). Эта трубка соединена с резервуаром для отходов, который уплотнен фильтровальной пластиной, которая не позволяет проходить экстракционному материалу (218). Однако акцепторный раствор может протекать обратно внутри трубки до приблизительно гидростатического заполняемого контейнера для хранения. Экстракционный материал направляют через трубку в контейнер (206). Указанный контейнер представляет собой часть системы очистки для очистки экстракционного материала. Очистку можно осуществить, используя физические или химические способы. После процесса очистки следует стадия окончательной очистки с использованием стерильной воды. Затем очищенный экстракционный материал собирают во втором контейнере, который соединен с насосом третичного циркуляционного контура.
Альтернативно, для очистки экстракционного материала в третичном циркуляционном контуре, можно подавать экстракционный материал из резервуара и сливать в другой резервуар после прохождения обменного модуля, используя те же самые трубки, которые были указаны ранее.
В соответствии с настоящим изобретением вышеуказанную процедуру или ее части можно комбинировать со стандартными методиками, применяемыми в гемотерапии, такими как диализ, гемоперфузия, гемофильтрация, гемодиафильтрация, выделение плазмы центрифугированием, плазмаферез, каскадная фильтрация и термофильтрация.
Здесь эффективность выделения повышают, осуществляя дополнительный гидролиз этерифицированных жирных кислот, усиливая липолиз и/или используя сайт аспирации центральной венозной крови для очистки крови.
Таким образом, одним особенно предпочтительным вариантом настоящего изобретения является удаление карбоновых кислот и особенно жирных кислот из крови путем использования раскрытых в настоящем изобретении солюбилизирующих соединений, и предпочтительно аргинина и производных аргинина. Наиболее общим способом очистки крови является диализ, который также можно использовать для удаления из крови жирных кислот и также связанных с альбумином жирных кислот.
Получение солюбилизирующих жидкостей для использования для людей
В предпочтительном варианте солюбилизацию жирных кислот достигают, используя солюбилизирующие соединения по настоящему изобретению. Их можно использовать в чистом виде или в растворе, pH которого регулируют, используя HCl или другие кислоты, разрешенные для использования для людей. Предпочтительный интервал значений pH составляет 7,5-10,0, более предпочтительно между 8,0 и 9,0. Может оказаться выгодным использовать добавки, такие как сорастворитель или буфер, как перечислено далее (см. глава E, 8. Добавки для препаратов аргинина или его аналогов). Предпочтительной добавкой является аскорбиновая кислота.
Клиническое использование
Способ по настоящему изобретению для сольватации и экстрагирования жирных кислот из крови человека можно применять, используя стандартные методики, известные специалистам в данной области, и он может быть частью процедуры гемодиализа, осуществляемого для нуждающегося в нем пациента из-за почечной или печеночной недостаточности. Использование указанной процедуры может быть также показано при других показаниях. Медицинские показания включают, но ими не ограничиваются, диагнозы или состояния, такие как сахарный диабет, метаболический синдром, избыточный вес, тучность, артериальная гипертония, гипертриглицеридемия, гиперхолестеринемия, гиперуринемия, целлюлит, атеросклероз, жировой метаморфоз печени, липоматоз, желудочковая экстрасистолия, желудочковая тахикардия, суправентрикулярная фибрилляция. Предпочтительным вариантом является сайт венозного доступа для аспирации и рециркуляции крови. Указанный сайт аспирации должен находиться в центральной венозной системе, наиболее предпочтительно внутри нижней полой вены. Очищенную кровь можно возвращать пациенту через тот же сайт доступа, отверстие которого удалено от отверстия сайта аспирации. Такой вариант реализуется в коммерчески доступных катетерных системах, подобных BioCath (Bionic Medizintechnik, Friedrichsdorf, Germany). Указанная система доступа должна иметь французский калибр между 8 и 14, более предпочтительно между 10 и 12. Наиболее предпочтительным сайтом венозного доступа является бедренная вена.
Соединения и уплотнения трубок должны быть выполнены так же, как в приборах для гемодиализа, и известны специалистам в данной области. Терапевтическая антикоагуляция является обязательной при осуществлении указанной процедуры. Ее можно осуществить, используя совместную инфузию гепарина или низкомолекулярных гепаринов, используя дозу как для достижения терапевтической блокады внешней схемы коагуляции крови, измеряемую по активированному частичному тромбобластиновому времени, или тестируя активность анти-Ха фактора, соответственно, как известно специалистам в данной области. Альтернативно, введение цитрата с целью образования комплекса с ионами кальция можно использовать для антикоагуляции крови в системе гемодиализа. Указанную процедуру осуществляют приборы для диализа, подобные Multifiltrat (Fresenius, Medical Care, Germany). Комплекс кальция подвергается диализу на начальной стадии гемодиализа. На протяжении дальнейшей обработки такая кровь не может коагулировать. Перед передачей очищенной крови пациенту ранее определенную дозу инфузионного раствора, содержащего ионы кальция, вводят совместно в поток крови, восстанавливая коагуляционную способность.
В соответствии с открытием настоящего изобретения, состоящим в том, что экстрагированную фракцию процедуры можно увеличить за счет стимуляции липолиза у пациента, подвергающегося обработке, предпочтительно применять индуцирующие липолиз лекарственные средства, такие как агонисты β1-, β2-, β3-адренорецептора, ингибиторы фосфодиэстеразы-III, агонисты α-1 и α-2 адренорецептора, нитроксид или доноры нитроксида, гормон-чувствительная липаза, лептин, натрийуретический пептид, вазопрессин, гепарин и аналоги, тирозин, йохимбин.
Кроме того, способ стимуляции липолиза по настоящему изобретению относится к местному усилению липолитической активности за счет локальной подкожной инфильтрации вышеуказанного липолитического лекарственного средства, также как анестезирующего средства, липосом, включая фосфолипиды, вазодилаторов, включая гистамин. Дальнейшее усиление липолиза можно обеспечить, используя стимуляцию электрическим полем или применяя ультразвук или энергию импульсов электромагнитного поля.
Солюбилизирующие соединения, такие как аргинин, как другие небольшие растворимые в воде молекулы, легко проходят сквозь гидрофильные диализные мембраны. Хотя они и не являются токсичными, удаление нефизиологических высоких концентраций аргинина из крови/плазмы путем завершающего диализа с использованием стандартного диализатора (высокоскоростного или низкоскоростного) является предпочтительным. Завершающий диализ обеспечивает восстановление физиологической концентрации электролитов, осмолярности и значения pH.
Может оказаться полезным повысить концентрацию в крови альбумина, фосфолипидов или циклодекстринов с целью повышения транспортной способности неэтерифицированных жирных кислот во время процедуры.
Во время такой комбинированной обработки обязательным является тщательный контроль гемодинамических параметров (кровяное давление, частота сердечных сокращений, температура, оксигенация гемоглобина), также как метаболических параметров (содержание в крови глюкозы, значение pH, содержание натрия и калия). Длительность одного эпизода процедуры зависит от клинических параметров. Обычно процедура занимает от 3 до 12 часов, более предпочтительно длится от 4 до 6 часов. Количество экстрагированных жирных кислот зависит от селективности фильтрационной мембраны, используемой для удаления патогенных жирных кислот. Предпочтительное количество экстрагированных жирных кислот находится между 100 и 2000 мл, более предпочтительно между 500 и 1500 мл.
Процедуру очистки для клинического использования можно осуществить как способ диализа, фильтрации, адсорбции, осаждения или их комбинаций.
Крупномасштабное экстрагирование свободных жирных кислот в промышленности
Свободные карбоновые кислоты часто обнаруживаются в растворах или эмульсиях, получаемых или используемых на крупных заводах. Например, жирные кислоты присутствуют в сырых растительных маслах, в оболочке и кожуре зерновых, фруктов и овощей; в биомассах или сточных водах; в сыром минеральном масле или образуются в процессе переработки, также как в содержащих масла почвах; в отработанных маслах и удаленных смазочных веществах. В большинстве случаев физические процедуры используют для удаления тех карбоновых кислот, которые требуют больших энергетических затрат. В некоторых случаях процедура выделения вызывает нежелательные последствия для очищенного продукта. Например, для рафинирования масла экспонируют пару с целью удаления летучих жирных кислот. Во время такой процедуры экспонирование при высокой температуре может привести к трансизомеризации этерифицированных карбоновых кислот. В этом состоит опасность для потребителя. Поэтому желательно избегать таких процедур.
Было обнаружено, что указанную задачу можно решить, используя способ по настоящему изобретению.
В соответствии с настоящим изобретением подлежащие очистке водные или органические растворы образуются из растений, органических веществ, ископаемых материалов, природных или синтетических реакционных смесей.
Одним предпочтительным вариантом является очистка масла от свободных карбоновых кислот путем добавления водных растворов по меньшей мере одного солюбилизирующего соединения, как раскрыто в описании, такого как соединения общей формулы (I) или аргинин или аналоги аргинина и смеси таких соединений (Фиг.4). Подлежащее очистке масло поступает из резервуара для хранения (402) в реакционную емкость (401). Заранее определенное количество концентрированного раствора солюбилизирующего соединения из резервуара для хранения (403) добавляют в реакционную емкость. Предпочтительно смешивать раствор с помощью системы смесеобразования (411). Затем смесь перекачивают (насос 412) в сборный резервуар (405), где водная и масляная фазы спонтанно разделяются за счет гравитации. Нижняя водная фаза содержит карбоновые кислоты, которые рассеиваются в микро- или наноэмульсиях, и удаляются через выходное отверстие в нижней части резервуара. Альтернативно, указанную смесь переносят в центрифугу или в мембранный разделитель. Указанную процедуру можно повторить, если требуется более высокая степень очистки. Было показано, что выгодно слегка подогревать растворы при их перемешивании с целью достижения полноты процесса солюбилизации. Процесс перемешивания ускоряется при применении ультразвука. Было обнаружено, что если указанную смесь пропускают через мембранный сепаратор, выгодно использовать, главным образом, анион-селективные мембраны. Очищенное масло (триглицеридная фаза) обычно совсем не содержит солюбилизирующих соединений после удаления воды. Однако для масла высокой степени очистки может быть полезно повторить промывку водой или использовать катионные адсорберы. Очищенную триглицеридную фазу из верхней фазы сборного резервуара непрерывно удаляют через выходное отверстие, расположенное в верхней части резервуара и подают в резервуар для хранения триглицеридов (404). Водный раствор перекачивают из нижней части сборного резервуара (405) во вторую реакционную емкость (406). Заранее определенное количество кислоты добавляют из резервуара для хранения кислоты (407). Полученный раствор в реакционной емкости смешивают, используя систему смесеобразования (411). После этого смешанный раствор перекачивают (412) во второй разделительный резервуар (408). Жирные кислоты и солюбилизирующие соединения, солюбилизированные в воде, разделяются под действием силы тяжести. Однако вместо этого можно использовать другие способы разделения, как известно специалистам в данной области. Очищенные жирные кислоты, которые концентрируются в верхней части второго разделительного резервуара, постоянно передают в резервуар для хранения жирной кислоты (409). Водный раствор солюбилизирующего соединения, который концентрируется в нижней части второго разделительного резервуара, непрерывно перекачивают в секцию электродиализа (410). Электродиализ можно использовать с целью удаления катионов и/или анионов, используя методики и устройства, как это известно специалистам в данной области, и с помощью ионо-селективных мембран (413). Очищенный раствор солюбилизирующего соединения перекачивают в резервуар для хранения солюбилизирующего соединения (403). Предпочтительными солюбилизирующим соединениями для указанной цели являются производные аргинина и особенно аргинин.
Альтернативно, для разделения под действием силы тяжести, солюбилизированные карбоновые кислоты внутри водной фазы можно разделить различными способами, используя электрофорез, пневматику или нанофильтрацию, иммобилизацию, агрегацию, дистилляцию или межфазный перенос, используя органический растворитель. В предпочтительном варианте используют адсорбцию летучих карбоновых кислот углеродом, комплексообразование с кальцием, межфазный перенос с использованием органических растворителей, электродиализ и органо-нанофильтрацию. Предпочтительным вариантом является использование эстераз при использовании процедуры солюбилизации по настоящему изобретению при обработке сточных вод или при производстве биодизельного топлива (см. глава E, 2. Гидролазы). Их комбинированное использование повышает эффективность и полноту удаления органических, соответственно маслянистых, компонентов или химическую реакционную способность.
Для реализации способов по настоящему изобретению карбоновые кислоты могут находиться в растворе, и добавляют по меньшей мере одно солюбилизирующее соединение общей формулы (I) или (II).
Альтернативно, карбоновые кислоты добавляют к макро-, микро- или наноэмульсиям, содержащим по меньшей мере одно солюбилизирующее соединение общей формулы (I) или (II), с целью использования указанной эмульсии для высвобождения, разрушения комплексов, осуществления взаимодействия, агрегации, образования комплексов, седиментации или разделения комплексов, содержащих карбоновую кислоту.
Указанные способы по настоящему изобретению можно использовать для инициализации, усиления, поддержания или ослабления физико-химических или химических взаимодействий, обеспечения возможности, усиления захвата и транспорта продуктов взаимодействия или компонентов процессов биологических или химических взаимодействий, отделения, солюбилизации, высвобождения, конвектирования, переноса вещества за счет захвата пузырьками, или делая возможным или усиливая проникновение эмульгированных карбоновых кислот через гидрофильные или амфифильные среды или твердые вещества.
Предпочтительные промышленные применения включают:
- удаление жирных кислот из растворов, содержащих жирные кислоты, образующихся при обработке сырого масла или топлива. В частности способ по настоящему изобретению можно применять при производстве и обработке минерального масла и топлива, соответственно биотоплива.
- удаление жирных кислот из растворов, содержащих жирные кислоты, образующихся при промышленной обработке пищевых продуктов. В частности, указанный способ может быть полезен при производстве пищевых масел, переработке кукурузы, риса и сыворотки из отрубей, овощей, также как молока и рыбных продуктов, пищевых продуктов с низким содержанием жира и не содержащих жира продуктов, и маслосодержащих или вырабатывающих масло организмов, соответственно.
- удаление жирных кислот из растворов, содержащих жирные кислоты, образующихся при переработке сточных вод, содержащих биоорганические соединения, или промышленных сточных вод. Например, указанный способ можно применить при обработке сточных вод из биореакторов.
- удаление жирных кислот из органических или водных растворов, содержащих жирные кислоты, образующихся при промышленной очистке продуктов, таких как шерсть, хлопок или другие текстильные материалы; при обработке сточных вод, образующихся при промышленных очистках заводских контейнеров, танкеров, мытье машин, скотобоен, и др.
- удаление жирных кислот, образующихся при химических или фармацевтических процессах, таких как получение адгезивов или красок.
- удаление веществ, не являющихся карбоновыми кислотами, которые образуют агрегаты с солюбилизированными карбоновыми кислотами или прилипают к ним, при этом подвергаясь совместной солюбилизации и выделению или удалению вместе с солюбилилизирующими веществами по настоящему изобретению и карбоновыми кислотами, как это должно использоваться при очистке сырых жиров и масел минерального или органического происхождения, с целью удаления комплексообразующих фосфолипидов, гликолипидов, стеролов, пестицидов, которые уже солюбилизированы или иммобилизованы на органическом или неорганическом веществе.
- удаление адгезивных, связанных или закомплексованных веществ с помощью макро-, микро или наноэмульсий солюбилизилизирующих веществ по настоящему изобретению и карбоновых кислот для экстрагирования органического масла семян, нефтеносных песков или нефтесодержащих пород и нефтеносных месторождений.
Применение для анализа жирных кислот в водных растворах
Качественный и количественный анализы карбоновых кислот представляют собой трудоемкую задачу. Карбоновые кислоты с длиной углеродной цепочки, превышающей 6-10 атомов, в зависимости от присутствия гидрофильных или гидрофобных заместителей нельзя измерить в водных средах, невозможно их измерение с помощью электрофореза или кондуктометрии. Кроме того, аналитическим измерениям может препятствовать неполная растворимость карбоновых кислот из органических соединений, даже если используют органические растворители. Стандартный анализ осуществляют, используя газовую хроматографию (ГХ). Однако карбоновые кислоты необходимо метилировать, чтобы их можно было использовать в ГХ, что делает указанный способ затратным по времени и подверженным методологическим недостаткам. Указанные затруднения можно преодолеть, используя процедуру сольватации по настоящему изобретению.
В соответствии с настоящим изобретением указанный способ можно также использовать для качественного и количественного анализа содержания жирных кислот в водных растворах. Он также пригоден для дифференциации относительного содержания этерифицированных и неэтерифицированных жирных кислот.
Предпочтительным вариантом процедур сольватации по настоящему изобретению является их использование для анализа карбоновых кислот методами электрофореза, кондуктометрии и спектрометрии.
Подготовка аналитических образцов
Смеси масла и жирной кислоты, также как смеси с водой, такие как эмульсии типа масло-в-воде (м/в) и вода-в-масле (в/м), загружают в реакционную камеру. Добавляют раствор, содержащий солюбилизирующее соединение по настоящему изобретению. Для определения этерифицированных жирных кислот вначале можно добавить эстеразы вместе с или после добавления солюбилизированного соединения с целью их высвобождения. Полученные растворы следует инкубировать. Было показано, что помогает умеренный нагрев объема образца, снижение ионной силы или уменьшение значения pH перед добавлением солюбилизирующего соединения. Можно провести следующие анализы:
- анализ раствора в его существующем состоянии,
- анализ путем осаждения свободных карбоновых кислот,
- анализ путем экстрагирования органическим растворителем.
Использование полученных аналитов со стандартными аналитическими способами раскрыто далее.
Процедура гель-электрофореза
Для анализа карбоновых кислот с помощью электрофореза водный аналит можно использовать в его существующей форме или в виде фильтрата после электро-нанофильтрации или диализа, растворенного солюбилизирующим соединением в виде микро- или наноэмульсии. Можно использовать стандартное устройство для гель-электрофореза (например, BIOTEC-FISCHER GmbH, PHERO-vert 1010-E) и SDS-полиакриламидный гель. Может оказаться полезным добавить к аналиту протонсодержащие растворители, такие как этанол. В предпочтительном варианте используют органогель (см. 6. Органогели). Калибровку и считывание показаний можно осуществить известными специалистам в данной области способами.
Дистилляция
Раствор, содержащий неэтерифицированные жирные кислоты, солюбилизированные в водном растворе солюбилизирующего соединения, можно очистить, используя одностадийную или двухстадийную дистилляцию. Процесс можно осуществить, нагревая и обрабатывая паром раствор при нормальном давлении воздуха или в условиях вакуума с целью снижения температуры испарения жирных кислот, подлежащих дистилляции. Предпочтительным вариантом является использование тонкопленочного испарителя (Normag, Roatafil apparatus).
Процедура осаждения/комплексообразования
Осаждение или комплексообразование солюбилизированных карбоновых кислот можно осуществить, как раскрыто ранее и как известно специалистам. А именно, предпочтительны способы, такие как комплексообразование с ионами металлов или циклодекстринами. Осадок следует экстрагировать и промыть водой, как известно специалистам в данной области. Затем очищенный осадок растворяют в сильной кислоте (HCl, уксусной кислоте, карбоновой кислоте) до полного растворения и протонирования карбоновых кислот. Затем карбоновые кислоты экстрагируют органическим растворителем (н-гексан, диэтиловый эфир, хлороформ и т.д.). Органическую фазу тщательно удаляют и обрабатывают для дальнейших анализов.
Предпочтительным аналитическим способом является жидкостная хроматография.
Процедура экстрагирования растворителем
Экстрагирование карбоновых кислот из сред, не восприимчивых к повышению кислотности или экспонированию органическим растворителям, можно осуществить непосредственно из водной среды. Использование солюбилизирующего соединения по способу настоящего изобретения имеет решительное преимущество в том, что условия экстрагирования не должны быть жесткими по сравнению с процедурами экстрагирования только растворителем. Процедуру осуществляют, когда подлежащие экстрагированию карбоновые кислоты уже растворены в водной фазе, используя способ сольватации по настоящему изобретению. Осторожное подкисление в присутствии фазы органического растворителя заставляет протонированные карбоновые кислоты переходить в фазу растворителя без необходимости в интенсивном перемешивании растворителя и среды. Затем осуществляют экстрагирование растворителем, как это известно специалистам в данной области. Раствор растворителя можно использовать для ближней ИК-, ИК или дальней ИК-спектрометрии или непосредственно для жидкостной хроматографии.
Процедура электронанофильтрации/диффузии
Следующим предпочтительным аналитическим методом является электрофоретическая или электростатическая фильтрация или диффузия для выделения, которую можно использовать со способом солюбилизации по настоящему изобретению (Фиг.5). Приготавливают раствор/эмульсию органического или неорганического материала, используя вышеописанную солюбилизацию. Значение pH следует довести до значений >6,0, предпочтительно до значений между 8 и 11. Затем определенный объем образца переносят в донорную камеру/реакционную камеру аналитического прибора. Указанная донорная камера (503) расположена между камерой, заполненной католитами (502), и разделительной камерой (505). Донорная камера/реакционная камера и камера, содержащая католиты, разделены мембраной (504). Предпочтительно, чтобы указанная мембрана была ионоселективной. Разделительная камера заполнена хроматофором (например, гелем, предпочтительно органогелем). Альтернативно, она может состоять из микрофлюидной системы или функционализированной нанофильтрационной или диффузионной мембраны (510), как раскрыто далее (см. глава E, 3. Мембраны, и 4. Материалы для функционализации поверхности). С другой стороны разделительной мембраны расположена акцепторная камера контейнер (508), который заполнен раствором аргинина или раствором любого другого солюбилизирующего соединения. Указанная акцепторная камера/контейнер примыкает к следующей камере/контейнеру (507), который служит для приема анолита. Указанные камеры/контейнеры разделены мембраной (506). Альтернативно, разделительная панель представляет собой капилляры, заполненные органогелем. Предпочтительно, чтобы мембрана была ионоселективной. Когда подают напряжение между катодом (501) и анодом (509), ионизированные соединения карбоновой кислоты, присутствующие в донорной камере/контейнере, в частности жирные кислоты, как анионы направляются через разделительную камеру/мембрану и таким образом перемещаются в акцепторную камеру/контейнер. Раствор в акцепторной камере/контейнере можно немедленно анализировать. Предпочтительно осуществлять анализ, используя способы кондуктометрии, спектроскопии или масс-спектрометрического обнаружения. Альтернативно, добавляют дополнительный агент (например, индикатор, модифицирующий агент) и осуществляют анализ. Подходящими анолитами и католитами являются растворы аргинина, растворы производных аргинина, HCl и др. Добавление, перемешивание и перемещение агентов предпочтительно осуществляют в микрофлюидной системе. Такой способ особенно удобен для создания "lab-on-the-chip" аналитической системы (системы, которая включает одну или несколько лабораторных функций, размещенных в исключительно малом пространстве).
Конкретными применениями являются медико-биохимические анализы содержания жирных кислот в жидкостях организма, взятых в качестве образов у субъекта. Такой анализ может служить диагностическим критерием. Медицинские диагнозы включают, но ими не ограничиваются, атеросклероз, гипертонию, сахарный диабет, ожирение, гиперлипопротеинемию, инфаркт миокарда, удар, почечную недостаточность. Научные применения включают использование способа в химии, биохимии, фармацевтике, фармакологии, в научных материалах, в биологии, в промышленной переработке пищевых продуктов. Указанный аналитический метод можно также использовать в промышленных применениях, как было раскрыто в предыдущем разделе, при крупномасштабном экстрагировании свободных жирных кислот.
Устройства и процедуры диализа/экстрагирования
Предметом настоящего изобретения является интегрированный диализатор/экстрактор. Для осуществления способа по настоящему изобретению солюбилизации и выделения карбоновых кислот в водной или органический среде, используя солюбилизирующее соединение общей формулы (I) или (II), такой интегрированный диализатор/экстрактор должен включать следующие существенные ключевые компоненты, которые существенны для большинства вариантов, независимо от их применения:
i) первая камера для осуществления взаимодействия водной или органической среды, содержащей карбоновую кислоту, с солюбилизирующим соединением общей формулы (I) или (II);
ii) вторая камера для приема солюбилизированных карбоновых кислот;
iii) разделительная панель между указанной первой камерой и указанной второй камерой, включающую разделительную мембрану или блок полых капилляров; и
iv) средства для подачи указанного реакционного раствора из указанной первой камеры во вторую камеру через указанную разделительную панель, под действием концентрационного градиента, термического градиента, физико-химического градиента, пневматического градиента, электрического градиента или их комбинации.
Указанное устройство можно использовать для медицинской терапии, медицинских анализов, анализов продуктов питания, переработки пищевых продуктов, анализов продуктов переработки масел, анализа масел, продуктов переработки топлива, продуктов переработки химических, фармакологических или фармацевтических веществ, в фармацевтической или химической промышленности или науке, для удаления карбоновых кислот из сточных вод после частных, коммерческих или промышленных чисток, для удаления карбоновых кислот из биореакторных процессов, очистки твердых маслянистых веществ, органожелирования или наноэмульсификации карбоновых кислот.
При использовании такого устройства применяют способ, включающий следующие ключевые стадии:
i) получение раствора или эмульсии или суспензии, содержащих карбоновые кислоты;
ii) добавление по меньшей мере эквимолярных количеств по меньшей мере одного солюбилизирующего соединения;
iii) выделение солюбилизированных карбоновых кислот из раствора или эмульсии или суспензии, используя фазовое разделение, фильтрацию, нанофильтрацию, диализ, абсорбцию, комплексообразование, дистилляцию и/или экстрагирование.
Более конкретно, стадию iii) предпочтительно осуществляют, используя один из следующих способов разделения или их комбинации:
прохождение карбоновых кислот отдельно или вместе с по меньшей мере одним солюбилизирующим соединением через разделительную мембрану или трубку или блок полых капилляров за счет создания концентрационного градиента, термического градиента, физико-химического градиента, пневматического градиента, электрического градиента или их комбинации; или осуществляя фазовое разделение за счет комбинации двух или более сред, обеспечивающих фазовое разделение; или
прохождение карбоновых кислот вместе с по меньшей мере одним солюбилизирующим соединением через поверхность раздела фаз, которая пропускает указанные карбоновые кислоты и указанное по меньшей мере одно солюбилизирующее соединение, создавая концентрационный градиент, термический градиент, физико-химический градиент, пневматический градиент, электрический градиент или их комбинации, где поверхность раздела фаз состоит из геля, органогеля или твердого материала, или их комбинации; или
фильтрация карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения; или нанофильтрация карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения; или диализ карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения; или адсорбция карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения; или комплексообразование карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения; или дистилляция карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения; или выделение карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения, используя суперкритическое жидкостное экстрагирование.
На стадии разделения гель и/или твердые материалы могут быть органического или неорганического происхождения, и они могут быть пористыми или не пористыми.
В соответствии с настоящим изобретением вышеуказанное устройство и способ можно использовать в следующих областях: медицинская терапия, медицинская аналитика, анализ пищевых продуктов, переработка пищевых продуктов, переработка масел, анализ масел, переработка топлив, модификация химических или физико-химических взаимодействий, солюбилизация плохо растворимых молекул, в химических, фармакологических или фармацевтических процессах, в анализах в фармацевтической или химической промышленности или науке, при удалении карбоновых кислот из сточных вод от частной, коммерческой или промышленной очистки, при удалении карбоновых кислот из биореакторных процессов переработки почвы или растений, при очистке маслянистых твердых веществ, при органожелировании или наноэмульсификации карбоновых кислот. Указанные аналитические способы могут быть количественными или качественными.
В более конкретной форме предпочтительные варианты включают следующие части:
a) первая камера для осуществления взаимодействия водной среды, содержащей карбоновую кислоту, с солюбилизирующими соединениями, имеющая первое входное отверстие для указанной водной среды, содержащей карбоновую кислоту;
b) контейнер для указанного солюбилизирующего соединения, имеющий второе входное отверстие для заполнения указанного контейнера указанным солюбилизирующим соединением и соединенный с указанной первой камерой через третье входное отверстие;
c) вторая камера для приема диализированного/фильтрованного раствора, содержащего карбоновую кислоту;
d) разделительная панель между указанной первой камерой и указанной второй камерой, включающая разделительную мембрану или блок полых капилляров; и
e) средства для передачи указанного реакционного раствора из указанной первой камеры в указанную вторую камеру через указанную разделительную панель за счет создания концентрационного градиента, термического градиента, электрического градиента, физико-химического градиента или их комбинации.
Необязательно устройство может также включать следующие компоненты:
f) средства для удаления ассоциатов карбоновой кислоты и солюбилизирующего соединения из указанного фильтрованного раствора путем удаления указанного фильтрованного раствора за счет конвекции акцепторного раствора, подаваемого через четвертое входное отверстие в указанную вторую камеру и предоставление возможности потоку вытекать через первое выходное отверстие из указанной второй камеры; и
g) средства для удаления очищенного раствора из указанной второй камеры через второе выходное отверстие.
Такой интегрированный диализатор/экстрактор пригоден для осуществления способа по настоящему изобретению солюбилизации и выделения карбоновых кислот в водной или органической среде в широком интервале медицинских и промышленных применений. Указанные ключевые компоненты составляют базовый узел устройств, созданных для специфических применений. Специфические варианты для конкретных применений подробно раскрыты далее.
Следует отметить, что в соответствии с настоящим изобретением все входные отверстия, выходные отверстия и транспортные средства могут иметь регулирующие устройства для корректировки соответствующего потока или скоростей перемещения. Указанные регулирующие устройства не будут точно названы для каждого из вариантов. Все регулирующие устройства, известные специалистам в данной области, будут подходящими в соответствии с настоящим изобретением.
Предметом настоящего изобретения является также способ, который применяет ключевые стадии для солюбилизации и выделения карбоновых кислот в водной или органической среде, используя вышеуказанный интегрированный диализатор/экстрактор. Основа способов по настоящему изобретению представлена следующими стадиями:
a) получение указанного раствора путем уменьшения ионной силы, используя комплексообразование, адсорбцию, выделение или диализ связанных или несвязанных катионов;
b) корректировка величины pH раствора путем добавления кислоты или основания;
c1) корректировка молярности солюбилизирующего соединения до значений в интервале от 1:10 до 20:1 по отношению к предполагаемой концентрации карбоновых кислот, подлежащих солюбилизации; и
d) добавление указанного солюбилизирующего соединения в твердой форме или в растворе к указанному водному или органическому раствору, содержащему указанную карбоновую кислоту, для oбpaзoвaнuя микро- или наноэмульсий.
Необязательно указанный способ может также включать любую из следующих стадий:
a1) высвобождение карбоновых кислот, связанных за счет образования комплекса или связанных ковалентно;
c2) если солюбилизирующее соединение вводят в растворе, корректировка pH указанного раствора с целью оптимизации совместимости и реакционных условий с карбоновыми кислотами, которые должны быть солюбилизированы за счет использования подкисления или подщелачивания;
e) добавление эстераз, гидролаз или комплексообразующего агента;
f) добавление к раствору воды и/или сорастворителя; и/или
g) оптимизация условий взаимодействия путем нагревания и/или перемешивания раствора, в результате чего образуются улучшенные микро- или наноэмульсии.
В приведенном выше описании устройств и способов по настоящему изобретению, также как в следующих модификациях и вариантах должны быть включены не все характерные особенности, соответственно не все стадии должны быть осуществлены, некоторые из них являются необязательными. Далее, в некоторых вариантах некоторые свойства или стадии модифицированы, соответственно заменены соответствующими свойствами или стадиями. Поэтому последовательность стадий соответствующего способа следует вначале рассматривать в алфавитном порядке. Во вторую очередь имеет значение числовой суффикс. Например, если присутствуют стадия c и стадия c1, стадию c1 следует осуществлять после стадии c. Другими словами, стадия c1 будет включена между стадией c и стадией d. Аналогичным образом, если в способе присутствуют стадия c1 и стадия c2, это означает, что стадию c1 необходимо осуществлять перед стадией c2. Другими словами, стадия c1 включена между стадиями b и c2. Если в варианте стадия a модифицирована, соответственно заменена по сравнению с предыдущим вариантом, она может находиться, например, в каждом варианте на различной стадии g. Последовательность указанных альтернативных стадий следует рассматривать в правильном алфавитном порядке. Итак, если модифицированная стадия g присутствует в списке стадий, это означает, естественно, что стадия g из другого варианта не включена в рассматриваемый вариант. В том случае, если включены необязательные стадии, указанные стадии могут присутствовать не в алфавитном порядке. Это не изменяет понятия последовательности стадий в алфавитном порядке. То же самое применимо к модификациям в соответствующих устройствах по настоящему изобретению.
В тех вариантах, в которых предусмотрены по меньшей мере две камеры, перечисление стадий способа по настоящему изобретению можно дополнить следующим образом:
g2) перемещение реакционного раствора из первой камеры во вторую камеру через разделительную панель, используя методику нанофильтрации, создавая концентрационный градиент, химический градиент, пневматический градиент, электрический градиент или их комбинации.
Необязательно, следующие стадии могут быть включены в указанные варианты:
h) удаление ассоциатов карбоновой кислоты и солюбилизирующего соединения из фильтрованного раствора за счет конвекции акцепторного раствора, подаваемого через входное отверстие в указанную вторую камеру, и предоставление возможности потоку вытекать через выходное отверстие указанной второй камеры; и
i) удаление очищенного раствора из указанной второй камеры через дополнительное выходное отверстие.
Стадии g2), h) и i) можно осуществить после стадии f), как раскрыто выше. Очень важным применением способа по настоящему изобретению является очистка крови пациента от летучих жирных кислот.
Поэтому представительный вариант интегрированного диализатора/экстрактора по настоящему изобретению имеет следующие модификации, и соответственно дополнительные особенности (Фиг.6):
f) средства для подачи крови или плазмы от указанного субъекта в указанную первую камеру (610) диализатора (603) через указанное первое входное отверстие;
g) насосная система и система перемешивания (602), которая обеспечивает подачу солюбилизирующего соединения из указанного контейнера (601) и перемешивание раствора;
h) необязательно, указанная первая камера содержит материалы подложки (604), на которых иммобилизованы гидролазы с целью высвобождения этерифицированных жирных кислот;
i) первая разделительная панель между указанной первой камерой второго диализатора и указанной второй камерой первого диализатора, включающая разделительную мембрану (605) или блок полых капилляров;
j) средства для подачи раствора, содержащего карбоновую кислоту, из указанной первой камеры первого диализатора во вторую камеру первого диализатора за счет создания концентрационного градиента, химического градиента, пневматического градиента, электрического градиента или их комбинации;
k) средства для перекачки (606) указанного фильтрованного раствора из указанной второй камеры в первую камеру второго диализатора (607);
l) средства для удаления ассоциатов карбоновой кислоты и солюбилизирующего соединения, проходящих через указанную вторую разделительную панель второго диализатора (607) за счет циркуляции третьего порядка;
m) контейнер для хранения акцепторного раствора;
n) средства для перекачки (612) акцепторного раствора карбоновой кислоты из указанного контейнера для хранения акцепторного раствора (609) в указанную вторую камеру второго диализатора;
o) средства для удаления акцепторного раствора с карбоновой кислотой в контейнер для сточных вод (608);
p) средства для передачи очищенного раствора, содержащего солюбилизирующее соединение, покидающее указанную первую камеру второго диализатора, в указанное входное отверстие указанной второй камеры первого диализатора; и
q) средства для передачи воссоединенных фракций крови, покидающих первую камеру первого диализатора в систему циркуляции крови указанного субъекта (611).
В следующих предпочтительных вариантах стандартный диализ крови предшествует и/или следует после стадий способа по настоящему изобретению. Преимущество состоит в том, что в одной процедуре объединены обычный диализ крови, как его обычно проводят пациентам с почечной недостаточностью, со специальной очисткой крови от летучих жирных кислот.
Представительный способ применения такого диализатора/экстрактора для очистки ex vivo образца крови от летучих жирных кислот включает дополнительные стадии, соответственно, модификации:
g1) высвобождение этерифицированных жирных кислот в крови субъекта с помощью гидролазы, иммобилизованной на материале подложки, внутри указанной первой камеры, в результате чего происходит образование микро- или наноэмульсий;
h) перекачку фильтрованного раствора из указанной второй камеры в первую камеру второго диализатора;
i) подачу раствора, содержащего карбоновую кислоту, из указанной первой камеры второго диализатора во вторую камеру второго диализатора через вторую разделительную панель за счет создания концентрационного градиента, пневматического градиента, электрического градиента или их комбинации;
j) удаление ассоциатов карбоновой кислоты и солюбилизирующего соединения, проходящих через указанную вторую разделительную панель за счет циркуляции третьего порядка;
k) подачу акцепторного раствора карбоновой кислоты из контейнера для хранения акцепторного раствора в указанную вторую камеру второго диализатора;
l) удаление акцепторного раствора с карбоновой кислотой в контейнер для хранения сточных вод; и
m) передачу очищенного раствора, содержащего солюбилизирующее соединение, покидающего указанную первую камеру второго диализатора, во входное отверстие указанной второй камеры первого диализатора.
Поверхность раздела фаз состоит из пористых мембран, гелей с пустотами или без пустот или трубок с пористыми стенками. Конфигурация мембран может быть плоской, или круглой, выполненной в виде пакетов, линий или модулей. Трубки могут быть единственными или могут иметь множество канальцев. В предпочтительном варианте используют полые камерные капилляры. Размеры их диаметров находятся между 100 и 300 мкм, и длина составляет величину между 200 и 400 мм. Количество полых камерных капилляров, расположенных параллельно, зависит от предполагаемой скорости потока крови (плазмы). Обычно количество капилляров в диализаторе составляет от 10000 до 40000. Длительность контакта крови (плазмы) с капиллярными стенками должна составлять от 2 до 50 секунд.
Материал поверхности раздела может состоять из неорганических или органических материалов или их комбинации. Материалы перечислены далее (см. глава E, 3. Мембраны). Предпочтительным вариантом является использование керамического, полимерного, металлического или углеродного материала подложки. Наиболее предпочтительны оксид алюминия и поликарбонат. Архитектура материала может быть симметричной или асимметричной, как известно специалистам в данной области. Перекрещивающиеся канальцы/пространства/пустоты могут иметь геометрическую или произвольную конфигурацию. Диаметры канальцев могут значительно отличаться, однако, их величина должна быть в интервале таких значений, чтобы обеспечить ультра-, микро- или нанофильтрацию. В предпочтительном варианте используют нанофильтрационные мембраны, как раскрыто ранее (см. главу Способы нанофильтрации).
В принципе, одни и те же мембраны можно использовать для фильтрации, диализа или осмоса. Однако мембраны для диализа или осмоса должны быть более селективными, соответственно, герметичными. Использование гелевых сеток в указанных структурах подложек используют в другом предпочтительном варианте. Такие гели могут состоять из гидрофильных или органофильных компонентов или из них обоих. В предпочтительном варианте используют гели, демонстрирующие самоассоциацию и демонстрирующие наноструктурированные структуры пор или канальцев после образования, соответственно экстракции, растворителем.
Экстрактор, используемый для биологических материалов, пищевых продуктов, сбросных растворов или промышленного использования может иметь различные размеры вышеуказанных компонентов, однако основные блоки одинаковы.
Концентрации карбоновых кислот в растворах, предназначенных для аналитических методов или очистки могут меняться в значительной степени. Для оптимальной солюбилизации желательно устанавливать отношение (солюбилизирующие соединения:карбоновая кислота) от 1:1 до 4:1 в зависимости от значения pH и ионной силы. Более низкое значение отношения приведет к неполной солюбилизации, а более высокое значение отношения может нарушить дальнейший процесс. Однако содержание карбоновых кислот может быть совсем неизвестно. Указанную проблему можно решить, контролируя степень помутнения водного раствора, соответственно эмульсии. Эмульсии являются мутными, и миниэмульсии демонстрируют помутнение при облучении их ультрафиолетовым светом. Микро- и наноэмульсии являются оптически прозрачными. Однако, измеряя нефелометрическую мутность с помощью многолучевой системы, можно определять частицы с размером от 1 вплоть до 1000 нм. Поэтому за развитием процесса солюбилизации можно следить, измеряя степень помутнения. В случае конкретных применений можно рассчитать количество солюбилизирующего соединения, которое необходимо добавить, для достижения определенной степени прозрачности, необходимой для достижения необходимого соотношения между солюбилизирующим соединением и подлежащими растворению карбоновыми кислотами. В случае, если указанные частицы не являются мицеллами карбоновых кислот, присутствующих и подлежащих солюбилизации, может оказаться выгодным отфильтровать указанные частицы или удалить их, используя центрифугирование.
С другой стороны, можно также использовать менее сложный процесс солюбилизации. Большинство солюбилизирующих соединений, таких как аргинин, проявляют незначительную токсичность. Кроме того, так как они хорошо растворимы в физиологических концентрациях, их можно удалить, используя стадии диализа, известные специалистам в данной области. Поэтому можно выбрать фиксированное значение концентрации, достигаемой по время процесса смешивания. Такая концентрация должна быть в интервале значений от 100 до 1000 ммоль/л, поэтому подачу раствора солюбилизирующего соединения с помощью инфузионного насоса в отделение смешивания можно рассчитать из данных о скорости потока крови (плазмы) и необходимой концентрации.
Типичная схема интегрированного диализатора/экстрактора представлена на Фиг.7. Модуль состоит из цилиндрического картриджа (701). Реакционная камера (702), расположенная со стороны входного отверстия потока, отделена от разделительной камеры (703) герметизирующей плоскостью A (704). В реакционной камере могут быть расположены различные системы для смешивания жидкостей. В данном примере изображены волнистые пластинки (705). Реакционная камера имеет отдельное впускное отверстие для солюбилизирующего соединения (712).
Пучок капилляров (706), включающий полые мембранные капилляры, заключен с обоих концов в герметизирующее соединение так, что они изолированы. Мембранные капилляры заключены в герметизирующее соединение герметизирующих плоскостей A и B (704, 707), причем их концы открыты в направления реакционной камеры (702) и сборной камеры (708), соответственно. Герметизирующие плоскости герметизированы так, что разделительная камера (703) отделена. Оба конца цилиндрического отделения закрыты крышкой с входом/выходом и соединительным разъемом (709). Указанное отделение имеет дополнительные входное/выходное отверстия (710, 711) расположенные в стенке отделения вблизи от обеих герметизирующих плоскостей, которые соединены с разделительной камерой. Трубки входного/выходного отверстий заключены в соединительные разъемы (не показаны). Материал отделения и герметизирующих плоскостей может состоять из полимеров, таких как PU, PA, PE.
Другим способом очистки крови является гемофильтрация. При этом подлежащую очистке кровь подают под давлением с помощью системы перистальтических насосов и ограничивающего поток клапана в экстрактор. В зависимости от необходимой фракции фильтрата создают трансмембранное давление вплоть до 500 мм рт. ст., что рассчитывают по формуле
Рна входе+Рна выходе/2 со стороны крови - Рна входе+Рна выходе/2 со стороны фильтрата.
Однако для промышленных применений могут потребоваться более высокие давления.
Эстеразы могут быть иммобилизованы, например, на композитной мембране, состоящей из полимерных связующих, таких как полисульфон, поли(тетрафторэтилен) и поли(винилиденфторид) и оксиды металлов, такие как TiO2, SrO2, HfO2 и Th02 (WO 1990/15137). Альтернативно, эстеразы могут быть ковалентно связаны с би- или полифункциональными композитами с фосфатными группами между указанным композитом и вышеуказанными оксидами металлов (WO 1999/32549).
Этерифицированные карбоновые кислоты не могут быть солюбилизированы непосредственно способом по настоящему изобретению. Во многих случаях может потребоваться гидролиз карбоновых кислот с целью сделать их пригодными для солюбилизации. Это можно осуществить, используя гидролазы, более конкретно эстеразы, соответственно липазы. Существует широкий круг такого класса ферментов, встречающихся в живых организмах и растениях. Для использования в крови или плазме представляют интерес эстеразы, которые гидролизуют ацильные остатки глицерина. Интерес может представлять гидролиз только карбоновых кислот моно-, ди- или триглицеридов с использованием триацилглицерингидролазы (EC 3.1.1.3) и удаление фосфолипидов. Однако в некоторых ситуациях может быть показано удаление всех классов этерифицированных карбоновых кислот, что можно осуществить, используя соответствующие эстеразы (EC 3.1). В некоторых случаях желателен гидролиз определенных жирных кислот, например, транс-жирных кислот, длинноцепочечных насыщенных жирных кислот. Обычно гидролиз длинноцепочечных жирных кислот (>12 атомов C) является предпочтительным вариантом способа по настоящему изобретению, если его используют для очистки крови или плазмы. Эстеразы должны быть иммобилизованы на материале подложки с тем, чтобы они не могли покинуть реакционную камеру. Материалы, пригодные для подложек для иммобилизации ферментов, могут быть тонкими пластинками, сетками, мембранами, трубками, сферами, цеолитами или гелями. Способ иммобилизации ферментов зависит от используемого материала подложки и не является предметом изобретения. В предпочтительном варианте для использования в экстракторах для медицинских целей в качестве материала для подложки используют оксид алюминия или оксид титана, с конфигурацией в виде блоков, с промежутками между трубками между 100 и 500 мкм, более предпочтительно между 200 и 400 мкм. Их поверхности функционализированы ферментами. Другим предпочтительным вариантом является использование микросфер, изготовленных из PMMA, PEEK, кремния, силикона или других материалов. Предпочтительный средний диаметр находится между 100 и 500 мкм, наиболее предпочтительно между 200 и 400 мкм. Их поверхности функционализированы ферментами. В следующем предпочтительном варианте карбоновые кислоты и/или триглицериды высвобождаются из фосфолипидных пузырьков, которые несут указанные молекулы в крови. Предпочтительно используемой формой для экстрактора является использование содержащих ферменты материалов в виде отдельных секций, которые можно хранить отдельно от экстрактора. Преимущество такой модульной техники состоит в том, что в случае необходимости хранения содержащих ферменты материалов при определенной температуре, уменьшается необходимое пространство для хранения. Кроме того, в случае потери ферментативной активности за время процесса обработки, такой компонент можно заменить без необходимости замены других компонентов.
Процедуры диализа/экстракции - Вариант II
В следующем предпочтительном варианте солюбилизирующее соединение иммобилизовано на разделительной мембране или на полых капиллярах. Таким образом, диализатор может быть упрощен и включает следующие части:
a) средства для подачи крови от субъекта в первую полость камеры;
b) первая полость камеры;
c) необязательно иммобилизованные липазы, которые используют для гидролиза жирных кислот и высвобождения жирных кислот, адсорбированных на белках липидах или клеточных мембранах или связанных с ними;
d) разделительная панель между первой полостью камеры и второй полостью камеры, включающая разделительную мембрану или полый капиллярный блок, характеризующаяся тем, что солюбилизирующее соединение иммобилизовано на разделительной мембране или внутри полых капилляров;
e) средства для подачи реакционного раствора из первой полости камеры во вторую полость камеры за счет создания пневматического градиента, электрического градиента или их комбинации;
f) вторая полость камеры для получения фильтрата/диализата;
g) резервуар для воссоединения очищенного фильтрата/диализата из второй полости камеры с остаточной фракцией крови из первой полости камеры; и
h) средства для передачи воссоединенной фракции крови в систему кровообращения субъекта.
Промышленное использование: Двухкамерные сепараторы
В соответствии с настоящим изобретением также предложено устройство для удаления жирных кислот из водных растворов, образующихся при промышленной обработке сырого масла, промышленной обработке пищевых продуктов, при промышленной обработке сточных вод, содержащих биоорганические соединения, или в связи с процессами в окружающей среде. Для указанных применений предпочтительна двухкамерная система, которая включает (Фиг.8):
a) первый контейнер (801) для получения водного раствора, содержащего жирные кислоты, содержащего карбоновые кислоты, непрерывно подаваемые в контейнер из потока поступающего материала (803);
b) средства для добавления раствора солюбилизирующего соединения в первый контейнер (804) и смешивания указанного раствора с водным раствором, содержащим жирные кислоты, с помощью соответствующей системы смешивания (805);
c) разделительную мембрану между первым контейнером и вторым контейнером, включающую разделительную мембрану (807) или полую трубку или капиллярный блок;
d) средства для подачи реакционного раствора из первого контейнера во второй контейнер за счет создания пневматического градиента, электрического градиента с помощью электрического поля между катодом (806) и анодом (808), или концентрационного градиента, химического градиента, или их комбинации;
e) второй контейнер (802);
f) средства для удаления ассоциатов соединения, солюбилизирующего жирные кислоты, из фильтрованного раствора путем удаления фильтрата за счет конвекции соответствующего акцепторного раствора, подаваемого через входное отверстие (809), и предоставляя возможность вытекания через выходное отверстие (810); и
g) средства для удаления очищенного раствора из первого контейнера через выходное отверстие (811).
В другом варианте указанного устройства для удаления жирных кислот из водных растворов, образующихся в вышеуказанных промышленных процессах, указанное солюбилизирующее соединение иммобилизовано на разделительной мембране или полой трубке или капиллярном блоке. Таким образом, указанное устройство можно упростить, и оно включает следующие части (Фиг.9):
a) первый контейнер (905) для получения водного раствора, содержащего жирные кислоты (901), и водного раствора солюбилизирующего соединения (902) после смешивания обеих жидкостей с помощью соответствующей системы смешивания (903, 904);
b) разделительная мембрана между первым контейнером и вторым контейнером, включающая разделительную мембрану или блок полых капилляров (906), необязательно содержащие указанное солюбилизирующее соединение, иммобилизованное на разделительной мембране или внутри полых трубок или с внутренней стороны модуля со спиральной насечкой;
c) средства для подачи реакционного раствора из первого контейнера во второй контейнер за счет создания концентрационного градиента, химического градиента, пневматического градиента, электрического градиента или их комбинаций; и
d) второй контейнер (908), в который поступает реакционный раствор, которому предоставляют возможность покидать камеру через выходное отверстие (909);
e) сборная камера (907), которая герметизирована относительно первого и второго контейнеров герметизирующими плоскостями (912, 913), которую пересекают полые трубки или внешняя сторона модулей со спиральными насечками; и
f) впускное отверстие (911) и выпускное отверстие (910) сборной камеры, обеспечивающие осуществление перфузии растворенных веществ через сборную камеру.
Другой вариант эффекта солюбилизации по настоящему изобретению представляет собой солюбилизацию и выделение карбоновых кислот из масел во время фармацевтических, химических или промышленных процессов переработки путем жидкость-жидкостного разделения. Карбоновые кислоты могут присутствовать в виде масла, эмульсии (М/В, В/М) или в виде системы жидкость/жидкость. Таким образом, указанный вариант может включать дополнительно следующие части:
h) средства для смешивания содержащего карбоновую кислоту раствора и солюбилизирующего соединения за счет нагревания, обработки ультразвуком, в условиях ламинарного или турбулентного потока в указанной первой камере;
i) средства для подачи смешанной эмульсии во вторую камеру и разделения смешанной эмульсии под действием сил гравитации или центрифугированием;
j) третья камера для получения очищенного масла из второго выходного отверстия второй камеры;
k) четвертая камера для получения ассоциатов карбоновой кислоты и солюбилизирующего соединения из первого выходного отверстия второй камеры;
l) резервуар для водорастворимой кислоты;
m) средства для суспендирования указанной водорастворимой кислоты из указанного резервуара в указанную четвертую камеру,
n) средства для перемешивания раствора в указанной четвертой камере;
o) пятая камера, пригодная для фазового разделения под действием силы тяжести для получения смешанного раствора из указанной четвертой камеры;
p) средства для подачи смешанного раствора из указанной четвертой камеры в указанную пятую камеру;
q) шестая камера для получения очищенных карбоновых кислот из указанной пятой камеры;
r) средства для подачи очищенных карбоновых кислот из указанной пятой камеры в указанную шестую камеру;
s) седьмая камера для получения раствора, содержащего солюбилизирующее соединение и водорастворимую кислоту, собирающиеся в донной части указанной пятой камеры;
t) средства для подачи раствора, содержащего солюбилизирующее соединение и водорастворимую кислоту в седьмую камеру;
u) средства для подачи раствора из седьмой камеры через электродиализное устройство или ионообменник для выделения солюбилизирующего соединения в камеру католита и добавленной водорастворимой кислоты в камеру анолита;
v) средства для подачи раствора из камеры католита в указанный контейнер для солюбилизирующего соединения;
w) средства для подачи раствора из камеры анолита в резервуар для водорастворимой кислоты;
x) средства для подачи очищенного ретинатного раствора после электродиализа на гидрофильный мембранный фильтр; и
y) средства для повторного использования водного фильтрата; и
необязательно включает
z) средства для суспендирования и смешивания органического растворителя с раствором седьмой камеры.
Соответствующий способ применения такого модифицированного интегрированного диализатора/экстрактора включает следующие дополнительные, соответственно модифицирующие стадии:
f) смешивание содержащего карбоновую кислоту раствора и солюбилизирующего соединения за счет обработки ультразвуком, условий ламинарного или турбулентного потока в указанной первой камере;
g) перенос смешанной эмульсии во вторую камеру;
h) разделение указанной смешанной эмульсии в указанной второй камере под действием сил тяжести или центрифугированием;
i) подача очищенного масла через второе выходное отверстие второй камеры в третью камеру;
j) суспендирование водорастворимой кислоты из резервуара в четвертую камеру;
k) перемешивание раствора в четвертой камере;
l) подача смешанного раствора из указанной четвертой камеры в пятую камеру;
m) осуществление фазового разделения за счет сил тяжести в указанной пятой камере раствора, поступающего из четвертой камеры;
n) подача очищенных карбоновых кислот из указанной пятой камеры в шестую камеру;
o) подача раствора, содержащего солюбилизирующее соединение и водорастворимую кислоту, собирающегося в донной части указанной пятой камеры, в седьмую камеру;
p) суспендирование и смешивание органического растворителя с раствором в седьмой камере;
q) подача раствора из седьмой камеры через электродиализное устройство для выделения солюбилизирующего соединения в камеру католита и добавленной водорастворимой кислоты в камеру анолита;
r) осуществление электродиализа раствора из седьмой камеры;
s) подача раствора из камеры католита в указанный контейнер для солюбилизированного соединения;
t) подача раствора из камеры анолита в резервуар для водорастворимой кислоты;
u) подача очищенного ретинатного раствора после электродиализа на гидрофильный мембранный фильтр; и
v) хранение водного фильтрата для повторного использования.
Кроме того, предпочтительно, чтобы указанное устройство для удаления жирных кислот из водных растворов в соответствии с двумя предыдущими вариантами дополнительно включало средства для иммобилизации эстеразы, используемой для высвобождения жирных кислот, адсорбированных на других соединениях или связанных с другими соединениями, присутствующими в водном или не водном растворе.
Другим вариантом эффекта солюбилизации по настоящему изобретению является солюбилизация и выделение карбоновых кислот из органических растворов, состоящих из белков, аминокислот и других водорастворимых молекул во время фармацевтической, химической, биологической или промышленной переработки или с помощью жидкость-жидкостного разделения. Такое устройство можно упростить, и оно включает следующие части (Фиг.10):
a) первый контейнер (1001) для получения раствора, содержащего органическое вещество/карбоновую кислоту (1009);
b) средства суспендирования раствора указанного солюбилизирующего соединение из контейнера для хранения (1010) в указанный раствор и перемешивания раствора из первого контейнера с раствором указанного солюбилизирующего соединения, используя систему смешивания (1011);
c) средства для подачи смешанного раствора во второй контейнер (1002);
d) средства для смешивания раствора, поступающего из первого контейнера, с раствором CaCl2 или другого комплексообразующего материала, поступающего из контейнера для хранения (1003) во второй контейнер (при этом осуществляя суспендирование с помощью насоса (1005)), что обеспечивает полное смешивание двух растворов, в результате происходит осаждение карбоновых кислот, солюбилизированных за счет солюбилизирующего соединения;
e) средства для фильтрации направляющегося вверх очищенного органического раствора с целью удержания выпавших в осадок частиц (1006);
d) средства для непрерывного механического удаления осадка (1007);
e) средства для переноса осадка в третий контейнер и промывки перенесенного осадка (1004);
f) средства для подкисления осадка в третьем контейнере;
g) средства для фазового разделения в третьем контейнере за счет органических растворителей;
h) средства для удаления верхней фазы в третьем контейнере, содержащем выделенные карбоновые кислоты;
i) средства для переноса очищенного органического раствора из второго контейнера (1002) в другой контейнер (1008); и
j) средства для выделения указанного солюбилизирующего соединения за счет электродиализа, диализа, использования катионообменных смол или комплексообразования катионов.
Необязательно могут быть включены следующие дополнительные стадии независимо друг от друга:
d1) средства для добавления одного или более из усилителей комплексообразования, агентов, регулирующих значение pH, и/или для добавления органических растворителей, выбранных из метанола, хлороформа и диэтилового эфира;
i1) средства для осуществления одной или более из стадий очистки с целью удаления органического и/или неорганического материала, все еще присутствующего в водной органической среде.
E. Материалы, необходимые для использования способа по настоящему изобретению
1. Поверхности раздела фаз и их материалы
Вообще, можно использовать все типы разделительных материалов для выделения солюбилизированных карбоновых кислот по способу по настоящему изобретению. Так как существует широкий круг применений, поверхность раздела фаз должна быть адаптирована к соответствующим условиям. В случае процессов, в которых размер солюбилизированных карбоновых кислот меньше, чем размеры подлежащих очистке соединений, можно осуществить классическую фильтрацию с исключением по размерам. Чем меньше различие между молекулами в подлежащем очистке растворе и карбоновыми кислотами, тем больше методик микро- и нанофлюидного разделения должно быть использовано. При их использовании свойства поверхности раздела определяют эффективность разделения. Так как подлежащие удалению карбоновые кислоты могут отличаться в зависимости от различных применений, свойства поверхностей, необходимых для высокой эффективности, могут отличаться. Вообще, микро- или нанофлюидные условия обеспечивают наилучшие условия для выделения на поверхности фазового разделения. Поэтому материалы поверхности раздела могут быть композитными материалами, состоящими из материала подложки, связующего/заполняющего материала и функционализирующего материала, состоящими из различных комбинаций. Материалы подложки могут быть органического или неорганического происхождения. Примеры перечислены в разделе "Материалы разделительной мембраны". Связующие или заполняющие материалы могут быть органическими или неорганическими и их выбирают из списка, перечисленного в разделе "Материалы разделительной мембраны". Предпочтительные соединения, которые должны функционализировать поверхность поверхности раздела, перечислены в разделе "Материалы для функционализации поверхности".
Поверхности, находящиеся в тесном контакте с объемом подлежащего очистке раствора, могут предъявлять различные требования к свойствам поверхности, чем к поверхности раздела фаз. Это может быть справедливым для случая применения для очистки крови. Для обеспечения гемосовместимости поверхность, которая находится в контакте с кровью или плазмой, должна быть покрыта материалами известной совместимости.
Кроме того, может быть желательно иммобилизовать солюбилизирующие соединения на материалах участка взаимодействий или на поверхность раздела фаз с целью избежать смешивания солюбилизирующих соединений с подлежащим очистке раствором или с целью уменьшить необходимое количество солюбилизирующего соединения. То же самое справедливо для использования гидролаз, если их использование необходимо в комбинации со способом по настоящему изобретению.
2. Гидролазы
Гидролазы являются основной группой ферментов (EC 3). Они способны гидролитически расщеплять сложные эфиры, простые эфиры, пептиды, гликозиды, ангидриды кислот и C-C связи. Основную подгруппу гидролаз составляют эстеразы (EC 3.1). Эстеразы представляют собой ферменты, которые разрушают сложноэфирную связь на спирт и органическую кислоту (омыление). Среди эстераз липазы (EC 3.1.1) составляют важную подгруппу. Липазы представляют собой ферменты, которые катализируют гидролиз сложноэфирных связей нерастворимых в воде липидных субстратов, чаще всего триглицеридов, на диглицериды, моноглицериды, жирные кислоты и глицерин. Поэтому липазы представляют собой подкласс эстераз. Они играют важные физиологические роли в расщеплении пищевых липидов, в превращении хранящейся в указанных соединениях энергии в доступную.
Промышленные применения липаз включают липазы из грибков и бактерий, которые играют важные роли в практических действиях человека, таких как старинное приготовление йогурта и при ферментации сыра. В более современных применениях липазы используют при хлебопечении, в стиральных порошках и даже в качестве биокатализаторов для превращения растительного масла в топливо.
Иммобилизация липаз предлагает преимущества облегчения восстановления ферментов для повторного использования. По сравнению с такими способами иммобилизации как адсорбция или инклюзия, ковалентная иммобилизация липофильных ферментов отличается тем преимуществом, что липофильную активность нельзя ликвидировать поверхностно-активными агентами. Было продемонстрировано, что липазы можно ковалентно иммобилизовать на углеродных трубках, так что их можно использовать как твердофазные катализаторы. Другое применение иммобилизации липаз было продемонстрировано на органогелях на целлюлозной основе. Другие примеры ковалентной иммобилизации липаз включают липазы на микронного размера магнитных шариках, на гранулах сефарозы и на полифенилсульфоне.
В соответствии с настоящим изобретением гидролазы можно использовать для высвобождения жирных кислот из моно-, ди- или триглицеридов в крови, тканях организма, в процессах переработки пищевых продуктов или топлива и масел. В предпочтительном варианте используют эстеразы. Более предпочтительны липазы. Наиболее предпочтительными являются триацилглицеринлипаза (E.C. 3.1.1.3), фосфолипаза A2 (E.C. 3.1.1.4), холинэстераза (E.C. 3.1.1.8) и липопротеинлипаза (E.C. 3.1.1.34).
3. Мембраны
a) Свойства мембран, используемых для диализа
В принципе можно использовать мембраны, классифицируемые как микромембраны ультра-нанофильтров. Архитектура может быть симметричной или асимметричной, пористой или компактной. Они могут состоять из материалов, перечисленных в разделе "Материалы или полимеры для подложек" в разделе "Материалы разделительной мембраны". Конфигурации мембран могут быть плоскими, или они могут состоять из полых трубок или волокон. Поверхность пересекающихся пор или канальцев и/или поверхность раздела с потоком поступающего материала можно функционализировать веществами, перечисленными в разделе "Материалы для функционализации поверхности".
В предпочтительном варианте трансмембранные отверстия состоят из цилиндрических или уплощенных канальцев или трубок с небольшими вариациями диаметров канальцев или трубок (<20%) с высоким порядком пересечения с мембраной под прямыми углами к поверхности. Предпочтительным вариантом является использование мембран, состоящих из перпендикулярных нанотрубок или мембранных фильтров со связанными липидными (двойными-) слоями или из структур, подобных плазменным мембранам, закрывающими поверхность мембраны.
Массовый транспорт карбоновых кислот можно осуществить, используя концентрационный градиент, химический градиент, пневматический градиент, электрический градиент или их комбинации. Диффузионные способы, использующие концентрационный градиент, используют чаще всего. Диффузионную способность можно повысить, используя акцепторные среды, демонстрирующие более высокий коэффициент разделения для подлежащих очистке веществ, чем в донорном растворе. В принципе, в предпочтительном варианте используют материалы с высокой способностью к связыванию органических анионов. Предпочтительный класс составляют молекулы, содержащие аминогруппы (первичные, вторичные, третичные, четвертичные), фосфатные группы или кальций. Такие молекулы, соответственно их структуры, должны иметь минимальные размеры, которые должны быть больше, чем самый маленький размер отверстий (канальцев) диализной мембраны или среды. Если размер молекул меньше, указанные молекулы могут вместо этого необратимо иммобилизовываться на матрице. В предпочтительном варианте используют поперечно-сшитый полистирол с амидной функциональностью, т.е. поли(акриламидо-N-пропилтриметиламмонийхлорид, поли[(3-(метакрилоиламино)пропил]триметиламмонийхлорид). Другим предпочтительным вариантом является использование макромолекул, подобных циклодекстринам и белкам, т.е. альбумина или белков, связывающих жирные кислоты. Такие белки можно легко солюбилизировать или иммобилизовать на матрице. Выбор материалов матрицы зависит от области применения. Материалы могут состоять из твердых веществ, волокон, сеток, гранул и цеолитов. Предпочтительно использование микрошариков и цеолитов. Указанные материалы могут состоять из кремния, металлов, керамики или полимеров. В предпочтительных вариантах используют алюминий, титан, кремний, полиакрилаты, полилактаты, поликарбонат, целлюлозу и ее сложные эфиры, ацетат целлюлозы, полисульфон (PS), полиэфирсульфон (PES), полиамид (PA), поливинилиденфторид (PVDF), полиакрилонитрил (PAN), полиэфиримид (PEI) и/или полиэфиркетон (PEEK).
3.1 Мембраны с иммобилизованными солюбилизирующими соединениями
В соответствии с настоящим изобретением также предложена разделительная мембрана, в которой солюбилизирующее соединение иммобилизовано на мембранной поверхности со стороны поступающего потока.
Выражение со стороны поступающего потока здесь обозначает ту сторону мембраны, через которую раствор просачивается через мембрану. В диализаторах по настоящему изобретению эта сторона относится к первому отделению камеры. В двухкамерных сепараторах по настоящему изобретению указанная сторона относится к первому контейнеру.
Солюбилизирующие соединения могут быть или непосредственно иммобилизованы на полимере, образующем мембрану, или они могут быть присоединены с помощью линкерных молекул. Такие линкерные молекулы могут представлять собой олигопептиды, состоящие из 1-10 аминокислот, или полипептиды, содержащие вплоть до нескольких сотен аминокислот. Указанные пептиды ковалентно связаны с аргинином и/или другими солюбилизирующими соединениями. В случае если солюбилизирующим соединением является аргинин или его производное, иммобилизованный аргинин должен предоставить свободный доступ к своей гуанидиногруппе для обеспечения того, чтобы могло осуществиться взаимодействие по настоящему изобретению с жирной кислотой.
В особенно предпочтительном варианте аргинин иммобилизован внутри пор мембраны. Такое расположение обеспечивает прохождение свободных жирных кислот вблизи аргинина во время прохождения их через мембрану. Указанная иммобилизация повышает эффективность процесса очистки. Поэтому требуется использовать меньшее количество аргинина. Альтернативно, физические параметры процесса диализа можно соответствующим образом корректировать. Это может быть особенно выгодным при диализе крови с целью консервации чувствительных компонентов крови.
В соответствии с настоящим изобретением также предложены мембраны, в которых солюбилизирующее соединение иммобилизовано на поверхности мембраны со стороны поступающего потока, также как и внутри пор мембраны.
В соответствии с настоящим изобретением предложены также полые капилляры, в которых солюбилизирующее соединение иммобилизовано внутри капилляра. В зависимости от полимера, из которого изготовлен капилляр, солюбилизирующее соединение может быть иммобилизовано способом, аналогичным способу иммобилизации внутри пор мембраны, как было раскрыто выше. Преимущества указанного варианта уже обсуждались в предыдущем разделе.
Таким образом, настоящее изобретение также относится к полым капиллярам, отличающимся тем, что солюбилизирующее соединение иммобилизовано внутри капилляра.
3.2 Мембраны с иммобилизованными гидролазами
В наиболее предпочтительном варианте на поверхности той стороны разделительной мембраны, с которой поступает поток, дополнительно иммобилизованы липазы. В способе по настоящему изобретению аргинин и/или другие солюбилизирующие соединения могут быть иммобилизованы или на той стороне мембраны, куда поступает поток, или внутри пор мембраны, или могут быть использованы оба варианта. Преимущество указанного варианта состоит в том, что не требуется больше никаких средств иммобилизации липаз. Кроме того, тесная близость между освобожденными под действием липаз жирными кислотами и иммобилизованным аргинином (или солюбизирующим соединением) повышает вероятность того, что осуществится взаимодействие свободной жирной кислоты с аргинином и/или другими солюбилизирующими соединениями. С увеличением расстояния повышается вероятность того, что освобожденная жирная кислота снова адсорбируется на гидрофобной структуре до взаимодействия с аргинином или солюбилизирующим соединением.
3.3 Материалы разделительных мембран
Было показано, что следующие полимеры пригодны для использования в разделительных мембранах: полиолефины, полиэтилен (HDPE, LDPE, LLPE), фторированный этилен, сополимеры этилена с бутеном-1, пентеном-1, гексеном-1, сополимеры этилена и пропилена, EPR-каучук или EPT-каучук (третий компонент с диеновой структурой и др.), дициклопентадиен, этилиденнорборнен, метилендометиленгексагидронафталин, цис-цис-циклооктадиен-1,5-гексадиен-1,4, гексил-(1-гексенметилгексадиен), сополимер этилена и винилацетата, сополимер этилена и метакриловой кислоты, этилен-N-винилкарбазол, метакриламид-N,N'-метилен-бис(мет)акриламидаллилглицидиловый эфир, глицидил(мет)акрилат, полиметакрилат, полигидроксиметакрилат, сополимеры стирола и глицидилметакрилата, полиметилпентен, поли(метилметакрилатметакрилоиламидоглутаминовая кислота), поли(глицидилметакрилат-co-этилендиметакрилат), сополимер стирола и поливинилпирролидона и глицидилметакрилата, смеси стирол-поливинилпирролидона с кросполивидоном, этилен-трифторэтиленом, полипропиленом, полибутеном-1, поли-4-(метилпентен-1), полиметилпентаном, сополимер полиизобутилена, сополимер изобутилена и стирола, бутилкаучук, полистирол и модифицированный стирол, хлорметилированный стирол, сульфонированный стирол, поли-(4-аминостирол), сополимер стирола и акрилонитрила, сополимер стирол-акрилонитрил-бутадиен, сополимер акрилонитрил-стирол-акрилового эфира, сополимер стирола и бутадиена, сополимер стирола и дивинилбензола, сополимер стирола и ангидрида малеиновой кислоты, полидиены цис-транс, 1-2 и 3-4 конфигураций, бутадиен, изопрен, очищенный природный каучук, сополимер стирол-бутадиен (SBR), трехблочные полимеры (SBS), NBR сополимер акрилонитрила и бутадиена, поли-(2,3-диметилбутадиен), трехблочный сополимер полибутадиена, оканчивающийся циклоалифатическими вторичными аминами, или -бензаль-L-глутаматом или полипептиды, или N-карбобензокси-L-лизин, поли(алкенамер)-полипентенамер, поли-(1-гексенметилгексадиен), полифенилены, поли(p-ксилилен), поливинилацетат, сополимер винилацетата и винилстеарата, сополимер винилацетата и винилпивалата, сополимер винилацетата и винилхлорида, поливиниловый спирт, поливинилформаль, поливинилбутираль, поливиниловый эфир, поли(N-винилкарбазол), поли-N-винилпирролидон, поли(4-винилпиридин), поли(2-винилпиридинийоксид), поли(2-метил-5-винилпиридин), сополимер бутадиена и (2-метил-5-винилпиридина), политетрафторэтилен, сополимер тетрафторэтилена и гексафторпропилена, сополимер тетрафторэтилена и перфторпропилвинилового эфира, сополимер тетрафторэтилен-этилен, сополимер тетрафторэтилен-трифторнитрозометан, сополимер тетрафторэтилен-перфторметилвиниловый эфир, сополимер тетрафторэтилен-(перфтор-4-цианобутилвиниловый эфир), поли-(трифторхлорметилен), сополимер трифторхлорэтилен-этилен, поливинилиденфторид, сополимер гексафторизобутилен-винилиденфторид, поливинилфторид, поливинилхлорид, удароустойчивый ПВХ с примесями ABS, MBS, NBR, хлорированный ПЭ, FVAC или полиакрилаты, мягкий ПВХ, постхлорированный ПВХ, сополимер поливинилхлорид-винилацетат, сополимер винилхлорид-пропилен, сополимер поливинилиденхлорид-винилхлорид-винилхлорид-винилиденхлорид, сополимер винилиденхлорид-акрилонитрил, полиакриловая кислота, сополимер акриловая кислота-итаконовая кислота, сополимер акриловая кислота-метакриловая кислота, сополимер эфира акриловой кислоты и акрилонитрила, сополимер эфир акриловой кислоты-2-хлорэтиленвиниловый эфир, поли(1,1-дигидроперфторбутилакрилат), поли-(3-перфторметокси-1,1-дигидроперфторпропилакрилат), полисульфон, полиакролеины, полиакриламид, сополимер акриловой кислоты и акриламида, сополимер акриламид-малеиновая кислота, сополимер акриламид-гидроксиметилметакрилат, сополимер акриламид-метилметакрилат, сополимер акриламид-метилакрилат, сополимер акриламид-ангидрид малеиновой кислоты, сополимер акриламид-ангидрид метакриловой кислоты, сополимер акриламид-анилин-акриламид, сополимер акриламид-(N-акрилол-4-карбоксиметил-2,2-диметилтиазолин), полиметакриламид, сополимер метакриловая кислота-метакрилонитрил, сополимер метакриловая кислота-3-фторстирол, сополимер метакриловая кислота-4-фторстирол, сополимер метакриловая кислота-3-фторанилид, нитрированные сополимеры метакриловой кислоты с метакриловая кислота-3-фторанилидом или фторстиролом или сополимеры метакриловой кислоты с 3,4-изотиоцианатостиролом, или N-винилпирролидона с ангидридом малеиновой кислоты, или поливиниловым спиртом и полиаллиловым спиртом, полиакрилонитрил, сополимер акрилонитрил-2-винилпиридин, сополимер акрилонитрил-металлилсульфонат, сополимер акрилонитрил-N-винилпирролидон, ПАН содержащие гидроксигруппы, сополимер акрилонитрил-винилацетат, сополимер акрилонитрил-акриловый эфир, полиаллильные соединения, полидиаллилфталаты, политриаллилцианураты, поли-α-цианоакрилат, полидиметиламиноэтилметакрилат и сополимеры акрилонитрила, сополимер метилметакрилат-лаурилметакрилат, сополимер P-ацетаминофенилэтоксиметакрилат-метилметакрилат, сополимер гликольдиметилметакрилат-метакрилат, поли-2-гидроксиэтилметакрилат, сополимер 2-гидроксиметилметакрилат-метилметакрилат, сополимер гликольдиметакрилат-метакрилат, поли-2-гидроксиметилметакрилат, сополимер 2-гидроксиметилметакрилат-метилметакрилат, сополимер гликольметакрилат-гликольдиметилметакрилат, блоксополимеры и привитые сополимеры HEMA-стирол, поли-N,N-P,P-оксидифениленмеллитимид, полидиэтиленгликольбисаллилкарбонат, алифатические полиэфиры, полиоксиметилены, полиоксиэтилены, полифтораль, полихлораль, полиэтиленоксиды, политетрагидрофуран, полипропиленоксид, сополимер этиленоксида и пропиленоксида, сополимер пропиленоксид-аллилглицидиловый эфир, полиэпихлоргидрин, сополимер этиленоксид-эпихлоргидрин, поли-1,2-дихлорметил-этиленоксид, поли-2,2-бис-хлорметилоксациклобутан, эпоксидные смолы, бис-фенол-A-диглицидиловый эфир, эпоксидированный фенолформальдегид, крезолформальдегид, смолы, сшитые с ангидридами карбоновой кислоты, амины, такие как диэтиленамин, изофорондиамины, 4,4-диаминодифенилметан, ароматические полиэфиры, полифениленоксиды, полифенол, феноксисмолы, алифатические поли(сложные эфиры), полилактид, полигликолид, поли-ß-пропионовая кислота, поли-ß-D-гидроксибутират, полипиволактон, поли-ε-капролактон, полиэтиленгликоль-адипат, полиэтиленгликоль-себакат, ненасыщенные полиэфиры ангидрида малеиновой кислоты, ангидрида фталевой кислоты, изофталевой кислоты, терефталевой кислоты или HET кислота с этиленгликолем, 1,2-пропиленгликолем, неопентилгликолем, оксэтилированные бисфенолы или циклододекандиол, ненасыщенные поли(сложноэфирные) смолы или смолы винилового сложного эфира, полученные в результате сополимеризации ненасыщенных поли(сложных эфиров) со стиролом, метакрилатом, виниловыми мономерами, винилацетатом, метилметакрилатом, поликарбонат, поликарбонат бисфенола A и его производные и полиэфиры, поли(сложные эфиры), сегментные поликарбонат бисфенола A и его производных и алифатические полиэфиры, также как алифатические поли(сложные эфиры) (см. выше), полиэтиленгликольтерефталат (PET) поверхностно-модифицированный, с привитой акриловой кислотой или за счет частичного гидролиза поверхности PET, полиэтиленгликольтерефталат, полиэтиленгликольтерефталат-адипат, полиэтиленгликольтерефталат, сегментированный с полиэфирными блоками и алифатическими поли(сложный эфир) блоками и политететрагидрофурановыми блоками, поли-p-гидроксибензоат, сополимер гидроксибензойная кислота-гидрохинон, сополимер гидроксибензойная кислота-терефталевая кислота, сополимер гидроксибензойная кислота-p,p-дифениловый эфир, поливинилпирролидон, сополимер поливинилпирролидон-ангидрид малеиновой кислоты, алкидные смолы глицерина, триметилпропана, пентаэритрита, сорбита с фталевой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, адипиновой кислотой и жирными кислотами льняного масла, касторового масла, соевого масла, кокосового масла, алифатические полисульфиды-(R-Sx-)=содержание серы, ароматические полисульфиды, политио-1,4-фенилен, ароматический полисульфидный эфир фенола и тиофена, полиэфирсульфоны, полисульфо-1,4-фенилен, поли-p-фениленсульфон, полиимины, полиэтиленимин, разветвленный полиэтиленимин, полиалкиленамин, полиамид, полигексаметиленадипамид, полигексаметиленамид себациновой кислоты, полигексаметилендодекандиамид, политридеканамид брассиловой кислоты, версамиды из растительных масел с диаминами и триаминами, полиамид ω-аминокарбоновых кислот с α,β,γ,δ-аминокарбоновыми кислотами или лактамами, сополимер терефталевая кислота-m-аминобензамид, полиамидгидразид, например, изофталевой кислоты и m-аминобензогидразида, полипиперазинамид, например, фумаровой кислоты и диметилпиперазина, полибензимидазолы терефталевой кислоты и тетраминобензола (замещенного), или диаминофениловых эфиров и дихлорфенилсульфона (замещенного и циклизованного), или m-фениленизофталамида и терефталамида, полиимиды, например, пиромеллитового диангидрида, метокси-m-фенилендиамина, пирроны, например, пиромеллитового диангидрида и диаминобензидина, ароматические полиамиды, поли-m-фениленизофталамид, поли-p-бензамид, поли-p-фенилентерефталамид, сополимер m-аминобензойная кислота-p-фенилендиамин-изофталевая кислота, поли-4,4'-дифенилсульфонтерефталамид из терефталевой кислоты и гексаметилентетрамина, терефталевой кислоты и триметилгексаметилендиамина и 2,4,4-триметилгексаметилендиамина, из терефталевой кислоты, диаминометиленнорборнена и ε-капролактама, из изофталевой кислоты и лауринлактама, из изофталевой кислоты и ди-4-(циклогексиламино-3-метил)метана, из 1,12-декандикарбоновой кислоты и 4,4'-диаминдициклогексилметана, ароматических полиамидов с гетероциклами, например, хлорида дикарбоновой кислоты, терефталевой кислоты и изофталевой кислоты, диаминных гетероциклов с оксидазолом, триазолом, битиазолом и бензимидазольными структурами, 3-(p-аминофенил)-7-амино-2,4-(1H,3H)-хиназолиндиона и изофталевой кислоты, полиаминокислоты, поли-метил-L-глутамат, поли-L-глутаминовая кислота и т.д., сополипептиды, например, из глутаминовой кислоты и лейцина, глутаминовой кислоты и фенилаланина, глутаминовой кислоты и валина, глутаминовой кислоты и аланина, лизина и лейцина, p-нитро-D,L-фенилаланина и лейцина и т.д., полимочевины из диизоцианатов с диаминами и мочевинами, полиуретаны из алифатических и ароматических диизоцианатов и бифункциональных и трифункциональных гидроксисодержащих поли(сложных эфиров) (см. выше) и алифатических полиэфиров (см. выше) и необязательно модификаций с бифункциональными материалами, содержащими аминогруппу, содержащими гидроксильную группу, содержащими карбоксильную группу, например, гексаметилендиизоцианат, дифенилметандиизоцианат, толуилендиизоцианат 2,4 и 2,6, толидиндиизоцианат, ксилилендиизоцианат, глицерин, этиленгликоль, пентаэритрит, 3-диметиламино-1,2-пропандиол и углеводы, алифатические и ароматические дикарбоновые кислоты и их производные, o,m,p-фенилендиамин, бензидин, метилен-бис-o-хлоранилин, p,p'-диаминодифенилметан, 1,2-диаминопропан, этилендиамин, аминосмолы из мочевины и циклической мочевины, меланин, тиомочевина, гуанидин, уретан, цианамид, амиды кислот и формальдегид, также как более длинноцепочечные альдегиды и кетоны, силиконы, полидиалкилсилоксан, диарилсилоксан и алкиларилсилоксаны, такие как диметил-, диэтил-, дипропил-, дифенил-, фенилметилсилоксан, силиконы, содержащие функциональные группы, например, аллильные группы, γ-замещенные фторсиликоны, содержащие аминогруппы и винильные группы, например, аминопропилтриэтоксисилоксан, 2-карбоксилпропилметилсилоксан, блок-полимеры с диметилсилоксановыми секциями и полистирольными или поликарбонатными блоками, триблоксополимеры стирола, бутилакрилата с α,ω-дигидрокси-полиметилсилоксаном, 3,3,3-трифторпропилметилсилоксан, авокан (90% силикона и поликарбонат), блоксополимеры силикона и поликарбоната, гидрофобные полимеры с добавками гидрофильных полимеров, например, полисульфонполивинилпирролидон, целлюлоза и производные целлюлозы, например, ацетилцеллюлоза, перфторбутирилэтилцеллюлоза, перфторацетилцеллюлоза, полиароматические полиамидные полимеры, нитрат целлюлозы, карбоксиметилцеллюлоза, регенерированная целлюлоза, регенерированная целлюлоза из вискозы и аналогичные производные целлюлозы, агароза, полисахариды, такие как каррагенан, декстран, маннан, фруктозан, хитин, хитозан (этиленгликоля диглицидиловый эфир, хитозон-EDGE), пектин, глюкозаминогликаны, крахмал, гликоген, альгиновые кислоты, и все деоксиполисахариды и галогено-деоксиполисахариды и их производные, амино-деоксиполисахариды или сульфгидрил-деоксиполисахариды и их производные, муреин, белки, например, альбумин, желатин, коллаген I-XII, кератин, фибрин и фибриноген, казеин, белки плазмы, молочные белки, кросповидон, структурные белки из тканей животных и растений, соевые белки, белки пищевой промышленности.
Для разделительных мембран предпочтительны следующие полимеры:
двуокись кремния, силиконы, полиолефины, политетрафторэтилен, поли(сложный эфир)уретан, полиэфируретан, полиуретаны, полиэтилентерефталаты, полиметилпентан, полиметилпентен, полисахариды, полипептиды, полиэтилен, поли(сложные эфиры), полистирол, полисульфонаты, полипропилен, полиэфирсульфоны, полипирролы, поливинилпирролидоны, полимолочная кислота, полигликолевая кислота, полиорто(сложные эфиры), полиароматические полиамиды, сефароза, углеводы, поликарбонат, сополимеры акрилатов или метакрилатов и полиамидов, эфир акриловой кислоты, эфир метакриловой кислоты, амид акриловой кислоты, амид метакриловой кислоты, полиакрилонитрил, сополимеры этиленгликольдиакрилата или этиленгликольдиметакрилата и глицидилакрилата или глицидилметакрилата и/или аллилглицидного эфира, регенерированная целлюлоза, ацетилцеллюлоза, гидрофобные полимеры с добавлением гидрофильных полимеров, например, полисульфонполивинилпирролидон, производные и сополимеры вышеперечисленных полимеров.
Поли(изогексилцианоакрилат) (PIHCA), поли(изобутилцианоакрилат) (PIBCA), поли(гексилцианоакрилат) (PHCA), поли(бутилцианоакрилат) (PBCA), поли(2-диметиламино)этилметакрилат (PDMAEMA), полимоно-метиламино-этилметакрилат (PMMAEMA), поли-N-триметил-аминоэтилметакрилат (PTMAEMC), полиаминоэтил-метакрилат (PAEMC), полиаминоэтил-метакриламид (PAHMAC), полиаминогексил-метакрилат (PAHMC), полистирол (PS), поливинилпирролидон (PVP), поливиниловый спирт (PVA), поли(молочная-co-гликолевая кислота) (PLGA), полиэтиленимин (PEI).
Неорганические материалы включают, но ими не ограничиваются, металлы, такие как алюминий, железо, магний, медь, золото, циркон, иридий, титан, цинк, олово, также как их оксиды, кремний и его оксиды, также как комплексы кремния, такие как карбид кремния (SiC), которые можно использовать отдельно или в комбинации с другими веществами, такими как нитрид кремния, нитрид алюминия, дисилицид молибдена и карбид вольфрама, альтернативно углерод и его оксиды, также как нитрид бора (BN), карбид бора (B4C).
3.4 Полые пористые капилляры или трубки
Вообще, все полимерные или керамические материалы, также как углеродные трубки, можно использовать для изготовления разделительных мембран, как перечислено выше, и аналогично они пригодны для изготовления полых капилляров. Материалы и размеры меняются в зависимости от различных областей применения.
Для использования в медицине
Длина полого волокна составляет величину между 30 и 500 мм, предпочтительно между 50 и 300 мм. Внешний диаметр такого полого волокна равен 0,1-1,5 мм, внутренний диаметр равен 0,01-1 мм и толщина стенок полого капилляра должна быть 5-200 мкм, предпочтительно 15-50 мкм.
Для промышленного использования
Полые волокна или трубки могут быть длиной между 150 мм и 2000 мм, предпочтительно между 500 мм и 1000 мм. Внешний диаметр таких полых волокон или трубок может быть между 1,5 мм и 10 мм, внутренний диаметр - между 1 мм и 4 мм, и толщина стенок полого капилляра должна быть от 200 мкм до 500 мкм, предпочтительно от 300 мкм до 400 мкм.
Стенки полых капилляров или трубок могут содержать поры. Пористость внутренних и внешних поверхностей полых капилляров или трубок, изготовленных для проницаемых для газов мембран, находится в интервале от 10 до 90%. Средний диаметр пор составляет 0-5 мкм и предпочтительно 0-1,5 мкм. Практически все полимерные материалы пригодны для изготовления полых капилляров или трубок. Особенно предпочтителен полиакрилонитрил. Пригодны также композитные материалы, полученные из органогелей и полимеров, также как керамические, целлюлозные и комбинированные из указанных материалов.
4. Материалы для функционализации поверхности
Выбор наиболее подходящего соединения в значительной степени зависит от подлежащих выделению карбоновых кислот. Можно использовать одно или более из соединений. В принципе, сеть зета-потенциалов поверхности раздела должна иметь положительный или отрицательный заряд, и указанная поверхность должна обладать органофильными/липофильными и гидрофобными свойствами. Соединения могут быть органическими или неорганическими, также как могут быть их комбинациями. Они включают, но ими не ограничиваются, алифатические или циклические углеводороды, также как их комплексные соединения, такие как холестерин, холевая кислота и ее производные, такие как хенодеоксихолевая кислота и урсодеоксихолевая кислота, тетраэфирные липиды и их конъюгаты.
Наиболее предпочтительны молекулы, имеющие заряд катиона, подобные циклогептатриенильному катиону, или содержащие электрофильные заместители, подобные йоду или брому.
Далее предпочтительны молекулы, имеющие аминогруппы (первичные, вторичные, третичные, четвертичные), подобные холину, этаноламину, диметиламину, триэтиламину, бетаину и их аналогам.
Далее предпочтительными являются молекулы ароматических углеродов, содержащие 2 или более атома азота, такие как диазин, такие как имидазол, инидазол, пурин, пиразол, пиримидин, пиридазин и триазин, такой как атразин, симазин, меламин, более конкретно 2,4,6-трифенилпирилий тетрафторборат (2,4,6-TPPT) и 1,3-бензодитиолилий тетрафторборат (1,3-BDYT), бромбензолдиазоний-, нитроний-, бензодитиолилий- и трифенилпирилий тетрафторборат.
Другими предпочтительными соединениями являются аргинин и его производные, такие как:
5-(диаминометилиденазанийил)-2-оксопентаноат, известный как оксоаргинин, (2S)-2-амино-5-[(N'-метилкарбамимидоил)амино]пентановая кислота, известная как омега-метиларгинин; 2-амино-5-(диаминометилиденамино)-N-(4-нитрофенил)пентанамид, известный как аргинин-4-нитроанилид; 2-бензамидо-5-(диаминометилиденамино)пентановая кислота, известная как бензоил-L-аргинин; (2S)-2-[[(2S)-2-амино-5-(диаминометилиденамино)пентаноил]амино]-5-(диаминометилиденамино)пентановая кислота, известная как ариниларгинин, (2S)-2-[[(2S)-2-амино-3-фенилпропаноил]амино]-5-(диаминометилиденамино)пентановая кислота, известная как фенилаланиларгинин; (2S)-2-амино-4-(диаминометилиденамино)бутановая кислота, известная как L-нораргинин; [1-амино-4-(диаминометилиденамино)бутил]гидрокси-оксофосфоний; (2S)-5-(диаминометилиденамино)-2-[(4-гидрокси-4-оксобутаноил)амино]пентановая кислота, известная как сукцинил-L-аргинин; (2S)-2-амино-5-[[амино(диметиламино)метилиден]амино]пентановая кислота, известная как N,N-диметил-L-аргинин; (2S)-2-(3-аминопропаноиламино)-5-(диаминометилиденамино)пентановая кислота, известная как бета-аланил-L-аргинин, 2-амино-5-[[амино-(фосфоноамино)метилиден]амино]пентановая кислота, известная как фосфоаргинин; 2-[[(2R)-5-(диаминометилиденазанийил)-1-оксидо-1-оксопентан-2-ил]азанийил]пентандиоат, известный как нопалин; 5-(диаминометилиденамино)-2-[(1-гидрокси-1-оксопропан-2-ил)амино]пентановая кислота, известный как октопин; (2S)-2-амино-5-[[амино-(гидроксиамино)метилиден]амино]пентановая кислота, известная как гидроксиаргинин; (2S)-2-(2-карбоксиэтиламино)-5-(диаминометилиденамино)пентановая кислота, известная как L-N2-(2-карбоксиэтил)аргинин; [(4S)-4-азанийил-5-гидрокси-5-оксопентил]-(диаминометилиден)азаний, известный как аргиндиум; 4-(диаминометилиденамино)бутанамид, известный как аугментин;
и соединения, содержащие аргинин и родственные аргинину молекулы, такие как:
аргинилфенилаланинанилид, 2-(4-аминобутил)гуанидин, известный как агмантин и его структурные аналоги; 2-(1-аминобутил)гуанидин; гидрохлорид 2-(4-аминобутил)гуанидина; 2-(4-аминобутил)-1-бромогуанидин; 2-(4-аминобутил)-1-хлоргуанидин; 2-(1-аминопропил)гуанидин; 2-(1-аминопропил)-1-(диамино-метилиден)гуанидин; 2-(3-аминопропил)-1-(диаминометилиден)гуанидин; 2-(3-аминопропил)гуанидин; 4-аминобутил(диаминометилиден)азаний; диаминометилиден-[3-(диаминометилиденамино)пропил]азаний; 2-[3-(диаминометилиденамино)пропил]гуанидин; 4-(диаминометилиденамино)бутанамид; 2-(4-аминобутил)-1-(дифторметил)гуанидин; [1-(диаминометилиден)пиперидин-1-ий-4-ил]метилазаний; [4-(аминометил)пиперидин-1-ий-1-илиден]метандиамин; 3-(2-аминоэтил)-2,5-дигидропиррол-1-карбоксимидамид; 3-(2-аминоэтилсульфанил)-1H-1,2,4-триазол-5-амин; 2-[3-(диметиламино)пропил]гуанидин; 3-(2-аминоэтил)азетидин-1-карбоксимидамид; 2-(3-аминопропил)гуанидин; 4-(аминометил)циклогексан-1-карбоксимидамид; 2-[2,2-бис(сульфанил)этил]гуанидин; 5-(аминометил)тиофен-3-карбоксимидамид; диаминометилиден-[4-(диаминометилиденазанийил)бутил]азаний; [амино-(диаминометилиденамино)метилиден]бутилазаний, [амино(бутилазанийилиден)метил]-(диаминометилиден)азаний; бутил(диаминометилиден)азаний.
Кроме того, фенилаланин и его производные, такие как:
4-гуанидинофенилаланин; N-гуанил-dl-фенилаланин; (2S)-2-[[(2S)-2-амино-5-(диаминометилиденамино)пентаноил]амино]-3-фенилпропановая кислота, известная как аргинилфенилаланин; (2S)-2-амино-3-[4-[(диаминометилиденамино)метил]фенил]пропановая кислота; 2-амино-3-фенилпропангидразид; (2S)-2-[[(2S)-2-амино-3-фенилпропаноил]амино]-5-(диаминометилиденамино)-N-нафталин-2-илпентанамид; и полифемузин I или II.
Кроме того, гуанидин и его аналогичные производные, такие как мочевина; 2-метилгуанидин; 2-[4-[4-(диаминометилиденамино)фенил]фенил]гуанидин; 3-(диаминометилиденамино)-5-[(диаминометилиденамино)метил]бензойная кислота; (2S)-2-амино-3-[4-(диаминометилиденамино)фенил]пропановая кислота; 2-[2-(азокан-1-ил)этил]гуанидин, известный как санотензин; N-(диаминометилиден)-2-(2,6-дихлорфенил)ацетамид, известный как гуанфацин; 2-[(3-йодофенил)метил]гуанидин; 2-метилгуанидин; 2-бутил-1-(диаминометилиден)гуанидин; 2-[(E)-[(1E)-1-(диаминометилиденгидразинилиден)пропан-2-илиден]амино]гуанидин; 2-[3-(1H-имидазол-5-ил)пропил]-1-[2-[(5-метил-1H-имидазол-4-ил)метилсульфанил]этил]гуанидин; 2-[(3-йоданилфенил)метил]гуанидин; 2-[йодо(фенил)метил]гуанидин; 2-бензилгуанидин; [(E)-N'-(N'-бензилкарбамимидоил)карбамимидоил]азаний; бензил(диаминометилиден)азаний; 2-[[4-[(диаминометилиденамино)метил]фенил]метил]гуанидин; 4-фенил-1,4-дигидро-1,3,5-триазин-2,6-диамин; 2-[[4-[[[амино-(диаминометилиденамино)метилиден]амино]метил]фенил]метил]-1-(диаминометилиден)гуанидин; 2-(2H-тетразол-5-ил)гуанидин; 4-[5-(4-карбамимидоилфенокси)пентокси]бензолкарбоксимидамид; 2-[карбамимидоил(метил)амино]уксусная кислота, известная как креатинин; 4-[2-(4-карбамимидоилфенил)иминогидразинил]бензолкарбоксимидамид; гидрохлорид 1-циано-2-метил-3-[2-[(5-метил-1H-имидазол-4-ил)метилсульфанил]этил]гуанидина; 2-[(Z)-[(1Z)-1-(диаминометилиденгидразинилиден)пропан-2-илиден]амино]гуанидин; 1-N-[амино(4-хлоранилин)метилиден]-1-N'-[N'-(4-хлорфенил)карбамимидоил]пиперазин-1,4-дикарбоксимидамид, метилглиоксаль бис(гуанилгидразон) (известный как митогуазон);
и бигуанидины, такие как
3-(диаминометилиден)-1,1-диметилгуанидин, известный как метформин; (1E)-2-[6-[[амино-[(E)-[амино(4-хлоранилин)метилиден]амино]метилиден]амино]гексил]-1-[амино-(4-хлоранилин)метилиден]гуанидин, известный как хлоргексидин; диметилоктадецил[3-(триметоксисилил)пропил]аммонийхлорид; октадецилгуанидинийхлорид; 1,10-бис(4-хлорфенил)-1,3,5,10,12,14-гексазадиспиро[5.2.5^9.2^(6)]гексадека-2,4,11,13-тетраен-2,4,11,13-тетрамин; гидрохлорид 3,5-диметил-4-фенилдиазенилпиразол-1-карбоксимидамида; N,N'-диоктадецилгуанидинийхлорид; 2,2,8,8-тетраалкил-3,4,6,7,8,9-гексагидро-2H-пиримидо-[1,2-a]-пиримидин; 3-(диаминометилиденамино)пропановая кислота; 2-[5-(диаминометилиденамино)пентил]гуанидин; 2-[4-(3-аминопропиламино)бутил]гуанидин: 2-(диамино-метилиденамино)уксусная кислота; 3-(диаминометилиденамино)бензойная кислота.
Кроме того, амины, такие как
бутанимидамид; гидрохлорид деканимидамида; 4-[4-(4-карбамимидоилфенил)фенил]бензолкарбоксимидамид; N,N-диметил-N'-(4-фенилметоксифенил)метанимидамид.
Кроме того, из аминокислот наиболее предпочтительны фенилаланин, изолейцин, лейцин, валин, аргинин, лизин, гистидин, триптофан, тирозин, пролин.
Кроме того, пептиды, состоящие из одной или более из указанных аминокислот. Наиболее предпочтительна "RDG"-пептидная последовательность (Arg-Asp-Glyc);
и белки и макромолекулы с известными липофильными свойствами, такие как альбумин, белки, связывающие жирные кислоты или обладающие свойством связывания жирных кислот, такие как аполипобелки, лактоглобулины, казеин. Кроме того, циклодекстрины или порфирины и тому подобные соединения, и вещества, подобные хлорину и корпину.
Амины и полиамины, такие как холин(2-гидроксиэтил(триметил)азаний); фосфохолин, бетаин(2-(триметилазанийил)ацетат); неостигмин; 2-[2,3-бис[2-(триэтилазанийил)этокси]фенокси]этилтриэтилазанийтрийод; [(2R)-2,4-дигидрокси-4-оксобутил]диметил-(тридейтериометил)азаний, известный как карнитин; 3-гидрокси-4-(триметилазанийил)бутаноат; 4-азанийилбутил(3-азанийилпропил)азаний, известный как спермидин; 3-азанийилпропил-[4-(3-азанийилпропилазанийил)бутил]азаний, известный как геронтин.
Кроме того, конъюгаты пептидов и карбоксилата, такие как (2S)-2,5-бис(3-аминопропиламино)-N-[2-(диоктадециламино)ацетил]пентанамид, известный как трансфектам; 6-амино-2-[[(2S)-2,5-бис(3-аминопропиламино)пентаноил]амино]-N,N-диоктадецилгексанамид; 2-амино-6-[[2-[3-[4-(3-аминопропиламино)бутиламино]пропиламино]ацетил]амино]-N,N-диоктадецилгексанамид;
и пептиды, такие как
(2S)-2-[[2-[[(2S)-2-амино-5-(диаминометилиденамино)пентаноил]амино]ацетил]амино]бутандиоевая кислота, известная как RGD-пептид; (2S)-2-[[(2S)-2-амино-5-(диаминометилиденамино)пентаноил]амино]бутандиоевая кислота, дипептиды аргинин-аспарагин, и
полипептиды, такие как 2-[[2-[[2-[[2-амино-5-(диаминометилиденамино)пентаноил]амино]-5-(диаминометилиденамино)пентаноил]амино]-5-(диаминометилиденамино)пентаноил]амино]бутандиоевая кислота; 2-[[2-(2,6-диаминогексаноиламино)-5-(диаминометилиденамино)пентаноил]амино]бутандиоевая кислота; 4-амино-2-[[2-амино-5-(диаминометилиденамино)пентаноил]амино]-4-оксобутановая кислота; 2-[[6-амино-2-[[2-амино-5-(диаминометилиденамино)пентаноил]амино]гексаноил]амино]-бутандиоевая кислота, известная как тимотринан; 2-[2-[[2-[[2-амино-5-(диаминометилиденамино)пентаноил]амино]-5-(диаминометилиденамино)пентаноил]амино]пропаноиламино]-бутандиоевая кислота; 3-[[2-амино-5-(диаминометилиденамино)пентаноил]амино]-4-[(1-гидрокси-1-оксопропан-2-ил)амино]-4-оксобутановая кислота; (2R)-2-[[(2S)-2-азанийил-5-(диаминометилиденазанийил)пентаноил]амино]бутандиоат.
Кроме того, белки, такие как альбумин, протамин, желатин, натрийуретические пептиды.
5. Акцепторные/адсорбентные молекулы/материалы
Процесс адсорбции определяют как адгезию молекул к поверхности. На основании природы связи между молекулой и поверхностью явление адсорбции можно подразделить на две категории: физическую сорбцию и химическую сорбцию. При физической сорбции не образуется никаких химических связей, и притяжение между адсорбентом и адсорбатом основано только на силах межмолекулярного электростатического взаимодействия, таких как силы Ван-дер-Ваальса. При химической сорбции адсорбат прилипает к твердой поверхности за счет образования химических связей с указанной поверхностью.
Если ассоциаты карбоновой кислоты и солюбилизирующего соединения адсорбированы во второй полости камеры или во втором контейнере, должен быть предусмотрен адсорбент, который пригоден для адсорбирования указанных ассоциатов.
Указанные соединения и/или материалы могут быть природного или искусственного происхождения. Примеры групп адсорбентных материалов, которые можно использовать в настоящем изобретении включают, но ими не ограничиваются, цеолиты, глины, активированный уголь, активированную окись алюминия, природные и синтетические полимеры, алканы, белки и силикагели. Материалы адсорбентов можно использовать в различных формах, таких как шарики, мембраны, волокна или покрытия. Возможны также комбинации различных адсорбентных материалов.
Цеолиты представляют собой микропористые алюмосиликатные минералы с пористой структурой, которые могут накапливать широкий круг катионов. Селективные в отношении формы свойства цеолитов также являются основой для их использования для молекулярной адсорбции. Они обладают способностью предпочтительно адсорбировать определенные молекулы, при этом, исключая другие. Примеры цеолитов включают, но ими не ограничиваются, амицит, аналцим, баррерит, беллбергит, бикитаит, боггсит, бревстерит, чабазит, клиноптилолит, ковлезит, дачиардит, эдингтонит, эпистильбит, эрионит, фауджазит, ферриэрит, гарронит, гисмондин, гмелинит, гоббинсит, гоннардит, гузекрекит, хармотом, херчелит, хеландит, лаумонтит, марикопалит, маззит, мерлиноит, мезолит, монтесоммаит, морденит, натролит, оффретит, паранатролит, паулингит, пентасил, перлиалит, филлипсит, поллицит, сколецит, содалит, натрийдачиардит, стеллерит, стиолбит, тетранатролит, томсонит, черничит, ваиракит, веллсит, виллхендерсонит и яагаваралит.
Глины представляют собой минеральные вещества, состоящие из мелких кристаллов двуокиси кремния и окиси алюминия. Минералы глины подразделяют на четыре основные группы: группу каолинита, группу монтмориллонита/смектита, группу иллита и группу хлорита. Примеры глин включают, но ими не ограничиваются, каолинит, дикит, накрит, пирофиллит, тальк, вермикулит, сауконит, сапонит, нонтронит, монтмориллонит, иллит, амезит, баилехлор, бентонит, чамозит, каеммерерит, кукеит, корундофилит, дафнит, деллесит, гониэрит, нимит, одинит или точамозит, пеннинит, паннантит, рипидолит, судоит и турингит.
Активированный углерод, называемый также активированным древесным углем или активированным углем, представляет собой форму углерода, которая была обработана таким образом, чтобы он стал крайне пористым и, тем самым, приобрел очень большую площадь поверхности, доступную для адсорбции или химических взаимодействий. На основании физических характеристик различают порошковый, гранулированный, экструдированный, пропитанный и покрытый полимером углерод.
Силикагель, оксид элемента кремния, представляет собой аморфную, сильно пористую, частично гидратированную форму кремния. Двуокись кремния встречается в природе, но может быть также получена синтетически. Кристаллическая двуокись кремния представляет собой ангидрид кремниевой кислоты, и поэтому силикагель представляет собой полимерную форму кремниевой кислоты. Кроме того, можно использовать пирогенную двуокись кремния, такую как Aerosil® или филлосиликаты, такие как тальк, гекторит и монтмориллонит, также как их полимерные покрытия.
Используют также синтетические полимеры, которые состоят из большого числа сильно сшитых микросфер. Такие микросетчатые структуры обеспечивают большую площадь поверхности и однородные по размеру поры. Примеры синтетических полимеров включают, но ими не ограничиваются, полиакрилат, полиамид, поли(сложный эфир), поликарбонат, полиимид, полистирол, акрилонитрилбутадиенстирол, полиакрилонитрил, полибутадиен, поли(бутилентерефталат), поли(эфирсульфон), полиэфирэфиркетон, полиэтилен, поли(этиленгликоль), поли(этилентерефталат), полипропилен, поли(метилметакрилат), поли(эфирэфиркетон), политетрафторэтилен, смолы на основе стирол-акрилонитрила, поли(триметилентерефталат), полиуретан, поливинилбутираль, поливинилхлорид, поливинилидендифторид, поли(винилпирролидон).
Предпочтительны поли(метилметакрилат) и полиэфирэфиркетон.
Связывающую способность можно повысить за счет функционализации поверхностей вышеуказанных материалов. Это можно осуществить, используя молекулы, обладающие органофильными свойствами. Такими свойствами обладают молекулы, указанные в разделе "Материалы для функционализации поверхности". Их можно использовать в предпочтительных вариантах.
Предпочтительный класс составляют молекулы, содержащие аминогруппы (первичные, вторичные, третичные, четвертичные), кальций или магний.
6. Органогели
Наиболее общим определением для геля является макроскопическое твердое вещество, жидкость, которая не обладает свойством стационарного течения. Другими словами, гель представляет собой твердый, желеобразный материал, который обладает свойствами в интервале от мягких и слабых до твердых и плотных. Трехмерная структурная сетка сшивок образует структуру геля.
Органогели представляют собой некристаллические, непрозрачные термообратимые твердые материалы, состоящие из жидкой органической фазы, которая претерпевает гелеобразование в виде трехмерной сшитой сетки. Свойства органогеля, такие как эластичность и твердость, определяются его растворимостью и размерами частиц. Жидкая органическая фаза желируется низкомолекулярными желирующими агентами, так называемыми гелеобразующими агентами. Органогели часто основаны на самоассоциациях органических молекул. На основании их характеристик органогели можно подразделить на твердые матричные и жидкие матричные органогели. Твердые гели представляют собой прочные системы, которые образуют устойчивые жесткие сетки при определенной температуре, тогда как жидкие гели образованы кратковременными сетками. Являются ли гели похожими на твердые вещества, характеризующимися устойчивыми жесткими сетками, такими как в вулканизированной резине, или гелями, похожими на жидкости, характеризующимися кратковременными сетками, такими как в невулканизированном природном каучуке, это также можно использовать для классификации гелей.
Почти все органические растворители могут быть с успехом преобразованы в гели, как включающие по определению алифатические и ароматические углеводороды, такие как гептаны, октан, нонан, декан, бензол, толуол, этилбензол, газолин, керосин, смазочные масла и подобные нефтяные фракции и галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, метилхлороформ, перхлорэтилен, пропилендихлорид, метиленбромид, этилендибромид, бутилбромид, аллилхлорид и пропаргилбромид или пропаргилхлорид. Другие типы органических жидкостей также образовывали гели, такие как минеральные и растительные масла, лецитин, полисилоксаны, парафины, нематические и смектические жидкокристаллические материалы, электролиты, полимеризуемые жидкости и другие.
Органические жидкости образуют гели под действием низкомолекулярных органожелаторов или полимерных желаторов. Органожелаторы создают трехмерную сеть за счет переплетения нановолокон или нанолент, образованных за счет самоорганизации в результате нековалентных взаимодействий, таких как водородные связи, взаимодействия Ван-дер-Ваальса, π-укладка и координация.
Благодаря природе внутримолекулярных взаимодействий образование гелей является термообратимым процессом.
Некоторые гелеобразующие агенты могут превращать в гель определенные растворители. Требованием для процесса гелеобразования является плохая растворимость гелеобразующего агента, так как соединение с плохой растворимостью и не склонное к кристаллизации, наиболее вероятно, будет образовывать гель. Затем растворитель захватывается в поры сетки и микрокристаллы гелеобразующего агента под действием капиллярных сил.
Молекулы, которые могут функционировать как LMWG (низкомолекулярный гелеобразующий агент), включают производные жирных кислот, производные стероидов, производные антрила, гелеобразующие агенты, содержащие стероидные и конденсированные ароматические кольца, аминокислотного типа органогелеобразующие агенты, смешанные типы гелеобразующих агентов и двухкомпонентные системы.
В качестве LMWG используют, например, углеводороды, галоалканы, спирты, ацетон, алканы, циклоалканы, гексадеканы, циклогексаны, толуол, p-ксилол, циклогексанон, дихлорэтан, ДМСО, этанол, пропанол, минеральное масло, керосин, хлорбензол, рапсовое масло, этилацетат, диалкилфталаты, ДМФ, DMA, диоксин, силиконовое масло, CHCl3, CH2Cl2, CCl4, ароматические углеводороды, пиридин, ацетонитрил, кетоны, диэтиловый эфир, галогенированные алканы, алифатические углеводороды, алифатические спирты, алифатические амины, метанол, масла, тетралин, додекан, длинноцепочечные алифатические углеводороды, циклоалканы, алкиллаураты, триалкиламины, метакрилаты и другие металлические мыла, жирные кислоты, перфторалкилалканы, стероиды, воски, производные мочевины, циклические соединения бисмочевины, терефталаматы, холамиды, углеводы, гемини-типа тенсиды, амиды болаформ аминокислот, камфорилтиосемикарбазид, циклопептиды, амиды аминокислот, белки, такие как альбумин, или белки, связывающие жирные кислоты, антранил, производные антрила, феназины, тримезамидтиофены, гелицены, лецитины, гидроксипропилметилцеллюлозу, нитроцеллюлозу или желатин, макроциклические гелеобразующие агенты, циклогексиламиды, циклогексанолы, производные холестерина, болаамфифилы, щелочные ураты, гуаниловые кислоты, нуклеозиды, бромфенол синий, конго красный, деоксихолаты, холаты и другие.
Органогели получают, добавляя гелеобразующий агент к растворителю, который должен образовать гель. Это может произойти при добавлении гелеобразующего агента к растворителю, при перемешивании раствора и нагревании его, при необходимости, до образования раствора. При охлаждении происходит желатинизация (горячая желатинизация). Гелеобразующий агент можно также добавить к небольшому количеству растворителя и нагревать до растворения, затем добавить раствор к растворителю, перемешать и оставить (холодная желатинизация). Органогели используют, и они имеют потенциал для использования в ряде применений, таких как фармацевтика, для доставки лекарств, в косметике, при консервации произведений искусства и в исследованиях.
Способность органогелей образовывать самоорганизующиеся структуры обеспечивает им большой потенциал для применения в нанотехнологиях. Ученые создали органические гелевые материалы, которые обладают наноразмерными пустотами, соединенными между собой сквозь образовавшуюся массу. Они обеспечивают массоперенос, управляемый капиллярными силами.
Органогели можно также использовать как матрицу для иммобилизации ферментов. Была описана липаза, которая была инкапсулирована в лецитине, и органогели на основе микроэмульсий, образованные с гидроксипропилметилцеллюлозой или желатином. Инкапсулированная липаза сохраняет свою способность катализировать взаимодействия этерификации.
Предпочтительно, использовать органогели, обладающие нанопустотами с липофильными свойствами. Другой предпочтительной формой органогеля является препарат ксерогеля.
7. Акцепторные растворы
Акцепторные растворы могут быть водными, органическими или эмульсиями. Водные растворы должны содержать растворенные или иммобилизованные акцепторные молекулы, как перечислено в разделе 4. Материалы для функционализации поверхности, или акцепторные материалы, как перечислено в разделе 5. Акцепторные/адсорбентные молекулы/материалы.
Органические растворы могут включать алканы, алкены, алкины, карбоновые кислоты, сложные эфиры, альдегиды, кетоны, ароматические углеводороды, моно-, ди- или триацилглицерины, силиконовые масла, органические растворители, подобные н-гексану, сложные эфиры, тетрагидрофуран, кетоны, лактоны, ацетон, ацетонитрил, нитрометан, нитроаран, диметилформамид, спирт, метилсиланы, октаметилциклотетрасилоксан, амиды, подобные формамиду, триэтиламин.
8. Добавки для получения солюбилизирующих соединений
Ряд солюбилизирующих соединений, таких как аргинин, протонируется в воде, что определяется их характеристикой как основания. Достигнутое значение pH зависит от соответствующей концентрации. Поэтому такое солюбилизирующее соединение может вызвать денатурацию белка или цитолиз, если его используют в высокой концентрации. Так как указанные солюбилизирующие соединения в основном представляют собой амфифильные молекулы, они имеют тенденцию к образованию агрегатов в результате электростатических взаимодействий между отрицательно заряженной карбоксигруппой и положительно заряженной α-аминогруппой при значениях pH>8, таким образом, образуя полимеры. Поэтому может оказаться желательным осуществить протонирование раствора по настоящему изобретению с солюбилизирующим соединением до некоторой степени с целью корректировки pH раствора. Предпочтительными протонирующими агентами являются короткоцепочечные карбоновые кислоты, хлористоводородная кислота (HCl), бромистоводородная кислота (HBr), серная кислота, фосфорная кислота, муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, пентановая кислота, лимонная кислота, щавелевая кислота, малоновая кислота, салициловая кислота, p-аминосалициловая кислота, яблочная кислота, фумаровая кислота, янтарная кислота, аскорбиновая кислота, малеиновая кислота, сульфоновая кислота, фосфоновая кислота, перхлоркислота, азотная кислота, глюконовая кислота, молочная кислота, винная кислота, гидроксималеиновая кислота, пировиноградная кислота, фенилуксусная кислота, бензойная кислота, p-аминобензойная кислота, p-гидроксибензойная кислота, метансульфоновая кислота, этансульфоновая кислота, азотистая кислота, гидроксиэтансульфоновая кислота, этиленсульфоновая кислота, p-толуолсульфоновая кислота, нафтилсульфоновая кислота, сульфаниловая кислота, камфорсульфоновая кислота, сульфоновая кислота, China кислота, миндальная кислота, o-метилминдальная кислота, гидробензолсульфоновая кислота, пикриновая кислота, адипиновая кислота, D-o-толилвинная кислота, тартроновая кислота, α-толуиловая кислота, (o, m, p)-толуиловая кислота, нафтиламинсульфоновая кислота, и другие минеральные кислоты и особенно уксусная кислота, лимонная кислота, молочная кислота, ацетилсалициловая кислота и салициловая кислота, бензойная кислота, аскорбиновая кислота, фолиевая кислота, или аминокислоты, такие как аспарагиновая кислота или глутаминовая кислота.
Предпочтительное значение pH для солюбилизации жирных кислот в среде находится между 7,4 и 10.
9. Микро- или наноэмульсии
Настоящее изобретение также относится к микроэмульсиям и наноэмульсиям в гидрофильном растворителе и особенно в воде, содержащей карбоновую кислоту, включая карбоновые дикислоты, трикислоты, также как жирные тетракислоты, и по меньшей мере одно солюбилизирующее соединение, где указанное солюбилизирующее соединение содержит по меньшей мере одну амидиногруппу и/или по меньшей мере одну гуанидиногруппу, и где указанное соединение имеет коэффициент разделения н-октанол-вода KOW<6,30. Таким образом, микроэмульсия по настоящему изобретению и наноэмульсия по настоящему изобретению содержат по меньшей мере одну карбоновую кислоту и особенно жирную кислоту и по меньшей мере одно солюбилизирующее соединение, как здесь раскрыто.
Солюбилизирующие соединения раскрыты выше подробно, и указанные солюбилизирующие соединения образуют микроэмульсию или наноэмульсию с карбоновой кислотой. Солюбилизирующие соединения имеют предпочтительно то же самое число атомов углерода, как раскрыто выше, предпочтительно ту же самую структуру, что раскрыта выше, и предпочтительно представляют собой производные аргинина, как раскрыто в описании, имеют предпочтительно тот же самый интервал значений pH для взаимодействия солюбилизации, предпочтительно то же самое молярное отношение карбоновой кислоты к солюбилизирующему соединению и предпочтительно те же самые условия взаимодействий, что раскрыты выше для солюбилизирующих соединений вообще.
Основные характеристики макро- и наноэмульсий, как определено в разделе B.
Существенной является спонтанная молекулярная самоассоциация солюбилизирующего вещества и карбоновой кислоты, которая возникает в результате электростатических сил взаимодействия, как было указано ранее. Они состоят из димеров, которые отличаются слабой тенденцией к агрегации с мицеллами. В наноэмульсиях все карбоновые кислоты могут быть связаны с солюбилизирующим веществом, создавая монопластные однофазные эмульсии без мицелл. Размер большинства пузырьковых структур, который можно измерить способом динамического светорассеяния (DLS), оказывается <150 нм для эмульсий с молекулярным отношением 1:1, см. также пример 12. При большем количестве солюбилизирующего соединения измеряемые пузырьки становятся меньше. При отношении 10:1 размер 98% пузырьков оказывается <2 нм в диаметре, и не обнаруживается агрегатов более крупных, чем 25 нм. Такая самоассоциация наночастиц является основной характеристикой наноэмульсий. Наноэмульсии полностью прозрачны и стабильны в течение более чем 6 месяцев при температурах в интервале от -20 до 100°C. Снижение pH при добавлении кислоты (HCl) уменьшает сольватационную способность, что можно преодолеть за счет добавления аргинина. Однако величина pH раствора является критической для наноэмульсификационной способности аргинина, которая снижается при значениях pH ниже 8.
Следующей основной характеристикой использования микро- или наноэмульсий по настоящему изобретению является солюбилизирующий/высвобождающий эффект, связанный с уменьшением поверхностного натяжения. Он обеспечивает проникновение и заполняемость наноразмерных пустот и капилляров. Амфифильная природа 1:1 агрегатов обеспечивает прилипание или адсорбцию на липофильных или гидрофильных веществах, соответственно твердых веществах, тем самым изменяя силы межфазного взаимодействия вышеуказанных веществ, соответственно твердых веществ, и/или обеспечивая разделение молекул указанной микро- или наноэмульсии по настоящему изобретению и/или молекул, растворенных в указанных микро- или наноэмульсиях по настоящему изобретению, внутри или на вышеуказанных веществах, соответственно твердых веществах, и обеспечивая сольватацию, ожижение, отделение или конвекцию вышеуказанных веществ, соответственно твердых веществ, как показано в примерах 5, 9 и 10.
Решительным преимуществом аргинина или солюбилизирующего соединения формулы I или II является то, что нет необходимости в сорастворителе для образования макро- или наноэмульсий. Однако добавление сорастворителя может повысить вышеописанный эффект солюбилизации.
Микроэмульсии и наноэмульсии предпочтительно имеют значение pH>7,0 и более предпочтительно в интервале значений pH от 7,0 до 9,0. Однако в зависимости от среды, из которой необходимо выделить карбоновые кислоты, значения pH микроэмульсий и наноэмульсий могут быть вплоть до 14, хотя предпочтительно использовать интервал значений pH между 7,0 и 8,0, если карбоновые кислоты нужно удалить из крови. Однако, если достигается неполная солюбилизация, что можно наблюдать, если микроэмульсия или наноэмульсия является непрозрачной и/или не бесцветной, можно добавить дополнительно солюбилизирующее соединение или можно повысить значение pH, или использовать обе указанные возможности до тех пор, пока не образуются прозрачные и в большинстве случаев бесцветные микроэмульсии или наноэмульсии.
Кроме того, микро- или наноэмульгирование карбоновых кислот можно использовать для обеспечения, соответственно, ускорения или замедления, соответственно, завершения их химических взаимодействий, как известно специалистам в данной области. Неионные жидкости или амфифильные поверхностно-активные агенты были использованы для растворения карбоновых кислот для такой цели. Однако до сих пор не было сообщений об использовании аргинина или солюбилизирующих соединений формулы I или II для таких изменений химической реакционной способности. Было обнаружено, что наноэмульгирование ускоряет химические взаимодействия как алкильных, так и карбоксильных групп, что продемонстрировано в примере 11. Слабые ионные силы и высокая стабильность указанных эмульсий являются решающими преимуществами при сравнении с ионными или неионными эмульгаторами. Кроме того, указанные эмульсии можно использовать в качестве реагент-специфических или продукт-специфических эмульгаторов, которые можно легко удалять из солюбилизированных карбоновых кислот, также как из органических реакционных растворов (Пример 9).
Чертежи
Фиг.1 представляет собой блок-схему процесса солюбилизации и способа выделения по настоящему изобретению.
Фиг.2 представляет собой интегрированный диализатор/экстрактор для очистки крови от летучих жирных кислот.
Фиг.3 представляет собой обменный модуль для карбоновой кислоты.
Фиг.4 представляет собой интегрированный диализатор/экстрактор для солюбилизации примесей карбоновых кислот, который можно использовать при промышленной переработке масел.
Фиг.5 относится к электрофоретической или электростатической фильтрации или диффузии для выделения, которые можно использовать для способа солюбилизации по настоящему изобретению.
Фиг.6 представляет собой другой вариант интегрированного диализатора/экстрактора для очистки крови от летучих жирных кислот.
Фиг.7 изображает типичный интегрированный диализатор/экстрактор.
Фиг.8 представляет собой вариант интегрированного диализатора/экстрактора, который можно использовать при переработке сырых масел, при промышленной переработке пищевых продуктов, при промышленной обработке сточных вод, содержащих биоорганические соединения, или в любых других промышленных процессах или связанных с окружающей средой процессах.
Фиг.9 представляет собой вариант упрощенного интегрированного диализатора/экстрактора для промышленного применения.
Фиг.10 представляет собой следующий вариант упрощенного интегрированного диализатора/экстрактора, который можно использовать для солюбилизации и выделения карбоновых кислот из органических растворов, состоящих из белков, аминокислот и других водорастворимых молекул, во время фармацевтической, химической, биологической или промышленной переработки с помощью жидкость-жидкостного разделения.
ПРИМЕРЫ
Пример 1
Исследование возможности удаления жирных кислот из плазмы с помощью диализа.
Неэтерифицированные жирные кислоты, хотя и представляют собой небольшие молекулы, не подвергаются диализу в водной среде, так как они образуют мицеллы благодаря своим низким значениям CMC, и поэтому слишком велики, чтобы просочиться сквозь обычные микропоры. Способ солюбилизации по настоящему изобретению повышает CMC и обеспечивает образование наноэмульсий, позволяющих эффективно выделить жирные кислоты. Поэтому солюбилизированные жирные кислоты присутствуют в виде анионов.
Использование способа солюбилизации по настоящему изобретению для очистки плазмы от летучих жирных кислот исследуют в модельной системе диализа. Указанная система состоит из ячейки диализатора, соединенной с трубками, двух резервуаров и двух перистальтических насосов. Диализаторная ячейка состоит из двух уплощенных стеклянных полусфер с уплощенными краями. Края обеих полусфер скреплены с тефлоновым держателем мембраны с помощью уплотнительного кольца, за счет чего герметизируются полости. Держатель диализной мембраны состоит из двух тефлоновых O-колец у которых имеются выступ и паз для того, чтобы можно было вставить мембрану диаметром 47 мм и закрепить указанную мембрану, сжимая оба О-кольца вместе. Каждая из стеклянных полусфер имеет сверление у противоположных полюсов, где смонтирована стеклянная воронка, соединенная со стеклом полусферы наконечником, причем ее основание направлено к мембране. Воронка функционирует как входное отверстие. Следующее отверстие полусфер соединено со стеклянной трубкой, функционирующей как выходное отверстие. Вход и выход соединены PTFE трубками. Трубка, соединенная с впускным отверстием, разделена силиконовой трубкой, составляющей часть перистальтического насоса. Концы впускной и выпускной трубок соединены в PTFE резервуаре, полный объем которого составляет 200 мл. Впускная трубка соединена с Y-образным адаптером, который имеет уплотнитель зажимного типа, через который проведен провод датчика давления в диализную камеру и закреплен снаружи. Исследование осуществляют в двойном экземпляре, используя одну из следующих мембран: поликарбонатную 'track-etch', 0,4 мкм (Satorius, Germany); полиарилэфирсульфоновую с отсечением 10000 Дальтон (Gambro, Germany); PVDF с отсечением 40 кДа (Rhone-Poulenc, France); PTFE, 0,05 мкм (Sartorius, Germany); алюминийоксидную (Anodisc), 0,02 мкм (Whatman, USA).
Для экспериментов используют плазму крови человека. Олеиновую кислоту (техническая степень чистоты, Sigma, Germany) добавляют до получения l00 ммоль раствора. Полученный раствор оставляют для растворения при перемешивании при 37°C в течение 10 минут. Затем добавляют 100 мл деионизированной воды или раствор аргинина (0,5 моль/л) при отношении объемов 1:1. Донорский сайт диализной системы заполняют 250 мл указанного раствора; при этом стараются исключить образование воздушных пузырьков. Акцепторный сайт диализной системы заполняют 250 мл 10% раствора альбумина. Перистальтические насосы прокачивают объем 200 мл/мин через обе полусферы. Принимают предосторожности, чтобы поддерживать одинаковое давление в обеих диализных камерах, причем разности между давлениями в полусферах выравнивают с помощью вентиля, соединенного с выпускным трубопроводом. Диализ осуществляют в течение 30 минут каждый. Объемы образцов отбирают после заполнения системы каждые 10 минут с донорной и акцепторной сторон. Водные образцы переносят в изооктан и сушат в потоке азота. Метилирование осуществляют, добавляя содержащую метанол 2% серную кислоту, и образец нагревают в течение 15 минут при 70°C. Образцы снова растворяют в воде и изооктане. Органическую фазу выделяют после центрифугирования и анализируют, используя ГХ (газовую хроматографию).
Результаты анализа показывают, что если диализ осуществляют без аргинина, в акцепторном растворе оказывается лишь незначительное количество олеиновой кислоты, или ее вовсе не оказывается. В случае диализа, осуществляемого с добавлением аргинина, наблюдается пропорционально увеличение содержания олеиновой кислоты в акцепторном растворе по сравнению с ее концентрацией в донорном растворе, и увеличение содержания олеиновой кислоты пропорциональное длительности диализа. Указанное повышение оказывается несколько меньше, если используют гидрофильные мембраны, такие как целлюлозная или полиарилэфирсульфоновая, и несколько больше, если используют гидрофобные мембраны, такие как PVDF и PTFE мембраны.
В следующей серии экспериментов исследуют возможности электродиализа. Для указанной цели описанную ячейку диализатора модифицируют, помещая в обе воронки платиновые сетки. Их соединяют с генератором высокого напряжения (EasyPhor, Biozyme, Germany) через герметизированные провода, которые подведены к Y-разъемам. Диализ осуществляют, используя те же самые мембраны, что и в предыдущем эксперименте и в тех же самых условиях, но используя различный DC (постоянный ток) при фиксированном напряжении 40 В. Образцы приготавливают, как описано раньше. Исследования повторяют, используя стеариновую кислоту и линоленовую кислоту. Результаты, полученные для олеиновой кислоты, можно подтвердить.
Вывод: Солюбилизация жирных кислот, связанных с белками плазмы, с использованием раствора аргинина и выделением жирных кислот с помощью электродиализа, осуществима.
Пример 2
Исследование сольватации аргинином для анализа содержания в плазме жирных кислот
Неэтерифицированные и этерифицированные жирные кислоты имеют важные функции в физиологии. Однако нарушение пропорции критических жирных кислот является патогенным при ряде заболеваний, таких как атеросклероз, гипертония или сахарный диабет. Поэтому существует необходимость в их точном определении для предотвращения, диагностики и контроля за процессом лечения. Клинические рутинные анализы созданы только для определения триглицеридов. Доступные аналитические способы для определения содержания летучих жирных кислот в крови являются редкими и дорогостоящими. Определение триглицеридов осуществляют, используя факт отсутствия. Однако результат позволяет только оценить истинное содержание этерифицированных жирных кислот, так как определяют ферментативно высвобожденный глицерин. Так как содержание жирных кислот, этерифицированных глицерином, может меняться, реальная концентрация является неопределенной. Кроме того, не существует универсального способа характеризации жирных кислот в соответствии с их классификацией.
Осуществляют сравнение результатов, для 10 образцов крови между клиническими рутинными способами определения триглицеридной фракции, аналитическим способом по настоящему изобретению и сравнительным способом. Для всех измерений кровь забирают натощак у пациента в сывороточную “monovette” (новая система взятия крови вакуумным шприцом с контейнером). Образцы оставляют коагулировать в течение 20 минут и центрифугируют со скоростью 3000 об/мин в течение 15 минут. Плазму выделяют и гомогенизируют перед тем, как распределяют объемы образцов в 3 пробирки Эппендорфа. В качестве внутреннего стандарта в образцах используют маргариновую кислоту для ГХ и электрофореза в наноорганогеле.
Ферментативная стандартная процедура для определения триглицеридов
Осуществляют клиническую процедуру в соответствии со стандартным ферментативным анализом (Serum Triglyceride Determination Kit, Catalog Number TR0100, Sigma-Aldrich, USA).
Образцы приготавливают следующим образом:
Не содержащий глицерина реагент (0,8 мл) вводят с помощью пипетки в каждую кювету и добавляют 10 мл (0,01 л) воды и глицерин в качестве стандарта. Затем их перемешивают, осторожно переворачивая, и инкубируют в течение 5 минут при 37°C. Регистрируют начальное поглощение (IA) контрольного образца, стандарта и образца на длине волны 540 нм против воды в качестве сравнительного соединения. В каждую кювету добавляют восстановленный триглицеридный реагент (0,2 мл), смешивают и инкубируют при 37°C еще в течение 5 минут. Регистрируют конечное поглощение (FA) контрольного образца, стандарта и образца на длине волны 540 нм против воды в качестве сравнительного соединения. Рассчитывают концентрации глицерина, истинных триглицеридов и всех триглицеридов в образце.
Стадии взаимодействий представлены следующим образом:


Определение жирных кислот с помощью ГХ
Образцы для измерений с помощью ГХ экстрагируют в соответствии с модифицированным способом Фолча (Folch, Lees & Sloan Stanley, 1957). Коротко, 2 г образца отвешивают в стеклянную колбу; добавляют 10 мл метанола+0,01% BHT, встряхивают и осаждают в течение нескольких минут. Добавляют CHCl3 (20 мл), раствор встряхивают и осаждают в течение нескольких часов или в течение ночи в холодильнике в атмосфере N2. Полученный раствор дважды фильтруют, добавляют 7 мл KCl и дополняют вплоть до 250 мл метанолом. Низкомолекулярную фракцию затем экстрагируют, фильтруя через Na2SO4 в чистую, большего размера центрифужную ампулу, и растворитель выпаривают. Затем липид переносят в ГХ ампулу, добавляют в ампулу 0,5 мл гексана+0,01% BHT, интенсивно встряхивают для растворения липида, затем, используя пастеровскую пипетку, переносят в ГХ ампулу, и ГХ осуществляют в соответствии со следующим протоколом: водные образцы переносят в изооктан и сушат потоком азота. Метилирование осуществляют, добавляя метанол, содержащий 2% серную кислоту, и нагревая образец в течение 15 минут при 70°C. Образцы снова растворяют в воде и изооктане. Органическую фазу выделяют после центрифугирования и анализируют, используя ГХ.
Анализ жирных кислот с помощью аналитического способа по настоящему изобретению
Устройство для анализа сконструировано, как раскрыто выше. Коротко, донорная камера и аналитическая камера разделены щелью для помещения разделительной среды. Края щели имеют уплотнения, которые позволяют полностью изолировать камеры и сменную поверхность разделения фаз. Камеры для анолита и католита разделены на донорную и акцепторную камеры, соответственно, расположенные на противоположных сторонах поверхности разделения фаз. Камеры анолита и католита разделены на донорную и акцепторную камеры ионоселективной мембраной. В камерах анолита и католита установлены платиновые электроды (Umicor, Germany), которые соединены с генератором высокого напряжения (EasyPhor, Biozyme, Germany).
Сменная поверхность разделения фаз состоит из PTFE O-кольца с диаметром 2,5 см и глубиной 3 мм, которое заполнено до краев смесью жидкий растворитель-гель. Органогель приготавливают, используя раскрытый всюду способ (Suzuki et al: Two-component Organogelators based on two L-Amino acids: Effect of Combination of L-Lysine with Various L-Amino-Acids on Organogelation behaviour, Langmuir, 2009, 25, 8579-8585). После образования геля обе стороны органогеля покрывают 'Track-Etched' поликарбонатной мембраной с диаметрами пор 1,0 мкм (Nucleopore, Whatman, USA), которая прикреплена к краям O-кольца. Поверхность раздела фаз тщательно уплотнена в пространстве между донорной и акцепторной камерами, и эту плотность контролируют.
Плазму (1 мл) и 1 мл раствора аргинина (200 ммоль/л) перемешивают на вортексе в течение 2 мин, инкубируют в течение 5 мин при 40°C и снова перемешивают на вортексе в течение 2 мин. Добавляют три коммерческие липазы (липазы A1 и A2 были поджелудочными липазами и липаза A3 была грибковой липазой), растворенные в толуоле, и осторожно перемешивают в течение 15 минут при 37°C. Образец взвешивают до и после отбора пипеткой 100 мкл. Отобранный пипеткой объем выливают в донорную камеру аналитического устройства. В акцепторную камеру помещают 100 мкл ацетонитрила. Анолитную и католитную камеры заполняют раствором аргинина 100 ммоль/л. В течение 15 минут пропускают постоянный ток при напряжении 40 Вольт. Содержимое акцепторной камеры собирают пипеткой и переносят в зонд. Акцепторную камеру промывают другой порцией 100 мкл ацетонитрила, который добавляют к содержимому зонда. Затем измеряют содержание жирных кислот, используя FT-NIR spectrometer MPA (спектрометр в ближней инфракрасной области с Фурье преобразованием)(Bucker Optic, Germany). На основании этих измерений рассчитывают содержание жирных кислот во всем образце.
Результаты: Сравнение результатов, полученных с помощью указанных трех аналитических способов, показывает, что (1) ферментативный косвенный способ определения триглицеридов преуменьшает количественное содержание жирных кислот в крови человека по сравнению с двумя другими способами, (2) результаты, полученные с помощью аналитического способа по настоящему изобретению и способа ГХ для определения полного количества жирных кислот, одинаковы, и (3) определение содержания различных жирных кислот с помощью аналитического способа по настоящему изобретению демонстрирует высокую степень корреляции с результатами, полученными с помощью ГХ.
Пример 3
Исследование очищающей способности аргинина и других солюбилизирующих соединений для очистки сырых растительных масел
Сырые растительные масла содержат различные количества неэтерифицированных жирных кислот. Так как указанные жирные кислоты понижают стабильность масел, их удаляют в процессе очистки до содержания менее 0,5%. Существуют два способа, используемые при переработке масел: омыление и дистилляция. Во время осуществления указанных процессов очистки могут произойти изменения этерифицированных жирных кислот. Поэтому было желательно исследовать применимость способа по настоящему изобретению для солюбилизации и выделения неэтерифицированных жирных кислот с помощью аргинина, и проанализировать влияние указанных способов на качество этерифицированных жирных кислот.
Исследуют сырые масла сои и рапса. Для указанной цели 10 литров сырого масла выливают в 50-литровый резервуар. Приготавливают 0,5 молярный раствор аргинина, добавляя 871 г аргинина к 10 литрам деионизированной воды. Аргинин оставляют растворяться, медленно вращая и нагревая раствор при 40°C в течение 2 часов. Соответствующие исследования осуществляют, используя L-NG-монометиларгинин, аргининосукциновую кислоту, L-канаванин, 2-гуанидиноглутаровую кислоту. Указанные растворы добавляют к сырому маслу, и эмульсии перемешивают в течение 1 часа, при этом нагревая до 40°C. Затем эмульсии оставляют осаждаться в течение 24 часов. После этого водные фазы сливают через гидрофильное сито, которое не пропускает триглицериды и которое расположено в конической нижней части резервуара. Водные растворы взвешивают, и образцы отбирают из органической и водной фаз. Образцы водных фаз подкисляют серной кислотой до значения pH около 3.
Образцы органических фаз выливают в образцовые ампулы установки для титрования. К 5 мл органической фазы добавляют 20 мл смеси этанол/гексан (1:1, об/об) с 3 каплями 1% фенолфталеина в этаноле, и перемешивают до тех пор, пока раствор не становится полностью прозрачным. Затем образцы титруют, используя KOH в этаноле, до появления розоватого оттенка, что указывает на количество неэтерифицированных жирных кислот. Содержание жирных кислот рассчитывают по формуле CFFA[ммоль/л]=(VK0H[I]·Скон[моль/л])/Vобр[l]·1000
VKOH/CKOH: объем/концентрация израсходованного KOH в этаноле
Vобр: использованный объем образца
CFFA: концентрация свободных жирных кислот
Образцы пищевого масла, полученные из того же источника, что и сырое масло после промышленной очистки, анализируют по содержанию в них неэтерифицированных жирных кислот. Кроме того, образцы из органических фаз гидролизуют и анализируют с помощью ГХ, как раскрыто выше.
Результаты: Анализы показывают, что содержание неэтерифицированных жирных кислот в сыром масле, которое вначале составляло 2,0 и 2,6%, можно снизить до 0,2 и 0,6%, используя способ по настоящему изобретению с помощью жидкость-жидкостного экстрагирования в комбинации со способом солюбилизации по настоящему изобретению. Значения, полученные для неэтерифицированных жирных кислот, оказались незначительно меньше, чем значения для образцов после их промышленного удаления. Кроме того, сравнение содержания триглицеридов жирных кислот по данным ГХ отличается от их содержания в зависимости от способов экстрагирования. При сравнении с жирными кислотами органической фазы вышеуказанного жидкость-жидкостного экстрагирования, жирные кислоты масла, очищенные способом омыления, демонстрируют более низкие концентрации ненасыщенных жирных кислот, хотя содержание жирных кислот с одинаковым числом атомов углерода было примерно одинаково. С другой стороны, жирные кислоты масла, очищенного способом дистилляции, демонстрируют большее количестве транс-изомеров ненасыщенных жирных кислот, чем при жидкость-жидкостном экстрагировании, также как несколько меньшее общее содержание ненасыщенных жирных кислот.
Пример 4
Исследование способности аргинина растворять большие количества карбоновых кислот в сыром и отработанном маслах.
У сырого пальмового масла содержание неэтерифицированных жирных кислот составляет вплоть до 35%, и у отработанного масла вплоть до 40%. Для коммерческого использования неэтерифицированные жирные кислоты должны быть удалены. Водное экстрагирование раствором аргинина осуществляют дважды. 10 л каждого сырого масла смешивают с 30 л 0,5 моль/л раствора аргинина в 50-л контейнере. Полученную смесь перемешивают в течение 15 минут и оставляют для разделения на 5 часов. Водную фазу сливают. Затем процедуру повторяют, используя 10 л 100 ммоль/л раствора аргинина. Аналогичные эксперименты осуществляют с растворами 1,1-диметилбигуанида, Arg-Gly-Asp, NG,NG-диметиларгинина, поли-L-аргинина. Анализ жирных кислот осуществляют по способу примера 2.
Содержание неэтерифицированных жирных кислот в сыром пальмовом масле и в отработанном масле составляет 33% и 36%, соответственно, что снижают до конечной концентрации в 0,1 и 0,3%, используя для экстрагирования аргинин. Другие тестированные соединения продемонстрировали снижение до конечной концентрации в 0,2-0,5 и 0,4-0,9%, соответственно.
Вывод: Карбоновые кислоты можно удалить из различных масел, используя водные растворы аргинина и сравнительных соединений, даже если они присутствуют в высокой концентрации.
Пример 5
Исследование способности аргинина и других солюбилизирующих соединений растворять карбоновые кислоты и ингредиенты сырых масел
Экстрагируемые фракции масел из растений и овощей содержат не-триглицериды в различных количествах, которые необходимо удалить для очистки маслопродуктов. Не-триглицериды включают карбоновые кислоты, пигменты, стеролы, гликолипиды, фосфолипиды, наряду с другими. Из них амфифилы, такие как фосфолипиды, карбоновые кислоты и гликолипиды, агрегируются в пузырьки, которые включают в себя другие не-триглицериды. Указанные амфифилы самостоятельно собираются в тонкие слои и мембраны. Было проведено исследование того, действительно ли воздействие способа солюбилизации по настоящему изобретению соединений по настоящему изобретению на пузырьки амфифилов, содержащих карбоновые кислоты, приводит к удалению указанных карбоновых кислот наряду с амфифилами, образующими комплексы с карбоновыми кислотами.
Сырые подсолнечное и кукурузное масла интенсивно перемешивают с растворами аргинина, 4-гуанидинобензойной кислоты, циметидина, полигексанида и меламина (100 ммоль/л; 1:1 об/об), соответственно. Фазы разделяются спонтанно, что приводит к образованию желто-зелено-оливковых мутных водных фаз и кремово-желтых масляных фаз. Водные фазы подкисляют, используя HCl, и доводя значения pH до 5. Карбоновые кислоты экстрагируют, смешивая с н-гексаном, который удаляют, и анализируют раскрытыми выше способами. Результаты подтверждают присутствие жирных кислот в аналитах без существенных различий в их содержании между исследованными веществами. Оставшиеся водные фазы далее анализируют, используя ВЭТХ (HP-TLC высокоэффективная тонкослойная хроматография) (LiChrosphere). Среди веществ, которые можно идентифицировать, присутствуют: фосфолипиды, зеленые пигменты, токоферол, фитостеролы. Полное содержание фосфатов в масляной фазе анализируют, используя F-l 6(99) DGF. Содержание свободных кислот в маслах определяют, используя титрование этанольным раствором KOH. Было обнаружено, что более чем 90% неэтерифицированных жирных кислот было удалено после первого экстрагирования исследуемыми веществами. Рассчитанное полное количество экстрагированных жирных кислот коррелирует с рассчитанным количеством жирных кислот, выделенных из водных фаз, после экстрагирования н-гексаном.
Содержание фосфатов в сырых маслах уменьшается более чем наполовину в результате способа водной экстракции с тестируемыми веществами.
Вывод: Солюбилизирующий эффект аргинина и других солюбилизирующих соединений по настоящему изобретению можно использовать для высвобождения закомплексованных карбоновых кислот в растворы или эмульсии масел и амфифилов, обеспечивающих их экстрагирование в водную среду. Кроме того, амфифилы, образующие комплексы с солюбилизированными карбоновыми кислотами, можно выделить (в водную фазу) в то же самое время в значительной степени.
Пример 6
Исследование способности аргинина и других солюбилизирующих соединений высвобождать, растворять и экстрагировать образовавшие комплексы карбоновые кислоты из твердых биологических материалов.
Большинство биологических материалов содержит неэтерифицированные карбоновые кислоты, которые обычно существуют в виде комплексов с другими органическими материалами. Одним из таких твердых материалов являются рисовые отруби, которые содержат жирные кислоты и масла в количестве вплоть до 35% в расчете на сухой вес. Исключительно тонко размолотые рисовые отруби суспендируют в 200 ммоль/л растворах аргинина, Νω-нитро-L-аргинина, октопина, 2-гуанидиноглутаровой кислоты и агмантина, соответственно. Растворы непрерывно перемешивают в течение 24 часов. Растворы приобретают бежево-серый цвет и во всех случаях оказываются очень мутными. Твердое вещество отфильтровывают. Водные фазы, рН которых составляет величину между 8 и 10, вместе с используемыми веществами экстрагируют диэтиловым эфиром. После этого водные растворы подкисляют, используя аскорбиновую кислоту, доводя значения pH до 6. Процессы экстрагирования неэтерифицированных карбоновых кислот, также как их определение, осуществляют по способу примера 5. Фракции, экстрагированные диэтиловым эфиром, сушат и взвешивают. После этого их снова растворяют и анализируют с помощью ВЭТХ по способу примера 5. То же самое проделывают с остаточными водными растворами.
Результаты: Фракции диэтилового эфира, содержащие триглицериды, обычно находятся в рисовых маслах, причем их содержание значительно не отличается между использованными веществами. Вес триглицеридов соответствует примерно 10-15% в расчете на сухой вес рисовых отрубей. Фракции н-гексана содержат карбоновые кислоты и в остаточных водных фазах можно найти амфифилы, такие как фосфолипиды и гликолипиды, также как пигменты.
Вывод: Карбоновые кислоты часто остаются в органических твердых веществах, которые образуются в результате переработки пищевых продуктов и которые обычно существуют в виде комплексов с фосфолипидами и другими липидами. Водный раствор аргинина или других солюбилизирующих соединений способен высвободить указанные закомплексованные карбоновые кислоты, тем самым, также уменьшая адгезию фосфолипидов и других липидов к твердому материалу и обеспечивая водный способ их экстрагирования.
Пример 7
Исследование способности аргинина растворять и экстрагировать агрегированные карбоновые кислоты в минеральных маслах.
Ископаемые масла содержат значительные количества карбоновых кислот, которые вызывают коррозию при их очистке. Поэтому необходимо уменьшить содержание карбоновых кислот. Наиболее часто встречающейся в минеральных маслах является нафтеновая кислота. Исследуют способность солюбилизирующих соединений удалять карбоновую кислоту, содержащуюся в образце сырого масла. Это масло было получено от компании из процесса промышленной переработки масла, и его плотность составляла 0,85 г/см3. TAN (общее кислотное число) определяют титрованием KOH.
100 мл сырого масла (содержащего около 40 ммоль карбоновых кислот) смешивают с 200 мл 300 ммоль/л раствора или аргинина или L-2-амино-3-гуанидинопропионовой кислоты, или L-канавалина в воде в течение 1 часа при 45°C. Фазы каждого из трех образцов разделяют, используя центрифугирование. После этого масляную фазу смешивают со 100 мл 100 ммоль/л раствора в воде или аргинина или L-2-амино-3-гуанидинопропионовой кислоты, или L-канавалина, использованных на первой стадии, в течение 30 минут при комнатной температуре, и фазы разделяют, предпочтительно центрифугированием. После этого определяют TAN масляной фазы.
Результаты: TAN во всех трех образцах снижается с 1,8 мг KOH/г до 0,16-0,3 мг KOH/г за счет водного экстрагирования с солюбилизирующими соединениями.
Вывод: TAN сырого масла можно уменьшить, используя солюбилизирующие соединения. Так как нафтеновая кислота превалирует в сырых маслах, возможно заметное ее уменьшение.
Пример 8
Исследование стабильности масел в присутствии аргинина и других солюбилизирующих соединений
Очищенное подсолнечное масло смешивают с растворами аргинина, варьируя концентрации и длительность. Концентрации растворов соответствуют 100, 200, 300 и 500 ммоль аргинина, гистидина, H-Cit-OH цитруллина, Ν-ω-гидрокси-L-нораргинина и L-NIL. Их добавляют в объемном соотношении 1:1. Все растворы интенсивно перемешивают в течение 60 минут, и затем оставляют для разделения за счет седиментации. По одному образцу каждой концентрации анализируют после 3 часов, затем после 7 дней и еще после 14 дней. Концентрации жирных кислот определяют по способу примера 2. При концентрациях 100 и 200 ммоль аргинина концентрация жирных кислот была одинаковой во всех образцах. При концентрациях 300 и 500 ммоль наблюдается незначительное повышение концентрации жирных кислот в зависимости от концентрации аргинина и длительности экспонирования.
Вывод: Аргинин и другие солюбилизирующие соединения не гидролизуют триглицериды при низкой или умеренной концентрации. Однако при более высоких концентрациях гидролиз может происходить в незначительной степени.
Пример 9
Исследование способности солюбилизирующих соединений растворять и экстрагировать карбоновые кислоты из масла при производстве топлива.
Получение биодизельного топлива основано на гидролизе этерифицированных карбоновых кислот. Чаще всего гидролиз осуществляют гидролазы. Однако указанные ферменты ингибируются продуктами своих взаимодействий. Поэтому необходимо удалять глицерин и карбоновые кислоты из активного центра указанных ферментов.
Устройство для диализа из примера 1 используют для тестирования применимости и эффективности непрерывного удаления жирных кислот во время осуществления гидролиза триглицеридов из соевого масла. Липазу (Novozyme 435) иммобилизуют по способу Lee (Lypase Immobilisation on Silica Gel Using Cross-linking Method, D. H. Lee, C. H. Park, J. M. Yeo, and S. W. Kim, J. Ind. Eng. Chem., Vol. 12, No. 5, (2006) 777-782). 150 мл очищенного соевого масла и 50 мл раствора или аргинина, или H-гомоаргинин-OH, или полигексанида (100 ммоль/л) интенсивно перемешивают и заполняют ими реакционную камеру. Циркуляционная система непрерывно перекачивает эмульсию со скоростью, которая не допускает фазового разделения. PTFE фильтр с эксклюзионным размером 0,4 мкм смонтирован у выходного воронкообразного отверстия донорной/реакционной камеры с целью сохранения шариков силикагеля в камере, где продолжает циркулировать реакционный раствор. Акцепторную камеру и циркуляционную систему заполняют 200 ммоль/л раствора реакционноспособного соединения. Используют PTFE разделительную мембрану, смонтированную между реакционной/донорной и акцепторной камерами. Между реакционной камерой и акцепторной камерой пропускают постоянный ток во время процесса гидролиза по способу примера 1. Раствор в акцепторной камере непрерывно циркулирует, и образцы отбирают каждые 10 минут. Процесс останавливают после 30 минут. 82% рассчитанного содержания жирных кислот триглицеридов, подвергаемых гидролизу, присутствует в акцепторной камере. Раствор из акцепторной камеры выделяют и подкисляют, используя HCl, до pH=4. Жирные кислоты выделяют экстрагированием н-гексаном. Выделенную гексановую фазу (10 мл) смешивают с 2 мл метанола. Добавляют Новозим 435, иммобилизованный на двуокиси кремния, как раскрыто ранее. Реакцию этерификации останавливают после 30 минут, фильтруя раствор. Раствор интенсивно перемешивают с 50 ммоль/л раствором солюбилизирующего вещества, использованного на предшествующей стадии. Органическую фазу выделяют после фазового разделения и направляют в роторный испаритель для удаления остатков метанола и гексана.
Результаты: Наблюдается быстрое повышение концентрации жирных кислот в акцепторных растворах до достижения плато. В акцепторных растворах не наблюдают моно-, ди- или триглицеридов или глицерина. Жирные кислоты, которые должны пройти в акцепторную камеру, следует очистить от растворенных в воде анионов, которые также прошли, путем подкисления и экстрагирования растворителем. Очищенные жирные кислоты этерифицируют в неводной среде за счет иммобилизованных эстераз. Не преобразованные жирные кислоты удаляют, используя водное экстрагирование с солюбилизирующими соединениями. Выпаривание спирта и растворителя приводит к получению высоко очищенного раствора метилового эфира жирной кислоты со степенью чистоты >98%.
Выводы: Гидролиз этерифицированных жирных кислот в растворе аргинина осуществим, что приводит к улучшению конвекции свободных жирных кислот и, тем самым, условий процесса. Гидролизованные жирные кислоты можно далее очистить, используя растворы солюбилизирующих соединений и перенося в неводную реакционную среду для метилэтерификации (т.е. для образования метилового эфира). Кроме того, нереакционноспособные карбоновые кислоты можно удалить на стадии конечной очистки, используя водный раствор солюбилизирующих соединений. Высокой степени чистоты метиловые эфиры жирных кислот получают после выпаривания растворителя без необходимости дистиллятивного удаления метиловых эфиров жирных кислот.
Пример 10
Исследование способности солюбилизирующих соединений растворять плохо растворимые вещества в водных растворах.
Многие реакционные субстраты или компоненты взаимодействий должны присутствовать в водной среде в незакомплексованной форме, особенно в биологических системах. Наноэмульсификация веществ повышает их доступность биологическим транспортным механизмам и взаимодействиям. Однако многие амфифильные системы носителей демонстрируют биологическую токсичность или низкую биосовместимость. Многие из солюбилизирующих соединений являются биосовместимыми. Поэтому эмульгирующую способность микро- или наноэмульсий указанных соединений и карбоновых кислот исследуют в отношении плохо растворимых веществ (мг растворимых в воде) таких как тетрафенилпорфирин (2 мг/л), судановый красный (нерастворим), азоксистробин (6,7 мг/л), со-фталоцианин (нерастворим), хлорпрофам (110 мг/л).
Исследуемые вещества вначале растворяют в органическом растворителе: тетрафенилпорфирин в дихлорметане (50 мг/мл), судановый красный в ацетоне (2 мг/мл), азоксистробин в толуоле (50 мг/мл), со-фталоцианин в ацетонитриле (2 мг/мл), хлорпрофам в этаноле (50 мг/мл).
Наноэмульсии (50 мл) олеиновой кислоты (50 ммоль/л) и аргинина (80 ммоль), линоленовой кислоты (50 ммоль) и L-2-амино-3-гуанидинопропионовой кислоты (l00 ммоль), и 12-гидрокси-9-октадеценовой кислоты (50 мг) и Νω-нитро-L-аргинина (130 ммоль) растворяют в органический среде, содержащей полностью солюбилизированные вещества. Полученные смеси интенсивно перемешивают. Органический растворитель выпаривают, при этом медленно перемешивая при комнатной температуре или при температурах вплоть до 50°C. Добавляют соответствующие наноэмульсии до тех пор, пока растворы не становятся прозрачными, или вплоть до объема 100 мл. Растворы анализируют в отношении прозрачности и определяют содержание остаточных твердых веществ немедленно и через 24 часа.
Результаты: Исследованные плохо растворимые в воде вещества можно эмульгировать в водных средах за счет наноэмульгирований после предварительного растворения в соответствующих органических растворителях. Не содержащие растворителей наноэмульгированные вещества приводят к получению прозрачных эмульсий без образования остаточных твердых веществ.
Вывод: Микро- и наноэмульсии солюбилизирующих соединений и карбоновых кислот могут обеспечить водную микро- или наноэмульсификацию плохо растворимых в воде веществ, создавая биосовместимую транспортную систему или систему носителя для таких веществ в водных средах.
Пример 11
Исследование микро- или наноэмульсификации карбоновых кислот для обеспечения проведения альтернативных химических взаимодействий
Гидрофобные карбоновые кислоты необходимо растворить в растворителях для обеспечения условий для многих химических взаимодействий, таких как пероксидация или полимеризация. Так как многие из указанных взаимодействий можно вести в водных средах, может оказаться выгодной процедура удаления растворителя. Наноэмульгированные молекулы располагают реагенты достаточно близко для осуществления взаимодействий. Независимо от того, наноэмульгированы карбоновые кислоты с аргинином или другими солюбилизирующими веществами, их можно использовать для обеспечения проведения химических взаимодействий, которые обычно ведут в органических растворителях, их тестируют в двух экспериментах.
Для доказательства способности микроэмульгированных карбоновых кислот реагировать с пероксидами за счет ферментативной этерификации, 200 ммоль 2-этилгексановой кислоты и 4-гуанидиномасляной кислоты (1,5 моль эквивалента) растворяют в смеси воды и ТГФ при комнатной температуре. Добавляют трет-бутилгидропероксид (200 ммоль/л) и осторожно перемешивают. Полученный раствор нагревают до 45°C и добавляют суспензию 40 мг липазы PS с целью обеспечить возможность осуществления взаимодействия конденсации с трет-бутилпероксо-2-этилгексаноатом. Реакцию заканчивают через 1 час. Степень превращения рассчитывают по количеству все еще присутствующей фракции пероксида, по способу йодометрического анализа. Повторные исследования дают значения степени превращения 65-72%. Эксперименты повторяют, используя агмантин и 6-гуанидиногексановую кислоту. Соответствующие степени превращения находятся в интервале между 55 и 78%.
Наноэмульсию, состоящую из 50 ммоль/л перилловой кислоты и 60 ммоль/л аргинина в смеси вода/ТГФ (9:1 об:об), смешивают с 2 экв. m-CPBA в 3 аликвотах при 25°C в течение 3 часов, и перемешивают в течение дополнительно 12 часов. Реакционную смесь подкисляют до pH 4, трижды экстрагируют CHCl3. Органическую фазу сушат над Na2SO4, выпаривают до 10 мл, и исследуют с помощью ГХ. Выход по данным ГХ 65%. Указанную процедуру проводят также с гераниевой кислотой, цитронелловой кислотой, олеиловой кислотой, линолевой кислотой, используя аргинин, 1,1-диметилбигуанид и Ν-ω-гидрокси-L-аргинин в качестве солюбилизирующих соединений. Достигнуты выходы в интервале между 45 и 85%.
Вывод: Наноэмульгированные карбоновые кислоты с использованием солюбилизирующих веществ по настоящему изобретению обеспечивают проведение химических взаимодействий в водных средах без использования растворителей.
Пример 12
Исследование растворимости различных карбоновых кислот в водной среде при использовании аргинина и других солюбилизирующих соединений.
Некоторые солюбилизирующие соединения тестируют в водной среде в отношении их потенциальной способности солюбилизировать сравнительную жирную кислоту, а именно олеиновую кислота.
Вначале тестируют влияние значения pH на растворимость олеиновой кислоты в водной среде. Указанные тесты проводят с целью исключения возможности того, что наблюдаемая растворимость олеиновой кислоты связана с изменениями pH, и не определяется взаимодействием функциональных групп.
Проведенные тесты показывают, что не существует взаимодействия между олеиновой кислотой и раствором в интервале значений pH 9-12 при комнатной температуре. Начиная со значения pH 13, олеиновая кислота начинает растворяться. При pH 14 добавление олеиновой кислоты приводит к образованию твердого осадка.
В следующих тестах олеиновую кислоту смешивают с тестируемыми веществами в H2O. Затем определяют logP и измеряют pH, и оценивают растворимость тестируемого вещества в H2O вместе с оценкой взаимодействия между олеиновой кислотой и тестируемым веществом в соответствии с представленной далее схемой.
Приготавливают растворы солюбилизирующих соединений в воде в концентрациях от 6 до 600 ммоль/л, и предпочтительно около 60 ммоль/л. К водным растворам солюбилизирующих соединений добавляют 0,833 моль эквивалента олеиновой кислоты или соответствующей карбоновой кислоты, и смешивают. Растворы оставляют на 1 час и измеряют pH. В случае неполного растворения и значения pH ниже 7 по каплям добавляют 1 M раствор NaOH до тех пор, пока раствор не станет прозрачным. Затем смеси перемешивают или встряхивают. С целью обеспечить стабильность полученных микро- или наноэмульсий, раствор нагревают в течение 1 часа при 60°C и охлаждают до комнатной температуры. Другую часть прозрачного раствора хранят в течение ночи при 4°C и затем снова возвращают к комнатной температуре. После этого растворы снова анализируют в отношении образования твердого вещества, измеряют содержание остаточного масла, вязкость, мутность и DLS.
В эмульсиях образуются или мицеллы, или пузырьки. Их размеры и объемы могут быть различными. В микро- и наноэмульсиях преобладают только видимые кластеры размера пузырьков. Соответствующее распределение и относительное количество можно измерить способом динамического лазерного светорассеяния (DLS), которое осуществляют для тех образцов, которые демонстрируют поведение микро- или наноэмульгирующей солюбилизации в отношении олеиновой кислоты. Для DLS измерений используют лазерный анализатор размеров наночастиц Zetasizer Nano S (Malvern (USA)). Все измерения повторяют трижды в неразбавленном виде или в водных растворах в разбавлениях 1:10 и 1:100. Для измерений используют вязкость воды и показатель преломления воды. Можно показать, что все использованные солюбилизирующие соединения вызывают солюбилизацию липофильных карбоновых кислот в воде.
Столбец "Солюбилизирующие соединения" в таблице A указывает на форму солюбилизирующего соединения, растворенного в воде. Если, например, указано "гидрохлорид", это значит, что гидрохлоридная соль растворена в воде. Однако при значениях pH, которые используют для солюбилизации карбоновых кислот, солюбилизирующее соединение может уже больше не существовать в форме гидрохлоридной соли. Таким образом, в столбце "Солюбилизирующие соединения" указан исходный материал, а не активная форма солюбилизирующего соединения, которая способна эмульгировать карбоновые кислоты в водной среде.
Максимальная интенсивность пиков: Величину определяют из непосредственных измерений, без взвешивания объема или числа частиц.
Пики представлены в соответствии с их процентным содержанием в образце.
Отношение максимумов пиков: Процентное распределение размеров частиц.
Оценка растворимости:
X=Соединение растворилось полностью
(X)=Соединение растворилось частично
((X))=Соединение не растворилось (визуальное определение), но наблюдается изменение значения pH. Поэтому предполагают, что по меньшей мере небольшая часть соединения растворилась.
-=не растворилось
Оценка взаимодействия между олеиновой кислотой и тестируемым веществом:
X=Взаимодействие между олеиновой кислотой и тестируемым веществом
(X)=Взаимодействие между олеиновой кислотой и тестируемым веществом. В растворе находится значительно меньше олеиновой кислоты, чем воды.
E=Эмульсия
S=Образование твердого осадка
E, S=Исследуемый раствор становится мутным с последующим образованием твердого осадка.
n.d. не определялось


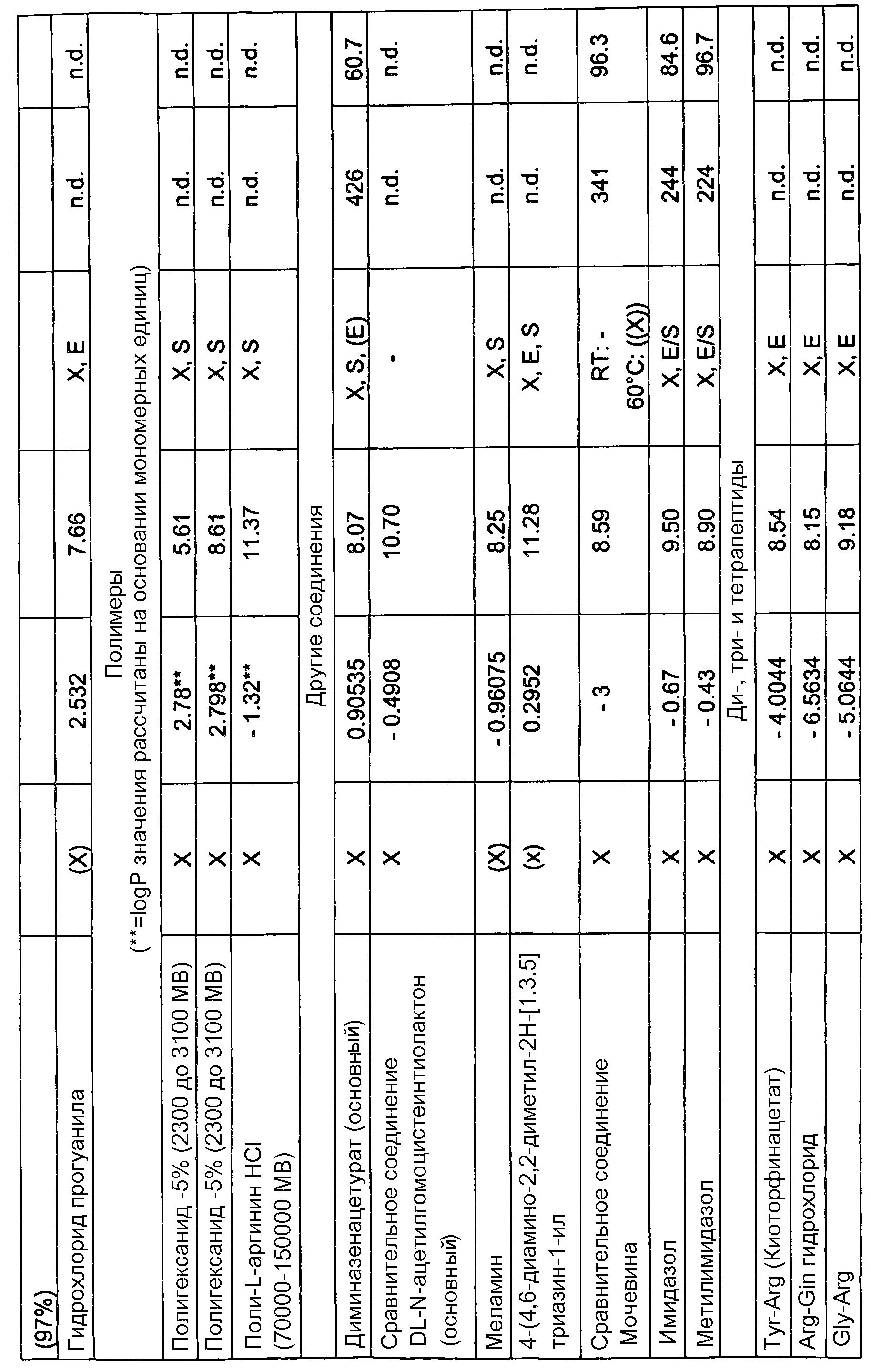
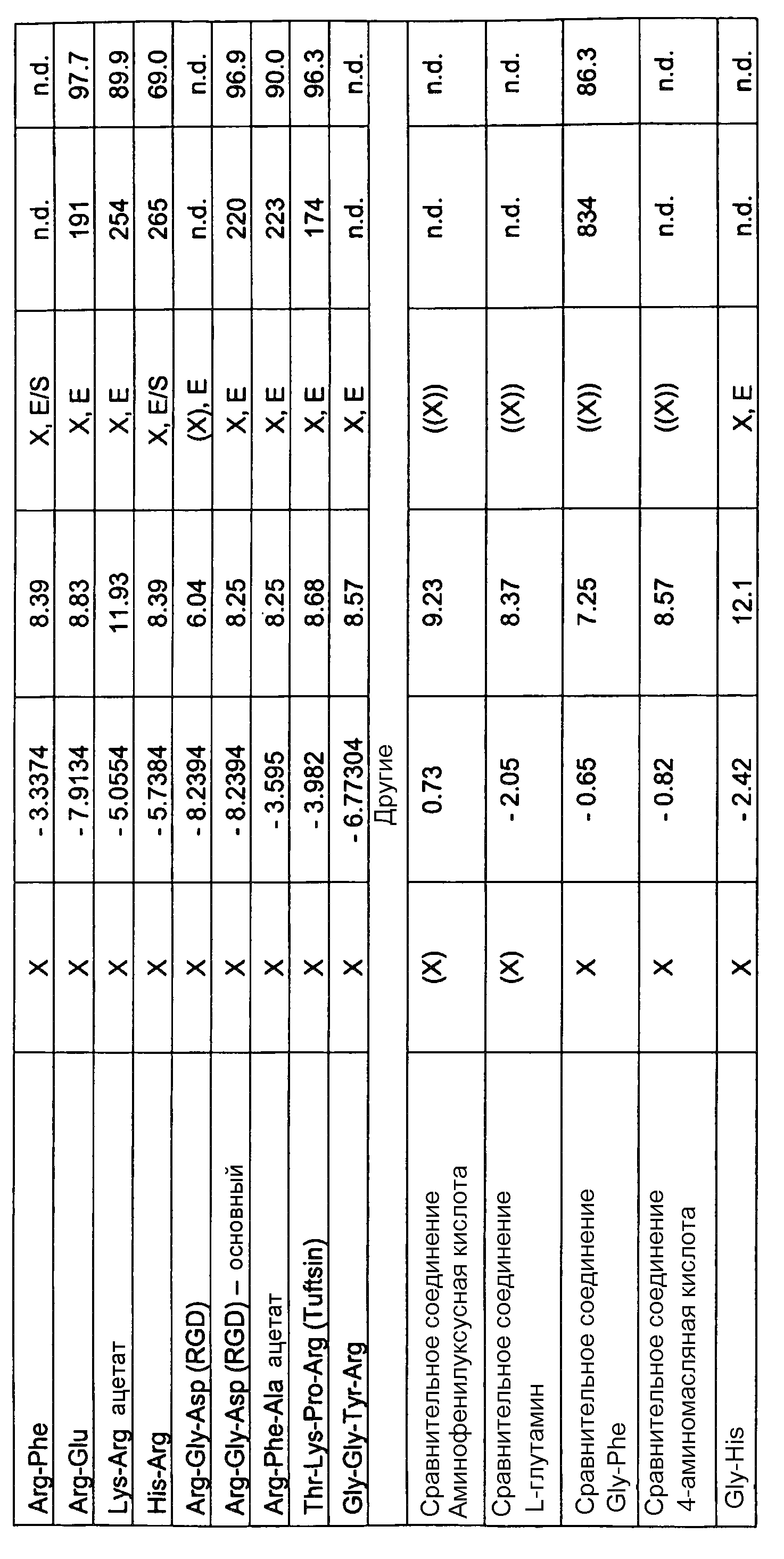
Каждое из следующих солюбилизирующих соединений (A)-(T):
L-аргинин (A), L-2-амино-3-гуанидинопропионовая кислота (B), L-NIL (C), Ν-ω-нитро-L-аргинин (D), NG,NG-диметиларгинин (E), агматин (F), 1,1-диметилбигуанид (G), L-канавалин (H), аргининоянтарная кислота (I), октопин (J), nω-монометил-L-аргинин (K), метиловый эфир аргинина (L), Ν-ω-гидрокси-L-аргинин (M), гистидин (N), H-гомоаргинин-OH (O), L-2-амино-3-гуанидинопропионовая кислота (P), 6-гуанидиногексановая кислота (Q), Ν-ω-гидрокси-L-нораргинин (R), 4-гуанидинобензойная кислота (S) и полигексанид (T), использовали для солюбилизации следующих карбоновых кислот (I) до (XII):
гексадекановая кислота (I), эйкозановая кислота (II), стеариновая кислота (III), докозапентаеновая кислота (IV), бензойная кислота (V), кофеиновая кислота (VI), терефталевая кислота (VII), нафтеновая кислота (VIII), перфтороктановая кислота (IX), эйкозапентаеновая кислота (20:5) (X), линоленовая кислота (18:3) (XI) и докозапентаеновая кислота (22:5) (XII).
Все карбоновые кислоты могут быть солюбилизированы с использованием соответствующих солюбилизирующих соединений, использованных в количестве 1,5 моль эквивалента при значениях рН между 8 и 10, что представлено далее в таблице В:

Реферат
Изобретение относится к усовершенствованному способу солюбилизации и выделения карбоновых кислот с использованием солюбилизирующего соединения общей формулы (I) или (II), в которых значения для групп Х, L, R'', R, R' приведены в формуле изобретения, из водных или органических растворов, эмульсий, суспензий, образующихся при лекарственной терапии, в аналитических методах медицины, в аналитических методах пищевой промышленности, при промышленной переработке продуктов питания, при промышленной переработке масел, при анализах масел, при промышленной переработке топлива, при модификации химических или физико-химических взаимодействий, для солюбилизации плохо растворимых молекул, в аналитических методах фармацевтической или химической промышленности или науки, для удаления карбоновых кислот из сточных вод после частных, коммерческих или промышленных чисток, для удаления карбоновых кислот из биореакторных процессов, при органожелировании или наноэмульсификации карбоновых кислот, где указанное солюбилизирующее соединение содержит по меньшей мере одну амидиногруппу и/или по меньшей мере одну гуанидиногруппу и где солюбилизирующее соединение имеет коэффициент разделения смеси н-октанол-вода K< 6,30, при этом использование указанного солюбилизирующего соединения приводит к образованию микро- или наноэмульсий указанных карбоновых кислот и обеспечивает их выделение посредством комплексообразования, адсорбции, абсорбции, диффузии, осмоса, диализа, фильтрации, нанофильтрации, дистилляции, жидкость-жидкостной экстракции или сверхкритической жидкостной экстракции, за счет создания концентрационного градиента, термического град
Формула

где
X представляет собой -NH-, -NR″″-, -О-, -S- или -СН2- или замещенный атом углерода;
L представляет собой гидрофильный заместитель, выбранный из группы, включающей или состоящей из -NH2, -ОН, -PO3H2, -PO3H-,
-PO32-, -OPO3H2, -ОРО3Н-, -ОРО32-, -СООН, -COO-, -CO-NH2, -NH3+, -NH-CO-NH2, -N(CH3)3+, -N(C2H5)3+, -N(C3H7)3+, -NH(CH3)2+, -NH(C2H5)2+, -NH(C3H7)2+, -NHCH3, -NHC2H5, -NHC3H7, -NH2CH3+, -NH2C2H5+, -NH2C3H7+, -SO3H, -SO3-, -SO2NH2, -CO-COOH, -O-CO-NH2, -C(NH)-NH2, -NH-C(NH)-NH2, -NH-CS-NH2, -NH-COOH и групп

или
L представляет собой C1-C8 неразветвленную или разветвленную и насыщенную или ненасыщенную углеродную цепочку, содержащую по меньшей мере один заместитель, выбранный из группы, включающей или состоящей из -NH2, -ОН, -PO3H2, -PO3H-, -PO32-, -OPO3H2, -OPO3H-, -OPO32-, -СООН, -COO-, -CO-NH2, -NH3+, -NH-CO-NH2, -N(CH3)3+,
-N(C2H5)3+, -N(C3H7)3+, -NH(CH3)2+, -NH(C2H5)2+, -NH(C3H7)2+,
-NHCH3, -NHC2H5, -NHC3H7, -NH2CH3+, -NH2C2H5+, -NH2C3H7+, -SO3H, -SO3-, -SO2NH2, -CO-COOH, -O-CO-NH2, -C(NH)-NH2, -NH-C(NH)-NH2, -NH-CS-NH2, -NH-COOH и групп

или
L представляет собой бензольное кольцо с по меньшей мере одним заместителем, выбранным из группы, включающей или состоящей из -NH2, -ОН, -PO3H2, -PO3H-, -PO32-, -OPO3H2, -OPO3H-, -OPO32-, -СООН, -COO-, -CO-NH2, -NH3+, -NH-CO-NH2, -N(CH3)3+, -N(C2H5)3+, -N(C3H7)3+, -NH(CH3)2+, -NH(C2H5)2+, -NH(C3H7)2+, -NHCH3, -NHC2H5, -NHC3H7,
-NH2CH3+, -NH2C2H5+, -NH2C3H7+, -SO3H, -SO3-, -SO2NH2, -CO-COOH, -O-CO-NH2, -C(NH)-NH2, -NH-C(NH)-NH2, -NH-CS-NH2, -NH-COOH и групп

при этом
R′, R″, R′″ и R″″ каждый независимо друг от друга представляет собой -Н, -ОН, -СН=СН2, -СН2-СН=СН2, -С(СН3)=СН2, -СН=СН-СН3,
-С2Н4-СН=СН2, -СН3, -С2Н5, -С3Н7, -СН(СН3)2, -С4Н9,
-СН2-СН(СН3)2, -СН(СН3)-С2Н5, -С(СН3)3, -С5Н11, -СН(СН3)-С3Н7,
-СН2-СН(СН3)-С2Н5, -СН(СН3)-СН(СН3)2, -С(СН3)2-С2Н5,
-СН2-С(СН3)3, -СН(С2Н5)2, -С2Н4-СН(СН3)2, -C6H13, -С7Н15,
цикло-С3Н5, цикло-С4Н7, цикло-С5Н9, цикло-С6Н11, -PO3H2, -PO3H-, -PO32-, -NO2, -С≡СН, -С≡С-СН3,_СН2_С≡СН, -С2Н4-С≡СН, -СН2-С≡С-СН3,
или R′ и R″ вместе образуют остаток -СН2-СН2-, -СО-СН2-, -СН2-СО-, -CH=CH-, -СО-СН=СН-, -СН=СН-СО-, -СО-СН2-СН2-, -СН2-СН2-CO-, -СН2-СО-СН2- или -СН2-СН2-СН2-,
из водных или органических растворов, эмульсий, суспензий, образующихся при лекарственной терапии, в аналитических методах медицины, в аналитических методах пищевой промышленности, при промышленной переработке продуктов питания, при промышленной переработке масел, при анализах масел, при промышленной переработке топлива, при модификации химических или физико-химических взаимодействий, для солюбилизации плохо растворимых молекул, в аналитических методах фармацевтической или химической промышленности или науки, для удаления карбоновых кислот из сточных вод после частных, коммерческих или промышленных чисток, для удаления карбоновых кислот из биореакторных процессов, при органожелировании или наноэмульсификации карбоновых кислот, где указанное солюбилизирующее соединение содержит по меньшей мере одну амидиногруппу и/или по меньшей мере одну гуанидиногруппу и где солюбилизирующее соединение имеет коэффициент разделения смеси н-октанол-вода KOW< 6,30, при этом использование указанного солюбилизирующего соединения приводит к образованию микро- или наноэмульсий указанных карбоновых кислот и обеспечивает их выделение посредством комплексообразования, адсорбции, абсорбции, диффузии, осмоса, диализа, фильтрации, нанофильтрации, дистилляции, жидкость-жидкостной экстракции или сверхкритической жидкостной экстракции, за счет создания концентрационного градиента, термического градиента, электрического градиента, физико-химического градиента или их комбинаций, и при этом способ включает следующие стадии:
i) получение раствора, или эмульсии, или суспензии, содержащих карбоновые кислоты;
ii) добавление, по меньшей мере, эквимолярных количеств по меньшей мере одного солюбилизирующего соединения;
iii) выделение солюбилизированных карбоновых кислот из раствора, или эмульсии, или суспензии путем фазового разделения, фильтрации, нанофильтрации, диализа, абсорбции, комплексообразования, электрофореза, испарения, дистилляции и/или экстракции.
прохождение карбоновых кислот раздельно или вместе с по меньшей мере одним солюбилизирующим соединением через разделительную мембрану или трубку или полый капиллярный блок под действием концентрационного градиента, термического градиента, физико-химического градиента, пневматического градиента, электрического градиента или их комбинаций; или
осуществление фазового разделения путем комбинирования двух или более сред, обеспечивающих фазовое разделение; или
прохождение карбоновых кислот вместе с по меньшей мере одним солюбилизирующим соединением через поверхность раздела фаз, что обеспечивает прохождение указанных карбоновых кислот и указанного по меньшей мере одного солюбилизирующего соединения за счет создания концентрационного градиента, термического градиента, физико-химического градиента, пневматического градиента, электрического градиента или их комбинации, где поверхность раздела фаз состоит из геля, органогеля или твердого материала или их комбинаций; или
фильтрация карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения; или нанофильтрация карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения; или
диализ карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения; или адсорбция карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения; или комплексообразование карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения; или
дистилляция карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения; или выделение карбоновых кислот путем использования по меньшей мере одного солюбилизирующего соединения, путем сверхкритической жидкостной экстракции.
a) получение указанного раствора путем уменьшения ионной силы посредством комплексообразования, адсорбции, выделения или диализа связанных или несвязанных катионов и анионов;
b) корректировка значения pH раствора путем добавления кислоты или основания;
c1) корректировка молярности солюбилизирующего соединения таким образом, чтобы она была в интервале от 1:10 до 20:1 по отношению к расчетной концентрации карбоновых кислот, подлежащих солюбилизации; и
d) добавление указанного солюбилизирующего соединения в твердой форме или в растворе к указанному водному или органическому раствору, содержащему карбоновые кислоты, для образования микро- или наноэмульсии;
необязательно включающий любую из стадий:
a1) высвобождение карбоновых кислот, связанных за счет комплексообразования или ковалентного связывания;
с2) если солюбилизирующее соединение вводят в растворе, то корректируют значения pH указанного раствора с целью оптимизации совместимости и условий взаимодействия с подлежащими солюбилизации карбоновыми кислотами с использованием подкисления или подщелачивания;
e) добавление эстераз, гидролаз или комплексообразующего агента;
f) добавление к раствору воды и/или сорастворителя; и/или
g) оптимизация условий взаимодействия путем нагревания и/или смешивания раствора, в результате чего образуется улучшенная микро- или наноэмульсия.
g2) подачу реакционного раствора из первой камеры во вторую камеру через разделительную панель путем использования способа нанофильтрации, за счет создания концентрационного градиента, химического градиента, пневматического градиента, электрического градиента или их комбинаций;
необязательно включающий стадии
h) удаления ассоциатов карбоновой кислоты и солюбилизирующего соединения из фильтрованного раствора за счет конвекции акцепторного раствора, подаваемого через входное отверстие в указанную вторую камеру, и которому предоставляется возможность вытекать через выходное отверстие указанной второй камеры; и
i) удаления очищенного раствора из указанной второй камеры через следующее выпускное отверстие.
g1) высвобождение этерифицированных жирных кислот в крови субъекта с использованием гидролаз, иммобилизованных на материале подложки внутри указанной первой камеры, в результате чего образуются микро- или наноэмульсии;
h) перекачивание фильтрованного раствора из указанной второй камеры в первую камеру второго диализатора;
i) подача раствора, содержащего карбоновую кислоту, из указанной первой камеры второго диализатора во вторую камеру второго диализатора через вторую разделительную панель за счет создания концентрационного градиента, химического градиента, пневматического градиента, электрического градиента или их комбинаций;
j) удаление ассоциатов карбоновой кислоты и солюбилизирующего соединения, проходящих через указанную вторую разделительную панель, за счет циркуляции третьего порядка;
k) перекачка акцепторного раствора карбоновой кислоты из контейнера для хранения акцепторного раствора в указанную вторую камеру второго диализатора;
l) удаление акцепторного раствора с карбоновой кислотой в контейнер для хранения сточных вод; и
m) возвращение очищенного раствора, содержащего солюбилизирующее соединение, покидающее указанную первую камеру второго диализатора, на входное отверстие указанной второй камеры первого диализатора.
i) первую камеру для осуществления взаимодействия водной или органической среды, содержащей карбоновые кислоты, с солюбилизирующим соединением общей формулы (I) или (II);
ii) вторую камеру для получения солюбилизированных карбоновых кислот;
iii) разделительную панель между указанной первой камерой и указанной второй камерой, включающую разделительную мембрану, трубку или полый капиллярный блок; и
iv) средства для подачи указанного реакционного раствора из указанной первой камеры в указанную вторую камеру через указанную разделительную панель за счет создания концентрационного градиента, термического градиента, физико-химического градиента, пневматического градиента, электрического градиента или их комбинации.
a) первую камеру для осуществления взаимодействия водной среды, содержащей карбоновую кислоту, с солюбилизирующим соединением,
содержащую первое входное отверстие для указанной водной среды, содержащей карбоновую кислоту;
b) контейнер для указанного солюбилизирующего соединения, содержащий второе входное отверстие для заполнения указанного контейнера указанным солюбилизирующим соединением и соединенный с указанной первой камерой через третье входное отверстие;
c) вторую камеру для получения фильтрованного реакционного раствора;
d) разделительную панель между указанной первой камерой и указанной второй камерой, включающую разделительную мембрану или полый капиллярный блок; и
e) средства для подачи указанного реакционного раствора из указанной первой камеры в указанную вторую камеру через указанную разделительную панель за счет создания концентрационного градиента, термического градиента, электрического градиента, физико-химического градиента или их комбинации;
необязательно включающее
f) средства для удаления ассоциатов карбоновой кислоты и солюбилизирующего соединения из указанного фильтрованного раствора путем удаления указанного фильтрованного раствора за счет конвекции акцепторного раствора, подаваемого через четвертое входное отверстие в указанную вторую камеру и которому предоставляется возможность вытекать через первое выходное отверстие указанной второй камеры; и
g) средства для удаления очищенного раствора из указанной второй камеры через второе выходное отверстие.
f) средства для подачи крови или плазмы от указанного субъекта или из указанной процедуры очистки в указанную первую камеру (610) диализатора (603) через указанное первое входное отверстие;
g) насосную систему и систему смешивания (602), которая обеспечивает подачу солюбилизирующего соединения из указанного контейнера (601) и смешивание раствора;
h) материалы подложки (604) в указанной первой камере, на которых иммобилизованы гидролазы, для высвобождения этерифицированных жирных кислот;
i) первую разделительную панель между указанной первой камерой второго диализатора и второй камерой первого диализатора, включающую разделительную мембрану (605) или блок полых капилляров;
j) средства для подачи раствора, содержащего карбоновые кислоты, из указанной первой камеры первого диализатора во вторую камеру первого диализатора, за счет создания концентрационного градиента, химического градиента, пневматического градиента, электрического градиента или их комбинаций;
k) средства для перекачивания (606) указанного фильтрованного раствора из указанной второй камеры в первую камеру второго диализатора (607);
l) средства для удаления ассоциатов карбоновой кислоты и солюбилизирующего соединения, поступающих через указанную вторую разделительную панель второго диализатора (607) за счет циркуляции третьего порядка;
m) контейнер для хранения акцепторного раствора;
n) средства для перекачивания (612) акцепторного раствора карбоновой кислоты из указанного контейнера для хранения акцепторного раствора (609) в указанную вторую камеру второго диализатора;
о) средства для удаления акцепторного раствора с карбоновой кислотой в контейнер для сточных вод (608);
p) средства для повторной передачи очищенного раствора, содержащего солюбилизирующее соединение, покидающего указанную первую камеру второго диализатора, во входное отверстие указанной второй камеры первого диализатора; и
q) средства для повторной передачи воссоединенных фракций крови, покидающих первую камеру первого диализатора, в кровеносную систему указанного субъекта (611).
h) средства для смешивания раствора, содержащего карбоновые кислоты, и солюбилизирующего соединения, с помощью нагревания, обработки ультразвуком, создания условий ламинарного или турбулентного потока в указанной первой камере;
i) средства для подачи смешанной эмульсии в указанную вторую камеру и средства для фазового разделения под действием гравитации или центрифугированием;
j) третью камеру для получения очищенного масла из второго выходного отверстия второй камеры;
k) четвертую камеру для получения ассоциатов карбоновой кислоты и солюбилизирующего соединения из первого выходного отверстия второй камеры;
l) резервуар для растворимой в воде кислоты;
m) средства для подачи указанной растворимой в воде кислоты из указанного резервуара в указанную четвертую камеру;
n) средства для смешивания раствора в указанной четвертой камере;
о) пятую камеру, пригодную для фазового разделения под действием гравитации, для получения смешанного раствора из указанной четвертой камеры;
p) средства для подачи смешанного раствора из указанной четвертой камеры в указанную пятую камеру;
q) шестую камеру для получения очищенных карбоновых кислот из указанной пятой камеры;
r) средства для подачи очищенных карбоновых кислот из указанной пятой камеры в указанную шестую камеру;
s) седьмую камеру для получения раствора, содержащего солюбилизирующее соединение и растворимую в воде кислоту, собирающегося в донной части указанной пятой камеры;
t) средства для подачи раствора, содержащего солюбилизирующее соединение и растворимую в воде кислоту, в седьмую камеру;
u) средства для подачи раствора из седьмой камеры через электродиализное устройство или ионообменник для выделения солюбилизирующего соединения в камеру католита и добавления растворимой в воде кислоты в камеру анолита;
v) средства для подачи раствора из камеры католита в указанный контейнер для солюбилизирующего соединения;
w) средства для подачи раствора из камеры анолита в резервуар для растворимой в воде кислоты;
x) средства для подачи очищенного ретинатного раствора после электродиализа на гидрофильный мембранный фильтр; и
y) средства для повторного использования водного фильтрата; и
необязательно включающее
z) средства для суспендирования и смешивания органического растворителя с раствором седьмой камеры.

Комментарии