Производное бензилсульфида, способ его получения и пестицид - RU2170728C2
Код документа: RU2170728C2
Чертежи
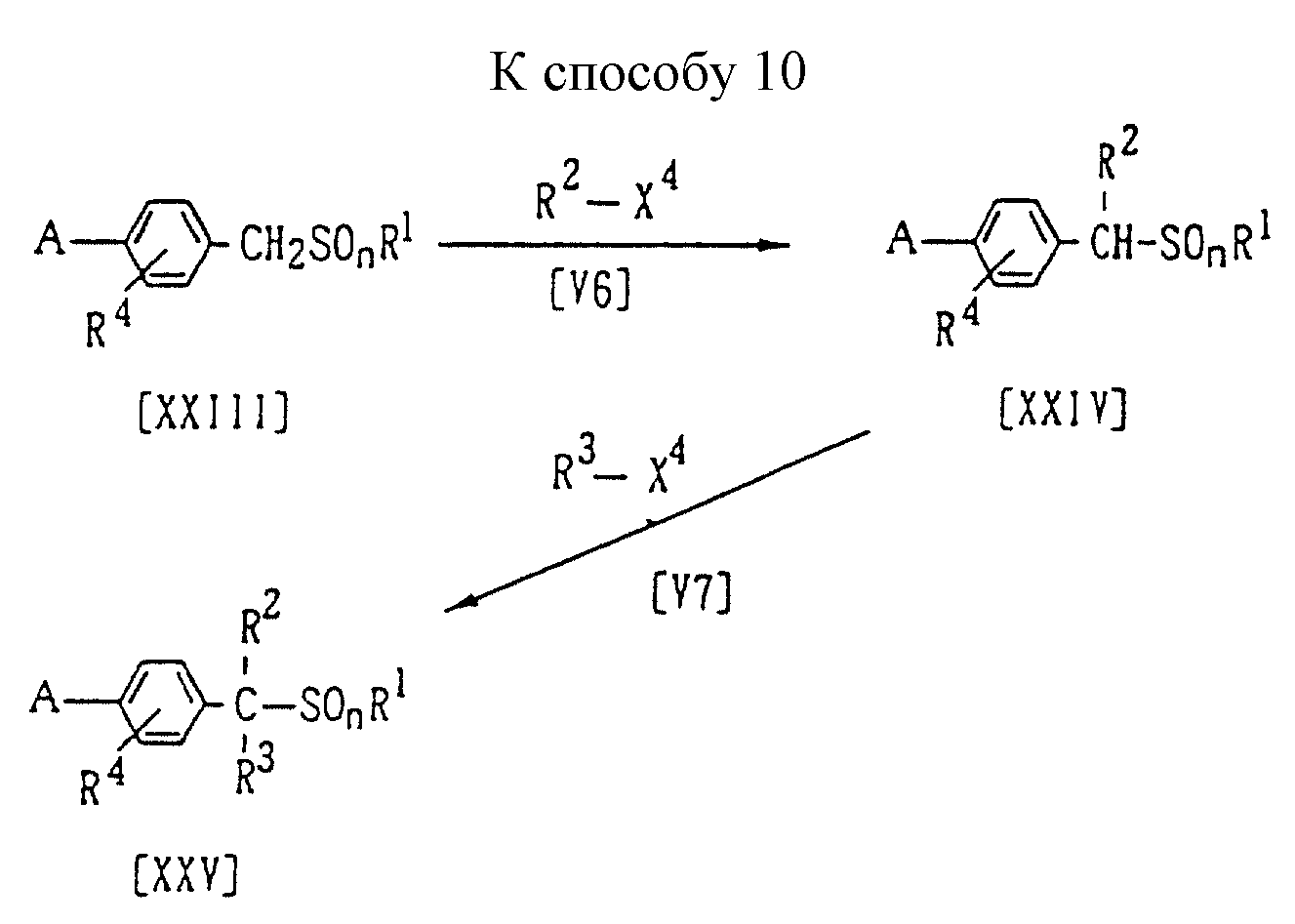
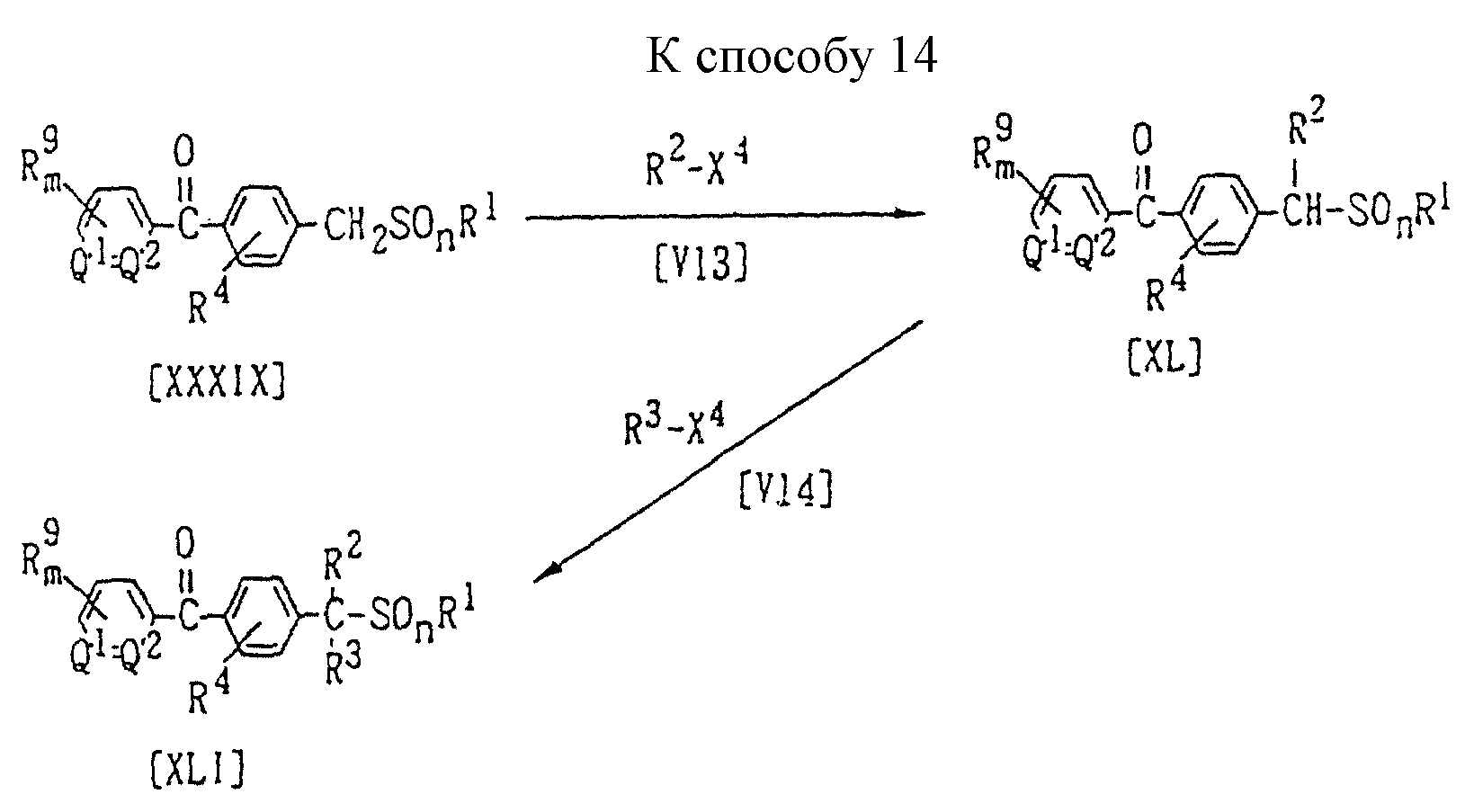
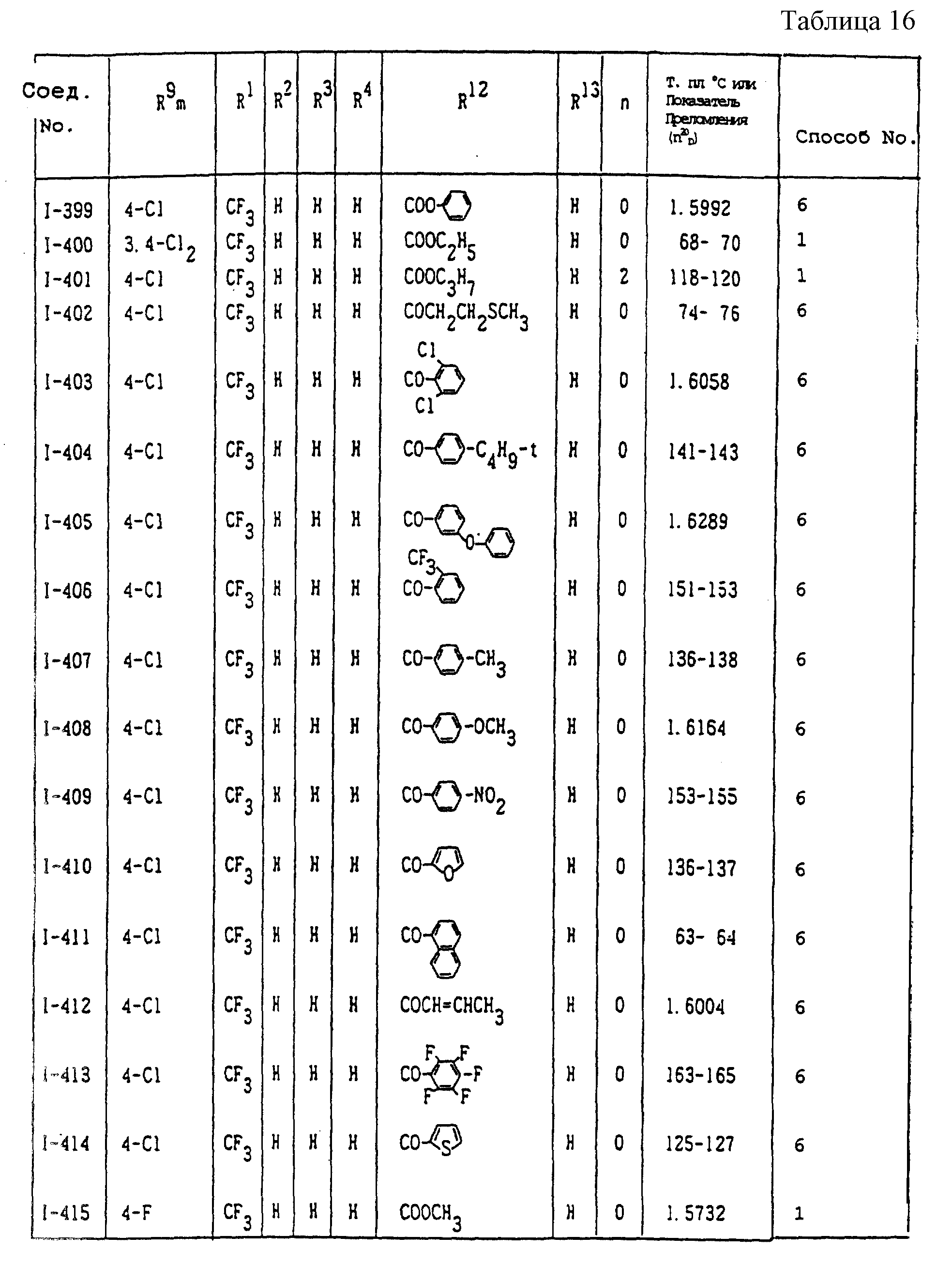


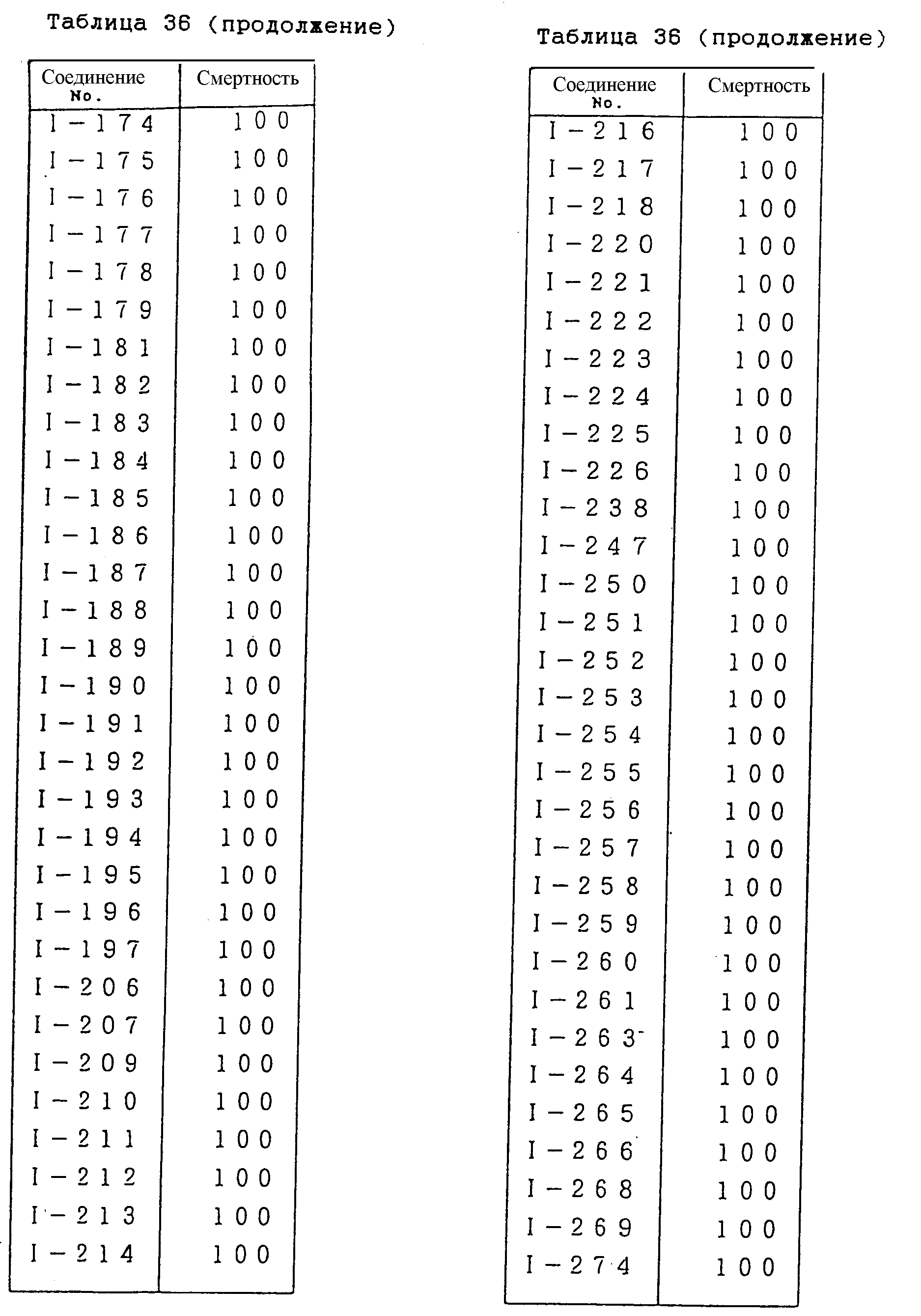

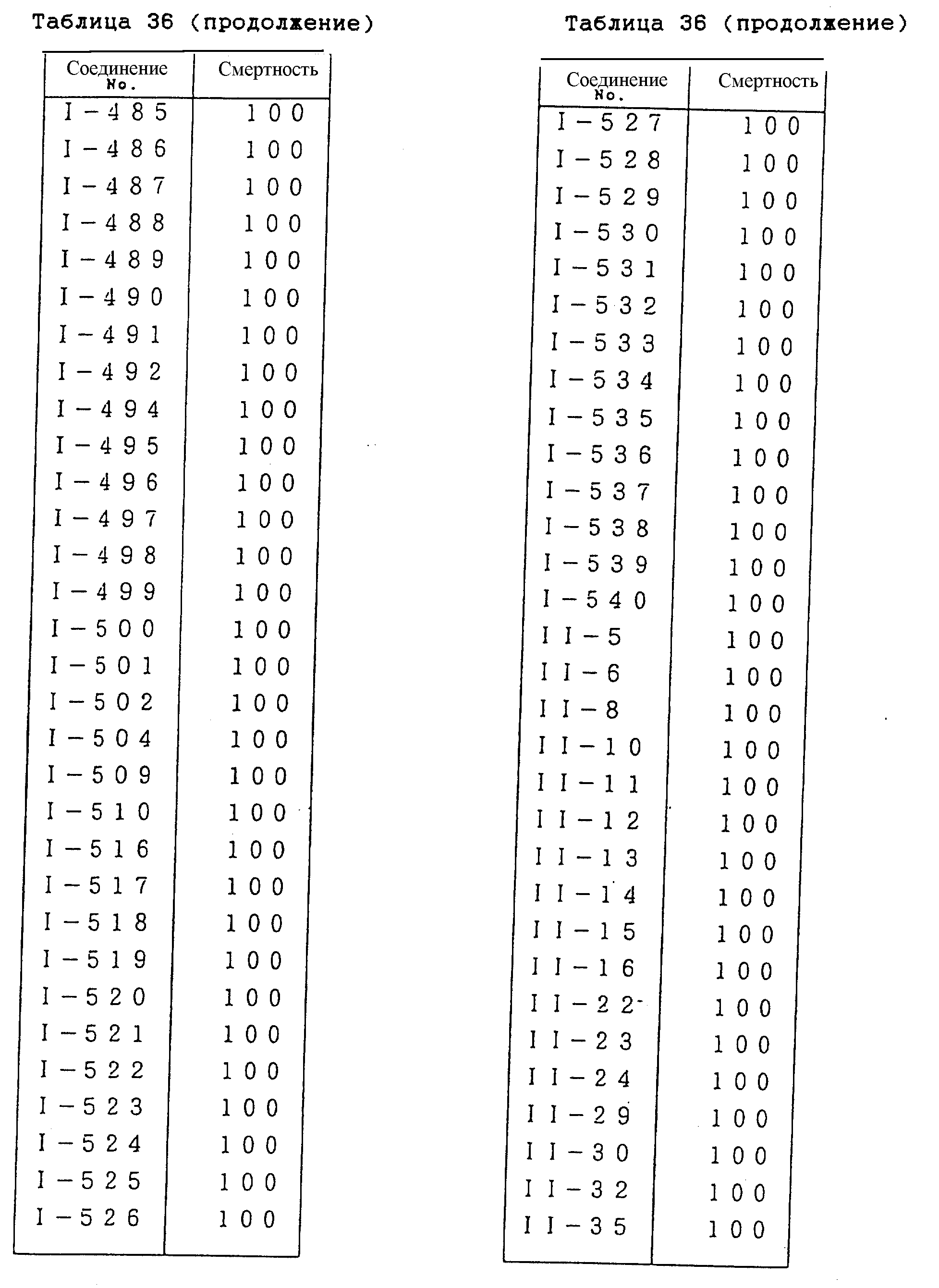

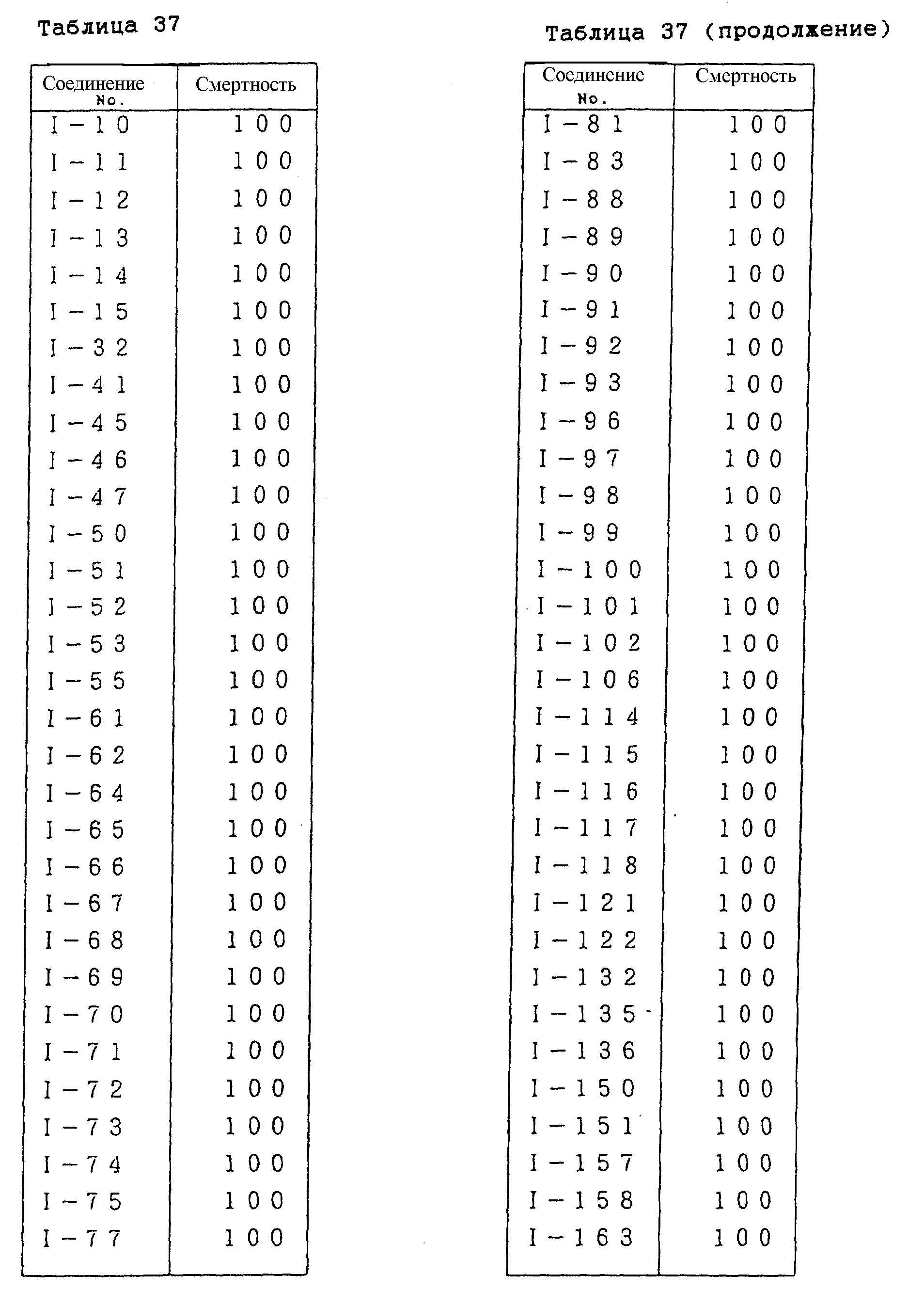
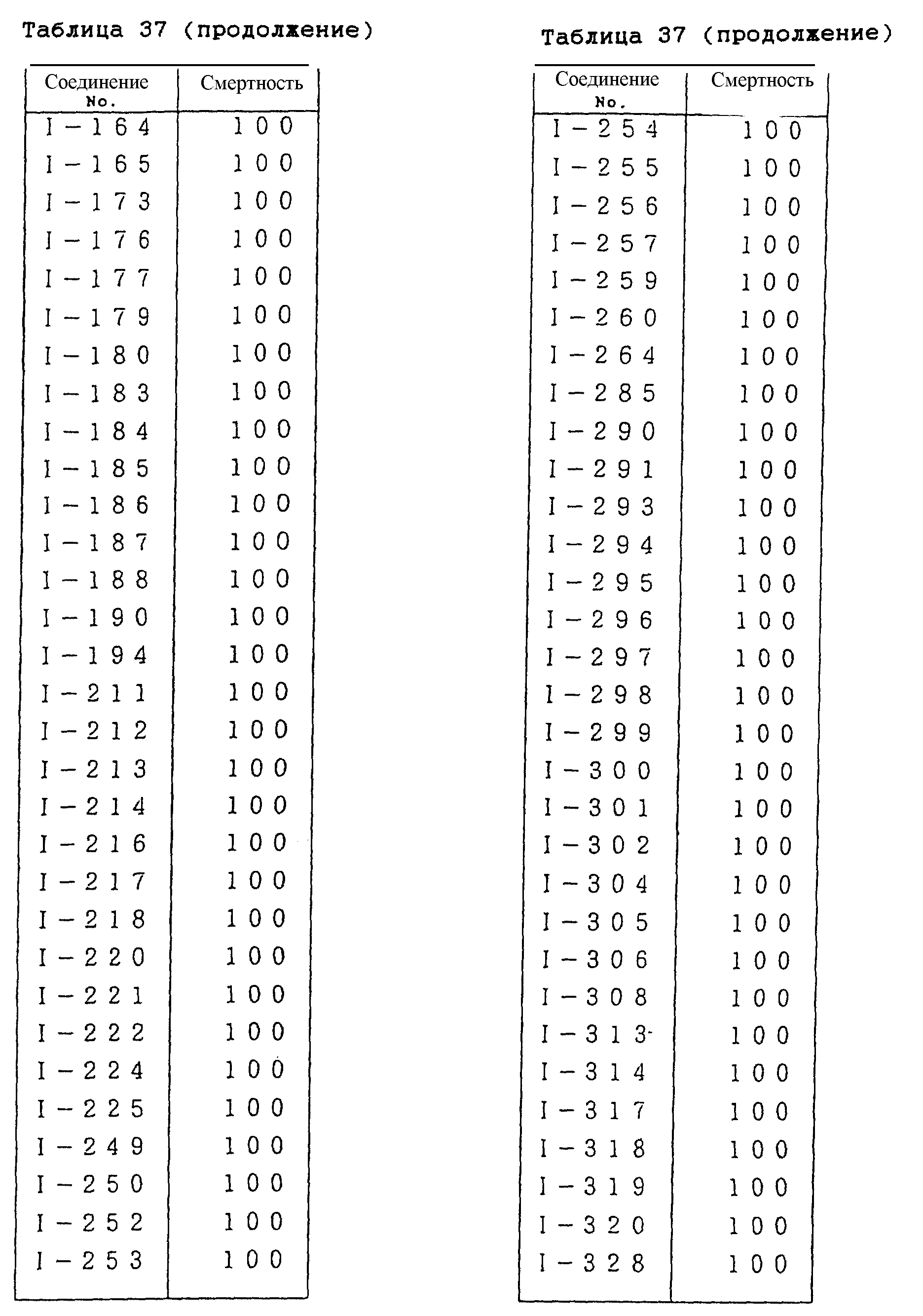
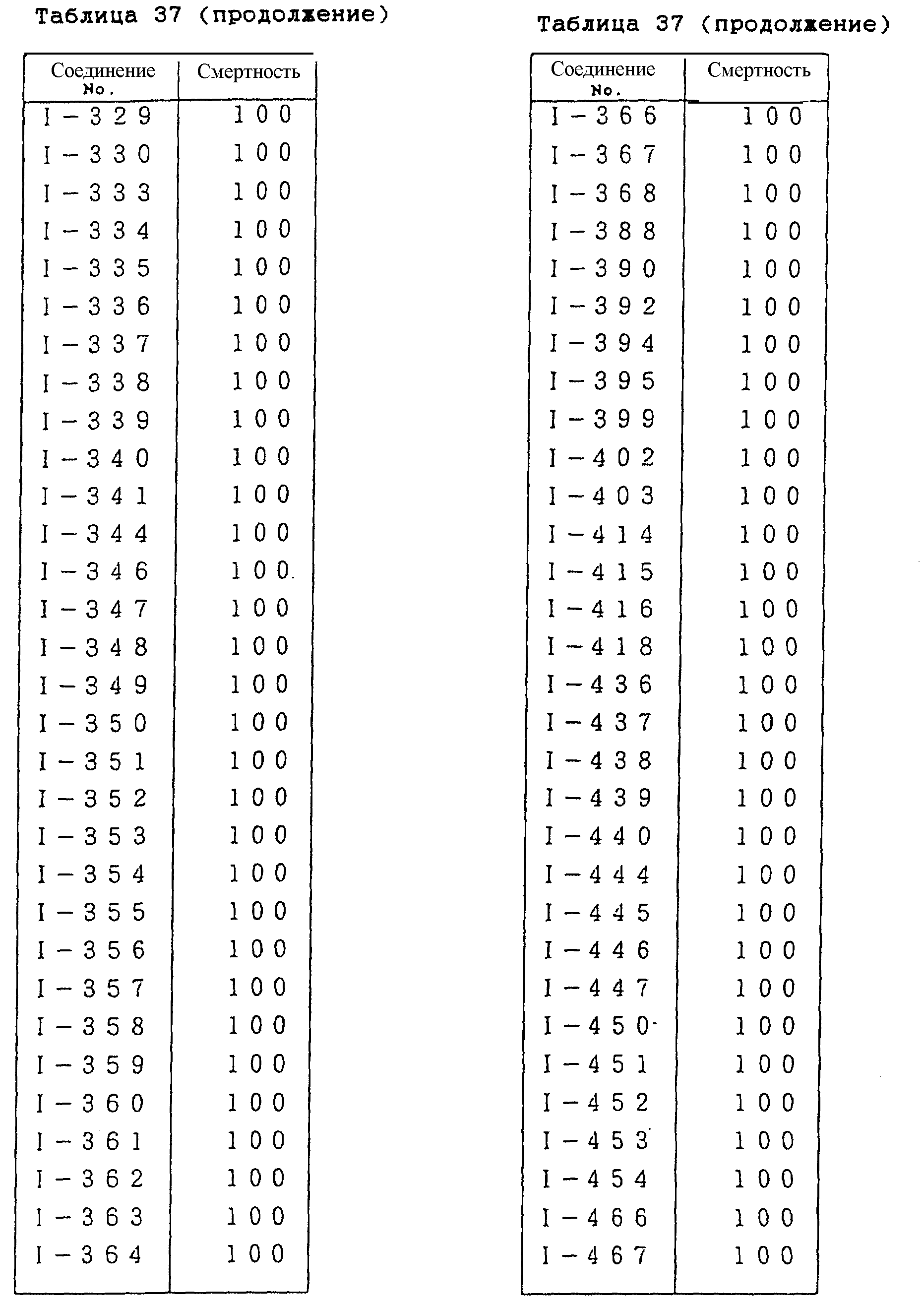


Описание
Изобретение относится к новому производному бензилсульфида, к способу его получения и пестициду, который включает его в качестве активного ингредиента.
Предпосылки изобретения
В настоящее время известно, например, из патента США 3732307 и не прошедших экспертизу патентных публикаций Японии с номерами 122261/1979 и 45452/1981, что производные бензогидразонфенилсульфида
полезны в качестве инсектицидов. Однако, производные бензилсульфида по настоящему изобретению до сих пор не были известны.
В последние годы было ограничено использование ряда промышленно выпускаемых инсектицидов вследствие вызываемых ими проблем, таких как остаточные эффекты, накопление инсектицидов или загрязнение окружающей среды, а некоторые инсектициды оказались не столь эффективны, как ожидалось, поскольку вредители приобрели устойчивость к действию указанных препаратов в течение длительного времени их использования. Таким образом, существует необходимость в разработке нового инсектицида, который бы обладал высокой эффективностью в малых дозах и отличался бы высокой безопасностью.
Заявители настоящего изобретения синтезировали различные производные бензилсульфида и исследовали их физиологическую активность. В результате проведенных исследований было обнаружено, что соединение по настоящему изобретению обладает очень высокой пестицидной активностью по отношению к различным вредителям, в частности по отношению к сельскохозяйственным и садовым вредителям, включая чешуекрылых вредных насекомых, таких как моль капустная (Plutella xylostella), огневка стеблевая азиатская (Chio suppressalis) и свекловичный ратный червь (Spodoptera exigua), полукрылых вредных насекомых, таких как дельфацида коричневая (Nilaparvata lugens), толстовка рисовая зеленая (Nephotetlix cincticeps) и тля хлопковая (Aphis gossypii), и надкрылых вредных насекомых, таких как долгоносик лучистой фасоли (Callosobrunchus chinensis). Это открытие легло в основу настоящего изобретения.
Описание изобретения
Таким образом, в настоящем изобретении заявляется
1) производное бензилсульфида формулы (I) или
его соль
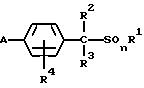
где R1 обозначает (C1-C6)алкильную группу, (C1-C4)цианоалкильную группу, (C1-C4)гидроксиалкильную группу, (C3-C6)циклоалкильную группу, (C1-C6)галогеналкильную группу, (C2-C4)алкенильную группу, (C2-C4)алкинильную группу, фенильную группу (которая может содержать в качестве заместителей атом галогена или (C1-C4)алкильную группу), цианогруппу, бензильную группу (которая может содержать в качестве заместителей атом галогена), тиазолильную группу, (C1-C4 )алкилкарбамоильную группу или группу формулы -N(R5)R6; каждый R2 или R3, которые не зависят друг от друга, обозначают атом водорода, атом галогена, цианогруппу, (C1-C4)алкильную группу, (C1- C3)галогеналкильную группу, (C1-C4)алкилтиогруппу, (C1-C4 )алкилкарбонильную группу, карбоксильную группу или (C1-C4)алкоксикарбонильную группу; или же R2 и R3 совместно с атомом углерода, к которому они присоединены, могут образовывать кольцо, включающее от трех до шести членов; или же R1 и R2 совместно с атомами серы и углерода, к которым они соответственно присоединены, могут образовывать кольцо, включающее от трех до восьми членов и содержащее один или несколько гетероатомов; R4 обозначает атом водорода, атом галогена, (C1-C4)алкильную группу, (C1-C4)галогеналкильную группу, (C1-C4)алкоксигруппу или (C1-C4)галогеналкоксигруппу; каждый R5 или R6, которые не зависят друг от друга, обозначают атом водорода, (C1-C6)алкильную группу или (C1-C4)галогеналкильную группу; или же R5 и R6 могут вместе образовывать группу формулы = CR7R8; или же R5 и R6 вместе с атомом азота, к которому они присоединены, могут образовывать кольцо, включающее от четырех до восьми членов и содержащее один или несколько гетероатомов; R7 обозначает атом водорода, (C1-C3)алкильную группу или (C1-C3 )алкилтиогруппу; R8 обозначает (C1-C3)алкилтиогруппу или (C1-C3)алкиламиногруппу; или же R7 и R8 вместе с атомом углерода, к которому они присоединены, могут образовывать насыщенное или ненасыщенное кольцо, включающее от четырех до восьми членов; A обозначает гидразиноаралкильную или гидразоноаралкильную группу формулы (A1) или (A2)
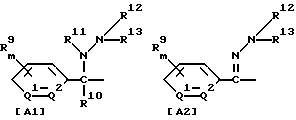
R9 обозначает атом водорода, атом галогена, нитрогруппу, цианогруппу, (C1-C4)алкильную группу, (C1-C4)галогеналкильную группу, (C1-C4)алкоксигруппу или (C1-C4)галогеналкоксигруппу, (C1-C4)алкилтиогруппу,
(C1-C4)галогеналкилтиогруппу, (C1-C4)алкилсульфонильную группу, (C2-C4 )алкилсульфонилметильную группу, (C1-C4)галогеналкилсульфонилоксигруппу, фенильную группу (которая может содержать в качестве заместителя атом галогена) или феноксигруппу (которая может содержать в качестве заместителя атом галогена); или же два заместителя R9 могут вместе образовывать пяти- или шестичленное кольцо; R10 обозначает атом водорода или (C1-C4)алкильную группу; каждый R11, R12 и R13, которые не зависят друг от друга, обозначают атом водорода, цианогруппу, (C1-C6)алкильную группу, (C1-C4)галогеналкильную группу, (C2-C10)алкоксиалкильную группу, (C3-C8)алкоксиалкоксиалкильную группу, (C2-C6)алкилтио-алкильнуго группу, (C2-C6)алкенильную группу, (C2-C4)алкинильную группу, (C1-C4)цианоалкильную группу, бензильную группу (которая может содержать в качестве заместителя атом галогена, (C1-C4)галогеналкильную группу или (C1-C4) алкильную группу), группу формулы -COR14, группу формулы -CSR14, группу формулы -COCR15, группу формулы -COSR15, группу формулы -CON(R16)R17, группу формулы -CSN(R16)R17, группу формулы -SN(R18)R19, группу формулы -SO2R20 или группу формулы -C(R21)=CHR22; или R12 и R13 могут вместе образовывать группу формулы =CR23R24; или R12 и R13 вместе с атомом азота, к которому они присоединены, могут образовывать кольцо, содержащее от четырех до восьми членов; R14 обозначает атом водорода, (C1-C20)алкильную группу, (C1-C8)галогеналкильную группу, (C2-C12)алкоксиалкильную группу, (C2-C10)галогеналкоксиалкильную группу, (C3-C16)алкоксиалкоксиалкильную группу, (C4 -C22)алкосиалкоксиалкоксиалкильную группу, (C2-C6)алкилтиоалкильную группу, (C3-C6)циклоалкильную группу, (C1-C6 )гидроксиалкильную группу, (C1-C6)аминоалкильную группу, (C1-C6)амидоалкильную группу, (C1-C8)цианоалкильную группу, (C3 -C12)алкоксикарбонилалкильную группу, (C2-C6)алкенильную группу, (C2-C4)алкинильную группу, фенильную группу (которая может содержать в качестве заместителя атом галогена, нитрогруппу, (C1-C4)алкильную группу, (C1-C4)галогеналкильную группу, феноксигруппу или (C1-C4 )алкоксигруппу), нафтильную группу (которая может содержать в качестве заместителя атом галогена или (C1-C4)алкильную группу) или гетероароматическую кольцевую группу (которая может содержать в качестве заместителя атом галогена или (C1-C4)алкильную группу); R15 обозначает (C1-C20)алкильную группу, (C2-C8)галогеналкильную группу, (C2-C12)алкоксиалкильную группу, (C2-C6)алкенильную группу, (C2-C4)алкинильную группу, бензильную группу (которая может содержать в качестве заместителя атом галогена, (C1-C4)алкоксигруппу или (C1-C4) алкильную группу) или фенильную группу (которая может содержать в качестве заместителя атом галогена); R16 обозначает атом водорода или (C1-C4)алкильную группу; R17 обозначает атом водорода, (C1 -C6)алкильную группу или фенильную группу (которая может содержать в качестве заместителя атом галогена, (C1-C4)галогеналкоксигруппу или (C1-C4 )алкильную группу); каждый R18 и R19, которые не зависят друг от друга, обозначают (C1-C4)алкильную группу (которая может содержать в качестве заместителя (C1-C4)алкоксикарбонильную группу) или (C2-C5)алкоксиалкильную группу; или же R18 и R19 вместе с атомом азота, к которому они присоединены, могут образовывать пяти- или шестичленное кольцо; R20 обозначает (C1-C4)алкильную группу, (C1-C4)галогеналкильную группу или (C2-C4)ди-алкиламиногруппу; R21 обозначает атом водорода или (C1-C6) алкильную группу; R22 обозначает (C2-C4)ацильную группу или (C2-C6)алкоксикарбонильную группу; каждый R23 и R24, которые не зависят друг от друга, обозначают атом водорода, атом галогена, (C1 -C6)алкильную группу или группу формулы -N(R25)R26; каждый R25 и R26, которые не зависят друг от друга, обозначают атом водорода, (C1 -C4)алкильную группу, (C1-C4)алкоксигруппу, (C2-C12)алкоксиалкильную группу или группу формулы -SO2R27; или же R25 и R26 вместе с атомом азота, к которому они присоединены, образуют пяти- или шестичленное кольцо; R27 обозначает (C1-C8) алкильную группу или фенильную группу (которая может содержать в качестве заместителя атом галогена или (C1-C4)алкильную группу); каждый Q1 и Q2 обозначают атом азота или группу формулы -CR9; m = 1, 2 или 3; а n = 0, 1 или 2;
2) производное бензилсульфида формулы (II)
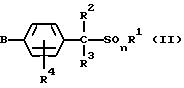
где значение R1, R2, R3, R4 и n указано в п. 1 формулы изобретения, а B обозначает аралкильную или арилкарбонильную группу формулы (В1) или (В2)
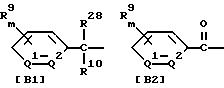
где значение R9, R10, m, Q1 и Q2 указано в п. 1 формулы изобретения, a R28 обозначает атом галогена или гидроксильную группу;
3) произвольное бензофенонгидразона формулы (III)
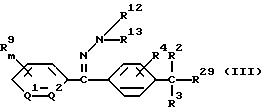
где значение R4, R9, R12, R13, m, Q1 и Q2 указано в n. 1 формулы изобретения; каждый R2 и R3, которые не зависят друг от друга, обозначают атом водорода или (C1-C4)алкильную группу, a R29 обозначает атом галогена, меркаптогруппу или гидроксильную группу;
4) способ получения производного бензилсульфида, где A обозначает группу формулы (A2), значение которой указано в п. 1 формулы изобретения, включающий взаимодействие соединения формулы (IV)
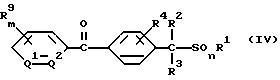
где значение R1, R2, R3, R4, R9, m, n, Q1 и Q2 указано в п. 1 формулы изобретения, с соединением формулы (V1)
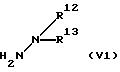
где значение R12 и R13 указано в п. 1 формулы изобретения;
5) способ получения производного бензилсульфида, где A обозначает группу формулы (A2), значение которой указано в п. 1 формулы изобретения, включающий взаимодействие соединения формулы (III)
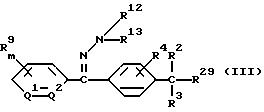
где значение R2, R3, R4, R9, R12, R13, R29, m, Q1 и Q2 указано в п. 3 формулы изобретения, с соединением формулы (V2)
Z - R1,
где Z обозначает атом галогена, (C1-C4 )алкилсульфонильную группу или бензолсульфонилоксигруппу (которая может содержать в качестве заместителя метильную группу), если R29 обозначает меркаптогруппу, или группу формулы -S(O)n М, если R29 обозначает атом галогена, или группу формулы -SSR1, если R29 обозначает гидроксильную группу; R1 обозначает (C1-C6 )алкильную группу, (C1-C4)цианоалкильную группу, (C3-C6)циклоалкильную группу, (C1-C6)галогеналкильную группу, (C2-C4) алкенильную группу или бензильную группу (которая может содержать в качестве заместителя атом галогена); М обозначает щелочной металл; a n = 0 или 2;
6) Способ получения производного бензилсульфида, где A обозначает группу формулы (A1), значение которой указано в п. 1 формулы изобретения, включающий взаимодействие соединения формулы (VI)
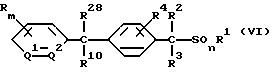
где значение R1, R2, R3, R4, R9, R10, m, n, Q1 и Q2 указано в п. 1 формулы изобретения, a R28 обозначает атом галогена, с соединением формулы (V1)
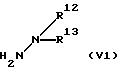
где значение R12 и R13 указано в п. 1 формулы изобретения; и
7) пестицид, содержащий в качестве активного ингредиента производное бензилсульфида по п. 1 формулы изобретения.
В настоящем изобретении атом галогена обозначает атом фтора, атом хлора, атом брома или атом йода.
Алкильная группа обозначает (C1-C20)алкильную группу с прямой или разветвленной цепью, такую как метильная группа, этильная группа, н-пропильная группа, изо-пропильная группа, н-бутильная группа, изо-бутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, изо-амильная группа, неопентильная группа, н-гексильная группа, изо-гексильная группа, 3,3-диметилбутильная группа, н-гептильная группа, н-октильная группа, н-нонильная группа или н-децильная группа.
Циклоалкильная группа обозначает (C3-C6)циклоалкильную группу, такую как циклопропильная группа, циклопентильная группа или циклогексильная группа.
Алкенильная группа обозначает (C2-C6)алкенильную группу с линейной или разветвленной цепью, такую как этенильная группа или 2-пропенильная группа.
Галогеналкильная группа обозначает (C1-C8)алкильную группу с прямой или разветвленной цепью, которая содержит в качестве заместителей от 1 до 10 атомов галогена, которые могут быть одинаковыми или отличными друг от друга, такую как хлор-метильная группа, трифторметильная группа или тетрафторметильная группа.
Цианоалкильная группа обозначает (C1-C8)алкильную группу с прямой или разветвленной цепью, замещенную цианогруппой.
Гидроксиалкильная группа обозначает (C1-C8)алкильную группу с прямой или разветвленной цепью, замещенную гидроксильной группой.
Алкоксигруппа обозначает группу алкил-О-, где значение алкильного фрагмента указано ранее, и она может быть, например, метоксигруппой или этоксигруппой.
Галогеналкоксигруппа обозначает группу галогеналкил-О-, где значение галогеналкильного фрагмента указано ранее, и она может быть, например, трифторметоксигруппой или 2-хлор этоксигруппой.
Алкилтиогруппа обозначает группу алкил-S-, где значение алкильного фрагмента указано ранее, и она может быть, например, метилтиогруппой или этилтиогруппой.
Галогеналкилтиогруппа обозначает группу галогеналкил-S-, где значение галогеналкильного фрагмента указано ранее, и она может быть, например, трифторметилтиогруппой или 2- хлорэтилтиогруппой.
Алкилсульфонильная группа обозначает группу алкил-SO2 -, где значение алкильного фрагмента указано ранее, и она может быть, например, метилсульфонильной группой или этилсульфонильной группой.
Алкилсульфонилметильная группа обозначает группу алкил-SO2CH2-, где значение алкильного фрагмента указано ранее, и она может быть, например, метилсульфонилметильной группой или этилсульфонилметильной группой.
Алкиленовая группа обозначает (C1-C8)алкиленовую группу с прямой или разветвленной цепью, такую как метиленовая группа, этиленовая группа, триметиленовая группа или тетраметиленовая группа.
Алкоксиалкильная группа обозначает алкил-О-алкиленовую группу, где значение алкильного и алкиленового фрагмента указано ранее, и она может быть, например, метоксиметильной группой или этоксиметильной группой.
Алкилтиоалкильная группа обозначает алкил-S-алкиленовую группу, где значение алкильного и алкиленового фрагмента указано ранее, и она может быть, например, метилтиометильной группой или этилтиометильной группой.
Алкоксиалкосиалкильная группа обозначает алкил-О-алкилен-О-алкиленовую группу, где значение алкильного и каждого алкиленового фрагмента указано ранее.
Алкоксиалкосиалкосиалкильная группа обозначает алкил-О-алкилен-О-алкилен-О-алкиленовую группу, где значение алкильного и каждого алкиленового фрагмента указано ранее.
Аминоалкильная группа обозначает (C1-C8)алкильную группу с прямой или разветвленной цепью, замещенную аминогруппой, моноалкиламиногруппой или диалкиламиногруппой.
Амидоалкильная группа обозначает (C1-C8)алкильную группу с прямой или разветвленной цепью, замещенную ациламиногруппой или N- алкил-N-ациламиногруппой.
Алкинильная группа обозначает линейную (C1-C4)алкинильную группу.
Гетероциклическая ароматическая группа обозначает пятичленную ароматическую кольцевую группу, содержащую от 1 до 4 атомов азота, кислорода или серы, или ее же пятичленную ароматическую кольцевую группу, содержащую от 1 до 4 атомов азота, кислорода или серы. Сконденсированную с бензольным кольцом, или же шестичленную ароматическую кольцевую группу, содержащую от 1 до 3 атомов азота, или шестичленную ароматическую кольцевую группу, содержащую от 1 до 3 атомов азота, конденсированную с бензольным кольцом, и она может быть, например, фурильной группой, тиенильной группой, пиразолильной группой, имидазолильной группой, бензофуранильной группой, бензотиазолильной группой, пиридильной группой, пиримидильной группой, пиридазинильной группой, триазинильной группой, хинолинильной группой или хиноксалинильной группой.
В соединении по настоящему изобретению соль обозначает соль соединения формулы (I) с кислотой или соль соединения формулы (I), где R2 или R3 обозначает карбоксильную группу, с металлом или амином. Кислота может быть, например, галогено-водородной кислотой, такой как соляная кислота или бромисто-водородная кислота, или сульфоновой кислотой, такой как метансульфокислота. Металл может быть, например, щелочным металлом, таким как натрий или калий, или щелочно-земельным металлом, таким как магний или кальций. Амин может быть, например, аммиаком, изопропиламином или триэтиламином.
Предпочтительную группу соединений приведенной ранее формулы (I) составляет группа соединений, в которой:
R1 обозначает (C1-C4)алкильную группу, (C1-C2)цианоалкильную группу, гидроксиэтильную группу, циклопентильную группу, (C1-C2)галогеналкильную группу,
фенильную (которая может содержать в качестве заместителя атом галогена), цианогруппу, (C1-C4)алкилкарбамоильную группу или тиазолильную группу;
каждый R2 и
R3, которые не зависят друг от друга и обозначают атом водорода, метильную группу или (C1-C2)алкоксикарбонильную группу; или же R1 и R2 вместе с
атомами серы и углерода, к которым они соответственно присоединены, могут образовывать пятичленное кольцо;
R4 обозначает атом водорода или атом фтора;
A обозначает
гидразиноаралкильную или гидразоноаралкильную группу формулы (A1) и (A2):
R9 обозначает атом водорода, атом галогена, нитрогруппу, цианогруппу, метильную группу, трифторметильную
группу, метоксигруппу, (C1-C2)галогеналкоксигруппу, метилтиогруппу, дифторметилтиогруппу, метилсульфонильную группу, метил-сульфонилметильную группу,
трифторметилсульфонилоксигруппу, фенильную группу, фенокси-группу, которая может содержать в качестве заместителя атом галогена, или метиленовую или ди-оксигруппу;
R10 обозначает
атом водорода;
R11 обозначает атом водорода, группу формулы -COR14 или группу формулы -COOR15;
каждый R12 и R13, которые не
зависят друг от друга, обозначают атом водорода, (C1-C4) алкильную группу, (C1-C4) галогеналкильную группу, (C2-C10)алкоксиалкильную
группу, (C3-C8)алкоксиалкоксиалкильную группу, (C2-C6)алкилтио-алкильную группу, цианометильную группу, бензильную группу (которая может содержать в
качестве заместителя атом галогена или трифторметильную группу), группу формулы -COR14, группу формулы - COOR15, группу формулы -CONHR17, группу формулы -SO2
R20 или группу формулы -C(R21) =CHR22; или R12 и R13 могут вместе образовать группу формулы =CR23R24; или R12 и
R13 вместе с атомом азота, к которому они присоединены, могут образовать пятичленное кольцо;
R14 обозначает (C1-C10) алкильную группу, (C1-C4) галоген-алкильную группу, (C1-C6)алкоксиалкильную группу, (C2-C4)галогеналкоксиалкильную группу, (C3-C10
)алкоксиалкоксиалкильную группу, (C4-C12)алкоксиалкоксиалкоксиалкильную группу, циклопропильную группу, (C1-C4) цианоалкильную группу, (C3-C6)алкоксикарбонилалкильную группу, фенильную группу (которая может содержать в качестве заместителя атом галогена, нитрогруппу, (C1-C4) алкильную группу, трифторметильную
группу, феноксигруппу или метоксигруппу), нафтильную группу, пиридильную группу, тиенильную группу или 2-фурильную группу;
R15 обозначает (C1-C10) алкильную
группу, (C2-C6)галогеналкильную группу, (C2-C6)алкоксиалкильную группу или фенильную группу;
R16 обозначает атом водорода или метильную
группу;
R17 обозначает атом водорода, (C1-C6) алкильную группу или фенильную группу (которая может содержать в качестве заместителя атом хлора или
трифторметоксигруппу);
R20 обозначает метильную группу или трифторметильную группу;
R21 обозначает атом водорода или метильную группу;
R22
обозначает ацетильную группу или метоксигруппу;
каждый R23 и R24, которые не зависят друг от друга, обозначают атом водорода, атом хлора, (C1-C4
)алкильную группу, 1-триазолильную группу или группу формулы -N(R25)R26;
каждый R25 и R26, которые не зависят друг от друга, обозначают атом
водорода, (C1-C4)алкильную группу, метоксигруппу или (C2-C4)алкоксиалкильную группу;
R27 обозначает (C1-C4
)алкильную группу или фенильную группу (которая может содержать в качестве заместителя атом галогена или метильную группу);
каждый Q1 и Q2 обозначают атом азота или
группу формулы CR9;
m = 1, 2 или 3;
n = 0, если R1 обозначает цианогруппу или (C1-C4)алкилкарбамоильную группу, или n = 0, 1 или 2 во всех
остальных случаях.
Предпочтительную группу соединений приведенной ранее формулы (II) составляет группа соединений, в которой:
R1 обозначает (C1-C4)алкильную группу, цианометильную группу, гидроксиэтильную группу, циклопентильную группу, (C1- C3)галогеналкильную группу, фенильную (которая может содержать в качестве
заместителя атом галогена), цианогруппу, (C1-C4)алкилкарбамоильную группу или тиазолильную группу;
каждый R2 и R3, которые не зависят друг от друга,
обозначают атом водорода, метильную группу или (C1-C2)алкоксикарбонильную группу; или же R1 и R2 вместе с атомами серы и углерода, к которым они
соответственно присоединены, могут образовать пятичленное кольцо;
R4 обозначает атом водорода или атом фтора;
B обозначает аралкильную или арилкарбонильную группу формулы
(В1) или (В2);
R3 обозначает атом галогена, трифторметильную группу, метоксигруппу, (C1-C2)фторалкоксигруппу или феноксигруппу, которая может содержать в
качестве заместителя атом галогена);
R10 обозначает атом водорода;
R28 обозначает атом хлора или гидроксильную группу;
каждый Q1 и Q2 обозначают атом азота или группу формулы -CR9;
m = 1 или 2; а
n = 0, если R1 обозначает цианогруппу или (C1-C4)алкилкарбамоильную
группу, или n = 0, 1 или 2 во всех остальных случаях.
Предпочтительную группу соединений приведенной ранее формулы (III) составляют, например, соединения, в которых:
каждый
R2, R3 и R4 обозначают атом водорода;
R9 обозначает атом хлора, находящийся в положении 4;
каждый R12 и R13
обозначают атом водорода, группу формулы -COR14 или группу формулы -COOR15;
R14 обозначает (C1-C4)алкильную группу;
R15 обозначает (C1-C4)алкильную группу;
R29 обозначает атом хлора, меркаптогруппу или гидроксильную группу;
каждый Q1 и Q2
обозначают метильную группу;
m = 1.
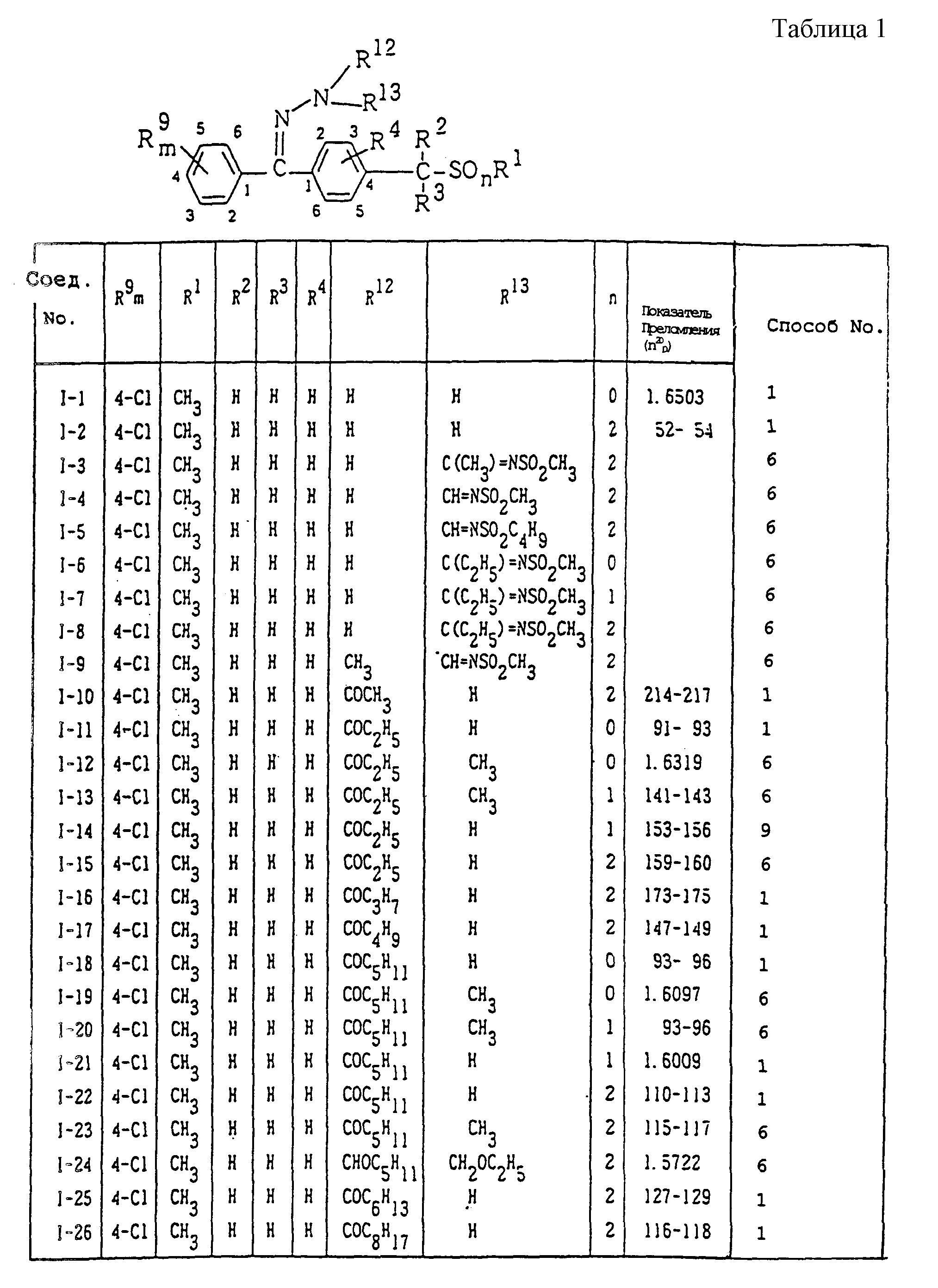
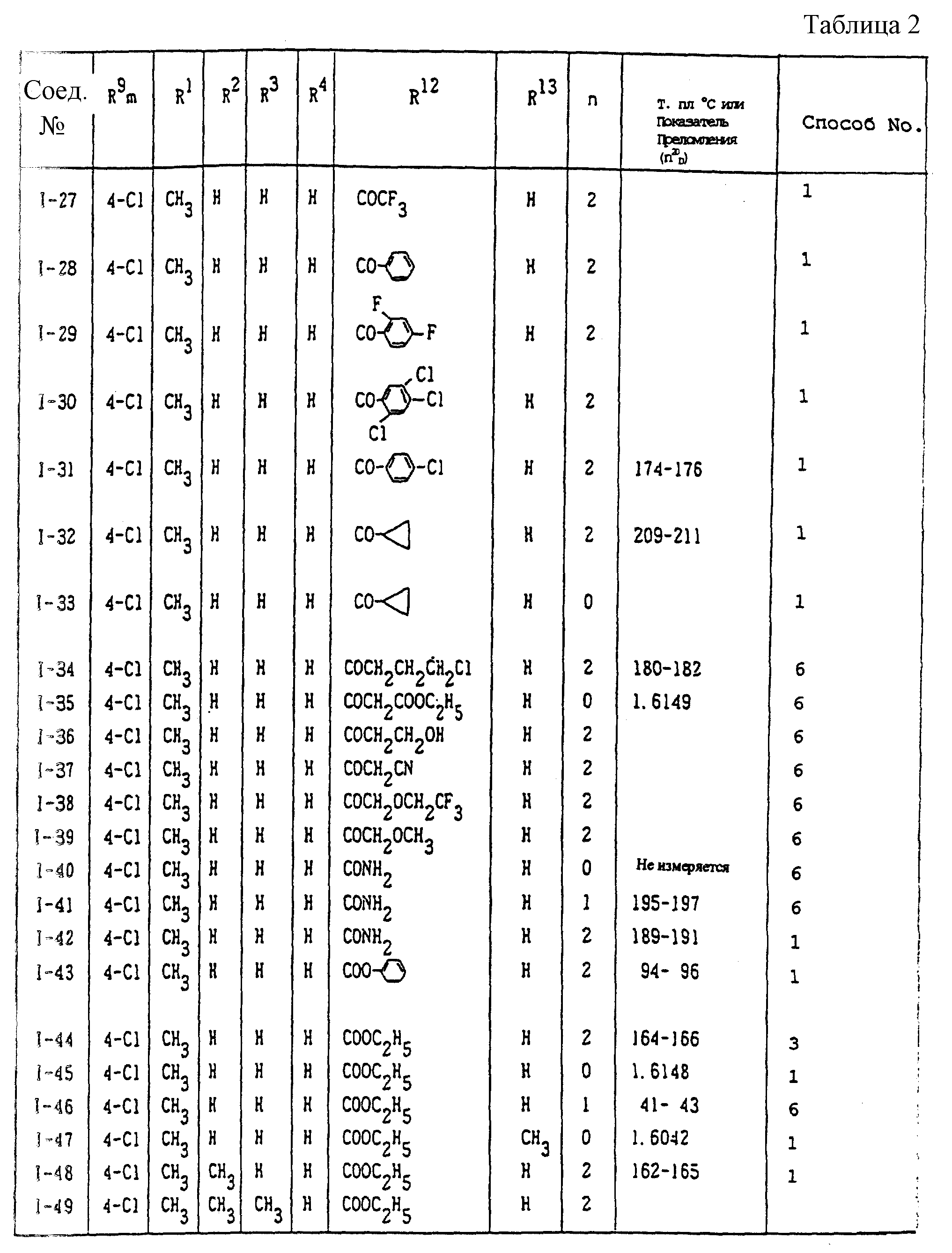
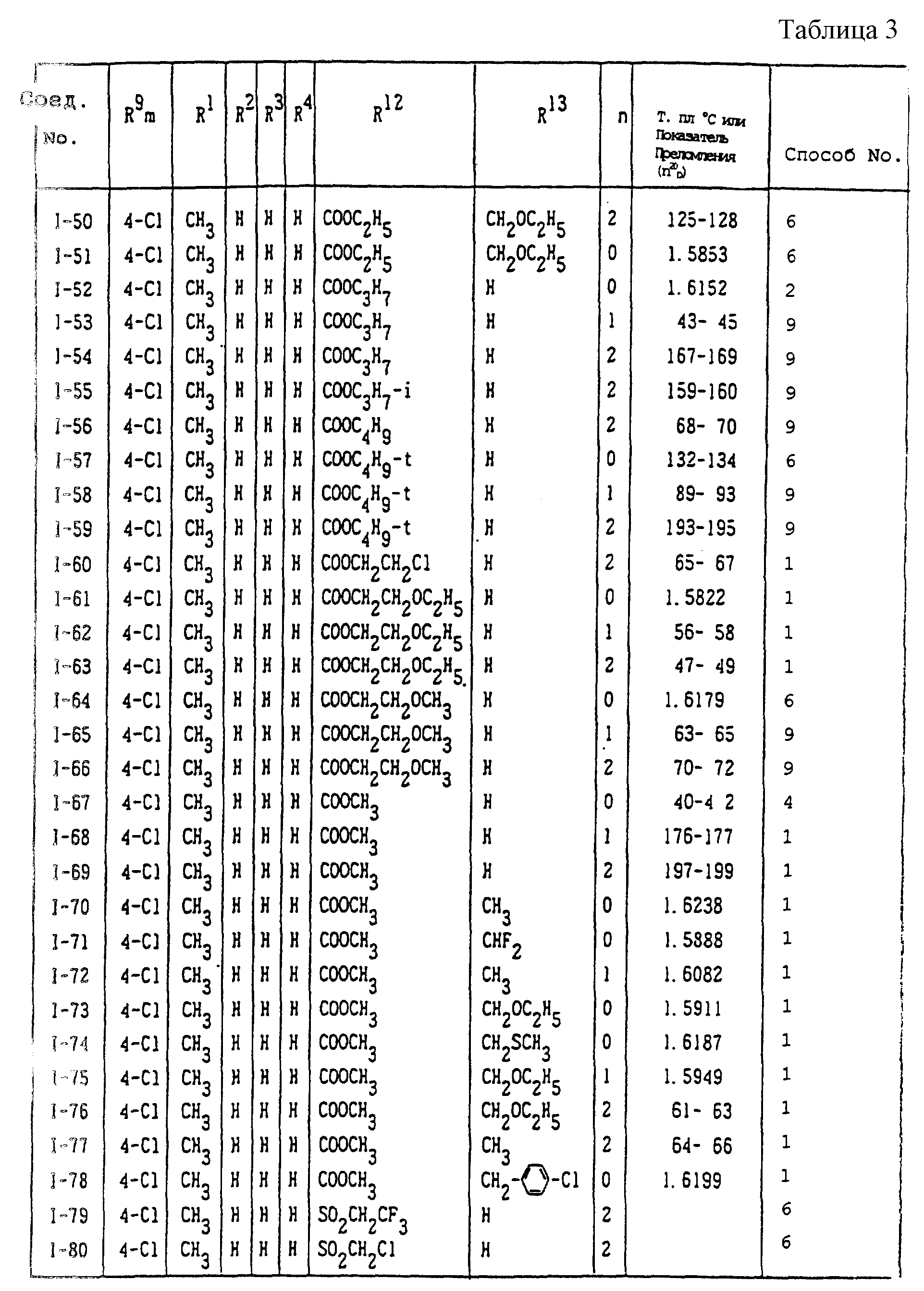
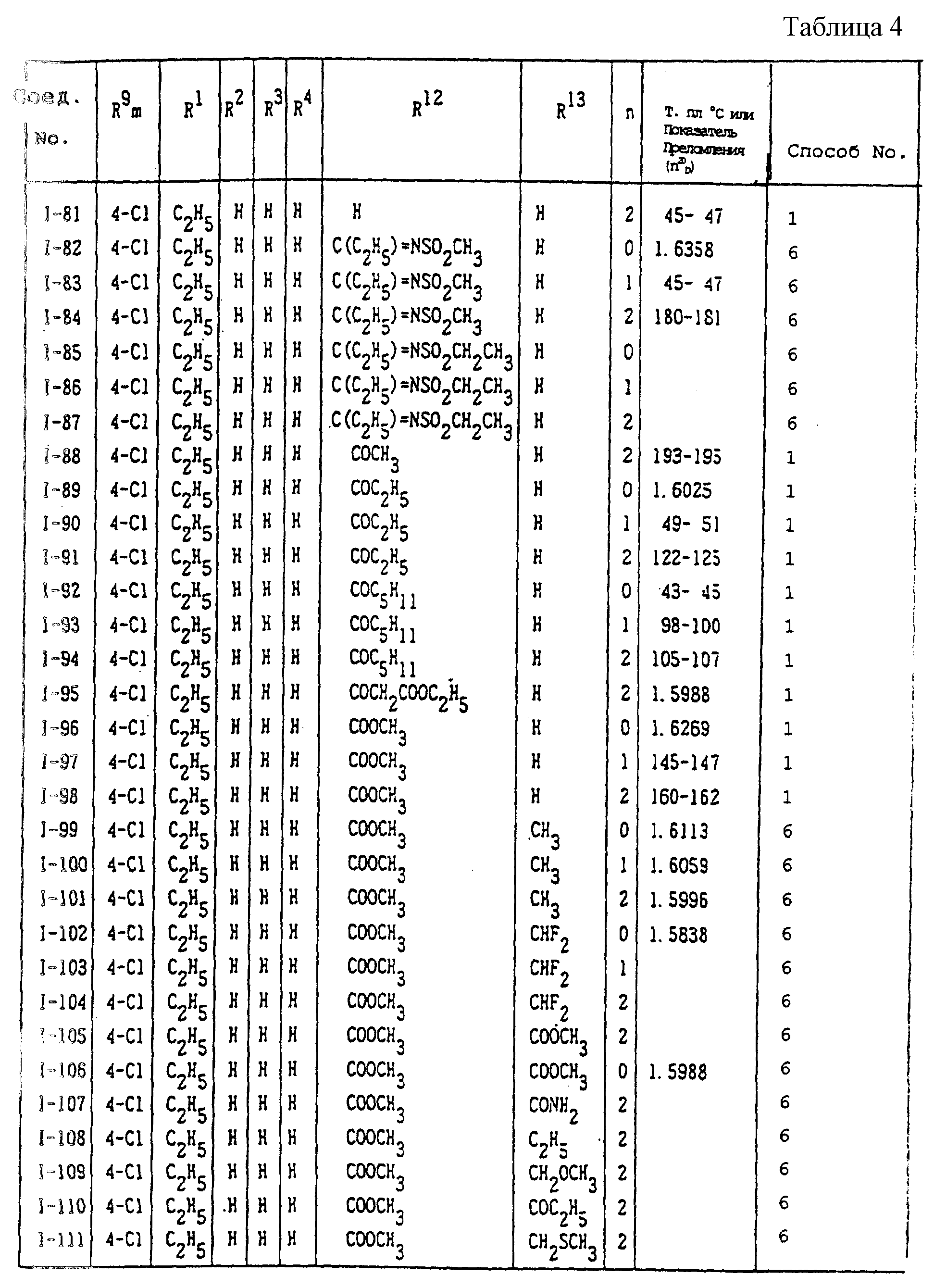
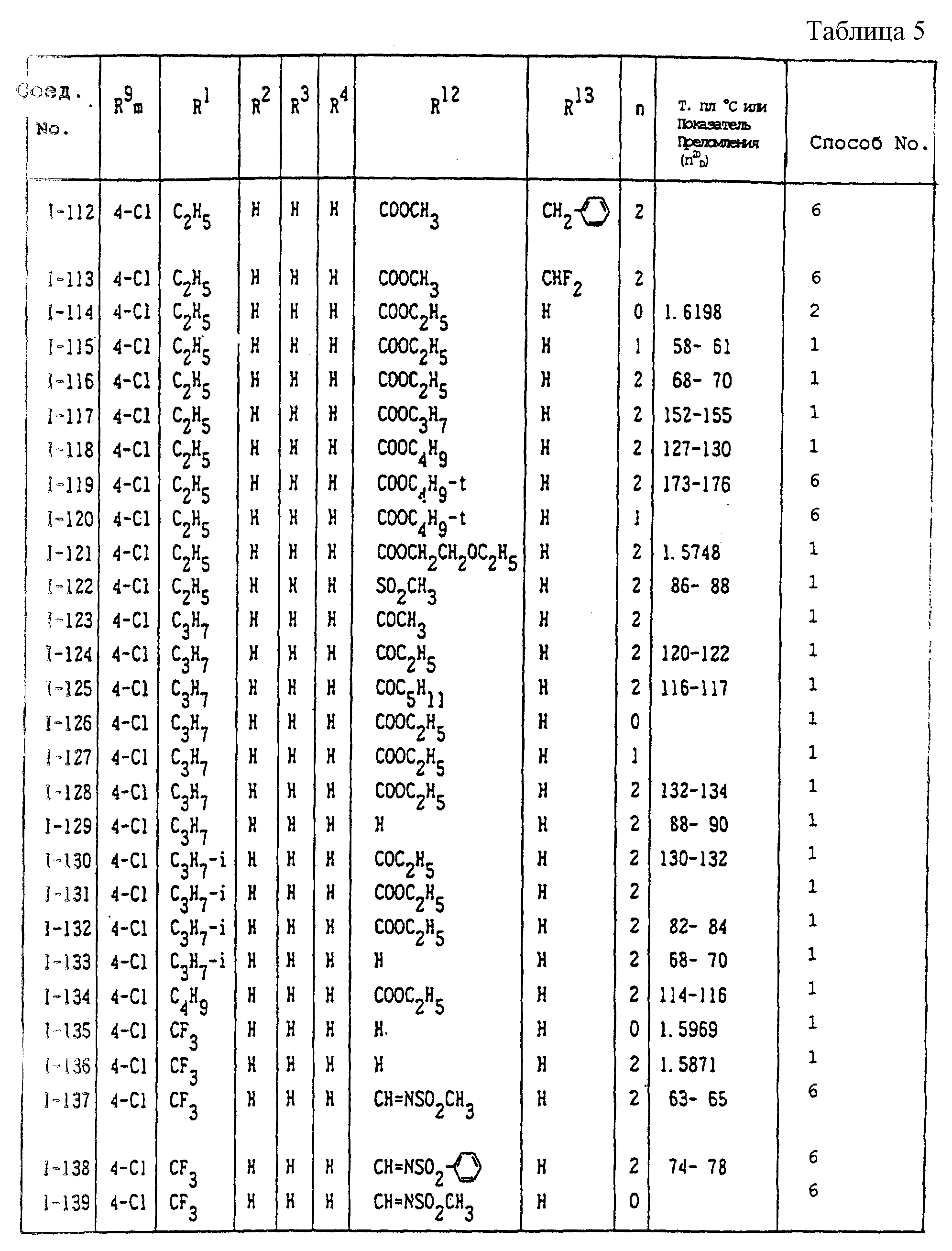
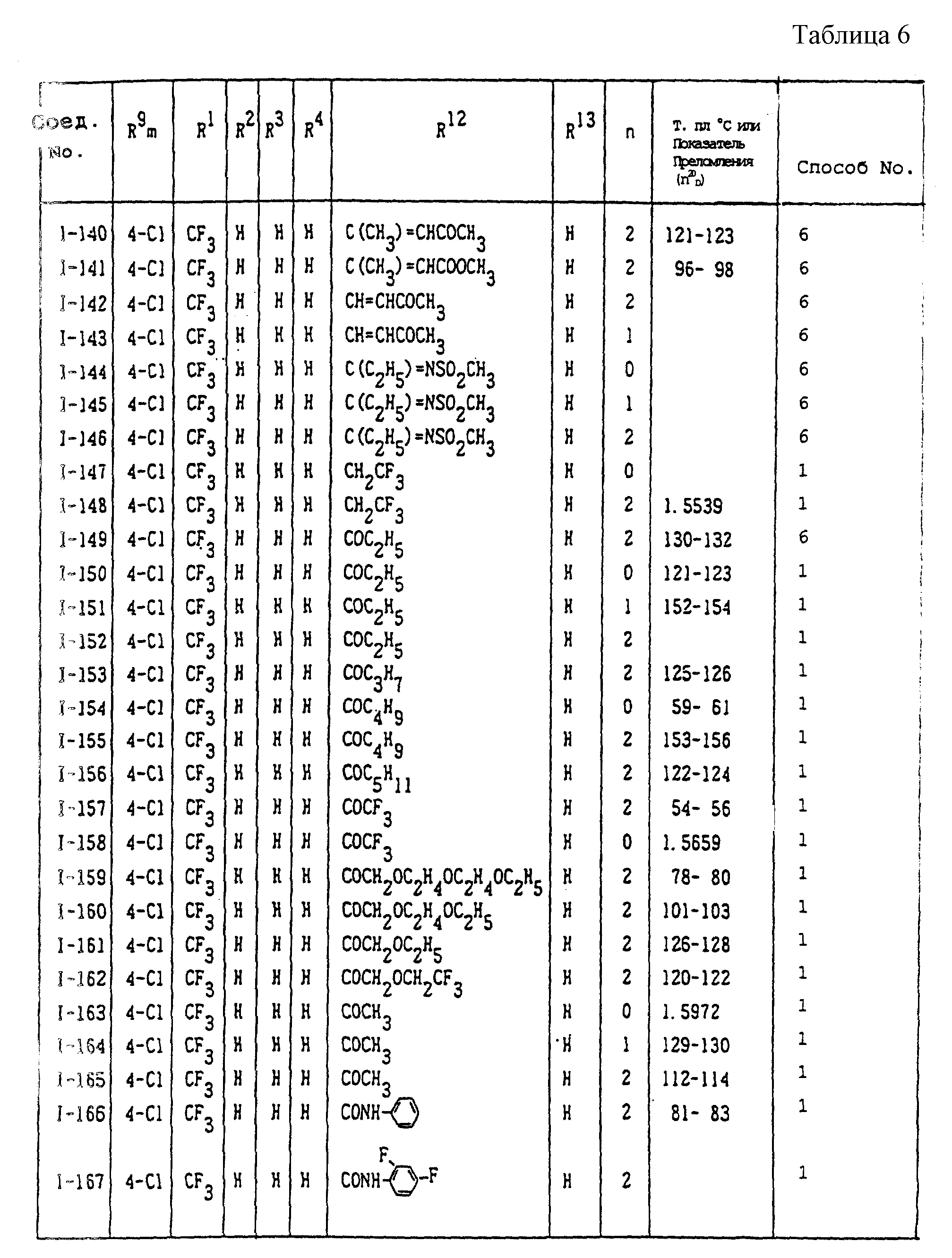
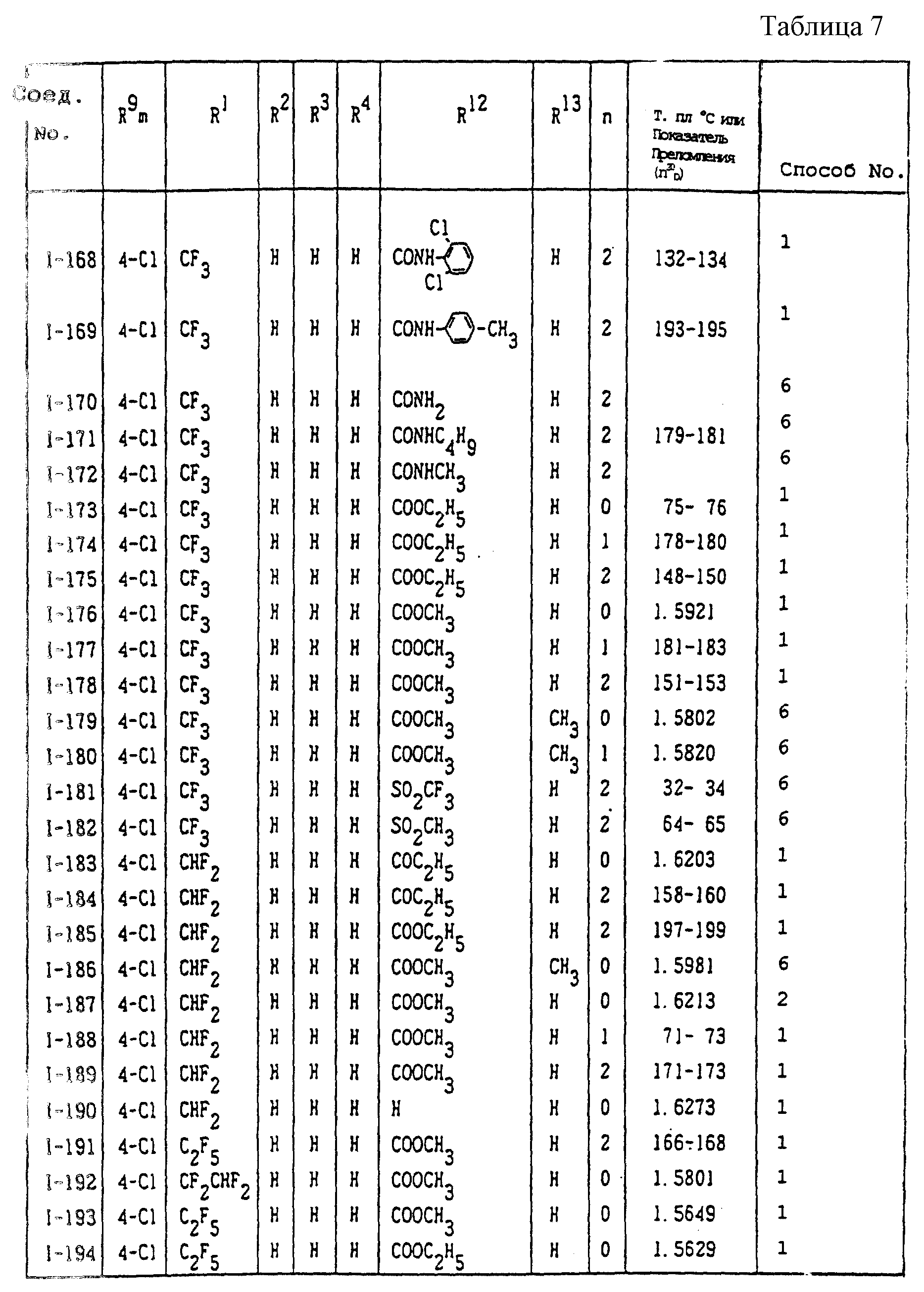
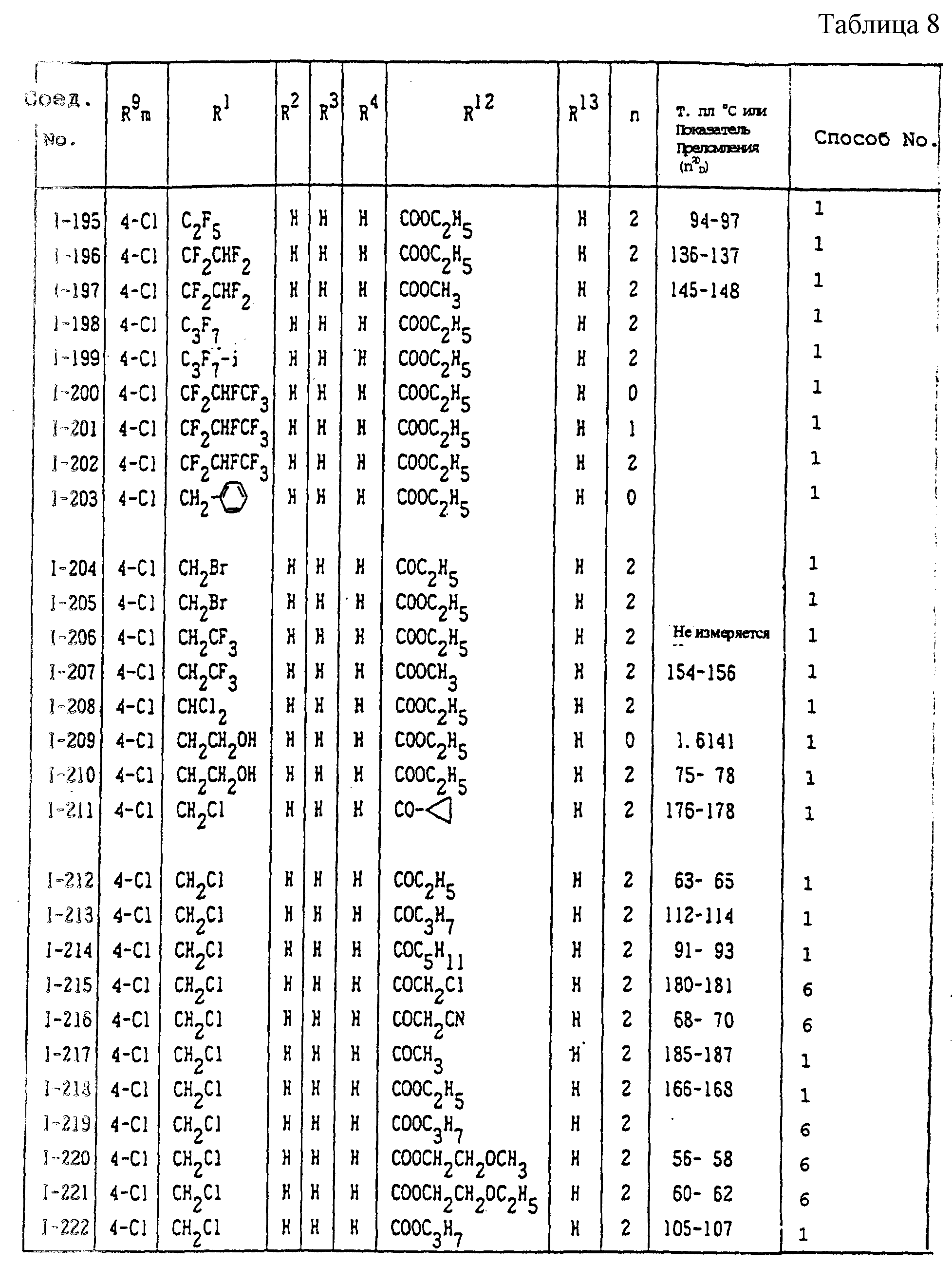
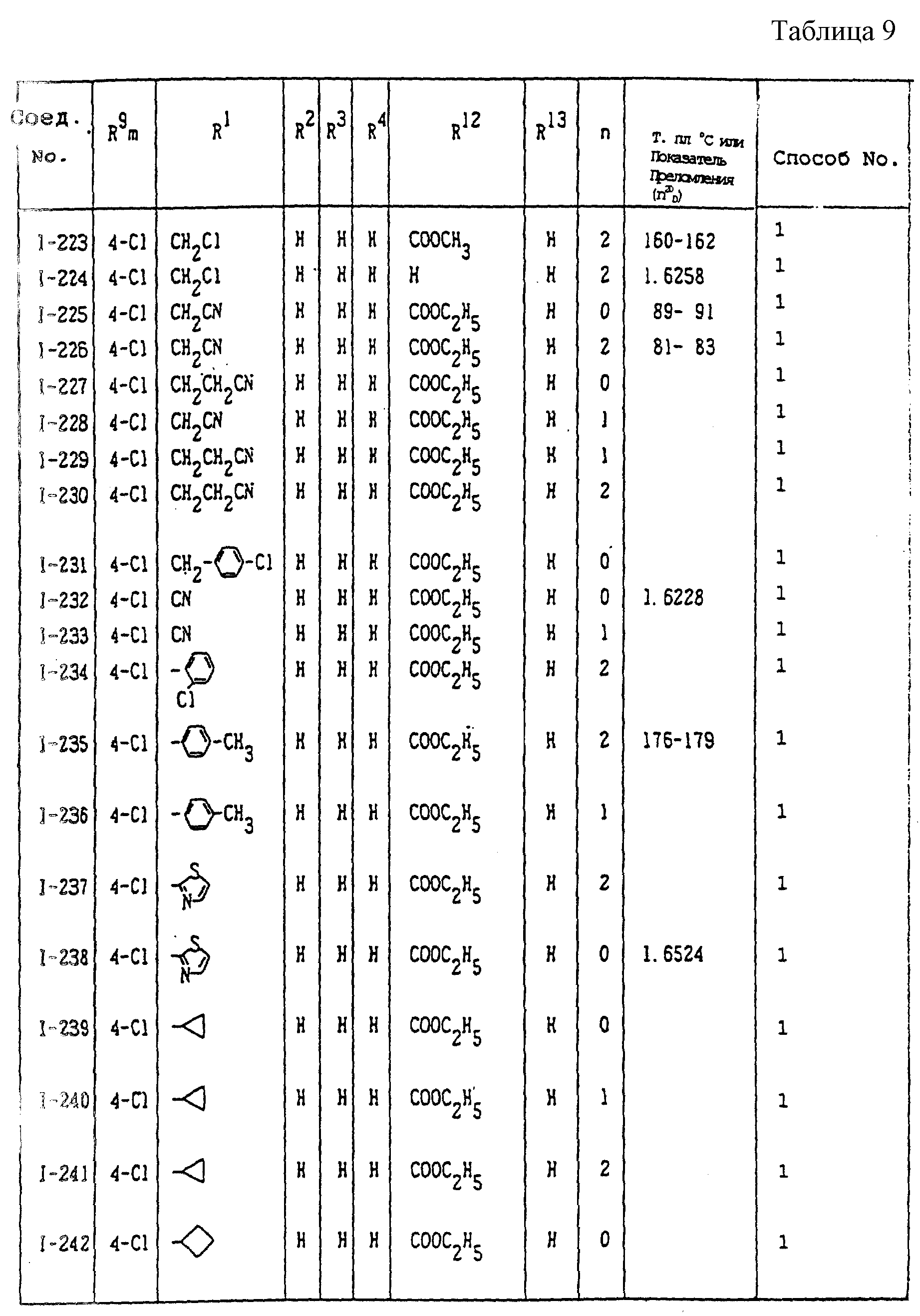
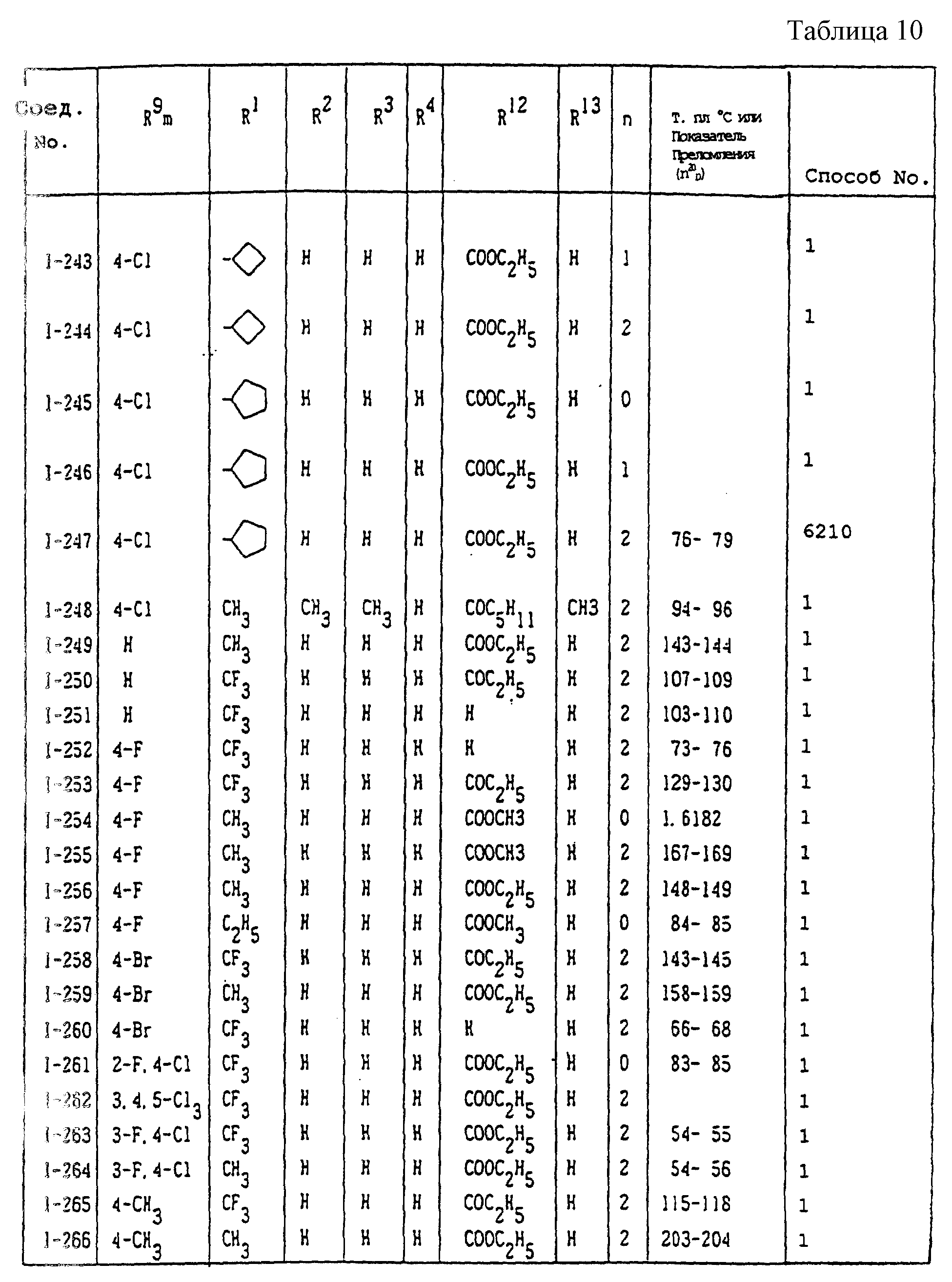
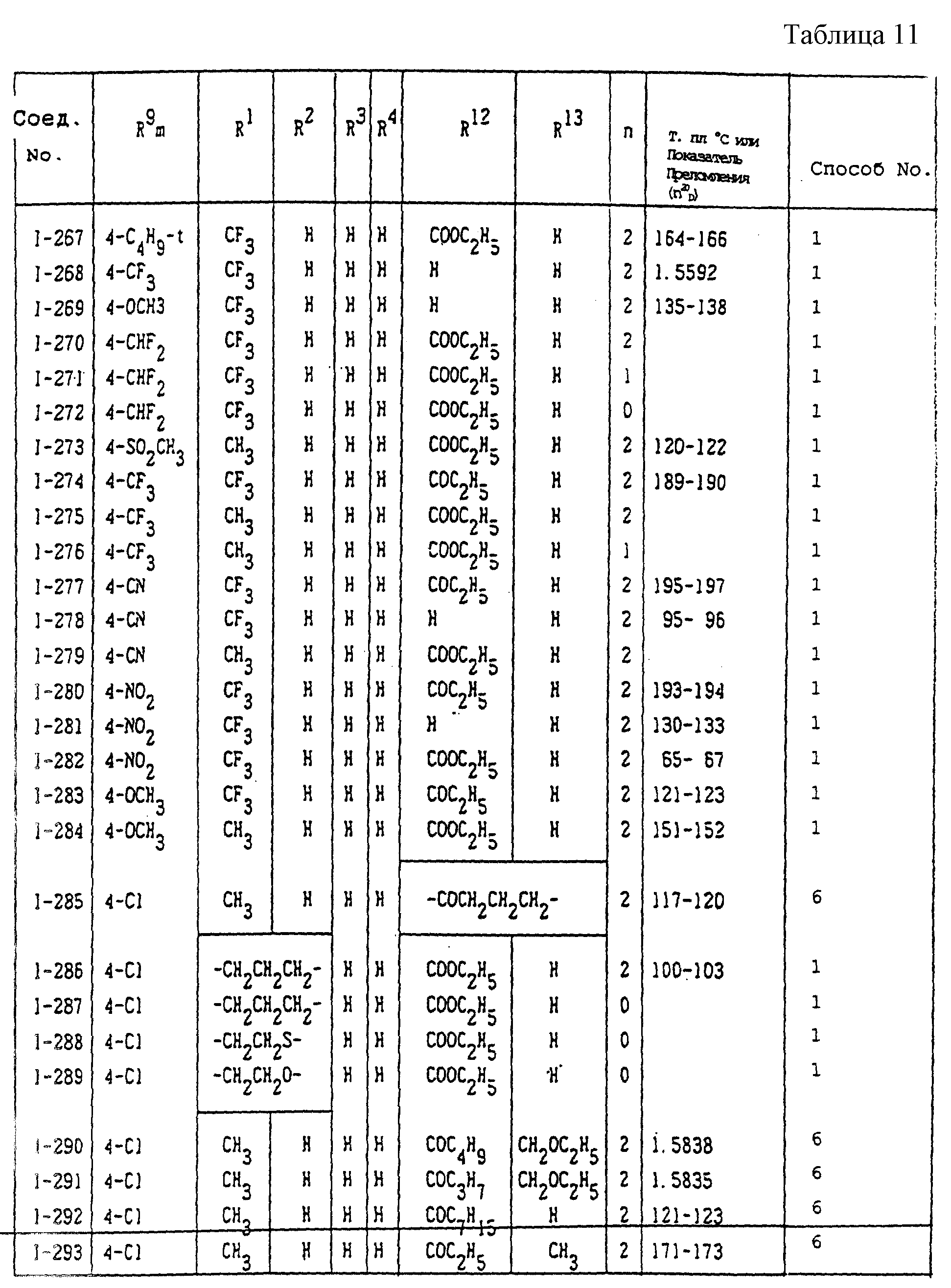
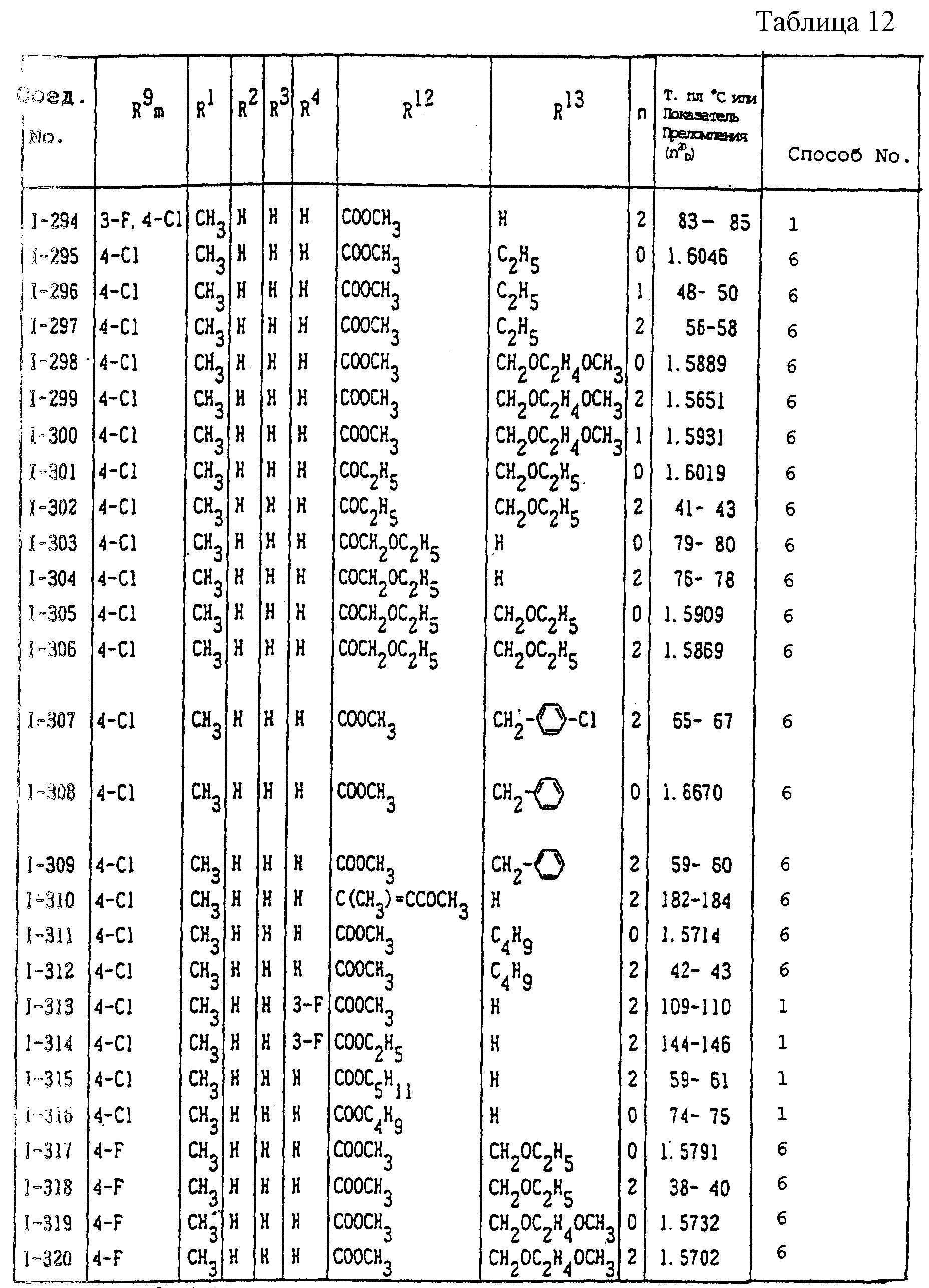
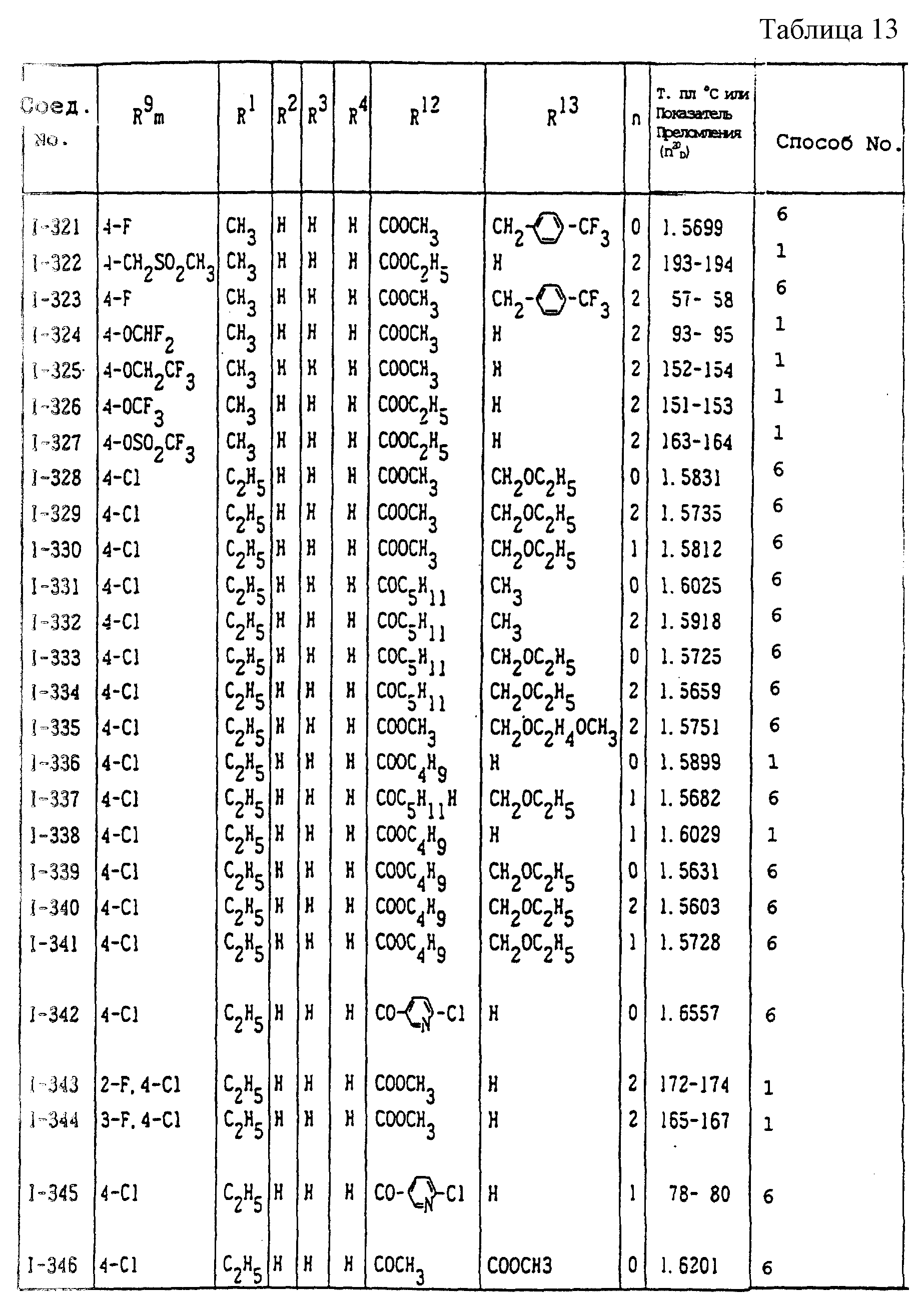
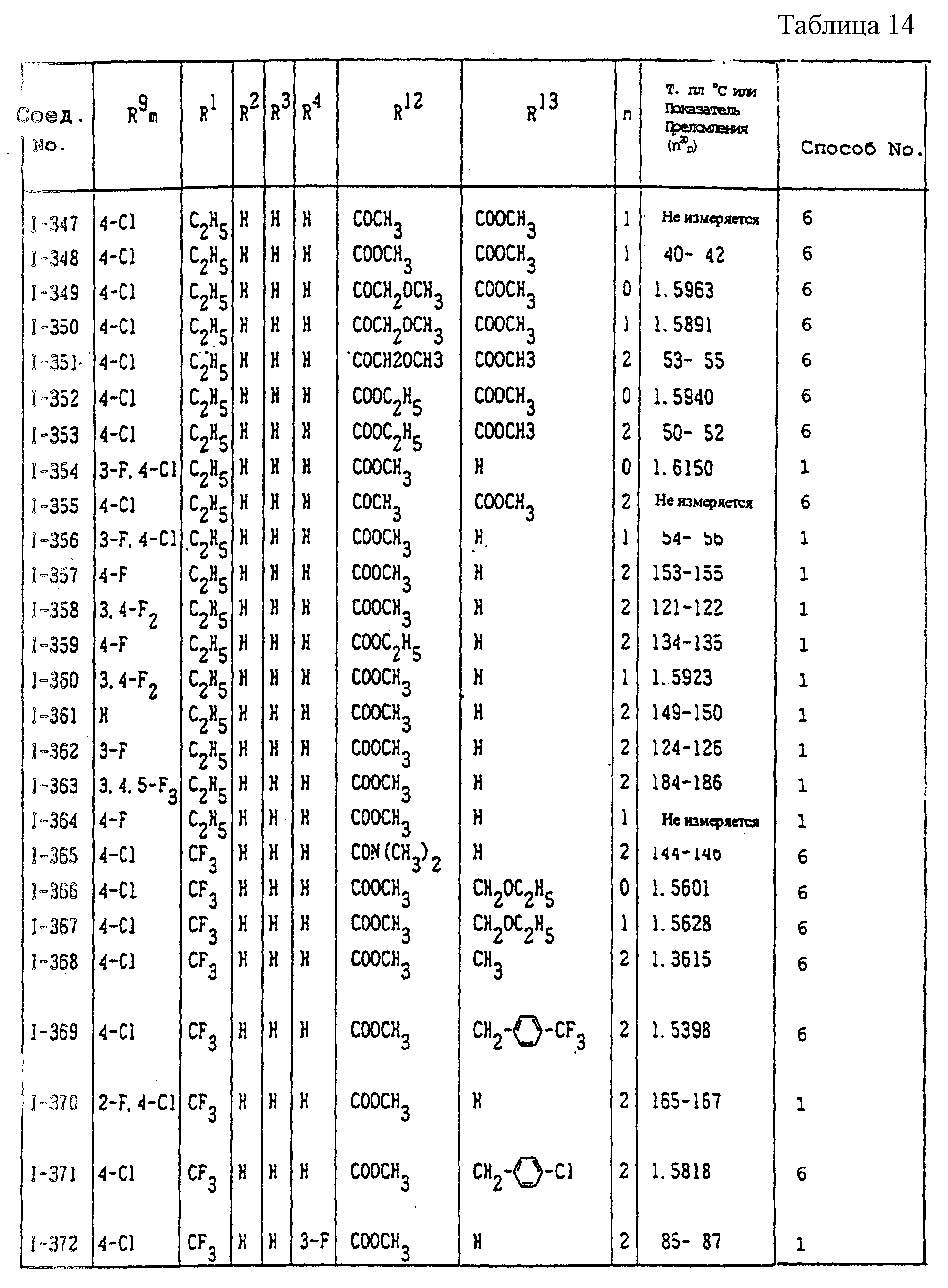
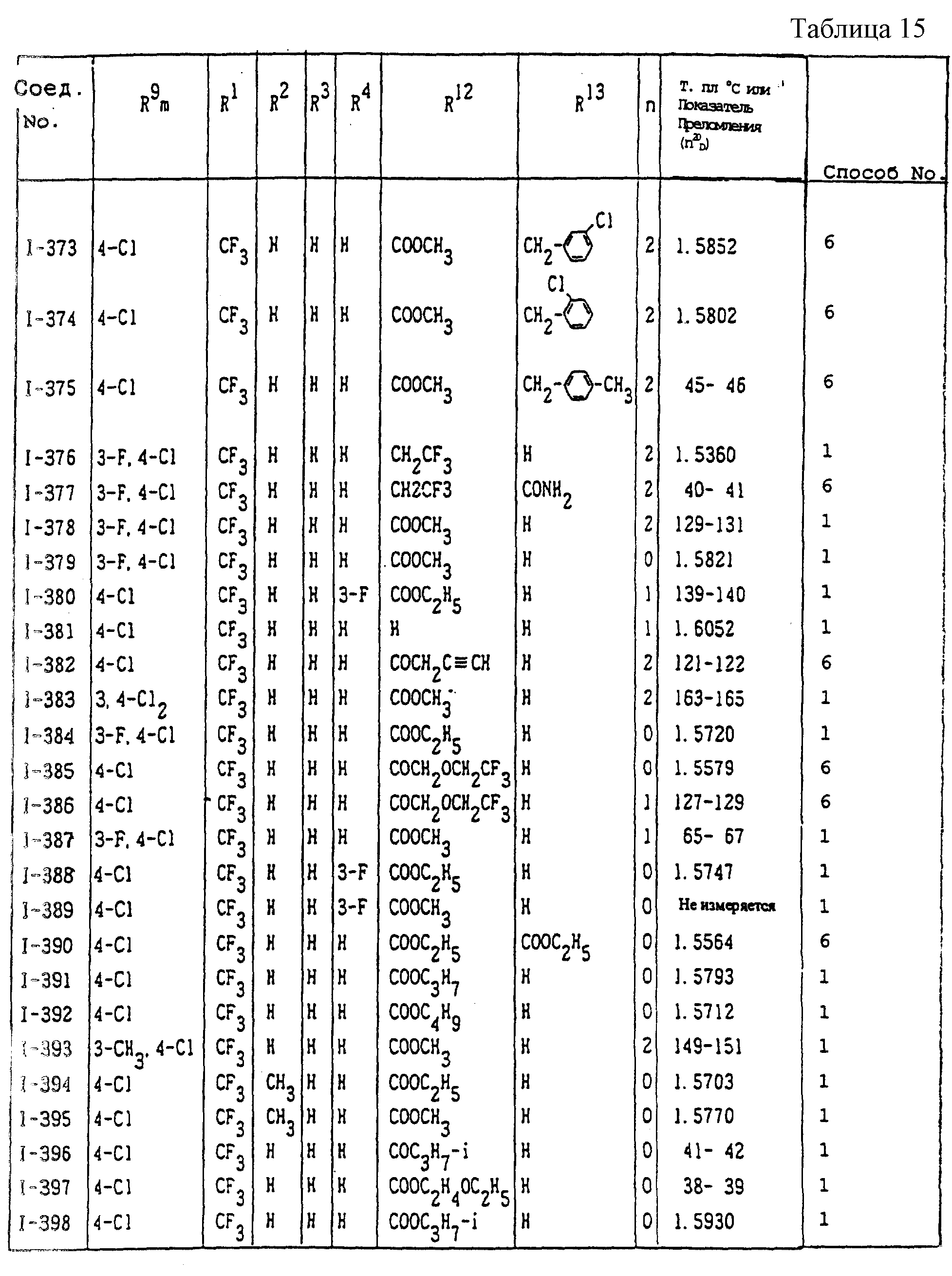
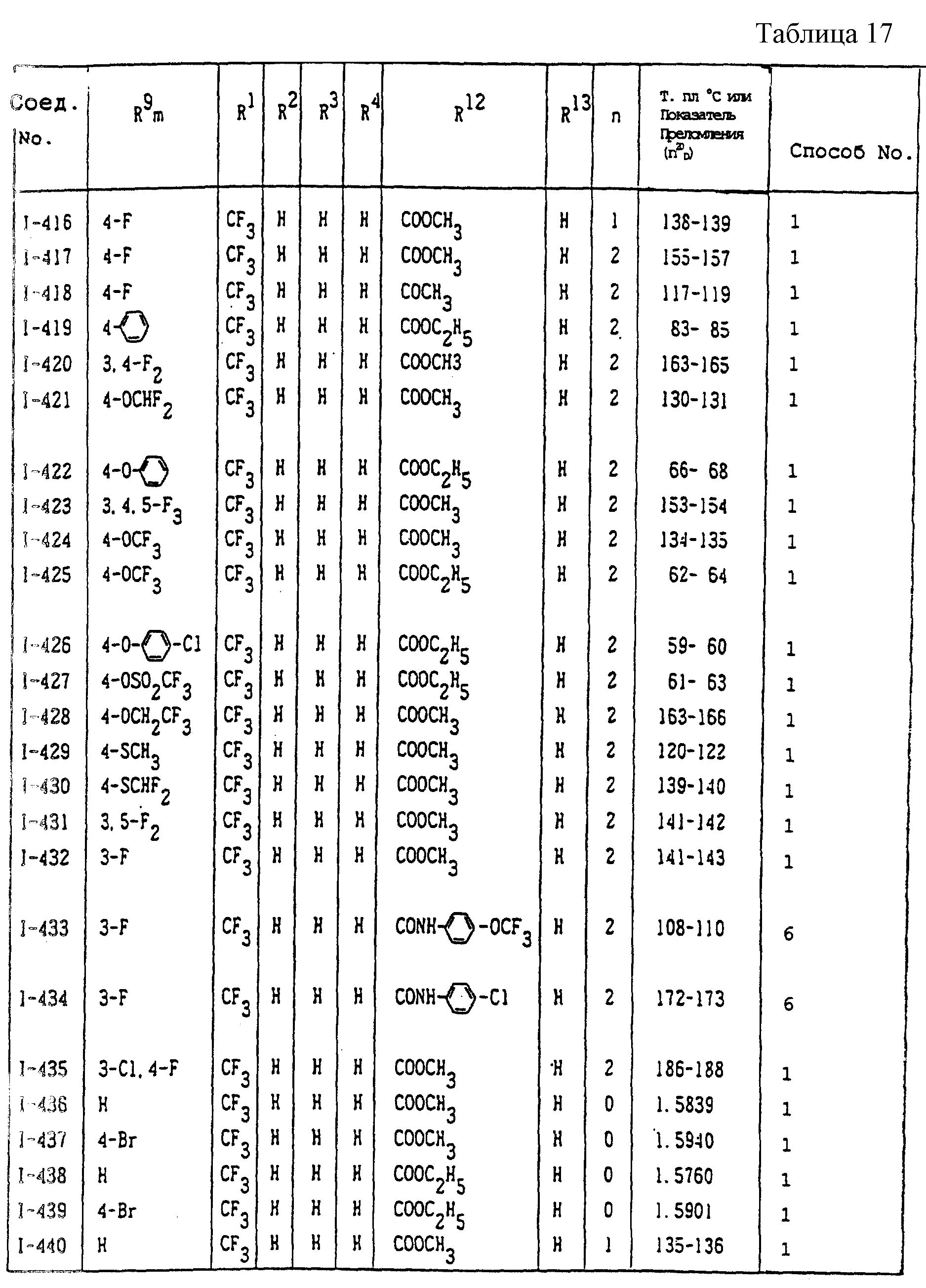
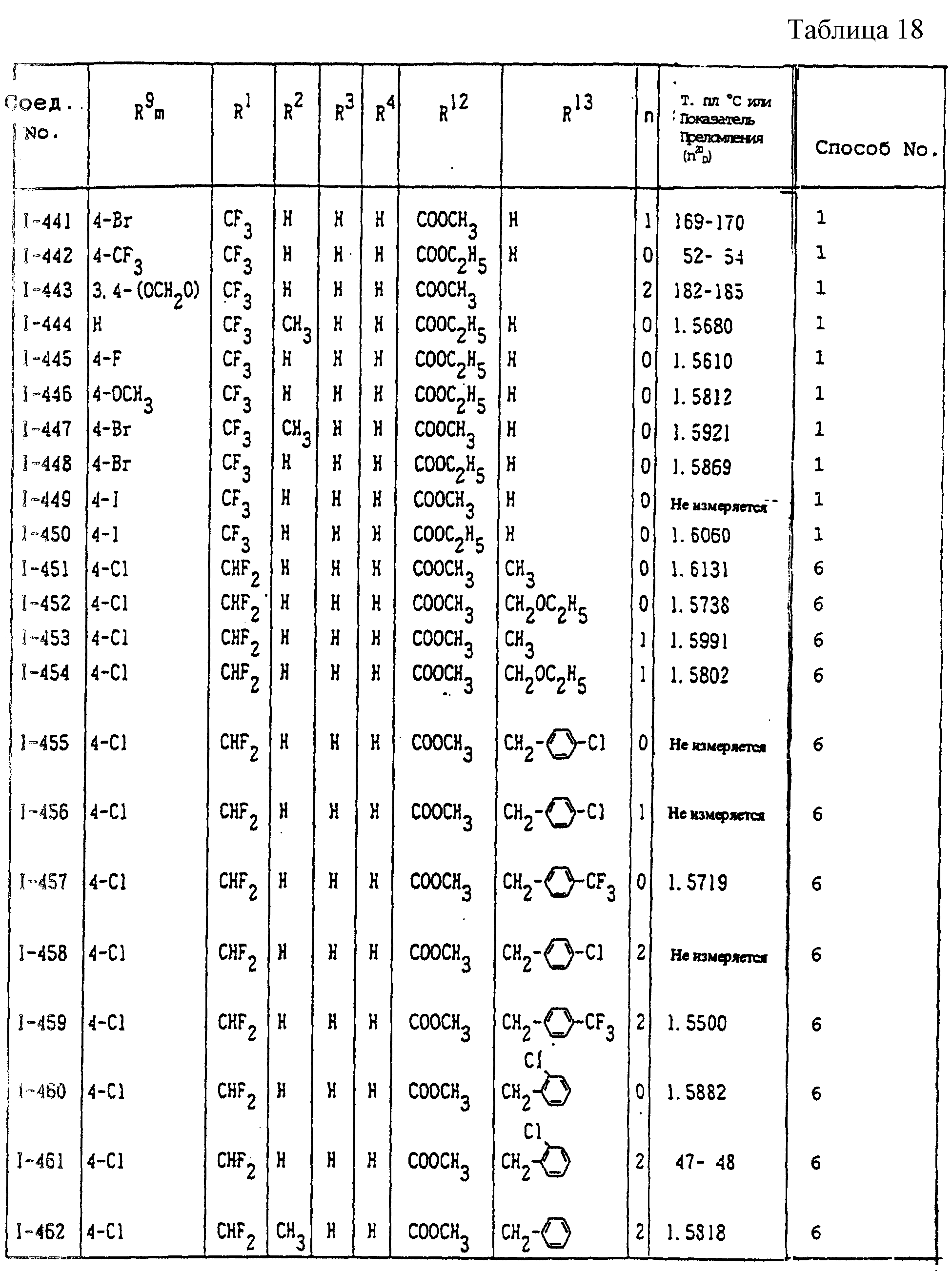
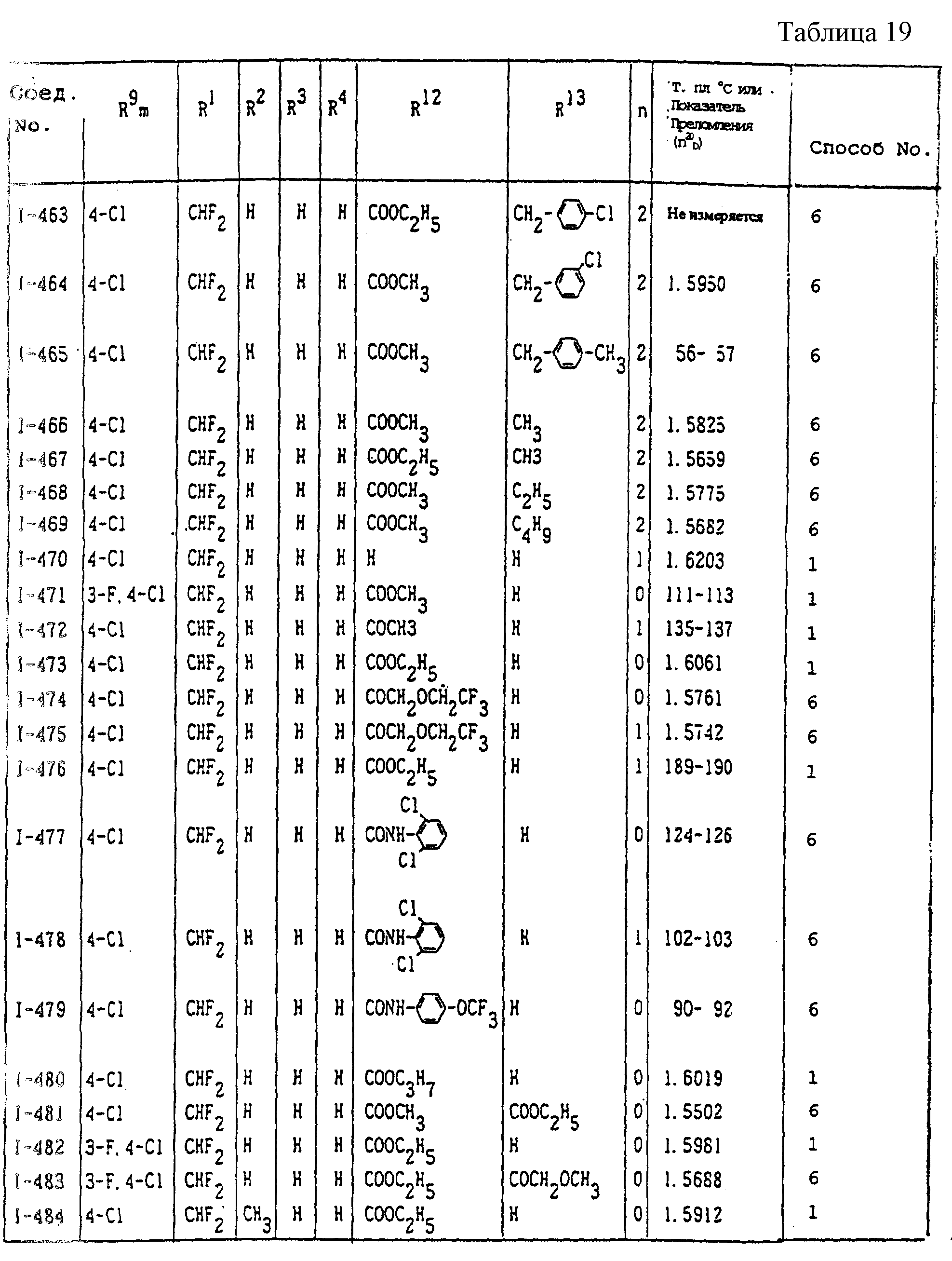
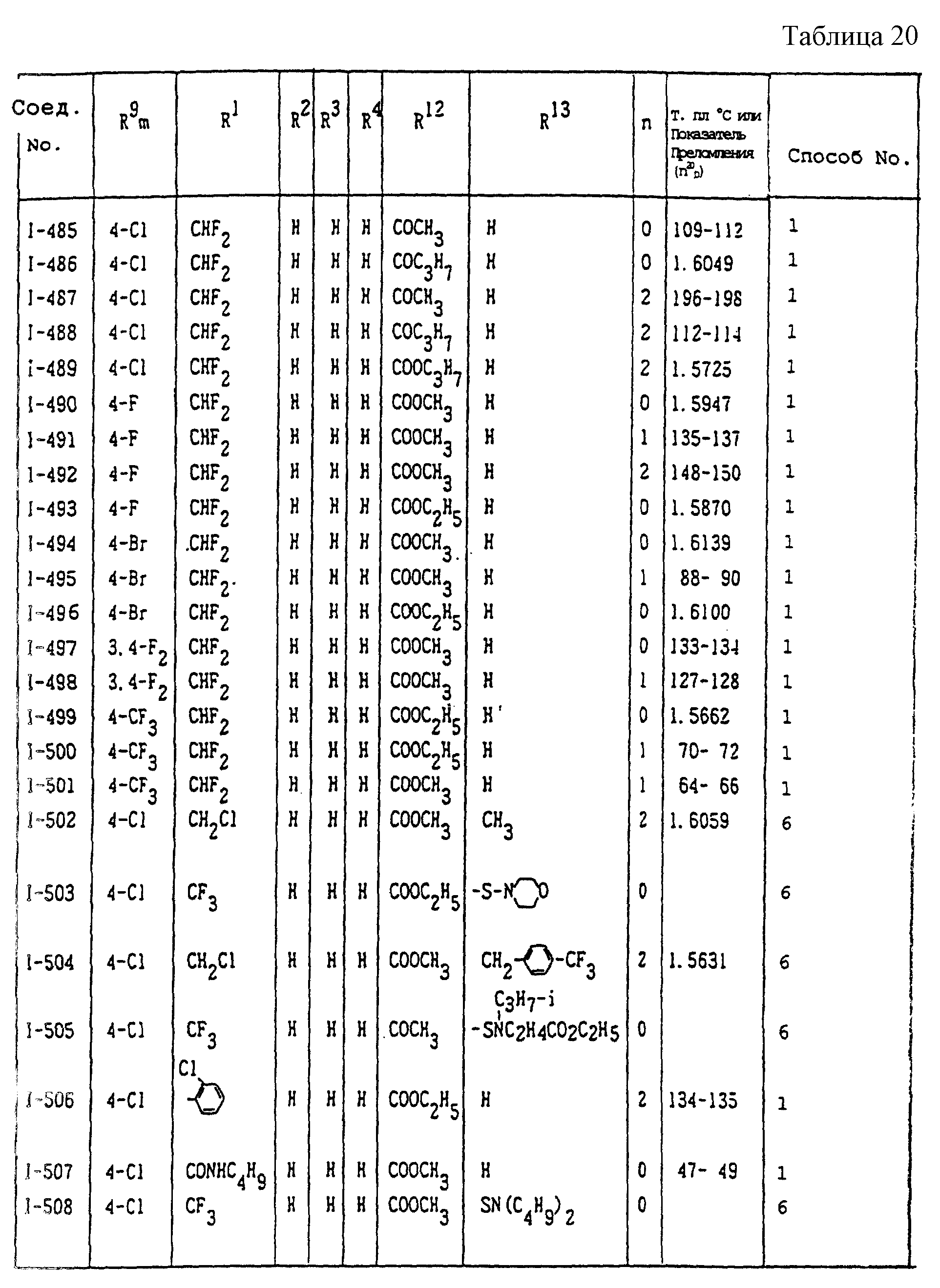
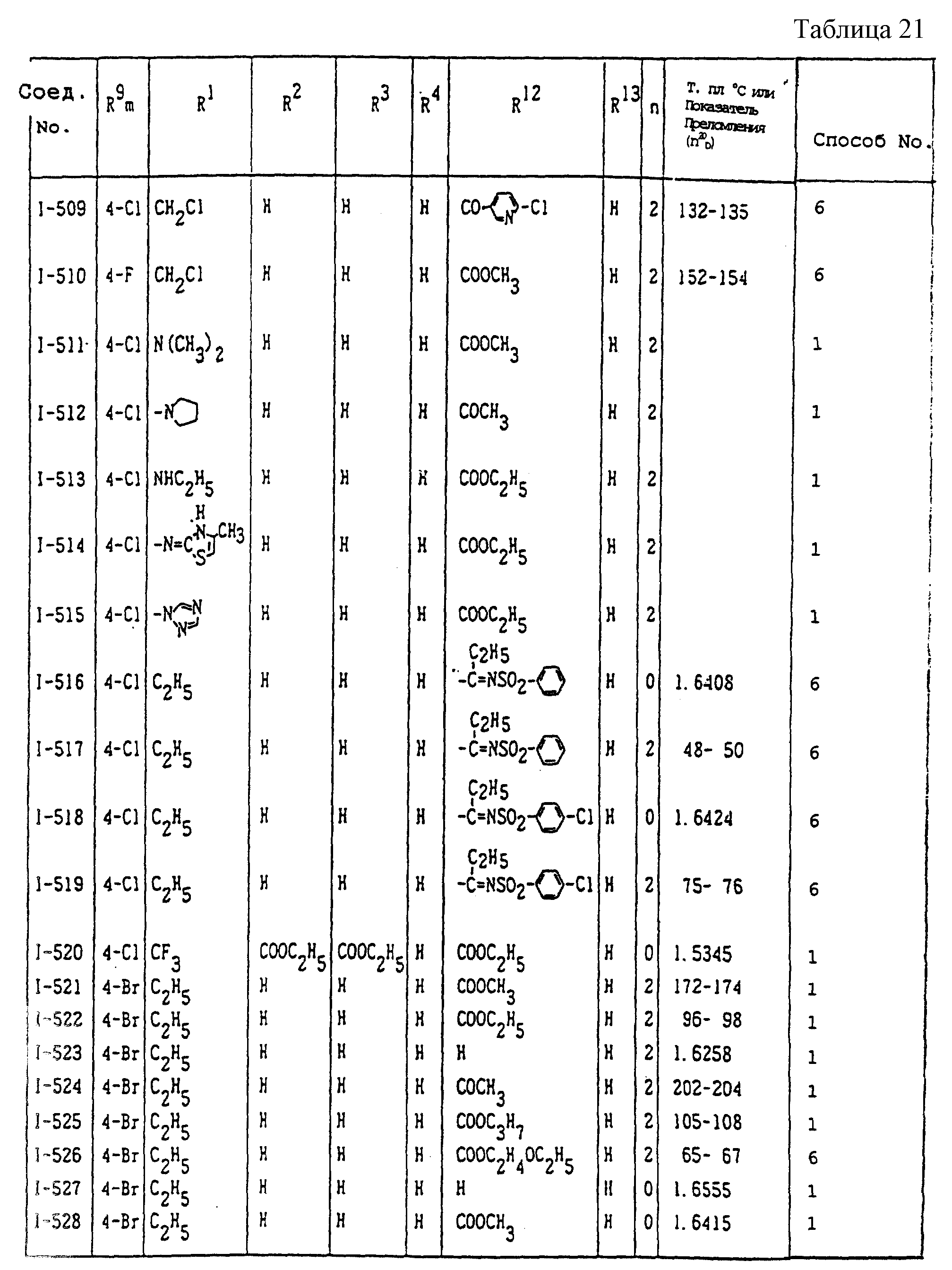
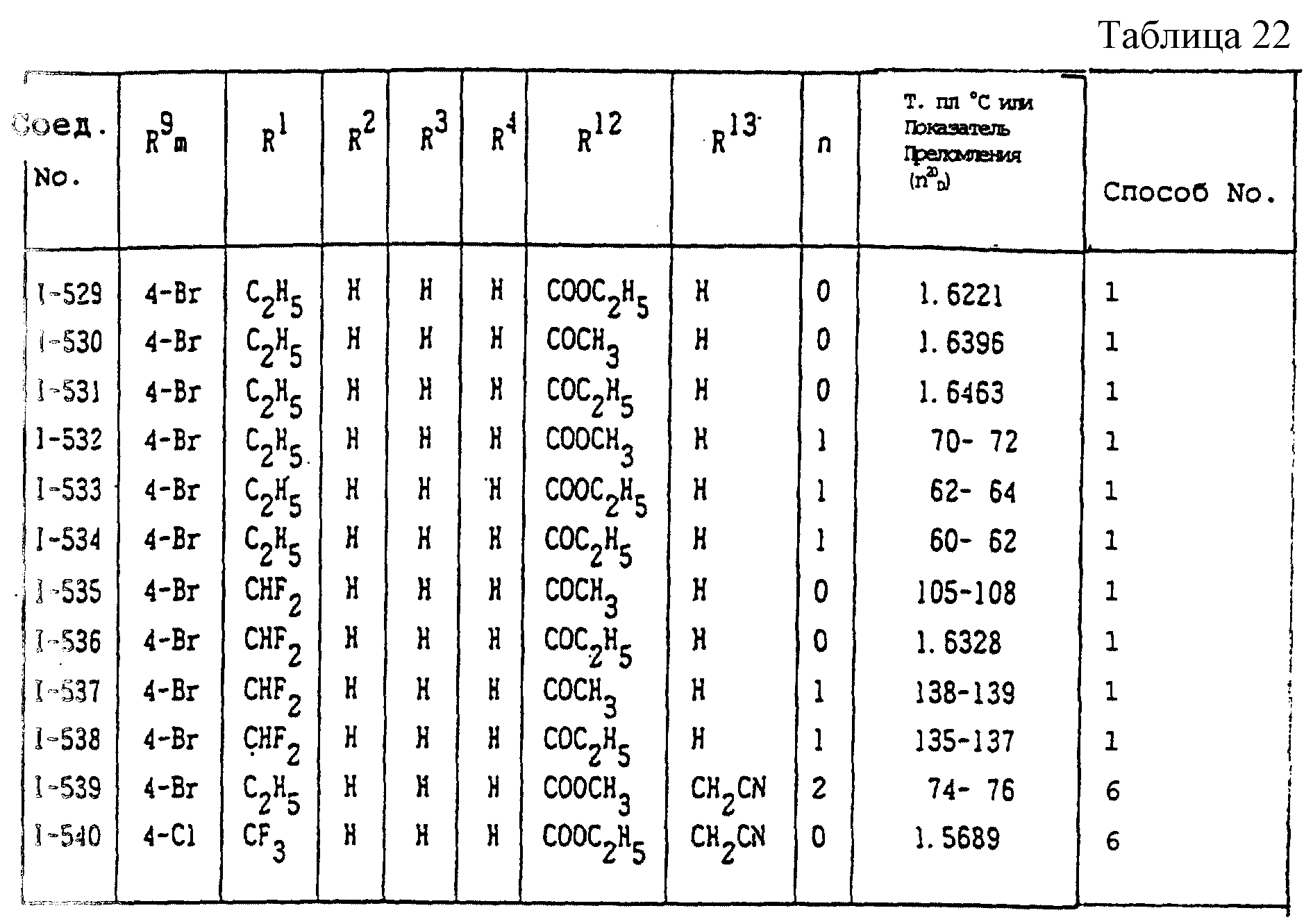
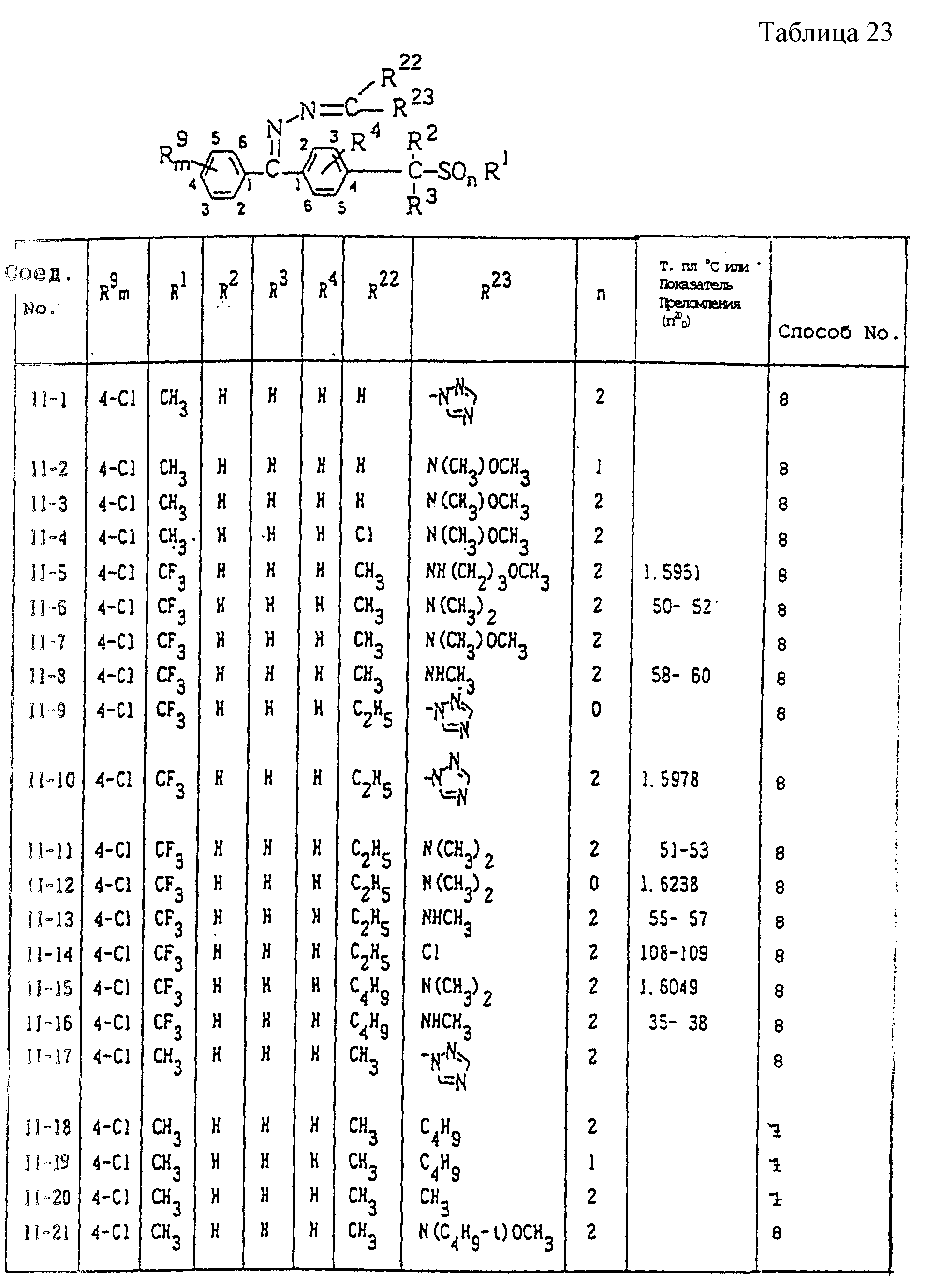
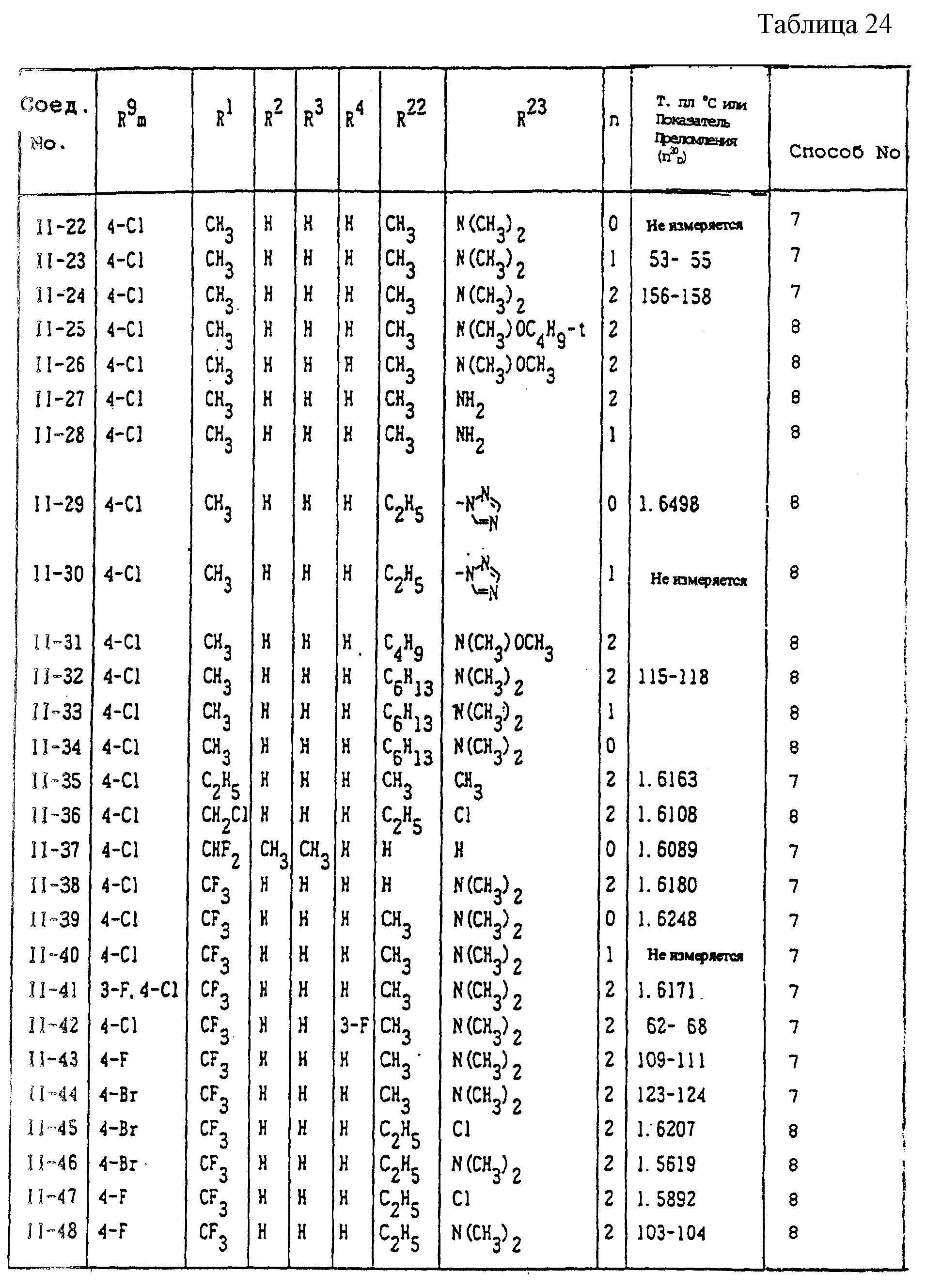
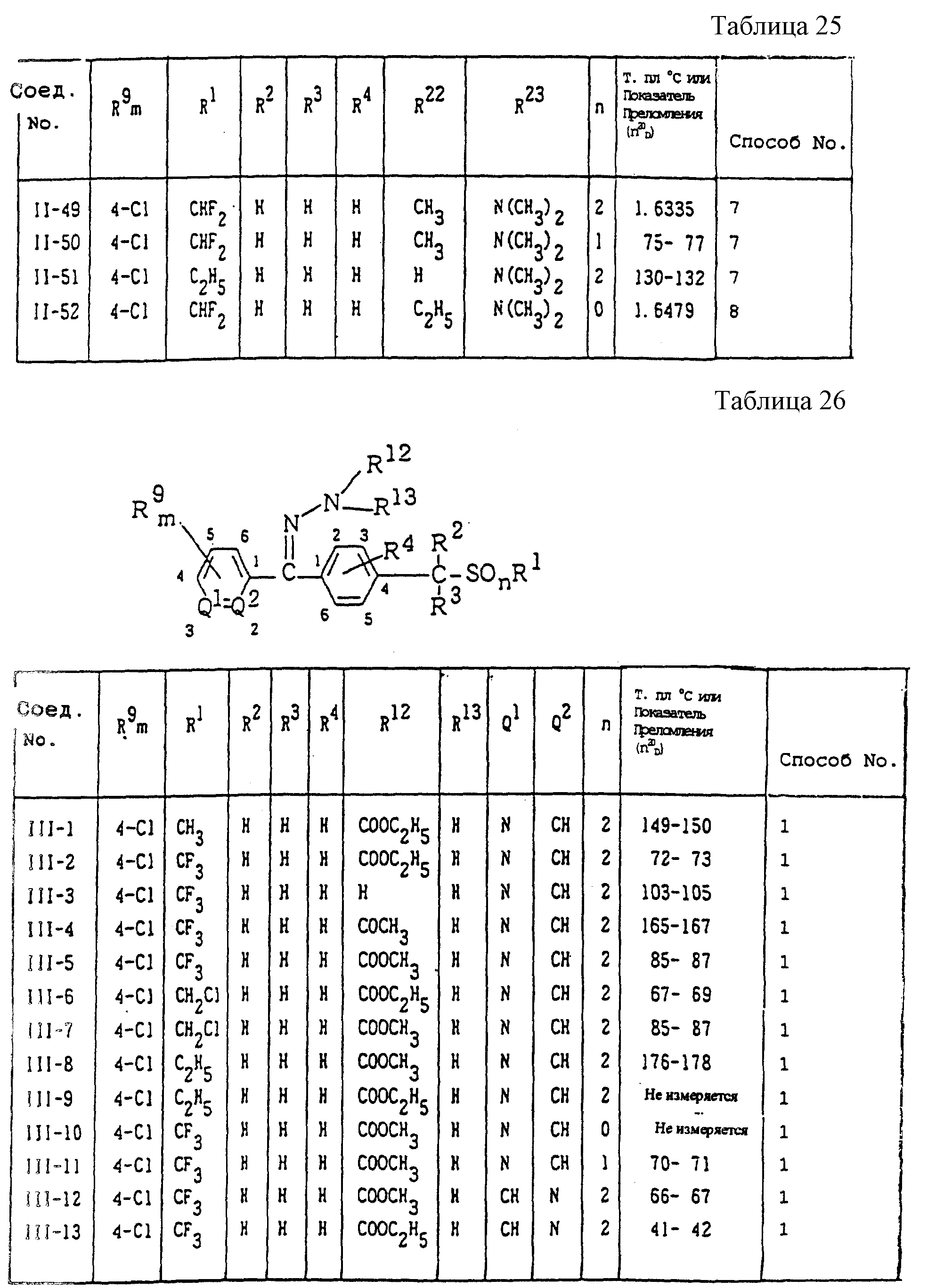
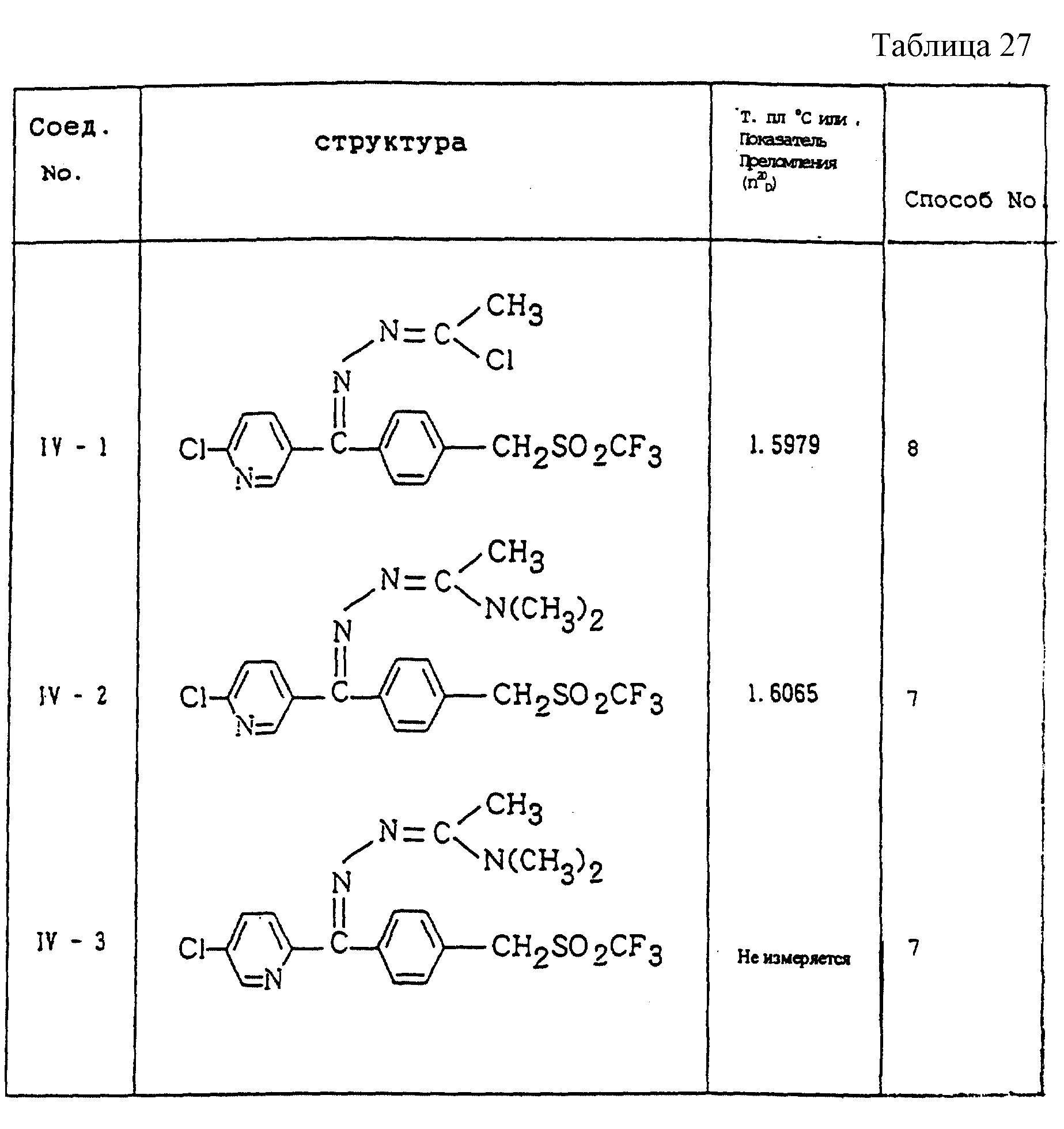
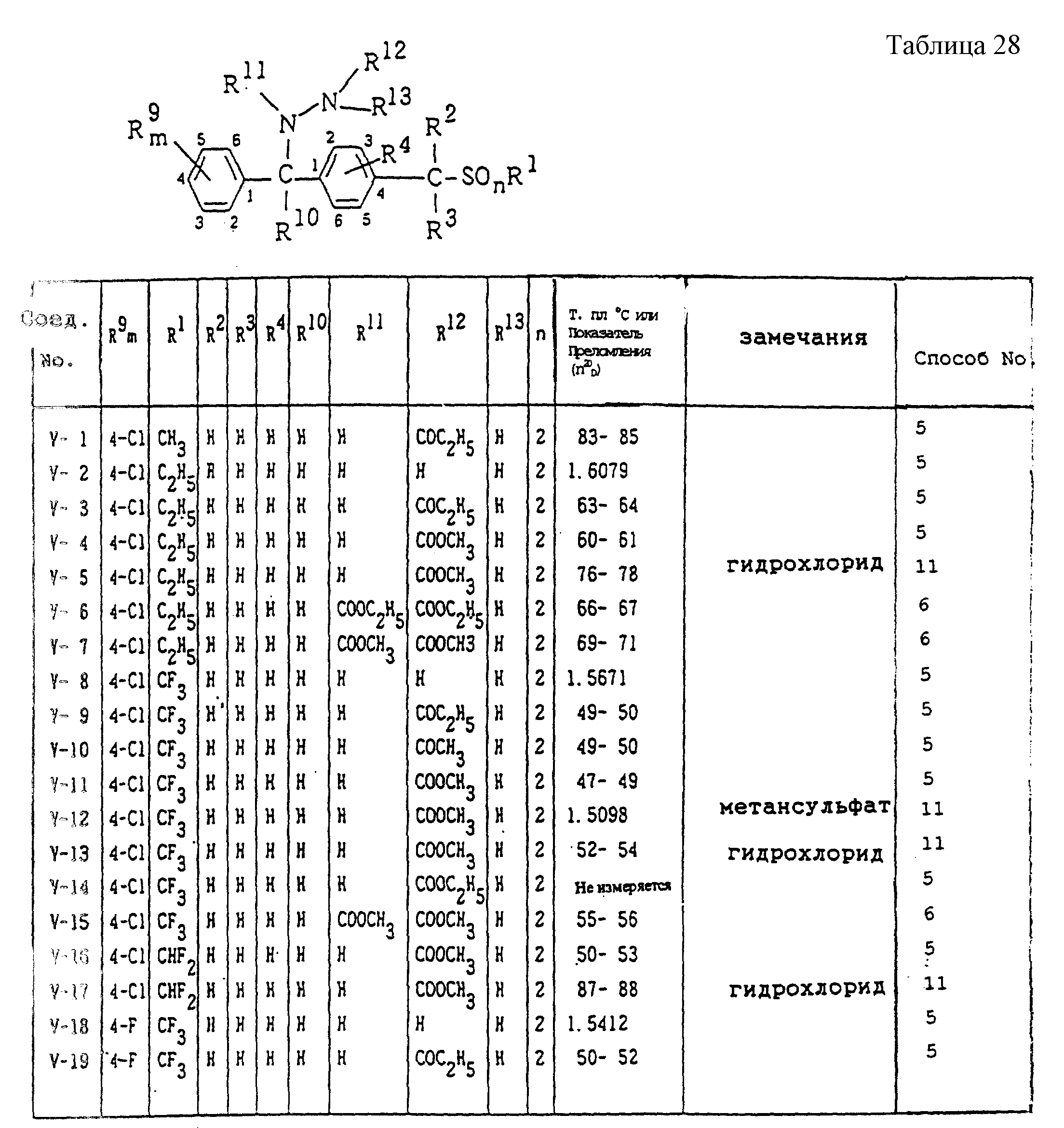
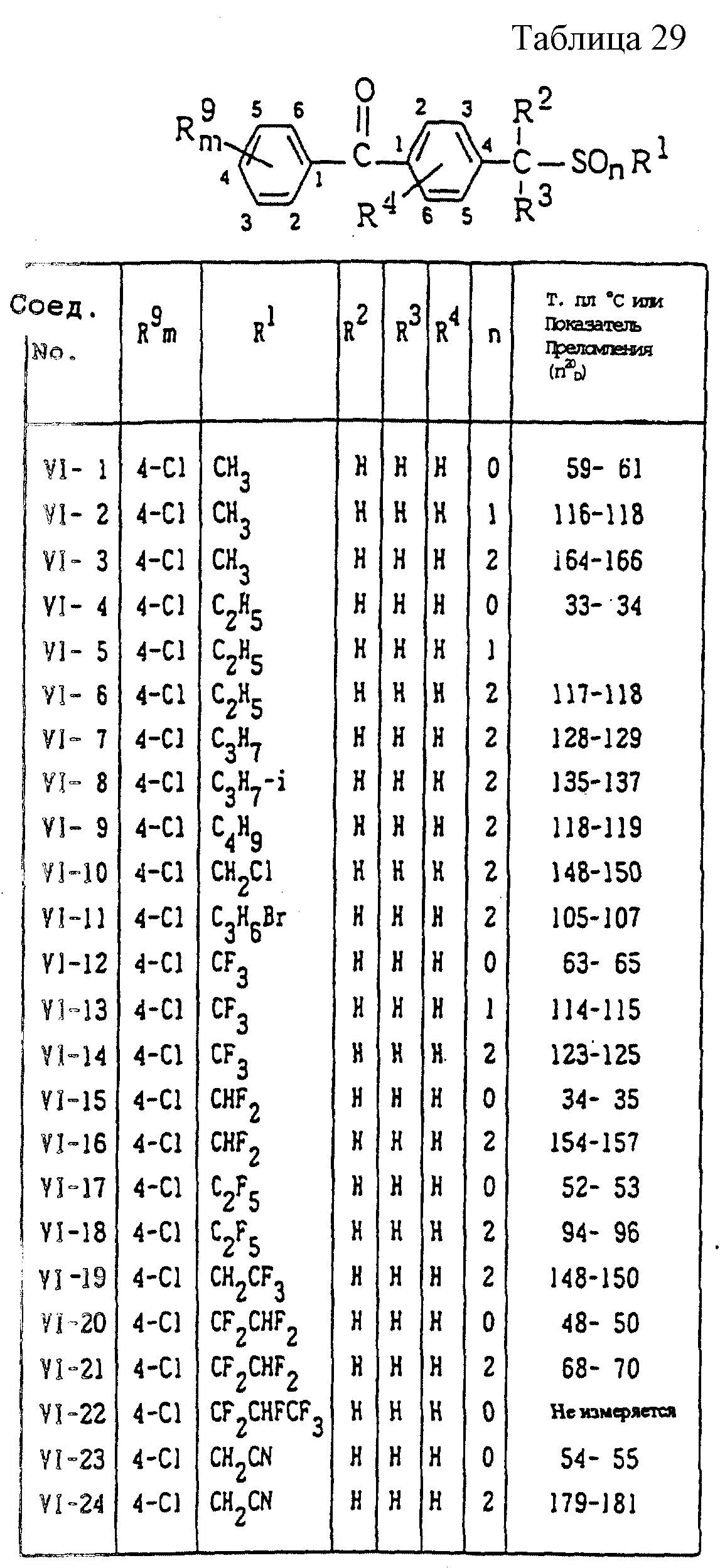
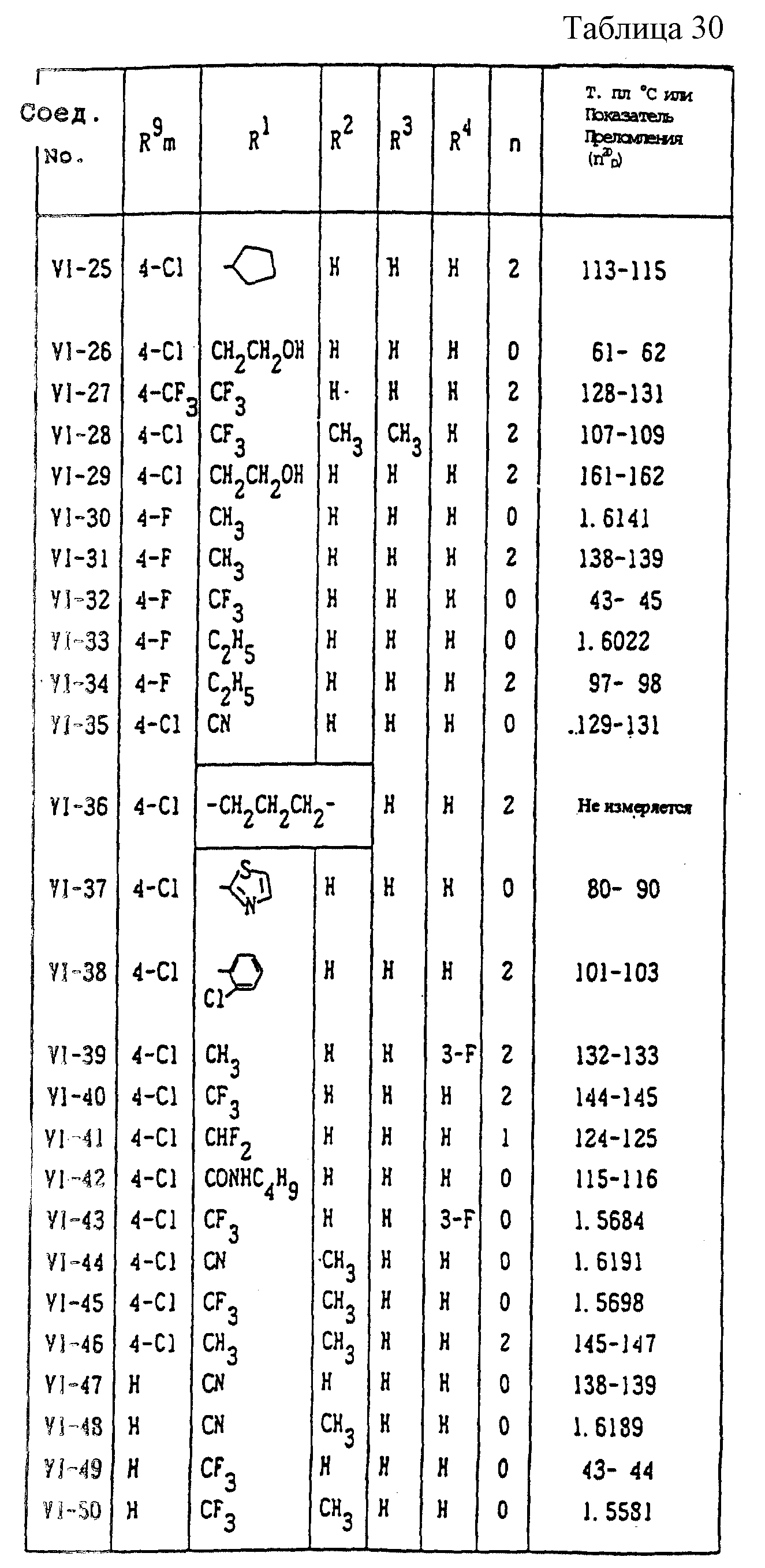
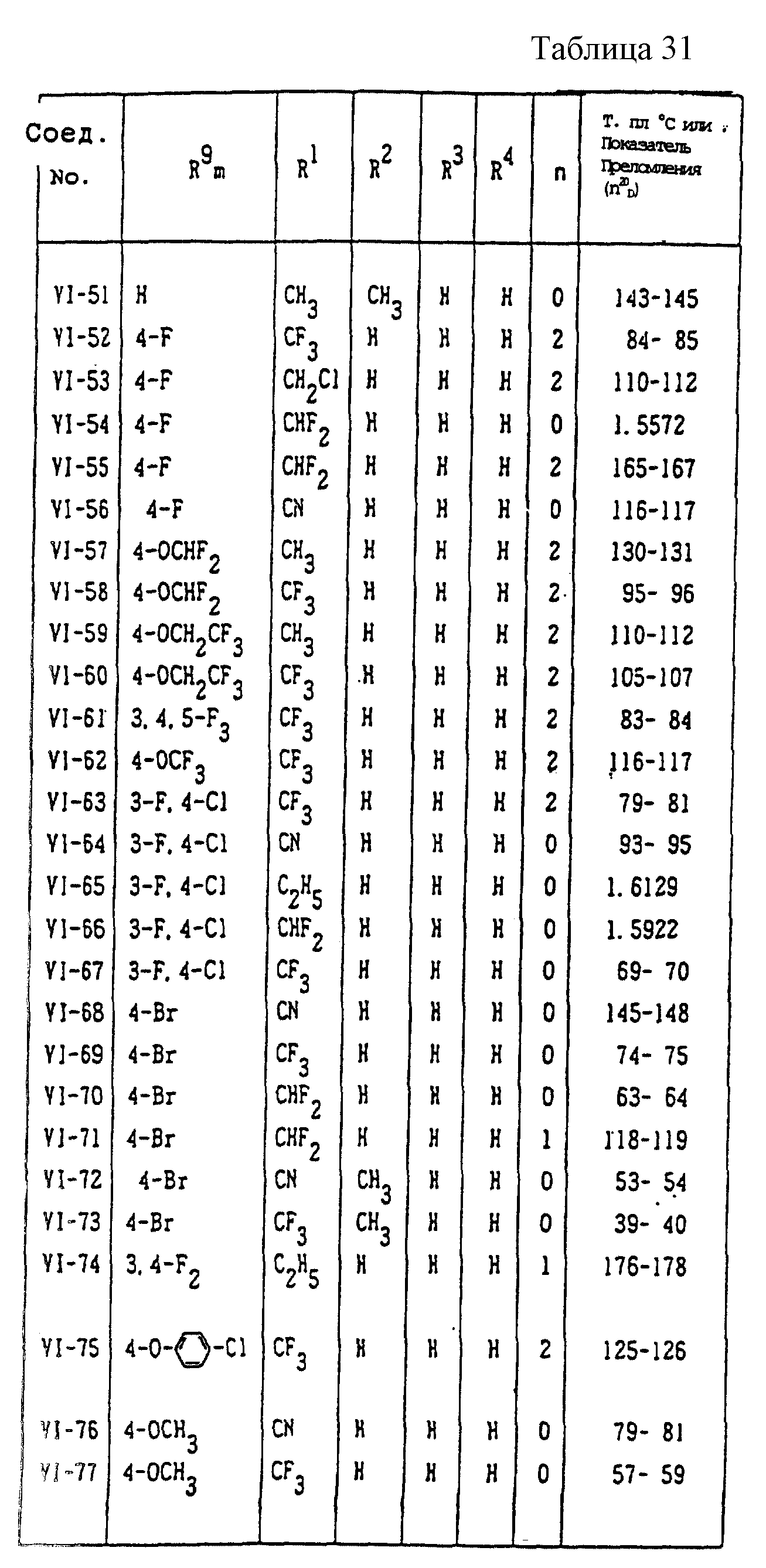
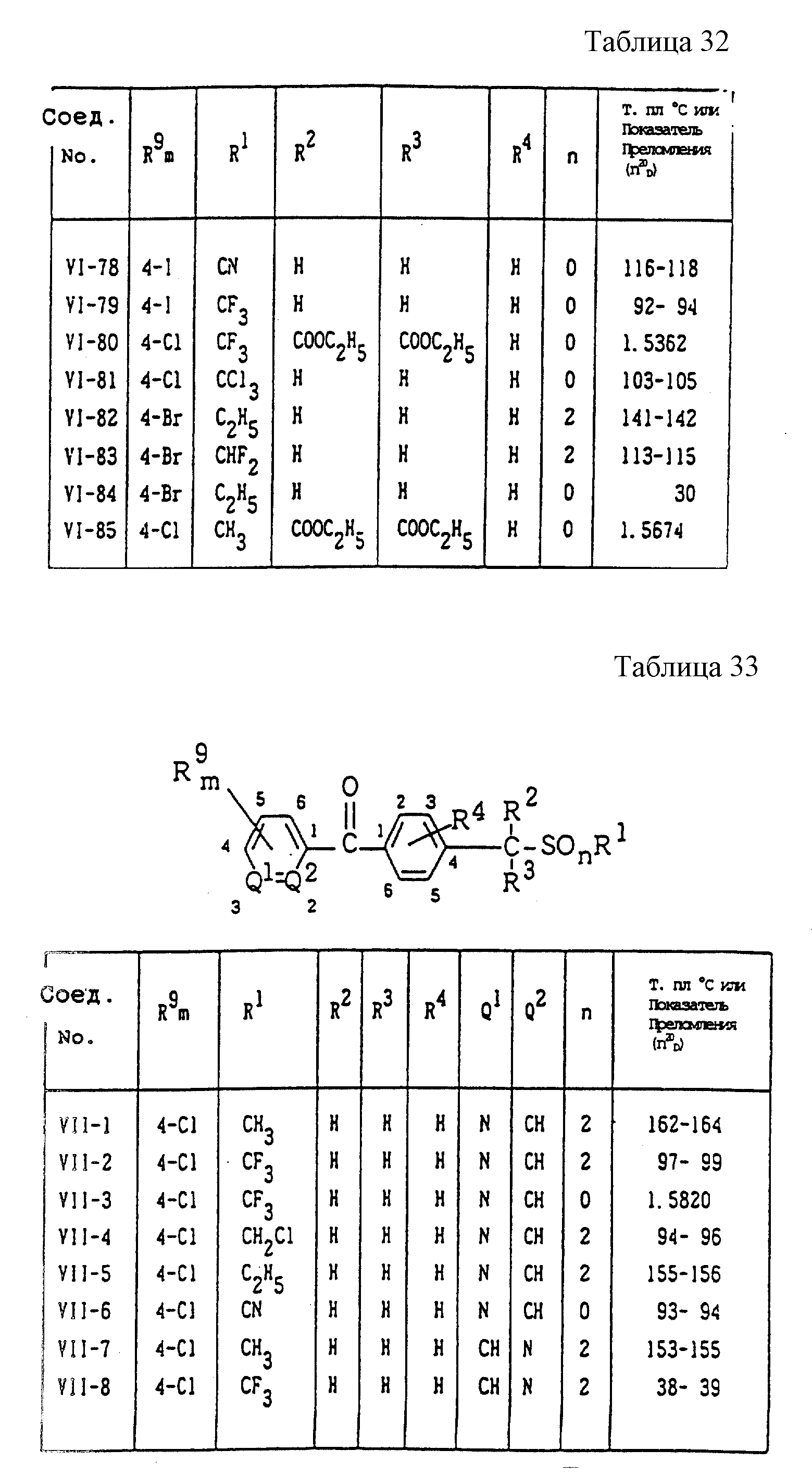
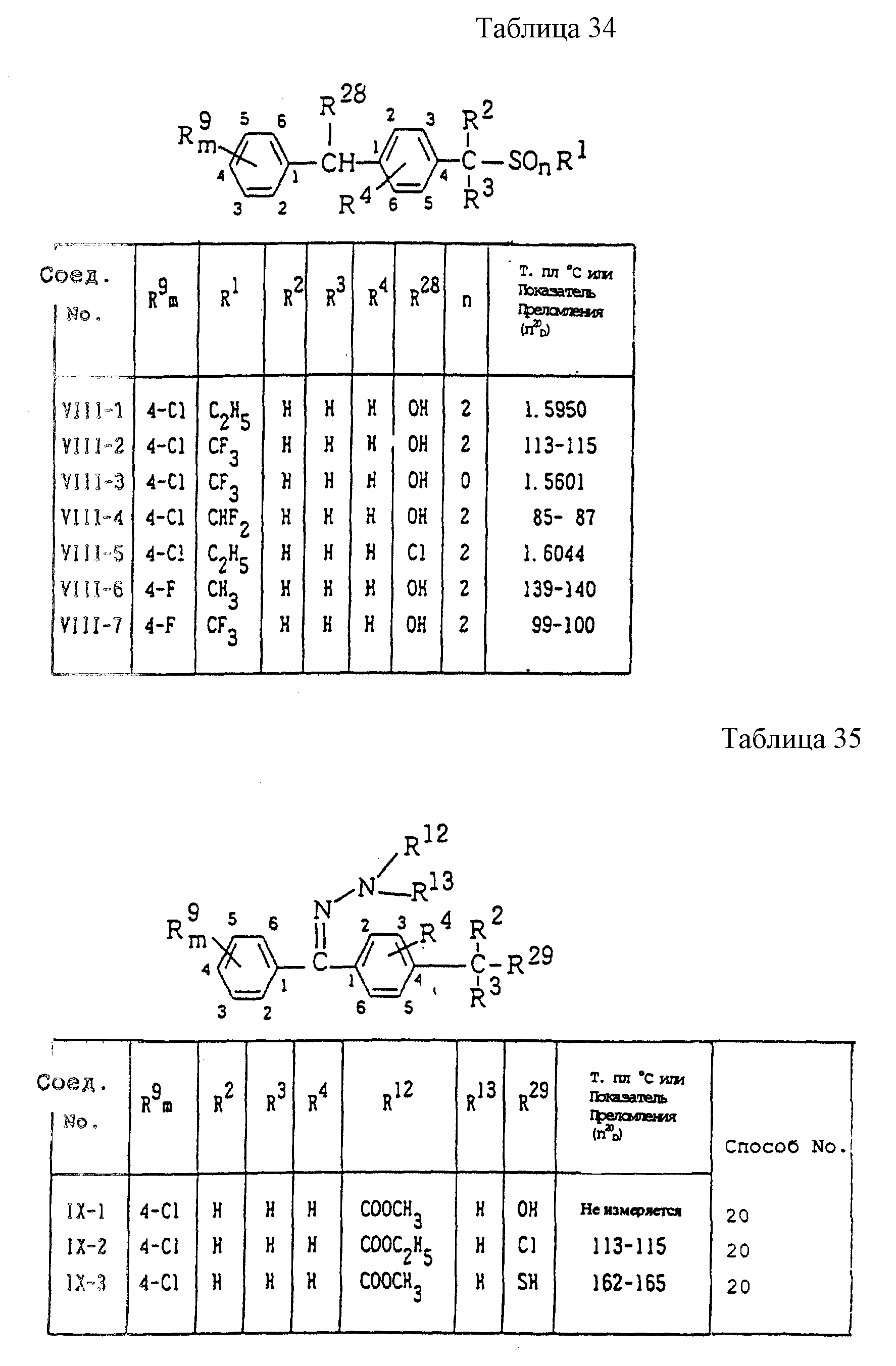
Конкретные типичные примеры соединений формулы (I), (II) и (III) по настоящему изобретению приведены в табл. 1-35. Номера соединений, которые используются в этих таблицах, сохранены в описании.
Соединение формулы (I) содержит связь C=N и, следовательно, имеет два геометрических изомера, т. е. цис(Е)-изомер и транс-(Z)-изомер. В качестве соединений по настоящему изобретению (Е)-изомер и (Z-)-изомер могут использоваться самостоятельно или же можно применять смесь этих соединений.
Далее, соединения формулы (I) по настоящему изобретению могут в некоторых случаях иметь таутомерные формы. Например, если группа формулы =CR23R24 представлена формулой =C(R23 )-N(R25)R26, a R25 обозначает атом водорода, то соединение, содержащее фрагмент -N=C(R26)NH-R26, может существовать в равновесии с таутомером содержащим фрагмент -NH-C(R23)=N-R23. Таким образом, следует понимать, что те соединения по настоящему изобретению, которые способны иметь таутомеры, действительно включают соответствующие таутомеры, даже если подобные таутомеры специально не указаны.
Далее приводятся методики получения соединений по настоящему изобретению.
Соединения формулы (I) по настоящему изобретению могут быть синтезированы в соответствии с приведенными ниже Способами 1-5.
Способ 1
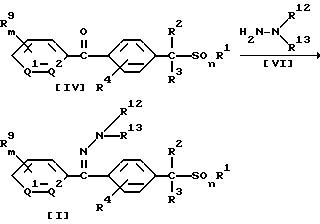
В приведенных выше формулах значения R1, R2, R3, R4, R9, R12, R13, m, n, Q1 и Q2 указаны ранее.
В соответствии со Способом 1 соединение формулы (I) по настоящему изобретению, в котором A обозначает (A2), может быть получено взаимодействием 1 моля бензофенона формулы (IV) с гидразином формулы (V1) или его гидратом, взятым в количестве от 1,0 до 10,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров, и, если необходимо, в присутствии кислотного катализатора, взятого в количестве от 0,01 до 1,0 молей.
Растворитель, который может быть использован в приведенной реакции, представляет собой, например, ароматический углеводород, такой как бензол, толуол, ксилол или хлорбензол; апротонный полярный растворитель, такой как N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, диметилсульфоксид или сульфолан; спирт, такой как метанол, этанол, этиленгликоль или глицерин; галогенсодержащий углеводород, такой как хлористый метилен или хлороформ; сложный эфир, такой как этилацетат или этилпропионат; алифатический углеводород, такой как гексан, циклогексан или гептан; пиридин, такой как пиридин или пиколин; уксусную кислоту или воду или смесь указанных растворителей.
Кислотный катализатор может быть, например, минеральной кислотой, такой как соляная кислота, серная кислота или азотная кислота, органической кислотой, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, метансульфокислота, бензолсульфокислота или моногидрат п-толуолсульфокислоты, кислотно-аддитивной солью амина, такой как гидрохлорид пиридина или гидрохлорид триэтиламина, галогенидом металла, таким как тетрахлорид титана, хлорид цинка, хлорид железа (II) или хлорид железа (III) или эфират трехфтористого бора.
Температура реакции может быть выбрана в интервале от минус 10oC до температуры кипения реакционной системы, предпочтительно от комнатной температуры до 150oC. Время реакции варьирует в зависимости от конкретного соединения, однако оно может составлять в пределах от 10 минут до 20 часов.
Способ 2
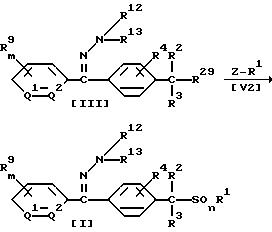
В приведенных выше формулах значения R1, R2, R3, R4, R9, R12, R13, m, Q1 и Q2 указаны ранее; R29 обозначает атом галогена; Z обозначает группу формулы MS(O)n; М обозначает щелочной металл; a n = 0 или 2.
В соответствии со Способом 2 соединение формулы (I) по настоящему изобретению, в котором A обозначает (A2), может быть получено взаимодействием 1 моля хлористого бензила формулы (III) с солью щелочного металла серусодержащего производного формулы (V2), взятой в количестве от 1,0 до 3,0 молей, в присутствии растворителя, взятого в количестве от 0 до 10 литров.
Растворитель, который может быть использован в приведенной реакции, представляет собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран или диоксан; ароматический углеводород, такой как бензол, толуол, ксилол или хлорбензол; апротонный полярный растворитель, такой как N, N-диметилформамид, N, N-диметилацетамид, N-метил-2-пирролидон, диметилсульфоксид или сульфолан; спирт, такой как метанол, этанол, этиленгликоль или глицерин; галогенсодержащий углеводород, такой как хлористый метилен или хлороформ; сложный эфир, такой как этилацетат или этилпропионат; алифатический углеводород, такой как пентан, гексан, циклогексан или гептан; пиридин, такой как пиридин или пиколин; или воду или смесь указанных растворителей.
Соль щелочного металла серусодержащего соединения, которую используют в этой реакции, может быть получена из серусодержащего соединения, в котором Z обозначает HS(O)n и щелочного металла, гидрида щелочного металла или гидроксида щелочного металла.
Температура реакции может быть выбрана в интервале от минус 10oC до температуры кипения реакционной системы, предпочтительно от комнатной температуры до 100oC. Время реакции варьирует в зависимости от конкретного соединения, однако оно может составлять в пределах от 10 минут до 20 часов.
Способ 3
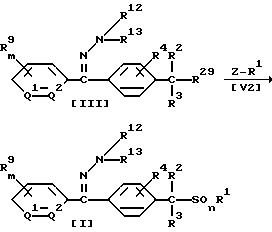
В приведенных выше формулах значения R1, R2, R3, R4, R9, R12, R13, m, Q1 и Q2 указаны ранее, R29 обозначает меркаптогруппу; обозначает атом галогена, (C1-C4)алкилсульфонилоксигруппу или бензолсульфонилоксигруппу (которая может содержать в качестве заместителя метильную группу).
В соответствии со Способом 3 соединение формулы (I) по настоящему изобретению, в котором A обозначает (A2), может быть получено взаимодействием 1 моля меркаптопроизводного формулы (III) с соединением формулы (V2), взятым в количестве от 1,0 до 5,0 молей, в растворителе, взятом в количестве от 0 до 5 литров, в присутствии основания, взятого в количестве от 1,0 до 3,0 молей.
Растворитель, который может быть использован в приведенной реакции, представляет собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран или диоксан; ароматический углеводород, такой как бензол, толуол, ксилол или хлорбензол; апротонный полярный растворитель, такой как N, N-диметилформамид, N, N-диметилацетамид, N-метил-2-пирролидон, диметилсульфоксид или сульфолан; галогенсодержащий углеводород, такой как хлористый метилен или хлороформ; нитрил, такой как ацетонитрил или пропионитрил; сложный эфир, такой как этилацетат или этилпропионат; алифатический углеводород, такой как пентан, гексан, циклогексан или гептан; пиридин, такой как пиридин или пиколин; или воду или смесь указанных растворителей.
Основание может представлять собой неорганическое основание, в частности гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия; гидроксид щелочно-земельного металла, такой как гидроксид кальция или гидроксид магния; карбонат щелочного металла, такой как карбонат натрия или карбонат калия; или бикарбонат щелочного металла, такой как бикарбонат натрия или бикарбонат натрия; гидрид металла, такой как гидрид натрия или гидрид калия; алкоксид, такой как метоксид натрия, этоксид натрия или трет-бутоксид калия; органическое основание, такое как триэтиламин, N,N-диметиланилин, пиридин, 4-N,N-диметиламинопиридин или 1,8-диaзaбициклo[5.4.0]-7-ундецен.
Температура реакции может быть выбрана в интервале от минус 30oC до температуры кипения реакционной системы, предпочтительно от 0oC до 150oC. Время реакции варьирует в зависимости от конкретного соединения, однако оно может составлять в пределах от 10 минут до 20 часов.
Способ 4
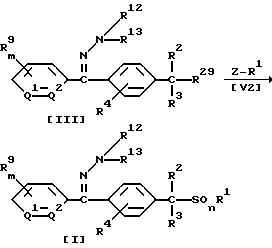
В приведенных выше формулах значения R1, R2, R3, R4, R9, R12, R13, m, Q1 и Q2 указаны ранее; R29 обозначает гидроксильную группу; Z обозначает группу формулы - SSR1.
В соответствии со Способом 4 соединение формулы (I) по настоящему изобретению, в котором A обозначает (A2), может быть получено взаимодействием 1 моля бензилового спирта формулы (III) с диаминохлорфосфином, взятым в количестве от 1,0 до 3,0 молей, в растворителе, взятом в количестве от 0,1 до 5 литров, в присутствии основания, взятого в количестве от 0,1 до 3,0 молей, при этом получают фосфит с последующим взаимодействием полученного фосфита с дисульфидом формулы (V2), взятым в количестве от 1,0 до 5,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров.
Растворитель и основание, которые используют при проведении этой реакции, могут быть теми же самыми, что и применяемые при осуществлении Способа 3.
Температура реакции может быть выбрана в интервале от минус 40oC до температуры кипения реакционной системы, предпочтительно от минус 30oC до 50oC. Время реакции варьирует в зависимости от конкретного соединения, однако оно может составлять в пределах от 10 минут до 20 часов.
Способ 5
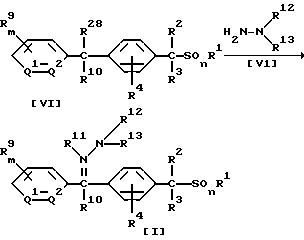
В приведенных выше формулах значения R1, R2, R3, R4, R9, R10, R12, R13, m, n, Q1 и Q2 указаны ранее; R11 обозначает атом водорода; а R28 обозначает атом галогена.
В соответствии со Способом 5 соединение формулы (I) по настоящему изобретению, в котором A обозначает (A1), может быть получено взаимодействием 1 моля соединения формулы (VI) с гидразином формулы (V1) или его гидратом, взятым в количестве от 1,0 до 10,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров, и, если необходимо, в присутствии основания, взятого в количестве от 1,0 до 3,0 молей.
Растворитель, который может быть использован в приведенной реакции, представляет собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран или диоксан; ароматический углеводород, такой как бензол, толуол, ксилол или хлорбензол; апротонный полярный растворитель, такой как N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, диметилсульфоксид или сульфолан; галогенсодержащий углеводород, такой как хлористый метилен или хлороформ; нитрил, такой как ацетонитрил или пропионитрил; сложный эфир, такой как этилацетат или этилпропионат; алифатический углеводород, такой как пентан, гексан, циклогексан или гептан; пиридин, такой как пиридин или пиколин; или воду или смесь указанных растворителей.
Основание может представлять собой неорганическое основание, в частности гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия; гидроксид щелочно-земельного металла, такой как гидроксид кальция или гидроксид магния; карбонат щелочного металла, такой как карбонат натрия или карбонат калия; или бикарбонат щелочного металла, такой как бикарбонат натрия или бикарбонат натрия; гидрид металла, такой как гидрид натрия или гидрид калия; алкоксид, такой как метоксид натрия, этоксид натрия или трет-бутоксид калия; или органическое основание, такое как триэтиламин, N, N-диметиланилин, пиридин, 4-N,N-диметиламинопиридин или 1,8-диазабицикло[5.4.0]-7-ундецен.
Температура реакции может быть выбрана в интервале от минус 30oC до температуры кипения реакционной системы, предпочтительно от 0oC до 150oC. Время реакции варьирует в зависимости от конкретного соединения, однако оно может составлять в пределах от 10 минут до 20 часов.
Соединение формулы (I) по настоящему изобретению можно также синтезировать, взяв в качестве исходного вещества само соединение формулы (I). Подобные процессы представлены в Способах 6-11. Однако указанные реакции не ограничиваются теми, которые приведены здесь с целью пояснения настоящего изобретения.
Способ 6
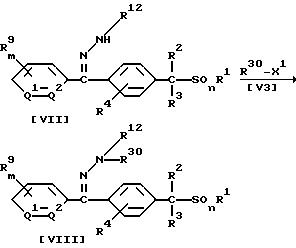
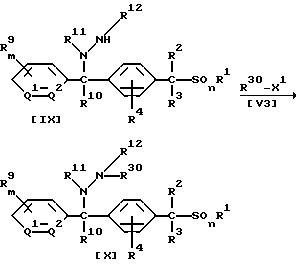
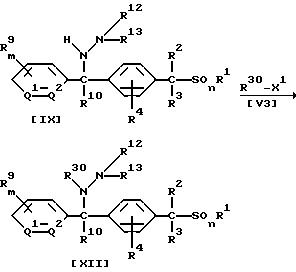
В приведенных выше формулах R30 обозначает цианогруппу, (C1-C6)алкильную группу, (C1-C4)галогеналкильную группу, (C2-C10)алкоксиалкильную группу, (C3-C8)алкоксиалкоксиалкильную группу, (C2-C6)алкилтиоалкильную группу, (C2-C6)алкенильную группу, (C2-C4)алкинильную группу, бензильную группу (которая может содержать в качестве заместителя атом галогена, метильную группу или трифторметильную группу), группу формулы -COR14, группу формулы -COOR15, группу формулы -CON(R16)R17, группу формулы -SN-(R18)R19, группу формулы -SO2R20, группу формулы -C(R21)=CHR22 или группу формулы -C(R23)= NR25; если R30 обозначает группу формулы -C(R21)=CHR22, то X1 обозначает атом галогена, гидроксильную группу, (C1-C4)алкоксигруппу, (C1-C4 )алкилкарбонилоксигруппу, меркаптогруппу, (C1-C4)алкилтиогруппу, (C1-C4)алкилсульфонилоксигруппу или бензолсульфонилоксигруппу (которая может содержать в качестве заместителя метильную группу), а в других случаях X1 обозначает атом галогена, (C1-C4)алкилсульфонилоксигруппу или бензолсульфонилоксигруппу (которая может содержать в качестве заместителя метильную группу), или же R30-X1 может образовать группу R17NCO или ClSO2NCO; значения R1, R2, R3, R4, R9, R10, R11, R12, R13, R14, R15, R16, R17, R18, R19, R20, R21, R22, R23, R25, Q1, Q2, m и n указаны ранее.
В частности, новые соединения (VIII), (X) или (XII) по настоящему изобретению могут быть получены взаимодействием 1 моля соединения (VII), (IX) или (XI) по настоящему изобретению с соединением формулы (V3), взятым в количестве от 1,0 до 10,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров, и, если необходимо, в присутствии кислоты или основания, взятых в количестве от 0,1 до 3,0 молей.
Растворитель и кислотный катализатор, которые используют при проведении этих реакций, могут быть теми же самыми, что и применяемые при осуществлении Способа 1.
Основание может представлять собой неорганическое основание, в частности гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия; гидроксид щелочно-земельного металла, такой как гидроксид кальция или гидроксид магния; карбонат щелочного металла, такой как карбонат натрия или карбонат калия; или бикарбонат щелочного металла, такой как бикарбонат натрия или бикарбонат натрия; гидрид металла, такой как гидрид натрия или гидрид калия; алкоксид, такой как метоксид натрия, этоксид натрия или трет-бутоксид калия; или органическое основание, такое как триэтиламин, N,N-диметиланилин, пиридин, 4-N, N-диметиламинопиридин или 1,8-диазабицикло[5.4.0]-7-ундецен.
Температура реакции может быть выбрана в интервале от минус 30oC до температуры кипения реакционной системы, предпочтительно от 0oC до 150oC. Время реакции варьирует в зависимости от конкретного соединения, однако оно может составлять в пределах от 10 минут до 20 часов.
В том случае, если хлорсульфонилизоцианат взаимодействует с вышеуказанным соединением (VII), (IX) или (XI), то полученный продукт реакции можно подвергнуть гидролизу после его выделения или без выделения и получить соединение по настоящему изобретению, в котором R30 обозначает амидную группу CONH2.
Способ 7
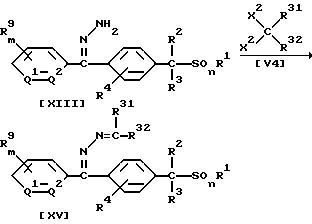
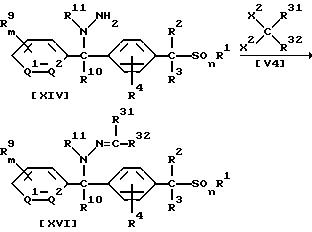
В приведенных выше формулах каждый R31 и R32, которые не зависят друг от друга, обозначают атом водорода, (C1-C6)алкильную группу или группу формулы -N(R25)R26; значения R1, R2, R3, R4, R9, R10, R11, m, n, Q1, Q2 указаны ранее; каждый R25 и R26, которые не зависят друг от друга, X2 обозначают (C1-C4)алкоксигруппу; или же два заместителя X2 вместе с атомом углерода могут образовать карбонильную группу.
В частности, новые соединения (XV) или (XVI) по настоящему изобретению могут быть получены взаимодействием 1 моля соединения (XIII) или (XIV) по настоящему изобретению с
соединением формулы (V4), взятым в количестве от 1,0 до 10,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров, и, если необходимо, в присутствии кислотного катализатора или
растворителя, взятых
в количестве от 0,01 до 1,0 молей.
Указанные реакции можно проводить в тех же самых условиях, что и условия, применяемые при осуществлении Способа 1.
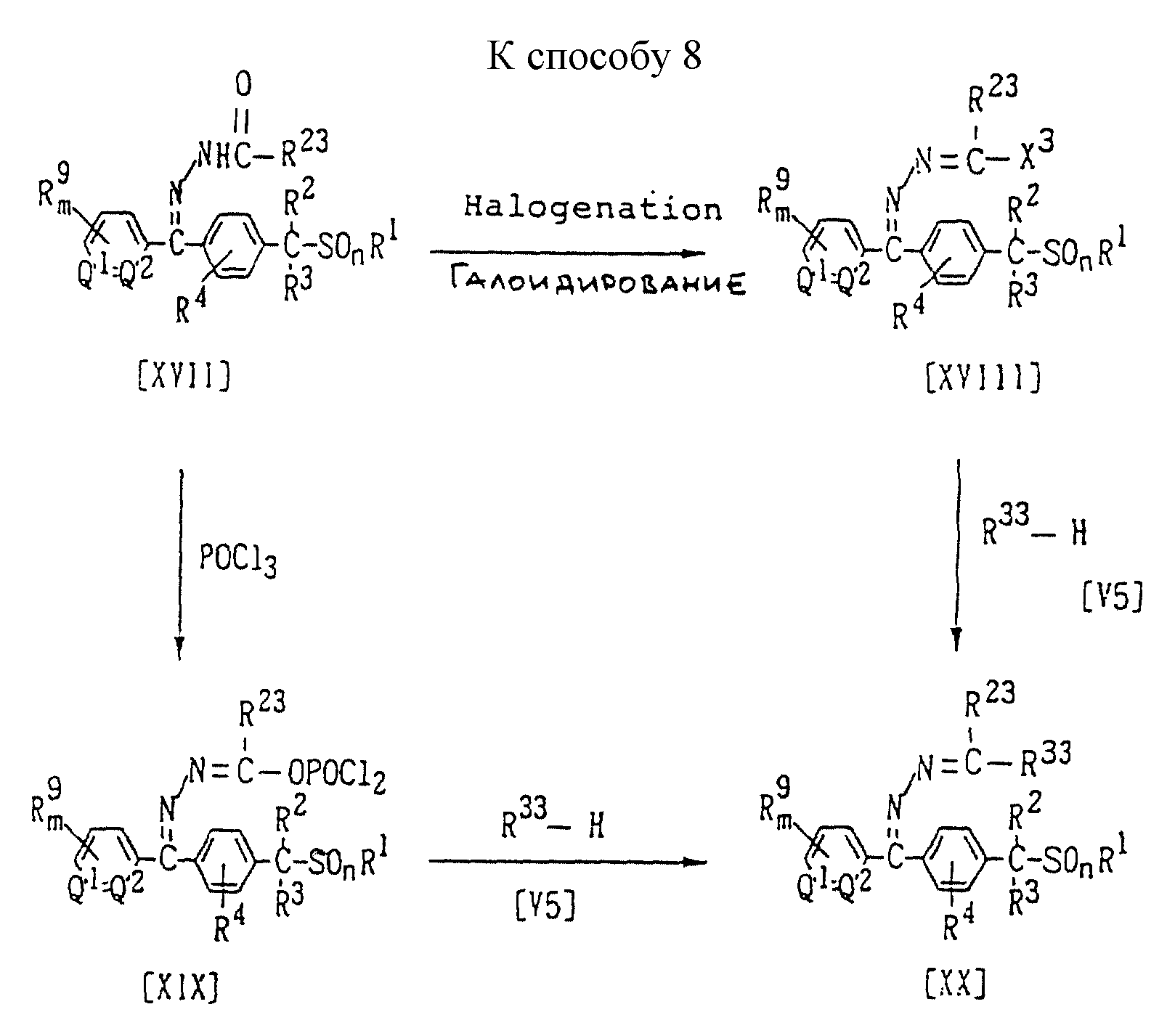
Способ 8 (схему см. в конце описания).
В приведенных на схеме формулах R23 обозначает азолильную группу или группу формулы -N(R25)R26; значения R1, R2, R3, R4, R9, R25, R26, m, n, Q1, Q2 указаны ранее; R23 обозначает атом водорода или (C1-C8)алкильную группу; а X3 является атомом хлора или атомом брома.
В частности, новые соединения (XVIII) по настоящему изобретению могут быть получены взаимодействием 1 моля соединения формулы (XVII) по настоящему изобретению с галогенирующим агентом, взятым в количестве от 1,0 до 10,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров. Затем вводят в реакцию от 1,0 до 5,0 молей соединения формулы (V5) в присутствии растворителя, взятого в количестве от 0 до 5 литров, если необходимо, в присутствии основания, взятого в количестве от 1,0 до 3,0 молей, и получают новое соединение (XX) по настоящему изобретению. Кроме того, соединение (XX) по настоящему изобретению можно получить, взяв вместо соединения формулы (XVIII) соединение формулы (XIX).
Галоидирующим агентом является, например, пентахлорид фосфора, хлористый тионил, смесь трифенилфосфин/четыреххлористый углерод или смесь трифенилфосфин/бром.
Растворитель, который может быть использован в приведенных реакциях, представляет собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран или диоксан; ароматический углеводород, такой как бензол, толуол, ксилол или хлорбензол; галогенсодержащий углеводород, такой как хлористый метилен или хлороформ; нитрил, такой как ацетонитрил или пропионитрил; сложный эфир, такой как этилацетат или этилпропионат; алифатический углеводород, такой как пентан, гексан, циклогексан или гептан, или смесь указанных растворителей. Кроме того, растворителем может служить галоидирующий агент.
Температура реакции может быть выбрана в интервале от 0oC до температуры кипения реакционной системы, предпочтительно от 10oC до 180oC. Время реакции варьирует в зависимости от конкретного соединения, однако оно может составлять в пределах от 10 минут до 20 часов.
Соединение формулы (XIX) может быть синтезировано по реакции соединения формулы (XVII) с оксихлоридом фосфора. Конкретный пример подобной реакции приводится, например, в Chemical Abstracts, Vol. 113, 97192b.
Соединения формулы (XX) по настоящему изобретению обычно можно получить по реакции соединения формулы (XVIII) или (XIX) с соединением формулы (V5) в присутствии растворителя, если необходимо, в присутствии основания и катализатора.
Применяемые растворитель и основание могут быть теми же, что и используемые в Способе 6. В качестве катализатора можно применять сульфинат, такой как метансульфинат натрия или п-толуолсульфинат натрия, или его гидрид. Температура реакции может быть выбрана в интервале от 0oC до температуры кипения реакционной системы, предпочтительно от 10oC до 100oC. Время реакции варьирует в зависимости от конкретного соединения, однако оно может составлять в пределах от 10 минут до 20 часов.
Способ 9
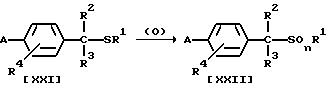
В приведенных выше формулах n = 1 или 2; а значения A, R1, R2, R3, R4 указаны ранее.
В частности, новое соединение формулы (XXII) по настоящему изобретению может быть получено взаимодействием 1 моля соединения формулы (XXI) по настоящему изобретению с окислительным агентом, взятым в количестве от 1,0 до 10,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров, и, если необходимо, в присутствии катализатора, взятого в количестве от 0,01 до 1,0 молей.
Окислительным агентом может быть, например, пероксид водорода, м-хлорнадбензойная кислота, периодат натрия, OXONE (торговый знак средства, содержащего кислый пероксосульфат калия, который выпускается компанией "E.I. DuPont"), N-хлорсукцинимид, N-бромсукцинимид, трет-бутилгипохлорит или гипохлорит натрия. В качестве катализатора можно, например, использовать вольфрамат натрия.
Растворитель, который может быть использован в данной реакции, представляет собой, например, простой эфир, ароматический углеводород, апротонный полярный растворитель, спирт, галогенсодержащий углеводород или алифатический углеводород, которые применяют при осуществлении Способа 1, уксусную кислоту, воду или кетон, такой как ацетон, метилэтилкетон или циклогексанон, или смесь указанных растворителей.
Температура реакции может быть выбрана в интервале от минус 20oC до температуры кипения реакционной системы, предпочтительно от 10oC до 100oC. Время реакции варьирует в зависимости от конкретного соединения, однако оно может составлять в пределах от 10 минут до 20 часов.
Способ 10 (схему см. в конце описания).
В приведенных на схеме формулах каждый R2 и R3, которые не зависят друг от друга, обозначают (C1-C4)алкильную группу или (C1-C3)галогеналкильную группу; значения A, R2, R4 и n указаны ранее; a R4 обозначает атом галогена, (C1-C4)алкилсульфинилоксигруппу или бензолсульфонилоксигруппу (которая может содержать в качестве заместителя метильную группу).
В частности, новое соединение формулы (XXIV) может быть получено взаимодействием 1 моля соединения формулы (XXIII) с алкилирующим агентом формулы (V6), взятым в количестве от 1,0 до 5,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров, и основания, взятого в количестве от 1,0 до 3,0 молей. Затем это соединение (XIV) после его выделения или без выделения может вступать во взаимодействие с алкилирующим агентом формулы (V7), взятым в количестве от 1,0 до 5,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров, и основания, взятого в количестве от 1,0 до 3,0 молей, при этом получают соединение формулы (XV).
Основание и растворитель, которые могут использоваться при проведении указанных реакций, могут быть, например, теми же самыми, что и применяемые при осуществлении Способа 6.
Температура реакции может быть выбрана в интервале от минус 30oC до температуры кипения реакционной системы, предпочтительно от 0oC до 100oC.
Способ 11
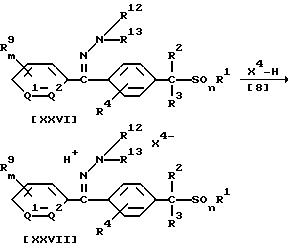
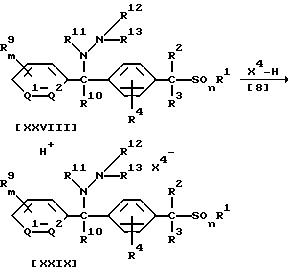
В приведенных выше формулах X4 обозначает атом галогена, (C1-C4)алкилсульфонилоксигруппу или бензолсульфонилоксигруппу (которая может содержать в качестве заместителя метильную группу); значения R1, R2, R3, R4, R9, R10, R11, R12, R13, Q1, Q2, m, n указаны ранее.
В частности, соль соединения (XVII) или (XIX) по настоящему изобретению может быть получена по реакции 1 моля соединения формулы (XXVI) или (XXVIII) по настоящему изобретению с кислотой формулы (V8), взятой в количестве от 1,0 до 3,0 молей, в присутствии растворителя, взятого в количестве от 0,1 до 5 литров.
Растворитель, который может использоваться в этой реакции, может быть, например, тем же растворителем, который применяют в Способе 1. Температура реакции может быть выбрана в интервале от минус 30oC до температуры кипения реакционной системы, предпочтительно от 0oC до 100oC.
Новые промежуточные соединения указанной выше формулы (II) и (III) могут быть синтезированы, например, в соответствии со следующими Способами 12-20.
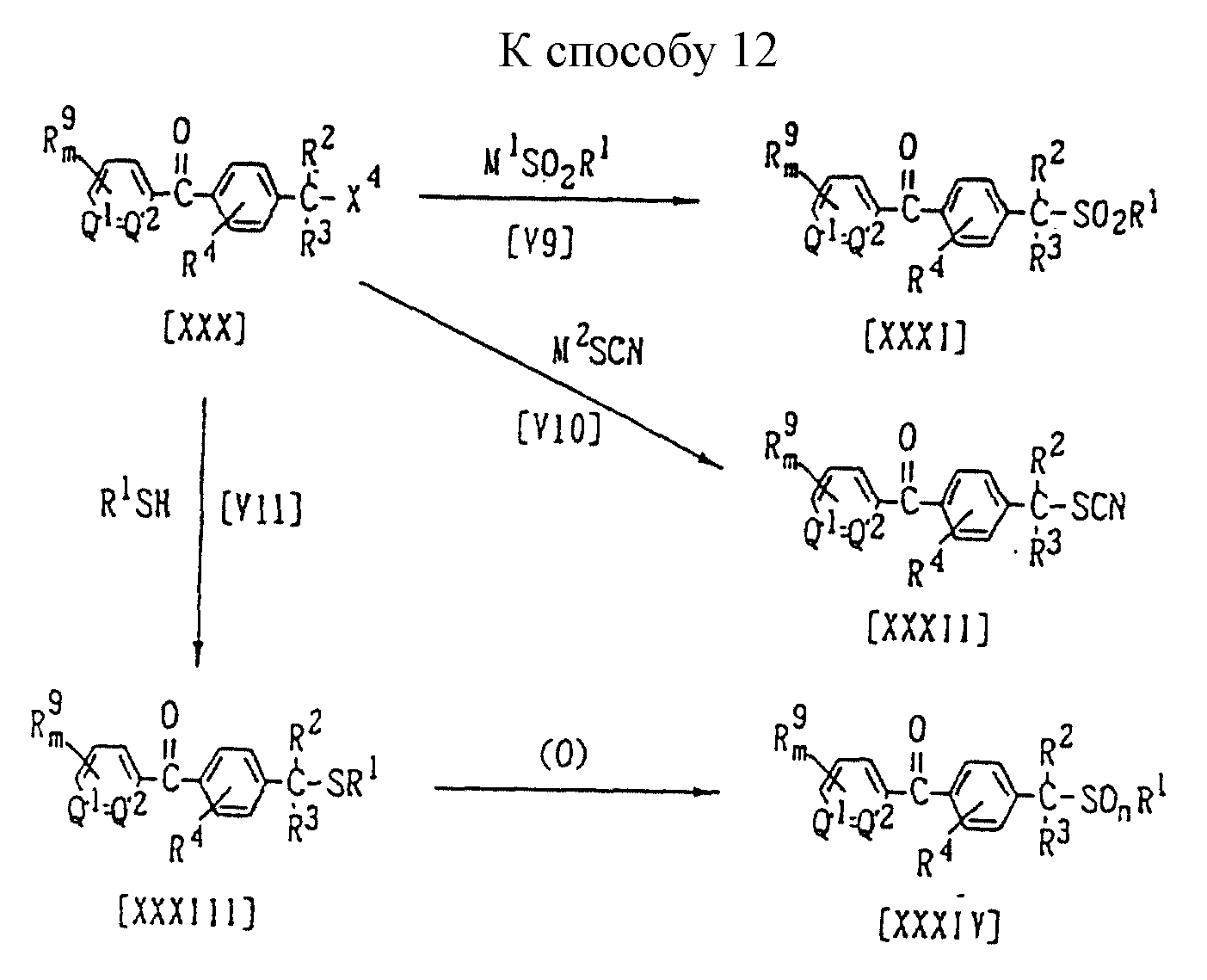
Способ 12 (схему см. в конце описания).
В приведенных на схеме формулах R1 обозначает (C1-C6)алкильную группу, (C1-C4)цианоалкильную группу, (C1-C4)гидроксиалкильную группу, (C3-C6)циклоалкильную группу, (C1-C6) галогеналкильную группу, фенильную группу (которая может содержать в качестве заместителя атом галогена или (C1 -C4)алкильную группу), бензильную группу (которая может содержать в качестве заместителя атом галогена) или тиазолильную группу; X4 обозначает атом галогена, (C1-C4)алкилсульфонилоксигруппу или бензолсульфонилоксигруппу (которая может содержать в качестве заместителя метильную группу); М1 обозначает щелочной металл; М2 обозначает щелочной металл или ион аммония; значения R2, R3, R4, m, Q1, Q2 указаны ранее; а n = 1 или 2.
В частности, производное бензилсульфона формулы (XXXI) можно получить взаимодействием 1 моля бензилгалогенида формулы (XXX) с солью щелочного металла сульфиновой кислоты формулы (V9), взятой в количестве от 1,0 до 3,0 молей, в присутствии растворителя, взятого в количестве от 0 до 10 литров.
Растворитель, который может быть использован в данной реакции, представляет собой, например, простой эфир, ароматический углеводород, апротонный полярный растворитель, спирт, галогенсодержащий углеводород или алифатический углеводород, или воду, или смесь указанных растворителей. Температура реакции может быть выбрана в интервале от 0oC до температуры кипения реакционной системы, предпочтительно от 10oC до 100oC.
Соль сульфиновой кислоты, которая применяется в данной реакции, является покупным реагентом или же может быть синтезирована обычным способом (в частности, по методике, приведенной в J. Chem. Soc., Vol. 636 (1945) или. J.Am. Chem. Soc., Vol. 96, N 7, р. 2275 (1974)).
Аналогично, из соединения формулы (XXX) и тиоцианата формулы (V10) можно получить соединение формулы (XXXII).
Кроме того, сульфид формулы (XXXIII) можно приготовить по реакции 1 моля соединения формулы (XXX) с меркаптаном формулы (VII), взятым в количестве от 1,0 до 3,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров, и в присутствии основания, взятого в количестве от 1,0 до 3,0 молей.
Растворитель и основание могут, например, быть теми же самыми, что и применяемые в Способе 6. Температура реакции может быть выбрана в интервале от минус 10oC до температуры кипения реакционной системы, предпочтительно от 0oC до 100oC.
Соединение формулы (XXXIV) по настоящему изобретению можно синтезировать по реакции 1 моля полученного ранее соединения формулы (XXXIII) с окислительным агентом, взятым в количестве от 1,0 до 10,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров, и, если необходимо, в присутствии катализатора, взятого в количестве от 0,01 до 1,0 молей.
Окислительным агентом может быть, например, пероксид водорода, м-хлорнадбензойная кислота, периодат натрия, OXONE (торговый знак средства, содержащего кислый пероксосульфат калия, который выпускается компанией "E.I. DuPont"), N-хлорсукцинимид, N-бромсукцинимид, трет-бутилгипохлорит или гипохлорит натрия.
Катализатором может быть, например, вольфрамат натрия.
Растворитель, который может быть использован в данной реакции, представляет собой, например, простой эфир, ароматический углеводород, апротонный полярный растворитель, спирт, галогенсодержащий углеводород или алифатический углеводород, которые применяют при осуществлении Способа 1, уксусную кислоту, воду или кетон, такой как ацетон, метилэтилкетон, или циклогексанон или смесь указанных растворителей.
Температура реакции может быть выбрана в интервале от минус 20oC до температуры кипения реакционной системы, предпочтительно от 10oC до 100oC.
Бензилгалогенид формулы (XXX), который применяют в качестве исходного вещества, является известным соединением и может быть получен обычными способами (в частности, по способу, приведенному в Org. Synth., Vol. 4, р. 921 (1963)) путем галогенирования метильной группы соответствующего арилкарбонилтолуола галоидирующим агентом (таким как хлор, бром, N-хлорсукцинимид, N-бромсукцинимид, хлористый сульфурил или бромистый сульфурил).
Арилкарбонилтолуол обычно получают по реакции толуола с галогенангидридом арилкарбоновой кислоты в присутствии кислоты Льюиса, такой как хлорид алюминия.
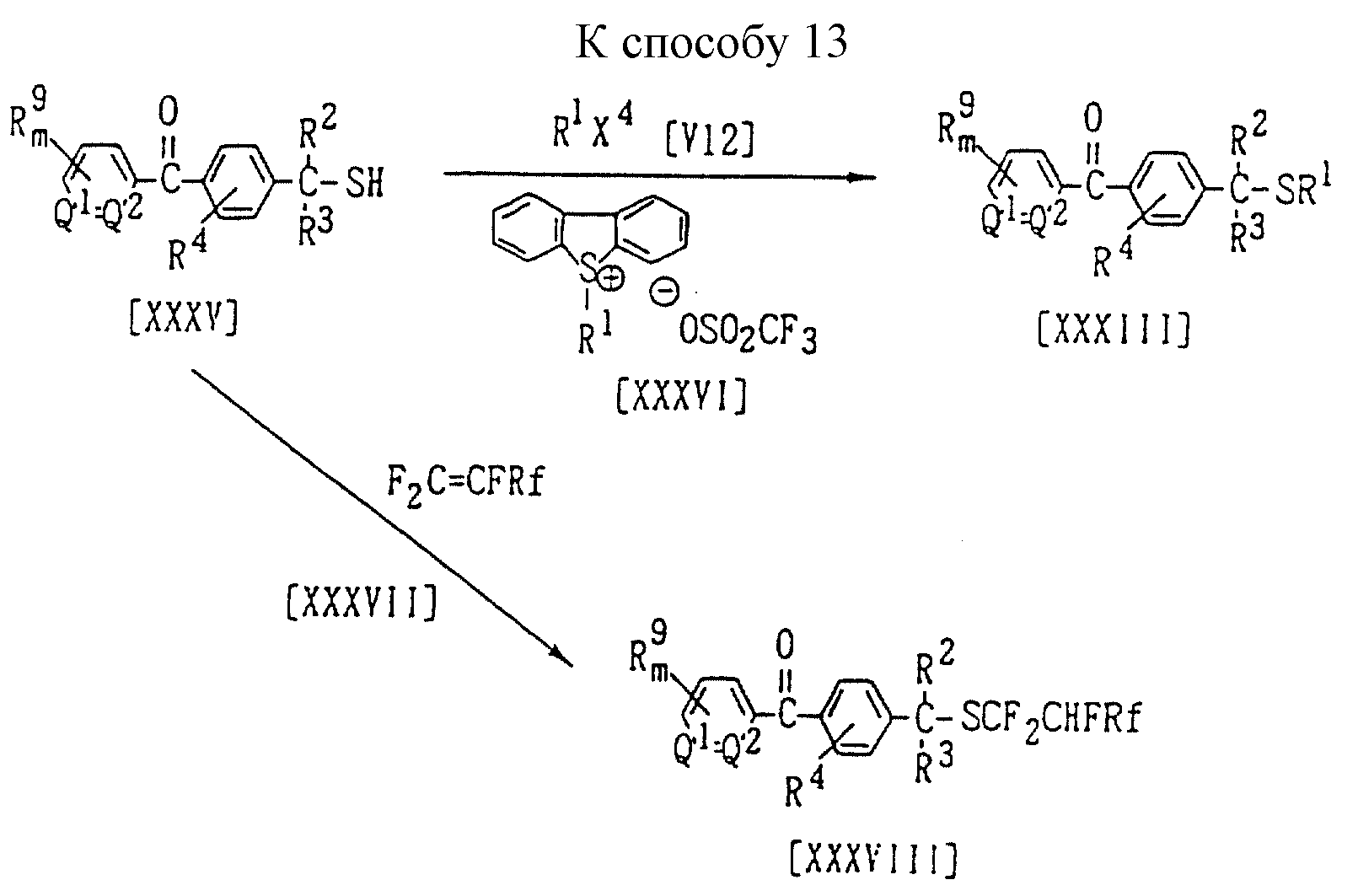
Способ 13 (схему см. в конце описания).
В приведенных на схеме формулах R1 обозначает (C1-C6)алкильную группу, (C3-C6)циклоалкильную группу, (C1-C6)галогеналкильную группу, (C1-C4)цианоалкильную группу, (C1-C4 )гидроксиалкильную группу; Rf обозначает атом фтора или перфторалкильную группу; X4 обозначает атом галогена, (C1-C4)алкилсульфонилоксигруппу или бензолсульфонилоксигруппу (которая может содержать в качестве заместителя метильную группу); значения R2, R3, R4, m, Q1, Q2 указаны ранее; а n = 1 или 2.
Сульфид формулы (XXXIII) или (XXXVIII) можно синтезировать по реакции 1 моля бензилмеркаптана формулы (XXXV) с алкилирующим агентом формулы (V12), взятым в количестве от 1,0 до 3,0 молей, и дибензотиофенийтрифторметансульфонатом формулы (XXXVI) или перфторалкеном формулы (XXXVII) в присутствии растворителя, взятого в количестве от 0 до 10 литров, и, если необходимо, в присутствии основания, взятого в количестве от 1,0 до 3,0 молей.
Основание и растворитель, которые используются в этой реакции, могут, например, быть теми же самыми, что и применяемые в Способе 6. Температура реакции может быть выбрана в интервале от 0oC до температуры кипения реакционной системы, предпочтительно от 10oC до 150oC.
Окислением полученного выше сульфида формулы (XIII) или (XVIII) с использованием того же метода окисления, что и в Способе 12, можно синтезировать соответствующее производное сульфоксида или сульфона.
Бензилмеркаптан формулы (XXXV), который используют в качестве исходного соединения, является известным соединением и может быть синтезирован известным способом (в частности, по методике, приведенной в Org. Synth., Vol. 3, р. 363 (1955)) или аналогичными способами. В частности, его можно получить взаимодействием бензилгалогенида формулы (XXX), который используют в качестве исходного соединения в Способе 12, с сульфидом натрия или взаимодействием указанного бензилгалогенида с тиомочевиной в присутствии основания с последующим гидролизом.
Способ 14 (схему см. в конце описания).
В приведенных на схеме формулах значения R1, R4, R9, m, n, Q1, Q2 указаны ранее; каждый R2 и R3 обозначают алкильную группу или галогеналкильную группу; X4 обозначает атом галогена, (C1-C4)алкилсульфонилоксигруппу или бензолсульфонилоксигруппу (которая может содержать в качестве заместителя метильную группу).
В частности, соединение формулы (XL) или (XVI) можно получить по реакции 1 моля соединения формулы (XXXIX) с алкилирующим агентом формулы (V13) или (V14), взятым в количестве от 1,0 до 5,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров, и в присутствии основания, взятого в количестве от 1,0 до 3,0 молей. Если в боковой цепи заместителя R1 присутствует группу X4, то R1 и R2 вместе с атомами серы и углерода, к которым они, соответственно, присоединены, образуют кольцо, содержащее от трех до восьми членов и включающее один или несколько гетероатомов.
Основание и растворитель, которые используются в этой реакции, могут, например, быть теми же самыми, что и применяемые в Способе 6. Температура реакции может быть выбрана в интервале от 0oC до температуры кипения реакционной системы, предпочтительно от 10oC до 150oC.
Способ 15
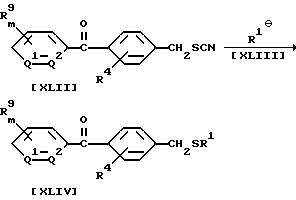
В приведенных выше формулах значения R4, R9, m, n, Q1 и Q2 указаны ранее; R1 обозначает алкильную группу или галогеналкильную группу.
В частности, соединение формулы (XLIV) может быть получено взаимодействием 1 моля соединения формулы (XLII) по настоящему изобретению с карбанионом формулы (XLIII), взятым в количестве от 1, 0 до 5,0 молей, в присутствии растворителя, взятого в количестве от 0 до 10 литров. Для генерирования карбоната формулы (XLIII) можно, например, воспользоваться 1) методом контактирования трихлорметана, взятого в количестве от 1,0 до 15,0 молей, с основанием, взятым в количестве от 1,0 до 15,0 молей, если необходимо, в присутствии катализатора фазового переноса, взятого в количестве от 0,01 до 1,0 молей, такого как соль тетраалкиламмония, соль бензилтриалкиламмония, соль тетраалкилфосфония или краун-эфир, 2) методом контактирования (триалкилсилил)алкилгалогенида, взятого в количестве от 1,0 до 15,0 молей, с фторидом, взятым в количестве от 1,0 до 15,0 молей, таким как фторид калия или тетрабутиламмонийфторид, или 3) методом контактирования алкилгалогенида или галогеналкилгалогенида, взятого в количестве от 1,0 до 5,0 молей, с металлом, таким как литий, натрий, медь или цинк, или с металлоорганическим соединением, таким как ди-изо-пропиламид лития, фениллитий или бутиллитий, взятым в количестве от 1,0 до 5,0 молей.
В качестве растворителя, можно использовать, например, простой эфир, ароматический углеводород, апротонный полярный растворитель, спирт, алифатический углеводород или воду или смесь указанных растворителей.
Температура реакции может быть выбрана в интервале от минус 70oC до температуры кипения реакционной системы, предпочтительно от минус 50oC до 50oC.
Способ 16
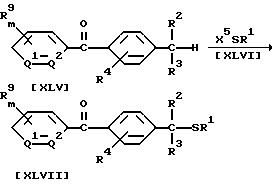
В приведенных выше формулах значения R2, R3, R4, R9, m, n, Q1 и Q2 указаны ранее; X5 обозначает атом галогена, цианогруппу или группу формулы SR1; R1 обозначает алкильную группу или галогеналкильную группу.
В частности, соединение формулы (XLVII) может быть получено по реакции 1 моля соединения формулы (XLV) по настоящему изобретению с соединением формулы (XLVI), взятым в количестве от 1,0 до 5,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров, и основания, взятого в количестве от 1,0 до 5,0 молей.
Основание и растворитель, которые используются в этой реакции, могут, например, быть теми же самыми, что и применяемые в Способе 6.
Температура реакции может быть выбрана в интервале от минус 70oC до температуры кипения реакционной системы, предпочтительно от минус 50oC до 50oC.
Способ 17
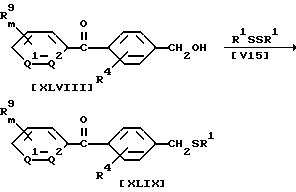
В приведенных выше формулах значения R1, R4, R9, m, n, Q1 и Q2 указаны ранее.
В частности, соединение формулы (XLIX) по настоящему изобретению может быть получено по реакции 1 моля бензилового спирта формулы (XLVIII) с диалкиламинохлорфосфином, взятым в количестве от 1,0 до 3,0 молей, обычно в присутствии растворителя и основания, в частности в присутствии от 0,1 до 5 литров растворителя и от 1,0 до 3,0 молей основания, при этом выделяют фосфит, а затем проводят реакцию с дисульфидом формулы (V15), взятым в количестве от 1,0 до 5, 0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров.
Растворитель, который может быть использован в приведенной реакции, представляет собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран или диоксан; ароматический углеводород, такой как бензол, толуол, ксилол или хлорбензол; апротонный полярный растворитель, такой как N, N-диметилформамид, N, N-диметилацетамид, N-метил-2-пирролидон, диметилсульфоксид или сульфолан; галогенсодержащий углеводород, такой как хлористый метилен или хлороформ; нитрил, такой как ацетонитрил или пропионитрил; сложный эфир, такой как этилацетат или этилпропионат; алифатический углеводород, такой как пентан, гексан, циклогексан или гептан; пиридин, такой как пиридин или пиколин, или смесь указанных растворителей.
Основание может представлять собой неорганическое основание, в частности, гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия; гидроксид щелочно-земельного металла, такой как гидроксид кальция или гидроксид магния; карбонат щелочного металла, такой как карбонат натрия или карбонат калия; или бикарбонат щелочного металла, такой как бикарбонат натрия или бикарбонат натрия; гидрид металла, такой как гидрид натрия или гидрид калия; или органическое основание, такое как триэтиламин, N,N-диметиланилин, пиридин, 4-N, N-диметиламинопиридин или 1,8-диазабицикло[5.4.0.]-7-ундецен.
Температура реакции может быть выбрана в интервале от минус 40oC до температуры кипения реакционной системы, предпочтительно от минус 30oC до 50oC.
Время реакции варьирует в зависимости от конкретного соединения, однако оно может составлять в пределах от 10 минут до 20 часов.
Способ 18
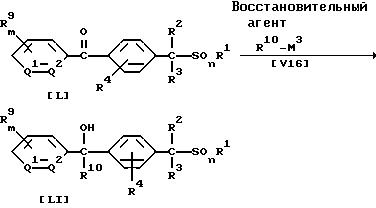
В приведенных выше формулах значения R1, R2, R3, R4, R9, R10, Q1, Q2, M3, m, n указаны ранее.
В частности, соединение формулы (LI) по настоящему изобретению может быть получено по реакции соединения (L) по настоящему изобретению с восстанавливающим агентом, взятым в количестве от 1,0 до 50,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров, и, если необходимо, в присутствии катализатора, взятого в количестве от 0,01 до 1,0 молей, или по реакции соединения (L) с алкильным производным металла формулы (V16), взятым в количестве от 1,0 до 5,0 молей.
Восстанавливающим агентом может служить, например, молекулярный водород, боргидрид натрия, алюмогидрид лития, или гидрид алюминия, или ди-изо-бутилалюминийгидрид. В качестве катализатора можно, например, применять платину, никель, кобальт или палладий.
Растворитель, который может быть использован в приведенной реакции, представляет собой, например, простой эфир, ароматический углеводород, апротонный полярный растворитель, спирт, алифатический углеводород, уксусную кислоту или воду или смесь указанных растворителей.
Температура реакции может быть выбрана в интервале от минус 20oC до температуры кипения реакционной системы, предпочтительно от 10oC до 100oC. Время реакции варьирует в зависимости от конкретного соединения, однако оно может составлять в пределах от 10 минут до 20 часов.
Способ 19
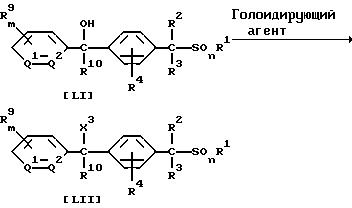
В приведенных выше формулах значения R1, R2, R3, R4, R9, R10, Q1, Q2, m, n указаны ранее; a X3 обозначает атом хлора или атом брома.
Новое соединение формулы (LII) по настоящему изобретению может быть получено взаимодействием 1 моля соединения формулы (LI) по настоящему изобретению с галоидирующим агентом, взятым в количестве от 1,0 до 10,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 литров.
Галоидирующим агентом может быть, например, хлористый водород, бромистый водород, трихлорид фосфора, трибромид фосфора, тионил хлорида, смесь трифенилфосфин/четыреххлористый углерод или смесь трифенилфосфин/бром.
Растворитель, который может быть использован в приведенной реакции, представляет собой, например, простой эфир, такой как диэтиловый эфир, тетрагидрофуран или диоксан; ароматический углеводород, такой как бензол, толуол, ксилол или хлорбензол; галогенсодержащий углеводород, такой как хлористый метилен или хлороформ; нитрил, такой как ацетонитрил или пропионитрил; алифатический углеводород, такой как пентан, гексан, циклогексан или гептан, или смесь указанных растворителей. Кроме того, растворителем может служить галоидирующий агент.
Температура реакции может быть выбрана в интервале от 0oC до температуры кипения реакционной системы, предпочтительно от 10oC до 180oC. Время реакции варьирует в зависимости от конкретного соединения, однако оно может составлять в пределах от 10 минут до 20 часов.
Способ 20
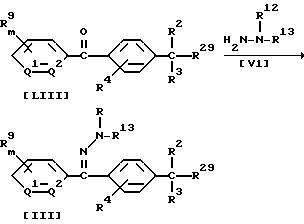
В приведенных выше формулах значения R2, R3, R4, R9, R12, R13, R29 , Q1, Q2 и m указаны ранее.
В частности, соединение формулы (III) по настоящему изобретению может быть получено по реакции 1 моля бензофенона формулы (LIII) с гидразином или его гидратом, взятым в количестве от 1,0 до 10,0 молей, в присутствии растворителя, взятого в количестве от 0 до 5 молей, и, если необходимо, в присутствии кислотного катализатора, взятого в количестве от 0,01 до 1,0 моля.
Растворитель и кислотный катализатор, которые используются в этой реакции, могут, например, быть теми же самыми, что и применяемые в Способе 1.
Температура реакции может быть выбрана в интервале от минус 10oC до температуры кипения реакционной системы, предпочтительно от 0oC до 100oC.
Наилучший способ осуществления изобретения
Далее настоящее изобретение поясняется более подробно с использованием Препаративных примеров, Примеров композиций и Примеров
испытаний.
Препаративный пример 1
Получение 4-хлор-4'- трифторметилсульфонилметилбензофенон-N'-этоксикарбонилгидразона (Соединение N I-175)
4-хлор-4'-трифторметилсульфонилметилбензофенон (0,5 г) и этилкарбазат (0,4 г) добавляют к смеси этанола (40 мл) и уксусной кислоты (5 мл) и полученную смесь кипятят с обратным холодильником в течение
18 часов. Реакционную смесь упаривают, остаток экстрагируют этилацетатом, органические вытяжки промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, а
остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 4:1) и получают целевой продукт (0,6 г, т. пл. 148-150oC, выход 96%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 1,30 (3Н, триплет), 4,23 (2Н, квартет), 4,35, 4,53 (2Н, два синглета), 7,03-7,80 (9Н, мультиплет).
Препаративный пример 2
Получение 4-хлор-4'-метилсульфонилметилбензофенонгидразона (Соединение N I-2)
4-Хлор-4'-метилсульфонилметилбензофенон (10,0 г) и моногидрат гидразина (4,9 г) добавляют к смеси этанола (200
мл) и уксусной кислоты (10 мл) и полученную смесь кипятят с обратным холодильником в течение 6 часов. Реакционную смесь упаривают, остаток экстрагируют этилацетатом, органические вытяжки промывают
водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 2:1) и получают целевой
продукт (10,0 г, т.пл. 52-54oC, выход 97%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,73 (3Н, синглет), 4,20, 4,30 (2Н, два синглета), 5,50 (2Н, широкий сигнал), 7,05-7,70 (8Н, мультиплет).
Препаративный пример 3
Получение 4-хлор-4'-метилсульфонилметилбензофенон-N'-пропионилгидразона (Соединение N I-15)
4-хлор-4'-метилсульфонилметилбензофенонгидразон (1,3 г), пропионилхлорид (0,4 г) и карбонат калия (0,7 г) добавляют к смеси этилацетата (150 мл) и воды (100 мл) и полученную смесь перемешивают в
течение 2 часов при комнатной температуре. Смесь подвергают жидкостной экстракции, слой этилацетата промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном
давлении, а остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 2:1) и получают целевой продукт (1,3 г, т.пл. 159-160oC, выход 86%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 1,23 (3Н, триплет), 2,85-3,00 (5Н, мультиплет), 4,30 (2Н, синглет), 7,00-8,00 (8Н, мультиплет), 8,25 (1Н, широкий сигнал).
Препаративный пример 4
Получение 4-хлор-4'-трифторметилсульфонилметилбензофенона-гидразона Соединение N I-136)
4-Хлор-4'-трифторметилсульфонилметилбензофенон (2,5 г), моногидрат
гидразина (4,3 г) и моногидрат п-толуолсульфокислоты (0,2 г) добавляют к этанолу (30 мл) и полученную смесь кипятят с обратным холодильником в течение 3 часов. Реакционную смесь упаривают, остаток
экстрагируют этилацетатом, органические вытяжки промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, а остаток очищают колоночной хроматографией на
силикагеле (н-гексан:этилацетат = 2:1) и получают целевой продукт (2,2 г, nD20 = 1,5871, выход 85%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 4,43, 4,53 (2Н, два синглета), 5,47, 5,53 (2Н, два синглета), 7,07-7,60 (8Н, мультиплет).
Препаративный пример 5
Получение
4-хлор-4'-трифторметилсульфонилметилбензофенон-N'-пропионилгидразона (Соединение N I-149)
4-Хлор-4'-трифторметилсульфонилметилбензофенон-гидразон (0,8 г), пропионилхлорид (0,22 г) и карбонат
калия (0,4 г) добавляют к смеси этилацетата (100 мл) и воды (100 мл) и полученную смесь перемешивают в течение 16 часов при комнатной температуре. Смесь подвергают жидкостной экстракции, слой
этилацетата промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, а полученный твердый остаток промывают н-гексаном и получают целевой продукт (0,75 г,
т.пл. 130-132oC, выход 75%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 1,20 (3Н, триплет), 2,60-3,00 (2Н, мультиплет), 4,47 (2Н, дублет), 7,03-7,63 (8Н, мультиплет), 8,22 (1Н, дублет).
Препаративный пример 6
Получение 4-хлор-4'-трифторметилсульфонилметилбензофенон'-(1- хлоропропилиден)гидразона (Соединение N II-14)
4-хлор-4'-трифторметилсульфонилметилбензофенон-пропионилгидразон (1,7 г), трифенилфосфин (1,5 г) и четыреххлористый углерод (1,2 г) растворяют в ацетонитриле и полученную смесь кипятят с обратным
холодильником в течение 10 минут. Реакционную смесь упаривают и остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 10:1), получая целевой продукт (1,7 г, т.пл. 108-109oC, выход 97%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 1,05, 1,10 (3Н, два триплета), 2,50, 2,55 (2Н, два квартета), 4,47 (2Н, синглет), 7,00-7,85 (8Н, мультиплет).
Препаративный пример 7
Получение 4-хлор-4'- трифторметилсульфонилметилбензофенон'-1-(1-Н-1,2,4-триазол-1- ил)пропилиден гидразона (Соединение N II-10)
4-хлор-4'-трифторметилсульфонилметилбензофенон'-(1-хлоропропилиден) гидразон (1,0 г), 1-Н-1,2,4-триазол (0,2 г), карбонат калия (0,4 г) и натриевую соль п-толуолсульфокислоты (0,3 г) добавляют к N,
N-диметилформамиду (70 мл) и полученную смесь перемешивают в течение 7 часов при температуре от 95 до 100oC. Реакционную смесь охлаждают до комнатной температуры и добавляют воду.
Экстрагируют этилацетатом, органические вытяжки объединяют, промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, а остаток очищают колоночной
хроматографией на силикагеле (н-гексан: этилацетат = 6: 1) и получают целевой продукт (0,7 г, nD20 = 1,5978, выход 66%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 1,28 (3Н, триплет), 3,28 (2Н, квартет), 4,52 (2Н, синглет), 7,05-7,86 (8Н, мультиплет), 7,95 (1Н, синглет), 8,40, 8,52 (1H, два синглета).
Препаративный
пример 8
Получение 4-хлор-4'- трифторметилсульфонилметилбензофенон'-[1-(N-метиламино) этилиден]гидразона (Соединение N II-8)
4-Хлор-4'-трифторметилсульфонилметилбензофенон'- (1-хлороэтилиден)гидразон (0,7 г) и 40%-ный водный раствор метиламина (0,3 г) добавляют к ксилолу (50 мл) и перемешивают смесь при кипячении с обратным
холодильником в течение часа. Реакционную смесь упаривают, остаток экстрагируют этилацетатом, органические вытяжки промывают водой и сушат над безводным сульфатом магния. Этилацетат отгоняют при
пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 1:1) и получают целевой продукт (0,6 г, т.пл. 58-60oC, выход 87%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,00, 2,20 (3Н, два синглета), 2,67, 2,94 (3Н, два дублета), 4,46 (2Н, синглет), 6,30 (lH, широкий сигнал), 6,95-7,78 (3Н, мультиплет).
Препаративный пример 9
Получение 4-хлор-4'-этилсульфонилметилбензофенон -N'- изопропилиденгидразона (Соединение N II-35)
4-Хлор-4'-этилсульфонилметилбензофенон-гидразон (0,7 г) растворяют в ацетоне (30 мл) и полученную смесь кипятят с обратным холодильником в течение 30 минут. Реакционную смесь упаривают и получают
целевое соединение (0,7 г, nD20 =1,6163, выход 88%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 1,34 (3Н, триплет), 2,00 (6Н, синглет), 2,90 (2Н, квартет), 4,20 (2Н, синглет), 7,00-7,87 (8Н, мультиплет).
Препаративный пример 10
Получение 4-хлор-4'-метилтиометилбензофенон-N'-[1 -N,
N-диметиламино)этилиден] гидразона (Соединение N II-22)
4-Хлор-4'-метилтиометилбензофенон-гидразон (2,0 г) и метилацетамид-диметилацеталь (1,4 г) растворяют в этаноле (100 мл) и полученную
смесь перемешивают при кипячении с обратным холодильником в течение 6 часов. Реакционную смесь упаривают, остаток экстрагируют этилацетатом. Органические вытяжки промывают водой и сушат над безводным
сульфатом магния. Растворитель (этилацетат) отгоняют при пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 6:1) и получают целевое соединение в
виде прозрачной вязкой жидкости желтоватого цвета (2,0 г, выход 81%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,00 (3Н, синглет), 2,35 (3Н, синглет), 2,88 (6Н, синглет), 3,66, 3,70 (2Н, два синглета), 7,03-7,75 (8Н, мультиплет).
Препаративный пример 11
Получение 4-хлор-4'-метилтиометилбензофенон-семикарбазона (Соединение N I-42)
4-хлор-4'-метилсульфонилметилбензофенон-гидразон (1,3 г) и хлорсульфонилизоцианат (0,63 г) растворяют в этилацетате (100 мл) и полученную смесь перемешивают при комнатной температуре в течение
часа. В реакционную смесь добавляют воду (100 мл) и перемешивают еще в течение 16 часов при комнатной температуре. Смесь подвергают жидкостной экстракции, слой этилацетата промывают водой и сушат над
безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, а остаток промывают смесью этилацетат: н-гексан = 4:1 и получают целевое соединение (162 г, т.пл. 189-181oC, выход
80%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,87, 2,97 (3Н, два синглета), 4,34, 4,50 (2Н, два синглета), 7,10-7,70 (8Н, мультиплет).
Препаративный пример 12
Получение 4-хлор-4'-метилтиометилбензофенон-N'-этоксикарбонил-N'-метилгидразона (Соединение N I-47)
4-Хлор-4'-метилтиометилбензофенон-N'-этоксикарбонилгидразон (4,3 г) растворяют в N, N-диметилформамиде (100 мл). К полученному раствору добавляют 60%-ный гидрид натрия (0,6 г) и перемешивают в течение
30 минут при комнатной температуре. К полученной смеси добавляют йодистый метил (2,5 г) и перемешивают при комнатной температуре в течение 16 часов. Добавляют воду и экстрагируют этилацетатом.
Органические вытяжки (слой этилацетата) промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле
(н-гексан: этилацетат = 5:1) и получают целевое соединение (4,3 г, nD20 = 1,6042, выход 89%).
Данные ПМР спектроскопии (80 МГц, дейтерохлороформ, δ ): 1,17 (3Н, триплет), 2,00 (3Н, синглет), 2,79, 3,00 (3Н, два синглета), 3,63, 3,87 (2Н, два синглета), 4,04 (2Н, квартет), 7,07-7,57 (8Н, мультиплет).
Препаративный пример 13
Получение 4-хлор-4'-трифторметилсульфонилметилбензофенон-4- бутилсемикарбазона (Соединение N I-171)
4-Хлор-4'-трифторметилсульфонилметилбензофенон-гидразон (1,2 г), триэтиламин (0,5 г)
и бутилизоцианат (0,8 г) растворяют в тетрагидрофуране (30 мл) и полученную смесь перемешивают в течение 16 часов при комнатной температуре. Реакционную смесь упаривают и остаток экстрагируют
этилацетатом. Органические вытяжки промывают 2N раствором соляной кислоты, водой и затем сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, а остаток очищают
колоночной хроматографией на силикагеле (н-гексан: этилацетат = 4:1) и получают целевое соединение (0,6 г, т.пл. 169-181oC, выход 40%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 0,75-1,65 (7Н, мультиплет), 3,15-3,50 (2Н, мультиплет), 2,50 (2Н, синглет), 6,20 (1Н, широкий сигнал), 6,90-7,70 (9Н, мультиплет).
Препаративный пример
14
Получение 4-хлор-4'-трифторметилсульфонилметилбензофенон-N'- метилсульфонилиминометилгидразона (Соединение N I-137)
4-хлор-4'-трифторметилсульфонилметилбензофенон-гидразон (1,2 г),
триэтиламин (1,6 г) и этиловый эфир N-метилсульфонилформамида (1,2 г) растворяют в диоксане (30 мл) и полученную смесь перемешивают при кипячении с обратным холодильником в течение 5 часов при
комнатной температуре. Реакционную смесь упаривают и остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 1:1), получая целевое соединение (0,8 г, т.пл. 63-65oC,
выход 52%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,95, 3,05 (3Н, два синглета) 4,45, 4,60 (2Н, два синглета), 4,95 (1Н, широкий сигнал), 7,10-7,80 (8Н, мультиплет), 8,80 (1Н, широкий сигнал).
Препаративный пример 15
Получение 4-хлор-4'-трифторметилсульфонилметилбензофенон-N'- метилсульфонилгидразона (Соединение N I-182)
4-Хлор-4'-трифторметилсульфонилметилбензофенон-гидразон (1,2 г) и триэтиламин (0,4 г) растворяют в этилацетате (30 мл). К полученному раствору при комнатной температуре добавляют по каплям
метансульфохлорид (0,4 г) и смесь перемешивают в течение часа. Реакционную смесь промывают 2N раствором соляной кислоты и водой, а затем сушат над безводным сульфатом магния. Этилацетат упаривают при
пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 4:1) и получают целевое соединение (0,5 г, т.пл. 64-65oC, выход 36%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 3,50 (3Н, синглет), 4,50 (2Н, дублет), 7,10-7,70 (9Н, мультиплет).
Препаративный пример 16
Получение
4-хлор-4'-метилсульфинилметилбензофенон-N'-пропионилгидразона (Соединение N I-14)
4-Хлор-4'-метилтиометилбензофенон-N'- пропионилгидразон (0,8 г) и перйодид натрия (0,5 г) растворяют в смеси
метанола (50 мл) и воды (7 мл) и полученную смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь упаривают и остаток экстрагируют этилацетатом. Органические вытяжки
промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 10:1) и
получают целевое соединение (0,7 г, т.пл. 153-156oC, выход 84%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 1,21 (3Н, триплет), 2,43, 2,56 (3Н, два синглета), 2,85 (2H, квартет), 3,93, 4,00 (2Н, два синглета), 6,96-7,70 (8Н, мультиплет), 8,23 (1Н, широкий сигнал).
Препаративный пример 17
Получение
4-хлор-4'-(2-метилсульфонил-2-пропил) бензофенон-N'-гексанолил-N'-метилгидразона (Соединение N I-128)
4-Хлор-4'-метилсульфонилметилбензофенон-N'-гексанолилгидразон (1,4 г) йодистый метил (5,8
г) и 60%-ный гидрид натрия (0,15 г) добавляют к N,N-диметилформамиду (80 мл) и полученную смесь перемешивают при комнатной температуре в течение 16 часов. Добавляют воду и смесь экстрагируют
этилацетатом. Органические вытяжки промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле
(н-гексан: этилацетат = 2:1) и получают целевое соединение (0,8 г, т.пл. 84-96oC, выход 53%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 0,90 (3Н, мультиплет), 1,10-1,93 (6Н, мультиплет), 1,87 (6Н, синглет, 2,16-2,67 (2Н, мультиплет), 2,57, 2,76 (3Н, синглет), 3,09 (3Н, синглет), 7,05-7,73 (8Н, мультиплет).
Препаративный пример
18
Получение 4-хлор-4'- трифторметилсульфонилметилбензгидрилгидразина (Соединение N V-8)
Моногидрат гидразина (50 мл) и 4-хлор-4'-трифторметилсульфонилметилбензгидрилхлорид добавляют
к толуолу (80 мл) и смесь медленно нагревают при перемешивании. Перемешивают смесь в течение двух часов при температуре 80oC, дают остыть до комнатной температуры и выливают в воду.
Добавляют с целью экстракции 200 мл этилацетата, органические вытяжки промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, а остаток перегоняют при
пониженном давлении и получают целевое соединение в виде желтоватого вязкого вещества (2,9 г, nD20 = 1,5671, выход 82,4%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 3,83 (2Н, широкий сигнал), 4,38 (2Н, синглет), 4,83 (1Н, синглет), 6,96-7,50 (8Н, мультиплет).
Препаративный пример 19
Получение
гидрохлорида N-(4-хлор-4'-трифторметилсульфонилметилбензгидрил) -метоксикарбонилгидразина (Соединение V-13)
N-(4-Хлор-4'-трифторметилсульфонилметилбензгидрил)-N'-метоксикарбонилгидразин (1,6
г) растворяют в метаноле (80 мл), к полученному раствору добавляют соляную кислоту (3 мл) и перемешивают при комнатной температуре. Смесь постепенно нагревают до температуры кипения и кипятят с
обратным холодильником в течение 2 часов, а затем охлаждают до комнатной температуры. Растворитель отгоняют при пониженном давлении и получают целевое соединение в виде порошка желтоватого цвета (1,6
г, т.пл. 52-54oC, выход 91,5%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 3,6 (3Н, синглет), 4,73 (2Н, синглет), 5,23 (1Н, синглет), 7,27-7,50 (8Н, мультиплет).
Препаративный пример 20
Получение 4-xлop-4'-этилтиoметилбензoфенoн-N'- этоксикарбонилгидразона (Соединение N I-114)
Этантиол (1,2 г) и гидроксид натрия
(1 г) суспендируют в N,N-диметилформамиде (50 мл), а затем добавляют 4-хлор-4'- хлорметилбензофенон-N'-этоксикарбонилгидразон (3,5 г). Смесь перемешивают при комнатной температуре в течение 16 часов,
добавляют воду и экстрагируют этилацетатом. Органические вытяжки промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, а остаток очищают колоночной
хроматографией на силикагеле (н-гексан: этилацетат = 4:1) и получают целевое соединение (2,0 г, nD20 = 1,6198, выход 53%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 1,34 (3Н, триплет), 2,53 (2Н, квартет), 3,70, 3,80 (2Н, два квартета), 7,10-7,77 (8Н, мультиплет).
Препаративный пример 21
Получение
4-хлор-4'- дифторметилтиометилбензофенон-N'-метоксикарбонилгидразона (Соединение N I-187)
4-хлор-4'-меркаптометилбензофенон-N'- метоксикарбонил-гидразон (1,5 г) и гидроксид калия (1,5 г)
добавляют к смеси диоксана (30 мл) и воды (30 мл). Через полученную реакционную смесь барботируют дифторметилхлорид при температуре 40oC до тех пор, пока не исчезнет весь исходный
4-хлор-4'-меркаптометилбензофенон-N'-метоксикарбонилгидразон. Охлаждают реакционную смесь до комнатной температуры и отфильтровывают. Фильтрат сушат над безводным сульфатом магния и упаривают. Остаток
очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 4:1) и получают целевое соединение (0,3 г, nD20 = 1,6213, выход 18%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 3,78 (3Н, синглет), 3,88, 4,10 (2Н, два синглета) 6,7, 6,8 (1Н, два триплета), 7,07-7,67 (8Н, мультиплет), 7,77 (1H, синглет).
Препаративный пример 22
Получение 4-хлор-4'-метилтиометилбензофенон-N'- метоксикарбонилгидразона (Соединение N I-67)
4-Хлор-4'-гидроксиметилбензофенон-N'-метоксикарбонил-гидразон (1,
2 г) и триэтиламин (0,5 г) растворяют в тетрагидрофуране (30 мл). К полученному раствору по каплям при температуре минус 20oC добавляют хлор-бис(диэтиламинофосфин) (1,1 г). Смесь
перемешивают при комнатной температуре в течение 2 часов, а затем растворитель отгоняют при пониженном давлении. Добавляют ледяную воду и этилацетат и проводят жидкостную экстракцию. Органический слой
отделяют, сушат над безводным сульфатом магния и упаривают, получая фосфит. Полученный фосфит растворяют в тетрагидрофуране (30 мл) и к полученному раствору добавляют при температуре 0oC
диметилсульфид (0,8 г). Перемешивают при комнатной температуре в течение 12 часов, пока не израсходуется весь исходный фосфит, растворитель упаривают при пониженном давлении, а остаток очищают
колоночной хроматографией на силикагеле (н-гексан: этилацетат = 4:1) и получают целевое соединение (0,3 г, т.пл. 40-42oC, выход 17%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 1,93, 2,08 (3Н, два синглета), 3,67, 3,77 (2Н, два синглета), 3,8 (3Н, синглет) 7,1-7,67 (8Н, мультиплет), 7,85 (широкий сигнал).
Препаративный пример
23
Получение 4-хлор-4'-метилсульфонилметилбензофенона (Соединение N VI-3)
4-Бромметил-4'-хлорбензофенон (3,1 г) и метансульфинат натрия (1,5 г) добавляют к N,N-диметилформамиду (50
мл) и полученную смесь перемешивают при комнатной температуре в течение 16 часов. Добавляют воду и экстрагируют этилацетатом. Органические вытяжки промывают водой и сушат над безводным сульфатом
магния. Растворитель отгоняют при пониженном давлении, а остаток промывают н-гексаном и получают целевое соединение (2,8 г, т.пл. 164-166oC, выход 90%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,90 (3Н, синглет), 4,47 (2Н, синглет), 7,37-7,83 (8Н, мультиплет).
Препаративный пример 24
Получение-4-хлор-4'- этилсульфонилметилбензофенона (Соединение N VI-6)
Сульфит натрия (24,5 г) и бикарбонат натрия (33 г) растворяют в воде (200 мл). К полученному раствору при комнатной
температуре в течение 30 минут по каплям добавляют этансульфонилхлорид (25 г) и полученную смесь перемешивают в течение часа. Смесь упаривают и остаток суспендируют в N,N-диметилформамиде (200 мл). К
ней добавляют 4-бромметил-4'- хлорбензофенон (10,0 г) и перемешивают при комнатной температуре в течение 16 часов. Добавляют воду и экстрагируют этилацетатом. Органические вытяжки промывают водой и
сушат над безводным сульфатом магния. Этилацетат отгоняют при пониженном давлении, а остаток промывают н-гексаном и получают целевое соединение (7,5 г, т.пл. 117-118oC, выход 72%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 1,37 (3Н, триплет), 2,93 (2Н, квартет), 4,27 (2Н, синглет), 7,20-7,83 (8Н, мультиплет).
Препаративный пример
25
Получение 4-хлор-4'-этилтиометилбензофенона (Соединение N VI-4)
4-Хлор-4'-меркаптометилбензофенон (16,0 г), бромистый этил (7,4 г) и гидроксид калия (4,3 г) добавляют к метанолу
(250 мл) и полученную смесь кипятят с обратным холодильником в течение 30 минут. Охлаждают реакционную смесь до комнатной температуры и упаривают. Добавляют воду и экстрагируют этилацетатом.
Органические вытяжки промывают водой и сушат над безводным сульфатом магния. Этилацетат отгоняют при пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле (н-гексан:
этилацетат = 10:1) и получают целевое соединение (14,0 г, т.пл. 33-34oC, выход 79%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,23 (3Н, триплет), 2,45 (2Н, синглет), 3,75 (2Н, синглет), 7,10-7,80 (8Н, мультиплет).
Препаративный пример 26
Получение 4-хлор-4'-дифторметилтиометилбензофенона (Соединение N VI-15)
4-Хлор-4'-меркаптометилбензофенон (14,7 г) и гидроксид калия (15 г) добавляют к смеси диоксана (100 мл) и воды (100 мл). Через раствор барботируют дифторметилхлорид при температуре 60oC до
тех пор, пока не израсходуется весь исходный 4-хлор-4'-меркаптометилбензофенон. Реакционную смесь охлаждают до комнатной температуры и отфильтровывают. Органическую часть фильтрата сушат над безводным
сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 5:1) и получают целевое соединение (6,4 г, т.пл. 34-35oC, выход 36%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 4,03 (2Н, синглет), 6,69 (1Н, триплет), 7,15-7,71 (8Н, мультиплет).
Препаративный пример 27
Получение 4-хлор-4'- дифторметилсульфонилметилбензофенона (Соединение N VI-16)
4-хлор-4'-дифторметилтиометилбензофенон (3,2 г) и м-хлор-надбензойную кислоту (5,3 г) добавляют к хлороформу
(150 мл). Полученную суспензию перемешивают при кипячении с обратным холодильником в течение 3 часов. Упаривают, добавляют воду и экстрагируют этилацетатом. Органические вытяжки промывают водой и
сушат над безводным сульфатом магния. Этилацетат отгоняют при пониженном давлении, а твердый остаток промывают н-гексаном и получают целевое соединение (2,7 г, т.пл. 154-157oC, выход
78%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 4,57 (2Н, синглет), 6,41 (1Н, триплет), 7,27-7,87 (8Н, мультиплет).
Препаративный пример 28
Получение 4-хлор-4'-трифторметилтиометилбензофенона (Соединение N VI-12)
4-Хлор-4'-меркаптометилбензофенон (4,5 г) растворяют в тетрагидрофуране (150 мл). К полученному раствору
добавляют 60%-ный гидрид натрия (0,8 г) и смесь перемешивают при комнатной температуре в течение 30 минут. Добавляют S-(трифторметил)дибензотиофенийтрифторметансульфонат (6,4 г) и перемешивают еще в
течение 30 минут. Реакционную смесь упаривают, добавляют воду и экстрагируют этилацетатом. Органические вытяжки промывают водой и сушат над безводным сульфатом магния. Этилацетат отгоняют при
пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 4:1) и получают целевое соединение (2,0 г т.пл. 63-65oC, выход 35%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 4,14 (2Н, синглет), 7,30-7,77 (8Н, мультиплет).
Препаративный пример 29
Получение 4-хлор-4'-(1,1,2,
2-тетрафторэтил)тиометилбензофенона (Соединение N VI-20)
4-Хлор-4'-меркаптометилбензофенон (5,0 г) и трет-бутоксид калия (0,9 г) добавляют к этанолу (150 мл). Через полученный раствор при
комнатной температуре барботируют перфторэтилен (2,9 г), а затем смесь перемешивают в течение 16 часов. Реакционную смесь отфильтровывают и упаривают. Остаток очищают колоночной хроматографией на
силикагеле (н-гексан: этилаацетат = 4: 1) и получают целевое соединение (5,3 г, т.пл. 48-50oC, выход 77%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ) 4, 13 (2Н, синглет), 5,77 (1Н, дублет триплетов), 7,23-7,73 (8Н, мультиплет).
Препаративный пример 30
Получение 4-хлор-4'-метилтиометилбензофенона (Соединение N VI-1)
4-Бромметил-4'-хлорбензофенон (3,1 г) и 15%-ный водный раствор натриевой соли метилмеркаптана (5,8 г) добавляют к метанолу (150 мл) и полученную смесь кипятят при перемешивании с обратным
холодильником в течение 30 минут. Упаривают и остаток экстрагируют этилацетатом. Органические вытяжки промывают водой и сушат над безводным сульфатом магния. Этилацетат отгоняют при пониженном
давлении, а твердый остаток промывают н-гексаном и получают целевое соединение (2,3 г, т.пл. 59-61oC, выход 83%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,00 (3Н, синглет), 3,70 (2Н, синглет), 7,13-7,74 (8Н, мультиплет).
Препаративный пример 31
Получение 4-хлор-4'-метилсульфинилметилбензофенона (Соединение N
VI-2)
4-Хлор-4'-метилтиометилбензофенон (4,2 г) растворяют в метаноле (150 мл). Перйодат натрия (3,6 г) растворяют в воде (20 мл) и добавляют к полученному ранее раствору в метаноле.
Полученную смесь перемешивают при комнатной температуре в течение 16 часов. Упаривают, добавляют воду и экстрагируют этилацетатом. Органические вытяжки промывают водой и сушат над безводным сульфатом
магния. Этилацетат отгоняют при пониженном давлении, а твердый остаток промывают н-гексаном и получают целевое соединение (4,1 г, т. пл. 116-118oC, выход 93%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,50 (2Н, синглет), 4,00 (2Н, синглет) 7,30-7,80 (8Н, мультиплет).
Препаративный пример 32
Получение 4-(3-бромпропил)
сульфонилметил-4'-хлорбензофенона (Соединение N VI-11)
4-(3-Бромпропил)тиометил-4'-хлорбензофенон (5,1 г) и 31%-ный водный раствор пероксида водорода (6 г) растворяют в уксусной кислоте (200
мл) и полученную смесь перемешивают в течение часа при температуре 80oC, а затем один час кипятят с обратным холодильником. Упаривают, добавляют воду и экстрагируют этилацетатом.
Органические вытяжки промывают водным раствором карбоната и водой и сушат над безводным сульфатом магния. Этилацетат отгоняют при пониженном давлении, а твердый остаток промывают н-гексаном и получают
целевое соединение (5,0 г, т.пл. 105-107oC, выход 91%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,17-2,60 (2Н, мультиплет), 3,00-3,17 (2Н, мультиплет), 3,53 (2Н, триплет), 4,33 (2Н, синглет), 7,23-7,87 (8Н, мультиплет).
Препаративный пример 33
Получение 4-хлор-4'-(1,1-диоксотиолан-2-ил)бензофенона (Соединение N
VI-36)
4-(3-Бромпропил)сульфонилметил-4'-хлорбензофенон (2,5 г) и 60%-ный гидрид натрия (0,3 г) добавляют к N,N-диметилацетамиду (70 мл) и полученную смесь перемешивают в течение 16 часов при
комнатной температуре. Добавляют воду и экстрагируют этилацетатом. Органические вытяжки промывают водой и сушат над безводным сульфатом магния. Этилацетат отгоняют при пониженном давлении, а остаток
очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 1: 1) и получают целевое соединение в виде вязкого вещества желтоватого цвета (1,0 г, выход 50%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,67-2,73 (4Н, мультиплет), 2,87-3,33 (2Н, мультиплет), 4,02-4,37 (2Н, мультиплет), 7,23-7,97 (8Н, мультиплет).
Препаративный
пример 34
Получение 4-хлор-4'-(2-трифторметилсульфонилпропил)бензофенона (Соединение N VI-28)
4-Хлор-4'-трифторметилсульфонилметилбензофенон (3,3 г) и 60%-ный гидрид натрия (0,8 г)
добавляют к N,N-диметилацетамиду (70 мл) и полученную смесь перемешивают в течение часа при комнатной температуре. К полученному раствору добавляют йодистый метил и смесь перемешивают при комнатной
температуре в течение 16 часов, добавляют воду и экстрагируют этилацетатом. Органические вытяжки промывают водой и сушат над безводным сульфатом магния. Этилацетат отгоняют при пониженном давлении, а
остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 4:1) и получают целевое соединение (3,1 г, т.пл. 107-109oC, выход 86%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,00 (6Н, синглет), 7,20-7,70 (8Н, мультиплет).
Препаративный пример 35
Получение 4-хлор-4'-тиоцианатометилбензофенона
(Соединение N VI-35)
4-Бромметил-4'-хлорбензофенон (5,7 г) и тиоцианат натрия (5,5 г) добавляют к этанолу (50 мл) и полученную смесь перемешивают при температуре 60oC в течение
часа. Реакционную смесь упаривают, добавляют воду и экстрагируют этилацетатом. Органические вытяжки промывают водой и сушат над безводным сульфатом магния. Этилацетат отгоняют при пониженном давлении,
а остаток промывают смесью н-гексан: этилацетат = 10:1 и получают целевое соединение (2,2 г, т.пл. 129-131oC, выход 42%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 4,18 (2Н, синглет), 7,23-7,87 (8Н, мультиплет).
Препаративный пример 36
Получение диэтилового эфира 2-{4-(4-хлорбензоил)фенил}-2-трифторметилтиомалоновой кислоты
(Соединение N VI-80)
60%-ный гидрид натрия (0,5 г) диспергируют в тетрагидрофуране (150 мл) и при температуре 0oC по каплям при перемешивании добавляют диэтиловый эфир 2-{
4-(4-хлорбензоил)фенил}малоновой кислоты (4,4 г). По окончании выделения водорода через смесь при температуре 0oC барботируют трифторметилсульфенилхлорид, а затем перемешивают при комнатной
температуре в течение часа. Упаривают, к остатку добавляют воду и экстрагируют этилацетатом. Органические вытяжки промывают водой и сушат над безводным сульфатом магния. Этилацетат отгоняют при
пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 8:1) и получают целевое соединение (4,7 г, nD20 = 1,5362, выход
87%).
Данные ПМР спектроскопии (80 МГц, дейтерохлороформ, δ): 1,3 (6Н, триплет), 4,35 (4Н, квартет), 7,4 (2Н, дублет), 7,75 (2Н, дублет), 7,8 (4Н, синглет).
Препаративный пример 37
Получение 4-хлор-4'- трихлорметилтиометилбензофенона (Соединение N VI-81)
Метилбензофенон-4-хлор-4'-тиоцианат (5,5 г) и триэтилбензиламмонийхлорид (0,5 г)
диспергируют в хлороформе (30 мл) и к полученной смеси при температуре 40oC добавляют 48%-ный водный раствор гидроксида натрия. Перемешивают в течение 3 часов.
К полученной смеси добавляют воду и проводят жидкостную экстракцию. Органический слой промывают водой и сушат над безводным сульфатом магния. Хлороформ отгоняют при пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 9:1) и получают целевое соединение (1,0 г, т.пл. 103-105oC, выход 13%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 4,4 (2Н, синглет), 7,15-7,8 (8Н, мультиплет).
Препаративный пример 38
Получение 4-хлор-4'- трифторметилсульфонилметилбензгидрола (Соединение N
VIII-2)
4-Хлор-4'-трифторметилсульфонилметилбензофенон (5,5 г) диспергируют в метаноле (200 мл). Порциями при перемешивании при комнатной температуре добавляют боргидрид натрия и оставляют
смесь перемешиваться на ночь при комнатной температуре. По окончании реакции метанол отгоняют при пониженном давлении и остаток экстрагируют этилацетатом (250 мл). Экстракт промывают водой и сушат над
безводным сульфатом магния. Этилацетат отгоняют при пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 2:1) и получают целевое соединение в виде
порошка белого цвета (4,2 г, т.пл. 113-115oC, выход 77%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 4,7 (2Н, синглет), 5,77 (2Н, синглет), 7,3 (4Н, синглет), 7,47 (4Н, синглет).
Препаративный пример 39
Получение 4-хлор-4'-этансульфонилметилбензгидрилхлорида (Соединение N VIII-5)
Смешивают
4-хлор-4'-этансульфонилметилбензгидрол (6,0 г), хлористый тионил (5,4 г), толуол (200 мл) и каталитическое количество N,N-диметилфopмaмидa и постепенно при перемешивании нагревают до температуры
кипения. Смесь кипятят с обратным холодильником в течение 4 часов и дают остыть. Растворитель отгоняют при пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле (н-гексан:
этилацетат = 2:1) и получают целевое соединение в виде вязкого вещества желтоватого цвета (4,6 г, nD20 = 1,6064, выход 75%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 1,33 (3Н, триплет), 2,88 (2Н, квартет), 4,37 (2Н, синглет), 6,05 (1Н, синглет), 7,27 (4Н, синглет), 7,35 (4Н, синглет).
Препаративный пример 40
Получение (6-хлор-3-пиридил) (4-трифторметилфенил)кетон (Соединение N VII-3)
(6-Хлор-3-пиридил) (4-тиоцианатметилфенил)кетон (5,0 г) растворяют в тетрагидрофуране (300 мл) и при
комнатной температуре добавляют трифторметилтриметилсилан (5,0 г). Смесь охлаждают до 5oC и по каплям при охлаждении добавляют тетрабутиламмонийфторид (1,0 М раствор в тетрагидрофуране, 23
г), а затем смесь оставляют перемешиваться на ночь. Тетрагидрофуран отгоняют при пониженном давлении и остаток экстрагируют этилацетатом. Экстракт промывают водой и сушат над безводным сульфатом
магния. Этилацетат отгоняют при пониженном давлении, а остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 4: 1) и получают целевое соединение (2,0 г nD20 = 1,5820, выход 35%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 4,15 (2Н, синглет), 7,4 (3Н, дублет дублетов), 7,72 (2Н, дублет дублетов), 8,05 (2Н, дублет дублетов), 8,67 (2Н, дублет).
Препаративный пример 41
Получение 4-хлор-4'-гидроксиметилбензофенон-N'- метоксикарбонилгидразона (Соединение N IХ-1)
4-Хлор-4'-гидроксиметилбензофенон (0,5 г) и метилкарбазат (0,4 г) добавляют к смеси этанола (60 мл) и уксусной кислоты (5 мл) и полученную смесь кипятят при перемешивании с обратным холодильником.
Реакционную смесь упаривают при пониженном давлении и остаток экстрагируют этилацетатом. Экстракт промывают водой и сушат над безводным сульфатом магния. Этилацетат отгоняют при пониженном давлении, а
остаток очищают колоночной хроматографией на силикагеле (н-гексан: этилацетат = 4:1) и получают целевое соединение (0,5 г, выход 83%).
Данные ПМР спектроскопии (60 МГц, дейтерохлороформ, δ): 2,17 (2Н, широкий сигнал), 3,77 (3Н, синглет), 4,63, 4,73 (2Н, два синглета), 6,97-7,63 (8Н, мультиплет), 7,73 (1Н, широкий сигнал).
Когда соединение по настоящему изобретению предполагается использовать в качестве активного компонента пестицида, его можно использовать индивидуально, однако его можно приготовить в виде различных композиций, таких как способный эмульгироваться концентрат, суспензия, дуст, гранула, таблетка, способный смачиваться порошок, растворимый в воде концентрат, раствор, подвижная (текучая) суспензия, способная диспергироваться в воде гранула, аэрозоль, паста, композиция в масле, концентрированная эмульсия в воде, в сочетании с различными носителями, поверхностно-активными веществами и другими вспомогательными соединениями, которые обычно используются в композициях для получения применяемых в сельском хозяйстве препаратов. Обычно их смешивают в такой пропорции, чтобы содержание активного ингредиента составляло от 0,1 до 90 весовых частей, а содержание применяемого в сельском хозяйстве вспомогательного ингредиента составляло от 10 до 99,9 весовых частей.
Носители, которые используются в указанных композициях, можно разделить на твердые носители и жидкие носители. Твердые носители включают, например, порошки животного и растительного происхождения, такие как крахмал, активированный уголь, соевая мука, пшеничная мука, древесный порошок, рыбная мука и порошковое молоко, и минеральные порошки, такие как тальк, каолин, бентонит, карбонат кальция, цеолит, диатомовая земля, тонкодисперсный порошок оксида кремния, глины и оксида алюминия. Жидкие носители включают, например, воду, спирты, такие как изоропиловый спирт и этиленгликоль, кетоны, такие как циклогексанон и метилэтилкетон, простые эфиры, такие как диоксан и тетрагидрофуран, алифатические углеводороды, такие как керосин и легкое масло, ароматические углеводороды, такие как силол, триметилбензол, тетраметилбензол, метилнафталин и лигроин, галогенсодержащие углеводороды, такие как хлорбензол, амиды кислот, такие как диметилацетамид, сложные эфиры, такие как эфиры глицерина с жирными кислотами, нитрилы, такие как ацетонитрил, и серусодержащие соединения, такие как диметилсульфоксид.
Поверхностно-активные вещества включают, например, соли алкилбензолсульфокислот с металлами, соли динафтилметандисульфокислот с металлами, сложные эфиры спиртов с серной кислотой, алкиларилсульфонаты, лигнинсульфонаты, эфиры полиоксиэтиленгликоля, алкилариловые эфиры полиоксиэтилена и моноалкиловые эфиры сорбита и полиоксиэтилена.
Другие вспомогательные соединения включают, например, адгезивы или загустители, такие как карбоксиметилцеллюлоза, гуммиарабик, аригнат натрия, смолу гуара, смолу траганта или поливиниловый спирт, пеногасители, такие как содержание металл мыла, агенты, модифицирующие физические свойства, такие как жирная кислота, алкилфосфат, кремнийорганическое соединение или парафин, и краситель.
Когда указанные составы используются на практике, их можно применять в том виде, в каком они приготовлены, или же их можно разбавить до определенной концентрации с помощью разбавителя, такого как вода. Различные композиции, содержащие соединения по настоящему изобретению, или их разбавленные растворы можно применять, используя обычные способы, т.е. методы нанесения (такие как разбрызгивание, распыление до туманообразного состояния, получение аэрозоля, нанесение в виде дуста, применение гранул, добавление в воду, применяемую для полива риса, или обработка в парнике), обработку почвы (такую как смешивание или орошение), нанесение на поверхность (в виде слоя, в виде удобрения или создание оболочки), обмакивание или приготовление приманок с ядом. Далее, указанный выше активный компонент можно вносить в виде добавок к еде домашних животных, так что заражение вредителями или рост вредителей, в частности вредных насекомых, можно подавить с помощью экскрементов животных. Кроме того, активные соединения можно применять, используя небольшие объемы так называемых сверхвысоких концентраций соединений, при этом содержание активных компонентов может достигать 100%.
В пестицидах по настоящему изобретению концентрация активного ингредиента составляет обычно от 0,1 до 50000 частей на миллион, предпочтительно от 1 до 10000 частей на миллион.
Концентрацию активного ингредиента можно изменять в зависимости от цели, времени года или места нанесения и степени поражения вредителями. Например, в случае живущих в воде вредителей их можно контролировать, внося в пораженное место композицию, содержание активного ингредиента в которой находится в указанных выше пределах, а потому содержание активного вещества в воде будет меньше, чем в указанных ранее пределах. Доза на единицу площади обычно составляет от 0,1 до 5000 г активного соединения на гектар, предпочтительно от 1 до 1000 г активного соединения на гектар. Однако доза может не ограничиваться указанным интервалом.
Соединения по настоящему изобретению достаточно активны, когда их используют индивидуально. Однако, если необходимо, их можно использовать в сочетании или в смеси с удобрениями или другими используемыми в сельском хозяйстве химическими соединениями, такими как пестициды, акарициды, нематициды, фунгициды, антивирусные агенты, атрактанты, гербициды или регуляторы роста растений, при этом за счет подобных сочетаний можно в некоторых случаях добиться дальнейшего улучшения.
Типичные примеры инсектицидов, фунгицидов и акарицидов, которые могут использоваться в сочетании с соединениями по настоящему изобретению, будут указаны далее.
Фосфорорганические соединения и карбаматные инсектициды: фентион, фенитротион, диазион, хлорпирифос, оксидепрофос, вамидотион, фентоат, диметоат, формотион, малатион, трихлорфон, тиометон, фосмет, дихлорвос, ацефат, O-2,4-дихлорфенил O-этилфенилфосфонотиоат, метилпаратион, оксидеметон-метил, этион, диоксабензофос, цианофос, изоксатион, пиридафентион, фозалон, метидатион, сульпрофос, хлорфенвинфос, тетрахлорвинфос, диметилвинфос, пропафос, изофенфос, дисулфотон, профенофос, пираклофос, монокротофос, азинфосметил, алдикарб, метомил, тиодикарб, карбофуран, карбосулфан, бенфуракарб, фуратиокарб, пропоксур, фенобкарб, метолкарб, изопрокарб, карбарил, пиримикарб, этиофенкарб, дихлорфентион, пиримифос-метил, хиналфос, хлорпирифос-метил, протиофос, налед, бендиокарб, оксамил, аланикарб, хлорэтоксифос и т.д.
Пиретроидные инсектициды: перметрин, циперметрин, дельтаметрин, фенвалерат, фенпропатрин, пиретрин, аллетрин, тетраметрин, разметрин, диметрин, пропартрин, фенотрин, протриан, флувалинат, цифлутрин, цигалотрин, флуцитринат, этофенпрокс, циклопротрин, тралометрин, силфлуофен, тефлутрин, бифентрин, акринатрин и т.п.
Инсектициды типа ацилмочевины и другие инсектициды: дифлубензурон, хлорфлуазурон, гексафлумурон, трифлумурон, тефлубензурон, флуфеноксурон, флуциклосурон, бупрофезин, пирипроксифен, луфенурон, циромазин, метопрен, эндосульфан, диафентриурон, имидаклоприд, фипронил, никотин-сульфат, ротенон, метальдегид, машинное масло, феноксикарб, картап, тиоциклам, бенсультап, тебуфенозид, хлорфенапир, эмамектин-бензоат, ацетамиприд, нитенпирам, пиметрозин, олеат натрия, рапсовое масло и т.п.
Нематициды: фенамифос, фостиазат, этопрофос, метилизо-тиоцианат, 1,3-дихлорпропен, DCIP и т.п.
Акарициды: хлорбензилат, фенизобромолат, дикофол, амитраз, пропаргинт, бензомат, гекситиазокс, фенбутатиноксид, полинактинз, хинометионат, хлорфензол, тетрадифон, авермектин, милбемектин, клофентезин, пиридабен, фенпироксимат, тебуфенпирад, пиримидифен, фенотиокарб, диенохлор, этоксазол, халфенпрокс и т.п.
Фунгициды: тиофанат-метил, беномил, карбендазол, тиабен-дазол, фолпет, тиурам, дирам, зинеб, манеб, манзеб, поликарбамат, ипробенфос, эдифенфос, фталид, пробеназол, изопротиолан, хлороталонил, каптан, полиоксин, бластицидин-S, касугамицин, стрептомицин, валидамицин, трициклазол, пирохилон, феназиноксид, мепронил, флутоланил, пенцикурон, ипродион, химексазол, металаксил, трифлумизол, трифорин, триадимефон, битетанол, фенаримол, пропиконазол, цимоксанил, прохлораз, пефуразоат, гексаконазол, миклобутанил, дикломезин, теклофталам, пропинеб, дитианон, прозетил, винклозолин, процимидон, оксадицил, гуазатин, пропамокарбгидрохлорид, флуазинам, оксолиновая кислота, гидроксиизоксазол, имибенконазол, дифеноконазол, мепанипирам.
Соединения по настоящему изобретению проявляют превосходную пестицидную активность по отношению к таким вредителям, как полукрылые насекомые, чешуекрылые насекомые, жесткокрылые насекомые, двукрылые насекомые, перепончатокрылые насекомые, прямокрылые насекомые, равнокрылые насекомые, насекомые, у которых чешуйками покрыта лишь часть крыла, клещи и паразитирующие на растениях нематоды. Среди них можно назвать следующих вредителей.
Полукрылые насекомые: клопы (Heteroptera), такие как бобовый клоп (Riptortus clavatus), южный зеленый клоп-щитник (Nezara viridula), клопы семейства Lygus sp. , клоп белокрылый (Blissus leucopterus) и клоп грушевый (Stepha nitis nashi); толстоголовки (Circulifer sp), такие как зеленая рисовая толстоголовка (Nephotettix cincticeps) и толстоголовки вида Enpoasca sp. , Erythroneura sp. circuligfer sp.; дельфациды (Delphacidae), такие как коричневая рисовая дельфацида (Nilaparvata lugens), белокрылая дельфацида (Sogatella furcifera) и малая коричневая дельфацида (Laodelphax striatellus); прыгающие растительные блохи (Psyllidae), такие как листоблошки (Psylla sp. ); белокрылки (Aleyrodidae), такие как картофельная белокрылка (Bemisia tabaci) и тепличная белокрылка (Trialeurodes vaporariorum); тли (Aplididae), такие как виноградная блошка (Viteus vitifolii), тля персиковая (Myzus persicae), яблочная тля (Aphis pomi), хлопковая тля (Aphis gossypii), Aphis fabae, тля ложнокапустная (Rhopalosiphum psedodrassicas), тепличная картофельная тля (Aulacorthuim solani) и тля злаковая обыкновенная (Schizaphis graminum), червецы мучнистые или щитовки, такие как червецы семейства Pseudococcus comstocki, красная восковая шитовка (Ceroplastes rubens), щитовка калифорнийская (Comstockaspis perniciosa) и восточная цитрусовая щитовка (Unaspis yanonensis).
Чешуекрылые насекомые: листовертки (Tortricidae), такие как листовертка восточная чайная (Homona magnanima), летняя листовертка плодовых деревьев (Adoxphyes orana), листовертки семейства Sparganothis pilleriana, листовертка восточная персиковая (Grapholitha molesta), бобовый точильщик (Leguminivora glycinivorella), плодожорка яблонная (Laspeyresia pomonella), листовертки семейства Eucosma sp. и виноградная листовертка (Lobesia botrana); слизни, такие как виноградный слизень (Eupocillia ambiquella); мешочницы (Psychidae), такие как мешочницы вида Bambalina sp.; моли (Tineidae), такие как европейская зерновая моль (Nemapogon granellus) и платяная моль (Tinea translucens); моли семейства Lyonetiidae; такие как Lyonetia prunifoliella; пестрянки, такие как моль яблонная листовая (Phyllonorycter rigoniello); Phyllocnistidae, такие как моль цитрусовая (Phyllocnistis cetrella); ипонометиды, такие как моль капустная (Plutella xyloctella) и ипонометидная моль (Prays citri): стеклянницы (Synanthedon sp.), такие как виноградная моль (Paranthene regalis) и стеклянницы семейства Synanthedon sp., моли семейства Gelechiidae, такие как розовый коробочный червь хлопчатника (Pectinophora gossypiella), картофельный клубневый червь (Phthorimaea operculella) и Stomopteryx sp., Carposinidae, такие как листовертка персиковая (Carposina niponensis); слизневые ложногусеничные листовертки, такие как слизневка восточная (Моnema flavescens); пиралидные моли, такие как огневка стеблевая рисовая (Chilo suppressalis), листовертка рисовая (Cnaphalocrocis medinalis), мотылек кукурузный европейский (ostrinia nubilalis), мотылек кукурузный восточный (Ostrinia furnacalis), огневка капустная (Hellula undalis), моль большая восковая (Galleria mellonella), малый мотылек кукурузный (Elasmopalpus lignosellus) и мотылек луговой (Loxostege sticticalis); белянки, такие как обычные гусеницы капустной белянки (Pieris rapae); геометридные моли, такие как полынная пяденица (Ascotis selenaria); гусеницы коконопрядов, таких как коконопряды вида Malacosoma neustria, бражники, такие как бражник табачный (Manduca sexta), волнянки, такие как волнянка чайная (Euproctis pseudoconspersa) и непарный шелкопряд (Lymantria dispar); медведицы, такие как американская белая бабочка (Hyphantria cunea); совки, такие как совка табачная (Heliothis virescens), совка хлопковая (Helicoverpa zea), свекловичный ратный червь (Spodoptera exigua), совка хлопковая (Helicoverpa armigera), совка обычная (Spodoptera litura), капустный ратный червь (Mamestra brassicae), совка ипсилон (Agrotis ipsilon), рисовый ратный червь (Pseudaletia separata) и совка ни (Trichoplusia ni).
Жесткокрылые насекомые: хрущи, такие как медный хрущ (Anomala cuprea), хрущик японский (Popillia japonica), соевый хрущик (Anomala rufocuprea) и Eutheola rugiceps; жуки-щелкуны (Conodeus sp.,), такие как личинки щелкуна видов Agriotes sp. и Conodeus sp.; божьи коровки, такие как двадцативосьмипятнистая божья коровка (Epilachna viginticetopunetata), и мексиканская божья коровка (Epilachna varivestis); чернотелки, такие как красно-коричневый хрущик рисовый (Tribolum castaneum); длиннорогие жуки, такие как бело-пятнистый длиннорогой жук (Anoplophora malasiaca) и усач черный (Monochamus alternatus); семенные жучки, такие как долгоносик фасоли (Acanthoscelides obtectus) и лучистый долгоносик фасоли (Callosotruchus chinensis); листоеды, такие как (Leptinotarsa decemlineata), блошка длинноусая (Diabrotica sp.), листоед рисовый (Oulema oryzae), свекловичный листоед мелкий (Chaetocnema concinna), горчичный жук (Phaedon cochlearias), злаковый листоед (Oulema melanopus) и листоеды семейства Dicladispa armigere Apionidae, такие как Apion godmani; долгоносики, такие как долгоносик рисовый (Anthonomus grandis); Rhynchophoridae, такие как долгоносик кукурузный (Sitophilus zeamais); короеды; трогиды; точильщик хлебный.
Двукрылые насекомые: долгоножка рисовая (Tipra ano), галлица рисовая (Tanytarsus oryzae), Orseolia oryzae, Ceratitis capitata, моль рисовая (Hydrellia griseola), дрозофила вишневая (Drosophila suzukii), мушка шведская (Oscinella frit), рисовая стеблевая личинка (Chlorops oryzae), бобовая минирующая мушка (Ophiomyia phascoli), моль бобовая (Liriomyza trifolii), муха свекловичная (Pegomya hyoscyami), личинка кукурузная (Hylemia platura), мушка сорго (Atherigona soccata), муха настоящая (Musca domestica), Gastrophilus sp. , мухи семейства Stomoxys sp., Aedes aegypti, Culex pipiens, Anopheles slensis и Culex tritaeniorhynohus.
Перепончатокрылые насекомые: хлебные пилильщики (Cephus sp.), эвритомиды (Harmolita sp. , ), пилильщик капустный (Athalia sp.), шершни (Vespa sp.) и муравей Рихтера.
Прямокрылые насекомые: таракан рыжий (Blatella germanica); таракан американский (Periplaneta americana); медведка (Gryllotapla africana); саранча перелетная (Locusta migratoria migratoriodes); и Melanoplus sanguinipes.
Термитные насекомые: термиты вида Reticulitermes speratus и Coptotermes formosanus.
Пузыреногие насекомые: желтый чайный трипc (Scirtothrips dorsalis); трипс вида Trips palmi; тепличный трипс (Heliothrips haemorrholidalis); цветочный трипс (Frankliniella occidentalis) и мохнатый трипс рисовый (Harlothrips aculeatus).
Клещи: клещик паутинный двупятнистый (Tetranychus urticae), клещик паутинный (Tetranychus kanzawai); клещик красный цитрусовый (Panonychus citri); клещ красный европейский (Panonychus ulmi), желтый паутинный клещик (Eotetranychus carpini), техасский цитрусовый клещик (Phyllocoptruta oleivora); клещик Polyhagotarsonemus latus); клещики паутинные ложные (Brevipalpus sp.): клещик корневой (Rhizoglyphus robini) и клещик плесневый (Tyrophagus putrescentiae).
Нематоды, паразитирующие на растениях: южная корневая нематода (Meloidogyne incognita); корневая нематода (Pratylenchus sp.); соевая циста (Heterodera glycines); рисовая белая нематода (Aphelenchoides besseyi) и нематода сосновая (Bursaphelenehus xylophilus).
Другие вредители и паразиты: Gastropoda, такие как улитка яблонная (Pomacea canaliculata), слизни (Incilaria sp.) и ахатина (Achatina fulica); мокрицы (Isopoda), такие как равноногие и многоногие мокрицы; вши (Liposcelis sp.); Ctenolepisma sp.; Pulex sp.; Trichodectes sp.; Cimex sp.; клещи, паразитирующие на животных, такие как Boophilus microplus, Aemaphysalis longicornis и Epidermoptidae.
Далее, соединения по настоящему изобретению эффективны также против вредителей, которые устойчивы к действию фосфорорганических соединений, карбаматных соединений, синтетических пиретроидных соединений, производных ацилмочевины или обычных инсектицидов.
Так, соединения по настоящему изобретению проявляют превосходную пестицидную активность по отношению к широкому кругу вредителей, включая полукрылых насекомых, чешуекрылых насекомых, жесткокрылых насекомых, двукрылых насекомых, перепончатокрылых насекомых, прямокрылых насекомых, равнокрылых насекомых, насекомых, у которых чешуйками покрыта лишь часть крыла, клещей и паразитирующих на растениях нематод, а также способны контролировать вредителей, которые приобрели устойчивость к действию обычных пестицидов.
Далее подробно рассматриваются способы приготовления составов с использованием Примеров композиций. Однако следует понимать, что типы и пропорции соединений и вспомогательных веществ не ограничиваются этими конкретными примерами и могут варьировать в широких пределах. В приведенных примерах "%" означают весовые проценты.
Пример композиции 1: Способный эмульгироваться
концентрат
30% соединения (I-22), 20% циклогексанона, 11% арилалкилового эфира полиоксиэтилена, 4% алкилбензолсульфоната кальция и 35% метилнафталина растворяют до образования однородной
массы и получают способный эмульгироваться концентрат.
Пример композиции 2: Способный смачиваться порошок
10% соединения (I-22), 0,5% натриевой соли продукта конденсации
нафталинсульфокислоты и формалина, 0,5% алкиларилового эфира полиоксиэтилена, 24% диатомовой земли и 65% глины смешивают до образования однородной массы и тонко измельчают, получая способный
смачиваться порошок.
Пример композиции 3: Дуст
2% соединения (I-22), 5% диатомовой земли и 93% глины смешивают до образования однородной массы и тонко измельчают, получая
дуст.
Пример композиции 4: Гранулы
5% соединения (I-22), 2% натриевой соли лаурилсульфата, 5% лигнинсульфоната натрия, 2% карбоксиметилцеллюлозы и 86% глины смешивают до
образования однородной массы и тонко измельчают. 100 весовых частей полученной смеси формуют с 20 весовыми частями воды и с помощью гранулятора экструзионного типа готовят гранулы размером от 14 до 32
меш, которые сушат и получают конечную композицию в виде гранул.
Далее действие композиций, содержащих в качестве активных ингредиентов соединения по настоящему изобретению, будет показано с использованием Примеров испытаний. Соединения для сравнения а и b представляют собой соединения, приведенные в Примере 165 и Примере 6 не прошедшей экспертизу патентной публикации Японии N 122261/1979; соединение для сравнения с представляет собой соединение, приведенное в Примере 88 не прошедшей экспертизу патентной публикации Японии N 45452/1981; а соединение для сравнения d представляет собой соединение, приведенное в Примере 6 патента США 3732307. Из указанных сравнительных соединений получают композиции аналогично композициям, приготовленным из соединений по настоящему изобретению.
Сравнительное соединение а: 4-хлор-4'-изопропилтиобензофенон-N'-этоксикарбонилгидразон.
Сравнительное соединение b: 4-хлор-4-пропилсульфонилбензофенон-N'-пропионилгидразон.
Сравнительное соединение с: 4-хлор-4'-метилсульфинилбензофенон-N'-этоксикарбонилгидразон.
Сравнительное соединение d: 4-трифторметилбензофенон-гидразон.
Пример испытаний 1. Инсектицидный тест против моли капустной
Способный смачиваться порошок, полученный по Примеру композиции
2, разбавляют водой таким образом, чтобы концентрация активного ингредиента составила 500 частей на миллион. Листья капусты погружают в полученный разбавленный раствор, сушат на воздухе и помещают в
чашку из поливинилхлорида. В чашку выпускают личинки капустной моли и чашку закрывают сверху крышкой. Затем чашку на 6 дней помещают в термостатируемую камеру с температурой 25oC и
подсчитывают количество умерших насекомых, с целью определить процент смертности по формуле (A). Полученные результаты приведены в табл. 36. Проводят два последовательных эксперимента.

Пример испытаний 2. Инсектицидный тест против рисовой дельфациды
Способный смачиваться порошок, полученный по Примеру композиции 2, разбавляют водой таким образом, чтобы концентрация активного ингредиента составила 500 частей на миллион. В полученный разбавленный раствор погружают стебли и листья риса, которые затем сушат на воздухе и помещают в пробирку. В пробирку выпускают 5 личинок коричневой рисовой дельфациды и отверстие пробирки затыкают пористым веществом. Затем пробирку на 6 дней помещают в термостатируемую камеру с температурой 25oC и подсчитывают количество умерших насекомых, с целью определить процент смертности по формуле (A). Проводят два последовательных эксперимента. Полученные результаты приведены в табл. 37.
Пример испытаний 3. Инсектицидный тест против долгоносика лучистой фасоли
Способный смачиваться
порошок, полученный по Примеру композиции 2, разбавляют водой до концентрации 100 частей на миллион. 0,75 мл полученного разбавленного раствора наносят в виде капель на фильтровальную бумагу диаметром
6 см, которую помещают в чашку из поливинилхлорида емкостью 60 мл. В чашку выпускают пять взрослых самок долгоносика лучистой фасоли и чашку закрывают крышкой. Затем чашку на 4 дня помещают в
термостатируемую камеру с температурой 25oC и подсчитывают количество умерших насекомых с целью определить процент смертности по формуле (A). Проводят два последовательных эксперимента.
Полученные результаты приведены в табл. 38.
Реферат
Изобретение относится к бензилсульфидам формулы I или его солям, где R1 - (C1-C6)алкил, (С1-С4)цианоалкил, (С1-С4)гидроксиалкил, (С3-С6)циклоалкил, (С1-С6)галогеналкил, бензил, который может быть замещен галогеном, тиазолил; R2 и R3 независимо - Н, (С1-С4)алкил либо R1 и R2 совместно с атомом серы и углерода образуют 3-8-членное кольцо; R4 - H, галоген; А - гидразиноаралкильная или гидразоноаралкильная группа формул А1 или A2; R9 - H, галоген, NO2, CN, (C1-C4)алкил, (C1-C4)галогеналкил, (С1-С4)алкокси, (С1-С4)галогеналкокси, (С1-C4)алкилтиo, (С1-С4)галогеналкилтио, (C2-C4)алкилсульфонилметил, (С1-С4)галогеналкилсульфонилокси, фенил, который может быть замещен галогеном, фенокси, который может быть замещен галогеном; R10 - H; R11, R12, R13 независимо - H, (C1-C6)алкил, (С1-С4)галогеналкил, (С2-С10)алкоксиалкил, (С3-С8)алкоксиалкоксиалкил, (С2-С6)алкилтиоалкил, (С1-С4)цианоалкил, бензил, который может замещен галогеном, (С1-С4)галогеналкилом, (С1-C4)алкилом, -COR14, -COOR15, -СОN(R16)R17, -SO2R20, -С(R21)= HR22; или R12 и R13 вместе могут образовывать группу формулы = CR23R24; R14 - (C1-C20)алкил, (С1-C8)галогеналкил, (C2-C12)алкоксиалкил, (C2-C6)алкилтиоалкил, (C3-C6)циклоалкил, (C1-C6)гидроксиалкил и др.; R15 - (С1-C20)алкил, (С2-С8)галогеналкил, (С2-С12)алкоксиалкил, фенил; R16 - H, (С1-С4)алкил; R17 - H, (С1-С6)алкил, фенил, который может быть замещен; R20 - (C1-C4)галогеналкил, (С2-С4)диалкиламино; R21 - (С1-С6)алкил; R22 - ацил, (С2-С6)алкоксикарбонил; R23, R24 независимо - H, галоген, (С1-С6)алкил, -NR25R26; R25 и R26 независимо - H, (С1-С4)алкокси, (С2-С12)алкоксиалкил; Q1 и Q2 - азот или -CR9, m = 1 - 3, n = 0, 1, 2. 9 с.п. ф-лы, 38 табл.
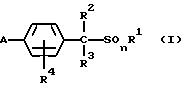
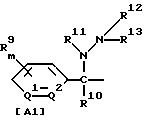
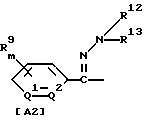
Формула
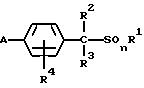
или его соль,
где R1 обозначает (С1-С6)алкильную группу, (С1-С4)цианоалкильную группу, (С1-С4)гидроксиалкильную группу, (С3-С6)циклоалкильную группу, (С1-С6)галогеналкильную группу, бензильную группу (которая может содержать в качестве заместителей атом галогена), тиазолильную группу;
R2 и R3 каждый независимо друг от друга обозначает атом водорода или (С1-С4)алкильную группу либо R2 и R1 совместно с атомами серы и углерода, к которым они соответственно присоединены, могут образовывать кольцо, включающее 3-8 членов;
R4 - атом водорода или атом галогена;
А - гидразиноаралкильная или гидразоноаралкильная группа формулы (А1) или (А2)
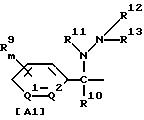
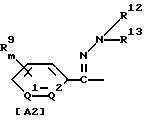
где R9 - атом водорода, атом галогена, нитрогруппа, цианогруппа, (С1-С4)алкильная группа, (С1-C4)гaлoгeнaлкильная группа, (С1-С4)алкоксигруппа или (С1-С4)галогеналкоксигруппа, (С1-С4)алкилтиогруппа, (С1-С4)галогеналкилтиогруппа, (C2-C4)алкилсульфонилметильная группа, (С1-С4)галогеналкилсульфонилоксигруппа, фенильная группа (которая может содержать в качестве заместителя атом галогена) или феноксигруппа (которая может содержать в качестве заместителя атом галогена);
R10 - атом водорода;
R11 - R13 каждый независимо обозначает атом водорода, (С1-С6)алкильную группу, (С1-С4)галогеналкильную группу, (С2-С10)алкоксиалкильную группу, (С3-С8)алкоксиалкоксиалкильную группу, (С2-С6)алкилтиоалкильную группу, (С1-С4)цианоалкильную группу, бензильную группу (которая может содержать в качестве заместителя атом галогена, (С1-С4)галогеналкильную группу или (С1-С4)алкильную группу), группу формулы -COR14, группу формулы -COOR15, группу формулы -CON(R16)R17, группу формулы -SO2R20 или группу формулы -C(R21)= HR22, или R12 и R13 вместе могут образовывать группу формулы = CR23R24, R14 обозначает (С1-С20)алкильную группу, (С1-С8)галогеналкильную группу, (С2-С12)алкоксиалкильную группу, (С2-С6)алкилтиоалкильную группу, (С3-С6)циклоалкильную группу, (С1-С6)гидроксиалкильную группу, (С1-С8)цианоалкильную группу, (С2-С6)алкенильную группу, (С2-С4)алкинильную группу, фенильную группу (которая может содержать в качестве заместителя атом галогена, нитрогруппу, (С1-С4)алкильную группу, (С1-С4)галогеналкильную группу, феноксигруппу или (С1-С4)алкоксигруппу, нафтильную группу или группу фурила, тиенила, пиридила (которые могут содержать в качестве заместителя атом галогена); R15 обозначает (С1-С20)алкильную группу, (С2-С8)галогеналкильную группу, (С2-С12)алкоксиалкильную группу, или фенильную группу; R16 - атом водорода или (С1-С4)алкильная группа; R17 обозначает атом водорода, (С1-С6)алкильная группа или фенильную группу (которая может содержать в качестве заместителя атом галогена, (С1-С4)галогеналкоксигруппу или (С1-С4)алкильную группу); R20 - (С1-С4)галогеналкильная группа или (С2-С4)диалкиламиногруппа; R21 - (С1-С6)алкильная группа; R22 - ацильная группа или (С2-С6)алкоксикарбонильная группа; R23 и R24 каждый независимо друг от друга - атом водорода, атом галогена, (С1-С6)алкильная группа или группу формулы -NR25R26, где R25 и R26 каждый независимо друг от друга - атом водорода, (С1-С4)алкильная группа, (С1-С4)алкоксигруппа, (С-С12)алкоксиалкильная группа;
Q1 и Q2 каждый - атом азота или группа формулы -CR9;
m - 1, 2, 3;
n = 0, 1 или 2.
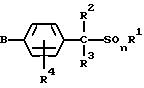
где значения R1 - R4 и n указаны в п.1;
B - аралкильная или арилкарбонильная группа формулы (В1) или (В2)
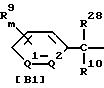
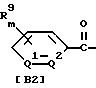
где значения R9, R10, m, Q1 и Q2 указаны в п.1;
R28 - атом галогена или гидроксильная группа.
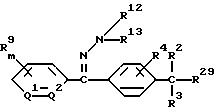
где значения R4, R9, m указаны в п.1;
R2 и R3 каждый - атом водорода;
R29 - атом галогена, меркаптогруппа или гидроксильная группа;
R12 и R13 независимо - водород или COOR15, где R15-(C1-С2) алкил;
Q1 и Q2 представляют собой CR9.
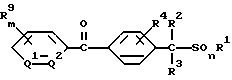
где значения радикалов приведены выше,
с соединением формулы Vl
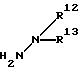
где значения R12 и R13 указаны выше.
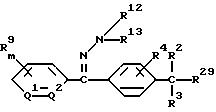
где эгачения R2, R3, R4, R9, R12, R13, m, Q1 и Q2 указаны в п.3;
R29 - атом галогена,
с соединением формулы (V2)
Z-R1,
где Z - группа -S(O)nM,
R1 - (C1-C6)aлкильная группа, (С1-С4)цианоалкильная группа (C3-C6)-циклoaлкильная группа, (С1-С6)галогеналкильная группа или бензильная группа (которая может содержать в качестве заместителя атом галогена);
М - щелочной металл;
n = 0 или 2.
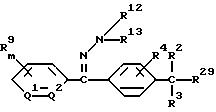
где значения R2, R3, R4, R9, R12, R13, m, Q1 и Q2 указаны в п.3;
R29 - меркаптогруппа,
с соединением формулы (V2)
Z-R1,
где Z - атом галогена, (C1-C4 ) алкилсульфонилоксигруппа или бензолсульфонилоксигруппа (которая может содержать в качестве заместителя метильную группу), а R1 - (С1-С6)алкильная группа, (С1-С4)цианоалкильная группа (С3-С6)-циклоалкильная группа (С1-C6)галогеналкильная группа или бензильная группа (которая может содержать в качестве заместителя атом галогена).
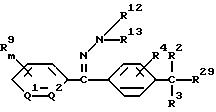
где значения R2, R3, R4, R9, R12, R13, m, Q1 и Q2 указаны в п.3;
R29 - гидроксигруппа,
с соединением формулы (V2)
Z-R1
где Z - группа формулы -SSR1,
R1 - (С1-С6)алкильная группа, (Cl-С4)цианоалкильная группа, (C3-C6)циклoaлкильная группа, (С1-С6)галогеналкильная группа или бензильная группа (которая может содержать в качестве заместителя атом галогена).
включающий взаимодействие соединения формулы VI
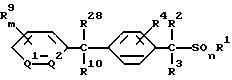
где значение R1, R2, R3, R4, R9, R10, m, n, Q1 и Q2 указаны выше;
R28 - атом галогена,
с соединением формулы VI
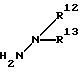
где значения R12 и R13 указаны выше.

Комментарии