Способ подавления фитопатогенных грибков, производное бензофенона, способ защиты растений от повреждения, вызванного фитопатогенным грибком, фунгицидная композиция и способы получения бензофенонов - RU2129788C1
Код документа: RU2129788C1
Чертежи

























Описание
Производство продуктов питания для обеспечения потребностей населения, численность которого постоянно увеличивается, остается важной проблемой и осуществляется с использованием разнообразных сельскохозяйственных технологий. При этом продукты питания должны быть доступными, питательными и хорошо храниться. Одним из таких методов, используемых во всем мире, является применение в сельском хозяйстве фунгицидов. Фунгициды представляют собой химические вещества, которые защищают сельскохозяйственные культуры и продукты питания от грибков и грибковых заболеваний. В настоящее время существует постоянная угроза воздействия на сельскохозяйственные культуры и продукты питания грибковых организмов, которые при отсутствии надлежащего контроля могут привести к потере урожая.
В частности, аскомицеты, вызывающие заболевания мучнистой росой, повсеместно распространенные, представляют собой угрозу, особенно для зерновых культур и фруктов. При этом применение фунгицидных агентов в дозах, контролирующих заболевание, может вызвать фитотоксическое повреждение полезных растений (посевов).
Поэтому объектом данного изобретения является разработка способа контроля (подавления) фитопатогенных грибков без фитотоксического повреждения растения-хозяина.
Другим объектом данного изобретения является эффективный и безопасный способ защиты важных с сельскохозяйственной точки зрения растений от ущерба, причиняемого заражением фитопатогенными грибками и болезнями, которые возникают вследствие такого заражения.
Еще одним объектом данного изобретения являются фунгициды на основе производных бензофенона соединений и фунгицидные композиции, содержащие бензофенон-производное.
Эти и другие объекты данного изобретения, а также их характерные черты представлены в подробном описании, которое следует далее.
Данное изобретения предлагает способ подавления фитопатогенных грибков или
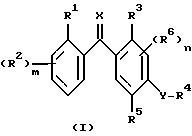
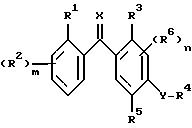
обусловленных их действием заболеваний, который включает контактирование указанных грибков с фунгицидно-эффективным количеством соединения - производного бензофенона - формулы I

где R1 - атом галогена, необязательно замещенная алкильная или алкоксигруппа, циано- или нитрогруппа; m равно 0 или принимает целые значения 1, 2, 3 или 4;
R2 - независимо атом галогена, необязательно замещенная алкильная или алкоксигруппа, нитрогруппа или, когда R1 и R2 присоединены к соседним атомам углерода, R1 и один из R2 могут вместе образовывать цепочку -CH=C-CH=CH- или необязательно замещенную алкилен или оксиалкиленокси, такой как O-CF2-O;
R3 - водород, галоген, необязательно замещенный алкил, алкокси, алкенил, алкилтио, алкилсульфинил, алкилсульфонил, цианогруппа, карбоксильная, гидрокси- и нитрогруппа или необязательно замещенная аминогруппа;
R4 - водород или необязательно замещенная алкильная или ацильная группа;
R5 - водород, галоген, необязательно замещенный алкил, алкокси, алкенилокси, алкинилокси, алкилтио, циклоалкил, циклоалкилокси, нитро-, гидрокси-, фенокси-, триалкилсилилокси-группа, -ONa, -OK, -OC(O)R7, -OCHR8(O)R7, -OC(O)NR8R9, -OS(O)2R8, -OS(O)2NR8R9, -OP(X1)(OR8)OR9,
-OR(X1)(R8)R9, -S(O)R8, -S(O)2R8, или R4 и R5 могут вместе образовывать необязательно замещенную алкиленовую или алкиленокси-цепочку; n равно 0 или принимает целые значения 1, 2; R6 независимо представляет собой атом водорода или необязательно замещенный алкил, алкенил, алкинил, алкокси, алкенилокси, алкинилокси, циклоалкил, циклоалкокси, гидрокси, -CO(O)R10 - группу или, когда R5 и R6 присоединяются к соседним атомам углерода, R5 и один R6 вместе могут образовывать цепочку -CH=CH-CH=CH- или необязательно замещенную оксилалкиленокси-цепочку;
R7 - атом водорода или необязательно замещенный алкил, алкокси или арил;
R8, R9 и R10 независимо друг от друга - атом водорода, алкил, арил или аралкил, или R8 и R9 вместе могут образовывать алкиленовую цепочку, необязательно включающую атом кислорода или азота, X - атом кислорода или серы или NOR-группа;
X1 представляет собой атом кислорода или серы;
Y - атом кислорода или серы или сульфонил- или сульфинилгруппа;
R представляет собой атом водорода или необязательно замещенный алкил, аралкил, арил или ацильную группу.
Используемый в описании и формуле изобретения термин "бензофенон" включает оксим-производные бензофенона (X=NOR), бензотиофеноны (X=S) и дериватизированную кетонную форму бензофенона (X=0).
Данное изобретение предлагает также способы защиты урожая, производные бензофенона формулы Ia, обладающие фунгицидной активностью, и фунгицидные композиции, включающие по меньшей мере одно соединение формулы I или Ia и сельскохозяйственно-приемлемый носитель.
Огромный урон наносится сельскому хозяйству в результате гибели и повреждения важных сельскохозяйственных и плодоовощных культур, которые вызываются грибковым заражением. Стратегия борьбы с вредителями, полевая устойчивость и вирулентные штаммы входят в круг особой заботы со стороны специалистов в сельском хозяйстве в их борьбе с грибковыми заболеваниями. В частности, агентами, которые продолжают представлять собой серьезную опасность для зерновых культур и фруктов, являются аскомицеты, вызывающие заболевания мучнистой росой. Кроме того, можно видеть, что применение различных фунгицидных агентов часто наносят фитотоксическое повреждение растению-хозяину.
Было установлено, что производные бензофенона формулы I являются высокоэффективными фунгицидами и особенно эффективны в борьбе с заболеваниями мучнистой росы, такими как настоящая мучнистая
роса. Соединениями формулы I, которые полезны для применения в способах борьбы с грибками, являются производные бензофенона, имеющие структуру:

где X, Y, R1, R2, R3, R4, R5, R6, m и n принимают значения, описанные выше.
Алкил, используемый в качестве заместителя или как часть других заместителей, таких как алкокси- или алкилтиогруппа, может иметь прямую или разветвленную цепочку и содержать до восемнадцати, предпочтительно до 14, наиболее предпочтительно до 10, атомов углерода. Конкретными примерами алкильных радикалов являются метил, этил, пропил, бутил, пентил, гексил и т.д. , а также их изомеры, такие как изопропил, изобутил, трет-бутил, изопентил и т.п. Низшие алкильные или алкоксигруппы содержат от 1 до 10 атомов углерода. Циклоалкильный фрагмент, используемый как заместитель или как часть других заместителей, в общем случае содержит от 3 до 10, предпочтительно от 3 до 6 атомов углерода. Алкенильная или алкинильная группа в общем случае содержит от 2 до 6, предпочтительно от 2 до 4, звеньев цепи, например этенил, пропенил, аллил, бутенил и т.п., что справедливо также для цепочек с более чем одной связью, такой как пентадиенил и т.п. Алкиленовая цепь обычно содержит от 1 до 5, предпочтительно от 1 до 4 атомов.
Ацильную группу сначала получают удалением гидроксила из карбоксильной группы и используют для введения формила или необязательно замещенных алкилкарбонильной и арилкарбонильной групп.
Атом галогена представляет собой атом фтора, хлора, брома и йода, предпочтительно хлора. Предпочтительными галогеналкильными фрагментами являются дифторметил и трифторметил.
Необязательно замещенные фрагменты могут быть незамещенными или содержать от одного до максимального химически возможного числа заместителей. Возможными заместителями могут быть любые из тех заместителей, что применяются на практике для получения биоцидных соединений, и/или видоизменения таких соединений для изменения их активности, персистентности, проникновения или любого другого свойства. Конкретными примерами таких заместителей являются галоген, в частности фтор, хлор или бром, нитро-, цианогруппа, гидроксильная, карбоксильная, аминогруппа, алкил- или аралкиламино, диалкиламино, циклоалкиламино, пиперидил, пиперидинил, морфолинил, карбамоил, арил- или бензилкарбамоил, моно- или диалкилкарбамоил, морфолинокарбонил, триалкилсилил, алкил, алкенил, алкинил, алкокси, алкоксиалкил, алкоксиалкокси, циклоалкил, циклоалкокси, ацил, необязательно замещенный бензоил, бензоксазолил, алкоксикарбонил, необязательно замещенный пиридил, фенокси или нафтил, фенил или фенил, содержащий один или более заместителей, выбранных из группы, включающей галоген, алкил, алкокси, алкоксиалкил, алкоксиалкокси, алкилтио, фенилтио, бензилтио, аралкокси, гидроксил, карбоксил, карбалкокси, цианогруппу, необязательно замещенную аминогруппу, нитрогруппу, трифторметил, трифторметокси и т.п. Алкильный фрагмент таких необязательных заместителей может содержать от 1 до 6 атомов углерода, предпочтительно 1 или 2 атома углерода. Если замещенная группа, указанная здесь, содержит два или более заместителей, такие заместители могут быть как одинаковыми, так и разными.
Производные бензофенона, соответствующие формуле I, представляют собой масла, смолистые вещества или в подавляющем большинстве твердые кристаллические вещества и обладают ценными фунгицидными свойствами. Например, они могут использоваться в сельском хозяйстве или смежных областях, таких как садоводство и виноградарство, для контроля фитопатогенных грибов, в частности аскомицет, и возбудителей мучнистой росы, таких как Erysiphe graminis, Podosphaera leucotricha, Uncinulf necator и т.п. Указанные производные бензофенона обладают высокой фунгицидной активностью в широкой области концентраций и могут использоваться в сельском хозяйстве без вредного фитотоксического воздействия на полезные растения.
Предпочтительными соединениями формулы I, используемыми в способе данного изобретения, являются соединения, в которых R1 представляет собой атом галогена или необязательно замещенную алкильную или алкоксигруппы; m равно 0 или принимает целые значения 1, 2, или 3; R2 независимо представляет собой атом галогена или необязательно замещенную алкильную или алкоксигруппу; или R1 и R2 вместе образуют фрагмент -CH=CH-CH=CH-, оксиалкиленокси, дифтороксиметиленокси или алкилен; R3 представляет собой атом галогена, необязательно замещенный алкил, алкенил, алкилтио- или алкилсульфонильную группу, нитрогруппу или необязательно замещенную аминогруппу; R5 представляет собой атом галогена, необязательно замещенный алкил, алкокси, алкенилокси, алкинилокси, циклоалкокси или алкилтио-группу, гидроксильную группу, триалкилсилилокси-группу или -OC(O)R7, -OCHR8C(O)R7, -OC(O)NR8R9 , NH-CO-R7, -OS(O)2R8 или -OS(O)2NR8R9 группы; или R4 и R5 вместе образуют необязательно замещенную алкиленокси-цепочку; n равно 0 или 1; R6 представляет собой необязательно замещенный алкил, алкенил, алкинил, алкилокси, алкенилокси, алкинилокси, циклоалкил или циклоалкоксигруппу или -OC(O)R10 группу; R7 представляет собой атом галогена, алкильную или алкоксигруппу; X представляет собой атом кислорода или NOR группу; R является водородом или необязательно замещенной алкильной группой.
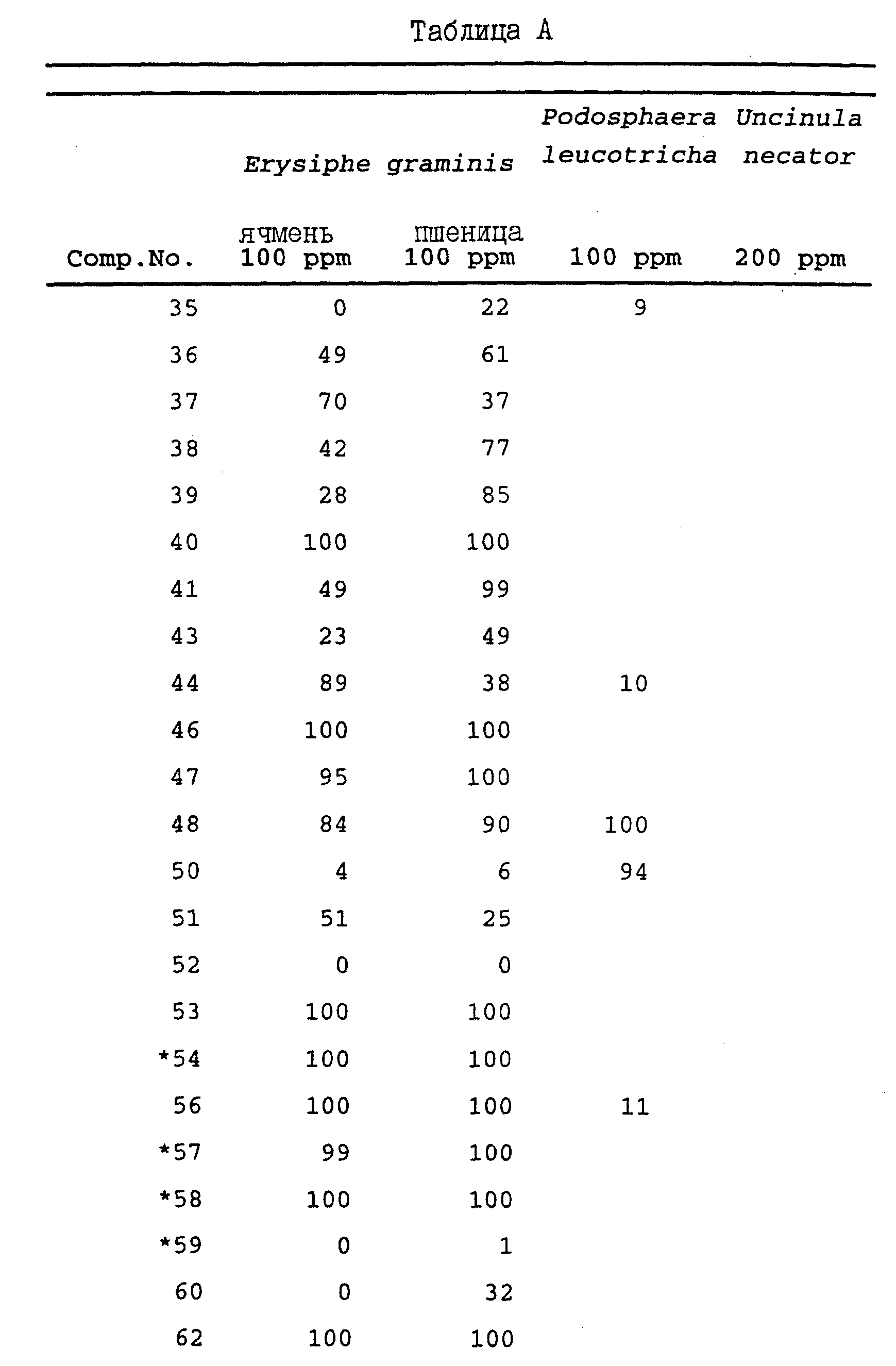
Хороший контроль (подавление) фитопатогенных грибов получают при использовании фунгицидно эффективного количества соединения формулы I, в котором R1 представляет собой атом галогена или необязательно замещенный низший алкил; m принимает целые значения 1 или 3; R2 независимо представляет собой атом галогена или необязательно замещенный низший алкил; R3 представляет собой атом галогена, необязательно замещенную алкильную или алкенильную группу или необязательно замещенную аминогруппу; R5 представляет собой необязательно замещенные алкил, алкокси, алкенилокси, алкинилокси, циклоалкокси или алкилтиогруппу, или R4 и R5 вместе могут образовывать необязательно замещенную алкиленокси-цепочку; n принимает значения 0 или 1; R6 представляет собой необязательно замещенные алкил, алкенил, алкинил, алкокси, алкенилокси, алкинилокси, циклоалкил или циклоалкоксигруппу или -OC(O)R10 группу; R7 представляет собой алкил или алкоксигруппу; X является атомом кислорода или группой NOR; Y является атомом кислорода; R является водородом или C1-C4 -алкилом.
Особенно предпочтительными являются те соединения формулы I, в которых R1 представляет собой атом галогена или C1-C4-алкильную группу; R2 независимо представляет собой атом галогена или необязательно замещенную C1-C4-алкильную группу; R3 представляет собой атом галогена или необязательно замещенную C1-C4-алкильную группу; R4 представляет собой необязательно замещенную C1-C4-алкильную группу; R5 представляет собой необязательно замещенные низший алкил, алкокси, алкенилокси, алкинилокси или циклоалкоксигруппу; R6 представляет собой необязательно замещенные C1-C4-алкокси, алкенилокси, алкинилокси или циклоалкоксигруппу.
Эффективный контроль фитопатогенных грибов может быть достигнут, например, при применении фунгицидно эффективного количества одного или
более соединений из группы, включающей:
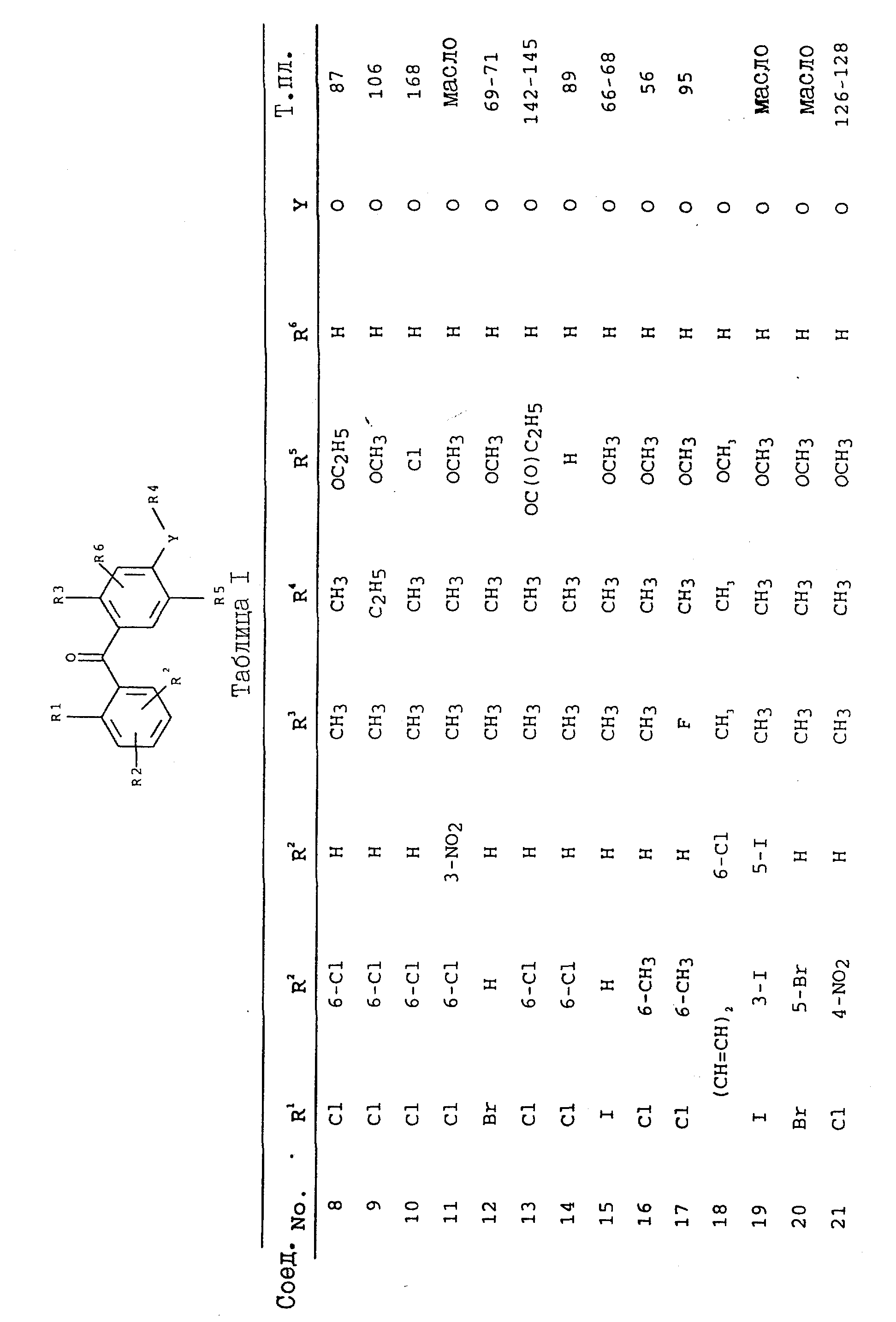
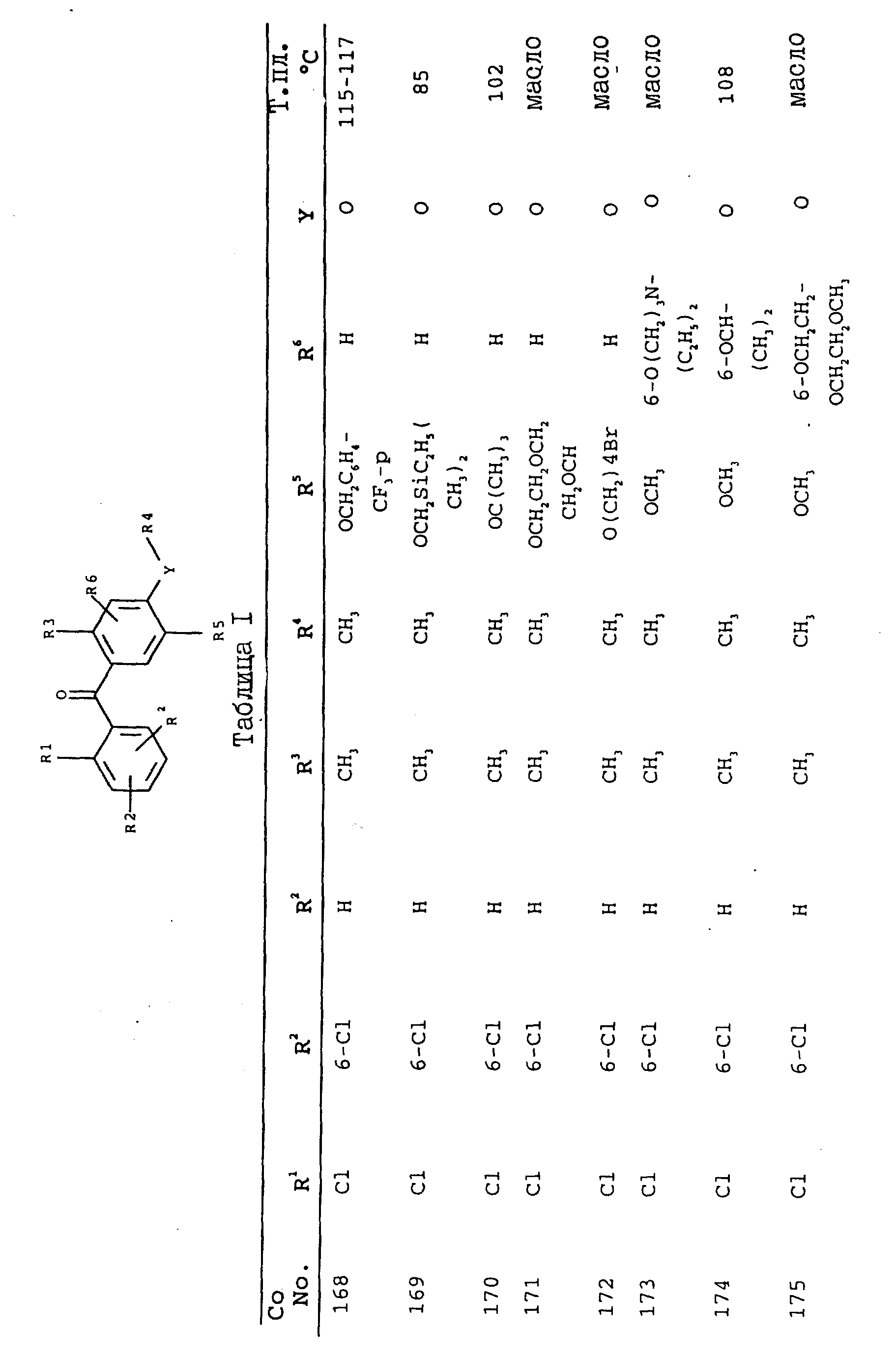
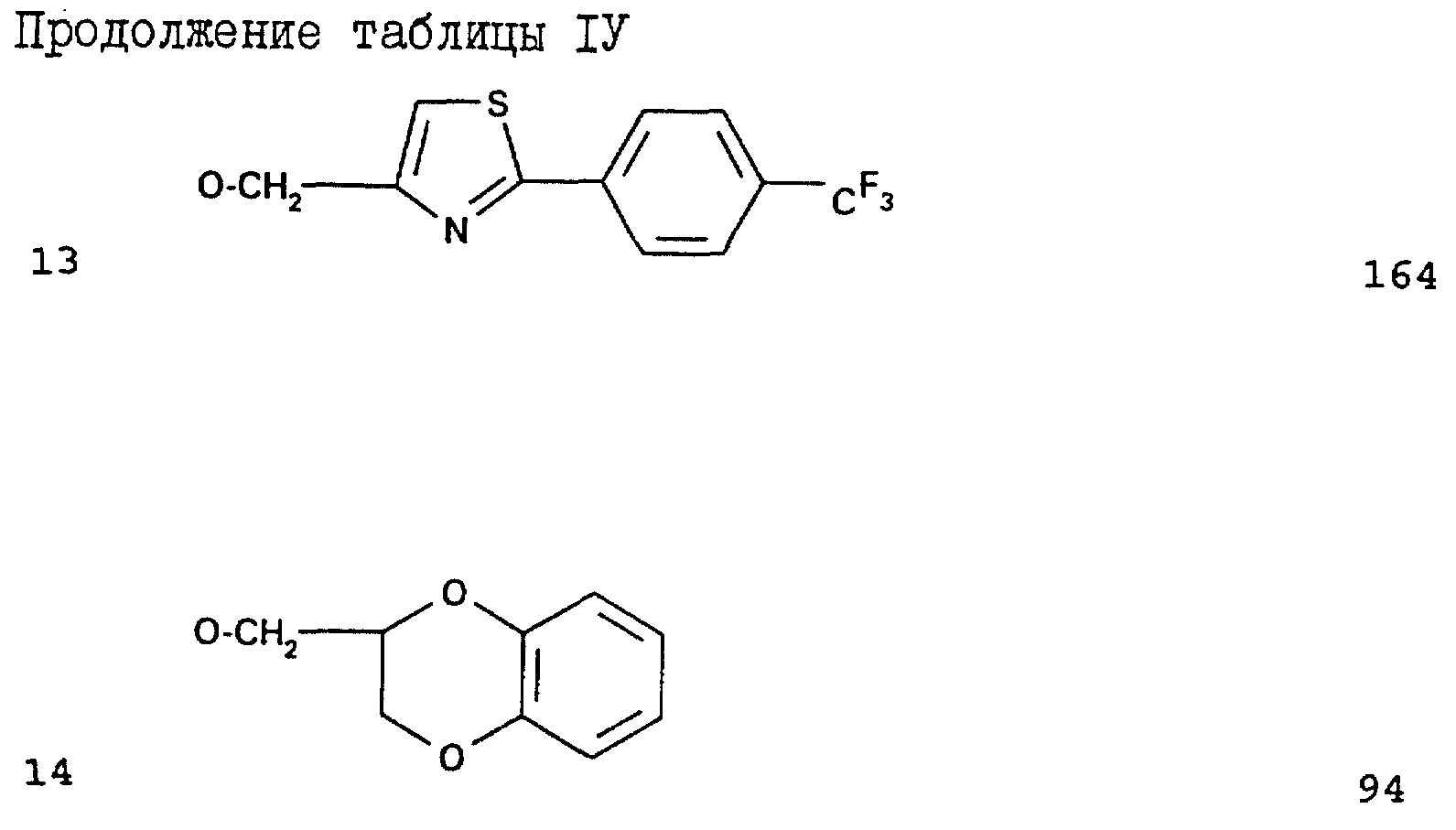
2,3,5,6-тетраметил-4',5',6'-триметокси-2'-метилбензофенон;
2,6 -дихлор-4',5'-диметокси-2'-метилбензофенон-O-метилоксим;
2,6
-дихлор-5'-трет-бутокси-4'-метокси-2'-метилбензофенон;
2,6 -дихлор-5'-6'-ди-н-бутокси-4'-метокси-2'-метилбензофенон;
2'-аллилокси-2,6-дихлор-3'-4'-диметокси-6'-метилбензофенон;
2'-бензилокси-2,6-дихлор-3',4'-диметокси-6'-метилбензофенон;
2'-бутокси-2,6-дихлор-3',4'-диметокси-6'-метилбензофенон;
2'-циклогексилметокси-2,6-дихлор-3',
4'-диметокси-6'-метилбензофенон;
2'-бензоилметокси-2,6-дихлор-3',4'-диметокси-6'-метилбензофенон;
2'-циклопентилокси-2,6-дихлор-3',4'-диметокси-6'-метилбензофенон;
2,
6-дихлор-2',3',4'-триметокси-6'-метилбензофенон;
2,6-дихлор-2'-этокси-3',4'-диметокси-6'-метилбензофенон;
2,6-дихлор-2'-гептилокси-3',4'-диметокси-6'-метилбензофенон;
2,
6-дихлор-2'-гексилокси-3',4'-диметокси-6'-метилбензофенон;
2,6-дихлор-3',4'-диметокси-2'-(2-метоксиэтокси)-6'-метилбензофенон;
2,6-дихлор-3',
4'-диметокси-6'-метил-2'-(3-метилбутокси)-бензофенон;
2,6-дихлор-3',4'-диметокси-6'-метил-2'-(проп-2-инилокси)-бензофенон;
2,6-дихлор-3',4'-диметокси-6'-метил-2'-пентилоксибензофенон;
2,6-дихлор-3',4'-диметокси-6'-метил-2'-пропоксибензофенон;
2,6-дихлор-4',5'-диметокси-2'-метилбензофенон;
2,6-дихлор-4'-метокси-2'-метил-5'-(3-метилбутокси)-бензофенон;
2,6-дихлор-4'-метокси-2'-метил-5'-(проп-2-инилокси)-бензофенон;
2,6-дихлор-4'-метокси-2'-метил-5'-(октилокси)-бензофенон;
2,
6-дихлор-4'-метокси-2'-метил-5'-(пентилокси)-бензофенон;
2,6-дихлор-4'-метокси-2'-метил-5'-пропоксибензофенон;
2,6-дихлор-4'-метокси-2'-метил-5'-триметилсиланилметоксибензофенон;
2,6-дихлор-5'-(1-этилпропокси)-4'-метокси-2'-метилбензофенон;
2,6-дихлор-5'-дифторметокси-4'-метокси-2'-метилензофенон;
2,6-дихлор-5'-этокси-4'-метокси-2'-метилбензофенон;
2,6-дихлор-5'-гептилокси-4'-метокси-2'-метилбензофенон;
2,6-дихлор-5'-гексилокси-4'-метокси-2'-метилбензофенон;
2,6-дихлор-5'-изобутокси-4'-метокси-2'-метилбензофенон;
2,6-дихлор-5'-изопропокси-4'-метокси-2'-метилбензофенон;
5-бутокси-2,6-дихлор-4'-метокси-2'-метилбензофенон;
5'-циклогексилметокси-2,6-дихлор-4'-метокси-2'-метилбензофенон;
5'-циклогексилокси-2,6-дихлор-4'-метокси-2'-метилбензофенон;
5'-циклопентилокси-2,6-дихлор-4'-метокси-2'-метилбензофенон;
5'-циклопропилметокси-2,
6-дихлор-4'-метокси-2'-метилбензофенон; или
5'-децилокси-2,6-дихлор-4'-метокси-2'-метилбензофенон.
Особенно полезными в качестве фунгицидов являются соединения формулы IB.

где Q представляет собой атом водорода или хлора;
R - атом водорода, C3-C8-циклоалкоксигруппа или C1-C8-алкоксигруппа, необязательно содержащая один или более атомов фтора, или один заместитель из группы, включающей фенил, фенокси, фенилтио или бензилоксигруппу, где фенильный фрагмент содержит заместитель из группы, включающей галоген, C1-C4-алкил, C1-C4-алкокси, трифторметил или трифторметоксигруппы;
R' представляет собой водород или C1-C10-алкил, необязательно содержащий один или более заместителей из группы, включающей атомы галогенов, C1-C4-алкокси-, фенил, фенокси-, или фенилтиогруппу, где фенильный фрагмент может содержать заместитель из группы, включающей галоген; C1-C4-алкил, C1 -C4-алкокси-, трифторметил или трифторметоксигруппу, при условии, что когда Q и R представляют собой водород R' не должен быть метилом.
Предпочтительными соединениями формулы IB являются соединения, где Q представляет собой атом водорода или хлора; R представляет собой атом водорода, C5-C7-циклоалкильную группу, C1-C6 -алкоксигруппу, необязательно содержащую один или более атомов фтора, или один заместитель из группы, включающей фенил, фенокси, фенилтио или бензилокси-группу, где фенильный фрагмент может содержать заместитель из группы, включающей галоген, метил, метокси-, трифторметил или трифторметоксигруппу, R' представляет собой водород или C1-C8-алкил, необязательно содержащий заместитель из группы, включающей фтор, хлор, C1-C4-алкокси, фенил, фенокси- или фенилтио-группу, где фенильный фрагмент может содержать заместитель из группы, включающей фтор, хлор, бром, метил, метокси-, трифторметил или трифторметокси-группу.
Также, особенно ценными соединениями являются соединения формулы IC
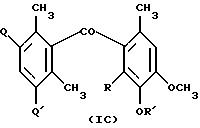
где Q и Q' независимо представляют собой атом водорода или метильную группу; R представляет собой атом водорода, C3-C8-циклоалкильную группу или C1-C8-алкоксигруппу, необязательно содержащую один или более заместителей из группы, включающей фтор, фенил, фенокси-, фенилтио- или бензилокси-группу, где фенильный фрагмент может содержать один или более заместителей из группы, включающей галоген, C1-C4-алкил, C1-C4-алкокси-, трифторметил или трифторметокси-группу; R' представляет собой водород или C1-C10-алкил, необязательно содержащий один или более заместителей из группы, включающей галоген, C1-C4-алкокси, фенил, фенокси- или финилтиогруппы, где фенильный фрагмент может содержать один или более заместителей из группы, включающей галоген, C1-C4-алкил, C1-C4-алкокси, трифторметильную или трифторметоксигруппы.
Предпочтительными соединениями формулы IC являются соединения, в которых Q и Q' независимо представляют собой атом водорода или метильную группу; R представляет собой атом водорода, C5-C7-циклоалкоксигруппу или C1-C6-алкоксигруппу, необязательно содержащую один или более атомов фтора или заместители из группы, включающей фенильную, фенокси, фенилтио или бензилоксигруппу, где фенильный фрагмент может содержат заместитель из числа фтора, хлора, брома, метила, метокси, трифторметила или трифторметоксигруппы; R' представляет собой водород или C1-C8-алкил, необязательно содержащий один или более заместителей из числа фтора, хлора, C1-C4-алкокси, фенила, фенокси или фенилтиогруппы, где фенильный фрагмент может содержать один или более заместителей из группы, включающей бром, метил, метокси, трифторметил или трифторметоксигруппу.
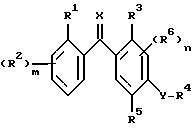
Данное изобретение относится также к новым производным бензофенона формулы Ia
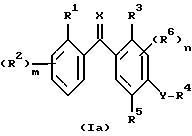
где R1 представляет собой атом галогена, необязательно замещенную алкильную группу или цианогруппу;
m представляет собой целые числа 1, 2 или 4;
R2 независимо представляет собой атом галогена, необязательно замещенный алкил или алкоксигруппу или, когда R1 и R2 присоединяются к соседним атомам углерода, R1 и R2 вместе могут образовывать CH=CH-CH=CH или необязательно замещенную алкиленовую или оксиалкиленокси группу;
R3 представляет собой атом водорода или галогена, необязательно замещенный алкил, алкокси, алкенил, алкилтио, алкилсульфинил, алкилсульфонил, циано, карбокси, гидрокси, нитрогруппу или необязательно замещенную аминогруппу;
R4 представляет собой необязательно замещенную алкильную или ацильную группу;
R5 представляет собой атом галогена, необязательно замещенный алкокси, алкенилокси, алкинилокси, алкилтио, циклоалкил, циклоалкилокси, триалкилсилилокси, -ONa, -OK, -OC(O)R7, -OCHR8C(O)R7, -OC(O)NR8R9, -OS(O)2R8, -OS(O)2NR8R9, -OR(X1)OR8)OR9, -OR(X1)(R8)R9, -S(O)R8 или -S(O)2R8 группу или R4 и R5 взятые вместе могут представлять собой необязательно замещенную алкиленовую или алкиленокси цепочку;
n равно 0 или представляет собой целые числа 1 или 2;
R6 независимо представляет собой необязательно замещенную алкоксигруппу, гидроксильную группу или -OC(O)R10 группу, когда присоединяются к соседним атомам углерода, или R5 и один R6 могут объединяться и представлять собой -CH=CH-CH=CH- или необязательно замещенную оксиалкиленокси цепочку;
R7 представляет собой атом водорода или необязательно замещенную алкил, арил или алкокси-группу;
R8, R9 и R10 независимо представляют собой атом водорода или алкильную группу или R8 и R9 могут вместе образовывать алкиленовую цепочку, необязательно включающую атом кислорода или азота;
X представляет собой атом кислорода, атом серы или NOR группу;
X1 представляет собой атом кислорода или серы;
Y представляет собой атом кислорода или серы или сульфонильную или сульфинильную группу;
R представляет собой атом водорода или необязательно замещенный алкил, аралкил, арил или ацильную группу при условии, что, когда X представляет собой атом кислорода или серы и
i) когда R1 представляет собой атом галогена, тогда (R2)m не должен представлять собой атом галогена или должен представлять собой не более чем одну алкильную или алкоксильную группу.
(ii)
когда R1 представляет собой алкильную группу, тогда R2 не должен представлять собой алкил;
(iii) когда m равно 1, тогда R2 не должен представлять собой
алкоксигруппу;
(iv) когда R3 представляет собой алкенильную группу, тогда R3 не может содержать в качестве заместителя алкокси- или ацильную группу;
(v) когда
R3 представляет собой галогеналкильную группу, тогда R1 и R2 не должны представлять собой галогеналкильную группу; и
(vi) когда Y представляет собой атом
кислорода, тогда R3 и R5 не должны представлять собой водород и n должно равняться 1 или 2.
Соединения формулы I могут быть получены общеизвестными способами.
Соединения, отвечающие формуле I (включая соединения формулы Ia), могут быть получены способом, который включает взаимодействие соединения формулы II
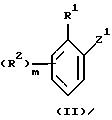
с соединением формулы III
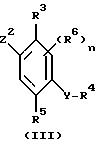
где R1, R2, R3, R4, R5, R6, Y, m и n принимают значения, определенные ранее, один из Z1 и Z2 представляет собой атом водорода, а другой представляет собой группу COCl; или один представляет собой группу галогенида магния МgHal, в которой Hal представляет собой атом галогена, предпочтительно брома или йода, а другой представляет собой альдегидную, нитрильную группу или группу COCl, в двух последних случаях с последующим окислением или гидролизом соответственно и необязательно с последующей дериватизацией.
Исходные вещества формул II и III являются продуктами и могут быть получены в соответствии с известными способами или согласно общепринятой практике их получения. Заместители от R1 до R9, которые не совместимы с выбранными условиями реакции, могут вводиться после образования структуры бензофенона. Они могут получаться известными способами, такими как последовательное получение производного, замещение соответствующей группы или расщепление подходящей защитной группы.
В том случае, когда один из Z1 и Z2 является водородом, а другой представляет собой COCl, таким способом является реакция Фриделя-Крафтса, которую проводят в присутствии катализатора - кислоты Льюиса по хорошо известным методикам. Подходящими катализаторами являются FeCl3, AlCl3, SnCl4, ZnCl2, TiCl4, SbCl5 и BF3, которые могут присутствовать в молярном эквивалентном количестве (в пересчете на ацилхлорид). Однако можно использовать меньшие количества катализатора при повышенных температурах, приемлемо до температур кипения, причем предпочтительными катализаторами при этих условиях являются FeCl3, I2, ZnCl2, железо, медь, сильные сульфоновые кислоты, такие как F3CSO3H, и кислотные ионно-обменные смолы, такие как Amberlyst 15 и Nafion. Предпочтительным катализатором является FeCl3 в молярном отношении от 0,001 до 0,2 при температуре приблизительно от 50 до 180oC. Реакция может проводиться в растворителе, который в условиях реакции является инертным, например в этилене или метиленхлориде, бензоле, октане, декане, в смеси растворителей или в отсутствие растворителя, при этом удобно использовать избыток одного из реагирующих веществ, например в интервале от 1:5 до 5:1. В том случае, когда например в качестве катализатора используется AlCl3, предпочтительное молярное соотношение имеет значение в интервале от 0,5 до 2, подходящими растворителями являются метиленхлорид или этиленхлорид и в общем случае используется температура в интервале от -10 до -70oC. Если в исходном соединении R3 является метилом, а R6 или один R6 представляет собой 5-алкоксигруппу (формула III), то для получения 6-гидроксипроизводного осуществляют расщепление эфирной группы и полученное таким образом производное может далее преобразовываться с получением соответствующих новых производных согласно известным способам.
Если соединение формулы II представляет собой 2,6-дихлорбензоилхлорид, а соединение формулы III представляет собой 1,2,3-триалкокси-5-алкилбензол, для получения различных продуктов (в зависимости от условий проведения реакции) может использоваться реакция Фриделя-Крафтса с AlCl3. В случае, когда молярное количество хлорида алюминия находится в интервале от 0,5 до 2, температура равна приблизительно от 0 до 25oC и в качестве растворителя используется метилен или этилен, расщепление эфирной группы имеет место в шестом положении (орто-положение) соединения формулы I в течение интервала времени, составляющего приблизительно от 1 до 20 часов; при более высокой температуре (около 40oC) и большем времени реагирования (приблизительно от 2 до 24 часов), расщепление эфирной группы может также осуществляться и в 5-(мета)-положении.
При необходимости, описанный ниже процесс может осуществляться с использованием других исходных веществ.
При использовании в качестве исходного, соединений формулы

где R1, R2 предпочтительно представляют собой хлор, метил, R представляет собой водород или O-алкил, и алкил предпочтительно представляет собой метил, расщепление эфирной группы при температуре в интервале приблизительно от 50 до 100oC с HBr/уксусной кислотой приводит к получению соединений формулы
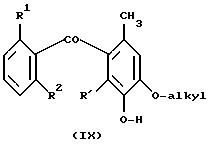
где R' представляет собой H или OH.
При использовании в качестве исходного соединения
формулы
где R1 и R2 принимают значения, определенные ранее, расщепление O-алкильной группы может осуществляться с использованием AlCl3 (0,5 - 2 моля) в инертном растворителе, таком как метиленхлорид, при температуре около 20 - 50oC, в результате образуется соответствующее OH-производное.
Алкилирование соединений формулы VIII, IX или продукта эфирного расщепления, полученного из X, может выполняться в соответствии с обычно используемыми способами.
Соединение формулы IX, где R' является водородом, может быть подвергнуто реакции с алкилгалогенидом (в котором алкильный фрагмент может быть замещенным) в низшем спирте в присутствии основного соединения, такого как карбонат калия, при повышенных температурах (например 60 - 150oC).
В том случае, когда гидроксильные группы находятся в других положениях (как в соединении VIII, R' = OH или продукте реакции, полученном из X), необходимо получить соль металла посредством взаимодействия гидрокси-соединения, например с хлоридом калия. Затем соль используют в реакции с необязательно замещенным алкилгалогенидом в полярном растворителе (например, в диметилформамиде) в отсутствие воды.
Диалкилирование соединений формулы IX, где R' представляет собой OH, с такими же необязательно замещенными алкильными группами может осуществляться с использованием в качестве исходного материала соответствующей двойной соли щелочного металла, предпочтительно динатриевой соли, которая может быть получена из дигидроксисоединения и гидрида натрия в инертном растворителе (например, тетрагидрофуране), затем на соль действуют избытком необязательно замещенного алкилгалогенида при температуре в интервале приблизительно от 80 до 120oC в инертном полярном растворителе (например диметилформамиде).
Диалкилирование дигалоген-производного соединения формулы Hal-(CH2)n-Hal (Hal = Cl, Br или I; n = от 1 до 4) приводит к циклизации (соединение XI; n как определено
ранее):
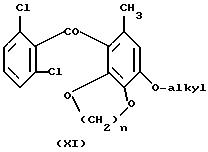
Взаимодействие дигидроксисоединения IX (R' = OH ) с дигалогенпроизводным проводят в присутствии избытка карбоната калия и оксида меди в качестве катализатора при температурах в интервале приблизительно от 10 до 50oC, предпочтительно при комнатной температуре.
Для получения ацилированных соединений соответствующее гидрокси соединение, например, формулы XII

где R1 и R2 представляют собой хлор или метил, в форме его соли (например, калиевой соли), подвергают взаимодействию в инертном полярном растворителе, таком как диметилформамид, с необязательно замещенным хлоридом кислоты при температуре в интервале приблизительно от 10 до 50oC.
Ацилирование соединений формулы IX (R' = H) может быть проведено посредством нагревания этого соединения с ангидридом кислоты в присутствии или без инертного растворителя при температурах в интервале приблизительно от 80 до 120oC.
Для получения соединений формулы XIII
где R представляет собой трет-бутоксигруппу, R1 и R2 принимают значения, указанные ранее, но предпочтительно представляют собой Cl, соответствующее гидрокси-соединение (XIII; R = OH) растворяют в инертном растворителе, раствор охлаждают до приблизительно - 70oC и после добавления каталитического количества трифторметансульфоновой кислоты через реакционную смесь в течение периода, составляющего от 2 до 6, пропускают 2-метилпропен. После нейтрализации кислоты образующееся трет-бутоксипроизводное может быть выделено известными способами.
5-Нитросоединение формулы XIV
(R = NO2) может быть получено нитрованием соответствующего соединения, незамещенного в положении 5 (R = H), концентрированной (65%) азотной кислотой при температуре в интервале от 50 до 100oC.
Нитрование соединений формулы XV
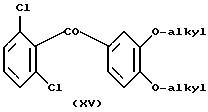
во второе положение может быть выполнено с использованием концентрированной (65%) азотной кислоты при температуре в интервале приблизительно от 30 до 60oC.
Образующиеся или полученные другим способом нитросоединения могут быть восстановлены до соответствующих аминосоединений, например, формулы
XVI

с избытком порошкообразного железа в смеси воды с уксусной кислотой в соотношении 50:1 при повышенной температуре (от 60 до 100oC).
Взаимодействие соединений, содержащих аминогруппу, с избытком муравьиной кислоты при температуре кипения приводит к формилированию аминогруппы.
Соединения формулы XIV (R=H) могут быть бромированы в положении 5 при добавлении по каплям к раствору этого соединения в трихлорметане эквимолярного количества брома (например, в трихлорметане) при температуре от 10 до 30oC.
Бензофенотионы (I; X = S) могут быть получены из соответствующих бензофенонов при нагревании их с пентансульфидом фосфора в инертном растворителе до температуры кипения в течение периода времени, составляющего от 2 до 10 часов.
При взаимодействии галогенида магния с нитрилом, т.е.
группа Z1 или Z2 (формулы II, III) представляет собой CN, непосредственным продуктом реакции является имин формулы IV
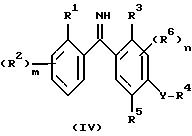
Этот продукт посредством кислотного гидролиза легко превращают в нужные производные бензофенона формулы I, где X представляет собой атом кислорода, причем в качестве минеральных кислот можно использовать такие кислоты, как соляная или серная.
В том случае, когда галогенид магния реагирует с альдегидом, т.е. группа Z1 или Z2 представляет собой группу CHO, непосредственным продуктом реакции является четвертичный спирт формулы V

Промежуточный продукт формулы V легко превращают в нужные производные бензофенона формулы I, где X - представляет собой атом кислорода, при помощи окисления, при этом приемлемо использование производных, содержащих Mn (IV), Mn (VII), Ce (IV) или Cr (VI), азотной кислоты или кислорода в присутствии катализатора.
Некоторые оксим-производные формулы I могут быть получены взаимодействием соответственно замещенного нитрилоксида формулы VI с подходящим O-диметоксибензолом формулы VII в присутствии хлорида алюминия и в инертном растворителе для образования промежуточного продукта с последующим гидролизом этого промежуточного продукта в водном растворе кислоты для получения нужных продуктов - соединений формулы Ib. Этот способ показан на схеме 1.
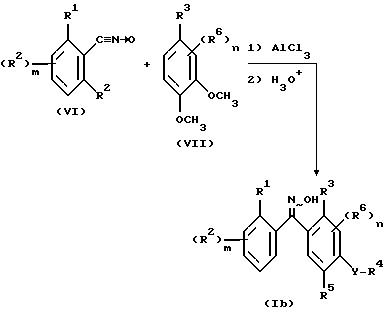
Для соединений формулы Ib заместители R1, R2, R3, R6 и n принимают значения, определенные ранее для формул I и Ia, m равно 0 или принимает значение целых чисел 1, 2, 3. Оксимы формулы Ib могут быть O-алкилированы или O-ацилированы с использованием общеизвестных способов алкилирования и ацилирования.
Заместители, содержащиеся в бензофенонах, полученных в соответствии с данным изобретением, могут далее подвергаться различным превращениям, таким как реакция гидрирования, ацилирования, расщепление эфирных мостиков, алкилирование или нитрование.
Соединения формулы Ia данного изобретения являются превосходными фунгицидами, особенно для контроля фитопатогенных грибов в сельском хозяйстве или смежных областях. Они полезны для контроля заболеваний мучнистой росы, особенно Erysiphe graminis, Podosphaera leucotricha или Uncinula necator. Благодаря хорошей устойчивости растений к данным соединениям, они могут применяться на всех культурных растениях, где нежелательно заражение грибками, которые могут быть уничтожены, например, на зерновых злаках, на яблонях, на винограде. Характерной особенностью данного изобретения является отсутствие фитотоксического воздействия на целевую сельскохозяйственную культуру при использовании фунгицидно-эффективных доз.
Данное изобретение относится также к фунгицидной композиции, которая включает соединение формулы I или Ia, которые описаны выше, и сельскохозяйственно-приемлемый носитель. Указанная композиция может содержать одно или более соединений данного изобретения. Предпочтительно по меньшей мере один из носителей в композиции согласно данному изобретению является поверхностно-активным агентом. Например, композиция может содержать по меньшей мере два носителя, из которых по меньшей мере один является поверхностно-активным агентом.
Соединения, соответствующие формуле I или формуле Ia, могут применяться в виде технического продукта, однако указанные соединения предпочтительно применяют в виде композиции, включающей помимо соединений формулы I или Ia адъюванты и вспомогательные вещества, которые широкого известны и используются в композициях. Указанные композиции выпускаются в виде эмульсионных концентратов, растворов, которые могут распыляться сразу или разбавляться непосредственно перед применением, разбавленных эмульсий, смачивающихся порошков, растворимых порошков, дустов, гранул, микрокапсулированных препаратов. Методы изготовления этих композиций достаточно хорошо известны. Способ применения, такой как опрыскивание, распыление, диспергирование, опудривание, может выбираться, как и композиции, в зависимости от объектов, где требуется применение, и условий применения.
Соединения формулы I или формулы Ia могут быть введены в композицию или применяться либо отдельно, либо в смеси с одним или более пестицидами или регуляторами роста растений. Пестициды, которые могут использоваться в смеси, могут быть гербицидами, инсектицидами или другими фунгицидами или их комбинациями. В том случае, когда соединения формулы I или формулы Ia применяются в смеси с другим пестицидом или пестицидами, они могут быть применены одновременно или последовательно. Фунгицидами, которые могут использоваться в смеси с соединениями формулы I являются 4,6-динитро-о-крезол, беналаксил, беномил, каптафол, каптан, карбендазим, хлорталонил, медь, цимоксанил (cymoxanil), дихлорфлуанид, дихлон, дифеноконазол (difenoconazol), диметоморф (dimethomorph), диниконзол (diniconzol), динокап (dinocap), дитианон, фенпиклонил (fenpiclonil), фенпропиоморф (fenpropiomorph), гимаксазол (hymaxazol), имазалил (imazalil), ипродион (iprodion), изопротиолан (isoprothiolan), касугамицин (kasugamicin), манкоцеб, мепронил, оксид ртути, оксадиксил, оксолиновая кислота, пенконазол, пропинеб, пронинеб, пирифенокс (pyrifenox), тиабендазол, тирам, толкофос-метил, триадимефон, трифлумизол, трифорин валидамицин A (triforin validomycin A), винклозолин (vinclozolin), цинеб, цирам и т.п.
Фунгицидные композиции данного изобретения могут быть получены с помощью широко известных методик, например, при интенсивном смешивании и/или измельчении активных ингредиентов с другими веществами, такими как наполнители, растворители, твердые носители и необязательно поверхностно-активные вещества (тензиды).
В качестве растворителей могут использоваться ароматические углеводороды, предпочтительно фракции с C8 по C12, например ксилол или ксилоловые смеси, замещенные нафталины, эфиры фталевой кислоты, такие как дибутил- и диоктилфталат, алифатические углеводороды, например циклогексан или парафины, спирты и гликоли, а также их простые и сложные эфиры, например этанол, моно- и диэтиловый эфир этиленгликоля, кетоны, такие как циклогексанон, высокополярные растворители, такие как N-метил-2-пирролидон, диметилсульфоксид, алкилфорамиды, эпоксидированные растительные масла, например эпоксидированное кокосовое или соевое масло, вода.
В качестве твердых носителей для дустов или диспергируемых порошков могут использоваться минеральные наполнители, такие как кальцит, тальк, каолин, монтмориллонит, аттупульгит. Физические свойства могут быть улучшены добавлением тонкодиспергированного силикагеля или тонко диспергированных полимеров.
В качестве носителей для гранулированных препаратов может использоваться пористый материал, например пемза, толченый кирпич, сепиолит, бентонит, в качестве несорбционных носителей может использоваться кальцит или песок. Кроме указанных веществ, может использоваться большое количество предварительно гранулированных неорганических и органических материалов, таких как доломит или измельченные остатки растений (древесная стружка).
В качестве подходящих поверхностно-активных веществ могут использоваться неионогенные, анионные или катионные ПАВ с хорошими диспергирующими, эмульгирующими и смачивающими свойствами в зависимости от природы бензофенонового производного, которое необходимо ввести в композицию. ПАВ могут также предоставлять собой смесь нескольких ПАВ.
Подходящими ПАВ могут быть так называемые водорастворимые мыла, а также водорастворимые синтетические поверхностно-активные вещества. Мыла обычно являются солями щелочных, щелочноземельных металлов, а также необязательно замещенных солей аммония и высших жирных кислот (C10-C20), например натриевая или калиевая соли олеиновой или стеариновой кислот или смеси натуральных жирных кислот, которые получают, например, из кокосового масла или таллового масла. Однако предпочтительно использовать так называемые синтетические ПАВ, такие как жирные сульфонаты, жирные сульфаты, сульфонированные бензимидазольные производные или алкиларилсульфонаты. Жирные сульфаты или жирные сульфонаты обычно используют в виде солей щелочных, щелочноземельных металлов или необязательно замещенных солей аммония, и как правило они включают алкильные фрагменты с 8 - 22 атомами углерода, поэтому алкил означает также алкильный фрагмент ацильных остатков, таких как натриевая или кальциевая соль лигнинсульфоновой кислоты, додецилат серной кислоты или смесь жирных спиртов, полученных из натуральных жирных кислот. К ним относятся также соли эфиров серной кислоты, сульфоновых кислот и аддукты жирных спиртов и этиленоксида. Сульфированные производные бензимидазола предпочтительно содержат 2 остатка сульфокислоты и остаток жирной кислоты с 8 - 22 атомами углерода. Алкиларилсульфонатами являются, например, натриевые, кальциевые или триэтиламмонийные соли додецилбензолсульфоновой кислоты, дибутилнафталинсульфоновой кислоты или продукта конденсирования нафталинсульфоновой кислоты и формальдегида. Кроме этого, могут использоваться фосфаты, такие как соли эфирного аддукта п-нонилфенол-(4-14)-этиленоксида фосфорной кислоты или фосфолипиды.
Неионными ПАВ предпочтительно являются полигликольэфирные производные алифатических и циклоалифатических спиртов, насыщенных или ненасыщенных жирных кислот и алкилфенолов, которые включают от 2 до 10 гликольных эфирных групп и от 8 до 20 атомов углерода в (алифатической) углеводородном остатке и от 6 до 18 атомов углерода в алкильном остатке алкилфенолов. Другими подходящими неионными ПАВ являются водорастворимые 20 - 250 этиленгликольные эфирные группы, содержащие полиаддукты этиленоксида и полипропиленгликоля, этилендиаминополипропиленгликоля и алкилполипропиленгликоля с 1 - 10 атомами углерода в алкильном фрагменте. Эти вещества обычно содержат от 1 до 5 этиленгликольных единиц на пропиленгликольную единицу. Примерами неионных ПАВ являются нонилфенолполиэтоксиэтанолы, полигликолевый эфир касторового масла, полиаддукты этиленоксида и полипропилена, трибутилфеноксиполиэтоксиэтанол, полиэтиленгликоль, октилфеноксиполиэтоксиэтанол. Кроме того, могут использоваться эфиры жирных кислот полиоксиэтилен-сорбитан, такие как полиоксиэтиленсорбитантриолеат.
Катионными поверхностно-активными веществами предпочтительно являются четвертичные аммониевые соли, содержащие по меньшей мере один алкильный остаток с 8 - 22 атомами углерода и, кроме того, низшие необязательно галогенированные алкильные, бензильные или гидроксиалкильные остатки. Соли предпочтительно являются галогенидами, метилсульфатами или алкилсульфатами, например стеарилтриметил хлорид аммония или бензил-бис-(2-хлорэтил)этил бромид аммония.
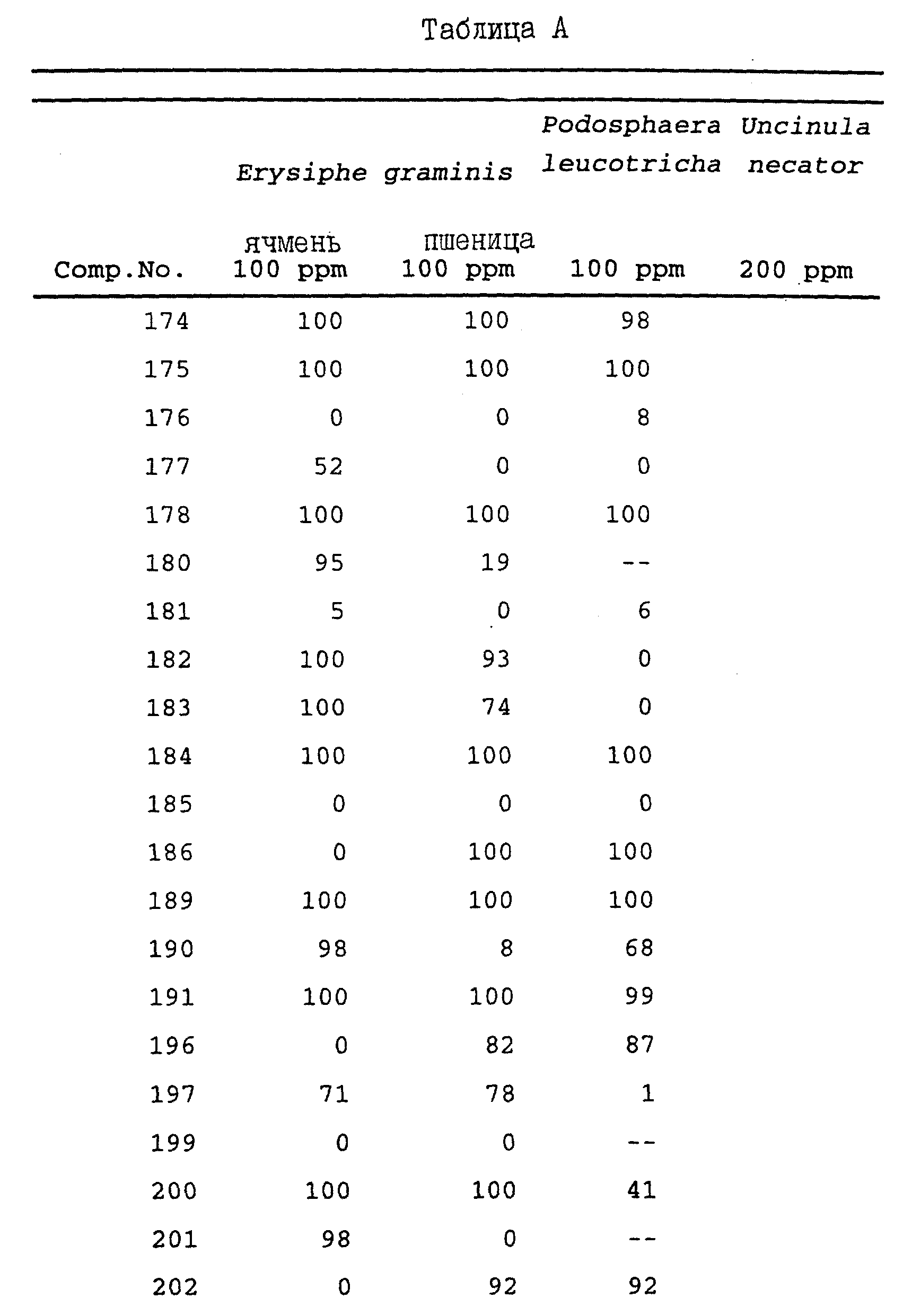
Перечень поверхностно-активных веществ, которые обычно используются для композиций, аналогичных композициям данного изобретения приведен в следующих публикациях:
"McCutcheon's
Detergents and Emulsifiers Annual", MC Publishing Corp., Ridgewood,. NY, USA 1981;
H. Stache, "Tensid-Taschenbuch; 2nd ed., C.Hanser, Munich, Vienna, 1981;
M. and J. Ash,
"Encyclopedia of Surfactants", Vol. I - III, Chemical Publishing Co., New York, NY, USA 1980 - 1981.
Пестицидные композиции данного изобретения могут содержать 0,1 - 95%, предпочтительно 0,1 - 80% по меньшей мере одного соединения формулы I или Ia, 1 - 99,9% твердого или жидкого адъюванта и 0 - 25%, предпочтительно 0,1 - 25% поверхностно-активного вещества.
Примерами композиций данного изобретения являются:
Эмульсионные Концентраты
Активный ингредиент: 1 - 20%, предпочтительно 5 - 10%;
Поверхностно-активное вещество:
5 - 30%, предпочтительно 10 - 20%;
Жидкий носитель: 50 - 94%, предпочтительно 70 - 85%.
Суспензионные концентраты
Активный ингредиент: 5 - 75%, предпочтительно 10
- 50%.
Вода: 94 - 24%, предпочтительно 88 - 30%.
Поверхностно-активное вещество: 1 - 40%, предпочтительно 2 - 30%.
Смачиваемые порошки
Активный
ингредиент: 0,5 - 90%, предпочтительно 1 - 80%.
Поверхностно-активное вещество: 0,5 - 20%, предпочтительно 1 - 15%.
Твердый носитель: 5 - 95%, предпочтительно 15 - 90%.
Дусты
Активный ингредиент: 0,1 - 10%, предпочтительно 0,1 - 18%.
Твердый носитель: 99,9 - 90%, предпочтительно 99,9 - 99%.
Гранулированные препараты
Активный ингредиент: 0,5 - 30%, предпочтительно 3 - 15%.
Твердый носитель: 99,5 - 70%, предпочтительно 97 - 85%.
Предпочтительно композиции находятся в концентрированной форме, а пользователь их разбавляет перед применением. Обычно композиции разбавляют до концентрации 0,001% а.и. Обычные дозы внесения 0,01 - 10 кг а.и./га.
Указанные композиции могут также включать другие вспомогательные вещества, такие как стабилизаторы, пеногасители, контролирующие вязкость агенты, загустители, адгезивы, удобрения или другие активные ингредиенты для получения специфических эффектов.
Далее приводятся примеры, которые только иллюстрируют, но не ограничивают область данного изобретения и основные принципы данного изобретения. В самом деле, различные модификации изобретения в дополнение к показанным и описанным, станут очевидными для квалифицированного специалиста из приведенных далее примеров и приведенного выше описания. Такие модификации также охватываются областью данного изобретения и формулой изобретения. Термины ПМР, МС и ИК, использующиеся в данных ниже примерах, означают протонно-магнитный резонанс, масс-спектроскопию и инфракрасный спектр соответственно.
Пример 1
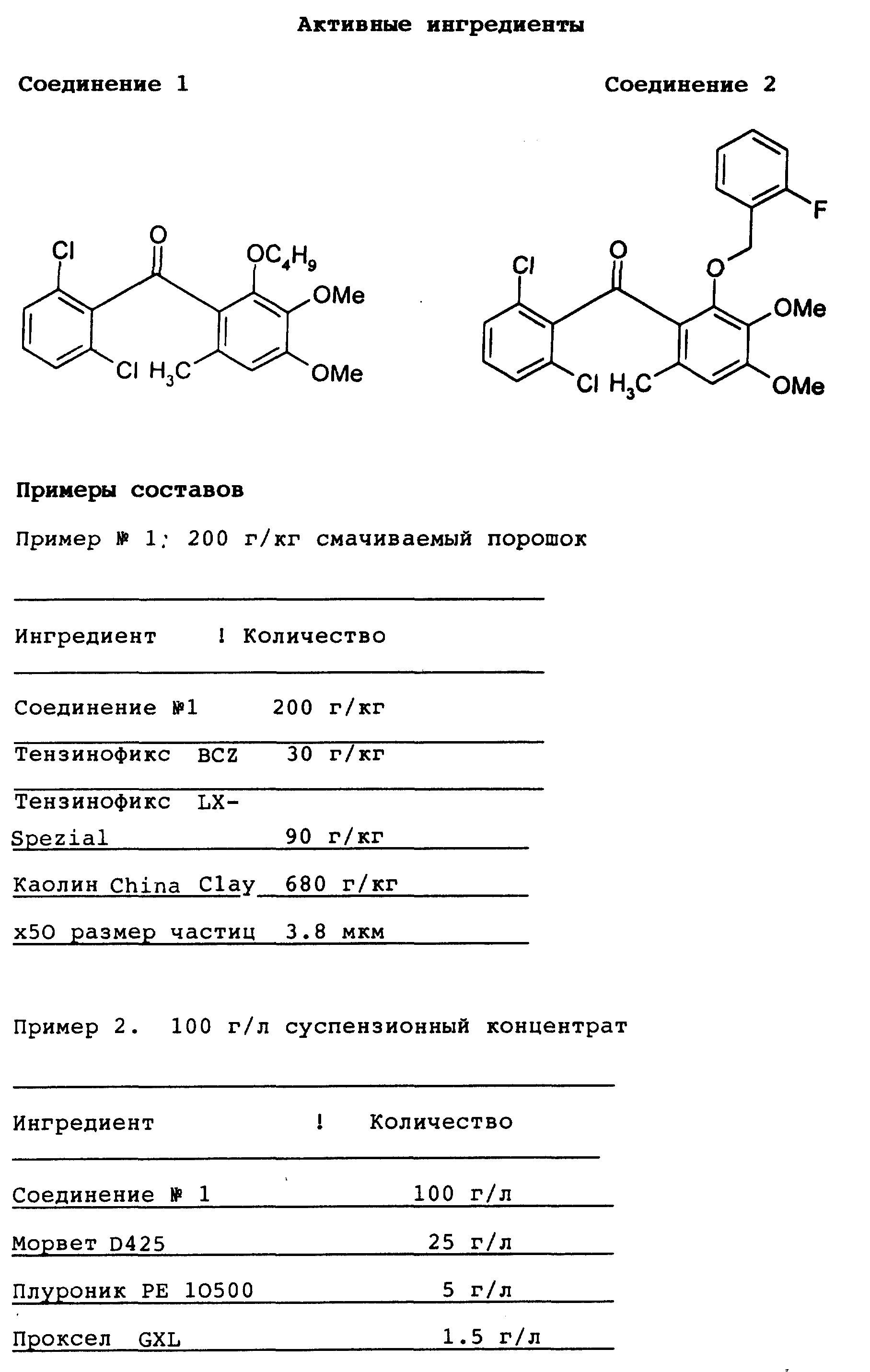
2,6-Дихлор-4',5'-диметокси-2'-метилбензофенон (Соединение 1)
(R1 = Cl, R2 = 6 - Cl, R3 = CH3, R4 = CH3, R5 = OCH3, X = O, Y = O, m = 1, n = 0)
Смесь 4-метилвератрола (76,6
г; 500 ммолей), 2,6-дихлорбензоилхлорида (120,4 г; 575 ммолей) и хлорида железа (III) (0,5 г) нагревают при перемешивании. Реакция начинается при температуре 90oC, показателем чего является
образование хлористого водорода, при этом основная реакция завершается по истечение 10 минут при температуре 95oC. Реакционную смесь перемешивают еще 30 минут при температуре 100o
C, затем охлаждают до 65oC. После добавления метанола (350 мл) начинается кристаллизация соединения 1. К смеси при температуре 40oC медленно добавляют смесь вода/метанол (1 : 1
объем-объем; 300 мл), а затем охлаждают до комнатной температуры и перемешивают в течение 30 минут. Твердое вещество выделяют фильтрованием под вакуумом, трижды промывают смесью метанол/вода (3 : 1
объем/объем; 3 x 100 мл) и сушат, в результате получают 148,6 г продукта в виде бесцветных кристаллов (91,4% выход), т. пл. 101,5oC.
Пример 2
Получение производных
бензофенона
A) 2,6-Дихлор-4',5'-диметокси-2'-нитробензофенон (Соединение 2)
(R1 = Cl, R2 = 6 - Cl, R3 = NO2, R4 = CH3
, R5 = OCH3, X = O, Y = O, m = 1, n = 0)
Порцию 2,6-дихлор-3', 4'-диметоксибензофенона (6,22 г, 20 ммолей), полученного способом, аналогичным приведенному в примере 1,
добавляют в течение 15 минут к азотной кислоте (65%, 40 мл), нагретой до 40oC. Прозрачный раствор перемешивают в течение 10 минут при температуре 40oC, а затем в течение 1 часа
при комнатной температуре. Реакционную смесь выливают в воду, после чего образуется медленно отвердевающее масло. Этот продукт растворяют в небольшом количестве N,N-диметилформамида при нагревании,
затем добавляют метанол, смесь охлаждают и фильтруют, в результате получают 5,57 г (выход 78%) соединения 2 в виде твердого кристаллического вещества желтого цвета, т. пл. 143oC.
B) 2'-Амино-2,6-дихлор-4',5'-диметоксибензофенон (Соединение 3)
(R1 = Cl, R2 = 6 - Cl, R3 = NH2, R4 = CH3, R5 = OCH3, X = O, Y = O, m = 1, n = 0)
Порцию 2,6-дихлор-3', 4'-диметокси-2'-нитробензофенона (соединение 2; 3,56 г, 10 ммолей) в течение 15 минут добавляют к смеси воды (50
мл), ледяной уксусной кислоты (1 мл) и порошкообразного железа (3,30 г, 60 ммолей), которая нагрета до 70oC. Реакционную смесь перемешивают при температуре 95oC еще 3 часа. После
охлаждения к смеси добавляют толуол (50 мл) и образующийся твердый осадок выделяют фильтрованием под вакуумом. Осадок на фильтре промывают толуолом. Фильтрат и промывной раствор соединяют и промывают
водой, сушат и вносят в колонку флэш-хроматографии (силикагель, 50 г). Колонку последовательно элюируют толуолом, и затем толуолом, содержащим 1%, 2%, 5% и 10% ацетона (по 250 мл). Фракцию,
элюированную 10%-ным раствором ацетона в толуоле упаривают под вакуумом до конечного объема 10 мл, в результате чего соединение 3 кристаллизуется в виде желтых кристаллов. Получают 1,61 г продукта
(выход 49%), т. пл. 181oC.
C) 2,6-Дихлор-4',5'-диметокси-2'-формиламино-бензофенон (Соединение 4)
(R1 = Cl, R2 = 6 - Cl, R3 = NHCHO,
R4 = CH3, R5 = OCH3, X = O, Y = O, m = 1, n = 0)
Смесь 2'-амино-2,6-дихлор-4',5'-диметоксибензофенона (соединение 3; 0,82 г, 2,5 ммоля) и
муравьиной кислоты (30 мл) нагревают до температуры кипения и кипятят в течение 24 часов, после чего упаривают под вакуумом. Остаток растворяют в небольшом количестве толуола. После добавления
циклогексана соединение 4 кристаллизуется, в результате получают 0,64 г соединения 4 в виде бесцветного кристаллического вещества (выход 72%), т. пл. 152oC.
D) 2,
6-Дихлор-5'-гидрокси-4'-метокси-2'-метилбензофенон (Соединение 5)
(R1 = Cl, R2 = 6 - Cl, R3 = CH3, R4 = CH3, R5 =
OH, X = O, Y = O, m = 1, n = 0)
Смесь 2,6-дихлор-4',5'-диметокси-2'-метилбензофенона (соединение 1; 2,5 г, 7,7 ммолей), раствора бромистого водорода в уксусной кислоте (33%, 10 мл) и ледяной
уксусной кислоты (10 мл) перемешивают в течение полутора часов при температуре 75oC, затем выливают в воду (100 мл) и экстрагируют дихлорметаном (2 x 50 мл). Экстракты соединяют, сушат и
упаривают под вакуумом. Образующееся масло вносят в верхнюю часть колонки для быстрой хроматографии (силикагель, 30 г). Элюируют толуолом и смесью толуол/ацетон (9 : 1) (по 500 мл). Фракции,
содержащие продукт с R = 0,54 (силикагель; толуол/ацетон, 9 : 1), соединяют, растворитель упаривают под вакуумом до конечного объема смеси 20 мл. После этого раствор экстрагируют три раза водным
раствором гидроксида натрия (2 N; 2 x 30 мл). Водный слой подкисляют соляной кислотой (6 М), выделившийся осадок фильтруют под вакуумом и сушат, в результате получают 1,1 г (выход 45,9%) соединения 5
в виде бесцветного кристаллического вещества, т. пл. 152oC.
E) 2,6-Дихлор-4'-метокси-2'-метил-5-н-пропоксибензофенон (Соединение 6)
(R1 = Cl, R2 = 6 - Cl, R3 = CH3, R4 = CH3, R5 = O-H-C3H7, X = O, Y = 0, m = 1, n = 0)
Смесь 2,
6-дихлор-5'-гидрокси-4'-метокси-2'-метилбензофенона (соединение 5; 1,0 г, 3,3 ммоля), н-пропилбромида (0,5 г, 4 ммоля), карбоната калия (2,8 г, 20 ммолей) и этанола (10 мл) перемешивают в течение 6
часов при температуре 80oC, фильтруют и фильтрат упаривают под вакуумом. Остаток подвергают очистке методом быстрой хроматографии в колонке для быстрой хроматографии (силикагель (30 г),
элюирование толуолом (750 мл)). В результате получают 800 мг (70,7% выход) соединения 6 в виде коричневого масла, которое медленно кристаллизуется (т.пл. 73 - 75oC).
F) 2,
6-Дихлор-4',5'-диметокси-2'-метилбензофенон (Соединение 7)
(R1 = Cl, R2 = 6 - Cl, R3 = CH3, R4 = O-CH3, R5 =
OCH3, X = S, Y = O, m = 1, n = 0)
Смесь 2,6-дихлор-4',5'-диметокси-2'-метилбензофенона (соединение 1; 3,25 г, 10,0 ммолей), пентансульфида фосфора (2,22 г, 10,0 ммолей) и толуола
(50 мл) перемешивают при температуре 110oC в течение 5 часов, затем обрабатывают н-диоксаном и перемешивают еще 24 часа при температуре 100oC. Супернатант отделяют от черных
дегтеобразных продуктов реакции, добавляют силикагель (15 г) и растворитель отгоняют под вакуумом. Силикагель с продуктами реакции помещают в верхнюю часть колонки для мгновенной (флэш) хроматографии,
которая заполнена силикагелем (100 г). Колонку последовательно элюируют смесью петролейный эфир/ацетон (98 : 2, объем/объем) и смесью петролейный эфир/ацетон (95 : 5, объем/объем, 750 мл), в
результате получают 40 мг (выход 1,2%) соединения 7 в виде темно-зеленого масла. После этого масло растирают в порошок и трижды обрабатывают циклогексаноном, в результате получают продукт в виде
твердого вещества с т. пл. 142oC.
Пример 3
Используя по существу методики, описанные в примерах 1 и 2, и применяя стандартные последовательности превращений,
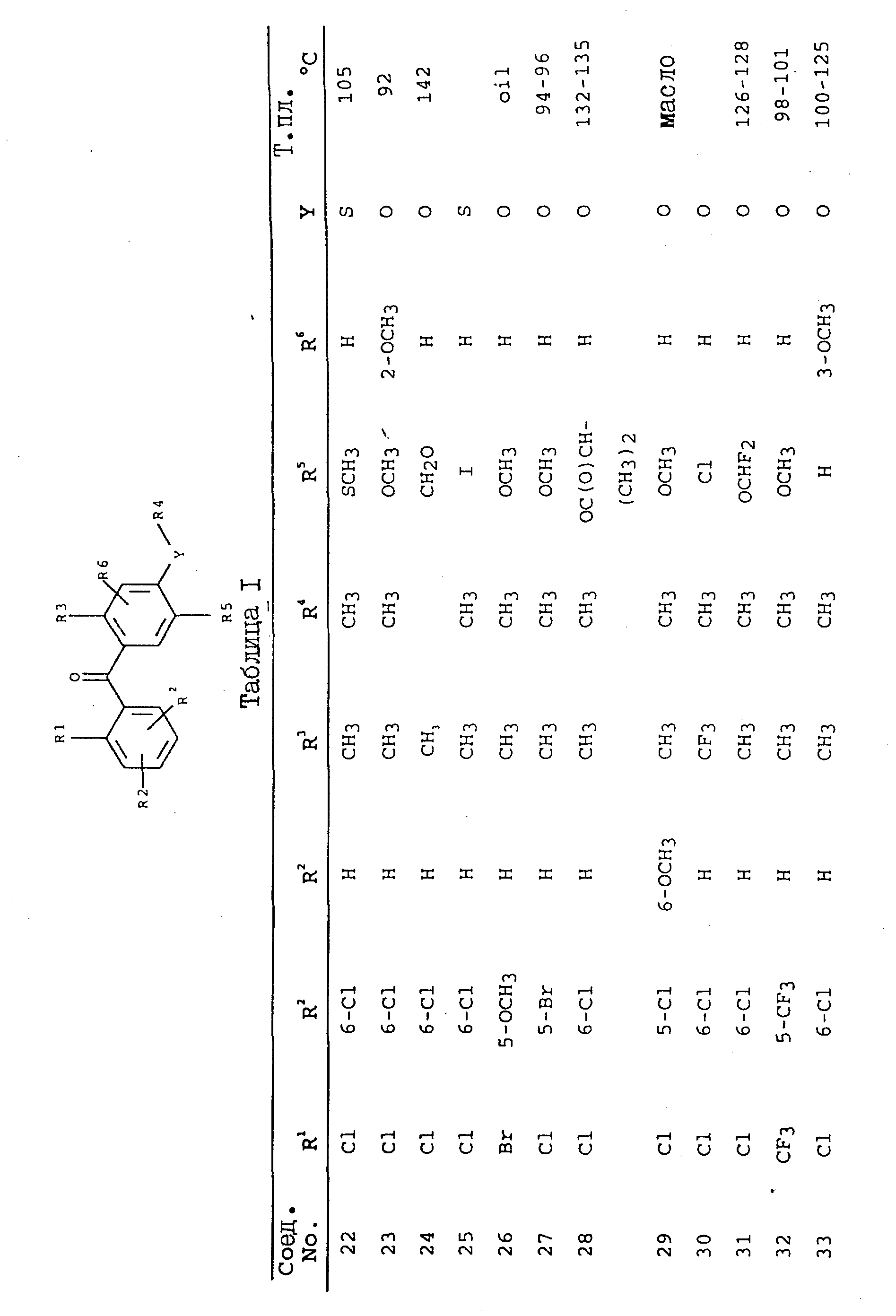
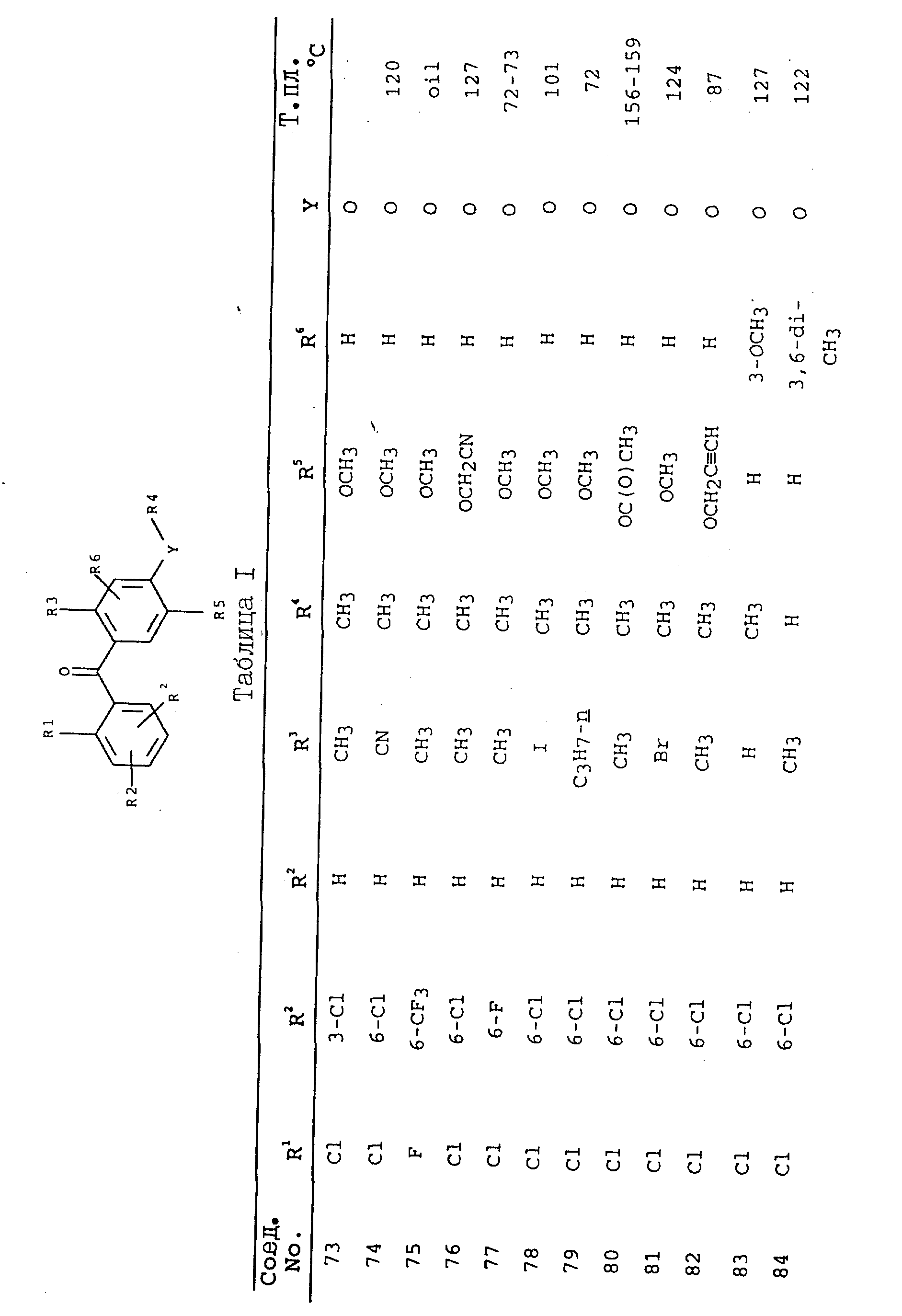
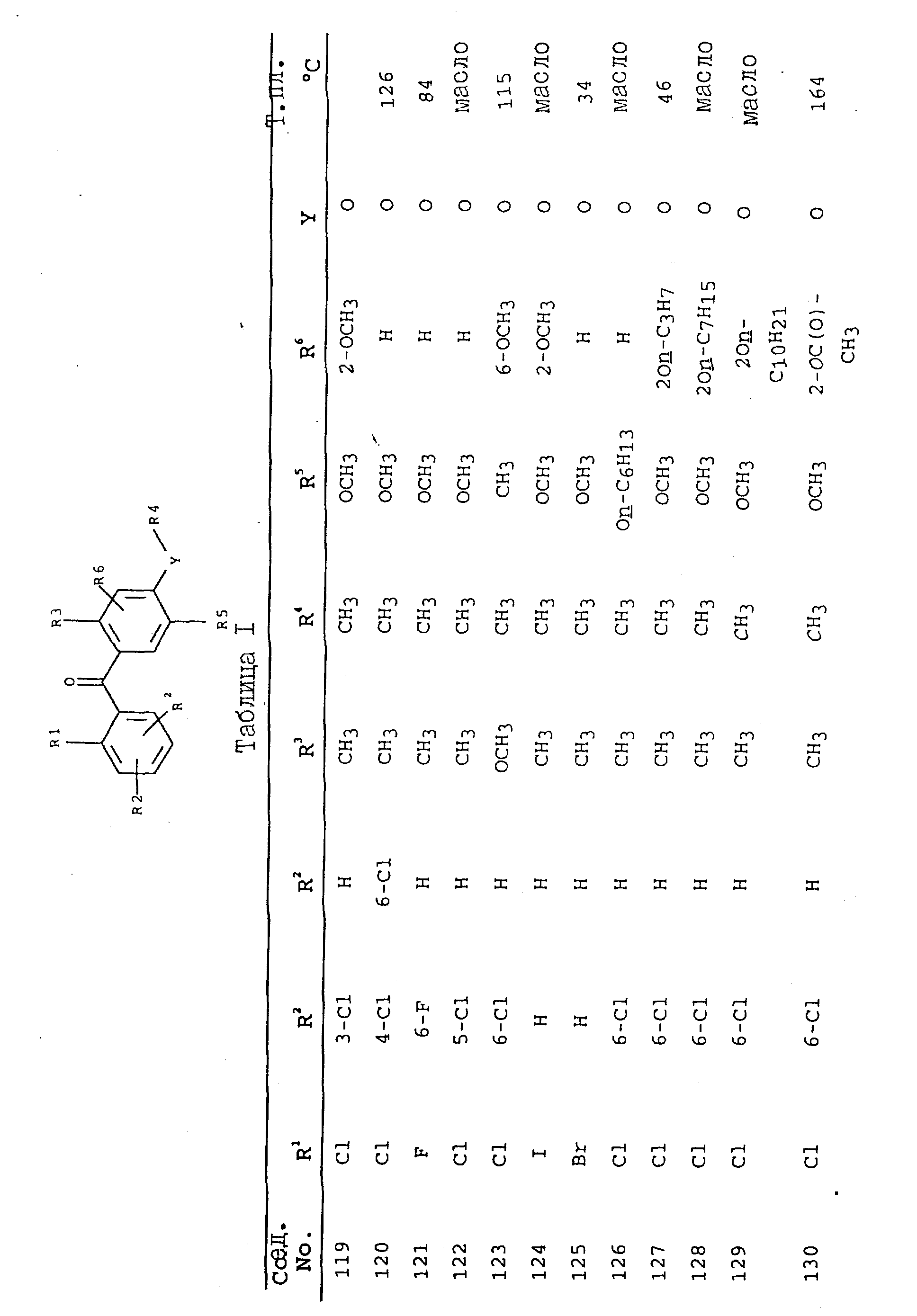
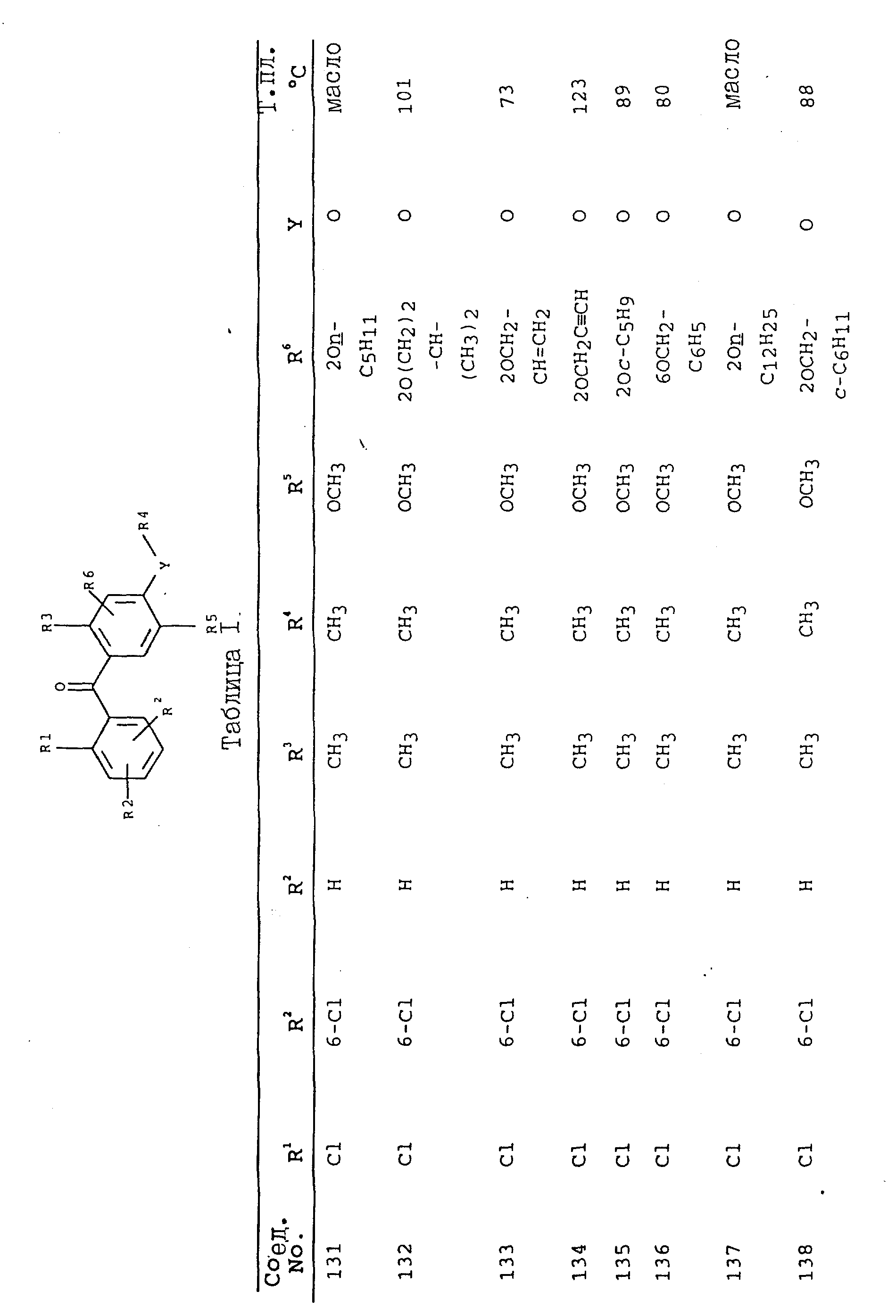
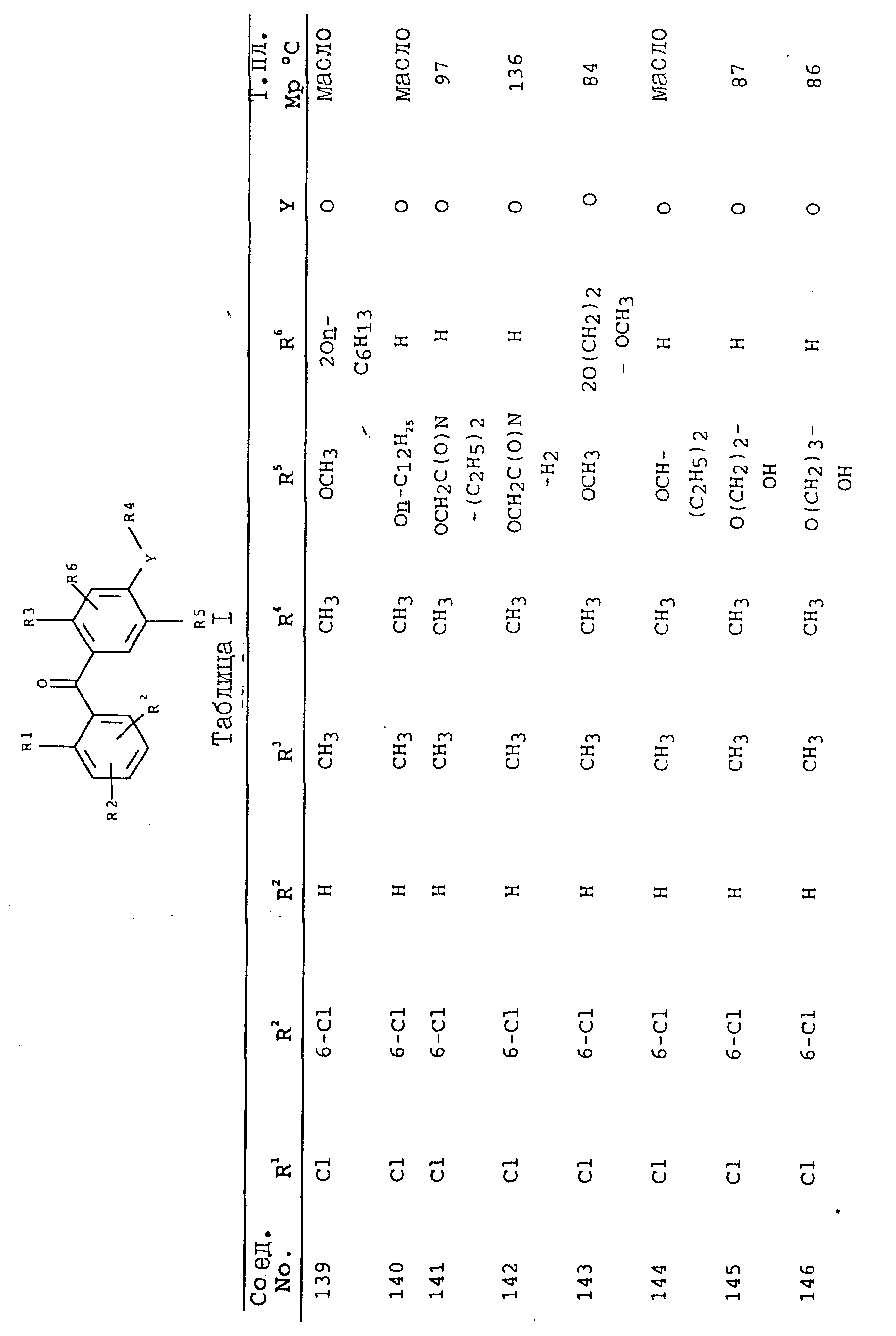
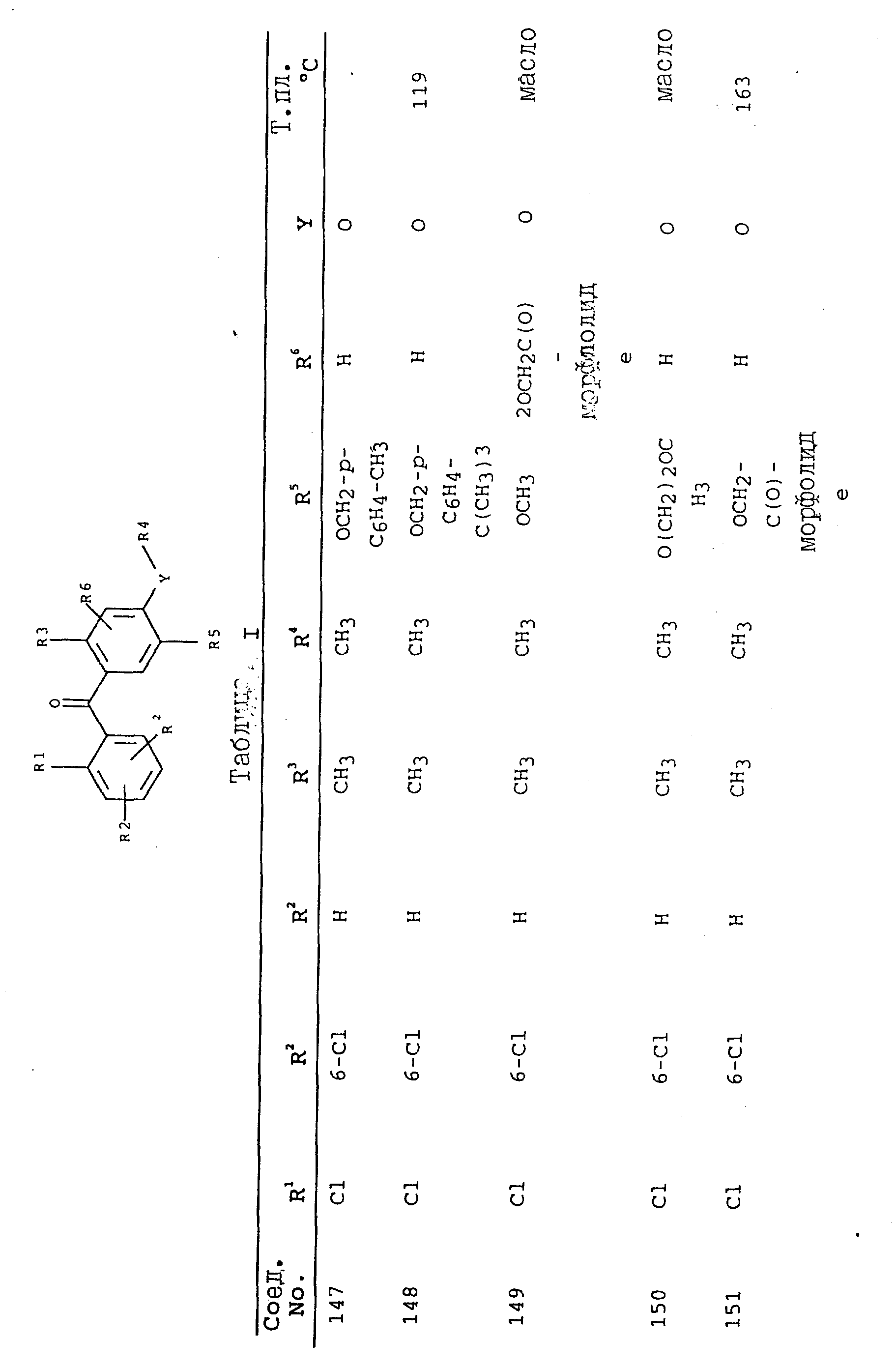
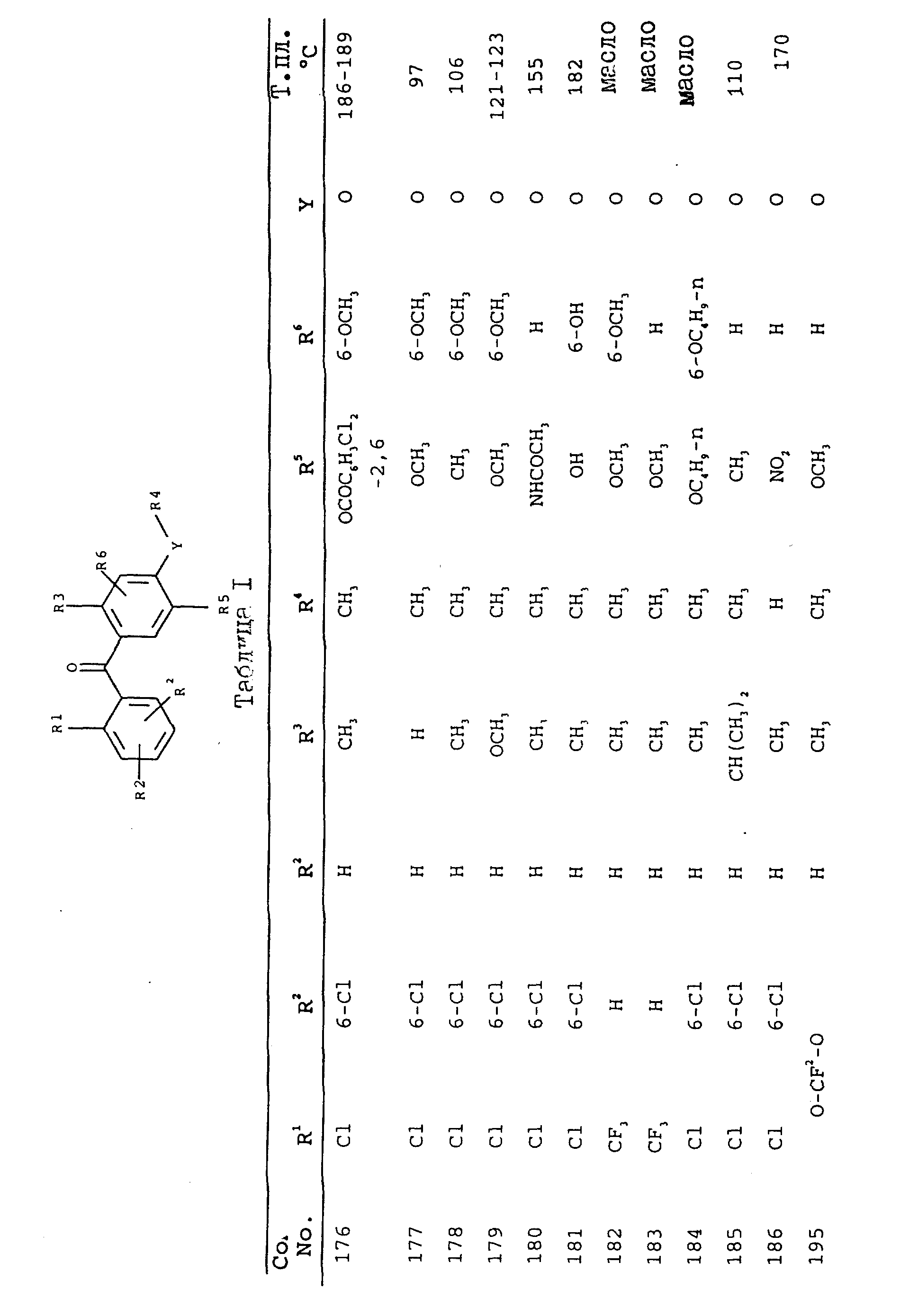
получают соединения, приведенные в табл. I.
Пример 4
2'-н-Бутокси-2,6-дихлор-3'4'-диметокси-6'- метилбензофенон (Соединение 187)
(R1=Cl, R2 =
6-Cl, R3 = CH3, R4 = CH3, R5 = OCH3, R6 = 2-O-(CH2)3-CH3, X = O, Y = O, m = 1, n = 1)
a) 2,6-Дихлор-3'4'-диметокси-2'-гидрокси-6'- метилбензофенон (соединение 59)
Хлорид алюминия (14,67 г, 0,1 моля), 2,6- дихлорбензоилхлорид (20,95 г, 0,1 моля) и раствор 3,4,
5- триметокситолуола (18,22 г, 0,1 моля) в дихлорметане (50 мл) медленно и равномерно добавляют к дихлорметану при перемешивании при температуре 0oC, смесь перемешивают в течение 1 часа при
температуре ледяной бани, затем 16 часов при комнатной температуре, после чего выливают в лед. Органический слой отделяют, промывают разбавленной соляной кислотой и водой, сушат и после добавления
силикагеля (100 г) упаривают под вакуумом. Колонку для быстрой хроматографии наполняют силикагелем (400 г) и помещают в верхнюю часть силикагель из реакционной смеси и элюируют смесью петролейный
эфир/этилацетат (90/10, 1 л; 80/20, 1 л; 50/50, 1 л). В результате получают 10,35 г (выход 30%) 2,6-дихлор-3',4'-диметокси-2'- гидрокси-6'-метилбензофенона, т. пл. 161oC.
b)
Натриевая соль 2,6-дихлор-3'3'-диметокси-2'-гидрокси- 6'-метилбензофенон (соединение 188)
(R1=Cl, R2 = 6-Cl, R3 = CH3, R4=CH3,
R5=OCH3, R6 = 2-OK, X = O, Y = O, m = 1, n = 1)
Раствор 2,6-дихлор-3',
4'-диметокси-2'-гидрокси-6'- метилбензофенона (10,24 г, 30 ммоля) растворяют в
растворе гидроксида калия в этаноле (1,98 г, 30 ммоля; 85% в этаноле (100 мл) и перемешивают при температуре 70oC в течение 15 минут. После этого этанол упаривают под вакуумом. Остаток
растворяют в теплом этаноле (50 мл), добавляют толуол и растворитель снова упаривают под вакуумом. В результате получают 11,7 г соединения 188.
с) 2'-н-Бутокси-2,
6-дихлор-3'4'-диметокси-2'гидрокси-6'-метил- бензофенон (соединение 187)
Смесь калиевой соли 2,6-дихлор-3',4'-диметокси-2'- гидрокси-6'-метилбензофенона (1,13 г; 3 ммоля), 1-бромбутана (0,69
г, 5 ммолей) и диметилформамида (5 мл) перемешивают при температуре 100oC в течение 8 часов, после чего упаривают под вакуумом. Остаток смешивают со взбалтыванием со смесью толуол/вода,
органическую фракцию выделяют, промывают водой и сушат. После добавления силикагеля (5 г) растворитель упаривают. Колонку для флэш-хроматографии заполняют силикагелем (25 г), сверху помещают
силикагель из реакционной смеси и элюируют смесью петролейный эфир/этилацетат (95/5, 500 мл). В результате получают 0,82 г (69% выход) указанного в заглавии соединения в виде бесцветного
кристаллического вещества, т. пл. 70oC.
Пример 5
Используя методики, описанные в примерах 1, 2 и 4, и стандартные последовательности превращений, получают
соединения, приведенные в табл. II.
Пример 6
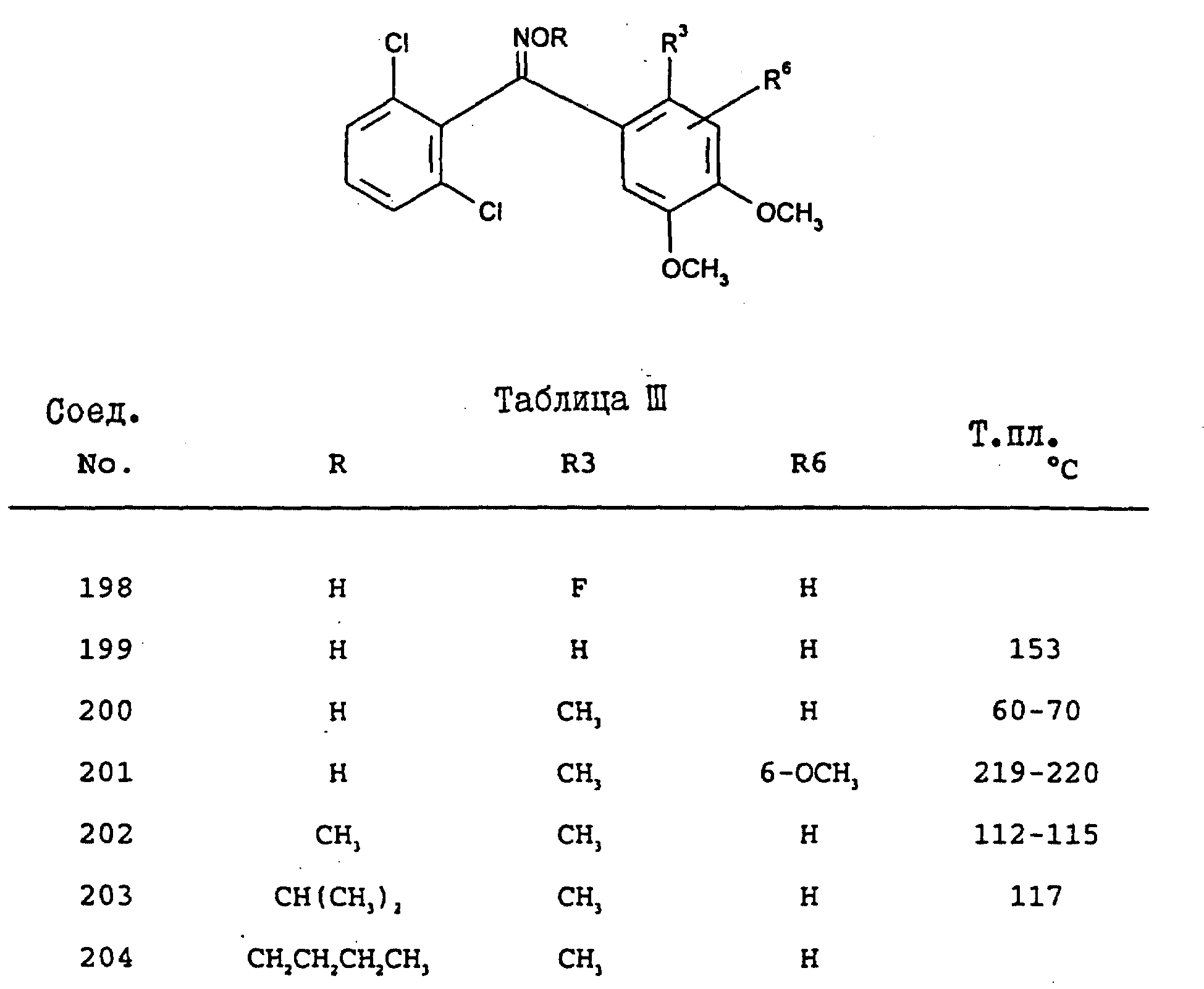
2,6-Дихлор-3'4'-диметокси-бензофенон оксим (соединение 195)
(R1 = Cl, R2 = 6-Cl, R3 = H,
Y = O, R4 = CH3, R5 = H, R6 = 4-OCH3, R = H)
Дисперсию безводного хлорида алюминия (2,93 г, 22 ммоля) в метиленхлориде при температуре
ледяной бани последовательно обрабатывают раствором 2,6-дихлорбензонитрилоксида (3,76 г, 20 ммолей) в метиленхлориде и по каплям раствором вератрола (3,22 г, 24 ммоля) в метиленхлориде перемешивают
полчаса, оставляют нагреваться до комнатной температуры, а затем перемешивают еще 4 - 5 часов при комнатной температуре. Реакционный раствор выливают в смесь соляной кислоты со льдом. Полученную
фазовую смесь разделяют. Органическую фазу промывают 2 М раствором соляной кислоты, обрабатывают силикагелем и упаривают досуха под вакуумом. Остаток переносят в верхнюю часть колонки, наполненной
силикагелем, и элюируют смесью петролейного эфира и этилацетата (5%, 10% и 20% пет. эфира соответственно), в результате получают 1,25 г (выход 19%) указанного в заглавии соединения в виде твердого
вещества белого цвета, т. пл. 153oC.
Пример 7
2,6-Дихлор-4',5'-диметокси-2'-метилбензофенон н-О-пропилоксим (соединение 196)
(R1 = Cl, R2 = 6-Cl, R3 = CH3, Y = O, R4 = CH3, R5 = OCH3, R6 = H, R = CH2CH2CH3)
Раствор 2,6-дихлор-4',5'-диметокси-2'-метилбензофенон оксима (1,5 г, 4,5 ммоля) в безводном тетрагидрофуране обрабатывают 60%-ной дисперсией гидрида натрия в минеральном масле (0,2 г, 4,8 ммоля NaH).
После прекращения выделения газообразного водорода реакционную смесь обрабатывают н-пропилйодидом (0,82 г, 5,3 ммоля), выдерживают 12 часов при комнатной температуре и разбавляют водой. Полученную
фазовую смесь экстрагируют этилацетатом. Органические фазы соединяют и упаривают под вакуумом до получения остатка. Остаток хроматографируют, используя силикагель и смесь петролейный эфир/этилацетат
(8/2), в результате получают 0,4 г (выход 23,8%) указанного в заглавии вещества в виде желтого масла, которое идентифицируют методом ядерно-магнитного резонанса (67:32, отношение изомеров ε/Z
).
Пример 8
2,6-Дихлор-4',5'-диметокси-2'-метилбензофенон н-О-ацетилоксим (соединение 197)
R1 = Cl, R2 = 6-Cl, R3 = CH3, Y
= O, R4 = CH3, R5 = OCH3, R6 = H, R = COCH3
Раствор 2,6-дихлор-4',5'-диметокси-2'-метилбензофенон оксима (2,3 г, 6,8 ммоля) в
безводном тетрагидрофуране обрабатывают 60%-ной дисперсией гидрида натрия в минеральном масле (0,3 г, 7,5 ммолей NaH). После прекращения выделения газообразного водорода реакционную смесь обрабатывают
ацетилхлоридом (0,55 г, 7,5 ммоля) при комнатной температуре, дают смеси экзотермически нагреться до температуры 30oC, перемешивают при температуре окружающей среды в течение 2 часов,
упаривают под вакуумом, обрабатывают водой и фильтруют. Осадок на фильтре промывают водой, сушат и перекристаллизовывают из метанола, в результате получают 1,0 г (выход 38,5%) указанного в заглавии
соединения в виде белого кристаллического вещества, т. пл. 158 - 149oC. Идентификация методом ЯМР показывает 100%-ное содержание Е-изомера.
Пример 9
Используя
методики, описанные в примерах 6 - 8, получают соединения, представленные в табл. III.
Пример 10
2,6-Дихлор-2',3',4'-триметокси-6'-метилбензофенон
Смесь 3,4,
5-триметокситолуола (9,11 г; 50 ммолей), октана (25 мл) и хлорида железа (III) (50 мг) перемешивают при температуре 105oC и, пропуская азот, по каплям в течение 15 минут добавляют 2,
6-дихлорбензоилхлорид (12,04 г; 57,5 ммоля). Смесь перемешивают при температуре 105oC в течение еще 15 минут и после охлаждения до 50oC добавляют 50 мл этилацетата. Полученную
смесь дважды промывают 2 N соляной кислотой, один раз водой и сушат. Этилацетат отгоняют (70oC), оставшуюся жидкость охлаждают при перемешивании. При температуре 50oC к смеси
добавляют петролейный эфир (50 мл). Выпавшие белые кристаллы выделяют, промывают петролейным эфиром и сушат, получают 12,55 г (выход 70,7%) указанного в заглавии вещества, т. пл. 92oC.
Пример 11
2,6-Дихлор-2',3'-дигидро-4'-метокси-6'-метилбензофенон
Смесь 2,6-дихлор-2',3'4'-триметокси-6'- метилбензофенона (1,78 г; 5 ммоля), бромистоводородной кислоты
(7,5 мл; 30%-ный раствор в уксусной кислоте) и уксусной кислоты (7,5 мл) перемешивают при температуре 75oC в течение 2 часов. К полученной смеси добавляют воду и экстрагируют
метиленхлоридом. Экстракт промывают водой и смешивают при взбалтывании с 2 N раствором гидроксида натрия. Щелочной раствор подкисляют соляной кислотой, выделенное вещество растворяют в метиленхлориде,
раствор промывают водой. После упаривания растворителя остаток подвергают очистке методом хроматографии (колонка для флэш-хроматографии с силикагелем (36 г), элюирование 500 мл смеси петролейный
эфир/этилацетата (1: 1, объем/объем). Целевую фракцию упаривают, продукт выпадает в виде желтых кристаллов. После промывки кристаллов петролейным эфиром и фильтрования получают 0,64 г (выход 39%)
указанного в заглавии соединения, т. пл. 182oC.
Пример 12
2'3'-Ди-н-бутокси-2,6-дихлор-4'-метокси-6'-метилбензофенон
Гидрид натрия (0,4 г; 60%; 10 ммолей)
при перемешивании добавляют к раствору 2,6-дихлор-2',3'-дигидрокси-4'-метокси-6'- метилбензофенона (1,64 г; 5 ммолей) в тетрагидрофуране. Растворитель упаривают и остаток растворяют в 30 мл
диметилформамида, к полученной смеси добавляют 1-йод-н-бутан (4,6 г; 25 ммолей) и перемешивают полученную массу при температуре 100oC в течение 8 часов, после чего растворитель упаривают.
Остаток смешивают со смесью толуол/2 N соляная кислота, органический слой отделяют, промывают водой и растворитель упаривают. Остаток очищают методом хроматографии (колонка для флэш-хроматографии,
заполненная 35 г силикагеля; элюирование 500 мл петролейного эфира, содержащего 2% этилацетата), в результате получают желтое масло (0,7 г; выход 32%).
Пример 13
7-(2,
6-Дихлорбензо-ил)-10-метокси-8-метил-2,3,4,5- тетрагидро-1,6-бензодиоксоцин
(R + R, = -О-(CH2)4-O-)
Смесь 2,6-дихлорбензоил-2',3'-дигидрокси
4'-метокси-6'- метилбензофенон (3,27 г; 10 ммолей), карбоната калия (4 г), оксида меди (II) (50 г), 1,4-дибромбутана (2,38 г; 11 ммолей) и диметилформамида (25 мл) перемешивают при комнатной
температуре в течение 15 часов. Затем добавляют воду и экстрагируют дважды этилацетатом. Фракцию этилацетата промывают водой, растворитель упаривают. Остаток подвергают очистке методом хроматографии
(колонка для флэш-хроматографии, наполненная силикагелем, элюирование смесью петролейный эфир/этилацетат в соотношении 8 : 2 (объем/объем)). Из обогащенных фракций продукт может быть кристаллизован с
метанолом. Продукт представляет собой белое кристаллическое вещество (0,56 г; выход 14,7%), т. пл. 103 - 104oC.
Пример 14
2,6-Дихлор-3',
4'-диметокси-6'-метил-2'- фенилацетоксибензофенон
К раствору гидроксида калия (0,66 г; 85%) в метаноле (30 мл) добавляют 2,6-дихлор-3', 4'-диметокси-2'-дигидрокси-6'- метилбензофенон (3,41 г;
10 ммолей). Метанол упаривают, остаток растворяют в диметилформамиде (30 мл), добавляют фенилацетилхлорид (1,70 г; 11 ммолей) и смесь перемешивают в течение 15 часов. Затем добавляют воду и смесь
экстрагируют три раза этилацетатом. После упаривания растворителя к остатку добавляют метанол, в результате получают 1,95 г (выход 42,5%) продукта в виде белого кристаллического вещества, т. пл.
106oC.
Пример 15
2,6-Дихлор-5'-дифторметокси-4'-метокси-2'-метилбензофенон
К раствору 2,6-Дихлор-5'-гидрокси-4'-метокси-2'- метилбензофенона (1,0 г; 3,2
ммолей) в диметоксиэтане (7 мл) добавляют раствор гидроксида натрия (0,6 г; 15 ммолей) в воде (1 мл). Смесь при перемешивании нагревают до температуры 60oC, а затем пропускают через нее в
течение 20 минут газообразный поток хлордифторметана. После дополнительного перемешивания в течение полутора часов растворитель упаривают. Остаток экстрагируют смесью трифторметана и воды.
Органическую фазу отделяют, сушат и упаривают растворитель. Для очистки используют метод быстрой хроматографии (колонка для флэш-хроматографии с силикагелем (30 г), элюирование смесью петролейный
эфир/этилацетат в соотношении 9: 1, затем в соотношении 8:2, затем 7:3 (объем/объем)). Получают 0,6 г продукта (выход 51,8%) в виде белого кристаллического вещества, т. пл. 126 - 128oC.
Пример 16
2,6-Дихлор-5'-пропокси-4'-метокси-2'-метилбензофенон
Смесь 2,6-дихлор-5'-гидрокси-4'-метокси-2'- метилбензофенона и ангидрида пропионовой кислоты (5 мл)
перемешивают при температуре 100oC в течение 5 часов. Добавляют смесь толуол/вода. Органическую фазу сушат и упаривают. Остаток подвергают очистке методом хроматографии (колонка для
флэш-хроматографии с силикагелем (30 г), элюирование толуолом). Толуол отгоняют. После обработки остатка циклогексаном получают 0,5 г продукта (выход 42,6%) в виде белого кристаллического вещества, т.
пл. 142-145oC.
Пример 17
2,6-Дихлор-5'-трет-бутокси- 4'-метокси-2'- метилбензофенон
Раствор 2,6-дихлор-5' гидрокси-4'-метокси-2'- метилбензофенона (3,0 г;
9,6 ммолей) в 50 мл метиленхлорида охлаждают до -70oC, добавляют трифторметансульфоновую кислоту (0,3 мл), затем через полученную смесь в течение 4 часов пропускают поток 2-метилпропена (5,
5 г; 100 ммолей). Добавляют триэтиламин (12,2 мл) и дают смеси нагреться до 20oC. Раствор смешивают при взбалтывании с разбавленным раствором гидроксида натрия и растворитель упаривают.
Остаток подвергают очистке методом хроматографии (колонка для флэш-хроматографии с 30 г силикагеля, элюирование смесью толуол/ацетон 20:1 (объем/объем)). Остаток обрабатывают петролейным эфиром,
получают 0,7 г продукта (выход 20%) в виде белого кристаллического вещества, т. пл. 102oC.
Пример 18
2,6-Дихлор-4'-метокси-2'-метил-5'-феноксибензофенон
Смесь 2-метокси-4-метил-дифенилэфира (2,1 г; 10 ммолей), 2,6- дихлорбензоилхлорида (2,5 г; 12 ммолей) и хлорида железа (III) нагревают до 100oC и перемешивают при этой температуре в течение
4 часов. После охлаждения смесью смешивают при взбалтывании со смесью толуол/вода. Органическую фракцию сушат и растворитель упаривают. Остаток подвергают очистке методом хроматографии (колонка для
флэш-хроматографии с силикагелем (30 г), элюирование смесью толуол/петролейный эфир с соотношением 1: 9 сменяется соотношением 1:1 (объем/объем). Растворитель упаривают, остаток кристаллизуется, после
обработки остатка диизопропиловым эфиром получают 1,5 г (выход 39%) продукта в виде белого кристаллического вещества, т. пл. 113,5oC.
Пример 19
2,
6-Дихлор-4'-метокси-2'-метилбензофенон
Смесь 2,6-дихлорбензоилхлорида (5,24 г; 25 ммолей), 2-метиланизола (2,44 г; 20 ммолей) и хлорида железа (III) (20 мг) нагревают до 100oC и
перемешивают в течение 45 минут. После охлаждения добавляют толуол, смесь смешивают со взбалтыванием с водой, органическую фазу отделяют, сушат и упаривают растворитель. Остаток подвергают очистке
методом хроматографии (колонка для флэш-хроматографии с силикагелем (70 г), элюирование смесью петролейный эфир/толуол, начиная с соотношения 75: 25, кончая соотношением 40: 60 (объем/объем)). После
упаривания растворителя из основной фракции остаток обрабатывают петролейным эфиром, в результате получают 1,33 г продукта (выход 22,5%) в виде белого кристаллического вещества, т. пл. 89o
C.
Пример 20
5'-Бром-2,6-дихлор-4'-метокси-2'-метилбензофенон
К раствору 2,6-дихлор-4'-метокси-2'-метилбензофенона (1,5 г; 5 ммолей в 5 мл трихлорметана) по каплям
при перемешивании добавляют раствор брома (0,25 мл в 3 мл трихлорметана, после чего перемешивают в течение 15 минут при температуре 20oC. Смесь смешивают со взбалтыванием с водой, раствором
гидрокарбоната натрия и водой. Органическую фазу сушат и упаривают. Остаток подвергают очистке методом хроматографии (колонка для флэш-хроматографии с силикагелем (30 г), элюирование смесью
петролейный эфир/этилацетат в соотношении 20: 1, 9:1, 8:2, 7:3 (объем/объем)). После упаривания растворителя остаток кристаллизуется, остаток обрабатывают смесью петролейный эфир/толуол, в результате
получают 0,45 г продукта (выход 24%), т. пл. 159oC.
Пример 20
2,6-Дихлор-5'-нитро-4'-метокси-2'-метилбензофенон
К азотной кислоте (10 мл, 65%) добавляют 2,
6-дихлор-4'-метокси-2'- метилбензофенон (0,75 г; 2,5 ммоля). Смесь перемешивают при температуре 80oC в течение 1 часа. После добавления воды продукт реакции кристаллизуется. В результате
очистки продукта методом хроматографии (колонка для флэш-хроматографии с силикагелем (30 г), элюирование толуолом) получают 0,35 г продукта (выход 41%) в виде белого кристаллического вещества, т. пл.
156 - 160oC.
Пример 21
2,6-Дихлор-4'-гидрокси-5'-нитро-2'-метилбензофенон
К раствору 2,6-дихлор-5'-нитро-4'-метокси-2'- метилбензофенона (1,8 г; 5,3
ммолей) в метиленхлориде (6 мл) добавляют хлорид алюминия (1,5 г; 11 ммолей). Смесь перемешивают в течение 30 минут при температуре 20oC и в течение 1 часа при температуре 45oC,
затем добавляют 5 мл концентрированной соляной кислоты в смеси со льдом. После смешивания со взбалтыванием с 20 мл метиленхлорида органическую фракцию отделяют и обрабатывают 2 N соляной кислотой и
водой, затем сушат, упаривают растворитель, осадок подвергают очистке методом быстрой хроматографии (колонка для флэш-хроматографии с силикагелем (30 г), элюирование толуолом). Остаток, полученный
после упаривания растворителя из основной фракции, обрабатывают диизопропиловым эфиром, в результате получают 1,2 г продукта (выход 73%) в виде твердого кристаллического вещества желтого цвета, т. пл.
170oC.
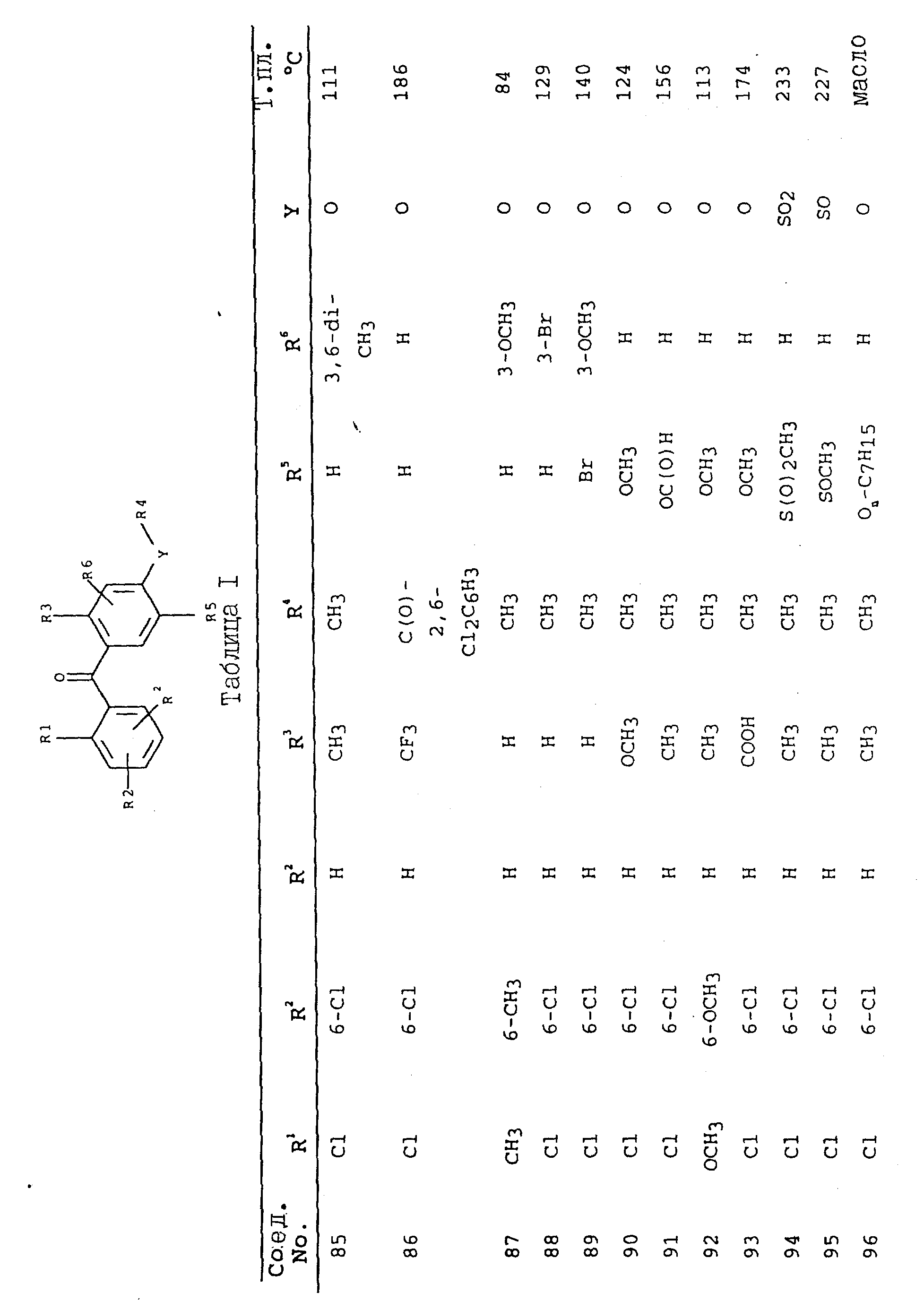
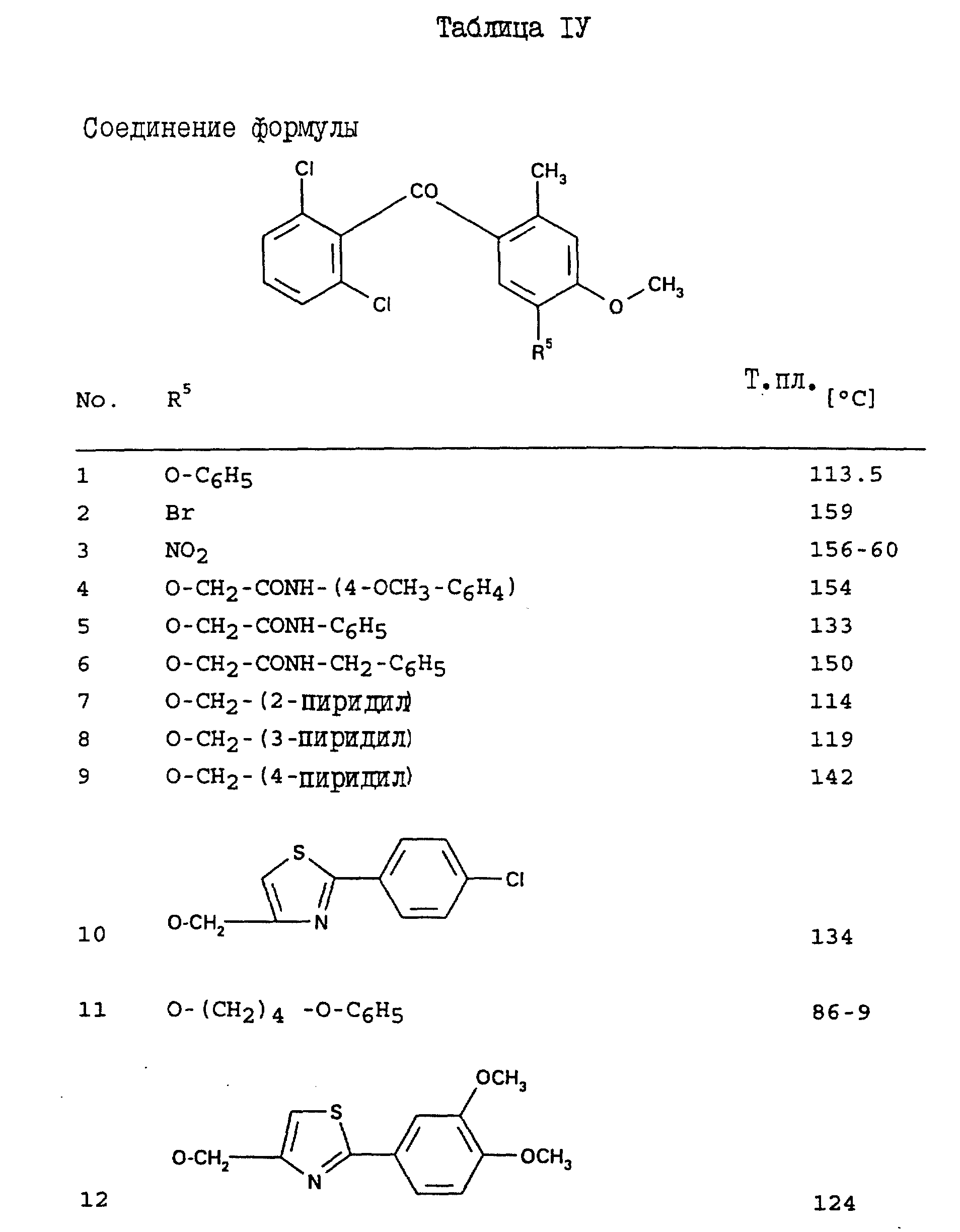
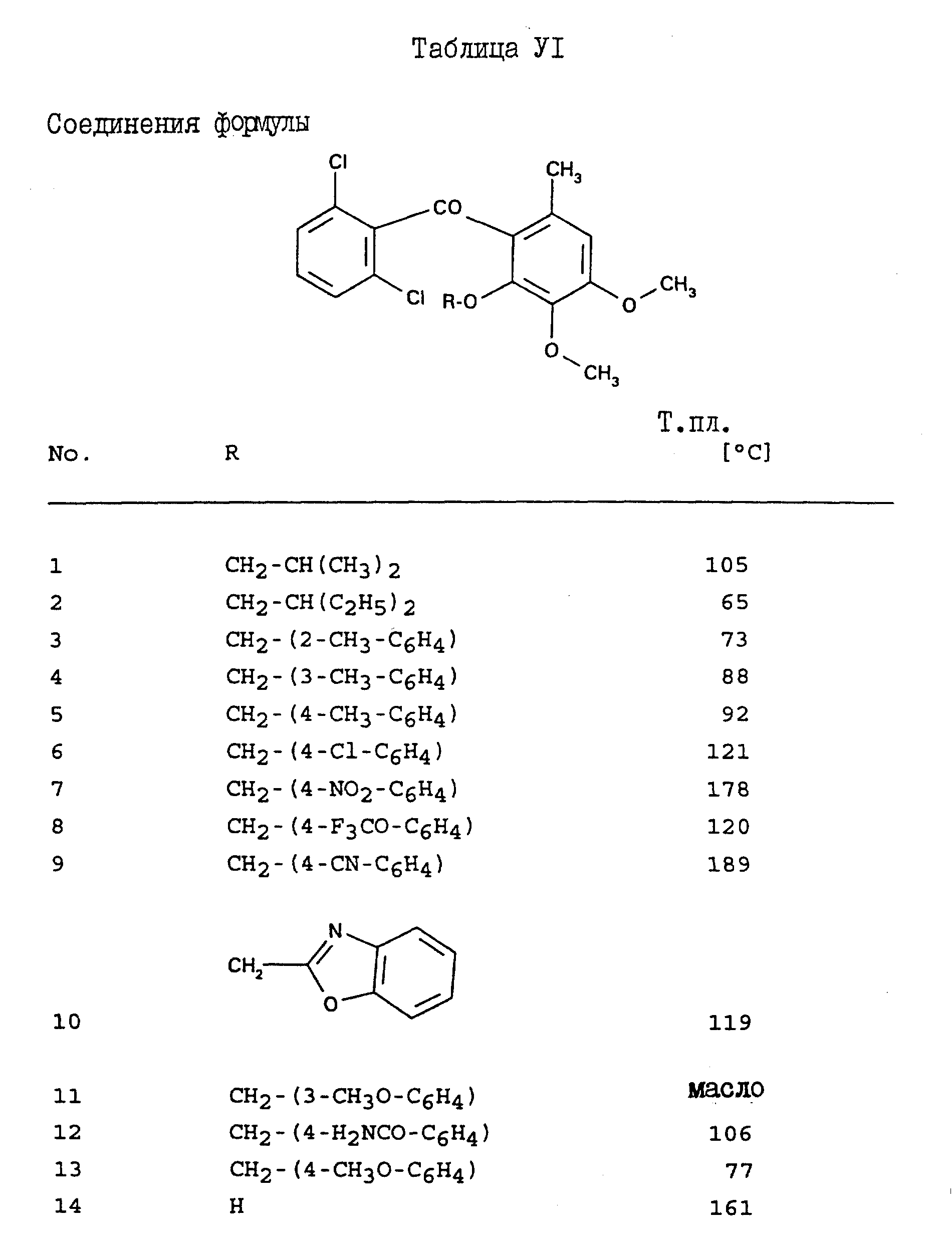
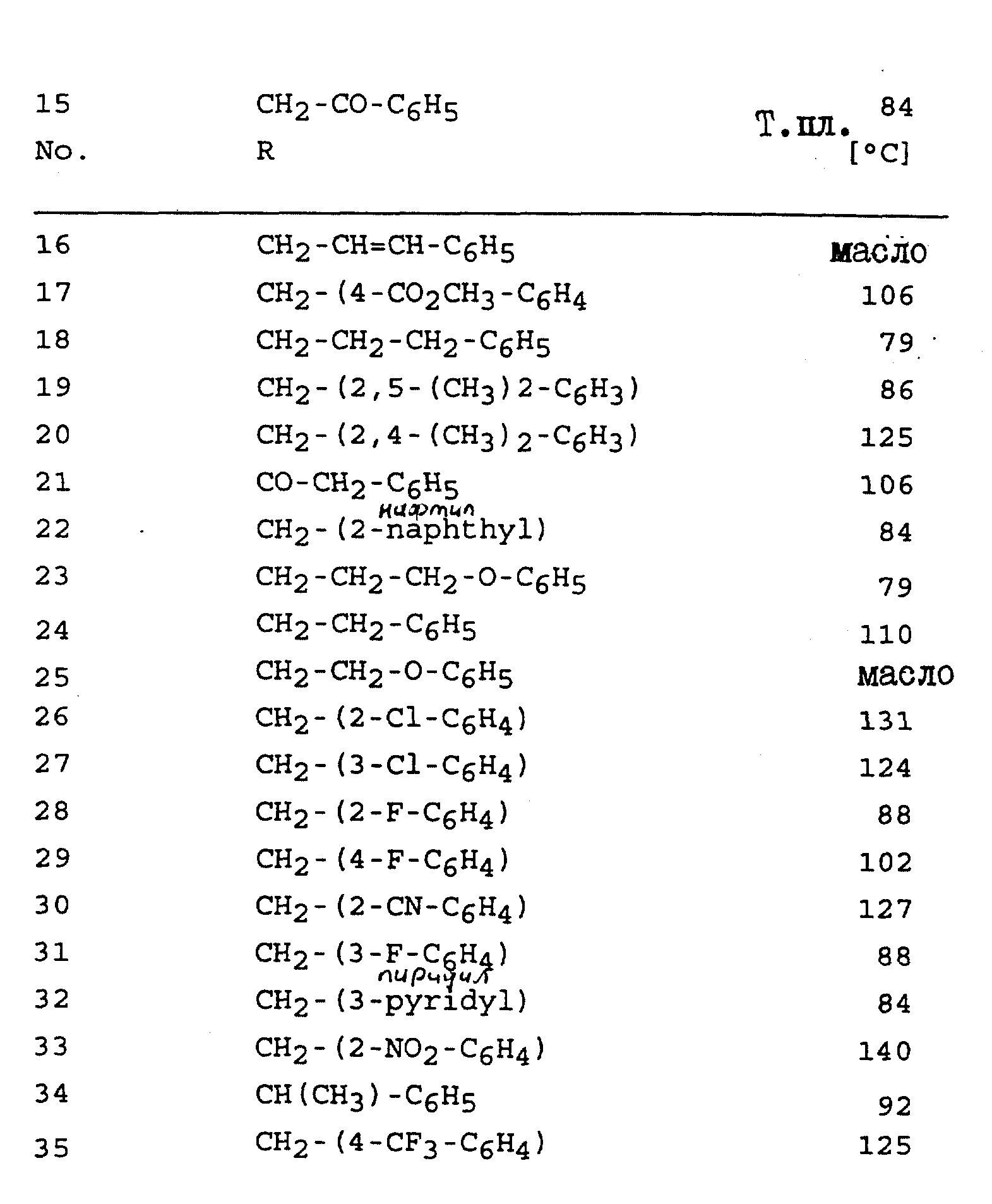
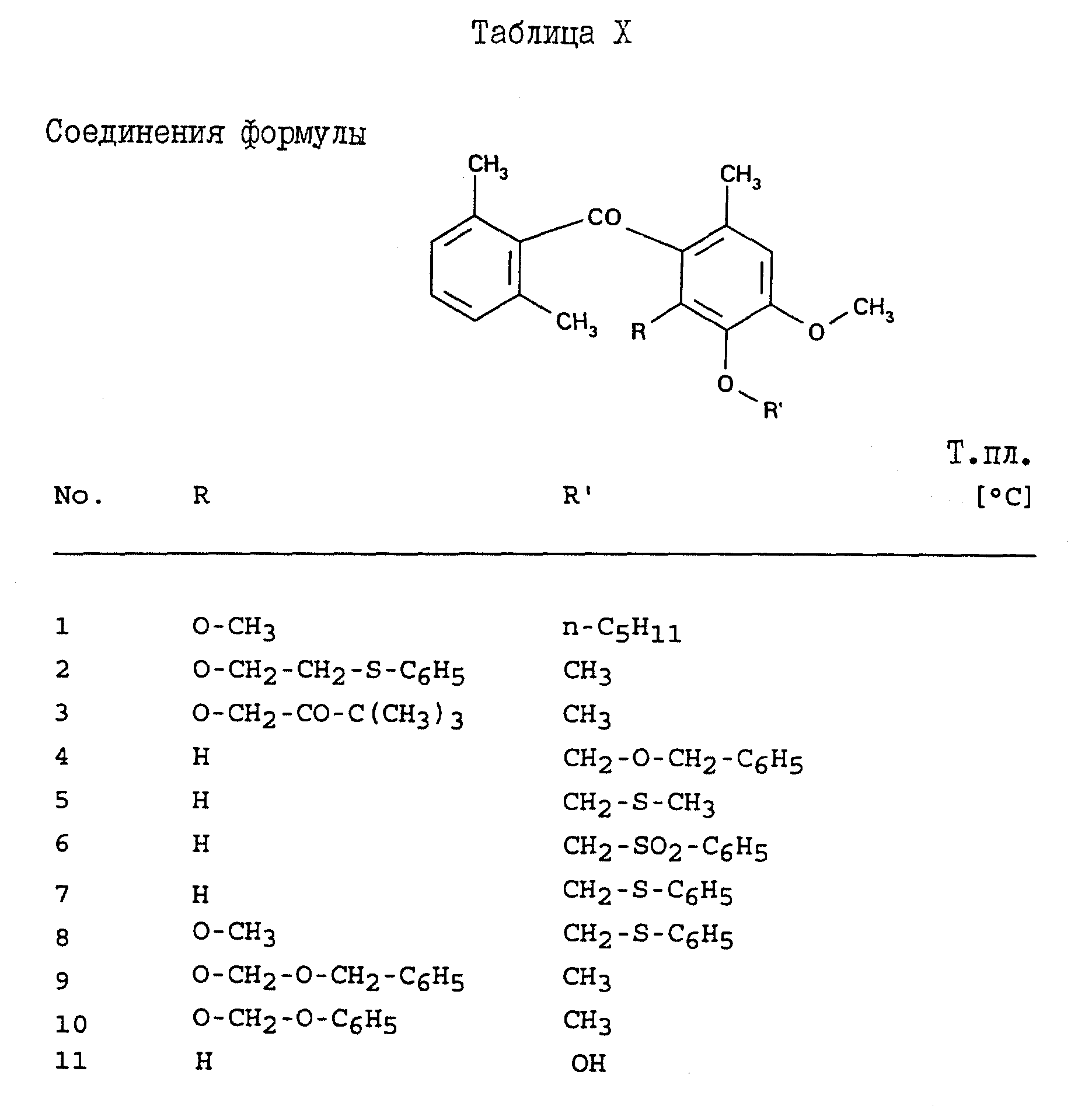
Соединения, представленные в таблицах с IV по X, могут быть получены по методикам, аналогичным описанным в приведенных выше примерах.
Результаты
биологических испытаний
Фунгицидная активность композиций и соединений данного изобретения исследовалась при помощи следующих опытов.
a) a) Активность против мучнистой росы
зерновых культур
(Erysiphe graminis f.sp hordei u f.sp. tritici).
В данном опыте определяется профилактическая активность испытываемых композиций и испытываемых соединений, примененных в виде лиственного опрыскивания. Проростки зерновых культур (ячмень, CV Golden Promise (Золотая надежда); пшеница, CV Kanzler (Канцлер)) выращивают до стадии развития одного листа. Растения опрыскивают раствором испытываемого соединения в воде, который получают из исходного раствора в ацетоне с концентрацией 5000 ppm (ч/млн), содержащего 5000 ppm TRlTON X 155 (неионный ПАВ полиоксиэтилен-эфир). Растения обрабатывают при использовании автоматической линии опрыскивания с распыляющими соплами. Объем опрыскивающего раствора составляет 20 мл. Через один-три дня после обработки проростки инокулируют мучнистой росой посредством встряхивания над ними культурных растений со спорулирующими патогенами (ячмень - Erysiphe graminis f. sp. herdei).
c)
Активность против мучнистой росы виноградной лозы (Uncinula necator)
В данном опыте определяют непосредственную защитную активность испытываемых композиций и испытываемых соединений при
лиственном опрыскивании. Черенки виноградной лозы (CV Muller-Thugau) выращивают до стадии развития 6 - 8 листьев и затем обрезают до четырех листьев равного размера. Растения опрыскивают до стекания в
поливочной камере раствором (20 мл) испытываемого соединения в воде, который получают из исходного раствора в ацетоне с концентрацией 5000 ppm, содержащего 5000 ppm TRITON X 155. Через два дня после
обработки черенки инокулируют конидиями Uncinula necator в специальной сушилке для осаждения спор. Споры выдувают из свежеспорулированных листьев виноградной лозы (исходная культура U, necator) в
верхнюю часть камеры и дают им осаждаться в течение 5 минут. Затем растения выдерживают в фитотроне при ночной температуре 18oC и дневной температуре 22oC в течение интервалов 12
часов ночи и 12 часов дня. Освещенность, которую получают с использованием флуоресцентных трубок, составляет 11200 люкс. Оценку проводят через 21 день посредством визуального наблюдения путем
вычисления процента, который составляет пораженная заболеванием площадь трех самых молодых листьев от площади трех самых молодых листьев контрольных растений. Результаты опытов представлены в таблицах
A и B, которые следуют далее. Соединения идентифицированы номерами, которые присвоены им в описаниях примеров 1 - 9 или в таблицах IV - X. Отсутствие оценки означает то, что ни один из описанных выше
опытов с данным соединением не проводился. Оценка 0 означает наличие заболевания как у необработанного контрольного растения, оценка 100 означает отсутствие заболевания.
Реферат
Описывается способ подавления фитопатогенных грибков или вызываемых ими заболеваний путем обработки их производным бензофенона общей формулы I, где значение заместителей обозначены в п. 1 формулы. Описывается способ защиты растений от повреждения, вызванного фитопатогенным грибком, с использованием соединения формулы I, а также фунгицидная композиция на основе соединения формулы I, описывается также способ получения соединения формулы I. Указанные бензофеноны обладают высокой фунгицидной активностью в широкой области концентраций и могут использоваться в сельском хозяйстве без вредного фитотоксического воздействия на полезные растения. 6 с. и 3 з.п. ф-лы, 12 табл.
Формула
где R1 представляет собой атом галогена, C1-C10-алкильную группу, возможно замещенную галогеном, цианогруппу;
m - 0 или целые числа 1,2,3;
R2 независимо представляет собой атом галогена, C1-C10-алкильную группу, возможно замещенную галогеном, C1-C10-алкоксигруппу, нитрогруппу или, когда R1 и R2 присоединены к соседним атомам углерода, могут вместе образовывать цепочку -СН=СН-СН=СН-;
R3 представляет собой атом водорода или галогена, циано-, карбокси-, гидрокси- или нитрогруппу, C1-C10-алкильную группу, возможно замещенную галогеном, C1-C10-алкоксигруппу, C1-C10-алкилтиогруппу, C1-C10-алкилсульфинил,
C1-C10-алкилсульфонил или аминогруппу, возможно замещенную C1-C6-алкилом или формилом;
R4 представляет собой C1-C10-алкильную группу, возможно замещенную галогеном, или бензоил, замещенный двумя атомами галогена;
R5 представляет собой атом водорода или галогена, нитрогруппу, C1-C10-алкил, C1-C10-алкокси, возможно замещенный галогеном, циано-, гидроксигруппой, фенилом (возможно замещенным C1-C6 -алкилом или трифторметилом), фенокси, пиридилом, карбамоилом, ди(C1-C6)алкилкарбамоилом, фенилкарбамоилом, бензилкарбамоилом, метоксифенилкарбамоилом, фенилтиазолилом (замещенным в фенильной части 1 - 2 заместителями, выбранными из галогена, C1-C6-алкокси, трифторметила), три(C1-C6)алкилсилилом, C3-C10-циклоалкилом; или R5 представляет C2-C6-алкенилокси-, C2-C6-алкинилокси-, C3-C10-циклоалкилокси-, гидрокси-, фенокси-, три(C1-C6)-алкилсилилоксигруппу, -ONa, -OK, -OC(O)R7, OCHR8C(O)R7, SO2-(C1-C6)-алкил, SО-(C1 -C6)-алкил; либо R4 и R5 могут вместе образовывать C1-C4-алкиленоксицепочку;
n равно 0, целое число 1 или 2;
R6 независимо представляет собой атом галогена или C1-C10-алкил, C2-C6-алкенилокси, возможно замещенный фенилом, C2-C6-алкенилокси, C3-C10-циклоалкокси, гидрокси, OC(O)R10-группу, C1-C10-алкокси, необязательно замещенный фенилом (возможно замещенным 1-2 заместителями, выбранными из C1-C6-алкила, галогена, нитро, циано, C1-C6-алкокси, карбамоила, C1-C6-алкоксикарбонила), C3-C10-циклоалкилом, C1-C6-алкокси, морфолинокарбонилом, C1-C6-диалкиламино, (C1-C6)-алкокси-(C1-C6)-алкокси, бензоксазолилом, нафтилом, фенокси; либо R5 и R6 вместе могут образовывать окси-(C1-C4)-алкиленоксицепочку;
R7 представляет собой атом водорода, C1-C10-алкил, C1-C10-алкокси;
R8 представляет собой атом водорода, C1-C10-алкил;
R10 представляет собой C1-C10-алкил, бензил;
Х представляет собой атом кислорода или NOR-группу;
Y представляет собой атом кислорода, или сульфонил-, или сульфинилгруппу;
R представляет собой атом водорода, C1-C10-алкильную, ацетильную группу,
в фунгицидно-эффективном количестве.
2,3,5,6-тетраметил-4',5',6'-триметокси-2'-метилбензофенон;
2,6-дихлор-4', 5'-диметокси-2'-метилбензофенон-О-метилоксим;
2,6-дихлор-5'-трет-бутокси-4'-метокси-2'-метилбензофенон;
2,6-дихлор-5',6'-ди-н-бутокси-4'-метокси-2'-метилбензофенон;
2'-бензоилметокси-2,6-дихлор-3',4'-диметокси-6'-метилбензофенон;
2'-аллилокси-2,6-дихлор-3',4'-диметокси-6'-метилбензофенон;
2'-бензилокси-2,6-дихлор-3', 4'-диметокси-6'-метилбензофенон;
2'-бутокси-2,6-дихлор-3',4'-диметокси-6'-метилбензофенон;
2'-циклогексилметокси-2,6-дихлор-3',4'-диметокси-6'-метилбензофенон;
2'-циклопентилокси-2,6-дихлор-3',4'-диметокси-6'-метилбензофенон;
2,6-дихлор-2',3',4'-триметокси-6'-метилбензофенон;
2,6-дихлор-2'-этокси-3',4'-диметокси-6'-метилбензофенон;
2,6-дихлор-2'-гептилокси-3',4'-диметокси-6'-метилбензофенон;
2,6-дихлор-2'-гексилокси-3',4'-диметокси-6'-метилбензофенон;
2,6-дихлор-3', 4'-диметокси-2'-(2-метоксиэтокси)-6'-метилбензофенон;
2,6-дихлор-3',4'-диметокси-6'-метил-2'-(3-метилбутокси)-бензофенон;
2,6-дихлор-3', 4'-диметокси-6'-метил-2'-(проп-2-инилокси)-бензофенон;
2,6-дихлор-3',4'-диметокси-6'-метил-2'-пентилоксибензофенон;
2,6-дихлор-3',4'-диметокси-6'-метил-2'-пропоксибензофенон;
2,6-дихлор-3',4'-диметокси-2'-метилбензофенон;
2,6-дихлор-4'-метокси-2'-метил-5'-(3-метилбутокси)-бензофенон;
2,6-дихлор-4'-метокси-2'-метил-5'-(проп-2-илокси)-бензофенон;
2,6-дихлор-4'-метокси-2'-метил-5'-(октилокси)бензофенон;
2,6-дихлор-4'-метокси-2'-метил-5'-(пентилокси)-бензофенон;
2,6-дихлор-4'-метокси-2'-метил-5'-пропоксибензофенон;
2, 6-дихлор-4'-метокси-2'-метил-5'-триметилсиланилметоксибензофенон;
2,6-дихлор-5'-(1-этилпропокси)-4'-метокси-2'-метилбензофенон;
2, 6-дихлор-5'-дифторметокси-4'-метокси-2'-метилбензофенон;
2,6-дихлор-5'-этокси-4'-метокси-2'-метилбензофенон;
2,6-дихлор-5'-гептилокси-4'-метокси-2'-метилбензофенон;
2, 6-дихлор-5'-гексилокси-4'-метокси-2'-метилбензофенон;
2,6-дихлор-4',5'-диметокси-2'-метилбензофенон-О-н-пропилоксим;
2,6-дихлор-5'-изобутокси-4'-метокси-2'-метилбензофенон;
2,6-дихлор-5'-изопропокси-4'-метокси-2'-метилбензофенон;
5'-бутокси-2,6-дихлор-4'-метокси-2' -метилбензофенон;
5'-циклогексилметокси-2,6-дихлор-4'-метокси-2' -метилбензофенон;
5'-циклопентилокси-2,6-дихлор-4'-метокси-2' -метилбензофенон;
5' -циклогексилокси-2,6-дихлор-4'-метокси-2' -метилбензофенон;
5'-циклопропилметокси-2,6-дихлор-4'-метокси-2' -метилбензофенон или
5'-децилокси-2,6-дихлор-4'-метокси-2'-метилбензофенон.
где R1 представляет собой атом галогена, C1-C10-алкил, возможно замещенный галогеном или цианогруппу;
R2 независимо представляет собой атом галогена, C1-C10-алкил, возможно замещенный галогеном, C1-C10-алкокси или, когда R1 и R2 присоединены к соседним атомам углерода, они могут вместе образовывать цепочку -CH=CH-CH=CH-;
m принимает целые значения 1,2,3,4;
R3 представляет собой атом водорода, галогена, C1-C10-алкил, возможно замещенный галогеном, C1-C10-алкоксигруппу, C2-C6-алкенил, C1-C10 -алкилтио, C1-C10-алкилсульфенил, C1-C10-алкисульфонил, циано-, карбокси-, гидрокси-, нитрогруппу или аминогруппу, возможно замещенную C1-C6-алкилом или формилом;
R4 представляет собой C1-C10-алкил, возможно замещенный галогеном, или бензоил, замещенный двумя атомами галогена;
R5 представляет собой группу OH, атом галогена, возможно замещенный C1-C10-алкокси, C2-C6-алкенилокси, C2-C6-алкинилокси, C1-C10-алкилтио;
цикло-C3-C10-алкилоксигруппу, три-C1-C6-алкилсилилоксигруппу, -ONa, -OK, - OC(O)R7, OCHR8C(O)R7, -S(O)R8, -SO2R8; или R4 и R5 могут вместе образовывать C1-C4-алкиленоксицепочку;
n равно 0 или принимает целые значения 1 или 2;
R6 независимо представляет гидроксильную группу, -OC(O)R10-группу или необязательно замещенную C1-C10 -алкоксигруппу или, когда R5 и R6 присоединены к соседним атомам углерода, они могут образовывать цепочку -CH=CH-CH= CH- или окси-(C1-C4)-алкиленоксицепочку;
R7 представляет собой атом водорода, C1-C10-алкил, C1-C10-алкоксигруппу;
R8 и R10 независимо друг от друга представляют собой атом водорода или C1-C10-алкил;
X представляет собой атом кислорода или серы или NOR-группу;
Y представляет собой атом кислорода или серы, или сульфонил-, или сульфинилгруппу;
R представляет собой атом водорода, C1-C10-алкил, ацетил при условии, что, когда X представляет собой атом кислорода или серы и:
i) когда R1 представляет собой атом галогена, тогда R2 должен отличаться от атома галогена или должен представлять собой не более чем одну C1-C10 -алкильную или C1-C10-алкоксильную группу;
ii) когда R1 представляет C1-C10-алкильную группу, тогда R2 должен отличаться от C1-C10-алкила;
iii) когда m = 1, тогда R2 не должен представлять собой C1-C10-алкоксигруппу;
iv) когда R3 представляет собой галоген-C1-C10-алкильную группу, тогда R1 и R2 не должны представлять собой галоген-C1-C10-алкильную группу;
v) когда Y представляет собой 0, то R3 должен отличаться от водорода, а n должно быть равно 1 или 2.

где Q представляет собой атом водорода или хлора;
R6 представляет собой атом водорода или C1-C8-алкоксигруппу, необязательно замещенную одним или более атомами фтора, или одним заместителем из группы, включающей фенил, фенокси, фенилтио или бензилоксигруппу, где фенильный фрагмент должен содержать заместитель из группы, включающей галоген, C1-C4-алкил, C1-C4-алкокси, трифторметил, трифторметокси;
R5 - группа OR1, где R1 представляет собой водород или C1-C4-алкил, необязательно содержащий один или более заместителей из группы, включающей галоген, C1-C4-алкокси-, фенил-, фенокси- или фенилтиогруппу, где фенильный фрагмент может содержать заместитель из группы, включающей галоген, C1-C4-алкил, C1-C4-алкокси, трифторметил или трифторметоксигруппу, при условии, что, когда Q и R6 представляет собой водород, R1 не должен быть метилом.
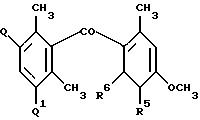
где Q и Q1 независимо представляет собой атом водорода или метильную группу;
R6 представляет собой атом водорода или C1-C8-алкоксигруппу, необязательно замещенную одним или более атомами фтора, фенилом, фенокси-, фенилтио- или бензилоксигруппой, где фенильный фрагмент может содержать один или более заместителей из группы, включающей галоген, C1-C4-алкил, C1 -C4-алкокси, трифторметил или трифторметоксигруппу;
R5 - группа OR1, где R1представляет собой водород или C1- C10-алкил, необязательно содержащий один или более заместителей из группы, включающей галоген, C1-C4-алкокси, фенил, фенокси или фенилтиогруппу, где фенильный фрагмент может содержать один или более заместителей из группы, включающей галоген, C1-C4-алкил, C1-C4-алкокси, трифторметильную или трифторметоксигруппы.
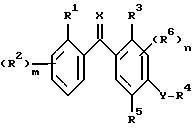
где R1 - R6, X, Y, m и n определены в п.1.
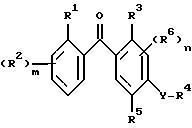
где R1 представляет атом галогена, C1-C10-алкил, возможно замещенный галогеном, C1-C10-алкокси, цианогруппу;
m означает 0 или целые числа 1,2,3,4;
R2 независимо представляет собой атом галогена C1-C10-алкил, возможно замещенный галогеном, C1-C10-алкокси, нитрогруппу или, когда R1 и R2 присоединены к соседним атомам углерода, они вместе образуют цепочку -CH=CH-CH= CH-;
R3 представляет собой атом водорода, галогена, циано-, карбокси-, гидрокси- или нитрогруппу, C1-C10-алкил, возможно замещенный галогеном, C1-C10-алкоксигруппу, C2-C6-алкенил, C1-C10-алкилтио, C1-C10-алкилсульфенил,
C1-C10-алкилсульфонил, аминогруппу;
R4 представляет собой водород, C1-C10-алкил, возможно замещенный галогеном, или бензоил, замещенный двумя атомами галогена;
R5 представляет собой OH-группу, атом водорода или галогена, нитрогруппу, C1-C10-алкил, возможно замещенный галогеном, возможно замещенный C1-C10-алкокси или C2-C6-алкенилокси, C2-C6-алкинилокси, цикло, C3-C10-алкилокси, - ONa, -OK, - OC(O)R7, C1-C10-алкилтио, гидрокси, фенилокси-, три-C1-C6-алкилсилилоксигруппу, OCHR8C(O)R7, -S(O)2R8, SOR8, или R4 и R5 могут вместе образовывать C1-C4-алкиленоксицепочку;
n равно 0 или целому числу 1 или 2;
R6 независимо представляют собой атом галогена, C1-C10-алкил, возможно замещенный C1-C10-алкокси, C2-C6-алкенилокси, C2-C6-алкинилокси, гидрокси, - OC(O)R10- группу, или, когда R5 и R6 присоединены к соседним атомам углерода, они могут образовывать цепочку -CH=CH-CH=CH- или окси-C1-C4-алкилен-оксицепочку;
R7 представляет собой атом водорода, C1-C10-алкил, C1-C10-алкоксигруппу;
R8 и R10 независимо представляют атом водорода, C1-C10-алкил;
Y представляет собой атом кислорода или серы или сульфонил-, или сульфинилгруппу;
R представляет собой атом водорода, C1-C10-алкил, C1-C10-ацильную группу,
отличающийся тем, что соединение формулы II
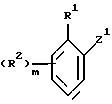
где Z1 представляет собой COСl;
R1 и R2 имеют значения, определенные выше,
подвергают взаимодействию с соединением формулы III
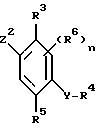
где Z2 означает водород; R3, R5, R6, n приведены выше.
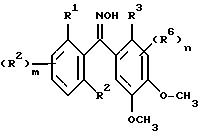
где n равно 0 или целое число 1,2,3;
R1 представляет атом галогена, C1-C10-алкил, возможно замещенный галогеном, C1-C10-алкокси, цианогруппу;
R2 независимо представляет собой атом галогена, C1-C10-алкил, возможно замещенный галогеном, C1-C10-алкокси, нитрогруппу или, когда R1 и R2 присоединены к соседним атомам углерода, они вместе образуют цепочку -CH=CH-CH= CH-;
R3 - галоген, водород, циано-, карбокси-, гидрокси- или нитрогруппа , C1-C10-алкил, возможно замещенный галогеном, C1-C10-алкокси, C2 -C6-алкенил, C1-C10-алкилтио, C1-C10-алкилсульфинил, C1-C10-алкилсульфонил или аминогруппа;
R6 независимо представляет собой атом галогена, C1-C10-алкил, возможно замещенный галогеном, C1-C10-алкокси, C2-C6-алкенилокси, C2-C6-алкинилокси, гидрокси-, - OC(O)R10- группу, или, когда R5 и R6 присоединены к соседним атомам углерода, они могут вместе образовывать цепочку -CH=CH-CH=CH- или окси-C1-C4-алкиленоксицепочку,
отличающийся тем, что соединение формулы VI
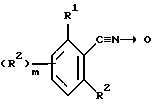
где значения R1, R2, n приведены выше,
подвергают взаимодействию с по меньшей мере одним молярным эквивалентом соединения формулы VII
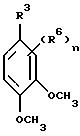
где значения R3, R6, n приведены выше,
в присутствии по меньшей мере одного молярного эквивалента хлорида алюминия и неполярного растворителя для образования промежуточного продукта и его гидролизуют в присутствии кислоты и воды с получением продукта соединения формулы Ib.

Комментарии