Пестицидные композиции и связанные с ними способы - RU2654327C2
Код документа: RU2654327C2
Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по предварительной заявке U.S. №61/739045, поданной 19 декабря 2012 г., полное содержание которой явно включено в настоящую заявку в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение, раскрытое в настоящем документе, относится к области способов получения молекул, которые применимы в качестве пестицидов (например, акарицидов, инсектицидов, моллюскоцидов и нематоцидов), к таким молекулам и способам применения таких молекул для борьбы с вредителями.
УРОВЕНЬ ТЕХНИКИ
Во всем мире вредители ежегодно приводят к гибели миллионов людей. Кроме того, имеется больше десяти тысяч видов вредителей, которые приводят к потерям в сельском хозяйстве. Ежегодные потери в сельском хозяйстве во всем мире составляют триллионы долларов США.
Термиты повреждают все виды частных и общественных строений. Ежегодные потери за счет повреждения термитами во всем мире составляют триллионы долларов США.
Вредители хранящихся пищевых продуктов поедают и ухудшают качество хранящихся пищевых продуктов. Ежегодные потери хранящихся пищевых продуктов во всем мире составляют триллионы долларов США и, что важнее, лишаются пищи нуждающихся в ней люди.
Настоятельно необходимы новые пестициды. У некоторых вредителей развивается устойчивость к применяющимся в настоящее время пестицидам. Сотни видов вредителей устойчивы к одному или большему количеству пестицидов. Хорошо известно развитие устойчивости по отношению к некоторым из старых пестицидов, таких как ДДТ, карбаматы и фосфорорганические соединения. Однако устойчивость развивается и по отношению к некоторым из новых пестицидов, например, по отношению к имидаклоприду.
Поэтому по многим причинам, включая указанные выше причины, необходимы новые пестициды.
ОПРЕДЕЛЕНИЯ
Примеры, приведенные в определениях, обычно не являются исчерпывающими, и их не следует рассматривать в качестве ограничивающих изобретение, раскрытое в настоящем документе. Следует понимать, что заместитель должен соответствовать правилам образования химических связей и ограничениям по стерической совместимости для конкретной молекулы, к которой он присоединен.
''Алкенил'' означает ациклический ненасыщенный (содержащий по меньшей мере одну двойную связь углерод-углерод), разветвленный или неразветвленный заместитель, состоящий из атомов углерода и водорода, например, винил, аллил, бутенил, пентенил и гексенил.
''Алкенилоксигруппа'' означает алкенил, дополнительно содержащий ординарную связь углерод-кислород, например, аллилоксигруппу, бутенилоксигруппу, пентенилоксигруппу, гексенилоксигруппу.
''Алкоксигруппа'' означает алкил, дополнительно содержащий ординарную связь углерод-кислород, например, метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу и трет-бутоксигруппу.
''Алкил'' означает ациклический, насыщенный разветвленный или неразветвленный заместитель, состоящий из атомов углерода и водорода, например, метил, этил, (С3)алкил, который представляет собой н-пропил и изопропил), (C4)алкил, который представляет собой н-бутил, втор-бутил, изобутил и трет-бутил.
''Алкинил'' означает ациклический ненасыщенный (содержащий по меньшей мере одну тройную связь углерод-углерод), разветвленный или неразветвленный заместитель, состоящий из атомов углерода и водорода, например, этинил, пропаргил, бутинил и пентинил.
''Алкинилоксигруппа'' означает алкинил, дополнительно содержащий ординарную связь углерод-кислород, например, пентинилоксигруппу, гексинилоксигруппу, гептинилоксигруппу и октинилоксигруппу.
''Арил'' означает циклический ароматический заместитель, состоящий из атомов водорода и углерода, например, фенил, нафтил и бифенил.
''(Сх-Cy)'', где нижние индексы ''х'' и ''y'' являются целыми числами, такими как 1, 2 или 3, означающими диапазон количества атомов углерода в заместителе, например, (С1-С4)алкил означает метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил и трет-бутил, каждый по отдельности.
''Циклоалкенил'' означает моноциклический или полициклический ненасыщенный (содержащий по меньшей мере одну двойную связь углерод-углерод) заместитель, состоящий из атомов углерода и водорода, например, циклобутенил, циклопентенил, циклогексенил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
''Циклоалкенилоксигруппа'' означает циклоалкенил, дополнительно содержащий ординарную связь углерод-кислород, например, циклобутенилоксигруппу, циклопентенилоксигруппу, норборненилоксигруппу и бицикло[2.2.2]октенилоксигруппу.
''Циклоалкил'' означает моноциклический или полициклический, насыщенный заместитель, состоящий из атомов углерода и водорода, например, циклопропил, циклобутил, циклопентил, норборнил, бицикло[2.2.2]октил и декагидронафтил.
''Циклоалкоксигруппа'' означает циклоалкил, дополнительно содержащий ординарную связь углерод-кислород, например, циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу, норборнилоксигруппу и бицикло[2.2.2]октилоксигруппу.
''Галоген'' означает фтор, хлор, бром и йод.
''Галогеналкоксигруппа'' означает алкоксигруппу, дополнительно содержащую от одного до максимально возможного количества одинаковых или разных галогенов, например, фторметоксигруппу, трифторметоксигруппу, 2,2-дифторпропоксигруппу, хлорметоксигруппу, трихлорметоксигруппу, 1,1,2,2-тетрафторэтоксигруппу и пентафторэтоксигруппу.
''Галогеналкил'' означает алкил, дополнительно содержащий от одного до максимально возможного количества одинаковых или разных галогенов, например, фторметил, трифторметил, 2,2-дифторпропил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
''Гетероциклил'' означает циклический заместитель, который может быть полностью насыщенным, частично ненасыщенным или полностью ненасыщенным, где циклическая структура содержит по меньшей мере один атом углерода и по меньшей мере один гетероатом, где указанный гетероатом представляет собой азот, серу или кислород. В случае серы этот атом может находиться в других состояниях окисления, таких как в сульфоксиде и сульфоне. Примеры ароматических гетероциклилов включают, но не ограничиваются только ими, бензофуранил, бензоизотиазолил, бензоизоксазолил, бензоксазолил, бензотиенил, бензотиазолил, циннолинил, фуранил, имидазолил, индазолил, индолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, тетразолил, тиазолинил, тиазолил, тиенил, триазинил и триазолил. Примеры полностью насыщенных гетероциклилов включают, но не ограничиваются только ими, пиперазинил, пиперидинил, морфолинил, пирролидинил, оксетанил, тетрагидрофуранил, тетрагидротиенил и тетрагидропиранил. Примеры частично ненасыщенных гетероциклилов включают, но не ограничиваются только ими, 1,2,3,4-тетрагидрохинолинил, 4,5-дигидрооксазолил, 4,5-дигидро-1H-пиразолил, 4,5-дигидроизоксазолил и 2,3-дигидро-[1,3,4]-оксадиазолил.
Дополнительные примеры включают следующие
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем документе раскрыты соединения, описывающиеся следующей формулой (''формула 1''):
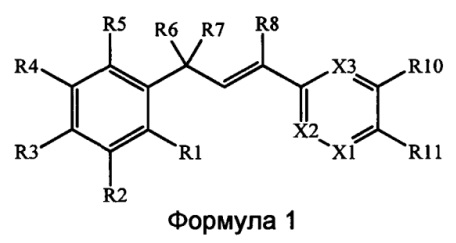
в которой:
(a) R1 выбран из группы, включающей
(1) Н, F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-С8)алкил, S(галоген(C1-C8)алкил), S(О)(C1-C8)алкил, S(О)(галоген(C1-С8)алкил), S(О)2(C1-C8)алкил, S(О)2(галоген(C1-С8)алкил), N(R14)(R15),
(2) замещенный (C1-C8)алкил, где указанный замещенный (C1-С8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
(3) замещенный галоген(C1-C8)алкил, где указанный замещенный галоген(C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
(4) замещенную (C1-C8)алкоксигруппу, где указанная замещенная (C1-C8)алкоксигруппа содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2, и
(5) замещенную галоген(C1-C8)алкоксигруппу, где указанная замещенная галоген(C1-C8)алкоксигруппа содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2;
(b) R2 выбран из группы, включающей
(1) Н, F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-С8)алкил, S(галоген(C1-C8)алкил), S(O)(C1-C8)алкил, S(О)(галоген(C1-C8)алкил), S(О)2(C1-C8)алкил, S(О)2(галоген(C1-C8)алкил), N(R14)(R15),
(2) замещенный (C1-C8)алкил, где указанный замещенный (C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
(3) замещенный галоген(C1-C8)алкил, где указанный замещенный галоген(C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
(4) замещенную (C1-C8)алкоксигруппу, где указанная замещенная (C1-C8)алкоксигруппа содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2, и
(5) замещенную галоген(C1-C8)алкоксигруппу, где указанная замещенная галоген(C1-C8)алкоксигруппа содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2;
(c) R3 выбран из группы, включающей
(1) Н, F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), S(O)(C1-C8)алкил, S(О)(галоген(C1-C8)алкил), S(О)2(C1-C8)алкил, S(О)2(галоген(C1-C8)алкил), N(R14)(R15),
(2) замещенный (C1-C8)алкил, где указанный замещенный (C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
(3) замещенный галоген(C1-C8)алкил, где указанный замещенный галоген(C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
(4) замещенную (C1-C8)алкоксигруппу, где указанная замещенная (C1-C8)алкоксигруппа содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2, и
(5) замещенную галоген(C1-C8)алкоксигруппу, где указанная замещенная галоген(C1-C8)алкоксигруппа содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2;
(d) R4 выбран из группы, включающей
(1) Н, F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), S(О)(C1-C8)алкил, S(О)(галоген(C1-C8)алкил), S(О)2(C1-C8)алкил, S(О)2(галоген(C1-C8)алкил), N(R14)(R15),
(2) замещенный (C1-C8)алкил, где указанный замещенный (C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
(3) замещенный галоген(C1-C8)алкил, где указанный замещенный галоген(C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
(4) замещенную (C1-C8)алкоксигруппу, где указанная замещенная (C1-C8)алкоксигруппа содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2, и
(5) замещенную галоген(C1-C8)алкоксигруппу, где указанная замещенная галоген(C1-C8)алкоксигруппа содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2;
(e) R5 выбран из группы, включающей
(1) Н, F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), S(О)(C1-C8)алкил, S(О)(галоген(C1-C8)алкил), S(О)2(C1-C8)алкил, S(О)2(галоген(C1-C8)алкил), N(R14)(R15),
(2) замещенный (C1-C8)алкил, где указанный замещенный (C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
(3) замещенный галоген(C1-C8)алкил, где указанный замещенный галоген(C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
(4) замещенную (C1-C8)алкоксигруппу, где указанная замещенная (C1-C8)алкоксигруппа содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2, и
(5) замещенную галоген(C1-C8)алкоксигруппу, где указанная замещенная галоген(C1-C8)алкоксигруппа содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2;
(f) R6 означает (C1-C8)галогеналкил;
(g) R7 выбран из группы, включающей Н, F, Cl, Br, I, ОН, (C1-C8)алкоксигруппу и галоген(C1-C8)алкоксигруппу;
(h) R8 выбран из группы, включающей Н, (C1-C8)алкил, галоген(C1-C8)алкил, OR14 и N(R14)(R15);
(i) R9 выбран из группы, включающей Н, F, Cl, Br, I, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, OR14 и N(R14)(R15);
(j) R10 выбран из группы, включающей
(1) Н, F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, цикло(С3-С6)алкил, S(C1-C8)алкил, S(галоген(C1-C8)алкил), S(О)(C1-C8)алкил, S(О)(галоген(C1-C8)алкил), S(О)2(C1-C8)алкил, S(О)2(галоген(C1-C8)алкил), NR14R15, С(=O)Н, С(=O)N(R14)(R15), CN(R14)(R15)(=NOH), (С=O)О(C1-C8)алкил, (С=O)ОН, гетероциклил, (С2-С8)алкенил, галоген(C2-C8)алкенил, (С2-С8)алкинил,
(2) замещенный (C1-C8)алкил, где указанный замещенный (C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и ОН, (C1-C8)алкоксигруппу, S(C1-C8)алкил, S(О)(C1-C8)алкил, S(О)2(C1-C8)алкил, NR14R15, и
(3) замещенный галоген(C1-C8)алкил, где указанный замещенный галоген(C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и (C1-C8)алкоксигруппу, S(C1-С8)алкил, S(O)(C1-C8)алкил, S(О)2(C1-C8)алкил и N(R14)(R15);
(k) R11 означает С(=X5)N(H)((С0-С8)алкил)N(R11a)(C(=X5)N(H)(R11b)),
где каждый Х5 независимо выбран из группы, включающей О или S, и
где каждый R11a независимо выбран из группы, включающей H, (C1-C8)алкил, замещенный (C1-C8)алкил, галоген(C1-C8)алкил, замещенный галоген(C1-C8)алкил, цикло(С3-C8)алкил, замещенный цикло(С3-С8)алкил,
где каждый указанный замещенный (C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, ОС(=O)Н, ОН, S(C1-C8)алкил, S(О)(C1-C8)алкил, S(О)2(C1-C8)алкил, OS(O)2арил, N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо), арил, замещенный арил, гетероциклил, замещенный гетероциклил, где каждый указанный замещенный арил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо) и оксогруппу, где каждый указанный замещенный гетероциклил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо), С(=O)(C1-C8)алкил, С(=O)(С3-С6)циклоалкил, S(=O)2(C1-C8)алкил, NR14R15 и оксогруппу, где каждый указанный замещенный арил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо) и оксогруппу,
где указанный замещенный галоген(C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
где каждый указанный замещенный цикло(С3-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
где каждый R11b независимо выбран из группы, включающей (C1-C8)алкил, замещенный (C1-C8)алкил, галоген(C1-C8)алкил, замещенный галоген(C1-C8)алкил, цикло(С3-С8)алкил, замещенный цикло(С3-С8)алкил,
где каждый указанный замещенный (C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, ОС(=O)Н, ОН, S(C1-C8)алкил, S(O)(C1-C8)алкил, S(О)2(C1-C8)алкил, OS(O)2арил, N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо), арил, замещенный арил, гетероциклил, замещенный гетероциклил, где каждый указанный замещенный арил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо) и оксогруппу, где каждый указанный замещенный гетероциклил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо), С(=O)(C1-C8)алкил, С(=O)(С3-С6)циклоалкил, S(=O)2(C1-C8)алкил, NR14R15 и оксогруппу, где каждый указанный замещенный арил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо) и оксогруппу,
где указанный замещенный галоген(C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
где каждый указанный замещенный цикло(С3-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2;
(l) R12 выбран из группы, включающей (v), Н, F, Cl, Br, I, CN, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу и цикло(С3-С6)алкил;
(m) R13 выбран из группы, включающей (v), Н, F, Cl, Br, I, CN, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу и галоген(C1-C8)алкоксигруппу;
(n) каждый R14 независимо выбран из группы, включающей Н, (C1-C8)алкил, (С2-С8)алкенил, замещенный (C1-C8)алкил, галоген(C1-C8)алкил, замещенный галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, цикло(С3-С6)алкил, арил, замещенный арил, (C1-C8)алкиларил, (C1-C8)алкил-(замещенный арил), О-(C1-C8)алкиларил, О-(C1-C8)алкил-(замещенный арил), гетероциклил, замещенный гетероциклил, (C1-C8)алкилгетероциклил, (C1-C8)алкил-(замещенный гетероциклил), O-(C1-C8)алкилгетероциклил, О-(C1-C8)алкил-(замещенный гетероциклил), N(R16)(R17), (C1-C8)алкил-С(=O)N(R16)(R17), С(=O)(C1-C8)алкил, С(=O)(галоген(C1-C8)алкил), С(=O)(С3-С6)циклоалкил, (C1-C8)алкил-С(=O)О(C1-C8)алкил, С(=O)Н,
где каждый указанный замещенный (C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
где каждый указанный замещенный галоген(C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
где каждый указанный замещенный арил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо) и оксогруппу, и
где каждый указанный замещенный гетероциклил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, (С3-С6)циклоалкил S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо), гетероциклил, С(=O)(C1-C8)алкил, С(=O)О(C1-C8)алкил и оксогруппу (где указанные алкил, алкоксигруппа и гетероциклил могут дополнительно содержать один или несколько заместителей F, Cl, Br, I, CN и NO2);
(о) каждый R15 независимо выбран из группы, включающей Н, (C1-C8)алкил, (С2-С8)алкенил, замещенный (C1-C8)алкил, галоген(C1-C8)алкил, замещенный галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, цикло(С3-С6)алкил, арил, замещенный арил, (C1-C8)алкиларил, (C1-C8)алкил-(замещенный арил), О-(C1-C8)алкиларил, О-(C1-C8)алкил-(замещенный арил), гетероциклил, замещенный гетероциклил, (C1-C8)алкилгетероциклил, (C1-C8)алкил-(замещенный гетероциклил), O-(C1-C8)алкилгетероциклил, О-(C1-C8)алкил-(замещенный гетероциклил), N(R16)(R17), (C1-C8)алкил-С(=O)N(R16)(R17), С(=O)(C1-C8)алкил, С(=O)(галоген(C1-C8)алкил), С(=O)(С3-C6)циклоалкил, (C1-C8)алкил-С(=O)О(C1-C8)алкил, С(=O)Н,
где каждый указанный замещенный (C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
где каждый указанный замещенный галоген(C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
где каждый указанный замещенный арил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо) и оксогруппу, и
где каждый указанный замещенный гетероциклил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, (С3-С6)циклоалкил S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо), гетероциклил, С(=O)(C1-C8)алкил, С(=O)O(C1-C8)алкил и оксогруппу (где указанные алкил, алкоксигруппа и гетероциклил могут дополнительно содержать один или несколько заместителей F, Cl, Br, I, CN и NO2);
(р) каждый R16 независимо выбран из группы, включающей Н, (C1-C8)алкил, замещенный (C1-C8)алкил, галоген(C1-C8)алкил, замещенный галоген(C1-C8)алкил, цикло(С3-С6)алкил, арил, замещенный арил, (C1-C8)алкиларил, (C1-C8)алкил-(замещенный арил), О-(C1-C8)алкиларил, О-(C1-C8)алкил-(замещенный арил), гетероциклил, замещенный гетероциклил, (C1-C8)алкилгетероциклил, (C1-C8)алкил-(замещенный гетероциклил), О-(C1-C8)алкилгетероциклил, О-(C1-C8)алкил-(замещенный гетероциклил), О-(C1-C8)алкил,
где каждый указанный замещенный (C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
где каждый указанный замещенный галоген(C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
где каждый указанный замещенный арил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо) и оксогруппу, и
где каждый указанный замещенный гетероциклил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо) и оксогруппу;
(q) каждый R17 независимо выбран из группы, включающей Н, (C1-C8)алкил, замещенный (C1-C8)алкил, галоген(C1-C8)алкил, замещенный галоген(C1-C8)алкил, цикло(С3-С6)алкил, арил, замещенный арил, (C1-C8)алкиларил, (C1-C8)алкил-(замещенный арил), О-(C1-C8)алкиларил, О-(C1-C8)алкил-(замещенный арил), гетероциклил, замещенный гетероциклил, (C1-C8)алкилгетероциклил, (C1-C8)алкил-(замещенный гетероциклил), O-(C1-C8)алкилгетероциклил, О-(C1-C8)алкил-(замещенный гетероциклил), О-(C1-C8)алкил,
где каждый указанный замещенный (C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
где каждый указанный замещенный галоген(C1-C8)алкил содержит один или несколько заместителей, выбранных из группы, включающей CN и NO2,
где каждый указанный замещенный арил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо) и оксогруппу, и
где каждый указанный замещенный гетероциклил содержит один или несколько заместителей, выбранных из группы, включающей CN и F, Cl, Br, I, CN, NO2, (C1-C8)алкил, галоген(C1-C8)алкил, (C1-C8)алкоксигруппу, галоген(C1-C8)алкоксигруппу, S(C1-C8)алкил, S(галоген(C1-C8)алкил), N((C1-C8)алкил)2 (где каждый (C1-C8)алкил выбран независимо) и оксогруппу;
(r) X1 выбран из группы, включающей N и CR12;
(s) X2 выбран из группы, включающей N, CR9 и CR13;
(t) Х3 выбран из группы, включающей N и CR9; и
(v) R12 и R13 вместе образуют звено, содержащее от 3 до 4 атомов, выбранных из группы, включающей С, N, О и S, где указанное звено связывается с кольцом с образованием 5-, - 6-членного насыщенного или ненасыщенного циклического кольца, где указанное звено содержит по меньшей мере один заместитель Х4, где Х4 выбран из группы, включающей R14, N(R14)(R15), N(R14)(C(=O)R14), N(R14)(C(=S)R14), N(R14)(С(=O)N(R14)(R14)), N(R14)(C(=S)N(R14)(R14)), N(R14)(C(=O)N(R14)((C2-C8)алкенил)), N(R14)(C(=S)N(R14)((С2-С8)алкенил)), где каждый R14 выбран независимо.
В другом варианте осуществления настоящего изобретения R1 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, F, Cl, Br, I, CN, NO2, метил, этил, (С3)алкил, (С4)алкил, (С5)алкил, (С6)алкил, (С7)алкил, (С8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(С5)алкил, галоген(С6)алкил, галоген(С7)алкил, галоген(C8)алкил, метоксигруппа, этоксигруппа, (С3)алкоксигруппа, (С4)алкоксигруппа, (С5)алкоксигруппа, (С6)алкоксигруппа, (С7)алкоксигруппа, (С8)алкоксигруппа, галогенметоксигруппа, галогенэтоксигруппа, галоген(С3)алкоксигруппа, галоген(С4)алкоксигруппа, галоген(C5)алкоксигруппа, галоген(С6)алкоксигруппа, галоген(С7)алкоксигруппа и галоген(С8)алкоксигруппа.
В другом варианте осуществления настоящего изобретения R2 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, F, Cl, Br, I, CN, NO2, метил, этил, (С3)алкил, (С4)алкил, (C5)алкил, (С6)алкил, (C7)алкил, (C8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(С6)алкил, галоген(С7)алкил, галоген(С8)алкил, метоксигруппа, этоксигруппа, (С3)алкоксигруппа, (С4)алкоксигруппа, (C5)алкоксигруппа, (С6)алкоксигруппа, (С7)алкоксигруппа, (C8)алкоксигруппа, галогенметоксигруппа, галогенэтоксигруппа, галоген(С3)алкоксигруппа, галоген(С4)алкоксигруппа, галоген(C5)алкоксигруппа, галоген(С6)алкоксигруппа, галоген(C7)алкоксигруппа и галоген(C8)алкоксигруппа.
В другом варианте осуществления настоящего изобретения R3 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, F, Cl, Br, I, CN, NO2, метил, этил, (С3)алкил, (С4)алкил, (С5)алкил, (C6)алкил, (С7)алкил, (С8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(С6)алкил, галоген(С7)алкил, галоген(С8)алкил, метоксигруппа, этоксигруппа, (С3)алкоксигруппа, (С4)алкоксигруппа, (C5)алкоксигруппа, (C6)алкоксигруппа, (С7)алкоксигруппа, (С8)алкоксигруппа, галогенметоксигруппа, галогенэтоксигруппа, галоген(С3)алкоксигруппа, галоген(С4)алкоксигруппа, галоген(C5)алкоксигруппа, галоген(C6)алкоксигруппа, галоген(C7)алкоксигруппа и галоген(С8)алкоксигруппа.
В другом варианте осуществления настоящего изобретения R4 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, F, Cl, Br, I, CN, NO2, метил, этил, (С3)алкил, (С4)алкил, (C5)алкил, (С6)алкил, (C7)алкил, (С8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(С6)алкил, галоген(С7)алкил, галоген(С8)алкил, метоксигруппа, этоксигруппа, (С3)алкоксигруппа, (С4)алкоксигруппа, (С5)алкоксигруппа, (С6)алкоксигруппа, (С7)алкоксигруппа, (C8)алкоксигруппа, галогенметоксигруппа, галогенэтоксигруппа, галоген(С3)алкоксигруппа, галоген(С4)алкоксигруппа, галоген(C5)алкоксигруппа, галоген(С6)алкоксигруппа, галоген(C7)алкоксигруппа и галоген(С8)алкоксигруппа.
В другом варианте осуществления настоящего изобретения R5 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, F, Cl, Br, I, CN, NO2, метил, этил, (С3)алкил, (С4)алкил, (C5)алкил, (С6)алкил, (С7)алкил, (С8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(С6)алкил, галоген(C7)алкил, галоген(С8)алкил, метоксигруппа, этоксигруппа, (С3)алкоксигруппа, (С4)алкоксигруппа, (C5)алкоксигруппа, (C6)алкоксигруппа, (С7)алкоксигруппа, (С8)алкоксигруппа, галогенметоксигруппа, галогенэтоксигруппа, галоген(С3)алкоксигруппа, галоген(С4)алкоксигруппа, галоген(C5)алкоксигруппа, галоген(С6)алкоксигруппа, галоген(С7)алкоксигруппа и галоген(С8)алкоксигруппа.
В другом варианте осуществления настоящего изобретения R2 и R4 выбраны из группы, включающей F, Cl, Br, I, CN и NO2, и R1, R3 и R5 означают Н.
В другом варианте осуществления настоящего изобретения R2, R3 и R4 выбраны из группы, включающей F, Cl, Br, I, CN и NO2, и R1 и R5 означают Н.
В другом варианте осуществления настоящего изобретения R2, R3 и R4 независимо выбраны из группы, включающей F и Cl, и R1 и R5 означают Н.
В другом варианте осуществления настоящего изобретения R1 выбран из группы, включающей Cl и Н.
В другом варианте осуществления настоящего изобретения R2 выбран из группы, включающей CF3, СН3, Cl, F и Н.
В другом варианте осуществления настоящего изобретения R3 выбран из группы, включающей ОСН3, СН3, F, Cl или Н.
В другом варианте осуществления настоящего изобретения R4 выбран из группы, включающей CF3, СН3, Cl, F и Н.
В другом варианте осуществления настоящего изобретения R5 выбран из группы, включающей F, Cl и Н.
В другом варианте осуществления настоящего изобретения R6 можно выбрать в виде любой комбинации одного или большего количества из следующих - галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(С6)алкил, галоген(C7)алкил и галоген(C8)алкил.
В другом варианте осуществления настоящего изобретения R6 означает трифторметил.
В другом варианте осуществления настоящего изобретения R7 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, F, Cl, Br и I.
В другом варианте осуществления настоящего изобретения R7 выбран из группы, включающей Н, ОСН3 и ОН.
В другом варианте осуществления настоящего изобретения R8 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, метил, этил, (С3)алкил, (С4)алкил, (C5)алкил, (С6)алкил, (С7)алкил, (С8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(C6)алкил, галоген(С7)алкил и галоген(С8)алкил.
В другом варианте осуществления настоящего изобретения R8 выбран из группы, включающей СН3 и Н.
В другом варианте осуществления настоящего изобретения R9 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, F, Cl, Br, I, метил, этил, (С3)алкил, (С4)алкил, (С5)алкил, (С6)алкил, (C7)алкил, (С8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(С6)алкил, галоген(C7)алкил, галоген(C8)алкил, метоксигруппа, этоксигруппа, (С3)алкоксигруппа, (С4)алкоксигруппа, (C5)алкоксигруппа, (С6)алкоксигруппа, (С7)алкоксигруппа, (С8)алкоксигруппа, галогенметоксигруппа, галогенэтоксигруппа, галоген(С3)алкоксигруппа, галоген(С4)алкоксигруппа, галоген(С5)алкоксигруппа, галоген(С6)алкоксигруппа, галоген(С7)алкоксигруппа и галоген(С8)алкоксигруппа.
В другом варианте осуществления настоящего изобретения R10 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, F, Cl, Br, I, CN, метил, этил, (С3)алкил, (С4)алкил, (C5)алкил, (С6)алкил, (C7)алкил, (С8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(С6)алкил, галоген(С7)алкил, галоген(С8)алкил, метоксигруппа, этоксигруппа, (С3)алкоксигруппа, (С4)алкоксигруппа, (С5)алкоксигруппа, (С6)алкоксигруппа, (С7)алкоксигруппа, (С8)алкоксигруппа, галогенметоксигруппа, галогенэтоксигруппа, галоген(С3)алкоксигруппа, галоген(С4)алкоксигруппа, галоген(С5)алкоксигруппа, галоген(С6)алкоксигруппа, галоген(C7)алкоксигруппа, галоген(С8)алкоксигруппа, циклопропил, циклобутил, циклопентил и циклогексил.
В другом варианте осуществления настоящего изобретения R10 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, Cl, Br, СН3 и CF3.
В другом варианте осуществления настоящего изобретения R10 выбран из группы, включающей Br, C(=NOH)NH2, C(=O)H, C(=O)NH2, С(=O)ОСН2СН3, С(=O)ОН, CF3, СН2СН3, CH2OH, СН3, Cl, CN, F, Н, NH2, NHC(=O)H, NHCH3, NO2, ОСН3, OCHF2 и пиридил.
В другом варианте осуществления настоящего изобретения R11 выбран из группы, включающей С(=O)N(Н)N(СН3)(С(=O)N(Н)(СН2СН3)), C(=O)N(H)N(CH3)(C(=O)N(H)(CH2CF3)), С(=O)N(Н)N(СН3)(C(=S)N(H)(СН2СН3)), C(=O)N(H)N(CH3)(C(=S)N(H)(CH2CF3)), С(=O)N(Н)CH2CH2N(СН3)(C(=O)N(H)(СН2СН3)) и C(=O)N(H)CH2CH2N(СН3)(С(=S)N(Н)(CH2CF3)).
В другом варианте осуществления настоящего изобретения R12 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, F, Cl, Br, I, метил, этил, (С3)алкил, (С4)алкил, (С5)алкил, (С6)алкил, (С7)алкил, (С8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(С6)алкил, галоген(С7)алкил, галоген(С8)алкил, галогенметоксигруппа, галогенэтоксигруппа, галоген(С3)алкоксигруппа, галоген(С4)алкоксигруппа, галоген(C5)алкоксигруппа, галоген(С6)алкоксигруппа, галоген(С7)алкоксигруппа и галоген(C8)алкоксигруппа.
В другом варианте осуществления настоящего изобретения R12 выбран из группы, включающей СН3 и Н.
В другом варианте осуществления настоящего изобретения R13 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, F, Cl, Br, I, метил, этил, (С3)алкил, (С4)алкил, (С5)алкил, (C6)алкил, (С7)алкил, (С8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(С6)алкил, галоген(C7)алкил, галоген(С8)алкил, галогенметоксигруппа, галогенэтоксигруппа, галоген(С3)алкоксигруппа, галоген(С4)алкоксигруппа, галоген(С5)алкоксигруппа, галоген(С6)алкоксигруппа, галоген(С7)алкоксигруппа и галоген(C8)алкоксигруппа.
В другом варианте осуществления настоящего изобретения R13 выбран из группы, включающей СН3, Cl и Н.
В другом варианте осуществления настоящего изобретения R12-R13 означают гидрокарбильное звено, содержащее СН=СНСН=СН.
В другом варианте осуществления настоящего изобретения R14 можно выбрать в виде любой комбинации одного или большего количества из следующих - H, метил, этил, (С3)алкил, (С4)алкил, (С5)алкил, (С6)алкил, (С7)алкил, (С8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(С5)алкил, галоген(С6)алкил, галоген(C7)алкил, галоген(C8)алкил, метиларил, этиларил, (С3)алкиларил, (С4)алкиларил, (C5)алкиларил, (С6)алкиларил, (С7)алкиларил, (C8)алкиларил, метил-(замещенный арил), этил-(замещенный арил), (С3)алкил-(замещенный арил), (С4)алкил-(замещенный арил), (С5)алкил-(замещенный арил), (С6)алкил-(замещенный арил), (С7)алкил-(замещенный арил), (С8)алкил-(замещенный арил), O-метиларил, O-этиларил, О-(С3)алкиларил, О-(С4)алкиларил, O-(C5)алкиларил, О-(С6)алкиларил, О-(С7)алкиларил, О-(С8)алкиларил, O-метил-(замещенный арил), O-этил-(замещенный арил), O-(С3)алкил-(замещенный арил), О-(С4)алкил-(замещенный арил), O-(С5)алкил-(замещенный арил), О-(C6)алкил-(замещенный арил), O-(С7)алкил-(замещенный арил), О-(C8)алкил-(замещенный арил), метилгетероциклил, этилгетероциклил, (С3)алкилгетероциклил, (С4)алкилгетероциклил, (C5)алкилгетероциклил, (С6)алкилгетероциклил, (C7)алкилгетероциклил, (С8)алкилгетероциклил, метил-(замещенный гетероциклил), этил-(замещенный гетероциклил), (С3)алкил-(замещенный гетероциклил), (С4)алкил-(замещенный гетероциклил), (C5)алкил-(замещенный гетероциклил), (С6)алкил-(замещенный гетероциклил), (С7)алкил-(замещенный гетероциклил), (С8)алкил-(замещенный гетероциклил), O-метилгетероциклил, O-этилгетероциклил, О-(С3)алкилгетероциклил, О-(С4)алкилгетероциклил, О-(C5)алкилгетероциклил, O-(С6)алкилгетероциклил, О-(С7)алкилгетероциклил, O-(C8)алкилгетероциклил, O-метил-(замещенный гетероциклил), O-этил-(замещенный гетероциклил), О-(С3)алкил-(замещенный гетероциклил), О-(С4)алкил-(замещенный гетероциклил), О-(C5)алкил-(замещенный гетероциклил), О-(С6)алкил-(замещенный гетероциклил), O-(С7)алкил-(замещенный гетероциклил), О-(C8)алкил-(замещенный гетероциклил), метил-С(=O)N(R16)(R17), этил-С(=O)N(R16)(R17), (С3)алкил-С(=O)N(R16)(R17), (С4)алкил-С(=O)N(R16)(R17), (C5)алкил-C(=O)N(R16)(R17), (С6)алкил-С(=O)N(R16)(R17), (С7)алкил-С(=O)N(R16)(R17) и (С8)алкил-С(=O)N(R16)(R17).
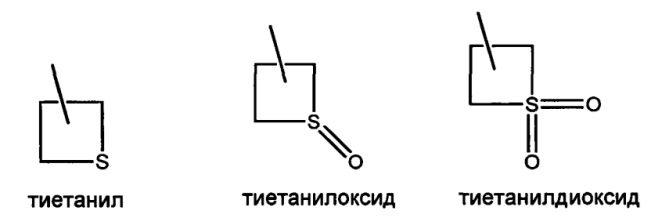
В другом варианте осуществления настоящего изобретения R14 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, СН3, CH2CF3, СН2-галогенпиридил, оксопирролидинил, галогенфенил, тиетанил, СН2-фенил, СН2-пиридил, тиетанилдиоксид, СН2-галогентиазолил, С((СН3)2)-пиридил, N(Н)(галогенфенил), СН2-пиримидинил, СН2-тетрагидрофуранил, СН2-фуранил, О-СН2-галогенпиридил и CH2C(=O)N(H)(CH2CF3).
В другом варианте осуществления настоящего изобретения R15 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, метил, этил, (С3)алкил, (С4)алкил, (С5)алкил, (С6)алкил, (С7)алкил, (С8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(С6)алкил, галоген(C7)алкил, галоген(С8)алкил, метиларил, этиларил, (С3)алкиларил, (С4)алкиларил, (С5)алкиларил, (С6)алкиларил, (C7)алкиларил, (С8)алкиларил, метил-(замещенный арил), этил-(замещенный арил), (С3)алкил-(замещенный арил), (С4)алкил-(замещенный арил), (C5)алкил-(замещенный арил), (С6)алкил-(замещенный арил), (С7)алкил-(замещенный арил), (C8)алкил-(замещенный арил), O-метиларил, O-этиларил, О-(С3)алкиларил, О-(С4)алкиларил, O-(С5)алкиларил, О-(С6)алкиларил, О-(С7)алкиларил, О-(С8)алкиларил, O-метил-(замещенный арил), O-этил-(замещенный арил), O-(С3)алкил-(замещенный арил), О-(С4)алкил-(замещенный арил), O-(С5)алкил-(замещенный арил), О-(С6)алкил-(замещенный арил), O-(С7)алкил-(замещенный арил), О-(С8)алкил-(замещенный арил), метилгетероциклил, этилгетероциклил, (С3)алкилгетероциклил, (С4)алкилгетероциклил, (С5)алкилгетероциклил, (С6)алкилгетероциклил, (С7)алкилгетероциклил, (С8)алкилгетероциклил, метил-(замещенный гетероциклил), этил-(замещенный гетероциклил), (С3)алкил-(замещенный гетероциклил), (С4)алкил-(замещенный гетероциклил), (C5)алкил-(замещенный гетероциклил), (С6)алкил-(замещенный гетероциклил), (С7)алкил-(замещенный гетероциклил), (С8)алкил-(замещенный гетероциклил), O-метилгетероциклил, O-этилгетероциклил, О-(С3)алкилгетероциклил, О-(С4)алкилгетероциклил, О-(C5)алкилгетероциклил, O-(С6)алкилгетероциклил, О-(C7)алкилгетероциклил, O-(С8)алкилгетероциклил, O-метил-(замещенный гетероциклил), O-этил-(замещенный гетероциклил), О-(С3)алкил-(замещенный гетероциклил), О-(С4)алкил-(замещенный гетероциклил), О-(C5)алкил-(замещенный гетероциклил), О-(С6)алкил-(замещенный гетероциклил), O-(С7)алкил-(замещенный гетероциклил), О-(С8)алкил-(замещенный гетероциклил), метил-С(=O)N(R16)(R17), этил-С(=O)N(R16)(R17), (С3)алкил-С(=O)N(R16)(R17), (С4)алкил-С(=O)N(R16)(R17), (С5)алкил-С(=O)N(R16)(R17), (С6)алкил-С(=O)N(R16)(R17), (С7)алкил-С(=O)N(R16)(R17) и (С8)алкил-С(=O)N(R16)(R17).
В другом варианте осуществления настоящего изобретения R15 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, СН3, CH2CF3, СН2-галогенпиридил, оксопирролидинил, галогенфенил, тиетанил, СН2-фенил, СН2-пиридил, тиетанилдиоксид, СН2-галогентиазолил, С((СН3)2)-пиридил, N(Н)(галогенфенил), СН2-пиримидинил, СН2-тетрагидрофуранил, СН2-фуранил, O-СН2-галогенпиридил и CH2C(=O)N(H)(CH2CF3).
В другом варианте осуществления настоящего изобретения R16 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, метил, этил, (С3)алкил, (С4)алкил, (C5)алкил, (С6)алкил, (С7)алкил, (C8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(С6)алкил, галоген(C7)алкил, галоген(С8)алкил, метиларил, этиларил, (С3)алкиларил, (С4)алкиларил, (С5)алкиларил, (С6)алкиларил, (С7)алкиларил, (С8)алкиларил, метил-(замещенный арил), этил-(замещенный арил), (С3)алкил-(замещенный арил), (С4)алкил-(замещенный арил), (C5)алкил-(замещенный арил), (С6)алкил-(замещенный арил), (С7)алкил-(замещенный арил), (C8)алкил-(замещенный арил), O-метиларил, O-этиларил, О-(С3)алкиларил, О-(С4)алкиларил, O-(C5)алкиларил, О-(С6)алкиларил, О-(С7)алкиларил, О-(С8)алкиларил, O-метил-(замещенный арил), O-этил-(замещенный арил), O-(С3)алкил-(замещенный арил), О-(С4)алкил-(замещенный арил), O-(С5)алкил-(замещенный арил), О-(С6)алкил-(замещенный арил), O-(С7)алкил-(замещенный арил), О-(С8)алкил-(замещенный арил), метилгетероциклил, этилгетероциклил, (С3)алкилгетероциклил, (С4)алкилгетероциклил, (C5)алкилгетероциклил, (С6)алкилгетероциклил, (С7)алкилгетероциклил, (С8)алкилгетероциклил, метил-(замещенный гетероциклил), этил-(замещенный гетероциклил), (С3)алкил-(замещенный гетероциклил), (С4)алкил-(замещенный гетероциклил), (C5)алкил-(замещенный гетероциклил), (С6)алкил-(замещенный гетероциклил), (С7)алкил-(замещенный гетероциклил), (C8)алкил-(замещенный гетероциклил), O-метилгетероциклил, O-этилгетероциклил, О-(С3)алкилгетероциклил, О-(С4)алкилгетероциклил, О-(C5)алкилгетероциклил, O-(С6)алкилгетероциклил, О-(С7)алкилгетероциклил, O-(C8)алкилгетероциклил, O-метил-(замещенный гетероциклил), O-этил-(замещенный гетероциклил), О-(С3)алкил-(замещенный гетероциклил), О-(С4)алкил-(замещенный гетероциклил), О-(C5)алкил-(замещенный гетероциклил), О-(C6)алкил-(замещенный гетероциклил), O-(С7)алкил-(замещенный гетероциклил) и О-(С8)алкил-(замещенный гетероциклил).
В другом варианте осуществления настоящего изобретения R16 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, CH2CF3, циклопропил, тиетанил, тиетанилдиоксид и галогенфенил.
В другом варианте осуществления настоящего изобретения R17 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, метил, этил, (С3)алкил, (С4)алкил, (С5)алкил, (С6)алкил, (С7)алкил, (C8)алкил, галогенметил, галогенэтил, галоген(С3)алкил, галоген(С4)алкил, галоген(C5)алкил, галоген(С6)алкил, галоген(С7)алкил, галоген(С8)алкил, метиларил, этиларил, (С3)алкиларил, (С4)алкиларил, (С5)алкиларил, (C6)алкиларил, (С7)алкиларил, (С8)алкиларил, метил-(замещенный арил), этил-(замещенный арил), (С3)алкил-(замещенный арил), (С4)алкил-(замещенный арил), (C5)алкил-(замещенный арил), (С6)алкил-(замещенный арил), (С7)алкил-(замещенный арил), (C8)алкил-(замещенный арил), O-метиларил, O-этиларил, О-(С3)алкиларил, О-(С4)алкиларил, O-(C5)алкиларил, О-(С6)алкиларил, О-(С7)алкиларил, О-(С8)алкиларил, O-метил-(замещенный арил), O-этил-(замещенный арил), O-(С3)алкил-(замещенный арил), О-(С4)алкил-(замещенный арил), O-(С5)алкил-(замещенный арил), О-(С6)алкил-(замещенный арил), О-(С7)алкил-(замещенный арил), О-(С8)алкил-(замещенный арил), метилгетероциклил, этилгетероциклил, (С3)алкилгетероциклил, (С4)алкилгетероциклил, (С5)алкилгетероциклил, (С6)алкилгетероциклил, (С7)алкилгетероциклил, (С8)алкилгетероциклил, метил-(замещенный гетероциклил), этил-(замещенный гетероциклил), (С3)алкил-(замещенный гетероциклил), (С4)алкил-(замещенный гетероциклил), (C5)алкил-(замещенный гетероциклил), (С6)алкил-(замещенный гетероциклил), (С7)алкил-(замещенный гетероциклил), (С8)алкил-(замещенный гетероциклил), O-метилгетероциклил, O-этилгетероциклил, О-(С3)алкилгетероциклил, О-(С4)алкилгетероциклил, О-(C5)алкилгетероциклил, O-(С6)алкилгетероциклил, О-(С7)алкилгетероциклил, O-(C8)алкилгетероциклил, O-метил-(замещенный гетероциклил), O-этил-(замещенный гетероциклил), О-(С3)алкил-(замещенный гетероциклил), О-(С4)алкил-(замещенный гетероциклил), О-(C5)алкил-(замещенный гетероциклил), О-(C6)алкил-(замещенный гетероциклил), O-(С7)алкил-(замещенный гетероциклил) и О-(С8)алкил-(замещенный гетероциклил).
В другом варианте осуществления настоящего изобретения R17 можно выбрать в виде любой комбинации одного или большего количества из следующих - Н, CH2CF3, циклопропил, тиетанил, тиетанилдиоксид и галогенфенил.
В другом варианте осуществления настоящего изобретения X1 означает CR12, Х2 означает CR13 и Х3 означает CR9.
В другом варианте осуществления настоящего изобретения гетероциклил предпочтительно содержит в кольцевой структуре примерно от 6 до 10 атомов, более предпочтительно от 6 до 8.
Молекулы формулы 1 обычно обладают молекулярной массой, равной от примерно 100 Да до примерно 1200 Да. Однако обычно предпочтительно, если молекулярная масса равна от примерно 120 Да до примерно 900 Да и обычно еще более предпочтительно, если молекулярная масса равна от примерно 140 Да до примерно 600 Да.
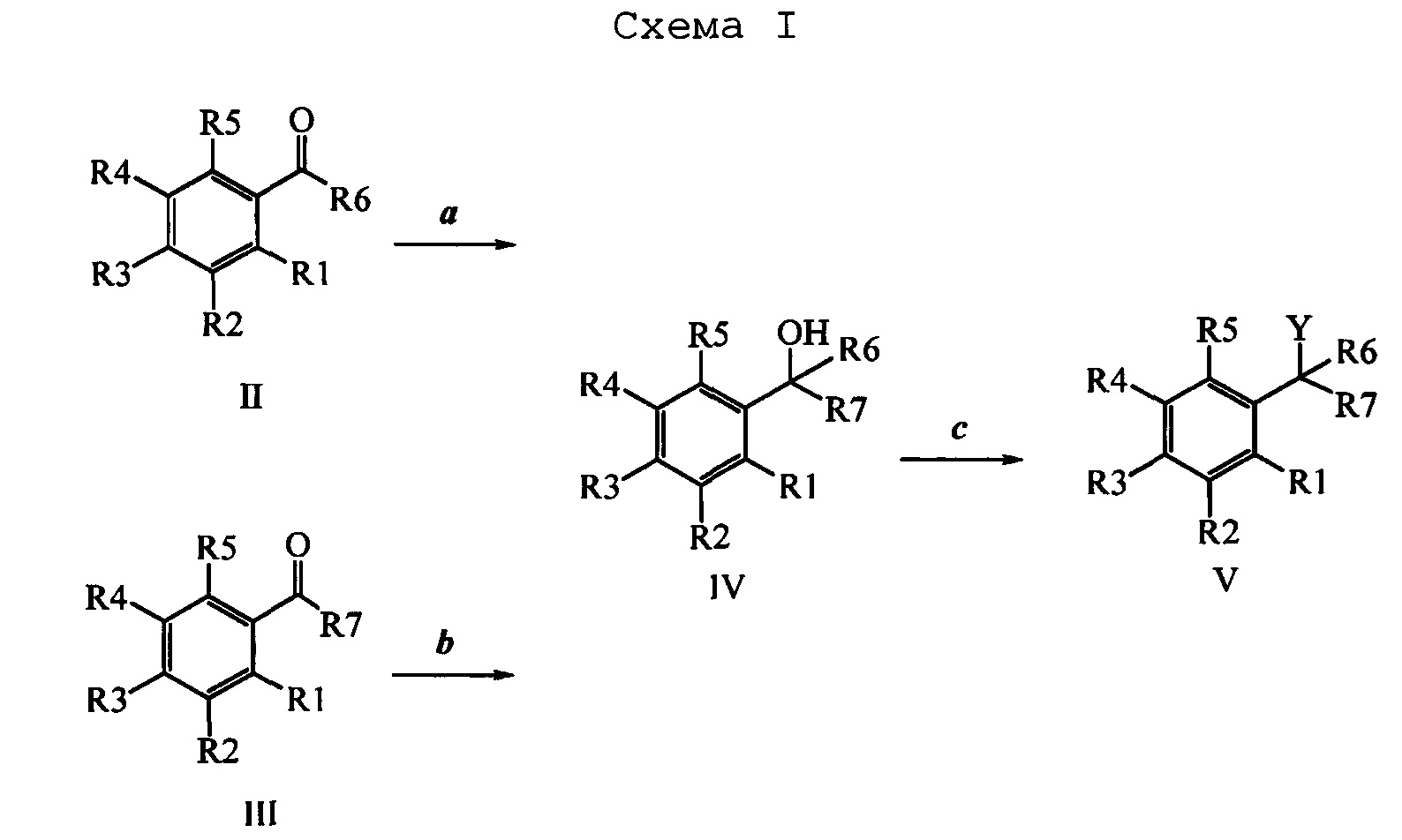
Бензиловый спирт формулы IV, в которой R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, можно синтезировать двумя путями. Один путь, раскрытый на стадии а схемы I, заключается в обработке кетона формулы II, в которой R1, R2, R3, R4, R5 и R6 являются такими, как раскрыто выше, восстановительным реагентом, таким как борогидрид натрия (NaBH4), в щелочной среде, такой как водный раствор гидроксида натрия (NaOH), в полярном протонном растворителе, таком как метиловый спирт (МеОН), при 0°С. Альтернативно, альдегид формулы III, в которой R1, R2, R3, R4, R5 и R7 являются такими, как раскрыто выше, вводят в реакцию с трифтортриметилсиланом в присутствии каталитического количества тетрабутиламмонийфторида в полярном апротонном растворителе, таком как тетрагидрофуран (ТГФ), как на стадии b схемы I. Соединение формулы IV можно превратить в соединение формулы V, в которой Y выбран из группы, включающей Br, Cl или I, и R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, по реакции с галогенирующим реагентом, таким как N-бромсукцинимид и триэтилфосфит в нереакционноспособном растворителе, таком как дихлорметан (CH2Cl2), при кипячении с обратным холодильником с получением Y=Br, или таким как тионилхлорид и пиридин в углеводородном растворителе, таком как толуол, при кипячении с обратным холодильником с получением Y=Cl, как на стадии с схемы I.
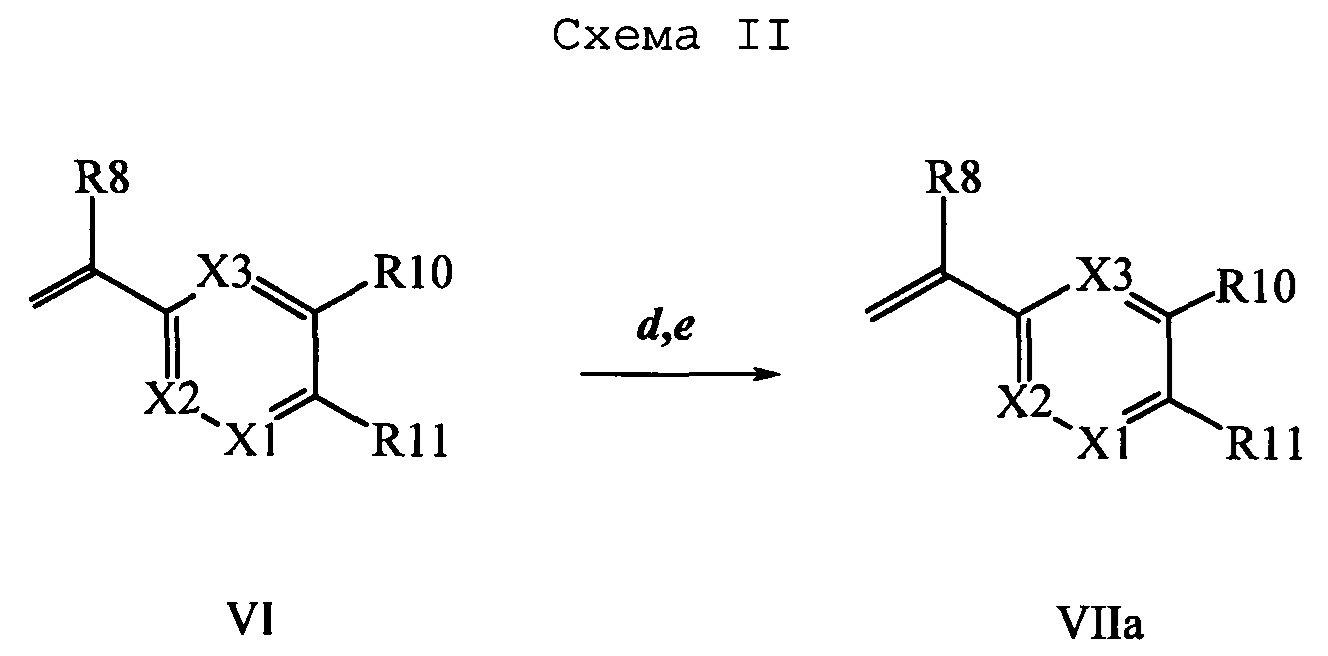
Образование компонентов сочетания для стирола можно провести, как показано на схемах II, III IV и V.
На схеме II винилбензойную кислоту формулы VI, в которой R11 означает (С=O)ОН и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, можно в две стадии превратить в винилбензамид формулы VIIa, в которой R11 означает (C=O)N(R14)(R15) и R8, R9, R10, R12, R13, R14, R15 и Х являются такими, как раскрыто выше. Как на стадии d схемы II, бензойную кислоту формулы VI обрабатывают оксалилхлоридом в присутствии каталитического количества ДМФ (диметилформамид) в нереакционноспособном растворителе, таком как CH2Cl2, и получают хлорангидрид кислоты, который затем вводят в реакцию с амином (HN(R14)(R15)), где R14 и R15 являются такими, как раскрыто выше, в присутствии основания, такого как триэтиламин (ТЭА), в полярном апротонном растворителе, таком как ТГФ, и получают винилбензамид формулы VIIa, в которой R11 означает (C=O)N(R14)(R15) и R8, R9, R10, R12, R13, R14, R15, X1, Х2 и Х3 являются такими, как раскрыто выше, как на стадии е схемы II.
На схемах III и IV галогенбензойную кислоту формулы VIII, в которой R18 означает Br или I R11 означает (С=O)ОН и R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, можно превратить в эфир винилбензойной кислоты формулы VIIb1 или формулы VIIb2, в которой R18 означает Br или I R11 означает (C=O)O(C1-C6 алкил) и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше. На стадии f схемы III галогенбензойную кислоту формулы VIII, в которой R18 означает Br, обрабатывают основанием, таким как н-бутиллитий (н-BuLi), и ДМФ в полярном апротонном растворителе, таком как ТГФ, при температуре, равной примерно -78°С. Полученную формилбензойную кислоту вводят в реакцию с кислотой, такой как серная кислота (H2SO4), в присутствии спирта, такого как этиловый спирт (EtOH), как на стадии g, и получают этиловый эфир формилбензойной кислоты формулы IX, в которой R11 означает (C=O)O(C1-C6 алкил) и R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше. Виниловый эфир бензойной кислоты формулы VIIb1 получают по реакции соединений формулы IX, с основанием, таким как карбонат калия (K2CO3), и метилтрифенилфосфонийбромидом в полярном апротонном растворителе, таком как 1,4-диоксан, при температуре окружающей среды, как на стадии А схемы III.
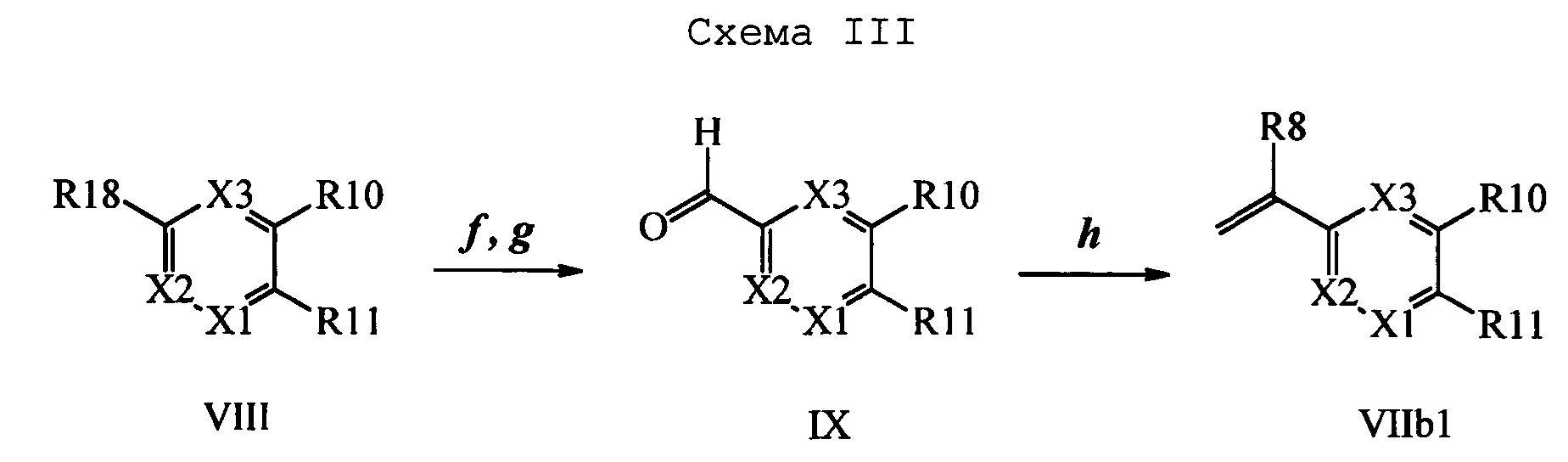
На стадии i схемы IV галогенбензойную кислоту формулы VIII, в которой R18 означает Br, R11 означает (С=O)ОН и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, обрабатывают ди-трет-бутилдикарбонатом в присутствии основания, такого как ТЭА, и каталитического количества 4-(диметиламино)пиридина (ДМАП) в полярном апротонном растворителе, таком как ТГФ, при температуре окружающей среды. Полученный трет-бутиловый эфир бензойной кислоты вводят в реакцию с комплексом ангидрида винилбороновой кислоты с пиридином в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4) у и основания, такого как K2CO3, в нереакционноспособном растворителе, таком как толуол, при кипячении с обратным холодильником, как на стадии j, и получают виниловый эфир бензойной кислоты формулы VIIb2, в которой R11 означает (C=O)O(C1-C6 алкил) и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше.
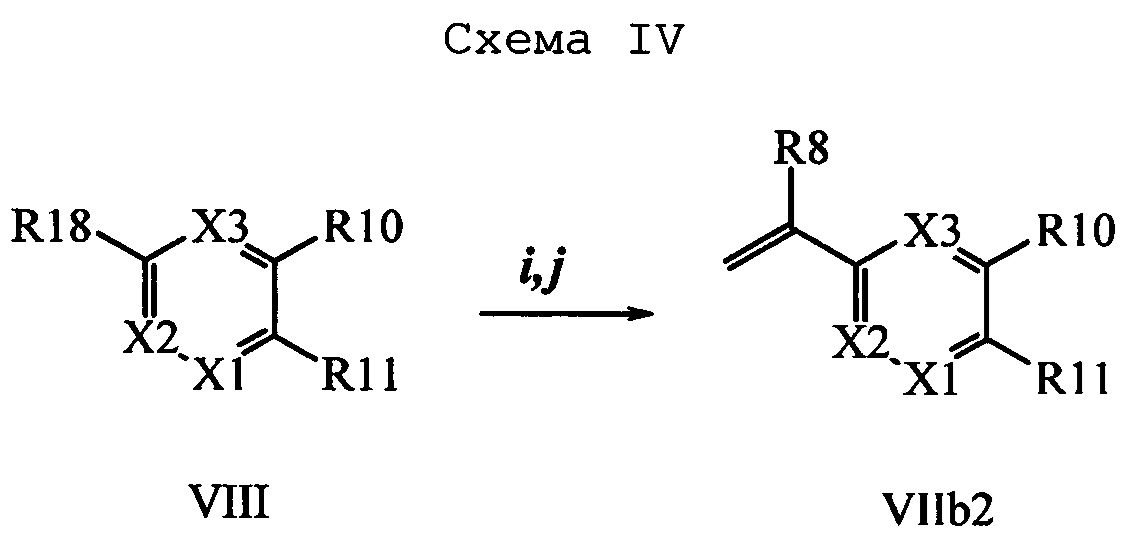
На стадии k схемы V виниловый эфир бензойной кислоты формулы VIIb2, в которой R10 означает Br, R11 означает (C=O)O(C1-C6 алкил) и R8, R9, R12, R13, X1, Х2 и Х3 являются такими, как определено выше, затем можно превратить в соответствующий виниловый эфир бензойной кислоты формулы VIIb3, в которой R10 означает CN, R11 означает (C=O)O(C1-C6 алкил) и R8, R9, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с цианидом меди(I) (CuCN) в полярном апротонном растворителе, таком как ДМФ, при 140°С.
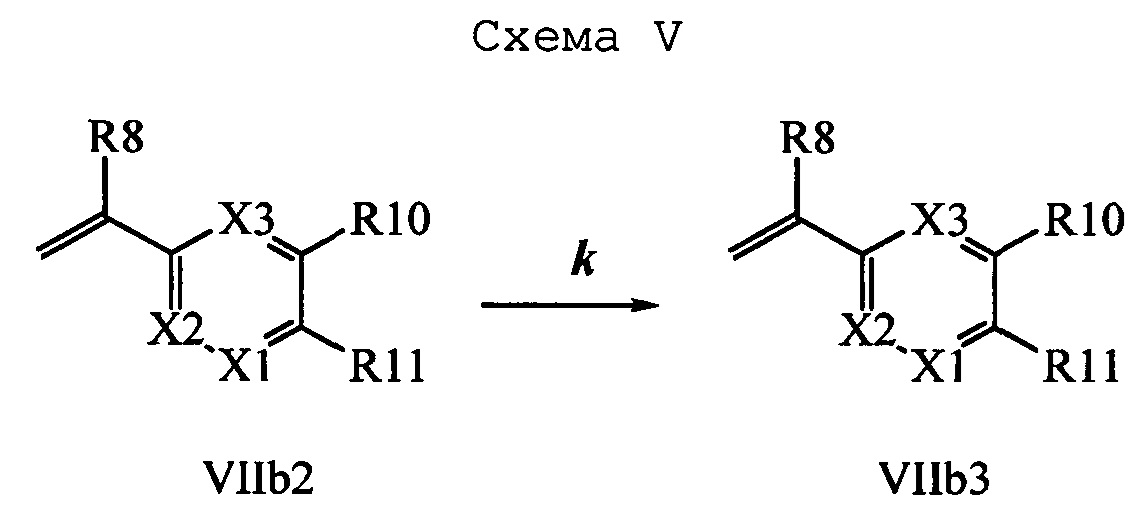
Сочетание соединений формулы V с соединениями формулы VIIa, VIIb1, VIIb2 и VIIb3 можно провести, как показано на схемах VI, VII и VIII. На стадии 1 схемы VI соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и винилбензамид формулы VIIa, в которой R11 означает (C=O)N(R14)(R15) и R8, R9, R10, R12, R13, R14, R15, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии хлорида меди(I) (CuCl) и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают молекулы формулы 1, в которой R11 означает (CO)N(R14)(R15) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, R14, R15, X1, Х2 и Х3 являются такими, как раскрыто выше.

На стадии 1 схемы VII соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и эфир винилбензойной кислоты формулы VI 1Ы, в которой R11 означает (C=O)O(C1-C6 алкил) и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают соединения формулы Ха, в которой R11 означает (C=O)O(C1-C6 алкил) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше. Затем соединения формулы Ха превращают в молекулы формулы 1, в которой R11 означает (C=O)N(R14)(R15) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, R14, R15, X1, Х2 и Х3 являются такими, как раскрыто выше, по двустадийной методике, раскрытой на стадиях m и n, или по одностадийной, раскрытой на стадии о. На стадии m схемы VII сложный эфир формулы Ха омыляют с получением соответствующей кислоты в кислой среде, такой как 11-нормальная (н.) хлористоводородная кислота (HCl), в полярном апротонном растворителе, таком как 1,4-диоксан, примерно при 100°С. Затем кислоту можно ввести в реакцию сочетания с амином (HN(R14)(R15)), где R14 и R15 являются такими, как раскрыто выше, с использованием реагентов, применяющихся при сочетании пептидов, таких как 1-гидроксибензотриазол (HOBt), N-(3-диметиламинопропил)-N'-этилкарбодиимидгидрохлорид (EDC⋅HCl), бензотриазол-1-илокситрипирролидинофосфонийгексафторфосфат (PyBOP), 2-хлор-1,3-диметилимидазолидинийгексафторфосфат (CIP), 1-гидрокси-7-азабензотриазол (HOAt) или O-бензотриазол-N,N,N',N'-тетраметилуронийгексафторфосфат (HBTU), в присутствии основания, такого как N',N'-диизопропилэтиламин (ДИПЭА) или ДМАП, и получить молекулы формулы 1, в которой R11 означает (C=O)N(R14)(R15) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, R14, R15, X1, Х2 и Х3 являются такими, как раскрыто выше. Альтернативно, сложный эфир формулы Ха вводят в реакцию с амином (HN(R14)(R15)) в присутствии раствора триметилалюминия в толуоле в нереакционноспособном растворителе, таком как CH2Cl2, при температуре окружающей среды, как на стадии о схемы VII, и получают молекулы формулы 1, в которой R11 означает (C=O)N(R14)(R15) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, R14, R15, X1, Х2 и Х3 являются такими, как раскрыто выше.

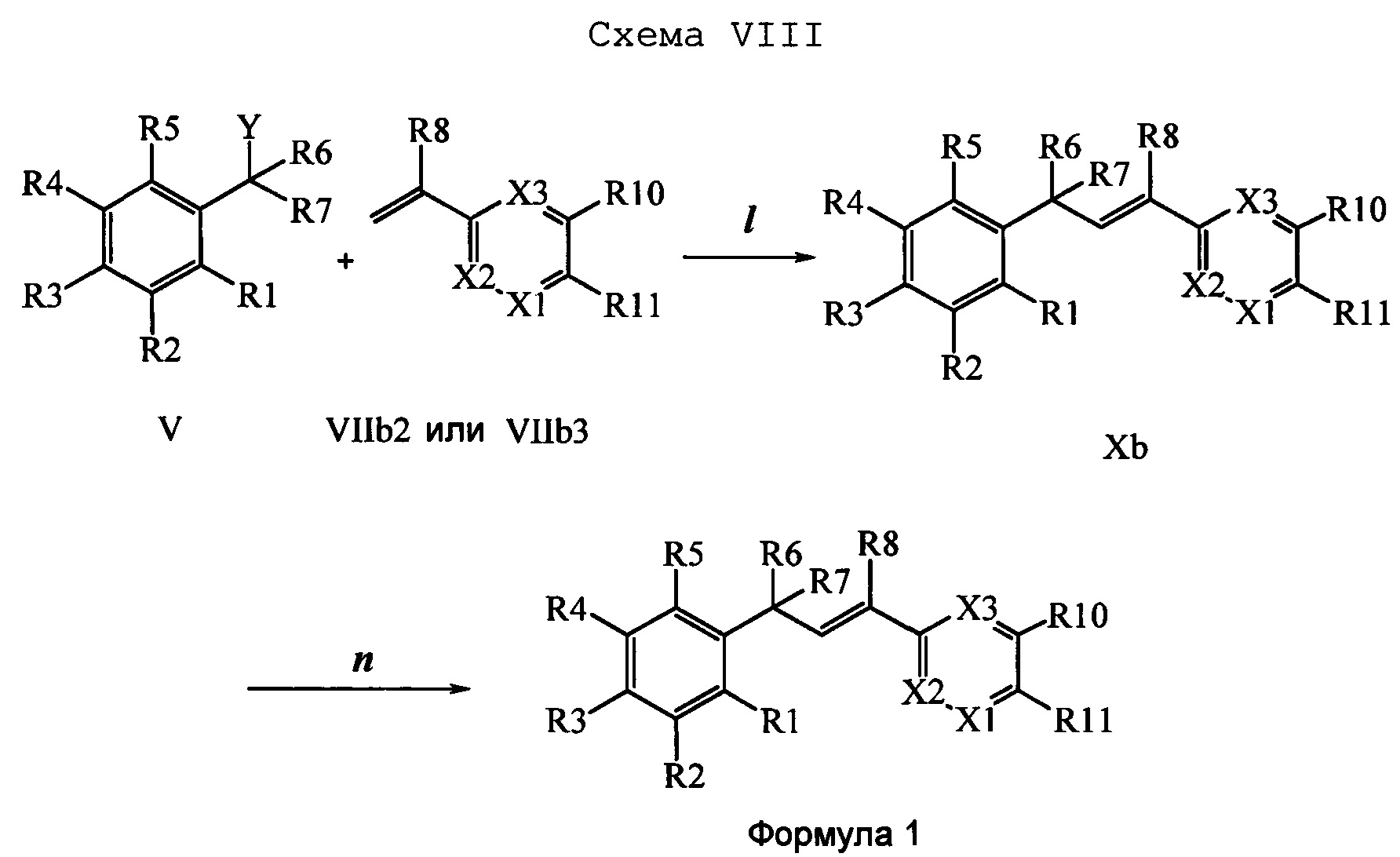
На стадии 1 схемы VIII соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и эфир винилбензойной кислоты формулы VIIb2 или VIIb3, в которой R11 означает (C=O)O(C1-C6 алкил) и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают соединения формулы Xb, в которой R11 означает (С=O)ОН и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, R14, R15, X1, Х2 и Х3 являются такими, как раскрыто выше. Затем соединения формулы Xb превращают в молекулы формулы 1, в которой R11 означает (C=O)N(R14)(R15) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, R14, R15, X1, X2 и Х3 являются такими, как раскрыто выше, в одну стадию, как это раскрыто на стадии n. На стадии n схемы VIII кислоту формулы Xb можно ввести в реакцию сочетания с амином (HN(R14)(R15)), где R14 и R15 являются такими, как раскрыто выше, с использованием реагентов, применяющихся при сочетании пептидов, таких как 1-гидроксибензотриазол (HOBt), N-(3-диметиламинопропил)-N'-этилкарбодиимидгидрохлорид (EDC⋅HCl), бензотриазол-1-илокситрипирролидинофосфонийгексафторфосфат (PyBOP), 2-хлор-1,3-диметилимидазолидинийгексафторфосфат (CIP), 1-гидрокси-7-азабензотриазол (HOAt) или O-бензотриазол-N,N,N',N'-тетраметилуронийгексафторфосфат (HBTU), в присутствии основания, такого как ДИПЭА или ДМАП, и получить молекулы формулы 1, в которой R11 означает (С=O)N(R14)(R15) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, R14, R15, X1, X2 и Х3 являются такими, как раскрыто выше.
На стадии j схемы IX галогенбензокетон формулы VIIIb, в которой R18 означает Br, R10 и R11 вместе образуют звено, содержащее 3-4 атома углерода и заместитель оксогруппу, и вместе с кольцевыми атомами углерода образуют 5- или 6-членное циклическое кольцо, и R8, R9, R12, R13, X1, X2 и Х3 являются такими, как раскрыто выше, вводят в реакцию с комплексом ангидрида винилбороновой кислоты с пиридином в присутствии палладиевого катализатора, такого как Pd(PPh3)4, и основания, такого как K2CO3, в нереакционноспособном растворителе, таком как толуол, при кипячении с обратным холодильником и получают винилбензокетон формулы VIIb4, в которой R10 и R11 вместе образуют звено, содержащее 3-4 атома углерода и заместитель оксогруппу, и вместе с кольцевыми атомами углерода образуют 5-или 6-членное кольцо, и R8, R9, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше.
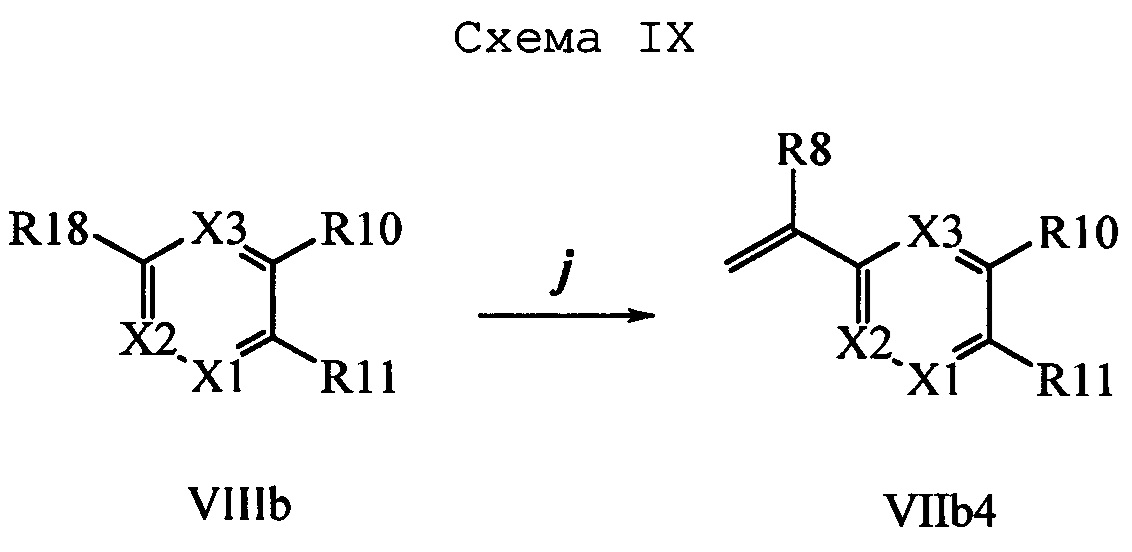
На стадии 1 схемы Х соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и винилбензокетон формулы VIIb4, раскрытой выше, в которой R8, R9, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают соединения формулы Хс, в которой R10 и R11 вместе образуют звено, содержащее 3-4 атома углерода и заместитель оксогруппу, и вместе с кольцевыми атомами углерода образуют 5- или 6-членное кольцо, и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше. Затем соединения формулы Хс превращают в молекулы формулы Xd, в которой R10 и R11 вместе образуют звено, содержащее 3-4 атома углерода и заместитель оксим [(C=N)(ОН)], и вместе с кольцевыми атомами углерода образуют 5- или 6-членное кольцо, и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, на стадии р. На стадии р схемы Х кетон формулы Хс вводят в реакцию с гидроксиламингидрохлоридом в присутствии ацетата натрия и в полярном протонном растворителе, таком как EtOH, при температуре, равной примерно 78°С, и получают молекулы формулы Xd, раскрытые выше.
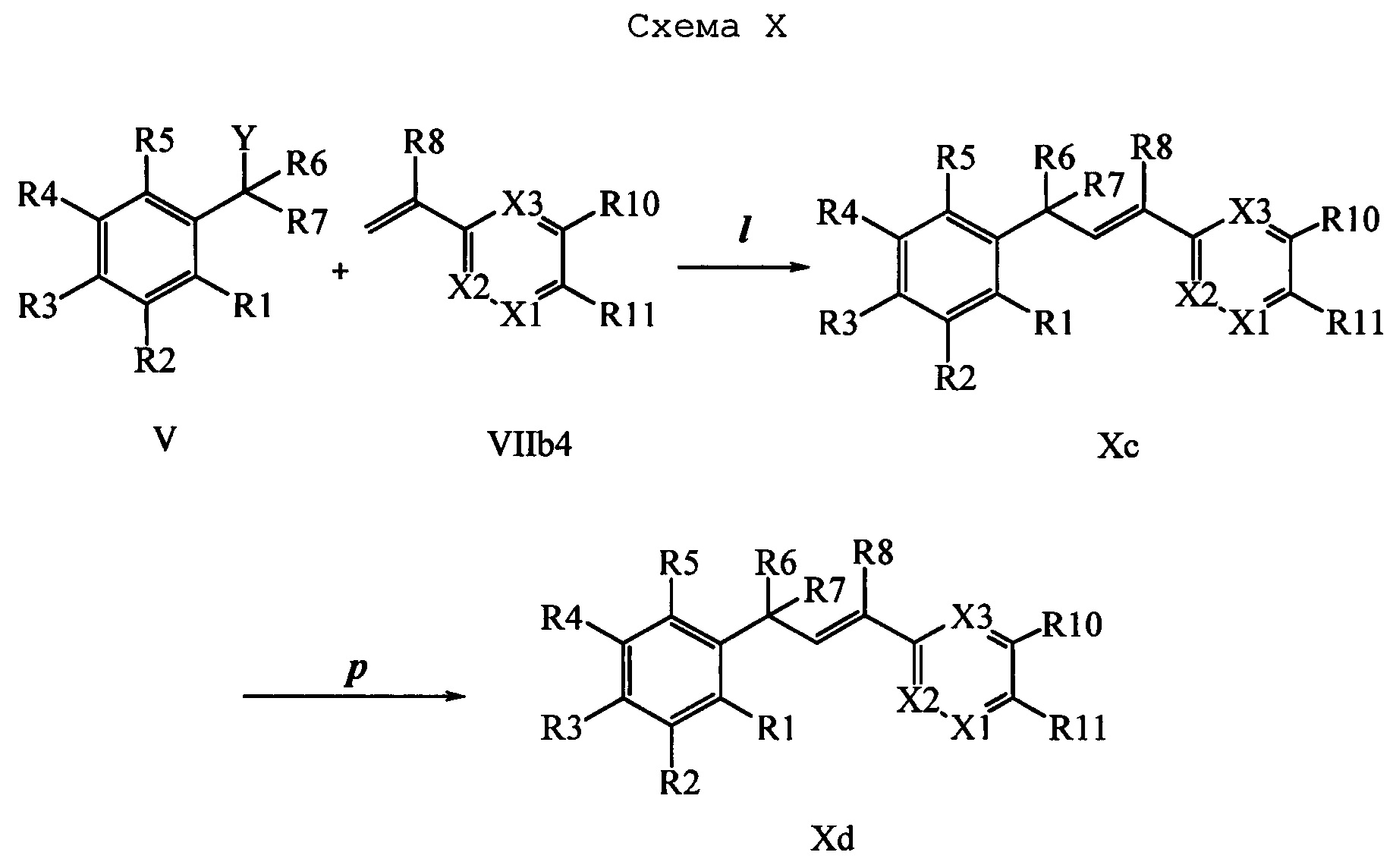
Соединения формулы Хс также превращают в молекулы формулы Хе, в которой R10 и R11 вместе образуют звено, содержащее 3-4 атома углерода и заместитель аминогруппу, и вместе с кольцевыми атомами углерода образуют 5- или 6-членное кольцо, и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, как показано на стадии q схемы X1. Кетон формулы Хс вводят в реакцию с ацетатом аммония в присутствии цианоборогидрида натрия и в полярном протонном растворителе, таком как МЕОН, при температуре, равной примерно 65°С, и получают молекулы формулы Хе.
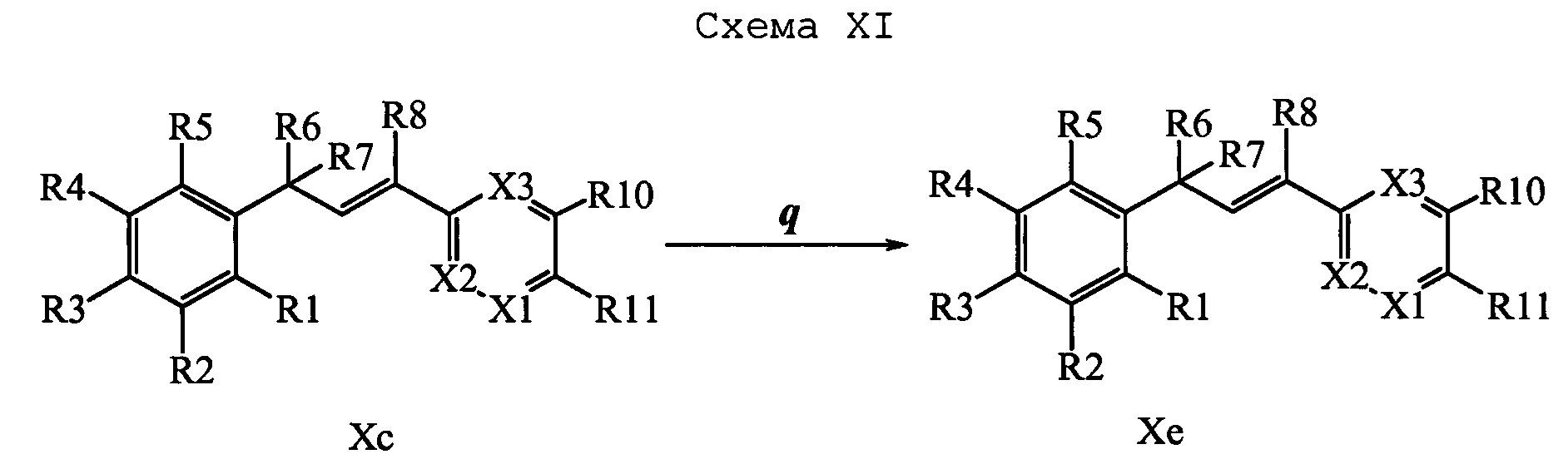
Соединения формулы Хе превращают в молекулы формулы 1, в которой R10 и R11 вместе образуют звено, как раскрыто выше в (u), и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, X1, X2 и Х3 являются такими же, как выше, в одну стадию, как раскрыто на стадиях r или s. На стадии r схемы XII амин формулы Хе вводят в реакцию с изоцианатом в полярном апротонном растворителе, таком как диэтиловый эфир, при температуре окружающей среды и получают молекулы формулы 1, раскрытые выше. На стадии s схемы XII амин формулы Хе вводят в реакцию сочетания с кислотой в присутствии HOBt⋅H2O и EDC⋅HCl в присутствии основания, такого как ДИПЭА, в нереакционноспособном растворителе, таком как CH2Cl2, и получают молекулы формулы 1, раскрытые выше.
На стадии t схемы XIII винилбензилхлорид формулы XIa, в которой R11 означает -CH2Cl и R8, R9, R10, R12, R13, X1, X2 и Х3 являются такими, как определено выше, можно превратить в соответствующий содержащий фталимидную защитную группу бензиламин формулы XIIa, в которой R11 означает CH2N(фталимид) и R8, R9, R10, R12, R13, X1, X2 и Х3 являются такими, как раскрыто выше, по реакции со фталимидом калия в полярном апротонном растворителе, таком как ДМФ, при 70°С.
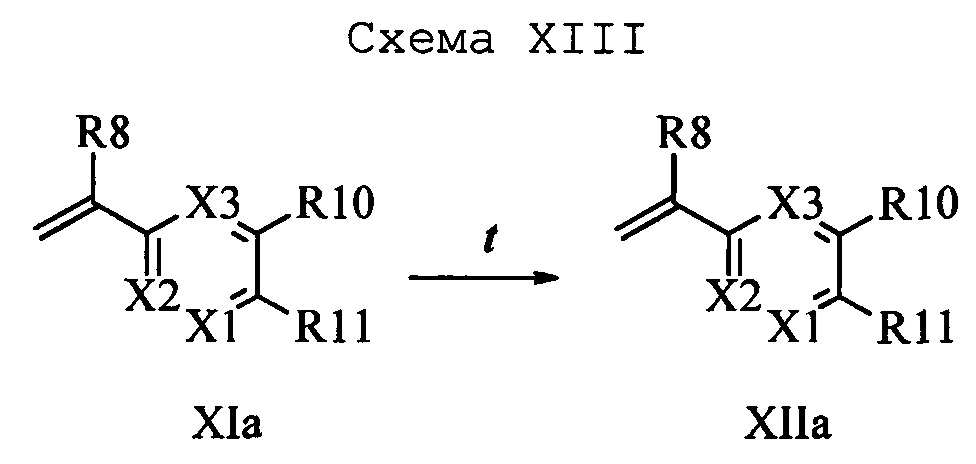
На стадии u схемы XIV 4-метилбензонитрил формулы XIIIa, в которой R11 означает СН3 и R9, R10, R12, R13, X1, X2 и Х3 являются такими, как определено выше, можно превратить в соответствующий бензилбромид формулы XIVa, в которой R11 означает CH2Br и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с N-бромсукцинимидом (NBS) и азобисизобутиронитрилом (АИБН) в нереакционноспособном растворителе, таком как тетрахлорид углерода, при 77°С. Нитрильную группу (CN) формулы XIVa можно восстановить и получить соответствующий альдегид формулы XVa, в которой R11 означает CH2Br и R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как определено выше, по реакции с диизобутилалюминийгидридом (DIBAL-H) в апротонном растворителе, таком как толуол, при 0°С, с последующей обработкой 1,0 М хлористоводородной кислотой (HCl), как на стадии v схемы XIV. Затем соединение формулы XVa можно превратить в соответствующий содержащий фталимидную защитную группу бензиламин формулы XVIa, в которой R11 означает CH2N(фталимид) и R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции со фталимидом калия в полярном апротонном растворителе, таком как ДМФ, при 60°С, как на стадии t схемы X1V. На стадии w схемы XIV альдегид формулы XVIa можно превратить в олефин формулы XIIb, в которой R11 означает CH2N(фталимид) и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с метилтрифенилфосфонийбромидом в полярном апротонном растворителе, таком как 1,4-диоксан, в присутствии основания, такого как K2CO3, при температуре окружающей среды.
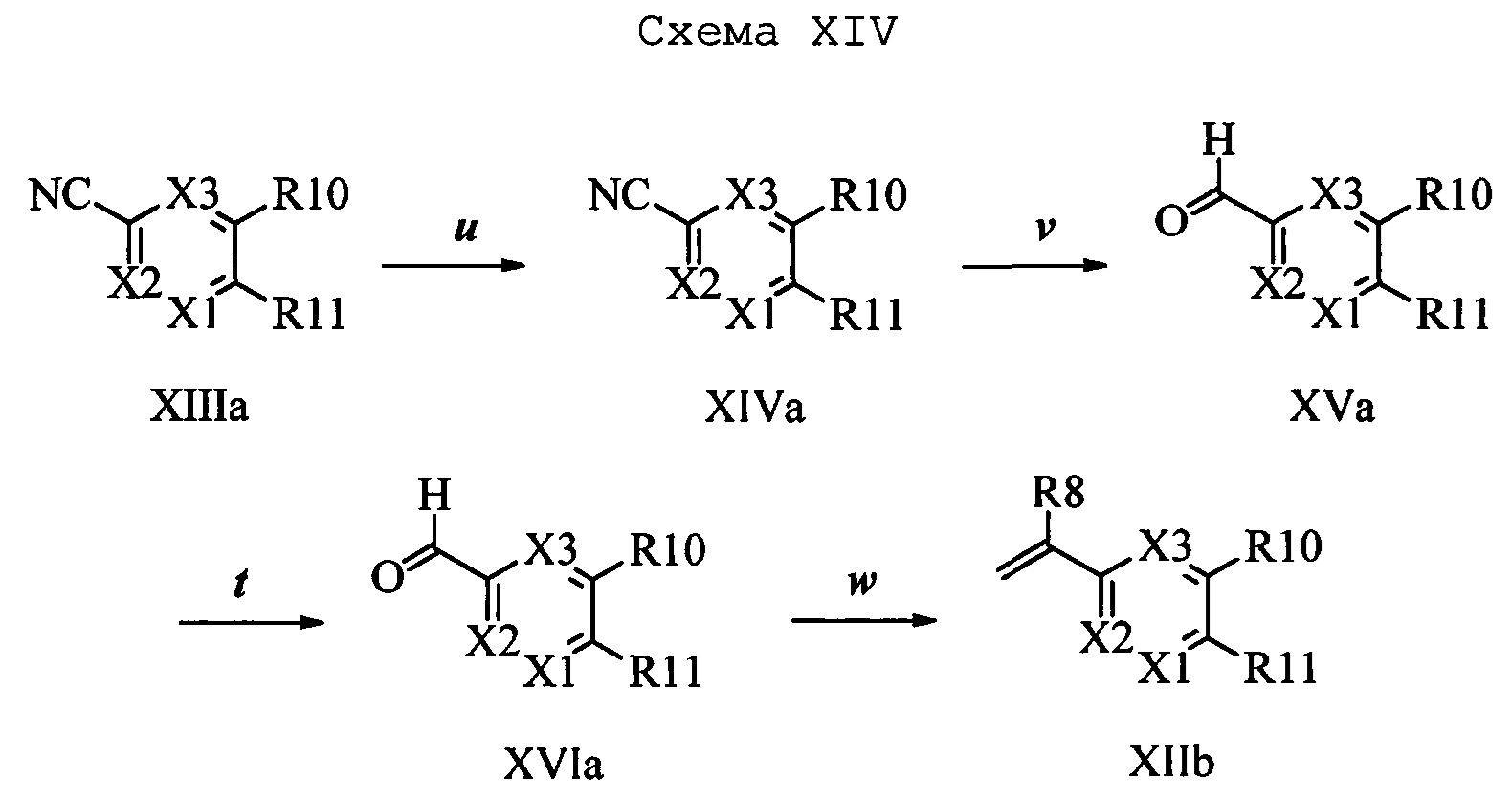
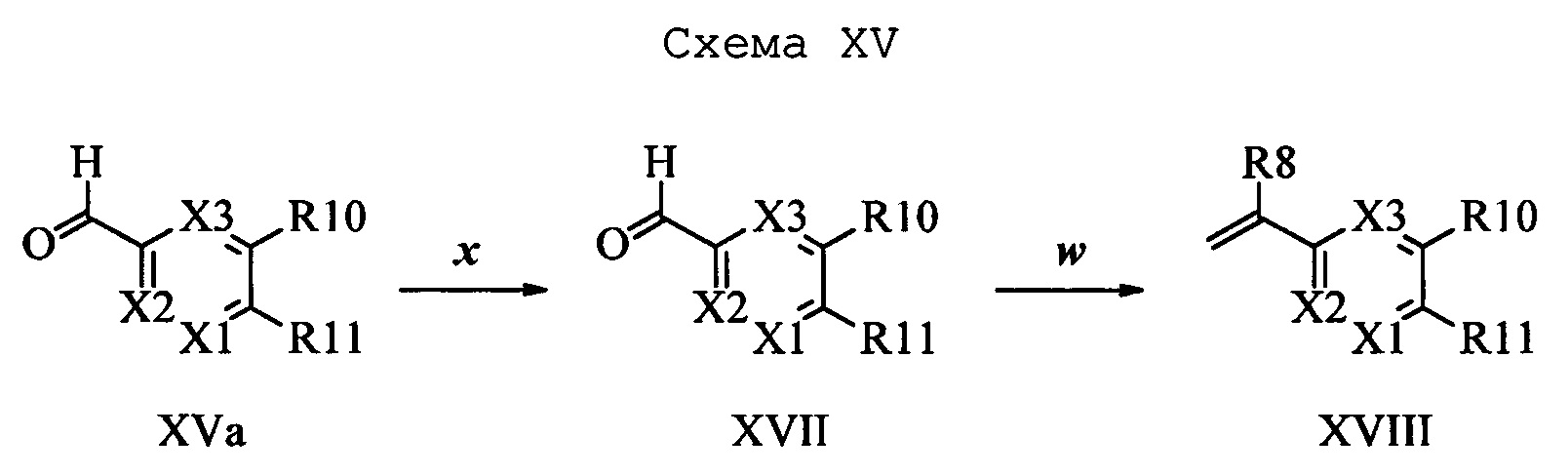
Альдегид формулы XVa, в которой R11 означает CH2Br и R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как определено выше, можно ввести в реакцию с нуклеофильным реагентом, таким как 2-аминопиридин, в полярном апротонном растворителе, таком как N,N-диметилацетамид (ДМА), в присутствии основания, такого как K2CO3, при температуре окружающей среды и получить соединение формулы XVII, в которой R11 означает CH2NH(2-пиридин) и R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, как на стадии х схемы XV. На стадии w схемы XV соединение формулы XVII можно превратить в олефин формулы XVIII, в которой R11 означает CH2NH(2-пиридин) и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше.
С помощью двустадийной проводимой в одном реакторе реакции, как на стадиях y и z схемы XVI, соединение формулы XIX можно ввести в реакцию с соединениями формулы XX, в которой R10 и R11 означают Cl, X1 означает N и R9, R13, Х2 и Х3 являются такими, как раскрыто выше, в присутствии основания, такого как гидрид натрия (NaH), и полярного апротонного растворителя, такого как ДМФ, при температуре окружающей среды и получить соединения формулы XXI, в которой R10 означает Cl, R11 означает (CH)NH2CO2CH2CH3, X1 означает N и R9, R13, Х2 и Х3 являются такими, как определено выше. Гидролиз и декарбоксилирование соединений формулы XXI можно провести по реакции в кислой среде, такой как 3 н. HCl, при кипячении с обратным холодильником и получить соединения формулы XXII, в которой R10 означает Cl, R11 означает CH2NH2⋅HCl, X1 означает N и R9, R13, Х2 и Х3 являются такими, как раскрыто выше, как на стадии аа на схеме XVI. Затем соединения формулы XXII можно превратить в соответствующие содержащие фталимидную защитную группу бензиламины формулы XXIIIa, в которой R10 означает Cl, R11 означает CH2N(фталимид), X1 означает N и R9, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции со фталевым ангидридом в присутствии основания, такого как ТЭА, и апротонного растворителя, такого как толуол, при кипячении с обратным холодильником, как на стадии ab схемы XVI. Бромид формулы XXIIIa можно превратить в олефин формулы XIIc, в которой R10 означает Cl, R11 означает CH2N(фталимид), X1 означает N и R8, R9, R13, Х2 и Х3 являются такими, как раскрыто выше, по реакции с комплексом ангидрида винилбороновой кислоты с пиридином в присутствии палладиевого катализатора, такого как Pd(PPh3)4, и основания, такого как K2CO3, в нереакционноспособном растворителе, таком как толуол, при кипячении с обратным холодильником, как на стадии ас схемы XVI.

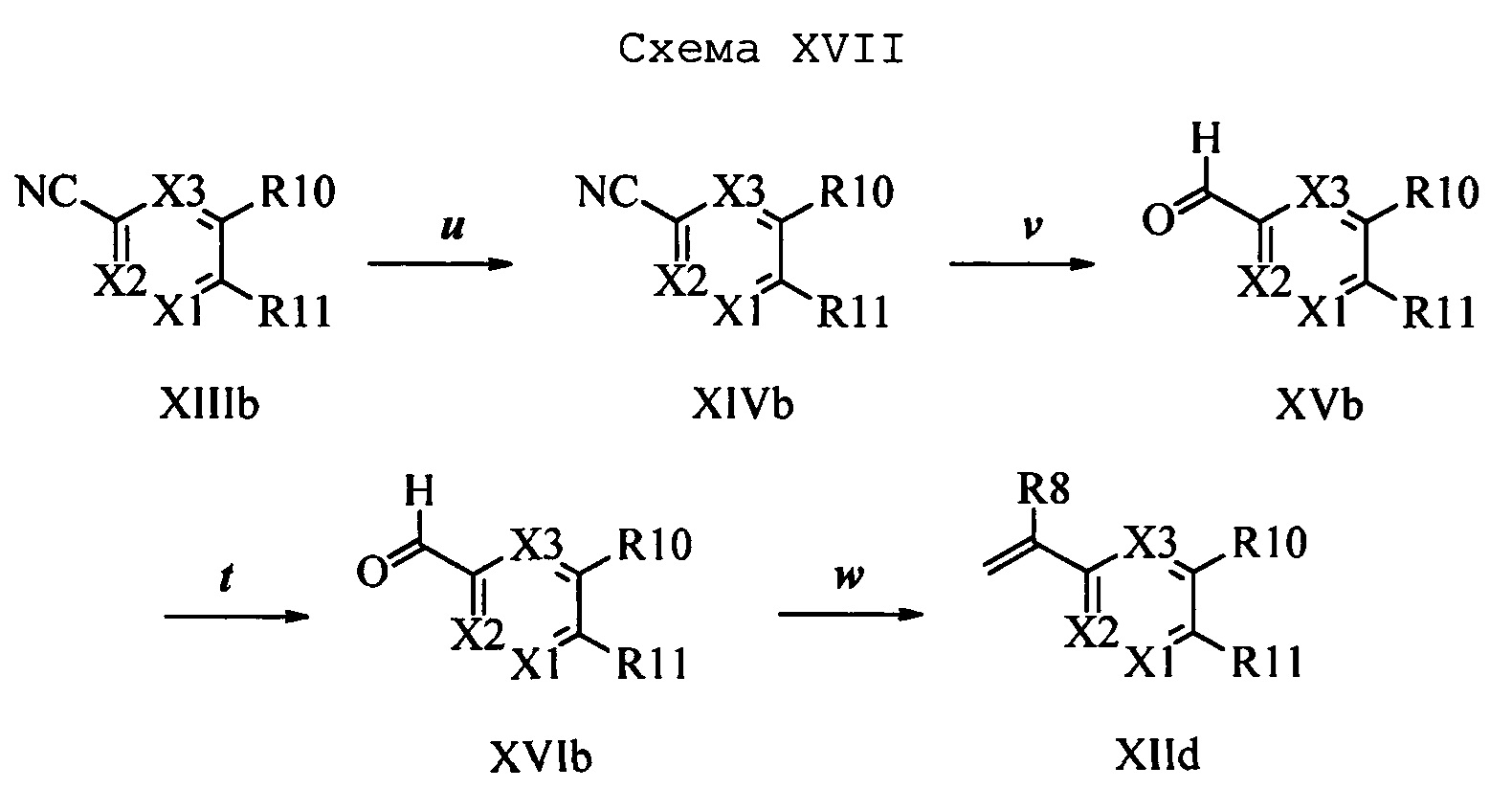
На стадии и схемы XVII 4-метилнафтонитрил формулы XIIIb, в которой Х3 означает CR9, R10 и Х3 вместе образуют звено, содержащее 4 атома углерода, и вместе с кольцевыми атомами углерода образуют 6-членное ароматическое кольцо, R11 означает СН3 и R12, R13, X1 и Х2 являются такими, как определено выше, можно превратить в соответствующий нафтилбромид формулы XIVb, в которой Х3 означает CR9, R10 и Х3 вместе образуют звено, содержащее 4 атома углерода, и вместе с кольцевыми атомами углерода образуют 6-членное ароматическое кольцо, R11 означает CH2Br и R12, R13, X1 и Х2 являются такими, как раскрыто выше, по реакции с N-бромсукцинимидом (NBS) и азобисизобутиронитрилом (АИБН) в нереакционноспособном растворителе, таком как тетрахлорид углерода, при 77°С. Нитрильную группу (CN) формулы XIVb можно восстановить и получить соответствующий альдегид формулы XVb, в которой Х3 означает CR9, R10 и Х3 вместе образуют звено, содержащее 4 атома углерода, и вместе с кольцевыми атомами углерода образуют 6-членное ароматическое кольцо (или при желании неароматическое кольцо), R11 означает CH2Br и R12, R13, X1 и Х2 являются такими, как определено выше, по реакции с диизобутилалюминийгидридом (DIBAL-H) в апротонном растворителе, таком как толуол, при 0°С, с последующей обработкой с помощью 1,0 М HCl, как на стадии v схемы XVII. Затем соединение формулы XVb можно превратить в соответствующий содержащий фталимидную защитную группу бензиламин формулы XVIb, в которой Х3 означает CR9, R10 и Х3 вместе образуют звено, содержащее 4 атома углерода, и вместе с кольцевыми атомами углерода образуют 6-членное ароматическое кольцо, R11 означает CH2N(фталимид) и R12, R13, X1 и Х2 являются такими, как раскрыто выше, по реакции со фталимидом калия в полярном апротонном растворителе, таком как ДМФ, при 60°С, как на стадии t схемы XVII. На стадии w схемы XVII, альдегид формулы XVIb можно превратить в олефин формулы X1Id, в которой Х3 означает CR9, R10 и Х3 вместе образуют звено, содержащее 4 атома углерода, и вместе с кольцевыми атомами углерода образуют 6-членное ароматическое кольцо, R11 означает CH3N(фталимид) и R8, R12, R13, X1 и Х2 являются такими, как раскрыто выше, по реакции с метилтрифенилфосфонийбромидом в полярном апротонном растворителе, таком как 1,4-диоксан, в присутствии основания, такого как K2CO3, при температуре окружающей среды.
Соединение формулы XXIV, в которой R11 означает NHNH2⋅HCl и R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, можно превратить в соответствующий содержащий фталимидную защитную группу гидразин формулы XXV, в которой R11 означает NHN(фталимид) и R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции со фталевым ангидридом в ледяной уксусной кислоте при кипячении с обратным холодильником, как на стадии ad схемы XVIII. Бромид формулы XXV можно превратить в олефин формулы XIIe, в которой R11 означает NHN(фталимид) и R8, R9, R10, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с комплексом ангидрида винилбороновой кислоты с пиридином в присутствии палладиевого катализатора, такого как Pd(PPh3)4, и основания, такого как K2CO3, в полярном апротонном растворителе, таком как 1,2-диметоксиэтан, при 150°С при нагревании микроволновым излучением, как на стадии ае схемы XVIII.

На стадии af схемы XIX соединение формулы XXVI, в которой R11 означает В(ОН)2 и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию с 2-гидроксиизоиндолин-1,3-дионом в присутствии CuCl и пиридина в растворителе, таком как 1,2-дихлорбензол, при температуре окружающей среды и получают соединение формулы XIIf, в которой R11 означает ON(фталимид) и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше.
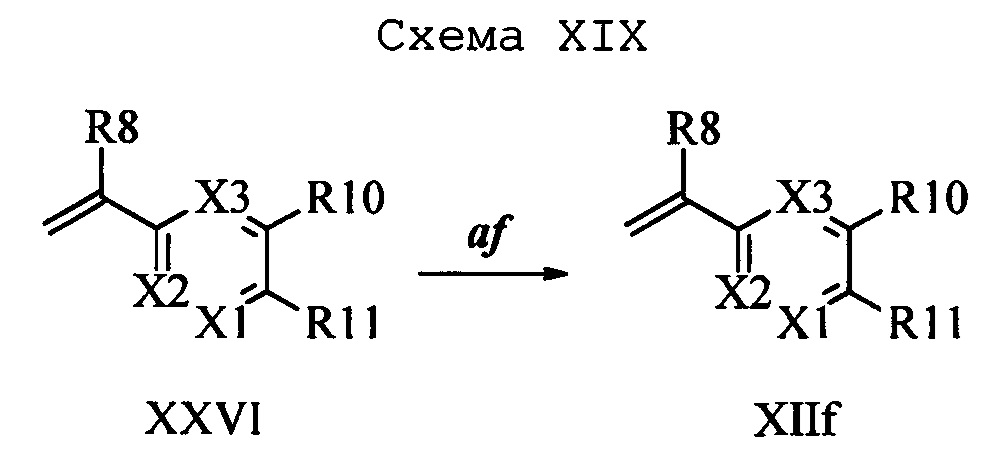
На стадии 1 схемы XX соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и соединения формулы XIIa, в которой R11 означает CH2N(фталимид) и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают соответствующие соединения формулы XXVIIa, в которой R11 означает CH2N(фталимид) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше. Фталимидную защитную группу в соединениях формулы XXVIIa удаляют, как на стадии ag схемы XX по реакции с гидразингидратом в полярном протонном растворителе, таком как EtOH, при 90°С и получают соединения формулы XXVIIIa, в которой R11 означает CH2NH2 и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше. Соединения формулы XXVIIIa можно превратить в соединения формулы 1, в которой R11 означает CH2N(C=O)(R14) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, путем ацилирования ангидридом, таким как уксусный ангидрид, и основанием, таким как ТЭА, в нереакционноспособном растворителе, таком как CH2Cl2, при 0°С, как на стадии ah1 схемы XX.
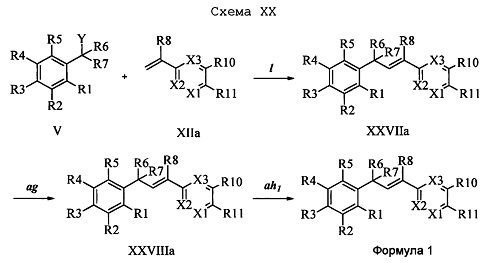
На стадии 1 схемы XXI соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и соединения формулы XIIb, в которой R11 означает CH2N(фталимид) и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают соответствующие соединения формулы XXVIIb, в которой R11 означает CH2N(фталимид) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше. Фталимидную защитную группу в соединениях формулы XXVIIb удаляют, как на стадии ag схемы XXI по реакции с гидразингидратом в полярном протонном растворителе, таком как EtOH, при 90°С и получают соединения формулы XXVIIIb, в которой R11 означает CH2NH2 и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше. Соединения формулы XXVIIIb можно превратить в соединения формулы 1, в которой R11 означает CH2N(С=O)(R14) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с кислотой в присутствии HOBt⋅H2O, EDC⋅HCl и основания, такого как ДИПЭА, в полярном апротонном растворителе, таком как ДМФ, как на стадии ah2a схемы XXI.
В другом варианте осуществления соединения формулы XXVIIIb можно превратить в соединения формулы 1, в которой R11 означает CH2N(C=S)(R14) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с тиокислотой в присутствии HOBt⋅H2O, EDC⋅HCl и основания, такого как ДИПЭА, в полярном апротонном растворителе, таком как ДМФ, как на стадии ah2 схемы XXI.
В другом варианте осуществления соединения формулы XXVIIIb можно превратить в соединения формулы 1, в которой R11 означает CH2N(C=O)N(R14)(R15) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, в две стадии. Первая стадия (стадия ah3a схемы XXI) включает реакцию с альдегидом в полярном протонном растворителе, таком как МеОН, затем реакцию с борогидридом натрия. Вторая стадия (стадия ah3b схемы XXI) включает ацилирование хлорангидридом кислоты, таким как циклопропилкарбонилхлорид, и основанием, таким как ТЭА, в нереакционноспособном растворителе, таком как CH2Cl2, при температуре окружающей среды схемы XXI.
В другом варианте осуществления соединения формулы XXVIIIb можно превратить в соединения формулы 1, в которой R11 означает CH2N(C=O)N(R14)(R15) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с изоцианатом (стадия ai1 схемы XXI) или карбамоилхлоридом (стадия ai2 схемы XXI) в присутствии основания, такого как ТЭА, и в нереакционноспособном растворителе, таком как CH2Cl2, при 0°С.
В другом варианте осуществления соединения формулы XXVIIIb можно превратить в соединения формулы 1, в которой R11 означает CH2N(C=S)N(R14)(R15) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с изотиоцианатом в присутствии основания, такого как ТЭА, и в нереакционноспособном растворителе, таком как CH2Cl2, при 0°С, как на стадиях aj схемы XXI.
В другом варианте осуществления соединения формулы XXVIIIb можно превратить в соединения формулы 1, в которой R11 означает CH2N(C=O)O(R14) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с дикарбонатом, таким как ди-трет-бутилдикарбонат, в присутствии основания, такого как ТЭА, и в нереакционноспособном растворителе, таком как CH2Cl2, при температуре окружающей среды, как на стадиях ak схемы XXI.
В еще одном варианте осуществления соединения формулы XXVIIIb можно превратить в соединения формулы 1, в которой R11 означает CH2N(С=O)(С=O)О(R14) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с эфиром хлорщавелевой кислоты, таким как 2-хлор-2-оксоацетат, в присутствии основания, такого как ТЭА, и в нереакционноспособном растворителе, таком как CH2Cl2, при 0°С, как на стадиях al схемы XXI.
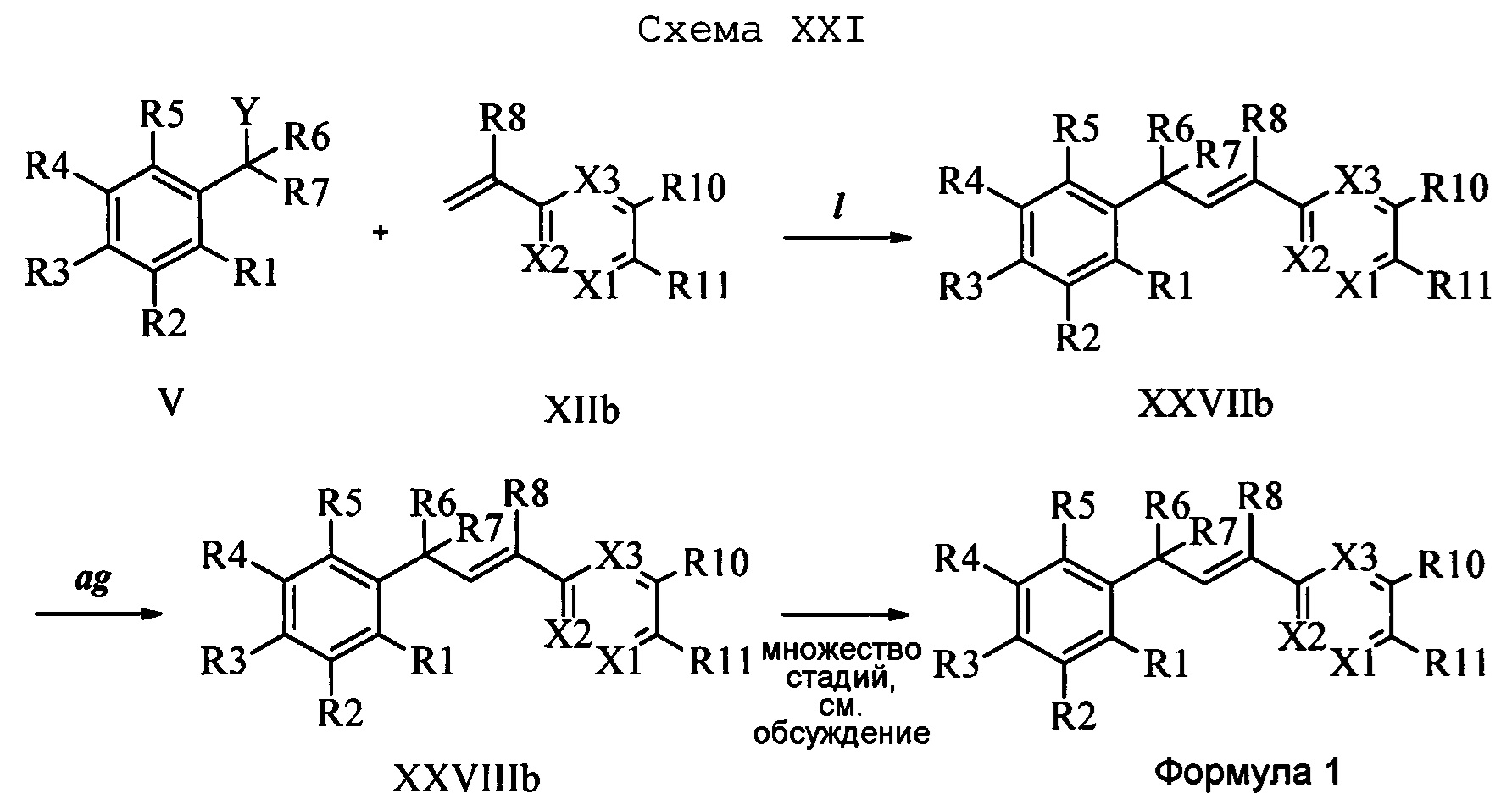
На стадии 1 схемы XXII соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и соединения формулы XIIc, в которой R10 означает Cl, R11 означает CH2N(фталимид), X1 означает N и R8, R9, R12, R13, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают соответствующие соединения формулы XXVIIc, в которой R10 означает Cl, R11 означает CH2N(фталимид), X1 означает N и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, Х2 и Х3 являются такими, как раскрыто выше. Фталимидную защитную группу в соединениях формулы XXVIIc удаляют, как на стадии ag схемы XXII, по реакции с гидразингидратом в полярном протонном растворителе, таком как EtOH, при 90°С и получают соединения формулы XXVIIIc, в которой R10 означает Cl, R11 означает CH2NH2, X1 означает N и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, Х2 и Х3 являются такими, как раскрыто выше. Соединения формулы XXVIIIc можно превратить в соединения формулы 1, в которой R10 означает Cl, R11 означает CH2N(C=O)(R14), X1 означает N и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, Х2 и Х3 являются такими, как раскрыто выше, по реакции с кислотой в присутствии HOBt⋅H2O, EDC⋅HCl и основания, такого как ДИПЭА, в полярном апротонном растворителе, таком как CH2Cl2, как на стадии ah2b схемы XXII.
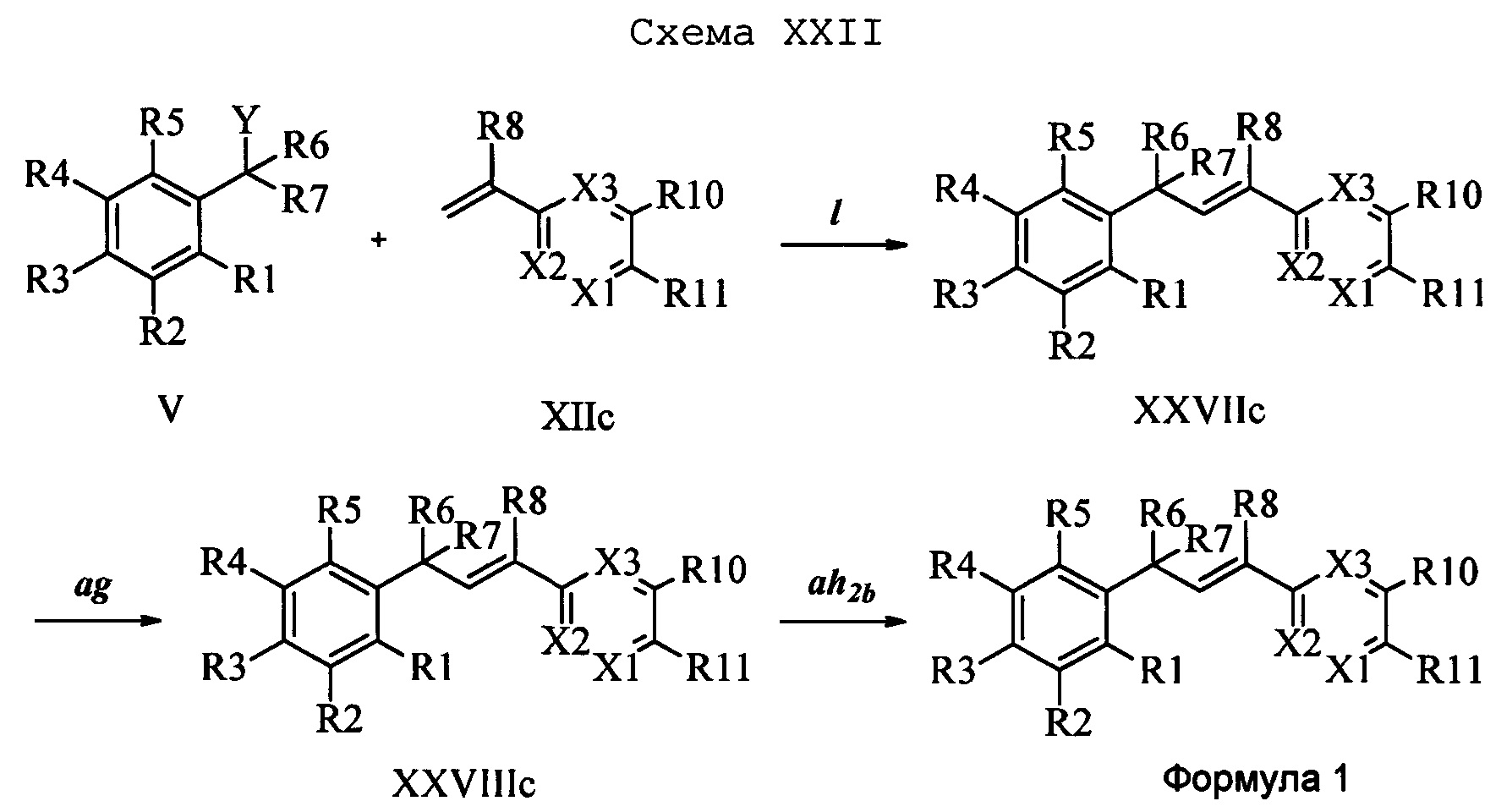
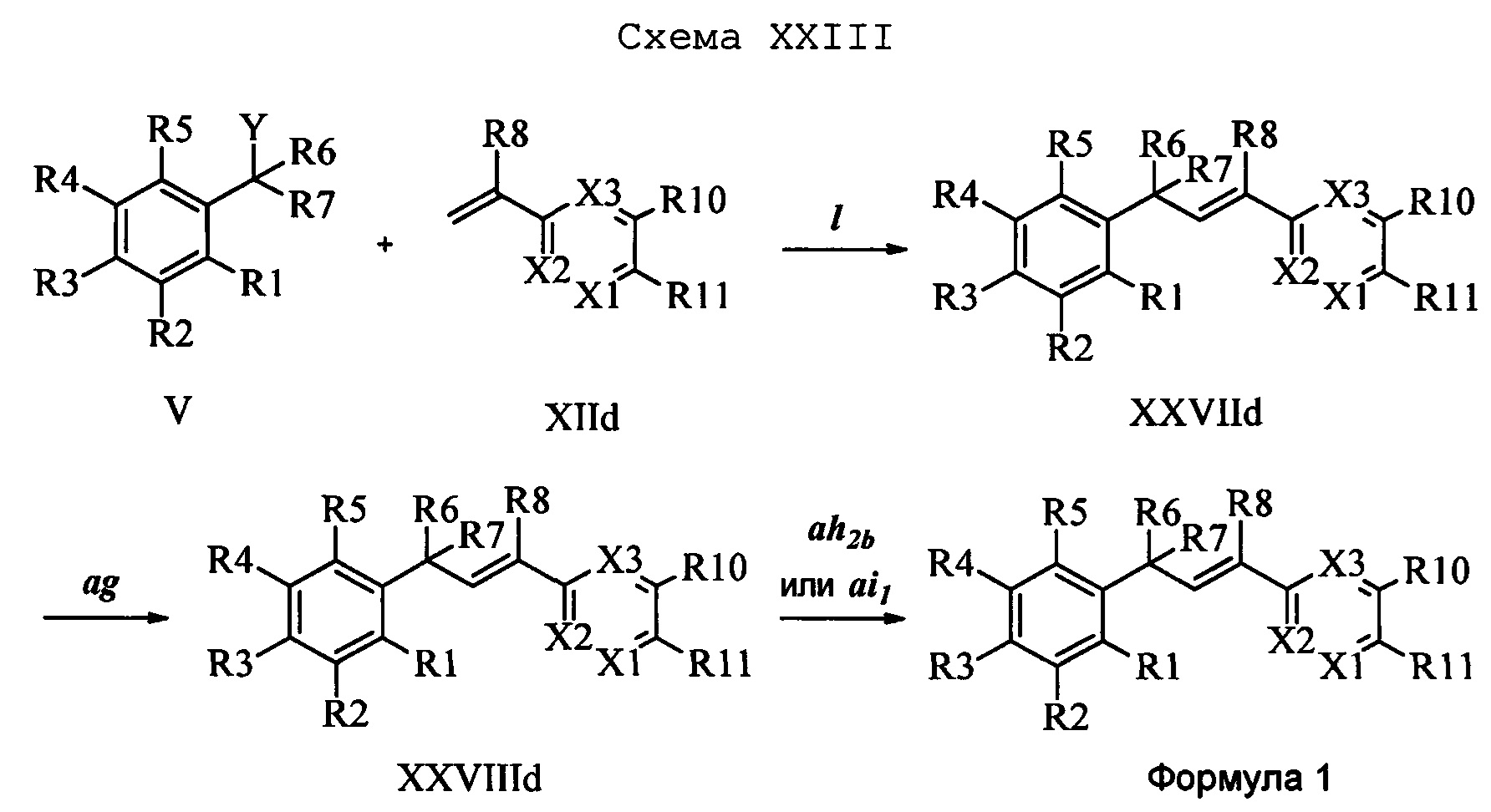
На стадии I схемы XXIII соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и соединения формулы XIId, в которой Х3 означает CR9, R10 и Х3 вместе образуют звено, содержащее 4 атома углерода, и вместе с кольцевыми атомами углерода образуют 6-членное ароматическое кольцо (или при желании неароматическое кольцо), R11 означает CH2N(фталимид) и R8, R9, R12, R13, X1 и Х2 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают соответствующие соединения формулы XXVIId, в которой Х3 означает CR9, R10 и Х3 вместе образуют звено, содержащее 4 атома углерода, и вместе с кольцевыми атомами углерода образуют 6-членное ароматическое кольцо, R11 означает CH2N(фталимид) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, X1 и Х2 являются такими, как раскрыто выше. Фталимидную защитную группу в соединениях формулы XXVIId удаляют, как на стадии ag схемы XXIII, по реакции с гидразингидратом в полярном протонном растворителе, таком как EtOH, при 90°С и получают соединения формулы XXVIIId, в которой Х3 означает CR9, R10 и Х3 вместе образуют звено, содержащее 4 атома углерода, и вместе с кольцевыми атомами углерода образуют 6-членное ароматическое кольцо, R11 означает CH2NH2 и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, X1 и Х2 являются такими, как раскрыто выше. Соединения формулы XXVIIId можно превратить в соединения формулы 1, в которой Х3 означает CR9, R10 и Х3 вместе образуют звено, содержащее 4 атома углерода, и вместе с кольцевыми атомами углерода образуют 6-членное ароматическое кольцо, R11 означает CH2N(С=O)(R14) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, X1 и Х2 являются такими, как раскрыто выше, по реакции с кислотой в присутствии HOBt⋅H2O, EDC⋅HCl и основания, такого как ДИПЭА, в полярном апротонном растворителе, таком как CH2Cl2, как на стадии ah2b схемы XXIII.
В другом варианте осуществления соединения формулы XXVIIId можно превратить в соединения формулы 1, в которой Х3 означает CR9, R10 и Х3 вместе образуют звено, содержащее 4 атома углерода, и вместе с кольцевыми атомами углерода образуют 6-членное ароматическое кольцо, R11 означает CH2N(C=O)N(R14)(R15) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1 и Х2 являются такими, как раскрыто выше, по реакции с изоцианатом в присутствии основания, такого как ТЭА, и в нереакционноспособном растворителе, таком как CH2Cl2, при 0°С, как на стадии ai1 схемы XXIII.
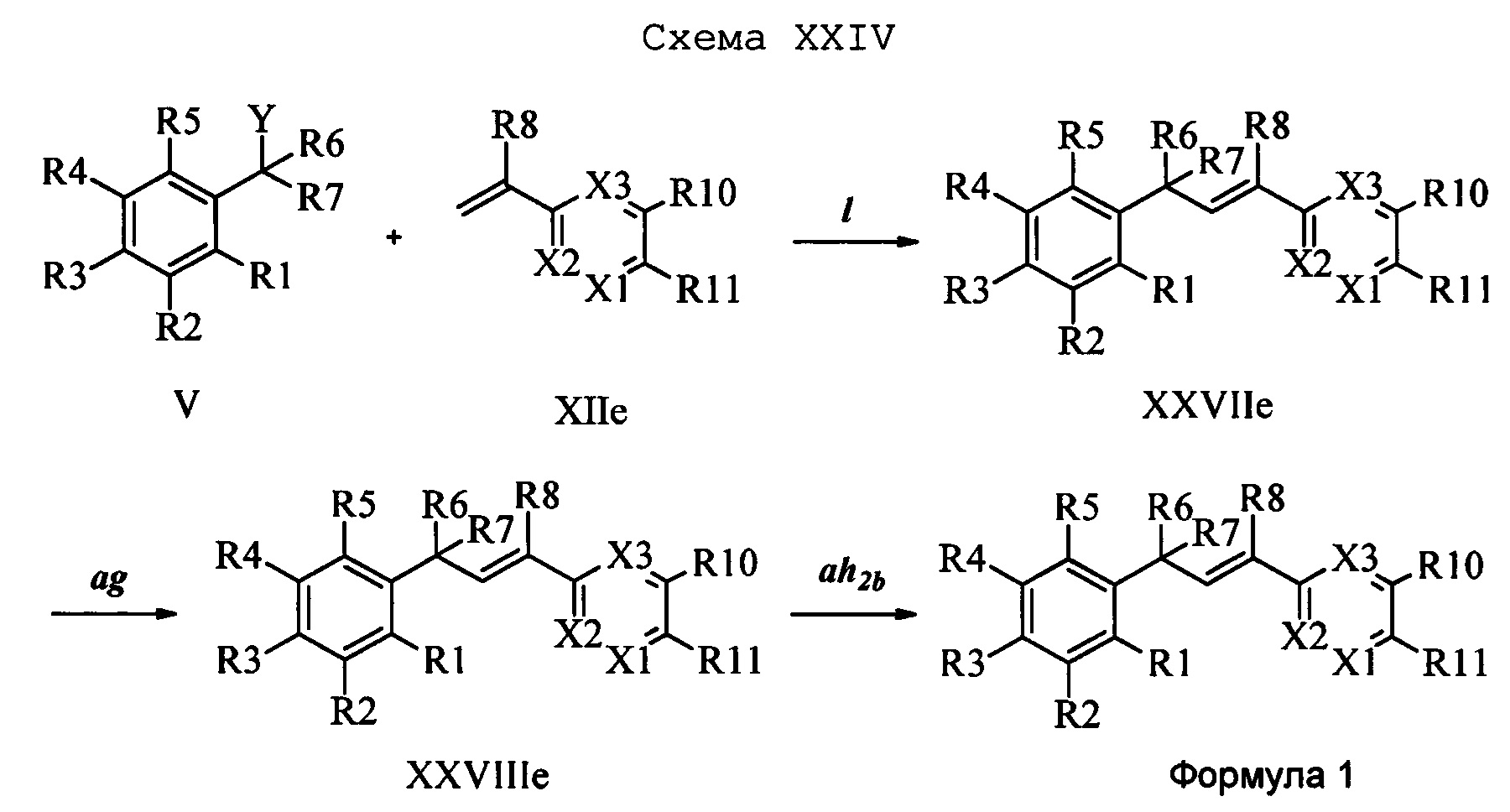
На стадии 1 схемы XXIV соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и соединения формулы XIIe, в которой R11 означает NHN(фталимид) и R8, R9, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают соответствующие соединения формулы XXVIIe, в которой R11 означает NHN(фталимид) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше. Фталимидную защитную группу в соединениях формулы XXVIIe удаляют, как на стадии ag схемы XXIV, по реакции с гидразингидратом в полярном протонном растворителе, таком как EtOH, при 90°С и получают соединения формулы XXVIIIe, в которой R11 означает NHNH2 и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше. Соединения формулы XXVI Не можно превратить в соединения формулы 1, в которой R11 означает NHN(C=O)(R14) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с кислотой в присутствии HOBt⋅H2O, EDC⋅HCl и основания, такого как ДИПЭА, в полярном апротонном растворителе, таком как CH2Cl2, как на стадии ah2b схемы XXIV.
На стадии 1 схемы XXV соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и соединения формулы XIIf, в которой R11 означает ON(фталимид) и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают соответствующие соединения формулы XXVIIf, в которой R11 означает ON(фталимид) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше. Фталимидную защитную группу в соединениях формулы XXVIIf удаляют, как на стадии ag схемы XXV, по реакции с гидразингидратом в полярном протонном растворителе, таком как EtOH, при 90°С и получают соединения формулы XXVIIIf, в которой R11 означает ONH2 и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше. Соединения формулы XXVIIIf можно превратить в соединения формулы 1, в которой R11 означает ON(C=O)(R14) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с кислотой в присутствии HOBt⋅H2O, EDC⋅HCl и основания, такого как ДИПЭА, в полярном апротонном растворителе, таком как CH2Cl2, как на стадии ah2b схемы XXV.

На стадии l схемы XXVI соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и соединения формулы XVIII, в которой R11 означает CH2NH(2-пиридин) и R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают соответствующие соединения формулы 1, в которой R11 означает CH2NH(2-пиридин) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R12, R13, X1, Х2 и Х3 являются такими, как раскрыто выше.
Соединения формулы 1 можно дополнительно обработать по стандартным методикам. Например, если R11 содержит простую тиоэфирную группу, то тиоэфирную группу можно окислить в сульфоновую группу путем обработки оксоном в присутствии смеси ацетон : вода при температуре окружающей среды. Если R11 содержит оксалатную группу, то соединение формулы 1 можно превратить в соответствующий оксаламид по реакции с гидрохлоридом амина и раствором триметилалюминия в толуоле в нереакционноспособном растворителе, таком как CH2Cl2.
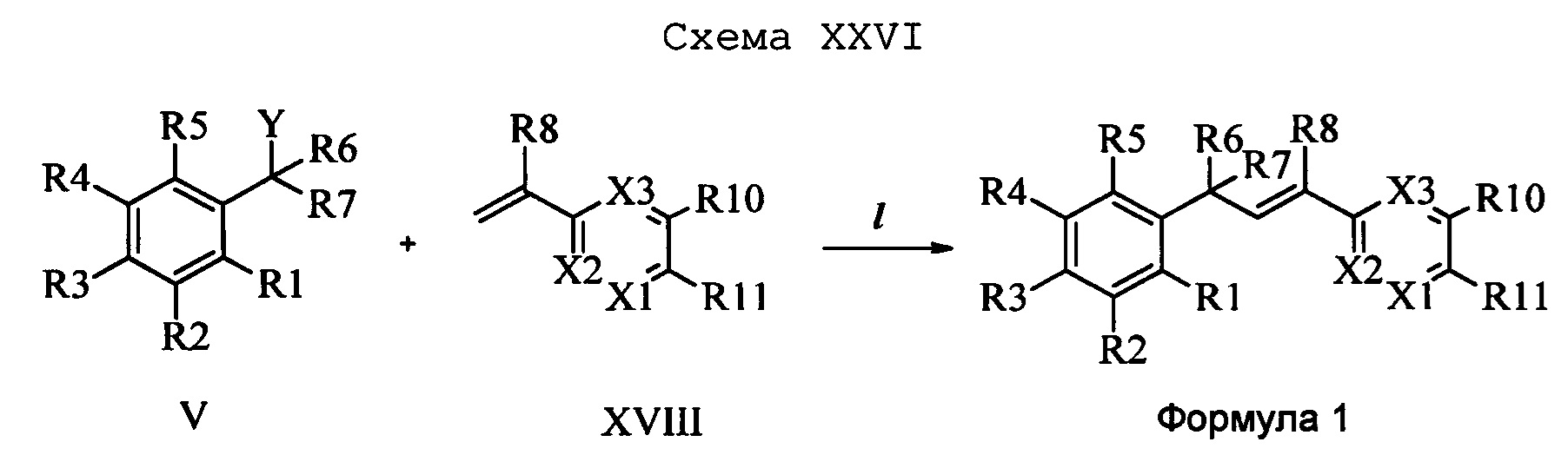
На схеме XXVII фторбензальдегид формулы XXIX, в которой R10, X1, Х2 и Х3 являются такими, как раскрыто выше, можно превратить в (1,2,4-триазол-1-ил)бензальдегид формулы XXX, в которой R11 означает замещенную или незамещенную 1,2,4-триазол-1-ильную группу и R10, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с замещенным или незамещенным 1,2,4-триазолом в присутствии основания, такого как карбонат калия, в растворителе, таком как ДМФ, как на стадии aj. На стадии ak (1,2,4-триазол-1-ил)бензальдегид формулы XXX превращают в (1,2,4-триазол-1-ил)винилбензол формулы XXXIa в которой R11 означает замещенную или незамещенную 1,2,4-триазол-1-ильную группу и R8, R10, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с трифенилфосфонийбромидом в присутствии основания, такого как карбонат калия, в апротонном растворителе, таком как 1,4-диоксан.
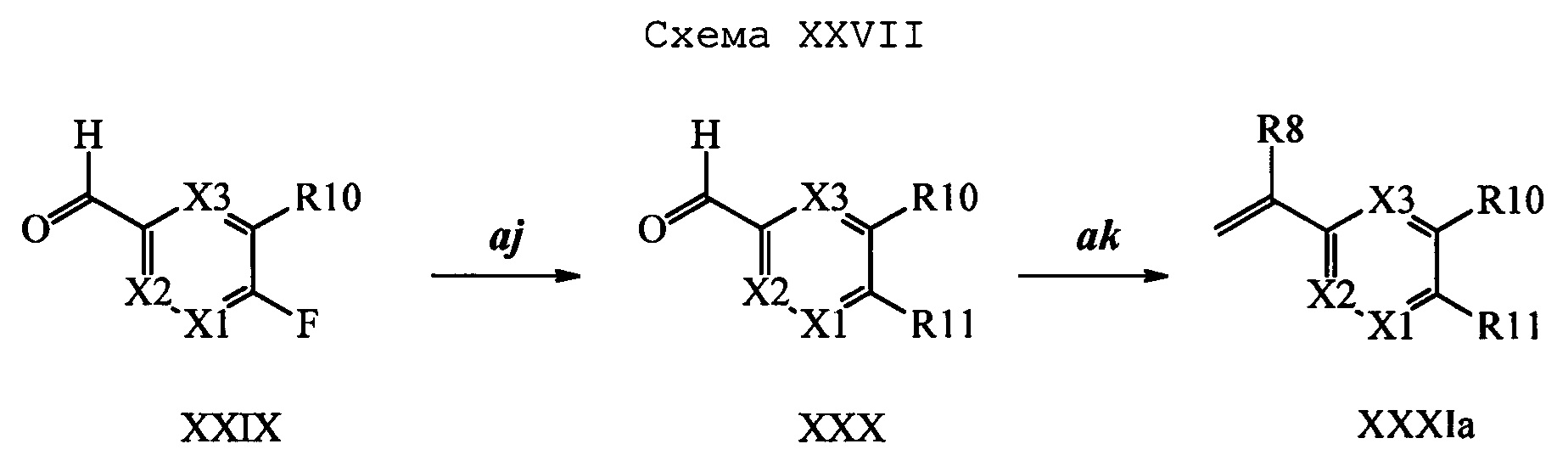
На схеме XXVIII бромфторбензол формулы XXXII, в которой R10, X1, Х2 и Х3 являются такими, как раскрыто выше, можно превратить в (1,2,4-триазол-1-ил)винилбензол формулы XXXIb, в которой R11 означает замещенную или незамещенную 1,2,4-триазол-1-ильную группу и R8, R10, X1, Х2 и Х3 являются такими, как раскрыто выше, в две стадии. На стадии al бромфторбензол вводят в реакцию с замещенным или незамещенным 1,2,4-триазолом в присутствии основания, такого как карбонат калия, в растворителе, таком как ДМФ, и получают (1,2,4-триазол-1-ил)бромбензол. На стадии cl (1,2,4-триазол-1-ил)бромбензол вводят в реакцию с комплексом ангидрида винилбороновой кислоты с пиридином в присутствии катализатора, такого как Pd(PPh3)4, и основания, такого как карбонат калия в растворителе, таком как толуол.
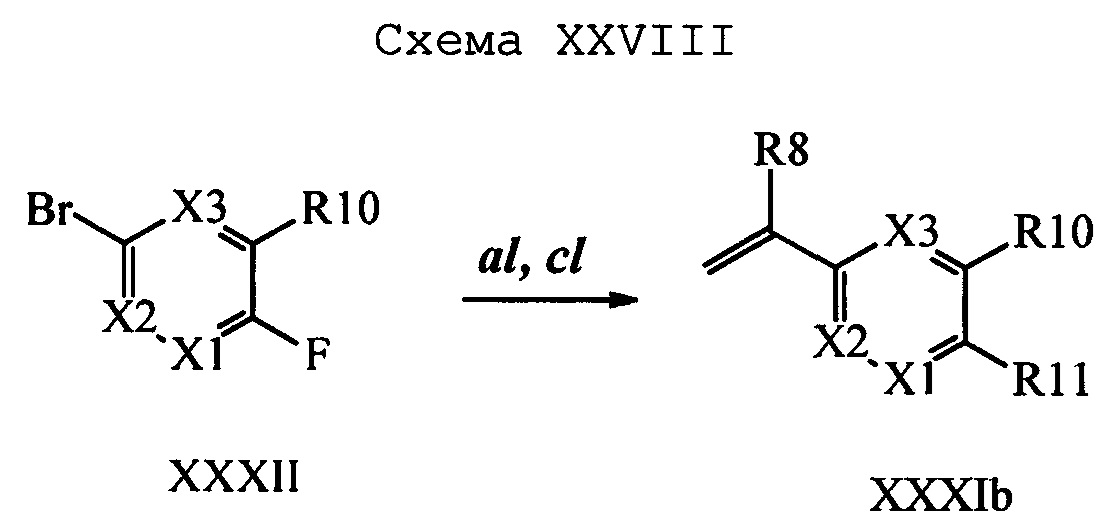
Сочетание соединений формулы V с соединениями формулы XXXIa и XXXIb можно провести, как показано на схемах XXIX. На стадии 1 соединение формулы V, в которой Y означает Br, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и винилбензол формулы XXXIa или XXXIb, в которой R11 означает замещенную или незамещенную 1,2,4-триазол-1-ильную группу и R8, R9, R10, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают молекулы формулы 1, в которой R11 означает замещенную или незамещенную 1,2,4-триазол-1-ильную группу и R1, R2, R3, R4, R5, R6, R7, R8, R10, X1, Х2 и Х3 являются такими, как раскрыто выше.
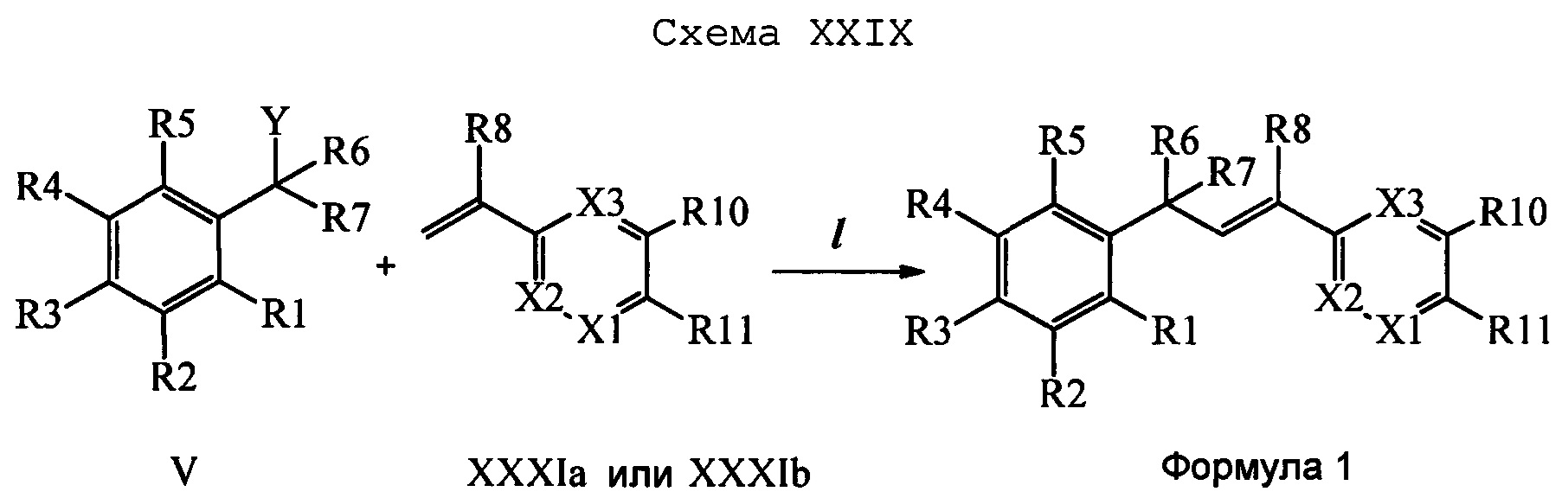
На схеме XXX соединения формулы XXXIII в которой R11 означает 3-нитро-1,2,4-триазол-1-ильную группу и R1, R2, R3, R4, R5, R6, R7, R8, R10, X1, Х2 и Х3 являются такими, как раскрыто выше, можно превратить в соединения формулы 1, в которой R11 означает 3-амидо-1,2,4-триазол-1-ильную группу и R1, R2, R3, R4, R5, R6, R7, R8, R10, X1, Х2 и Х3 являются такими, как раскрыто выше, по двустадийной методике. На стадии am 3-нитро-1,2,4-триазол-1-ильную группу восстанавливают и получают 3-амино-1,2,4-триазол-1-ильную группу в присутствии цинковой пыли и хлорида аммония в протонном растворителе, таком как МеОН. На стадии an 3-амино-1,2,4-триазол-1-ильную группу ацилируют хлорангидридом кислоты, таким как циклопропилкарбонилхлорид или ацетилхлорид, в присутствии основания, такого как ТЭА, в растворителе, таком как CH2Cl2.

На стадии ao схемы XXXI бромфенилметилкетон формулы XXXIV, в которой R10, X1, Х2 и Х3 являются такими, как раскрыто выше, превращают в фенилметилкетон формулы XXXV в которой R11 означает 1,2,4-триазол-1-ильную группу и R10, X1, Х2 и Х3 являются такими, как раскрыто выше, путем обработки 1,2,4-триазолом в присутствии основания, такого как карбонат цезия, и катализатора, такого как йодид меди, в растворителе, таком как ДМФ. На стадии ap 1,2,4-триазолилацетофенон формулы XXXV превращают в простой эфир триметилсилиленола формулы XXXVI путем обработки триметилсилилтрифторметансульфонатом в присутствии основания, такого как ТЭА, в апротонном растворителе, таком как CH2Cl2. На стадии ag простой эфир триметилсилиленола вводят в реакцию с соединением формулы V, в которой Y означает Br, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают кетон формулы XXXVII, в которой R11 означает 1,2,4-триазол-1-ильную группу и R1, R2, R3, R4, R5, R6, R7, R10, X1, Х2 и Х3 являются такими, как раскрыто выше. На стадии ar кетон формулы XXXVII обрабатывают метилмагнийбромидом в апротонном растворителе, таком как ТГФ, и получают третичный спирт. Затем третичный спирт вводят в реакцию элиминирования путем обработки каталитическим количеством п-толуолсульфоновой кислоты в растворителе, таком как толуол, путем нагревания при температуре, обеспечивающей азеотропное удаление воды, и получают соединения формулы 1 в которой R11 означает 1,2,4-триазол-1-ильную группу, R8 означает метил и R1, R2, R3, R4, R5, R6, R7, R10, X1, Х2 и Х3 являются такими, как раскрыто выше, как на стадии as.

На схеме XXXII соединение формулы XXXVIII, в которой R10 и R11 вместе образуют звено, содержащее 3-4 атома углерода и заместитель оксогруппу, и вместе с кольцевыми атомами углерода образуют 5- или 6-членное циклическое кольцо и R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше, превращают в молекулу формулы 1, в которой R10 и R11 вместе образуют звено, содержащее 3-4 атома углерода и заместитель алкиламиногруппу, и вместе с кольцевыми атомами углерода образуют 5- или 6-членное циклическое кольцо, и R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше, путем обработки алкиламином, таким как 3,3,3-трифторпропиламин, в присутствии восстановительного реагента, такого как цианоборогидрид натрия, в растворителе, таком как ДХЭ.
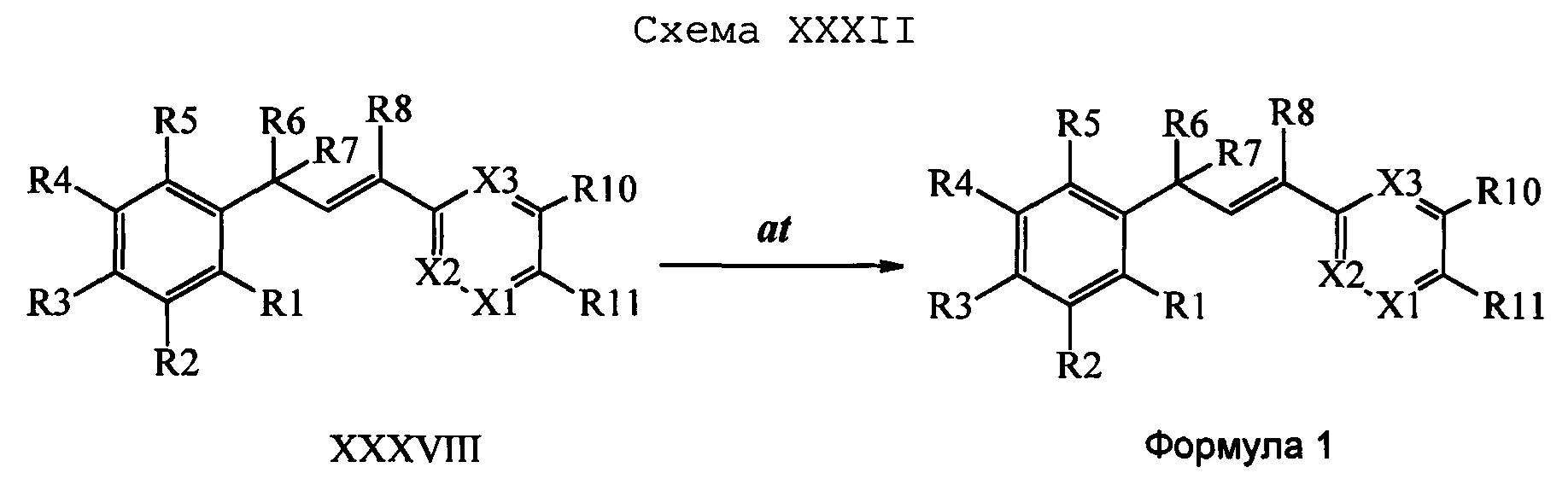
На схеме XXXIII соединение формулы XXXIX, в которой X1, Х2 и Х3 являются такими, как раскрыто выше, превращают в молекулу формулы XL, в которой X1, Х2 и Х3 являются такими, как раскрыто выше, путем обработки восстановительным реагентом, таким как цианоборогидрид натрия, в растворителе, таком как уксусная кислота, как на стадии au. На стадии av атом азота защищают трет-бутилоксикарбонильной (ВОС) группой по реакции с ди-трет-бутилдикарбонатом в присутствии катализатора, такого как ДМАП, в растворителе, таком как ацетонитрил. Бромид формулы XL можно превратить в олефин формулы XLI, в которой R8, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с винилтрифторборатом калия в присутствии палладиевого катализатора, такого как PdCl2(dppf), и основания, такого как K2CO3, в полярном апротонном растворителе, таком как ДМСО (диметилсульфоксид), при 100°С, как на стадии aw.
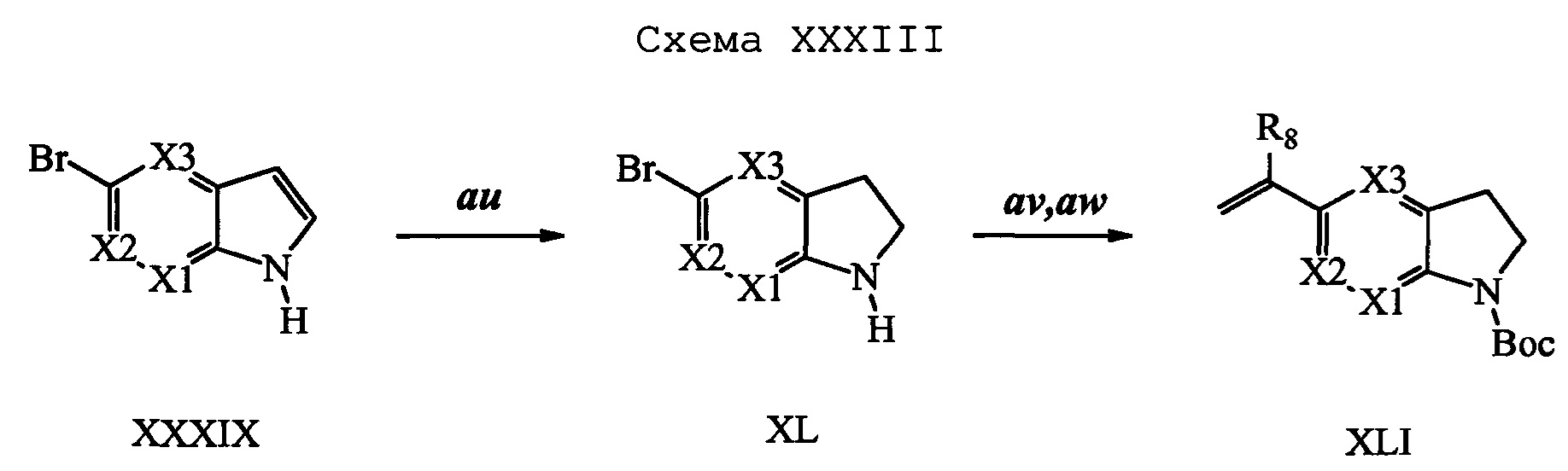
На схеме XXXIV соединение формулы XXXIX, в которой X1, Х2 и Х3 являются такими, как раскрыто выше, превращают в молекулу формулы XLII, в которой X1, Х2 и Х3 являются такими, как раскрыто выше, в две стадии. На стадии ax олефин получают путем обработки бромида винилтрифторборатом калия в присутствии палладиевого катализатора, такого как PdCl2, и лиганда, такого как трифенилфосфин, и основания, такого как Cs2CO3, в смеси растворителей, такой как ТГФ/Н2О. На стадии ау атом азота защищают трет-бутилоксикарбонильной (ВОС) группой по реакции с ди-трет-бутилдикарбонатом в присутствии катализатора, такого как ДМАП, в растворителе, таком как ацетонитрил.
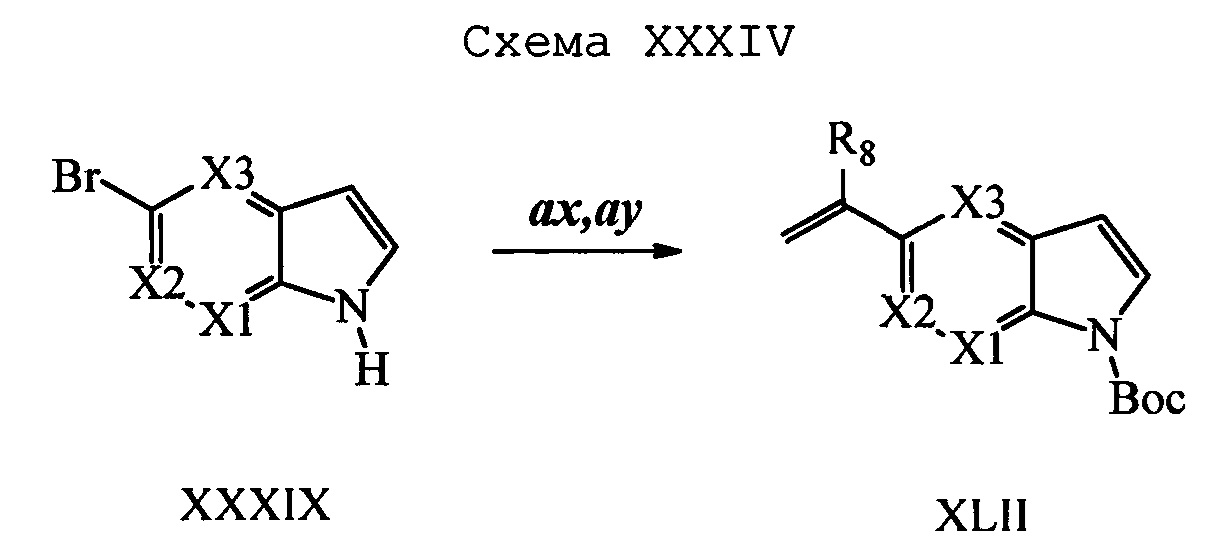
На стадии 1 схемы XXXV соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и соединения формулы XLI или XLII, в которой R8, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 150°С, и получают соответствующие соединения формулы XLIIIa или XLIIIb, в которой R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше.

На схеме XXXVI соединение формулы XLIIIa, в которой R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше, превращают в молекулу формулы XLIV, в которой R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше, путем обработки трифторуксусной кислотой, в растворителе, таком как CH2Cl2, как на стадии az. Затем соединения формулы XLIV можно превратить в соединения формулы XLV, в которой R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше, в две стадии. На стадии ba индолин обрабатывают нитритом натрия (NaNO2) в кислоте, такой как концентрированная HCl, при температуре около 5°С и получают нитрозоиндол. На стадии bb нитрозоиндол вводят в реакцию с хлоридом аммония в присутствии порошкообразного цинка в протонном растворителе, таком как МеОН. На стадии be соединения формулы XLV превращают в соединения формулы XLVI, в которой Х4 означает N(R14)(C(=O)R14) и R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше, путем обработки кислотой, такой как 3,3,3-трифторпропановая кислота, PyBOP, и основанием, таким как ДИПЭА, в полярном апротонном растворителе, таком как CH2Cl2.
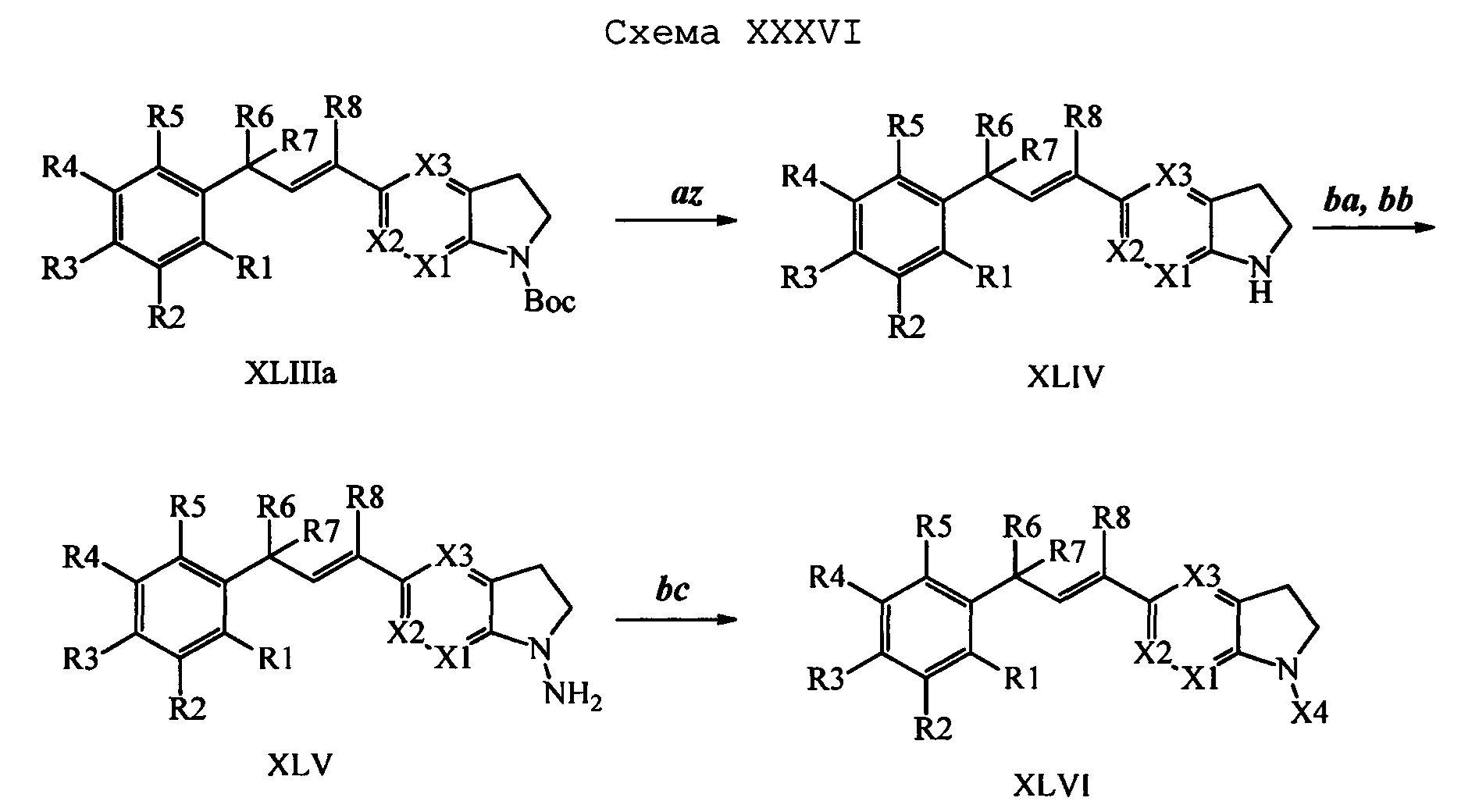
На схеме XXXVII соединение формулы XLIIIb, в которой R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше, превращают в индол формулы XLVII, в которой R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше, путем обработки трифторуксусной кислотой в растворителе, таком как CH2Cl2, как на стадии bd. Соединения формулы XLVII можно превратить в соединения формулы XLVIII, в которой R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с 4-нитрофенил-2-((трет-бутоксикарбонил)амино)ацетатом в присутствии фторида калия и краун-эфира, такого как 18-краун-6-эфир, в растворителе, таком как ацетонитрил, как на стадии be. Соединения формулы XLVIII можно превратить в соединения формулы XLIX, в которой R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше, в две стадии. На стадии bf группу Вое удаляют путем обработки трифторуксусной кислотой в растворителе, таком как CH2Cl2. На стадии bg амин обрабатывают 3,3,3-трифторпропановой кислотой, PyBOP, и основанием, таким как ДИПЭА, в полярном апротонном растворителе, таком как CH2Cl2.

На схеме XXXVIII соединение формулы L, в которой X1, Х2 и Х3 являются такими, как раскрыто выше, превращают в соединение формулы LI, в которой X1, Х2 и Х3 являются такими, как раскрыто выше, путем обработки пентагидратом сульфата меди(II) и порошкообразным Zn в основании, таком как гидроксид натрия, как на стадии bh. Соединения формулы LI можно превратить в соединения формулы LII, в которой X1, Х2 и Х3 являются такими, как раскрыто выше, по реакции с гидразином в растворителе, таком как вода, при температуре около 95°С, как на стадии bi. На стадии bj олефин формулы LIII, в которой X1, Х2 и Х3 являются такими, как раскрыто выше, получают путем обработки бромида винилтрифторборатом калия в присутствии палладиевого катализатора, такого как PdCl2(dppf), и основания, такого как K2CO3, в смеси растворителей, такой как ДМСО. Соединения формулы LIV, в которой X1, Х2 и Х3 являются такими, как раскрыто выше, можно получить из соединений формулы LIII по реакции с этилбромацетатом в присутствии основания, такого как Cs2CO3, в растворителе, таком как ДМФ.
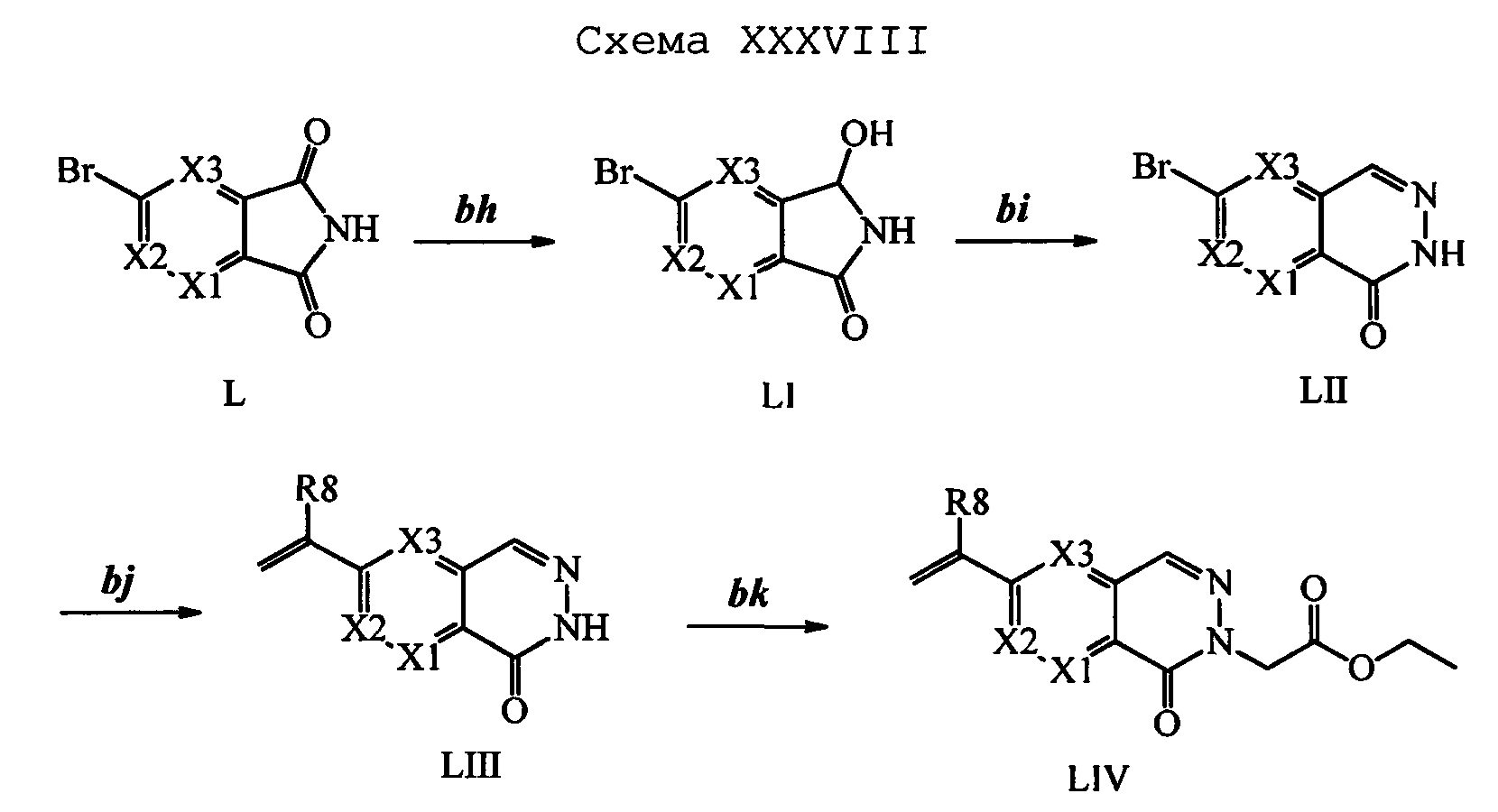
На стадии l схемы XXXIX соединение формулы V, в которой Y, R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, и соединение формулы LIV, в которой R8, X1, Х2 и Х3 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как 1,2-дихлорбензол, при температуре, равной примерно 180°С, и получают соответствующее соединение формулы LV, в которой R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше. Затем соединение формулы LV можно превратить в соединение формулы LVI, в которой R1, R2, R3, R4, R5, R6, R7, R8, X1, Х2 и Х3 являются такими, как раскрыто выше, в две стадии. На стадии bl сложный эфир гидролизуют с получением кислоты в присутствии HCl и уксусной кислоты при температуре, равной примерно 100°С. На стадии bm кислоту обрабатывают амином, таким как 2,2,2-трифторэтиламин, PyBOP, и основанием, таким как ДИПЭА, в полярном апротонном растворителе, таком как CH2Cl2.
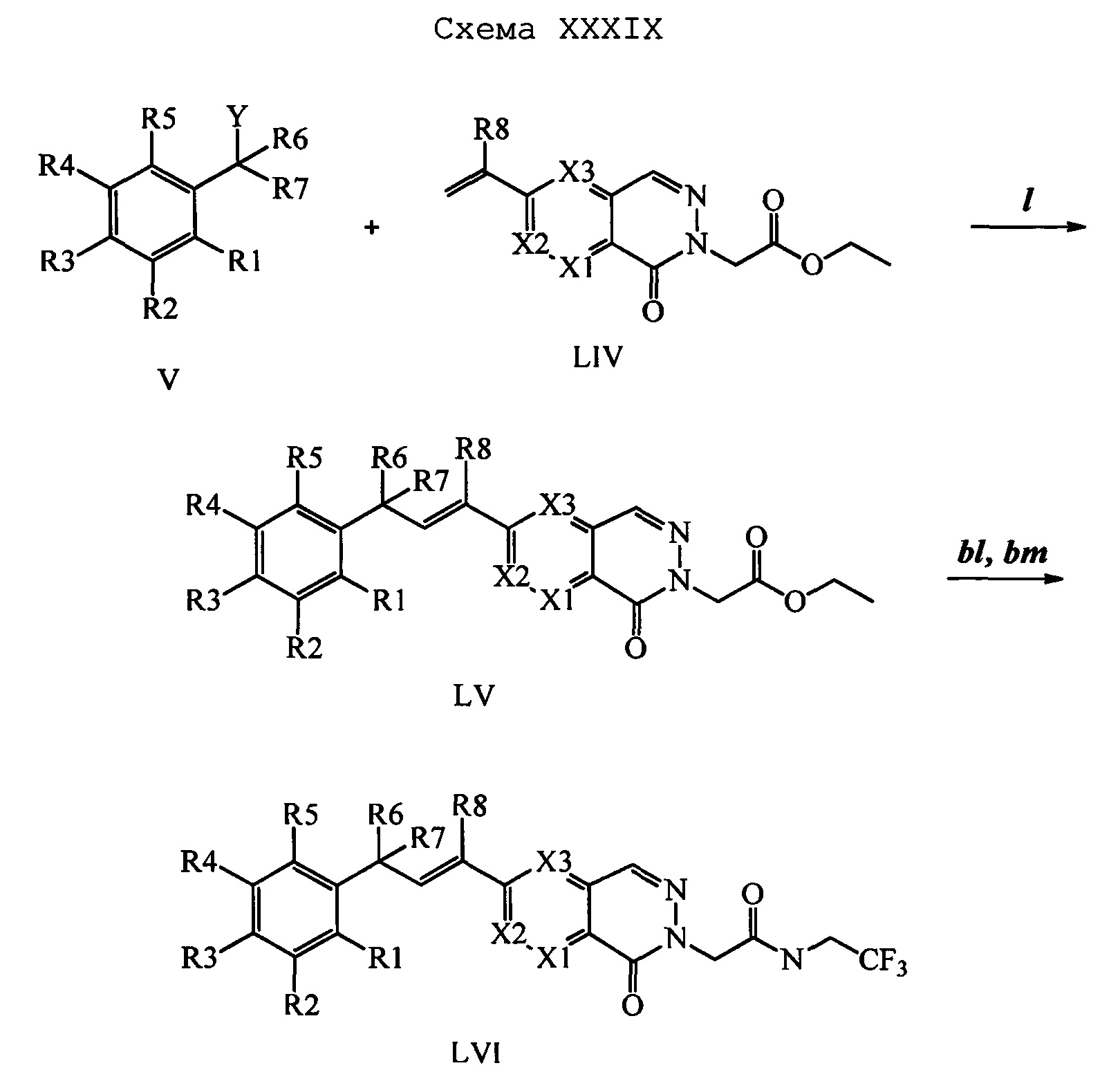
На стадии bn схемы XL карбоновые кислоты формулы LVII, в которой R11 означает С(=O)ОН и R8, R10, X1, Х2 и Х3 являются такими, как раскрыто выше, и соединения формулы V, в которой Y означает Br и R1, R2, R3, R4, R5, R6 и R7 являются такими, как раскрыто выше, вводят в реакцию в присутствии CuCl и 2,2-бипиридила в растворителе, таком как N-метилпирролидин, при температуре, равной примерно 150°С, и получают соединения формулы LVIII, в которой R11 означает (С=O)ОН и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, X1, Х2 и Х3 являются такими, как раскрыто выше. Затем соединения формулы LVIII можно превратить в соответствующие бензамиды формулы LIX, в которой R11 означает (C=O)N(R14)(R15) и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, X1, Х2 и Х3 являются такими, как раскрыто выше, путем обработки амином, таким как 2-амино-N-(2,2,2-трифторэтил)ацетамид, PyBOP, и основанием, таким как ДИПЭА, в полярном апротонном растворителе, таком как CH2Cl2, как на стадии bo.
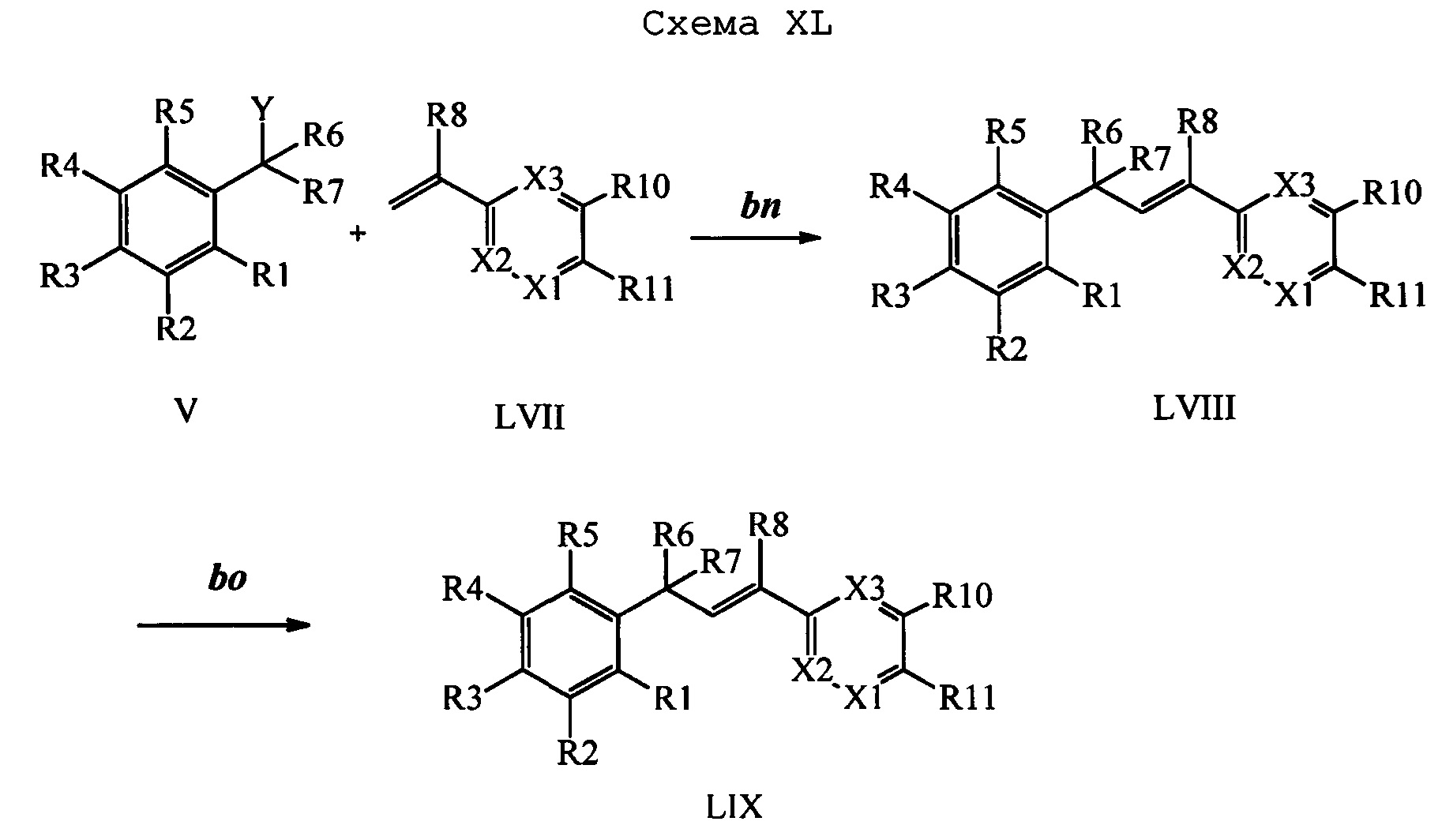
ПРИМЕРЫ
Примеры приведены для иллюстрации и их не следует рассматривать в качестве ограничивающих изобретение, раскрытое в настоящем документе, только вариантами осуществления, раскрытыми в этих примерах.
Исходные вещества, реагенты и растворители, которые получали из коммерческих источников, использовали без дополнительной очистки, если не указано иное. Безводные растворители приобретали в виде Sure/Seal™ у фирмы Aldrich и использовали в том виде, в котором они были получены. Температуры плавления измеряли с помощью капиллярного аппарата для определения температуры плавления Thomas Hoover Unimelt или с помощью автоматической системы для определения температуры плавления OptiMelt, выпускающейся фирмой Research Systems, и они являются не скорректированными. Молекулы представлены своими известными названиями, полученными с помощью программ, включенных в программы ISIS Draw, ChemDraw или ACD Name Pro. Если такие программы не смогли выработать название молекулы, то название молекулы получали в соответствии с обычными правилами номенклатуры. Данные спектров1H ЯМР приведены в част./млн (δ) и регистрировали при 300, 400 или 600 МГц и данные спектров13С ЯМР приведены в част./млн (δ) и регистрировали при 75, 100 или 150 МГц, если не указано иное.
Пример 1: Получение 1-(1-бром-2,2,2-трифторэтил)-3,5-дихлорбензол (AI1)
Стадия 1, методика А. 1-(3,5-Дихлорфенил)-2,2,2-трифторэтанол (AI2). При перемешивании к раствору 1-(3,5-дихлорфенил)-2,2,2-трифторэтанона (поставляет фирма Rieke Metals, UK; 5,0 граммов (г), 20,5 миллимоля (ммоля)) в МеОН (100 мл) при 0°С добавляли борогидрид натрия (NaBH4; 3,33 г, 92,5 мл) и 1-нормальный (н.) водный раствор гидроксида натрия (NaOH; 10 мл). Реакционную смесь нагревали до 25°С и перемешивали в течение 2 часов (ч). После того, как по данным тонкослойной хроматографии (ТСХ) реакцию считали завершенной, к реакционной смеси добавляли насыщенный водный раствор хлорида аммония (NH4Cl) и смесь концентрировали при пониженном давлении. Остаток разбавляли диэтиловым эфиром (Et2O) и промывали водой (H2O; 3×50 мл). Органический слой сушили над сульфатом натрия (Na2SO4) и концентрировали при пониженном давлении, и получали искомое соединение в виде жидкости (4,0 г, 79%):1H ЯМР (400 МГц, CDCl3) δ 7,41 (м, 3Н), 5,00 (м, 2Н), 2,74 (с, 1Н); ИЭРМС (масс-спектроскопия с ионизацией электрораспылением) m/z 242,97 ([М-Н]-).
Стадия 1, методика В. 1-(3,5-Дихлорфенил)-2,2,2-трифторэтанол (AI2). При перемешивании к раствору 3,5-дихлорбензальдегида (10 г, 57 ммоля) в ТГФ (250 мл) добавляли трифторметилтриметилсилан (9,79 г, 69,2 ммоля) и каталитическое количество тетрабутиламмонийфторида (ТБАФ). Реакционную смесь перемешивали при 25°С в течение 8 ч. После того, как по данным ТСХ реакцию считали завершенной, реакционную смесь разбавляли 3 н. хлористоводородной кислотой (HCl) и затем перемешивали в течение 16 ч. Реакционную смесь разбавляли с помощью Н2О и экстрагировали этилацетатом (EtOAc; 3×). Объединенные органические экстракты промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде жидкости (8,41 г, 60%).
Указанные ниже соединения получали по методикам, раскрытым выше на стадии 1, методика В примера 1.
2,2,2-Трифтор-1-(3,4,5-трихлорфенил)этанол (AI3)
Продукт выделяли в виде бледно-желтой жидкости (500 мг, 65%):1H ЯМР (400 МГц, CDCl3) δ 7,45 (с, 2Н), 5,00 (м, 1Н), 2,80 (с, 1Н); ИЭРМС m/z 278 ([М+Н]+); ИК (инфракрасная спектроскопия) (тонкая пленка) 3420, 1133, 718 см-1.
1-(3,5-Дихлор-4-фторфенил)-2,2,2-трифторэтанол (AI4)
Продукт выделяли в виде бледно-желтой жидкости (500 мг, 65%):1H ЯМР (400 МГц, CDCl3) δ 7,41 (с, 2Н), 5,00 (м, 1Н), 2,80 (с, 1Н); ИЭРМС m/z 262 ([М+Н]+); ИК (тонкая пленка) 3420, 1133, 718 см-1.
1-(3,4-Дихлорфенил)-2,2,2-трифторэтанол (AI5)
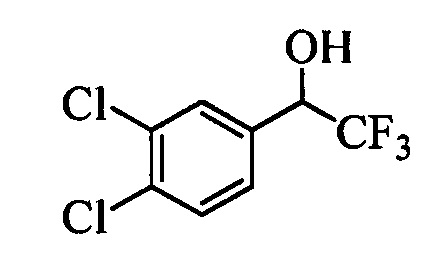
Продукт выделяли в виде бледно-желтой жидкости (500 мг, 65%):1H ЯМР (400 МГц, CDCl3) δ 7,60 (с, 1Н), 7,51 (м, 1Н), 7,35 (м, 1Н), 5,01 (м, 1Н), 2,60 (с, 1Н); ЭУМС m/z 244 ([М]+).
1-(3,5-Дибромфенил)-2,2,2-трифторэтанол
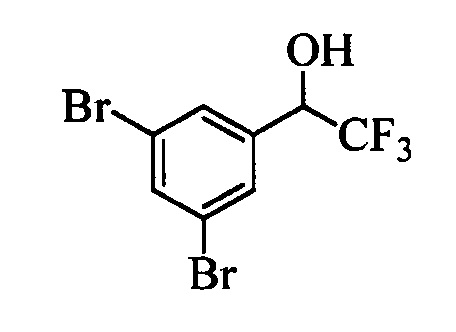
Искомое соединение выделяли в виде бесцветной жидкости:1H ЯМР (300 МГц, CDCl3) δ 7,67 (с, 1Н), 7,58 (с, 2Н), 5,08-5,02 (м, 1Н), 4,42 (шир.с, 1Н); ЭУМС m/z 333,7 ([М]+); ИК (тонкая пленка) 3417, 2966, 1128, 531 см-1.
1-(4-Бром-3,5-дихлорфенил)-2,2,2-трифторэтанол
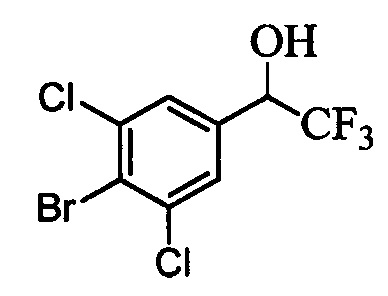
Продукт выделяли в виде бесцветной жидкости:1H ЯМР (300 МГц, ДМСО-d6) δ 7,75 (с, 2Н), 7,24 (д, J=6,0 Гц, 1Н), 5,34-5,29 (м, 1Н); ЭУМС m/z 321,88 ([М]+); ИК (тонкая пленка) 3420, 1706, 1267, 804, 679 см-1.
1-(3,5-Дибром-4-хлорфенил)-2,2,2-трифторэтанол
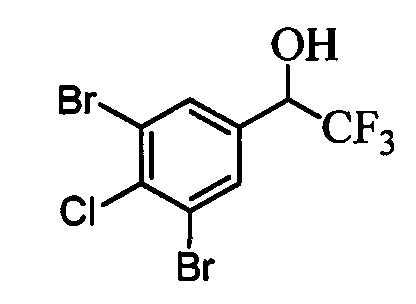
Продукт выделяли в виде бледно-желтой смолы:1H ЯМР (300 МГц, ДМСО-d6) δ 7,89 (с, 2Н), 7,20 (д, J=6,0 Гц, 1Н) 5,34-5,30 (м, 1Н); ЭУМС m/z 366,0 ([М]+).
Стадия 2. 1-(1-Бром-2,2,2-трифторэтил)-3,5-дихлорбензол (AI1). При перемешивании к раствору 1-(3,5-дихлорфенил)-2,2,2-трифторэтанола (4,0 г, 16,3 ммоля) в CH2Cl2 (50 мл) добавляли N-бромсукцинимид (NBS; 2,9 г, 16,3 ммоля) и трифенилфосфит (5,06 г, 16,3 ммоля) и полученную реакционную смесь кипятили с обратным холодильником в течение 18 ч. После того, как по данным ТСХ реакцию считали завершенной, реакционную смесь охлаждали до 25°С и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; при элюировании с помощью 100% пентана) давала искомое соединение в виде жидкости (2,0 г, 40%):1H ЯМР (400 МГц, CDCl3) δ 7,41 (с, 3Н), 5,00 (м, 1Н); ЭУМС (масс-спектроскопия с ионизацией электронным ударом) m/z 306 ([М]+).
Указанные ниже соединения получали по методикам, раскрытым на стадии 2 примера 1.
5-(1-Бром-2,2,2-трифторэтил)-1,2,3-трихлорбензол (AI6)
Продукт выделяли в виде бесцветного масла (300 мг, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,59 (с, 2Н), 5,00 (м, 1Н); ЭУМС m/z 340,00 ([М]+).
5-(1-Бром-2,2,2-трифторэтил)-1,3-дихлор-2-фторбензол (AI7)
Продукт выделяли в виде бесцветного масла (320 мг, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,45 (с, 2Н), 5,00 (м, 2Н); ЭУМС m/z 324,00 ([М]+).
4-(1-Бром-2,2,2-трифторэтил)-1,2-дихлорбензол (AI8)

Продукт выделяли в виде бесцветного масла (300 мг, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,63 (с, 1Н), 7,51 (м, 1Н), 7,35 (м, 1Н), 5,01 (м, 1Н); ЭУМС m/z 306,00 ([М]+).
1,3-Дибром-5-(1-бром-2,2,2-трифторэтил)бензол
Искомое соединение выделяли в виде бесцветной жидкости:1H ЯМР (300 МГц, CDCl3) δ 7,71 (с, 1Н), 7,59 (с, 2Н), 5,04-4,97 (м, 1Н); ЭУМС m/z 394,6 ([М]+); ИК (тонкая пленка) 1114, 535 см-1.
2-Бром-5-(1-бром-2,2,2-трифторэтил)-1,3-дихлорбензол
Искомое соединение выделяли в виде бесцветной жидкости:1H ЯМР (400 МГц, ДМСО-d6) δ 7,79 (с, 2Н), 6,27-6,21 (м, 1Н); ЭУМС m/z 383,9 ([М]+); ИК (тонкая пленка) 2924, 1114, 749, 534 см-1.
1,3-Дибром-5-(1-бром-2,2,2-трифторэтил)-2-хлорбензол

Искомое соединение выделяли в виде бледно-желтой жидкости:
1H ЯМР (300 МГц, ДМСО-d6) δ 7,97 (с, 2Н), 6,27-6,19 (м, 1Н); ЭУМС m/z 428,0 ([М]+).
Пример 2: Получение N-метил-4-винилбензамида (AI9)
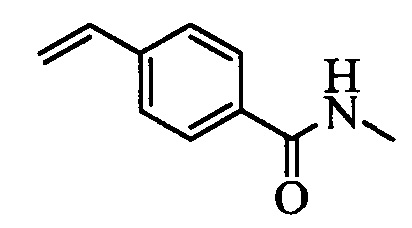
Стадия 1. 4-Винилбензоилхлорид (AI10). При перемешивании к раствору 4-винилбензойной кислоты (1 г, 6,75 ммоля) в CH2Cl2 (20 мл) при 0°С по каплям в течение 15 минут (мин) добавляли каталитическое количество ДМФ и оксалилхлорид (1,27 г, 10,12 ммоля). Реакционную смесь перемешивали при 25°С в течение 6 ч. После того, как по данным ТСХ реакцию считали завершенной, реакционную смесь концентрировали при пониженном давлении, и получали неочищенный хлорангидрид кислоты.
Стадия 2. N-Метил-4-винилбензамид (AI9). К 1 М раствору N-метиламина в ТГФ (13,5 мл, 13,5 ммоля) при 0°С добавляли ТЭА (1,34 мл, 10,12 ммоля) и хлорангидрид кислоты, полученный выше на стадии 1, в ТГФ (10 мл) и реакционную смесь перемешивали при 25°С в течение 3 ч. После того, как по данным ТСХ реакцию считали завершенной, реакцию останавливали водой и затем экстрагировали с помощью EtOAc (3×). Объединенный слой, содержащий EtOAc, промывали рассолом и сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде почти белого твердого вещества (650 мг, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,76 (д, J=8,0 Гц, 2Н), 7,45 (д, J=8,0 Гц, 2Н), 6,79 (м, 1Н), 6,20 (шир.с, 1Н), 5,82 (д, J=17,6 Гц, 1Н), 5,39 (д, J=10,8 Гц, 1Н); ИЭРМС m/z 161,95 ([М+Н]+).
Указанные ниже соединения получали по методикам, раскрытым в примере 2.
N,N-Диметил-4-винилбензамид (AI11)
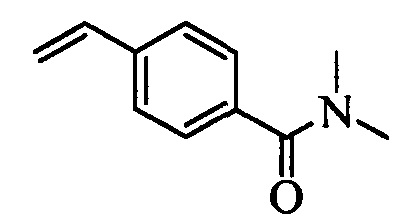
Продукт выделяли в виде почти белого твердого вещества (650 мг, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,42 (м, 4Н), 6,71 (м, 1Н), 5,80 (д, J=17,6 Гц, 1Н), 5,31 (д, J=10,8 Гц, 1Н), 3,05 (с, 3Н), 3,00 (с, 3Н); ИЭРМС m/z 176,01 ([М+Н]+).
N-(2,2,3-Трифторметил)-4-винилбензамид (AI12)

Продукт выделяли в виде почти белого твердого вещества (900 мг, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,76 (д, J=8,0 Гц, 2Н), 7,45 (д, J=8,0 Гц, 2Н), 6,79 (м, 1Н), 6,20 (шир.с, 1Н), 5,82 (д, J=17,6 Гц, 1Н), 5,39 (д, J=10,8 Гц, 1Н), 4,19 (м, 2Н); ИЭРМС m/z 230,06 ([М+Н]+).
Морфолино(4-винилфенил)метанон (AI13)
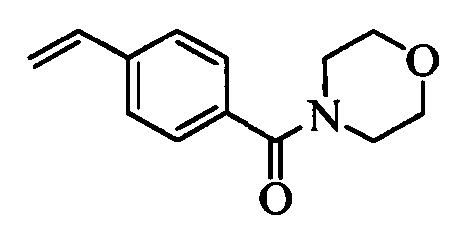
Продукт выделяли в виде белого твердого вещества (850 мг, 60%): ИЭРМС m/z 218,12 ([М+Н]+).
Пример 3: Получение этил-2-метил-4-винилбензоат (AI14)
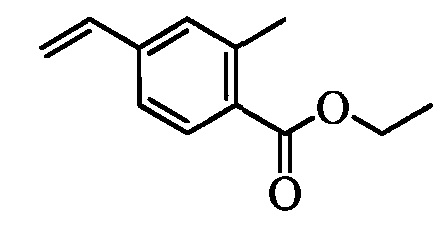
Стадия 1. 4-Формил-2-метилбензойная кислота (AI15). При перемешивании к раствору 4-бром-2-метилбензойной кислоты (10 г, 46,4 ммоля) в сухом ТГФ (360 мл) при -78°С добавляли н-BuLi (1,6 М раствор в гексане; 58,17 мл, 93,0 ммоля) и ДМФ (8 мл). Реакционную смесь перемешивали при -78°С в течение 1 ч затем нагревали при 25°С и перемешивали в течение 1 ч. Реакцию останавливали 1 н. раствором HCl и экстрагировали с помощью EtOAc. Объединенные экстракты в EtOAc промывали рассолом и сушили над Na2SO4, и концентрировали при пониженном давлении. Остаток промывали н-гексаном и получали искомое соединение в виде твердого вещества (3,0 г, 40%): температура плавления 196-198°С;1H ЯМР (400 МГц, ДМСО-d6) δ 13,32 (шир.с, 1Н), 10,05 (с, 1Н), 7,98 (м, 1Н), 7,84 (м, 2Н), 2,61 (с, 3Н); ИЭРМС m/z 163,00 ([М-Н]-).
Стадия 2. Этил-4-формил-2-метилбензоат (AI16). При перемешивании к раствору 4-формил-2-метилбензойной кислоты (3 г, 18,2 ммоля) в этиловом спирте (EtOH; 30 мл) добавляли серную кислоту (H2SO4, × М; 2 мл) и реакционную смесь нагревали при 80°С в течение 18 ч. Реакционную смесь охлаждали до 25°С и концентрировали при пониженном давлении. Остаток разбавляли с помощью EtOAc и промывали с помощью H2O. Объединенные экстракты в EtOAc промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде твердого вещества (2,8 г, 80%):1H ЯМР (400 МГц, CDCl3) δ 10,05 (с, 1Н), 8,04 (м, 1Н), 7,75 (м, 2Н), 4,43 (м, 2Н), 2,65 (с, 3Н), 1,42 (м, 3Н).
Стадия 3. Этил-2-метил-4-винилбензоат (AI14). При перемешивании к раствору этил-4-формил-2-метилбензоата (2,8 г, 4 ммоля) в 1,4-диоксане (20 мл) при 25°С добавляли карбонат калия (K2CO3; 3,01 г, 21,87 ммоля) и метилтрифенилфосфонийбромид (7,8 г, 21,87 ммоля). Затем реакционную смесь нагревали при 100°С в течение 18 ч. После того, как по данным ТСХ реакцию считали завершенной, реакционную смесь охлаждали до 25°С и фильтровали и фильтрат концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью флэш-хроматографии (SiO2, 100-200 меш; при элюировании с помощью 25-30% EtOAc в н-гексане) и получали искомое соединение в виде твердого вещества (2,0 г, 72%):1H ЯМР (400 МГц, CDCl3) δ 7,86 (м, 1Н), 7,27 (м, 2Н), 6,68 (дд, J=17,6, 10,8 Гц, 1Н), 5,84 (д, J=17,6 Гц, 1Н), 5,39 (д, J=10,8 Гц, 1Н), 4,39 (м, 2Н), 2,60 (с, 3Н), 1,40 (м, 3Н); ИЭРМС m/2 191,10 ([М-Н]-); ИК (тонкая пленка) 2980, 1716, 1257 см-1.
Пример 4: Получение трет-бутил-2-хлор-4-винилбензоата (AI17)

Стадия 1. трет-Бутил-4-бром-2-хлорбензоат (AI18). При перемешивании к раствору 4-бром-2-хлорбензойной кислоты (5 г, 21,37 ммоля) в ТГФ (30 мл) добавляли ди-трет-бутилдикарбонат (25,5 г, 25,58 ммоля), ТЭА (3,2 г, 31,98 ммоля) и ДМАП (0,78 г, 6,398 ммоля) и реакционную смесь перемешивали при 25°С в течение 18 ч. Реакционную смесь разбавляли с помощью EtOAc и промывали с помощью H2O. Объединенный органический слой промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (SiO2, 100-200 меш; при элюировании с помощью 2-3% EtOAc в н-гексане) и получали искомое соединение в виде жидкости (3,2 г, 51%):1Н ЯМР (400 МГц, CDCl3) δ 7,62 (м, 2Н), 7,44 (д, J=8,4 Гц, 1Н), 1,59 (с, 9Н); ИЭРМС m/z 290,10 ([М+Н]+); ИК (тонкая пленка) 1728 см-1.
Указанные ниже соединения получали по методикам, раскрытым на стадии 1 примера 4.
трет-Бутил-2-бром-4-йодбензоат (AI19)
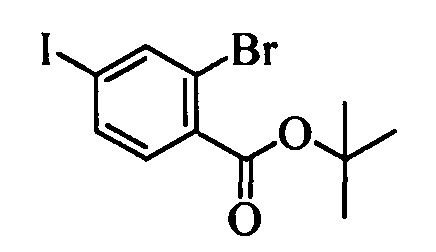
Продукт выделяли в виде бесцветного масла (1,2 г, 50%):1H ЯМР (400 МГц, CDCl3) δ 8,01 (с, 1Н), 7,68 (д, J=8,4 Гц, 1Н), 7,41 (д, J=8,0 Гц, 1Н), 1,59 (с, 9Н); ИЭРМС m/z 382,10 ([М+Н]+); ИК (тонкая пленка) 1727 см-1.
трет-Бутил-4-бром-2-(трифторметил)бензоат (AI20)
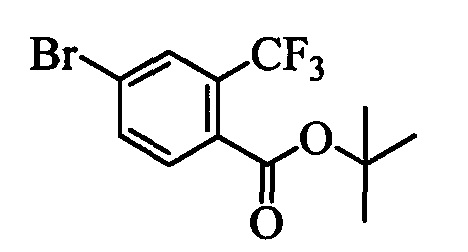
Продукт выделяли в виде бесцветного масла (1 г, 52%):1H ЯМР (400 МГц, CDCl3) δ 7,85 (с, 1Н), 7,73 (д, J=8,4 Гц, 1Н), 7,62 (д, J=8,4 Гц, 1Н), 1,57 (с, 9Н); ИЭРМС m/z 324,10 ([М+Н]+); ИК (тонкая пленка) 1725 см-1.
Стадия 2. трет-Бутил-2-хлор-4-винилбензоат (AI17). При перемешивании к раствору трет-бутил-4-бром-2-хлорбензоата (1,6 г, 5,50 ммоля) в толуоле (20 мл) добавляли тетракис (трифенилфосфин) палладий(0) (Pd(PPh3)4; (0,31 мг, 0,27 ммоля), K2CO3 (2,27 г, 16,5 ммоля) и комплекс ангидрида винилбороновой кислоты с пиридином (2,0 г, 8,3 ммоля) и реакционную смесь кипятили с обратным холодильником в течение 16 ч. Реакционную смесь фильтровали и фильтрат промывали с помощью H2O и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; при элюировании с помощью 5-6% EtOAc в н-гексане) давала искомое соединение в виде жидкости (0,6 г, 46%):1H ЯМР (400 МГц, CDCl3) δ 7,72 (д, J=8,1 Гц, 1Н), 7,44 (м, 1Н), 7,31 (д, J=8,0 Гц, 1Н), 6,69 (дд, J=17,6, 10,8 Гц, 1Н), 5,85 (д, J=17,6 Гц, 1Н), 5,40 (д, J=10,8 Гц, 1Н), 1,60 (с, 9Н); ИЭРМС m/z 238,95 ([М+Н]+); ИК (тонкая пленка) 2931, 1725, 1134 см-1.
Указанные ниже соединения получали по методикам, раскрытым на стадии 2 примера 4.
трет-Бутил-2-бром-4-винилбензоат (AI21)

Продукт выделяли в виде бесцветного масла (1 г, 52%):1H ЯМР (400 МГц, CDCl3) δ 7,68 (м, 2Н), 7,36 (д, J=8,0 Гц, 1Н), 6,68 (дд, J=17,6, 10,8 Гц, 1Н), 5,84 (д, J=17,6 Гц, 1Н), 5,39 (д, J=10,8 Гц, 1Н), 1,60 (с, 9Н); ИЭРМС m/z 282,10 ([М+Н]+); ИК (тонкая пленка) 2978, 1724, 1130 см-1.
трет-бутил-2-(трифторметил)-4-винилбензоат (AI22)

Продукт выделяли в виде бесцветного масла (1,2 г, 50%):1H ЯМР (400 МГц, CDCl3) δ 7,71 (д, J=6, 4 Гц, 2Н), 7,59 (д, J=7,6 Гц, 1Н), 6,77 (дд, J=17,6, 10,8 Гц, 1Н), 5,89 (д, J=17,6 Гц, 1Н), 5,44 (д, J=10,8 Гц, 1Н), 1,58 (с, 9Н); ИЭРМС m/z 272,20 ([М+Н]+); ИК (тонкая пленка) 2982, 1727, 1159 см-1.
Пример 5: Получение трет-бутил-2-циано-4-винилбензоата (AI23)
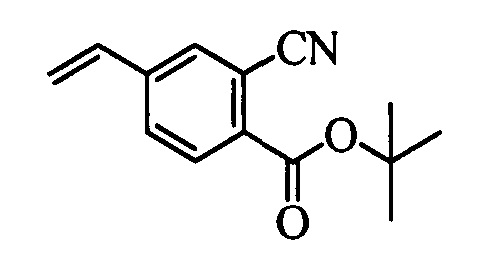
При перемешивании к раствору трет-бутил-2-бром-4-винилбензоата (0,5 г, 1,77 ммоля) в ДМФ (20 мл) добавляли цианид меди(I) (CuCN; 0,23 г, 2,65 ммоля) и реакционную смесь нагревали при 140°С в течение 3 ч. Реакционную смесь охлаждали до 25°С, разбавляли с помощью H2O и экстрагировали с помощью EtOAc. Объединенный органический слой промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (SiO2, 100-200 меш; при элюировании с помощью 15% EtOAc в н-гексане) и получали искомое соединение в виде белого твердого вещества (0,3 г, 72%): температура плавления 51-53°С;1H ЯМР (400 МГц, CDCl3) δ 8,03 (с, 1Н), 7,77 (с, 1Н), 7,64 (д, J=8,4 Гц, 1Н), 6,75 (дд, J=17,6, 10,8 Гц, 1Н), 5,93 (д, J=17,6 Гц, 1Н), 5,51 (д, J=10,8 Гц, 1Н), 1,65 (с, 9Н); ИЭРМС m/z 229,84 ([М+Н]+); ИК (тонкая пленка) 2370, 1709, 1142 см-1.
Пример 6: Получение этил-2-бром-4-йодбензоата (AI46)
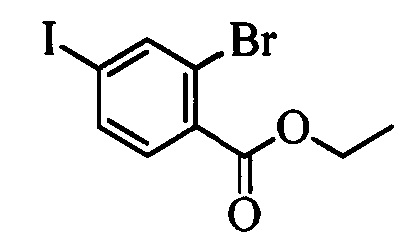
При перемешивании к раствору 4-йод-2-бромбензойной кислоты (5 г, 15,29 ммоля) в этиловом спирте (EtOH; 100 мл) добавляли серную кислоту (H2SO4; 5 мл) и реакционную смесь нагревали при 80°С в течение 18 ч. Реакционную смесь охлаждали до 25°С и концентрировали при пониженном давлении. Остаток разбавляли с помощью EtOAc (2×100 мл) и промывали с помощью H2O (100 мл). Объединенные экстракты в EtOAc промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали соединение в виде бледно-желтого твердого вещества (5 г, 92%):1H ЯМР (400 МГц, ДМСО-d6) δ 8,04 (д, J=1,2 Гц, 1Н), 7,71 (д, J=7,6 Гц, 1Н), 7,51 (д, J=8,4 Гц, 1Н), 4,41 (кв., J=7,2 Гц, 2Н), 1,41 (т, J=7,2 Гц, 3Н).
Указанные ниже соединения получали по методикам, раскрытым в примере 6.
Этил-4-бром-2-хлорбензоат (AI47)

Искомое соединение выделяли в виде почти белого твердого вещества (2,0 г, 80%):1H ЯМР (400 МГц, ДМСО-d6) δ 8,25 (д, J=1,2 Гц, 1Н), 7,79 (д, J=7,6 Гц, 1Н), 7,65 (д, J=8,4 Гц, 1Н), 4,65 (кв., J=7,2 Гц, 2Н), 1,56 (т, J=7,2 Гц, 3Н).
Этил-4-бром-2-метилбензоат (AI48)
Искомое соединение выделяли в виде бледно-желтой жидкости (3,0 г, 83%):1H ЯМР (400 МГц, CDCl3) δ 7,79 (д, J=8,4 Гц, 1Н), 7,41 (с, 1Н), 7,39 (д, J=8,4 Гц, 1Н), 4,42 (кв., J=7,2 Гц, 2Н), 2,60 (с, 3Н), 1,40 (т, J=7,2 Гц, 3Н); ИЭРМС m/z 229,11 ([М+Н]+); ИК (тонкая пленка) 1725 см-1.
Этил-4-бром-2-фторбензоат (AI49)

Искомое соединение выделяли в виде бесцветной жидкости (9,0 г, 79%):1H ЯМР (400 МГц, ДМСО-d6) δ 7,84 (т, J=8,4 Гц, 1Н), 7,76 (д, J=2,0 Гц, 1Н), 7,58 (д, J=1,6 Гц, 1Н), 4,34 (кв., J=7,2 Гц, 2Н), 1,32 (т, J=7,2 Гц, 3Н); ИЭРМС m/z 246,99 ([М+Н]+), ИК (тонкая пленка) 1734 см-1.
Пример 7: Получение этил-4-бром-2-этилбензоата (AI50)
При перемешивании к раствору 4-бром-2-фторбензойной кислоты (2,0 г, 9,17 ммоля) в ТГФ (16 мл) по каплям при 0°С добавляли 1,0 М этилмагнийбромид в ТГФ (32 мл, 32,0 ммоля) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Реакцию останавливали с помощью 2 н. HCl и экстрагировали этилацетатом. Объединенный этилацетатный слой сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенную 4-бром-2-этилбензойную кислоту в виде бесцветной жидкости, которую использовали на следующей стадии без очистки (0,4 г):1H ЯМР (400 МГц, CDCl3) δ 7,64 (д, J=8,4 Гц, 1Н), 7,47 (м, 1Н), 7,43 (м, 1Н), 2,95 (кв., J=4,0 Гц, 2Н), 1,32 (т, J=4,0 Гц, 3Н); ИЭРМС m/z 228,97 ([М+Н]+).
Искомое соединение синтезировали из 4-бром-2-этилбензойной кислоты по методике, приведенной в примере 6, выделяли в виде бесцветной жидкости (0,15 г, 68%):1H ЯМР (400 МГц, ДМСО-d6) δ 7,90 (д, J=8,4 Гц, 1Н), 7,47 (м, 2Н), 4,40 (кв., J=7,2 Гц, 2Н), 3,06 (кв., J=7,6 Гц, 2Н), 1,42 (т, J=7,2 Гц, 3Н), 1,26 (т, J=7,6 Гц, 3Н); ИЭРМС m/z 226,96 ([М-Н]-); ИК (тонкая пленка) 3443, 1686, 568 см-1.
Пример 8: Получение этил-2-бром-4-винилбензоата (AI51)
При перемешивании к раствору этил-2-бром-4-йодбензоата (5 г, 14,3 ммоля) в ТГФ/вода (100 мл, 9:1) добавляли винилтрифторборат калия (1,89 г, 14,3 ммоля), Cs2CO3 (18,27 г, 56,07 ммоля) и трифенилфосфин (0,22 г, 0,85 ммоля) и реакционную смесь дегазировали аргоном в течение 20 мин, затем добавляли PdCl2 (0,05 г, 0,28 ммоля). Реакционную смесь кипятили с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали через слой целита, и промывали этилацетатом. Фильтрат повторно экстрагировали этилацетатом и объединенные органические слои промывали водой и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение. Неочищенное соединение очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; при элюировании смесью 2% этилацетат/петролейный эфир) и получали искомое соединение в виде светло-коричневого смолообразного вещества (2 г, 56%):1Н ЯМР (400 МГц, CDCl3) δ 7,78 (д, J=8,4 Гц, 1Н), 7,71 (д, J=1,2 Гц, 1Н), 7,51 (д, J=8,4 Гц, 1Н), 6,69 (дд, J=17,6, 10,8 Гц, 1Н), 5,86 (д, J=17,6 Гц, 1Н), 5,42 (д, J=11,2 Гц, 1Н), 4,42 (кв., J=7,2 Гц, 2Н), 1,43 (т, J=3,6 Гц, 3Н); ИЭРМС m/z 255,18 ([М+Н]+); ИК (тонкая пленка) 1729 см-1.
Указанные ниже соединения получали по методикам, раскрытым в примере 8.
Этил-2-метил-4-винилбензоат (AI52)
Искомое соединение выделяли в виде бесцветной жидкости (0,8 г, 80%):1H ЯМР (400 МГц, CDCl3) δ 7,89 (д, J=8,4 Гц, 1Н), 7,27 (м, 2Н), 6,79 (дд, J=17,6, 10,8 Гц, 1Н), 5,86 (д, J=17,6 Гц, 1Н), 5,42 (д, J=11,2 Гц, 1Н), 4,42 (кв., J=7,2 Гц, 2Н), 2,60 (с, 3Н), 1,43 (т, J=7,2 Гц, 3Н); ИЭРМС m/z 191,10 ([М+Н]+); ИК (тонкая пленка) 1717, 1257 см-1.
Этил-2-фтор-4-винилбензоат (AI53)
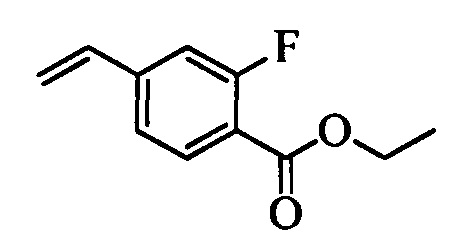
Искомое соединение выделяли в виде бледно-желтой жидкости (2,0 г, 50%):1H ЯМР (400 МГц, ДМСО-d6) δ 7,87 (т, J=8,0 Гц, 1Н), 7,51 (д, J=16,0 Гц, 1Н), 7,48 (д, J=16,0 Гц, 1Н), 6,82 (дд, J=17,6, 10,8 Гц, 1Н), 6,09 (д, J=17,6 Гц, 1Н), 5,50 (д, J=10,8 Гц, 1Н), 4,35 (кв., J=7,2 Гц, 2Н), 1,35 (т, J=7,2 Гц, 3Н); ИЭРМС m/z 195,19 ([М+Н]+); ИК (тонкая пленка) 1728 см-1.
Пример 9: Получение этил-2-хлор-4-винилбензоата (AI54)
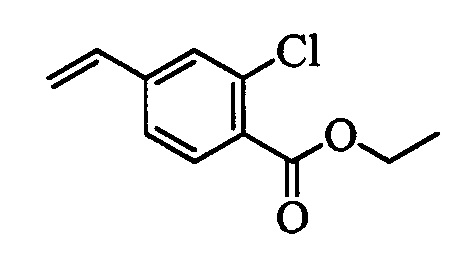
При перемешивании к раствору этил-2-хлор-4-бромбензоата (2 г, 7,63 ммоля) в диметилсульфоксиде (20 мл) добавляли винилтрифторборат калия (3,06 г, 22,9 ммоля) и карбонат калия (3,16 г, 22,9 ммоля). Реакционную смесь дегазировали аргоном в течение 30 мин. Добавляли бистрифенилфосфин(дифенилфосфиноферроцен)палладийдихлорид (0,27 г, 0,38 ммоля) и реакционную смесь нагревали при 80°С в течение 1 ч. Реакционную смесь разбавляли водой (100 мл), экстрагировали этилацетатом (2×50 мл), промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали соединение в виде коричневого смолообразного вещества (1,1 г, 69%):1Н ЯМР (400 МГц, CDCl3) δ 7,81 (д, J=8,4 Гц, 1Н), 7,46 (с, 1Н), 7,33 (д, J=8,4 Гц, 1Н), 6,70 (дд, J=17,6, 11,2 Гц, 1Н), 5,87 (д, J=17,6 Гц, 1Н), 5,42 (д, J=10,8 Гц, 1Н), 4,41 (кв., J=7,2 Гц, 2Н), 1,43 (т, J=7,2 Гц, 3Н); ИЭРМС m/z 211,22 ([М+Н]+); ИК (тонкая пленка) 1729, 886 см-1.
Указанные ниже соединения получали по методикам, раскрытым в примере 9.
Этил-2-этил-4-винилбензоат (AI55)

Искомое соединение выделяли в виде бесцветной жидкости (1,0 г, 66%):1H ЯМР (300 МГц, CDCl3) δ 7,85 (м, 1Н), 7,29 (м, 2Н), 6,76 (д, J=10,8 Гц, 1Н), 5,86 (д, J=17,6 Гц, 1Н), 5,36 (д, J=10,5 Гц, 1Н), 4,41 (кв., J=7,2 Гц, 2Н), 3,10 (кв., J=7,2 Гц, 2Н), 1,40 (т, J=7,2 Гц, 3Н), 1,30 (т, J=7,2 Гц, 3Н); ИЭРМС m/z 205,26 ([М+Н]+); ИК (тонкая пленка) 1720, 1607, 1263 см-1.
Метил-2-метокси-4-винилбензоат (AI56)
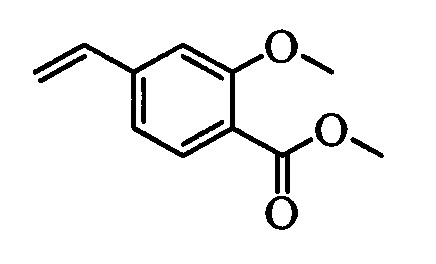
Искомое соединение выделяли в виде бледно-желтой жидкости (1,2 г, 75%):1H ЯМР (400 МГц, CDCl3) δ 7,79 (д, J=8,0 Гц, 1Н), 7,04 (д, J=1,2 Гц, 1Н), 6,97 (с, 1Н), 6,74 (дд, J=11,2, 11,2 Гц, 1Н), 5,86 (д, J=17,6 Гц, 1Н), 5,39 (д, J=17,6 Гц, 1Н) 3,93 (с, 3Н), 3,91 (с, 3Н). ИЭРМС m/z 193,18 ([М+Н]+); ИК (тонкая пленка) 1732 см-1.
Пример 10: Получение (Е)-этил-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)-2-метилбензоата (А124)
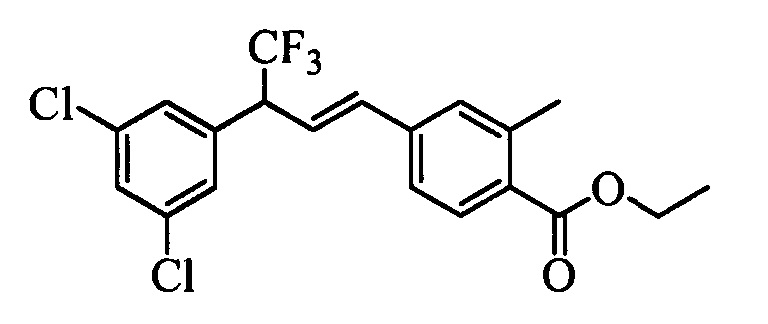
При перемешивании к раствору этил-2-метил-4-винилбензоата (2,0 г, 10,5 ммоля) в 1,2-дихлорбензоле (25 мл) добавляли 1-(1-бром-2,2,2-трифторэтил)-3,5-дихлорбензол (6,44 г, 21,0 ммоля), хлорид меди(I) (CuCl; 208 мг, 21 ммоля) и 2,2-бипиридил (0,65 г, 4,1 ммоля). Реакционную смесь дегазировали аргоном в течение 30 мин и затем перемешивали при 180°С в течение 24 ч. После того, как по данным ТСХ реакцию считали завершенной, реакционную смесь охлаждали до 25°С и фильтровали и фильтрат концентрировали при пониженном давлении. Очистка с помощью флэш-хроматографии (SiO2, 100-200 меш; при элюировании с помощью 25-30% EtOAc в петролейном эфире) давала искомое соединение в виде твердого вещества (1,7 г, 40%):1H ЯМР (400 МГц, CDCl3) δ 7,91 (д, J=8,0 Гц, 1Н), 7,37 (м, 1Н), 7,27-7,24 (м, 4Н), 6,59 (д, J=16,0 Гц, 1Н), 6,59 (дд, J=16,0, 8,0 Гц, 1Н), 4,38 (кв., J=7,2 Гц, 2Н), 4,08 (м, 1Н), 2,62 (с, 3Н), 1,42 (т, J=7,2 Гц, 3Н); ИЭРМС m/z 415,06 ([М-Н]-); ИК (тонкая пленка) 1717, 1255, 1114 см-1.
Соединения AI25, AI57-AI68 и АС1-АС5 (таблица 1) получали по методикам, раскрытым в примере 10.
(Е)-Этил-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2-(трифторметил)-бензойная кислота (AI25)
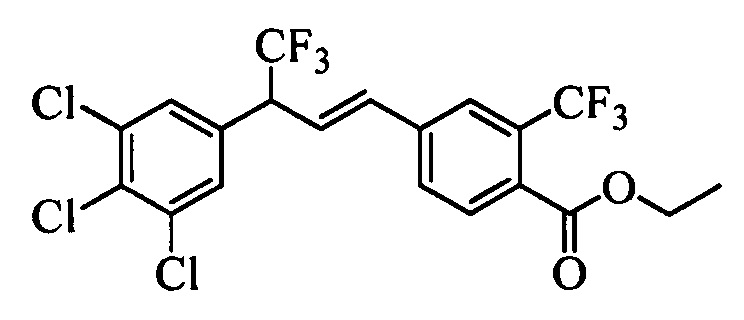
Продукт выделяли в виде бледно-коричневой смолообразной жидкости (500 мг, 40%):1H ЯМР (400 МГц, CDCl3) δ 7,79 (д, J=8,0 Гц, 1Н), 7,71 (м, 1Н), 7,61 (д, J=7,6 Гц, 1Н), 7,42 (с, 2Н), 6,70 (д, J=16,0 Гц, 1Н), 6,57 (дд, J=16,0, 8,0 Гц, 1Н), 4,42 (кв., J=7,2 Гц, 2Н), 4,19 (м, 1Н), 1,40 (т, J=7,6 Гц, 3Н); ИЭРМС m/z 502,99 ([М-Н]-); ИК (тонкая пленка) 1730, 1201, 1120, 749 см-1.
(E)-Этил-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)-2-фторбензоат (AI57)
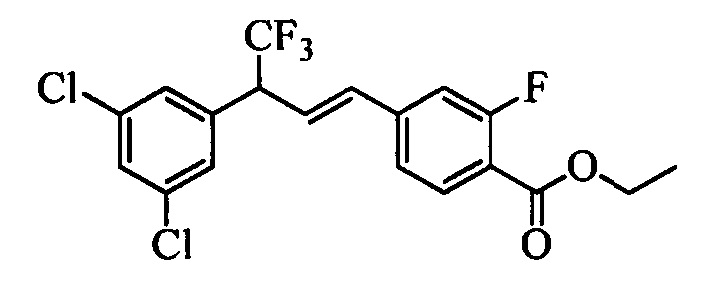
1H ЯМР (400 МГц, CDCl3) δ 7,38 (с, 1Н), 7,26 (с, 3Н), 7,21 (д, J=8,4 Гц, 1Н), 7,16 (д, J=11,6 Гц, 1Н), 6,59 (д, J=16,0 Гц, 1Н), 6,47 (дд, J=,16,0, 8,0 Гц, 1Н), 4,41 (кв., J=6,8 Гц, 2Н), 4,18 (м, 1Н), 1,41 (т, J=6,8 Гц, 3Н); ИЭРМС m/z 419,33 ([М-Н]-); ИК (тонкая пленка) 1723, 1115, 802 см-1.
(Е)-Этил-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)-2-бромбензоат (AI58)
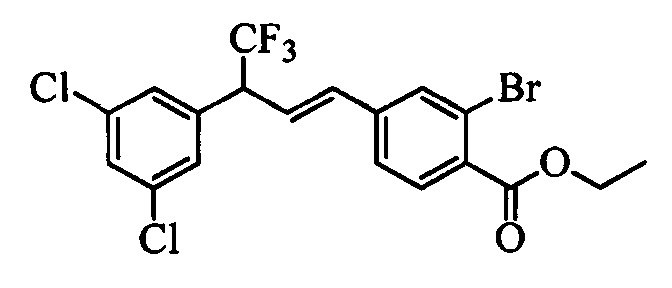
1H ЯМР (400 МГц, CDCl3) δ 7,79 (д, J=8,0 Гц, 1Н), 7,67 (с, 1Н), 7,38 (м, 2Н), 7,26 (м, 2Н), 6,56 (д, J=16,0 Гц, 1Н), 6,45 (дд, J=16,0, 7,6 Гц, 1Н), 4,42 (кв., J=7,2 Гц, 2Н), 4,39 (м, 1Н), 1,42 (т, J=7,2 Гц, 3Н); ИЭРМС m/z 481,22 ([М-Н]-); ИК (тонкая пленка) 1727, 1114, 801, 685 см-1.
(Е)-Этил-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензоат (AI59)
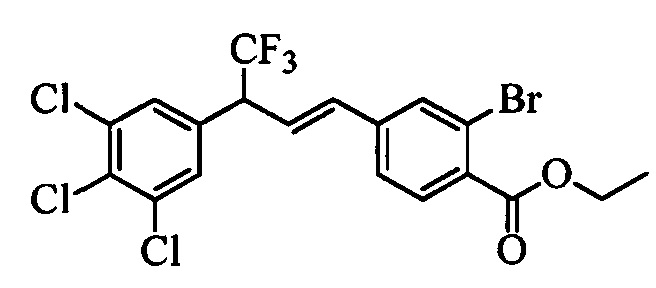
1H ЯМР (400 МГц, CDCl3) δ 7,79 (д, J=8,0 Гц, 1Н), 7,67 (д, J=1,6 Гц, 1Н), 7,40 (с, 2Н), 7,36 (д, J=1,6 Гц, 1Н), 6,56 (д, J=16,0 Гц, 1Н), 6,44 (дд, J=16,0, 7,6 Гц, 1Н), 4,42 (кв., J=6,8 Гц, 2Н), 4,15 (м, 1Н), 1,42 (т, J=6,8 Гц, 3Н); ИЭРМС m/z 514,74 ([М-Н]-); ИК (тонкая пленка) 1726, 1115, 808, 620 см-1.
(E)-Этил-2-метил-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензоат (AI60)
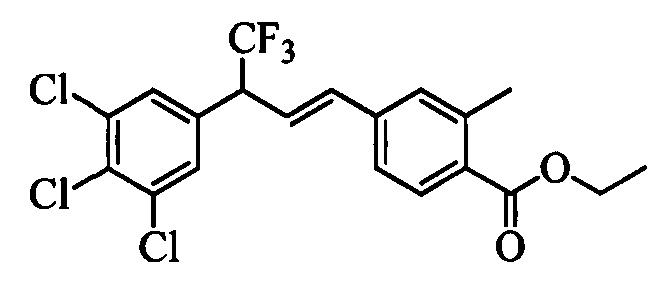
Искомое соединение выделяли в виде светло-коричневого смолообразного вещества:1H ЯМР (400 МГц, CDCl3) δ 7,90 (д, J=8,8 Гц, 1Н), 7,34 (д, J=6,0 Гц, 2Н), 7,25 (д, J=7,2 Гц, 2Н), 6,59 (д, J=16,0 Гц, 1Н), 6,42 (дд, J=16,0, 8,0 Гц, 1Н), 4,38 (кв., J=7,2 Гц, 2Н), 4,19 (м, 1Н), 2,63 (с, 3Н), 1,41 (т, J=7,2 Гц, 3Н).
(E)-Этил-2-хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензоат (AI61)
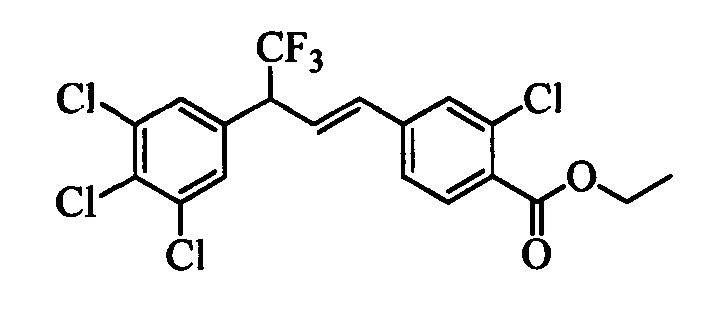
1H ЯМР (400 МГц, CDCl3) δ 7,87 (д, J=8,0 Гц, 1Н), 7,46 (д, J=1,6 Гц, 1Н), 7,40 (с, 2Н), 7,31 (д, J=1,6 Гц, 1Н), 6,57 (д, J=16,0 Гц, 1Н), 6,44 (дд, J=16,0 Гц, 8,0 Гц, 1Н), 4,42 (кв., J=6,8 Гц, 2Н), 4,15 (м, 1Н), 1,42 (т, J=6,8 Гц, 3Н); ИЭРМС m/z 470,73 ([М-Н]-); ИК (тонкая пленка) 1726, 1115, 809, 3072 см-1.
(Е)-Этил-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2-(трифторметил)бензоат (AI62)
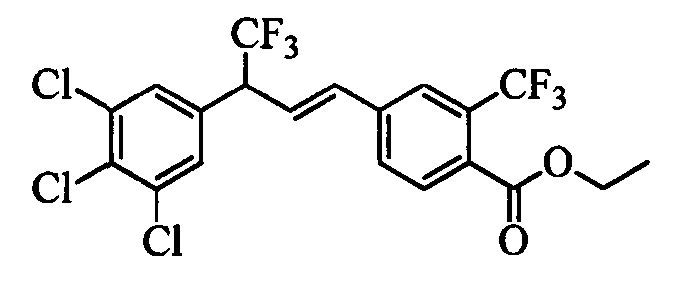
Искомое соединение выделяли в виде бледно-коричневой жидкости (1,0 г, 46,3%):1H ЯМР (400 МГц, CDCl3) δ 7,79 (д, J=8,0 Гц, 1Н), 7,71 (с, 1Н), 7,61 (д, J=7,6 Гц, 1Н), 7,41 (с, 2Н) 6,65 (д, J=16,0 Гц, 1Н), 6,49 (дд, J=16,0, 8,0 Гц, 1Н), 4,42 (кв., J=7,6 Гц, 2Н), 4,15 (м, 1Н), 1,42 (т, J=7,6 Гц, 3Н); ИЭРМС m/z 502,99 ([М-Н]-); ИК (тонкая пленка) 1730, 1202, 1120, 750 см-1.
(Е)-Этил-2-хлор-4-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)бензоат (AI63)
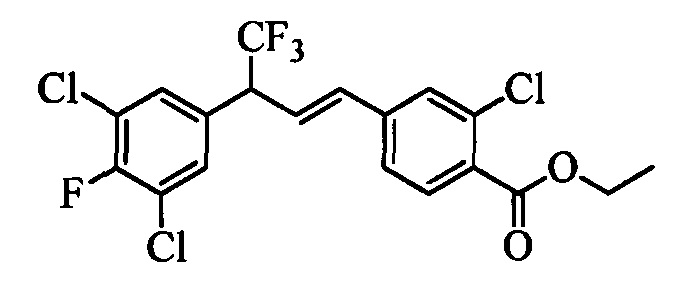
1H ЯМР (400 МГц, CDCl3) δ 7,85 (д, J=6,0 Гц, 1Н), 7,46 (д, J=1,8 Гц, 2Н), 7,34 (м, 1Н), 7,24 (м, 1Н), 6,57 (д, J=16,2 Гц, 1Н), 6,45 (дд, J=16,2, 7,2 Гц, 1Н), 4,43 (кв., J=7,2 Гц, 2Н), 4,13 (м, 1Н), 1,41 (т, J=7,2 Гц, 3Н); ИЭРМС m/z 455,0 ([М+Н]+); ИК (тонкая пленка) 1728, 1115, 817 см-1.
(E)-Этил-2-фтор-4-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)бензоат (AI64)
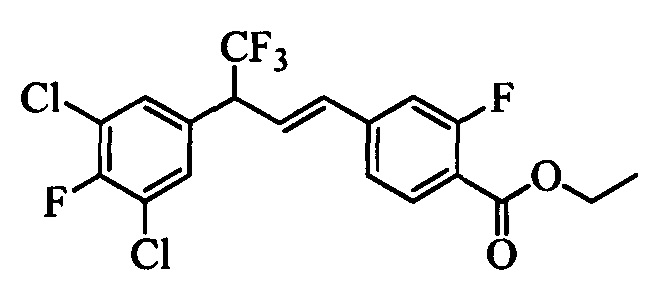
1H ЯМР (400 МГц, CDCl3) δ 7,93 (т, J=7,6 Гц, 1Н), 7,34 (д, J=5,6 Гц, 2Н), 7,21 (д, J=8,0 Гц, 1Н), 7,16 (д, J=11,6 Гц, 1Н), 6,59 (д, J=16,0 Гц, 1Н), 6,49 (дд, J=16,0, 7,6 Гц, 1Н), 4,42 (кв., J=7,6 Гц, 2Н), 4,13 (м, 1Н), 1,41 (т, J=7,6 Гц, 3Н); ИЭРМС m/z 436,81 ([М-Н]-); ИК (тонкая пленка) 1725 см-1.
(E)-Этил-2-бром-4-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)бензоат (AI65)
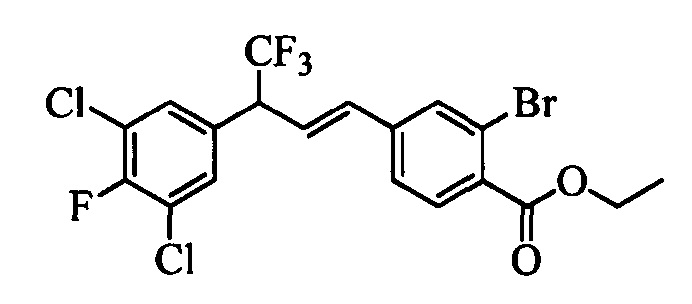
1H ЯМР (400 МГц, CDCl3) δ 7,94 (д, J=8,0 Гц, 1Н), 7,67 (с, 1Н), 7,36 (м, 3Н), 6,56 (д, J=15,6 Гц, 1Н), 6,44 (дд, J=15,6, 8,0 Гц, 1Н), 4,42 (кв., J=6,8 Гц, 2Н), 4,10 (м, 1Н), 1,42 (т, J=6,8 Гц, 3Н); ИЭРМС m/z 498,74 ([М-Н]-); ИК (тонкая пленка) 1726, 1114, 820, 623 см-1.
(Е)-Этил-2-метил-4-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)бензоат (AI66)
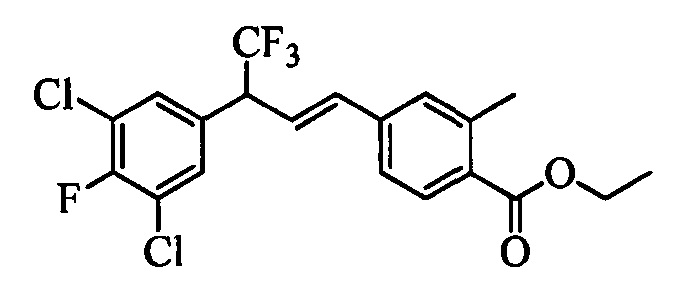
Искомое соединение выделяли в виде коричневого полужидкого вещества:1H ЯМР (400 МГц, CDCl3) δ 7,90 (д, J=8,8 Гц, 1Н), 7,34 (д, J=6,0 Гц, 2Н), 7,25 (д, J=7,2 Гц, 2Н), 6,59 (д, J=16,0 Гц, 1Н), 6,42 (дд, J=16,0 Гц, 8,0 Гц, 1Н), 4,38 (кв., J=7,2 Гц, 2Н), 4,19 (м, 1Н), 2,63 (с, 3Н), 1,41 (т, J=7,2 Гц, 3Н); ИЭРМС m/z 432,90 ([М-Н]-); ИК (тонкая пленка) 1715 см-1.
(E)-Метил-2-метокси-4-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)бензоат (AI67)
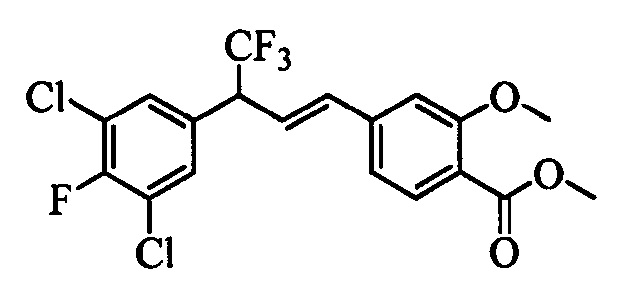
1H ЯМР (400 МГц, CDCl3) δ 7,80 (д, J=8,4 Гц, 1Н), 7,35 (д, J=6,0 Гц, 2Н), 7,03 (д, J=1,2 Гц, 1Н), 6,92 (с, 1Н), 6,59 (д, J=15,6 Гц, 1Н), 6,42 (дд, J=15,6, 8,0 Гц, 1Н), 4,13 (м, 1Н), 3,93 (с, 3Н), 3,88 (с, 3Н); ИЭРМС m/z 437,29 ([М+Н]+); ИК (тонкая пленка) 1724 см-1.
(Е)-Этил-2-этил-4-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)бензоат (AI68)

1H ЯМР (400 МГц, CDCl3) δ 7,85 (д, J=8,0 Гц, 1Н), 7,35 (д, J=9,6 Гц, 2Н), 7,26 (м, 1Н), 7,24 (м, 1Н), 6,60 (д, J=15,6 Гц, 1Н), 6,42 (дд, J=15,6, 8,0 Гц, 1Н), 4,38 (кв., J=7,2 Гц, 2Н), 4,14 (м, 1Н), 3,01 (кв., J=7,6 Гц 2Н), 1,41 (т, J=7,2 Гц, 3Н), 1,26 (т, J=7,6 Гц, 3Н); ИЭРМС m/z 447,05 ([М-Н]-); ИК (тонкая пленка) 1715, 1115, 817 см-1.
Пример 11: Получение (Е)-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)-2-метилбензойной кислоты (AI32)
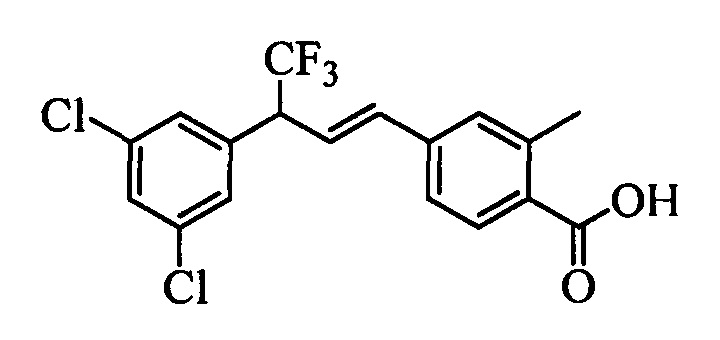
При перемешивании к раствору (E)-этил-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)-2-метилбензоата (1,7 г, 4,0 ммоля) в 1,4-диоксане (10 мл) добавляли 11 н. HCl (30 мл) и реакционную смесь нагревали при 100°С в течение 48 ч. Реакционную смесь охлаждали до 25°С и концентрировали при пониженном давлении. Остаток разбавляли с помощью Н2О и экстрагировали хлороформом (CHCl3). Объединенный органический слой сушили над Na2SO4 и концентрировали при пониженном давлении, и неочищенное соединение промывали н-гексаном и получали искомое соединение в виде белого твердого вещества (0,7 г, 50%): температура плавления 142-143°С;1H ЯМР (400 МГц, ДМСО-d6) δ 12,62 (шир.с, 1Н), 7,81 (д, J=8,0 Гц, 1Н), 7,66 (с, 3Н), 7,52-7,44 (м, 2Н), 6,89 (дд, J=16,0, 8,0 Гц, 1Н), 6,78-6,74 (д, J=16,0 Гц, 1Н), 4,84 (м, 1Н), 2,50 (с, 3Н); ИЭРМС m/z 387,05 ([М-Н]-); ИК (тонкая пленка) 3448, 1701, 1109, 777 см-1.
Указанные ниже соединения получали по методикам, раскрытым в примере 11.
(E)-2-Метил-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензойная кислота (AI26)
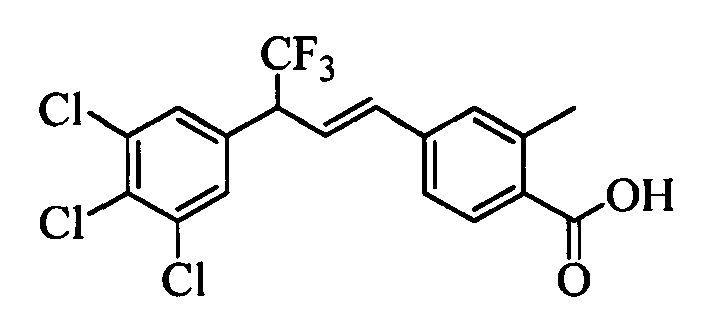
Продукт выделяли в виде бледно-коричневой смолообразной жидкости (1 г, 46%):1H ЯМР (400 МГц, CDCl3) δ 7,97 (д, J=8,0 Гц, 1Н), 7,77 (с, 1Н), 7,65 (м, 1Н), 7,41 (с, 2Н), 6,68 (д, J=16,0 Гц, 1Н), 6,53 (дд, J=16,0, 8,0 Гц, 1Н), 4,16 (м, 1Н), 2,50 (с, 3Н); ИЭРМС m/z 422,67 ([М-Н]-).
(Е)-2-Хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензойная кислота (AI27)
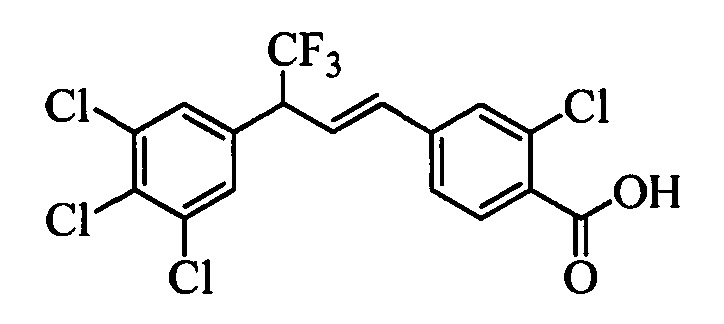
Продукт выделяли в виде почти белого полужидкого вещества (1 г, 45%):1H ЯМР (400 МГц, CDCl3) δ 7,99 (д, J=8,4 Гц, 1Н), 7,50 (м, 1Н), 7,40 (с, 1Н), 7,36 (м, 2Н), 6,59 (д, J=15,6 Гц, 1Н), 6,48 (дд, J=15,6, 7,6 Гц, 1Н), 4,14 (м, 1Н); ИЭРМС m/z 442,72 ([М-Н]-); ИК (тонкая пленка) 3472, 1704, 1113, 808 см-1.
(E)-2-Бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензойная кислота (AI28)
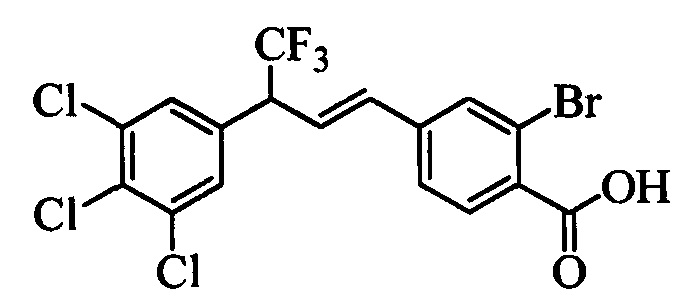
Продукт выделяли в виде коричневого твердого вещества (1 г, 45%): температура плавления 70-71°С;1H ЯМР (400 МГц, CDCl3) δ 7,99 (д, J=8,0 Гц, 1Н), 7,72 (с, 1Н), 7,40 (м, 3Н), 6,58 (д, J=16,0 Гц, 1Н), 6,48 (дд, J=16,0, 8,0 Гц, 1Н), 4,14 (м, 1Н); ИЭРМС m/z 484,75 ([М-Н]-); ИК (тонкая пленка) 3468, 1700 см-1.
(E)-2-Циано-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензойная кислота (AI29)

Продукт выделяли в виде почти белого твердого вещества (500 мг, 45%): температура плавления 100-101°С;1Н ЯМР (400 МГц, CDCl3) δ 7,90 (с, 1Н), 7,85 (д, J=7,6 Гц, 1Н), 7,72 (д, J=8,0 Гц, 1Н), 7,65 (шир.с, 1Н), 7,42 (с, 2Н), 6,73 (д, J=16,0 Гц, 1Н), 6,58 (дд, J=16,0, 8,0 Гц, 1Н), 4,19 (м, 1Н); ИЭРМС m/z 431,93 ([М-Н]-).
Е)-4-(3-(3,4-Дихлорфенил)-4,4,4-трифторбут-1-енил)-2-метилбензойная кислота (AI30)
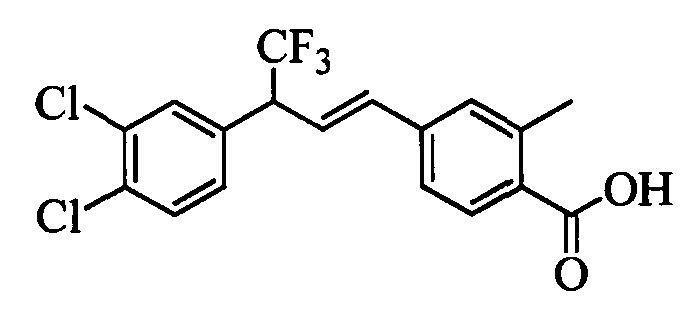
Продукт выделяли в виде бледно-коричневой жидкости (500 мг, 46%):1H ЯМР (400 МГц, CDCl3) δ 8,03 (м, 1Н), 7,49 (м, 2Н), 7,29 (м, 1Н), 7,22 (м, 2Н), 6,73 (д, J=16,0 Гц, 1Н), 6,58 (дд, J=16,0, 7,8 Гц, 1Н), 4,16 (м, 1Н), 2,64 (с, 3Н); ИЭРМС m/z 386,84 ([М-Н]-); ИК (тонкая пленка) 3428, 1690, 1113, 780 см-1.
(E)-4-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-2-метилбензойная кислота (AI31)

Продукт выделяли в виде белого твердого вещества (500 мг, 50%): температура плавления 91-93°С;1H ЯМР (400 МГц, CDCl3) δ 8,02 (д, J=8,0 Гц, 1Н), 7,35 (д, J=5,6 Гц, 1Н), 7,30 (м, 3Н), 6,61 (д, J=16,0 Гц, 1Н), 6,48 (дд, J=16,0, 8,0 Гц, 1Н), 4,13 (м, 1Н), 2,65 (с, 3Н); ИЭРМС m/z 406,87 ([М-Н]-).
(E)-4-(4,4,4-Трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2-(трифторметил)бензойная кислота (AI33)
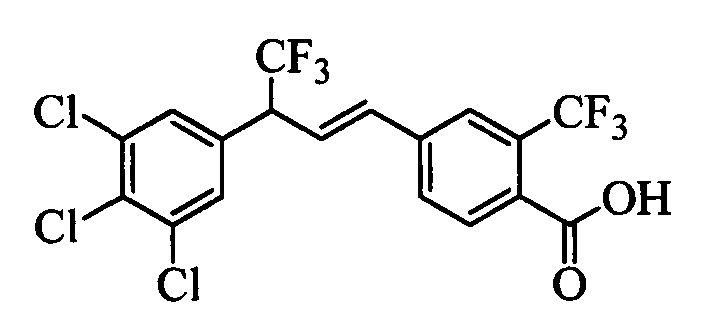
Продукт выделяли в виде белого твердого вещества (500 мг, 45%): температура плавления 142-143°С;1H ЯМР (400 МГц, CDCl3) δ 7,97 (д, J=8,0 Гц, 1Н), 7,77 (с, 1Н), 7,65 (м, 1Н), 7,41 (с, 2Н), 6,68 (д, J=16,0 Гц, 1Н), 6,53 (дд, J=16,0, 8,0 Гц, 1Н), 4,16 (м, 1Н); ИЭРМС m/z 474,87 ([М-Н]-).
(E)-2-Бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензойная кислота (AI69)
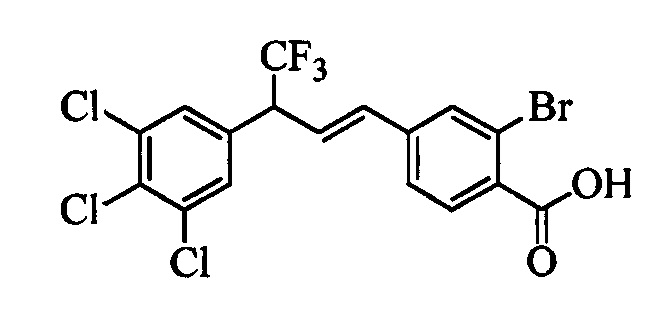
Искомое соединение выделяли в виде коричневого твердого вещества (0,8 г, 28%):1H ЯМР (400 МГц, CDCl3) δ 13,42 (шир., 1Н), 7,98 (д, J=1,5 Гц, 1Н), 7,94 (м, 2Н), 7,75 (д, J=8,1 Гц, 1Н), 7,65 (м, 1Н), 7,06 (дд, J=15,9, 9,0 Гц, 1Н), 6,80 (д, J=15,9 Гц, 1Н), 4,91 (м, 1Н); ИЭРМС m/z 484,75 ([М-Н]-); ИК (тонкая пленка) 3469, 1700 см-1.
(Е)-2-Бром-4-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)бензойная кислота (AI70)
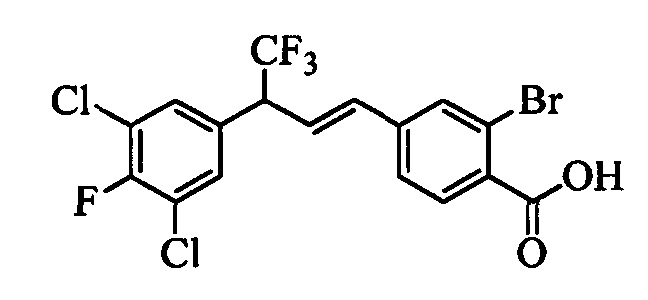
Искомое соединение выделяли в виде желтой жидкости (0,3 г, неочищенная):1H ЯМР (300 МГц, CDCl3) δ 7,79 (д, J=8,1 Гц, 1Н), 7,67 (с, 1Н), 7,34 (м, 3Н), 6,56 (д, J=15,9 Гц, 1Н), 6,45 (дд, J=15,9, 7,6 Гц, 1Н), 4,43 (м, 1Н); ИЭРМС m/z 471,0 ([M-H]-).
(E)-4-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-2-этилбензойная кислота (AI71)
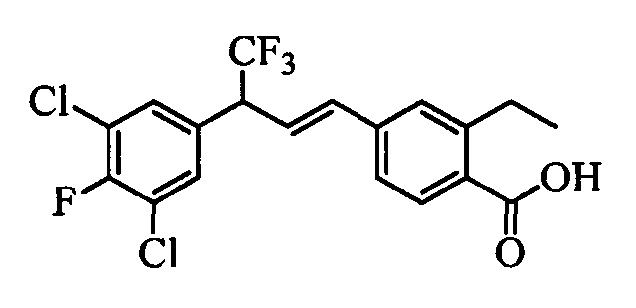
Искомое соединение выделяли в виде коричневого смолообразного вещества (0,2 г, неочищенная):1H ЯМР (300 МГц, ДМСО-d6) δ 12,5 (шир., 1Н), 7,85 (д, J=6,3 Гц, 2Н), 7,75 (д, J=8,1 Гц, 1Н), 7,52 (м, 2Н), 6,96 (дд, J=8,7, 8,7 Гц, 1Н), 6,78 (д, J=15,6 Гц, 1Н), 4,80 (м, 1Н), 4,06 (кв., J=7,2 Гц, 2Н), 1,33 (т, J=7,2 Гц, 3Н); ИЭРМС m/z 419,06 ([М-Н]-).
(E)-2-Хлор-4-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)бензойная кислота (AI72)

Искомое соединение выделяли в виде желтой жидкости (0,7 г, 95%):1H ЯМР (300 МГц, CDCl3) δ 7,85 (д, J=6,0 Гц, 1Н), 7,46 (д, J=1,8 Гц, 1Н), 7,41 (с, 3Н), 6,57 (д, J=16,0 Гц, 1Н), 6,45 (дд, J=16,0, 8,0 Гц, 1Н), 4,16 (м, 1Н); ИЭРМС m/z 455,0 ([М+Н]+); ИК (тонкая пленка) 1728, 1115, 817 см-1.
(E)-4-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-2-метилбензойная кислота (AI73)
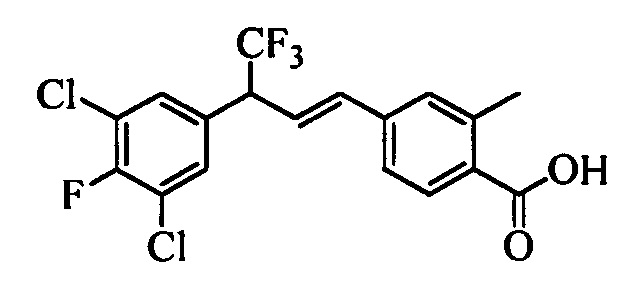
Искомое соединение выделяли в виде светло-коричневого смолообразного вещества (0,7 г, 38%): температура плавления 91-93°С;1H ЯМР (400 МГц, CDCl3) δ 8,02 (д, J=8,0 Гц, 1Н), 7,35 (д, J=5,6 Гц, 1Н), 7,30 (м, 3Н), 6,10 (д, J=16,0 Гц, 1Н), 6,46 (дд, J=16,0, 8,0 Гц, 1Н), 4,03 (м, 1Н), 2,65 (с, 3Н); ИЭРМС m/z 406,87 ([М-Н]-).
(Е)-4-(3-(3,5-Дихлорфенил)-4,4,4-трифторбут-1-енил)-2-фторбензойная кислота (AI74)
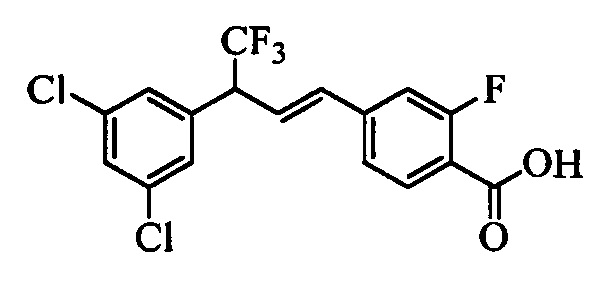
Искомое соединение выделяли в виде светло-коричневой жидкости (0,3 г, неочищенная): ИЭРМС m/z 393,15 ([М-Н]-).
(Е)-2-Бром-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)бензойная кислота (AI75)
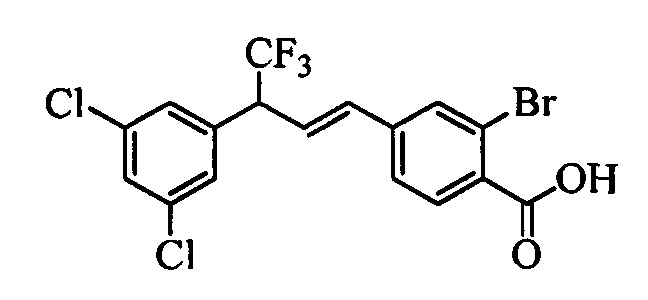
Искомое соединение выделяли в виде светло-коричневой жидкости (0,35 г, неочищенная): ИЭРМС m/z 451,91 ([М-Н]-).
Возможно, соединения AI34, AI36-AI41, AI44-AI45 (таблица 1) можно было получить по методикам, раскрытым в примере 10 или в примерах 10 и 11.
Пример 12: Получение (E)-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)-2-метил-N-(2,2,2-трифторэтил)бензамида (АС6)
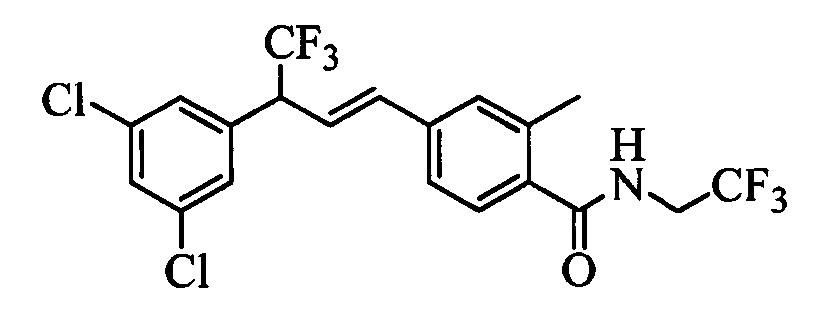
При перемешивании к раствору (E)-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)-2-метилбензойной кислоты в ДМФ добавляли 2,2,2-трифторэтиламин, гидрат 1-гидроксибензотриазола (HOBt⋅H2O), N-(3-диметиламинопропил)-N'-этилкарбодиимидгидрохлорид (EDC⋅HCl) и ДИПЭА и реакционную смесь перемешивали при 25°С в течение 18 ч. Реакционную смесь разбавляли с помощью Н2О и экстрагировали с помощью EtOAc. Объединенный органический слой промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; при элюировании смесью гексан : EtOAc давала белое полужидкое вещество (110 мг, 50%):1H ЯМР (400 МГц, CDCl3) 7,40 (м, 2Н), 7,26 (м, 3Н), 6,56 (д, J=16,0 Гц, 1Н), 6,48 (дд, J=16,0, 8,0 Гц, 1Н), 5,82 (шир.с, 1Н), 4,08 (м, 3Н), 2,52 (с, 3Н); ИЭРМС m/z 468,40 ([М-Н]-); ИК (тонкая пленка) 1657, 1113, 804 см-1.
Соединения АС7-АС38, АС40-АС58, АС110-АС112, АС117 и АС118 (таблица 1) получали по методикам, раскрытым в примере 12.
Пример 13: Получение 4-((Е)-3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)-2-метил-N-((пиримидин-5-ил)метил)бензамида (АС39)
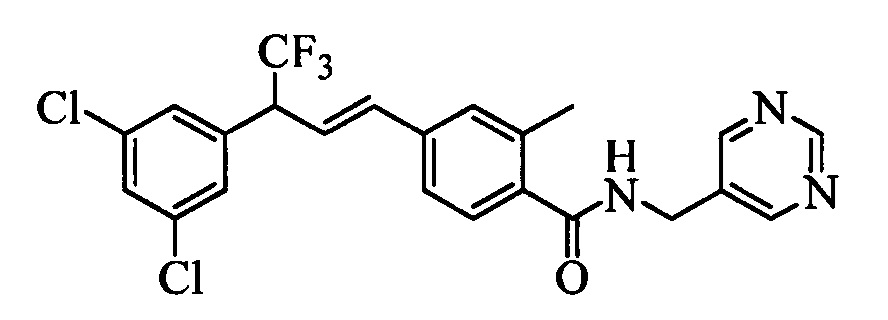
При перемешивании к раствору (пиримидин-5-ил)метанамина (0,15 г, 1,43 ммоля) в CH2Cl2 (10 мл) по каплям добавляли триметилалюминий (2 М раствор в толуоле; 0,71 мл, 1,43 ммоля) и реакционную смесь перемешивали при 25°С в течение 30 мин. К реакционной смеси при 25°С по каплям добавляли раствор этил-4-((E)-3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)-2-метилбензоат (0,3 г, 0,71 ммоля) в CH2Cl2. Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 18 ч, охлаждали до 25°С, реакцию останавливали 0,5 н. раствором HCl (50 мл) и экстрагировали с помощью EtOAc (2×50 мл). Объединенные органические экстракты промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью флэш-хроматографии (SiO2, 100-200 меш; при элюировании с помощью 40% EtOAc в н-гексане) и получали искомое соединение (0,18 г, 55%): температура плавления 141-144°С;1H (400 МГц, CDCl3) δ 9,19 (с, 1Н), 8,79 (с, 2Н), 7,37 (м, 2Н), 7,23 (м, 2Н),7,21 (м, 1Н), 6,57 (д, J=16,0 Гц, 1Н), 6,40 (дд, J=16,0, 7,6 Гц 1Н), 6,21 (м, 1Н), 4,65 (с, 2Н), 4,11 (м, 1Н), 2,46 (с, 3Н); ИЭРМС m/z 477,83 ([М-Н]-).
Пример 14: Получение (Е)-2-хлор-N-(2-оксо-2-((2,2,2-трифторэтил)амино)этил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензамида (АС64)

При перемешивании к раствору глицинамида (0,15 г, 0,58 ммоля) в CH2Cl2 (5 мл) по каплям добавляли триметилалюминий (2 М раствор в толуоле; 1,45 мл, 2,91 ммоля) и реакционную смесь перемешивали при 28°С в течение 30 мин. К реакционной смеси при 28°С по каплям добавляли раствор (E)-этил-2-хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензоат (0,3 г, 0,58 ммоля) в CH2Cl2 (5 мл). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 18 ч, охлаждали до 25°С, реакцию останавливали 1 н. раствором HCl (50 мл) и экстрагировали с помощью CH2Cl2 (2×50 мл). Объединенные органические экстракты промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью флэш-хроматографии (SiO2, 100-200 меш; при элюировании с помощью 40% EtOAc в н-гексане) и получали искомое соединение в виде желтого твердого вещества (0,15 г, 50%): температура плавления 83-85°С;1H ЯМР (400 МГц, CDCl3) δ 7,72 (д, J=8,0 Гц, 1Н), 7,44 (с, 1Н), 7,40 (с, 2Н), 7,36 (д, J=6,8 Гц, 1Н), 7,05 (т, J=5,2 Гц, 1Н), 6,70 (т, J=5,2 Гц, 1Н), 6,57 (д, J=15,6 Гц, 1Н), 6,44 (дд, J=15,6, 8,0 Гц, 1Н), 4,23 (д, J=5,6 Гц, 2Н), 4,15 (м, 1Н), 4,01 (м, 2Н); ИЭРМС m/z 580,72 ([М-Н]-).
Соединения АС59-АС75 (таблица 1) получали по методикам, раскрытым в примере 14.
Пример 15: Получение (E)-2-бром-4-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-N-(2-оксо-2-((2,2,2-трифторэтил)амино)этил)бензамида (АС79)
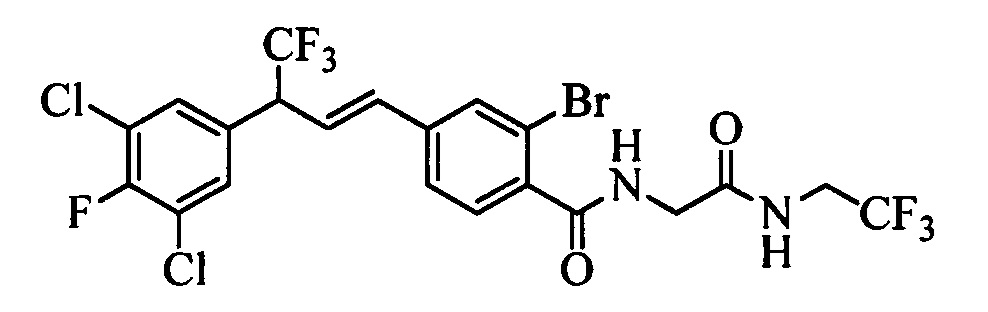
При перемешивании к раствору (Е)-2-бром-4-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)бензойной кислоты (300 мг, 0,638 ммоля) в CH2Cl2 (5,0 мл) добавляли 2-амино-N-(2,2,2-трифторэтил)ацетамид (172 мг, 0,638 ммоля), затем бензотриазол-1-илокситрипирролидинофосфонийгексафторфосфат (PyBOP) (364,5 мг, 0,701 ммоля) и ДИПЭА (0,32 мл, 1,914 ммоля) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью CH2Cl2. Объединенный слой, содержащий CH2Cl2, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; при элюировании смесью 40% этилацетат/петролейный эфир) давала искомое соединение в виде почти белого твердого вещества (121 мг, 31%):1H ЯМР (400 МГц, CDCl3) δ 8,69 (т, J=6,0 Гц, 1Н), 8,58 (т, J=6,0 Гц, 1Н), 7,92 (с, 1Н), 7,87 (д, J=6,4 Гц, 2Н), 7,62 (д, J=8,4 Гц, 1Н), 7,45 (д, J=8,4 Гц, 1Н), 7,0 (м, 1Н), 6,76 (д, J=15,6 Гц, 1Н), 4,83 (т, J=8,0 Гц, 1Н), 3,98 (м, 4Н); ИЭРМС m/z 610,97 ([М+Н]+); ИК (тонкая пленка) 3303, 1658, 1166, 817 см-1.
Соединения АС76-АС80, АС96-АС102 и АС113 (таблица 1) получали по методикам, раскрытым в примере 15.
Пример 16: Получение (Е)-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-N-(1,1-диоксидотиетан-3-ил)-2-фторбензамида (АС83)
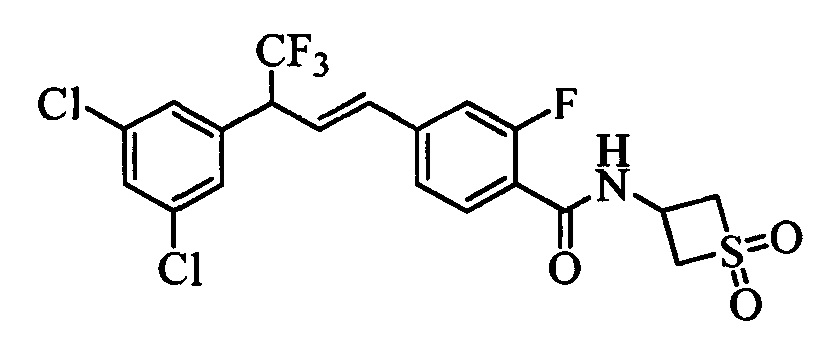
При перемешивании к раствору (Е)-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)-2-фтор-N-(тиетан-3-ил)бензамида (100 мг, 0,2159 ммоля) в смеси ацетон/вода (1:1, 5,0 мл) добавляли оксон (266 мг, 0,4319 ммоля) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 4 ч. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Объединенный этилацетатный слой сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; при элюировании смесью 30% этилацетат/петролейный эфир) давала искомое соединение в виде почти белого твердого вещества (70,0 мг, 66%):1H ЯМР (400 МГц, CDCl3) δ 8,07 (т, J=8,4 Гц, 1Н), 7,39 (т, J=1,6 Гц, 1Н), 7,31 (д, J=1,2 Гц, 1Н), 7,26 (м, 2Н), 7,23 (м, 2Н), 7,19 (д, J=1,6 Гц, 1Н), 6,60 (д, J=16,8 Гц, 1Н), 6,49 (дд, J=16,8, 7,6 Гц, 1Н), 4,90 (м, 1Н), 4,64 (м, 2Н), 4,14 (м, 2Н); ИЭРМС m/z 493,83 ([М-Н]-); ИК (тонкая пленка) 1527, 1113, 801, 1167, 1321 см-1.
Соединения АС81-АС87 (таблица 1) получали по методикам, раскрытым в примере 16.
Пример 17: Получение (Е)-N-((5-циклопропил-1,3,4-оксадиазол-2-ил)метил)-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-метилбензамида (АС89)
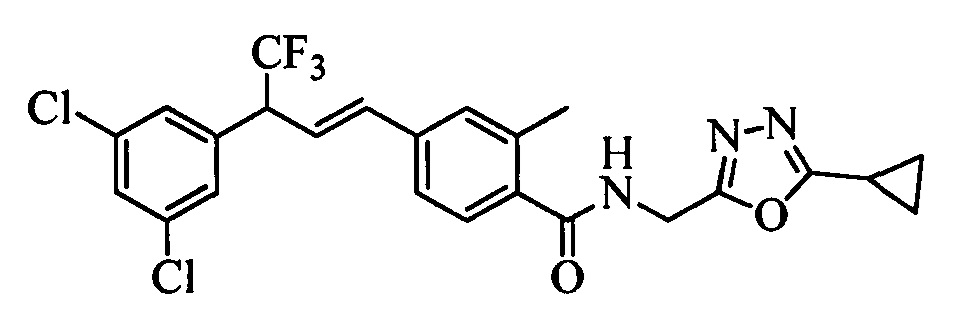
Раствор (Е)-N-(2-(2-(циклопропанкарбонил)гидразинил)-2-оксоэтил)-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)-2-метилбензамида (200 мг, 0,379 ммоля) в POCl3 (2,0 мл) перемешивали при температуре окружающей среды в течение 10 мин, затем полученную реакционную смесь нагревали при 50°С в течение 1 ч. Реакцию останавливали водой со льдом при 0°С и экстрагировали этилацетатом. Объединенный этилацетатный слой промывали насыщенным раствором NaHCO3 и рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; при элюировании смесью 50% этилацетат/петролейный эфир) давала искомое соединение в виде светло-коричневого столообразного вещества (70,0 мг, 36%):1H ЯМР (400 МГц, CDCl3) δ 7,43 (м, 2Н), 7,27 (м, 2Н), 7,23 (м, 2Н), 6,58 (д, J=16,0 Гц, 1Н), 6,41 (дд, J=16,0, 7,6 Гц, 1Н), 4,79 (д, J=5,6 Гц, 2Н), 4,14 (м, 1Н), 2,48 (с, 3Н), 2,18 (м, 1Н), 1,16 (м, 4Н); ИЭРМС m/z 509,89 ([М+Н]+); ИК (тонкая пленка) 1666, 1166, 1112, 800 см-1.
Пример 18: Получение (E)-2-бром-N-(2-тиооксо-2-((2,2,2-трифторэтил)амино)этил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензотиоамида (АС90)
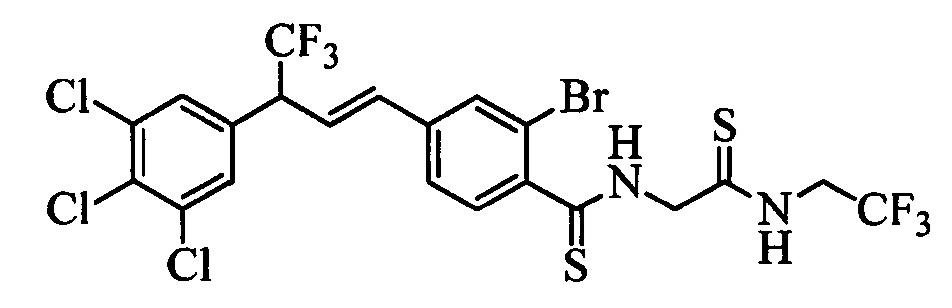
При перемешивании к раствору (Е)-2-бром-N-(2-оксо-2-((2,2,2-трифторэтил)амино)этил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензамида (400 мг, 0,638 ммоля) в 5 мл ТГФ при температуре окружающей среды одной порцией добавляли 2,4-бис(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфид (реагент Лавессона) (336 мг, 0,830 ммоля). Полученную реакционную смесь перемешивали в течение 18 ч. ТСХ показывала, что реакция не завершилась, поэтому дополнительно добавляли реагент Лавессона (168 мг, 0,415 ммоля) и реакционную смесь перемешивали в течение 48 ч. После того, как по данным ТСХ реакцию считали завершенной, реакционную смесь концентрировали при пониженном давлении. Очистка с помощью флэш-хроматографии (SiO2, 230-400 меш; при элюировании с помощью 20% EtOAc в гексанах) давала искомое соединение в виде желтого прозрачного масла (188 мг, 44,7%):1H ЯМР (400 МГц, CDCl3) δ 8,34 (м, 1Н), 8,27 (м, 1Н), 7,60 (д, J=1,6 Гц, 1Н), 7,49 (д, J=8,0 Гц, 2Н), 7,40 (с, 2Н), 7,36 (дд, J=8,2, 1,7 Гц, 1Н), 6,53 (д, J=16,0 Гц, 1Н), 6,38 (дд, J=15,9, 7,9 Гц, 1Н), 4,89 (д, J-8,4, 5,5 Гц, 2Н), 4,48 (кв.д, J=9,0, 6,0 Гц, 2Н), 4,11 (м, 1Н); ИЭРМС m/z 656,9 ([М-Н]-).
Пример 19: Получение (E)-2-(2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенилтиоамидо)-N-(2,2,2-трифторэтил)ацетамида (АС91)
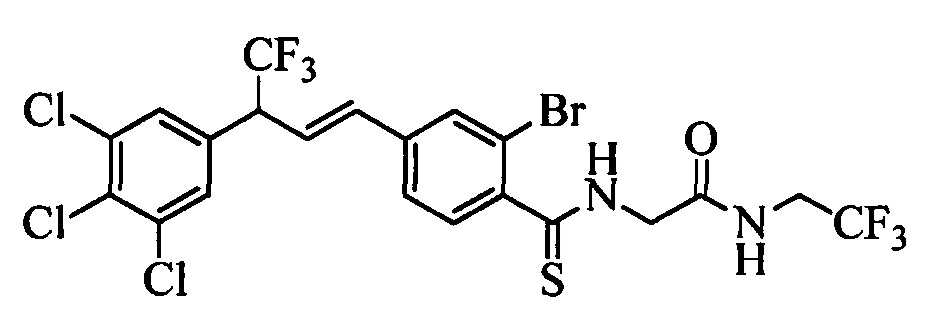
При перемешивании к раствору (Е)-2-бром-N-(2-оксо-2-((2,2,2-трифторэтил)амино)этил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензамида (400 мг, 0,638 ммоля) в δ мл ТГФ при температуре окружающей среды одной порцией добавляли реагент Лавессона (64,5 мг, 0,160 ммоля). Полученную реакционную смесь перемешивали в течение 18 ч и затем реакционную смесь концентрировали при пониженном давлении. Очистка с помощью флэш-хроматографии (SiO2, 230-400 меш; при элюировании с помощью 20% EtOAc в гексанах) давала искомые соединения в виде желтого масла (18,5 мг, 4,51%):1H ЯМР (400 МГц, CDCl3) δ 8,18 (т, J=5,0 Гц, 1Н), 7,58 (д, J=1,6 Гц, 1Н), 7,47 (д, J=8,0 Гц, 1Н), 7,40 (с, 2Н), 7,34 (дд, J=8,1, 1,6 Гц, 1Н), 6,52 (м, 2Н), 6,37 (дд, J=15,9, 7,9 Гц, 1Н), 4,54 (д, J=4,9 Гц, 2Н), 4,12 (м, 1Н), 3,99 (кв.д, J=8,9, 6,5 Гц, 2Н); ИЭРМС m/z 640,9 ([М-Н]-).
Указанное ниже соединение получали по методикам, раскрытым в примере 19.
(Е)-2-Бром-N-(2-тиооксо-2-((2,2,2-трифторэтил)амино)этил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензамид (АС92)
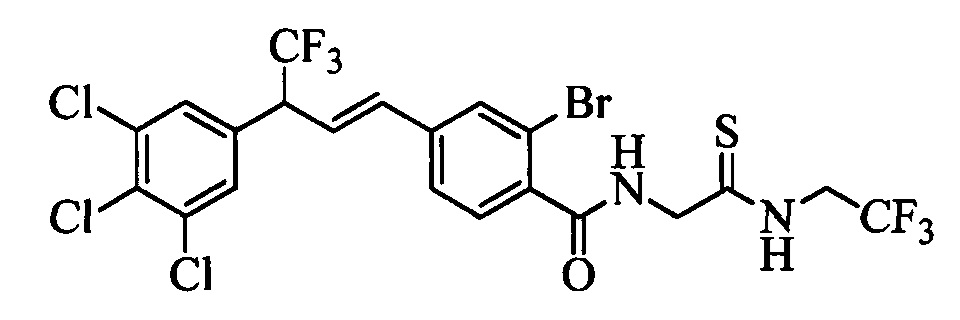
Продукт выделяли в виде бесцветного масла (17,9 мг, 4,36%):1H ЯМР (400 МГц, CDCl3) δ 9,16 (д, J=6, 1 Гц, 1Н), 7,65 (д, J=1,6 Гц, 1Н), 7,57 (д, J=8,0 Гц, 1Н), 7,41 (м, 3Н), 7,21 (т, J=5,6 Гц, 1Н), 6,55 (д, J=15,9 Гц, 1Н), 6,41 (дд, J=15,9, 7,8 Гц, 1Н), 4,59 (д, J=5,6 Гц, 2Н), 4,45 (кв.д, J=9,0, 6,0 Гц, 2Н), 4,12 (кв., J=7,2 Гц, 1Н); ИЭРМС m/z 640,9 ([М-Н]-).
Пример 106: Получение этил-(Z)-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензоата (AI76)
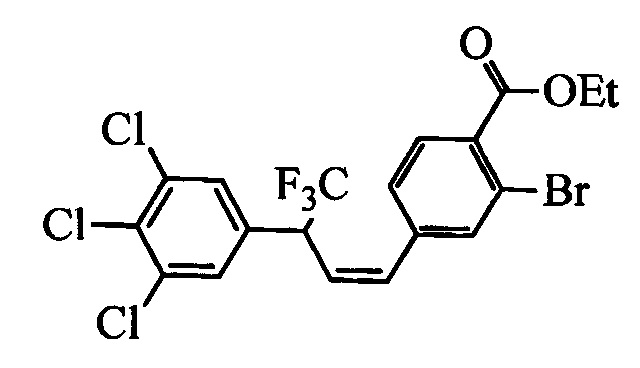
Искомое соединение получали по методике, раскрытой в примере 88, и выделяли в виде желтого вязкого масла (416 мг, 23%):1H ЯМР (400 МГц, CDCl3) δ 7,80 (д, J=8,0 Гц, 1Н), 7,40 (д, J=1,7 Гц, 1Н), 7,35 (с, 2Н), 7,12 (дд, J=8,0, 1,7 Гц, 1Н), 6,86 (д, J=11,4 Гц, 1Н), 6,23-5,91 (м, 1Н), 4,42 (кв., J=7,1 Гц, 2Н), 4,33-4,10 (м, 1Н), 1,42 (т, J=7,2 Гц, 3Н);19F ЯМР (376 МГц, CDCl3) δ -69,34 (д, J=8,3 Гц); ЭУМС m/z 514,10 ([М]-); ИК (тонкая пленка) 2983, 1727, 1247, 1204, 1116 см-1.
Пример 107: Получение (Z)-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензойной кислоты (AI77)
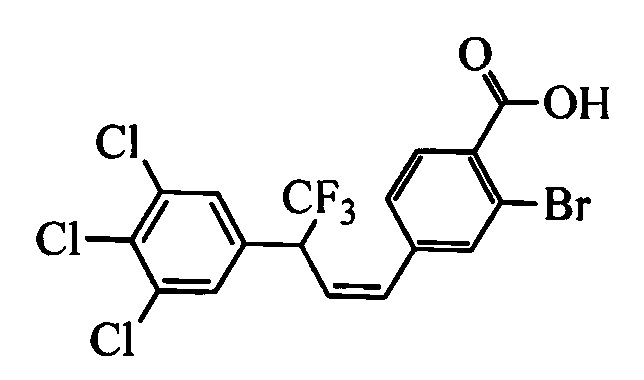
При перемешивании к раствору (Z)-этил-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензоата (360 мг, 0,70 ммоля) в CH3CN (1,0 мл) добавляли йодтриметилсилан (0,28 мл, 2,8 ммоля). Реакционную смесь кипятили с обратным холодильником в течение 20 ч, давали охладиться до температуры окружающей среды и подвергали распределению между CH2Cl2 и 10% водным раствором Na2S2O3. Органическую фазу один раз промывали 10% водным раствором Na2S2O3 и сушили над MgSO4, и концентрировали в вакууме. Пропускание вещества через слой диоксида кремния с использованием 10% EtOAc в гексанах, затем 20% МеОН в CH2Cl2 в качестве элюирующих растворителей давало искомое соединение в виде желтого вспененного вещества (143 мг, 42%): температура плавления 54-64°С;1H ЯМР (400 МГц, CDCl3) δ 11,36 (с, 1Н), 7,99 (д, J=8,0 Гц, 1Н), 7,43 (с, 1Н), 7,30 (с, 2Н), 7,14 (д, J=7,9 Гц, 1Н), 6,85 (д, J=11,4 Гц, 1Н), 6,15 (т, J=10,9 Гц, 1Н), 4,36-4,09 (м, 1Н);19F ЯМР (376 МГц, CDCl3) δ -69,30.
Пример 108: Получение (Z)-2-бром-N-(2-оксо-2-((2,2,2-трифторэтил)амино)этил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензамида (АС95)
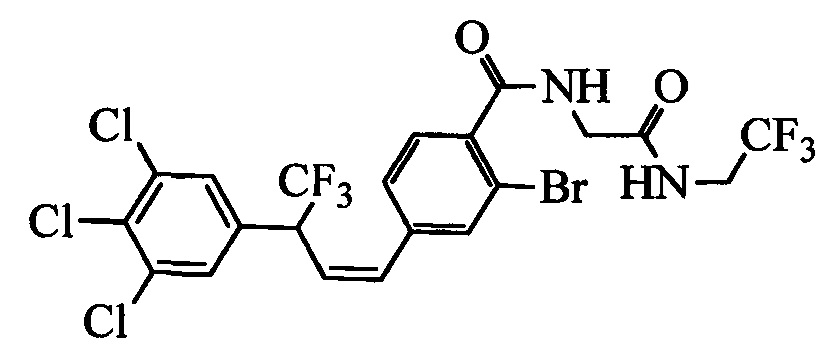
При перемешивании к раствору (Z)-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензойной кислоты (200 мг, 0,41 ммоля) в безводном ТГФ (5,0 мл) добавляли DCI (82 мг, 0,51 ммоля). Смесь нагревали на масляной бане при 50°С в течение 1,5 ч, обрабатывали 2-амино-N-(2,2,2-трифторэтил)ацетамидгидрохлоридом (109 мг, 0,057 ммоля) и полученную смесь кипятили с обратным холодильником в течение 8 ч. После охлаждения до температуры окружающей среды смесь переносили в Et2O и дважды промывали 5% водным раствором NaHSO4 (2×) и один раз насыщенным раствором NaCl (1×). После сушки над MgSO4, концентрирования в вакууме и очистки с помощью хроматографии среднего давления на диоксиде кремния с использованием смесей EtOAc/гексаны в качестве элюентов искомое соединение получали в виде белого вспененного вещества (160 мг, 41%) температура плавления 48-61°С:1H ЯМР (400 МГц, CDCl3) δ 7,58 (д, J=7,9 Гц, 1Н), 7,44-7,29 (м, 3Н), 7,14 (дд, J=7,9, 1,6 Гц, 1Н), 6,86 (д, J=11,4 Гц, 1Н), 6,76 (т, J=5,9 Гц, 1Н), 6,59 (шир.с, 1Н), 6,21-6,04 (м, 1Н), 4,23 (д, J=5,5 Гц, 1Н), 3,98 (кв.д, J=9,0, 6,5 Гц, 2Н);19F ЯМР (376 МГц, CDCl3) δ -69,31, -72,3; ЭУМС m/z 626,9 ([M+1]+).
Пример 109а: Получение (E)-2-бром-N-(пиперидин-4-ил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензамида (АС114)
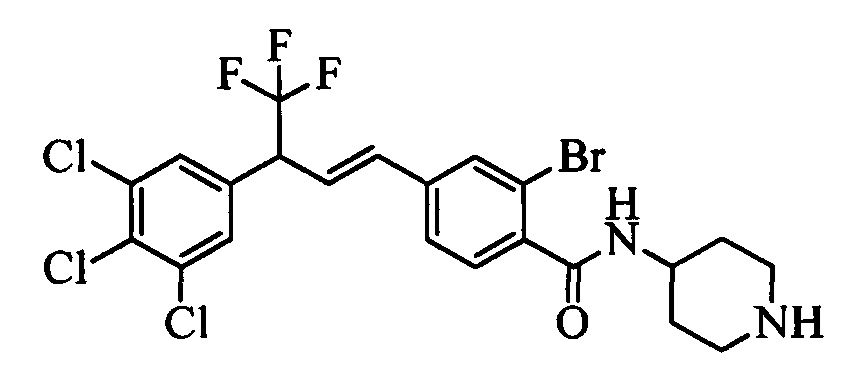
(Е)-трет-Бутил-4-(2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамидо)пиперидин-1-карбоксилат (0,75 г, 1,11 ммоля) при 0°С добавляли к диоксан.HCl (10 мл) и перемешивали в течение 18 ч. Реакционную смесь концентрировали при пониженном давлении и растирали с диэтиловым эфиром и получали соединение в виде светло-коричневого твердого вещества (0,6 г, 88%).
Пример 109b: Получение (E)-N-(1-ацетилпиперидин-4-ил)-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензамида (АС103)

При перемешивании к раствору (Е)-2-бром-N-(пиперидин-4-ил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамида (0,1 г, 0,16 ммоля) в CH2Cl2 (10,0 мл) добавляли ТЭА (0,046 мл, 0,35 ммоля) и перемешивали в течение 10 мин. Затем ацетилхлорид (0,014, 0,18 ммоля) добавляли и перемешивали в течение 16 ч при температуре окружающей среды. Реакционную смесь разбавляли с помощью CH2Cl2 и промывали насыщенным раствором NaHCO3 и рассолом. Объединенный слой, содержащий CH2Cl2, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение. Неочищенное соединение промывали смесью 5% диэтиловый эфир/н-пентан и получали искомое соединение в виде белого твердого вещества (0,054 г, 50%).
Пример 110: Получение (Е)-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)-N-(1-(3,3,3-трифторпропаноил)пиперидин-4-ил)бензамида (АС104)
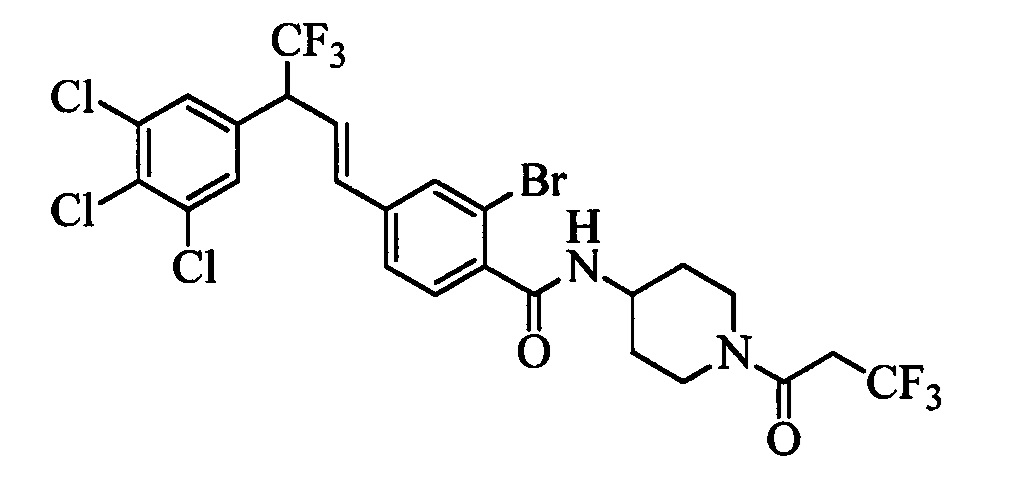
При перемешивании к раствору 3,3,3-трифторпропановой кислоты (0,02 г, 0,16 ммоля) в CH2Cl2 (10,0 мл) при температуре окружающей среды добавляли (Е)-2-бром-N-(пиперидин-4-ил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамид (0,1 г, 0,16 ммоля), PYBOP (0,09 г, 0,17 ммоля) и ДИПЭА (0,06 г, 0,48 ммоля). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 ч. Реакционную смесь разбавляли с помощью CH2Cl2. Объединенный слой, содержащий CH2Cl2, промывали с помощью 3 н. HCl и насыщенным раствором NaHCO3, отделенный слой, содержащий CH2Cl2, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение. Неочищенное соединение очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; при элюировании с помощью 2% МеОН в CH2Cl2) и получали искомое соединение в виде почти белого смолообразного вещества (0,035 г, 29%).
Пример 111: Получение (Е)-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)-N-(1-(2,2,2-трифторэтил)пиперидин-4-ил)бензамида (АС105)
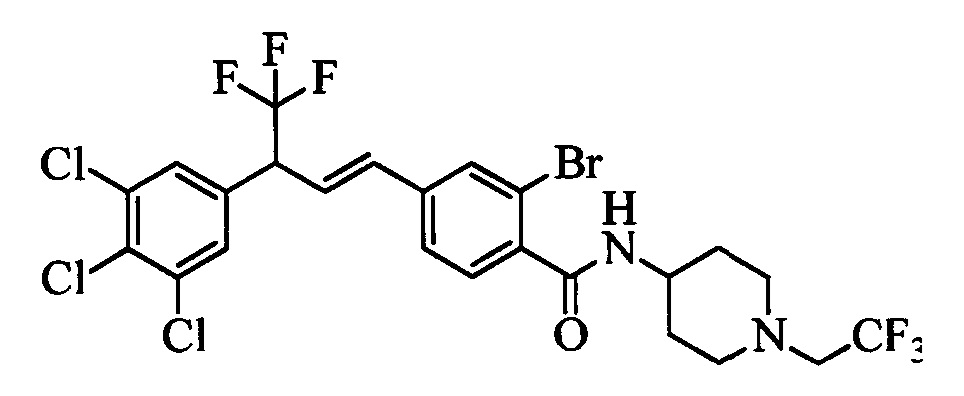
При перемешивании к раствору (E)-2-бром-N-(пиперидин-4-ил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамида (0,1 г, 0,16 ммоля) в ТГФ (5,0 мл) добавляли ТЭА (0,06 мл, 0,64 ммоля) и перемешивали в течение 10 мин. Затем добавляли 2,2,2-трифторэтилтрифторметансульфонат (0,03, 0,16 ммоля) и перемешивали в течение 16 ч при температуре окружающей среды. Реакционную смесь разбавляли этилацетатом и промывали насыщенным раствором NaHCO3 и рассолом. Объединенный этилацетатный слой сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде коричневого твердого вещества (0,05 г, 44%).
Пример 112: Получение (Е)-2-бром-N-(1-метилпиперидин-4-ил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензамида (АС106)
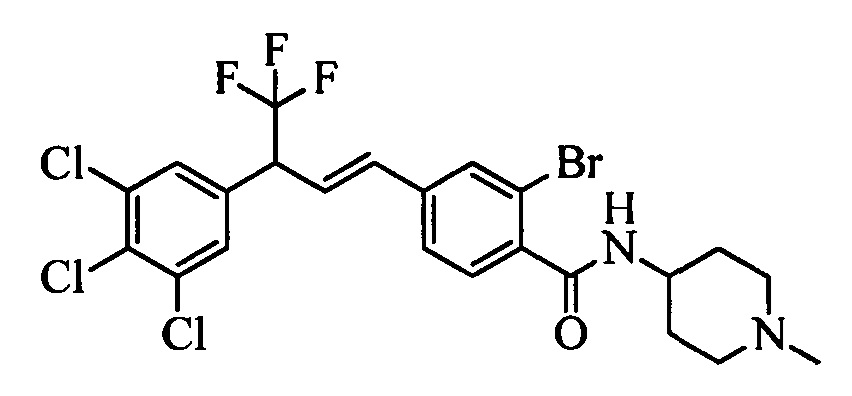
Раствор (Е)-2-бром-N-(пиперидин-4-ил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамида (0,1 г, 0,16 ммоля), формальдегида (30% в воде) (0,1 мл, 0,16 ммоля) и уксусной кислоты (0,01 мл) в МеОН (5,0 мл) перемешивали при температуре окружающей среды в течение 30 мин. Затем при 0°С добавляли NaBH3CN (0,01 г, 0,16 ммоля) и реакционную смесь перемешивали в течение 8 ч при температуре окружающей среды. Растворитель удаляли при пониженном давлении, и получали остаток, который разбавляли этилацетатом и промывали насыщенным водным раствором NaHCO3 и рассолом. Объединенный этилацетатный слой сушили над Na2SO4 и концентрировали при пониженном давлении, и получали остаток, который растирали со смесью диэтиловый эфир/пентан, и получали искомое соединение в виде бледно-желтого смолообразного вещества (0,06 г, 59%).
Пример 113: Получение ((Е)-2-бром-N-(1-(цианометил)пиперидин-4-ил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензамида (АС107)

При перемешивании к раствору (S)-2-бром-N-(пиперидин-4-ил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамида (0,25 г, 0,43 ммоля) в ТГФ (10,0 мл) добавляли ТЭА (0,16 мл, 1,29 ммоля) и реакционную смесь перемешивали в течение 10 мин. Затем добавляли 2-бромацетонитрил (0,07, 0,65 ммоля) и реакционную смесь перемешивали в течение 8 ч при температуре окружающей среды. Реакционную смесь разбавляли этилацетатом и промывали насыщенным рассолом. Объединенный этилацетатный слой сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде почти белого твердого вещества (0,125 г, 46,8%).
Пример 114: Получение (E)-2-бром-N-(1-(оксетан-3-ил)пиперидин-4-ил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензамида (АС108)
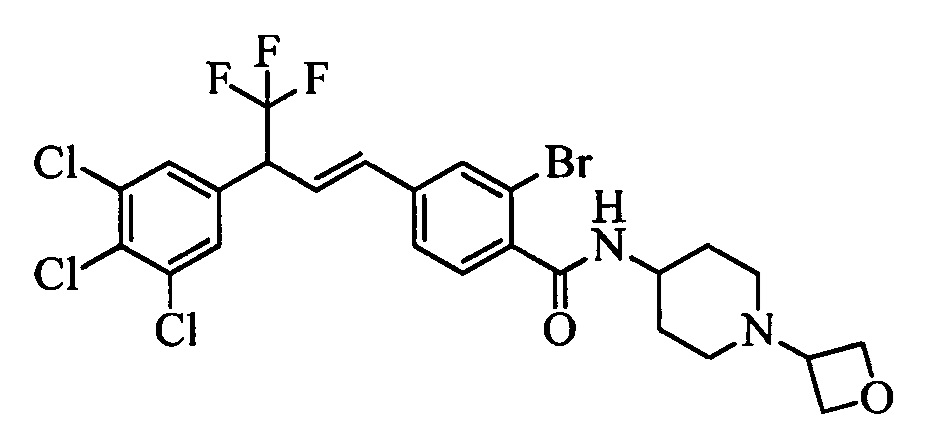
Раствор (Е)-2-бром-N-(пиперидин-4-ил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамида (0,2 г, 0,35 ммоля), оксетан-3-она (0,027 г, 0,38 ммоля) и уксусной кислоты (0,01 мл) в МеОН (5,0 мл) перемешивали при температуре окружающей среды в течение 30 мин. Затем при 0°С в течение 10 мин порциями медленно добавляли NaBH3CN (0,022 г, 0,35 ммоля) и реакционную смесь перемешивали в течение 8 ч при температуре окружающей среды. Растворитель удаляли при пониженном давлении, и получали остаток, который разбавляли этилацетатом и промывали насыщенным раствором NaHCO3 и рассолом. Объединенный этилацетатный слой сушили над Na2SO4 и концентрировали при пониженном давлении, и получали остаток, который растирали со смесью диэтиловый эфир/пентан и получали искомое соединение в виде почти белого твердого вещества (0,05 г, 23%).
Пример 115: Получение (Е)-2-бром-N-(1-(2-гидроксиэтил)пиперидин-4-ил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензамида (АС109)
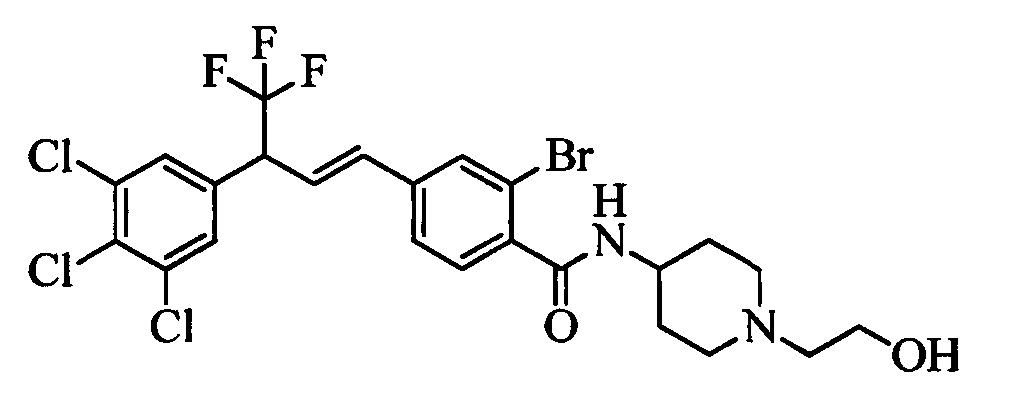
При перемешивании к раствору (E)-2-бром-N-(пиперидин-4-ил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамида (0,25 г, 0,43 ммоля) в ТГФ (10,0 мл) добавляли ТЭА (0,16 мл, 1,29 ммоля) и реакционную смесь перемешивали в течение 10 мин. Затем добавляли 2-хлорэтанол (0,05, 0,65 ммоля) и реакционную смесь перемешивали в течение 8 ч при температуре окружающей среды. Реакционную смесь разбавляли этилацетатом и промывали насыщенным рассолом. Объединенный этилацетатный слой сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде почти белого твердого вещества (0,09 г, 34%).
Пример 116: Получение (Е)-2-(2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензамидо)уксусной кислоты (AI78)
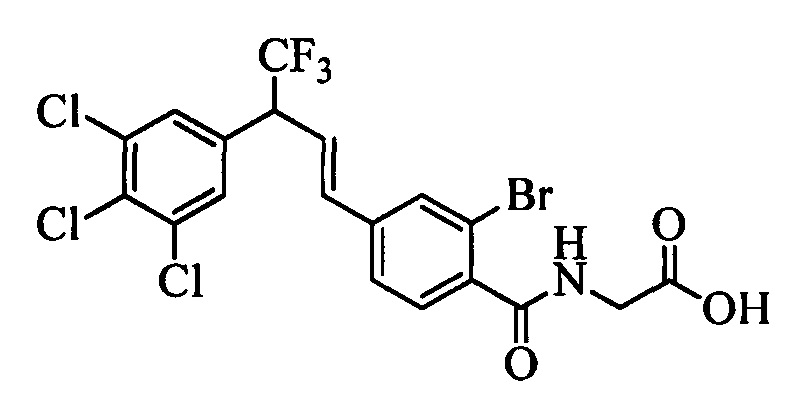
При перемешивании к раствору (Е)-трет-бутил-2-(2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамидо)ацетата (440 мг, 0,734 ммоля) в CH2Cl2 (36,0 мл) добавляли ТФК (трифторуксусная кислота) (4,0 мл) и реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении, и получали остаток, который промывали н-пентаном и получали искомое соединение в виде почти белого твердого вещества (310 мг, 78%):1H ЯМР (400 МГц, CDCl3) δ 13,0 (с, 1Н), 8,75 (т, J=5,7 Гц, 1Н), 7,93 (м, 2Н), 7,62 (д, J=7,5 Гц, 1Н), 7,40 (д, J=8,1 Гц, 1Н), 6,96 (дд, J=15,3, 9,3 Гц, 1Н), 6,78 (д, J=15,3 Гц, 1Н), 4,83 (м, 1Н), 3,90 (д, J=5,7 Гц, 2Н); ИЭРМС m/z 543,61([М+Н]+); ИК (тонкая пленка) 3429, 1635, 1114, 772 см-1.
Пример 117: Получение (E)-N-((6-хлорпиридин-3-ил)метил)-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-метилбензотиоамида (АС115)
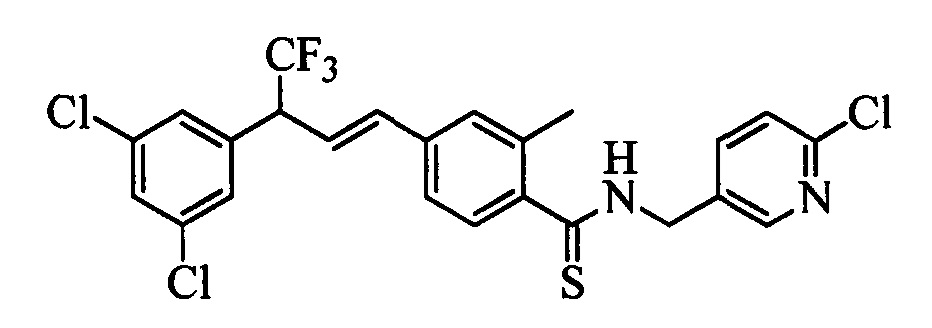
При перемешивании к раствору (Е)-N-((6-хлорпиридин-3-ил) метил)-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)-2-метилбензамида (0,06 г, 0,117 ммоля) в толуоле (3 мл) добавляли реагент Лавессона (0,14 г, 0,351 ммоля) и реакционную смесь обрабатывали микроволновым излучением при 100°С в течение 1 ч, затем охлаждали до температуры окружающей среды и концентрировали при пониженном давлении, и получали неочищенное соединение. Неочищенный продукт очищали с помощью препаративной ВЭЖХ и получали продукт в виде желтого твердого вещества (0,03 г, 49%).
Пример 118: Получение (Е)-4-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-N-(2-оксо-2-((2,2,2-трифторэтил)амино)этил)-2-(трифторметокси)бензамида (АС116)

Стадия 1. 2-(Трифторметокси)-4-винилбензойная кислота (AI79): При перемешивании к раствору 4-бром-2-(трифторметокси)бензойной кислоты (1 г, 3,67 ммоля) в ДМСО (20 мл) добавляли винилтрифторборат калия (1,47 г, 11,02 ммоля) и карбонат калия (1,52 г, 11,02 ммоля). Реакционную смесь дегазировали аргоном в течение 30 мин. Добавляли бистрифенилфосфин(дифенилфосфиноферроцен)палладийдихлорид (0,13 г, 0,18 ммоля) и реакционную смесь нагревали при 80°С в течение 1 ч. Реакционную смесь разбавляли водой (100 мл), экстрагировали этилацетатом (2×50 мл), промывали рассолом и сушили над Na2SO4. Концентрирование при пониженном давлении давало неочищенное соединение, которое очищали с помощью колоночной флэш-хроматографии, и получали продукт в виде бледно-желтого смолообразного вещества (0,4 г, 47%):1H ЯМР (400 МГц, CDCl3) δ 8,05 (д, J=8,1 Гц, 1Н), 7,44 (д, J=1,8 Гц, 1Н), 7,35 (с, 1Н), 6,78 (дд, J=17,4,1, 11,1 Гц, 1Н), 5,92 (д, J=17,4 Гц, 1Н), 5,51 (д, J=10,8 Гц, 1Н); ИЭРМС m/z 232,97 ([М+Н]+).
Стадия 2. (E)-4-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-2-(трифторметокси)бензойная кислота (А180):
При перемешивании к раствору 2-(трифторметокси)-4-винилбензойной кислоты (0,356 г, 1,53 ммоля) в 1 н. метилпирролидине (5,0 мл) добавляли 1-(1-бром-2,2,2-трифторэтил)-3,5-дихлор-4-фторбензол (1,0 г, 3,07 ммоля), хлорид меди(I) (CuCl; 0,03 г, 0,307 ммоля) и 2,2-бипиридил (0,095 г, 0,614 ммоля). Реакционную смесь перемешивали при 150°С в течение 1 ч. После завершения реакции по данным ТСХ реакционную смесь разбавляли водой (100 мл) и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение, которое очищали с помощью колоночной флэш-хроматографии и получали продукт в виде бледно-желтого смолообразного вещества (0,3 г, 21%):1H ЯМР (400 МГц, CDCl3) δ 8,08 (д, J=8,0 Гц, 1Н), 7,45 (д, J=1,6 Гц, 1Н), 7,35 (с, 3Н), 6,63 (д, J=16,0 Гц, 1Н), 6,50 (дд, J=16,0, 8,0 Гц, 1Н), 4,15 (м, 1Н); ИЭРМС m/z 474,81 ([М-Н]-).
Стадия 3. (E)-4-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-N-(2-оксо-2-(2,2,2-трифторэтиламино)этил)-2-(трифторметокси)бензамид (АС116): Смесь (Е)-4-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-2-(трифторметокси)бензойной кислоты (0,25 г, 0,52 ммоля), 2-амино-N-(2,2,2-трифторэтил)ацетамида (0,158 г, 0,62 ммоля), PyBOP (0,40 г, 0,78 ммоля) и ДИПЭА (0,134 г, 1,04 ммоля) в CH2Cl2 (10,0 мл) перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью CH2Cl2. Объединенный слой, содержащий CH2Cl2, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; при элюировании смесью 20% этилацетат/петролейный эфир) давала искомое соединение в виде бледно-желтого смолообразного вещества (0,15 г, 47%).
Указанные ниже молекулы получали по методикам, раскрытым в примере 118, стадия 2:
(Е)-4-(3-(3,5-Дибромфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-(трифторметил)бензойная кислота
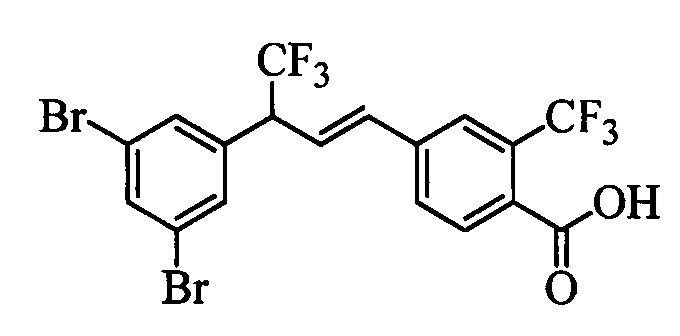
Искомое соединение выделяли в виде коричневого твердого вещества:1H ЯМР (300 МГц, ДМСО-d6) δ 13,5 (шир.с, 1Н), 8,03 (с, 1Н), 7,95-7,85 (м, 4Н), 7,81 (д, J=7,8 Гц, 1Н), 7,14 (дд, J=15,6, 9,6 Гц, 1Н), 6,90 (д, J=15,9 Гц, 1Н), 4,86-4,79 (м, 1Н); ИЭРМС m/z 528,82 ([М-Н]+); ИК (тонкая пленка) 3437, 1707, 1153, 555 см-1.
(E)-4-(3-(3,5-Дибром-4-хлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-(трифторметил)бензойная кислота
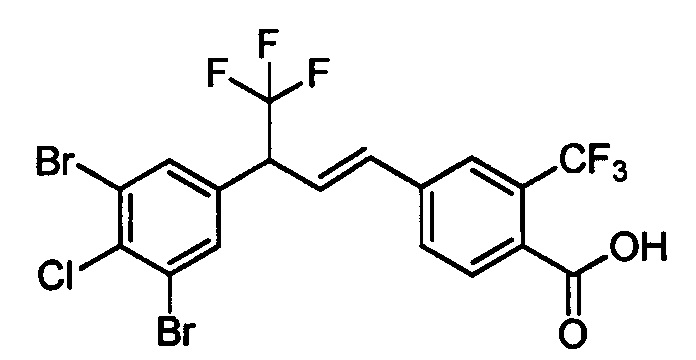
Выделяли в виде коричневой смолы:1H ЯМР (300 МГц, ДМСО-d6) δ 13,36 (шир.с, 1Н) 8,05(с, 2Н), 7,95 (д, J=8,1 Гц, 1Н), 7,87-7,67 (м, 2Н), 7,14 (дд, J=9,0, 15,6 Гц, 1Н), 6,96 (д, J=15, 6 Гц, 1Н), 4,88-4,82 (м, 1Н); ИЭРМС m/z 564,58 ([M+H]+).
(E)-4-(3-(4-Бром-3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-(трифторметил)бензойная кислота
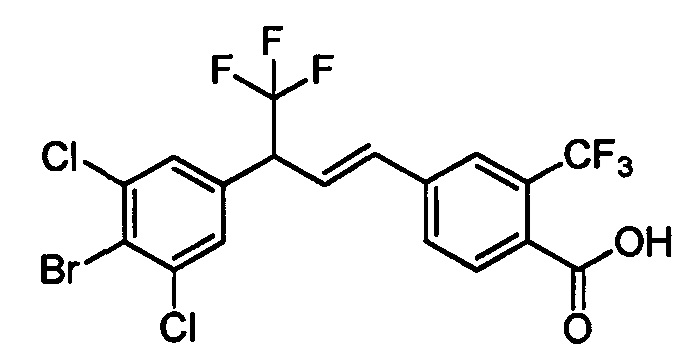
Выделяли в виде коричневой смолы:1H ЯМР (300 МГц, ДМСО-d6) δ 13,6 (шир.с, 1Н) 8,03 (с, 1Н), 7,95 (д, J=8,4 Гц, 1Н), 7,88 (с, 2Н), 7,81 (д, J=8,1 Гц, 1Н), 7,13 (дд, J=16,2, 7,5 Гц, 1Н), 6,91 (д, J=15,9 Гц, 1Н), 4,89-4,83 (м, 1Н); ИЭРМС m/z 532,0 ([М+Н]+).
(E)-4-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-(трифторметил)бензойная кислота
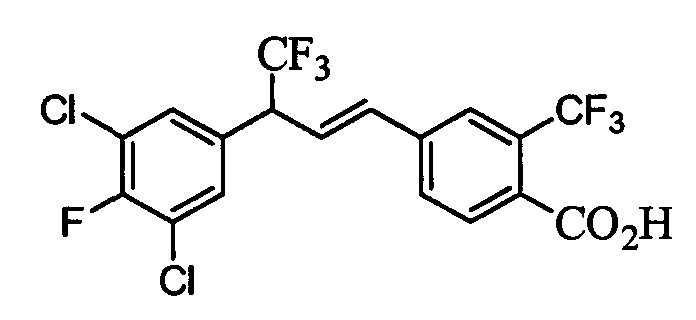
Искомое соединение выделяли в виде почти белого твердого вещества: температура плавления 140-143°С;1H ЯМР (400 МГц, ДМСО) δ 13,60 (шир.с, 1Н), 8,02 (с, 1Н), 7,94-7,90 (м, 1Н), 7,88-7,86 (м, 2Н), 7,81-7,79 (м, 1Н), 7,12 (дд, J=15,6, 8,8 Гц, 1Н), 6,89 (д, J=15,6 Гц, 1Н), 4,86-4,81 (м, 2Н); ИЭРМС m/z 458,88 ([M-H]-).
Пример 20: Получение 5-винил-2,3-дигидро-1H-инден-1-она (BI1)

При перемешивании к раствору 5-бром-2,3-дигидро-1H-инден-1-она (5 г, 23,7 ммоля) в толуоле добавляли комплекс ангидрида винилбороновой кислоты с пиридином (8,55 г, 35,54 ммоля), Pd(PPh3)4 (0,1 г, 0,094 ммоля), K2CO3 (22,88 г, 165,83 ммоля). Полученную реакционную смесь кипятили с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до 25°С и фильтровали и фильтрат концентрировали при пониженном давлении. Остаток разбавляли с помощью EtOAc и промывали с помощью Н2О и рассолом. Объединенные органические экстракты сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной флэш-хроматографии (SiO2, 5% EtOAc в петролейном эфире) и получали искомое соединение в виде твердого вещества (1,8 г, 48%):1H ЯМР (400 МГц, CDCl3) δ 7,74 (д, J=7,2 Гц, 1Н), 7,49 (шир.с, 1Н), 7,44 (д, J=7,2 Гц, 1Н), 6,82 (м, 1Н), 5,90 (д, J=7,4 Гц, 1Н), 5,42 (д, J=6,4 Гц, 1Н), 3,20 (м, 2Н), 2,70 (м, 2Н); ИЭРМС m/z 159,06 ([М+Н]-).
Указанное ниже соединение получали по методикам, раскрытым в примере 20.
6-Винил-3,4-дигидронафталин-1(2Н)-он (BI2)
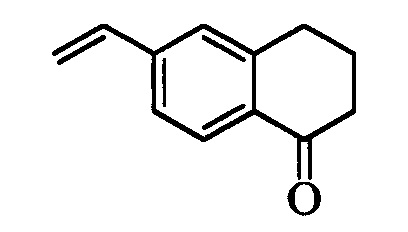
Продукт выделяли в виде почти белого твердого вещества (5 г, 48%):1H ЯМР (400 МГц, ДМСО-d6) δ 7,85 (д, J=8,4 Гц, 1Н), 7,48 (м, 2Н), 6,82 (м, 1Н), 6,02 (д, J=7,4 Гц, 1Н), 5,44 (д, J=6,4 Гц, 1Н), 2,95 (м, 2Н), 2,60 (м, 2Н), 2,00 (м, 2Н); ИЭРМС m/z 173,14 ([М-Н]-); ИК (тонкая пленка) 1681 см-1.
Пример 21: Получение (Е)-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2,3-дигидро-1H-инден-1-она (BI3)
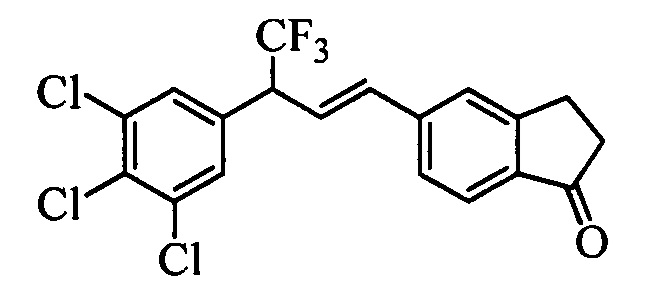
5-(1-Бром-2,2,2-трифторэтил)-1,2,3-трихлорбензол (4 г, 11,7 ммоля), 5-винил-2,3-дигидро-1H-инден-1-он (0,92 г, 5,8 ммоля), CuCl (0,115 г, 1,171 ммоля) и 2,2-бипиридил (0,053 г, 0,34 ммоля) в 1,2-дихлорбензоле (25 мл) нагревали при 180°С в течение 16 ч. Реакционную смесь охлаждали до 25°С и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной флэш-хроматографии (SiO2, 5% EtOAc в петролейном эфире) и получали искомое соединение в виде жидкости (1,28 г, 25%):1H ЯМР (400 МГц, CDCl3) δ 7,76 (д, J=7,4 Гц, 1Н), 7,52 (м, 3Н), 6,68 (д, J=7,4 Гц, 1Н), 6,52 (м, 1Н), 4,18 (м, 1Н), 3,18 (м, 2Н), 2,75 (м, 2Н); ИЭРМС m/z 419,14 ([М+Н]-); ИК (тонкая пленка) 1708,94, 1113,60, 807,77 см-1.
Указанное ниже соединение получали по методикам, раскрытым в примере 21.
(Е)-5-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-2,3-дигидро-1H-инден-1-он (BI4)
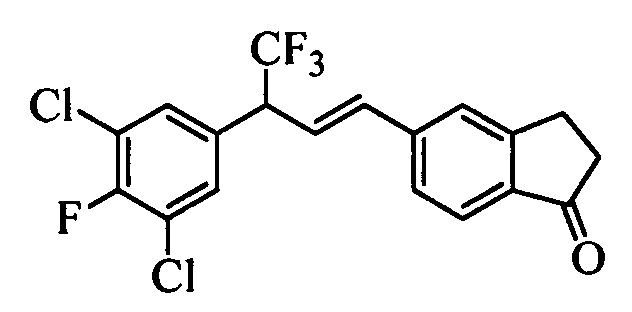
Продукт выделяли в виде коричневого полужидкого вещества (1,2 г, 16%):1H ЯМР (400 МГц, CDCl3) δ 7,76 (д, J=7,4 Гц, 1Н), 7,54 (м, 3Н), 7,30 (с, 1Н), 6,68 (д, J=7,4 Гц, 1Н), 6,52 (м, 1Н), 4,18 (м, 1Н), 3,18 (м, 2Н), 2,75 (м, 2Н); ИЭРМС m/z 400,84 ([М-Н]-); ИК (тонкая пленка) 815, 1113, 1709 см-1.
(E)-6-(4,4,4-Трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-3,4-дигидронафталин-1(2H)-он (BI5)
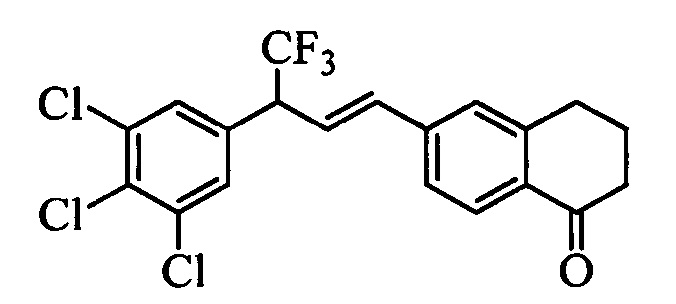
Продукт выделяли в виде бледно-желтого полужидкого вещества (1,2 г, 30%):1H ЯМР (400 МГц, CDCl3) δ 8,20 (д, J=8,0 Гц, 1Н), 7,42 (с, 2Н), 7,35 (м, 1Н), 7,24 (м, 2Н), 6,62 (д, J=16 Гц, 1Н), 6,46 (м, 1Н), 4,18 (м, 1Н), 2,95 (м, 2Н), 2,65 (м, 2Н), 2,19 (м, 2Н); ИЭРМС m/z 432,94 ([М-Н]-); ИК (тонкая пленка) 1680, 1113, 808 см-1.
Пример 22: Получение (Е)-5-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-фтор-2,3-дигидро-1H-инден-1-она (BI6)

При перемешивании к раствору (Е)-5-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-2,3-дигидро-1H-инден-1-она (0,5 г, 1,24 ммоля) в ацетонитриле (20 мл), добавляли Selectfluor® (0,52 г, 1,48 ммоля) и реакционную смесь кипятили с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, концентрировали при пониженном давлении и разбавляли с помощью CH2Cl2. Раствор промывали водой и рассолом, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, и получали неочищенный продукт, который очищали с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; 15% EtOAc в петролейном эфире) и получали искомое соединение в виде бледно-желтого полужидкого вещества (0,1 г, 24%):1H ЯМР (400 МГц, CDCl3) δ 7,80 (м, 1Н), 7,48 (м, 2Н), 7,32 (м, 2Н), 6,65 (д, J=16,0 Гц, 1Н), 6,54 (дд, J=16,0, 8,0 Гц, 1Н), 5,38 (м, 1Н), 4,18 (м, 1Н), 3,62 (м, 1Н), 3,32 (м, 1Н); ИЭРМС m/z 419,06 ([М-Н]-); ИК (тонкая пленка) 1728, 1114, 817 см-1.
Пример 23: Получение (Е)-5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-N-(3,3,3-трифторпропил)-2,3-дигидро-1Н-инден-1-амина (ВС10)

При перемешивании при охлаждении к раствору (Е)-5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-2,3-дигидро-1H-инден-1-она (0,15 г, 0,35 ммоля) в ДХЭ (10 мл), добавляли трифторпропиламин (0,048 г, 0,42 ммоля) и цианоборогидрид натрия (0,055 г, 0,875 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли с помощью ДХЭ, промывали водой и рассолом и сушили над безводным сульфатом натрия. Концентрированно при пониженном давлении давала неочищенное соединение, которое очищали с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; 10-15% EtOAc в петролейном эфире) и получали искомое соединение в виде бесцветного смолообразного вещества (0,042 г, 24%):1H ЯМР (400 МГц, CDCl3) δ 7,38-7,20 (м, 5Н), 6,62 (д, J=16,0 Гц, 1Н), 6,34 (дд, J=16,0, 8,0 Гц, 1Н), 5,83 (шир., 1Н), 5,52 (м, 1Н), 4,12 (м, 1Н), 3,02 (м, 3Н), 2,82 (м, 1Н), 2,50 (м, 2Н), 1,82 (м, 1Н), 1,42 (м, 1Н); ИЭРМС m/z 497,98 ([М-Н]-); ИК (тонкая пленка) 3027, 1654, 815 см-1.
Пример 24: Получение оксима 6-((E)-4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-3,4-дигидронафталин-1(2H)-она (BI5a)
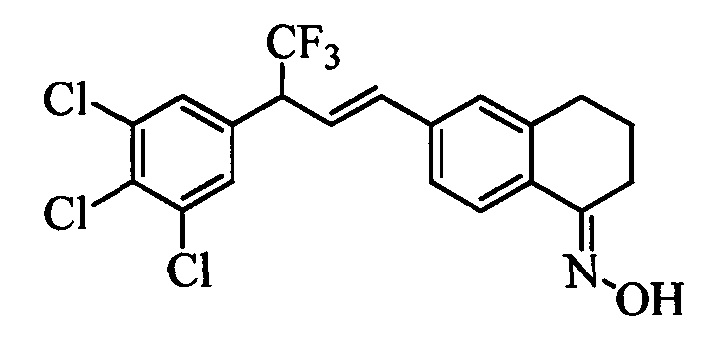
При перемешивании к раствору ((E)-6-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-3,4-дигидронафталин-1(2H)-она (0,4 г, 0,92 ммоля) в EtOH (50 мл) добавляли гидроксиламингидрохлорид (0,128 г, 1,85 ммоля) и ацетат натрия (0,23 г, 2,77 ммоля) и реакционную смесь кипятили с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении и остаток разбавляли с помощью Н2О и экстрагировали с помощью EtOAc. Объединенные органические экстракты промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение, которое очищали с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; 10-15% EtOAc в петролейном эфире). Искомое соединение выделяли в виде твердого вещества (0,3 г, 73%): температура плавления 155-158°С;1H ЯМР (400 МГц, CDCl3) δ 7,89 (д, J=8,4 Гц, 1Н), 7,41 (с, 2Н), 7,24 (м, 1Н), 7,17 (м, 1Н), 6,57 (д, J=16 Гц, 1Н), 6,46 (дд, J=16,0, 8,0 Гц, 1Н), 4,13 (м, 1Н), 2,82 (м, 4Н), 2,04 (м, 2Н); ИЭРМС m/z 445,95 ([М-Н]-).
Пример 25: Получение (Е)-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2,3-дигидро-1H-инден-1-амина (BI5b)
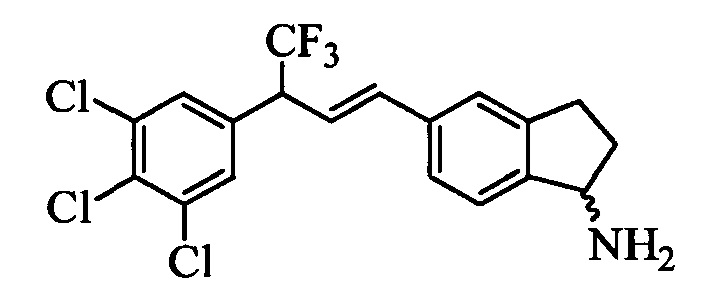
При перемешивании к раствору (E)-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2,3-дигидро-1H-инден-1-она (1 г, 2,39 ммоля) в МеОН (10 мл) добавляли ацетат аммония (1,84 г, 23,9 ммоля) и цианоборогидрид натрия (NaCNBH3; 0,44 г, 7,17 ммоля) и реакционную смесь кипятили с обратным холодильником в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и остаток разбавляли с помощью Н2О и экстрагировали с помощью EtOAc. Объединенные органические экстракты промывали с помощью H2O и насыщенным водным раствором бикарбоната натрия (насыщенным водным раствором NaHCO3), сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде жидкости (500 мг, неочищенная):1H ЯМР (400 МГц, ДМСО-d6) δ 7,85 (с, 2Н), 7,40 (с, 1Н), 7,30 (с, 2Н), 6,71 (с, 2Н), 4,78 (м, 1Н), 4,2 (м, 1Н), 2,80 (м, 1Н), 2,73 (м, 1Н), 1,60 (м, 2Н); ИЭРМС m/z 419,02 ([М+Н]+); ИК (тонкая пленка) 2924, 1552, 1112, 807 см-1.
Указанное ниже соединение получали по методикам, раскрытым в примере 25.
(Е)-5-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-2,3-дигидро-1H-инден-1-амин (BI7)

Продукт выделяли в виде светло-коричневого смолообразного вещества, которое использовали на следующей стадии без обработки (0,15 г, неочищенное соединение): ИЭРМС m/z 401,97 ([М-Н]-).
(Е)-5-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-фтор-2,3-дигидро-1Н-инден-1-амин (BI8)

Продукт выделяли в виде светло-коричневого смолообразного вещества, которое использовали на следующей стадии без обработки (0,15 г, неочищенное соединение): ИЭРМС m/z 420,15 ([М-Н]-).
(E)-6-(4,4,4-Трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-1,2,3,4-тетрагидронафталин-1-амин (BI9)

Продукт выделяли в виде бледно-желтой жидкости (500 мг, неочищенная).
Пример 26: Получение (Е)-1-метил-3-(5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)-бут-1-енил)-2,3-дигидро-1H-инден-1-ил)тиомочевины (ВС1)

При перемешивании к раствору (Е)-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2,3-дигидро-1H-инден-1-амина (0,1 г, 0,23 ммоля) в Et2O (5 мл) добавляли метилизотиоцианат (0,026 г, 0,35 ммоля) и смесь перемешивали в течение 2 ч при 25°С. Реакционную смесь концентрировали при пониженном давлении и остаток очищали с помощью колоночной флэш-хроматографии (SiO2, 20% EtOAc в петролейном эфире). Искомое соединение выделяли в виде жидкости (65 мг, 50%):1H ЯМР (400 МГц, CDCl3) δ 7,39 (с, 2Н), 7,25-7,18 (м, 3Н), 6,58 (д, J=16,0 Гц, 1Н), 6,30 (дд, J=16,0, 8,4 Гц, 1Н), 5,91-5,70 (шир., 2Н), 4,05 (м, 1Н), 3,05-2,80 (м, 6Н), 2,70 (м, 1Н), 1,81 (м, 1Н); ИЭРМС m/z 492,17 ([М+Н]+); ИК (тонкая пленка) 3211, 1569, 1113, 806 см-1.
Соединения ВС2-ВС3, указанные в таблице 1, получали по методикам, раскрытым в примере 26.
Пример 27: Получение (Е)-3,3,3-трифтор-N-(5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2,3-дигидро-1H-инден-1-ил)пропанамида (ВС4)
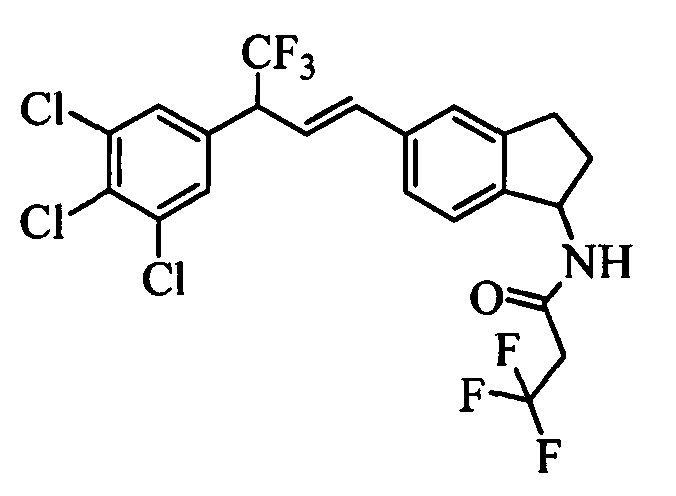
При перемешивании к раствору (Е)-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2,3-дигидро-1H-инден-1-амина (0,1 г, 0,23 ммоля) в CH2Cl2 (10 мл) добавляли трифторпропионовую кислоту (0,044 г, 0,34 ммоля), EDC⋅HCl (0,038 г, 0,35 ммоля), HOBt⋅H2O (0,07 г, 0,46 ммоля) и ДИПЭА (0,074 г, 0,57 ммоля) и реакционную смесь перемешивали в течение 16 ч при 25°С. Реакционную смесь разбавляли с помощью CH2Cl2 и промывали с помощью H2O. Объединенный органический слой промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенное вещество очищали с помощью колоночной флэш-хроматографии (SiO2, 15% EtOAc в петролейном эфире) и получали искомое соединение в виде жидкости (65 мг, 65%):1H ЯМР (400 МГц, CDCl3) δ 7,39 (с, 2Н), 7,25-7,20 (м, 3Н), 6,34 (д, J=16,0 Гц, 1Н), 6,30 (дд, J=16,0, 8,0 Гц, 1Н), 5,81 (шир., 1Н), 5,48 (м, 1Н), 4,10 (м, 1Н), 3,10 (м, 2Н), 2,86-3,07 (м, 2Н), 2,86 (м, 1Н), 1,81 (м, 1Н); ИЭРМС m/z 529,02 ([М+Н]+); ИК (тонкая пленка) 3283, 1652, 1241, 811 см-1.
Соединения ВС5-ВС9, ВС11, указанные в таблице 1, получали по методикам, раскрытым в примере 27.
Пример 28: Получение трет-бутил-5-винилиндолин-1-карбоксилата (BI10)
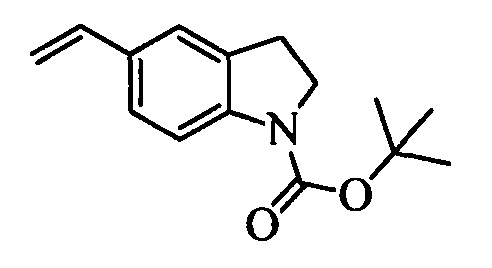
Стадия 1. 5-Броминдолин (BIll): К 5-бром-1Н-индолу (2,5 г, 12,82 ммоля) в уксусной кислоте (10,0 мл) при 10°С в течение 20 мин порциями добавляли NaCNBH3 (2,38 г, 38,46 ммоля). Затем реакционную смесь перемешивали при температуре окружающей среды в течение 3 ч. Реакционную смесь разбавляли водой и экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным раствором NaHCO3, водой и рассолом. Объединенный эфирный слой сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде бледно-желтого полужидкого вещества (1,8 г, 71%).
Стадия 2. трет-Бутил-5-броминдолин-1-карбоксилат (BI12):
При перемешивании к раствору 5-броминдолина (3,0 г, 15 ммоля) в ацетонитриле (100 мл) добавляли ДМАП (0,185 г, 1,522 ммоля) и ди-трет-бутилдикарбонат (3,98 г, 18,3 ммоля) и реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении, и получали остаток, который разбавляли диэтиловым эфиром и промывали водой и рассолом (2×). Объединенный эфирный слой сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенный продукт в виде почти белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки (3,0 г).
Стадия 3. трет-Бутил-5-винилиндолин-1-карбоксилат (BI10):
При перемешивании раствор трет-бутил-5-броминдолин-1-карбоксилата (2,0 г, 6,73 ммоля), винилтрифторбората калия (2,6 г, 20,20 ммоля) и K2CO3 (2,78 г, 20,2 ммоля) в ДМСО (50,0 мл) дегазировали аргоном в течение 20 мин при температуре окружающей среды. При температуре окружающей среды добавляли PdCl2(dppf) (0,49 г, 0,67 ммоля), затем реакционную смесь нагревали при 100°С в течение 3 ч. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали через слой целита в вакууме, и промывали диэтиловым эфиром. Реакционную смесь экстрагировали диэтиловым эфиром. Объединенный содержащий диэтиловый эфир слой сушили над Na2SO4 и концентрировали при пониженном давлении, и получали неочищенный продукт. Неочищенное соединение очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; при элюировании смесью 2% этилацетат/петролейный эфир) и получали искомое соединение в виде почти белого твердого вещества (1,2 г, 73%): Температура плавления 85,5-88,6°С;1H ЯМР (400 МГц, CDCl3) δ 7,23 (м, 3Н), 6,69 (дд, J=17,4, 10,8 Гц, 1Н), 5,64 (д, J=10,5 Гц, 1Н), 5,13 (д, J=10,5 Гц, 1Н), 4,00 (т, J=9,0 Гц, 2Н), 3,10 (т, J=9,0 Гц, 2Н), 1,55 (шир.с, 9Н).
Пример 29: Получение (Е)-трет-бутил-5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)индолин-1-карбоксилата (BI13)

При перемешивании к раствору трет-бутил-5-винилиндолин-1-карбоксилата (1,28 г, 5,23 ммоля) в 1,2-дихлорбензоле (10,0 мл) добавляли 5-(1-бром-2,2,2-трифторэтил)-1,3-дихлор-2-фторбензол (3,4 г, 10 ммоля), CuCl (103 мг, 1,05 ммоля) и 2,2-бипиридил (0,326 г, 2,092 ммоля) и полученную реакционную смесь дегазировали аргоном в течение 30 мин, и нагревали при 150°С в течение 1 ч. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали, и фильтрат концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; 2% этилацетат/петролейный эфир) и получали искомое соединение в виде бледно-желтого смолообразного вещества (0,3 г, 61%):1H ЯМР (400 МГц, CDCl3) δ 7,34 (д, J=6,0 Гц, 2Н), 7,22 (с, 2Н), 7,16 (д, J=8,4 Гц, 1Н), 6,52 (д, J=16,0 Гц, 1Н), 6,21 (дд, J=16,0, 7,6 Гц, 1Н), 4,07 (м, 3Н), 3,10 (т, J=8,4 Гц, 2Н), 1,55 (с, 9Н); ИЭРМС m/z 433,79 ([М-Н]-); ИК (тонкая пленка) 1168, 858 см-1.
Пример 30: Получение (Е)-5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)индолин-1-амин (BI14)
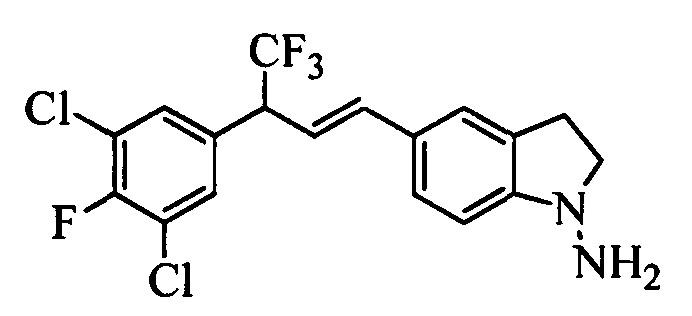
Стадия 1. (Е)-5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)индолин (BI15): При перемешивании к раствору (Е)-трет-бутил-5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)индолин-1-карбоксилата (0,2 г, 0,4 ммоля) в CH2Cl2 (10,0 мл) добавляли ТФК (0,6 мл) и реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч. Реакционную смесь разбавляли с помощью CH2Cl2, промывали насыщенным водным раствором NaHCO3, водой и рассолом. Отделенный слой, содержащий CH2Cl2, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенный продукт в виде светло-коричневого смолообразного вещества, которое использовали на следующей стадии без дополнительной очистки (0,12 г):1H ЯМР (400 МГц, CDCl3) δ 7,33 (д, J=6,4 Гц, 2Н), 7,21 (с, 1Н), 7,02 (д, J=8,0 Гц, 1Н), 6,57 (д, J=8,4 Гц, 1Н), 6,49 (д, J=15,6 Гц, 1Н), 6,21 (дд, J=15,6, 8,4 Гц, 1Н), 4,07 (м, 1Н), 3,61 (т, J=8,4 Гц, 2Н), 3,05 (т, J=8,4 Гц, 2Н); ИЭРМС m/z 389,89 ([М+Н]+); ИК (тонкая пленка) 3385, 1112, 816 см-1.
Стадия 2. 5-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-!-енил)-1-нитрозоиндолин (BI16): К (Е)-5-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)индолину (0,2 г, 0,5 ммоля) в концентрированной HCl (5,0 мл) при 5°С медленно добавляли раствор NaNO2 в воде и реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч. Реакционную смесь разбавляли с помощью CH2Cl2 и слой, содержащий CH2Cl2, промывали водой и рассолом. Отделенный слой, содержащий CH2Cl2, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенный продукт в виде бледно-желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки (0,2 г):1H ЯМР (400 МГц, CDCl3) δ 7,33 (д, J=8,4 Гц, 1Н), 7,39 (м, 4Н), 6,61 (д, J=16,0 Гц, 1Н), 6,35 (дд, J=16,0, 8,4 Гц, 1Н), 4,07 (м, 3Н), 3,23 (т, J=8,4 Гц, 2Н); ИЭРМС m/z 418,82 ([М+Н]+); ИК (тонкая пленка) 1488, 1112, 860 см-1.
Стадия 3. (E)-5-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)индолин-1-амин (BI14): К (Е)-5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-1-нитрозоиндолину (0,1 г, 0,2 ммоля) в МеОН (10,0 мл) добавляли порошкообразный цинк (77,5 мг) и NH4Cl (36,9 мг, 0,69 ммоля) в воде (2,0 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 ч. Реакционную смесь разбавляли с помощью CH2Cl2 и слой, содержащий CH2Cl2, промывали водой и рассолом. Отделенный слой, содержащий CH2Cl2, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение, которое очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; при элюировании смесью 2% этилацетат/петролейный эфир) и получали искомое соединение в виде светло-коричневого смолообразного вещества (0,08 г): ИЭРМС m/z 404,86 ([М+Н]+).
Пример 31: Получение (E)-N-(5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)индолин-1-ил)-3,3,3-трифторпропанамида (ВС12)
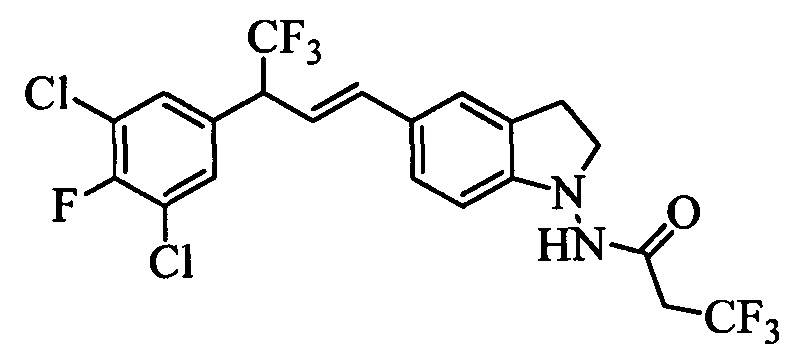
При перемешивании к раствору (Е)-5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)индолин-1-амина (0,1 г, 0,247 ммоля) в CH2Cl2 (10,0 мл) добавляли 3,3,3-трифторпропановую кислоту (0,038 г, 0,297 ммоля), PyBOP (0,192 г, 0,370 ммоля) и ДИПЭА (0,047 г, 0,370 ммоля) и реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Реакционную смесь разбавляли с помощью CH2Cl2 и отделенный слой, содержащий CH2Cl2, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение. Неочищенное соединение очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; 20-25% этилацетат/петролейный эфир) и получали искомое соединение в виде светло-коричневого смолообразного вещества (0,12 г, 33%):1H ЯМР (400 МГц, CDCl3) δ 7,32, (д, J=6,0 Гц, 2Н) 7,28 (м, 1Н), 7,20 (д, J=8,0, 1H), 7,14 (д, J=8,8, 1H), 6,70 (д, J=8,0 Гц, 1H), 6,60 (м, 2Н), 4,15 (м, 1H), 3,85 (м, 1H), 3,65 (м, 1H), 3,46 (м, 2Н), 3,19 (м, 2Н); ИЭРМС m/z 514,86 ([М+Н]+); ИК (тонкая пленка) 3428, 1112, 857 см-1.
Пример 32: Получение трет-бутил-5-винил-1H-индол-1-карбоксилата (BI17)
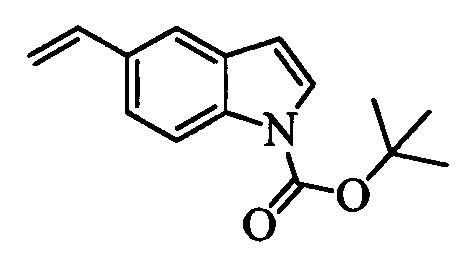
Стадия 1. 5-Винил-1H-индол (BI18): Смесь 5-бром-1H-индола (2,5 г, 12,82 ммоля), винилтрифторбората калия (2,57 г, 19,2 ммоля), Cs2CO3 (12,53 г, 38,46 ммоля) и трифенилфосфина (201 мг, 0,769 ммоля) в смеси ТГФ/вода (9:1, 75 мл) дегазировали аргоном в течение 20 мин, затем добавляли PdCl2 (45,3 мг, 0,256 ммоля). Реакционную смесь кипятили с обратным холодильником в течение 16 ч, затем охлаждали до температуры окружающей среды, фильтровали через слой целита и промывали этилацетатом. Фильтрат повторно экстрагировали этилацетатом и объединенный органический слой промывали водой и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение. Неочищенное соединение очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; 2% этилацетат/петролейный эфир) и получали искомое соединение в виде светло-коричневого смолообразного вещества (1,5 г, 83%):1H ЯМР (400 МГц, CDCl3) δ 8,20 (шир., 1Н), 7,68 (с, 1Н), 7,45 (с, 2Н), 7,21 (м, 1Н), 6,90 (дд, J=16,0, 10,8 Гц, 1Н), 6,55 (м, 1Н), 5,75 (д, J=10,5 Гц, 1Н), 5,21 (д, J=10,5 Гц, 1Н); ИЭРМС m/z 142,05 ([М-Н]-).
Стадия 2. трет-Бутил-5-винил-1H-индол-1-карбоксилат (ВI17):
При перемешивании к раствору 5-винил-1H-индола (0,7 г, 4,89 ммоля) в ацетонитриле (20 мл) добавляли ДМАП (59,65 мг, 0,489 ммоля) и ди-трет-бутилдикарбонат (1,38 г, 6,36 ммоля) и реакционную смесь перемешивали при температуре окружающей среды в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении, и получали остаток, который разбавляли с помощью CH2Cl2 и промывали водой и рассолом. Объединенный слой, содержащий CH2Cl2, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение. Неочищенное соединение очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; 2% этилацетат/петролейный эфир) и получали искомое соединение в виде почти белого полужидкого вещества (0,7 г, 59%):1H ЯМР (400 МГц, CDCl3) δ 8,15 (д, J=8,0 Гц, 1H), 7,60 (с, 2Н), 7,30 (д, J=8,4 Гц, 1Н), 7,21 (м, 1Н), 6,90 (дд, J=16,0, 10,8 Гц, 1Н), 6,59 (с, 1Н), 5,75 (д, J=10,5 Гц, 1Н), 5,21 (д, J=10,5 Гц, 1Н), 1,65 (с, 9Н); ИЭРМС m/z 242,10 ([М-Н]-); ИК (тонкая пленка) 1630 см-1.
Пример 33: Получение (E)-трет-бутил-5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-1H-индол-1-карбоксилата (BI19)

При перемешивании к раствору трет-бутил-5-винил-1H-индол-1-карбоксилата (0,65 г, 2,67 ммоля), в 1,2-дихлорбензоле (10,0 мл) добавляли 5-(1-бром-2,2,2-трифторэтил)-1,3-дихлор-2-фторбензол (1,74 г, 5,37 ммоля), CuCl (53 мг, 0,537 ммоля) и 2,2-бипиридил (167 мг, 1,07 ммоля). Полученную реакционную смесь дегазировали аргоном в течение 30 мин и нагревали при 150°С в течение 2 ч. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали и фильтрат концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; 2% этилацетат/петролейный эфир) и получали искомое соединение в виде светло-коричневого смолообразного вещества (0,25 г, 10%):1H ЯМР (400 МГц, CDCl3) δ 8,20 (д, J=8,0 Гц, 1Н), 7,60 (м, 2Н), 7,39 (м, 3Н), 6,69 (д, J=16,0 Гц, 1Н), 6,55 (д, J=10,5 Гц, 1Н), 6,36 (дд, J=16,0, 8,0 Гц, 1Н), 4,10 (м, 1Н), 1,65 (с, 9Н); ИЭРМС m/z 485,91 ([М-Н]-); ИК (тонкая пленка) 1165, 854 см-1.
Пример 34: Получение (Е)-5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-1H-индола (BI20)

При перемешивании к раствору (E)-трет-бутил-5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-1H-индол-1-карбоксилата (0,2 г, 0,40 ммоля) в CH2Cl2 (10,0 мл) добавляли ТФК (70 мг, 0,61 ммоля) и реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч. Реакционную смесь разбавляли с помощью CH2Cl2 и промывали насыщенным раствором NaHCO3, водой и рассолом. Отделенный слой, содержащий CH2Cl2, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде светло-коричневого твердого вещества (0,2 г, 97%): температура плавления 132,9-138,8°С;1H ЯМР (400 МГц, CDCl3) δ 11,19 (шир., 1Н), 8,20 (д, J=8,0 Гц, 1Н), 7,60 (м, 2Н), 7,39 (м, 3Н), 6,69 (д, J=16,0 Гц, 1Н), 6,55 (д, J=10,5 Гц, 1Н), 6,36 (дд, J=16,0, 8,0 Гц, 1Н), 4,82 (м, 1Н); ИЭРМС m/z 387,98 ([М+Н]+).
Пример 35: Получение 4-нитрофенил 2-((трет-бутоксикарбонил)амино)ацетата (BI21)
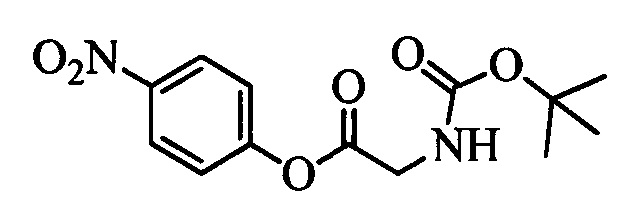
При перемешивании к раствору 4-нитрофенола (1,0 г, 7,19 ммоля) в CH2Cl2 (20,0 мл) добавляли N-Boc-глицин (1,38 г, 7,91 ммоля) и EDC.HCl (2,05 г, 10,785 ммоля) и реакционную смесь перемешивали при температуре окружающей среды в течение 24 ч. Реакционную смесь разбавляли с помощью CH2Cl2 и промывали водой и насыщенным рассолом. Отделенный слой, содержащий CH2Cl2, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде светло-коричневого смолообразного вещества, которое использовали на следующей стадии без дополнительной очистки (1,1 г):1H ЯМР (400 МГц, CDCl3) δ 8,29 (д, J=9,2 Гц, 2Н), 7,33 (д, J=8,8 Гц, 2Н), 5,07 (шир., 1Н), 4,20 (с, 2Н), 1,47 (с, 9Н); ИЭРМС m/z 296,27 ([М+Н]+).
Пример 36: Получение (E)-трет-бутил-(2-(5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-1H-индол-1-ил)-2-оксоэтил)карбамата (BI22)
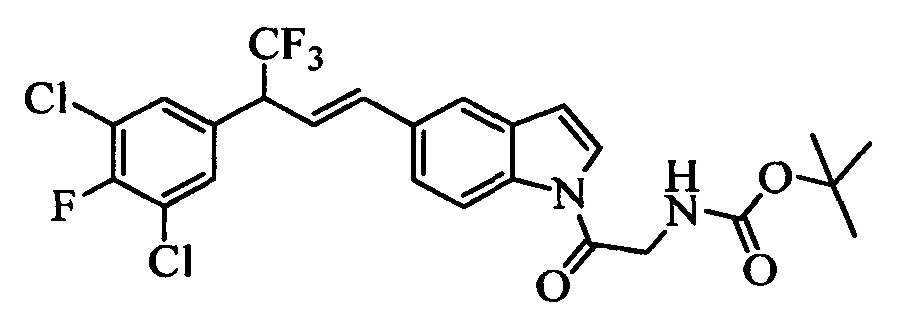
При перемешивании к раствору (Е)-5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-1H-индола (0,1 г, 0,258 ммоля) в ацетонитриле (5,0 мл) добавляли 4-нитрофенил-2-(трет-бутоксикарбониламино)ацетат (0,114 г, 0,387 ммоля), фторид калия (0,03 г, 0,516 ммоля), 18-краун-6-эфир (0,075 г, 0,283 ммоля) и ДИПЭА (0,0332 г, 0,258 ммоля) и реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь концентрировали и получали остаток, который разбавляли с помощью CH2Cl2 и промывали водой и рассолом. Отделенный слой, содержащий CH2Cl2, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное искомое соединение в виде светло-коричневого смолообразного вещества, которое использовали на следующей стадии без дополнительной очистки (0,1 г): ИЭРМС m/z 545,23 ([М+Н]+).
Пример 37: Получение (Е)-N-(2-(5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-1H-индол-1-ил)-2-оксоэтил)-3,3,3-трифторпропанамида (ВС13)
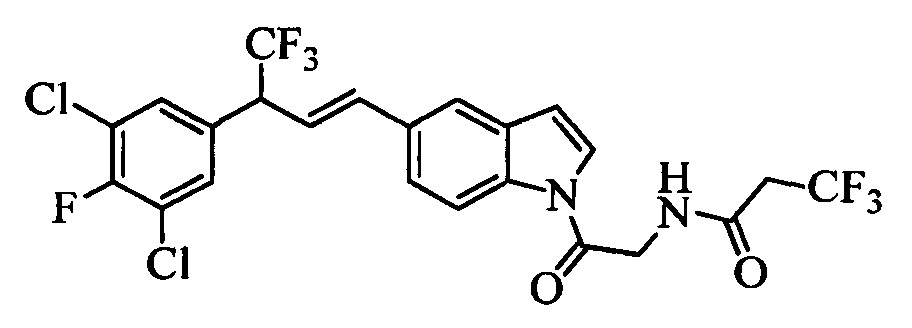
Стадия 1. (E)-2-Амино-1-(5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-1H-индол-1-ил)этанон (BI23): При перемешивании к раствору (E)-трет-бутил-2-(5-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-1H-индол-1-ил)-2-оксоэтилкарбамата (0,05 г, 0,09 ммоля) в CH2Cl2 (5,0 мл) добавляли ТФК (0,01 мл) и реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь разбавляли с помощью CH2Cl2 и промывали насыщенным раствором NaHCO3, водой и рассолом. Отделенный слой, содержащий CH2Cl2, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное искомое соединение, которое использовали на следующей стадии без дополнительной очистки (50 мг).
Стадия 2. (Е)-N-(2-(5-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-1H-индол-1-ил)-2-оксоэтил)-3,3,3-трифторпропанамид (ВС13): При перемешивании к раствору (Е)-2-амино-1-(5-(3-(3,5-Дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-1H-индол-1-ил)этанона (0,04 г, 0,09 ммоля) в CH2Cl2 (5,0 мл) добавляли 3,3,3-трифторпропановую кислоту (17,5 мг, 0,136 ммоля), PyBOP (70 мг, 0,135 ммоля) и ДИПЭД (29 мг, 0,225 ммоля) и реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь разбавляли с помощью CH2Cl2 и слой, содержащий CH2Cl2, промывали водой и насыщенным рассолом. Отделенный слой, содержащий CH2Cl2, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение, которое очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; 10% этилацетат/петролейный эфир) и получали искомое соединение в виде почти белого твердого вещества (30 мг, 60%): температура плавления 121-126°С;1H ЯМР (400 МГц, CDCl3) δ 8,33 (шир., 1Н), 7,59 (с, 1Н), 7,45 (м, 4Н), 6,72 (д, J=3,6 Гц, 3Н), 6,39 (м, 1Н), 4,71 (т, J=7,2 Гц, 2Н), 4,15 (м, 1Н), 3,51 (м, 1Н), 3,28 (м, 1Н); ИЭРМС m/z 553,06 ([М-Н]-).
Пример 38: Получение этил-2-(1-оксо-6-винилфталазин-2(1H)-ил)ацетата (BI24)
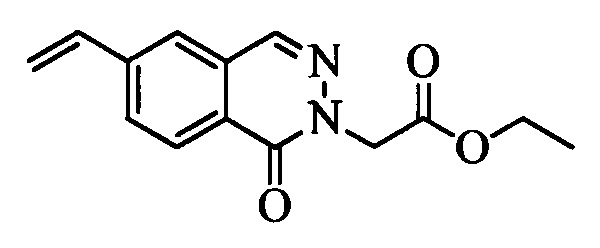
Стадия 1. 5-Бром-3-гидроксиизоиндолин-1-он (BI25): Смесь порошкообразного Zn (1,73 г, 26,154 ммоля), пентагидрата сульфата меди(II) (0,02 г, 0,08 ммоля) и 2М водного раствора NaOH (27 мл) охлаждали до 0°С. При такой же температуре в течение 30 мин добавляли 5-бромизоиндолин-1,3-дион (5 г, 22 ммоля). Реакционную смесь перемешивали при 0°С в течение 30 мин и в течение 3 ч при температуре окружающей среды. Реакционную смесь фильтровали и фильтрат нейтрализовывали концентрированной HCl. Реакционную смесь разбавляли этанолом и экстрагировали этилацетатом. Объединенный этилацетатный слой сушили над Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное искомое соединение в виде коричневого твердого вещества, которое использовали на следующей стадии без дополнительной очистки (1,3 г): температура плавления 258-261°С;1H ЯМР (400 МГц, ДМСО-d6) δ 9,03 (шир., 1Н), 7,81 (м, 2Н), 7,69 (м, 1Н), 6,44 (м, 1Н), 5,88 (д, J=9,3 Гц, 1Н); ИЭРМС m/z 225,83 ([М-Н]-); ИК (тонкая пленка) 1684, 3246, 606 см-1.
Стадия 2. 6-Бромфталазин-1(2H)-он (BI26): При перемешивании к раствору 5-бром-3-гидроксиизоиндолин-1-она (1,0 г, 4,40 ммоля) в воде, добавляли гидразингидрат (0,45 г, 8,80 ммоля) и нагревали при 95°С в течение 5 ч. Реакционную смесь охлаждали до температуры окружающей среды, фильтровали и промывали диэтиловым эфиром и пентаном (1:1) и получали искомое соединение в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки (0,5 г): ИЭРМС m/z 225,15 ([М+Н]+).
Стадия 3. 6-Винилфталазин-1(2H)-он (BI27): Раствор 6-бромфталазин-1(2H)-она (0,25 г, 1,11 ммоля), винилтрифторбората калия (0,446 г, 3,33 ммоля) и K2CO3 (0,46 г, 3,33 ммоля) в ДМСО (2 мл) дегазировали аргоном в течение 20 мин при температуре окружающей среды. При температуре окружающей среды добавляли PdCl2(dppf) (0,04 г, 0,055 ммоля) и реакционную смесь нагревали при 80°С в течение 2 ч. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали через слой целита в вакууме, и промывали этилацетатом. Реакционную смесь экстрагировали этилацетатом и объединенный этилацетатный слой сушили над Na2SO4 и концентрировали при пониженном давлении, и получали неочищенный продукт. Неочищенное соединение очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; 50% этилацетат/петролейный эфир) и получали искомое соединение в виде коричневого твердого вещества (0,12 г, 63%):1H ЯМР (400 МГц, ДМСО-d6) δ 13,61 (шир., 1Н), 8,33 (м, 1Н), 8,19 (м, 1Н), 8,01 (м, 2Н), 6,97 (м, 1Н), 6,15 (м, 1Н), 5,56 (д, J=10,8 Гц, 1Н); ИЭРМС m/z 172,93 ([M+H]+); ИК (тонкая пленка) 1748, 1655, 3241 см-1.
Стадия 4. Этил-2-(1-оксо-6-винилфталазин-2(1Н)-илацетат (BI24): При перемешивании к раствору 6-винилфталазин-1(2H)-она (0,5 г, 2,90 ммоля) в ДМФ (5,0 мл) добавляли Cs2CO3 (0,94 г, 2,90 ммоля) и реакционную смесь перемешивали в течение 10 мин. К реакционной смеси при температуре окружающей среды добавляли этилбромацетат (0,48 г, 2,90 ммоля) и реакционную смесь перемешивали в течение 8 ч при температуре окружающей среды. Реакционную смесь разбавляли и экстрагировали этилацетатом и слой, содержащий этилацетат, промывали водой и рассолом (2×). Отделенный слой, содержащий этилацетат, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенный продукт. Неочищенное соединение очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; 25% этилацетат/петролейный эфир) и получали искомое соединение в виде коричневого твердого вещества (0,34 г, 45%):1H ЯМР (400 МГц, ДМСО-d6) δ 8,45 (м, 1Н), 8,24 (м, 1Н), 8,04 (м, 2Н), 7,01 (м, 1Н), 6,17 (д, J=2,1 Гц, 1Н), 5,56 (д, J=10,8 Гц, 1Н), 4,92 (с, 2Н), 4,19 (м, 2Н), 1,23 (м, 3Н). ИЭРМС m/z 259,10 ([M+H]+); ИК (тонкая пленка) 1750, 1660 см-1.
Пример 39: Получение (Е)-этил-2-(6-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-1-оксофталазин-2(1Н)-ил)ацетата (BI28)
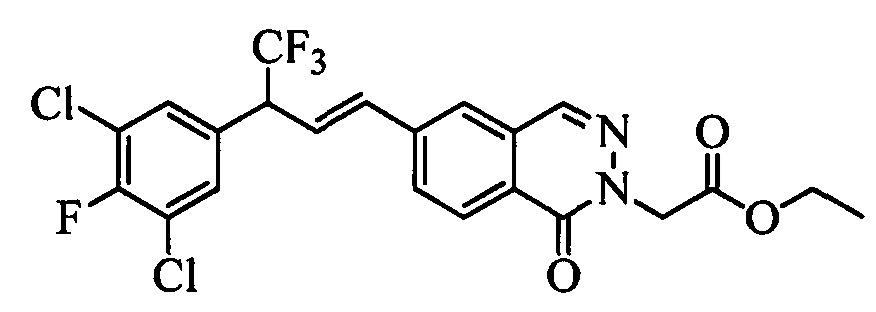
При перемешивании к раствору этил-2-(1-оксо-6-винилфталазин-2(1H)-илацетата (0,07 г, 0,27 ммоля) в 1,2-дихлорбензоле (1,0 мл) добавляли 5-(1-бром-2,2,2-трифторэтил)-1,3-дихлор-2-фторбензол (0,17 г, 0,54 ммоля), CuCl (0,005 г, 0,05 ммоля) и 2,2-бипиридил (0,016 г, 0,10 ммоля) и полученную реакционную смесь дегазировали аргоном в течение 30 мин и нагревали при 180°С в течение 12 ч. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали и фильтрат концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; 10-15% этилацетат/петролейный эфир) и получали искомое соединение в виде коричневого твердого вещества (40 мг, 29%):1H ЯМР (400 МГц, ДМСО-d6) δ 8,40 (д, J=8,4 Гц, 1Н), 7,84 (д, J=1,5 Гц, 1Н), 7,65 (с, 1Н), 7,37 (д, J=6,3 Гц, 2Н), 6,76 (д, J=16,0 Гц, 1Н), 6,59 (дд, J=16,0, 8,0 Гц, 1Н), 4,96 (с, 2Н), 4,29 (м, 3Н), 1,31 (т, J=7,2 Гц, 3Н); ИЭРМС m/z 503,0 ([М+Н]+); ИК (тонкая пленка) 1660, 1114, 817 см-1.
Пример 40: Получение (Е)-2-(6-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-1-оксофталазин-2(1H)-ил)уксусной кислоты (BI29)
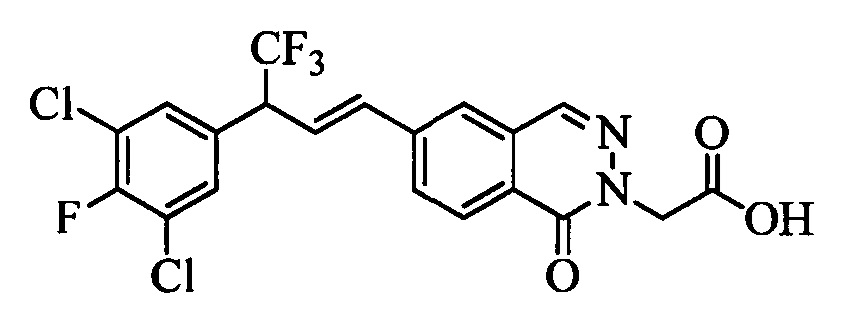
Раствор (Е)-этил-2-(6-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-1-оксофталазин-2(1H)-ил)ацетата (0,04 г, 0,07 ммоля) в HCl (0,5 мл) и уксусной кислоте (0,5 мл) нагревали при 100°С в течение 3 ч. Растворитель удаляли при пониженном давлении и остаток разбавляли водой. Водный слой экстрагировали этилацетатом и отделенный слой, содержащий этилацетат, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение. Неочищенное соединение растирали со смесью диэтиловый эфир-пентан и получали искомое соединение в виде коричневого твердого вещества (0,03 г):1H ЯМР (400 МГц, ДМСО-d6) δ 13,0 (шир.с, 1Н), 8,43 (м, 1Н), 8,23 (д, J=8,1 Гц, 1Н), 8,14 (м, 2Н), 7,91 (м, 2Н), 7,16 (дд, J=16,0, 8,0 Гц, 1Н), 6,99 (д, J=16,0 Гц, 1Н), 4,96 (м, 3Н); ИЭРМС m/z 473,0 ([М-Н]-); ИК (тонкая пленка) 1629, 1168, 817 см-1.
Пример 41: Получение (Е)-2-(6-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)-1-оксофталазин-2(1Н)-ил)-N-(2,2,2-трифторэтил)ацетамида (ВС14)
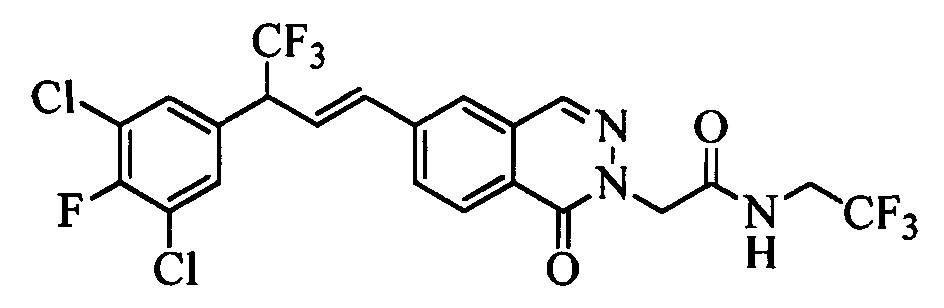
При перемешивании к раствору (E)-2-(6-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-енил)-1-оксофталазин-2(1H)-ил)уксусной кислоты (0,15 г, 0,31 ммоля) в CH2Cl2 (20,0 мл) при температуре окружающей среды добавляли 2,2,2-трифторэтанамин (0,03 г, 0,31 ммоля), PyBOP (0,17 г, 0,34 ммоля) и ДИПЭА (0,15 мл, 0,93 ммоля) и реакционную смесь перемешивали в течение 18 ч. Реакционную смесь разбавляли с помощью CH2Cl2 и промывали с помощью 3 н. HCl (2×20 мл), NaHCO3 (2×20 мл) и рассолом (2×). Отделенный слой, содержащий CH2Cl2, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение. Неочищенное соединение очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; 20-25% этилацетат/петролейный эфир) и получали искомое соединение в виде коричневого твердого вещества (0,11 г): температура плавления 172-175°С;1H ЯМР (400 МГц, CDCl3) δ 8,83 (т, J=6,6 Гц, 1Н), 8,42 (т, J=14,7 Гц, 1Н), 8,22 (д, J=8,1 Гц, 1Н), 8,13 (т, J=6,3 Гц, 1Н), 7,98-7,86 (м, 2Н), 7,16-7,07 (м, 1Н), 7,01-6,93 (м, 1Н), 4,96-4,81 (м, 3Н), 4,00-3,88 (м, 2Н); ИЭРМС m/z 554,0 ([М-Н]-).
Пример 42: Получение 2-(4-винилбензил)изоиндолин-1,3-диона (CI1)

При перемешивании к раствору 1-(хлорметил)-4-винилбензола (10 г, 66 ммоля) в ДМФ (100 мл) добавляли фталимид калия (13,3 г, 72,1 ммоля) и полученную реакционную смесь нагревали при 70°С в течение 16 ч. Реакционную смесь разбавляли с помощью H2O и экстрагировали с помощью CHCl3. Объединенный слой, содержащий CHCl3, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Перекристаллизация из МЕОН давала искомое соединение в виде почти белого твердого вещества (8 г, 46%):1H ЯМР (400 МГц, CDCl3) δ 7,83 (м, 2Н), 7,71 (м, 2Н), 7,39 (м, 4Н), 6,65 (дд, J=17,6, 10,8 Гц, 1Н), 5,72 (д, J=17,6 Гц, 1Н), 5,21 (д, J=10,8 Гц, 1Н), 4,82 (с, 2Н); ГХМС (газовая хроматография-масс-спектрометрия) m/z 263,2 ([М]+); ИК (тонкая пленка) 3420, 1133, 718 см-1.
Пример 43: Получение (Е)-2-(4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)бензил)изоиндолин-1,3-диона (CI2)
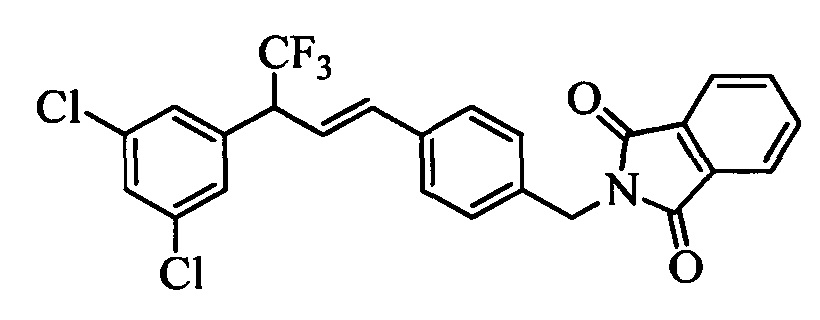
По методике примера 10 с использованием 2-(4-винилбензил)изоиндолин-1,3-диона и 1-(1-бромэтил)-3,5-дихлорбензола в качестве исходных веществ искомое соединение выделяли в виде почти белого твердого вещества (0,3 г, 40-50%): температура плавления 142-145°С;1H ЯМР (400 МГц, CDCl3) δ 7,86 (м, 2Н), 7,74 (м, 2Н), 7,42 (м, 2Н), 7,36 (м, 3Н), 7,27 (м, 2Н), 6,58 (д, J=16,0 Гц, 1Н), 6,32 (дд, J=16,0, 8,0 Гц, 1Н), 4,82 (с, 2Н), 4,05 (м, 1Н); ИЭРМС m/z 488,17 ([М-Н]-).
Указанное ниже соединение получали по методикам, раскрытым в примере 43.
(Е)-2-(4-(4,4,4-Трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)изоиндолин-1,3-дион (CI3)
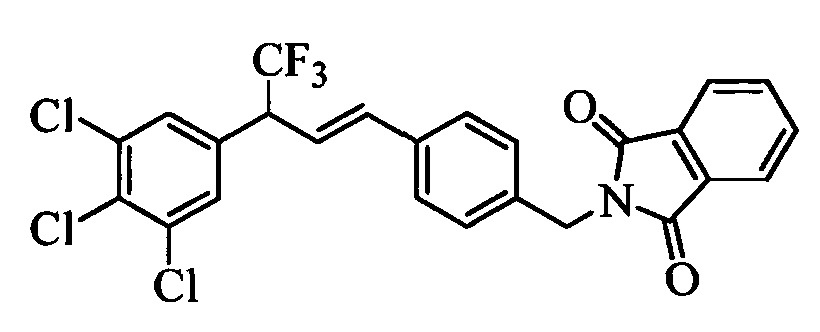
Искомое соединение выделяли в виде почти белого твердого вещества (0,3 г, 56%): температура плавления 145-146°С;1H ЯМР (400 МГц, CDCl3) δ 7,86 (м, 2Н), 7,74 (м, 2Н), 7,42-7,31 (м, 6Н), 6,58 (д, J=16,0 Гц, 1Н), 6,53 (дд, J=16,0, 8,0 Гц, 1Н), 4,82 (с, 2Н), 4,05 (м, 1Н); ИЭРМС m/z 522,2 ([М-Н]-); ИК (тонкая пленка) 1716, 1110, 712 см-1.
Возможно, соединения CI4-CI5 (таблица 1) можно было получить по методикам, раскрытым в примере 43.
Пример 44: Получение (Е)-(4-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)фенил)метанамин (CI6)
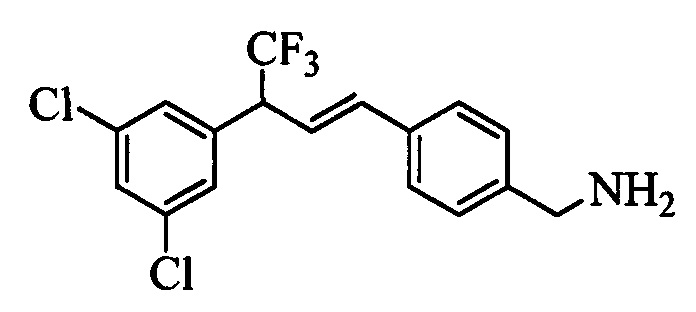
При перемешивании к раствору (Е)-2-(4-(3-(3,5-дихлорфенил)бут-1-ен-1-ил)бензил)-изоиндолин-1,3-диона (1,2 г, 2,45 ммоля) в EtOH добавляли гидразингидрат (0,61 г, 12 ммоля) и полученную реакционную смесь нагревали при 90°С в течение 1 ч. Реакционную смесь фильтровали и фильтрат концентрировали. Остаток растворяли в CH2Cl2, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное искомое соединение в виде смолообразной жидкости (0,9 г), которую использовали без дополнительной очистки.
Указанные ниже соединения получали по методикам, раскрытым в примере 44.
(Е)-(4-(4,4,4-Трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенил)метанамин (CI7)
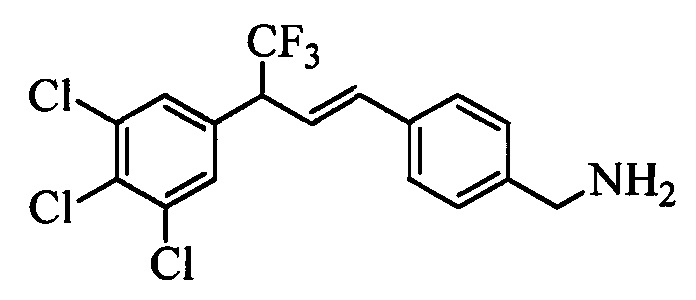
Искомое соединение выделяли и использовали без дополнительной очистки.
Возможно, соединения CI8-CI9 (таблица 1) можно было получить по методикам, раскрытым в примере 44.
Пример 45: Получение 4-(бромметил)-3-хлорбензонитрил (CI10)
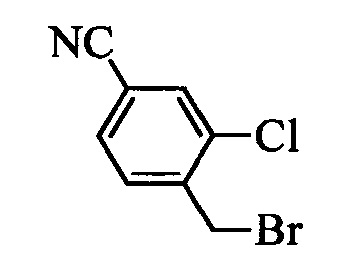
При перемешивании к раствору 3-хлор-4-метилбензонитрила (5 г, 25,4 ммоля) в тетрахлориде углерода (CCl4; 50 мл) в атмосфере аргона добавляли NBS (5,16 г, 29 ммоля) и смесь дегазировали в течение 30 мин. К ней добавляли азобисизобутиронитрил (АИБН; 0,3 г, 1,8 ммоля) и полученную реакционную смесь кипятили с обратным холодильником в течение 4 ч. Реакционную смесь охлаждали до температуры окружающей среды, промывали с помощью Н2О и экстрагировали с помощью CH2Cl2. Объединенный слой, содержащий CH2Cl2, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; 5% EtOAc в н-гексане) и получали искомое соединение в виде белого твердого вещества (4,8 г, 68%): температура плавления 87-88°С;1H ЯМР (400 МГц, CDCl3) δ 7,71 (с, 1Н), 7,59 (с, 2Н), 4,60 (с, 2Н); ИЭРМС m/z 229,77 ([М+Н]+); ИК (тонкая пленка) 2235, 752, 621 см-1.
Указанные ниже соединения получали по методикам, раскрытым в примере 45.
4-(Бромметил)-3-(трифторметил)бензонитрил (CI11)

Искомое соединение выделяли в виде почти белого смолообразного вещества (5 г, 66%):1H ЯМР (400 МГц, CDCl3) δ 7,96 (с, 1Н), 7,86 (д, J=8,0 Гц, 1Н), 7,76 (д, J=8,0 Гц, 1Н), 4,62 (с, 2Н); ИЭРМС m/z 262,11 ([М-Н]-); ИК (тонкая пленка) 2236, 1132, 617 см-1.
3-Бром-4-(бромметил)бензонитрил (CI12)
Искомое соединение выделяли в виде почти белого твердого вещества (5 г, 67%): температура плавления 82-83°С;1H ЯМР (400 МГц, CDCl3) δ 7,90 (с, 1Н), 7,61 (м, 2Н), 4,62 (с, 2Н); ЭУМС m/z 272,90; ИК (тонкая пленка) 2229, 618 см-1.
4-(Бромметил)-3-фторбензонитрил (CI13)
Искомое соединение выделяли в виде почти белого твердого вещества (2 г, 60%): температура плавления 79-81°С;1H ЯМР (400 МГц, CDCl3) δ 7,54 (т, J=8,0 Гц, 1Н), 7,48 (дд, J=8,0 Гц, 8,0, 1Н), 7,38 (дд, J=5 Гц, 1Н), 4,5 (с, 2Н); ЭУМС m/z 215.
Пример 46: Получение 4-(бромметил)-3-хлорбензальдегида (CI14)

При перемешивании к раствору 4-(бромметил)-3-хлорбензонитрила (4,8 г, 17 ммоля) в толуоле (50 мл) при 0°С по каплям добавляли диизобутилалюминийгидрид (DIBAL-H, 1,0 М раствор в толуоле; 23,9 мл) и реакционную смесь перемешивали при 0°С в течение 1 ч. 10 М HCl в Н2О (5 мл) добавляли, пока реакционная смесь не превращалась в белую взвесь, и затем дополнительно добавляли 1 н. HCl (20 мл). Органический слой собирали и водный слой экстрагировали с помощью CHCl3. Объединенный органический слой сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; 5% EtOAc в н-гексане) и получали искомое соединение в виде белого твердого вещества (3,8 г, 80%): температура плавления 64-66°С;1H ЯМР (400 МГц, CDCl3) δ 10,00 (с, 1Н), 7,92 (с, 1Н), 7,78 (д, J=8,0 Гц, 1Н), 7,64 (д, J=8,0 Гц, 1Н), 4,60 (с, 2Н); ИЭРМС m/z 232,78 ([М+Н]+).
Указанные ниже соединения получали по методикам, раскрытым в примере 46.
4-(Бромметил)-3-(трифторметил)бензальдегид (CI15)

Искомое соединение выделяли в виде бледно-желтого низкоплавкого твердого вещества (5 г, 60%):1H ЯМР (400 МГц, CDCl3) δ 10,09 (с, 1Н), 8,19 (с, 1Н), 8,09 (м, 1Н), 7,81 (м, 1Н), 4,61 (с, 2Н); ИЭРМС m/z 265,04 ([М-Н]-); ИК (тонкая пленка) 1709, 1126, 649 см-1.
3-Бром-4-(бромметил)бензальдегид (CI16)
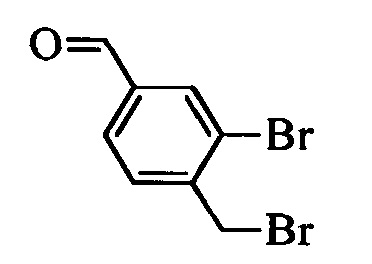
Искомое соединение выделяли в виде бледно-желтого твердого вещества (5 г, 62%): температура плавления 94-95°С;1H ЯМР (400 МГц, CDCl3) δ 9,96 (с, 1Н), 8,05 (с, 1Н), 7,81 (д, J=8,0 Гц, 1Н), 7,62 (д, J=8,0 Гц, 1Н), 4,60 (с, 2Н); ЭУМС m/z 275,90.
4-(Бромметил)-3-фторбензальдегид (CI17)

Искомое соединение выделяли в виде почти белого твердого вещества (5 г, 61%): температура плавления 43-45°С;1H ЯМР (400 МГц, CDCl3) δ 9,1 (с, 1Н), 7,54 (т, J=8 Гц, 1Н), 7,48 (д, J=8 Гц, 1Н), 7,38 (д, J=5 Гц, 1Н), 4,5 (с, 2Н); ЭУМС m/z 216.
Пример 47: Получение 3-хлор-4-((1,3-диоксоизоиндолин-2-ил)метил)бензальдегида (CI18)

При перемешивании к раствору 4-(бромметил)-3-хлорбензальдегида (3,8 г, 14 ммоля) в ДМФ (40 мл) добавляли фталимид калия (3,54 г, 19,14 ммоля) и смесь нагревали при 60°С в течение 6 ч. Реакционную смесь охлаждали до температуры окружающей среды и разбавляли с помощью H2O (100 мл). Полученное твердое вещество отделяли фильтрованием и сушили в вакууме, и получали искомое соединение в виде белого твердого вещества (2,8 г, 60%): температура плавления 123-126°С;1H ЯМР (400 МГц, CDCl3) δ 9,95 (с, 1Н), 8,21 (с, 1Н), 7,91 (м, 3Н), 7,80 (м, 2Н), 7,20 (м, 1Н), 5,05 (с, 2Н); ИЭРМС m/z 298,03 ([М-Н]-).
Указанные ниже соединения получали по методикам, раскрытым в примере 47.
4-((1,3-Диоксоизоиндолин-2-ил)-3-(трифторметил)бензальдегид (CI19)

Искомое соединение выделяли в виде почти белого твердого вещества (1 г, 62%): температура плавления 142-143°С;1H ЯМР (400 МГц, CDCl3) δ 10,05 (с, 1Н), 8,15 (с, 1Н), 7,91 (м, 2Н), 7,80 (м, 3Н), 7,27 (м, 1Н), 5,19 (с, 2Н); ИЭРМС m/z 332,03 ([М-Н]-).
3-Бром-4-((1,3-диоксоизоиндолин-2-ил)метил)бензальдегид (CI20)

Искомое соединение выделяли в виде почти белого твердого вещества (0,5 г, 64%): температура плавления 159-161°С;1H ЯМР (400 МГц, CDCl3) δ 9,95 (с, 1Н), 8,21 (с, 1Н), 7,91 (м, 3Н), 7,80 (м, 2Н), 7,20 (м, 1Н), 5,05 (с, 2Н); ИЭРМС m/z 314,00 ([М-СНО]-).
4-((1,3-Диоксоизоиндолин-2-ил)-3-фторбензальдегид (CI21)
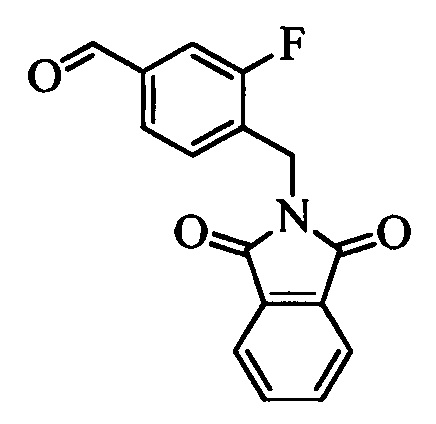
Искомое соединение выделяли в виде белого твердого вещества (2 г, 60%): температура плавления 154-156°С;1H ЯМР (400 МГц, CDCl3) δ 9,95 (с, 1Н), 7,9 (м, 2Н), 7,75 (м, 2Н), 7,6 (м, 2Н), 7,5 (т, J=7,6 Гц, 1Н), 5,05 (с, 2Н); ЭУМС m/z 283,1.
Пример 48: Получение 2-(2-хлор-4-винилбензил)изоиндолин-1,3-диона (CI22)
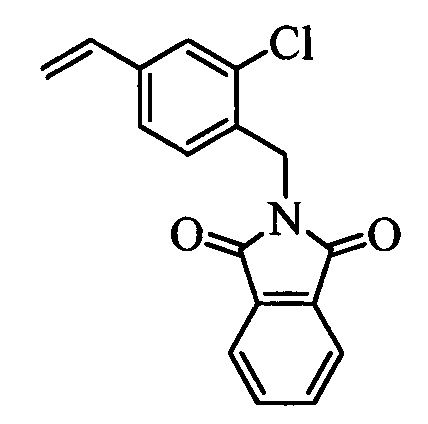
При перемешивании при температуре окружающей среды к раствору 3-хлор-4-((1,3-диоксоизоиндолин-2-ил)метил)бензальдегида (2,8 г, 8,2 ммоля) в 1,4-диоксане (30 мл) добавляли K2CO3 (1,68 г, 12,24 ммоля) и метилтрифенилфосфонийбромид (4,37 г, 12,24 ммоля). Затем полученную реакционную смесь нагревали при 100°С в течение 18 ч. После того, как по данным ТСХ реакцию считали завершенной, реакционную смесь охлаждали до температуры окружающей среды и фильтровали и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (SiO2, 100-200 меш; 20% EtOAc в н-гексане) и получали искомое соединение в виде белого твердого вещества (1,94 г, 70%): температура плавления 141-143°С;1H ЯМР (400 МГц, CDCl3) δ 7,85 (м, 2Н), 7,70 (м, 2Н), 7,41 (м, 1Н), 7,21 (м, 2Н), 6,71 (дд, J=17,6, 10,8 Гц, 1Н), 5,72 (д, J=17,6 Гц, 1Н), 5,23 (д, J=10,8 Гц, 1Н), 4,92 (с, 2Н); ИЭРМС m/z 298,10 ([M-H]-).
Указанные ниже соединения получали по методикам, раскрытым в примере 48.
2-(2-(Трифторметил)-4-винилбензил)изоиндолин-1,3-дион (CI23)

Искомое соединение выделяли в виде светло-коричневого твердого вещества (0,5 г, 60%): температура плавления 134-135°С;1H ЯМР (400 МГц, CDCl3) δ 7,92 (м, 2Н), 7,80 (м, 2Н), 7,71 (с, 1Н), 7,46 (д, J=8,0 Гц, 1Н), 7,16 (д, J=8,0 Гц, 1Н), 6,65 (м, 1Н), 5,80 (д, J=17,8 Гц, 1Н), 5,19 (д, J=10,8 Гц, 1Н), 5,09 (с, 2Н); ИЭРМС m/z 332,10 ([М+Н]+).
2-(2-Бром-4-винилбензил)изоиндолин-1,3-дион (CI24)
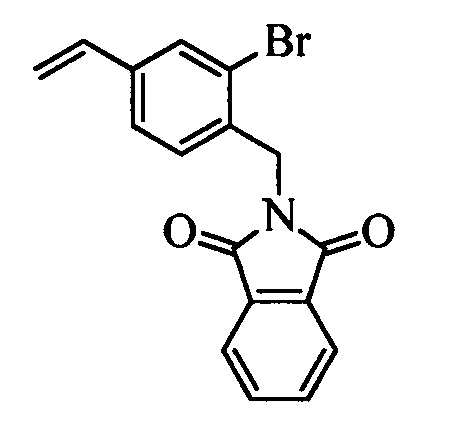
Искомое соединение выделяли в виде почти белого твердого вещества (0,5 г, 62%): температура плавления 126-128°С;1H ЯМР (400 МГц, CDCl3) δ 7,92 (м, 2Н), 7,79 (м, 2Н), 7,62 (с, 1Н), 7,21 (м, 1Н), 7,16 (д, J=8,0 Гц, 1Н), 6,62 (м, 1Н), 5,72 (д, J=17,8 Гц, 1Н), 5,15 (д, J=10,8 Гц, 1Н), 4,95 (с, 2Н); ЭУМС m/z 341,10.
2-(2-Фтор-4-винилбензил)изоиндолин-1,3-дион (CI25)

Искомое соединение выделяли в виде белого твердого вещества (0,5 г, 61%): температура плавления 140-142°С;1H ЯМР (400 МГц, CDCl3) δ 7,85 (м, 2Н), 7,72 (м, 2Н), 7,25 (м, 1Н), 7,11 (м, 2Н), 6,63 (м, 1Н), 5,80 (д, J=17,6 Гц, 1Н), 5,28 (д, J=10,8 Гц, 1Н), 4,92 (с, 2Н); ЭУМС m/z 282,08.
Пример 49: Получение (Е)-2-(2-хлор-4-(3-(3,5-дихлорфенил)4,4,4-трифторбут-1-ен-1-ил)бензил)изоиндолин-1,3-диона (CI26)
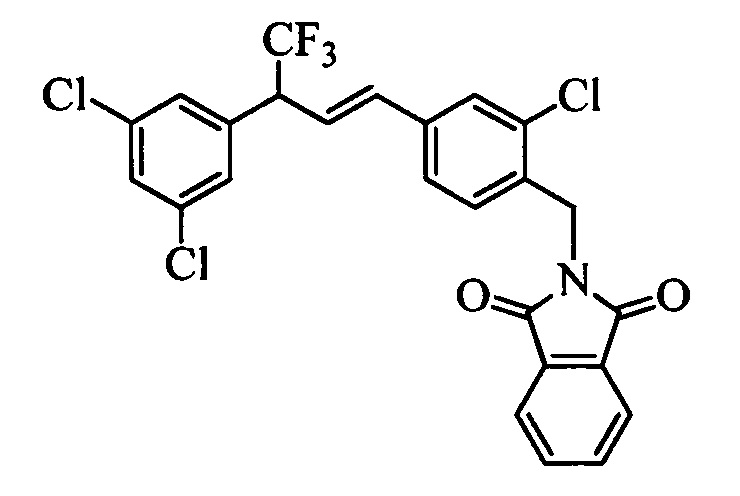
При перемешивании к раствору 2-(2-хлор-4-винилбензил)изоиндолин-1,3-диона (2,0 г, 6,51 ммоля) в 1,2-дихлорбензоле (25 мл) добавляли 1-(1-бром-2,2,2-трифторэтил)-3,5-дихлорбензол (3,48 г, 11,36 ммоля), CuCl (112 мг, 1,13 ммоля) и 2,2-бипиридил (0,35 г). Полученную реакционную смесь дегазировали аргоном в течение 30 мин и затем перемешивали при 180°С в течение 24 ч. После того, как по данным ТСХ реакцию считали завершенной, реакционную смесь охлаждали до температуры окружающей среды и фильтровали, и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (SiO2, 100-200 меш; 25-30% EtOAc в н-гексане) и получали искомое соединение в виде твердого вещества (1,3 г, 50%): температура плавления 141-143°С;1H ЯМР (400 МГц, CDCl3) δ 7,92 (м, 2Н), 7,79 (м, 2Н), 7,42 (м, 2Н), 7,24 (м, 2Н), 7,20 (м, 2Н), 6,54 (д, J=16,0 Гц, 1Н), 6,34 (дд, J=16,0, 8,0 Гц, 1Н), 5,00 (с, 2Н), 4,10 (м, 1Н); ИЭРМС m/z 524,07 ([M+H]+).
Указанные ниже соединения получали по методикам, раскрытым в примере 49.
(Е)-2-(2-Хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)изоиндолин-1,3-дион (CI27)

Искомое соединение выделяли в виде белесого твердого вещества (0,2 г, 55%): температура плавления 128-129°С;1H ЯМР (400 МГц, CDCl3) δ 7,92 (м, 2Н), 7,79 (м, 2Н), 7,42 (м, 3Н), 7,22 (м, 2Н), 6,52 (д, J=16,0 Гц, 1Н), 6,32 (дд, J=16,0, 8,0 Гц, 1Н), 5,00 (с, 2Н), 4,05 (м, 1Н); ИЭРМС m/z 557,99 ([М+Н]+).
(E)-2-(2-Хлор-4-(3-(3,5-дихлор-4-фторфенил)-4,4,4-трифторбут-1-ен-1-ил)бензил)изоиндолин-1,3-дион (CI28)
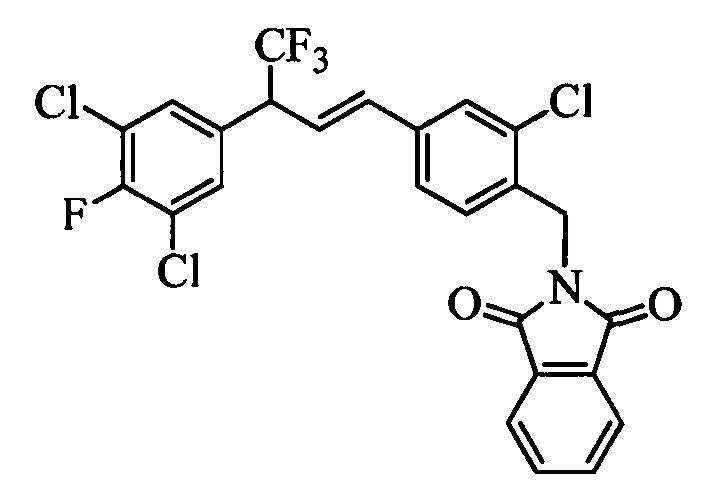
Искомое соединение выделяли в виде почти белого твердого вещества (0,2 г, 54%): температура плавления 177-180°С;1Н ЯМР (400 МГц, CDCl3) δ 7,90 (м, 2Н), 7,77 (м, 2Н), 7,42 (с, 1Н), 7,32 (д, J=8,0 Гц, 2Н), 7,21 (м, 2Н), 6,52 (д, J=16,0 Гц, 1Н), 6,32 (дд, J=16,0, 8,0 Гц, 1Н), 5,00 (с, 2Н), 4,05 (м, 1Н); ИЭРМС m/z 540,08 ([М-Н]-); ИК (тонкая пленка) 1716 см-1.
(Е)-2-(2-Хлор-4-(3-(3,4-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)бензил)изоиндолин-1,3-дион (CI29)

Искомое соединение выделяли в виде почти белого твердого вещества (0,2 г, 59%):1H ЯМР (400 МГц, CDCl3) δ 7,89 (м, 2Н), 7,76 (м, 2Н), 7,47 (м, 3Н), 7,21 (м, 3Н), 6,50 (д, J=16,0 Гц, 1Н), 6,32 (дд, J=16,0, 7,6 Гц, 1Н), 4,97 (с, 2Н), 4,11 (м, 1Н); ИЭРМС m/z 522,27 ([М-Н]-); ИК (тонкая пленка) 3064, 1717, 1111, 715 см-1.
(E)-2-(4-(3-(3,5-Дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-(трифторметил)-бензил)изоиндолин-1,3-дион (CI30)

Искомое соединение выделяли в виде почти белого твердого вещества (0,2 г, 54%): температура плавления 141-142°С;1H ЯМР (400 МГц, CDCl3) 7,94 (м, 2Н), 7,80 (м, 2Н), 7,69 (с, 1Н), 7,44 (м, 1Н), 7,38 (м, 1Н), 7,24 (м, 2Н), 7,19 (м, 1Н), 6,60 (д, J=16,0 Гц, 1Н), 6,39 (дд, J=16,0, 7,6 Гц, 1Н), 5,10 (с, 2Н), 4,11 (м, 1Н); ИЭРМС m/z 556,00 ([М-Н]-).
(E)-2-(4-(4,4,4-Трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)-2-(трифторметил)-бензил)изоиндолин-1,3-дион (CI31)
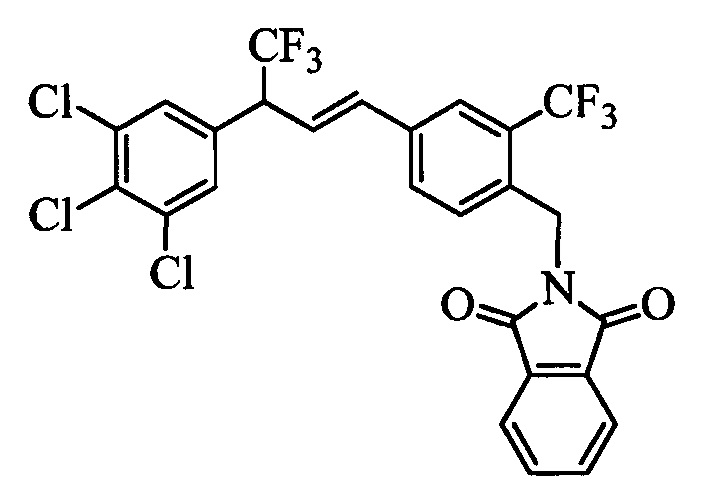
Искомое соединение выделяли в виде почти белого твердого вещества (0,2 г, 56%): температура плавления 130-132°С;1H ЯМР (400 МГц, CDCl3) δ 7,94 (м, 2Н), 7,80 (м, 2Н), 7,69 (с, 1Н), 7,44 (м, 3Н), 7,19 (м, 1Н), 6,61 (д, J=16,0 Гц, 1Н), 6,38 (дд, J=16,0, 7,6 Гц, 1Н), 5,10 (с, 2Н), 4,12 (м, 1Н); ИЭРМС m/z 589,57 ([М-2Н]-).
(E)-2-(2-Бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)-изоиндолин-1,3-дион (CI32)
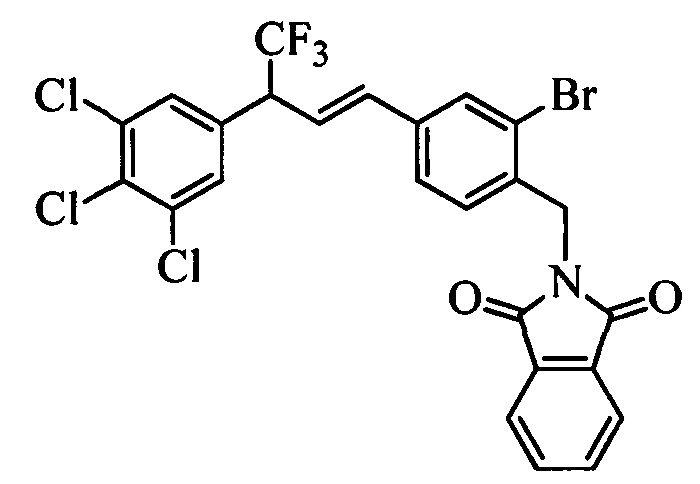
Искомое соединение выделяли в виде бледно-желтого твердого вещества (0,2 г, 55%): температура плавления 160-162°С;1H ЯМР (400 МГц, CDCl3) δ 7,92 (м, 2Н), 7,80 (м, 2Н), 7,62 (с, 1Н), 7,39 (с, 2Н), 7,24 (м, 1Н), 7,16 (м, 1Н), 6,52 (д, J=16,0 Гц, 1Н), 6,32 (дд, J=16,0, 8,0 Гц, 1Н), 4,98 (с, 2Н), 4,12 (м, 1Н); ИЭРМС m/z 599,78 ([М-Н]-).
(Е)-2-(2-Фтор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)-изоиндолин-1,3-дион (CI33)
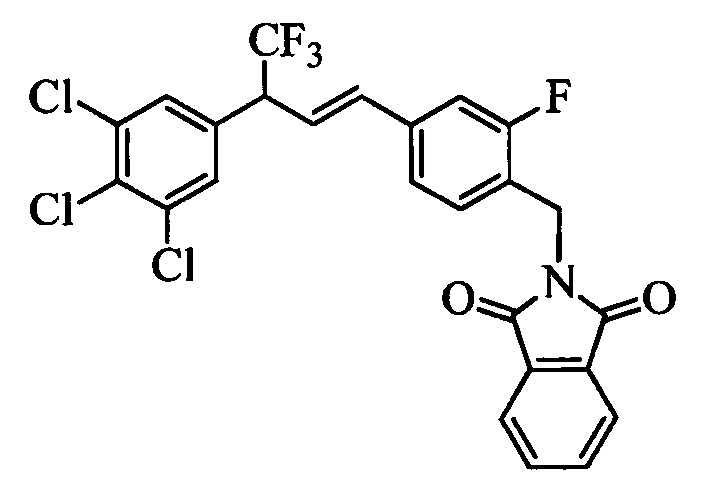
Искомое соединение выделяли в виде почти белого твердого вещества (0,2 г, 55%): температура плавления 72-74°С;1H ЯМР (400 МГц, CDCl3) δ 7,88 (м, 2Н), 7,74 (м, 2Н), 7,38 (с, 2Н), 7,34 (м, 1Н), 7,18 (м, 2Н), 6,54 (д, J=16,0 Гц, 1Н), 6,32 (дд, J=16,0, 8,0 Гц, 1Н), 4,91 (с, 2Н), 4,08 (м, 1Н); ИЭРМС m/z 539,89 ([М-Н]-); ИК (тонкая пленка) 1773 см-1.
Возможно, соединения CI34-CI41 (таблица 1) можно было получить по методикам, раскрытым в примере 49.
Пример 50: Получение (E)-(2-хлор-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)фенил)метанамина (CI42)
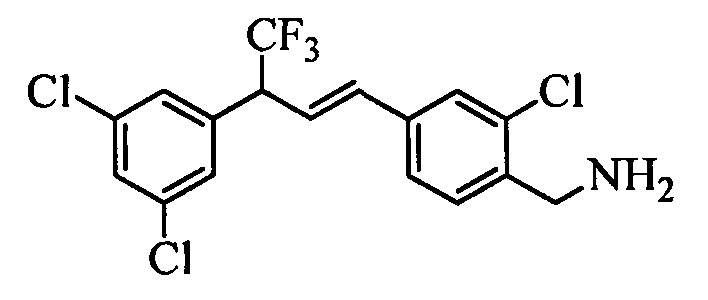
При перемешивании к раствору (Е)-2-(2-хлор-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)бензил)изоиндолин-1,3-диона (0,4 г, 0,76 ммоля) в EtOH добавляли гидразингидрат (0,38 г, 7,6 ммоля) и полученную реакционную смесь нагревали при 80°С в течение 2 ч. Реакционную смесь фильтровали и фильтрат концентрировали. Остаток растворяли в CH2Cl2, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде смолообразной жидкости (0,3 г), которую использовали на следующей стадии без дополнительной очистки.
Указанные ниже соединения получали по методикам, раскрытым в примере 50.
(Е)-(2-Хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенил)-метанамин (CI43)

Продукт, полученный по этой реакции, использовали на следующей стадии без дополнительной очистки.
(Е)-(2-Хлор-4-(3-(3,4-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)фенил)-метанамин (CI44)
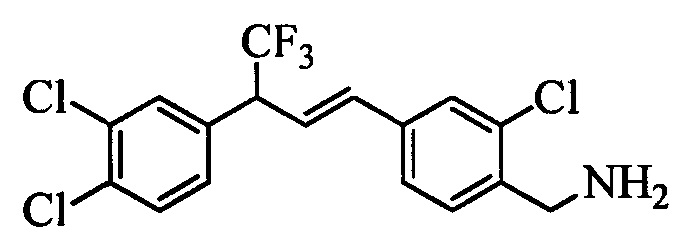
Продукт, полученный по этой реакции, использовали на следующей стадии без дополнительной очистки:1H ЯМР (400 МГц, CDCl3) δ 7,48 (д, J=8,4 Гц, 2Н), 7,39 (м, 2Н), 7,23 (м, 2Н), 6,52 (д, J=16,0 Гц, 1Н), 6,38 (дд, J=16,0, 7,6 Гц, 1Н), 4,12 (м, 1Н), 3,90 (с, 2Н); ИЭРМС m/z 391,90 ([М-Н]-); ИК (тонкая пленка) 3370, 3280, 1111, 817 см-1.
(Е)-(4-(4,4,4-Трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)-2-(трифторметил)-фенил)метанамин (CI45)
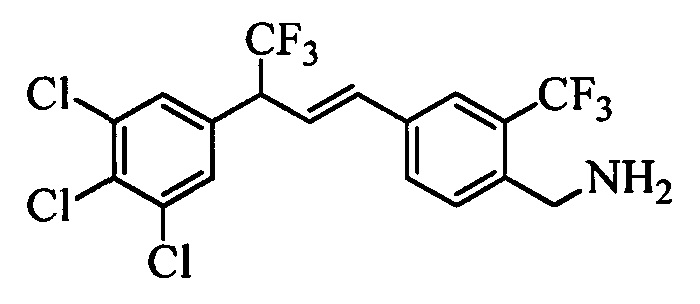
Искомое соединение выделяли в виде смолообразного вещества. Продукт, полученный по этой реакции, использовали на следующей стадии без дополнительной очистки.
(Е)-(2-Бром-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)фенил)-метанамин (CI46)
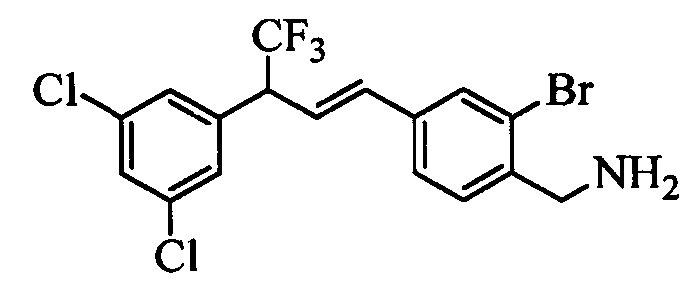
Искомое соединение выделяли в виде смолообразного вещества:
Продукт, полученный по этой реакции, использовали на следующей стадии без дополнительной очистки.
(Е)-(2-Бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенил)-метанамин (CI47)
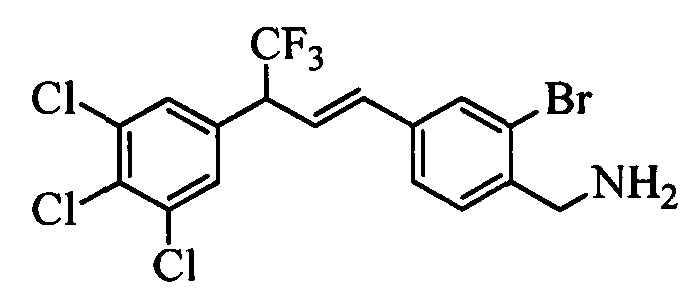
Искомое соединение выделяли в виде смолообразного вещества. Продукт, полученный по этой реакции, использовали на следующей стадии без дополнительной очистки.
(Е)-(2-Фтор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенил)-метанамин (CI48)
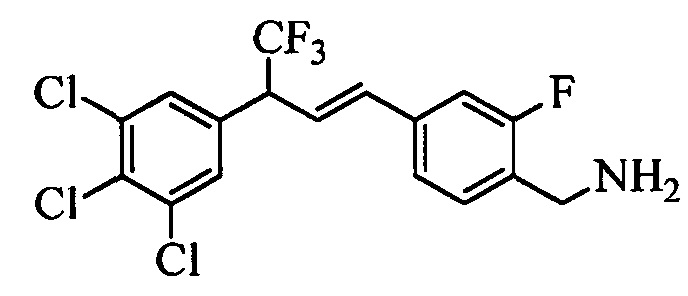
Искомое соединение выделяли в виде смолообразного вещества:1H ЯМР (400 МГц, CDCl3) δ 7,40 (с, 2Н), 7,33 (т, J=7, 6 Гц, 1Н), 7,13 (м, 2Н), 6,56 (д, J=16,0 Гц, 1Н), 6,33 (дд, J=16,0, 7,6 Гц, 1Н), 4,08 (м, 1Н), 3,90 (с, 2Н); ИЭРМС m/z 413,84 ([М+Н]+); ИК (тонкая пленка) 3368, 3274, 1114, 808 см-1.
Возможно, соединения CI49-CI57 (таблица 1) можно было получить по методикам, раскрытым в примере 50.
Пример 51: Получение 3-хлор-4-((пиридин-2-иламино)метил)бензальдегида (CI58)
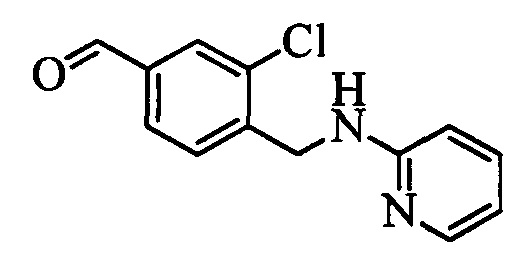
При перемешивании к раствору 4-(бромметил)-3-хлорбензальдегида (2 г, 9 ммоля) в N,N-диметилацетамиде (ДМА; 20 мл) добавляли K2CO3 (2,36 г, 17,16 ммоля) и 2-аминопиридин (0,84 г, 8,58 ммоля) и реакционную смесь перемешивали при температуре окружающей среды в течение 4 ч. Реакционную смесь разбавляли с помощью Н2О и экстрагировали с помощью EtOAc. Объединенный органический слой промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; 20% EtOAc в н-гексане) и получали искомое соединение в виде почти белого твердого вещества (1,05 г, 50%): температура плавления 122-123°С;1H ЯМР (400 МГц, CDCl3) δ 9,94 (с, 1Н), 8,11 (с, 1Н), 7,88 (с, 1Н), 7,72 (д, J=4,8 Гц, 1Н), 7,62 (д, J=5,7 Гц, 1Н), 7,4 (м, 1Н), 6,64 (д, J=3,9 Гц, 1Н), 6,38 (д, J=6,3 Гц, 1Н), 5,04 (шир.с, 1Н), 4,71 (с, 2Н); ИЭРМС m/z 246,97 ([М+Н]+).
Пример 52: Получение N-(2-хлор-4-винилбензил)пиридин-2-амина (CI59)
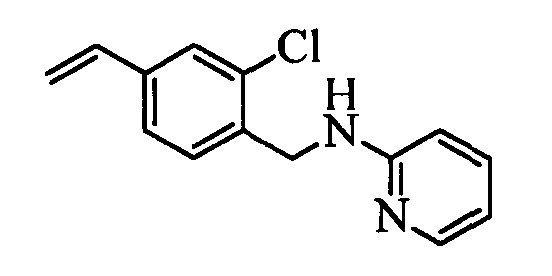
При перемешивании при температуре окружающей среды к раствору 3-хлор-4-((пиридин-2-иламино)метил)бензальдегида (1 г, 4. ммоля) в 1,4-диоксане (20 мл) добавляли K2CO3 (0,84 г, 6,09 ммоля) и метилтрифенилфосфонийбромид (2,17 г, 6,09 ммоля). Затем полученную реакционную смесь нагревали при 100°С в течение 18 ч. После того, как по данным ТСХ реакцию считали завершенной, реакционную смесь охлаждали до температуры окружающей среды и фильтровали и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (SiO2, 100-200 меш; 10% EtOAc в н-гексане) и получали искомое соединение в виде белого твердого вещества (0,5 г, 50%): температура плавления 119-121°С;1H ЯМР (400 МГц, CDCl3) δ 8,12 (с, 1Н), 7,42-7,40 (м, 3Н), 7,26 (с, 1Н), 6,66 (м, 2Н), 6,36 (д, J=6,3 Гц, 1Н), 5,75 (д, J=13,2 Гц, 1Н), 4,92 (шир.с, 1Н), 4,60 (с, 2Н); ИЭРМС m/z 245,05 ([М+Н]+).
Пример 53: Получение этил-2-амино-2-(5-бром-3-хлорпиридин-2-ил)ацетата (CI60)

Этил-2-(дифенилметиленамино)ацетат (10,2 г, 38,2 ммоля) при 0°С добавляли к гидриду натрия (NaH; 3,18 г, 133,52 ммоля) в ДМФ (50 мл) и смесь перемешивали в течение 30 мин. К ней добавляли 5-бром-2,3-дихлорпиридин (12,9 г, 57,23 ммоля) и реакционную смесь перемешивали в течение 3 ч при температуре окружающей среды. Реакцию останавливали 2 н. раствором HCl и затем перемешивали в течение 4 ч при температуре окружающей среды. Смесь экстрагировали с помощью EtOAc. Объединенный слой, содержащий EtOAc, промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (20-30% EtOAc в гексане) давала искомое соединение в виде жидкости (1,3 г, 20%):1H ЯМР (400 МГц, CDCl3) δ 8,52 (с, 1Н), 7,89 (с, 1Н), 5,09 (slH), 4,23 (м, 2Н), 2,27 (шир.с, 2Н), 1,26 (м, 3Н); ИЭРМС m/z 293,05 ([М+Н]+); ИК (тонкая пленка) 3381, 3306, 1742, 759, 523 см-1.
Пример 54: Получение (5-бром-3-хлорпиридин-2-ил)метанамингидрохлорида (CI61)
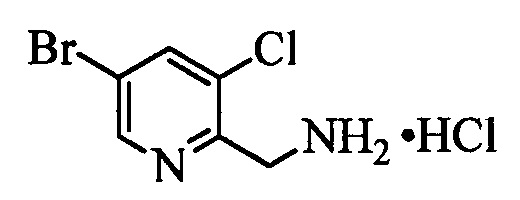
При перемешивании раствор этил-2-амино-2-(5-бром-3-хлорпиридин-2-ил) ацетата (0,5 г, 1,7 ммоля) в 3 н. HCl (25 мл) кипятили с обратным холодильником в течение 4 ч. Реакционную смесь промывали диэтиловым эфиром и с помощью H2O. Объединенный эфирный слой концентрировали при пониженном давлении и получали искомое соединение в виде почти белого твердого вещества (400 мг, 65%):1H ЯМР (400 МГц, CDCl3) δ 8,78 (с, 1Н), 8,70 (шир.с, 2Н), 8,45 (с, 1Н), 4,56 (м, 2Н); ИЭРМС m/z 221,15 ([М+Н]+).
Пример 55: Получение 2-((5-бром-3-хлорпиридин-2-ил)метил)изоиндолин-1,3-диона (CI62)
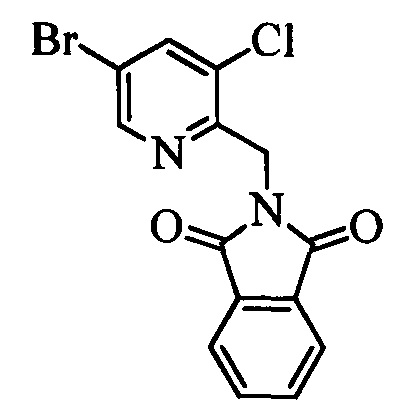
При перемешивании к раствору (5-бром-3-хлорпиридин-2-ил)метанамингидрохлорида (0,3 г, 1,4 ммоля) в толуоле (40 мл) добавляли ТЭА (0,41 г, 4,08 ммоля) и фталевый ангидрид (0,24 г, 1,63 ммоля) и реакционную смесь кипятили с обратным холодильником в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении и остаток разбавляли с помощью Н2О и экстрагировали с помощью EtOAc. Объединенный слой, содержащий EtOAc, промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии (20-30% EtOAc в гексане) и получали искомое соединение в виде белого твердого вещества (0,25 г, 65%):1H ЯМР (400 МГц, CDCl3) δ 8,78 (с, 1Н), 8,45 (с, 1Н), 7,88 (м, 2Н), 7,74 (м, 2Н), 4,56 (м, 2Н); ИЭРМС m/z 349 ([М-Н]-); ИК (тонкая пленка) 3307, 1665, 1114, 813 см-1.
Пример 56: Получение 2-((3-хлор-5-винилпиридин-2-ил)метил)изоиндолин-1,3-диона (CI63)
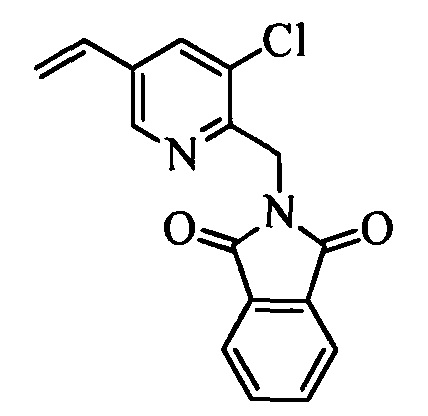
При перемешивании к раствору 2-((5-бром-3-хлорпиридин-2-ил)метил)изоиндолин-1,3-диона (0,23 г, 0,65 ммоля) в толуоле (10 мл) добавляли Pd(PPh3)4 (3,7 мг, 0,003 ммоля), K2CO3 (0,269 г, 1,95 ммоля) и комплекс ангидрида винилбороновой кислоты с пиридином (0,78 г, 3,28 ммоля) и реакционную смесь кипятили с обратным холодильником в течение 16 ч. Реакционную смесь фильтровали и фильтрат промывали с помощью H2O и рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (20-30% EtOAc в гексане) давала искомое соединение в виде почти белого твердого вещества (0,2 г, 65%):1H ЯМР (400 МГц, CDCl3) δ 8,30 (с, 1Н), 7,91 (м, 2Н), 7,77 (м, 3Н), 7,72 (м, 1Н), 6,63 (м, 1Н), 5,79 (д, J=16,0 Гц, 1Н), 5,39 (д, J=16,0 Гц, 1Н), 5,12 (с, 2Н); ИЭРМС m/z 299,20 ([М+Н]+).
Пример 57: Получение (Е)-2-((3-хлор-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)пиридин-2-ил)метил)изоиндолин-1,3-диона (CI64)
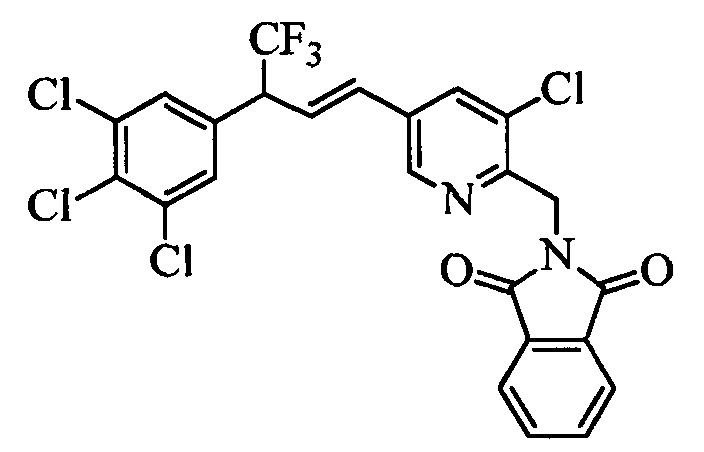
При перемешивании к раствору 2-((3-хлор-5-винилпиридин-2-ил)метил)изоиндолин-1,3-диона (0,35 г, 1,17 ммоля) в 1,2-дихлорбензоле (10 мл) добавляли 5-(1-бром-2,2,2-трифторэтил)-1,2,3-трихлорбензол (0,8 г, 2,3 ммоля), CuCl (23 мг, 0,12 ммоля), 2,2-бипиридил (0,073 г, 0,234 ммоля) и реакционную смесь нагревали при 180°С в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и очищали с помощью колоночной хроматографии (20-30% EtOAc в гексане) и получали искомое соединение в виде жидкости (0,4 г, 50%): температура плавления 79-82°С;1H ЯМР (400 МГц, CDCl3) δ 8,27 (с, 1Н), 7,91 (м, 2Н), 7,77 (м, 3Н), 7,36 (с, 2Н), 6,51 (д, J=15,6 Гц, 1Н), 6,32 (дд, J=15,6, 8,0 Гц, 1Н), 5,30 (с, 2Н), 4,13 (м, 1Н); ИЭРМС m/z 559 ([М+Н]+).
Пример 58: Получение (E)-(3-хлор-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)пиридин-2-ил)метанамина (С165)
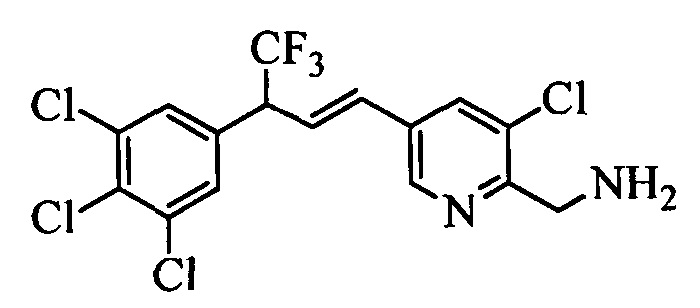
При перемешивании к раствору (E)-2-((3-хлор-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)пиридин-2-ил)метил)изоиндолин-1,3-диона (200 мг, 0,358 ммоля) в EtOH (5 мл) добавляли гидразингидрат (89,6 мг, 1,79 ммоля) и реакционную смесь кипятили с обратным холодильником в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в CH2Cl2. Органический слой промывали с помощью H2O и рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде твердого вещества (100 мг). Продукт, полученный по этой реакции, использовали на следующей стадии без дополнительной очистки.
Пример 59: Получение 4-(бромметил)-1-нафтонитрила (CI66)
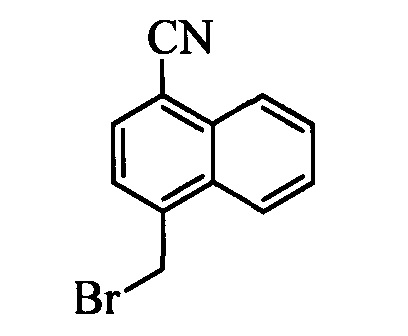
При перемешивании к раствору 4-метил-1-нафтонитрила (5 г, 30 ммоля) в CCl4 (50 мл) в атмосфере аргона добавляли NBS (6,06 г, 34,09 ммоля) и реакционную смесь дегазировали в течение 30 мин. Добавляли АИБН (0,3 г, 2,1 ммоля) и полученную реакционную смесь кипятили с обратным холодильником в течение 4 ч. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли с помощью H2O и экстрагировали с помощью CH2Cl2 (3×100 мл). Объединенный слой, содержащий CH2Cl2, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; 5% EtOAc в н-гексане) и получали искомое соединение в виде белого твердого вещества (3,8 г, 52%): температура плавления 131-133°С;1H ЯМР (400 МГц, CDCl3) δ 8,33 (м, 1Н), 8,24 (м, 1Н), 7,88 (д, J=8,0 Гц, 1Н), 7,78 (м, 2Н), 7,62 (д, J=8,0 Гц, 1Н), 4,95 (с, 2Н); ИЭРМС m/z 245,92 ([М+Н]+); ИК (тонкая пленка) 2217 см-1.
Пример 60: Получение 4-(бромметил)-1-нафтальдегида (CI67)
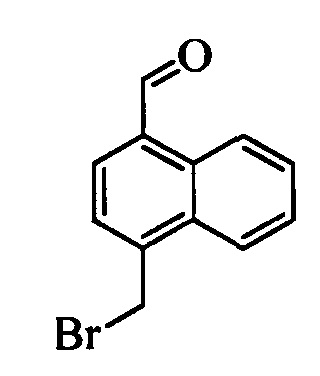
При перемешивании к раствору 4-(бромметил)-1-нафтонитрила (8 г, 33 ммоля) в толуоле (100 мл) при 0°С по каплям добавляли DIBAL-H (1,0 М раствор в толуоле; 43 мл) и реакционную смесь перемешивали при 0°С в течение 1 ч. 3 н. HCl в H2O (50 мл) добавляли к смеси пока она не превращалась в белую взвесь, и затем дополнительно добавляли 1 н. HCl (20 мл). Органический слой собирали и водный слой экстрагировали с помощью EtOAc (3×100 мл). Объединенный органический слой сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; 5% EtOAc в петролейном эфире) давала искомое соединение в виде белого твердого вещества (7 г, 88%): температура плавления 115-116°С;1H ЯМР (400 МГц, CDCl3) δ 10,41 (с, 1Н), 9,35 (м, 1Н), 8,22 (м, 1Н), 7,90 (д, J=8,0 Гц, 1Н), 7,75 (м, 3Н), 4,95 (с, 2Н); ИЭРМС m/z 248,88 ([М+Н]+).
Пример 61: Получение 4-((1,3-диоксоизоиндолин-2-ил)метил)-1-нафтальдегида (CI68)

При перемешивании к раствору 4-(бромметил)-1-нафтальдегида (7 г, 28. ммоля) в ДМФ (100 мл) добавляли фталимид калия (7,3 г, 39,5 ммоля) и смесь нагревали при 85°С в течение 2 ч. Реакционную смесь охлаждали до температуры окружающей среды и разбавляли с помощью H2O (100 мл). Полученное твердое вещество отделяли фильтрованием и сушили в вакууме, и получали искомое соединение в виде белого твердого вещества (8,8 г, 98%): температура плавления 190-192°С;1H ЯМР (400 МГц, CDCl3) δ 10,39 (с, 1Н), 9,25 (м, 1Н), 8,41 (м, 1Н), 8,10 (д, J=8,0 Гц, 1Н), 7,95 (м, 4Н), 7,80 (м, 4Н), 7,61 (м, 4Н), 5,39 (с, 2Н); ИЭРМС m/z 316,09 ([М+Н]+); ИК (тонкая пленка) 1708 см-1.
Пример 62: Получение 2-((4-винилнафталин-1-ил)метил)изоиндолин-1,3-диона (CI69)
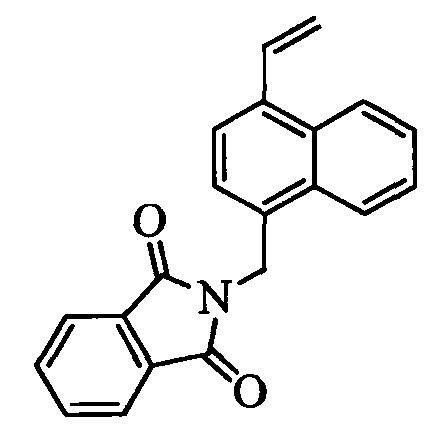
При перемешивании к раствору 4-((1,3-диоксоизоиндолин-2-ил)метил)-1-нафтальдегида (9 г, 28,5 ммоля) в 1,4-диоксане (100 мл) при температуре окружающей среды добавляли K2CO3 (6 г, 42,8 ммоля) и метилтрифенилфосфонийбромид (15,3 г, 35,7 ммоля). Реакционную смесь нагревали при 100°С в течение 14 ч и затем охлаждали до температуры окружающей среды. Реакционную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Очистка с помощью флэш-хроматографии (SiO2, 100-200 меш; 20% EtOAc в петролейном эфире) давала искомое соединение в виде белого твердого вещества (6 г, 67%): температура плавления 146-147°С;1H ЯМР (400 МГц, CDCl3) δ 8,35 (м, 2Н), 7,95 (м, 4Н), 7,65 (м, 4Н), 7,39 (м, 1Н), 5,81 (м, 1Н), 5,45 (м, 1Н), 5,21 (с, 2Н); ИЭРМС m/z 314,13 ([М+Н]+).
Пример 63: Получение (Е)-2-((4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)нафталин-1-ил)метил)изоиндолин-1,3-диона (CI70)
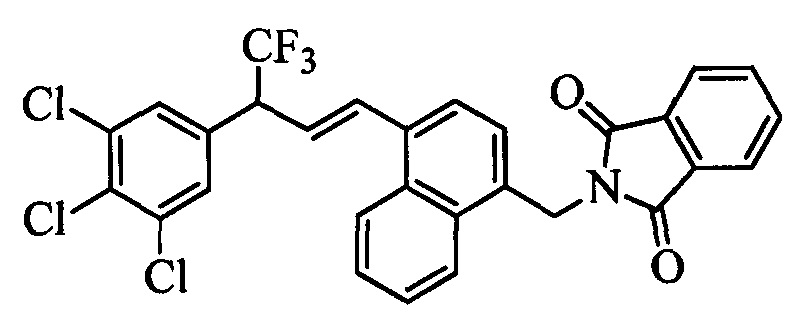
При перемешивании к раствору 2-((4-винилнафталин-1-ил)метил)изоиндолин-1,3-диона (1,5 г, 4,79 ммоля) в 1,2-дихлорбензоле (15 мл) добавляли 1-(1-бром-2,2,2-трифторэтил)-3,4,5-трихлорбензол (3,2 г, 9,5 ммоля), CuCl (24 мг, 0,24 ммоля) и 2,2-бипиридил (0,149 г, 0,95 ммоля) и полученную реакционную смесь дегазировали аргоном в течение 30 мин и затем перемешивали при 180°С в течение 14 ч. После того, как по данным ТСХ реакцию считали завершенной, реакционную смесь охлаждали до температуры окружающей среды и фильтровали и фильтрат концентрировали при пониженном давлении. Очистка с помощью флэш-хроматографии (SiO2, 100-200 меш; 25-30% EtOAc в петролейном эфире) давала искомое соединение в виде почти белого твердого вещества (1,5 г, 56%): температура плавления 158-160°С;1H ЯМР (400 МГц, CDCl3) δ 8,40 (м, 1Н), 7,89 (м, 2Н), 7,74 (м, 2Н), 7,64 (м, 2Н), 7,58 (м, 2Н), 7,46 (с, 2Н), 7,36 (м, 2Н), 6,31 (м, 1Н), 5,30 (с, 2Н), 4,21 (м, 1Н); ИЭРМС m/z 572,08 ([М-Н]-).
Пример 64: Получение (Е)-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)нафталин-1-ил)метанамина (CI71)
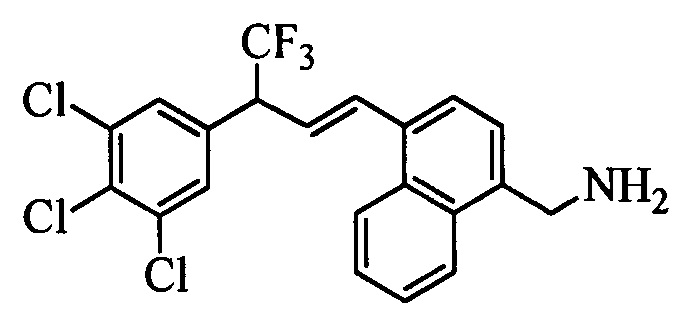
При перемешивании к раствору (E)-2-((4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)нафталин-1-ил)метил)изоиндолин-1,3-диона (0,4 г, 0,7 ммоля) в EtOH добавляли гидразингидрат (0,18 г, 3,5 ммоля) и полученную реакционную смесь нагревали при 80°С в течение 2 ч. Реакционную смесь фильтровали и фильтрат концентрировали. Остаток растворяли в CH2Cl2 и раствор промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Искомое соединение выделяли в виде смолообразной жидкости (150 мг, 50%). Продукт, полученный по этой реакции, использовали на следующей стадии без дополнительной очистки.
Пример 65: Получение 2-((4-бромфенил)амино)изоиндолин-1,3-диона (CI72)
При перемешивании к раствору (4-бромфенил)гидразингидрохлорида (0,5 г, 2,2 ммоля) в ледяной уксусной кислоте (8 мл) добавляли фталевый ангидрид (0,398 г, 2,690 ммоля) и реакционную смесь перемешивали при 130°С в течение 1 ч в атмосфере азота. Реакцию останавливали насыщенным водным раствором NaHCO3 и фильтровали, и получали твердое вещество. Очистка с помощью колоночной хроматографии (SiO2, 0-10% EtOAc в петролейном эфире) давала искомое соединение в виде твердого вещества (60 мг, 84%): температура плавления 205-206°С;1H ЯМР (400 МГц, CDCl3) δ 8,71 (с, 1Н), 7,99 (м, 4Н), 7,32 (д, J=8,8 Гц, 2Н), 6,79 (д, J=8,8 Гц, 2Н); ИЭРМС m/z 314,95 ([М-Н]-).
Пример 66: Получение 2-((4-винилфенил)амино)изоиндолин-1,3-диона (CI73)
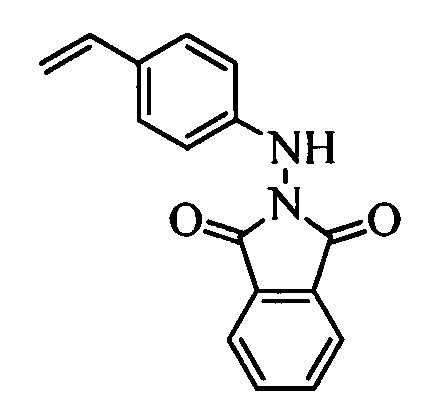
К раствору 2-(4-бромфениламино)изоиндолин-1,3-диона (2 г, 6,0 ммоля) в 1,2-диметоксиэтане (20 мл) и H2O (4 мл) добавляли комплекс ангидрида винилбороновой кислоты с пиридином (4,57 г, 18,98 ммоля) и K2CO3 (1,3 г, 9,5 ммоля), затем Pd(PPh3)4 (0,219 г, 0,189 ммоля). Полученную реакционную смесь нагревали при 150°С в микроволновой печи в течение 30 мин и затем концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (SiO2, 15% EtOAc в петролейном эфире) давала искомое соединение в виде твердого вещества (200 мг, 13%): температура плавления 174-176°С;1H ЯМР (400 МГц, CDCl3) δ 8,65 (с, 1Н), 7,94 (м, 4Н), 7,29 (д, J=8,4 Гц, 2Н), 6,72 (д, J=8,4 Гц, 2Н), 6,61 (м, 1Н), 5,61 (д, J=17,6 Гц, 1Н), 5,05 (д, J=11,2 Гц, 1Н); ИЭРМС m/z 263,18 ([М-Н]-).
Пример 67: Получение (E)-2-((4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенил)амино)изоиндолин-1,3-диона (CI74)
При перемешивании к раствору 2-(4-винилфениламино)изоиндолин-1,3-диона (0,3 г, 1,1 ммоля) в 1,2-дихлорбензоле (5 мл) добавляли CuCl (0,022 г, 0,273 ммоля), 2,2-бипиридил (0,07 г, 0,46 ммоля) и 5-(1-бром-2,2,2-трифторэтил)-1,2,3-трихлорбензол (0,77 г, 2,27 ммоля). Реакционную смесь дегазировали аргоном в течение 30 мин и нагревали при 180°С в течение 2 ч. Затем реакционную смесь концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии (SiO2, 0-30% EtOAc в петролейном эфире), и получали искомое соединение в виде твердого вещества (450 мг, 75%): температура плавления 187-189°С;1H ЯМР (400 МГц, CDCl3) δ 8,75 (с, 1Н), 7,96 (м, 4Н), 7,82 (с, 2Н), 7,37 (д, J=8,8 Гц, 1Н), 6,73 (д, J=8,4 Гц, 2Н), 6,61 (м, 2Н), 6,58 (м, 1Н), 4,59 (м, 1Н); ИЭРМС m/z 523,05 ([М-Н]-).
Пример 68: Получение (E)-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенил)гидразина (CI75)

При перемешивании к раствору (Е)-2-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)фениламино)изоиндолин-1,3-диона (0,16 г, 0,31 ммоля) в EtOH (5 мл) добавляли гидразингидрат (0,076 г, 1,52 ммоля) и реакционную смесь нагревали при 85°С в течение 1 ч. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали и фильтрат концентрировали при пониженном давлении, и получали искомое соединение в виде твердого вещества (0,08 г, 66%), которое использовали на следующей стадии без дополнительной очистки.
Пример 69: Получение 2-(4-винилфенокси)изоиндолин-1,3-диона (CI76)
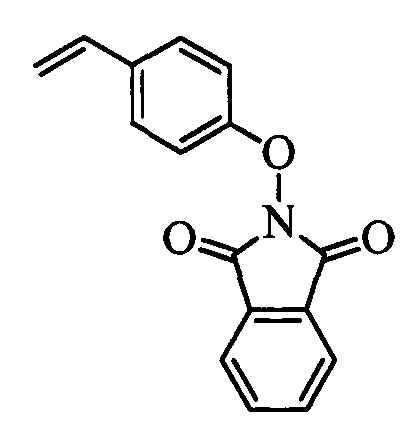
При перемешивании к раствору 4-винилфенилбороновой кислоты (2 г, 13 ммоля), 2-гидроксиизоиндолин-1,3-диона (3,63 г, 24,53 ммоля) и CuCl (1,214 г, 12,26 ммоля) в 1,2-дихлорэтане (50 мл) добавляли пиридин (1,065 г, 13,48 ммоля) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 48 ч. Реакционную смесь разбавляли с помощью H2O и экстрагировали с помощью CHCl3. Объединенный слой, содержащий CHCl3, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2; 20% EtOAc в петролейном эфире) давала искомое соединение в виде белого твердого вещества (2 г, 63%): температура плавления 129-131°С;1H ЯМР (400 МГц, CDCl3) δ 7,93 (д, J=2,0 Гц, 2Н), 7,82 (д, J=3,2 Гц, 2Н), 7,38 (д, J=2,0 Гц, 2Н), 7,14 (д, J=2,0 Гц, 2Н), 6,70 (м, 1Н), 5,83 (д, J=16,0 Гц, 1Н), 5,22 (д, J=10,8 Гц, 1Н); ИЭРМС m/z 266,12 ([М+Н]+).
Пример 70: Получение (E)-2-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенокси)изоиндолин-1,3-диона (CI77)

При перемешивании к раствору 2-(4-винилфенокси)изоиндолин-1,3-диона (0,3 г, 1,1 ммоля) в 1,2-дихлорбензоле (10 мл) добавляли 1-(1-бромэтил)-3,4,5-трихлорбензол (769 мг, 2,26 ммоля), CuCl (22 мг, 0,22 ммоля) и 2,2-бипиридил (35 мг, 0,44 ммоля) и полученную реакционную смесь дегазировали аргоном в течение 30 мин и нагревали при 180°С в течение 24 ч. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали и фильтрат концентрировали при пониженном давлении. Неочищенное вещество очищали с помощью колоночной хроматографии (SiO2, 100-200 меш; 20% EtOAc в петролейном эфире) и получали искомое соединение в виде твердого вещества (0,29 г, 50%):1H ЯМР (400 МГц, CDCl3) δ 7,90 (м, 1Н), 7,62 (м, 2Н), 7,50 (м, 1Н), 7,40 (с, 2Н), 7,12 (с, 1Н), 6,90 (м, 2Н), 6,60 (м, 2Н), 6,20 (м, 1Н), 4,08 (м, 1Н); ИЭРМС m/z 524,09 ([М-Н]-).
Пример 71: Получение (Е)-О-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенил)гидроксиламина (CI78)

При перемешивании к раствору (E)-2-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)фенокси)изоиндолин-1,3-диона (0,2 г, 0,4 ммоля) в EtOH добавляли гидразингидрат (0,1 г, 1,9 ммоля) и полученную реакционную смесь нагревали при 90°С в течение 1 ч. Реакционную смесь фильтровали и фильтрат концентрировали. Остаток растворяли в CH2Cl2, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное искомое соединение в виде смолообразной жидкости (0,08 г, 53%):1H ЯМР (400 МГц, CDCl3) δ 7,40 (с, 2Н), 6,98 (с, 1Н), 6,82 (с, 2Н), 6,48 (м, 1Н), 6,20 (м, 1Н), 5,02 (с, 1Н), 4,08 (м, 1Н); ИЭРМС m/z 394,94 ([М-Н]-).
Пример 72: Получение (E)-N-(4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-енил)бензил)ацетамида (СС1)

При перемешивании к раствору (Е)-(2-хлор-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)фенил)метанамина (0,3 г, 0,8 ммоля) в CH2Cl2 (10 мл) добавляли уксусный ангидрид (0,12 мл, 1,14 ммоля) и ТЭА (0,217 мл, 1,52 ммоля) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 6 ч. Реакционную смесь разбавляли с помощью H2O и экстрагировали с помощью CH2Cl2. Объединенный слой, содержащий CH2Cl2, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; 30-50% этилацетат в гексане) давала искомое соединение в виде почти белого твердого вещества (0,2 г, 60%) температура плавления 107-109°С;1H ЯМР (400 МГц, CDCl3) δ 7,37 (м, 3Н), 7,28 (м, 4Н), 6,60 (д, J=16,0 Гц, 1Н), 6,36 (дд, J=16,0, 8,0 Гц, 1Н), 5,75 (шир.с, 1Н), 4,46 (д, J=6 Гц, 2Н), 4,01 (м, 1Н), 2,11 (с, 3Н); ИЭРМС m/z 402,00 ([М+Н]+).
Соединения СС2-СС6, указанные в таблице 1, получали по методикам, раскрытым в примере 72. Кроме того, соединение DC56, указанное в таблице 1, получали из соединения DC55 по методикам, раскрытым в примере 72.
Пример 73: Получение (E)-N-(2-хлор-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)бензил)ацетамида (СС7)
При перемешивании к раствору (E)-(2-хлор-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)фенил)метанамина (0,3 г, 0,8 ммоля) в ДМФ (5 мл) добавляли 2,2,2-трифторпропановую кислоту (97 мг, 0,76 ммоля), HOBt⋅H2O (174 мг, 1,14 ммоля) и EDC⋅HCl (217 мг, 1,14 ммоля) и ДИПЭА (196 мг, 1,52 ммоля) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Реакционную смесь разбавляли с помощью H2O и экстрагировали с помощью EtOAc. Объединенный слой, содержащий EtOAc, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; этилацетат в гексане (30-50% давала искомое соединение в виде почти белого твердого вещества (0,2 г, 60%): температура плавления 127-128°С;1H ЯМР (400 МГц, CDCl3) δ 7,42 (м, 4Н), 7,24 (м, 2Н), 6,53 (д, J=16,0 Гц, 1Н), 6,36 (дд, J=16,0, 8,0 Гц, 1Н), 5,86 (шир.с, 1Н), 4,51 (д, J=6,0 Гц, 2Н), 4,05 (м, 1Н), 2,02 (с, 3Н); ИЭРМС m/z 436,03 ([М+Н]+).
Соединения СС8-СС28, указанные в таблице 1, получали по методикам, раскрытым в примере 73.
Пример 74: Получение (E)-N-(пиридин-2-илметил)-N-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2-(трифторметил)бензил)циклопропанкарбоксамида (СС29)
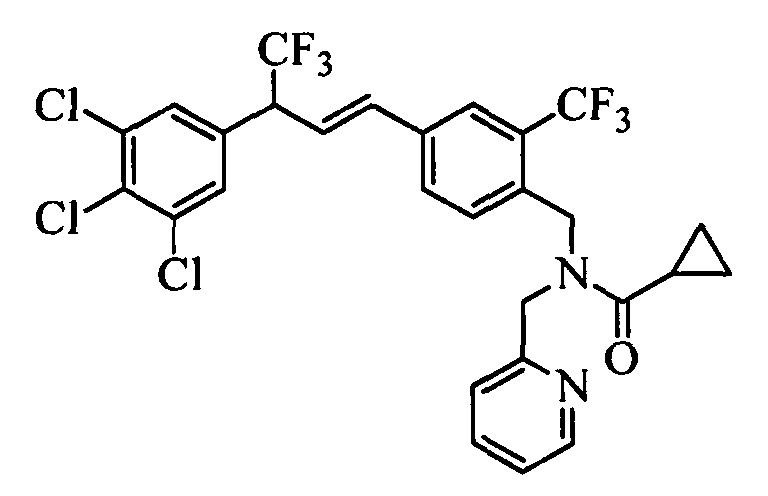
Стадия 1: (E)-1-(Пиридин-2-ил)-N-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2-(трифторметил)бензил)метанамин. (E)-(4-(4,4,4-Трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)-2-(трифторметил)фенил)метанамин (0,46 г, 1 ммоля) растворяли в МЕОН (3 мл). К смеси добавляли пиридин-2-карбальдегид (0,107 г, 1 ммоля). Реакционную смесь перемешивали в течение 1 ч. Через 1 ч добавляли NaBH4 (0,076 г, 2 ммоля) и выдерживали при температуре окружающей среды в течение 3 ч. Реакционную смесь концентрировали и получали маслообразный остаток. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; 30-50% EtOAc в гексане) давала искомое соединение в виде бледно-желтой жидкости (0,22 г, 40%):1H ЯМР (400 МГц, CDCl3) δ 8,58 (д, J=4,8 Гц, 1Н), 7,74 (м, 1Н), 7,62 (м, 2Н), 7,52 (м, 1Н), 7,4 (с, 2Н), 7,3 (м, 1Н), 7,2 (м, 2Н), 6,60 (д, J=16,0 Гц, 1Н), 6,38 (дд, J=16,0, 8,0 Гц, 1Н), 4,10 (м, 1Н), 4,02 (с, 2Н), 3,96 (с, 2Н); ИЭРМС m/z 552,95 ([М+Н]+); ИК (тонкая пленка) 3338, 1114, 808 см-1.
Стадия 2: (E)-N-(Пиридин-2-илметил)-N-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2-(трифторметил)бензил)циклопропанкарбоксамид. (E)-1-(Пиридин-2-ил)-N-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)-2-(трифторметил)бензил)метанамин (0,27 г, 0,05 ммоля) переносили в CH2Cl2 (3 мл). К смеси добавляли ТЭА (0,14 мл, 0,1 ммоля). Реакционную смесь перемешивали в течение 10 мин. Через 10 мин реакционную смесь охлаждали до 0°С и добавляли циклопропилкарбонилхлорид (0,08 мл, 0,075 ммоля). Реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч и затем промывали с помощью H2O и насыщенным водным раствором NaHCO3. Органический слой сушили над безводным Na2SO4 и выпаривали и получали бледно-желтое смолообразное вещество (0,15 г, 50%):1H ЯМР (400 МГц, CDCl3) δ 8,58 (д, J=4,6 Гц, 1Н), 7,74 (м, 1Н), 7,62 (м, 2Н), 7,52 (м, 1Н), 7,4 (с, 2Н), 7,3 (м, 1Н), 7,2 (м, 2Н), 6,60 (д, J=16,0 Гц, 1Н), 6,38 (дд, J=16,0, 8,0 Гц, 1Н), 5,02 (с, 1Н), 4,8 (с, 1Н), 4,8 (д, J=10 Гц, 2Н), 4,10 (м, 1Н), 1,8 (м, 1Н), 1,2 (м, 2Н), 0,6 (м, 2Н); ИЭРМС m/z 620,86 ([М-Н]-); ИК (тонкая пленка) 1645, 1115, 808 см-1.
Пример 75: Получение (Е)-N-(2-хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)-3-(метилсульфонил)пропанамида (СС30)
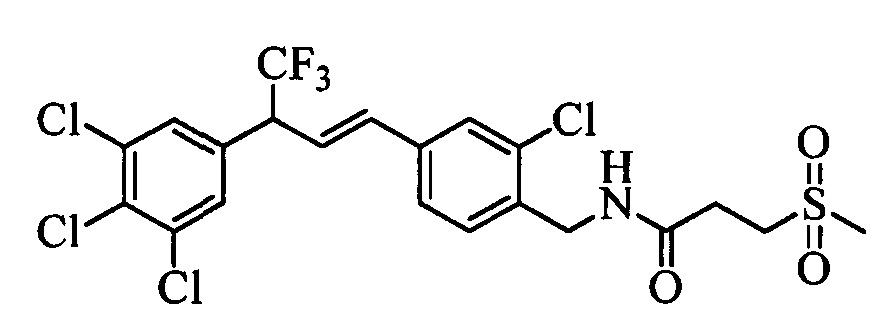
(Е)-N-(2-хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)-3-(метилтио)пропанамид (0,15 г, 0,28 ммоля) в течение 4 ч при температуре окружающей среды обрабатывали оксоном (0,175 г, 0,569 ммоля) в смеси 1:1 ацетон : вода (20 мл). Ацетон выпаривали и получали белое твердое вещество (0,095 г, 60%): температура плавления 101-104°С;1Н ЯМР (400 МГц, CDCl3) δ 7,41 (м, 4Н), 7,24 (м, 1Н), 6,53 (д, J=16,0 Гц, 1Н), 6,35 (дд, J=16,0, 8,0 Гц, 1Н), 6,12 (шир.с, 1Н), 4,53 (м, 2Н), 4,10 (м, 1Н), 3,42 (м, 2Н), 2,91 (с, 3Н), 2,78 (м, 2Н); ИЭРМС m/z 559,75 ([М-Н]-).
Пример 76: Получение (Е)-1-(2-хлор-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)бензил)-3-этилмочевины (СС31)

При перемешивании к раствору (Е)-(2-хлор-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)фенил)метанамина (0,2 г, 0,5 ммоля) в CH2Cl2 (5 мл) при 0°С добавляли ТЭА (0,141 мл, 1 ммоля) и этилизоцианат (0,053 г, 0,75 ммоля) и реакционную смесь перемешивали в течение 1 ч при 0°С. Реакционную смесь разбавляли с помощью CH2Cl2. Органический слой промывали с помощью Н2О и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (SiO2, 100-200 меш; 30-50% EtOAc в гексане) давала искомое соединение в виде твердого вещества (0,141 г, 60%): температура плавления 177-178°С;1H ЯМР (400 МГц, CDCl3) δ 7,58 (м, 2Н), 7,41 (м, 3Н), 7,24 (м, 1Н), 6,53 (д, J=16,0 Гц, 1Н), 6,35 (дд, J=16,0, 8,0 Гц, 1Н), 4,70 (шир.с, 1Н), 4,43 (с, 2Н), 4,08 (м, 1Н), 3,21 (м, 2Н), 1,25 (м, 3Н); ИЭРМС m/z 463 ([М-Н]-).
Соединения СС32-СС35, указанные в таблице 1, получали по методикам, раскрытым в примере 76.
Пример 77: Получение (E)-3-(2-хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)-1,1-диметилмочевины (СС36)
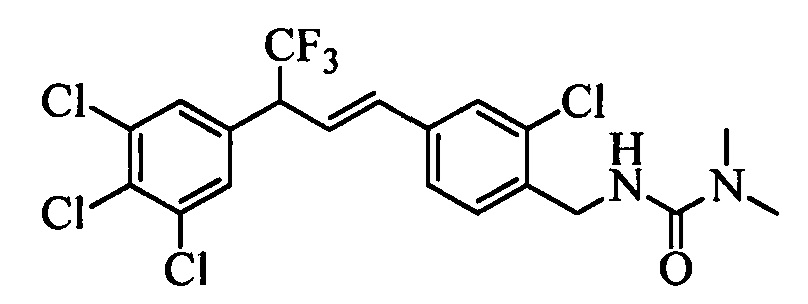
При перемешивании к раствору (E)-(2-хлор-4-(3-(3,4,5-трихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)фенил)метанамина (0,2 г, 0,5 ммоля) в CH2Cl2 (5 мл) при 0°С добавляли ТЭА (0,141 мл, 1 ммоля) и N,N-диметилкарбамоилхлорид (0,08 г, 0,075 ммоля) и реакционную смесь перемешивали в течение 1 ч при 0°С. Реакционную смесь разбавляли с помощью CH2Cl2. Органический слой промывали с помощью H2O и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (SiO2, 100-200 меш; 30-50% EtOAc в гексане) давала искомое соединение в виде твердого вещества (0,15 г, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,39 (м, 4Н), 7,28 (м, 1Н), 6,54 (д, J=16,0 Гц, 1Н), 6,34 (дд, J=16,0, 8,0 Гц, 1Н), 4,97 (шир.с, 1Н), 4,38 (д, J=6,0 Гц, 2Н), 4,10 (м, 1Н), 2,9 (с, 3Н), 2,7 (с, 3Н); ИЭРМС m/z 497 ([M-H]-); ИК (тонкая пленка) 3350, 1705, 1114, 808 см-1.
Пример 78: Получение (E)-1-(2-хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)-3-этилтиомочевины (СС37)
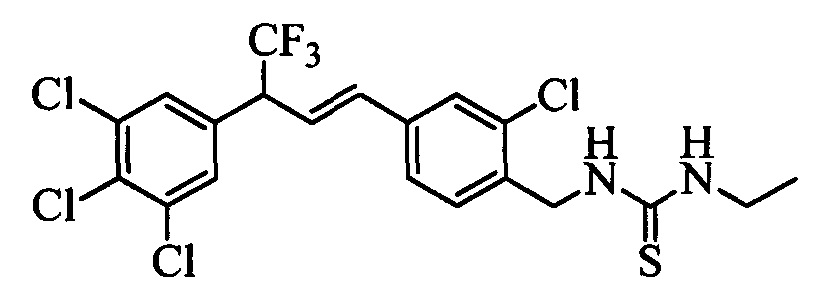
При перемешивании к раствору (E)-(2-хлор-4-(3-(3,4,5-трихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)фенил)метанамина (0,2 г, 0,5 ммоля) в CH2Cl2 (5 мл) при 0°С добавляли ТЭА (0,141 мл, 1 ммоля) и этилизотиоцианат (0,053 г, 0,75 ммоля) и реакционную смесь перемешивали в течение 1 ч при 0°С. Реакционную смесь разбавляли с помощью CH2Cl2. Органический слой промывали с помощью H2O и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (SiO2, 100-200 меш; 30-50% EtOAc в гексане) давала искомое соединение в виде твердого вещества (0,14 г, 60%); температура плавления 88-91°С;1H ЯМР (400 МГц, CDCl3) δ 7,49 (д, J=8 Гц, 1Н), 7,41 (д, J=7,2 Гц, 2Н), 7,26 (м, 2Н), 6,50 (д, J=16 Гц, 1Н), 6,35 (дд, J=16,0, 8,0 Гц, 1Н), 6,0 (шир.с, 1Н), 5,73 (шир.с, 1Н), 4,80 (шир.с, 2Н), 4,09 (м, 1Н), 1,23 (м, 3Н); ИЭРМС m/z 515,01 ([М+Н]+).
Соединение СС38, указанное в таблице 1, получали по методикам, раскрытым в примере 78.
Пример 79: Получение (E)-трет-бутил-(2-хлор-4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)бензил)-3-этилмочевины (СС39)
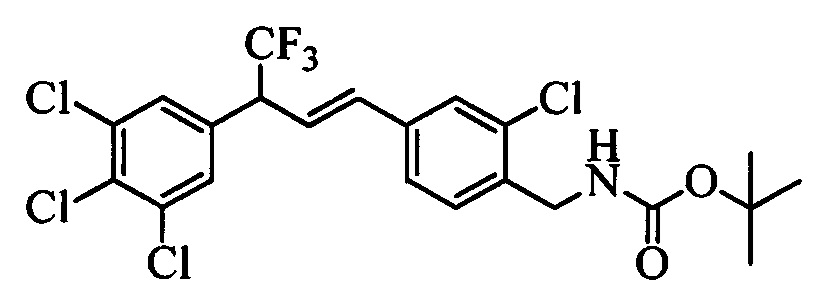
При перемешивании к раствору (E)-(2-хлор-4-(3-(3,4,5-трихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)фенил)метанамина (0,2 г, 0,5 ммоля в CH2Cl2 (5 мл) при 0°С добавляли ТЭА (0,141 мл, 1 ммоля) и ди-трет-бутилдикарбонат (0,163 мл, 0,75 ммоля) и реакционную смесь перемешивали в течение 4 ч при температуре окружающей среды. Реакционную смесь разбавляли с помощью CH2Cl2. Органический слой промывали с помощью H2O и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (SiO2, 100-200 меш; 10-20% EtOAc в гексане) давала искомое соединение в виде белого твердого вещества (0,147 г, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,39 (м, 4Н), 7,28 (м, 1Н), 6,54 (д, J=16,0 Гц, 1Н), 6,34 (дд, J=16,0, 8,0 Гц, 1Н), 4,97 (шир.с, 1Н), 4,38 (д, J=6,0 Гц, 2Н), 4,10 (м, 1Н), 1,53 (с, 9Н); ИЭРМС m/z 526,09 ([М-Н]-); ИК (тонкая пленка) 3350, 1705, 1114, 808 см-1.
Соединение СС40, указанное в таблице 1, получали по методикам, раскрытым в примере 79.
Пример 80: Получение (Е)-метил-2-((2-хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)амино)-2-оксоацетата (СС41)

При перемешивании к раствору (Е)-(2-хлор-4-(3-(3,4,5-трихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)фенил)метанамина (0,2 г, 0,5 ммоля) в CH2Cl2 (5 мл) при 0°С добавляли ТЭА (0,141 мл, 1 ммоля) и метил-2-хлор-2-оксоацетат (0,09 г, 0,75 ммоля) и реакционную смесь перемешивали в течение 1 ч при 0°С. Реакционную смесь разбавляли с помощью CH2Cl2. Органический слой промывали с помощью H2O и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (SiO2, 100-200 меш; 20% EtOAc в гексане) давала искомое соединение в виде твердого вещества (0,12 г, 50%):1Н ЯМР (400 МГц, CDCl3) δ 7,48 (м, 1Н). 7,43 (м, 3Н), 7,38 (м, 1Н), 7,23 (с, 1Н), 6,55 (д, J=16,0 Гц, 1Н), 6,36 (дд, J=16,0, 8,0 Гц, 1Н), 4,60 (д, J=4,4 Гц, 2Н), 4,18 (м, 1Н), 3,85 (с, 3Н); ИЭРМС m/z 512,22 ([М-Н]-); ИК (тонкая пленка) 1740, 1701, 1114, 808 см-1.
Пример 81: Получение (Е)-N1-(2-хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)-N2-(2,2,2-трифторэтил)оксаламида (СС42)
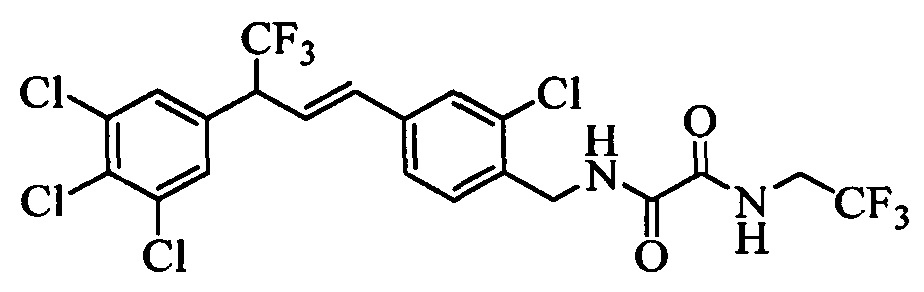
При перемешивании к раствору 2,2,2-трифторэтиламингидрохлорида (0,1 г, 0,77 ммоля) в CH2Cl2 (10 мл) по каплям добавляли триметилалюминий (2 М раствор в толуоле; 0,39 мл, 0,77 ммоля) и реакционную смесь перемешивали при 25°С в течение 30 мин. К реакционной смеси при 25°С по каплям добавляли раствор (Е)-метил-2-((2-хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)-2-оксоацетата (0,2 г, 0,38 ммоля) в CH2Cl2 (5 мл). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 18 ч, охлаждали до 25°С, реакцию останавливали 0,5 н. раствором HCl (50 мл) и экстрагировали с помощью EtOAc (2×50 мл). Объединенные органические экстракты промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью флэш-хроматографии (SiO2, 100-200 меш; 20%-40% EtOAc в н-гексане) и получали искомое соединение (0,13 г, 60%): температура плавления 161-163°С;1Н ЯМР (400 МГц, ДМСО-d6) δ 9,45 (шир.с, 2Н), 7,90 (с, 2Н), 7,75 (с, 1Н), 7,46 (с, 1Н), 7,28 (с, 1Н), 6,93 (м, 1Н), 6,75 (м, 1Н), 4,80 (м, 1Н), 4,40 (с, 2Н), 3,90 (с, 2Н); ИЭРМС m/z 578,96 ([М-Н]-).
Пример 82: Получение (E)-N-(2-хлор-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)пиридин-2-амина (СС43)
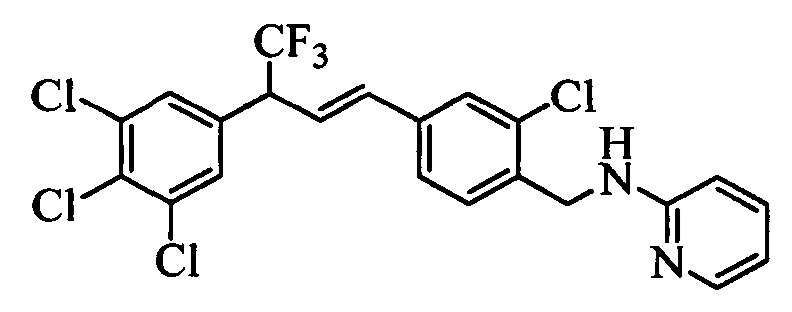
При перемешивании к раствору N-(2-хлор-4-винилбензил)пиридин-2-амина (0,3 г, 1,22 ммоля) в 1,2-дихлорбензоле (5 мл) добавляли 5-(1-бром-2,2,2-трифторэтил)-1,2,3-трихлорбензол (0,83 г, 2,44 ммоля), CuCl (24 мг, 0,24 ммоля) и 2,2-бипиридил (76 мг, 0,48 ммоля). Полученную реакционную смесь дегазировали аргоном в течение 30 мин и затем перемешивали при 180°С в течение 24 ч. После того, как по данным ТСХ реакцию считали завершенной, реакционную смесь охлаждали до температуры окружающей среды и фильтровали и фильтрат концентрировали при пониженном давлении. Очистка с помощью флэш-хроматографии (SiO2, 100-200 меш; 15% EtOAc в н-гексане) давала искомое соединение в виде почти белого твердого вещества (0,2 г, 35%): температура плавления 140-142°С;1H ЯМР (400 МГц, CDCl3) δ 8,11 (д, J=4,0 Гц, 1Н), 7,40 (м, 5Н), 7,22 (м, 1Н), 6,61 (м, 2Н), 6,35 (м, 2Н), 4,94 (шир.с, 1Н), 4,61 (д, J=6,4 Гц, 2Н), 4,11 (м, 1Н); ИЭРМС m/z 505,39 ([М+Н]+).
Пример 83: Получение (Е)-N-((3-хлор-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)-бут-1-ен-1-ил)пиридин-2-ил)метил)-3,3,3-трифторпропанамида (СС44)

При перемешивании к раствору (E)-(3-хлор-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)пиридин-2-ил)метанамина (0,1 г, 0,2 ммоля) в CH2Cl2 (5 мл) добавляли 3,3,3-трифторпропановую кислоту (45 мг, 0,350 ммоля), EDC⋅HCl (67 мг, 0,350 ммоля), HOBt⋅H2O (71 мг, 0,467 ммоля) и ДИПЭА (60,2 мг, 0,467 ммоля) и реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Реакционную смесь разбавляли с помощью CH2Cl2 и промывали с помощью H2O. Объединенный слой, содержащий CH2Cl2, промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; 15% EtOAc в петролейном эфире) давала искомое соединение в виде бледно-желтой жидкости (30 мг, 35%):1H ЯМР (400 МГц, CDCl3) δ 8,41 (с, 1Н), 7,77 (с, 1Н), 7,47 (шир.с, 1Н), 7,40 (с, 2Н), 6,58 (д, J=16,0 Гц, 1Н), 6,45 (дд, J=16,0, 8,0 Гц, 1Н), 4,68 (д, J=4,0 Гц, 2Н), 4,14 (м, 1Н), 3,24 (кв., J=10,8 Гц, 2Н); ИЭРМС m/z 536,88 ([М-Н]-); ИК (тонкая пленка) 3320, 1674, 1114, 808.
Соединение СС45, указанное в таблице 1, получали по методикам, раскрытым в примере 83.
Пример 84: Получение (E)-3,3,3-трифтор-N-((4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)нафталин-1-ил)метил)пропанамида (СС46)
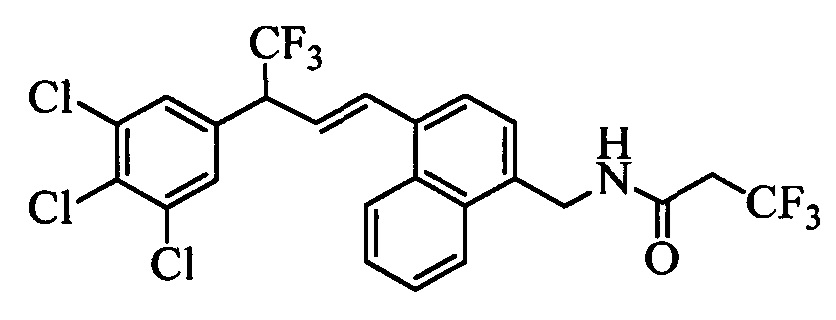
При перемешивании к раствору (E)-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)нафталин-1-ил)метанамина (0,1 г, 0,22 ммоля) в CH2Cl2 (8 мл) добавляли 3,3,3-трифторпропановую кислоту (0,032 г, 0,24 ммоля), HOBt⋅H2O (52 мг, 0,33 ммоля), EDC⋅HCl (0,065 г, 0,33 ммоля) и ДИПЭА (0,044 г, 0,45 ммоля) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Реакционную смесь разбавляли с помощью H2O и экстрагировали с помощью EtOAc (3×30 мл). Объединенный слой, содержащий EtOAc, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; 15% EtOAc в н-гексане) давала искомое соединение в виде смолообразного вещества (60 мг, 50%): температура плавления 151-153°С;1H ЯМР (400 МГц, CDCl3) δ 8,06 (м, 1Н), 7,61 (м, 4Н), 7,48 (с, 2Н), 7,44 (д, J=8,0 Гц, 1Н), 7,38 (м, 1Н), 6,42 (м, 1Н), 5,92 (шир.с, 1Н), 4,92 (м, 2Н), 4,24 (м, 1Н), 3,12 (м, 2Н); ИЭРМС m/z 554,04 ([М-Н]-).
Соединения СС47-СС48, указанные в таблице 1, получали по методикам, раскрытым в примере 84.
Пример 85: Получение (E)-1-этил-3-((4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)нафталин-1-ил)метил)мочевины (СС49)
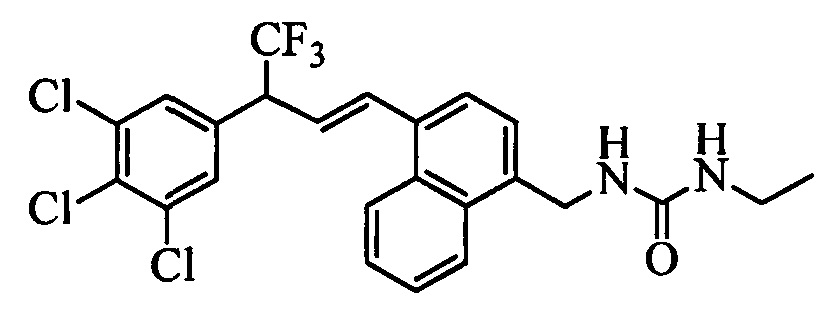
При перемешивании к раствору (Е)-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)нафталин-1-ил)метанамина (0,1 г, 0,22 ммоля) в CH2Cl2 при 0°С добавляли ТЭА (0,064 мл, 0,44 ммоля) и этилизоцианат (0,023 мл, 0,33 ммоля) и реакционную смесь перемешивали в течение 1 ч при 0°С. Реакционную смесь разбавляли с помощью CH2Cl2. Органический слой промывали с помощью Н2О и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (SiO2, 100-200 меш; 30% EtOAc в гексане) давала искомое соединение в виде твердого вещества (0,07 г, 60%): температура плавления 84-87°С;1H ЯМР (400 МГц, CDCl3) δ 8,06 (м, 1Н), 7,98 (м, 1Н), 7,61 (м, 3Н), 7,48 (с, 2Н), 7,44 (д, J=8,0 Гц, 1Н), 7,38 (м, 2Н), 6,42 (м, 1Н), 4,92 (с, 2Н), 4,6 (шир.с, 1Н), 4,24 (м, 1Н), 3,21 (м, 2Н), 1,2 (т, J=4,6 Гц, 3Н); ИЭРМС m/z 515,33 ([М+Н]+).
Пример 86: Получение (E)-N'-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенил)циклопропанкарбогидразида (СС50)
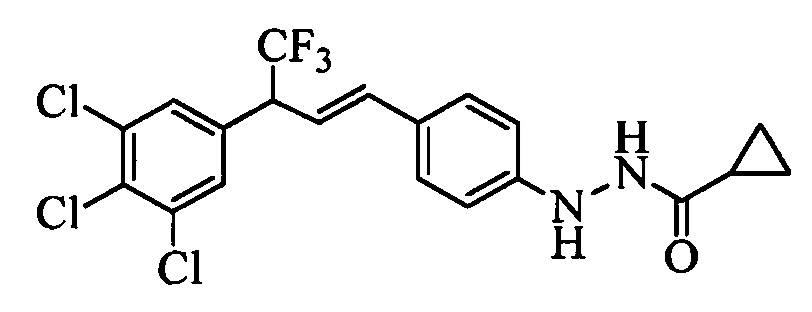
При перемешивании к раствору (E)-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенил)гидразина (0,1 г, 0. 3 ммоля) в CH2Cl2 (10 мл) добавляли ДИПЭА (65 мг, 0,51 ммоля), HOBt⋅H2O (59 мг, 0,38 ммоля), EDC⋅HCl (73 мг, 0,38 ммоля) и циклопропанкарбонилхлорид (0,024 г, 0,28 ммоля) и реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч. Реакционную смесь разбавляли насыщенным водным раствором NaHCO3 и экстрагировали с помощью CH2Cl2. Объединенный слой, содержащий CH2Cl2, промывали рассолом, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2; 5-25% EtOAc в петролейном эфире) давала искомое соединение в виде твердого вещества (65 мг, 55%): температура плавления 138-140°С;1H ЯМР (400 МГц, CDCl3) δ 9,81 (с, 1Н), 7,90 (с, 1Н), 7,84 (с, 2Н), 7,34 (д, J=8,4 Гц, 2Н), 6,65 (д, J=15,6 Гц, 1Н), 6,61 (м, 1Н), 6,57 (с, 1Н), 6,48 (дд, J=15,6, 8,8 Гц, 1Н), 4,74 (м, 1Н), 1,64 (м, 1Н), 0,75 (м, 4Н); ИЭРМС m/z 461,32 ([М-Н]-).
Соединение СС51, указанное в таблице 1, получали по методикам, раскрытым в примере 86.
Пример 87: Получение (E)-N-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенокси)циклопропанкарбоксамида (СС52)

При перемешивании к раствору (E)-О-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенил)гидроксиламина (0,15 г, 0,38 ммоля) в CH2Cl2 (5 мл) добавляли EDC⋅HCl (0,109 г, 0,569 ммоля), HOBt⋅H2O (0,087 г, 0,569 ммоля), ДИПЭА (0,097 г, 0,758 ммоля) и циклопропанкарбоновую кислоту (0,049 г, 0,569 ммоля). Полученную реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Реакционную смесь разбавляли с помощью H2O и экстрагировали с помощью CHCl3 (35 мл) Объединенный слой, содержащий CHCl3, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной флэш-хроматографии (SiO2; 20% EtOAc в гексане) давала искомое соединение в виде коричневой жидкости (0,06 г, 34%):1H ЯМР (400 МГц, CDCl3) δ 7,40 (с, 2Н), 7,18 (с, 1Н), 7,08 (с, 1Н), 6,85 (м, 1Н), 6,45 (м, 1Н), 6,65 (м, 1Н), 6,20 (м, 1Н), 5,55 (с, 1Н), 4,08 (м, 1Н), 1,90 (м, 1Н), 1,30-1,10 (м, 4Н); ИЭРМС m/z 464,87 ([М-Н]-).
Соединение СС53, указанное в таблице 1, получали по методикам, раскрытым в примере 87.
Пример 88: Получение (Z)-3,3,3-трифтор-N-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)пропанамида (СС54)
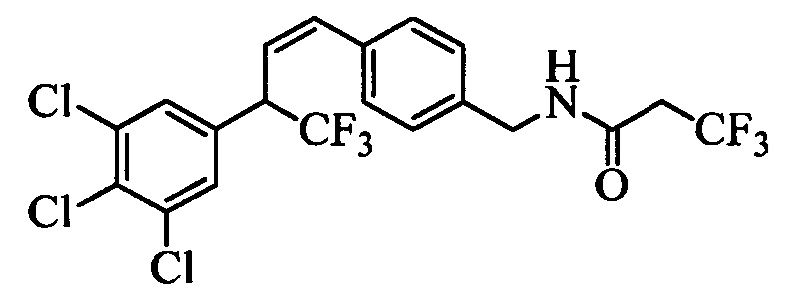
В сосуд из боросиликатного стекла помещали (E)-3,3,3-трифтор-N-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензил)пропанамид (133 мг, 0,269 ммоля) и диметилсульфоксид (ДМСО; 10 мл). Смесь на 72 ч помещали на расстоянии от 0,6 до 1 метров (м) от группы из восьми ультрафиолетовых ламп по 115 Вт Sylvania FR48T12/350BL/VHO/180 Fluorescent Tube Black Lights и от четырех по 115 Вт ламп дневного света Sylvania F48T12/D/VHO Straight T12 Fluorescent Tube Lights. Смесь концентрировали в вакууме и очищали с помощью хроматографии с обращенной фазой и получали искомое соединение в виде бесцветного масла (11 мг, 8%):1H ЯМР (300 МГц, CDCl3) δ 7,28 (с, 2Н), 7,25 (м, 2Н), 7,10 (д, J=8,0 Гц, 2Н), 6,89 (д, J=11,4 Гц, 1Н), 6,07 (шир.с, 1Н), 6,01 (м, 1Н), 4,51 (д, J=5,8 Гц, 2Н), 4,34 (м, 1Н), 3,12 (кв., J=7,5 Гц, 2Н);13С ЯМР (101 МГц, CDCl3) δ 162,44, 137,20, 135,38, 135,23, 134,82, 134,68, 131,71, 129,00, 128,80, 128,69, 128,10, 127,96, 122,63,76,70, 47,33 (кв., J=28 Гц), 43,59, 42,12 (кв., J=30 Гц); ИЭРМС m/z 504 ([М+Н]+).
Соединения DC46, АС93, АС94, указанные в таблице 1, получали по методикам, раскрытым в примере 88.
Пример 89: Получение 1-(1-бром-2,2,2-трифторэтил)-3-хлорбензола (DI2)
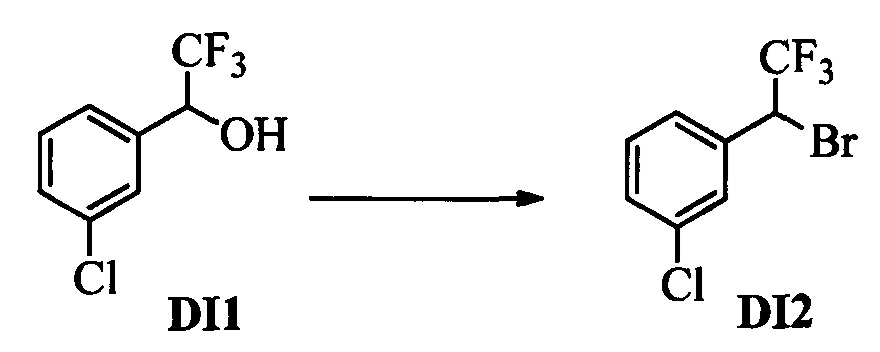
Искомое соединение синтезировали в две стадии с использованием промежуточного 1-(3-хлорфенил)-2,2,2-трифторэтанола (DI1, получали, как на стадии 1, методика В в примере 1); выделяли в виде бесцветного вязкого масла (1,5 г, 75%):1H ЯМР (400 МГц, CDCl3) δ 7,50 (с, 1Н), 7,42-7,35 (м, 3Н), 5,02 (м, 1Н), 2,65 (шир.с, 1Н)) и стадии 2 в примере 1 и выделяли (0,14 г, 22%):1H ЯМР (400 МГц, CDCl3) δ 7,50 (шир.с, 1Н), 7,42-7,35 (м, 3Н), 5,07 (м, 1Н).
Указанные ниже соединения получали по методикам, раскрытым в примере 89.
(1-Бром-2,2,2-трифторэтил)бензол (DI4)
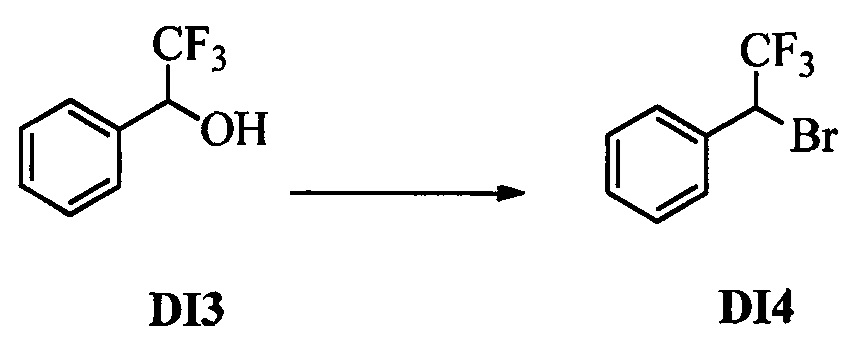
Выделяли 2,2,2-трифтор-1-фенилэтанол (DI3) (10 г, 80%):1H ЯМР (300 МГц, CDCl3) δ 7,48 (м, 2Н), 7,40 (м, 3Н), 5,02 (м, 1Н), 2,65 (д, J=7,1 Гц, 1Н). Искомое соединение (DI4) выделяли в виде жидкости (8,0 г, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,50 (м, 2Н), 7,40 (м, 3Н), 5,00 (кв., J=7,5 Гц, 1Н).
1-(1-Бром-2,2,2-трифторэтил)-3,5-диметилбензол (DI20)
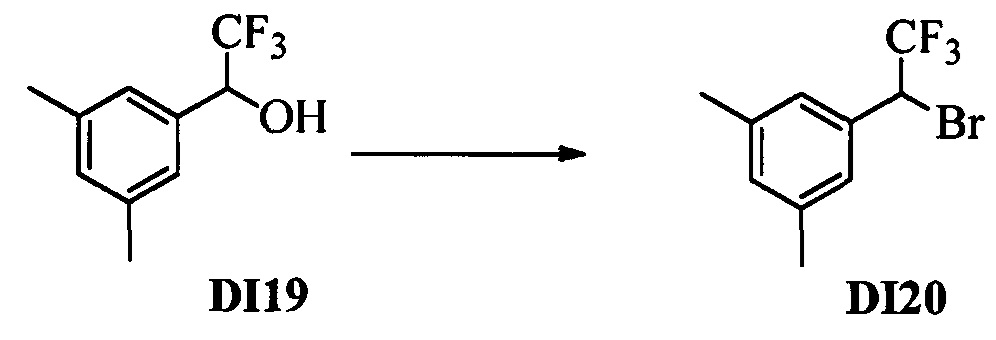
1-(3,5-Диметилфенил)-2,2,2-трифторэтанол (DI19) выделяли в виде почти белого твердого вещества:1H ЯМР (400 МГц, CDCl3) δ 7,05 (с, 2Н), 7,02 (с, 1Н), 4,95 (м, 1Н), 2,32 (с, 6Н); ИЭРМС m/z 204 ([М]-). Искомое соединение (DI20) выделяли (3,0 г, 51%).
1-(1-Бром-2,2,2-трифторэтил)-2,4-дихлорбензол (DI22)
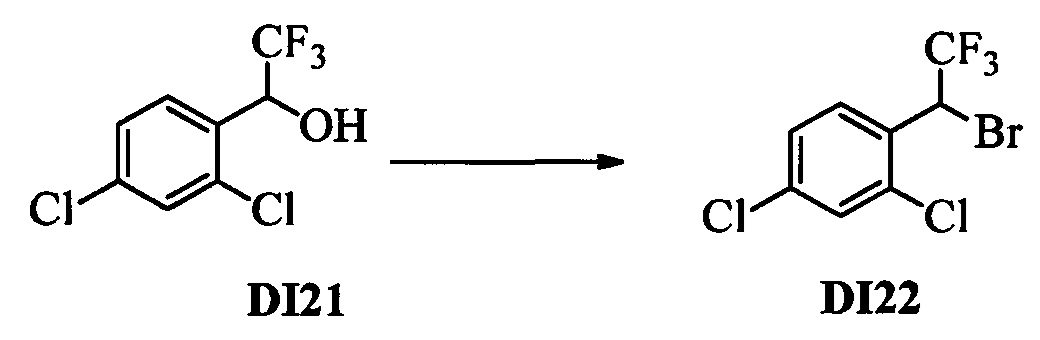
1-(2,4-Дихлорфенил)-2,2,2-трифторэтанол (DI21) выделяли в виде почти белого порошкообразного вещества (5,3 г, 61%): температура плавления 49-51°С;1H ЯМР (400 МГц, CDCl3) δ 7,62-7,66 (д, 1Н), 7,42-7,44 (д, 1Н), 7,32-7,36 (д, 1Н), 5,6 (м, 1Н), 2,7 (с, 1Н); ИЭРМС m/z 244 ([М]+). Выделяли искомое соединение (DI22) (3,2 г, 50%):1H ЯМР (400 МГц, CDCl3) δ 7,62-7,72 (м, 1Н), 7,4-7,42 (м, 1Н), 7,3-7,38 (м, 1Н), 5,7-5,8 (м, 1Н).
1-(1-Бром-2,2,2-трифторэтил)-2,3-дихлорбензол (DI24)

1-(2,3-Дихлорфенил)-2,2,2-трифторэтанол (DI23) выделяли в виде бледно-желтого масла (5,2 г, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,62-7,64 (д, 1Н), 7,52-7,54 (м, 1Н), 7,29-7,33 (т, 1Н), 5,6-5,76 (м, 1Н), 2,7 (с, 1Н); ИЭРМС m/z 243,9 ([М]+). Искомое соединение (DI24) выделяли в виде масла (8,7 г, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,62-7,71 (м, 1Н), 7,44-7,52 (м, 1Н), 7,27-7,3 (с, 1Н), 5,81-5,91 (м, 1Н).
2-(1-Бром-2,2,2-трифторэтил)-1,4-дихлорбензол (DI26)
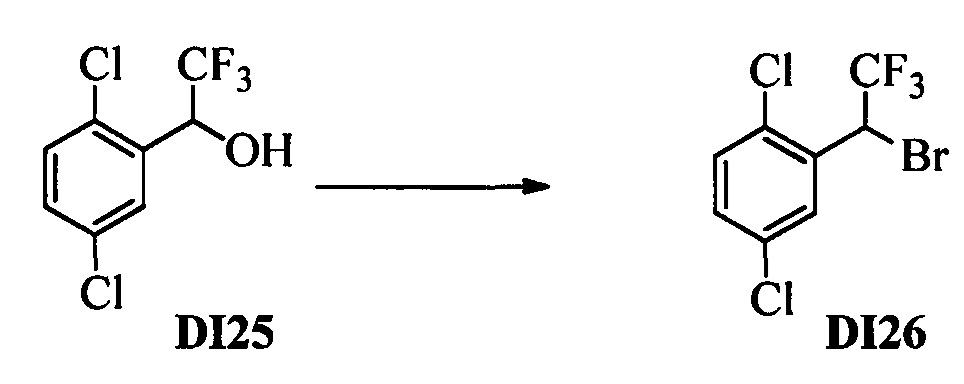
1-(2,5-Дихлорфенил)-2,2,2-трифторэтанол (DI25) выделяли в виде желтого масла (4,1 г, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,68-7,7 (с, 1Н), 7,3-7,37 (м, 2Н), 5,51-5,6 (м, 1Н), 2,7 (с, 1Н); ИЭРМС m/z 244 ([М]+)). Выделяли искомое соединение (DI26) (3,0 г, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,7-7,78 (м, 1Н), 7,3-7,4 (м, 2Н), 5,7-5,8 (м, 1Н).
1-(1-Бром-2,2,2-трифторэтил)-3,5-бис(трифторметил)бензол (DI28)
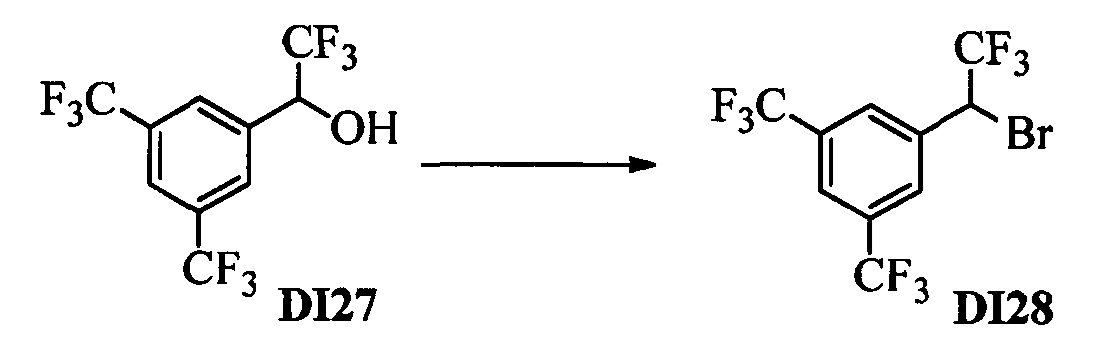
Выделяли 1-(3,5-бис(трифторметил)фенил)-2,2,2-трифторэтанол (DI27) (3,8 г, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,98 (м, 3Н), 5,25 (м, 1Н), 3,2 (шир., 1Н); ИЭРМС m/z 312,2 ([М]+). Получали искомое соединение (DI28) и его использовали в неочищенном виде.
1-(1-Бром-2,2,2-трифторэтил)-2,3,5-трихлорбензол (DI30)
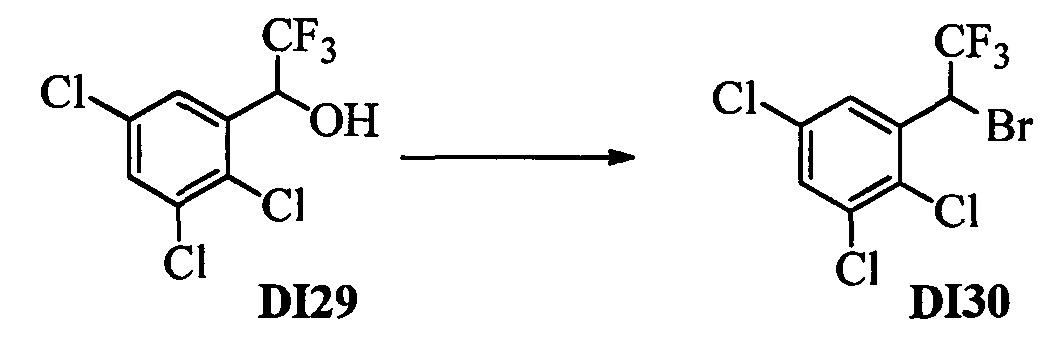
2,2,2-Трифтор-1-(2,3,5-трихлорфенил)этанол (DI29) выделяли в виде белого твердого вещества (4,0 г, 60%): температура плавления 113-115°С;1H ЯМР (400 МГц, CDCl3) δ 7,62 (д, 1Н), 7,50 (д, 1Н), 5,60-5,70 (м, 1Н), 2,75 (с, 1Н); ИЭРМС m/z 278,0 ([М+). Выделяли искомое соединение (DI30) (2,9 г, 60%):1H ЯМР (400 МГц, CDCl3) δ 7,70 (д, 1Н), 7,50 (д, 1Н), 5,72-5,82 (м, 1Н).
1-(1-Бром-2,2,2-трифторэтил)-3-хлор-5-(трифторметил)бензол (DI32)
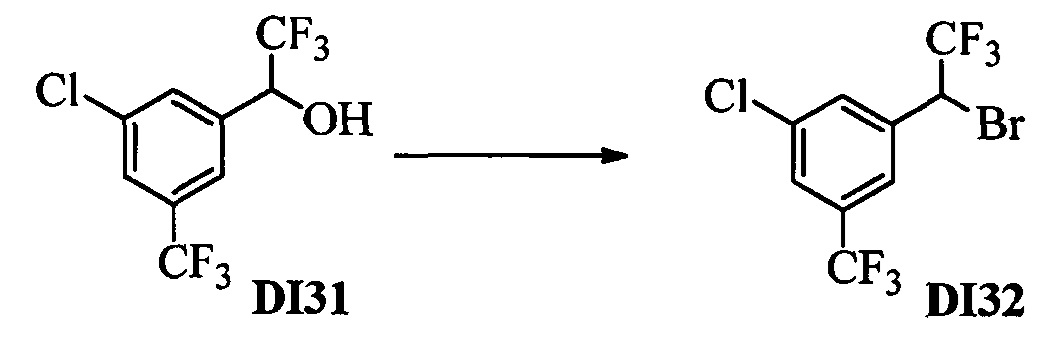
1-(3-Хлор-5-(трифторметил)фенил)-2,2,2-трифторэтанол (DI31) выделяли в виде бледно-желтого масла (2,0 г, 50%):1H ЯМР (400 МГц, CDCl3) δ 7,51 (м, 3Н), 5,08 (м, 1Н), 2,81 (с, 1Н); ИЭРМС m/z 278,1 ([М]+). Искомое соединение (DI32) выделяли в виде масла (2,0 г, 40%): ИЭРМС m/z 342 ([M]+).
5-(1-Бром-2,2,2-трифторэтил)-1,3-дихлор-2-метоксибензол (DI34)

1-(3,5-Дихлор-4-метоксифенил)-2,2,2-трифторэтанол (DI33) выделяли в виде почти белого твердого вещества (0,8 г, 60%); температура плавления 92-95°С:1H ЯМР (400 МГц, CDCl3) δ 7,41 (с, 2Н), 5,00 (м, 1Н), 3,89 (с, 3Н), 2,64 (м, 1Н); ИЭРМС m/z 274 ([М]+). Искомое соединение (DI34) выделяли в виде бесцветной жидкости (0,6 г, 57%).
Пример 90: Получение 1-(1-бром-2,2,2-трифторэтил)-3,5-дифторбензола (DI36)

Искомое соединение синтезировали в две стадии с использованием промежуточного 1-(3,5-дифторфенил)-2,2,2-трифторэтанола (DI35, получали, как на стадии 1, методика А в примере 1; выделяли в виде бесцветного масла (0,2 г, 75%):1H ЯМР (400 МГц, CDCl3) δ 7,05 (м, 2Н), 6,88 (м, 1Н), 5,06 (м, 1Н), 2,66 (с, 1Н); ИЭРМС m/z 212 ([М]+) и стадии 2 в примере 1 и выделяли (3,2 г, 50%);1H ЯМР (400 МГц, CDCl3) δ 7,05 (м, 2Н), 6,86 (м, 1Н), 5,03 (кв., J=7,4 Гц, 1Н).
Указанные ниже соединения получали по методикам, раскрытым в примере 90.
1-(1-Бром-2,2,2-трифторэтил)-4-хлорбензол (DI38)
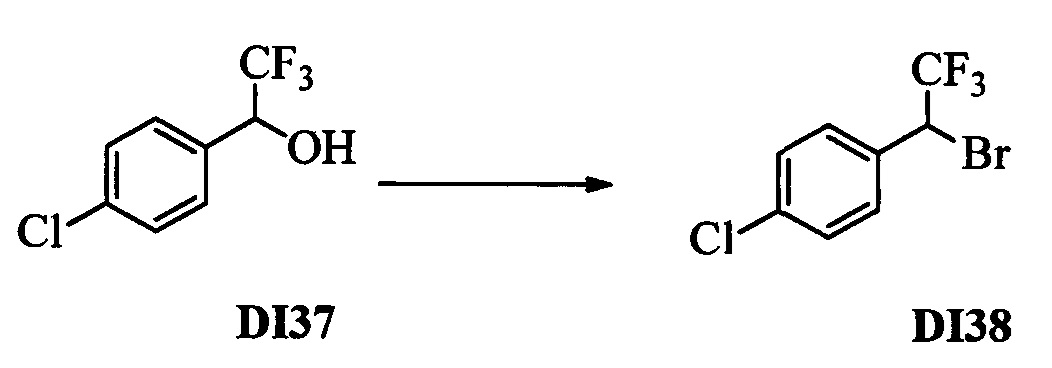
1-(4-Хлорфенил)-2,2,2-трифторэтанол (DI37) выделяли в виде бесцветного масла (5,0 г, 99%):1H ЯМР (400 МГц, CDCl3) δ 7,44-7,38 (м, 4Н), 5,05 (м, 1Н), 2,55 (с, 1Н); ИЭРМС m/z 210 ([М]+). Выделяли искомое соединение (DI38) (3,0 г, 46%):1H ЯМР (400 МГц, CDCl3) δ 7,45 (д, J=8,2 Гц, 2Н), 7,37 (д, J=8,2 Гц, 2Н), 5,10 (кв., J=7,2 Гц, 1Н).
1-(1-Бром-2,2,2-трифторэтил)-4-метоксибензол (DI40)

2,2,2-Трифтор-1-(4-метоксифенил)этанол (DI39) выделяли в виде бледно-желтой жидкости:1H ЯМР (400 МГц, CDCl3) δ 7,41 (д, J=8,8 Гц, 2Н), 6,95 (м, J=8,8 Гц, 2Н), 5,00 (м, 1Н), 3,82 (с, 3Н), 2,44 (с, 1Н); ИЭРМС m/z 206,1 ([М]+). Выделяли искомое соединение (DI40) (3,8 г, 62%).
1-(1-Бром-2,2,2-трифторэтил)-4-фторбензол (DI42)
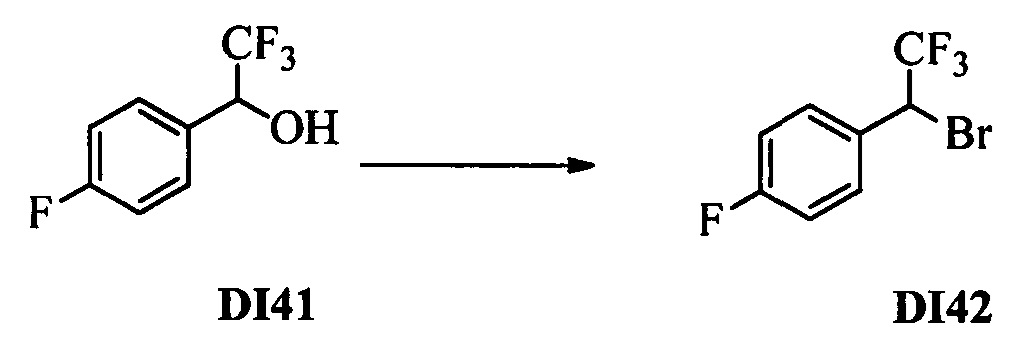
2,2,2-Трифтор-1-(4-фторфенил)этанол (DI41) выделяли в виде бесцветного масла (5 г, 99%):1H ЯМР (400 МГц, CDCl3) δ 7,48-7,45 (м, 2Н), 7,13-7,07 (м, 2Н), 5,06 (м, 1Н), 2,53 (с, 1Н); ИЭРМС m/z 194 ([М]+). Получали искомое соединение (DI42) и его использовали в неочищенном виде в качестве промежуточного продукта.
1-(1-Бром-2,2,2-трифторэтил)-4-метилбензол (DI44)
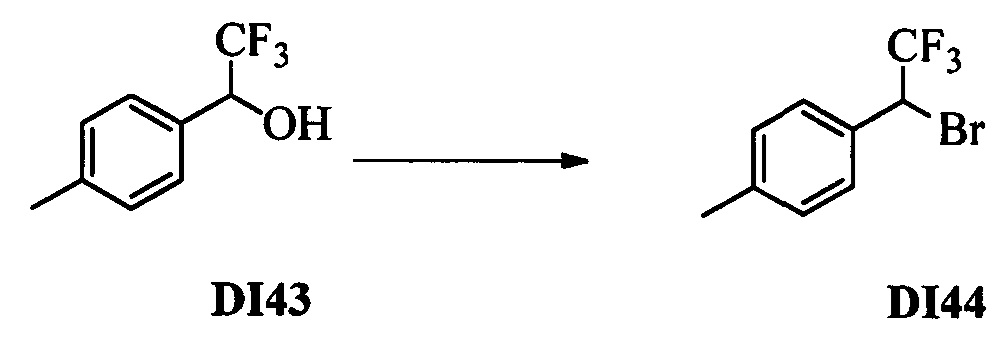
2,2,2-Трифтор-1-(п-толил)этанол (DI43) выделяли в виде бесцветного масла (5,0 г, 99%):1H ЯМР (400 МГц, CDCl3) δ 7,37 (д, J=8,0 Гц, 2Н), 7,23 (д, J=8,0 Гц, 2Н), 5,02 (м, 1Н), 2,46 (м, 1Н), 2,37 (с, 3Н); ИЭРМС m/z 190 ([М]+). Выделяли искомое соединение (DI44) (3,0 г, 45%).
1-(1-Бром-2,2,2-трифторэтил)-3-фторбензол (DI46)
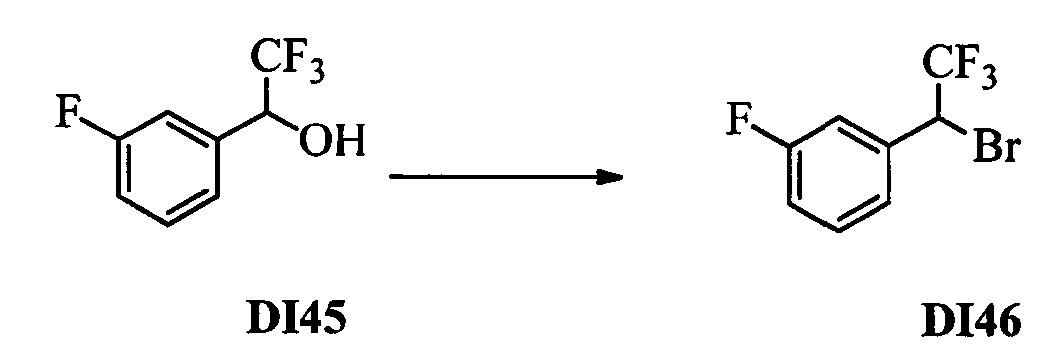
2,2,2-Трифтор-1-(3-фторфенил)этанол (DI45) выделяли в виде бесцветного вязкого масла (2,8 г, 93%):1H ЯМР (400 МГц, CDCl3) δ 7,41 (м, 1Н), 7,25 (м, 2Н), 7,14 (м, 1Н), 5,06 (м, 1Н), 2,60 (с, 1Н); ИЭРМС m/z 194 ([М]+). Выделяли искомое соединение (DI46) (2,0 г, 61%).
1-(1-Бром-2,2,2-трифторэтил)-2-фторбензол (DI48)
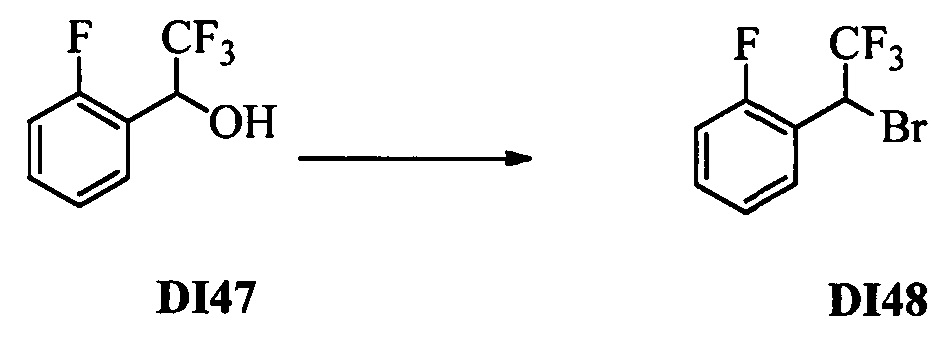
2,2,2-Трифтор-1-(2-фторфенил)этанол (DI47) выделяли в виде бесцветного масла (2,5 г, 99%):1H ЯМР (400 МГц, CDCl3) δ 7,40 (м, 1Н), 7,43 (м, 1Н), 7,24 (м, 1Н), 7,13 (м, 1Н), 5,42 (м, 1Н), 2,65 (с, 1Н); ИЭРМС m/z 194 ([М]+). Выделяли искомое соединение (DI48) (2,0 г, 61%):1H ЯМР (400 МГц, CDCl3) δ 7,61 (м, 1Н), 7,40 (м, 1Н), 7,23 (м, 1Н), 7,10 (м, 1Н), 5,40 (м, 1Н); ГХМС m/z 255 ([М-Н]-).
Пример 91: Получение 4-(1H-1,2,4-триазол-1-ил)бензальдегида (DI5)

При перемешивании к раствору 4-фторбензальдегида (10,0 г, 80,6 ммоля) в ДМФ (150 мл) добавляли K2CO3 (13,3 г, 96,7 ммоля) и 1,2,4-триазол (6,67 г, 96,7 ммоля) и полученную реакционную смесь перемешивали при 120°С в течение 6 ч. После завершения реакции (по данным ТСХ) реакционную смесь разбавляли с помощью H2O и экстрагировали с помощью EtOAc (3×100 мл). Объединенный слой, содержащий EtOAc, промывали с помощью H2O и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде твердого вещества (9,0 г, 65%): температура плавления 145-149°С:1H ЯМР (400 МГц, CDCl3) δ 10,08 (с, 1Н), 8,70 (с, 1Н), 8,16 (с, 1Н), 8,06 (д, J=8,0 Гц, 2Н), 7,92 (д, J=8,0 Гц, 2Н); ИЭРМС m/z 173,9 ([М+Н]+).
Указанное ниже соединение получали по методикам, раскрытым в примере 91.
5-Формил-2-(1H-1,2,4-триазол-1-ил)бензонитрил (DI49)
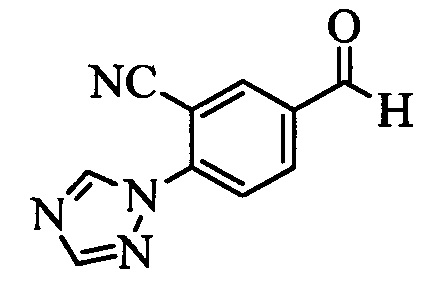
Выделяли искомое соединение (2,8 г, 60%);1H ЯМР (400 МГц, CDCl3) δ 10,10 (с, 1Н), 8,98 (с, 1Н), 8,35 (с, 1Н), 8,30 (д, 1Н), 8,22 (с, 1Н), 8,07 (д, 1Н); ИК (тонкая пленка) 3433, 3120, 1702, 1599, 1510 см-1.
2-Хлор-4-(1H-1,2,4-триазол-1-ил)бензальдегид (DI50)

Искомое соединение выделяли в виде почти белого твердого вещества (3,0 г, 40%): температура плавления 149-151°С;1H ЯМР (400 МГц, CDCl3) δ 10,05 (с, 1Н), 8,74 (с, 1Н), 8,17 (с, 1Н), 8,10 (с, 1Н), 7,90 (м, 2Н); ИЭРМС m/z 208,10 ([М+Н]+).
5-Метил-4-(1H-1,2,4-триазол-1-ил)бензальдегид (DI51)
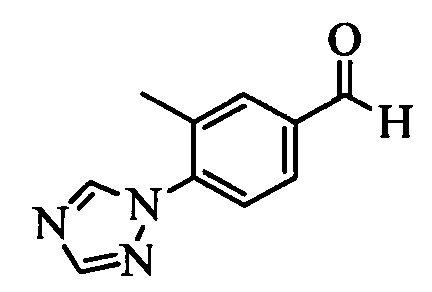
Искомое соединение выделяли в виде белого твердого вещества (0,5 г, 74%): температура плавления 109-111°С;1H ЯМР (400 МГц, D6-ДМСО) δ 10,06 (с, 1Н), 9,00 (с, 1Н), 8,30 (с, 1Н), 7,99 (с, 1Н), 7,92 (д, J=9,2 Гц, 1Н), 7,69 (д, J=9,2 Гц, 1Н), 2,30 (с, 3Н); ИЭРМС m/z 188,13 ([М+Н]+).
Пример 92: Получение 5-формил-2-(3-нитро-1H-1,2,4-триазол-1-ил)бензонитрила (DI52)

При перемешивании к раствору 2-фтор-5-формилбензонитрилг (0,5 г, 3,3 ммоля) в ДМФ (25 мл) добавляли K2CO3 (0,68 г, 4,95 ммоля) и 3-нитро-1,2,4-триазол (0,45 г, 4,2 ммоля) и полученнув реакционную смесь перемешивали при температуре окружающей среды в течение 14 ч. После завершения реакции (по данным ТСХ) реакционную смесь разбавляли водой и экстрагировали с помощь EtOAc. Объединенный слой, содержащий EtOAc, промывали водой и рассолом, затем сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде бледно-желтого твердого вещества (0,36 г, 45%): температуре плавления 170-172°С;1H ЯМР (300 МГц, ДМСО-d6) δ 10,12 (с, 1Н), 9,61 (с, 1Н), 8,69 (с, 1Н), 8,45 (д, J=9,3 Гц, 1Н), 8,23 (д, J=9,3 Гц, 1Н); ИЭРМС m/z 242,3 ([М-Н]-); ИК (тонкая пленка) 2238, 1705, 1551, 1314 см-1.
Пример 93: Получение 4-(3-метил-1H-1,2,4-триазол-1-ил)бензальдегида (DI53)
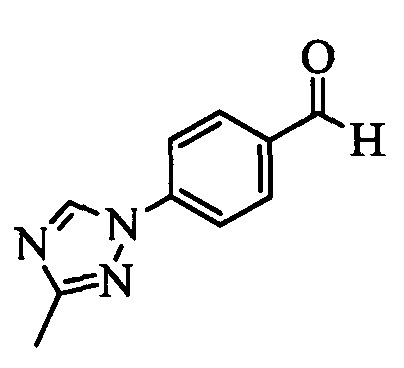
При перемешивании к раствору 4-фторбензальдегида (5,0 г, 40,32 ммоля) в ДМФ (50 мл), добавляли K2CO3 (3,34 г, 40,32 ммоля) и 3-метил-1,2,4-триазол (3,34 г, 40,32 ммоля) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 4 ч. После завершения реакции (по данным ТСХ) реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc (3×). Объединенный слой, содержащий EtOAc, промывали водой и рассолом, затем сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде белого твердого вещества (4,1 г, 60%): температура плавления 125-128°С;1H ЯМР (400 МГц, CDCl3) δ 10,05 (с, 1Н), 8,76 (с, 1Н), 8,02 (д, 2Н), 7,85 (д, 2Н), 2,50 (с, 3Н); ИЭРМС m/z 188,04 ([М+Н]+).
Указанное ниже соединение получали по методикам, раскрытым в примере 93.
4-(1H-1,2,4-Триазол-1-ил)-3-(трифторметил)бензальдегид (DI54)
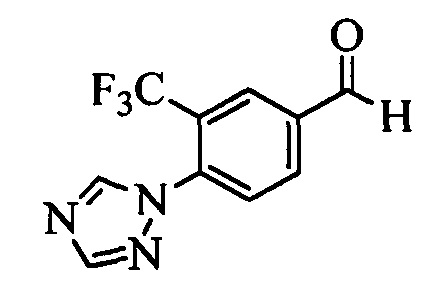
Искомое соединение выделяли в виде белого твердого вещества (1,05 г, 60%): температура плавления 81-83°С;1H ЯМР (400 МГц, CDCl3) δ 10,15 (с, 1Н), 8,43 (с, 1Н), 8,37 (с, 1Н), 8,25 (д, J=7,2 Гц, 1Н), 8,18 (с, 1Н), 7,79 (д, J=7,2 Гц, 1Н); ИЭРМС m/z 241,0 ([М]+).
4-(3-Нитро-1H-1,2,4-Триазол-1-ил)бензальдегид (DI55)
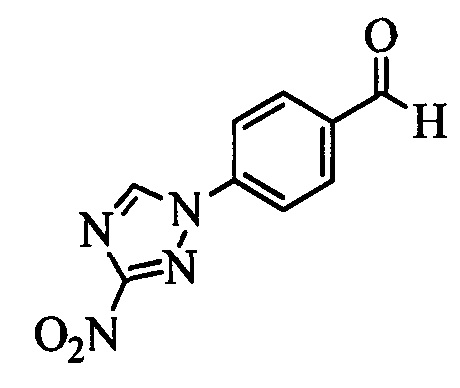
Искомое соединение выделяли в виде бледно-желтого твердого вещества (0,10 г, 23%): температура плавления 159-161°С;1H ЯМР (400 МГц, CDCl3) δ 10,10 (с, 1Н), 8,89 (с, 1Н), 8,15 (м, 2Н), 8,00 (м, 2Н); ИЭРМС m/z 217,11 ([М-Н]-).
3-Бром-4-(1H-1,2,4-триазол-1-ил)бензальдегид (DI56)

Искомое соединение выделяли в виде белого твердого вещества (3,2 г, 51%): температура плавления 126-128°С;1H ЯМР (400 МГц, CDCl3) δ 10,04 (с, 1Н), 8,69 (с, 1Н), 8,27 (м, 1Н, 8,18 (с, 1Н) 7,99 (д, J=9,2 Гц, 1Н), 7,76 (д, J=9,2 Гц, 1Н); ИЭРМС m/z 250,9 ([М]+).
5-Формил-2-(3-метил-1H-1,2,4-триазол-1-ил)бензонитрил (DI57)

Искомое соединение выделяли в виде белого твердого вещества (0,13 г, 30%): температура плавления 147-149°С;1H ЯМР (400 МГц, CDCl3) δ 10,07 (с, 1Н), 8,89 (с, 1Н), 8,32 (д, J=1,8 Гц, 1Н), 8,24 (дд, J=8,6, 1,3 Гц, 1Н), 8,06 (д, J=8,6 Гц, 1Н), 2,54 (с, 3Н); ИЭРМС m/z 213,09 ([М+Н]+); ИК (тонкая пленка) 2239, 1697 см-1.
3-Нитро-4-(1H-1,2,4-триазол-1-ил)бензальдегид (DI58)
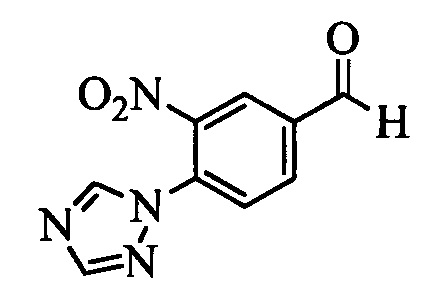
Искомое соединение выделяли в виде бледно-желтого твердого вещества (3,0 г, 60%): температура плавления 116-118°С;1H ЯМР (400 МГц, CDCl3) δ 10,15 (с, 1Н), 8,48 (с, 1Н), 8,46 (с, 1Н), 8,26 (д, J=6,9 Гц, 1Н), 8,16 (с, 1Н), 7,83 (д, J=6, 9 Гц, 1Н); ИЭРМС m/z 219,00 ([M+H]+).
Пример 94: Получение 1-(4-винилфенил)-1H-1,2,4-триазола (DI59)
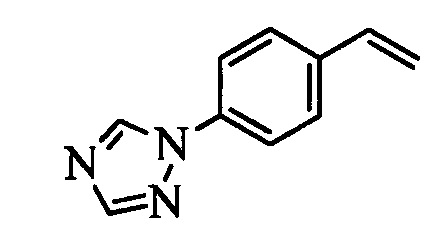
При перемешивании к раствору 4-[1,2,4]триазол-1-илбензальдегида (9,0 г, 52 ммоля) в 1,4-диоксане (100 мл) при комнатной температуре добавляли K2CO3 (10,76 г, 78 ммоля) и метилтрифенилфосфонийбромид (22,2 г, 62,4 ммоля). Полученную реакционную смесь нагревали при 70°С в течение 18 ч. После завершения реакции (по данным ТСХ) реакционную смесь охлаждали до комнатной температуры и фильтровали и полученный фильтрат концентрировали при пониженном давлении. Очистка с помощью флэш-хроматографии (SiO2, 100-200 меш; 25-30% EtOAc в петролейном эфире) и получали искомое соединение в виде белого твердого вещества (5,6 г, 63%): ИЭРМС m/z 172,09 ([М+Н]+).
Указанное ниже соединение получали по методикам, раскрытым в примере 94.
1-(2-Метил-4-винилфенил)-1H-1,2,4-триазол (DI60)
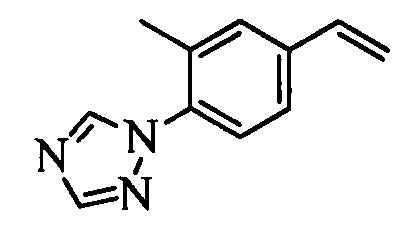
Искомое соединение выделяли в виде почти белого твердого вещества (1,5 г, 76%):1H ЯМР (400 МГц, CDCl3) δ 8,25 (с, 1Н), 8,11 (с, 1Н), 7,35 (м, 2Н), 7,27 (д, J=8,7 Гц, 1Н), 6,74 (м, 1Н), 5,82 (д, J=17,3 Гц, 1Н), 5,36 (д, J=10,0 Гц, 1Н), 2,25 (с, 3Н); ИЭРМС m/z 186,14 ([М+Н]+).
2-(1H-1,2,4-Триазол-1-ил)-5-винилбензонитрил (DI61)
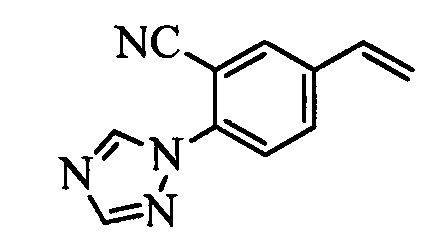
Искомое соединение выделяли в виде почти белого твердого вещества (1,40 г, 71%): температура плавления 126-129°С;1H ЯМР (400 МГц, CDCl3) δ 8,76 (с, 1Н), 8,18 (с, 1Н), 7,82-7,84 (м, 1Н), 7,72-7,80 (м, 2Н), 6,70-6,80 (дд, J=17,6, 10,8 Гц, 1Н), 5,90-5,95 (д, J=17,6 Гц, 1Н), 5,50-5,70 (д, J=10,8 Гц, 1Н); ИЭРМС m/z 197,03 ([М+Н]+).
Пример 95: Получение 2-(3-нитро-1H-1,2,4-триазол-1-ил)-5-винилбензонитрила (DI62)

При перемешивании к раствору 5-формил-2-(3-нитро-1H-1,2,4-триазол-1-ил)бензонитрила (0,36 г, 1,49 ммоля) в 1,4-диоксане (25 мл) добавляли K2CO3 (0,3 г, 2,2 ммоля) и метилтрифенилфосфонийбромид (0,63 г, 1,79 ммоля). Полученную реакционную смесь нагревали при 100°С в течение 18 ч. После завершения реакции (по данным ТСХ) реакционную смесь охлаждали до комнатной температуры и фильтровали и полученный фильтрат концентрировали при пониженном давлении. Очистка с помощью флэш-хроматографии (SiO2, 100-200 меш; 25-30% EtOAc в петролейном эфире) давала искомое соединение в виде твердого вещества (0,25 г, 70%): температура плавления 103-105°С;1H ЯМР (400 МГц, ДМСО-d6) δ 9,50 (с, 1Н), 8,34 (м, 1Н), 7,98 (д, J=7,8 Гц, 1Н), 7,68 (д, J=7,8 Гц, 1Н), 6,87 (м, 1Н), 6,20 (д, J=15,7 Гц, 1Н), 5,56 (д, J=11,8 Гц, 1Н); ИЭРМС m/z 240,27 ([М-Н]-); ИК (тонкая пленка) 2240, 1514, 1312 см-1.
Указанное ниже соединение получали по методикам, раскрытым в примере 95.
1-(3-Хлор-4-винилфенил)-1H-1,2,4-триазол (DI63)
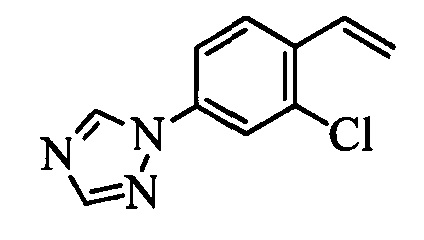
Искомое соединение выделяли в виде почти белого твердого вещества (2,3 г, 80%): температура плавления 134-137°С;1H ЯМР (400 МГц, CDCl3) δ 8,56 (с, 1Н), 8,11 (с, 1Н), 7,76 (с, 1Н), 7,70 (д, J=9,0 Гц, 1Н), 7,57 (д, J=9,0 Гц, 1Н), 7,10 (м, 1Н), 5,80 (д, J=17,2 Гц, 1Н), 5,47 (д, J=12,4 Гц, 1Н); ИЭРМС m/z 206,04 ([M+H]+.
3-Метил-1-(4-винилфенил)-1Н-1,2,4-триазол (DI64)
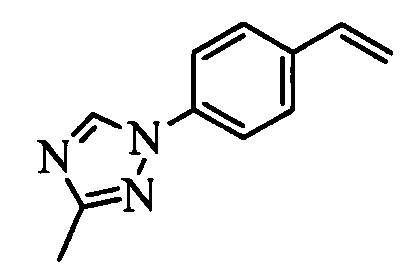
Искомое соединение выделяли в виде белого твердого вещества (0,6 г, 60%): температура плавления 109-111°С;1H ЯМР (400 МГц, CDCl3) δ 8,42 (с, 1Н), 7,40-7,60 (м, 4Н), 6,70-7,00 (дд, J=17,6, 10,8 Гц, 1Н), 5,80 (д, J=17,6 Гц, 1Н), 5,30 (д, J=17,6 Гц, 1Н), 2,50 (с, 3Н); ИЭРМС m/z 186,20 ([М+Н]+).
1-(2-(Трифторметил)-4-винилфенил)-1Н-1,2,4-триазол (DI65)
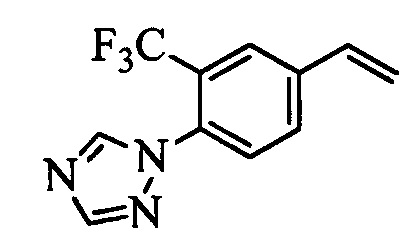
Искомое соединение выделяли в виде бесцветного масла (0,6 г, 60%):1H ЯМР (400 МГц, CDCl3) δ 8,32 (с, 1Н), 8,14 (с, 1Н), 7,84 (с, 1Н), 7,72 (д, J=8,0 Гц, 1Н), 7,50 (д, J=7,6 Гц, 1Н), 6,70-6,90 (дд, J=17,6, 10,8 Гц, 1Н), 5,90-6,00 (д, J=17,6 Гц, 1Н), 5,50-5,80 (д, J=10,8 Гц 1Н); ИЭРМС m/z 240,16 ([M+H]+).
3-Нитро-1-(4-винилфенил)-1H-1,2,4-триазол (DI66)
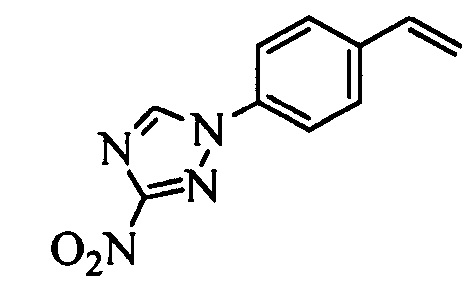
Искомое соединение выделяли в виде бледно-желтого твердого вещества (61 мг, 20%): температура плавления 137-139°С;1H ЯМР (400 МГц, CDCl3) δ 8,60 (с, 1Н), 7,68 (д, J=7,7 Гц, 2Н),7,60 (д, J=8,3 Гц, 2Н), 6,77 (дд, J=17,7, 10,8, 1Н), 5,87 (д, J=17,7 Гц, 1Н), 5,42 (д, J=10,8 Гц, 1Н); ИЭРМС m/z 217,28 ([М+Н]+).
1-(2-Бром-4-винилфенил)-1Н-1,2,4-триазол (DI67)
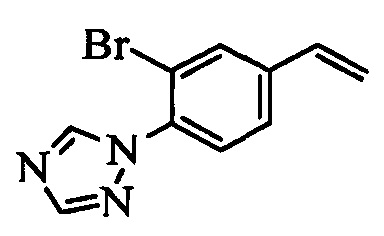
Искомое соединение выделяли в виде белого твердого вещества (1,2 г, 40%): температура плавления 75-77°С;1H ЯМР (400 МГц, CDCl3) δ 8,48 (с, 1Н), 8,12 (с, 1Н), 7,75 (с, 1Н) 7,42 (с, 2Н), 6,70 (м, 1Н), 5,83 (д, J=18 Гц, 1Н), 5,42 (д, J=12 Гц, 1Н); ИЭРМС m/z 249,1 ([М]+).
2-(3-Метил-1H-1,2,4-триазол-1-ил)-5-винилбензонитрил (DI68)
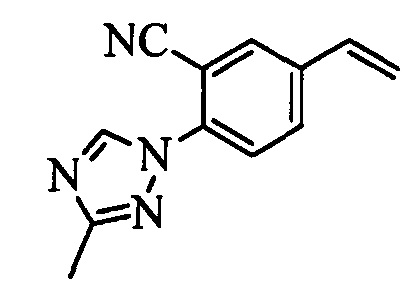
Искомое соединение выделяли в виде почти белого твердого вещества (0,6 г, 60%): температура плавления 96-97°С;1H ЯМР (400 МГц, CDCl3) δ 8,66 (с, 1Н), 7,80 (с, 1Н), 7,74 (м, 2Н), 6,73 (дд, J=17,6 Гц, 10,8 Гц, 1Н), 5,88 (д, J=17,6 Гц, 1Н), 5,49 (д, J=10,8 Гц, 1Н), 2,52 (с, 3Н); ИЭРМС m/z 211,10 ([М+Н]+); ИК (тонкая пленка) 2229 см-1.
1-(2-Нитро-4-винилфенил)-1H-1,2,4-триазол (DI69)

Искомое соединение выделяли в виде желтого твердого вещества (1,78 г, 60%): температура плавления 102-104°С;1H ЯМР (400 МГц, CDCl3) δ 8,40 (с, 1Н), 8,12 (с, 1Н), 8,02 (с, 1Н), 7,72-7,76 (д, J=8,0 Гц, 1Н), 7,52-7,56 (д, J=17,6 Гц, 1Н), 6,70-6,82 (дд, J=17,6, 10,8 Гц, 1Н), 5,85-6,00 (д, J=17,6 Гц, 1Н), 5,50-5,60 (д, J=10,8, Гц 1Н); ИЭРМС m/z 217,0 ([М+Н]+).
Пример 96: Получение 3-метил-2-(1H-1,2,4-триазол-1-ил)-5-винилбензонитрила (DI70)
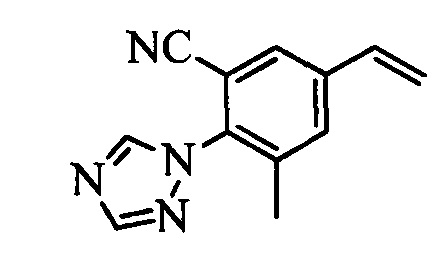
Стадия 1. 5-Бром-2-фтор-3-метилбензальдегид: При перемешивании к раствору диизопропиламина (4,01 г, 39,88 ммоля) в ТГФ (20 мл) при -78°С медленно по каплям в течение 10 мин добавляли н-бутиллитий (1,6 М в гексане) (19,9 мл, 31,91 ммоля), реакционную смесь перемешивали при -78°С в течение 30 мин. При -78°С добавляли раствор 4-бром-1-фтор-2-метилбензола (5,0 г, 26,6 ммоля) в ТГФ (30,0 мл) и реакционную смесь перемешивали в течение 1 ч при такой же температуре. Добавляли ДМФ (5,0 мл) и перемешивали при -78°С в течение еще 30 мин. За протеканием реакции следили с помощью ТСХ; затем реакцию останавливали 1 н. водным раствором HCl при 0°С. Водный слой экстрагировали диэтиловым эфиром, промывали водой и насыщенным рассолом. Объединенный органический слой сушили над безводным Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение, которое очищали с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; при элюировании смесью 5% этилацетат/петролейный эфир), и получали искомое соединение в виде белого твердого вещества (3,6 г, 64%); температура плавления 48-50°С:1H ЯМР (400 МГц, CDCl3) δ 8,33 (с, 1Н), 8,22 (с, 1Н), 7,67 (с, 1Н), 7,60 (с, 1Н), 6,75 (дд, J=17,6, 10,8 Гц, 1Н), 5,92 (дд, J=17,6, 10,8 Гц, 1Н), 5,52 (д, J=17,6 Гц, 1Н), 2,21 (с, 3Н); ИЭРМС m/z 211,35 ([М-Н]-).
Стадия 2. (Е)-5-Бром-2-фтор-3-метилбензальдегид оксим: При перемешивании к раствору 5-бром-2-фтор-3-метилбензальдегида (3,5 г, 16,2 ммоля) в этаноле (50,0 мл) при температуре окружающей среды добавляли ацетат натрия (2,0 г, 24,3 ммоля) и гидроксиламингидрохлорид (1,69 г, 24,3 ммоля). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 ч. Реакционную смесь концентрировали в роторном испарителе и получали неочищенное соединение, которое промывали водой, фильтровали и сушили в вакууме, и получали искомое соединение в виде белого твердого вещества: температура плавления 126-127°С;1H ЯМР (400 МГц, CDCl3) δ 8,32 (с, 1Н), 7,73 (д, J=2,4 Гц, 1Н), 7,51 (с, 1Н), 7,34 (д, J=2,4 Гц, 1Н), 2,25 (с, 3Н); ИЭРМС m/z 232,10 ([М+Н]+).
Стадия 3. 5-Бром-2-фтор-3-метилбензонитрил: При перемешивании раствор оксима (Е)-5-бром-2-фтор-3-метилбензальдегида (0,5 г, 2,2 ммоля) в уксусном ангидриде (5,0 мл) кипятили с обратным холодильником в течение 18 ч. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Объединенный этилацетатный слой промывали рассолом и сушили над Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение в виде светло-коричневого смолообразного вещества (0,4 г, неочищенное): ИЭРМС m/z 213,82 ([М+Н]+).
Стадия 4. 5-Бром-3-метил-2-(1Н-1,2,4-триазол-1-ил)бензонитрил (DI71): При перемешивании к раствору 5-бром-2-фтор-3-метилбензонитрила (1,0 г, 47,716 ммоля) в ДМФ (10,0 мл) при температуре окружающей среды добавляли карбонат калия (1,95 г, 14,14 ммоля), затем 1H-1,2,4-триазол (0,811 г, 9,433 ммоля). Реакционную смесь нагревали при 140°С в течение 18 ч. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли водой и экстрагировали этилацетатом (2×100 мл). Объединенный этилацетатный слой промывали рассолом и сушили над Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение, которое очищали с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; при элюировании смесью 30% этилацетат/петролейный эфир), и получали искомое соединение в виде розового твердого вещества (0,6 г, 49%):1H ЯМР (400 МГц, CDCl3) δ 8,39 (с, 1Н), 8,23 (с, 1Н), 7,91 (д, J=2,4 Гц, 2Н), 2,21 (с, 3Н), ИЭРМС m/z 262,57 ([М+Н]+); ИК (тонкая пленка) 2231, 554 см-1.
Стадия 5. 3-Метил-2-(1Н-1,2,4-триазол-1-ил)-5-винилбензонитрил (DI70): Смесь 5-бром-3-метил-2-(1Н-1,2,4-триазол-1-ил)бензонитрила (0,6 г, 2,3 ммоля), карбоната калия (0,95 г, 6,87 ммоля), ангидрида винилбороновой кислоты (0,82 г, 3,43 ммоля) и трифенилфосфина (0,13 г, 0,114 ммоля) в толуоле (20,0 мл) перемешивали и дегазировали аргоном в течение 30 мин. Реакционную смесь кипятили с обратным холодильником в течение 18 ч. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли водой и экстрагировали этилацетатом (2×100 мл). Объединенный этилацетатный слой промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали неочищенное соединение, которое очищали с помощью колоночной флэш-хроматографии (SiO2, 100-200 меш; при элюировании смесью 30% этилацетат/петролейный эфир) и получали искомое соединение в виде розового твердого вещества (0,25 г, 52%):1H ЯМР (400 МГц, CDCl3) δ 8,33 (с, 1Н), 8,22 (с, 1Н), 7,67 (с, 1Н), 7,60 (с, 1Н), 6,75 (дд, J=17,6, 10,8 Гц, 1Н), 5,92 (д, J=17,6, 1Н), 5,52 (д, J=10,8 Гц, 1Н), 2,21 (с, 3Н), ИЭРМС m/z 211,35 ([М+Н]+); ИК (тонкая пленка) 2236, 1511 см-1.
Указанное ниже соединение получали по методикам, раскрытым на стадиях 4 и 5 примера 96.
1-(2-Фтор-4-винилфенил)-1Н-1,2,4-триазол (DI72)
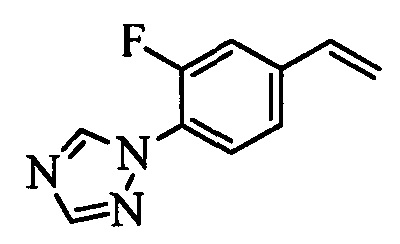
1-(4-Бром-2-фторфенил)-1Н-1,2,4-триазол (DI73) выделяли в виде бледно-желтого твердого вещества (3,0 г, 75%): температура плавления 113-116°С;1H ЯМР (400 МГц, CDCl3) δ 8,69 (с, 1Н), 8,13 (м, 2Н), 7,50 (м, 1Н), 7,21 (м, 1Н); ИЭРМС m/z 241,93 ([М]+). Искомое соединение (DI72) выделяли в виде желтого твердого вещества (1,0 г, 71%): температура плавления 67-70°С;1H ЯМР (400 МГц, CDCl3) δ 8,67 (с, 1Н), 8,13 (с, 1Н), 7,94 (м, 1Н), 7,41 (м, 1Н), 7,24 (с, 1Н), 6,75 (дд, J=17,6, 10,8 Гц, 1Н), 5,81 (д, J=17,6 Гц, 1Н), 5,37 (д, J=10,8 Гц, 1Н); ИЭРМС m/z 190,00 ([М+Н]+).
Пример 119: Получение 1-(1-(4-винилфенил)-1H-1,2,4-триазол-5-ил)этанона (DI78)
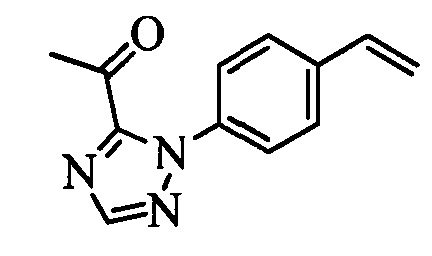
При перемешивании к раствору 1-(4-винилфенил)-1Н-[1,2,4]триазола (1 г, 5,8 ммоля) в 25 мл ТГФ при -78°С добавляли н-BuLi (0,37 г, 5,8 ммоля) и перемешивали в течение 30 мин. К нему добавляли N-метокси-N-метилацетамид в ТГФ (0,66 г, 6,4 ммоля) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакцию останавливали насыщенным водным раствором NH4Cl и экстрагировали с помощью EtOAc (3×50 мл). Объединенный слой, содержащий EtOAc, промывали рассолом и сушили над сульфатом натрия и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью флэш-хроматографии (SiO2, 100-200 меш, 40% EtOAc в петролейном эфире) и получали искомое соединение в виде почти белого твердого вещества (280 мг, 23%): температура плавления 97-98°С;1H ЯМР (400 МГц, CDCl3) δ 8,10 (с, 1Н), 7,50 (д, 2Н), 7,38 (д, 2Н), 6,68 (дд, 1Н), 5,85 (д, 1Н), 5,38 (д, 1Н), 2,75 (с, 3Н); ИЭРМС m/z 214,14 ([М+Н]+).
Пример 120: Получение циклопропил(1-(4-винилфенил)-1Н-1,2,4-триазол-5-ил)метанона (DI79)
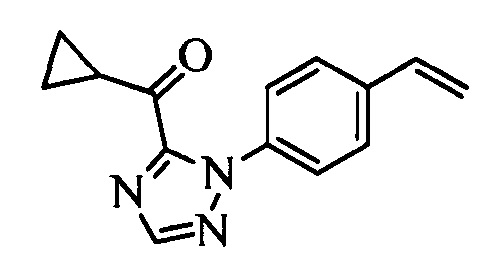
При перемешивании к раствору 1-(4-винилфенил)-1H-[1,2,4] триазола (1 г, 5,8 ммоля) в 25 мл ТГФ при -78°С добавляли н-BuLi (0,37 г, 5,8 ммоля) и перемешивали в течение 30 мин. К нему добавляли N-метокси-N-метилциклопропоксид в ТГФ (0,82 г, 6,4 ммоля) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакцию останавливали насыщенным водным раствором NH4Cl и экстрагировали с помощью EtOAc (3×25 мл). Объединенный слой, содержащий EtOAc, промывали рассолом и сушили над сульфатом натрия, и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью флэш-хроматографии (SiO2, 100-200 меш, 40% EtOAc в петролейном эфире) и получали искомое соединение в виде почти белого твердого вещества (420 мг, 30%): температура плавления 90-91°С;1H ЯМР (400 МГц, CDCl3) δ 8,12 (с, 1Н), 7,50 (д, J=7,8 Гц, 2Н), 7,38 (д, J=7,8 Гц, 2Н), 6,75 (дд, J=16,3, 10,7 Гц, 1Н), 5,81 (д, J=16,3 Гц, 1Н), 5,35 (д, J=10,7 Гц, 1Н), 3,22 (м, 1Н), 1,27(м, 2H), 1,18 (м, 2Н); ИЭРМС m/z 240,18 ([М+Н]+); ИК (тонкая пленка) 2922, 1630 см-1.
Пример 121: Получение 5-(метилтио)-1-(4-винилфенил)-1H-1,2,4-триазола (DI80)
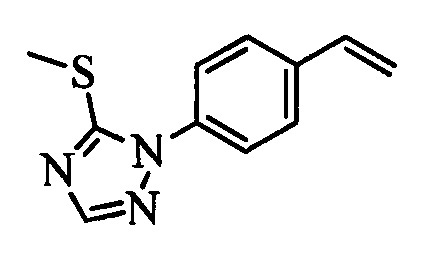
При перемешивании к раствору 1-(4-винилфенил)-1Н-[1,2,4]триазола (1 г, 5,8 ммоля) в 50 мл ТГФ при -78°С добавляли н-BuLi (0,41 г, 6,4 ммоля) и перемешивали в течение 30 мин. К нему добавляли диметилдисульфид в ТГФ (0,6 г, 6,43 ммоля) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакцию останавливали насыщенным водным раствором NH4Cl и экстрагировали с помощью EtOAc (3×25 мл). Объединенный слой, содержащий EtOAc, промывали рассолом и сушили над сульфатом натрия и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью флэш-хроматографии (SiO2, 100-200 меш, 40% EtOAc в петролейном эфире) и получали искомое соединение в виде почти белого твердого вещества (0,6 г, 48%): температура плавления 68-70°С;1H ЯМР (400 МГц, CDCl3) δ 7,96 (с, 1Н), 7,05 (м, 4Н), 6,75 (дд, J=16,4, 10,7 Гц, 1Н), 5,81 (д, J=16,4 Гц, 1Н), 5,35 (д, J=10,7 Гц, 1Н), 2,73 (с, 3Н); ИЭРМС m/z 218,09 ([М+Н]+).
Пример 122: Получение 5-метил-1-(4-винилфенил)-1H-1,2,4-триазола (DI81)
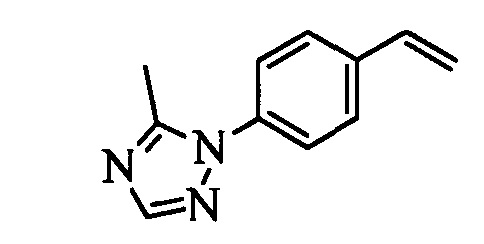
При перемешивании к раствору 1-(4-винилфенил)-1H-[1,2,4]триазола (0,5 г, 2,9 ммоля) в 10 мл ТГФ при -78°С добавляли н-BuLi (0,22 г, 3,5 ммоля) и перемешивали в течение 30 мин. К нему добавляли метилйодид в ТГФ (0,50 г, 3,5 ммоля) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакцию останавливали насыщенным водным раствором NH4Cl и экстрагировали с помощью EtOAc (3×25 мл). Объединенный слой, содержащий EtOAc, промывали рассолом и сушили над сульфатом натрия и концентрировали при пониженном давлении Неочищенное соединение очищали с помощью флэш-хроматографии (SiO2, 100-200 меш, 40% EtOAc в петролейном эфире) и получали искомое соединение в виде бледно-коричневой жидкости (250 мг, 46%):1H ЯМР (400 МГц, CDCl3) δ 7,93 (с, 1Н), 7,55 (д, J=9 Гц, 2Н), 7,42 (д, J=9 Гц, 2Н), 6,76 (дд, J=18, 11 Гц, 1Н), 5,83 (д, J=18 Гц, 1Н), 5,38 (д, J=11 Гц, 1Н), 2,55 (с, 3Н); ИЭРМС m/z 186,13 ([М+Н]+); ИК (тонкая пленка) 1517, 1386, 1182, 847 см-1.
Пример 97: Получение (Е)-1-(4-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)фенил)-1H-1,2,4-триазола (DC1)
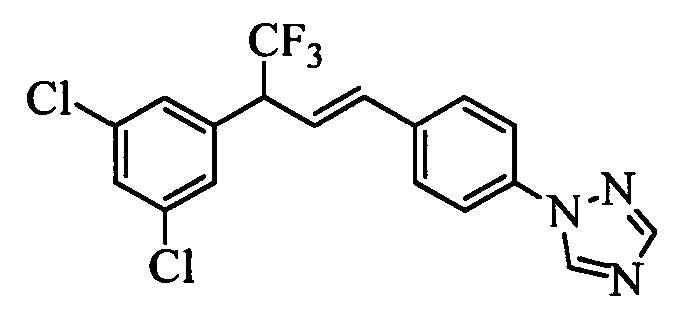
При перемешивании к раствору 1-(1-бром-2,2,2-трифторэтил)-3,5-дихлорбензола (2,0 г, 6,51 ммоля) в 1,2-дихлорбензоле (25 мл) добавляли 1-(4-винилфенил)-1Н-[1,2,4]триазол (2,22 г, 13,0 ммоля), CuCl (64 мг, 0,65 ммоля) и 2,2-бипиридил (0,2 г, 1,3 ммоля). Полученную реакционную смесь дегазировали аргоном в течение 30 мин, затем перемешивали при 180°С в течение 24 ч. После завершения реакции (по данным ТСХ) реакционную смесь охлаждали до температуры окружающей среды и фильтровали и фильтрат концентрировали при пониженном давлении. Очистка с помощью флэш-хроматографии (SiO2, 100-200 меш; 25-30% EtOAc в петролейном эфире) давала искомое соединение в виде почти белого твердого вещества (0,8 г, 32%): температура плавления 93-97°С;1H ЯМР (300 МГц, CDCl3) δ 8,56 (с, 1Н), 8,11 (с, 1Н), 7,68 (д, J=8,4 Гц, 2Н), 7,54 (д, J=8,4 Гц, 2Н), 7,38 (т, J=1,8 Гц, 1Н), 7,29 (с, 2Н), 6,62 (д, J=15,6 Гц, 1Н), 6,42 (дд, J=15,6, 8,2 Гц, 1Н), 4,15 (м, 1Н); ИЭРМС m/z 398,05 ([М+Н]+).
Соединения DC2-DC37, DC44, DC45, DC47-49, DC50, DC51, DC54, DC58, DC60, DC62 и DC63-DC67, указанные в таблице 1, получали по методикам, раскрытым в примере 97.
Пример 98: Получение (Е)-2-(3-нитро-1H-1,2,4-триазол-1-ил)-5-(А,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензонитрила (DC40)
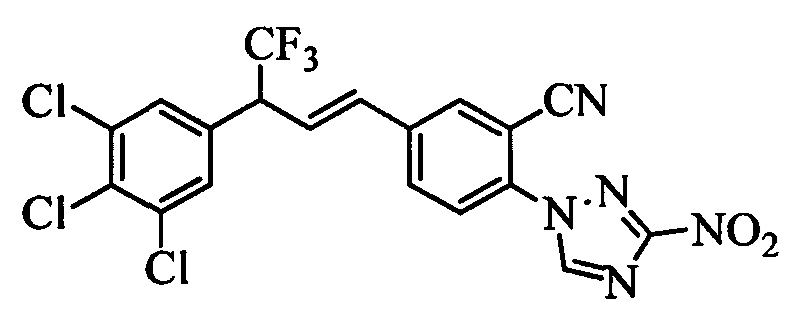
При перемешивании к раствору 2-(3-нитро-1H-1,2,4-триазол-1-ил)-5-винилбензонитрила (0,9 г, 3,7 ммоля) в 1,2-дихлорбензоле (10 мл) добавляли 5-(1-бром-2,2,2-трифторэтил)-1,2,3-трихлорбензол (2,5 г, 7,5 ммоля), CuCl (73 мг, 0,74 ммоля) и 2,2-бипиридил (0,23 г, 1,49 ммоля) и полученную реакционную смесь дегазировали аргоном в течение 30 мин и затем перемешивали при 180°С в течение 14 ч. После завершения реакции (по данным ТСХ) реакционную смесь охлаждали до температуры окружающей среды и фильтровали и фильтрат концентрировали при пониженном давлении. Очистка с помощью флэш-хроматографии (SiO2, 100-200 меш, 25-30% EtOAc в петролейном эфире) давала искомое соединение в виде почти белого твердого вещества (0,9 г, 50%): температура плавления 70-73°С;1H ЯМР (300 МГц, CDCl3) δ 8,86 (с, 1Н), 7,88 (м, 3Н), 7,44 (с, 2Н), 6,67 (д, J=16,0 Гц, 1Н), 6,56 (дд, J=16,0, 7,6 Гц, 1Н), 4,19 (м, 1Н); ИЭРМС m/z 436,11 ([М-2Н]-).
Пример 99: Получение (Е)-2-(3-амино-1H-1,2,4-триазол-1-ил)-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензонитрила (DC41)

При перемешивании к раствору (Е)-2-(3-нитро-1H-1,2,4-триазол-1-ил)-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензонитрила (0,6 г, 1,2 ммоля) в МеОН (10 мл) добавляли Zn пыль (0,39 г, 5,98 ммоля) и насыщенный водный раствор NH4Cl (5 мл) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч. После завершения реакции (по данным ТСХ) реакционную массу концентрировали при пониженном давлении. Реакционную массу разбавляли с помощью CH2Cl2, фильтровали через слой целита и полученный фильтрат концентрировали при пониженном давлении, и получали искомое соединение в виде твердого вещества (0,5 г, 89%): температура плавления 72-75°С;1H ЯМР (300 МГц, ДМСО-d6) δ 8,72 (с, 1Н), 8,26 (с, 1Н), 8,01 (д, J=8,4 Гц, 1Н), 7,91 (с, 2Н), 7,77 (д, J=8,4 Гц, 1Н), 6,42 (дд, J=15,6, 9,2 Гц, 1Н), 6,83 (д, J=15,6 Гц, 1Н), 5,87 (с, 2Н), 4,89 (м, 1Н); ИЭРМС m/z 469,95 ([М-Н]-).
Соединение DC38, указанное в таблице 1, получали по методикам, раскрытым в примере 99. Кроме того, соединение DC55, указанное в таблице 1, получали из соединения DC54 по методикам, раскрытым в примере 99, с тем отличием, что использовали формиат аммония вместо хлорида аммония.
Пример 100: Получение (Е)-N-(1-(2-циано-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенил)-1Н-1,2,4-триазол-3-ил)-N-(циклопропанкарбонил)циклопропанкарбоксамида (DC42)
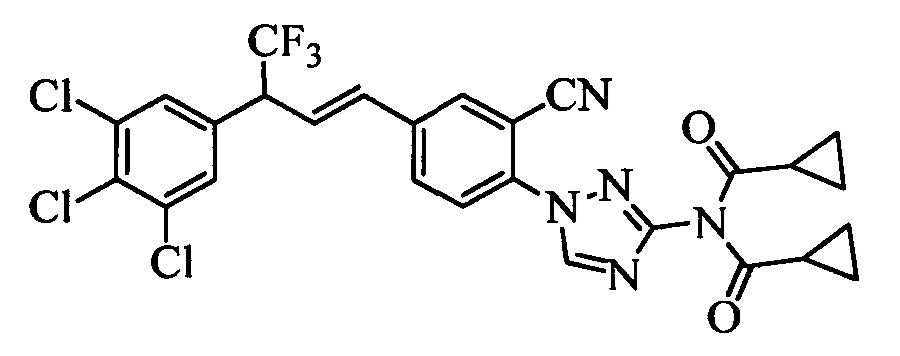
При перемешивании к раствору (Е)-2-(3-амино-1H-1,2,4-триазол-1-ил)-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензонитрила (0,1 г, 0,21 ммоля) в CH2Cl2 при температуре окружающей среды добавляли циклопропилкарбонилхлорид (0,045 г, 0,42 ммоля) и реакционную смесь перемешивали в течение 2 ч при температуре окружающей среды. Реакционную смесь разбавляли с помощью CH2Cl2 и промывали водой и рассолом, и сушили над Na2SO4. Концентрирование при пониженном давлении и очистка с помощью препаративной ВЭЖХ давали искомое соединение в виде твердого вещества (0,09 г, 79%): температура плавления 104-107°С;1H ЯМР (300 МГц, CDCl3) δ 8,78 (с, 2Н), 7,83 (с, 1Н), 7,80 (м, 2Н), 7,42 (с, 2Н), 6,65 (д, J=16,4 Гц, 1Н), 6,51 (дд, J=7,6, 8,0 Гц, 1Н), 4,17 (м, 1Н), 2,16 (м, 2Н), 1,25 (м, 4Н), 1,00 (м, 4Н); ИЭРМС m/z 609,98 ([М+Н]+); ИК (тонкая пленка) 2234, 1714, 1114, 807 см-1.
Пример 101: Получение (Е)-N-(1-(2-циано-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)фенил)-1H-1,2,4-триазол-3-ил)циклопропанкарбоксамида (DC43)

При перемешивании к раствору (Е)-2-(3-амино-1H-1,2,4-триазол-1-ил)-5-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензонитрила (0,15 г,0,31 ммоля) в CH2Cl2 при 0°С добавляли ТЭА (0,1 г, 1 ммоля) и циклопропилкарбонилхлорид (0,04 г, 0,38 ммоля) и реакционную смесь перемешивали в течение 1 ч при 0°С. Реакционную смесь разбавляли с помощью CH2Cl2 и промывали водой и рассолом и сушили над Na2SO4. Концентрирование при пониженном давлении и очистка с помощью колоночной хроматографии (SiO2, 100-200 меш) давала искомое соединение в виде твердого вещества (66 мг, 34%): температура плавления 109-112°С;1H ЯМР (300 МГц, ДМСО-d6) δ 10,94 (шир.с, 1Н), 8,36 (с, 1Н), 8,08 (м, J=8,4 Гц, 1Н), 7,91 (с, 2Н), 7,84 (д, J=8,4 Гц, 1Н), 7,13 (дд, J=15,6, 9,2 Гц, 1Н), 6,87 (д, J=15,6 Гц, 1Н), 4,92 (м, 1Н), 1,99 (шир.с, 1Н), 0,82 (с, 4Н); ИЭРМС m/z 540,04 ([М+Н]+); ИК (тонкая пленка) 3233, 2233, 1699, 1114, 807 см-1.
Соединение DC39, указанное в таблице 1, получали по методикам, раскрытым в примере 101.
Пример 102: Получение 1-(4-(1H-1,2,4-триазол-1-ил)фенил)этанона (DI74)
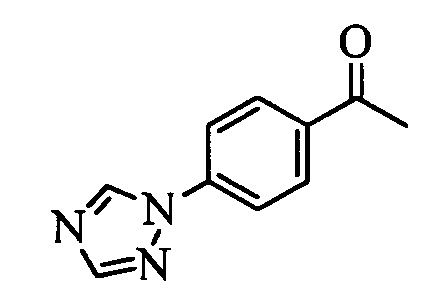
При перемешивании к раствору 4-бромацетофенона (10 г, 50 ммоля) в ДМФ (100 мл) добавляли 1,2,4-триазол (5 г, 75 ммоля), Cs2CO3 (32,6 г, 100,5 ммоля) и Cul (1,4 г, 10,1 ммоля) и полученную реакционную смесь кипятили с обратным холодильником в течение 48 ч. После завершения реакции (по данным ТСХ) реакционную смесь охлаждали до температуры окружающей среды и разбавляли водой (200 мл), и экстрагировали с помощью EtOAc. Объединенный органический слой промывали рассолом и сушили над Na2SO4, и концентрировали при пониженном давлении. Очистка путем промывки диэтиловым эфиром давала искомое соединение в виде твердого вещества (5 г, 96%):1H ЯМР (400 МГц, CDCl3) δ 8,71 (с, 1Н), 8,16, (с, 1Н), 8,13 (д, J=8,6 Гц, 2Н), 7,83 (д, J=8,6 Гц, 2Н), 2,66 (с, 3Н); ИЭРМС m/z 186,02 ([М-Н]-).
Пример 103: Получение 1-(4-(1H-1,2,4-триазол-1-ил)фенил)-3-(3,5-дихлорфенил)-4,4,4-трифторбутан-1-она (DI75)

Стадия 1. 1-(4-(1-(Триметилсилилокси)винил)фенил)-1Н-1,2,4-триазол (DI76): При перемешивании к раствору 1-(4-(1H-1,2,4-триазол-1-ил) фенил) этанона (4,5 г, 24,0 ммоля) в CH2Cl2 при 0°С добавляли ТЭА (3,7 г, 36,1 ммоля) и триметилсилилтрифторметансульфонат (8 г, 36 ммоля) и полученную реакционную смесь перемешивали в течение 1 ч. Реакцию останавливали смесью насыщенного водного раствора бикарбоната натрия и эфира. Эфирный слой отделяли, промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение (5,5 г), которое использовали на следующей стадии без обработки.
Стадия 2. 1-(4-(1H-1,2,4-триазол-1-ил)фенил)-3-(3,5-дихлорфенил)-4,4,4-трифторбутан-1-он (DI75): При перемешивании раствор 1-(4-(1-(Триметилсилилокси)винил)фенил)-1H-1,2,4-триазола (6 г, 23 ммоля) и 1-(1-бром-2,2,2-трифторэтил)-3,5-дихлорбензола (7,1 г, 34,7 ммоля) в 1,2-дихлорбензоле (30 мл) дегазировали аргоном. К указанной выше реакционной смеси добавляли CuCl (0,23 г, 2,31 ммоля) и 2,2-бипиридил (0,73 г, 4,63 ммоля) и полученную реакционную смесь нагревали при 180°С в течение 18 ч. После завершения реакции (по данным ТСХ) реакционную смесь абсорбировали на силикагеле и очищали с помощью колоночной хроматографии (SiO2; 10% EtOAc в петролейном эфире) и получали искомое соединение в виде твердого вещества (3 г, 31%):1H ЯМР (400 МГц, CDCl3) δ 8,67 (с, 1Н), 8,15 (с, 1Н), 8,10 (д, J=8,3 Гц, 2Н), 7,82 (д, J=8,3 Гц, 2Н), 7,33 (м, 1Н), 7,30 (м, 2Н), 4,20 (м, 1Н), 3,63 (м, 2Н); ИЭРМС m/z 412,14 ([М-Н]-).
Пример 104: Получение 2-(4-(1H-1,2,4-триазол-1-ил)фенил)-4-(3,5-дихлорфенил)-5,5,5-трифторпентан-2-ола (DI77)

К раствору 1-(4-(1H-1,2,4-триазол-1-ил)фенил)-3-(3,5-дихлорфенил)-4,4,4-трифторбутан-1-она (300 мг, 0,726 ммоля) в ТГФ, охлажденному до 0°С, по каплям добавляли метилмагнийбромид (450 мг, 5 ммоля). Реакционную смесь перемешивали в течение 3 ч при 0°С, затем реакцию останавливали насыщенным водным раствором NH4Cl и экстрагировали этилацетатом. Объединенный слой, содержащий EtOAc, промывали водой и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (SiO2, 100-200 меш; 20%-25% EtOAc в петролейном эфире) давала искомое соединение в виде твердого вещества (100 мг, 32%):1H ЯМР (400 МГц, CDCl3) δ два диастереизомера 8,58 (с, 1Н, малоинтенсивный пик), 8,48 (с, 1Н, интенсивный пик), 8,13 (с, 1Н, малоинтенсивный пик), 8,09 (с, 1Н, интенсивный пик), 7,70 (д, J=9,0 Гц, 2Н, малоинтенсивный пик), 7,53 (д, J=9,0 Гц, 2Н, малоинтенсивный пик), 7,40 (д, J=9,0 Гц, 2Н, интенсивный пик), 7,31 (м, 1Н, малоинтенсивный пик), 7,27 (д, J=9,0 Гц, 2Н, интенсивный пик), 7,20 (м, 2Н, малоинтенсивный пик), 7,01 (м, 1Н, интенсивный пик), 6,75 (м, 2Н, интенсивный пик), 350 (м, 1Н), 2,50 (м, 2Н), 1,56 (с, 3Н, интенсивный пик), 1,54 (с, 3Н, малоинтенсивный пик); ИЭРМС m/z 430,05 ([М+Н]+).
Пример 105: Получение (Е)-1-(4-(4-(3,5-дихлорфенил)-5,5,5-трифторпент-2-ен-2-ил)фенил)-1Н-1,2,4-триазола (DC68)
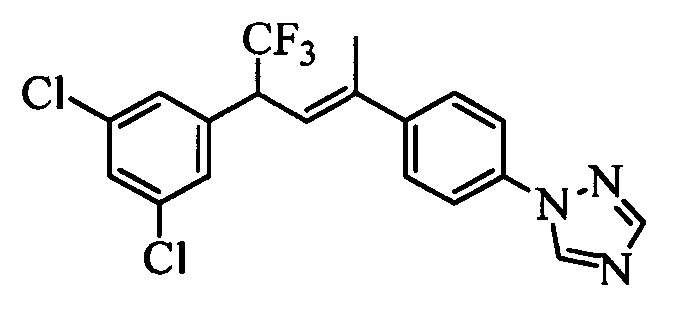
К раствору 2-(4-(1H-1,2,4-триазол-1-ил)фенил)-4-(3,5-дихлорфенил)-5,5,5-трифторпентан-2-ола (100 мг, 0,233 ммоля) в толуоле добавляли каталитическое количество п-толуолсульфоновой кислоты (ПТСК) и воду в течение 12 ч удаляли путем азеотропной отгонки. Реакционную смесь охлаждали до комнатной температуры и растворяли в этилацетате. Раствор промывали насыщенным водным раствором NaHCO3 и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (SiO2, 100-200 меш; 20%-25% EtOAc в петролейном эфире) давала искомое соединение в виде твердого вещества (30 мг, 31%).
Пример 123: Получение (E)-5-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-(1Н-1,2,4-триазол-1-ил)бензальдегида (DC52)
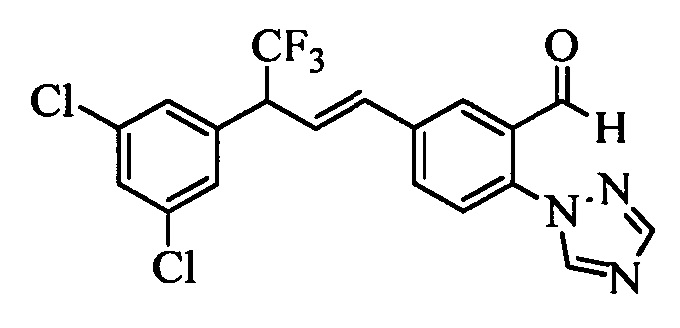
При перемешивании к раствору (Е)-5-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-(1Н-1,2,4-триазол-1-ил)бензонитрила (0,3 г, 0,71 ммоля) в толуоле (10 мл) при -78°С по каплям добавляли диизобутилалюминийгидрид (DIBAL-H, 1,0 М раствор в толуоле; 0,85 мл) и реакционную смесь перемешивали при -78°С в течение 20 мин. Реакцию останавливали путем добавления 1 н. раствора HCl, затем водный слой экстрагировали с помощью EtOAc (2×). Объединенные органические слои промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной флэш-хроматографии (SiO2; 50% EtOAc/петролейный эфир) и получали искомое соединение в виде желтого масла.
Соединение DC53, указанное в таблице 1, получали по методикам, раскрытым в примере 123.
Пример 124: Получение (E)-5-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-N-метил-2-(1H-1,2,4-триазол-1-ил)анилина (DC57)

При перемешивании к раствору (E)-5-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-(1H-1,2,4-триазол-1-ил)анилина (0,3 г, 0,7 ммоля) в CH2Cl2 (10 мл) добавляли ТЭА (0,155 мл, 1,09 ммоля) и метилйодид (0,124 г, 0,873 ммоля). Реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Слой, содержащий CH2Cl2, промывали водой и рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной флэш-хроматографии (SiO2; 50% EtOAc/петролейный эфир) и получали искомое соединение в виде желтого полужидкого вещества (0,07 г, 70%).
Пример 125: Получение (E)-5-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-(1H-1,2,4-триазол-1-ил)бензойной кислоты (DC61)
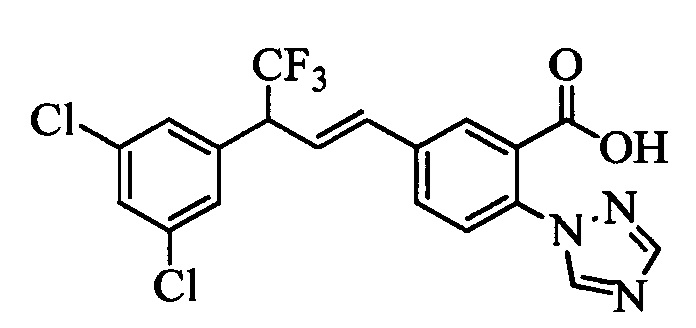
Раствор (Е)-этил 5-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-(1H-1,2,4-триазол-1-ил)бензоата (0,2 г, 0,4 ммоля) в 6 н. HCl (10 мл) перемешивали при 100°С в течение 18 ч. Реакционную смесь охлаждали до температуры окружающей среды и получали белый твердый осадок. Осадок отфильтровывали и получали искомое соединение в виде белого твердого вещества (0,12 г, 60%).
Пример 126: Получение (Z)-5-((E)-3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-N'-гидрокси-2-(1Н-1,2,4-триазол-1-ил)бензимидамида (DC59)
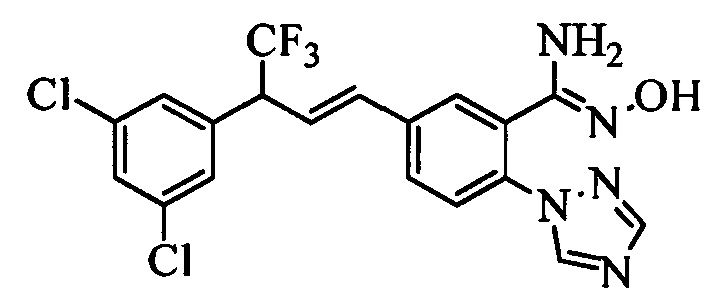
Раствор (Е)-5-(3-(3,5-дихлорфенил)-4,4,4-трифторбут-1-ен-1-ил)-2-(1H-1,2,4-триазол-1-ил)бензонитрила (0,3 г, 0,71 ммоля), ацетата натрия (0,087 г, 1,065 ммоля) и гидрохлорида гидроксиламина (0,072 г, 1,065 ммоля) в смеси 9:1 этанол/вода (10 мл) перемешивали при 70°С в течение 8 ч. Реакционную смесь охлаждали до температуры окружающей среды и этанол выпаривали. Остаток растворяли в воде и экстрагировали с помощью EtOAc (2×). Объединенные органические слои промывали рассолом, сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде почти белого твердого вещества.
Пример 127: Получение (E)-1-(4-(3-(3,5-дихлорфенил)-4,4,4-трифтор-3-метоксибут-1-ен-1-ил)фенил)-1H-1,2,4-триазола (DC70)

Стадия 1. (Е)-3-(4-(1H-1,2,4-триазол-1-ил)фенил)-1-(3,5-дихлорфенил)проп-2-ен-1-он: К раствору 1-(3,5-дихлорфенил)этанона (0,5 г, 2,6 ммоля) в этаноле (20 мл) добавляли 4-(1H-1,2,4-триазол-1-ил)бензальдегид (0,46 г, 2,65 ммоля) и реакционную смесь охлаждали до 0°С. Затем добавляли гидроксид натрия (0,22 г, 5,29 ммоля) в воде (10 мл) и реакционную смесь перемешивали в течение 2 ч при 0°С.Реакционную смесь экстрагировали с помощью EtOAc и объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение (0,149 г, 17%):); ИЭРМС m/z 430,05 ([М+Н]+) 344,08
Стадия 2. (Е)-4-(4-(1H-1,2,4-триазол-1-ил)фенил)-2-(3,5-дихлорфенил)-1,1,1-трифторбут-3-ен-2-ол (DC69): К раствору (E)-3-(4-(1H-1,2,4-триазол-1-ил)фенил)-1-(3,5-дихлорфенил)проп-2-ен-1-она (1 г, 3 ммоля) в ТГФ (150 мл) при 0°С добавляли трифторметилтриметилсилан (0,517 г, 3,644 ммоля) и тетра-н-бутилфторид аммония (ТБАФ) (1,0 М, 1 мл). Реакционную смесь медленно нагревали до температуры окружающей среды и перемешивали в течение 2 ч. Затем реакционную смесь охлаждали до 0°С и добавляли 5 М раствор HCl, и реакционную смесь перемешивали в течение еще 4 ч при температуре окружающей среды. Реакционную смесь экстрагировали с помощью CH2Cl2 и объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной флэш-хроматографии (SiO2; 25% EtOAc/гексаны) и получали искомое соединение в виде почти белого твердого вещества (0,3 г, 25%).
Стадия 3. (Е)-1-(4-(3-(3,5-Дихлорфенил)-4,4,4-трифтор-3-метоксибут-1-ен-1-ил)фенил)-1Н-1,2,4-триазол (DC70): К раствору (Е)-4-(4-(1H-1,2,4-триазол-1-ил)фенил)-2-(3,5-дихлорфенил)-1,1,1-трифторбут-3-ен-2-ола (0,15 г, 0,36 ммоля) в ТГФ (5 мл) при 0°С добавляли NaH (60%, 10 мг, 0,44 ммоля). Реакционную смесь перемешивали при 0°С в течение 30 мин, затем медленно добавляли метилйодид (61 мг, 0,44 ммоля) и реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 4 ч. Реакцию останавливали водным раствором NH4Cl и экстрагировали с помощью CH2Cl2. Объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении, и получали искомое соединение в виде почти белого твердого вещества (55 мг, 35%).
Возможный пример F1: Получение (Е)-2-(2-Бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензоил)-N-этил-1-метилгидразинкарбоксамида (F1)
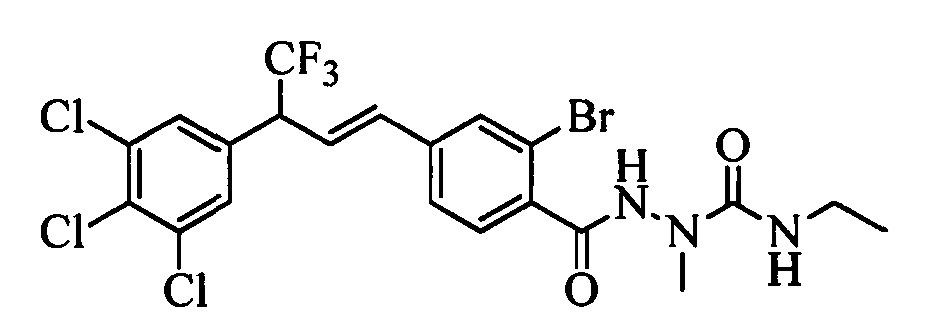
Возможно, (Е)-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензойную кислоту можно ввести в реакцию с N-этил-1-метилгидразинкарбоксамидом в присутствии N-(3-диметиламинопропил)-N'-этилкарбодиимидгидрохлорида (EDC⋅HCl) и ДМАП и получить искомое соединение (Org. Lett. 2004, 6, 929-
Пример 128: Получение (Е)-2-(2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензоил)-N-(2,2,2-трифторэтил)гидразинкарбоксамида (F7)

Стадия 1. трет-Бутил-2-((2,2,2-трифторэтил)карбамоил)гидразинкарбоксилат: При перемешивании к раствору трет-бутилгидразинкарбоксилата (1,0 г, 8 ммоля) в безводном бензоле (10,0 мл) шприцем добавляли неразбавленный 1,1,1-трифтор-2-изоцианатоэтан (1,06 г, 8 ммоля) и получали желатиноподобную смесь. Добавляли безводный ТГФ и получали прозрачный раствор, который перемешивали в течение 10 мин, и затем реакционную смесь выпаривали и получали искомое соединение в виде белого твердого вещества (1,62 г, 79%):1H ЯМР (400 МГц, CDCl3) δ 6,63 (с, 1Н), 6,40 (д, J=2,2 Гц, 1Н), 5,84 (с, 1Н), 3,88 (кв.д, J=9,0, 6,6 Гц, 2Н), 1,48 (с, 9Н);19F ЯМР (376 МГц, CDCl3) δ -73,20. Это вещество использовали без дополнительной очистки.
Стадия 2. N-(2,2,2-Трифторэтил)гидразинкарбоксамидгидрохлорид: При перемешивании к раствору трет-бутил-2-((2,2,2-трифторэтил)карбамоил)гидразинкарбоксилата (1,62 г, 6,30 ммоля) в безводном диоксане (10,0 мл) добавляли HCl (4М в диоксане, 2-3 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч, затем кипятили с обратным холодильником в течение 2-3 ч. Реакционной смеси давали охладиться до температуры окружающей среды и затем выпаривали и получали искомое соединение в виде белого твердого вещества (1,33 г, 109%):1H ЯМР (400 МГц, ДМСО-d6) δ 10,12 (с, 3Н), 9,25 (с, 1Н), 7,72 (т, J=6,5 Гц, 1Н), 3,91 (кв.д, J=9,7, 6,5 Гц, 2Н);19F ЯМР (376 МГц, ДМСО-d6) δ -71,41; ИЭРМС m/z 156 ([М-Н]-). Это вещество использовали без дополнительной очистки.
Стадия 3. (Е)-2-(2-Бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензоил)-N-(2,2,2-трифторэтил)гидразинкарбоксамид: К раствору, содержащему (Е)-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)бензойную кислоту (120 мг, 0,246 ммоля), 1,2-дихлорэтан (ДХЭ) (5 мл) последовательно добавляли EDC⋅HCl (70,6 мг, 0,368 ммоля), N-(2,2,2-трифторэтил)гидразинкарбоксамидгидрохлорид (52,3 мг, 0,270 ммоля) и ДМАП (63,0 мг, 0,516 ммоля). Реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Реакционную смесь разбавляли с помощью CH2Cl2, промывали с помощью 0,1 н. HCl затем водным раствором NaHCO3, сушили (MgSO4), фильтровали и выпаривали досуха. Неочищенный продукт очищали с помощью колоночной флэш-хроматографии и получали искомое соединение в виде прозрачного масла (40 мг, 26%):1H ЯМР (400 МГц, CDCl3) δ 8,12 (с, 1Н), 7,65 (с, 1Н), 7,60 (д, J=8,0 Гц, 1Н), 7,51 (д, J=6,4 Гц, 1Н), 7,40 (с, 3Н), 6,54 (д, J=15,8 Гц, 1Н), 6,42 (дд, J=16,0, 7,7 Гц, 1Н), 5,95 (с, 1Н), 4,10 (с, 1Н), 3,91 (м, 2Н);19F ЯМР (376 МГц, CDCl3) δ -68,56, -73,02; ИЭРМС m/z 627,9 ([М+Н]+).
Пример 129: Получение (Е)-1-изопропил-2-(4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)-2-(трифторметил)бензоил)-N-(2,2,2-трифторэтил)гидразинкарбоксамида (FA3)
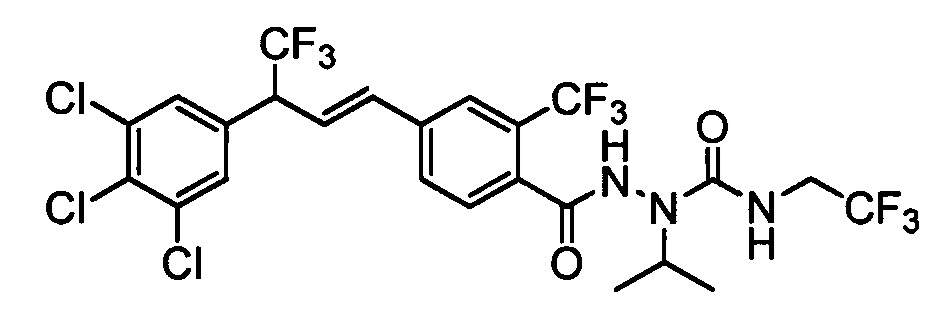
ДИПЭА (0,32 мл, 1,88 ммоля), гексафторфосфат 1-[[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (HATU) (263 мг, 0,69 ммоля) и гидрохлорид 1-амино-1-изопропил-3-(2,2,2-трифторэтил)мочевины (178 мг, 0,75 ммоля) при перемешивании при температуре окружающей среды добавляли к раствору 2-(трифторметил)-4-[(Е)-4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил]бензойной кислоты (300 мг, 0,63 ммоля) в ДМФ (2 мл) и реакционную смесь перемешивали в течение 4 ч. К реакционной смеси добавляли воду и смесь экстрагировали с помощью EtOAc. Органический слой промывали рассолом, затем водой, сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали с помощью колоночной хроматографии на диоксиде кремния при элюировании с помощью 20% EtOAc в петролейном эфире и получали искомое соединение в виде коричневой смолы (135 мг, 29%).
Пример 130: Получение 1-изопропил-N-(2,2,2-трифторэтил)гидразинкарбоксамидгидрохлорида:
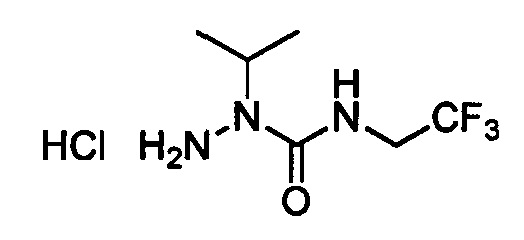
Стадия 1. трет-Бутил-2-изопропил-2-(2,2,2-трифторэтилкарбамоил)гидразинкарбоксилат: 2,2,2-Трифторэтанамин (284 мг, 2,87 ммоля), ТЭА (0,8 мл, 5,74 ммоля)) в CH2Cl2 (6 мл) при -40°С добавляли к раствору трифосгена (298 мг, 1 ммоля) в CH2Cl2 (8 мл) и реакционную смесь перемешивали в течение 30 мин. Затем к реакционной смеси при -40°С добавляли трет-бутил-N-(изопропиламино)карбамат (JOC, 2013, 78, 3541-3552.) (500 мг, 2,87 ммоля) в CH2Cl2 (4 мл) и перемешивали при температуре окружающей среды в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали с помощью CH2Cl2. Органический слой промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали и получали искомое соединение в виде почти белого твердого вещества (580 мг, неочищенное): температура плавления 90-94°С;1H ЯМР (400 МГц, ДМСО-d6) δ 8,70 (шир.с, 1Н), 6,81 (т, J=6,3, 1Н), 3,89-3,80 (м, 2Н), 3,11-3,08 (м, 1Н), 1,40 (с, 9Н), 0,97 (д, J=6,0 Гц, 6Н); ИЭРМС m/z 241,9 ([М-трет-бутил]+).
Указанные ниже соединения получали по методикам, раскрытым на стадии 1 примера 130.
Бензил-2-метил-2-(2,2,2-трифторэтилкарбамоил)гидразинкарбоксилат
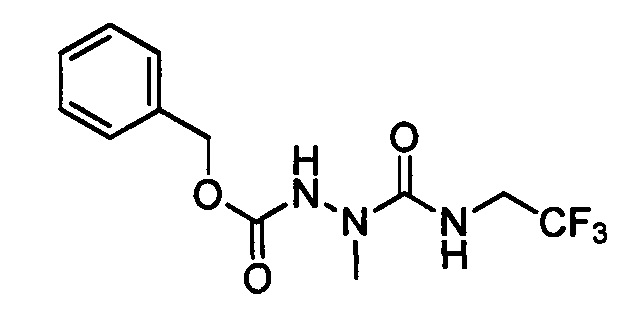
Искомое соединение выделяли в виде бесцветного смолообразного вещества (8,0 г, 20%):1H ЯМР (300 МГц, ДМСО-d6) δ 9,45 (с, 1Н), 7,41 (м, 6Н), 5,11 (с, 2Н), 3,85-3,73 (м, 2Н), 2,95 (с, 3Н); ИК (тонкая пленка) 3332, 2960, 1735, 1161, 742 см-1.
Бензил-2-((2,2-дифторэтил)карбамоил)-2-метилгидразинкарбоксилат

Искомое соединение выделяли в виде коричневого твердого вещества: температура плавления 79-82°С;1H ЯМР (300 МГц, ДМСО-d6) δ 9,39 (шир.с, 1Н), 7,38-7,35 (м, 5Н), 6,10-5,75 (м, 1Н), 5,72 (шир.с, 1Н), 5,10 (с, 2Н), 3,41-3,36 (м, 2Н), 2,94 (с, 3Н).
Бензил-2-метил-2-((3,3,3-трифторпропил)карбамоил)гидразинкарбоксилат
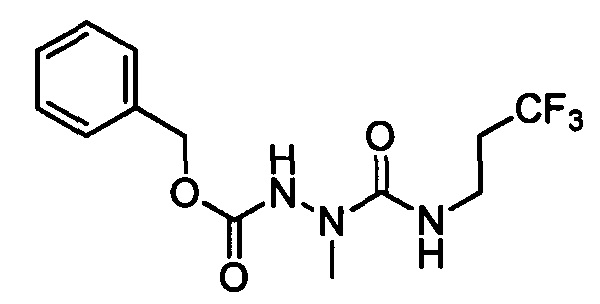
Искомое соединение выделяли в виде коричневого твердого вещества:1H ЯМР (300 МГц, ДМСО-d6) δ 9,46 (шир.с, 1Н), 7,37-7,30 (м, 5Н), 5,10 (с, 2Н), 4,50 (шир.с, 1Н), 3,31-3,19 (м, 2Н), 2,92 (с, 3Н), 2,38-2,33 (м, 2Н); ИЭРМС m/z 320,3 ([М+Н]+); ИК (тонкая пленка) 3415, 1647, 1267, 1143, 742, 514 см-1.
Стадия 2. 1-Изопропил-N-(2,2,2-трифторэтил)гидразинкарбоксамидгидрохлорид: HCl (4 М в диоксане, 10 мл) при перемешивании при 0°С добавляли к раствору трет-бутил-N-[изопропил(2,2,2-трифторэтилкарбамоил)амино]карбамата (530 мг, 1,77 ммоля) в 1,4-диоксане (5 мл) и реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч. Летучие вещества выпаривали и остаток промывали пентаном и получали искомое соединение в виде бледно-желтого твердого вещества. (360 мг, неочищенное):1H ЯМР (300 МГц, ДМСО-d6) δ 11,2 (шир.с, 2Н), 9,81 (с, 1Н), 6,98 (т, J=6,3 Гц, 1Н), 3,90-3,80 (м, 2Н), 3,07-3,03 (м, 1Н), 1,18 (д, J=6,6 Гц, 6Н);13С ЯМР (300 МГц, ДМСО-d6) δ 157,06, 126,90, 52,25, 45,33, 17,49;19F ЯМР (300 МГц, ДМСО-d6) δ -71,52; ИЭРМС m/z 200,0 ([M-HCl]+).
Пример 131: Получение 1-метил-N-(2,2,2-трифторэтил)гидразинкарбоксамидгидрохлорида:
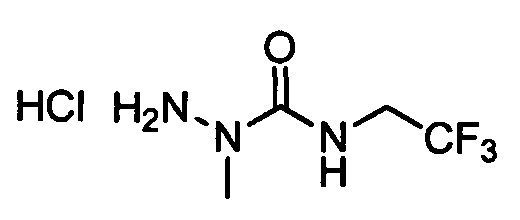
Pd-C (10%, 0,88 г, 8,24 ммоля) при перемешивании порциями добавляли к раствору бензил-N-(2,2,2-трифторэтилкарбамоиламино)карбамата (8,0 г, 27,47 ммоля) в МеОН (80 мл) и реакционную смесь перемешивали в атмосфере водорода (30 фунт/дюйм2) при температуре окружающей среды в течение 12 ч. Реакционную смесь фильтровали через целит® и промывали с помощью МеОН. Фильтрат концентрировали и остаток растворяли в 1,4-диоксане (20 мл) и при перемешивании добавляли HCl (4 М в 1,4-диоксане, 10 мл). После перемешивания при температуре окружающей среды в течение 3 ч летучие вещества выпаривали в вакууме и остаток промывали с помощью EtOAc. Осадившееся твердое вещество сушили в вакууме и получали искомое соединение в виде белого твердого вещества (3 г, 50%):1H ЯМР (300 МГц, ДМСО-d6) δ 9,88 (шир.с, 2Н), 7,99 (шир.с, 1Н), 3,94-3,82 (м, 2Н), 3,12 (с, 3Н);19F ЯМР (300 МГц, ДМСО-d6) δ -71,11; ИЭРМС m/z 171,2 ([М-HCl]+); ИК (тонкая пленка) 3243, 1679, 1565, 1157, 648 см-1.
Указанные ниже соединения получали по методикам, раскрытым в примере 131, без последующей обработки с помощью HCl.
N-(2,2-Дифторэтил)-1-метилгидразинкарбоксамид
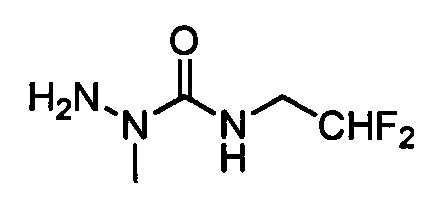
Искомое соединение выделяли в виде бледно-желтого твердого вещества: температура плавления 81-84°С;1H ЯМР (300 МГц, ДМСО-d6) δ 7,00 (т, J=6,3 Гц, 1Н), 6,14-5,74 (м, 1Н), 4,52 (шир.с, 2Н), 3,46-3,32 (м, 2Н), 2,95 (с, 3Н); ЭУМС m/z 153,2 ([М]+).
1-Метил-N-(3,3,3-трифторпропил)гидразинкарбоксамид

Искомое соединение выделяли в виде желтого полужидкого вещества:1H ЯМР (300 МГц, ДМСО-d6) δ 6,93 (шир.с, 1Н), 4,40 (шир.с, 2Н), 3,25-3,02 (м, 2Н), 2,91 (с, 3Н), 2,87-2,56 (м, 2Н); ЭУМС m/z 185,2 ([М]+); ИК (тонкая пленка) 3409, 1652, 1530, 1144, 763, 552 см-1.
Пример 132: Получение 3,5-дибром-4-хлорбензальдегида

Стадия 1. Метил-4-амино-3,5-дибромбензоат:
Концентрированную H2SO4 (1,35 мл, 25,48 ммоля) при перемешивании по каплям добавляли к раствору 4-амино-3,5-дибромбензойной кислоты (5,0 г, 16,99 ммоля) в МеОН (50 мл) при температуре окружающей среды и затем реакционную смесь перемешивали при 80°С в течение 8 ч. Реакционной смеси давали охладиться до температуры окружающей среды, летучие вещества выпаривали и к остатку добавляли воду со льдом и экстрагировали с помощью EtOAc. Органический слой промывали водным раствором NaHCO3, затем рассолом и водой, сушили (Na2SO4), фильтровали и концентрировали и получали искомое соединение в виде почти белого твердого вещества (5,0 г, 95%):1H ЯМР (300 МГц, ДМСО-d6) δ 7,91 (с, 2Н), 6,20 (шир.с, 2Н), 3,78 (с, 3Н); ИЭРМС m/z 307,0 ([М]+); ИК (тонкая пленка) 3312, 2953, 1726, 595 см-1.
Стадия 2. Метил-3,5-дибром-4-хлорбензоат: CuCl2 (2,82 г, 21,0 ммоля) в MeCN (30 мл) перемешивали при 80°С в течение 30 мин. Затем при такой же температуре по каплям добавляли трет-бутилнитрит (2,7 мл, 23 ммоля) и смесь перемешивали в течение еще 10 мин. К реакционной смеси по каплям добавляли метил-4-амино-3,5-дибромбензоат (5,0 г, 16 ммоля) в MeCN (30 мл) и перемешивали при 80°С в течение 30 мин. Реакционной смеси давали охладиться до температуры окружающей среды и к реакционной смеси добавляли водный раствор аммиака (20 мл) и экстрагировали петролейным эфиром. Органический слой промывали рассолом, затем водой, сушили (Na2SO4), фильтровали и концентрировали и получали искомое соединение в виде почти белого твердого вещества (4,5 г, 84%).1H ЯМР (300 МГц, ДМСО-d6) δ 8,21 (с, 2Н), 3,94 (с, 3Н); ИЭРМС m/z 326 ([М]+); ИК (тонкая пленка) 1732, 746 см-1.
Стадия 3. (3,5-Дибром-4-хлорфенил)метанол: NaBH4 (1,53 г, 40,65 ммоля) при перемешивании при 0°С порциями добавляли к раствору метил-3,5-дибром-4-хлорбензоата (4,45 г, 13,6 ммоля) в МеОН (50 мл). Затем реакционную смесь перемешивали при температуре окружающей среды в течение 8 ч. Летучие вещества выпаривали и остаток разбавляли с помощью CH2Cl2 и промывали рассолом, затем водой. Органический слой сушили (Na2SO4), фильтровали и концентрировали и получали искомое соединение в виде почти белого твердого вещества (3,3 г, 80%):1H ЯМР (300 МГц, ДМСО-d6) δ 7,71 (с, 2Н), 5,49 (шир.с, 1Н), 4,48 (д, J=4,5 Гц, 2Н); ИЭРМС m/z 297,9 ([М]+); ИК (тонкая пленка) 3460, 747, 534 см-1.
Стадия 4. 3,5-Дибром-4-хлорбензальдегид:
Пиридинийхлорхромат (ПХХ, 3,44 г, 15,9 ммоля) при температуре окружающей среды при перемешивании одной порцией добавляли к раствору (3,5-дибром-4-хлорфенил)метанола (3,2 г, 11,0 ммоля) в CHCl3 (40 мл) и реакционную смесь перемешивали в течение ночи. Реакционную смесь фильтровали через целит®, слой целита® промывали с помощью CHCl3 и фильтрат концентрировали и получали искомое соединение в виде почти белого твердого вещества (2,0 г, 62%): температура плавления 110-113°С;1H ЯМР (300 МГц, ДМСО-d6) δ 9,93 (с, 1Н), 8,27 (с, 2Н); ИЭРМС m/z 297,0 ([М]+).
Пример 133: Получение 4-бром-3,5-дихлорбензальдегида
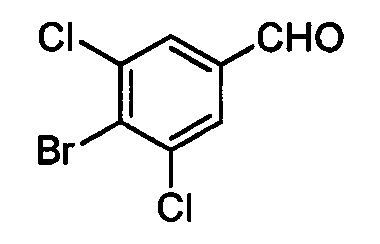
Стадия 1. Метил-4-амино-3,5-дихлорбензоат: Концентрированную H2SO4 (2,5 мл, 97,04 ммоля) при 0°С при перемешивании по каплям добавляли к раствору 4-амино-3,5-дихлорбензойной кислоты (10,0 г, 48,54 ммоля) в МеОН (150 мл) и затем реакционную смесь перемешивали при 80°С в течение 8 ч. Летучие вещества выпаривали; к остатку добавляли воду со льдом и экстрагировали с помощью EtOAc. Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении, и получали искомое соединение в виде белого твердого вещества (7,5 г, 70%):1H ЯМР (300 МГц, ДМСО-d6) δ 8,05 (с, 2Н), 3,96 (с, 3Н); ИЭРМС m/z 282 ([M]+); ИК (KBr): 1733, 762, 514 см-1.
Стадия 2. Метил-4-бром-3,5-дихлорбензоат: CuBr2 (7,5 г, 34,08 ммоля) в MeCN (50 мл) перемешивали при 80°С в течение 30 мин. При такой же температуре по каплям добавляли трет-бутилнитрит (6,5 мл, 54,55 ммоля) и смесь перемешивали в течение еще 10 мин. К реакционной смеси при перемешивали при 80°С в течение 30 мин по каплям добавляли метил-4-амино-3,5-дихлорбензоат в MeCN (30 мл). Реакционной смеси давали охладиться до температуры окружающей среды и добавляли водный раствор аммиака (20 мл) и экстрагировали петролейным эфиром. Органический слой промывали рассолом, затем водой, сушили (Na2SO4), фильтровали и концентрировали и получали искомое соединение в виде почти белого твердого вещества (7,5 г, 77%):1H ЯМР (300 МГц, ДМСО-d6) δ 8,02 (с, 2Н), 3,94 (с, 3Н); ИЭРМС m/z 282 ([М]+); ИК (тонкая пленка) 1733, 762, 514 см-1.
Стадия 3. (4-Бром-3,5-дихлорфенил)метанол: DIBAL-H (1M в толуоле, 66 мл, и 66,0 ммоля) при -78°С при перемешивании по каплям добавляли к раствору метил-4-бром-3,5-дихлорбензоата (7,5 г, 26,0 ммоля) в ТГФ (50 мл). Реакционной смеси давали нагреться до температуры окружающей среды и перемешивали в течение 6 ч. Реакционную смесь выливали в смесь воды со льдом и экстрагировали с помощью CH2Cl2. Органический слой промывали рассолом, затем водой, сушили (Na2SO4), фильтровали и концентрировали и получали 6,0 г смеси (4-бром-3,5-дихлорфенил)метанола и 4-бром-3,5-дихлорбензальдегида в виде почти белого твердого вещества, которое использовали на следующей стадии без очистки.
Стадия 4. 4-Бром-3,5-дихлорбензальдегид: ПХХ (7,5 г, 35,16 ммоля) при температуре окружающей среды при перемешивании одной порцией добавляли к раствору, содержащему смесь (4-бром-3,5-дихлорфенил)метанола и 4-бром-3,5-дихлорбензальдегида (6,0 г) в CHCl3 (40 мл), и реакционную смесь перемешивали в течение ночи. Реакционную смесь фильтровали через целит. Слой целита промывали с помощью CHCl3. Фильтрат концентрировали и получали искомое соединение в виде почти белого твердого вещества (3,5 г, 67%): температура плавления 125-128°С;1H ЯМР (300 МГц, ДМСО-d6) δ 9,96 (с, 1Н), 8,10 (с, 2Н); ИЭРМС m/z 252 ([М]+).
Пример 134: Получение (Е)-N-(2-аминоэтил)-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамида
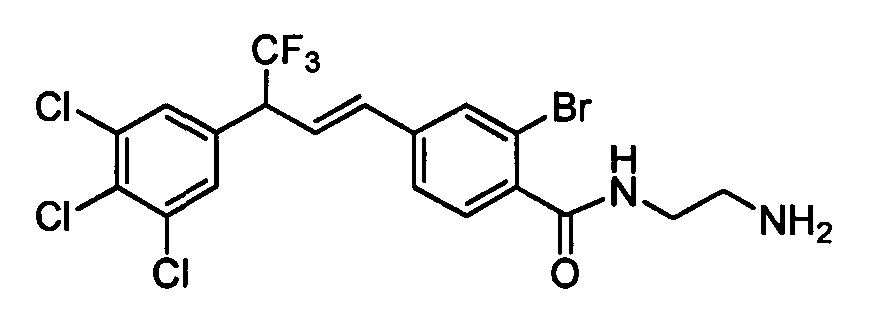
Стадия 1. (E)-трет-бутил-2-(2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамидо)этилкарбамат: PyBOP (420 мг, 0,82 ммоля) и ДИПЭА (0,410 мл, 2,46 ммоля) при перемешивании добавляли к раствору (Е)-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензойной кислоты (400 мг, 0,82 ммоля) и трет-бутил-2-аминоэтилкарбамата (130 мг, 0,82 ммоля) в CH2Cl2 (10 мл) и реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. К реакционной смеси добавляли воду и ее затем экстрагировали с помощью CH2Cl2 (25 мл). Органический слой промывали с помощью 2 н. HCl, затем насыщенным водным раствором NaHCO3 и рассолом. Органический слой сушили (Na2SO4), фильтровали, концентрировали и остаток очищали с помощью колоночной хроматографии на диоксиде кремния (100-200 меш) при элюировании с помощью 40% EtOAc в петролейном эфире и получали искомое соединение в виде коричневого твердого вещества (200 мг, 39%):1H ЯМР (400 МГц, ДМСО-d6) δ 8,38 (т, J=5,2 Гц, 1Н), 7,91-7,89 (м, 3Н), 7,58 (д, J=6,8 Гц, 1Н), 7,41 (д, J=7,6 Гц, 1Н), 6,99 (дд, J=15,6, 9,2 Гц, 1Н), 6,84 (т, J=6,0 Гц, 1Н), 6,76 (т, J=15,6 Гц, 1Н), 4,84-4,80 (м, 1Н), 3,24-3,20 (м, 2Н), 3,11-3,08 (м, 2Н), 1,30 (с, 9Н); ИЭРМС m/z 628,80 ([М+Н]+); ИК (тонкая пленка) 3365, 1701, 1167, 699, 555 см-1.
Стадия 2. (E)-N-(2-Аминоэтил)-2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамид: ТФК (0,5 мл) при перемешивании при 0°С добавляли к раствору (E)-трет-бутил-2-(2-бром-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-енил)бензамидо)этилкарбамата (200 мг, 0,31 ммоля) в CH2Cl2 (10 мл) и затем реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Летучие вещества выпаривали при пониженном давлении; к остатку добавляли воду и смесь экстрагировали с помощью CH2Cl2. Органический слой промывали рассолом, сушили (Na2SO4), фильтровали, концентрировали и остаток очищали с помощью колоночной хроматографии на диоксиде кремния (100-200 меш) при элюировании с помощью 1-5% МеОН в CH2Cl2 и получали искомое соединение в виде коричневого твердого вещества (50 мг, 31%):1H ЯМР (400 МГц, ДМСО-d6) δ 8,56 (шир.с, 1Н), 7,70 (шир.с, 2Н), 7,94-7,91 (м, 3Н), 7,62-7,59 (м, 1Н), 7,50 (д, J=7,6 Гц, 1Н), 7,00 (дд, J=15,6, 9,2 Гц, 1Н), 6,77 (д, J=15,6 Гц, 1Н), 4,84-4,81 (м, 1Н), 3,46-3,41 (м, 2Н), 2,95-2,92 (м, 2Н); ИЭРМС m/z 528,72 ([М+Н]+); ИК (тонкая пленка) 3435, 1671, 1113, 722, 555 см-1.
Пример 135: Получение (Е)-N-(2-аминоэтил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)-2-(трифторметил)бензамида (FA10)
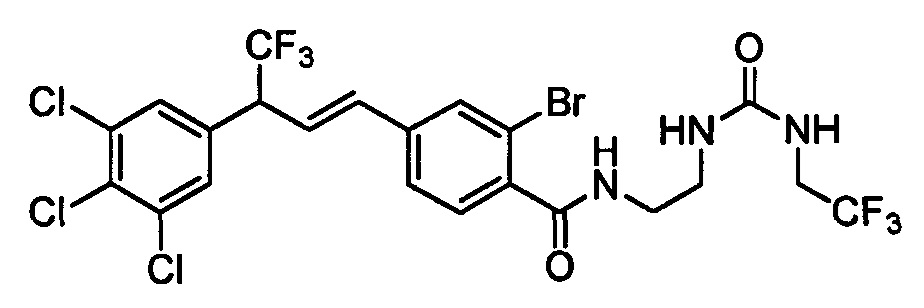
К раствору (Е)-N-(2-аминоэтил)-4-(4,4,4-трифтор-3-(3,4,5-трихлорфенил)бут-1-ен-1-ил)-2-(трифторметил)бензамида (0,2 г, 0,385 ммоля) в CH2Cl2 (4 мл) в атмосфере азота при охлаждении в бане со льдом добавляли трифосген (228 мг, 0,770 ммоля) и триэтиламин (0,445 мл, 3,19 ммоля). Смесь перемешивали при температуре окружающей среды в течение 1,5 ч, затем обрабатывали 2,2,2-трифторэтанамином (0,248 мл, 3,01 ммоля). После перемешивания в течение 18 ч при температуре окружающей среды смесь подвергали распределению между водой и EtOAc. Водную фазу экстрагировали с помощью EtOAc. Объединенные органические фазы концентрировали в вакууме и полученное неочищенное масло очищали с помощью колоночной хроматографии на диоксиде кремния при элюировании с помощью EtOAc и гексанов и получали искомое соединение в виде желто-зеленого вязкого масла (50 мг, 20%).
Указанные ниже возможные молекулы можно было получить по методикам, раскрытым в возможном примере F1:
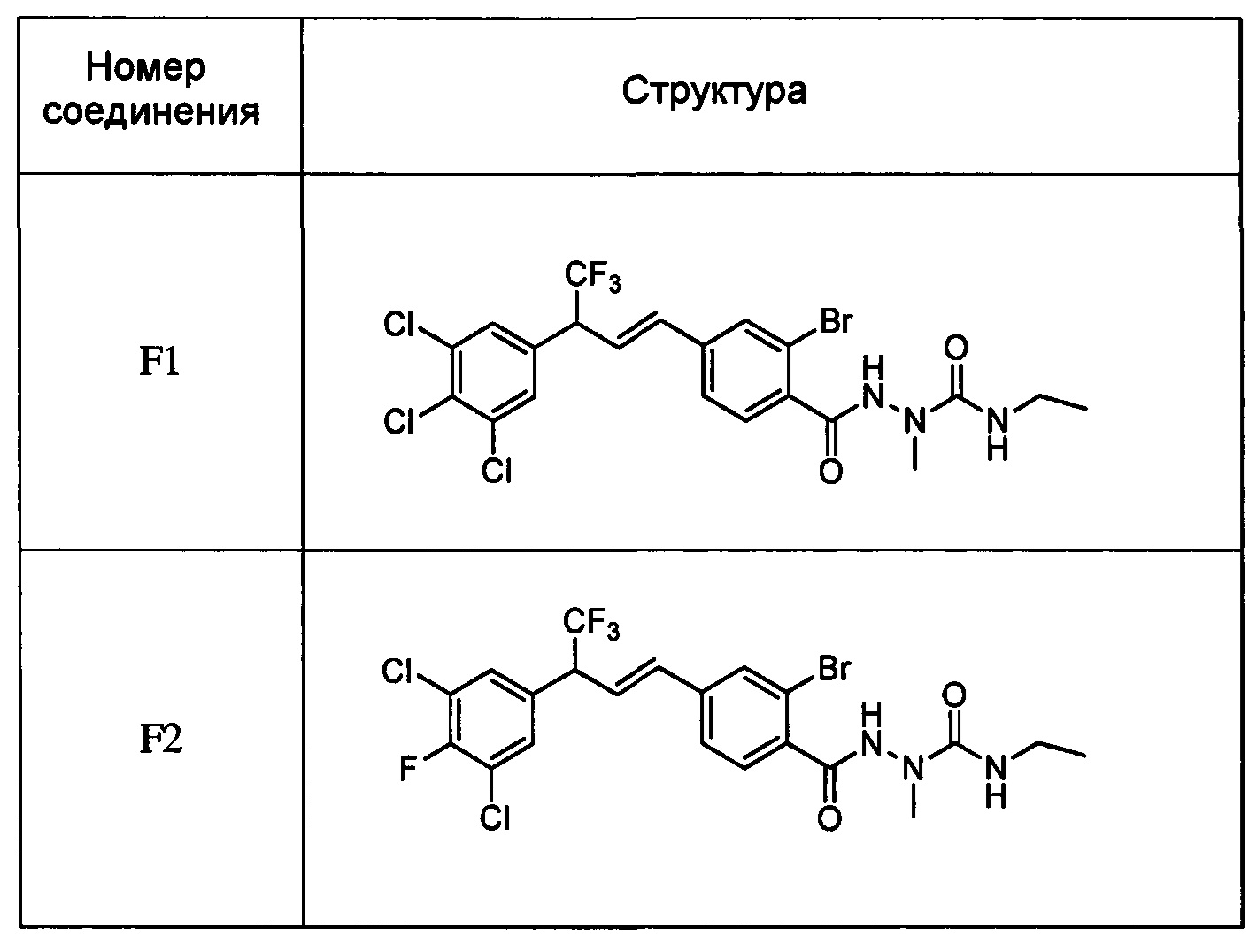
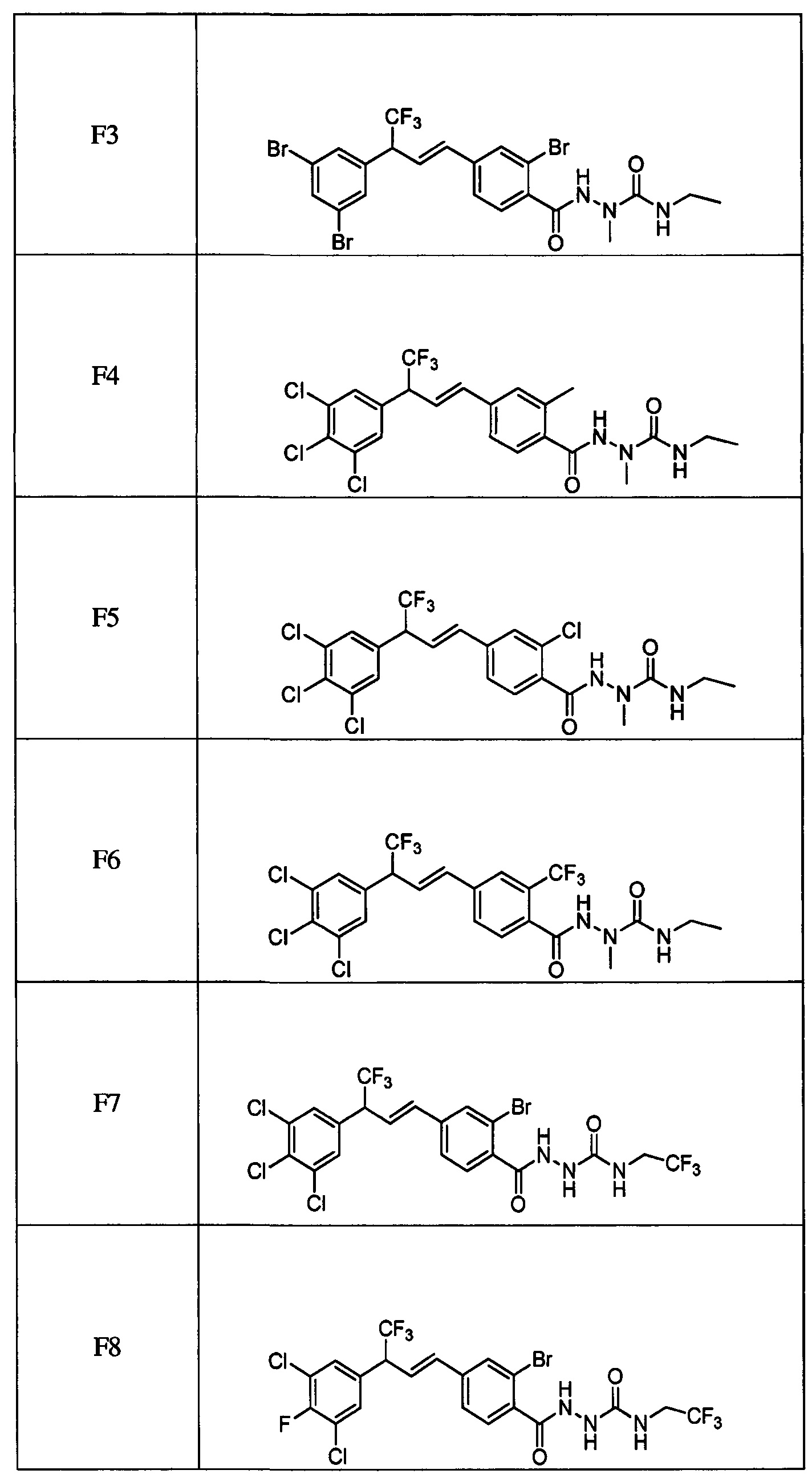
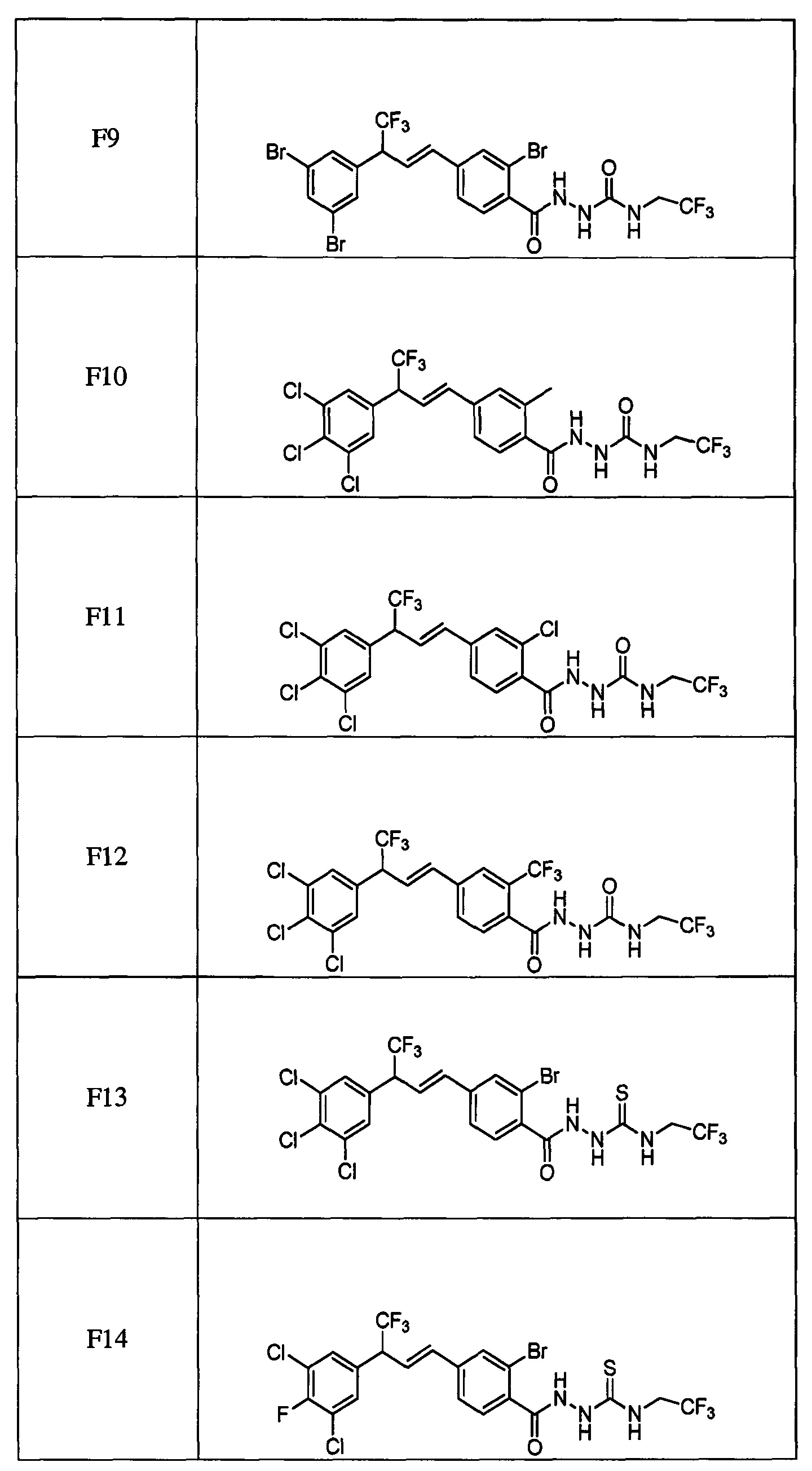
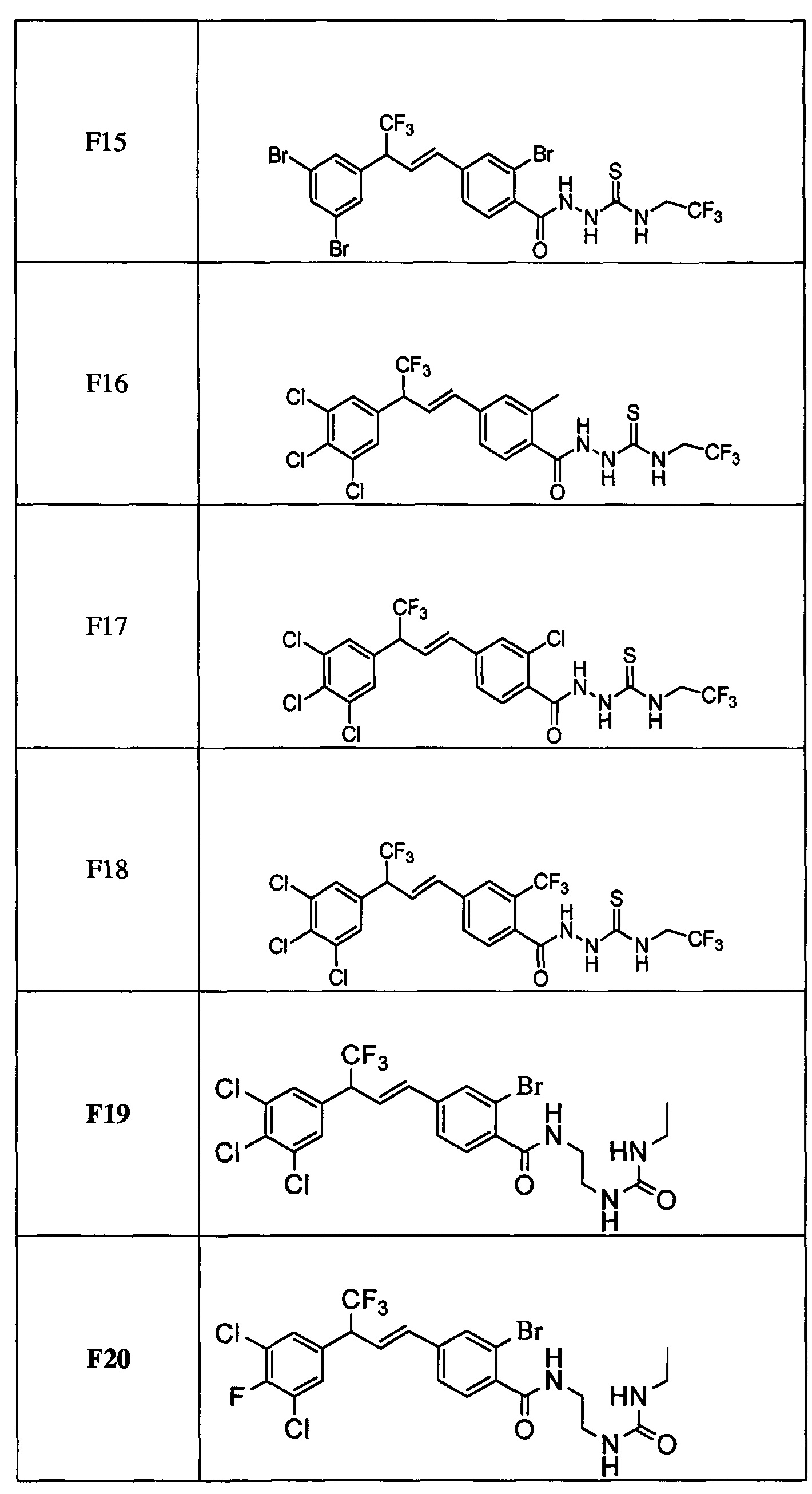
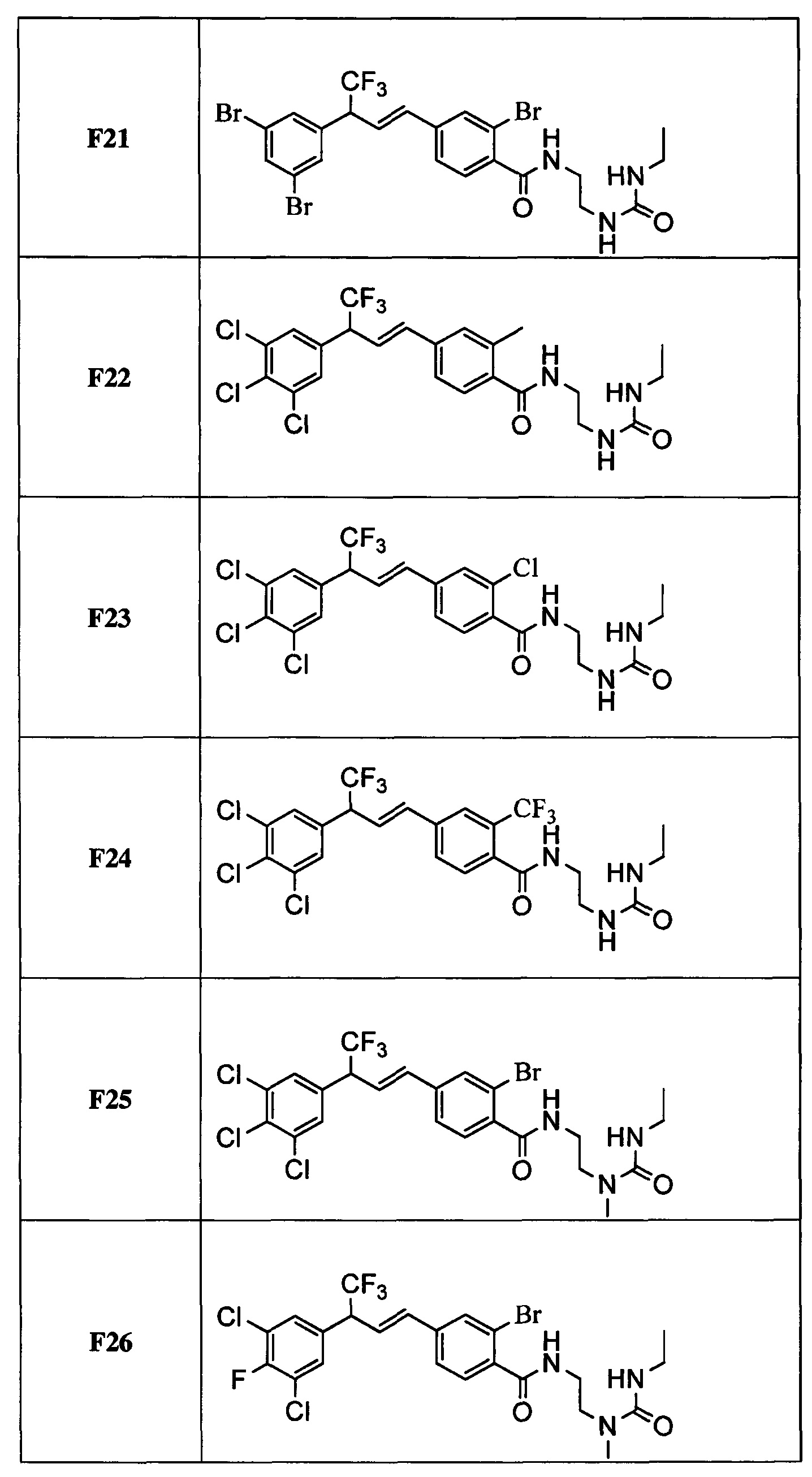
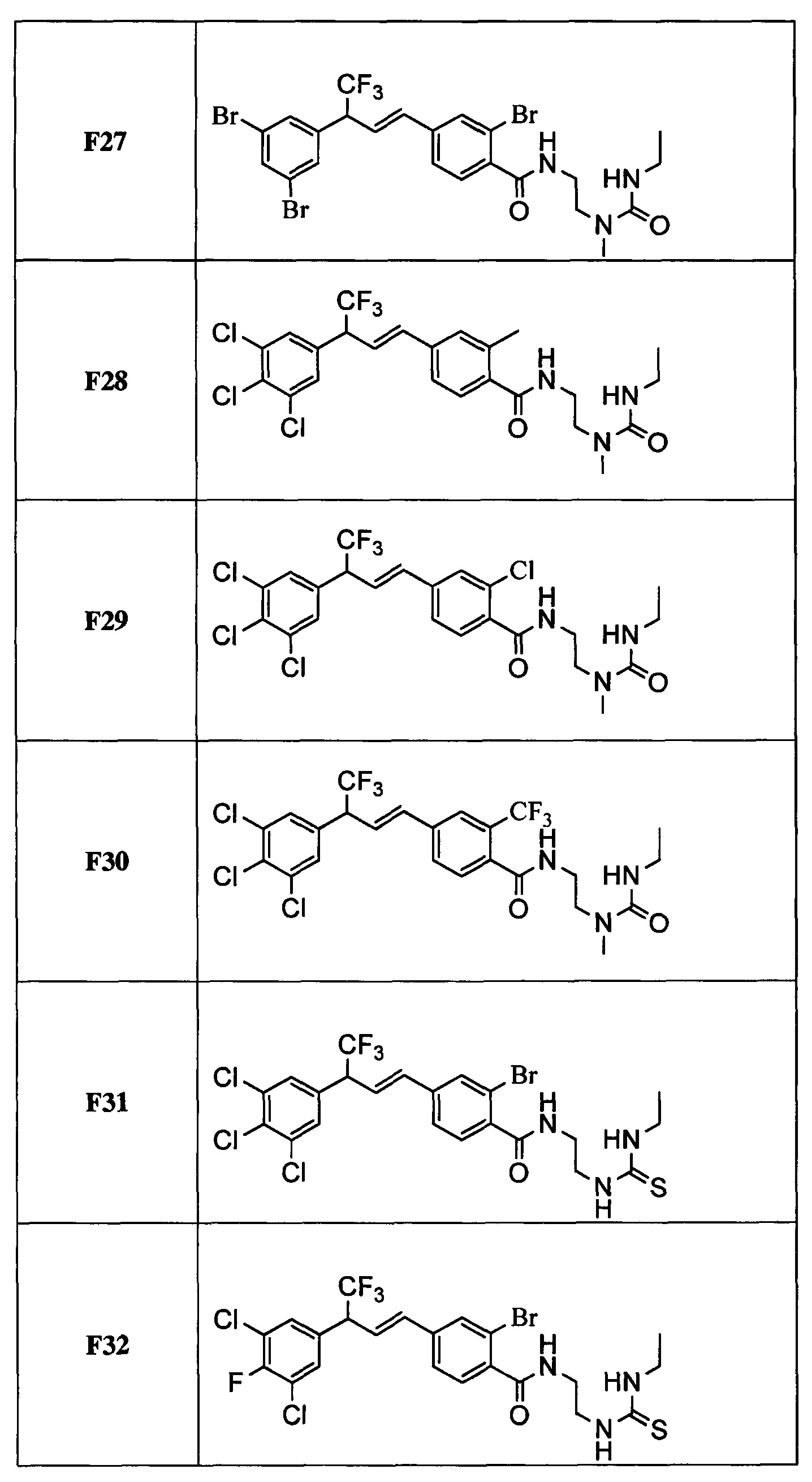
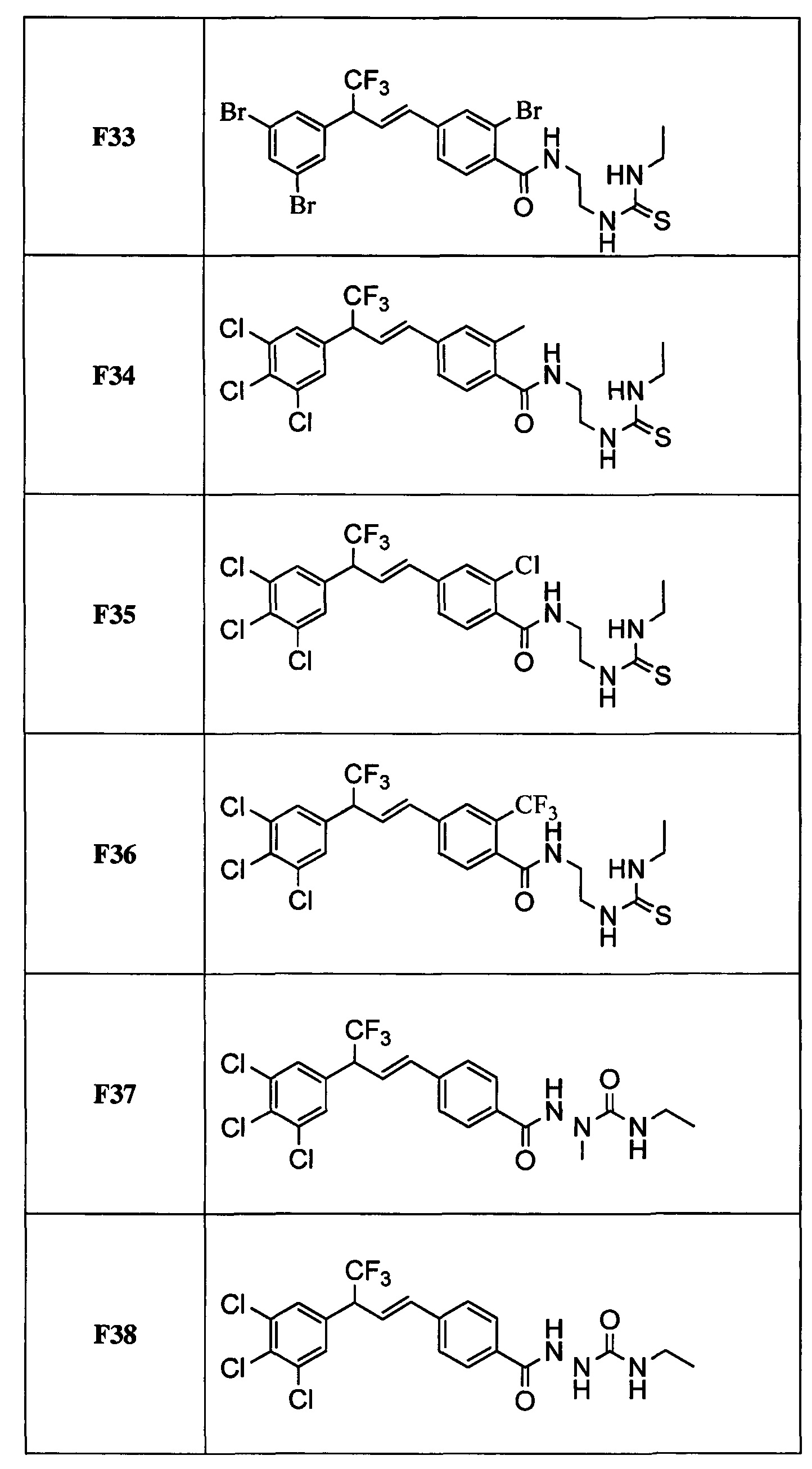
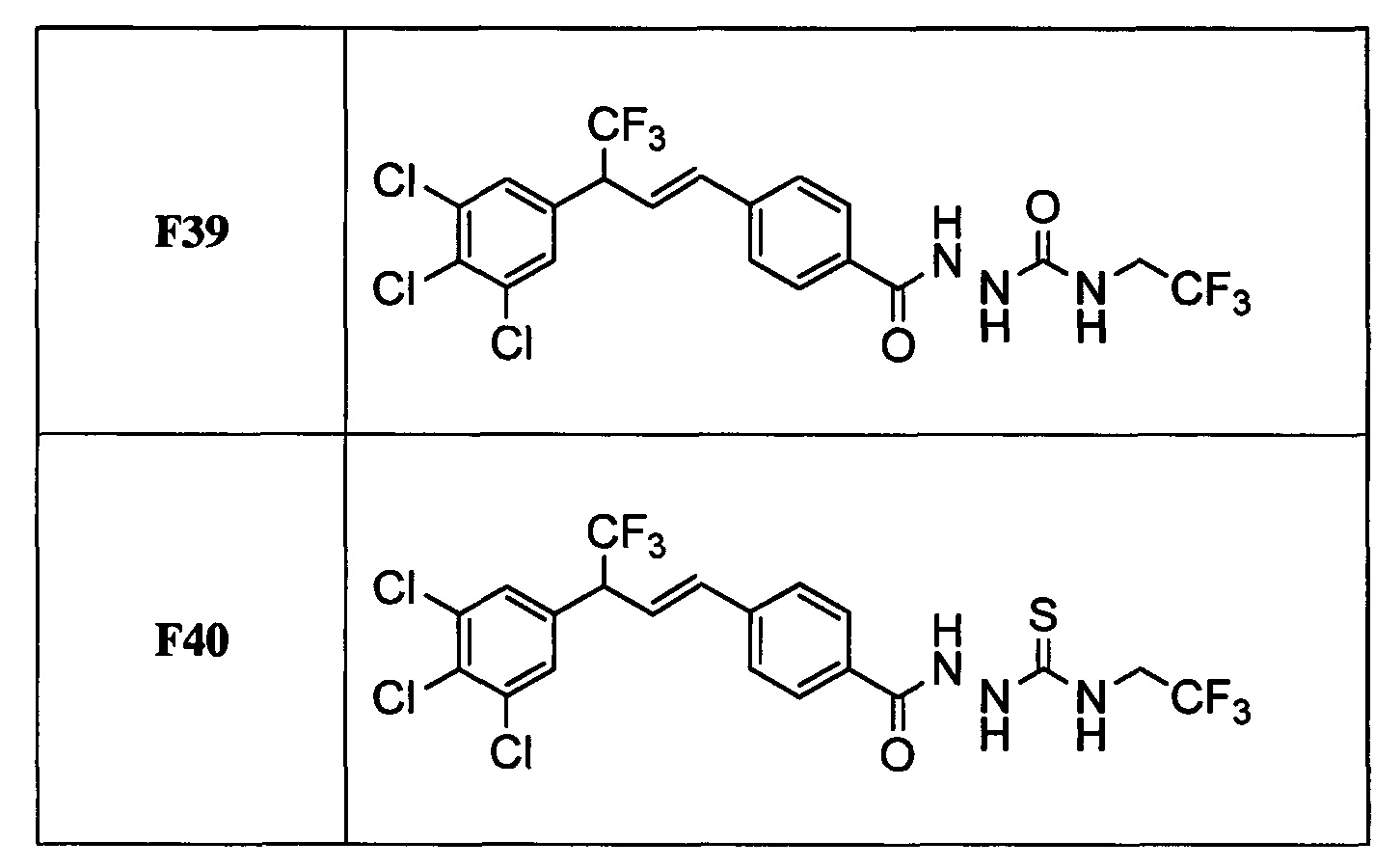
Указанные ниже возможные молекулы можно было получить по методикам, раскрытым в настоящей заявке:





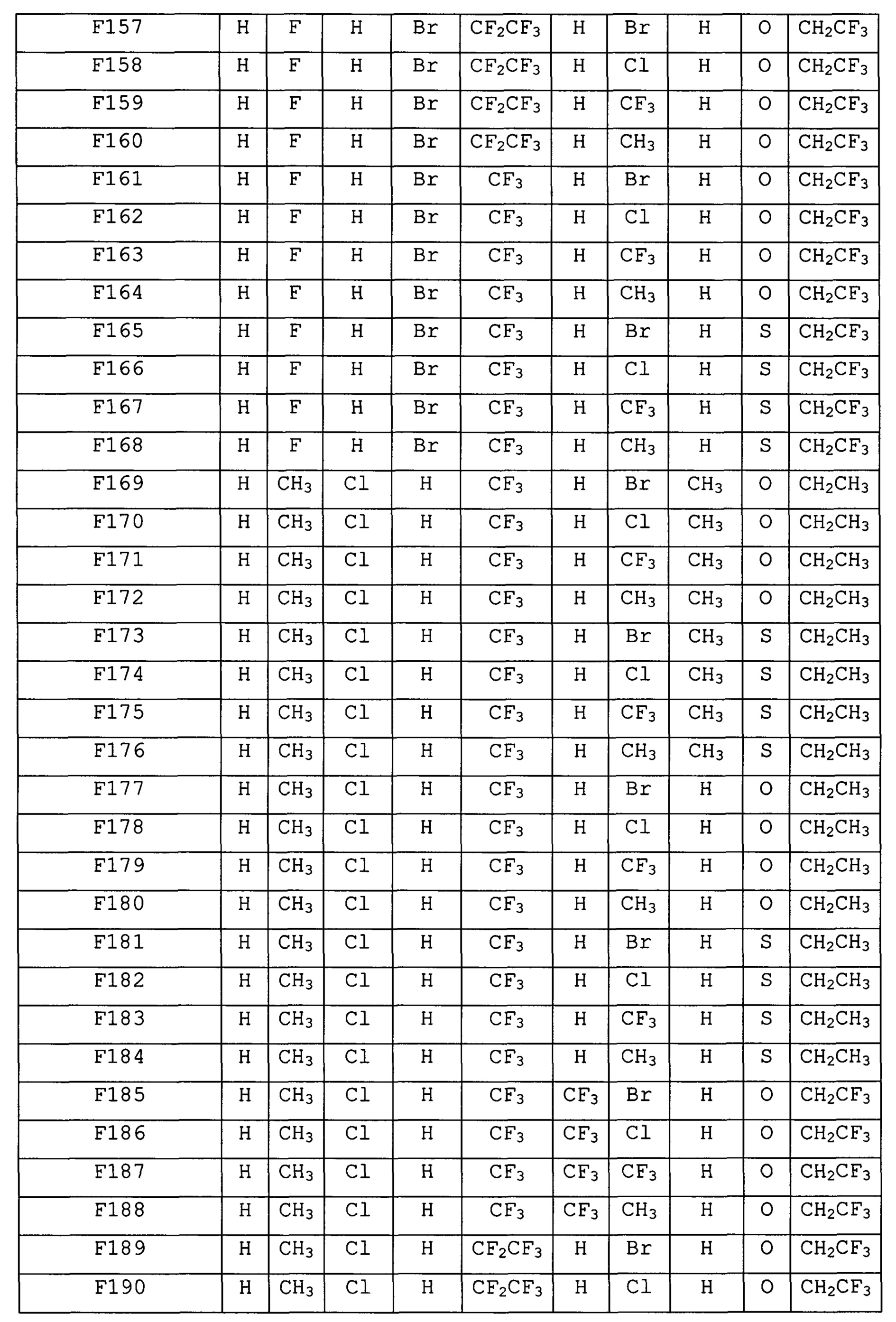

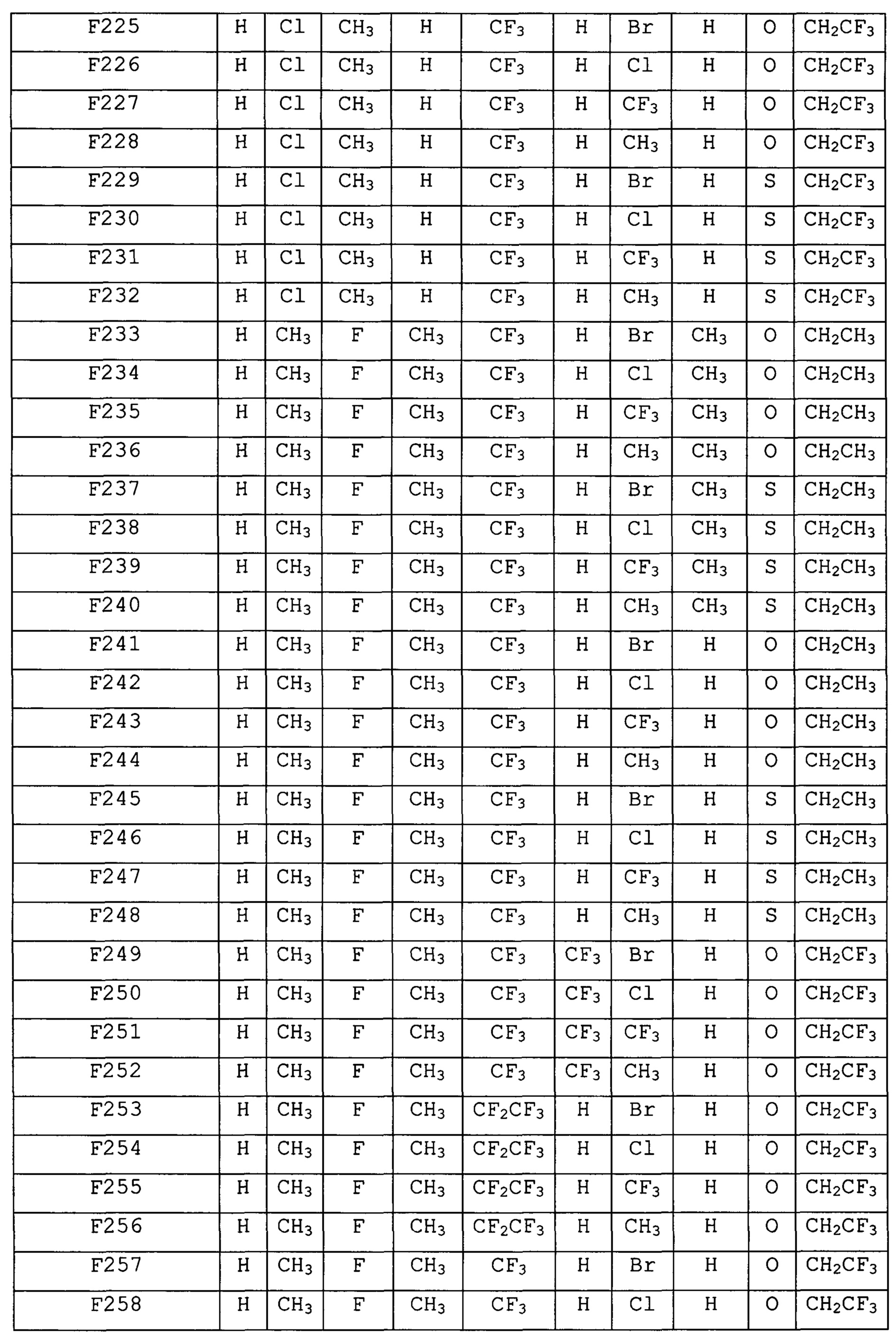
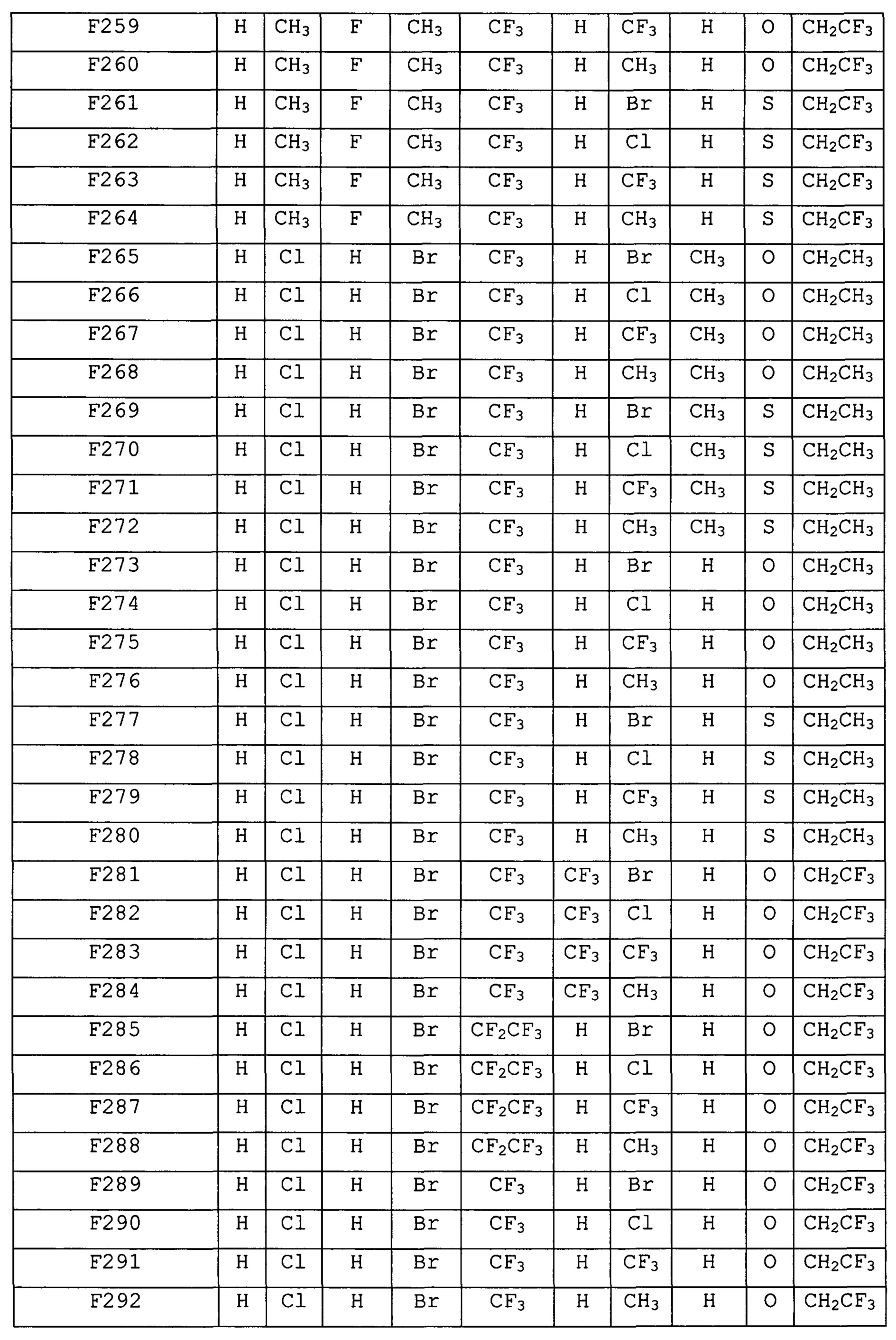
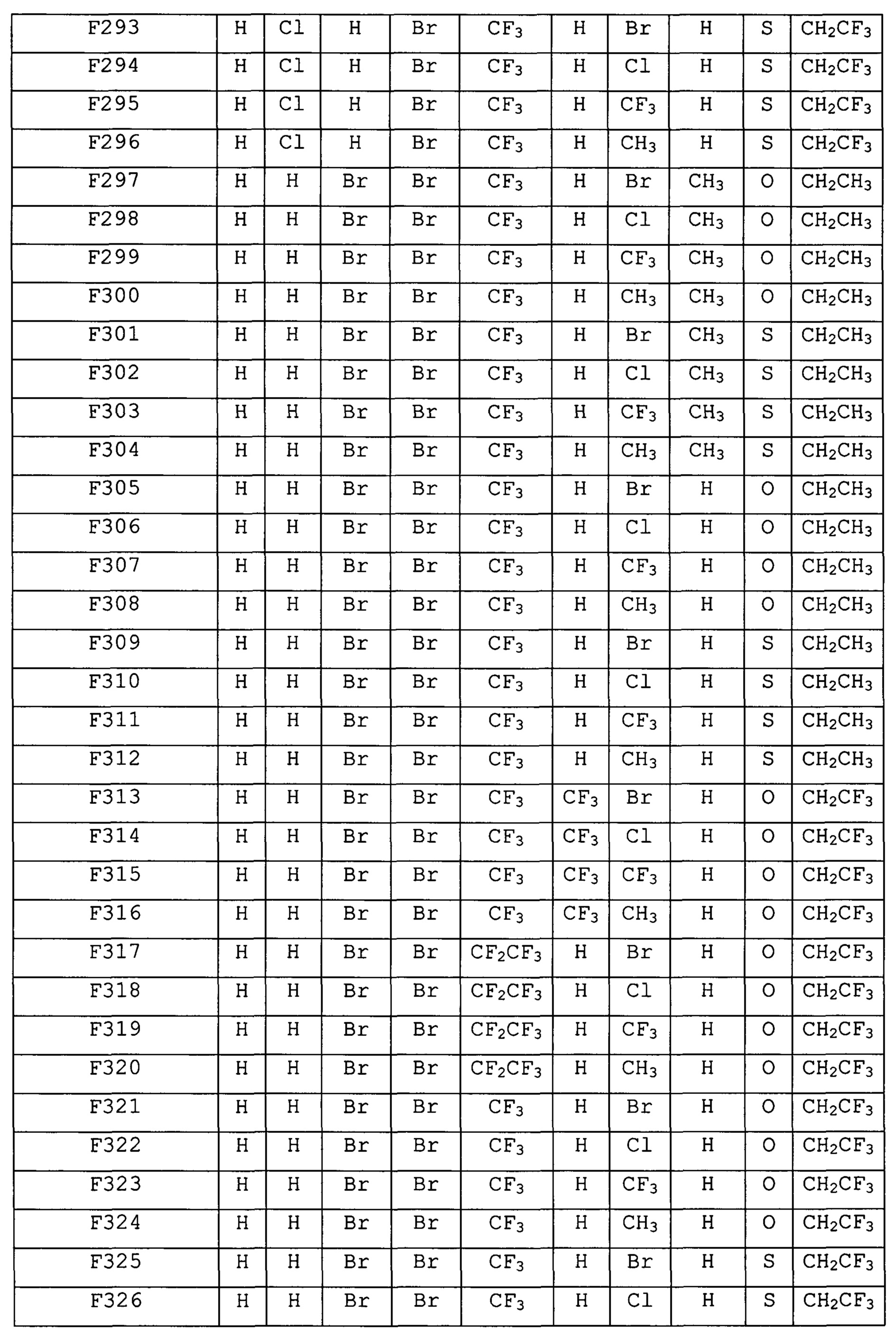
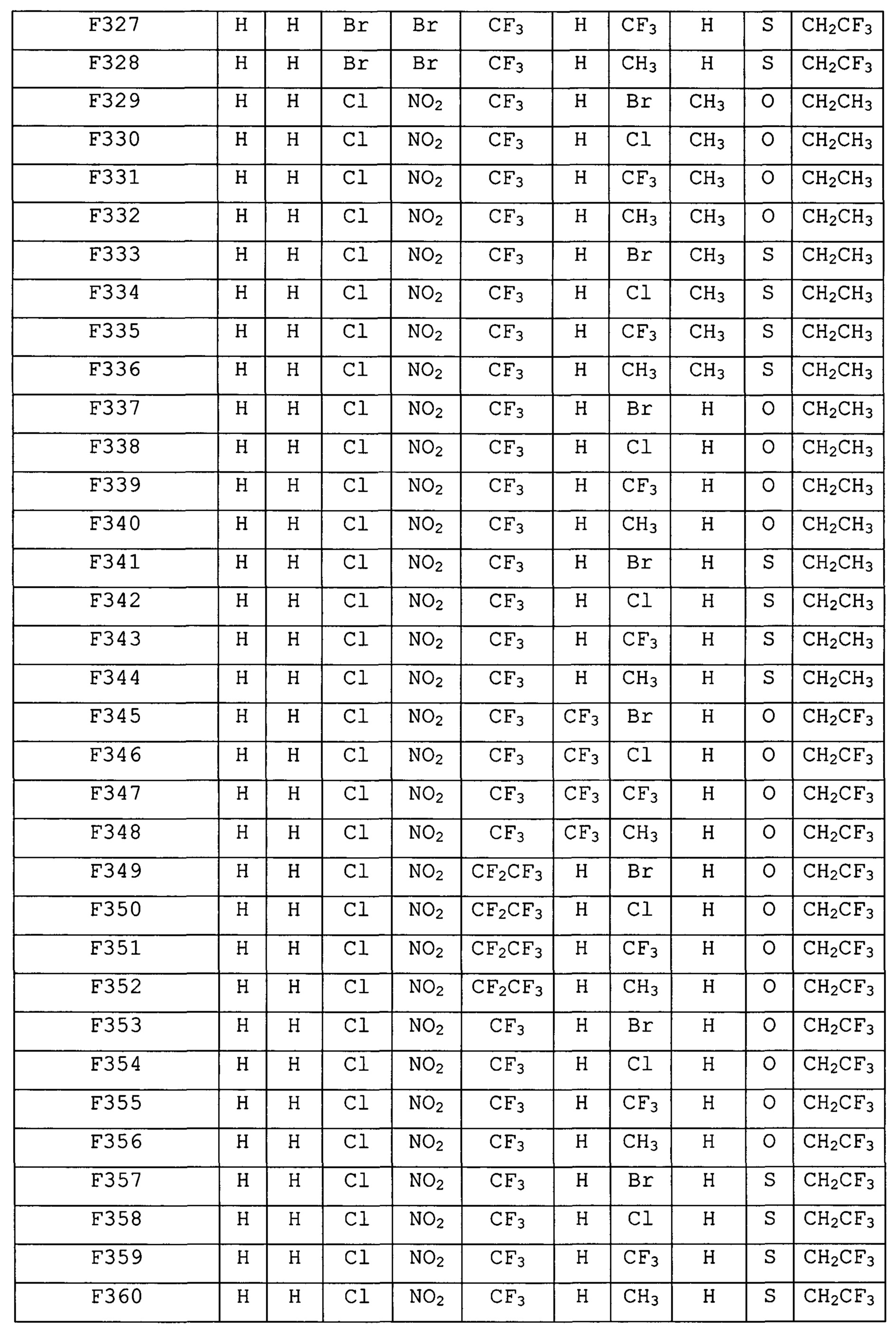
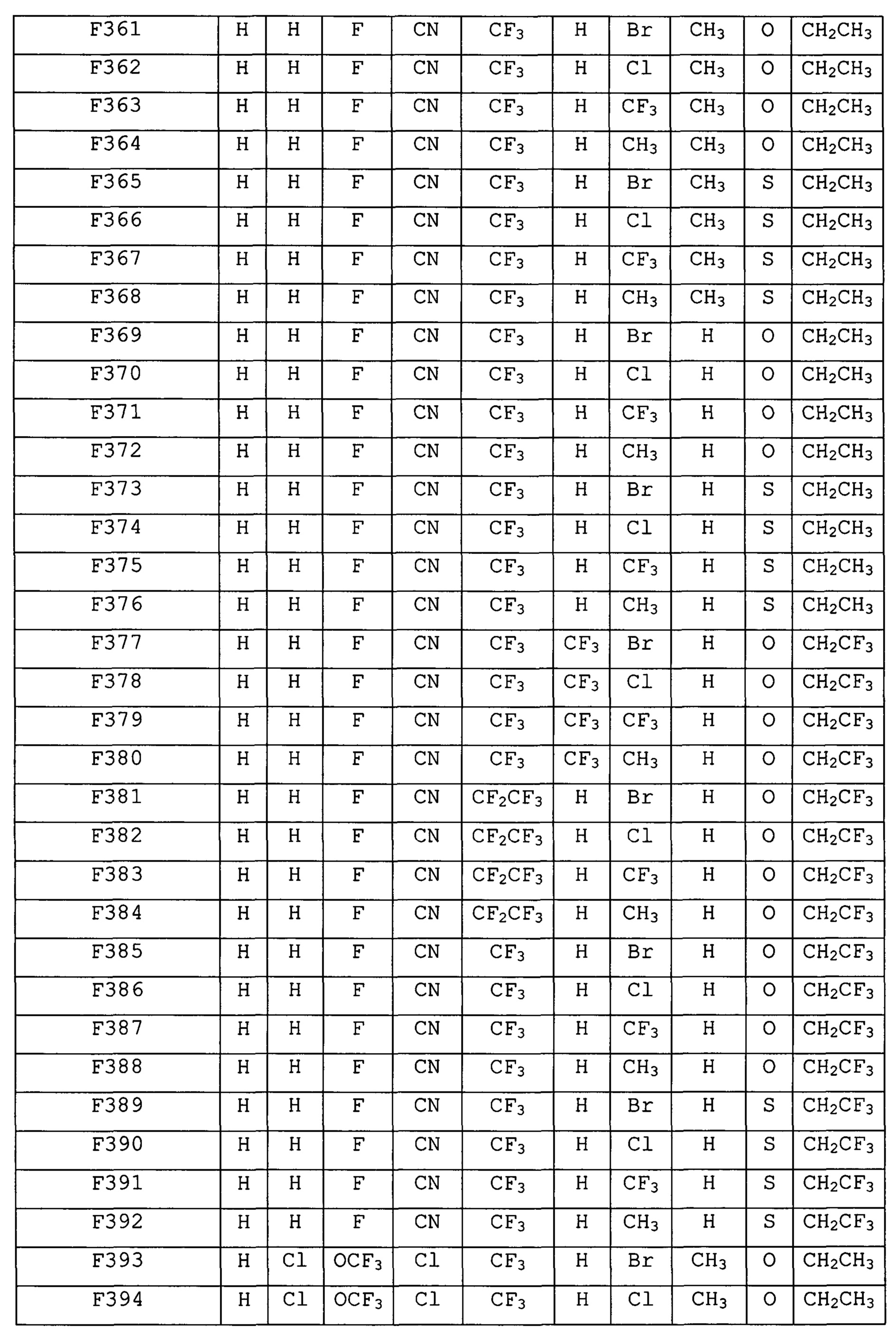
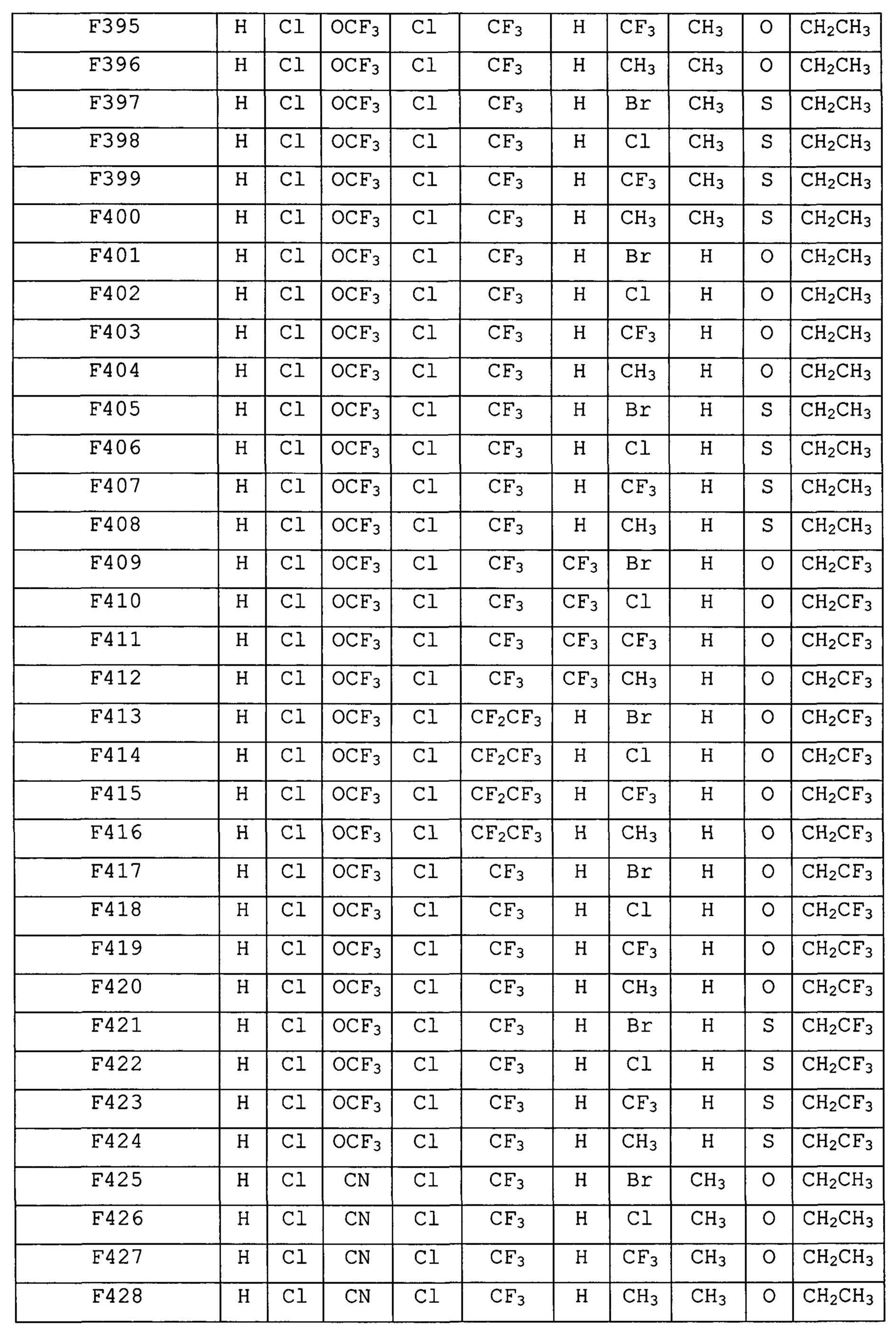
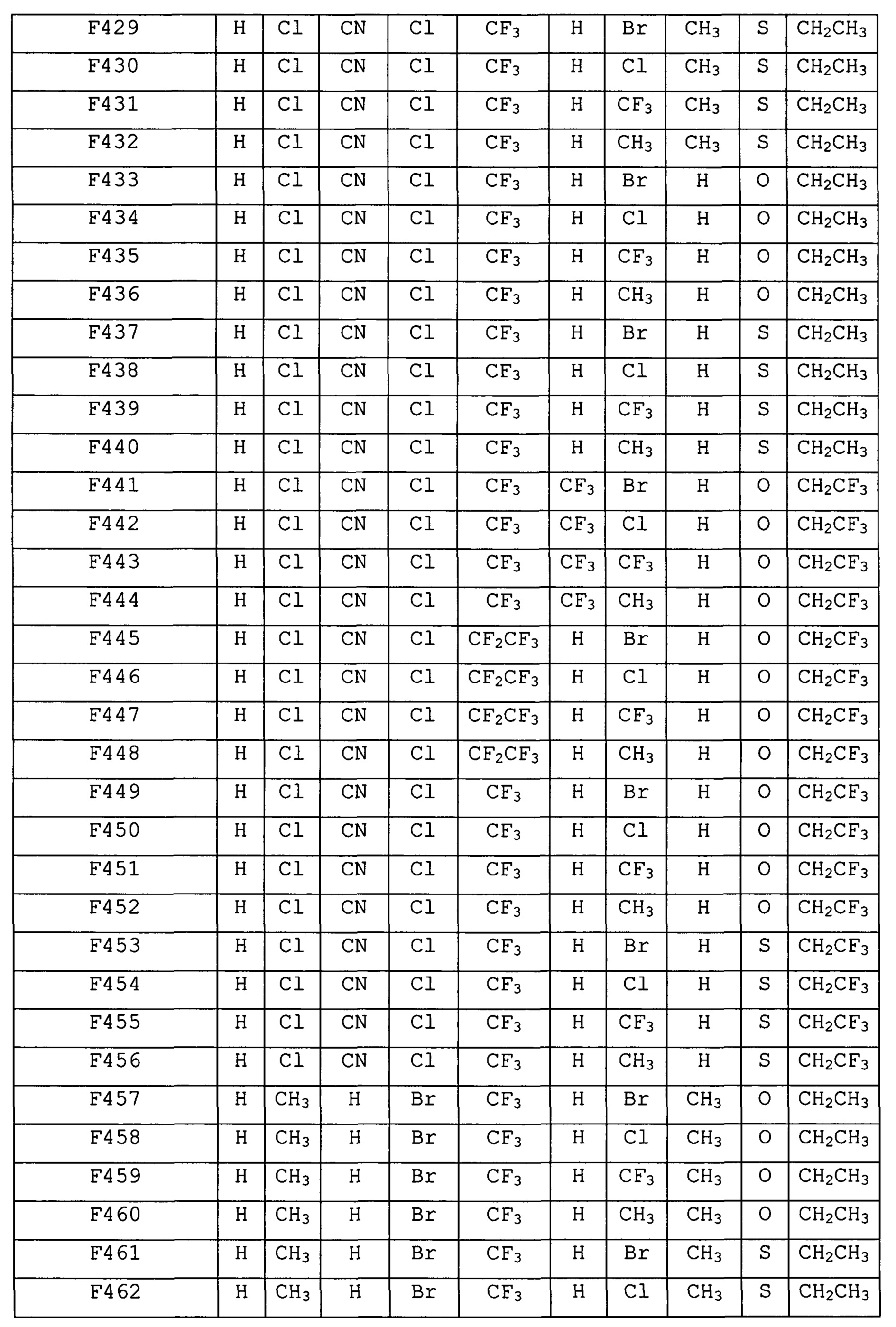
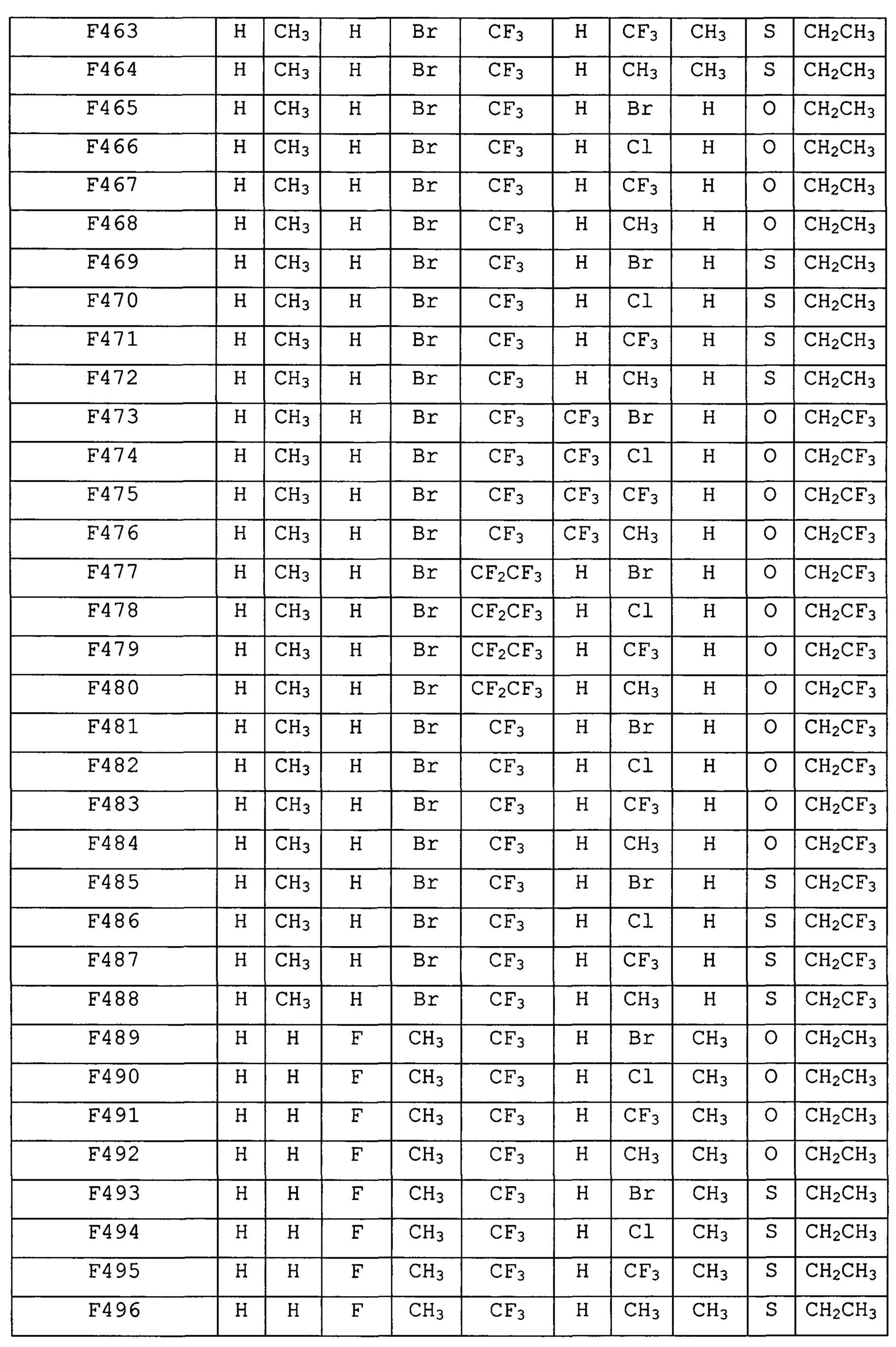
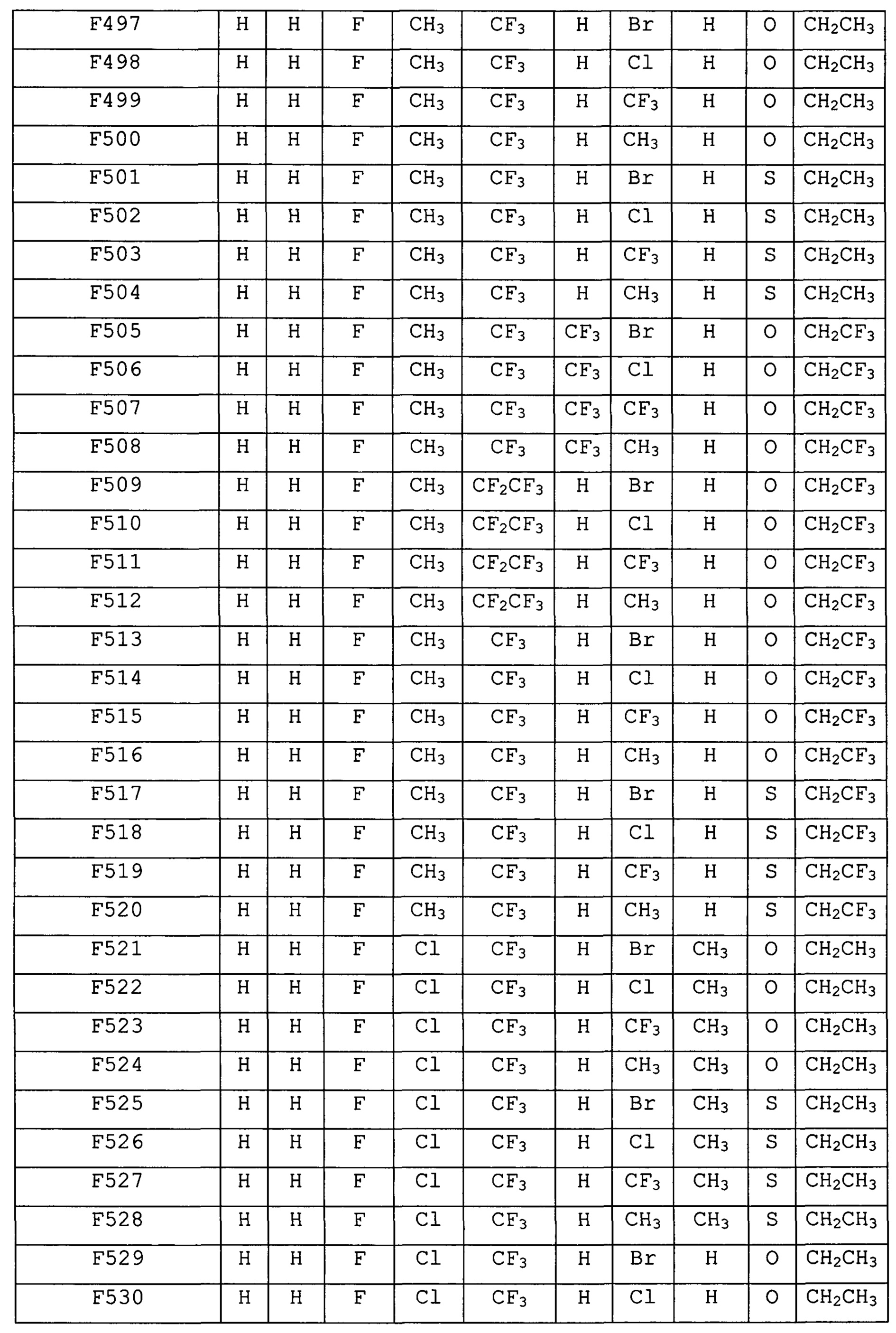
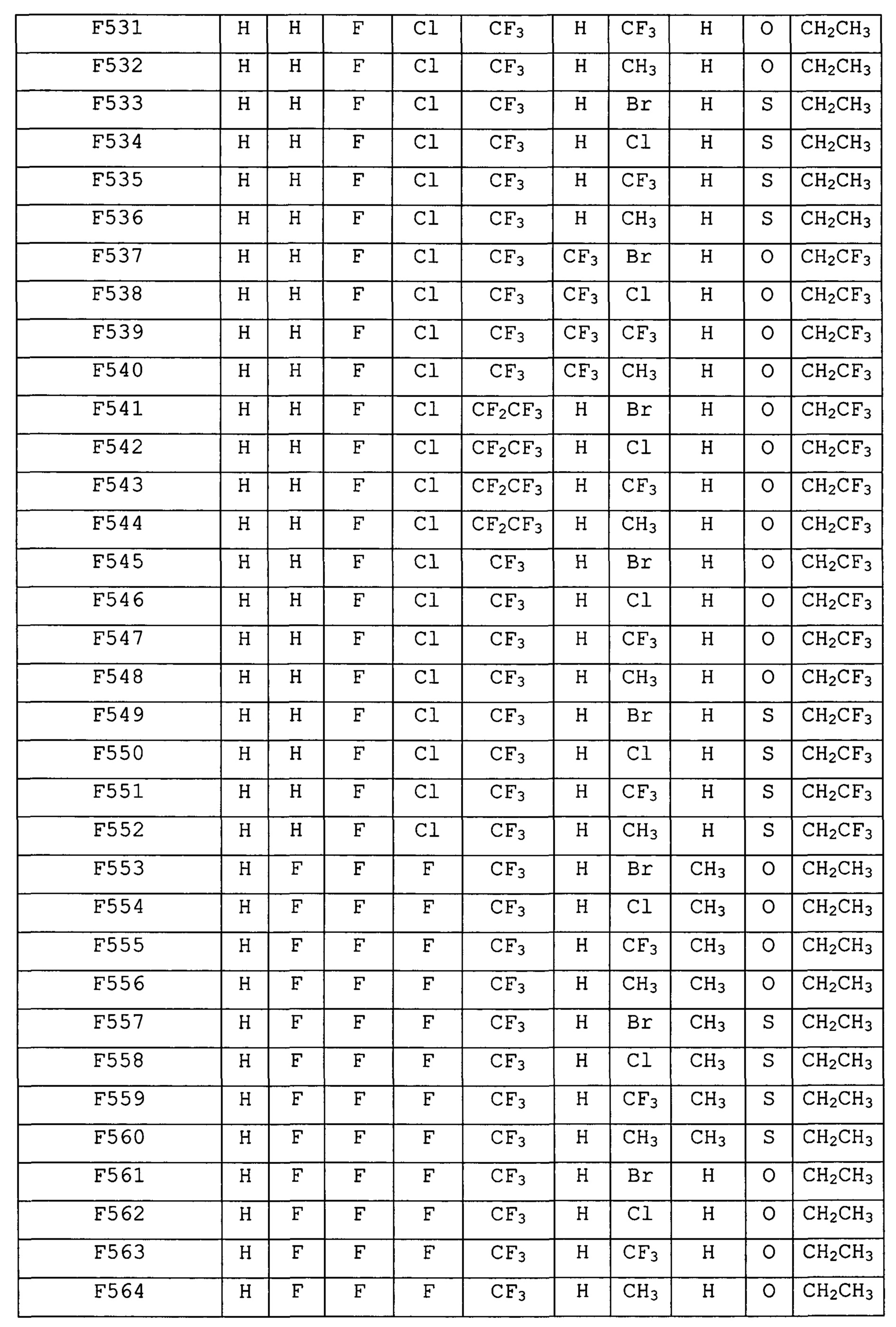
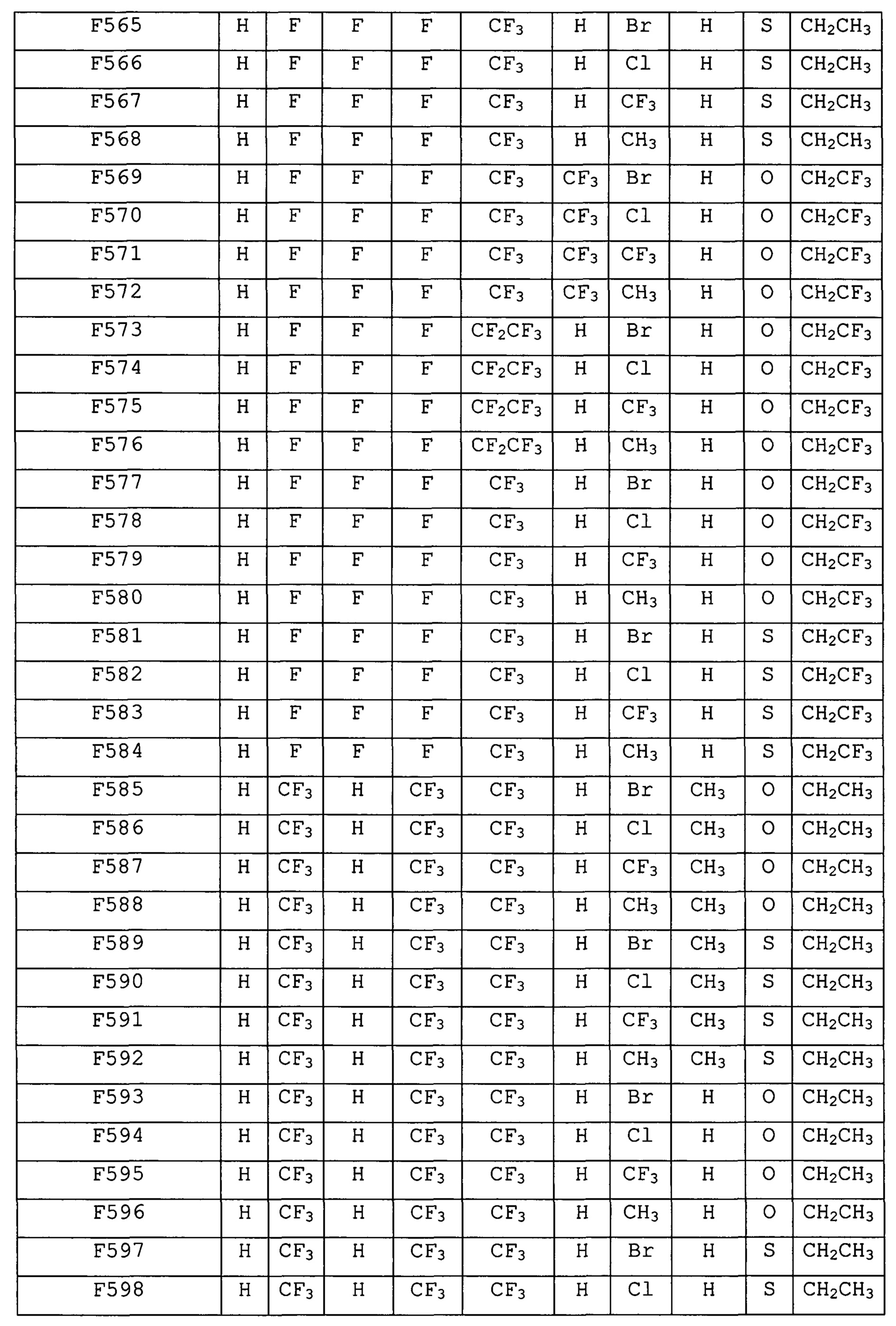

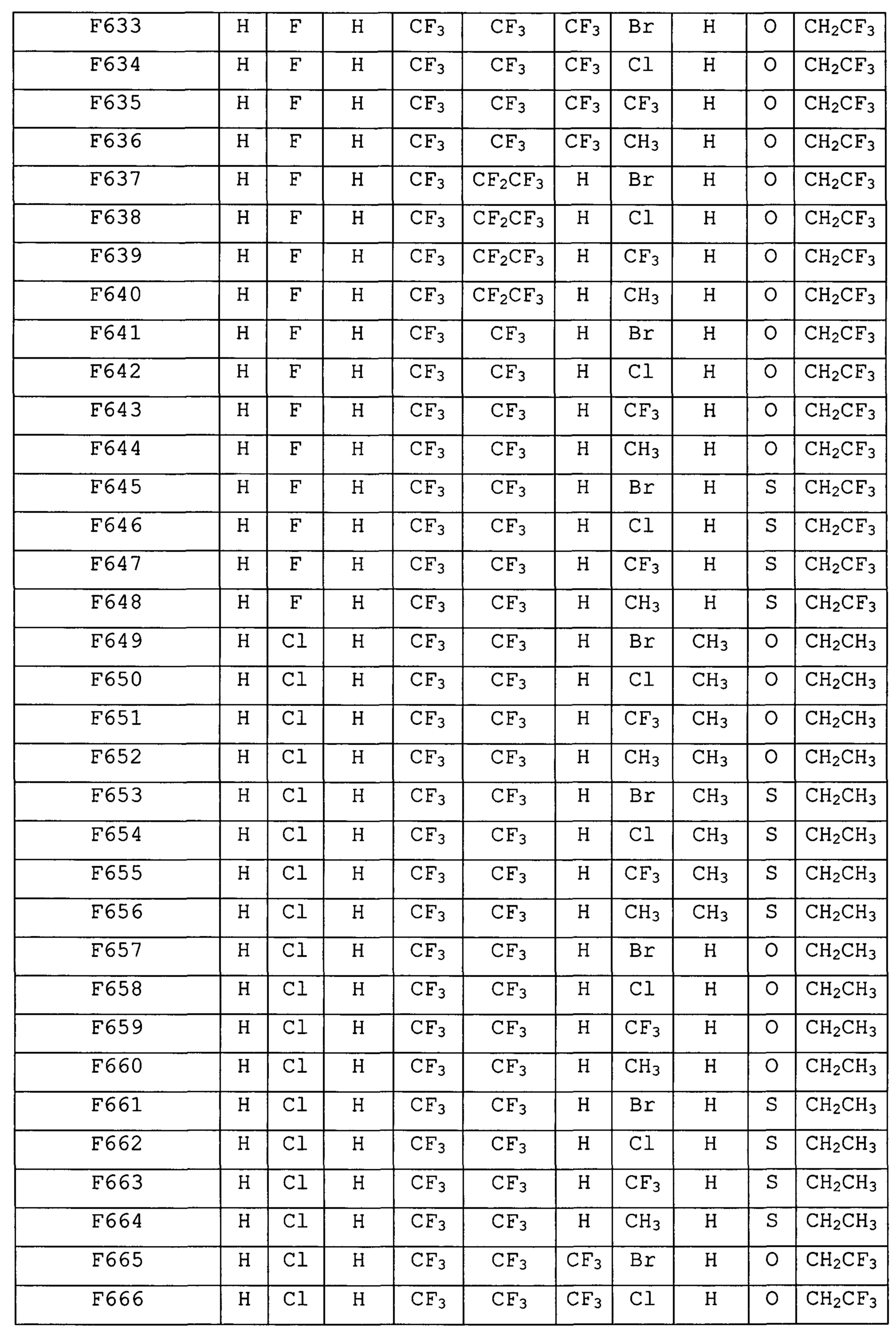



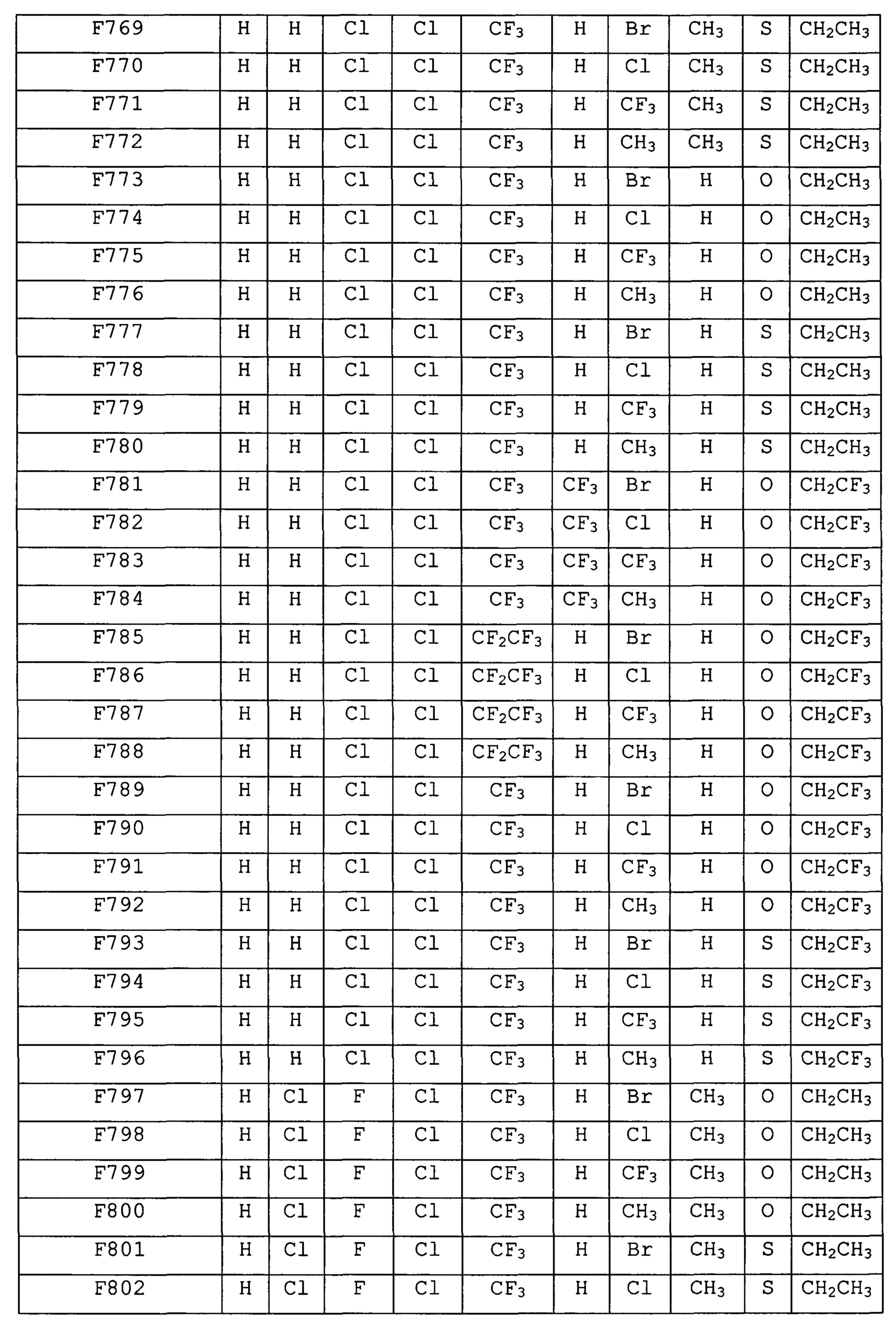
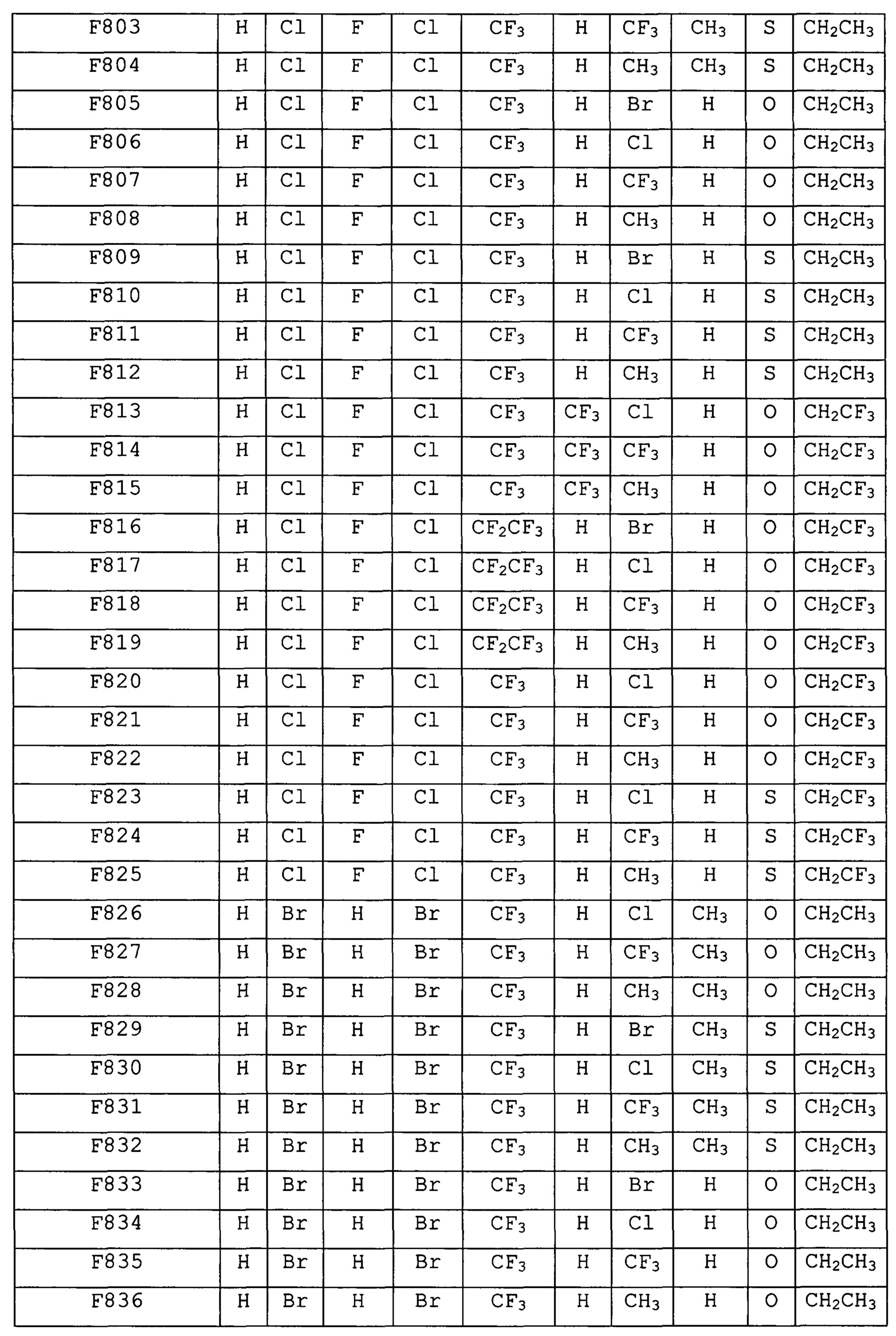
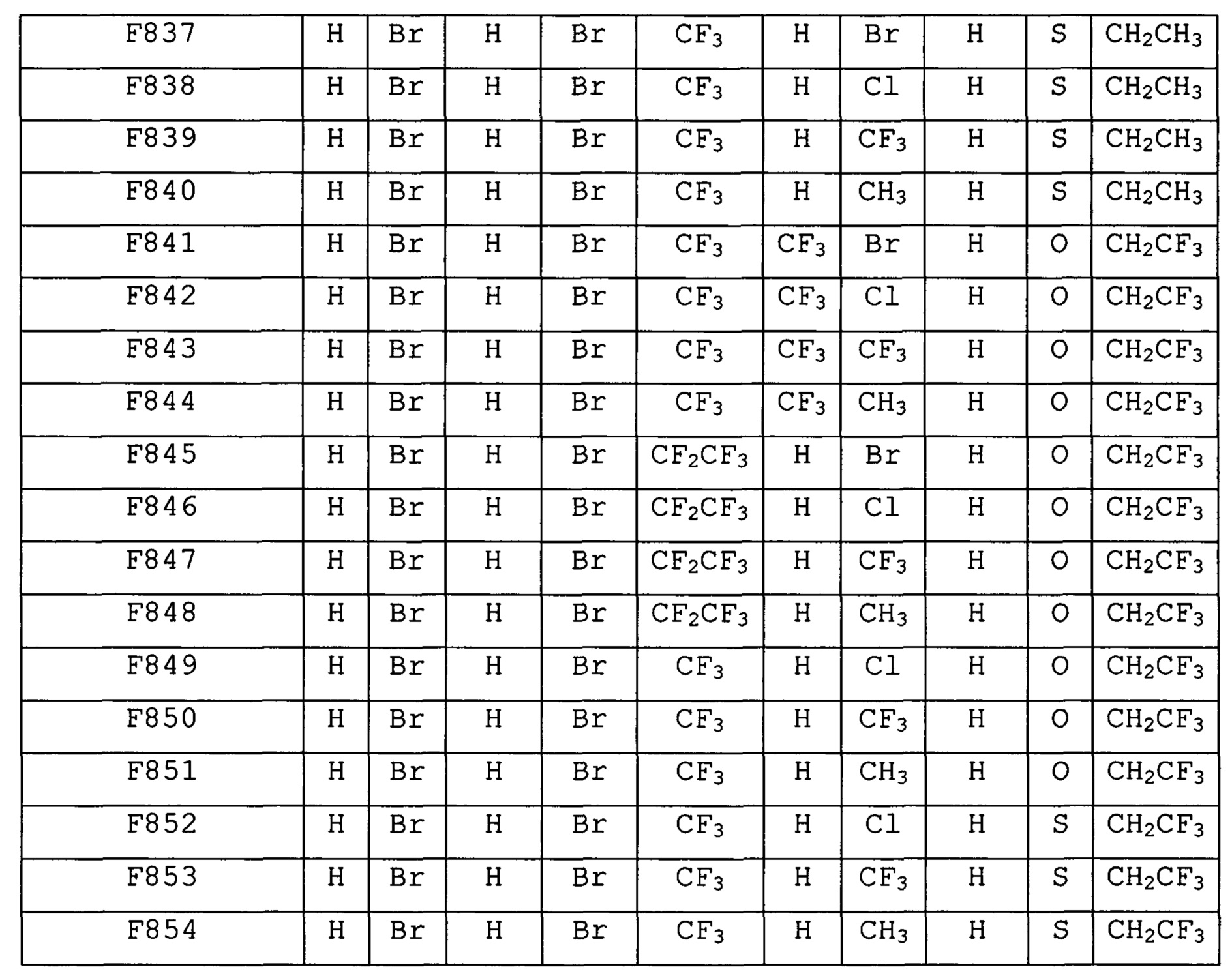
Пример А: Биологические исследования с использованием совки малой (''BAW''), совки хлопковой (''CEW'') и совки ни (''CL'')
Для BAW имеется немного эффективных паразитов, болезней или хищников, которые уменьшают ее популяцию. BAW заражает многие сорняки, деревья, травы, бобовые и полевые культуры. В разных местностях она приводит к экономическому ущербу, наряду с другими растениями, для спаржи, хлопчатника, кукурузы, сои, табака, люцерны, сахарной свеклы, перцев, томатов, картофеля, лука, гороха, подсолнечника и цитрусовых. Известно, что CEW поражает кукурузу и томаты, но она, наряду с другими растениями, также поражает артишок, спаржу, капусту, канталупу, браунколь, коровий горох, огурцы, баклажаны, латук, лимскую фасоль, дыню, бамию, горох, перцы, картофель, тыкву, лущильные сорта фасоли, шпинат, тыкву крупноплодную, батат и дыню. Также известно, что CEW устойчива по отношению к некоторым инсектицидам. CL кормится на самых различных возделываемых растениях и сороняках. Она охотно поедает крестоцветные, и сообщали, что она поражает брокколи, капусту, цветную капусту, китайскую капусту, браунколь, кормовую капусту, горчицу, редис, брюкву, турнепс и кресс водяной. Другие поражаемые овощные культуры включают свеклу, канталупу, сельдерей, огурец, лимскую фасоль, латук, пастернак, горох, перец, картофель, лущильные сорта фасоли, шпинат, тыкву крупноплодную, батат, томат и дыню. Также известно, что CL устойчива по отношению к некоторым инсектицидам. Вследствие указанных выше факторов важно бороться с этими вредителями. Кроме того, молекулы, которые обеспечивают борьбу с этими вредителями, применимы для борьбы с другими вредителями.
Некоторые молекулы, раскрытые в настоящем документе, исследованы для борьбы с BAW и CEW и CL по методикам, описанным в приведенных ниже примерах. При описании результатов использовали ''Таблицу показателей для BAW, CEW и CL'' (см. Раздел таблиц).
Биологические исследования с использованием BAW (Spodoptera exigua)
Биологические исследования с использованием BAW проводили посредством исследования питания с помощью 128-луночного лотка. От 1 до 5 личинок BAW второй личиночной стадии помещали в каждую лунку лотка для исследования питания (3 мл), в которую предварительно помещали 1 мл искусственной питательной среды, к которой добавляли 50 мкг/см2 исследуемого соединения (растворенного в 50 мкл смеси 90:10 ацетон-вода) (в каждую из 8 лунок) и затем ей давали высохнуть. Лотки закрывали прозрачной самоклеющейся крышкой и выдерживали при 25°С в течение 5-7 дней в цикле освещение: затемнение 14:10. Для каждой лунки регистрировали смертность личинок в процентах; затем данные по активности для 8 лунок усредняли. Результаты приведены в таблице под названием ''Таблица 3: результаты биологических исследований'' (см. Раздел таблиц).
Биологические исследования с использованием CEW (Helicoverpa zea)
Биологические исследования с использованием CEW проводили посредством исследования питания с помощью 128-луночного лотка. От 1 до 5 личинок CEW второй личиночной стадии помещали в каждую лунку лотка для исследования питания (3 мл), в которую предварительно помещали 1 мл искусственной питательной среды, к которой добавляли 50 мкг/см2 исследуемого соединения (растворенного в 50 мкл смеси 90:10 ацетон-вода) (в каждую из 8 лунок) и затем ей давали высохнуть. Лотки закрывали прозрачной самоклеющейся крышкой и выдерживали при 25°С в течение 5-7 дней в цикле освещение: затемнение 14:10. Для каждой лунки регистрировали смертность личинок в процентах; затем данные по активности для 8 лунок усредняли. Результаты приведены в таблице под названием ''Таблица 3: результаты биологических исследований'' (см. Раздел таблиц).
Биологические исследования с использованием CL (Tnchoplusia ni)
Биологические исследования с использованием CL проводили посредством исследования питания с помощью 128-луночного лотка. От 1 до 5 личинок CL второй личиночной стадии помещали в каждую лунку лотка для исследования питания (3 мл), в которую предварительно помещали 1 мл искусственной питательной среды, к которой добавляли 50 мкг/см2 исследуемого соединения (растворенного в 50 мкл смеси 90:10 ацетон-вода) (в каждую из 8 лунок) и затем ей давали высохнуть. Лотки закрывали прозрачной самоклеющейся крышкой и выдерживали при 25°С в течение 5-7 дней в цикле освещение: затемнение 14:10. Для каждой лунки регистрировали смертность личинок в процентах; затем данные по активности для 8 лунок усредняли. Результаты приведены в таблице под названием ''Таблица 3А: результаты биологических исследований'' (см. Раздел таблиц).
Пример В: Биологические исследования с использованием тли персиковой зеленой (''GPA'') (Myzus persicae)
GPA является наиболее значительным вредителем-тлей персиковых деревьев, вызывающих уменьшение роста, увядание листьев и гибель различных тканей. Они также являются опасными, поскольку выступают в качестве вектора для переноса вирусов растений, таких как вирус Y картофеля и вирус скручивания листьев картофеля, на представителей пасленовых/картофеля семейства Solanaceae, и различных вирусов мозаики на многие другие продовольственные культуры. GPA наряду с другими растениями поражает такие растения, как брокколи, лопух, капуста, морковь, цветная капуста, дайкон, баклажан, зеленая фасоль, латук, макадамия, папайя, перцы, батат, томаты, кресс водяной и цукини. GPA также поражает многие декоративные культуры, такие как гвоздика, хризантема, цветущая белокочанная капуста, пуансеттия и розы. У GPA развилась устойчивость ко многим пестицидам.
Некоторые молекулы, раскрытые в настоящем документе, исследованы для борьбы с GPA по методикам, описанным в приведенном ниже примере. При описании результатов использовали ''Таблицу показателей для GPA'' (см. Раздел таблиц).
Для исследования использовали рассаду капусты, выращенную в 3-дюймовых горшках, с 2-3 небольшими (3-5 см) настоящими листьями. За 1 день до нанесения химиката рассаду заражали с помощью 20-50 GPA (бескрылые взрослые и насекомые на стадии куколок). Для каждой обработки использовали по 4 горшка, содержащих по одному экземпляру рассады. Исследуемые соединения (2 мг) растворяли в 2 мл растворителя ацетон/метанол (1:1), получая исходные растворы, содержащие 1000 част./млн исследуемого соединения. Исходные растворы разбавляли 5Х с помощью 0,025% Tween 20 в H2O и получали раствор, содержащий 200 част./млн исследуемого соединения. Для опрыскивания раствором обеих сторон листьев капусты до отекания использовали ручное опрыскивающее устройство типа аспиратора. Контрольные растения (проверка растворителя) опрыскивали только разбавителем, содержащим 20% об. смеси ацетон/метанол (1:1). Обработанные растения до обследования выдерживали в камере для хранения в течение 3 дней примерно при 25°С и относительной влажности (ОВ) окружающей среды. Обследование проводили путем подсчета количества живых куколок на одном растении с помощью микроскопа. Степень уничтожения в процентах рассчитывали по скорректированной формуле Абботта (W.S. Abbott, ''A Method of Computing the Effectiveness of an Insecticide'' J. Econ. Entomol. 18 (1925), pp. 265-267) следующим образом.
Скорректированная степень уничтожения, %=100*(X-Y)/X,
где
X = количество живых куколок на контрольных растениях, обработанных только растворителем, и
Y = количество живых куколок на обработанных растениях.
Результаты приведены в таблице под названием ''Таблица 3: результаты биологических исследований'' (см. Раздел таблиц).
ПЕСТИЦИДНО ПРИЕМЛЕМЫЕ СОЛИ ПРИСОЕДИНЕНИЯ С КИСЛОТАМИ, ПРОИЗВОДНЫЕ СОЛЕЙ, СОЛЬВАТЫ, СЛОЖНОЭФИРНЫЕ ПРОИЗВОДНЫЕ, ПОЛИМОРФНЫЕ ФОРМЫ, ИЗОТОПЫ И РАДИОНУКЛИДЫ
Молекулы формулы 1 можно приготовить в виде солей присоединения с пестицидно приемлемыми кислотами. В качестве неограничивающих примеров можно отметить, что амины могут образовать соли с хлористоводородной, бромистоводородной, серной, фосфорной, уксусной, бензойной, лимонной, малоновой, салициловой, яблочной, фумаровой, щавелевой, янтарной, винной, молочной, глюконовой, аскорбиновой, малеиновой, аспарагиновой, бензолсульфоновой, метансульфоновой, этансульфоновой, гидроксиметансульфоновой и гидроксиэтансульфоновой кислотами. Кроме того, в качестве неограничивающего примера можно отметить, что кислоты могут образовать соли, включая соли щелочных или щелочноземельных металлов и соли с аммиаком и аминами. Примеры предпочтительных катионов включают катионы натрия, калия и магния.
Молекулы формулы 1 можно приготовить в виде солей. В качестве неограничивающего примера можно отметить, что соль можно получить путем взаимодействия свободного основания с достаточным количеством необходимой кислоты с получением соли. Свободное основание можно регенерировать путем обработки соли разбавленным водным раствором подходящего основания, таким как разбавленный водный раствор гидроксида натрия (NaOH), карбоната калия, аммиака и бикарбоната натрия. Например, во многих случаях пестицид, такой как 2,4-D, лучше растворяется в воде при превращении в соль с диметиламином.
Молекулы формулы 1 можно приготовить в виде стабильных комплексов с растворителем, так что комплекс не изменяется после удаления незакомплексованного растворителя. Эти комплексы часто называют ''сольватами''. Однако особенно предпочтительно получать стабильные гидраты с водой в качестве растворителя.
Молекулы формулы 1 можно приготовить в виде сложноэфирных производных. Затем эти сложноэфирные производные можно использовать таким же образом, как используется настоящее изобретение, раскрытое в этом документе.
Молекулы формулы 1 можно приготовить в виде различных полиморфных кристаллических форм. Полиморфизм важен для разработки сельскохозяйственных химикатов, поскольку разные полиморфные кристаллические формы или структуры одной молекулы могут обладать сильно различающимися физическими характеристиками и биологической активностью.
Молекулы формулы 1 можно приготовить с различными изотопами. Особенно важны молекулы, содержащие2H (также известный, как дейтерий) вместо1H.
Молекулы формулы 1 можно приготовить с различными радионуклидами. Особенно важны молекулы, содержащие14С.
СТЕРЕОИЗОМЕРЫ
Молекулы формулы 1 могут существовать в виде одного или большего количества стереоизомеров. Таким образом, некоторые молекулы можно получить в виде рацемических смесей. Специалисты в данной области техники должны понимать, что один стереоизомер может быть более активным, чем другие стереоизомеры. Отдельные стереоизомеры можно получить по известным методикам селективного синтеза с использованием разделенных исходных веществ или по обычным методикам разделения. Некоторые молекулы, раскрытые в настоящем документе, могут существовать в виде двух или большего количества изомеров. Различные изомеры включают геометрические изомеры, диастереоизомеры и энантиомеры. Таким образом, молекулы, раскрытые в настоящем документе, включают геометрические изомеры, рацемические смеси, отдельные стереоизомеры и оптически активные смеси. Специалисты в данной области техники должны понимать, что один изомер может быть активнее, чем другие. Структуры, раскрытые в настоящем описании, изображены только в одной геометрической форме для ясности, но подразумевается, что они характеризуют все геометрические формы этой молекулы.
КОМБИНАЦИИ
Молекулы формулы 1 также можно использовать в комбинации (такой как композиционная смесь, или путем одновременного или последовательного внесения) с одним или большим количеством соединений, обладающих акарицидной, альгицидной, авицидной, бактерицидной, фунгицидной, гербицидной, инсектицидной, моллюскоцидной, нематоцидной, родентицидной или вироцидной способностью. Кроме того, молекулы формулы 1 также можно использовать в комбинации (такой как композиционная смесь, или путем одновременного или последовательного внесения) с соединениями, которые представляют собой антифиданты, средства для отпугивания птиц, хемостерилизаторы, антидоты гербицидов, приманки для насекомых, средства для отпугивания насекомых, средства для отпугивания млекопитающих, средства, препятствующие спариванию, активаторы растений, регуляторы роста растений или синергетики. Примерами таких соединений указанных выше групп, которые можно использовать с молекулами формулы 1, являются: (3-этоксипропил)меркурбромид, 1,2-дихлорпропан, 1,3-дихлорпропен, 1-метилциклопропен, 1-нафтол, 2-(октилтио)этанол, 2,3,5-трийодбензойная кислота, 2,3,6-ТВА, 2,3,6-ТВА-диметиламмоний, 2,3,6-ТВА-литий, 2,3,6-ТВА-калий, 2,3,6-ТВА-натрий, 2,4,5-Т, 2,4,5-Т-2-бутоксипропил, 2,4,5-Т-2-этилгексил, 2,4,5-Т-3-бутоксипропил, 2,4,5-ТВ, 2,4,5-Т-бутометил, 2,4,5-Т-бутотил, 2,4,5-Т-бутил, 2,4,5-Т-изобутил, 2,4,5-Т-изоктил, 2,4,5-Т-изопропил, 2,4,5-Т-метил, 2,4,5-Т-пентил, 2,4,5-Т-натрий, 2,4,5-Т-триэтиламмоний, 2,4,5-Т-троламин, 2,4-D, 2,4-D-2-бутоксипропил, 2,4-D-2-этилгексил, 2,4-D-3-бутоксипропил, 2,4-D-аммоний, 2,4-DB, 2,4-DB-бутил, 2,4-DB-диметиламмоний, 2,4-DB-изоктил, 2,4-DB-калий, 2,4-DB-натрий, 2,4-D-бутотил, 2,4-D-бутил, 2,4-D-диэтиламмоний, 2,4-D-диметиламмоний, 2,4-D-диоламин, 2,4-D-додециламмоний, 2,4-DEB, 2,4-DEP, 2,4-D-этил, 2,4-D-гептиламмоний, 2,4-D-изобутил, 2,4-D-изоктил, 2,4-D-изопропил, 2,4-D-изопропиламмоний, 2,4-D-литий, 2,4-D-мептил, 2,4-D-метил, 2,4-D-октил, 2,4-D-пентил, 2,4-D-калий, 2,4-D-пропил, 2,4-D-натрий, 2,4-D-тефурил, 2,4-D-тетрадециламмоний, 2,4-D-триэтиламмоний, 2,4-D-трис(2-гидроксипропил)аммоний, 2,4-D-троламин, 2iP, 2-метоксиэтилмеркурхлорид, 2-фенилфенол, 3,4-DA, 3,4-DB, 3,4-DP, 4-аминопиридин, 4-СРА, 4-СРА-калий, 4-СРА-натрий, 4-СРВ, 4-СРР, 4-гидроксифенетиловый спирт, 8-гидроксихинолинсульфат, 8-фенилмеркуроксихинолин, абамектин, абсцизовая кислота, АСС, ацефат, ацехиноцил, ацетамиприд, ацетион, ацетохлор, ацетофос, ацетопрол, ацибензолар, ацибензолар-3-метил, ацифлюорфен, ацифлюорфен-метил, ацифлюорфен-натрий, аклонифен, акреп, акринатрин, акролеин, акрилонитрил, аципетакс, аципетакс-медь, аципетакс-цинк, алахлор, аланикарб, албендазол, альдикарб, альдиморф, альдоксикарб, альдрин, аллетрин, аллицин, аллидохлор, аллосамидин, аллоксидим, аллоксидим-натрий, аллиловый спирт, аллилоксикарб, алорак, альфа-циперметрин, альфа-эндосульфан, аметоктрадин, аметридион, аметрин, амбузин, амикарбазон, амикартиазол, амидитион, амидофлумет, амидосульфурон, аминокарб, аминоциклопирахлор, аминоциклопирахлорметил, аминоциклопирахлор-калий, аминопиралид, аминопиралид-калий, аминопиралид-трис(2-гидроксипропил)аммоний, амипрофос-метил, амипрофос, амисулбром, амитон, амитоноксалат, амитраз, амитрол, сульфамат аммония, а-нафталинацетат аммония, амобам, ампропилфос, анабазин, анцимидол, анилазин, анилофос, анисурон, антрахинон, анту, афолат, арамит, триоксид мышьяка, асомат, аспирин, асулам, асулам-калий, асулам-натрий, атидатион, атратон, атразин, ауреофунгин, авиглицин, авиглицингидрохлорид, азаконазол, азадирахтин, азафенидин, азаметифос, азимсульфурон, азинфос-этил, азинфос-метил, азипротрин, азитирам, азобензол, азоциклотин, азотоат, азоксистробин, бахмедеш, барбан, гексафторсиликат бария, полисульфид бария, бартрин, ВСРС, бефлубутамид, беналаксил, беналаксил-М, беназолин, беназолиндиметиламмоний, беназолин-этил, беназолин-калий, бенкарбазон, бенклотиаз, бендиокарб, бенфлуралин, бенфуракарб, бенфуресат, беноданил, беномил, беноксакор, беноксафос, бенхинокс, бенсульфурон, бенсульфурон-метил, бенсулид, бенсултап, бенталурон, бентазон, бентазон-натрий, бентиаваликарб, бентиаваликарб-изопропил, бентиазол, бентранил, бензадокс, бензадокс-аммоний, бензалконийхлорид, бензамакрил, бензамакрилизобутил, бензаморф, бензфендизон, бензипрам, бензобициклон, бензофенап, бензофтор, бензогидроксамовая кислота, бензоксимат, бензоилпроп, бензоилпроп-этил, бензтиазурон, бензилбензоат, бензиладенин, берберин, берберинхлорид, бета-цифлутрин, бета-циперметрин, бетоксазин, бициклопирон, бифеназат, бифенокс, бифентрин, бифужунци (метил-(EZ)-3-(фторметокси)-2-[2-(3,5,6-трихлор-2-пиридилоксиметил)фенил]акрилат, биланафос, биланафос-натрий, бинапакрил, бинджинжгксиао (этил (2EZ)-2-циано-3-метилтио-3-(2-нитроанилино)акрилат, биоаллетрин, биоэтанометрин, биоперметрин, биоресметрин, бифенил, бисазир, бисмертиазол, биспирибак, биспирибак-натрий, бистрифлурон, битертанол, битионол, биксафен, бластицидин-3, бура, бордосская жидкость, борная кислота, боскалид, брассинолид, брассинолид-этил, бревикомин, бродифакум, брофенвалерат, брофлутринат, бромацил, бромацил-литий, бромацил-натрий, бромадиолон, брометалин, брометрин, бромфенвинфос, бромацетамид, бромбонил, бромобутид, бромоциклен, бром-DDT, бромфеноксим, бромофос, бромофос-этил, бромпропилат, бромталонил, бромоксинил, бромоксинилбутират, бромоксинилгептаноат, бромоксинилоктаноат, бромоксинилкалий, бромпиразон, бромуконазол, бронопол, букапролат, буфенкарб, буминафос, бупиримат, бупрофезин, бургундская жидкость, бисульфан, бутакарб, бутахлор, бутафенацил, бутамифос, бутатиофос, бутенахлор, бутетрин, бутидазол, бутиобат, бутиурон, бутокарбоксим, бутонат, бутопироноксил, бутоксикарбоксим, бутралин, бутроксидим, бутурон, бутиламин, бутилат, какодиловая кислота, кадусафос, кафенстрол, арсенат кальция, хлорат кальция, цианамид кальция, полисульфид кальция, калвинфос, камбендихлор, камфехлор, камфора, каптафол, каптан, карбаморф, карбанолат, карбарил, карбасулам, карбендазим, карбендазимбензолсульфонат, карбендазимсульфит, карбетамид, карбофуран, дисульфид углерода, тетрахлорид углерода, карбофенотион, карбосульфан, карбоксазол, карбоксид, карбоксин, карфентразон, карфентразон-этил, карпропамид, картап, картапгидрохлорид, карвакрол, карвон, CDEA, целлоцидин, СЕРС, цералур, смесь Чесхант, хинометионат, хитозан, хлобентиазон, хлометоксифен, хлоралоза, хлорамбен, хлорамбенаммоний, хлорамбен-диоламин, хлорамбен-метил, хлорамбен-метиламмоний, хлорамбен-натрий, хлорамин фосфор, хлорамфеникол, хлораниформетан, хлоранил, хлоранокрил, хлорантранилипрол, хлоразифоп, хлоразифоп-пропаргил, хлоразин, хлорбензид, хлорбензурон, хлорбициклен, хлорбромурон, хлорбуфам, хлордан, хлордекон, хлордимеформ, гидрохлорид хлордимеформа, хлорэмпентрин, хлорэтоксифос, хлорэтурон, хлорфенак, хлорфенак-аммоний, хлорфенак-натрий, хлорфенапир, хлорфеназол, хлорфенетол, хлорфенпроп, хлорфенсон, хлорфенсульфид, хлорфенвинфос, хлорфлуазурон, хлорфлуразол, хлорфлуфен, хлорфлуфен-метил, хлорфлуренол, хлорфлуренол-метил, хлоридазон, хлоримурон, хлоримурон-этил, хлормефос, хлормекват, хлормекват хлорид, хлорнидин, хлорнитрофен, хлорбензилат, хлординитронафталины, хлороформ, хлоромебуформ, хлорометиурон, хлоронеб, хлорофацинон, хлорофацинон-натрий, хлорпикрин, хлоропон, хлорпропилат, хлороталонил, хлортолурон, хлороксурон, хлороксинил, хлорфоний, хлорфонийхлорид, хлорфоксим, хлорпразофос, хлорпрокарб, хлорпрофам, хлорпирифос, хлорпирифос-метил, хлорхинокс, хлорсульфурон, хлортал, хлортал-диметил, хлортал-монометил, хлортиамид, хлортиофос, хлозолинат, холинхлорид, хромафенозид, цинерин I, цинерин II, цинерины, цинидон-этил, цинметилин, циносульфурон, циобутид, цисанилид, цисметрин, клетодим, климбазол, клиодинат, клодинафоп, клодинафоп-пропаргил, клоэтокарб, клофенцет, клофенцет-калий, клофентезин, клофибриновая кислота, клофоп, клофоп-изобутил, кломазон, кломепроп, клопроп, клопроксидим, клопиралид, клопиралид-метил, клопиралид-оламин, клопиралид-калий, клопиралид-трис(2-гидроксипропил)аммоний, клохинтоцет, клохинтоцет-мексил, клорансулам, клорансулам-метил, клозантел, клотианидин, клотримазол, клоксифонак, клоксифонак-натрий, CMA, кодлелур, колофонат, ацетат меди, ацетоарсенит меди, арсенат меди, основной карбонат меди, гидроксид меди, нафтенат меди, олеат меди, оксихлорид меди, силикат меди, сульфат меди, хромат меди-цинка, кумахлор, кумафурил, кумафос, куматетралил, кумитоат, кумоксистробин, СРМС, CPMF, СРРС, кредазин, крезол, кримидин, кротамитон, кротоксифос, круфомат, криолит, ку-лур, куфранеб, кумилурон, купробам, оксид меди(I), куркуменол, цианамид, цианатрин, цианазин, цианофенфос, цианофос, циантоат, циантранилипрол, циазофамид, цибутрин, циклафурамид, цикланилид, циклетрин, циклоат, циклогексимид, циклопрат, циклопротрин, циклосульфамурон, циклоксаприд, циклоксидим, циклурон, циенопирафен, цифлуфенамид, цифлуметофен, цифлутрин, цигалофоп, цигалофоп-бутил, цигалотрин, цигексатин, цимиазол, цимиазолгидрохлорид, цимоксанил, циометринил, ципендазол, циперметрин, циперкват, циперкватхлорид, цифенотрин, ципразин, ципразол, ципроконазол, ципродинил, ципрофурам, ципромид, ципросульфамид, циромазин, цитиоат, даимурон, далапон, далапон-кальций, далапон-магний, далапон-натрий, даминозид, dayoutong, дазомет, дазомет-натрий, DBCP, d-камфора, DCIP, DCPTA, DDT, дебакарб, декафентин, декарбофуран, дегидроуксусная кислота, делахлор, дельтаметрин, демефион, демефион-O, демефион-S, деметон, деметон-метил, деметон-O, деметон-O-метил, деметон-S, деметон-S-метил, деметон-S-метилсульфон, десмедифам, десметрин, пиретроидный сложный эфир (d-fanshiluquebingjuzhi), диафентиурон, диалифос, диаллат, диамидафос, диатомовая земля, диазинон, дибутилфталат, дибутилсукцинат, дикамба, дикамба-дигликольамин, дикамба-диметиламмоний, дикамба-диоламин, дикамба-изопропиламмоний, дикамба-метил, дикамба-оламин, дикамба-калий, дикамба-натрий, дикамба-троламин, дикаптон, дихлобенил, дихлофентион, дихлофлуанид, дихлон, дихлоральмочевина, дихлорбензурон, дихлорфлуренол, дихлорфлуренол-метил, дихлормат, дихлормид, дихлорофен, дихлорпроп, дихлорпроп-2-этилгексил, дихлорпроп-бутотил, дихлорпроп-диметиламмоний, дихлорпроп-этиламмоний, дихлорпроп-изоктил, дихлорпроп-метил, дихлорпроп-Р, дихлорпроп-Р-2-этилгексил, дихлорпроп-Р-диметиламмоний, дихлорпроп-калий, дихлорпроп-натрий, дихлорвос, дихлозолин, диклобутразол, диклоцимет, диклофоп, диклофоп-метил, дикломезин, дикломезин-натрий, диклоран, диклосулам, дикофол, дикумарол, дикрезил, дикротофос, дицикланил, дициклонон, диэльдрин, диенохлор, диэтамкват, диэтамкватдихлорид, диэтатил, диэтатилэтил, диэтофенкарб, диэтолат, диэтилпирокарбонат, диэтилтолуамид, дифенакум, дифеноконазол, дифенопентен, дифенопентен-этил, дифеноксурон, дифензокват, дифензокват метилсульфат, дифетиалон, дифловидазин, дифлубензурон, дифлуфеникан, дифлубензопир, дифлубензопир-натрий, дифлуметорим, дикегулак, дикегулак-натрий, дилор, диматиф, димефлутрин, димефокс, димефурон, димепиперат, диметахлон, диметан, диметакарб, диметахлор, диметаметрин, диметенамид, диметенамид-Р, диметипин, диметиримол, диметоат, диметоморф, диметрин, диметилкарбат, диметилфталат, диметилвинфос, диметилан, димексано, димидазону димоксистробин, динекс, динекс-диклексин, динджунезуо (пиризоксазол), диниконазол, диниконазол-М, динитрамин, динобутон, динокап, динокап-4, динокап-6, диноктон, динофенат, динопентон, динопроп, диносам, диносеб, диносебацетат, диносеб-аммоний, диносеб-диоламин, диносеб-натрий, диносеб-троламин, диносульфон, динотефуран, динотерб, динотербацетат, динотербон, диофенолан, диоксабензофос, диоксакарб, диоксатион, дифацинон, дифацинон-натрий, дифенамид, дифенилсульфон, дифениламин, дипропалин, дипропетрин, дипиритион, дикват, дикват дибромид, диспарлур, дисул, дисульфирам, дисульфотон, дисул-натрий, диталимфос, дитианон, дитикрофос, простой дитиоэфир, дитиопир, диурон, d-лимонен, DMPA, DNOC, DNOC-аммоний, DNOC-калий, DNOC-натрий, додеморф, додеморфацетат, додеморфбензоат, додицин, додицингидрохлорид, додицин-натрий, додин, дофенапин, доминикалур, дорамектин, дразоксолон, DSMA, дуфулин, ЕВЕР, ЕВР, экдилстерон, эдифенфос, эглиназин, эглиназин-этил, эмамектин, эмамектинбензоат, ЕМРС, эмпентрин, эндосульфан, эндотал, эндотал-диаммоний, эндотал-дикалий, эндотал-динатрий, эндотион, эндрин, энестробурин, EPN, эпохолеон, эпофенонан, эпоксиконазол, эприномектин, эпроназ, ЕРТС, эрбон, эргокальциферол,, эрлуджиксианкаоан ((RS)-3',4'-дихлор-2-метилвалеранилидэсдепаллетрин, эсфенвалерат, эспрокарб, этацелазил, этаконазол, этафос, этем, этабоксам, этахлор, эталфлуралин, этаметсульфурон, этаметсульфурон-метил, этапрохлор, этефон, этидимурон, этиофенкарб, этиолат, этион, этиозин, этипрол, этиримол, этоат-метил, этофумезат, этогексадиол, этопрофос, этоксифен, этоксифен-этил, этоксихин, этоксисульфурон, этихлозат, этилформиат, этил-α-нафталинацетат, этил-DDD, этилен, этилендибромид, этилендихлорид, этиленоксид, этилицин, этилмеркур-2,3-дигидроксипропилмеркаптид, этилмеркурацетат, этилмеркурбромид, этилмеркурхлорид, этилмеркурфосфат, этинофен, этнипромид, этобензанид, этофенпрокс, этоксазол, этридиазол, этримфос, эвгенол, EXD, фамоксадон, фампур, фенамидон, фенаминосульф, фенамифос, фенапанил, фенаримол, фенасулам, феназафлор, феназахин, фенбуконазол, фенбутатиноксид, фенхлоразол, фенхлоразол-этил, фенхлорфос, фенклорим, фенетакарб, фенфлутрин, фенфурам, фенгексамид, фенитропан, фенитротион, фенджутонг (2'-гидроксибутирофенон, фенобукарб, фенопроп, фенопроп-3-бутоксипропил, фенопроп-бутометил, фенопроп-бутотил, фенопроп-бутил, фенопроп-изоктил, фенопроп-метил, фенопроп-калий, фенотиокарб, феноксакрим, феноксанил, феноксапроп, феноксапроп-этил, феноксапроп-Р, феноксапроп-Р-этил, феноксасульфон, феноксикарб, фенпиклонил, фенпиритрин, фенпропатрин, фенпропидин, фенпропиморф, фенпиразамин, фенпироксимат, фенридазон, фенридазон-калий, фенридазон-пропил, фензон, фенсульфотион, фентеракол, фентиапроп, фентиапроп-этил, фентион, фентион-этил, фентин, фентинацетат, фентинхлорид, фентингидроксид, фентразамид, фентрифанил, фенурон, фенурон-ТСА, фенвалерат, фербам, феримзон, сульфат железа (II), фипронил, флампроп, флампроп-изопропил, флампроп-М, флампроп-метил, флампроп-М-изопропил, флампроп-М-метил, флазасульфурон, флокумафен, флометоквин, флоникамид, флорасулам, флуакрипирим, флуазифоп, флуазифоп-бутил, флуазифоп-метил, флуазифоп-Р, флуазифоп-Р-бутил, флуазинам, флуазолат, флуазурон, флубендиамид, флубензимин, флукарбазон, флукарбазон-натрий, флуцетосульфурон, флухлоралин, флукофурон, флуциклоксурон, флуцитринат, флудиоксонил, флуенетил, флуенсульфон, флуфенацет, флуфенерим, флуфеникан, флуфеноксурон, флуфенпрокс, флуфенпир, флуфенпир-этил, флуфипрол, флуметрин, флуметовер, флуметралин, флуметсулам, флумезин, флумиклорак, флумиклорак-пентил, флумиоксазин, флумипропин, флуморф, флуометурон, флуопиколид, флуопирам, фторбензид, флуоридамид, фторацетамид, фтордифен, фторгликофен, фторгликофен-этил, фторимид, фтормидин, фторнитрофен, флуотиурон, флуотримазол, флуоксастробин, флупоксам, флупропацил, флупропадин, флупропанат, флупропанат-натрий, флупирадифурон, флупирсульфурон, флупирсульфурон-метил, флупирсульфурон-метилнатрий, флухинконазол, флуразол, флуренол, флуренол-бутил, флуренол-метил, флуридон, флурохлоридон, флуроксипир, флуроксипир-бутометил, флуроксипир-мептил, флурпримидол, флурсуламид, флуртамон, флусилазол, флусульфамид, флутиацет, флутиацет-метил, флутанил, флутоланил, флутриафол, флувалинат, флуксапироксад, флуксофеним, фолпет, фомесафен, фомесафен-натрий, фонофос, форамсульфурон, форхлорфенурон, формальдегид, форметанат, гидрохлорид форметаната, формотион, формпаранат, гидрохлорид формпараната, фосамин, фосаминаммоний, фосетил, фосетилалюминий, фосметилан, фоспират, фостиазат, фостиетан, фронталин, фуберидазол, фукаоджинг (6-(дифторметилтио)-N2,N4-диизопропил-1,3,5-триазин-2,4-диамин), фукаоми, фунаигекаолинг (метил(2R)-2-[7-(2-хлор-α,α,α-трифтор-п-толилокси)-2-нафтилоксипионат), фуфентиомочевина, фуралан, фуралаксил, фураметрин, фураметпир, фуратиокарб, фуркарбанил, фурконазол, фурконазол-цис, фуретрин, фурфураль, фурилазол, фурмециклокс, фурофанат, фурилоксифен, гамма-цигалотрин, гамма-НСН, генит, гиббереллиновая кислота, гиббереллины, глифтор, глуфосинат, глуфосинат-аммоний, глуфосинат-Р, глуфосинат-Р-аммоний, глуфосинат-Р-натрий, глиодин, глиоксим, глифосат, глифосат-диаммоний, глифосат-диметиламмоний, глифосат-изопропиламмоний, глифосат-моноаммоний, глифосат-калий, глифосат-сесквинатрий, глифосат-тримезий, глифосин, госсиплур, грандлур, гризеофульвин, гуазатин, гуазатинацетаты, галакринат, галфенпрокс, галофенозид, галосафен, галосульфурон, галосульфурон-метил, галоксидин, галоксифоп, галоксифоп-этотил, галоксифоп-метил, галоксифоп-Р, галоксифоп-Р-этотил, галоксифоп-Р-метил, галоксифоп-натрий, НСН, хемель, хемпа, HEOD, гептахлор, гептенофос, гептопаргил, гетерофос, гексахлорацетон, гексахлорбензол, гексахлорбутадиен, гексахлорофен, гексаконазол, гексафлумурон, гексафлурат, гексалур, гексамид, гексазинон, гексилтиофос, гекситиазокс, HHDN, голосульф, хуанкайво (ацетон О-(12Н-дибензо[d,g][1,3]-диоксоцин-6-илкарбонил)оксим,
хуанкаолинг (''фосаметин''), хуанджунзуо (цис-1-(4-хлорфенил)-2-(1Н-1,2,4-триазол-1-ил)циклогептанол), гидраметилнон, гидраргафен, гашеная известь, цианид водорода, гидропрен, гимексазол, хиквинкарб, IAA, IBA, икаридин, имазалил, имазалилнитрат, имазалилсульфат, имазаметабенз, имазаметабенз-метил, имазамокс, имазамокс-аммоний, имазапик, имазапик-аммоний, имазапир, имазапир-изопропиламмоний, имазахин, имазахинаммоний, имазахин-метил, имазахин-натрий, имазетапир, имазетапир-аммоний, имазосульфурон, имибенконазол, имициафос, имидаклоприд, имидаклотиз, иминоктадин, иминоктадинтриацетат, иминоктадинтриальбезилат, имипротрин, инабенфид, инданофан, индазифлам, индоксакарб, инезин, йодобонил, йодокарб, йодметан, йодосульфурон, йодосульфурон-метил, йодосульфурон-метилнатрий, иофенсульфурон, иофенсульфурон-натрий, иоксинил, иоксинилоктаноат, иоксинил-литий, иоксинилнатрий, ипазин, ипконазол, ипфенкарбазон, ипробенфос, ипродион, ипроваликарб, ипримидам, ипсдиенол, ипсенол, IPSP, изамидофос, изазофос, изобензан, изокарбамид, изокарбофос, изоцил, изодрин, изофенфос, изофенфос-метил, изолан, изометиозин, изонорурон, изополинат, изопрокарб, изопропалин, изопротиолан, изопротурон, изопиразам, изопиримол, изотиоат, изотианил, изоурон, изоваледион, изоксабен, изоксахлортол, изоксадифен, изоксадифен-этил, изоксафлутол, изоксапирифоп, изоксатион, ивермектин, изопамфос, японилур, жапотрины (5-аллилфурфурил(±)-цис-транс-хризантемат), жасмолин I, жасмолин II, жасмоновая кислота, = ((αEZ)-α-[(EZ)-втор-бутилиденгидразоно]-α-(4-хлорфенил)-п-толилметансульфонат (jiahuangchongzon), O,O-диметил O-фенилфосфоротиоат (jiajizengxiaolin), куметоксистробин (jiaxiangjunzhi), цзекаован (2-(дихлорметил)-2-метил-1,3-диоксолан), (N-аллил-N-(аллилкарбамоилметил)-2,2-дихлорацетамид (jiecaoxi), иодфенфос, ювенильный гормон I, ювенильный гормон II, ювенильный гормон III, кадетрин, карбутилат, каретазан, каретазан-калий, касугамицин, касугамицингидрохлорид, кежунлин, келеван, кетоспирадокс, кетоспирадокс-калий, кинетин, кинопрен, крезоксим-метил, куикаокси, лактофен, лямбда-цигалотрин, латилур, арсенат свинца, ленацил, лепимектин, лептофос, линдан, линеатин, линурон, лиримфос, литлур, лооплур, луфенурон, лвдингджунши (Ivdingjunzhi), лвксианкаолин (Ivxiancaolin), литидатион, МАА, малатион, гидразид малеиновой кислоты, малонобен, мальтодекстрин, МАМА, манкоппер, манкозеб, мандипропамид, манеб, матрин, мазидокс, МСРА, МСРА-2-этилгексил, МСРА-бутотил, МСРА-бутил, МСРА-диметиламмоний, МСРА-диоламин, МСРА-этил, МСРА-изобутил, МСРА-изоктил, МСРА-изопропил, МСРА-метил, МСРА-оламин, МСРА-калий, МСРА-натрий, МСРА-тиоэтил, МСРА-троламин, МСРВ, МСРВ-этил, МСРВ-метил, МСРВ-натрий, мебенил, мекарбам, мекарбинзид, мекарфон, мекопроп, мекопроп-2-этилгексил, мекопроп-диметиламмоний, мекопроп-диоламин, мекопроп-этадил, мекопроп-изоктил, мекопроп-метил, мекопроп-Р, мекопроп-Р-2-этилгексил, мекопроп-Р-диметиламмоний, мекопроп-Р-изобутил, мекопроп-калий, мекопроп-Р-калий, мекопроп-натрий, мекопроп-троламин, медимеформ, мединотерб, мединотербацетат, медлур, мефенацет, мефенпир, мефенпир-диэтил, мефлуидид, мефлуидид-диоламин, мефлуидид-калий, мегатомоевая кислота, меназон, мепанипирим, меперфлутрин, мефенат, мефосфолан, мепикват, мепикватхлорид, мепикватпентаборат, мепронил, мептилдинокап, хлорид ртути(II), оксид ртути(II), хлорид ртути(I), мерфос, мезопразин, мезосульфурон, мезосульфурон-метил, мезотрион, месульфен, месульфенфос, метафлумизон, металаксил, металаксил-М, метальдегид, метам, метам-аммоний, метамифоп, метамитрон, метам-калий, метам-натрий, метазахлор, метазосульфурон, метазоксолон, метконазол, метепа, метфлуразон, метабензтиазурон, метакрифос, металпропалин, метамидофос, метасульфокарб, метазол, метфуроксам, метидатион, метиобенкарб, метиокарб, метиопирисульфурон, метиотепа, метиозолин, метиурон, метокротофос, метометон, метомил, метопрен, метопротрин, метохин-бутил, метотрин, метоксихлор, метоксифенозид, метоксифенон, метилафолат, метилбромид, метилэвгенол, метилйодид, метилизотиоцианат, метилацетофос, метилхлороформ, метилдимрон, метиленхлорид, метилмеркурбензоат, метилмеркурдициандиамид, метилмеркурпентахлорфеноксид, метилнеодеканамид, метирам, метобензурон, метобромурон, метофлутрин, метолахлор, метолкарб, метоминостробин, метосулам, метоксадиазон, метоксурон, метрафенон, метрибузин, метсульфовакс, метсульфурон, метсульфурон-метил, мевинфос, мексакарбат, миешуан (3-пиридилметил 4-нитрокарбанилат, милбемектин, милбемициноксим, мильнеб, мипафокс, мирекс, MNAF, могучун ((3RS)-окт-1-ен-3-ол; аттрактант), молинат, молосултап, моналид, монисоурон, монохлоруксусная кислота, монокротофос, монолинурон, моносульфурон, моносульфурон-сложный эфир, монурон, монурон-ТСА, морфамкват, морфамкватдихлорид, мороксидин, мороксидингидрохлорид, морфотион, морзид, моксидектин, MSMA, мускалур, миклобутанил, миклозолин, N-(этилмеркур)-п-толуолсульфонанилид, набам, нафталофос, налед, нафталин, нафталинацетамид, нафтойный ангидрид, нафтоксиуксусные кислоты, напроанилид, напропамид, напталам, напталам-натрий, натамицин, небурон, никлосамид, никлосамид-оламин, никосульфурон, никотин, нифлуридид, нипираклофен, нитенпирам, нитиазин, нитралин, нитрапирин, нитрилакарб, нитрофен, нитрофторфен, нитростирол, нитротал-изопропил, норбормид, норфлуразон, норникотин, норурон, новалурон, новифлумурон, нуаримол, ОСН, октахлордипропиловый эфир, октилинон, офурац, ометоат, орбенкарб, орфралур, орто-дихлорбензол, ортосульфамурон, орикталур, орисастробин, оризалин, остол, острамон, оксабетринил, оксадиаргил, оксадиазон, оксадиксил, оксамат, оксамил, оксапиразон, оксапиразон-димоламин, оксапиразон-натрий, оксасульфурон, оксазикломефон, оксин-медь, оксолиновая кислота, окспоконазол, окспоконазол фумарат, оксикарбоксин, оксидеметон-метил, оксидепрофос, оксидисульфотон, оксифлуорфен, оксиматрин, окситетрациклин, окситетрациклингидрохлорид, паклобутразол, пайхонгдинг (пиридилметиламин неоникотиноидный инсектицид), пара-дихлорбензол, парафлурон, паракват, паракватдихлорид, паракватдиметилсульфат, паратион, паратион-метил, паринол, пебулат, перфуразоат, пеларгоновая кислота, пенконазол, пенцикурон, пендиметалин, пенфлуфен, пенфлурон, фенокссулам, пентахлорфенол, пентанохлор, пентиопирад, пентметрин, пентоксазон, перфлуидон, перметрин, пентоксамид, фенамакрил, феназиноксид, фенизофам, фенкаптон, фенмедифам, фенмедифам-этил, фенобензурон, фенотрин, фенпроксид, фентоат, фенилмеркурмочевина, фенилмеркурацетат, фенилмеркурхлорид, фенилмеркурпроизводное пирокатехина, фенилмеркурнитрат, фенилмеркурсалицилат, форат, фосацетим, фозалон, фосдифен, фосфолан, фосфоланметил, фосглицин, фосмет, фоснихлор, фосфамидон, фосфин, фосфокарб, фосфор, фостин, фоксим, фоксим-метил, фталид, пиклорам, пиклорам-2-этилгексил, пиклорам-изоктил, пиклорам-метил, пиклорам-оламин, пиклорам-калий, пиклорам-триэтиламмоний, пиклорам-трис(2-гидроксипропил)аммоний, пиколинафен, пикоксистробин, пиндон, пиндон-натрий, пиноксаден, пипералин, пиперонилбутоксид, пиперонил циклонен, пиперофос, пипроктанил, пипроктанилбромид, пипротал, пириметафос, пиримикарб, примиоксифос, пиримифос-этил, пиримифос-метил, плифенат, поликарбамат, полиоксины, полиоксорим, полиоксорим-цинк, политиалан, арсенит калия, азид калия, цианат калия, гиберрелат калия, нафтенат калия, полисульфид калия, тиоцианат калия, α-нафталинацетат калия, pp'-DDT, праллетрин, прекоцен I, прекоцен II, прекоцен III, претилахлор, примидофос, примисульфурон, примисульфурон-метил, пробеназол, прохлораз, прохлораз-марганец, проклонол, проциазин, процимидон, продиамин, профенофос, профлуазол, профлуралин, профлутрин, профоксидим, проглиназин, проглиназин-этил, прогександион, прогександион-кальций, прогидрожасмон, промацил, промекарб, прометон, прометрин, промурит, пропахлор, пропамидин, пропамидиндигидрохлорид, пропамокарб, пропамокарбгидрохлорид, пропанил, пропафос, пропахизафоп, пропаргит, пропартрин, пропазин, пропетамфос, профам, пропиконазол, пропинеб, пропизохлор, пропоксур, пропоксикарбазон, пропоксикарбазон-натрий, пропилизом, пропирисульфурон, пропизамид, проквиназид, просулер, просульфалин, просульфокарб, просульфурон, протидатион, протиокарб, протиокарбгидрохлорид, протиоконазол, протиофос, протоат, протрифенбут, проксан, проксан-натрий, принахлор, пиданон, пиметрозин, пиракарболид, пираклофос, пираклонил, пираклостробин, пирафлуфен, пирафлуфен-этил, пирафлупрол, пирамат, пираметостробин, пираоксистробин, пирасульфотол, пиразолинат, пиразофос, пиразосульфурон, пиразосульфурон-этил, пиразотион, пиразоксифен, пиресметрин, пиретрин I, пиретрин II, пиретрины, пирибамбенз-изопропил, пирибамбенз-пропил, пирибенкарб, пирибензоксим, пирибутикарб, пириклор, пиридабен, пиридафол, пиридалил, пиридафентион, пиридат, пиридинитрил, пирифенокс, пирифлухиназон, пирифталид, пириметанил, пиримидифен, пириминобак, пириминобак-метил, пиримисульфан, пиримитат, пиринурон, пириофенон, пирипрол, пирипропанол, пирипроксифен, пиритиобак, пиритиобак-натрий, пиролан, пирохилон, пироксасульфон, пироксулам, пироксихлор, пироксифур, кассия, хинацетол, хинацетолсульфат, хиналфос, хиналфос-метил, хиназамид, хинклорак, хинконазол, хинмерак, хинокламин, хинонамид, хинотион, хиноксифен, хинтиофос, квинтоцен, хизалофоп, хизалофоп-этил, хизалофоп-Р, хизалофоп-Р-этил, хизалофоп-Р-тефурил, кувензхи (этил N-ацетил-N-бутил-β-аланинат), куюнгдинг (дипропилпиридин-2,5-дикарбоксилат), рабензазол, рафоксанид, ребемид, ресметрин, родетанил, родожапонин-III, рибавирин, римсульфурон, ротенон, риания, сафлуфенацил, саижунмао (дитиолановый фунгицид), сайсентонг, салициланилид, сангвинарин (четвертичный аммониевый фунгицид, сантонин, шрадан, сциллирозид, себутилазин, секбуметон, седаксан, селамектин, семиамитраз, семиамитразхлорид, сезамекс, сезамолин, сетоксидим, шуангжиаанкаолин (фосфорорганический гербицид), сидурон, сиглур, силафлуофен, силатран, силикагель, силтиофам, симазин, симеконазол, симетон, симетрин, синтофен, SMA, 3-метолахлор, арсенит натрия, азид натрия, хлорат натрия, фторид натрия, фторацетат натрия, гексафторсиликат натрия, нафтенат натрия, ортофенилфеноксид натрия, пентахлорфеноксид натрия, полисульфид натрия, тиоцианат натрия, α-нафталинацетат натрия, софамид, спинеторам, спиносад, спиродиклофен, спиромезифен, спиротетрамат, спироксамин, стрептомицин, сесквисульфат стрептомицина, стрихнин, сулкатол, сулкофурон, сулкофурон-натрий, сулкотрион, сульфаллат, сульфентразон, сульфирам, сульфлурамид, сульфометурон, сульфометурон-метил, сульфосульфурон, сульфотеп, сульфоксафлор, сульфоксид, сульфоксим, сера, серная кислота, сульфурилфторид, сулгликапин, сульпрофос, сультропен, свел, тау-флувалинат, таврон, тазимкарб, ТСА, ТСА-аммоний, ТСА-кальций, ТСА-этадил, ТСА-магний, ТСА-натрий, TDE, тебуконазол, тебуфенозид, тебуфенпирад, тебуфлохин, тебупиримфос, тебутам, тебутиурон, теклофталам, текназен, текорам, тефлубензурон, тефлутрин, тефурилтрион, темботрион, темефос, тепа, ТЕРР, тепралоксидим, тераллетрин, тербацил, тербукарб, тербухлор, тербуфос, тербуметон, тербутилазин, тербутрин, тетциклацис, тетрахлорэтан, тетрахлорвинфос, тетраконазол, тетрадифон, тетрафлурон, тетраметрин, тетраметилфлутрин, тетрамин, тетранактин, тетрасул, сульфат таллия, тенилхлор, тета-циперметрин, тиабендазол, тиаклоприд, тиадифтор, тиаметоксам, тиапронил, тиазафлурон, тиазопир, тикрофос, тициофен, тидиазимин, тидиазурон, тиенкарбазон, тиенкарбазон-метил, тифенсульфурон, тифенсульфурон-метил, тиоцикламгидрохлорид, тифлузамид, тиобенкарб, тиокарбоксим, тиохлорфенфим, тиоциклам, тиоцикламоксалат, тиодиазол-медь, тиодикарб, тиофанокс, тиофлуоксимат, тиохемпа, тиомерсал, тиометон, тионазин, тиофанат, тиофанат-метил, тиохинокс, тиосемикарбазид, тиосултап, тиосултап-диаммоний, тиосултап-динатрий, тиосултап-мононатрий, тиотепа, тирам, турингенсин, тиадинил, тиаожиеан (4,4-диметилморфолин-4-ий хлорид), тиокарбазил, тиоклорим, тиоксимид, тирпат, толклофос-метил, толфенпирад, толилфлуанид, толилмеркурацетат, топрамезон, тралкоксидим, тралоцитрин, тралометрин, тралопирил, трансфлутрин, трансперметрин, третамин, триаконтанол, триадимефон, триадименол, триафамон, триаллат, триамифос, триапентенол, триаратен, триаримол, триасульфурон, триазамат, триазбутил, триазифлам, триазофос, триазоксид, трибенурон, трибенурон-метил, трибуфос, трибутилоловооксид, трикамба, трихламид, трихлорфон, трихлорметафос-3, трихлоронат, триклопир, триклопир-бутотил, триклопир-этил, триклопир-триэтиламмоний, трициклазол, тридеморф, тридифан, триэтазин, трифенморф, трифенофос, трифлоксистробин, трифлоксисульфурон, трифлоксисульфурон-натрий, трифлумизол, трифлумурон, трифлуралин, трифлусульфурон, трифлусульфурон-метил, трифоп, трифоп-метил, трифопсим, трифорин, тригидрокситриазин, тримедлур, триметакарб, триметурон, тринексапак, тринексапак-этил, трипрен, трипропиндан, триптолид, тритак, тритиконазол, тритосульфурон, трунк-калл, униконазол, униконазол-Р, урбацид, уредепа, валерат, валидамицин, валифеналат, валон, вамидотион, вангард, ванилипрол, вернолат, винклозолин, варфарин, варфарин-калий, варфарин-натрий, ксиаохонглиулин, ксинжунан, ксиводжунан, ХМС, ксилахлор, ксиленолы, ксилилкарб, йишижинг (N'-бензоил-N-трет-бутилбензогидразид), зариламид, зеатин, зенгксиаон, дзета-циперметрин, нафтенат цинка, фосфид цинка, цинк тиазол, зинеб, зирам, золапрофос, зоксамид, зуомихуанглонг, α-хлоргидрин, α-экдизон, α-мультистриатин и α-нафталинуксусная кислота. Дополнительная информация приведена в публикации ''compendium of pesticide common names'', находящейся по адресу http://www.alanwood.net/pesticides/index.html. Также см. публикацию ''The Pesticide Manual'' 14th Edition, edited by С D S Tomlin, copyright 2006 by British Crop Production Council, или ее предыдущие или последующие издания.
БИОПЕСТИЦИДЫ
Молекулы формулы 1 также можно использовать в комбинации (такой как композиционная смесь, или путем одновременного или последовательного внесения) с одним или большим количеством биопестицидов. Термин ''биопестицид'' используют для обозначения микробиологических средств для борьбы с вредителями, которые применяют по методикам, аналогичным использующимся для химических пестицидов. Обычно они являются бактериальными, но имеются примеры грибковых средств борьбы, включая Trichoderma spp. и Ampelomyces quisqualis (средство борьбы с настоящей мучнистой росой винограда). Bacillus subtilis используют для борьбы с патогенами растений. С помощью микробиологических средств также борются с сорняками и грызунами. Одним хорошо известным примером инсектицида является Bacillus thuringiensis, средство борьбы с бактериальным заболеванием чешуекрылых, жесткокрылых и двукрылых. Поскольку он мало влиянт на другие организмы, его считают экологически более приемлемым, чем синтетические пестициды. Биологические инсектициды включают продукты, основанные на:
1. энтомопатогенных грибах (например, Metarhizium anisopliae);
2. энтомопатогенных нематодах (например, Steinernema feltiae); и
3. энтомопатогенных вирусах (например, грануловирус Cydia pomonella).
Другие примеры энтомопатогенных микроорганизмов включают, но не ограничиваются только ими, бакуловирусы, бактерии и другие прокариотные микроорганизмы, грибы, простейшие и микроспоридии. Биологически образованные инсектициды включают, но не ограничиваются только ими, ротенон, вератридин, а также микробные токсины; стойкие или резистентные к насекомым сорта растений; и микроорганизмы, модифицированные с помощью технологии рекомбинантной ДНК, так что они вырабатывают инсектициды или придают генетически модифицированному микроорганизму стойкость к насекомым. В одном варианте осуществления молекулы формулы 1 можно использовать с одним или большим количеством биопестицидов для обработки семян и улучшения почвы. В публикации The Manual of Biocontrol Agents приведен обзор имеющихся биологических инсектицидных (и основанных на биологических веществах систем борьбы) продуктов. Copping L.G. (ed.) (2004). The Manual of Biocontrol Agents (formerly the Blopesticide Manual) 3rd Edition. British Crop Production Council (BCPC), Farnham, Surrey UK.
ДРУГИЕ АКТИВНЫЕ СОЕДИНЕНИЯ
Молекулы формулы 1 также можно использовать в комбинации (такой как композиционная смесь или путем одновременного или последовательного внесения) с одним или большим количеством следующих соединений:
1. 3-(4-хлор-2,6-диметилфенил)-4-гидрокси-8-окса-1-азаспиро[4,5]дец-3-ен-2-он;
2. 3-(4'-хлор-2,4-диметил[1,1'-бифенил]-3-ил)-4-гидрокси-6-окса-1-азаспиро[4,5]дец-3-ен-2-он;
3. 4-[[(6-хлор-3-пиридинил)метил]метиламине]-2(5H)-фуранон;
4. 4-[[(6-хлор-3-пиридинил)метил]циклопропиламино]-2(5H)-фуранон;
5. 3-хлор-N2-[(1S)-1-метил-2-(метилсульфонил)этил]-N1-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-1,2-бензолдикарбоксамид;
6. 2-циано-N-этил-4-фтор-3-метоксибензолсульфонамид;
7. 2-циано-N-этил-3-метоксибензолсульфонамид;
8. 2-циано-3-дифторметокси-N-этил-4-фторбензолсульфонамид;
9. 2-циано-3-фторметокси-N-этилбензолсульфонамид;
10. 2-циано-6-фтор-3-метокси-N,N-диметилбензолсульфонамид;
11. 2-циано-N-этил-6-фтор-3-метокси-N-метилбензолсульфонамид;
12. 2-циано-3-дифторметокси-N,N-диметилбензолсульфонамид;
13. 3-(дифторметил)-N-[2-(3,3-диметилбутил)фенил]-1-метил-1H-пиразол-4-карбоксамид;
14. N-этил-2,2-диметилпропионамид-2-(2,6-дихлор-α,α,α-трифтор-п-толил)гидразон;
15. N-этил-2,2-дихлор-1-метилциклопропан-карбоксамид-2-(2,6-дихлор-α,α,α-трифтор-п-толил)гидразон никотина;
16. O-{(Е-)-[2-(4-хлорфенил)-2-циано-1-(2-трифторметилфенил)-винил]}S-метилтиокарбонат;
17. (Е)-N1-[(2-хлор-1,3-тиазол-5-илметил)]-N2-циано-N1-метилацетамид;
18. 1-(6-хлорпиридин-3-илметил)-7-метил-8-нитро-1,2,3,5,6,7-гексагидроимидазо[1,2-а]пиридин-5-ол;
19. 4-[4-хлорфенил-(2-бутилидин-гидразоно)метил)]фенилмезилат; и
20. N-Этил-2,2-дихлор-1-метилциклопропанкарбоксамид-2-(2,6-дихлоральфа,альфа,альфа-трифтор-п-толил)гидразон.
СИНЕРГЕТИЧЕСКИЕ СМЕСИ
Молекулы формулы 1 можно использовать с соединениями инсектицидной группы с образованием синергетических смесей, где тип воздействия таких соединений по сравнению с типом воздействия молекул формулы 1 может быть таким же, сходным или иным. Примеры воздействий, включают, но не ограничиваются только ими: ингибитор ацетилхолинэстеразы; модулятор натриевого канала; ингибитор биосинтеза хитина; регулируемый посредством ГАМК (гамма-аминомасляная кислота) и глутамата антагонист хлоридного канала; регулируемый посредством ГАМК и глутамата агонист хлоридного канала; агонист ацетилхолинового рецептора; антагонист ацетилхолинового рецептора; ингибитор MET I; стимулируемый с помощью Mg ингибитор АТФазы (аденозинтрифосфатаза); никотиновый ацетилхолиновый рецептор; средство, разрушающее мембрану средней кишки; средство, нарушающее окислительное фосфорилирование, и рианодиновый рецептор (RyRs). Обычно массовые отношения молекул формулы 1 в синергетической смеси с другим соединением составляют от примерно 10:1 до примерно 1:10, в другом варианте осуществления от примерно 5:1 до примерно 1:5 и в другом варианте осуществления от примерно 3:1 и в другом варианте осуществления примерно 1:1.
ПРЕПАРАТЫ
Пестицид редко применим для использования в чистом виде. Обычно необходимо добавлять другие вещества, так чтобы пестицид можно было использовать при необходимой концентрации и в подходящей форме, обеспечивающей легкое применение, обращение, транспортировку, хранение и максимальную активность пестицида. Таким образом, пестициды готовят, например, как приманки, концентрированные эмульсии, дусты, эмульгирующиеся концентраты, фумиганты, гели, гранулы, микрокапсулированные препараты, средства для обработки семян, концентраты суспензий, суспоэмульсии, таблетки, растворимые в воде жидкости, диспергирующиеся в воде гранулы или сухие сыпучие смеси, смачивающиеся порошки и сверхмалообъемные растворы. Дополнительная информация о типах препаратов приведена в публикации ''Catalogue of Pesticide Formulation Types and International Coding System'' Technical Monograph n°2, 5th Edition by CropLife International (2002).
Пестициды чаще всего используют в виде водных суспензий или эмульсий, полученных из концентрированных препаратов таких пестицидов. Такие растворимые в воде, суспендирующиеся или эмульгирующиеся в воде препараты представляют собой твердые вещества, обычно известные, как смачивающиеся порошки или диспергирующиеся в воде гранулы, или жидкости, обычно известные, как эмульгирующиеся концентраты, или водные суспензии. Смачивающиеся порошки, которые можно спрессовать в диспергирующиеся в воде гранулы, представляют собой однородную смесь пестицида, носителя и поверхностно-активных веществ. Концентрация пестицида обычно равна от примерно 10% до примерно 90% мас.. Носитель обычно выбирают из группы включающей аттапульгитовые глины, монтмориллонитовые глины, диатомовые земли или очищенные силикаты. Эффективные поверхностно-активные вещества, содержащие от примерно 0,5% до примерно 10% смачивающегося порошка, включают сульфированные лигнины, конденсированные нафталинсульфонаты, нафталинсульфонаты, алкилбензолсульфонаты, алкилсульфаты и неионогенные поверхностно-активные вещества, такие как аддукты этиленоксида с алкилфенолами.
Эмульгирующиеся концентраты пестицидов содержат пестицид в обычной концентрации, такой как равная от примерно 50 до примерно 500 г/л жидкости, растворенный в носителе, которым является смешивающийся с водой растворитель или смесь несмешивающегося с водой органического растворителя и эмульгаторов. Подходящие органические растворители включают ароматические соединения, в особенности ксилолы и фракции нефти, в особенности высококипящие нафталиновые и олефиновые фракции нефти, такие как тяжелая ароматическая нафта. Также можно использовать другие органические растворители, такие как терпеновые растворители, включая производные канифоли, алифатические кетоны, такие как циклогексанон, и сложные спирты, такие как 2-этоксиэтанол. Подходящие эмульгаторы для эмульгирующихся концентратов выбирают из числа обычных анионогенных и неионогенных поверхностно-активных веществ.
Водные суспензии включают суспензии нерастворимых в воде пестицидов, диспергированных в водном носителе при концентрации, находящейся в диапазоне от примерно 5% до примерно 50% мас. Суспензии получают путем тонкого размола пестицида и его энергичного смешивания с носителем, включающим воду и поверхностно-активные вещества. Для увеличения плотности и вязкости водного носителя также можно добавить такие ингредиенты, как неорганические соли и синтетические или натуральные камеди. Часто наиболее эффективно размалывать и смешивать пестицид одновременно путем приготовления водной смеси и ее гомогенизации в аппарате, таком как песочная мельница, шаровая мельница или гомогенизатор поршневого типа.
Пестициды также можно использовать в виде гранулированных композиций, которые являются особенно подходящими для внесения в почву. Гранулированные композиции обычно содержат от примерно 0,5% до примерно 10% мас. пестицида, диспергированного в носителе, который включает глину или аналогичное вещество. Такие композиции обычно готовят путем растворения пестицида в подходящем растворителе и его нанесения на гранулированный носитель, который предварительно сформован в частицы подходящего размера, находящегося в диапазоне от примерно 0,5 до примерно 3 мм. Такие композиции также можно получить путем приготовления теста или пасты из носителя и соединения и измельчения и сушки с получением гранул необходимого размера.
Дусты, содержащие пестицид, получают путем тщательного смешивания пестицида в порошкообразном виде с подходящим пылеобразным сельскохозяйственным носителем, таким как каолиновая глина, размолотая вулканическая порода и т.п. Дусты предпочтительно могут содержать от примерно 1% до примерно 10% пестицида. Их можно использовать в качестве средства для протравливания семян или для некорневого внесения с помощью опыливателя.
Столь же целесообразно использовать пестицид в виде раствора в подходящем органическом растворителе, обычно нефтяном масле, таком как инсектицидные масла, которые широко используют в агрохимии.
Пестициды также можно использовать в виде аэрозольных композиций. В таких композициях пестицид растворен или диспергирован в носителе, которым является создающая давление смесь пропеллентов. Аэрозольная композиция упакована в контейнер, из которого смесь дозируется через распыляющий клапан.
Пестицидные приманки получают, когда пестицид смешивают с кормом или аттрактантом, или с ними обоими. Когда вредители поедают приманку, они также потребляют пестицид. Приманки могут находиться в форме гранул, гелей, сыпучих порошков, жидкостей или твердых веществ. Их можно использовать в местах укрытия вредителей.
Фумиганты представляют собой пестициды, которые обладают относительно высоким давлением насыщенных паров, и поэтому могут находится в виде газа в концентрациях, достаточных для уничтожения вредителей в почве или закрытых пространствах. Токсичность фумиганта пропорциональна его концентрации и длительности воздействия. Они характеризуются хорошей способностью к диффузии и действуют путем проникновения в дыхательную систему вредителя или впитывания через кутикулу вредителя. Фумиганты используют для борьбы с вредителями хранящихся продуктов с использованием листового материала, защищающего от выхода газа, в герметизированных помещениях или строениях или в специальных камерах.
Пестициды можно микрокапсулировать путем суспендирования частиц или капелек пестицида в полимерах разных типов. Путем изменения химического строения полимера или изменения характеристик обработки можно сформировать микрокапсулы разных размеров, растворимости, с разной толщиной стенок и степенью проникновения. Эти факторы определяют скорость, с которой высвобождается находящийся там активный ингредиент, что, в свою очередь, влияет на остаточное воздействие, скорость действия и запах продукта.
Концентраты масляных растворов получают путем растворения пестицида в растворителе, который удерживает пестицид в растворе. Масляные растворы пестицида обычно обеспечивают более быстрое разрушение и уничтожение вредителей, чем другие препараты, поскольку сами растворители обладают пестицидным воздействием и растворение воскообразного покрытия наружного покрова увеличивает скорость поступления пестицида. Другие преимущества масляных растворов включают лучшую стабильность при хранении, лучшее проникновение через трещины и лучшую адгезию к жирным поверхностям.
Другим вариантом осуществления является эмульсия типа масло-в-воде, где эмульсия содержит масляные шарики, на которых находится слоистое жидкокристаллическое покрытие и которые диспергированы в водной фазе, где каждый шарик содержит по меньшей мере одно соединение, которое сельскохозяйственно активно, и по отдельности покрыто моноламеллярным или олиголамеллярным слоем, включающим: (1) по меньшей мере одно неионогенное липофильное поверхностно-активное вещество, (2) по меньшей мере одно неионогенное гидрофильное поверхностно-активное вещество и (3) по меньшей мере одно ионогенное поверхностно-активное вещество, где шарики обладают средним диаметром, равным менее 800 нм. Дополнительная информация об этом варианте осуществления раскрыта в публикации патента U.S. 20070027034, опубликованной 1 февраля 2007 г., обладающей номером заявки на патент 11/495228. Для удобства использования этот вариант осуществления обозначен, как ''OIWE''.
Дополнительная информация приведена в публикации ''Insect Pest Management'' 2nd Edition by D. Dent, copyright CAB International (2000). Кроме того, более подробная информация приведена в публикации ''Handbook of Pest Control - The Behavior, Life History, and Control of Household Pests'' by Arnold Mallis, 9th Edition, copyright 2004 by GIE Media Inc.
ДРУГИЕ КОМПОНЕНТЫ ПРЕПАРАТОВ
Обычно, когда молекулы, раскрытые в формуле 1, используют в препарате, такой препарат также может содержать другие компоненты. Эти компоненты включают, но не ограничиваются только ими (этот перечень не является исчерпывающим и взаимоисключающим), смачиватели, распределяющие средства, клеющие средства, средства, обеспечивающие проницаемость, буферы, комплексообразующие соединения, агенты, уменьшающие снос, агенты, обеспечивающие совместимость, противовспениватели, очищающие агенты и эмульгаторы. Некоторые компоненты описаны ниже.
Смачивающий агент является веществом, которое при добавлении к жидкости усиливает растекание или проникающую способность жидкости путем уменьшения межфазного натяжения между жидкостью и поверхностью, по которой она растекается. Смачивающие агенты используются в агрохимических препаратах для двух основных целей: во время обработки и изготовления для повышения степени смачивания порошков в воде при приготовлении концентратов растворяющихся жидкостей или концентратов суспензий; и во время смешивания продукта с водой в баке для опрыскивания для уменьшения времени смачивания смачивающихся порошков и для улучшения проникновения воды в диспергирующиеся в воде гранулы. Примерами смачивающих агентов, использующихся в препаратах смачивающихся порошков, концентратов суспензий и диспергирующихся в воде гранул, являются: лаурилсульфат натрия; диоктилсульфосукцинат натрия; алкилфенолэтоксилаты; и этоксилаты алифатических спиртов.
Диспергирующий агент является веществом, которое адсорбируется на поверхности частиц и способствует сохранению частиц в диспергированном состоянии, и предупреждает их повторную агрегацию. Диспергирующие агенты добавляют к агрохимическим препаратам для облегчения диспергирования и суспендирования при изготовлении и для обеспечения повторного диспергирования в воде в баке для опрыскивания. Они широко используются в смачивающихся порошках, концентратах суспензий и диспергирующихся в воде гранулах. Поверхностно-активные вещества, которые используют в качестве диспергирующих агентов, обладают способностью прочно адсорбироваться на поверхности частицы и создавать зарядовый или стерический барьер для повторной агрегации частиц. Чаще всего использующиеся поверхностно-активные вещества являются анионогенными, неионогенными или смесями этих двух типов. Для препаратов смачивающихся порошков чаще всего использующимися диспергирующими агентами являются лигносульфонаты натрия. Для концентратов суспензий очень хорошая адсорбция и стабилизация обеспечиваются при использовании полиэлектролитов, таких как продукты конденсации нафталинсульфоната натрия с формальдегидом. Также используют тристирилфенолэтоксилатфосфаты. Неионогенные соединения, такие как продукты конденсации алкиларилэтиленоксида с блок-сополимерами ЭО-ПО (этиленоксид-пропиленоксид) иногда объединяют с анионогенными соединениями в качестве диспергирующих агентов для концентратов суспензий. В последние годы для использования в качестве диспергирующих агентов разработаны новые типы обладающих очень большой молекулярной массой полимерных поверхностно-активных веществ. Они обладают очень длинными гидрофобными основными цепями и большим количеством этиленоксидных цепей, образующих ''зубья'' ''гребенки'' поверхностно-активного вещества. Эти обладающие очень большой молекулярной массой полимеры могут придать концентратам суспензий очень длительную стабильность, поскольку гидрофобные основные цепи обладают способностью закрепляться во многих положениях на поверхностях частиц. Примерами диспергирующих агентов, использующихся в агрохимических препаратах, являются: лигносульфонаты натрия; продукты конденсации нафталинсульфоната натрия с формальдегидом; тристирилфенолэтоксилатфосфаты; этоксилаты алифатических спиртов; алкилэтоксилаты; блок-сополимеры ЭО-ПО; и привитые сополимеры.
Эмульгирующий агент является веществом, которое стабилизирует суспензию капелек жидкой фазы в другой жидкой фазе. Без эмульгирующего агента две жидкости разделяются на две несмешивающиеся жидкие фазы. Чаще всего использующиеся смеси эмульгаторов содержат алкилфенол или алифатический спирт, содержащий 12 или несколько этиленоксидных звеньев, и маслорастворимую кальциевую соль додецилбензолсульфоновой кислоты. В диапазоне значений показателя липофильно-гидрофильного баланса (''ЛГБ''), составляющем от 8 до 18, обычно образуются эмульсии, обладающие хорошей стабильностью. Стабильность эмульсии иногда можно улучшить путем добавления небольшого количества блок-сополимерного поверхностно-активного вещества ЭО-ПО.
Солюбилизирующий агент является поверхностно-активным веществом, которое образует в воде мицеллы при концентрациях, превышающих критическую концентрацию мицеллообразования. Затем мицеллы могут растворять или солюбилизировать нерастворимые в воде вещества внутри гидрофобной части мицеллы. Типами поверхностно-активных веществ, обычно использующихся для солюбилизации, являются неионогенные вещества, сорбитанмоноолеаты, сорбитанмоноолеатэтоксилаты и метилолеаты.
Поверхностно-активные вещества иногда используют по отдельности или вместе с другими добавками, такими как минеральные или растительные масла, в качестве вспомогательных веществ в баковых смесях для опрыскивания с целью улучшения биологического воздействия пестицида на мишень. Типы поверхностно-активных веществ, использующихся для усиления биологического воздействия, обычно зависят от природы и типа воздействия пестицида. Однако они часто являются неионогенными, такими как: алкилэтоксилаты; этоксилаты линейных алифатических спиртов; алифатические аминэтоксилаты.
Носитель или разбавитель в сельскохозяйственном препарате является веществом, добавляемым к пестициду для получения продукта необходимой концентрации. Носители обычно являются веществами, обладающими высокой абсорбционной емкостью, а разбавители обычно являются веществами, обладающими низкой абсорбционной емкостью. Носители и разбавители используют для приготовления дустов, смачивающихся порошков, гранул и диспергирующихся в воде гранул.
Органические растворители используют преимущественно для приготовления эмульгирующихся концентратов, эмульсий типа масло-в-воде, суспоэмульсий и сверхмалообъемных препаратов и в меньшей степени в гранулированных препаратов. Иногда используют смеси растворителей. Первыми главными группами растворителей являются алифатические парафиновые масла, такие как керосин или рафинированные парафины. Вторая главная группа (и самая распространенная) включает ароматические растворители, такие как ксилол и обладающие более высокой молекулярной массой фракции С9 и С10 ароматических растворителей. Хлорированные углеводороды применимы в качестве сорастворителей для предупреждения кристаллизации пестицидов, когда препарат эмльгируют в воде. Спирты иногда используют в качестве сорастворителей для увеличения растворяющей способности. Другие растворители могут включать растительные масла, масла из семян растений и сложные эфиры растительных масел и масел из семян растений.
Загустители или гелеобразующие агенты используют преимущественно при приготовлении концентратов суспензий, эмульсий и суспоэмульсий для изменения реологических характеристик или характеристик текучести жидкости и для предупреждения разделения и осаждения диспергированных частиц или капелек. Загущающие, гелеобразующие и препятствующие осаждению агенты обычно подразделяются на две категории, а именно, нерастворимые в воде измельченные частицы и растворимые в воде полимеры. Препараты концентратов суспензий можно получить с использованием глин и диоксидов кремния. Примеры материалов этих типов включают, но не ограничиваются только ими, монтмориллонит, бентонит, алюмосиликат магния и аттапульгит. Растворимые в воде полисахариды в течение многих лет используют в качестве загущающих-гелеобразующих агентов. Этими чаще всего использующимися типами полисахаридов являются натуральные экстракты семян и морских водорослей или синтетические производные целлюлозы. Примеры материалов этих типов включают, но не ограничиваются только ими, гуаровую камедь; камедь плодов рожкового дерева; каррагенан; альгинаты; метилцеллюлозу; натриевую соль карбоксиметилцеллюлозы (НКМЦ); гидроксиэтилцеллюлозу (ГЭЦ). Другие типы препятствующих осаждению агентов основаны на модифицированных крахмалах, полиакрилатах, поливиниловом спирте и полиэтиленоксиде. Другим хорошим препятствующим осаждению агентом является ксантановая камедь.
Микроорганизмы могут испортить готовые продукты. Поэтому для устранения или уменьшения их влияния используют консервирующие агенты. Примеры таких агентов включают, но не ограничиваются только ими: пропионовую кислоту и ее натриевую соль; сорбиновую кислоту и ее натриевую или калиевую соли; бензойную кислоту и ее натриевую соль; натриевую соль п-гидроксибензойной кислоты; метил п-гидроксибензоат; и 1,2-бензизотиазолин-3-он (БИТ).
Наличие поверхностно-активных веществ часто приводит к вспениванию препаратов на водной основе во время операций приготовления и применения с помощью бака для опрыскивания. Для уменьшения склонности к вспениванию противовспениватели часто добавляют на стадии изготовления или до расфасовки в бутылки. Обычно имеются два типа противовспенивателей, а именно, силиконы и не являющиеся силиконами. Силиконы обычно представляют собой водные эмульсии диметилполисилоксана, несиликоновые противовспениватели представляют собой нерастворимые в воде масла, такие как октанол и нонанол, или диоксид кремния. В обоих случаях назначением противовспенивателя является смещение поверхностно-активного вещества с границы раздела воздух-вода.
''Зеленые'' агенты (например, вспомогательные вещества, поверхностно-активные вещества, растворители) могут уменьшить общее влияние средств защиты растений на окружающую среду. ''Зеленые'' агенты являются биологически разлагающимися и обычно их получают из природных и/или стабильных источников, например, из растительных и животных источников. Конкретными примерами являются: растительные масла, масла из семян растений и их сложные эфиры, а также алкоксилированные алкилполиглюкозиды.
Дополнительная информация приведена в публикации ''Chemistry and Technology of Agrochemical Formulations'' edited by D.A. Knowles, copyright 1998 by Kluwer Academic Publishers. См. также ''Insecticides in Agriculture and Environment - Retrospects and Prospects'' by A.S. Perry, I. Yamamoto, I. Ishaaya, and R. Perry, copyright 1998 by Springer-Verlag.
ВРЕДИТЕЛИ
Обычно молекулы формулы 1 можно использовать для борьбы с вредителями, например, жуками, кожистокрылыми, таракановыми, мухами, тлями, щитовками, белокрылками, цикадками, муравьями, осами, термитами, молью, бабочками, вшами, кузнечиками, саранчой, сверчками, блохами, трипсами, щетинохвостками, клещами, иксодовыми клещами, нематодами и многоножками.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями типов нематоды и/или членистоногие.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями подтипов хелицеровые, мириаподы и/или гексаподы.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями классов паукообразные, многоножки и/или насекомые.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда вши. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Haematopinus spp., Hoplopleura spp., Linognathus spp., Pediculus spp. и Polyplax spp. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Haematopinus asini, Haematopinus suis, Linognathus setosus, Linognathus ovillus, Pediculus humanus capitis, Pediculus humanus humanus и Pthirus pubis.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда жесткокрылые. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Acanthoscelides spp., Agriotes spp., Anthonomus spp., Apion spp., Apogonia spp., Aulacophora spp., Bruchus spp., Cerosterna spp., Cerotoma spp., CeutorAynchus spp., Chaetocnema spp., Colaspis spp., Ctenicera spp., Curculio spp., Cyclocephala spp., Diabrotica spp., Hypera spp., Jps spp., Lyctus spp., Megascelis spp., Meligethes spp., Otiorhynchus spp., Pantomorus spp., Phyllophaga spp., Phyllotreta spp., Rhizotrogus spp., Rhynchites spp., Rhynchophorus spp., Scolytus spp., Sphenophorus spp., Sitophilus spp. и Tribolium spp. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Acanthoscelides obtectus, Agrilus planipennis, Anoplophora glabripennis, Anthonomus grandis, Ataenius spretulus, Atomaria linearis, Bothynoderes punctiventris, Bruchus pisorum, Callosobruchus maculatus, Carpophilus hemipterus, Cassida vlttata, Cerotoma trifurcata, Ceutorhynchus assimilis, Ceutorhynchus napi, Conoderus scalaris, Conoderus stigmosus, Conotrachelus nenuphar, Cotinis nitida, Crioceris asparagi, Cryptolestes ferruginous, Cryptolestes pusillus, Cryptolestes turcicus, Cylindrocopturus adspersus, Deporaus marginatus, Dermestes lardarius, Dermestes maculatus, Epilachna varivestis, Faustinus cubae, Hylobius pales, Hypera postica, Hypothenemus hampei, Lasioderma serricorne, Leptinotarsa decemlineata, Liogenys fuscus, Liogenys suturalis, Lissorhoptrus oryzophilus, Maecolaspis Joliveti, Melanotus communis, Meligethes aeneus, Melolontha melolontha, Oberea brevis, Oberea linearis, Oryctes rhinoceros, Oryzaephilus mercator, Oryzaephilus surinamensis, Oulema melanopus, Oulema oryzae, Phyllophaga cuyabana, Popillia Japonica, Prostephanus truncatus, Rhyzopertha dominica, Sitona lineatus, Sitophilus granarius, Sitophilus oryzae, Sitophilus zeamais, Stegobium paniceum, Tribolium castaneum, Tribolium confusum, Trogoderma variabile и Zabrus tenebrioides.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда кожистокрылые.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда таракановые. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Blattella germanica, Blatta orientalis, Parcoblatta pennsylvanica, Periplaneta americana, Periplaneta australasiae, Periplaneta brunnea, Periplaneta fuliginosa, Pycnoscelus surinamensis и Supella longipalpa.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда двукрылые. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Aedes spp., Agromyza spp., Anastrepha spp., Anopheles spp., Bactrocera spp., Ceratitis spp., Chrysops spp., Cochliomyia spp., Contarinia spp., Culex spp., Dasineura spp., Delia spp., Drosophila spp., Fannia spp., Hylemyia spp., Liriomyza spp., Musca spp., Phorbia spp., Tabanus spp. и Tipula spp. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Agromyza frontella, Anastrepha suspensa, Anastrepha ludens, Anastrepha obliqa, Bactrocera cucurbitae, Bactrocera dorsalis, Bactrocera invadens, Bactrocera zonata, Ceratitis capitata, Dasineura brassicae, Delia platura, Fannia canicularis, Fannia scalaris, Gasterophilus intestinalis, Gracillia perseae, Haematobia irritans, Hypoderma lineatum, Liriomyza brassicae, Melophagus ovinus, Musca autumnalis, Musca domestica, Oestrus ovis, Oscinella frit, Pegomya betae, Psila rosae, Rhagoletis cerasi, Rhagoletis pomonella, Rhagoletis mendax, Sitodiplosis mosellana и Stomoxys calcitrans.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда полужесткокрылые. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Adelges spp., Aulacaspis spp., Aphrophora spp., Aphis spp., Bemisia spp., Ceroplastes spp., Chionaspis spp., Chrysomphalus spp., Coccus spp., Empoasca spp., Lepidosaphes spp., Lagynotomus spp., Lygus spp., Macrosiphum spp., Nephotettix spp., Nezara spp., Philaenus spp., Phytocoris spp., Piezodorus spp., Planococcus spp., Pseudococcus spp., Rhopalosiphum spp., Saissetia spp., Therioaphis spp., Toumeyella spp., Toxoptera spp., Trialeurodes spp., Triatoma spp. и Unaspis spp. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Acrosternum hilare, Acyrthosiphon pisum, Aleyrodes proletella, Aleurodicus dispersus, Aleurothrixus floccosus, Amrasca biguttula biguttula, Aonidiella aurantii, Aphis gossypii, Aphis glycines, Aphis pomi, Aulacorthum solani, Bemisia argentifolii, Bemisia tabaci, Blissus leucopterus, Brachycorynella asparagi, Brevennia rehi, Brevicoryne brassicae, Calocoris norvegicus, Ceroplastes rubens, Cimex hemipterus, Cimex lectulanus, Dagbertus fasciatus, Dichelops furcatus, Diuraphis noxia, Diaphorina citri, Dysaphis plantaginea, Dysdercus suturellus, Edessa meditabunda, Eriosoma lanigerum, Eurygaster maura, Euschistus heros, Euschistus servus, Helopeltis antonii, Helopeltis theivora, Icerya purchasi, Idioscopus nitidulus, Laodelphax striatellus, Leptocorisa oratorius, Leptocorisa varicornis, Lygus hesperus, Maconellicoccus hirsutus, Macrosiphum euphorbiae, Macrosiphum granarium, Macrosiphum rosae, Macrosteles quadnlineatus, Mahanarva frimbiolata, Metopolophium dirhodum, Mictis longicornis, Myzus persicae, Nephotettix cinctipes, Neurocolpus longirostris, Nezara viridula, Nilaparvata lugens, Parlatoria pergandii, Parlatoria ziziphi, Peregrinus maidis, Phylloxera vitifoliae, Physokermes piceae, Phytocoris californicus, Phytocoris relativus, Piezodorus guildinil, Poecllocapsus lineatus, Psallus vaccinicola, Pseudacysta perseae, Pseudococcus brevipes, Quadraspidiotus perniciosus, Rhopalosiphum maidis, Rhopalosiphum padi, Saissetia oleae, Scaptocorls castanea, Schizaphis graminum, Sitobion avenae, Sogatella furcifera, Trialeurodes vaporariorum, Trialeurodes abutiloneus, Unaspis yanonensis и Zulia entrerriana.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда перепончатокрылые. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Acromyrmex spp., Atta spp., Camponotus spp., Diprion spp., Formica spp., Monomorium spp., Neodiprion spp., Pogonomyrmex spp., Polistes spp., Solenopsis spp., Vespula spp. и Xylocopa spp. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Athalia rosae, Atta texana, Iridomyrmex humilis, Monomorium minimum, Monomorium pharaonis, Solenopsis invicta, Solenopsis geminata, Solenopsis molesta, Solenopsis richtery, Solenopsis xyloni и Tapinoma sessile.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда термиты. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Coptotermes spp., Cornitermes spp., Cryptotermes spp., Heterotermes spp., Kalotermes spp., Incisitermes spp., Macrotermes spp., Marginitermes spp., Microcerotermes spp., Procornitermes spp., Reticulitermes spp., Schedorhinotermes spp. и Zootermopsis spp. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Coptotermes curvignathus, Coptotermes frenchi, Coptotermes formosanus, Heterotermes aureus, Microtermes obesi, Reticulitermes banyulensis, Reticulitermes grassei, Reticulitermes flavipes, Reticulitermes hageni, Reticulitermes hesperus, Reticulitermes santonensis, Reticulitermes speratus, Reticulitermes tibialis и Reticulitermes virginicus.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда чешуекрылые. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Adoxophyes spp., Agrotis spp., Argyrotaenia spp., Cacoecia spp., Caloptilia spp., Chilo spp., Chrysodeixis spp., Colias spp., Crambus spp., Diaphania spp., Diatraea spp., Earias spp., Ephestia spp., Epimecis spp., Feltia spp., Gortyna spp., Helicoverpa spp., Heliothis spp., Indarbela spp., Lithocolletis spp., Loxagrotis spp., Malacosoma spp., Peridroma spp., Phyllonorycter spp., Pseudaletia spp., Sesamia spp., Spodoptera spp., Synanthedon spp. и Yponomeuta spp. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Achaea Janata, Adoxophyes orana, Agrotis ipsilon, Alabama argillacea, Amorbia cuneana, Amyelois transitella, Anacamptodes defectaria, Anarsia lineatella, Anomis sabulifera, Anticarsia gemmatalis, Archips argyrospila, Archips rosana, Argyrotaenia citrana, Autographa гамма, Bonagota cranaodes, Borbo cinnara, Bucculatrix thurberiella, Capua reticulana, Carposina niponensis, Chlumetia transversa, Choristoneura rosaceana, Cnaphalocrocis medinalis, Conopomorpha cramerella, Cossus cossus, Cydia caryana, Cydia funebrana, Cydia molesta, Cydia nigricana, Cydia pomonella, Darna diducta, Diatraea saccharalis, Diatraea grandiosella, Earlas insulana, Earias vittella, Ecdytolopha aurantianum, Elasmopalpus lignosellus, Ephestia cautella, Ephestia elutella, Ephestia kuehniella, Epinotia aporema, Epiphyas postvittana, Erionota thrax, Eupoecilia ambiguella, Euxoa auxiliaris, Grapholita molesta, Hedylepta indicata, Helicoverpa armigera, Helicoverpa zea, Heliothis virescens, Hellula undalis, Keiferia lycopersicella, Leucinodes orbonalis, Leucoptera coffeella, Leucoptera malifoliella, Lobesia botrana, Loxagrotis albicosta, Lymantria dispar, Lyonetia clerkella, Mahasena corbetti, Mamestra brassicae, Maruca testulalis, Metisa plana, Mythimna unipuncta, Neoleucinodes elegantalis, Nymphula depunctalis, Operophtera brumata, Ostrina nubilalis, Oxydia vesulia, Pandemis cerasana, Pandemis heparana, Papilio demodocus, Pectinophora gossypiella, Peridroma saucia, Perileucoptera coffeella, Phthorimaea operculella, Phyllocnistis citrella, Pieris rapae, Plathypena scabra, Plodia interpunctella, Plutella xylostella, Polychrosis viteana. Prays endocarpa. Prays oleae, Pseudaletia unipuncta, Pseudoplusia includens, Rachiplusia nu, Sclrpophaga incertulas, Sesamia inferens, Sesamia nonagrioides, Setora nitens, Sitotroga cerealella, Sparganothis pilleriana, Spodoptera exigua, Spodoptera frugiperda, Spodoptera eridania, Thecia basllides, Tineola bisselliella, Trichoplusia ni, Tuta absoluta, Zeuzera coffeae и Zeuzera pyrina.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда пухоеды. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Anaticola spp., Bovicola spp., Chelopistes spp., Goniodes spp., Menacanthus spp. и Trichodectes spp. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Bovicola bovis, Bovicola caprae, Bovicola ovis, Chelopistes meleagridis, Goniodes dissimilis, Goniodes gigas, Menacanthus stramineus, Menopon gallinae и Trichoctectes canis.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда прямокрылые. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Melanoplus spp. и Pterophylla spp. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Anabrus simplex, Gryllokalpa africana, Gryllotalpa australis, Gryllotalpa brachyptera, Gryllotalpa hexadactyla, Locuska migratoria, Microcentrum retinerve, Schistocerca gregaria и Scudderia furcata.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда блохи. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Ceratophyllus gallinae, Ceratophyllus niger, Ctenocephalides canis, Ctenocephalides felis и Pulex irritans.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда бахромчатокрылые. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Caliothrips spp., Frankliniella spp., Scirtothrips spp. и Thrips spp. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Frankliniella fusca, Frankliniella occidentalis, Frankliniella schultzei, Frankliniella williamsi, Heliothrips haemorrhoidalis, Rhipiphorothrips cruentatus, Scirtothrips citri, Scirtothrips dorsalis и Taeniothrips rhopalantennalis, Thrips hawaiiensis, Thrips nigropilosus, Thrips orientalis, Thrips tabaci.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда щетинохвостки. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Lepisma spp. и Thermobia spp.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда клещи. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Acarus spp., Aculops spp., Boophilus spp., Demodex spp., Dermacentor spp., Epitrimerus spp., Eriophyes spp., Ixodes spp., Oligonychus spp., Panonychus spp., Rhizoglyphus spp. и Tetranychus spp. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Acarapis woodi, Acarus siro, Aceria mangiferae, Aculops lycopersici, Aculus pelekassi, Aculus schlechtendali, Amblyomma americanum, Brevipalpus obovatus, Brevipalpus phoenicis, Dermacentor variabilis, Dermatophagoides pteronyssinus, Eotetranychus carpini, Notoedres cati, Oligonychus coffeae, Oligonychus ilicis, Panonychus citri, Panonychus ulmi, Phyllocoptruta oleivora, Polyphagotarsonemus latus, Rhipicephalus sanguineus, Sarcoptes scabiei, Tegolophus perseaflorae, Tetranychus urticae и Varroa destructor.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями отряда многоножки. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Scutigerella immaculata.
В другом варианте осуществления молекулы формулы 1 можно использовать для борьбы с вредителями типа нематоды. Неисчерпывающий перечень конкретных родов включает, но не ограничивается только ими, Aphelenchoides spp., Belonolaimus spp., Criconemella spp., Ditylenchus spp., Heterodera spp., Hirschmanniella spp., Hoplolaimus spp., Meloidogyne spp., Pratylenchus spp. и Radopholus spp. Неисчерпывающий перечень конкретных видов включает, но не ограничивается только ими, Dirofilaria immitis, Heterodera zeae, Meloidogyne incognita, Meloidogyne Javanica, Onchocerca volvulus, Radopholus similis и Rotylenchulus reniformis.
Дополнительная информация приведена в публикации ''Handbook of Pest Control - The Behavior, Life History, and Control of Household Pests'' by Arnold Mallis, 9th Edition, copyright 2004 by GIE Media Inc.
ПРИМЕНЕНИЕ
Молекулы формулы 1 для обеспечения борьбы обычно используют в количествах, равных от примерно 0,01 г/га до примерно 5000 г/га. Количества, равные от примерно 0,1 г/га до примерно 500 г/га, обычно являются предпочтительными и количества, равные от примерно 1 г/га до примерно 50 г/га, обычно являются более предпочтительными.
Участком, на который наносят молекулу формулы 1, может быть любой участок, на котором обитают (или могут обитать, или который пересекают) вредители, например, на котором произрастают: сельскохозяйственные культуры, деревья, фрукты, злаки, фуражные культуры, виноград, травяной покров и декоративные растения; на котором постоянно находятся одомашненные животные; внутренние или наружные поверхности зданий (таких как помещения, в которых хранят зерно), строительные материалы, использующиеся в зданиях (такие как пропитанная древесина) и почва вокруг зданий. Предпочтительными участками, для использования молекулы формулы 1 включают участки, на которых произрастают яблони, кукуруза, подсолнечник, хлопчатник, соя, канола, пшеница, рис, сорго, ячмень, овес, картофель, апельсины, люцерна, латук, земляника, томаты, перцы, крестоцветные, груши, табак, миндаль, сахарная свекла, фасоль и другие ценные культуры или на которых будут высевать их семена. При выращивании различных растений также предпочтительно использовать сульфат аммония вместе с молекулой формулы 1.
Борьба с вредителями обычно означает, что на участке уменьшают популяции вредителя, активность вредителя или их обе. Это может быть, когда: популяции вредителя удаляют с участка; когда вредителей делают недееспособными на участке или вокруг участка; или вредителей полностью или частично уничтожают на участке или вокруг участка. Разумеется, может происходить сочетание этих результатов. Обычно популяции вредителя, активность или их обе желательно уменьшить более, чем на 50%, предпочтительно более, чем на 90%. Обычно участок не находится в или на человеке; следовательно, местоположением обычно не является участок, занятый людьми.
Молекулы формулы 1 можно использовать в смеси, использовать одновременно или последовательно, по отдельности или с другими соединениями для увеличения мощности растения (например, для выращивания лучшей корневой системы, лучшего перенесения трудных условий произрастания). Такими другими соединениями являются, например, соединения, которые модулируют этиленовые рецепторы растения, наиболее примечательным является 1-метилциклопропен (также обозначаемый, как 1-МЦП). Кроме того, такие молекулы можно использовать в периоды времени, когда активность вредителя является низкой, такие как предшествующие тому, когда растущее растение начинает образовывать ценные сельскохозяйственные продукты. Такие периоды времени включают ранний сезон посадки, когда количество вредителей обычно является небольшим.
Молекулы формулы 1 можно использовать для борьбы с вредителями на лиственных и плодовых частях растений. Молекулы или приходят в непосредственное взаимодействие с вредителем, или вредитель потребляет пестицид при поедании листьев, плодовой массы или при высасывании сока, который содержит пестицид. Молекулы формулы 1 также можно вносить в почву и при использовании таким образом борьбу могут обеспечить корни и стебли, поедаемые вредителями. Корни могут поглощать молекулу, передавая ее в лиственные части растения для борьбы с указанными грунтовыми жующими и высасывающими сок вредителями.
Обычно при использовании приманок их размещают на грунте, где, например, термиты могут соприкасаться с приманкой и/или привлекаться к приманке. Приманки также можно наносить на поверхность здания (горизонтальную, вертикальную или наклонную поверхность), на которой, например, муравьи, термиты, таракановые и мухи могут соприкасаться с приманкой и/или привлекаться к приманке. Приманки могут включать молекулу формулы 1.
Молекулы формулы 1 можно капсулировать внутри капсулы или помещать на поверхность капсулы. Размер капсул может быть от нанометрового (диаметром примерно 100-900 нм) до микрометрового (диаметром примерно 10-900 мкм).
Вследствие специфической стойкости яиц некоторых вредителей по отношению к некоторым пестицидам, для борьбы с появившимися личинками может быть желательно нанесение молекул формулы 1.
Системное перемещение пестицидов в растениях можно использовать для борьбы с вредителями в одной части растения путем нанесения (например, путем опрыскивания участка) молекул формулы 1 на разные участки растения. Например, борьбу с насекомыми, поедающими листья, можно обеспечить с помощью капельного орошения или внесения в борозды, путем обработки почвы, например, путем орошения почвы до или после высевания или путем обработки семян растения до высевания.
Обработку семян можно проводить для всех типов семян, включая те, из которых вырастают растения, генетически модифицированные для экспрессирования специальных признаков. Типичные примеры включают семена, экспрессирующие белки, токсичные для беспозвоночных вредителей, таких как Bacillus thuringiensis, или другие инсектицидные токсины, вырабатывающие стойкость к гербициду, такому как ''Roundup Ready'' для семян, или обладающие последовательностью посторонних генов, экспрессирующих инсектицидные токсины, обеспечивающие стойкость к гербициду, усиленное питание, засухоустойчивость или любые другие благоприятные признаки. Кроме того, такие средства для обработки семян молекулами формулы 1 могут дополнительно усилить способность растения лучше переносить трудные условия произрастания. Это приводит к более здоровым, более сильным растениям, что может привести к большей урожайности в период уборки. Обычно к благоприятным результатам предположительно приводит примерно от 1 грамма молекул формулы 1 до примерно 500 г на 100000 семян, количества, равные от примерно 10 г до примерно 100 г на 100000 семян предположительно приводят к лучшим результатам и количества, равные от примерно 25 г до примерно 75 г на 100000 семян предположительно приводят к еще лучшим результатам.
Должно быть очевидно, что молекулы формулы 1 можно использовать на растениях, в растениях или вокруг растений, генетически модифицированных для экспрессирования специальных признаков, таких как Bacillus thuringiensis или другие инсектицидные токсины, или выработки стойкости к гербициду, или обладающих последовательностью посторонних генов, экспрессирующих инсектицидные токсины, обеспечивающие стойкость к гербициду, усиленное питание или любые другие благоприятные признаки.
Молекулы формулы 1 можно использовать для борьбы с эндопаразитами и эктопаразитами в ветеринарии или в области содержания животных, не являющихся людьми. Молекулы формулы 1 используют, например, путем перорального введения в виде, например, таблеток, капсул, питья, гранул, путем нанесения на кожу посредством, например, погружения, опрыскивания, полива, нанесения на участки и опыливания и посредством парентерального введения, например, с помощью инъекции.
Молекулы формулы 1 также эффективно можно использовать при содержании домашнего скота, например, крупного рогатого скота, овец, свиней, цыплят и гусей. Их также эффективно можно использовать для домашних животных, таких как, лошади, собаки и кошки. Особенно важно проводить борьбу с такими вредителями, как блохи и иксодовые клещи, которые беспокоят таких животных. Подходящие препараты вводят животным перорально с питьевой водой или кормом. Дозы и то, какие препараты являются подходящими, зависят от вида.
Молекулы формулы 1 также можно использовать для борьбы с паразитическими червями, в особенности в кишечнике перечисленных выше животных.
Молекулы формулы 1 также можно использовать в терапевтических методиках лечения людей. Такие методики включают, но не ограничиваются только ими, пероральное введение в виде, например, таблеток, капсул, питья, гранул и путем нанесения на кожу.
Во всем мире вредители мигрируют на новые (для такого вредителя) территории и затем превращаются в новые инвазивные виды на такой новой территории. Молекулы формулы 1 также можно использовать для борьбы с такими новыми инвазивными видами на такой новой территории.
Молекулы формулы 1 также можно использовать на участке, на котором произрастают растения, такие как сельскохозяйственные культуры (например, до высадки, после высадки, до уборки), и на котором имеется небольшое количество вредителей (или даже они отсутствуют), которые могут привести к крупномасштабному повреждению таких растений. Применение таких молекул на таком участке также благоприятно для растений, произрастающих на участке. Такие благоприятные факторы могут включать, но не ограничиваются только ими, улучшение состояния растения, повышение урожайности растения (например, увеличение биомассы и/или увеличение содержания ценных компонентов), улучшение мощности растения (например, улучшение роста растения и/или образование более зеленых листьев), улучшение качества растения (например, увеличение содержания или улучшение состава некоторых компонентов) и улучшение стойкости растения к абиотическому и/или биотическому стрессу.
Прежде чем становится возможным использование или выпуск в продажу пестицида, различные государственные органы (местные, региональные, штатные, национальные и международные) проводят длительные процедуры исследования такого пестицида. Регламентирующие органы определяют многочисленные требования, и они должны соблюдаться при получении данных и предоставлении продукта регистрирующим лицом или третьей стороной от имени регистрирующего лица, часто с использованием компьютера, присоединенного к Интернету. Затем эти государственные органы рассматривают такие данные и, если сделано заключение о безопасности, предоставляют возможному потребителю или продавцу продукта постановление о регистрации. Затем такой потребитель или продавец может использовать или продавать такой пестицид в районе, в котором проведена и утверждена регистрация продукта.
Молекулы формулы 1 можно исследовать для определения ее эффективности для борьбы с вредителями. Кроме того, можно провести исследование типа воздействия для определения того, обладает ли указанная молекула типом воздействия, отличающимся от воздействия других пестицидов. Затем эти полученные данные можно направить третьим сторонам, например, с помощью Интернета.
Заголовки настоящего документа приведены только для удобства и их не следует использовать для интерпретации какого-либо его раздела.
Раздел таблиц



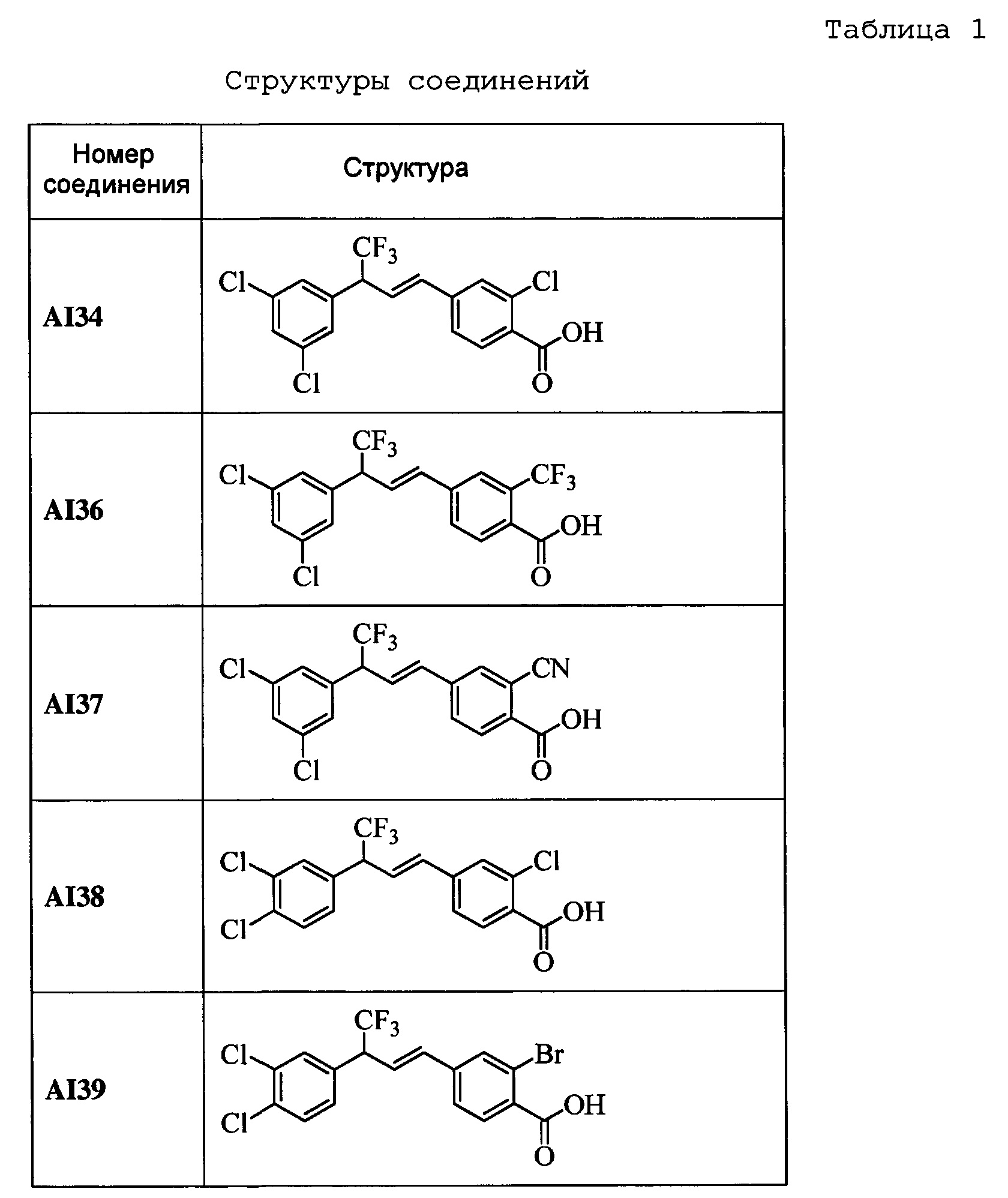
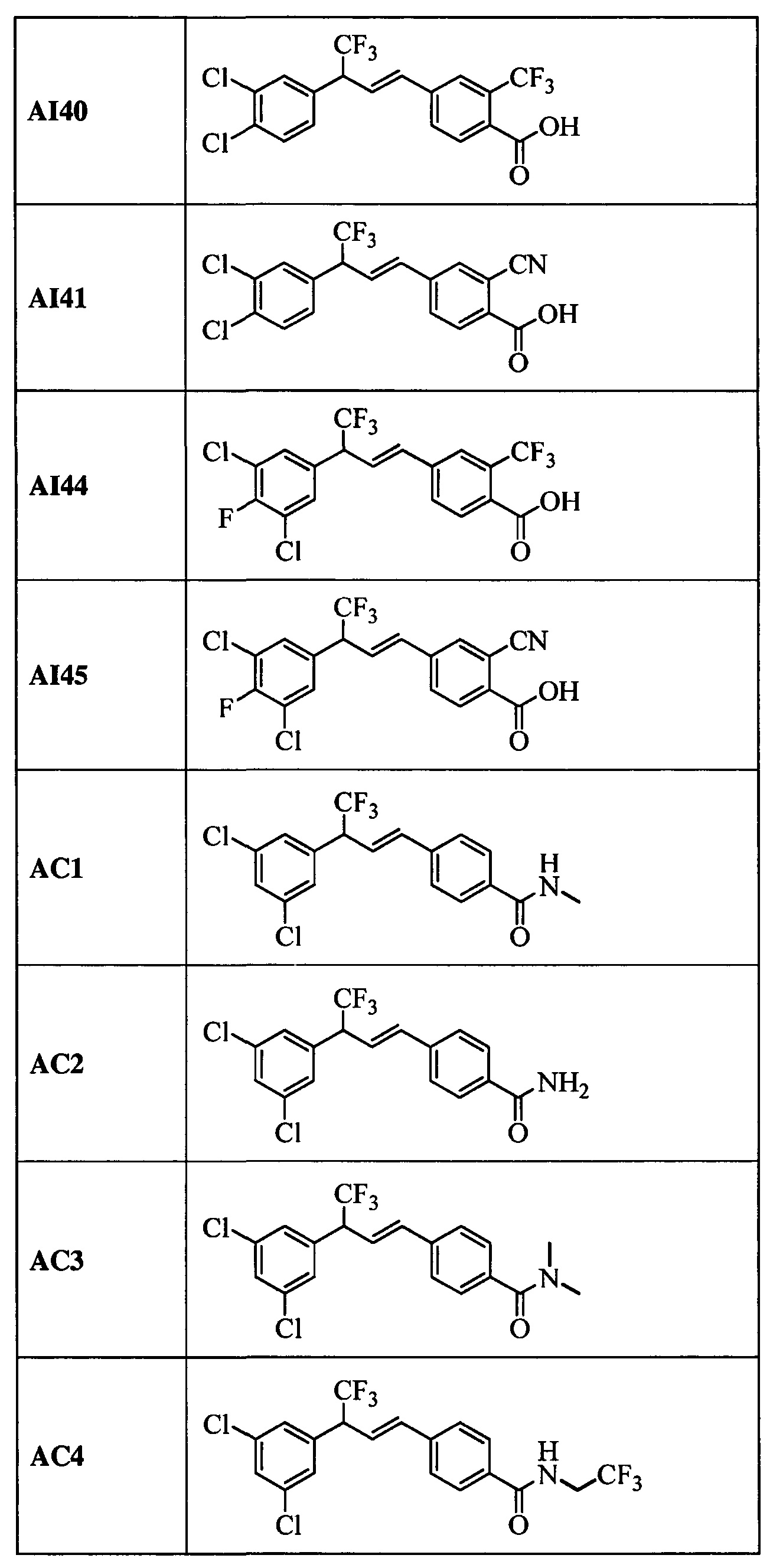
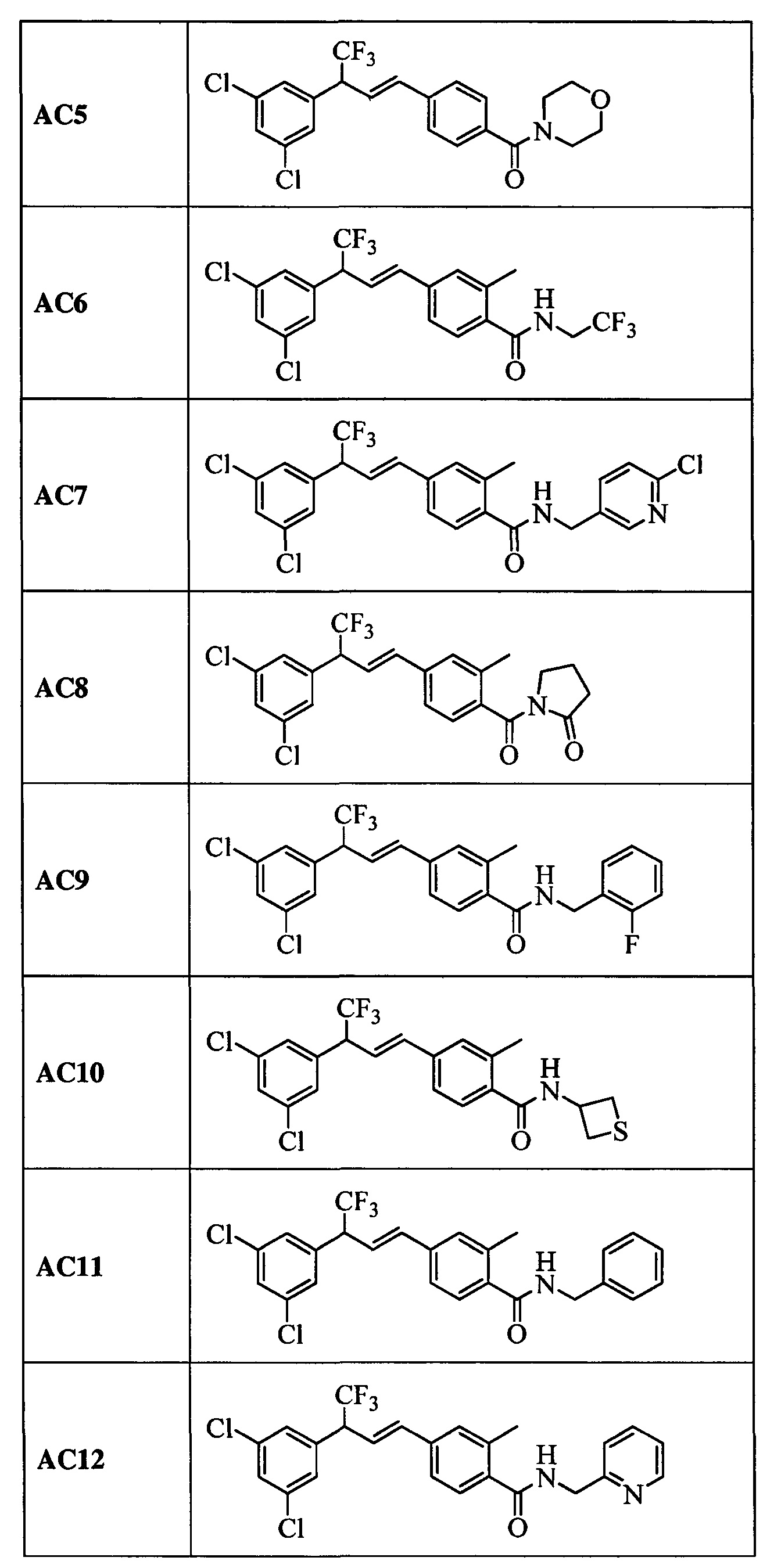

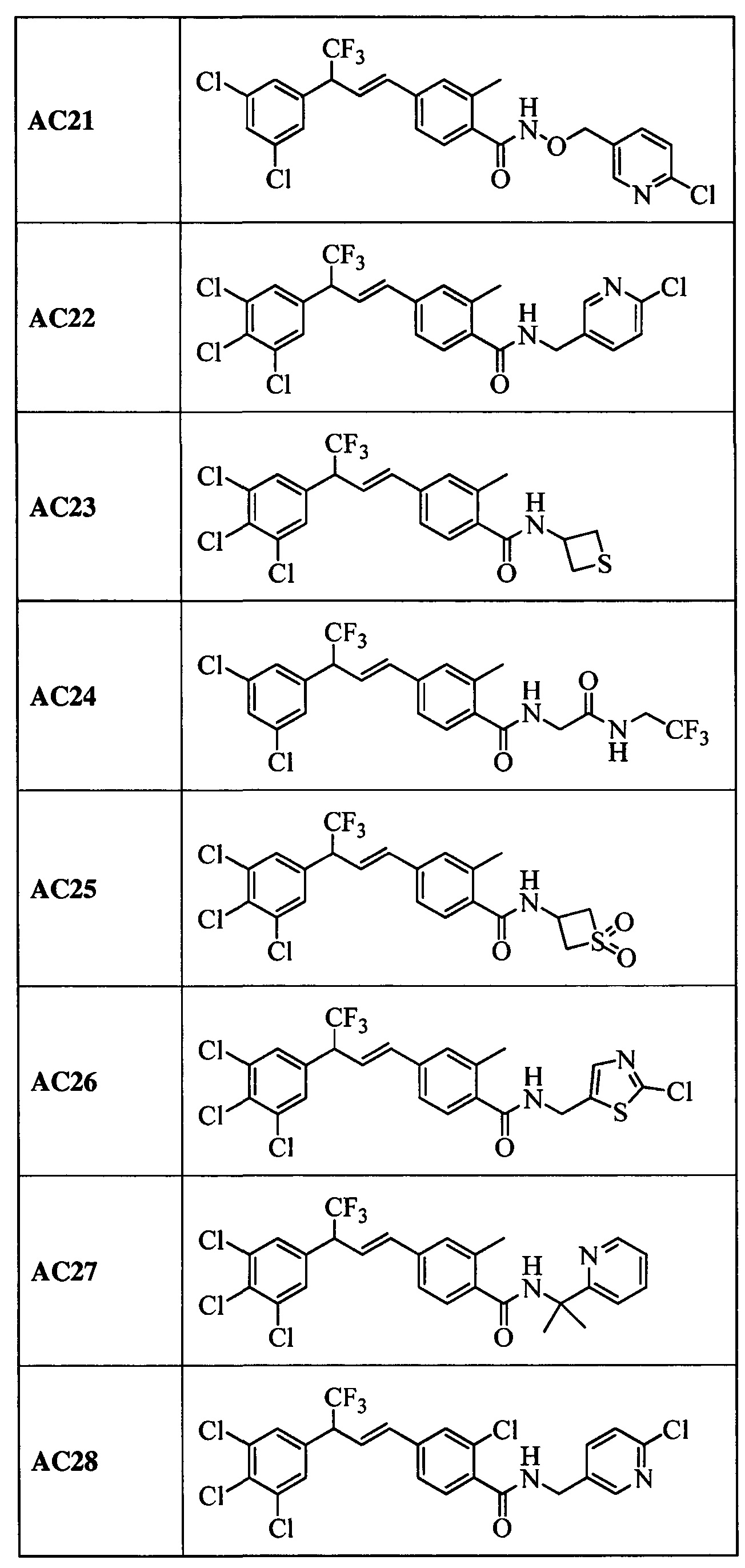


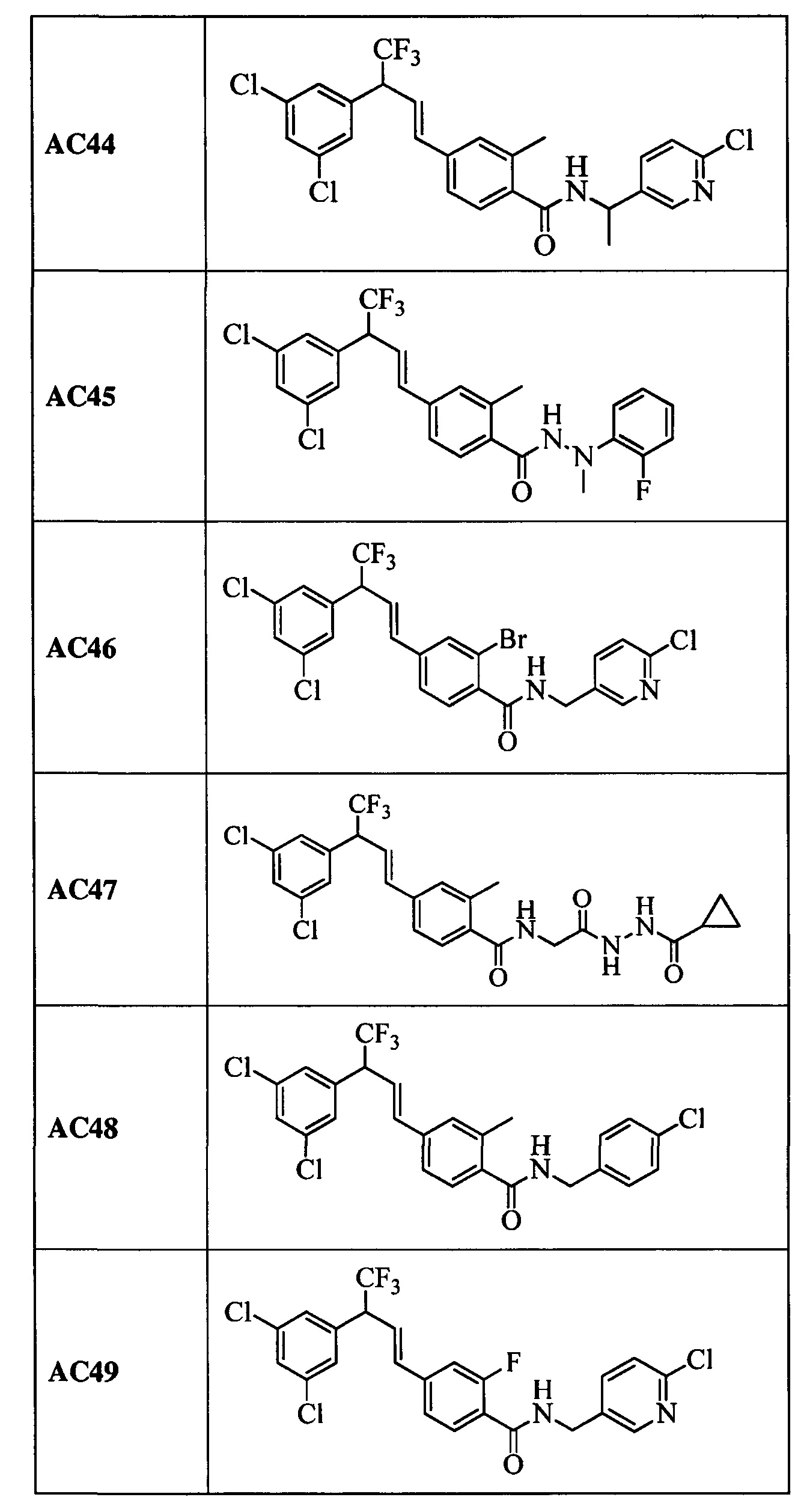


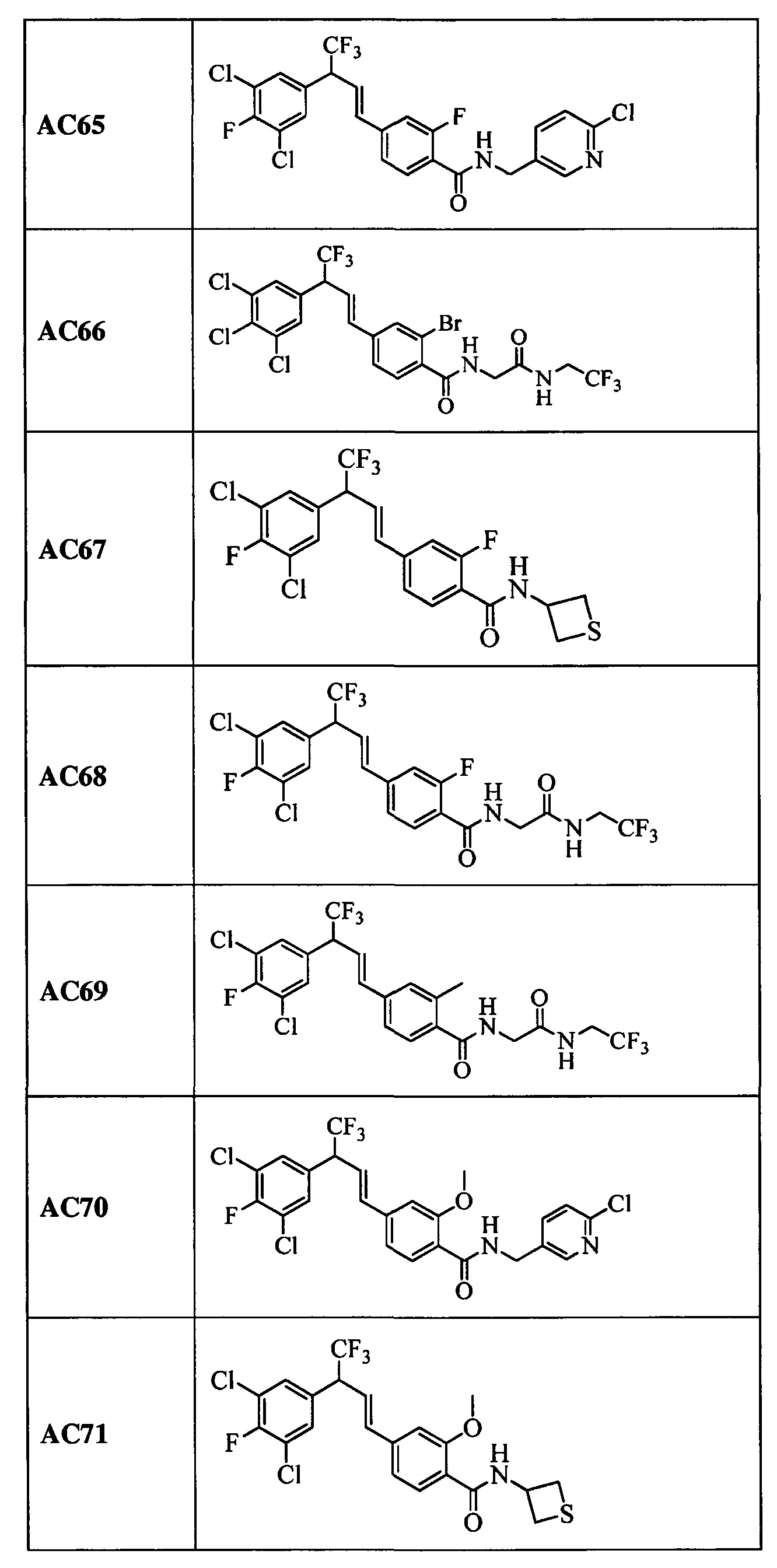
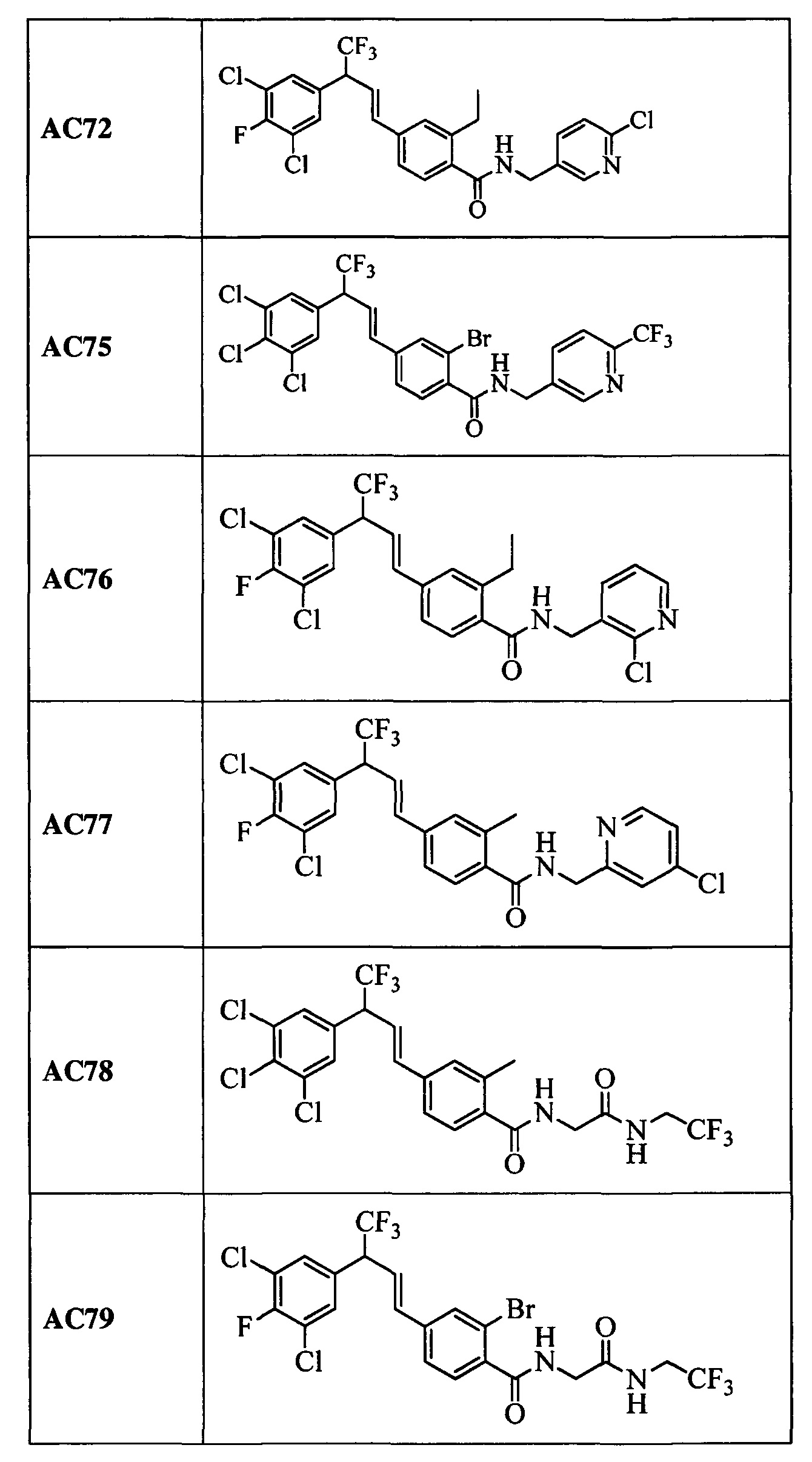


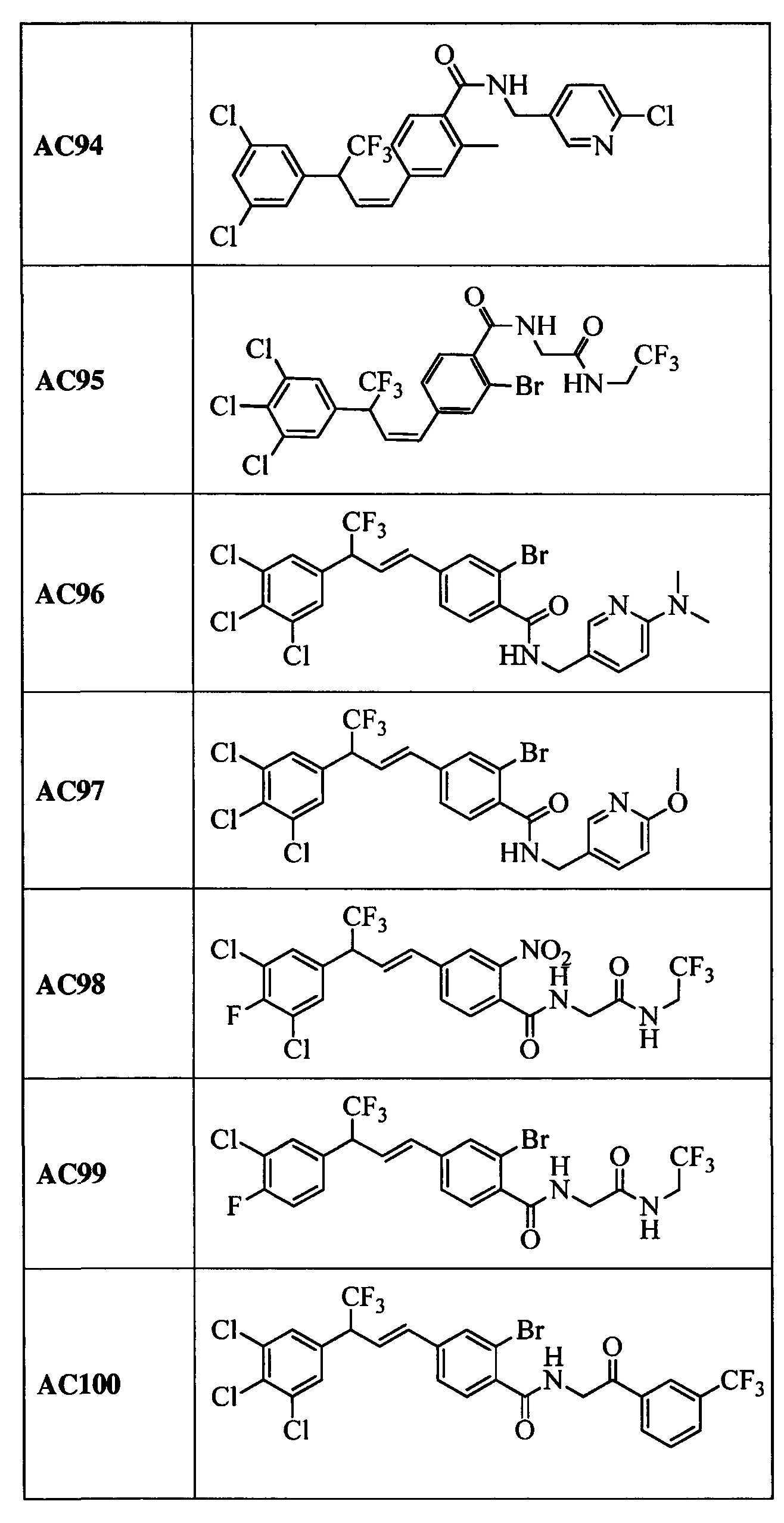

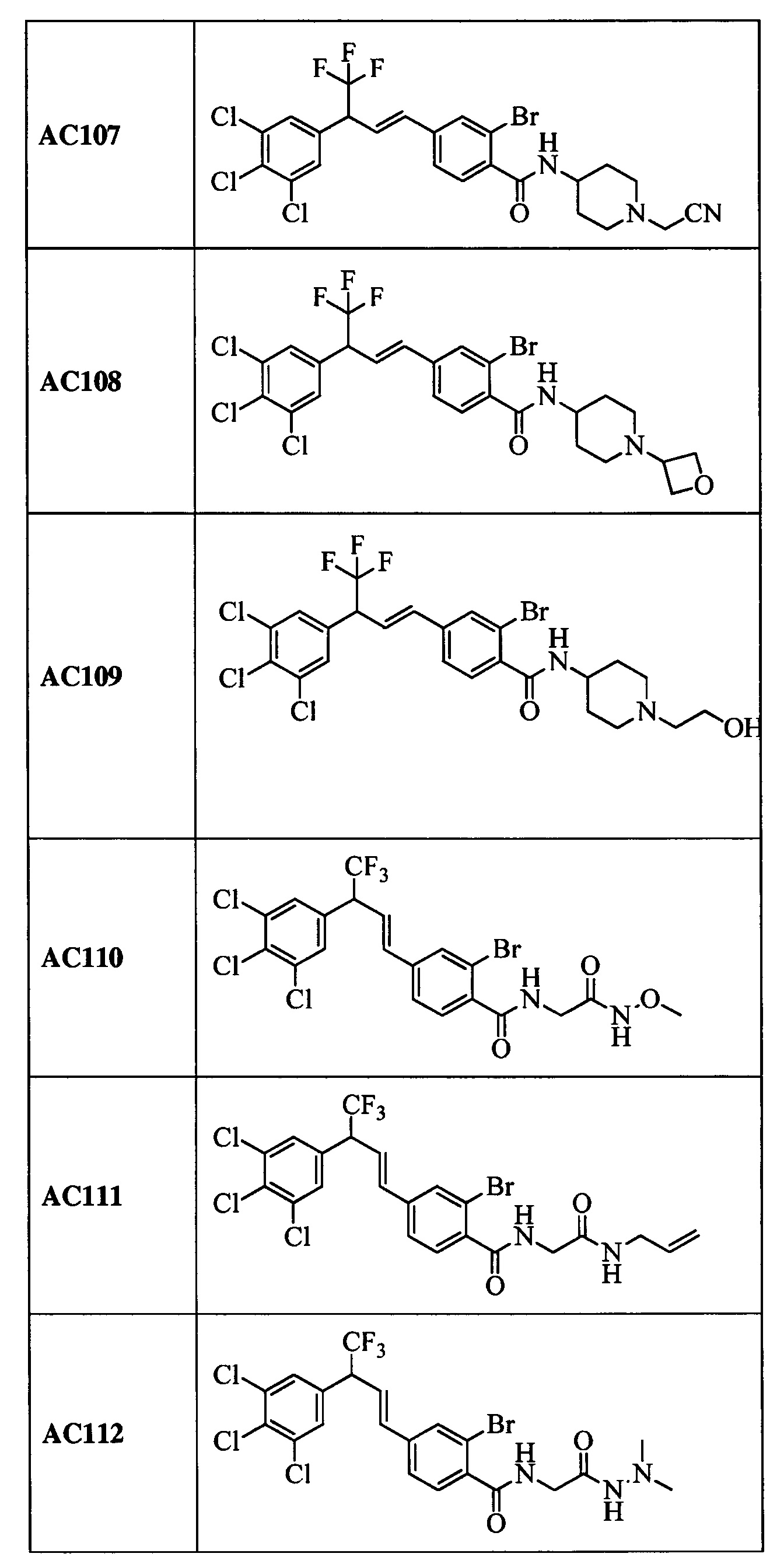
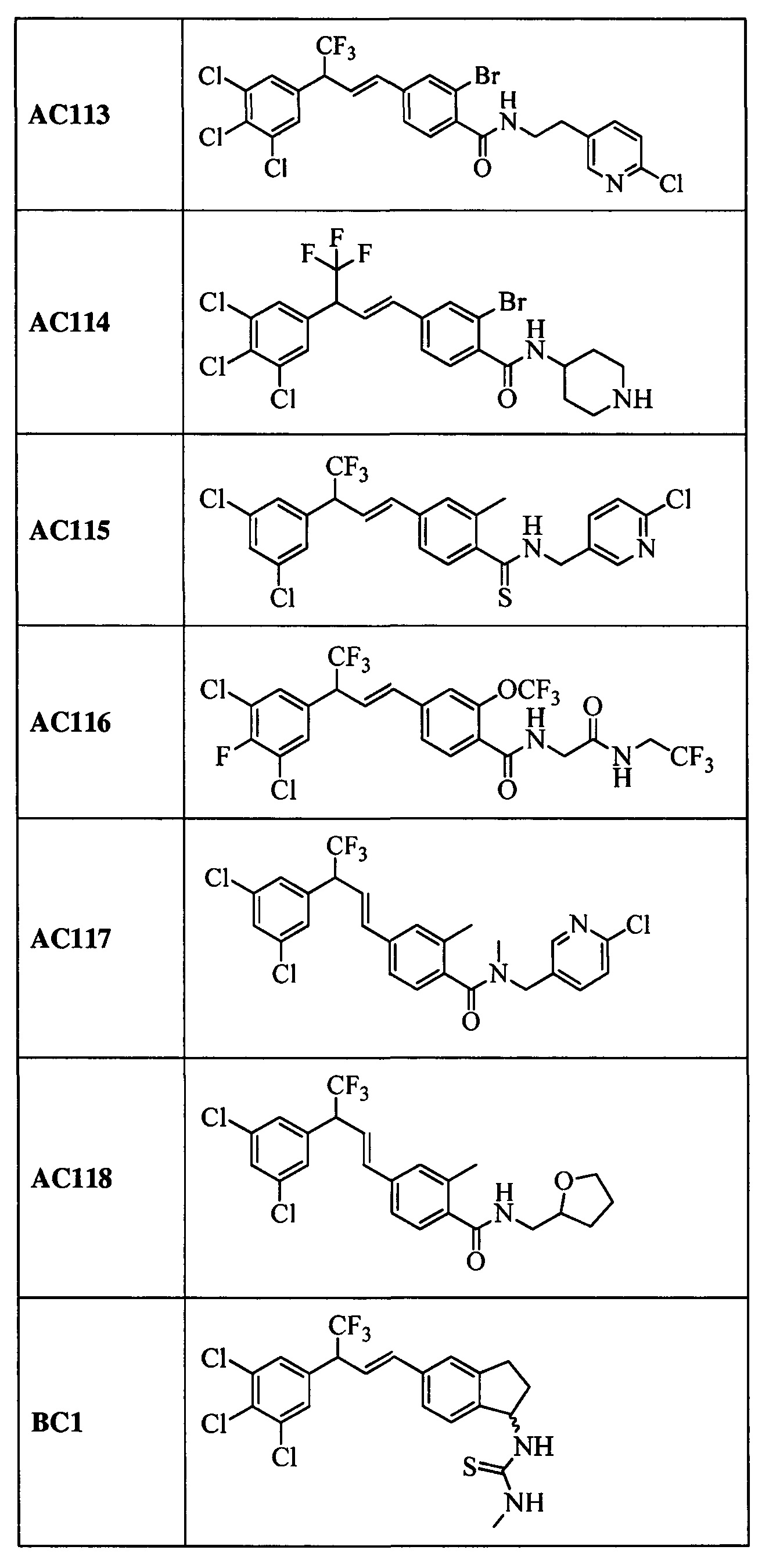

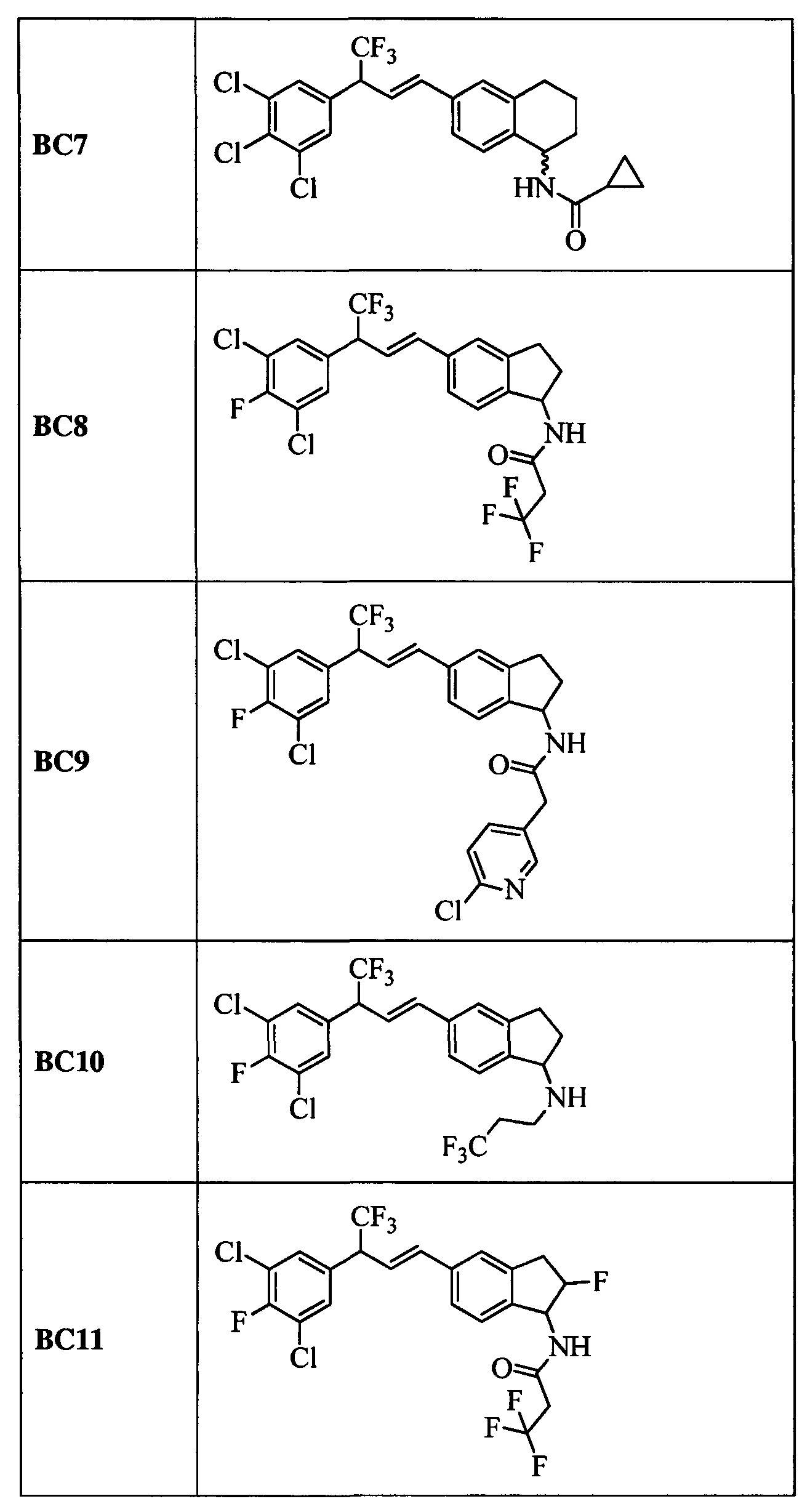

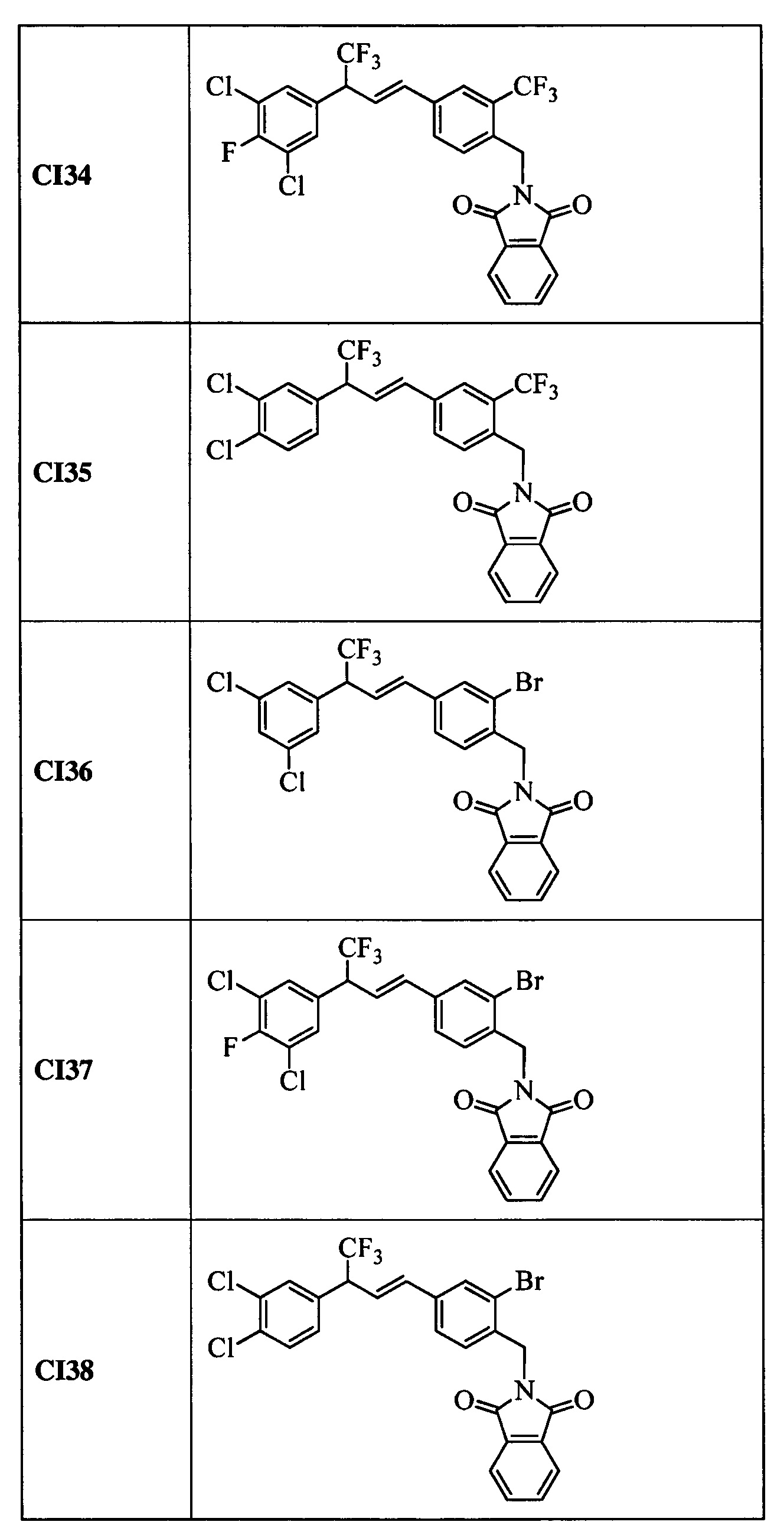
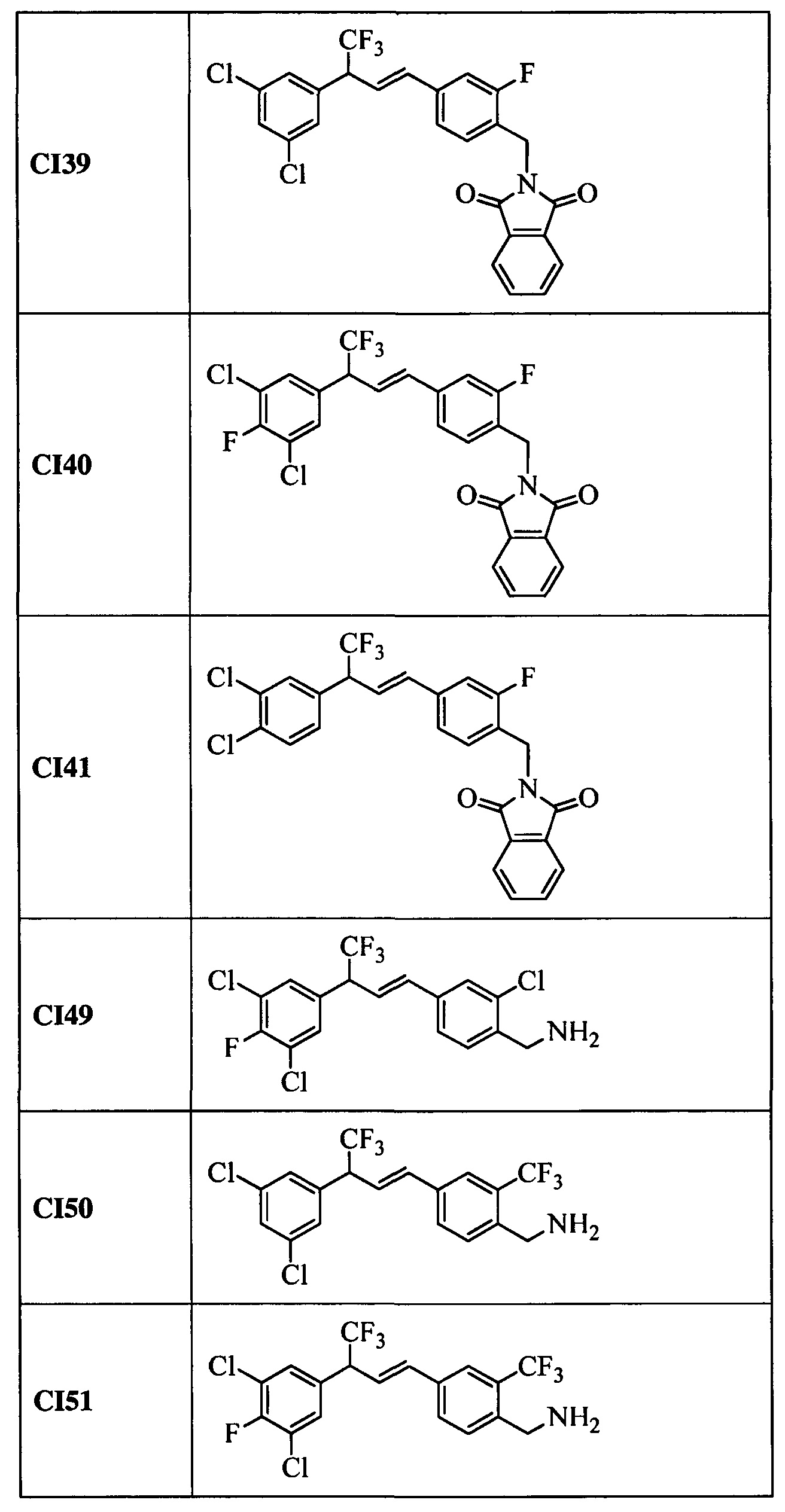
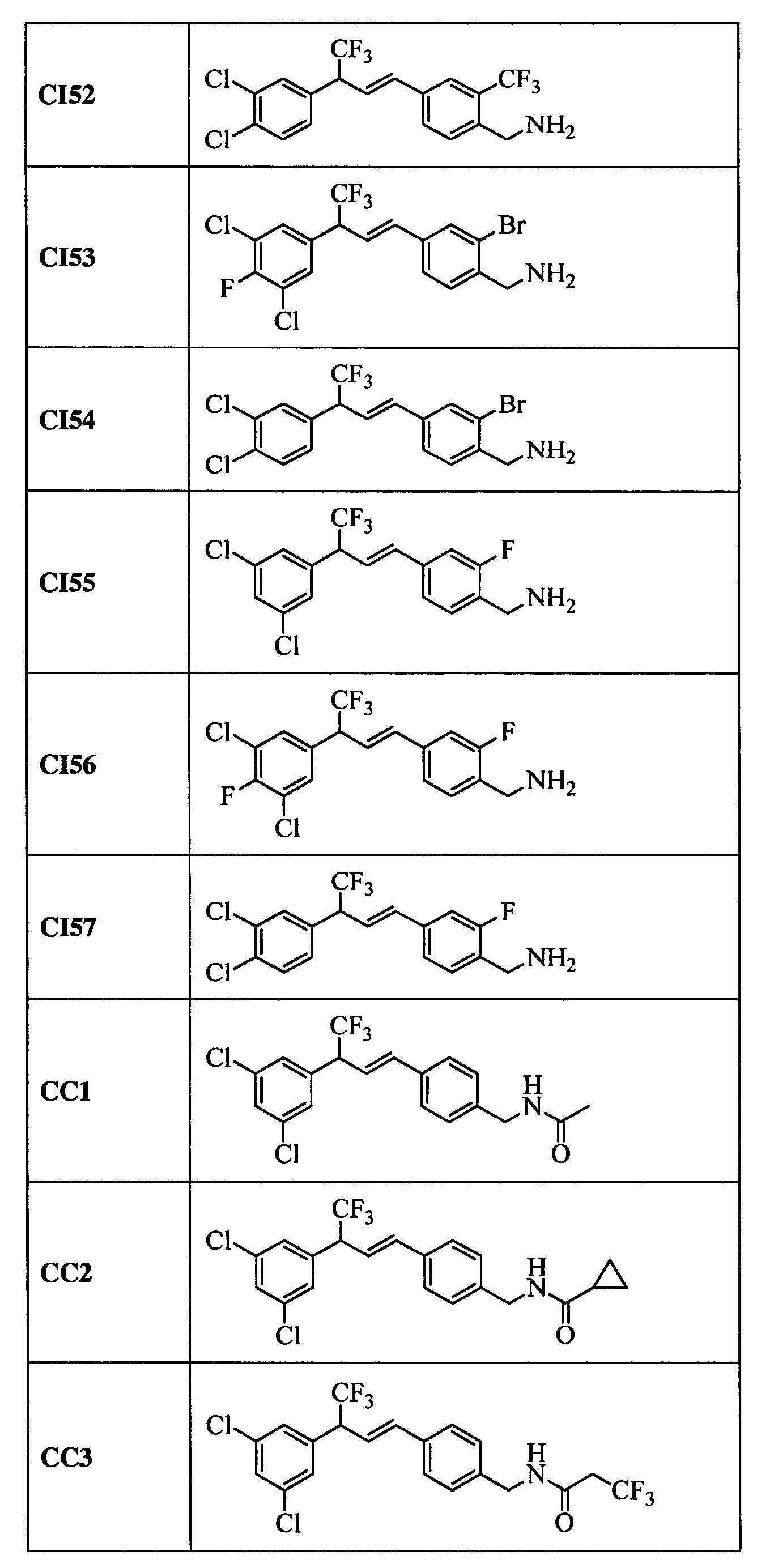
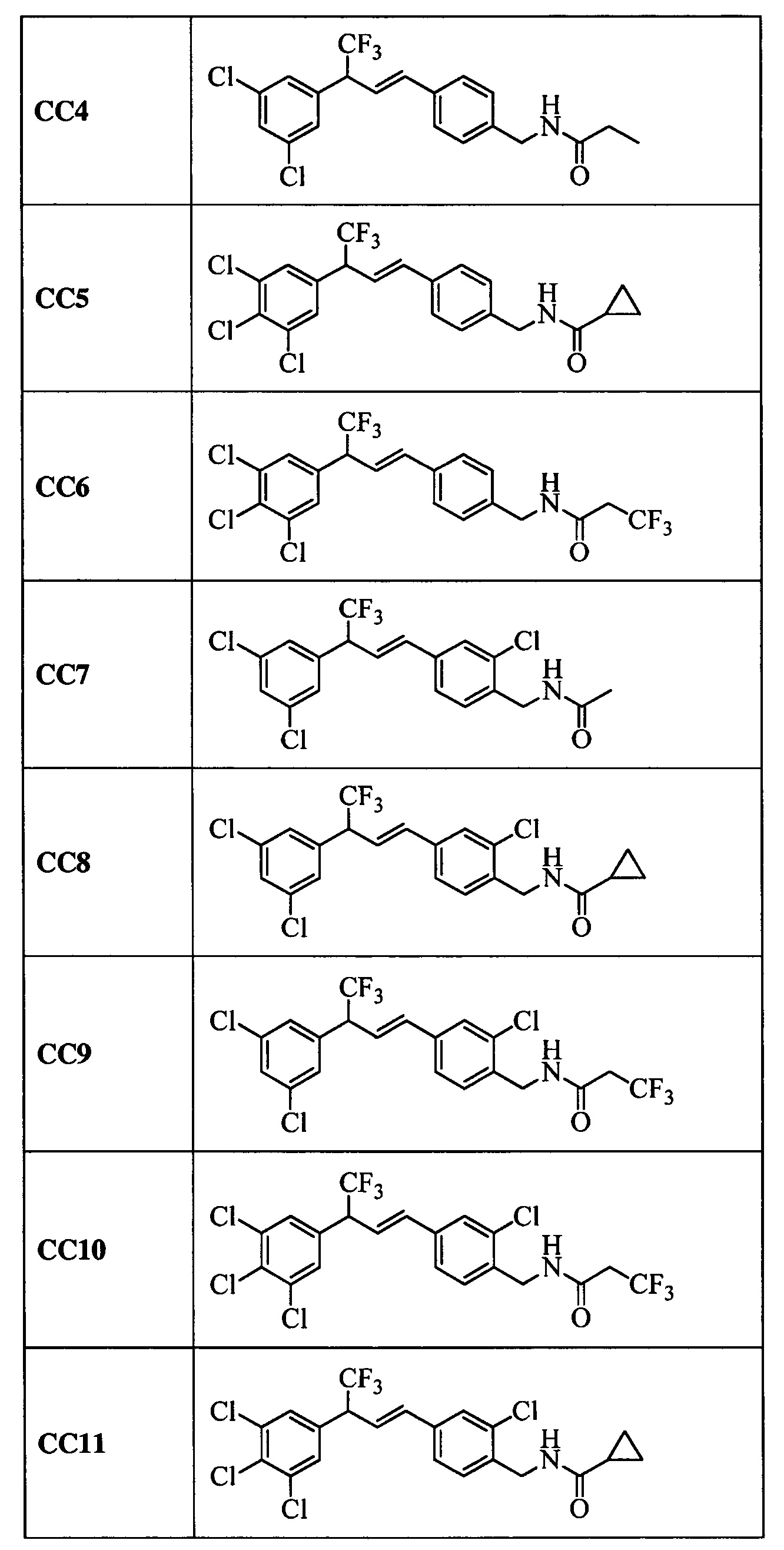



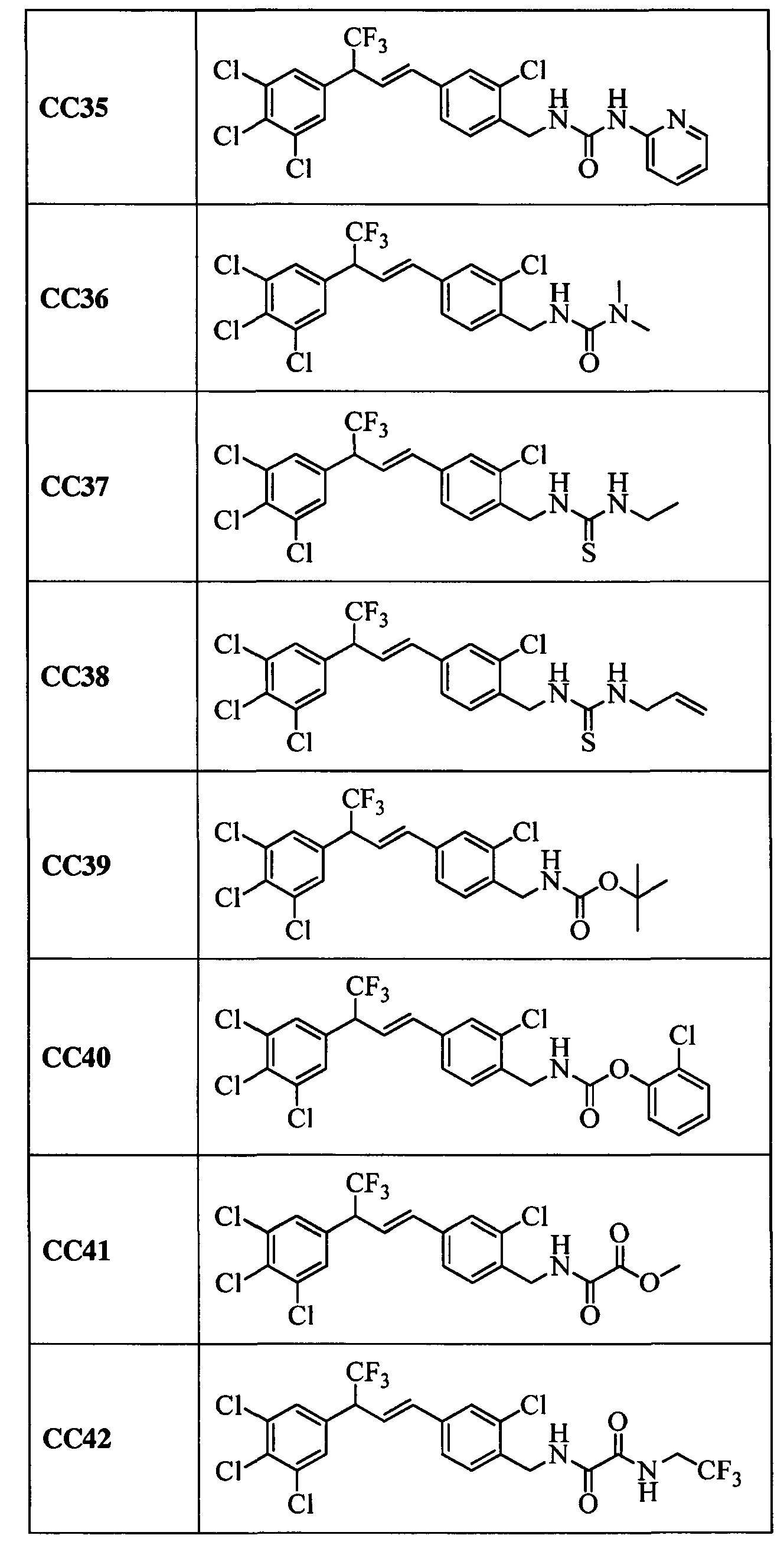
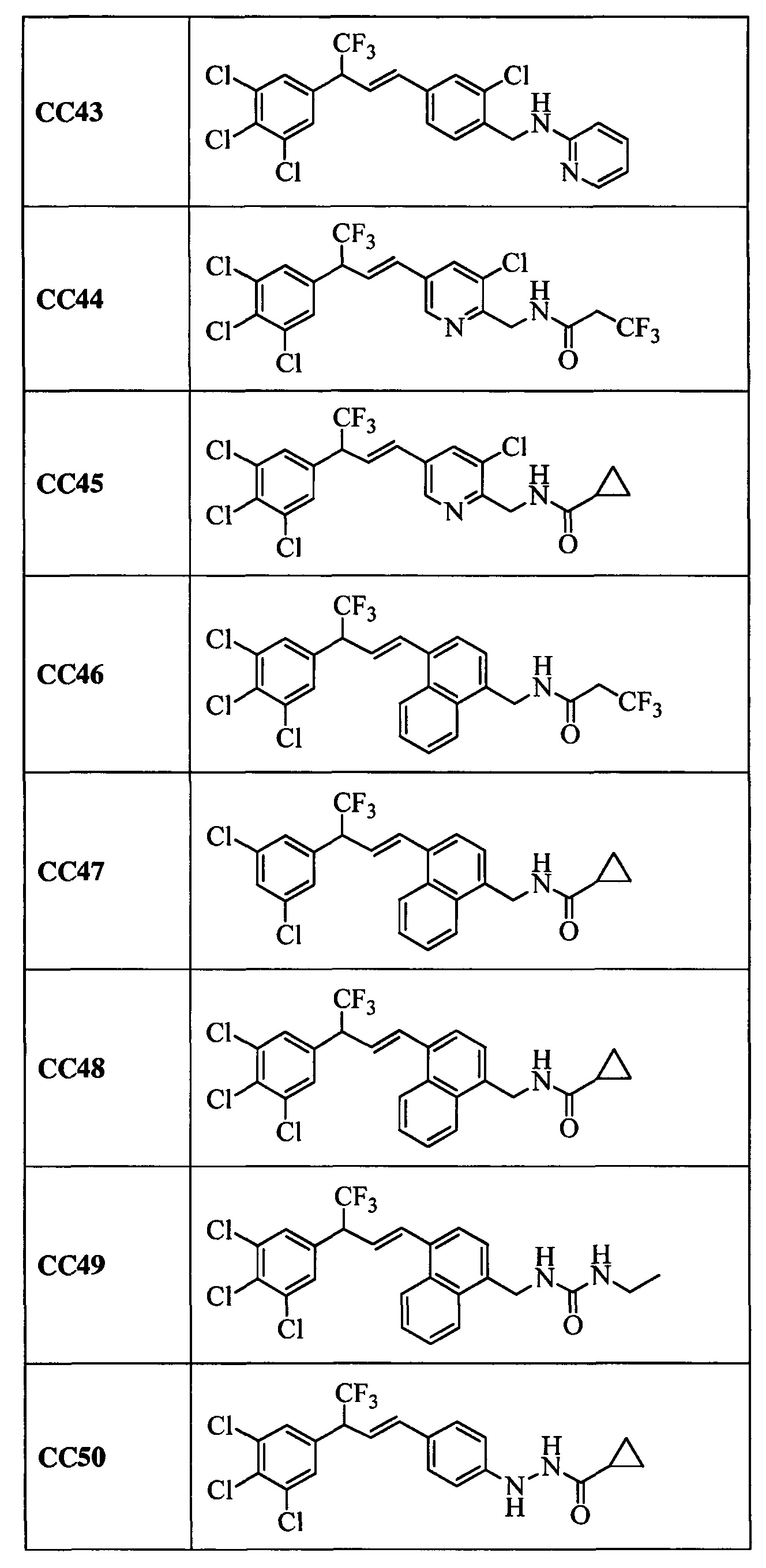

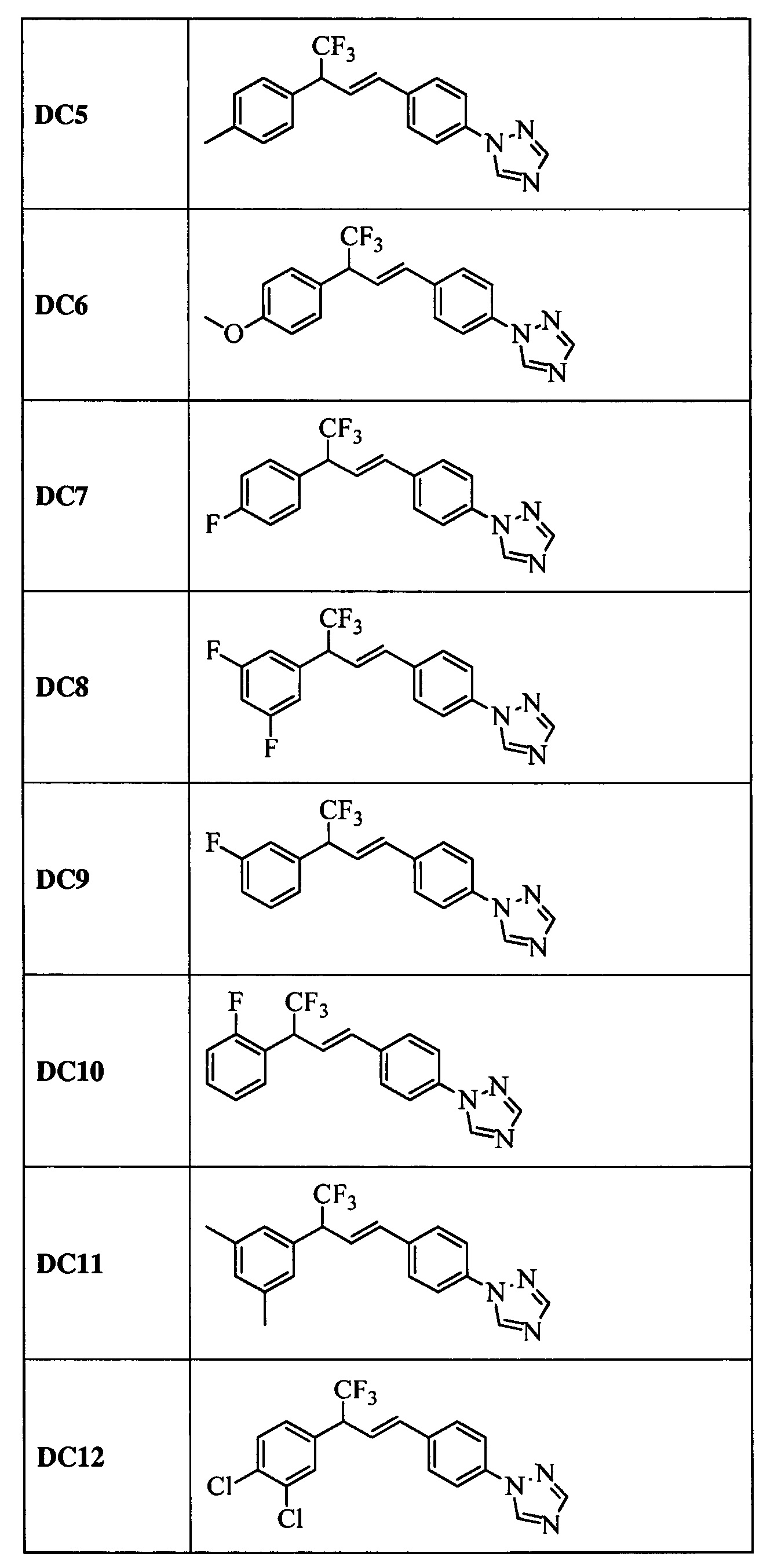

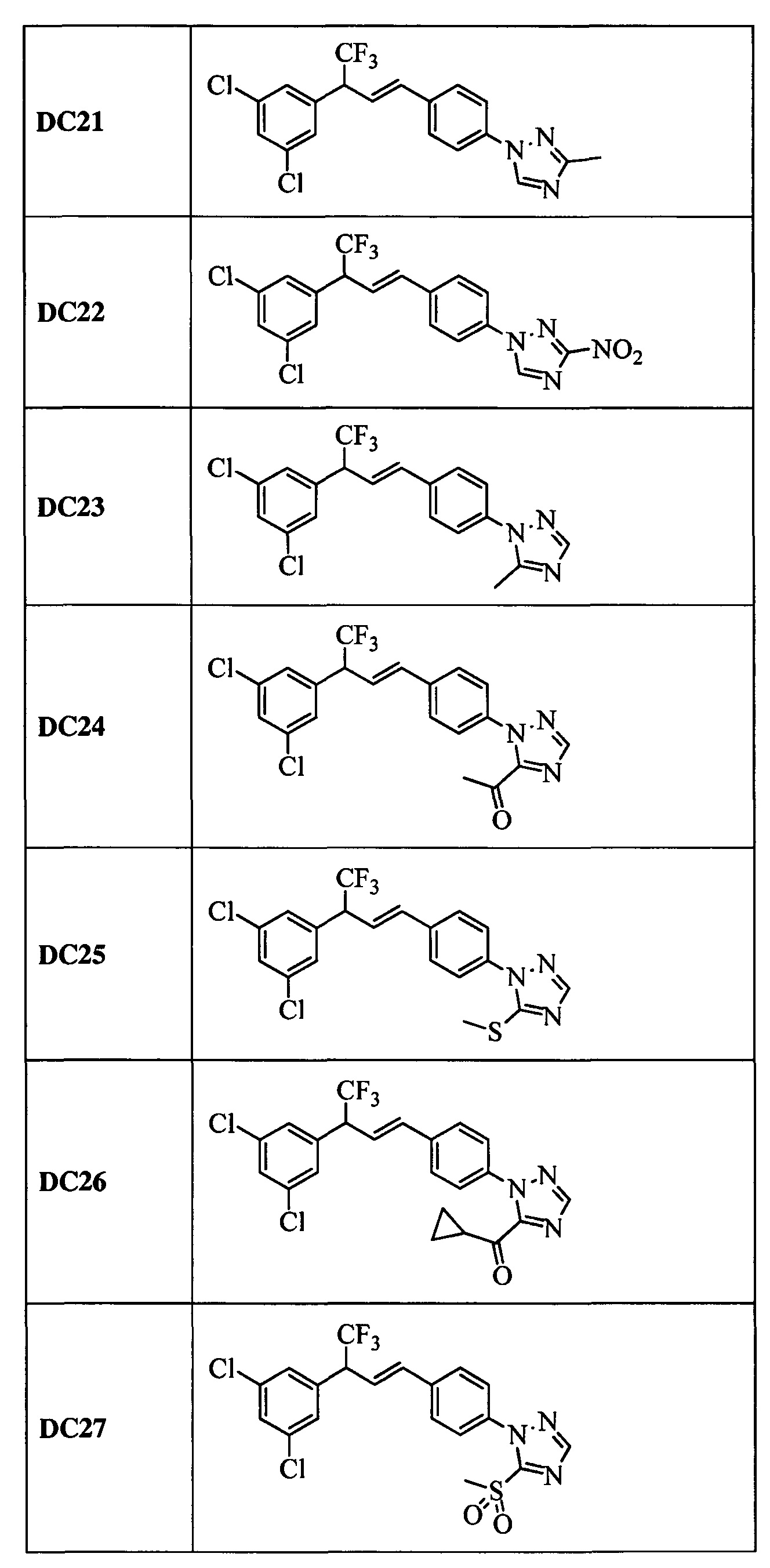


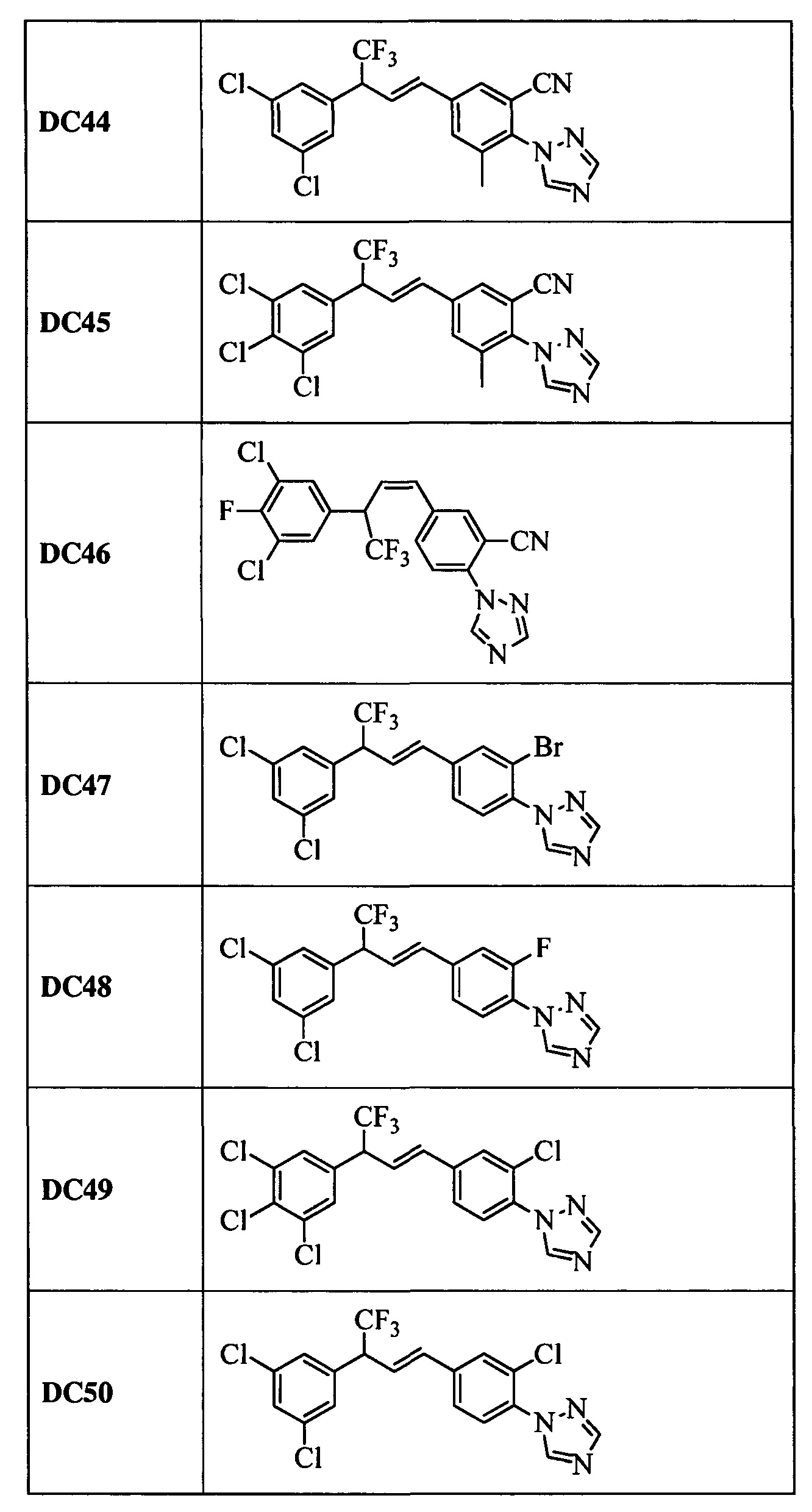
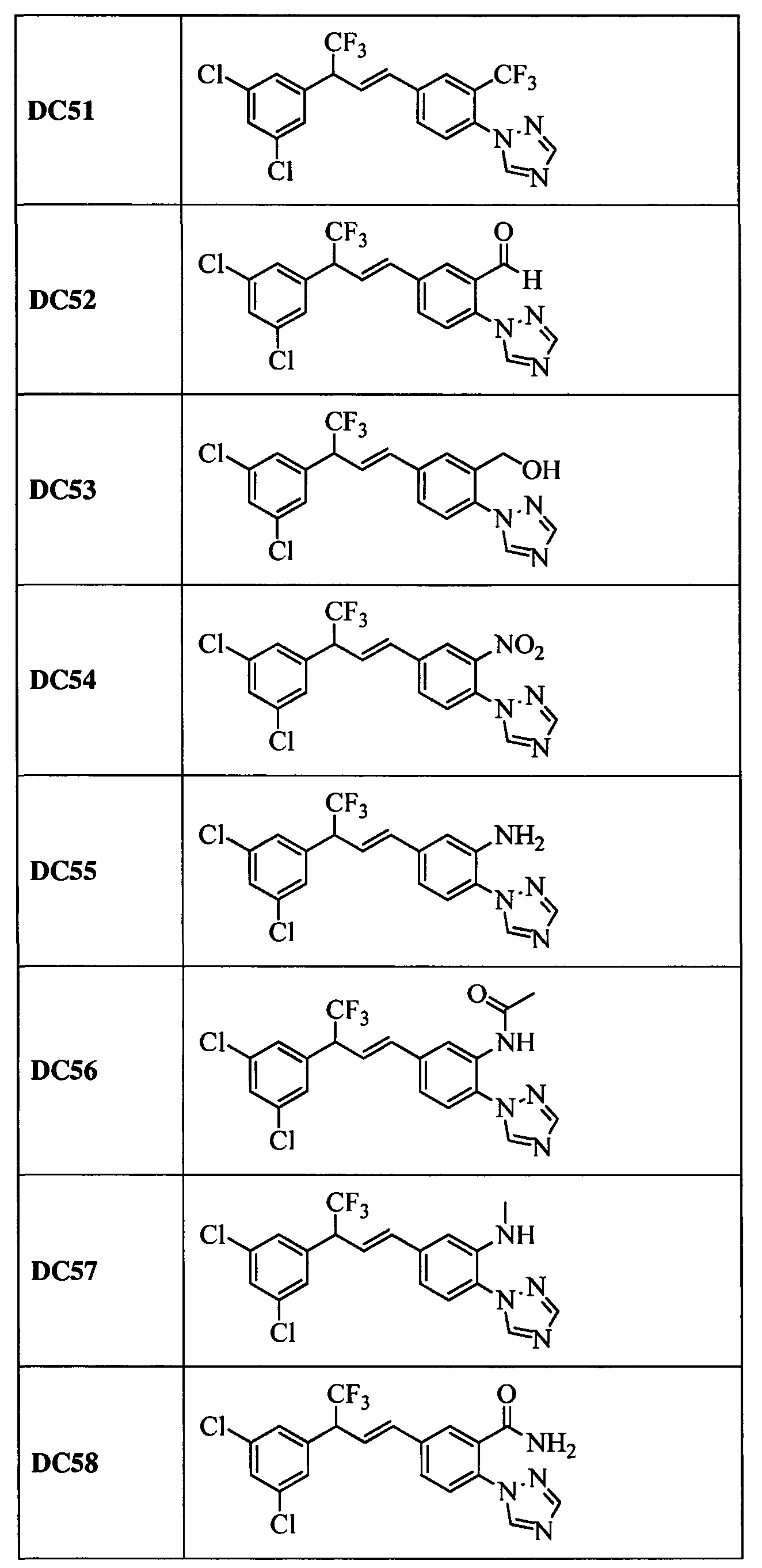
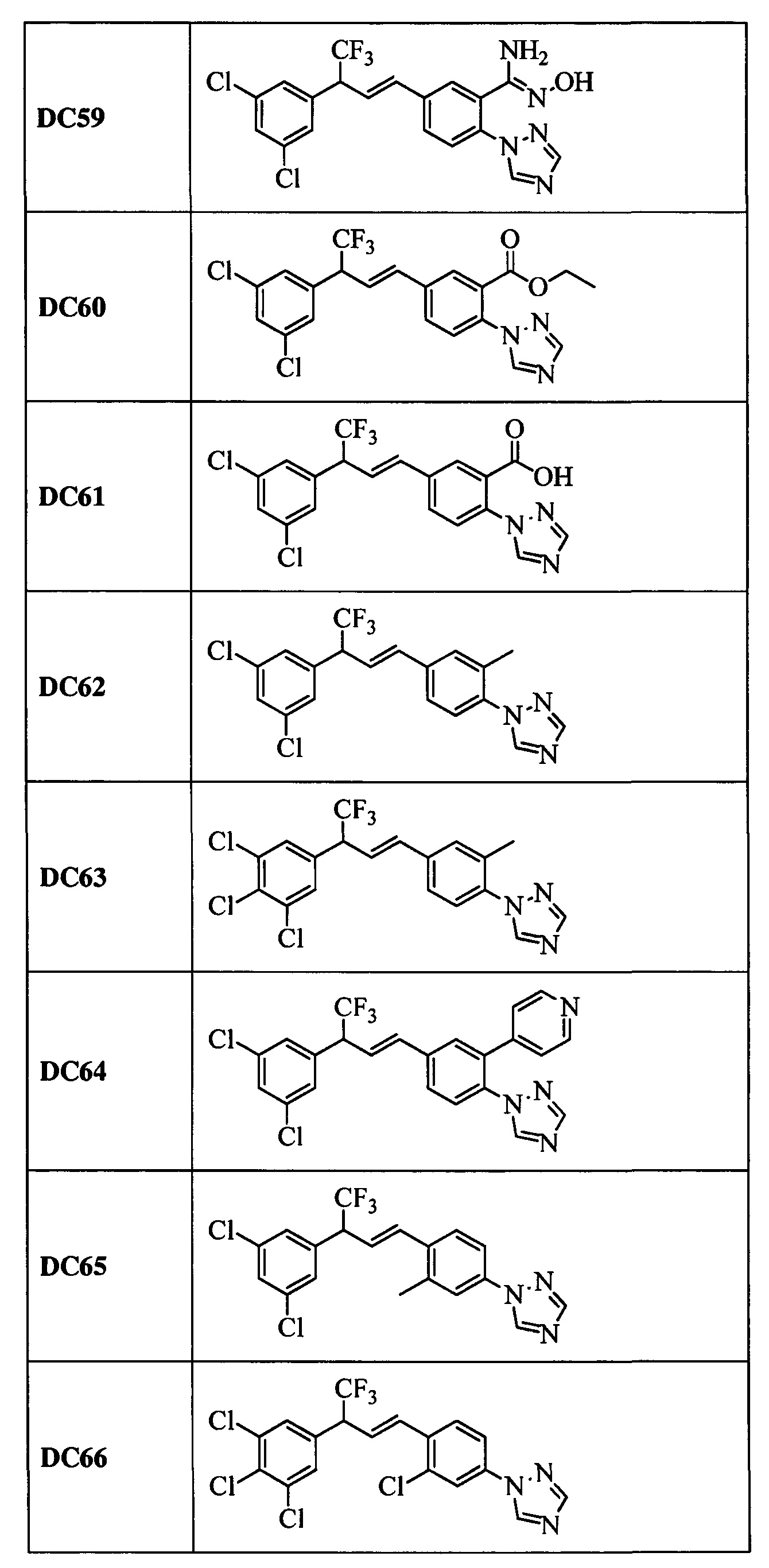

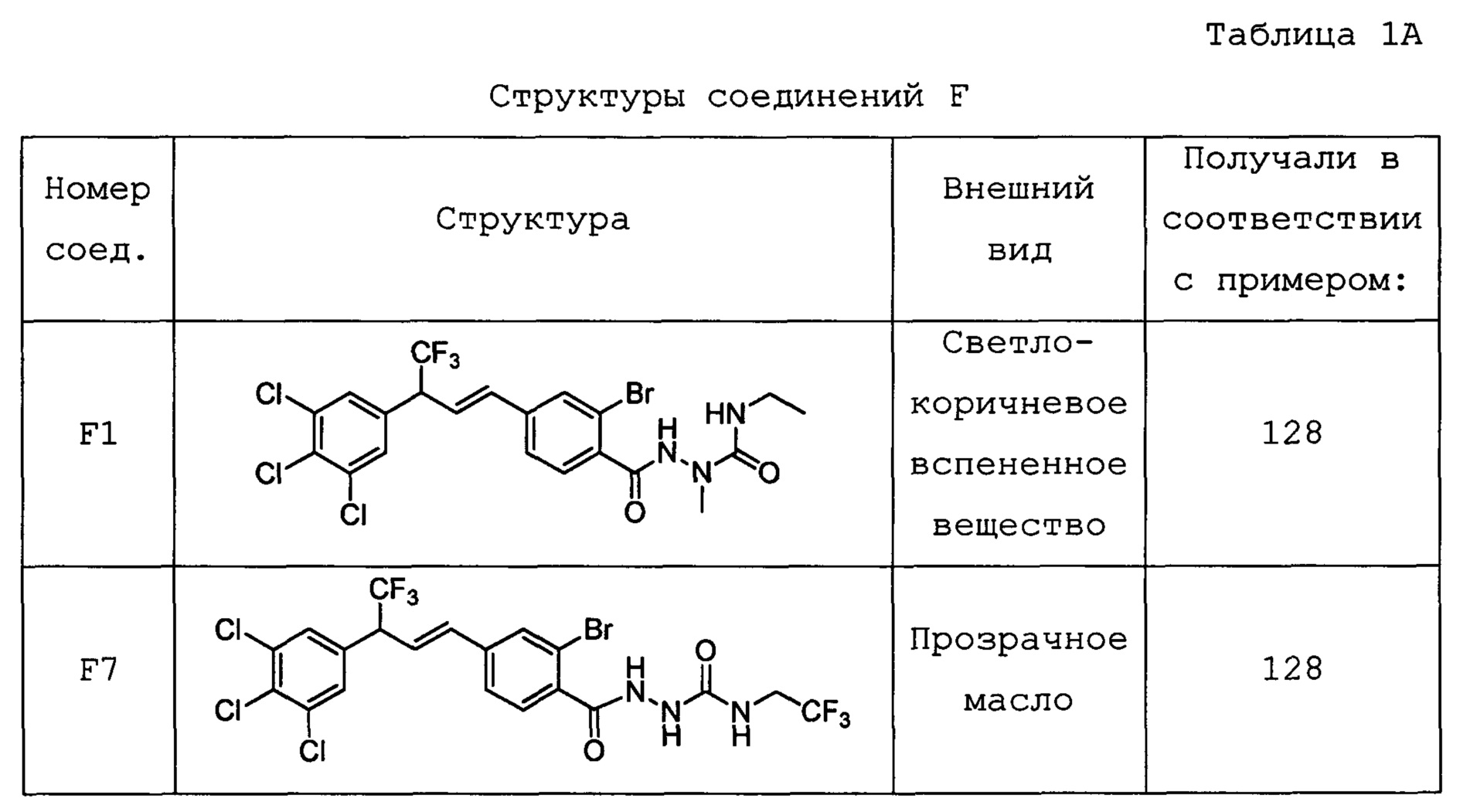
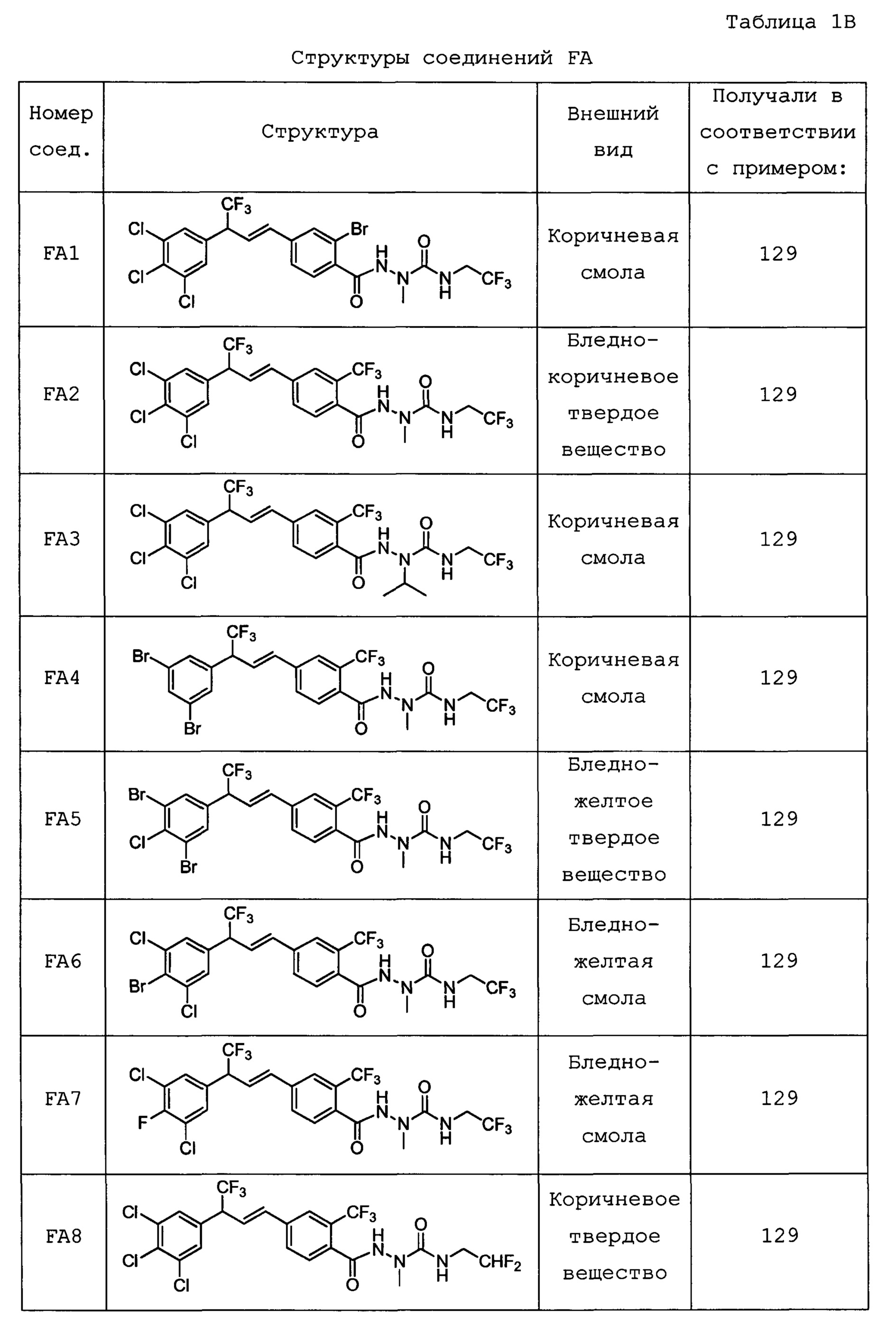


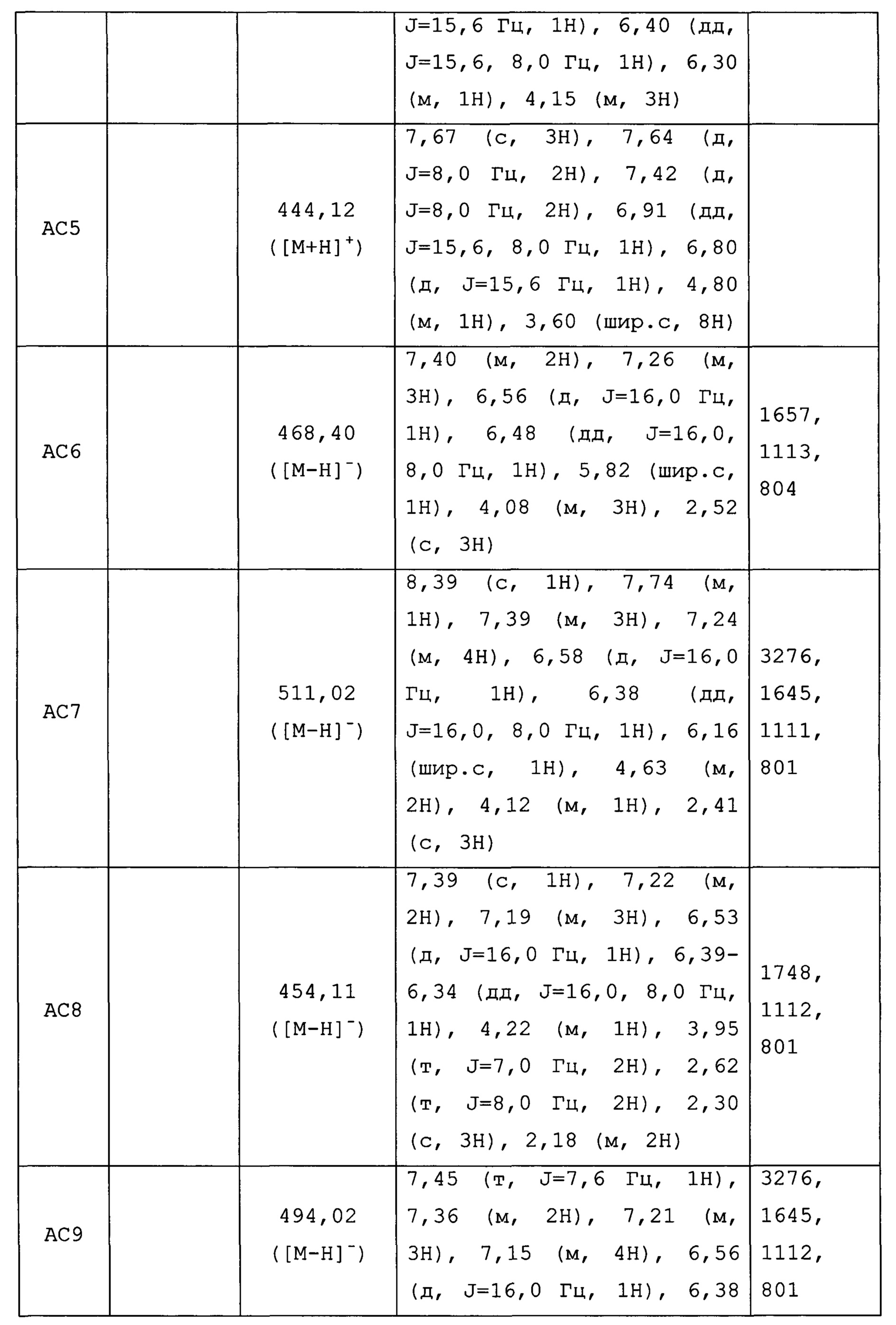
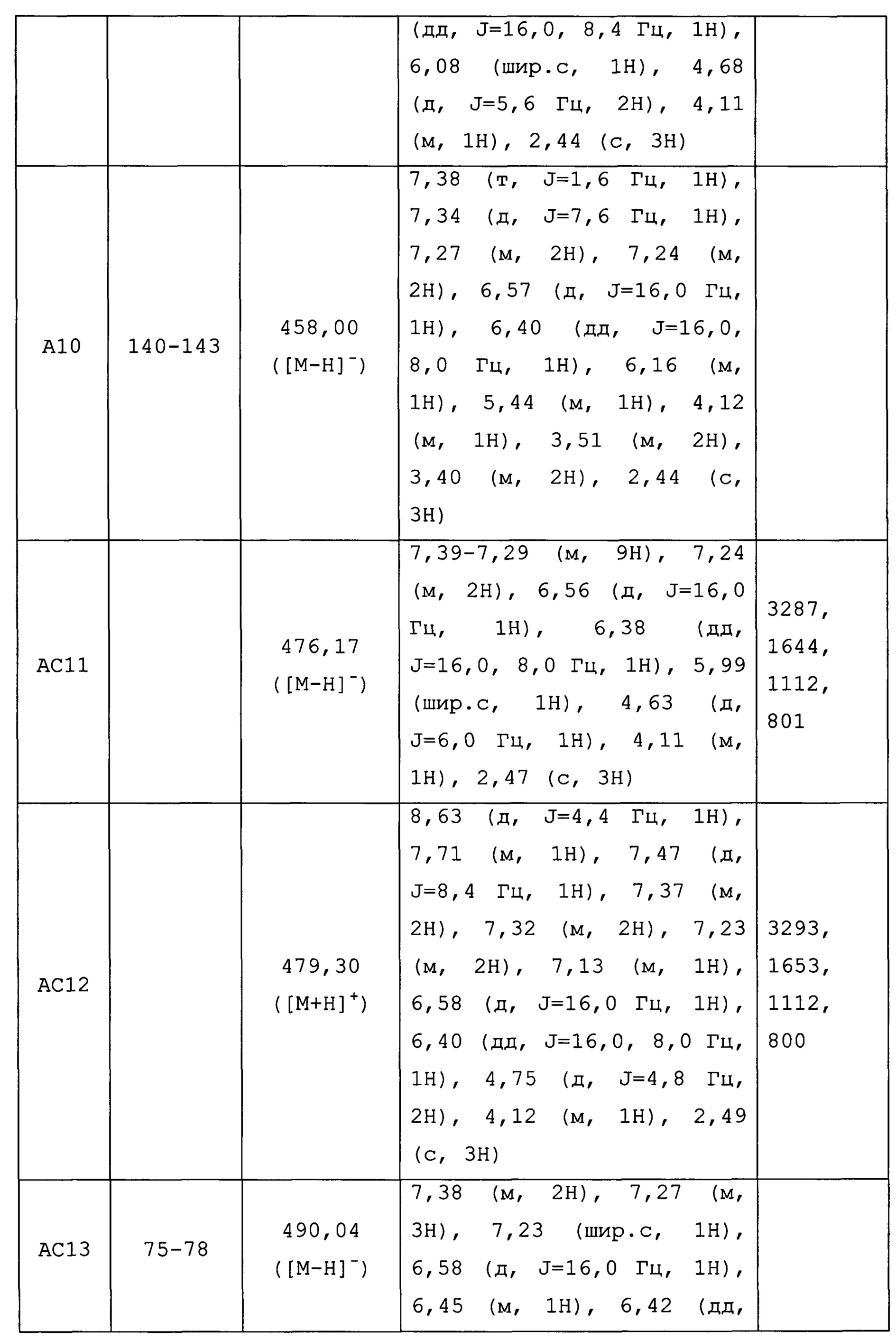
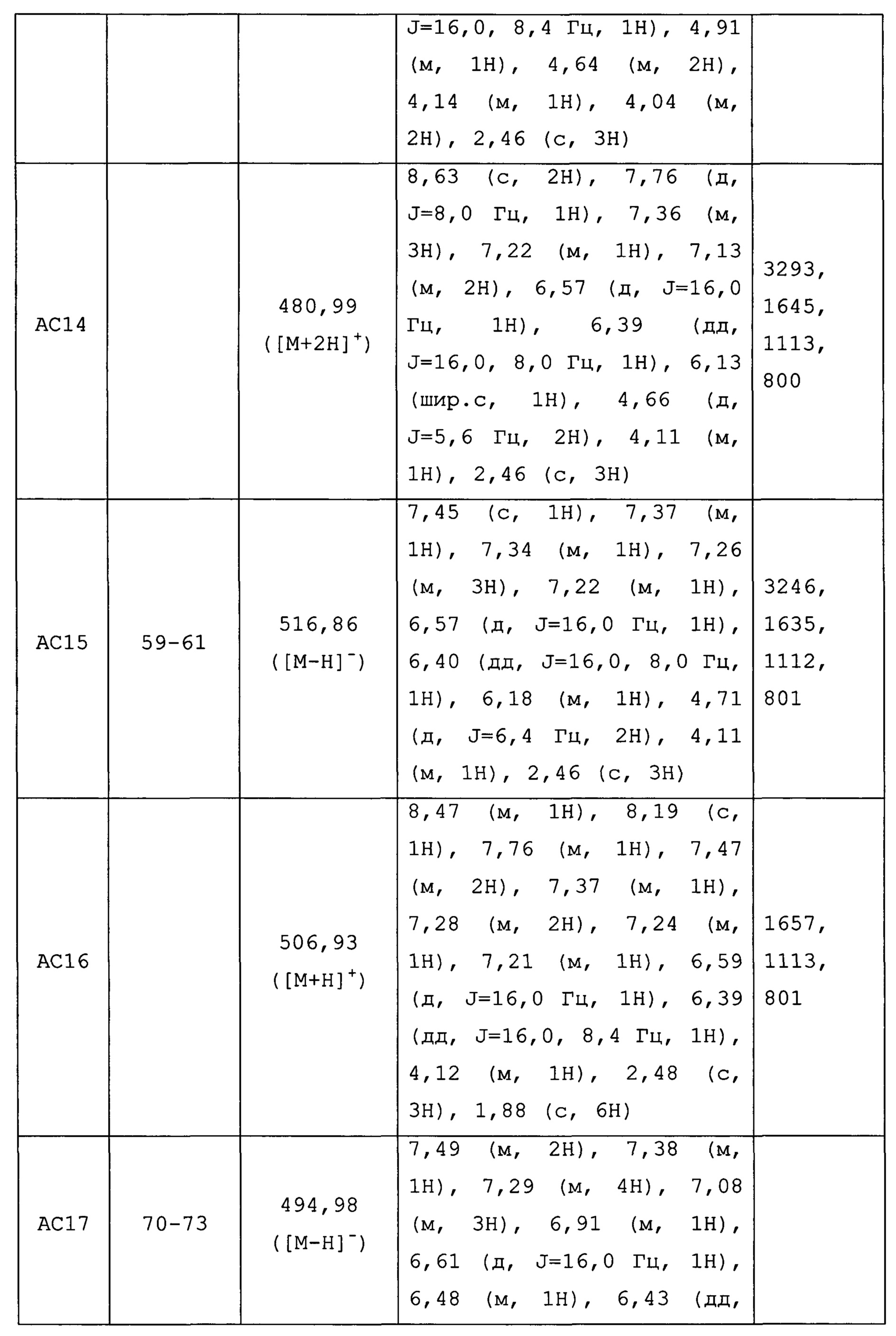
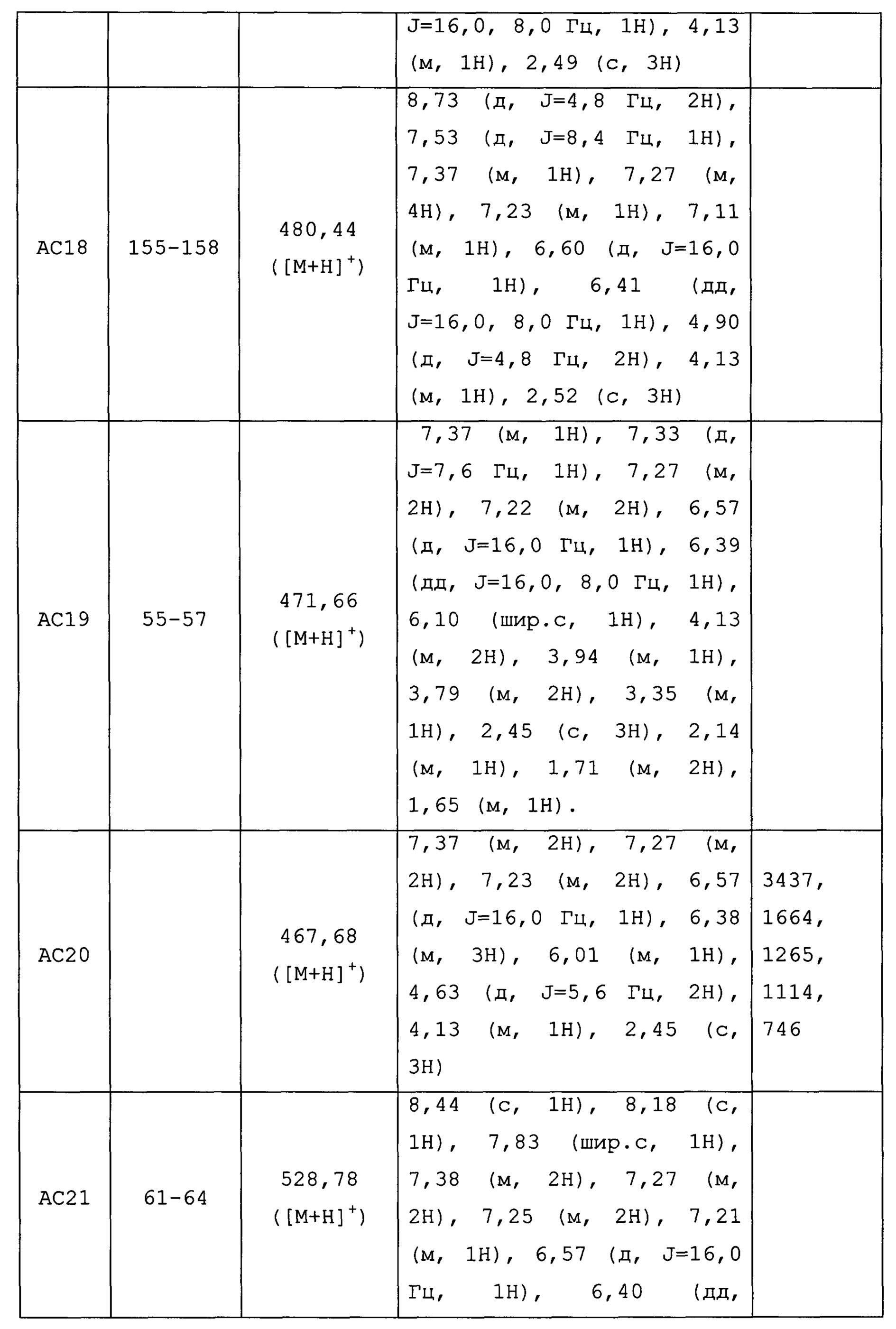


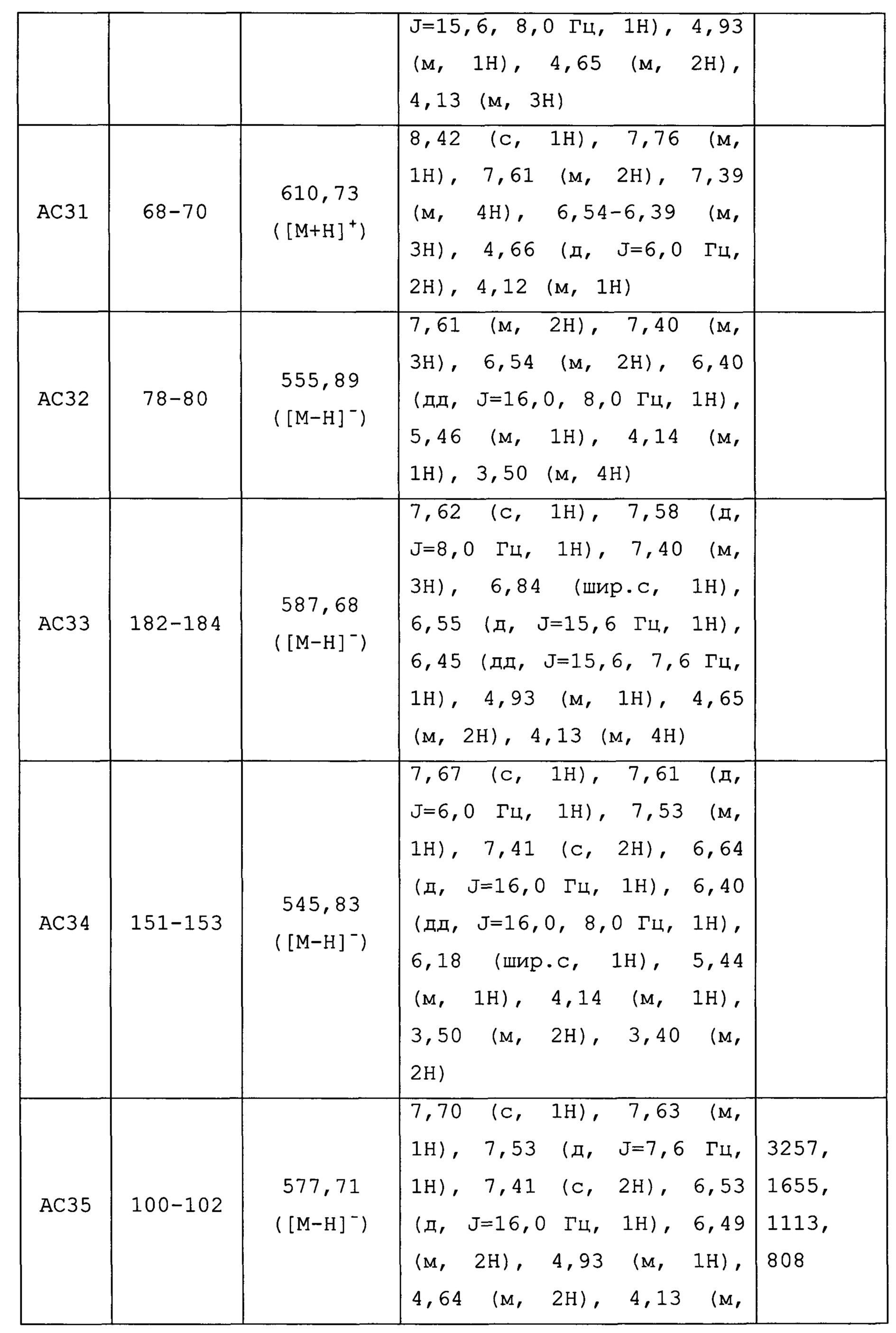
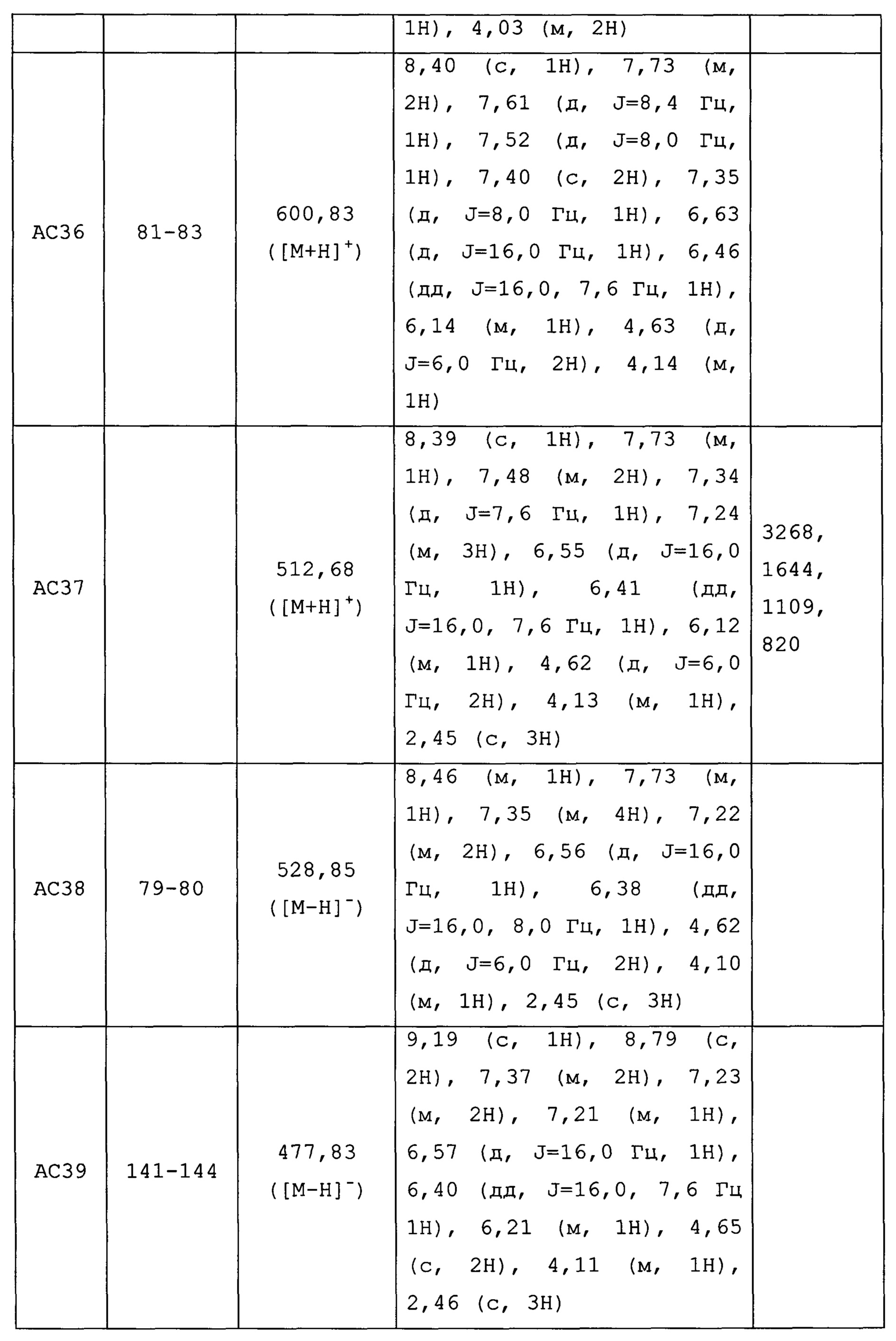
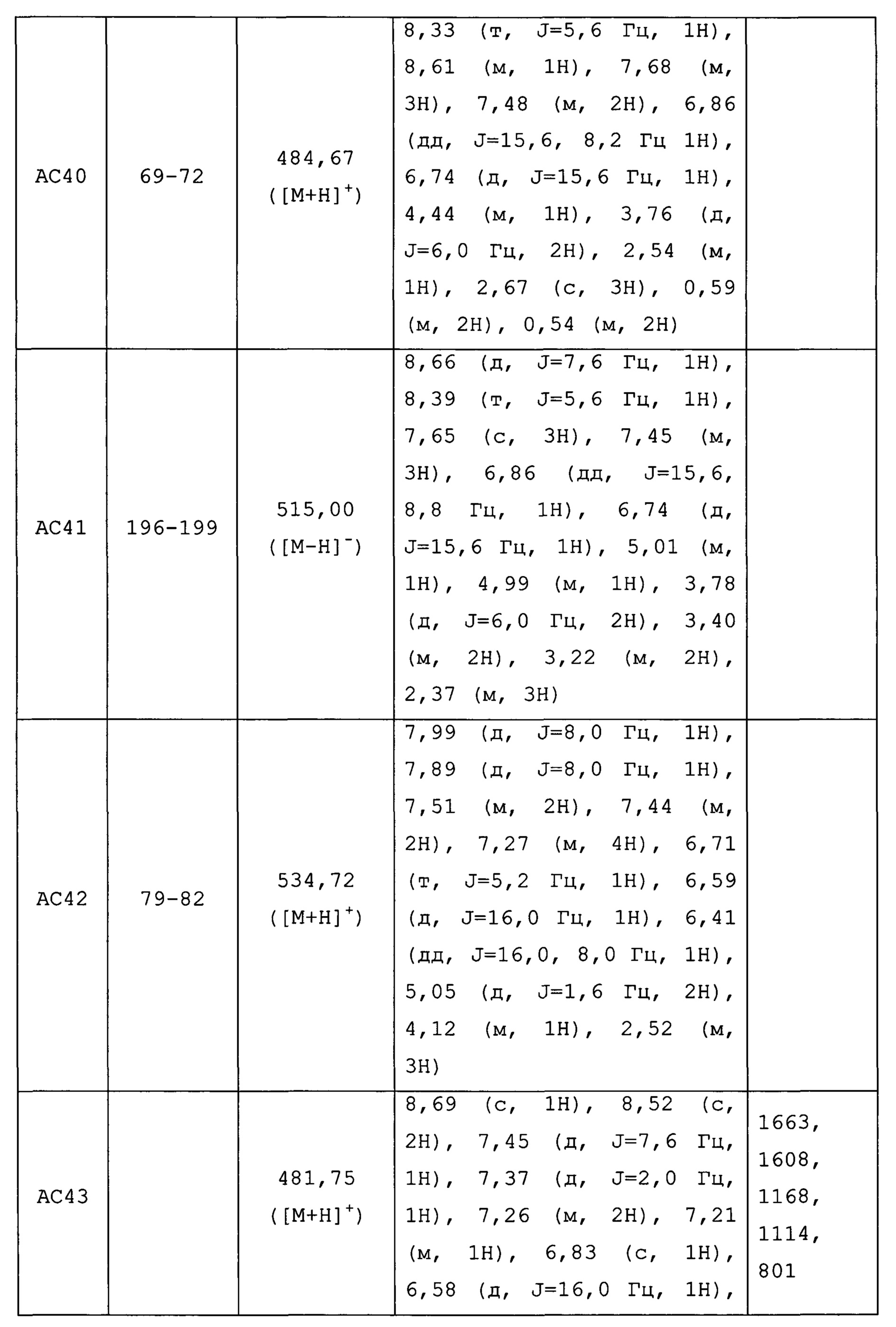
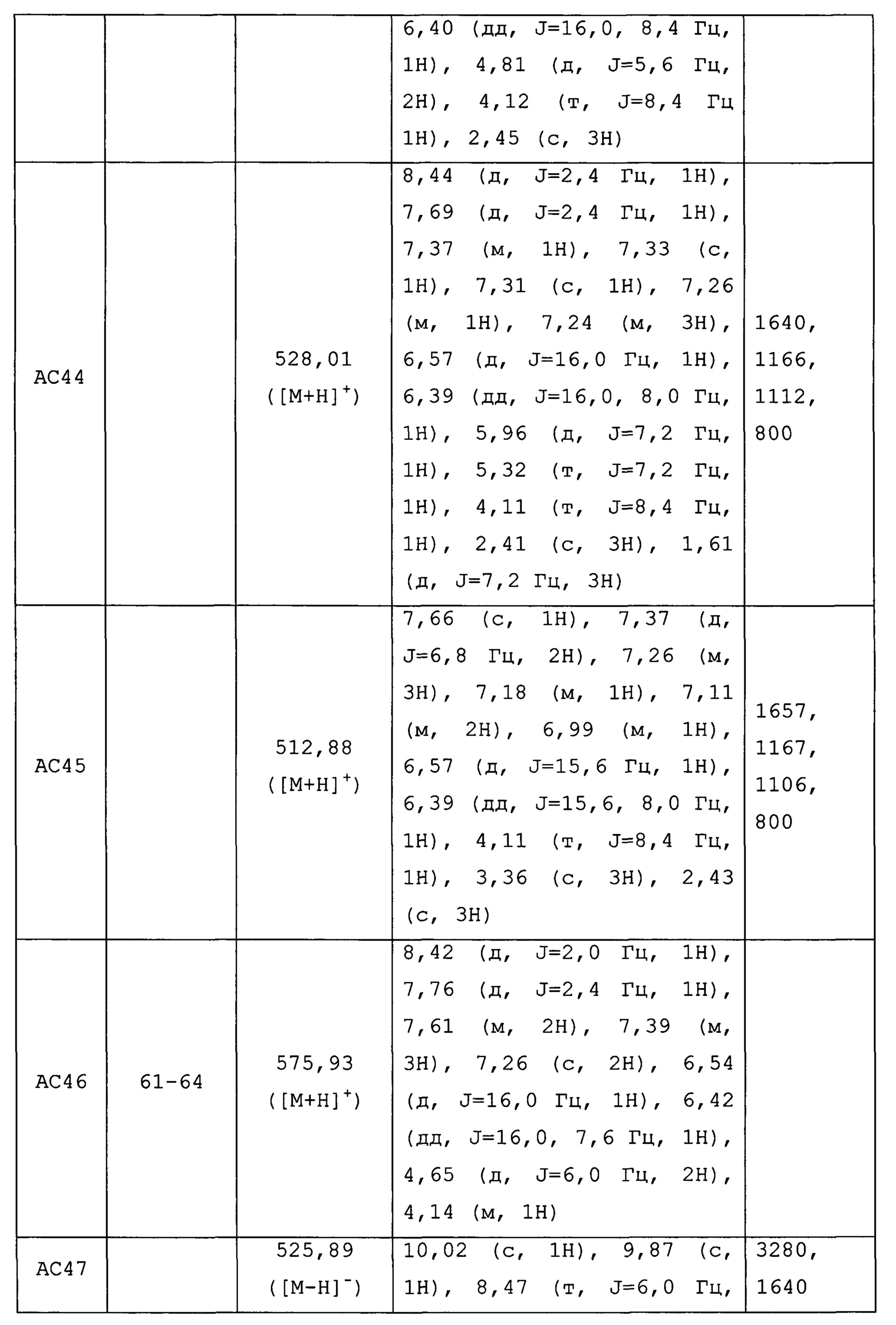
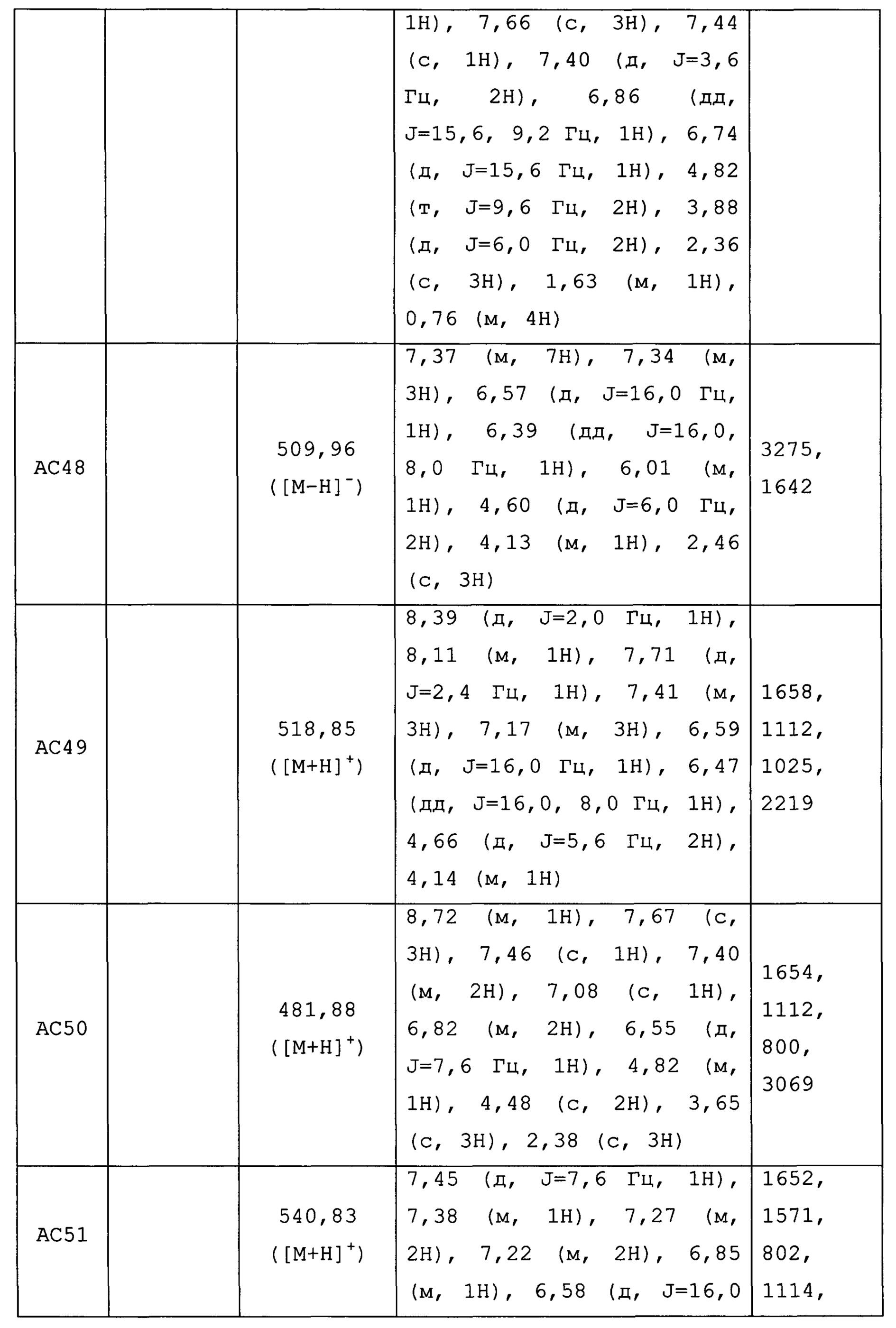
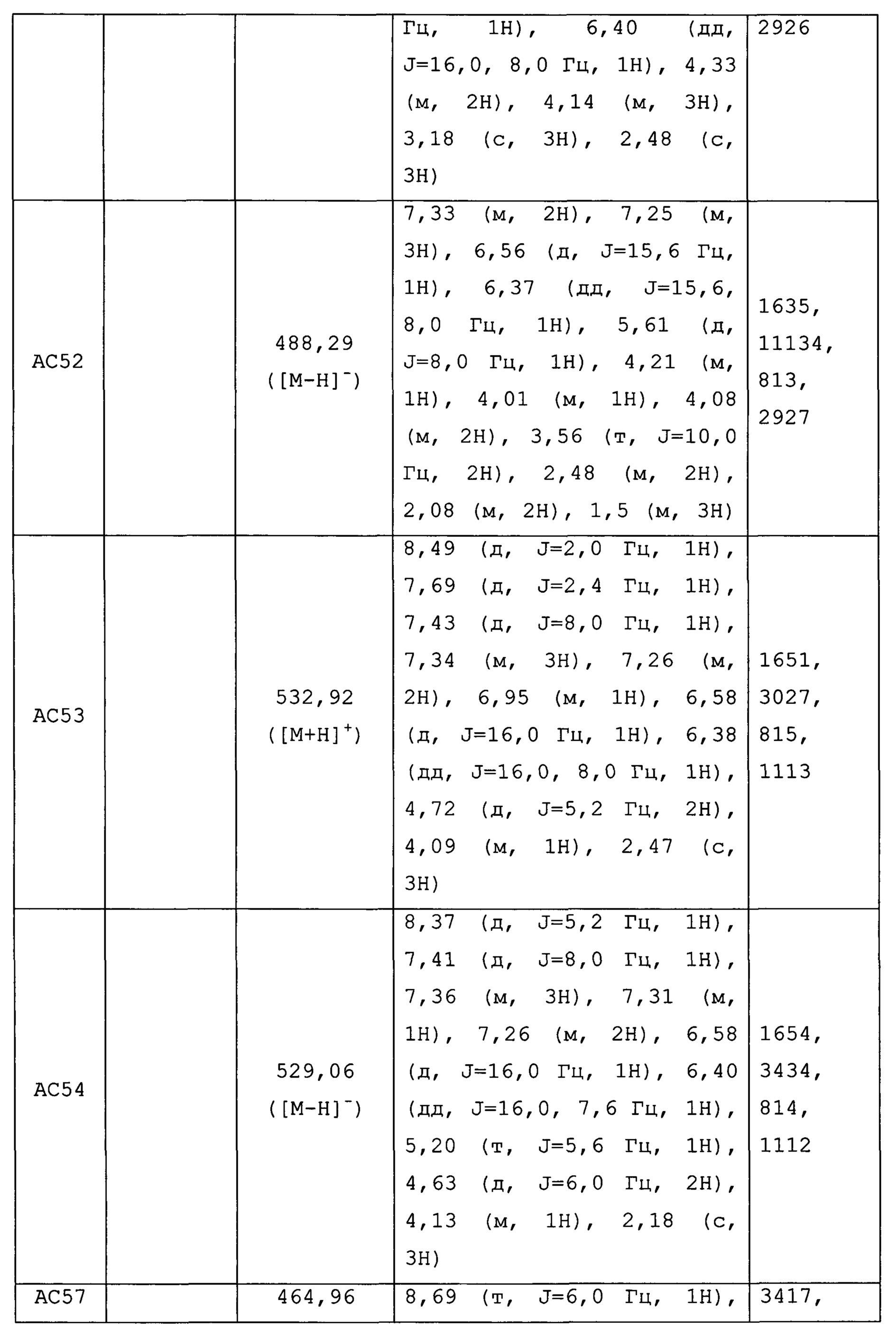
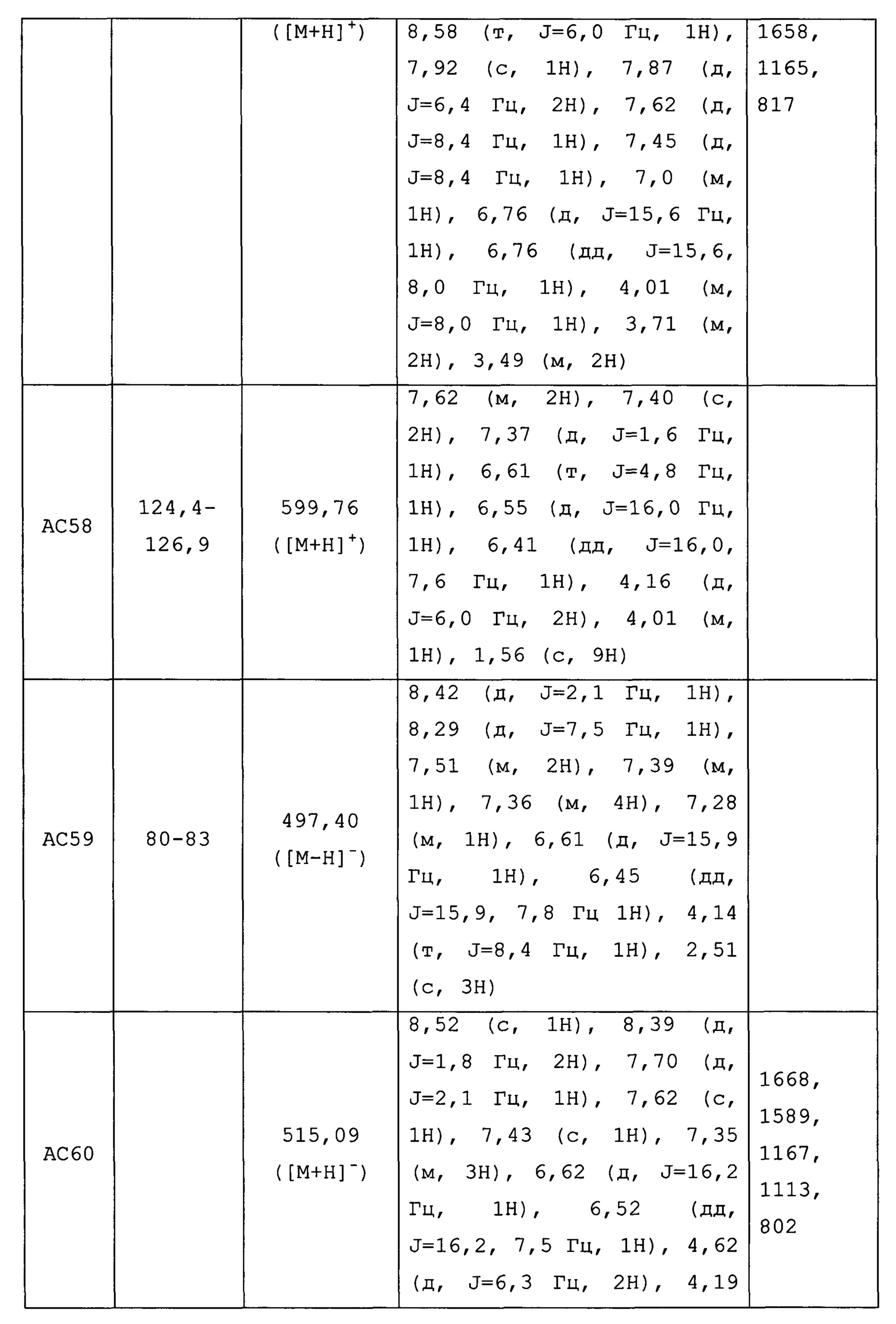

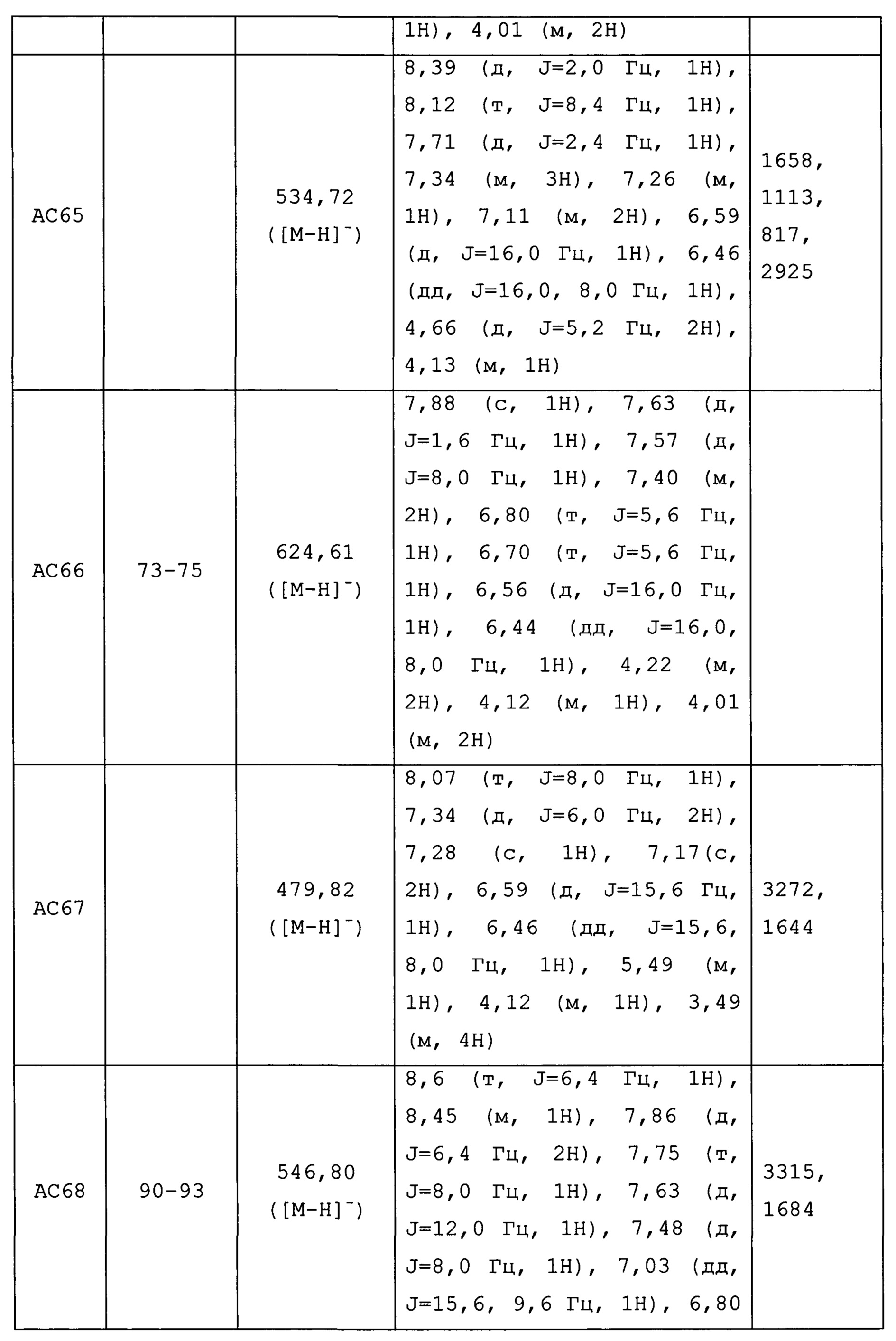
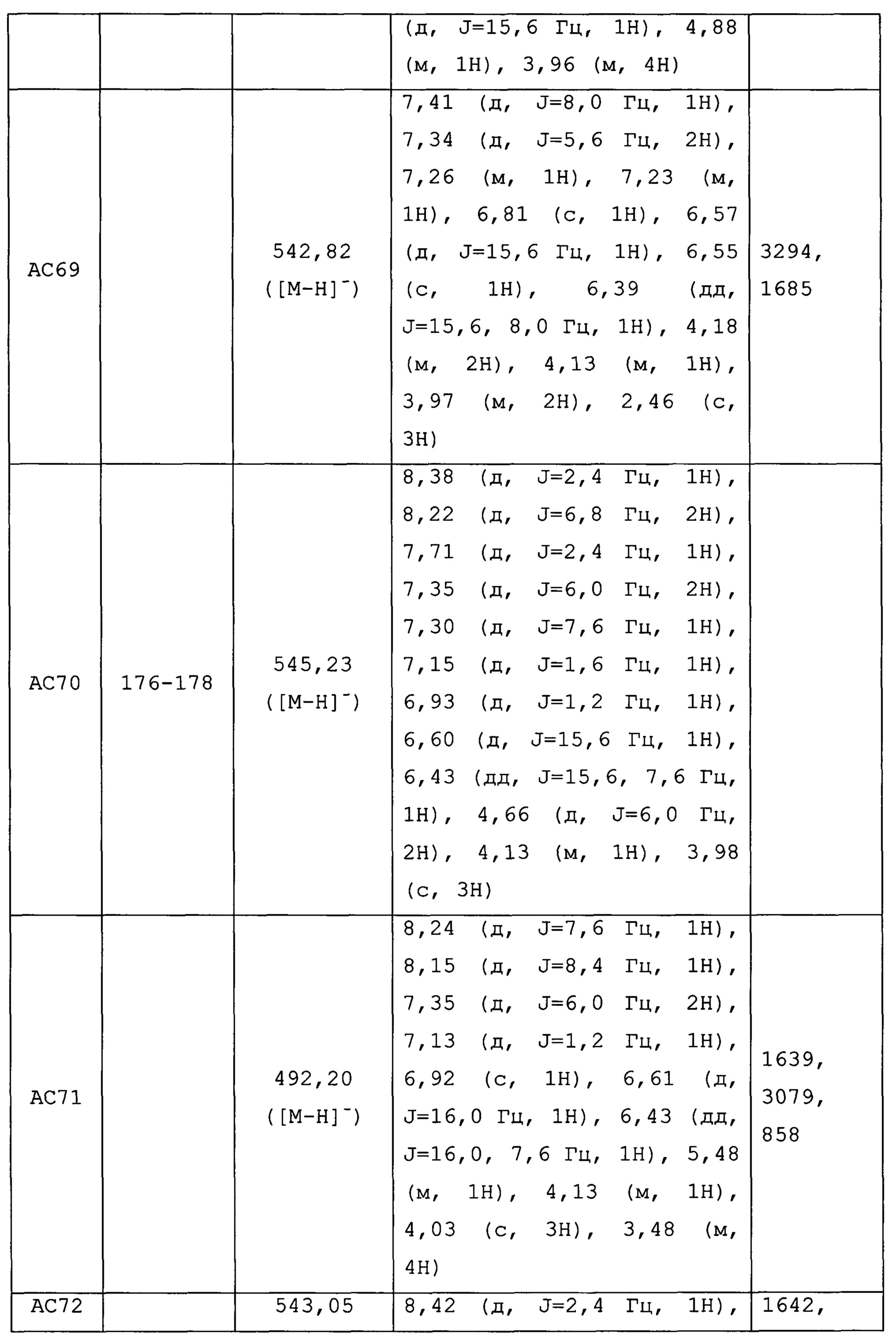

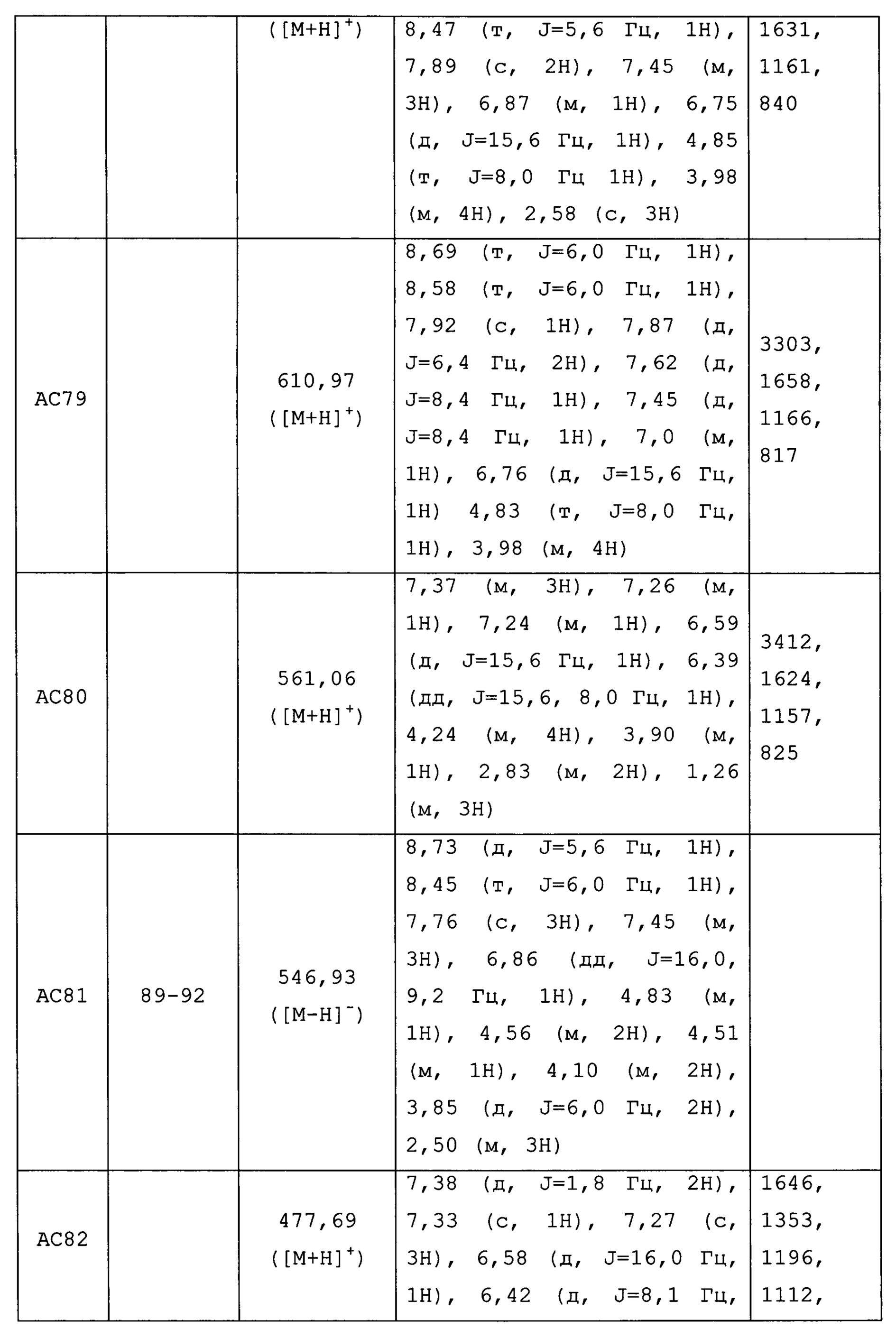
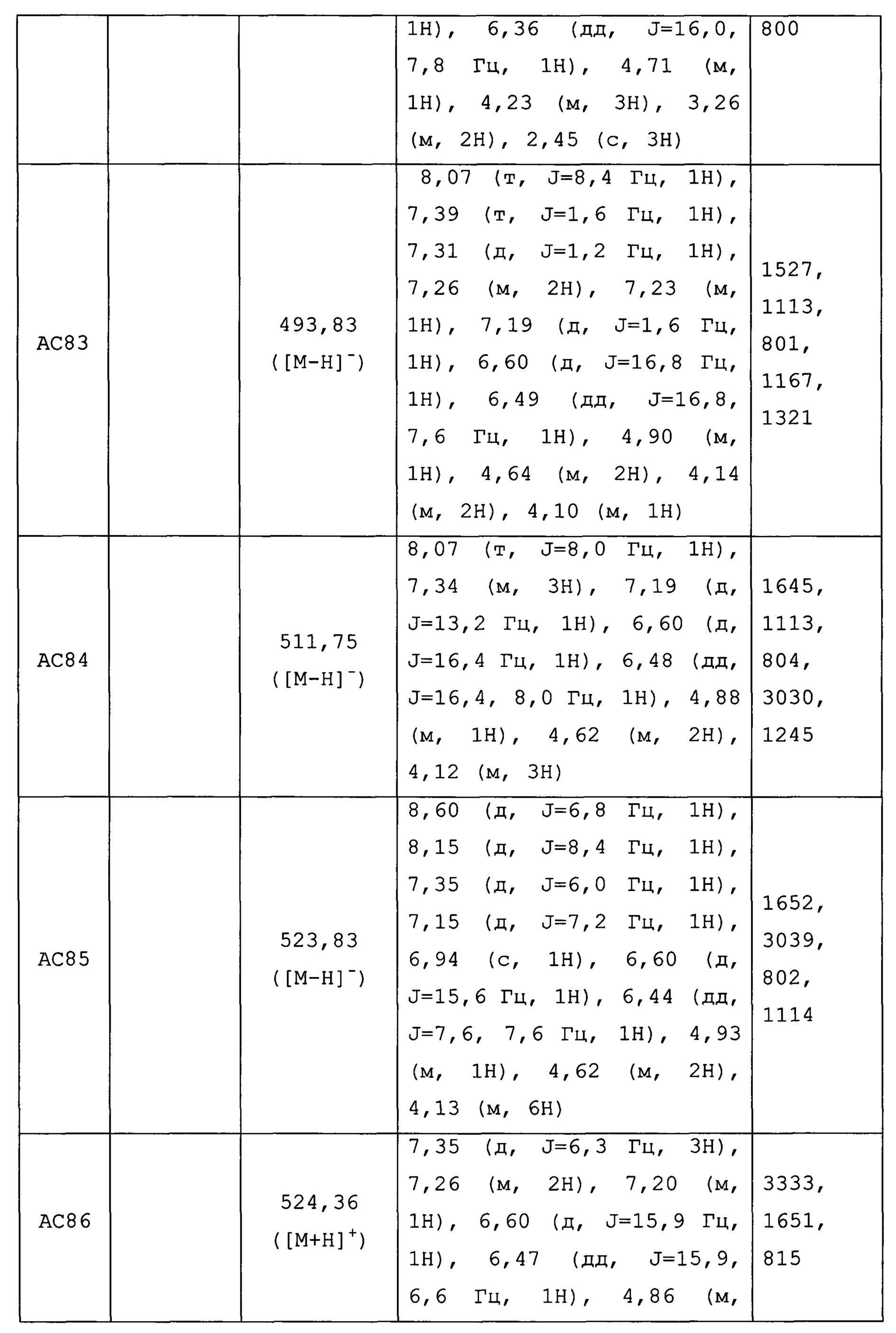
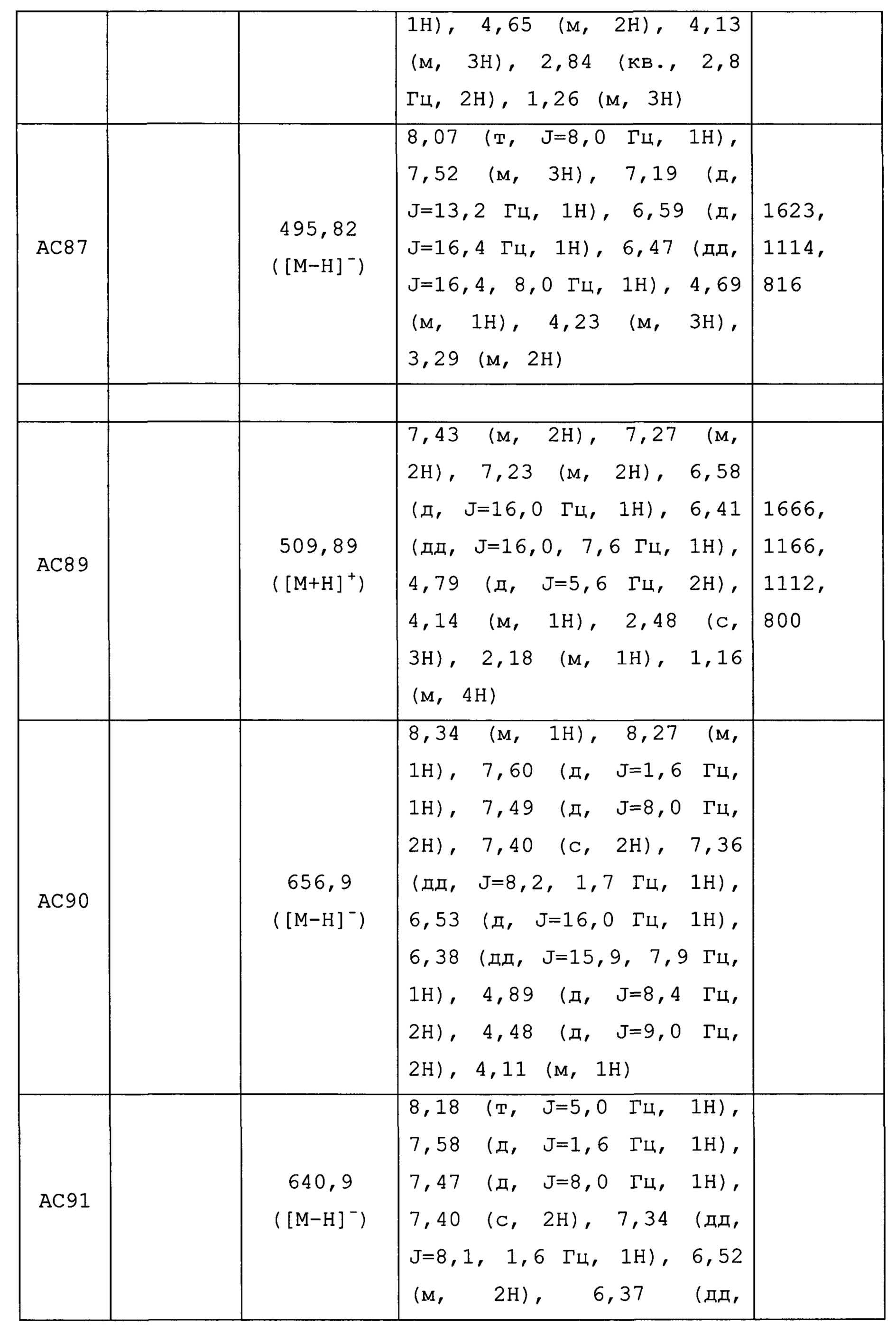
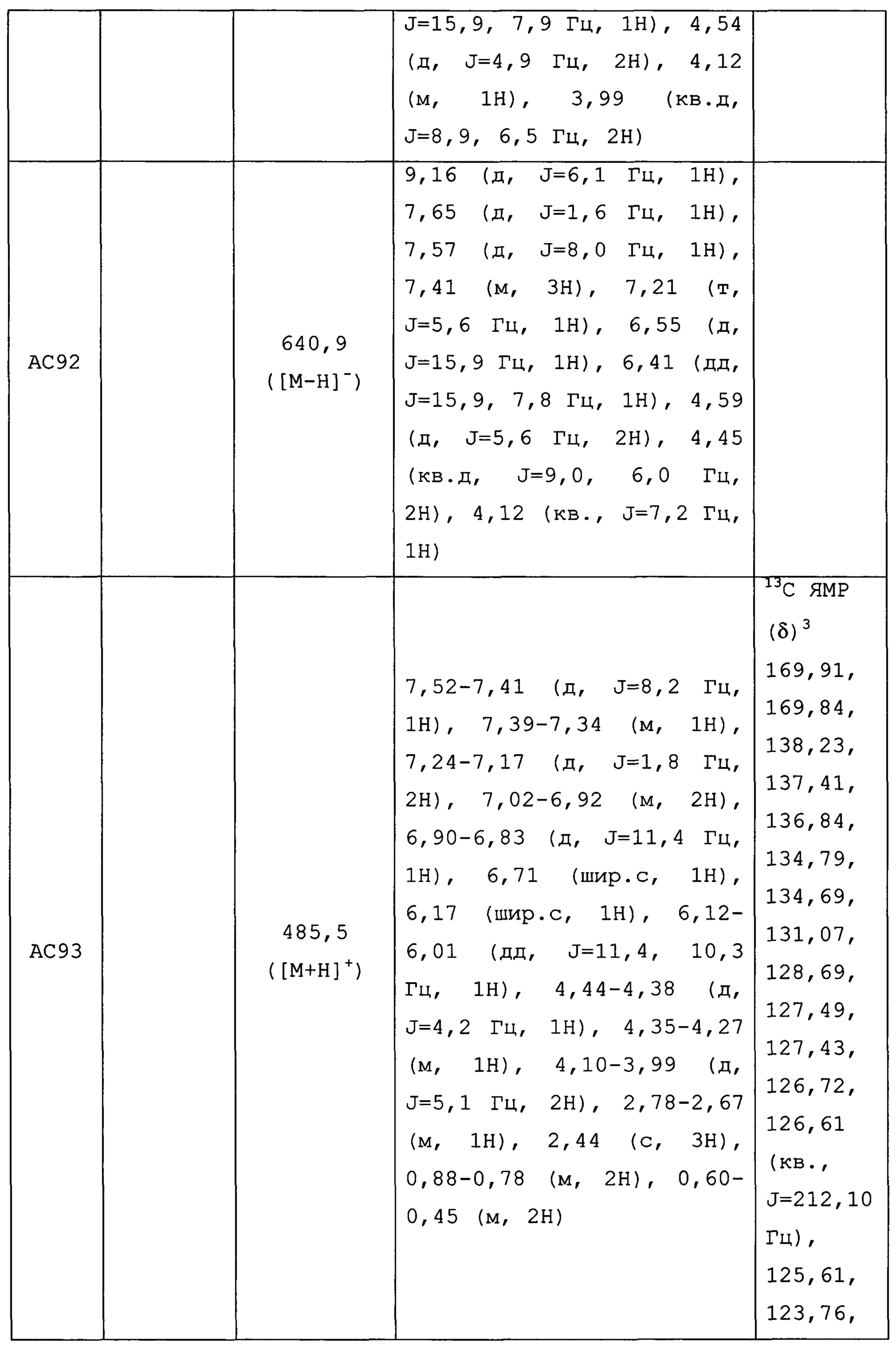
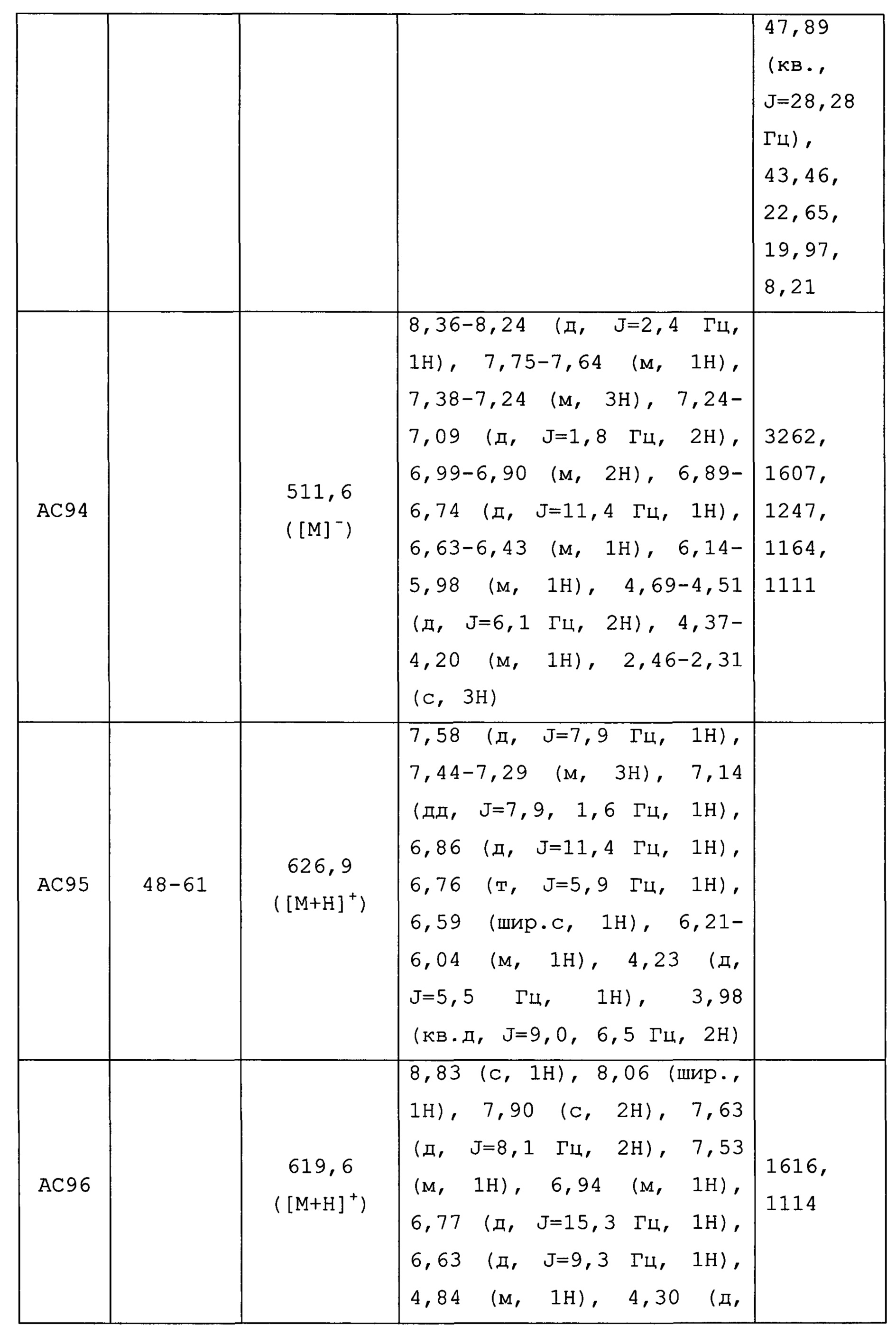
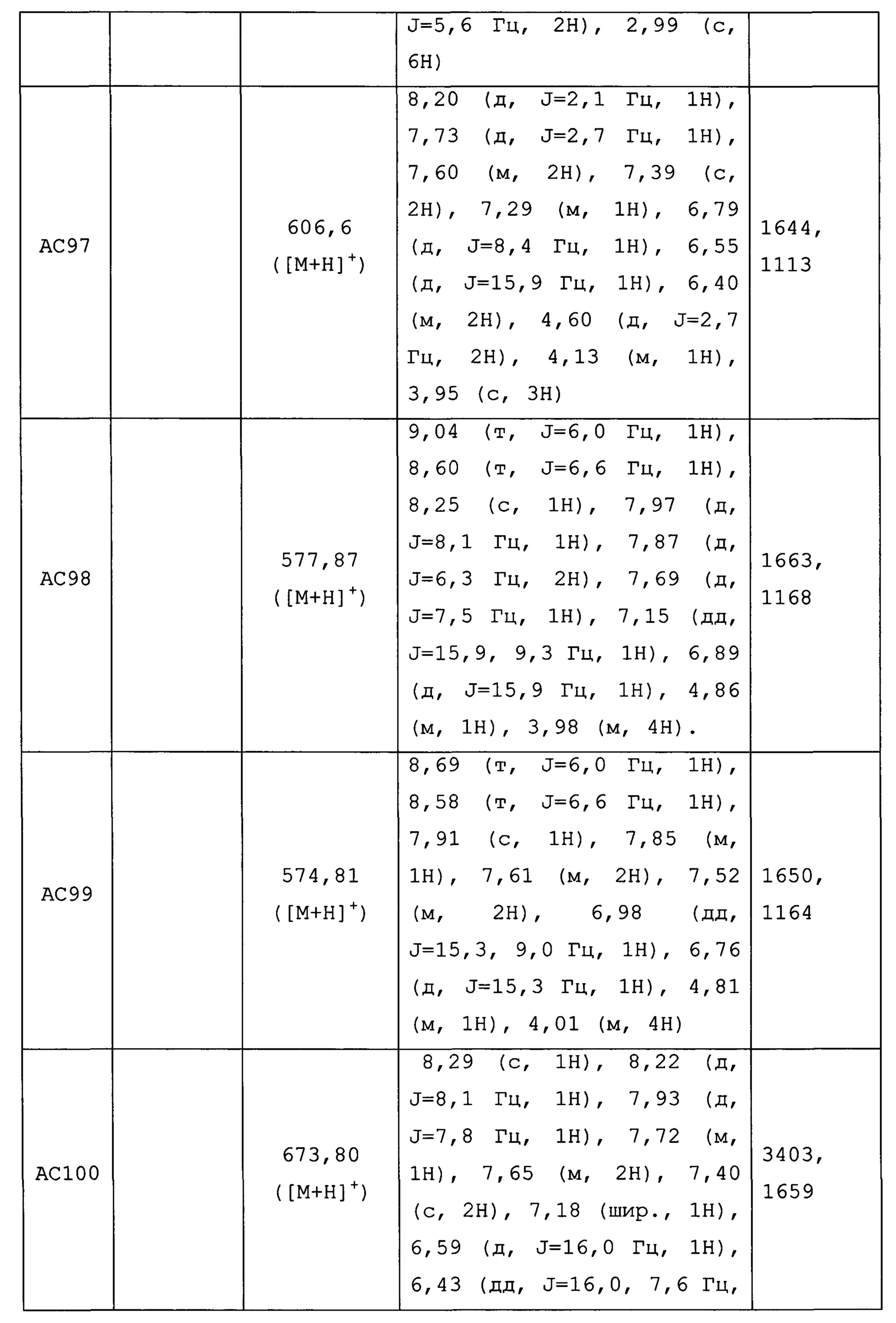
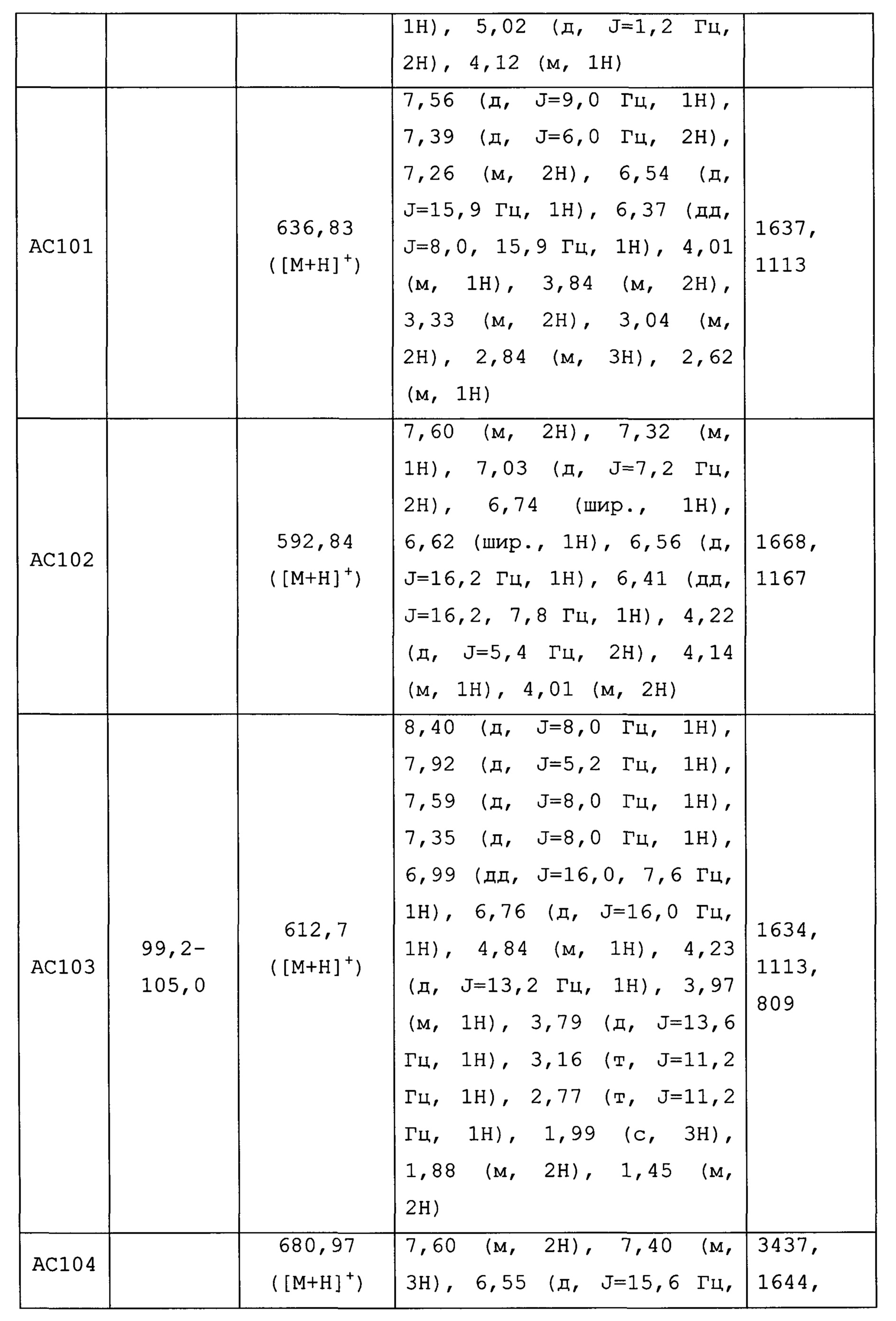

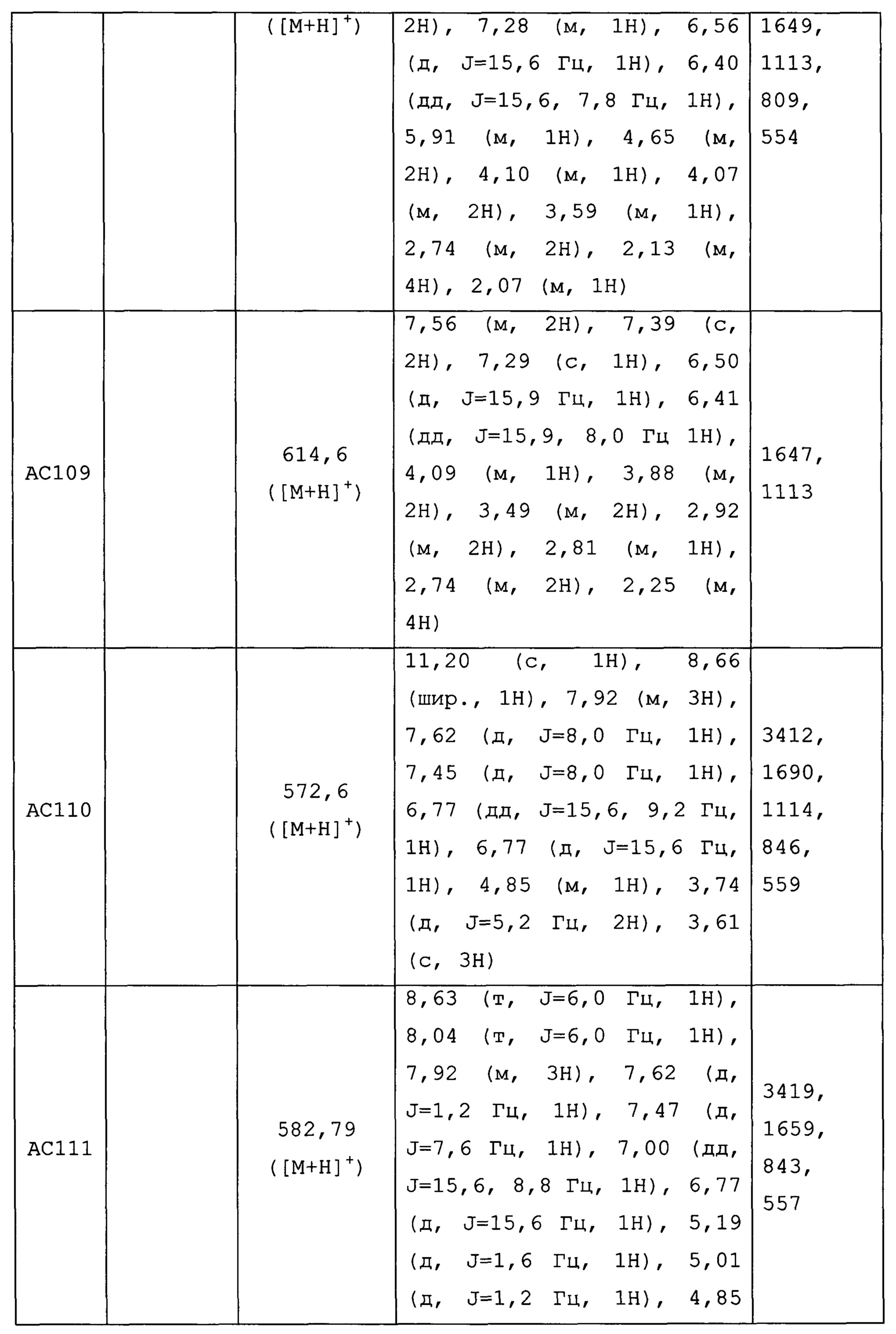

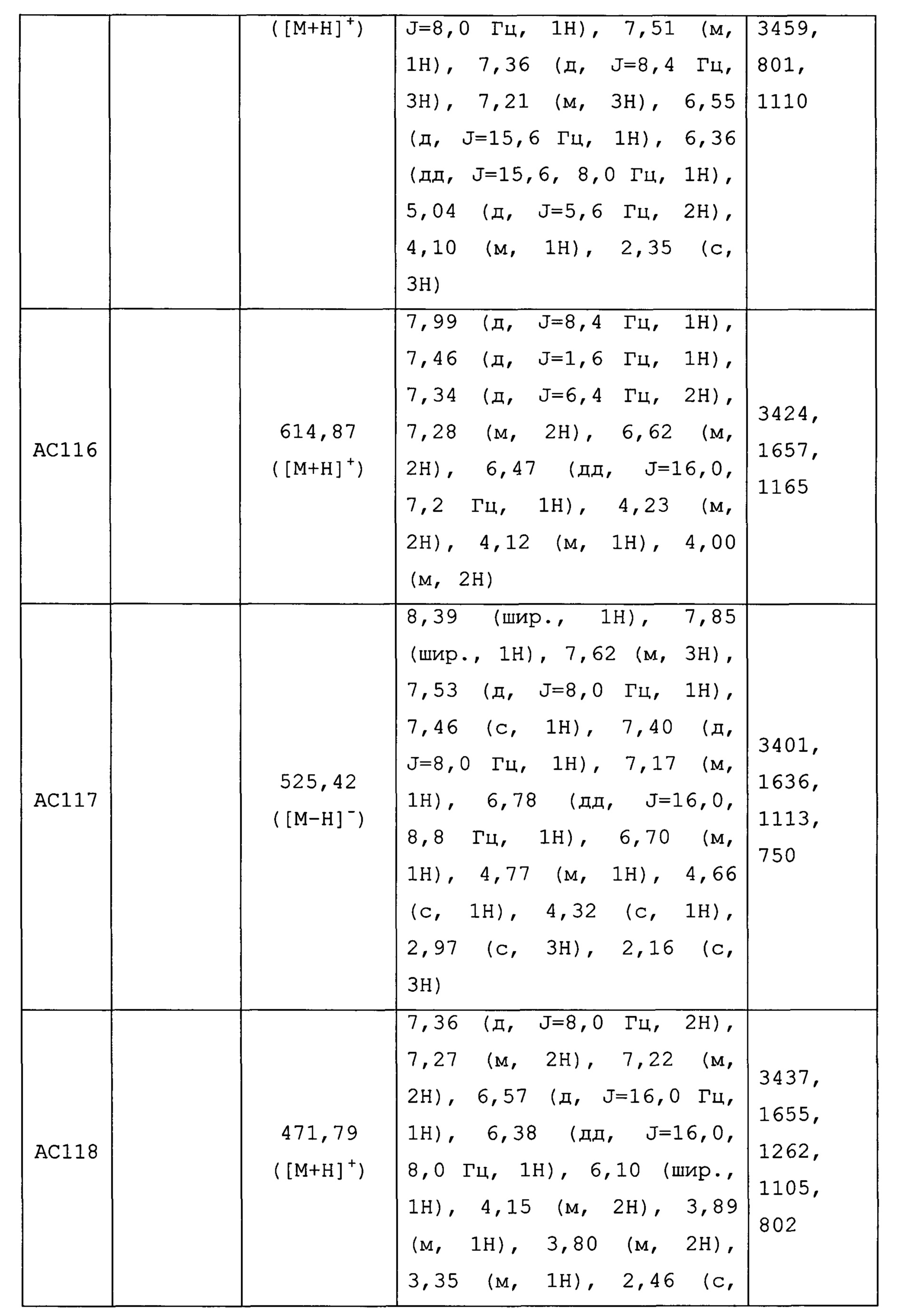
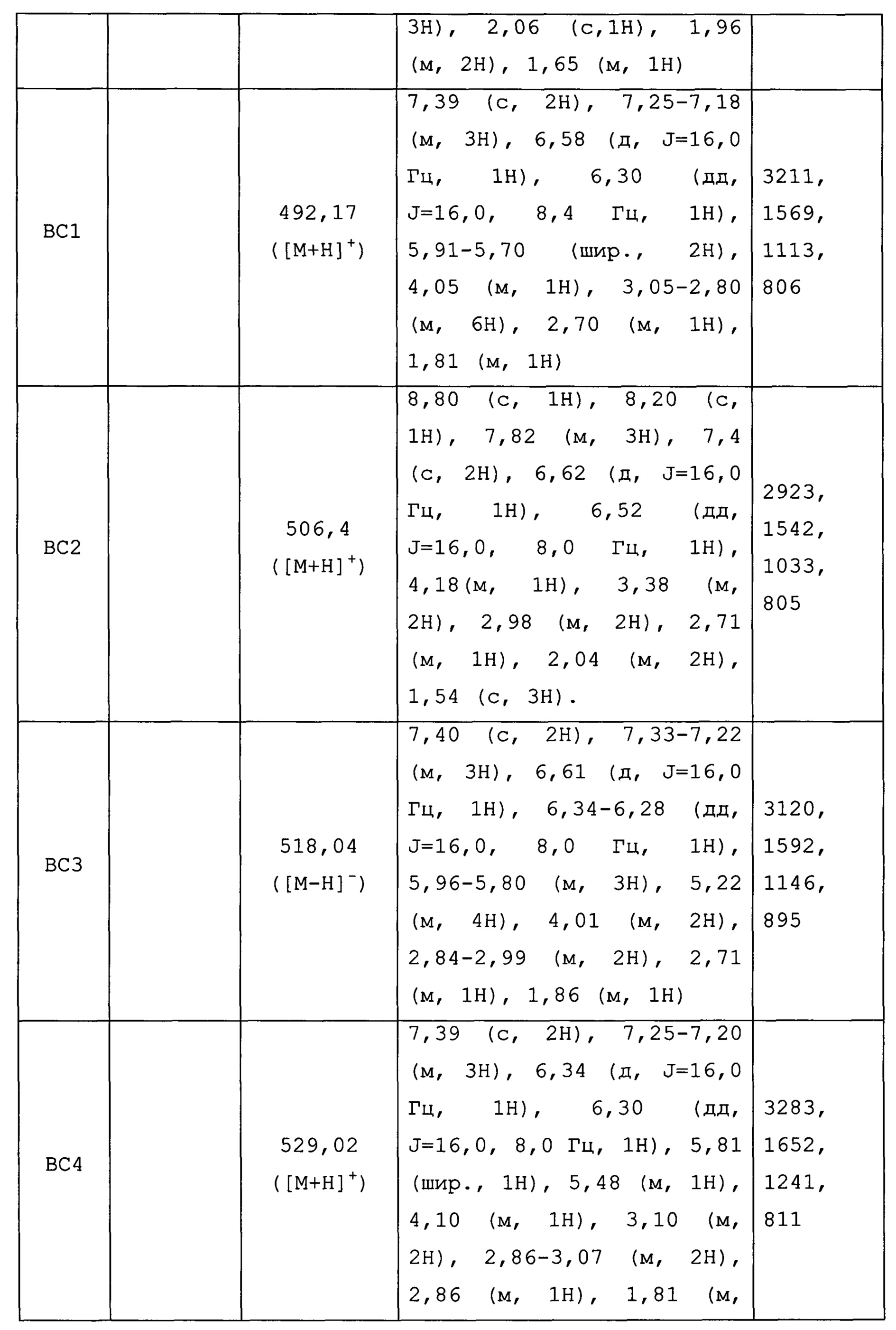
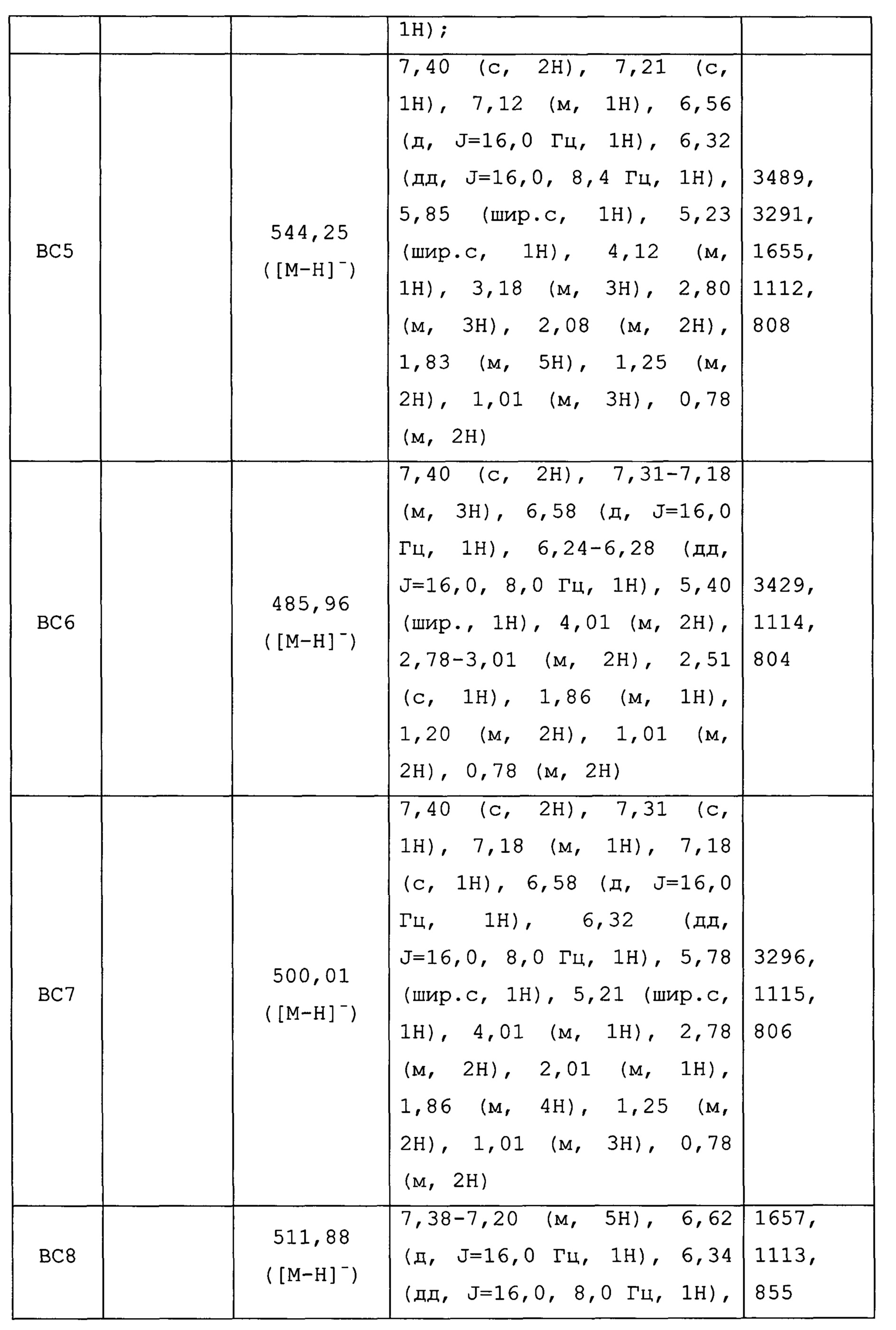

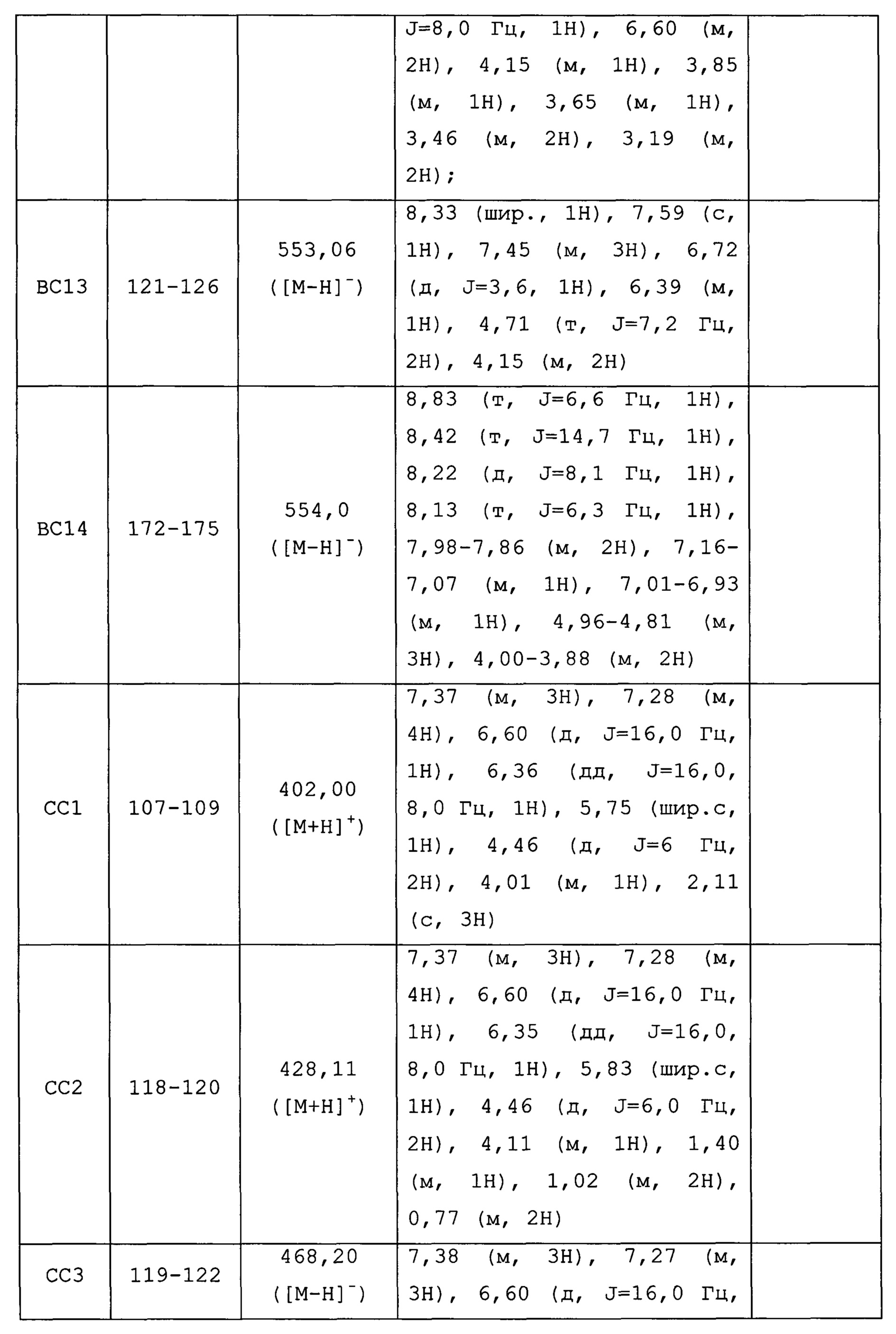


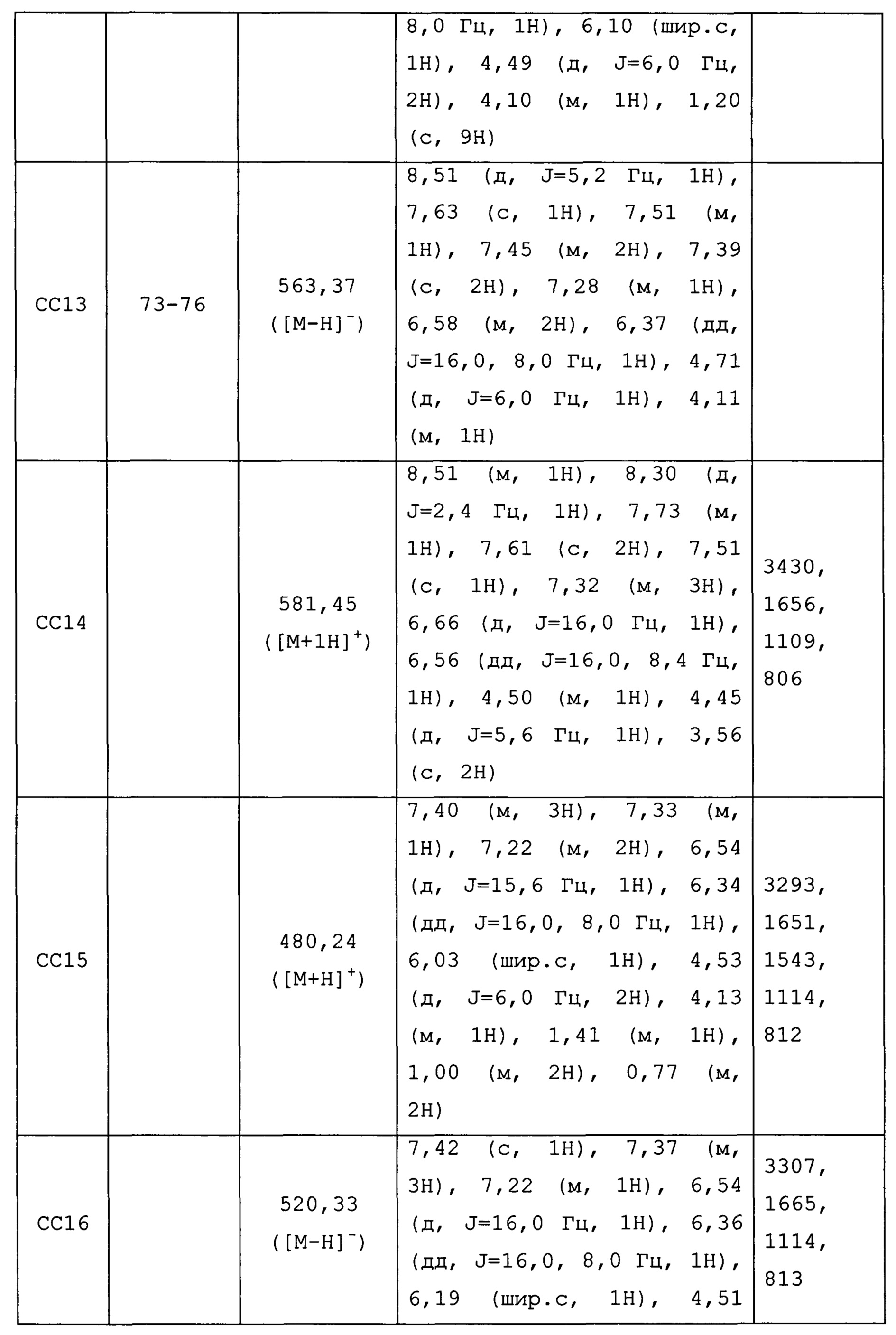
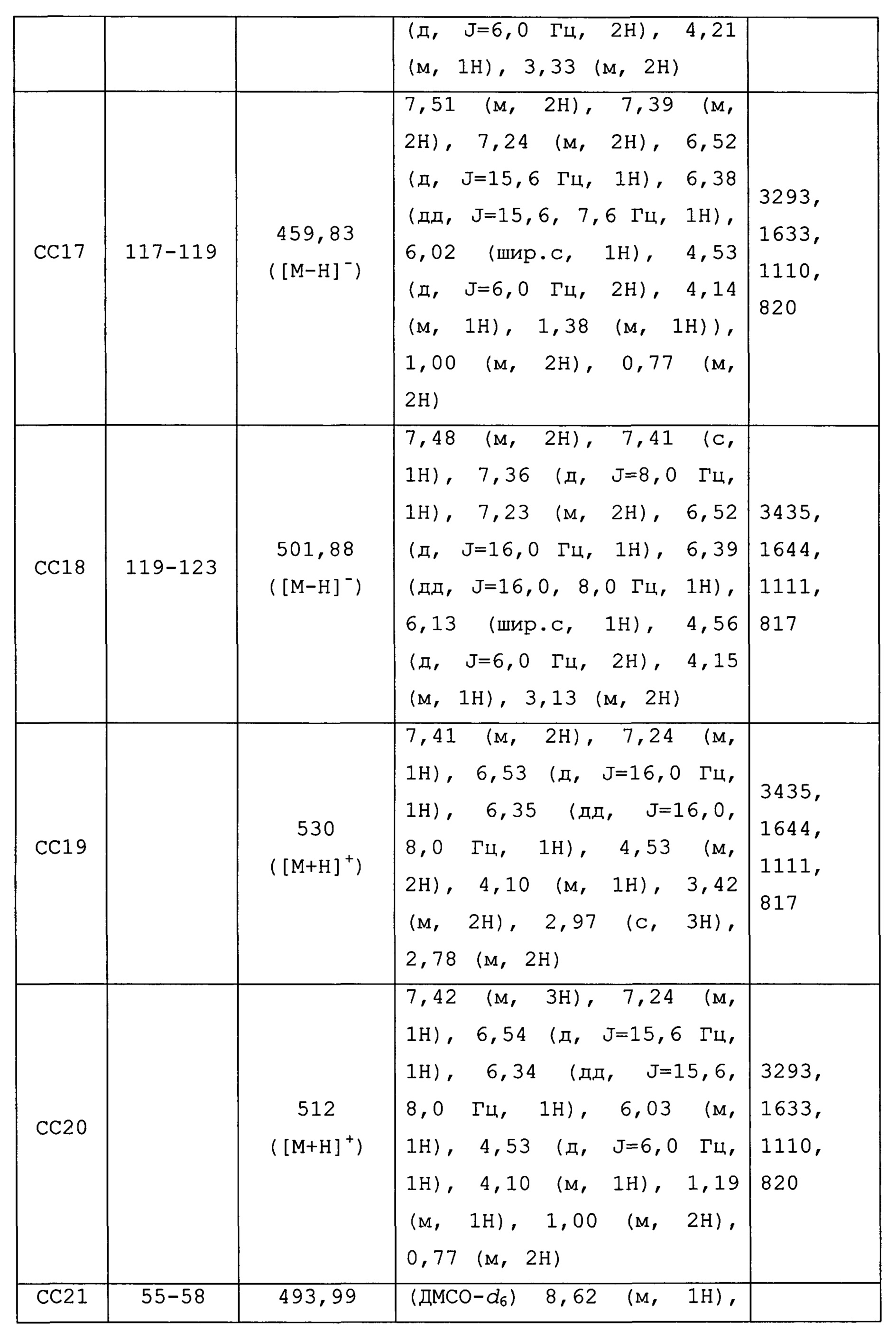



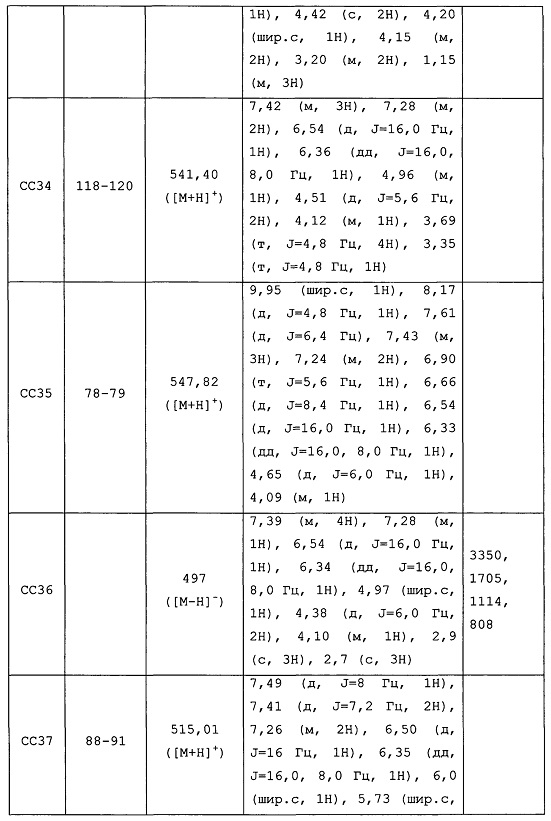
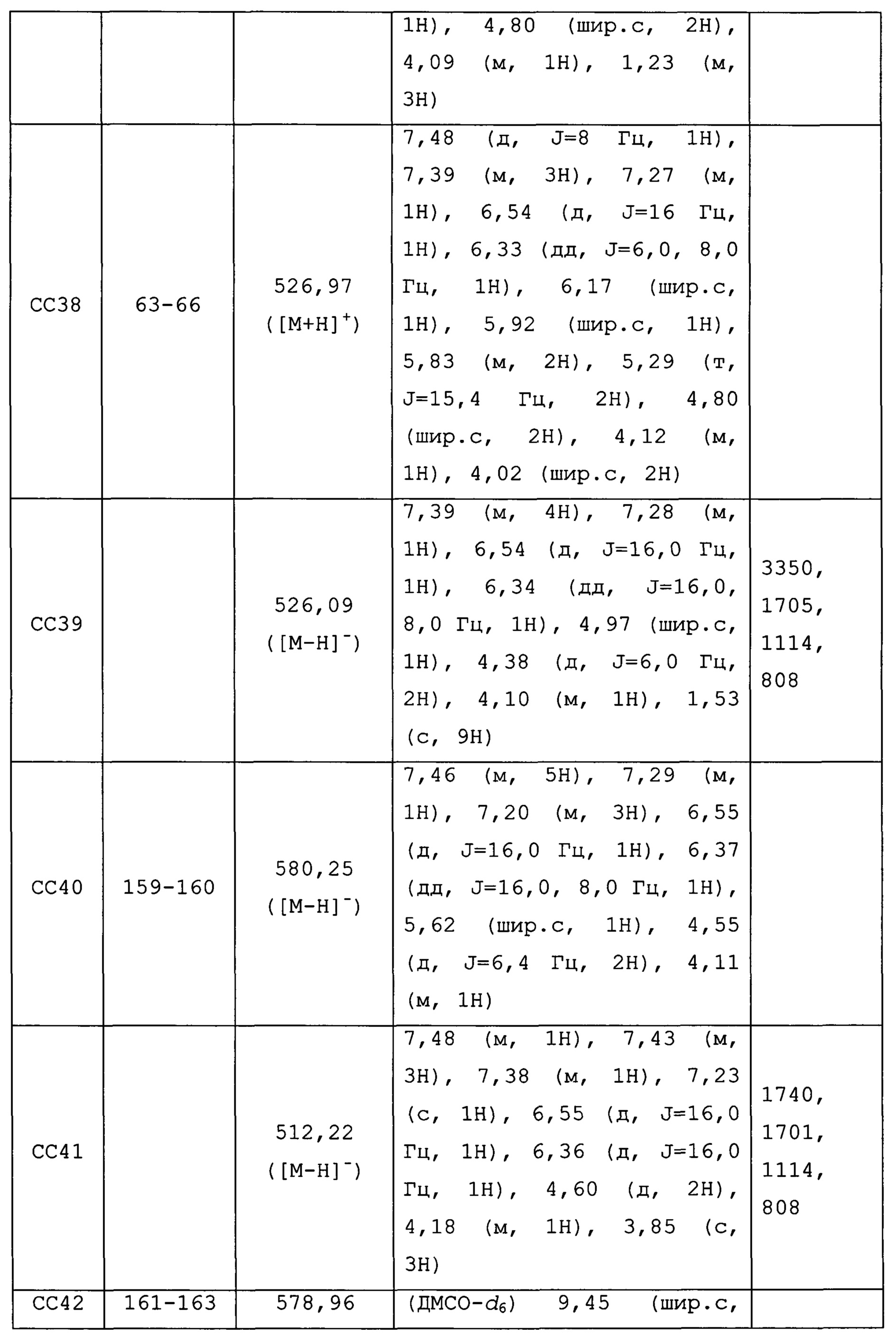
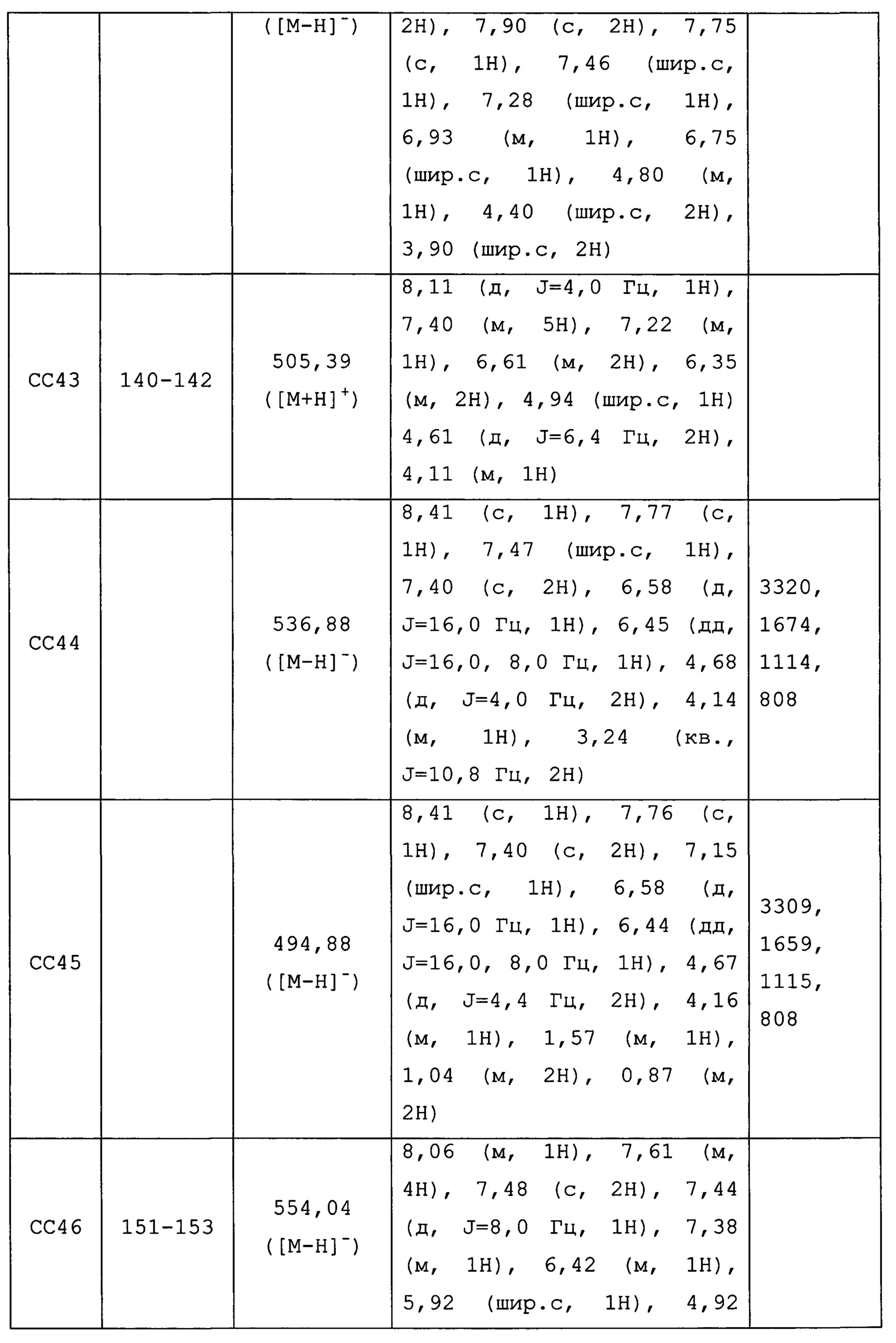
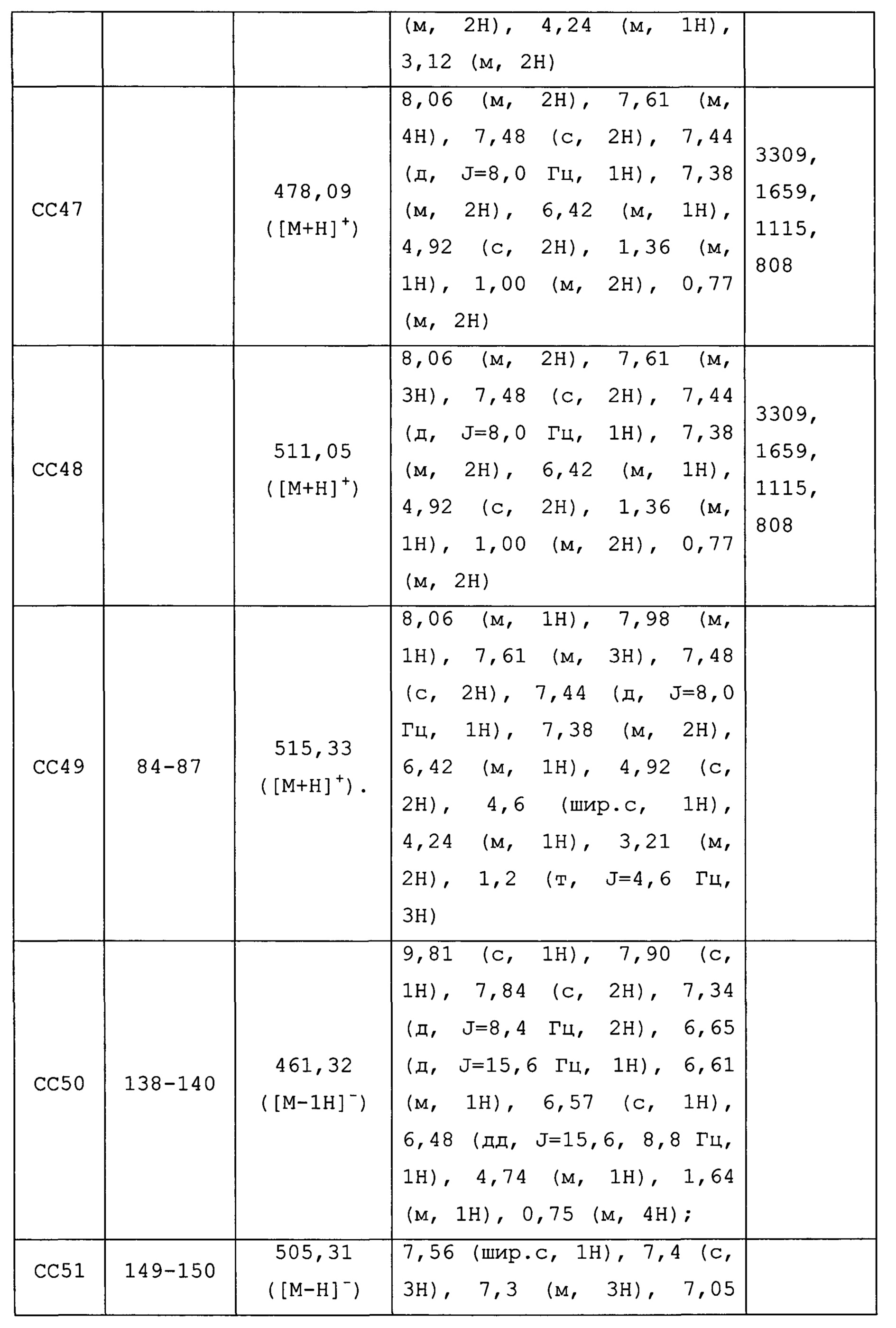
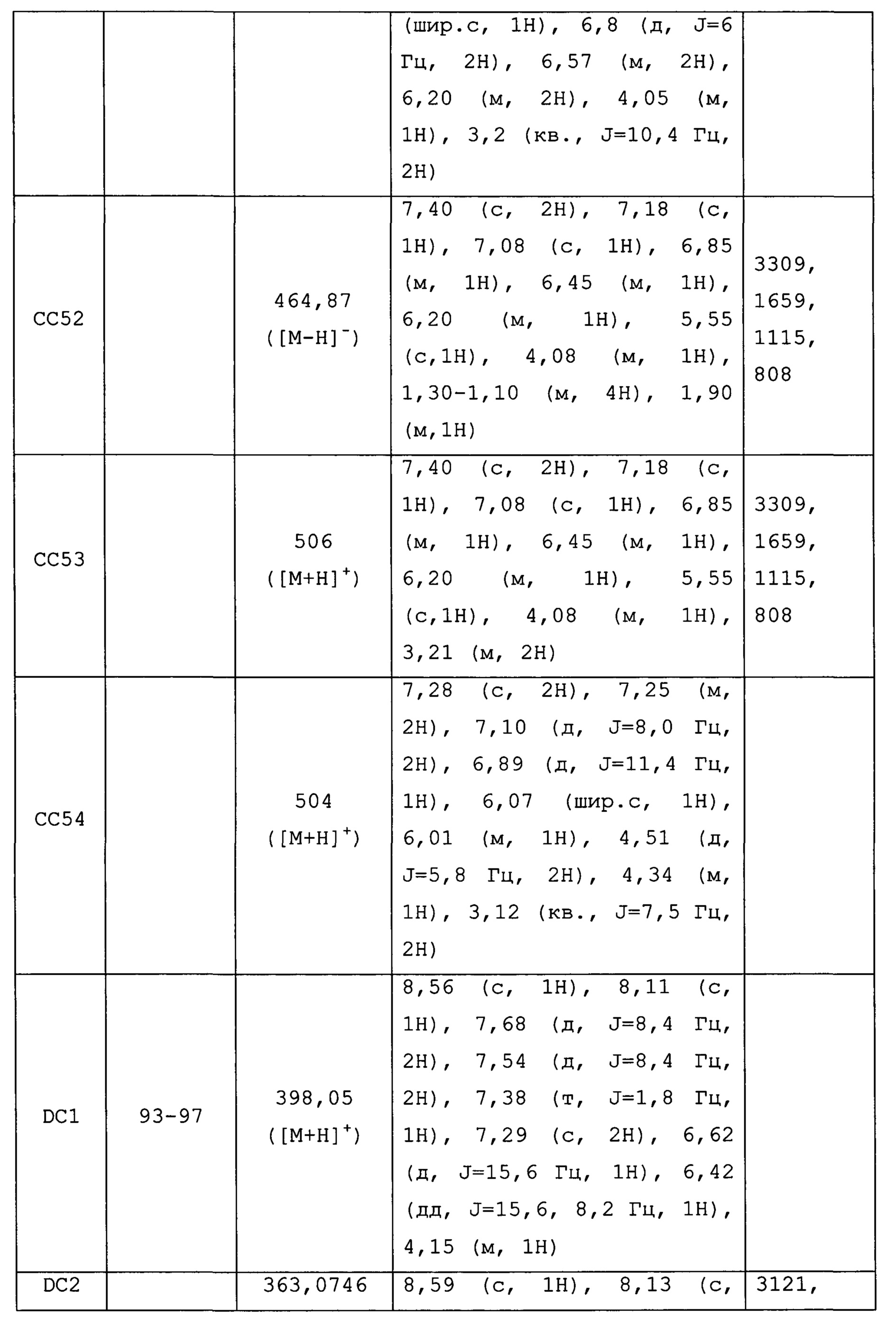
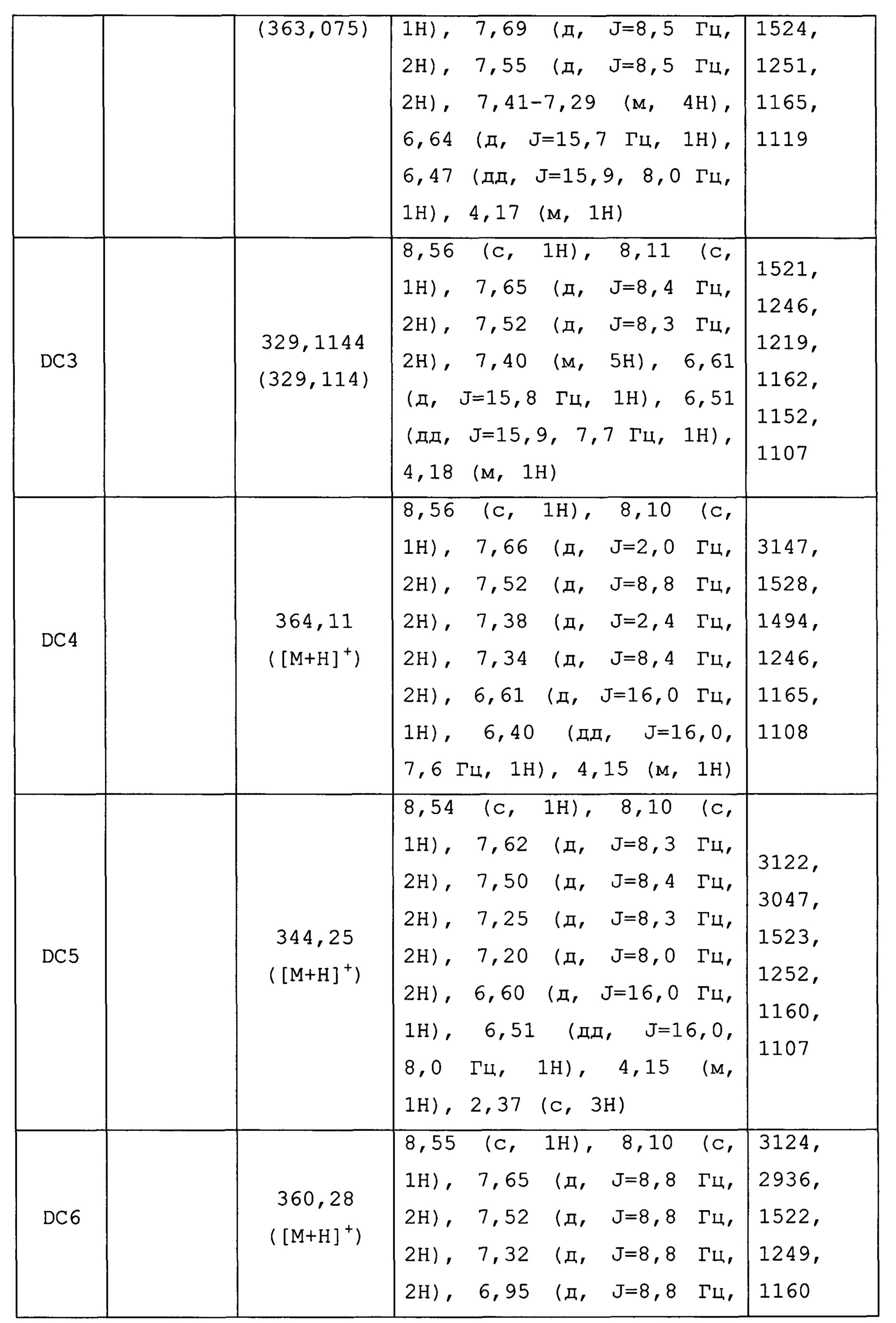

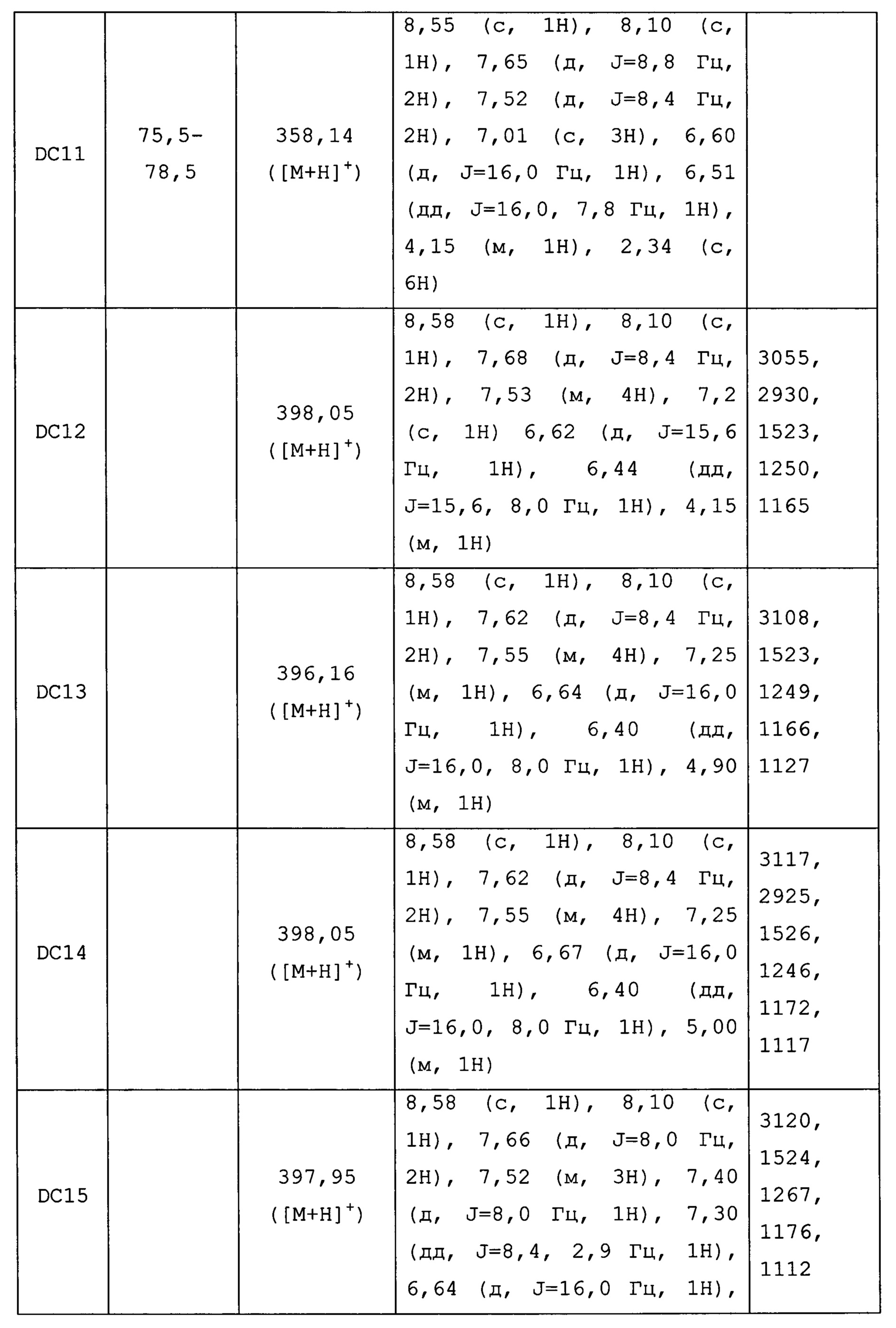
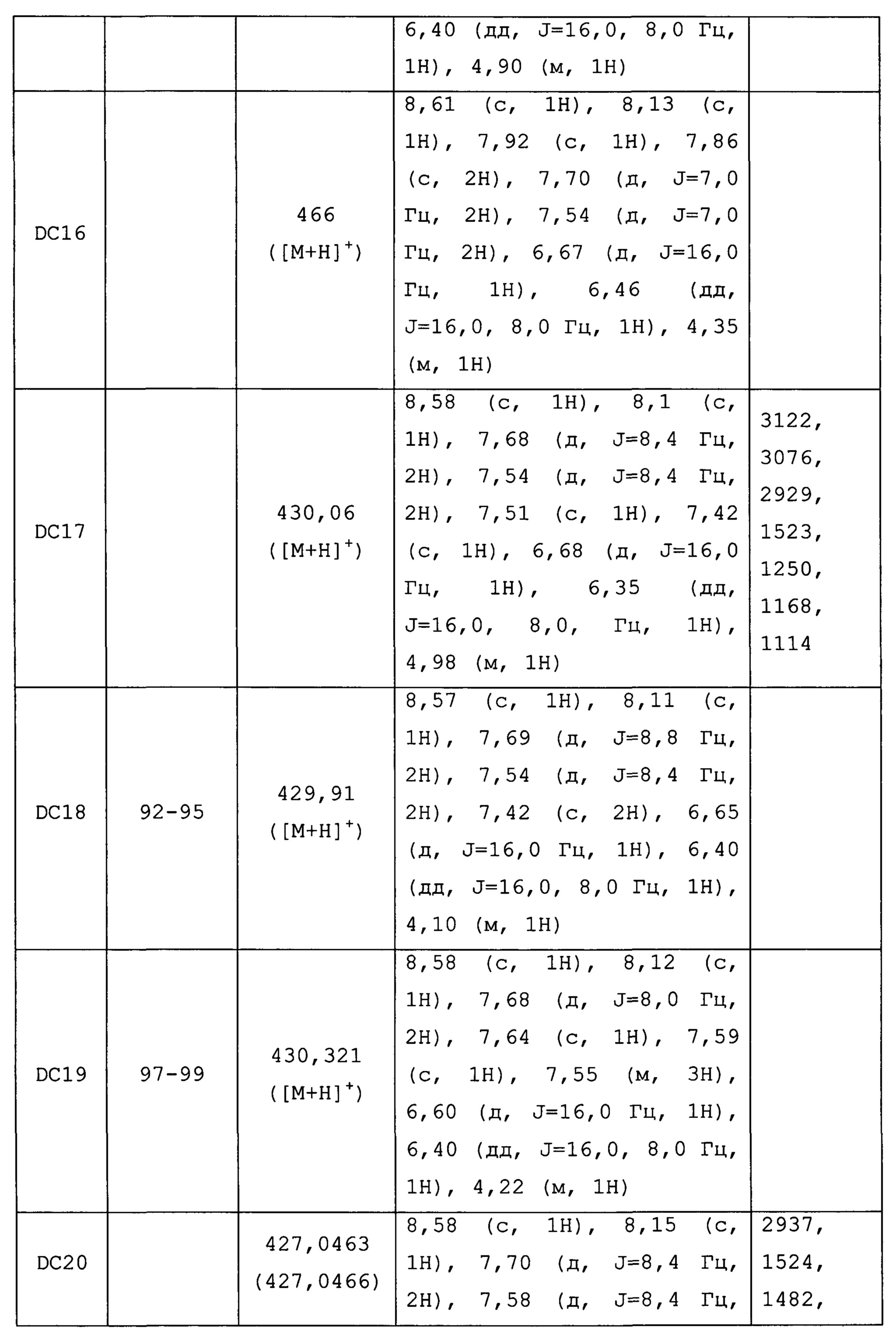
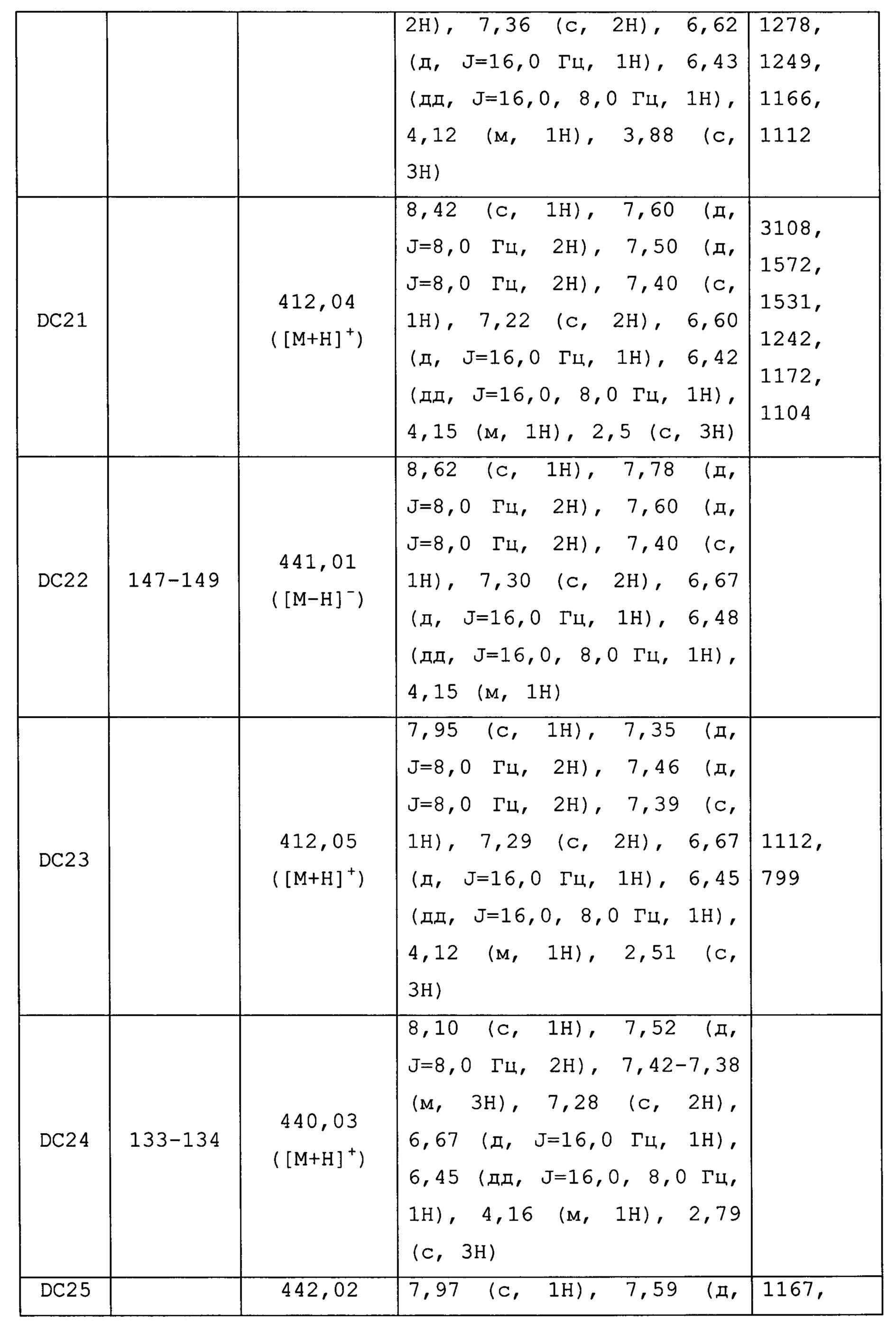
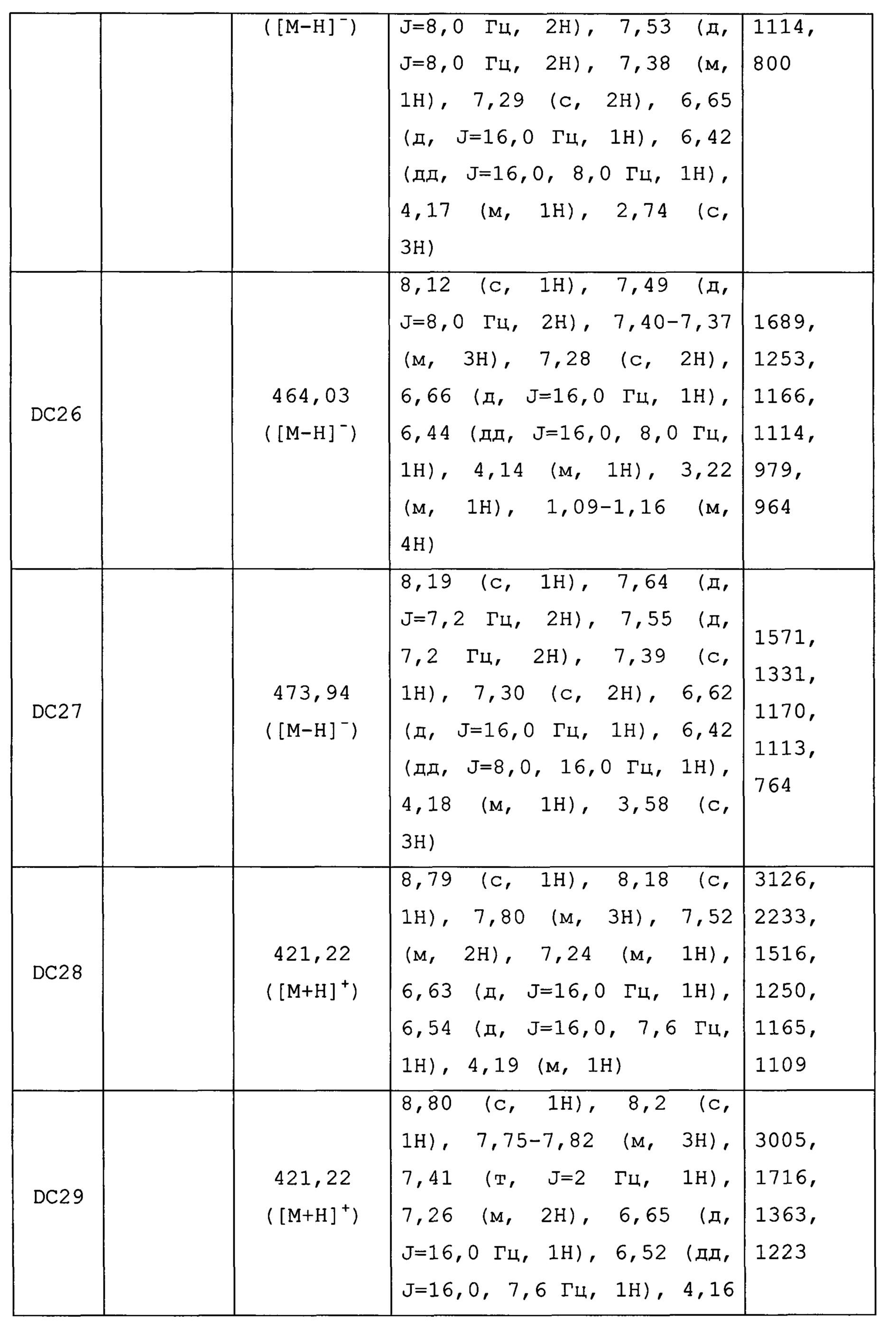
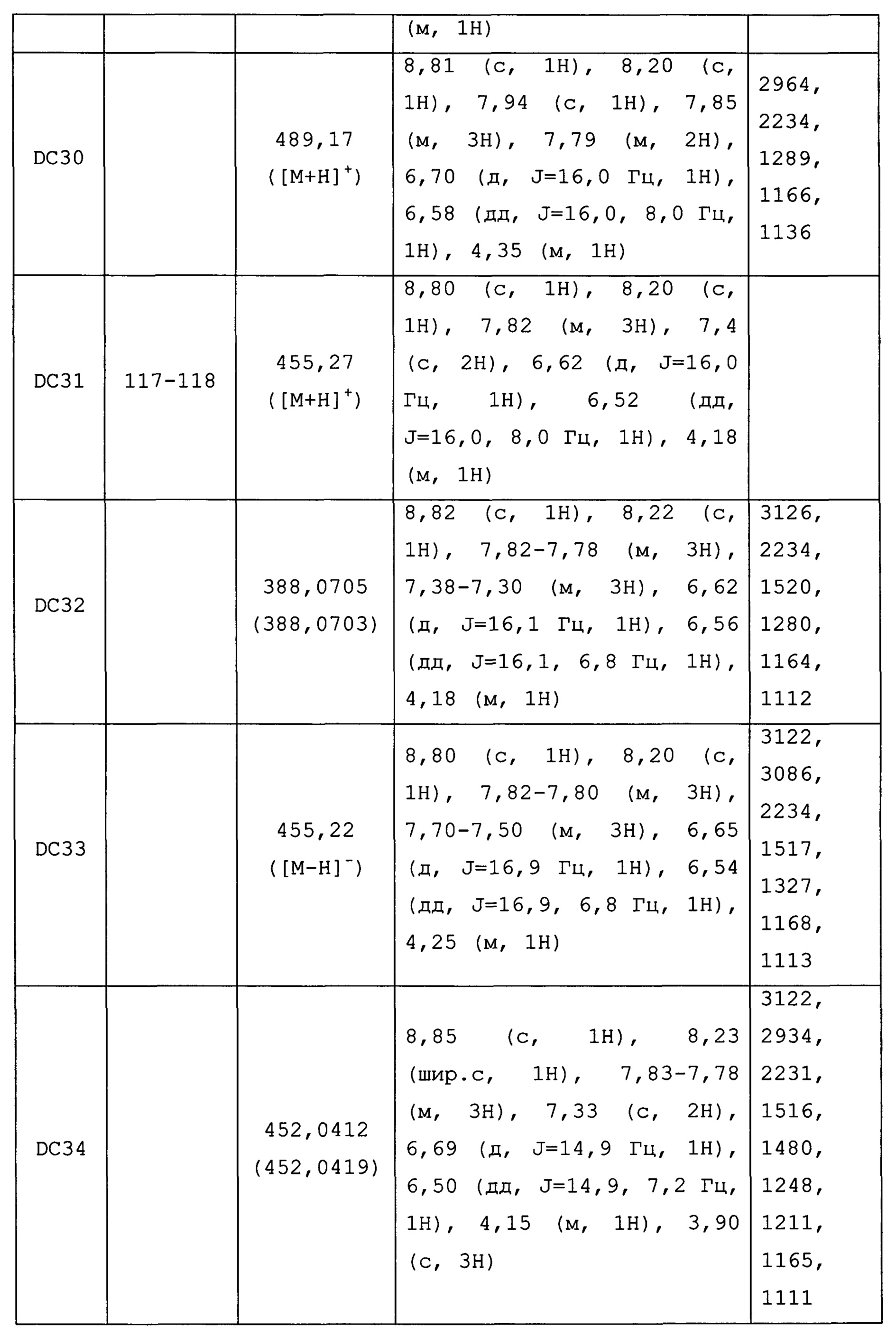

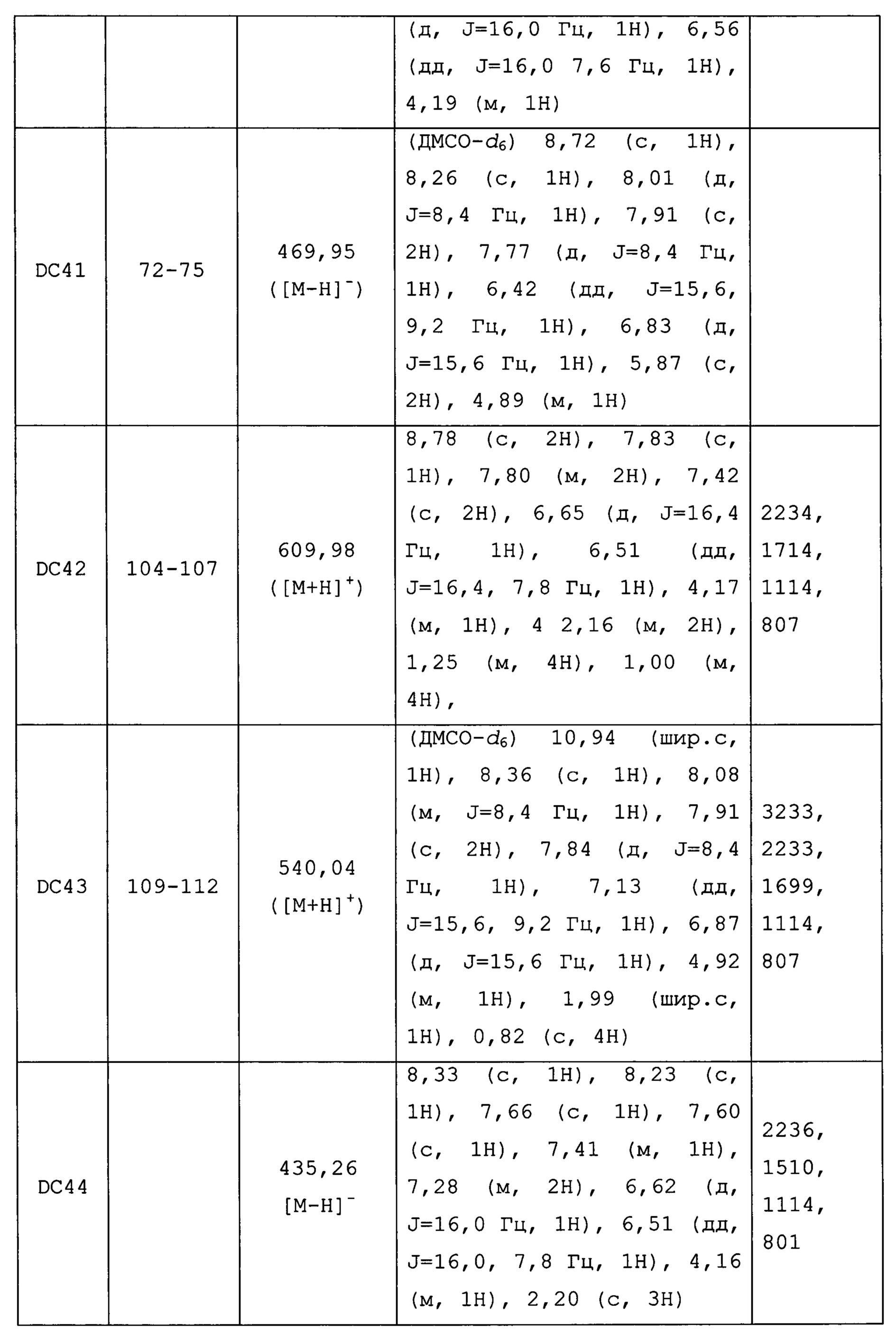
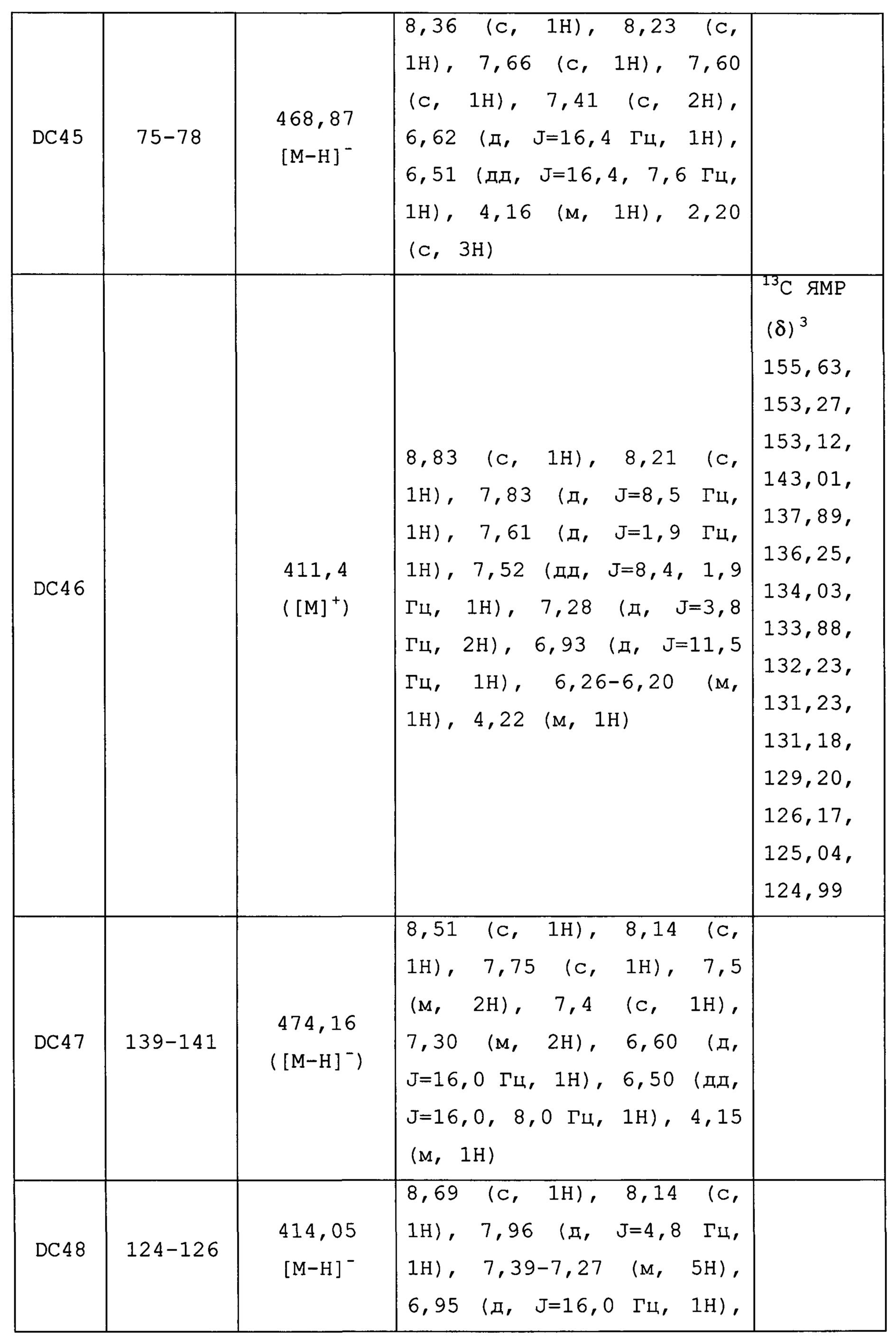

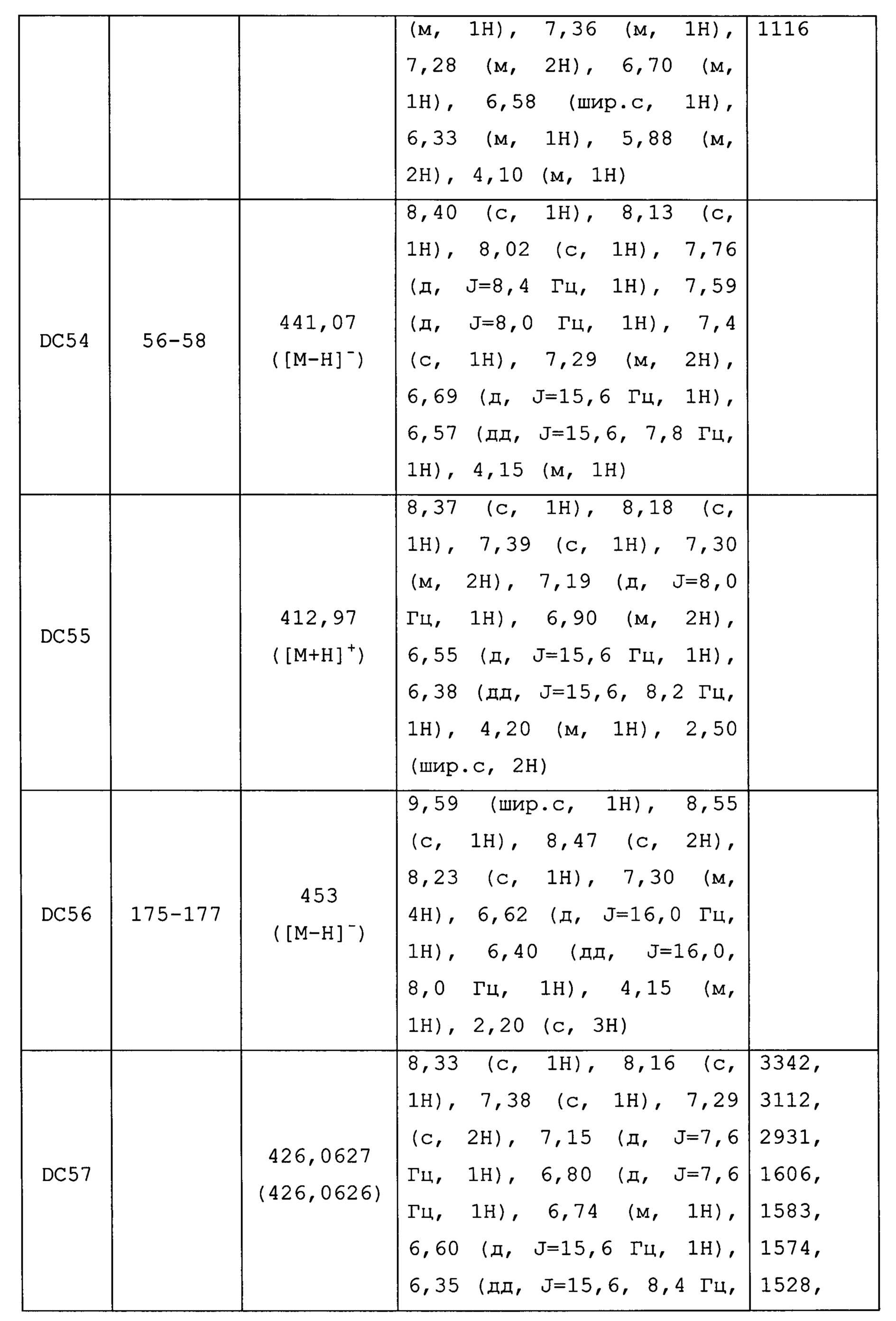
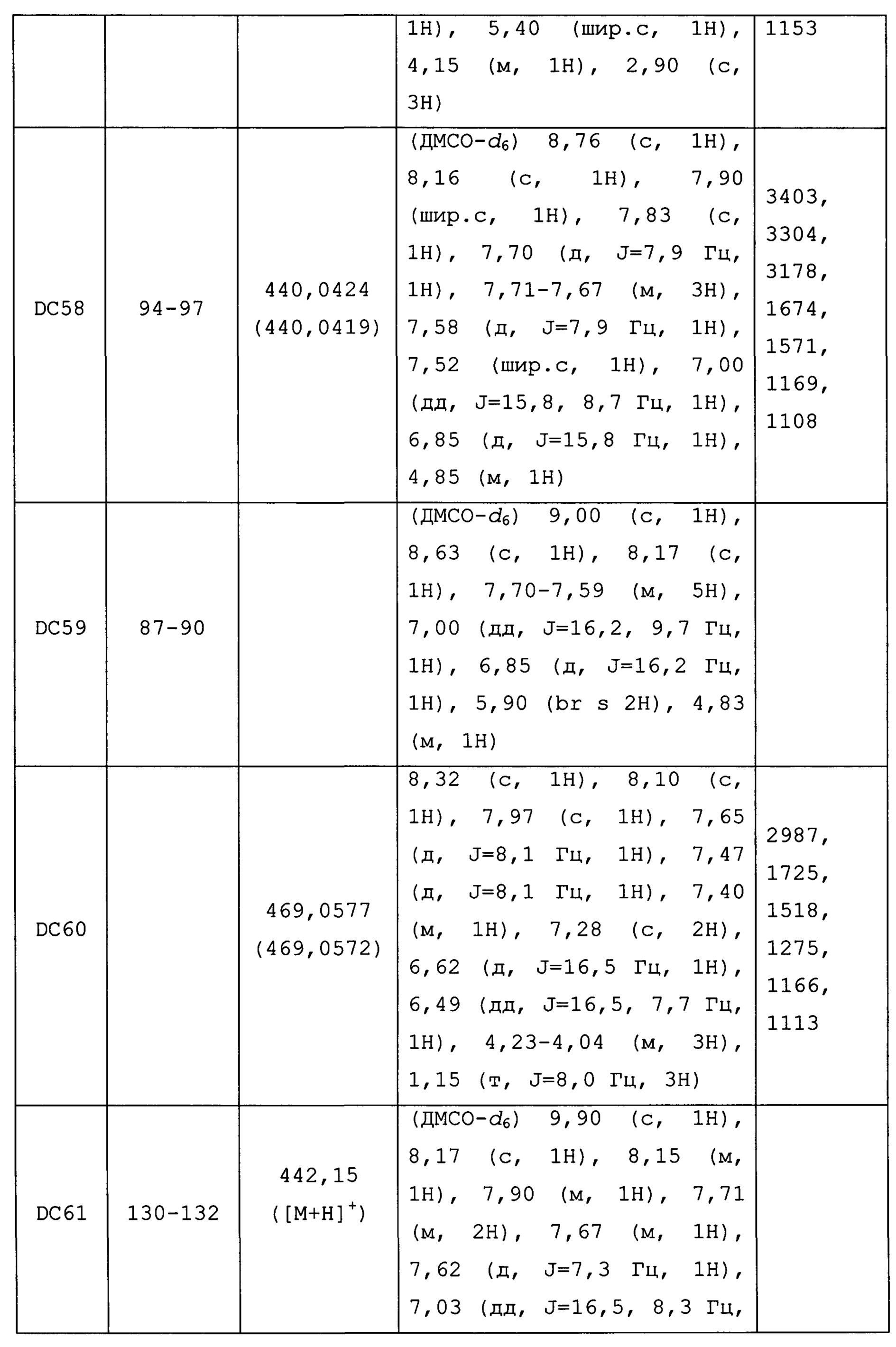
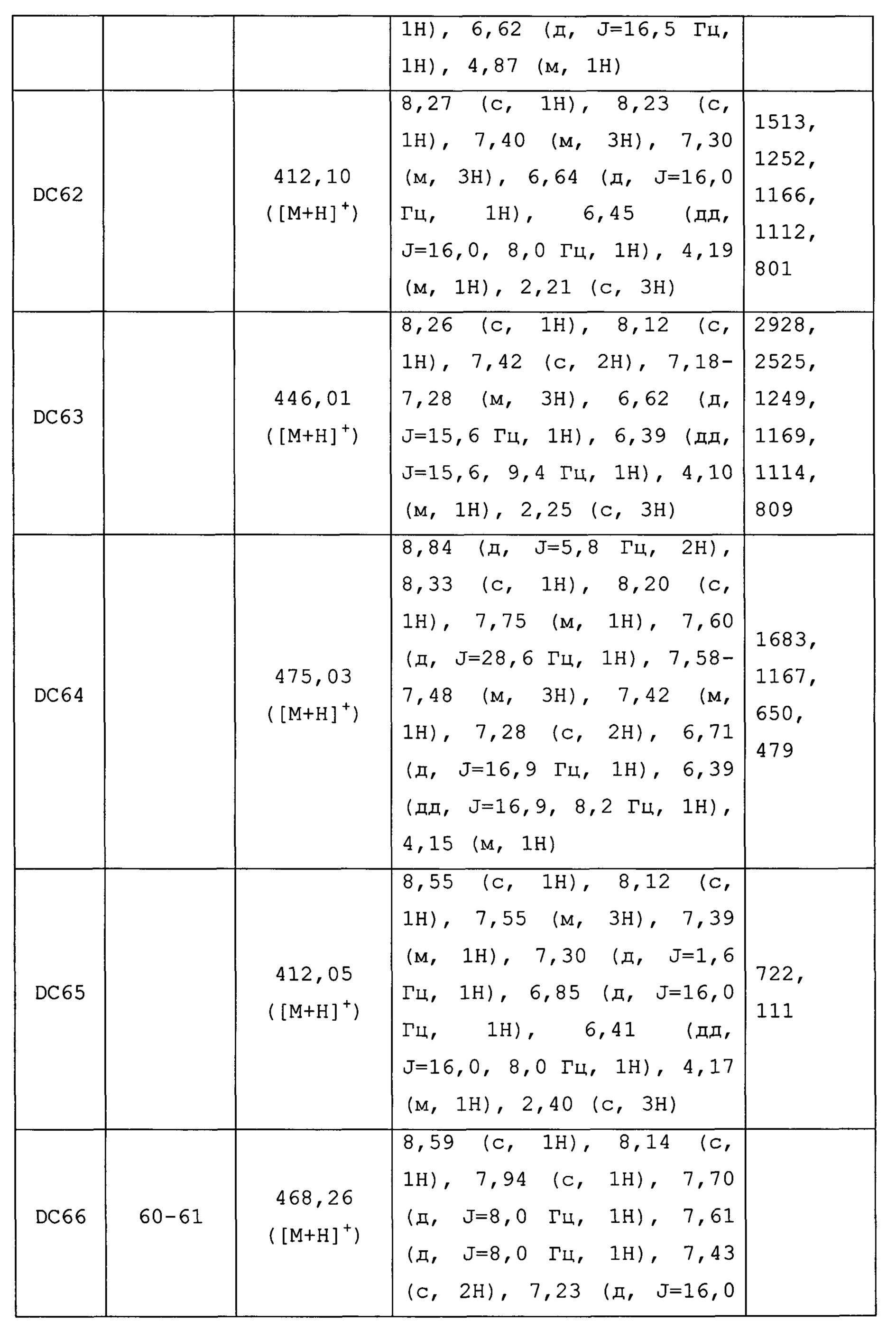


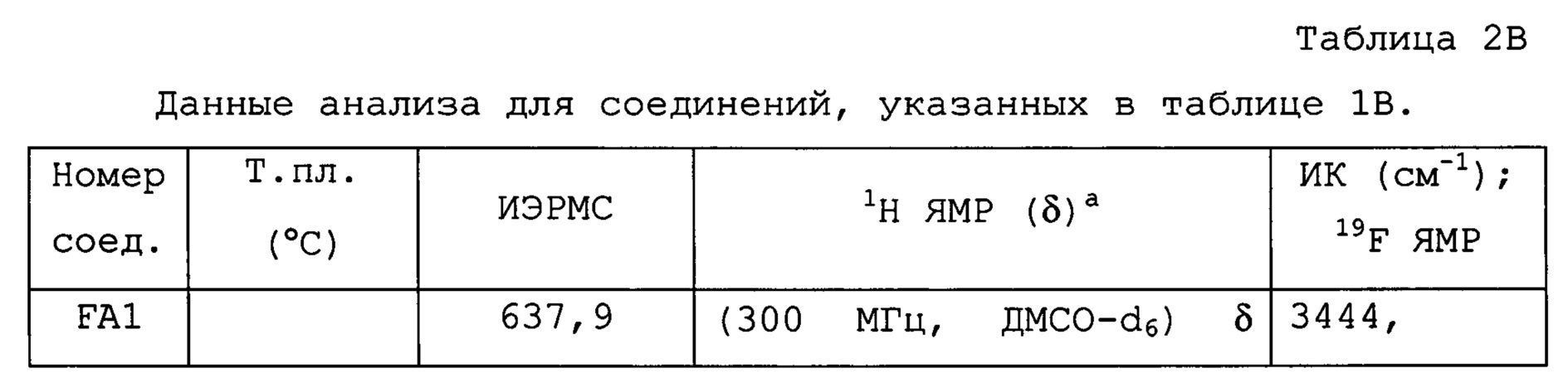
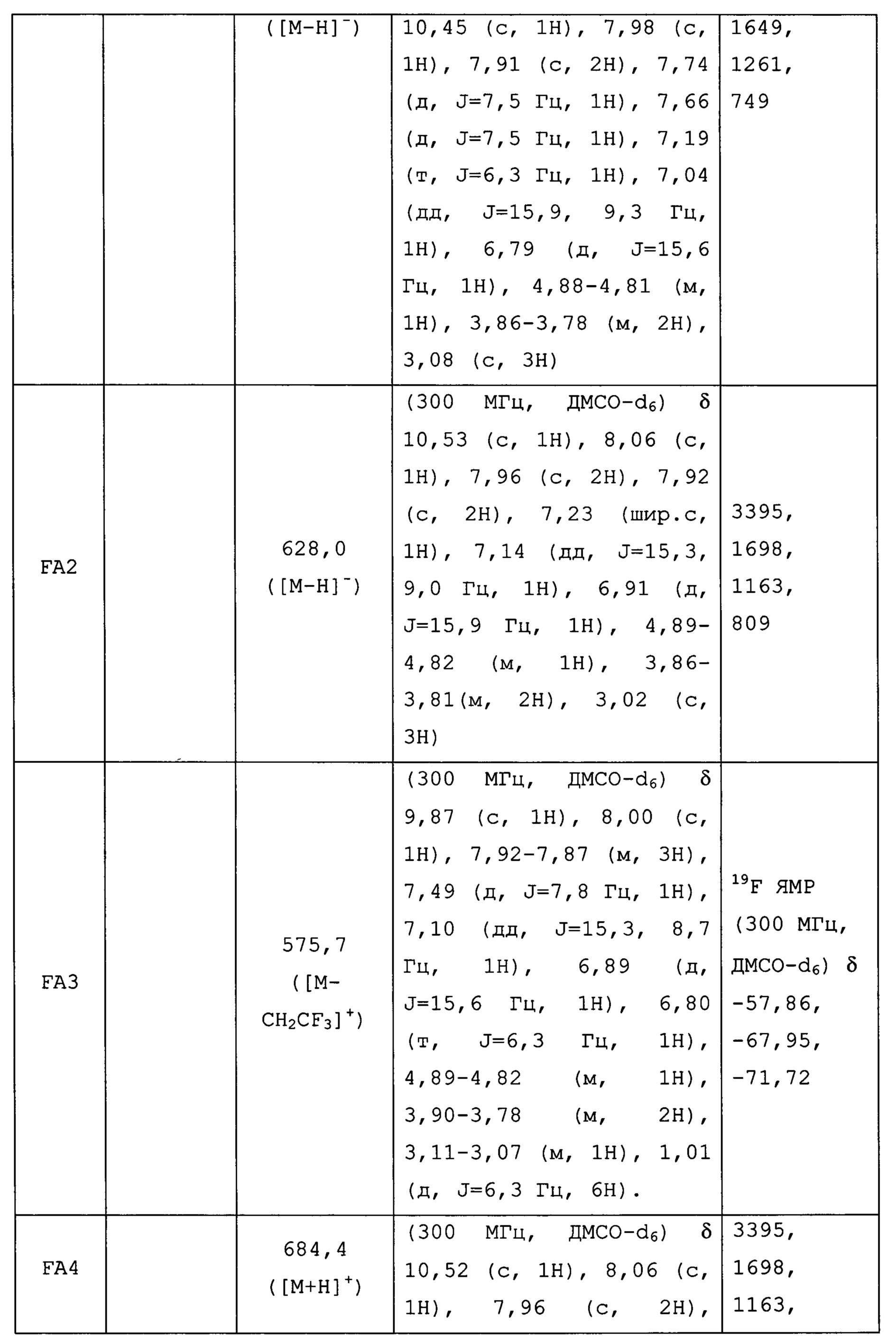
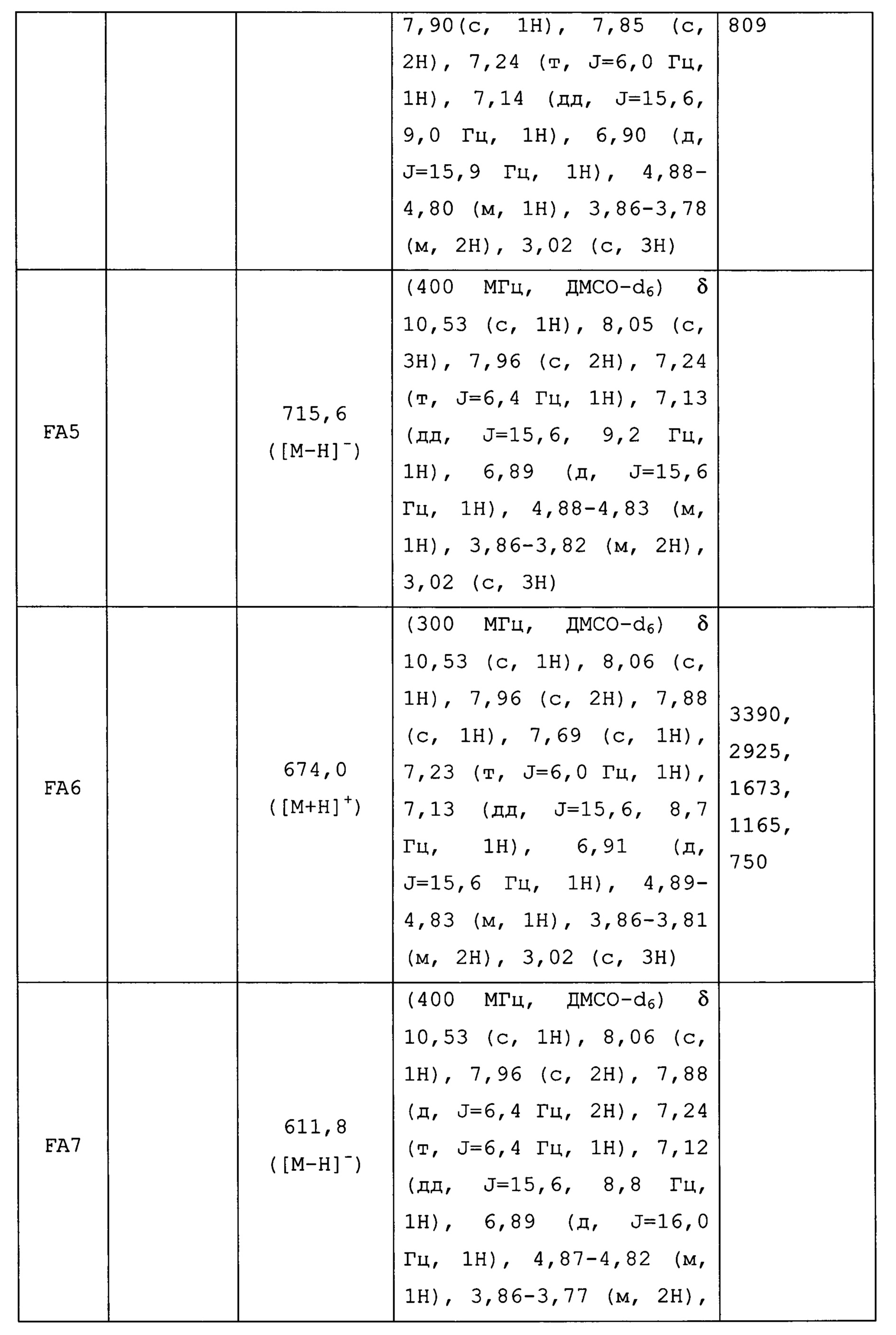

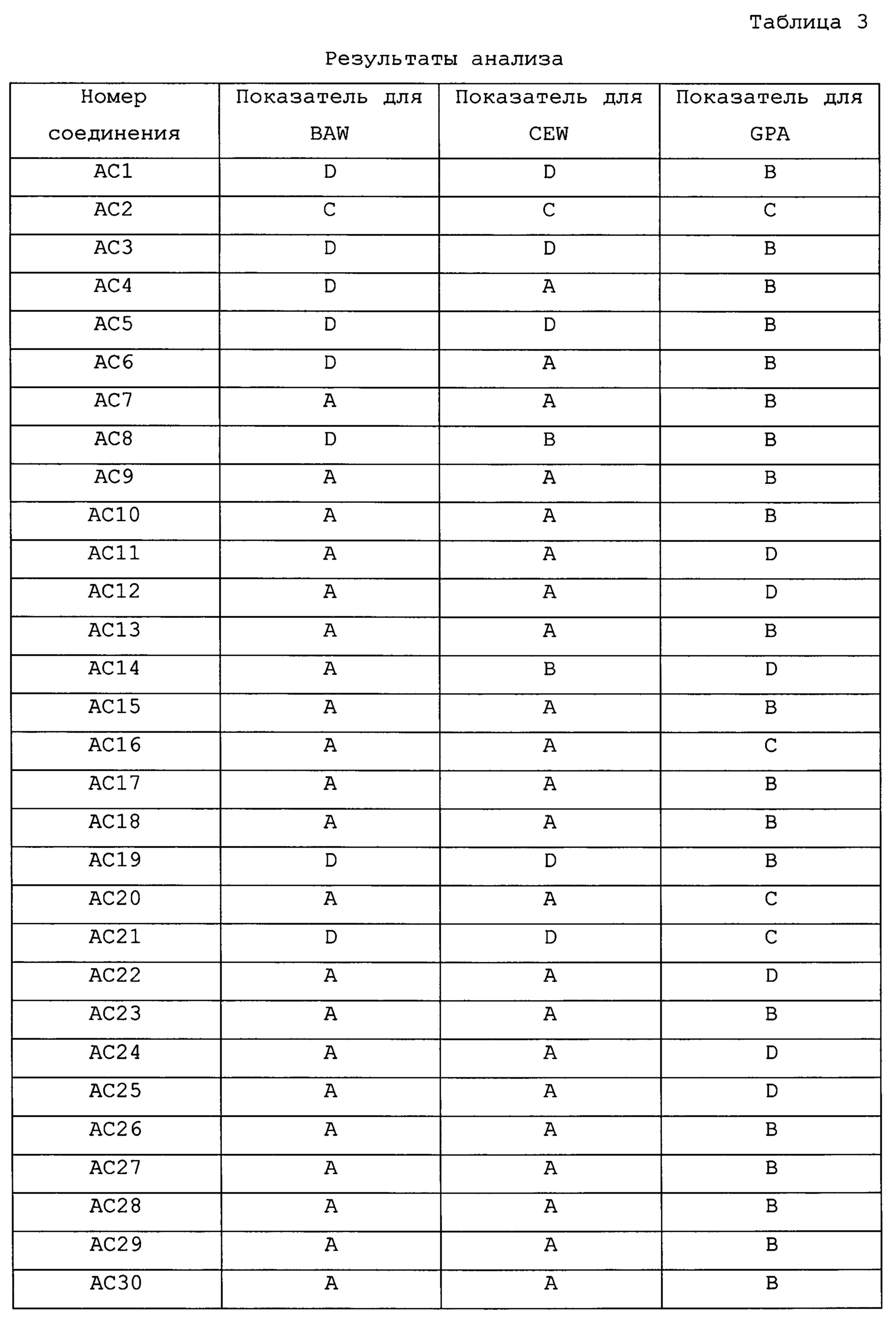

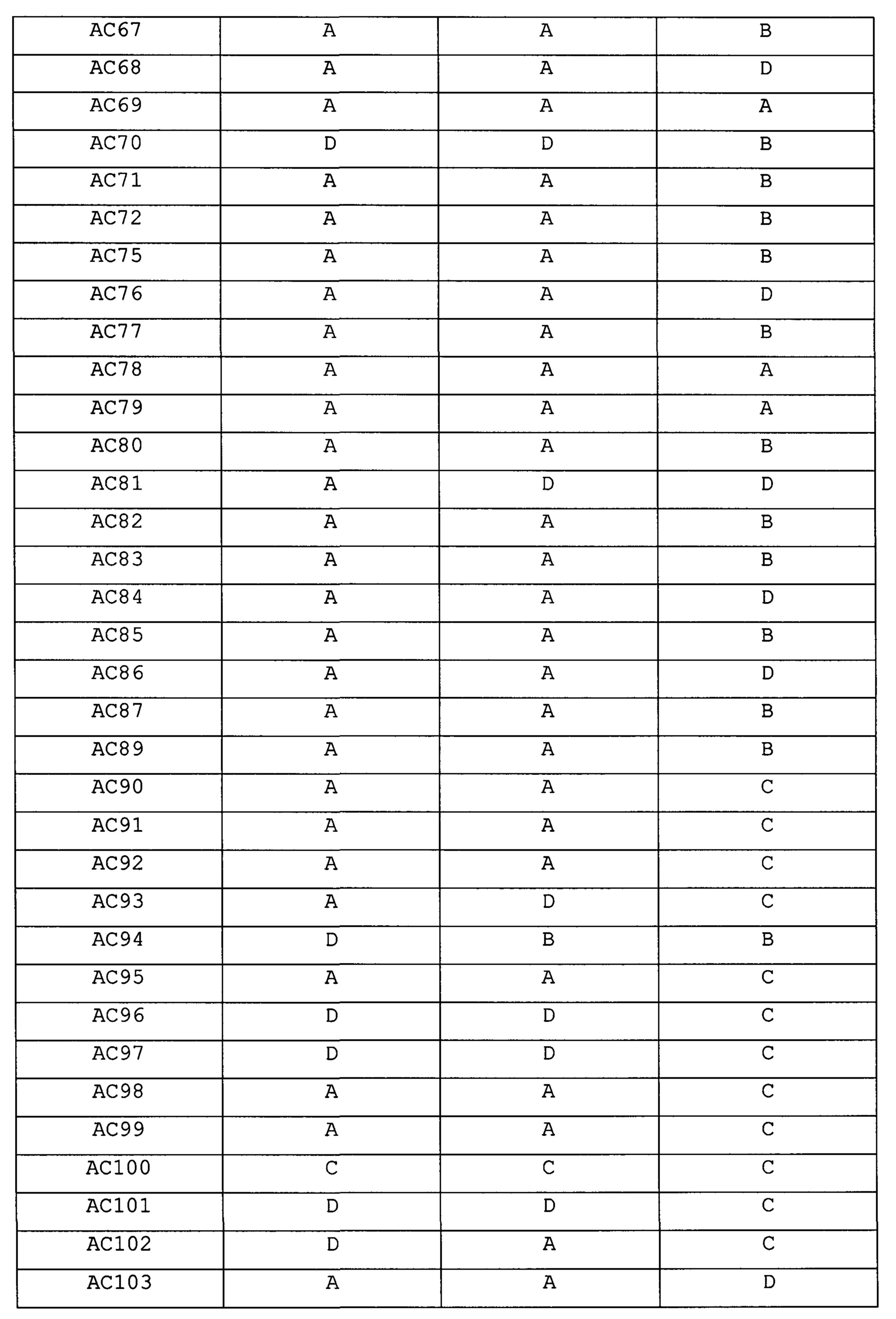

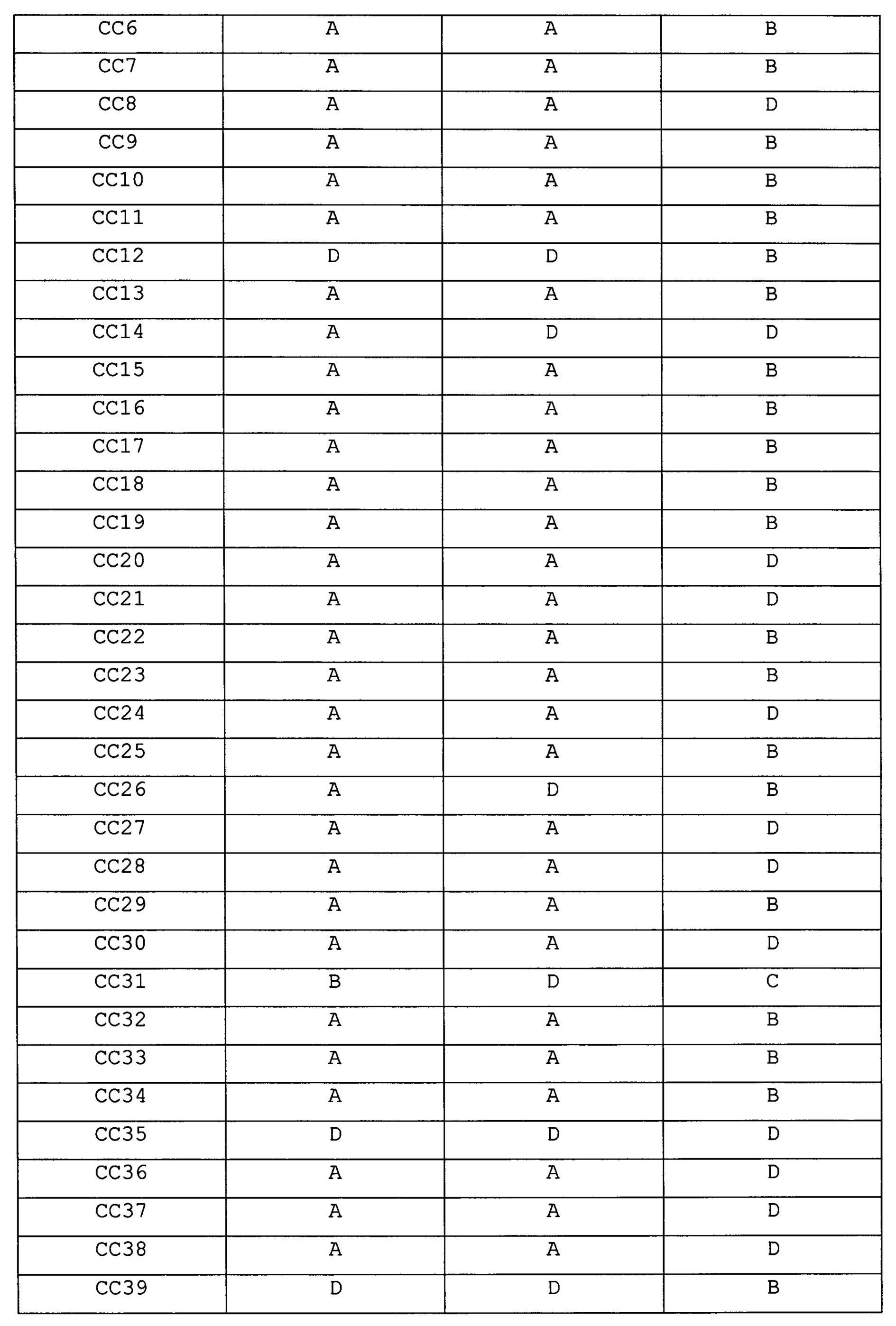
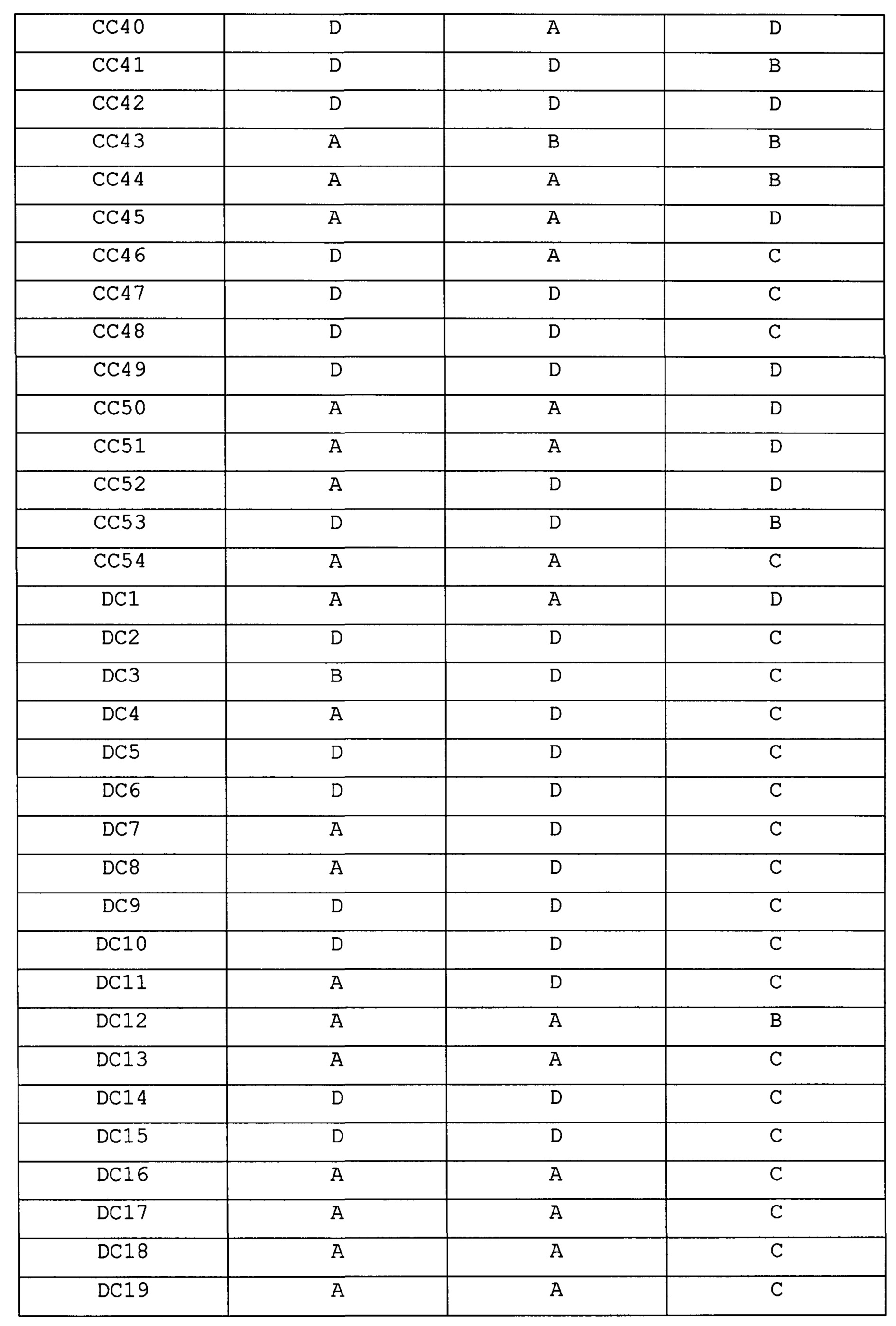

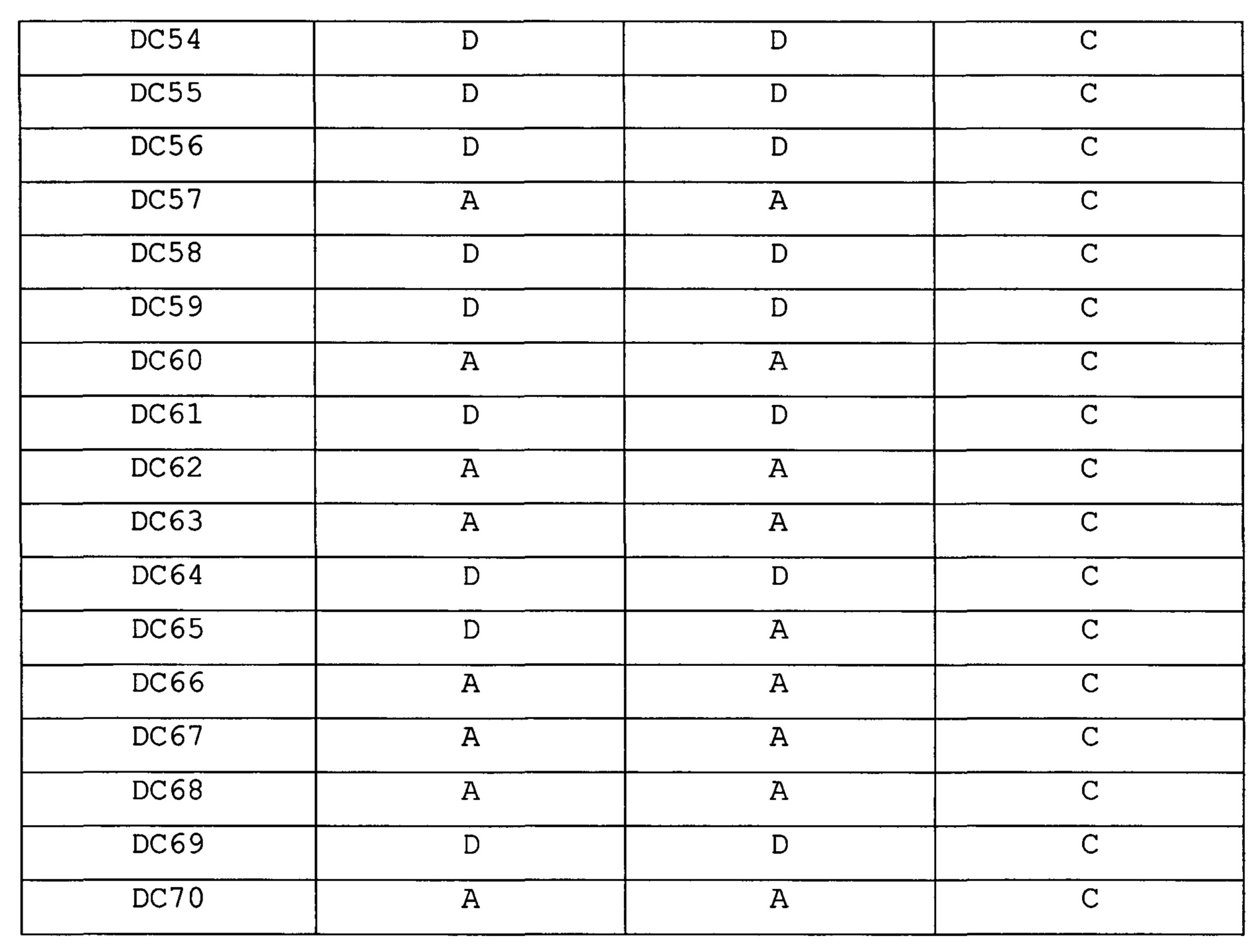
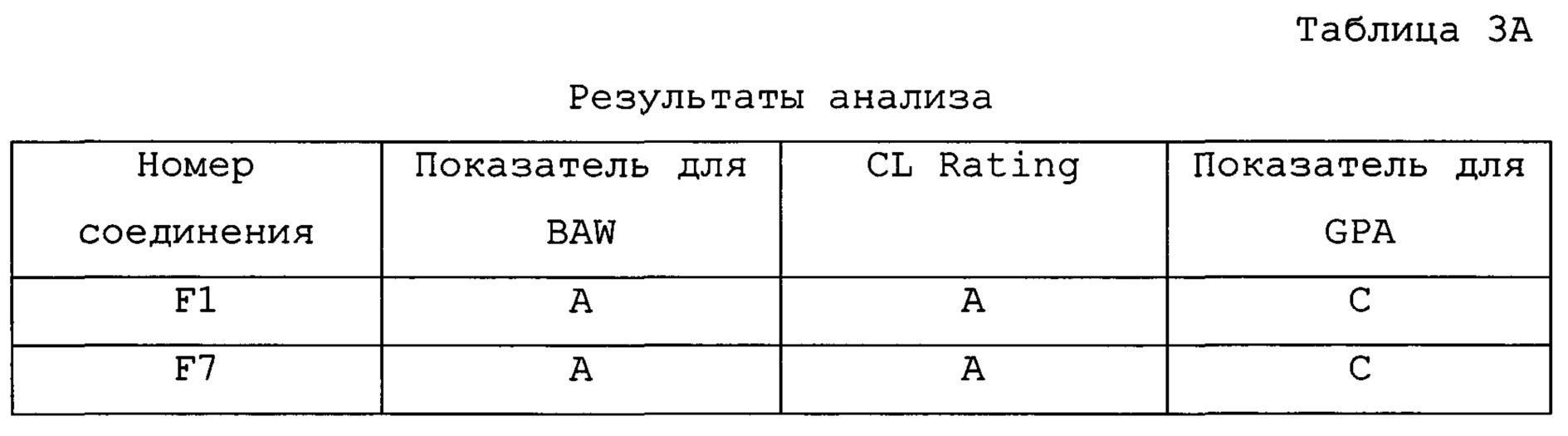

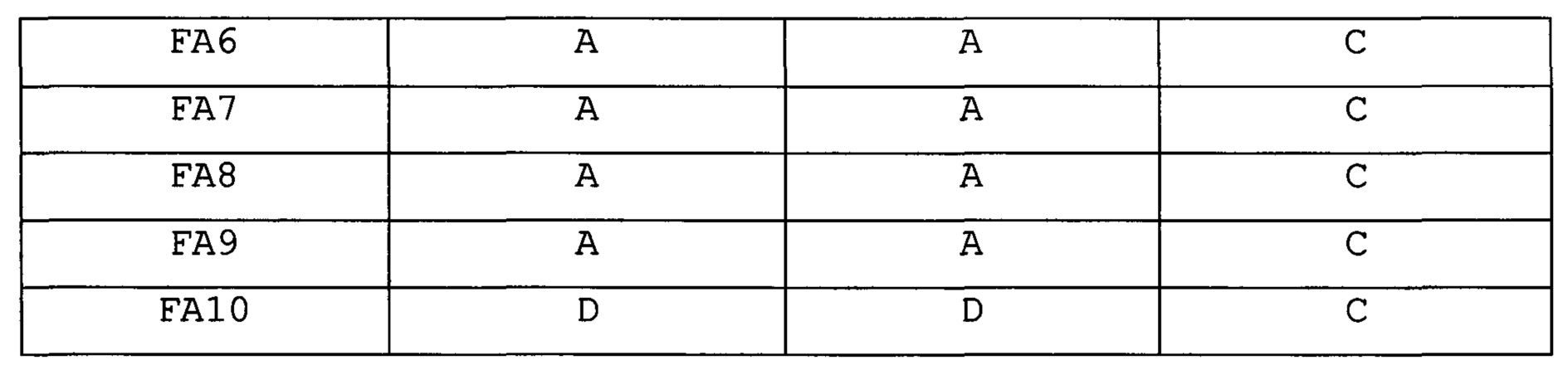
Реферат
Молекулы, описывающиеся формулой:и связанные с ними способы. Изобретение позволяет повысить эффективность борьбы с вредителями. 4 н. и 67 з.п. ф-лы, 9 табл., 135 пр.
Формула
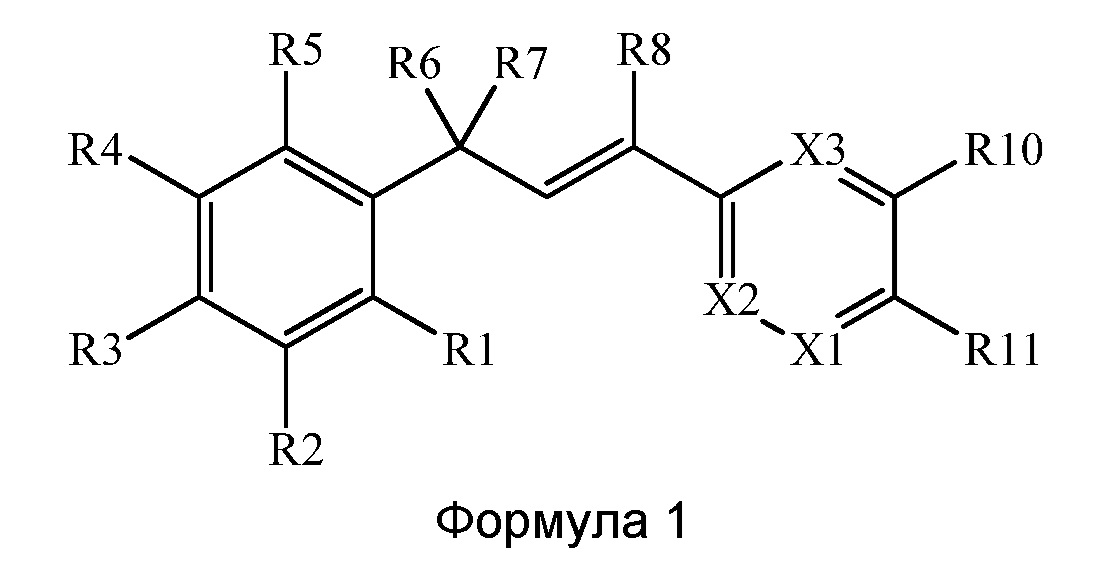
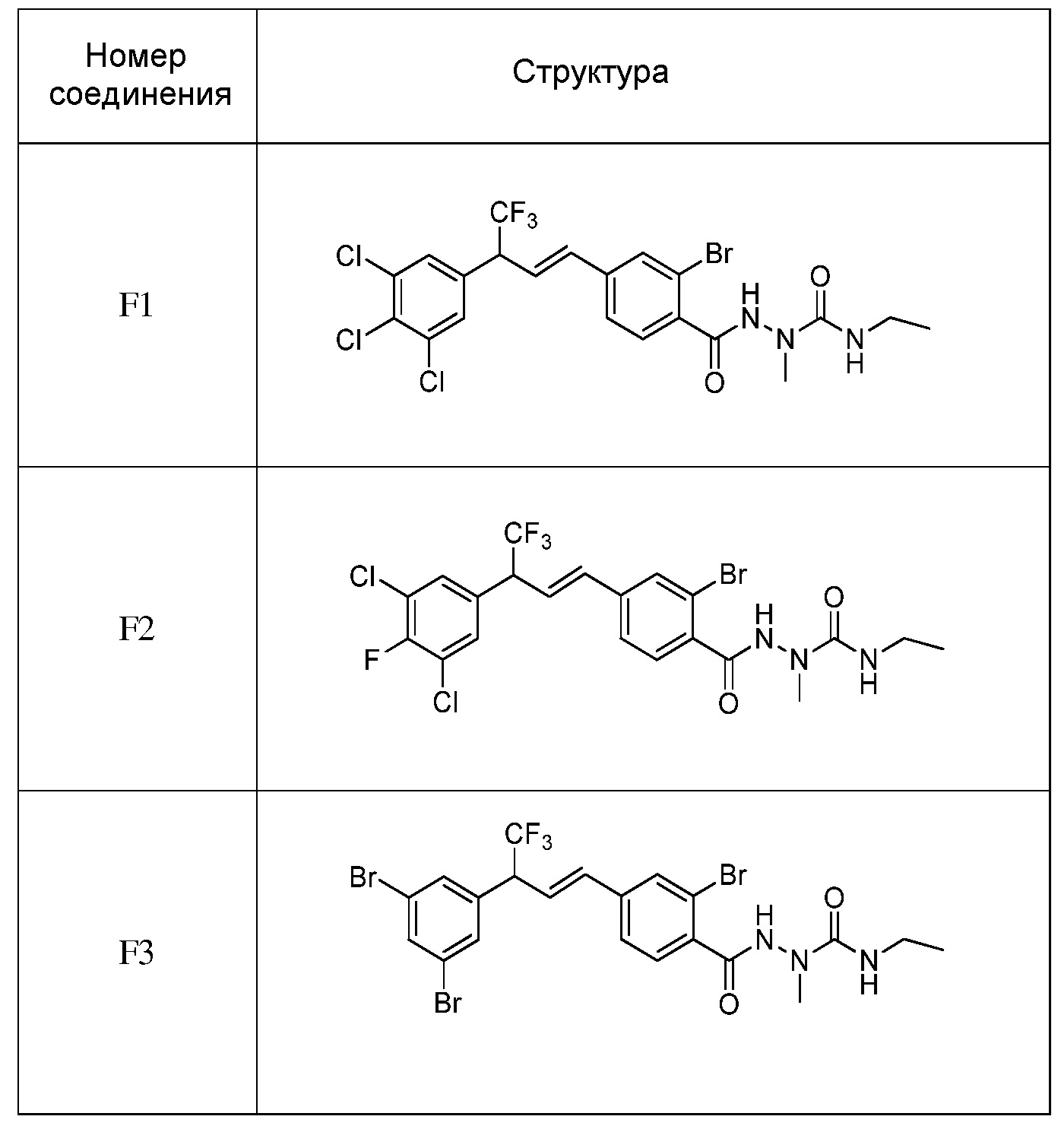
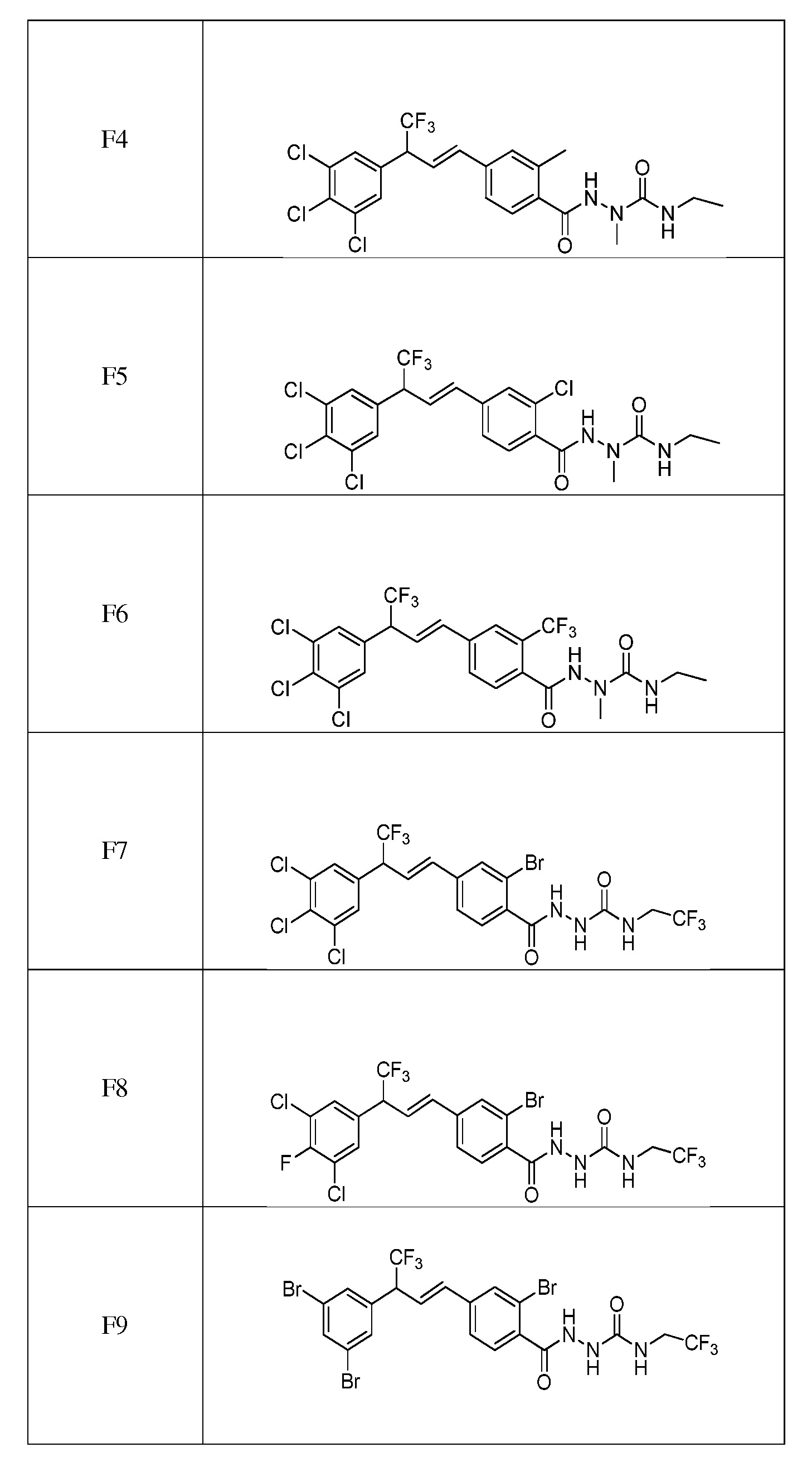

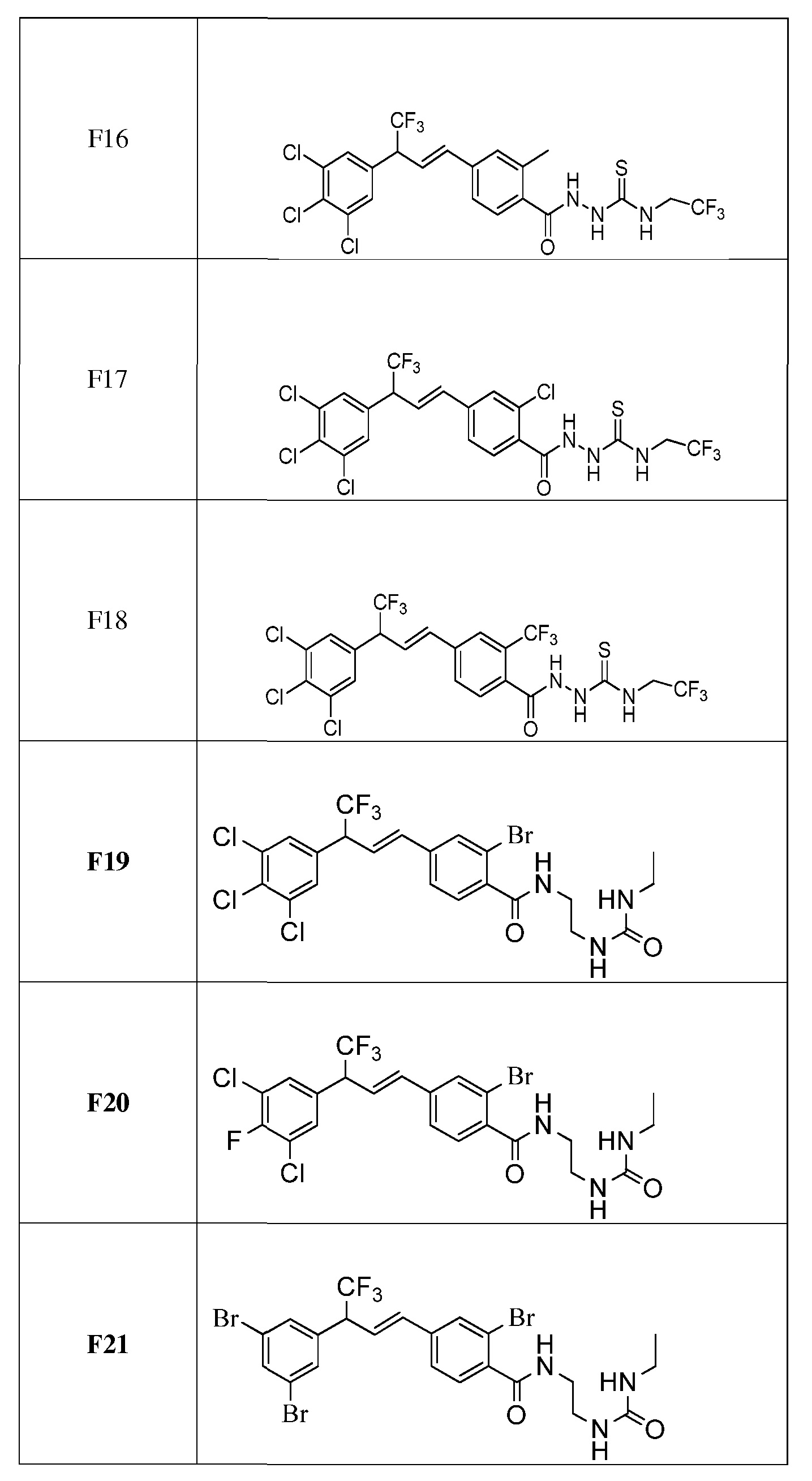
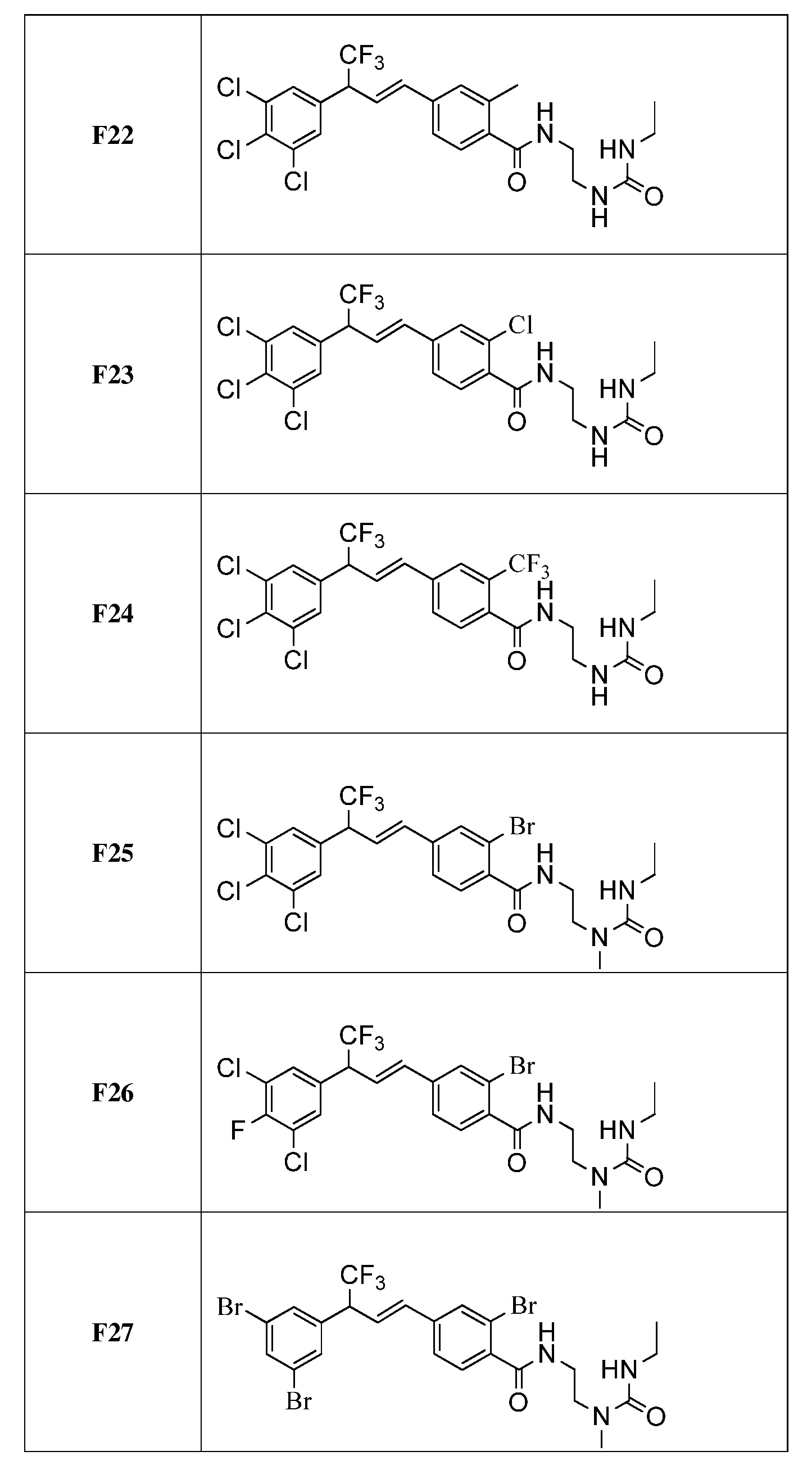
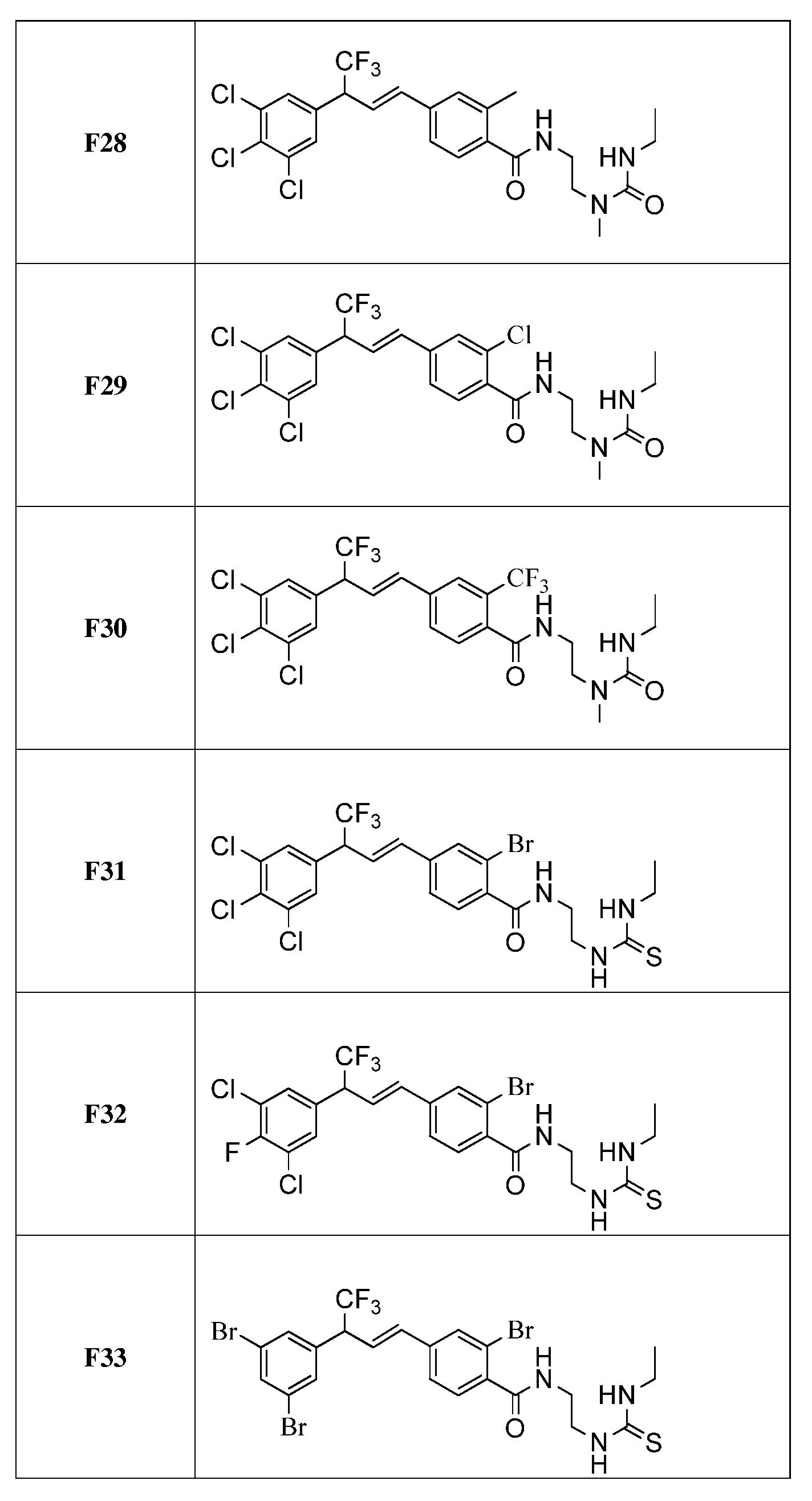

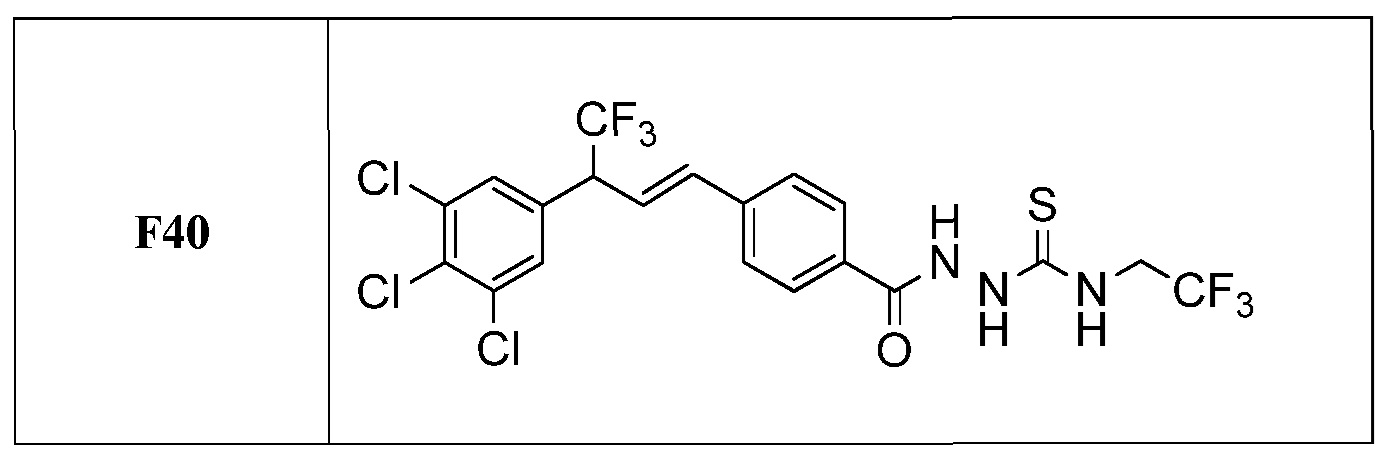
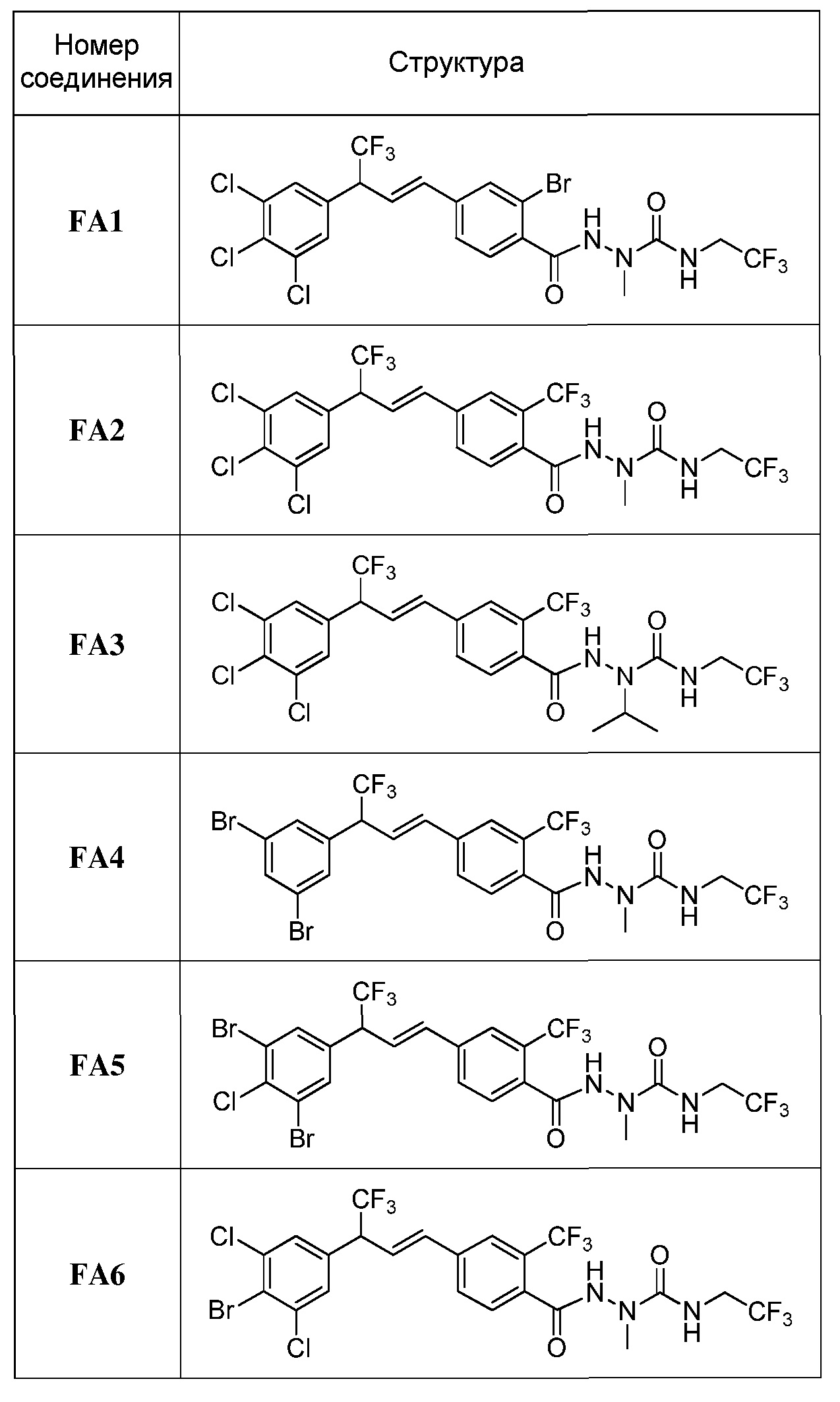

Документы, цитированные в отчёте о поиске
Инсектицидные соединения

Комментарии