Дигалоидпропеновые соединения, инсектицидно-акарицидные средства, содержащие их, и промежуточные соединения для их получения - RU2144526C1
Код документа: RU2144526C1
Чертежи
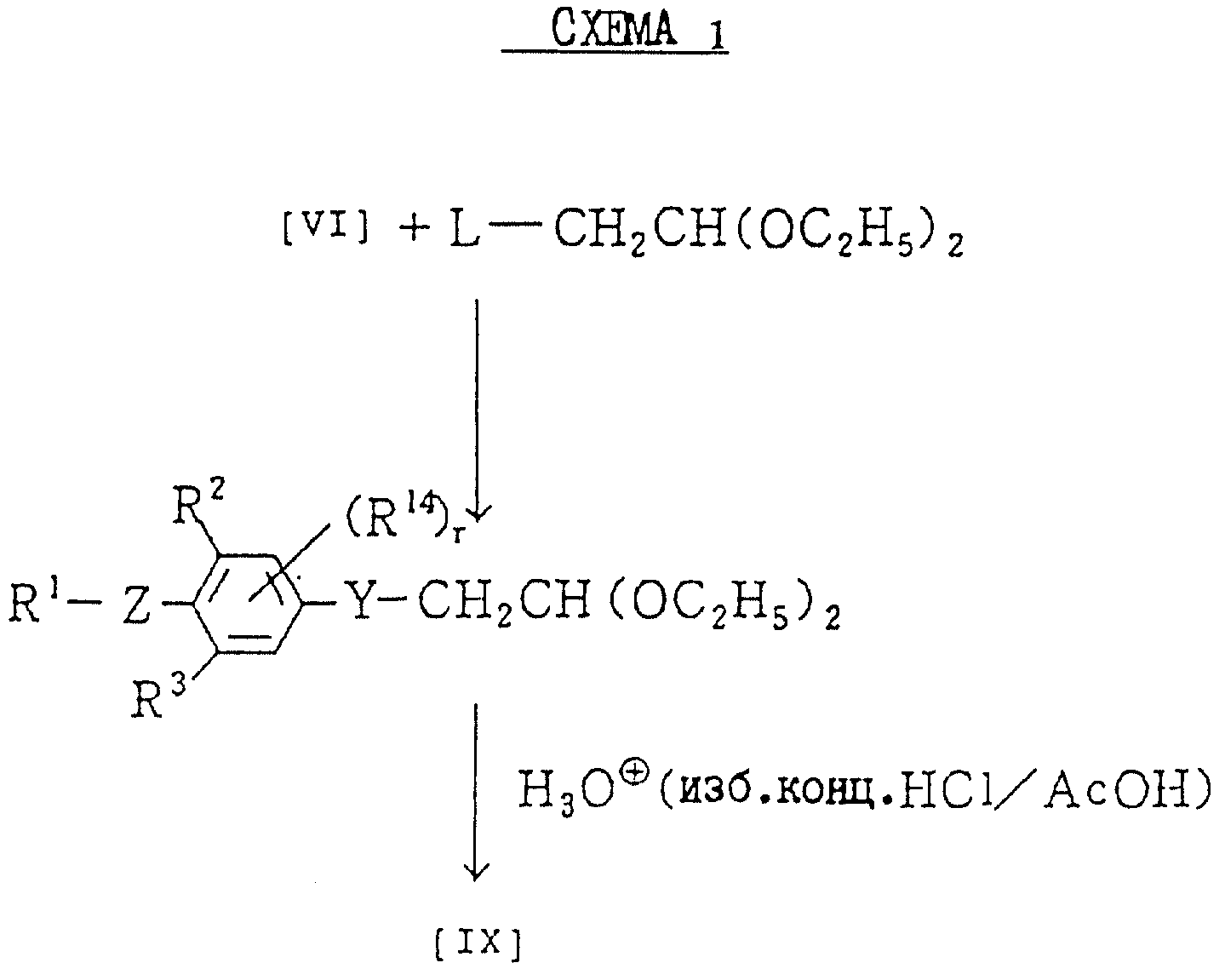




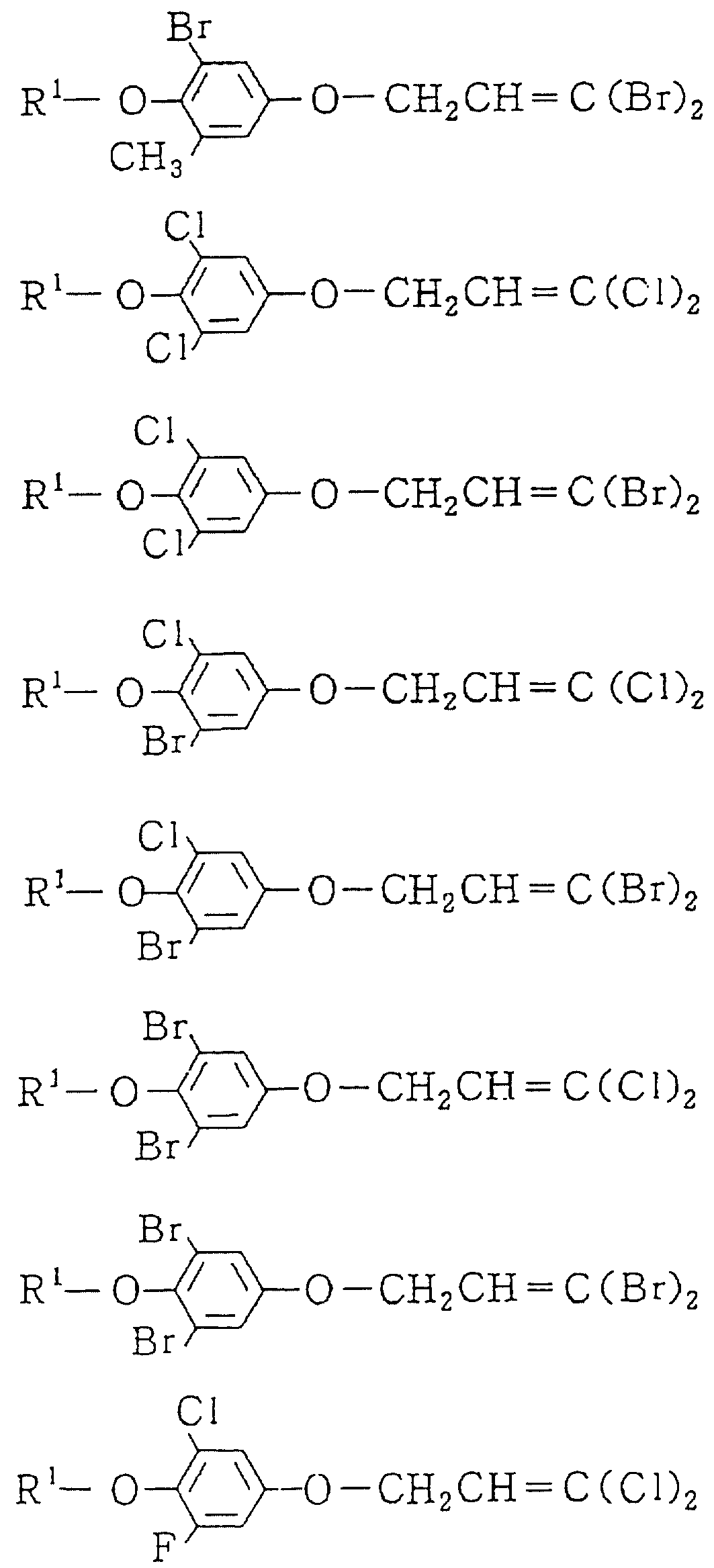





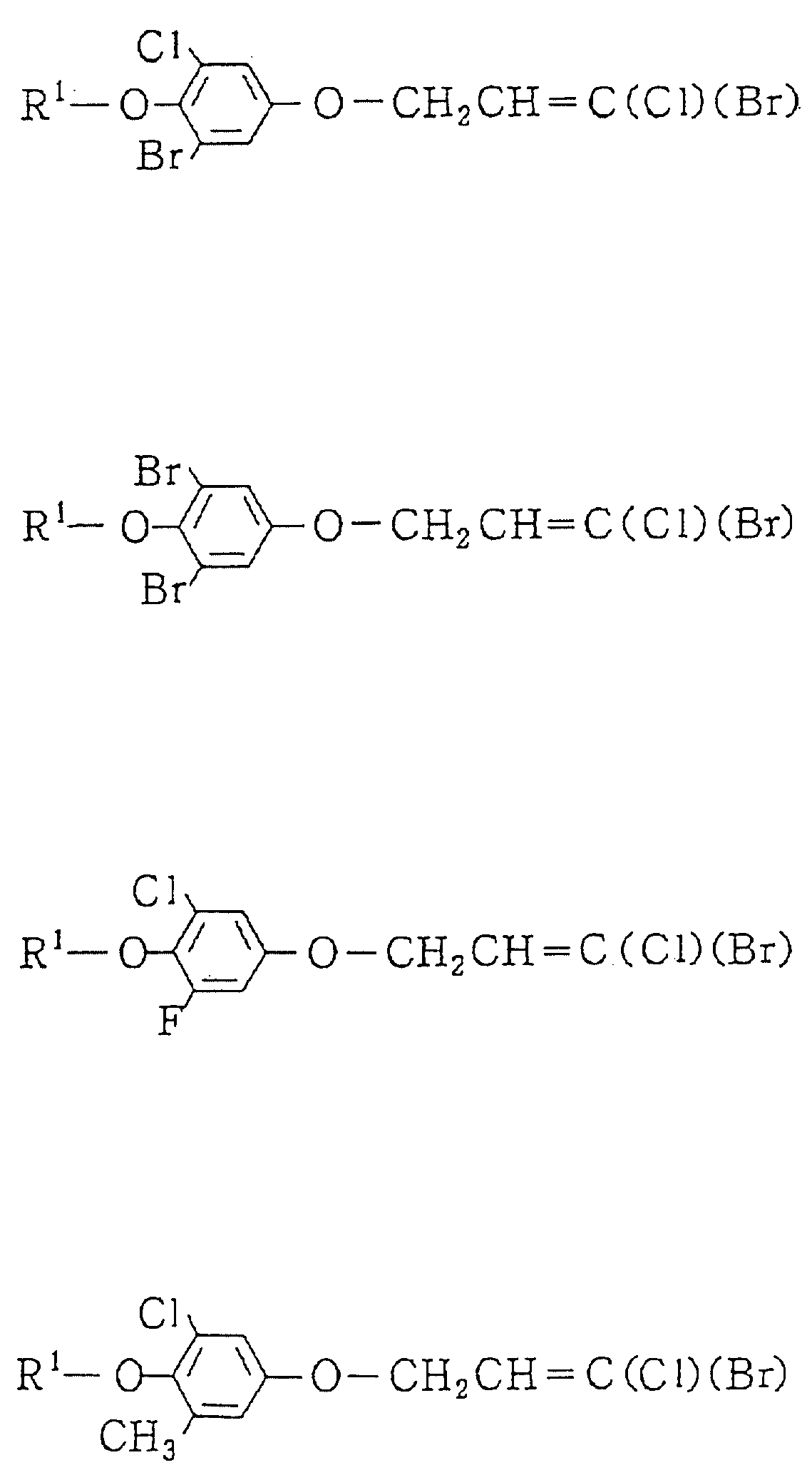

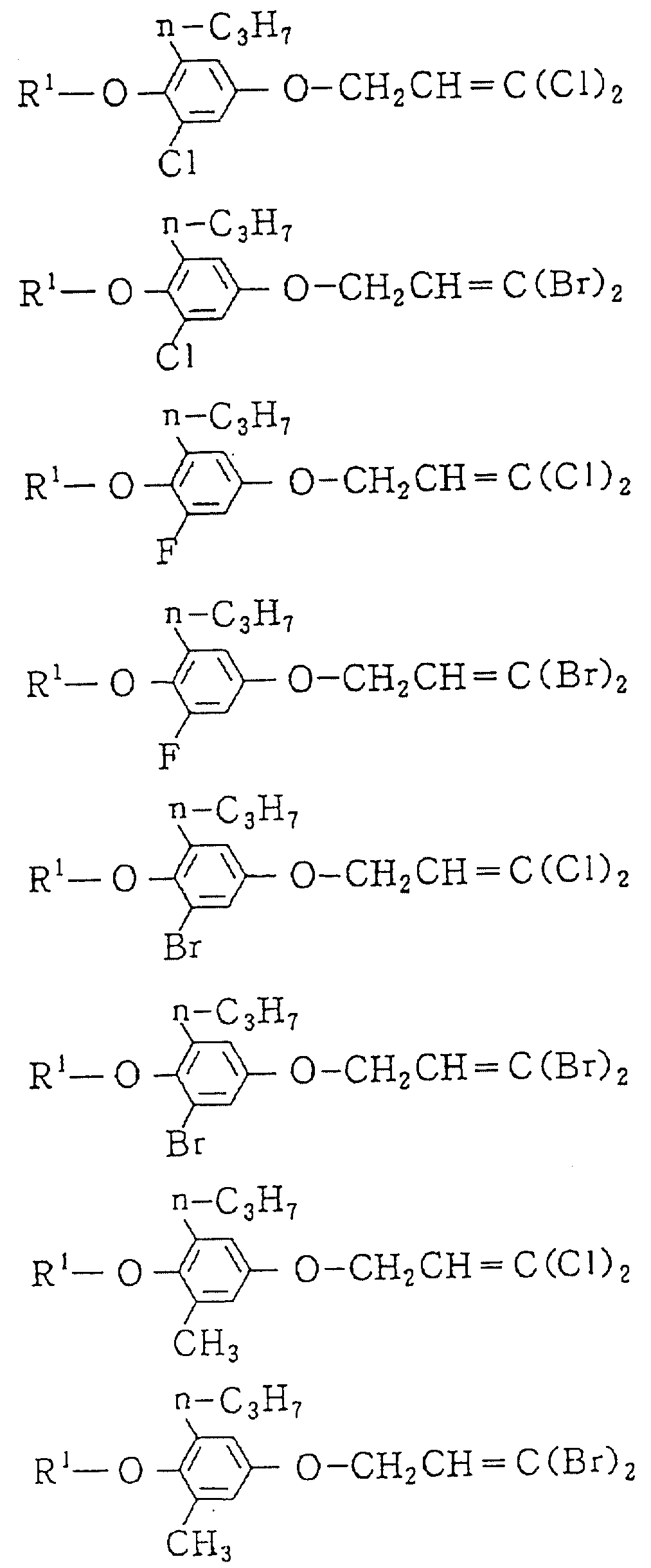
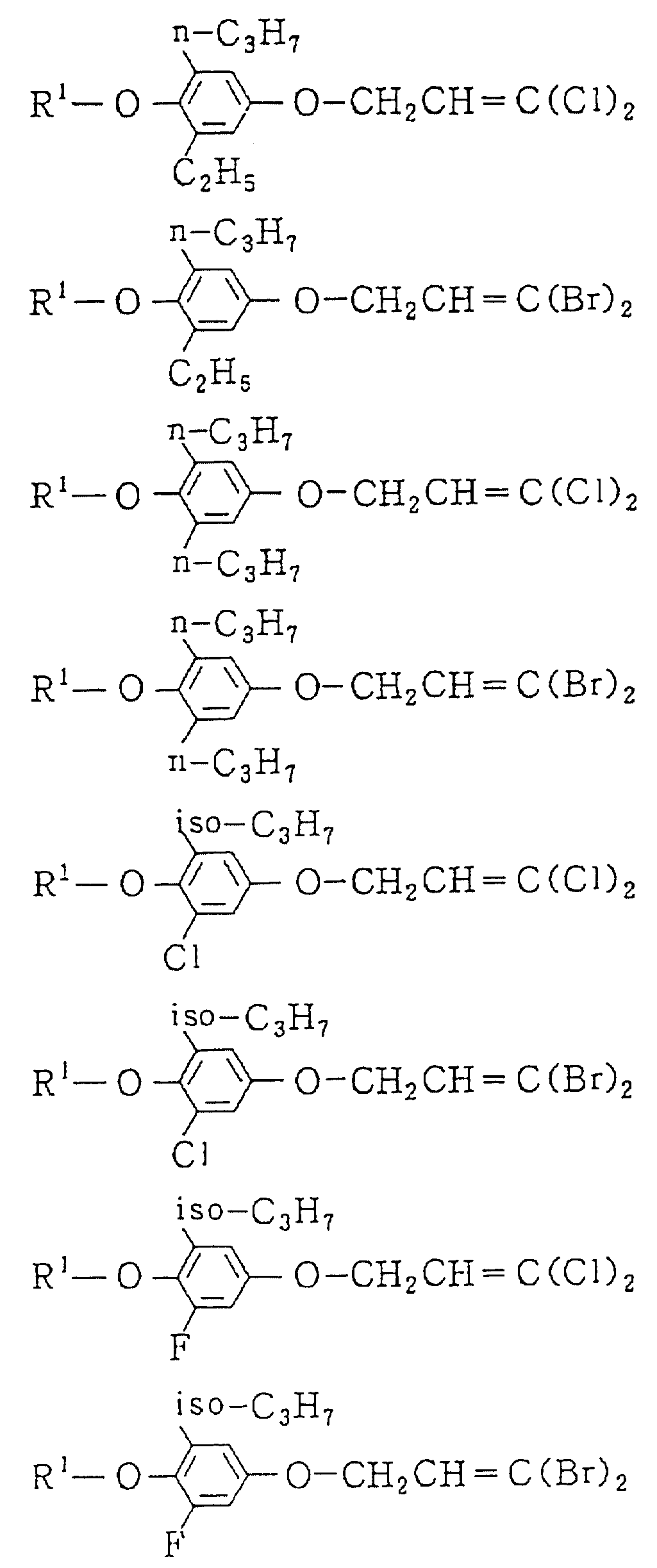
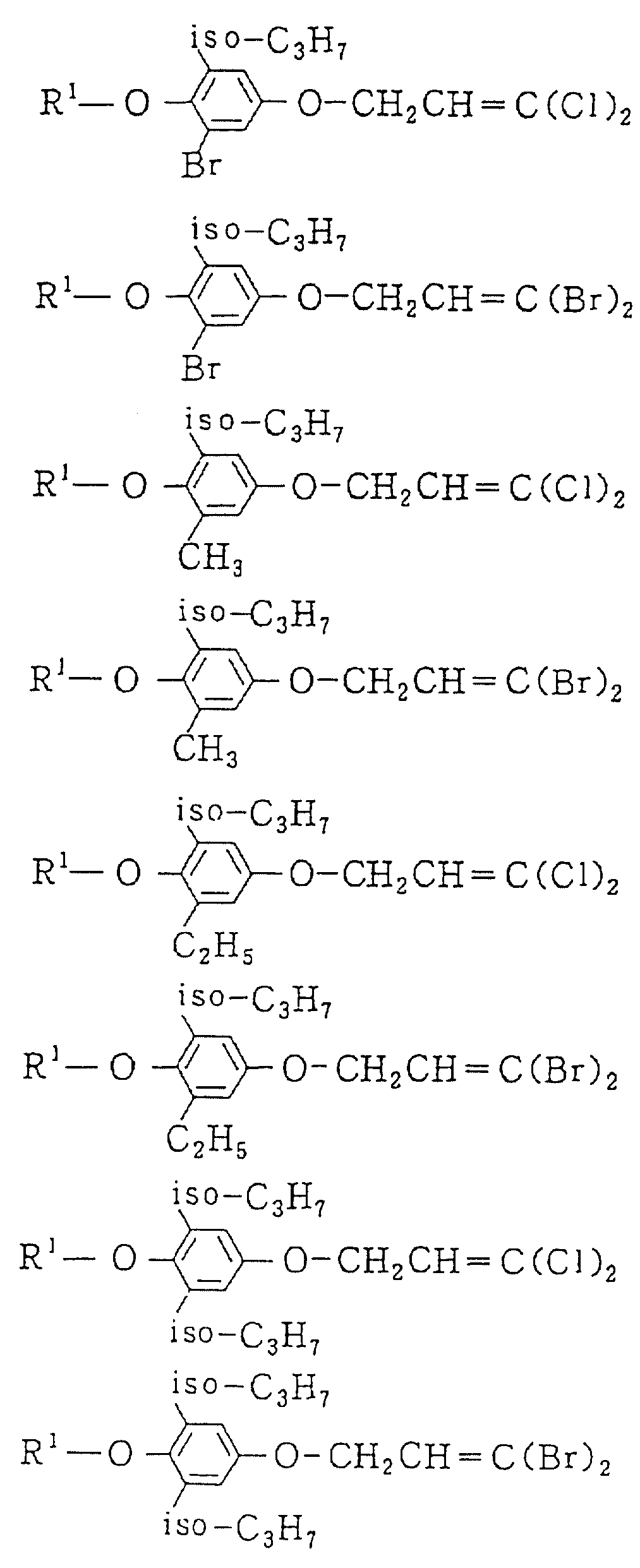

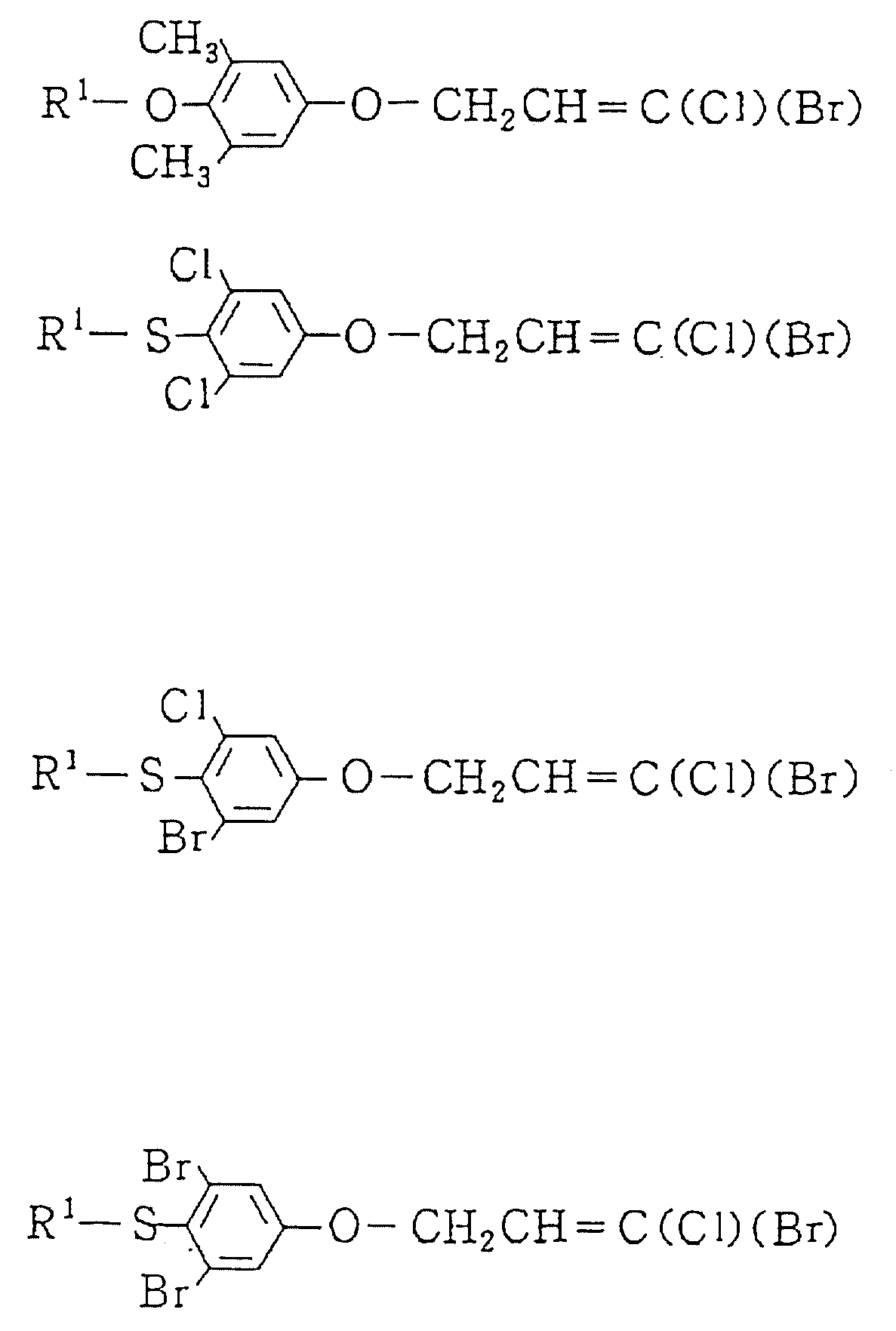
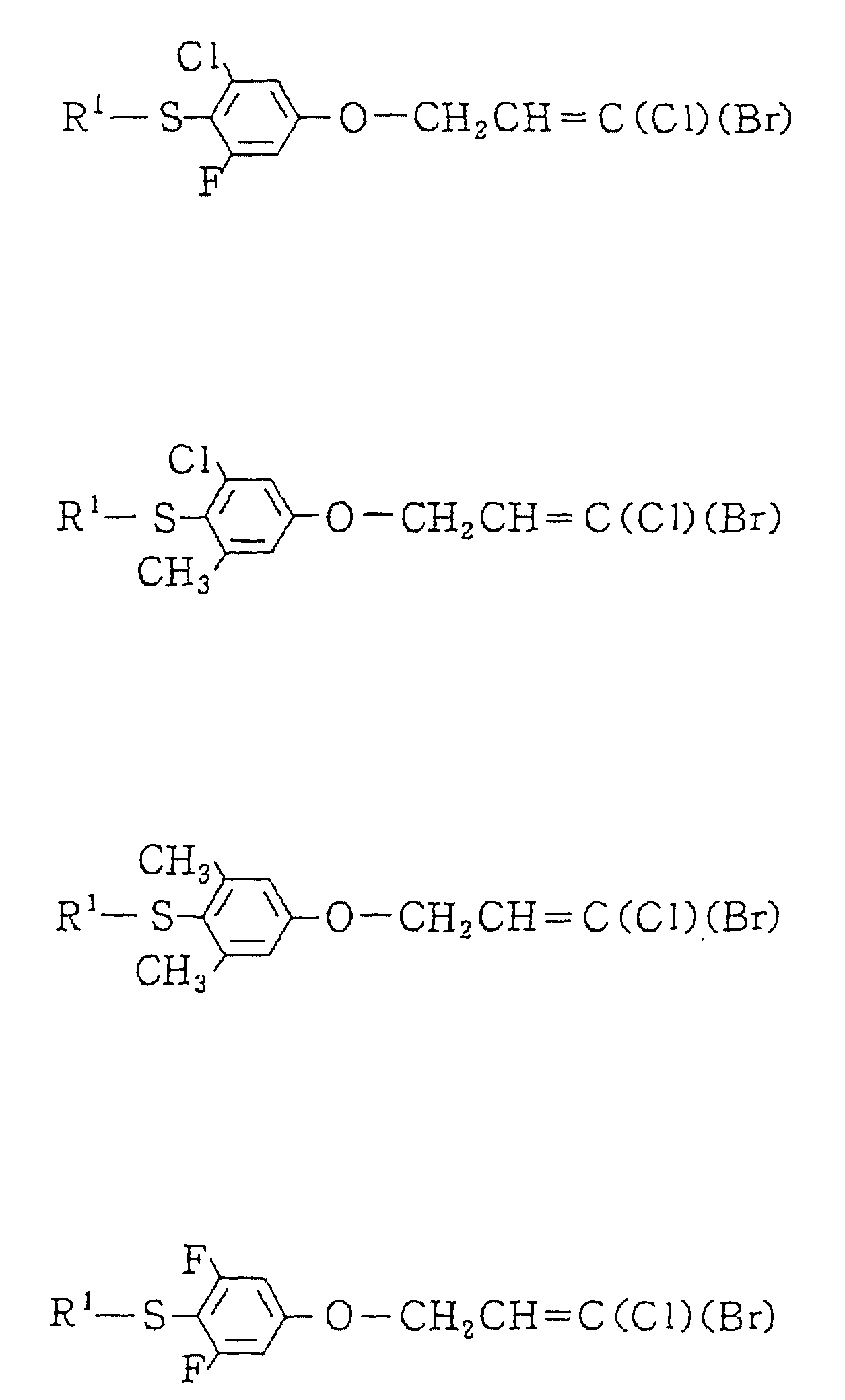

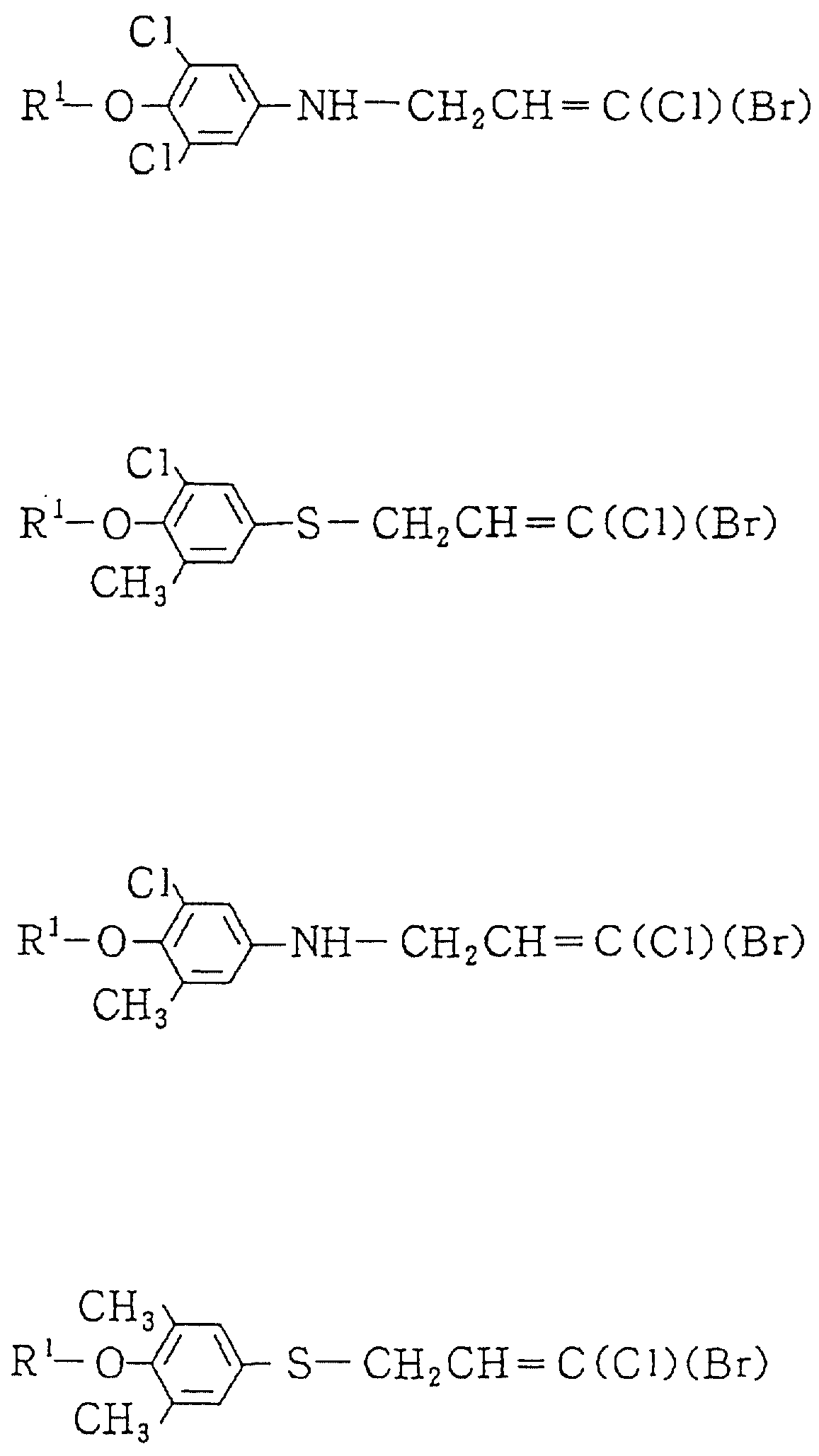
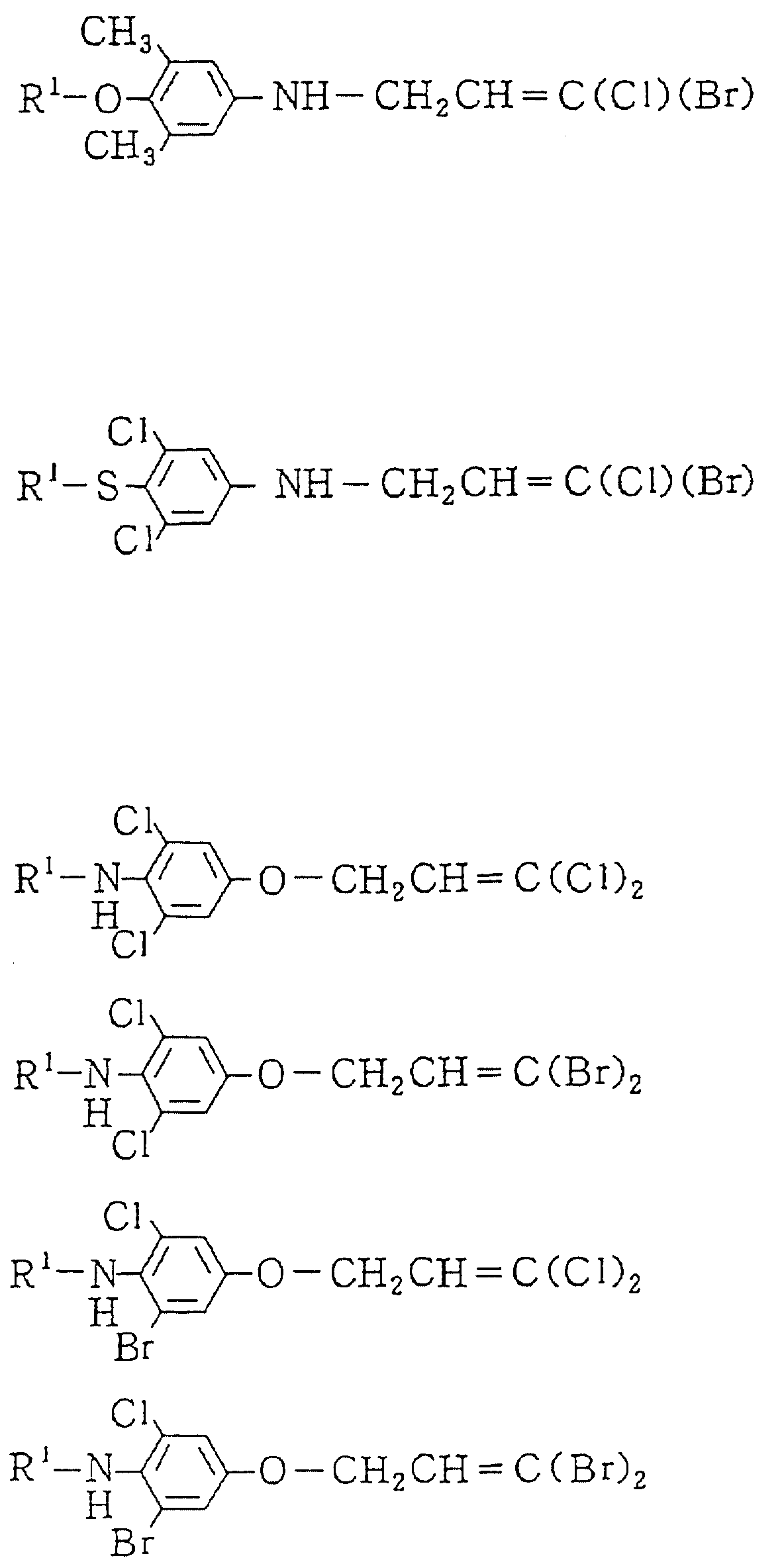

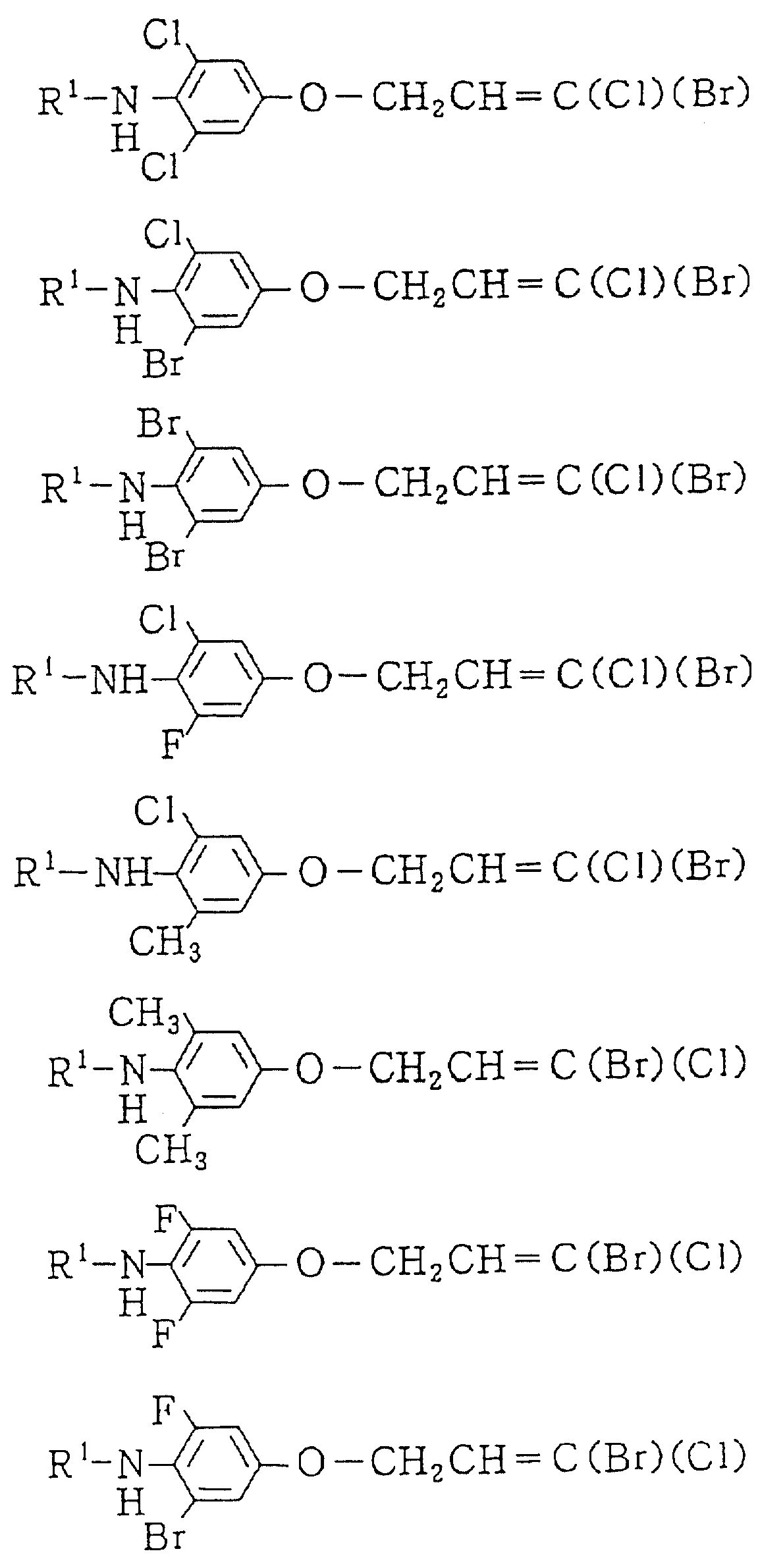
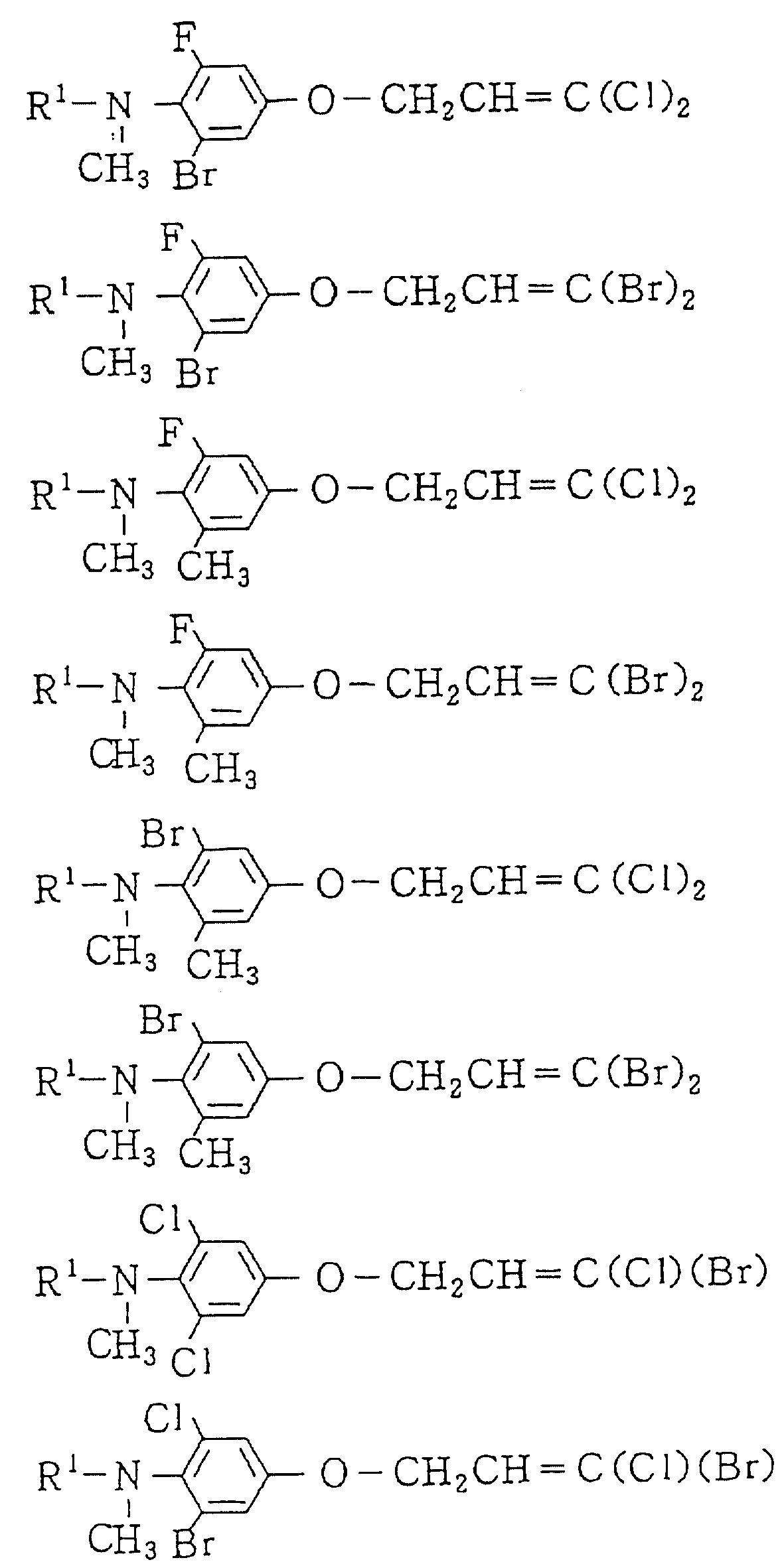
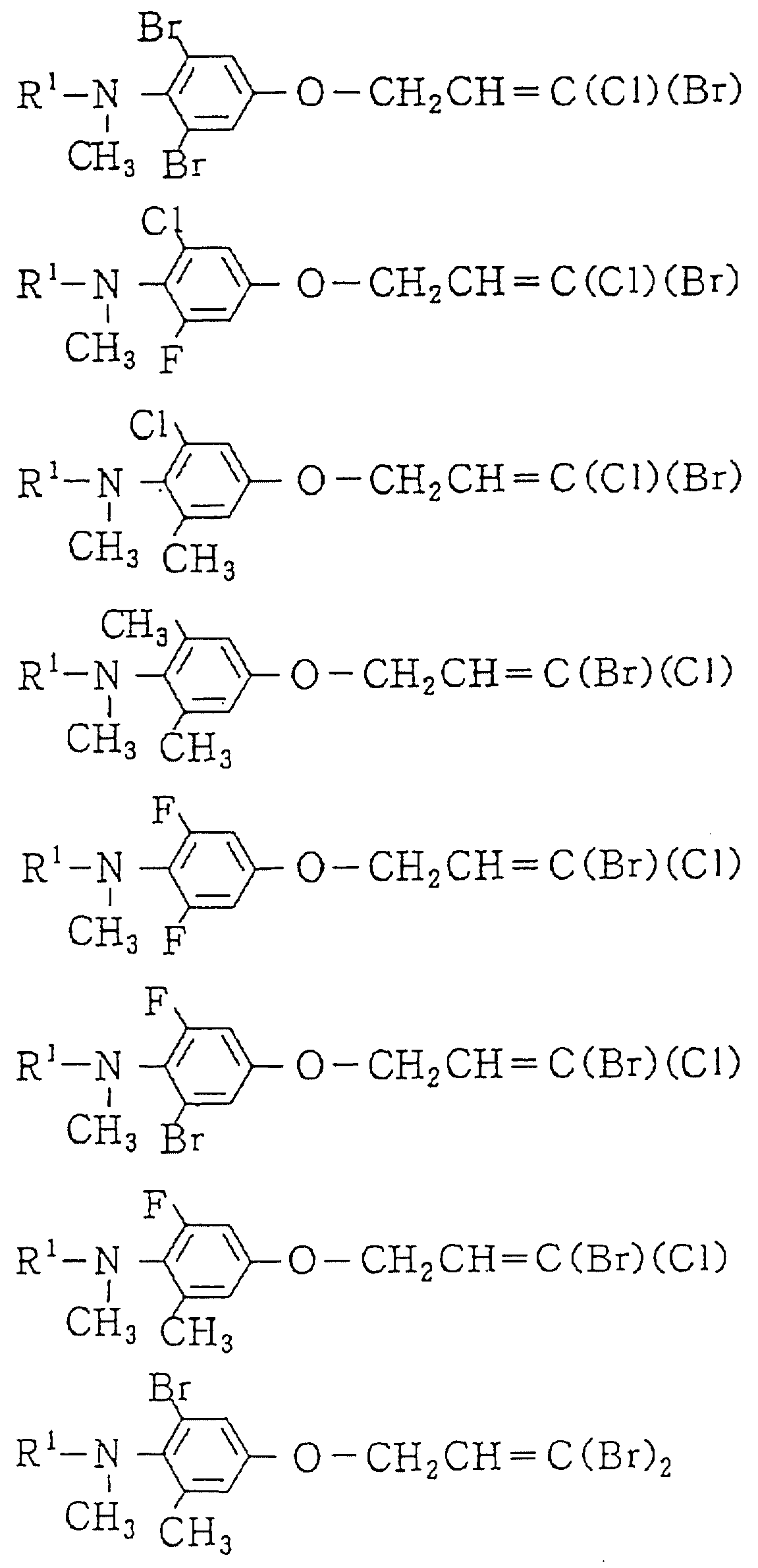



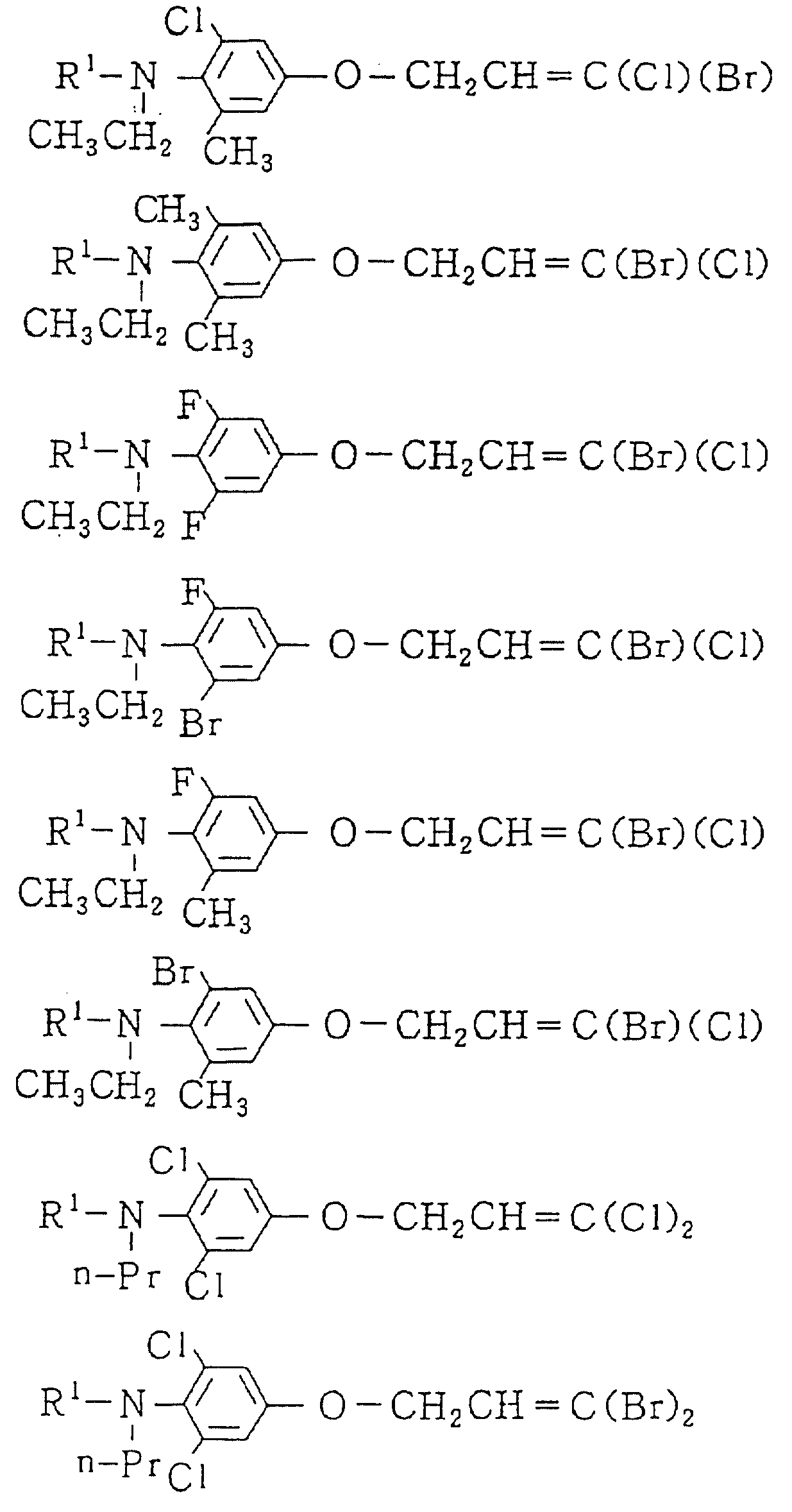
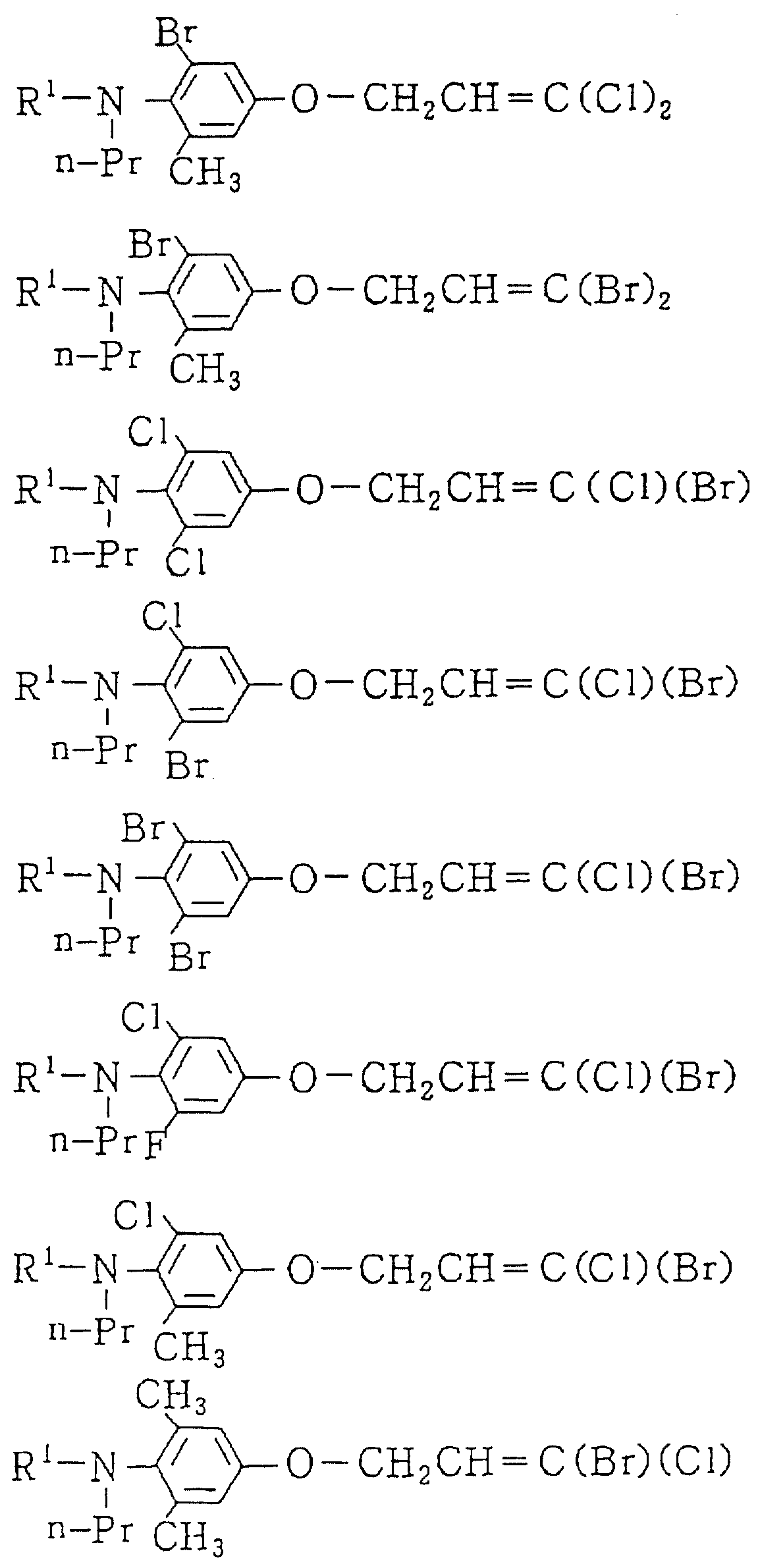
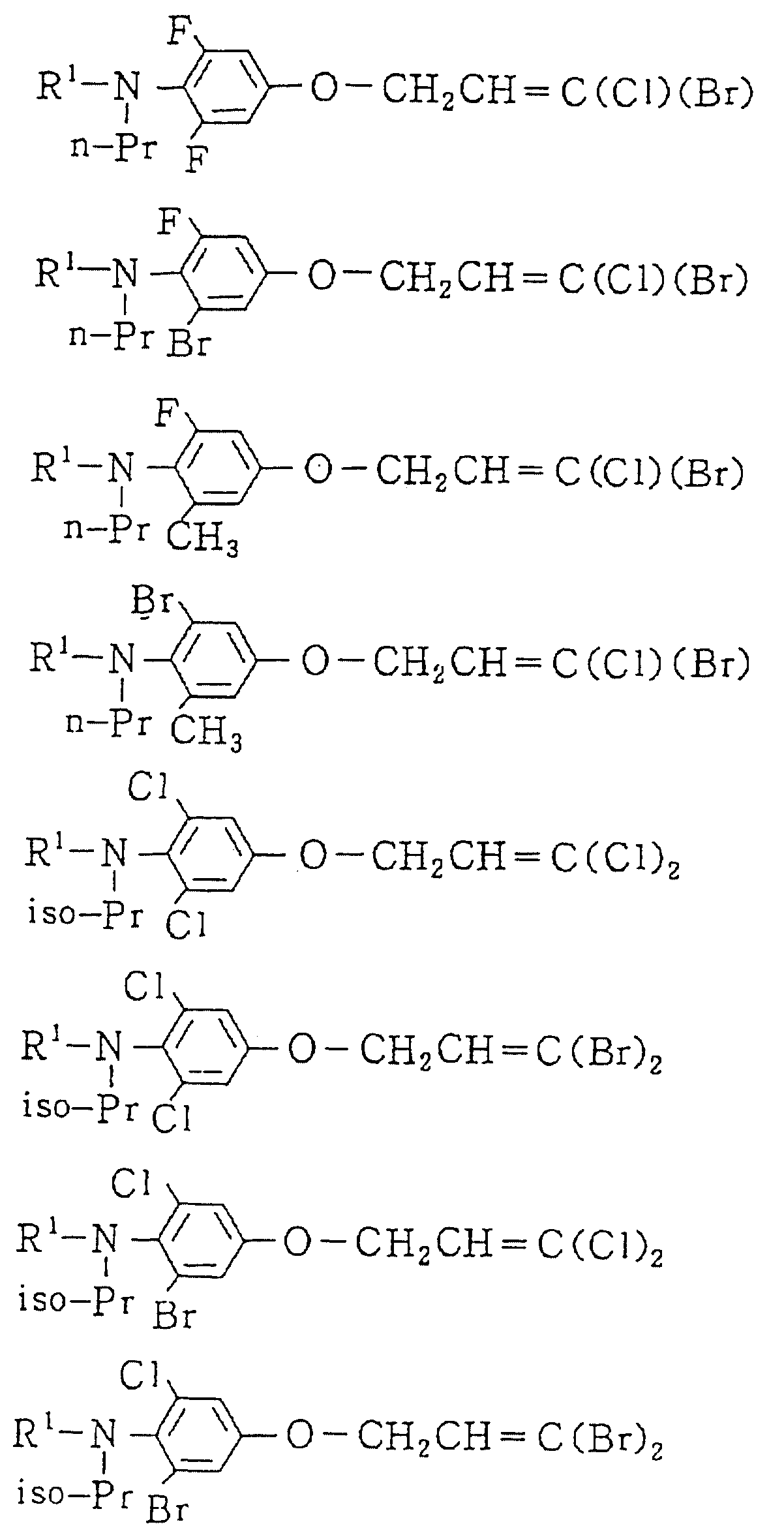

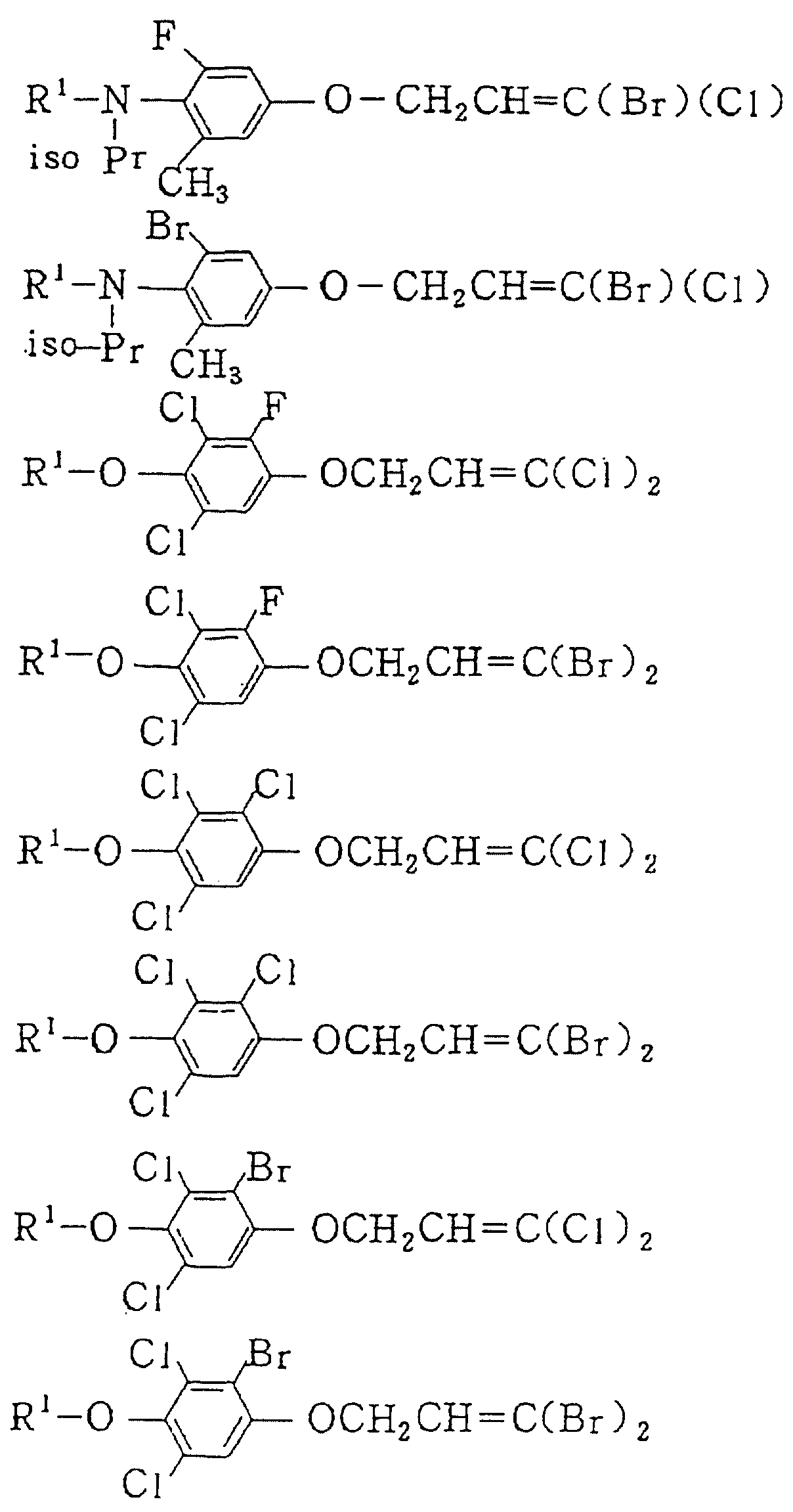














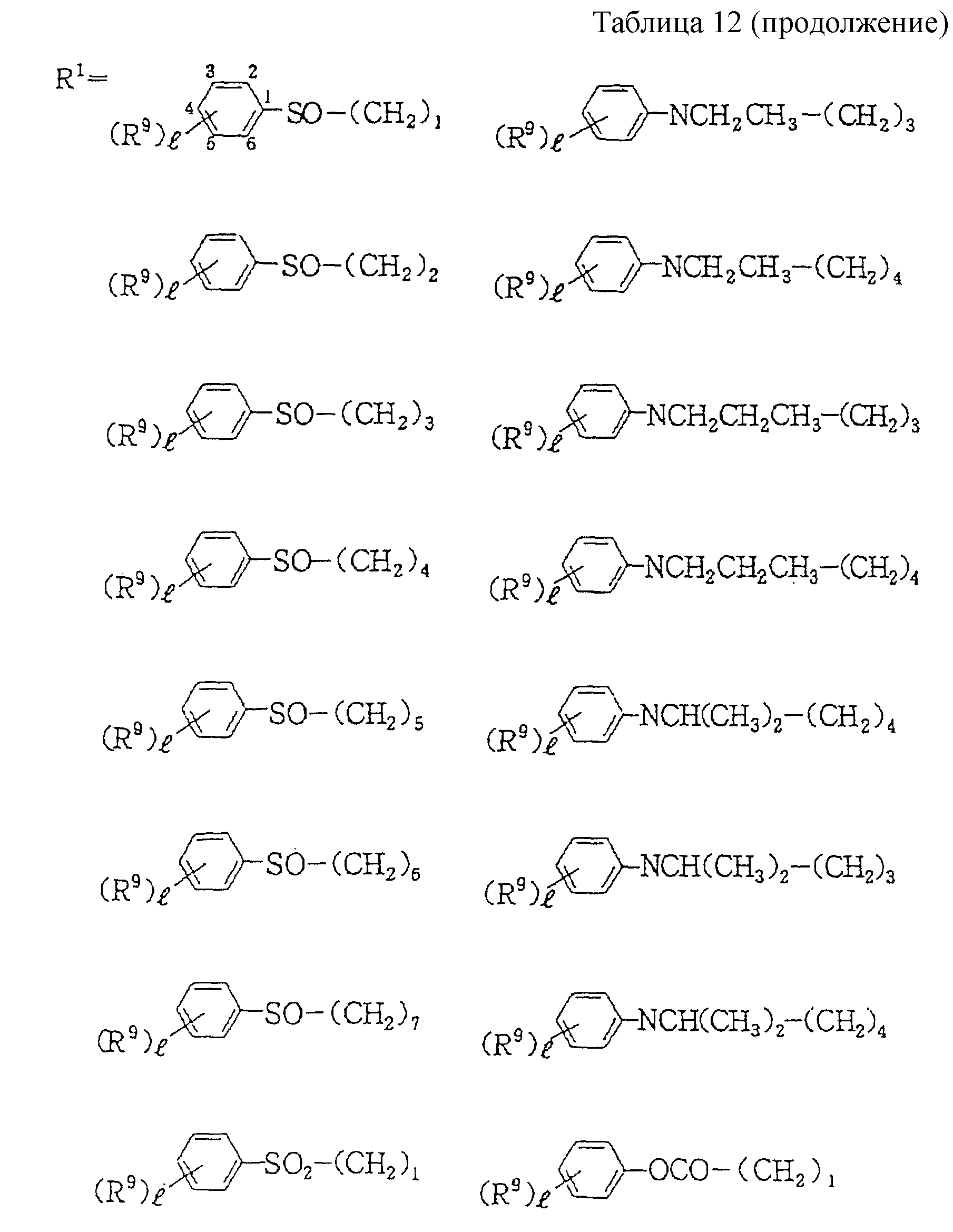

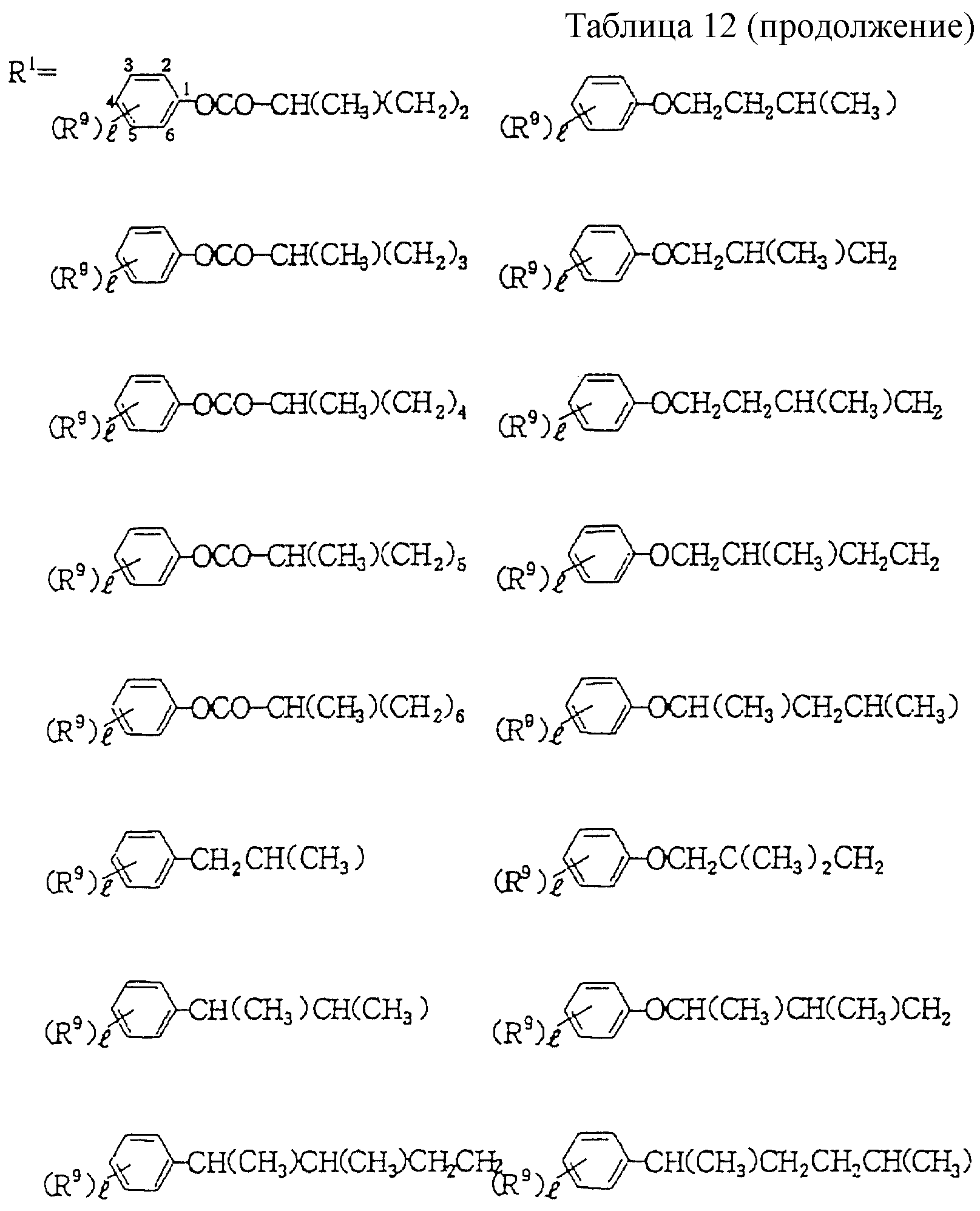














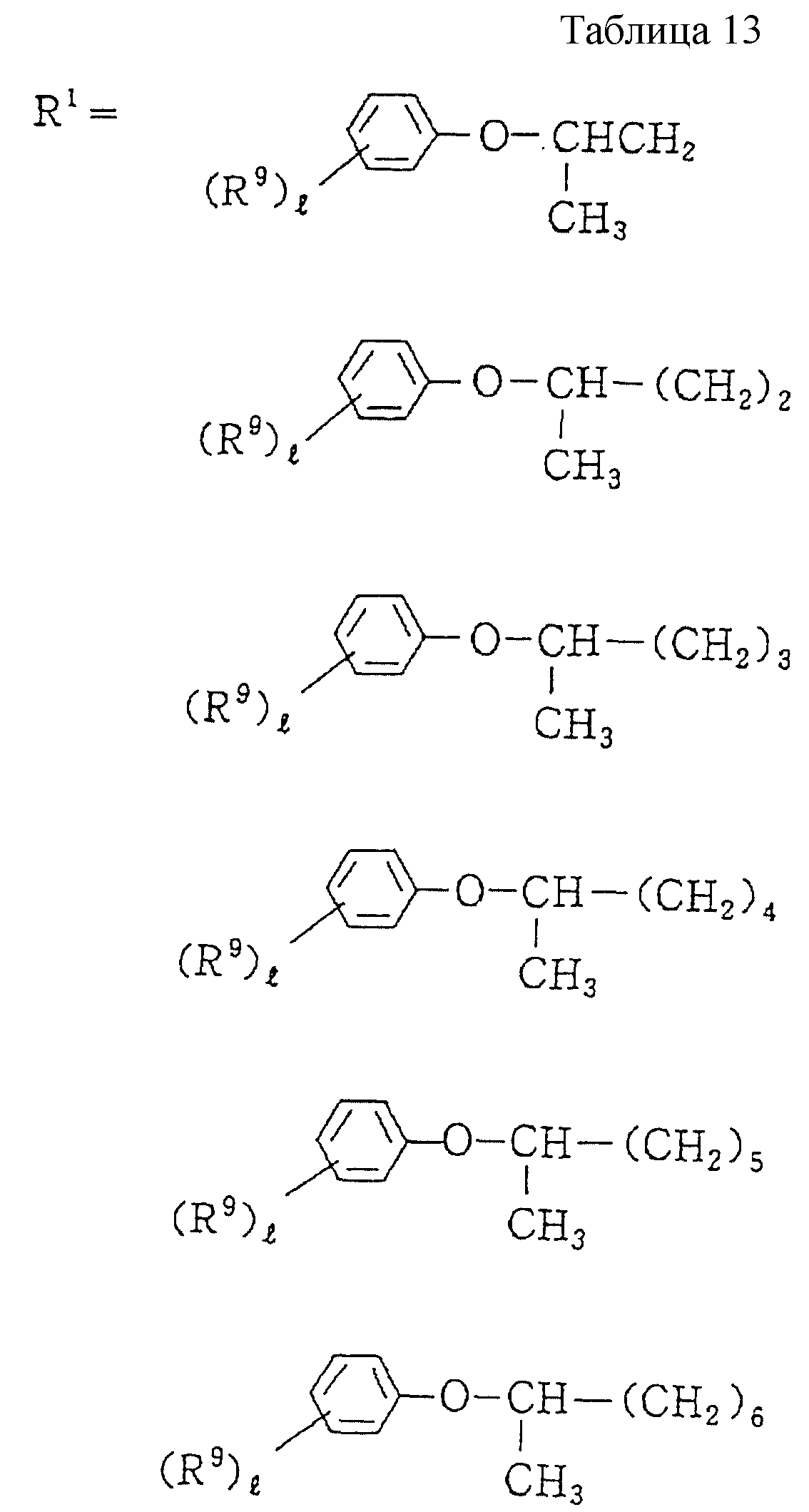

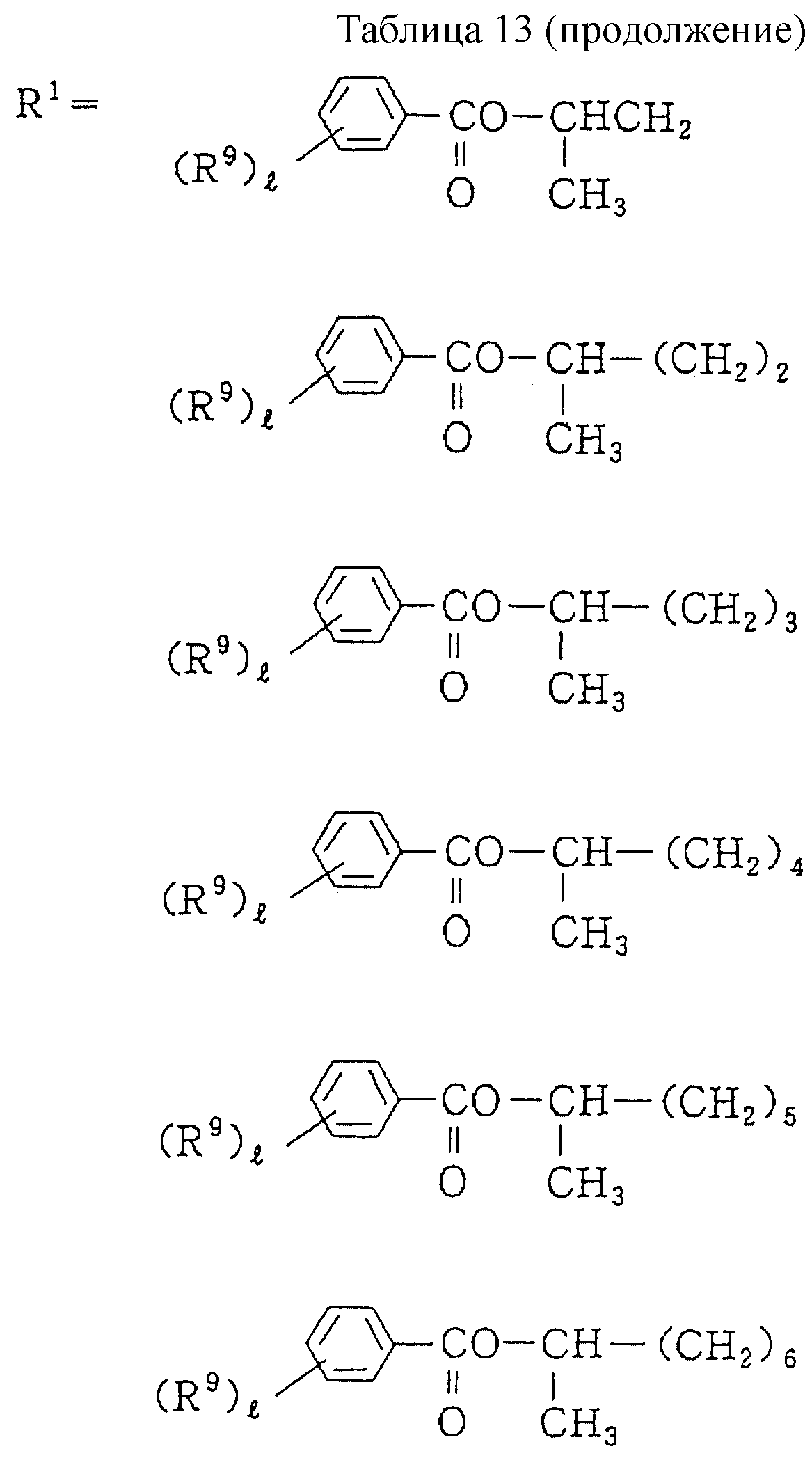

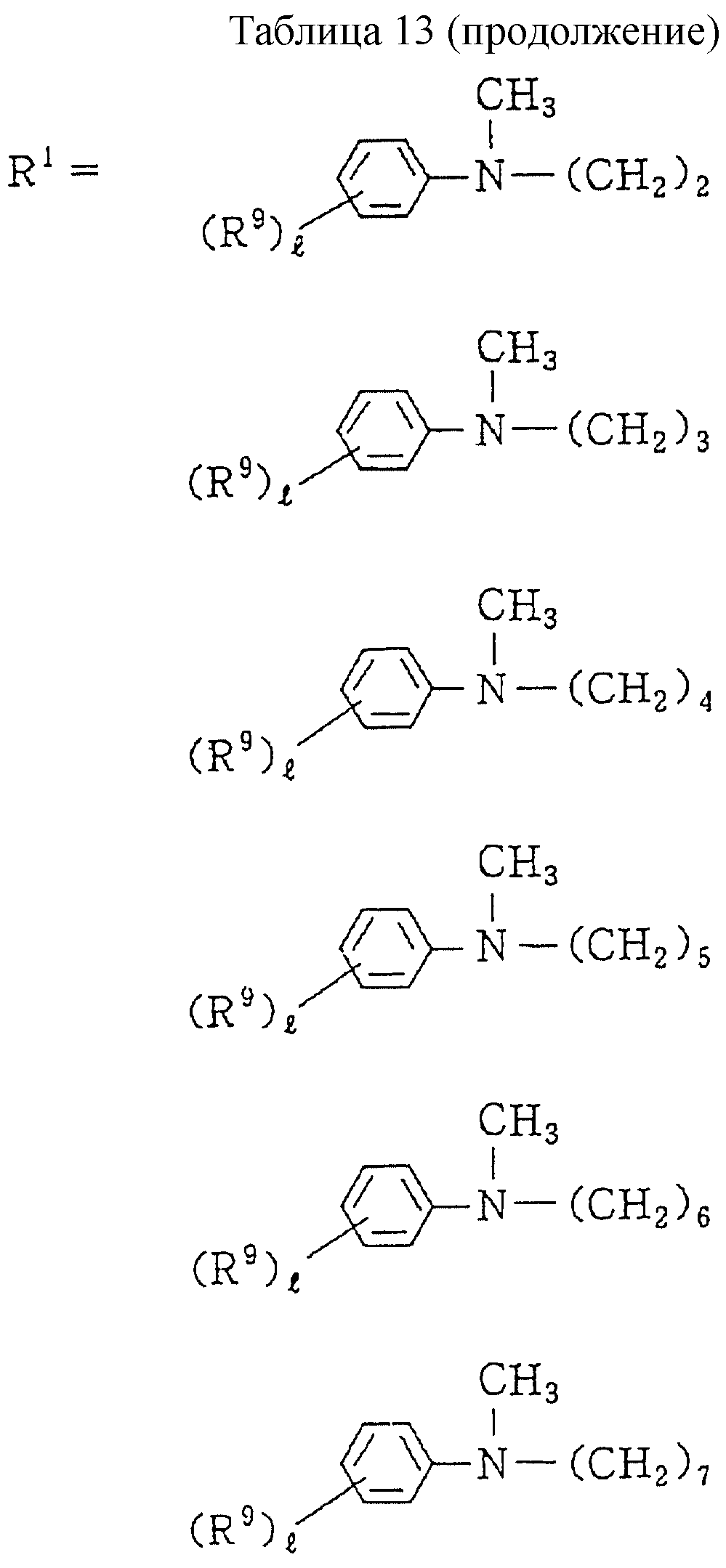
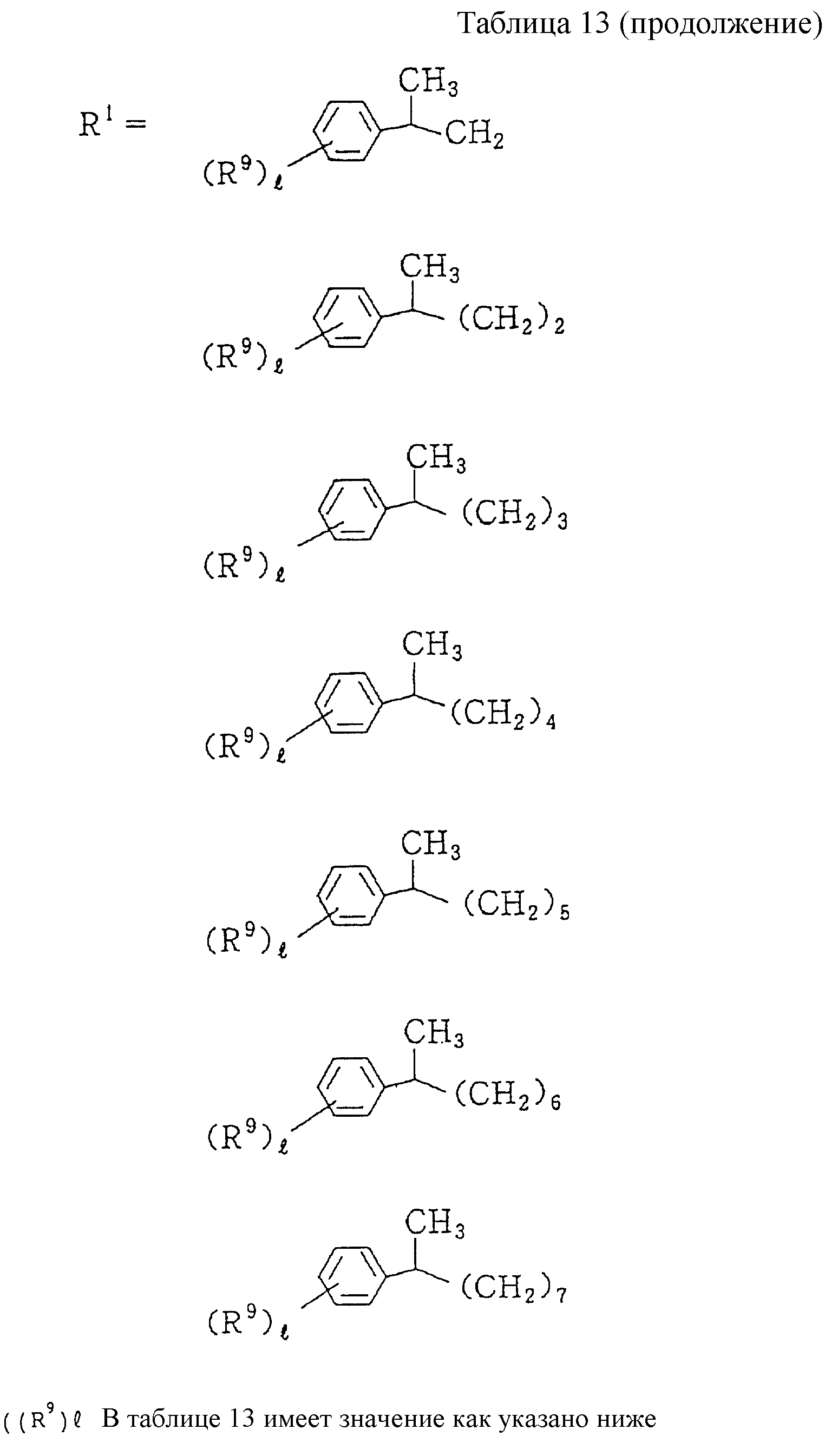










Описание
Изобретение относится к дигалоидпропеновым соединениям, инсектицидно-акарицидным средствам, содержащим эти соединения, и к промежуточным соединениям для их получения.
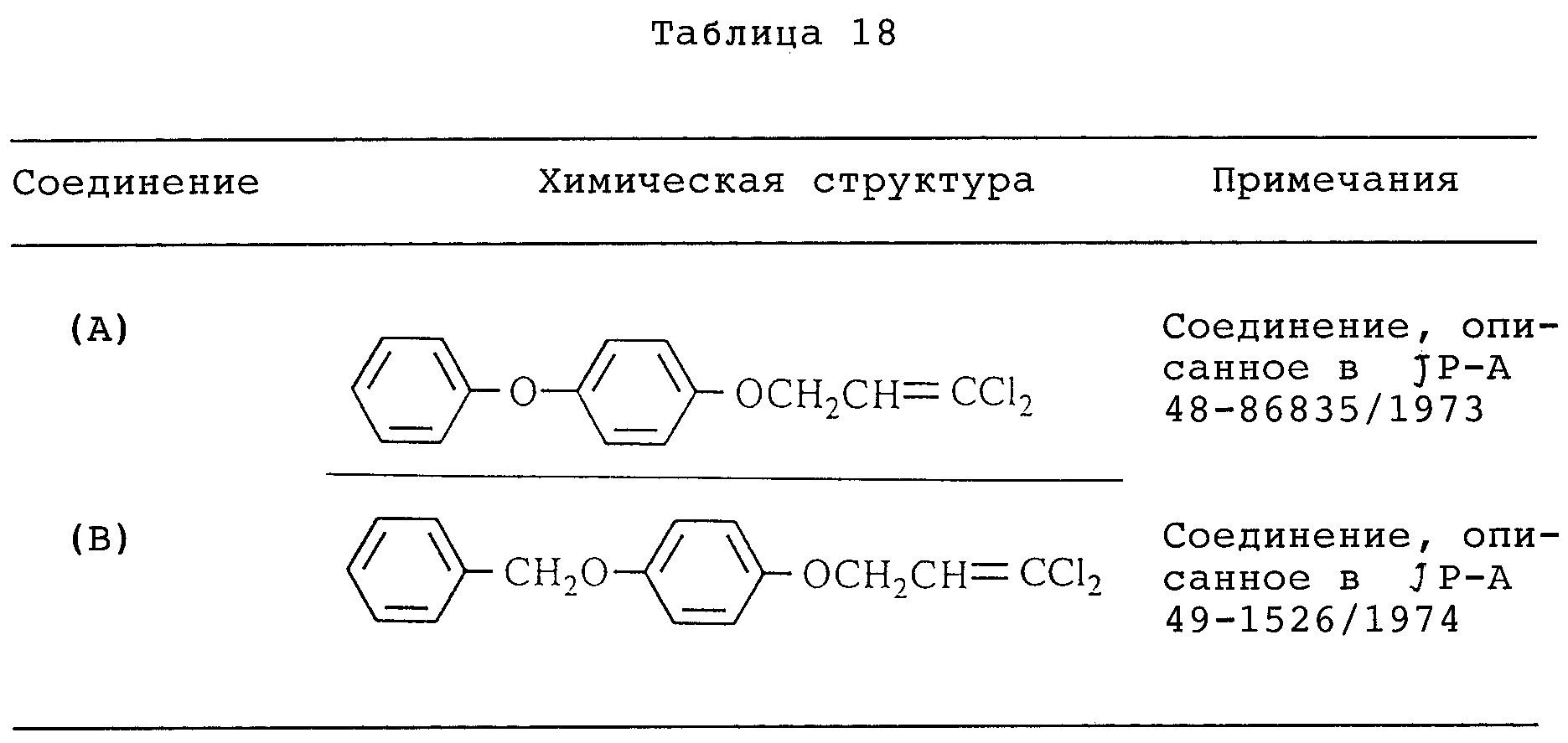
Как описывается в JP-A 48-86835/1973 и JP-A 49-1526/1974, например, хорошо известно, что некоторые виды пропеновых соединений могут использоваться в качестве активных ингредиентов инсектицидов.
Ввиду их инсектицидно-акарицидной активности нельзя утверждать всегда, что данные соединения в удовлетворительной степени активны для борьбы с вредными насекомыми, клещами и иксодовыми клещами.
Настоящие изобретатели провели интенсивные исследования в поиске соединений, имеющих превосходную инсектицидно-акарицидную активность. В результате они обнаружили, что некоторые дигалоидпропеновые соединения обладают удовлетворительной инсектицидно-акарицидной активностью для борьбы с вредными насекомыми, клещами и иксодовыми клещами, и тем самым создали настоящее изобретение.
Изобретение представляет дигалоидпропеновые соединения (называемые здесь далее настоящими
соединениями) общей формулы:

в которой R1 представляет (1-10)C-алкил, (1-5)C-галоидалкил, (2-10)C-алкенил, (2-6)C-галоидалкенил, (3-9)C-алкинил, (3-5)C-галоидалкинил, (2-7)C-алкоксиалкил, (1-3)C-алкокси-(1-7)C-карбонилалкил, (2-7)C-алкинилтиоалкил; (3-6)C-циклоалкил, который может быть замещен (1-4)C-алкилом, (1-3)C-алкокси или (1-3)C-галоидалкокси группой; (4-9)C-циклоалкилалкил, который может быть замещен (1-4)C-алкилом; (5-6)C-циклоалкенил, который может быть замещен (1-4)C-алкилом; (6-8)C-циклоалкенилалкил, который может быть замещен (1-4)C-алкилом; или
Q1, Q2, Q3, Q4, Q5, Q6, Q7, Q8, Q9 или Q10 общей формулы:
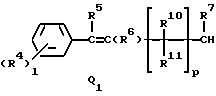

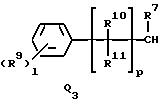

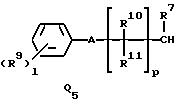


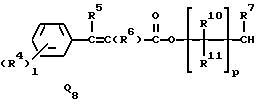
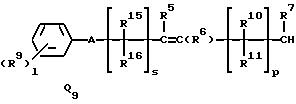
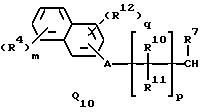
где R4 и R12 представляют независимо галоген, (1-4)C-алкил, (1-3)C-галоидалкил, (1-3)C-алкокси или (1-3)C-галоидалкокси,
R5 и R6 представляют независимо водород, (1-3)C-алкил, трифторметил или галоген,
R7 представляет водород или (1-3)C-алкил,
R8 представляет водород, галоген или метил,
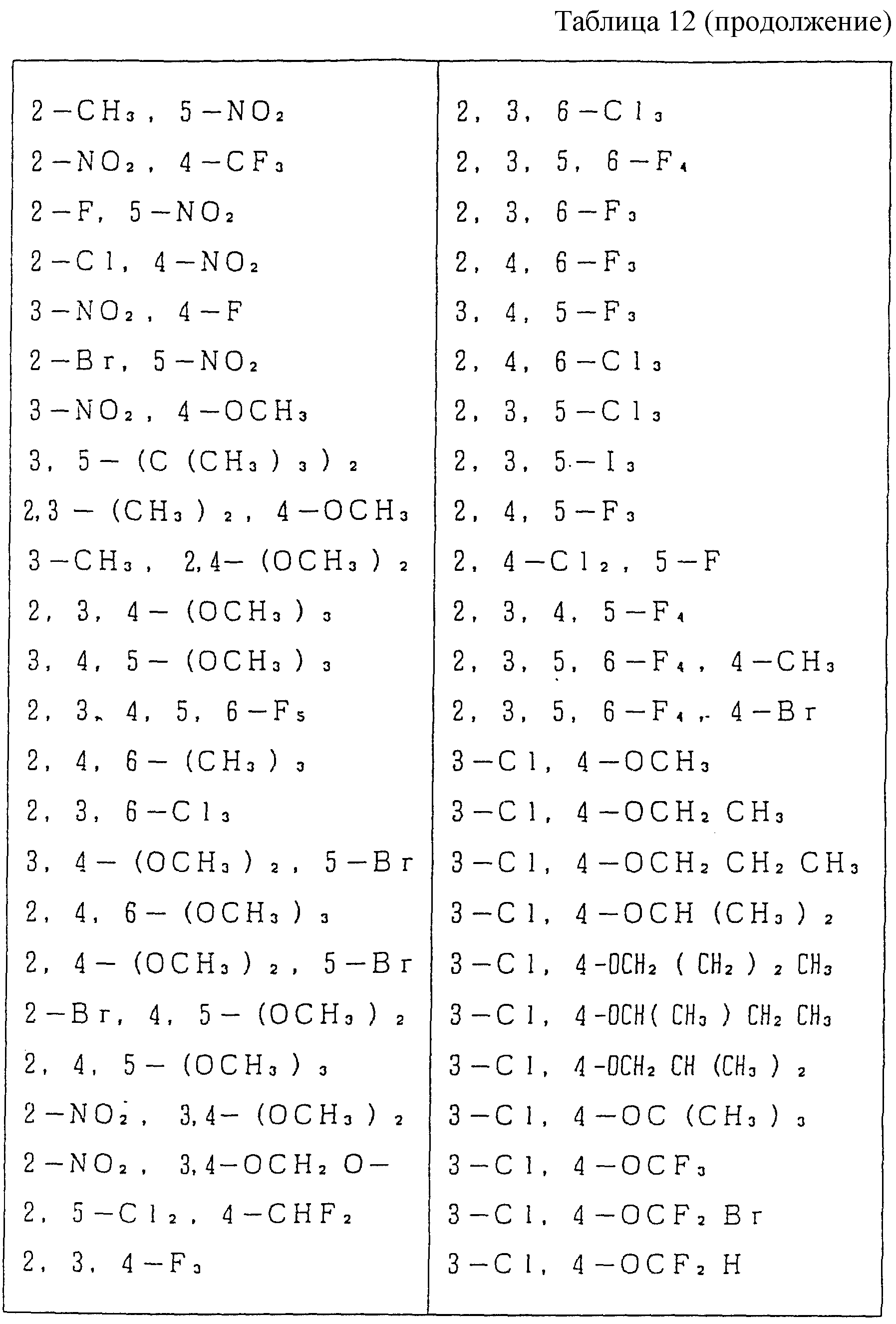
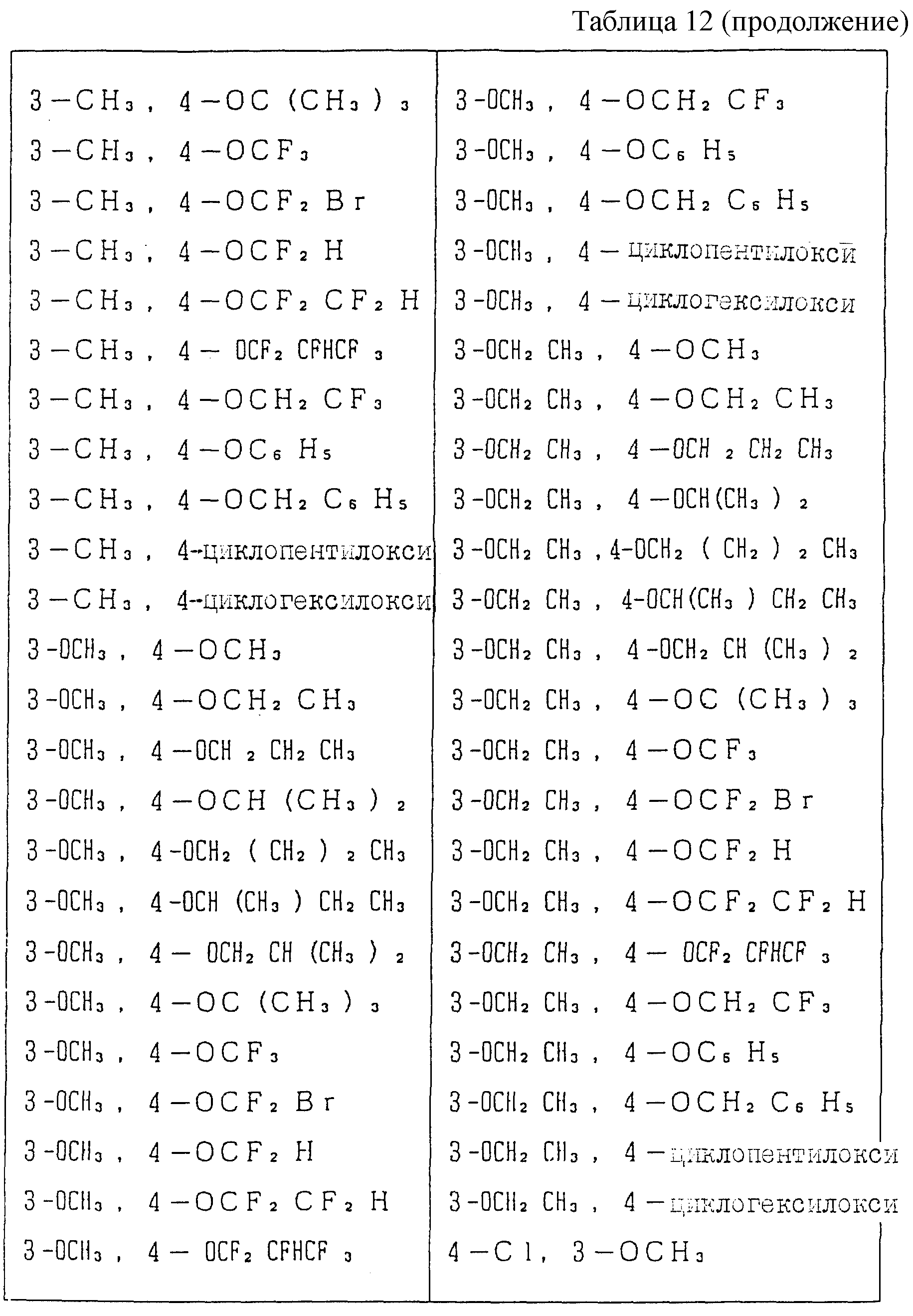
R9 представляет галоген, циано, нитро, гидрокси, пентафторсульфанил (F5S), (1-8)C-алкил, (1-3)C-галоидалкил, (1-8)C-алкокси, (1-3)C-галоидалкокси, (1-3)C-алкилтио, (1-3)C-галоидалкилтио, (3-6)C-алкенилокси, (3-6)C-галоидалкенилокси, (1-3)C-гидроксиалкил, (2-4)C-алкенил, (2-4)C-галоидалкенил, (2-4)C-алкинил, (2-4)C-алкинилокси, (2-4)C-галоидалкинил, (2-4)C-галоидалкинилокси, (2-4)C-алкоксиалкил, (2-4)C-алкилтиоалкил, (3-6)C-циклоалкил, (5-6)C-цилкоалкенил, (2-5)C-алкоксикарбонил, (3-6)C-циклоалкилокси, (5-6)C-циклоалкенилокси; фенил, который может быть замещен галогеном, (1-4)C-алкилом, (1-3)C-галоидалкилом, (1-3)C-алкокси, (1-3)C-галоидалкокси, (3-6)C-алкенилокси или (3-6)C-галоидалкенилокси; фенокси, который может быть замещен галогеном, (1-4)C-алкилом, (1-3)C-галоидалкилом, (1-3)C-алкокси, (1-3)C-галоидалкокси, (3-6)C-алкенилокси или (3-6)C-галоидалкенилокси; бензил, который может быть замещен галогеном, (1-4)C-алкилом, (1-3)C-галоидалкилом, (1-3)C-алкокси, (1-3)C-галоидалкокси, (3-6)C-алкенилокси или (3-6)C-галоидалкенилокси; бензилокси, который может быть замещен галогеном, (1-4)C-алкилом, (1-3)C-галоидалкилом, (1-3)C-алкокси, (1-3)C-галоидалкокси, (3-6)C-алкенилокси или (3-5)C-галоидалкенилокси; или пиридилокси, который может быть замещен галогеном, (1-4)C-алкилом, (1-3)C-галоидалкилом, (1-3)C-алкокси, (1-3)C-галоидалкокси, (3-6)C-алкенилокси или (3-6)C-галоидалкенилокси; или
когда l представляет целое число от 2 до 5, два соседних радикала взяты вместе, образуя триметилен, тетраметилен, метилендиокси, который может быть замещен галогеном или (1-3)C-алкилом; или этилендиокси, который может быть замещен галогеном или (1-3)C-алкилом,
R10, R11, R15 и R16 представляют независимо водород, (1-3)C-алкил или трифторметил,
A представляет кислород, S(O)t, NR13, C(=G1)G2 или G1C(=G2), где G1 и G2 представляют независимо кислород или серу, R13 представляет водород, ацетил или (1-3)C-алкил и t представляет целое число от 0 до 2,
Z1 представляет кислород, серу или NR17, где R17 представляет водород, ацетил или (1-3)C-алкил,
l представляет целое число от 0 до 5,
m представляет целое число от 0 до 4,
n представляет целое число 1 или 2,
p представляет целое число от 0 до 6,
q представляет целое число от 0 до 3, и
s представляет целое число от 0 до 6,
R2, R3 и R14 представляют независимо галоген, (1-3)C-галоидалкил или (1-3)C-алкил,
r представляет целое число от 0 до 2,
X радикалы представляют независимо хлор или бром,
y представляет кислород, NH или серу, и
Z представляет кислород, серу или NR13, где R13 представляет водород, ацетил или (1-3)C-алкил.
Настоящее изобретение представляет также инсектицидно-акарицидное средство, содержащее указанное выше дигалоидпропиленовое соединение в качестве активного ингредиента.
Настоящее изобретение далее предоставляет следующие соединения, которые полезны в
качестве промежуточных соединений для получения некоторых из настоящих соединений:
соединения общей формулы:
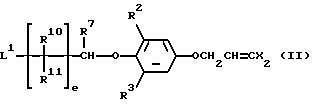
в которой R2 и R3 независимо представляют галоген, (1-3)C-алкил или (1-3)C-галоидалкил;
R7 представляет водород или (1-3)C-алкил;
R10 и R11 представляют независимо водород, (1-3)C-алкил или трифторметил;
радикалы X представляют независимо хлор или бром;
L1 представляет гидрокси, галоген, метансульфонилокси или п-толуолсульфонилокси; и
e представляет целое число от 2 до 4;
и особенно соединения, в которых R7, R10 и R11 все представляют водород и e представляет 2 или 3;
соединения общей формулы:
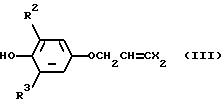
в которой R2 и R3 независимо представляют галоген, (1-3)C-алкил или (1-3)C-галоидалкил; и
радикалы X представляют независимо хлор или бром;
соединения общей формулы:

в которой R21 и R22 представляют независимо галоген или (1-3)C-алкил;
R19 представляет галоген, (1-3)C-галоидалкокси или трифторметил;
u представляет целое число от 1 до 4, и
l представляет целое число от 1 до 5;
соединение общей формулы:

в которой R2 и R3 представляют независимо галоген, (1-3)C-алкил или (1-3)C-галоидалкил;
R7 представляет водород или (1-3)C-алкил;
R10 и R11 представляют независимо водород; (1-3)C-алкил или трифторметил;
R20 представляет галоген, (1-3)C-алкокси, трифторметил или (1-3)C-галоидалкокси;
l представляет целое число от 1 до 5, и
e представляет целое число от 1 до 4;
и особенно соединения, в которых B представляет кислород; соединения, в которых R2 и R3 представляют независимо галоген или (1-3)C-алкил; R7, R10 и R11 все представляют водород, e представляет целое число от 1 до 4, и B представляет кислород, S(O)t или NR13, где R13 представляет водород, ацетил или (1-3)C-алкил и t представляет целое число от 0 до 2.
Подробное описание изобретения
Переменные в приведенных выше формулах для
настоящих соединений и их промежуточных соединений могут иметь в качестве примеров следующие конкретные значения.
Примерами атома галогена, представленного радикалами R2, R3, R4, R5, R6, R8, R9 или R12 или присутствующего в R9, являются фтор, хлор, бром или иод.
Примерами (1-10)C-алкильной группы, представленной R1, являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, трет-пентил, н-гексил, н-гептил, изогексил, н-октил, н-нонил, н-децил, 3-н-пентил, 2-этилбутил, 1-метилпентил, 1-этилбутил, 3-метилпентил, 1,3-диметилбутил, 1-метилгептил и 1-метилоктил.
Примерами (1-4)C-алкильной группы, присутствующей в R1 или R9, или представленной радикалами R4 или R12, являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил.
Примерами (1-3)C-алкильной группы, представленной радикалами R2, R3, R5, R6, R7, R10, R11, R13, R14, R15 или R16, являются метил, этил, н-пропил и изопропил.
Примерами (1-8)C-алкильной группы, представленной R9, являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, трет-пентил, 1-этилпропил, н-гексил, изогексил, 2-этилбутил, 1-метилпентил, 1-этилбутил, 3-метилпентил, 1,3-диметилбутил, н-гептил, н-октил и 1-метилгептил.
Примерами (1-5)C-галоидальной группы, представленной R1, являются трифторметил, дифторметил, бромдифторметил, 2,2,2-трифторэтил, перфторэтил, 2-фторэтил, 2-хлорэтил, 2-бромэтил, 2-иодэтил, 2,2-дихлорэтил, 2-бром-1,1,2,2-тетрафторэтил, 1,1,2,2-тетрафторэтил, 2-хлор-1,1,2-трифторэтил, 2-бром-1, 1,2-трифторэтил, 2,2,2-трихлорэтил, 2,2,2-трибромэтил, 3-хлорпропил, 3-бромпропил, 3-фторпропил, 3-иодпропил, 3,3,3-трифторпропил, 2,2,3,3,3-пентафторпропил, 1,1,2,3,3,3-гексафторпропил, 2-хлорпропил, 1-хлор-1-метилэтил, 1-бром-1-метилэтил, 2-фтор-1-(фторметил)этил, 2-хлор-1-(хлорметил)этил, 2-бром-1-(бромметил)этил, 2,2,2-трифтор-1-(трифторметил)этил, 2,3-дибромпропил, 4-фторбутил, 4-бромбутил, 4-хлорбутил, 4-иодбутил, 4-(бромбутил)пропил, 3-хлор-2,2-диметил-н-пропил, 3-бром-2,2-диметилпропил, 2,2,3,4,4,4-гексафторбутил, 3-бром-1-(бромметил)пропил и 2,2,3,3,4,4,5,5-октафторпентил.
Примерами (1-3)C-галоидальной группы, представленной R2, R3, R4, R9 и R14, и присутствующей в R9, являются трифторметил, дифторметил, бромдифторметил, 2,2,2-трифторэтил, 2-фторэтил, 2-хлорэтил, 2-бромэтил, 1-фторэтил, 1-хлорэтил, 1-бромэтил, 2,2,3,3,3-пентафторпропил, 3,3,3-трифторпропил, 1-фторпропил, 2-хлорпропил и 3-бромпропил.
Примерами (2-10)C-алкильной группы, представленной R1, являются винил, аллил, гомоаллил, изопропенил, 2-бутенил, 1-метил-2-пропенил, 2-метил-2-пропенил, 3-метил-3-бутенил, 1-этил-2-пропенил, 2-этил-2-пропенил, 2-пентенил, 2-метил-2-бутенил, 1-метил-2-бутенил, 2-метил-3-бутенил, 4-пентенил, 1-метил-3-бутенил, 1-этил-2-пропенил, 1-пропил-2-пропенил, 3-гексенил, 2-изопропил-2-пропенил, 2-этил-2-бутенил, 2-метил-2-пентенил, 1-этил-2-бутенил, 1-метил-4-пентенил, 1,3-диметил-2-бутенил, 2-гексенил, 4-гексенил, 5-гексенил, 1-н-пропил-2-пропенил, 1-аллил-3-бутенил, 2-гектенил, 1,5-диметил-4-гексенил, 1-пентенил-2-пропенил, 1,7-диметил-6-октенил и геранил.
Примерами (2-6)C-галоидалкенильной группы, представленной R1, являются 2-хлорэтенил, 2,2-дихлорэтенил, 3-хлор-2-пропенил, 3-бром-2-пропенил, 2-хлор-2-пропенил, 2-бром-2-пропенил, 3,3-дихлор-2-пропенил, 3,3-дибром-2-пропенил, 3,3-дифтор-2-пропенил, 2-(хлорметил)-2-пропенил, 4-хлор-2-бутенил. 4-бром-2-бутенил, 3-хлор-4,4,4-трифтор-2-бутенил, 4-бром-3-фтор-4,4-дифтор-2-бутенил, 3,4,4,4-тетрафтор-2-бутенил, 4,4-дихлор-3-бутенил, 4, 4-дибром-3-бутенил, 3-хлор-2-бутенил и 6,6-дихлор-5-гексенил.
Примерами (2-4)C-алкенильной группы, представленной R9, являются винил, изопропенил, 1-пропенил, 2-метил-1-пропенил, 1-метил-1-пропенил, аллил, 2-метил-2-пропенил и 2-бутенил.
Примерами (2-4)C-галоидалкенильной группы, представленной R9, являются 2,2-дихлорэтенил, 2, 2-дибромэтенил, 3,3-дихлораллил, 3,3-дибромаллил, 2,3-дихлораллил, 2,3-дибромаллил, 2-хлор-2-пропенил, 3-хлор-2-пропенил, 2-бром-2-пропенил и 3-хлор-2-бутенил.
Примерами (3-9)C-алкинильной группы, представленной R1, являются 2-пропинил, 1-метил-2-пропинил, 2-бутинил, 3-бутинил, 2-метил-3-бутинил, 1-метил-3-бутинил, 2-пентинил, 4-пентинил, 3-пентинил, 1-этил-2-пропинил, 2-гексинил, 3-гексинил, 5-гексинил, 1-пентил-2-пропинил и 3-нонинил.
Примерами (3-5)C-галоидальной группы, представленной R1, являются 3-хлор-2-пропинил, 3-бром-2-пропинил, 4-хлор-2-бутинил, 3-хлор-1-метил-2-пропинил, 3-бром-1-метил-2-пропинил, 4-хлор-3-бутинил, 4-бром-3-бутинил, 4-хлор-2-метил-3-бутинил, 4-бром-2-метил-3-бутинил, 1-метил-4-хлор-3-бутинил, 1-метил-3-бром-3-бутинил, 5-хлор-4-пентинил, 5-бром-4-пентинил, 1-этил-3-хлор-2-пропинил и 1-этил-3-бром-2-пропинил.
Примерами (2-4)C-алкинильной группы, представленной R9, являются этинил, 1-пропинил, 2-пропинил и 1-метил-2-пропинил.
Примерами (2-4)C-галоидалкинильной группы, представленной R9, являются хлорэтинил, бромэтинил, иодэтинил, 3-хлор-2-пропинил, 3-бром-2-пропинил, 3-иод-2-пропинил, 1-метил-3-хлор-2-пропинил, 1-метил-3-бром-2-пропинил и 1-метил-3-иод-2-пропинил.
Примерами (2-4)C-алкинилокси группы, представленной R9, являются этинилокси, 1-пропинилокси, 2-пропинилокси и 1-метил-2-пропинилокси.
Примерами (2-4)C-галоидалкинилокси группы, представленной R9, являются хлорэтинилокси, 3-хлор-2-пропинилокси, 3-бром-2-пропинилокси, 1-метил-3-хлор-2-пропинилокси и 1-метил-3-бром-2-пропинилокси.
Примерами (2-7)C-алкоксиалкильной группы, представленной R1, являются метоксиметил, 2-метоксиэтил, этоксиметил, изопропоксиметил, н-пропоксиметил, 1-метоксиэтил, 2-этоксиэтил, 1-этоксиэтил, 3-метоксипропил, 2-метоксипропил, 1-метоксипропил, 2-метокси-1-метилэтил, н-пропоксиэтил, 2-этоксипропил, 2-этокси-1-метилэтил, 2-метоксибутил, 2-метокси-1-этилэтил, 3-окэтоксипропил, 3-метокси-н-бутил, 3-метокси-2-метилпропил, 3-метокси-1-метилпропил, 2-изопропоксиметил, 3-метоксибутил, 3-метил-3-метоксибутил, 2-бутоксиэтил и 2-бутокси-1-метилэтил.
Примерами (2-4)C-алкоксиалкильной группы, представленной R9, являются метоксиметил, этоксиметил, н-пропилоксиметил, изопропилоксиметил, 2-метоксиэтил, 1-метоксиэтил, 2-этоксиэтил, 1-этоксиэтил, 3-метоксипропил, 2-метоксипропил, 1-метоксипропил и 2-метокси-1-метилэтил.
Примерами (2-7)C-алкилтиоалкильной группы, представленной R1, являются метилтиометил, этилтиометил, 2-метилтиоэтил, 1-метилтиоэтил, пропилтиометил, изопропилтиометил, 2-этилтиоэтил, 1-этилтиоэтил, 3-(метилтио)пропил, 2-(метилтио)пропил, 1-(метилтио)пропил, 1-метил-2-метилтиоэтил, 2-изопропилтиоэтил, 2-(пропилтио)этил, 2-метилтио-1,2-диметилэтил, 2-(метилтио)бутил, 1-этил-2-метилтиоэтил, 2-(этилтио)пропил, 2-этилтио-1-метилэтил, 3-(этилтио)пропил, 3-(метилтио)бутил, 2-(метилтио)бутил, 2-метил-3-(метилтио)пропил, 1-метил-3-(метилтио)пропил, 2-трет-бутилтиоэтил, 2-изобутилтиоэтил, 2-вторбутилтиоэтил, 3-(трет-бутилтио)пропил, 3-(изобутилтио)пропил и 3-(втор-бутилтио)пропил.
Примерами (2-4)C-алкилтиоалкильной группы, представленной R9, являются метилтиометил, этилтиометил, пропилтиометил, изопропилтиометил, 2-метилтиоэтил, 1-метилтиоэтил, 2-этилтиоэтил, 3-метилтиопропил, 2-метилтиопропил, 1-метилтиопропил и 2-метилтио-1-метилэтил.
Примерами (3-6)C-циклоалкильной группы, представленной R1, которая может быть замещена (1-4)C-алкильной, (1-3)C-алкокси или (1-3)C-галоидалкокси группой, являются циклопропил, циклобутил, 2-метоксициклопентил, 2-этоксициклопентил, 2-пропоксициклопентил, 2-изопропоксициклопентил, 2-бутоксициклопентил, 2-изобутилоксициклопентил, 2-втор-бутилоксициклопентил, 2-трет-бутилоксициклопентил, циклопентил, 2-метилциклопентил, 2-метилциклопентил, 3-метоксициклогексил, 3-этоксициклогексил, 3-пропоксициклогексил, 3-изопропоксициклогексил, 3-бутоксициклогексил, 3-изобутилоксициклогексил, 3-втор-бутилоксициклогексил, 3-трет-бутилоксициклогексил, 4-этоксициклогексил, 4-пропоксициклогексил, 4-изопропоксициклогексил, 4-бутоксициклогексил, 4-изобутилоксициклогексил, 4-втор-бутилоксициклогексил и 4-трет-бутилоксициклогексил.
Примерами (4-9)C-циклоалкилалкильной группы, представленной R1, которая может быть замещена (1-4)C-алкилом, являются циклопропилметил, циклобутилметил, 1-циклопропилэтил, 2-метилциклопропилметил; 2-(2-метилциклопропил)этил, циклопентилметил, циклогексилметил, 2-циклогексилэтил, 3-циклопентилпропил и 3-циклогексилпропил.
Примерами (5-6)C-циклоалкенильной группы, представленной R1, которая может быть замещена (1-4)C-алкилом, являются 2-циклогексенил, 3,5,5-триметил-2-циклогексенил, 3-метил-2-циклогексенил, 3-циклогексенил, 2-циклогептенил и 3-циклопентенил.
Примерами (6-8)C-циклоалкенилалкильной группы, представленной R1, которая может быть замещена (1-4)C-алкилом, являются (1-циклопентенил)метил, (3-циклогексенил)метил и 2-(3-циклогексенил)этил.
Примерами (3-6)C-циклоалкильной группы, представленной R9, являются циклопропил, циклобутил, циклопентил и циклогексил.
Примерами (5-6)C-циклоалкенильной группы, представленной R9, являются 1-циклопентенил, 2-циклопентенил, 3-циклопентенил, 1-циклогексенил, 2-циклогексенил и 3-циклогексенил.
Примерами (3-6)C-циклоалкилокси группы, представленной R9, являются циклопропилокси, циклобутилокси, циклопентилокси и циклогексилокси.
Примерами (5-6)C-циклоалкенилокси группы, представленной R9, являются 1-циклопентенилокси, 2-циклопентенилокси, 3-циклопентенилокси, 1-циклогексенилокси, 2-циклогексенилокси и 3-циклогексенилокси.
Примерами (1-3)C-алкокси группы, присутствующей в R1 или R9, или представленной R4 или R12, являются метокси, этокси, н-пропокси и изопропокси.
Примерами (1-3)C-алкокси (1-7)C-карбонилалкильной группы, представленной R1, являются 1-(этоксикарбонил)метил, 1-(метоксикарбонил)метил, 1-(н-пропоксикарбонил)метил, 2-(метоксикарбонил)этил, 1-(изопропоксикарбонил)метил, 3-(метоксикарбонил)пропил, 4-(метоксикарбонил)бутил, 5-(метоксикарбонил)пентил, 6-(метоксикарбонил)гексил и 7-(метоксикарбонил)гептил.
Примерами (1-8)C-алкокси группы, представленной R9, являются метокси, этокси, пропокси, изопропокси, н-бутокси, втор-бутокси, изобутокси, трет-бутокси, н-пентилокси, изопентилокси, неопентилокси, трет-пентилокси, (1-этилпропил)окси, н-гексилокси, октилокси и н-гептилокси.
Примерами (1-3)C-галоидалкокси группы, присутствующей в R1 или представленной R4 или R9, являются трифторметокси, дифторметокси, бромдифторметокси, 2-фторэтокси, 2,2,2-трифторэтокси, 2-хлорэтокси, 2-бромэтокси, 2-хлор-1,1,2-трифторэтокси, 2-бром-1,1,2-трифторэтокси, 1,1,2, 2-тетрафторэтокси, 1,2,2,3,3,3-гексафторпропокси, 3-фторпропокси, 3-хлорпропокси, 3-бромпропокси, 2,2,3,3,3-пентафторпропокси, 3,3,3-трифторпропокси и 1,1,2,2,2-пентафторэтокси.
Примерами (1-3)C-алкилтио группы, представленной R9, являются метилтио, этилтио, н-пропилтио и изопропилтио.
Примерами (1-3)C-галоидалкилтио группы, представленной R9, являются трифторметилтио, дифторметилтио, бромдифторметилтио, 2,2,2-трифторэтилтио, 2-хлор-1,1,2-трифторэтилтио, 2-бром-1,1,2-трифторэтилтио, 1,1,2,2-тетрафторэтилтио, 2-хлорэтилтио, 2-фторэтилтио, 2-бромэтилтио, 3-фторпропилтио, 3-хлорпропилтио, (3-бромпропил)тио, 2,2,3,3,3-пентафторпропилтио и 3,3,3-трифторпропилтио.
Примерами (3-6)C-алкенилокси группы, представленной R9, являются аллилокси, 2-метилаллилокси, 2-бутенилокси, 3-метил-2-бутенилокси, 2-метил-2-бутенилокси, 2-пентилокси и 2-гексенилокси.
Примерами (3-6)C-галоидалкенилокси группы, представленной R9, являются 3,3-дихлораллилокси, 3,3-дибромаллилокси, 2,3-дихлораллилокси, 2,3-дибромаллилокси, 2-хлор-2-пропенилокси, 3-хлор-2-пропенилокси, 2-бром-2-пропенилокси и 3-хлор-2-бутенилокси.
Примерами (1-3)C-гидроксиалкильной группы, представленной R9, являются гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил, 3-гидроксипропил, 2-гидроксипропил и 1-гидроксипропил.
Примерами (2-5)C-алкоксикарбонильной группы, представленной R9, являются метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропокси, н-бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил и трет-бутоксикарбонил.
Нижеследующие соединения являются предпочтительными примерами
настоящих соединений:
дигалоидпропеновые соединение, в которых R2 и R3 представляют независимо галоген или (1-3)C-алкил и r представляет 0;
дигалоидпропеновые
соединение, в которых R2 и R3 представляют независимо хлор, бром, метил, этил или изопропил и r представляет 0;
дигалоидпропеновые соединение, в которых R2 и
R3 оба представляют хлор и r представляет 0;
дигалоидпропеновые соединение, в которых R2 представляет хлор, R3 представляет метил и r представляет 0;
дигалоидпропеновые соединение, в которых R2 представляет этил, R3 представляет метил и r представляет 0;
дигалоидпропеновые соединение, в которых R2 и R3 оба представляют бром и r представляет 0;
дигалоидпропеновые соединение, в которых R2 и R3 оба представляют этил и r представляет O;
дигалоидпропеновые
соединение, в которых R2 и R3 представляют независимо галоген или (1-3)C-алкил, r представляет 1 или 2 и R14 представляет галоген или (1-3)C-алкил;
дигалоидпропеновые соединение, в которых R2 и R3 представляют независимо галоген или (1-3)C-алкил, r представляет 1 или 2 и R14 представляет галоген;
дигалоидпропеновые соединение, в которых Y и Z представляют оба кислород;
дигалоидпропеновые соединение, в которых R1 представляет Q3;
дигалоидпропеновые
соединение, в которых R1 представляет Q3, p представляет O и R9 представляет галоген, (1-4)C-алкил, (1-3)C-галоидалкил, (1-4)C-алкокси, (1-3)C-галоидалкокси,
(1-3)C-алкилтио, (1-3)C-галоидалкилтио, циано, нитро или 3,4-метилендиокси;
дигалоидпропеновые соединение, в которых R1 представляет Q3, p представляет O и R9
представляет фенил, который может быть замещен галогеном, пентафторсульфанилом, (1-4)C-алкилом, (1-3)C-галоидалкилом, (1-3)C-алкокси или (1-3)C-галоидалкокси; бензил, который может быть замещен
галогеном, пентафторсульфанилом, (1-4)C-алкилом, (1-3)C-галоидалкилом, (1-3)C-алкокси или (1-3)C-галоидалкокси; фенокси, который может быть замещен галогеном, пентафторсульфанилом, (1-4)C-алкилом,
(1-4)C-галоидалкилом, (1-3)C-алкокси или (1-3)C-галоидалкокси; или бензилокси, который может быть замещен галогеном, пентафторсульфанилом, (1-4)C-алкилом, (1-3)C-галоидалкилом, (1-3)C-алкокси или
(1-3)C-галоидалкокси;
дигалоидпропеновые соединения, в которых R1 представляет Q3, p представляет от 1 до 3, R10 и R11 оба представляют водород, и
R9 представляет галоген, трифторметил, пентафторсульфанил или (1-3)C-галоидалкокси;
дигалоидпропеновые соединения, в которых R1 представляет Q5;
дигалоидпропеновые соединения, в которых R1 представляет Q5, p представляет от 1 до 4, R10 и R11 оба представляют водород и R9 представляет
галоген, трифторметил, (1-3)C-галоидалкокси, дифторметилендиокси или пентафторсульфанил;
дигалоидпропеновые соединения, в которых R1 представляет Q5, p представляет 2
или 3, R10 и R11 оба представляют водород, R9 - галоген, трифторметил, изопропилокси, (1-3)C-галоидалкокси, пентафторсульфанил или дифторметилендиокси, и A
представляет кислород;
дигалоидпропеновые соединения, в которых R1 представляет Q5, p представляет 2 или 3, R10 и R11 оба представляют водород,
R9 представляет галоген, трифторметил, изопропилокси или (1-3)C-галоидалкокси, и A - кислород; и
дигалоидпропеновые соединения, в которых R1 представляет (1-10)C-алкил,
(1-5)C-галоидалкил, (2-10)C-алкенил, (2-6)C-галоидалкенил, (3-9)C-алкинил, (3-5)C-галоидалкинил, (2-7)C-алкоксиалкил, (1-3)C-алкокси-(1-7)C-карбонилалкил или (2-7)C-алкилтиоалкил; (3-6)C-циклоалкил,
который может быть замещен (1-4)C-алкилом, (1-3)C-алкокси или (1-3)C-галоидалкокси; (4-9)C-циклоалкилалкил, который может быть замещен (1-4)C-алкилом; (5-6)C-циклоалкенил, который может быть замещен
(1-4)C-алкилом; или (6-8)C-циклоалкенилалкил, который может быть замещен (1-4)C-алкилом.
Следующие ниже являются особенно предпочтительными примерами настоящих соединений, где номера в
скобках являются номерами соответствующих соединений, используемых ниже:
(100) 3,5-Дихлор-4-(3-(4-трифторметоксифенокси)пропилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол,
(166) 3,
5-Дихлор-4-(3-(4-трифторметилфенокси)пропилокси)-
1-(3,3-дихлор-2-пропенилокси)бензол,
(203) 3,5-Дихлор-4-(4-(4-изопропилоксифенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол,
(222) 3,5-Дихлор-4-(4-(4-хлорфенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, и
(284) 3-Этил-5-метил-4-(3-(4-трифторметилфенокси)пропилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол.
Настоящие соединения могут получаться, например, с помощью следующих процессов получения A - G.
(Процесс получения A)
По данному процессу соединение общей
формулы:
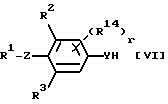
в которой R1, R2, R3, R14, Y и Z каждый имеет значения, определенные выше, подвергается реакции с галогенидными соединениями общей формулы:
L - CH2CH = CX2 (VII)
где X имеет значения, определенные выше, и
L представляет галоген (например, хлор, бром, иод), мезилокси или тозилокси.
Реакция предпочтительно проводится в инертном растворителе в присутствии подходящего основания.
Примерами растворителя, который может использоваться, являются кетоны, такие как ацетон, метилэтилкетон и циклогексанон; простые эфиры, такие как 1,2-диметоксиэтан, тетрагидрофуран, диоксан и диалкиловый (например, (1-4)C) эфир (например, диэтиловый эфир, диизопропиловый эфир); N,N-диметилформамид, диметилсульфоксид, гексаметилфосфорный триамид, сульфолан, ацетонитрил, нитрометан; галоидированные углеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; и вода. Если необходимо, может использоваться смесь этих растворителей.
Примерами оснований, которые могут использоваться, являются гидроокиси щелочных металлов или щелочноземельных металлов, такие как гидроокись лития, гидроокись натрия, гидроокись калия и гидроокись кальция; карбонаты щелочных или щелочноземельных металлов, такие как карбонат лития, карбонат калия, карбонат натрия и карбонат кальция; гидриды щелочных или щелочноземельных металлов, такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция; алкоголяты щелочных металлов (например, (1-4)C), такие как метилат натрия, этилат натрия и трет-бутилат калия, и органические основания, такие как триэтиламин и пиридин. Если необходимо, в реакционную систему могут добавляться катализаторы, такие как аммониевые соли (например, триэтилбензиламмонийхлорид) при соотношении 0,01-1 моль на моль соединения общей формулы (VI).
Температура реакции обычно составляет в интервале -20 - 150oC или точка кипения растворителя, используемого в реакции, предпочтительно -5 - 100oC или точка кипения растворителя, используемого в реакции.
Молярное соотношение исходных материалов и оснований, используемых в реакции, может быть легко определено, а благоприятным является проведение реакции при эквимолярном соотношении или при близком к нему.
После завершения реакции реакционная смесь подвергается обычным процедурам последующей обработки, таким как экстракция органическим растворителем и концентрирование, и может отделяться желаемое соединение настоящего изобретения. Далее, если необходимо, может осуществляться очистка с помощью обычных приемов, таких как хроматография, перегонка или перекристаллизация.
(Процесс получения B соединений
изобретения, в которых Y представляет кислород)
В данном процессе соединение общей формулы (VI) подвергается реакции со спиртовым соединением общей формулы:
HO-CH2
CH=CX2 (VIII)
где X имеет значения, определенные выше.
Реакция предпочтительно проводится в инертном растворителе, если необходимо, в присутствии подходящего дегидратирующего агента.
Примерами дегидратирующих агентов, которые могут использоваться, являются дициклогексилкарбодиимид и диалкил (например, (1-4)C-азодикарбоксилаты (например, диэтилазодикарбоксилат, диизопропилазодикарбоксилат)-триалкил (например, (1-20)C)-фосфин или триарилфосфин (например, трифенилфосфин, триоктилфосфин, трибутилфосфин).
Примерами растворителей, которые могут использоваться, являются углеводороды, такие как бензол, ксилол и толуол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан, и галоидированные углеводороды, такие как четыреххлористый углерод, дихлорметан, хлорбензол и дихлорбензол.
Температура реакции устанавливается обычно в интервале -20oC до 200oC или на уровне точки кипения растворителя, используемого в реакции.
Молярное соотношение исходных материалов и дегидратирующих агентов, используемых в реакции, может быть легко определено, но благоприятно проводить реакцию при эквимолярном соотношении или близко к нему.
После завершения реакции реакционная смесь может подвергаться обычной последующей обработке, такой как экстракция органическим растворителем и концентрирование, и могут выделяться желаемые соединения настоящего изобретения. Далее, может осуществляться очистка с помощью обычных технологических приемов, таких как хроматография, перегонка или перекристаллизация.
(Процесс получения C настоящих соединений, в которых Y-кислород)
В данном процессе
альдегидное соединение общей формулы:
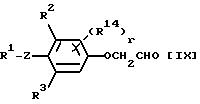
в которой R1, R2, R3, R14, r и Z каждый имеет значения, определенные выше,
подвергается взаимодействию с четыреххлористым углеродом или четырехбромистым углеродом.
Реакция проводится предпочтительно в инертном растворителе в присутствии подходящего триалкилфосфина или триарилфосфина, и, если необходимо, в присутствии металлического цинка.
Примерами растворителей, которые могут использоваться, являются углеводороды, такие как бензол, ксилол и толуол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; и галоидированные углеводороды (исключая четыреххлористый углерод и четырехбромистый углерод), такие как дихлорметан, 1,2-дихлорэтан и хлорбензол.
Температура реакции обычно устанавливается в интервале -30 - 150oC или при точке кипения растворителя, используемого в реакции.
Примерами триалкил (например, (1-20)C)-фосфина или триарилфосфина являются трифенилфосфин и триоктилфосфин. Металлический цинк, который используется, если это необходимо, представлен предпочтительно в форме дуста.
Молярное соотношение исходных материалов и реагентов, используемых в реакции, может быть легко определено, но предпочтительно соотношение является таким, что четыреххлористый или четырехбромистый углерод, триалкилфосфин или триарилфосфин и цинк составляют 2 моля, 2 или 4 моля (2 моля, когда используется цинк) и 2 моля на моль альдегидного соединения общей формулы (IX), или благоприятно проводить реакцию при соотношении, близком к указанному.
После окончания реакции реакционная смесь подвергается обычной последующей обработке, такой как экстракция органическим растворителем и концентрирование, и могут выделяться желаемые соединения настоящего изобретения. Далее может осуществляться очистка с помощью общепринятых приемов, таких как хроматография, перегонка или перекристаллизация.
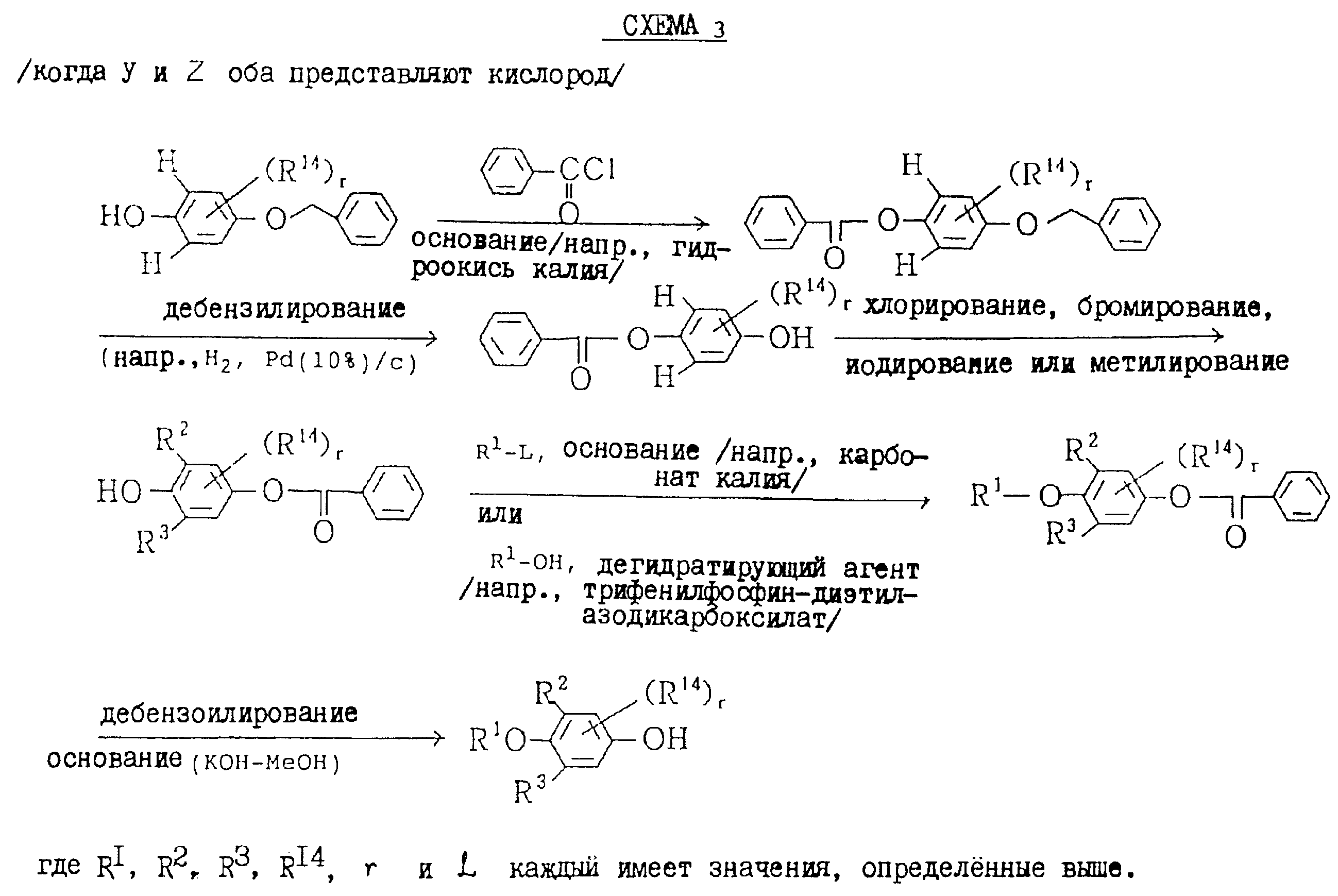
(Процесс
получения D настоящих соединений, в которых Y и Z оба представляют кислород)
В данном процессе соединение общей формулы:

в которой R2, R3, R14, r Y и Z каждый имеет значения, определенные выше,
подвергается реакции с соединением общей формулы:
R1-L (XI)
в которой R1 и L каждый имеет значения, определенные выше.
Реакция предпочтительно проводится в инертном растворителе, в присутствии подходящего основания.
Примерами растворителей, которые могут использоваться, являются кетоны, такие как ацетон, метилэтилкетон и циклогексанон; простые эфиры, такие как 1, 2-диметоксиэтан, тетрагидрофуран, диоксан; и диалкил (например, (1-4)C)-эфиры (например, диэтиловый эфир, диизопропиловый эфир); N,N-диметилформамид, диметилсульфоксид, гексаметилфосфорный триамид, сульфолан, ацетонитрил, нитрометан; галоидированные углеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; и вода. Если необходимо, может использоваться смесь этих растворителей.
Примерами оснований, которые могут использоваться, являются гидроокиси щелочных или щелочноземельных металлов, таких как
гидроокись лития, гидроокись натрия,
гидроокись калия и гидроокись кальция; карбонаты щелочных и щелочноземельных металлов, такие как карбонат лития, карбонат калия, карбонат натрия и
карбонат кальция; гидриды щелочных и щелочноземельных металлов, такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция; алкоголяты щелочных металлов (например, (1-4)C-алкоголяты), такие
как метилат натрия, этилат натрия и трет-бутилат калия; органические основания, такие как триэтиламин и пиридин. Если необходимо, в реакционную систему могут добавляться катализаторы, такие как
аммониевые соли (например, триэтилбензиламмонийхлорид) в соотношении 0,01 - 1 моль на моль соединения общей формулы (X).
Температура реакции обычно устанавливается в интервале -20 - 150oC или при точке кипения используемого в реакции растворителя, предпочтительно от -5oC до 100oC или при температуре кипения растворителя, используемого в реакции.
Молярное соотношение исходных материалов и дегидратирующих агентов, используемых в реакции, может быть легко определено, но благоприятно проводить реакцию при эквимолярном соотношении или при близком к нему.
После окончания реакции реакционная смесь подвергается обычной последующей обработке, такой как экстракция органическим растворителем и концентрирование, и желаемое соединение настоящего изобретения может выделяться. Далее, может осуществляться очистка с помощью общепринятых приемов, таких как хроматография, перегонка или перекристаллизация.
(Процесс получения E настоящих соединений, в которых Y и Z оба представляют кислород)
В данном процессе соединение общей формулы (X) подвергается реакции
со спиртовым соединением общей формулы:
R1-OH (XII)
в которой R1 имеет значения, определенные выше.
Реакция предпочтительно проводится в инертном растворителе, если необходимо, в присутствии подходящего дегидратирующего агента.
Примерами дегидратирующих агентов, которые могут использоваться, являются дициклогексилкарбодиимид и (например, (1-4)C)-диалкилазодикарбоксилаты (например, диэтилазодикрабоксилат, диизопропилазокарбоксилат) триалкил (например, (1-20)C)-фосфин или триарилфосфин (например, трифенилфосфин, триоктилфосфин, трибутилфосфин).
Примерами растворителя, который может использоваться, являются углеводороды, такие как бензол, ксилол и толуол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан, и галоидированные углеводороды, такие как четыреххлористый углерод, дихлорметан, хлорбензол и дихлорбензол.
Температура реакции составляет обычно в пределах -20oC - 200oC или равна температуре кипения растворителя, используемого в реакции.
Молярное соотношение материалов и дегидратирующих агентов, используемых в реакции, может свободно определяться, и благоприятным является проведение реакции при эквимолярном соотношении или соотношении, близком к эквимолярному.
После окончания реакции реакционная смесь подвергается обычной последующей обработке, такой как экстракция органическим растворителем и концентрирование, и могут выделяться желаемые соединения настоящего изобретения. Далее может осуществляться очистка с помощью обычных технологических приемов, таких как хроматография, перегонка или перекристаллизация.
(Процесс получения F настоящих соединений, в которых Y и Z оба представляют кислород и R1 представляет Q5 (при условии, что A представляет A2), Q6 (при условии, что A представляет A2), Q7, Q8 или Q10 (при условии, что A представляет A2) (где A2 представляет кислород, серу или NR13, и R13 имеет значения, определенные выше)).
В данном процессе соединение общей формулы:
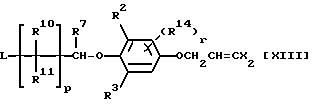
где R2, R3, R7, R10, R11, R14, X, L, p и r каждый имеет значения, определенные выше,
подвергается взаимодействию с соединением Q51, Q61, Q71, Q81 или Q101 общей формулы:

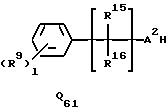

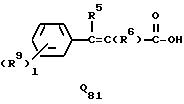

где R4, R5, R6, R12, R15, R16, Z1, A2, l, m, q и s каждый имеет значения, определенные выше.
Реакция предпочтительно проводится в инертном растворителе в присутствии подходящего основания.
Примерами растворителя, который может использоваться, являются кетоны, такие как ацетон, метилэтилкетон и циклогексанон; простые эфиры, такие как 1,2-диметоксиэтан, тетрагидрофуран, диоксан и диалкиловые (например, (1-4)C) эфиры (например, диэтиловый эфир, диизопропиловый эфир); N,N-диметилформамид, диметилсульфоксид, гексаметилфосфорный триамид, сульфолан, ацетонитрил, нитрометан, галоидированные углеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; и вода. Если необходимо, может использоваться смесь этих растворителей.
Примерами основания, которое может использоваться, являются гидроокиси щелочных или щелочноземельных металлов, такие как гидроокись лития, гидроокись натрия, гидроокись калия и гидроокись кальция; карбонаты щелочных или щелочноземельных металлов, такие как карбонат лития, карбонат калия, карбонат натрия и карбонат кальция; гидриды щелочных или щелочноземельных металлов, такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция; алкоголяты щелочных металлов (например (1-4)C), такие как метилат натрия, этилат натрия и трет-бутилат калия; органические основания, такие как триэтиламин и пиридин. Если необходимо, в реакционную систему могут добавляться катализаторы, такие как аммониевые соли (например, триэтилбензиламмонийхлорид), в соотношении 0,01 - 1 моль на моль соединения общей формулы (XIII).
Температура реакции обычно устанавливается в интервале от -20oC до 150oC или на уровне точки кипения растворителя, используемого в реакции, предпочтительно от -5oC до 100oC или равной точке кипения растворителя, используемого в реакции.
Молярное соотношение исходных веществ и дегидратирующих агентов, используемых в реакции, может свободно определяться, и благоприятно проводить реакцию при эквимолярном или близком к нему соотношении.
После завершения реакции реакционная смесь подвергается обычным последующим обработкам, таким как экстракция органическим растворителем и концентрирование, и может выделяться желаемое соединение настоящего изобретения. Далее может осуществляться очистка с помощью общепринятых приемов, таких как хроматография, перегонка или перекристаллизация.
(Процесс получения G настоящих соединений, в которых Y и Z оба
представляют кислород, и R1 представляет Q5 (при условии, что A представляет кислород), Q6 (при условии, что A представляет кислород), Q7, Q8 или
Q10 (при условии, что A представляет кислород))
В данном процессе соединение общей формулы:
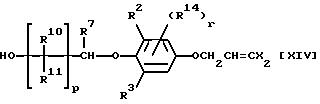
где R2, R3, R7, R10, R11, R14, X, p и r каждый имеет значения, определенные выше,
подвергается реакции с соединением Q52, Q62, Q71, Q81 или Q102 общей формулы:

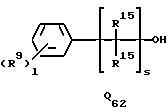



где R4, R5, R6, R12, R15, R16, Z1, l, m, q и s каждый имеет значения, определенные выше.
Реакция предпочтительно проводится в инертном растворителе, если необходимо, в присутствии подходящего дегидратирующего агента.
Примерами дегидратирующих агентов, которые могут использоваться, являются дициклогексилкарбодиимид и диалкил (например, (1-4)C)азодикарбоксилаты (например, диэтилазодикарбоксилат, диизопропилазодикарбоксилат)-триалкил (например, (1-20)C)-фосфин или триарилфосфин (например, трифенилфосфин, триоктилфосфин, трибутилфосфин).
Примерами растворителя, который может использоваться, являются углеводороды, такие как бензол, ксилол и толуол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; и галоидированные углеводороды, такие как четыреххлористый углерод, дихлорметан, хлорбензол и дихлорбензол.
Температура реакции обычно составляет в интервале от -20oC до 200oC или точки кипения растворителя, используемого в реакции.
Молярное соотношение веществ и дегидратирующих агентов, используемых в реакции, может легко определяться, и благоприятно проводить реакцию при эквимолярном соотношении или соотношении, близком к эквимолярному.
После завершения реакции реакционная смесь подвергается обычным последующим обработкам, таким как экстракция растворителем и концентрирование, и желаемое соединение настоящего изобретения может выделяться. Далее, может осуществляться очистка с помощью общепринятых приемов, таких как хроматография, перегонка или перекристаллизация.
Когда настоящее соединение имеет асимметрический атом углерода, следует понимать, что оно включает оптически активные изомеры ((+)-форму и (-)-форму), имеющие биологическую активность, и их смеси в любом соотношении. Когда настоящее соединение проявляет геометрический изомеризм, следует иметь в виду, что оно включает его геометрические изомеры (цис-форму и транс-форму) и их смеси в любом соотношении.
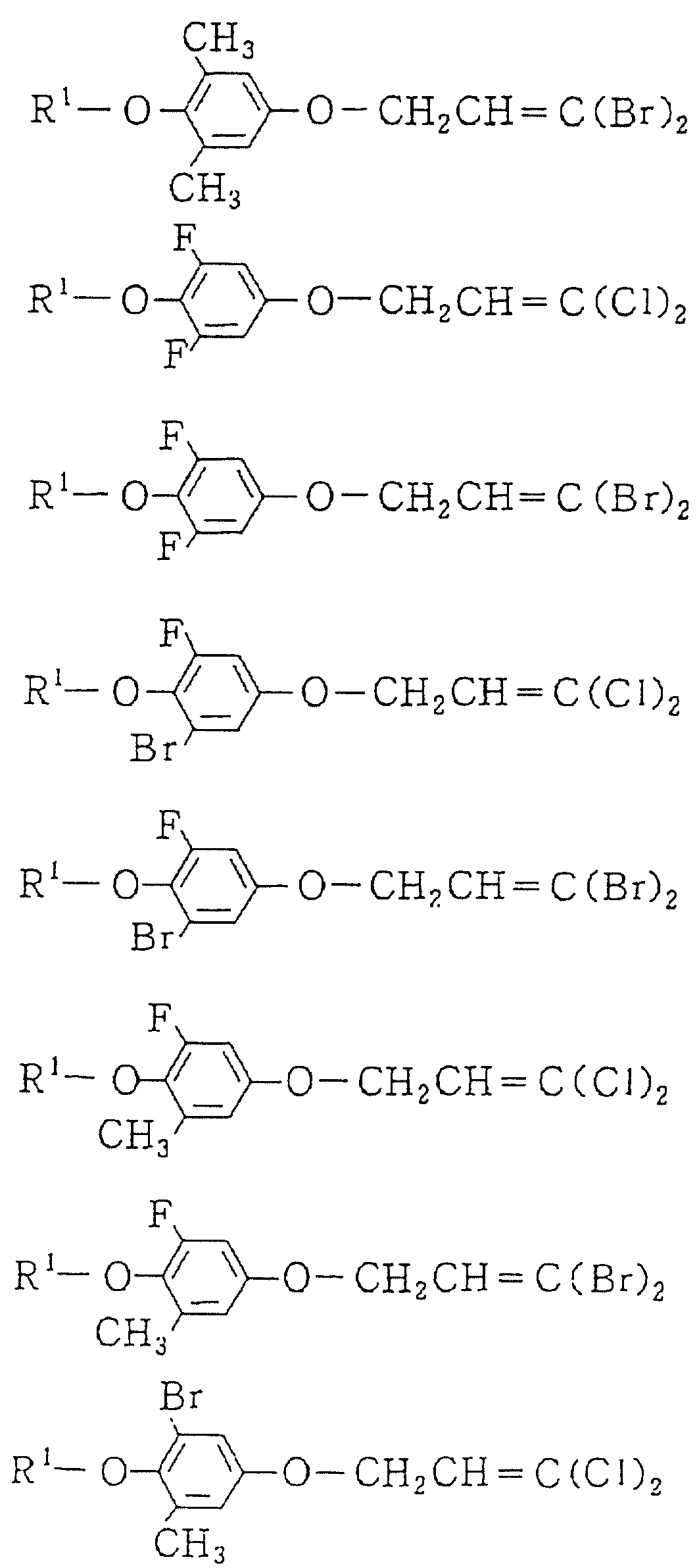
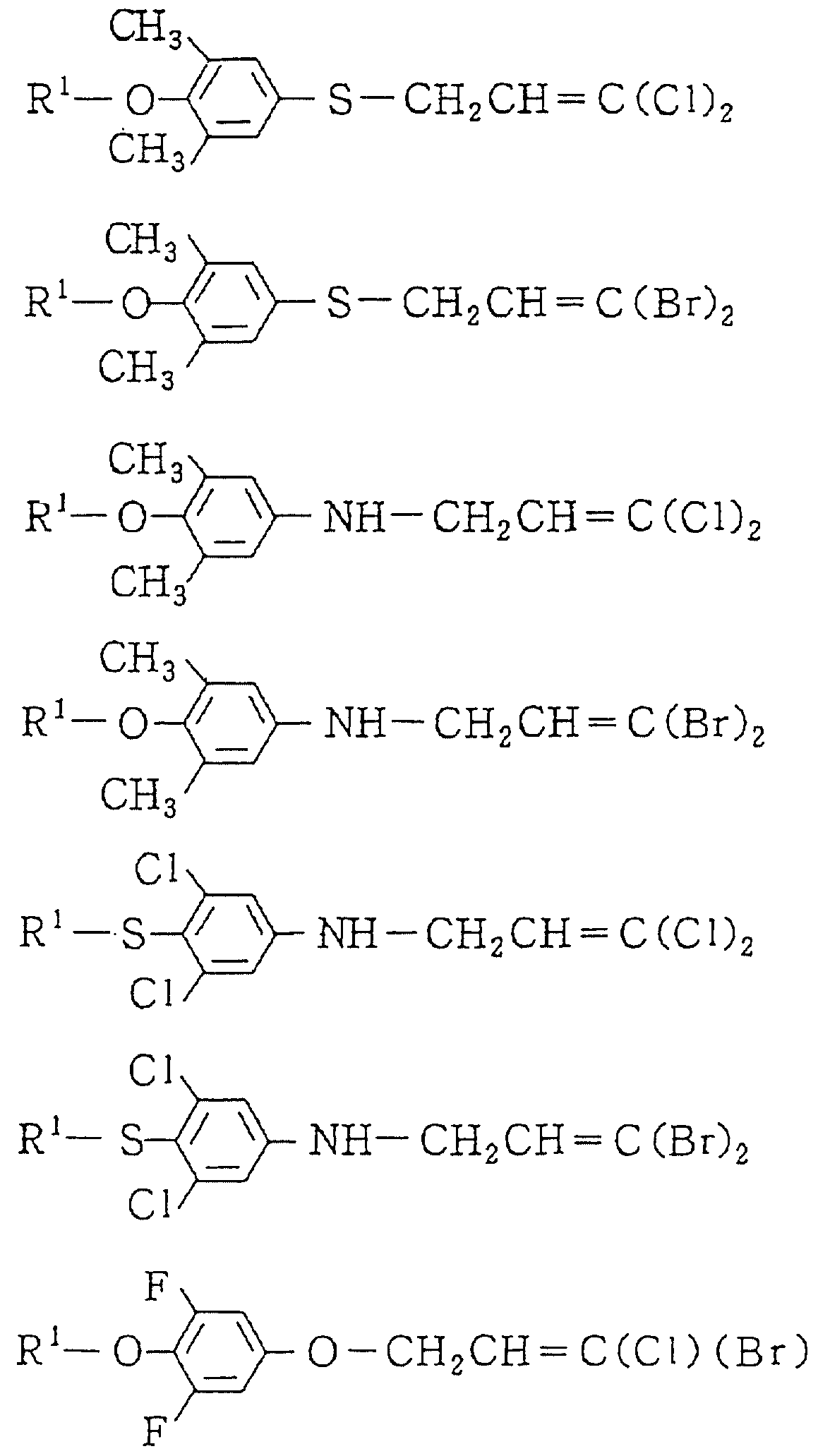
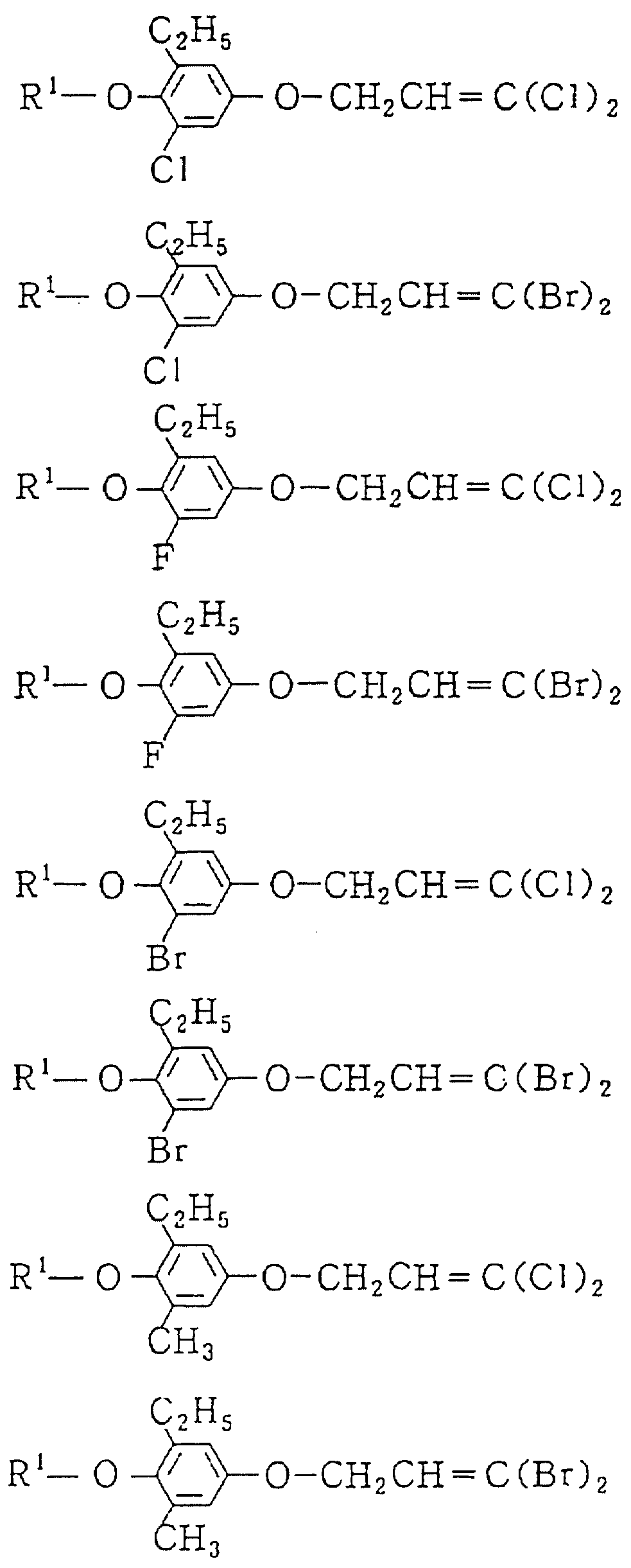
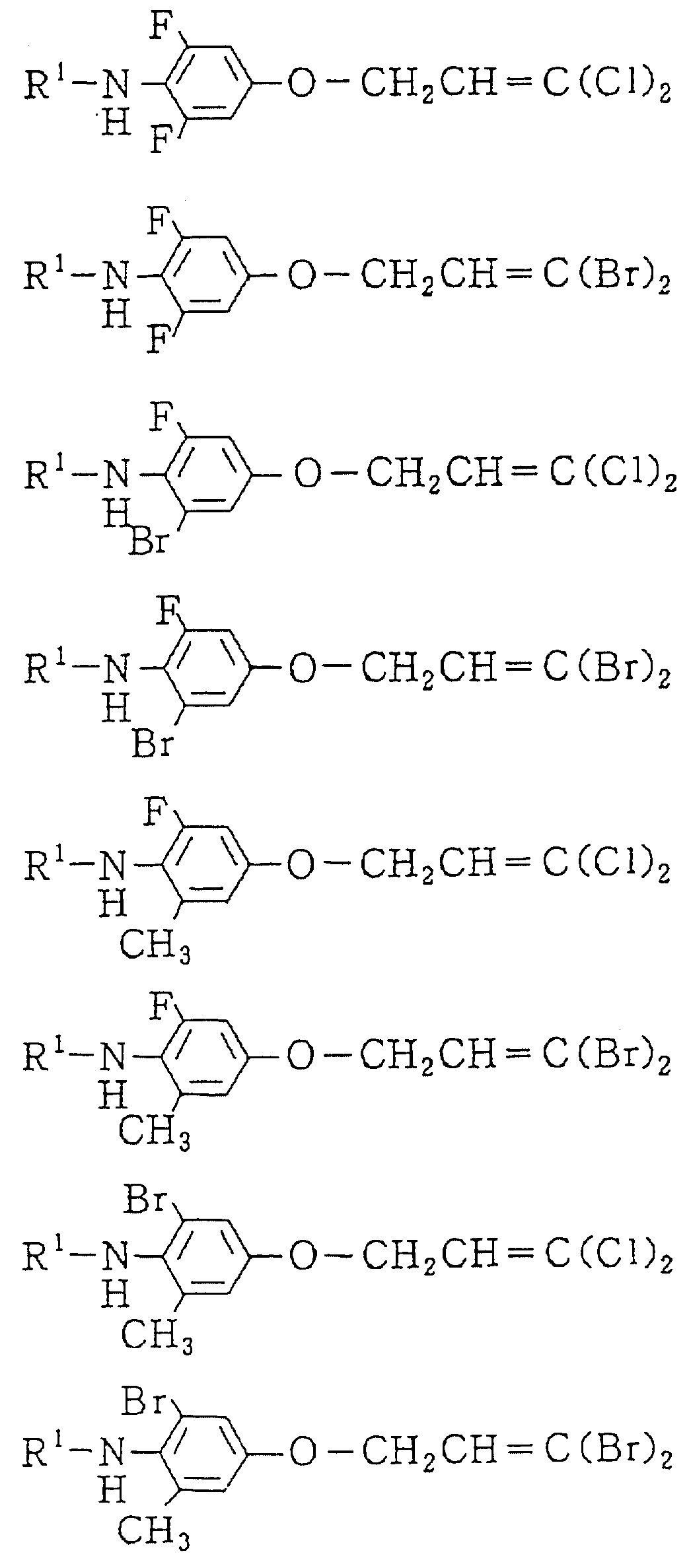
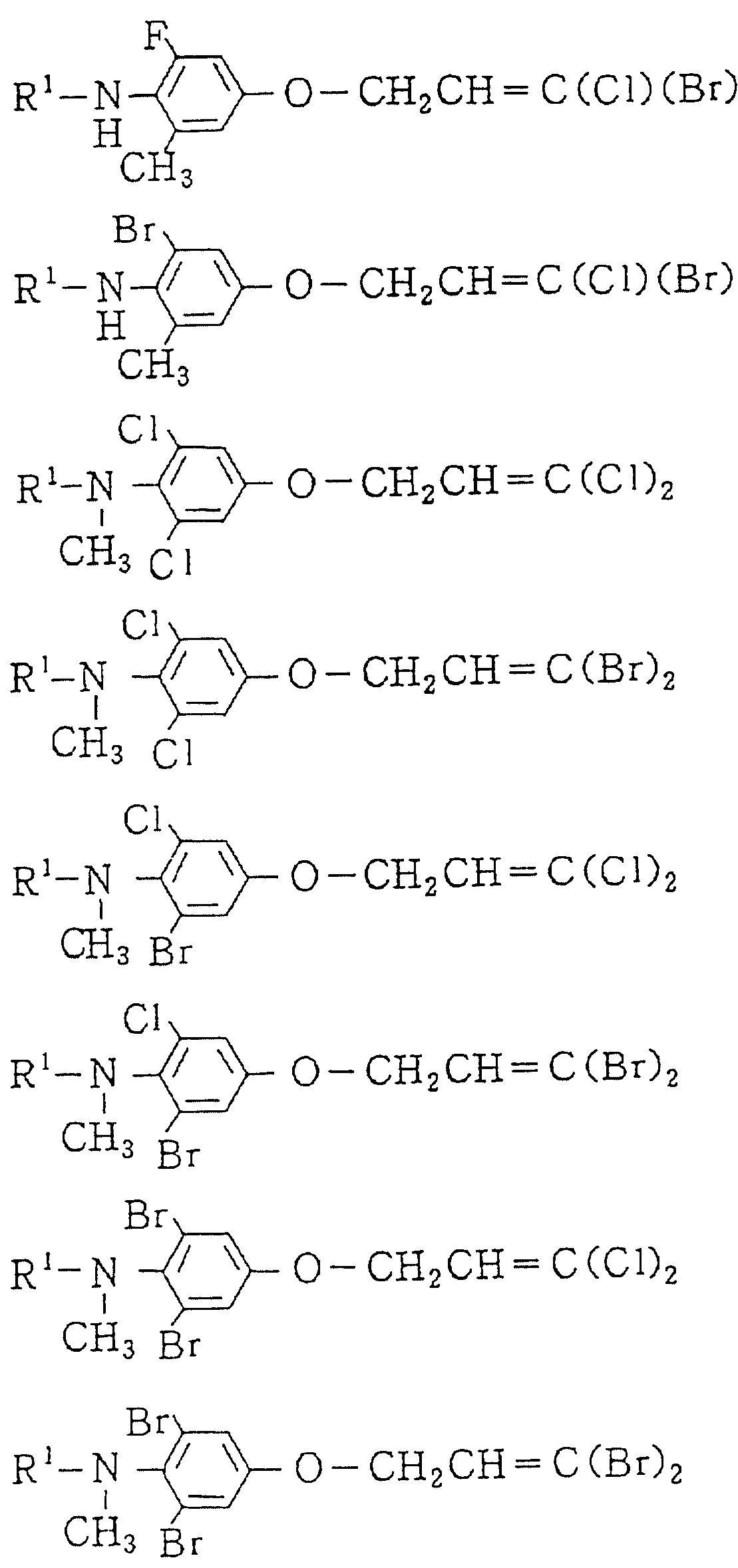
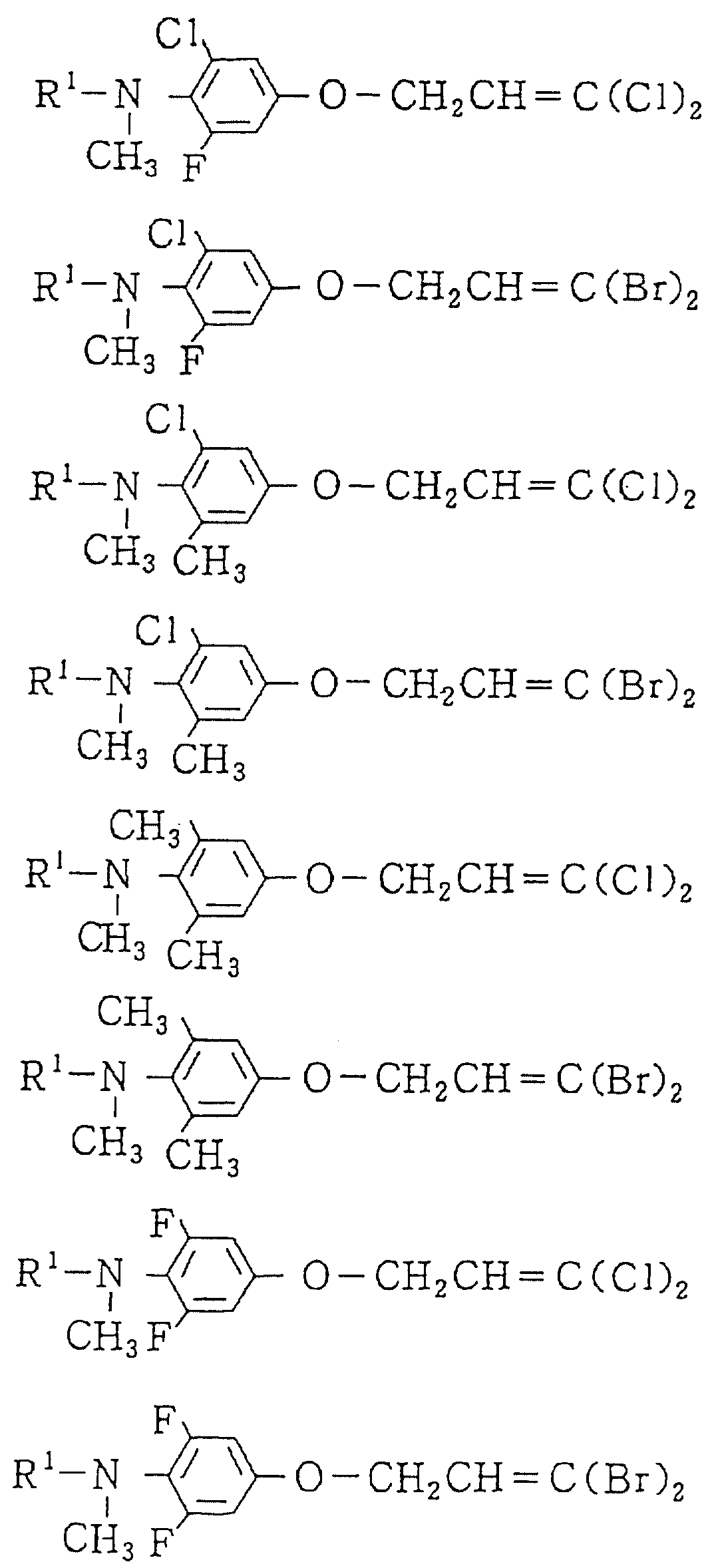
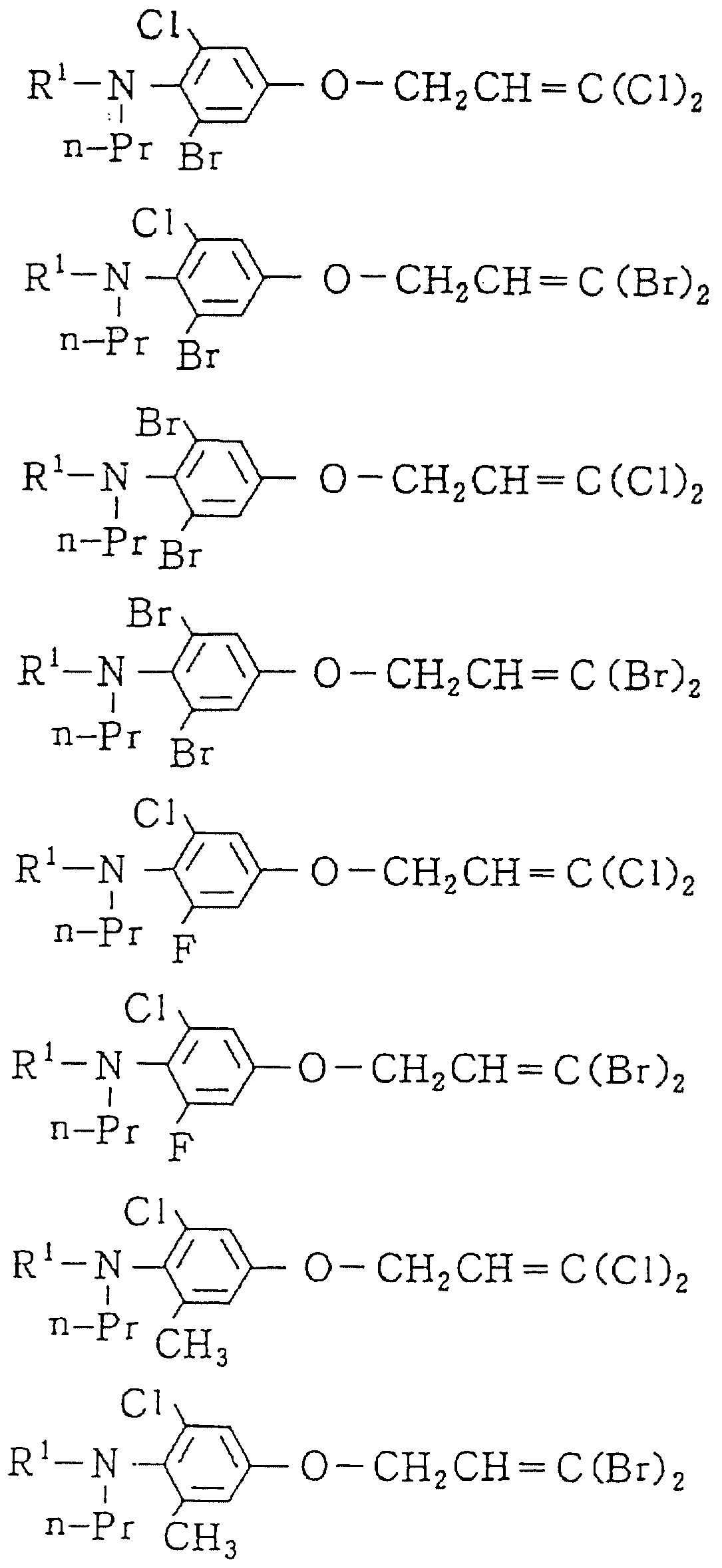
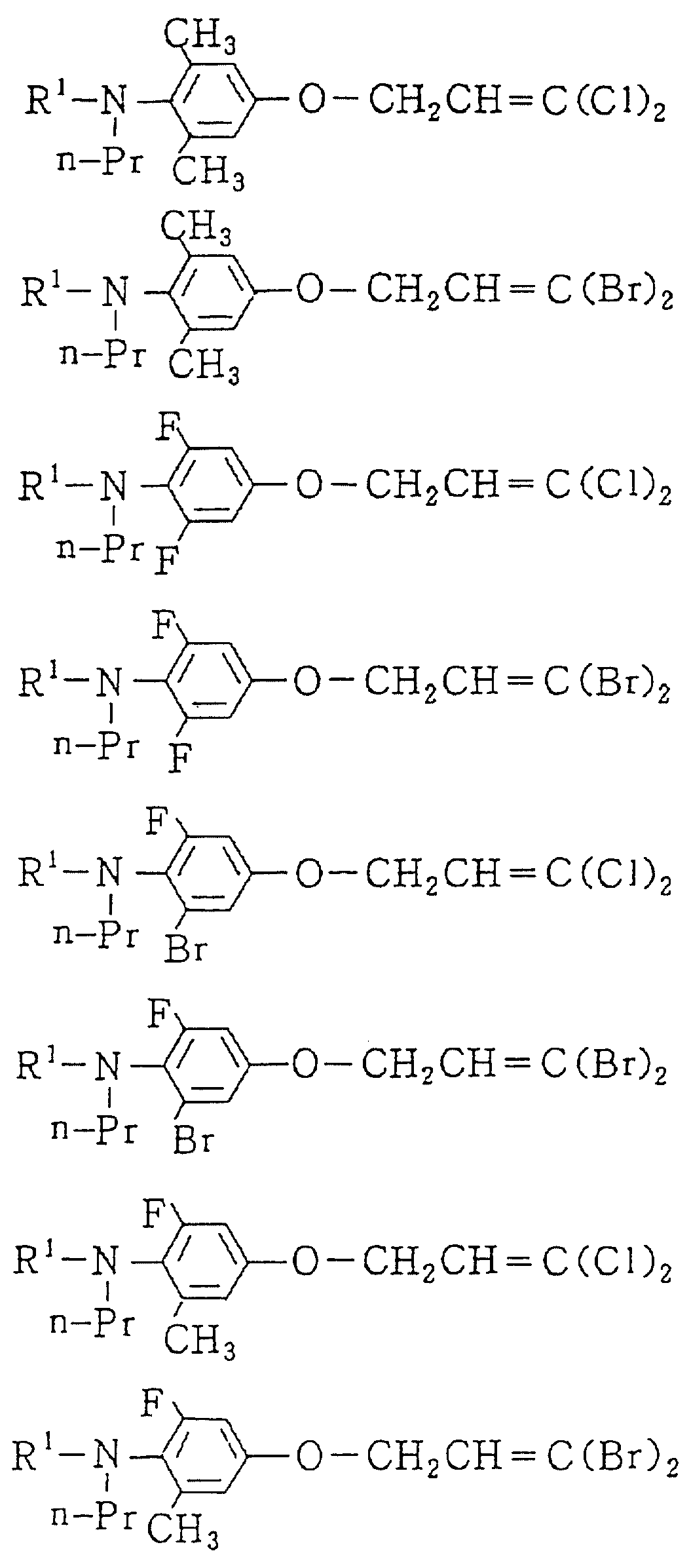
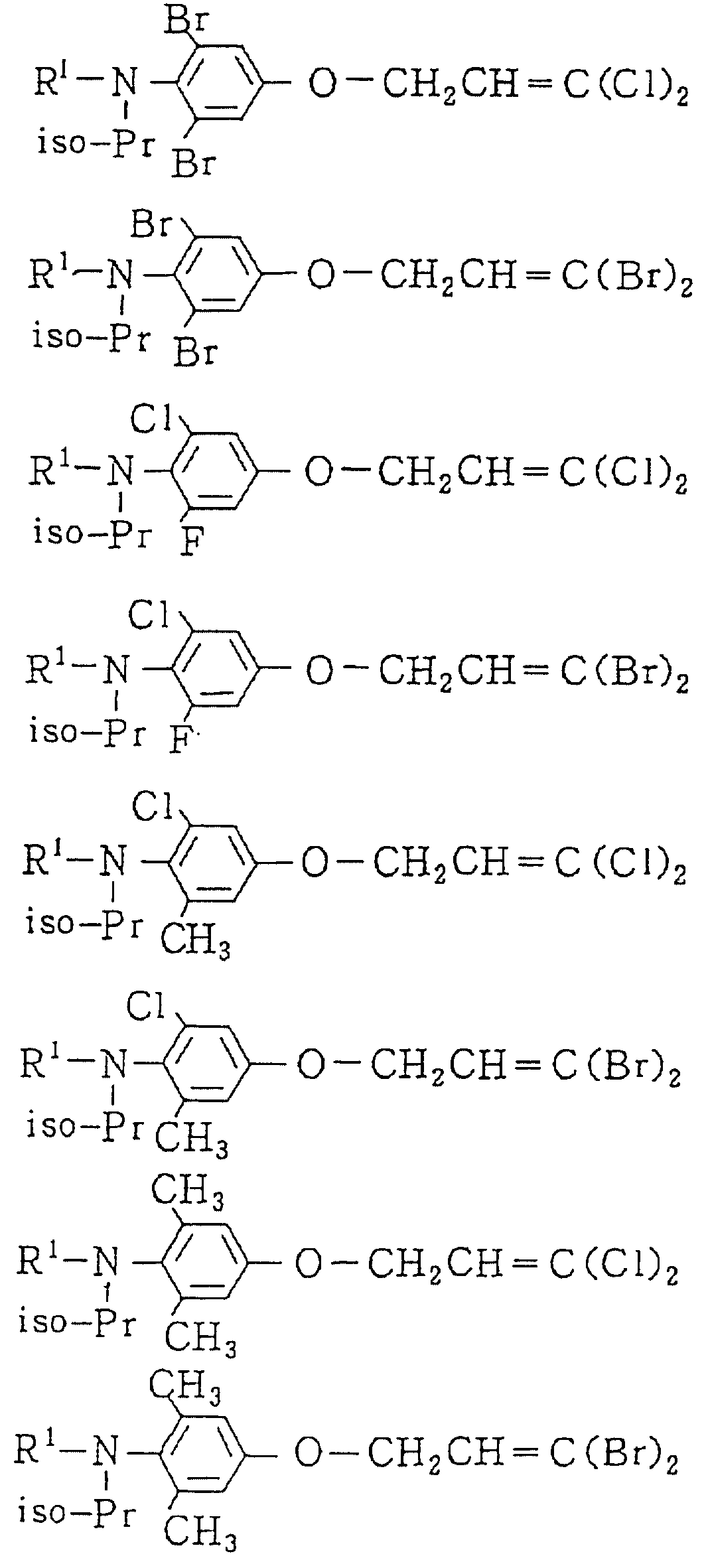
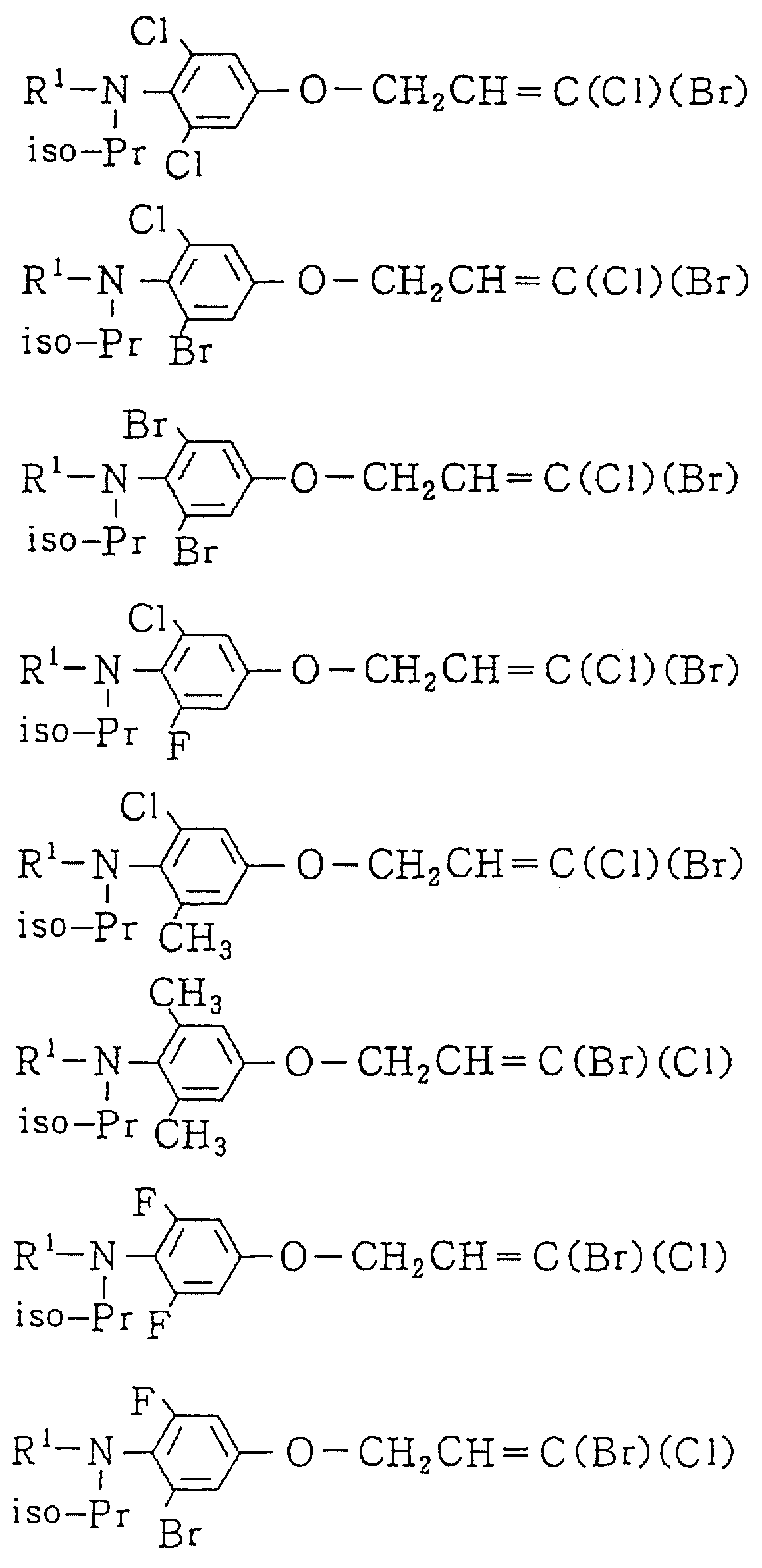
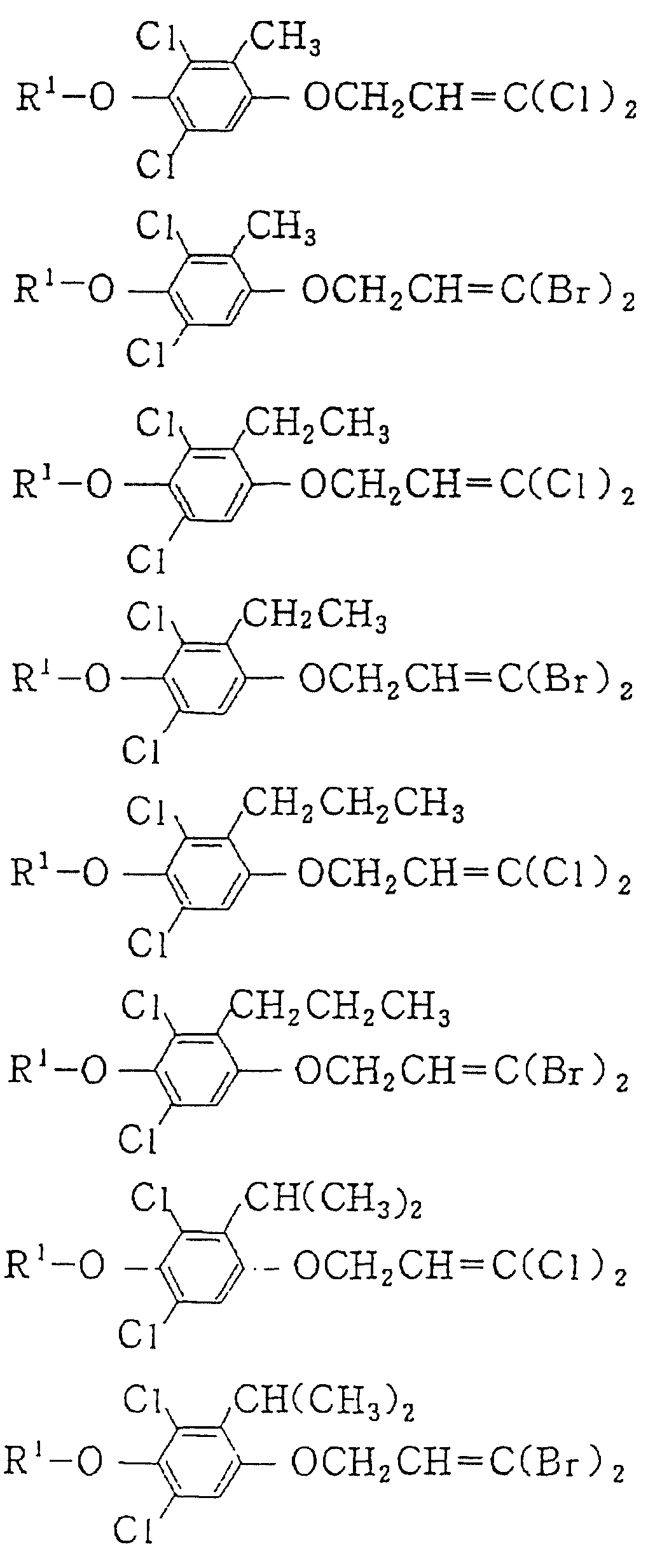
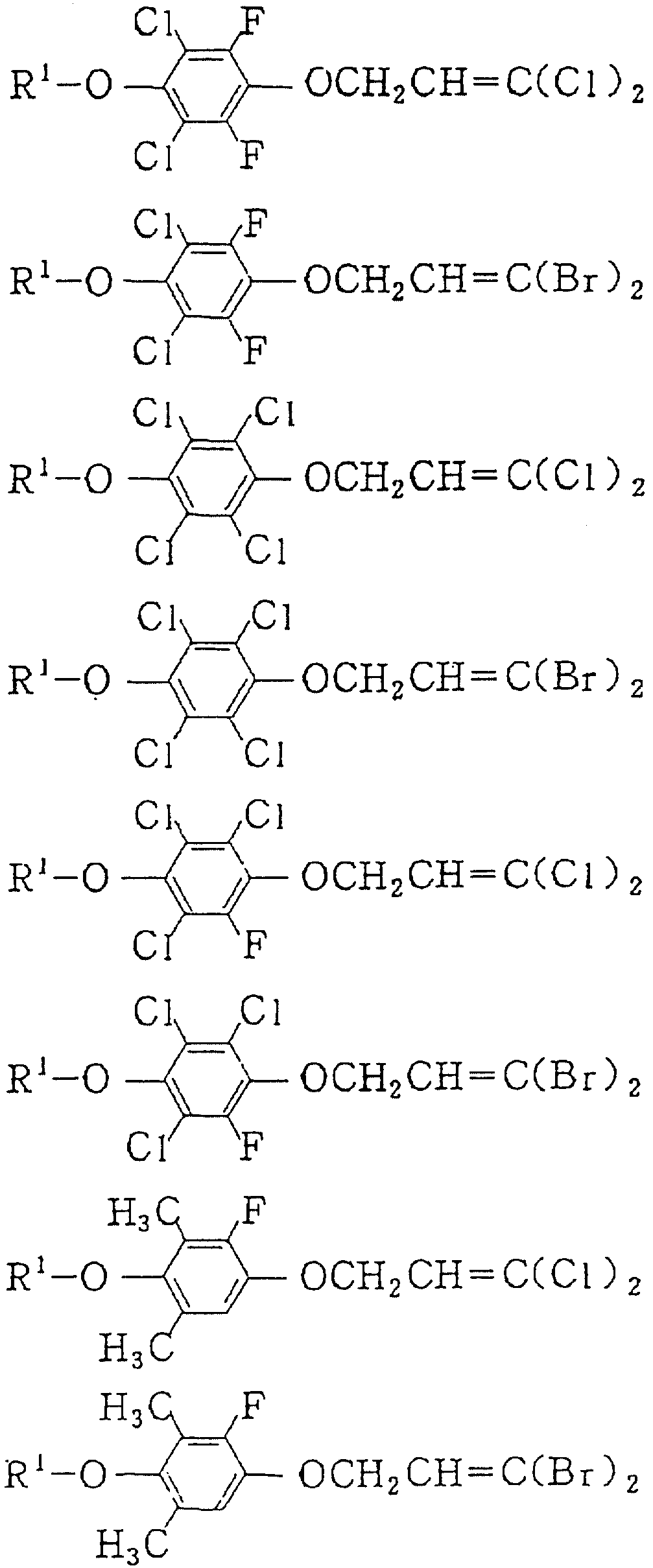
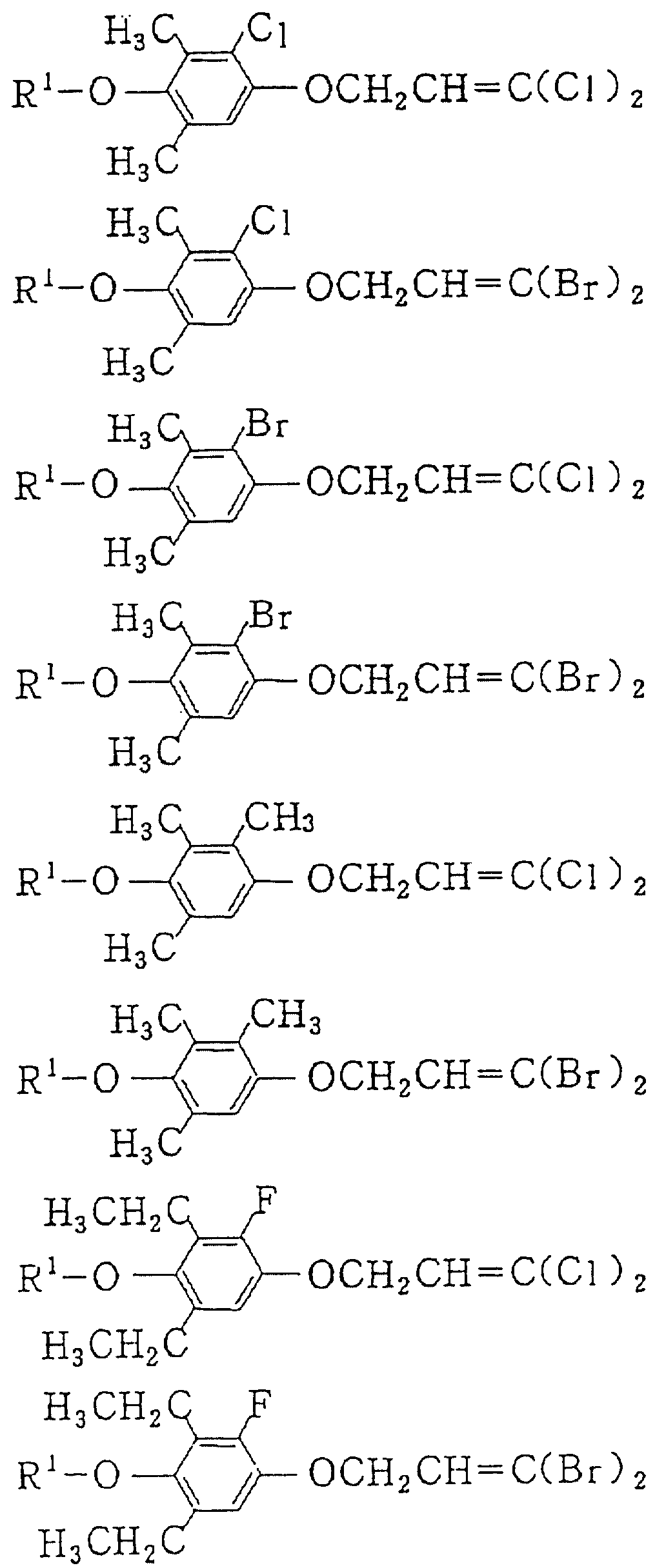
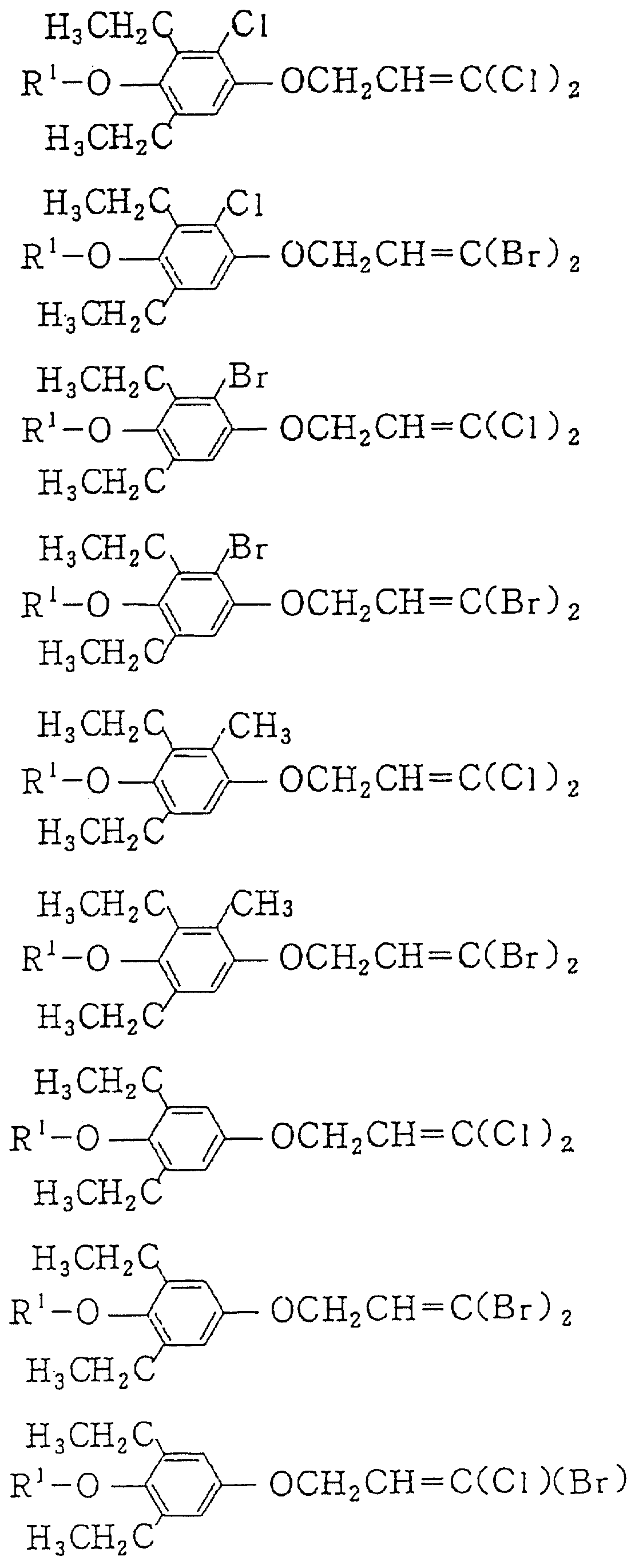
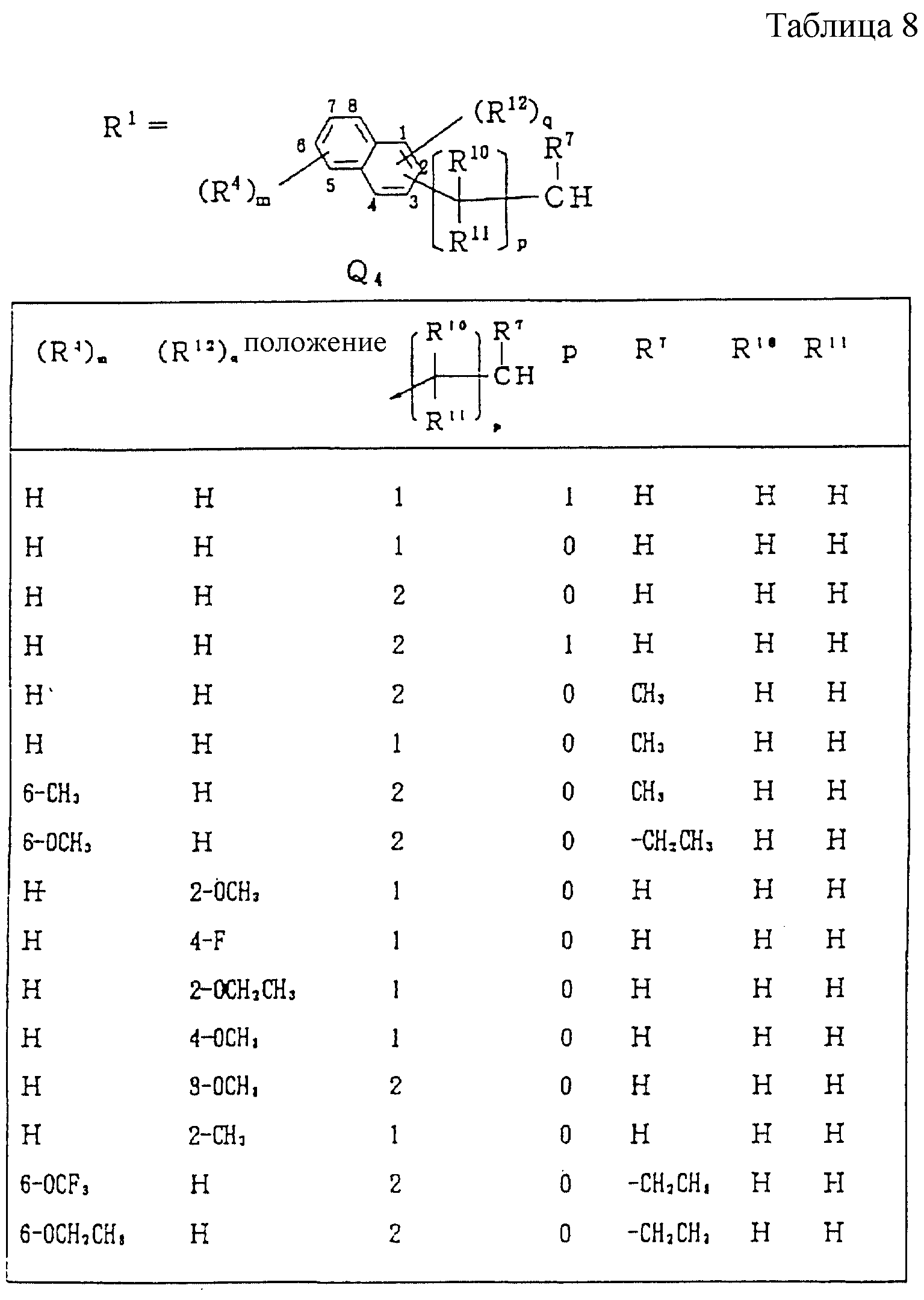
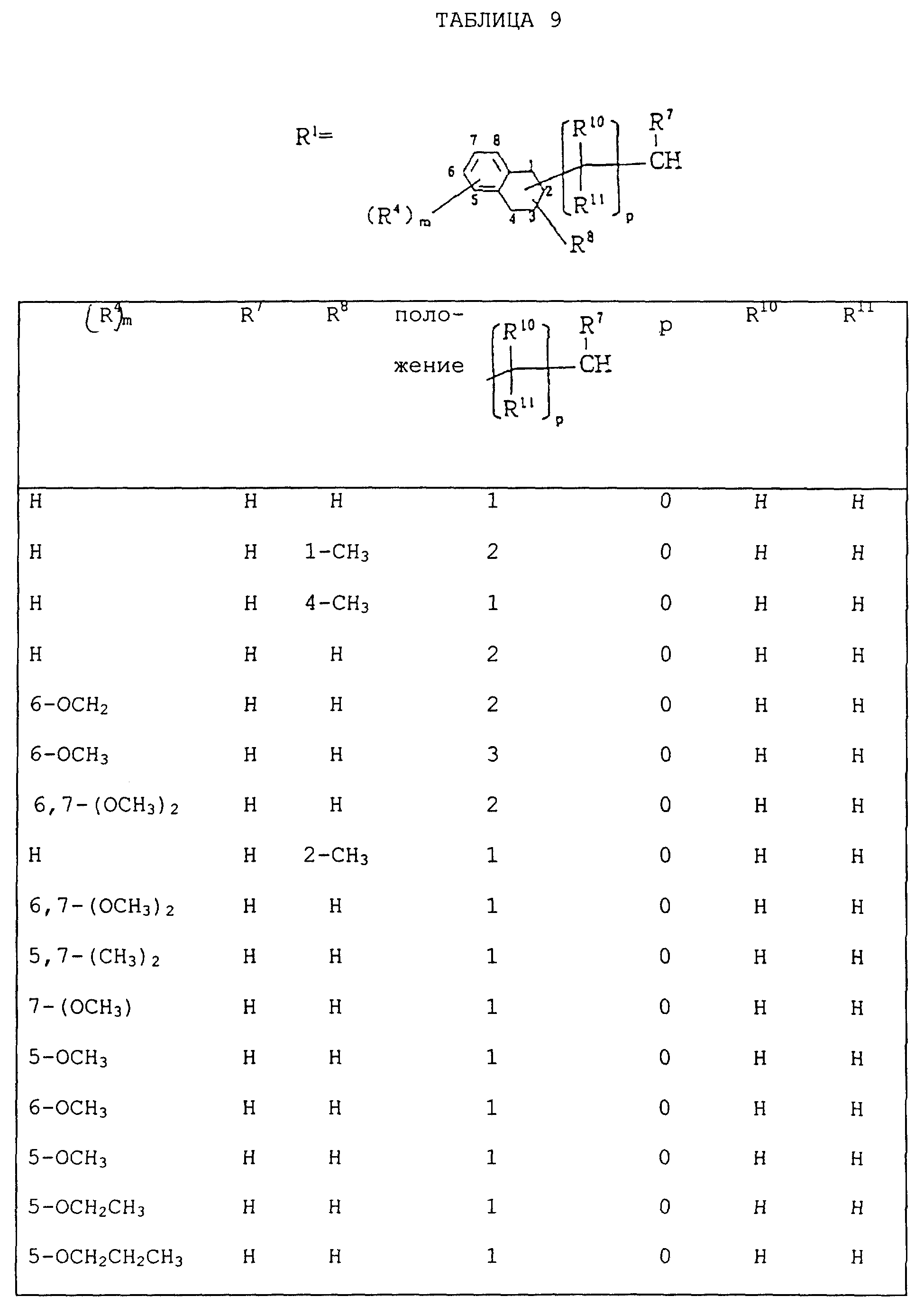
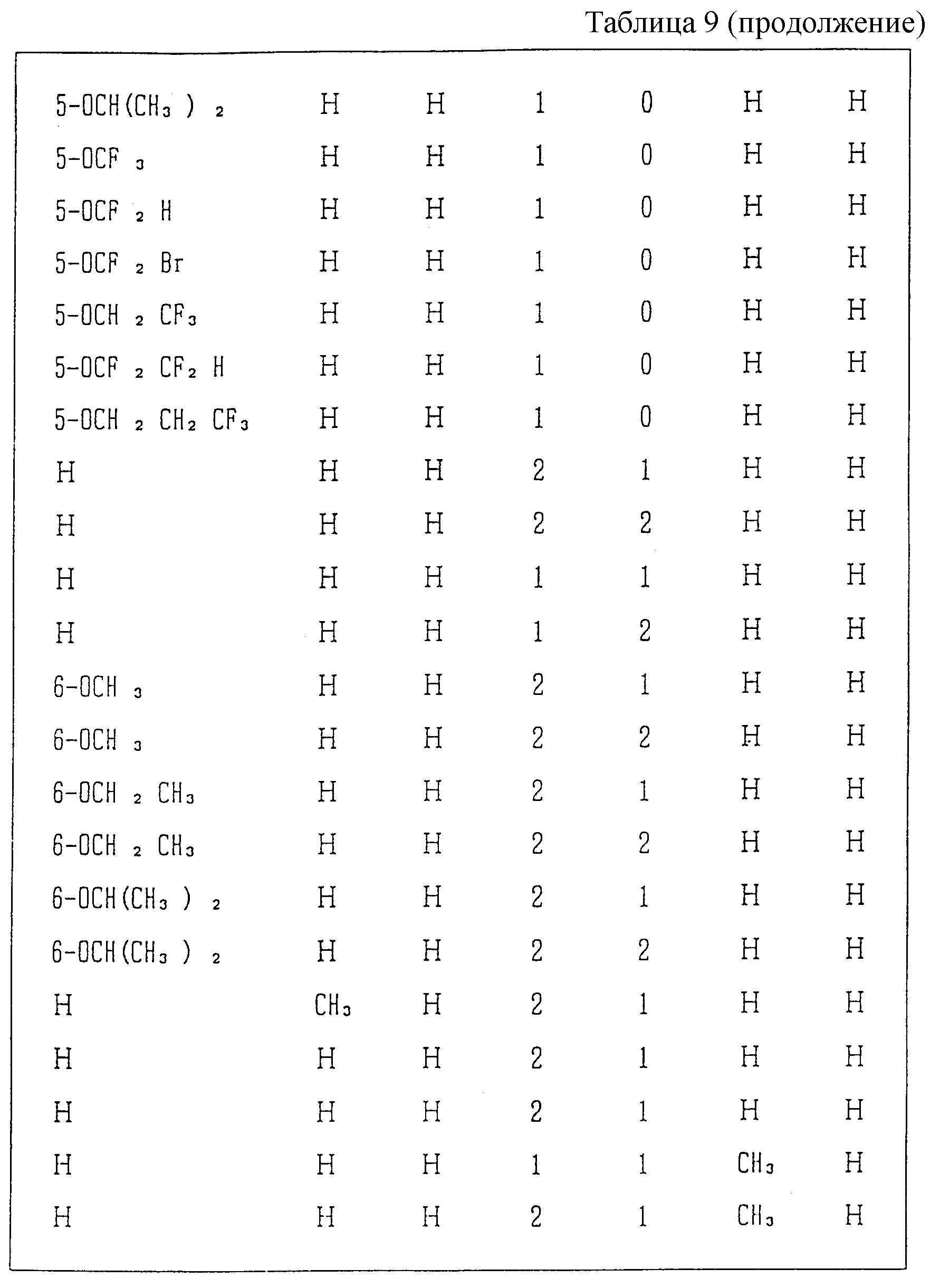
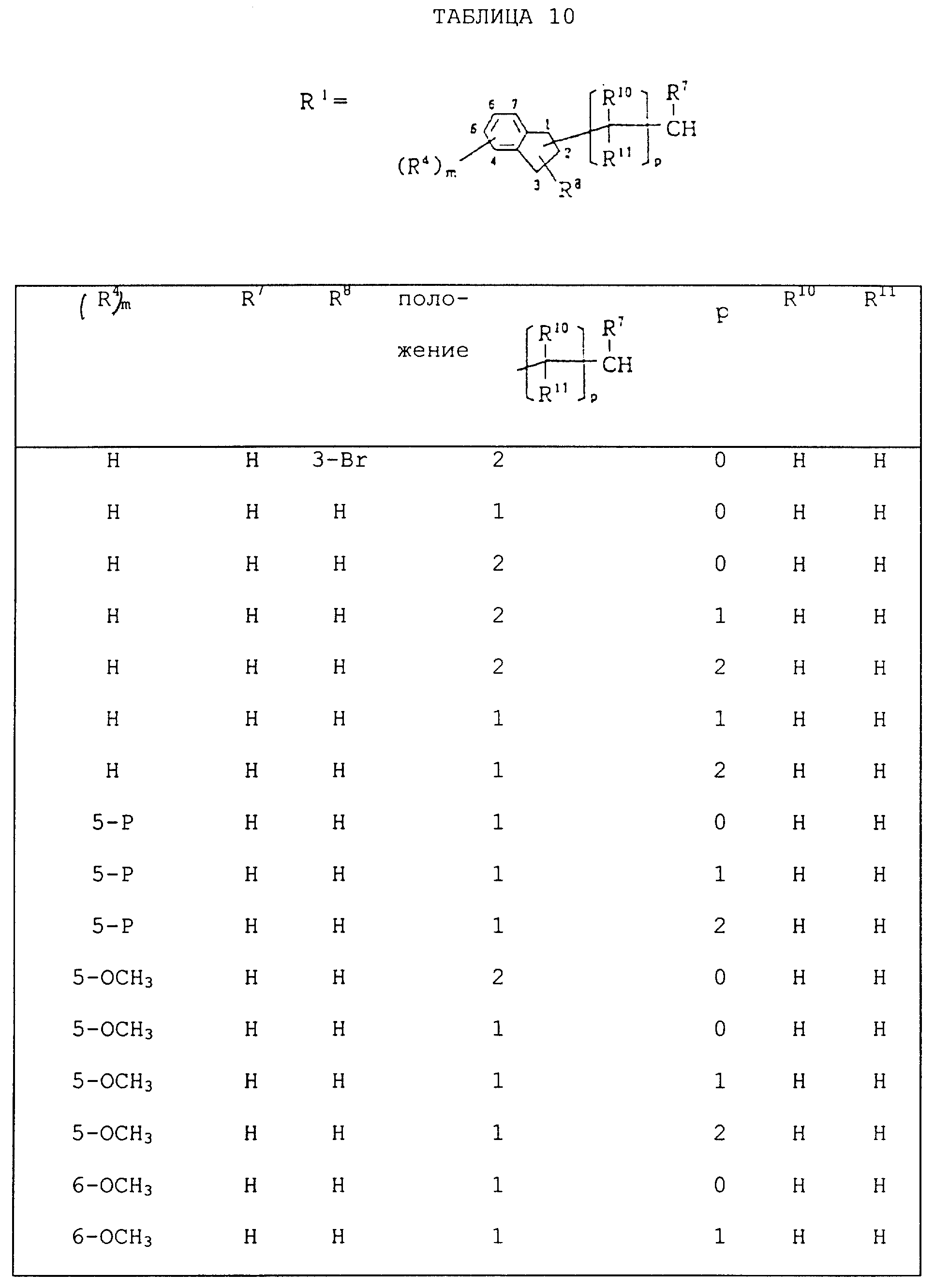
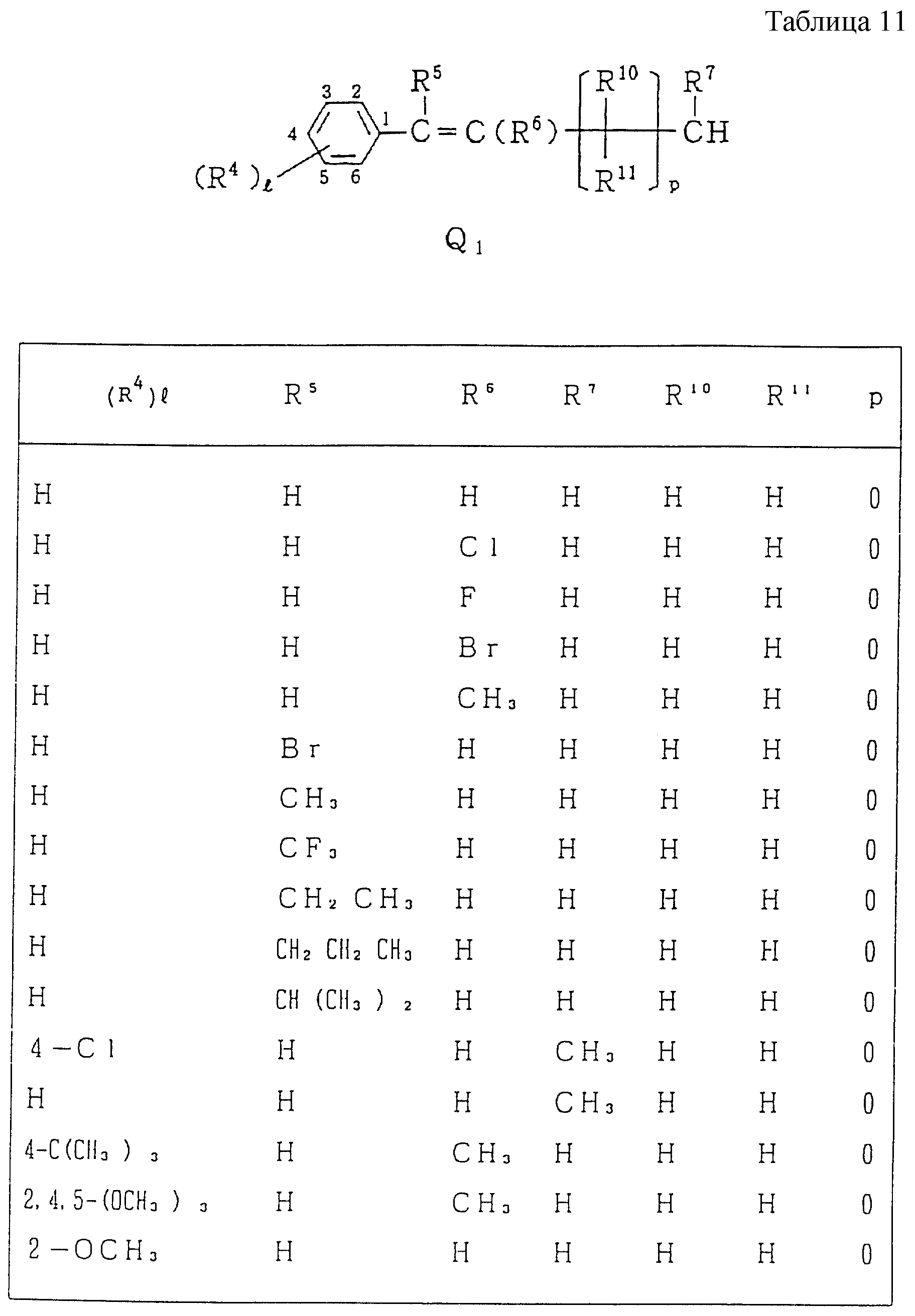
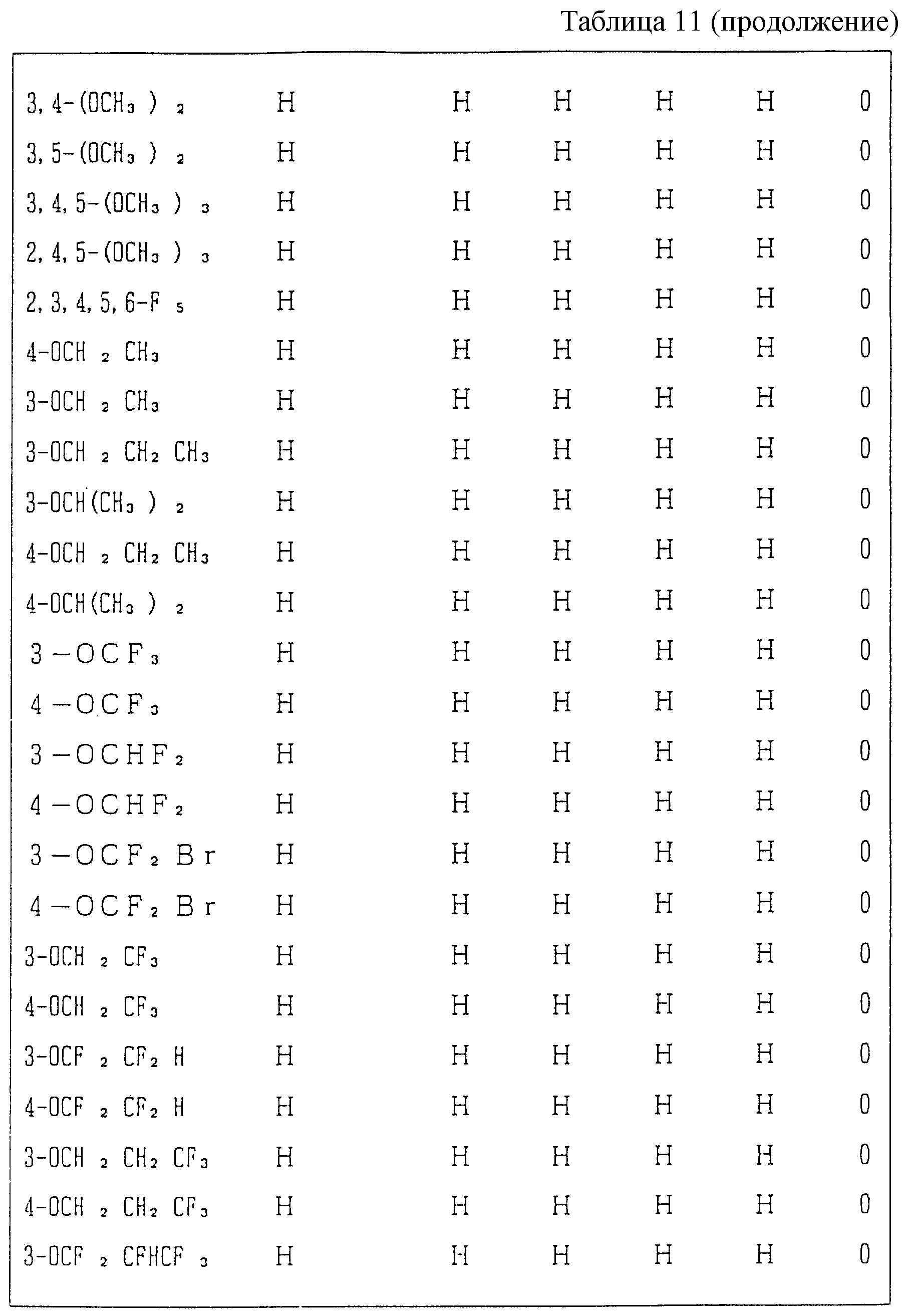
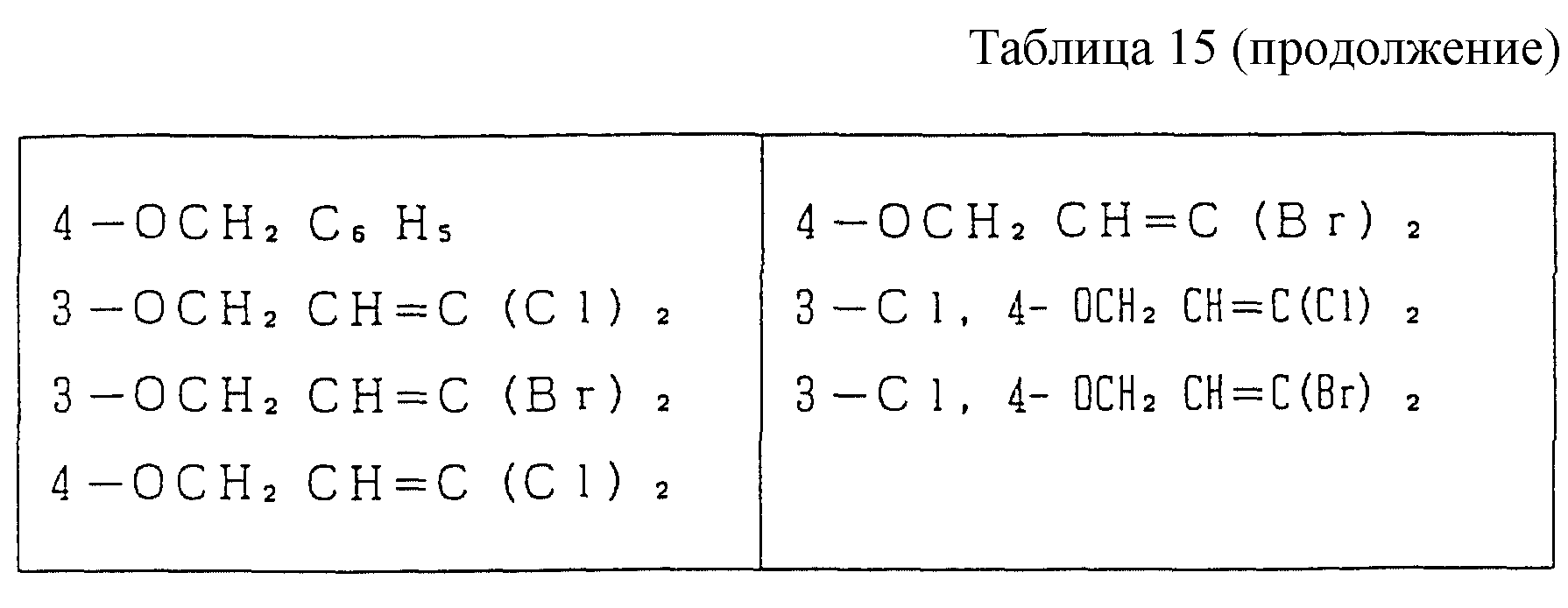
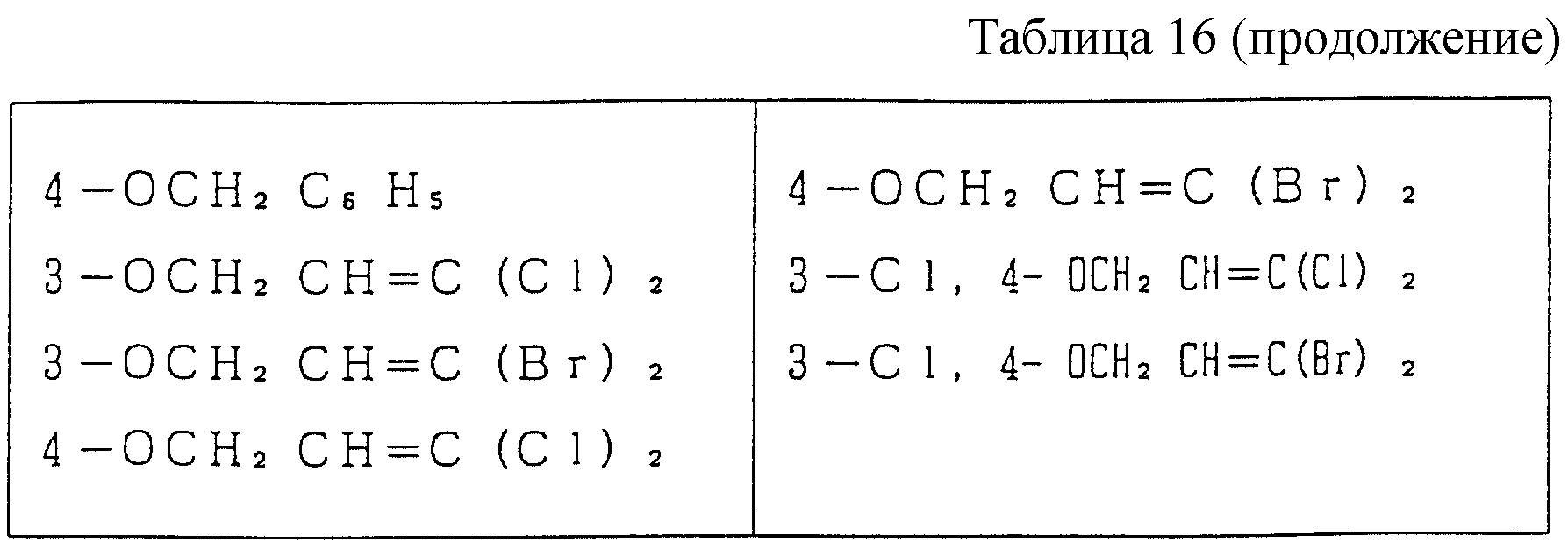
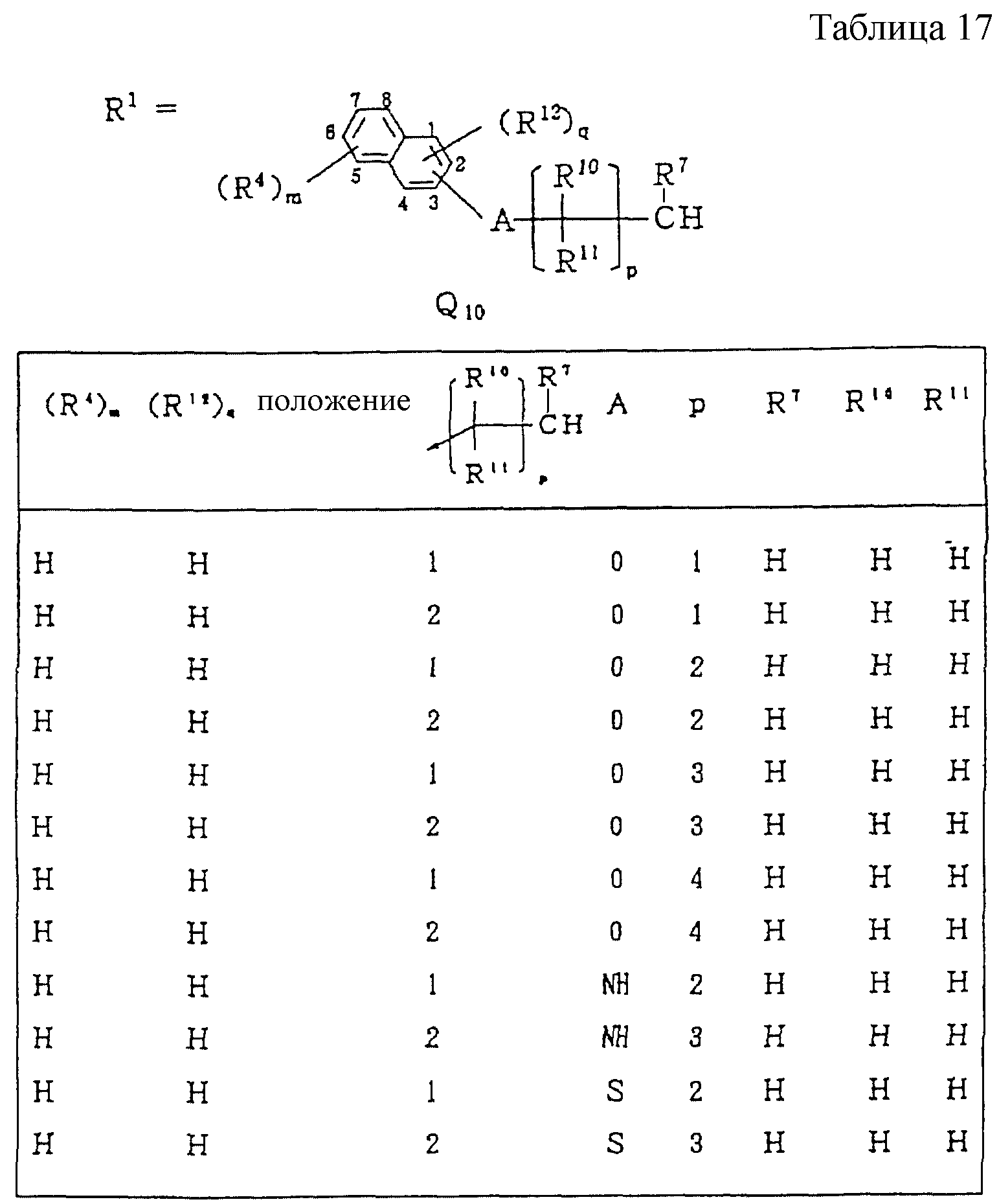
Следующие ниже соединения являются типичными примерами настоящих соединений (в которых R1 имеет значения, показанные в таблицах с 1 по 17), которые не следует рассматривать как ограничивающие объемы настоящего изобретения.
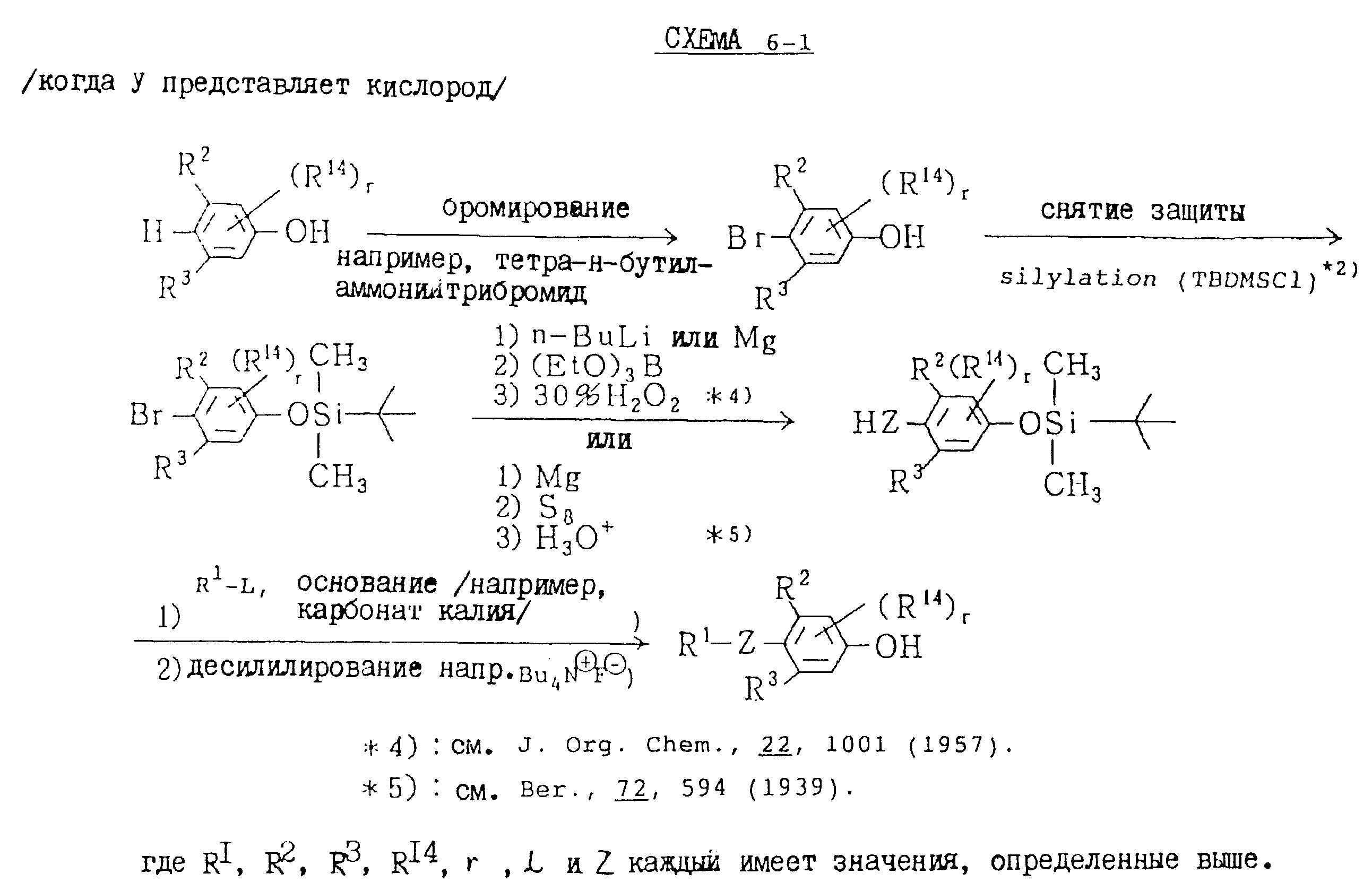
Альдегидное соединение общей формулы (X), которое является промежуточным соединением для использования при получении настоящих соединений, может быть получено, например, в соответствии со схемой 1, где все переменные имеют значения, определенные выше.
Соединения общей формулы (IV), (V) и (VI),
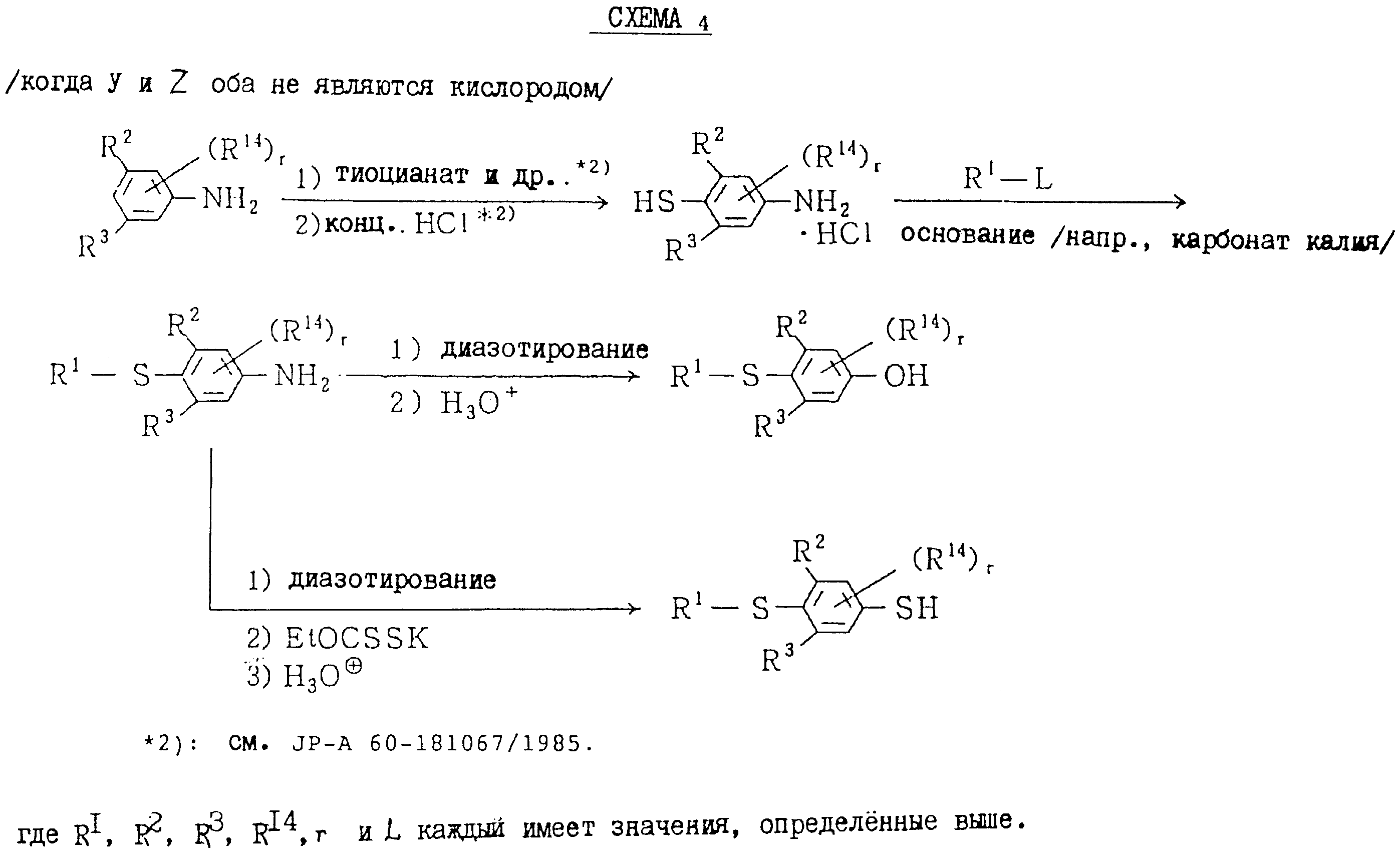
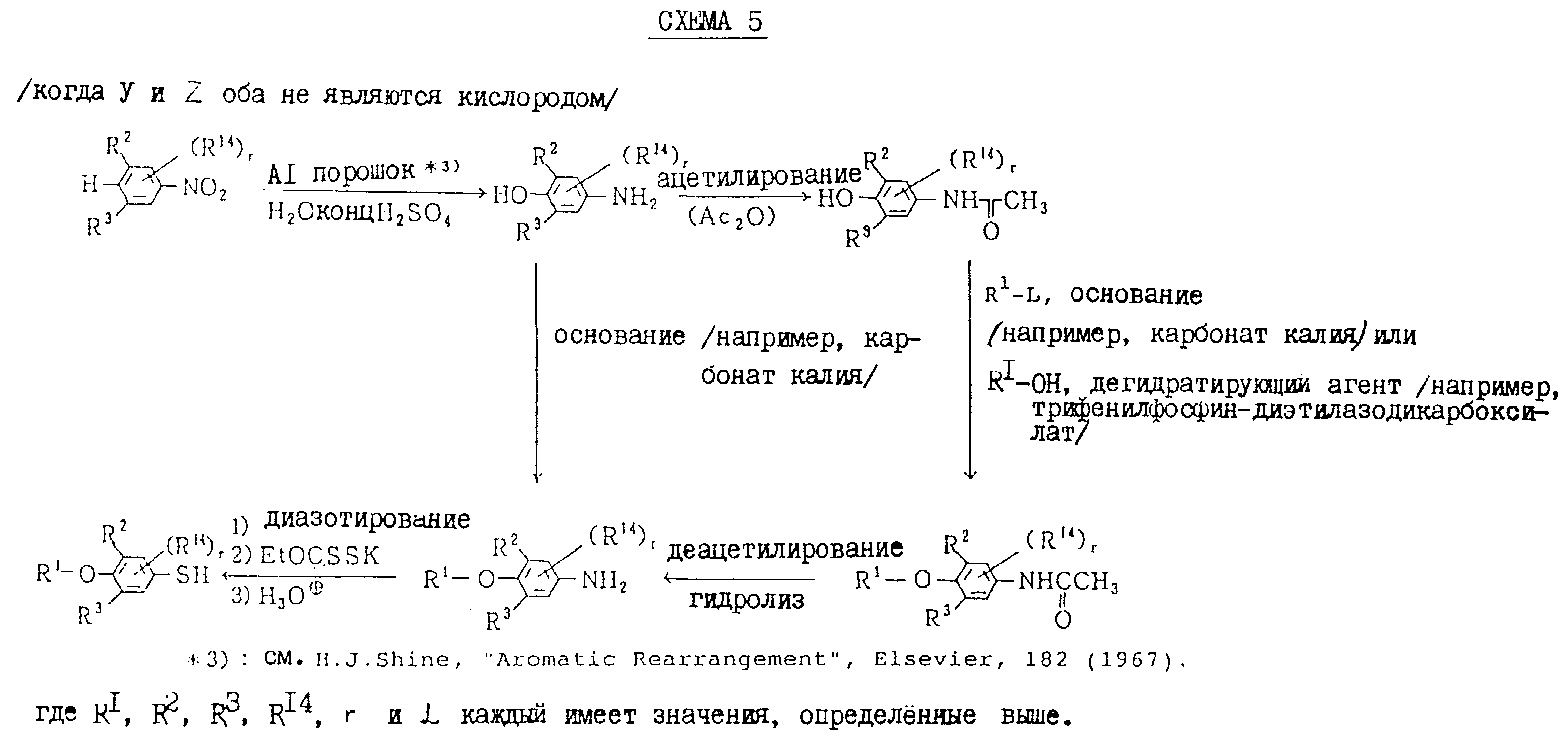
которые являются промежуточными соединениями для использования при получении настоящих соединений, могут получаться, например, в соответствии со схемами 2 - 6,
где R1 представляет
(1-10)C-алкил, (1-5)C-галоидалкил, (2-10)C-алкенил, (2-6)C-галоидалкенил, (3-9)C-алкинил, (3-5)C-галоидалкинил, (2-7)C-алкоксиалкил, (2-7)C-алкилтиоалкил; (3-6)C-циклоалкил, который может быть замещен
(1-4)C-алкилом, (1-3)C-алкокси или (1-3)C-галоидалкокси группой; (4-9)C-циклоалкилалкил, который может быть замещен (1-4)C-алкилом; (6-8)C-циклоалкенилалкил, который может быть замещен (1-4)C-алкилом;
и
R2, R3, R14, r и L каждый имеет значения, определенные выше.
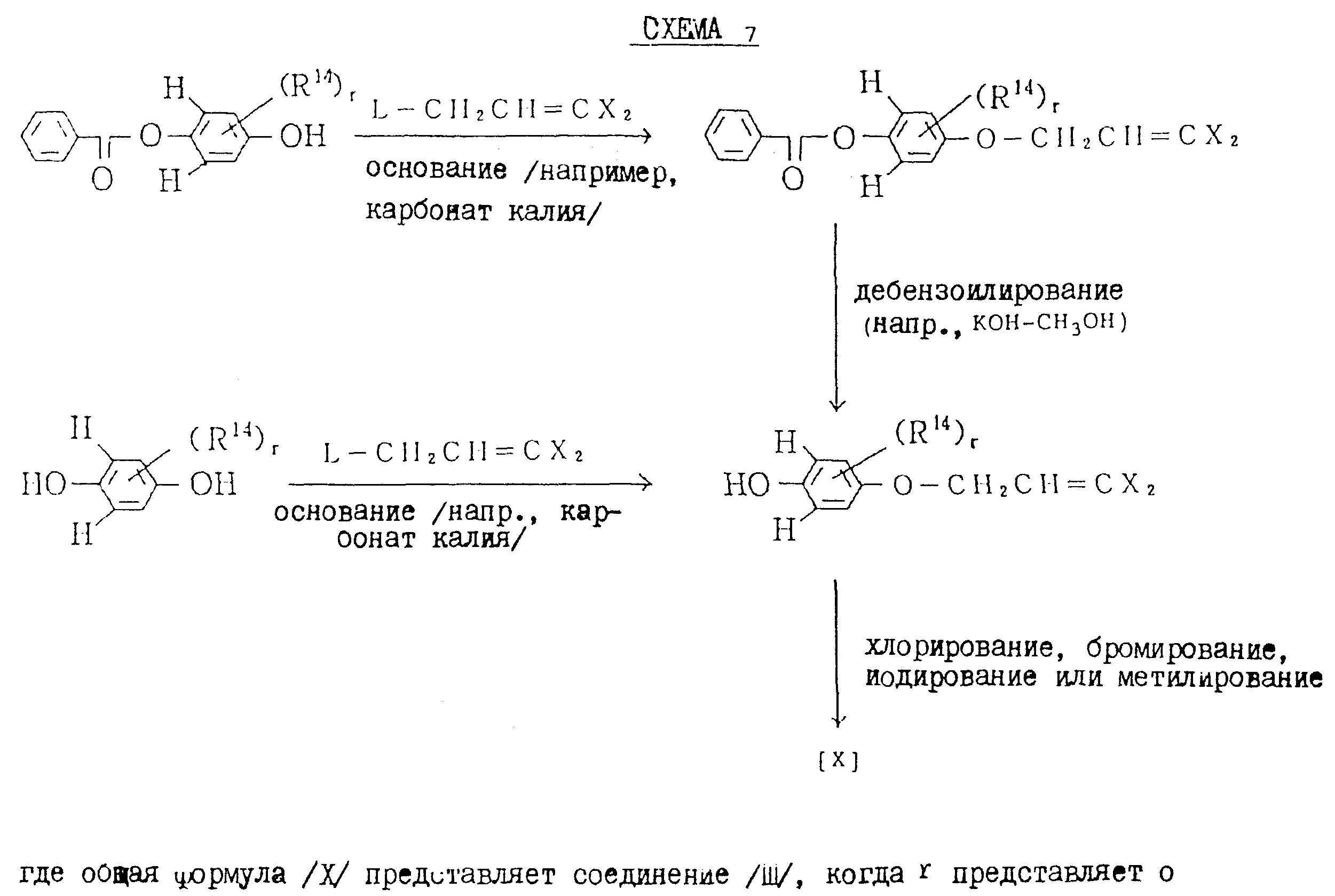
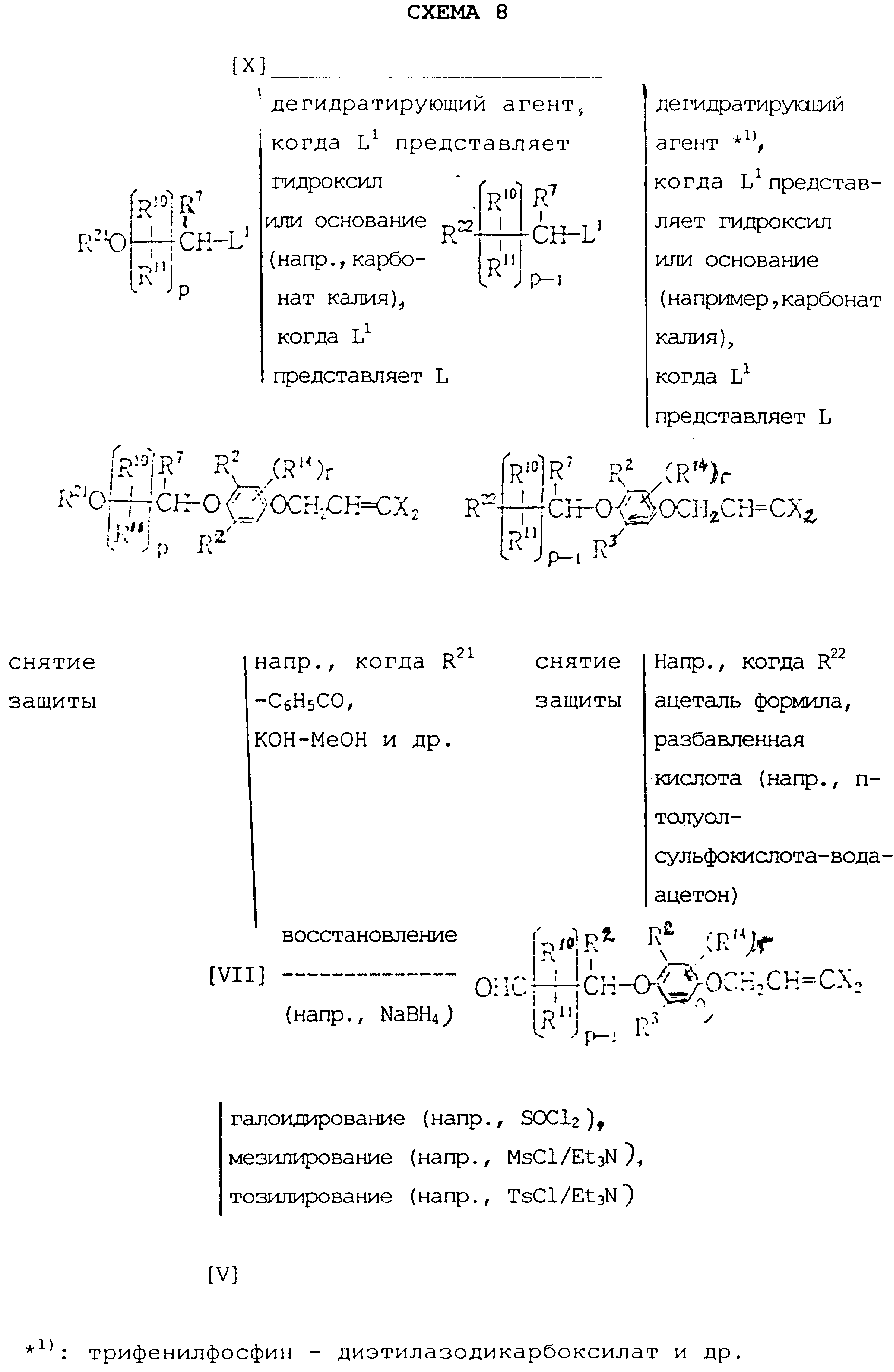
Соединения общей формулы (III) или (X), которые являются промежуточными
соединениями для использования при получении настоящих соединений, могут быть получены, например, в соответствии со схемами 7 и 8,
где общая формула (XIV) представляет соединение (II), в
котором L1 представляет OH, когда r представляет O, общая формула (XIII) представляет соединение (II), в котором L1 представляет L, когда r представляет O, R21
представляет защитную группу (например, бензоил) для спиртов, Ms представляет мезил (т.е. метилсульфонил), Ts представляет тозил (т.е. н-CH3C6H4O2Cl), а
другие переменные имеют каждый значения, определенные выше.
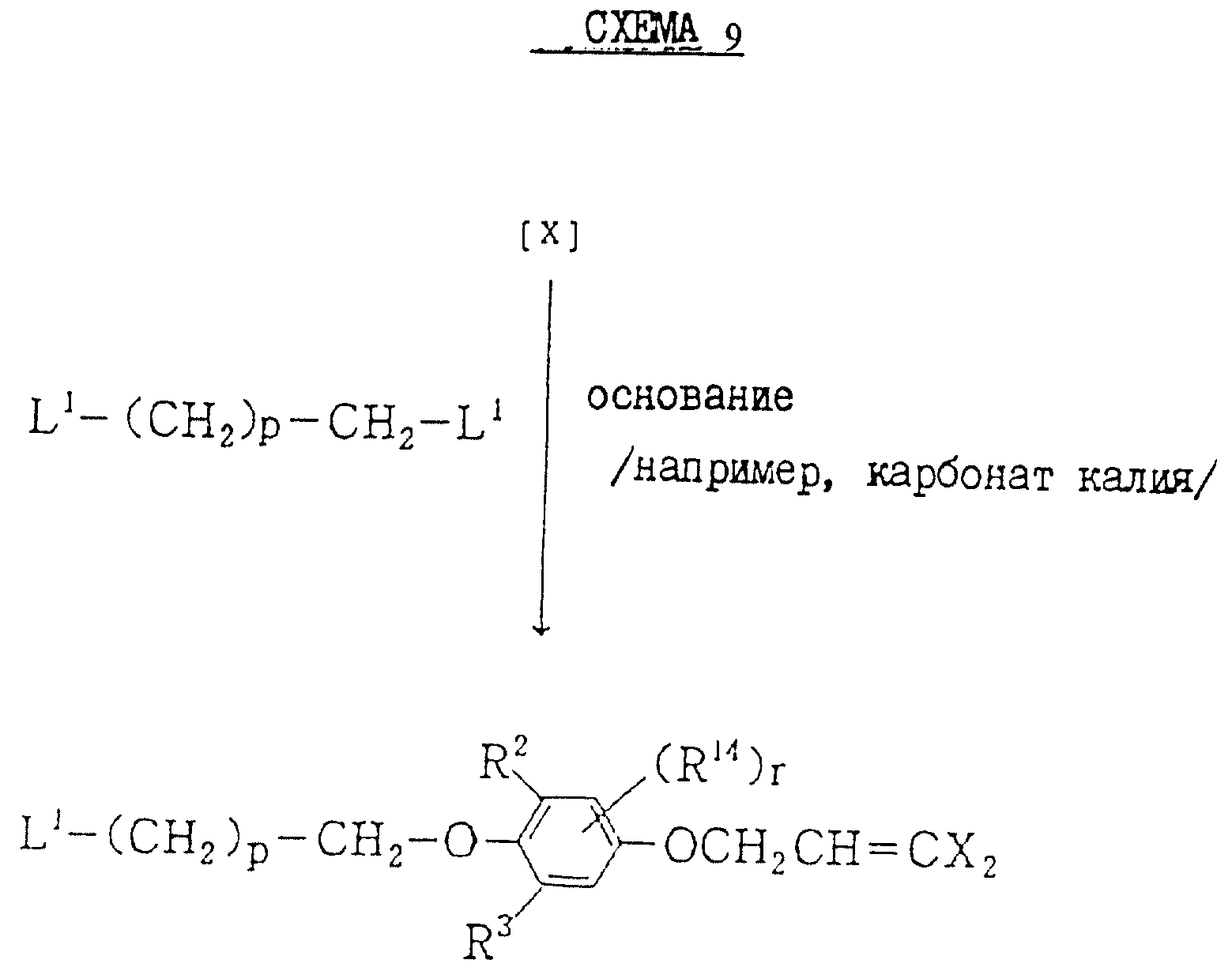
В схеме 9 получаемыми соединениями являются соединение (XIII) или (XIV), в которых R7, R10 и R11 все представляют водород, и соединение (II), в котором r представляет O, и все переменные каждый имеет значения, определяемые выше.
Соединение общей формулы (VII) и спиртовое соединение общей формулы (VIII), которые являются промежуточными соединениями для использования при получении настоящих соединений, являются промышленно доступными или могут получаться, например, в соответствии со схемой 10, где L2 представляет хлор или бром, L3 представляет мезилокси или тозилокси, и X имеет значения, определенные выше.
В схеме 11 L2 представляет хлор или бром, L3 представляет мезилокси или тозилокси, и X имеет значения, определенные выше.
Настоящие соединения являются эффективными в
удовлетворительной степени для борьбы с разнообразными насекомыми, клещами или клещиками и иксодовыми клещами, примерами которых являются следующие:
Hemiptera:
Delphacide, такие как
Laodelphax striatellus, Nilaparvata lugens и Sоgatella furcifera, Deltocephalidae, такие как Nephotettix cincticeps и Nephotettix virescens, Aphididae, Pentatomidae, Allyrodidae, Tingidae, Coccidae,
Psyllidae и др.
Lepidoptera;
Pyralidae, такие как Chilo suppressalis, Cnaphalocrocis medinalis, Ostrinia nubilalis, Parapediasia teterrella, Notarcha derogata и Plodia
interpunctella, Noctuidae, такие как Spodoptera litura, Spodoptera exigua, Spodoptera litoralis, Pseudaletia separata, Mamestra brassiode, Agrotis ipsilon, Trichoplusia spp., Heliothis spp.,
Helicoverpa spp. и Earias ssp., Pieridae, такие как Pieris rapae crucivora, Tortricidae such, такие как Adoxophyes spp. , Graphоlita molesta и Cydia pomonella, Carposinidae, такие как Carposina
niponeasis, Lyonettidae, такие как Lyonetia spp., Lymantriidae такие как Lymantria spp. и Euproctis spp., Yponomeutidae такие как Plutella xylostella, Gelechudae, такие как Pectinophora gossypiella,
Arctiidae, такие как Hyphantria cunea, Tuneidae такие как Tinea translucens и Tineola bisselliella и др.
Diptera:
Culex, такие как Culex pipiens pallens и Cules
tritaeniorhynchus, Aedes, такие как Aedes albopictus и Aedes aegypti, Anopheles, такие как Anophelinae sinensis, Chironomidae, Mushidae, такие как Musca domestica и Muscina stabutans, Calliphoridae,
Sarcophagidae, Fannia canicularis, Antromyiidae, такие как Delia Platura и Delia antigua, Trypetidae, Drosophilidae, Psychodidae, Tabanidae, Simuliidae, Stomoxyinae и др.
Coleoptera:
Diabrotica, такие как Diabrotica virgifera и Diabrotica undecimpunctаta, Scarabaeidae, такие как Anomala cuprea и Anomala rufocuprea, Curculionidae, такие как Lissorphoptrus
oryzophilus, Hypera pastica и Calosobruchys chinensis, Tenebrionidae, такие как Tenebrio molitor и Tribolium castaneum, Chrysomelidae, такие как Phyllotreta striolata и Aulacophora femоralis,
Anoliidae, Epilachna spp. , такие как Henosepilachna vigontioctopunctata, Lyctidae, Bostrychidae, Cerambyсidae, Paederus fuscipes и др.
Dyctyoptera:
Blattella germanica,
Periplaneta fuliginosa, Peroplaneta americana, Periplaneta brunnea, Blatta crientalis и др.
Thysanoptera:
Thrips palmi, Trips hawaiiensis и др.
Hymenoptera:
Formicidae, Vespidae, Bethylidae, Tenthredinidae такие как Athalia rosae и др.
Orthoptera:
Gryllotolpidae, Acrididae и др.
Siphonaptera:
Purex irritans и др.
Anoplura:
Pediculus humanus capitis, Phthirus pubis и др.
Isoptera (termites):
Reticulitermes speratus,
Coptotermes formosanus и др.
Acarina:
Паразиты растений Tetranychidae, такие как Tetranychus uriticae, Panonychus citri, Tetranychus cinnabarinus и Panonychus ulmi, паразиты
животных Ixodidae, такие как Boophilus microphus, домовые клещи и др.
Настоящие соединения являются также эффективными для борьбы с разнообразными вредными насекомыми, клещами и иксодовыми клещами, обладающими устойчивостью к обычным инсектицидам и акаридицам.
Когда настоящее соединение используется в качестве активного ингредиента инсектицидно-акарицидных средств, оно может использоваться как таковое без какого-либо добавления других ингредиентов. Однако обычно настоящее соединение преобразуется или формируется в дозированные формы, такие как масляные спреи, эмульгируемые концентраты, смачиваемые порошки, текучие препараты, гранулы, дусты, аэрозоли, фумиганты (туманообразующие препараты) и ядовитые приманки. Эти препаративные формы обычно приготавливаются путем смешения настоящего соединения с твердым носителем, жидким носителем, газообразным носителем или приманкой, и, если необходимо, с добавлением поверхностно-активного вещества или веществ, и других вспомогательных агентов, используемых для получения готовых препаративных форм.
Каждая из препаративных форм обычно содержит настоящее изобретение в качестве активного ингредиента в количестве от 0,01 до 95% по весу.
Примерами твердых носителей, используемых для препаративных форм, являются тонкодисперсные порошки или гранулы глиняных материалов, таких как каолиновая глина, диатомовая земля, синтетическая гидратированная окись кремния, бентонит, глина фубазами и кислая глина; различные виды талька, керамических веществ, других неорганических минералов, таких как серцит, кварц, сера, активированный уголь, карбонат кальция и гидратированная двуокись кремния; и химические удобрения, такие как сульфат аммония, фосфат аммония, нитрат аммония, мочевина и хлористый аммоний.
Примерами жидкого носителя являются вода; спирты, такие как метанол и этанол; кетоны, такие как ацетон и метилэтилкетон; ароматические углеводороды; такие как бензол, толуол, ксилол, этилбензол и метилнафталин; алифатические углеводороды, такие как гексан, циклогексан, керосин и газойль; сложные эфиры, такие как этилацетат и бутилацетат; нитрилы, такие как ацетонитрил и изобутиронитрил; простые эфиры, такие как диизопропиловый эфир и диоксан; амиды кислот, такие как N,N-диметилформамид и N,N-диметилацетамид; галоидированные углеводороды, такие как дихлорметан, трихлорэтан и четыреххлористый углерод; диметилсульфоксид; и растительные масла, такие как соевое масло и масло хлопковых семян.
Примерами газообразного носителя или ракетных топлив являются флоновый газ, бутановый газ, LPG (сжиженный нефтяной газ), диметиловый эфир и двуокись углерода.
Примерами поверхностно-активных веществ являются алкилсульфаты, алкилсульфонаты, алкиларилсульфонаты, алкилариловые простые эфиры и их полиоксиэтиленовые производные, полиэтиленгликолевые эфиры, сложные эфиры многоатомных спиртов и сахаро-спиртовые производные.
Примерами вспомогательных агентов, используемых для препаративных форм, таких как фиксирующие агенты или диспергирующие агенты, являются казеин, желатин, полисахариды, такие как крахмал, аравийская камедь, производные целлюлозы и альгиновая кислота, производные лигнина, бентонит, сахара и синтетические водорастворимые полимеры, такие как поливиниловый спирт, поливинилпирроролидон и полиакриловая кислота.
Примерами стабилизаторов являются PAP (кислый изопропилфосфат), BHT (2,6-ди-трет-бутил-4-метилфенол), BHA (смеси 2-трет-бутил-4-метоксифенола и 3-трет-бутил-4-метоксифенола), растительные масла, минеральные масла, поверхностно-активные агенты, жирные кислоты и их сложные эфиры.
Примерами материала основы, используемого в ядовитых приманках, являются приманочные вещества, такие как порошок из семян зерновых, растительные масла, сахара и кристаллическая целлюлоза; антиоксиданты, такие как дибутилгидрокситолуол и нордигидрогвайаретовая кислота; предохранительные или консервирующие агенты, такие как дегидроуксусная кислота; вещества для предотвращения съедания по ошибке, такие как красный перец в виде горошка; привлекающие ароматические вещества, такие как сырное ароматизирующее или вкусовое вещество или луковое ароматизирующее вещество.
Полученная таким образом препаративная форма используется как таковая или после разбавления водой. Препаративные формы могут также использоваться в сочетании с другими инсектицидами, нематоцидами, акарицидами, бактерицидами, фунгицидами, гербицидами, регуляторами роста растений, синергистами, удобрениями, агентами кондиционирования почвы и/или животным кормом в условиях несмешения или в условиях предварительного смешения.
Примерами инсектицидов, акарицидов и/или нематоцидов, которые могут использоваться, являются фосфороорганические соединения, такие как фенитрион[(0,
0-диметил 0-(3-метил-4-нитрофенил)фосфоротиоат] , фентион[0,0-диметил 0-(3-метил-4-метилтио)фенил фосфоротиоат] , диазинон[0,0-диэтил-0-2-изопропил-6-метилпиримидин-4-ил-фосфоротиоат] , хлорпирифос[0,
0-диэтил-0-3,5,6-трихлор-2-пиридилфосфоротиоат] , ацефат[0,S-диметилацетилфосфорамидотиоат], метидахион[S-2,3-дигидро-5-метокси-2-оксо-1,3,4-тиадиазол-3-ил- метил 0,0-диметилфосфородитиоат],
дисульфотон[0,0-диэтил S-2-этилтиоэтилфосфоротиоат], DDVP[2,2-дихлорвинилдиметилфосфат] , сульпрофос[0-этил-0-4-(метилтио)фенил S-пропилфосфородитиоат] , цианофос[0-4-цианофенил 0,
0-диметилфосфоротиоат], диоксабензофос[2-метокси-4H-1,2,3-бензодиоксафосфинил-2-сульфид] , диметоат[0,0-диметил-S-(N-метилкарбамоилметил)дитиофосфат] , фентоат[этил
2-диметоксифосфинотиоилтио(фенил)ацетат], малатион[диэтил(диметоксифосфинотиоилтио)сукцинат] , трихлорфон[диметил 2,2,2-трихлор-2-гидроксиэтилфосфонат] , азинфос-метил[S-3,4-дигидро-4-оксо-1,2,
3-бензотриазин-3-ил-метил- 0,0-диметилфосфородитиоат] , монокротофос [диметил (E)-1-метил-2-(метилкарбамоил)винилфосфат] , профенфос [0-4-бром-2-хлорфенил 0-этил-пропилфосфоротиоат] и этион [0,0,0',
0'-тетраэтил S, S-метиленбис(фосфородитиоат)] ; карбаматные соединения, такие как BPMC [2-втор-бутилфенилметилкарбамат] , бенфуракарб [этил N-[2,3-дигидро-2,
2-диметилбензофуран-7-ил-оксикарбонил(метил)аминотио] -N-изопропил- β -аланинат], пропоксур [2-изопропоксифенил N-метилкарбамат] , карбосульфан [2,3-дигидро-2,2-диметил-7-бензо(b)-фуранил
N-дибутиламинотио-N-метилкарбамат], карбарил [1-нафтил-N-метилкарбамат] , метомил [S-метил-N-[(метилкарбамоил)окси]-тиоацетоимидат], этиофенкарб [2-(этилтиометил)фенилметилкарбамат], альдикарб
[2-метил-2-(метилтио)пропанальдегид O-метилкарбамоилоксим], оксамил [N,N-диметил-2-метилкарбамоилоксиимино-2-(метилтио)ацетамид] , тиодикарб [3,7,9,13-тетраметил-5,11-диокса-2,8,14-тритио-4,7,9,
12- тетраазапентадека-3,12-диен-6,10-дион] , ананилкарб [этил-(Z)-N-бензил-N-{[метил-(1-метилтиоэтилиденаминооксикарбонил) амино]-тио}- β -аланилат] и фенотиокарб [S-4-феноксибутил)-N,
N-диметилтиокарбамат];
пиретроидные соединения, такие как этофенпрокс [2-(4-этоксифенил)-2-метилпропил-3-феноксибензиловый эфир] , фенвалерат [(RS)- α -циано-3-феноксибензил
(RS)-2-(4-хлорфенил)-3-метилбутират] , эсфенвалерат [(S)- α
-циано-3-феноксибензил (S)-2-(4-хлорфенил)-3-мебутират] , фенпропатрин [(RS)- α -циано-3-феноксибензил-2,2,3,
3-тетраметилциклопропанкарбоксилат], циперметрин [(RS(- α -циано-3-феноксибензил(1RS,3RS)-3-(2,2-дихлорвинил)-2,2- диметилциклопропанкарбоксилат] , перметрин [3-феноксибензил (1RS,3RS) -3-(2,
2-дихлорвинил)-2,2-диметилциклопропанкарбоксилат] , цигалотрин [(RS)- α -циано-3-феноксибензил (Z)-(1RS, 3RS)-3-(2-хлор-3,3,3- трифторпропенил)-2,2-диметилциклопропанкарбоксилат], дельтаметрин
[(S)- α -циано-м-феноксибензил (1R, 3R)-3-(2,2-дибромвинил)- 2,2-диметилциклопропанкарбоксилат] , циклопропин [(RS)- α -циано-3-феноксибензил (RS)-2,2-дихлор-1-(4-этоксифенил)
циклопропанкарбоксилат] , флувалинат [ α -циано-3-феноксибензил N-(2-хлор- α,α,α -трифтор-п-толил)-D-валинат] , бифентрин [2-метилбифенил-3-ил-метил)
(Z)-(1RS)-цис-3-(2-хлор-3,3,3- трифторпропан-1-ил)-2,2-диметилциклопропанкарбоксилат] , акринатрин [циано-(3-феноксифенил)метил[1R-{1 α (S*), 3 α (Z)}] -2,
2- диметил-3-[3-оксо-3-(2,2,2-трифтор-1-(трифторметил)этокси-1-пропенил] циклопропанкарбоксилат] , 2-метил-2-(4-бромдифторметоксифенил) пропил-(3-феноксибензиловый эфир), трарометрин [(S)- α
-циано-3-феноксибензил (1R, 3R)-3-[(1'RS)(1', 1', 2',2'-тетрабромэтил)]-2,2- диметилциклопропанкарбоксилат] и силафлуофен [4-этоксифенил[3-(4- фтор-3-феноксифенил)пропил]диметилсилан];
производные тиадиазина, такие как бупрофезин [2-трет- бутилимино-3-изопропил-5-фенил-1,3,5-тиадиазин-4-он];
производные нитроимидазолидина, такие как имидаклоприд
[1-(6-хлор-3-пиридилметил)-N-нитроимидазолидин-2-илиденамид);
нереистоксиновые производные, такие как картап [S,S'-(2-диметиламинотриметилен)бистиокарбамат] , тиоциклам [N,N-диметил-1,2,
3-тритиан-5-иламин] и бенсультап [S,S'-2-диметиламинотриметилен-ди(бензолтиосульфонат)];
N-цианоамидиновые производные, такие как ацетамиприд
[N-циано-N'-метил-N'-(6-хлор-3-пиридилметил)-ацетамидин];
хлорированные углеводороды, такие как эндосульфан [6,7,8,9,10,10-гексахлор-1,5,5a,6,9,9a-гексагидро-6,9-метано-2,4,
3- бензодиоксатиепиноксид], γ -BHC[1,2,3,4,5,6-гексахлорциклогексан] и кельтан [1,1-бис-(хлорфенил)-2,2,2-трихлорэтанол] ; бензоилфенилмочевиновые соединения, такие как хлорфлуазурон [1-(3,
5-дихлор-4-(3-хлор-5-трифторметилпиридин-2-ил-окси)фенил)-3- (2,6-дифторбензоли)-мочевина] , тефлубензурон[1-(3,5-дихлор-2,4-дифторфенил)-3-(2,6-дифторбензоил) мочевина] и фулфеноксрон
[1-(4-(2-хлор-4-трифторметилфенокси)-2- фторфенил)-3-(2,6-дифторбензоил)мочевина] ; производные формамидина, такие как амитраз [N,N'-[(метилимино)-диметилидин]-ди-2,4-ксилидин] и хлордимеформ
[N'-(4-хлор-2-метилфенил)-N,N-диметилметанимидамид] ;
тиомочевиновые производные, такие как диафентиурон [N-(2,6-диизопропил-4-феноксифенил)-N'-трет-бутилкарбодиимид] , фипронил [5-амино-1-(2,
6-дихлор- α,α,α -трифтор-п-толил)-4- трифторметилсульфинилпиразол-3-карбонитрил] , тебфенозид [N-трет-бутил-N'-(4-этилбензоил)-3,5-диметилбензогидразид] ,
4-бром-2-(4-хлорфенил)-1-этоксиметил-5-трифторметилпиррол-3- карбонитрил, хлорфенапил [4-бром-2-(4-хлорфенил)-1-этоксиметил- -трифторметилпиррол-3-карбонитрил], бромопропилат [изопропил-4,
4'-дибромбензилат], тетрадифон [4-хлорфенил-2,4,5-трихлорфенилсульфон], хинометионат [S,S-6-метилхиноксалин-2,3-ди-илдитиокарбонат] , пропаргит [2-(4-трет-бутилфенокси)циклогексил-проп-2-ил-сульфит] ,
фенбутатин оксид [бис[трис(2-метил-2-фенилпропил)-олово] оксид] , гекситиазокс [(4RS,5RS)-5-(4-хлорфенил)-N-хлоргексил-4-метил-2-оксо-1,3- триазолидин-3-карбоксамид] , хлорфентизин [3,
6-бис-(2-хлорфенил)-1,2,4,5-тетразин], пиридабен [2-трет-бутил-5- (4-трет-бутилбензилтио)-4-хлорпиридазин-3(2H)-он] , фенпироксимат [трет-бутил(E)-4-[(1,3-диметил-5-феноксипиразол-4-ил)
метиленаминооксиметил] -бензоат], тебфенпирад [N-(4-третбутилбензил) -4-хлор-3-этил-1-метил-5-пиразолкарбоксамид] ; полиактиновые комплексы, включая тетранактин, тринактин и динактин; милбемектин,
авермектин, ивермектин, азадилактин (AZAD), пиримидифен [5-хлор-N-[2-{ 4-(2-этоксиэтил)-2,3-диметилфенокси}-этил]- 6-этилпиримидин-4-амин] и пиметрозин [2,3,4,
5-тетрагидро-3-оксо-4- [(пиридин-3-ил)метиленамино] -6-метил-1,2,4-триазин].
Когда настоящее соединение используется в качестве активного ингредиента инсектицидно-акарицидных средств для сельского хозяйства, применяемое количество его обычно находится в интервале 0,1 - 100 г на 10 ар. В случае эмульгируемых концентратов, смачиваемых порошков и текучих или сыпучих концентратов, которые используются после разбавления водой, применяемая концентрация его обычно лежит в интервале от 0,1 до 500 част./млн. В случае гранул и дустов, они применяются как таковые без какого-либо разбавления. Когда настоящее соединение используется в качестве активного ингредиента инсектицидно/акарицидных средств для предотвращения эпидемии, оно преобразуется в дозированные формы, такие как эмульгируемые концентраты, смачиваемые порошки и текучие концентраты, которые применяются после разбавления водой до обычной концентрации 0,1 - 500 част./млн.; или оно преобразуется в дозированные формы, такие, как масляные спреи, аэрозоли, фумиганты и ядовитые приманки, которые применяются как таковые без какого-либо разбавления.
Применяемое количество и применяемая концентрация могут варьировать в зависимости от различных условий, таких как тип препаративной формы, времени применения, места и способа применения, в зависимости от вида вредных насекомых, клещей и иксодовых клещей, и от степени повреждения, и они могут увеличиваться или снижаться без ограничения указанным выше интервалом.
Настоящее изобретение будет далее проиллюстрировано с помощью следующих примеров получения, примеров препаративных форм и примеров испытаний, которые не следует рассматривать как ограничивающие объем изобретения.
Следующие ниже примеры являются примерами получения настоящих соединений в соответствии с различными процессами получения.
Пример получения 1. Получение соединения (64) с помощью процесса получения E
К раствору 0,30 г 4-(3,3-дихлор-2-пропенилокси)-2,6- дихлорфенола, 0,16 г 4-фенил-1-бутанола и 0,27 г трифенилфосфина, растворенных в 10 мл тетрагидрофурана, добавлялся по каплям раствор 0,21 г
диэтилазодикарбоксилата, растворенного в 5 мл тетрагидрофурана, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 24 часов, реакционная смесь
концентрировалась с получением остатка. Остаток подвергался хроматографии на силикагеле, что давало 0,32 г 3,5-дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(4-фенилбутилокси)бензола (выход 73%).
nD26.0 = 1,5716.
Пример получения 2. Получение соединения (77) с помощью процесса получения E
К раствору 0,30 г 2,6-дихлор-4-(3,
3-дихлор-2-пропенилокси)фенола, 0,16 г 3-фенокси-2-пропанола и 0,27 г трифенилфосфина, растворенного в 10 мл тетрагидрофурана, добавлялся по каплям раствор 0,21 г диизопропилазодикарбоксилата,
растворенного в 5 мл тетрагидрофурана, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 24 часов, реакционная смесь концентрировалась с получением
остатка. Остаток подвергался хроматографии на силикагеле, что давало 0,36 г 3,5-дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(3-феноксипропилокси)бензола (82% выход).
nD25.0 = 1,5762.
Пример получения 3. Получение соединения (34) с помощью процесса получения E
К раствору 0,33 г 4-(3,3-дихлор-2-пропенилокси)-2,6- дихлорфенола, 0,23
г м-феноксибензилового спирта и 0,34 г трифенилфосфина, растворенных в 10 мл тетрагидрофурана, добавлялся по каплям раствор 0,26 г диизопропилизодикарбоксилата, растворенного в 5 мл тетрагидрофурана,
при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 12 часов реакционная смесь концентрировалась, а затем смешивалась с 20 мл диэтилового эфира. Осадок
отфильтровывался, и фильтрат концентрировался. Остаток подвергался хроматографии на силикагеле, что давало 0,31 г 3,5-дихлор-4-(3-феноксибензил)-1-(3,3-дихлор-2-пропенилокси)бензола (57% выход), nD25.5 = 1,6066.
Пример получения 4. Получение соединения (35) с помощью процесса получения E
К раствору 0,47 г 4-(3,3-дихлор-2-пропенилокси)-2,
6-дихлорфенола, 0,32 г п-феноксибензолового спирта и 0,46 г трифенилфосфина, растворенных в 10 мл тетрагидрофурана, добавлялся по каплям раствор 0,35 г диизопропилазодикарбоксилата, растворенного в 5
мл тетрагидрофурана, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 12 часов реакционная смесь концентрировалась, а затем смешивалась с 20 мл
диэтилового эфира. Осадок отфильтровывался, и фильтрат концентрировался. Остаток подвергался хроматографии на силикагеле, что давало 0,51 г 3,5-дихлор-4-(4-феноксибензил)-1-(3,
3-дихлор-2-пропенилокси)бензола (68% выход), nD25.5 = 1,6084.
Пример получения 5. Получение соединения (63) с помощью процесса получения E
К
раствору 0,30 г 4-(3,3-дихлор-2-пропенилокси)-2,6-дихлорфенола, 0,16 г 4-хлор- β -фенэтилового спирта и 0,27 г трифенилфосфина, растворенных в 10 мл тетрагидрофурана, добавлялся по каплям
раствор 0,21 г диэтилазодикарбоксилата, растворенного в 5 мл тетрагидрофурана, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 24 часов реакционная
смесь концентрировалась и получался остаток. Остаток подвергался хроматографии на силикагеле, что давало 0,32 г 4-(4-хлор- β -фенэтилоксид)-3,5-дихлор-1-(3,3-дихлор-2-пропенилокси) бензола
(выход 72%), nD24.5 = 1,5868.
Пример получения 6. Получение соединения (1) с помощью процесса получения A
К смеси 600 мг 3,5-дихлор-4-(1,1,2,
2-тетрафторэтокси)фенола, 330 мг карбоната калия и 10 мл N,N-диметилформамида добавлялся по каплям раствор 340 мг 1,1,3-трихлор-1-пропена, растворенного в 3 мл N,N-диметилформамида, при перемешивании
при комнатной температуре. После продолжения перемешивания при комнатной температуре в течение 5 часов реакционная смесь выливалась в смесь льда и воды и экстрагировалась дважды 40 мл диэтилового
эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 630 мг
3,5-дихлор-4-(1,1,2,2-тетрафторэтокси)-1-(3,3-дихлор-2- пропенилокси)бензола (выход 82%), nD24.6 = 1,5067.
Пример получения 7. Получение соединения (41)
с помощью процесса получения A
К смеси 1,10 г 3,5-дихлор-4-(4-фтор-3-фенокси)бензилоксифенола, 0,44 г карбоната калия и 20 мл N,N-диметилформамида добавлялся по каплям раствор 0,89 г 1,1,
3-трибромпропена, растворенного в 5 мл N,N-диметилформамида, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 7 часов реакционная смесь выливалась в
смесь льда и воды и экстрагировалась два раза 50 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался с получением сырого или
неочищенного продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало 1,16 г 3,5-дихлор-4-(4-фтор-3-фенокси)бензилокси-1-(3,3-дибром-2- пропенилокси)бензола (выход 69%), nD22.5 = 1,6062.
Пример получения 8. Получение соединения (3) с помощью процесса получения B
К раствору 0,54 г 4-(3,3-дихлор-2-пропенилокси)-3,
5- дихлорфенола, 0,24 г 3,3-дихлораллилового спирта и 0,49 г трифенилфосфина, растворенных в 15 мл тетрагидрофурана, добавлялся по каплям раствор 0,38 г диизопропилазодикарбоксилата, растворенного в 5
мл тетрагидрофурана, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 24 часов реакционная смесь концентрировалась с получением остатка. Остаток
подвергался хроматографии на силикагеле, что давало 0,52 г 4-(3,3-дихлор-2-пропенилокси)-3,5-дихлор-1-(3,3-дихлор-2- пропенилокси)бензола (выход 70%), т.пл. 75,8oC.
Пример
получения 9. Получение соединения (47) с помощью процесса получения C
В реакционный сосуд помещалось 0,26 г цинковой пыли, 1,0 г трифенилфосфина, 1,3 г четырехбромистого углерода и 20 мл
метиленхлорида с последующим перемешиванием при комнатной температуре. Спустя 24 часа, к вышеуказанному раствору по каплям добавлялся раствор 0,70 г (4-(2-хлорбензилокси)3,5-дихлорфенокси)
ацетальдегида, растворенного в 5 мл метиленхлорида, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 6 часов реакционная смесь концентрировалась с
получением остатка. Остаток подвергался хроматографии на силикагеле, что давало 0,63 г 4-(2-хлорбензилокси)-3,5-дихлор-1-(3,3-дибром-2- пропенилокси)бензола (63% выход), т.пл. 83,5oC.
Пример получения 10. Получение соединения (23) с помощью процесса получения D
К смеси 0,51 г 2,6-дихлор-4-(3,3-дихлор-2-пропенилокси)-фенола, 0,27 г карбоната калия и 20 мл N,
N-диметилформамида добавлялся по каплям раствор 0,29 г м-хлорбензилхлорида, растворенного в 5 мл N,N-диметилформамида, при перемешивании при комнатной температуре. После перемешивания при комнатной
температуре в течение 7 часов реакционная смесь выливалась в смесь льда и воды, и экстрагировалась дважды 50 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным
сульфатом магния и концентрировался с получением неочищенного продукта. Неочищенный продукт подвергался хроматографии на силикагеле, что давало 0,50 г 3,5-дихлор-4-(3-хлорбензилокси)-1-(3,
3-дихлор-2-пропенилокси)бензола (69% выход), т.пл. 87,0oC.
Пример получения 11. Получение соединения (27) с помощью процесса получения D
К смеси 0,72 г 2,
6-дихлор-4-(3,3-дихлор-2-пропенилокси)-фенола, 0,38 г карбоната калия и 20 мл N,N-диметилформамида добавлялся по каплям раствор 0,71 г 3-фтор-4-феноксибензилбромида, растворенного в 5 мл N,
N-диметилформамида, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 7 часов реакционная смесь выливалась в смесь лед-вода и экстрагировалась дважды
50 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на
силикагеле, что давало 1,05 г 3,5-дихлор-4-(3-фтор-4-фенокси)бензилокси-1-(3,3-дихлор-2-пропенилокси)бензола (выход 86%), nD22,5 = 1,5973.
Пример
получения 12. Получение соединения (37) с помощью процесса получения E
К раствору 0,41 г 4-(3-дихлор-2-пропенилокси)-2,6-дихлорфенола, 0,17 г α -фенэтилового спирта и 0,37 г
трифенилфосфина, растворенного в 10 мл тетрагидрофурана, добавлялся по каплям раствор 0,29 г диизопропилазодикарбоксилата, растворенного в 5 мл тетрагидрофурана, при перемешивании при комнатной
температуре. После перемешивания при данной температуре в течение 12 часов реакционная смесь концентрировалась, а затем смешивалась с 20 мл диэтилового эфира. Осадок отфильтровывался, а фильтрат
концентрировался. Остаток подвергался хроматографии на силикагеле, что давало 0,27 г 3,5-дихлор-4-фенэтилокси-1-(3,3-дихлор-2-пропенилокси)бензола (48% выход), nD26,0 = 1,
5830.
Пример получения 13. Получение соединения (42) с помощью процесса получения E
К раствору 0,30 г 4-(3-дихлор-2-пропенилокси)-2,6-дихлорфенила, 0,12 г β
-фенэтилового спирта и 0,27 г трифенилфосфина, растворенных в 10 мл тетрагидрофурана, добавлялся по каплям раствор 0,21 г диизопропилазодикарбоксилата, растворенного в 5 мл тетрагидрофурана, при
перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 12 часов реакционная смесь концентрировалась и смешивалась с 20 мл диэтилового эфира. Осадок
отфильтровывался, а фильтрат концентрировался. Остаток подвергался хроматографии на силикагеле, что давало 0,25 г 3,5-дихлор-4- β -фенэтилокси-1-(3,3-дихлор-2-пропенилокси)бензола (61% выход),
nD28,5 = 1,5816.
Пример получения 14. Получение соединения (19) с помощью процесса получения D
К смеси 0,51 г 2,6-дихлор-4-(3,
3-дихлор-5-пропенилокси)-фенола, 0,27 г карбоната калия и 20 мл N,N-диметилформамида добавлялся по каплям раствор 0,31 г 2-( α -хлорметил)нафталина, растворенного в 5 мл N,N-диметилформамида,
при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 7 часов реакционная смесь выливалась в лед-воду и экстрагировалась дважды 50 мл диэтилового эфира.
Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало 0,58 г
3,5-дихлор-4-(2-нафтилметилокси)-1- (3,6-дихлор-2-пропенилокси)бензола (76% выход), т.пл. 86,7oC.
Пример получения 15. Получение соединения (16) с помощью процесса
получения D
К смеси 0,62 г 2,6-дихлор-4-(3,3-дихлор-5-пропенилокси)-фенола, 0,33 г карбоната калия и 20 мл N,N-диметилформамида добавлялся по каплям раствор 0,43 г циннамилбромида,
растворенного в 5 мл N,N-диметилформамида, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 7 часов, реакционная смесь выливалась в смесь льда и
воды и экстрагировалась дважды 50 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт
подвергался хроматографии на силикагеле, что давало 0,70 г 3,5-дихлор-4-(циннамилокси)-1- (3,3-дихлор-2-пропенилокси)бензола (80% выход), т.пл. 51,3oC.
Пример получения 16.
Получение соединения (68) с помощью процесса получения D
К смеси 0,51 г 2,6-дихлор-4-(3,3-дихлор-5-пропенилокси)-фенола, 0,17 г карбоната калия и 20 мл N,N-диметилформамида добавлялся раствор
0,34 г 2-фтор-5-(4-фторфенокси)бензилбромида, растворенного в 5 мл N,N-диметилформамида, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 24 часов
реакционная смесь выливалась в смесь лед-вода и экстрагировалась дважды 50 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался с
получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало 0,50 г 3,5-дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(2-фтор-5-(4- фторфенокси)бензилокси)-бензола (выход
68%), nD26,0 = 1,5871.
Пример получения 17. Получение соединения (84) с помощью процесса получения E
К раствору 0,30 г 2,6-дихлор-4-(3,
3-дихлор-5-пропенилокси)-фенола, 0,16 г 3-хлорфенэтилового спирта и 0,27 г трифенилфосфина, растворенного в 10 мл тетрагидрофурана, добавлялся по каплям раствор 0,21 г диизопропилазодикарбоксилата,
растворенного в 5 мл тетрагидрофурана, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 24 часов реакционная смесь концентрировалась с получением
остатка. Остаток подвергался хроматографии на силикагеле, что давало 0,36 г 3,5-дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(2-(3-хлорфенил)этокси)бензола (81% выход), nD26,0
= 1,5897.
Пример получения 18. Получение соединения (86) с помощью процесса получения E
К раствору 0,30 г 2,6-дихлор-4-(3,3-дихлор-5-пропенилокси)-фенола, 0,20 г
3-(трифторметил)фенэтилового спирта и 0,27 г трифенилфосфина, растворенных в 10 мл тетрагидрофурана, добавлялся по каплям раствор 0,21 г диизопропилазодикарбоксилата, растворенного в 5 мл
тетрагидрофурана, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 24 часов реакционная смесь концентрировалась с получением остатка. Остаток
подвергался хроматографии на силикагеле, что давало 0,39 г 3,5-дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(2-(3-трифторметил) фенилэтокси)-бензола (81% выход), nD26,0 = 1,
5497.
Пример получения 19. Получение соединения (91) с помощью процесса получения E
Смесь 1,14 г 2,6-дихлор-4-(3,3-дихлор-2-пропенилокси)-фенола, 1,20 г
3-(4-хлорфенокси)пропилбромида, 0,83 г карбоната калия и 20 мл N,N-диметилформамида перемешивалась при 80oC в течение 6 часов. Реакционная смесь выливалась в смесь льда и воды и
экстрагировалась дважды 50 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался
хроматографии на силикагеле, что давало 1,01 г 3,5-дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(3-(4-хлорфенокси) пропилокси)бензола (55% выход). nD25,0 = 1,5822.
Пример получения 20. Получение соединения (99) с помощью процесса получения E
К раствору 0,30 г 2,6-дихлор-4-(3,3-дихлор-5-пропенилокси)-фенола, 0,24 г
3-(4-бромфенокси)-1-пропанола и 0,27 г трифенилфосфина, растворенных в 10 мл тетрагидрофурана, добавлялся по каплям раствор 0,21 г диизопропилазодикарбоксилата, растворенного в 5 мл тетрагидрофурана,
при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 24 часов реакционная смесь концентрировалась, давая остаток. Остаток подвергался хроматографии на
силикагеле, что давало 0,34 г 3,5-дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(3-(4-бромфенокси) пропилокси)бензола (выход 65%), nD25,0 = 1,5917.
Пример
получения 21. Получение соединения (100) с помощью процесса получения E
К раствору 0,30 г 2,6-дихлор-4-(3,3-дихлор-2-пропенилокси)-фенола, 0,25 г 3-(4-трифторметокси)фенокси-1-пропанола и 0,
27 г трифенилфосфина, растворенных в 10 мл тетрагидрофурана, добавлялся по каплям раствор 0,21 г диизопропилазодикарбоксилата, растворенного в 5 мл тетрагидрофурана, при перемешивании при комнатной
температуре. После перемешивания при комнатной температуре в течение 24 часов реакционная смесь концентрировалась, давая остаток. Остаток подвергался хроматографированию на силикагеле, что давало 0,41
г 3,5-дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(3-(4-трифторметокси) фенокси)пропилокси)бензола (78% выход), nD25,0 = 1,5342.
Пример получения 22.
Получение соединения (166) с помощью процесса получения F
Смесь 0,56 г 3,5-дихлор-4-(3-бромпропилокси)-1-(3,3-дихлор- 2-пропенилокси)бензола, 0,22 г 4-трифторметилфенола, 0,21 г карбоната
калия и 20 мл N, N-диметилформамида перемешивалась при комнатной температуре. После перемешивания в течение 7 часов реакционная смесь выливалась в смесь льда и воды и экстрагировалась два раза 50 мл
диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что
давало 0,48 г 3,5-дихлор-4-(3-(4-трифторметилфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензола (71% выход), nD24,4 = 1,5390.
Пример получения 23.
Получение соединения (203) с помощью процесса получения F
Смесь 0,88 г 3,5-дихлор-4-(4-бромбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензола, 0,32 г 4-изопропоксифенола, 0,32 г карбоната калия
и 20 мл N, N-диметилформамида перемешивалась при комнатной температуре. Спустя 7 часов, реакционная смесь выливалась в смесь лед-вода и экстрагировалась дважды 50 мл диэтилового эфира. Объединенный
эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало 0,54 г 3,
5-дихлор-4-(4-(4-изопропоксифенокси)бутокси)-1- (3,3-дихлор-2-пропенилокси)бензола (51% выход), nD23,0 = 1,5578.
Пример получения 24. Получение
соединения (222) с помощью процесса получения F
Смесь 0,61 г 3,5-дихлор-4-(4-бромбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензола, 0,19 г 4-хлорфенола, 0,22 г карбоната калия и 20 мл N,
N-диметилформамида перемешивалась при комнатной температуре. Спустя 7 часов, реакционная смесь выливалась в смесь лед-вода и экстрагировалась дважды 50 мл диэтилового эфира. Объединенный эфирный слой
промывался водой, сушился безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало 0,54 г 3,
5-дихлор-4-(4-(4-хлорфенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензола (59% выход), т.пл. 54,5oC.
Пример получения 25. Получение соединения (152) с помощью процесса
получения F
В реакционный сосуд помещалось 0,29 г 3,5-дихлор-4-(3-бромпропилокси)-1-(3,3-дихлор-2-пропенилокси)бензола, 0,12 г 4-этоксибензойной кислоты, 0,12 г карбоната калия и 10 мл N,
N-диметилформамида с последующим перемешиванием при комнатной температуре в течение 12 часов. Реакционная смесь выливалась в воду и экстрагировалась 50 мл диэтилового эфира. Объединенный эфирный слой
промывался водой, сушился безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало 0,30 г 3,
5-дихлор-4-(3-(4-этоксибензоилокси)пропилокси)- 1-(3,3-дихлор-2-пропенилокси)бензола (86% выход), nD24,0 = 1,5715.
Пример получения 26. Получение
соединения (253) с помощью процесса получения F
В реакционный сосуд помещалось 0,20 г 3,5-дихлор-4-(3-бромпропилокси)-1-(3,3-дихлор-2-пропенилокси)бензола, 0,10 г 4-хлорфенилуксусной кислоты,
0,08 г карбоната калия и 5 мл N,N-диметилформамида с последующим перемешиванием при комнатной температуре в течение 12 часов. Реакционная смесь выливалась в воду и экстрагировалась дважды 30 мл
диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что
давало 0,22 г 3,5-дихлор-4-(3-(4-хлорфенилацетилокси)-1-(3,3-дихлор-2-пропенилокси) бензола (90% выход), nD22,0 = 1,5698.
Пример получения 27. Получение
соединения (236) с помощью процесса получения F
В реакционный сосуд помещалось 0,20 г 3,5-дихлор-4-(3-бромпропилокси)-1-(3,3-дихлор-2-пропенилокси)бензола, 0,11 г 4-хлоркоричной кислоты, 0,08
г карбоната калия и 5 мл N,N-диметилформамида с последующим перемешиванием при комнатной температуре в течение 12 часов. Реакционная смесь выливалась в воду и экстрагировалась дважды 30 мл диэтилового
эфира. Объединенный эфирный слой промывался водой, сушился над безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что
давало 0,24 г 3,5-дихлор-4-(3-(4-хлорциннамоилокси)пропилокси)-1-(3,3-дихлор-2-пропенилокси) бензола (выход 96%), т. пл. 62,2oC.
Пример получения 28. Получение соединения
(237) с помощью процесса получения F
В реакционный сосуд помещалось 0,20 г 3,5-дихлор-4-(3-бромпропилокси)-1-(3,3-дихлор-2-пропенилокси)бензола, 0,11 г 4-хлорфеноксиуксусной кислоты, 0,08 г
карбоната калия и 5 мл N,N-диметилформамида с последующим перемешиванием при комнатной температуре в течение 12 часов. Реакционная смесь выливалась в воду и экстрагировалась дважды 30 мл диэтилового
эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало
0,23 г 3,5-дихлор-4-(3-(4-хлорфеноксиацетилокси)пропилокси-1-(3,3-дихлор-2-пропенилокси) бензола (выход 91%), nD22,0 = 1,5709.
Пример получения 29.
Получение соединения (185) с помощью процесса получения C
К раствору 1,10 г 3,5-дихлор-4-(3-гидроксипропокси)-1-(3,3-дихлор-2-пропенилокси)бензола, 0,56 г 3-трифторметоксифенола и 0,83 г
трифенилфосфина, растворенных в 20 мл тетрагидрофурана, добавлялся по каплям раствор 0,64 г диизопропилазодикарбоксилата, растворенного в 10 мл тетрагидрофурана, при перемешивании при комнатной
температуре. После перемешивания при комнатной температуре в течение 24 часов реакционная смесь концентрировалась и получался остаток. Остаток подвергался хроматографии на силикагеле, что давало 1,03
г 3,5-дихлор-4-(3-(4-трифторметоксифенокси)пропилокси-1-(3,3-дихлор-2-пропенилокси) бензола (65% выход), nD23,4 = 1,5343.
Пример получения 30. Получение
соединения (276) с помощью процесса получения F
Смесь 3,9 г 4-(трифторметил)анилина и 0,50 г 1-(3-бромпропилокси)-2,6-дихлор-4-(3,3-дихлор-2-пропенилокси)бензола перемешивалась при 90
- 100oC в течение 3 часов. После охлаждения до комнатной температуры реакцинная смесь подвергалась хроматографии на силикагеле, что давало 0,37 г 3,5-дихлор-1-(3,
3-дихлор-2-пропенилокси)-4-(3-(4-трифторметил) фениламино)пропилокси)бензола (62% выход), nD23,5 = 1,5617.
Пример получения 31. Получение соединения
(277)
Смесь 0,37 г 3,5-дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(3- (4-трифторметил)фениламино)пропилокси)бензола, 0,1 мл метилиодида, 0,12 г карбоната калия и 10 мл N,N-диметилформамида
перемешивалась при 50oC в течение 3 часов. После охлаждения до комнатной температуры реакционная смесь выливалась в смесь льда и воды и экстрагировалась дважды 50 мл этилацетата.
Объединенный этилацетатный слой промывался водой, сушился безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало
0,26 г 3,5-дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(3-метил-(4- (трифторметил)фенил)амино)пропилокси)бензола (выход 68%), nD25,5 = 1,5593.
Пример
получения 32. Получение соединения (182) согласно процессу получения F
Смесь 0,47 г 4-хлортиофенола, 1,33 г 1-(3-бромпропилокси)-2,6-дихлор-4-(3,3-дихлор-2-пропенилокси)бензола, 0,49 г
карбоната калия и 20 мл N,N-диметилформамида перемешивалась при комнатной температуре в течение 24 часов. Реакционная смесь выливалась в смесь льда и воды и экстрагировалась дважды 50 мл диэтилового
эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало
1,24 г 1-(3-(4-хлорфенилтио)пропилокси)-2,6-дихлор-4-(3,3-дихлор-2- пропенилокси)бензола (выход 81%), nD26,0 = 1,6035.
Пример получения 33. Получение
соединения (268)
Смесь 0,50 г 1-(3-(4-хлорфенилтио)пропилокси)-2,6-дихлор- 4-(3,3-дихлор-2-пропенилокси)бензола и 20 мл метиленхлорида перемешивалась при охлаждении смесью льда и воды и к ней
добавлялось 0,26 г м-хлорнадбензойной кислоты. После перемешивания при комнатной температуре в течение 24 часов метиленхлоридный слой отделялся, промывался последовательно насыщенным водным раствором
сульфита натрия, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушился сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался
хроматографии на силикагеле, что давало 0,38 г 1-(3-(4-хлорфенилсульфинил)пропилокси)-2,6-дихлор-4-(3,3- дихлор-2-пропенилокси)бензола (выход 73%), nD24,5 = 1,5962.
Пример получения 34. Получение соединения (285)
Смесь 0,50 г 1-(3-(4-хлорфенилтио)пропилокси)-2,6-дихлор-4-(3,3-дихлор-2- пропенилокси)бензола и 20 мл метиленхлорида перемешивалась
при охлаждении льдом с водой, к смеси добавлялось 0,52 г м-хлорнадбензойной кислоты. После перемешивания при комнатной температуре в течение 24 часов метиленхлоридный слой отделялся, промывался
последовательно
насыщенным раствором водным сульфита натрия, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушился над сульфатом магния и концентрировался с
получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало 0,44 г 1-(3-(4-хлорфенилсульфонил)пропилокси)-2,6-дихлор-4-(3,3- дихлор-2-пропенилокси)бензола (82% выход),
nD24,5 = 1,5863.
Пример получения 35. Получение соединения (242) с помощью процесса получения E
В реакционный сосуд помещалось 0,53 г
4-(3-фторфенил)-3-бутен-1-ола и 50 мл этилацетата и воздух в сосуде заменялся азотом. Затем туда добавлялось 0,1 г 10% палладия на угле, и азот в сосуде заменялся водородом с последующим
перемешиванием при комнатной температуре в течение 24 часов. После того, как водород в сосуде обменивался на азот, реакционный раствор фильтровался через слой целита, и фильтрат концентрировался.
Остаток подвергался хроматографии на силикагеле, что давало 0,48 г 4-(3-фторфенил)-1-бутанола.
К раствору 0,18 г 4-(3-фторфенил)-1-бутанола, 0,30 г 2,6-дихлор-4-(3, 3-дихлор-2-пропенилокси)фенола и 0,27 г трифенилфосфина, растворенных в 10 мл тетрагидрофурана, добавлялся по каплям раствор 0,20 мл N,N-диизопропилазодикарбоксилата, растворенного в 5 мл тетрагидрофурана, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 24 часов, реакционная смесь концентрировалась с получением остатка. Остаток подвергался хроматографии на силикагеле, что давало 0,38 г 3,5-дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(4-(3-фторфенил) бутокси)бензола (выход 83%), nD25,0 = 1,5620.
Пример получения 36. Получение соединения (239) с помощью процесса получения E
Смесь 4,0 г (3-гидроксипропил)трифенилфосфонийбромида и 20 мл тетрагидрофурана охлаждалась до 0oC, к смеси медленно по каплям добавлялось 12,5 мл 1.6 М н-бутиллития (в виде раствора в гексане). Реакционная смесь перемешивалась при 0oC в течение 30 минут, и к смеси медленно по
каплям при той же температуре добавлялась смесь 1,24 г 3-фторбензальдегида и 10 мл тетрагидрофурана с последующим дополнительным перемешиванием при комнатной температуре в течение 6 часов. Реакционная
смесь выливалась в смесь льда и воды, подкислялась добавлением 10% соляной кислоты и экстрагировалась дважды 50 мл диэтилового эфира. Объединенный эфирный слой промывался насыщенным солевым раствором,
сушился безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало 0,70 г 4-(3-фторфенил)-3-бутен-1-ола.
К раствору 0,17 г 4-(3-фторфенил)-1-бутен-1-ола, 0,30 г 2,6-дихлор-4-(3,3-дихлор-2-пропенилокси)фенола и 0,27 г трифенилфосфина, растворенных в 10 мл тетрагидрофурана, добавлялся по каплям раствор 0,20 мл N,N-диизопропилазодикарбоксилата, растворенного в 5 мл тетрагидрофурана, при перемешивании при комнатной температуре. После того, как перемешивание при комнатной температуре продолжалось в течение 24 часов, реакционная смесь концентрировалась и получался остаток . Остаток подвергался хроматографии на силикагеле, что давало 0,38 г 3,5-дихлор-1-(3, 3-дихлор-2-пропенилокси)-4-(4-(3-фторфенил)-3- бутенилокси)бензола (выход 84%), nD25,5 = 1,5857.
Пример получения 37. Получение соединения (270) с
помощью процесса получения E
К смеси 20,4 г 1,3-дибромпропана, 7,1 г карбоната калия и 100 мг N,N-диметилформамида добавлялся по каплям раствор 9 г 4-трифторметоксифенола, растворенного в 30
мл N,N-диметилформамида, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 24 часов реакционная смесь фильтровалась, и растворитель удалялся из
фильтрата с помощью перегонки при пониженном давлении. Остаток подвергался хроматографии на силикагеле, что давало 9,1 г 1-(3-бромпропилокси)-4-трифторметоксибензола (60% выход).
К смеси 0,6 г 3,5-диэтил-4-[3-(4-(трифторметокси)фенокси) пропилокси]фенола, полученного таким образом, 0,21 г карбоната калия и 10 мл N,N-диметилформамида добавлялся по каплям раствор 0,30 1,1, 3-трифтор-1-пропена, растворенного в 5 мл N,N-диметилформамида, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 12 часов реакционная смесь выливалась в смесь льда и воды и экстрагировалась дважды 100 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало 0,56 г 3,5-диэтил-4-[3-(4-трифторметоксифенокси)пропилокси] -1- (3,3-дихлор-2-пропенилокси)бензола (80% выход), nD25,9 = 1,5115.
Пример получения 38. Получение соединения (216) с помощью процесса получения D
Сначала 0,35 г 1-(3-бромпропилокси)-4-трифторметилбензола
(полученного таким же образом, как описано выше для 1-(3-бромпропилокси)-4-трифторметоксибензола) и 0,2 г карбоната калия растворялись в 100 мл N,N-диметилформамида, и к смеси добавлялось 0,3 г
2-хлор-6-метил-4-(3,3-дихлор-2-пропенилокси)фенола, и смесь перемешивалась при комнатной температуре в течение 24 часов. Реакционная смесь смешивалась с 200 мл диэтилового эфира, промывалась водой,
сушилась безводным сульфатом магния и концентрировалась с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало 0,50 г
3-хлор-3-[3-(4- трифторметилфенокси)пропилокси]-5-метил-1- (3,3-дихлор-2-пропенилокси)бензола (выход 94%), nD23,0 = 1,5330.
Пример получения 39.
Получение соединения (272) с помощью процесса получения A
К смеси 0,6 г 3-этил-[3-(4-трифторметоксифенокси)пропилокси]-5- метилфенола, 0,22 г карбоната калия и 10 мл N,N-диметилформамида
добавлялся по каплям раствор 0,31 г 1,1,3-трихлор-1-пропена, растворенного в 5 мл N,N-диметилформамида, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в
течение 12 часов реакционная смесь выливалась в смесь льда и воды и экстрагировалась дважды 100 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и
концентрировался, давая сырой продукт. Сырой или неочищенный продукт подвергался хроматографии на силикагеле, что давало 0,5 г 3-этил-4-3-(4-трифторметоксифенокси)пропилокси)-5-метил-1- (3,
3-дихлор-2-пропенилокси)бензола (71% выход), nD23,5 = 1,5150.
Следующие ниже соединения являются конкретными примерами настоящих соединений, приведенных под соответствующими номерами соединений, с указанием их физических свойств, если они измерялись.
(1) 3,5-Дихлор-4-(1,1,2,2-тетрафторэтокси)-1-(3,3-дихлор- 2-пропенилокси)бензол,
nD24,6 = 1,5067
(2) 3,5-Дихлор-4-(1,1,2,2-тетрафторэтокси)-1-(3,3-дибром- 2-пропенилокси)бензол, nD24,6 = 1,5333
(3) 2,
6-Дихлор-4-(3,3-дихлор-2-пропенилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 75,8oC
(4) 2,6-Дихлор-4-(3,3-дибром-2-пропенилокси)-1- (3,3-дибром-2-пропенилокси)бензол, nD22,5 = 1,6459
(5) 3,5-Дихлор-4-этокси-1-(3,3-дихлор-2-пропенилокси)бензол nD24,5 = 1,5561
(6) 3,5-Дихлор-4-этокси-1-(3,
3-дибром-2-пропенилокси)бензол nD24,5 = 1,5865
(7) 3,5-Дихлор-4-(3,3-дибром-2-пропенилокси)-1-(3,3- дихлор-2-пропенилокси)бензол, т.пл. 51,9oC
(8) 3,5-Дихлор-4-(4-трифторметилбензилокси)-1-(3,3- дихлор-2-пропенилокси)бензол, т.пл. 77,1oC
(9) 3,5-Дихлор-4-(3-метил-2-бутенилокси)-1-(3,3- дихлор-2-пропенилокси)бензол, nD24,0 = 1,5556
(10) 3,5-Дихлор-4-(3-хлор-2-бутенилокси)-1-(3,3- дихлор-2-пропенилокси)бензол, nD24,0 = 1,5552
(11) 3,
5-Дихлор-4-(3-хлор-2-пропенилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD24,0 = 1,5694
(12) 3,5-Дихлор-4-(3-трифторметилбензилокси)-1-(3,
3-дихлор- 2-пропенилокси)бензол, т.пл. 51,6oC
(13) 3,5-Дихлор-4-(4-трет-бутоксикарбонилбензилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 78,3oC
(14) 3,
5-Дихлор-4-(4-трет-бутилбензилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,5 = 1,5670
(15) 3,5-Дихлор-4-(4-метоксибензилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, т.пл. 95,4oC
(16) 3,5-Дихлор-4-(4-циннамилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 51,3oC
(17) 3,5-Дихлор-4-(3,
5-бис(трифторметил)бензилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 58,8oC
(18) 3,5-Дихлор-4-(3-метоксибензилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 73,9oC
(19) 3,5-Дихлор-4-(2-нафтилметилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 86,7oC
(20) 3,5-Дихлор-4-(1-нафтилметокси)-1- (3,3-дихлор-2-пропенилокси)бензол,
т.пл. 84,1oC
(21) 3,5-Дихлор-4-(3-цианобензилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 122,9oC
(22) 3,5-Дихлор-4-(3-фторбензилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, т.пл. 75,3oC
(23) 3,5-Дихлор-4-(3-хлорбензилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 87,0oC
(24) 3,
5-Дихлор-4-(3-бромбензилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 73,6oC
(25) 3,5-Дихлор-4-бензилокси-1-(3,3-дихлор-2-пропенилокси) бензол, т.пл. 46,8oC
(26) 3,5-Дихлор-4-(3-метилбензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, т.пл. 43,6oC
(27) 3,5-Дихлор-4-(3-фтор-4-фенокси)бензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD22,5 = 1,5973
(28) 3,5-Дихлор-4-(4-хлорбензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, т.пл. 67,8oC
(29) 3,5-Дихлор-4-(2-хлорбензилокси)-1-(3,
3-дихлор- 2-пропенилокси)бензол, т.пл. 82,0oC
(30) 3,5-Дихлор-4-(2,4-дихлорбензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, т.пл. 89,3oC
(31) 3,5-Дихлор-4-(2,
5-дихлорбензилокси)-1-(/6/-дихлор- 2-пропенилокси)бензол, т.пл. 98,9oC
(32) 3,5-Дихлор-4-(3,4-дихлорбензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, т.пл. 95,2oC
(33) 3,5-Дихлор-4-(4-бромбензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, т.пл. 85,5oC
(34) 3,5-Дихлор-4-(3-феноксибензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD25,5 = 1,6066
(35) 3,5-Дихлор-4-(4-феноксибензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD25,5 = 1,6084
(36) 3,
5-Дихлор-4-(4-фенилбензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, т.пл. 112,6oC
(37) 3,5-Дихлор-4-( α -фенетилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD26,0 = 1,5830
(38) 3,5-Дихлор-4-(3,4-метилендиоксибензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, т.пл. 97,3oC
(39) 3,
5-Дихлор-4-(3-бензилоксибензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD25,0 = 1,6040
(40) 3,5-Дихлор-4-(1-(2-метилнафтил)метокси)-1-(3,
3-дихлор- 2-пропенилокси)бензол, т.пл. 120,3oC
(41) 3,5-Дихлор-4-(4-фтор-3-фенокси)бензилокси)-1-(3,3-дибром- 2-пропенилокси)бензол, nD22,5 = 1,
6062
(42) 3,5-Дихлор-4-( β -фенэтилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD28,5 = 1,5816
(43) 3,5-Дихлор-4-(2-метил-3-фенилбензилокси)-1-(3,
3-дихлор- 2-пропенилокси)бензол, nD28,5 = 1,6125
(44) 3,5-Дихлор-4-(2-фенилбензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD28,5
= 1,6164
(45) 3,5-Дихлор-4-(4-фторбензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, т.пл. 72,0oC
(46) 3,5-Дихлор-4-(2-метилбензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол,
т.пл. 52,9oC
(47) 4-(2-Хлорбензилокси)-3,5-дихлор-1-(3,3-дибром- 2-пропенилокси)бензол, т.пл. 83,5oC
(48) 3,5-Дихлор-4-(2-бромбензилокси)-1-(3,
3-дихлор- 2-пропенилокси)бензол, т.пл. 82,5oC
(49) 3,5-Дихлор-4-(2-фторбензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, т.пл. 60,6oC
(50) 3,5-Дихлор-4-(2,
6-дихлорбензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, т.пл. 135,6oC
(51) 3,5-Дихлор-4-(2-бромэтокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD24,0
= 1,5813
(52) 3,5-Дихлор-4-(2,2-дихлорэтокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD24,0 = 1,5719
(53) 3,5-Дихлор-4-(4-(метилтио)бутокси)-1-(3,
3-дихлор- 2-пропенилокси)бензол, nD24,0 = 1,5673
(54) 3,5-Дихлор-4-(3-фенилпропокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD23,5 =
1,5794
(55) 3,5-Дихлор-4-(3-изопропокси-4-хлорбензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD22,5 = 1,5780
(56) 3,
5-Дихлор-4-(4-бензилоксибензилокси)-1-(3,3-дихлор- 2-пропенилокси)бензол, nD23,5 = 1,6047
(57) 3,5-Дихлор-4-(4-хлор-3-феноксибензилокси)-1-(3,
3-дихлор- 2-пропенилокси)бензол, nD23,0 = 1,6112
(58) 3,5-Дихлор-4-(4-метокси-3-бензилоксибензилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD22,0 = 1,5958
(59) 3,5-Дихлор-4-(3-(3,4-дихлорфенокси)бензилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD22,0 = 1,6160
(60) 3,
5-Дихлор-4-(3-(3-трифторметилбензилокси)бензилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD22,0 = 1,5713
(61) 3,5-Дихлор-4-(3-(4-хлорфенокси)бензилокси)- 1-(3,
3-дихлор-2-пропенилокси)бензол, nD22,5 = 1,6087
(62) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(3-(3- феноксифенил)пропокси)бензол, nD25,
0 = 1,5928
(63) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(4- хлорфенэтилокси)бензол, nD24,5 = 1,5868
(64) 3,5-Дихлор-1-(3,
3-дихлор-2-пропенилокси)-4-((4-фенил)- бутилокси)бензол, nD26,0 = 1,5716
(65) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4-((5-фенил)- пентилокси)бензол, nD26,0 = 1,5690
(66) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(1-инданилокси) бензол, nD26,0 = 1,5982
(67) 3,5-Дихлор-1-(3,
3-дихлор-2-пропенилокси)-4-(2-метил-1- (4-феноксифенил)-н-пропокси)бензол, nD26,0 = 1,5885
(68) 3,5-Дихлор-1-(3,
3-дихлор-2-пропенилокси)-4-(2-фтор-5- (4-фторфенокси)бензилокси)бензол, nD26,0 = 1,5871
(69) 3,5-Дихлор-1-(3,
3-дихлор-2-пропенилокси)-4-(4- фторфенэтилокси)бензол, nD26,5 = 1,5711
(70) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(4- бромфенэтилокси)бензол, nD26,5 = 1,5985
(71) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(4- метилфенэтилокси)бензол, nD26,5 = 1,5815
(72) 3,5-Дихлор-1-(3,
3-дихлор-2-пропенилокси)-4-(4- метоксифенэтилокси)бензол, nD26,5 = 1,5806
(73) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(1-(4- феноксифенил)этокси)бензол,
nD25,0 = 1,6007
(74) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4- (2-хлорфенэтокси)бензол, nD24,5 = 1,5872
(75) 3,
5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4- (2-(1-нафтил)этокси)бензол, nD24,5 = 1,6189
(76) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4- (2-фенокси)этокси)бензол,
nD25,0 = 1,5836
(77) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4- (3-феноксипропилокси)бензол, nD25,0 = 1,5762
(78) 3,
5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4- (2-бром-5-феноксибензилокси)бензол, nD26,5 = 1,6188
(79) 3,5-Дихлор-1-(3,
3-дихлор-2-пропенилокси)-4- (4-(4-(трифторметил)фенокси)бензилокси)бензол, nD26,5 = 1,5730
(80) 3,5-Дихлор-1-(3,
3-дихлор-2-пропенилокси)-4- (3-(4-третбутилфенокси)бензилокси)бензол, nD26,5 = 1,5889
(81) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4- (6-фенилгексилокси)бензол,
nD26,0 = 1,5702
(82) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(3- (4-метилфенокси)бензилокси)бензол, nD26,0 = 1,6019
(83) 3,5-Дихлор-1-(3,3-дихлор-2-пропенилокси)-4-(3- (3,5-дихлор-фенокси)бензилокси)бензол, nD26,0 = 1,6148
(84) 3,5-Дихлор-1-(3,
3-дихлор-2-пропенилокси)-4-(2- (3-хлорфенил)этокси)бензол, nD26,0 = 1,5897
(85) 3,5-Дихлор-1-(3,
3-дихлор-2-пропенилокси)-4-(2- (2-трифторметил)фенил)этокси)бензол, nD26,0 = 1,5516
(86) 3,5-Дихлор-2-(3,
3-дихлор-2-пропенилокси)-4-(2- (3-трифторметилфенил)этокси)бензол, nD26,0 = 1,5497
(87) 3,5-Дихлор-4-метоксиметокси-1-(3,3-дихлор-2-пропенилокси) бензол, nD26,5 = 1,5596
(88) 3,5-Дихлор-4-(3-(3-трифторметилфенил)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5430
(89)
3,5-Дихлор-4-(3-(3-хлорфенил)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5828
(90) 3,5-Дихлор-4-(3-(4-хлорфенил)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5832
(91) 3,5-Дихлор-4-(3-(4-хлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5822
(92) 3,5-Дихлор-4-(2-(4-хлорфенокси)этокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 78,6oC
(93) 3,5-Дихлор-4-(3-(4-фторфенокси)бензилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5961
(94) 3,5-Дихлор-4-(4-этоксибензилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 84,0oC
(95) 3,5-Дихлор-4-(2-(фенилтио)этокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,6063
(96) 3,5-Дихлор-4-(3-трифторметоксибензилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5416
(97) 3,5-Дихлор-4-(4-трифторметоксибензилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 72,1oC
(98) 3,5-Дихлор-4-(3-(3-хлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5817
(99) 3,5-Дихлор-4-(3-(4-бромфенокси)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5917
(100) 3,5-Дихлор-4-(3-(4-трифторметоксифенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5342
(101) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси) пропилбензоат, nD25,0 = 1,5698
(102) 3,
5-Диметил-4-бензилокси-1-(3,3-дихлор-2-пропенилокси) бензол, nD21,0 = 1,5697
(103) 3,5-Диметил-4-бензилокси-1-(3,3-дибром-2-пропенилокси) бензол, т. пл. 70,2oC
(104) 3-Хлор-5-метил-4-бензилокси-1-(3,3-дихлор-2-пропенилокси) бензол, nD25,0 = 1,5793
(105) 3-Хлор-5-метил-4-бензилокси-1-(3,
3-дибром-2-пропенилокси) бензол, nD25,0 = 1,5998
(106) 4-(2,6-дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- бутилбензоат, nD23,5 =
1,5711
(107) 3,5-Дихлор-4-(3-(4-трет-бутилфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,8 = 1,5601
(108) 3,
5-Дихлор-4-(3-(4-этилфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,8 = 1,5673
(109) 3,5-Дихлор-4-(3-(3-(3-трифторметил)фенокси)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5443
(110) 3,5-Дихлор-4-(3-(3-фторфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5647
(111) 3,5-Дихлор-4-(3-(4-этоксифенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5620
(112) 3,
5-Дихлор-4-(3-(4-бензилфенокси)пропиленокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,3 = 1,5761
(113) 3,5-Дихлор-4-(3-(4-бромпропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5693
(114) 3,5-Дихлор-4-(3-(4-фторфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD22,3 = 1,5689
(115) 3,5-Дихлор-4-(3-((4-(трифторметокси)фенил))фенокси) пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD22,3 = 1,5751
(116) 3,
5-Дихлор-4-(3-(3-хлор-4-(3-хлор-5-трифторметил-2- пиридилокси)фенокси)пропилокси)-1-(3,3-дихлор-2-пропенилокси) бензол, nD22,3 = 1,5710
(117) 3,
5-Дихлор-4-(3-(4-(1,1,3,3-тетраметилбутил)фенокси)- пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD22,3 = 1,5570
(118) 3,
5-Дихлор-4-(3-(4-н-октилоксифенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD22,3 = 1,5526
(119) 3,5-Дихлор-4-(2-(3-фторфенил)этокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,5548
(120) 3,5-Дихлор-4-(2-(3-бромфенил)этокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,
0 = 1,5900
(121) 3,5-Дихлор-4-(3-(3-фторфенил)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD22,0 = 1,5730
(122) 3,
5-Дихлор-4-(3-(4-фторфенил)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,5 = 1,5669
(123) 3,5-Дихлор-4-(3-(3-дихлорфенокси)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD25,7 = 1,5837
(124) 3,5-Дихлор-4-(3-(2,3,4-трихлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5857
(125) 3,5-Дихлор-4-(3-(2,4,6-трихлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5799
(126) 3,
5-Дихлор-4-(3-(2,3,4-трихлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,7 = 1,5857
(127) 3,5-Дихлор-4-(3-(2,4,
5-трихлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,7 = 1,5870
(128) 3,5-Дихлор-4-(3-(2,3,4,6-тетрахлорфенокси)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD25,7 = 1,5870
(129) 3,5-Дихлор-4-(3-(4-метилтиофенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,7 = 1,5898
(130) 3,5-Дихлор-4-(3-(3-этоксифенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,7 = 1,5628
(131) 3,
5-Дихлор-4-(3-(3-метоксифенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,7 = 1,5625
(132) 2-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)-этил- (4-хлор)бензоат, т.пл. 72,3oC
(133) 2-(2,6-Дихлор-4-(3,3-дибром-2-пропенилокси)фенокси)-этил- (4-хлор)бензоат, nD24,
0 = 1,5811
(134) 2-(2,6-Дихлор-4-(3,3-дибром-2-пропенилокси)фенокси)- этилбензоат, nD23,5 = 1,5794
(135) 3,
5-Дихлор-4-(3-(3-трифторметоксифенил)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5354
(136) 3,
5-Дихлор-4-(3-(4-трифторметоксифенил)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5337
(137) 2-(2,6-Дихлор-4-((3,
3-дибром-2-пропенилокси)фенокси)- этил-(4-трифторметокси)бензоат, nD25,5 = 1,5320
(138) 2-(2,6-Дихлор-4-((3,3-дибром-2-пропенилокси)фенокси)- этил-(3,
5-дихлор)бензоат, т.пл. 86,1oC
(139) 3,5-Дихлор-4-(3-(4- (1,1,2,2-тетрафторэтокси)фенокси)- пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD23,5 =
1,5662
(140) 3,5-Дихлор-4-(3-(4-(1,1,2,2-тетрафтор-2-бромэтокси)- фенокси)пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD23,5 = 1,5302
(141) 3,
5-Дихлор-4-(3-(4-бромдифторметоксифенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,5 = 1,5481
(142) 3,
5-Дихлор-4-(2-(4-трифторметилфенил)этокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD22,0 = 1,5462
(143) 3,5-Дихлор-4-(3-(3-бромфенил)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD22,0 = 1,5913
(144) 3,5-Дихлор-4-(4-(4-хлорфенил)-3-бутенилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 53,6o
C
(145) 3,5-Дихлор-4-(4-(4-фторфенил)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD22,0 = 1,5653
(146) 3,
5-Дихлор-4-(4-(4-трифторметилфенил)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD22,0 = 1,5409
(147) 3,5-Дихлор-4-(4-(4-трифторметоксифенил)бутилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD22,0 = 1,5325
(148) 2-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- этилфенилацетат, nD21,5
= 1,5717
(149) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил-(2-хлор)бензоат, nD24,0 = 1,5744
(150) 3-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- пропил-(3-хлор)бензоат, nD24,0 = 1,5766
(151) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил-(4-хлор)бензоат,
nD24,0 = 1,5791
(152) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил-(4-этокси)бензоат, nD24,0 = 1,5715
(153)
3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил-(4-трифторметокси)бензоат, nD24,0 = 1,5370
(154) 2-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- этил-(2-хлор)бензоат, т.пл. 51,9oC
(155) 2-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- этил-(3-хлор)бензоат, nD24,
8 = 1,5793
(156) 3,5-Дихлор-4-(2-(4-хлорфенилтио)этокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD22,5 = 1,6121
(157) 3-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- пропил(3-фенокси)бензоат, nD24,5 = 1,5753
(158) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил(4-фтор)бензоат,
nD24,5 = 1,5627
(159) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил(4-бром)бензоат, nD24,5 = 1,5832
(160)
3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил(2-фтор-4-трифторметил)бензоат, nD24,5 = 1,5351
(161) 3-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- пропил(3,5-бистрифторметил)бензоат, nD24,5 = 1,5146
(162) 3,5-Дихлор-4-(3-(4-изопропоксифенокси)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD24,4 = 1,5608
(163) 3,5-Дихлор-4-(3-(3-изопропоксифенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,4 = 1,5611
(164) 3,5-Дихлор-4-(3-(4-(2,2,2-трифторэтокси)фенокси) пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD24,4 = 1,5371
(165) 3,5-Дихлор-4-(3-(3-(2,2,2-трифторэтокси)фенокси) пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD24,4 = 1,5361
(166) 3,
5-Дихлор-4-(3-(4-трифторметилфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,4 = 1,5390
(167) 3,5-Дихлор-4-(3-(3-(1,1,2,
2-тетрафторэтокси)фенокси)- пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD23,4 = 1,5267
(168) 3,5-Дихлор-4-(3-(3-(2-бром-1,1,2,
2-тетрафторэтокси)- фенокси)пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD23,4 = 1,5343
(169) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил-(2,
4-дихлор)бензоат, nD25,0 = 1,5850
(170) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил-(3,4-диэтокси)бензоат, nD25,0 =
1,5664
(171) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил-(3-трифторметил)бензоат, nD25,0 = 1,5410
(172) 3-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- пропил-(3,4-диметокси)бензоат, т.пл. 66,2oC
(173)
3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил-(4-изопропил)бензоат,
(174) 3,5-Дихлор-4-(4-бромбутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5666
(175) 3,5-Дихлор-4-(3-(2,6-дихлор-4-(3,3-дихлор-2-пропенилокси)
фенокси)пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, т.пл. 115,0oC
(176) 3,5-Дихлор-4-(4-(2,6-дихлор-4-(3,3-дихлор-2-пропенилокси) фенокси)бутилокси)-1-(3,
3-дихлор-2-пропенилокси)бензол, т.пл. 111,0oC
(177) 2-Хлор-5-метил-4-(2-(4-бромфенил)этокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,2 = 1,5865
(178) 3-Хлор-5-метил-4-(3-(4-хлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5720
(179) 3-Хлор-5-метил-4-(4-фенилбутилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5720
(180) 3-Хлор-5-метил-4-(2-(4-бромфенил)этокси)-1- (3,3-дибром-2-пропенилокси)бензол, т.пл. 70,7oC
(181) 3,5-Дихлор-4-(3-(фенилтио)пропилокси)-1- (3,3-дибром-2-пропенилокси)бензол, nD26,0 = 1,5997
(182) 3,5-Дихлор-4-(3-(4-хлорфенилтио)пропилокси)-1- (3,
3-дибром-2-пропенилокси)бензол, nD26,0 = 1,6035
(183) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил-1-нафтоат, nD25,5
= 1,5978
(184) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил-2-нафтоат, т.пл. 71,4oC
(185) 3,5-Дихлор-4-(3-(3-трифторметоксифенокси)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD23,4 = 1,5343
(186) 4-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- бутил(4-этокси)бензоат, nD24,
0 = 1,5652
(187) 2-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- этил(4-изопропокси)бензоат, nD24,0 = 1,5703
(188) 3-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- пропил(4-изопропокси)бензоат, nD24,0 = 1,5650
(189) 2-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- этил(4-этокси)бензоат,
т.пл. 77,8oC
(190) 3,5-Дихлор-4-(3,7-диметилоктилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,7 = 1,5340
(191) 3,5-Дихлор-4-(3,
7-диметил-6-октенилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,7 = 1,5446
(192) 3,5-Дихлор-4-(3,7-диметил-2,2-октадиенокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD23,7 = 1,5762
(193) 3,5-Дихлор-4-(п-октилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD20,5 = 1,
5297
(194) 3,5-Дихлор-2-(4-хлорбензилокси)этокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,7 = 1,5777
(195) 4-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- бутил(2-хлор)бензоат, nD23,5 = 1,5734
(196) 4-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- бутил(3-хлор)бензоат, nD23,5 = 1,5732
(197) 4-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- бутил(4-хлор)бензоат, nD23,5 = 1,5746
(198) 4-(2,
6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- бутил(4-трифторметокси)бензоат, nD23,5 = 1,5326
(199) 4-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- бутил(4-изопропокси)бензоат, nD23,5 = 1,5622
(200) 3,5-Дихлор-4-(3-(4-трифторметилфенилтио)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5635
(201) 3,5-Дихлор-4-(3-(4-трет-бутилфенилтио)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5777
(202) 3,5-Дихлор-4-(4-(4-трифторметоксифенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,5367
(203) 3,
5-Дихлор-4-(4-(4-изопропилоксифенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,5578
(204) 3,5-Дибром-4-(2-(4-бромфенил)этокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,6180
(205) 3,5-Дибром-4-(3-(4-хлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,5983
(206) 3,5-Дибром-4-(4-фенилбутилокси)-1- (3,3-дихлор-2-пропенил)бензол, nD23,0 = 1,5918
(207) 3,
5-Дибром-4-(4-(4-хлорфенил)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD21,5 = 1,5721
(208) 2-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- этил(3-этокси)бензоат, nD24,5 = 1,5716
(209) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил(3-этокси)бензоат,
nD24,5 = 1,5646
(210) 4-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- бутил(3-этокси)бензоат, nD24,5 = 1,5585
(211)
2-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- этил(4-трифторметил)бензоат, nD25,5 = 1,5427
(212) 3-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- пропил(4-трифторметил)бензоат, nD25,5 = 1,5396
(213) 3,5-Дихлор-4-(3-метил-3-(4-хлорфенокси)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD23,5 = 1,5693
(214) 3,5-Дихлор-4-(1-метил-3-(4-хлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,5 = 1,5613
(215) 3,5-Дихлор-4-(3-метил-3-бутенилокси)-1- (3,3-дихлор-2-пропенилокси)бензол,
(216) 3-Хлор-5-метил-4-(3-(4-трифторметилфенокси)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,5330
(217) 3,5-Дихлор-4-(3-(4-метоксифенилтио)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5990
(218) 3,5-Дихлор-4-(3-(4-фторфенилтио)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5844
(219) 3,
5-Дихлор-4-(3-(2,3,5,6-тетрафторфенилтио)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5619
(220) 3,
5-Дихлор-4-(3-(3-хлорфенилтио)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,6004
(221) 3,5-Дихлор-4-(3-(4-бромфенилтио)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,6717
(222) 3,5-Дихлор-4-(4-(4-хлорфенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 54,5oC
(223) 3,5-Дихлор-4-(4-(3-изопропоксифенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD20,3 = 1,5615
(224) 3,
5-Дихлор-4-(4-(3-трифторметоксифенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD20,3 = 1,5355
(225) 3,5-Дихлор-4-(4-(4-(1,1,2,
2-тетрафторэтокси)фенокси) бутилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD20,3 = 1,5283
(226) 3,5-Дихлор-4-(4-(3-(1,1,2,2-тетрафторэтокси)фенокси)
бутилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD20,3 = 1,5298
(227) 3,5-Дихлор-4-(4-(4-(2,2,2-трифторэтокси)фенокси) бутилокси)-1-(3,
3-дихлор-2-пропенилокси)бензол, nD20,3 = 1,5384
(228) 3,5-Дихлор-4-(4-(3-(2,2,2-трифторэтокси)фенокси) бутилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD20,3 = 1,5431
(229) 3,3-Дихлор-4-(4-(4-дифторметоксифенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD20,3 = 1,5484
(230) 3,5-Дихлор-4-(4-(3-дифторметоксифенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,3 = 1,5446
(231) 3,
5-Дихлор-4-(3-(4-дифторметоксифенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD20,3 = 1,5519
(232) 3,
5-Дихлор-4-(3-(3-дифторметоксифенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,3 = 1,5500
(233) 3,
5-Дихлор-4-(4-(4-трифторметилфенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD20,3 = 1,5418
(234) 3,
5-Дихлор-4-(4-(3-трифторметилфенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD20,3 = 1,5375
(235) 3-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- пропил(4-хлор)фенилацетат, nD22,0 = 1,5698
(236) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил(4-хлор)циннамат,
т.пл. 62,2oC
(237) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил(4-хлор)феноксиацетат, nD22,0 = 1,5709
(238) 3,
5-Дихлор-4-(3-N-метиланилино)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5887
(239) 3,5-Дихлор-4-(4-(3-фторфенил)-3-бутенилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5857
(240) 3,5-Дихлор-4-(4-(3-трифторметилфенил)-3-бутенилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5588
(241) 3,5-Дихлор-4-(4-(3-трифторметоксифенил)-3-бутенилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5502
(242) 3,5-Дихлор-4-(4-(3-фторфенил)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5620
(243) 3,5-Дихлор-4-(4-(3-трифторметилфенил)бутилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5373
(244) 3,5-Дихлор-4-(4-(3-трифторметоксифенил)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5314
(245) 2-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- этил(4-(2,2,2-трифторэтокси))бензоат, т.пл. 57,6oC
(246) 3-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- пропил(4-(2,2,2-трифторэтокси))бензоат, т.пл. 53,9oC
(247) 3,5-Дихлор-4-((3-этоксикарбонил)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD22,0 = 1,5367
(248) 3,5-Дихлор-4-(3-(4-(трифторметокси)феноксикарбонил) пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,
5307
(249) 3,5-Дихлор-4-(2-метил-3-(4-хлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол,
(250) 3-Хлор-5-метил-4-(3-(4-трифторметоксифенокси)пропилокси)- 1-(3,
3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,5279
(251) 3-(2-Хлор-6-метил-4-(3,3-дихлор-2-пропенилокси)фенокси) пропил(4-бром)бензоат, nD24,
0 = 1,5798
(252) 3,5-Дихлор-4-(2-(4-изопропоксифенил)этокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5632
(253) 3,
5-Дихлор-4-(2-(4-(трифторметокси)фенил)этокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5370
(254) 3,5-Дихлор-4-(3-(4-бромфенил)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5891
(255) 3,5-Дихлор-4-(3-(4-(трифторметил)фенил)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5367
(256) 3,5-Диметил-4-(3-(4-хлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,5638
(257) 3,
5-Дихлор-4-(4-(4-хлорфенил)-2-(Z)-бутенилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD21,9 = 1,5827
(258) 3,
5-Дихлор-4-(4-(4-хлорфенокси)-2-(E)-бутенилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD21,9 = 1,5824
(259) 3-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- пропил(4-дифторметил)бензоат, nD23,0 = 1,5535
(260) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- пропил(4-(1,1,2,
2-тетрафторэтокси)бензоат, nD23,0 = 1,5329
(261) 3-(2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси)- метил(3-метил-2-(4-хлорфенил))бутират, nD23,0 = 1,5565
(262) 3,5-Дихлор-4-(4-(4-хлорфенилтио)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD22,5 = 1,5910
(263) 3,
5-Дихлор-4-(4-(4-трифторметилфенилтио)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD22,5 = 1,5608
(264) 3,5-Дихлор-4-(4-(4-гидроксифенилтио)бутилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD22,5 = 1,5998
(265) 3,5-Дихлор-4-(3-(4-трифторметоксифенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD22,0 = 1,5183
(266) 3,5-Дихлор-4-(4-(4-метоксифенилтио)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5831
(267) 3,
5-Дихлор-4-(4-(4-изопропоксифенилтио)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5718
(268) 3,
5-Дихлор-4-(3-(4-хлорфенилсульфенил)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,5 = 1,5962
(269) 3,
5-Диизопропил-4-(4-(4-трифторметоксифенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,5070
(270) 3,
5-Диэтил-4-(4-(4-трифторметоксифенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD25,6 = 1,5115
(271) 3,
5-Диметил-4-(4-(4-трифторметоксифенокси)бутилокси)- 1-(3,3-дибром-2-пропенилокси)бензол, nD25,9 = 1,5292
(272)
3-Этил-5-метил-4-(4-(4-трифторметоксифенокси)бутилокси)- 1-(3,3-дибром-2-пропенилокси)бензол, nD23,5 = 1,5150
(273) 3-(2,6-Дихлор-4-(3,
3-дихлор-2-пропенилокси)фенокси)- пропил(4-трифторметил)циннамат, nD25,5 = 1,5542
(274) 3,5-Дихлор-4(3-(4-трифторметоксианилино)пропилокси)-1-(3,
3-дихлор-2-пропенилокси)бензол, nD25,0 = 15503
(275) 3,5-Дихлор-4-(3-анилино)пропилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD20,
0 = 1,5974
(276) 3,5-Дихлор-4-(3-(4-трифторметиланилино)пропилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD23,5 = 1,5617
(277) 3,
5-Дихлор-4-(3-(N-метил-4-трифторметиланилино) пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5593
(278) 3,
5-Дихлор-4-(3-(N-ацетил-4-трифторметиланилино) пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол, nD25,5 = 1,5395
(279) 3,
5-Дихлор-4-(3-(4-трифторметоксифенилтио)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD23,5 = 1,5569
(280) 3,5-Дихлор-4-(4-трифторметилбензилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол
(281) 3,5-Дихлор-4-(2-(4-трифторметилфенил)этокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(282) 3,5-Дихлор-4-(3-(4-трифторметилфенил)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD25,0 = 1,5367
(283) 3,5-Дихлор-4-(3-(4-трифторметилфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 52,1oC
(284) 3-Этил-5-метил-4-(3-(4-трифторметилфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD21,5 = 1,5234
(285) 3,
5-Дихлор-4-(3-(4-хлорфенилсульфонил)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,5 = 1,5863
(286) 2,3,5,
6-Тетрахлор-4-(3-(4-трифторметилфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(287) 2,3,5,6-Тетрахлор-1,4-бис(3,3-дихлор-2-пропенилокси)бензол
(288) 3,
5-Дихлор-4-(4-анилино)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD21,5 = 1,5919
(289) 3,5-Дихлор-4-(4-(4-трифторметиланилино)бутилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол, nD21,5 = 1,5606
(290) 3,5-Дихлор-4-(4-(4-трифторметоксианилино)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD21,5 = 1,5491
(291) 3,5-Дихлор-4-(3-(4-трифторметилфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD20,0 = 1,5230
(292) 3,
5-Дихлор-4-(3-(4-изопропоксикарбонилфенокси)пропилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD22,7 = 1,5440
(293) 3,
5-Дихлор-4-(3-(4-метоксикарбонилфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD27,7 = 1,5519
(294)
3-Хлор-5-метил-4-(4-(4-трифторметоксифенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,5208
(295)
3-Хлор-5-метил-4-(4-(4-трифторметилфенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,5285
(296)
3-Хлор-5-метил-4-(4-(4-хлорфенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, т.пл. 54,5oC
(297) 3-Хлор-5-метил-4-(3-(4-бромфенокси)пропилокси)- 1-(3,
3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5812
(298) 3-Хлор-5-метил-4-(4-(4-бромфенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, т.пл. 51,6o
C
(299) 3-Хлор-5-метил-4-(3-(4-изопропоксифенокси)пропилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5485
(300)
3-Хлор-5-метил-4-(4-(4-изопропоксифенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5482
(301)
3-Этил-5-метил-4-(4-(4-трифторметоксифенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,5160
(302)
3-Этил-5-метил-4-(4-(4-трифторметилфенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD23,0 = 1,5221
(303)
3-Этил-5-метил-4-(3-(4-хлорфенокси)пропилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD23,5 = 1,5562
(304) 3-Этил-5-метил-4-(4-(4-хлорфенокси)бутилокси)- 1-(3,
3-дихлор-2-пропенилокси)бензол, nD21,3 = 1,5554
(305) 3-Этил-5-метил-4-(3-(4-бромфенокси)пропилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD23,5 = 1,5670
(306) 3-Этил-5-метил-4-(4-(4-бромфенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD21,3 = 1,5620
(307)
3-Этил-5-метил-4-(3-(4-изопропоксифенокси)пропилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD23,5 = 1,5430
(308)
3-Этил-5-метил-4-(4-(4-изопропоксифенокси)бутилокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD21,3 = 1,5429
(309) 3,
5-Диэтил-4-(4-(4-трифторметоксифенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(310) 3,5-Диэтил-4-(4-(4-трифторметилфенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(311) 3,5-Диэтил-4-(3-(4-хлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(312) 3,5-Диэтил-4-(4-(4-хлорфенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(313) 3,
5-Диэтил-4-(3-(4-бромфенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(314) 3,5-Диэтил-4-(4-(4-бромфенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(315) 3,
5-Диэтил-4-(3-(4-изопропоксифенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(316) 3,5-Диэтил-4-(4-(4-изопропоксифенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(317)
3,5-Диизопропил-4-(4-(4-трифторметоксифенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(318) 3,5-Диизопропил-4-(3-(4-трифторметилфенокси)пропилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол
(319) 3,5-Диизопропил-4-(4-(4-трифторметилфенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(320) 3,
5-Диизопропил-4-(3-(4-хлорфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(321) 3,5-Диизопропил-4-(4-(4-хлорфенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(322) 3,
5-Диизопропил-4-(3-(4-бромфенокси)пропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(323) 3,5-Диизопропил-4-(4-(4-бромфенокси)бутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
(324) 3,
5-Диизопропилокси-4-(3-(4-изопропилоксифенокси) пропилокси)-1-(3,3-дихлор-2-пропенилокси)бензол
(325) 3,5-Диизопропил-4-(4-(4-изопропоксифенокси)бутилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол.
(326) 3,5-Дихлор-4-(2-(2-метилпропокси)этокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5311
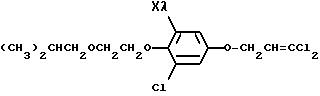
(327) 3,5-Дихлор-4-(3-(1,1-диметилэтокси)пропокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD25,2 = 1,5227
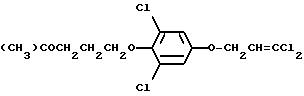
(328) 3,5-Дихлор-4-(5-(этоксикарбонил)пентилокси)-1- (3, 3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5297
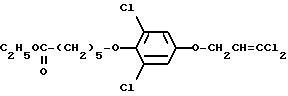
(329) 3, 5-Дихлор-4-(4-(этоксикарбонил)бутокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5331
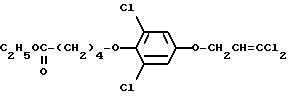
(330) 3,5-Дихлор-4-(4-(изопропоксикарбонил)бутокси)- 1-(3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5259.
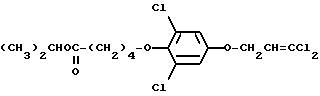
Следующие ниже примеры являются примерами получения промежуточных соединений формы (IV), (V) или (VI).
Пример 1 получения промежуточного соединения:
Получение промежуточного соединения 1)
Реакционный сосуд загружался 25,5 г гидрохинон-монобензилового эфира, 17,9 г
бензоилхлорида, 0,50 г тетрабутиламмонийбромида и 100 мл толуола, к смеси медленно по каплям при охлаждении льдом и перемешивании добавлялось 78,6 г 10% раствора гидроокиси калия. Через 24 часа
реакционная смесь слегка подкислялась добавлением 20% соляной кислоты, и выпавшие в осадок кристаллы собирались фильтрованием. Полученные таким образом кристаллы последовательно промывались 10%
соляной кислотой и водой и сушились, что давало 38 г 4-бензилокси-фенилбензоата (98% выход).
Реакционный сосуд загружался 38 г 4-бензилоксифенилбензоата и 500 мл этанола, и воздух в сосуде заменялся азотом. Затем туда добавлялось 1,0 г 10% палладия на угле, и азот в сосуде заменялся водородом с последующим энергичным перемешиванием при комнатной температуре в течение 24 часов. Водород в сосуде заменялся азотом, после чего смесь фильтровалась через целит, и фильтрат концентрировался, что давало 24,5 г 4-гидроксифенилбензоата (выход 94%).
Реакционный сосуд загружался 24,5 г 4-гидроксифенилбензоата и 500 мл четыреххлористого углерода, в сосуд добавлялся медленно по каплям при перемешивании и охлаждении льдом раствор 24,8 г трет-бутилгипохлорита, растворенного в 20 мл четыреххлористого углерода. Спустя 24 часа, реакционная смесь выливалась в воду с последующим разделением фаз. Органический слой (т. е. слой четыреххлористого углерода) промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 29,5 г 3, 5-дихлор-4-гидроксифенилбензоата (91% выход).
В реакционный сосуд загружалось 1,54 г 3,5-дихлор-4-гидроксифенилбензоата, 0,83 г карбоната калия, 1,53 г 4-фтор-3-феноксибензилбромида и 10 мл N, N-диметилформамида с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционная смесь выливалась в воду и экстрагировалась дважды 50 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 2,32 г 3, 5-дихлор-4-(4-фтор-3-феноксибензилокси)фенилбензоата (выход 88%).
В реакционный сосуд загружалось 1,36 г 3,5-дихлор-4-(4-фтор-3-феноксибензилокси)фенилбензоата и 10 мл метанола, к смеси медленно по каплям, при охлаждении льдом, добавлялось 4,2 г 10% раствора гидроокиси калия. После перемешивания в течение 1 часа реакционная смесь слегка подкислялась добавлением 10% соляной кислоты и экстрагировалась дважды 50 мл диэтилового эфира при высаливании. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 0,97 г 3,5-дихлор-4-(4-фтор-3-феноксибензилокси)фенола (91% выход), т.пл. 144,8oC.
Пример 2 получения промежуточного соединения.
Получение промежуточного соединения 2)
Смесь 2,27 г 4-бензоилокси-2,6-дихлорфенола, 1,29 2-хлорбензилхлорида, 1,21 карбоната калия и 50 мл N,
N-диметилформамида перемешивалась при 80oC в течение 6 часов. Реакционная смесь охлаждалась до комнатной температуры, выливалась в ледяную воду и экстрагировалась дважды 50 мл диэтилового
спирта. Объединенный эфирный слой промывался водой и сушился безводным сульфатом магния с последующим удалением растворителя с помощью перегонки при пониженном давлении. Остаток подвергался
хроматографии на силикагеле, что давало 2,87 г 1-бензоилокси-4-(2-хлорбензоилокси)-3,5-дихлорбензола (88% выход).
К смеси 2,87 г 1-бензоилокси-4-(2-хлорбензоилокси)-3,5-дихлорбензола и 100 мл метанола добавлялось по каплям 5,1 г 10% (вес/вес) водного раствора гидроокиси калия при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 6 часов реакционная смесь слегка подкислялась добавлением 10% соляной кислоты и метанол удалялся перегонкой при пониженном давлении. Остаток экстрагировался дважды 10 мл этилацетата. Объединенный эфирный слой промывался водой и сушился безводным сульфатом магния с последующим удалением растворителя с помощью перегонки при пониженном давлении. Остаток подвергался хроматографии на силикагеле, что давало 1,17 г 4-(2-хлорбензилокси)-3,5-дихлорфенола (выход 55%), т.пл. 108,3oC.
Пример 3 получения промежуточного соединения.
Получение промежуточного
соединения 264)
Смесь 27 г 2-этил-6-метиланилина, 36 мл концентрированной серной кислоты и 100 мл воды перемешивалась при температуре 0-5oC, и к смеси добавлялся по каплям раствор
16,1 г нитрита натрия, растворенного в 50 мл воды. Затем туда добавлялось 150 г холодной воды, 1,5 г мочевины и 150 г льда.
Данный водный раствор добавлялся по каплям к смеси 100 мл серной кислоты, 100 мл воды и 150 г сульфата натрия при нагревании до 135oC при перемешивании. В то же самое время смесь подвергалась перегонке с паром. После завершения добавления водный раствор, полученный с помощью паровой перегонки, подвергался высаливанию хлоридом натрия, сушился безводным сульфатом магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало 16 г 2-этил-6-метилфенола (59% выход).
Затем 16 г 2-этил-6-метилфенола растворялось в 200 мл хлороформа с последующим перемешиванием при 0oC, к смеси небольшими порциями добавлялось 56,6 г тетрабутиламмонийбромида. После перемешивания при комнатной температуре в течение 1 часа растворитель удалялся с помощью перегонки при пониженном давлении, и остаток растворялся в 300 мл диэтилового эфира. Раствор последовательно промывался 10% соляной кислотой и водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 23 г 4-бром-2-этил-6-метилфенола (92% выход).
К смеси 10 г 4-бром-2-этил-6-метилфенола, 14,0 г 1-(3-бромпропилокси)-4-трифторметоксибензола и 100 мл N,N-диметилформамида добавлялось 7 г карбоната калия при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 12 часов реакционная смесь выливалась в ледяную воду и экстрагировалась дважды 200 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 18,1 г 4-бром-2-этил-6-метил-1-[3-(4-трифторметоксифенокси)пропилокси]бензола (90% выход).
Затем 6,6 г 4-бром-2-этил-6-метил-1-[3-(4-трифторметоксифенокси)пропилокси]бензола растворялось в 200 мл тетрагидрофурана, и раствор перемешивался при -70oC, к раствору по каплям добавлялось 9,6 мл н-бутиллитиевого раствора (в гексане, 1,58 мол/литр) с последующим дополнительным перемешиванием при -70oC в течение 2 часов. К данной реакционной смеси добавлялся по каплям раствор 2,2 г триэтоксиборана, растворенного в 60 мл тетрагидрофурана. Затем реакционная смесь перемешивалась в течение 1 часа при подогреве до комнатной температуры, и небольшими порциями добавлялось 13 мл 10% водного раствора соляной кислоты с последующим перемешиванием при комнатной температуре в течение 20 минут. Тетрагидрофурановый слой промывался водой, сушился безводным сульфатом магния и концентрировался, к нему добавлялось 50 мл толуола, и смесь нагревалась при 70oC при перемешивании, к смеси добавлялось по каплям 6 мл 30% водного раствора перекиси водорода. Смесь нагревалась в условиях дефлегмации в течение 1 часа и промывалась один раз водой, два раза 10% водным раствором аммонийсульфата железа и один раз водой. Толуольный слой сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 3,4 г 3-этил-4-[3-(4-трифторметоксифенокси)пропилокси]-5- метилфенола (61% выход), nD25,4 = 1,4955.
Пример 4 получения промежуточного
соединения:
Получение промежуточного соединения 263)
К смеси 10 г 4-бром-2,
6-диэтилфенола, 13,5 г 1-(3-бромпропилокси)-4-трифторметоксибензола и 100 мл N,N-диметилформамида добавлялось 6,6 г карбоната калия при перемешивании при комнатной температуре. После перемешивания при
комнатной температуре в течение 12 часов реакционная смесь выливалась в ледяную воду и экстрагировалась дважды 200 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным
сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 14,8 г
4-бром-2-этил-6-метил-1-[3-(4- трифторметоксифенокси)пропилокси]бензола (76% выход).
Затем в 200 мл тетрагидрофурана растворялось 7,0 г 4-бром-2-этил-6-метил-1-[3-(4-трифторметоксифенокси)пропилокси] бензола с последующим перемешиванием при -70oC, к раствору по каплям добавлялось 10,0 мл раствора н-бутиллития (в гексане, 1, 58 мол/литр) с последующим дополнительным перемешиванием при -70oC в течение 2 часов. К данной реакционной смеси добавлялся по каплям раствор 2,4 г триметоксиборана, растворенного в 60 мл тетрагидрофурана. Реакционная смесь перемешивалась в течение 1 часа, при подогреве до комнатной температуры, и небольшими порциями добавлялось 13 мл 10% водного раствора соляной кислоты с последующим перемешиванием при комнатной температуре в течение 20 минут. Тетрагидрофурановый слой промывался водой, сушился безводным сульфатом магния и концентрировался, к нему добавлялось 50 мл толуола, и смесь нагревалась при 70oC при перемешивании, и к смеси по каплям добавлялось 6 мл 30% водного раствора перекиси водорода. Смесь нагревалась в условиях дефлегмации в течение 1 часа и промывалась один раз водой и два раза 10% водным раствором аммонийсульфата железа и один раз водой. Толуольный слой сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 4,3 г 3,5-диэтил-4-[3-(4-трифторметоксифенокси)пропилокси] фенола (50% выход), nD25,4 = 1,5060.
Следующие ниже соединения являются конкретными примерами промежуточных соединений общей формулы (IV), (V) или (VI) с указанием соответствующих номеров соединений и их физических свойств, если они определялись.
1) 3,5-Дихлор-4-(4-фтор-3-феноксибензилокси)фенол, т.пл. 144,8oC
2) 4-(2-Хлорбензилокси)-3,5-дихлорфенол, т.пл. 108,3oC
3) 3,
5-Дихлор-4-(1,1,2,2-тетрафторэтокси)фенол
4) 3,5-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенол
5) 3,5-Дихлор-4-(3,3-дибром-2-пропенилокси)фенол
6) 3,5-Дихлор-4-этоксифенол
7) 3,5-Дихлор-4-(4-трифторметилбензилокси)фенол
8) 3,5-Дихлор-4-(3-метил-2-бутенилокси)фенол
9) 3,5-Дихлор-4-(3-хлор-2-бутенилокси)фенол
10) 3,
5-Дихлор-4-(3-хлор-2-пропенилокси)фенол
11) 3,5-Дихлор-4-(4-трет-бутоксикарбонилбензилокси)фенол
12) 3,5-Дихлор-4-бензилоксифенол
13) 3,
5-Дихлор-4-(3-метилбензилокси)фенол
14) 3,5-Дихлор-4-(4-хлорбензилокси)фенол
15) 3,5-Дихлор-4-(2,4-дихлорбензилокси)фенол
16) 3,5-Дихлор-4-(2,5-дихлорбензилокси)фенол
17) 3,5-Дихлор-4-(3,4-дихлорбензилокси)фенол
18) 3,5-Дихлор-4-(4-бромбензилокси)фенол
19) 3,5-Дихлор-4-(3-феноксибензилокси)фенол
20) 3,
5-Дихлор-4-(4-феноксибензилокси)фенол
21) 3,5-Дихлор-4-(4-фенилбензилокси)фенол
22) 3,5-Дихлор-4-( α -метилбензилокси)фенол
23) 3,
5-Дихлор-4-(4-трет-бутилбензилокси)фенол
24) 3,5-Дихлор-4-(4-метоксибензилокси)фенол
25) 3,5-Дихлор-4-(3-фенил-2-пропенилокси)фенол
26) 3,5-Дихлор-4-(3,
5-бис(трифторметил)бензилокси)фенол
27) 3,5-Дихлор-4-(3-метоксибензилокси)фенол
28) 3,5-Дихлор-4-(2-нафтилметокси)фенол
29) 3,5-Дихлор-4-(1-нафтилметокси)фенол
30)
3,5-Дихлор-4-(3-цианобензилокси)фенол
31) 3,5-Дихлор-4-(3-фторбензилокси)фенол
32) 3,5-Дихлор-4-(3-хлорбензилокси)фенол
33) 3,5-Дихлор-4-(3-бромбензилокси)фенол
34)
3,5-Дихлор-4-(3,4-метилендиоксибензилокси)фенол
35) 3,5-Дихлор-4-(3-бензилоксибензилокси)фенол
36) 3,5-Дихлор-4-(1-(2-метилнафтил))метокси)фенол
37) 3,
5-Дихлор-4-(фенетилокси)фенол
38) 3,5-Дихлор-4-(2-метил-3-фенилбензилокси)фенол
39) 3,5-Дихлор-4-(2-фенилбензилокси)фенол
40) 3,5-Дихлор-4-(4-фторбензилокси)фенол
41) 3,5-Дихлор-4-(2-метилбензилокси)фенол
42) 3,5-Дихлор-4-(2-бромбензилокси)фенол
43) 3,5-Дихлор-4-(2-фторбензилокси)фенол
44) 3,5-Дихлор-4-(2,6-дихлорбензилокси)фенол
45) 3,5-Дихлор-4-(2-бромэтокси)фенол
46) 3,5-Дихлор-4-(2,2-дихлорэтокси)фенол
47) 3,5-Дихлор-4-(4-(метилтио)бутокси)фенол
48) 3,5-Дихлор-4-(3-фенилпропокси)фенол
49) 3,5-Дихлор-4-(4-хлор-3-изопропоксибензилокси)фенол
50) 3,5-Дихлор-4-(4-бензилокси)бензилоксифенол
51) 3,5-Дихлор-4-(4-хлор-3-фенокси)бензилоксифенол
52) 3,
5-Дихлор-4-(4-метокси-3-бензилокси)бензилоксифенол
53) 3,5-Дихлор-4-(3-(3,4-дихлорфенокси)бензилокси)фенол
54) 3,5-Дихлор-4-(3-(3-трифторметилбензилокси)бензилокси)фенол
55)
3,5-Дихлор-4-(3-(4-хлорфенокси)бензилокси)фенол
56) 3,5-Дихлор-4-(3-трифторметилбензилокси)фенол
57) 3,5-Дихлор-4-(3-(3-феноксифенил)пропилокси)фенол
58) 3,
5-Дихлор-4-(2-(4-хлорфенил)этокси)фенол
59) 3,5-Дихлор-4-(4-фенилбутокси)фенол
60) 3,5-Дихлор-4-(5-фенилпентилокси)фенол
61) 3,5-Дихлор-4-(1-инданилокси)фенол
62) 3,
5-Дихлор-4-(2-метил-1-(4-феноксифенил)пропилокси)фенол
63) 3,5-Дихлор-4-(2-фтор-5-(4-фторфенокси)бензилокси)фенол
64) 3,5-Дихлор-4-(2-(4-фторфенил)этокси)фенол
65) 3,
5-Дихлор-4-(2-(4-бромфенил)этокси)фенол
66) 3,5-Дихлор-4-(2-(4-метилфенил)этокси)фенол
67) 3,5-Дихлор-4-(2-(4-метоксифенил)этокси)фенол
68) 3,
5-Дихлор-4-(1-(4-феноксифенил)этокси)фенол
69) 3,5-Дихлор-4-(2-(2-хлорфенил)этокси)фенол
70) 3,5-Дихлор-4-(2-(1-нафтил)этокси)фенол
71) 3,
5-Дихлор-4-(2-феноксиэтокси)фенол
72) 3,5-Дихлор-4-(3-феноксиэтокси)фенол
73) 3,5-Дихлор-4-(2-бром-5-феноксибензилокси)фенол
74) 3,
5-Дихлор-4-(4-(4-трифторметилфенокси)бензилокси)фенол
75) 3,5-Дихлор-4-(3-(4-трет-бутилфенокси)бензилокси)фенол
76) 3,5-Дихлор-4-(6-фенилгексилокси)фенол
77) 3,
5-Дихлор-4-(3-(4-метилфенокси)бензилокси)фенол
78) 3,5-Дихлор-4-(3-(3,5-дихлорфенокси)бензилокси)фенол
79) 3,5-Дихлор-4-(2-(3-хлорфенил)этокси)фенол
80) 3,
5-Дихлор-4-(2-(2-трифторметилфенил)этокси)фенол
81) 3,5-Дихлор-4-(2-(3-трифторметилфенил)этокси)фенол
82) 3,5-Дихлор-4-метоксиметоксифенол
83) 3,
5-Дихлор-4-(3-(3-трифторметилфенил)пропилокси)фенол
84) 3,5-Дихлор-4-(3-(3-хлорфенил)пропилокси)фенол
85) 3,5-Дихлор-4-(3-(4-хлорфенил)пропилокси)фенол
86) 3,
5-Дихлор-4-(3-(4-хлорфенокси)пропилокси)фенол
87) 3,5-Дихлор-4-(2-(4-хлорфенокси)этокси)фенол
88) 3,5-Дихлор-4-(3-(4-фторфенокси)бензилокси)фенол
89) 3,
5-Дихлор-4-(4-этоксибензилокси)фенол
90) 3,5-Дихлор-4-(2-фенилтиоэтокси)фенол
91) 3,5-Дихлор-4-(3-трифторметоксибензилокси)фенол
92) 3,
5-Дихлор-4-(4-трифторметоксибензилокси)фенол
93) 3,5-Дихлор-4-(3-(3-хлорфенокси)пропилокси)фенол
94) 3,5-Дихлор-4-(3-(4-бромфенокси)пропилокси)фенол
95) 3,
5-Дихлор-4-(3-(4-трифторметоксифенокси)пропилокси)фенол nD25,0 = 1,5000
96) 3-(2,6-Дихлор-4-гидроксифенокси)пропилбензоат
97) 3,
5-Диметил-4-бензилоксифенол, т.пл. 81,6oC
98) 3-Хлор-5-метил-4-бензилоксифенол, nD25,0 = 1,5842
99) 4-(2,
6-Дихлор-4-гидроксифенокси)бутилбензоат
100) 3,5-Дихлор-4-(3-трет-бутилфенокси)пропилокси)фенол
101) 3,5-Дихлор-4-(3-(4-этилфенокси)пропилокси)фенол
102) 3,
5-Дихлор-4-(3-(3-трифторметил)фенокси)пропилокси)фенол
103) 3,5-Дихлор-4-(3-(3-трифторметоксифенокси)пропилокси)фенол
104) 3,5-Дихлор-4-(3-(4-этоксифенокси)пропилокси)фенол
105) 3,5-Дихлор-4-(3-(4-бензилфенокси)пропилокси)фенол
106) 3,5-Дихлор-4-(3-бромпропилокси)фенол
107) 3,5-Дихлор-4-(3-(4-фторфенокси)пропилокси)фенол
108) 3,
5-Дихлор-4-(3-(4-(4-трифторметоксифенил)фенокси) пропилокси)фенол
109) 3,5-Дихлор-4-(3-(3-хлор-5-трифторметил-2-пиридилокси) фенокси)пропилокси)фенол
110) 3,5-Дихлор-4-(3-(4-(1,1,3,
3-тетраметибутил)фенокси) пропилокси)фенол
111) 3,5-Дихлор-4-(3-(4-н-октилоксифенокси)пропилокси)фенол
112) 3,5-Дихлор-4-(2-(3-фторфенил)этокси)фенол
113) 3,
5-Дихлор-4-(2-(3-бромфенил)этокси)фенол
114) 3,5-Дихлор-4-(3-(3-фторфенил)пропилокси)фенол
115) 3,5-Дихлор-4-(3-(4-фторфенил)пропилокси)фенол
116) 3,5-Дихлор-4-(3-(3,
4-дихлорфенокси)пропилокси)фенол
117) 3,5-Дихлор-4-(3-(2,3,4-трихлорфенокси)пропилокси)фенол
118) 3,5-Дихлор-4-(3-(2,4,6-трихлорфенокси)пропилокси)фенол
119) 3,
5-Дихлор-4-(3-(2,3,6-трихлорфенокси)пропилокси)фенол
120) 3,5-Дихлор-4-(3-(2,4,5-трихлорфенокси)пропилокси)фенол
121) 3,5-Дихлор-4-(3-(2,3,4,5-тетрахлорфенокси)пропилокси)фенол
122) 3,5-Дихлор-4-(3-(4-метилтиофенокси)пропилокси)фенол
123) 3,5-Дихлор-4-(3-(3-этоксифенокси)пропилокси)фенол
124) 3,5-Дихлор-4-(3-(3-метоксифенокси)пропилокси)фенол
125) 2-(2,6-Дихлор-4-гидроксифенокси)этил(4-хлор)бензоат
126) 2-(2,6-Дихлор-4-гидроксифенокси)этил(4-бром)бензоат
127) 2-(2,6-Дихлор-4-гидроксифенокси)этилбензоат
128) 3,
5-Дихлор-4-(3-(3-трифторметоксифенил)пропилокси)фенол
129) 3,5-Дихлор-4-(3-(4-трифторметоксифенил)пропилокси)фенол
130) 2-(2,6-Дихлор-4-гидроксифенокси)этил(4-трифторметокси)
бензоат
131) 2-(2,6-Дихлор-4-гидроксифенокси)этил(3,5-дихлор)бензоат
132) 3,5-Дихлор-4-(3-(4-(1,1,2,2-тетрафторэтокси)фенокси) пропилокси)фенол
133) 3,5-Дихлор-4-(3-(4-(1,1,
2,2-тетрафтор-2-бромэтокси)фенокси)- пропилокси)фенол
134) 3,5-Дихлор-4-(3-(4-бромдифторметоксифенокси)пропилокси)фенол
135) 3,5-Дихлор-4-(2-(4-трифторметилфенил)этокси)фенол
136) 3,5-Дихлор-4-(3-(3-бромфенил)пропилокси)фенол
137) 3,5-Дихлор-4-(4-(4-хлорфенил)-3-бутенилокси)фенол
138) 3,5-Дихлор-4-(4-(4-фторфенил)бутилокси)фенол
139) 3,
5-Дихлор-4-(4-(4-трифторметилфенил)пропилокси)фенол
140) 3,5-Дихлор-4-(4-(4-трифторметоксифенил)пропилокси)фенол
141) 2-(2,6-Дихлор-4-гидроксифенокси)этилфенилацетат
142)
3-(2,6-Дихлор-4-гидроксифенокси)пропил(2-хлор)бензоат
143) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(3-хлор)бензоат
144) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(4-хлор)бензоат
145) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(4-этокси)бензоат
146) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(4-трифторметокси) бензоат
147) 2-(2,
6-Дихлор-4-гидроксифенокси)этил(2-хлор)бензоат
148) 2-(2,6-Дихлор-4-гидроксифенокси)этил(3-хлор)бензоат
149) 3,5-Дихлор-4-(2-(4-хлорфенилтио)этокси)фенол
150) 3-(2,
6-Дихлор-4-гидроксифенокси)пропил(3-фенокси)бензоат
151) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(4-фтор)бензоат
152) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(4-бром)бензоат
153) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(2-фтор-4- трифторметил)бензоат
154) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(3,5-бистрифторметил) бензоат
155) 3,
5-Дихлор-4-(3-(4-изопропоксифенокси)пропилокси)фенол
156) 3,5-Дихлор-4-(3-(3-изопропоксифенокси)пропилокси)фенол
157) 3,5-Дихлор-4-(3-(4-(2,2,2-трифторэтокси)фенокси)пропилокси)
фенол
158) 3,5-Дихлор-4-(3-(3-(2,2,2-трифторэтокси)фенокси)пропилокси) фенол
159) 3,5-Дихлор-4-(3-(4-трифторметилфенокси)пропилокси)фенол nD25,0 = 1,
5151
160) 3,5-Дихлор-4-(3-(3-(1,1,2,2-тетрафторэтокси)фенокси) пропилокси)фенол
161) 3,5-Дихлор-4-(3-(3-(2-бром-1,1,2,2-тетрафторэтокси)фенокси) пропилокси)фенол
162) 3-(2,
6-Дихлор-4-гидроксифенокси)пропил(2,4-дихлор)бензоат
163) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(3,4-дихлор)бензоат
164) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(3-трифторметил)
бензоат
165) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(3,4-диметокси) бензоат
166) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(4-изопропил) бензоат
167) 3,
5-Дихлор-4-(4-бромбутилокси)фенол
168) 3,5-Дихлор-4-(3-(2,6-дихлор-4-(3,3-дихлор-2-пропенилокси)- фенокси)пропилокси)фенол
169) 3,5-Дихлор-4-(4-(2,6-дихлор-4-(3,
3-дихлор-2-пропенилокси)- фенокси)бутокси)фенол
170) 3-Хлор-5-метил-4-(2-(4-бромфенил)этокси)фенол
171) 3-Хлор-5-метил-4-(3-(4-хлорфенил)пропилокси)фенол
172)
3-Хлор-5-метил-4-(4-фенилбутилокси)фенол
173) 3-Хлор-5-метил-4-(2-(4-бромфенил)этокси)фенол
174) 3,5-Дихлор-4-(3-(фенилтио)пропилокси)фенол
175) 3,
5-Дихлор-4-(3-(4-хлорфенилтио)пропилокси)фенол
176) 3-(2,6-Дихлор-4-гидроксифенокси)пропил-1-нафтоат
177) 3-(2,6-Дихлор-4-гидроксифенокси)пропил 2-нафтоат
178) 3,
5-Дихлор-4-(3-трифторметоксифенокси)пропилокси)фенол
179) 4-(2,6-Дихлор-4-гидроксифенокси)бутил(4-этокси)бензоат
180) 2-(2,6-Дихлор-4-гидроксифенокси)этил(4-изопропокси)бензоат
181) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(4-изопропокси)бензоат
182) 2-(2,6-Дихлор-4-гидроксифенокси)этил(4-этокси)бензоат
183) 3,5-Дихлор-4-(3,7-диметилоктилокси)фенол
184) 3,5-Дихлор-4-(3,7-диметил-6-октенилокси)фенол
185) 3,5-Дихлор-4-(3,7-диметил-2,6-октадиен-1-ил-окси)фенол
186) 3,5-Дихлор-4-(н-октилокси)фенол
187) 3,
5-Дихлор-4-(2-(4-хлорбензилокси)этокси)фенол
188) 4-(2,6-Дихлор-4-гидроксифенокси)бутил(2-хлор)бензоат
189) 4-(2,6-Дихлор-4-гидроксифенокси)бутил(3-хлор)бензоат
190) 4-(2,
6-Дихлор-4-гидроксифенокси)бутил(4-хлор)бензоат
191) 4-(2,6-Дихлор-4-гидроксифенокси)бутил(4-трифторметокси)- бензоат
192) 4-(2,
6-Дихлор-4-гидроксифенокси)бутил(4-изопропокси)бензоат
193) 3,5-Дихлор-4-(3-(4-трифторметилфенилтио)пропилокси)фенол
194) 3,5-Дихлор-4-(3-(4-трет-бутилфенилтио)пропилокси)фенол
195) 3,5-Дихлор-4-(4-(4-трифторметоксифенокси)бутилокси)фенол
196) 3,5-Дихлор-4-(4-(4-изопропилоксифенокси)бутилокси)фенол nD25,5 = 1,5484
197) 3,
5-Дихлор-4-(2-(4-бромфенил)этокси)фенол, nD26,0 = 1,5875
198) 3,5-Дибром-4-(3-(4-хлорфенокси)пропилокси)фенол, т.пл. 80,3oC
199) 3,
5-Дибром-4-(4-фенилбутилокси)фенол, т.пл. 80,3oC
200) 3,5-Дихлор-4-(4-(4-хлорфенил)бутилокси)фенол
201) 2-(2,6-Дихлор-4-гидроксифенокси)этил(3-этокси)бензоат
202)
3-(2,6-Дихлор-4-гидроксифенокси)пропил(3-этокси)бензоат
203) 4-(2,6-Дихлор-4-гидроксифенокси)бутил(3-этокси)бензоат
204) 2-(2,6-Дихлор-4-гидроксифенокси)этил(4-трифторметил)
бензоат
205) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(4-трифторметил) бензоат
206) 3,5-Дихлор-4-(3-метил-3-(4-хлорфенокси)пропилокси)фенол
207) 3,
5-Дихлор-4-(1-метил-3-(4-хлорфенокси)пропилокси)фенол
208) 3,5-Дихлор-4-(3-метил-3-бутенилокси)фенол
209) 3,5-Дихлор-4-(3-(4-метоксифенилтио)пропилокси)фенол
210) 3,
5-Дихлор-4-(3-(4-фторфенилтио)пропилокси)фенол
211) 3,5-Дихлор-4-(3-(2,3,5,6-тетрафторфенилтио)пропилокси)фенол
212) 3,5-Дихлор-4-(3-(3-хлорфенилтио)пропилокси)фенол
213) 3,
5-Дихлор-4-(3-(4-бромфенилтио)пропилокси)фенол
214) 3,5-Дихлор-4-(4-(4-хлорфенокси)бутилокси)фенол, nD25,0 = 1,5540
215) 3,
5-Дихлор-4-(4-(3-изопропоксифенокси)бутилокси)фенол
216) 3,5-Дихлор-4-(4-(4-трифторметоксифенокси)бутилокси)фенол
217) 3,5-Дихлор-4-(4-(4-(1,1,2,
2-тетрафторэтокси)фенокси)- бутилокси)фенол
218) 3,5-Дихлор-4-(4-(3-(1,1,2,2-тетрафторэтокси)фенокси)- бутилокси)фенол
219) 3,5-Дихлор-4-(4-(4-(2,2,
2-трифторэтокси)фенокси)- бутилокси)фенол
220) 3,5-Дихлор-4-(4-(3-(2,2,2-трифторэтокси)фенокси)- бутилокси)фенол
221) 3,5-Дихлор-4-(4-(4-дифторметоксифенокси)бутилокси)фенол
222) 3,5-Дихлор-4-(4-(3-дифторметоксифенокси)бутилокси)фенол
223) 3,5-Дихлор-4-(3-(4-дифторметоксифенокси)пропилокси)фенол
224) 3,
5-Дихлор-4-(3-(3-дифторметоксифенокси)бутилокси)фенол
225) 3,5-Дихлор-4-(4-(4-трифторметилфенокси)бутилокси)фенол
226) 3,5-Дихлор-4-(4-(3-трифторметилфенокси)бутилокси)фенол
227) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(4-хлор)фенилацетат
228) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(4-хлор)циннамат
229) 3-(2,
6-Дихлор-4-гидроксифенокси)пропил(4-хлор)феноксиацетат
230) 3,5-Дихлор-4-(3-(N-метиланинино)пропилокси)фенол
231) 3,5-Дихлор-4-(4-(3-фторфенил)-3-бутенилокси)фенол
232) 3,
5-Дихлор-4-(4-(3-трифторметилфенил)-3-бутенилокси)фенол
233) 3,5-Дихлор-4-(4-(3-трифторметоксифенил)-3-бутенилокси)фенол
234) 3,5-Дихлор-4-(4-(3-фторфенил)бутилокси)фенол
235) 3,5-Дихлор-4-(4-(3-трифторметилфенил)бутилокси)фенол
236) 3,5-Дихлор-4-(4-(3-трифторметоксифенил)бутилокси)фенол
237) 2-(2,6-Дихлор-4-гидроксифенокси)этил(4-(2,2,
2- трифторэтокси))бензоат
238) 3-(2,6-Дихлор-4-гидроксифенокси)пропил(4-(2,2,2- трифторэтокси))бензоат
239) 3,5-Дихлор-4-((3-этоксикарбонил)пропилокси)фенол
240)
4-(трифторметокси)фенокси-4-(4-гидрокси-2,6-дихлорфенокси)- бутират
241) 3,5-Дихлор-4-(2-метил-3-(4-хлорфенокси)пропилокси)фенол
242)
3-Хлор-5-метил-4-(3-(4-трифторметоксифенокси)пропилокси) фенол
243) 3-(2-Хлор-6-метил-4-гидроксифенокси)пропил 4-бромбензоат
244) 3,5-Дихлор-4-(2-(4-изопропоксифенил)этокси)фенол
245) 3,5-Дихлор-4-(2-(4-трифторметоксифенил)этокси)фенол
246) 3,5-Дихлор-4-(3-(4-бромфенил)пропилокси)фенол
247) 3,5-Дихлор-4-(3-(4-трифторметилфенил)пропилокси)фенол
248) 3,5-Диметил-4-(3-(4-хлорфенокси)пропилокси)фенол
249) 3,5-Дихлор-4-(4-(4-хлорфенокси)-2(Z)-бутенилокси)фенол
250) 3,5-Дихлор-4-(4-(4-хлорфенокси)-2(E)-бутенилокси)фенол
251) 3-(2,6-Дихлор-4-гидроксифенокси)пропил 4-дифторметилбензоат
252) 3-(2,6-Дихлор-4-гидроксифенокси)пропил 4-(1,1,2,2- тетрафторэтокси)бензоат
253) 3-(2,
6-Дихлор-4-гидроксифенокси)пропил 3-метил-2- (4-хлорфенил)бутират
254) 3,5-Дихлор-4-(4-(4-хлорфенилтио)бутилокси)фенол
255) 3,5-Дихлор-4-(4-(4-трифторметилфенилтио)бутилокси)фенол
256) 3,5-Дихлор-4-(4-(4-гидроксифенилтио)бутилокси)фенол
257) 3,5-Дихлор-4-(3-(4-трифторметоксифенокси)пропилокси)фенол
258) 3,
5-Дихлор-4-(4-(4-метоксифенилтио)бутилокси)фенол
259) 3,5-Дихлор-4-(4-(4-изопропоксифенилтио)бутилокси)фенол
260) 3,5-Дихлор-4-(3-(4-хлорфенилсульфенил)пропилокси)фенол
261)
3,5-Дихлор-4-(4-(4-хлорфенокси)бутилокси)фенол
262) 3,5-Диизопропил-4-(4-(4-трифторметоксифенокси) бутилокси)фенол
263) 3,5-Диэтил-4-(3-(4-трифторметоксифенокси)пропилокси)фенол
nD20,4 = 1,5060
264) 3-Этил-5-метил-4-(3-(4-трифторметоксифенокси)пропилокси) фенол, nD25,4 = 1,4955
265) 3-(2,
6-Дихлор-4-гидроксифенокси)пропил(4-трифторметил)- циннамат
266) 3,5-Дихлор-4-(3-(4-трифторметоксианилино)пропилокси)фенол
267) 3,5-Дихлор-4-(3-анилино)пропилокси)фенол
268)
3,5-Дихлор-4-(3-(4-трифторметиланилино)пропилокси)фенол
269) 3,5-Дихлор-4-(3-(N-метил-4-трифторметиланилино) пропилокси)фенол
270) 3,5-Дихлор-4-(3-(N-ацил-4-трифторметиланилино)
пропилокси)фенол
271) 3,5-Дихлор-4-(3-(4-трифторметоксифенилтио)пропилокси)фенол
272) 3,5-Дихлор-4-(4-трифторметилбензилокси)тиофенол
273) 3,
5-Дихлор-4-(2-(4-трифторметилфенил)этокси)фенол
274) 3,5-Дихлор-4-(3-(4-трифторметилфенил)пропилокси)фенол
275) 3,5-Дихлор-4-(3-(4-трифторметилфенокси)пропилокси)фенол
276)
3-Этил-5-метил-4-(3-(4-трифторметилфенокси)пропилокси)фенол
277) 3,5-Дихлор-4-(3-(4-хлорфенилсульфонил)пропилокси)фенол
278) 2,3,5,6-Тетрахлор-4-(3-(4-трифторметилфенокси)
пропилокси)фенол
279) 3,5-Дихлор-4-(4-анилино)бутилокси)фенол
280) 3,5-Дихлор-4-(4-(4-трифторметиланилино)бутилокси)фенол
281) 3,
5-Дихлор-4-(4-(4-трифторметоксианилино)бутилокси)фенол
282) 3,5-Диэтил-4-(3-(4-трифторметилфенокси)пропилокси)фенол
283) 3,
5-Дихлор-4-(3-(4-изопропоксикарбонилокси)пропилокси)фенол
284) 3,5-Дихлор-4-(3-(4-метоксикарбонилфенокси)пропилокси)фенол
285)
3-Хлор-5-метил-4-(4-(4-трифторметоксифенокси)бутилокси)фенол
286) 3-Хлор-5-метил-4-(4-(4-трифторметилфенокси)бутилокси)фенол
287)
3-Хлор-5-метил-4-(4-(4-хлорфенокси)бутилокси)фенол
288) 3-Хлор-5-метил-4-(3-(4-бромфенокси)пропилокси)фенол
289) 3-Хлор-5-метил-4-(4-(4-бромфенокси)бутилокси)фенол
290)
3-Хлор-5-метил-4-(3-(4-изопропоксифенокси)пропилокси)фенол
291) 3-Хлор-5-метил-4-(4-(4-изопропоксифенокси)бутилокси)фенол
292)
3-Этил-5-метил-4-(4-(4-трифторметоксифенокси)бутилокси)фенол
293) 3-Этил-5-метил-4-(4-(4-трифторметилфенокси)бутилокси)фенол
294)
3-Этил-5-метил-4-(3-(4-хлорфенокси)пропилокси)фенол
295) 3-Этил-5-метил-4-(4-(4-хлорфенокси)бутилокси)фенол
296) 3-Этил-5-метил-4-(3-(4-бромфенокси)пропилокси)фенол
297)
3-Этил-5-метил-4-(4-(4-бромфенокси)бутилокси)фенол
298) 3-Этил-5-метил-4-(3-(4-изопропоксифенокси)пропилокси)фенол
299) 3-Этил-5-метил-4-(4-(4-изопропоксифенокси)бутилокси)фенол
300) 3,5-Диэтил-4-(4-(4-трифторметоксифенокси)бутилокси)фенол
301) 3,5-Диэтил-4-(4-(4-трифторметилфенокси)бутилокси)фенол
302) 3,
5-Диэтил-4-(3-(4-хлорфенокси)пропилокси)фенол
303) 3,5-Диэтил-4-(4-(4-хлорфенокси)бутилокси)фенол
304) 3,5-Диэтил-4-(3-(4-бромфенокси)пропилокси)фенол
305) 3,
5-Диэтил-4-(4-(4-бромфенокси)бутилокси)фенол
306) 3,5-Диэтил-4-(3-(4-изопропоксифенокси)пропилокси)фенол
307) 3,5-Диэтил-4-(4-(4-изопропоксифенокси)бутилокси)фенол
308) 3,
5-Диизопропил-4-(4-(4-трифторметоксифенокси)бутилокси) фенол
309) 3,5-Диизопропил-4-(3-(4-трифторметоксифенокси)пропилокси)- фенол
310) 3,
5-Диизопропил-4-(4-(4-трифторметоксифенокси)бутилокси)фенол
311) 3,5-Диизопропил-4-(3-(4-хлорфенокси)пропилокси)фенол
312) 3,5-Диизопропил-4-(4-(4-хлорфенокси)бутилокси)фенол
313) 3,5-Диизопропил-4-(3-(4-бромфенокси)пропилокси)фенол
314) 3,5-Диизопропил-4-(4-(4-бромфенокси)бутилокси)фенол
315) 3,
5-Диизопропил-4-(3-(4-изопропоксифенокси)пропилокси)фенол
316) 3,5-Диизопропил-4-(4-(4-изопропоксифенокси)бутилокси)фенол
Приведенный ниже пример является примером получения
промежуточного соединения общей формулы (IX).
Пример 5 получения промежуточного соединения.
Получение 4-(2-хлорбензилокси)-3,5-дихлорфеноксиацетальдегида
Смесь 0,85 г 4-(2-хлорбензилокси)-3,5-дихлорфенола, 0,47 мл бромацетальдегиддиэтацеталя, 0,46 г карбоната калия и 20 мл N,N-диметилформамида перемешивалась при 90oC в течение 6 часов. После
охлаждения до комнатной температуры реакционная смесь выливалась в ледяную воду и экстрагировалась дважды 50 мл диэтилового эфира. Объединенный эфирный слой промывался водой и сушился безводным
сульфатом магния с последующим удалением растворителя с помощью перегонки при пониженном давлении. Остаток подвергался хроматографии на силикагеле, что давало 0,85 г 4-(2-хлорбензилокси)-3,
5-дихлор-феноксиацетальдегиддиэтилацеталя (72% выход).
Затем 0,85 г 4-(2-хлорбензилокси)-3,5-дихлорфеноксиацетальдегиддиэтилацеталя растворялось в 10 мл уксусной кислоты, и к раствору добавлялся по каплям 1 мл концентрированной соляной кислоты при перемешивании при охлаждении льдом. После перемешивания при охлаждении льдом в течение 2 часов реакционная смесь выливалась в ледяную воду и экстрагировалась дважды диэтиловым эфиром. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния с последующим удалением растворителя с помощью перегонки при пониженном давлении, что давало 0,70 г 4-(2-хлорбензилокси)-3,5-дихлорфеноксиацетальдегида в неочищенной форме.
Приведенные ниже являются примерами получения промежуточных соединений общей формулы (III) или (X).
Пример 6 получения промежуточного соединения.
Получение промежуточного соединения 317)
Реакционный сосуд загружался 30,5 г
4-гидроксифенилбензоата, 21,6 г карбоната калия, 20,8 г 1,1,3-трихлорпропена и 100 мл N,N-диметилформамида. После перемешивания при комнатной температуре в течение 15 часов реакционная смесь
выливалась в воду и экстрагировалась дважды 150 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой
продукт подвергался хроматографии на силикагеле, что давало 44,1 г 4-(3,3-дихлор-2-пропенилокси)фенилбензоата (96% выход).
Реакционный сосуд загружался 44,1 г 4-(3, 3-дихлор-2-пропенилокси)фенилбензоата и 400 мл метанола, и к смеси добавлялось по каплям медленно при охлаждении льдом 33 г 30% гидроокиси калия. После перемешивания в течение 1 часа реакционная смесь слегка подкислялась добавлением 10% соляной кислоты и экстрагировалась дважды 150 мл диэтилового эфира при высаливании. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 26,0 г 4-(3,3-дихлор-2-пропенилокси)фенола (87% выход).
Реакционный сосуд загружался 26,0 г 4-(3,3-дихлор-2-пропенилокси)фенола и 500 мл четыреххлористого углерода. К смеси добавлялся медленно по каплям при перемешивании и при охлаждении льдом раствор 27,1 трет-бутилгипохлорита, растворенного в 20 мл четыреххлористого углерода. Спустя 24 часа, реакционная смесь выливалась в воду с последующим разделением фаз. Органический слой (т. е. слой четыреххлористого углерода) промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 11,0 г 2, 6-дихлор-4-(3,3-дихлор-2-пропенилокси)фенола (32% выход), nD22,5 = 1,5895.
Пример 7 получения промежуточного соединения.
Получение
промежуточного соединения 325)
Раствор 50 г 4-бром-6-хлор-2-метилфенола и 42,5 бензилбромида, растворенных в 200 мл N,N-диметилформамида, перемешивался при комнатной температуре, к раствору
добавлялось 37,4 г карбоната калия, и смесь перемешивалась в течение 12 часов. После завершения реакции растворитель удалялся с помощью перегонки при пониженном давлении, и остаток добавлялся к 400 мл
диэтилового эфира, промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 63 г
4-бром-6-хлор-2-метил-1-бензилоксибензола (выход 90%).
Затем 40 г 4-бром-6-хлор-2-метил-1-бензилоксибензола растворялось в 400 мл тетрагидрофурана с последующим перемешиванием при
-70oC, к раствору по каплям добавлялось 76 мл раствора н-бутиллития (в гексане, 1,69 мол/литр) с последующим дополнительным перемешиванием при -70oC в течение 2 часов. К данной
реакционной смеси добавлялся по каплям раствор 13,3 г триметоксиборана, растворенного в 50 мл тетрагидрофурана. Затем реакционная смесь перемешивалась в течение 1 часа при подогревании до комнатной
температуры, и небольшими
порциями добавлялось 100 мл 10% водного раствора соляной кислоты с последующим перемешиванием в течение 20 минут. Тетрагидрофурановый слой промывался водой, сушился
безводным сульфатом магния и концентрировался. Остаток смешивался с 200 мл толуола и нагревался при 70oC при перемешивании, к нему добавлялось по каплям 36 мл 30% водного раствора перекиси
водорода. После нагревания в условиях дефлегмации в течение 1 часа реакционная смесь промывалась один раз водой, два раза 10% водным раствором аммонийсульфата железа и один раз водой с последующим
разделением фаз. Толуольный слой сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 29 г
4-бензилокси-3-хлор-5-метилфенола (91% выход).
К раствору 27,3 г 4-бензилокси-3-хлор-5-метилфенола, растворенного в 250 мл хлороформа и перемешиваемого при 0oC, добавлялось 15,4 г бензоилхлорида, а затем 13,3 г триэтиламина. После перемешивания при комнатной температуре в течение 2 часов хлороформный слой промывался водой, сушился безводным сульфатом магния и концентрировался. Остаток подвергался хроматографии на силикагеле, что давало 35 г 4-бензилокси-3-хлор-5-метил-1-бензоилоксибензола (90% выход).
Реакционный сосуд загружался 35 г 4-бензилокси-3-хлор-5-метил-1-бензоилоксибензола и 200 мл этилацетата, и воздух в сосуде заменялся азотом. Затем добавлялось 2 г 10% палладия на угле и азот в сосуде заменялся водородом с последующим энергичным перемешиванием при комнатной температуре в течение 10 часов. Водород в сосуде заменялся азотом, после чего реакционная смесь фильтровалась, и фильтрат концентрировался. Остаток подвергался хроматографии на силикагеле, что давало 25 г 4-бензоилокси-2-хлор-6-метилфенола (выход 96%).
Затем 24 г 4-бензоилокси-2-хлор-6-метилфенола растворялось в 250 мл хлороформа, к раствору добавлялось 12 г хлорметилового эфира при перемешивании при 0oC, и по каплям добавлялось 21 г N-этилдиизопропиламина. После нагревания в условиях дефлегмации в течение 1 часа хлороформный слой промывался водой и концентрировался. Остаток подвергался хроматографии на силикагеле, что давало 27,4 г 3-хлор-4-метоксиметокси-5-метил-1-бензоилоксибензола (выход 96%).
Затем в 200 мл метанола растворялось 26 г 3-хлор-4-метоксиметокси-5-метил-1-бензоилоксибензола, и раствор перемешивался при комнатной температуре при добавлении по каплям 60 мл 10% водного раствора гидроокиси калия. После завершения реакции растворитель удалялся с помощью перегонки при пониженном давлении. Остаток добавлялся к 150 мл воды, нейтрализовался 10% водным раствором соляной кислоты и экстрагировался 200 мл диэтилового эфира. Растворитель удалялся с помощью перегонки при пониженном давлении, и остаток подвергался хроматографии на силикагеле, что давало 17,4 г 3-хлор-4-метоксиметокси-5-метилфенола (96% выход).
К смеси 10 г 3-хлор-4-метоксиметокси-5-метилфенола, 7 г карбоната калия и 100 мл N,N-диметилформамида добавлялся по каплям раствор 8 г 1,1,3-трихлор-1-пропена, растворенного в 30 мл N,N-диметилформамида, при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 12 часов реакционная смесь выливалась в ледяную воду и экстрагировалась 200 мл диэтилового эфира. Объединенный эфирный экстракт промывался водой, сушился безводным сульфатом магния и концентрировался. Остаток подвергался хроматографии на силикагеле, что давало 14,1 г 3-хлор-4-метоксиметокси-5-метил-1-(3,3-дихлор-2- пропенилокси)бензола (91% выход).
Затем 14,1 г 3-хлор-4-метоксиметокси-5-метил-1-(3, 3-дихлор-2- пропенилокси)бензола растворялось в 100 мл 80% раствора уксусной кислоты с последующим нагреванием в условиях дефлегмации при перемешивании в течение 1 часа. После завершения реакции реакционная смесь смешивалась с 200 мл воды и экстрагировалась дважды 200 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался. Остаток подвергался хроматографии на силикагеле, что давало 11,3 г 2-хлор-6-метил-(3,3-дихлор-2-пропенилокси)фенола (93% выхода), т.пл. 70oC.
Следующие ниже соединения являются конкретными примерами промежуточных соединений общей формулы (III) или (X) под соответствующими номерами соединений с указанием их физических свойств, если они определялись.
317) 2,6-Дихлор-4-(3,3-дихлор-2-пропенилокси)фенол
1H-ЯМР (CDCl3/TMC) δ (млн. дол): 4,57 (2H, д), 5,50 (1H, шир.с), 6,11 (1H, т), 3,85 (2H, с).
318) 2,6-Дихлор-4-(3,3-дибром-2-пропенилокси)фенол
319) 2-Хлор-6-бром-4-(3,3-дихлор-2-пропенилокси)фенол
320) 2-Хлор-6-бром-4-(3,3-дибром-2-пропенилокси)фенол
321) 2,
6-Дибром-4-(3,3-дихлор-2-пропенилокси)фенол
322) 2,6-Дибром-4-(3,3-дибром-2-пропенилокси)фенол
323) 2,6-Диметил-4-(3,3-дихлор-2-пропенилокси)фенол
324) 2,6-Диметил-4-(3,
3-дибром-2-пропенилокси)фенол
325) 2-Хлор-6-метил-4-(3,3-дихлор-2-пропенилокси)фенол, т.пл. 70oC
326) 2-Хлор-6-метил-4-(3,3-дибром-2-пропенилокси)фенол
327) 2,
6-Диэтил-4-(3,3-дихлор-2-пропенилокси)фенол
328) 2,6-Диэтил-4-(3,3-дибром-2-пропенилокси)фенол
329) 2,6-Диизопропил-4-(3,3-дихлор-2-пропенилокси)фенол
330) 2,
6-Диизопропил-4-(3,3-дибром-2-пропенилокси)фенол
331) 2-Этил-6-метил-4-(3,3-дихлор-2-пропенилокси)фенол
332) 2-Этил-6-метил-4-(3,3-дибром-2-пропенилокси)фенол
333)
2-Этил-6-хлор-4-(3,3-дихлор-2-пропенилокси)фенол
334) 2-Этил-6-хлор-4-(3,3-дибром-2-пропенилокси)фенол
335) 2,6-Дифтор-4-(3,3-дихлор-2-пропенилокси)фенол
336) 2,
6-Дифтор-4-(3,3-дибром-2-пропенилокси)фенол
337) 2-Хлор-6-фтор-4-(3,3-дихлор-2-пропенилокси)фенол
338) 2-Хлор-6-фтор-4-(3,3-дибром-2-пропенилокси)фенол
339)
2-Изопропил-6-метил-4-(3,3-дихлор-2-пропенилокси)фенол
340) 2-Изопропил-6-метил-4-(3,3-дибром-2-пропенилокси)фенол
341) 2-Изопропил-6-этил-4-(3,3-дихлор-2-пропенилокси)фенол
342) 2-Изопропил-6-этил-4-(3,3-дибром-2-пропенилокси)фенол
343) 2-Изопропил-6-хлор-4-(3,3-дихлор-2-пропенилокси)фенол
344) 2-Изопропил-6-хлор-4-(3,3-дибром-2-пропенилокси)фенол
345) 2-Бром-6-метил-4-(3,3-дихлор-2-пропенилокси)фенол
346) 2-Бром-6-метил-4-(3,3-дибром-2-пропенилокси)фенол
347) 2-Бром-6-этил-4-(3,3-дихлор-2-пропенилокси)фенол
348) 2-Бром-6-этил-4-(3,3-дибром-2-пропенилокси)фенол
349) 2-Бром-6-изопропил-4-(3,3-дихлор-2-пропенилокси)фенол
350) 2-Бром-6-изопропил-4-(3,3-дибром-2-пропенилокси)фенол
351) 2-Фтор-6-метил-4-(3,3-дихлор-2-пропенилокси)фенол
352) 2-Фтор-6-метил-4-(3,3-дибром-2-пропенилокси)фенол
353) 2-Фтор-6-этил-4-(3,3-дихлор-2-пропенилокси)фенол
354)
2-Фтор-6-этил-4-(3,3-дибром-2-пропенилокси)фенол
355) 2-Фтор-6-изопропил-4-(3,3-дихлор-2-пропенилокси)фенол
356) 2-Фтор-6-изопропил-4-(3,3-дибром-2-пропенилокси)фенол
357)
2-Бром-6-фтор-4-(3,3-дихлор-2-пропенилокси)фенол
358) 2-Бром-6-фтор-4-(3,3-дибром-2-пропенилокси)фенол
359) 2-Хлор-6-трифторметил-4-(3,3-дихлор-2-пропенилокси)фенол
360)
2-Хлор-6-трифторметил-4-(3,3-дибром-2-пропенилокси)фенол
361) 2-Фтор-6-трифторметил-4-(3,3-дихлор-2-пропенилокси)фенол
362) 2-Фтор-6-трифторметил-4-(3,
3-дибром-2-пропенилокси)фенол.
Следующие примеры являются примерами получения промежуточных соединений общей формулы (II) или (XIII).
Пример 8 получения промежуточного соединения.
Получение промежуточного соединения 363)
Реакционный сосуд загружался 10,6 1,3-дибропропана, 5,53 г карбоната калия и 100 мл N,N-диметилформамида,
к смеси добавлялся медленно по каплям раствор 30,5 г 2,6-дихлор-4-(3,3-дихлор-2-пропенилокси)фенола, растворенного в 40 мл N,N-диметилформамида. После перемешивания при комнатной температуре в течение
24 часов реакционная смесь выливалась в воду и экстрагировалась дважды 150 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался,
давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 11,1 г 3,5-дихлор-4-(3-бромпропилокси)-1-(3,3-дихлор-2-пропенилокси)бензола (77% выход), nD24,0 = 1,5693.
Пример 9 получения промежуточного соединения.
Получение промежуточного соединения 365)
Реакционный сосуд загружался 22,67 г 1,
4-дибромбутана, 11,06 г карбоната калия и 200 мл N,N-диметилформамида, к смеси медленно по каплям добавлялся раствор 20,16 г 2,6-дихлор-4-(3,3-дихлор-2-пропенилокси)фенола, растворенного в 80 мл N,
N-диметилформамида. После перемешивания при комнатной температуре в течение 24 часов реакционная смесь выливалась в воду и экстрагировалась дважды 300 мл диэтилового эфира. Объединенный эфирный слой
промывался водой, сушился безводным сульфатом магния и концентрировался, давая сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 21,7 г 3,
5-дихлор-4-(4-бромбутилокси)-1-(3,3-дихлор-2-пропенилокси)бензола (74% выход), nD25,0 = 1,5666.
Следующие ниже примеры являются примерами получения промежуточных соединений общей формулы (II) и (XIV).
Пример 10 получения промежуточного соединения.
Получение промежуточного соединения 367)
Реакционный
сосуд загружался 11,1 г 3,5-дихлор-4-(3-бромпропилокси)-1-(3,3-дихлор-2-пропенилокси)бензола, 3,31 г бензойной кислоты, 3,90 г карбоната калия и 50 мл N,N-диметилформамида. После перемешивания при
комнатной температуре в течение 24 часов реакционная смесь выливалась в воду и экстрагировалась дважды 150 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом
магния и концентрировался с получением сырого продукта. Сырой продукт подвергался хроматографии на силикагеле, что давало 11,6 г 3,5-дихлор-4-(3-бензоилоксипропилокси)-1-(3,3-дихлор-2-пропенилокси)
бензола (95% выход).
Реакционный сосуд загружался 11,6 г 3,5-дихлор-4-(3-бензоилоксипропилокси)-1-(3,3-дихлор-2-пропенилокси) бензола, 15,2 г 10% водного раствора гидроокиси калия и 300 мл метанола. После перемешивания при комнатной температуре в течение 24 часов реакционная смесь концентрировалась. Концентрат выливался в воду и экстрагировался дважды 150 мл диэтилового эфира. Объединенный эфирный слой промывался водой, сушился безводным сульфатом магния и концентрировался, и получался сырой продукт. Сырой продукт подвергался хроматографии на силикагеле, что давало 7,41 г 3-(2,6-дихлор-4-(3,3-дихлор-2-пропенилокси)фенокси-1-пропилового спирта (83% выход), т.пл. 56,6oC.
Следующие соединения являются конкретными примерами промежуточных соединений общей формулы (II), (XIII) или (XIV) с указанием соответствующих номеров соединений и их физических свойств, если они определялись.
363) 3,
5-Дихлор-4-(3-бромпропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD24,0 = 1,5693
364) 3,5-Дихлор-4-(3-хлорпропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
365) 3,5-Дихлор-4-(4-бромбутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, nD22,5 = 1,5666
366) 3,5-Дихлор-4-(4-хлорбутилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол
367) 3,5-Дихлор-4-(3-гидроксипропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол, т.пл. 56,6oC
368) 3,5-Дихлор-4-(3-гидроксибутилокси)-1- (3,
3-дихлор-2-пропенилокси)бензол
369) 3,5-Дихлор-4-(3-бромпропилокси)-1- (3,3-дибром-2-пропенилокси)бензол
370) 3,5-Дихлор-4-(3-хлорпропилокси)-1- (3,3-дибром-2-пропенилокси)бензол
371) 3,5-Дихлор-4-(4-бромбутилокси)-1- (3,3-дибром-2-пропенилокси)бензол
372) 3,5-Дихлор-4-(4-хлорбутилокси)-1- (3,3-дибром-2-пропенилокси)бензол
373) 3,
5-Дихлор-4-(3-гидроксипропилокси)-1- (3,3-дибром-2-пропенилокси)бензол, т.пл. 56,6oC
374) 3,5-Дихлор-4-(4-гидроксибутилокси)-1- (3,3-дибром-2-пропенилокси)бензол
375)
3-Хлор-5-метил-4-(3-бромпропилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
376) 3-Хлор-5-метил-4-(3-хлорпропилокси)-1- (3,3-дибром-2-пропенилокси)бензол
377)
3-Хлор-5-метил-4-(4-бромбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
378) 3-Хлор-5-метил-4-(4-хлорбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
379)
3-Хлор-5-метил-4-(3-гидроксипропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
380) 3-Хлор-5-метил-4-(4-гидроксибутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
381)
3-Хлор-5-метил-4-(3-бромпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
382) 3-Хлор-5-метил-4-(3-хлорпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
383)
3-Хлор-5-метил-4-(4-бромбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
384) 3-Хлор-5-метил-4-(4-хлорбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
385)
3-Хлор-5-метил-4-(3-гидроксипропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
386) 3-Хлор-5-метил-4-(4-гидроксибутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
387)
3-Этил-5-метил-4-(3-бромпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
388) 3-Этил-5-метил-4-(3-хлорпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
389)
3-Этил-5-метил-4-(4-бромбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
390) 3-Этил-5-метил-4-(4-хлорбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
391)
3-Этил-5-метил-4-(3-гидроксипропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
392) 3-Этил-5-метил-4-(4-гидроксибутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
393)
3-Этил-5-метил-4-(3-бромпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
394) 3-Этил-5-метил-4-(3-хлорпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
395)
3-Этил-5-метил-4-(3-бромбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
396) 3-Этил-5-метил-4-(4-хлорбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
397)
3-Этил-5-метил-4-(3-гидроксипропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
398) 3-Этил-5-метил-4-(4-гидроксибутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
399) 3,
3-Дибром-4-(3-бромпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
400) 3,5-Дибром-4-(3-хлорпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
401) 3,5-Дибром-4-(3-бромпропилокси)-1-(3,
3-дихлор-2- пропенилокси)бензол
402) 3,5-Дибром-4-(4-хлорбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
403) 3,5-Дибром-4-(3-гидроксипропилокси)-1-(3,
3-дихлор-2- пропенилокси)бензол
404) 3,5-Дибром-4-(4-гидроксибутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
405) 3,5-Дибром-4-(3-бромпропилокси)-1-(3,
3-дибром-2- пропенилокси)бензол
406) 3,5-Дибром-4-(3-хлорпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
407) 3,5-Дибром-4-(4-бромбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
408) 3,5-Дибром-4-(4-хлорбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
409) 3,5-Дибром-4-(3-гидроксипропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
410) 3,
5-Дибром-4-(4-гидроксибутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
411) 3,5-Диметил-4-(3-бромпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
412) 3,
5-Диметил-4-(3-хлорпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
413) 3,5-Диметил-4-(4-бромбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
414) 3,
5-Диметил-4-(4-хлорбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
415) 3,5-Диметил-4-(3-гидроксипропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
416) 3,
5-Диметил-4-(4-гидроксибутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
417) 3,5-Диметил-4-(3-бромпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
418) 3,
5-Диметил-4-(3-хлорпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
419) 3,5-Диметил-4-(4-бромбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
420) 3,
5-Диметил-4-(4-хлорбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
421) 3,5-Диметил-4-(3-гидроксипропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
422) 3,
5-Диметил-4-(4-гидроксибутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
423) 3,5-Диэтил-4-(3-бромпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
424) 3,
5-Диэтил-4-(3-хлорпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
425) 3,5-Диэтил-4-(4-бромбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
426) 3,5-Диэтил-4-(4-хлорбутилокси)-1-(3,
3-дихлор-2- пропенилокси)бензол
427) 3,5-Диэтил-4-(3-гидроксипропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
428) 3,5-Диэтил-4-(4-гидроксибутилокси)-1-(3,
3-дихлор-2- пропенилокси)бензол
429) 3,5-Диэтил-4-(3-бромпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
430) 3,5-Диэтил-4-(3-хлорпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
431) 3,5-Диэтил-4-(4-бромбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
432) 3,5-Диэтил-4-(4-хлорбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
433) 3,
5-Диэтил-4-(3-гидроксипропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
434) 3,5-Диэтил-4-(4-гидроксибутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
435) 3,
5-Диизопропил-4-(3-бромпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
436) 3,5-Диизопропил-4-(3-хлорпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
437) 3,
5-Диизопропил-4-(4-бромбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
438) 3,5-Диизопропил-4-(4-хлорбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
439) 3,
5-Диизопропил-4-(3-гидроксипропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
440) 3,5-Диизопропил-4-(4-гидроксибутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
441) 3,
5-Диизопропил-4-(3-бромпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
442) 3,5-Диизопропил-4-(3-хлорпроплиокси)-1-(3,3-дибром-2- пропенилокси)бензол
443) 3,
5-Диизопропил-4-(4-бромбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
444) 3,5-Диизопропил-4-(4-хлорбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
445) 3,
5-Диизопропил-4-(3-гидроксипропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
446) 3,5-Диизопропил-4-(4-гидроксибутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
447) 3,
5-Дифтор-4-(3-бромпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
448) 3,5-Дифтор-4-(3-хлорпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
449) 3,5-Дифтор-4-(4-бромбутилокси)-1-(3,
3-дихлор-2- пропенилокси)бензол
450) 3,5-Дифтор-4-(4-хлорбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
451) 3,5-Дифтор-4-(3-гидроксипропилокси)-1-(3,
3-дихлор-2- пропенилокси)бензол
452) 3,5-Дифтор-4-(4-гидроксибутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
453) 3,5-Дифтор-4-(3-бромпропилокси)-1-(3,
3-дибром-2- пропенилокси)бензол
454) 3,5-Дифтор-4-(3-хлорпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
455) 3,5-Дифтор-4-(4-бромбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
456) 3,5-Дифтор-4-(4-хлорбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
457) 3,5-Дифтор-4-(3-гидроксипропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
458) 3,
5-Дифтор-4-(4-гидроксибутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
459) 3-Хлор-5-фтор-4-(3-бромпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
460)
3-Хлор-5-фтор-4-(3-хлорпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
461) 3-Хлор-5-фтор-4-(4-бромбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
462)
3-Хлор-5-фтор-4-(4-хлорбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
463) 3-Хлор-5-фтор-4-(3-гидроксипропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
464)
3-Хлор-5-фтор-4-(4-гидроксибутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
465) 3-Хлор-5-фтор-4-(3-бромпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
466)
3-Хлор-5-фтор-4-(3-хлорпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
467) 3-Хлор-5-фтор-4-(4-бромбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
468)
3-Хлор-5-фтор-4-(4-хлорбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
469) 3-Хлор-5-фтор-4-(3-гидроксипропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
470)
3-Хлор-5-фтор-4-(4-гидроксибутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
471) 3-Бром-5-хлор-4-(3-бромпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
472)
3-Бром-5-хлор-4-(3-хлорпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
473) 3-Бром-5-хлор-4-(4-бромбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
474)
3-Бром-5-хлор-4-(4-хлорбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
475) 3-Бром-5-хлор-4-(3-гидроксипропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
476)
3-Бром-5-хлор-4-(4-гидроксибутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
477) 3-Бром-5-хлор-4-(3-бромпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
478)
3-Бром-5-хлор-4-(3-хлорпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
479) 3-Бром-5-хлор-4-(4-бромбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
480)
3-Бром-5-хлор-4-(4-хлорбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
481) 3-Бром-5-хлор-4-(3-гидроксипропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
482)
3-Бром-5-хлор-4-(3-гидроксибутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
483) 3-Хлор-5-этил-4-(3-бромпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
484)
3-Хлор-5-этил-4-(3-хлорпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
485) 3-Хлор-5-этил-4-(4-бромбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
486)
3-Хлор-5-этил-4-(4-хлорбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
487) 3-Хлор-5-этил-4-(3-гидроксипропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
488)
3-Хлор-5-этил-4-(4-гидроксибутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
489) 3-Хлор-5-этил-4-(3-бромпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
490)
3-Хлор-5-этил-4-(3-хлорпропилокси)-1-(3,3-дибром-2- пропенилокси)бензол
491) 3-Хлор-5-этил-4-(4-бромбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
492)
3-Хлор-5-этил-4-(4-хлорбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
493) 3-Хлор-5-этил-4-(4-хлорбутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
494)
3-Хлор-5-этил-4-(4-гидроксибутилокси)-1-(3,3-дибром-2- пропенилокси)бензол
495) 3-Хлор-5-изопропил-4-(3-бромпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
496)
3-Хлор-5-изопропил-4-(3-хлорпропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
497) 3-Хлор-5-изопропил-4-(4-бромбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
498)
3-Хлор-5-изопропил-4-(4-хлорбутилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
499) 3-Хлор-5-изопропил-4-(3-гидроксипропилокси)-1-(3,3-дихлор-2- пропенилокси)бензол
500)
3-Хлор-5-изопропилокси-4-(4-гидроксибутилокси)-1- (3,3-дихлор-2-пропенилокси)бензол
501) 3-Хлор-5-изопропил-4-(3-бромпропилокси)-1- (3,3-дибром-2-пропенилокси)бензол
502)
3-Хлор-5-изопропил-4-(3-хлорпропилокси)-1- (3,3-дибром-2-пропенилокси)бензол
503) 3-Хлор-5-изопропил-4-(4-бромбутилокси)-1- (3,3-дибром-2-пропенилокси)бензол
504)
3-Хлор-5-изопропил-4-(4-хлорбутилокси)-1- (3,3-дибром-2-пропенилокси)бензол
505) 3-Хлор-5-изопропил-4-(3-гидроксипропилокси)-1- (3,3-дибром-2-пропенилокси)бензол
506)
3-Хлор-5-изопропил-4-(4-гидроксибутилокси)-1- (3,3-дибром-2-пропенилокси)бензол.
Нижеследующие примеры являются примерами препаративных форм, в которых "части" выражены по весу, и настоящие соединения обозначены соответствующими номерами, которые приведены выше.
Пример 1 препаративных форм: Эмульгируемые концентраты
10 частей каждого из настоящих
соединений (1) - (330) растворялись в 35 частях ксилола и 35 частях N,N-диметил-формамида, к раствору добавлялись 14 частей полиоксиэтилен-стирилфенилового эфира и 6 частей додецилбензолсульфоната
кальция, и смесь хорошо перемешивалась, давая 10% эмульгируемый концентрат каждого соединения.
Пример 2 препаративных форм: Смачиваемые порошки
20 частей каждого из настоящих
соединений (1) - (330) добавлялись к смеси 4 частей лаурилсульфата натрия, 2 частей лигнинсульфоната кальция, 20 частей синтетической гидратированной окиси кремния в виде тонкого порошка и 54 частей
инфузорной или диатомовой земли, и смесь перемешивалась с помощью смесителя, давая 20% смачиваемый порошок каждого соединения.
Пример 3 препаративных форм: Гранулы
К 5 частям
каждого из настоящих соединений (1) - (300) добавляются 5 частей тонкодисперсного порошка синтетической гидратированной окиси кремния, 5 частей додецилсульфоната натрия, 30 частей бентонита и 55
частей глины, и смесь тщательно перемешивается. Затем к смеси добавляется достаточное количество воды, смесь дополнительно перемешивается, гранулируется с помощью гранулятора, а затем сушится на
воздухе, давая 5% гранулы каждого соединения.
Пример 4 препаративных форм: Дусты
Одна часть каждого из настоящих соединений (1) - (330) растворяется в подходящем количестве
ацетона, к раствору добавляется 5 частей тонкодисперсного порошка синтетической гидратированной окиси кремния, 0,3 части PAP и 93,7 части глины, и смесь перемешивается смесителем. Удаление ацетона с
помощью выпаривания дает 1% дуст каждого соединения.
Пример 5 препаративных форм: Текучие или сыпучие препараты
20 частей каждого из настоящих соединений (1) - (330)
смешивается с 1,5 части сорбитантриолета и 28,5 части водного раствора, содержащего 2 части поливинилового спирта, и смесь пульверизуется или распыляется на тонкодисперсные частицы, имеющие размер не
более 3 мкм, с помощью пескоструйной мельницы, и к ним добавляется 40 частей водного раствора, содержащего 0,05 части ксантановой смолы и 0,1 части алюминиймагниевого силиката, а затем добавляется 10
частей пропиленгликоля. Смесь перемешивается, давая основанную на воде 20% суспензию каждого соединения.
Пример 6 препаративных форм: Масляные растворы
Сначала 0,1 части
каждого из настоящих соединений (1) - (330) растворяется в 5 частях ксилола и 5 частях трихлорэтана. Затем раствор смешивается с 89,9 частями дезодорированного керосина, давая 0,1% масляный раствор
каждого соединения.
Пример 7 препаративных форм: Аэрозоли на основе масла
Сначала 0,1 части каждого из настоящих соединений (1) - (330), 0,2 части тетраметрина, 0,1 части
d-фенотрина и 10 частей дихлорэтана растворяется в 59,6 частях дезодорированного керосина, и раствор помещается в аэрозольный сосуд. Затем сосуд снабжается клапаном, через который под повышенным
давлением загружается 30 частей ракетного топлива (ожиженный нефтяной газ), давая аэрозоль на масляной основе каждого соединения.
Пример 8 препаративных форм: Аэрозоли на водной
основе
Сосуд для аэрозоля заполняется 50 частями чистой воды и смесью 0,2 части каждого из настоящих соединений (1) - (330), 0,2 части d-аллетрина, 0,2 части d-фенотрина, 5 частей ксилола, 3,
4 части дезодорированного керосина и 1 части эмульгирующего агента [ATMOS 300 (зарегистрированная торговая марка фирмы Атлас Кемикал Ко.)]. Затем сосуд снабжается клапаном, через который под давлением
загружается 40 частей ракетного топлива (ожиженный нефтяной газ), давая аэрозоль каждого соединения на водной основе.
Пример 9 препаративных форм: Комариные спирали
Сначала 0,
3 г каждого из настоящих соединений (1) - (330) смешивается с 0,3 части d-аллетрина, и смесь растворяется в 20 мл ацетона. Раствор равномерно смешивается с 99,4 г носителя для москитных (комариных)
спиралей (приготовленного смешением порошка Табу, порошка пиретрума и древесной муки в соотношении 4:3:3) при перемешивании. Смесь тщательно смешивается с 120 мл воды, формуется и сушится, давая
комариные спирали с каждым из соединений.
Пример 10 препаративных форм: Электрические комариные подстилки
Сначала 0,4 части каждого из настоящих соединений (1) - (330), 0,4
части d-аллетрина и 0,4 г пипенилбутоксида растворяется в ацетоне до общего объема 10 мл. Затем 0,5 мл раствора равномерно абсорбируется на субстрате для электрических комариных подстилок, имеющих
размер 2,5 см х 1,5 см х 0,3 см [приготовленных путем преобразования фибриллированной смеси хлопкового линтера (подпушка) и мезги или жома в форму листа], давая электрические комариные подстилки с
каждым из соединений.
Пример 11 препаративных форм: Окуривающие препаративные формы
Сначала в подходящем количестве ацетона растворялось 100 мг каждого из настоящих
соединений (1) - (330). Затем раствор абсорбировался на пористой керамической пластине размером 4,0 см х 4,0 см х 1,2 см, давая препаративную форму каждого соединения для окуривания.
Пример 12 препаративных форм: Ядовитые приманки
Прежде всего по 10 мг каждого из настоящих соединений (1) - (330) растворялось в 0,5 мл ацетона, и раствор однородно смешивался с 5 г порошка
твердой приманки для животных (Breeding Solid Feed Powder CE-2, торговая марка японской фирмы Clea Co. , Ltd.). Затем удаление ацетона с помощью воздушной сушки дает 05% ядовитую приманку с каждым из
соединений.
Следующие ниже примеры испытаний демонстрируют, что настоящие соединения полезны в качестве активных ингредиентов инсектицидно/акарицидных препаратов. В данных примерах испытаний настоящие соединения обозначены соответствующими номерами, как описано выше, а соединения, использованные для сравнения, обозначены соответствующими буквенными символами, как показано в таблице 18.
Пример 1 испытаний: Инсектицидное испытание против Spodoptera litura.
Разбавленный в 200 раз препарат, содержащий активный ингредиент в дозе 500 част. /млн. , который был приготовлен разбавлением водой эмульгируемого концентрата испытываемого соединения, полученного в соответствии с примером 1 препаративных форм, абсорбировался в объеме 2 мл на 13 г искусственного корма для Spodoptera litura, который приготавливался в полиэтиленовой чашке диаметром 11 см. Десять личинок четвертой стадии Spodoptera litura помещались свободно в чашку. Спустя 6 дней проверялось выживание личинок для определения смертности. Испытание проводилось с двукратным повторением.
В результате было обнаружено, что настоящие соединения (1)-(39), (41)-(49), (51)-(66), (68)-(72), (74)-(86), (88)-(101), (104)-(172), (174)-(189), (191), (193)-(200), (202)-(246), (248), (250)-(274), (276)-(279), (284)-(286) и (288)-(308), (320-(330) показывали смертность в 80% или более. В противоположность этому оба соединения (A) и (B), взятых для сравнения, показали смертность в 0%.
Пример 2 испытаний: Испытание против Tetranychus urticae Koch
Десять взрослых самок Tetranychus urticae Koch, помещенных на один лист, получали возможность паразитировать на горшочной фасоли в стадии первичного листа в течение 7 дней после посадки, и эти
горшочки помещались в термостатированное помещение при 25oC. Через 6 дней распылялся раствор химического соединения, содержащего активный ингредиент в дозе 500 част./млн., который
приготавливался разбавлением водой эмульгируемого концентрата испытываемого соединения, полученного согласно примеру 1 препаративных форм, в объеме 15 мл на каждый горшок, на поворачивающемся столе. В
то же самое время в почву вводилось 2 мл того же раствора. Спустя 8 дней оценивалась степень повреждения соответствующих растений, вызываемого Tetranychus urticae Koch. Эффект определялся в
соответствии со следующими критериями оценок:
-: Повреждение почти не наблюдается.
+: Повреждение слегка наблюдается.
++: Повреждение наблюдается в той же степени, что и на необработанном поле.
В результате было найдено, что настоящие соединения (7)-(8), (25)-(27), (42)-(43), (49), (63), (69)-(72), (76), (77), (102), (104), (119) и (252) были оценены показателем "-" или "+". В противоположность этому соединения (A) и (B), взятые для сравнения, получили оценку "++".
Пример 3 испытаний: Инсектицидное испытание
против Heliothis virescens
Разбавленный препарат, содержащий активный ингредиент в количестве 100 част. /млн. , который приготавливался путем разбавления водой эмульгируемого концентрата
испытываемого соединения, полученного в соответствии с примером 1 препаративных форм, вводился в объеме 0,2 мл в искусственный корм. Несколько личинок H.virescens второй стадии помещались в
пластиковый сосуд, и им давали корм. Спустя 6-7 дней определялась смертность.
В результате было найдено, что настоящие соединения (27), (34), (35), (42), (43), (54)-(57), (60), (64), (65), (68)-(70), (77)-(81), (84)-(86), (88)-(92), (98)-(101), (107), (108), (112), (114)-(116), (119), (122), (124), (125), (127)-(129), (139), (142), (146), (147), (164), (166), (185), (202), (203), (222), (224)-(226), (229), (233), (262), (263) и (272) дали смертность 80% или более. В противоположность этому соединения (A) и (B), взятые для сравнения, обнаружили смертность в 0%.
Пример испытаний 4: Инсектицидное испытание против Plutella Xylostella
Раствор химического соединения, содержащий активный ингредиент в количестве 50 част./млн., который приготавливался
разбавлением эмульгируемого концентрата испытываемого соединения, полученного согласно примеру 1 препаративных форм, водой, содержащей агент, способствующий распределению на поверхности RINOU (фирмы
Nihon Nouyaku K.K/), до такой степени, чтобы агент распределения был разбавлен в 1000 раз, распылялся в объеме 25 мл на каждый горшок с горшечной капустой в стадии пяти листьев. Обработанные растения
сушились на воздухе, и на них помещалось по 10 личинок третьей личиночной стадии Plutella xylostella. Спустя 4 дня определялась смертность.
В результате было найдено, что настоящие соединения (27), (63)-(65), (68), (70), (77), (81), (98), (100), (101), (106), (108), (111), (120), (130), (139)-(142), (145)-(147), (149)-(153), (157)-(159), (162), (164)-(166), (185), (188), (199), (202)-(204), (209), (212), (214), (216), (222)-(234) (236), (242), (246), (250), (251), (259), (260), (262), (263), (267), (272), (284), (292), (294)-(296), (299)-(302), (304), (306) и (308) вызывали смертность 80% или более. В сравнении с ними оба соединения и (A) и (B) вызывали смертность 0%.
Промышленная применимость.
Настоящие соединения обладают превосходной инсектицидно-акарицидной активностью, так что они являются активными в удовлетворительной степени для борьбы с вредными насекомыми, клещами и иксодовыми клещами.
Реферат
Дигалоидпропеновые соединения формулы I, где R1 - C1-10алкил, С1-5галоилалкил, С2-10алкенил, С2-6галоидалкенил, С2-7алкоксиалкил, С1-3алоксикарбонил-С1-7алкил, С2-7алкилтиоалкил, или остаток формулы Q1-10 (другие обозначения см. в п.1 ф-лы). Соединения формулы I обладают удовлетворительной инсектицидно-акарицидной активностью для борьбы с вредными насекомыми, клещами и иксодовыми клещами. 7 с. и 83 з.п. ф-лы, 18 табл.
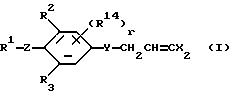
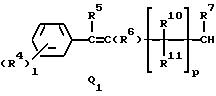

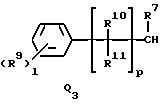

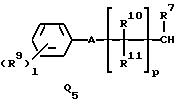

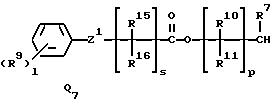
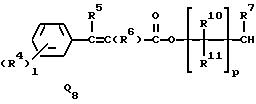

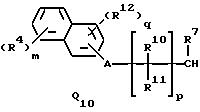
Формула
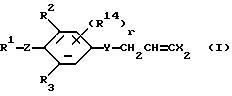
где R1 представляет (1-10)C-алкил, (1-5)C-галоидалкил, (2-10)C-алкенил, (2-6)C-галоидалкенил, (2-7)C-алкоксиалкил, (1-3)C-алкокси(1-7)C-карбонилалкил, (2-7)C-алкилтиоалкил; или Q1, Q2, Q3, Q4, Q5, Q6, Q7, Q8, Q9, Q10 общей формулы:
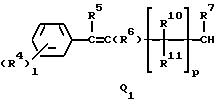
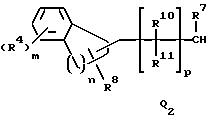

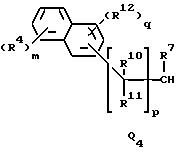

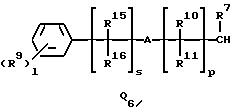
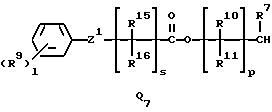
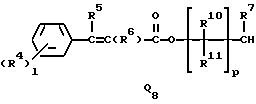

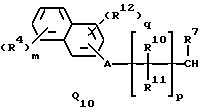
где R4 и R12 независимо представляют галоген, (1-4)C-алкил, (1-3)C-галоидалкил, (1-3)C-алкокси или (1-3)C-галоидалкокси;
R5 и R6 являются водородом;
R7 представляет водород или (1-3)C-алкил;
R8 представляет водород, галоген или метил;
R9 представляет галоген, циано, гидрокси, (1-8)C-алкил, (1-3)C-галоидалкил, (1-8)C-алкокси, (1-3)C-галоидалкокси, (1-3)C-алкилтио, (3-6)C-алкенилокси, (3-6)C-галоидалкенилокси, (1-3)C-гидроксиалкил, (2-5)C-алкоксикарбонил, фенил, который может быть замещен галогеном, (1-4)C-алкилом, (1-3)C-галоидалкилом, (1-3)C-алкокси, (1-3)C-галоидалкокси, фенокси, который может быть замещен галогеном, (1-4)C-алкилом, (1-3)C-галоидалкилом, (1-3)C-алкокси, (1-3)C-галоидалкокси, бензилокси, который может быть замещен галогеном, (1-4)C-алкилом, (1-3)C-галоидалкилом, или пиридилокси, который может быть замещен галогеном, (1-4)C-алкилом, (1-3)C-галоидалкилом, или когда 1 = 2-5, два смежных R9 взяты вместе, образуя триметилен, тетраметилен, метилендиокси;
R10, R11, R15 и R16 независимо представляют водород, (1-3)C-алкил;
A представляет кислород, S(O)t, NR13, C(=G1)G2 или G1C(=G2) где G1 и G2 оба являются кислородом, R13 представляет водород, ацетил или (1-3)C-алкил, и t = 0 - 2;
Z1 представляет кислород, серу или NR17, где R17 является водородом;
1 = 0 - 5;
m = 0 - 4;
n = 1 или 2;
p = 0 - 6;
q = 0 - 3;
s = 1 - 6;
R2, R3 и R14 представляют независимо галоген или (1-3)C-алкил;
r = 0 - 2;
X радикалы представляют независимо хлор или бром;
Y представляет кислород;
Z представляет кислород.

где R2 и R3 представляют независимо галоген, (1-3)C-алкил или (1-3)C-галоидалкил;
R7 представляет водород или (1-3)C-алкил;
R10 и R11 представляют независимо водород, (1-3)C-алкил;
X радикалы представляют независимо хлор или бром;
L1 представляет гидрокси, галоген, метансульфонилокси или п-толуолсульфонилокси;
e = 2 - 4.
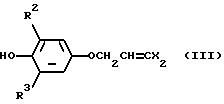
где R2 и R3 представляют независимо галоген, (1-3)C-алкил или (1-3)C-галоидалкил;
X представляют независимо хлор или бром.

где R21 и R22 представляют независимо галоген, (1-3)C-алкил;
R19 представляет галоген, (1-3)C-галоидалкокси или трифторметил;
u = 1 - 4;
1 = 0 - 5.
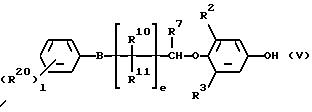
где R2 и R3 представляют независимо галоген, (1-3)C-алкил или (1-3)C-галоидалкил;
R7 представляет водород или (1-3)C-алкил;
R10 и R11 представляют независимо водород, (1-3)C-алкил;
R20 представляет галоген, (1-3)C-алкокси, трифторметил или (1-3)C-галоидалкокси;
1 = 0 - 5;
e = 1 - 4;
B представляет кислород, S(O)t или NR13, где R13 представляет водород, ацетил или (1-3)C-алкил, и t = 0 - 2.
04.08.94 по пп.40, 53 - 56, 60 - 61;
07.10.94. по пп.12, 41 - 46, 59, 62 - 63, 67, 71, 73 - 74, 76;
14.04.95. по пп.1 - 11, 13 - 18, 49 - 52, 57 - 58, 64 - 66, 68 - 70, 72, 75, 77 - 90;
20.07.95. по пп.28 - 39, 47 - 48.

Комментарии