Способы получения нового поколения безопасных с биологической точки зрения продуктов klh, применяемых для лечения рака, для разработки конъюгированных терапевтических вакцин и в качестве стимулирующих средств - RU2672105C2
Код документа: RU2672105C2
Описание
УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к обеспечению безопасной с биологической точки зрения сыворотки гемолимфы, предпочтительно, гемоцианина, более предпочтительно, KLH (keyhole limpet hemocyanin, гемоцианина фиссуреллы).
Гемоцианин представляет собой голубой медь-содержащий белок, который присутствует в крови многочисленных моллюсков и членистоногих в свободной растворенной форме и транспортирует кислород. Среди моллюсков гемоцианин содержат головоногие, хитоны, большинство брюхоногих и некоторые двустворчатые моллюски. Среди членистоногих гемоцианин характерен для паукообразных, мечехвостов, высших ракообразных и рода Scutigera. Множество видов насекомых содержат белки, происходящие из гемоцианина. Гемоцианины присутствуют во внеклеточной среде и плавают в гемолимфе.
В то время как максимальный диаметр гемоцианина членистоногих под электронным микроскопом составляет 25 нм, а молекулярная масса его субъединицы составляет 75000 Дальтон (Да), размер цианинов моллюсков является в значительной степени большим. Так, например, диаметр гемоцианина Megathura составляет 35 нм, и данный белок состоит из 2 субъединиц. Молекулярная масса каждой субъединицы составляет приблизительно 400000 Да. Каждая субъединица разделена на восемь кислород-связывающих доменов, молекулярная масса каждого из которых составляет приблизительно 50000. Домены различаются с иммунологической точки зрения.
Молекулярная масса гемоцианина брюхоногих, видимого под электронным микроскопом, составляет приблизительно 8 миллионов Да, и данный белок представляет собой дидекамер. Гемоцианин головоногих, напротив, организован в виде изолированного декамера, четвертичная структура которого также в значительной степени отличается от структуры гемоцианина брюхоногих.
Традиционно гемоцианин получали из гемолимфы Megathura crenulata. В последнее время рынок гемоцианинов брюхоногих расширился с включением гемоцианинов Haliotistuberculata и Concholepus concholepus. Также проводятся исследования гемолимфы других брюхоногих моллюсков для определения ее полезных свойств.
Гемоцианин калифорнийской фиссуреллы Megathura crenulata представляет особый интерес с точки зрения иммунологии. Вследствие этого гемоцианин также называют гемоцианином фиссуреллы (KLH). Гемоцианины представляют собой очень мощные антигены. Иммунизация позвоночного животного приводит к неспецифичной активации иммунной системы, причем на сегодняшний день данная активация не достаточно изучена. Затем посредством общей активации иммунной системы также возможно обеспечить иммунную реакцию на другие чужеродные структуры, реакция на которые ранее не возникала. KLH используют, главным образом, в качестве носителя для гаптена с целью таким образом обеспечить образование антител против гаптена.
Помимо Megathura crenulata морское ушко Haliotis tuberculata также принадлежит к группе Archaegastropoda, которая является относительно старой с точки зрения эволюции. Известно, что Haliotis также образуют гемоцианин.
Природный KLH обнаружен в гемолимфе (pH 6,0-8,0) в коллоидном растворе в виде дидекамера (молекулярная масса приблизительно 8 миллионов Да) и в виде мультидекамеров (молекулярная масса от 12 до приблизительно 32 миллионов Да). Количественное распределение данных агрегатов варьирует. Дидекамеры и мультидекамеры KLH состоят из 2 типов субъединиц со средней молекулярной массой приблизительно 400000 Да. Два различных типа субъединиц, а также два различных типа вариантов агрегации обусловлены тем, что природный KLH представлен двумя различными типами, KLH 1 и KLH 2.
KLH представляет собой смесь двух различных гемоцианинов, которые называют KLH1 и KLH2. Субъединица KLH1 представляет собой полипептид молекулярной массой 390 кДа, состоящий из восьми глобулярных доменов, которые называют 1а-1h в зависимости от последовательности доменов в субъединице. С другой стороны, молекулярная масса KLH2 составляет 360 кДа, и данная субъединица, согласно последним данным, также содержит 8 доменов, которые называют 2а-2h. Каждый тип субъединицы in vivo образует гомоолигомеры, в то время как образование гетероолигомеров обнаружено не было.
Гемоцианины можно получить в питомниках от подопытных животных. Описанные способы отбора гемолимфы включают введение иглы в мышцу ноги для проникновения в педальный кровеносный синус (Harris et al., "Keyhole Limpet Haemocyanin: Negative Staining in the Presence of Trehalose," Micron, 26 (1) : 25-33 (1995)). Были разработаны полуавтоматизированные системы, которые позволяют собирать большие количества гемолимфы без умерщвления животного. Технологический процесс позволяет проводить выделение коммерческих количеств гемоцианина из животных, выращиваемых в контролируемой внешней среде (публикации WO 02/085389, US 2002/192633).
Существует множество хорошо известных способов очистки гемоцианинов от неочищенной гемолимфы, которая является биологическим источником гемоцианинов. Данные способы включают дифференциальное центрифугирование, гель-проникающую хроматографию и ионообменную хроматографию (патент США №5,407,912). Очищенные гемоцианины являются коммерчески доступными во многих формах.
Включение гемоцианинов в состав перспективных новых терапевтических продуктов (см., например, публикации Jurincic-Winkler et al., "Antibody Response to Keyhole Limpet Hemocyanin (KLH) Treatment in Patients with Superficial Bladder Carcinoma," Anticancer Res., 16 (4A): 2105-10 (1996); и Biomira, Inc. Company Press Release, Biomira. com, 2001) вызвало потребность в постоянном снабжении коммерческими количествами гемоцианина, наработанного в условиях, соответствующих стандартам здравоохранения и безопасности, которые предъявляются Управлением по контролю над качеством пищевых продуктов и лекарственных средств США и другими регуляторными органами.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В связи с природным происхождением гемоцианины, такие как KLH, подвержены риску биологической контаминации патогенами, например, патогенными компонентами крови, такими как токсины, бактерии, включая образованные бактериями эндотоксины, а также вирусы.
Вследствие этого целью настоящего изобретения является обеспечение средств и способов для минимизации биологической нагрузки патогенов в природном гемоцианине. Данная задача включает в себя следующую цель - обеспечение процесса, посредством которого можно получить безопасный и в высшей степени очищенный гемоцианин.
Авторы настоящего изобретения обнаружили, что кровь и гемолимфа, полученные от моллюсков, незамедлительно собранных в море, могут являться контаминированными вирусами, бактериями, токсинами или эндотоксинами. Таким образом, существует потребность в уменьшении контаминации моллюсков и полученной из моллюсков крови или гемолимфы.
Обычно для удаления вирусов можно использовать различные процессы: инактивацию вирусов, например, обработку белка с применением способа на основе детергента/растворителя, ионизирующее излучение, термическую обработку (приблизительно 60°C) и инкубацию при значениях pH<3. Данные процессы нельзя использовать при обработке гемоцианинов, таких как KLH, поскольку такие подходы вызывают денатурацию белка. В связи с высокомолекулярной структурой KLH является чрезвычайно чувствительным к данным способам инактивации. Также нельзя использовать и другие подходы, например, нанофильтрацию вирусов, которая была разработана в течение последних нескольких лет. Данные фильтры не обеспечивают значительной степени удаления вирусов в связи с незначительным различием размеров вирусных контаминантов и целевого белка. Метод гель-фильтрации, принцип которого основан на разделении по молекулярной массе, также не приемлем для удаления вирусных контаминантов, поскольку размер вирусов существенно не отличается от размера гемоцианинов.
Таким образом, существует потребность в обеспечении новых способов для уменьшения вирусной нагрузки в гемоцианинах и для отделения вирусов от гемоцианинов.
Для решения вышеуказанных проблем в настоящем изобретении предложены способы и соединения, а также композиции, представленные ниже:
Согласно первому аспекту в настоящем изобретении предложен способ получения сыворотки гемолимфы из моллюсков, причем указанный способ включает этап пункции педального кровеносного синуса моллюска под холодовым наркозом.
Предпочтительно моллюск представляет собой Megathura crenulata. Другие моллюски представляют собой, например, Haliotis tuberculata (европейское морское ушко), Haliotis rubra (австралийское морское ушко).
Согласно предпочтительному варианту реализации настоящего изобретения в ходе пункции моллюска содержат в специальных условиях карантина, в которых моллюсков после получения из природных источников содержат в карантинной аквариумной системе в условиях отсутствия поступления какой-либо органической пищи, и/или воду в аквариумной системе очищают посредством удаления биологических контаминантов. Удаление биологических контаминантов может включать биологическую фильтрацию, отделение белка и т.д.
Затем кровь, полученную в результате пункции, можно стерилизовать, предпочтительно, с применением мембранного фильтра с размером пор 0,2 мкм.
Согласно второму аспекту в настоящем изобретении предложен способ выделения природного гемоцианина, причем указанный способ включает обеспечение сыворотки гемолимфы, такой как сыворотка гемолимфы, полученная в способе согласно первому аспекту, и выделение гемоцианина, такого как KLH, из сыворотки гемолимфы, предпочтительно, с применением прямой хроматографии.
Согласно предпочтительному варианту реализации настоящего изобретения прямая хроматография представляет собой ионообменную хроматографию.
Способ может также включать этап диссоциации гемоцианина на субъединицы олигомера гемоцианина. Также необязательно проводят этап очистки субъединиц гемоцианина. Необязательно проводят этап повторной ассоциации субъединиц в олигомерную форму гемоцианина.
Согласно предпочтительному варианту реализации настоящего изобретения проводят очистку субъединиц гемоцианина, включающую этап нанофильтрации для удаления потенциальной биологической контаминации.
Предпочтительно, проводят этап повторной ассоциации, который включает этап диафильтрации или этап диализа.
Можно провести итоговую очистку повторно ассоциированного гемоцианина методом гель-фильтрации.
Предпочтительно, гемоцианин смешивают со стабилизирующей буферной системой для долгосрочного хранения.
Согласно данному аспекту также предложен способ получения синтетического гемоцианина, такого как синтетический KLH, причем указанный способ включает этап диссоциации гемоцианина, например, природного KLH, для получения субъединиц, нанофильтрацию субъединиц, полученных таким образом, с применением фильтров, удаляющих вирусы, предпочтительно, нанофильтров с размером пор от 15 до 35 нм, более предпочтительно, от 20 до 25 нм, и повторную ассоциацию полученных субъединиц после нанофильтрации для получения синтетического гемоцианина, предпочтительно, синтетического KLH.
Согласно предпочтительному варианту реализации настоящего изобретения субъединицы представляют собой иммуноцианин. Более предпочтительно, молекулярная масса субъединиц составляет менее 800000, 500000, 400000, 350000 или 300000 Дальтон, соответственно. Наиболее предпочтительно, молекулярная масса субъединиц составляет от 300000 до 500000 Дальтон.
Согласно данному аспекту настоящего изобретения диссоциацию гемоцианина на субъединицы осуществляют посредством применения pH от 8 до 10, предпочтительно, от 9 до 10. Предпочтительно, диссоциация происходит при щелочном pH от 8 до 10, предпочтительно, от 9 до 10, при удалении двухвалентных катионов кальция (Ca++) и магния (Mg++). Удаление Ca++ и Mg++ можно осуществить посредством добавления средства, образующего хелат, например, EDTA. В данных условиях природный KLH диссоциирует на субъединицы. Было обнаружено, что диссоциация является обратимой, т.е. субъединицы могут повторно ассоциироваться в результате повторного установления нейтрального значения pH (от 6 до 9, предпочтительно, от 7 до 8) с образованием гетерогенной смеси дидекамеров и мультидекамеров, предпочтительно, при добавлении ионов Ca++ и Mg++. Наиболее предпочтительный вариант реализации для диссоциации гемоцианина, такого как природный KLH, является следующим: гемоцианин стабилизируют в стабилизирующем буфере при нейтральном pH, содержащем ионы Ca++ и Mg++, предпочтительно, в буфере, содержащем TRIS/HCL при pH от 7 до 8. В данном буфере гемоцианин все еще находится в нативной форме без денатурации. Добавляют щелочной буфер, pH которого находится в диапазоне от 8 до 10, предпочтительно, от 9 до 10. Наиболее предпочтительно, температура составляет ниже 10°C, наиболее предпочтительно, ниже 5°C, в особенности, от 2 до 8°C. Предпочтительные щелочные буферы включают глицин и NaOH. Другие предпочтительные буферы включают буфер TRIS/HCl, pH 8,9, буфер TRIS/HCl, pH 8,9 плюс EDTA, буфер на основе фосфата натрия, pH 8,0, буфер на основе карбоната аммония, pH 8,0, буфер на основе бикарбоната натрия, pH 10,1, буфер на основе бикарбоната натрия, pH 9,5, в буферы можно добавить NaCl и/или EDTA. Типичные концентрации буфера составляют 1-100 мМ, предпочтительно, 2-50 мМ, более предпочтительно, 10-20 мМ. При добавлении EDTA используют в концентрации от 1/10 до 1/2 от концентрации буфера. Для NaCl в случае его добавления предусмотрены те же концентрации, что и для EDTA. Буфер может содержать EDTA и/или NaCl.
Полученный таким образом раствор субъединиц (или раствор иммуноцианина) хранят при щелочном pH (от 8 до 10, предпочтительно, от 9 до 10) в течение более одного месяца, более двух месяцев, наиболее предпочтительно, более трех месяцев, при температуре ниже 10°C, более предпочтительно, от 2 до 8°C.
Субъединицы, например иммуноцианин, могут быть свободны от вирусной контаминации. Ранее было показано, что нанофильтрация эффективно удаляет различные вирусы из растворов белков. Однако авторы настоящего изобретения обнаружили, что в связи с огромным размером и склонностью к агрегации изомеров KLH в случае KLH в нативной форме нельзя применять нанофильтрацию. Однако сдвиг молекулярной массы природного KLH от более 8 миллионов Дальтон к молекулярной массе менее 500000 Дальтон, как правило, к однородной молекулярной массе приблизительно 400000 Дальтон, соответствующей субъединицам KLH (иммуноцианину), создал основу для удаления вирусов, которое осуществили авторы настоящего изобретения. Нанофильтрацию можно проводить с применением коммерчески доступных нанофильтров. Как правило, размер пор данных фильтров составляет 15-35 нм, более предпочтительно, от 20 до 25 нм. Такие фильтры являются коммерчески доступными в форме капсул для фильтрации, например, капсул для фильтрации Planova. Согласно одному варианту реализации настоящего изобретения такие нанофильтры представляют собой средства однократного использования. В нанофильтрах может применяться микропористая мембрана из пустотелого волокна с низким связыванием с белками, изготовленная из гидрофильной от природы медноаммиачной регенерированной целлюлозы с узким распределением пор. Можно применять широкий диапазон эффективных площадей поверхности: от 0,001 м2 до 4 м2, предпочтительно, от 0,01 м2 до 0,3 м2.
Авторы настоящего изобретения обнаружили, что применение нанофильтрации в отношении субъединиц гемоцианина (иммуноцианина) в стандартных условиях коммерческих нанофильтров являлось не очень эффективным. Как правило, белки подвергают нанофильтрации с использованием белковой суспензии раствора и нагнетания белковой суспензии раствора при постоянной скорости потока от 0,01 до 10 мл/минуту, более предпочтительно, от 0,1 до 1 мл/минуту, на фильтр так, чтобы поверхность нанофильтра являлась перпендикулярной направлению потока. Данный подход является эффективным для удаления вирусов. К сожалению, в связи с высокой молекулярной массой субъединиц KLH (иммуноцианина) вирусные фильтры удерживают не только вирус, но также большие количества белка. Классическая фильтрация вирусов потоком, перпендикулярным поверхности фильтра, также известна как «тупиковая фильтрация». Авторы настоящего изобретения обнаружили, что тупиковая фильтрация не является предпочтительной для удаления вирусов из иммуноцианина или субъединиц гемоцианина. Гемоцианин даже после диссоциации невозможно подвергнуть нанофильтрации без значительной потери белка. В примере 2 проводится сравнение «тупиковой фильтрации» с предпочтительным способом фильтрации согласно настоящему изобретению, который описан ниже. Тупиковая фильтрация приводит к потере более 40%, более 60% или даже более 80% белка.
Соответственно, существовала потребность в обеспечении улучшенного и модифицированного подхода вирусной фильтрации. Авторы настоящего изобретения обнаружили, что те же нанофильтры, описанные выше, необходимо использовать новым и измененным способом: суспензию или раствор белка необходимо нагнетать потоком, параллельным поверхности мембраны. Скорость потока может составлять от 0,01 до 100 мл/минуту, предпочтительно, от 0,1 до 100 мл/минуту, более предпочтительно, от 1 до 70 мл/минуту. Давление, применяемое к раствору или суспензии белка, составляет менее 0,1 мПа, предпочтительно, менее 10 кПа. Суспензию или раствор белка нагнетают или пропускают через поверхность мембраны, предпочтительно, несколько раз, более предпочтительно, при добавлении большего количества раствора или суспензии белка, содержащего субъединицы гемоцианина, так, чтобы образовался цикл, включающий поток неочищенного материала. Нанофильтрация происходит предпочтительно в щелочном буфере, наиболее предпочтительно, в щелочном буфере, который используют для диссоциации. Исходный материал протекает через фильтр предпочтительно в диапазоне концентрации от 0,1 до 10 мг/мл, более предпочтительно, от 0,1 до 1 мг/мл, наиболее предпочтительно, от 0,3 до 7 мг/мл. Выход белка после фильтрации составляет более 80%, более предпочтительно, более 90%, более предпочтительно, более 93%.
Авторы настоящего изобретения установили, что с применением данного подхода нанофильтрации, который назван в настоящей заявке фильтрацией «поперечного потока», при котором направление потока является параллельным поверхности мембраны нанофильтра, становится возможным проведение практически количественной очистки белка. Соответственно, данный способ фильтрации пригоден для получения субъединиц гемоцианина или иммуноцианина, соответствующих коммерческим требованиям.
Авторы настоящего изобретения также установили, что вирусную нагрузку можно значительно уменьшить. С применением способов согласно настоящему изобретению, предпочтительно, фильтрации поперечного потока, из белкового материала удаляют по меньшей мере 99,9% вирусов. Так называемый логарифмический фактор снижения является мерой удаления вирусов. Логарифмический фактор снижения (log reduction factor, LRF) представляет собой количество вируса, удаленное из исходного состава белкового раствора, т.е. белка или суспензии белка, выраженное по логарифмической шкале (шкале десятичных логарифмов). LRF 1 означает, что удалено 90% вирусов, 10% осталось. LRF 2 означает, что удалено 99% вирусов, 1% остался. LRF 3 означает, что удалено 99,9% вирусов, 0,01% остался. С применением фильтрации поперечного потока согласно настоящему изобретению достигают по меньшей мере LRF 2 или более, более предпочтительно, достигают LRF 3 или более. Более предпочтительно, достигают LRF 4 или более.
Экспериментальное подтверждение данной концепции представлено в примере 3 (оценка целесообразности фильтрации поперечного потока). В данном эксперименте использовали фильтр Planova с размером пор 20 нм и площадью поверхности фильтра 0,12 м2. Скорость потока составляла 50 мл/минуту. Добавляли суммарную вирусную нагрузку 10620 (0,5% от композиции белка). Вирус, который использовали для исследований, представлял собой ПВС (парвовирус свиней), один из самых маленьких вирусов (диаметр 20 нм). Выход белка составил более 97% (4662,4 г очищенного белка по сравнению с 4814,9 г предфильтрата). LRF составил 3,14 +/- 0,32.
Полученный фильтрат можно использовать для терапевтических целей (для препаратов иммуноцианина). Соответственно, в настоящем изобретении предложен способ получения иммуноцианина, причем указанный способ включает этапы диссоциации природного гемоцианина для получения субъединиц и нанофильтрацию субъединиц, полученных таким образом, через фильтр с размером пор от 15 до 35 нм. Предпочтительно, фильтрация представляет собой фильтрацию поперечного потока. Более предпочтительно, количество полученного белка составляет более 60%, более 70%, предпочтительно, более 80%, более предпочтительно, более 90%, наиболее предпочтительно, более 93% иммуноцианина или субъединиц гемоцианина.
Согласно другому варианту реализации настоящего изобретения иммуноцианин или субъединицы гемоцианина повторно ассоциируются после нанофильтрации с образованием «синтетического» гемоцианина, предпочтительно «синтетического» KLH. Повторную ассоциацию осуществляют посредством восстановления нейтрального значения pH. Суспензия белка или раствор белка повторно ассоциируется в гетерогенную смесь дидекамеров или мультидекамеров в результате сдвига pH в диапазон от 6 до 9, предпочтительно, от 7 до 8. Согласно более предпочтительному варианту реализации настоящего изобретения повторную ассоциацию осуществляют посредством добавления ионов Ca++ и Mg++. Более предпочтительно, количество каждого из ионов Ca++ и Mg++ составляет менее 0,5 М. Более предпочтительно, применяют буферы, такие как 0,05-0,1 М буфер TRIS/HCl, pH 7,4, необязательно вместе с от 0,05 М до 0,2 М MgCl2 и/или от 0,05 М до 0,2 М CaCl2, и/или от 0,15 М до 0,3 М NaCl. Другие буферы представляют собой глицин/NaOH, pH 7,4 или фосфат натрия, pH 7,4.
Соответственно, согласно одному варианту реализации настоящего изобретения предложен способ получения синтетического KLH или синтетического гемоцианина, причем указанный способ включает этапы диссоциации природного KLH с получением субъединиц, нанофильтрацию полученных таким образом субъединиц с применением фильтров с размером пор от 15 до 35 нм и повторную ассоциацию субъединиц, полученных после нанофильтрации, для получения синтетического гемоцианина или синтетического KLH. Предпочтительно фильтрация представляет собой фильтрацию поперечного потока, более предпочтительно, фильтрацию поперечного потока, описанную выше. Как правило, количество полученного белка составляет более 60% от количества природного KLH. Более предпочтительно, полученный продукт (синтетический KLH или синтетический гемоцианин) составляет более 70%, более предпочтительно, более 80%, наиболее предпочтительно, более 90% или 93% от количества природного KLH.
Согласно третьему аспекту в настоящем изобретении предложена гемолимфа, полученная посредством способа согласно первому и/или второму аспекту, гемоцианин или субъединицы гемоцианина, полученные посредством способов согласно второму аспекту настоящего изобретения. Данный аспект включает обеспечение иммуноцианина, который представляет собой смесь субъединиц гемоцианина в соотношении, существующем в природе.
Согласно четвертому аспекту предложены гемолимфа, гемоцианин или субъединицы гемоцианина согласно третьему аспекту для применения в качестве лекарственного препарата.
Данный аспект также включает фармацевтическую композицию, содержащую гемолимфу, гемоцианин или субъединицы гемоцианина согласно третьему аспекту настоящего изобретения.
Фармацевтические композиции или лекарственные препараты предназначены, например, для применения при лечении рака, предпочтительно, рака мочевого пузыря, или в качестве иммуностимулирующего средства или носителя.
Согласно пятому аспекту настоящего изобретения предложены субъединицы гемоцианина, которые являются результатом селективной диссоциации гемоцианина, полученного согласно второму аспекту.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно первому аспекту настоящего изобретения предложен способ получения сыворотки гемолимфы с низким содержанием эндотоксинов/низкой биологической нагрузкой из моллюсков, таких как Megathura crenulata, в коммерческих количествах.
Согласно одному варианту реализации настоящее изобретение направлено на способ получения исходного материала фармацевтической степени чистоты, полученного из моллюсков, предпочтительно, фиссурелл. Качество сыворотки гемолимфы, которое характеризуется низким содержанием эндотоксинов/низкой биологической нагрузкой, достигается посредством применения специальной процедуры карантина в отношении фиссурелл из природных источников или из аквакультуры. Карантинная аквариумная система (Quarantine Aquaria System) собственной разработки приводит к значительному снижению биологической контаминации, т.е. бактерий, эндотоксинов и вирусов.
Принципиальным пунктом данного первого аспекта настоящего изобретения является обработка моллюсков в карантинной аквариумной системе. Животных содержат в специальных температурных условиях, и/или карантинный аквариум содержит средства для удаления белка, такие как центрифужный отделитель белка и/или один или несколько биологических фильтров.
Предпочтительно, в аквариуме используют искусственную морскую воду и, более предпочтительно, для обработки моллюсков применяют быструю циркуляцию искусственной морской воды. Поток в аквариуме может имитировать прибойную зону моря. Биологические контаминанты можно удалить посредством экстенсивного вспенивания и/или биологической фильтрации карантинной воды.
Аквариумная система согласно первому аспекту приводит к уменьшению биологических контаминантов. Данная система позволяет эффективно удалять экскременты и, вследствие этого, обеспечивает удаление бактерий и бактериальных эндотоксинов. В ходе обработки в аквариуме животных предпочтительно не кормят, что также снижает содержание органических компонентов и приводит к уменьшению контаминации.
Проводимость, значение pH и окислительно-восстановительный потенциал морской воды предпочтительно контролируют и постоянно измеряют.
Температура воды в природной среде фиссурелл составляет от 10 до 20°C, предпочтительно, от 12 до 16°C; вследствие этого необходимо охлаждение воды в аквариуме. Для данной цели в резервуаре может быть расположено теплообменное устройство. Температуру воды контролируют с применением сенсоров температуры в бассейне, обеспечения заданной целевой температуры с помощью охлаждающих установок (14°C±2°C).
Вода в аквариуме предпочтительно представляет собой искусственную морскую воду, т.е. воду, в которой контролируют проводимость и pH и, предпочтительно, окислительно-восстановительный потенциал и, более предпочтительно, дополнительно контролируют содержание соли для соответствия содержанию соли в морской воде. Например, значение проводимости составляет от 46 до 52 мС/см, и pH составляет от 7,5 до 8,5. Согласно одному варианту реализации настоящего изобретения плотность может варьировать от 1,020 до 1,030. Предпочтительным является окислительно-восстановительный потенциал >100.
Перед отбором животных для пункции необходимо выдержать животных в аквариуме в течение одного, предпочтительно, двух, более предпочтительно, трех, более предпочтительно, четырех, более предпочтительно, пяти, более предпочтительно, шести, более предпочтительно, семи дней, более предпочтительно, 10 дней, наиболее предпочтительно, 13 дней.
Процедуры карантина животных собственной разработки согласно настоящему изобретению способствуют снижению биологической нагрузки. Например, содержание бактерий группы кишечной палочки у животных можно уменьшить в результате культивирования в карантинных условиях.
После карантина животным проводят пункцию педального кровеносного синуса под Холодовым наркозом.
Соответственно, вторым принципиальным пунктом первого аспекта настоящего изобретения является процедура пункции моллюсков. Перед пункцией («экстракцией гемолимфы») моллюсков вынимают из аквариума, необязательно проводят визуальный осмотр, предпочтительно, обмывают и переносят в чистое помещение.
Животных предпочтительно переносят в чистое помещение и промывают изотоническим раствором гемолимфы (hemolymph isotonic solution, HIS) - раствором хлорида натрия собственной разработки, концентрация соли в котором изотонична сыворотке животных.
Животных взвешивают и помещают на предварительно подготовленные стеллажи для пункции.
В ходе данной операции предпочтительно стараются не повредить внутренние органы, в особенности, пищеварительную систему, по двум причинам: во-первых, чтобы предотвратить контаминацию продукта фекальными массами, а во-вторых, чтобы избежать гибели животного. Если происходит случайное повреждение пищеварительной системы, о чем свидетельствует фекальная контаминация сыворотки гемолимфы, материал отбрасывают.
После дезинфекции можно провести пункцию в задней трети основания ноги при помощи иголки, которая содержит люмбальную канюлю. Входное отверстие канюли можно воткнуть в мышцу ноги, после чего канюлю продвигают дальше до тех пор, пока не будет достигнут педальный синус. Пункцию буккального синуса или кардиального синуса предпочтительно не проводят.
Согласно одному варианту реализации настоящего изобретения после завершения экстракции крови, предпочтительно, через канюлю инъецируют стерильный изотоничный раствор и исследуют вытекающую жидкость для определения того, был ли достигнут кровеносный синус, о чем свидетельствует появление жидкости голубого цвета.
Согласно предпочтительному варианту реализации настоящего изобретения в стерильную центрифужную пробирку собирают от 10 до 60 мл, более предпочтительно, 30-50 мл или 10-20 %, предпочтительно, 12-15% гемолимфы относительно массы тела животного.
Согласно одному варианту реализации настоящего изобретения гемолимфу, которую отобрали, заменяют раствором HIS.
Гемолимфу предпочтительно хранят в холодильнике при температуре от 2 до 8°C; гемолимфу можно объединять.
Животных предпочтительно возвращают назад, промывают и переносят в аквариумные резервуары для восстановления собственной разработки. Животных можно контролировать в течение от 1 до 4 дней и возвратить в природную среду. Данный способ позволяет возвращать живых моллюсков в океан.
Согласно третьему принципиальному пункту первого аспекта настоящего изобретения полученную кровь можно очистить и стерилизовать с применением мембранного фильтра с размером пор 0,2 мкм.
Перед объединением необходимо продемонстрировать соответствие фракций гемолимфы спецификации внутрипроизводственного контроля, который проводят на отдельных образцах. Охлажденные фракции гемолимфы объединяют в стерильной одноразовой бутылке и тщательно перемешивают, избегая пенообразования.
Согласно второму аспекту настоящего изобретения предложен способ получения гемоцианина или субъединиц гемоцианина с низким содержанием эндотоксинов/низкой биологической нагрузкой из моллюсков, таких как Megathura crenulata, в коммерческих количествах.
Предпочтительно, способ обеспечивает получение безопасного с биологической точки зрения безвирусного стандартизованного молекулярным способом гемоцианина, например, KLH, или субъединиц гемоцианина, например, субъединиц KLH, в коммерческих количествах.
Способ включает выделение гемоцианина из сыворотки гемолимфы, предпочтительно, посредством прямой хроматографии, более предпочтительно, посредством ионообменной хроматографии.
Способ предпочтительно включает этап диссоциации гемоцианина на субъединицы гемоцианина.
Способ может также включать этап очистки субъединиц гемоцианина.
Способ предпочтительно также включает этап нанофильтрации. На данном этапе вирусы могут быть отделены от субъединиц гемоцианина, т.е. данный этап осуществляют с целью удаления потенциальной вирусологической контаминации.
Способ предпочтительно также включает этап повторной ассоциации гемоцианина из субъединиц.
Сыворотка гемолимфы в связи с происхождением из морских моллюсков помимо гемоцианина и других компонентов сыворотки содержит высокие уровни хлорида натрия и других минералов. Проводимость сыворотки гемолимфы за счет высокого содержания соли составляет в среднем приблизительно 50 мС/см. Для достижения количественного связывания гемоцианина, например, KLH, проводимость необходимо снизить до <20 мС/см.
Для снижения проводимости, как описано выше, сыворотку гемолимфы можно частично обессолить подходящими способами, такими как гель-фильтрация, электродиализ, диафильтрация или разведение. Удаление солей приводит к преципитации других компонентов сыворотки, т.е. белка и углеводов. Преципитат можно удалить посредством низкоскоростного центрифугирования, глубинной фильтрации или мембранной фильтрации (0,8 и 0,45 мкм).
Затем коллоидный растворенный высокомолекулярный KLH можно выделить с применением процедур хроматографии, т.е. ионообменной хроматографии, после чего может следовать диссоциация и очистка субъединиц.
Возможны два предпочтительных способа диссоциации природного гемоцианина, такого как KLH: диссоциация in situ на ионообменной захватывающей колонке или диссоциация посредством диафильтрации.
Полученные субъединицы гемоцианина можно очистить посредством дополнительного этапа ионообменной хроматографии и, наконец, очистить методом гель-фильтрации.
Природный кислород-связывающий белок гемоцианин согласно одному варианту реализации настоящего изобретения очищают из гемолимфы методом ионообменной хроматографии. Гемоцианин будет связываться с анионообменником, а затем диссоциировать на колонке на субъединицы KLH (иммуноцианин) в щелочном буфере (pH от 7 до 10, предпочтительно, от 8,6 до 9,6). Иммуноцианин снимают с колонки с применением градиентного элюирования в соли. Полученный в результате раствор иммуноцианина можно обессолить и сконцентрировать методом диафильтрации/ультрафильтрации. Затем концентрированный раствор иммуноцианина можно очистить с применением следующего этапа ионообменной хроматографии.
Согласно другому варианту реализации настоящего изобретения природный кислород-связывающий белок гемоцианин очищают из гемолимфы методом ионообменной хроматографии. Гемоцианин связывается с анионообменником, а затем гемоцианин снимают с колонки с применением градиентного элюирования в соли. Полученный в результате раствор гемоцианина обессоливают, концентрируют и вызывают диссоциацию на субъединицы KLH (иммуноцианин) посредством диафильтрации, диализа или ультрафильтрации в щелочном буфере (pH от 7 до 10, предпочтительно, от 8,6 до 9,6). Наконец, раствор иммуноцианина можно концентрировать с последующим дополнительным этапом ионообменной хроматографии.
Согласно другому варианту реализации настоящего изобретения природный кислород-связывающий белок гемоцианин очищают из гемолимфы методом ионообменной хроматографии. Гемоцианин связывается с анионообменником, а затем гемоцианин снимают с колонки с применением градиентного элюирования в соли. Гемоцианин из полученного в результате раствора гемоцианина выделяют посредством ультрацентрифугирования. Затем полученный в результате осадок гемоцианина растворяют и вызывают диссоциацию на субъединицы KLH (иммуноцианин) в щелочном буфере (pH от 7 до 10, предпочтительно, от 8,6 до 9,6). Наконец, раствор иммуноцианина можно концентрировать с последующим дополнительным этапом ионообменной хроматографии.
Для достижения диссоциации гемоцианин, как правило, можно растворить в буфере для диссоциации (pH от 8 до 10, предпочтительно, от 8,6 до 9,6, предпочтительно, не содержащем Ca++ и Mg++). Данный буфер создает щелочные условия, приводящие к диссоциации молекулы природного гемоцианина на субъединицы.
Раствор иммуноцианина можно концентрировать. Перед итоговой очисткой («полировкой»), например, методом гель-фильтрации, раствор иммуноцианина можно концентрировать до содержания белка 20 мг/мл (±2,5 мг/мл), например, методом ультрафильтрации. С данной целью предпочтительно используют полисульфоновые или полиэфирсульфоновые мембраны с низким связыванием с белками (предел отсечения 30000 Дальтон; площадь фильтра ≥700 см2), встроенные в установку для ультрафильтрации из нержавеющей стали. После ультрафильтрации концентрированный раствор иммуноцианина фильтруют, например, через мембранный фильтр с размером пор 0,22 мкм.
Затем концентрированный раствор иммуноцианина можно очистить, например, посредством жидкостной хроматографии среднего давления на колонке для гель-фильтрации.
Предпочтительная колонка представляет собой Superose® 6 (препаративной степени чистоты; состоит из в высокой степени перекрестно-сшитых пористых агарозных бусин); размер бусин составляет 20-40 мкм, диапазон фракционирования - 5000-5000000 Да. В качестве элюента можно использовать элюирующий буфер (pH 8-10, не содержит Ca++ и Mg++). Концентрированный раствор иммуноцианина можно нанести на колонку в асептических условиях. Собирают основной пик иммуноцианина молекулярной массой 400000. Фракцию иммуноцианина предпочтительно немедленно охлаждают до температуры +2-8°C и фильтруют, например, через мембранный фильтр с размером пор 0,22 мкм.
В связи с происхождением природных гемоцианинов, таких как KLH, существует вирологический риск, вызванный патогенами человека. Чтобы гарантировать биологическую безопасность нижестоящий процесс получения биологических препаратов предпочтительно включает этапы инактивации или удаления потенциальной вирусной контаминации. Исследовали доступные способы инактивации KLH, и было установлено, что в случае гемоцианинов данные способы не являются подходящими в связи с разрушающим действием на препараты KLH.
Согласно настоящему изобретению нанофильтрацию предпочтительно используют для получения очищенных субъединиц гемоцианина, например, субъединиц KLH, т.е. для удаления потенциальной вирусной контаминации.
На данном этапе можно выбрать подходящие вирусные фильтрующие мембраны, которые не оказывают влияния на содержание и биохимические, химические и физические характеристики субъединиц гемоцианина, например, субъединиц KLH. Нефильтрованные и фильтрованные субъединицы гемоцианина сравнивают в исследовании сопоставимости с целью показать, что субъединицы не повреждены с функциональной точки зрения. Можно провести исследование вирусной валидации (Virus Validation Study), чтобы продемонстрировать влияние вирусной фильтрации субъединиц гемоцианина на удаление модельных вирусов различных размеров.
С целью подтверждения безопасности фармацевтических белков, полученных из биологических источников, производитель таких продуктов обязан продемонстрировать эффективную инактивацию и/или удаление патогенных вирусов в ходе процесса производства. Обычно такую демонстрацию проводят посредством преднамеренного добавления в вариант процесса производства меньшего масштаба соответствующих вирусов и/или модельных вирусов.
Согласно настоящему изобретению методом нанофильтрации осуществляют удаление по меньшей мере вируса лейкемии мышей, вируса псевдобешенства, реовируса типа 3 и парвовируса свиней. Для изучения удаления в исследуемый образец добавляют вирусы в определенных титрах, а затем проводят нанофильтрацию образцов. Образцы можно отбирать из предварительно отфильтрованного исследуемого образца с добавкой, а также из нанофильтрата и контролировать для определения вируса посредством титрования до конечной точки и посредством валового анализа, соответственно.
Удаление вирусов предпочтительно осуществляют с целью уменьшить титр вируса на 50%, предпочтительно, на 60%, более предпочтительно, на 70%, более предпочтительно, на 80, более предпочтительно, 90, более предпочтительно, 99%, наиболее предпочтительно, на 99,9%.
Соответствующие вирусы, которые представляют собой потенциальные контаминанты продуктов гемоцианина, являются следующими:
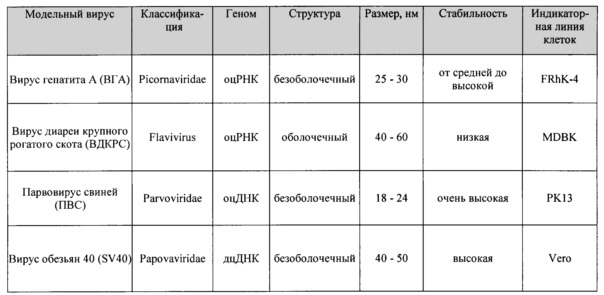
Вирус гепатита А (ВГА) - безоболочечный небольшой (25 - 30 нм) одноцепочечный РНК-вирус (АТСС VR-1402) с от средней до высокой устойчивостью к физико-химической инактивации. Гепатит А относится к семейству Picornaviridae, которое также включает ВЭМК (вирус энцефаломиокардита) и Poliovirus. Данный вирус является потенциальным контаминантом крови и плазмы человека, и вследствие этого ВГА по возможности следует использовать в исследованиях. Однако присутствие нейтрализующих антител против данного вируса в продуктах крови и плазмы означает, что применение ВГА ограничено ситуациями, в которых данная проблема не возникает.
Парвовирус свиней (ПВС) - безоболочечный небольшой (~18-25 нм) одноцепочечный ДНК-вирус (предоставлен Octapharma AG, Франкфурт, Германия) с высокой устойчивостью к физико-химической инактивации. Вследствие этого данный вирус обеспечивает строгий тест для определения очистки и способности системы нижестоящего процесса уменьшать вирусную нагрузку. Парвовирус человека В19 может в высоких титрах присутствовать в плазме человека, и вследствие этого ПВС можно использовать в качестве модели для В19 при валидации продуктов, полученных из плазмы человека. Также сообщалось о случаях контаминации рекомбинантных продуктов парвовирусами, такими как мелкий вирус мышей; ПВС можно использовать в качестве модели для данного класса вирусов.
Вирус диареи крупного рогатого скота (ВДКРС) - оболочечный одноцепочечный РНК-вирус (АТСС VR-534) среднего размера (~40-60 нм) со средней устойчивостью к физико-химической инактивации. ВДКРС принадлежит к семейству Flaviviridae, к которому также относятся вирусы гепатита С и гепатита G. Вследствие этого ВДКРС представляет собой подходящий модельный вирус в тех случаях, когда гепатит С или G вызывает беспокойство, в частности, в продуктах, полученных из крови человека, а также модельный вирус для других контаминантов Flavivirus и Togavirus, например, при использовании материалов, полученных от крупного рогатого скота.
Вирус обезьян 40 (SV40) - безоболочечный небольшой (~40 нм) двухцепочечный ДНК-вирус (АТСС VR-305) с высокой устойчивостью к физико-химической инактивации. SV40 обеспечивает строгий тест нижестоящего процесса и его способности удалять/инактивировать вирусы. Данный вирус выступает в качестве модели других резистентных безоболочечных вирусов, которые могут присутствовать в качестве контаминантов в исходном материале, и представляет собой модель контаминантов, относящихся к вирусам папилломы и полиомы.
Согласно настоящему изобретению удаляют по меньшей мере ВГА, ВДКРС и SV40, предпочтительно, с LRF, составляющим для каждого вируса более 2, 3, 4, 5 или 6. ПВС можно удалить с LRF, составляющим более 2, 3 или 4. В качестве альтернативы или дополнительно, из гемоцианина или иммуноцианина согласно настоящему изобретению также удалены вирусы, указанные ниже: вирус лейкоза мышей (ВЛМ), вирус псевдобешенства (ВПБ) и реовирус типа III (Reo III). Данные вирусы также удалены с LRF, составляющим для каждого вируса по меньшей мере 2 или 3.
Стабилизацию субъединиц гемоцианина после вирусной фильтрации можно осуществить посредством лиофилизации. Растворы белка (в особенности высокомолекулярных белков), как правило, являются нестабильными в течение длительного времени. В ходе хранения наблюдается преципитация белка и утрата активности. Хранение в стабилизирующих буферных системах или в подходящих растворах для фармацевтического применения в условиях охлаждения не приводит к получению препаратов KLH, удовлетворяющих требованиям к стабильности, которые предъявляются к фармацевтическим препаратам (2-3 года). Лиофилизация высокомолекулярных белков с сохранением полной биологической активности возможна исключительно в подходящей смеси вспомогательных веществ. Согласно настоящему изобретению можно использовать стабилизаторы белков, например, лактозу, маннитол, сахарозу и т.д. Данные стабилизаторы можно добавлять к очищенному раствору иммуноцианина в виде растворов с концентрациями 100-700 мг/мл и объемом от 0,1 мл до 1,0 мл на 1 мг белка каждый.
Лиофилизация субъединиц KLH сохраняет полную биологическую активность и молекулярную интактность указанных субъединиц.
Стабилизацию субъединиц гемоцианина после вирусной фильтрации можно также осуществить посредством обессоливания. Обессоливание посредством диафильтрации с водой для инъекций приводит к получению высококонцентрированного раствора (20 мг/мл) субъединиц гемоцианина, не содержащего соли, в воде, который характеризуется неожиданной стабильностью при длительном хранении в условиях охлаждения (1-2 года). Раствор субъединиц гемоцианина, не содержащий соли, является идеальным носителем для получения конъюгированных вакцин.
Средства и способы обессоливания известны специалистам в данной области техники. Как правило, обессоливание осуществляют, пока проводимость фильтрата в повторяющемся процессе фильтрации не составит ≥10 мкС/см или пока проводимость ретентата не составит ≥150 мкС/см.
В субъединицах гемоцианина, не содержащих соли, сохраняется полная биологическая активность и молекулярная интактность указанных субъединиц.
Субъединицы гемоцианина можно использовать в качестве смеси в соотношении, которое наблюдается у природного гемоцианина («иммуноцианин»), или отдельные субъединицы можно отделять и использовать после выделения.
С целью получить «синтетический» гемоцианин следует осуществить повторную ассоциацию субъединиц, т.е. рефолдинг субъединиц KLH после вирусной фильтрации.
Размер олигомеров гемоцианина, например, дидекамеров KLH (приблизительно 35 нм) соответствует размеру крупных вирусов. Описанные способы выделения и очистки (ионообменная хроматография и гель-фильтрация) в случае природного KLH не приводят к требуемым коэффициентам снижения потенциальной вирологической контаминации согласно утвержденным руководствам по вирологической безопасности биологических продуктов, полученных из животных источников. Диссоциация на субъединицы гемоцианина уменьшает размер, в случае KLH - до приблизительно 400000 Дальтон, и делает возможной нанофильтрацию белка. Рефолдинг проводят с заменой буфера, например, посредством диафильтрации или диализа в условиях повторной ассоциации (pH 7-8, Ca++, Mg++). Затем повторно ассоциированный гемоцианин можно очистить методом гель-фильтрации.
Для достижения повторной ассоциации к смеси субъединиц гемоцианина добавляют буфер для повторной ассоциации.
Высокомолекулярный KLH производят из концентрированного раствора иммуноцианина посредством смены буфера с получением условий для повторной ассоциации, pH 7-8, Ca++, Mg++ и, предпочтительно, посредством этапа концентрирования. Обе данные процедуры можно провести посредством одного или нескольких, вплоть до серий, этапов ультрафильтрации с применением полисульфоновой мембраны с номинальным пределом отсечения 50000 Да.
Дополнительные варианты реализации настоящего изобретения являются следующими:
1. Способ получения сыворотки гемолимфы из моллюсков,
включающий:
а) пункцию педального кровеносного синуса моллюска под Холодовым наркозом.
2. Способ согласно варианту реализации 1, отличающийся тем, что указанный моллюск представляет собой Megathura crenulata.
3. Способ согласно любому варианту реализации 1 или 2, отличающийся тем, что перед проведением пункции указанного моллюска содержат в специальных условиях карантина при отсутствии поступления какой-либо органической пищи, и/или воду в аквариумной системе очищают посредством удаления биологических контаминантов.
4. Способ согласно любому из вариантов реализации 1-3, отличающийся тем, что кровь, полученную в результате указанной пункции, стерилизуют с применением мембранного фильтра с размером пор 0,2 мкм.
5. Способ выделения природного гемоцианина или смеси его субъединиц, включающий:
a) обеспечение сыворотки гемолимфы, полученной после осуществления любого из вариантов реализации 1-4,
b) выделение гемоцианина из указанной сыворотки гемолимфы с применением прямой хроматографии,
6. Способ согласно варианту реализации 5, отличающийся тем, что указанная прямая хроматография представляет собой ионообменную хроматографию.
7. Способ согласно любому из вариантов реализации 5 или 6, дополнительно включающий этап диссоциации гемоцианина на субъединицы олигомера гемоцианина, очистки субъединиц KLH и необязательно повторной ассоциации субъединиц в олигомерную форму гемоцианина.
8. Способ согласно варианту реализации 7, отличающийся тем, что указанную очистку проводят с применением нанофильтрации с целью устранить потенциальную биологическую контаминацию.
9. Способ согласно любому из вариантов реализации 7 или 8, отличающийся тем, что указанную повторную ассоциацию проводят на этапе диафильтрации или на этапе гель-фильтрации.
10. Способ согласно любому из вариантов реализации 5-9, отличающийся тем, что гемоцианин смешивают со стабилизирующей буферной системой для долгосрочного хранения.
11. Гемолимфа, полученная посредством любого из вариантов реализации 1-4, гемоцианин или смесь субъединиц гемоцианина, полученных посредством любого из вариантов реализации 5-10.
12. Гемолимфа, полученная посредством любого из вариантов реализации 1-4, гемоцианин или смесь субъединиц гемоцианина, полученных посредством любого из вариантов реализации 5-10, в качестве лекарственного средства.
14. Фармацевтическая композиция, содержащая гемолимфу, полученную посредством любого из вариантов реализации 1-4, гемоцианин или смесь субъединиц гемоцианина, полученных посредством любого из вариантов реализации 5-10.
15. Гемолимфа согласно варианту реализации 11 или гемоцианин согласно варианту реализации 12 для применения при лечении рака, предпочтительно, рака мочевого пузыря, либо в качестве иммуностимулирующего средства или носителя.
16. Способ обеспечения одной или нескольких субъединиц гемоцианина, включающий осуществление способа согласно любому из вариантов реализации 1-4 и способа согласно любому из вариантов реализации 5-10, а также этапа селективной диссоциации полученного таким способом повторно ассоциированного гемоцианина.
17. Одна или несколько субъединиц гемоцианина, полученных посредством способа согласно варианту реализации 16.
18. Фармацевтический препарат, содержащий одну или несколько субъединиц гемоцианина согласно варианту реализации 17. Одна или несколько субъединиц гемоцианина согласно варианту реализации 17 могут предназначаться для применения при лечении рака или в качестве иммуностимулирующего средства.
19. Применение фильтрации поперечного потока для удаления вирусов из составов белка.
20. Применение согласно варианту реализации 19, отличающееся тем, что указанный состав белка содержит белок от 100000 до 1000000 Дальтон.
21. Применение согласно вариантам реализации 19 и 20, отличающееся тем, что для указанной фильтрации поперечного потока применяют фильтры с размером пор от 15 до 35 нм.
ПРИМЕРЫ
Пример 1: Карантин Megathura crenulata
С момента начала производственной деятельности на площадке в Карлсбаде, Калифорния в феврале 2002 года авторы настоящего изобретения в различные периоды времени отобрали 13 партий животных. Идентификационный код участка отбора представляет собой номер зоны, который определен графиком рыболовства Южной Калифорнии (Southern California Fisheries Chart, SCFC).
Природные условия в Калифорнии в процессе отбора животных для партий МС-001 -МС-013 являлись обычными. Однако в процессе отбора более поздней партии животных, МС-014, перед отбором животных в Калифорнии наблюдались необычно дождливые условия, при этом в день отбора животных дождей не было.
Следует отметить, что включение методов исследования развивалось с тех пор, как авторы настоящего изобретения начали деятельность на производственной площадке. Исследование фекальных колиформных бактерий у животных, токсичных веществ, анализ ДДТ (дихлордифенилтрихлорэтана) и ПХД (полихлорированного дифенила) были начаты на партии № МС-002. Исследование pH и проводимости проводили для всех данных партий, исследование нитрата, нитрита и аммиака было начато на образце морской воды с партией № МС-006.
pH и проводимость морской воды находились в диапазоне от 8,0 до 8,3 и от 45,0 до 52,4, соответственно. Содержание нитрата, нитрита и аммиака варьировало от 0 до 80 ч./млн, от 0 до 0,25 ч./млн и от 0,25 до 1,0 ч./млн, соответственно, верхняя граница диапазона соответствует значениям для партии МС-014, которую, как отмечалось, отбирали после обильных дождей. Содержание фекальных колиформных бактерий в образцах морской воды составляло <2 НВЧ (наиболее вероятное число)/100 мл для образцов, отобранных из МС-002 - МС-013, и составляло 29, 11 и 49 НВЧ для наиболее поздней партии МС-014, соответствующей трем образцам воды «0», «50» и «100», соответственно.
Результаты тестов ДДТ и ПХД свидетельствуют, что содержание данных веществ составляет менее предела обнаружения соответствующих анализов. Представляется, что присутствие ДДТ и ПХД не является проблемой на участках отбора 718 и 719, в которых отбирали животных.
Данные о фекальных колиформных бактериях у животных свидетельствуют, что содержание фекальных колиформных бактерий составляло, как правило, <18 и максимум 20 НВЧ/100 грамм для партий № МС-002 - МС-013, однако для МС-014 данные значения являлись очень высокими, 3500 НВЧ/100 грамм. Полученные результаты в совокупности с данными о содержании фекальных колиформных бактерий в окружающей морской воде свидетельствуют, что данные животные имеют тенденцию концентрировать фекальные колиформные бактерии.
После получения лабораторных результатов анализа фекальных колиформных бактерий у животных авторы настоящего изобретения решили отправить на исследование образцы животных из карантинных резервуаров; 19 января 2005 года 3 животных были отобраны из Резервуара Q1 и 3 - из Резервуара Q2. Животные поступили в резервуары 6 января 2005 года и, следовательно, перед проведением исследования находились в резервуарной воде в течение 13 дней. Авторы настоящего изобретения инициировали данное исследование для определения того, будут ли карантинные процедуры, которые авторы настоящего изобретения включили в график производства, оказывать эффект на снижение содержания фекальных колиформных бактерий у животных. Копия отчета об анализе включена в данный отчет в качестве приложения. Полученные результаты свидетельствуют, что содержание фекальных колиформных бактерий у животных составляло <18 НВЧ/100 грамм. Полученные результаты являются весьма обнадеживающими и свидетельствуют, что проводимые процедуры эффективно снижают содержание колиформных бактерий у животных в случае присутствия указанных бактерий, как в данной партии МС-014.
Анализ данных относительно животных и морской воды свидетельствует, что:
pH и проводимость морской воды обеспечивают информацию об условиях природной морской воды и будут полезными для сравнения с искусственной морской водой, приготовленной согласно собственной разработке. На сегодняшний день в разработанной авторами настоящего изобретения спецификации для искусственной морской воды указаны нормы pH от 7,5 до 8,5 и проводимости - от 46 до 52 мС/см. Данная спецификация, как представляется, точно соответствует диапазонам для природной морской воды.
Токсикологический скрининг морской воды из участков отбора был начат по совету доктора Роберта Муни (Robert Mooney, Merkel & Associates), который выступал в качестве внешнего ветеринарного инспектора для первых трех полученных партий животных, а именно МС-001 - МС-004. Результаты, полученные на сегодняшний день, свидетельствуют, что ДДТ и ПХД не составляют проблему для областей, в которых отбирают и выпускают фиссурелл.
Процедуры карантина собственной разработки для животных, как представляется, способствуют снижению содержания колиформных бактерий у животных и представляют собой весьма полезную процедуру. На сегодняшний день требуется, чтобы животные, отобранные для производства, находились на карантине в течение минимум семи дней; данные относительно фекальных колиформных бактерий животных для МС-014 были получены на животных через 13 дней содержания животных в резервуарах собственной разработки. Возможно, необходимо инициировать проведение более систематического исследования длительности карантина и снижения содержания фекальных колиформных бактерий, а также определения того, является ли принятое на сегодняшний день требование семи дней достаточным. Такие исследования будут инициированы после отбора животных из воды с высоким содержанием колиформных бактерий, как в случае МС-014.
Пример 2: Прямое хроматографическое выделение природного гемоцианина из сыворотки гемолимфы
Сыворотка гемолимфы в связи с происхождением из морских моллюсков помимо гемоцианина и других компонентов сыворотки содержит высокие уровни хлорида натрия и других минералов. Проводимость в среднем составляет приблизительно 50 мС/см. В данных условиях KLH не может связываться с ионообменными смолами. Для достижения количественного связывания KLH проводимость необходимо снизить до < 20 мС/см.
Для снижения проводимости, как описано выше, сыворотку гемолимфы частично обессоливали подходящими способами, такими как гель-фильтрация, электродиализ, диафильтрация или разведение. Удаление солей приводит к преципитации других компонентов сыворотки, т.е. белка и углеводов. Преципитат удаляли посредством низкоскоростного центрифугирования, глубинной фильтрации или мембранной фильтрации (0,8 и 0,45 мкм).
Затем коллоидный растворенный высокомолекулярный KLH выделяли с применением процедур хроматографии, т.е. ионообменной хроматографии, после чего следовали диссоциация и очистка субъединиц.
Диссоциация гемоцианина
Способ 1:
Природный кислород-связывающий белок гемоцианин очищали из гемолимфы методом ионообменной хроматографии. Гемоцианин связывался с анионообменником, а затем диссоциировал на колонке на субъединицы KLH (иммуноцианин) в щелочном буфере (pH 9,6). Иммуноцианин снимали с колонки посредством градиентного элюирования в соли. Полученный в результате раствор иммуноцианина обессоливали и концентрировали посредством диафильтрации/ультрафильтрации. Затем концентрированный раствор иммуноцианина можно очистить посредством следующего этапа ИО (ионообменной) хроматографии.
Способ 2:
Природный кислород-связывающий белок гемоцианин очищали из гемолимфы методом ионообменной хроматографии. Гемоцианин связывался с анионообменником, а затем гемоцианин снимали с колонки посредством градиентного элюирования в соли. Полученный в результате раствор гемоцианина обессоливали, концентрировали и вызывали диссоциацию на субъединицы KLH (иммуноцианин) посредством диафильтрации, диализа или ультрафильтрации в щелочном буфере (pH 9,6). Наконец, раствор иммуноцианина концентрировали с последующей очисткой посредством следующего этапа ИО хроматографии.
Гемоцианин, полученный согласно Способу 1/Способу 2, растворяли в буфере для диссоциации (pH 9,6, не содержит Ca++ и Mg++). Данный буфер создает щелочные условия, которые приводят к диссоциации молекулы природного гемоцианина на субъединицы. Совокупность данных субъединиц называют иммуноцианином.
Способ 3:
Природный кислород-связывающий белок гемоцианин очищали из гемолимфы методом ионообменной хроматографии. Гемоцианин связывался с анионообменником, после чего гемоцианин снимали с колонки посредством градиентного элюирования в соли. Гемоцианин выделяли из полученного в результате раствора гемоцианина посредством ультрацентрифугирования. Полученный осадок растворяли в буфере для диссоциации. Наконец, раствор иммуноцианина концентрировали; полученный раствор можно очистить посредством следующего этапа ИО хроматографии.
Концентрирование раствора иммуноцианина
Перед итоговой очисткой («полировкой») методом гель-фильтрации раствор иммуноцианина концентрировали до содержания белка 20 мг/мл (±2,5 мг/мл) методом ультрафильтрации. С данной целью использовали полисульфоновые или полиэфирсульфоновые мембраны с низким связыванием с белками (предел отсечения 30000 Дальтон; площадь фильтра ≥700 см2), встроенные в установку для ультрафильтрации из нержавеющей стали.
После ультрафильтрации концентрированный раствор иммуноцианина фильтровали через мембранный фильтр с размером пор 0,22 мкм.
Очистка («полировка»)
Концентрированный раствор иммуноцианина, наконец, очищали методом жидкостной хроматографии среднего давления на колонке для гель-фильтрации.
Пример 3: Нанофильтрации очищенных субъединиц KLH (иммуноцианина)
В связи с природным происхождением KLH существует вирологический риск, вызванный патогенами человека. Чтобы гарантировать биологическую безопасность нижестоящий процесс получения биологических препаратов должен включать этапы инактивации или удаления потенциальной вирусной контаминации. Исследовали коммерчески доступные способы инактивации KLH, и было установлено, что в случае гемоцианинов данные способы не являются подходящими в связи с разрушающим действием на препараты KLH (снижение pH, термическая обработка).
Ранее было показано, что нанофильтрация эффективно удаляет различные вирусы из композиций белков. Однако нанофильтрация оказалась непригодной для гемоцианинов или природного KLH в связи с молекулярной массой природного KLH от >8 млн Дальтон. Фильтры не могут отделить вирусы от белка, т.е. белок является слишком большим, чтобы пройти через мембрану типичных вирусных фильтров (размер пор от 15 до 35 нм). Снижение однородной молекулярной массы до приблизительно 400000 Дальтон, что соответствует субъединицам KLH, позволило обойти данное ограничение. Несколько вирусных фильтров с различным размером пор исследовали в процессе меньшего масштаба.
Сравнительный пример: протокол тупиковой фильтрации, вирусная фильтрация субъединиц KLH
Белок молекулярной массой приблизительно 400 кД в концентрации приблизительно 5 мг/мл, полученный из крови калифорнийской морской улитки, фильтровали через фильтр Planova 20N, 0,001 м2 тупиковым способом при постоянном давлении 2,0 бар. Скорость потока составляла 0,4 мл/мин. Состав белка был приготовлен при pH 9,6 в буфере глицин/NaOH. Наносили 1 г исходного материала. При использовании тупиковой фильтрации получили 0,1 г белка в концентрации 0,5 мг/мл, т.е. выход белка составил 10%. Помимо этого, снижение исходных количеств белка или концентрации белка с коэффициентом 10 или более не приводило к получению отличных результатов. Снижение давления или увеличение размера также не приводило к изменениям выхода белка.
Рабочий пример: протокол фильтрации поперечного потока; вирусная фильтрация субъединиц KLH
Белок молекулярной массой приблизительно 400 кД в концентрации приблизительно 0,45 мг/мл, полученный из крови калифорнийской морской улитки, фильтровали через фильтр Planova 20N, 0,12 м2 способом поперечного потока при постоянном давлении 0,16 бар. Состав был приготовлен в буфере на основе глицина и NaOH при pH 9,6. Количество исходного материала составляло 5000 г в концентрации 0,45 мг/мл. Количество белка, полученное после нанофильтрации, составило 4688 г в концентрации 0,42 мг/мл, что соответствует выходу 93%.
Данный пример демонстрирует, что, в отличие от тупиковой фильтрации, фильтрация поперечного потока позволяет проводить фильтрацию количественных объемов белка гемоцианина после диссоциации на субъединицы. Можно применять нанофильтры с размером пор от 15 до 35 нм, которые достаточны для удаления наименьших из известных вирусов.
Пример 4: Экспериментальное подтверждение концепции: оценка целесообразности
В данном примере продемонстрирована пригодность фильтрации поперечного потока для удаления небольших вирусов, диаметр которых соответствует наименьшим из известных вирусов. В данном примере исследовали ПВС. Диаметр ПВС составляет 20 нм, и вирус добавляли в концентрации 0,5% на белок. К иммуноцианину, белку однородной молекулярной массой приблизительно 400000 Дальтон, соответствующей субъединицам KLH, добавляли 0,5% ПВС. Суммарная вирусная нагрузка в предфильтрате составила 10620. Количество белка после добавления вируса составило 4814,9 г. Нанофильтрацию проводили с применением нанофильтров Planova 20N, 0,12 м2 способом поперечного потока. Выбранная скорость потока составила 50 мм/мин. при постоянном давлении 0,28 бар. В фильтрате сохранилось 4662,4 г белка. LRF для ПВС составил 3,14 +/- 0,32. Соответственно, количество белка составило более 93%, и было достигнуто удаление вирусов более 99,9%.
В данном примере продемонстрировано, что фильтрация поперечного потока является подходящей для получения KLH или субъединиц KLH в не содержащей вирус форме в коммерчески приемлемом масштабе с выходом более 90%.
Пример 5: Стабилизация очищенных субъединиц KLH посредством обессоливания
Принцип
Бессолевую KLH BULK LIQUID (жидкость KLH большого объема) получали из очищенного иммуноцианина посредством обессоливания и концентрирования. Обе данные процедуры проводили посредством серий этапов ультрафильтрации с применением полисульфоновой мембраны с номинальным пределом отсечения 30000 Да.
Получение обессоленной партии
С целью минимизировать вариации от партии к партии в ходе процесса обессоливания очищенный раствор иммуноцианина концентрировали методом ультрафильтрации до содержания иммуноцианина от 10 мг/мл до 40 мг/мл (± 2 мг/мл). С данной целью использовали полисульфоновые или полиэфирсульфоновые мембраны с низким связыванием с белками (предел отсечения 30000 Да), встроенные в установку для ультрафильтрации из нержавеющей стали. Перед применением мембраны кондиционировали посредством рециркуляции щелочного буфера для диссоциации при температуре ±2-8°C. Поток обеспечивали с применением перистальтического насоса. Наконец, кондиционирование изучали посредством внутрипроизводственного контроля pH и бактериальных эндотоксинов. Перед началом процесса концентрирования проверяли целостность установки для ультрафильтрации.
Концентрирование
Затем раствор иммуноцианина переносили в установку для ультрафильтрации и рециркулировали при температуре +2-8°C. Концентрацию контролировали посредством взвешивания полученного ультрафильтрата. Максимальное давление на входе в установку для ультрафильтрации не должно превышать 1 бар, предпочтительно, 0,5 бар. Раствор иммуноцианина рециркулировали до тех пор, пока не было собрано рассчитанное количество ультрафильтрата. Наконец, концентрат исследовали в ходе внутрипроизводственного контроля для определения значения pH, осмоляльности, проводимости, содержания иммуноцианина.
Обессоливание
Концентрированный раствор иммуноцианина (= концентрированную обессоленную партию) обессоливали либо посредством разведения в соотношении 1:1 водой для инъекций на каждом цикле ультрафильтрации либо, в качестве альтернативы, посредством добавления воды для инъекций с использованием постоянного объема для процедуры промывки. Процесс обессоливания контролировали посредством взвешивания ультрафильтрата, концентрированной обессоленной партии и исследования проводимости ультрафильтрата и обессоленной партии.
Если проводимость ультрафильтрата достигала <10 мкС/см или если проводимость концентрированной обессоленной партии составляла <150 мкС/см, процесс обессоливания заканчивали, и содержание иммуноцианина в обессоленной партии определяли с целью получения финальной партии бессолевой KLH BULK LIQUID.
Получение финальной партии бессолевой KLH BULK LIQUID
Финальную партию бессолевой KLH BULK LIQUID получали из концентрата иммуноцианина посредством разведения до содержания иммуноцианина 20 мг/мл. С данной целью взвешивали отфильтрованный концентрат иммуноцианина. Требуемое количество воды для инъекций точно взвешивали и медленно добавляли к отфильтрованному концентрату иммуноцианина. Раствор аккуратно перемешивали и отбирали образец для внутрипроизводственного контроля для определения значения pH, плотности, осмоляльности, проводимости, содержания иммуноцианина.
Выделенный раствор, наконец, стерилизовали посредством фильтрации через мембранный фильтр с размером пор 0,22 мкм непосредственно в инфузионные мешки.
Инфузионные мешки хранили при температуре +2-8°C.
В процессе фильтрации отбирали образцы для контроля качества.
Пример 6: Рефолдинг субъединиц KLH после вирусной фильтрации и итоговая очистка.
Принцип
Высокомолекулярный KLH получали из концентрированного раствора иммуноцианина посредством диафильтрации (смены буфера к условиям повторной ассоциации, pH 7-8, Са++, Mg++) и концентрирования. Обе данные процедуры проводили, например, посредством серии этапов ультрафильтрации с применением полисульфоновой мембраны с номинальным пределом отсечения 50000 Да.
Концентрирование очищенного раствора иммуноцианина
С целью оптимизировать условия повторной ассоциации очищенный раствор иммуноцианина концентрировали до содержания иммуноцианина 20 мг/мл (±2 мг/мл) методом ультрафильтрации. С данной целью использовали полисульфоновые или полиэфирсульфоновые мембраны с низким связыванием с белками (предел отсечения 30000 Да), встроенные в установку для ультрафильтрации из нержавеющей стали. Перед применением мембраны кондиционировали элюирующим буфером следующим образом. Сначала систему для ультрафильтрации промывали элюирующим буфером при температуре +2-8°C, в то время как выходные отверстия для фильтрата были закрыты. Поток обеспечивали с применением перистальтического насоса. Наконец, элюирующий буфер полностью удаляли из системы. Со стороны ретентата отбирали образец для внутрипроизводственного контроля pH, бактериальных эндотоксинов. Перед началом процесса концентрирования проверяли целостность установки для ультрафильтрации. Затем раствор иммуноцианина переносили в отсек для ретентата установки для ультрафильтрации. Начинали рециркуляцию, и ультрафильтрат собирали во взвешенный лабораторный стакан. Поддерживали температуру +2-8°C. Как и в процессе кондиционирования, максимальное давление на входе установки для ультрафильтрации не должно превышать 1 бар. Раствор иммуноцианина рециркулировали до тех пор, пока не было собрано рассчитанное количество ультрафильтрата. Ретентат перемешивали при закрытых выходных отверстиях для фильтрата, и отбирали образец для внутрипроизводственного контроля значения pH, осмоляльности, проводимости, содержания иммуноцианина.
Повторная ассоциация
Для рефолдинга субъединиц KLH использовали вторую систему ультрафильтрации с полисульфоновыми или полиэфирсульфоновыми мембранами с низким связыванием с белками (предел отсечения 50000 Да), встроенными в установку для ультрафильтрации из нержавеющей стали. Перед применением мембраны кондиционировали буфером для повторной ассоциации следующим образом. Систему ультрафильтрации сначала промывали буфером для повторной ассоциации при температуре +2-8°C при закрытых выходных отверстиях для фильтрата. Поток обеспечивали с применением перистальтического насоса. Наконец, буфер для повторной ассоциации полностью удаляли из системы. Со стороны ретентата отбирали образец для внутрипроизводственного контроля pH, бактериальных эндотоксинов. Перед началом процесса повторной ассоциации проверяли целостность установки для ультрафильтрации. Для повторной ассоциации в системе ультрафильтрации рециркулировали буфер для повторной ассоциации (от 2- до 10-кратный объем концентрированного раствора иммуноцианина) при закрытых выходных отверстиях для фильтрата. Концентрированный раствор иммуноцианина медленно инъецировали в рециркулирующий буфер для повторной ассоциации. В течение всего процесса повторной ассоциации поддерживали температуру +2-8°C. После завершения инъекции концентрированного раствора иммуноцианина проводили диафильтрацию партии после повторной ассоциации против от 2- до 10-кратного буфера для повторной ассоциации с применением процедуры промывки постоянным объемом. Наконец, партию концентрировали до содержания KLH 20 мг/мл.
После повторной ассоциации концентрированный раствор KLH фильтровали через мембранный фильтр с размером пор 0,22 мкм.
Очистка KLH, прошедшего рефолдинг, методом гель-фильтрации
Наконец, концентрированный раствор KLH очищали методом жидкостной хроматографии среднего давления на колонке для гель-фильтрации.
Биологическая активность и специфическая активность - сопоставимость с природным KLH
Проводили сравнение природного KLH и синтетического KLH, полученного после повторной ассоциации способом согласно настоящему изобретению. Синтетический KLH и природный KLH сравнивали методом спектроскопии КД (кругового дихроизма). Полосы при спектроскопии КД являлись идентичными.
Полосы белков на ДСН ПААГ (полиакриламидном геле с додецилсульфатом натрия) при сравнении синтетического и природного KLH являлись идентичными. В синтетическом KLH фрагменты белка обнаружены не были.
Для сравнения синтетического и природного KLH также проводили 2-мерный иммуноэлектрофорез. Использовали антисыворотку против KLH1 и KLH. Иммуноэлектрофоретические профили природного и синтетического KLH являлись идентичными. Для природного и синтетического KLH наблюдалось два максимума преципитации (один для KLH1 и один для KLH2).
Исследования природного и синтетического KLH с помощью электронного микроскопа продемонстрировали типичные декамеры, дидекамеры и тридекамеры.
Анализы методом нативного электрофореза в ПААГ и денситометрии продемонстрировали, что как синтетический, так и природный KLH содержат типичные полосы белка. Было получено соотношение между KLH1 и KLH2, составляющее от 0,9 до 1,0, как для синтетического, так и для природного KLH.
Реферат
Настоящее изобретение относится к способу получения синтетического гемоцианина фиссуреллы (KLH). Способ получения синтетического гемоцианина фиссуреллы (KLH), включающий следующие этапы: a) диссоциацию природного KLH для получения субъединиц, b) нанофильтрацию субъединиц, полученных на этапе а), с применением фильтров с размером пор от 15 до 35 нм; и c) ассоциацию субъединиц, полученных после нанофильтрации, с получением синтетического KLH. Способ получения иммуноцианина. Синтетический гемоцианин фиссуреллы (KLH), полученный вышеописанным способом. Синтетический иммуноцианин, полученный вышеописанным способом. Способ удаления вируса из препарата гемоцианина. Вышеописанный способ позволяет получить синтетический гемоцианин и иммуноцианин фиссуреллы с высокой степенью очистки. 5 н. и 15 з.п. ф-лы, 6 пр.

Комментарии