Дезинфицирующее средство для борьбы с паразитическими простейшими - RU2419287C2
Код документа: RU2419287C2
Описание
Настоящее изобретение относится к дезинфицирующим средствам, более конкретно к дезинфицирующему средству для борьбы с паразитическими простейшими, содержащему комбинацию биоцидных фенолов, феноксифенола, а также салициловую кислоту в качестве кератолитического средства.
Указанные дезинфицирующие средства имеют особенно большое значение, например, для борьбы с кокцидиозом пользовательных животных. Eimeria tenella являются простейшими микроорганизмами, возбудителями кокцидиоза птиц - заболевания, которое с переходом на интенсивное напольное содержание цыплят и кур превратилось в серьезную экономическую проблему. Инфицирование животных наступает вследствие поглощения ими выделяющих споры ооцистов, являющихся носителями инфекционных одноклеточных спорозоитов. Спорозоиты заселяют кишечные клетки, которые осуществляют защиту от миллионократного размножения паразитных форм. К патологии заболевания кокцидиозом относятся кровянистые диареи, которые из-за пониженного усвоения пищи курами и их убыли в массе способны нанести большой экономический ущерб.
Ежегодные расходы на противококциодиозные мероприятия, связанные с профилактикой указанного заболевания, в настоящее время составляют, по меньшей мере, 350 миллионов долларов США. С 1970 года химиотерапевтическое лечение кокцидиоза осуществляют главным образом полиэфирными ионофорными монензином, наразином, салиномицином и лазалоцидом. Наряду с тяжелейшей медикаментозной нагрузкой, серьезнейшей проблемой химиотерапевтического лечения кур является возникновение у них резистентности к медикаментам. Первым признаком развития резистентности нередко является повторное усиленное выделение ооцистов.
Альтернативой химиотерапевтическому лечению кокцидиоза могла бы стать ранняя дезинфекция птичников. Однако вместе с фекалиями животные выделяют стойкие формы эймерии, так называемые ооцисты, которые вместе с остатками фекалий и компонентами корма способны выживать на покрытиях пола, на поверхностях и в щелях стен, а также в устройствах для содержания животных, и, являясь постоянными источниками инфекции, в течение длительного времени вызывать новые случаи их заболевания. Ооцисты видов эймерия могут вызывать инфекцию в течение года после их выделения. Дополнительные проблемы в этот период создает занос ооцистов людьми или животными в соседние птичники.
Ооцисты вида Eimeria tenella обладают размерами 24,5-18,3 мкм и многими миллионами формируются в кишечных клетках инфицированных животных сразу после циклов бесполого размножения. Женский макрогамонт оплодотворяется мужской микрогаметой и формирует зиготу, окруженную двумя типичными слоями: гладким наружным слоем, возникающим после слияния образующего оболочку тела I (WFI), и внутренним слоем, возникающим после слияния образующего оболочку тела II (WFII). До завершения формирования обоих слоев зреющая ооциста остается в паразитофорной вакуоли инфицированных кишечных клеток и лишь после этого выделяется с испражнениями. В присутствии кислорода начинается так называемое спорообразование: из недифференцированных споронтов в результате редукционного деления возникают четыре спороциста, каждый из которых содержит два спорозоита. Спорообразование Eimeria tenella, как правило, продолжается в течение 2-3 дней. Ооциста становится заразной лишь после завершения спорообразования.
Структура и состав обеих стенок ооцисты характеризуются выраженной биохимической и физиологической сопротивляемостью и представляют собой эффективный защитный барьер, обеспечивающий выживание микроорганизмов паразитов на открытом воздухе. В то время как наружная стенка ооцистов построена из фосфолипидов, длинноцепочечных спиртов и триглицеридов, их внутренний слой состоит из стабилизированных дисульфидными мостиками гликопротеинов. Протеин основной стенки ооцистана (12-14 килодальтонов) содержит аминокислоты серин, тирозин и треонин и соединен с углеводами. Подобные протеины придают структуре ооциста высокую устойчивость к воздействию жара или холода. Липиды наружного слоя обусловливают повышенную стойкость ооциста к воздействию химикатов.
Простые физические дезинфекционные мероприятия (воздействие жары, холода, сушки или облучения) можно использовать лишь в весьма ограниченном масштабе. Так, например, в лабораторных условиях при температуре от 60 до 100°С ооцисты погибают в течение нескольких минут, однако, дезинфицирующее действие горячей воды в практических условиях животноводческого помещения чаще всего бывает незначительным, поскольку при попадании на пол вода слишком быстро остывает. В случае высоконапорной очистки при кратковременном воздействии также обеспечивают лишь частичную дезинфекцию. В то же время ооцисты характеризуются довольно высокой устойчивостью к воздействию холода. Ооцисты видов эймерия сохраняют присущую им жизнеспособность и остаются заразными в течение периода, составляющего более 14 дней, при снижении температуры даже до -25°С. Сушка оказывает на них определенное поражающее действие, однако подобный метод дезинфекции характеризуется недостаточно высокой надежностью.
Гамма-лучи и электронные лучи при дозе от 3,5 до 4,0 кГр приводят к утрате способности ооцистов к спорообразованию, однако сельские жители не могут воспользоваться подобными методами дезинфекции в связи с высокими расходами на приобретение необходимых для этого приборов.
Большинство химических дезинфицирующих средств, эффективных по отношению к бактериям и вирусам, не оказывают действия на ооцисты видов эймерия, оболочки которых обладают сложной химической структурой и затрудняют проникновение химикатов. Специфичное для этих паразитов дезинфицирующее средство сначала должно проникнуть через содержащие липиды наружные оболочки ооцисты, а затем оказать воздействие на устойчивые гликопротеины ее внутренней оболочки, прежде чем сможет нанести ущерб содержащим мембраны спороцистам и спорозоитам.
Ооцисты видов эймерия по сравнению с бактериями характеризуются в тысячи раз более высокой стойкостью к агрессивным неорганическим веществам, таким как раствор едкого натра (NaOH) или гипохлорит натрия (NaOCl). Подобные микроорганизмы не утрачивают присущей им инфекциозности даже при концентрациях указанных веществ более 5% и времени их воздействия до 120 минут. В восточноевропейских странах для борьбы с ооцистами иногда успешно используют аммиак (NH3) при времени его воздействия, составляющем 24 часа, однако одновременно происходит сопровождаемое сильным запахом насыщение атмосферы аммиачными парами.
Этанол (при концентрации от 70 до 90%) и формальдегид на практике не оказывают сколько-нибудь достаточного воздействия на стойкие ооцисты видов эймерия.
В качестве единственных органических действующих веществ некоторые торговые препараты содержат лишь производные фенола, особенно, п-хлор-м-крезол, иногда также в комбинации с сероуглеродом и хлороформом (таблица 1). На практике подобные препараты используют для борьбы с кокцидиозом сельскохозяйственной птицы в пустых секциях животноводческих помещений.
В международной заявке WO 94/17661 описано дезинфицирующее средство с паразитицидной эффективностью, которое содержит один или несколько фенолов в комбинации с кератолитически действующими органическими кислотами, простыми диалкиловыми эфирами этиленгликоля, а также алкилсульфонатами или сульфатами натрия или калия.
В соответствии с директивами Немецкого ветеринарного общества эффективность противопаразитарных дезинфицирующих средств по отношению к ооцистам вида Eimeria tenella в Германии проверяют в экспериментах с суспензиями (испытания на разрушение), а также при инфекционных испытаниях на курах. Ооцисты вида Eimeria tenella (штамм „Houghton") классифицируют как особенно стойкие микроорганизмы, в связи с чем для тестирования рекомендуют использовать именно эти микроорганизмы.
Серьезную практическую проблему, прежде всего, представляет собой борьба с ооцистами видов эймерия. Однако подобной структурой обладают стенки кисты других простейших, особенно кокцидий, а также гельминтий. В связи с этим представления, изложенные выше на примере видов эймерия, могут быть перенесены и на эти организмы.
При использовании указанных выше систем тестирования неожиданно было обнаружено, что дезинфицирующая эффективность средств, содержащих комбинацию разных биоцидных фенолов, соответственно производных фенола, при одновременном применении кератолитических средств значительно превышает дезинфицирующую эффективность существующих дезинфицирующих средств.
Таким образом, настоящее изобретение относится к дезинфицирующему средству, содержащему
(а) 45-60 мас.%, в пересчете на фенольные биоциды, 4-хлор-3-метил-фенола,
(b) 15-30 мас.%, в пересчете на фенольные биоциды, 2-бензил-4-хлорфенола и/или 13-45 мас.%, в пересчете на фенольные биоциды, 2-фенилфенола,
(с) 10-20 мас.%, в пересчете на фенольные биоциды, феноксиэтанола,
(d) 5-18 мас.%, в пересчете на фенольные биоциды, салициловой кислоты,
(e) 30-50 мас.%, в пересчете на средство, неводных растворителей,
(f) воду - остальное.
Согласно предпочтительной форме выполнения изобретения предлагаемое средство содержит 4-хлор-3-метил-фенол и 2-бензил-4-хлорфенол.
Согласно другой предпочтительной форме выполнения изобретения предлагаемое средство содержит 4-хлор-3-метил-фенол и 2-фенилфенол.
Предлагаемое средство можно переводить в разного рода препараты, причем пригодными являются как твердые, так и жидкие препараты.
Твердые препараты можно использовать, например, в виде порошков, пылевидных материалов, гранулятов и тому подобное. Обычно они содержат основы и/или вспомогательные вещества. Действующие вещества можно смешивать с основами и/или вспомогательными веществами или наносить на них.
Однако предпочтительными являются жидкие препараты, например, препараты в виде эмульсий, суспензий или, прежде всего, растворов. Жидкие препараты можно использовать непосредственно: речь при этом предпочтительно идет о концентратах, которые перед применением, как правило, разбавляют до пригодной концентрации водой.
Эмульсии могут быть либо типа «вода в масле», либо типа «масло в воде». Приготовление подобных эмульсий состоит в растворении действующих веществ либо в гидрофобной, либо в гидрофильной фазе, которую затем гомогенизируют с растворителем другой фазы с помощью соответствующих эмульгаторов и, при необходимости, используемых других вспомогательных веществ, таких как красители, консерванты, антиоксиданты, светостабилизаторы и повышающие вязкость вещества.
Пригодной гидрофобной фазой (маслом) являются парафиновые масла, силиконовые масла, натуральные растительные масла, такие как кунжутное масло, миндальное масло и касторовое масло, синтетические триглицериды, такие как диглицерид каприловой/каприновой кислоты, смесь триглицеридов с растительными жирными кислотами с 8-12 атомами углерода или другими, особым образом подобранными натуральными жирными кислотами, смеси частичных глицеридов с насыщенными или ненасыщенными жирными кислотами, которые могут содержать также гидроксильные группы, моноглицериды и диглицериды жирных кислот с 8-10 атомами углерода; сложные эфиры жирных кислот, такие как этилстеарат, ди-н-бутириладипат, сложный гексиловый эфир лауриновой кислоты, ди-пропиленгликольпеларгонат, сложные эфиры разветвленной жирной кислоты со средней длиной алкильной цепи и насыщенных алифатических спиртов с 16-18 атомами углерода, изопропилмиристат, изопропилпальмитат, сложные эфиры каприловой/каприновой кислоты и насыщенных алифатических спиртов с 12-18 атомами углерода, изопропилстеарат, сложный олеиловый эфир олеиновой кислоты, сложный дециловый эфир олеиновой кислоты, этилолеат, сложный этиловый эфир молочной кислоты, воскоподобные сложные эфиры жирных кислот, такие как дибутилфталат, сложный диизопропиловый эфир адипиновой кислоты, смеси родственных последним сложных эфиров, в частности эфиров на основе алифатических спиртов, таких как изотридециловый спирт, 2-октилдодеканол, цетил-стеариновый спирт, олеиловыи спирт; жирные кислоты, например, такие как олеиновая кислота, а также их смеси.
В качестве гидрофильной фазы пригодны вода, спирты, например, такие как пропиленгликоль, глицерин, сорбит, этанол, 1-пропанол, 2-пропанол и н-бутанол, а также смеси указанных растворителей.
Пригодными эмульгаторами являются следующие соединения:
неионогенные поверхностно-активные вещества (ПАВ), например, полиоксиэтилированное касторовое масло, полиоксиэтилированный сорбитанмоноолеат, сорбитанмоностеарат, глицеринмоностеарат, полиоксиэтилстеарат или алкилфенолполигликоли, амфотерные ПАВ, такие как динатрий-N-лаурил-β-иминодипропионат или лецитин,
анионоактивные ПАВ, такие как сульфаты простых эфиров алифатических спиртов, алкилсульфонаты или алкилсульфаты с 8-18 атомами углерода, такие как натрийлаурилсульфат или вторичные алкилсульфонаты (Mersolate®, предпочтительно со средней длиной алкильной цепи, которая состоит из 15 атомов углерода), сложный эфир моно/диалкилполигликоля и фосфорной кислоты - соль моноэтаноламина,
катионоактивные ПАВ, такие как цетилтриметиламмонийхлорид.
Другими вспомогательными веществами являются повышающие вязкость и стабилизирующие эмульсию вещества, такие как карбоксиметилцеллюлоза, метилцеллюлоза и другие производные целлюлозы и крахмала, полиакрилаты, альгинаты, поливинилпирролидон, поливиниловый спирт, сополимеры метилвинилового эфира и малеинового ангидрида, полиэтиленгликоли, воска, коллоидные кремниевые кислоты или смеси указанных веществ.
Для приготовления суспензий действующее вещество суспендируют в жидкой основе, при необходимости, с добавлением других вспомогательных веществ, таких как смачивающие агенты, красители, консерванты, антиоксиданты и светостабилизаторы.
В качестве жидких основ пригодны любые указанные в настоящем описании растворители и гомогенные смеси растворителей.
В качестве смачивающих агентов (диспергаторов) пригодны указанные выше ПАВ.
Для приготовления растворов действующее вещество растворяют в соответствующем растворителе и добавляют возможно используемые добавки, такие как ПАВ, гидротропные солюбилизаторы, кислоты, основания, буферные соли, антиоксиданты и консерванты.
Пригодными растворителями являются вода, спирты, такие как алканолы с 1-4 атомами углерода (например, этанол, 1-пропанол, 2-пропанол или н-бутанол), ароматические замещенные спирты, такие как бензиловый спирт и фенилэтанол; глицерин, гликоли, пропиленгликоль, полиэтиленгликоли, полипропиленгликоли, сложные эфиры, такие как этилацетат, бутилацетат и бензилбензоат, простые эфиры, такие как алкиловые эфиры алкиленгликолей, например, монометиловый эфир дипропиленгликоля или монобутиловый эфир диэтиленгликоля, кетоны, такие как ацетон и метилэтилкетон, ароматические и/или алифатические углеводороды, растительные или синтетические масла, диметилформамид, диметилацетамид, N-метил-пирролидон, 2-диметил-4-оксиметилен-1,3-диоксолан, а также их смеси.
Предназначенными для использования в растворах поверхностно-активными веществами могут являться ПАВ, указанные выше при рассмотрении эмульсий, предпочтительными из которых являются анионные ПАВ, прежде всего, алкилсульфонаты или алкилсульфаты с 8-18 атомами углерода, например, вторичные алкилсульфонаты (Mersolate®) предпочтительно со средней длиной алкильной цепи, которая состоит из 15 атомов углерода.
Гидротропными солюбилизаторами являются растворители, способствующие растворению действующего вещества в базовом растворителе или предотвращающие его осаждение. Примерами пригодных гидротропных солюбилизаторов являются поливинилпирролидон, полиоксиэтилированное касторовое масло и полиоксиэтилированный сложный эфир сорбита.
В качестве других вспомогательных веществ или добавок предлагаемые в изобретении дезинфицирующие средства дополнительно могут содержать отвердители и/или ингибиторы коррозии.
Пригодными отвердителями являются, например, добавки, обычно используемые в сфере водоподготовки, например фосфоновые кислоты, цепочкообразные полифосфаты или низкомолекулярные поликарбоновые кислоты.
Предлагаемые дезинфицирующие средства предпочтительно содержат ПАВ, концентрация которых обычно составляет от 3 до 20 мас.%, предпочтительно от 5 до 20 мас.%, особенно предпочтительно от 5 до 15 мас.%, в перечете на средство.
В качестве неводных растворителей предпочтительно используются алканолы с 14 атомами углерода (например, этанол, 1-пропанол, 2-пропанол, н-бутанол). Вода предпочтительно содержится в количестве до 30 мас.%, более предпочтительно в количестве от 5 до 25 мас.%, в частности от 5 до 20 мас.%, в пересчете на средство.
Предлагаемые дезинфицирующие средства являются концентратами, которые перед применением, как правило, разбавляют водой. Готовые к употреблению растворы обычно содержат от 0,5 до 20 об.%, предпочтительно от 1 до 10 об.%, особенно предпочтительно от 1 до 5 об.% концентрата дезинфицирующего средства. Используемую концентрацию можно варьировать в зависимости от цели применения дезинфицирующего средства. Так, например, необходимые для достижения удовлетворительного эффекта периоды воздействия являются более кратковременными при использовании средств, обладающих более высокой концентрацией.
Типичное время воздействия, составляет, например, от 0,5 до 5 часов, предпочтительно от 1 до 4 часов.
Предлагаемые дезинфицирующие средства также пригодны для борьбы с гельминтами, встречающимися при содержании и разведении животных, которыми могут являться пользовательные, племенные, лабораторные, подопытные или любительские животные. При этом дезинфицирующие средства эффективны главным образом по отношению к стойким формам (внеклеточным кистозным формам) паразитических простейших и гельминтов.
К паразитическим простейшим относятся следующие микроорганизмы:
Sarcomastigophora (ризоподы), такие как Entamoebidae, например, Entamoeba histolytica, Hartmanellidae, например, Acanthamoeba sp. Hartmanella sp.
Apicomplexa (споровики), прежде всего, кокцидии, такие как Eimeridae, например, Eimeria acervulina, E.adenoides, E.alabahmensis, E.anatis, E.anseris, E.arloingi, E.ashata, E.auburnensis, E.bovis, E.brunetti, E.canis, E.chinchillae, E.clupearum, E.columbae, E.contorta, E.crandalis, E.debliecki, E.dispersa, E.ellipsoidales, E.falciformis, E.faurei, E.flavescens, E.gallopavonis, E.hagani, E.intestinalis, E.iroquoina, E.irresidua, E.labbeana, E.leucarti, E.magna, E.maxima, E.media, E.meleagridis, E.meleagrimitis, E.mitis, E.necatrix, E.ninakohlyakimovae, E.ovis, E.parva, E.pavonis, E.perforans, E.phasani, E.piriformis, E.praecox, E.residua, E.scabra, E.spec., E.stiedai, E.suis, E.tenella, E.truncata, E.truttae, E.zuernii, Globidium spec., Isospora belli, I.canis, I.felis, I.ohioensis, I.rivolta, I.spec., I.suis, Neospara caninum, Cystisospora spec., Cryptosporidium spec., такие как Toxoplas-madidae, например, Toxoplasma gondii, такие как Sarcocystidae, например, Sarcocystis bovicanis, S.bovihominis, S.ovicanis, S.ovifelis, S.spec. и S.suihominis.
Mastigophora (биченосцы), например, такие как Giardia lamblia, G.canis.
А также миксоспора и микроспора, например, Glugea spec., Nosema spec.
К гельминтам относятся трематоды, солитеры и нематоды.
К трематодам относятся, например, возбудители семейств/родов Fasciola, Paramphistomum, Dicrocoelium и Opisthorchis (двуустка).
К солитерам относятся, например, возбудители семейств/родов Moniezia, Anoplocephala, Diphyllobothrium, Taenia, Echinococcus, Dipylidium, Raillietina, Choanotaenia и Echinuria.
К нематодам относятся, например, возбудители семейств/родов: Strongyloides, Haemonchus, Ostertagia, Trichostrongylus, Cooperia, Nematodirus, Trichuris, Oesophagostomum, Chabertia, Bunostomum, Toxocara vitulorum, Ascaris, Parascaris, Oxyuris, Oesophagostumum, Globocephalus, Hyostrongylus, Spirocerca, Toxascaris, Toxocara, Ancylostoma, Uncinaria, Capillaria, Prosthogonimus, Amidostomum, Capillaria, Ascaridia, Heterakis, Syngamus и Acanthocephalen.
Помимо применения для борьбы с простейшими и гельминтами предлагаемые в изобретении дезинфицирующие средства можно использовать также, например, для борьбы с бактериями, например, такими как Clostridien, Escherichia coli, Salmonella spec. Pseudomonas spec. Staphylococcus spec., Mycobacterium tuberculosis, а также
дрожжами, например, такими как Candida albicans, и микотическими инфекциями.
Кроме того, предлагаемые в изобретении дезинфицирующие средства можно использовать для борьбы с вирусами, например, такими как вирусы гриппа. Известны вирусы гриппа типов А и В. Так, например, для птиц, выращиваемых в птичниках, особую угрозу представляют вирусы гриппа, относящиеся к типу А. Соответствующим примером являются вирусы субтипа H5N1.
К пользовательным и племенным животным относятся, например, такие млекопитающие, как коровы, лошади, овцы, свиньи, козы, верблюды, индийские буйволы, ослы, мулы, зебры, кролики, лани и северные олени, пушные звери, например, такие как норка, шиншилла и енот, птицы, например, такие как куры, гуси, индейки, утки, голуби и фазаны, а также виды птиц, предназначенные для домашнего содержания и зоопарков.
К лабораторным и подопытным животным относятся мыши, крысы, морские свинки, золотистые хомяки, собаки и кошки.
К любительским животным относятся собаки и кошки.
Предлагаемые в изобретении дезинфицирующие средства пригодны для использования главным образом при содержании скота на промышленной основе, прежде всего, например, при выращивании сельскохозяйственной птицы (например, содержании кур), а также при содержании телят или свиней.
Примеры
I. Примеры приготовления препаратов
Общая инструкция
Фенолы при перемешивании растворяют в спирте, соответственно смеси спиртов. В полученный спиртовой раствор, при необходимости, добавляют феноксиэтанол, салициловую кислоту и алкансульфонат (Mersolat® W93), которые растворяют при постоянном перемешивании.
Материалы и методы биологических контрольных испытаний
Дезинфекционные препараты тестировали, ориентируясь на директивы контроля химических средств дезинфекции Немецкого ветеринарного общества, а также известные из литературы методы Daugschies и других (2002).
1. Получение ооцистов
Для испытаний использовали штамм "Houghton" Eimeria tenella (Институт здоровья животных, лаборатория Комптона, Near Newbury, Berks. RG16 ONN, Великобритания). Для размножения и получения ооцистов использовали мужские особи цыплят яичного направления (штамм LSL) в возрасте 14 дней, предоставленные фирмой Brinkschulte. Животные были поставлены в животноводческий центр в виде суточного молодняка и до начала экспериментов содержались в животноводческом центре в отсутствие кокцидий на сбалансированном корме для молодняка, не содержащем кокцидиостатики, и воде ad libitum. С целью инфицирования осуществляли индивидуальную инокуляцию животных 13000 ооцистами в 0,2 мл воды на каждый пищеводный зонд. На седьмой день после инфицирования животных безболезненно умерщвляли диоксидом углерода и из их слепой кишки выделяли ооцисты, которые с целью спорообразования помещали на четыре дня в раствор бихромата калия концентрацией 2%. В день эксперимента бихромат калия отделяли от суспензии ооцистов трехкратным центрифугированием соответственно по 5 минут при 2000 об/мин, и осадок после центрифугирования повторно суспендировали в воде. Концентрацию ооцистов в суспензии после третьего цикла центрифугирования устанавливали посредством камеры Бюркера на уровне 25000 ооцистов в миллилитре раствора штамма.
2. Дезинфекция ооцистов (испытание на лизис)
Непосредственно перед выполнением каждого испытания устанавливали двойную рабочую концентрацию испытуемых дезинфицирующих средств в бидистиллированной воде. Из раствора штамма готовили растворы концентрацией 1%, 2% и 4%:
100 мкл раствора штамма + 4900 мкл дистиллированной воды (концентрация 1%, двойная!),
200 мкл раствора штамма + 4800 мкл дистиллированной воды (концентрация 2%, двойная!),
400 мкл раствора штамма + 4600 мкл дистиллированной воды (концентрация 4%, двойная!).
В каждом эксперименте осуществляли двойное определение для каждого препарата. Для каждого состава в двух стеклянных химических стаканах объемом 25 мл смешивали по 0,5 мл суспензии ооцистов (12500 ооцистов, что соответствовало 100%) и 0,5 мл дезинфицирующего раствора. Для внутреннего контрольного опыта без лечения (KI) 0,5 мл воды смешивали с 0,5 мл суспензии ооцистов. В течение периода воздействия (1, 2 или 3 часа) суспензии подвергали легкому встряхиванию на качающемся устройстве.
По истечении соответствующего времени воздействия содержимое обоих химических стаканов переносили в одну соответствующую коническую колбу объемом 2000 мл. Химические стаканы споласкивали водой, промывочную воду сливали в коническую колбу, доводя общий объем в ней до 1500 мл. Содержимое колбы перемешивали и после происходящей в течение 24 часов при комнатной температуре седиментации надосадочную жидкость декантировали до остаточного объема в колбе 100 мл. Осадок переносили в центрифужную пробирку объемом 200 мл, в которую добавляли воду до 200 мл и оставляли на ночь. На следующий день надосадочную жидкость отсасывали до остаточного объема около 30 мл, осадок переносили в центрифужную пробирку объемом 50 мл и добавляли воду до 50 мл. После обусловленного инверсией перемешивания пипетировали 6×200 мкл дезинфицирующего состава в шесть лунок микротитровального планшета с 96 лунками. Прежде чем приступить к микроскопической оценке, планшеты выдерживали в холодильнике при 4°С. Подсчет присутствующих ооцистов выполняли под инверсионным микроскопом при 200-кратном увеличении. Подсчету подлежали только неповрежденные ооцисты, не имеющие заметного изменения наружной оболочки.
3. Вычисление «нормы лизиса»
Основой для вычисления нормы лизиса являлись средние арифметические значения количества вновь обнаруженных в двух микротитровальных планшетах ооцистов для каждого дезинфицирующего состава (планшет 1, планшет 2, двойное определение). При этом определяли отношение нормы повторного обнаружения (WR) для отдельных составов дезинфицирующих средств к норме повторного обнаружения для контрольного опыта без лечения: относительная норма повторного обнаружения WR [%]=WR для дезинфицированных ооцистов/WR для контрольного опыта×100 (KI). Эффективность дезинфицирующих препаратов выражали в виде «нормы лизиса» ооцистов: норма лизиса [%]=100-относительная норма WR [%].
4. Основной контроль in vivo (инфекционное испытание на цыплятах)
Для подтверждения факта гибели дезинфицированных ооцистов и утраты присущей им инфекциозности согласно директивам Немецкого ветеринарного общества необходимо выполнять также инфекционное испытание дезинфицированных ооцистов на цыплятах.
В соответствующих экспериментах цыплят яичного направления (штамм LSL) в возрасте около 14 дней инфицировали дезинфицированными ооцистами. С этой целью концентрацию суспензии ооцистов, полученной в результате дезинфекции и прекращения реакции, уменьшали до теоретической дозы 2000/мл, используя определенный для соответствующих контрольных опытов коэффициент разбавления. Для этого использовали полученные при контроле лизиса in vitro результаты подсчета ооцистов в 96-луночных микротитровальных планшетов, которые позволяли определить количество миллилитров суспензии, содержащие 2000 спорообразующих ооцистов из пробирки объемом 50 мл в контрольном опыте KI. Определенный при этом объем с целью инфицирования отбирали также от всех других дезинфицирующих смесей независимо от количества содержащихся в них ооцистов. Применяемый на цыплятах объем составлял 0,5 мл. В дополнение к внутреннему контролю осуществляли инфекционный контроль с использованием 0,3 мл первоначальной суспензии ооцистов с установленным в этом объеме содержанием ооцистов 2000/мл. На седьмой день после инфицирования цыплят безболезненно умерщвляли диоксидом углерода.
Для оценки эффективности учитывали следующие критерии: прибавку в массе в период между началом и завершением эксперимента, обусловленную инфицированием норму гибели, результаты макроскопической оценки склонности к диарее и выделению крови на пятый и седьмой дни после инфицирования (в баллах от 0 до 6), результаты макроскопической оценки поражения слизистой оболочки кишечника, прежде всего слепой кишки (в баллах от 0 до 6), и выделения ооцистов. Количество ооцистов в фекалиях определяли с помощью счетной камеры Макмастера. Отдельные данные сопоставляли с не подвергавшимися лечению неинфицированными контрольными группами и вычисляли общую оценку (Haberkorn, Greif, 1999).
Экспериментальные результаты, полученные в примерах с использованием предлагаемых в изобретении препаратов, приведены в нижеследующих таблицах. Повышенная эффективность новых препаратов по сравнению со сравнительным препаратом не в соответствии с изобретением особенно очевидна по снижению выделения ооцистов.
Данные, указанные в колонке «Лечение» приведенных ниже таблиц В, Е, F, Н, означают следующее:
«Контроль без инфицирования» означает неинфицированную контрольную группу,
«Контроль с инфицированном» означает инфицированную контрольную группу,
«Пример 1» означает препарат согласно примеру номер 1.
В колонке «Гибель» указано отношение количества погибших животных к количеству использованных в эксперименте животных. В колонке «Масса в % к контролю без инфицирования» указано отношение массы подвергнутых лечению животных к массе неинфицированных животных контрольной группы. В колонках «Диарея», «Поражения» и «Ооцисты» приведены данные, относящиеся к отдельным воздействиям. В колонке «Эффективность, %» приводится общая оценка эффективности, причем 0% означает отсутствие воздействия, 100% полноценное воздействие.
2. Результаты биологических испытаний
Пример биологического применения А
Проверка воздействия различных дезинфицирующих препаратов (4%) in vitro на ооцистов вида Eimeria tenella (по истечении времени воздействия 3 часа)
Биологический пример В
Проверка воздействия различных дезинфицирующих препаратов (4%) in vivo на ооцисты вида Eimeria tenella на цыплятах (по истечении времени воздействия 3 часа)
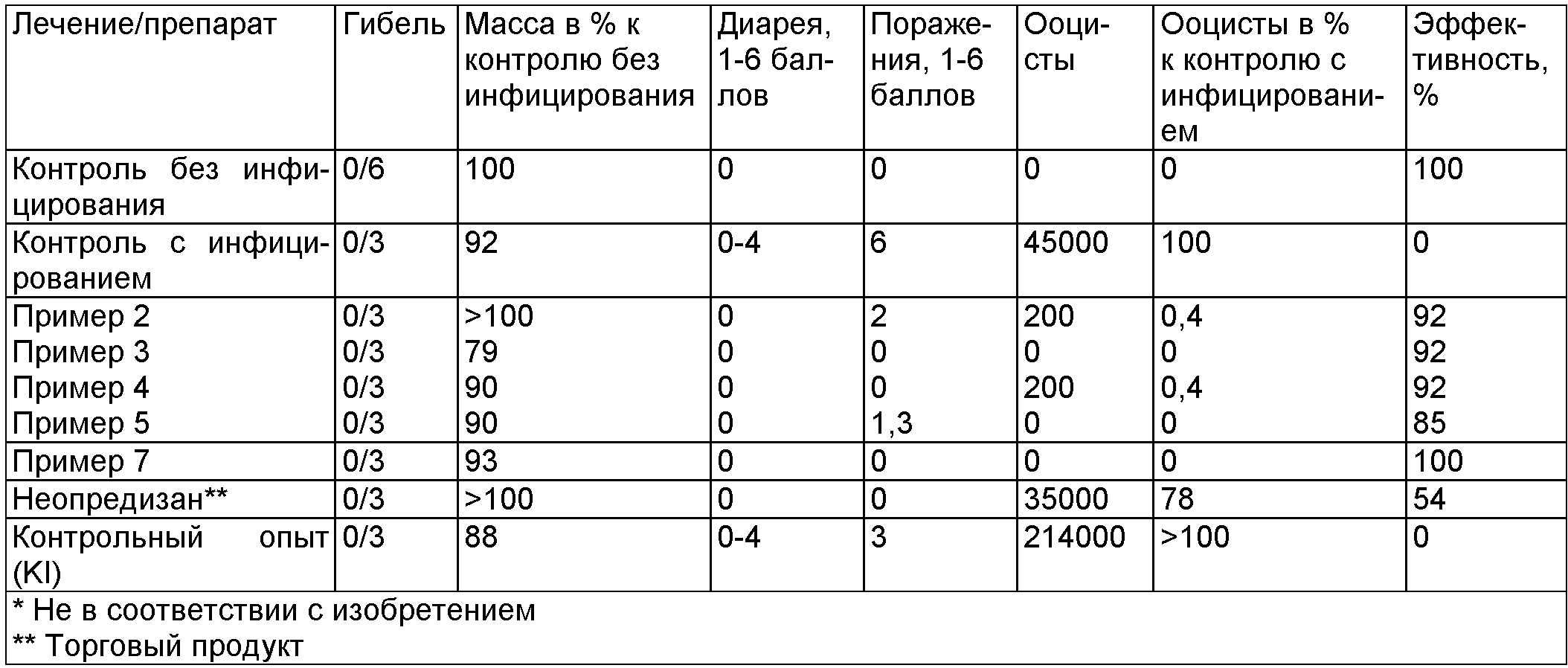
Биологический пример С
Проверка воздействия различных дезинфицирующих препаратов (1%, 2%, 4%) in vitro на ооцисты вида Eimeha tenella (по истечении времени воздействия 3 часа)
Биологический пример D
Проверка воздействия различных дезинфицирующих препаратов (4%) in vitro на ооцисты вида Eimeria tenella (по истечении времени воздействия 1, 2 и 3 часа)
Биологический пример Е
Проверка воздействия различных дезинфицирующих препаратов (4%) in vivo на ооциты вида Eimeria tenella на цыплятах (по истечении времени воздействия 3 часа)
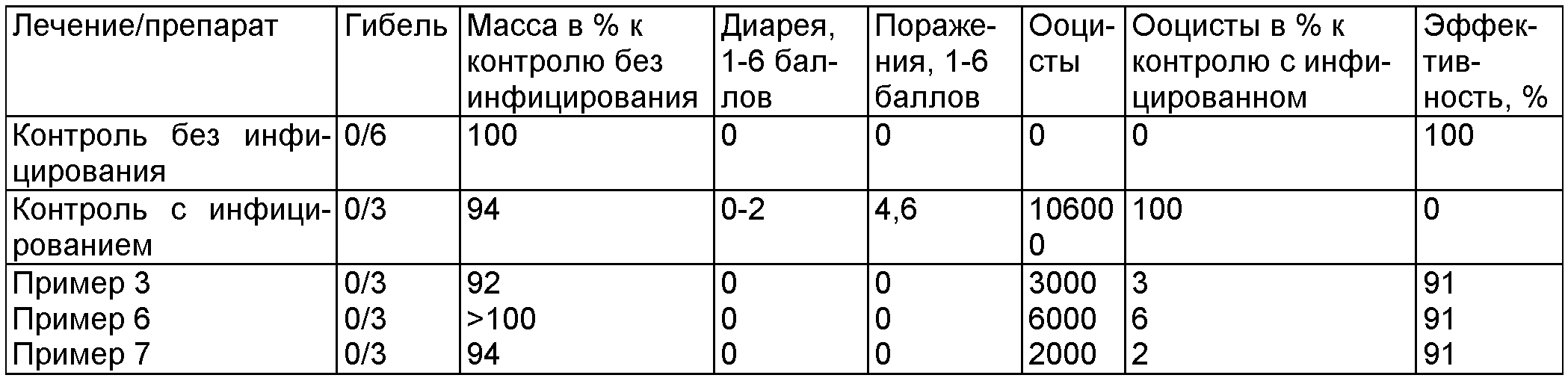
Биологический пример F
Проверка воздействия различных дезинфицирующих препаратов (4%) in vivo на ооцисты вида Eimeria tenella на цыплятах (по истечении времени воздействия 1 час)
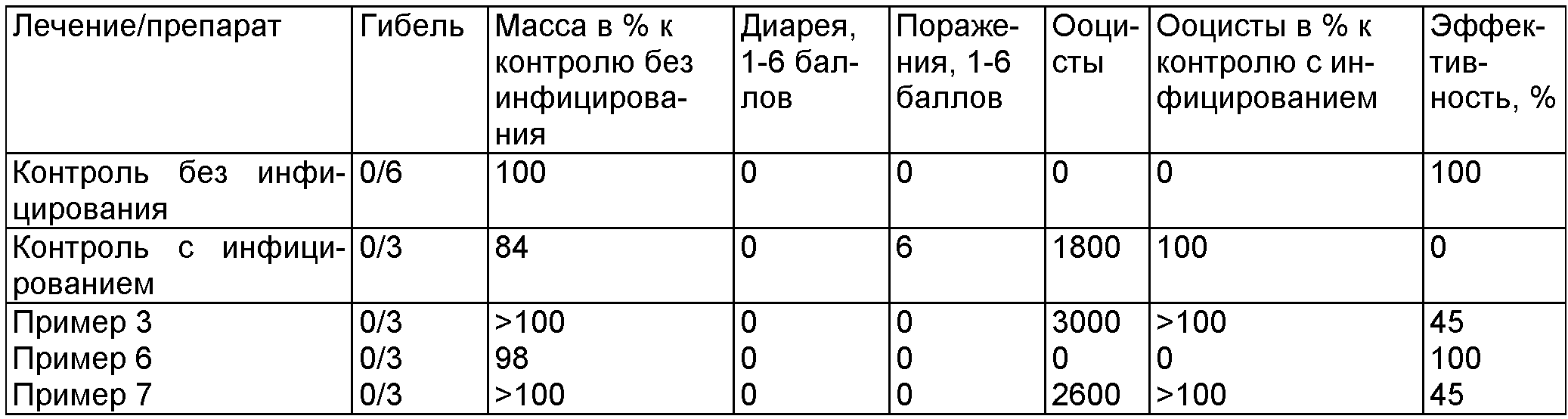
Биологический пример G
Проверка воздействия дезинфицирующего препарата из примера 6 (1%) in vitro на ооцисты вида Eimeria tenella по сравнению с неопредизаном (1%) (по истечении времени воздействия 1, 2 и 3 часа)
Биологический пример Н
Проверка воздействия дезинфицирующего препарата из примера 6 (1%, 4%) in vivo по сравнению с неопредизаном® (1%, 4%) на ооцисты вида Eimeria tenella на цыплятах (по истечении времени воздействия 1 час)
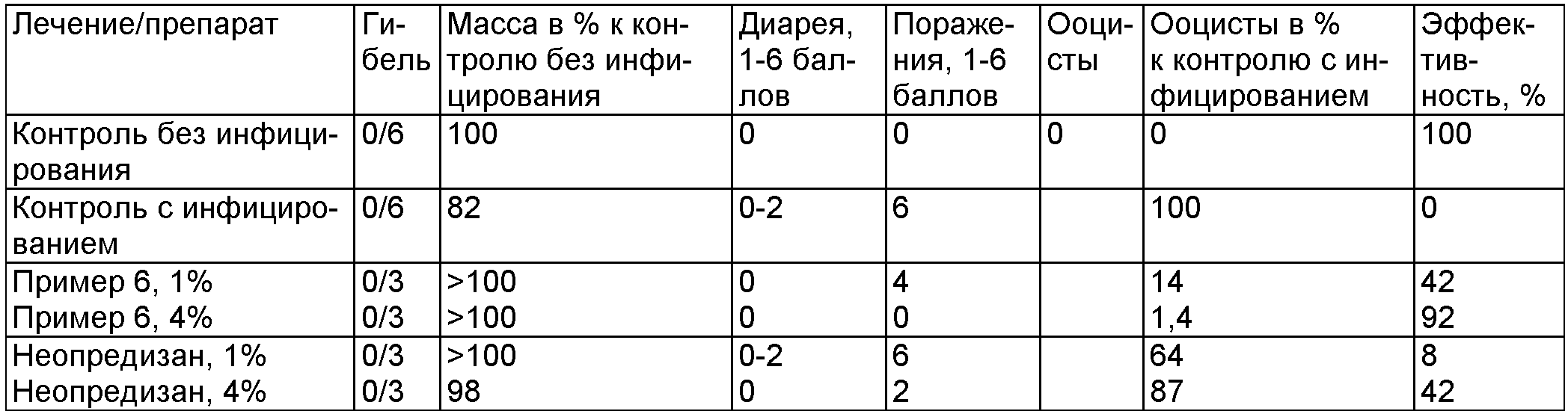

Реферат
Описывается дезинфицирующее средство, содержащее особую комбинацию биоцидных фенолов и при необходимости производных фенола, а также кератолитическое средство. Дезинфицирующее средство пригодно, прежде всего, для борьбы с паразитическими простейшими, включая их стойкие формы. 2 з.п. ф-лы, 8 табл.
Формула
(a) 45-60 мас.%, в пересчете на фенольные биоциды, 4-хлор-3-метил-фенола,
(b) 15-30 мас.%, в пересчете на фенольные биоциды, 2-бензил-4-хлорфенола и/или 13-45 мас.%, в пересчете на фенольные биоциды, 2-фенилфенола,
(c) 10-20 мас.%, в пересчете на фенольные биоциды, феноксиэтанола,
(d) 5-18 мас.%, в пересчете на средство, салициловой кислоты,
(e) 30-50 мас.%, в пересчете на средство, неводных растворителей,
(f) воду - остальное.
Документы, цитированные в отчёте о поиске
Способ получения галоидзамещенных соединений гидроксидифенила

Комментарии