Способ получения эфиров циклопропанкарбоновых кислот - SU584759A3
Код документа: SU584759A3
Описание
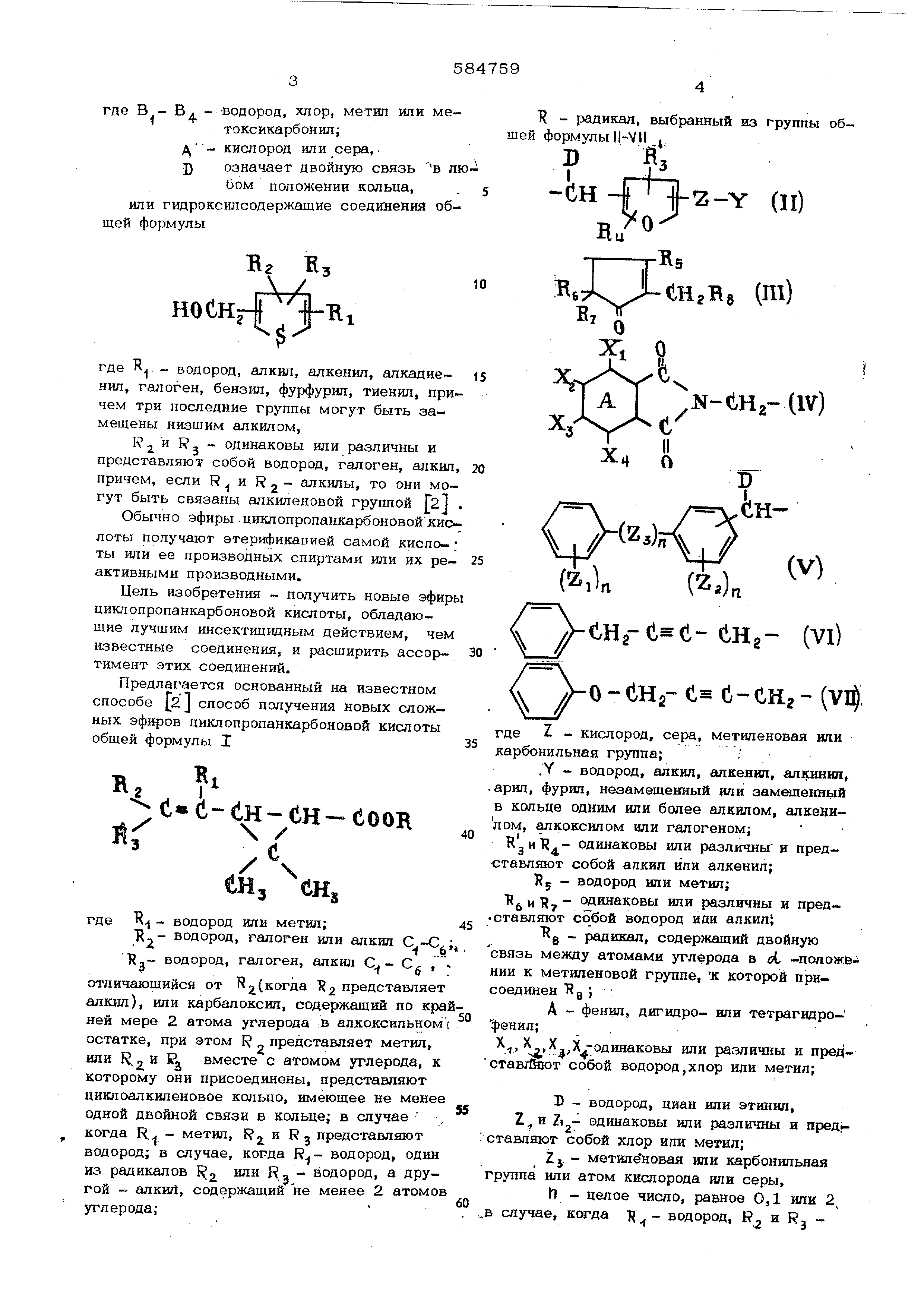
где В - Вд - водород, хлор, метил или метоксикарбонил; д - кислород или сера,. J) означает двойную связь в любом положении кольца,. или гидроксилсодержащие соединения общей формулы ХА НОСНг{7|-Ж; где R - водород, алкил, алкенил, алкадиеНИЛ , галоген, бензил, фурфурил, тиенил, причем три последние группы могут быть замещены низшим алкилом, R- - одинаковы или различны и представляют собой водород, галоген, алкил причем, если R и R 2 - алкилы, то они могут быть связаны алкиленовой группой Г21 Обычно эфиры .циклопропанкарбоновой кио лоты получают этерификацией самой кислоты или ее производных спиртами или их ре- активными производными. Цель изобретения - получить новые эфир циклопропан1сарбоновой кислоты, обладающие лучшим инсектицидным действием, чем известные соединения, и расширить ассор- тимент этих соединений. Предлагается основанный на известном способе 2j способ получения новых сложных эфиров циклопропанкарбоновой кислоты общей формулы I ; е«с-ен-ен еоок / енз енз где Т - водород или метил; R - водород, галоген или алкил , то R - водород, галоген, алкил С - С , отличающийся от Н2.( 2 представляет алк1ш), или карбалоксил, содержащий по кра ней мере 2 атома углерода :В алкоксильном остатке, при этом R представляет метил, или а вместе с атомом углерода, к которому они присоединены, представляют циклоалкиленовое кольцо, имеющее не менее одной двойной связи в кольце; в случае , когда R - метил, Rj и Rj представляют водород; в случае, когда водород, один из радикалов 1 -3 РУгой - алкиЛ, содержащий не менее 2 атомов углерода;
К - радикал, выбранный из шей формулы II-VII ,
в;
D
-СН -I -(-2-Y (II)
Уо
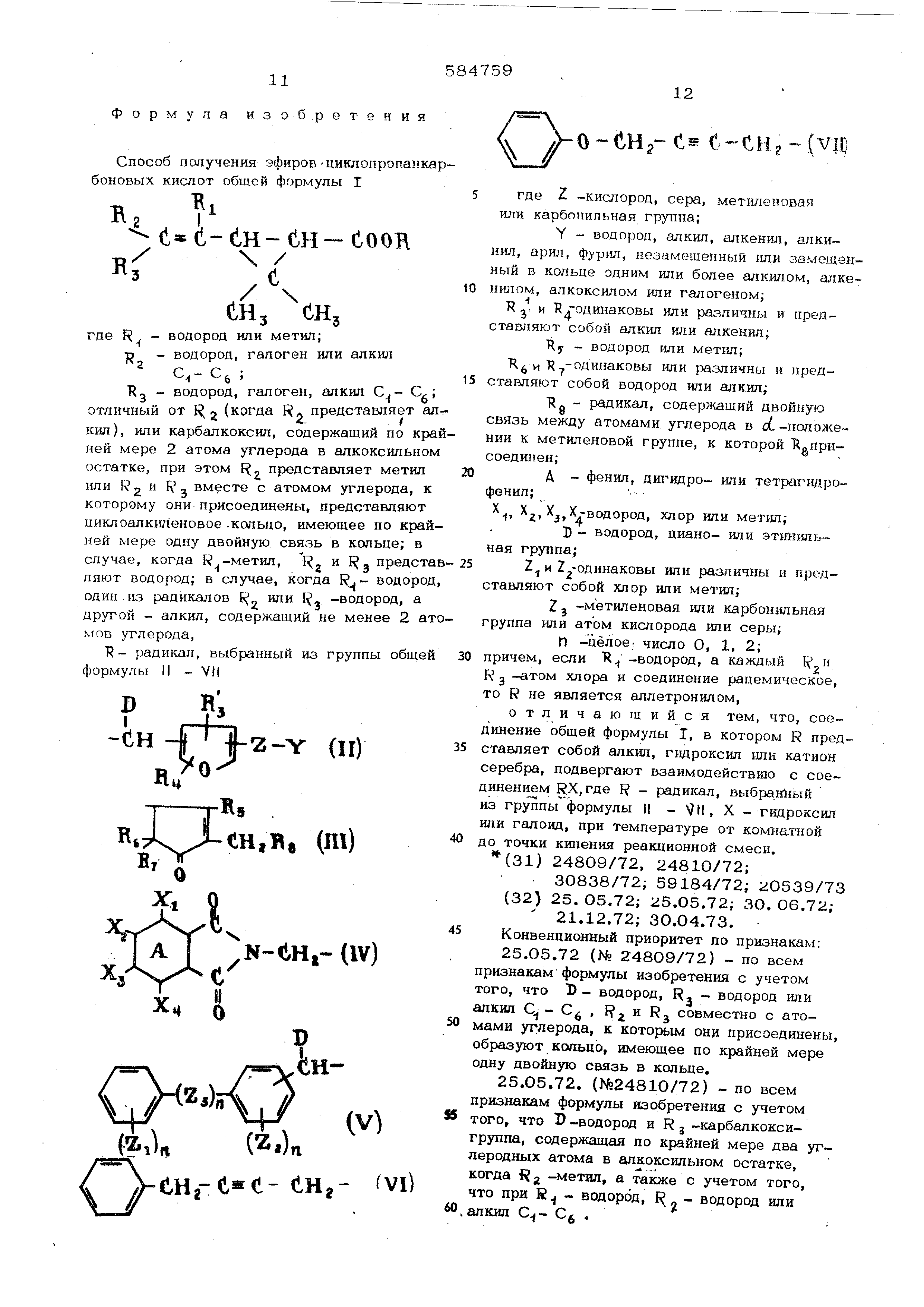
Дц бтЦ еНгВв (Ш) N-toa-llV) (гз)„-{ ( 2ii)n(Z.)n CLHg- (Vl) o-CHg-c-s (v4 где Z - кислород, сера, метиленовая или карбонильная группа;. , Y - водород, алкил, гшкенил, алкинип, арил, фурил, незамещенный или замшдекный в кольце одним или бсшее алкилом, алкенилом , алкоксилом или галогеном; к и Т.- одинаковы или различны и представляют собой апкип или алкенил; Т 5 - водород или метил; Т1 и одинаковы или различны и представляют собой водород иди алкил - радикал, содержащий двойную связь между атомами углерода в oi -ПОЛОЖЁ-; НИИ к метиленовой группе, К которой присоединен ; : А - фенил, дигидро- или тетрагидро- фенил; , 5,ХХ-одинаковы или различны и представЛйют собой водород,хпор или метил; Б - водород, циан или этинип, Z и 1 - одинаковы или различны и пред ставляют собой хлор или метил; Zj. - метиленовая или карбонильная группа или атом кислорода или серы, h - целое число, равное ОД иди 2 в случае, когда водород, R.J и Rj хлор и соединение рацемическое, то К не должно быть аллетронилом. Способ осуществляют взаимодействием циклопропаукарбоновой кислоты формулы 1 где R представляет собой алкил, гидроксил или катион серебра, с соединением RX, где R - радикал, выбранный из группы формулы И - , X -гидроксил или галоиДо Изомеры цис Итранс можно разделить селективной кристаллизацией из гексана, в котором цис- изомер лучше растворяетс Изомерную смесь можно растворить в гек сане при комнатной температуре и раствор охладить до осаждения транс-изомера. Такой осадок измельчают, промывают неболь шим объемом гексана при комнатной температуре и остаток перекристаллизовывают из гексана при температуре О или -20 С и получают транс-изомер. Цис-изомер выде ляют из гексановогб раствора. Согласно изобретению получают следую щие соединения: 5-бензил-З-фурилметиловый эфир 2,2-диметил-З- (бут-1-енил)-циклопропанкарб новой кислоты; 5-бензил-З-фУрилметиловый эфир 2,2-1диметил 3- (2 хлорвинил )-цикдопропанкарбоновой кислоты; 5-бенаил-З-фурилметиловый эфир 2,2метил-3- (2,2-дихлорвинил)-ч1Иклопропанка боновой кислоты; 5-бензил-3-фурилметиловый эфир 2,2- ил-3-( 2,2-аибромвинил)-циклопропан- карбоновой кислоты; З-феноксибензиловый эфир 2,2-диметш13- ( 2,2-тДихлорвинип) -циклопропанкарбоновой кислоты; ( Х-циан-З-феноксибензиловый эфир 2,2диметил-З- (2,2-дихл орвинил) -циклопропанкарбоновой кислоты; dC -циан-5-бензш1-3фурилметиловый эфир 2,2-днметил-3-(2,2йихлорвинил )-циклопропанкарбоновой кислоты; или с -циан-3-феноксибензш1овый эфир 2,2-диметил-3-(2,2-дихлорвиншт)-циклопропанкарбоновой кислоты. Пример. 0,2 моля натрия медленно добавляют к раствору 2 молей 5-бензил -фурилметилового спирта в толуоле. После окончания реакции натрия и спирта с образованием алкоголята натрия к реакционной смеси добавляют толуольный раствор, содержащий примерно 1 моль метилового или этилового эфира формулы 1 . Смесь нагревают с обратным холодильником с отделением метанола или этанола, образующегося в реакции переэтерификации. Из охлажденного раствора выделяют целевой 5-бензил-3-фу рил метиловый эфир с выходами 5О-7О% в пересчете на исходный алкилоБЫЙ эфир, структура подтверждена данными ЯМР и газожидкостной хроматографии. В табл. 1, приведены характеристики аналогично полученных соединений формулы, 1, в которых F 5-б нзил-З-фурилметил. Таблица 1





Реферат

Формула


Комментарии