Способ получения сахарного раствора - RU2516792C2
Код документа: RU2516792C2
Чертежи










Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения сахарного раствора из биомассы, содержащей целлюлозу.
Уровень техники
Процесс ферментационного получения химических продуктов при использовании сахаров в качестве сырья применяли для производства различных промышленных материалов. В настоящее время в качестве сахаров, используемых в качестве исходного сырья для ферментации, в промышленности используют сахара, полученные из пищевых материалов, таких как сахарный тростник, крахмал и сахарная свекла. Впрочем, ввиду того, что в будущем из-за увеличения мирового населения ожидается рост цен на пищевую продукцию, или по этическим соображениям, ввиду того, что сахара в качестве промышленных материалов могут конкурировать с сахаром как пищевым продуктом, необходимо разработать способ эффективного производства сахарного раствора из возобновляемого непищевого ресурса, то есть целлюлозосодержащей биомассы, или способ эффективной переработки полученного сахарного раствора как исходного сырья для ферментации в промышленный материал.
Примеры раскрытых способов получения сахарного раствора из целлюлозосодержащей биомассы включают способы получения сахарных растворов с применением серной кислоты, такие как способы получения сахарных растворов с помощью кислотного гидролиза целлюлозы и гемицеллюлозы при использовании концентрированной серной кислоты (Патентные документы 1 и 2), и способ, в котором целлюлозосодержащую биомассу подвергают гидролизной обработке с использованием разбавленной серной кислоты, а затем энзиматически обрабатывают целлюлазой и т.п. с получением сахарного раствора (Непатентный документ 1).
Кроме того, примеры раскрытых способов, в которых не используются кислоты, включают способ, в котором для получения сахарного раствора целлюлозосодержащую биомассу гидролизуют, используя воду в докритических условиях при температуре приблизительно 250-500°C (Патентный документ 3), способ, в котором целлюлозосодержащую биомассу подвергают обработке водой в докритических условиях с последующей ферментной обработкой, с получением сахарного раствора (Патентный документ 4), и способ, в котором целлюлозосодержащую биомассу подвергают гидролизной обработке под давлением водой, нагретой до 240°C-280°C, а затем обработке ферментами с получением сахарного раствора (Патентный документ 5).
Однако во время гидролиза целлюлозосодержащей биомассы, одновременно с разложением целлюлозного или гемицеллюлозного компонента или подобного, протекают реакции разложения образующихся сахаров, таких как глюкоза и ксилоза, при этом образуются такие побочные продукты, как соединения фурана, включая фурфурол и гидроксиметилфурфурол (ГМФ), а также органические кислоты, включая муравьиную кислоту, уксусную кислоту и левулиновую кислоту, которые представляют собой проблему. Кроме того, поскольку целлюлозосодержащая биомасса содержит лигниновые компоненты, которые являются ароматическими полимерами, лигниновые компоненты расщепляются в стадии кислотной обработки с образованием низкомолекулярных ароматических соединений, таких как фенолы, также являющиеся побочными продуктами. Указанные соединения оказывают ингибирующее действие в ходе стадии ферментации с использованием микроорганизмов и вызывают ингибирование роста микроорганизмов, что приводит к уменьшению выхода продукта ферментации. Таким образом, указанные соединения называются веществами, ингибирующими ферментацию, и представляют серьезную проблему при использовании сахарного раствора, полученного из целлюлозосодержащей биомассы, в качестве исходного сырья для ферментации.
Примеры раскрытого способа удаления подобных ингибирующих ферментацию веществ в ходе процесса производства сахарного раствора включают способ избыточной обработки известью (Непатентный документ 2). В данном способе, в ходе стадии нейтрализации целлюлозы, обработанной кислотой, или осахаренной жидкости с помощью добавления извести, жидкость выдерживают при нагревании до приблизительно 60°C в течение некоторого периода, с целью удаления ингибирующих ферментацию веществ, таких как фурфурол и ГМФ, вместе с образующимся сульфатом кальция. Однако избыточная обработка известью дает слабый эффект при удалении органических кислот, таких как муравьиная кислота, уксусная кислота и левулиновая кислота, которые являются проблематичными.
Далее, в качестве другого способа удаления веществ, ингибирующих ферментацию, был раскрыт способ, в котором в сахарный раствор, полученный из целлюлозосодержащей биомассы, пропускают водяной пар для удаления ингибирующих ферментацию веществ выпариванием (Патентный документ 6). Впрочем, поскольку такой способ удаления выпариванием зависит от температуры кипения ингибирующих ферментацию веществ, эффективность удаления ингибирующих ферментацию веществ, таких как органические кислоты, имеющие низкую температуру кипения, крайне низка, при этом для получения достаточной эффективности удаления требуется большое количество энергии, что является проблематичным.
Также существует способ, в котором вещества, ингибирующие ферментацию, удаляют посредством ионного обмена (Патентный документ 7), однако данный способ сложен ввиду высокой стоимости. Кроме того, существует способ, в котором проводят адсорбционное удаление при использовании древесного карбида, то есть активированного угля или подобного материала, однако удаляемые вещества ограничены гидрофобными соединениями, что является проблематичным (Патентный документ 8).
Документы из предшествующего уровня техники
Патентные документы
[Патентный документ 1] опубликованная японская переведенная заявка на патент PCT 11-506934
[Патентный документ 2] JP 2005-229821 A
[Патентный документ 3] JP 2003-212888 A
[Патентный документ 4] JP 2001-95597 A
[Патентный документ 5] JP 3041380 B
[Патентный документ 6] JP 2004-187650 A
[Патентный документ 7] опубликованная японская переведенная заявка на патент PCT 2001-511418
[Патентный документ 8] JP 2005-270056 A
Непатентные документы
[Непатентный документ 1] А A. Aden et al., "Lignocellulosic Biomass to Ethanol Process Design and Economics Utilizing Co-Current Dilute Acid Prehydrolysis and Enzymatic Hydrolysis for Corn Stover" NREL Technical Report (2002)
[Непатентный документ 1] M. Alfred et al., "Effect of pH, time and temperature of overliming on detoxification of dilute-acid hydrolyzates for fermentation by Saccaromyces cerevisiase" Process Biochemistry, 38, 515-522 (2002)
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Задачи, решаемые изобретением
В настоящем изобретении предложены способы решения вышеуказанных проблем, а именно способ, в котором ингибирующие ферментацию вещества, образующиеся в стадии получения сахара из целлюлозосодержащей биомассы, удаляются в ходе стадии получения сахарного раствора, а также способ получения очищенного сахарного раствора, содержащего очень малое количество ингибирующих ферментацию веществ.
Способы решения задач
Авторы настоящего изобретения тщательно изучали вышеуказанные проблемы с целью их решения и обнаружили, что при пропускании сахарного раствора через нанофильтрационную мембрану и/или обратноосмотическую мембрану в ходе стадии получения сахара из целлюлозосодержащей биомассы, сахар, который будет использоваться в качестве исходного сырья для ферментации, и ингибирующие ферментацию вещества могут быть разделены, при этом ингибирующие ферментацию вещества могут быть удалены из сахарного раствора. Таким образом, настоящее изобретение составлено следующими пунктами [1]-[14].
[1] Способ получения сахарного раствора с применением в качестве сырья целлюлозосодержащей биомассы, включающий:
(1) стадию гидролиза целлюлозосодержащей биомассы с получением водного сахарного раствора; и
(2) стадию пропускания полученного водного сахарного раствора через нанофильтрационную мембрану и/или обратноосмотическую мембрану со сбором очищенного сахарного раствора со стороны впуска и удалением ингибирующих ферментацию веществ со стороны фильтрата.
[2] Способ получения сахарного раствора согласно [1], где pH водного сахарного раствора в Стадии (2) доведен до 1-5.
[3] Способ получения сахарного раствора согласно [1] или [2], где ингибирующие ферментацию вещества включают одно или несколько веществ, выбранных из группы, состоящей из органических кислот, соединений фурана и фенольных соединений.
[4] Способ получения сахарного раствора согласно [3], где органическая кислота является муравьиной кислотой или уксусной кислотой.
[5] Способ получения сахарного раствора согласно [3], где соединение фурана является гидроксиметилфурфуролом или фурфуролом.
[6] Способ получения сахарного раствора согласно [3], где фенольное соединение является ванилином, ацетованилином или сиреневой кислотой.
[7] Способ получения сахарного раствора согласно любому из [1]-[6], где очищенный сахарный раствор в Стадии (2) является сахарным раствором, содержащим моносахарид в качестве основного компонента.
[8] Способ получения сахарного раствора согласно любому из [1]-[7], где водный сахарный раствор, полученный в Стадии (1), пропускают через микрофильтрационную мембрану и/или ультрафильтрационную мембрану для удаления мелких частиц и макромолекулярных компонентов перед обработкой в Стадии (2).
[9] Способ получения сахарного раствора согласно любому из [1]-[8], где температуру водного сахарного раствора в Стадии (2) доводят до 1-15°C и фильтруют раствор через нанофильтрационную мембрану.
[10] Способ получения сахарного раствора согласно любому из [1]-[8], где температуру водного сахарного раствора в Стадии (2) доводят до 40°C-80°C и фильтруют раствор через обратноосмотическую мембрану.
[11] Способ получения сахарного раствора согласно любому из [1]-[10], где Стадия (2) является стадией фильтрования водного сахарного раствора через нанофильтрационную мембрану и фильтрования полученного фильтрата через обратноосмотическую мембрану.
[12] Способ получения сахарного раствора согласно любому из [1]-[11], где функциональный слой (слои) нанофильтрационной мембраны и/или обратноосмотической мембраны в Стадии (2) представляет собой полиамид.
[13] Способ получения сахарного раствора согласно любому из [1]-[12], где функциональный слой нанофильтрационной мембраны в Стадии (2) включает сшитый пиперазин полиамид в качестве основного компонента и дополнительно включает составной компонент, представленный Химической формулой 1:
Химическая формула 1

(в которой R обозначает -H или -CH3, а n обозначает целое число от 0 до 3).
[14] Способ получения химического продукта, где в способе в качестве исходного сырья для ферментации применяется сахарный раствор, полученный с помощью способа получения сахарного раствора согласно любому из [1]-[13].
Технический результат изобретения
В соответствии с настоящим изобретением, соединения фурана, такие как фурфурол и ГМФ; органические кислоты, такие как уксусная кислота, муравьиная кислота и левулиновая кислота; и фенольные соединения, такие как ванилин; которые являются веществами, ингибирующими ферментацию, могут быть полностью удалены из водного сахарного раствора, полученного из целлюлозосодержащей биомассы, и в то же время сахара, такие как глюкоза и ксилоза, могут быть получены с высокой чистотой и высоким выходом. В результате, с применением очищенного сахарного раствора, полученного согласно настоящему изобретению, в качестве исходного сырья для ферментации, может быть повышена эффективность ферментационного получения различных химических продуктов.
Краткое описание фигур
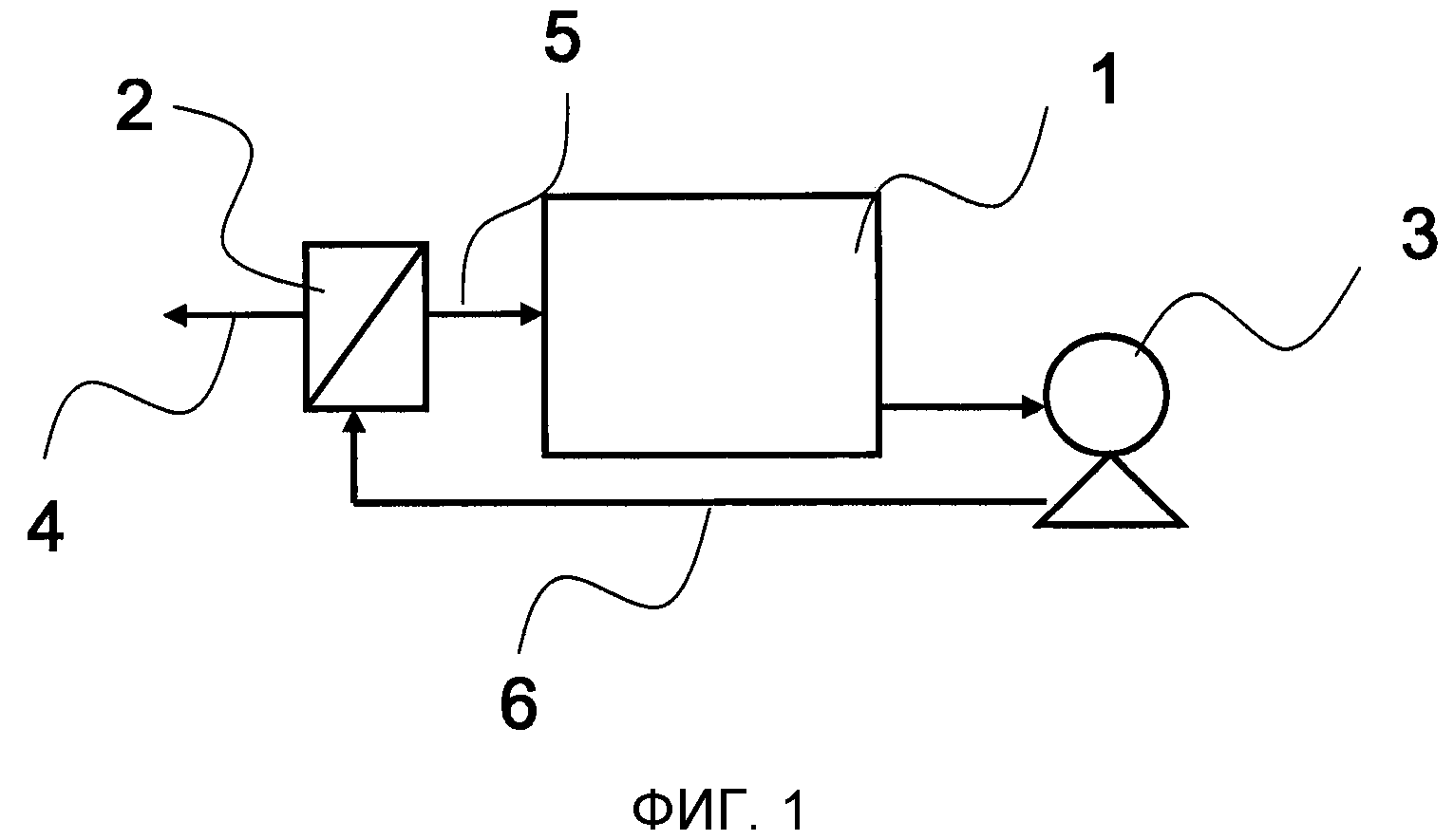
На фиг. 1 показан общий вид фильтрационного устройства, в котором применяется нанофильтрационная мембрана/обратноосмотическая мембрана.
На фиг. 2 показано схематическое изображение камеры из нержавеющей стали, которую использовали в тесте с плоской мембраной.
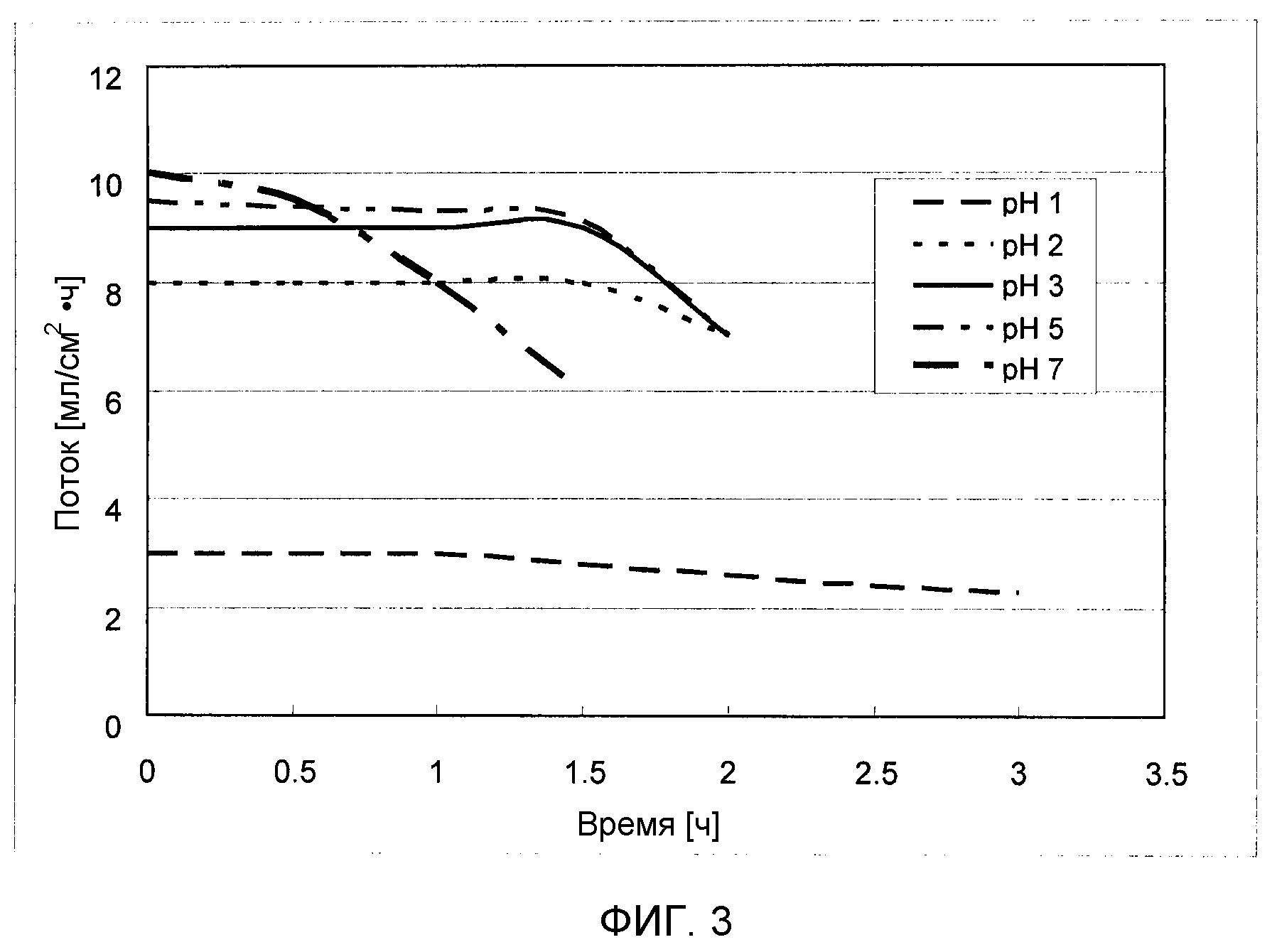
Фиг. 3 представляет собой график, на котором показано сравнение величины потока при различных pH в процессе фильтрации сахарного раствора через нанофильтрационную мембрану.
Фиг. 4 представляет собой график, на котором показано сравнение величины потока посредством способа, в котором сахарный раствор фильтруют через микрофильтрационную мембрану или ультрафильтрационную мембрану перед фильтрацией сахарного раствора через нанофильтрационную мембрану.
На фиг. 5 показаны фотографии поверхности мембраны до и после фильтрации гидротермически обработанной жидкости через микрофильтрационную мембрану, которые были сделаны с помощью растрового электронного микроскопа.
На фиг. 6 показаны результаты измерения распределения элементов при наблюдении растрово-электронных микрофотографий, показанных на фиг. 5, выполненного с помощью рентгеноспектрального анализатора на основе метода энергетической дисперсии, присоединенного к растровому электронному микроскопу.
Фиг. 7 представляет собой диаграмму, на которой показана схема дрожжевого вектора экспрессии pTRS11.
Наилучший вариант осуществления изобретения
Далее настоящее изобретение будет описано более подробно.
Примеры целлюлозосодержащей биомассы, используемой в способе получения сахарного раствора по настоящему изобретению, включают травяные биомассы, такие как выжимки сахарного тростника, просо прутьевидное, кукурузная солома, рисовая солома и пшеничная солома; а также древесную биомассу, такую как древесина и строительные отходы. Указанные целлюлозосодержащие биомассы содержат целлюлозу или гемицеллюлозу, которые являются полисахаридами, образующимися при конденсации и дегидратации сахаров. При гидролизе таких полисахаридов могут быть получены сахарные растворы, которые могут применяться в качестве исходного сырья для ферментации.
Сахарный раствор в настоящем изобретении означает водный сахарный раствор, полученный путем гидролиза целлюлозосодержащей биомассы. Сахара обычно классифицируют, с учетом степени полимеризации моносахаридов, на моносахариды, такие как глюкоза и ксилоза, олигосахариды, образованные при конденсации с дегидратацией 2-9 моносахаридов, и полисахариды, образованные при конденсации с дегидратацией не менее чем 10 моносахаридов. Сахарный раствор по настоящему изобретению означает сахарный раствор, содержащий моносахарид(ы) в качестве основного компонента (компонентов), и более конкретно, сахарный раствор по настоящему изобретению содержит глюкозу или ксилозу в качестве основного компонента. Кроме того, сахарный раствор по настоящему изобретению также содержит олигосахариды, такие как целлобиоза; и моносахариды, такие как арабиноза и манноза, хотя их количество является небольшим. В данном случае термин "содержит моносахарид в качестве основного компонента" означает, что моносахарид(ы) составляет(ют) не менее 80% по весу от общей массы сахаров, таких как моносахариды, олигосахариды и полисахариды, растворенных в воде. Конкретные примеры способа анализа моносахаридов, олигосахаридов и полисахаридов, растворенных в воде, включают количественный анализ ВЭЖХ, основанный на сравнении со стандартным образцом. Конкретные условия ВЭЖХ: реакционный раствор не используется; используется колонка Luna NH2 (производства Phenomenex, Inc.); подвижная фаза, вода сверхвысокой очистки:ацетонитрил = 25:75; скорость потока 0,6 мл/мин; время измерения 45 мин; способ детектирования, RI (дифференциальный показатель преломления); температура 30°C.
Далее будет описана Стадия (1), которая является стадией гидролиза целлюлозосодержащей биомассы в способе получения сахарного раствора по настоящему изобретению.
Когда целлюлозосодержащую биомассу подвергают гидролизу, целлюлозосодержащая биомасса может использоваться без дополнительной обработки или может быть подвергнута известной обработке, такой как обработка паром, измельчение или истирание. С помощью такой обработки эффективность гидролиза может быть повышена.
Стадия гидролиза целлюлозосодержащей биомассы не ограничивается, и ее конкретные примеры главным образом включают 6 методов, то есть методику A: метод, в котором используют только кислоту; методику B: метод, в котором проводят обработку кислотой с последующим использованием фермента; методику C: метод, в котором используют только гидротермическую обработку; методику D: метод, в котором проводят гидротермическую обработку с последующим использованием фермента; методику E: метод, в котором проводят обработку щелочью с последующим использованием фермента; и методику F: метод, в котором проводят обработку аммиаком с последующим использованием фермента.
В методике A для гидролиза целлюлозосодержащей биомассы используется кислота. Примеры используемой кислоты включают серную кислоту, азотную кислоту и соляную кислоту, при этом предпочтительно используется серная кислота.
Концентрация кислоты не ограничивается, при этом может использоваться кислота с концентрацией 0,1-99% по весу. В случаях, когда концентрация кислоты составляет 0,1-15% по весу, предпочтительно 0,5-5% по весу, температуру реакции устанавливают в пределах диапазона 100-300°C, предпочтительно 120-250°C, а время реакции устанавливают в пределах диапазона от 1 секунды до 60 минут. Количество циклов обработки не ограничивается, при этом вышеописанная обработка может быть выполнена 1 или более раз. В частности, в тех случаях, когда вышеописанную обработку выполняют 2 или более раз, условия при первой обработке могут отличаться от условий при второй и последующих обработках.
Кроме того, в случаях, когда концентрация кислоты составляет 15-95% по весу, предпочтительно 60-90% по весу, температуру реакции устанавливают в пределах диапазона 10-100°C, а время реакции устанавливают в пределах диапазона от 1 секунды до 60 минут.
Количество циклов обработки кислотой не ограничивается, при этом вышеописанная обработка может быть выполнена 1 или более раз. В частности, в тех случаях, когда вышеописанную обработку выполняют 2 или более раз, условия при первой обработке могут отличаться от условий при второй и последующих обработках.
Поскольку гидролизат, полученный после обработки кислотой, содержит кислоты, такие как серная кислота, его нужно нейтрализовать, чтобы он мог применяться в качестве исходного сырья для ферментации. Нейтрализация может быть выполнена либо в случае водного раствора кислоты, полученного при удалении твердых компонентов из гидролизата, или в состоянии, в котором содержатся твердые компоненты. Щелочной реагент, используемый для нейтрализации, не ограничивается и предпочтительно представляет собой одновалентный щелочной реагент. В случаях, когда кислотные и щелочные компоненты являются солями, имеющими валентность 2 или выше, во время стадии (2) они не проходят через нанофильтрационную мембрану, при этом соли осаждаются в жидкости в процессе концентрирования жидкости, что может вызвать забивание мембраны.
В случаях, когда используется одновалентная щелочь, примеры щелочи включают, помимо прочего, аммиак, гидроксид натрия и гидроксид калия.
В случаях, когда используется щелочной реагент, имеющий валентность 2 или выше, необходимо снижать количество кислоты и щелочи или использовать механизм для удаления осадков в ходе Стадии (2), чтобы избежать осаждения солей во время Стадии (2). В случаях, когда используется щелочь, имеющая валентность 2 или выше, щелочью предпочтительно является гидроксид кальция с учетом его низкой стоимости. Поскольку в тех случаях, когда используется гидроксид кальция, при нейтрализации образуется сульфат кальция, его нужно удалять разделением твердой и жидкой фаз. Примеры способа разделения твердой и жидкой фаз включают, помимо прочих, центрифугирование и разделение с помощью мембраны, при этом сульфат кальция также может быть удален с помощью нескольких типов стадий разделения.
Как правило, при гидролизе с использованием кислоты, сначала протекает гидролиз гемицеллюлозного компонента, имеющего низкую кристалличность, после чего протекает гидролиз целлюлозного компонента, имеющего высокую кристалличность. Поэтому при использовании кислоты можно получить жидкость, содержащую большое количество ксилозы, образующейся из гемицеллюлозы. Кроме того, при обработке кислотой, если после обработки подвергать биомассу, содержащую твердую фазу, реакции при более высоком давлении и более высокой температуре, чем при вышеуказанной обработке, целлюлозный компонент, имеющий более высокую кристалличность, может расщепляться с получением раствора, содержащего большое количество глюкозы, полученной из целлюлозы. Устанавливая двухэтапную стадию гидролиза, могут быть подобраны такие условия гидролиза, которые подходят для гемицеллюлозы и целлюлозы, при этом могут быть повышены эффективность разложения и выход сахара. Кроме того, при хранении сахарного раствора, полученного при первых условиях разложения, и сахарного раствора, полученного при вторых условиях разложениях, отдельно друг от друга, могут быть получены два типа сахарных растворов с различными отношениями моносахаридов, содержащихся в гидролизатах. Таким образом, также можно отделить сахарный раствор, полученный при первых условиях разложения, как сахарный раствор, содержащий в качестве основного компонента ксилозу, и сахарный раствор, полученный при вторых условиях разложения, как сахарный раствор, содержащий в качестве основного компонента глюкозу. Посредством разделения моносахаридных компонентов, содержащихся в сахарном растворе, как описано выше, ферментация может быть выполнена отдельно как ферментация, в которой в качестве исходного сырья для ферментации используется ксилоза в сахарном растворе, и как ферментация, в которой в качестве исходного сырья для ферментации используется глюкоза в сахарном растворе, где для соответствующих типов ферментации могут быть подобраны и применены наиболее подходящие виды микроорганизмов. Следует отметить, что сахар, полученный из обоих компонентов, также может быть получен сразу, без разделения гемицеллюлозного компонента/целлюлозного компонента, выполнением высокотемпературной обработки кислотой при высоком давлении в течение длительного времени.
В методике B обработанный раствор, полученный в методике A, дополнительно подвергают ферментативному гидролизу целлюлозосодержащей биомассы. Концентрация кислоты, которая используется в методике B, предпочтительно составляет 0,1-15% по весу, более предпочтительно 0,5-5% по весу. Температура реакции может быть установлена в пределах диапазона 100-300°C, предпочтительно 120-250°C. Время реакции может быть установлено в пределах диапазона от 1 секунды до 60 минут. Количество циклов обработки не ограничено, при этом вышеописанная обработка может быть выполнена 1 или более раз. В частности, в тех случаях, когда вышеописанную обработку выполняют 2 или более раз, условия при первой обработке могут отличаться от условий при второй и последующих обработках.
Поскольку гидролизат, полученный при обработке кислотой, содержит кислоты, такие как серную кислоту, он должен быть нейтрализован, чтобы его можно было далее подвергнуть реакции гидролиза ферментом или использовать в качестве исходного сырья для ферментации. Нейтрализация может быть выполнена аналогичным образом, как и нейтрализация в методике A.
Фермент не ограничивается, при условии, что он является ферментом, обладающим целлюлозорасщепляющей активностью, при этом могут применяться стандартно используемые целлюлазы. Фермент предпочтительно является целлюлазой, включающей целлюлазу экзо-типа или целлюлазу эндо-типа, которая обладает способностью расщеплять кристаллическую целлюлозу. В качестве подобной целлюлазы предпочтительна целлюлаза, продуцируемая микроорганизмом, принадлежащим к роду Trichoderma. Род Trichoderma включает микроорганизмы, относящиеся к нитчатым грибам, которые секретируют большое количество различных целлюлаз внеклеточно. Целлюлаза, используемая в настоящем изобретении, предпочтительно является целлюлазой из Trichoderma reesei. Кроме того, в качестве фермента, используемого для гидролиза, β-глюкозидаза, которая является ферментом, расщепляющим целлобиозу, может быть добавлена для повышения эффективности производства глюкозы, при этом β-глюкозидаза может также использоваться вместе с вышеуказанной целлюлазой для гидролиза. β-глюкозидаза не ограничивается, но предпочтительно происходит из рода Aspergillus. Реакциюгидролиза с использованием таких ферментов предпочтительно проводят при pH приблизительно 3-7, более предпочтительно при pH приблизительно 5. Температура реакции предпочтительно составляет 40-70°C. Кроме того, после завершения ферментативного гидролиза предпочтительно проводить разделение твердой и жидкой фаз, чтобы удалить твердые компоненты, которые не были расщеплены. Примеры способа удаления твердых компонентов включают центрифугирование и разделение с помощью мембран, впрочем, данный способ не ограничивается этим. Кроме того, такие способы разделения твердой и жидкой фаз могут применяться в виде комбинации нескольких способов.
В случаях, когда обработка кислотой сопровождается ферментативным гидролизом целлюлозосодержащей биомассы, предпочтительно проводить гидролиз гемицеллюлозы, имеющей низкую кристалличность, путем обработки кислотой при первом гидролизе, с последующим проведением гидролиза целлюлозы, имеющей высокую кристалличность, при использовании фермента во втором гидролизе. При использовании фермента во втором гидролизе стадию гидролиза целлюлозосодержащей биомассы можно провести более эффективно. Более конкретно, при первом гидролизе кислотой главным образом протекает гидролиз гемицеллюлозного компонента, содержащегося в целлюлозосодержащей биомассе, и частичное разложение лигнина, при этом получаемый в результате гидролизат разделяется на раствор кислоты и твердые компоненты, содержащие целлюлозу. Затем твердые компоненты, содержащие целлюлозу, гидролизуют при добавлении фермента. Поскольку разделенный/выделенный раствор в разбавленной серной кислоте в качестве основного компонента содержит ксилозу, которая является пентозой, водный сахарный раствор может быть выделен при нейтрализации кислотного раствора. Кроме того, из продукта реакции гидролиза твердых компонентов, содержащих целлюлозу, могут быть получены моносахаридные компоненты, содержащие глюкозу в качестве основного компонента. Водный сахарный раствор, полученный в результате нейтрализации, может быть смешан с твердыми компонентами, с последующим добавлением к полученной смеси фермента и проведением гидролиза.
В методике C, в частности, не добавляют кислоту, а воду добавляют таким образом, чтобы концентрация целлюлозосодержащей биомассы составляла 0,1-50% по весу, с последующей обработкой при температуре 100-400°C в течение от 1 секунды до 60 минут. При выполнении обработки в таких температурных условиях происходит гидролиз целлюлозы и гемицеллюлозы. Количество циклов обработки не ограничивается, при этом обработка может быть выполнена 1 или более раз. В частности, в случаях, когда вышеописанную обработку выполняют 2 или более раз, условия при первой обработке могут отличаться от условий при второй и последующих обработках.
Как правило, при гидролизе, в котором используют гидротермическую обработку, сначала протекает гидролиз гемицеллюлозного компонента, имеющего низкую кристалличность, с последующим разложением целлюлозного компонента, имеющего высокую кристалличность. Таким образом, при использовании гидротермической обработки можно получить раствор, содержащий большое количество ксилозы, полученной из гемицеллюлозы. Кроме того, при гидротермической обработке, подвергая после обработки твердые компоненты биомассы реакции при более высоком давлении и более высокой температуре, чем при вышеуказанной обработке, может быть расщеплен целлюлозный компонент, имеющий более высокую кристалличность, с получением раствора, содержащего большое количество глюкозы, полученной из целлюлозы. При введении двухэтапной стадии гидролиза могут быть подобраны условия гидролиза, подходящие для гемицеллюлозы и целлюлозы, при этом могут быть повышены эффективность разложения и выход сахара. Кроме того, при хранении сахарного раствора, полученного при первых условиях разложения, и сахарного раствора, полученного при вторых условиях разложения, отдельно друг от друга, могут быть получены два типа сахарных растворов с различными соотношениями моносахаридов, содержащихся в гидролизатах. Таким образом, также можно разделить сахарный раствор, полученный при первых условиях разложения, как сахарный раствор, содержащий в качестве основного компонента ксилозу, и сахарный раствор, полученный при вторых условиях разложения, как сахарный раствор, содержащий в качестве основного компонента глюкозу. Посредством разделения моносахаридных компонентов, содержащихся в сахарном растворе, как описано выше, ферментация может быть выполнена отдельно, как ферментация, в которой в качестве исходного сырья для ферментации используется ксилоза в сахарном растворе, и как ферментация, в которой в качестве исходного сырья для ферментации используется глюкоза в сахарном растворе, где могут быть подобраны и применены виды микроорганизмов, которые являются наиболее подходящими для соответствующих типов ферментации.
В методике D обработанную жидкость, полученную в методике C, дополнительно подвергают ферментативному гидролизу целлюлозосодержащей биомассы.
Используемый фермент может быть таким же, как фермент, используемый в методике B. Условия ферментной обработки также могут быть такими же, как соответствующие условия в методике B.
В тех случаях, когда гидротермическая обработка сопровождается гидролизом целлюлозосодержащей биомассы с использованием фермента, предпочтительно проводить гидролиз гемицеллюлозы, имеющей низкую кристалличность, с помощью гидротермической обработки при первом гидролизе, с последующим проведением гидролиза целлюлозы, имеющей высокую кристалличность, с использованием фермента при втором гидролизе. При использовании фермента во втором гидролизе стадию гидролиза целлюлозосодержащей биомассы можно провести более эффективно. Более конкретно, при первом гидролизе с помощью гидротермической обработки главным образом протекает гидролиз гемицеллюлозного компонента, содержащегося в целлюлозосодержащей биомассе, и частичное разложение лигнина, при этом получаемый в результате гидролизат разделяется на водный раствор и твердые компоненты, содержащие целлюлозу. Затем твердые компоненты, содержащие целлюлозу, гидролизуют при добавлении фермента. Разделенный/выделенный водный раствор в качестве основного компонента содержит ксилозу, которая является пентозой. Кроме того, из продукта реакции гидролиза твердых компонентов, содержащих целлюлозу, могут быть получены моносахаридные компоненты, содержащие в качестве основного компонента глюкозу. Водный раствор, полученный в результате гидротермической обработки, может быть смешан с твердыми компонентами, с последующим добавлением к полученной смеси фермента и проведением гидролиза.
В методике E используемая щелочь более предпочтительно является гидроксидом натрия или гидроксидом кальция. Указанные щелочи добавляют к целлюлозосодержащей биомассе таким образом, чтобы их концентрации находились в пределах диапазона 0,1-60% по весу, при этом обработка может быть выполнена при температуре в пределах диапазона 100-200°C, предпочтительно 110-180°C. Количество циклов обработки не ограничивается, при этом вышеописанная обработка может быть выполнена 1 или более раз. В частности, в тех случаях, когда вышеописанную обработку выполняют 2 или более раз, условия при первой обработке могут отличаться от условий при второй и последующих обработках.
Поскольку обработанный продукт, полученный в результате обработки щелочью, содержит такие щелочи, как гидроксид натрия, его необходимо нейтрализовать, чтобы его можно было подвергнуть далее реакции гидролиза с использованием фермента. Нейтрализация может быть выполнена либо для водного щелочного раствора, полученного в результате удаления твердых компонентов из гидролизата при разделении твердой и жидкой фаз, или в состоянии, в котором содержатся твердые компоненты. Кислотный реагент, используемый для нейтрализации, не ограничивается и предпочтительно является одновалентным кислотным реагентом. В случаях, когда и кислотные, и щелочные компоненты являются солями, имеющими валентность 2 или выше, в ходе Стадии (2) они не проходят через нанофильтрационную мембрану, при этом соли осаждаются в жидкости в ходе процесса концентрирования жидкости, что может вызвать забивание мембраны.
В случаях, когда используется одновалентная кислота, примеры кислоты включают, помимо прочих, азотную кислоту и соляную кислоту.
В случаях, когда используется кислотный реагент, имеющий валентность 2 или выше, необходимо снижать количества кислоты и щелочи или использовать механизм для удаления осадков в ходе Стадии (2), чтобы избежать осаждения солей во время Стадии (2). В случаях, когда используется кислота, имеющая валентность 2 или выше, кислота предпочтительно является серной кислотой или фосфорной кислотой. Поскольку в тех случаях, когда используется гидроксид кальция, в результате нейтрализации образуется сульфат кальция, сульфат кальция необходимо удалять путем разделения твердой и жидкой фаз. Примеры способа разделения твердой и жидкой фаз включают, помимо прочего, центрифугирование и разделение с помощью мембран, при этом сульфат кальция может быть также удален при выполнении нескольких типов стадий разделения.
Используемый фермент может быть таким же, как фермент, используемый в методике B. Условия ферментной обработки также могут быть такими же, как условия в методике B.
В случаях, когда после обработки щелочью целлюлозосодержащую биомассу гидролизуют с использованием фермента, лигниновый компонент вокруг гемицеллюлозного и целлюлозного компонентов удаляется путем смешивания целлюлозосодержащей биомассы с водным раствором, содержащим щелочь, и нагревания полученной смеси, что переводит, таким образом, гемицеллюлозный и целлюлозный компоненты в активное состояние, с последующим проведением ферментативного гидролиза гемицеллюлозы, имеющей низкую кристалличность, и целлюлозы, имеющей высокую кристалличность, которые не были расщеплены в гидротермическом процессе во время обработки щелочью. Более конкретно, при обработке щелочью главным образом протекает гидролиз части гемицеллюлозного компонента, содержащегося в целлюлозосодержащей биомассе, и частичное разложение лигнина, при этом получаемый в результате гидролизат разделяется на щелочной раствор и твердые компоненты, содержащие целлюлозу. Затем твердые компоненты, содержащие целлюлозу, после доведения pH гидролизуют при добавлении к ним фермента. В случаях, когда концентрация в щелочном растворе низкая, гидролиз может быть проведен сразу, при добавлении фермента после нейтрализации, без выделения твердых компонентов. Из продукта реакции гидролиза твердых компонентов, содержащих целлюлозу, могут быть получены моносахаридные компоненты, содержащие в качестве основного компонента глюкозу и ксилозу. Поскольку разделенный/выделенный щелочной раствор в качестве основного компонента содержит в дополнение к лигнину ксилозу, которая является пентозой, водный сахарный раствор может быть выделен при нейтрализации щелочного раствора. Водный сахарный раствор, полученный в результате нейтрализации, может быть смешан с твердыми компонентами, с последующим добавлением к полученной смеси фермента и проведением гидролиза.
Условия для обработки аммиаком в методике F основаны на JP 2008-161125 A и JP 2008-535664 A. Например, концентрация аммиака, добавляемого к целлюлозосодержащей биомассе, находится в пределах 0,1-15% по весу относительно целлюлозосодержащей биомассы, при этом обработку проводят при температуре 4-200°C, предпочтительно 90-150°C. Добавляемый аммиак может находиться в жидком или газообразном состоянии. Кроме того, добавляемый аммиак может быть в форме чистого аммиака или водного раствора аммиака. Количество циклов обработки не ограничивается, при этом обработка может быть выполнена 1 или более раз. В частности, в тех случаях, когда обработку выполняют 2 или более раз, условия при первой обработке могут отличаться от условий при второй и последующих обработках.
Обработанный продукт, полученный в результате обработки аммиаком, необходимо подвергнуть нейтрализации аммиака или удалению аммиака, чтобы затем выполнять реакцию гидролиза с использованием фермента. Нейтрализация может быть выполнена для аммиака, полученного при удалении твердых компонентов из гидролизата при разделении твердой и жидкой фаз, или в состоянии, в котором содержатся твердые компоненты. Кислотный реагент, используемый для нейтрализации, не ограничивается. Примеры кислотного реагента включают соляную кислоту, азотную кислоту и серную кислоту, при этом кислотным реагентом предпочтительно является серная кислота, принимая во внимание предотвращение коррозии в системе трубопроводов и предотвращение ингибирования ферментации. Аммиак может быть удален при выдерживании обработанного аммиаком продукта при пониженном давлении с целью испарения аммиака в виде газа. Удаленный аммиак можно улавливать и возвращать в процесс.
Известно, что при гидролизе с использованием фермента, после обработки аммиаком, кристаллическая структура целлюлозы изменяется при обработке аммиаком, в результате чего измененная кристаллическая структура позволяет легче протекать ферментной реакции. Таким образом, позволяя ферменту действовать на твердые компоненты после такой обработки аммиаком, гидролиз можно проводить более эффективно. Используемый фермент может быть таким же, как фермент, используемый в методике B. Условия при ферментной обработке также могут быть такими же, как условия в методике B.
В случаях, когда используется водный раствор аммиака, водный компонент, помимо аммиака, может давать эффект, аналогичный методике C (гидротермическая обработка), при этом могут проходить гидролиз гемицеллюлозы и разложение лигнина. В случаях, когда проводят обработку водным раствором аммиака с последующим гидролизом целлюлозосодержащей биомассы с использованием фермента, лигниновый компонент вокруг гемицеллюлозного и целлюлозного компонентов удаляется при смешивании целлюлозосодержащей биомассы с водным раствором, содержащим аммиак, и нагревании полученной смеси, что переводит таким образом гемицеллюлозный и целлюлозный компоненты в активное состояние, с последующим проведением ферментативного гидролиза гемицеллюлозы, имеющей низкую кристалличность, и целлюлозы, имеющей высокую кристалличность, которые не были расщеплены в гидротермическом процессе в ходе обработки аммиаком. Более конкретно, при обработке водным раствором аммиака главным образом протекает гидролиз части гемицеллюлозного компонента, содержащегося в целлюлозосодержащей биомассе, и частичное разложение лигнина, при этом получаемый в результате гидролизат разделяется на водный раствор аммиака и твердые компоненты, содержащие целлюлозу. Затем твердые компоненты, содержащие целлюлозу, после доведения pH гидролизуют при добавлении к ним фермента. В случаях, когда концентрация аммиака доходит до приблизительно 100%, большая часть аммиака может быть удалена при помощи дегазации, с последующей нейтрализацией и добавлением фермента, без выделения твердых компонентов с целью проведения гидролиза. Из продукта реакции гидролиза твердых компонентов, содержащих целлюлозу, могут быть получены моносахаридные компоненты, содержащие в качестве основного компонента глюкозу и ксилозу. Поскольку разделенный/выделенный водный раствор аммиака в качестве основного компонента в дополнение к лигнину содержит ксилозу, которая является пентозой, водный сахарный раствор может быть выделен при нейтрализации щелочного раствора. Затем водный сахарный раствор, полученный в результате нейтрализации, может быть смешан с твердыми компонентами, с последующим добавлением к ним фермента и проведением гидролиза.
Водный сахарный раствор, полученный в Стадии (1), может быть получен путем центрифугирования или разделения с помощью мембран с целью удаления твердых компонентов, как указано выше. В таких случаях, в зависимости от условий разделения, в особенности от используемой для разделения мембраны, удаление твердых компонентов может быть неполным и в растворе могут содержаться мелкие частицы. Примеры компонентов, составляющих такие мелкие частицы, включают, помимо прочего, лигнин, танин, кремнезем, кальций и нерасщепленную целлюлозу. Кроме того, крупность мелких частиц не ограничивается. Кроме того, в дополнение к мелким частицам также могут содержаться водорастворимые макромолекулярные компоненты. Примеры водорастворимых макромолекулярных компонентов, содержащихся в водном сахарном растворе, включают олигосахариды, полисахариды и танин, и, в случае водного сахарного раствора, полученного при использовании фермента, содержится большое количество фермента.
Присутствие мелких частиц или водорастворимых макромолекул, содержащихся в водном сахарном растворе, может вызывать забивание во время упоминаемой ниже непрерывной работы нанофильтрационной мембраны и/или обратноосмотической мембраны, хотя при этом работа может продолжаться. Вследствие этого частота замены нанофильтрационной мембраны и/или обратноосмотической мембраны может возрастать. В таких случаях предпочтительно удалять мелкие частицы в последующей обработке Стадии (1), пропуская водный сахарный раствор через микрофильтрационную мембрану и/или ультрафильтрационную мембрану, которые могут надежно удалять такие мелкие частицы и водорастворимые макромолекулы. Примеры фильтрации включают, помимо прочего, фильтрацию под давлением, вакуумную фильтрацию и фильтрацию на центрифуге. Кроме того, операция фильтрования примерно классифицируется на фильтрацию при постоянном давлении, фильтрацию при постоянном потоке и фильтрацию при непостоянном давлении/непостоянном потоке, впрочем, примеры операции фильтрования не ограничиваются этим. Операция фильтрования может быть также многостадийной фильтрацией, в которой микрофильтрационная мембрана или ультрафильтрационная мембрана используются 2 или более раз для эффективного удаления твердых компонентов. В данном случае материал и свойства используемой мембраны не ограничиваются.
Микрофильтрационная мембрана, используемая в настоящем изобретении, представляет собой мембрану, имеющую средний размер пор 0,01 мкм - 5 мм, которую для краткости называют микрофильтрационной, MF мембраной и т.п. Ультрафильтрационная мембрана, используемая в настоящем изобретении, представляет собой мембрану, имеющую границу пропускания по молекулярной массе 1000-200000, которую для краткости называют ультрафильтрационной, UF мембраной и т.п. В данном случае, в ультрафильтрационной мембране размер пор слишком мал, чтобы можно было измерить размер пор на поверхности мембраны с помощью электронного микроскопа или подобного, поэтому значение, называемое границей пропускания по молекулярной массе, используется в качестве показателя размера пор вместо среднего размера пор. Как описано, "кривую, полученную при отложении молекулярных масс растворенных веществ по оси абсцисс и процента задерживаемых веществ по оси ординат, называют кривой границы пропускания по молекулярной массе. Молекулярную массу, при которой процент задерживаемых веществ достигает 90%, называют границей пропускания по молекулярной массе", стр. 92, Membrane Society of Japan ed., Membrane Experiment Series, Vol. III, Artificial Membrane, редакционная комиссия: Shoji Kimura, Shin-ichi Nakao, Haruhiko Ohya и Tsutomu Nakagawa (1993, опубликовано Kyoritsu Shuppan Co., Ltd.), граница пропускания по молекулярной массе известна квалифицированным специалистам в данной области как показатель эффективности ультрафильтрационной мембраны.
Материал микрофильтрационной мембраны или ультрафильтрационной мембраны не ограничивается, при условии, что с ее помощью может быть достигнуто удаление мелких частиц, которое является целью настоящего изобретения, как указано выше, при этом соответствующие примеры материалов включают органические материалы, такие как целлюлоза, сложный эфир целлюлозы, полисульфон, полиэфирсульфон, хлорированный полиэтилен, полипропилен, полиолефин, поливиниловый спирт, полиметилметакрилат, поливинилиденфторид и политетрафторэтилен; металлы, такие как нержавеющая сталь; и неорганические материалы, такие как керамика. Материал микрофильтрационной мембраны или ультрафильтрационной мембраны может быть предпочтительно выбран в зависимости от свойств гидролизата и/или эксплуатационных затрат, при этом материалом предпочтительно является органический материал, более предпочтительно хлорированный полиэтилен, полипропилен, поливинилиденфторид, полисульфон или полиэфирсульфон.
Затем, при фильтровании водного сахарного раствора, полученного в Стадии (1), в особенности через ультрафильтрационную мембрану, фермент, который использовался для осахаривания, можно регенерировать на стороне впуска. Далее описывается процесс регенерации фермента. Фермент, используемый при гидролизе, имеет молекулярную массу в пределах 10000-100000, и, пропуская сахарный раствор, полученный в Стадии (1) настоящего изобретения, через ультрафильтрационную мембрану, имеющую границу пропускания по молекулярной массе, при которой фермент может быть задержан, фермент можно регенерировать из фракции на стороне впуска. Предпочтительно, при использовании ультрафильтрационной мембраны с границей пропускания по молекулярной массе в пределах 10000-30000, фермент, используемый при гидролизе, можно эффективно регенерировать. Форма используемой ультрафильтрационной мембраны не ограничивается, при этом мембрана может быть в форме плоской мембраны или в форме полого волокна. При повторном использовании регенерируемой целлюлазы при гидролизе в Стадии (1) количество используемого фермента может быть уменьшено. При выполнении такой фильтрации водного сахарного раствора с использованием ультрафильтрационной мембраны водный сахарный раствор предпочтительно предварительно обрабатывают, пропуская его через микрофильтрационную мембрану для удаления мелких частиц.
Примеры стадии обработки с применением микрофильтрационной мембраны и/или ультрафильтрационной мембраны после Стадии (1) включают методику α: метод, в котором жидкость фильтруют через микрофильтрационную мембрану; методику β: метод, в котором жидкость центрифугируют, а затем фильтруют через микрофильтрационную мембрану; методику γ: метод, в котором жидкость центрифугируют, а затем фильтруют через микрофильтрационную мембрану, с последующим фильтрованием через ультрафильтрационную мембрану; методику δ: разделение твердой и жидкой фаз выполняют с использованием фильтр-пресса, затем фильтрат фильтруют через ультрафильтрационную мембрану; и методику ε: разделение твердой и жидкой фаз выполняют с использованием фильтр-пресса, затем проводят микрофильтрацию, после чего фильтрат дополнительно пропускают через ультрафильтрационную мембрану.
В методике α сахарный раствор, полученный в Стадии (1), подвергают разделению твердой и жидкой фаз, используя только микрофильтрационную мембрану, в тех случаях, когда количество веществ, которые особенно склонны забивать поверхность микрофильтрационной мембраны, таких как твердые компоненты, представленные неразложенной целлюлозой и гелеобразными компонентами, образующимися из макромолекул, является небольшим. В данном случае можно удалить неразложенную целлюлозу и неорганические компоненты, такие как кремнезем, имеющие диаметр частиц не меньше нескольких десятков нанометров, содержащиеся в биомассе. Если такие твердые компоненты не удалить при пропускании жидкости через поверхность нанофильтрационной мембраны и/или обратноосмотической мембраны в Стадии (2), поверхность мембраны может быть повреждена, а мембрана может быть разрушена, или твердые компоненты могут быстро накапливаться на поверхности, уменьшая поток.
Далее, в случаях, когда количество твердых компонентов, таких как неразложенная целлюлоза, является большим и весь объем жидкости невозможно отфильтровать с помощью только микрофильтрационной мембраны из-за сильного уменьшения потока с течением времени, предварительно проводят центрифугирование, а затем выполняют обработку с использованием микрофильтрационной мембраны согласно методике β, обеспечивая таким образом удаление неразложенной целлюлозы и неорганических компонентов, таких как кремнезем, имеющих диаметр частиц не меньше нескольких десятков нанометров, содержащихся в биомассе. В методике β, также в тех случаях, когда количество твердых компонентов и гелеобразных компонентов является небольшим, компоненты, имеющие относительно большую массу, можно предварительно удалять с помощью центрифугирования, что уменьшает необходимость обслуживания микрофильтрационной мембраны и снижает общую стоимость процесса.
Далее, в методике γ, в которой, в дополнение к методике β, обработку ультрафильтрационной мембраной выполняют в следующей стадии, могут быть удалены неорганические частицы, имеющие размер не больше нескольких десятков нанометров, которые нельзя удалить с помощью микрофильтрационной мембраны; водорастворимые макромолекулярные компоненты, образовавшиеся из лигнина (танин); сахара, которые были гидролизованы, но все еще находятся в середине процесса разложения на моносахариды в виде олигосахаридов или полисахаридов; и фермент, используемый для гидролиза сахара. В упомянутой ниже Стадии (2) неорганические частицы могут повреждать и разрушать мембрану, или накапливаться на мембране, уменьшая поток. Кроме того, ультрадисперсные частицы/агрегаты, имеющие диаметр не более чем несколько нанометров, которые обычно агрегируют и существуют в виде частиц/агрегатов, имеющих диаметр несколько десятков нанометров, могут проникать внутрь мембраны и забивать мембрану. Аналогичным образом, танин, олигосахариды, полисахариды и ферменты могут быть факторами, которые образуют гель и накапливаются на мембране или забивают мембрану изнутри. Таким образом, при дополнительной обработке с использованием ультрафильтрационной мембраны, загрязнение мембраны в Стадии (2) предотвращается, и может быть значительно снижена стоимость обслуживания мембраны. Далее, в случае стадии, в которой фермент используется при проведении гидролиза, фермент может регенерироваться при использовании ультрафильтрационной мембраны, после чего фермент, задержанный ультрафильтрационной мембраной, может повторно использоваться при возвращении в стадию гидролиза в Стадии (1), что является преимуществом.
Далее, в случаях, когда выбирается методика δ, в которой для дополнительного увеличения прозрачности жидкости в ходе разделения твердой и жидкой фаз может использоваться фильтр-пресс, фильтрование на центрифуге, скоростное центрифугирование и т.п., стадия микрофильтрации из методики γ может быть пропущена, и может непосредственно выполняться стадия фильтрования на ультрафильтрационной мембране.
Далее, в случаях, когда прозрачность жидкости является низкой, то есть в случаях, когда высока мутность жидкости, забивание мембраны более часто происходит в стадии фильтрования на ультрафильтрационной мембране, что может привести к повышению стоимости обслуживания. Таким образом, при выборе, в зависимости от эксплуатационных затрат для ультрафильтрационной мембраны, методики ε, которая является методом разделения твердой и жидкой фаз с получением жидкой фазы высокой прозрачности, включающим обработку на микрофильтрационной мембране перед обработкой на ультрафильтрационной мембране с целью предотвращения забивания ультрафильтрационной мембраны, общие эксплуатационные затраты для микрофильтрационной мембраны и ультрафильтрационной мембраны могут снизиться по сравнению с методикой δ, в которой используется только ультрафильтрационная мембрана.
Далее описывается Стадия (2) способа получения сахарного раствора по настоящему изобретению, которая является стадией, в которой водный сахарный раствор пропускают через нанофильтрационную мембрану и/или обратноосмотическую мембрану, регенерируют очищенный сахарный раствор на стороне впуска и удаляют вещества, ингибирующие ферментацию, на стороне фильтрата.
Термин "ингибирование ферментации", используемый в настоящем изобретении, означает явление, при котором количество готового продукта, количество накопления или производительность уменьшаются в случаях, когда химический продукт производят, используя в качестве исходного сырья для ферментации сахарный раствор, полученный при использовании в качестве исходного материала целлюлозосодержащей биомассы, содержащей ингибирующие ферментацию вещества, по сравнению со случаями, в которых в качестве исходного сырья для ферментации используется химически чистый моносахарид. Степень такого ингибирования ферментации в настоящем изобретении не ограничивается, поскольку степень, в которой микроорганизм ингибируется, изменяется в зависимости от типов ингибирующих ферментацию веществ, присутствующих в осахаренной жидкости, и их количества, причем степень ингибирования также изменяется в зависимости от видов используемых микроорганизмов и типа химического продукта, продуцируемого микроорганизмом.
Любой водный сахарный раствор, полученный с помощью методик гидролиза целлюлозосодержащей биомассы, содержит ингибирующие ферментацию вещества, хотя их количество или состав изменяются в зависимости от методики или типа целлюлозосодержащей биомассы, используемой в качестве сырья. Такие ингибирующие ферментацию вещества могут быть удалены из водного сахарного раствора в Стадии (2). Ингибирующие ферментацию вещества являются такими соединениями, которые образуются в процессе гидролиза целлюлозосодержащей биомассы и оказывают ингибирующее действие, как указано выше, в ходе стадии ферментации с использованием сахарного раствора, полученного согласно способу получения по настоящему изобретению. Ингибирующие ферментацию вещества образуются в особенности в ходе стадии обработки целлюлозосодержащей биомассы кислотой и приблизительно могут быть отнесены к органическим кислотам, соединениям фурана и фенольным соединениям.
Примеры органических кислот включают уксусную кислоту, муравьиную кислоту и левулиновую кислоту. Примеры соединений фурана включают фурфурол и гидроксиметилфурфурол (ГМФ). Такие органические кислоты и соединения фурана являются продуктами, образующимися при разложении глюкозы или ксилозы, которые являются моносахаридами.
Конкретные примеры фенольных соединений включают ванилин, ацетованилин, ванилиновую кислоту, сиреневую кислоту, галловую кислоту, конифериловый альдегид, дигидроконифериловый спирт, гидрохинон, пирокатехин, ацетогваякон, гомованилиновую кислоту, 4-гидроксибензойную кислоту и 4-гидрокси-3-метоксифенильные производные (кетоны Хибберта). Указанные соединения образуются из лигнина или предшественников лигнина.
Далее, в случаях, когда в качестве целлюлозосодержащей биомассы используются строительные отходы, фанера или подобное, в качестве веществ, ингибирующих ферментацию, могут содержаться такие компоненты, как клеи и краски, используемые в процессе деревообработки. Примеры клеев включают карбамидные смолы, меламиновые смолы, фенольные смолы и сополимеры карбамида/меламина. Примеры ингибирующих ферментацию веществ, образующихся из таких клеев, включают уксусную кислоту, муравьиную кислоту и формальдегид.
Водный сахарный раствор, полученный в Стадии (1), содержит, по меньшей мере, одно из веществ, замедляющих ферментацию, при этом водный сахарный раствор фактически содержит множество веществ. Указанные ингибирующие ферментацию вещества могут быть обнаружены и количественно проанализированы с помощью стандартного метода анализа, такого как тонкослойная хроматография, газовая хроматография или высокоэффективная жидкостная хроматография.
Нанофильтрационная мембрана, используемая в настоящем изобретении, также называется нанофильтром (нанофильтрационной мембраной, NF мембраной) и обычно определяется как "мембрана, которая пропускает одновалентные ионы, но задерживает двухвалентные ионы". Мембрана, как считают, имеет мелкие пустоты, имеющие размер приблизительно нескольких нанометров, и главным образом применяется для задержки мелких частиц, молекул, ионов и солей, содержащихся в воде.
Обратноосмотическая мембрана, используемая в настоящем изобретении, также называется RO мембраной и обычно определяется как "мембрана, выполняющая функцию обессоливания воды, которая также может удалять одновалентные ионы". Мембрана, как считают, имеет ультрамелкие пустоты, имеющие размер в пределах от приблизительно нескольких ангстремов до нескольких нанометров, и главным образом применяется для удаления ионных компонентов, например, при опреснении морской воды и получения ультраочищенной воды.
Термин "фильтрованный через нанофильтрационную мембрану и/или обратноосмотическую мембрану" в настоящем изобретении означает, что сахарный раствор, полученный при гидролизе целлюлозосодержащей биомассы, фильтруют через нанофильтрационную мембрану и/или обратноосмотическую мембрану с целью задержки или отделения сахарного раствора, содержащего растворенные сахара, в особенности растворенные моносахариды, такие как глюкоза и ксилоза, на стороне впуска, в то время как ингибирующие ферментацию вещества проходят в виде пермеата или фильтрата.
Эффективность нанофильтрационной мембраны и/или обратноосмотической мембраны, используемой в настоящем изобретении, может быть оценена посредством вычисления степени проницаемости (%) для рассматриваемого соединения (ингибирующего ферментацию вещества, моносахарида и т.п.), содержащегося в водном сахарном растворе. Способ вычисления степени проницаемости (%) представлен в Уравнении 1.
Степень проницаемости (%) = (концентрация рассматриваемого соединения на стороне фильтрата/концентрация рассматриваемого соединения в нефильтрованной жидкости)×100...(Уравнение 1)
Способ измерения концентрации рассматриваемого соединения в Уравнении 1 не ограничивается, при условии, что концентрация может быть измерена с высокой точностью и воспроизводимостью, и предпочтительные примеры способа включают высокоэффективную жидкостную хроматографию и газовую хроматографию. В случаях, когда рассматриваемым соединением является моносахарид, его степень проницаемости через нанофильтрационную мембрану и/или обратноосмотическую мембрану, используемую в настоящем изобретении, предпочтительно является низкой, тогда как в случаях, когда рассматриваемым соединением является вещество, ингибирующее ферментацию, его степень проницаемости предпочтительно является высокой.
Что касается эффективности фильтрации нанофильтрационной мембраны, предпочтительно используется нанофильтрационная мембрана, у которой объемная скорость фильтрации хлорида натрия (500 мг/л) на единицу площади мембраны (м3/м2/день) при давлении фильтрации 0,3 МПа составляет 0,5-0,8. Объемная скорость фильтрации на единицу площади мембраны (поток через мембрану или поток) может быть вычислена в соответствии с Уравнением 2, путем измерения количества фильтрованной жидкости, времени накопления фильтрованной жидкости и площади мембраны.
Поток через мембрану (м3/м2/день) = количество фильтрованной жидкости/площадь мембраны/время накопления жидкости... (Уравнение 2)
Значение pH водного сахарного раствора, пропускаемого через нанофильтрационную мембрану и/или обратноосмотическую мембрану, не ограничивается и предпочтительно составляет 1-5. В случаях, когда pH меньше 1, мембрана, при ее использовании в течение длительного времени, разрушается, что приводит к существенному уменьшению показателей производительности мембраны, таких как поток и степень проницаемости, тогда как в случаях, когда pH больше 5, может значительно снизиться степень удаления органических кислот, таких как уксусная кислота, муравьиная кислота и левулиновая кислота. Поскольку поверхность(и) нанофильтрационной мембраны и/или обратноосмотической мембраны заряжена, вещества, ионизированные в растворе, подвержены удалению или задержке в большей степени, чем неионизированные вещества, таким образом, в случаях, когда содержание органических кислот, содержащихся в водном сахарном растворе, является высоким, или в случаях, когда требуется высокая эффективность удаления, эффективность удаления может быть значительно повышена путем регуляции pH водного сахарного раствора в пределах вышеописанного диапазона. Другой эффект фильтрования водного сахарного раствора, pH которого был доведен до 1-5, через нанофильтрационную мембрану и/или обратноосмотическую мембрану, заключается в предотвращении забивания мембраны. В большинстве случаев начальные значения потока уменьшаются с уменьшением pH, однако, особенно в случае водного сахарного раствора, полученного из целлюлозосодержащей биомассы, стабильность мембраны может поддерживаться дольше при pH 1-5.
Далее, особенно в случае обратноосмотической мембраны, pH водного сахарного раствора предпочтительно доводят до 1-3. Аналогично нанофильтрационной мембране, в случаях, когда pH меньше 1, обратноосмотическая мембрана разрушается при ее длительном использовании, что приводит к значительному снижению показателей производительности мембраны, таких как поток и степень проницаемости. С другой стороны, в случаях, когда pH больше 3, уровень удаления органических кислот может быть недостаточным. Это может быть вызвано тем, что вследствие меньших размеров пор обратноосмотической мембраны, чем у нанофильтрационной мембраны или подобной, радиус иона, который является эффективным радиусом органической кислоты, является слишком большим, чтобы сохранялась эффективность удаления, эквивалентная эффективности нанофильтрационной мембраны, без дальнейшей потери заряда, возникающего в результате ионизации элюируемых компонентов.
Применение обратноосмотической мембраны низкого давления/ультранизкого давления, при использовании которой может быть снижено рабочее давление, среди обратноосмотических мембран, позволяет достичь степени удаления органических кислот, эквивалентной соответствующему показателю RO мембраны, которая не является мембраной низкого давления/ультранизкого давления, даже в случаях, когда доведенный уровень pH исходной жидкости превышает 3. Таким образом может быть достигнут эффект уменьшения количества кислоты, используемой для доведения pH, и уменьшения количества щелочи, используемой для доведения pH, на стадии ферментации в последующем процессе, при этом степень удаления органических кислот увеличивается по сравнению с обратноосмотической мембраной, которая не является мембраной низкого давления/ультранизкого давления, таким образом, в настоящем изобретении предпочтительно применяется обратноосмотическая мембрана низкого давления/ультранизкого давления. В данном случае обратноосмотическая мембрана низкого давления/ультранизкого давления означает обратноосмотическую мембрану, у которой объемная скорость фильтрации хлорида натрия (500 мг/л) на единицу площади мембраны (м3/м2/день) при давлении фильтрации 0,75 МПа составляет не менее 0,4.
Кислота или щелочь, используемые для доведения pH водного сахарного раствора, не ограничиваются. Кислота предпочтительно является соляной кислотой, серной кислотой, азотной кислотой или фосфорной кислотой, более предпочтительно серной кислотой, азотной кислотой или фосфорной кислотой, с учетом того, что во время ферментации ингибирование будет происходить с меньшей вероятностью, и еще более предпочтительно серной кислотой, с учетом экономической эффективности. Щелочью предпочтительно является аммиак, гидроксид натрия или гидроксид кальция, или содержащий их водный раствор, ввиду экономической эффективности, более предпочтительно аммиак или натрий, которые являются одновалентными ионами, ввиду забивания мембраны, еще более предпочтительно аммиак, с учетом того, что во время ферментации ингибирование будет происходить с меньшей вероятностью.
Стадия, в которой проводят регуляцию pH водного сахарного раствора, может предшествовать обработке на нанофильтрационной мембране и/или обратноосмотической мембране. Кроме того, в случаях, когда фермент используется для гидролиза целлюлозосодержащей биомассы, pH может быть доведен не более чем до 5 при выполнении реакции гидролиза. Кроме того, в случаях, когда используется процесс регенерации фермента при использовании ультрафильтрационной мембраны, фермент, вероятно, будет дезактивирован, если pH снизится не более чем до 4, таким образом, после обработки на ультрафильтрационной мембране pH фильтрата предпочтительно регулируют.
Температура водного сахарного раствора, подвергаемого обработке нанофильтрационной мембраной и/или обратноосмотической мембраной в настоящем изобретении, не ограничивается, при этом температура может быть установлена в соответствии с задачей повышения способности удаления веществ, ингибирующих ферментацию, во время фильтрации через используемую мембрану.
Более конкретно, в случаях, когда фильтрацию выполняют через обратноосмотическую мембрану, способность удаления веществ, ингибирующих ферментацию, обратноосмотической мембраны является высокой, если температура водного сахарного раствора составляет 40-80°C, поэтому температуру предпочтительно устанавливают в пределах указанного диапазона. Это вызвано тем, что способность удаления начинает увеличиваться при температуре водного сахарного раствора 40°C или выше в случаях, когда фильтрацию выполняют через нанофильтрационную мембрану, однако температура выше 80°C может вызвать разрушение обратноосмотической мембраны, приводя к потере свойств мембраны.
В случаях, когда фильтрацию выполняют через нанофильтрационную мембрану, температуру водного сахарного раствора предпочтительно устанавливают в пределах 1-15°C. Если температура водного сахарного раствора меньше 1°C в случаях, когда фильтрацию выполняют через нанофильтрационную мембрану, трубы могут замерзнуть изнутри, вызывая ошибки устройства, тогда как в случаях, когда температура превышает 15°C, эффект уменьшения потери не проявляется в значительной степени. Регулирование температуры основано на том, что в случаях, когда температура является высокой, происходит набухание мембраны, вещества с большой молекулярной массой удаляются, при этом величина удаления имеет тенденцию увеличиваться, тогда как в случаях, когда температура является низкой, происходит сжатие мембраны, при этом размеры пор мембраны уменьшаются, что приводит к уменьшению потери сахара на сторону фильтрата.
Так как нанофильтрационная мембрана обычно классифицируется как мембрана, имеющая больший размер пор, чем обратноосмотическая мембрана, в случаях, когда нанофильтрационная мембрана используется в Стадии (2), вещества, ингибирующие ферментацию, проходят через мембрану, при этом масса удаляемых веществ больше по сравнению с массой веществ, удаляемых обратноосмотической мембраной, впрочем, с другой стороны, считается, что масса моносахаридов, которые являются целевыми продуктами, теряемых на стороне фильтрата, также велика. В частности, в тех случаях, когда концентрация сахара высока, подобная тенденция проявляется в значительной степени. С другой стороны, в тех случаях, когда обратноосмотическая мембрана используется в Стадии (2), считается, что из-за малых размеров пор масса ингибирующих веществ, имеющих большую молекулярную массу, которые могут быть удалены, меньше, чем в случае нанофильтрационной мембраны. Таким образом, предпочтительно из нанофильтрационных мембран и обратноосмотических мембран выбрать подходящую мембрану, в зависимости от массы ингибирующих ферментацию веществ и молекулярной массы основных ингибирующих ферментацию веществ в сахарном растворе, полученном при вышеописанной обработке. Количество типов выбираемых мембран не должно быть обязательно равно одному, при этом несколько типов мембран может быть выбрано из нанофильтрационных мембран и обратноосмотических мембран, используемых в комбинации для фильтрации.
Было обнаружено, что в случаях, когда очищенный сахарный раствор получают с использованием нанофильтрационной мембраны, в процессе выполнения очистки моносахаридов, улавливаемых на стороне концентрата нанофильтрационной мембраны, и увеличения их концентрации, тенденция потери моносахаридов на стороне фильтрата резко возрастает. С другой стороны, в случаях, когда очистку выполняют с использованием обратноосмотической мембраны, тенденция потери моносахаридов постоянно практически равна нулю, даже когда концентрация моносахаридов на стороне концентрата увеличивается, впрочем, ввиду удаления ингибирующих ферментацию веществ, нанофильтрационная мембрана показывает более высокую эффективность, чем обратноосмотическая мембрана. Таким образом, было обнаружено, что потеря моносахаридов на стороне фильтрата может быть понижена с одновременным удалением большого количества ингибирующих ферментацию веществ при выполнении процесса очистки с применением нанофильтрационной мембраны, с помощью которой может быть удалено большее количество ингибирующих ферментацию веществ по сравнению с обратноосмотической мембраной, до концентрации, при которой потеря сахаров с фильтратом является высокой, с последующим продолжением процесса очистки с применением обратноосмотической мембраны, которая обеспечивает несколько меньшую эффективность удаления ингибирующих ферментацию веществ, чем нанофильтрационная мембрана, но может концентрировать моносахариды без потери. Таким образом, в случаях, когда нанофильтрационная мембрана и обратноосмотическая мембрана применяются в комбинации для получения очищенного сахарного раствора в настоящем изобретении, комбинация не ограничивается, однако предпочтительно фильтровать водный сахарный раствор, полученный в Стадии (1), сначала через нанофильтрационную мембрану, с последующим фильтрованием полученного фильтрата через обратноосмотическую мембрану.
Примеры материала нанофильтрационной мембраны, которая может применяться в настоящем изобретении, включают макромолекулярные материалы, такие как полимеры ацетилцеллюлозы, полиамиды, полиэфиры, полиимиды и виниловые полимеры. Мембрана не ограничивается мембраной, состоящей только из одного материала, и может быть мембраной, включающей несколько мембранных материалов. С учетом структуры мембраны, мембрана может быть либо асимметричной мембраной, которая имеет плотный слой, по меньшей мере, на одной стороне, и микропоры, размер пор которых постепенно увеличивается в направлении от плотного слоя внутрь мембраны или по направлению к другой стороне мембраны, или композитной мембраной, которая имеет очень тонкий функциональный слой, сформированный из другого материала на плотном слое асимметричной мембраны. Примеры композитной мембраны, которая может применяться, включают композитную мембрану, описанную в JP 62-201606 A, имеющую нанофильтр, который состоит из полиамидного функционального слоя на поддерживающей мембране, включающей в качестве мембранного материала полисульфон.
Из перечисленного предпочтительна композитная мембрана, с функциональным слоем из полиамида, так как она устойчива к высокому давлению, обладает высокой проницаемостью и высокой эффективностью удаления растворенных веществ, что делает мембрану чрезвычайно перспективной. Для сохранения стойкости при рабочем давлении, высокой проницаемости и высокой задерживающей эффективности подходит мембрана, имеющая структуру, в которой в качестве функционального слоя используется полиамидный слой, который поддерживается на подложке, включающей пористую мембрану и нетканый материал. Кроме того, в качестве полупроницаемой полиамидной мембраны подходит композитная полупроницаемая мембрана, которая на подложке имеет функциональный слой сшитого полиамида, полученного в результате реакции поликонденсации между полифункциональным амином и полифункциональным галогенангидридом.
В нанофильтрационной мембране, функциональный слой которой состоит из полиамида, предпочтительные примеры карбоновых кислот мономеров, составляющих полиамид, включают ароматические карбоновые кислоты, такие как тримезиновая кислота, бензофенонтетракарбоновая кислота, тримеллитовая кислота, пиромеллитовая кислота, изофталевая кислота, терефталевая кислота, нафталиндикарбоновая кислота, дифенилкарбоновая кислота и пиридинкарбоновая кислота. Ввиду растворимости по отношению к пленкообразующим растворителям, более предпочтительными являются тримезиновая кислота, изофталевая кислота и терефталевая кислота, а также их смеси.
Предпочтительные примеры аминокомпонента мономеров, составляющих полиамид, включают первичные диамины, имеющие ароматическое кольцо, такие как м-фенилендиамин, бензидин, метилен-бис-дианилин, 4,4'-диаминобифенилэфир, дианизидин, 3,3',4-триаминобифениловый эфир, 3,3',4,4'-тетрааминобифениловый эфир, 3,3'-диоксибензидин, 1,8-нафталиндиамин, м(п)-монометилфенилендиамин, 3,3'-монометиламино-4,4'-диаминобифениловый эфир, 4,N,N'-(4-аминобензоил)-п(м)-фенилендиамин-2,2'-бис(4-аминофенилбензоимидазол), 2,2'-бис(4-аминофенилбензооксазол) и 2,2'-бис(4-аминофенилбензотиазол); а также вторичные диамины, такие как пиперазин, пиперидин и их производные. Из перечисленного предпочтительно используется нанофильтрационная мембрана, функциональный слой которой состоит из сшитого полиамида, включающего пиперазин или пиперидин в качестве мономеров, так как он обладает теплостойкостью и химической стойкостью в дополнение к долговечности и устойчивости к давлению. Полиамид более предпочтительно содержит в качестве основного компонента сшитый пиперазин полиамид или сшитый пиперидин полиамид и дополнительно содержит составляющий компонент, представленный Химической формулой 1, еще более предпочтительно в качестве основного компонента содержит сшитый пиперазин полиамид и дополнительно содержит составной компонент, представленный Химической формулой 1. Кроме того, предпочтительно, в Химической формуле 1 n=3. Примеры нанофильтрационной мембраны, функциональный слой которой состоит из полиамида, содержащего сшитый пиперазин полиамид в качестве основного компонента и дополнительно содержащего составной компонент, представленный Химической формулой 1, включают мембрану, описанную в JP 62-201606 A, и ее конкретные примеры включают UTC60, изготовленную компанией TORAY INDUSTRIES, INC., которая представляет собой нанофильтрационную мембрану из сшитого пиперазин полиамида, функциональный слой которой состоит из полиамида, содержащего в качестве основного компонента сшитый пиперазин полиамид и дополнительно содержащего составной компонент, представленный Химической формулой 1, в которой n=3.
Нанофильтрационная мембрана обычно применяется в виде мембранного модуля со спиральной намоткой, при этом нанофильтрационная мембрана, применяемая в настоящем изобретении, также предпочтительно используется в виде мембранного модуля со спиральной намоткой. Конкретные предпочтительные примеры нанофильтрационного мембранного модуля включают GEsepa, который представляет собой ацетилцеллюлозную нанофильтрационную мембрану, изготавливаемую фирмой GE Osmonics; NF99 и NF99HF, которые являются нанофильтрационными мембранами с функциональным слоем из полиамида, изготавливаемыми фирмой Alfa-Laval; NF-45, NF-90, NF-200, NF-270 и NF-400, которые являются нанофильтрационными мембранами с функциональным слоем из сшитого пиперазин полиамида, изготавливаемыми корпорацией Filmtec; и SU-210, SU-220, SU-600 и SU-610, которые являются нанофильтрационными мембранными модулями, которые, как и UTC60, производит TORAY INDUSTRIES, INC., и функциональный слой которых состоит из полиамида, содержащего сшитый пиперазин полиамид в качестве основного компонента и дополнительно содержащего составной компонент, представленный Химической формулой 1. Нанофильтрационным мембранным модулем более предпочтительно является NF99 или NF99HF, которые являются нанофильтрационными мембранами с функциональным слоем из полиамида, производимыми фирмой Alfa-Laval; NF-45, NF-90, NF-200 или NF-400, которые являются нанофильтрационными мембранами с функциональным слоем из сшитого пиперазин полиамида, производимыми корпорацией Filmtec; или SU-210, SU-220, SU-600 или SU-610, которые являются нанофильтрационными мембранными модулями, производимыми, как и UTC60, TORAY INDUSTRIES, INC., функциональный слой которых состоит из полиамида, содержащего сшитый пиперазин полиамид в качестве основного компонента и дополнительно содержащего составной компонент, представленный Химической формулой 1. Нанофильтрационным мембранным модулем еще более предпочтительно является SU-210, SU-220, SU-600 или SU-610, которые являются нанофильтрационными мембранными модулями, производимыми, как и UTC60, TORAY INDUSTRIES, INC., функциональный слой которых состоит из полиамида, содержащего сшитый пиперазин полиамид в качестве основного компонента и дополнительно содержащего составной компонент, представленный Химической формулой 1.
Фильтрация через нанофильтрационную мембрану в Стадии (2) может быть выполнена под давлением, причем давление фильтрации предпочтительно находится в пределах 0,1-8 МПа. В случаях, когда давление фильтрации меньше 0,1 МПа, может уменьшиться степень проницаемости мембраны, тогда как в случаях, когда давление фильтрации больше 8 МПа, мембрана может быть повреждена. В случаях, когда давление фильтрации находится в пределах 0,5-7 МПа, поток через мембрану является высоким, поэтому сахарный раствор может эффективно проходить, и возможность повреждения мембраны остается низкой, что более предпочтительно. Наиболее предпочтительно диапазон составляет 1-6 МПа.
С учетом материала обратноосмотической мембраны, применяемой в настоящем изобретении, примеры мембраны включают композитную мембрану с функциональным слоем из ацетилцеллюлозного полимера (в дальнейшем также называемую ацетилцеллюлозной обратноосмотической мембраной) и композитную мембрану, функциональный слой которой состоит из полиамида (в дальнейшем также называемую полиамидной обратноосмотической мембраной). В данном случае примеры ацетилцеллюлозного полимера включают полимеры, полученные на основе сложных эфиров целлюлозы и органических кислот, такие как ацетилцеллюлоза, диацетилцеллюлоза, триацетилцеллюлоза, пропионат целлюлозы и бутират целлюлозы, которые можно использовать отдельно, в виде смеси или в виде смешанного эфира. Примеры полиамида включают линейные полимеры и сшитые полимеры, состоящие из алифатических и/или ароматических диаминовых мономеров.
Конкретные примеры обратноосмотической мембраны, применяемой в настоящем изобретении, включают полиамидные обратноосмотические мембранные модули, производимые TORAY INDUSTRIES, INC., такие как модули ультранизкого давления SUL-G10 и SUL-G20, модули низкого давления SU-710, SU-720, SU-720F, SU-710L, SU-720L, SU-720LF, SU-720R, SU-710P и SU-720P, а также модули высокого давления SU-810, SU-820, SU-820L и SU-820FA, содержащие UTC80 в качестве обратноосмотической мембраны; ацетилцеллюлозные обратноосмотические мембраны SC-L100R, SC-L200R, SC-1100, SC-1200, SC-2100, SC-2200, SC-3100, SC-3200, SC-8100 и SC-8200, изготавливаемые тем же производителем; NTR-759HR, NTR-729HF, NTR-70SWC, ES10-D, ES20-D, ES20-U, ES15-D, ES15-U и LF10-D, производимые корпорацией Nitto Denko; RO98pHt, RO99, HR98PP и CE4040C-30D, производимые Alfa-Laval; GE Sepa производимые GE; BW30-4040, TW30-4040, XLE-4040, LP-4040, LE-4040, SW30-4040 и SW30HRLE-4040, производимые корпорацией FilmTec; TFC-ЧАС и TFC-ULP, производимые KOCH; а также ACM-1, ACM-2 и ACM-4, производимые TRISEP.
В настоящем изобретении предпочтительно применяется обратноосмотическая мембрана, материалом которой является полиамид. Это объясняется тем, что когда ацетилцеллюлозная мембрана используется в течение длительного времени, ферменты, используемые в предыдущей стадии, особенно часть целлюлазного компонента, могут проникать в мембрану и расщеплять целлюлозу, которая является материалом мембраны.
Примеры формы мембраны, которая может применяться в качестве подходящей, включают плоскую мембрану, мембрану со спиральной намоткой и мембрану из полого волокна.
Фильтрация через обратноосмотическую мембрану в Стадии (2) может быть выполнена под давлением, при этом давление фильтрации предпочтительно находится в пределах диапазона 0,1-8 МПа. В случаях, когда давление фильтрации меньше 0,1 МПа, может уменьшаться степень проницаемости мембраны, тогда как в случаях, когда давление фильтрации больше 8 МПа, мембрана может быть повреждена. В случаях, когда давление фильтрации находится в пределах диапазона 0,5-7 МПа, поток через мембрану является высоким, поэтому сахарный раствор может эффективно проходить, и возможность повреждения мембраны остается низкой, что более предпочтительно. Наиболее предпочтительно диапазон составляет 1-6 МПа.
В Стадии (2) вещества, ингибирующие ферментацию, удаляются из водного сахарного раствора, проникая через нанофильтрационную мембрану и/или обратноосмотическую мембрану. Из веществ, ингибирующих ферментацию, предпочтительно могут проходить/удаляться ГМФ, фурфурол, уксусная кислота, муравьиная кислота, левулиновая кислота, ванилин, ацетованилин и сиреневая кислота. С другой стороны, сахар, содержащийся в водном сахарном растворе, задерживается или отделяется на стороне впуска нанофильтрационной мембраны и/или обратноосмотической мембраны. Сахар содержит моносахариды, такие как глюкоза и ксилоза, в качестве основных компонентов, а также содержит сахарные компоненты, которые не были полностью расщеплены на моносахариды в ходе процесса гидролиза в Стадии (1), такие как дисахариды и олигосахариды.
В Стадии (2), при сравнении с водным сахарным раствором до прохождения через нанофильтрационную мембрану и/или обратноосмотическую мембрану, очищенный сахарный раствор, полученный со стороны впуска нанофильтрационной мембраны и/или обратноосмотической мембраны, имеет пониженное содержание в особенности веществ, ингибирующих ферментацию, относительно их исходного содержания. Сахарные компоненты, содержащиеся в очищенном сахарном растворе, являются сахарами, полученными из целлюлозосодержащей биомассы, и, по существу, они не отличаются значительно от сахарных компонентов, полученных при гидролизе в Стадии (1). Таким образом, моносахариды, содержащиеся в очищенном сахарном растворе по настоящему изобретению, включают глюкозу и/или ксилозу в качестве основного компонента(ов). Соотношение между глюкозой и ксилозой изменяется в зависимости от стадии гидролиза в Стадии (1) и не ограничивается в настоящем изобретении. Таким образом, в случаях, когда проводят гидролиз главным образом гемицеллюлозы, ксилоза является основным моносахаридным компонентом, тогда как в случаях, когда гемицеллюлоза расщеплена и затем только целлюлозный компонент отделяют и гидролизуют, основным моносахаридным компонентом является глюкоза. Далее, в тех случаях, когда разложение гемицеллюлозы, разложение целлюлозы и разделение не проводят, в качестве основных моносахаридных компонентов содержатся глюкоза и ксилоза.
Очищенный сахарный раствор, полученный в Стадии (2), может быть сконцентрирован однократно при использовании концентратора, такого как испаритель, или очищенный сахарный раствор можно дополнительно профильтровать через нанофильтрационную мембрану и/или обратноосмотическую мембрану, чтобы увеличить концентрацию. Ввиду снижения расхода энергии при концентрировании, предпочтительно используется стадия дополнительного увеличения концентрации путем фильтрования очищенного сахарного раствора через нанофильтрационную мембрану и/или обратноосмотическую мембрану. Мембрана, используемая в данной стадии концентрирования, является мембранным фильтром, который удаляет ионы и низкомолекулярные соединения, используя в качестве движущей силы больший перепад давления, чем осмотическое давление обрабатываемой жидкости, при этом примеры мембран, которые могут применяться, включают целлюлозные мембраны, например, изготовленные из ацетилцеллюлозы, и мембраны, изготовленные с помощью поликонденсации полифункционального аминосоединения и полифункционального галогенангидрида, с получением разделительного функционального слоя, изготовленного из полиамида, на микропористой поддерживающей мембране. В целях предотвращения загрязнения, то есть забивания поверхности (поверхностей) нанофильтрационной мембраны и/или обратноосмотической мембраны, также может предпочтительно использоваться мало загрязняемая обратноосмотическая мембрана, которая в основном применяется для очистки сточных вод и которую изготавливают, покрывая поверхность разделительного функционального слоя, изготовленного из полиамида, водным раствором соединения, имеющего, по меньшей мере, одну реакционноспособную группу, взаимодействующую с галогенангидридной группой, в результате чего галогенангидридные группы, остающиеся на поверхности разделительного функционального слоя, образуют ковалентные связи с реакционноспособными группами. В качестве нанофильтрационной мембраны и/или обратноосмотической мембраны, применяемой в настоящем изобретении, более предпочтительно может применяться мембрана, обладающая более высокой степенью задержки моносахаридов, таких как глюкоза и ксилоза, чем нанофильтрационная мембрана и/или обратноосмотическая мембрана, используемые в Стадии (2).
Конкретными примерами нанофильтрационной мембраны или обратноосмотической мембраны, используемой для концентрирования, являются такие же конкретные примеры нанофильтрационной мембраны или обратноосмотической мембраны, как описанные выше.
Вода, выходящая в виде фильтрата в Стадии (2), может повторно использоваться в стадии получения сахара, такой как гидролиз или очистка сахара, или в последующей стадии получения химического продукта, такой как ферментация или очистка химического продукта. Кроме того, перед повторным использованием фильтрат можно профильтровать через нанофильтрационную мембрану и/или обратноосмотическую мембрану еще раз. Более предпочтительно pH доводят до 1-5 и очищают жидкость, используя нанофильтрационную мембрану и/или обратноосмотическую мембрану, с последующим пропусканием фильтрата через нанофильтрационную мембрану и/или обратноосмотическую мембрану и его повторным использованием. Еще более предпочтительно pH доводят до 1-5 и очищают жидкость с помощью нанофильтрационной мембраны и/или обратноосмотической мембраны, с последующим повторным повышением pH, селективным удалением в особенности органических кислот при использовании нанофильтрационной мембраны и/или обратноосмотической мембраны и повторным использованием.
Далее описывается способ получения химического продукта с применением в качестве исходного сырья для ферментации очищенного сахарного раствора, полученного с помощью способа получения сахарного раствора по настоящему изобретению.
При использовании очищенного сахарного раствора, полученного согласно настоящему изобретению, в качестве исходного сырья для ферментации может быть получен химический продукт. Очищенный сахарный раствор, получаемый в настоящем изобретении, содержит в качестве основных компонентов глюкозу и/или ксилозу, которые являются источниками углерода для роста микроорганизмов или культивируемых клеток. С другой стороны, содержание ингибирующих ферментацию веществ, таких как соединения фурана, органические кислоты и ароматические соединения, является очень низким. Таким образом, очищенный сахарный раствор может эффективно применяться в качестве исходного сырья для ферментации, в особенности источника углерода.
Примеры микроорганизмов или культивируемых клеток, применяемых в способе получения химического продукта согласно настоящему изобретению, включают дрожжи, такие как хлебопекарные дрожжи, которые обычно применяются в ферментационной промышленности; бактерии, такие как E. coli и коринеформные бактерии; нитчатые грибы; актиномицеты; клетки животных и клетки насекомых. Используемые микроорганизмы или культивируемые клетки могут быть выделены из окружающей среды, или могут быть такими, свойства которых были частично модифицированы в результате мутации или рекомбинации генов. В частности, так как сахарный раствор, полученный из целлюлозосодержащей биомассы, содержит пентозы, такие как ксилоза, то предпочтительно могут использоваться микроорганизмы, у которых были усовершенствованы пути метаболизма пентоз.
В качестве питательной среды, используемой в способе получения химического продукта согласно настоящему изобретению, предпочтительно используются жидкая питательная среда, содержащая в дополнение к очищенному сахарному раствору источники азота, неорганические соли и, при необходимости, органические питательные микроэлементы, такие как аминокислоты и витамины. Очищенный сахарный раствор по настоящему изобретению содержит в качестве источников углерода моносахариды, которые могут использоваться микроорганизмами, такие как глюкоза и ксилоза, однако, в некоторых случаях, сахара, такие как глюкоза, сахароза, фруктоза, галактоза и лактоза; осахаренные крахмальные растворы, содержащие указанные сахара; патока из батата; патока из сахарной свеклы; высококачественная патока; органические кислоты, такие как уксусная кислота; спирты, такие как этанол; глицерин и т.п. могут быть дополнительно добавлены в качестве источников углерода при использовании очищенного сахарного раствора в качестве исходного сырья для ферментации. Примеры используемых источников азота включают газообразный аммиак, водный раствор аммиака, соли аммония, мочевину и соли азотной кислоты; и другие органические источники азота, используемые дополнительно, такие как жмых, гидролизаты сои, гидролизаты казеина, другие аминокислоты, витамины, кукурузные экстракты, дрожжи или дрожжевые экстракты, мясные экстракты, пептиды, такие как пептоны, а также клетки различных ферментационных микроорганизмов и их гидролизаты. Примеры неорганических солей, которые могут быть добавлены в качестве подходящих, включают соли фосфорной кислоты, соли магния, соли кальция, соли железа и соли марганца.
В случаях, когда микроорганизм, применяемый в настоящем изобретении, требует специфических питательных веществ для своего роста, питательные вещества могут быть добавлены в виде препаратов или природных продуктов, содержащих их. При необходимости также может быть добавлен пеногаситель.
Культивирование микроорганизма обычно проводят при уровне pH в пределах 4-8, при температуре в пределах 20-40°C. Уровень pH питательной среды заранее доводят минеральной или органической кислотой, щелочным веществом, мочевиной, карбонатом кальция, газообразным аммиаком и т.п. до заданного значения в пределах, обычно, 4-8. В случаях, когда скорость подачи кислорода требуется увеличить, может использоваться способ, в котором концентрацию кислорода поддерживают на уровне не менее 21%, добавляя кислород в воздух; культивирование проводят под давлением; скорость перемешивания увеличивают; объем аэрации увеличивают и т.д.
В качестве способа получения химического продукта с применением в качестве исходного сырья для ферментации, очищенного сахарного раствора, полученного способом получения сахарного раствора согласно настоящему изобретению, может применяться способ ферментации в культуре, известный специалистам в данной области техники, однако, ввиду производительности, предпочтительно применяется непрерывный способ культивирования, раскрытый в WO2007/097260.
Химический продукт, полученный способом получения химического продукта согласно настоящему изобретению, не ограничивается, при условии, что он является веществом, продуцированным в питательной среде вышеуказанным микроорганизмом или клетками. Конкретные примеры химического продукта, получаемого в настоящем изобретении, включают спирты, органические кислоты, аминокислоты и нуклеиновые кислоты, которые являются веществами, в большом количестве получаемыми в ферментационной промышленности. Примеры веществ включают спирты, такие как этанол, 1,3-пропандиол, 1,4-пропандиол и глицерин; органические кислоты, такие как уксусная кислота, молочная кислота, пировиноградная кислота, янтарная кислота, яблочная кислота, итаконовая кислота и лимонная кислота; нуклеиновые кислоты, такие как нуклеозиды, включая инозин и гуанозин, и нуклеотиды, включая инозиновую кислотную и гуаниловую кислоту; а также диаминосоединения, такие как кадаверин. Кроме того, настоящее изобретение может быть также применено при получении таких веществ, как ферменты, антибиотики и рекомбинантные белки.
ПРИМЕРЫ
Далее способ получения сахарного раствора согласно настоящему изобретению описывается более подробно посредством Примеров. Впрочем, настоящее изобретение не ограничивается данными Примерами.
Справочный пример 1: Способ анализа концентрации моносахарида
Концентрации моносахаридов, содержащихся в полученном водном сахарном растворе, анализировали количественно при условиях ВЭЖХ, описанных ниже, на основании сравнения со стандартными образцами.
Колонка: Luna NH2 (производства Phenomenex, Inc.)
Подвижная фаза: ультраочищенная вода:ацетонитрил = 25:75 (скорость потока, 0,6 мл/мин)
Реакционный раствор: нет
Способ детектирования: RI (дифференциальный показатель преломления)
Температура: 30°C
Справочный пример 2: Способ анализа концентраций веществ, ингибирующих ферментацию
Вещества, ингибирующие ферментацию, на основе фурана (ГМФ, фурфурол) и фенольные ингибирующие ферментацию вещества (ванилин, ацетованилин, сиреневая кислота, левулиновая кислота и 4-гидроксибензойная кислота), содержащиеся в сахарном растворе, анализировали количественно при условиях ВЭЖХ, описанных ниже, на основании сравнения со стандартными образцами.
Колонка: Synergi HidroRP 4,6 мм × 250 мм (производства Phenomenex, Inc).
Подвижная фаза: ацетонитрил-0,1% H3PO4 (скорость потока, 1,0 мл/мин)
Способ детектирования: УФ (283 нм)
Температура: 40°C
Вещества, ингибирующие ферментацию, на основе органических кислот (уксусная кислота, муравьиная кислота), содержащиеся в сахарном растворе, анализировали количественно при условиях ВЭЖХ, описанных ниже, на основании сравнения со стандартными образцами.
Колонка: Shim-Pack SPR-H и Shim-Pack SCR101H (производства корпорации Shimadzu), последовательно
Подвижная фаза: 5 мМ п-толуолсульфоновая кислота (скорость потока, 0,8 мл/мин)
Реакционный раствор: 5 мМ п-толуолсульфоновая кислота, 20 мМ Бис-Трис, 0,1 мМ ЭДТА-2Na (скорость потока, 0,8 мл/мин)
Способ детектирования: электропроводность
Температура: 45°C
Справочный пример 3: Стадия гидролиза целлюлозосодержащей биомассы с использованием разбавленной серной кислоты/обработки ферментами
В отношении стадии гидролиза целлюлозосодержащей биомассы в Стадии (1) описан пример способа гидролиза целлюлозосодержащей биомассы при использовании 0,1-15% по весу разбавленной серной кислоты и фермента.
В качестве целлюлозосодержащей биомассы использовали солому риса. Целлюлозосодержащую биомассу пропитывали 1%-ым водным раствором серной кислоты и подвергали обработке с использованием автоклава (производства Nitto Koatsu Co., Ltd.) при 150°C в течение 30 минут. После обработки проводили разделение твердой и жидкой фаз, чтобы отделить целлюлозу, обработанную серной кислотой, от водного раствора серной кислоты (в дальнейшем называемого "жидкость после обработки разбавленной серной кислотой"). Затем целлюлозу, обработанную серной кислотой, смешивали с жидкостью после обработки разбавленной серной кислотой при перемешивании таким образом, чтобы концентрация твердых компонентов составила 10% по весу, и доводили pH до приблизительно 5 гидроксидом натрия. К полученной смеси в качестве целлюлаз добавляли целлюлазу Trichoderma (Sigma Aldrich Japan) и Novozyme 188 (полученный из Aspergillus niger препарат β-глюкозидазы, Sigma Aldrich Japan) и перемешивали полученную смесь при 50°C в течение 3 дней с целью проведения реакции гидролиза. Затем проводили центрифугирование (3000g) для отделения/удаления неразложенной целлюлозы и лигнина, с получением водного сахарного раствора. Мутность водного сахарного раствора составляла 700 NTU (нефелометрических единиц мутности). Состав веществ, ингибирующих ферментацию, и моносахаридов, содержащихся в водном сахарном растворе, приведен в таблицах 1 и 2.
Справочный пример 4: Стадия гидролиза целлюлозосодержащей биомассы с помощью гидротермической обработки/обработки ферментами
В отношении стадии гидролиза целлюлозосодержащей биомассы в Стадии (1), описан пример способа гидролиза целлюлозосодержащей биомассы с использованием гидротермической обработки и фермента.
В качестве целлюлозосодержащей биомассы использовали солому риса. Целлюлозосодержащую биомассу пропитывали водой и подвергали обработке с использованием автоклава (производства Nitto Koatsu Co., Ltd.) при 180°C, в течение 20 минут, при перемешивании. Обработку проводили при давлении 10 МПа. После обработки разделение твердой и жидкой фаз проводили с помощью центрифугирования (3000g), чтобы отделить обработанную биомассу от раствора (в дальнейшем называемого "гидротермически обработанной жидкостью"). Уровень pH гидротермически обработанной жидкости составлял 4,0, а мутность гидротермически обработанной жидкости составляла 800 NTU.
Затем измеряли содержание воды в обработанной биомассе, при этом к данному компоненту добавляли RO воду (очищенную с помощью обратного осмоса) таким образом, чтобы концентрация твердых компонентов составила 15% по весу в расчете на абсолютно сухую обработанную биомассу, с последующим добавлением, в качестве целлюлазы, целлюлазы Trichoderma (Sigma Aldrich Japan) и Novozyme 188 (препарат β-глюкозидазы, полученной из Aspergillus niger, Sigma Aldrich Japan), и перемешиванием полученной смеси при 50°C в течение 3 дней с целью проведения реакции гидролиза. Затем проводили центрифугирование (3000g), чтобы отделить/удалить неразложенную целлюлозу и лигнин с получением водного сахарного раствора. Уровень pH водного сахарного раствора составил 5,2, а мутность водного сахарного раствора составила 900 NTU. Состав ингибирующих ферментацию веществ и моносахаридов, содержащихся в гидротермически обработанной жидкости и водном сахарном растворе, приведен в таблицах 3 и 4.
Справочный пример 5: Стадия гидролиза целлюлозосодержащей биомассы с помощью обработки аммиаком/обработки ферментами
В отношении стадии гидролиза целлюлозосодержащей биомассы в Стадии (1), описан пример способа гидролиза целлюлозосодержащей биомассы с использованием 5,0-100% по весу водного раствора аммиака и фермента. В качестве целлюлозосодержащей биомассы использовали солому риса. Целлюлозосодержащую биомассу загружали в малый реактор (производства корпорации Taiatsu Techno, TVS-N2 30 мл) и охлаждали жидким азотом. В данный реактор подавали газообразный аммиак, при этом образец полностью пропитывался жидким аммиаком. Крышку реактора закрывали и оставляли реактор при комнатной температуре приблизительно на 15 минут. Затем реактор обрабатывали в масляной бане при 150°C в течение 1 часа. После этого реактор вынимали из масляной бани и выпускали газообразный аммиак в вытяжном шкафу, с последующим вакуумированием реактора до 10 Па с помощью вакуумного насоса, проводя, таким образом, сушку целлюлозосодержащей биомассы. Указанную обработанную целлюлозосодержащую биомассу смешивали с чистой водой при перемешивании таким образом, чтобы концентрация твердых компонентов составила 15% по весу, и доводили pH до приблизительно 5 серной кислотой. К полученной смеси в качестве целлюлазы добавляли целлюлазу Trichoderma (Sigma Aldrich Japan) и Novozyme 188 (препарат β-глюкозидазы, полученной из Aspergillus niger, Sigma Aldrich Japan) и перемешивали полученную смесь при 50°C в течение 3 дней с целью проведения реакции гидролиза. Затем проводили центрифугирование (3000g), чтобы отделить/удалить неразложенную целлюлозу и лигнин, с получением водного сахарного раствора. Мутность водного сахарного раствора составила 600 NTU. Состав ингибирующих ферментацию веществ и моносахаридов, содержащихся в водном сахарном растворе, приведен в Таблицах 5 и 6.
Пример 1: Стадия фильтрования обработанного разбавленной серной кислотой/ферментом водного сахарного раствора через нанофильтрационную мембрану или обратноосмотическую мембрану
Стадия фильтрования водного сахарного раствора, полученного в Справочном примере 3, через нанофильтрационную мембрану (NF мембрану) или обратноосмотическую мембрану (RO мембрану) и сбор очищенного сахарного раствора со стороны впуска, с удалением ингибирующих ферментацию веществ со стороны фильтрата, описывается в качестве примера. Через ПВДФ мембрану, имеющую размер пор 0,05 мкм, фильтровали 20 л водного сахарного раствора, полученного в Справочном примере 3, после чего фильтрат обрабатывали с помощью нанофильтрационного мембранного или обратноосмотического мембранного модуля. В емкость для неочищенной жидкости 1 мембранного фильтрующего устройства, показанного на фиг. 1, подавали 20 л водного сахарного раствора, полученного в Примере 2. Затем в емкость для неочищенной жидкости 1 добавляли 200 л RO воды. В качестве нанофильтрационной мембраны была установлена нанофильтрационная мембрана UTC60 (производства TORAY INDUSTRIES, INC.) из сшитого пиперазин полиамида или, в качестве RO мембраны, была установлена обратноосмотическая мембрана UTC80 (производства TORAY INDUSTRIES, INC.) из сшитого полностью ароматического полиамида, на фиг. 2 данная мембрана обозначена позицией 7. Температуру неочищенной жидкости доводили до 25°C, а давление доводили до 3 МПа с помощью насоса высокого давления 3, удаляя, таким образом, фильтрат. В общей сложности удаляли 200 л фильтрата, и к раствору, оставшемуся в емкости для неочищенной жидкости, объем которой был немного меньше 20 л, добавляли RO воду до конечного объема 20 л. Полученный в результате разбавленный раствор использовали в качестве очищенного сахарного раствора.
Ингибирующие ферментацию вещества (ГМФ, фурфурол, ванилин, ацетованилин и сиреневая кислота), содержащиеся в водном сахарном растворе, полученном в Справочном примере 3, и в вышеуказанных очищенных сахарных растворах, анализировали количественно при условиях ВЭЖХ, описанных в Справочном примере 1, на основании сравнения со стандартными образцами. Кроме того, концентрации моносахаридов определяли количественно при условиях ВЭЖХ, описанных в Справочном примере 1, на основании сравнения со стандартными образцами. Результаты приведены в таблицах 7 и 8. В анализе было показано, что в качестве ингибирующих ферментацию веществ содержались уксусная кислота, муравьиная кислота, фурфурол, ГМФ, ванилин, ацетованилин, сиреневая кислота и левулиновая кислота. Далее, в отношении моносахаридов, содержащихся в соответствующих сахарных растворах, глюкоза и ксилоза являлись основными компонентами. Кроме того, хотя количество было очень малым, арабиноза и манноза также были обнаружены. Далее, были подтверждено, что очищенные сахарные растворы содержали значительно сниженное количество веществ, ингибирующих ферментацию, по сравнению с водным сахарным раствором, полученным в Справочном примере 3. С другой стороны, так как концентрации сахаров в очищенных сахарных растворах не были значительно снижены, можно утверждать, что обработка водного сахарного раствора с помощью нанофильтрационной мембраны или обратноосмотической мембраны позволяет удалять вещества, ингибирующие ферментацию, в виде фильтрата, позволяя в то же время выделять очищенный сахарный раствор, в котором концентрации ингибирующих ферментацию веществ уменьшены, со стороны впуска.
Пример 2: Стадия фильтрования гидротермически обработанного/обработанного ферментом водного сахарного раствора через нанофильтрационную мембрану или обратноосмотическую мембрану
В отношении стадии фильтрования водного сахарного раствора, полученного в Справочном примере 4, через нанофильтрационную мембрану или обратноосмотическую мембрану и сбора очищенного сахарного раствора со стороны впуска, с удалением ингибирующих ферментацию веществ со стороны фильтрата, очищенный сахарный раствор получен аналогичным образом, как в Примере 1, после чего количественно определяли концентрации ингибирующих ферментацию веществ и моносахаридов. Результаты приведены в таблицах 9 и 10. Анализ показал, что в качестве веществ, ингибирующих ферментацию, содержались уксусная кислота, муравьиная кислота, фурфурол, ГМФ, ванилин, ацетованилин и сиреневая кислота. Кроме того, в отношении моносахаридов, содержащихся в соответствующих сахарных растворах, глюкоза и ксилоза являлись основными компонентами. Далее, хотя количество было очень малым, арабиноза и манноза также были обнаружены.
Было подтверждено, что соответствующие очищенные сахарные растворы содержали значительно сниженное количество ингибирующих ферментацию веществ по сравнению с водным сахарным раствором, полученным в Справочном примере 4. С другой стороны, так как в очищенных сахарных растворах концентрации сахаров не были значительно снижены, можно утверждать, что обработка водного сахарного раствора с помощью нанофильтрационной мембраны или обратноосмотической мембраны позволяет удалять ингибирующие ферментацию вещества в виде фильтрата, и в то же время обеспечивает получение очищенного сахарного раствора, в котором уменьшены концентрации ингибирующих ферментацию веществ, со стороны впуска.
Пример 3: Стадия фильтрования обработанного аммиаком/обработанного ферментом водного сахарного раствора через нанофильтрационную мембрану или обратноосмотическую мембрану
В отношении стадии фильтрования водного сахарного раствора, полученного в Справочном примере 5, через нанофильтрационную мембрану или обратноосмотическую мембрану и сбора очищенного сахарного раствора со стороны впуска с удалением ингибирующих ферментацию веществ со стороны фильтрата, очищенный сахарный раствор получали аналогичным образом, как в Примере 1, и количественно определяли концентрации ингибирующих ферментацию веществ и моносахаридов. Результаты приведены в таблицах 11 и 12. Анализ показал, что в качестве веществ, ингибирующих ферментацию, содержались уксусная кислота, муравьиная кислота, фурфурол, ГМФ, ванилин, ацетованилин и сиреневая кислота. Далее, в отношении моносахаридов, содержащихся в соответствующих сахарных растворах, глюкоза и ксилоза являлись основными компонентами. Кроме того, хотя их количество было очень малым, арабиноза и манноза также были обнаружены.
Было подтверждено, что соответствующие очищенные сахарные растворы содержали значительно сниженное количество ингибирующих ферментацию веществ по сравнению с водным сахарным раствором, полученным в Справочном примере 5. С другой стороны, так как в очищенных сахарных растворах концентрации сахаров не были значительно снижены, можно утверждать, что обработка водного сахарного раствора с помощью NF мембраны или RO мембраны позволяет удалять ингибирующие ферментацию вещества в виде фильтрата, и в то же время обеспечивает получение очищенного сахарного раствора, в котором уменьшены концентрации ингибирующих ферментацию веществ, со стороны впуска.
Пример 5: Стадия фильтрования гидротермически обработанной жидкости через нанофильтрационную мембрану или обратноосмотическую мембрану
В отношении стадии фильтрования гидротермически обработанной жидкости, полученной в Справочном примере 4, через нанофильтрационную мембрану или обратноосмотическую мембрану и сбора очищенного сахарного раствора со стороны впуска с удалением ингибирующих ферментацию веществ со стороны фильтрата, очищенный сахарный раствор получали аналогичным образом, как в Примере 1, и количественно определяли концентрации ингибирующих ферментацию веществ и моносахаридов. Результаты приведены в таблицах 13 и 14. Анализ показал, что в качестве веществ, ингибирующих ферментацию, содержались уксусная кислота, муравьиная кислота, фурфурол, ГМФ, ванилин, ацетованилин и сиреневая кислота. Далее, в отношении моносахаридов, содержащихся в соответствующих сахарных растворах, глюкоза и ксилоза являлись основными компонентами. Кроме того, хотя их количество было очень малым, арабиноза и манноза также были обнаружены.
Было подтверждено, что соответствующие очищенные сахарные растворы содержали значительно сниженное количество ингибирующих ферментацию веществ по сравнению с гидротермически обработанной жидкостью, полученной в Справочном примере 4. С другой стороны, так как в очищенных сахарных растворах концентрации сахаров не были значительно снижены, можно утверждать, что обработка водного сахарного раствора с помощью NF мембраны или RO мембраны позволяет удалять ингибирующие ферментацию вещества в виде фильтрата, и в то же время обеспечивает получение очищенного сахарного раствора, в котором уменьшены концентрации ингибирующих ферментацию веществ, со стороны впуска.
Пример 6: Стадия фильтрования модельных сахарных растворов через нанофильтрационную мембрану или обратноосмотическую мембрану
В качестве модельных сахарных растворов, имитирующих водный сахарный раствор, полученный при гидролизе биомассы, приготавливали один раствор, содержащий сахара в высоких концентрациях (модельный водный сахарный раствор A), и один раствор, содержащий сахар в низких концентрациях (модельный водный сахарный раствор B). Их составы показаны в таблицах 15 и 16.
Уровни pH модельных сахарных растворов A и B доводили серной кислотой или гидроксидом натрия до pH 0,5, 1, 2, 3, 4, 5, 6 или 7, после чего жидкости фильтровали так же, как в Примере 1, с последующим определением концентраций веществ, ингибирующих ферментацию, и сахаров, содержащихся в пермеатах, с помощью способа, описанного в Справочном примере 1. Результаты представлены в таблицах 17-20. Степени проницаемости для моносахаридов модельных растворов A и B были различны, но не отличались при различных pH. Кроме того, степени проницаемости для ингибирующих ферментацию веществ отличались при различных значениях pH, но не отличались между модельными растворами A и B.
Из представленных выше результатов было обнаружено, что нанофильтрационная мембрана или обратноосмотическая мембрана позволяют увеличивать концентрации моносахаридов при одновременном удалении ингибирующих ферментацию веществ на стороне фильтрата. Кроме того, было обнаружено, что степень потери моносахаридов на сторону фильтрата через нанофильтрационную мембрану увеличивается в тех случаях, когда концентрация сахара является высокой, тогда как потеря сахаров через обратноосмотическую мембрану, даже в таких случаях, почти не происходит. Также было обнаружено, что степень удаления органических кислот в значительной степени изменяется в зависимости от pH.
Пример 7: Стадия фильтрования гидротермически обработанного/обработанного ферментом водного сахарного раствора через обратноосмотическую мембрану (эффект снижения загрязнения при регулировании pH)
Исследовали эффект снижения загрязнения при регулировании pH водного сахарного раствора, полученного в Справочном примере 4. Десять литров водного сахарного раствора, полученного в Справочном примере 4, фильтровали через микрофильтрационную мембрану (производства Millipore; размер пор 0,45 мкм; ПВДФ мембрана). Мутность в данный момент не превышала 1 NTU. Затем проводили фильтрацию, используя ультрафильтрационную мембрану (GE SEPA серии PW; полиэфирсульфон; граница пропускания по молекулярной массе 10000). После этого фильтрат делили на аликвоты объемом 2 л, и в каждую из этих аликвот добавляли серную кислоту или аммиак таким образом, чтобы pH стал равен 1, 2, 3, 5 или 7, с последующим фильтрованием через обратноосмотическую мембрану аналогичным образом, как в Примере 1, пока объем, остающийся в емкости для неочищенной жидкости, не уменьшился до 0,5 л (4-кратное концентрирование). Величину потока во время сбора фильтрата вычисляли на основании различий изменения общего количества фильтрата с течением времени. Результаты вычисления потока представлены на фиг. 3. В результате, при pH 1 поток был очень слабым, и фильтрация занимала много времени, а при pH 7 в середине процесса наблюдали заметное уменьшение потока. Также, при pH 2, 3 и 5 уменьшение потока наблюдали приблизительно через 1,5 часа, и это было вызвано, как предположили, увеличением концентрации сахара, что привело к резкому повышению осмотического давления. Концентрации моносахаридов и ингибирующих ферментацию веществ в водном сахарном растворе и очищенных сахарных растворов представлены в таблицах 21 и 22, при этом можно утверждать, что хотя моносахариды были сконцентрированы до соответствующего отношения концентрации, уровни концентрации ингибирующих ферментацию веществ были низкими, что позволяет подтвердить удаление ингибирующих ферментацию веществ из водного сахарного раствора.
Пример 8: Стадия фильтрования гидротермически обработанной жидкости через нанофильтрационную мембрану (эффект снижения загрязнения при фильтровании через микрофильтрационную мембрану/ультрафильтрационную мембрану)
Эффект снижения загрязнения при фильтрационной обработке, которую проводили перед концентрированием гидротермически обработанной жидкости, полученной в Справочном примере 4, через нанофильтрационную мембрану, исследовали с помощью ускоренного теста при использовании уменьшенного объема жидкости. Приготавливали три типа жидкостей, а именно жидкость, полученную только с помощью центрифугирования гидротермически обработанной жидкости, полученной в Справочном примере 4, жидкость, обработанную с помощью микрофильтрационной мембраны (производства Millipore; размер пор 0,45 мкм; ПВДФ мембрана), и жидкость, обработанную с помощью ультрафильтрационной мембраны (GE SEPA серии PW; полиэфирсульфон; граница пропускания по молекулярной массе 10000), после чего их pH доводили до 3. Мутность обработанной центрифугированием жидкости составляла 800 NTU, а мутность двух других жидкостей не превышала 1 NTU. Каждую жидкость в объеме 2 л фильтровали через нанофильтрационную мембрану аналогичным образом, как в Примере 1, пока объем, остающийся в емкости для неочищенной жидкости, не уменьшился до 0,5 л, при этом величину потока во время сбора фильтрата вычисляли на основании различий изменения общего количества фильтрата с течением времени. Результаты вычисления потока представлены на фиг. 4. В результате было показано, что в случае обработки только с помощью центрифугирования мутность оставалась высокой, и в ходе концентрирования поток значительно падал. Предполагали, что это было обусловлено адгезией компонентов, ответственных за мутность, на мембране в ходе концентрирования, что в результате приводило к резкому уменьшению фильтрующей способности мембраны.
Пример 9: Идентификация загрязняющих компонентов
Гидротермически обработанную жидкость, полученную в Справочном примере 4, аэрировали и промывали, выполняя при этом микрофильтрацию, после чего мембрану сушили в вакууме и исследовали с помощью растрового электронного микроскопа (производства корпорации Hitachi High-Technologies, S-4800). Затем проводили анализ состава с использованием рентгеноспектрального анализатора на основе метода энергетической дисперсии (производства HORIBA, Ltd., EX-250), присоединенного к растровому электронному микроскопу. В результате на микрофильтрационной мембране наблюдалось много гелеобразного осадка и частиц, имеющих размеры от нескольких нанометров до нескольких микрометров, как показано на фиг. 5. Указанные компоненты подвергали анализу дисперсии компонентов, в режиме отображения рентгеноспектрального анализатора на основе метода энергетической дисперсии, и обнаруживали большие количества Si (кремния) и O (кислорода) на местах расположения частиц (фиг. 6). Указанные твердые частицы, как предположили, являлись SiO2 (диоксидом кремния). Кроме того, в качестве гелеобразных компонентов вокруг частиц наблюдали C (углерод) и O (кислород). Таким образом, гелеобразный осадок, как полагали, представлял собой неразложенную целлюлозу, лигнин и т.п. Затем фильтрат, полученный после микрофильтрации, фильтровали через ультрафильтрационную мембрану, при этом ультрафильтрационную мембрану слегка промывали RO водой. Затем ультрафильтрационную мембрану сушили в вакууме и подвергали только элементному анализу с помощью рентгеноспектрального анализатора на основе метода энергетической дисперсии, при использовании растрового электронного микроскопа при напряжении 20 кВ и увеличении ×100, в 3 различных положениях. В результате обнаружили C (углерод) при содержании 72-77% и O (кислород) при содержании 20-25%. Таким образом, в отношении удаляемых компонентов было установлено, что водорастворимые полисахариды, танин, полифенол и т.п. накапливались на ультрафильтрационной мембране и удалялись.
Пример 10: Регенерация ферментов
Описан пример регенерации ферментов из водного сахарного раствора, полученного в вышеуказанном Справочном примере 1. Для регенерации ферментов ультрафильтрационную мембрану из полиэфирсульфона (диаметр 44,5 мм; Millipore) с границей пропускания по молекулярной массе 10000 помещали в ультрафильтрационные ячейки с перемешиванием Stirred Cells Series 8000 (Millipore), и проводили фильтрацию под давлением, используя баллон с азотом. В фильтрации под давлением 50 мл сахарного раствора, полученного в Примере 1, подавали со стороны впуска и 45 мл жидкости удаляли в виде фильтрата. Затем измеряли концентрацию фермента (концентрацию белка) в 5 мл сахарного раствора, оставшегося на стороне впуска. Концентрацию фермента измеряли колориметрически, с использованием набора для измерения концентрации белка BCA (BCA Protein Assay Regent kit, производства PIERCE), путем измерения поглощения при 562 нм, с использованием бычьего альбумина (2 мг/мл) в качестве стандарта. В результате, принимая начальную концентрацию фермента перед подачей жидкости за 100%, подтверждали, что концентрация фермента в жидкости, регенерируемой в Справочном примере 1, находилась в пределах 10-60% в относительном выражении.
Пример 11: Изменение способности удаления ингибирующих ферментацию веществ в зависимости от температуры водного сахарного раствора
Стадия фильтрования обработанного аммиаком/обработанного ферментом водного сахарного раствора, полученного в Справочном примере 5, через микрофильтрационную мембрану и ультрафильтрационную мембрану, а затем дополнительного фильтрования раствора через обратноосмотическую мембрану, с последующим выделением очищенного сахарного раствора со стороны впуска и удалением ингибирующих ферментацию веществ со стороны фильтрата, описывается в качестве примера. Через микрофильтрационную мембрану (производства Millipore; размер пор 0,45 мкм; ПВДФ мембрана) фильтровали 4 л водного сахарного раствора, полученного в Справочном примере 5. Мутность в данный момент не превышала 1 NTU. Затем проводили фильтрацию, используя ультрафильтрационную мембрану (GE SEPAG серии PW; полиэфирсульфон; граница пропускания по молекулярной массе 10000). Уровень pH указанного водного сахарного раствора доводили серной кислотой до 3, и аликвоту объемом 2 л полученного раствора фильтровали при температуре водного сахарного раствора 25°C или 50°C через обратноосмотическую мембрану аналогичным образом, как в Примере 1, пока объем, остающийся в емкости для неочищенной жидкости, не уменьшился до 0,5 л, с последующим выделением фильтрата. После завершения фильтрации RO воду добавляли к каждому раствору до конечного объема 2 л, с получением, таким образом, очищенного сахарного раствора. Концентрации ингибирующих ферментацию веществ в очищенных сахарных растворах при температурах водных сахарных растворов 25°C и 50°C приведены в таблице 23. Повышенная температура водного сахарного раствора улучшала способность удаления ингибирующих ферментацию веществ. Как предположили, это было вызвано увеличением размера пор мембраны, обусловленным повышенной температурой водного сахарного раствора.
Пример 12: Изменение уровня снижения потери моносахаридов в зависимости от температуры водного сахарного раствора
Стадия фильтрования обработанного аммиаком/обработанного ферментом водного сахарного раствора, полученного в Справочном примере 5, через микрофильтрационную мембрану и ультрафильтрационную мембрану, а затем дополнительного фильтрования раствора через нанофильтрационную мембрану, с последующим выделением очищенного сахарного раствора со стороны впуска и удалением ингибирующих ферментацию веществ со стороны фильтрата, описывается в качестве примера. Через микрофильтрационную мембрану (производства Millipore; размер пор 0,45 мкм; ПВДФ мембрана) фильтровали 4 л водного сахарного раствора, полученного в Справочном примере 5. Мутность в данный момент не превышала 1 NTU. Затем проводили фильтрацию, используя ультрафильтрационную мембрану (GE SEPAG серии PW; полиэфирсульфон; граница пропускания по молекулярной массе 10000, производства GE Osmonics). Уровень pH указанного водного сахарного раствора доводили серной кислотой до 3, и аликвоту объемом 2 л полученного раствора фильтровали при температуре водного сахарного раствора 25°C или 10°C через нанофильтрационную мембрану аналогичным образом, как в Примере 1, пока объем, остающийся в емкости для неочищенной жидкости, не уменьшился до 0,5 л, с последующим выделением фильтрата. После завершения фильтрации RO воду добавляли к каждому раствору до конечного объема 2 л, с получением таким образом очищенного сахарного раствора. Концентрации сахаров в очищенных сахарных растворах при температурах водных сахарных растворов 25°C и 10°C приведены в таблице 24, при этом показано, что пониженная температура водного сахарного раствора уменьшала величину потери сахаров. Как предположили, это было вызвано уменьшением размера пор мембраны, обусловленным пониженной температурой водного сахарного раствора.
Пример 13: Примеры получения очищенных сахарных растворов при использовании различных нанофильтрационных мембран
Водный сахарный раствор, полученный в Справочном примере 3, дополнительно фильтровали через микрофильтрационную мембрану (производства Millipore; размер пор 0,05 мкм; ПВДФ мембрана), затем 20 л раствора, полученного при 20-кратном разбавлении водного сахарного раствора RO водой, обрабатывали с помощью нанофильтрационной мембраны, пока объем раствора не уменьшился до 1 л, аналогичным образом, как в Примере 1. В качестве 90φ нанофильтрационной мембраны использовали нанофильтрационную мембрану UTC60 из сшитого пиперазин полиамида (нанофильтрационная мембрана 1, производства TORAY INDUSTRIES, INC.), нанофильтрационную мембрану NF-400 из сшитого пиперазин полиамида (нанофильтрационная мембрана 2, производства корпорации Filmtec), нанофильтрационную мембрану NF99 из полиамида (нанофильтрационная мембрана 3, производства Alfa-Laval) и нанофильтрационную мембрану GE Sepa DK из ацетилцеллюлозы (нанофильтрационная мембрана 4, производства GE Osmonics). Вычисляли степень проницаемости для ингибирующих ферментацию веществ (уксусная кислота, муравьиная кислота, ГМФ, фурфурол, ванилин, ацетованилин, сиреневая кислота и левулиновая кислота) и степень проницаемости для моносахаридов (глюкоза и ксилоза), содержащихся в фифльтрате. Результаты показали, что моносахариды и ингибирующие ферментацию вещества могли задерживаться всеми нанофильтрационными мембранами, и что, в частности, нанофильтрационные мембраны 1-3, а именно полиамидная нанофильтрационная мембрана и нанофильтрационные мембраны из сшитого пиперазин полиамида, обладали низкой степенью проницаемости для моносахаридов, обладая в то же время высокой степенью проницаемости для ингибирующих ферментацию веществ (таблицы 25 и 26).
Пример 14: Примеры получения очищенных сахарных растворов с использованием различных обратноосмотических мембран
Водный сахарный раствор, полученный в Справочном примере 5, фильтровали через микрофильтрационную мембрану (производства Millipore; размер пор 0,45 мкм, ПВДФ мембрана). Мутность в данный момент не превышала 1 NTU. Затем выполняли дополнительную фильтрацию, используя ультрафильтрационную мембрану (GE SEP серии PW; полиэфирсульфон; граница пропускания по молекулярной массе 10000). Уровень pH фильтрата доводили серной кислотой до 3, и аликвоты объемом 20 л полученного раствора обрабатывали аналогичным образом, как в Примере 1, с помощью обратноосмотических мембран. В качестве обратноосмотических мембран использовали обратноосмотическую мембрану UTC80 из сшитого полностью ароматического полиамида (обратноосмотическая мембрана 1, производства TORAY INDUSTRIES, INC.), мембрану, подготовленную путем пропитки обратноосмотической мембраны UTC80 из сшитого полностью ароматического полиамида раствором фермента целлюлазы Novozyme 188 (препарата β-глюкозидазы, полученной из Aspergillus niger, Sigma Aldrich Japan) при 50°C в течение 1 дня и промывки полученной мембраны RO водой (обратноосмотическая мембрана 2), обратноосмотическую мембрану DESAL-3B из полиамида (обратноосмотическая мембрана 3; производства DESAL), обратноосмотическую мембрану GE SEPA CE из ацетилцеллюлозы (обратноосмотическая мембрана 4, производства GE Osmonics) (Сравнительный пример), и мембрану, подготовленную путем пропитки ацетилцеллюлозной обратноосмотической мембраны GE SEPA CE (производства GE Osmonics) раствором фермента целлюлазы Novozyme 188 (препарата β-глюкозидазы, полученной из Aspergillus niger, Sigma Aldrich Japan, Sigma Aldrich Japan) при 50°C в течение 1 дня и промывки полученной мембраны RO водой (обратноосмотическая мембрана 5), при этом все фильтраты собирали до тех пор, пока объем неочищенной жидкости не уменьшался до одной четверти от первоначального объема.
Воду RO в том же объеме, как и фильтрат, подавали в концентрированную жидкость в емкости для неочищенной жидкости, и концентрации ингибирующих ферментацию веществ, содержащихся в емкости для неочищенной жидкости и фильтрате, анализировали с помощью системы ВЭЖХ (производства корпорации Shimadzu), вычисляя таким образом степень проницаемости для ингибирующих ферментацию веществ (уксусной кислоты, муравьиной кислоты, ГМФ, фурфурола, ванилина, ацетованилина и сиреневой кислоты) и степень проницаемости для моносахаридов (глюкозы и ксилозы). Результаты показали, что моносахариды и ингибирующие ферментацию вещества могли задерживаться всеми обратноосмотическими мембранами, и что, в частности, обратноосмотические мембраны 1 и 2, а именно обратноосмотические мембраны из полиамида и сшитого полностью ароматического полиамида, обладали низкой степенью проницаемости для моносахаридов, обладая при этом высокой степенью проницаемости для ингибирующих ферментацию веществ. Также было показано, что ацетилцеллюлозные мембраны обладали меньшей стойкостью к целлюлазе (таблицы 27 и 28).
Пример 15: Сравнение эффектов при концентрировании моносахаридов и веществ, ингибирующих ферментацию
Для сравнения эффектов при концентрировании моносахаридов и ингибирующих ферментацию веществ сравнивали степени концентрирования моносахаридов и веществ, ингибирующих ферментацию, в случаях фильтрации водного сахарного раствора через нанофильтрационную мембрану и/или обратноосмотическую мембрану. После приготовления 60 л обработанного аммиаком/обработанного ферментом водного сахарного раствора, полученного в Справочном примере 5, с pH 3, доведенным водным раствором аммиака и серной кислотой, полученный раствор фильтровали через микрофильтрационную мембрану. Затем раствор дополнительно фильтровали через ультрафильтрационную мембрану. Мутность в данный момент не превышала 0,5 NTU. Фильтрат разделяли на 3 аликвоты (по 20 л каждая) и обрабатывали только с помощью нанофильтрационной мембраны, пока объем на стороне неочищенной жидкости не уменьшился до 5 л (4-кратное концентрирование); обрабатывали с помощью нанофильтрационной мембраны до уменьшения объема на стороне неочищенной жидкости до 10 л (2-кратное концентрирование), с последующей обработкой с помощью обратноосмотической мембраны, пока объем на стороне неочищенной жидкости не уменьшался до 5 л (дополнительное 2-кратное концентрирование: в общей сложности 4-кратное концентрирование), или обрабатывали только с помощью обратноосмотической мембраны, пока объем на стороне неочищенной жидкости не уменьшился до 5 л (4-кратное концентрирование); аналогичным образом, как в Примере 7. В качестве нанофильтрационной мембраны использовали нанофильтрационную мембрану UTC60 из сшитого пиперазин полиамида (нанофильтрационная мембрана 1, производства TORAY INDUSTRIES, INC.), а в качестве обратноосмотической мембраны использовали обратноосмотическую мембрану UTC80 из сшитого полностью ароматического полиамида (обратноосмотическая мембрана 1, производства TORAY INDUSTRIES, INC.).
В таблице 29 представлены результаты анализа концентраций моносахаридов и ингибирующих ферментацию веществ, содержащихся в очищенном сахарном растворе, где анализ проводили при условиях ВЭЖХ, показанных в Справочном примере 1. Под концентрациями, показанными в таблице, показана концентрация, ожидаемая после разбавления раствора таким образом, чтобы была достигнута концентрация глюкозы 50 г/л. В результате было показано, что степени концентрирования ингибирующих ферментацию веществ были ниже, чем степени концентрирования моносахаридов, и что эффективность удаления веществ, ингибирующих ферментацию, на единицу концентрации глюкозы была наиболее высокой в случае обработки нанофильтрационной мембраной, затем в случае обработки нанофильтрационная мембраной с последующей обработкой обратноосмотической мембраной, и в случае обработки обратноосмотической мембраной, в указанном порядке. С другой стороны, при использовании нанофильтрационной мембраны и обратноосмотической мембраны в комбинации, заметная потеря сахаров на сторону фильтрата нанофильтрационной мембраны, которая происходит в случаях, когда концентрация сахара составляет не менее 100 г/л, может быть снижена, при этом эффективность удаления ингибирующих ферментацию веществ была значительно повышена по сравнению со случаем обработки только с помощью обратноосмотической мембраны.
Пример 16: Примеры получения очищенных сахарных растворов с применением обратноосмотических мембран низкого давления/ ультранизкого давления
Для сравнения эффектов при концентрировании моносахаридов и веществ, ингибирующих ферментацию, с помощью различных типов обратноосмотических мембран, модельный сахарный раствор фильтровали через обратноосмотические мембраны, имеющие различные скорости потока фильтрата, аналогичным образом, как в Примере 6. Состав модельных сахарных растворов, имитирующих водный сахарный раствор, полученный при гидролизе биомассы, приведен в таблице 30.
В качестве обратноосмотических мембран использовали BW-30, производства корпорации Filmtec (обратноосмотическая мембрана 6), и SU-700, производства TORAY INDUSTRIES, INC. (обратноосмотическая мембрана 7), которые являются мембранами низкого давления; TFC-ULP, производства KOCH (обратноосмотическая мембрана 8), и SUL-G10, производства TORAY INDUSTRIES, INC. (обратноосмотическая мембрана 9), которые являются мембранами ультранизкого давления; и DESAL-3B, производства DESAL (обратноосмотическая мембрана 10), которая является мембраной среднего давления, для сравнения. Скорости потока фильтрации хлористого натрия (500 мг/л) на единицу площади мембраны (м3/м2/день), наблюдаемые для соответствующих мембран при давлении фильтрации 0,75 МПа и pH 6,5, показаны в таблице 31.
Модельные сахарные растворы A и B, уровни pH которых доводили серной кислотой или гидроксидом натрия до 2, 3, 4, 5, 6 или 7, фильтровали аналогичным образом, как в Примере 1, после чего концентрации уксусной кислоты, которая является веществом, ингибирующим ферментацию, и сахаров, содержащихся в фильтрате, определяли с помощью способа, описанного в Справочном примере 1. Результаты представлены в таблицах 32 и 33. Степень проницаемости для уксусной кислоты изменялась в зависимости от pH, а потеря сахаров была ниже для мембран низкого давления, чем для мембран ультранизкого давления, хотя различие было очень малым. На основе полученных результатов было показано, что обратноосмотические мембраны низкого давления/ультранизкого давления обеспечивают превосходную эффективность при удалении органических кислот и могут эффективно удалять вещества, ингибирующие ферментацию, даже в тех случаях, когда pH неочищенной жидкости превышает 3.
Далее, в качестве Примеров, более подробно описываются способы получения химических продуктов с применением очищенного сахарного раствора, полученного согласно настоящему изобретению, в качестве исходного сырья для ферментации, для L-молочной кислоты, D-молочной кислоты, этанола, кадаверина и янтарной кислоты. Впрочем, химические продукты, полученные согласно настоящему изобретению, не ограничиваются приведенными ниже примерами.
Справочный пример 6: Способы измерения концентраций химических продуктов
L-молочная-кислота, D-молочная-кислота
Концентрацию накапливаемой L-молочной кислоты или D-молочной кислоты подтверждали путем измерения количества молочной кислоты методом ВЭЖХ.
Колонка: Shim-Pack SPR-H (производства корпорации Shimadzu)
Подвижная фаза: 5 мМ п-толуолсульфоновая кислота (скорость потока 0,8 мл/мин)
Реакционный раствор: 5 мМ п-толуолсульфоновая кислота, 20 мМ Бис-Трис, 0,1 мМ ЭДТА-2Na (скорость потока 0,8 мл/мин)
Способ детектирования: электропроводность
Температура: 45°C
Далее, оптическую чистоту L-молочной кислоты измеряли методом ВЭЖХ при следующих условиях.
Колонка: TSK-гель Enantio L1 (производства корпорации Tosoh)
Подвижная фаза: 1 мМ водный раствор сульфата меди
Скорость потока: 1,0 мл/мин
Способ детектирования: УФ 254 нм
Температура: 30°C
Далее, оптическую чистоту L-молочной кислоты вычисляли согласно следующему уравнению.
Оптическая чистота (%)=100×(L-D)/(L+D)
В данном уравнении L обозначает концентрацию L-молочной кислоты, а D обозначает концентрацию D-молочной кислоты. Также аналогичным способом вычисляли оптическую чистоту D-молочной кислоты.
Этанол
Концентрацию накапливаемого этанола определяли методом газовой хроматографии. Оценку производили путем детектирования/вычисления, используя хроматограф Shimadzu GC-2010 с капиллярной ГХ-колонокой TC-1 (GL science) 15 м × I.D.0,53 мм, df 1,5 мкм, с пламенно-ионизационным детектором.
Кадаверин
Кадаверин оценивали следующим методом ВЭЖХ.
Используемая колонка: CAPCELL PAK C18 (производства Shiseido Co., Ltd.)
Подвижная фаза: 0,1% (об/об) водный раствор фосфорной кислоты:ацетонитрил = 4,5:5,5
Детектирование: УФ 360 нм
Предварительная обработка образца: к 25 мкл анализируемого образца в качестве внутренних стандартов добавляли 25 мкл 1,4-диаминобутана (0,03 М), 150 мкл гидрокарбоната натрия (0,075 М) и раствор 2,4-динитрофторобензола (0,2 М) в этаноле и инкубировали полученную смесь при 37°C в течение 1 часа.
В 1 мл ацетонитрила растворяли 50 мкл вышеуказанного реакционного раствора и центрифугировали полученный раствор при 10000 об/мин в течение 5 минут, после чего 10 мкл супернатанта анализировали с помощью ВЭЖХ.
Янтарная кислота
Измерение концентрации накапливаемой янтарной кислоты проводили с помощью анализа с использованием ВЭЖХ (производства корпорации Shimadzu; LC10A; RI монитор: RID-10A; колонка: Aminex HPX-87H). Устанавливали температуру колонки 50°C. После уравновешивания колонки 0,01н H2SO4 вводили образец и проводили элюирование 0,01н H2SO4 для выполнения анализа.
Справочный пример 7: Получение штамма дрожжей, обладающих способностью продуцировать L-молочную кислоту
Штамм дрожжей, обладающий способностью продуцировать L-молочную кислоту, получали следующим образом. Штамм дрожжей, обладающий способностью продуцировать L-молочную кислоту, получали путем соединения человеческого гена LDH по ходу транскрипции с промотором PDC1 в дрожжевом геноме. Полимеразную цепную реакцию (ПЦР) проводили, используя La-Taq (производства TAKARA BIO INC.) или KOD-Plus полимеразу (производства Toyobo Co. Ltd.), согласно прилагаемым инструкциям.
Линию клеток рака молочной железы человека (MCF-7) культивировали и собирали выращенные клетки, с последующей экстракцией РНК при использовании TRIZOL Reagent (производства INVITROGEN) и выполнением реакции обратной транскрипции с использованием полученной РНК в качестве матрицы и Superscript Choice System (производства INVITROGEN), синтезируя таким образом кДНК. Что касается деталей соответствующих операций, следовали инструкциям производителя. Полученную кДНК использовали в качестве матрицы для последующей ПЦР-амплификации.
При использовании кДНК, полученной вышеуказанными операциями, в качестве матрицы для амплификации, олигонуклеотидов, имеющих последовательности, приведенные в SEQ ID NO:1 и SEQ ID NO:2, в качестве набора праймеров, и KOD-Plus полимеразы (производства Toyobo Co. Ltd.), проводили ПЦР с целью клонирования гена L-ldh. Каждый ПЦР-амплифицированный фрагмент очищали и фосфорилировали по концам T4-полинуклеотидкиназой (производства TAKARA BIO INC.), с последующим лигированием в вектор pUC118 (расщепленный рестриктазой HincIIи дефосфорилированный в сайте расщепления). Лигирование проводили, используя набор DNA Ligation Kit Ver. 2 (производства TAKARA BIO INC.). E. coli DH5α трансформировали продуктами лигирования плазмиды, после чего выделяли плазмидную ДНК с получением плазмид, в которые были субклонированы различные гены L-ldh (SEQ ID NO:3). Полученные плазмиды pUC118, в которые были встроены гены L-ldh, расщепляли рестриктазами XhoIи NotI с получением фрагментов ДНК, каждый из которых затем встраивали по сайтам XhoI/NotI в дрожжевой вектор экспрессии pTRS11 (фиг. 7). Таким образом, получали плазмиду pL-ldh5, экспрессирующую человеческий ген L-ldh (ген L-ldh). Вышеописанную pL-ldh5, которая является плазмидой, экспрессирующей человеческий ген L-ldh, депонировали в Международном Патентном Депозитарии Организмов (International Patent Organism Depositary), Национальном Институте Развития Технических Наук и Технологии (National Institute of Advanced Industrial Science and Technology, AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Япония), под регистрационным номером FERM AP 20421 (дата депонирования: 21 февраля 2005 года), в форме плазмиды, непосредственно.
Используя плазмиду pL-ldh5, содержащую человеческий ген LDH, в качестве матрицы для амплификации, и олигонуклеотиды, имеющие последовательности, приведенные в SEQ ID NO:4 и SEQ ID NO:5, в качестве набора праймеров, проводили ПЦР с целью амплификации фрагмента ДНК, содержащего человеческий ген LDH, имеющий длину 1,3 т.п.н., и терминаторную последовательность гена TDH3 Saccharomyces cerevisiae. Затем, используя плазмиду pRS424 в качестве матрицы для амплификации, и олигонуклеотиды, имеющие последовательности, приведенные в SEQ ID NO:6 и SEQ ID NO:7, в качестве набора праймеров, проводили ПЦР с целью амплификации фрагмента ДНК, содержащего ген TRP1 Saccharomyces cerevisiae длиной 1,2 т.п.н. Каждый фрагмент ДНК выделяли из электрофорезного 1,5%-го агарозного геля и очищали согласно стандартной методике. Используя смесь полученных таким образом фрагмента длиной 1,3 т.п.н. и фрагмента длиной 1,2 т.п.н. в качестве матрицы для амплификации, и олигонуклеотиды, имеющие последовательности, приведенные в SEQ ID NO:4 и SEQ ID NO:7, в качестве набора праймеров, проводили ПЦР, получив продукт, который затем подвергали электрофорезу в 1,5%-ом агарозном геле, получив таким образом фрагмент ДНК, имеющий длину 2,5 т.п.н., который содержал связанные человеческий ген LDH и ген TRP1. Указанным фрагментом ДНК, имеющим длину 2,5 т.п.н., трансформировали почкующиеся дрожжи Saccharomyces cerevisiae NBRC10505 на прототрофность по триптофану, согласно стандартной методике.
Подтверждение того, что полученные трансформированные клетки несли человеческий ген LDH после промотора PDC1 в дрожжевом геноме, проводили следующим образом. Геномную ДНК трансформированных клеток получали согласно стандартной методике, а затем проводили ПЦР, используя полученную геномную ДНК в качестве матрицы для амплификации, и олигонуклеотиды, имеющие последовательности, приведенные в SEQ ID NO:8 и SEQ ID NO:9, в качестве набора праймеров, с подтверждением получения амплифицированного фрагмента ДНК, имеющего длину 0,7 т.п.н. Затем способность трансформированных клеток продуцировать молочную кислоту подтверждали, культивируя трансформированные клетки в питательной среде SC (METHODS IN YEAST GENETICS 2000 EDITION, CSHL PRESS), с подтверждением содержания в культуральном супернатанте молочной кислоты путем измерения количества молочной кислоты методом ВЭЖХ.
С помощью ВЭЖХ анализа обнаружили L-молочную кислоту в концентрации 4 г/л, при этом концентрация D-молочной кислоты находилась ниже предела чувствительности. Из вышеописанных исследований подтверждали, что полученный трансформант обладал способностью продуцировать L-молочную кислоту. Полученные трансформированные клетки обозначили как дрожжевой штамм SW-1 и использовали данный штамм для последующей ферментации с целью получения L-молочной кислоты.
Справочный пример 8: Ферментация с получением L-молочной кислоты (дрожжи)
Ферментацию с целью получения L-молочной кислоты проводили при использовании штамма дрожжей, полученного в Справочном примере 7 (SW-1). Питательная среда в качестве источника углерода содержала глюкозу и Yeast Synthetic Drop-out Medium Supplement без триптофана (Sigma Aldrich Japan, таблица 34, Drop-out MX), Yeast Nitrogen Base без аминокислот и сульфата аммония (Difco, Yeast NTbase), а также сульфат аммония, в качестве других компонентов, смешанные в соотношении, показанном в таблице 34. Питательную среду перед использованием в ферментации стерилизовали фильтрованием (Millipore, Stericup 0,22 мкм). Концентрацию глюкозы определяли с использованием Glucose Test Wako (производства Wako Pure Chemical Industries, Ltd.). Количество молочной кислоты, продуцируемой в каждой культуре, измеряли с помощью ВЭЖХ при аналогичных условиях, как в Справочном примере 6.
Штамм SW-1 культивировали в 5 мл среды для ферментации (среды для прекультивирования) в пробирке в течение ночи со встряхиванием (прекультура). Клетки дрожжей собирали из прекультуры с помощью центрифугирования тщательно промывали клетки 15 мл стерильной воды. Промытые дрожжевые клетки инокулировали в 100 мл среды, состав которой описан в таблице 34, и выращивали в колбе Сакагучи объемом 500 мл в течение 40 часов со встряхиванием (основная культура).
Справочный пример 9: Способ ферментации с получением L-молочной кислоты (молочнокислая бактерия)
Среду для бактериальной ферментации с целью получения L-молочной кислоты, показанную в таблице 35, автоклавировали (121°C, 15 минут) и использовали в качестве питательной среды. В качестве молочнокислой бактерии использовали штамм Lactococcus lactis JCM 7638, который является прокариотическим микроорганизмом, а в качестве питательной среды использовали среду для ферментации молочнокислых бактерий, состав которой показан в таблице 35, с целью получения молочной кислоты. L-молочную кислоту, содержащуюся в среде ферментации, анализировали таким же способом, как в Справочном примере 1. Концентрацию глюкозы измеряли, используя Glucose Test Wako C (производства Wako Pure Chemical Industries, Ltd.).
Штамм Lactococcus lactis JCM 7638 выращивали в статической культуре, в объеме 5 мл, в обработанной током азота среде для ферментации молочной кислоты, состав которой показан в таблице 35, в пробирке, в течение 24 часов при температуре 37°C (прекультура). Полученную культуру инокулировали в 50 мл свежей, обработанной током азота, среды для ферментации молочной кислоты, и выращивали статическую культуру в течение 48 часов при температуре 37°C (основная культура).
Справочный пример 10: Ферментация с получением этанола (дрожжи)
Изучали ферментацию с синтезом этанола штаммом дрожжей (OC2, Saccharomyces cerevisiae, винные дрожжи). Среду, используемую для ферментации, приготавливали, подвергая среду, имеющую состав согласно Справочному примеру 8, стерилизации фильтрованием (Millipore, Stericup 0,22 мкм). Концентрацию глюкозы определяли, используя Glucose Test Wako (производства Wako Pure Chemical Industries, Ltd.). Количество этанола, продуцируемого в каждой культуре, измеряли с помощью ГХ при аналогичных условиях, как в Справочном примере 7.
Штамм OC2 культивировали в 5 мл среды для ферментации (среда для прекультивирования), в пробирке со встряхиванием в течение ночи (прекультура). Клетки дрожжей выделяли из прекультуры с помощью центрифугирования, и тщательно промывали клетки 15 мл стерильной воды. Промытые клетки дрожжей инокулировали в 100 мл среды, состав которой описан в таблице 34, и выращивали в колбе Сакагучи объемом 500 мл в течение 24 часов, со встряхиванием (основная культура).
Справочный пример 11: Ферментация с получением кадаверина (Corynebacterium glutamicum)
В качестве микроорганизма для получения кадаверина использовали штамм Corynebacterium glutamicum TR-CAD1, описанный в JP 2004-222569 A, с целью изучения ферментации кадаверина при ассимиляции глюкозы. Среду для ферментации кадаверина получали, приготавливая сахарный раствор, такой как глюкозосодержащую композицию, показанную в таблице 36, в качестве источника углерода, уровень pH доводили до 7,0 3 М водным раствором аммиака. Оценку концентрации кадаверина, который является продуктом, проводили путем измерения методом ВЭЖХ. Концентрацию глюкозы измеряли, используя Glucose Test Wako C (производства Wako Pure Chemical Industries, Ltd.).
К штамму Corynebacterium glutamicum TR-CAD1B в пробирке объемом 5 мл добавляли среду для ферментации кадаверина, с добавкой канамицина (25 мкг/мл) и выращивали штамм в течение ночи со встряхиванием (прекультура). Из прекультуры штамм Corynebacterium glutamicum TR-CAD1 выделяли с помощью центрифугирования и клетки тщательно промывали 15 мл стерильной воды. Промытые бактериальные клетки инокулировали в 100 мл вышеописанной среды и выращивали в колбе Сакагучи объемом 500 мл в течение 24 часов, со встряхиванием (основная культура).
Справочный пример 12: Ферментация с получением D-молочной кислоты
В качестве микроорганизма использовали дрожжевой штамм NBRC10505/pTM63, описанный в JP 2007-074939 A, а в качестве питательной среды использовали среду для получения D-молочной кислоты, состав которой показан в Таблице 37. Анализ концентрации D-молочной кислоты, которая являлась продуктом, проводили путем измерения методом ВЭЖХ аналогичным образом, как в Справочном примере 1. Концентрацию глюкозы измеряли, используя Glucose Test Wako C (производства Wako Pure Chemical Industries, Ltd.).
Штамм NBRC10505/pTM63 культивировали в 5 мл среды для получения D-молочной кислоты, в пробирке, в течение ночи со встряхиванием (прекультура). Полученную культуру инокулировали в 50 мл свежей среды для получения D-молочной кислоты и выращивали в колбе Сакагучи объемом 500 мл в течение 24 часов при температуре 30°C со встряхиванием (основная культура).
Справочный пример 13: Способ ферментации с получением янтарной кислоты
В качестве микроорганизма, обладающего способностью продуцировать янтарную кислоту, использовалиштамм Anaerobiospirillum succiniciproducens ATCC53488, с целью проведения ферментации янтарной кислоты. В колбу Эрленмейера объемом 125 мл вносили 100 мл культуральной среды для посева, состав которой показан в таблице 38, с последующей термической стерилизацией.
В анаэробном боксе с перчатками в среду добавляли 1 мл 30 мМ Na2CO3 и 0,15 мл 180 мМ H2SO4, а также 0,5 мл восстанавливающего раствора, содержащего 0,25 г/л цистеина·HCl и 0,25 г/л Na2S, с последующей инокуляцией штамма ATCC53488 и выращиванием статической культуры при 39°C в течение 24 часов (основная культура).
Пример 17: Ферментация в целях получения химических продуктов с применением сахарных растворов, очищенных из обработанного разбавленной серной кислотой/обработанного ферментом водного сахарного раствора
Из 1 литра каждого водного сахарного раствора и очищенных сахарных растворов (раствора, обработанного с помощью нанофильтрационной мембраны, и раствора, обработанного с помощью обратноосмотической мембраны) в Примере 1 выпаривали воду при пониженном давлении (200 гПа) при использовании роторного испарителя (производства Tokyo Rikakikai), с получением приблизительно трехкратно концентрированного раствора/жидкости. Используя указанные компоненты и, для сравнения, химически чистую глюкозу, приготавливали компоненты питательной среды, подходящие для соответствующих случаев ферментации при условиях концентрирования соответствующих продуктов среды, описанных в условиях ферментации, показанных в Справочных примерах 8-13, и использовали приготовленные компоненты питательной среды в основной культуре. В прекультуре использовали химически чистую глюкозу, а каждый сахарный раствор использовали только в основной культуре. В результате, как показано в таблице 39, в случаях, в которых проводили обработку с помощью мембраны, было показано наилучшее предотвращение ингибирования ферментации и повышенные концентрации накапливаемых химических продуктов по сравнению со случаем, в котором обработку с помощью мембраны не производили.
В отношении теста ферментации с получением L-молочной кислоты при использовании дрожжей (Справочный пример 8), количество глюкозы в сахарном растворе, расходуемой в процессе ферментации, и выход относительно сахара (глюкозы) показаны в таблице 40. Обработка водного сахарного раствора с помощью нанофильтрационной мембраны или обратноосмотической мембраны также приводила к улучшениям в расходовании сахара, по сравнению со случаем, в котором обработку не производили.
Пример 18: Ферментация для получения химических продуктов с применением сахарных растворов, очищенных из гидротермически обработанного/обработанного ферментом водного сахарного раствора
Приблизительно из 1 литра каждого водного сахарного раствора и очищенных сахарных растворов (раствора, обработанного с помощью нанофильтрационной мембраны, и раствора, обработанного с помощью обратноосмотической мембраны) в Примере 2 воду выпаривали при пониженном давлении (200 гПа) с использованием роторного испарителя (производства Tokyo Rikakikai), получив приблизительно 1,2-кратно концентрированный раствор/жидкость. Используя указанные компоненты и, для сравнения, химически чистую глюкозу, приготавливали компоненты среды, подходящие для соответствующих случаев ферментации при условиях концентрирования соответствующих компонентов среды, описанных в условиях ферментации, показанных в Справочных примерах 8-13, и использовали приготовленные компоненты среды в основной культуре. В прекультуре использовали химически чистую глюкозу, а каждый сахарный раствор использовали только в основной культуре. В результате, как показано в таблице 41, в случаях, в которых проводили обработку с помощью мембраны, было показано улучшение предотвращения ингибирования ферментации и повышенные концентрации накапливаемых химических продуктов, по сравнению со случаем, в котором обработку мембраной не производили.
Пример 19: Ферментация для получения химических продуктов с применением сахарных растворов, очищенных из обработанного аммиаком/обработанного ферментом водного сахарного раствора
Приблизительно из 1 литра каждого водного сахарного раствора и очищенных сахарных растворов (раствора, обработанного с помощью нанофильтрационной мембраны, и раствора, обработанного с помощью обратноосмотической мембраны) в Примере 3 воду выпаривали при пониженном давлении (200 гПа) с использованием роторного испарителя (производства Tokyo Rikakikai), получив приблизительно 1,2-кратно концентрированный раствор/жидкость. Используя указанные компоненты и, для сравнения, химически чистую глюкозу, приготавливали компоненты среды, подходящие для соответствующих случаев ферментации при условиях концентрирования соответствующих компонентов среды, описанных в условиях ферментации, показанных в Справочных примерах 8-13, и использовали приготовленные компоненты среды в основной культуре. В прекультуре использовали химически чистую глюкозу, а каждый сахарный раствор использовали только в основной культуре. В результате, как показано в таблице 42, в случаях, в которых проводили обработку с помощью мембраны, было показано улучшенное предотвращение ингибирования ферментации и повышенные концентрации накапливаемых химических продуктов, по сравнению со случаем, в котором обработку не производили.
Пример 20: Ферментация для получения химических продуктов с применением сахарных растворов, очищенных из гидротермически обработанного водного сахарного раствора
Из 1 литра каждого водного сахарного раствора и очищенных сахарных растворов (раствора, обработанного с помощью NF мембраны, и раствора, обработанного с помощью RO мембраны) в Примере 5 воду выпаривали при пониженном давлении (200 гПа) с использованием роторного испарителя (производства Tokyo Rikakikai), получив приблизительно 20-кратно концентрированный раствор/жидкость. Используя указанные компоненты и, для сравнения, химически чистую глюкозу, приготавливали компоненты среды, подходящие для соответствующих случаев ферментации при условиях концентрирования соответствующих компонентов среды, описанных в условиях ферментации, показанных в Справочных примерах 8-13, и использовали приготовленные компоненты среды в основной культуре. В прекультуре использовали химически чистую глюкозу, а каждый сахарный раствор использовали только в основной культуре. В результате, как показано в таблице 43, в случаях, в которых проводили обработку с помощью мембраны, было показано улучшение предотвращения ингибирования ферментации и повышенные концентрации накапливаемых химических продуктов, по сравнению со случаем, в котором обработку не производили.
Пример 21: Влияние pH водного сахарного раствора на получение химического продукта
Для исследования влияния pH водного сахарного раствора на получение химических продуктов с применением очищенного сахарного раствора сравнивали и изучали результаты ферментации L-молочной кислоты с применением водных сахарных растворов, имеющих различные pH. В качестве источников углерода в среде для ферментации использовали два типа очищенных сахарных растворов в Примере 7 (полученных при обработке водных сахарных растворов при pH 3 и 7 с помощью обратноосмотической мембраны), а в качестве контроля использовали химически чистую глюкозу. Уровень pH каждой из очищенных сахарных растворов в Примере 7 в объеме 0,5 л доводили серной кислотой и водным раствором аммиака до pH 5, и полученные растворы разбавляли до концентрации глюкозы 55 г/л, получив сахарные растворы A и В (A: обработанный через обратноосмотическую мембрану при pH 3; B: обработанный через обратноосмотическую мембрану при pH 7). К указанным сахарным растворам добавляли Yeast Synthetic Drop-out Medium Supplement без триптофана (Sigma Aldrich Japan, таблица 34, Drop-out MX), Yeast Nitrogen Base без аминокислот и сульфата аммония (Difco, Yeast NTbase), и сульфат аммония таким образом, чтобы было достигнуто соотношение, показанное в таблице 34 для среды ферментации L-молочной кислоты в Справочном примере 8, с получением среды на основе очищенного сахарного раствора A и В, соответственно. Аналогичным образом приготавливали среду на основе химически чистого моносахарида, смешивая химически чистую глюкозу в соотношении, показанном в таблице 34.
Каждую питательную среду стерилизовали фильтрованием (Millipore, Stericup 0,22 мкм) перед применением в ферментации. Концентрацию глюкозы определяли с использованием Glucose Test Wako (производства Wako Pure Chemical Industries, Ltd.). Количество молочной кислоты, продуцируемой в каждой культуре, измеряли с помощью ВЭЖХ при аналогичных условиях, как при измерении органических кислот методом ВЭЖХ в Справочном примере 2.
В соответствии со способом в Справочном примере 8, дрожжевой штамм SW-1 прекультивировали в 5 мл среды на основе химически чистого моносахарида в пробирке, а затем основную культуру выращивали в среде на основе очищенного сахарного раствора A и B и в среде на основе химически чистого моносахарида. В результате, как показано в таблице 44, применение очищенного сахарного раствора, полученного при обработке водного сахарного раствора (pH 3) через обратноосмотическую мембрану, приводило к более высокому расходованию глюкозы микроорганизмами, которое было эквивалентно расходованию, наблюдаемому в случае среды на основе химически чистого моносахарида, по сравнению со случаем очищенного сахарного раствора, полученного при обработке водного сахарного раствора (pH 7) через обратноосмотическую мембрану. Таким образом, можно утверждать, что ингибирование ферментации в первом случае было снижено. Кроме того, также было показано, что концентрация накапливаемой молочной кислоты в случае среды на основе очищенного сахарного раствора, полученного при фильтровании водного сахарного раствора (pH 3) через обратноосмотическую мембрану, была эквивалентна концентрации в случае среды на основе химически чистого моносахарида.
Пример 22: Сравнение эффективности нанофильтрационной мембраны и обратноосмотической мембраны при получении химических продуктов
Для сравнения эффективности нанофильтрационной мембраны и обратноосмотической мембраны при получении химических продуктов сравнивали и изучали результаты ферментации этанола с применением сахарного раствора, полученного с помощью очистки через нанофильтрационную мембрану, сахарного раствора, полученного с помощью очистки через обратноосмотическую мембрану, и сахарного раствора, полученного с помощью очистки через нанофильтрационную мембрану и обратноосмотическую мембрану. В качестве источника углерода использовали три типа очищенных сахарных растворов в Примере 15 (растворов, подвергнутых обработке с помощью нанофильтрационной мембраны, обработке с помощью обратноосмотической мембраны, или обработке с помощью нанофильтрационной мембраны с последующей обработкой с помощью обратноосмотической мембраны) и, в качестве контроля, химически чистую глюкозу. Каждый из концентрированных сахарных растворов, полученных в Примере 15, в объеме 0,5 л доводили до pH 5 водным раствором аммиака, и полученные растворы разбавляли до концентрации глюкозы 55 г/л, получив сахарные растворы E, F и G (E: обработанный через нанофильтрационную мембрану; F: обработанный через нанофильтрационную мембрану, а затем через обратноосмотическую мембрану; G: обработанный через обратноосмотическую мембрану). К указанным сахарным растворам добавляли Yeast Synthetic Drop-out Medium Supplement без триптофана (Sigma Aldrich Japan, таблица 34, Drop-out MX), Yeast Nitrogen Base без аминокислот и сульфата аммонияа (Difco, Yeast NTbase), и сульфат аммония таким образом, чтобы было достигнуто соотношение, показанное в таблице 34, в Справочном примере 8, получив среды на основе очищенного сахарного раствора C-E, соответственно. Аналогичным образом приготавливали среду на основе химически чистого моносахарида, смешивая химически чистую глюкозу в соотношении, показанном в таблице 34.
Каждую среду стерилизовали фильтрованием (Millipore, Stericup 0,22 мкм) перед применением в ферментации. Концентрацию глюкозы определяли с использованием Glucose Test Wako (производства Wako Pure Chemical Industries, Ltd.). Количество этанола, продуцируемого в каждой культуре, измеряли с помощью ГХ при условиях, описанных в Справочном примере 1.
В соответствии со способом в Справочном примере 9, штамм OC2 прекультивировали в 5 мл среды на основе химически чистого моносахарида в пробирке, а затем основную культуру выращивали в среде на основе очищенного сахарного раствора C-E и среде на основе химически чистого моносахарида. В результате, как показано в таблице 45, C и D, в которых использовали сахарные растворы, очищенные с помощью нанофильтрационной мембраны, показали уровни расходования глюкозы и концентрации накапливаемого этанола, эквивалентные полученным в случае среды на основе химически чистого моносахарида. Таким образом можно утверждать, что в указанных случаях ингибирование ферментации было снижено. В случае E, в котором использовали сахарный раствор, очищенный с помощью обратноосмотической мембраны, как было также подтверждено, была показана ферментация, практически эквивалентная ферментации в случае среды на основе химически чистого моносахарида, хотя несколько хуже, чем в случае C и D.
Справочный пример 14: Получение E. coli для ферментации кадаверина
Для повышения уровня экспрессии гена лизиндекарбоксилазы, который присутствует в хромосоме E. coli и повышает эффективность ферментации кадаверина, предприняли попытку получения штамма, в котором промотор гена лизиндекарбоксилазы заменен промотором гена gapA (гена глицеральдегиддегидрогеназы) E. coli. Замену промотора производили с помощью модифицированного метода прерывания гена посредством гомологичной рекомбинации при использовании FLP-рекомбиназы. Способ получения был следующим.
<1> Клонирование промотора гена gapA
Штамм E. coli W3110 культивировали и собирали с помощью центрифугирования, после чего экстрагировали геномную ДНК, используя набор для выделения ДНК UltraClean Microbial DNA Isolation Kit (производства MO BIO Laboratories, Inc.). Что касается деталей операции, следовали инструкциям производителя.
Используя полученную таким образом геномную ДНК в качестве матрицы и олигонуклеотиды (SEQ ID NO:10 (KS029) и SEQ ID NO:11 (KS030)) в качестве набора праймеров проводили ПЦР с целью амплификации промотора гена gapA (500 п.н. слева от гена gapA; в дальнейшем называемого "gapA-промотором"). Для реакции ПЦР-амплификации использовали KOD-Plus полимеразу (производства Toyobo Co. Ltd.), а также реакционный буфер и смесь дНТФ, прилагаемые к полимеразе. Приготавливали пятьдесят микролитров реакционной системы таким образом, что в смеси содержалось 50 нг/образец геномной ДНК, полученной, как описано выше, в соответствии с инструкциями производителя, прилагаемыми к полимеразе, 50 пмоль/образец праймеров и 1 единица/образец KOD-Plus полимеразы (производства Toyobo Co. Ltd.). Реакционную смесь подвергали термической денатурации при использовании ПЦР-амплификатора iCycler (производства BIO-RAD) при 94°C в течение 5 минут; с последующими 30 циклами: 94°C в течение 30 секунд (термическая денатурация), 55°C в течение 30 секунд (отжиг праймеров) и 68°C в течение 30 секунд (элонгация комплементарной цепи); после чего раствор охлаждали до температуры 4°C. Получали праймеры для амплификации гена (SEQ ID NO:10 (KS029) и SEQ ID NO:11 (KS030)), которые содержали сайты узнавания HindIII на их 5'-концах и 3'-концах.
Каждый ПЦР-амплифицированный фрагмент фосфорилировали по концам T4-полинуклеотидкиназой (производства TAKARA BIO INC.), с последующим лигированием в вектор pUC118 (расщепленный рестриктазой HincII и дефосфорилировали по сайту расщепления). Лигирование проводили с использованием набора DNA Ligation Kit Ver. 2 (производства TAKARA BIO INC.). Компетентные клетки E. coli DH5a (производства TAKARA BIO INC.) трансформировали лигазной смесью и сеяли на чашки LB, содержащие 50 мкг/л антибиотика ампициллина, с последующим выращиванием клеток в течение ночи. Плазмидную ДНК выделяли из выращенных колоний с помощью Miniprep и расщепляли рестриктазой HindIII, с последующим отбором плазмид, в которые был встроен промотор gapA. Все операции проводили в соответствии с прилагаемыми инструкциями производителя.
<2> Клонирование гена лизиндекарбоксилазы
Далее ПЦР проводили, используя геномную ДНК E. coli W3110, полученную в <1>, в качестве матрицы и олигонуклеотиды (SEQ ID NO:12 (CadAF2) и SEQ ID NO:13 (CadAR2)) в качестве набора праймеров, с целью клонирования гена cadA, кодирующего лизиндекарбоксилазу. Реакцию ПЦР-амплификации проводили при тех же условиях, как в <1>, за исключением того, что реакцию элонгации проводили в течение 2 минут. Праймеры для амплификации гена (SEQ ID NO:12 (CadAF2) и SEQ ID NO:13 (CadAR2)) получали таким образом, что последовательность, узнаваемая HindIII, была присоединена на их 5'-концах, а последовательность, узнаваемая XbaI, присоединена на их 3'-концах. Полученный ДНК-фрагмент лигировали в вектор pUC118 аналогичным образом, как в <1>, с получением вектора pUC118, в который был встроен ген cadA. Полученный вектор расщепляли по HindIII и XbaI для подтверждения вставки гена cadA в плазмиду.
Затем вектор pUC118, в который был встроен ген cadA, расщепляли рестриктазами HindIIIи XbaI,а полученный ДНК-фрагмент, содержащий ген cadA, лигировали по сайтам HindIII/XbaI в pUC19. Полученную плазмидную ДНК выделяли и расщепляли рестриктазами HindIII и XbaI, проводя таким образом отбор вектора экспрессии, в который был встроен ген cadA. Полученную плазмиду обозначили как pHS7.
<3> Клонирование гена устойчивости к хлорамфениколу
Ген cat клонировали с помощью ПЦР, используя в качестве матрицы вектор pKD3, содержащий ген устойчивости к хлорамфениколу (ген cat) и фланкирующие его сайты узнавания FLP, и в качестве набора праймеров олигонуклеотиды (SEQ ID NO:14 и SEQ ID NO:15). Реакцию ПЦР-амплификации проводили при таких же условиях, как в <1>, за исключением того, что реакцию элонгации проводили в течение 1 минуты. Праймеры для амплификации гена (SEQ ID NO:14 и SEQ ID NO:15) получали таким образом, что последовательность, узнаваемая BamHI, былаприсоединена на их 5'-концы, а последовательность, узнаваемая SacI, былаприсоединена на их 3'-концы. Полученный ДНК-фрагмент лигировали в вектор pUC118 аналогичным образом, как в <1>, с получением вектора pUC118, в который был встроен ген cat. Полученный вектор расщепляли рестриктазами BamHIи SacI для подтверждения вставки гена cat в плазмиду.
<4> Встраивание гена cat и промотора gapA в pHS7
Далее, вектор pUC118, в который был встроен ген cat, расщепляли рестриктазой BamHI,и получали плазмиду, встраивая полученный ДНК-фрагмент по сайтам BamHI/SacIвышеописанной pHS7. Полученный вектор расщепляли рестриктазами BamHI и SacI для подтверждения вставки гена cat в плазмиду. Таким образом, полученную плазмиду обозначили как pKS5.
<5> Введение кассеты gapA промотора-гена cadA в хромосому
Далее вектор pUC118, в который был встроен промотор gapA, расщепляли рестриктазой HindIII и получали плазмиду, встраивая полученный ДНК-фрагмент по сайту HindIII вышеописанной pKS5. ПЦР проводили, используя указанную плазмидную ДНК в качестве матрицы и олигонуклеотиды (SEQ ID NO:16 SEQ (Ml3 RV) и SEQ ID NO:11 (KS030) SEQ) в качестве набора праймеров. Для ПЦР использовали PremixTaq ExTaq Ver (производства TAKARA BIO INC.). С помощью ПЦР плазмиду, с которой мог быть получен амплифицированный фрагмент длиной приблизительно 500 п.н., отбирали как целевую плазмиду. Таким образом, полученную плазмиду обозначили как pKS8.
Используя в качестве матрицы pKS8, полученную, как описано в <4>, а в качестве набора праймеров олигонуклеотиды (SEQ ID NO:17 (KS032) и SEQ ID NO:18 (KS033)), проводили ПЦР с целью амплификации фрагмента ДНК, содержащего gapA промотор, ген cadA и ген cat. Для реакции ПЦР-амплификации использовали KOD-Plus полимеразу (производства Toyobo Co. Ltd.), а также реакционный буфер и смесь дНТФ, прилагаемые к полимеразе. Пятьдесят микролитров реакционной системы приготавливали таким образом, что в смеси содержалось 50 нг/образец плазмидной ДНК, 50 пмоль/образец праймеров и 1 единица/образец KOD-Plus полимеразы (производства Toyobo Co. Ltd.). Реакционную смесь подвергали термической денатурации, используя ПЦР-амплификатор iCycler (производства BIO-RAD) при 94°C в течение 5 минут; с последующими 30 циклами: 94°C в течение 30 секунд (термическая денатурация), 65°C в течение 30 секунд (отжиг праймеров) и 68°C в течение 3 минут и 30 секунд (элонгация комплементарной цепи); после чего раствор охлаждали до температуры 4°C. Полученный амплифицированный фрагмент длиной приблизительно 3,5 т.п.н. выделяли из агарозного геля после электрофореза согласно стандартному методу и доводили концентрацию до 500 нг/мкл.
Штамм (в дальнейшем называемый W3110/pKD46), полученный путем введения плазмиды pKD46, несущей FLP рекомбиназу, в штамм W3110, инокулировали в 5 мл среды LB и выращивали в течение ночи при 30°C (прекультура). Полученную прекультуру подвергали 1%-ой инокуляции в 5 мл среды SOB (с добавкой 1 мМ арабинозы), после чего выращивали при 30°C до OD600 0,6 (основная культура). Основную культуру центрифугировали для сбора бактериальных клеток, бактериальные клетки промывали 3 раза охлажденным на льду 10%-ым глицерином, после чего бактериальные клетки суспендировали в 50 мкл 10%-го глицерина. К полученной суспензии бактериальных клеток добавляли 2 мкл ПЦР-амплифицированного фрагмента, очищенного, как описано выше, и охлаждали полученную смесь на льду в течение 30 минут. Затем суспензию переносили в кювету для электропорации (0,2 см) и проводили электропорацию (2500 В, 25 мкФ, 200 Ω) при использовании GenePulser Xcell (производства BIO-RAD). После приложения электрического импульса, в кювету добавляли 1 мл среды SOC и собирали суспензию бактериальных клеток, с последующим подращиванием при 37°C в течение 2,5 часов. Культуру сеяли на LB агар с добавкой 25 мкг/л хлорамфеникола и выращивали при 37°C в течение ночи.
После подтверждения того, что полученная колония не росла на среде LB с ампициллином, с помощью ПЦР, используя выделенный геном в качестве матрицы и олигонуклеотиды (SEQ ID NO:19 (KS007) и SEQ ID NO:20 (KS008)) в качестве праймеров, подтверждали, что это - целевой штамм, в котором промотор гена cadA заменен gapA промотором. В целевом штамме, полученном посредством гомологичной рекомбинации, получали амплифицированный продукт размером приблизительно 3,8 т.п.н., тогда как в штамме, в котором вставка в результате гомологичной рекомбинации не содержалась в нужном положении, получали амплифицированный продукт размером приблизительно 2,3 т.п.н. В результате можно было подтвердить амплифицированный продукт размером приблизительно 3,8 т.п.н. Указанный штамм, в котором промотор гена cadA заменили gapA промотором, обозначили как штамм W3110(gapA-cadA).
Пример 23: Получение очищенного сахарного раствора, содержащего ксилозный компонент
В качестве сахарных растворов, содержащих большое количество ксилозного компонента, уровни pH обработанного разбавленной серной кислотой раствора в Справочном примере 3 (концентрация ксилозы 15 г/л) и гидротермически обработанного раствора в Справочном примере 4 (концентрация ксилозы 14 г/л) доводили до pH 3 и 7 водным раствором гидроксида кальция и серной кислотой, соответственно, с последующим фильтрованием полученных жидкостей через микрофильтрационную мембрану. Мутность каждой жидкости в данный момент не превышала 1,0 NTU. Указанные водные сахарные растворы, в общей сложности 4 типа, обрабатывали через нанофильтрационную мембрану аналогичным способом, как в Примере 1, с получением очищенных сахарных растворов. Используя в качестве нанофильтрационной мембраны нанофильтрационную мембрану UTC60 из сшитого пиперазин полиамида (нанофильтрационная мембрана 1; производства TORAY INDUSTRIES, INC.), фильтрацию проводили до тех пор, пока объем неочищенной жидкости не уменьшился до одной четверти от первоначального объема. Концентрации ингибирующих ферментацию веществ и моносахаридов, содержащихся на данный момент в каждом концентрате в емкости для неочищенной жидкости, анализировали с помощью ВЭЖХ (производства корпорации Shimadzu). Результаты, полученные для ингибирующих ферментацию веществ (уксусная кислота, муравьиная кислота, ГМФ, фурфурол, ванилин, ацетованилин и сиреневая кислота) и моносахаридов (глюкоза и ксилоза), приведены в таблицах 46 и 47.
Пример 24: Ферментация кадаверина E. coli с применением ксилозосодержащего сахарного раствора
Проводили тест на ферментацию с целью получения кадаверина в процессе ферментации кадаверина штаммом E. coli в Справочном примере 14 (штамм W3110(gapA-cadA)). В отношении среды, в общей сложности использовали 5 типов источников углерода, а именно 4 типа очищенных сахарных растворов в Примере 23 и, для сравнения, приготовленный на основе химически чистого моносахарида с использованием химически чистой глюкозы и ксилозы. Уровень pH каждого из очищенных сахарных растворов в объеме 0,5 л доводили серной кислотой и водным раствором аммиака до 5, получив сахарные растворы F, G, H и I (F: приготовленный путем обработки гидротермически обработанной жидкости через нанофильтрационную мембрану при pH 3; G: приготовленный путем обработки гидротермически обработанной жидкости через нанофильтрационную мембрану при pH 7; H: приготовленный путем обработки жидкости, обработанной разбавленной серной кислотой, через нанофильтрационную мембрану при pH 3; I: приготовленный путем обработки жидкости, обработанной разбавленной серной кислотой, через нанофильтрационную мембрану при pH 7). К полученным сахарным растворам добавляли сульфат магния, сульфат аммония, гидрофосфат калия и полипептон S в соотношении, показанном в таблице 48, получив среды на основе очищенного сахарного раствора F-I, соответственно. Среду на основе химически чистого моносахарида приготавливали путем смешивания вышеуказанных компонентов в соотношении, показанном в таблице 48, таким образом, чтобы концентрация химически чистой ксилозы составила 50 г/л. Каждую среду стерилизовали фильтрованием (Millipore, Stericup 0,22 мкм) перед применением в процессе ферментации. Концентрацию ксилозы определяли количественно, используя набор для измерения концентрации ксилозы (Megazyme).
Штамм W3110(gapA-cadA) культивировали в 5 мл среды на основе химически чистого моносахарида в пробирке при встряхивании в течение ночи (прекультура). Бактериальные клетки собирали из прекультуры с помощью центрифугирования и тщательно промывали 15 мл стерильной воды. Промытые бактериальные клетки инокулировали в 100 мл каждой среды, описанной в таблице 48, и выращивали в колбе Сакагучи объемом 500 мл в течение 24 часов при встряхивании. В результате, как показано в таблице 49, применение очищенных сахарных растворов F и H, обработанных через нанофильтрационную мембрану при pH 3, приводило к более высоким уровням расходования ксилозы, по сравнению со случаями очищенных сахарных растворов G и I, обработанных через нанофильтрационную мембрану при pH 7. Таким образом, можно утверждать, что в двух первых случаях ингибирование ферментации было снижено. Кроме того, было показано, что концентрация накапливаемого кадаверина также была эквивалентна концентрации в случае среды на основе химически чистого моносахарида.
Промышленная применимость
В соответствии с настоящим изобретением ингибирующие ферментацию вещества могут быть удалены из водного сахарного раствора, полученного из целлюлозосодержащей биомассы, и, с другой стороны, очищенные сахарные растворы, содержащие такие моносахариды, как глюкозу и ксилозу, могут быть получены с высокой чистотой и высоким выходом, таким образом, применение очищенного сахарного раствора в качестве исходного сырья для ферментации позволяет повысить эффективность ферментационного производства различных химических продуктов.
Описание условных обозначений
1 - Емкость для неочищенной жидкости
2 - Камера, оснащенная нанофильтрационной мембраной или обратноосмотической мембраной
3 - Насос высокого давления
4 - Поток жидкости, проходящей через мембрану
5 - Поток жидкости, концентрируемой на мембране
6 - Поток культуры, подаваемой насосом высокого давления, или фильтрата из нанофильтрационной мембраны
7 - Нанофильтрационная мембрана или обратноосмотическая мембрана
8 - Поддерживающая пластина
Реферат
Изобретение относится к химии сахаров. Способ включает стадию гидролиза целлюлозосодержащей биомассы с получением водного сахарного раствора. Затем полученный водный сахарный раствор фильтруют через нанофильтрационную мембрану и/или обратноосмотическую мембрану. Очищенный сахарный раствор собирают со стороны впуска и удаляют ингибирующие ферментацию вещества со стороны фильтрата. Указанные ингибирующие ферментацию вещества представляют собой одно или более соединений из органических кислот, соединений фурана и фенольных соединений. Изобретение позволяет получить очищенный от ингибирующих ферментацию соединений сахарный сироп простым способом и повысить эффективность ферментационного получения различных химических продуктов. 2 н. и 11 з.п. ф-лы, 7 ил., 49 табл., 24 пр.
Формула
(1) стадию гидролиза целлюлозосодержащей биомассы с получением водного сахарного раствора; и
(2) стадию фильтрования полученного водного сахарного раствора через нанофильтрационную мембрану и/или обратноосмотическую мембрану, со сбором очищенного сахарного раствора у стороны впуска и удалением ингибирующих ферментацию веществ со стороны фильтрата, где указанные ингибирующие ферментацию вещества включают одно или более выбранных из группы, состоящей из органических кислот, соединений фурана и фенольных соединений.

(в которой R обозначает -H или -CH3; а n обозначает целое число от 0 до 3).
культивирование микроорганизмов или культивируемых клеток при использовании сахарного раствора в качестве исходного сырья для ферментации.

Комментарии