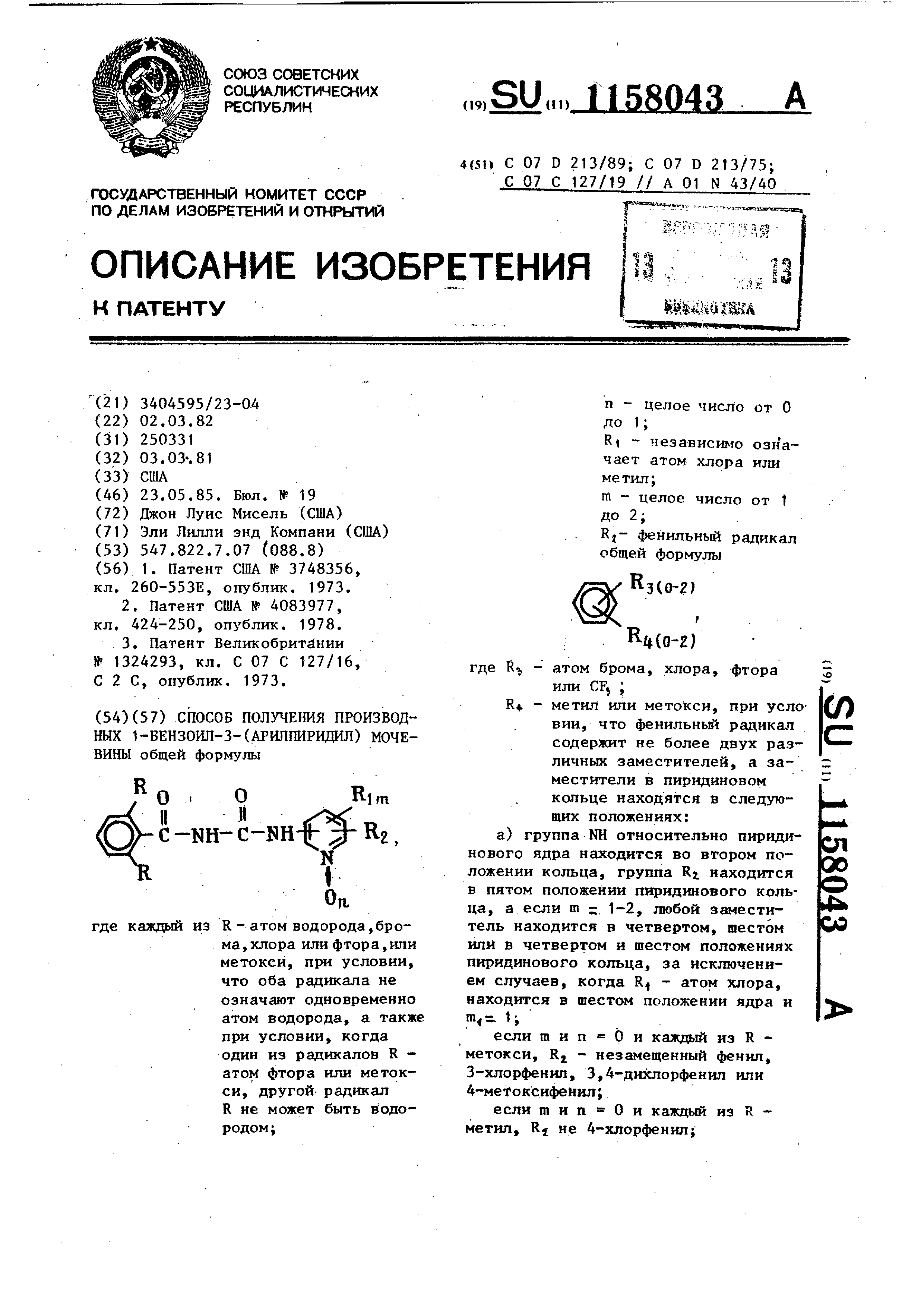
Изобретение относится к способам получения новых производных 1-бензо ил-3-(арш1пирвдш1)мочевины общей формулы R о ( О С-Ш-С-Ш-( Re, R где казвдый из R - атом водорода, брома, хлора или фтора, или метокси, при условии, что оба радикала не означают одновременно атом водорода , а также при условии, что когда один из R - атом фтора или метокси, другой R -не водородi n - целое число от О до 1 i- . Rf - независимо озна4keT атом хлора или метилi m - целое число от 1 до 2; Rj - фен1й1ьный радикал общей формулы где Rj атом брома, хлора, фтора или CFj ; R4. - метил или метокси, при условии , что фенилъный радикал содержит не более двух различных заместителей, а заместители в пиридиновом кольце находятся в следующих положениях; а) группа NH относительно пириди нового ядра находится во втором положении кольца, группа Rj находится в пятом положении пиридинового кольца, если m 1-2, любой замести тель находится в четвертом, шестом или четвертом и шестом положениях пиридинового кольца, за исключением случаев, когда RI - атом хлора, находится в шестом положении ядра и m 1-, если m и п О и каждый из R - : метокси, R - незамеьченный фенил, 3-хлорфенил, 3,4-дихлорфенил или 4-метоксифенил; если m и п О и каждый из R метил , Ri не 4-хлорфенил; если m и п О, а один из R атом хлора, а другой - атом-водорода , Rj не 3-хлорфенил, 3,4-дихлорфенил , 4-толил, 4-метоксифенил; если m 2 и п О, один из R атом хлора, а другой R - атом водорода , RJ - не 3-хлорфенил, 3,4-дихлорфенил , 4-толил или 4-метоксифенил; . если m 2 и п О, один из R, метил , а другой R не атом хлора-, если п 1, ни один из R не явля ется метилом или метокси, любой из R, - метил или атом хлора, а Rj фенил , в пара-положении замещенный атомом брома, хлора или фтора, метилом и CFj i если п 1 и один из R - атом водорода, m 1-2, б) группа NH относительно пирид нового кольца находится в третьем положении ядра, группа RI находится в шестом положении пиридинового кол ца, а если m 1, любой из заместителей RI находится вПЯТОМ положени пиридинового кольца, за исключением соединений, в которых m 0-1, если п О, R, - метил, если п О, один из R - метил, а другой - атом водорода Rj не явл ется незамещенным фенилом; если h , 1 , каждый из R нгзаписиМО друг от друга атом хлора или фтора; 1 - метил-, R, - пара-замещсчный феннп, атомом брома, хлора или фтора, мет1лпом, которые могут быть использованы в качестве .ипсекпщидои в сельском хозяйстпе. Известно взаимодер1ствие изоцианатов с аминами 1 . Как правило, реакцию проводят в органическом растворителе, таком как -углеводород, галоидуглеводород, этилацетат или ацетонитрил при температуре от О С до кипения растворителя, предпочтительно при комнатной темпе-ратуре Q2 . Наиболее близким по структуре, аналогом является 1-(2,6-дифторбензоил)-3- (4-хлорфенш1)мочевина (Дифлюбензурон ), обладающий инсектицидными свойствами , Цель изобретения - разработка на основе известного метода способа получения новых производных 1-бензоил-3- (арилпиридил)мочевины, обладающих инсектицидными свойствами. Поставленная цель достигается способом получения производных 1-бензоил-3- (арилпиридил)мочевины общей формулы I , заключающимся в том, что бензоильное производное общей формулы где R имеет указанные значения, подвергают взаимодействию с производHbw пиршзина общей формулы (2, где RI , Rj., тип имеют указанные значения, и целевой продукт вьщеляют в свободном виде. Исходные соединения общих формул 1 и iM получают известньми способами . Пример 1. 2- 4-XлopфeнJiл- (3-димeтипaминo)J акролеин. 81 г Диметилформамида по каплям добавляют к 138 г оксихлоркда фосфора , поддерживая температуру реакционной массы 20-30 С внешним охлаждением .
Смесь перемешивают в течение
15мин при комнатной температуре с Последующим добавлением к ней 50 г 4-хлорфенш1уксусной кислоты в 30 мл ДМФ. После выдержки при 65-75 С в течение 20 ч реакционную смесь охладают , выливают в 1 кг льда и подщелачивают до рН 12 добавлением 50%ного гидрата окиси натрия с последущей вьщержкой при повышенной температуре над паровой баней в течение
1 ч. Образовавшийся осадок отфильтрвьшают , а затем перекристаллизовывают из этилацетата, в результате чего получают желаемый продукт с Т.Ш1. 117-120°С.
Пример 2. 5-(4-Хлорфенил)-3-циано-2 (1Н)-пиридон..
7 г натрия в 300 мл метанола перемешивают с одновременным добавлением в него метанольного раствора
16г 2-цианоацетамида и 37 г 2-(4-хлорфенш1 )-3-(диметиламино)-акролеина . Затем приготовленную смесь вьщерживают в течение 1 ч при температуре кипения с обратным холодильником , а образовавшийся осадок отфильтровывают, промывают этанолом , растворяют в горячей воде и затем подкисляют. Образовавшийся
осадок отфильтровывают, промывают водой, Идентифицируют его как деле- вой продукт с т.пл. 278-280 С.
Пример 3. 2-Хлор-5-(4-хлорфенил )-3-пиридинкарбонитрил..
Смесь 2,0 г 3-циано-5-(4-хлорфенил-2-/1Н/-пиридона с 3,8 г фенилфосфондихлорида выдерживают 4 ч при 175 С на масляной бане. Затем смесь вьтивагот в смесь воды со льдо и подщелачивает добавлением гидрата окиси аммония при перемешивании. Образовавшийся коричневатый твердый продукт используют без дальнейшей очистки (2,0 г, т.пл. t85-l87c).
I .
Пример 4. 2-Амино-5-(4-хлорфенил )-3-пиридинкарбонитрил.
Раствор 2,0 г 2-хлор-5-(4-хлорфенил )-3-пиридинкарбонитрила в 30 мл ДМСО выдерживают на масляной бане при 80-90°Cj а затем обрабатывают 2,5 ч газообразн№« аммиаком. Далее реакционная смесь стоит при комнатной температуре в течение приблизительно 60 ч с последующим
добавлением в нее дополнительно 5 г исходного реагента в 35 мл ДМСО. Затем смесь при 80-90 С в течение примерно 28 ч обрабатывают аммиаком после чего ее выливают в смесь воды со льдом. Образовавшийся рыжевато-коричневый твердый осадок отфильтровьгеают в количестве 5,5 г с т.пл. С и используют в дальнейшем без предварительной очистки .
Пример 5. 2-Лмино-5-(4-хлорфенил )-3-пиридинкарбоновая кислота.
2,0 г 2-амино-5-(4-хлорфенип)-3-пиридинкарбонитрила в 25 мл 50%-ной серной кислоты вьщерживают при температуре кипения с обратным холодильником в течение 24 ч. Подкисленный раствор выливают в смесь воды со льдом с получением 2,7 г твердого желтого осадка, который отфильтровывают и с помощью ЯМР-спектрограммы и идентифицируют как целевой продукт
Синтез целевого продукта можно также проводить путем щелочного гидролиза. Для этого 2,0 г 2-амино-5- (4-хлорфенил)-3-пирвдинкарбонитрила и 2,0 г гидрата окиси калия в 30 MJi этилен гликоля выдерживают на масляной бане при 150 С. Через 3 ч реакция завершается, и щелочной раствор выливают в смесь воды со льдом с последующим подкислением, в результате чего получают целевой продукт. Конечный продукт вновь идентифицируют с помощью ЯМР-спектрограмМЬ1 (выход - 2,3 г, т.пл. 300-315°С, разл.).
Пример 6, 5-(4-Хлорфенил)-2-пиридипамин .
1,0 г 2-амино-5-(4-хлорфенш1)-3-пиридинкарбоновой кислоты, 0,2 г порошкообразной меди и 10 мл хинолина вьщерживают на масляной бане при 205°С. По истечении 2,5 ч Температуру в течение дополнительного часа повышают до . В результате образуется твердый осадок, который собирают, а затем промывают этилацетатом . Затем раствор отдел5пот и осадок подвергают хроматографической обработке на 300 мл силикагеля. Смолоподобный твердый продукт с помощью .диэтилового эфира вводят в верхнюю часть колонки с последующим элюированием дополнительньм количеством диэтилового эфира до полного удаления хинолина. В результате элюирования этилацетатом очень медленно 7 вьщеляется коркчневый твердый продукг , который перекристаллизовываю из смеси метанола с водой, в резул тате чего получают 400 мг рыжевато коричневых плоских кристаллов с т.пл. 122-1244. Вычислено,%: С 24,56; Н А,43; N 13,69. Найдено,%: С 24,48; Н 4,33; .N 13,99. Пример 7. 1-(2,6-Дихлорбензоил )(4-хлорфенил)-2-пиридилД-мочевина . При комнатной температуре проводят реакцию между 0,6 г 5-(4-хлорфенил )-2-пиридиламина и 0,8 г 2,6-дихлорбензоилизоцианата в небольш количестве дихлорметана. Несколько экзометрическая реакция сопровожда ется почти немедленным вьщелением осадка. По истечении 3 ч при комнатной температуре реакционную сме охлаждают на ледяной бане, а затем фильтруют с получением 770 мг бесцветных кристаллов. Идентичность этого продукта с т.пл. 230-233 С подтверждается ЯМР-спектрограммой, выход продукта 62,4%. Вычислено,%: С 54,25; Н 2,88, N 9,99. Найдено,%: С 54,28; Н 3,00; N 10,23. Пример 8, 1-(2,6-Диметокс бензоил)-3- 5-(4-хлорфенил)-2-пиридилЗ-мочевИИа . Проводят реакцию между 0,6 г 5-(4-хлорфенил)-2-пиридиламина и 0,8 г 2,6-диметоксибензоилизоциана та в небольшом количестве дихлорме тана в течение 2 ч при комнатной температуре. Эта реакция также несколько экзотермична, но не сопровождается вьтадением осадка. Далее смесь кипятят 30 мин с обратньм холодильником, охлаждают до. комнат ной температуры и разделяют. Образовавшийся сырой твердай продукт п рекристаллизовывают приблизительно из 50 мл зтанола, в результате чег получают 780 мг иглоподобных кристаллов . Идентичность конечного про дукта с т.пл. 205-215°С подтвержда ется ЯМР-спектрограммой, выход про ду1ста 64,6%. Вычислено,%: С 21,24; Н 4,41; N fo,20.. Найдено,%: С 20,99; Н 4,24; N 10,01. 438 Пример 9. 1-(2-Хлорбеняоил )-3- 5-(4-хлорфенил)-2-пириднл} -мочевина . Проводят реакцию между 0,6 г 5- (4-хлорфенил)-2-пиридиламина и 0,7 г 2-хлорбензоилизоциан-ата в соответствии с примером 7. Идентичность продукта, выход которого 920 мг, а т.пл. 228-231°С, подтверждается ЯМР-спектрограммой, выход продукта 81,3%. Вычислено,%: С 59,09; Н 3,39; N 10,88. Найдено,%: С 58,83; Н 3,12; N 10,64. Пример 10. N-f2-(4-Xлopфeнил )-3-(диметиламино)-2-пропенилиден -N- feтIшмeтaнaминийпepxлopaт. 219 г ДМФ при постоянном перемешивании и с применением ледяной бани для поддержания температуры в интервале 27-30 С по каплям добавляют в 162 МЛ хлорокиси фосфора. Эту смесь перемешивают при комнатной температуре в течение 45 мин, добавляют в нее 102,3 г 4-хлорфенилуксусной кислоты, после чего смесь вьщерживают на масляной бане при 80-90° С в течение 3 ч. После перемешивания в течение примерно 18 ч реакционную смесь вьшивают на лед с применением ледяной бани для поддержания температуры, близкой к комнатной. При интенсивном перемешивании добавляют твердый моногидрат NaClO., в результате чего образуется твердый продукт, который отфильтровьшают, промывают 15%-ным раствором NaClO., высушивают на воздухе и перекристаллизовывают из кипящего этанола (выход продукта 170,3 г, т.пл. 142-146°С). TI р и м е р 11. 2-Амино-5-(4-хлорфенил )-3-пиридинкарбонитрил. ,у 16,2 г метоксида натрия в 300 мл метаТгола и 19,8 г малокон,итрила в 50-100 мл метанола при О С на бане из смеси спирта со льдом добавляют к 101,1 г (4-хлорфенил)-3-(диметиламино )-2-пропенилиденЗ -N-метилмета наминийперхлората в 300 мл пиридина. Реакционную смесь при комнатной температуре .перемешивают в течение приблизительно 20 ч, после чего ее вновь охлаждают до . Далее в нее добавляют 120 мл гидроокиси аммония. Через 3 ч образовывается обильный осадок. Этот твердый осадок отфильтровьшают, промывают водой и с помощью ЯМР-спектрограммы устанав ливают, что это целевой продукт (выход - 44 г, т.пл. 202-204°С). В результате добавления в фильтрат 600-800 мл воды получают дополнител ное количество продукта, хотя он и содержит примеси. Пример 12. 5-(4-Хлорфенил) -2-пиридиламин. В соответствии с примерами 5 и 6 проводят конверсию 5-(4-хлорфенил)-2-амино-З-пиридинкарбонитрила в целевой продукт. Идентичность этого продукта подтверждена ЯМР-анализом. П ри м е р 13. 1-(2,6-Дифторбензоил )-3-Г5-(4-хлорфеншт)-2-пиридил -мочевина . 2г 5-(4-хлорфенил)-2-пиридиламина растворяют в 90 мл ацетонитрила с последующим проведением реакции в зоне азота при комнатной температуре с 2,6г 2,6-дифторбензоилизоци ната. Немедленно образовывается тве дый продукт, который после перемети вания в течение приблизительно 15 ч собирают и с помощью ЯМР-анализа и идентифицируют как целевой продукт (выход 3,4 г, т.пл. 229-234с), выход продукта 88,0%. Вычислено,%: G 58,85; Н 3,12 N 10,84. Найдено,%: С 58,70-, Н 3, N 10,92. Пример 14. 5-(Диметиламино )-4-фенш1-2,4-пентадиеннитрил. 5,64 г триметилсилипацетонитрила в 10 мл ТГФ при температуре от -68 до -70 С добавляют к 20,6 мл Н-буТШ1ЛИТИЯ в 20 мл ТГФ. Для поддержания этой температуры в течение приблизительно 45 мин после операции добавления используют баню из смеси сухого льда с ацетоном. Затем реакционную смесь нагревают до температуры примерно -40 С и доволь но быстро по каплям добавляют в нее раствор 15 г винамидиновой соли (аналогичной указанной в примере 10 в 40 мл пиридина, поддерживая температуру в интервале приблизительно от -45 до -40 С. По истечении примерно 1 ч реакционную смесь, нагр вают до комнатной температуры, и тверда1й продукт, который образ овался в процессе добавления, переходит в раствор. Далее эту смесь перемешивают в течение 20 ч. После удаления из нее в вакууме растворителя образуется густой маслоподобный продукт, который растворяют в этилацетате . Образовавшийся органический слой несколько раз промьшают водой, затем насыщенным раствором поваренной соли и высушивают в вакууме с получением маслоподобного продукта, которьй кристаллизуется. Этот кристаллизованный продукт перекристаллизовывают из этанола и идентифицируют ЯМР-спектральньм анализом как целевой продукт (выход - 5,4 г, т.пл. 75-81° С). Вычислено,%: С 78,75-, Н 7,12; N 14,19. Найдено,%: С 77,27; Н 7,41; N 13,72. Из этанола повторно перекристаллизовьшают небольшое количество материала с т.пл. 81-83 С. Найдено,%: С 78,52; Н 6,92; N 13,86. Осуществляют также другую процедуру получения целевого продукта. В раствор 11,3 мл н-бутиллития в 75 мл ТГФ в бане из смеси сухого льда с ацетоном добавляют 2,58 г диизопропштамина. После перемеш1геания в течение приблизительно 10 мин добавляют 1,02 г ацетонитрила в 25 мл ТГФ, поддерживая температуру на уровне около -70°С. Реакционную смесь перемешивают в течение приблизительно 40-50 мин при -78°С, а затем добавляют в нее 7,5 г винамидиновой соли в 20 мл пиридина. Перед добавлением температуру повьппают до -45°С, после чего поддерживают ее в интервале от -45 до -40°С до полного завершения операции добавления, В дальнейшем реакционную смесь перемешивают при температуре приблизительно -45 С в течение 1 ч, оставляют нагреваться до комнатной температуры и перемешивают ее в течение дополнительных 18 ч. Растворитель удаляют, получая маслоподобный продукт, который растворяют в этилацетате. Органический слой несколько раз промьшают водой, затем насьш1енным раствором хлористого натрия и, наконец, высушивают в вакууме с получением маслоподобного остатка, который твердеет. Этот твердый продукт перекристаллизовывают из этанола (выход-1,5 г, т,шт, 77-83 С), Пример 15. 5-Фенял-2-1Шридиламин . . Через слой из 50 мл ДМСО в течение приблизительно 0,5 ч пропускают пузырьки аммиака, а затем добавляют 3,0 г 5-(диметиламина)-4-феншт-2,4-пентадиеннитрила . Эту реакционную смесь постепенно нагревают до 110°С вьщерживают при этой температуре в течение приблизительно Л2 ч с после дующим выливанием в смесь воды со льдом и экстракционной обработкой этилацетатом. Цдя разрушения эмульсии используют диэтиловый эфир, пос ле, чего проводят 2-3 экстракционной обработки хлороформом. Обе порции высушивают в вакууме, в результат,е чего получают 1,1 г сырого полутвер дого продукта из эфирной порции и 2,3 г сырого полутвердого продукта из хлороформной порции. ХроматографИческая обработка экстрагируемой диэтиловым эфиром фракции на силика геле с использованием этилацетата в качестве элюента позволяет получить приблизительно 300 мг конечног продукта с т.пл, 129-132 С. Вычислено,% С 77,6; Н 5,92; N 16,46. Найдено,%: С 77,38; Н 6,10; N 19,25. Пример 16. 1-(2,6-Дихлорбе зоил)-3-(5-фенш1-2-пиридш1)-мочевин . 1,5 г 2,6-дихлбрбензоилизоцианат в небольшом количестве дихлорметана добавляют в раствор 1,0 г 5 фенил-2-пиридш1амина в 15 мл дихлорметана После кипячения в течение приблизительно 5 мин с обратньм холодильником образуется осадок. После этого реакционную смесь перемешивают при комнатной температуре, затем охлаждают, отфильтровьтают осадок и перекристаллизовывают его из этанола с получением 1,8 г продукта. Идентичность конечного продукта под тверждена ЯМР-спектральным анализом (т.пл. 221-23Гс), выход продукта 79,3%. Вычислено,%: С 59,09; Н 3,39; N 10,88. Найдено,%: С 58,,95; Н 3,47-, N 10,83. Пример 17. 1-Метил-2-фенилэтилиденпропандинитрил . 66 г малононитрила, 134 г фенилацетона , 8 г ацетата аммония и 24 мл ледяной уксусной кислоты кипя тят в 400 мл бензола в течение приблизительно 2 ч с обратньм холодильником . Добавляют воду, а затем бензольный слой пpo a roaloт несколько раз, высушивают и отгоняют в вакууме с получением маслоподобного продукта. Тонкослойный хроматографический анализ (диэтиловый эфир) этого маслоподобного продукта дает одно основное пятно, показывая незначительное содержание нескольких примесей. Идентичность маслоподобного продукта как целевого соединения подтверждена ЯМР-спектрапьным анализом. Пример 18. 3,3-Диэтокси-1-метил-2-фенилпропилиденпропандинитрил . 9 т 1-метил-2-фенилэтилиденпропандинитрила обрабатывают 45 мл триэтилортоформиата и 5 каплями бортфторидной соли эфира на масляной бане при 140-150°С в течение приблизительно 18 ч. Реакционную смесь кипятят с обратньм холодильником в течение приблизительно 4ч, а затем в нее добавляют 10 мл триэтилортоформата и несколько капель бортрифторидной соли эфира. Далее смесь вновь нагревают, разделяют отгонкой легких фракций, а после добавления в нее дихлорметана вновь отгоняют легкие фракции, в результате чего получают остаток в виде сырого конечного продукта. Пример 19. 3,3-Диметокси-1-метил-2-фенш1Пропилиденпропандинитрил . Целевой продукт получают в соответствии с примером 18, за исключением того, что в качетве исходного реагента используют не триэтилортоформиат , а триметилортоформиат. Пример 20. Смесь 2-амино-4-метил-5-фенил-3-пиридинкарбонитрила с 2-амино-6-метип-5-фенил-3-пиридинкарбонитрилом . При комнатной температуре к 7 г 3,3-диметокси-1-мвтил-2-фенилпропили-, енпропандинитрила в 350 мл ТГФ по каплям добешляют 40 мл гидрата окиси аммония. После перемешивания реакционной смеси в течение приблизительно 18 ч в нее добавляют дополнительно 10 мл гидрата окиси аммония. По истечении примерно 24 ч из смеси отгонят легкие фракции, в результате чего получают сырой продукт темного вета, который подвергают хроматограической обработке на 300 мл силикагеля с использованием дихлорметана и смеси дихлорметана с 50% этилацетата в качестве элюентов. Далее сырой продукт перекристаллизовьшают из метанола с получением серых игло- 5 подобных кристаллов, которые, как установлено ЯМР-спектральным анализом , содержит приблизительно 60% 4 мети11- и примерно 40% 6-метилизомеров (выход - 4,95 г, т.пл. 156-159°С).°
Вычислено,%: С 74,64; И 5,26; N 20,10.
Найдено,%: С 74,41; Н 5,23; N 20,35.,.. Пример 21.Смесь 2-амино-4 метил-5-фенил-3-пиридинкарбонитрила с 2-амино-6-метш1-5-фенш1-3-пиридинкарбонитрилом (другая процедура).
20 мл гидрата окиси аммония по каплям добавляют при комнатной тем- 20 пературе в смесь подвергнутых хроматографической обработке 4,1 г 3,3-диэтокси-1-метил-2-фенш1пропилиденпропандинитрила и 1,9 г 3, 3-диметокси-1-метил-2 фенш1Пропилиден- 25 пропандинитр1-ша, которые получают в соответствии с примерами 18 и 19, в 100 мл ТГФ. В результате осуществления процеруры, описанной в примере 20, и перекристаллизации из эта- 30 нола получают 2,4 г целевой смеси с т.пл. 157-163°С.
Пример 22. Смесь 2-амино-4-метил-5-фенил-З-пиридинкарбоновой 35 кислоты с 2-амино-6-метш1-5-фенил-3-пиридинкарбоновой кислотой.
2 г смеси примера 21 с 2 г гидроокиси калия в 90 мл этиленгликоля выдерживаютв течение 2 ч при 150- 40 . Затем в смесь добавляют дополнительно 3 г гидроокиси калия и , кипятят смесь с обратным холодильником в течение дополнительных 2ч. Далее реакционную смесь выливают в 45 воду и нейтрализуют до рН 4-5, в результате чего получают 5,5 г сырого твердого продукта в виде различных фракций с т.пл. 258-272°С (с разл.). Этот сырой продукт вновьSO
омыливают 9 г гидроокиси калия в 90 мл этиленгликоля при 170°С в течение 12ч. Затем эту реакционную смесь выливают в воду и нейтрализуют до рН 7. При этом рбразовывается55
коричневатый твердый продукт, который отфильтровывают, и ЯМР-спектральный анализ подтверждает, что он
является целевым продуктом (4,45 г с т.пл. 264-270°С (с разл.).
Приме р 23. Смесь 4-метил-5-фенил-2-пиридиламина с 6-метип-5-фенил-2-пиридиламином и ее разделение .
9,8 г смеси примера 22 и 2 г порошкообразной меди в 100 мл хинолина выдерживают а масляной бане при 255-290°С (в основном, при 260270 С) в течение приблизительно 3-4 ч до завершения реакции. Тонкослойный хроматографический анализ (двуокись алюминия-этилацетат/10% метанола) показьшает наличие двух возможных аминовых пятен А и В. Реакционную смесь подвергают хроматографической обработке на 600 мл нейтральной окиси алюминия сорта BejjbM. Элюирование этилацетатом позволяет выделить вначале хинолин, затем пятно А совместно с некоторым количеством примесей, после чего - пятно В. Элюирование пятна В завершают смесью этилацетата с 5-10% метанола. Материал пятна В перекристаллизовывают из смеси толуола с петролейным эфиром с получением рыжевато-коричневых кристаллов , которые, как показал ЯМРспектральный анализ, представляют собой целевой 4-метильньй продукт с т.пл. 109-113°С (выход 2,35 г).
Материал пятна А также перекристаллизовьвают из смеси толуола с петролейным эфиром, в результате чего получают рыжевато-коричневые иглоподобные кристаллы, которые, как показал ЯМР-спектральньй анализ представляют собой целевой 6-метильный продукт с т.пл. 112-116°С (выход - 1,1 г).
Вычислено,I: С 78,23; Н 6,57-, N 15,21.
Найдено,% С 78,03; Н 6,37j N 15,01.
Пример 24. 1-(2,6-Дихлорбензоил )-3-(6-метил-5-фенил-2-пирвдил )-мочевина.
620 мг 2,6-дихлорбензоилизоцианата смешивают с 500 мг 6-метИл-5-феннл-2-пиридипамина в 25 мл этилацетата при комнатной температуре,,В результате образуется осадок, который отфильтровьшают и с помощью ЯМР-спектрапьного анализа устанавливают , что он является целевым прО дуктрм с т.пл. 219-220 С, выход продукта 460 мг, 42,2%, Вычислено,%: С 60,02; Н 3,78-, N 10,50. Найдено,%: С 59,77; Н 3,66; N 10,42. Пример .25. 1-(2,6-Дихлорбензоил )-3-(4-метил-5-фенил-2-пиридил )-мочевина. Проводят реакцию 1,4 г 2,6-дихлор бензоилизоцианата с 0,9 г 4-метил-5-фенил-2-пиридиламина в дихлорэтане . Непосредственно после совмещения реагентов начинается экзотермическая реакция, которая сопровождается само произвольным кипением с обратным хол дилъником. Затем реакционную смесь перемешивают при комнатной температуре , HQ осадка не образуется. После отгонки из смеси летучих фракций остаток пёрекристалшизовывают из этанола, в результате чего получили 1,0 г рыжевато-коричневых кристалло с т.пл. 210-214 С. Идентичность пол ченного продукта целевому была подтверждена ЯМР-спектрапьным анализом вьрсод продукта 51,1%. Вычислено,%: С 60,02; Н 3,78; N 10,50.Найдено ,%: С 60,22; Н 3,69 .N 10,21. Пример 26. 3-Фенилпентан-2 ,4-дион. В раствор 4,46 г фенипацетона, 0,6 г пара-толуолсульфокислоты и ук сусного ангидрида на водной бане при комнатной температуре с перемеш ванием и по каплям добавляют 34,8 г 36%-ной бортрифторидуксусной кислоты После перемешивания в течение ночи образуется твердый осадок, который собирают и промьгоают водой, а затем подвергают кипячению с обратным хол дильником в 100 мл воды и 9,0 г ацетата натрия в течение 2-3 г. Первоначальную реакционную смесь также вьщерживают при повьшенной температу ре совместно с 200 мл воды и 13,5 г ацетата натрия в течение того же времени. Обе смеси по отдельности подвергают экстракционной обработке с последующей промывкой насыщенным раствором бикарбоната натрия до полного удаления кислоты. Эфирные фракции высушивают, а затем выпаривают в вакууме с получен м маслоподобного остатка, который твердеет (выход - 1,4 г, т.пл, 40-52с). : Пример 27. 3-ит1ано-4,6-дтметил-5-фенил-2-пиридои . 24,6 г З-феннппентанг-2 ,4-диона растворяют приблизительно в 50 мл . диэтилового э4мра, а затем приготовленный раствор добавляют в раствор 7,8 г метоксида натрия в 200 мл диЭТИ .ПОВОГО эфира. Немедленно образуется осадок, который растворяют при перемешивании после добавления 100 мл воды. Приготовленный таким образом водньй раствор натриевой соли З-фенилпентан-2,4-диона обрабатывают 2-цианоацетамидом, 2 мл уксусной кислоты, 4,9 мл воды и пиперидином , количество которого достаточно для придания раствору основной реакции. После этого реакционную смесь кипятят с обратным холодильником в течение ночи, в результате чего обр1азуется маслоподобный остаток . Для доведения величины Н раствора до 5 в него добавляют уксусную кислоту, а после охлаждения воду декантируют и добавляют этанол с целью обеспечить сбор твердого продукта , выход которого составляет 7,05 г, а т.кип. 355-368 С (с разл.) Вычислено,%: С 74,98; Н5,39; N 12,49. Найдено,%: С 72,18; Н 4,97; N 11,82. Приме р 28. 2-Хлор-4,6-диметил-5-фенил-З-пиридинкарбонитрил . 7,0 г 3-циано-4,6-диметш1-5-фенил-2-пиридона и 12,1 г фенилфосфонийдихлорида вьщерживают в течение 2-3 ч при 175-180°С. Затем раствор охлаждают, выливают в смесь воды со льдом и подщелачивают до бавлением гидрата окиси аммония. В результате образуется осадок, кото- рый собирают, высушивают на воздухе и подвергают ЯМ-спектральному анализу , подтверждающему что это целевой продукт (выход - 7,6 г, т.пл. 118-123° С). Пример 29. 2-АМИНО-4,6-димeтttп-5-фeнил-3-пиpидинкapбoнитpил . 8,3 г 2-хлор-4,6-диметил-5-фенил-З-пиридинкарбонитрила растворяют в 110 мл ДМСО и подвергают обработке газообразным аммиаком при 100-110°G. После приблизительно 66-часовой выдержки при повьшенной температуре и обработки аммиаком реакционную смесь охлаждают и выливают в смесь воды со льдом Образовавшийся твердый осадок собирают промьюают водой, а затем высушивают в сушильной печи. Идентичность полу ченного продукта целевому подтвержд ена ЯМР-спектральным анализом„ Пример 30. 2-Амино-А,6-диметил-5-фенил-З-пиридинкарбоновая кислота, 0,5 г 2-амино-4,6-диметил-5-фенил-3-пиридинкарбонитрила и 1,0 г гидроокиси калия выдерживают в 15 м этиленгликоля при температуре прибл зительно 165° С в течение примерно 6 ч. Затем реакционную смесь выпива ют в смесь воды со льдo с последую щим ее подкислением до рН 4-6, В ре зультате образуется твердый продукт который собирают, промывают водой и идентифицируют тонкослойным хромато графическим и ЯМР-спектральным анал зами Как целевой продукт, П р и м е р 31, 4,6-Д1метил-5-ф нил-2-пиридиламин,, 6,1 г 2-амино-4,6-диметил-5-фени -3-пиридинкарбоновой кислоты и 1,0 порошкообразной меди выдерживают в течение приблизительно 3 ч в 50 мл хинолина при 270-290°С, Далее всю реакционную смесь подвергают хромато графической обработке на 600 мл силикагеля сорта Грейс 923 с исполь зованием вначале диэтилового эфира а затем этилацетата, в результате чего получают 3,0 г целевого продук та с т,пл, 105-112°С, Вычислено,%: С 78,75; Н 7,12; N 14,13, Найдено,%: С 78,59, Н 6,97; N13,93, П р и м е р 32, 1-(2-Хпорбензоил )-3-(4,6-диметил-5-фенил-2-пиридил )-мочевина, 0,5 г 4,6-диметил-5-фенил-2-пири диламина растворяют в 25 мл ацётонитрила и проводят реакцию между раствором.(в токе азота при комнатной температуре) и 0,6 г 2-хлорбенз илизоцианата. Сразу же образуется осадок, причем реакционную смесь перемешивают в те чтение приблизитель но 2 ч. Полученный твердый продукт собирают, промывают небольшим количеством ацетонитрипа и с помощью ЯМР-спектрального анализа иденти - фицируют в качестве целевого продук та с т.ил, 176-189°С, выход продукт 300 мг, т,е. 77%. Вычислено,%: С 66,40; Н 4,78; N 11,06, Найдено,%: С 66,68; Н 4,63; N 11,20, Пример 33,гамме-Ацетилбензолбутаинитрил , 0,6 г натрия добавляют в 120 г фенилацетона и смесь перемешивают при 95 С до расплавления натрия, Затег отводят избыток теплоты и продукты реагируют еще 5 мин, в результате чего натрий полностью растворяется . Далее по каплям при в течение 20-25 мин добавляют 31,8 г акрилонитрила с одновременным охлаждением для поддержания температуры. Затем реакционную смесь перемешивают в течение дополнительных 30 мин, охлаждают смесью воды со льдом и нейтрализзтот 4 мл ледяной уксусной кислоты. После добавления диэтилового эфира смесь 5 раз промывают водой , высушивают над сульфатом натрия и выпаривают в вакууме , В результ ате получают желтый маслоподобный продукт , который перегоняют. При 115° С и остаточном добавлении 0,50ммрт,ст, жидкость начала последовательно дистиллируют, отбирая при этом несколько фракций. Целевое соединение, идентифицированное ЯМР-спектральным анализом, со следами примеси собирают при температуре кипения 120122С , Вычислено,%: С 76,98; Н 7,00; N 7,48, Найдено,%: С 75,76; Н 6,89; N 6,83, Пример 34. 3,4-Дигидро-6метш1-5-фенил-2/1Н/-пиридон . При 0-5 С 1,5 г этанола добавляют в раствор 4,92 г. гамма-ацетилбен- золбутаннитрила в 150 мл диэтилового , пропуская одновременно . через раствор слабый ток газообразного хлористого водорода, Реакцион- ную смесь вьщерживают в сухих условиях и по истечении приблизительно 3 ч барбртирования хлористым водородом оставляют стоять в течение примерно 18 ч. Затем в вакууме удаляют из него растворитель, в реэультате чего остается маслоподоб- ньй продукт, который частично затвердевает . После добавления приблизительно 5 мл этанола образуется пригодный для сбора водонерастворимый осадок, который собирают и рас19 с полутирают в порошок в ацетоне чением 0,32 г продукта с т пл. 310330°С . Вычислено,%: С 76,98; Н N 7,48. Найдено,%: С 76,75; Н 6,78; N 7,40. П р и м е р 35. 6-Метил-5-фенил -2/1Н/-пиридон. 25,6 г 3,4-дигидро-6-метил-5-фенип-2/1Н/-пиридона и 4,9 г 5%-но го палладия на угле кипятят с обрат ньм холодильником в течение приблизительно 18 ч в 750 мл п-кумола. Поскольку после охлаждения образуется мало продукта, реакционную смесь кипятят и nejjeгоняют до дости жения постоянной температуры 173°С Кипячение продолжается 36 ч, затем реакционную смесь фильтруют в горячем состоянии. После охлаждения образовывается твердый осадок, который собирают и промывают диэтиловым эфиром, в результате чего пол чают 13,0 г продукта с т.пл. 201208° С. Пример 36. 6-Метш1-5-фенип -2-пиридиламин. Смесь 12,0 г 6-метил-5-фенил-2-пиридона и 14,4 г фенилфосфордиами дата в 300 мл дифенилового эфира вьщерживают в течение 19-20 ч при температуре приблизительно 220225 С (250°С). После охлаждения реа ционную смесь подвергают хроматогра фической обработке на силикагеле с использованием этилацетата. В общ сложности собирают 0,8 г целевого п зодукта, который предварительно перекристаш1изовьгоают из смеси дихлорметана с петролейным э4мром (с т.пл. 110-113 С). Вычислено,%: С 78,23; Н 6,57; N 15,21. Найдено,%: С 78,46, Н 6,29, N 15,07. . Пример 37. гамма-Ацетил-Бм -метилбензолбутаннитрил. 0,2 г натрия добавляют в 40 г фенипацетона, и смесь перемешивают при 95°С до расплавления натрия. Затем удаляют избыток теплоты реакции , и продукты взаимодействуют еще 5 мин до полного растворения натрия Затем при 80°С в течение 20-25 мин добавляютпо каплям 13,4 г кротоненитрипа с одновременным охлаждением для поддержания температуры. Далее 43 реакционную смесь выдерживают при 80-85 С в течение приблизительно 3-4 ч, после чего ее охлаждают и нейтрализуют небольшим количеством ледяной уксусной кислоты. После добавления диэтилового эфира смесь промывают 5 раз водой, высушивают над сульфатом натрия и выпаривают в вакууме. В результате образуется желтое масло, которое .перегоняют в вакууме. Целевой продукт дистиллируют при 140-142°С и остаточном давлении 0,5-0,6 мм рт.ст., что позволяет выделить 20,5 г продукта. Вычислено,%: С 77,58; Н 7,51,N 6,96. Найдено,%: С 77,72, Н 7,28; N 6,77. Пример 38. 4,6-Диметил-5-фенил-2-пиридиламин . Конверсию гамма-ацетил-бета-ме- типбензолбутаннитрила в целевой продукт проводят в соответствии с примерами 34-36. Пример 29. 1-(2,6-Дифторбензош1 )-3-(6-метил-5-фенил-2-пирИДил )-мочевина. Проводят реакцию 500 мг 6-метил-5-фенил-2-пиридиламина с 650 мг 2,6дифторбензоила в 25 мл этилацетата. В результате образуется остаток, которьй отфильтровывают, высушивают и идентифицируютЯМР-спектральным анализом как целевой продукт с т.пл. 206-208 С, выход продукта 600 мг, т.е. 62,5%. Вычислено,%: С 65,39; Н 4,12; N 11,14. Найдено,% С 65,35; Н 3,87; N 11,29. Пример 40. 1-(2,6-Дихлорбензоил )-3-(4,6-диметил-5-фенил-2-пиридил )-мочевина. В 25 мл этипацетата проводят реакцию 500 мг 4,6-д1метш1-5-фен1ш-2-пиридиламина с 650 мг 2,6-дихлорбензоипизоцианата , В результате образуется осадок, который отфильтровьшают , высушивают и с помощью ЯМР-спектрального анализа идентифицируют как целевой продукт с т.пл. 230-235 С, выход продукта 800 мг, т.е. 76,7%. Вычислено,%: С 60,88; Н 4,14; N 10,14. Найдено,%: С 60,63; Н 4,03; N 10,13.
211
Пример 41. 4-(4-Хлорфенил)-2-циано-5- (диметиламино)-2,4-пентадиенкарбоновая кислота, этиловый эфир.
50,5 г винамидиновой соли примера 10 в 160 мл пиридина при температуре ниже 0° С в бане из смеси сухого льда с ацетоном обрабатывают этоксидом натрия, полученным растворением 3,5 г натрия в 160 мл этанола при температуре ниже 0°С, 16,9 г этилцианоацетата по каплям добавляют в реакционную смесь с ее охлаждением таким образом, чтобы температура реакционной смеси поддерживалась на уровне ниже 5 С. После этого ,. смеси позволяют нагреться до комнатной температуры и перемешивают ее в течение приблизительно 18 ч, Затем растворитель удаляют в вакууме добавляют хлороформ и раствор промывают несколько раз водой. Во время сушки растворитель удаляют, и оставшийся твердый материал перекристаллизовынают из этанола, в результате чего получают 27,5 г продукта с т.пл. 168-170с. Тонкослойный хроматографический анализ (диэтиловый э4ир) дает одно желтое пятно со следами материала в начале . Небольшую пробу конечного продукта (380 мг) перекристаллизовывают повторна с получением продукта, которьй плавится при 168-170С,
Вычислено,%: С 63,05-, Н 5,62-, N 9,19.
, Найдено,%: С 62,83; Н 5,38, N9,27.
Пример 42. 2.Амино-5-(4-хлорфенип )-3-пиридинкарбоновая кислота , этиловый эфир-1-оксид.
3,04 г этилового эфира 4-(4-хлорфенш1 )-2-циано-5-(диметиламино)-2,4-пентадиенкарбоновой кислоты и 1,04 г гидроксиламина HG1 в 20 мл пиридина перемешивают в течение 18ч при 20-25°С. Затем реакционную смесь выливают в воду, в результате чего происходят быстрое осаждение. После отделения и промывки водой твердый продукт перекристаллизовывают из зтанола с получением 2,6 г вещества с т.пл. 141-153 С.
. Вычислено,%: С 57,44- Н 4,48; N 9,57.
Найдено,%: С 57,68; Н 4,51; N 9,72.
58043 . 22
Приме р 43. 6-Хлор-5-(4-хлорфеннл )-2-формамидо-3-пиридинкарбоновая кислота, этиловый эфир.
г сухого ДМФ по каплям добавляют к 114 мл , с одновременным охлаждением с целью поддержания температуры на уровне 40°С или ниже. В виде одной порции добавляют 23,8 г этилового эфир-1-оксида 2-амино-50 -(4-хлорфенил)-3-пиридинкарбоновоЙ1 кислоты. В результате температура быстро повьпиается до точки кипения и по истечении 15-25 мин реакционную смесь охлаждают с последующим
5 удалением из нее РОСй. Остаточный маслоподобный продукт выливают в смесь,воды со льдом и добавляют туда дихлорэтан. Затем органический слой многократно промывают насыщенным
0 раствором бикарбоната натрия с последующими сушкой и отгонкой в вакууме легких фракций, вследствие чего остается маслоподобный продукт, который твердеет. Тонкослойный хромато5 графический анализ (дихлорметан) показывает присутствие, в основном, целевого продукта, хотя в нем и имеется, некоторое количество примесей. Твердый продукт заметно растворим в
0 дихлорметане. Его подвергают хроматографической обработке на силикагеле Волема с использованием дихлорметана (необходимо 6-7 галлонов, 22,712-26,497 л дихлорметана), в ре , зультате чего получают 13,4 г продукта , с т.пл. 184-187°С.
П р им е р 44. 2-Амино-6-хлор-5- (4-хлорфенил)-3-пиридинкарбоновая кислота, этиловый .эфир.
0,5 г 6-xлop-5-(4-xлopфeнил)-2-фopмaмидo-3-пиpидинкapбoнoвoй кислоты (этилового эфира) частично растворяют в 50 мл этанола, и раствор обрабатывают приблизительно 5-6 капj лями концентрированной соляной кислоты . Реакционную смесь кипятят с обратньм холодильником в течение примерно 3ч, а после охлаяздения собирают твердый осадок, выход которого 350 мг, а т.пл. |95-198С.
Вычислено,%: С 54,04; Н 3,89; N 9,00.
Найдено,%: С 34,26; Н 3,80;
/ 9,29.
Пример 45. 2-Амино-6-хлор- . -5-(4-хлорфенил)-3-пиридинкарбоновая кислота. 0,3 Г этилового эфира 2-амино-6 -хлор-5-(4-хлорфенил)-3-пигидинкар боновон кислоты частично растворяю в 3 мл воды и 3 мл диоксана, а затем в раствор добавляют 0,2 г гидрата окиси натрия. Реакционную смесь кипятят в течение 1,5-2 ч с обратные холодильником. После нейт рализации смеси ледяной уксусной кислоты образуется осадок, который собирают и промывают водой с получением приблизительно 250 мг проду та с т.пл. 280-284°С (с разл.). Вычислено,%: С 50,91; Н 2,85; N 9,89. Найдено,%: С 48,86; Н 2,60; N 9,38. 46. 6-Хлор-5-(4Пример -хлорфенил)-2-пиридш1амин. 9 г 2-амино-6-хлор-5-(4-хлорфенил )-3-пирицинкарбоновой кислоты, 300 мл серной кислоты и 90 мл воды выдерживают на масляной бане при 220-230 0 в течение 1 ч. Затем реакционную смесь разбавляют до 2 л, охлаждают и нейтрализуют 50%ной гидроокисью натрия. В результа те образуется смолоподобный твердый продукт, который только частич удаляется фильтрованием. Далее фильтрат четырежды подвергают экст ракционной обработке 800-1000-миллилитровыми порциями дихлорметана, принимая меры предосторожности про тив возможного удаления при этом смолоподобного твердого продукта. Объединенные дихлорметановые слои высушивают над сульфатом магния. Отфильтрованный твердый продукт растворяют в этипацетате, а затем смесь воды с твердым продуктом под вергают экстракционной обработке некоторым количеством растворител Тонкослойный хроматографический анализ этого экстракта показывает наличие целевого продукта и примесей Затем дихлорметановые экстрак : ты фильтруют К ОТГОНЯЮТ ИХ летучие фракции, в результате чего получаю приблизительно 0,6 г целевого прод та с т.пл, 178г182С. Одновременно с этим обрабатывают этилацетатный экстракт с получением твердого остатка . Растирание этого твердого продукта в горячем дшспорметане с последующими фильтрованием и отгон кой легких акций позволяет получ приблизительно 0,8 г целевого продукта с Т.Ш1. 179-183 С. Пример 47. 1-(2,6-Дифторбензоил )-3- Сб-хлор-5-(4-хлорфеннп)-2-пиридил -мочевина . 0,3 г 6-хлор-5-(4-хлорфен1111)-2-пиридиламина растворяют в 25 мл ацетонитрила и обрабатывают 0,5 г 2,6-дифторбензош1изоцианата в токе азота и при комнатной температуре. Практически сразу же образуется осадок и по истечении приблизительно 3 ч перемешивания твердый продукт собирают и промывают ацетонитрилом, в результате чего получают 0,36 г продукта с т.пл. 237-241 С, выход продукта 63,3%. Вычислено,%: С 54, Н 2,63-, N 9,95. Найдено.%: С 54,26; Н 2,67; N 10,15. Пример 48. 6-(4-Хлорфенил)-З-циано-2-пиридон . Смесь 100 г 4-хлорацетофенона с 48 г этилформаита по каплям в течение 3 ч добавляют в интенсивно перемешиваемую холодную суспензию метилата натрия в 540 мл безводного диэтилового эфира. Для предотвращения повьнаения температуры до 3° С добавление проводят на ледяной бане. После завершения добавления баню со льдом удаляют и реакционную смесь перемешивают в течение приблизительно 18 ч при комнатной температуре. После этого суспензию бензоилацетальдегидной натриевой соли подвергают экстракционной обработке 400 мл воды и разделяют. 54,5 г цианоацетамида , раствор 9 мл уксусной кислоты, 22 мл воды и достаточное количество пиперидина добавляют в смесь для установления щелочной реакции, которую определяют с помощью лакмусовой бумажки. Далее реакционную смесь кипятят с обратньм холодильником в течение 2 ч, подкисляют добавлением уксусной кислоты до рН и тщательно охлаждают. Затем образовавшийся твердый продукт дважды нагревают в кипящем с обратным холодильником этаноле и каждый раз собирают нерастворившийся материал, ЯМР-спектральньо1 анализ показал, что этот твердый нерастворимый материал представляет собой целевой продукт с т,пл, 330339 С, который используют без дальнейшей очистки. 25 Вычислено,%: С 62,49-, F1 3,06; N12,15/ Найдено,%: С 63,63j Н 3,57j N 12,68. Пример 49. 2-Хлор-6-(4-хл фенил)-3-пиридинкарбонитрип. 42 г -(4-хлорфенил)-3-циано-2-пиридона и фенилфосфондихлорид, выдерживают в течение 2,5 ч при 175-180°С, принимая меры предостор ности дпя поддержания сухих услови проведения реакции. После охлаждения реакционную смесь выливают в 500 мл смеси воды со льдом, после чего ее слегка подщелачивают добав лением, концентрированной ,гидроокиси аммония. В результате образуетс твердый продукт, который тщательно пронь1вают водой и перекристаллизовывают из смеси этанола с ДМФ, пол чая 42 г продукта с т.пл. 179-181° Вычислено,%: С 57,86; Н-2,43; N 11,25. Найдено,%: С 57,91; Н 2,59; N 11,32. Пример 50. 6-(4-Хлорфенш1 -3-пиридинкарбонитрил. 2,49 г. 2-хлор-6-(4-хлорфенил)-3 -пиргвдинкарбонитрила используют для проведения- реакции в.присутствии 0,3 г 5%-ного палладия на угле в 100 мл даФ во встряхивателе Парр Затем реакционную смесь фильтруют и фильтрат выливают в смесь воды со льдом. В результате образуется твердый продукт, которьй собирают перекристаллизовьшают из этанола с получением 0,85 г вещества. Пример 51.. 6-(4-Хлорфенил )-3-пиридинкарбоксиамид. . 1,61 г 6-(4-хлорфенил)-3-пириди карбонитрила, 3,0 мл 30%-ной перекиси водорода, 0,3 мл 6 н.гидрооки си натрия и примерно 6 мл этанола помещают в реакционный сосуд и слегка охлаждают. Температура реак ционной смеси повьппается приблизительно до 50°С, и смесь перемешива ют затем примерно 1 ч. После охлаж дения реакционной смеси образуется твердьй осадок, который собираю т фильтрованием. Как показал тонкослойный хроматографический анализ, чистый продукт получен нагреванием этого твердого продукта в кипящем с обратным холодильником ацетоне, в результате чего вьщеляют 0,4 г в щества с т.пл. 245-258 С. 43.26 Пример 52. 6-(4-Хлорфенил)-3-пиридиламин . 2,14 г брома по каплям добавляют ,в охлажденный льдом раствор 2,68 г гидроакисй натрия в 32.мл воды. Затем в виде порций, поддерживая температуру на уровне приблизительно 0°С, добавляют пасту, .которая содержит 6-(.4-хлорфенил)-3-пиридинкарбоксиамид и воду. После перемешивания в течение 30 мин реакционную смесь нагревают до комнатной температуры , а затем ее медленно нагревают до 75-80°С и выдерживают при этой температуре 1 ч. В результате образуется темный осадок, которьтй отфильтровывают . Полученньй таким образом твердый продукт растворяют в диэтиловом эфире, а нерастворившиеся мат.ериалы удаляют фильтрованием. Эфирную порцию высушивают и выпаривают в вакууме с получением маслоподобного остатка. Этот материал дает несколько пятен при хроматогра.фической обработке на сипикагеле с использованием этилацетата. Как ИК-спектральньй, так и 5ГМР-спектральньй анализы подтверждают, что среднее и наиболее значительное пятно относится к целевому продукту, выход которого 180-190 мг.. Пример 53. 1-(2,6-Диxлopбeнзoип )(4-xдopфeншl)-3-пиpидил -мoчeвинa . 170 .мг 6-(4-хлорфенил)-3-пиридиламйна растворяют в 45 мл ацетонитрила и обрабатывают в токе азота и при комнатной температуре 0,25 г 2,6-дихлорбензоилизоцйаната. Практически сразу же образовывается осадок, и по истечении приблизительно 2ч перемешивания этот твердый .продукт собирают и перекристаллизовывают из этанола с получением 20 мг вещбетва с т.пл. 225-229°С. Идентичность этого продукта целевому подтверждает ЯМР-спектральный анализ, выход продукта 57,1%. Вычислено,%: С 54,25-, Н 2,88; N 9,99. Найдено,%: С 54,97; Н 3,19; N 10,63., Пример 54. 3-Циа1но-5-гметил-6-фенилпиридон . . Это соединение получают в соответствии с примером 48j за исключением того, что в данном случае вместо . 4-хлорацетофенона в качестве исходного pearetira и с пол ь; уют пропилфеион. Конечный продукт перс.крнсталлизовывают из ацетона, в резулг тате чего получают вещество с т.пл. 250-257 С.
Вычислено,%: С 7А,27; Н /4,79; N 13,33.
Найдено,%: С 74,16; Н 4,56; N 13,59.
Пример 55. 2-Хлор-5-метил-6-фенил-З-пиридинкарбонитрил .
Целевой продукт получают в соответствии с примером 49. Идентичность целевого продукта подтверждена данными ЯМР-спектрального анализа.
Пример 56. 5-:Метил-6-фенш1-3-пиридинкарбонитрил ,
Целевой продукт получают в Ьоответсвии с пpи Iepoм 50. Идентичность целевого продукта определяют по данным ЯМР-спектрально1о анализа.
Пример 57. 5-Метил-6-фенил-3-пиридиккарбоксамид .
Целевой продукт получают в соответствии с примером 51. Идентичность целевого продукта определяют по данным ЯМР-спектрального анализа.
Приме р 58. 5-Метил-6-фенип-3-пиридиламин .
Целевой продукт получают в соответствии с примером 52. Конечный продукт перекристаллизовывают из дшспорметана, а затем из петролейного эфира с получением продукта с т.пл. 93-98°С.
Пример 59. 1-(2,6-Дихлорбензоил )-3-(5-метил-6-фенил-3-пиридил )-мочевина.
0,4 г 5-метилг6-фенил-3-пиридиламина в 20 мл ацетонитрипа в токе азота и при комнатной температуре добавляют к 0,5 г 2,6-дихлотрбензоилизоцианата . По истечении приблизительно 10-20 мин абразуется осадок. Реакционную смесь далее перемешивают в течение примерно 4-5 ч, образовавшийся продукт отфильтровьшают И промывают ацетонитрипом, в результате чего получает 580 г вещества с т,пл. 202-205 С. Небольшое количество этого продукта перекристаллизовывают из этанола, выделяют продукт с т.пл. 204-209 С, вькод продукта 66,8%.
Вычислено,%: С 60,02; Н 3,78-, N 10,50.
Найдено,%: С 59,77; Н 3,82; N 10,61.
158043 .28
Пример 60. 6-(4-Х.порфрнш1 )-2-пнриднламин-1 -оксид.
1,5 г 5-(4-хлорфенил)-2-пиридамина , полученного в соответствии с. 5 примерами 1-6, в 30 мл апетона добавляют в раствор 1,7 г 85%-ной 4-(2-метип-4-хлорфенокси)-масляно1 кислоты в 30 мл ацетона. По истечении приблизительно 5 мин образовы0 вается осадок, а по истечении дополнительных 2 ч реакционную смесь охлаждают в холодильнике и выдерживают ее в нем в течение приблизительно 18 ч. Затем эту смесь фильт15 рутот с получением 2,1 г твердого материала, который суспендируют в 200 мл хлороформа и перемешивают ) совместно с твердым карбонатом калия.
Далее добавляют 4б мл воды с целью 20 растворить твердый продукт с последующей экстракционной обработкой водного слоя. После этого проводят четыре- дополнительных экстракционных обработки«с использованием 1-200 мл 5 хлороформа с целью поЛцого удаления продукта. После сушки и перемешивания получают желтоватый твердый продукт , который, как показали данные ЯМР-спектрального анализа, представ0 ляет собой целевой продукт (выход 1 ,2 г) с т.пл. 224-226°С.
Пример 61. 1-(2,6-Дихлорбензоил )-3-С5-(4-хлорфенил)-2-пиридил-1-оксил -моче вин а.
0,7 г 2,6-дихлорбензоипизоцианата в дихлорметане добавляют в растворсуспензию г 5-(4-хлорфенип)-2-пиридиламин-1-оксида в 25 мл дихлорметана . Практически сразу же образу0 ется осадок. Реакционную смесь перемешивают в течение приблизительно 3 дней.при комнатной температуре, а затем после охлаждения осадок отфильтровывают , в результате чего по5 лучают 510 мг целевого соединения с т.пл. 235-237 С (с разл.), выход продукта 51,5%.
Вычислено,%: С 52,26; Н 2,77; N 9,62.
0Найдено,%: С 52,50, Н 2,69;
N 9,67.
Пример 62. 4-Диметштамино-З-фенил-З-бутен-2-он .
Смесь 13,4 г фенилацетона с 13,0 г 5 диметилформамиддиметилацеталя выдерживают при 90-95° С на паровой бане в течение приблизите хьно 2,5 ч. В результате получают сырой маслокодобnbni продукт, который далее подверга ют хроматографической обра) на 600 мл сштикагеля с использовани этилацетата в качестве элюента. Конечный продукт, строение которого подтверждается данными ЯМР-спектрал Hoio анапиза, представляет собой 15,5 г желтого маслоподобного материала , который при стоянии кристалл зуется. Пример 63, З-Циано-6-метил -5-фенил-2-пиридон. Смесь 14,1 г 4-диметиламино-З-фе нил-З-бутен-2-она с 5,9 г цианоацет амида в 100 мл метанола дабавляют к 7,9 г метоксида натрия в 100 мл метанола. Эту смесь кипятят в течение 18 ч с обратным холодильником, остаток растворяют в небольшом коли честве горячей воды. Подкисление раствора до рН 6-7 позволяет получить смолоподобный твердый материал которьм собирают фил-ьтровайием. Дал нейшее Подкисление для снижения величины рН дает только маслоподобньй продукт. Растирание смолоподобного продукта в этнлацетате и его охлажд ние позволяет получить не совмем бе лый твердый продукт, который идентифицируют как целевой продукт (выход - 2,8 г), с т.шт. 280-290°С. П р и м е р 64. 2-Амино-6-метил -5-фенил-З-пиридинкарбонитрил. Проводят конверсию З-циано б-метил-5-фенил-2-пиридона , полученного согласно примеру 63, в целевой продукт в соответствии с примерами 3 и 4. Строение конечного продукта подтверждается ЯМР-спектрапьным анализом, его т.пл. составляет 182-189°С. Пример 65. 2-Амино-6-метил -5-фенил-З-пиридинкарбоновая кислота . Данный продукт получают в соответствии с примером 5. Строение конечного продукта подтверждают данными ЯМР-спектрапьного анализа, его т.пл, составляет 300-308 С (с раэл.). Пример 66. 6-Метил-5-фвнил -2 пиридиламин. Данный продукт получают в соответствии с примером 6 (в примере 23 приведено описание другой процедуры ). Химическое строение конечного продукта подтверждается данными ЯМР-спектрапьного анализа. 4330 Прим е р 67. 1 - (2-Iip()M6PH3oип ) -- 3- (6-ме тил- т-ф€н и.ч-2-пиридил) -мочевина . Проводят peaKiuw) 650 мг 2-брс1мбенлоилизоцияната с SOO мг 6-метил-5-фенш1-2-г ирШ1Илами а в 25 мл этилацетата. В результатр образуется осадок, который, как определяют после отфильтровывания, составляет целевой продукт, т.пл. 172-177 (, выход продукта 83,4%. Пример 68. 4-Хлор-гамма- (1-оксоэтил)-бета-метилбеизобутаннитрип . г продукта Тритон В по каплям добавляют к 21,8 г 4-хлорфенилацетона в 78 мл бутанола. После ЭТОГО подобным же образом в смесь добавляют 9,17 г кротононитрила с первоначальным охлаждением для понижения температуры до . Поскольку эта реакция не является экзотермической, после достижения требуемой температуры отсутствует необходимость в каком-либо дополнительном охлаждении. Затем реакционную смесь выдерживают при 65 С в течение 2,5 ч и после ее охлаждения на ледяной бане в смесь ,в виде порций добавляют 262 мл 1 н.соляной кислоты. Далее реакционную смесь подвергают экстракционной обработке диэтиловым эфиром, промывают водой, высушивают и выпаривают в вакууме, В результате получают маслоподобньй продукт, который перегоняют в вакузт 1е с. получением 18,6 г вещества с т.кип. 130-131° С. Пример 69. 4-Хлор-гамма- 1- (метоксиимино)-этил -бета-метилбензолбутаннитрил , 4,4 г 4-хлор-гамма-(1-оксиэтил) -бета-метилбензобутадиена и 3,7 г метоксиамингидрохлорида в 80 мл пиридина перемешивают при комнатной температуре. Затем эту смесь выливают в лед, содержащий концентрированную соляную кислоту в количестве, достаточном для нейтрализации пиридина , перемешивают и подвергают экстракционной обработке дихлорметаном . Приготовленный дихлорметановый раствор промывают водой и насьпценным раствором хлористого натрия с последующей его сушкой над сульфатом маг- кия. Фильтрование и отгонка легких . фракций позволяет получить прозрачньй бесцветньм смолоподобный продукт, который, no лапиьпч ЯМР- и ИК-спектрп .ггьных анализов, предстапляет собой ц еле в ой up од ук т. Вычисле.но,%: С 63,51-, Н 6,47; N 10,58. Найдено,%: С 63,80; Н 6,19; N10,63. Пример 70. 5-(4-Хлорфенил)-А ,6-диметил-2-пиридиламин. 19,5 г. метансульфокислоты в 500 млЮ ковую,
хлорбензола медленно перегоняют с использованием короткой дистилляционной головки и хлоркальциевой трубки до полного устранения гетерогенности и до достижения т.кип. 130131°С . В течение .последующих 10 мин по каплям добавляют 25 г 4-хлор-гамма- С1-(метоксиимино)-этил -бета-метилбензобутаннитрила в 150 мл хлорбензола , одновременно подвергая смесь20 быть
медленной перегонке и перемешиванию с помощью .магнитной мешалки. Далее реакционную смесь кипятят в течение приблизительно 18 ч с последующим охлаждением, разбавлением дихлорметаном и промывкой 100 мл гидроокиси натрия, водой и, наконец, насыщенным раствором хлористого натрия. После сушки над сульфатом магния сырой материал подвергают хроматографической зо обработке на силикагеле с использов нием по 1 л дихлорметана с 1 и 2% метанола и 2,5 л 5%-ного метанола, в результате чего получают 8,1 чист го целевого продукта. Идентичность конечного продукта целевому подтверждают данные ЯМР-спектрального анализа (т.пл. 148-152°С). Пример 71. 1-(2,6-Дифторбензош1 )-3-Г5-(4-хлорфенил)-4,6-диметил-2-пиридилЗ-мочевина . Проводят реакцию 500 мг 4,6-диметил-5- (4-хлорфенип)-2-пиридилймина и 650 мг 2,6-фторбензоилизоциана та в 25 мл дихлорметана. В результа те образуется осадок, которьй отфильтровьгоают , высушивают и иденти фицируют ЯМР-спектральньм анализом как целевой продукт с т.пл. 204206°С , выход продукта 34,7%. Вычислено,%: С 60,66; Н 3,88i N 10,11. Найдено,%: С 60,54j Н 3,85; N.9,86. Ана.поги1но синтезируют другие ти пичные соединения, приведенные в табл. 1.
ковую египетску, походных червей, fall-походных червей, луговых мотыльков , бражника, пядениц, beet-походных червей, моль капустную, imported cabbage Worm; Orthoptera, в частности таракана рыжего, таракана американского и Thysanoptera, в частности пузыреногих.
Предлагаемые соединения могут
для борьбы с другими насекомыми, в частности, с жигалкой коровьей малой, согапюп cattle grub, жигалкой осенней, face fly, комарами, личинкой мясной мухи, tabanid. fly, совкой актебией, мелкими двукрылыми насекомыми, огневкой югозападной кзпсурузной, точильщиком кукурузным , horse bot fly, личинкой 4332 Г1ред.пагаемг11е соединения могут быть нспользоваЕ{ы для борьбы с иасекомьмн различных отрядов, включая отряд Coleoptera, в частности божью коровку, жука колорадского, личинок хрущаJ Diptera, в частности желтолихорадочного комара, муху комнатную, Lepidoptera, в частности мотылька кукурузного, совку хлопсовку табачную, совку хлопдополнительно использованы капустной йесенней, совкой pecanmit casebearer, розовым коробочным червем хлопчатника, гусеницей плодожорки гикори, совкой, вредителем клевера зеленым, alfalfa caterpillar, минирующими мушками, yellowstriped armyworra, rednecked peanutworm совкой, огневкой подсолнечниковой , гусеницей бражника пятиточечного , листоверткой,восточной персиковой, долгоносиком сливовым , стеклянницей, black fly, nose bot fly, листоверткой виноградной, рунцом овечьим, листовертками вообще и spruce bud worms. Вероятно, предлагаемые соединения действуют на механизм превращения насекомых, вызывая тем самым их гибель. Инсектицидную активность предлагаемых соединений определяют путем проведения испытаний на их эффективность в отношении личинки божьей коровки и личинки червя южной бабочки. Композиции наносят на листву растений, после чего эту листву скармливают личинкам . Предлагаемые соединения подвергают испытаниям в широком диапазоне концентраций, которые изменягт в интервале приблизительно от 1UUO до 1 ч./1000000 ч. Композиции на основе каждого из испытываемых соединений готовят раст ворением соединения в растворителе, приготовленном с использованием небольших количеств продуктов Токсимул R и Токсимул S, обычно соответственно 5,9 и 4,0 г/л безводной смеси в соотношении 1 г 1 этанола и ацетона . Затем в раствор добавляют воду в количестве, необходимом для приготовления раствора, который содержит данное соединение в концентрации 1000 ч./1000000 ч. В дальнейшем порции жидкости разбавляют водой, содер жащей небольшие количества продуктов Токсимул- R и Токс1шул S, что позволя ет готовить растворы для обработки более низкой концентрации. Продукт Токсимул R, как и продукт Токсимул S, представляет собой сульфонат (неионогенную смесь, выпускаемую фирмой Степан кемикал компани) Раствором испытываемого соедине кия опрыскивают по два (101,6 мм) квадратньк горшка с бобовыми растени ми, причем в каждом из горшков имеет ся от 6 до 10 растений. Затем растениям дают высохнуть, удаляют с них 12 листьев и срезанные концы обертывают смоченной водой ватой. Далее листья разделяют по шести пластмассовым чашкам.Петри размерами 100 f 20 мм, В каждую из трех чашек ПетI ри помещают пять личинок божьей коровки на второй возрастной стадии и пять личинок червя южной бабочки. После этого чашки помещают в термоЧисло выживших личинок в - число выживших личинок Процентная эф фективность Число выживших личинок в
Сравнение биологической активности предлагаемых и известного соединений показывает более высокий в первом случае процент уничтожения насекомых (для дифлюбензурона процент уничтожения червя южной бабочки ниже). 1
Результаты сравнения приведены в табл. 2.
Эффективность борьбы с божьей коровкой и червем ночной бабочки при различных концентрациях предлагаемых соединений дана в табл. 3 и 3 в котором температуру и относительную влажность поддерживают на уровне соответственно приблизительно (25,6С и 51% в течение 4 дней, а по истечении этого времени производят первую оценку эффективности испытьшаемых соединений. После этой оценки в каждую чашку помещают по два свежих листа с ранее обработанных в горшках растений. Чашки Петри вновь выдерживают в помещении с регулируемыми температурой и относительной влажностью в течение дополнительных трех дней, после чего производят конечную оценку за семь дней. Инсектицидный эффект определяют путем подсчета числа выживших личинок в каждой тарелке. Результаты всех обработок сопоставляют с результатами , достигнутыми при обработке растворителем, и в отсутствие обработки. При этом используют следующую шкалу оценок: 0-0% 1- 1-50% 2- 51-99% 3- 100%-ная эффективность борьбы. Результаты испытаний сведены в табл. 1. Предлагаемые соединения испытывают в аналогичных условиях, но при более низких концентрациях. В ходе проведения этих испытаний эффективность борьбы с насекомыми определяют путем подсчета числа выживших личшок на каждую чашку Петри с помощью формулы Аббота: контрольном эксперименту после обработки контрольном-эксперименте
35
72 1-(2-Хлорбензоил)-3-(5-фенил-2-пиридил )-мочевина
72 1-(2-Хлор-6-фторбензошт)-3-Г5-(-хло фенил)-2-пиридил -мочевина
741-(2-Метилбензоил)(4-хлорфенил-2-пиридил -мочевргаа
751-(2-Хлор-6-метоксибензоил) (4-клорфенил)-2-пиридш1 -мочевина
761-(2,6-Дихлорбензоил)(3-хлорфенил )-2-пиридил -мочевина
771-(2,6-Дихлорбензоил)(4-бромфенип )2-пиркдил}-мочевина
78t1(2-Xлopбeнзoил)-3-C5-(4-бpoмфeнил) -2-пиpидил} -мочевина
791-(2,6-Динетоксибензоил)-3- 5- 4-бромфенил )-2-пиридил -мочевина
801-(2,6-Дихлорбензоил)-3-С5-(4-тояил) -2-пирчцил -мочевина
811-(2,6-Диметоксибензоил)-3- С5-(4-толил )-2 пирвдш13-мочевина
821-(2,6-Дихлорбензоил)-3-Г5-(3-трифторметилфенил )-2-пиридил2-мочевина
831-(2-Хлорбензоил)-3-Г5-(3- трифторметилфeнил )-2-пиpидилJ-мочевина
841-(2,6-Днметоксибензонл) 3- (трифторметил)-фекил -2-пиридйп -мочевина
851-(2,6-Дифторбензош1) С3-(тр фтормвтил )-фенил -2-пиридил|-мочевина
861-(2,6-Дихлорбензоип)-3-Г5-(4-метоксифенил )-2-пиридип -мочевина
871-(2,6-Дихлорбензоил)(2,4-дихлорфеншт )-2-пиридил -«очевина
36
П58043 Таблица 1
77,3 (205-207) 83,1 ((211-2-21) 56,1 (233-235) 89,5 (212-221) 54,7 (211-216) 58,1 (231-234)
67.7(228-230) 37,3 (221-228)
65.8(230-234) 39,7 (197-199) 52,7 (192-194) 71,0 (207-209)
А4,5 (198-206)
73,3 (225-227) 52,0 (233-237) 54,5 (214-224)
37
1-(2-Хлор-6-фторбензоил)-4-С5-(4-хлорфенил )-4-метил-2-пирвдил -мочевина
1-(2-Хлорбензоил)-3-С5-(4-бромфенил )-4-метил-2-пиридилЗ-мочевина
1 - (2,6-Дифторбензоил)-3- В- (А- бромфенил )-4-метил-2-пиридил -мочевина
1-(2,6-Дихлорбензоил)-3-Г4-метил-5- (4-толш1)-2-пиридш1}-мочеврша
1-(2-Хлорбензоил)-3-С4-метил-5- ( 4-толил)-2-пиридшт -мочевин а
1-(2,6-Дифторбензош1)-3-С4-метил-5- (4-толил)-2-пиридил -мочевина
1-(2-Хлорбензоил)-3- З-(3-хлорфенил )-4-метил-2-пиридил -мочевина
1-(2,6-Дифторбензоил)-3-Г5-(3-: -хлорфенил)-4-метш1-2.-пирНцил -мочевина
1-(2-Хлорбензоил)-3-(6-метип-5-фе ти .п-2-пир ид ил)-мочевина
П580ДЗ38
Продолжер1ие табл, 1
36,7(209-215)
14,2(210-216)
20.6(245-248) 51,7.(208-211)
47.5(180-185) 55,2(208-211)
34,2(206-211)
13.7(191-204)
86.6(213-216)
1-(2,6-Диметоксибензоил)-3-(6-метил-5-фенил-2-пиридш1 )-мочевина
1-(2-Метилбензоил)-3-(6-метил-5-фенил-2-пиридил )-мочевина
1(2,6-Дйхлорбензоил)(4-хлорфенш1 )-6-метил-2-пиридип -мочевина
« I
1-(2--Хлорбензош1)-3-С5-(4-хлорфенил )-6-метил-2-пиридилЗ-мочевина
1-(2,6-Диметоксибензоип)-3-С5-(4хлорфенил )-6-метил-2-пирндил -мочевина
1-(2,6-Дифторбензоил)(4-хлоренип )-6-ме.тил-2-пиридш1 -мочевина
1-(2-Фтор-6-хлорбензоил)-3-15-(4-хлорфенип )-6-мвтил-2 пиридиц -мочевина
1(2-Хлор-6-метоксибензоил) (4-хлорфенил)-6-метил-2-пиридил -мочевина
1-(2-Метилбензоил)(4-хлорфенил )-6-мет1ш-2-пиридил -мочевина
1-(2,6-Дихлорбензоил)-3-С5-(4-метоксифенил )-6-метил-2-пирвдип -мочевина
1-(2-Хлорбензоил)-3-Г5-(4-метоксифенил )-6-метил-2-пиридип 1-мочевина
1-(2,6-Диметоксибензоил)-3-Г5-(4-метоксифенип )-6-метнл-2-пирццил2-мочевина
1-(2,6-Дифторбензоип)-3-С5-(4-метоксифенил )-6-метил-2-1гар1адш1 -мочевина
1-(2-Метилбензоил)-3-Г5-(4-метоксиенил )-6-метил-2-пиридип2-мочевина
1-(2,6-Диметилбензоил)-3-Г5-(4-метоксифенил .)-6-метил-2-пнрид1тЗ-мочеина
Продолжение табл. 1
43,5. (188-197) 76,3 (221-222)
67,1 (225-228)
67.7(223-225)
69,6 (219-222)
70.8(218-221)
76.0(226-231)
7J,2 (225-230) - (231-236)
74,8 (216-220)
84.5(239-241)
53,51(203-206)
87.6(236-240)
82.1(225-229)
95.7(218-221) - 1158043 iiizziiiizii 1-(2,6-Дихлорбензош1)-3-Сб-метил 5- (4-толил)-2-пиридип}-мочевина 1211-(2-Хлорбензоил)-3- б-метил-5-(4-толип )-2-пиридил -мочевина 1221-(2,6-Диметоксибензоил)-3- б-метил-5- (4-толш1)-2-пирид11л -мочевина 1231-(2,6-Дифторбензоил)-3- 6-метил-5- (4-толш1)-2-пиридш1 -мочевина 1241-(2,6-Диметилбензоил)-3 Сб-метил-5- (4-толил)-2-пиридип -мочевина 1251-(2-Хлорбензоил)(4-бромфенип) -6-метил-2-пиридил -мочевина 1261-(2,6-Дифторбензоил-3-Сб-нетил-5- (3-хлорфенил)-2-пиридш1 |-мочевина 1271-(2-Хлорбензоил)-3- б-хлор-5-(4-хлорфенил )-2-пиридип}-мочевина 1281-(2,6-Дифторбензоил)-3-Сб-хлор-5- (4-хлорфенил)-2-пиридип -мочевина 1291-(2-Хл6р-6-фторбензоил)-3-Сб-хлор-5- (4-хлорфенш1)-2 пиридилЗ-мочевина 1301-(2,6-Дифторбензоил)-3-(4,6-диметил-5-фенил-2-пиридил )-мочевина 1311-(2-Метилбензокл)-3-(4,6-диметил-5-фенил-2-пириди т -мочевина 1321-(2-Хлор-6-фторбензоил)-3-С5-(4-хлорфенил )-4,6-диметил-2-пиридил -мочевина 1331-(2-Хлорбензоил)-3-Г5-(4-хлорфенил) -4,6-диметил-2-пиридил2-мочевина 1341-(2,6-Дихлор6ензоил)-3-(6-фенил-3-пирвдт )-мочевина 1351-(2-Хлорбензош1)-3-(6-фенил-3-пиридил )-мочевина 1361-{2,6-Диметоксибензоид)-3- 6-фенил-3-пиридил )-мочевина 1371-(2-Хлорбензоил)-3-Гamp;-(1-хлорфенип )-3-пиридш: -мочевина - 42 должение табл. 1 3 66,7 (203-204) 82,1 (221-223) 33,3 (203-207) 81,4 (223-226) 46,4 (213-216) 8,0 (228-233) 13,6 (194-197) 87,8 (240-243) 76,4 (237-241) 39,9 (215-221) 78,1 (215-218) 84,8 (216-222) 91,5 (222-225) 89,7 (209-213) 22,0 (209-216) 75,0 (184-194) 54,1 (210-213) 84,8 (214-219)
43
2. 1381- (2,6-Диметоксибензоил)-3-Сб-(4-хлорфенил )-3-пиридил}-мочевина
1391-(2,6-Дифторбензоип)-3-Сб-(4-хлорфенил )3-пиридип -мочевин а
1401-(2,6-Дихлорбензоил)-3-Сб-(3-хлорфенил )-3-пиридил}-мочевина
1411-(2,6-Диметоксибензоил)(3-хлорфенип )-3-пирчдип}-мочевина
1421-(2,6-Дихлорбензоил)-3- 6-|3-(трИфторметип )-фенил -пиридил}-мочевина
1431-(2-Хлорбензоил)-3-i6-С3-(трифторметип )-фенш13-3-пирвдил -мочевина
144 1-(2,6-Диметоксибензоил)-3-(6-EЗ- (трифторметил )-фенил -3-пиридш -: -мочевина
1451-(2,6-Дихлорбензоил)(4-толип-З-пиридип }-мочевина
1461-(2-Хлорбензоил)(4-толил)-3-пиридил}-мочевина
1471-(2,6-Д1 1етоксибензоил)-3-Сб-(4-толил )-3-пиридип -мочевина
1481 - (2,6-Дихлорбензош1)-3- Сб- (4-мегоксифенип )-3-пиридилД-мочевина
1491-(2-Хлорбензоил)-Э-Сб-(4-метаксифенил )-3-пирвдш1 -мочевина
1501-(2,6-Диметоксибензоил)-3-Сб-(4-метоксифеннл )-3-пиридип -мочевина
1511-(2-Хлорбензош1)-3-(5-метил-6-фе-нип-З-пиридкп )-мочевина
. - .
1521-(2 6-Диметоксибензоил)-3-(5-метил-6-фен ил-3-пиридил)-мочевин а
1531-(2,6-Дифторбензоип)-3-(5-метил-6-фенил-3-пирвдил )-мочевина
1541-(2,6-Дихлорбензош1)-3-Сб-(-хлорфенил )-5-метил-3-пирииил -мочевина
1551-(27Хлорбензоип)-3- Сб-(4-хлорфенш1 )-5-метшг-3-пиридил7гмочевина
1158043
44 Продолжение табл. 1
-1-f76 .4(214-219)
92.3(246-252)
83.6(217-220)
45.7(19Ы94) 52,6(201-208)
85.5(196-199)
42,9(185-188)
78.4(220-223) 95,9(206-210)
56.6(224-227) 40,1(203-205) 87,4(210-213) 43,4(203-206) 60,7,(160-161) 34,0(200-205) 82,9; (204-208)
50,4(178-191)
43.7(165-188) А 511580/43 i:::::::iz:::::::i 1 1561-(2,6-Днметоксибензоил)-3-Пб-(4 хлорфенип )-5-метил-3-пиридил -мочевина 1571-(2,6-Дифторбензоил)-3-С5-(4-бромфенил )-А, 6-д№1етил-2-пиридипЗ -мочевина 1581-(2-Хлор-6-фторбёнзоил)-3-С5-(А-бромфенил )-4,6-диметил-2-пир1Идил -мрчевина , 1591-(2-Хлорбензоил)(4-бромфенил )-4,6-диметип-2-пиридил -мочевина 1601-(2,6-Дихлорбензоил)(-4-бромфенйл )-4,6-диметил-2-пиридип -мо . чевина 1611-(2,6-Дифторбензоил)-3-С4,6-диметйл-5- (4 -метоксифенил)-2-пиридил -мочевина . 1621-(2-Хлор-6-фторбензоШ1)-3-С4,6-диметил-5- (4-метоксифенил)-2-пиридил -мочевина1631- (2-Бромбензош1)-3-С5-(4-хлорфенил )-2-пиридил -мочевина . 1641-(2-Хлор-6-фтррбензош1)-3-(6-метил-5-фенш1-2-пиридил )-мочевина 1651-(2-Бромбензоил)-3- б-метил-5-(4-толил )-пиридилЗ-мочевина 1661-(2-Бромбензоил)-3-Г5-(4-хлорфенил )-4,6-диметил-2-пиридш1 -мочевин 1671-(2-Хлор-6-метоксибензоил)-3-С5- (4-хлорфенил)-4,6-диметил-2-пиридютД-мочевина 1681-(2-Метнлбензоил)-3-С5-(4-хлорфеннл )-4,6-диметил-2-пиридил -мочевин 1691-(2,6-Дихлорбензоил)-3-С5-(4-хлорфенил )-4,6-диметил-2-пиридипЗ-мочевина . 1701-(2,6-Диметилбензоил)(4-хлорфенил )-4,6-диметнл 2-пирндил 1-мочевина 1711-(2,6-Диметоксибензоил)-3-Г5-(4-бромфенип )-4,6-диметил-2-пиридилЗ-мочевина /ift должение табл. 1 7,7 (173-177) А8,0 (210-212) 51,1 (227-232) 100 (216-224) 36,6 (207-220) 75,9 (224-226) 52,9 (200-207) 85,4 (223-230) 48,1 (194-198) 79,1 (208-214) 47,4 (210-213) 73,5 (235-240) 84,0 (218-224) 84,7 (232-234) 72,3 (248-251) 7,6 (250-256;.
Таблица 2
Таблица 3
Продолжение табл. 3
51
.
1000
100 1000
100 1000
100 1000
100 1000
100 1000
100 1000
100
1000
100 1000
100 1000
100 1000
100 1000
100
52
П58043 Продолжение табл. 3
3 2 3 3 3 3 3 3 3 3 2
1
3 3
3 2 2 1 3 2 3 3 3 3
53
1000
8
100
9 1000
100 1000
0
100
91 1000
100 1000
2
100 1000
93
100 1000
94
100 1000
95
100 1000
96
100 1000
97
100 1000
98
100 1000
99
100
115804.Ч
5Продолжение табл. 3
3
Продолжение табл. 3
57
11580ДЯ
58 Продолжение табл. 3
59
60
158043 Продолжение табл. 3
Прололжение табл.3
Продолжение табл. 3 Эффективность Концентрация при обработке Ч./1 млн.ч. Божья коровка
Через 4 дня 1 Через 7 дней
100 1000
ioo
100 1000
100 1000
100 1000
100 1000
100 1000
IOO
100 Результат испытаний не определен из-за действующе bo соединения. Результат не определялся.
Е
Через 4 дня I Через 7 дней
3 3 3 3
.3. 3 3 3 3 3 3 3
3 3 2 Продолжение табл.3 борьбы с насекомыми Червь ночной бабочки отсутствия в. растворе активноТаблица 4
67
1 158043-68
Продолжение табл. А
г
2,5 1 10
5 2,5
1
100 50 25 10 10
5
2,5
1 10
5
2,5
1 100
50 25 10 100 50 25 10
Продолжение табл. А
77
100 50 25 10 10
20
5
2,5
t,o
100
13
50 25 10 10
5
2,5
1,0
1,0
0,5
0,25
0,125
100
50
25
10
1158043
78 Продолжение табл. 4
100
100
100
100
79
10
5,0
2,5
1,0 100 50 25 10 10
5,0
2,5
1
0,5
0,25
0,125
0,063
100
50
25
10
100
50
25
10
i 80
1158043
Продолжение табл. 4
О
81
10 5
2,5
о 1,0 100 10 5 1
100
50
10
1
100 50 25 10
100 10
5
1,0 50 25 10
1,0
82
л Продолжение табл. 4|
83
100 50 25 10 10 5
67
2.5 1.0 1,0 0.5 0,25 0,125 100 50 10 1,0
33 0,5 0,25 0,125 100
50 25
10
10
5
84
1158043 Продолжение табл. 4
100
27
100
100
2,5 1,0 1,0 0,5 0,25 0,125 1,0 0,5 0,25 0,125 100
10 1,0 0,5 1,0 0,5 0,25 0,125 100
50
25
10 100
50
Продолжение табл. 4
87
88
1158043 Продолжение табл.А
89
25
10 100
50
25
10
100
50
25
10
100
50
25
10
100
50
25
10
10
5
2,5
1
100 50
90
1 I 58043 Продолжение табл. 4 Эффективность борьбы с Концентрация при обработке, Ч./1 млн.ч. Божья коровка насекомыми Червь ночной бабочки
3:
Через 4 дня I Через 7 дней
. 10
1 10
1 10
1 10
1 10
1 Результат не определен из-за отсутствия в соединения. Результат не определяется.
3 3 3 3 3 2 3 Г
3 2 растворе активнодействующего

















































Комментарии