Способ получения производных бензоилмочевины - SU1447278A3
Код документа: SU1447278A3
Описание
О4
Изобретение относится к способу получения новых производных бензоил- мочевины общей юрмулы
А IP CONHCONR
tX)n
А - X - п
R фтор или хлор}
фтор;
о, 1, 2, 3;
водород или группа формулы
SNR.2R.,
где R-2 - С -С -алкил; ЕЗ- С -С -алкил,
или группа формулы COR4 или COjR, где R С 1-С,-алкил; или R и R ii вместе образуют Группу
-(CH,j)3CH(C02CH .,),
которые проявляют инсектицидную и акарицидную активность и -могут найти применение в сельском хозяйстве.
Целью изобретения является разработка способа получения новых производных бензоилм:очевиныГ, которые по .сравнению с известными бензоилмоче- винами обладают повьшенной акарицид- ной активностью.
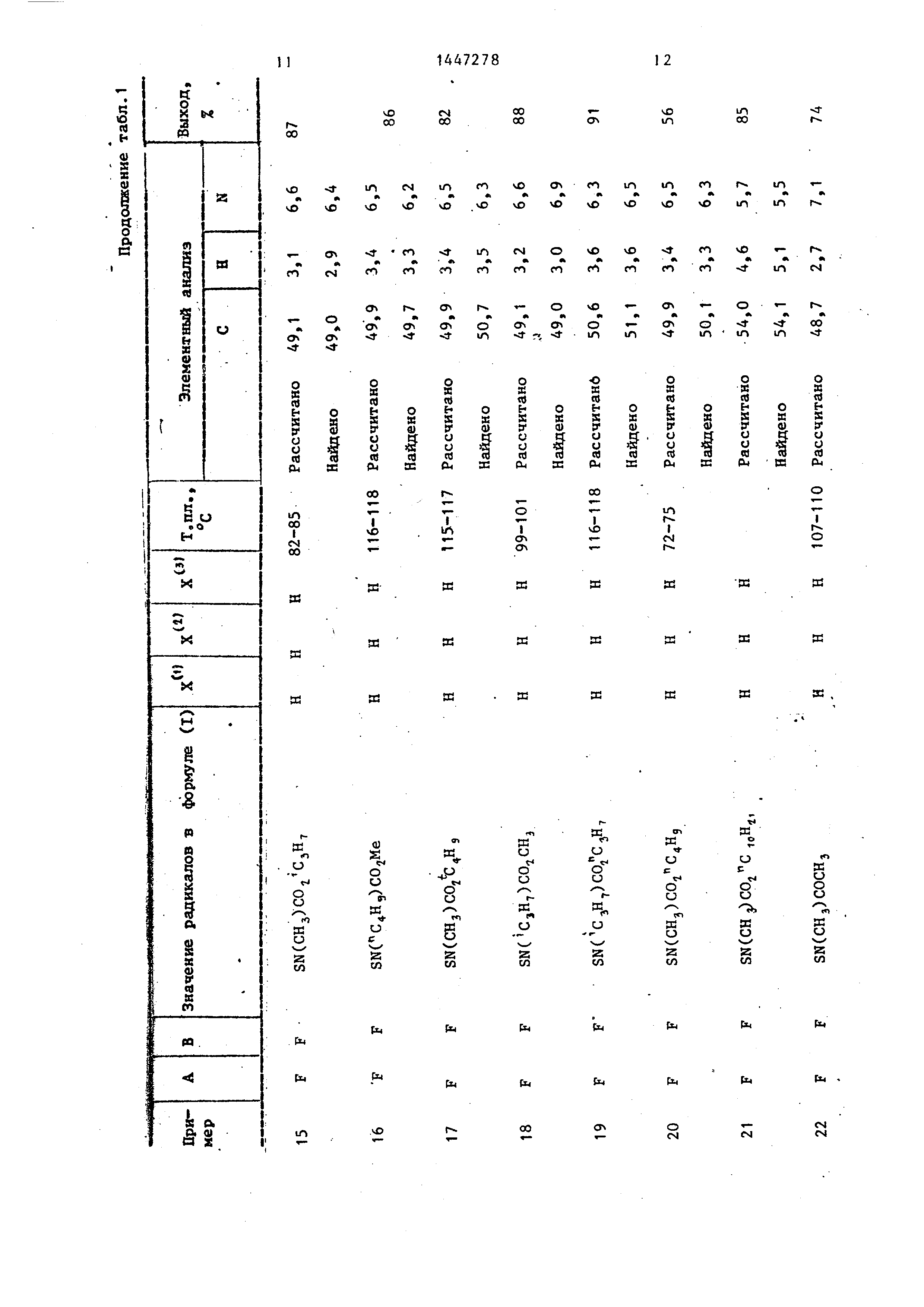
На примерах 1-4 показано получение промежуточных соединений формулы (II), на примеры 5-9 - получение соединений формулы (I), Пример 1. Получение 2-фторо- -4-С2-хлоро-4-(трифторметил)фенокси анилина.
Раствор 2-фторо-4-оксианилйна (7,1 г) и гидрата окиси калия (3,7 г, 85% чистоты) в диметилсуль- фоксиде (25 мл) нагревают до 80 С и обрабатывают раствором 1,2-дихло- ро-4-(трифтороМ гтил)-бензола (10,9 г) в диметилсульфоксиде (10мл).Смесь перемешиватот при 90-85°С в течение 20 ч, а после этого времени ее разбавляют смесью воды и дихлорметана. Органическую фазу высушивают над сульфатом натрия и выпаривают, полу- чают 3,6 г неочщенного целевого продукта в виде коричневого масла.
Хроматография на силикагеле с использованием смеси толуола/петролей
0
5
0
г
ного эфира (отношение 4:1) дает 1,1 г чистого амина в виде желтого масла.
Найдено, %: С 50,3; Н 2,7; N 4,3.
Рассчитано, %: С 51,1; Н 2,6- N 4,6,
Пример 2, Получение пропи- лового эфира N-CCC4- 2-xлopo-4(-тpи- Q фторометил)-фенокси}-2 -фторофенил}- амино тио J-N-метилкарбаминовой кислоты ..
Раствор пропилового эфира М-хло- росульфенил-К-метилкарбаминовой кис- 5 лоты (12,1 г) в диэтиловом эфире (20 мл) добавляют к перемешиваемому раствору соединения примера 1 (18,3 г) и триэтиламина (7 г) в том же самом растворителе (70 мл) в те- 0 чение 20 мин, причем температуру поддерживают при охлаждении 15-20°С, Перемешивание продолжают при комнатной температуре еще в течение 1 1/2 ч. Затем реакционную смесь 5 разбавляют диэтиловым эфиром (200мл) промывают водой, высушивают и отгоняют растворитель. Остаток добавляют к 100 мл толуола, толуол удаляют под пониженным давлением, оставляют 26,5 г целевого продукта в неочищенном виде в форме коричневого масла.
Пример 3, Получение NCCC4- -С2-хлоро-4 -(трифторометил)фенокси J- 2-фторофенил амино7тио -М-метилбутан- амида.
Раствор двухлористой серы (11,3 г) в дихлорометане (10 мл) добавляют в течение 20 минут к раствору N-метил- бутанамида (10,1 г) в том же самом растворителе (35 мл) при перемешивании .
5
0
причем температуру поддерзш- вают при 10 С, Перемешивание при этой температуре продолжают еще н течение 30 мин, после чего добавляют раствор пиридина (8,7 г) в дихлорме- тане (l5 мл). Затем смесь перемешивают и дают ей нагреться до комнатной температуры в течение 2 ч, а затем ее отфильтровывают. Растворитель отгоняют и остаток экстрагируют диэтиловым эфиром. После фильтрования , удаления и перегонки растворителя получают 12,1 г хлористого сульфенила в виде масла, имеюще- го т, кип, 82-84 С при 13 мм рт.ст., 4,4 г этого масла растворяют в диэтиловом ьфпре (10 мл), а полученный раствор добав;гяют в течение 20 Mvra
15
20
31447278
к смеси соединения примера 1 (7,6 г). и триэтиламнна (2,7 г) в диэтиловом эфире (30 мл). После перемешивания в течение 30 мин при комнатной те| пературе добавляют 150 мл диэтилово- го эфира, полученный раствор промывают три раза водой, высушивают, отгоняют растворитель и очищают хро- матографией на силикагеле, используя в качестве элюента дихлоромет н. 9,1 г целевого продукта получают в виде коричневого масла.
Пример 4. Получение метилового эфира N-CC CA-C2-xлopo-4 -(тpи- фтopoмeтил) -фенокси }-2-фторофенш1 ами- но тио -Ъ-пролина.
Раствор двухлористой серы (1t,3 г) в дихлорометане (20 мл) добавляют при комнатной температуре в течение 15 мин к перемешиваемому раствору метилового эфира L-пролина, гидрохлорида (16,6 г) в том же самом растворителе (50 мл), после чего раствор пиридина (17,4 г) в том же самом растворителе (20 мл) добавляют к реакционной смеси в течение 30 мин. После перемешивания в течение ночи смесь разбавляют диэтиловбм .эфиром (150 мл), отфильтровьшают и отгоняют растворитель, оставив 17,8 г неочищенного продукта, 4,3 г этого продукта растворяют в диэтиловом эфире (10 мл) и добавляют в течение 15 мин при комнатной температуре к перемешиваемой смеси соединения примера 1 (6,1 г), триэтиламина (2,2 г) и дк- этилового эфира (50 мл) . После, перемешивания при комнатной температуре в течение 30 мин добавляют 250 мл диэтиловсго эфира и петролейного эфира в качестве элюента, получают 6,9 г нужного неочищенного продукта в видеXкоричневого масла.
Найдено, %: N 5,7.
Рассчитано, N 5,7 .
Пример
С 51,7- Н 2,1; I: С 51,6; Н 2,3;
6. Получение пропи- лового эфира 4- 4-С2-хлоро-А-(три- фторометил)фенокси3-2-фторофенил}-7- - (2,6-дифторофенил) г -метил- З ; 7-диок- 10 со-3-тиа-2,4,6-триазагептановой кислоты .
Раствор 2,6-дифторобензош1изоциа- ната (2,0 г) в безводном хлористом метилене (10 мл) быстро добавляют к перемешиваемому раствору соединения ттримера 2 (4,5 г) в том же самом растворителе (20 мл) при комнатной температуре. После перемешивания в течение 4 ч растворитель удаляют под пониженным давлением, и остаток очищают хроматографией (2х) на силикагеле , используя сначала хлористый метилен, а затем диэтиловый эфир в качестве элюента. Полученный таким
25 образом продукт окончательно очищают кристаллизацией из диэтилового эфира/петролейного эфира, получают бесцветные кристаллы (4,5 г),, плавящиеся при 98-99 С.
30 Найдено, %: С 49,4; Н 3,U N 6,5 .
Рассчитано, %: С 49,1;Н 3,2; N 6,6.
Пример 7. Получение Н- Г435 .- 2-хлоро-4-(трифторметил)фенокси }- -2-фторофенил Ct(2,6-дифтopoбeнзoил)- aминo карбонил амино -тио-Н-метилбу- танамида.
Раствор 2,6-дифторобензоилизоциа- ната (20 г) в смеси 1:1 толуола и петролейного эфира (5 мл) добавляют в течение 30 мин к раствору соединения примера 3 в том же растворителе (20 мл). После выдерживания при
40
Пример 6, Получение N-(-2,6- 45 комнатной температуре выпавший твер- -дифторбензоил)-Н - 2-фторо-4-С2-хло- дый продукт отфильтровывают и перекристаллизовывают из смеси диэтилового эфира и петролейного эфира, по лучают 4,3 г целевого продукта,имею- gQ щего т. пл. 136-1 .
Найдено, %: С 50,6; Н 3,2; N 6,6.
Рассчитано, %: С 50,4; Н 3,2; N 6,8.
eg П р и м et.p 8. Получение метило
промьшшот холодным во го эфира N-CCC4-C2-xлopo-4-(тpи- фтopoмeтил)фeнoкcи -2-фторофенил j ( 2,6-дифторобензоил) амино}карбонил J- -амино тио-Ь-пролина.
ро-4-(трифторметил)фенокси}фенил5мочевины .
Раствор соединения примера 1 (0,9 г) в безводном толуоле (5 мл) обрабатывают 2,6-дифторобензоилизоил- изоцианатом (0,56 г) и смесь перемешивают при комнатной температуре в течение ночи. Затем осажденный продукт отделяют.
метанолом и высушивают в печи при 60°С. Получают 1,15 г нужного продукта , имеющего т. пл. 173-174 С,
5
0
Найдено, %: N 5,7.
Рассчитано, N 5,7 .
Пример
С 51,7- Н 2,1; I: С 51,6; Н 2,3;
6. Получение пропи- лового эфира 4- 4-С2-хлоро-А-(три- фторометил)фенокси3-2-фторофенил}-7- - (2,6-дифторофенил) г -метил- З ; 7-диок- 0 со-3-тиа-2,4,6-триазагептановой кислоты .
Раствор 2,6-дифторобензош1изоциа- ната (2,0 г) в безводном хлористом метилене (10 мл) быстро добавляют к перемешиваемому раствору соединения ттримера 2 (4,5 г) в том же самом растворителе (20 мл) при комнатной температуре. После перемешивания в течение 4 ч растворитель удаляют под пониженным давлением, и остаток очищают хроматографией (2х) на силикагеле , используя сначала хлористый метилен, а затем диэтиловый эфир в качестве элюента. Полученный таким
5 образом продукт окончательно очищают кристаллизацией из диэтилового эфира/петролейного эфира, получают бесцветные кристаллы (4,5 г),, плавящиеся при 98-99 С.
0 Найдено, %: С 49,4; Н 3,U N 6,5 .
Рассчитано, %: С 49,1;Н 3,2; N 6,6.
Пример 7. Получение .- 2-хлоро-4-(трифторметил)фенокси }- -2-фторофенил Ct(2,6-дифтopoбeнзoил)- aминo карбонил амино -тио-Н-метилбу- танамида.
Раствор 2,6-дифторобензоилизоциа- ната (20 г) в смеси 1:1 толуола и петролейного эфира (5 мл) добавляют в течение 30 мин к раствору соединения примера 3 в том же растворителе (20 мл). После выдерживания при
0
5.14
Раствор 2,6-дифторобензоилизоциа ната (2,8 г) в смеси 1:1 толуола и петролейного эфира (10 мл) добавляют при комнатной температуре в тече- ние 30 мин к перемешиваемому раствору соединения примера 4 (6,5 г) в том же растворителе (20 мл). После перемешивания при комнатной температуре в течение 3 ч растворитель отго няют, а остаток очищают хроматографией на кремнеземе, используя дихлор метан в качестве элюента, получив 5,5 г целевого продукта, имеющего т. пл. 65-68°С.
Найдено, %: С 50,2; Н 3,3; N 6,3.
Рассчитано, %: С 50,0; Н 3,1; N 6,5.Примеры 9-25. Способами аналогичными способам примеров 5-8 получают из промежуточньк соединений общей формулы (II) другие соединени общей формулы (I).
Элементный анализ и выход их ука зан в табл. 1.
П р и м е -р 9. Получение N-(2,6- -дифторобензоил)-Ы -С2-фтор-4-2-хлор -4-(трифторметил)фенокси фвнилмоче- вины.
2-Фтор-4- 2-хлор-4-(трифторме- тил)феноксианилин в толуоле обраба- тынают хлорис тым водородом и полученный гидрохлорид (19,45 кг) в виде суспензии в толуоле (50 л), содержащем диметилформамид.(50 мл) добйв- ляют фосген (7,2 кг), поддерживая температуру ниже . Затем смесь 110°С 7 ч и еще 1,5 ч
нагревают при
при , когда хлористый водород и избыток фосгена продуют с паром азота. После охлаждения до к смеси добавляют 2,6-дифторбензамид (5,34 кг) и смесь нагревают с обратным холодильником 16 ч. Толуол удаляют перегонкой в присутствии метанола (70 л) и получают целевой продукт в виде твердого вещества (13,3 кг), вдентичный соединению примера 5.
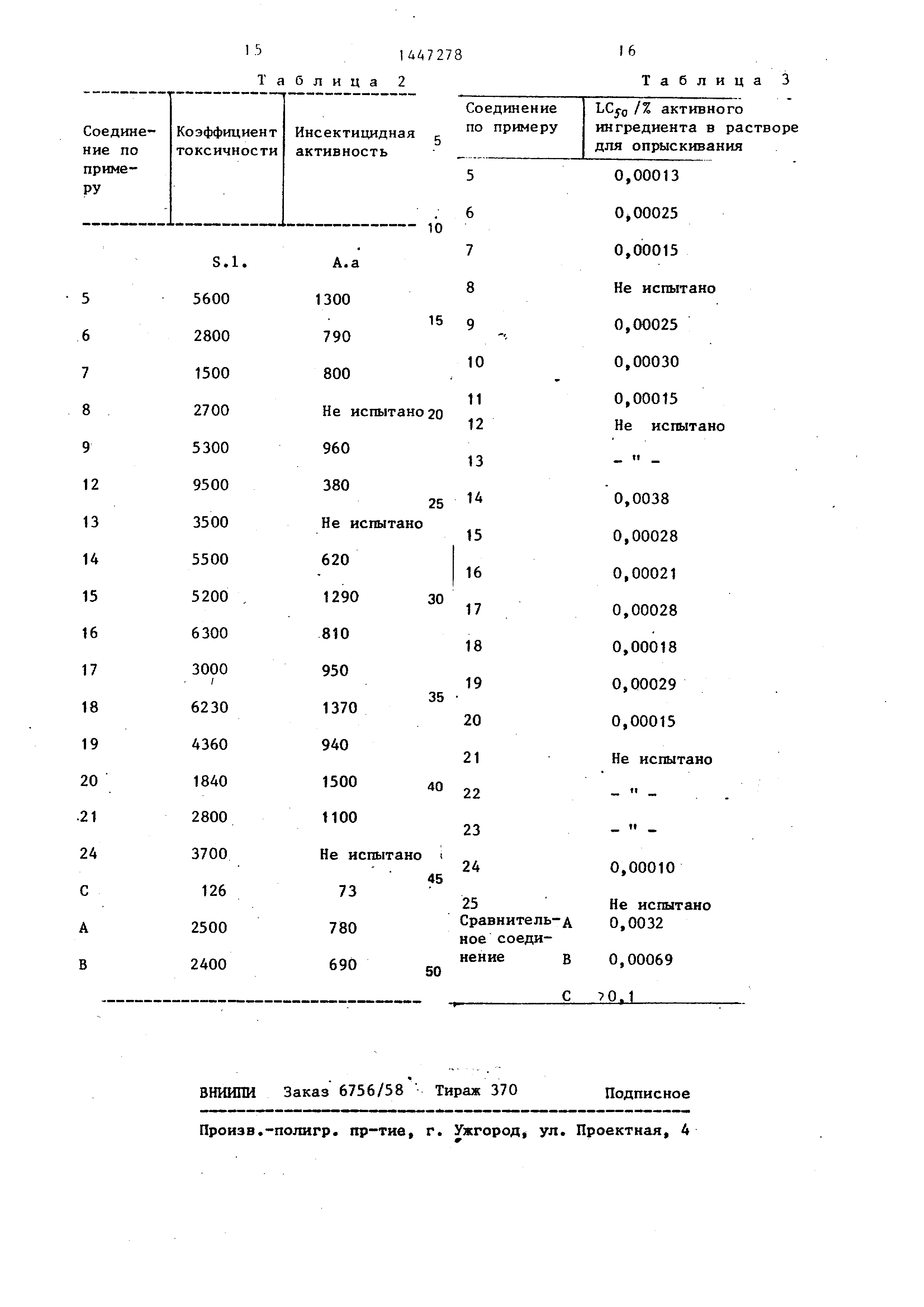
Пример 10. Инсектицидная активность.
Инсектицидную активность соедине- НИИ по предлагаемому способу определяют в следующих испытаниях, используя насекомых Spodoptera Litto- ralis (s.l.) и Aedes aegypti (A.A), В каждом случае испытания проводят при нормальных условиях (23 ± 2°С,
свет и влажность специальным образом не создаются).
В каждом испытании для сое/:1инения рассчитьшают (доза активного вещества, которая необходима, чтобы убить половину испытуемых насекомых) из данных по смертности, эту величину сравнивают с соответствующей LC50 для стандартного инсектицида, зтилпаратиона (ethyl parathion) в тех же испытаниях. Результаты выражают в виде коэффициента токсичности.
Коэффициент токсичности
LC so (паратиона)
LCjo (исследуемого соединения)
X 100.
Результаты приведены в табл. 2, 4 где А, В, С - известные соединения.
А / -еоянсош
F
№. V -Q-o ()-сР,
С1ч CL
O CONHCONH- -O ,
1
Р Р
С014НСОНН
tl
(А) Spodeprera hittoralis (s.l.). Приготовляют растворы или суспензии соединения в некотором диапазое концентраций в 10%-ной смеси ацетона/воды , содержащей 0,025% Тритона XI00. Эти растворы наносят с помощью логарифмического распылительного устройства на чашки Петри, содержащие питательную среду, на которой выращивают личинки Spodoptera littoralis. Когда осажденны оп- рыскивательный состав высок, к.аждую чашку заражают 10 личинкш и во второй возрастной стадии. Оценки (мерт- ности проводят через 7 дней после
опрыскивания.
(Б) Aedes aegypti (А.а.). Приготовляют несколько растворов исследуемого соединения в различных концентрациях как в примере
А. 100 мкл полученного раствора добавляют к 100 мл водопроводной воды и ацетону дают улетучиться. 10 личинок в.ранней четвертой возрастной стадии помещают в исследуебензоилмочевины общей формулы
АFV Qv
rV CONHCONR-O-.0
Sin
где A - фтор или хлор}
X - фтор;
п о, 1, 2, или 3i
R - водород или группа формулы
лп
COR(
(III)
где при RS -NCO, R - NH и при R с - NHR,где R имеет указанные значения , Ri - NCO.
Приоритет по признаТГ Л М
1 о .04.84 при R - Н, 17.08.84 при. R-SNRj S
4А7278
16
Таблица 3






Реферат
Изобретение относится к получению- производных мочевины, в частности производных бензоилмочевины фор- мулы А 1 Fv W OMCONR-O-O -Q-CFj p i a)n где A - F, Cl{ X - Ft m 0,1,2 или 3; R - H или группа формулы , где R - С -С4-алкил; R 3- С -Сд-ал- кил или группа формулы COR4 или COiR4, где R4- ,,-алкил, или R 2 и Rj вместе образуют группу - (СИ 7) j СН (СО гСН з), которые проявляют инсектицидную и акарицидную активность и могут найти применение в сельскс хозяйстве. Цель - разработка способа получения новых соединений. Получение ведут из соединения формулы FV- cav а)п и соединения f и CORe Р О) где при R 5 - NCO R - NH и при R j - NHR, где R указано выше, R NCO. 3 табл. 4 4ib -si to 00

Формула


Комментарии