Способ количественной оценки экспрессии гена с использованием мультиплексной конкурентной обратно-транскриптазной полимеразной цепной реакции (варианты), прибор для количественного определения уровня экспрессии генов-мишеней - RU2190019C2
Код документа: RU2190019C2
Чертежи



















Описание
Методы полимеразной цепной реакции вообще описаны в Патентах США No. 4683195; 4683202 и 4965188. В методе ПЦР используется процесс амплификации любой желаемой последовательности нуклеиновой кислоты, заключенной в молекуле нуклеиновой кислоты. Процесс ПЦР предусматривает обработку отдельных комплементарных нитей нуклеиновой кислоты избытком двух олигонуклеотидных праймеров. Праймеры удлиняются с образованием продуктов удлинения праймеров, которые служат матрицами для синтеза нужной последовательности нуклеиновой кислоты. Процесс ПЦР осуществляют одновременным ступенчатым способом, при этом он может быть повторен любое число раз для достижения повышенного уровня амплификации нужной последовательности нуклеиновой кислоты. В соответствии с процессом ПЦР, последовательность ДНК между праймерами на соответствующих нитях ДНК избирательно амплифицируется по сравнению с остальными порциями ДНК и выбранным образцом. Процесс ПЦР используют для специфической амплификации нужной области ДНК.
Выход продукта ПЦР возрастает экспоненциально в течение неопределенного количества циклов. По неизвестным причинам в какой-то точке реакция становится ограниченной и количество продукта ПЦР возрастает с неизвестной скоростью. Показано, что выход амплифицированного продукта варьирует не менее чем в 6 раз для идентичных образцов, используемых одновременно. (Gilliand, G., et al. , Proc. Natl. Acad. Sci. 87:2725-2729, 1990). Поэтому после определенного количества циклов ПЦР исходные концентрации ДНК-мишени не могут быть определены точно с помощью экстраполяции. С тем чтобы сделать ПЦР количественной, различные исследователи анализировали образцы, амплифицированные в течение такого количества циклов, которое дает экспоненциальную амплификацию (Horikoshi, Т., et al., Cancer Res. 52:108-116 (1992); Noonan, K.E. et al., Proc.Natl.Acad.Sci. 87:7160-7164 (1990); Murphy, L.D., et al., Biochemistry 29: 10351-10356 (1990); Carre, P. C., et al., J.Clin. Invest. 88: 1802-1810 (1991); Chelly, J. , et al., Eur.J.Biochem. 187:691-698 (1990); Abbs, S. , et al., J.Med.Genet. 29:191-196 (1992); Feldman, A.M., et al., Circulation 83: 1866-1872 (1991). В целом, эти анализы были проведены на ранних этапах ПЦР, когда количество продукта ПЦР можно определить с помощью радиоактивных зондов и авторадиографии, но не спектрофотометрически или денситометрически в окрашенных этидииум бромидом гелях. Использование радиоактивности представляет неудобства по соображениям безопасности и дороговизны. Кроме того, экспоненциальная фаза должна быть определена для каждого набора экспериментальных условий, что требует дополнительных затрат времени и материалов.
Другим развитием ПЦР явилась разработка конкурентной ПЦР, при осуществлении которой ПЦР осуществляют в присутствии конкурентных матриц, мутированных по одному основанию (Gilliand, supra; Becker-Andre, et al., Nucleic Acids Res. 17:9437-9446 (1989)). Известное количество конкурентной матрицы коамплифицируется вместе с неизвестным количеством последовательности-мишени. Конкурент представляет собой ту же самую последовательность (за исключением мутации по одному основанию или делеции части последовательности), что и мишень, использует для амплификации те же праймеры, что и кДНК-мишень, и амплифицируется с той же эффективностью, что и кДНК-мишень. Исходное соотношение мишень/стандарт сохраняется в ходе всего процесса амплификации, даже после того, как экспоненциальная фаза завершена.
Конкурентная ПЦР обсуждается в целом Siebert, P.D. et al., Nature 359: 557-558 (1992); Siebert, P.D. et al., BioTechniques 14:244-249 (1993) и в Clontech Brochure, 1993, Обратнотранскриптазная ПЦР (RT-PCR). Однако конкурентная ПЦР сама по себе недостаточно полно контролирует вариации в исходных количествах матрицы. Деградация образцов и ошибки пипетирования могут приводить к вариациям. При использовании Нозерн анализа для определения экспрессии гена эту проблему можно преодолеть путем гибридизации одного и того же блота с геном-мишенью и с "хаускипинг"-геном, экспрессия которого не должна меняться от одного образца ткани к другому или в ответ на стимулы. "Хаускипинг"-ген выступает в роли деноминатора при определении относительной экспресии гена-мишени. В попытках осуществить данную концепцию другие исследователи проводили ПЦР-амплификацию в раздельных пробирках. Однако, когда два гена амплифицируют в раздельных пробирках, возможны вариации в условиях амплификации и неизбежны ошибки пипетирования. При том, что неконкурентная мультиплексная ПЦР, при которой ген-мишень и "хаускипинг"-ген амплифицируются в одной пробирке, также была описана Noonan, supra, этот метод неудобен, поскольку требует построения стандартных кривых для определения экспоненциального предела амплификации нуклидов.
Заявка WO/94/23023 основана на одной из более ранних работ авторов и относится к определению экспрессии гена-мишени путем амплификации в мультиплексной конкурентной обратнотранскриптазной полимеразной цепной реакции. В данной заявке не содержится обсуждения или предположений по поводу относительной экспрессии множества генов или анализа характера экспрессии генов.
Патент ЕР-А-636413 относится к прибору и способу постановки полимеразной цепной реакции в одной реакционной смеси для одного гена. В данном документе не обсуждаются применения мультиплексной конкурентной обратнотранскриптазной ПЦР и не содержится предположений о том, что множество генов может быть оценено количественно и может быть проанализирован характер относительной экспрессии гена.
Поэтому, очевидно, имеется потребность в методе количественного определения экспрессии гена, лишенного перечисленных выше недостатков, и который может проводиться лаборантом, обладающим стандартной подготовкой. Это достигается разработкой методики, в которой может быть использован любой процесс ПЦР и которая осуществляется простым прямым способом. В настоящем изобретении предлагаются существенные усовершенствования ранее описанных подходов к анализу ДНК и метода ПЦР.
Способ, заявленный в настоящем изобретении, является усовершенствованием процесса амплификации ПЦР, которое дает возможность одновременной амплификации гена-мишени, хаускипинг-гена и конкурентных матриц для каждого их этих генов. В соответствии с настоящим изобретением, термины "ДНК последовательность-мишень" и "ген-мишень" вообще относятся к представляющему интерес гену, который (или последовательность ДНК) желательно селективно амплифицировать. Термин "хаускипинг"-ген обозначает гены, которые удобны в качестве внутренних стандартов количества РНК на одну реакцию ПЦР. Вообще говоря, ключевым моментом настоящего изобретения явлется одновременное использование праймеров для гена-мишени, праймеров для хаускипинг-гена и двух внутренних стандартов - конкурентных матриц, представляющих собой мутантные ген-мишень и хаускипинг-ген. Эти мутации могут быть точечными мутациями, инсерциями, делениями и т.п.
В широком смысле настоящее изобретение направлено на способ определения количества ДНК последовательности-мишени в пределах идентифицированной области выбранной молекулы кДНК, которая присутствует в гетерогенной смеси молекул кДНК. Необходимо понимать, что могут быть использованы более чем один ген-мишень и/или хаускипинг-ген и что количественное определение таких гена-мишени и/или хаускипинг-гена потребует введения в качестве внутреннего стандарта конкурентной матрицы, содержащей мутацию этого гена-мишени и/или хаускипинг-гена. Мутированные конкурентные матрицы содержат по меньшей мере один нуклеотид, мутированный по отношению к соответствующему нуклеотиду последовательности-мишени. Необходимо отметить, что мутация одного нуклеотида, комплементарного соответствующему нуклеотиду в последовательности хаускипинг-гена, необходима для успешного осуществления настоящего изобретения. Однако понятно, что более длинные делеции, инсерции или альтерации применимы при осуществлении настоящего изобретения. Праймеры гена-мишени (которые служат праймерами для нативной и конкурентной матриц гена-мишени), праймеры хаускипинг-гена (которые служат праймерами для нативной и конкурентной матриц хаускипинг-гена), конкурентную матрицу гена-мишени и конкурентую матрицу хаускипинг-гена подвергают процессу ПЦР вместе с нативной кДНК, которая содержит ДНК как гена-мишени, так и хаускипинг-гена. В результате процесса ПЦР получают кДНК-продукты 1) нативной кДНК гена-мишени и хаускипинг-гена и 2) мутированную конкурентную матрицу кДНК гена-мишени и хаускипинг-гена. кДНК-продукты выделяют с использованием методов, пригодных для выделения кДНК-продуктов. Относительное присутствие продуктов нативной кДНК и продуктов мутированной кДНК определяют путем измерения количеств нативной кДНК, кодирующей ген-мишень, и мутированной кДНК, кодирующей конкурентную матрицу гена-мишени по сравнению с количетсвами нативной кДНК, кодирующей хаускипинг-ген, и мутированной кДНК, кодирующей конкурентную матрицу хаускипинг-гена.
Другим аспектом настоящего изобретения являются молекулы новых нуклеотидных праймеров, используемые в ПЦР для определения количества ДНК-последовательности-мишени.
В контексте настоящего описания термин "образец" обычно означает образец ткани или жидкости, взятый от растения, индивидуума или из компонентов клеточной культуры in vitro.
Термины "праймеры", "нуклеиновые кислоты" и "олигонуклеотиды" означают полирибонуклеотиды и полидезоксирибонуклеотиды безотносительно длины последовательностей, обозначаемых данными терминами. В большей степени эти термины относятся к первичной структуре молекулы. Эти термины объединяют дву- и однонитчатые РНК и дву- и однонитчатые ДНК. Необходимо понимать, что олигонуклеотиды могут быть получены из любой существующей или природной последовательности или генерированы любым способом. Олигонуклеотиды могут быть получены путем химического синтеза, обратной транскрипцией, репликацией ДНК или сочетанием этих методов. Термин "праймер" обычно означает олигонуклеотид, способный действовать в качестве точки инициации синтеза вдоль комплементарной нити в условиях, приемлемых для синтеза продукта удлинения праймера. К условиям синтеза относится наличие четырех различных дезоксирибонуклеотид-трифосфатов и по меньшей мере одного индуцирующего полимеризацию агента, такого как обратная транскриптаза или ДНК-полимераза. Данные компоненты присутствуют в соответствующем буфере, который может также содержать и другие компоненты, являющиеся кофакторами или же влияющие на такие условия, как рН и т. п., при различных приемлемых температурах. Надо понимать, что праймер предпочтительно является однонитчатой последовательностью и при этом эффективность амплификации оптимизирована, однако при осуществлении настоящего изобретения могут применяться и двунитчатые последовательности.
Термины "ген-мишень", "последовательность" или "последовательность нуклеиновой кислоты-мишень" означают ту область олигонуклеотида, которая должна быть амплифицирована и/или обнаружена. Надо понимать, что последовательность-мишень расположена между праймерными последовательностями, используемыми в процессе амплификации.
Согласно одному из вариантов осуществления настоящего изобретения количественную оценку экспрессии гена проводят путем амплификации в мультиплексной конкурентной ПЦР а) кДНК по меньшей мере одного представляющего интерес гена-мишени и меньшей мере одного "хаускипинг"-гена и б) внутренних мутированных стандартов - конкурентных матриц, представляющих мутанты по основаниям кДНК представляющего интерес гена-мишени и хаускипинг-гена, причем данные мутации обусловливают утрату или приобретение сайта узнавания эндонуклеазы рестрикции. Согласно другому варианту осуществления настоящего изобретения способ предусматривает ПЦР-амплификацию а) кДНК по меньшей мере одного представляющего интерес гена-мишени и по меньшей мере одного "хаускипинг"-гена и б) конкурентных матриц, содержащих последовательности представляющего интерес гена-мишени и по меньшей мере одного "хаускипинг"-гена, которые были искусственно укорочены. Эти укороченные последовательности сохраняют гомологию праймерам как гена-мишени, так и хаускипинг-гена, используемым в ПРЦ-амплификации. Из тестируемых клеток или тканей выделяют РНК, которую подвергают обратной транскрипции. Последовательные разведения кДНК амплифицируют ПЦР в присутствии олигонуклеотидных гомологов гена-мишени и хаускипинг-гена, а затем определяют количество мутированных конкурентных матриц, служащих внутренним стандартом. Амплифицированную ДНК подвергают рестрикции эндонуклеазами и электрофорезу в геле агарозы, окрашенном этидиум бромидом, в котором происходит разделение нативного и мутированного продуктов. Для количественной оценки полос проводят денситометрию. Данная методика определения относительной экспрессии гена-мишени к экспрессии хаускипинг-гена точна и воспроизводима, если определения проводятся с одной и той же мастер-смесью и разведением внутренних стандартов. Значения относительной экспрессии гена варьируют менее чем на 25% по сравнению со средним значением. Эта методика применима для определения изменений экспрессии гена. Данная методика особенно полезна, когда объем тестируемого образца ограничен или уровень экспрессии гена низок.
Согласно другому варианту осуществления настоящего изобретения количественное определение экспрессии гена проводят, предваряя одновременную амплификацию полимеразной цепной реакцией для каждой мутированной матрицы следующими этапами: две исходные полимеразные цепные реакции, которые проводят с использованием внешнего праймера и внутреннего праймера для мутированного по одному основанию внутреннего стандарта с получением двух перекрывающихся фрагментов ДНК; выделение и очистка перекрывающихся фрагментов ДНК; применение полимеразной цепной реакции для амплификации каждого из двух перекрывающихся фрагментов ДНК с использованием только внешних праймеров; проведение первой полимеразной цепной реакции без праймеров, что дает возможность образоваться гетеродимеру; очистка и амплификация продуктов ПЦР, полученных на предыдущем этапе, с последующим разведением для использования в качестве конкурентных матриц.
Согласно другому варианту осуществления настоящего изобретения в одну смесь конкурентных матриц включают конкурентные матрицы для многих различных генов, а не только конкурентные матрицы для одного хаускипинг-гена и единственного гена-мишени. Кроме того, количественная ОТ-ПЦР может быть успешно осуществлена и без амплификации хаускипинг-гена и гена-мишени в одной пробирке. Настоящее изобретение также относится к прибору для автоматического молекулярного фенотипирования.
Таким образом, задачей настоящего изобретения явлется разработка усовершенствованного метода количественной оценки экспрессии гена.
Другой задачей настоящего изобретения явлется разработка метода оценки экспрессии гена, основанного на количественной ПЦР и применимого в качестве коммерческого процесса.
Эти и другие задачи, особенности и дополнительные преимущества изобретения будут более понятны по прочтении последующего подробного описания и рассмотрения приведенных чертежей.
Фиг. 1 представляет рабочую схему количественного определения относительной экспрессии гена-мишени при помощи ПЦР.
На фиг. 2 приведена фотография, отражающая последовательные разведения кДНК (представляющие от 0.25 мкг до 0.05 мкг тотальной РНК) бронхиальной эпителиальной клеточной линии человека, иммортализованной папилломатозным вирусом человека (BEP2D), которые были коамплифицированы с постоянными количествами внутренних стандартов, содержащих мутацию по одному основанию (10 аттомолей каждый), подвергнуты рестрикции EcoRI и электрофорезу в геле агарозы. Негативную фотографию данного геля затем подвергли денситометрии для количественной оценки полос.
На фиг. 3 представлен график соотношения нативного продукта oGSH-Рх (глютатион пероксидаза) и nGAPDH (глицеральдегид-3-фосфатдегидрогеназа) к тотальной РНК. При небольших количествах исходной РНК (первые три квадрата для GSH-Px и GAPDH) реакции экспоненциальны, однако с увеличением количеств РНК в какой-то точке амплификации реакции становятся неэкспоненциальными, что приводит к образованию меньшего количества продукта, нежели можно было ожидать при неограниченной реакции. Прямыми линиями показаны теоретические количества продукта ПЦР (для GSH-Px или GAPDH), который образовался бы, если бы амплификация оставалась экспоненциальной в ходе всего процесса.
На фиг. 4 представлен график соотношения продуктов амплификации Нативный/Мутированный (oGSH-Px и nGAPDH) к тотальной РНК. Отношение остается линейным для GSH-Px (r2=0.982) и GAPDH (r2=0.973) в использованных интервалах концентраций тотальной РНК. Это согласуется с данными Gilliand, G., et al., Proc. Natl. Acad. Sci. 87:2725-2729, 1990. Это отношение характеризует количественную природу мультиплексной конкурентной ПЦР.
Фиг. 5 представляет собой фотографию, на которой приведен а) Нозерн-анализ РНК, полученной из клеток BEP2D, обработанных 1% ДМСО в качестве контроля, или b-нафтофлавоном для индукции цитохрома р450 IA1 (CYPIA1); и б) анализ ПРЦ-амплифицированных последовательных разведений кДНК из тех же клеток, что и в "а". кДНК была коамплифицирована в присутствии внутренних стандартов - конкурентных матриц для GAPDH и CYPIA1 и олигонуклетидных праймеров к данным генам.
На фиг. 6 представлена схематическая иллюстрация прибора для количественного определения экспрессии гена.
В течение многих лет экспрессию гена оценивали путем количественного определения РНК на Нозерн- или дот-блотах. При осуществлении этих способов для каждого определения требуется такое количество РНК, которое получается как минимум из 105 клеток. Биопсия часто дает только несколько клеток, что достаточно для гистологической диагностики, но это количество гораздо меньше 105 клеток. Недавно разработанные методы ПЦР сделали возможным определение РНК в количествах, содержащихся всего лишь в 100 клетках. Однако описанные до сих пор методы давали возможность проводить только качественное, но не количественное определение.
Настоящее изобретение относится к способу применения амплификации посредством мультиплексной конкурентной обратнотранскриптазной полимеразной цепной реакции для упрощения и усовершенствования количественного определения экспрессии гена. Выделенную из образцов ДНК обратно транскрибируют и подвергают амплификации ПЦР в присутствии праймеров для хаускипинг-гена и представляющего интерес гена-мишени.
Экспрессию генов оценивают путем сравнения количества по меньшей мере одного гена-мишени с таковым для хаускипинг-гена. Имеются различные приемлемые хаускипинг-гены, которые применимы для осуществления настоящего изобретения, включая, например, такие хаускипинг-гены, которые используются в качестве внутренних стандартов при Нозерн-анализе экспрессии гена, включая, GAPDH, b-актин, 28S РНК и 18S РНК и рибонуклеарные белки Devereux et al., Nucleic Acids Res. 12:387 (1984); Barbu et al., Nucleic Acids Res. 17:7115 (1989). В соответствии с одним из вариантов осуществления изобретения могут быть использованы синтезированные олигонуклеотиды, гомологичные любой последовательности, содержащей известный сайт распознавания эндонуклеазы рестрикции или любую последовательность, содержащую одно или два несовпадения в сайте узнавания известной рестриктазы в хаускипинг-гене. Назначение этих сайтов узнавания эндонуклеазами рестрикции состоит или в мутировании естественных существующих сайтов в нераспознаваемые сайты, или в мутировании несовпадающих сайтов в совпадающие сайты, в любом случае с образованием мутантных последовательностей, пригодных в качестве внутренних стандартов - мутированных матриц. Конкретные размеры хаускипинг-гена, используемого для анализа любого другого конкретного гена, зависят от сайтов совпадений и несовпадений, которые присутствуют в другом гене. Одной детерминантой является размер фрагментов ДНК, образующихся из хаускипинг-гена и гена-мишени. Желательно, чтобы эти фрагменты хорошо разделялись электрофоретически.
Кроме того, все олигонуклеотиды, которые содержат последовательности, гомологичные последовательностям хаускипинг-генов могут быть использованы при осуществлении настоящего изобретения. Такие гомологичные последовательности могут быть использованы для получения искусственно укороченных конкурентных матриц хаускипинг-генов в соответствии с методом, описанным Celi et al., Nucleic Acids Res. 21:1047 (1993).
Для идентификации и сопоставления по всем известным сайтам узнавания последовательностей с одним или двумя несовпадениями по основаниям можно использовать программу Map, входящую в пакет программ Genetics Computer Group (Devereux et al. , supra, 1984). Для каждого гена получают последовательности кДНК, а затем каждый ген оценивают на наличие совпадений в несовпадающих по одному или двум основаниям последовательностям для каждой известной эндонуклеазы рестрикции. В соответствии с настоящим изобретением можно использовать каждый ген, содержащий любую из указанных последовательностей узнавания или с одним или двумя несовпадениями по основаниям в данных последовательностях.
Применение мультиплексной конкурентной ПЦР в соответствии с настоящим изобретением (для любой данной мастер-смеси и разведения мутированных старндартов) дает воспроизводимые отношения ген-мишень/хаускипинг-ген. Поскольку отношение количества нативного продукта к количеству исходной тотальной РНК не остается линейным с увеличением количества РНК (фиг. 3), очевидно, что амплификация не является экспоненциальной в ходе всего процесса. Однако постоянные отношения ген-мишень/хаускипинг-ген получаются с использованием конкурентной матрицы для каждого из генов. Количественные результаты иллюстрируются линейной зависимостью между отношением нативная матрица /мутированная матрица против тотальной исходной РНК для каждого из генов (фиг. 4). Этим иллюстрируется применимость внутренних контролей - конкурентных матриц; отпадает необходимость оставаться в пределах экспоненциальной фазы амплификации для количественного определения относительной экспрессии гена. Для измерения экспрессии гена необходима только одна пробирка, в которой все полосы поличественно определимы. Это упрощает процедуру и дает возможность количественной оценки многих различных образцов в одно и то же время.
Согласно одному из вариантов осуществления изобретения для разделения мутированных и нативных продуктов имеется выбор сайтов узнавания эндонуклеаз рестрикции. Кроме того, необходимо учитывать конечную длину продукта ПЦР, образующегося после рестрикции эндонуклеазами. В некоторых случаях гели агарозы более предпочтительны, чем полиакриламидные гели, но в этом случае для адекватного разделения требуется большая разница в размере фрагментов ДНК (разница приблизительно в 50-100 пар оснований). Заявленный в изобретении способ можно упростить используя один и тот же сайт узнавания для гена-мишени и хаускипинг-гена. Часто для этого подходит сайт EcoRI. В конкретном варианте осуществления изобретения были получены конкурентные матрицы GAPDH, которые разделялись от нативного GAPDH на основе рестрикции EcoRI и BamHI. Однако необходимо понимать, что может также иметь место разделение на основе рестрикции EcoRI и другими эндонуклеазами рестрикции, которые имеют сайты узнавания в гораздо большем числе генов.
Значительные вариации (до 200 раз) в величине отношения экспрессии ген-мишень/хаускипинг-ген (GSH-Px/GAPDH) наблюдались в исследованиях, выполненных с кДНК клеток BEP2D с использованием различных мастер-смесей и разведении мутированных стандартов. Поскольку образцы, подвергнутые обратной транскрипции раздельно, дали сходные результаты, доля вариабельности, внесенная на данном этапе, незначительна. Любые различия в условиях реакции будут в равной степени влиять на амплификацию конкурентной матрицы, а также и нативной матрицы, и потому их отношение будет оставаться постоянным. Поэтому наиболее вероятно, что вариации являются результатом различий в количестве использумой в реакции конкурентной матрицы. Концентрация конкурентной матрицы столь мала (фемтомолярный интервал), что любые изменения числа молекул в реакции могут служить источником серьезной ошибки.
Заявленный в настоящем изобретении способ точен при любом варианте осуществления, как это иллюстрируется воспроизводимостью результатов для различных образцов, полученных с использованием одной мастер-смеси с конкурентными матрицами. Поэтому в соответствии с предпочтительным вариантом осуществления изобретения желательно, чтобы сравниваемые образцы обрабатывались одновременно с использованием одной мастер-смеси и того же разведения конкурентных матриц в качестве внутреннего стандарта.
В предпочтительном варианте осуществления изобретения в состав реакционной смеси входят: а) конкурентная матрица для хаускипинг-гена, б) конкурентная матрица для гена-мишени, в) олигонуклеотидные праймеры для ПЦР-амплификации хаускипинг-гена, г) олигонуклеотидные праймеры для ПЦР-амплификации представляющего интерес гена-мишени, д) реакционный буфер и е) кДНК из тестируемого образца.
Предпочтительно также, чтобы условия ПЦР были стандартизированы в каждом эксперименте путем, например, использования мастер-смеси, содержащей 1х ПЦР буфер (например, 50 мМ КСl, 10 мМ Трис-HCl, 1.5 мМ MgCl2), праймеры для гена-мишени и хаускипинг-гена (25 пмолей каждый), 0.2 мМ dNTP's (A, T, C, G) и постоянные количества каждой конкурентной матрицы на 100 мкл реакционной смеси. Taq ДНК-полимеразу (2.5 единиц) добавляют к 100 мкл реакционной смеси перед амплификацией. Амплификацию ПЦР предпочтительно проводят в течение 35-38 циклов: 1 мин при 94oС, 1 мин при 60oС и 1 мин при 72oС или же в оптимальных для конкретной амплифицируемой области условиях. После амплификации продукты ПЦР нагревают в течение 10 минут для максимизации образования гетеродимера.
Для реакции с использованием конкурентных матриц, мутированных согласно методу Higuchi, образцы (40 мкл) из каждой ПЦР пробирки подвергают рестрикции эндонуклеазами в течение 12-16 часов. Эти продукты подвергают электрофорезу в геле 3% Нузайв, 1% LE агарозы, окрашенном этидиум бромидом в течение 2-3 часов при 60 В. Делают негативную фотографию геля, используя позитивную/негативную пленку Полароид 665.
Негативную фотографию денситометрируют (Zeineh Soft Laser Scanning Densitometer Model SLR 2D/1D с использованием Zeineh 1D Autostepover Videophoresis Program Software, Biomed Instruments, Fullerton, California). Альтернативно, окрашенный гель можно денситометрировать впрямую с использованием цифровой камеры или прибора для оценки секвенирующих гелей (таком, например, который предлагает Applied Biosystems, Inc.). Вычисляют площади под каждой кривой и используют для количественной оценки. Вносят поправки на образование гетеродимера и относительный размер полос. Результат выражают в виде отношения "ген-мишень" к хаускипинг-гену.
Мультиплексная конкурентная ПЦР усовершенствывает и упрощает количественную оценку экспрессии гена. Экспрессия гена может быть определена в очень небольших образцах ткани или клеток без применения радиоактивной метки. В результате, мультиплексная обратнотранскриптазная ПЦР оказывается дешевле и безопасней, нежели применение радиоактивной метки. Результаты воспроизводимы при использовании одной и той же мастер-смеси и разведении конкурентных матриц, используемых в качестве внутренних стандартов.
Необходимо понимать, что в соответствии с заявленным в настоящем изобретении способом при осуществлении изобретения могут использоваться все олигонуклеотиды, гомологичные каждой нити кДНК известных или потенциальных хаускипинг-генов (включая, без ограничений перечисленными, GAPDH, b-актин, 28S РНК, 18S РНК человека, мыши и крысы, а также все гены рибонуклеарных белков) и содержащие последовательности сайтов узнавания эндонуклеаз рестрикции. Олигонуклеотиды используются для получения конкурентных матриц хаускипинг-генов при постановке количественной ПЦР.
Необходимо также понимать, что в соответствии с заявленным в настоящем изобретении способом все олигонуклеотиды, которые содержат последовательности, гомологичные последовательностям известных или потенциальных хаускипинг-генов (включая, без ограничений перечисленными GAPDH, b-актин, 28S РНК, 18S РНК, а также все гены рибонуклеарных белков), применимы для получения искусственно укороченных конкурентных матриц. Олигонуклеотиды используются для получения конкурентных матриц хаускипинг-генов при осуществлении изобретения.
Рассматриваются следующие применения нового заявленного способа: а) количественная оценка экспрессии гена в тканях, полученных при эндоскопической биопсии (щеткой или пинцетом), при аспирации при помощи иглы или при биопсии костного мозга; б) количественная оценка экспрессии репортерного гена в тестах на транзиторную трансфекцию; в) количественная оценка экспрессии трансфицированных генов после генотерапии.
При том, что метод, описанный Morales, M.J., and Gottlieb, D.I. (метод полимеразной цепной реакции для обнаружения и количественной оценки экспрессии репортерного гена в тестах на транзиторную трансфекцию, Analytical Biochemistry, 210, 188-194 (1993)), дает возможность измерения транскрипции репортерного гена, в этом случае не поддаются контролю вариации, обусловленные различиями в количестве РНК, включенной в реакцию. Заявленный в настоящем изобретении способ также применим для одновременной оценки экзогенного репортерного гена и эндогенного хаускипинг-гена, такого как РНК GAPDH из трансфицированных клеток.
Хотя показано, что при кистозном фиброзе имеются многочисленные различные мутации гена регулятора трансмембранной проводимости (CFTR), наиболее общей мутацией, связанной с заболеванием, является делеция 3 оснований в положении 508. Можно так приготовить олигонуклеотидные праймеры, что амплифицироваться будут только ненормальный 508-делетированный ген или только нормальный ген CFTR. При этом используется недавно описанный метод (Cha, R. S. , Zarbi, H., Keohavong, P., Thilly, W.G., Тест на совпадение амплифицированных мутаций (МАМА): применение в случае гена с-На ras. Методы и применение ПЦР, 2:14-20 (1992). Считается, что возможно определить относительное количество экзогенного CFTR на клетку с использованием заявленного в настоящем изобретении способа. Без сравнения количества аномального CFTR с каким-либо внутренним стандартом невозможно количественно определить эффективность трансфекции. Образцы слишком малы для определения РНК Нозерн-анализом.
Заявленный в настоящем изобретении способ пригоден для разработки систем ПЦР для селективной амплификации экзогенного нормального гена дистрофина в присутствии мутированного эндогенного гена. В случае дистрофина заболевание является результатом сравнительно больших делений. Возможны и другие варианты. С применением заявленного в настоящем изобретении способа могут быть разработаны различные системы ПЦР для селективной амплификации трансфицированного нормального гена и конститутивного аномального гена для каждого их этих случаев. Это может быть осуществлено путем выбора праймеров, перекрывающих делетированную область.
Необходимо отметить, что согласно заявленному способу одновременно может быть проведена количественная оценка более чем одного гена.
Методы
Очищенные дезоксирибонуклеотиды, полученные от Pharmacia (Piscataway, N. J. )
разводили для получения стокового раствора с концентрацией 10 мМ. Рекомбинантная ДНК-полимераза Thermus aquaticus (Taq-полимераза ), обратная транскриптаза вируса птичьего миелобластоза (AMV) и
ингибитор рибонуклеазы (РНазин) были получены Promega (Madison, W.I.). Фермент рестрикции EcoRI был получен от USB (Cleveland, Ohio). Праймеры синтезировали с помощью синтезатора Applied Biosystems,
модель 391 PCR-Mate ЕР ТМ. ПЦР проводили в Perkins, Elmer, Cetus DNA Thermal Cycler 480. Другие использованные буферы и растворы были из различных источников и имели степень чистоты, пригодную для
молекулярной биологии.
Исследования проводили на бронхиальной эпителиальной клеточной линии человека, иммортализованной папилломатозным вирусом человека (BEP2D) (Willey et al., Cancer Res. 51:5370-5377, 1990).
Выделение РНК проводили следующим образом: выделение РНК основывалось на способе, описанном Chomczynski and Sacchi (Analytical Biochemistry 162: 156-159, 1987). Из флаконов, содержащих клетки линии BEP2D, удаляли культуральную среду. Немедленно к клеткам добавляли буфер GIT (4.0 М гуанидин-тиоцианат, 0.1 М Трис-HCl, рН=7.5, 1% бета-меркаптоэтанол) (приблизительно 500 мкл на 5-10 миллионов клеток). Каждые 500 мкл буфера GIT, содержащего клетки, переносили в 1.5 мл микроцентрифужные пробирки. В каждую пробирку последовательно добавляли 50 мкл 2М Na-ацетата рН=4, 500 мкл водонасыщенного фенола и 100 мкл смеси хлороформ: изоамиловый спирт (49:1). Затем пробирки тщательно встряхивали, помещали на лед на 15 минут и центрифугировали 20 минут при 14000 об/мин и 4oС. Водную фазу из каждой пробирки переносили в новую пробирку и еще раз проводили описанную процедуру экстракции. Водную фазу из каждой пробирки переносили в новую пробирку с изопропанолом (500 мкл) и помещали на 15 минут на -70oС. Затем РНК осаждали центрифугированием при 14000 об/мин 20 минут при 4oС. РНК дважды промывали 70%-ным этанолом и высушивали под вакуумом. РНК растворяли в воде, обработанной 0.1% диэтилпирокарбоната (DEPC) и определяли ее количество спектрофотометрически (Gilford Instrument Spectrophotometer 260).
Обратную транскрипцию проводили следующим образом: выделенную РНК помещали в стерильную микроцентрифужную пробирку. На каждый 1 мкг РНК добавляли 0.2 мг олиго dT. Смесь нагревали 5 минут при 65oС и помещали на лед на 1 минуту. Затем добавляли 2 мкл 1-мМ dNTP's 2 мкл обратнотранскриптазного (RT) буфера (50.0 мМ Трис, 40.0 мМ КСl и 80 мМ MgCl2), 0.5 мкл РНазина и 1 мкл обратной транскриптазы AMV (9.500 ед/мл). Смесь инкубировали при 42oС один час и нагревали до 80oС в течение 10 минут для остановки реакции. Полученную кДНК хранили при -20oС.
Получение праймеров и конкуретных матриц внутренних стандартов проводили следующим образом: были идентифицированы идеальные последовательности с использованием программы Oligo-TM Primer Analysis (National Biosciences, Hamel, Mn. ). Праймеры синтезировали с использованием ДНК-синтезатора Applied Biosystems Model 391 PCR-Mate. Последовательности праймеров описаны ниже.
Глютатион Пероксидаза (GSH-Px) (Chada et al., Genomics 6:268-271, 1990).
"Внешние" праймеры, использованные для амплификации как нативных, так и мутированных
матриц, приводили к образованию продукта длиной 354 пары оснований. "Внешними" праймерами были:
Последовательность I.D. No. l (Chada et al., Genomics 6:268-271, 1990).
Pos.
241 5'-GGGCCTGGTGGTGCTTCGGCT-3' (кодирующая смысловая), соответствует основаниям 241-261 клонированной последовательности и
Последовательности I.D. No. 2 (Chada et al., Genomics 6:268-271,
1990).
Pos. 574 5'-СААТGGTСТGGААGСGGСGGС-3' (антикодирующая смысловая), которая гибридизуется с основаниями 574-594.
"Внутренние" праймеры, использованные для синтеза
мутированного внутреннего стандарта, удаляли сайт узнавания эндонуклеазы рестрикции EcoRI (GAATTC) путем замены пары оснований нативной кДНК (эти основания выделены жирным шрифтом). "Внутренними"
праймерами были:
Последовательность I.D. No. 3 (Chada et al., Genomics 6:268-271, 1990).
Pos. 309 5'-ATTCT GATTTC CCTCAAGTACGTCCGGCCT-3' (кодирующая смысловая)
Последовательность I.D. No. 4 (Chada et al., Genomics 6:268-271, 1990).
Pos. 309 3'-TAAGA CTAAAG GGAGTTCATGCAGGCCGGA-5' (антикодирующая смысловая)
Оба праймера соответствовали
основаниям 309-338 клонированной последовательности. Мутация приводила к замене нативного А на Т в положении 316 смысловой нити. Рестрикция нативного GSH-Px эндонуклеазой давала два фрагмента:
размером 280 и 74 пар оснований. Глицеральдегид-3-Фосфат Дегидрогеназа (GADPH) (Tso et al., Nucleic Acids Res. 13:2485-2502, 1985).
"Внешние" праймеры, использованные для амплификации
как нативных, так и мутированных матриц, приводили к образованию продукта длиной 788 или 790 пар оснований. "Внешними" праймерами были:
Последовательность I.D. No. 5 (Tso et al., Nucleic
Acids Res. 13:2485-2502, 1985).
Pos. 46 5'-GGTCGGAGTCAACGGATTTGGTCG-3' (кодирующая смысловая), соответствует основаниям 241-261 клонированной последовательности и
Последовательность I.D. No. 6 (Tso et al., Nucleic Acids Res. 13:2485-2502, 1985).
Pos. 812 5'-CCTCCGACGCCTGCTTCACCAC-3' (антикодирующая смысловая), которая гибридизуется с основаниями 777-798.
"Внутренние" праймеры, использованные для синтеза мутированного внутреннего стандарта, создавали сайт узнавания эндонуклеазы рестрикции EcoRI (GAATTC) путем замены одной пары
оснований нативной кДНК (эти основания выделены жирным шрифтом). "Внутренними" праймерами были:
Последовательность I.D. No. 7 (Tso et al., Nucleic Acids Res. 13:2485-2502, 1985).
Pos. 234 5'-TGATCAATG GAATTC CCATCACCA-3' (кодирующая смысловая)
Последовательность I.D. No. 8 (Tso et al., Nucleic Acids Res. 13:2485-2502, 1985).
Pos.234
3'-ACTAGTTAC CTTAAG GGTAGTGGT-5' (антикодирующая смысловая)
Оба праймера соответствовали основаниям 199-22 клонированной последовательности. Мутация была результатом замены нативного А на Т в
положении 211 смысловой нити. Рестрикция мутированного GAPDH эндонуклеазой давала два фрагмента: размером 588 и 200 пар оснований.
В нескольких опытах была использована другая мутированная матрица GAPDH. В эту матрицу был введен новый сайт узнавания рестриктазы BamHI.
"Внешние" праймеры, использованные для амплификации как нативных, так и мутированных матриц,
приводили к образованию продукта длиной 634 пары оснований. "Внешними" праймерами были:
Последовательность I.D. No. 9 (Tso et al., Nucleic Acids Res. 13:2485-2502, 1985).
Pos. 200 5'-CATGGCACCGTCAAGGCTGAGAAC-3' (кодирующая смысловая), соответствующая основаниям 165-188 клонированных последовательностей, и
Последовательность I. D. No. 10 (Tso et al., Nucleic
Acids Res. 13: 2485-2502, 1985).
Pos. 813 5'-CCTCCGACGCCTGCTTCACCAC-3' (антикодирующая смысловая), которая гибридизуется с основаниями 777-798.
"Внутренние" праймеры,
использованные для синтеза мутированного внутреннего стандарта, создавали сайт узнавания эндонуклеазы рестрикции BamHI (GGATCC) путем замены одной пары оснований нативной кДНК (эти основания выделены
жирным шрифтом). "Внутренними" праймерами были:
Последовательность I. D. No. 11 (Tso et al., Nucleic Acids Res. 13: 2485-2502, 1985).
Pos. 368 5'-CAGGGG GGATCC
AAAAGGGTCATCAT-3' (кодирующая смысловая)
Последовательность I. D. No. 12 (Tso et al., Nucleic Acids Res. 13: 2485-2502, 1985).
Pos. 368 3'-GTCCCC CCTAGG TTTTCCCAGTAGTA-5'
(антикодирующая смысловая)
Оба праймера соответствовали основаниям 333-358 клонированной последовательности. Мутация была результатом замены нативного G на Т в положении 324 смысловой нити.
Рестрикция этого мутированного GAPDH эндонуклеазой давала два фрагмента: 460 пар оснований и 174 пары оснований.
Мутированные внутренние стандартные конкурентные матрицы получали сайт-направленным мутагенезом, как описано Higuchi et al., Nucleic Acids Res. 16: 7351-7367, 1988. Мутации по одному основанию приводили к приобретению (GAPDH) или утрате (GSH-Px) сайта узнавания эндонуклеазы рестрикции EcoRI. (Были также поставлены опыты с использованием мутированного GAPDH с введенным сайтом BamHI). Для каждого мутированного продукта в ходе двух первых полимеразных цепных реакций с использованием "внешнего" праймера и "внутреннего" праймера с несовпадением по одному основанию, было получено два перекрывающихся фрагмента ДНК. (Праймеры 1 и 4, 2 и 3 для GSH-Px; Праймеры 5 и 8, 6 и 7 для GAPDH). Эти перекрывающиеся фрагменты ДНК подвергали электрофорезу в геле 3% Нузайв, 1% LE агарозы, окрашенном этидиум бромидом. Полосы вырезали и очищали с помощью фильтра Millipore Ultrafree-MC 0.45 мкм (Nihon Millipore Kogyo К.К., Yonesawa, Japan). Очищенную ДНК осаждали этанолом, отмывали, высушивали в вакууме и растеряли в 100 мкл стерильной деионизированной воды. По 1 мкл каждого из двух перекрывающихся фрагментов ДНК амплифицировали ПЦР с использованием только внешних праймеров. Первый цикл ПЦР проводили без праймеров, что давало возможность образоваться гетеродимеру. Таким образом образовывался и амплифицировался полный мутированный продукт. Его очищали в геле как описано выше и подвергали реамплификации с получением балк-продукта. Балк-продукт также очищали в геле и определяли его количество спектрофотометрически. Для использования в качестве конкурентных матриц мутированные продукты разводили до аттомолярного интервала. В качестве носителя использовали ДНК спермы сельди (1 мкг/мл) (Lofstrand, Bethesda, MD). Для того чтобы убедиться в отсутствии контаминации, образцы каждой мутированной матрицы подвергали рестрикции эндонуклеазами.
Условия ПЦР были следующими: условия ПЦР были стандартизованы для каждого эксперимента использованием мастер-смеси, содержащей 1х ПЦР буфер (например, 50мМ КСl, 10 мМ Трис-HCl, 1.5 мМ MgCl2 ), праймеры для гена-мишени и хаускипинг-гена (25 пмолей каждый), 0.2 мМ dNTP's (A,T,C,G) и постоянные количества каждого внутреннего стандарта на 100 мкл реакционной смеси. Taq-полимеразу (2.5 единицы) добавляли к каждым 100 мкл реакционной смеси до амплификации. кДНК, полученную из клеточной линии BEP2D, последовательно разводили и добавляли в пробирки для ПЦР. Во всех экспериментах в контрольных пробирках не было матрицы, а присутствовала только нативная кДНК, или же амплифицировали только мутированные стандарты для проверки контаминации или полноты рестрикции.
Амплификацию ПЦР проводили в течение 35 циклов: 1 мин при 94oС, 1 мин при 60oС и 1 мин при 72oС. После амплификации продукты ПЦР нагревали в течение 10 мин для максимизации образования гетеродимера.
Количество продуктов оценивали следующим образом: образцы (40 мкл) для каждой пробирки ПЦР рестрицировали эндонуклеазой EcoRI в течение 12-16 часов (в опытах с мутированным GAPDH с новым сайтом рестрикции BamHI обработку эндонуклеазой BamHI проводили в течение 4-5 часов). Рестрикционные фрагменты разделяли электрофорезом в геле 3% Нузайв, 1% LE агарозы, окрашенном этидиум бромидом в течение 2-3 часов при 60 В. Делали негативную фотографию геля, используя позитивную/негативную пленку Полароид 665.
Проводили денситометрию негативной фотографии (Zeineh Soft Laser Scanning Densitometer Model SLR 2D/1D с использованием Zeineh 1D Autostepover Videophoresis Program Software, Biomed Instruments, Fullerton, California). Вычисляли площади под каждой кривой и использовали для количественной оценки. Вносили поправки на образование гетеродимера и относительный размер полос. Результат выражали в виде отношения ген-мишени к хаускипинг-гену.
Во второй серии экспериментов для для количественной оценки гена цитохрома р450 (CYP) IA1 в клетках BEP2D, обработанных b-нафтофлавоном, была использована
мультиплексная конкурентная обратнотранскриптазная полимеразная цепная реакция (МС RT-PCR) с конкурентными матрицами, полученными по методу Celi. Индукцию экспрессии гена CYP IA1 оценивали как с
помощью МС RT-PCR с конкурентными матрицами Celi, так и Нозерн-анализом. Конкурентные матрицы были приготовлены для генов CYP IA1 и GADPH. Праймеры, использованные при получении конкурентной матрицы
для GADPH, были:
Последовательность I. D. No. 13 (Tokunaga et al., Cancer Res. 47:5616-5619, 1990).
Pos. 75 5'-GGT CGG AGT CAA CGG ATT TGG TCG-3' Pos. 94
и:
Последовательность I. D. No. 14 (Tokunaga et al., Cancer Res. 47:5616-5619, 1990)
Pos. 822\/Pos. 636
Нижним наружным праймером, использованным в сочетании с Последовательностью I. D.
No. 13 для амплификации конкурентной и нативной матриц, была последовательность:
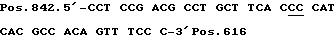
Последовательность I. D. No. 15 (Tokunaga et al., Cancer Res. 47:5616-5619, 1990).
Pos. 842 5'-CCT CCG ACG CCT GCT TCA CC-3' Pos. 822
Праймерами, использованными для получения
конкурентной матрицы для CYPIA1, были:
Последовательность I. D. No. 16 (Jaiswal et al., Science 228:80-83, 1989). Pos. 1241 5'-CAT CCC CCA CAG CAC AAC AAG-3' Pos. 1262 и:
Последовательность I.D. No. 17 (Jaiswal et al., Science 228:80-83, 1989)
Pos. l555\/Pos. l428
Pos. 1575 5'-ACA GCA GGC ATG CTT CAT CGG TCT CAC CGA TAC ACT TCC G-3' Pos. 1448
Нижним наружным праймером, использованным в сочетании с
Последовательностью I.D. No. 18 для амплификации конкурентной и нативной матриц, была
Последовательность I.D. No. 18 (Jaiswal
et al., Science 228:80-83, 1989)
Pos. 1575 5'-ACA GCA GGC ATG CTT CAT GG-3' Pos. 1555
Условия амплификации ПЦР были аналогичны описанным для экспериментов с конкурентными матрицами,
полученными для GAPDH и GSH-Px по методу Higuchi, с тем исключением, что температура гибридизации была 55oС, а амплификацию проводили в течение 38 циклов.
Поскольку нативную и конкурентную матрицы разделяли при предварительной рестрикции эндогуклеазами, образцы брали прямо из реакционных пробирок ПЦР и наносили для электрофореза в гель 3% Нузайв, 1% LE агарозы, окрашенный этидиум бромидом. После этого появлялась возможность количественной оценки продуктов путем получения негативной фотографии геля на позитивной/негативной пленке Полароид 665 с последующей денситометрией.
РНК из клеток BEP2D, проинкубированных различное время с b-нафтофлавоном (10 мкМ), подвергали электрофорезу в 1% LE денатурирующем геле с формальдегидом для Нозерн-анализа или амплифицировали в МС RT-PCR, как описано выше. Для Нозерн-анализа после переноса РНК на мембранные фильтры GeneScreen фильтры гибридизовали с меченой32Р-кДНК CYPIA1.
Результаты
Процедура, использованная для количественной оценки ПЦР, схематически приведена на фиг. 1. Последовательные разведения кДНК BEP2D (содержащие от 0.25 мкг до 0.05 мкг
тотальной РНК) были коамплифицированы с постоянными количествами каждого мутированного по одному основанию внутреннего стандарта (10 аттомолей каждый). Затем их анализировали как описано выше.
Негативную фотографию геля анализировали денситометрически с тем, чтобы количественно оценить каждую полосу, как показано на фиг. 2.
Исходя из площадей под каждой кривой, отношения продуктов нативный/мутированный, вычисляли следующим образом. Вносили поправки на относительный размер полос (т. е. мутированный GAPDH умножали на 788/588 при сравнении с нативным GAPDH, а нативный GSH-Px умножали на 354/280 при сравнении с мутированным GSH-Px). После ПЦР максимизировали образование гетеродимера, нагревая продукты до 100oС в течение 10 минут с последующим медленным охлаждением. После максимизации образования гетеродимера определяли количество каждого продукта на основе денситометрических данных с использованием квадратичной формулы, поскольку образование гетеродуплексов в данных условиях следует биномиальному распределению (Gilliland et al., Proc. Natl. Acad. Sci. 87: 2725-2729 (1990), Becker-Andre et al., Nucleic Acids Res., 17:9437-9446 (1989). Конечные значения выражали в виде двойных отношений нативный/мутированный GSH-Px к нативный/мутированный GAPDH. При том, что график (фиг. 3), отражающий количество нативного продукта (в относительных денситометрических единицах) в зависимости от тотальной исходной РНК, не оставался линейным ни для GSPN-Px, ни для GAPDH, график отношений нативный/мутированный GSH-Px к исходной тотальной РНК и нативный/мутированный GAPDH к исходной тотальной РНК оставался линейным для обоих генов. Путем усреднения отношений, полученных для каждой пробирки (2.18:1, 1.14:1, 2.00:1, 1.76: 1, 2.46:1, 2.71:1 и 1.92:1), было получено среднее значение отношения нативный/мутированный GSH-Px к нативный/мутированный GAPDH, равное 2.17:1, со средним отклонением, равным 0.33. Ни одно значение не отклонялось более чем на 25% от среднего.
Для оценки вариабельности данного метода был проведен эксперимент, аналогичный описанному выше, но с использованием различных разведении мутированных стандартов и новой мастер-смеси. Путем усреднения отношений, полученных для каждой пробирки (1:9.09, 1:8.13, 1:9.43, 1:8.13, 1:6.62, 1:8.77, 1: 7.69, 1: 10.00, 1:7.58 и 1:7.04), было получено среднее значение отношения нативный/мутированный GSN-Px к нативный/мутированный GAPDH, равное 1:8.25, со средним отклонением, равным 1.07. Ни одно значение не отклонялось более чем на 22% от среднего. Этим подтверждается точность данного метода и иллюстрируется вариабельность, обусловленная новыми мастер-смесями, содержащими новые разведения мутированных стандартов.
Для оценки вариабельности между образцами с использованием одной мастер-смеси и разведений мутированных стандартов РНК BEP2D выделяли независимо из клеток, растущих в трех флаконах, и обратно транскрибировали в кДНК. Были приготовлены только грубые (пятикратные) разведения кДНК. Для каждого исследования использовали четыре пробирки ПЦР. Полученные отношения GSH-Px нативный/мутированный к GAPDH нативный/мутированный составили 15.01:1, 17.69:1 и 21.76: 1 (среднее = 18.15, S.D. = 3.40). Все три значения варьировали не более чем на 20% от среднего. Этим подтверждается точность данного метода при сравнении образцов, которые были обратнотранскрибированы независимо, но амплифицированы с использованием одной мастер-смеси и разведений внутренних стандартов.
Нозерн-анализ РНК BEP2D показал отношение мРНК GSH-Px/GAPDH, приблизительно равное 1:8.
Пример 1. Последовательные разведения кДНК BEP2D коамплифицировали с постоянными количествами мутированных по одному основанию внутренних стандартов - конкурентных матриц (10 аттомолей каждой), а затем оценивали. Негативные фотографии гелей (показаны на фиг. 2) анализируют денситометрически с тем, чтобы количественно оценить каждую полосу.
Исходя из площадей под каждой кривой, полученной в ходе денситометрических определений, отношения продуктов нативный/мутированный, вычисляли
следующим образом. Вносили поправки на относительный размер полос. (Мутированный GAPDH умножали на 788/588 при сравнении с нативным GAPDH, а нативный GSH-Px умножали на 354/280 при сравнении с
мутированным GSH-Px). В ходе ПЦР, когда концентрация праймера является лимитирующим фактором, гетерологичные однонитчатые ДНК с гомологией по последовательностям могут гибридизоваться с образованием
гетеродимеров (Gilliland, G. , Perrin, S., Blanchard, K. , and Bunn, H.F. (1990) Proc. Natl. Acad. Sci. 87:2725-2729). Когда гетерологичные нити отличаются только по одной паре оснований, как в случае
настоящего изобретения, гетерологичные нити регибридизуются случайно (Gilliland et al., supra; Thomson, J.D., Brodsky, I., and Yunis, J.J. (1992) Blood 79: 1629-1635), как это показано ниже на
квадрате Паннета:
N М
N NN NM
М NM MM
где N - доля однонитчатого нативного продукта до регибридизации; М - доля однонитчатого мутированного продукта до
регибридизации; NN (или N2) - доля двунитчатого нативного продукта после регибридизации, 2NM - доля гетеродимера, образовавшегося после регибридизации, и ММ (или М2) - доля
двунитчатого мутированного продукта после регибридизации.
Гетеродимеры определяют косвенно, поскольку они не разрезаются ферментом рестрикции и имеют такую же электрофоретическую подвижность, что и неразрезанный гомодимер. Поэтому гетеродимеры определяют денситометрически вместе с нерестрицированным гомодимером. Для количественной оценки продуктов на основе распределения квадрата Паннета подтверждают случайное образование гетеродимера после ПЦР. Это достигается (в соответствии с методами, описанными Gilliland et al. , supra и Thomson et al., supra) нагреванием продуктов до 100oС в течение 10 минут с последующим медленным охлаждением.
В случае GAPDH ни нативный продукт (NN), ни гетеродимер (NM) не рестрицируются EcoRI. Поэтому наибольшая полоса представляет как нативный гомодимер GAPDH (NN), так и гетеродимер NM. Эту полосу можно арифметически представить как N2 +2NM, в соответствии с квадратом Паннета, при том, что вклад в эту полосу, вносимый рестрикцией EcoRI, будет представлен значением М2. Поэтому, когда до ПЦР количества нативной (N) и мутированной (М) матрицы равны (1:1), то после образования гетеродимера отношение будет составлять 3:1 [N2 + 2NM): M2] . С целью дальнейшей иллюстрации в таблице и на фиг. 2 приведены первичные денситометрические данные для первого ряда образцов, которые математически обработаны с получением окончательных отношений, приведенных ниже.
Значение М2 известно (2,214) так же, как и значение N2+2NM (10,095). Исходя из этого вычисляется М (47.05), а значение N определяют из квадратного уравнения (аХ2+bХ+с=0): N2+2N(47.05)-10,095=0.
Квадратное
уравнение (N= -b+/-Цb2-4ас/2а) используют для определения значения N. В этом случае, а=1, b=94,1, с=10,095 и потому N=63.89. Отсюда следует, что отношение N/M равно 63.89/47.10 или 1.36/1.
(При том, что вычисляется доля однонитчатой ДНК, присутствующей после ПЦР, она идентична таковой для соответствующей двунитчатой ДНК, присутствующей до ПЦР.)
Поскольку денситометрические
значения являются относительными, можно избежать неудобств пользования квадратными уравнениями, приписывая полосам пропорциональные денситометрические значения, которые в сумме = 1 или (N2
+2NM)+М2= 1. Решая это уравнение, получаем (N2+2NM)+М2=(N+M)2=1 и потому N+M=1.
Относительную долю в 1, соответствующую каждой полосе, определяют из их относительных денситометрических значений (таблица). Поскольку суммарное денситометрическое значение для обоих полос составляет 12,309 (10,095+2,214), относительная доля большей полосы (N2+2NM) составляет 0.82 (10,095/12,309) и относительная доля меньшей полосы (М2) составляет 0.18 (2,214/12,309). Таким образом, доля мутированного гомодимера GAPGH (М2) составляет 0.18, а доля однонитчатого мутированного GAPGH (М) составляет 0.424. Поскольку N+M= 1, доля однонитчатого нативного GAPDH (N) составляет 1-0.424 или 0.576, и отношение нативного продукта к мутированному составляет 0.576/0.424, или, как вычислено выше, 1.36/1.
Затем те же самые вычисления проводят с использованием денситометрических значений для нативного и мутированного GSH-Px из той же полосы, аналогично значениям для GARDH (таблица): N2=0.558, N=0.747 и М=1-0.747=0.253.
Получены отношения нативный/мутированный:
GSH-Px нативный/мутированный = 0.747/0.253=2.95/1;
GAPDH нативный/мутированный = 0.576/0.424=1.36/1.
И, наконец, получают двойные отношения:
GSN-Px
нативный/мутированный : GAPDH нативный/мутированный = 2.95/1.36 = 2.17/1.
Как показано выше, окончательные значения выражают как двойные отношения нативный/мутированный GSH-Px к нативный/мутированный GAPDH. При том, что отношение между количеством нативного продукта (в относительных денситометрических единицах) и тотальной исходной РНК не оставалось линейным ни для GSN-Px, ни для GAPDH (как видно на фиг. 3), график отношений нативный/мутированный GSH-Px к исходной тотальной РНК и нативный/мутированный GAPDH к исходной тотальной РНК оставался линейным для обоих генов (как видно на фиг. 4). Путем усреднения отношений нативный/мутированный GSH-Px к нативный/мутированный GAPDH, полученных для каждой пробирки (2.17:1, 2.14:1, 2.00: 1, 1.76: 1, 2.46:1, 2.71:1 и 1.92:1), было получено среднее значение, равное 2.17:1, со средним отклонением, равным 0.33. Ни одно значение не отклонялось более чем на 25% от среднего.
Для оценки вариабельности данного метода был проведен эксперимент, аналогичный описанному выше, но с использованием различных разведений мутированных стандартов и новой мастер-смеси. Путем усреднения отношений нативный/мутированный GSH-Px к нативный/мутированный GAPDH, полученных для каждой пробирки (1: 9.09, 1:8.13, 1:9.43, 1:8.13, 1:6.62, 1:8.77, 1:7.69, 1:10.00, 1: 7.58 и 1:7.04), было получено среднее значение, равное 1:8.25, со средним отклонением, равным 1.07. Ни одно значение не отклонялось более чем на 22% от среднего.
Для оценки вариабельности между образцами с использованием одной мастер-смеси и
разведении мутированных стандартов (с использованием
мутированного GAPDH с новым сайтом рестрикции BamHI), РНК BEP2D выделяли независимо из клеток, растущих в трех флаконах, и обратно
транскрибировали в кДНК. Были приготовлены пятикратные разведения кДНК. Для каждого исследования использовали четыре пробирки ПЦР. Полученные отношения GSH-Px нативный/мутированный к GAPDH
нативный/мутированный составили 15.01:1, 17.69:1 и 21.76:1 (среднее = 18.15, S.D. = 3.40). Все три
значения варьировали не более чем на 20% от среднего.
Экспрессию гена CYPIA1 наблюдали при помощи Нозерн-анализа и МС RT-PCR приблизительно в одинаковой степени, как это видно на фиг. 5. При сопоставлении полос хаускипинг-гена GAPDH, представляющего нативную и конкурентную матричную кДНК, становится ясно, что примерно одно и то же количество кДНК было нанесено на полосу в 1 мкл образце из контрольных клеток на на полосу в 3 мкл образце кДНК из обработанных b-нафтофлавоном клеток. При том, что нагрузка на полосы была одинаковой, понятно, что полоса, представляющая нативный ген CYPIA1, представлена значительно сильнее в полосе, содержащей кДНК из обработанных b-нафтофлавоном клеток по сравнению с контрольными клетками.
Пример 2. 40 Конкурентных матриц комбинируют в одной смеси, так что 40 генов можно быстро оценить количественно (смесь содержит гены, кодирующие ферменты ксенобиотического метаболизма, дифференционно-специфические белки, транскрипционные факторы, ферменты репарации ДНК, гены белков апоптоза и др. ) в каждом конкретном образце. В отдельных вариантах осуществления изобретения используют конкурентные матрицы более чем для 80 генов. В конкретных предпочтительных вариантах совсем не обязательно оценивать все эти гены одновременно; скорее всего, потребуется приготовление смесей приблизительно 50 генов.
Наибольшим источником ошибок и потери данных, а также операцией, которая требует больше всего времени, является приготовление реакционных смесей ПЦР и заполнение лунок гелей для электрофореза.
В настоящем изобретении описаны способ и прибор для автоматизации процесса молекулярного фенотипирования посредством количественной ОТ-ПЦР в аппарате с капиллярными трубопроводами. Представленный новый прибор представляет собой усовершенствованный синтезатор олигоДНК. В соответствии с заявленным способом, реакционные смеси для ПЦР готовят из стоковых растворов в резервуарах, соединенных капиллярными трубками. После смешивания и подбора соответствующих аликвот каждого компонента, необходимого для амплификации конкретного гена из конкретной кДНК, смесь перемещается по микрокапиллярам в термосайклер. Затем после ПЦР смесь переносится прямо в лунки агарозных гелей. После проведения электрофореза в течение достаточного времени гели автоматически сканируют и полученный образ автоматически анализируют для количественной оценки экспрессии гена. Единственной ручной стадией остается программирование прибора для амплификации нужных генов и перенос образца кДНК для анализа в прибор с тем, чтобы могли быть приготовлены соответствующие аликвоты. Время амплификации всех выбранных генов составляет: 10 минут на смешивание, 30 минут на ПЦР-амплификацию, 90 минут на электрофорез и 10 минут на сканирование и анализ данных, при этом суммарное время составляет 2 часа и 15 минут.
В конкретных вариантах осуществления изобретения прибор представляет собой 40-канальное устройство, при помощи которого можно анализировать 40 генов немногим более чем за два часа. Объемом настоящего изобретения также предусмотрено, что может быть сконструирован прибор с 200 или 1000 или более каналов.
На фиг. 6 приведена схематическая иллюстрация прибора, заявленного в настоящем изобретении. Схема может включать Y-клапаны 1, 2 и 4, многоканальный коннектор 1. Прибор работает следующим образом.
Раствор А в стеклянном флаконе А представляет собой стоковый раствор реакционной смеси для ПЦР, содержащий dNTPs, буфер, электрофорезный краситель, а также праймеры для b-актина или GAPDH (праймеры могут отсутствовать). Капиллярная трубка проходит через уплотнительное кольцо в крышке стеклянного флакона А, затем через клапан "Вкл/выкл" и входит в Y-клапан 1. Другая капиллярная трубка, входящая в Y-клапан 1, идет от многоканального коннектора 1. В приведенном варианте прибора имеется 20 капиллярных трубок, входящих в многоканальный коннектор 1. Каждая из 20 капиллярных трубок, входящих в многоканальный коннектор 1, проходит через клапан "Вкл/выкл". Капиллярные трубки, идущие в клапаны "Вкл/выкл", выходят через уплотнительные кольца в крышках стеклянных флаконов, содержащих раздельные смеси конкурентных матриц (СТ) (растворы В). Имеется 4 группы смесей СТ (каждая группа содержит 100 различных СТ в пяти различных молярностях (10Е-12-10Е-16 М). Можно менять группы смесей СТ в зависимости от потребности. Капилляр, идущий от Y-клапана 1 входит в Y-клапан 2. Другой капилляр, входящий в Y-клапан 2, идет от многоканального коннектора 2. Капилляр, идущий от Y-клапана 2, входит в Y-клапан 4. Другой капилляр, входящий в Y-клапан 4, идет от многоканального коннектора 3. Капилляр, идущий от Y-клапана 4, входит в Y-клапан 5.
Прибор также содержит Y-клапан 3 и многоканальный коннектор 2. В приведенном варианте прибора имеется 40 капиллярных трубок, входящих в многоканальный коннектор 2 и идущих от одного из сорока Y-клапанов 3, каждый из которых содержит раствор праймеров (растворы С) для конкретного гена. Между Y-клапанами 3 и многоканальным коннектором имеются клапаны "Вкл/выкл". Другие капилляры, идущие от Y-клапанов 3, попадают в Y-клапаны 7.
Прибор также содержит Y-клапаны 5, 6 и 7 и многоканальный коннектор 4. В приведенном варианте прибора капиллярная трубка, выходя из каждого Y-клапана 3, проходит клапан "Вкл/выкл" и соединяется с Y-клапаном 7. Другие трубки входят в Y-клапаны 7 из многоканального коннектора 4 через клапаны "Вкл/выкл". Капилляр, входящий в многоканальный коннектор 4, идет от Y-клапана 5. Десять трубок от Y-клапанов 7 идут в Y-клапаны 8. Другие трубки, входящие в Y-клапаны 8, идут от Y-клапанов 6 через клапаны "Вкл/выкл". Трубки от остальных 30-ти Y-клапанов 7 и трубки из 10 Y-клапанов 8 соединяются с раздельными стеклянными капиллярами в воздушном термосайклере.
Необходимые растворы могут включать следующие материалы.
К компонентам ПЦР относятся буфер, краска для электрофореза, глицерин и dNTPs вместе с праймерами для актина или GAPDH или без них (6 мкл для каждой реакции), хранятся при 0oС.
Смеси конкурентных матриц (СТ) в 10Х концентрации. Имеются резервуары для четырех различных смесей 50 CTs в пяти различных концентрациях, т.е. всего 20 резервуаров для смесей СТ.
Праймеры (1 мкл для каждой реакции). Имеется 50 сепараторных резервуаров для растворов праймеров. Каждый раствор содержит пару праймеров в 10Х концентрации. Растворы комбинируются в блоки по 50 так, что они могут быть заменены в зависимости от того, какие растворы СТ планируется использовать в эксперименте.
Раствор Taq-полимеразы (1 мкл для каждой реакции) хранится при 0oС.
Растворы кДНК (в каждой реакции используется 1 мкл) могут готовиться заново для каждого эксперимента. Каждый раствор кДНК содержит b-актин и/или внутренний стандарт GAPDH для повышения эффективности обратной транскрипции. До обратной транскрипции к каждому образцу РНК добавляют известное количество последовательности РНК, содержащей полиА-"хвост", колинеарный с последовательностью b-актина или GAPDH. Эта последовательность является укороченной последовательностью b-актина или GAPDH, которая будет амплифицироваться с праймерами, используемыми для амплификации нативной последовательности.
Применение высокоплотностных олигонуклеотидных матриц для определения продуктов ПЦР после количественной ОТ-ПЦР в соответствии с описываемым способом может быть проведено со следующими модификациями. Олигонуклеотид, гибридизующийся со смысловой нитью каждой кДНК, подлежащей амплификации, метят флуоресцентным красителем. Один или несколько dNTP's в ПЦР метят флуоресцентным красителем.
Можно получить высокоплотностные олигонуклеотидные матрицы со следующими свойствами. Для каждого гена готовят две олигонуклеотидные матрицы. К одной матрице прикреплены олигонуклеотиды ("а" на фиг. 2), которые гомологичны и будут связываться с последовательностями, уникальными для нативной матрица гена, который был ПЦР-амплифицирован в соответствии с описанными способами. К другой матрице прикреплены олигонуклеотиды ("b" на фиг. 2), которые гомологичны и будут связываться с последовательностями, которые покрывают промежуток между 5'-концом конкурентной матрицы и усеченным несовпадающим 3'-концом конкурентной матрицы, полученной в соответствии с методом Celi.
Продукты ПЦР наносят на высокоплотностные олигонуклеотидные матрицы в соответствии с описанным выше методом. Экспрессию гена-мишени количественно оценивают по интенсивности флуоресценции матриц для нативных и СТ для хаускипинг-генов и генов-мишеней.
Реферат
Изобретение относится к генной инженерии. Выделяют клеточную мРНК генов-мишеней, хаускипинг-генов. Гены обратно транскрибируют и специфически амплифицируют в присутствии конкурентных матриц. Получают отношение каждого гена-мишени к каждому хаускипинг-гену. Это отношение используют для количественной оценки экспрессии каждого гена-мишени. Такое же определение можно проводить в тканях. Прибор для количественного определения уровня экспрессии генов состоит из флаконов с растворами А, В и С. Раствор А во флаконе А представляет собой стоковый раствор реакционной смеси для ПЦР. Содержит dNTPs, буфер, электрофорезный краситель, а также праймеры для b-актина или GAPDH (праймеры могут отсутствовать). Капиллярная трубка проходит через уплотнительное кольцо в крышке флакона А, затем через клапан "Вкл/выкл" и входит в Y-клапан 1. Другая капиллярная трубка, входящая в Y-клапан 1, идет от многоканального коннектора 1. Многочисленные капиллярные трубки, входящие в многоканальный коннектор 1, проходят через клапан "Вкл/выкл", капиллярные трубки, идущие в клапаны "Вкл/выкл", выходят через уплотнительные кольца в крышках флаконов, содержащих раздельные смеси конкурентных матриц (СТ) (растворы В). Имеется 4 группы смесей СТ (каждая группа содержит 100 различных СТ в пяти различных молярностях (10Е-12-10Е-16 М), и можно менять группы смесей СТ в зависимости от потребности. Капилляр, идущий от Y-клапана 1, входит в Y-клапан 2, другой капилляр, входящий в Y-клапан 2, идет от многоканального коннектора 2, капилляр, идущий от Y-клапана 2, входит в Y-клапан 4, другой капилляр, входящий в Y-клапан 4, идет от многоканального коннектора 3, и капилляр, идущий от Y-клапана 4, входит в Y-клапан 5. Многочисленные капиллярные трубки, входящие в многоканальный коннектор 2 и идущие от одного из Y-клапанов 3, идут от стеклянных флаконов, каждый из которых содержит раствор праймеров (растворы С) для конкретного гена. Между Y-клапанами 3 и многоканальным коннектором имеются клапаны "Вкл/выкл", а другие капилляры, идущие от Y-клапанов 3, попадают в Y-клапаны 7. Капиллярная трубка, выходя из каждого Y-клапана 3, проходит клапан "Вкл/выкл" и соединяется с Y-клапаном 7. Другие трубки входят в Y-клапаны 7 из многоканального коннектора 4 через клапаны "Вкл/выкл". Капилляр, входящий в многоканальный коннектор 4, идет от Y-клапана 5. 1/4 часть трубок от Y-клапанов 7 идет в Y-клапаны 8. Другие трубки, входящие в Y-клапаны 8, идут от Y-клапанов 6 через клапаны "Вкл/выкл". Трубки от остальных 3/4 Y-клапанов 7 и трубки из Y-клапанов 8 соединяются с раздельными стеклянными капиллярами в воздушном термосайклере. Изобретение позволяет проводить анализ малых образцов клеток и тканей. 3 с. и 25 з.п. ф-лы, 7 ил., 1 табл.


Комментарии