Замещённые сиднонимины в качестве антидотов гербицидов - RU2772224C1
Код документа: RU2772224C1
Описание
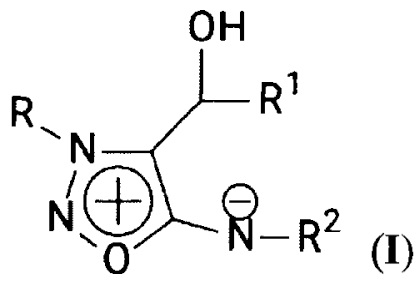
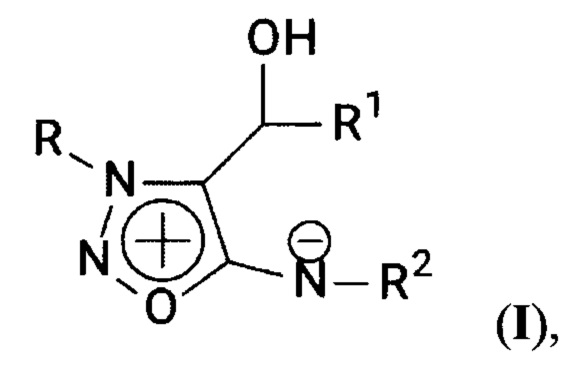
Изобретение относится к сельскому хозяйству, конкретно к химическим средствам защиты растений, а именно к применению замещенных сиднониминов формулы
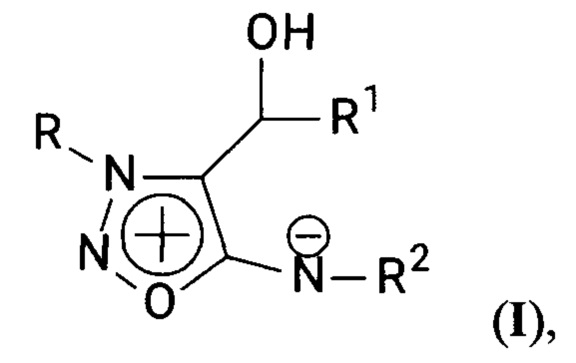
где
R обозначает линейную или разветвленную алкильную или алкоксиалкильную группу, содержащую от 1 до 5 атомов углерода; R1 обозначает фенильную группу или замещенную фенильную группу, R2 обозначает Н или трет-бутоксикарбонильную группу,
и их биологически приемлемых солей, например гидрохлоридов, в качестве антидотов гербицидов класса сульфонилмочевин.
Наиболее эффективно изобретение может быть использовано для повышения урожайности кукурузы путем предпосевной обработки семян и посадочного материала с целью снижения или полного устранения негативного влияния на рост и развитие кукурузы со стороны гербицидов класса сульфонилмочевин, оставшихся в почве после выращивания предшествующих культур в севооборотах.
Сиднонимины представляют собой известные и хорошо изученные вещества, которые относятся к классу мезоионных гетероциклических соединений [Яшунский В.Г., Холодов Л.Е. Химия сиднониминов. // Успехи химии, 49, 54-91 (1980); Cherepanov I.A., Moiseev S.K. Recent developments in the chemistry of sydnones and sydnone imines. // Adv. Heterocycl. Chem., 131, 49-164 (2020)]. Известно, что сиднонимины и их производные с заместителями различной природы обладают разнообразной физиологической активностью и нашли применение в медицине [Яшунский В.Г., Холодов Л.Е. Химия сиднониминов. // Успехи химии, 49, 54-91 (1980); Gorkin V.Z., Yashunskii V.G., Mashkovskii M.D., et al. Synthesis and pharmacological effects of some alkyl- aryl, and aralkylsydnonimines. // Journal of Medicinal Chemistry, 14(10), 1013-15 (1971); Бурбелло А. Т., Шабров А.В. Современные лекарственные средства: клинико-фармакологический справочник практического врача (4-е изд.) М.: ОЛМА Медиа Групп, 2007 - 800 с.].
Установлено, что производные сиднонимина способны понижать кровяное давление (гипотензивный эффект) [патент Великобритании GB 1219254], расширять кровеносные сосуды, расслаблять мышцы [патент США US 3312690], нормализовывать работу системы кровообращения [патент США US 4421754], противодействовать агрегации тромбоцитов [Gerzer R., Karrenbrock В., Siess W., Heim J., Direct comparison of the effects of nitroprusside, SIN 1, and various nitrates on platelet aggregation and soluble guanylate cyclase activity // Thrombos Research - 1988 - Vol. 52 - P. 11-21; Provost P., Tremblay J., Merhi Y., The antiadhesive and antithrombotic effects of the nitric oxide donor SIN-1 are combined with a decreased vasoconstriction in a porcine model of balloon angioplasty // Arteriosclerosis, Thrombosis and Vascular Biology. - 1997 - Vol. 17, 1806-1812]. Известно, что токсичность сиднониминов и их производных существенно ниже, чем токсичность других веществ с аналогичной фармакологической активностью [патент США US 3312690]. В медицине используются психостимуляторы сиднофен [Veksler I.G., Riabukha V.N., Balitskii K.P., Al'tshuler R.A., Mashkovskii M.D. Immunostimulating and antitumor action of psychotropic preparations of the sydnonimine series. // Farmakologiia i Toksikologiia. 1980, 43(3), 349-52; Koniaeva E.I, Beketov A.I. Effect of caffeine and sidnofen on the blood supply of the brain, kidneys and hindlimbs during antiorthostatism. // Farmakologiia i Toksikologiia. 1987, 50(3), 39-42] и сиднокарб [GB Patent 1262830], сосудорасширяющее средство молсидомин, используемое для лечения стенокардии [Rosenkranz В.; Winkelmann В.R.; Parnham, М.J. Clinical pharmacokinetics of molsidomine. // Clinical pharmacokinetics, 30 (5), 1996; Косарев В.В., Бабанов С.А. Современные подходы к антиангинальной терапии при ишемической болезни сердца: в фокусе сиднонимины. // Русский мед. журнал, 14, 895-901, 2011], которые являются производными сиднонимина.
Известна также способность солей N(3)-замещенных производных сиднониминов и N(3),N6-дизамещенных производных сиднониминов стимулировать рост кукурузы [патент РФ RU 2656212, 01.06.2018, Бюл. №16].
Однако способность производных сиднониминов проявлять свойства антидотов гербицидов до настоящего времени не была известна.
Антидоты гербицидов представляют собой индукторы устойчивости растений к действию фитотоксикантов (гербицидов). Их применяют как в сочетании с гербицидами для повышения селективности действия последних в отношении сорняков с целью снижения негативного воздействия гербицидов на культурные растения, а также для снижения или полного устранения негативного эффекта остатков гербицидов при возделывании сельскохозяйственных культур на почвах, содержащих такие остатки после выращивания предшествующих культур [Спиридонов Ю.Я., Хохлов П.С, Шестаков В.Г. Антидоты гербицидов. // Агрохимия, №5, 81-91, 2009; J. Davies. // Pestic. Outlook, 12, 10-15 (2001)]. Остатки гербицидов в почве могут вызывать снижение урожайности культурных растений до 25%. Поэтому применение антидотов позволяет расширить выбор культур, пригодных для использования в севооборотах.
Особенно опасны в отношении негативного воздействия на сельскохозяйственные культуры гербициды класса сульфонилмочевин, которые получили очень широкое распространение в сельском хозяйстве, они способны оказывать токсическое действие даже в малых дозах и медленно подвергаются биодеградации. Снижение или полное устранение негативного влияния гербицидов класса сульфонилмочевин на культурные растения привело бы к значительному снижению потерь сельскохозяйственных культур, вызываемого этим фактором.
К настоящему времени выявлено большое число антидотов, которые снижают фитотоксичность гербицидов в отношении важнейших сельскохозяйственных культур. Вещества, проявляющие свойства антидотов гербицидов, принадлежат к различным классам химических соединений, основными из которых являются: амиды галогенкарбоновьгх кислот (в первую очередь, дихлоруксусной кислоты) и среди них - диаллиламид дихлоруксусной кислоты (дихлормид); производные карбоновых кислот и других карбонильных соединений (в том числе, мочевины); нафталевый ангидрид и его производные; производные гидроксиламина и сульфокислот [Спиридонов Ю.Я., Хохлов П.С., Шестаков В.Г. Антидоты гербицидов. //Агрохимия, №5, 81-91, 2009; A.W. Abu-Qare, H.J. Duncan // Chemosphere, 48, 965-974 (2002); J. Davies. // Pestic. Outlook, 12, 10-15 (2001); Environmental Science & Technology Letters (2015), 2(10), 260-269 [DOI:10.1021/acs.estlett.5b00220]; Rosinger, Chris; Bartsch, Klaus; Schulte, Wolfgang. Safeners for herbicides. // In: Modern Crop Protection Compounds (2nd Edition), Edited By: Kraemer, Wolfgang. (2012), 1, 371-397 [DOI:10.1002/9783527644179.ch8]. Антидотный эффект проявляют также представители других классов химических соединений [Спиридонов Ю.Я., Хохлов П.С., Шестаков В. Г. Антидоты гербицидов. // Агрохимия, №5, 81-91, 2009; WO 2012097629 А1 20120726 (2012); US 20120184435 А1 20120719 (2012)] и продукты, извлекаемые из растительного сырья [CN 109221263 А 20190118 (2019); CN 105660635 А 20160615 (2016); International Journal of Agriculture and Biology (2016), 18(4), 698-702; Pesticide Biochemistry and Physiology (2014), 110, 44-49 [DOI:10.1016/j.pestbp.2014.02.006]; CN 105284799 A 20160203 (2016); CN 101965833 A 20110209 (2011)].
Однако наибольшее число антидотов гербицидов относится к гетероциклическим соединениям, в том числе, содержащим несколько различных гетероатомов. В частности, на рынке антидотов гербицидов представлены оксабетринил, флуразол, фенхлорим, беноксакор, флуксофеним, клохинтоцет-мексил, фенхлоразол-этил, фурилазол, мефенпир-диэтил, 1-метил-1-(дихлорметил)диоксолан-1,3 (MG 191), димепиперат [Спиридонов Ю.Я., Хохлов П.С, Шестаков В.Г. Антидоты гербицидов. // Агрохимия, №5, 81-91, 2009; A.W. Abu-Qare, H.J. Duncan // Chemosphere, 48, 965-974 (2002); J. Davies. // Pestic. Outlook, 12, 10-15 (2001); Rosinger, Chris; Bartsch, Klaus; Schulte, Wolfgang. Safeners for herbicides. // In: Modern Crop Protection Compounds (2nd Edition), Edited By: Kraemer, Wolfgang. (2012), 1, 371-397 [DOI:10.1002/9783527644179.ch8], изоксадифен-этил [International Journal of Pest Management (2018), 64(1), 11-18 [DOI:10.1080/09670874.2017.1293307]; WO 2018202544 A1 20181108 (2018); CN 107652245 A 20180202 (2018)] никосулъфурон, трифенсулъфурон-метил, флорасулам [патент РФ RU 2644011 С1, опубл. 07.02.2018, Бюл. №4], дициклонон [Brit. UK Pat. Appl. (2014), GB 2515003 A 20141217; Brit. UK Pat. Appl. (2014), GB 2515002 A 20141217].
Тем не менее, существует потребность в разработке новых антидотов против наиболее распространенных гербицидов [A.W. Abu-Qare, H.J. Duncan // Chemosphere, 48, 965-974 (2002)].
Описано применение (1,2,4-оксадиазол-3-ил)пиридинов в качестве антидотов для снижения негативного влияния гербицида 2,4-Д на рост проростков и корневой системы подсолнечника [патент РФ RU 2356900 C1, опубл. 27.05.2009, Бюл. №15]. Хорошо известно, что антидотные свойства проявляют производные оксазолидина [Спиридонов Ю.Я., Хохлов П.С., Шестаков В.Г. Антидоты гербицидов. // Агрохимия, №5, 81-91, 2009].
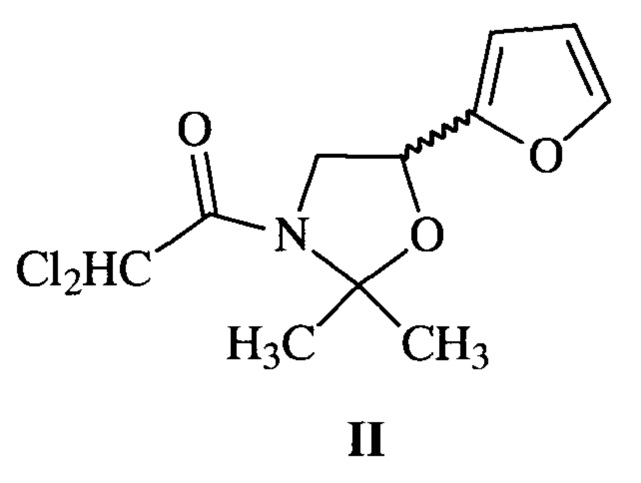
В настоящем изобретении в качестве аналога по действию использован (RS)-2,2-диметил-5-(2-фуранил)-3-дихлорацетил-1,3-оксазолидин (фурилазол) формулы II, типичный антидот гербицидов класса сульфонилмочевин [Спиридонов Ю.Я., Хохлов П.С., Шестаков В.Г. Антидоты гербицидов. // Агрохимия, №5, 81-91, 2009], [Н.А. Куликова, Г.Ф.Лебедева. Гербициды и экологические аспекты их применения. -М: Книжный дом «ЛИБРОКОМ», 2010, с. 135], применяемый, в том числе, для защиты посевов кукурузы [Спиридонов Ю.Я., Хохлов П.С., Шестаков В.Г. Антидоты гербицидов. // Агрохимия, №5, 81-91, 2009].
Задачей изобретения является создание новых антидотов гербицидов, способных при применении в сверхмалых дозах снижать или устранять негативное действие гербицидов, и расширение ассортимента эффективных антидотов гербицидов, используемых в сверхмалых дозах.
Задача решается применением замещенных сиднониминов общей формулы I
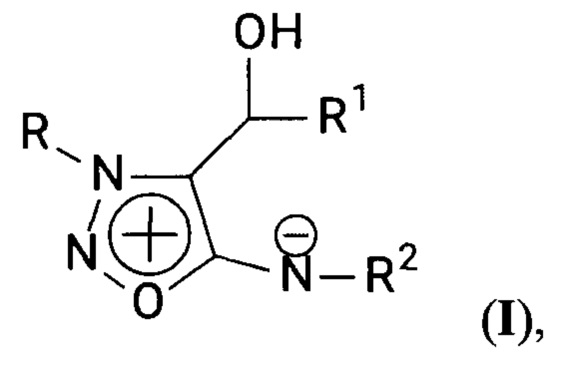
где
R обозначает линейную или разветвленную алкильную или алкоксиалкильную группу, содержащую от 1 до 5 атомов углерода; R1 обозначает фенильную группу или замещенную фенильную группу, R2 обозначает Н или трет-бутоксикарбонильную группу,
и их биологически приемлемых солей, например гидрохлоридов, в качестве антидотов гербицидов класса сульфонилмочевин, причем используемая доза соединения формулы I или его гидрохлорида для предпосевной обработки семян составляет 1,0 г или менее на 1 тонну семян.
Технический результат состоит в создании новых антидотов гербицидов, способных снижать или полностью устранять негативное действие гербицидов и в расширении ассортимента антидотов гербицидов, эффективных при использовании в сверхмалых дозах.
Замещенные N6-трет-бутоксикарбонильные производные сиднониминов формулы I, в которых R2 обозначает трет-бутоксикарбонильную группу, известны и описаны способы их получения, которые включают депротонирование незамещенных по положению С(4) соответствующих N6-трет-бутоксикарбонильных производных сиднониминов действием н-бутиллития и последующую обработку образующихся литиевых производных бензальдегидом или замещенными бензальдегидами [Cherepanov, I.А., & Kalinin, V.N. (2000). Synthesis and reactivity of 4-lithium and 4-copper derivatives of sydnone], [Cherepanov, I.A., Samarskaya, A.S., Godovikov, I.A., Lyssenko, K.A., Pankratova, A.A., & Kalinin, V.N. (2018). N6-tert -Butoxycarbonyl derivatives of sydnone imines: Preparation and synthetic use. Tetrahedron Letters, 59(8), 727-729. doi:10.1016/j.tetlet.2018.01.019]. Действием на образовавшиеся продукты хлористого водорода получают гидрохлориды сиднониминов формулы I, в которых R обозначает Н [Cherepanov, I. A., Samarskaya, A.S., Godovikov, I.A., Lyssenko, K.А., Pankratova, А.А., & Kalinin, V.N. (2018). N6-tert -Butoxycarbonyl derivatives of sydnone imines: Preparation and synthetic use. Tetrahedron Letters, 59(8), 727-729. doi:10.1016/j.tetlet.2018.01.019].
Возможности осуществления заявленного изобретения подтверждаются примерами результатов биологических испытаний ряда соединений формулы I (а именно, соединений Ia-Ih).
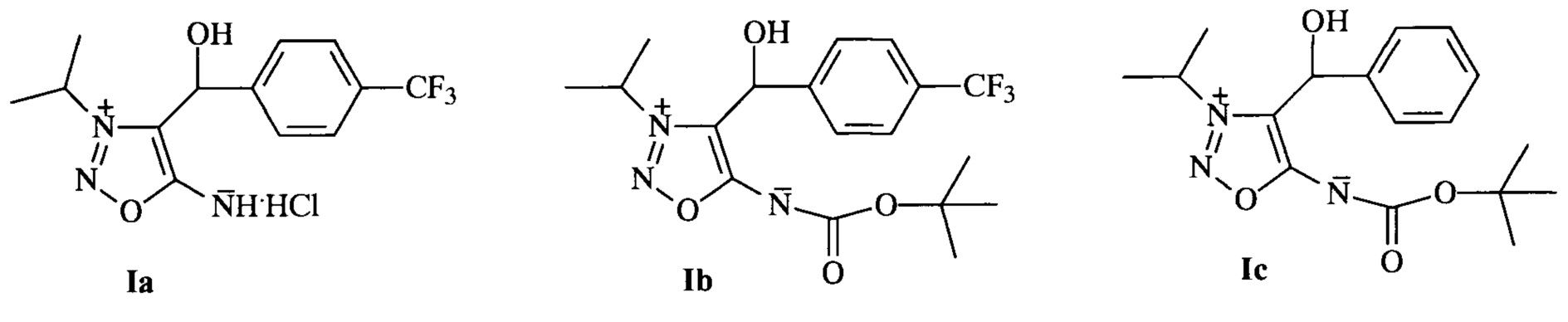
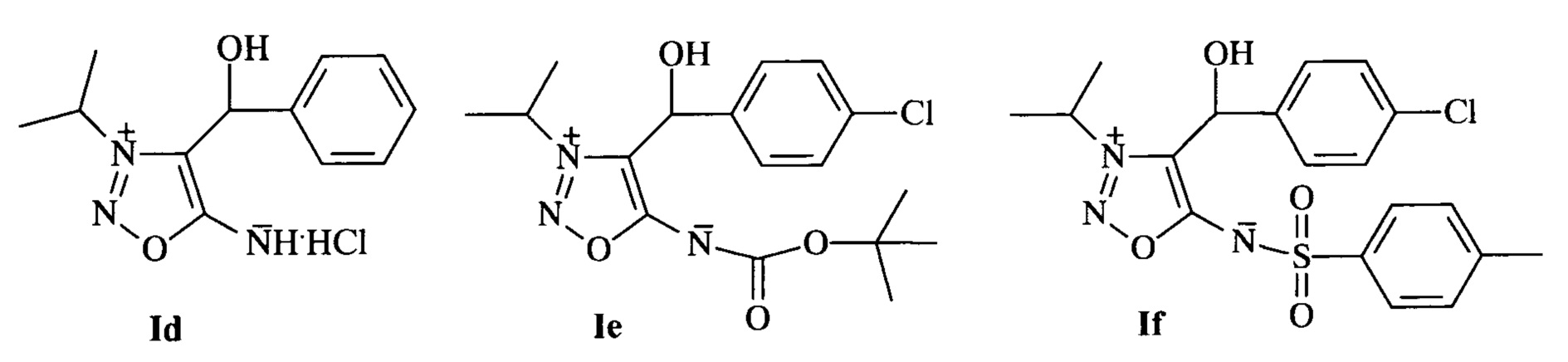
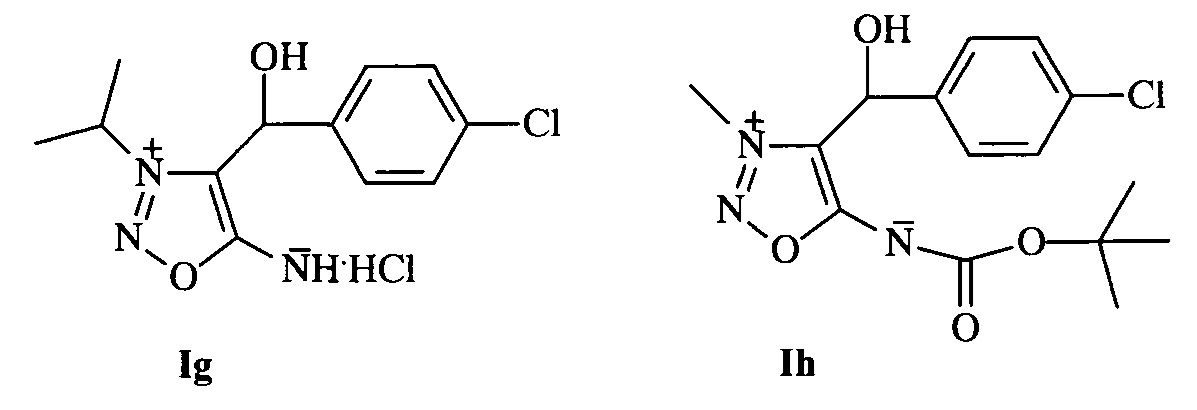
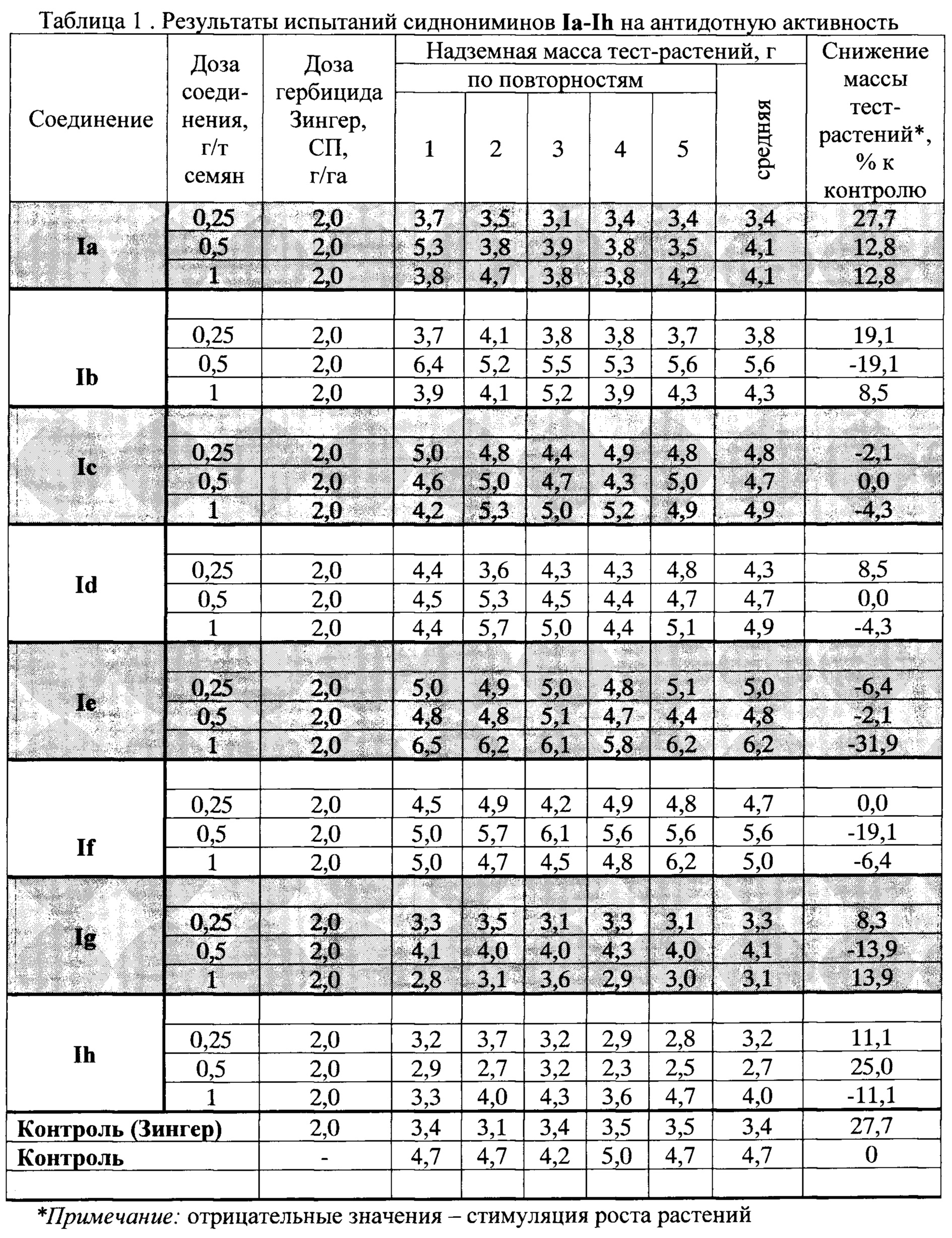
Биологические испытания проводили в вегетационных опытах с использованием в качестве тест-растения кукурузы сорта Краснодарский 291 АМВ. Соединения Ia-Ih использовали для предпосевной обработки семян кукурузы. Результаты испытаний представлены в таблице 1.
Для испытаний каждого вещества в дозах 0,25; 0,5 или 1,0 г/т семян взвешивали по 30 г семян кукурузы сорта Краснодарский 291 АМВ и помещали семена в круглодонные колбы объемом 100 мл. Далее готовили растворы для выбранных доз испытуемого вещества. Для этого брали навеску 10 мг испытуемого соединения, помещали в пробирку и растворяли в 10 мл дистиллированной воды или 75% этанола, или диметилсульфоксида. Определенные части этого раствора разбавляли водой для получения разбавленных растворов нужной концентрации. Аликвотную часть (2 мл) соответствующего разбавленного раствора, содержащую испытуемое вещество в количестве, эквивалентном дозе 0.25, 0.5 или 1.0 г/тонну семян, вносили в колбу, содержащую 30 г семян кукурузы. Содержимое колбы встряхивали вручную до полного поглощения жидкости семенами в течение 15-20 мин. После этого обработанные таким образом семена высыпали в чашки Петри и оставляли на 3 сут при комнатной температуре в открытом виде.
При проведении вегетационных опытов на антидотную активность дерново-подзолистую почву обрабатывали гербицидом метсульфурон-метил (Зингер, СП) в дозе 2 г/га с помощью лабораторного опрыскивателя. Через сутки обработанную гербицидом почву распределяли в парафинированные бумажные стаканы вместимостью 600 г и проводили посев тест-растений кукурузы по 5 штук семян на сосуд. Повторность опыта пятикратная для каждой дозы испытуемого вещества.
Для контрольных вариантов (с семенами, которые не обрабатывали испытуемыми веществами) семена при предпосевной подготовке обрабатывали вместо раствора испытуемого вещества дистиллированной водой, а для опытов использовали почву, обработанную гербицидом как указано выше (гербицидный контроль, Кгерб), либо не обработанную гербицидом (водный контроль, Кводн); повторность опытов в контрольных вариантах также пятикратная.
Выращивание тест-растений осуществляли в контролируемых условиях лаборатории искусственного климата (ЛИК): влажность воздуха в камере 70%, длительность дня 16 ч, ночи -8 ч, освещенность днем 20 тыс. лк, температура воздуха днем 25°С, ночью 16°С, влажность почвы поддерживали на уровне 60% от полевой влагоемкости (ПВ) путем ежедневного полива по массе каждого вегетационного сосуда водопроводной обессоленной водой. Через 18 сут надземную массу тест-растений срезали и взвешивали.
Снижение (увеличение) надземной массы тест-растений по отношению к водному контролю (в процентах) рассчитывали по формуле:
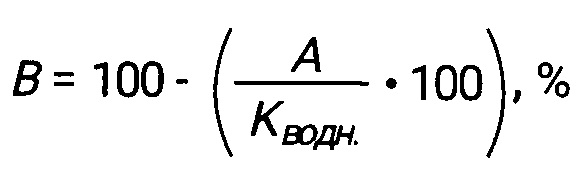
где:
В - снижение или увеличение надземной массы тест-растений по отношению к водному контролю,
А - надземная масса тест-растений в опытном варианте или в варианте с гербицидным контролем (Кгерб),
Кводн - надземная масса тест-растений в варианте с водным контролем.
Таким образом, отрицательные значения В означают увеличение надземной массы тест-растений по отношению к водному контролю (Кводн), а положительные значения В означают уменьшение надземной массы тест-растений по отношению к водному контролю (Кводн).
Данные таблицы 1 показывают, что соединения общей формулы I (Ia - Ih) и их гидрохлориды проявляют статистически достоверное антидотное действие против метсульфурон-метила. При этом соединения, указанные в таблице 1, проявляют в сверхмалых дозах (от 0,25 г до 1,0 г/тонну семян) антидотный эффект, который в ряде случаев является дозозависимым и проявляется в частичном или полном устранении негативного действия гербицида, или даже приводит к некоторой стимуляции роста кукурузы.
Полученные данные подтверждают возможность применения соединений общей формулы I в сверхмалых дозах в качестве антидотов гербицидов класса сульфонилмочевин, обеспечивающих снижение или полное устранение отрицательного действия гербицида на рост кукурузы.
Реферат
Изобретение относится к сельскому хозяйству, конкретно к применению в качестве антидотов гербицидов замещенных сиднониминов общей формулы I, где R обозначает линейную или разветвленную алкильную или алкоксиалкильную группу, содержащую от 1 до 5 атомов углерода; R1обозначает фенильную группу или замещенную фенильную группу, R2 обозначает Н или трет-бутоксикарбонильную группу, или их солей, например гидрохлоридов. Указанные сиднонимины I являются эффективными антидотами гербицидов класса сульфонилмочевин при использовании в сверхмалых дозах (от 0.25 до 1.0 г/тонну семян) для предпосевной обработки семян. Изобретение снижает или устраняет токсическое воздействие гербицидов на рост и развитие растений, что может быть применено в растениеводстве при выращивании зерновых культур. Технический результат - создание новых антидотов гербицидов, способных снижать или полностью устранять негативное действие гербицидов, и расширение ассортимента антидотов гербицидов, эффективных при использовании в сверхмалых дозах. 2 з.п. ф-лы, 1 табл.
Формула

Комментарии