Способ защиты вегетирующих растений подсолнечника от повреждающего действия 2,4-дихлорфеноксиуксусной кислоты - RU2679493C1
Код документа: RU2679493C1
Описание
Изобретение относится к технологии защиты культурных растений от повреждающего действия гербицидов.
Известен способ защиты вегетирующих культурных растений от повреждающего действия гербицидов, предусматривающий их обработку антидотом после использования гербицида (Питина М.Р. и др., Современный уровень и перспективные направления защиты сельскохозяйственных культур от нежелательных последствий применения гербицидов // Агрохимия, 1986, №4, с. 107-136).
Задачей изобретения является расширение арсенала антидотов подсолнечника от повреждающего действия 2,4-Д.
Техническим результатом изобретения является защита вегетирующих растений подсолнечника от повреждающего действия 2,4-Д, выражающаяся в повышении урожайности по сравнению с обработанным гербицидом контролем.
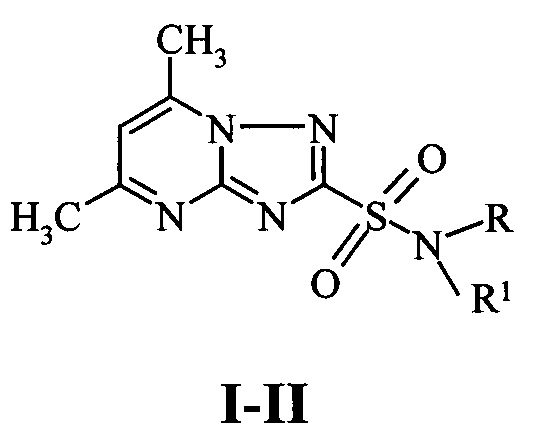
Этот результат достигается тем, что в способе защиты вегетирующих растений от повреждающего действия 2,4-Д, предусматривающем их обработку антидотом после использования гербицида, согласно изобретению в качестве антидота используют N-замещенные амиды 5,7-диметил-1,2,4-триа-золо[1,5-а]пиримидин-2-сульфокислоты I-II:
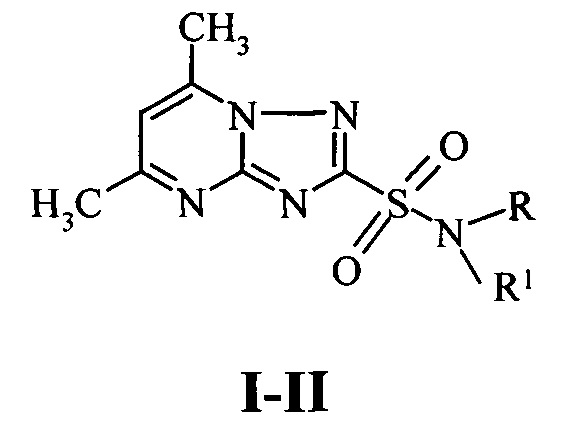
I R=СН3, R1=4-хлорфенил;
II R=Н, R1=2,5-диэтоксифенил;
в количестве 40 г/га через 1 сутки после использования гербицида.
К наиболее близкому аналогу по химической структуре заявляемых соединений и, одновременно, аналогу по свойствам (прототип), может быть отнесен 2,5-диметоксифениламид 5,7-диметил-1,2,4-триазоло[1,5-а]пиримидин-2-сульфоновой кислоты III (Стрелков В.Д., Дядюченко Л.В и др. «Антидотная активность производных пиримидинотриазолов», Агрохимия, №12, 1998, с. 49-50). Этот препарат проявил высокую антидотную активность в дозе 200 г/га.
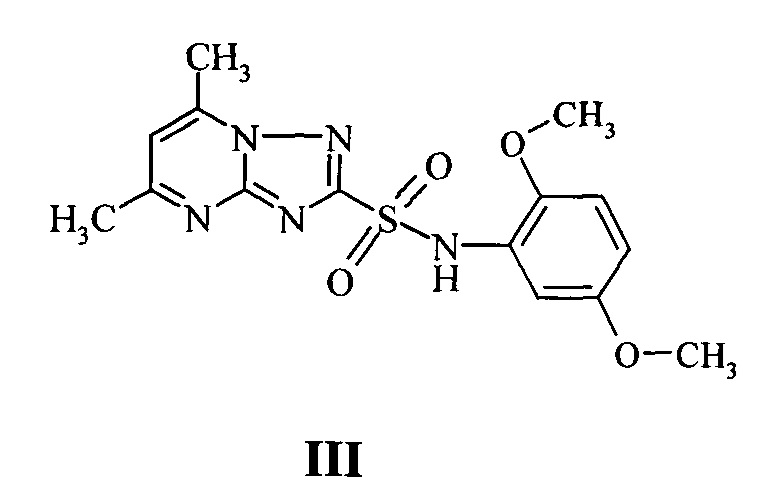
Недостатком этого препарата является высокая доза применения, что создает дополнительную нагрузку на экологию.
Синтез антидотов впервые осуществлен авторами по схеме:

Методики синтеза:
N-Метил-N-(4-хлорфенил)амид 5,7-диметил-1,2,4-триазоло[1,5-а] пиримидин-2-сульф кислоты (соединение I).
К раствору 1,0 г (4,1 ммоль) 5,7-диметил-1,2,4-триазоло[1,5-а]пиримидил-2-сульфонилхлорида в 15 мл абсолютного бензола при перемешивании прибавляют малыми порциями раствор 0,65 г (4,5 ммоль) N-метил-4-хлоранилина и 0,41 г (4,1 ммоль) триэтиламина в 15 мл бензола. Перемешивание продолжают при комнатной температуре еще 4,5 ч. Выделившийся осадок отфильтровывают, промывают на фильтре бензолом, обильно водой, сушат. После перекристаллизации из изопропанола получают 1,1 г (77%) целевого продукта I с т.пл. 196-197°С.
Найдено, %: С 47,56; Н 4,09; N 19,60; S 9,23. C14H14ClN5O2S;
Вычислено, %: С 47,80; Н 4,01; N 19,91; S 9,11.
Спектр ЯМР1Н, δ, м.д. (группа): 2,58 (с, 3Н, 5-СН3); 2,77 (с, 3Н, 7-СН3); 3,68 (с, 3Н, N-СН3); 7,02 (с, 1H, 6-Н Het); 7,29 и 7,43 (два д., 4Н, J=8 Гц, Ar).
2,5-Диэтоксифениламид 5,7-диметил-1,2,4-триазоло[1,5-а] пиримидин-2-сульфокислоты (соединение II).
К раствору 1,0 г (4,1 ммоль) 5,7-диметил-1,2,4-триазоло[1,5-а]пиримидил-2-сульфонилхлорида в 15 мл абсолютного бензола при перемешивании прибавляют малыми порциями раствор 0,81 г (4,5 ммоль) 2,5-диэтоксианилина и 0,41 г (4,1 ммоль) триэтиламина в 15 мл бензола. Перемешивание продолжают при комнатной температуре еще 6 ч. Выделившийся осадок отфильтровывают, промывают на фильтре бензолом, обильно водой, сушат. После перекристаллизации из этанола получают 1,15 г (72%) целевого продукта II с т.пл. 172-173°С.
Найдено, %: С 52,51; Н 5,48; N 17,60; S 8,33. C17H21N5O4S;
Вычислено, %: С 52,16; Н 5,41; N 17,89; S 8,19.
Спектр ЯМР1H, δ, м.д. (группа): 1,40 (с, 6Н, ОСН2СН3); 2,59 (с, 3Н, 5-СН3); 2,79 (с, 3Н, 7-СН3); 3,97 (к, 4Н, J=8 Гц, ОСН2СН3); 6,98 (с, 1H, 6-Н Het); 6,79…6,94 (м, 3Н, Ar); 8,58 (уш.с, 1Н, N-H).
2,5-Диметоксифениламид 5,7-диметил-1,2,4-триазоло[1,5-а] пиримидин-2-сулъфокислоты (соединение III).
К раствору 1,0 г (4,1 ммоль) 5,7-диметил-1,2,4-триазоло[1,5-а]пиримидил-2-сульфонилхлорида в 15 мл абсолютного бензола при перемешивании прибавляют малыми порциями раствор 0,69 г (4,5 ммоль) 2,5-диметоксианилина и 0,41 г (4,1 ммоль) триэтиламина в 15 мл бензола. Перемешивание продолжают при комнатной температуре еще 5,5 ч. Выделившийся осадок отфильтровывают, промывают на фильтре бензолом, обильно водой, сушат. После перекристаллизации из этанола получают 1,00 г (69%) целевого продукта III с т.пл. 187-188°С.
Найдено, %: С 49,58; Н 4,72; N 19,27; S 8,82. C15H17N5O4S;
Вычислено, %: С 49,30; Н 4,65; N 19,15; S 8,68.
Спектр ЯМР1H, δ, м.д. (группа): 2,59 (с, 3Н, 5-СН3); 2,78 (с, 3Н, 7-СН3); 3,73 (с, 3Н, ОСН3); 6,76 (с, 1Н, 6-Н Het); 6,82…6,99 (м, 3Н, Ar); 8,43 (уш.с, 1H, N-H).
5,7-диметил-1,2,4-триазоло[1,5-а]пиримидил-2-сулъфонилхпорид (соединение IV).
Суспензию из 4,0 г 2-бензилтио-5,7-диметил-1,2,4-триазоло[1,5-а]пиримидина, 14 мл уксусной кислоты и 14 мл воды охлаждают до температуры -8…-6°С и барботируют хлор в течение 2,5 ч, поддерживая температуру постоянной. Затем реакционную смесь выдерживают 40 мин при температуре 0°С, осадок отфильтровывают, промывают ледяной водой, высушивают досуха в вакуумном эксикаторе при 5-7 мм. рт.ст. После перекристаллизации из смеси безводных гексан : ацетон = 1:1 получают 2.8 г (68%) целевого продукта IV.
Найдено, %: С 34,40; Н 2,78; N 22,45; S 13,21. C7H7ClN4O2S;
Вычислено, %: С 34,08; Н 2,86; N 22,71; S 13,00.
Спектр ЯМР1Н, δ, м.д. (группа): 2,61 (с, 3Н, 5-СН3); 2,80 (с, 3Н, 7-СН3); 7,04 (с, 1Н, 6-Н Het).
Оценку антидотной активности заявляемых соединений I-II и прототипа (соединение III) проводили на экспериментальном поле Всероссийского научно-исследовательского института биологической защиты растений по следующей методике.
В полевых условиях растения подсолнечника сорта Родник в фазу 10-16 листьев обрабатывали бутиловым эфиром 2,4-дихлорфеноксиуксусной кислоты в дозе 18 г/га и через 1 сутки наносили раствор антидота в дозах 40 г/га с нормой расхода рабочей жидкости 300 л/га.
Прототип испытывали в дозах 40 и 200 г/га, т.к. активность препаратов зависит от сорта культуры, погодных условий, почвы и других факторов. В опыте предусмотрены следующие варианты:
- контроль - необработанные растения;
- «гербицид» (эталон) - растения обработанные гербицидом;
- «гербицид + антидот» - растения обработанные гербицидом и антидотом.
Опыты проводили на делянках площадью 2,8 м2, повторность пятикратная. Уборку урожая подсолнечника проводили в момент полного созревания семян.
Антидотный эффект определяли по абсолютной величине прибавки урожая к гербицидному эталону и в процентах по формуле:
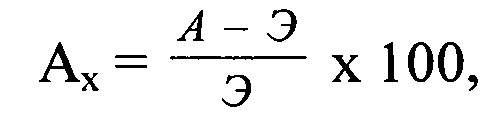
Аx - антидотный эффект, %;
А - урожай в варианте антидот + гербицид;
Э - урожай в варианте эталон (гербицид).
Полученные данные статистически обработаны с использованием t-критерия Стьюдента.
Результаты испытаний представлены в таблице.
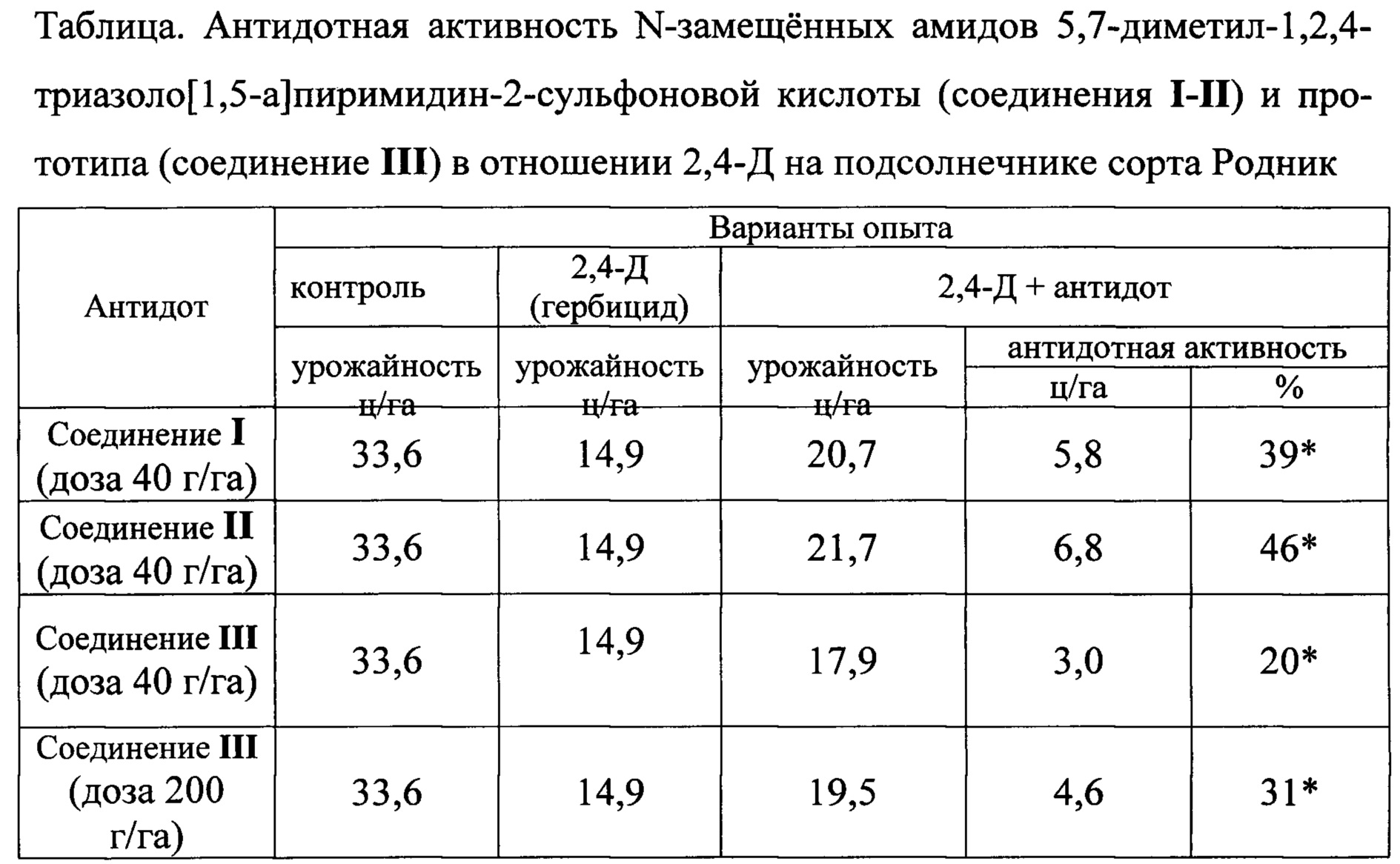
*Различия между вариантами достоверны при Р=0,90
Таким образом, предлагаемое изобретение позволяет обеспечить антидотный эффект на уровне 39 и 46% соответственно, против 20% у прототипа, что увеличивает урожайность подсолнечника на 5,8-6,8 ц/га.
Реферат
Изобретение относится к сельскому хозяйству. Способ защиты вегетирующих растений подсолнечника от повреждающего действия 2,4-Д предусматривает обработку N-замещенными амидами 5,7-диметил-1,2,4-триазоло[1,5-а]пиримидин-2-сульфокислоты в количестве 40 г/га через 1 сутки после использования гербицида. Предлагаемый способ защиты вегетирующих растений подсолнечника позволяет повысить урожайность подсолнечника, при этом снижая пестицидную нагрузку на экологию окружающей среды. 1 табл.
Формула
Документы, цитированные в отчёте о поиске
Способ защиты вегетирующих растений подсолнечника от повреждающего действия 2,4-дихлорфеноксиуксусной кислоты

Комментарии