Изобретешь относится к технологии получения микрокапсул, содержащих
активно леипдующее вещество, способное воздействовать на окружающую
среду.
Цель изобретения - изменение продолжительности
пролонгирования.
Пример 1. Приготовление водной
суспензии микрокапсул слабой пористости , содержащей (S) рЈ-циано 3- феноксибензиловый эфир 1 R, цис-2,2-
диметнл 3-(2,2-дибромвинил) циклопро- пан-1-карбоновой кислоты или декамет- рин (продукт А).
Перемешивают со скоростью 500 об/мин при 50°С 20 г желатина и
20 г смолы акации в 760 мл обессоленной воды в присутствии 0,5 г вторичного
октанола. Получают первый раствор (I) .
Готовят второй раствор (II), перемешивая
со скоростью 500 об/мин при 50°С /15 г соединения А, 46,4 г ксилола , 96,6 г диметилфталата, 4,0 г
вторичного октанола, 6,5 г водоне- растворимой этилгидроксиэтилцеллюло-
зы (ВНЕС) (16,25% от общей массы жела тина и смолы акации), 0,8 г анионного
поверхностно-активного вещества на основе алкиларилсульфоната - галорила
ЕМ 520 и 0,2 г галорила ЕМ 60 - продукта конденсации окиси этилена с гид-
роксилсодержащим сложным полиэфиром.
Готовят эмульсию масло в воде,
медленно вводят раствор II в раствор I при скорости перемешивания 500 об/мин и 50 °С.
j
Полученная эмульсия содержит таким
образом 2,51 мас.% соединения А и 4,02 мас.% коллоида - желатина и смолы акации.
Когда эмульсия масло в воде получена , доводят рН реакционной среды
до 4,2-4,4 прибавлением 10%-ного раствора уксусной кислоты, а затем медленно понижают в течение около
1 ч температуру до 20°С.
Затем прибавляют при перемешивании
(500 об/мин) 5 мл 25%-ной раствора глутарового альдегида. Потом, также при перемешивании со скоростью
500 об/мин по истечении около 1 ч прибавляют 10 г 15%-ного водного раствора танина.
Реакционную смесь при перемешивании со скоростью 500 об/мин выдерживают
при комнатной температуре 3 ч (приблизительно ) . Таким образом получают
микрокапсулы со сшитой структурой, диаметр которых равен не менее 30 мкм
К полученной эмульсии сшитых микрокапсул последовательно прибавляют 1 г
5
0
5
0
5
0
5
0
5
вторичного октанола, 119 г хлористого кальция (маленькими фракциями, или
11,95 мас.% от массы эмульсии микрокапсул ), 10 г водорастворимой этилгид-
роксиэтилцеллюлозы (или 1 мас.% от массы эмульсии микрокапсул), 12 г Галорил ЕМ 42 и 0,04 г Родамин В,
а затем продолжают перемешивание около 3 .ч и пропускают полученную суспензию
через решето. Эта суспензия содержит 98,1% исходного активного начала .
П р и м е р 2 (сравнительный). Приготовление водной суспензии микрокапсул
с сильной пористостью, содержащих соединение А.
Способ осуществляют по примеру 1, употребляя те же количества компонентов
, но без использования водоне- растворимой этилгидроксиэтилцеллюлоэы
в растворе fl, получают суспензию микрокапсул, которые обладают повышенной
пористостью. Эта суспензия содержит 98,7% исходного активного начала.
П р и м е р 3. Приготовление порошка на основе микрокапсул.
Микрокапсулы, полученные по примерам 1 и 2, могут быть также выделены в виде порошка. Для того, чтобы
получить такой порошок, при перемешивании со скоростью 500 об/мин прибавляют
к общей реакционной смеси, полученной после образования сшитой структуры коацервата примера 1 или 2,
110 г (или 11,05 мас.% от массы эмульсии микрокапсул) талька, поддерживают
перемешивание еще около 15 мин, пропускают суспензию через сито, отсасывают микрокапсулы и сушат.
Полученный порошок может быть затем кондиционирован обычными способами
, например, в виде приманок.
П р и м е р 4. Получение порошка
на основе микрокапсул, содержащих вирус Heliothis Nuclear Polyhedrosis.
При перемешивании со скоростью 500 об/мин при 50°с приготовляют первый раствор из 20 г желатина и
20 г смолы акации в 760 мл обессоленной воды.
Готовят второй раствор (II) при перемешивании со скоростью 500 об/мин
при исходя из 25 г порошка вируса Heliothis Nuclear Polyhedrosis,
46,4 г ксилола, 96,6 г диметилфталата , 0,8 г Галорила ЕМ 520 и 0,2 г Галорила ЕМ 60.
Приготавливают эмульсию масло в воде, медленно вводя раствор II в
раствор I при перемешивании (500 об/мин, 50° с).
После получения эмульсии масло в воде устанавливают рН реакционной среды 4,2 - 4,4 добавлением 10%-ного
раствора уксусной кислоты, а затем меддтнно в течение около 1 ч снижают температуру до 20°С.
Затем при скорости перемешивания 500 об/мин прибавляют 5 мл 25%-ного
раствора глутарового альдегида. По истечении около 1 ч при постоянном перемешивании со скоростью 500 об/мин
прибавляют 10 г 15%-ного водного раствора танина. Реакционную смесь выдерживают
при перемешивании со скоростью 500 об/мин при комнатной температуре в течение 3 ч (приблизительно
). Таким образом получают сшитые микрокапсулы, диаметр которых ра- вен 30 jti (максимум) .
10
ровальной бумаги. В качестве конт-
Ьоля помещают эквивалентное количество немикроннкапсулированного нафталина
. Изучение ведется в темноте, при и средней относительной влажности 60%, в потоке воздуха со скоростью
в 143 м3/ч.
Определение сублимата нафталина ведется на аппарате хроматографии в
паровой фазе и после 24 ч, 7 и 28 дн
Нафталин, который не микроинкапсу-
лирован, оказался совершенно сублимированным после
ч, тогда как микро15
капсулы проб А,В и С дали потерн нафталина в зависимости от времени и количества
органорастворимой этилгидро- ксиэтилцеллюлозы (КНКС), находящейся.
в стенках микрокапсул (см. табл. 2). 20 На основании этих проо можно установить
, что разница пористости микрокапсул зависит от концентрации ЕНЕС в стенках.
Итак, изменяя концентрацию органоПосле образования сшитых микрокап- 25 растворимой этилгидроксиэтилцеллюлосул
прибавляют при перемеиотвании со скоростью 500 об/мин в общую реакционную
смесь, полученную после образования сшитой структуры коацервата,
зы, находящейся в микрокапсула но контролировать пористость с микрокапсулы в зависимости от
ды инкапсулируемого активного
110 г талька (или 11,17% от массы сус- 30 ства и от целей употребления.
пензии микрокапсул), выдерживают перемешивание
в течение 15 мин (приблизительно ) пропускают суспензию через решето, отсасывают микрокапсулы
и сушат их.
Полученный мороюок может быть затем
кондиционирован обычными способами , например, в виде приманки.
Предлагаемый способ обеспечивает микроинкапсупиро вание вируса без его уничтожения.
Примерз. Изучение пористости микрокапсул, полученных по предлагаемому способу.
Для изучения пористости микрокапсул приготовляют их по способу, описанному
в примерах 1 и 2, но выбирая в качестве вещества для микроинкапсулирования нафталин, а не соединение
А.
Концентрацию органорастворимой этилгидроэтилцеллюлозы раствора I
изменяют в зависимости от испытаний (см. табл.1).
1i)0 мг полученных микрокапсул, содержащих нафталин, взятых из проб А,В и С, собирают на кружки фильтII
р и м е р 6. Исследование ты против светового излучения,
печенной микрокапсулами (приго ными по предлагаемому способу)
эг ному веществу.
Светочувствительное соедине например 5-бензил-З-фурилметил
эфир (1R, 3S, Е) 2,2-диметил-3 оксо-2,3,4,5-терагидро-З-тиофе
40 иденметил)циклопропанкарбоново лоты или кадетрин (соединение микрокапсулировано и микрокапс
введены в суспензию по пре;цтг мому способу. Эта суспензия и
45 гируемый концентрат на основе и того же светочувствительного соединения и при той же концен
подвергнуты одному и тому же о нию, воспроизводящему солнечны
50 спектр. Средняя температура и сительная влажность соответств 25°С и 75%.
55
Определения потерь активног ства (соединение В) произведен
истечении 24 ч, 7 и 14 дн эксп ции при освещении и посредство рата хроматографии в жидкой фа
высоком давлении.
ровальной бумаги. В качестве конт-
Ьоля помещают эквивалентное количество немикроннкапсулированного нафталина
. Изучение ведется в темноте, при и средней относительной влажности 60%, в потоке воздуха со скоростью
в 143 м3/ч.
Определение сублимата нафталина ведется на аппарате хроматографии в
паровой фазе и после 24 ч, 7 и 28 дн.
Нафталин, который не микроинкапсу-
лирован, оказался совершенно сублимированным после
ч, тогда как микрокапсулы
проб А,В и С дали потерн нафталина в зависимости от времени и количества органорастворимой этилгидро-
ксиэтилцеллюлозы (КНКС), находящейся. в стенках микрокапсул (см. табл. 2).
На основании этих проо можно установить , что разница пористости микрокапсул
зависит от концентрации ЕНЕС в стенках.
Итак, изменяя концентрацию органозы
, находящейся в микрокапсулах, можно контролировать пористость стенок
микрокапсулы в зависимости от природы инкапсулируемого активного вегцеII
р и м е р 6. Исследование защиты против светового излучения, обеспеченной
микрокапсулами (приготовленными по предлагаемому способу) активному веществу.
Светочувствительное соединение, например 5-бензил-З-фурилметиловый
эфир (1R, 3S, Е) 2,2-диметил-3-(2- оксо-2,3,4,5-терагидро-З-тиофенилиденметил
)циклопропанкарбоновой кислоты или кадетрин (соединение В), микрокапсулировано и микрокапсулы
введены в суспензию по пре;цтгае мому способу. Эта суспензия и эмульгируемый
концентрат на основе одного и того же светочувствительного соединения и при той же концентрации
подвергнуты одному и тому же освещению , воспроизводящему солнечный
спектр. Средняя температура и относительная влажность соответственно 25°С и 75%.
Определения потерь активного вещества (соединение В) произведены по
истечении 24 ч, 7 и 14 дн эксплуатации при освещении и посредством аппарата
хроматографии в жидкой фазе при высоком давлении.
Результаты этих проб даны в табл. 3.
Эти результаты доказывают эффективность
защиты микроинкапсулирован- ного активного вещества.
Пример 7. Исследование сохранения биологической активности микро- инкапсулированного активного вещества
Соединение А (декаметрин) микроин- капсулировано и введено в суспензию
или кондиционировано в виде гранул, исходя из порошка данных микрокапсул
Эта суспензия и эти гранулы сравнивают с эмульгируемым концентратом на основе данного продукта А при той же
концентрации.
Исследование биологической активности
суспензии микрокапсул и эмульгируемого концентрата.
Насекомым, употребляемым для этой биологической пробы, является SPODOP-
TERA LITTORALIS. Разбавляют водой суспензию микрокапсул и эмульгируемый
концентрат, затем оба разбавленных водных раствора, содержащих продукт А
распыляются в количестве 1) мл на . 4 саженца бобов (3 листьев). На каж-
дый саженец по истечении 0,3,5,7 и 14 дн после обработки сажают 20
гусениц (стадия L4) . Контроль производится через 24 и 48 ч после инвазии
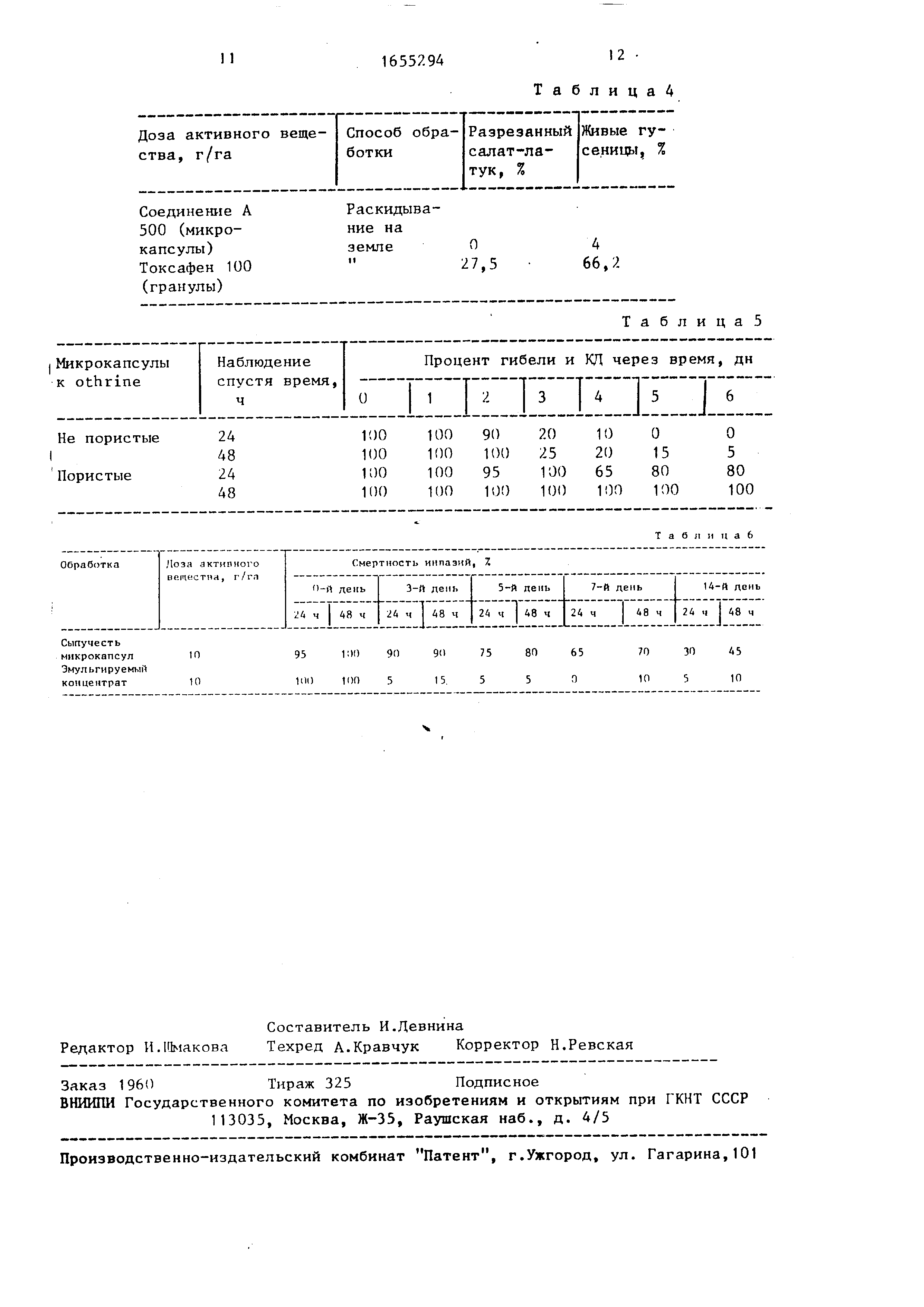
Результаты приведены в табл. 6.
.Данные табл. 6 показывают, что
эмульгируемый концентрат проявляет явное понижение активности после
3-го дня, тогда как суспензия микрокапсул обладает еще некоторой активностью после 4-го дня.
Исследование биологической актив ности микроинкапсулированного вещества
и затем кондиционированного в виде приманки в гранулах.
Эти приманки в виде гранул получаются из отдельных микрокапсул, находящихся в виде порошка и содержащи
продукт А в качестве активного вещества .
Они разбросаны на земле для защит
салата латук от нашествия гусениц (SPODOPTERA LITTORALIS). Предварительно установлено, что продукт А,
введенный прямо в приманки, без микроинкапсулирования , портится очень
быстро и быстро теряет свою биологическую активность.
Обрабатываемый участок содержит двадцать салатов-латук в стадии 2-3 листа, пересаженные по 4 линии.
0
5
0
5
0
5
0
5
0
5
На землю кладут 20 гусениц. Контроль
ведется 19 дней после заражения . Результаты контроля приведены в табл. 4.
Последствие двух типов микрокапсул .
Тест с насекомыми: гусеницы Spodo-
ptera littoralis (4-я стадия: 1,5- I см).
Способ обработки: прямая пульверизация .
Количество используемого раствора:
10 мл водного токсичного раствора на 5 хлопковых растений.
Обработанная основа: 4 хлопковых растения.
Заражение: день 0, день 1, день 2,
день 3, день 4, день 5, день 6 с помощью 20 индивидуумов.
Контроль: 24 и 48 ч после заражения .
Дозы МА, г/л: 0,1 г МА/л.
Результаты приведены в табл. 5.
Формула изобретения
Способ получения микрокапсул приготовлением эмульсии масло в воде
при смешивании со скоростью 500 об/мин и при 50°С раствора, содержащего
2,51% от общей массы эмульсии биологически активного вещества в качестве
материала ядра и органический растворитель , с водным раствором, содержащим
4,02% от общей массы эмульсии коллоида - желатина и смолы акации
при равном их соотношении, в присутствии эмульгатора, понижением рН реакционной
среды до 4,2-4,4 и температуры до 20°С в течение 1 ч с сохранением той же скорости перемешивания
и сшивкой оболочки микрокапсул, отличающийся тем, что, с целью регулирования пролонгирования
действия биологически активного вещества , в качестве эмульгатора используют
0,4% от общей массы эмульсии вторичного октилового спирта в присутствии
смеси анионного поверхностно-активного вещества на основе алкиларил-
сульфоната с неионогенным поверхностно-активным веществом на основе продукта
конденсации окиси этилена с гидроксилосодержащим сложным полиэфиром , в эмульсию дополнительно вводят
5,0-16,25% от массы коллоида водоне- растворимой этилоксиэтилцеллюлозы,
сшивку осуществляют последовательной
обработкой микрокапсул, 25%-ным раствором глутарового альдегида в течение
1 ч и водным раствором танина в течение 3 ч при перемешивании со скоростью
500 об/мин, затем в полученную эмульсию сшитых микрокапсул с изменяемой пористостью вводят 11,95% от массы
Оргонорастворимая этилгидроксиэтилцеллюлоэа
Соединение
Нафталин немикро- капсули-
рованный Микрокапсулы с 0% ЕНЕС
Микрокапсулы с 5% ЕНЕС Микрокапсулы
с 10% ЕНЕ
эмульсии хлористого кальция и 1% водорастворимой этилгидроксиэтилцеллю-
лозы до получения суспензии микрокапсул или 11,17 - 11,65% от массы эмульсии
талька с медленным перемешиванием при 7.0 С с последующей сушкой и выделением порошка микрокапсул.
I Таблица 1
10
Таблица2
Сублимация %, в сроки, дн
1 (7.4 ч) 1
28
100
28
30
16
22
24
ТаблицаЗ
10 10
95 1:10 90 9(1 75 80 65 140 100 5 15 5 5 П
Таблица4
Т а б л и ц а 6
30 5
45








Комментарии