Фармацевтически приемлемый буфер для уничтожения клеток и способ их уничтожения - RU2423050C2
Код документа: RU2423050C2
Чертежи

















Описание
Область техники, к которой относится изобретение
Предлагаемое изобретение относится к средствам и способам уничтожения клеток при помощи воздействия на них твердыми буферами.
Уровень техники
Как известно, различные формы клеточного материала вредны и потенциально летальны для человека. Например, раковые клетки являются второй из наиболее распространенных причин смерти в Соединенных Штатах Америки после сердечно-сосудистых заболеваний (Boring и др., СА Cancel J. Clin. 43:7 (1993)). Клеточные микроорганизмы также являются причиной целого ряда заболеваний. Уничтожение клеток и избирательное уничтожение клеток (например, рака) хорошо изучены в области биотехнологии.
Рак является злокачественной опухолью с потенциально неограниченными возможностями роста. Это, главным образом, патогенная репликация (утрата нормального регулирующего контроля) клеток различного вида в организме человека. На начальных этапах для лечения болезни часто используется хирургия, лучевая терапия или их сочетание, но часто наблюдаются местные рецидивы заболевания и появление метастазов. Для лечения некоторых видов рака используется также химиотерапия, но она редко приводит к долговременной регрессии. Таким образом, она часто не приводит к излечению. Обычно опухоли и их метастазы становятся невосприимчивыми к химиотерапии в случае, известном как развитие множественной лекарственной устойчивости. Во многих случаях опухоли по своей природе резистентны к некоторым классам химиотерапевтических препаратов. Кроме того, такие виды лечения представляют угрозу нераковым клеткам, создают стрессовые условия для человеческого организма и приводят к всевозможным побочным эффектам. Таким образом, имеется необходимость в улучшенных препаратах, которые способны целенаправленно воздействовать на раковые клетки.
Микроорганизмы могут вторгаться в ткани организма-хозяина и пролиферировать, вызывая симптомы тяжелого заболевания. Патогенные бактерии были идентифицированы как основная причина множества подрывающих силы и смертельных заболеваний, включая, например, туберкулез, холеру, коклюш, чуму и т.п. Для лечения этих тяжелых инфекций используется введение лекарственных препаратов, таких как антибиотики, которые убивают возбудителей инфекции. Однако обычно развивается резистентность патогенных бактерий к антибиотикам, и для предотвращения распространения инфекций, связанных с этими микроорганизмами, необходимы улучшенные препараты.
Одним из главных предметов озабоченности относительно продуктов, которые проникают в организм или пролагают путь в организм другим агентам, является бактериальная инфекция. Предотвращение инфекционных болезней при помощи имплантируемых медицинских устройств может оказаться очень проблематичным, поскольку бактерии могут образовывать биопленки, которые защищают микробы от уничтожения иммунной системой индивидуума. Все эти инфекции трудно поддаются лечению антибиотиками, что часто влечет за собой необходимость извлечения устройства, что является травматичным для пациента и повышает расходы на лечение. Соответственно, для таких медицинских аппаратов данная область техники давно находится в поиске средств и способов придания таким медицинским аппаратам и устройствам антибактериальных и, желательно, антимикробных свойств.
Общий подход для данной области техники состоит в покрытии медицинских устройств или их поверхностей бактерицидными веществами. Однако в связи с тем, что многие бактерицидные вещества частично растворимы в воде или, по крайней мере, требуют достаточной солюбилизации для эффективного антибактериального действия, простое покрытие бактерицидными веществами оказалось ненадежным. По этой причине данная область техники находится в поиске способов включения бактерицидных веществ в медицинские устройства или, по крайней мере, обеспечения наличия на них стабилизированного покрытия.
В качестве альтернативы, материалы могут быть пропитаны антимикробными агентами, такими как антибиотики, четвертичные аммонийные соединения, ионы серебра или йод, которые постепенно высвобождаются со временем в окружающий раствор и уничтожают находящиеся там микроорганизмы. Хотя эффективность этих подходов была подтверждена для водных растворов, содержащих бактерии, предполагается, что они не будут эффективно действовать на присутствующие в воздухе бактерии в отсутствие жидкой среды. Это особенно справедливо для материалов, в основе действия которых лежит принцип постепенного высвобождения, которые также должны стать инертными после израсходования выщелачивающегося бактерицидного средства.
Любое средство, используемое для ингибирования образования биопленок в средах организма, должно также быть безопасным для пользователя. Некоторые биоциды в количествах, достаточных для создания препятствий образованию биопленок, могут также повреждать ткани организма-хозяина. Антибиотики, введенные в ткани местно, могут вызывать образование резистентных микроорганизмов, которые впоследствии могут образовывать сообщества в виде биопленок, планктонные микроорганизмы которых аналогичным образом окажутся резистентными к конкретным антибиотикам. Любое средство борьбы с образованием биопленок и средство, предохраняющее от биологического обрастания, кроме того, не должно препятствовать реализации целебного действия медицинского устройства. Были подобраны определенные материалы, с которыми особенно удобно обращаться оператору, обладающие мягкостью, водонепроницаемостью, растяжимостью и долговечностью при сжатии, характеристиками, которые не могут быть изменены при введении средства, обладающего антимикробным действием.
Пищевые продукты также являются источником бактериальной инфекции, и их консервация является делом первостепенной важности с точки зрения обеспечения безопасности пищевых продуктов при их употреблении и для ингибирования или предотвращения порчи питательного вещества или органолептических изменений, делающих пищу менее аппетитной и даже токсичной. Консервация пищевых продуктов может достигаться при помощи различных способов. Физические манипуляции с пищевыми продуктами, которые оказывают консервирующее действие, включают, например, замораживание, охлаждение, тепловую обработку, перегонку, пастеризацию, сушку, вакуумную упаковку и герметизацию в упаковке в отсутствие воздуха. Некоторые из этих способов могут быть частью процесса переработки пищевых продуктов. Стадии процесса переработки пищевых продуктов выбирают, предпочтительно, так, чтобы соблюсти баланс между гарантиями получения микробиологически безопасного пищевого продукта и получением пищевого продукта желаемого качества.
Учитывая возрастающую роль полимеров как материалов, использующихся при изготовлении медицинских аппаратов, для упаковки и переработки пищевых продуктов, использование антимикробных полимеров становится все более желательным. Хотя в данной области техники антимикробные полимеры уже используются, все же ощущается необходимость в улучшенном антимикробном полимерном покрытии, которое можно было бы легко и дешево наносить на субстрат с целью получения изделия, которое обладает превосходными антимикробными свойствами и которое сохраняло бы свои антимикробные свойства долговременно и не подвергаясь выщелачиванию при контакте с клеточным материалом в течение длительного времени.
В патентной заявке США №20050271780 предлагается бактерицидная полимерная матрица, связанная с ионообменным материалом, таким как четвертичная аммонийная соль, предназначенная для использования при консервации пищевых продуктов. Полимерная матрица уничтожает бактерии за счет включения в нее бактерицидного агента (например, четвертичной аммонийной соли). Положительный электрический заряд агента только способствует электростатическому притяжению между ним и отрицательно заряженными клеточными стенками. Кроме того, в описанной выше заявке не предлагается использовать твердые буферные системы, обладающие буферной емкостью по всей их массе.
В патентной заявке США №20050249695 предлагается провести иммобилизацию обладающих антимикробными свойствами молекул, таких как четвертичные аммонийные соли или соли фосфония (катионные, положительно заряженные частицы), за счет ковалентного связывания с твердой поверхностью для придания поверхности бактерицидных свойств. Полимеры, описанные в упомянутой заявке, прикреплены к твердой поверхности при помощи аминогрупп, присоединенных к этой поверхности, и в связи с этим такой полимер способен образовывать только монослой на твердой поверхности.
В патентной заявке США №20050003163 предлагаются субстраты, имеющие антимикробные и/или антистатические свойства. Такие свойства возникают за счет нанесения покрытия или пленки, образованной положительно заряженным, в связи с наличием катионов, полимерным составом. Активность полимеров, как описано в патентных заявках США №№20050271780, 20050249695 и 20050003163, связана с непосредственным контактом бактерицидных материалов с клеточной мембраной. Степень токсичности сильно зависит от поверхностной концентрации бактерицидных частиц. Это требование накладывает серьезные ограничения, поскольку подвергающийся воздействию катионный материал в ходе реакций ионного обмена может быть насыщен очень быстро. Кроме того, ни в одной из вышеописанных патентных заявок США не предлагается способ уничтожения эукариотических клеток. Как и не предлагается в них использовать полимеры in vivo в качестве веществ, обладающих цитотоксической активностью по отношению к клеткам либо эукариотического, либо прокариотического типа. Более того, ни в одной из вышеуказанных патентных заявок США не предлагается конфигурация полимера, способного избирательно уничтожать клетки определенного типа.
Таким образом, до настоящего времени ощущается необходимость в веществах, способных оказать цитотоксическое действие как на эукариотические, так и на прокариотические клетки, и было бы очень полезно получить эти вещества.
Раскрытие изобретения
Согласно одному аспекту предлагаемого изобретения, предлагается способ инициирования изменений в клеточном процессе в клетках-мишенях многоклеточного организма, причем способ включает приведение в контакт клетки-мишени с твердой буферной системой для того, чтобы изменить внутриклеточный pH, по меньшей мере, в одном участке клетки, тем самым инициируя изменения в клеточном процессе в клетке-мишени многоклеточного организма.
Согласно другому аспекту предлагаемого изобретения, предлагается способ уничтожения клетки-мишени многоклеточного организма, который включает приведение в контакт клетки-мишени с твердой буферной системой для того, чтобы изменить внутриклеточный pH, по меньшей мере, в одном участке клетки, тем самым уничтожая клетку-мишень.
Согласно еще одному аспекту предлагаемого изобретения, предлагается способ инициирования изменений в клеточном процессе в клетках-мишенях, причем способ включает приведение в контакт клетки-мишени с твердой буферной системой, а твердая буферная система имеет анионную природу, причем указанный контакт нужен для того, чтобы изменить внутриклеточный pH, по меньшей мере, в одном участке клетки, тем самым инициируя изменения в клеточном процессе в клетке-мишени.
Согласно еще одному аспекту предлагаемого изобретения, предлагается способ инициирования изменений в клеточном процессе в клетках-мишенях, причем способ включает приведение в контакт клетки-мишени с твердой буферной системой, в котором твердая буферная система включает буферирующий слой и водопроницаемый слой, расположенный на внешней поверхности буферирующего слоя, для того, чтобы изменить внутриклеточный pH, по меньшей мере, в одном участке клетки, тем самым уничтожая клетку.
Согласно еще одному аспекту предлагаемого изобретения, предлагается способ уничтожения клетки, включающий приведение в контакт клетки с твердой буферной системой, причем твердая буферная система имеет значение объемной буферной емкости, превышающее 50 ммоль Н+/л·ед. pH, а значение pH либо выше 8, либо ниже 4,5, тем самым уничтожая клетку.
Согласно еще одному аспекту предлагаемого изобретения, предлагается способ выбора твердой буферной системы, способной уничтожать клетки, причем способ состоит в выборе твердой буферной системы, которая имеет значение объемной буферной емкости выше 50 ммоль Н+/л·ед. pH, а значение pH выше 8, либо ниже 4,5, что придает твердой буферной системе способность уничтожать клетки.
Согласно еще одному аспекту предлагаемого изобретения, предлагается способ уничтожения интересующей субпопуляции клеток, причем способ включает приведение в контакт образца, содержащего интересующую субпопуляцию клеток, с твердой буферной системой, имеющей значения объемной буферной емкости и pH, пригодные для избирательного уничтожения интересующей субпопуляции клеток, тем самым уничтожая интересующую субпопуляцию клеток.
Согласно еще одному аспекту предлагаемого изобретения, предлагается промышленное изделие, включающее:
(i) пленку-подложку и
(ii) твердый буферный слой, прикрепленный, по меньшей мере, к части поверхности пленки-подложки, причем твердая буферная система включает буферирующий слой и ионопроницаемый слой, расположенный на внешней поверхности буферирующего слоя.
Согласно еще одному аспекту предлагаемого изобретения, предлагается промышленное изделие, включающее:
(i) пленку-подложку и
(ii) твердый буферный слой, прикрепленный, по меньшей мере, к части поверхности пленки-подложки, причем твердая буферная система является анионной по своей природе.
Согласно еще одному аспекту предлагаемого изобретения, предлагается использование твердого буфера для производства лекарственного средства для лечения медицинского состояния, связанного с популяцией патологических клеток, включающий применение твердой буферной системы.
Согласно еще одному аспекту предлагаемого изобретения, предлагается фармацевтическая композиция, включающая в качестве действующего вещества твердую буферную систему, а также фармацевтически приемлемый носитель или разбавитель.
Согласно еще одному аспекту предлагаемого изобретения, предлагается способ выбора оптимального твердой буферной системы для уничтожения интересующего вида клеток, причем способ включает:
(i) приведение в контакт нескольких видов клеток с несколькими твердыми буферными агентами;
(ii) идентификацию твердого буферного агента из нескольких твердых буферных агентов, способного вызывать гибель одного вида клеток из нескольких видов клеток, причем твердый буферный агент оптимизируется для уничтожения интересующего вида клеток.
Согласно еще одному аспекту предлагаемого изобретения, предлагается способ лечения медицинского состояния, связанного с популяцией патологических клеток, причем способ включает введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества твердой буферной системы для того, чтобы изменить, по меньшей мере, частично, значение внутриклеточного pH для популяции патологических клеток, тем самым, оказав лечебное воздействие на медицинское состояние, связанное с популяцией патологических клеток.
Еще одной особенностью предпочтительных вариантов осуществления изобретения, описанных ниже, является то, что индукция изменений приводит к гибели клетки.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что многоклеточным организмом является высшее растение.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что многоклеточным организмом является млекопитающее.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что контакт реализуется в условиях in vivo.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что контакт реализуется в условиях ex vivo.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что контакт реализуется в условиях in vitro.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что в твердой буферной системе имеется градиент pH, по меньшей мере, вдоль одного ее участка.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система интернализуется клеткой-мишенью.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система присоединяется к связывающему компоненту.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что связывающий компонент выбран из группы, состоящей из антитела, лиганда рецептора и углевода.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система, по меньшей мере, частично покрыта селективным барьером.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что в качестве селективного барьера служит механический барьер.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система включает буферирующий слой и водопроницаемый слой, расположенный на внешней поверхности буферирующего слоя.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что в качестве водопроницаемого слоя используется полимер с открытыми порами.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что полимер с открытыми порами выбран из группы, включающей поливиниловый спирт (ПВС), целлюлозу и полиуретан.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система как лекарственная форма состоит из частиц.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система как лекарственная форма состоит из аэрозольных частиц.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система включена внутрь капсульных частиц.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система прикреплена к поверхности частиц.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что частицы выбраны из группы, включающей полимерные частицы, микрокапсулы, липосомы, микросферы, микроэмульсии, наночастицы, нанокапсулы и наносферы.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система является анионообменным материалом, включенным в водопроницаемую полимерную матрицу.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система является катионообменным материалом, включенным в водопроницаемую полимерную матрицу.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система состоит из катионообменного материала и анионобменного материала, включенных в водопроницаемую полимерную матрицу.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что катионообменный материал выбран из группы, включающей сульфоновую кислоту и ее производные, фосфоновую кислоту и ее производные, карбоновую кислоту и ее производные, фосфиновую кислоту и ее производные, фенолы и их производные, арсоновую кислоту и ее производные, и селеновую кислоту и ее производные.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что анионообменный материал выбран из группы, включающей четвертичный амин, третичный амин, вторичный амин и первичный амин.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система является полимером.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система содержит матрицу, обладающую собственной ионной проводимостью.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система является иономером.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что в качестве иономера служит сульфонированный тетрафторэтиленовый сополимер (нафион) и его производные.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система обладает объемной буферной емкостью выше, чем примерно 20 ммоль Н+/л·ед. pH.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система включает участок со значением pH больше 8.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система включает участок со значением pH меньше 4,5.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что клетка является больной клеткой.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что твердая буферная система прикреплена, по меньшей мере, к части поверхности пленки-подложки.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что образец содержит, по меньшей мере, вторую субпопуляцию клеток, причем содержащаяся в образце интересующая субпопуляция клеток и вторая субпопуляция клеток проявляют различные буферные емкости плазмы.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что лечение проводится в условиях ex vivo.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что лечение проводится в условиях in vivo.
Еще одной особенностью описанных предпочтительных вариантов осуществления изобретения является то, что промышленное изделие образует, по меньшей мере, часть упаковочного материала, медицинского устройства, ткани, каркаса, фильтра или бактерицидного устройства.
Предлагаемое изобретение успешно устраняет недостатки известных в настоящее время устройств, предлагая новые способы инициирования изменений в клетках путем приведения клеток в контакт с твердой буферной системой.
Если не оговорено иначе, все технические и научные термины, использованные в настоящем описании, имеют те же значения, которые известны среднему специалисту в области техники, к которой относится предлагаемое изобретение. Хотя на практике или при проверке предлагаемого изобретения могут использоваться способы и материалы, аналогичные и эквивалентные описанным здесь, ниже дано описание подходящих способов и материалов. Все публикации, патентные заявки, патенты и другие литературные источники, упомянутые здесь, включены в настоящую заявку во всей полноте посредством ссылки. В случае возникновения конфликта интересов будет учитываться описание изобретения, включая определения. Кроме того, материалы, способы и примеры даны только для иллюстрации и не являются ограничивающими.
Краткое описание чертежей
Описание предлагаемого здесь изобретения, только в качестве примеров, дано со ссылкой на прилагаемые фигуры. Что касается ссылок на приведенные здесь на подробных фигурах конкретные примеры, то следует подчеркнуть, что подробности приведены только для примера и для иллюстрации описания предпочтительных вариантов осуществления предлагаемого изобретения и представлены в целях предоставления материала, который является наиболее полезным и легко понимаемым описанием принципов и концептуальных аспектов предлагаемого изобретения. В этом отношении не предпринимается никаких попыток показать структурные особенности вариантов осуществления предлагаемого изобретения более подробно, чем это необходимо для понимания основных принципов изобретения, причем описание совместно с чертежами делает очевидным для специалиста в данной области техники то, как несколько форм изобретения могут быть реализованы на практике.
На фигурах показано:
На фигурах 1А-1В приведены графики, иллюстрирующие пространственное распределение нативной и денатурированной в присутствии мочевины форм белка фикоцианина в полосках, содержащих гели на основе полиакриламида, которые имеют градиент pH. На графике фигуры 1А приведены результаты сканирования нативного (не денатурированного) фикоцианина. На графике фигуры 1В приведены результаты сканирования фикоцианина, денатурированного в присутствии 8 моль/л раствора мочевины. На вертикальной оси приведены значения оптической плотности в единицах оптической плотности, а на горизонтальной оси представлены положения на сканированной гелевой полоске, выраженные в единицах pH.
На фигурах 2А-2В приведены графики, иллюстрирующие пространственное распределение нативной и денатурированной в присутствии мочевины форм белка миоглобина в полосках, содержащих гели на основе полиакриламида, которые имеют градиент pH. На графике фигуры 2А приведены результаты сканирования нативного (не денатурированного) миоглобина. На графике фигуры 2В приведены результаты сканирования миоглобина, денатурированного в присутствии 8 моль/л раствора мочевины.
На вертикальной оси приведены значения оптической плотности в единицах оптической плотности, а на горизонтальной оси представлены положения на сканированной гелевой полоске, выраженные в единицах pH.
На фигурах 3А-3В приведены фотографии, представляющие две различные стадии результатов эксперимента, свидетельствующего о pH-зависимом разделении и перераспределении этих двух разных белков, миоглобина и фикоцианина. На фигуре 3А приведен вид сверху на экспериментальную камеру сразу после помещения смеси миоглобина и фикоцианина в среднее отделение 2. На фигуре 3В приведен вид сверху на ту же экспериментальную камеру, сфотографированный через семь дней после помещения смеси миоглобина и фикоцианина в среднее отделение 2.
На фигурах 4А-4С приведены микрофотографии, иллюстрирующие изменение во времени распределения зеленого флуоресцентного белка (ЗФБ) в клетке после прикрепления клетки к pH-модифицирующей микрогрануле. На фигуре 4А изображена клетка (8), прикрепленная к микрогрануле (6) в начальный момент времени (определенный как время прикрепления клетки к микрогрануле). На фигуре 4В изображена клетка (8), прикрепленная к микрогрануле (6), сфотографированная через десять минут после того, как была сделана самая левая фотография. На фигуре 4С изображена клетка (8), прикрепленная к микрогрануле (6), сфотографированная через тридцать (30) минут после того, как была сделана самая левая фотография. Флуоресцирующая точка, отмеченная жирной белой стрелкой, представляет собой флуоресценцию белка ЗФБ, который мигрирует и накапливается в точке контакта микрогранулы 6 и клетки 8.
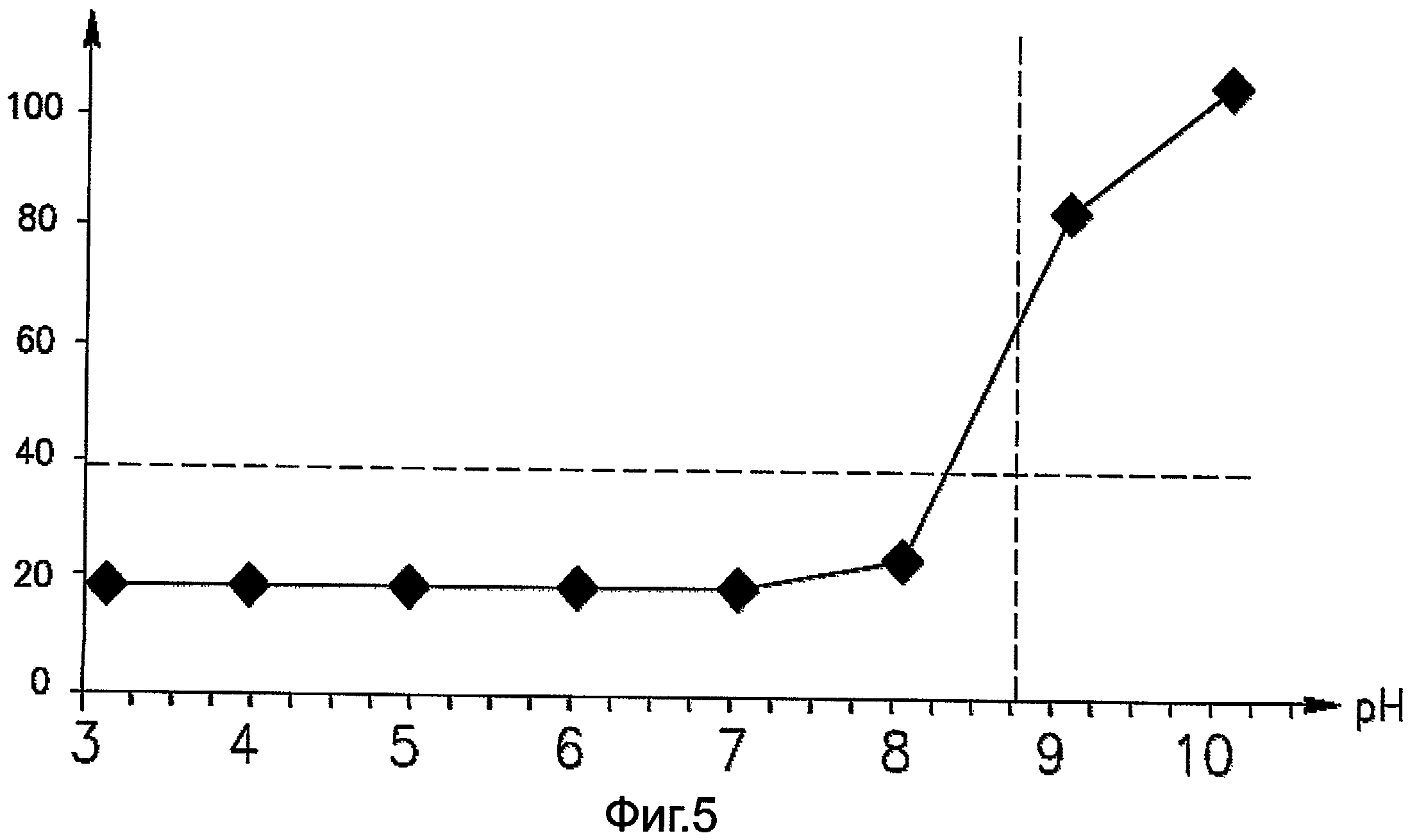
На фигуре 5 изображен график пространственного распределения желтого флуоресцентного белка (ЖФБ) на полосках из геля на основе полиакриламида, содержащих иммобилин™, которые имеют градиент pH. На вертикальной оси представлена оптическая плотность, а на горизонтальной оси представлены положения на полоске (стрипе) из геля на основе полиакриламида, содержащих иммобилин, выраженные в единицах pH.
На фигурах 6А - 6В приведены микрофотографии, свидетельствующие о цитотоксическом действии пленки из нафиона на клетки линии Jurkat. На фигуре 6А изображены клетки линии Jurkat на поверхности, отличной от нафиона. На фигуре 6В изображены клетки линии Jurkat на поверхности нафиона.
На фигуре 7 приведена диаграмма в виде ломаной линии, показывающей (красным) процент мертвых клеток линии Jurkat после воздействия пленок серий MVC/HT/56 А, В, С и D согласно предлагаемому изобретению.
На фигурах 8A - 8D приведены микрофотографии, иллюстрирующие цитотоксическое действие пленок ВIOАСТ 13, 15, 16 и 110 на клетки линии Jurkat, измеренное при помощи набора для определения жизнеспособности бактерий LIVE/DEADR BacLight™ Bacterial Viability Kit (производства компании Molecular probes), в котором мертвые клетки под флуоресцентным микроскопом видны красными, а живые клетки - зелеными. На фигуре 8А изображена контрольная проба клеток линии Jurkat (без воздействия биоактивной пленки) через 1 минуту. На фигуре 8В изображены клетки линии Jurkat через 1 минуту после добавления пленки ВIOАСТ 13. На фигуре 8С изображена контрольная проба клеток линии Jurkat (без воздействия биоактивной пленки) через 10 минут. На фигуре 8D изображены клетки линии Jurkat через 10 минут после добавления пленки ВIOАСТ 13. На фигурах 9А-9С приведены фотографии, свидетельствующие об антинекротическом действии микрогранул ионообменной смолы. На фигуре 9А приведена фотография некротической ткани до введения микрогранул ионообменной смолы. На фигуре 9В приведена фотография той же ткани через два дня после введения микрогранул ионообменной смолы. На фигуре 9С приведена фотография ткани, на которую были нанесены микрогранулы ионообменной смолы.
Осуществление изобретения
Задачей предлагаемого изобретения является создание способов воздействия на клеточные процессы при помощи твердых буферных систем. Конкретно, предлагаемое изобретение может использоваться для самых разных целей, начиная от уничтожения больных клеток организма, таких как раковые клетки, и заканчивая уничтожением вредных прокариотических клеток в окружающей среде.
Принципы действия предлагаемого изобретения можно лучше понять, если рассмотреть прилагаемые фигуры и описания.
Перед подробным объяснением вариантов воплощения предлагаемого изобретения следует принять во внимание, что изобретение не ограничивается, что касается сфер его применения, подробностями, излагаемыми в последующем описании, или приведенными в примерах. Другие варианты осуществления предлагаемого изобретения могут быть реализованы разными способами. Кроме того, следует иметь в виду, что формулировки и термины использованы здесь в описательных целях и не должны считаться ограничивающими.
Предлагаемое изобретение является следствием случайного получения его авторами неожиданных результатов. Они показали, что молекулы биологического происхождения (например, белки), как правило, обладают кислотно-основными свойствами, которые определяют их пространственное распределение вдоль градиента pH (см. Пример 1). Дальнейшие опыты показали, что подобное распределение может также происходить поперек биологической мембраны (см. Пример 3, фигуры 4А-4С).
Вначале авторы предлагаемого изобретения обнаружили, что на процессы внутри клетки можно воздействовать путем изменения внеклеточного pH твердой буферной системой при контакте с ней. Соответственно, авторы предлагаемого изобретения показали, что нарушение гомеостаза pH клеток может быть инициировано путем приведения клеток в контакт c твердой буферной системой, имеющей значение pH, отличное от значения pH внутриклеточных компонентов. Этот контакт приводит к изменению внутриклеточного pH в цитоплазме и обычно приводит к изменению клеточного процесса. Гибель клетки может быть достигнута, когда значение pH буферного материала лежит за пределами значений pH, соответствующих условиям жизнеспособности конкретной клетки.
В патентных заявках США №№20050271780, 20050249695 и 20050003163 описаны бактерицидные полимеры. Действие описанных в них полимеров основано на непосредственном контакте полимера с клеточной мембраной, поскольку его бактерицидная активность связана с наличием молекул с активными катионами, иммобилизованных на поверхности или включенных в полимерную структуру. Степень токсичности сильно зависит от поверхностной концентрации бактерицидных частиц. Это требование накладывает серьезные ограничения, поскольку подвергающийся воздействию катионный материал в ходе реакций ионного обмена может быть насыщен очень быстро. Твердые буферные системы, описанные здесь, не ограничены полимерами с активными катионами, но включают также анионные буферные системы, поскольку новый механизм предлагаемого изобретения заключается не в проникновении катионных групп, приводящем к разрушению клеточной мембраны, а в общем объемном буферном действии. Твердые буферные системы, описанные здесь, не ограничены созданием поверхностной концентрации бактерицидной частицы, поскольку их цитотоксическая активность связана с их объемными свойствами, а не только с поверхностными свойствами.
Хотя описание предлагаемого изобретения ограничено практическими нуждами, авторы предлагаемого изобретения показали, что твердые буферные системы могут оказывать цитотоксическое действие на все типы клеток, такие, например, как дрожжевые клетки (Пример 4, таблица 2), клетки млекопитающих, линии Jurkat (Пример 5, таблица 3), бактериальные клетки (Пример 11, таблица 5) и клетки грибов (Пример 12).
Авторы предлагаемого изобретения дополнительно показали, что смертность клеток можно контролировать при помощи подбора значения pH твердой буферной системы, имеющего контакт с клетками, так, чтобы смертность клеток тонко регулировалась за счет соответствующего изменения значений pH твердой буферной системы, имеющего контакт с клетками (см., например, Пример 4, таблицу 2).
Кроме того, авторы предлагаемого изобретения показали, что pH-индуцированная цитотоксичность требует непосредственного контакта клеток с твердой буферной системой. Таким образом, к твердой буферной системе могут быть прикреплены физические барьеры с определенным размером пор так, чтобы гомеостаз pH нарушался (изменялся) только для клеток определенного размера. Таким образом, могут быть атакованы клетки определенного размера, а остальные клетки останутся неизменными (см. Пример 8).
Более того, авторы предлагаемого изобретения показали, что водопроницаемый слой, расположенный на внешней поверхности буферирующего слоя, все же дает возможность твердой буферной системе оказывать воздействие на клетки, поскольку водопроницаемый слой дает возможность ионам перераспределяться и тем самым не ослабляет общего объемного действия твердой буферной системы. Таким образом, как это иллюстрирует Пример 14, на твердые буферные системы могут быть нанесены полимеры с открытыми порами, и эти системы все же способны при этом оказывать цитотоксическое действие.
Таким образом, согласно одному аспекту предлагаемого изобретения, предлагается способ инициирования изменений в клеточном процессе в клетках-мишенях многоклеточного организма, причем способ включает приведение в контакт клетки-мишени с твердой буферной системой для того, чтобы изменить значение pH внутри клетки, по меньшей мере, в одном участке клетки, тем самым инициируя изменения в клеточном процессе в клетке-мишени многоклеточного организма.
Согласно предлагаемому изобретению клетки могут находиться в любой клеточной среде, например, в виде изолированных клеток, в суспензии клеток, в культуре клеток, в ткани или в организме. Клетки могут быть здоровыми или больными (например, клетки опухоли), или их комбинацией.
Что касается использованного в настоящем документе выражения "изменения в клеточном процессе", то оно относится как к стимуляции, так и к ингибированию клеточного процесса. Типичными клеточными процессами, которые могут быть изменены согласно этому аспекту предлагаемого изобретения, включают, но не ограничиваются, смерть клеток (апоптоз или некроз), клеточную дифференцировку, передачу клеточных сигналов, рост клеток, деление клеток, пролиферацию клеток, рост опухоли, васкуляризацию опухоли, метастазирование опухоли, миграцию и мобильность опухолевых клеток, миграцию клеток, функционирование органелл (включая, но не ограничиваясь этим, образование псевдоподий, жгутиковую подвижность и т.п.) и молекулярный перенос через различные клеточные и внутриклеточные мембраны и компартменты.
Согласно наиболее предпочтительному варианту осуществления этого аспекта предлагаемого изобретения, изменение клеточного процесса приводит к уничтожению клетки. Ниже описана калибровка твердой буферной системы, способной оказать цитотоксическое действие.
Что касается использованного в настоящем документе выражения "многоклеточный организм", то оно относится к любому организму, содержащему больше одной клетки. Типичные многоклеточные организмы включают эукариоты (например, млекопитающих) и высшие растения.
Подразумевается, что твердые буферные системы согласно предлагаемому изобретению могут также использоваться для воздействия на клеточные процессы в прокариотических клетках, например, грибов и грамположительных и грамотрицательных бактерий.


Что касается использованного в настоящем документе выражения "твердая буферная система", то оно относится к любому твердому материалу, который обладает буферной емкостью. Буферная емкость, согласно определению, - способность буферной системы сопротивляться изменению значения ее pH при добавлении к буферу кислот или оснований (титрование) и определяется как концентрация ионов Н+, добавленных на единицу объема, которая может вызвать изменение значения pH буферной системы на 1 единицу pH. Буферная емкость системы обычно определяется сосуществованием в системе диссоциированных и недиссоциированных соединений, способных поддерживать постоянный ресурс ионов Н+. Таким образом, любое кислое или основное вещество (например, ионообменный материал), включенное в обладающую ионной проводимостью или водо/ионопроницаемую матрицу, может быть отнесено к твердым буферным системам. Буферная емкость твердых веществ обычно связана с наличием различных функциональных групп, которые могут высвобождать или связывать ионы Н+, а ее значение определяется степенью насыщения этими веществами, а именно концентрацией ионов Н+, при которой все эти функциональные группы находятся в равновесии.
Типичные катионообменные материалы включают, но не ограничиваются этим, сульфоновую кислоту и ее производные, фосфоновую кислоту и ее производные, карбоновую кислоту и ее производные, фосфиновую кислоту и ее производные, фенолы и их производные, мышьяковую кислоту и ее производные, и селеновую кислоту и ее производные.
Типичные анионообменные материалы включают, но не ограничиваются этим, группу соединений, содержащую третичные, вторичные, первичные и четвертичные амины.
Примеры водопроницаемых матриц включают, но не ограничиваются этим, полимеры с открытыми порами, керамику с открытыми порами и гели.
Типичные полимеры с открытыми порами включают, но не ограничиваются этим, ПВС, целлюлозу и полиуретан.
В качестве альтернативы, твердая буферная система может включать матрицу, обладающую собственной ионной проводимостью. Примеры обладающих собственной ионной проводимостью твердых буферных систем включают, но не ограничиваются этим, иономеры и поликатионные материалы.
Некоторыми видами выпускаемых на рынок иономеров являются нафион™, мембраны из перфторированной сульфоновой кислоты, производимые компанией Дюпон (Уилмингтон, Делавэр, США), и сурлин™, термопластичная смола, также производимая компанией Дюпон.
Как правило, в качестве твердой буферной системы используется полимер. Подразумевается, что существует множество полимеров, которые могут использоваться в качестве твердых буферных систем согласно этому аспекту предлагаемого изобретения.
Ниже приведен ограниченный перечень таких полимеров: поли-4-винил-N-алкилпиридиний бромид, поли-метакрилоил-оксидодецил-пиридиний бромид, N-алкилированный поли-4-винилпиридин, поливинил-N-гексилпиридин, поли-N-алкилвинил-пиридин, поли-N-алкил-этиленимин, поли-4-винил-N-гексилпиридиний бромид, поли-1-хлорметилсуб-4-винилбензол, полидиметил-октил-4-винилфенил-метиламмоний хлорид, полидиметил-додецил-4-винилфенил-метиламмоний хлорид, полидиметилтетрадецил-4-винилфенил-метиламмоний хлорид, 50:50 поли-1-хлорметил-4-винилбензол: полидиметил-додецил-4-винилфенил-метиламмоний хлорид, 50:50 поли-1-хлорметил-4-винилбензол: полидиметил-октил-4-винилфенил-метиламмоний хлорид, 50:50 полидиметилдодецил-4-винилфенил-метиламмоний хлорид: полидиметил-октил-4-винилфенил-метиламмоний хлорид, политрибутил-4-винилфенил-метилфосфоний хлорид и политриоктил-4-винилфенил-метилфосфоний хлорид.
Подразумевается, что твердая буферная система согласно предлагаемому изобретению может также включать гелевую матрицу, такую как полиакриламидную и агарозную гелевую матрицу, которые были соответствующим образом приготовлены с использованием соответствующих буферных систем (например, с акриламидными буферными системами с иммобилином™. Количества буферных систем с иммобилином, с соответствующим значением pK, использованных для получения гелей с определенными значениями pH, приведены ниже в таблице 1 раздела описания примеров. В качестве твердых буферных систем согласно предлагаемому изобретению могут также использоваться микрогранулы ионообменной смолы, покрытые слоем полимера микрогранулы ионообменной смолы или микрогранулы ионообменной смолы, включенные в ионопроницаемую матрицу.
Термин «приведение в контакт», используемый здесь, относится к позиционированию клетки по отношению к твердой буферной системе и ограничению в пространстве, связанному с необходимостью создания возможности для подведения ионов твердой буферной системы к клетке и наоборот.
Таким образом, согласно одному варианту осуществления этого аспекта предлагаемого изобретения, клетка и твердая буферная система находятся в непосредственном физическом контакте друг с другом. Например, твердая буферная система может иметь контакт с внешней частью клетки или сцепиться с внешней частью клетки. Альтернативно, твердая буферная система может интернализоваться в клетку посредством известных процессов интернализации внеклеточных веществ, таких как, но не ограничиваясь этим, фагоцитоз, эндоцитоз, опосредованный рецептором эндоцитоз, процессы интернализации, связанные с клатрин-окаймленными ямками или везикулами, трансферрин-трансфекция и т.п.
Согласно другому варианту осуществления этого аспекта предлагаемого изобретения, твердая буферная система отделена от клетки водопроницаемым слоем. Такой водопроницаемый слой позволяет протекать току ионов из твердой буферной системы внутрь клетки и наоборот и, таким образом, не препятствует твердой буферной системе оказывать буферное действие. Типичными водопроницаемыми слоями являются ПВС, этилцеллюлоза, ацетатцеллюлоза, полиакриламид, любая микропористая матрица без гидрофильных добавок или с ними и т.д. Приведение в контакт может реализоваться in vivo, ex vivo (т.е. в клетках, выделенных из организма) и/или in vitro (например, в линии клеток).
Как упоминалось выше, твердые буферные системы согласно предлагаемому изобретению могут быть воплощены в лекарственной форме для инициирования изменений в определенном клеточном процессе. Как правило, следующими тремя свойствами твердой буферной системы можно управлять так, чтобы дать возможность твердой буферной системе воздействовать на процесс: значением pH, буферной емкостью и ионной проводимостью.
Ниже приведен пример, как можно выбрать твердую буферную систему для воздействия (например, ускорения) на процесс гибели клеток.
1. Значение pH твердой буферной системы должно быть вне диапазона значений pH, соответствующих условиям жизнеспособности клетки. Этот диапазон специфичен для каждого вида клеток и бактерий. Как правило, значение pH твердой буферной системы ниже 4 или выше 8 влияет на кислотно-основную стабильность клетки.
Подразумевается, что твердая буферная система может быть воплощена в лекарственную форму так, чтобы она включала градиент pH. Градиент может быть полезен тем, что он обеспечит постепенное изменение биологического воздействия твердой буферной системы на клетки. Например, использование такого градиента в твердых буферных системах может привести к тому, что часть твердой буферной системы оказывает цитостатическое воздействие на клетки, тогда как остальные части твердой буферной системы оказывают цитотоксическое воздействие.
Подразумевается, что для специалиста в данной области техники очевидно, что изменений в форме, величине, положении и общей структуре таких градиентов можно достичь за счет соответствующих материалов - регуляторов ионного обмена, включенных в матрицу твердой буферной системы, все из которых, как подразумевается, входят в объем предлагаемого изобретения. Градиентные буферные слои могут быть синтезированы с использованием иммобилина™, как описано ниже в разделе описания примеров.
Более того, подразумевается, что твердая буферная система согласно предлагаемому изобретению может также включать комбинацию катионообменных материалов и анионообменных материалов, организованных в виде структуры, способной к эффективному уничтожению клеток. Таким образом, твердая буферная система может, например, представлять собой смесь микрогранул анионообменной и катионообменной смол. Микрогранулы могут быть одного размера или разных размеров, в зависимости от расположения клеток-мишеней.
2. Поскольку общепринятыми значениями буферной емкости цитозоля и большинства остальных клеточных компонентов обычно являются значения больше 20 ммоль Н+/л·ед. pH, то для того, чтобы вызвать изменения среды цитозоля, буферная емкость твердого буферного материала должна быть выше этого значения. Типичная буферная емкость твердой буферной системы, которая может использоваться для уничтожения большинства видов клеток, составляет примерно 100 ммоль H+/л·ед. pH или выше.
3. Изменение ионной проводимости (протонной проводимости) твердой буферной системы влияет на скорость, с которой твердая буферная система способна уничтожать клетки. Как правило, ионная подвижность в водопроницаемой твердой буферной системе определяется диффузионным переносом протонов в воде и составляет величину примерно порядка 10-8м2/с для константы диффузии, что соответствует дрейфовой скорости 0,1 мм/с. Такие твердые буферные системы вызывают гибель клеток в течение нескольких секунд после контакта с клеткой.
Таким образом, типичный способ уничтожения клетки состоит в приведении в контакт клетки с твердой буферной системой, причем твердая буферная система имеет значение буферной емкости около 50 ммоль Н+/л·ед. pH, а значение pH, способное воздействовать на среду клетки, тем самым, приводя к их гибели, обычно либо выше 8, либо ниже 4,5. Методы измерения pH и определения буферной емкости хорошо известны специалистам в данной области техники.
Подразумевается, что буферная емкость плазмы клеток и ее значение pH зависит от вида клеток, и, таким образом, управление этими параметрами может дать возможность целенаправленно воздействовать на конкретный вид клеток. Например, общеизвестно, что опухолевые клетки имеют более щелочную среду, чем обычные клетки, и, таким образом, чтобы оказать оптимальное цитотоксическое действие на опухолевые клетки, твердая буферная система должна оказывать меньшее воздействие (или не оказать никакого воздействия) на клетки других видов. Кроме того, каждый вид клеток имеет конкретную величину проницаемости мембран, и, таким образом, может по своей природе быть более (или менее) восприимчивым к действию твердых буферных систем согласно предлагаемому изобретению.
Еще один пример: известно, что буферная емкость бактерий выше, чем у клеток млекопитающих, но чувствительность бактерий к изменению среды за счет воздействия буферных систем выше, поскольку масса буферной среды у бактерий примерно на три порядка ниже, чем в клетках млекопитающих. Это делает возможным использование твердых буферных систем с низкой буферной емкостью для уничтожения бактерий, не уничтожая при этом клетки организма млекопитающих.
Одним из методов изменения значения pH и буферной емкости твердых буферных систем является изменение концентрации ионообменного материала в водорастворимой (ионопроницаемой) матрице. В качестве альтернативы, концентрацию ионообменного материала можно оставить неизменной, а заменить сам ионообменный материал. Твердую буферную систему, оптимальную для уничтожения конкретного вида клеток, можно подобрать, испытывая действие множества твердых буферных систем, имеющих различные значения pH и буферной емкости, на смесь клеток, содержащую клетки интересующего вида. Интересующий вид клеток можно исследовать для определения оптимального состава твердой буферной системы. Методы исследований интересующего вида клеток включают микроскопию, иммуногистохимию и другие методы биологического анализа, известные специалистам в данной области техники.
Поскольку предлагаемое изобретение предполагает использование твердых буферных систем для лечебного воздействия на медицинское состояние (например, связанное с клетками патологической популяции), твердую буферную систему обычно вводят в организм либо in vivo, либо ex vivo, и, следовательно, очень важно, чтобы твердые буферные системы оказывали селективное целенаправленное воздействие на определенные виды клеток.
Таким образом, согласно варианту осуществления этого аспекта предлагаемого изобретения, твердая буферная система может быть прикреплена к связывающему звену, такому как антитело, лиганд рецептора или молекула углевода. Примеры антител, которые могут быть использованы согласно этому аспекту предлагаемого изобретения, включают, но не ограничиваются этим, антитела к клеткам опухоли, антитела к СD20-антигену и антитела к IL-2R-альфа. Типичные рецепторы включают, но не ограничиваются этим, фолатные рецепторы и рецепторы эпидермального фактора роста. Типичным углеводом, который может использоваться, согласно этому аспекту предлагаемого изобретения, является лектин.
Связывающее звено может быть ковалентно или нековалентно связано или адсорбировано на твердой буферной системе при помощи химического или физического связывания и/или химического линкера, известного специалистам в данной области техники. Точный тип и химическая природа таких кросс-линкеров и методов перекрестной сшивки предпочтительно адаптированы к типу используемой связывающей группы и природы твердой буферной системы. Методы связывания или адсорбирования или химического связывания таких связывающих звеньев и групп известны специалистам в данной области техники.
Согласно одному предпочтительному варианту воплощения предлагаемого изобретения, клетками-мишенями могут быть метастазирующие раковые клетки, вырабатывающие идентифицируемые поверхностные маркеры. Если значение pH и величина буферной емкости твердой буферной системы выбраны так, чтобы уничтожать такие клетки при контакте с ними, связывающими звеньями может быть одно или более антител против специфичных маркеров, вырабатываемых такими злокачественными клетками.
Другой метод нацеливания на определенные виды клеток (например, нацеливания на прокариотические клетки, но не на эукариотические клетки), предлагаемый авторами изобретения, основан на избирательном предотвращении физического контакта между твердой буферной системой и конкретными видами клеток. Таким образом, согласно другому варианту осуществления этого аспекта предлагаемого изобретения, твердая буферная система, по меньшей мере, частично покрыта селективным барьером. Например, если поверхность твердой буферной системы покрыта или защищена механическим барьером, имеющим контролируемый размер пор (таким как, но не ограничиваясь этим, фильтр, например, нейлоновый фильтр, имеющий определенный размер пор, или сетка, имеющая определенный размер отверстий, или подобное устройство), то становится возможным исключить клетки, превышающие определенный размер, из процесса прикрепления или вступления в контакт с твердой буферной системой, при этом все же давая возможность клеткам, имеющим меньший размер, входить в поры или проходить сквозь механический барьер и вступать в контакт с твердой буферной системой.
Нацеливание твердых буферных систем согласно предлагаемому изобретению может быть достигнуто путем использования «пассивного» нацеливания. В нем используется повышенная проницаемость и удерживание частиц в тканях опухоли в связи с нарушениями непроницаемости сосудистой сети и недостаточностью лимфатического дренажа. Специалистам в данной области техники известно, что селективность тканей опухолей к частицам размера от 200 до 600 нанометров на один-два порядка выше, чем здоровых тканей. В этом конкретном виде пассивного нацеливания могут использоваться частицы, которые не функционализируются распознающими элементами или звеньями. Твердая буферная система согласно предлагаемому изобретению может быть введена в организм в чистом виде или в составе фармацевтической композиции, где она смешана с соответствующими носителями или наполнителями.
Что касается использованного в настоящем документе выражения "фармацевтическая композиция", то оно относится к препарату, состоящему из смеси одного или более действующих веществ, описанных здесь, с другими химическими ингредиентами, такими как физиологически приемлемые носители и наполнители. Назначением фармацевтической композиции является ускорение введения соединения в организм.
Что касается использованного в настоящем документе выражения "действующее вещество", то оно относится к твердой буферной системе, предназначенной для оказания предполагаемого биологического воздействия.
Ниже словосочетания «физиологически приемлемый носитель» и «фармацевтически приемлемый носитель», которые могут использоваться попеременно, относятся к носителю или разбавителю, который не вызывает заметной ответной реакции организма и не подавляет биологическую активность и свойства вводимого соединения. Адъювант также описывается этим словосочетанием.
Термин «наполнитель» в настоящем документе относится к инертному веществу, добавляемому к фармацевтической композиции с целью дополнительно способствовать введению действующего вещества. Примеры наполнителей включают, но не ограничиваются этим, карбонат кальция, фосфат кальция, различные сахара и виды крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли. Методики приготовления лекарственных форм и их введения можно найти в последнем издании справочника «Фармацевтические науки» Ремингтона (Remington′s Pharmaceutical Sciences), изд-во Mack Publishing Co., Истон, штат Пенсильвания, США, описания которых данной ссылкой полностью включаются в текст настоящего документа.
Твердая буферная система согласно предлагаемому изобретению может входить в состав фармацевтической композиции в виде частиц или микрогранул и может выпускаться со средним размером в диапазоне от нескольких нанометров до нескольких миллиметров и более.
Твердая буферная система может быть прикреплена к поверхности частиц или включена внутрь капсульных частиц. Подразумевается, что если твердая буферная система включена внутрь частиц, инкапсулирующая частица должна быть изготовлена из обладающего ионной проводимостью материала для того, чтобы обеспечить обмен ионами между твердой буферной системой и клеткой. Типичные частицы включают, но не ограничиваются этим, полимерные частицы, микрокапсулы, липосомы, микросферы, микроэмульсии, наночастицы, нанокапсулы и наносферы.
Твердые буферные системы согласно предлагаемому изобретению могут быть также покрыты поддающимися биологическому разложению покрытиями с целью повышения селективности и предотвращения проявления активности в процессе кровообращения.
Типичные поддающиеся биологическому разложению покрытия включают полиэтилениминовые (ПЭИ) покрытия, полиэтиленгликольные (ПЭГ) покрытия, модифицированные желатиновые покрытия или покрытия из любого другого соответствующего материала.
Подходящим способом введения в организм может быть, например, пероральный, ректальный, через слизистые оболочки, особенно через слизистую носа, интестинальный или парентеральный, включая внутримышечные, подкожные или интрамедуллярные инъекции, равно как интратекальные, прямые внутрижелудочковые, внутривенные, интраперитонеальные, интраназальные и внутриглазные инъекции.
В качестве альтернативы, можно ввести фармацевтическую композицию местно, а не системно, например, в виде инъекции фармацевтической композиции непосредственно в определенные ткани пациента.
Фармацевтические композиции согласно предлагаемому изобретению могут быть изготовлены по технологии, хорошо известной специалистам в данной области техники, например, при помощи традиционных процессов смешивания, растворения, гранулирования, изготовления драже, растирания в порошок, эмульгирования, инкапсулирования, включения в гель или лиофилизации.
Фармацевтические композиции для использования согласно предлагаемому изобретению могут быть, таким образом, приготовлены традиционным способом, с использованием одного или более физиологически приемлемых носителей, включающих наполнители и вспомогательные средства, которые способствуют переработке действующих веществ в препараты, которые можно использовать в фармацевтике. Приготовление надлежащей лекарственной формы зависит от выбранного способа введения.
Для инъекций действующие вещества фармацевтических композиций могут быть приготовлены в виде водных растворов, предпочтительно в физиологически совместимых буферных системах, таких как раствор Хенкса, раствор Рингера или физиологический раствор. При введении через слизистые оболочки, в лекарственную форму вводят смачивающий реагент, соответствующий характеру барьера, через который она должна проникнуть. Такие смачивающие реагенты обычно известны специалистам в данной области техники.
Для местного введения твердые буферные системы согласно предлагаемому изобретению могут быть приготовлены в виде геля, крема, лосьона, полоскания или аэрозоля. Они могут быть нанесены, если твердая буферная система наносится местно на тело субъекта или на любую твердую поверхность.
Фармацевтическую композицию для перорального применения можно легко приготовить посредством смешивания действующих веществ с фармацевтически приемлемыми носителями, хорошо известными специалистам в данной области техники. Такие носители позволяют получить фармацевтические композиции в виде таких лекарственных форм, как таблетки, пилюли, драже, капсулы, растворы, гели, сиропы, суспензии и т.п. для их приема пациентом внутрь. Фармацевтические препараты для приема внутрь можно приготовить с использованием твердого наполнителя, при необходимости, путем измельчения полученной смеси и переработки смеси гранул, после введения в нее по желанию соответствующих вспомогательных средств для получения таблеток и сердцевины драже. Подходящими наполнителями являются, в частности, сахара, включая лактозу, сахарозу, маннит или сорбит, препараты целлюлозы, такие, например, как кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксиметилцеллюлоза и натрий-карбоксиметилцеллюлоза и/или физиологически приемлемые полимеры, такие как поливинилпирролидон (ПВП). По желанию, могут быть добавлены расщепители, такие как поперечносшитый поливинилпирролидон, агар или альгиновая кислота и ее соли, такие как альгинат натрия.
На сердцевины драже нанесены соответствующие покрытия. Для этой цели могут использоваться концентрированные растворы сахара, которые могут при необходимости содержать гуммиарабик, тальк, поливинилпирролидон, карбополовый гель, полиэтиленгликоль, двуокись титана, растворы лака и соответствующие органические растворители или их смеси. Для идентификации или для придания отличительных признаков различных комбинаций доз действующих веществ в покрытия таблеток и драже могут быть введены красители или пигменты.
Фармацевтические композиции для перорального применения включают удобные для проглатывания капсулы из желатина, а также мягкие закупоренные капсулы из желатина и пластификатора, такого как глицерин или сорбит. Удобные для проглатывания капсулы могут содержать действующие вещества в смеси с наполнителем, таким как лактоза, связующие вещества, такие как различные виды крахмала, смазывающие вещества, такие как тальк или стеарат магния, и, при необходимости, стабилизаторы. В мягких капсулах действующие вещества могут содержаться в растворенном или суспендированном виде в соответствующих жидкостях, таких как жирные масла, медицинское парафиновое масло или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Все лекарственные формы для перорального применения должны быть приготовлены в дозировке, пригодной для выбранного способа введения.
Для трансбуккального способа введения композиции могут быть изготовлены в форме таблеток или лепешек, приготовленных традиционным способом.
В случае введения назальной ингаляцией действующие вещества для использования согласно предлагаемому изобретению могут быть легко введены в форме аэрозоля из упаковки под давлением или распылителя с использованием соответствующего вытеснителя, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана или диоксида углерода, а в случае аэрозоля под давлением дозировку можно определить при помощи клапана для введения отмеренной дозы. Капсулы и картриджи, например, из желатина для использования в дозаторе, могут быть приготовлены в виде порошковой смеси композиции по изобретению и соответствующей порошковой основы, такой как лактоза или крахмал.
Описанная здесь фармацевтическая композиция может быть приготовлена для парентерального введения, например, для болюсного вливания или длительной инфузии. Составы для инъекции могут быть реализованы в виде лекарственных форм, например, ампул или многодозовых контейнеров с добавленным, при необходимости, консервантом.
Композиции могут быть в виде суспензий, растворов или эмульсий в масляной или водной среде и могут содержать формирователи, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты.
Фармацевтические композиции для парентерального введения включают водные растворы действующего вещества в водорастворимой форме. Кроме того, могут быть приготовлены суспензии действующих веществ в виде соответствующих суспензий для инъекций на масляной или водной основе. Соответствующие липофильные растворители или среды включают жирные масла, такие как кунжутное масло, или эфиры синтетических жирных кислот, такие как этилолеат, триглицериды или липосомы. Водные суспензии для инъекций могут содержать вещества, которые повышают вязкость суспензии, такие как натрий-карбоксиметилцеллюлоза, сорбит или декстран. При необходимости суспензия может также содержать соответствующие стабилизаторы или вещества, которые повышают растворимость действующих веществ, чтобы обеспечить возможность приготовления высококонцентрированных растворов.
Фармацевтическая композиция согласно предлагаемому изобретению может также быть приготовлена в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, с использованием, например, традиционных суппозиторных основ, таких как масло какао или прочие глицериды.
Фармацевтические композиции, подходящие для использования в контексте предлагаемого изобретения, включают композиции, в которых действующие вещества содержатся в количестве, достаточном для достижения поставленной цели. Конкретно, «терапевтически эффективное количество» означает количество действующих веществ (например, компонентов нуклеиновых кислот), которое эффективно предупреждает, облегчает или улучшает симптомы заболевания (например, ишемии) или продлевает выживание субъекта, подвергающегося лечению.
Определение терапевтически эффективного количества вполне по силам специалисту в данной области, особенно с учетом приведенного здесь подробного описания. Для любого препарата, использованного в способах согласно предлагаемому изобретению, дозу или терапевтически эффективное количество можно оценить первоначально из опытов in vitro и исследования клеток в культуре. Например, доза может быть подобрана в исследованиях на животных моделях с целью достижения желаемой концентрации или титра. Эта информация может использоваться при более точном определении эффективных доз в исследованиях на человеке.
Токсичность и терапевтическая эффективность описанных здесь действующих веществ можно определить при помощи стандартных фармацевтических методов исследования in vitro, в культурах клеток или на экспериментальных животных. Данные, полученные в этих исследованиях in vitro, в культурах клеток или на экспериментальных животных, могут использоваться при приготовлении ассортимента лекарственных форм для человека. Дозировка может изменяться в зависимости от использованной лекарственной формы и от применяемого способа введения. Точный состав готовой лекарственной формы, способ введения и дозировку может подобрать личный лечащий врач, исходя из состояния пациента (см., например, Fingl, Е и др. (1975), «Фармакологические основы терапии» ("The Pharmacological Basis of Therapeutics"), гл.1, c.1).
Дозировку и частоту введения можно откорректировать индивидуально, чтобы обеспечить наличие концентраций действующего вещества в плазме или веществе головного мозга, достаточных для того, чтобы вызвать или подавить соответствующий биологический эффект (т.е. минимальную эффективную концентрацию, МЭК). МЭК различна для разных препаратов, но ее можно оценить на основании данных исследования in vitro. Дозировки, обеспечивающие достижение МЭК, зависят от индивидуальных особенностей пациента и от способа введения. Для определения концентрации в плазме могут использоваться различные методы обнаружения.
В зависимости от тяжести и восприимчивости медицинского состояния к проводимому лечению, вводимые дозы могут быть однократными и многократными с длительностью курса лечения от нескольких суток до нескольких недель или до достижения лечебного эффекта, или до ослабления симптомов заболевания.
Конечно, масса вводимой фармацевтической композиции зависит от индивидуальных особенностей подвергающегося лечению субъекта, тяжести заболевания, способа введения, мнения врача, прописавшего ее введение, и т.д.
Композиции согласно предлагаемому изобретению могут, по желанию, поставляться в упаковке или в дозирующем устройстве, в виде разрешенного к применению Управлением FDA набора, который содержит одну или более единиц лекарственной формы, содержащих действующее вещество. Упаковка может, например, включать металлическую фольгу или пластиковую пленку, такую как блистерная упаковка. Упаковка или дозирующее устройство могут сопровождаться инструкцией по применению. Упаковка и дозирующее устройство могут сопровождаться уведомлением в форме, предусмотренной правительственным агентством, регулирующим производство, применение и продажу фармацевтических продуктов. В уведомлении приводится разрешение агентства на использование лекарственных форм композиций для введения человеку и животным. Такое уведомление может, к примеру, включать этикетку, разрешенную Управлением по контролю за пищевыми продуктами и лекарственными средствами США для лекарств, отпускаемых по рецепту, или листок-вкладыш к разрешенному для применения продукту. Композиции, включающие препарат согласно предлагаемому изобретению, приготовленные в фармацевтически приемлемом носителе, также могут быть приготовлены, помещены в соответствующий контейнер и сопровождены этикеткой с описанием способа применения для лечения указанных медицинских состояний, как было подробно описано выше.
Подразумевается, что предлагаемое изобретение предполагает также покрытие твердой поверхности или материала твердой буферной системой согласно предлагаемому изобретению. Термин «поверхность», используемый здесь, относится к любой поверхности любого материала, включая стекло, пластмассы, металлы, полимеры и т.п. Он может включать поверхности, состоящие более чем из одного материала, в том числе и поверхности с покрытием.
Твердая буферная система может быть прикреплена к поверхности при помощи любого известного специалистам в данной области техники способа, включая распыление, смачивание, погружение, окунание, окрашивание, ультразвуковую сварку, сварку, связывание или сцепление, или иными способами обеспечение поверхности твердой буферной системой согласно предлагаемому изобретению. Твердые буферные системы согласно предлагаемому изобретению могут быть прикреплены в виде моно- или полислоев.
Типичной твердой поверхностью, которая может быть покрыта твердыми буферными системами согласно предлагаемому изобретению, является интракорпоральное или экстракорпоральное медицинское устройство или имплантат.
Термин «имплант», используемый здесь, относится к любому объекту, предназначенному для помещения в организм человека, который не является живой тканью. Имплант может быть временным и постоянным. Импланты включают объекты биологического происхождения, которые были переработаны таким образом, что их живые ткани стали безжизненными. Как пример, костный трансплантат может быть обработан так, что его живые клетки удалены (бесклеточный биоматрикс), но так, что его форма сохранена для того, чтобы служить в качестве шаблона для врастания внутрь костной ткани организма-хозяина. Другой пример: встречающийся в природе коралл можно переработать с целью получения препаратов гидроксиапатита, которые могут быть внесены в организм для определенных ортопедических и стоматологических терапевтических процедур. Имплантом может быть изделие, содержащее искусственные ингредиенты.
Таким образом, например, предлагаемое изобретение предполагает покрытие сосудистых стентов твердыми буферными системами согласно предлагаемому изобретению. Твердые буферные системы могут отталкивать или притягивать конкретный вид белков клеток, которые могут оказать воздействие на клеточный цикл клеток эндотелия, находящихся в контакте с поверхностью, с целью снижения рестеноза, или имплантов, покрытых способом согласно предлагаемому изобретению с целью достижения положительного результата в виде сращения импланта с тканью.
Другой возможной областью применения твердых буферных систем согласно предлагаемому изобретению является покрытие поверхностей, находящихся в средах организма и ротовой полости.
Поверхности, находящиеся в средах организма, включают внутренние и наружные части различных инструментов и устройств как одноразового использования, так и для повторного использования. Примеры включают целый спектр изделий, приспособленных для медицинского применения, включая скальпели, иглы, ножницы и прочие устройства, использующиеся в инвазивных хирургических, терапевтических или диагностических процедурах; фильтры крови, имплантируемые медицинские устройства, включая искусственные кровеносные сосуды, катетеры и прочие устройства для отбора или введения жидкостей пациенту, искусственные сердца, искусственные почки, ортопедические штифты, пластинки и импланты; катетеры и прочие трубки (включая урологические и трубки для желчи, эндотрахеальные трубки, центральные венозные катетеры, вводимые периферийно, диализные катетеры, туннельные центральные венозные катетеры длительного использования, периферийные венозные катетеры, центральные венозные катетеры кратковременного применения, артериальные катетеры, катетеры для легочной артерии, катетеры Сван-Ганца, уретральные катетеры, перитонеальные катетеры), уретральные устройства (включая уретральные устройства длительного использования, уретральные устройства для соединения тканей, искусственные сфинктеры мочевого пузыря, расширители мочевого пузыря), шунты (включая вентрикулярные и артериовенозные шунты), протезы (включая грудные имплантаты, протезы пениса, протезы сосудов, устройства для пластики аневризмы, сердечные клапаны, искусственные суставы, искусственные гортани, кохлеарные имплантаты), анастомотические устройства, порты внутрисосудистых катетеров, зажимы, устройства для профилактики эмболических осложнений, трубки для дренирования ран, шунты для лечения гидроцефалии, ритмоводители и имплантируемые дефибрилляторы и т.п. Другие примеры совершенно очевидны для специалистов в данной области техники.
Поверхности, которые можно обнаружить в средах организма, включают также внутренние и наружные части медицинского оборудования, медицинскую одежду и принадлежности, носимые персоналом в медицинских учреждениях. Такие поверхности могут включать поверхности столов и инвентаря в помещениях для проведения медицинских процедур или подготовки медицинской аппаратуры, трубок и баллонов, использующихся для лечебных процедур для дыхательной системы, включая введение кислорода, растворимых лекарственных препаратов в распылителях и анестетиков. Сюда также входят поверхности, предназначенные для создания биологического барьера для возбудителей инфекции в медицинских учреждениях, такие как перчатки, фартуки и защитные лицевые маски. Традиционно использующиеся материалы для создания биологического барьера могут быть изготовлены как на основе латекса, так и не на его основе. Винил обычно используется в качестве материала для хирургических перчаток не на латексной основе. Другие поверхности такого рода могут включать ручки и кабели для медицинского и стоматологического оборудования, к которому не предъявляется требование стерильности. Кроме того, такие поверхности могут включать такие нестерильные наружные поверхности трубок и прочих аппаратов, имеющихся в помещениях, в которых обычно проводятся работы с кровью или биологическими жидкостями, или с другими опасными материалами биологического происхождения.
Другие поверхности, имеющие отношение к сохранению здоровья, включают внутренние и наружные части тех изделий, которые используются при очистке воды, хранении воды и водоснабжении, и тех изделий, которые используются при приготовлении пищи. Таким образом, предлагаемое изобретение предполагает его использование для покрытия твердых поверхностей контейнеров с пищевыми продуктами и напитками с целью увеличения срока годности их содержимого.
Поверхности, имеющие отношение к сохранению здоровья, включают также внутренние и наружные части тех предметов домашнего обихода, которые используются в приготовлении пищи, санитарной обработке и профилактике заболеваемости. Примеры могут включать оборудование для приготовления пищи для домашнего использования, материалы для ухода за младенцами, тампоны и унитазы.
Как показывает Пример 15, твердые буферные системы согласно предлагаемому изобретению могут использоваться для повышения антибактериальной активности раневых повязок. Аналогично, твердые буферные системы согласно предлагаемому изобретению могут использоваться для повышения антибактериальной активности наложенных швов, одежды, ткани и мази для лечения ран.
В соответствии с другим вариантом воплощения данного изобретения, твердая поверхность может быть предметным стеклом, шкафом для культивирования клеток и тканей, чашкой Петри или любым другим сосудом для культур клеток тканей или контейнером, известным специалистам в данной области техники.
Что касается использованного в настоящем документе термина "около", то он относится к диапазону значений в пределах плюс или минус 10%.
Дополнительные задачи, преимущества и отличительные признаки предлагаемого изобретения становятся очевидными специалисту в данной области при рассмотрении следующих примеров, которые не должны считаться ограничивающими. Кроме того, каждый из различных вариантов осуществления и аспектов предлагаемого изобретения, схематически описанных выше и заявленных в приведенном ниже разделе «Формула изобретения», находит экспериментальное подтверждение в следующих примерах.
ПРИМЕРЫ
Следующие примеры вместе с приведенным выше описанием иллюстрируют предлагаемое изобретение неограничивающим образом.
В целом, использованная здесь терминология и лабораторные методики, описанные в предлагаемом изобретении, имеют отношение к молекулярно-биологическим, биохимическим, микробиологическим и генно-инженерным методам. Эти методики исчерпывающе описаны в литературе. См., например, "Molecular Cloning: A laboratory Manual (Молекулярное клонирование. Лабораторное руководство)" Sambrook и др., (1989); "Current Protocols in Molecular Biology (Современные протоколы молекулярной биологии)" Volumes I-III Ausubel, R. M., под ред. (1994); Ausubel и др., "Current Protocols in Molecular Biology (Современные протоколы молекулярной биологии)", John Wiley and Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning (Практическое руководство по молекулярному клонированию)", John Wiley & Sons, New York (1988); Watson и др., "Recombinant DNA (рекомбинантная ДНК)", Scientific American Books, New York; Birren и др. "Genome Analysis (Анализ генома): Серия «Лабораторные руководства»), Vols. 1 - 4, Cold Spring Harbor Laboratory Press, New York (1998); методики, изложенные в патентах США №№4666828; 4683202; 4801531; 5192659 и 5272057; "Cell Biology: А Laboratory Handbook (Биология клетки. Лабораторное руководство)", Volumes I-III Cellis, J. Е., под ред. (1994); "Culture of Animal Cells - A Manual of Basic Technique (Культура клеток животных. Руководство к основным методикам)" Freshney, Wiley-Liss, N.Y. (1994), Third Edition; "Current Protocols in Immunology (Современные протоколы в иммунологии)" Volumes I-III Coligan J.E., (1994); Stites и др., "Basic and Clinical Immunology (Общая и клиническая иммунология)" (8th Edition), Appleton & Lange, Norwalk, CT (1994); Mishell and Shiigi, "Selected Methods in Cellular Immunology (Избранные методы клеточной иммунологии)", W.Н.Freeman and Co., New York (1980); использующиеся методы иммуноанализа широко описаны в патентной и научной литературе, например, в патентах США 3791932; 3839153; 3850752; 3850578; 3853987; 3867517; 3879262; 3901654; 3935074; 3984533; 3996345; 4034074; 4098876; 4879219; 5011771 и 5281521; "Oligonucleotide Synthesis (Синтез олигонуклеотидов)" Gait, М.J., (1984); "Nucleic Acid Hybridization (Гибридизация нуклеиновых кислот)" Hames, В.D., and Higgins S.J., (1985); "Transcription and Translation (Транскрипция и трансляция)" Hames, В.D., Higgins S.J., (1984); "Animal Cell Culture (Культура клеток животных)" Freshney, R.L, (1986); "Immobilized Cells and Enzymes (Иммобилизованные клетки и ферменты)" IRL Press, (1986); "A Practical Guide to Molecular Cloning (Практическое руководство по молекулярному клонированию)" Perbal, В., (1984) и "Methods in Enzymology (Методы энзимологии)" Vol.1-317, Academic Press; "PCR Protocols: A Guide To Methods And Applications (Протоколы полимеразной цепной реакции. Руководство к методам и приложения)", Academic Press, San Diego, CA (1990); Marshak и др., "Strategies for Protein Purification and Characterization - A Laboratory Course Manual (Стратегия очистки белков и определения аминокислотной последовательности их молекул - руководство к курсу лабораторных работ)" CSHL Press (1996); описания которых данной ссылкой полностью включаются в текст настоящего документа. Другие ссылки общего характера приведены в тексте настоящего документа. Считается, что описанные здесь методики хорошо известны специалистам в данной области техники и приведены здесь для справки. Вся информация, упомянутая здесь, включена в настоящий документ посредством ссылки.
ПРИМЕР 1
Распределение белков в градиенте pH
С целью выяснения вопроса, обладают ли белки специфическими кислотно-основными характеристиками, был проведен следующий опыт.
МАТЕРИАЛЫ И МЕТОДЫ
Приготовление геля: Были использованы четыре гелевые полоски с иммобилином длиной приблизительно семь сантиметров. Каждая полоска была вырезана из амфолин-содержащего полиакриламидного геля, имеющего градиент pH от 4 до 9, приготовленного известным специалистам в данной области техники способом (гель содержал 4% полиакриламида и 5% бисакриламида в качестве сшивающего агента). Приготовление растворов белков: Были приготовлены растворы четырех различных белков. Первый раствор содержал 1,0 мг/мл миоглобина (серийно выпускаемый компанией Sigma, США - каталожный номер М - 0630) в ДДВ (дважды деионизированной воде). Второй раствор содержал 1,0 мг/мл миоглобина в ДДВ и имел конечную концентрацию мочевины, равную 8 моль/л, для денатурации белков. Третий раствор содержал 1,0 мг/мл фикоцианина (серийно выпускаемого компанией Sigma, США - каталожный номер Р - 2172) в ДДВ. Четвертый раствор содержал 1,0 мг/мл фикоцианина в ДДВ и имел конечную концентрацию мочевины, равную 8 моль/л, для денатурации белков. Все растворы белков имели значение pH около 7,0.
Методика эксперимента: Десять миллилитров каждого из описанных выше растворов белков помещали в чашку Петри, и в каждый из них погружали гелевую полоску. Чашки Петри закрывали, и гели инкубировали в течение 3-5 дней при комнатной температуре. В конце периода инкубации гелевые полоски вынимали из чашек Петри, тщательно удаляли промоканием избыток жидкости и сканировали офисным планшетным сканером марки Epson.
РЕЗУЛЬТАТЫ
Как свидетельствуют фигуры 1А-1В и 2А-2В, белки по-разному адсорбируются на различных участках гелевых полосок, в соответствии со значением pH на различных участках полоски. У миоглобина значение pl~6, а у фикоцианина pl~4.2. Тогда как сдвиг пространственного (и pH-зависимого) распределения для миоглобина между нативным и денатурированным белком довольно мал (фигуры 2А-2В), для имеющего гораздо большую молекулу фикоцианина (фигуры 1А-1В) наблюдается очень большой сдвиг (различие пространственного распределения оптической плотности как функции от значения pH вдоль гелевой полоски).
ЗАКЛЮЧЕНИЕ
Распределение белка в среде, имеющей градиент pH, является свойством, специфичным для каждого исследованного белка, и может быть представлено в качестве кислотно-основной характеристики белка.
ПРИМЕР 2
Перераспределение белков на гелевой мембране согласно их кислотно-основным характеристикам
МАТЕРИАЛЫ И МЕТОДЫ
Приготовление геля: Прямоугольную камеру разделили на три отделения, разместив в ней две гелевые мембраны, имеющие форму пластинок на основе полиакриламидного геля, толщиной 2 мм, как показано на фигурах 3А-3В. Гели готовили путем добавления 10 мкл иммобилина™ (производства компании Amersham), 0,5 мкл персульфата аммония (ПСА), 0,25 мкл ТЕМЕД (тетраметилэтилендиамина) (1:10), 10% полиакриламида и 5% бисакриламида. Одну гелевую мембрану приготовили для рН 4 (кислая, полиакриламидная, с иммобилином), а другую гелевую мембрану приготовили для pH 6 (основная, полиакриламидная, с иммобилином).
Приготовление растворов белков: Миоглобин и фикоцианин растворяли в дважды деионизированной воде (ДДВ), каждый до концентрации 0,1 г/л.
Методика эксперимента: 300 мкл каждого раствора белка помещали в центральное отделение, ограниченное двумя мембранами. Отделение с кислотной стороны заполняли буферным раствором 1 ммоль/л глутаминовой кислоты (рН 3,8), а отделение с основной стороны заполняли 1 ммоль/л раствором ТРИС (рН 8,3). Камеру оставляли в неподвижном состоянии при комнатной температуре. Через несколько дней камеру осматривали визуально, а также фотографировали (вид сверху) при помощи цифровой камеры.
РЕЗУЛЬТАТЫ
В начале эксперимента раствор в среднем отделении 2 описанной выше камеры, состоящей из нескольких отделений, имеет темный цвет, возникающий в результате совместного поглощения света миоглобином и фикоцианином, содержащимися в среднем отделении 2, тогда как никакой окраски не наблюдалось в отделениях, отмеченных цифрами 1 и 3, которые содержали кислый (1 ммоль/л глутаминовой кислоты, рН 3,8) буферный раствор и основный буферный раствор (1 ммоль/л раствор ТРИС, рН 8,3), соответственно, как показано на фигуре 3А.
Как показано на фигуре 3В, к моменту окончания эксперимента раствор в среднем отделении 2 описанной выше камеры, состоящей из нескольких отделений, имеет намного более слабый ярко-красный цвет, появляющийся в результате совместного поглощения оставшихся в ней фикоцианина и миоглобина в гораздо более низких концентрациях. Появление сильного красноватого цвета наблюдалось в отделении, отмеченном цифрой 1, в котором содержался кислый (1 ммоль/л глутаминовой кислоты, рН 3,8) буферный раствор, в который мигрировала значительная часть миоглобина. Появление сильного синеватого цвета наблюдалось в отделении, отмеченном цифрой 3, в котором содержался основный буферный раствор (1 ммоль/л раствор ТРИС, рН 8,3), в который мигрировала значительная часть фикоцианина. ЗАКЛЮЧЕНИЕ
Происходит почти полное перераспределение и разделение двух окрашенных белков, связанное с различными значениями pH в отделениях, разделенных мембранами с иммобилином™.
ПРИМЕР 3
С целью продемонстрировать осуществимость оказания влияния на внутриклеточное распределение цитоплазматического белка в живой функционирующей клетке был проведен следующий эксперимент.
МАТЕРИАЛЫ И МЕТОДЫ
Была проведена трансфекция клеток линии HeLa, чтобы они экспрессировали белок ЗФБ в своем цитозоле. После лизиса выделившиеся белки исследовались для определения диапазона значений pH с максимальным накоплением зеленого флуоресцентного белка (ЗФБ), как описано выше в примере 1. Было обнаружено, что область максимального накопления белка ЗФБ (определенная по пику флуоресценции на сканированной гелевой полоске) лежит около значения рН 9.
Серийно выпускаемые полиакриламидные микрогранулы, имеющие средний диаметр приблизительно 50 мкм (Biogel Р10, Каталожный номер 1504140, производства компании Biorad, США), вымачивали в растворе сополимера полиакриламида и иммобилинов при рН 9 (приготовленного, как подробно описано выше в Примере 2). Раствору иммобилина™ и полиакриламида давали возможность полимеризоваться химически, после чего водную суспензию полученных микрогранул добавляли к культуре клеток HeLa, экспрессирующих белок ЗФБ. Некоторые клетки прикреплялись к микрогранулам. Смесь клеток и микрогранул затем иммобилизовали при помощи заливки клеток и микрогранул раствором агарозы (агароза с низкой температурой плавления, каталожный номер 1620019, компания Biorad, США, имеющая температуру плавления около 36°С), давая после этого раствору агарозы охладиться примерно до 25°С. Клетки в контакте с микрогранулами наблюдали через флуоресцентный микроскоп (флуоресцентный микроскоп марки Axioscope 2 производства компании Цейс, Германия), и за изменением распределения белка GFP следили визуально и регистрировали фотографически на протяжении 30 минут.
РЕЗУЛЬТАТЫ
Как видно из фигур 4А-4С, интенсивность флуоресценции в точке прикрепления клетки к микрогрануле была примерно в пятьдесят раз выше через 30 минут после момента прикрепления, чем начальная ее интенсивность в клетках в момент времени «ноль». Измеренная интенсивность объясняется тем, что основная часть белка ЗФБ перешла в клетку. Аналогичное явление наблюдалось для нескольких клеток, которые прикрепились к микрогранулам.
Контрольные эксперименты с аналогичными микрогранулами, покрытыми при рН 7 (не показаны), не обнаружили никаких изменений в картине распределения белка ЗФБ в клетках, прикрепленных к микрогранулам, за которыми наблюдали аналогичным образом.
ЗАКЛЮЧЕНИЕ
Описанные выше результаты экспериментальных наблюдений ясно показывают, что в живых клетках может быть индуцировано локальное накопление или перераспределение белка ЗФБ, вызванное распределением по pH, и что возможно создать градиент концентраций или локальную концентрацию внутриклеточного белка в результате контакта с материалом или объектом, который имеет контролируемое значение pH на его поверхности. Данный эксперимент также показал, что это свойство может использоваться для того, чтобы вызвать перераспределение одного или более белков в живых клетках.
ПРИМЕР 4
Влияние значения pH на цитотоксичность дрожжевых клеток
Эксперимент проводили с целью исследования цитотоксичности pH-модифицирующих поверхностей по отношению к дрожжевым клеткам.
МАТЕРИАЛЫ И МЕТОДЫ
Дно девяти пластиковых чашек Петри было покрыто слоем полиакриламидного геля с иммобилином толщиной 0,5 мм (акриламидный буфер), причем каждый гель имел отличие в значении pH от предшествующего образца геля, примерно равное 1. В качестве покрытия первой чашки использовался акриламидно-иммобилиновый буферный гель, имеющий значение рН 3, в качестве покрытия второй чашки использовался акриламидно-иммобилиновый буферный гель, имеющий значение рН 4, в качестве покрытия третьей чашки использовался акриламидно-иммобилиновый буферный гель, имеющий значение рН 5, и т.д., а в качестве покрытия девятой чашки использовался акриламидно-иммобилиновый буферный гель, имеющий значение рН 11.
Покрытие получали при помощи стандартных способов полимеризации, известных специалистам в данной области техники. Состав иммобилинов приведен ниже в Таблице 1:
По 1-2 миллиона клеток Sacharomices (имеющихся в продаже пекарских дрожжей), суспендированных в культуральной тканевой среде (Roswell Park Memorial Tissue Culture Media, RPMI-1640 Dutch Mod. 01-1-7-1), помещали в каждую чашку Петри. Клетки осаждали на дно чашки, приводили в контакт с поверхностью полиакриламида и оставляли в чашке на заданное время, как указано ниже в Таблице 2. После выдержки в течение указанного промежутка времени клетки окрашивали при помощи красителя трипанового синего, и оценивали число мертвых клеток для каждой чашки.
РЕЗУЛЬТАТЫ
В приведенной ниже Таблице 2 указаны данные о смертности клеток (в виде % от общего числа клеток) при оговоренных значениях pH и времени экспозиции.
Как видно из таблицы 2, при экстремальных значениях рН (рН 3, рН 4, рН 10 и рН 11) клетки погибают за относительно короткое время контакта с субстратом - регулятором кислотности. При значениях рН 7 и рН 8, не наблюдается заметной токсичности по отношению к клеткам даже после продолжительного времени. При промежуточных значениях рН (в диапазоне от 5 до 9) наблюдается зависящая от времени токсичность.
ЗАКЛЮЧЕНИЕ
Единственной характеристикой геля, которая подвергалась изменению, был состав буферной системы на основе акриламида. Поскольку гель очень стабилен к вымачиванию в воде, трудно предположить выделение каких-либо токсичных реагентов в питательную среду для культур клеток. Таким образом, наиболее вероятно, что наблюдающаяся токсичность по отношению к клеткам вызвана перераспределением ионов (заряженных молекул белков, ионов водорода и натрия и других ионов, содержащихся внутри клетки) в клетке при контакте с поверхностью акриламидных гелей - регуляторов кислотности, использованных в этом эксперименте. В пользу этого предположения свидетельствует также тот факт, что при сравнении составов и токсичности, наблюдаемых при значениях рН, равных 3, 4, 5 и 6, концентрация сильнокислого ингредиента остается почти постоянной, тогда как изменения токсичности очень заметны. То же самое можно наблюдать на основной стороне, где концентрация обладающего наибольшей основностью ингредиента изменяется очень слабо при значениях рН, равных 11, 10, 9 и 8, тогда как изменения токсичности очень заметны. Этот факт доказывает, что токсичность не является следствием включения сильных анионных или катионных частиц, как утверждалось в предшествующем уровне техники, а обусловлена объемными кислотно-основными свойствами.
Результаты данного эксперимента дополнительно свидетельствуют о том, что смертность клеток (отсроченное цитотоксическое действие) можно контролировать посредством выбора значения рН вещества или субстрата - регулятора кислотности, находящегося в контакте с клетками, и что на такие последствия (смертность клеток) можно тонко воздействовать, соответствующим образом модифицируя значения рН поверхности или субстрата, находящегося в контакте с клетками.
ПРИМЕР 5
рН-индуцированное цитотоксическое действие на клетки линии Jurkat
МАТЕРИАЛЫ И МЕТОДЫ
Клетки линии Jurkat, клон Е6-1, были выращены на питательной среде RPMI 1640 с добавлением 2 ммоль/л L-глутамина, 10 ммоль/л HEPES-буфера, 10 ммоль/л пирувата натрия и 10% фосфатного буферного раствора. Клетки подвергали воздействию поверхностей с различными значениями рН, как описано выше для дрожжевых клеток (Пример 4).
РЕЗУЛЬТАТЫ
В приведенной ниже таблице 3 указаны данные о смертности клеток (в виде % от общего числа клеток) при оговоренных значениях рН и времени экспозиции. Результаты свидетельствуют о высокой цитотоксичности поверхностей, имеющих низкие и высокие значения рН.
ПРИМЕР 6
Параметры поглощения желтого флуоресцентного белка (ЖФБ)
МАТЕРИАЛЫ И МЕТОДЫ
1 мкг клеток линии H1299 рака легких, экспрессирующих желтый флуоресцентный белок (источник Phialadium sp.SL-2003), был подвергнут лизису. Выделившиеся белки исследовались для определения диапазона значений рН с максимальным накоплением белка ЖФБ на сухой полоске иммобилино-полиакриламидного геля (производства компании Amersham Biosciences, Immobiline™ Dry Strip pH 3-10). Полоску погружали в раствор на 22 часа, после чего сканировали УФ-сканером Axiscope 2 Plus компании Цейс и наблюдали под УФ-микроскопом.
РЕЗУЛЬТАТЫ
Как видно из фигуры 5, максимальное накопление белка ЖФБ наблюдается в интервале значений рН от 9,5 до 10.
ПРИМЕР 7
Физические и механические барьеры предотвращают рН-индуцированную цитотоксичность.
Следующий эксперимент был поставлен с целью оценить, требуется ли для проявления рН-индуцированной цитотоксичности непосредственный контакт клетки с поверхностью субстрата - регулятора кислотности.
МАТЕРИАЛЫ И МЕТОДЫ
Слой иммобилино-полиакриламидного геля (ИПГ) толщиной 0,5 мм, имеющий значение рН 3, наливали на дно чашки Петри. Нейлоновый фильтр толщиной 10 мкм со средним диаметром пор 2 мкм (серийно выпускаемый компанией Nalgene, США) приводили в тесный контакт с поверхностью слоя ИПГ. В чашку Петри помещали суспензию, содержащую 0,2 миллиона дрожжевых клеток в культуральной тканевой среде Roswell Park Memorial Tissue Culture Media, RPMI- 1640 Dutch Mod. 01-1-7-1, и клеткам давали осесть, оставив на шесть часов. В конце шестичасового периода седиментации клетки окрашивали трипановым синим.
РЕЗУЛЬТАТЫ
Подсчитанное число мертвых клеток составляло приблизительно 5% от общего числа подсчитанных клеток.
ЗАКЛЮЧЕНИЕ
Нейлоновый фильтр, помещенный между клетками и поверхностью субстрата - регулятора кислотности, предотвращает рН-индуцированную цитотоксичность.
ПРИМЕР 8
Устройство, обеспечивающее проявление избирательной цитотоксичности
С целью получить дополнительные свидетельства о необходимости непосредственного контакта клетки с субстратом - регулятором кислотности для проявления рН-индуцированной цитотоксичности, ниже описано использование фильтра, позволяющего бактериальным клеткам входить в контакт с субстратом, в то же время не давая возможности дрожжевым клеткам находиться в контакте с субстратом.
МАТЕРИАЛЫ И МЕТОДЫ
Слой иммобилино-полиакриламидного геля с (ИПГ) толщиной 0,5 мм, имеющего значение рН 3, наливали на дно чашки Петри. Нейлоновый фильтр толщиной 10 мкм со средним диаметром пор 2 мкм, описанный выше в Примере 6, приводили в тесный контакт с поверхностью слоя ИПГ. Смесь бактерий E.Coli (100 Ед/мкл) и дрожжевых клеток (1 млн/мл), суспендированную в 0,5 мл питательной среды для культур клеток, помещали в чашку Петри поверх нейлонового фильтра, и чашку инкубировали в течение 12 часов при 37°С. По окончании периода инкубации проводили отбор пробы культуральной среды для исследования бактериальных колоний на агаре МакКонки. Затем дрожжевые клетки окрашивали трипановым синим для подсчета числа мертвых клеток.
РЕЗУЛЬТАТЫ
Никаких бактериальных колоний не было обнаружено, и никаких свидетельств заметной смертности клеток не наблюдалось.
ЗАКЛЮЧЕНИЕ
Результаты этого эксперимента показывают, что бактериальные клетки, которые находились в контакте с веществом, обладающим цитотоксической активностью, были уничтожены, тогда как дрожжевые клетки, которые не находились в контакте с веществом, обладающим цитотоксической активностью, остались живыми. Результаты этого эксперимента дают дополнительные свидетельства наличия бактериотоксических свойств у субстрата - регулятора кислотности.
ПРИМЕР 9
рН-индуцированное цитотоксическое действие на клетки линии Jurkat
С целью выяснения, наблюдается ли рН-индуцированное цитотоксическое действие на клетки линии Jurkat, был проведен следующий эксперимент.
МАТЕРИАЛЫ И МЕТОДЫ
Из смеси полиакриламид - иммобилин™, имеющей значение рН 9,0, была приготовлена суспензия микрогранул на основе полиакриламида со средним размером микрогранул около одного микрона. Микрогранулы добавили к одному миллиону клеток линии Jurkat, суспендированных в 1 мл культуральной тканевой среды, так, чтобы соотношение микрогранул к клеткам составляло примерно 20 микрогранул на одну клетку линии Jurkat. Были отобраны аликвоты проб через 0,5, 1,0 и 2,0 часа после добавления микрогранул к суспензии клеток. Клетки окрашивали при помощи красителя трипанового синего, и подсчитывали число мертвых клеток и общее число клеток.
РЕЗУЛЬТАТ
Через 0,5 часа после добавления микрогранул доля мертвых клеток в образце составляла 5%. Через 1 час после добавления микрогранул к клеткам доля мертвых клеток в образце составляла 10%. Через 2,0 час после добавления микрогранул к клеткам доля мертвых клеток в образце составляла 27%.
ПРИМЕР 10
Цитотоксическое действие нафиона
Сульфонированные тетрафторэтиленовые сополимеры (например, нафион) являются кислотными (имеющими заряженные анионы) биологически активными полимерами с сильными буферными свойствами и высокими значениями буферной емкости. Такие виды пленок состоят из субстрата (например, полиметилакрилата, нейлона или полиэфира) и сульфонированного полимера в качестве активного слоя. Считается, что нафион не обладает цитотоксическим или бактерицидным действием. Он обычно используется в качестве ионопроводящего электрода в топливных элементах. Для выяснения токсичности нафиона по отношению к клеткам были проведены следующие испытания токсичности.
МАТЕРИАЛЫ И МЕТОДЫ
1 миллион клеток линии Jurkat в фосфатном буферном растворе осаждали на 1 квадратном сантиметре серийно выпускаемой мембраны из нафиона (NAFION 117, перфторированная мембрана, компания Sigma, 274674-IEA). Для проведения различия между живыми и мертвыми клетками мембрану окрашивали в 1 мкл раствора пропидий йодида концентрацией 1 мкг/мкл или красителя трипанового синего.
РЕЗУЛЬТАТЫ
После 10 минут воздействия со стороны нафиона более чем 95% клеток оказались мертвыми, как видно из фигур 6А-6В.
ПРИМЕР 11
Бактерильная токсичность и цитотоксическое действие ламинатов
МАТЕРИАЛЫ И МЕТОДЫ
Образцы ламинатов: Образцы ламинатов представляли собой пленки, нанесенные на полиэфирную основу толщиной 110 мкм.
Серии BIOACT 13, 15 и 16:
BIOACT 16: Полиэфирная основа толщиной 110 мкм + подслой полиуретанакрилата.
BIOACT 13: Полиэфирная основа толщиной 110 мкм + подслой полиуретанакрилата + «активный» катионообменный субмикронный силикагель в ПВС в качестве связующего (соотношение по массе 4:1); общая масса покрытия 0,97 г/м2, значение рН покрытия 4,06.
BIOACT 15: Полиэфирная основа толщиной 110 мкм + подслой полиуретанакрилата + «активный» катионообменный полиуретановый полимер в ПВС в качестве связующего (соотношение по массе 4:1); общая масса покрытия 0,76 г/м2, значение рН покрытия 4. Непокрытый образец был предоставлен как контрольный.
Серии MVC/HT/56 А, В и С: Этот набор ламинатов получен при помощи введения соли n-толуолсульфоновой кислоты (рН 3) в полидиэтиламинэтилметакрилат в качестве активного компонента покрытий.
MVC/HT/56 А: Полиэфирная основа толщиной 110 мкм + ПВС + соль n-толуолсульфоновой кислоты. Общая масса покрытия, в пересчете на сухое вещество, составляет 0,9 г/м2 (0,9 микрона), из которого масса активного компонента в покрытии, в пересчете на сухое вещество, составляет 0,6 г/м2.
MVC/HT/56: Идентична продукту MVC/HT/56 А, но другая партия.
MVC/HT/56 С: Полиэфирная основа толщиной 110 мкм + ПВС + соль n-толуолсульфоновой кислоты. Общая масса покрытия, в пересчете на сухое вещество, составляет 0,58 г/м2 (0,5 микрона), из которого масса активного компонента в покрытии, в пересчете на сухое вещество, составляет 0,24 г/м2.
MVC/HT/56 D. Идентична продукту MVC/HT/56 А, но другая партия.
Приготовление суспензий живых и мертвых бактериальных клеток: 10 мл бактерии E.coli DH5 было выращено до стадии поздней лог-фазы в среде LB broth. 1 мл культуры концентрировали центрифугированием при скорости 5000 об/мин в течение 5 минут. Осадок в пробирке после центрифугирования ресуспендировали в 100 мкл 0,85% раствора NaCl. 50 мкл этой суспензии добавляли к 950 мкл 0,85% раствора NaCl (для живых бактерий) или в 850 мкл 70% раствора 2-пропанола (для мертвых бактерий). Оба образца инкубировали при комнатной температуре в течение 1 часа, после чего их осаждали в пробирке центрифугированием при скорости 5000 об/мин в течение 5 минут. Полученные осадки в пробирках после центрифугирования ресуспендировали в 500 мкл 0,85% раствора NaCl и повторно центрифугировали. Наконец, оба осадка в пробирках после центрифугирования ресуспендировали в 50 мкл 0,85% раствора NaCl.
Окрашивание суспензий живых и мертвых бактериальных клеток: Окрашивание проводили при помощи набора для определения жизнеспособности бактерий LIVE/DEADRBacLight™ Bacterial Viability Kit (Молекулярные пробы). Смесью красителей SYTO9 и пропидий йодида бактерии с интактными клеточными мембранами приобретают флуоресцирующую зеленую окраску, тогда как бактерии с поврежденными мембранами приобретают флуоресцирующую красную окраску. По существу, 2 мкл красителя SYTO9, 1,67 ммоль пропидий йодида и 1,67 ммоль Компонента А смешивали с 2 мкл 1,67 ммоль пропидий йодида и 18,3 ммоль Компонента В. 0,15 мкл смеси красителей добавляли к 50 мкл суспензий бактериальных клеток. 2,5 мкл окрашенных бактериальных клеток помещали между предметным и покровным стеклом. Живые и погибшие клетки наблюдали через флуоресцентный микроскоп.
Испытания антибактериальной активности пленок: Были проведены две серии испытаний: на неактивированных (в состоянии как при покупке) пленок и пленок, обработанных в 1 моль/л растворе NaCl в течение 20 минут. В обеих антибактериальную активность оценивали по результатам подсчета под флуоресцентным микроскопом числа мертвых и живых окрашенных бактериальных клеток в образце, нанесенном на биоактивную пленку.
Испытания цитотоксической активности пленок: Живые и мертвые клетки линии Jurkat подсчитывали после воздействия биоактивной пленкой по следующей методике: 0,15 мкл смеси красителей добавляли к одному миллиону клеток линии Jurkat в 50 мкл фосфатного буферного раствора. 2,5 мкл окрашенных клеток помещали между активированной пленкой и покровным стеклом. Живые и погибшие клетки наблюдали через флуоресцентный микроскоп.
РЕЗУЛЬТАТЫ
Испытания антибактериальной активности MVC НТ 56 А, В, С и D: После 30 минут инкубации клеток линии Jurkat с описанными выше ламинатами живые (движущиеся) клетки наблюдали в контрольном образце, пленке MVC/HT/56/B и пленке MVC/HT/56/D, которые через зеленый светофильтр (5-2) выглядят зелеными или красноватыми. Для сравнения, после 1 минуты инкубации ламинатов MVC/HT/56/A и /56С все клетки оказались прикрепленными и через зеленый светофильтр выглядели красными.
Испытания цитотоксической активности МVС HТ 56 А, В, С и D: Как видно из приведенных ниже фигуры 7 и таблицы 4, взаимодействие клеток линии Jurkat с пленками 56/А и 56/С отличается от такового с пленками 56/В и 56/D.
Испытания антибактериальной активности пленок BIOACT 13, 15 и 16: После 45 минут инкубации на пленках BIOACT 13 50-70% клеток E.coli были мертвыми. В то же время, от 20 до 40% клеток бактерии E.coli оказались мертвыми после инкубации на пленке BIOACT 15. Клетки E.coli не прикреплялись к пленке BIOACT 16. После 20-30 минут инкубации на пленке BIOACT 15 почти все клетки E.coli оказались мертвыми. Оценка прикрепления этих клеток была затруднена вследствие высокого уровня шума от фонового сигнала.
Испытания цитотоксической активности пленок BIOACT 13, 15 и 16: Результаты трех отдельных экспериментов приведены ниже в таблице 5. Они представлены в виде соотношения числа зеленых и красных клеток линии Jurkat и процентного содержания зеленых в целом.
Приведенная ниже таблица 6 подводит итог результатов трех экспериментов в виде процентного содержания красных клеток. На фигурах 8A-8D приведены результаты типичного эксперимента, полученные после воздействия пленки BIOACT 13 на клетки линии Jurkat.
ЗАКЛЮЧЕНИЕ
Взаимодействие клеток E.coli и клеток линии Jurkat с пленками 56/А и 56/С отличается от такового для пленок 56/В и 56/D. В сериях пленок BIOACT 13, 15 и 16 пленка BIOACT 13 проявила самую высокую цитотоксическую и антибактериальную активность.
ПРИМЕР 12
Бактерицидная активность нафиона и полиакриламидного геля с градиентом рН
Были проведены следующие испытания токсичности с целью оценки того, являются ли нафион и другие пленки токсичными для бактерий.
МАТЕРИАЛЫ И МЕТОДЫ
На бактерицидное действие было испытано шесть типов полимерных пленок.
1. Нафион (производства компании Дюпон);
2. Нафион (производства компании Дюпон);
3. Полиакриламид с иммобилином, на полиэфирной основе, толщиной 500 мкм, рН 10;
4. Та же, что и 3, но со значением рН 9;
5. Полиуретановая пленка (серийно выпускаемая);
6. Полиакриамид на полиэфирной основе, толщиной 500 мкм, рН 5;
Контрольный образец - полиэфирная пленка
Испытание на бактериях Staph. Aureus, Staph. Spp, Strept. Beta-hemolit.gr.A и Strept. Beta-hemolit.gr.G: Жизнеспособность этих бактерий испытывали на кровяном агаре с использованием так называемого метода посева. По существу, 0,01 мл жидкой культуры микроорганизмов распределяли по кровяному агару при помощи специальной бактериальной петли. Каждую из шести полимерных пленок (10 мм × 10 мм) помещали в чашку Петри активной стороной вниз. После оставления на ночь для инкубации при 37°С проводили подсчет выросших колоний. Сравнивали результаты для испытываемой и контрольной группы.
Испытание общих микробиологических средств и грибковых агентов: Общее антимикробное и противогрибковое действие вышеупомянутых пленок испытывалось в среде Сабуро агар методом седиментации. Непокрытым чашкам Петри с Сабуро агаром давали возможность постоять 8 часов открытыми. Каждую из шести полимерных пленок (10 мм × 10 мм) помещали в чашку Петри активной стороной вниз. После оставления на ночь для инкубации при 37°С проводят подсчет выросших колоний. Сравнивают результаты для испытываемой и контрольной группы.
РЕЗУЛЬТАТЫ
Воздействие пленок согласно предлагаемому изобретению на рост бактерий Staph. Aureus обобщено в Таблице 7. Воздействие пленок согласно предлагаемому изобретению на рост бактерий Staph. Spp обобщено в Таблице 8. Воздействие пленок согласно предлагаемому изобретению на рост бактерий Strept. Beta-hemolit.gr.A обобщено в Таблице 9. Воздействие пленок согласно предлагаемому изобретению на рост бактерий Strept. Beta-hemolit.gr.G обобщено в Таблице 10. Воздействие пленок согласно предлагаемому изобретению на общие микробиологические средства и грибковые агенты обобщено в Таблице 11.
ЗАКЛЮЧЕНИЕ
Как нафионовая, так и пленка №3 (полиакриламид с иммобилином, на полиэфирной основе, толщиной 500 мкм, рН 10) проявили высокую антибактериальную активность и общее антимикробное и противогрибковое действие.
ПРИМЕР 13
Испытания на срок хранения молока
Пленки согласно предлагаемому изобретению испытывали на характер их воздействия на срок хранения молока.
МАТЕРИАЛЫ И МЕТОДЫ
Испытания устойчивости молока при хранении при использовании пленок согласно предлагаемому изобретению проводились на пастеризованном гомогенизированном молоке. В обеих сериях экспериментов использовалось молоко после обработки ультрафиолетовым излучением.
Испытание 1: Семь пустых чашек Петри диаметром 35 мм заполняли доверху свежим молоком. Шесть чашек покрывали пленками согласно предлагаемому изобретению так, чтобы их активная сторона входила в контакт с молоком без воздушной прослойки между ними. Седьмую чашку использовали как контрольный образец. Чашки выдерживали на столе при комнатной температуре в течение шести дней. Каждый день проверяли значение рН в чашках. Для компенсации потерь вследствие испарения каждый день добавляли стерильную ДДВ. Суммарный объем добавленной ДДВ составил менее 5% от общего объема молока. Таким образом, предполагалось, что она не оказывает влияния на динамику изменения значения рН. Этот эксперимент повторяли дважды.
Испытание 2. 14-дневное испытание с нафионом: Испытание проводили с серийно выпускаемой пленкой из нафиона в качестве активного материала (слоя). Для испытаний устойчивости молока при хранении использовалось пастеризованное гомогенизированное молоко (без антибиотиков). Три пустых чашки Петри диаметром 35 мм заполняли доверху свежим молоком. Две из них покрывали пленкой из нафиона так, чтобы активная сторона входила в контакт с молоком без воздушной прослойки между ними. Третью чашку использовали как контрольный образец. Чашки выдерживали на столе при комнатной температуре в течение четырнадцати дней. Каждый день проверяли значение рН в чашках. Для компенсации потерь вследствие испарения каждый день добавляли стерильную ДДВ. Суммарный объем добавленной ДДВ составил менее 5% от общего объема молока. Таким образом, предполагалось, что она не оказывает влияния на динамику изменения значения рН.
Испытание общих микробиологических средств и грибковых агентов: Испытания проводили в среде Сабуро агар методом седиментации. Непокрытым чашкам Петри с Сабуро агаром давали возможность постоять 8 часов открытыми. Кусочек нафиона (10 мм × 10 мм) помещали в чашку Петри активной стороной вниз. После оставления на ночь для инкубации при 37°С проводили подсчет выросших колоний. Сравнивали результаты для испытываемой и контрольной группы.
РЕЗУЛЬТАТЫ
Данные для значений рН молока после Испытания 1 приведены ниже в Таблице 12.
Данные для значений рН молока (Испытание 1, повторный эксперимент) приведены ниже в Таблице 13.
Данные для значений рН молока после 14-дневных испытаний (Испытание 2) приведены ниже в Таблице 14.
Данные испытаний общих микробиологических средств и грибковых агентов приведены ниже в Таблице 15.
ПРИМЕР 14
Испытания цитотоксического действия второй серии ламинатов
Вторая серия ламинатов на полиэфирной основе была изготовлена методом термического ламинирования полимерных материалов. Ламинаты состояли из компонентов с активными анионами в матрице из ПВС.
У некоторых образцов активный слой был покрыт сверху слоем ПВС.
Составы и строение ламинатов приведено ниже в Таблице 16.
МАТЕРИАЛЫ И МЕТОДЫ
Определение значения рН: После замачивания пленок в воде значение рН определяли при помощи рН-метра модели pH-Fix 0-14 (производства компании Macherey-Nagel).
Испытания цитотоксического действия: Испытания цитотоксического действия проводили, как описано в Примерах 12 и 13.
РЕЗУЛЬТАТЫ
Результаты измерения рН приведены ниже в Таблице 17.
Результаты определения цитотоксичности приведены ниже в Таблице 18. Цитотоксический эффект измеряли как % окрашенных пропидий йодидом (мертвых) клеток. В контрольном образце (без пленки) после 20 минут выдержки приблизительно 80% клеток имеют зеленую окраску.
Следует отметить, что образцы 3, 4 и 7 имеют нейтральное внешнее покрытие из ПВС и, тем не менее, обнаруживают высокую цитотоксичность.
ПРИМЕР 15
Антибактериальная ткань
С целью выяснения, возможно ли использование материалов согласно предлагаемому изобретению для предупреждения некроза, микрогранулы ионообменной смолы внедрили в хлопковую ткань и привели ее в контакт с некротической тканью на срок в два дня.
МАТЕРИАЛЫ И МЕТОДЫ
Исходный материал: Ионообменная смола AG 501-Х8 (D) производства компании Biorad (каталожный номер 142-6425). Было добавлено приблизительно 100 микрогранул на 1 см2 хлопковой ткани.
РЕЗУЛЬТАТЫ
Как иллюстрируют фигуры 9А-9С, хлопок, содержащий ионообменную смолу компании Biorad, обладает антинекротическим действием.
ЗАКЛЮЧЕНИЕ
Материалы, содержащие ионообменные смолы, обладающие буферными свойствами, эффективны для предотвращения некроза.
Подразумевается, что определенные особенности предлагаемого изобретения, которые для наглядности описаны в контексте разных вариантов осуществления изобретения, могут также быть получены в их сочетании в одном воплощении. И наоборот, различные особенности предлагаемого изобретения, которые для краткости описаны в контексте одного из воплощений, могут также быть получены по отдельности или в любой подходящей субкомбинации.
Хотя предлагаемое изобретение описано в виде конкретных его воплощений, ясно, что многие альтернативные решения, модификации и варианты очевидны для специалиста в данной области техники. Таким образом, подразумевается, что оно охватывает все такие альтернативные решения, модификации и варианты, которые соответствуют сущности и объему прилагаемой формулы изобретения во всей своей полноте. Все публикации, патенты и патентные заявки, упомянутые в данном описании, включены посредством ссылки в настоящую заявку в их совокупности до той же степени, до которой каждая отдельная публикация, патент или патентная заявка конкретно и индивидуально указана включенной в настоящую заявку посредством ссылки. Кроме того, цитирование или описание любой ссылки в настоящей патентной заявке не должно истолковываться как признание такой ссылки в качестве предшествующего уровня техники для предлагаемого изобретения.
Реферат
Изобретение относится к медицинской и пищевой отраслям промышленности. Фармацевтически приемлемый буфер для уничтожения клеток представляет собой твердую буферную систему, включающую один или более ионообменных материалов со значением рН <4,5 или >8,0. Когда указанный материал находится в окружающей среде, которая может транспортировать ионы H+, твердая буферная система способна вызывать гибель, по меньшей мере, одной клетки-мишени, находящейся в указанной среде или в контакте с указанной средой. Изобретение позволяет избирательно уничтожать клетки-мишени. 6 н. и 73 з.п. ф-лы, 20 ил., 18 табл.
Формула
Документы, цитированные в отчёте о поиске
Коньюгат антимеланомного антитела и цитотоксического агента и способ ингибирования меланомы

Комментарии