Полимерные системы доставки действующих веществ - RU2523714C2
Код документа: RU2523714C2
Чертежи


Описание
Данное изобретение относится к композициям и препаратам, содержащим действующее вещество, в особенности гидрофобные действующие вещества, совместно с системой доставки, которая способствует растворению данных веществ.
Многие наиболее эффективные лекарственные вещества и потенциальные лекарственные вещества нерастворимы в воде. Препарат малорастворимых лекарственных веществ, таких как паклитаксел (PTX) с водорастворимостью, равной примерно 1 мкг/мл, остается главной проблемой в доставке лекарств (Huh, K. M., et al., J. Controlled Release 126, 122-129 (2008); Dabholkar, R. D., et al. Int. J. Pharm. 315, 148-157 (2006); Yang, T., et al., Int. J. Pharm. 338, 317-326 (2007); Torchilin, V.P., Cell. Mol. Life. Sci 61, 2549-2559 (2004); Haag, R., Angew. Chem. Int. Ed. 43, 278-282 (2004)). В настоящее время клинический препарат паклитаксела, Taxol®, содержит менее 1% мас./мас. действующего лекарственного вещества и 99% мас./мас. носителя, который вызывает значительные побочные эффекты у пациентов. Подобные проблемы имеют действующие вещества, используемые в других технических областях, таких как защита растений от паразитов и т.п. Было разработано несколько способов солюбилизации или диспергирования действующих веществ. Традиционные способы обычно основаны на использовании растворителей, поверхностно-активных веществ или хелатообразующих веществ. Эти способы имеют один или несколько недостатков, связанных с токсичностью носителей, ограниченной стабильностью препаратов в водной среде, в частности, при разбавлении, или со сложностью процесса формулирования.
В последнее время липосомы (Wu, J., et al., Int. J. Pharm. 316, 148-153 (2006)), микро- и наночастицы (Desai, N.P. et al., Anti-Cancer Drugs 19, 899-909 (2008)), а также полимерные мицеллы (Huh, K. M., et al., J. Controlled Release 126, 122-129 (2008); Konno, T., et al., J. Biomed. Mat. Res., Part A, 65A, 210-215 (2002); Kim, S.C., et al., J. Controlled Release 72, 191-202 (2001)) активно изучались как системы солюбилизации/доставки лекарственных веществ. Каждый из этих подходов имеет свои преимущества и недостатки. Одно из главных ограничений полимерных мицелл - это емкость загрузки и общее количество лекарственного вещества, которое может быть растворено. Патентная заявка США 20040185101 раскрывает полимерные композиции со способностью солюбилизировать гидрофобные лекарственные вещества в водной среде. Тем не менее, емкость загрузки этих композиций ограничена к примеру до <10% мас./мас. для паклитаксела или менее чем 1% мас./мас. для циклоспорина А.
Поли(2-оксазолин)ы в последнее время привлекли особое внимание для применения в области биомедицины. В частности, большой интерес вызывают гидрофильные поли(2-метил-оксазолин)ы п(МеОкс) и поли(2-этил-2-оксазолин)ы п(ЭтОкс), так как они обладают маскирующими (Zalipsky, S., et al., J. Pharm. Sci. 85, 133-137 (1996); Woodle, M. C., et al., Bioconjugate Chem. 5, 494-496 (1994)) и белок-отталкивающими свойствами (Konradi, R., et al., Langmuir 24, 613-616 (2008)) и подвергаются быстрому почечному клиренсу (Gaertner, F.C., et al., J. Controlled Release 119, 219-300 (2007)), подобными свойствам поли(этиленгликоля), широко используемого полимера в инъецируемых системах доставки лекарственных веществ.
Задача настоящего изобретения состоит в предоставлении композиций, содержащих систему доставки, которая позволяет эффективно солюбилизировать и/или формулировать действующие вещества, в частности гидрофобные действующие вещества. В частности, композиции должны быть просты в изготовлении и иметь высокую емкость загрузки для конкретного действующего вещества.
Для того чтобы решить эту проблему, настоящее изобретение предоставляет композиции, содержащие
(а) по меньшей мере один сополимер, содержащий повторяющиеся звенья формулы (I),

где RA означает углеводородную группу, необязательно замещенную -OH, -SH, -COOH, -NR'2, -COOR', -CONR', -CHO, где R' означает Н или С1-3 алкил, и RA выбирают таким образом, что повторяющееся звено формулы (I) является гидрофильным,
и повторяющиеся звенья формулы (II),

где RB означает углеводородную группу, необязательно замещенную галогеном, -OH, -SH, -COOH, -NR''2, -COOR'', -CONR'', -CHO, где R'' означает Н, алкил, алкенил, а RB выбирается таким образом, что повторяющееся звено формулы (II) более гидрофобно, чем повторяющееся звено формулы (I); и
(b) одно или более действующих веществ.
Более того, данное изобретение предоставляет перечисленные выше сополимеры. Композиции согласно изобретению могут быть использованы в различных технических областях, включая фармацевтику, диагностику (включая ветеринарию) и защиту растений.
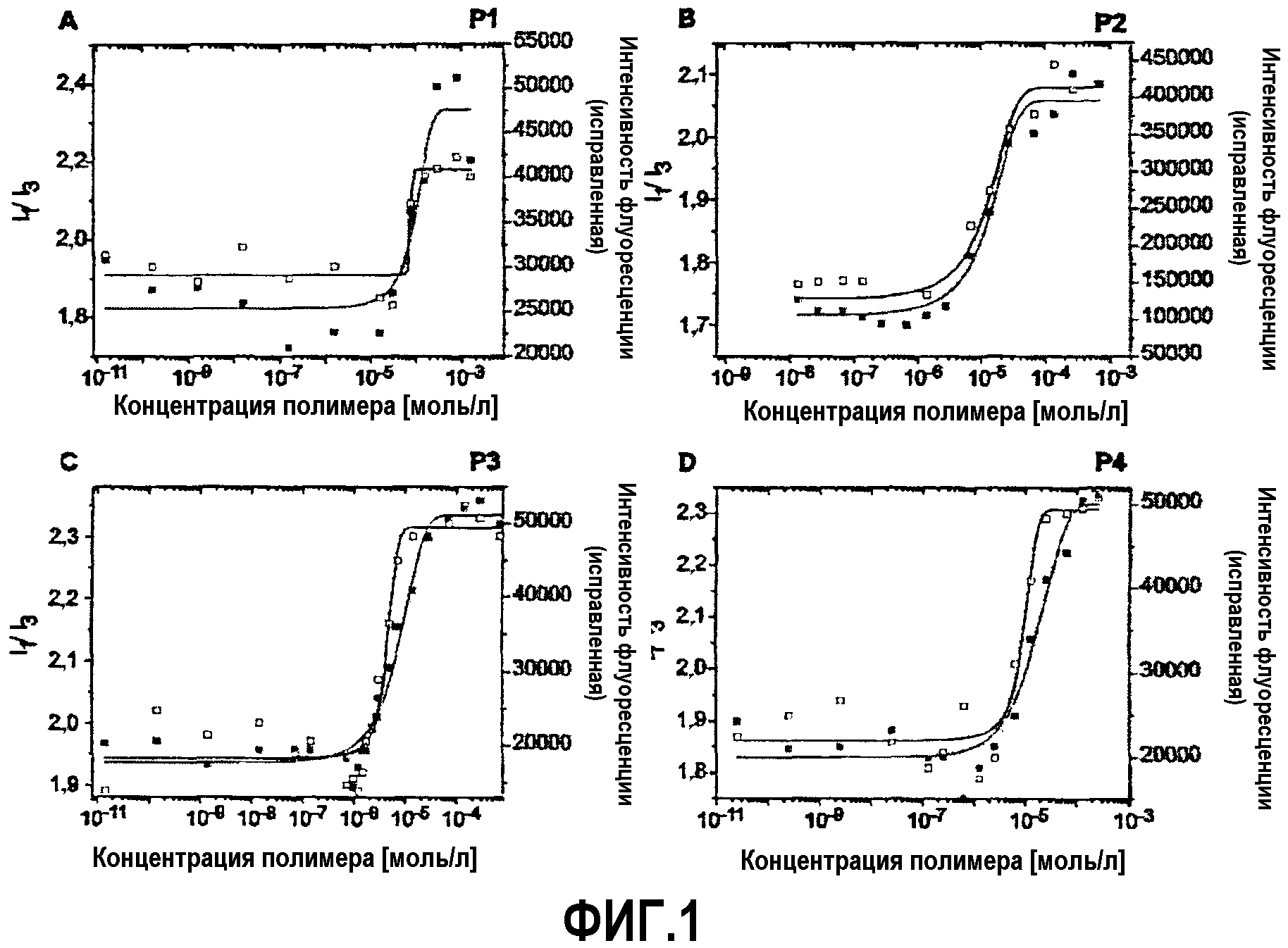
На фиг.1представлены интенсивности флуоресценции и отношения I1/I3растворов пурина в зависимости от концентрации определенных сополимеров, используемых в контексте изобретения, при 25°C.
На фиг.2 представлены результаты растворения PTX с амфифильными сополимерами методом тонких пленок.
На фиг.3 представлены результаты измерений динамического светорассеяния заполненных лекарством мицелл, сформированных композициями согласно данному изобретению.
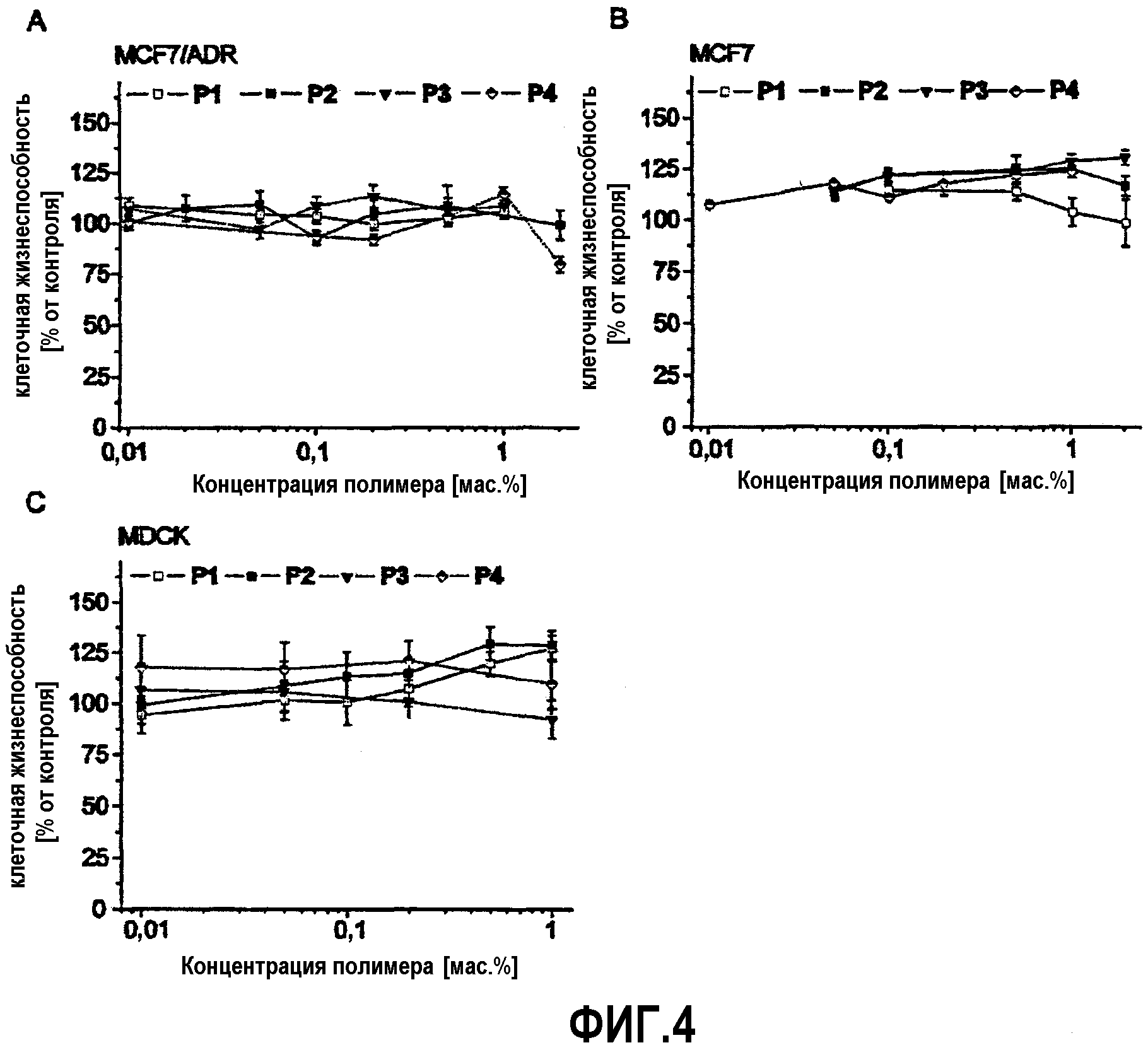
На фиг.4 представлены результаты измерений цитотоксичности полимеров, используемых в рамках данного изобретения, в различных клеточных линиях.
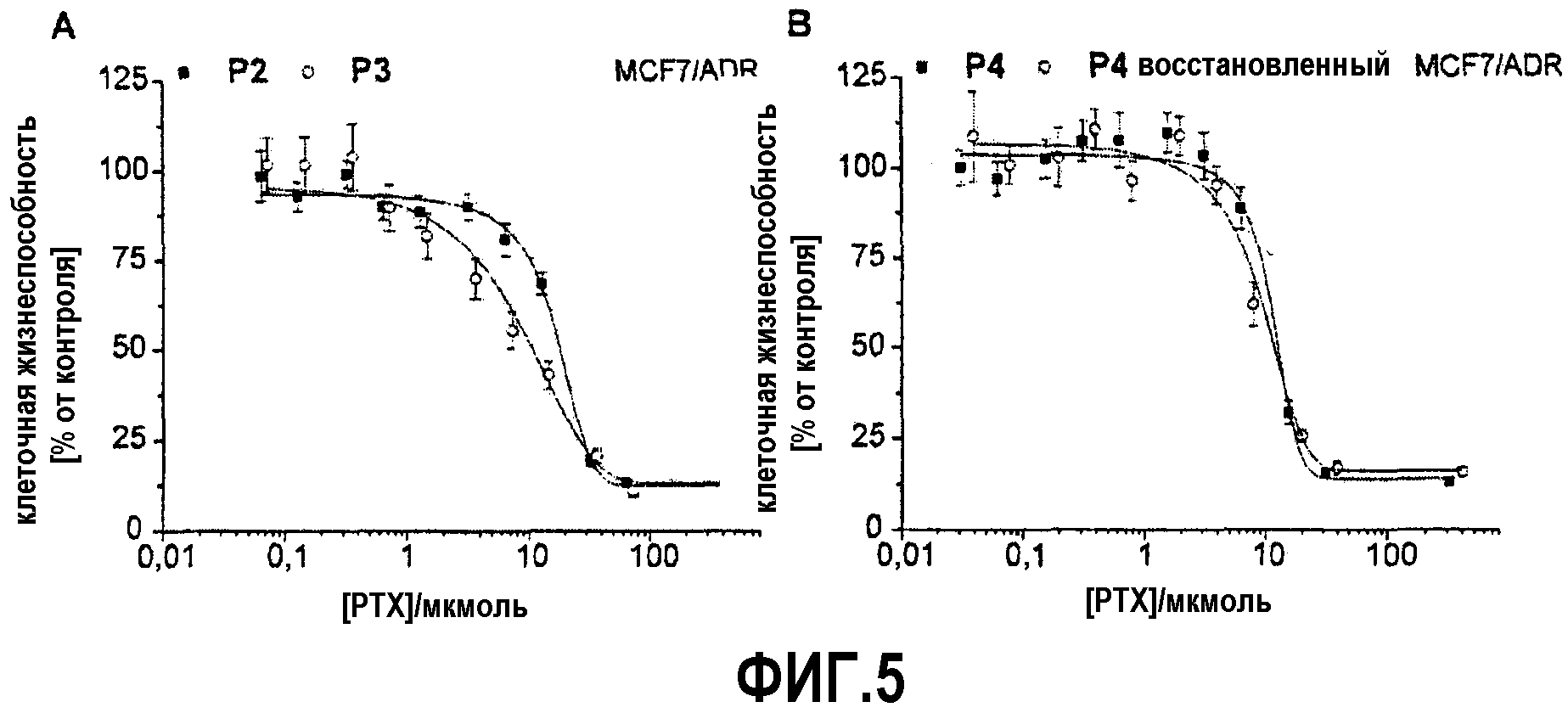
На фиг.5 представлена зависимость жизнеспособности клеток с множественной лекарственной устойчивостью линии MCF7/ADR в зависимости от дозы палитакселя, в смесях, приготовленных согласно изобретению.
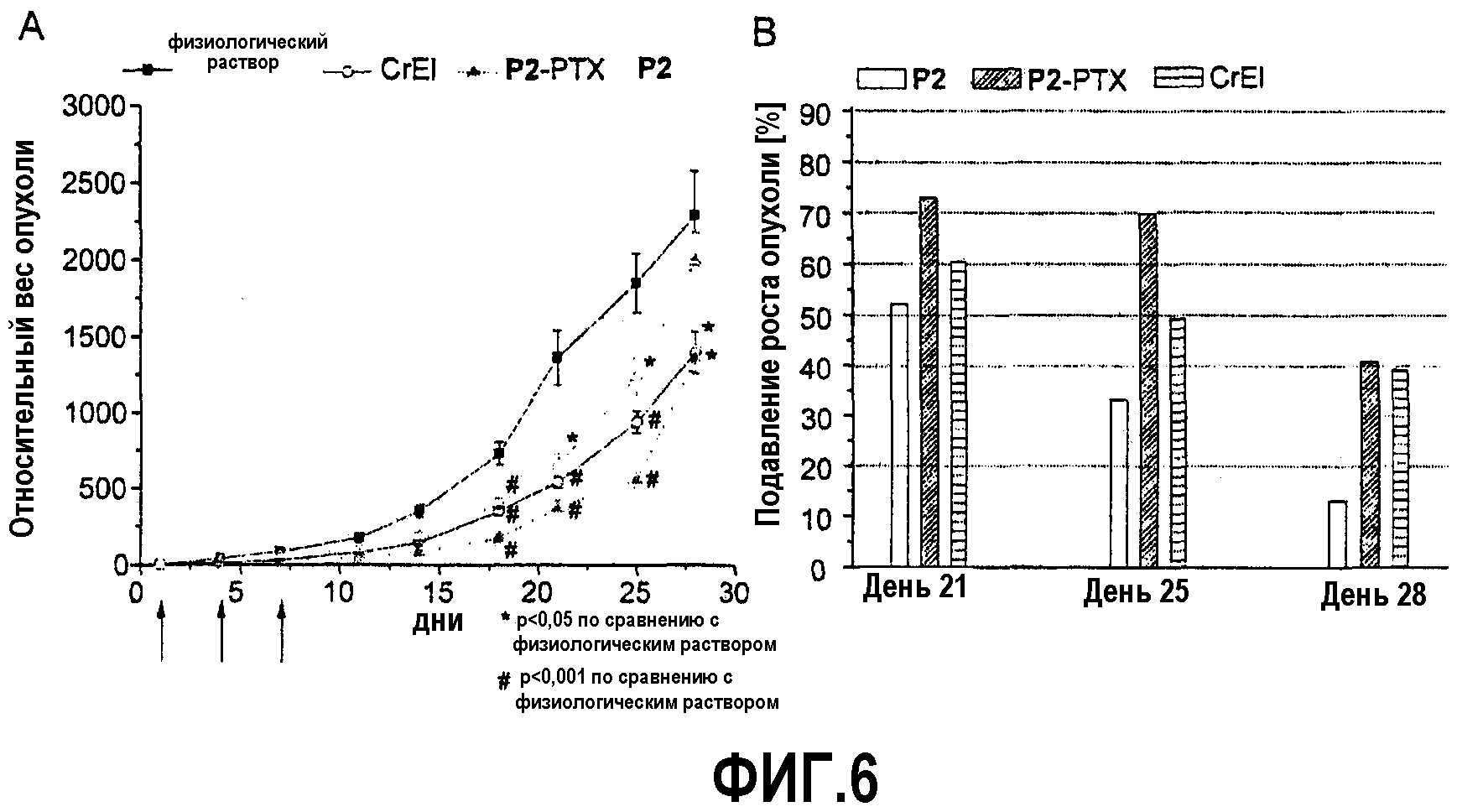
На фиг.6 представлены относительные массы опухолей (А) и подавление роста опухолей (В) относительно негативных контролей мышей, подвергнутых лечению композициями, приготовленными согласно изобретению и коммерческим продуктом.
Как упомянуто выше, в звеньях формулы (I) RA является углеводородной группой, необязательно замещенной -OH, -SH, -COOH, -NR'2, -COOR', -CONR', -CHO, где R' представляет H или C1-3 алкил, и RA выбран таким образом, что повторяющееся звено формулы (I) является гидрофильным.
Предпочтительно, в качестве RAвыбирать C1-8углеводородную группу, предпочтительно, C1-6углеводородную группу, более предпочтительно, C1-3 углеводородную группу и в особенности, C1-2углеводородную группу, все из которых могут быть необязательно замещены. Предпочтительными углеводородными группами являются алкильные группы.
Понятно, что гидрофильное свойство звена формулы (I), как описано выше, будет зависеть от размера углеводородной группы в составе RA. При выборе короткой углеводородной группы, такой как метильная или этильная, полученная группа RA, незамещенная или замещенная перечисленными заместителями, всегда будет гидрофильна. При выборе большей углеводородной группы, наличие заместителей может вносить вклад в дополнительную полярность звеньев формулы (I). Поэтому, предпочтительно, выбирать RA соответственно конкретному случаю из метила или этила, необязательно замещенных галогеном, -OH, -SH, -COOH, -NR'2, -COOR', -CONR', -CHO, где R' представляет H или C1-3 алкил, особенно предпочтительно, RAвыбирают из метила или этила.
В звеньях формулы (II), RBявляется углеводородной группой, необязательно замещенной галогеном, -OH, -SH, -COOH, -NR''2, -COOR'', -CONR'', -CHO, где R'' представляет водород, алкил или алкенил, и RBвыбирается таким образом, что повторяющееся звено формулы (II) более гидрофобно, чем повторяющееся звено формулы (I). Если R'' является алкилом или арилом, то предпочтительна C1-8 алкильная или арильная группы. Если присутствуют галогенные заместители, предпочтительно, выбирать Cl или F.
Предпочтительно, в качестве RBвыбирать C3-20углеводородную группу, предпочтительно, C3-12углеводородную группу, более предпочтительно, C3-6углеводородную группу, и в особенности, C4-6углеводородную группу, все из которых могут быть необязательно замещены. Однако, более предпочтительно, чтобы углеводородная группа не имела заместителя.
В качестве углеводородной группы предпочтительны алифатические или ароматические группы, такие как алкильные группы, арильные группы или алкарильные группы. Более предпочтительны алкильные группы, такие как пропил, бутил, пентил, гексил, гептил, октил или нонил, еще более предпочтительны C4-6 алкильные группы, т.е. бутил, пентил, гексил и особенно предпочтительны бутильные группы, особенно н-бутил.
Термины “гидрофильный” и “гидрофобный”, применяемые в контексте данного описания, широко используются в данной области. «Гидрофильный» обозначает предпочтительность водного окружения для субстанции или ее части, т.е. гидрофильная субстанция или ее часть легче растворяются или смачиваются водой, чем неполярными растворителями, такими как углеводороды. «Гидрофобный» обозначает предпочтительность неполярного окружения, т.е. гидрофобная субстанция или ее часть легче растворяются или смачиваются неполярными растворителями, такими как углеводороды, по сравнению с водой. Термин «амфифильный» обозначает одновременное присутствие гидрофильных и менее гидрофильных или более гидрофобных частей в веществе, что часто наблюдается у поверхностно-активных веществ. Таким образом, сополимеры, используемые в контексте данного изобретения, также относятся к амфифильным сополимерам, поскольку включают гидрофильные части структуры и менее гидрофильные/более гидрофобные части, соответственно.
При необходимости, т.е. в случае, если из химической структуры RA и RBне очевидно, что конкретное звено формулы (II) более гидрофобно, чем определенное звено формулы (I), это может быть установлено путем сравнения гомополимеров из соответствующих звеньев и определения для них значений logP в одинаковых условиях. LogP, как известно, является логарифмом коэффициента разделения, наблюдаемого для вещества А между водой и н-октанолом. В частности, коэффициент разделения P для вещества А определяется как отношение коэффициента разделения P=[A]н-октанол/[A]вода, где [A] обозначает концентрацию вещества А в соответствующей фазе. Более гидрофильная субстанция будет иметь большие концентрации в воде. Обычно, для измерений используется одинаковый объем воды и октанола.
В предпочтительном варианте осуществления данного изобретения, надлежащий выбор RBдля получения звеньев формулы (II) c большей гидрофобностью по отношению к звеньям формулы (I) может быть проверен путем определения критической концентрации мицелообразования (ККМ) сополимера, содержащего данные структурные звенья, по методике, детально описываемой далее. Если ККМ может быть измерена, требования к гидрофильным свойствам звеньев формулы (I) и более гидрофобным/менее гидрофильным свойствам звеньев формулы (II) надлежаще выполнены.
Требования к звеньям формулы (I) быть гидрофильными, и со звеньями формулы (II) быть более гидрофобными, по сравнению к звеньям формулы (I) также будут надлежаще выполнены для любой возможной комбинации предпочтительных конструкций RA и RB, что будет ясно из соответствующих структур. А именно, в качестве RA предпочтительно, выбирать метил или этил, необязательно замещенные -ОН, -SH, -COOH, -NR'2, -COOR', -CONR', -CHO, где R' может быть Н или C1-3 аклилом, и наиболее предпочтительно, выбирать в качестве RAметил или этил; и RB выбирается из незамещенной C3-20углеводородной группы, предпочтительно, C3-12углеводородной группы, более предпочтительно, C3-6углеводородной группы, и в особенности, C4-6углеводородной группы, где в качестве углеводородных групп предпочтительны алифатические или ароматические группы, такие как алкильные группы, арильные группы или алкарильные группы. Более предпочтительны алкильные группы, такие как пропил, бутил, пентил, гексил, гептил, октил или нонил, еще более предпочтительны, C4-6 алкильные группы, т.е. бутил, пентил, гексил и особенно предпочтительны, бутильные группы, в частности н-бутил.
Следует понимать, что под водным окружением, водной средой, водными растворами и тому подобным в данной заявке подразумеваются системы растворителей, где 50% (в объемном отношении) или более, предпочтительно, 70% или более, еще более предпочтительно, 90% и более и, в частности, полностью 100% от общего объема растворителя(-лей) является вода.
Сополимер, содержащий повторяющиеся звенья формулы (I) и (II), описанные выше, может быть легко приготовлен путем полимеризации с раскрытием цикла из 2-замещенных-2-оксазолинов (или 2-замещенных-4,5-дигидрооксазолей по номенклатуре IUPAC). Таким образом, полимеры, используемые в контексте данного изобретения, также относятся к поли(2-оксозолин)ам.
Сополимер согласно данному изобретению может включать другие повторяющиеся звенья, помимо повторяющихся звеньев (I) и (II), обозначенных выше. Однако предпочтительно, что большей частью всех повторяющихся звеньев, т.е. больше 50%, более предпочтительно, больше 75%, еще более предпочтительно, больше 90% и особенно предпочтительно, 100%, относительно общего числа повторяющихся звеньев, являются повторяющиеся звенья формулы (I) или (II), как определены выше. При этом все повторяющиеся звенья формулы (II), содержащиеся в сополимере, будут более гидрофобными, чем любые из повторяющихся звеньев формулы (I), содержащихся в сополимере.
Отношение количества повторяющихся звеньев формулы (I) к количеству повторяющихся звеньев формулы (II), как правило, варьирует от 20:1 до 1:2, предпочтительно, от 10:1 до 1:1 и более предпочтительно, от 7:1 до 3:1.
Относительно расположения повторяющихся звеньев (I) и (II), обозначенных выше, сополимеры согласно изобретению могут быть статистическими сополимерами, сополимерами, содержащими сегменты полимеризованных звеньев одного типа (т.е. сегменты, содержащие звенья формулы (I), и/или сегменты, содержащие звенья формулы (II)), градиентными сополимерами или блоксополимерами. Блоксополимеры особенно предпочтительны.
Термин «блоксополимер» используется здесь в соответствии с его установленным значением в данной области и относится к сополимерам, где повторяющиеся звенья определенного типа организованы в блоки, т.е. повторяющиеся звенья одного типа полимеризованы последовательно непосредственно одно за другим, в отличие от, например, последовательностей случайно чередующихся повторяющихся звеньев различных типов. Другими словами, блоки в блоксополимере, такие как блоки А и В, о которых будет говориться ниже, представляют полимерные соединения сами по себе, полученные путем полимеризации идентичных мономеров или имеющих схожие характеристики.
Блоксополимер, который будет использоваться в соответствии с настоящим изобретением, содержит по меньшей мере один блок А поли(2-оксазолин)а, состоящий из повторяющихся звеньев формулы (I), как определено выше (который является гидрофильным благодаря присутствию соответствующих звеньев) и по меньшей мере один блок В поли(2-оксазолин)а, состоящий из повторяющихся звеньев формулы (II), как определено выше (который является более гидрофобным, чем блок А, благодаря присутствию соответствующих звеньев).
Блоксополимер по изобретению может называться амфифильным сополимером благодаря присутствию по меньшей мере одного гидрофильного участка (блок А) и по меньшей мере одного менее гидрофильного или более гидрофобного участка (блок В).
Предпочтительно, чтобы хотя бы один блок А блоксополимера, более предпочтительно, все блоки А в случае, если их много, был(были) представлены формулой (II):

где RAпредставлен метильной или этильной группой, предпочтительно, метильной группой, и n указывает число повторяющихся звеньев в блоке А. Предпочтительно, n равен 5 или более, более предпочтительно, 10 или более, наиболее предпочтительно, 20 или более. В большинстве случаев n менее 300, более предпочтительно, 200 или менее, еще более предпочтительно, 100 или менее, в особенности 50 или менее.
Предпочтительно, чтобы хотя бы один блок B блоксополимера, более предпочтительно, все блоки В, в случае если их много, - был/были представлены структурой (III):

где RB- это C3-20углеводородная группа, предпочтительно, C3-12углеводородная группа, более предпочтительно, C3-6углеводородная группа и в особенности предпочтительно, C4-6углеводородная группа. В качестве углеводородных групп предпочтительны алифатические или ароматические группы, такие как алкильные группы, арильные группы или алкарильные группы. Более предпочтительны алкильные группы, такие как пропил, бутил, пентил, гексил, гептил, октил или нонил, еще более предпочтительны C4-6 алкильные группы, т.е. бутил, пентил, гексил и особенно предпочтительны бутильные группы, особенно н-бутил. Вариабельная n предпочтительно, равна 5 или более, более предпочтительно, 10 или более. В большинстве случаев n менее 300, более предпочтительно, 200 или менее или 100 или менее, и особенно предпочтительно, 50 или менее.
Блоксополимер, используемый в контексте данного изобретения в качестве системы доставки лекарственного средства, содержит по крайней мере один блок А и по крайней мере один блок B, как описано выше. Также, он может содержать один или более дополнительных блоков, отличных от A или B. Однако, предпочтительно, чтобы блоксополимер содержал только блоки А и B, которые соответствуют приведенному выше описанию. Более предпочтительно, чтобы все повторяющиеся звенья блоксополимера являлись повторяющимися звеньями формулы (I) или (II), описанными выше.
Касательно расположения блоков A и B в сополимере, используемом в контексте данного изобретения, предпочтительная структура сополимера может быть описана как (AB)mили (BA)m, где m равно 1, 2 или 3, например, ABA или BAB. Более предпочтительно, чтобы блоксополимер являлся AB или BA диблоксополимером или ABA триблоксополимером.
Таким образом, в наиболее предпочтительном варианте исполнения данного изобретения, полимер состоит из А блока(ов), состоящего из полимеризованных 2-метил-2-оксазолина или 2-этил-2-оксазолина (также упоминаемых в тексте как «поли(2-метил-2-оксазолин)овые блоки» или «поли(2-этил-2-оксазолин)овые блоки») и блока(ов) B, состоящего из полимеризованного 2-(C4-6 алкил)-2-оксазолина. Еще более предпочтительно, чтобы сополимер состоял из блока(ов) A, состоящего из полимеризованных 2-метил-2-оксазолина или 2-этил-2-оксазолина и блока(ов) B, состоящих из полимеризованных 2-бутил-2-оксазолина (также называемого «поли(2-бутил-2-оксазолин)овый блок»). Более предпочтительны AB или ABA ди- и триблоксополимеры с вышеуказанной структурой.
Сополимеры, используемые в контексте данного изобретения, обычно имеют среднечисловую молекулярную массу (Mn), измеренную гельпроникающей хроматографией, в пределах от 3 до 30, более предпочтительно, от 4 до 25 и наиболее предпочтительно, от 6 до 20 кг/моль. При этом индекс полидисперсности (ИПД=Mw/Mn, где Mw- средневесовая молекулярная масса) обычно менее 1,3, предпочтительно, менее 1,25 и может даже иметь значение 1,001.
Следует понимать, что композиции также включают комбинации, например смеси или комбинации двух или более разных типов сополимеров, также описанных в данном изобретении, например комбинация сополимеров, содержащих различные группы RA и/или RB, или комбинация сополимеров с различной последовательностью расположения их повторяющихся звеньев, например комбинация статистического полимера и блоксополимера.
Сополимеры, используемые в контексте данного изобретения, могут быть приготовлены общеизвестными методами полимеризации. Например, поли(2-оксазолин)ы могут быть получены путем катионной полимеризации с раскрытием цикла по механизму живых цепей. Получение статистических сополимеров, градиент сополимеров и блоксополимеров детально описано, например, R. Luxenhofer and R. Jordan, Macromolecules 39, 3509-3516 (2006), T. Bonné et al., Colloid. Polym. Sci., 282, 833-843 (2004) или T. Bonné et al. Macromol. Chem. Phys. 2008, 1402-1408, (2007).
Что касается действующего вещества (или действующего соединения), содержащегося в композициях согласно данному изобретению, следует понимать, что композиции обычно являются удобными для формулирования действующих веществ, которые являются малорастворимыми в воде, предпочтительно, гидрофобными действующими веществами или нерастворимыми в воде действующими веществами. Поэтому предпочтительны действующие вещества c растворимостью в воде, например, в деминерализованной воде при 20°C менее 1 мг/мл, предпочтительно, менее 0,1 мг/мл, или даже менее 0,01 мг/мл, и в частности, растворимостью менее чем 0,001 мг/мл. Предпочтительно, чтобы ограниченная растворимость наблюдалась в воде в пределах pH от 4 до 10.
Действующее вещество (или действующее соединение), используемое в контексте данного изобретения, предпочтительно, является биологически активным веществом (или биологически активным соединением), включая, но не ограничиваясь, вещества, используемые в терапии (т.е. лекарствами) или в диагностике, фунгицидах, инсектицидах, пестицидах или гербицидах и любыми другими соединениями, используемыми для защиты растений или урожая, такими как фитогормоны, или действующими веществами, используемыми в ветеринарии. Используемый здесь термин «действующее вещество» также включает соединения, которые подвергаются скринингу в качестве потенциальных лидеров в процессе разработки лекарственных средств или препаратов для защиты растений. Более того, настоящее изобретение включает метод определения действующих соединений, взаимодействующих с интересующей мишенью, обычно биологической мишенью, такой как белок в общем смысле, фермент или рецептор, тестом методом скрининга, включающим этапы введения в состав препарата действующего соединения согласно изобретению и проведения скрининг-теста полученной композиции.
Конкретные примеры биоактивных веществ включают, но не ограничиваются, лекарственными средствами в следующих категориях: лекарственные средства, действующие на синаптические и нейроэффекторные узловые участки, лекарственные средства, действующие на центральную нервную систему, лекарственные средства, влияющие на воспалительные процессы, лекарственные средства, влияющие на состав жидкостей организма, лекарственные средства, влияющие на почечную функцию и метаболизм электролитов, сердечно-сосудистые лекарственные средства, лекарственные средства, воздействующие на желудочно-кишечную функцию, лекарственные средства, влияющие на маточную сократительную способность, химиотерапевтические вещества для гиперпролиферативных заболеваний, в частности рака, химиотерапевтические вещества для паразитических инфекций, химиотерапевтические вещества для микробных заболеваний, противоопухолевые вещества, иммунодепрессивные вещества, лекарственные средства, воздействующие на органы кроветворения и деградации, гормоны и их антагонисты, дерматологические препараты, антагонисты тяжелых металлов, витамины и питательные вещества, вакцины, олигонуклеотиды и генные терапии. Конкретные лекарственные вещества, которые могут быть упомянуты как подходящие для использования в настоящем изобретении, включают амфотерицин В, нифедипин, гризеофульвин, таксаны, включая паклитаксел и доцетаксел, доксорубицин, дауномицин, индометацин, ибупрофен, этопозид, циклоспорин А, витамин Е и тестостерон, в частности, паклитаксел, циклоспорин А и амфотерицин В. Как упоминалось выше, конкретная полезность данного изобретения продемонстрирована для действующих веществ, которые считаются нерастворимыми в воде.
Предполагается, что композиции, содержащие комбинации, например смеси или комбинации двух или более действующих веществ, таких как два лекарственных вещества, также включены в изобретение.
Обычно предпочтительно, что сополимер образует агрегаты в композициях в соответствии с изобретением, и более предпочтительно, что образующиеся агрегаты таковы, что агрегаты сополимеров включают действующее вещество. Особенно предпочтительной формой таких агрегатов является мицелла. Мицелла, как упоминается здесь, в общих чертах является агрегатом амфифильных сополимеров с представленной гидрофильной короной, образованной гидрофильными частями сополимера, и секвестрированными гидрофобными частями упомянутого амфифильного сополимера во внутреннюю часть мицеллы. Особенно подходящими сополимерами для образования мицелл являются блоксополимеры, описанные выше как предпочтительный вариант сополимеров. Мицеллы, упоминаемые в данном изобретении, являются трехмерными структурами. Обычно мицеллы формируются, когда концентрация амфифильных молекул, их составляющих, в водной среде превышает определенное значение. Это значение называется критической концентрацией мицеллообразования (ККМ), которая может быть измерена методом флуоресцентного зонда, такого как пирен, который накапливается в гидрофобной сердцевине мицелл, сформированных при концентрациях выше ККМ. Более конкретно, мицеллы, согласно данному изобретению, формируются, например, путем самоорганизации амфифильных блоксополимеров в гидрофильной, предпочтительно, водной среде. При формировании мицелл гидрофильные области упомянутых амфифильных сополимеров находятся в контакте с окружающим растворителем, тогда как гидрофобные области обращены к центру мицеллы. В контексте данного изобретения, центр мицеллы обычно заключает в себе гидрофобное действующее вещество. Мицеллу также можно назвать «полимерной наночастицей», в связи с ее размером, измеряемым нанометром, и поскольку она образована полимером.
Сополимеры, особенно блоксополимеры, используемые в контексте данного изобретения, обычно имеют низкие значения ККМ, обычно менее 250 мг/мл. В основном, значение ККМ варьирует между 5 и 150 или даже 5 и 100 мг/л.
Согласно данному изобретению, агрегаты, особенно мицеллы различных размеров, могут быть сформированы фармацевтическими композициями согласно изобретению, в зависимости от таких факторов, как молекулярный вес используемого сополимера или объем загрузки лекарственным средством. В основном, предпочтительно, использовать агрегаты или мицеллы с размером в пределах 5-500 нм. Однако агрегаты или мицеллы размером 5-100 или 10-50 нм или даже 10-30 нм, как показано методом динамического светорассеяния, также могут быть успешно сформированы, что особенно удобно для внутривенного введения. Примечательно, что мицеллы обычно имеют узкое распределение частиц по размерам (ИПД ≤0,2 или даже ≤0,1).
Обычно агрегаты и, в частности, мицеллы формируются в воде или водной среде. Поэтому, агрегаты и, в частности, мицеллы композиции согласно изобретению, могут быть сформированы, например, методом растворения тонких пленок. В данном методе сополимер и действующее вещество растворяются в общем растворителе, таком как ацетонитрил или диметилсульфоксид. После удаления растворителя (например, в потоке инертного газа, мягким нагреванием и/или под действием низкого давления), пленки, образованные из полимера и из действующего вещества, могут быть легко растворены в воде или водных растворителях и могут быть доведены до нужного состояния при повышении температуры. После растворения пленок происходит формирование агрегатов, преимущественно мицелл. Стабильность формирующихся агрегатов позволяет высушить полученный раствор для получения порошка. Например, сушку можно проводить путем лиофилизации, обычно без необходимости использовать криозащитные вещества, с возможностью дальнейшего восстановления в воде или водных растворителях без уменьшения емкости загрузки или нарушения целостности частиц.
При использовании описанных выше сополимеров, композиции согласно изобретению обычно формируют агрегаты, растворимые в воде или в водных растворах, где они стабильны по крайней мере 12 часов при комнатной температуре и более высоких температурах, особенно при температурах ниже 40°C, что позволяет парентеральное введение упомянутых композиций животным в общем и человеку в частности.
Соотношение масс действующего(-их) вещества(-в) к сополимеру(-ам) в композициях согласно изобретению составляет обычно 1:20 или выше, в том числе 1:10 и выше. Предпочтительное значение весового соотношения равно по крайней мере 1:9, более предпочтительно, по крайней мере 2:8, еще более предпочтительно, по крайней мере 3:7 и наиболее предпочтительно, - 4:6. В основном, соотношение равно 1:1 или менее, при необходимости, 8:10 или менее.
Композиции согласно изобретению могут быть успешно получены активной загрузкой или лекарственной загрузкой (т.е. отношение массы действующего вещества или лекарственного вещества к суммарной массе действующего вещества и блоксополимера выражается в процентах) на 10% или более, предпочтительно, на 25% или более, еще более предпочтительно, на 30% или более, еще более предпочтительно, на 35% или более и особенно на 40% или более. Примечательно, что достаточная растворимость в воде может быть, в конечном счете, получена даже для композиций согласно изобретению, имеющих настолько высокие уровни лекарственной загрузки даже для действующих веществ с растворимостью 10 мкг/мл или даже менее 5 мкг/мл, таких как паклитаксел. Таким образом, к примеру, композиции согласно изобретению позволяют солюбилизировать более 7 мг/мл паклитаксела, в частности 8 мг/мл или более, в воде и водных растворах.
Высокая емкость даже для гидрофобных действующих веществ совпадает с необычными значениями, полученными при измерении спектров флуоресценции пирена в фармацевтических композициях согласно изобретению. Отношение интенсивностей пиков I1 и I3 в спектре флуоресценции пирена является мерой полярности (K. Kalyanasundaram, J.K. Thomas, J. Am. Chem. Soc. 1977, 99, 2039-2044) окружения пиреновой пробы. В водной или схожей по полярности среде это отношение обычно варьирует между 1,6 и 1,9 (K. W. Street, Jr., W. W. Acree, Jr. Analyst 1986, 111, 1197-1201). В присутствии полимерных мицелл пирену становится доступна менее полярная среда и отношение I1/I3 обычно уменьшается параллельно с увеличением интенсивности флуоресценции. Примечательно, что в случае сополимеров, и в особенности, блоксополимеров, описанных здесь, может наблюдаться противоположный эффект, когда отношение I1/I3 увеличивается до значений выше 2, предпочтительно, 2,1 или даже выше 2,2, например, до 2,35.
Благодаря высокой эффективности солюбилизации описанных выше сополимеров и, в частности, блоксополимеров, для композиций, в частности для фармацевтических композиций, в соответствии с изобретением находящихся в форме водных растворов, в принципе достаточно, если количество сополимера варьирует от настолько низкой концентрации как 1 мг/мл, предпочтительно, 2 мг/мл, до 100 мг/мл, предпочтительно, 50 мг/мл или 20 мг/мл. Поскольку сополимеры являются биосовместимыми, т.е. нетоксичными, и быстро выводятся при почечном очищении крови, высокие концентрации не являются ограничивающим фактором, но обычно не требуются. Это позволяет значительно уменьшить количество солюбилизаторов при парентеральном применении лекарства, по сравнению с препаратами гидрофобных лекарственных средств, имеющихся на рынке, и, таким образом, уменьшить риск побочных эффектов.
Фактически, описанный блоксополимер способен снизить необходимое количество носителя для растворения паклитаксела примерно в 100 и в 9 раз по сравнению с Cremophor EL/этанол (CrEL) и AbraxaneTM,соответственно.
Более того, для композиций, описанных изобретением, емкость загрузки (т.е. количество растворенного действующего вещества/количество исходно используемого действующего вещества)*100%) может быть равна 100% и, как правило, очень высока (>80%). Это является серьезным преимуществом, так как высокая эффективность загрузки очень важна для коммерческого применения для снижения цены производства.
Как описано выше, сополимеры согласно данному изобретению могут быть использованы для повышения растворимости в воде или водных растворах действующих веществ, являющихся малорастворимыми в воде, преимущественно гидрофобными действующими веществами или нерастворимыми в воде действующими веществами, и, таким образом, они действуют как солюбилизатор для данных соединений.
В результате, в предпочтительном варианте исполнения настоящего изобретения, композиции по данному изобретению также содержат воду в виде водного раствора, эмульсии или суспензии, и в частности, предпочтительно, что они являются водными растворами действующего вещества и сополимера. Следует понимать, что термин “раствор” в конкретном контексте включает коллоидные растворы в виде, как их могут образовывать мицеллы в воде. Тем не менее, так как сополимеры, используемые в контексте данного изобретения, позволяют лиофилизацию композиций без снижения активности и стабильности действующего вещества и без необходимости использовать криопротектор, порошки, особенно лиофилизированные порошки, формируют другой предпочтительный вариант исполнения композиций согласно изобретению. Эти порошки могут быть восстановлены в воде или водных растворах.
Таким образом, сополимеры, основанные на поли(2-оксазолин)ах, описанные выше, могут служить, например, универсальной системой доставки с высокой загрузкой для гидрофобных и структурно различных лекарственных веществ, таких как паклитаксел, циклоспорин А и амфотерицин В.
Другие формы данного изобретения подытожены в следующих пунктах:
1. Фармацевтические композиции, состоящие из
(а) по крайней мере одного биосовместимого водорастворимого амфифильного блоксополимера, состоящего по крайней мере из одного блока А и по крайней мере одного блока B, где А является гидрофильным полимером, выбранным из гидрофильных поли(2-оксазолин)ов и B выбран из амфифильных или гидрофобных поли(2-оксазолин)ов и
(b) гидрофобное биоактивное соединение, которое формирует агрегаты, растворимые в воде или водных растворах, которые стабильны по крайней мере 12 часов при комнатной температуре и более высоких температурах, особенно при температурах ниже 40°C, что обеспечивает парентеральное применение упомянутых композиций для животных в общем и человека в частности.
2. Фармацевтические композиции по п.1, где B представлен следующей структурной формулой (III):

где RB - гидрофобная боковая цепь (содержащая насыщенную алифатическую цепь, содержащая ненасыщенную алифатическую цепь, насыщенное алифатическое кольцо или ненасыщенное алифатическое кольцо или их комбинации) и n выбирается равной от 1 до 300.
3. Фармацевтическая композиция по любому из пп.1 или 2, где гидрофобное биоактивное соединение представлено пептидами, пептоидами, полиенами, макроциклами, гликозидами, терпенами, терпеноидами, алифатическими и ароматическими соединениями и их производными и другими соединениями, имеющими растворимость в воде или водной среде при pH в пределах 4-10, равной менее 1 мг/мл, предпочтительно, менее 100 мкг/мл, еще более предпочтительно, менее 50 мкг/мл и наиболее предпочтительно, менее 10 мкг/мл.
4. Фармацевтические композиции по любому из пп.1-3, где гидрофобное биоактивное соединение выбирается из амфотерицина B, нифедипина, гризеофульвина, паклитаксела, докорубицина, дауномицина, индометацина, ибупрофена, этопозида и циклоспорина А.
5. Фармацевтические композиции по любому из пп.1-3, где гидрофобное биоактивное соединение - паклитаксел.
6. Фармацевтические композиции по любому из пп.1-5, где блоксополимеры AB соединены через стабильные или нестабильные сшивки для формирования соединений, которые могут быть описаны как (AB)m, где m варьирует от 2 до 100, формируя, например, линейные или звездчатые блоксополимеры, графт блоксополимеры, дендримеры или гиперразветвленные блоксополимеры.
7. Фармацевтические композиции по любому из пп.2-6, в которых гидрофобная боковая цепь R состоит из 3-6 атомов углерода.
8. Фармацевтические композиции по любому из пп.1-7, где амфифильный блоксополимер содержит блок, который частично или полностью состоит из повторяющихся звеньев производных 2-бутил-2-оксазолина.
9. Фармацевтические композиции по любому из пп.1-8, где гидрофильный полиоксазолин представлен поли(2-метил-2-оксазолин)ом или поли(2-этил-2-оксазолин)ом.
10. Фармацевтические композиции по любому из пп.1-9, где растворимые агрегаты в водной среде имеют размер от 5 до 200 нм, предпочтительно, 10-100 нм.
11. Фармацевтические композиции по любому из пп.1-10, включающие гидрофобное биоактивное соединение и амфифильный блоксополимер в весовом соотношении по крайней мере 1:9, предпочтительно, 2:8, более предпочтительно, 3:7 и наиболее предпочтительно, 4:6.
Благодаря присущей многофункциональности фармацевтических композиций согласно предпочтительному варианту исполнения данного изобретения при включении биоактивных веществ/соединений, следует понимать, что композиции подходят для лечения или профилактики широкого спектра заболеваний или расстройств, таких как рак, нейродегенеративные заболевания, гепато-билиарные заболевания, сердечно-сосудистые заболевания и заболевания легких. Настоящее изобретение также предусматривает применение блоксополимеров, как определено выше, для приготовления фармацевтической композиции для лечения или профилактики любых из этих заболеваний. Более того, изобретением также предусмотрено диагностическое применение этих композиций.
Термин «рак» в контексте данного изобретения обозначает класс заболеваний или расстройств, характеризуемых неконтролируемым клеточным делением и способностью к распространению либо путем непосредственного инвазивного прорастания в соседние ткани, либо путем внедрения в удаленные ткани при метастазировании (при переносе раковых клеток кровяным потоком или лимфатической системой).
Термин «нейродегенеративные заболевания» в контексте данного изобретения обозначает класс заболеваний или расстройств, при которых происходит разрушение нейронов и в связи с неспособностью организма к регенерации нейронов (не считая небольшого числа нейронных стволовых клеток), клетки мозга или спинного мозга, например, не могут быть полноценно восстановлены. Сопутствующими синдромами у больных являются атаксия и слабоумие.
Термин «желудочно-кишечное и гепато-билиарное заболевание» в контексте данного изобретения обозначает класс заболеваний или расстройств, действующих на печень, желчный пузырь и желчные протоки. К таким заболеваниям и расстройствам относятся, например, цирроз, гепатиты, вирусный гепатит, опухоли печени, жировой метаморфоз печени, поликистоз печени, болезнь Крона, язвенный колит, холангиокарценома.
Термин «сердечно-сосудистые заболевания» в контексте данного изобретения обозначает класс заболеваний или расстройств, действующих на сердце и/или сосуды.
Термин «заболевания легких» в контексте данного изобретения обозначает класс заболеваний, действующих на дыхательную систему, которые могут быть классифицированы как обструкционные, т.е. препятствующие потоку воздуха в и из легких, и рестрективные, т.е. снижающие функциональный объем легких, состояния. К таким заболеваниям относятся, например, астма, бронхиты, асбестозы, фиброзы, саркоидозы, рак легких, пневмония, отек легких и легочная гипертензия.
Фармацевтические композиции по данному изобретению могут быть необязательно составлены совместно с одним или несколькими применяемыми в фармацевтике вспомогательными веществами, такими как носители, разбавители, наполнители, разрыхлители, смазывающие вещества, связующие компоненты, красители, пигментные вещества, стабилизаторы, консерванты и/или антиоксиданты.
Фармацевтические композиции могут быть приготовлены по технологиям, хорошо известным в данной области, таким как технологии, опубликованные в 20-ом издании Фармацевтических Наук под редакцией Ремингтона. Фармацевтические композиции могут быть приготовлены для перорального, парентерального, такого как внутримышечного, внутривенного, подкожного, интрадермального, внутриартериального, ректального, наружного, пульмонального или вагинального введения. Лекарственная форма для перорального применения может быть представлена в виде таблеток, покрытых или не покрытых оболочкой, мягких желатиновых капсул, твердых желатиновых капсул, пастилок, лепешек, растворов, эмульсий, суспензий, сиропов, эликсиров, порошков и гранул для растворения, диспергируемых порошков и гранул, лекарственных жевательных резинок, жевательных таблеток и шипучих таблеток. Лекарственные формы для парентерального применения включают растворы, эмульсии, суспензии, дисперсии, а также порошки и гранулы для растворения. Лекарственная форма эмульсий является предпочтительной для парентерального применения. Лекарственные формы для ректального и вагинального применения включают свечи и овулы. Лекарственная форма для пульмонального применения/пульмональной доставки может быть в виде ингаляции или инсуффляции, например, как ингалятор отмеренных доз. Лекарственные формы для наружного применения могут быть в виде кремов, гелей, мазей, масел, пластырей и трансдермальных систем доставки.
Введение пациенту фармацевтических композиций по данному изобретению может проводиться любым удобным путем, как системно/периферически, так и местно, включая, но не ограничиваясь, один или более из таких, как пероральное (например, в виде таблеток, капсул или применяемых во внутрь растворов), местно (например, трансдермально, интраназально, окулярно, трансбуккально или сублингвально), парентеральное (например, методом инъекций или инфузий, включая к примеру подкожное, кожное, внутримышечное, внутривенное, внутриартериальное, интракардиальное, интратекальное, внутрипозвоночное, внутрикапсулярное, подкапсулярное, интраорбитальное, интраперитонеальное, интратрахеальное, под кутикулу, внутрисуставное, субарахноидальное или подложечное введения с помощью, например, импланта депо, например, подкожно или внутримышечно), легочное (например, путем ингаляции или инсульфации препарата, используя, к примеру, аэрозоль, например, через рот или нос), гастроинтестинальное, внутриматочное, внутриглазное, подкожное, глазное (включая интравитреальное или межкамерное), ректальное и вагинальное введение. Пероральное и парентеральное, в особенности внутривенное введение в общем предпочтительно, так как, согласно изобретению, композиции предоставляют достаточную растворимость и биодоступность для этих методов введения, даже в случае, когда используются гидрофобные действующие вещества.
Если фармацевтические препараты вводятся парентерально, тогда примеры такого введения включают одно или более из внутривенного, внутриартериального, интраперитониального, интратекального, интравентрикулярного, внутриматочного, подложечного, интракраниального, внутримышечного или подкожного введения соединений фармацевтических композиций, и/или используя методы инфузии. В случае парентерального введения, композиции должны использоваться в виде стерильных водных растворов, которые могут содержать другие вещества, например, достаточно солей и глюкозы, чтобы раствор был изотоничен по отношению к крови. Эти водные растворы при необходимости могут быть соответствующе забуферены (предпочтительно, при рН от 3 до 9). Приготовление подходящих парентеральных препаратов в стерильных условиях может быть легко достигнуто путем стандартных фармацевтических методов, известных специалистам в данной области.
Фармацевтические композиции могут также вводиться перорально в виде таблеток, капсул, овул, эликсиров, растворов или суспензий, которые могут содержать вкусовые или цветовые добавки для немедленного, замедленного, модифицированного, пролонгированного, прерывистого или контролируемого высвобождения.
Таблетки могут содержать такие носители как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, двуосновный фосфат кальция и глицин, дезинтегрирующие агенты, такие как крахмал (предпочтительно, кукурузный, картофельный или крахмал кассавы), натрия гликолят крахмала, натрия кросскармелоза и определенные комплексы силикатов и связующие компоненты для грануляции, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (ГПМЦ), гидроксипропилцеллюлоза (ГПЦ), сахароза, желатин и аравийская камедь. Кроме того, смазывающие компоненты, такие как стеарат магния, стеариновая кислота, глицерил бегенат и тальк, могут быть включены. Твердые композиции сходного типа также могут быть использованы как наполнители в желатиновых капсулах. Предпочтительные носители в данном случае включают лактозу, крахмал, целлюлозу, молочный сахар или высокомолекулярные полиэтиленгликоли. В водных суспензиях и/или эликсирах действующее вещество может быть смешано с различными подсластителями или вкусовыми добавками, цветовыми субстанциями или красителями, с эмульгирующими и/или суспендирующими веществами, а также с растворителями, такими как вода, этанол, пропиленгликоль и глицерин, а также их комбинациями.
Альтернативно, фармацевтические композиции могут применяться в виде свечей или вагинальных суппозиториев, или применяться наружно в форме гелей, гидрогелей, лосьонов, растворов, кремов, мазей или присыпок. Композиции данного изобретения могут также применяться дермально или трансдермально, например, при использовании кожных пластырей.
Фармацевтические композиции могут, в том числе, вводиться пульмональным или ректальным путем, а также оккулярно. При введении оккулярно, они могут быть сформулированы в виде микроизмельченных изотонических суспензий в физиологическом растворе с нормализованным pH или, предпочтительно, в виде изотонических растворов с нормализованным pH на основе физиологического раствора, необязательно в комбинации с консервантом, таким как бензиламмония хлорид. С другой стороны, композиции могут быть сформулированы в виде мази, такой как петролатум.
Для местного применения на коже, фармацевтические композиции могут быть сформулированы в форме мази, содержащей суспендированное или растворенное в них действующее вещество, например, смешаны с одним или более из следующих веществ: минеральное масло, жидкий петролатум, белый петролатум, пропиленгликоль, неионный эмульгированный воск и вода. С другой стороны, они могут быть сформулированы как специальный лосьон или крем, суспендированный или растворенный, к примеру, в смеси одного или нескольких из следующих веществ: минеральное масло, сорбитанмоностеарат, полиэтиленгликоль, жидкий парафин, полисорбат 60, цетиловые сложные эфиры воска, 2-октилдодеканол, бензиловый спирт и вода.
Учитывая хорошие солюбилизирующие свойства композиций по данному изобретению, следует понимать, что предпочтительно, они должны вводиться в виде и/или в соответствии со способами введения, которые требуют растворения биологически активного ингредиента в воде.
Предполагается, что в типичной ситуации врач определяет дозировку фармацевтических композиций, наиболее соответствующих конкретному субъекту. Уровень конкретной дозировки и частота применения у конкретного субъекта может варьировать и зависит от ряда факторов, включая болезнь или расстройство, подлежащее лечению или профилактике, тип применяемого биоактивного соединения, метаболическую стабильность и период действия соединения, возраст, вес тела, общее состояние здоровья, пол, диету, способ и время введения, скорость выведения препарата из организма, применение одновременно с другими лекарственными средствами, степень тяжести заболевания и тип проходимой субъектом терапии.
Предлагаемая, но не ограничивающая доза композиций по данному изобретению для использования у человека (имеющего вес примерно 70 кг) может быть от 0,1 мкг до 10 г, предпочтительно, от 0,1 мг до 0,5 г, в зависимости от массы действующего вещества (т.е. лекарственного средства) в стандартной дозе. Стандартная доза может применяться, например, от 1 до 4 раз в день. Доза должна зависеть от способа применения. Следует понимать, что может возникнуть необходимость рутинного подбора дозировки, в зависимости от возраста и веса пациента/субъекта, а также от серьезности состояния, подлежащего лечению. Конкретная доза и способ применения должны назначаться по усмотрению лечащим врачом или ветеринаром.
Рассматриваемые данным изобретением субъекты или пациенты, нуждающиеся в лечении или профилактике, которым вводятся композиции по данному изобретению, относятся к млекопитающим. Помимо лечения людей, данное изобретение предусматривает лечение экономически и агрономически важных млекопитающих. Неограничивающими примерами агрономически важных животных могут служить: овцы, крупный рогатый скот и свиньи, тогда как, например, кошки и собаки могут рассматриваться как экономически важные животные. Предпочтительно, рассматриваемый субъект/пациент - человек.
Термин «лечение расстройства или заболевания», применяемый здесь, широко распространен в данной области. «Лечение расстройства или заболевания» предполагает, что расстройство или заболевание было диагностировано у пациента/субъекта. Пациент/субъект, страдающий от заболевания или расстройства, обычно проявляет специфичные клинические и/или патологические симптомы, которые, могут быть легко соотнесены с конкретным патологическим состоянием (т.е. поставлен диагноз заболевания или расстройства) специалистом.
«Лечение расстройства или заболевания» может, например, приводить к остановке прогрессии расстройства или заболевания (т.е. не происходит ухудшения симптомов) или замедление в прогрессии расстройства или заболевания (в случае если задержка в прогрессии является лишь временной). «Лечение расстройства или заболевания» может также приводить к частичному ответу (т.е. улучшение симптомов) или полному ответу (т.е. исчезновение симптомов) у субъекта/пациента, страдающего данным заболеванием или расстройством. «Улучшение» при расстройстве или заболевании может, например, приводить к задержке прогрессии заболевания или расстройства или приостановке в прогрессии заболевания или расстройства. За полным или частичным ответом на лечение может следовать рецидив. Следует понимать, что конкретный субъект/пациент может иметь широкий спектр ответов на лечение (например, такие, как перечислены выше). Лечение расстройства или заболевания может в том числе иметь целебное действие (предпочтительно, приводить к полному ответу и, в конечном итоге, к выздоровлению от расстройства или заболевания) или паллиативному действию (включая исчезновение симптомов).
Также, термин «предупреждение расстройства или заболевания» используемый здесь, широкоупотребим в данной области. Например, предупреждение заболевания или расстройства может быть полезно для пациента/субъекта, для которого предполагается предрасположенность к появлению заболевания или расстройства, как упоминается в контексте. Например, указанный субъект/пациент может иметь предрасположенность или склонность к заболеванию или расстройству, включая, но не ограничиваясь, наследственной предрасположенностью. Такая предрасположенность может быть определена стандартными методами, используя, например, генетические маркеры или фенотипические индикаторы. Следует понимать, что расстройство или заболевание, подлежащее предупреждению по данному изобретению, не были или не могут быть диагностированы у конкретного пациента/субъекта (например, упомянутый пациент/субъект может не проявлять клинических или патологических симптомов). Таким образом, «предупреждение» подразумевает применение соединений согласно данному изобретению до появления или диагностирования любых клинических и/или патологических симптомов или до того как они могут быть диагностированы или определены при посещении врача.
В этом описании цитируется большое количество документов, включая статьи журналов и патенты. Сообщаемая данными документами информация, хотя не может рассматриваться как патентуемая данным изобретением, включена путем ссылки на них целиком. Точнее говоря, все цитируемые документы включены при помощи ссылок в той же степени, как если бы цитата каждого отдельного документа специально и индивидуально указывалась.
Примеры
Более детально данное изобретение будет проиллюстрировано в следующих примерах. Следует отметить, что включенные здесь описания приводятся не для ограничения распространения применения данного изобретения.
1. Общие материалы и методы
Все вещества для приготовления полимеров были приобретены в Aldrich (Штайнхайм, Германия) и Acros (Геел, Бельгия) и были использованы в том виде, как получены, если отдельно не оговорено другое. 2-Бутил-2-оксазолины (БуОкс) были приготовлены как было недавно описано (Huber, S. and Jordan, R., Colloid Polym. Sci. 286, 395-402 (2008)). Метил трифторметилсульфонат (МеОТф), 2-метил-2-оксазолин (МеОкс), 2-этил-2-оксазолин (ЭтОкс), ацетонитрил (АЦН) и другие растворители для синтеза полимеров были высушены путем нагревания в обратном холодильнике над СаН2 в атмосфере сухого азота и последующей дистилляцией перед использованием. ЯМР спектры были получены на Bruker Avance III 400, Bruker ARX 300 или Bruker AC 250 при комнатной температуре. Спектры были откалиброваны, используя сигналы растворителя (CDCl3, 7,26 м.д., D2O 4,67 м.д.). Гельпроникающая хроматография (ГПХ) осуществлялась на системе Waters (насос модели 510, ИК детектор модели 410, предколонка Plgel и две PL Resipore колонки (3 мкм, 300×7,5 мм) с N,N-диметилацетамидом (ДМА) (75 ммоль/л LiBr, 80°C, 1 мл/мин) в качестве элюента, и откалибрована против ПММА стандартов. Динамическое светорассеяние осуществлялось на приборе Zetasizer Nano-ZS (Malvern Instruments Inc., Саусборо, Массатчусетс) при комнатной температуре.
2. Методы синтеза
Полимеризации и методы выделения продуктов проводились в соответствии с ранее описанным методом (Luxenhofer, R. and Jordan, R., Macromolecules 39, 3509-3516 (2006); Bonné, T. B., et al., Colloid Polym. Sci. 282, 833-843 (2004)).
Например, получение метил-П[МеОкс27-б-БуОкс12-б-МеОкс27]-пиперидина (Р1) проводился следующим образом (здесь “Метил” означает, что полимер несет терминальную метильную группу, “П” означает, что часть в скобках является полимерной частью, “МеОкс” означает полимерные звенья, полученные при полимеризации 2-метил-2-оксазолина, индексы означают число повторяющихся звеньев в соответствующем полимерном блоке, “б” означает начало нового блока, “БуОкс” означает полимерные звенья, полученные при полимеризации 2-бутил-2-оксазолина и пиперидин является другой терминальной группой полимерной цепи):
В сухих инертных условиях 32,2 мг (0,2 ммоль, 1 экв.) метил трифторметилсульфоната (метил трифлат, МеОТф) и 440 мг (5,17 ммоль, 26 экв.) 2-метил-2-оксазолина (МеОкс) были растворены в 3 мл сухого ацетонитрила при комнатной температуре. Смесь была подвергнута микроволновому облучению (150 Вт максимум, 130°C) в течение 15 минут. После охлаждения до комнатной температуры, мономер второго блока, 2-бутил-2-оксазолин (256 мг, 2,01 ммоль, 10 экв.) был добавлен, и смесь была облучена таким же способом, как в первом блоке. Процедура была повторена для третьего блока с 442 мг (5,19 ммоль, 26 экв.). Наконец, Р1 был терминирован путем добавления 0,1 мл пиперидина (1,01 ммоль, 5 экв.) при комнатной температуре. После перемешивания в течение ночи, был добавлен избыток К2СО3 и смесь перемешивалась еще несколько часов. Растворитель был удален после фильтрации и к остатку были добавлены 3 мл хлороформа. После осаждения из холодного диэтилового эфира (приблизительно 10-тикратного количества по отношению к раствору полимера) продукт был выделен путем центрифугирования. Осаждение проводилось в трех повторностях и полученный полимер имел вид бесцветного порошка (792 мг, 67%, Mth=5,8 кг/моль) после лиофилизации из воды. ГПХ (ДМА): Mn=8,5 кг/моль (ПДИ 1,21);1H-ЯМР (CDCl3, 298 K): δ=3,45 (ушир, 255H, (N-CH2CH2)); 3,04/2,95 (м, 3H, N-CH3Ini); 2,43-1,86 (м, 212H, CO-CH3, CO-CH2, CH2Pid); 1,56 (ушир, 29H, CH2-CH2-CH2-); 1,32 (ушир, 28H, -CH2-CH3); 0,91 м.д. (ушир, 37H, -CH3бутил), Mn=6,2 кг/моль (МеОкс27-б-БуОкс12-б-МеОкс27).
Получение метил-П[МеОкс37-б-БуОкс23-б-МеОкс37]пиперидина (Р2)
Р2 был получен соответствующим образом, используя 24 мг МеОТф (0,146 ммоль, 1 экв), 333 мг МеОкс (3,91 ммоль, 27 экв, 1-й блок), 286 мг БуОкс (2,25 ммоль, 15 экв, 2-ой блок) и 333 мг МеОкс (3,91 ммоль, 27 экв, 3-й блок) и 80 мкл пиперидина в качестве завершающего реагента. Полученный продукт имел вид бесцветного твердого вещества (795 мг, 83%, Mth=6,6 кг/моль).
ГПХ (ДМА): Mn=10,4 кг/моль (ПДИ 1,18);1H-ЯМР (CDCl3, 298 K): δ=3,44 (ушир, 360H, (N-CH2CH2)); 3,03/2,94 (м, 3H, N-CH3Ini); 2,33-1,9 (м, 279H, CO-CH3, CO-CH2, CH2Pid); 1,55 (ушир, 47H, CH2-CH2-CH2-); 1,32 (ушир, 45H, -CH2-CH3); 0,91 м.д. (ушир, 68H, -CH3бутил), Mn=9,3 кг/моль (МеОкс37-б-БуОкс23-б-МеОкс37).
Получение метил-П[МеОкс36-б-БуОкс30-б-МеОкс36]пиперидина (Р3)
Р3 был получен соответствующим образом, используя 24,7 мг метил трифлата (0,150 ммоль, 1 экв.) и 334 мг 2-метил-2-оксазолина (3,9 ммоль, 26 экв., 1-й блок). Аликвота в 136 мг (5% мас./мас.) реакционной смеси была отобрана для анализа первого блока с помощью ЯМР и ГПХ. То же было сделано после второго блока (364,4 мг БуОкс; 2,87 ммоль, 20 экв., 10% мас./мас. были отобраны для анализа). Третий блок (306,9 мг МеОкс; 3,6 ммоль, 28 экв.) был добавлен, полимеризация была остановлена добавлением 80 мкл пиперидина и полученный продукт имел вид бесцветного твердого вещества (598 мг, 65%, Mth=6,6 кг/моль).
ГПХ (ДМА): Mn=9,9 кг/моль (ПДИ 1,23);1H-ЯМР (CDCl3, 298 K): δ=3,45 (ушир, 405H, (N-CH2CH2)); 3,03/2,95 (м, 3H, N-CH3Ini); 2,43-1,86 (м, 329H, CO-CH3, CO-CH2, CH2Pid); 1,57 (ушир, 63H, CH2-CH2-CH2-); 1,32 (ушир, 60H, -CH2-CH3); 0,91 м.д. (ушир, 88H, -CH3бутил), Mn=10,0 кг/моль (МеОкс36-б-БуОкс30-б-МеОкс36).
Получение метил-П[ЭтОкс50-б-БуОкс19]пиперазина (Р4)
Р4 был получен соответствующим образом из 10 мг МеОТф (61 мкмоль, 1 экв.), 321 мг 2-этил-2-оксазолина (ЭтОкс, 3,24 ммоль, 53 экв., 1-й блок) и 157 мг БуОкс (1,23 ммоль, 20 экв., 2-ой блок), используя 150 мг пиперазина в качестве завершающего агента. Для осаждения была использована растворяющая смесь циклогексана и диэтилового эфира (50/50 по объему). Полученный продукт был в виде бесцветного твердого вещества (выход 0,36 г, 77%, Mth=7,8 кг/моль).
ГПХ (ДМА): Mn=11,5 кг/моль (ПДИ 1,09);1H-ЯМР (CDCl3, 298 K): δ=3,45 (ушир, 276H, (N-CH2CH2)); 3,04/2,95 (м, 3H, N-CH3Ini); 2,5-2,2 (м, 144H, CO-CH2-CH3, CO-CH2, CH2Pid); 1,58 (ушир, 37H, CH2-CH2-CH2-); 1,34 (ушир, 41H, -CH2-CH3); 1,11 (ушир, 151H, CO-CH2-CH3); 0,91 м.д. (ушир, 56H, -CH3бутил), Mn=7,5 кг/моль (ЭтОкс50-б-БуОкс19).
3. Измерение флуоресценции пирена
ККМ была определена стандартным методом. Коротко, раствор пирена в ацетоне (2,5 мМ) был добавлен во флаконы и растворитель выпаривали. Растворы полимеров соответствующих концентраций в экспериментальном растворе были добавлены в те же флаконы таким образом, что конечная концентрация пирена была 5×10-7 М. Растворы инкубировали при 25°С (>2 ч) и спектр флуоресценции пирена был измерен на Fluorolog3 (HoribaJobinYvon) при λвозб=333 нм, λисп=360-400 нм, ширина щели (возб) = ширина щели (исп) = 1 нм, ширина шага измерения 0,5 нм. Обычно усреднялись 5 спектров для каждого значения (время интеграции 0,1 сек, если необходимо усреднялись 10 спектров с 0,2 сек интеграцией), ККМ определяется как та концентрация, при которой наблюдается резкое увеличение интенсивности флуоресценции. Более того, интенсивность флуоресценции полосы I1 сравнивалась с интенсивностью полосы I3, что позволяет оценить полярность окружения пиреновой пробы. Формирование димеров в электронно-возбужденном состоянии не было обнаружено.
Используя данный подход, мы установили низкие критические концентрации мицелообразования (ККМ), разнящиеся от 100 мг/л (15 мкМ, Р1), 20 мг/л (2,7 мкМ, Р2), 7 мг/л (1 мкМ, Р3) до 6 мг/л (0,7 мкМ, Р4), соответственно (см. фиг.1).
На фиг.1 представлена интенсивность флуоресценции и отношения I1/I3 растворов пирена (5×10-7 М в фосфатно-солевом буфере) как функция концентрации блоксополимеров, используемых в контексте изобретения, при 25°C.
4. Исследования солюбилизации лекарственных средств
4.1 Солюбилизация паклитаксела (PTX)
Растворы полимеров с лекарственным средством были приготовлены по методу тонких пленок. Соответствующие количества полимера и паклитаксела (Sigma-Aldrich, Сент-Луис, Миссури, номер заказа Т7191)(исходный раствор 5-8 мг/мл в ацетонитриле или этаноле) были растворены в минимальных количествах ацетонитрила или этанола, соответственно. После полного удаления растворителя, твердая пленка полимера и лекарственного средства была смочена рабочим буфером или деионизированной водой. Типовая процедура проводится следующим образом:
Растворитель был удален в потоке воздуха или при слабом нагревании и пленки были подвержены 0,2 мбар по крайней мере в течение 3 часов, чтобы удалить следы растворителя. Затем 200 мкл рабочего буфера (водный раствор, содержащий 122 мМ NaCl, 25 мМ Na2CO3, 10 мМ HEPES, 10 мМ глюкозы, 3 мМ KCl, 1,4 мМ CaCl2 и 0,4 мМ K2HPO4, рН=7,4) были добавлены, чтобы получить конечную концентрацию полимера. При более высоких концентрациях паклитаксела растворение было облегчено путем инкубации растворов при 50-60°С обычно в течение 5-10 минут. Прозрачные растворы были отфильтрованы через ВЭЖХ фильтры для шприцев (размер пор 0,45 мкм) и подвергнуты анализу ВЭЖХ (см. ниже). Замена относительно токсичного ацетонитрила на более инертный этанол в качестве общего растворителя до образования пленки не снизила эффективность загрузки.
Была предпринята попытка растворить 4, 7 и 10 мг/мл паклитаксела в 10 мг/мл Р2. Вплоть до концентраций паклитаксела 7 мг/мл были получены прозрачные растворы после непродолжительного слабого нагревания (приблизительно 40°C). При этих условиях, солюбилизация паклитаксела была полной, как подтверждено методом ВЭЖХ (см. фиг.2А).
Только при концентрации паклитаксела 10 мг/мл некоторые прозрачные кристаллы оставались нерастворенными даже после 30-ти минутного нагревания при 60°C. Тем не менее необычно большие количества паклитаксела (8,2 мг/мл) были растворены и найдены в водной фазе, другими словами, полученный препарат состоит по меньшей мере на 40% мас. из паклитаксела. Схожие результаты были получены с другими полимерами, включая Р1, который имеет всего 12 звеньев в блоке БуОкс (см. фиг.2В).
Даже при такой низкой концентрации полимера как 2 мг/мл были получены отличные эффективности загрузки и общая загрузка лекарства в 30% мас. (см. фиг.2С, D). Таким образом, сополимеры, используемые в данном изобретении, могут снизить количество носителя, необходимое для растворения паклитаксела в примерно 100 и 9 раз по сравнению с Cremophor EL/этанолом (CrEL) и AbraxaneTM, соответственно.
На фиг.2 представлены результаты солюбилизации паклитаксела с амфифильными блоксополимерами, используя метод тонких пленок А-D). Концентрация паклитаксела в растворе (столбики гистограммы) и эффективность загрузки (перекрещенные круги), полученные при использовании различных полимеров и целевые концентрации паклитаксела: А) Р2 (10 мг/мл) и 4 мг/мл, 7 мг/мл и 10 мг/мл паклитаксела; B) Р1-Р4 (10 мг/мл) и 4 мг/мл паклитаксела; C) Р3 (2 мг/мл) и 100 мкг/мл, 500 мкг/мл и 1 мг/мл паклитаксела; D) Р1-Р3 (2 мг/мл) и 500 мкг/мл паклитаксела.
Данные представлены как средние (n=3; кроме C: 1 мг/мл паклитаксела n=1 и B: Р4 n=2) ± стандартное отклонение.
4.2 Солюбилизация циклоспорина А
Солюбилизация циклоспорина А (Alexis Corporation, Сан Диего, Калифорния, номер заказа 380-002-G001) осуществлялась соответствующим образом по методу тонких пленок. С использованием Р2 и циклоспорина А были получены прозрачные и стабильные растворы.
4.3 Солюбилизация амфотерицина B
Солюбилизация амфотерицина с использованием Р2 проводилась по методу замены растворителя путем диализа. Р2 (10,2 мг) и тригидрат амфотерицина B (2,1 мг, Riedel-de Haën, Сиелц, Германия, номер заказа 46006) были растворены в 250 мкл диметилсульфоксида (ДМСО), чтобы получить прозрачный желтый раствор. Всего было добавлено 750 мкл деионизированной воды, после 100 мкл раствор помутнел. Полученная смесь была помещена в диализный пакет (MWCO 3500 г/моль). Раствор диализировали против 2 л деионизированной воды (воду меняли через 2, 4 и 22 часа). После суммарно 50 часов, суспензию (4 мл) собрали из пакета. Аликвоту в 500 мкл отфильтровали (0,45 мкм), чтобы избавиться от частиц и прозрачный желтый раствор был лиофилизирован с получением 1 мг желтого пенообразного твердого вещества. Остаток был растворен в 200 мкл ДМСО, и количество амфотерицина В было определено спектрофотометрическим путем измерения абсорбции при 410 нм. Диализированный раствор содержал 366 мкг амфотерицина В (18% мас./мас., по отношению к Р2). Другая аликвота 1 мл была лиофилизирована (2,2 мг желтой пены) и впоследствии растворена в 100 мкл деионизированной воды. Пена полимера и лекарственного средства быстро растворилась полностью с образованием ярко-желтого раствора с низкой вязкостью. Таким образом, 3,7 мг/мл амфотерицина B может быть солюбилизировано с использованием только 18,3 мг/мл Р2 без использования криозащитных веществ. Используя тот же метод, водная растворимость амфотерицина B была определена равной приблизительно 0,4 мкг/мл.
4.4 ВЭЖХ анализ солюбилизации лекарственных веществ
ВЭЖХ проводилась при изократичных условиях на системе Shimadzu, включающей SCL-10A системный регулятор, SIL-10A автоинжектор, SPD-10AV УФ детектор и 2 LC-10 AT насоса. Nucleosil C18-5 мкл колонка (250 мм × 4 мм) использовалась как стационарная фаза, смесь ацетонитрил/вода (55/45 по объему) использовалась как подвижная фаза. Детекция проводилась при 220 нм. Количество паклитаксела в растворе полимера было рассчитано по калибровочной кривой, полученной, используя известные концентрации паклитаксела, растворенного в ацетонитриле, и анализировано соответственно.
ВЭЖХ растворов циклоспорина А, полученных по методу, описанному выше, проводилась с использованием смеси ацетонитрил/вода (90/10 по объему) как подвижной фазы при 70°С. В 5 мг/мл Р2 растворялось 1,03 мг/мл циклоспорина А. Это соответствует 82% эффективности загрузки и 17% загрузки (мас./мас.). Таким образом, используя Р2 удалось получить приблизительно 120-тикратное увеличение растворимости циклоспорина А.
4.5 Характеризация мицелл
Нагруженные лекарственным веществом мицеллы оказались очень маленькими (радиус 12-22 нм) и показали узкое распределение по размерам (полидисперсность ≈ 0,04-0,12), измеренное методом динамического светорассеяния. На фиг.3 представлены результаты измерений динамического светорассеяния нагруженных лекарственным веществом мицелл Р1 и Р2 (10 мг/мл), в обоих случаях содержащих 4 мг/мл паклитаксела.
5. Метод определения цитотоксичности; анализ на основе 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромида (МТТ)
Клетки линии MCF7/ADR (полученные из клеток рака молочной железы человека MCF7 (ATCC HT-B22) путем селекции с доксорубицином) были любезно предоставлены Y. L. Lee (William Beaumont Hospital, Роял Оак, шт. Мичиган). Клетки культивировали в среде Игла в модификации Дульбекко (DMEM) с добавлением 10% теплоинактивированной эмбриональной бычьей сыворотки (FBS) и 1% пеницилин/стрептомицина, как описано в прочих источниках. Вся среда для культивирования клеток была приобретена в Gibco Life Technologies Inc. (Гранд Айланд, шт.Нью-Йорк).
Клетки MCF7/ADR сажались в 96-луночные плашки (104 клеток на лунку) и оставлялись для прикрепления на 24 часа. Действующие растворы приготовлялись из 1 мг/мл исходного раствора полимера в рабочем буфере (содержащем 122 мМ NaCl, 25 мМ NaHCO3, 10 мМ глюкозы, 10 мМ HEPES, 3 мМ KCl, 1,2 мМ MgSO4, 1,4 мМ CaCl2 и 0,4 мМ K2HPO4, рН 7,4) путем разбавления в соответствующих количествах среды (среда Игла в модификации Дульбекко (DMEM) с добавлением 10% FBS, 25 ммоль HEPES и 1% пенициллин/стрептомицина). Клетки инкубировали 48 часов в 200 мкл действующего раствора. После удаления действующего раствора, клетки трижды промывали фосфатно-солевым буфером (ФСБ). Затем к клеткам добавили DMEM, не содержащую FBS (100 мкл/лунка), а также 25 мкл 5 мг/мл раствора 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромида (МТТ, Invintrogen, Юджин, шт. Орегон) в ФСБ и инкубировали в течение 2 часов при 37°С. Затем среду удаляли и добавляли 100 мкл растворителя (25% мас./мас. ДМФ, 20% мас./объем ДСН в воде). Пурпурный формазановый продукт растворялся в течение ночи, после чего была измерена абсорбция при 570 нм на планшет-ридере (SpectraMax M5, Molecular devices). Положительными контролями служили клетки, инкубированные только со средой; отрицательными контролями были лунки без клеток. Каждая концентрация измерялась в 4 повторениях, данные представлены как среднее ± стандартное отклонение.
На фиг.4 представлены результаты цитотоксичности полимеров Р1-Р4 в клетках с множественной лекарственной устойчивостью (MCF7/ADR, A) и нерезистентных (MCF7, В) клетках человеческой аденокарциномы и клетках Мадин-Дарби почек собаки (MDCK) после 24-х часовой (А) и 2-х часовой инкубации (В, С). Данные представлены как среднее ± стандартное отклонение (n=4). Р1-Р4 одни оказались нецитотоксичными при концентрациях до 20 мг/мл при 24-х часовой инкубации в различных клеточных линиях.
В противовес одним полимерам, мицеллы, нагруженные паклитакселом, обладают значительной концентрационно-зависимой токсичностью в человеческих и мышиных клеточных линиях опухоли (фиг.5А). К примеру, после 24-х часов инкубации с мицеллами Р2, Р3, и Р4, нагруженными паклитакселом, значения концентрации, необходимой, чтобы подавить рост клеток на 50%, IC50, в резистентных клетках (MCF7/ADR) были в пределах 10 мкМ. Коммерчески доступный препарат CrEL-PTX был использован как контроль и вызвал сравнительное подавление роста клеток. Мицеллы, нагруженные паклитакселом, могут быть лиофилизированы без необходимости использования криозащитных агентов и могут быть легко ресуспендированы в воде или физиологическом растворе, не нанося вреда загрузке лекарственного вещества, размеру частиц или эффективности лекарственного средства in vitro (фиг.5В).
На фиг.5 представлена зависимость жизнеспособности клеток с множественной лекарственной устойчивостью, MCF7/ADR, от концентрации паклитаксела. А) Сравнение препаратов паклитаксела с Р2 и Р3 показывает отсутствие значительной разницы в клеточной жизнеспособности в зависимости от материала носителя после 24-х часовой инкубации. В) На примере Р4 показано, что изменений в активности паклитаксела после лиофилизации и ресуспендирования в деионизированной воде не обнаружено. Данные представлены как среднее ± стандартное отклонение (n=3).
6. Эксперименты с животными
Все эксперименты проводились на самках С57/BI/6 мышей в возрасте 11-12 недель (Taconic Laboratories, Германтаун, шт.Нью-Йорк). Животные содержались по 5 в клетке с крышкой с фильтром воздуха в помещении с контролируемым световым циклом (12-ти часовой цикл свет/темнота) и температурой (22F1 8C). Все процедуры с животными проводились в стерильном ламинаре. Еда и вода давались неограниченно. Животные содержались в соответствии с Принципами Содержания Животных, определенными Национальным институтом здоровья, и протоколы были утверждены институционным комитетом содержания и использования животных Медицинского центра Университета Небраски. Клетки легочной карциномы Льюиса (LLC 3Т) растили в Т75 сосудах и собирались с помощью сбалансированного солевого раствора Хенкса. Суспензии клеток (1×106/мышь) вводились подкожно в 50 мкл в правый бок. После того, как опухоли сформировались, они были измерены (день 1) и действующие растворы с концентрацией паклитаксела 10 мг/мл вводились внутривенно в дни 1, 4 и 7.
In vivo противоопухолевый эффект мицелл, нагруженных паклитакселем был исследован у C57/BI/6 мышей с подкожными опухолями легочной карциномы Льюиса (фиг.6). Коммерчески доступный CrEL, также как и восстановленные препараты поли(2-оксазолин)а и паклитаксела (Р2-РТХ) значительно (р<0,05) снизили тяжесть опухоли после единственной инъекции (день 4, ингибирование роста опухоли 72% и 63%, соответственно). Опухоли у мышей, которым вводили Р2-РТХ, оставались значительно меньше (р<0,05) чем у мышей, которым вводили коммерчески продукт между днями 11 и 25. Мы обнаружили, что подавление роста опухоли препаратом Р2-РТХ в этот период было приблизительно 70% по сравнению с 50-60% в группе мышей, которым вводили CrEL. Тем не менее после 28 дней наблюдалось резкое ухудшение тяжести опухоли у животных в группе Р2-РТХ, и было показано схожее подавление роста опухоли в обеих группах лечения.
На фиг.6 А) представлено сравнение относительных масс подкожных опухолей легочной карциномы Льюиса у C57/BI/6 мышей в отрицательных контролях (физиологический раствор, только Р2), мышей, которым вводили паклитаксель, солюбилизированный в поли(2-оксазолин)е (Р2-РТХ) и коммерческий продукт CrEL при одинаковых дозах РТХ (10 мг/кг). Стрелками показано время инъекции. В) Подавление роста опухоли Р2, Р2-РТХ и коммерческим продуктом CrEL. Данные представлены как среднее ± стандартное отклонение (n=5). На фиг.6 В) представлено рассчитанное подавление роста опухоли в группах лечения Р2, Р2-РТХ и CrEL в различные моменты времени.
Реферат
Изобретение относится к композициям, содержащим действующее вещество. Описана композиция для доставки действующего вещества, содержащая: а) по меньшей мере один блоксополимер, содержащий по меньшей мере один поли(2-оксазолиновый) блок А, состоящий из повторяющихся звеньев формулы (I), где Rозначает углеводородную группу, которая необязательно может быть замещена -OH, -SH, -COOH, -NR', -COOR', -CONR', -CHO, где R' означает Н или Салкил, и Rвыбирают таким образом, что повторяющееся звено формулы (I) является гидрофильным; и по меньшей мере один поли(2-оксазолиновый) блок В, состоящий из повторяющихся звеньев формулы (II), где Rозначает углеводородную группу, которая необязательно может быть замещена галогеном, -OH, -SH, -COOH, -NR'', -COOR'', -CONR'', -CHO, где R'' означает Н, алкил или алкенил, и Rвыбирают таким образом, что повторяющееся звено формулы (II) более гидрофобно, чем повторяющееся звено формулы (I); и (b) одно или более действующее вещество. Также описано применение сополимера для солюбилизации действующего вещества в воде или водном растворе. Технический результат - описанные сополимеры служат универсальной системой доставки с высокой загрузкой для лекарственных веществ. 2 н. и 10 з.п. ф-лы, 6 ил.
Формула
(a) по меньшей мере один блоксополимер, содержащий по меньшей мере один поли(2-оксазолиновый)блок А, состоящий из повторяющихся звеньев формулы (I)

где RA означает углеводородную группу, которая необязательно может быть замещена -OH, -SH, -COOH, -NR′2, -COOR′, -CONR′, -CHO, где R′ означает H или C1-3алкил, и RA выбирается таким образом, что повторяющееся звено формулы (I) является гидрофильным;
и по меньшей мере один поли(2-оксазолиновый) блок В, состоящий из повторяющихся звеньев формулы (II),

где RB означает углеводородную группу, которая необязательно может быть замещена галогеном, -OH, -SH, -COOH, -NR″2, -COOR″, -CONR″, -CHO, где R″ означает H, алкил или алкенил, и RB выбирают таким образом, что повторяющееся звено формулы (II) более гидрофобно, чем повторяющееся звено формулы (I); и
(b) одно или более действующее вещество.

Комментарии