Композиции и способы для уничтожения клеток - RU2471349C2
Код документа: RU2471349C2
Чертежи








Описание
Область техники, к которой относится изобретение
Предлагаемое изобретение относится к композициям и способам для уничтожения клеток. Более конкретно, к композициям и способам для уничтожения живых клеток-мишеней или иного нарушения жизненно важных внутриклеточных процессов и/или межклеточных взаимодействий, в то же время эффективно сохраняя на прежнем уровне значение рН среды, окружающей клетки.
Уровень техники
Различные виды клеточного материала, как известно, вредны и потенциально смертельны для человека. Например, злокачественные клетки - вторая ведущая причина смертности в Соединенных Штатах после сердечных заболеваний (Boring и др., (1993), СА Cancer Journal for Clinicians 43:7). Клеточные микроорганизмы также ответственны за широкий диапазон болезней. Целевое и выборочное уничтожение клеток (например, раковых клеток и патогенных бактерий) экстенсивно исследовано в биотехнологической индустрии.
Микроорганизмы могут проникать в ткани организма-хозяина и пролиферировать там, вызывая серьезные болезненные симптомы. Патогенные бактерии были идентифицированы как первопричина множества истощающих или фатальных заболеваний, включая, например, туберкулез, холеру, коклюш, чуму и т.п. Для лечения таких серьезных инфекций применяют лекарства, такие как антибиотики, которые убивают инфекционного агента. Однако патогенные бактерии обычно вырабатывают сопротивляемость антибиотикам, и требуются улучшенные средства, чтобы предотвратить распространение инфекций, вызываемых такими микроорганизмами.
Инфекция является частым осложнением множества инвазивных хирургических, терапевтических и диагностических процедур. Для процедур с использованием имплантируемых медицинских устройств предотвращение инфицирования может оказаться особенно проблематичным, поскольку бактерии могут образовывать биопленки, которые защищают микробы от уничтожения иммунной системой индивидуума. Поскольку эти инфекции трудно поддаются лечению антибиотиками, это часто влечет за собой необходимость извлечения имплантированного устройства, что является травматичным для пациента и повышает расходы на лечение.
Ввиду того, что трудности, связанные с устранением инфекций, обусловленных наличием биопленок, хорошо известны, был разработан целый ряд технологий обработки поверхностей и жидкостей для промывки поверхностей с целью предотвращения или уменьшения скорости образования биопленок. Биопленки оказывают неблагоприятное воздействие на медицинское оборудование и прочие системы, играющие важную роль в здравоохранении, такие как системы водоснабжения и пищеблоки. Был предложен ряд технологий обработки поверхности органическими или неорганическими материалами с целью воспрепятствования образованию биопленок. Например, были использованы различные методы покрытия поверхности медицинских устройств антибиотиками (см., напр., патенты США №4107121, 4442133, 4895566, 4917686, 5013306, 4952419, 5853745 и 5902283) и другими бактериостатическими соединениями (см., напр., патенты США №4605564, 4886505, 5019096, 5295979, 5328954, 5681575, 5753251, 5770255 и 5877243).
Несмотря на применение этих технологий, загрязнение медицинских устройств и связанный с этим риск развития инвазивной инфекции продолжают оставаться актуальной проблемой.
Возбудители инфекции повсеместны в медицинской среде, невзирая на энергичные действия по соблюдению антисептики. Присутствие этих микроорганизмов может приводить к инфицированию госпитализированных больных и медицинского персонала. Такая инфекция, называемая нозокомиальной, часто включает микроорганизмы, более вирулентные и более необычные, чем микроорганизмы, встречающиеся вне стен больничных учреждений. Кроме того, более вероятно, что приобретенные в больнице инфекции связаны с микроорганизмами, у которых сформировалась резистентность по отношению к целому ряду антибиотиков. Хотя санитарно-гигиеническая обработка и борьба с бактериальными загрязнениями являются обычной практикой, возбудители инфекции легко колонизируют различные поверхности в медицинской среде, особенно те поверхности, на которых конденсируется влага или которые погружены в жидкость. Даже материалы, использующиеся для создания биологического барьера, такие как материал перчаток, фартуков и щитков, могут служить источником инфекции для пользующегося ими персонала и для прочих лиц в медицинском учреждении. Несмотря на стерилизацию и санитарно-гигиеническую обработку, различные металлические и неметаллические материалы в медицинских учреждениях могут аккумулировать опасные микроорганизмы, попавшие в биопленку, из которой они могут переходить к другим организмам-хозяевам.
Любое средство, используемое для ингибирования образования биопленок в медицинской среде, должно быть безопасным для пользователя. Некоторые биоциды в количествах, достаточных для создания препятствий образованию биопленок, могут также повреждать ткани организма-хозяина. Антибиотики, введенные в ткани местно, могут вызывать образование резистентных микроорганизмов, способных впоследствии образовывать сообщества в виде биопленок, планктонные микроорганизмы которых аналогичным образом окажутся резистентными к конкретным антибиотикам. Любое средство борьбы с образованием биопленок и средство, предохраняющее от биологического обрастания, кроме того, не должно препятствовать реализации целебного действия медицинского устройства. Были подобраны определенные материалы, с которыми особенно удобно обращаться оператору, обладающие мягкостью, водонепроницаемостью, растяжимостью и долговечностью при сжатии, характеристиками, которые не могут быть изменены при введении средства, обладающего антимикробным действием. Еще одной проблемой является вероятность того, что материалы, наносимые на поверхность имплантируемых устройств с целью ингибирования загрязнения и образования биопленок, оказывают тромбогенное действие.
Образование биопленок является важной проблемой для здравоохранения. Известно, что системы питьевой воды являются скоплением биопленок, даже если эти системы содержат дезинфицирующие средства. В любой системе, имеющей границу раздела между твердой поверхностью и жидкостью, возможно образование биопленок. Хорошо известно, что градирни кондиционеров воздуха являются источником риска для учреждений здравоохранения вследствие образования биопленок, что подтверждают эпизодические вспышки инфекций, таких как болезнь легионеров. Биопленки были обнаружены в трубках, по которым текут жидкости, таких как гемодиализные трубки, и в трубопроводах систем водоснабжения. Было также обнаружено, что биопленки вызывает биообрастание в некоторых городских резервуарах-накопителях, колодцах частных домовладений и в ирригационных системах капельного орошения, причем обработка хлором в концентрациях вплоть до 200 ppm не препятствует этому.
Образование биопленок является постоянной проблемой при производстве пищевых продуктов. В производство пищевых продуктов вовлечены жидкости, твердые материалы и их комбинации. В качестве примера в линиях по переработке молока имеются трубы для транспортировки жидкостей и поверхности постоянного контакта с жидкостями. Очистка доильных установок и оборудования по переработке молока в настоящее время производится с использованием совокупности механических, тепловых и химических процессов в методах очистки на местах с использованием аэрации. Кроме того, сам молочный продукт подвергается пастеризации. При сыроварении биопленки могут приводить к образованию кристаллов лактата кальция в случае производства сыра сорта Чеддер. Линии для переработки и упаковки мяса аналогичным образом подвержены образованию биопленок. Они могут образовываться как на неметаллических, так и на металлических поверхностях. Биопленки на предприятиях по мясопереработке были обнаружены на резиновых «пальцах», пластиковых завесах, материалах ленточных транспортеров, оборудовании для потрошения и поверхностях изделий из нержавеющей стали. Борьбу с образованием биопленок и с загрязнением микроорганизмами при производстве пищевых продуктов затрудняет необходимость соблюдения дополнительного требования, чтобы используемое средство не влияло на вкус, текстуру и внешний вид продукта.
Таким образом, существует необходимость придания различным поверхностям бактерицидных свойств. Имеется активный интерес к материалам, способным уничтожать вредные микроорганизмы. Такие материалы могут использоваться для нанесения на поверхности предметов общего пользования людьми в повседневной жизни, например на дверные ручки, детские игрушки, клавиатуры компьютеров, телефоны, полотенца, медицинские устройства и т.д. с целью придания им антисептических свойств и тем самым лишения их способности быть средством передачи бактериальных инфекций. Поскольку обычно материалы не обладают антимикробными и цитоцидными свойствами, необходимо их модифицировать. Например, поверхности, химически модифицированные полиэтиленгликолем и некоторыми другими синтетическими полимерами, способны отторгать (хотя и не уничтожать) микроорганизмы (Bridgett, M.J., и др., (1992) Biomaterials 13,411- 416; Arciola, С.R., и др. Alvergna, P., Cenni, E. & Pizzoferrato, A. (1993) Biomaterials 14, 1161-1164; Park, К.D., Kim, Y.S, Han, D.K., Kim, Y.H., Lee, E.H.В., Suh, H. & Choi, K.S. (1998) Biomaterials 19, 51-859).
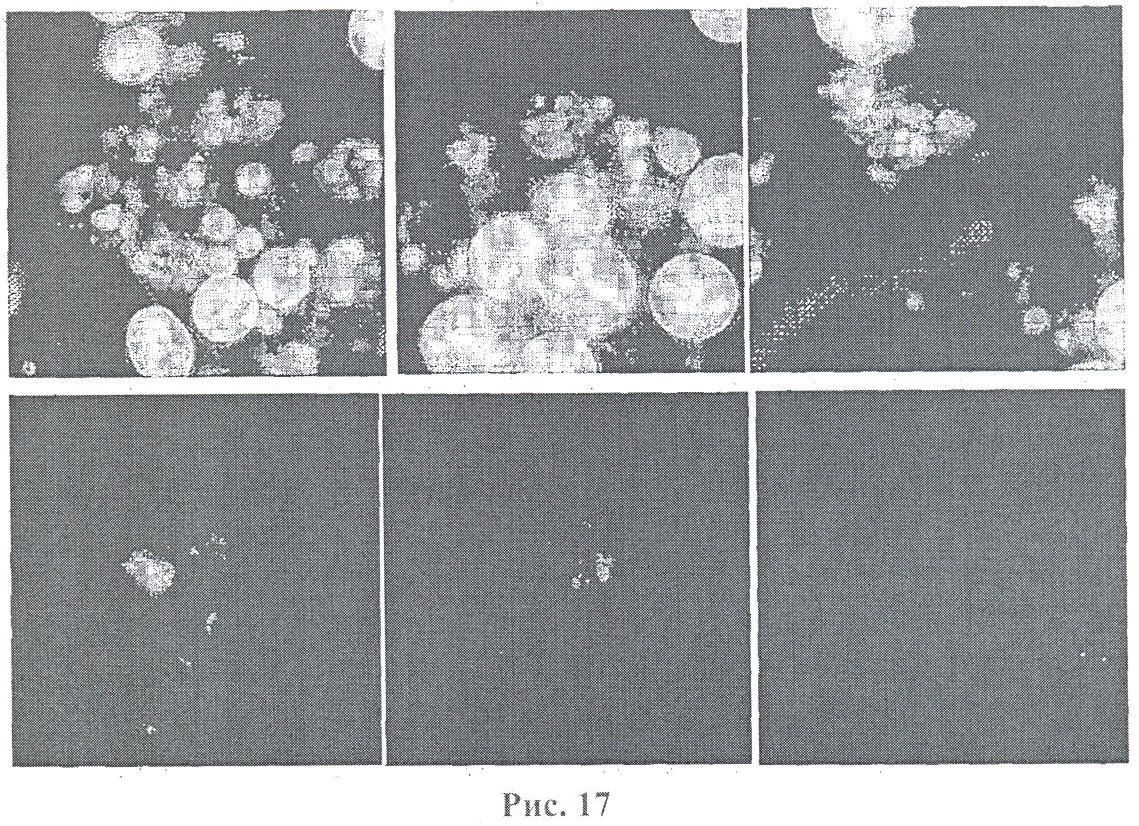
В качестве альтернативы материалы могут быть пропитаны антимикробными средствами, такими как антибиотики, четвертичные аммонийные соединения, ионы серебра или йода, которые постепенно высвобождаются со временем в окружающий раствор и уничтожают находящиеся там вредоносные клетки и микроорганизмы (Medlin, J. (1997) Environ. Health Preps. 105,290-292; Nohr, R.S. & Macdonald, G.J. (1994) J. Biomater. Sci., Polymer Edn. 5,607-619 Shearer, A.E.H., и др. (2000) Biotechnol. Bioeng 67,141-146). Хотя эффективность этих подходов и была подтверждена для водных растворов, содержащих бактерии, предполагается, что они не будут эффективно действовать на присутствующие в воздухе бактерии в отсутствие жидкой среды. Это особенно справедливо для материалов, в основе действия которых лежит принцип постепенного высвобождения, которым также свойственна потеря активности после израсходования выщелачивающегося антибактериального средства.
Были разработаны общие методики покрытия/модификации поверхностей, которые применимы к большей части материалов, независимо от их природы.
Существуют полимеры, которым присущи антимикробные или антистатические свойства. Такие полимеры могут применяться или использоваться в сочетании с широким спектром субстратов (например, со стеклом, тканями, металлом, целлюлозными материалами, пластиками и т.д.) для придания субстрату антимикробных и/или антистатических свойств. Кроме того, такие полимеры могут также использоваться в сочетании с другими полимерами для придания этим другим полимерам антимикробных и/или антистатических свойств.
К этим материалам, однако, предъявляются как требование высокой стойкости, так и совместимости, а также возможности их использования на широком спектре полимерных материалов и субстратов и совместно с ними. Были предложены различные добавки и полимерные системы, придающие антимикробные свойства. См., например, патент США №3872128, автор Byck, патент США №5024840, авторы Blakely и др., патент США №5290894, авторы Malrose и др., патенты США №5967714, 6203856 и 6248811, авторы Ottersbach и др., патент США №6194530, авторы Klasse и др., и патент США авторов Siddiqui и др.
Остается, однако, необходимость в потенциально менее токсичных полимерных композициях, придающих стойкую способность уничтожать клетки широкому спектру субстратов и материалов.
Очень хорошо известно, что заряженные молекулы в растворе способны уничтожать бактерии (Endo и др., 1987; Fidai и др., 1997; Friedrich и др., 2000; Isquith и др., 1972). Однако позднее стало понятно, что заряженные частицы, присоединенные к поверхностям, также способны уничтожать бактерии при контакте с ними. Все они содержат катионные, положительно заряженные группы, такие как группы четвертичного аммония (Thome и др., 2003) или фосфония (Kanazawa и др., 1993; Рора и др., 2003). Были исследованы различные структуры: самособирающиеся монослои (Atkins, 1990; Gottenbos и др. 2002; Rondelez & Bezou, 1999), слои полиэлектролитов (Lee и др., 2004; Lin и др., 2002, 2003; Рора и др., 2003; Sauvet и др., 2000; Thome и др., 2003; Tiller и др., 2001) и дендримеры ветвистой структуры (Cen и др., 2003; Chen & Cooper, 2000, 2002). Важным преимуществом такого подхода является то, что молекулы биоцидов ковалентно присоединены к субстратам, что обеспечивает возможность их повторного использования после процессов очистки и предотвращает неконтролируемое высвобождение материала в окружающую среду. Однако сущность механизмов биоцидного действия до сих пор не установлена.
Недавно Kigler и др. (2005) сообщили о существовании порогового значения плотности заряда, выше которого быстро происходит гибель бактерий при адсорбции на субстратах, несущих катионные группы четвертичного аммония. Авторы привили кватернизованные цепи поливинилпиридина к поверхности стекла двумя различными методами и изменяли плотность заряда во внешнем слое (ПЗВС) внутри органического слоя в диапазоне от 1012 до 1016 положительных зарядов на см2. Проведенные ими измерения показали, что этот параметр оказывает большое влияние на эффективность уничтожения микроорганизмов. Гибель бактерий происходит менее чем за 10 мин в фазе покоя при превышении порогового значения. Значения ПЗВС оказались в 10-100 раз меньше для бактерий в состоянии роста. Значение ПЗВС также зависит от вида бактерий, и авторы упомянутого исследования наблюдали 10-кратное различие между бактериями Escherichia coli и Staphylococcus epidermidis в условиях быстрого деления. На основании полученных результатов эти авторы предложили механизм уничтожения клеток, основанный на ионном обмене между бактериальной мембраной и функционализированной поверхностью.
Тем не менее, во всех вышеупомянутых публикациях и патентах США описаны влияние вида обработки поверхности, поверхностных свойств и подчеркивается насущная необходимость обеспечения тесного контакта с поверхностью для того, чтобы уничтожить клетки. Ни в одном из вышеописанных источников не описан «ОБЪЕМНЫЙ ЭФФФЕКТ» твердых кислотных или основных протонных и гидроксильных проводников и буферных систем на живые клетки. В них также не предлагается использование покрытия из барьерных слоев цитотоксичных полимеров в качестве способа уничтожения клеток. Более того, ни в одном из вышеописанных патентов США не предлагается конфигурация полимера, способного избирательно уничтожать клетки определенного типа.
Таким образом, до настоящего времени ощущается насущная потребность в материалах, способных оказывать устойчивое и длительное цитотоксическое воздействие как на эукариотические, так и на прокариотические клетки. Одним из способов достижения этих желательных целей является нанесение на твердые ионообменные материалы (ТИОМ) покрытий из материалов, которые, в общем, обладают способностью создавать диффузионный барьер и которым не присущи фармакологическое и токсическое действие. Эти материалы покрытий ограничивают транспорт конкурирующих противоионов внутрь поверхности ТИОМ и из нее, при этом все же обеспечивая переход протонов/ионов гидроксила. Тем самым они предотвращают или существенно снижают степень насыщения ионообменного материала противоионами, обеспечивая его устойчивую и длительную активность.
В патенте США №6001392, авторы Wen и др., описано использование смеси покрытых и непокрытых катионообменных смол, функционализированных сульфоновой кислотой (AmberliteTM (амберлит) IRP-69, производства компании Rohm and Haas), к которым методом поперечного сшивания присоединен дивинилбензол, на который был нанесен декстрометорфан (обычное средство против кашля) с целью обеспечения замедленного высвобождения лекарственного средства из жидкого фармацевтического состава. Около 30% комплексов лекарственное средство - смола покрыты смесью этилцеллюлозы или латекса с этилцеллюлозой с пластификаторами и диспергируемыми в воде полимерами, такими как SURELEASE. Другими примерами смол и материалов покрытий, описанных как использовавшиеся для достижения вышеупомянутой цели, являются: Dow XYS-40010.00 (Компания Dow Chemical Company). Амберлит IRP-69 и Dow (Доу) XYS-40010.00, оба являющиеся сульфонированными полимерами, состоящими из полистирола, поперечно сшитого дивинилбензолом в концентрации 8%, с ионообменной емкостью примерно от 4,5 до 5,5 мэкв/г в пересчете на сухую смолу (Н+-форма). Их основным различием является физическая форма. Амберлит IRP-69 состоит из частиц неправильной формы размером от 47 до 149 мкм, полученных размолом исходных сфер большого размера Амберлита IRP-120. Продукт Доу XYS-40010.00 состоит из сферических частиц размером в диапазоне от 45 до 150 мкм. Другая пригодная для использования ионообменная смола, Доу XYS-40013.00, является полимером, состоящим из полистирола, поперечно сшитого дивинилбензолом в концентрации 8%, функционализированного группами четвертичного аммония. Ее обменная емкость обычно лежит в диапазоне приблизительно от 3 до 4 мэкв/г в пересчете на сухую смолу.
Материалом покрытия может быть, в общем, любой из большого числа традиционных природных или синтетических пленкообразующих материалов, используемых индивидуально, в смеси друг с другом и в смеси с пластификаторами, пигментами и т.д., способными создавать диффузионный барьер и которым не присущи фармакологическое и токсическое действие. Как правило, основные компоненты покрытия должны быть нерастворимыми в воде и водопроницаемыми. Однако может оказаться полезным включить в его состав водорастворимое вещество, такое как метилцеллюлозу, с целью изменения проницаемости покрытия, или включить в его состав нерастворимое в кислотах, растворимое в щелочах вещество для использования в качестве кишечно-растворимого покрытия. Материал покрытия может быть нанесен в виде суспензии на водной основе или в виде раствора в органических растворителях. Примеры таких пригодных для использования материалов покрытия описаны R.С.Rowe в работе «Материалы, используемые в фармацевтических составах» (под ред. А.Т.Florence, Blac kwell S cientific Publications, Oxford, 1-36 (1984), которая включена в настоящий документ посредством ссылки. Водопроницаемый диффузионный барьер выбран из группы, состоящей из этилцеллюлозы, метилцеллюлозы и их смесей, примером которого является продукт SURELEASE, производимый компанией Colorcon, представляющий собой водную полимерную дисперсию этилцеллюлозы, пластифицированной дибутилсебацинатом или растительными маслами. Другими неограничивающими примерами материалов покрытия являются AQUACOAT, производимый компанией FMC Corporation, Филадельфия, США, который является псевдолатексом на основе этилцеллюлозы; раствор этилцеллюлозы в органическом растворителе; шеллак; зеин, эфиры канифоли; ацетатцеллюлоза; EUDRAGITS, производимые компанией Rohm and Haas, Филадельфия, США, которые являются акриловыми смолами; силиконовые эластомеры; поливинилхлорид; метилцеллюлоза и гидроксипропилметилцеллюлоза.
Для нанесения покрытия на частицы могут использоваться обычные растворители для нанесения покрытий и традиционные методы нанесения покрытий (такие как нанесение покрытий из псевдоожиженного слоя и нанесение покрытий распылением). Методики нанесения покрытий из псевдоожиженного слоя предлагаются, например, в патентах США №3089824, 3117027 и 3253944. Неограничивающими примерами растворителями для нанесения покрытий являются этанол, смесь метиленхлорида и ацетона, эмульсии для нанесения покрытий, метилацетон, тетрагидрофуран, четыреххлористый углерод, метилэтилкетон, дихлорэтилен, трихлорэтилен, гексан, метиловый спирт, изопропиловый спирт, метилизобутилкетон, толуол, 2-нитропропан, ксилол, изобутиловый спирт, н-бутилацетат. Описанный выше уровень техники может использоваться в предлагаемом изобретении для получения ТИОМ с покрытиями с целью избирательного и целенаправленного уничтожения клеток.
Точно установлено, что экстремальные значения рН раствора (выше 7,0 и ниже 5,5) вредны для клеток (как микроорганизмов, так и млекопитающих) вследствие того, что оказывают цитотоксическое действие. В патенте Великобритании №2374287, авторы Bennett и др., описана композиция для санитарной обработки и/или дезинфекции непористых твердых поверхностей, которая содержит спирт, выбранный из группы, состоящей из метанола, этанола, н-пропанола, изопропанола, н-бутанола, бензилового спирта и их смесей, который присутствует в количестве примерно от 40 до 70 мас.%, и из эффективного количества средства, модифицирующего значение рН таким образом, чтобы диапазон значений рН композиции составлял примерно от 7,0 до 13,0, в котором количество спирта тем меньше, чем больше значение рН данной композиции, и наоборот. Было обнаружено, что за счет увеличения значения рН композиции можно использовать меньшие количества спирта. Были предложены эффективные дезинфицирующие композиции со сниженным содержанием ЛОС (летучих органических соединений). С другой стороны, в патенте США №5614241, автор Woodrow, описана порошковая водорастворимая сбалансированная пищевая композиция, которая, будучи смешанной с водой, имеет низкое значение рН (между 5,5 и 2,0), длительный срок хранения, высокую антимикробную активность, и которая содержит альфа-аминокислоты белков в растворенном виде или в виде суспензии. В пищевой композиции используется бинарная система стабилизации белков с низким значением рН и система стабилизации бактерий с высокой общей кислотностью и низким значением рН.
Однако в вышеупомянутых патентах и прочих документах предшествующего уровня техники предлагается использование антимикробного эффекта рН жидких растворов. Ни в одной из вышеупомянутых публикаций не описывается и не предлагается использование цитотоксического действия твердых буферных систем и ионообменных материалов, связанного с обменом протонов между клеточными мембранами и ионообменными материалами, не оказывающего при этом неблагоприятного воздействия на значение рН раствора.
Нижеследующие публикации использованы здесь в качестве ссылок: Arciola, С.R., Alvergna, P., Cenni, E. & Pizzoferrato, А. (1993) Biomaterials 14, 1161-1164. Atkins, P.W. (1990). Physical Chemistry. New York: W.H.Freeman & Company. Boring и др., СА Cancer Journal for Clinicians. 43: 7 1993. Bridgett, M.J., и др., (1992). Biomaterials 13, 411-416. Cen, L., Neoh, К.G. & Kang, E.T. (2003).. Langmuir 19, 10295-10303. Chen, С.Z. & Cooper, S. L. (2000). Adv Materials 12, 843-846. Chen, С.Z. & Cooper, S. L. (2002). Biomaterials 23, 3359-3368. Endo, Y., Tani, T. & Kodama, M. (1987). Appl Environ Microbiol 53, 2050-2055. Fidai, S., Farer, S.W. & Hancock, R.E. (1997). Methods Mol Biol 78, 187-204. Friedrich, С.L., Moyles, D., Beverige, T.J. & Hancock, R.E.W. (2000).. Antimicrob Agents Chemother 44, 2086-2092. Gottenbos, В., van der Mei, H.C, Klatter, F., Nieuwenhuis, P. & Busscher, H.J. (2002). Biomaterials 23, 1417- 1423. Isquith, A.J., Abbott, E.A. & Walters, P.A. (1972). Appl Microbiol 24, 859-863. Kanazawa, A., Ikeda, T. & Endo, T. (1993). J Polym Sci Part A Polym Chem 31, 1467-1472. Kugler R., Bouloussa О. и Rondelez F., (2005) Microbiology, 151, 1341-1348. Lee, S.В., Koepsel, R.R., Morley, S.W., Matyajaszewski, K., Sun, Y. & Russell, A.J. (2004). Biomacromolecules 5, 877-882. Lin, J., Qiu, S., Lewis, K. & Klibanov, A. M. (2002). Biotechnol Prog 18, 1082-1096. Lin, J., Qiu, S., Lewis, K. & Klibanov, A.M. (2003). Biotechnol Bioeng 83, 168-172. Medlin J. 1997. Germ warfare. Environ Health Persp 105: 290-292. Nohr R S и Macdonald G J. 1994. J Biomater Sci, Polymer Edn 5: 607-619. Park, K.D., Kirn, Y.S., Han, D.K., Kim, Y.H., Lee, E.H. В., Suh, H. & Choi, K.S. (1998) Biomaterials 19, 51-859. Popa, A., Davidescu, C.M., Trif, R., Ilia, Gh., IIiescu, S. & Dehelean, Gh. (2003). React Funct Polym 55, 151-158. Rondelez, F. & Bezou, P. (1999). Actual Chim 10, 4-8. Rowe R.C. (1984). Материалы, используемые в фармацевтических составах (под редакцией А.Т. Florence), Blackwell Scientific Publications, Oxford, 1-36. Shearer, A.E.H., et al., (2000), Biotechnol. Bioeng 67,141-146. Sauvet, G., Dupond, S., Kazmierski, K. & Chojnowski, J. (2000). J Appl Polym Sci 75, 1005-1012. Thome, J., Hollander, A., Jaeger, W., Trick, I. & Oehr, C. (2003). Surface Coating Technol 174-175, 584-587. Tiller, J.C, Liao, C, Lewis, K. & Klibanov, A.M. (2001). Proc Natl Acad Sci USA 98, 5981-5985.
Раскрытие изобретения
Таким образом, одной из целей предлагаемого изобретения является создание нерастворимого протонного резервуара или источника (ПРИ), пригодного для уничтожения живых клеток-мишеней (ЖКМ) или иного нарушения жизненно важных внутриклеточных процессов в ЖКМ и/или межклеточных взаимодействий ЖКМ при контакте. Указанный ПРИ содержит (i) протонный резервуар или источник, обеспечивающий буферную емкость, и (ii) средство, обеспечивающее протонную проводимость и/или электрический потенциал, в котором упомянутый ПРИ эффективно нарушает гомеостаз рН и/или электрический баланс внутри замкнутого объема ЖКМ и/или нарушает жизненно важные межклеточные взаимодействия ЖКМ, в то же время эффективно сохраняя на прежнем уровне значение рН среды, окружающей клетки ЖКМ.
В объем предлагаемого изобретения входит ПРИ, который является нерастворимым гидрофобным анионным, либо катионным, либо амфотерным заряженным полимером, пригодным для уничтожения живых клеток-мишеней (ЖКМ) или иного нарушения жизненно важных внутриклеточных процессов в ЖКМ и/или межклеточных взаимодействий ЖКМ при контакте. Дополнительно или альтернативно к этому, в объем предлагаемого изобретения входит ПРИ, который является нерастворимым гидрофильным анионным, либо катионным, либо амфотерным заряженным полимером, в комбинации с несмешивающимися с водой полимерами, пригодным для уничтожения живых клеток-мишеней (ЖКМ) или иного нарушения жизненно важных внутриклеточных процессов в ЖКМ и/или межклеточных взаимодействий ЖКМ при контакте. Кроме того, в объем предлагаемого изобретения входит ПРИ, который является нерастворимым гидрофильным анионным, либо катионным, либо амфотерным заряженным полимером, в комбинации с несмешивающимся с водой анионным, либо катионным, либо амфотерным заряженным полимером, пригодным для уничтожения живых клеток-мишеней (ЖКМ) или иного нарушения жизненно важных внутриклеточных процессов в ЖКМ и/или межклеточных взаимодействий ЖКМ при контакте.
Также в объем предлагаемого изобретения входит ПРИ, который неограничивающим образом приспособлен для того, чтобы входить в контакт с живой клеткой-мишенью, либо в объеме, либо на поверхности, например, на наиболее удаленных границах организма либо на неживых объектах, которые обладают способностью входить в контакт с ПРИ согласно предлагаемому изобретению, на внутренних мембранах и поверхностях микроорганизмов, животных и растений, которые обладают способностью входить в контакт с ПРИ любым из нескольких путей чрескожной доставки и т.д., в объеме, независимо от того, обеспечено ли перемешивание в упомянутом объеме или не обеспечено, и т.д.
Кроме того, в объем предлагаемого изобретения входит либо (i) ПРИ, либо (ii) продукт производства, содержащий ПРИ, который также содержит эффективное количество, по меньшей мере, одной добавки.
Еще одной целью предлагаемого изобретения является создание ПРИ согласно любому из приведенных выше описаний, в котором протонная проводимость обеспечивается за счет водопроницаемости и/или за счет смачивания, особенно в котором смачивание обеспечивается за счет гидрофильных добавок.
Еще одной целью предлагаемого изобретения является создание ПРИ согласно любому из приведенных выше описаний, в котором протонная проводимость или смачиваемость обеспечивается за счет материалов с собственной протонной проводимостью (МСПП) и/или гидрофильных по своей природе полимеров (ГСПП), особенно за счет МСПП и/или ГСПП, выбранных из группы, состоящей из сульфонированных тетрафторэтиленовых сополимеров, сульфонированных материалов, выбранных из группы, состоящей из диоксида кремния, полиэфирсульфона (ПЭС), стирол-этилен-бутилен-стирольного блок-сополимера (СЭБС), полиэфирэфиркетона (ПЭЭК), полиариленэфирсульфона (ПАЭС), привитого сополимера стирола с поливинилиденфторидом (ПВДФ), полибензимидазола (ПБИ) и полифосфазена, причем протонообменная мембрана приготовлена литьем раствора полистиролсульфоната (ПСС) с суспендированными частицами ионообменной смолы микронного размера, поперечно сшитой ПСС, коммерчески доступного нафиона (Nafion™) и его производных.
Еще одной целью предлагаемого изобретения является создание ПРИ согласно любому из приведенных выше описаний, в котором ПРИ присутствует в виде конъюгата, содержащего два или более либо двумерных (2D), либо трехмерных (3D) ПРИ, причем каждый из этих ПРИ состоит из материалов, содержащих легко диссоциирующие катионные и/или анионные группы (ЛДКАГ), пространственно организованные так, чтобы эффективно минимизировать изменения значения рН среды, окружающей ЖКМ. Каждая из ЛДКАГ при необходимости эффективно пространственно организована в виде конкретных либо 2D-, с топологически складчатыми 20-поверхностями, либо 3D-структур, которые сводят к минимуму изменения значения рН среды, окружающей ЖКМ, кроме того, при необходимости, по меньшей мере, часть пространственно организованных ЛДКАГ имеют 2D- или 3D-структуру вида, выбранного из группы, состоящей из (i) чередующихся; (ii) перекрывающихся; (iii) сопряженных; (iv) смешанных либо гомогенно, либо гетерогенно фрагментов и (v) из сочетания перечисленных структур.
В этом отношении следует подчеркнуть, что термин ЛДКАГ неограничивающим образом относится согласно одному конкретному варианту воплощения предлагаемого изобретения к ионообменным материалам, например к несмешивающимся с водой ионным гидрофобным материалам.
Еще одной целью предлагаемого изобретения является создание ПРИ согласно любому из приведенных выше описаний, в котором упомянутый ПРИ эффективно нарушает гомеостаз рН в замкнутом объеме, в то же время сохраняя целостность среды, окружающей ЖКМ; и в котором целостность упомянутой среды дополнительно характеризуется параметрами, выбранными из группы, состоящей из функциональных свойств среды, химического состава, концентрации растворимых веществ, в том числе концентрации отличных от протона и гидроксила компонентов, параметров биологической природы, параметров экологической природы, физическими параметрами, особенно распределением частиц по размеру, реологическими свойствами и консистенцией, параметрами безопасности, в особенности токсичностью или иными параметрами, влияющими на LD50 или ICT50, обонятельными или органолептическими параметрами (например, цветом, вкусом, запахом, текстурой, агрегатным состоянием и т.д.) или их любой комбинации.
Еще одной целью предлагаемого изобретения является создание ПРИ согласно любому из приведенных выше описаний, в котором упомянутый ПРИ обеспечивает нарушение жизненно важных внутриклеточных процессов и/или межклеточных взаимодействий ЖКМ, в то же время (i) как эффективно сохраняя на прежнем уровне значение рН среды, окружающей ЖКМ, так и (ii) минимально воздействуя на целостность среды, окружающей ЖКМ, так, чтобы выщелачивание из ПРИ либо ионизированных, либо нейтральных атомов, молекул или частиц (АМЧ) в среду, окружающую ЖКМ, сводилось к минимуму.
Находясь полностью в рамках объема изобретения, вышеупомянутое выщелачивание сводится к минимуму так, чтобы концентрация выщелоченных ионизированных или нейтральных атомов составляла менее 1 ppm. В качестве альтернативы вышеупомянутое выщелачивание сводится к минимуму таким образом, чтобы концентрация выщелоченных ионизированных или нейтральных атомов составляла менее 50 ppb. В качестве альтернативы вышеупомянутое выщелачивание сводится к минимуму таким образом, чтобы концентрация выщелоченных ионизированных или нейтральных атомов составляла менее 50 ppb и более 10 ppb. В качестве альтернативы вышеупомянутое выщелачивание сводится к минимуму так, чтобы концентрация выщелоченных ионизированных или нейтральных атомов составляла менее 10 ppb и более 0,5 ppb. В качестве альтернативы вышеупомянутое выщелачивание сводится к минимуму так, чтобы концентрация выщелоченных ионизированных или нейтральных атомов составляла менее 0,5 ppb.
Еще одной целью предлагаемого изобретения является создание ПРИ согласно любому из приведенных выше описаний, в котором упомянутый ПРИ обеспечивает нарушение жизненно важных внутриклеточных процессов в ЖКМ и/или межклеточных взаимодействий ЖКМ, в то же время в меньшей степени нарушая гомеостаз рН и/или электрический баланс внутри, по меньшей мере, еще одного замкнутого объема (например, клеток, не являющихся мишенью, КНМ).
Еще одной целью предлагаемого изобретения является создание ПРИ согласно любому из приведенных выше описаний, в котором дифференциация между ЖКМ и КНМ производится при помощи одного или более из следующих средств: (i) обеспечением различной ионообменной емкости, (ii) обеспечением различных значений рН, (iii) оптимизацией ПРИ по отношению к размерам клеток-мишеней, (iv) обеспечением различных пространственных конфигураций ПРИ, либо 20-структур с топологически складчатыми 2D поверхностями, либо 3D-структур, (v) обеспечением критического количества частиц, являющихся ПРИ (или критической площади активной поверхности) с определенным значением емкости, приходящейся на данный объем, и (vi) обеспечением средств исключения по размеру.
Еще одной целью предлагаемого изобретения является создание продукта производства, содержащего, по меньшей мере, один нерастворимый невыщелачивающийся ПРИ согласно любому из приведенных выше описаний. Указанный ПРИ, расположенный на внутренней и/или внешней поверхности продукта производства, при контакте обеспечивает нарушение гомеостаза рН и/или электрического баланса внутри, по меньшей мере, части ЖКМ, в то же время эффективно сохраняя на прежнем уровне значение рН и функциональные свойства упомянутой поверхности.
Еще одной целью предлагаемого изобретения является создание продукта производства, содержащего, по меньшей мере, один нерастворимый невыщелачивающийся ПРИ согласно любому из приведенных выше описаний, особенно пригодный для уничтожения клеток-мишеней. Указанный ПРИ имеет, по меньшей мере, одну наружную протонпроводящую поверхность с определенными функциональными свойствами (такими как электропроводность, сродство, избирательность и т.д.), причем поверхность, по меньшей мере, частично состоящую из ПРИ, либо содержащую ПРИ в виде наружного слоя и/или в виде подслоя, так что обеспечивается нарушение жизненно важных внутриклеточных процессов в ЖКМ и/или межклеточных взаимодействий ЖКМ, и в то же время эффективно сохраняются на прежнем уровне значение рН среды, окружающей ЖКМ, и ее функциональные свойства.
Еще одной целью предлагаемого изобретения является создание продукта производства, содержащего, по меньшей мере, один нерастворимый невыщелачивающийся ПРИ согласно любому из приведенных выше описаний, содержащего поверхность с определенными функциональными свойствами и один или более наружных протонпроводящих слоев, причем каждый из этих слоев расположен, по меньшей мере, на части поверхности, в котором упомянутый слой, по меньшей мере, частично состоит из ПРИ или содержит слой ПРИ так, что нарушаются жизненно важные внутриклеточные процессы в ЖКМ и/или межклеточные взаимодействия ЖКМ, в то же время эффективно сохраняются на прежнем уровне значение рН и функциональные свойства среды, окружающей ЖКМ.
Еще одной целью предлагаемого изобретения является создание продукта производства, содержащего, по меньшей мере, один нерастворимый невыщелачивающийся ПРИ согласно любому из приведенных выше описаний, как системы на основе ПРИ, содержащей (i), по меньшей мере, один ПРИ и (ii) один или более предохранительных барьеров, обеспечивающих ПРИ стабильную длительную активность, предпочтительно в котором, по меньшей мере, один барьер является полимерным предохранительным барьером, пригодным для предотвращения диффузии тяжелых ионов, и более предпочтительно в котором полимер является иономерным барьером, особенно коммерчески доступным нафионом (Nafion™).
В этом отношении следует подчеркнуть, что наличие или включение барьеров, которые избирательно пропускают протоны и ионы гидроксила, но не пропускают другие конкурирующие ионы внутрь поверхности ТИОМ и/или из нее, предотвращает или существенно снижает степень насыщения ионообменного материала противоионами, придавая материалам и композициям согласно предлагаемому изобретению устойчивую и длительную способность к уничтожению клеток.
В объем предлагаемого изобретения входит создание продукта производства, в котором обмен протонами и/или гидроксильными ионами между клеткой и сильнокислотными и/или сильнощелочными материалами и композициями может приводить к нарушению гомеостаза рН и, в результате, к гибели клеток. Наличие протонной проводимости, объемной буферной емкости и объемной активности являются главными и ключевыми условиями предлагаемого изобретения.
Кроме того, в объем предлагаемого изобретения входит создание продукта производства, в котором рН-индуцированная цитотоксичность может модулироваться пропиткой или покрытием ионообменных материалов, содержащих кислотные или основные группы, полимерными и/или иономерными материалами с барьерными свойствами.
Еще одной целью предлагаемого изобретения является создание продукта производства, содержащего, по меньшей мере, один нерастворимый невыщелачивающийся ПРИ согласно любому из приведенных выше описаний, приспособленный для того, чтобы предотвратить развитие резистентности ЖКМ и отбора мутаций, определяющих резистентность.
Еще одной целью предлагаемого изобретения является создание продукта производства согласно любому из приведенных выше описаний, который разработан и изготовлен как член группы, состоящей из барьеров, мембран, наполнителей, прокладок, ячеистых материалов, сеток, вкладышей, материала в виде твердых частиц, порошков, порошков из наночастиц и пр., наполнителей, носителей или везикул, содержащих ПРИ (например, липосом с ПРИ), с введенным в виде добавки, покрытым, нанесенным погружением, включенным, пропитанным, иммобилизованным, захваченным, присоединенным, встроенным в виде колонки, солюбилизированным или иным образом связанным материалом, содержащим ПРИ.
Еще одной целью предлагаемого изобретения является создание продукта производства, характеризующегося, по меньшей мере, одним из следующих: (i) регенерируемым протонным источником или резервуаром, (ii) регенерируемой буферной емкостью и (iii) регенерируемой протонной проводимостью.
Еще одной целью предлагаемого изобретения является создание способа уничтожения живых клеток-мишеней (ЖКМ) или иного нарушения жизненно важных внутриклеточных процессов в ЖКМ и/или межклеточного взаимодействия ЖКМ при контакте. Указанный способ включает стадии создания, по меньшей мере, одного ПРИ, содержащего (i) протонный источник или резервуар, обеспечивающий буферную емкость, и (ii) средство, обеспечивающее протонную проводимость и/или генерирование электрического потенциала, и обеспечивающего контакт ЖКМ с ПРИ; причем указанный ПРИ обеспечивает эффективное нарушение гомеостаза рН и/или электрического баланса внутри ЖКМ, в то же время эффективно сохраняя на прежнем уровне значение рН среды, окружающей ЖКМ.
Еще одной целью предлагаемого изобретения является создание способа согласно приведенному выше описанию, в котором указанная первая стадия создания ПРИ дополнительно включает этап придания ПРИ характеристик водопроницаемости и/или смачиваемости, в особенности, в котором протонная проводимость и смачиваемость, по меньшей мере, частично обеспечиваются за счет введения в ПРИ гидрофильных добавок.
Еще одной целью предлагаемого изобретения является создание способа согласно приведенному выше описанию, который дополнительно включает стадию обеспечения ПРИ материалами с собственной протонной проводимостью (МСПП) и/или гидрофильными по своей природе полимерами (ГСПП), особенно за счет выбора МСПП и/или ГСПП из группы, состоящей из сульфонированных тетрафторэтиленовых сополимеров, коммерчески доступного нафиона (Nafion™) и его производных.
Еще одной целью предлагаемого изобретения является создание способа согласно приведенному выше описанию, который дополнительно включает стадии создания двух или более либо двумерных (2D), с топологически складчатыми 2D поверхностями, либо трехмерных (3D) ПРИ, причем каждый из этих ПРИ состоит из материалов, содержащих легко диссоциирующие катионные и/или анионные группы (ЛДКАГ); и формирования пространственной структуры ЛДКАГ таким образом, который эффективно сводит к минимуму изменения значения рН среды, окружающей ЖКМ.
Еще одной целью предлагаемого изобретения является создание способа согласно приведенному выше описанию, который дополнительно включает стадию пространственной организации каждой ЛДКАГ в виде определенной либо 2D-, либо 3D-структуры таким образом, чтобы свести к минимуму изменения значения рН среды, окружающей ЖКМ.
Еще одной целью предлагаемого изобретения является создание способа согласно приведенному выше описанию, в котором стадию формирования пространственной структуры осуществляют способом, который выбран из группы, состоящей из (i) чередования ЛДКАГ; (ii) перекрывания ЛДКАГ; (iii) сопряжения ЛДКАГ; (iv) гомогенного либо гетерогенного смешивания ЛДКАГ и (v) сочетания перечисленных структур.
Еще одной целью предлагаемого изобретения является создание способа согласно приведенному выше описанию, который дополнительно включает стадию нарушения гомеостаза рН и/или электрического потенциала внутри, по меньшей мере, части ЖКМ под воздействием ПРИ, в то же время как (i) эффективно сохраняя на прежнем уровне значение рН среды, окружающей ЖКМ, так и (ii) минимально воздействуя на целостность среды, окружающей ЖКМ, в особенности способа, обеспечивающего сведение к минимуму выщелачивания либо ионизированных, либо нейтральных атомов, молекул или частиц (АМЧ) из ПРИ в среду, окружающую ЖКМ.
Еще одной целью предлагаемого изобретения является создание способа согласно приведенному выше описанию, который дополнительно включает стадию избирательного нарушения гомеостаза рН и/или электрического баланса внутри, по меньшей мере, одного первого замкнутого объема (например, в живых клетках-мишенях, ЖКМ), в то же время меньше нарушая гомеостаз рН внутри, по меньшей мере, одного второго замкнутого объема (например, клеток, не являющихся мишенью, КНМ).
Еще одной целью предлагаемого изобретения является создание способа согласно приведенному выше описанию, в котором дифференциация между ЖКМ и КНМ производится при помощи одной или более из следующих стадий: (i) обеспечение различной ионообменной емкости, (ii) обеспечение различных значений рН, (iii) оптимизация соотношения размеров ПРИ и ЖКМ, (iv) обеспечение различных пространственных конфигураций границ ПРИ поверх объема ПРИ, (v) обеспечение критического количества частиц, являющихся ПРИ (или критической площади активной поверхности) с определенным значением емкости, приходящейся на данный объем, и (vi) обеспечение средств исключения по размеру, например, сетки, решеток и т.д.
Еще одной целью предлагаемого изобретения является создание способа изготовления продукта производства, включающего стадии получения ПРИ согласно приведенному выше описанию, размещения ПРИ на поверхности или под поверхностью продукта производства, и, путем контакта ПРИ с ЖКМ, нарушения гомеостаза рН и/или электрического баланса внутри, по меньшей мере, части ЖКМ, в то же время эффективно сохраняя на прежнем уровне значение рН и функциональные свойства упомянутой поверхности.
Еще одной целью предлагаемого изобретения является создание способа согласно приведенному выше описанию, который дополнительно включает стадии: получения, по меньшей мере, одной наружной протонпроницаемой поверхности с заданными функциональными свойствами; создания, по меньшей мере, на части упомянутой поверхности, по меньшей мере, одного ПРИ и/или нанесении слоя, по меньшей мере, одного ПРИ на поверхность или под поверхностью; и уничтожения ЖКМ или иного нарушения жизненно важных внутриклеточных процессов в ЖКМ и/или межклеточных взаимодействий ЖКМ, в то же время эффективно сохраняя на прежнем уровне значение рН и функциональные свойства среды, окружающей ЖКМ.
Еще одной целью предлагаемого изобретения является создание способа согласно приведенному выше описанию, который дополнительно включает стадии: получения, по меньшей мере, одной внешней протонпроводящей поверхности с заданными функциональными свойствами; размещения одного или более наружных протонпроводящих слоев на, по меньшей мере, части указанной поверхности и/или под ней, причем один или более слоев, по меньшей мере, частично состоят из одного ПРИ или содержат слой с, по меньшей мере, одним ПРИ; и уничтожения ЖКМ или иного нарушения жизненно важных внутриклеточных процессов в ЖКМ и/или межклеточных взаимодействий ЖКМ, в то же время эффективно сохраняя на прежнем уровне значение рН и функциональные свойства среды, окружающей ЖКМ.
Еще одной целью предлагаемого изобретения является создание способа согласно приведенному выше описанию, который дополнительно включает стадии получения, по меньшей мере, одного ПРИ, и обеспечения указанного ПРИ, по меньшей мере, одним предохранительным барьером для того, чтобы получить стабильную длительную активность.
Еще одной целью предлагаемого изобретения является создание способа согласно приведенному выше описанию, в котором стадия создания барьера реализуется с использованием полимерного предохранительного барьера, способного предотвратить диффузию тяжелых ионов, предпочтительно с использованием полимера, служащего барьером для проникновения определенных ионов, особенно коммерчески доступного продукта нафион (Nafion™).
В объем предлагаемого изобретения входят также один или более следующих материалов: инкапсулированные буферные системы на основе сильных кислот и оснований в твердых или полутвердых оболочках, твердые ионообменные материалы (ТИОМ), иономеры, ТИОМ с покрытием, мелкопористые ТИОМ с высокой степенью поперечной сшивки, ТИОМ с заполненными порами, встроенные в матрицу ТИОМ, встроенные в матрицу частицы иономеров, смесь анионных (кислотных) и катионных (основных) ТИОМ и т.д.
Еще одной целью предлагаемого изобретения является создание ПРИ согласно любому из приведенных выше описаний, в котором в качестве ПРИ выступают композиции встречающихся в природе органических кислот, содержащих различные карбоксильные и/или сульфокислотные группы, из семейства абиетиновой кислоты (C20H30O2), такие как канифоль, древесная смола и подобные вещества, кислые и основные терпены.
Еще одной целью предлагаемого изобретения является создание способа индуцирования апоптоза, по меньшей мере, у части популяции ЖКМ. Предлагаемый способ включает стадии: создания, по меньшей мере, одного ПРИ согласно любому из приведенных выше описаний; приведение ПРИ в контакт с ЖКМ; и эффективное нарушение гомеостаза рН и/или электрического баланса внутри ЖКМ для того, чтобы достичь апоптоза ЖКМ, в то же время эффективно сохраняя на прежнем уровне значение рН среды, окружающей ЖКМ.
Еще одной целью предлагаемого изобретения является создание способа предотвращения развития резистентности ЖКМ и отбора мутаций, определяющих резистентность. Предлагаемый способ включает стадии: создания, по меньшей мере, одного ПРИ согласно приведенному выше описанию; приведения ПРИ в контакт с ЖКМ; и эффективного нарушения гомеостаза рН и/или электрического баланса внутри ЖКМ для того, чтобы предотвратить развитие резистентности ЖКМ и отбор мутаций, определяющих резистентность, в то же время эффективно сохраняя на прежнем уровне значение рН среды, окружающей ЖКМ, и безопасность пациента.
Еще одной целью предлагаемого изобретения является создание способа лечения пациента, который содержит стадии получения медицинского имплантата, не встречающегося в природе, обеспечения указанного имплантата, по меньшей мере, одним ПРИ согласно приведенному выше описанию, способным эффективно нарушать гомеостаз рН и/или электрический баланс внутри ЖКМ, имплантирования имплантата в организм пациента или наложения имплантата на поверхность тела пациента таким образом, чтобы имплантат приходил в контакт, по меньшей мере, с одной ЖКМ, нарушая жизненно важные внутриклеточные процессы в ЖКМ и/или межклеточные взаимодействия ЖКМ, в то же время эффективно сохраняя на прежнем уровне значение рН среды, окружающей ЖКМ, и безопасность пациента.
Еще одной целью предлагаемого изобретения является создание способа лечения пациента, включающего стадию введения пациенту эффективного количества ПРИ согласно приведенному выше описанию, способом, обеспечивающим контакт ПРИ, по меньшей мере, с одной ЖКМ, и стадию нарушения жизненно важных внутриклеточных процессов в ЖКМ и/или межклеточных взаимодействий ЖКМ, в то же время эффективно сохраняя на прежнем уровне значение рН среды, окружающей ЖКМ. В объем предлагаемого изобретения входит способ введения ПРИ, например, перорально, ректально, эндоскопически, при помощи брахитерапии, местно или внутривенно, системно, в форме материала в виде твердых частиц, который вводят в том виде, как есть, или при помощи фармацевтически приемлемого носителя.
Еще одной целью предлагаемого изобретения является создание способа регенерации ПРИ согласно приведенному выше описанию, содержащего, по меньшей мере, одну стадию, выбранную из группы, включающей (i) регенерацию ПРИ; (ii) регенерацию его буферной емкости; и (iii) регенерацию его протонной проводимости.
Краткое описание чертежей
Чтобы понять сущность изобретения и ознакомиться с тем, как оно может быть реализовано на практике, ниже приводится целый ряд предпочтительных вариантов осуществления изобретения, только в виде неограничивающих примеров, со ссылкой на приложенные фигуры, которые иллюстрируют следующее:
На фигуре 1 приведен график, показывающий цитотоксический эффект микрогранул диоксида кремния, покрытых ПААГ, на клетки линии Jurkat в зависимости от значения рН и времени. Клетки линии Jurkat подвергали воздействию микрогранул диоксида кремния, покрытых ПААГ, в течение 0, 10, 20 и 30 мин. Жизнеспособность клеток оценивали при помощи набора LIVE/DEAD Viability Kit.
На фигуре 2 приведен график, показывающий цитотоксический эффект микрогранул диоксида кремния, покрытых ПААГ, с различными значениями рН на клетки линии Jurkat в зависимости от концентрации микрогранул. Клетки линии Jurkat подвергали воздействию микрогранул диоксида кремния, покрытых ПААГ, в течение 0, 10, 20, 30 и 60 мин. Жизнеспособность клеток оценивали при помощи набора LIVE/DEAD Viability Kit.
На фигуре 3 приведен график, показывающий цитотоксический эффект микрогранул диоксида кремния, покрытых ПААГ, на клетки линии Jurkat в зависимости от значения рН микрогранул и времени инкубации. Клетки линии Jurkat подвергали воздействию микрогранул диоксида кремния, покрытых ПААГ, в течение 0, 10, 20 и 30 мин. Жизнеспособность клеток оценивали при помощи набора LIVE/DEAD Viability Kit.
На фигуре 4 приведен график, показывающий цитотоксический эффект микрогранул диоксида кремния, покрытых ПААГ, на клетки линии НТ-29 в зависимости от значения рН микрогранул. Клетки линии НТ-29 подвергали воздействию микрогранул диоксида кремния, покрытых ПААГ, в течение 50 часов. Жизнеспособность клеток оценивали с помощью метода анализа с использованием красителя сульфородамина.
На фигуре 5 приведен график, показывающий цитотоксический эффект микрогранул диоксида кремния, покрытых ПААГ, на клетки линии НТ-29 в зависимости от концентрации. Клетки линии НТ-29 подвергали воздействию различных концентраций микрогранул диоксида кремния, покрытых ПААГ, в течение 50 часов. Жизнеспособность клеток оценивали с помощью метода анализа с использованием красителя сульфородамина.
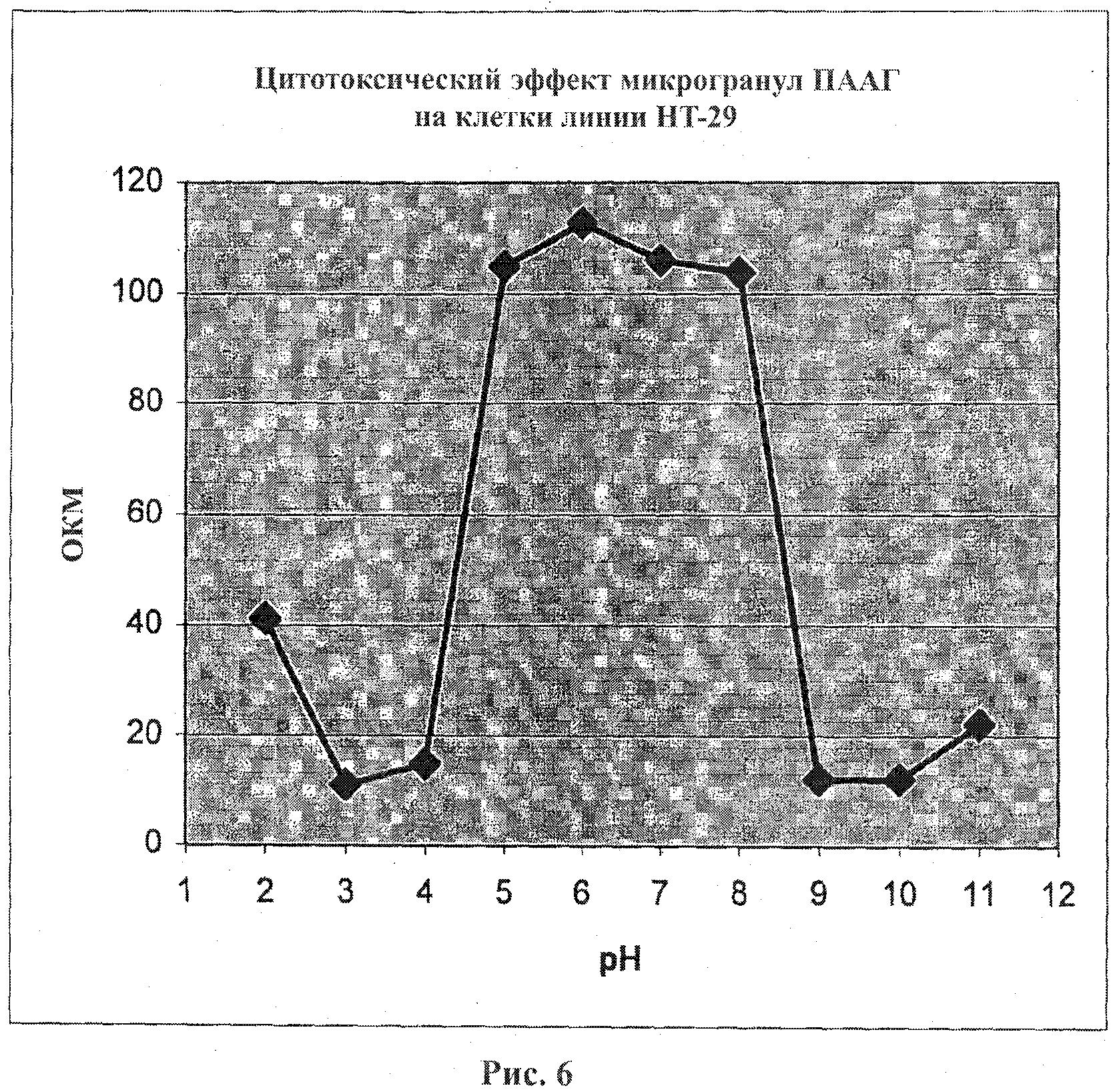
На фигуре 6 приведен график, показывающий цитотоксический эффект микрогранул ПААГ на клетки линии НТ-29 в зависимости от значения рН микрогранул. Клетки линии НТ-29 подвергали воздействию микрогранул диоксида кремния, покрытых ПААГ, в течение 50 часов. Жизнеспособность клеток оценивали с помощью метода анализа с использованием красителя сульфородамина.
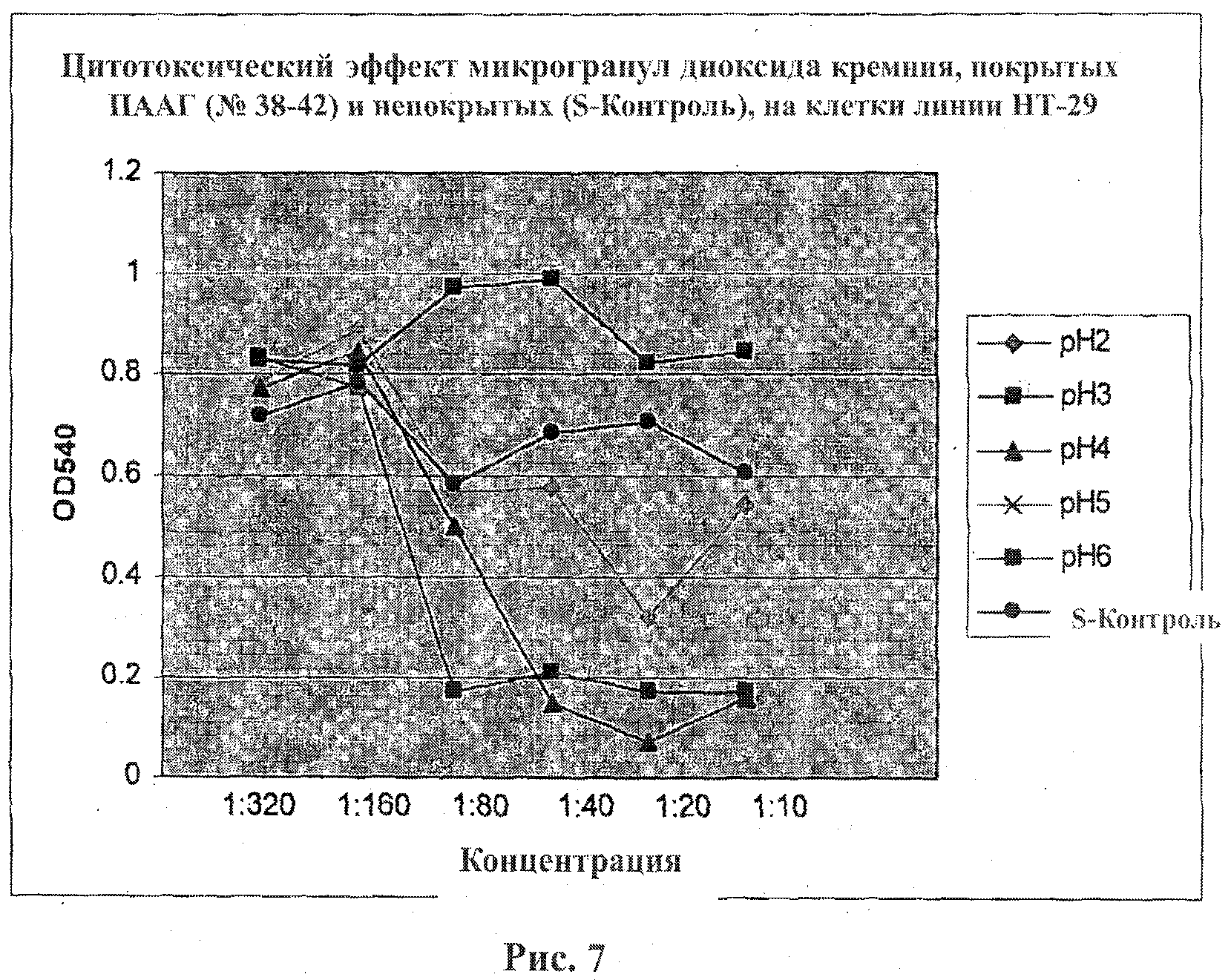
На фигуре 7 приведен график, показывающий цитотоксический эффект микрогранул ПААГ, имеющих значения рН в диапазоне от 2 до 6, на клетки линии НТ-29 в зависимости от концентрации. Клетки линии НТ-29 подвергали воздействию различных концентраций микрогранул диоксида кремния, покрытых ПААГ, в течение 50 часов. Жизнеспособность клеток оценивали с помощью метода анализа с использованием красителя сульфородамина.
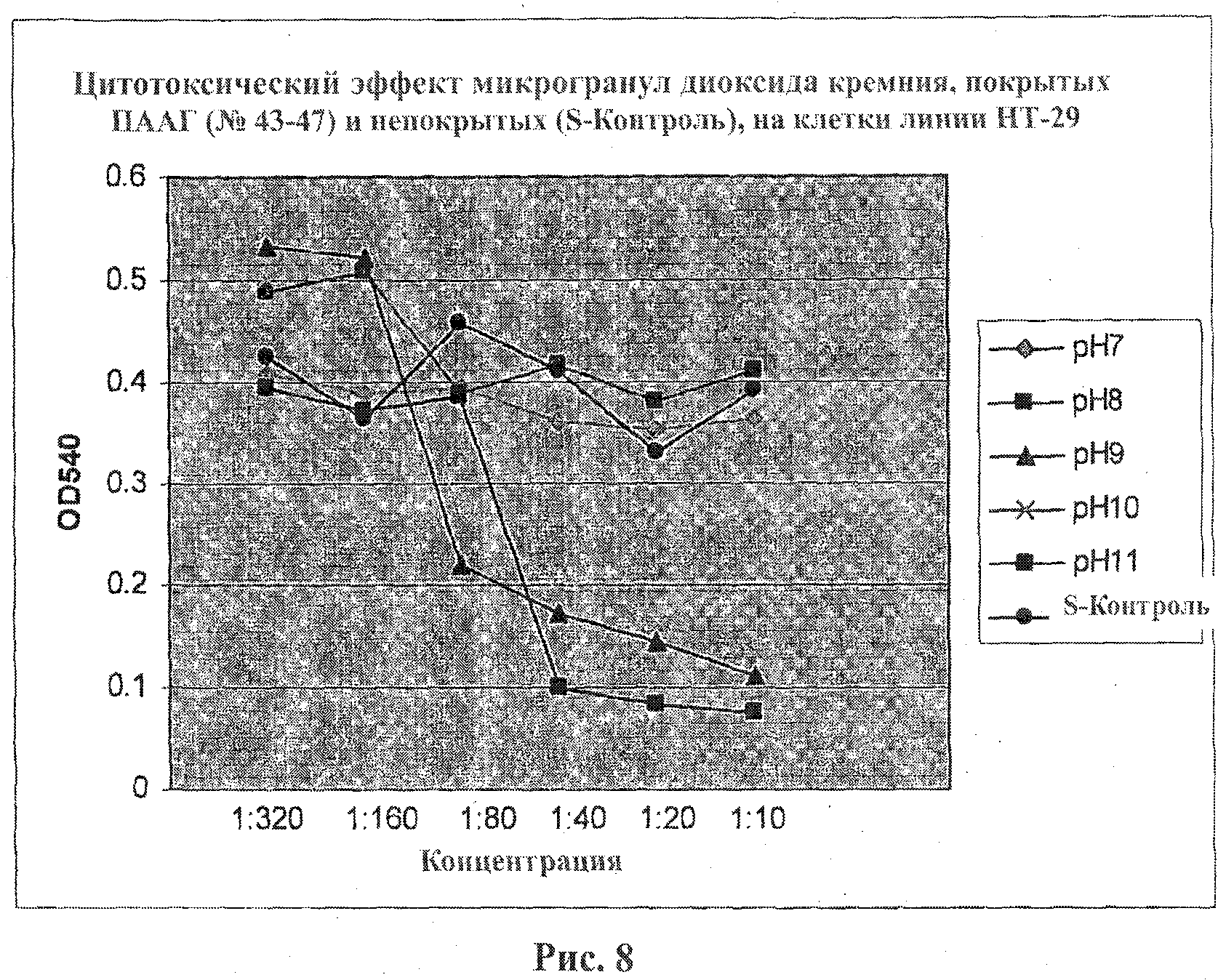
На фигуре 8 приведен график, показывающий цитотоксический эффект микрогранул ПААГ, имеющих значения рН в диапазоне от 7 до 11, на клетки линии НТ-29 в зависимости от концентрации.. Клетки линии НТ-29 подвергали воздействию различных концентраций микрогранул диоксида кремния, покрытых ПААГ, в течение 50 часов. Жизнеспособность клеток оценивали с помощью метода анализа с использованием красителя сульфородамина.
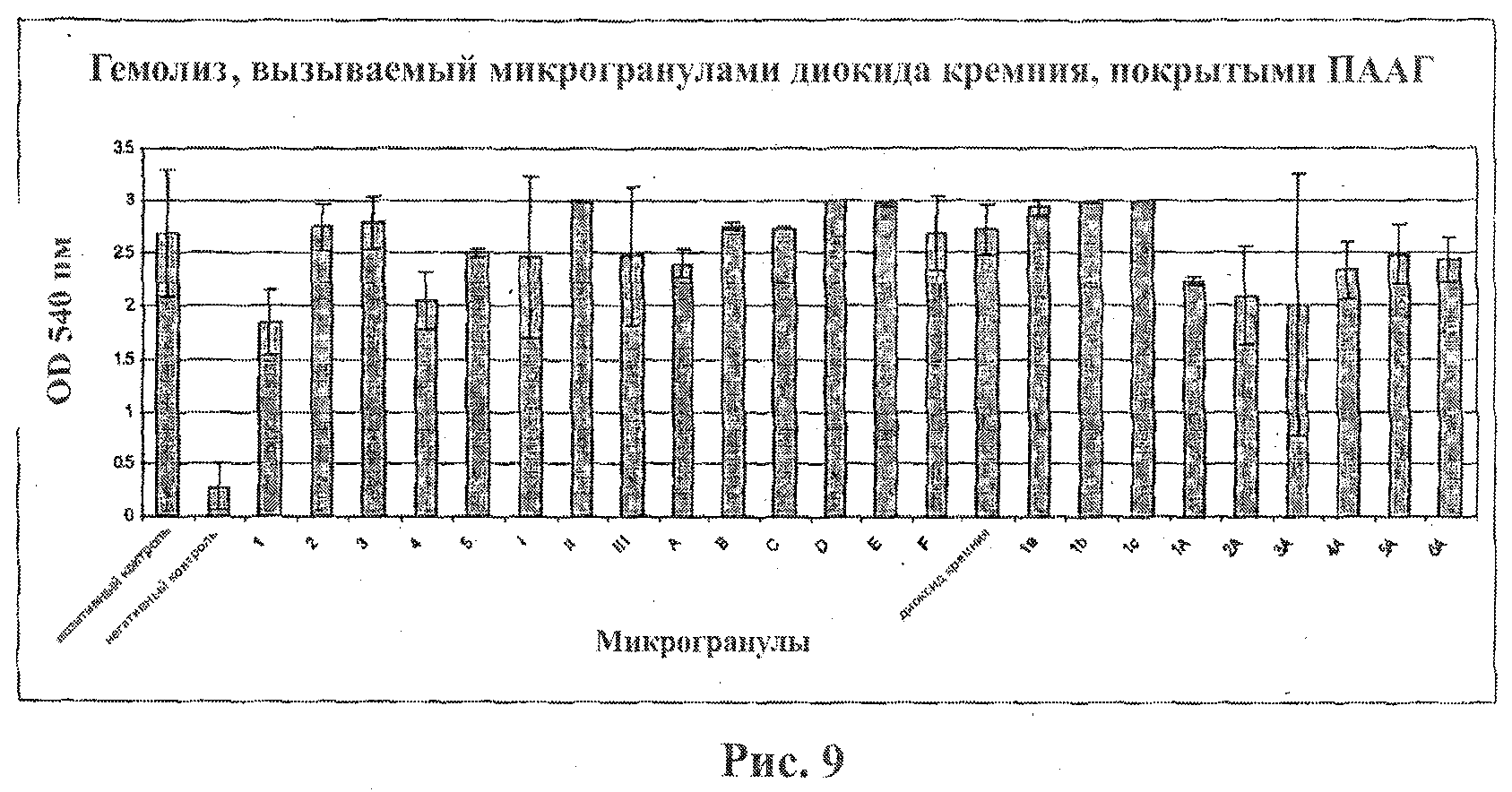
На фигуре 9 приведен график, показывающий гемолитическую активность микрогранул диоксида кремния, покрытых ПААГ. Эритроциты подвергали воздействию микрогранул диоксида кремния, покрытых ПААГ, в течение 4 часов. Гемолитическую активность микрогранул определяли спектрофотометрически.
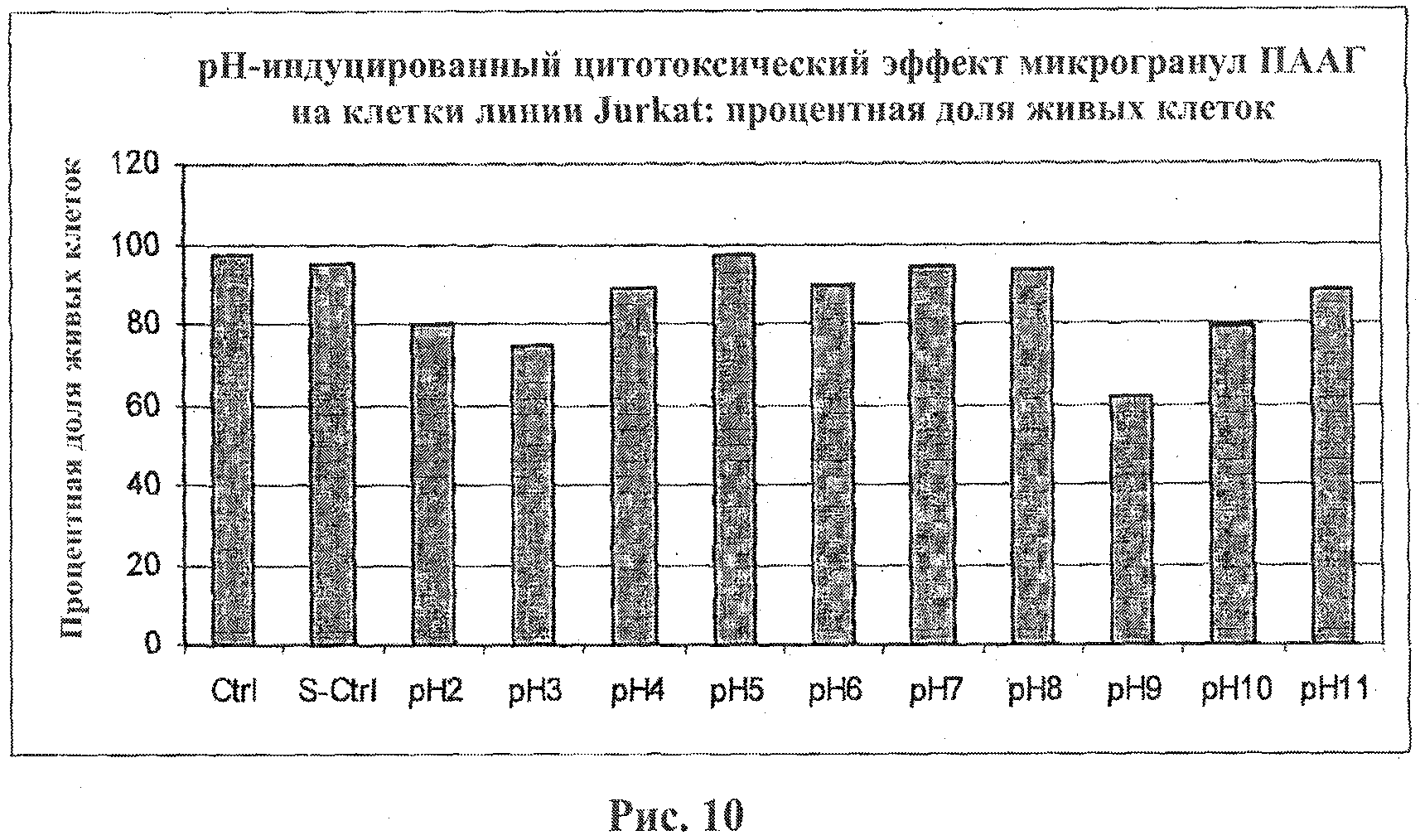
На фигуре 10 приведен график, показывающий рН-индуцированный цитотоксический эффект микрогранул ПААГ на клетки линии Jurkat. Клетки линии Jurkat подвергали воздействию микрогранул ПААГ в течение 20 мин. Процентную долю живых клеток оценивали при помощи набора LIVE/DEAD Viability Kit.
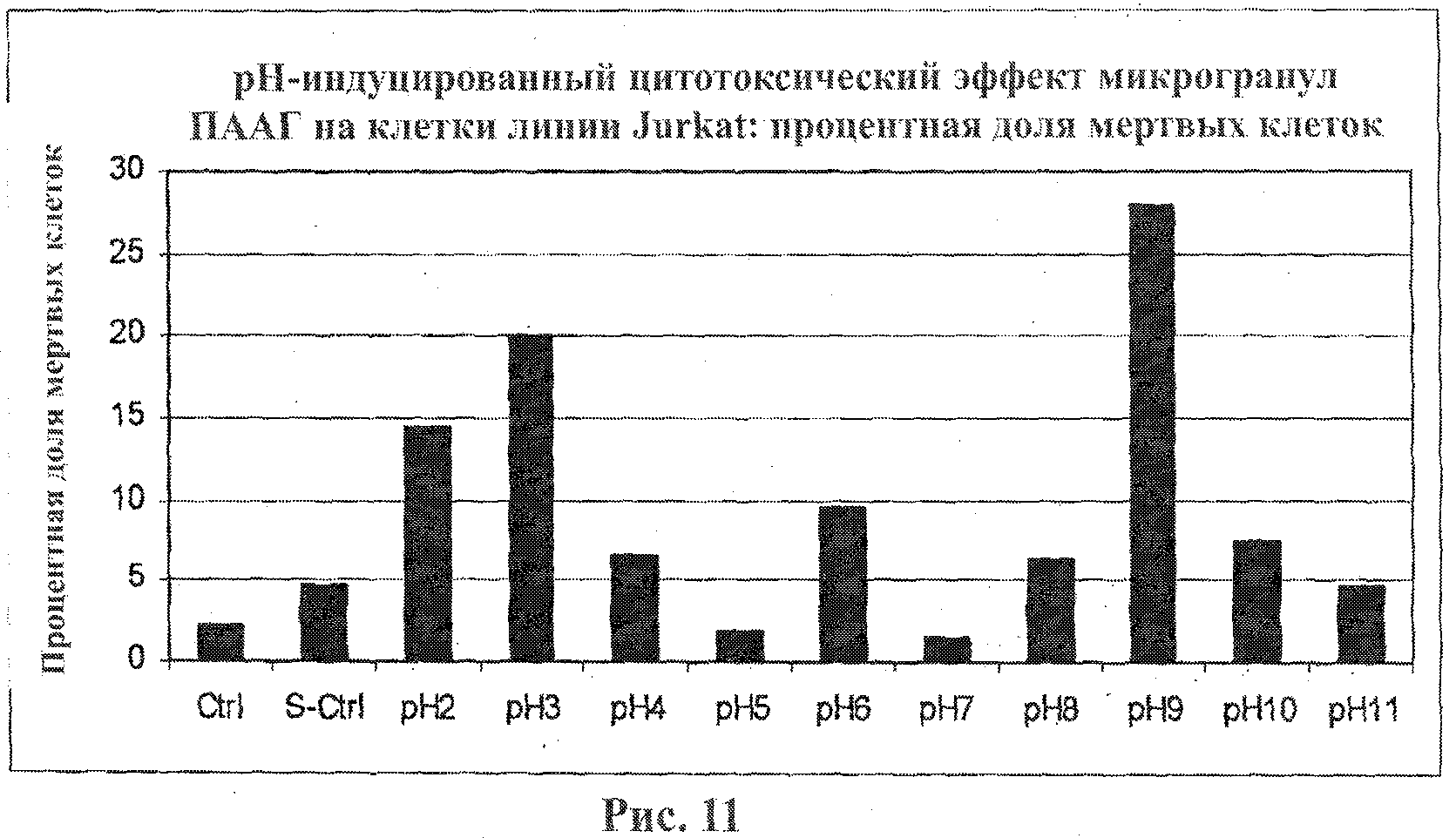
На фигуре 11 приведен график, показывающий рН-индуцированный цитотоксический эффект микрогранул ПААГ на клетки линии Jurkat. Клетки линии Jurkat подвергали воздействию микрогранул ПААГ в течение 20 мин. Процентную долю мертвых клеток оценивали при помощи набора LIVE/DEAD Viability Kit.
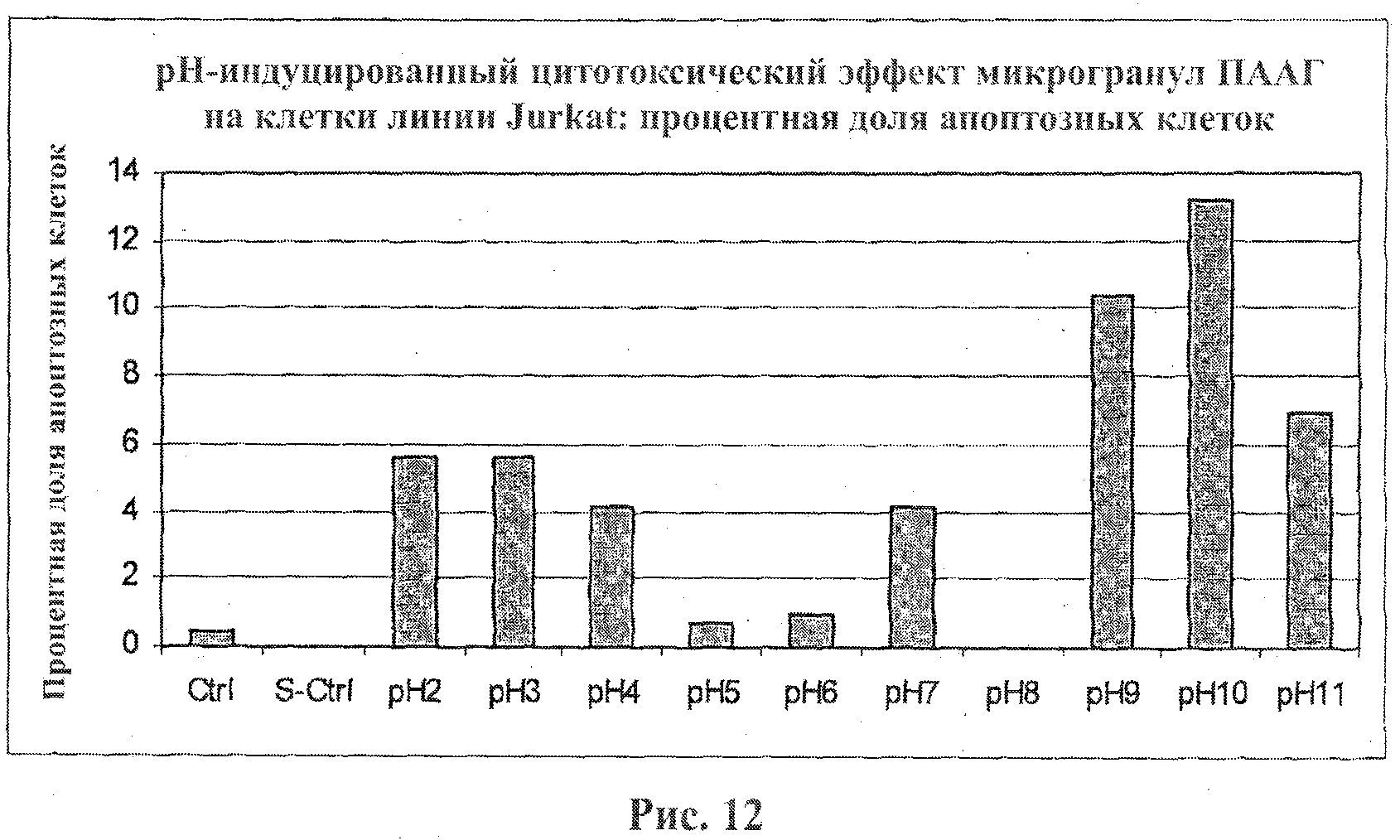
На фигуре 12 приведен график, иллюстрирующий апоптоз клеток линии Jurkat, индуцированный микрогранулами ПААГ. Клетки линии Jurkat подвергали воздействию микрогранул ПААГ в течение 20 мин. Для детекции апоптоза использовался диагностический набор с аннексином V, Annexin V Apoptosis Detection Kit.
На фигуре 13 приведен график, показывающий цитотоксический эффект микрогранул диоксида кремния, покрытых ПААГ, на клетки линии Jurkat. Клетки линии Jurkat подвергали воздействию микрогранул диоксида кремния, покрытых ПААГ, в течение 20 мин. Процентную долю живых клеток оценивали при помощи набора LIVE/DEAD Viability Kit.
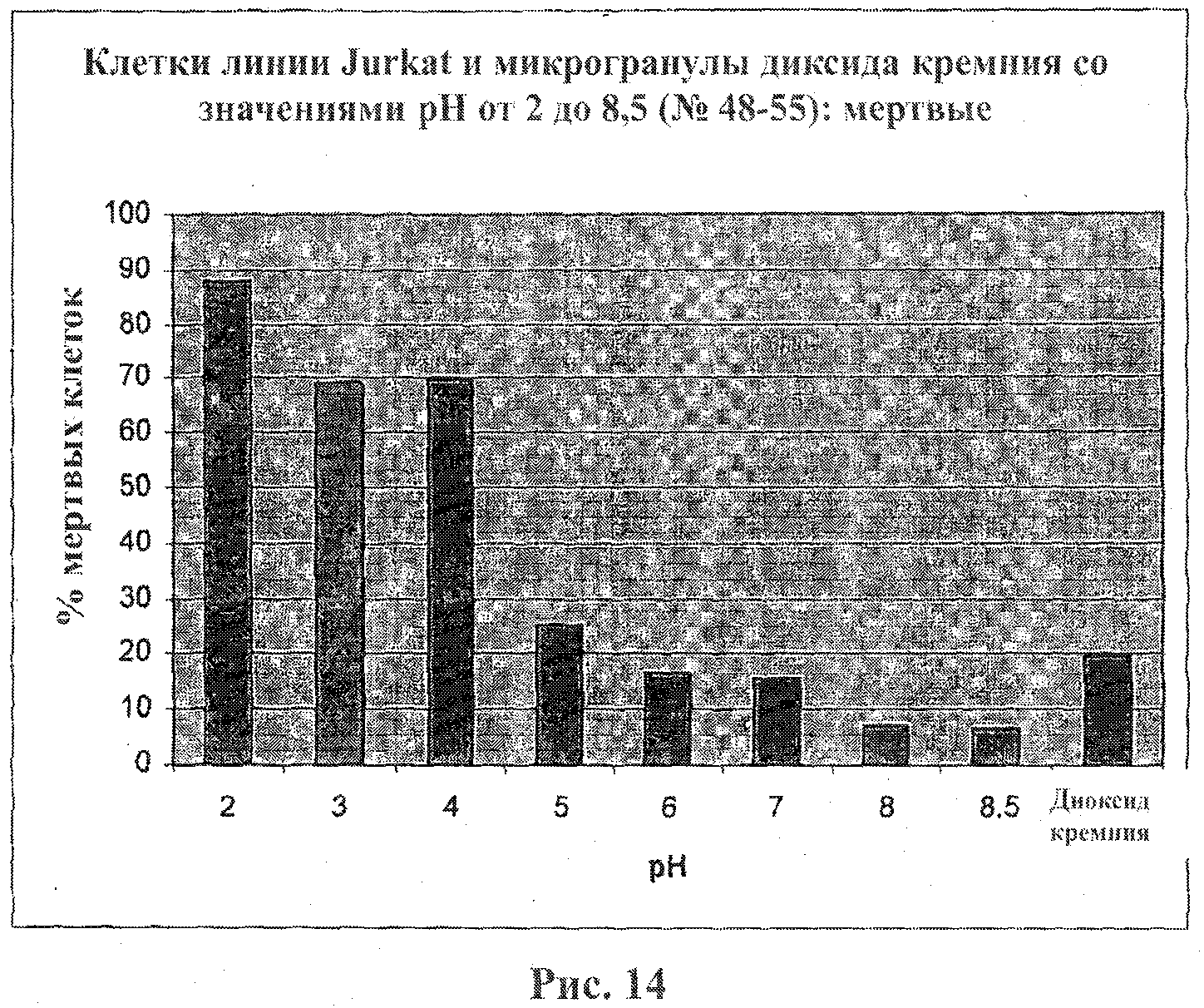
На фигуре 14 приведен график, показывающий цитотоксический эффект микрогранул диоксида кремния, покрытых ПААГ, на клетки линии Jurkat. Клетки линии Jurkat подвергали воздействию микрогранул диоксида кремния, покрытых ПААГ, в течение 20 мин. Процентную долю мертвых клеток оценивали при помощи набора LIVE/DEAD Viability Kit.
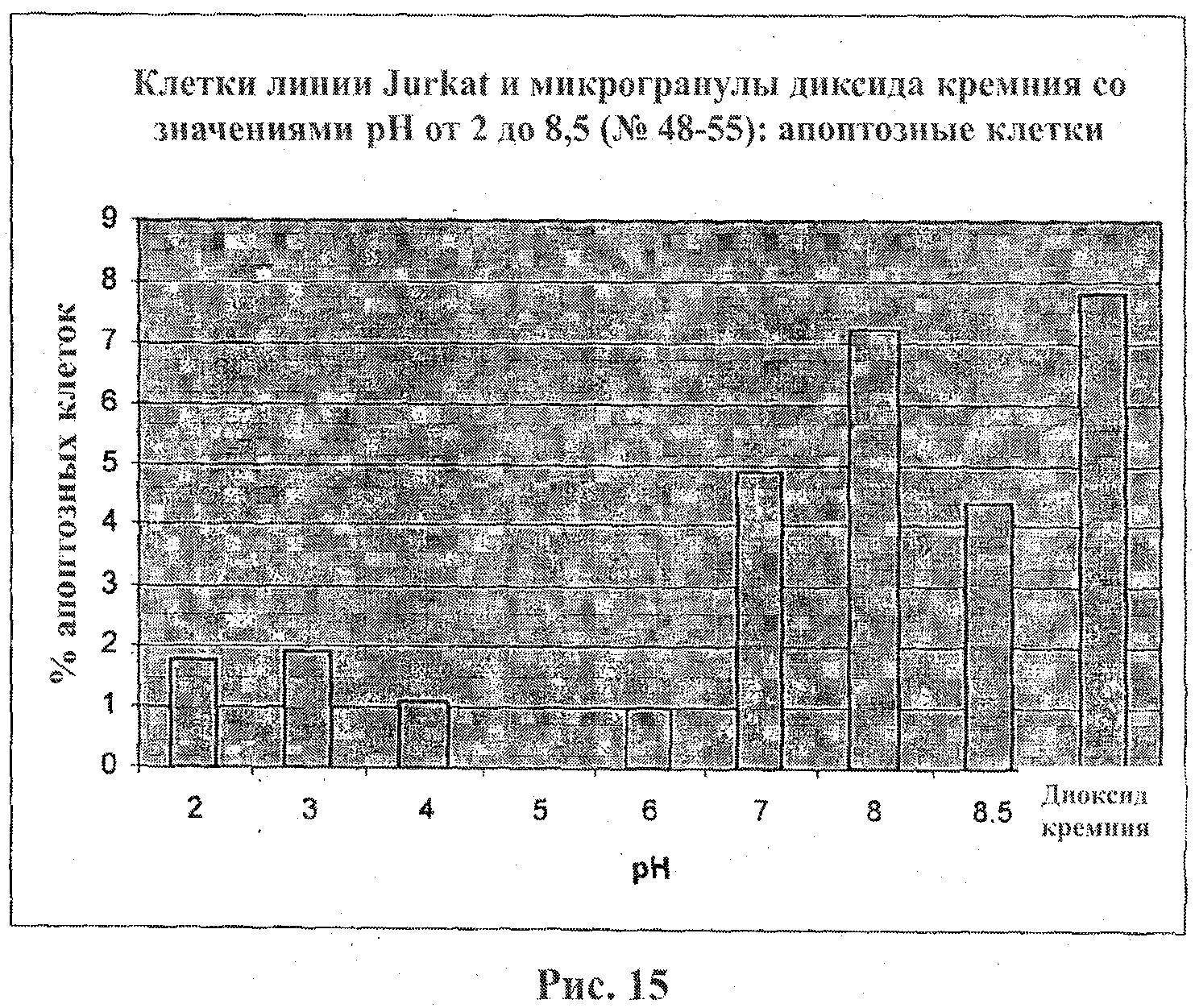
На фигуре 15 приведен график, иллюстрирующий апоптоз клеток линии Jurkat, индуцированный микрогранулами диоксида кремния, покрытыми ПААГ. Клетки линии Jurkat подвергали воздействию микрогранул диоксида кремния, покрытых ПААГ, в течение 20 мин. Для детекции апоптоза использовался диагностический набор с аннексином V, Annexin V Apoptosis Detection Kit.
На фигуре 16 приведены микрофотографии, полученные при морфологическом исследовании клеток линии Jurkat, как контрольных, так и обработанных микрогранулами диоксида кремния, покрытыми ПААГ. Клетки подвергали воздействию микрогранул диоксида кремния №48, покрытых ПААГ, а затем исследовали с помощью красителя Hoechst 33342 после конденсации хроматина.
На фигуре 17 приведены микрофотографии, полученные при морфологическом исследовании клеток линии Jurkat, как контрольных, так и обработанных микрогранулами диоксида кремния, покрытыми ПААГ. Клетки подвергали воздействию микрогранул диоксида кремния №48, покрытых ПААГ. При морфологическом исследовании были обнаружены набухшие клетки и сморщивание цитоплазматических мембран, что характерно для апоптоза.
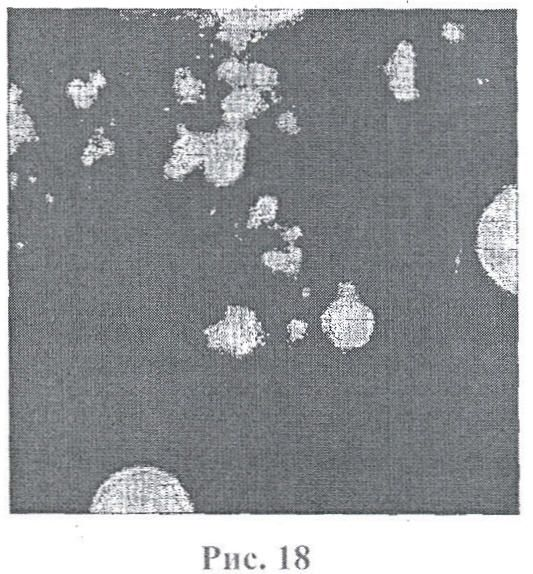
На фигуре 18 приведены микрофотографии, полученные при морфологическом исследовании клеток линии Jurkat, как контрольных, так и обработанных микрогранулами диоксида кремния, покрытыми ПААГ. Клетки подвергали воздействию микрогранул диоксида кремния №48, покрытых ПААГ. При морфологическом исследовании были обнаружены набухшие клетки и сморщивание цитоплазматических мембран, что характерно для апоптоза.
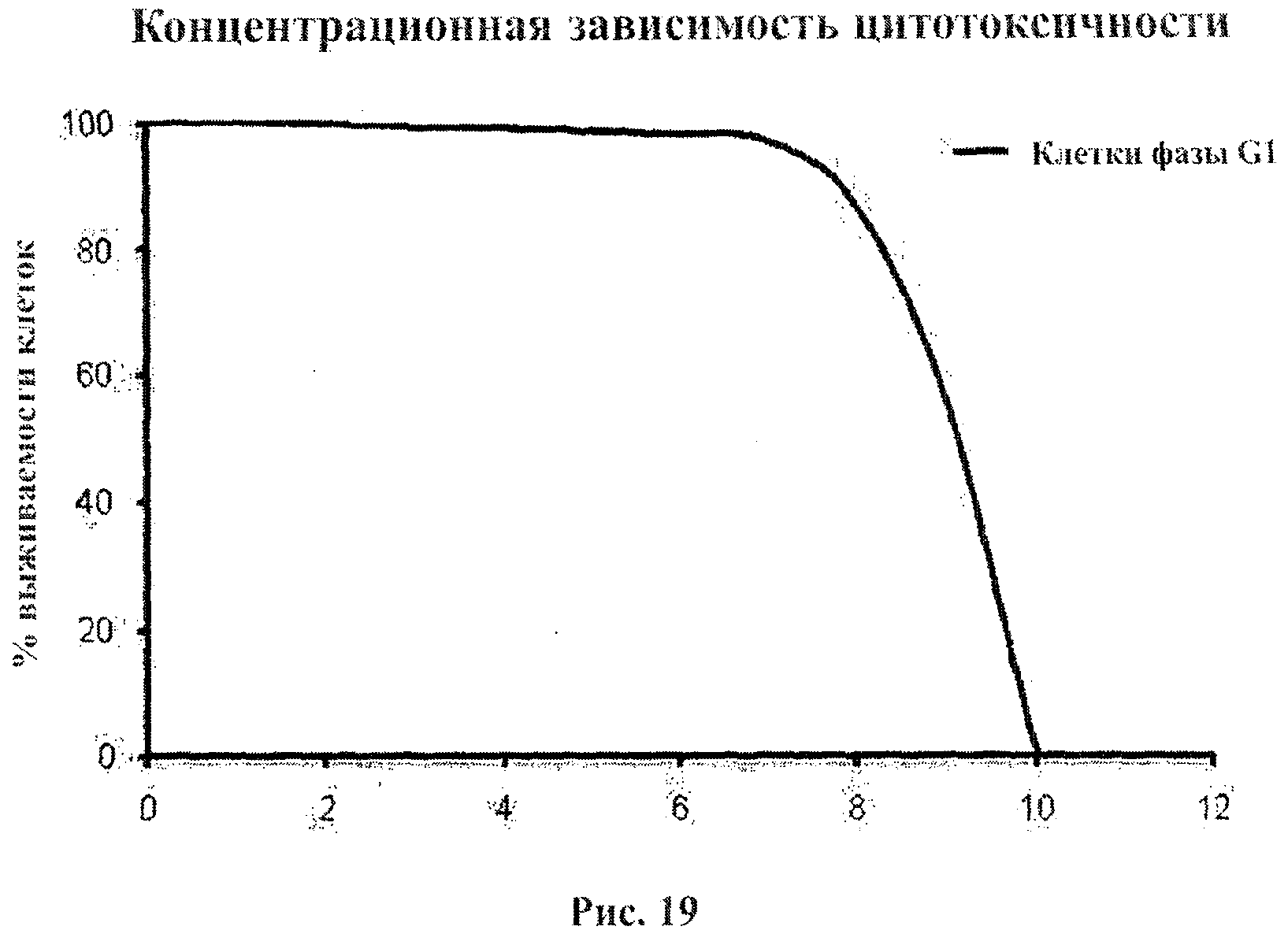
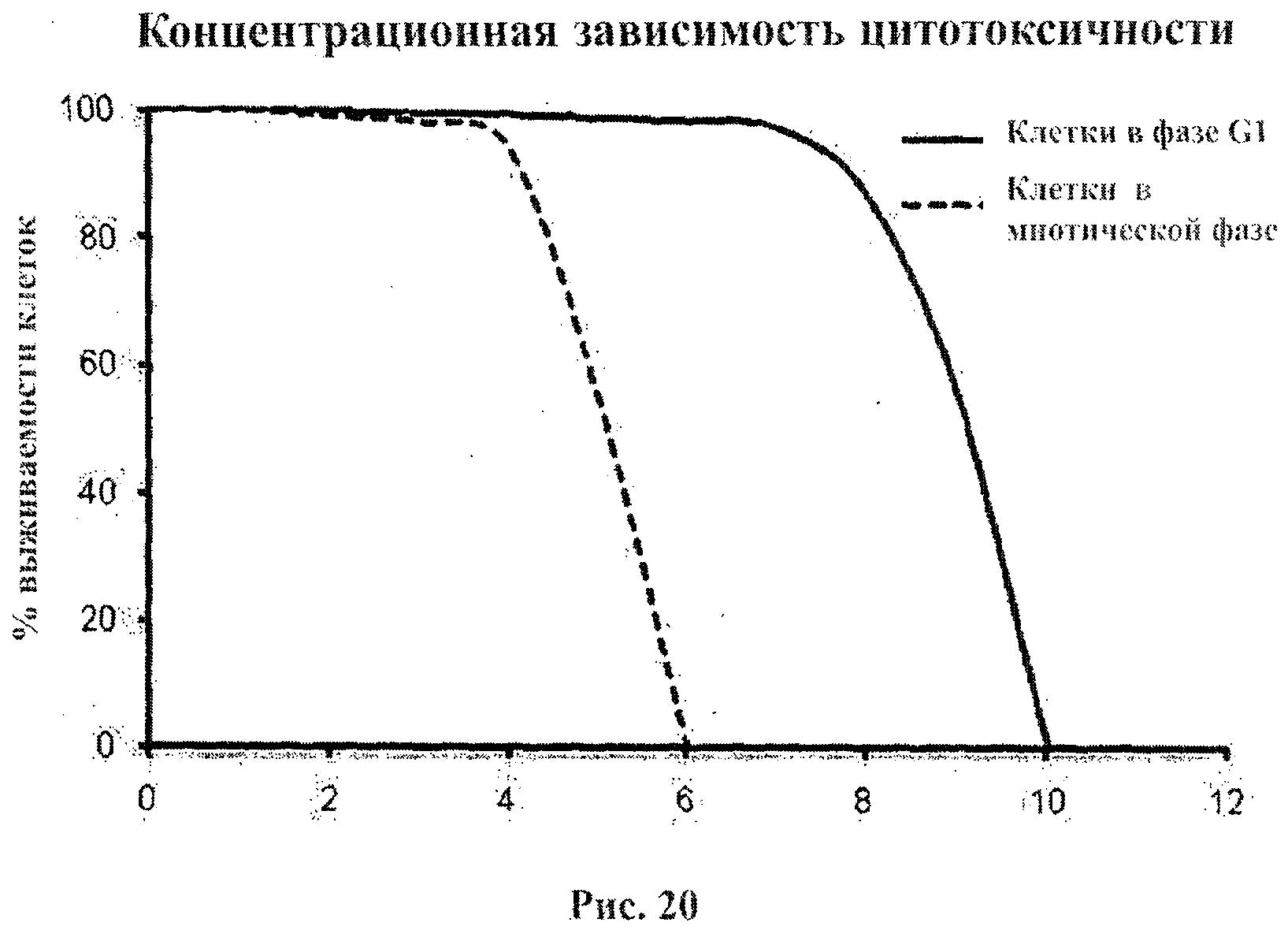
На фигуре 19 приведена концентрационная зависимость цитотоксического эффекта в фазе G1 клеточного цикла.
На фигуре 20 приведена концентрационная зависимость цитотоксического эффекта в фазе G1 и в митотической фазе клеточного цикла.
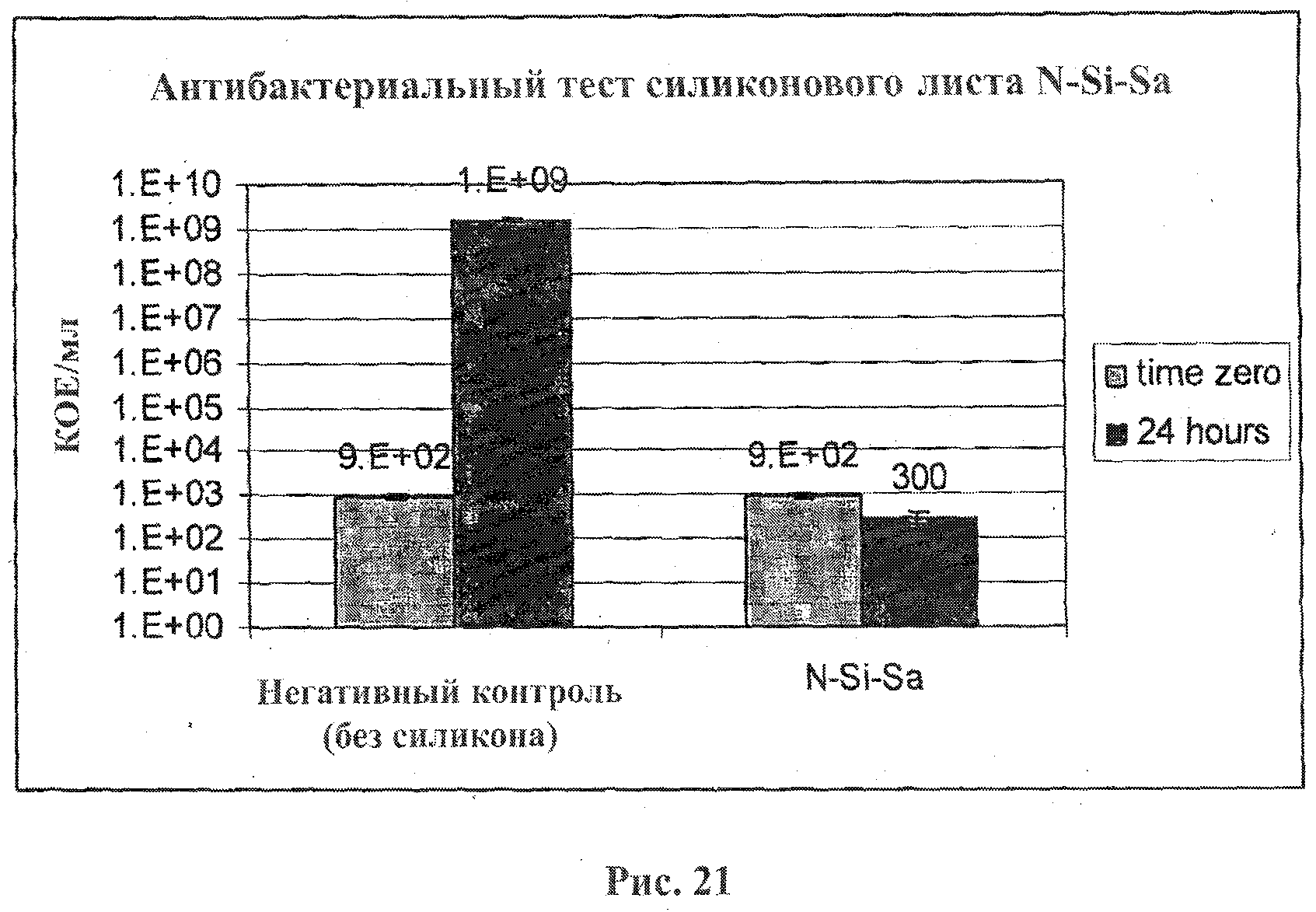
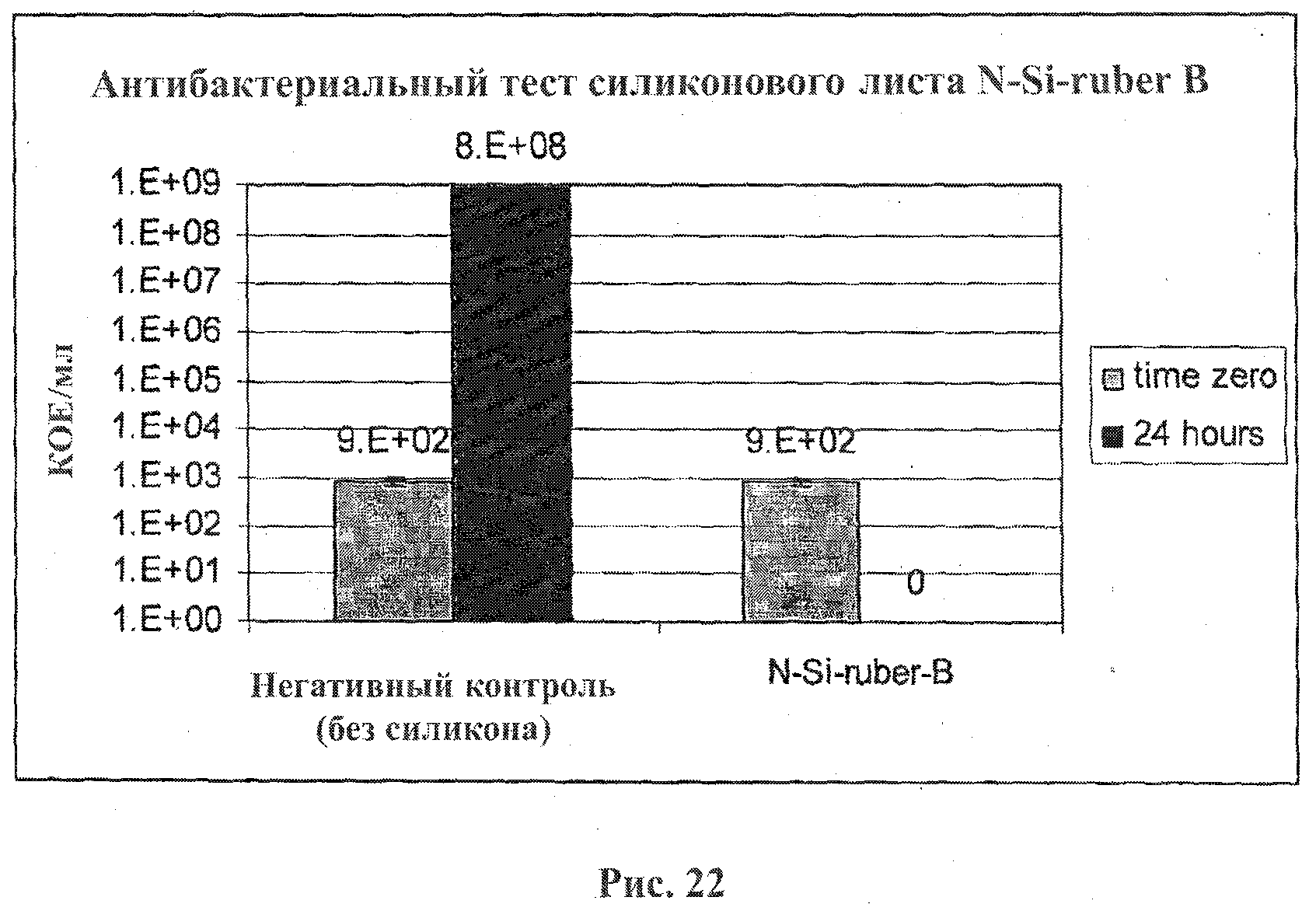
На фигурах 21 и 22 представлены результаты исследования активности композиций А и В соответственно.
На фигуре 23 приведены результаты исследования воздействия ПРИ на штамм Candida albicans (ATCC 10231).
Осуществление изобретения
В следующих описаниях, проиллюстрированных соответствующими чертежами, излагаются предпочтительные варианты воплощения предлагаемого изобретения. Варианты воплощения предлагаемого изобретения, описанные в данном документе, являются лучшими вариантами воплощения изобретения, предполагаемыми изобретателями, для реализации их изобретения с коммерческой выгодой, хотя следует понимать, что в рамках предлагаемого изобретения возможны разного рода изменения и модификации.
Термин «контакт», использующийся ниже в данном документе, относится к непосредственному и косвенному контакту ПРИ с замкнутым объемом (живой клеткой-мишенью или вирусом - ЖКМ), при котором упомянутые ПРИ и ЖКМ расположены рядом, например, при котором ПРИ приближается либо к внутренним, либо к внешним участкам ЖКМ, и при котором дополнительно упомянутые ПРИ и ЖКМ находятся в такой степени близости, которая обеспечивает (i) эффективное нарушение гомеостаза рН и/или электрического баланса или (ii) иное нарушение жизненно важных внутриклеточных процессов в ЖКМ и/или межклеточных взаимодействий упомянутых ЖКМ.
Термины «эффективно» и «эффективное», использующиеся ниже в данном документе, относятся к увеличению эффективности более чем на 10%, дополнительно или альтернативно этому, упомянутые термины относятся к увеличению эффективности более чем на 50%, дополнительно или альтернативно этому, упомянутые термины относятся к увеличению эффективности более чем на 80%. В рамках предлагаемого изобретения, что касается целей уничтожения ЖКМ, упомянутый термин относится к уничтожению более чем 50% популяции ЖКМ за заданный промежуток времени, например за 10 мин.
Термин «добавки» используется ниже в данном документе по отношению к одному или более членам группы, включающей биоциды, например органические биоциды, такие как масло чайного дерева, канифоль, абиетиновая кислота, терпены, розмариновое масло и т.д., и неорганические биоциды, такие как оксиды цинка, медь и ртуть, соли серебра и т.д.; маркеры, биомаркеры, красители, пигменты, меченные радиоактивными изотопами материалы, клеи, адгезивы, смазочные материалы, медикаменты, лекарственные средства замедленного высвобождения, питательные вещества, пептиды, аминокислоты, полисахариды, ферменты, гормоны, комплексоны, поливалентные ионы, эмульгаторы и деэмульгаторы, связующие вещества, наполнители, загустители, факторы, кофакторы, ингибиторы ферментов, отдушки, средства доставки, такие как липосомы, многослойные везикулы и прочие везикулы, магнитные и парамагнитные материалы, ферромагнитные и неферромагнитные материалы, материалы, повышающие биологическую совместимость и/или биодеградируемые материалы, такие как полимолочные кислоты и полиглутаминовые кислоты, антикоррозионные пигменты, пигменты для необрастающих покрытий, поглотители УФ-излучения и добавки, усиливающие воздействие УФ-излучения, добавки, ускоряющие коагуляцию крови, антикоагулянты, например гепарин и т.п., или любая комбинация этих веществ.
Термин «материал в виде твердых частиц» используется ниже в данном документе по отношению к одному или более членам группы, включающей порошки из наночастиц, порошки с частицами микронного размера, тонкоизмельченные порошки, сыпучие порошки, пыли, агрегаты частиц, частицы, имеющие средний диаметр в диапазоне примерно от 1 нм до 1000 нм или примерно от 1 мм до 25 мм.
Термин «примерно» используется ниже в данном документе по отношению к значениям, отличающимся не более чем на ±20% от указанного значения.
Термин «поверхность» используется ниже в данном документе в самом широком смысле этого слова. В одном значении упомянутый термин используется по отношению к наиболее удаленным границам организмов или неживых объектов (например, сред, зданий и оборудования для производства пищевых продуктов и т.д.), с которыми могут входить в контакт композиции согласно предлагаемому изобретению (например, в отношении животных: к коже, шерсти и меху и т.д., а в отношении растений: к листьям, стеблям, частям цветков, семенам, корням и плодовым телам и т.д.). В другом значении термин также относится к внутренним мембранам и поверхностям животных и растительных организмов (например, в отношении животных: к пищеварительному тракту, сосудистой ткани и т.п., а в отношении растений: к сосудистой ткани и т.д.), с которыми могут входить в контакт композиции посредством любого из числа путей чрескожной доставки (например, в виде инъекций, чрескожной доставки, ингаляции и т.п.).
В объем предлагаемого изобретения входит композиция, содержащая нерастворимый ПРИ в виде полимера, керамики, геля, смолы или оксида металла. ПРИ является носителем сильнокислых или сильноосновных функциональных групп (или обоих видов групп), значения рН которых доведено примерно до <4,5 или примерно до >8,0. В объем предлагаемого изобретения входит композиция, в которой нерастворимым ПРИ является твердая буферная система.
В объем предлагаемого изобретения входит также такая композиция материалов, в которой упомянутые группы доступны для воды независимо от того, расположены ли они на поверхности или внутри ПРИ. Контакт живой клетки (например, клетки бактерий, грибов, животных или растений) с ПРИ уничтожает клетку за период времени и с эффективностью, зависящими от значения рН ПРИ, массы ПРИ, вошедшего в контакт с клеткой, конкретных функциональных групп, носителем которых является ПРИ, и от вида клетки. Клетка уничтожается в результате протекания процесса, подобного титрованию, при котором ПРИ вызывает изменение значения рН внутри клетки. Клетка часто эффективно уничтожается до наступления разрушения клеточной мембраны и лизиса клеток. ПРИ уничтожает клетки без прямого контакта с клетками, если контакт осуществляется сквозь покрытие или мембрану, проницаемую для воды, ионов H+ и ОН-, но не для других ионов и молекул. Такое покрытие служит также для предотвращения изменения значения рН ПРИ или раствора, окружающего клетку-мишень, за счет диффузии противоионов по направлению к функциональным группам ПРИ. В этом отношении следует подчеркнуть, что в предшествующем уровне техники раскрыт факт уничтожения клеток сильнокатионными (основными) молекулами и полимерами, когда уничтожение, вероятно, происходит путем разрушения клеточных мембран и требует наличия контакта с сильнокатионным материалом или внедрения, по меньшей мере, части материала во внешнюю клеточную мембрану.
В объем предлагаемого изобретения входит также композиция, в которой нерастворимый полимер, керамика, гель, смола или оксид металла являются носителями сильнокислых (например, серной или фосфорной кислоты) или сильноосновных (например, четвертичных аммониевых соединений или третичных аминов) функциональных групп (или обоих видов групп), значения рН которых составляет примерно <4,5 или примерно >8,0. Функциональные группы по всему ПРИ доступны для молекул воды, с объемной буферной емкостью примерно от 20 и до примерно 100 ммоль Н+/л·ед. рН, которая обеспечивает получение нейтральных значений рН при погружении в незабуференную воду (например, примерно 5 < рН > примерно 7,5), но при этом уничтожает живые клетки при контакте с ними.
В объем предлагаемого изобретения входит также композиция согласно приведенным выше описаниям, в которой нерастворимый полимер, керамика, гель, смола или оксид металла покрыты барьерным слоем, проницаемым для воды и для ионов Н+ и ОН-, но не для более крупных ионов и молекул, который уничтожает живые клетки при их контакте с барьерным слоем.
В объем предлагаемого изобретения входит также композиция согласно приведенным выше описаниям, содержащая нерастворимый полимер, керамику, гель, смолу или оксид металла, пригодные для уничтожения живых клеток путем изменения значения рН внутри клеток при контакте с ними.
В объем предлагаемого изобретения входит также композиция согласно приведенным выше описаниям, содержащая нерастворимый полимер, керамику, гель, смолу или оксид металла, пригодные для уничтожения живых клеток без необходимости внедрения в их структуру или связывания с клеточными мембранами.
В объем предлагаемого изобретения входит также композиция согласно приведенным выше описаниям, которая содержит нерастворимый полимер, керамику, гель, смолу или оксид металла, пригодные для уничтожения живых клеток без необходимости предварительного разрушения клеточной мембраны и лизиса клеток.
В объем предлагаемого изобретения входит также композиция согласно приведенным выше описаниям, которая содержит нерастворимый полимер, керамику, гель, смолу или оксид металла, способные вызывать изменения значения рН примерно на <0,2 единиц рН в физиологическом растворе или биологической жидкости, окружающей живую клетку, тем самым уничтожая живую клетку при контакте с ней.
В объем предлагаемого изобретения входит также композиция согласно приведенным выше описаниям, которая содержит нерастворимый полимер, керамику, гель, смолу или оксид металла, выполненные в виде покрытия, пленки, пластинок, микрогранул, частиц, микрочастиц, наночастиц, волокон, нитей, порошков и суспензий этих частиц.
Ко всему тексту раздела, описывающего экспериментальные результаты, приложимы изложенные выше терминология и пояснения. Если не оговорено иное, в описанных ниже экспериментах использовались все или некоторые из перечисленных ниже материалов и композиций (см. таблицы 1 и 2). Все эксперименты повторяли, по меньшей мере, два или три раза.
ПРИМЕР 1
Цитотоксический эффект микрогранул диоксида кремния, покрытых полиакриламидным гелем (ПААГ) и непокрытых, на клетки линии Jurkat
Материалы и методы
Непокрытые микрогранулы диоксида кремния (размером ~40 нм, производства компании Sigma, каталожный номер 421553) в виде суспензии и микрогранулы диоксида кремния, покрытые при помощи фотополимеризации полиакриламидом, включающим производные акриламида с кислотными и основными функциональными группами (иммобилины), хранили в холодильнике при +4°С до момента использования.
Использовали культуру клеток линии Jurkat E6-1 острой Т-клеточной лейкемии (номер TIB-152 в коллекции АТСС). Клетки линии Jurkat хранили в среде RPMI-1640 с добавлением 1 ммоль/л пирувата натрия, 10% эмбриональной сыворотки телят (ЭСТ) и пенициллина-стрептомицина-амфотерицина(1:100).
Жизнеспособность и микроскопические исследования
2 мкл микрогранул (разбавленные 0,1% раствором SDS) добавляли к клеткам линии Jurkat в количестве 106 в 25 мкл фосфатного буферного раствора (ФБР). Добавляли краситель Live/Dead (из набора для оценки жизнеспособности клеток LIVE-DEAD Viability Kit, компании Molecular Probes) (0,15 мкл) и проводили инкубацию при комнатной температуре. Морфологию и жизнеспособность клеток исследовали при помощи флуоресцентного микроскопа (Axioskop 2 plus; фильтр 4-3).
Результаты
Микроскопические исследования обработанных микрогранулами диоксида кремния клеток линии Jurkat были выполнены с использованием набора для оценки жизнеспособности клеток LIVE-DEAD Viability Kit компании Molecular Probes. В этом наборе используется смесь красителей SYT09, дающих зеленую флуоресценцию при взаимодействии с нуклеиновыми кислотами, и пропидийиодида (ПИ), дающего красную флуоресценцию при взаимодействии с нуклеиновыми кислотами. Эти красители отличаются как по спектральным характеристикам, так и по способности проникать в здоровые клетки. При помощи красителя SYT09 обычно метят клетки с интактными мембранами и клетки с поврежденными мембранами. Напротив, ПИ проникает только в клетки с поврежденными мембранами, вызывая уменьшение флуоресценции SYT09, когда присутствуют оба красителя. Таким образом, клетки с поврежденными мембранами флуоресцируют красным, тогда как клетки с интактными мембранами - зеленым. Флуоресценцию как живых, та к и мертвых клеток можно наблюдать одновременно со стандартным набором светофильтров GREEN (зеленый) и RED (красный).
Клетки линии Jurkat были приведены в контакт с функционализированными микрогранулами диоксида кремния. Соотношение объемов микрогранул и клеток лежало в диапазоне от 1:20 до 1:80, что отвечает соотношению от 3×106 до 0,75×106частиц на одну клетку соответственно. Процентную долю мертвых и живых клеток для различных групп покрытых ПААГ микрогранул диоксида кремния определяли методом флуоресцентной микроскопии для 7-10 произвольно выбранных участков в поле зрения микроскопа. Непокрытые микрогранулы использовали в этих экспериментах в качестве контроля.
Фигура 1 иллюстрирует зависимость от значения рН и времени экспозиции цитотоксического эффекта микрогранул диоксида кремния, покрытых ПААГ, на клетки линии Jurkat. Аналогично, на фигуре 2 приведена концентрационная зависимость цитотоксического эффекта микрогранул диоксида кремния, покрытых ПААГ, на клетки линии Jurkat.
На фигуре 19 приведена концентрационная зависимость цитотоксического эффекта в фазе G1 клеточного цикла, а на фигуре 20 приведена концентрационная зависимость цитотоксического эффекта в фазе G1 и в митотической фазе клеточного цикла. Фигура 19 показывает, что процент выживания клеток высок вплоть до концентраций примерно 8 мкг/мл. Подбор концентрации ПРИ является эффективным инструментом дифференциации при уничтожении ЖКМ. На фигуре 20 показаны два вида ЖКМ, которые в митотической фазе клеточного цикла уничтожаются при концентрации ПРИ менее 5 мкг/мл. Другими словами, при концентрации 5 мкг/мл избирательность ПРИ по отношению к клеткам в фазе G1 составляет примерно 2:1. Кроме того, фигура 20 иллюстрирует роль ПРИ в дифференциации между ЖКМ и КНМ, достигаемой за счет критического числа частиц ПРИ (или критической площади активной поверхности) при определенной величине емкости, приходящейся на данный объем.
Процентные доли мертвых клеток линии Jurkat в каждом эксперименте приведены на фигурах 1 и 2. Полученные данные свидетельствуют о том, что микрогранулы диоксида кремния, покрытые ПААГ, являющиеся носителями как большого положительного, так и большого отрицательного зарядов, проявляют высокие цитотоксические свойства (фигуры 1 и 2). Этот эффект оказался зависимым от времени и концентрации (фигура 2). Инкубация клеток линии Jurkat с неразбавленной суспензией микрогранул диоксида кремния приводит к немедленному лизису клеток.
Кислотные микрогранулы (со значением рН от 2 до 4) обнаружили меньший цитотоксический эффект в сравнении с оснóвными микрогранулами. Оценивали два вида анионных заместителей: заместители, несущие сильнокислые сульфогруппы, которые являются сильными и поляризуемыми в условиях нейтральных сред, и заместители, несущие слабокислые карбоксильные группы, для которых степень диссоциации превышает 98% при значениях рН~7.
Микрогранулы диоксида кремния, несущие слабокислые карбоксильные заместители, не проявляют цитотоксической активности в отличие от микрогранул с сульфокислотными заместителями.
Оказалось, что микрогранулы двуокиси кремния, несущие заместители со слабокислыми, нейтральными и слабоосновными свойствами, со значениями рН в диапазоне от 5 до 8, не проявляют токсичность в отношении клеток линии Jurkat.
ПРИМЕР 2
Цитотоксический эффект микрогранул ПААГ на клетки линии Jurkat
Материалы и методы
Микрогранулы ПААГ с введенными при различных значениях рН иммобилинами (размером ~500 нм) были приготовлены по стандартным методикам эмульгирования. Исходные растворы хранили в холодильнике при +4°С до момента использования.
Использовали культуру клеток линии Jurkat E6-1, Т-клеточной лейкемии (номер TIB-152 в коллекции АТСС). Клетки линии Jurkat хранили в среде RPMI-1640 с добавлением 1 ммоль/л пирувата натрия, 10% ЭСТ и пенициллина-стрептомицина-амфотерицина (1:100).
Жизнеспособность и микроскопические исследования
2 мкл микрогранул (разбавленные 0,1% раствором SDS) добавляли к клеткам линии Jurkat в количестве 106 в 25 мкл фосфатного буферного раствора (ФБР). Добавляли 0,15 мкл красителя Live/Dead (из набора для оценки жизнеспособности клеток LIVE-DEAD Viability Kit, компании Molecular Probes) и проводили инкубацию при комнатной температуре. Морфологию и жизнеспособность клеток исследовали при помощи флуоресцентного микроскопа (Axioskop 2 plus; фильтр 4-3).
Результаты
Микроскопические исследования обработанных микрогранулами диоксида кремния клеток линии Jurkat были выполнены с использованием набора для оценки жизнеспособности клеток LIVE-DEAD Viability Kit компании Molecular Probes, как описано выше.
Клетки линии Jurkat были приведены в контакт с микрогранулами ПААГ. Соотношение объемов микрогранул и клеток лежало в диапазоне от 1:20 до 1:80, что отвечает соотношению от 3×106 до 0,75×106 частиц на одну клетку соответственно. Процентную долю мертвых и живых клеток для различных групп функционализированных микрогранул диоксида кремния определяли методом флуоресцентной микроскопии для 7-10 произвольно выбранных участков в поле зрения микроскопа. Непокрытые микрогранулы использовали в этих экспериментах в качестве контроля.
Фигура 3 иллюстрирует зависимость цитотоксического эффекта микрогранул ПААГ от значения рН и времени экспозиции.
Процентные доли мертвых клеток линии Jurkat в данном эксперименте приведены на фигуре 3. Полученные данные свидетельствуют о том, что микрогранулы ПААГ, являющиеся носителями как большого положительного, так и большого отрицательного зарядов, проявляют высокие цитотоксические свойства. Этот эффект оказался зависимым от времени и концентрации.
Кислотные микрогранулы (со значением рН от 2 до 4) обнаружили меньший цитотоксический эффект в сравнении с оснóвными микрогранулами. Оценивали два вида анионных заместителей: заместители, несущие сильнокислые сульфогруппы, которые являются сильными и поляризуемыми в условиях нейтральных сред, и заместители, несущие слабокислые карбоксильные группы, для которых степень диссоциации превышает 98% при значениях рН~7.
ПРИМЕР 3
Цитотоксический эффект двух видов микрогранул амберлита, CG-120-I и CG-400-II, на клетки линии Jurkat
Материалы и методы
Было испытано действие двух видов микрогранул Амберлита, CG-120-1 и CG-400-II, на клетки линии Jurkat: Амберлита CG-120-11 (производства компании Fluka, каталожный номер 06469), сильнокислотной смолы гелевого типа, с сульфоновой кислотой в качестве функциональных групп, в форме Na+, размером 200-400 меш, и Амберлита CG-400-II (производства компании Fluka, каталожный номер 06471), сильноосновной смолы гелевого типа, с функциональными группами четвертичного аммония, в форме Cl-, размером 200-400 меш.
0,15 мкл смеси красителей (набор для оценки жизнеспособности клеток LIVE-DEAD Viability Kit компании Molecular Probes) добавили к 20 мкл культуры клеток линии Jurkat в ФБР (5×105 клеток). 5 мкл микрогранул амберлита в ФБР (5×105 клеток) добавили затем к суспензии клеток). 7 мкл окрашенной суспензии клеток были немедленно перенесены на предметное стекло и накрыты покровным стеклом. Количество живых и мертвых клеток было измерено на флуоресцентном микроскопе с использованием зеленого фильтра 4-3.
Результаты
Было показано, что практически нет никакой разницы между результатами, полученными для контрольных клеток и клеток, обработанных микрогранулами амберлита двух видов. Оказалось, что форма Na+ и форма Cl- не обладают цитотоксичностью по отношению к клеткам линии Jurkat.
ПРИМЕР 4
Цитотоксический эффект микрогранул замещенного амберлита двух видов: CG-120-1 и CG-400-II, на клетки линии Jurkat
Материалы и методы
Вышеупомянутые микрогранулы амберлита были переведены в формы Н+ и ОН- по следующей методике: Амберлит GC-120 (~100 мг) выдерживали в 2 мл 0,5 ммоль/л HCl при комнатной температуре в течение 30 мин. Амберлит GC-400 (~100 мг) выдерживали в 2 мл 0,5 ммоль/л NaOH при комнатной температуре в течение 30 мин. Микрогранулы затем промывали порциями по 50 мл дистиллированной воды до получения значения рН промывной воды от 5 до 6 для обоих видов амберлита (GC-120 и GC-400). Исходная суспензия в воде была приготовлена в концентрации 1 мг/мл (105 микрогранул/мл): амберлит CG-120-II (производства компании Fluka, каталожный номер 06469), сильнокислотная смола гелевого типа, с сульфоновой кислотой в качестве функциональных групп, в форме Н+ размером 200-400 меш. Амберлит CG-400-II (производства компании Fluka, каталожный номер 06471), сильноосновная смола гелевого типа, с функциональными группами четвертичного аммония, в форме ОН-, размером 200-400 меш.
0,15 мкл смеси красителей (набор для оценки жизнеспособности клеток LIVE-DEAD Viability Kit компании Molecular Probes) добавили к 20 мкл культуры клеток линии Jurkat в ФБР (5×105 клеток). 5 мкл микрогранул Амберлита в ФБР (5×105 клеток) добавили затем к суспензии клеток). 7 мкл окрашенной суспензии клеток были немедленно перенесены на предметное стекло и накрыты покровным стеклом. Количество живых и мертвых клеток было измерено на флуоресцентном микроскопе с использованием зеленого фильтра 4-3.
Результаты
Оба типа микрогранул амберлита CG-120-1 и CG-400-II были переведены в H+ и ОН- формы. Взаимодействие клеток линии Jurkat с Амберлитом CG-400 в форме ОН- ведет к лизису клеток, и не наблюдалось каких-либо различий между формой Н+ Амберлита CG-120 и контролем.
Не наблюдалось никаких различий между формой Н+ Амберлита CG-120 и контролем. Взаимодействие клеток линии Jurkat с формой ОН- Амберлита CG-400 приводит к лизису клеток.
ПРИМЕР 5
Цитотоксический эффект микрогранул диоксида кремния, покрытых ПААГ, на клетки НТ-29
Материалы и методы
Покрытые ПААГ и непокрытые микрогранулы диоксида кремния (производства компании Sigma, каталожный номер 42155) были приготовлены, как описано выше. Исходные растворы хранили в холодильнике при +4°С до момента использования. Клетки линии НТ-29 хранили в среде Игла в модификации Дульбекко (DMEM) с добавлением 10% ЭСТ и пенициллина-стрептомицина-амфотерицина (1:100).
Испытание цитотоксического действия с использованием сульфородамина (на клетках линии НТ-29)
Аликвоты среды, содержащей 1-2×104 клеток, распределяли по лункам 96-луночного планшета (производства компании Falcon). На следующий день среду заменяли 95 мкл свежей среды и 5 мкл суспензии, содержащей различные концентрации соответствующих микрогранул. Планшет затем инкубировали в течение 72 ч при 37°С, после чего в каждую лунку добавляли по 50 мкл 50% трихлоруксусной кислоты (ТХУК). Затем добавляли сульфородаминовый реагент и оценивали цитотоксический эффект в соответствии с изложенным ниже Протоколом.
Первый день: Добавляют 2,5 мл/чашку трипсина-ЭДТА и инкубируют в течение 10 мин при комнатной температуре (снятие клеток с подложки). Переносят клетки с трипсином-ЭДТА в пробирку вместимостью 50 мл. Добавляют 30 мл среды DMEM с 10%-ами фетальной сыворотки теленка (ФСТ). Центрифугируют в течение 10 мин при 1500 об./мин. Суспендируют клетки в 20 мл среды DMEM с 10% ФСТ. Центрифугируют в течение 10 мин при 1500 об./мин. Ресуспендируют клетки в 4 мл среды. Готовят смесь из Х мл суспензии клеток и Y мл среды, добавляют 200 мкл клеток (2×104 клеток/200 мкл) в каждую лунку 96-луночного планшета. Инкубируют в течение 24 часов в CO2 инкубаторе при 37°С.
Второй день: Заменяют среду и добавляют среду, растворитель и микрогранулы в 6 различных концентрациях: Добавляют свежую среду, растворитель и суспензию микрогранул. Инкубируют в течение 50 часов в CO2 инкубаторе при 37°С.
Третий день: Промывают свежей средой пять раз. Добавляют 50 мкл 50% ТХУК (конечная конц. ТХУК 10%). Инкубируют в течение 1 ч при 4°С. Декантируют надосадочную жидкость. Промывают 5 раз водопроводной водой. Переворачивают планшет верх дном и стряхивают на фильтровальную бумагу остаток жидкости. Дают высохнуть на воздухе в вытяжном шкафу в течение ночи.
Четвертый день: Добавляют 100 мкл раствора сульфородамина В (0,4 мас./об.% в 1% уксусной кислоте). Планшет инкубируют в течение 10 мин при комнатной температуре. Удаляют несвязавшийся краситель промывкой в 5 порциях 1% АсОН по 200 мкл. Дают планшету высохнуть на воздухе в вытяжном шкафу в течение, по меньшей мере, 2 часов. Экстрагируют краситель из клеток при помощи 200 мкл 10 ммоль/л Трис-основания, рН 10,3. Инкубируют не менее 10 мин при комнатной температуре при постоянном встряхивании. Измеряют оптическую плотность при 540 нм на планшет-ридере (фоновый сигнал регистрируют при 620 нм).
Результаты
С помощью анализа с использованием сульфородамина В (SRB) определяли число клеток, исходя из результатов определения содержания клеточного белка. Анализ основан на способности сульфородамина В (SRB) связываться с белками клеток, которые были осаждены в лунках планшета с культурой клеток трихлоруксусной кислотой (ТХУК). Сульфородамин В (SRB) является ярко-розовым аминоксантеновым красителем, связывающимся с основными аминокислотными остатками в слабокислой среде и диссоциирующим в основной среде. Поскольку связывание сульфородамина В (SRB) носит стехиометрический характер, количество красителя, экстрагирующегося из окрашенных клеток, прямо пропорционально массе клеток. Высокая интенсивность окрашивания сульфородамином В (SRB) позволяет проводить анализ в 96-луночном формате планшета. Результаты анализа с использованием сульфородамина В (SRB) показывают, что динамический диапазон охватывает значения числа клеток от 7,5×103до 1,8×105 на одну лунку, что соответствует конфлюэнтности 1-200%.
Анализ с использованием сульфородамина В (SRB) был модифицирован авторами для исследования токсичности функционализированных микрогранул по отношению к культуре клеток линии НТ-29 (аденокарциномы толстой кишки человека). Для удобства сравнения результатов, полученных в различных экспериментальных условиях, показатель GI50был выражен в виде относительного количества микрогранул (ОКМ), необходимых для того, чтобы вызвать ингибирование роста клеток на 50%. Другими словами, значение ОКМ является величиной, обратной измеренной процентной доле мертвых клеток, использованной в других примерах, описанных в предлагаемом изобретении.
В описанных ниже экспериментах клетки линии НТ-29 приводили в контакт с микрогранулами диоксида кремния с функционализированным покрытием ПААГ. Систематически проводились также контрольные эксперименты с микрогранулами без заряженных частиц. Соотношение объемов микрогранул и культуры клеток НТ-29 изменяли в диапазоне от 1:20 до 1:160 и более, что означает, что на каждую клетку НТ-29 приходится от 156 до 19,5 миллионов микрогранул. Анализ с использованием сульфородамина В повторяли, и для каждой концентрации микрогранул определения проводили от шести до восьми раз (Таблица 3 и фигуры 4 и 5).
Эти эксперименты показывают, что микрогранулы диоксида кремния, покрытые ПААГ, который является носителем сильнокислых или сильноосновных функциональных групп, оказывают цитотоксический эффект на клетки линии НТ-29. Этот эффект качественно подобен их эффекту на клетки линии Jurkat (см. фигуры 1-3, приведенные выше). Тем не менее оказалось, что цитотоксический эффект микрогранул диоксида кремния, которые обладают кислыми свойствами, на примыкающие клетки линии НТ-29 сильнее эффекта микрогранул, обладающих основными свойствами.
Фигура 4 иллюстрирует зависимость от значения рН цитотоксического эффекта микрогранул диоксида кремния, покрытых ПААГ, на клетки линии НТ-29 аденокарциномы человека.
Оказалось, что при этих экспериментальных условиях микрогранулы диоксида кремния, покрытые ПААГ со слабокислыми и слабоосновными свойствами, не проявляют цитотоксичности по отношению к клеткам линии НТ-29 аденокарциномы толстой кишки.
Ингибирование роста клеток линии НТ-29 микрогранулами диоксида кремния, покрытыми ПААГ, является процессом, зависящим от концентрации (фиг.5). Взаимодействие клеток НТ-29 с неразбавленной суспензией микрогранул диоксида кремния №48 (рН 2) очень быстро приводит к лизису клеток.
На фигуре 5 показан цитотоксический эффект микрогранул диоксида кремния, покрытых ПААГ, на клетки линии НТ-29, в зависимости от концентрации.
ПРИМЕР 6
Цитотоксический эффект микрогранул ПААГ на клетки линии НТ-29
Материалы и методы
Микрогранулы ПААГ с введенными при различных значениях рН иммобилинами (размером ~500 нм) были приготовлены по стандартным методикам эмульгирования. Исходные растворы хранили в холодильнике при +4°С до момента использования. Клетки линии НТ-29 хранили в среде DMEM с добавлением 10% ЭСТ и пенициллина-стрептомицина-амфотерицина (1:100).
Испытание цитотоксического действия с использованием сульфородамина (на клетках линии НТ-29)
Аликвоты среды, содержащей 1-2×104 клеток, распределяли по лункам 96-луночного планшета (производства компании Falcon). На следующий день среду заменяли 95 мкл свежей среды и 5 мкл суспензии, содержащей различные концентрации соответствующих микрогранул. Планшет затем инкубировали в течение 72 ч при 37°С, после чего в каждую лунку добавляли по 50 мкл 50% трихлоруксусной кислоты (ТХУК). Затем добавляли сульфородаминовый реагент, и оценивалось цитотоксическое действие в соответствии с изложенным ниже Протоколом.
Результаты
Методика анализа с использованием сульфородамина В (SRB) описана в приведенном выше примере 5. Фигура 6 иллюстрирует зависимость от значения рН цитотоксического эффекта микрогранул ПААГ на клетки линии НТ-29 аденокарциномы человека. В описанных ниже экспериментах клетки линии НТ-29 приводили в контакт с микрогранулами диоксида кремния с функционализированным покрытием ПААГ. Систематически проводились также контрольные эксперименты с микрогранулами без заряженных частиц. Соотношение объемов микрогранул и культуры клеток НТ-29 изменяли в диапазоне от 1:20 до 1:160 и более, что означает, что на каждую клетку НТ-29 приходится от 156 до 19,5 миллионов микрогранул. Анализ с использованием сульфородамина В повторяли, и для каждой концентрации микрогранул определения проводили от шести до восьми раз (фигуры 6, 7 и 8).
Эти эксперименты показывают, что микрогранулы ПААГ, которые являются носителем сильнокислых или сильноосновных функциональных групп, оказывают цитотоксический эффект на клетки линии НТ-29. Этот эффект качественно подобен эффекту микрогранул диоксида кремния, покрытых ПААГ, на клетки линии Н-29 и на клетки линии Jurkat (фигуры 1-5).
Оказалось, что при этих экспериментальных условиях микрогранулы ПААГ, обладающие слабокислыми и слабоосновными свойствами, не проявляют цитотоксичности по отношению к клеткам линии НТ-29 аденокарциномы толстой кишки.
На фигуре 7 показана зависимость от значения рН и концентрации цитотоксического эффекта на клетки линии НТ-29 микрогранул ПААГ со значениями рН в диапазоне от 2 до 6, а на фигуре 8 - со значениями рН в диапазоне от 7 до 11. Ингибирование роста клеток линии НТ-29 микрогранулами ПААГ является процессом, зависящим от концентрации (фигуры 7 и 8). Взаимодействие клеток НТ-29 с неразбавленной суспензией микрогранул диоксида кремния №48 (рН 2) очень быстро приводит к лизису клеток.
ПРИМЕР 7
Гемолиз, вызванный микрогранулами диоксида кремния, покрытыми ПААГ
Материалы и методы
Разбавление суспензии микрогранул: Готовят 0,2 мл разбавленной суспензии микрогранул: 10+190 мкл ФБР (Са, Mg); Приготовление эритроцитов (RBC): Добавляют 2 мл крови к 13 мл ФБР. Осторожно перемешивают. Центрифугируют в течение 7 мин при 2000 об./мин, 10°С. Декантируют надосадочную жидкость без эритроцитов. Добавляют 13 мл ФБР к осадку и осторожно перемешивают. Центрифугируют, как описано выше. Декантируют надосадочную жидкость и ресуспендируют эритроциты в ФБР до конечного объема в 10 мл. Хранят на льду до использования.
Определение гемолитической активности: Добавляют 10 мкл разбавленной суспензии микрогранул к 50 мкл промытых эритроцитов. Инкубируют при 37°С при непрерывном встряхивании в течение 4 часов. Центрифугируют планшет при 2000 об./мин в течение 7 мин при 10°С. Переносят надосадочную жидкость в новый планшет (с плоским дном) и определяют оптическую плотность при 540 нм.
Результаты
Фигура 9 иллюстрирует роль гемолиза эритроцитов, вызванного действием микрогранул диоксида кремния, покрытых ПААГ (см. Таблицу 1). Показано, что все функционализированные, равно как и немодифицированные, микрогранулы диоксида кремния оказывают сильный гемолитический эффект.
Разбавление суспензии микрогранул: Готовят 0,2 мл разбавленной суспензии микрогранул: 10 мкл+190 мкл ФБР (Са, Mg).
Приготовление эритроцитов: Добавляют 2 мл крови к 13 мл ФБР. Осторожно перемешивают. Центрифугируют в течение 7 мин при 2000 об./мин, 10°С. Декантируют надосадочную жидкость без эритроцитов. Добавляют 13 мл ФБР к осадку и осторожно перемешивают. Центрифугируют, как описано на стадии 3. Декантируют надосадочную жидкость и ресуспендируют эритроциты в ФБР до конечного объема в 10 мл. Хранят на льду до использования. Определение гемолитической активности. Добавляют 10 мкл разбавленной суспензии микрогранул к 50 мкл промытых эритроцитов. Инкубируют при 37°С при непрерывном встряхивании в течение 4 часов. Центрифугируют планшет при 2000 об./мин в течение 7 мин при 10°С. Переносят надосадочную жидкость в новый планшет (с плоским дном) и определяют оптическую плотность при 540 нм.
Результаты
Показано, что все функционализированные, равно как и немодифицированные микрогранулы диоксида кремния оказывают сильный гемолитический эффект (Фиг.9).
ПРИМЕР 8
Апоптоз клеток линии Jurkat, индуцированный микрогранулами ПААГ и микрогранулами диоксида кремния, покрытыми ПААГ
Материалы и методы
Микрогранулы ПААГ и микрогранулы диоксида кремния, покрытые ПААГ и непокрытые (производства компании Sigma, каталожный номер 421553), были приготовлены, как описано выше. Исходные растворы хранили в холодильнике при +4°С до момента использования.
Жизнеспособность и микроскопические исследования
2 мкл микрогранул (разбавленные 0,1% раствором SDS) добавляли к клеткам линии Jurkat в количестве 106 в 25 мкл фосфатного буферного раствора (ФБР). Добавляли 0,15 мкл красителя Live/Dead (из набора для оценки жизнеспособности клеток LIVE-DEAD Viability Kit, компании Molecular Probes) и проводили инкубацию при комнатной температуре. Морфологию и жизнеспособность клеток исследовали при помощи флуоресцентного микроскопа (Axioskop 2 plus; фильтр 4-3).
Для исследования апоптоза использовали набор с аннексином V, Annexin V Apoptosis Detection Kit (производства компании Santa Cruz Biotechnology)
Индукция апоптоза и некроза
Использовался следующий метод: Добавляют 2 мкл суспензии микрогранул (разбавленной раствором SDS в соотношении 1:30) к 20 мкл (106 клеток) клеток линии Jurkat в ФБР и инкубируют при комнатной температуре в течение 20 мин. Собирают клетки центрифугированием при 2000 об./мин в течение 3 мин. Промывают осажденную клеточную массу при помощи ФБР и ресуспендируют в неразведенном буфере для анализа до концентрации 106 клеток/100 мкл. Добавляют 2 мкл аннексина V, конъюгированного с флуоресцеинизотиоцианатом, и 10 мкл ПИ (из набора Annexin V Apoptosis Detection Kit, производства компании Santa Cruz Biotechnology). Перемешивают вихревым вращением и инкубируют в течение 15 мин при комнатной температуре в темноте. Помещают 10 мкл суспензии клеток на предметное стекло и накрывают покровным стеклом. Используют фильтр 4-3 (или 4-4 в случае контрольного образца с одним лишь ПИ) для микроскопического исследования образцов. Использовались следующие контрольные образцы: Аннексии V, конъюгированный с флуоресцеинизотиоцианатом, и ПИ; без Аннексина V, конъюгированного с флуоресцеинизотиоцианатом, и без ПИ, один лишь Аннексии V, конъюгированный с флуоресцеинизотиоцианатом; один лишь ПИ.
Результаты
Здесь следует сослаться на фигуры 10-18. Фигура 10 иллюстрирует рН-индуцированный цитотоксический эффект микрогранул ПААГ на клетки линии Jurkat, выраженный в виде процентной доли живых клеток. Фигура 11 иллюстрирует рН-индуцированный цитотоксический эффект микрогранул ПААГ на клетки линии Jurkat, выраженный в виде процентной доли мертвых клеток. На фигуре 12 приведены результаты исследования рН-индуцированного апоптоза в клетках линии Jurkat в результате воздействия микрогранул ПААГ. Фигура 13 иллюстрирует рН-индуцированный цитотоксический эффект микрогранул диоксида кремния, покрытых ПААГ, на клетки линии Jurkat, выраженный в виде процентной доли живых клеток. Фигура 14 иллюстрирует рН-индуцированный цитотоксический эффект микрогранул диоксида кремния, покрытых ПААГ, на клетки линии Jurkat, выраженный в виде процентной доли мертвых клеток. На фигуре 15 приведены результаты исследования рН-индуцированного апоптоза в клетках линии Jurkat в результате воздействия микрогранул диоксида кремния, покрытых ПААГ. Фигура 16 иллюстрирует окрашивание клеток линии Jurkat красителем Hoechst 33342 после инкубации клеток с микрогранулами диоксида кремния, покрытыми ПААГ, имеющими значение рН 2 (№48 в таблице 1) в течение 5 мин. Фигура 17 иллюстрирует окрашивание клеток линии Jurkat смесью аннексина V и ПИ и красителем из набора LIVE/DEAD Viability Kit после инкубации с микрогранулами диоксида кремния, покрытыми ПААГ, имеющими значение рН 2 (№48 в таблице 1) в течение 30 мин. Фигура 18 иллюстрирует окрашивание клеток линии Jurkat смесью аннексина V и ПИ и красителем из набора LIVE/DEAD Viability Kit после инкубации с микрогранулами диоксида кремния, покрытыми ПААГ, имеющими значение рН 2 (№48 в Таблице 1) в течение 90 мин.
Присутствие ранних апоптических клеток (ограниченная фрагментация ядер и зеленая окраска) было обнаружено после обработки микрогранулами диоксида кремния №3 (рН 4,5) и №48 (рН 2) и микрогранулами ПААГ №45-47 (от рН 9 до рН 11). С другой стороны, наблюдался также поздний апоптоз с характерной фрагментацией ядер после обработки микрогранулами диоксида кремния №48 (Таблица 4 и Фигуры 10-18).
ПРИМЕР 9
Модуляция рН-индуцированной цитотоксичности пропиткой или покрытием микрогранул ионообменных материалов, содержащих кислотные или основные группы
Эксперимент 1
Целью данного эксперимента была демонстрация того факта, что антибактериальные свойства усиливаются в результате пропитки и покрытия микрогранул ионообменных материалов, содержащих кислотные или основные группы, нейтральным водопроницаемым полимером, который создает селективный барьер для ионов и замедляет процесс обмена ионами.
Материалы и методы
Коммерчески доступные ионообменные материалы, такие как микрогранулы Амберлита CG-400-II (OH--форма) и Амберлита IR-120 II (H+-форма) (производства компании Rohm and Haas, размер микрогранул 100 мкм) были пропитаны 20% раствором полиакриламида.
Эти микрогранулы наносили на поверхность агаровой среды в чашке Петри, засеянной бактериями S. aureus, и проводили оценку бактериальной токсичности по радиусу ореола, образующегося вследствие подавления бактериального роста вокруг микрогранул после инкубации в течение 24 часов при 37°С.
Контрольный опыт ставили с необработанными микрогранулами.
Результаты
Радиус ореола вокруг покрытых микрогранул был вдвое больше, чем вокруг непокрытых микрогранул (1 мм в сравнении с 0,5 мм).
Эксперимент 2
Целью данного примера является иллюстрация того факта, что рН-индуцированная токсичность для бактерий материалов и композиций согласно предлагаемому изобретению может быть увеличена за счет пропитки микрогранул из ионообменной смолы ионсодержащими полимерами.
Материалы и методы
Коммерчески доступные ионообменные материалы и микрогранулы Амберлита IR-120 II (H+-форма) (производства компании Rohm and Haas, размер микрогранул - 100 мкм) были пропитаны раствором коммерчески доступного нафиона (NafionTM производства компании Dupont) и оставлены сохнуть и полимеризоваться внутри пористой матрицы ионообменной смолы.
Полученные согласно этой методике микрогранулы наносили на поверхность агаровой среды в чашке Петри, засеянной бактериями S. aureus, и проводили оценку токсичности для бактерий по радиусу ореола вокруг микрогранул, образующегося после инкубации в течение 24 часов при 37°С. Контрольный опыт ставили с необработанными микрогранулами.
Результаты
В результате радиус ореола вокруг микрогранул, покрытых нафионом (Nafion™), был более чем в 4 раза больше, чем вокруг непокрытых микрогранул (3 мм в сравнении с 0,7 мм соответственно).
Выводы
Результаты экспериментов, описанных в предлагаемом изобретении, иллюстрируют и предоставляют свидетельства справедливости предлагаемого в данном документе основного механизма уничтожения клеток, основанного на предпочтительном обмене протонами и/или ионами гидроксила между клеткой и сильнокислотными и/или сильнощелочными материалами и композициями. Материалы и композиции согласно предлагаемому изобретению оказывают уничтожающее действие на клетки посредством процесса, подобного титрованию, в котором клетка приходит в контакт с сильнокислотными и/или сильнощелочными буферными системами и им подобными.
Был исследован основной механизм, который оказался эффективным как при воздействии на клетки линии Jurkat, растущие в суспензии, так и на примыкающие клетки НТ-29, а также на бактериальные клетки.
Было обнаружено, что цитотоксическое действие материалов и композиций согласно предлагаемому изобретению является процессом, зависящим от значения рН, времени воздействия и концентрации. Использование микрогранул диоксида кремния, несущих частицы с высоким зарядом, при конечном разведении 1:20 приводит к почти мгновенному лизису клеток линий Jurkat и НТ-29. Такое же воздействие наблюдалось также при взаимодействии клеток линии Jurkat с амберлитом CG-400, переведенным в OH--форму.
Эту рН-индуцированную цитотоксичность можно модулировать пропиткой или покрытием ионообменных материалов, содержащих кислотные или основные группы, полимерными и/или иономерными материалами с барьерными свойствами.
Механизм действия, лежащий в основе уничтожающего действия материалов и композиций согласно предлагаемому изобретению на клетки, включает, помимо прочего, как ранний, так и поздний апоптоз клеток-мишеней, предшествующий разрушению их клеточных мембран и лизису клеток. Этот факт дополнительно свидетельствует в пользу того, что в отличие от других материалов и композиций, которые встречались в предшествующем уровне техники, материалы и композиции согласно предлагаемому изобретению оказывают уничтожающее действие на клетки посредством процесса, подобного титрованию, который приводит к нарушению гомеостаза рН клеток и, в результате, к гибели клеток.
ПРИМЕР 10
Антибактериальный силиконовый лист, сохраняющий значение рН на прежнем уровне
Была приготовлена силиконовая матрица, в состав которой входит смесь микрогранул ионообменных смол, содержащих кислотные и основные группы. Композиция содержала микрогранулы амберлита 1200IRA (OH--форма), 40% (производства компании Rohm and Haas), и амберлита IR 120 (Н+-форма), 60% (производства компании Rohm and Haas). Эта смесь ионообменных микрогранул была введена в инертный раствор силиконового каучука в виде смеси, содержащей 40% силиконового каучука (производства компании General Electric) и 60% упомянутой смеси двух видов амберлита, осаждена на внутренней поверхности небольшого стеклянного стаканчика и прошла полимеризацию при 80°С в течение 12 часов.
Антибактериальная активность стаканов с покрытием была испытана согласно следующей методике: Была приготовлена взвесь бактерий E.coli для засевания концентрацией 660 КОЕ/мл. 5 мл триптон-соевого бульона (ТСБ) и бактерий Е.coli добавили в стаканчик. Через 24 часа были отобраны пробы из стаканчиков, приготовлены их децимальные разведения и проведен их посев на чашки Петри с триптон-соевым агаром (ТСА). После инкубации в течение 24 часов при 30°С колонии были подсчитаны.
Результаты
Значение рН было равно 7 в пробирке с антибактериальным материалом "NEUTRAL".
На фигурах 21 и 22 представлены результаты исследования активности композиций А и В соответственно.
Для опытов по исследованию выщелачивания к 5 мл стерильной воды добавляли 100 мг антибактериального материала "NEUTRAL". Инкубацию проводили в течение 48 часов при 30°С. Содержание ионов калия, кремния, натрия и сульфат-ионов было определено методом спектроскопии с индуктивно-связанной плазмой (ИСП).
Результаты Таблицы 6 показывают незначительное высвобождение материалов из покрытий.
ПРИМЕР 11
Невыщелачивающийся биологически активный полимер (SuflonTM)
Композиционный кислотный полимер синтезировали по следующей методике:
Мономер для получения тефлона (тетрафторэтилен) в виде эмульсии (20%) в н-октане (регистрационный номер CAS [116-14-3], производства компании Du Pont), смешивали с раствором неупорядоченного поперечно-сшитого полистиролсульфоната в кислотной форме (27%) (каталожный номер компании Sigma 659592, 25 мл), в н-гексане (производства компании Frutarom, Израиль).
Смесь осаждали в автоклаве и проводили сополимеризацию при 50°С и давлении 10 атмосфер.
Проводили осаждение из полученного раствора введением 0,1% раствора SDS (додецилсульфата натрия) и осадок прессовали в листы толщиной 0,5 мм.
Антибактериальное действие полимера на рост бактерий E.coli было испытано по следующей методике:
Фрагмент активного полимера массой 40 мг осаждали в 1 мл разбавленной взвеси бактерий (1.Е+04 КОЕ/мл) в ТСБ. Пробирка с контролем содержит только бактерии в ТСБ. Пробирки выдерживают в орбитальном шейкере-инкубаторе при 30°С в течение 24 часов, а затем отбирают пробы для подсчета КОЕ и измерения значения рН.
Результаты оказались следующими:
Результаты показывают усиление ингибирования пролиферации бактерий E.coli в присутствии полимера Suflon™.
Для опытов по исследованию выщелачивания инкубируют 5 мл стерильной воды (контроль) и раствор 40 мг полимера Suflon™ в 5 мл стерильной воды при 30°С в течение 24 часов в полипропиленовых пробирках вместимостью 15 мл. Эти два образца воды были проанализированы методом ИСП-МС компанией Spectrolab Ltd. (Израиль).
Результаты показывают незначительное высвобождение материалов из полимерной матрицы.
ИСП анализ показал, что Na, K и S не были обнаружены в воде, содержащей образец активного полимера, что свидетельствует о том, что полимерная композиция не выщелачивает никаких ингредиентов.
ПРИМЕР 12
Антибактериальная активность силиконовых листов
Было приготовлено два вида силиконовых смол, проявляющих бактерицидную активность.
Композиция А 10% 2-фенилбензимидазол-5-сульфоновой кислоты (производства компании Sigma, каталожный номер 437166, 25 мл); 5% неупорядоченного сополимера стирола и этилена, сульфонированного, (производства компании Sigma, каталожный номер 659401, 25 мл); 80% силиконового каучука силопрен LSR 2060 (производства компании General Electric); 5% пластификатора RE-AS-2001 (производства компании MFK Inc). Смесь распределяли по поверхности чашек Петри (толщиной 1 г/10 см2) и полимеризовали при 200°С в течение 3 часов. Полимеризованные листы отделяли от поверхности стекла и исследовали.
Композиция В 15% 2-фенилбензимидазол-5-сульфоновой кислоты (производства компании Sigma, каталожный номер 437166, 25 мл); 80% силопрена LSR 2060 (производства компании General Electric); 5% пластификатора RE-AS-2001. Смесь распределяли по поверхности чашек Петри (слоем толщиной 1 г/10 см2) и полимеризовали при 200°С в течение 3 часов. Полимеризованные листы отделяли от поверхности стекла и исследовали.
Культуру E.coli выращивали в течение ночи и разбавляли в соотношении 1:104. Образцы силиконовых листов композиции А и композиции В массой по 100 мг вырезали и хранили в пробирках Эппендорфа. В пробирки добавляли по 1 мл разбавленной культуры клеток. Пробирки помещали в устройство, обеспечивающее их вращение при комнатной температуре, и из них производили отбор проб в начальный момент времени и через 24 часа. Образцы использовались для приготовления децимальных разведении, и был проведен их посев на чашки Петри с ТСА. Колонии подсчитывали через 24 часа.
Для экспериментов по выщелачиванию образцы силиконовых листов композиций А и композиции В массой по 100 мг помещали в 5 мл стерильной воды. Инкубацию проводили в течение 48 часов при 30°С. Содержание K, Na, S и Si было определено методом ИСП.
Результаты показывают незначительное высвобождение материалов из покрытий.
На фигурах 21 и 22 представлены исследования бактирицидной активности композиций А и В соответственно. На фигуре 23 представлены исследуемые микроорганизмы для штамма Candida albicans (ATCC 10231).
Таким образом, испытанные системы ПРИ проявляют высокую эффективность при уничтожении бактерий, в то же время обеспечивая лишь незначительное выщелачивание в среду, окружающую клетки ЖКМ, и незначительное изменение значения рН этой среды.
ПРИМЕР 13
Регенерация биоцидной активности силиконовых листов, содержащих ПРИ
Было приготовлено два вида силиконовых смол, проявляющих бактерицидную активность. Использовалось эффективное количество кислоты, в данном случае аскорбиновой кислоты (витамина С), совместно с ионообменным материалом, содержащим эффективное количество полистиролсульфоната натрия, а также совместно с другими видами ПРИ. Было обнаружено, что упомянутая кислота регенерирует солевую форму ПРИ, снабжая ее протонами.
Кроме того, в такие продукты производства, как наружные оболочки и упаковка для продуктов питания, напитков (например, соков), лосьонов, кремов, была введена, причем в эффективном количестве, кислота, и опять-таки в результате этого было достигнуто восстановление активности ПРИ.
ПРИМЕР 14
Значение рН межклеточной среды в сравнении с внутриклеточным значением рН
Материалы и методы
Композиция содержала микрогранулы Амберлита 1200IRA (OH--форма), 40% (производства компании Rohm and Haas), и Амберлита IR 120 (Н+-форма), 60% (производства компании Rohm and Haas). Эта смесь ионообменных микрогранул была введена в инертный раствор силиконового каучука в соотношении 40% силиконового каучука (производства компании General Electric) на 60% смеси амберлитов, осаждена на внутренней поверхности небольшого стеклянного стаканчика и подвергнута полимеризации при 80°С в течение 12 часов. Использовались бактерии Е coli, как описано выше. Аналогично, микрогранулы ПААГ и микрогранулы диоксида кремния, покрытые ПААГ и непокрытые, были приготовлены, как описано выше. Исходные растворы хранили в холодильнике при +4°С до момента использования. Культуру клеток линии Jurkat E6-1, острой Т-клеточной лейкемии, использовали, как описано выше. Клетки линии Jurkat хранили в среде RPMI-1640 с добавлением 1 ммоль/л пирувата натрия, 10% ЭСТ и пенициллина-стрептомицина-амфотерицина (1:100). Использовались коммерчески доступные индикаторы, окраска которых зависит от значения рН.
Результаты
Было показано значительное изменение внутриклеточного значения рН путем введения кислотно-основного индикатора внутрь клеток. Изменение окраски индикаторов наблюдалось при изменении значения рН внутри клетки.
Реферат
Изобретение относится к материалам и способам уничтожения живых клеток-мишеней. Материал для уничтожения живых клеток-мишеней содержит, по меньшей мере, один нерастворимый гидрофобный анионный, катионный или амфотерный заряженный полимер. Указанный полимер при контакте с водосодержащей окружающей средой: а. является носителем сильнокислых или сильноосновных функциональных групп; b. имеет значение рН меньше чем 4,5 или больше чем 8,0 и с. обладает протонной проводимостью и/или электрическим потенциалом, достаточными, чтобы эффективно нарушать гомеостаз рН и/или электрический баланс внутри замкнутого объема указанной клетки. Этот заряженный полимер сохраняет значение рН среды, окружающей указанные клетки. Указанный материал может быть регенерирован путем регенерации заряженного полимера, регенерации буферной емкости указанного материала, регенерации протонной проводимости указанного материала. Продукт производства содержит указанный материал. Изобретение позволяет реализовать указанное назначение. 4 н. и 14 з.п. ф-лы, 23 ил., 10 табл., 14 пр.
Формула
а. является носителем сильнокислых или сильноосновных функциональных групп;
b. имеет значение рН меньше, чем 4,5 или больше, чем 8,0 и,
с. обладает протонной проводимостью и/или электрическим потенциалом, достаточными, чтобы эффективно нарушать гомеостаз рН и/или электрический баланс внутри замкнутого объема указанной клетки, причем указанный заряженный полимер сохраняет значение рН среды, окружающей указанные клетки.
(а) достаточно высокую устойчивость к выщелачиванию, так что общая концентрация веществ, выщелачиваемых из указанного материала в указанную водосодержащую среду, не превышает 1 млн-1; и
(b) достаточно большую инертность, так что, по меньшей мере, один параметр указанной водосодержащей среды, выбранный из группы, включающей (i) концентрацию, по меньшей мере, одного заранее определенного растворимого в воде вещества; (ii) распределение частиц по размеру; (iii) реологические свойства; (iv) токсичность; (v) цвет; (vi) вкус; (vii) запах и (viii) текстуру, остается неизменным согласно заданным условиям, причем указанные условия адаптированы к указанной конкретной среде и соответствуют последней.
(a) сульфонированных тетрафторэтиленовых сополимеров;
(b) сульфонированных материалов, выбранных из группы, состоящей из диоксида кремния, полиэфирсульфона (ПЭС), стирол-этилен-бутилен-стирольного блоксополимера (СЭБС), полиэфирэфиркетона (ПЭЭК), полиариленэфирсульфона (ПАЭС), привитого сополимера стирола с поливинилиденфторидом (ПВДФ), полибензимидазола (ПБИ) и полифосфазена;
(c) протонообменных мембран, приготовленных литьем раствора полистиролсульфоната (ПСС) с суспендированными микронными частицами ионообменной смолы, поперечно сшитой ППС.
(i) регенерируемым протонным источником или резервуаром;
(ii) регенерируемой буферной емкостью; и
(iii) регенерируемой протонной проводимостью.
(a) получение материала для уничтожения клеток, содержащего, по меньшей мере, один нерастворимый анионный, катионный или амфотерный заряженный полимер, который при контакте с указанной водосодержащей средой:
(i) является носителем сильнокислых или сильноосновных групп,
(ii) имеет значение рН меньше, чем 4,5 или больше, чем 8,0 и (iii) способен генерировать электрический потенциал внутри указанного замкнутого объема клетки достаточный, чтобы эффективно нарушать электрический баланс внутри указанного замкнутого объема указанной клетки; и
(b) приведение указанного материала в контакт с указанной водосодержащей средой.

Комментарии