Биологически активные и/или целевые дендримерные конъюгаты - RU2127125C1
Код документа: RU2127125C1
Чертежи


















































































Описание
Область техники, к которой относится изобретение.
Изобретение относится к применению плотных звездчатых полимеров в качестве носителей сельскохозяйственных, фармацевтических и других материалов, особенно таких материалов, которые являются биологически активными и/или целевыми. Изобретение также включает в себя дендритные полимеры в качестве носителей биологических модификаторов ответа, которые также могут быть целевыми.
Известна композиция, содержащая дендритный полимер, образующий комплекс по крайней мере с одной единицей несущего материала, (см. WO, заявка 88/01180, кл. A 61 K, 49/02, 1988).
Предпосылки создания изобретения
В последние годы разработаны полимеры, названные плотными звездчатыми полимерами, или STARBURST ("ВЗРЫВ
ЗВЕЗДЫ")
- полимерами (торговая марка фирмы Dendritech Inc.).
Было установлено, что размер, форма и свойства этих плотных звездчатых полимеров могут быть молекулярно оформлены так, чтобы соответствовать конкретному конечному назначению. Плотные звездчатые полимеры имеют значительные преимущества, которые могут дать средства передачи высоких концентраций носимого материала на единицу полимера, контролируемой передачи, целевой передачи и/или многократной передачи или применения частиц.
Краткое описание изобретения
В одном аспекте, настоящее
изобретение
относится к полимерным коньюгативным материалам, содержащим плотные звездчатые полимеры, ассоциированного с желаемыми материалами (далее эти полимерные коньюгаты часто называются
"плотными звездчатыми
полимерными коньюгатами", или "плотными звездчатыми коньюгатами", или "коньюгатами"), способу получения этих коньюгатов, композициям, содержащим коньюгаты, и способам
применения
коньюгатов и
композиций.
Также изобретение охватывает плотный звездчатый полимер, ассоциированный по крайней мере с одним указателем цели (направителем) и по крайней мере одной единицей переносимого материала. Такие конъюгаты могут быть включены в рецептуры вместе с приемлемыми носителями, разбавителями и наполнителями, предназначенные, например, для фармацевтического или сельскохозяйственного применения.
Конъюгаты настоящего изобретения предназначены для использования в ряде применений, где требуется заданная передача, и, в частности, предназначены для передачи биологически активных агентов. В предпочтительном варианте настоящего изобретения плотные звездчатые конъюгаты состоят из одного или более плотных звездчатых полимеров, ассоциированных с одним или более биоактивных агентов.
В одном аспекте изобретения, плотный звездчатый полимерный конъюгат применяется для передачи переносимого
биологически активного агента (например,
биологического
модификатора), имеющего по крайней мере один плотный звездчатый полимер, ассоциированный по крайней мере с одной единицей по крайней мере
одного переносимого биологически активного
агента, причем
полимер имеет (a) ядро инициатора, (b) не менее двух концентрических дендритных слоя ("генераций") с симметричными разветвлениями, причем
слои расходятся радиально в геометрической
прогрессии от ветви
ядра, поэтому отношение концевых групп к ветви(-ям) ядра составляет не менее 4:1, и (с) наружную поверхность функциональности концевых
групп. Другой путь определения этих плотных
звездчатых полимеров
состоит в виде дендритного полимерного конъюгата, который имеет
(i) дендритный полимер, имеющий
(a) начальное ядро,
(b) внутренний слой по крайней мере
трех (3) генераций,
состоящих из радиально симметричных повторяющихся единиц, связанных с начальным ядром, и
(c) наружную поверхность,
составленную концевыми функциональными атомами или
атомными группами
(концевые функциональные группы), связанные с самой наружной генерацией, и
(ii) по крайней мере один переносимый
биологически активный материал, который непосредственно
ассоциирован с
указанным дендритным полимером.
Еще одним путем для определения этих плотных звездчатых полимеров является
определение в виде класса дендритного полимера, где
дендритный полимер
(i) имеет регулярную разветвленную структуру, фактически представленную последующей формулой (1), которая имеет ядро
(C), имеющее число (a) валентности или функциональности
1 или более, причем
по крайней мере одна из валентностей указанного ядра (C) связана с группой (B) через группу (A), указанная группа (B),
имеющая не менее двух функциональностей (r1,
r2...),
связанных затем с группой (A), причем единица (AB), образованная соединением указанной группы (A) с указанной группой (B),
представляет ответвление, причем указанные ответвления
(AB) повторяются при
желаемом числе генераций (C) не менее трех, и функциональность группы (B) каждого из последних ответвлений (AB)
блокируется по крайней мере двумя (rG) атомами или
атомными группами (X):
C[AB(AB(AB...(AB(ABXrG)rG-1)rG-2...) r2)r1]s, (1)
в которой каждое прибавляемое число из 1, 2,
... G-1 и G из r1, r2 ... rG-1 и rG определяет число каждой генерации увеличивающегося
ответвления (AB), считая первое ответвление или ответвления (AB),
которые соединяются с
ядром (C) как первую генерацию, а именно G = 1, каждый, r1, r2, ... rG
представляет число функциональности группы (B) ответвления (AB)
соответствующей генерации,
причем указанная функциональность способна соединяться с группой (A) другого ответвления (AB) следующей
генерации,
S - целое число не менее 1, но большее, чем
валентность или функциональность
ядра (C).
Каждая из групп (A) и (B) может быть одинаковой или различной для каждой генерации, а X представляет атомы или атомные группы для блокирования функциональности функциональных групп (B) последующих ответвлений, которые могут быть одинаковыми или различными.
Предпочтительные конъюгаты настоящего изобретения включают в себя такие, у которых плотный звездчатый полимерный конъюгат содержит по крайней мере один плотный звездчатый полимер, ассоциированный с по крайней мере одной единицей по крайней мере одного биологического модификатора. Некоторыми примерами этих биологических модификаторов являются интерлейкины, интерфероны, фактор некроза опухоли, фактор, стимулирующий колонии гранулоцитов, вирусы, вирусные фрагменты и другие генетические материалы. Используемый здесь термин "генетический материал" относится к материалам на основе нуклеотидов, включающим в себя без ограничения вирусы и вирусные фрагменты, плазмиды, фаги, космиды, гены и фрагменты генов (т.е., экзоны, интроны), дезоксирибонуклеиновую кислоту (ДНК) как одноцепочечную, так и двуцепочечную, рибонуклеиновую кислоту (РНК), рибосомную РНК (рРНК), каталитическую РНК (кРНК), ядрышковую РНК (яРНК), информационную РНК (иРНК), транспортную РНК (тРНК), олигонуклеотиды ДНК и РНК (как одно-, так и двуцепочечные) или олигомеры и (антисмысловые) олигонуклеотиды, протеиновые нуклеиновые кислоты (ПНК) и замещенные олигонуклеотиды нуклеиновых кислот. Генетический материал, особенно, вирусы и вирусные фрагменты, может образовать комплекс или быть сопряжен (спарен) с некоторым протеином. Термин "генетический материал" также предназначается для того, чтобы включить в себя "модифицированные нуклеотиды", как описано более полно ниже.
В науке известно, что плотные звездчатые конъюгаты обладают значительными преимуществами по сравнению с другими носителями благодаря превосходным свойствам плотных звездчатых полимеров. Плотные звездчатые полимеры являются частным видом дендритного полимера. Однако в более широких аспектах настоящего изобретения, где биологический модификатор (особенно, генетический материал) является переносимым материалом, могут быть использованы другие типы дендритных полимеров.
"Дендритный полимер" является полимером, имеющим правильное дендритное разветвление, образованное последовательным или генерационным присоединением разветвленных слоев к или от ядра. Термин "дендритный полимер" охватывает "дендримеры", которые характеризуются ядром, по крайне мере, одним внутренним разветвленным слоем и поверхностным разветвленным слоем. (Смотри Petar R. Dvornic and Donald A. Tomalia in Chem. in Britain, 641-645, август 1994). "Дендрон" является частицей дендримера, имеющего разветвления, исходящие из фокальной точки, которая является или может быть соединена с ядром, либо прямо, либо через соединительный остаток с образованием дендримера. Многие дендримеры содержат два или более дендронов, связанных с общим ядром. Однако, термин "дендример" используется широко с охватом простого дендрона.
Дендритные полимеры включают в себя, но не ограничиваются этим, симметричные и несимметричные разветвленные дендримеры, каскадные молекулы, арборомы и т.п., хотя наиболее предпочтительными дендритными полимерами являются плотные звездчатые полимеры. Рассматриваемые здесь плотные звездчатые дендримеры (РАМАМ) являются симметричными, при этом плечи разветвлений имеют равную длину. Разветвление имеет место у водородных атомов концевой NH2-группы на разветвлении предшествующей генерации. Дендримеры на основе лизина являются несимметричными, при этом плечи ветвей являются различной длины. Одна ветвь имеется при ε-N молекулы лизина, тогда как другая ветвь имеется при α-N, смежный с реакционной карбоксильном группой, которая присоединяет ветвь к ветви предыдущей генерации.
Даже несмотря на то, что не образуется регулярное последовательное присоединение разветвленных слоев, гиперразветвленные полимеры, например гиперразветвленные полиолы, могут быть эквивалентны дендритному полимеру, где структура разветвления имеет степень регулярности, приближающуюся к дендримеру.
Плотные звездчатые полимеры имеют молекулярное строение, характеризующееся регулярным дендритным разветвлением с радиальной симметрией, т.е. в точке разветвления. Эти радиально симметричные молекулы относятся к обладающим "плотной звездчатой топологией". Эти полимеры выполняются в манере, которая может дать концентрические дендритные ряды вокруг ядра инициатора. Плотная звездчатая топология достигается упорядоченной сборкой органических повторяющихся единиц в концентрические дендритные ряды вокруг ядра инициатора; это сопровождается введением многократности (мультиплетности) и саморепликации (в каждый ряд) в геометрической прогрессии через ряд молекулярных генераций. Получающиеся высокофункционализированные молекулы называются "дендримерами" в отличие от их разветвленной (древовидной) структуры, а также их олигомерной природы. Таким образом, термины "плотный звездчатый олигомер", плотный звездчатый дендример" и "STARBURST - дендример" охватываются термином "плотный звездчатый полимер" или "STARBURST полимер".
Топологическими полимерами с доменами контролируемых размеров и формы, являются дендримеры, которые ассоциируются друг с другом (например, ковалентными мостиками или через другую ассоциацию, как определено далее) через их концевые реакционные группы, которые называются плотными звездчатыми "мостиковыми дендримерами". Термин "мостиковый дендример" также охватывается термином "плотный звездчатый полимер" или "STARBURST-полимер". Когда более двух плотных звездчатых дендримера ассоциируются вместе, они называются "плотными звездчатыми агрегатами" или "STARBURST-агрегатами" и также охватываются термином "плотный звездчатый полимер" или "STARBURST-полимер".
Поэтому, дендритные полимеры включают в себя мостиковые дендримеры и дендримерные агрегаты. Дендритные полимеры охватывают как генерационно монодисперсные, так и генерационно полидисперсные растворы дендримеров. Дендримеры в монодисперсном растворе все являются фактически одной генерации, и поэтому одного размера и формы. Дендримеры в полидисперсном растворе содержат распределение дендримеров различных генераций.
Дендримерные полимеры также включают в себя поверхностно-модифицированные дендримеры. Например, поверхность ПАМАМ (РАМАМ)-дендримера может быть модифицирована присоединением аминокислоты, например лизина или аргинина.
Необходимо понимать, что ссылка на любой конкретный тип дендритного полимера, как, например, "полимер", "плотный звездчатый полимер, "несимметричный дендритный полимер", "каскадный полимер", также предназначена охватить мостиковые дендримеры этого типа, дендримерные агрегаты этого типа, полидисперсные дендримеры этого типа и поверхностно-модифицированные дендримеры этого типа.
Дендримерные полимерные конъюгаты биологических модификаторов используются в широком ряду терапевтических и диагностических применений. Например, дендритные полимерные конъюгаты биологических модификаторов, содержащие генетические материалы, имеют широкую применимость в областях генной терапии, анализе, модификации, активации, антисмысловых применениях и т.п.; а дендритные полимерные конъюгаты биологических модуляторов, содержащие негенетические материалы, такие как протеины (например, интерлейкины, интерфероны, фактор некроза опухоли, фактор, стимулирующий гранулоцитные колонии, и другие протеины), используются в качестве терапевтических агентов (например, противовирусных агентов) и диагностических агентов.
Так, сюда входят: композиция, которая содержит комплекс дендритного полимера с генетическим материалом, необязательно, в растворе с DEAE-декстраном; и композиция, которая содержит комплекс первого дендритного полимера и генетического материала, который помещается в раствор, содержащий второй дендритный полимер, причем второй дендритный полимер больше, чем указанный первый дендритный полимер.
Также в настоящее изобретение
входит способ получения этих конъюгатов. Например, способ получения конъюгата дендритного полимера и
биологического модификатора включает в себя взаимодействие дендритного полимера с биологическим
модификатором с соответствующим растворителем при температуре, которая облегчает соединение
биологического модификатора и дендритного полимера. Если биологический модификатор является генетическим
материалом, получается комплекс при:
(1) взаимодействии указанного дендритного
полимера с указанным генетическим материалом в соответствующем растворителе при температуре, которая облегчает
образование комплекса указанного генетического материала с указанным дендритным
полимером,
причем указанный способ необязательно включает помещение указанного комплекса в раствор с DEAE-декстраном;
или
(2) образовании комплекса генетического материала с первым
дендритным полимером
при взаимодействии полимера с генетическим материалом в соответствующем растворителе при температуре,
которая облегчает соединение генетического материала с полимером, затем
помещении указанного
комплекса в раствор, содержащий второй дендритный полимер, причем указанный второй дендритный полимер
больше, чем указанный первый дендритный полимер. Более конкретно, по
отношению к указанному выше
способу (1), 1-10 мкг генетического материала на 1 мл или на 20 мкл, в зависимости от требуемой
концентрации, взаимодействует с достаточным количеством дендритного
полимера при pH около 5 - 10 и
температуре примерно 20 - 40oC с получением комплекса генетический материал : дендритный
полимер при соотношении зарядов от примерно 3:1 до примерно
1:10000. Более полное рассмотрение
способов приводится ниже.
Способы применения этих конъюгатов включают в себя эффективную клеточную трансфекцию и биологическую доступность генетического материала, включая обеспечение комплекса дендритного полимера и генетического материала и превращение указанного комплекса в доступный для клеток, предназначенных для трансфекции. Образование комплекса стабилизирует и уплотняет генетический материал, защищает генетический материал от гидролиза в процессе прохождения к и трансфекции в клетку, и облегчает перенос генетического материала через клеточную мембрану и в клетку, включая ядро клетки.
Кроме того, способами изобретения являются: перенос (транспортирование) генетического материала через клеточную мембрану и в ядро клетки, содержащий комплексообразование генетического материала с дендритным полимером, последующее превращение указанного комплекса в доступный для клеток, предназначенных для трансфекции; и защита генетического материала от гидролиза в процессе прохождения к и трансфекции в клетку, содержащая комплексообразование указанного генетического материала с дендритным полимером перед выдержкой указанного генетического материала в пищеварительных ферментах (гидролизующих энзимах); и стабилизация и уплотнение генетического материала, содержащее комплексообразование указанного генетического материала с дендритным полимером.
Следующее описание фигур поможет в понимании настоящего изобретения.
На фиг. 1 представлены различные генерации плотных звездчатых дендримеров.
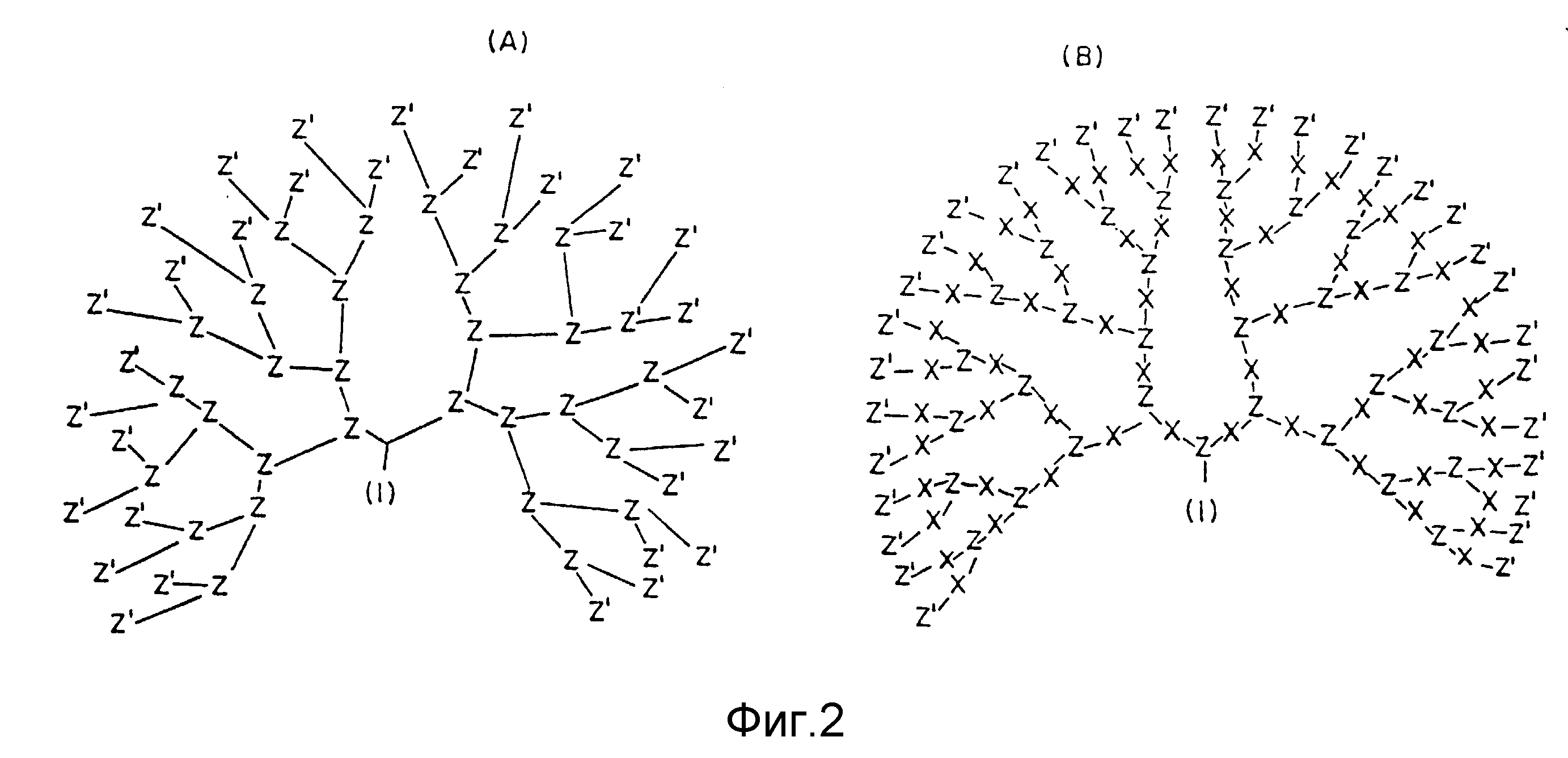
На фиг. 2 (A) показан дендример, имеющий несимметричные (неравные) соединения ветвей.
На фиг. 2 (B) показан дендример, имеющий симметричные (равные) соединения ветвей.
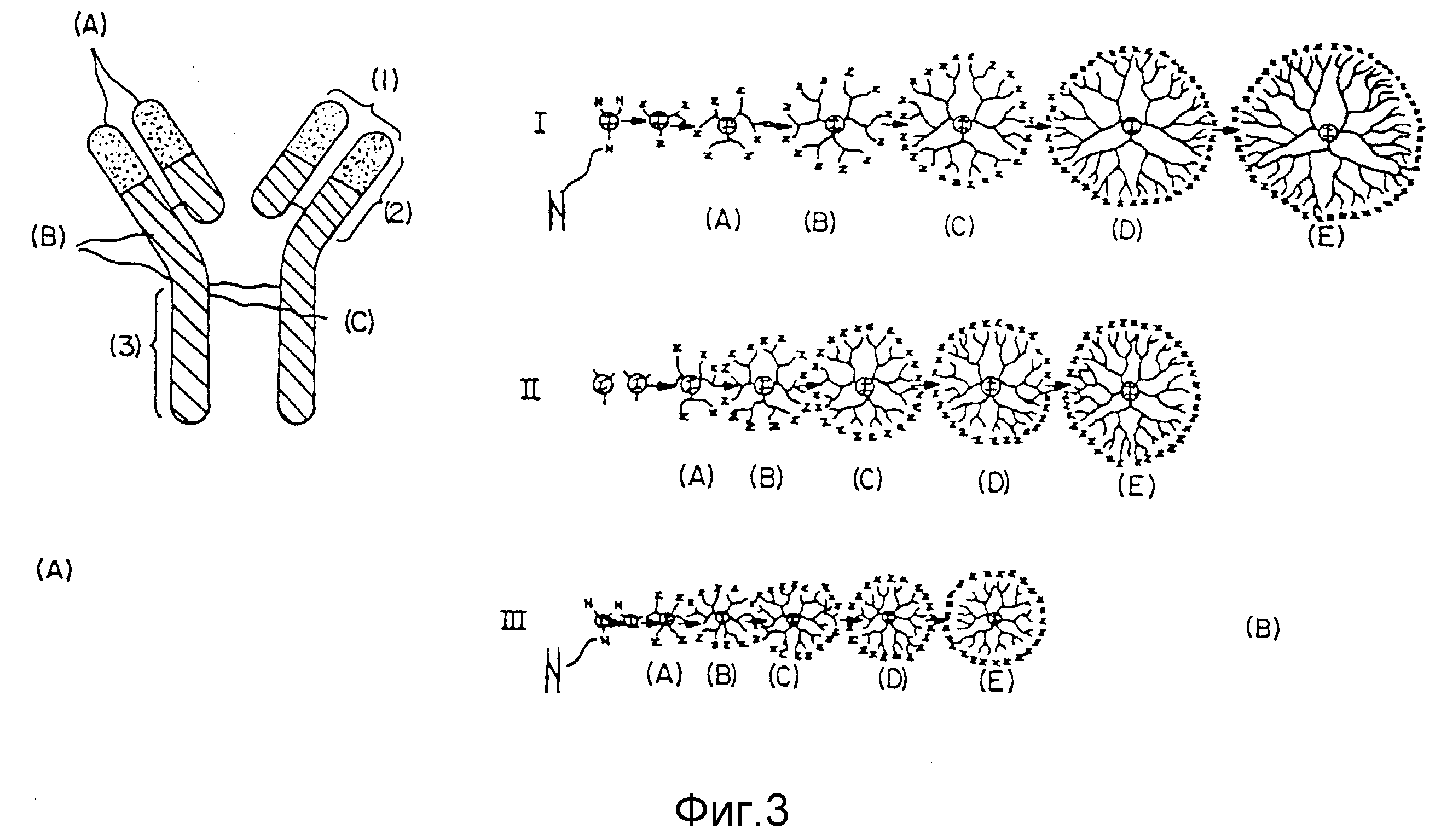
На фиг. 3 представлены размеры различных семейств дендримеров [I, II, III - (B)] относительно размеров антитела (A).
На фиг. 4 представлено время С13 -спин-релаксации (T1) решетки для аспирина, введенного в различные дендримерные генерации, пример 1. По вертикальной оси отложено время (секунды), а по горизонтальной оси - генерация присоединенного плотного звездчатого ПАМАМ (РАМАМ) дендримера.
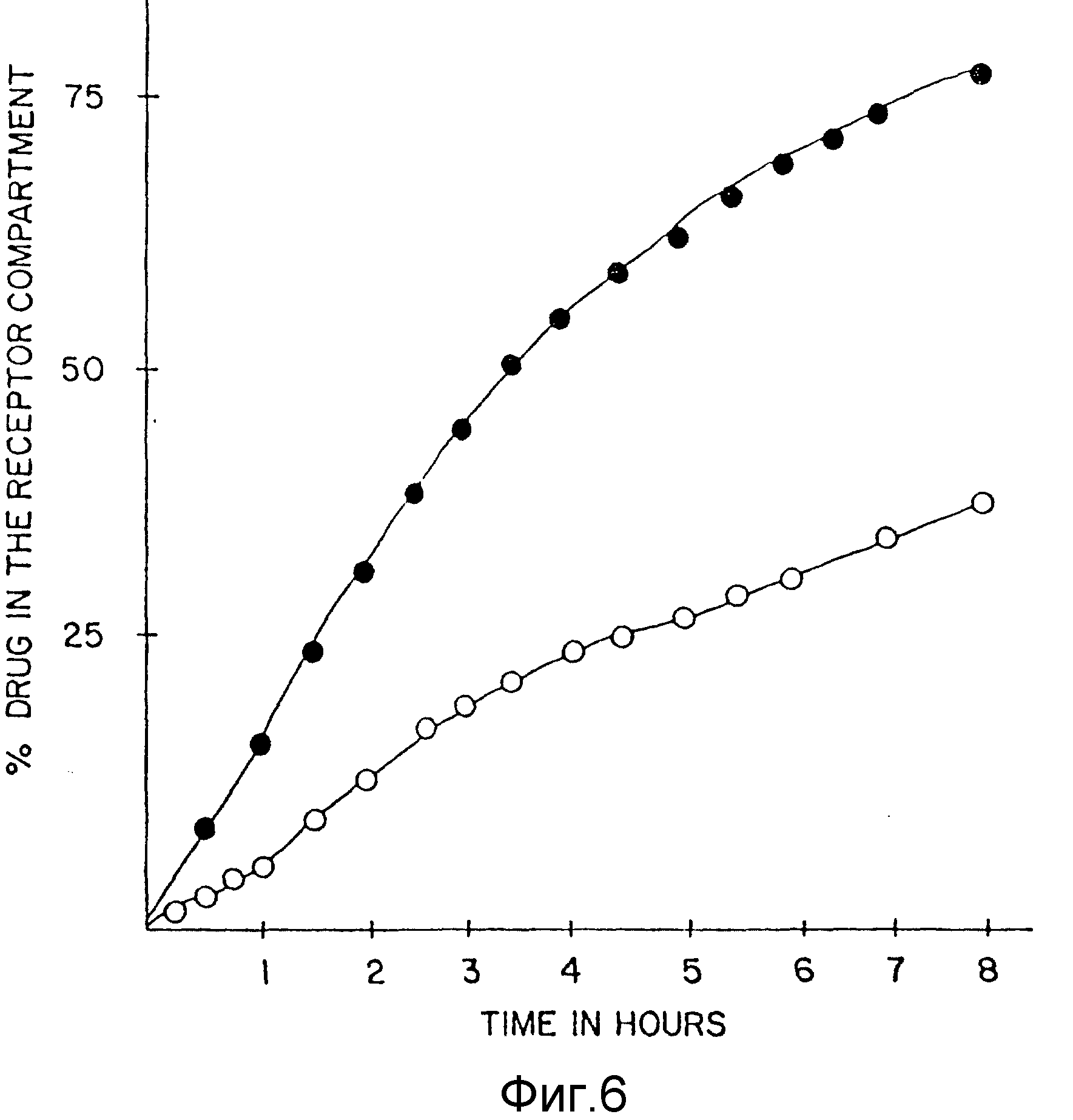
На фиг. 5 представлены результаты динамического анализа примера 2. По вертикальной оси отложено процентное содержание (%) лекарств в рецепторной фазе, по горизонтальной оси - время (часы).
Фиг. 6 показывает влияние генерации 6,5 дендримера на скорость диализа псевдоэфедрина при pH 9,5 из примера 2. На вертикальной оси представлено процентное содержание (%) лекарства в рецепторном участке, а по горизонтальной оси - время (часы).
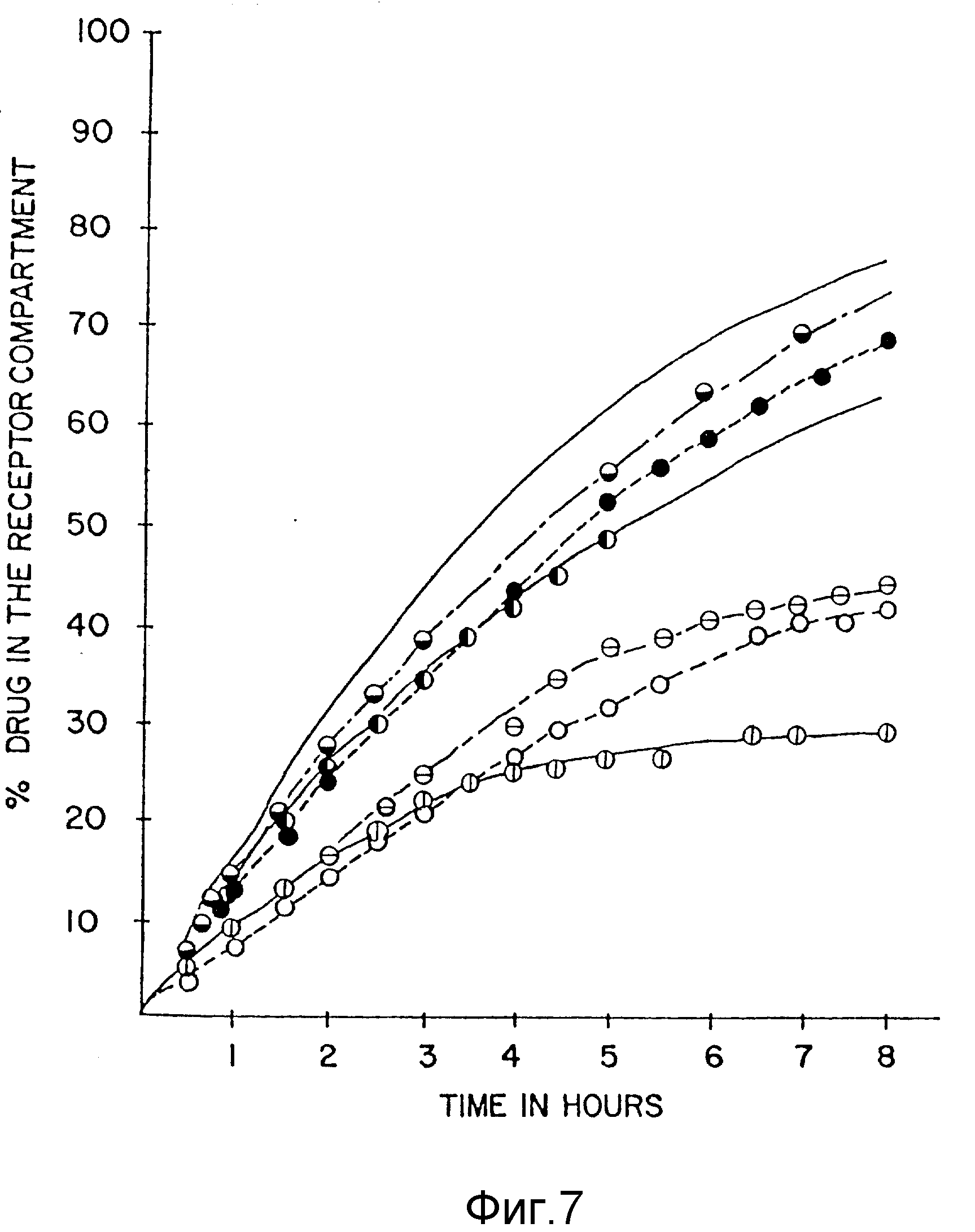
Фиг. 7 показывает влияние гидролиза дендримера на проницаемость псевдоэфедрина из примера 3. На вертикальной оси отложено процентное содержание (%) лекарства в рецепторном участке, а по горизонтальной оси - время (часы).
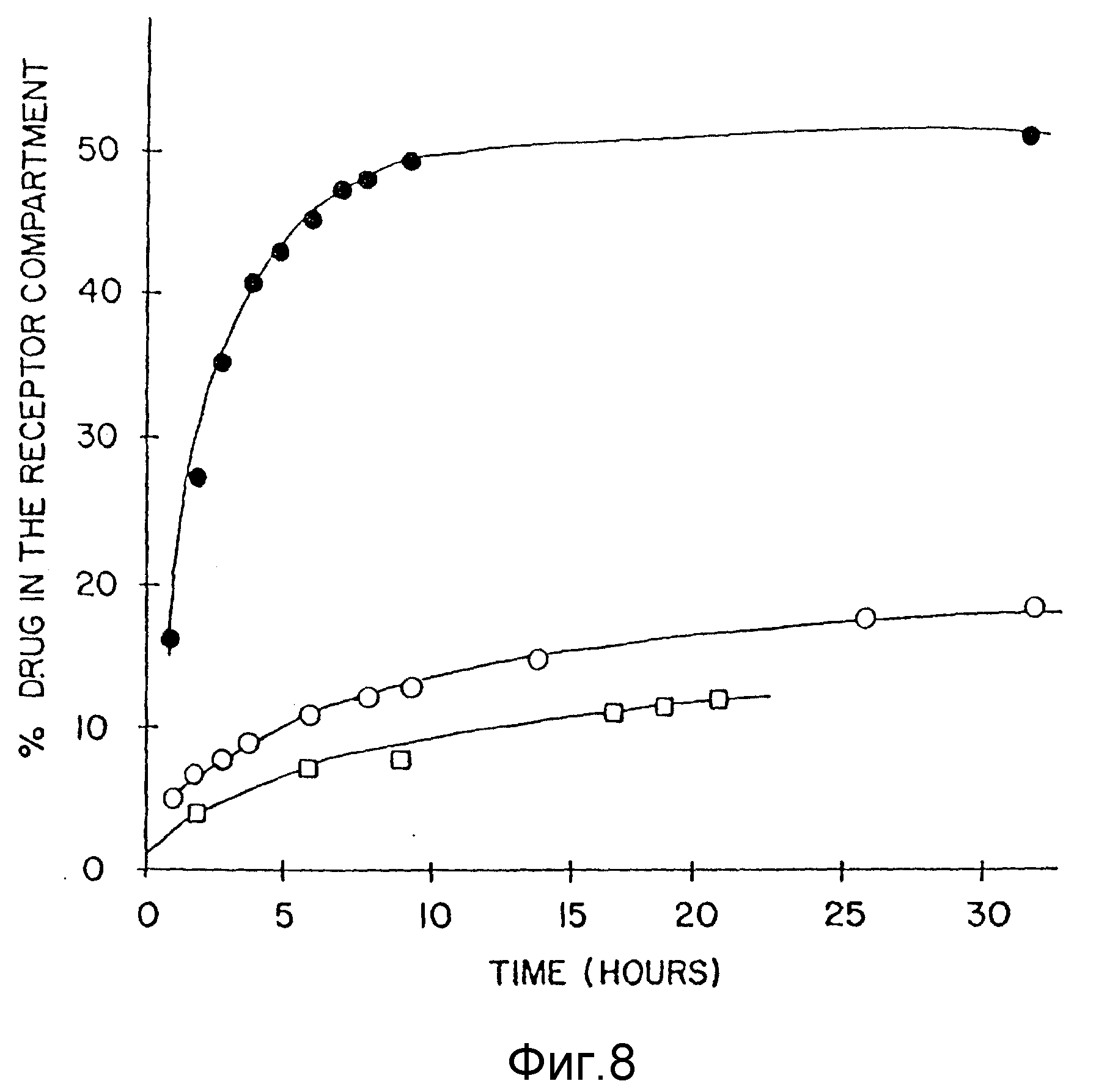
Фиг. 8 показывает сравнение процентного содержания салициловой кислоты, высвобожденной в рецепторном участке в присутствии плотного звездчатого полимера (Gen=4,0) при pH 5,0 и 6,65 с контролем салициловой кислоты, пример 4. По вертикальной оси отложено процентное содержание (%) лекарства в рецепторном участке, а по горизонтальной оси - время (часы).
Фиг. 9 показывает сравнение процентного содержания салициловой кислоты, теряемой из донорного участка с плотным звездчатым полимером (Gen=4,0) в рецепторном участке при pH 8,0 к содержанию салициловой кислоты, пример 4. По вертикальной; оси отложено процентное содержание (%) лекарства в донорном участке, а по горизонтальной оси - время (часы).
Фиг. 10 показывает сравнение процентного содержания салициловой кислоты, теряемой из донорного участка в присутствии плотного звездчатого полимера (Gen= 4,5), с контролем салициловой кислоты, пример 4. По вертикальной оси отложено процентное содержание (%) лекарства в донорном участке, а по горизонтальной оси - время (часы).
Фиг. 11 показывают время (T1) C13-спин-релаксации решетки для 24-D, введенного в различные генерации дендримеров, пример 15. По вертикальной оси отложено время (секунды), а по горизонтальной оси - генерация присоединенного плотного звездчатого ПАМАМ (РАМАМ)-дендримера.
Фиг. 12 является столбцовой диаграммой, содержащей способность трансфекции ДНК дендримеров при различных соотношениях зарядов ДНК: дендример, при исследовании активности люциферазы после трансфекции, пример 44. По вертикальной оси отложены относительные единицы света/мкг протеина, а цифры на горизонтальной оси - номера образцов (описанных в примере 44) для контроля как различного дендримера, так и ДНК-комплексов при различных соотношениях зарядов ДНК:дендример, как представлено в таблице XV.
На фиг. 13 представлен электрофоретический гель, содержащий ДНК-связывающую способность дендримеров при различных соотношениях зарядов ДНК: дендример, при использовании тех же комплексов ДНК: дендример, которые были использованы на рисунке 12, пример 44.
Фиг. 14 представляет график процентного увеличения трансфекции по сравнению с контролем по отношению к генерации дендримера, использованного в комплексе ДНК:дендример, пример 45. По вертикальной оси отложено процентное увеличение трансфекции по отношению к контролю декстрана, а по горизонтальной оси - генерация дендримера. Сплошные кружки - дендримеры с аммиачным (NH3) ядром, а сплошные квадраты - дендримеры с этилендиаминным (ЭДА) ядром.
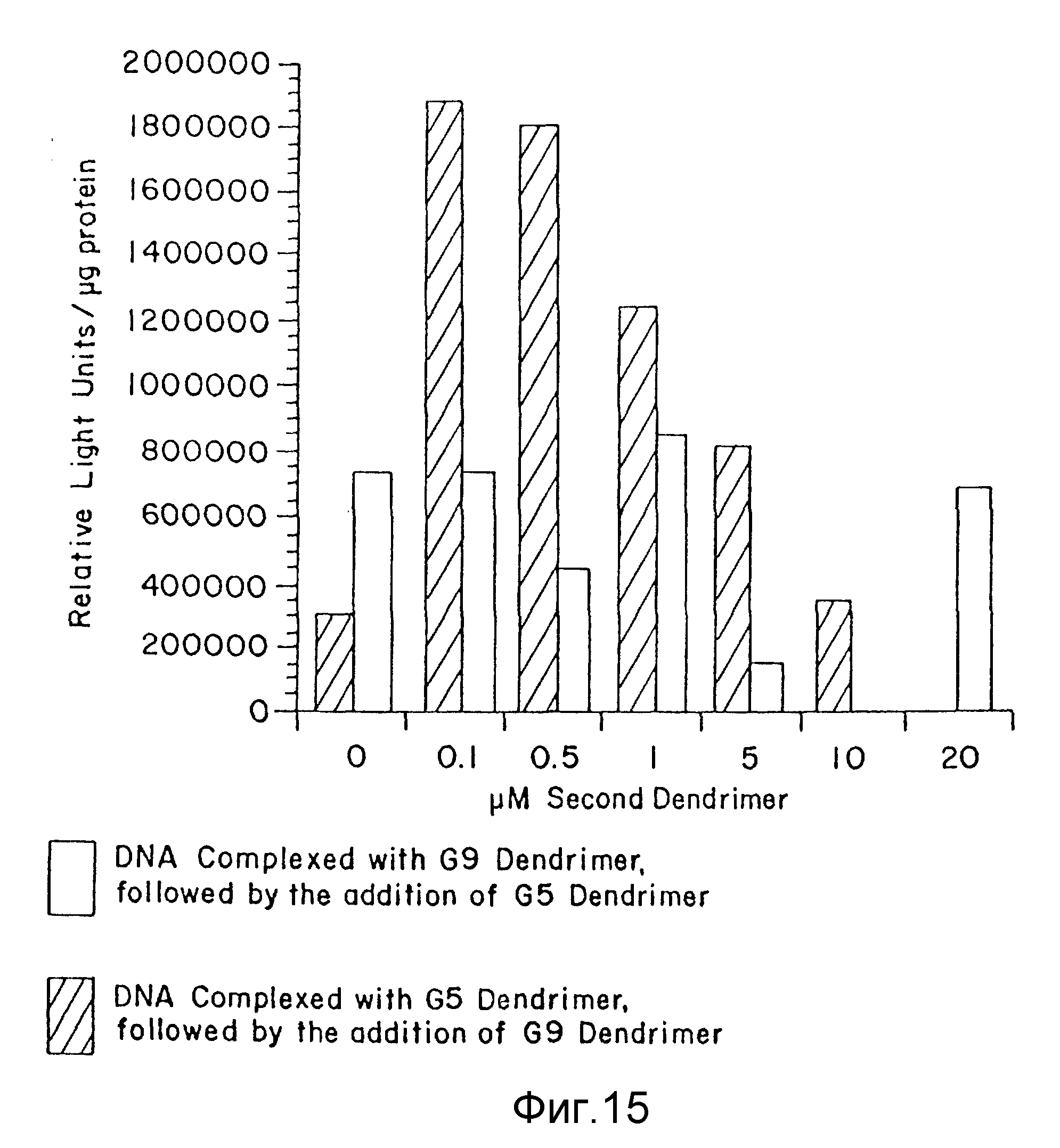
Фиг. 15 является столбцовой диаграммой, представляющей влияние порядка присоединения различных дендримеров к ДНК-дендримерному комплексу на трансфекционную эффективность в клетках RAT-2 для дендримеров с ЭДА-ядром, пример 46. По вертикальной оси отложено относительные единицы света/мкг протеина, а по горизонтальной оси - концентрация (мкМ) второго дендримера. Незаштрихованные столбцы - результаты для комплекса ДНК-G9-дендример, с последующим присоединением G5- дендримера. Заштрихованные по диагонали столбцы - результаты для комплекса ДНК-G5-дендример, с последующим присоединением G9-дендримера.
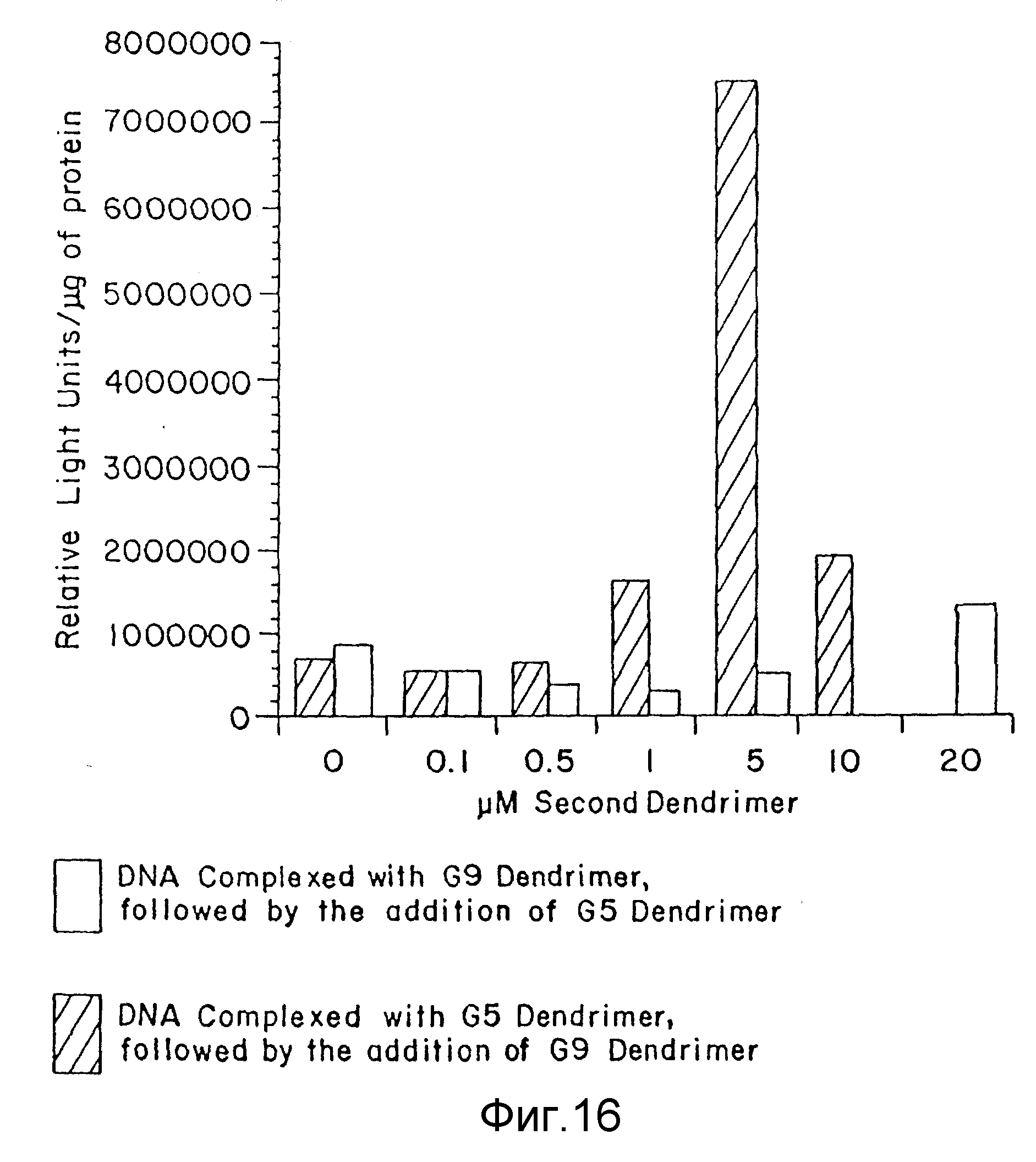
Фиг. 16 представляет ту же информацию, что и на фиг. 15, но для дендримеров с NH3-ядром, пример 46. По вертикальной оси отложены относительные единицы света/мкг протеина, а на горизонтальной оси - концентрация (мкМ) второго дендримера. Незаштрихованные столбцы - результаты для комплекса ДНК-G9-дендример, с последующим присоединением G5-дендримера. Заштрихованные по диагонали столбцы - результаты для комплекса ДНК-G5-дендример, с последующим присоединением G9-дендримера.
Фиг. 17 представляет единицы света на мкг протеина после трансфекций, осуществленных с различными ДНК-дендримерными конъюгатами и контрольными в различных условиях, пример 42. На вертикальной оси отложены относительные световые единицы на мкг протеина, а цифры на горизонтальной оси являются номерами образцов для контрольный и различных ДНК-дендримерных комплексов при различных соотношениях ДНК:дендример, как представлено в таблице XIII.
Фиг. 18 подобна фиг. 17, но данные представлены для широкой вариации отношения дендример: ДНК, пример 42. На вертикальной оси даны относительные световые единицы на мкг протеин, а цифры на горизонтальной оси являются номерами образцов для контрольных и различных ДНК-дендримерных комплексов при различных соотношениях ДНК:дендример, как представлено в таблице XIV.
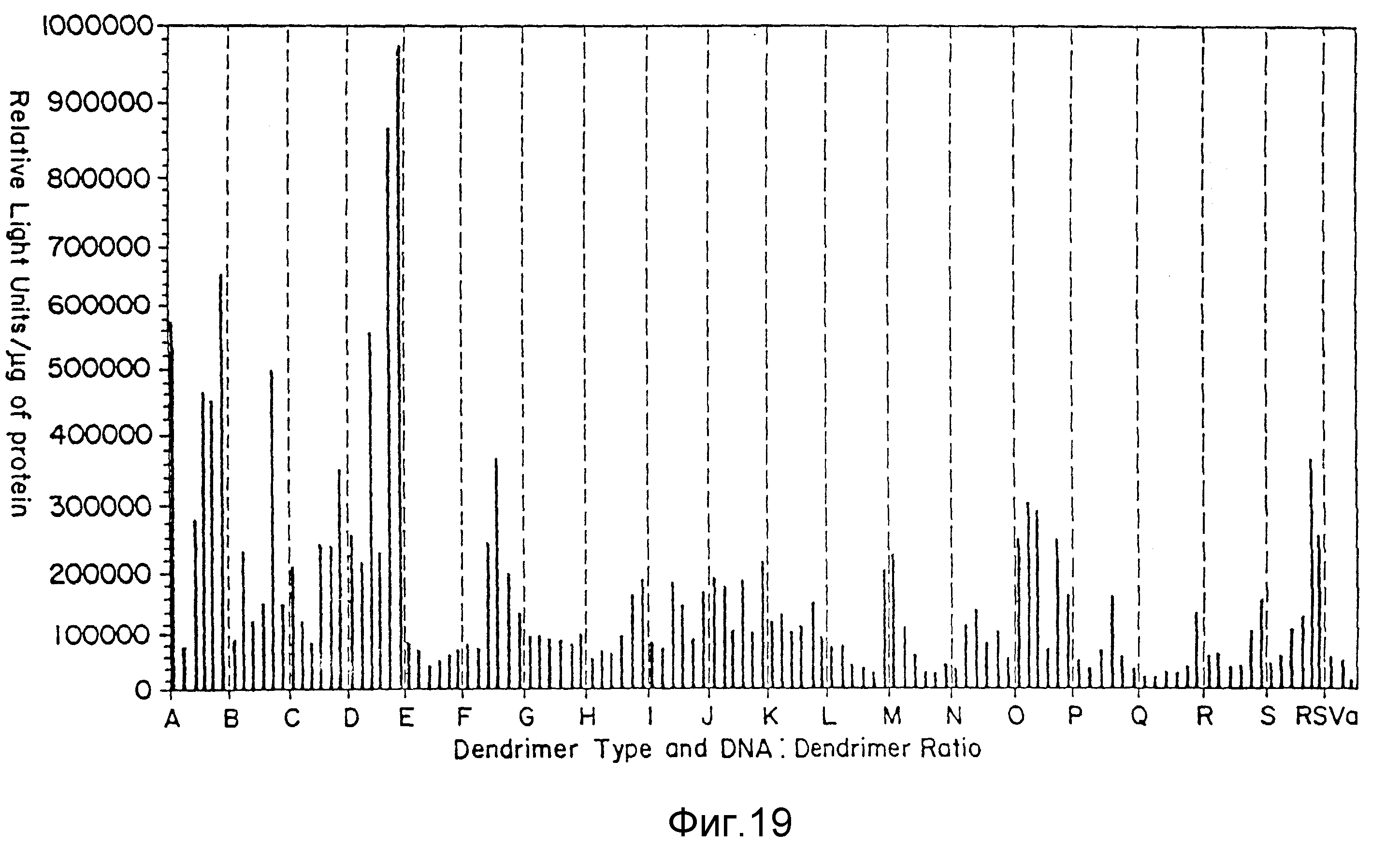
Фиг. 19 является столбцовой диаграммой относительных световых единиц на мкг протеина для трансфекции конъюгата дендример:ДНК для дендримера A-S, пример 42. На вертикальной оси указаны относительные световые единицы/мкг протеина, а на горизонтальной оси - использованный дендример и соотношение ДНК:дендример в каждом сегменте оси 1:2, 1:2, 1:10, 1:10, 1:20 и 1:20.
Фиг. 20 представляет электрофоретический гель, содержащий комплексообразующие свойства нескольких дендримеров с (NH3)-ядром с синтетической одноцепочной ДНК длиной 15 нуклеотидов, пример 47.
Фиг. 21 представляет поглощение радиомеченного синтетического двуцепочечного олигомера длиной 23 нуклеотида в линии моноцитной клетки во времени, сравнивая трансфекцию отдельной ДНК, трансфекцию ДНК в комплексе с генерацией 8 (G8) дендримера с (NH3)-ядром (т.е., G8 (NH3)-дендример) и трансфекцию комплексов ДНК-дендример в присутствии азида натрия, пример 47. На вертикальной оси отложено 102 спм/104 клеток, а по горизонтальной оси - время (часы). Сплошные (затушеванные) квадраты представляют синтетический одноцепочечный олигомер длиной 23 нуклеотида; сплошные (затушеванные) кружки представляют ДНК/G8 (NH3)-дендример; а сплошные (затушеванные) треугольники представляют ДНК/G8 (NH3)-дендример + азид натрия.
Фиг. 22 является столбцовой диаграммой трансфекции по отношению к комплексу дендример-ДНК, где часть ДНК является линейной, а часть кольцевой или суперскрученной, пример 48. На вертикальной оси отложены относительные световые единицы на мкг протеина, а по горизонтальной оси - комплекс дендример - ДНК. Незатушеванные столбцы представляют результаты для случая отсутствия DEAE-декстрана. Затушеванные столбцы представляют результаты для 0,5 мкМ DEAE-декстрана.
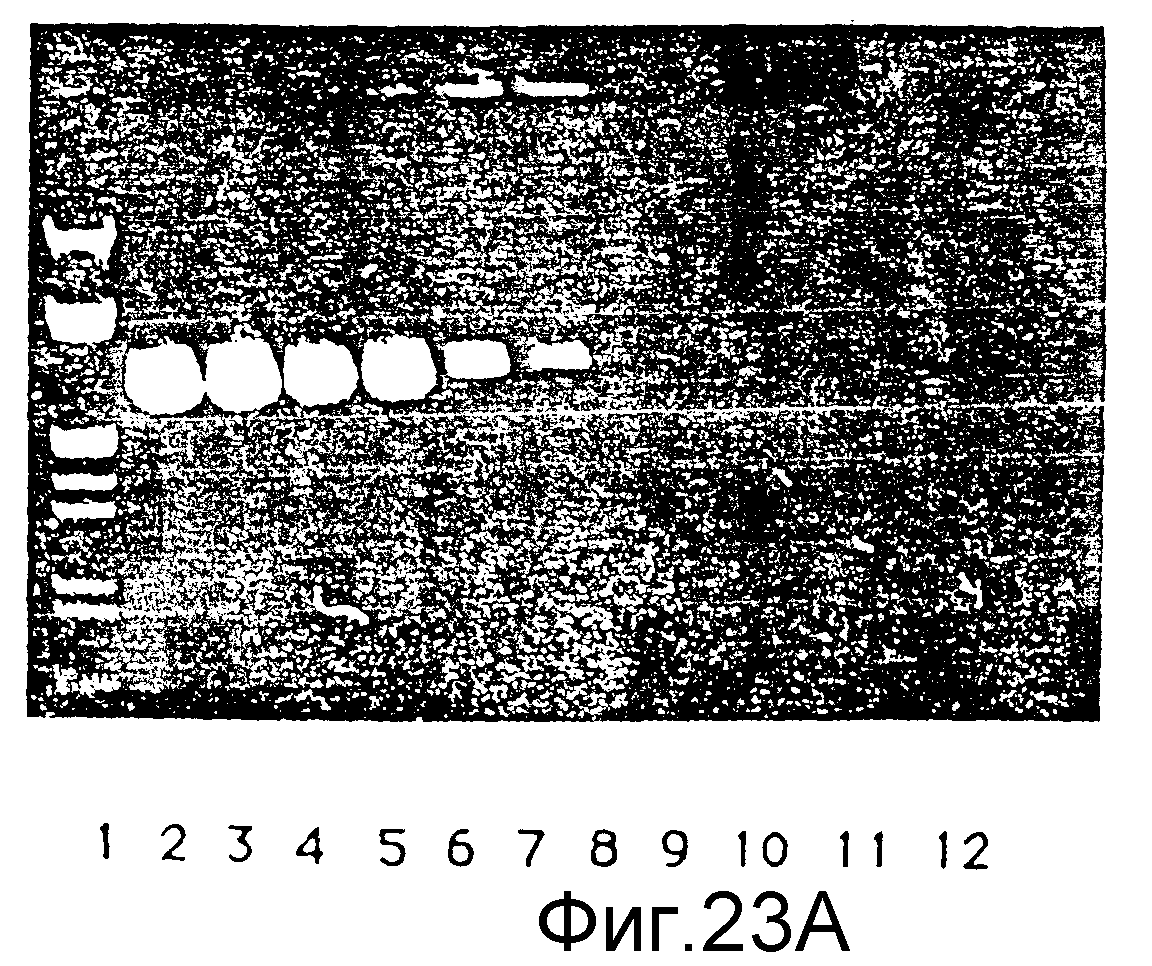
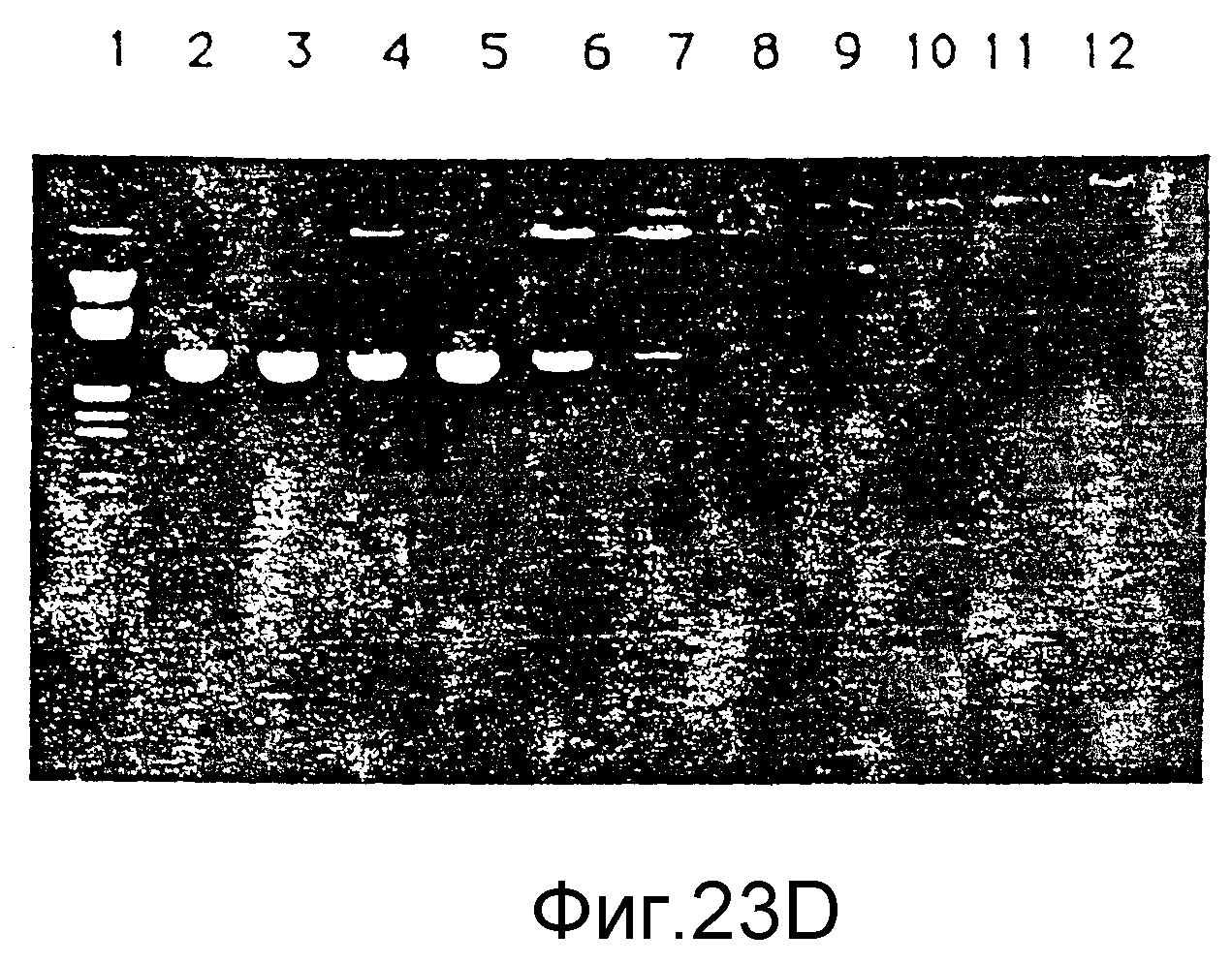
Фиг. 23 (A) - (D) представляет четыре электрофоретических геля, показывающих комплексообразующую по отношению к ДНК способность G8 (NH3)-дендримера и G8 (ЭДА)-дендримера при различных соотношениях и в различных условиях, пример 49.
Фиг. 24 представляет электрофоретический гель, содержащий соединительные по отношению к ДНК свойства G8 (NH3)-дендримеров и G11 (ЭДА)-дендримеров с различными мольными соотношениями, пример 50.
Фиг. 25 представляет электрофоретический гель, показывающий соединительные по отношению к ДНК свойства G8 (NH3)-дендримеров и G8 (ЭДА)-дендримеров в широком интервале pH, пример 51.
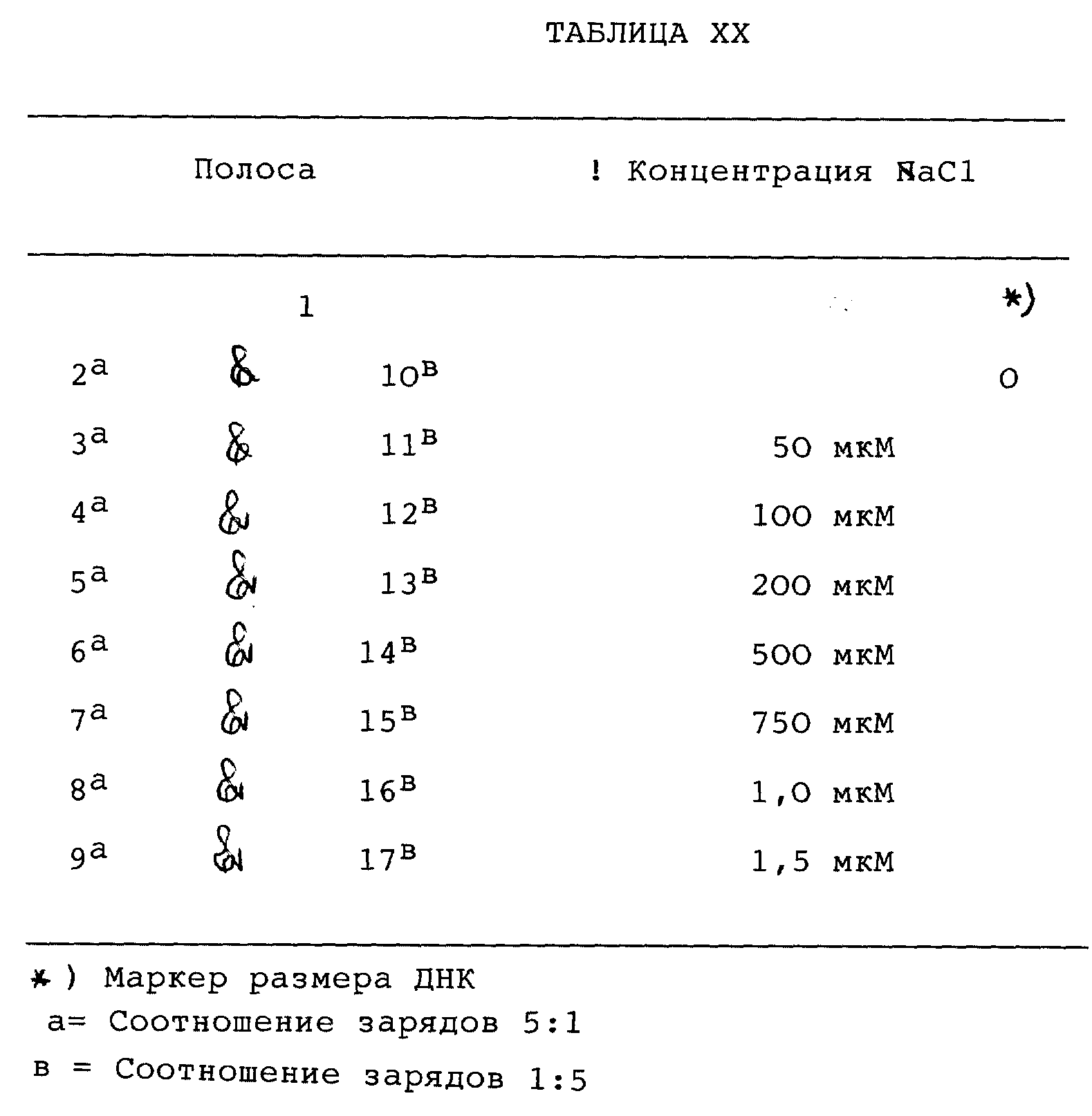
Фиг. 26 (A) и (B) представляет электрофоретические гели, показывающие ДНК-дендримерную соединительную стабильность в солевых растворах с увеличивающейся концентрацией хлористого натрия, пример 52.
Фиг. 27 представляет электрофоретический гель, показывающий стабильность и защиту ДНК, образующую комплекс с G8 (NH3)-дендримерами и G11 (ЭДА)-дендримерами в присутствии различных ферментов рестрикции ДНК, пример 53.
Фиг. 28 представляет электрофоретический гель, показывающий стабильность и защиту ДНК, образующую комплекс с G8 (ЭДА)-дендримерами в присутствии клеточных нуклеаз, пример 54.
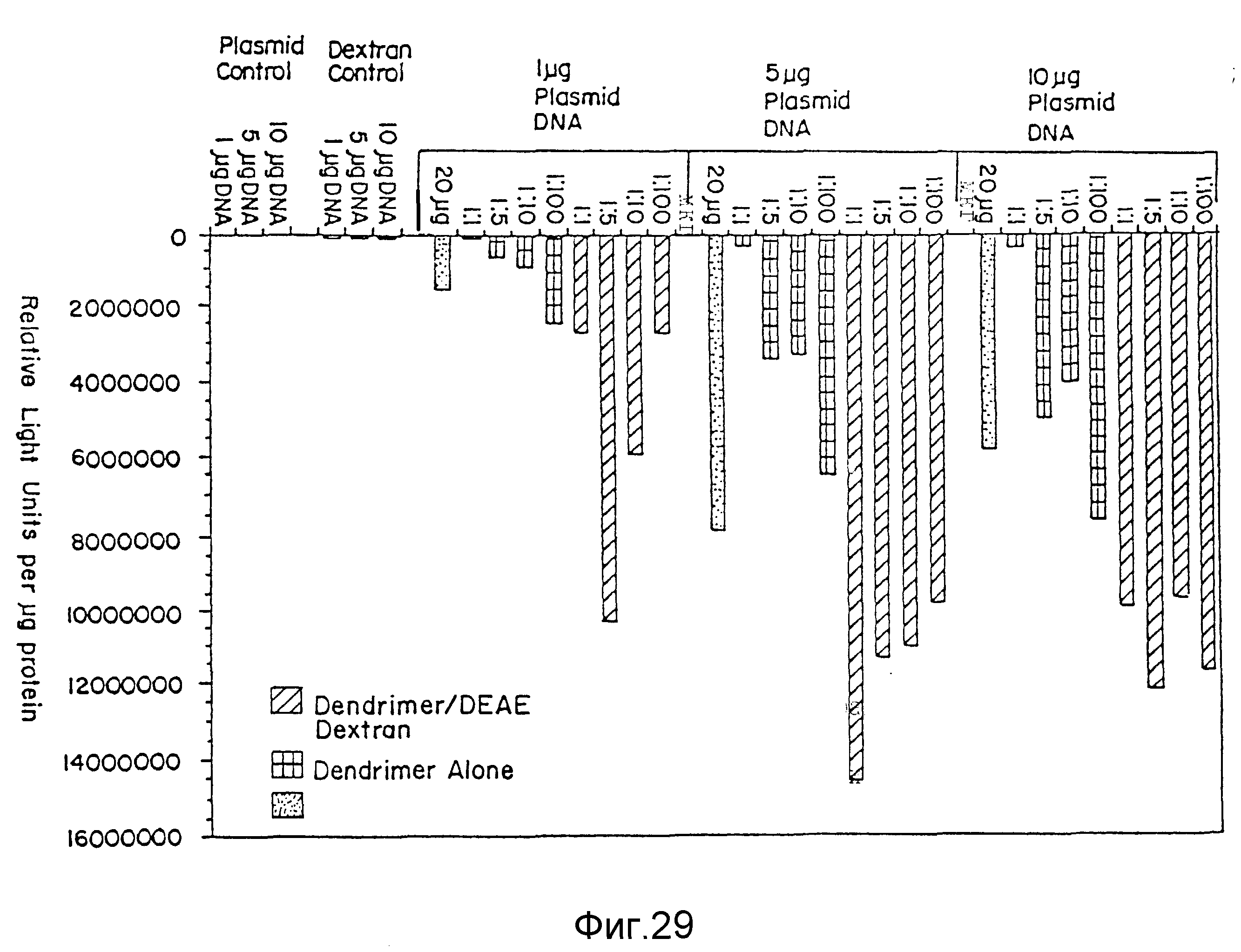
На фиг. 29 представлено сравнение степени трансфекции ДНК, образующей комплекс с дендрикерами при различных соотношениях зарядов ДНК:дендример и различных концентрациях ДНК, по отношению к тем же комбинациям в присутствии диэтиламиноэтилового эфира декстрана (DEAE-декстрана). Имеются примеры трансфекции с липидами, т.е. подставляя ЛИПОФЕКТИН (LIPOFECTIN), использованный вместо дендримера, и в отсутствии DEAE-декстрана, пример 55. На вертикальной оси указаны контрольный образец плазмиды, контрольный образец декстрана и различные комплексы плазмида-ДНК 1 мкг, 5 мкг и 10 мкг, а по горизонтальной оси - относительные световые единицы на мкг протеина. Заштрихованные по диагонали столбцы представляют результаты для дендример/DEAE - декстрана. Заштрихованные поперек столбцы представляют результаты только для одного дендримера. В крапинку (заполненные точками) столбцы представляют результаты для (LIPOFECTIH) ЛИПОФЕКТИНА.
Фиг. 30 представляет степень трансфекции для (NH3)-дендримеров и (ЭДА)-дендримеров при различных соотношениях зарядов ДНК:дендример, в присутствии DEAE-декстрана в ряде случаев и без DEAE-декстрана в других, пример 56. На вертикальной оси указываются относительные световые единицы/мкг протеина, а по горизонтальное оси - соотношение ДНК:дендример. Затушеванные квадраты с сплошными линиями представляют G9 (ЭДА)-дендример; незатушеванные квадраты с штриховыми линиями представляют G9 (ЭДА)-дендример + DEAE-декстран; затушеванные кружки с сплошными линиями представляют G9 (NH3)-дендример; и незатушеванные кружки с штриховыми линиями представляют G9 (NH3)-дендример + DEAE-декстран.
Фиг. 31 аналогична фиг. 30, но для G8 (NH3)-дендримеров и G11 (ЭДА)-дендримеров, и везде в присутствии DEAE-декстрана, пример 56. По вертикальной оси отложены относительные световые единицы на мкг протеина, и по горизонтальной оси - соотношение зарядов ДНК:дендример. Затушеванные кружки представляют G8 (NH3 )-дендример; и затушеванные треугольники представляют G11 (ЭДА)-дендример.
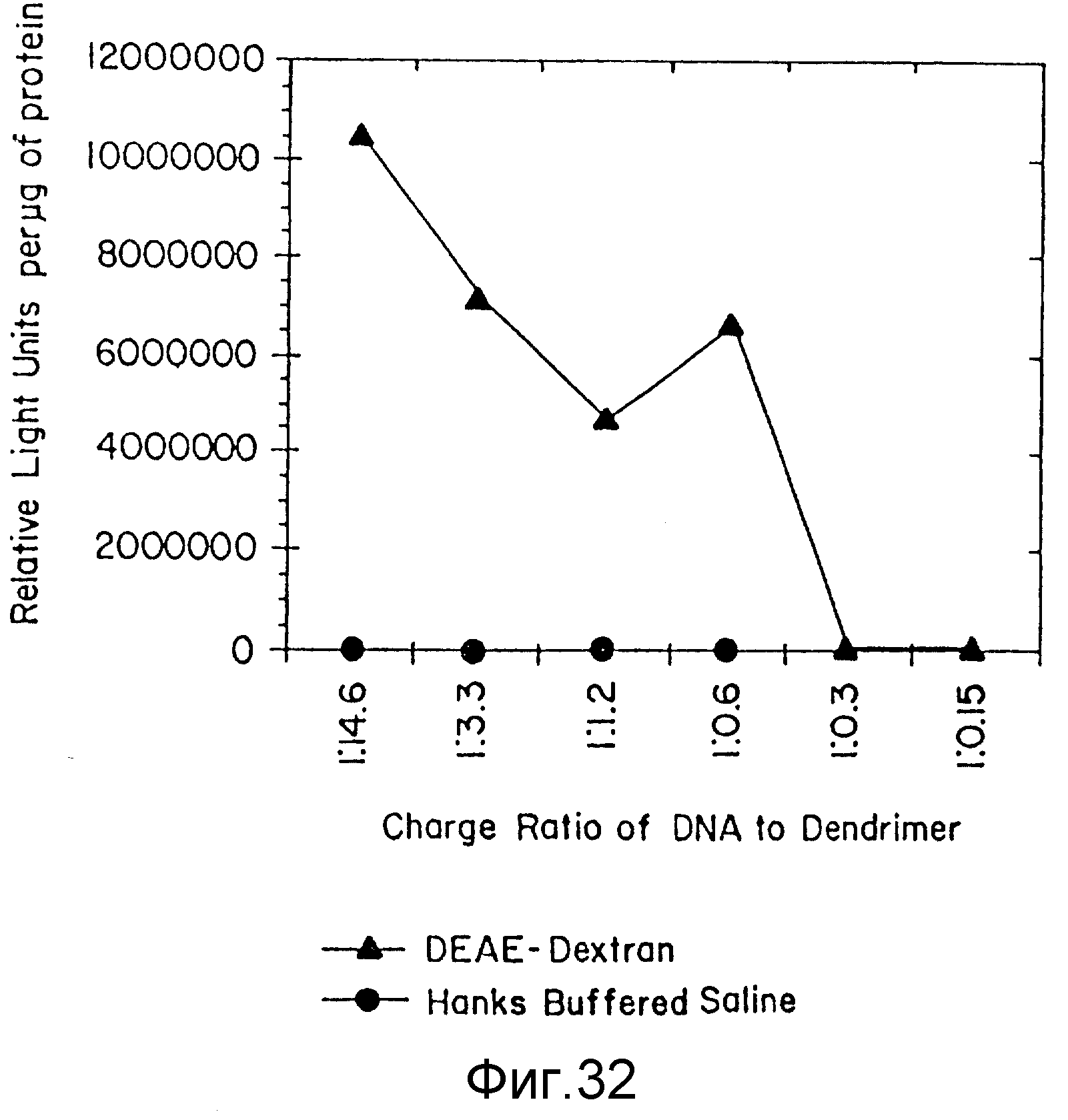
Фиг. 32 представляет трансфекционную эффективность комплексов ДНК:G7 (NH3)-дендример в присутствии или DEAE-декстрана, или буферного солевого раствора Хенкса (HB5), пример 57. По вертикальной оси отложены относительные световые единицы на мкг протеина; а по горизонтальной оси - отношение ДНК: дендример. Затушеванные кружки представляют буферный солевой раствор Хенкса, а затушеванные треугольники представляют DEAE-декстран.
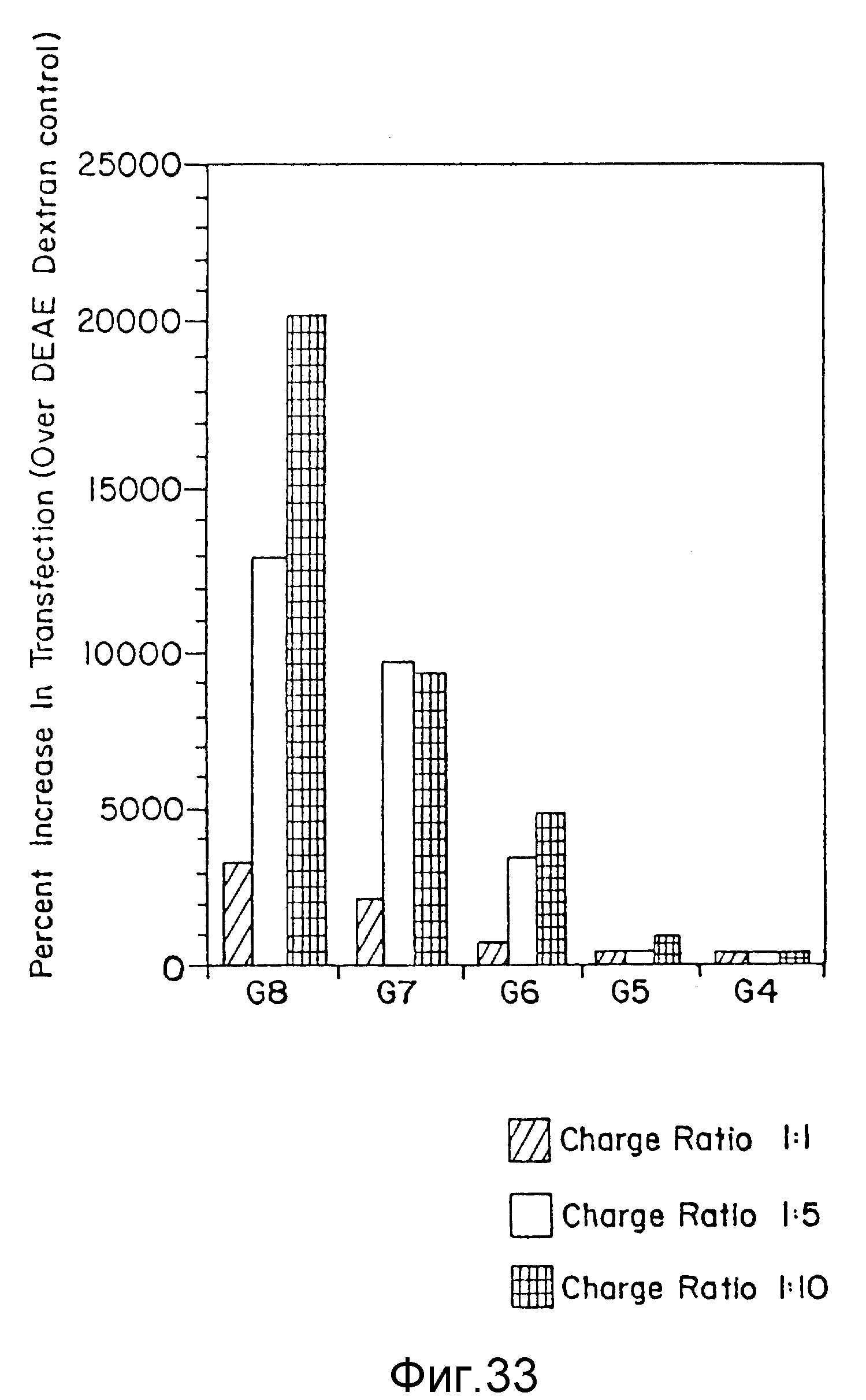
Фиг. 33 представляет процентное увеличение трансфекции для комплексов (NH3)-дендример-ДНК в DEAE-декстране при различных соотношениях зарядов ДНК: дендример, пример 58. По вертикальной оси указывается процентное увеличение трансфекции (по отношению к контролю DEAE-декстран), а по горизонтальной оси - дендримерная генерация. Столбцы, заштрихованные по диагонали, представляют соотношение зарядов 1: 1, незатушеванные столбцы представляют соотношение зарядов 1: 5, а заштрихованные поперек столбцы представляют соотношение зарядов 1:10.
Фиг. 34 представляет эффективность трансфекции комплексов ДНК-дендример при различных соотношениях зарядов, в присутствии DEAE-декстрана и без DEAE-декстрана, пример 59. По вертикальной оси указываются относительные световые единицы на мкг протеина, а по горизонтальной оси - соотношение зарядов ДНК: дендример (довольно правильная запись имеет контроль плазмида - DEAE-декстран). Незатушеванные столбцы представляют DEAE-декстран; а затушеванные столбцы представляют случай без DEAE-декстрана.
На фиг. 35 представлена эффективность трансфекции для комплексов ДНК:дендример при различных соотношениях зарядов и при различных концентрациях DEAE-декстрана, пример 60. По вертикальной оси указываются относительные световые единицы на мкг протеина, по верхней горизонтальной оси концентрация DEAE-декстрана в мкМ; а по нижней горизонтальной оси - различные соотношения зарядов ДНК: дендример для каждого сегмента, включая контрольный образец плазмид.
На фиг. 36 представлена эффективность трансфекции для комплексов ДНК:дендример соотношением 1:5, по сравнению с трансфекциями с помощью ЛИПОФЕКТИНА (LIPOFECTIN); в различных клеточных линиях, пример 61. Цифры на вертикальной оси являются номерами образцов, идентифицирующими используемые агенты трансфекции (как определено в примере 61), а на горизонтальной оси указываются относительные световые единицы на мкг протеина. Различными сегментами (данные под диаграммой) для линий испытываемых клеток являются: обезьяна:COS 7; человек:HMEC-1; мышь:10-1; мышь: NJH 3T3; и крыса:Clone9.
На фиг. 37 представлена эффективность трансфекции для комплексов ДНК-дендример при соотношении зарядов 1:5 в двух различных линиях трансфекционных клеток по сравнению с трансфекциями с помощью ЛИПОФЕКТИНА (LIPOFECTIN) в таких линиях клеток, пример 62. На вертикальной оси указаны номера примеров, а по горизонтальной оси - относительные световые единицы на мкг протеина. Использованные линии клеток представлены наклонно заштрихованными столбцами для NRK52E и затушеванными столбцами для YB2.
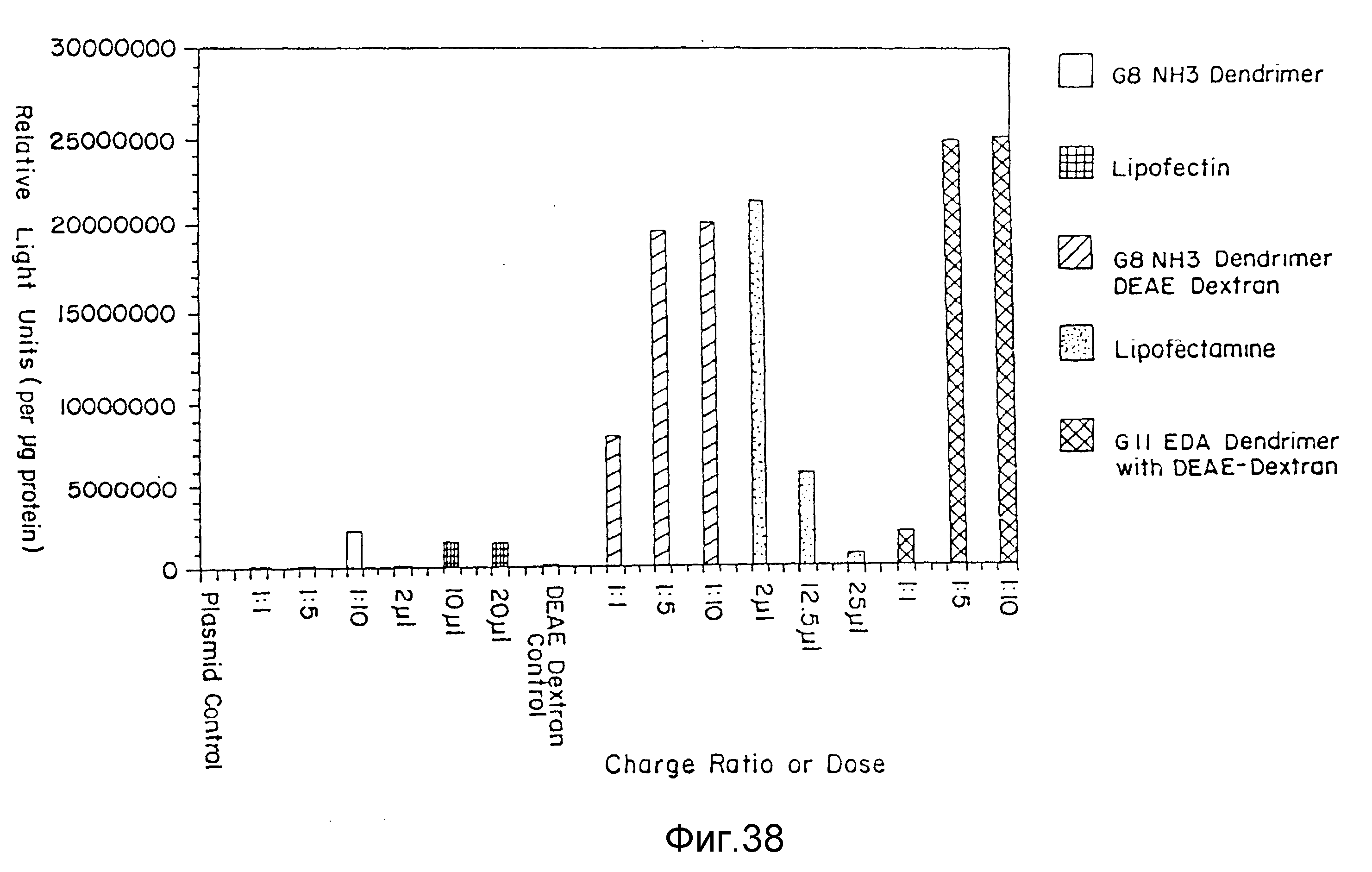
На фиг. 38 представлена эффективность трансфекции различных комплексов ДНК-дендример с и без DEAE-декстрана, по сравнению с трансфекциями с помощью ЛИПОФЕКТИНА и ЛИПОФЕКТАМИНА (LIPOFECTIN and LIPOFECTAMIN), пример 63. На вертикальной оси указываются относительные световые единицы, а на горизонтальной оси - соотношение или доза, включая контрольные. Незаштрихованные столбцы представляют G8 (NH3) дендример; заштрихованные вертикально столбцы представляют ЛИПОФЕКТИН (LIPOFECTIN); затушеванные по диагонали столбцы представляют G8 (NH3) дендример с DEAE-декстраном; в крапинку столбцы представляют ЛИПОФЕКТАМИН (LIPOFECTAMIN), и наклонно заштрихованные столбцы представляют C11 (ЭДА)-дендример с DEAE-декстраном.
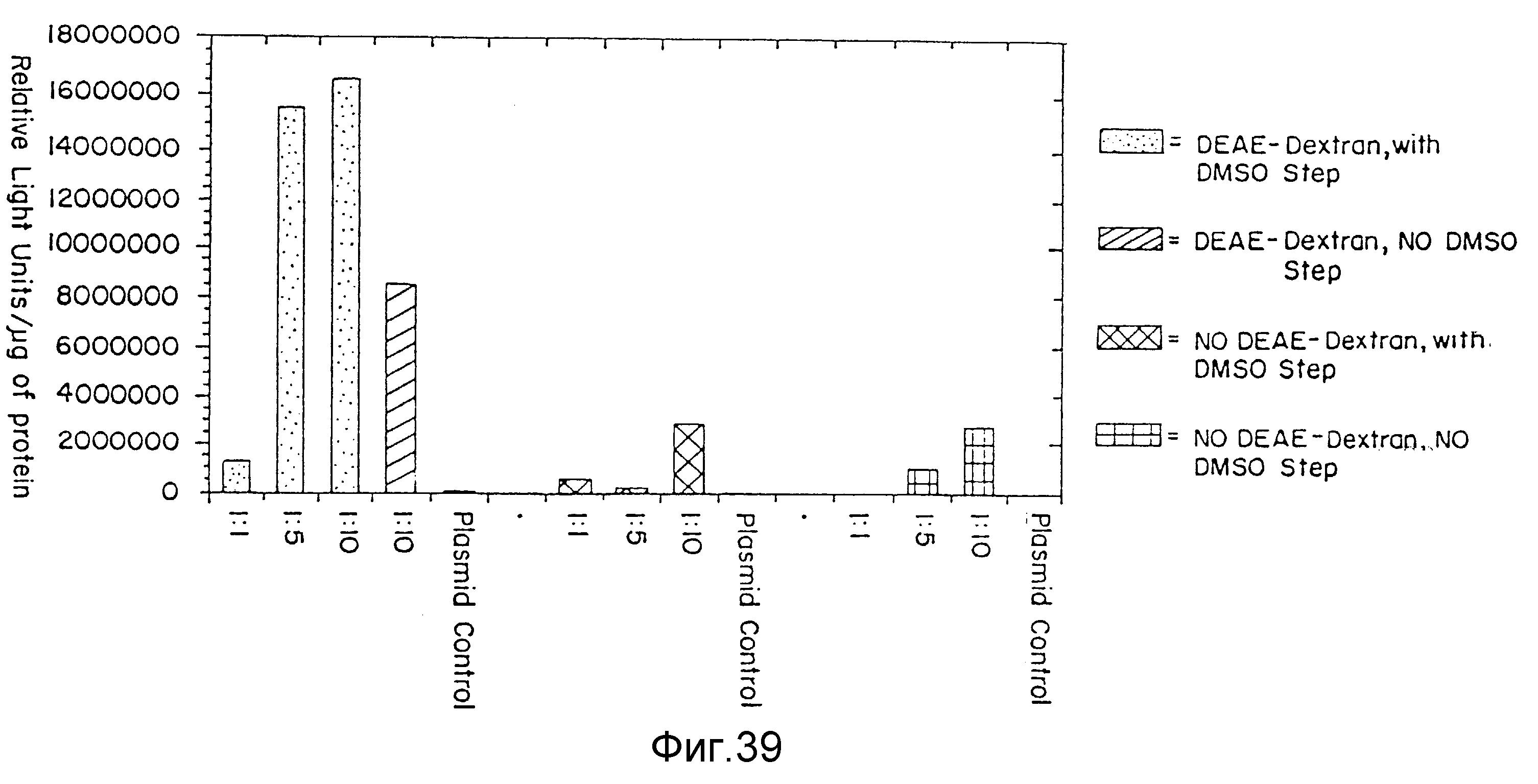
На фиг. 39 представлена эффективность трансфекции комплексов ДНК:дендример при различных соотношениях и в присутствии либо DEAE-декстрана, диметилсульфоксида (ДМСО), смеси вышеуказанного, ничего из вышеуказанного, пример 64. На вертикальной оси указываются относительные световые единицы на мкг протеина; а на горизонтальной оси - соотношение зарядов, включая контрольные образцы плазмид. В крапинку столбцы представляют DEAE-декстран с ДМСО-стадией; заштрихованные по диагонали столбцы представляют DEAE-декстран с стадией не-ДМСО; наклонно заштрихованные столбцы представляют не-DEAE-декстрана с ДМСО-стадией; и вертикально заштрихованные столбцы представляют не-DEAE-декстран с стадией не-ДМСО.
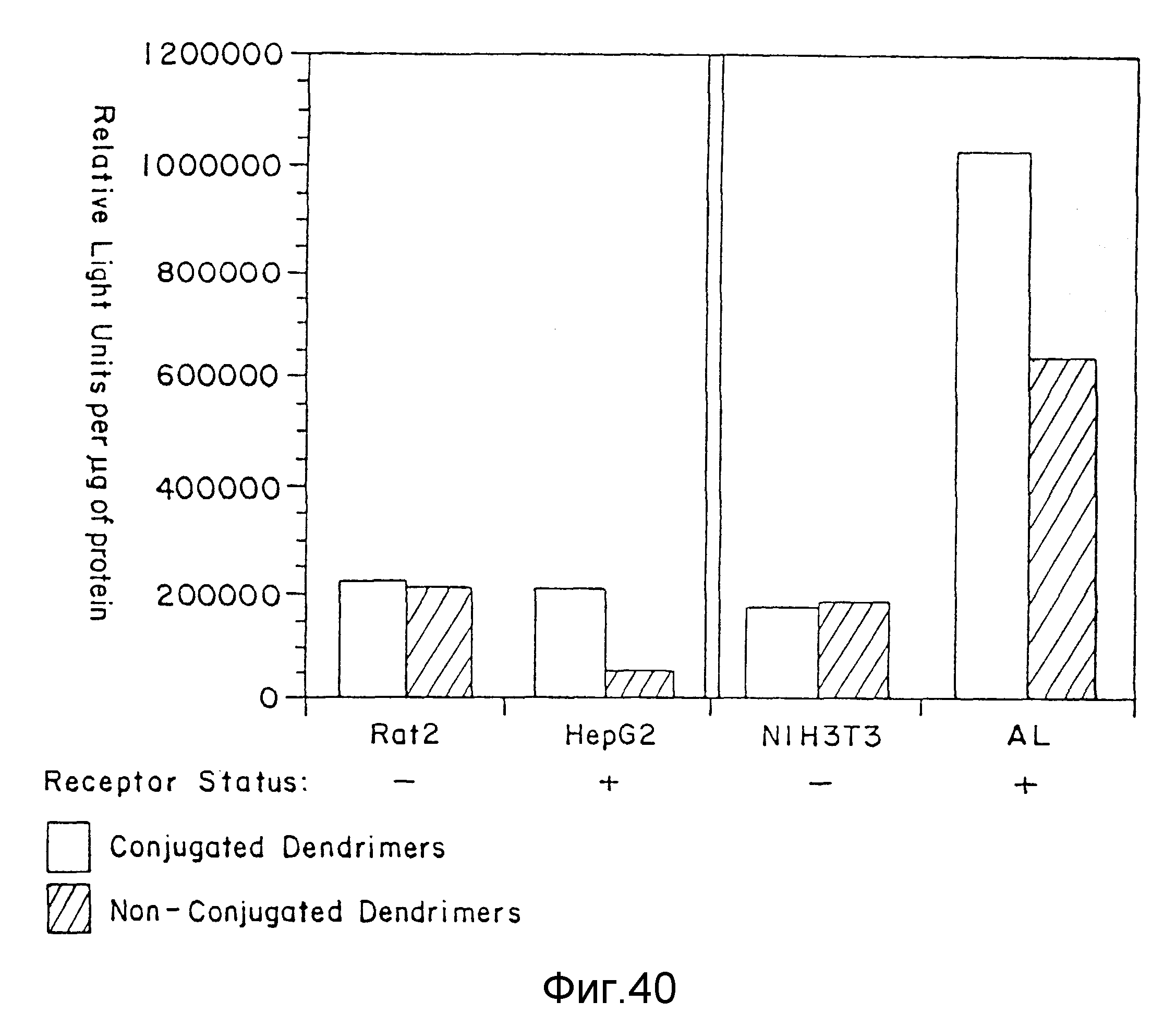
На фиг. 40 представлена эффективность трансфекции ASGPR целевой ДНК, образующей комплекс с конъюгированным с галактоза-трисахаридом дендримером, пример 65. На вертикальной оси представлены относительные световые единицы на мкг протеина, а на горизонтальной оси - клеточные линии и уровень рецептора. Незаштрихованные столбцы представляют конъюгированные дендримеры; а заштрихованные по диагонали столбцы представляют неконъюгированные дендримеры.
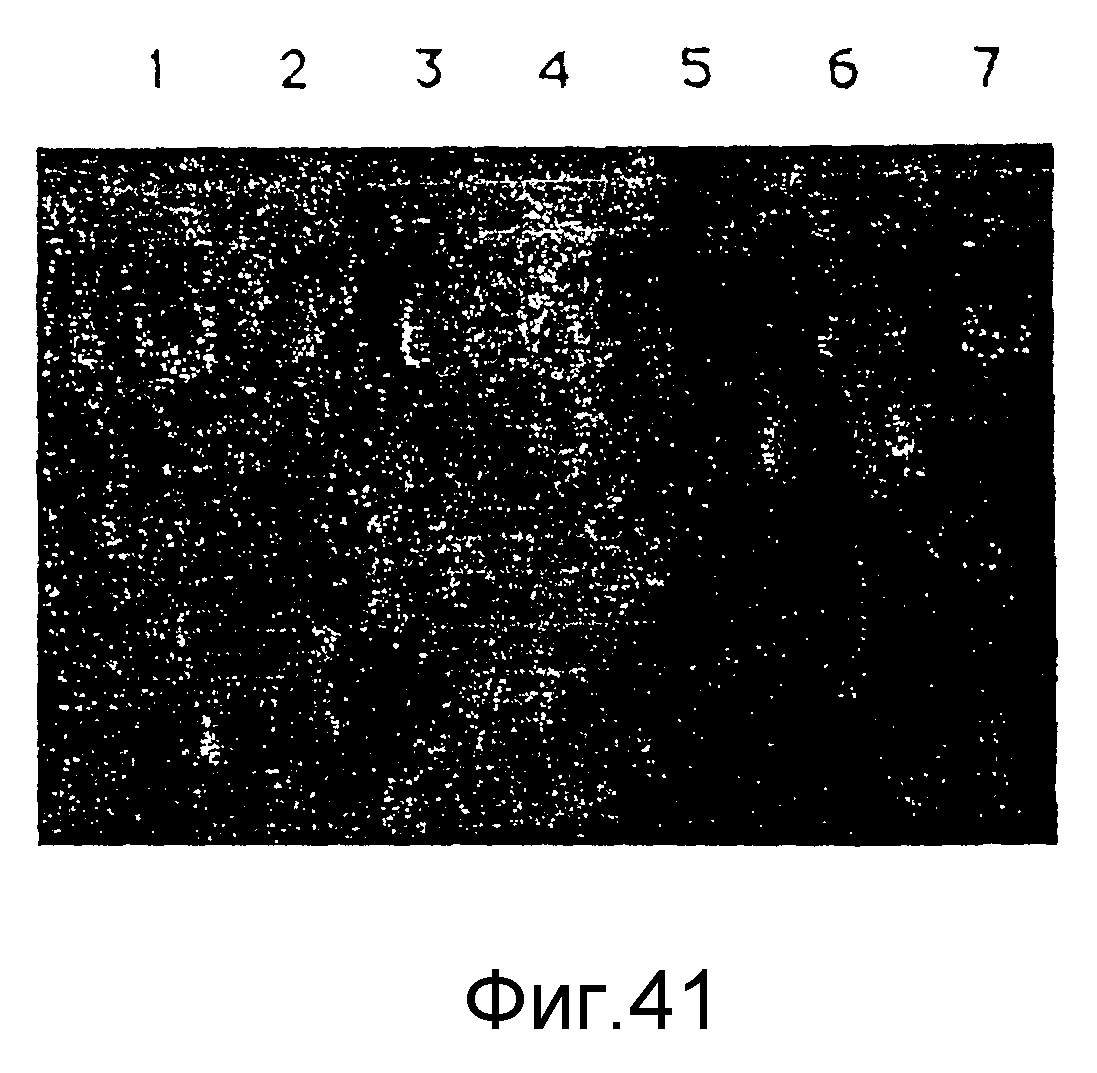
На фиг. 41 представлен электрофоретический гель, иллюстрирующий соединительную с ДНК способность G11 (ЭДА) с и без галактоза-трисахарида, конъюгированного с ним, пример 65.
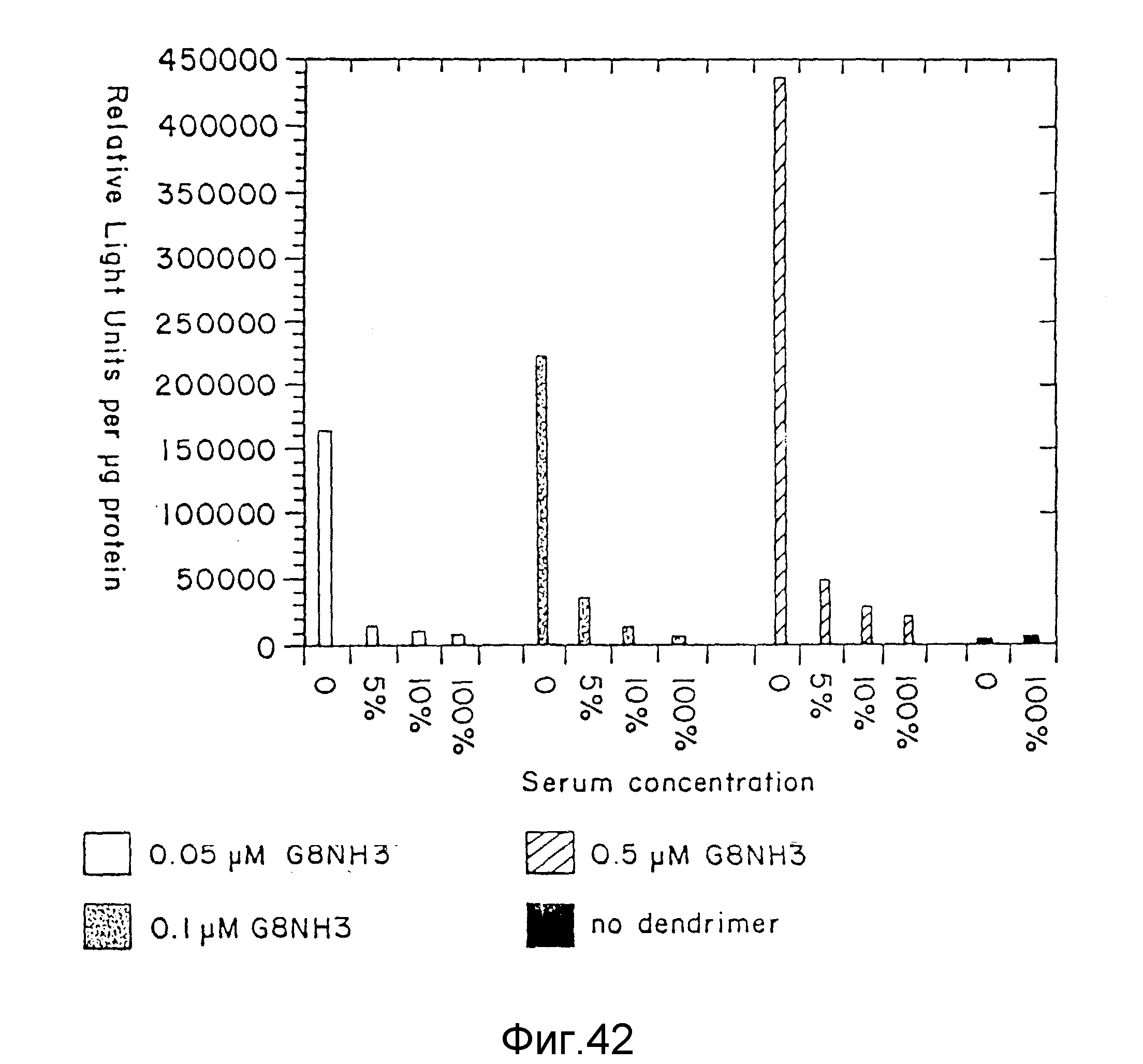
На фиг. 42 представлена эффективность трансфекции для комплекса ДНК с G8 (NH3)-дендримером при различных концентрациях дендримера и в различных концентрациях сыворотки, пример 66. На вертикальной оси указываются относительные единицы света на мкг протеина, а на горизонтальной оси - концентрация сыворотки. Незаштрихованные столбцы представляют 0,05 мкМ G8 (NH3)-дендримеры; в крапинку столбцы представляют 0,1 мкМ G8 (NH3)-дендримеры; заштрихованные по диагонали столбцы представляют 0,5 мкМ G8 (NH3 )-дендримеры; а затушеванные столбцы представляют недендример.
На фиг. 43 представлена эффективность трансфекции для комплексов ДНК с различными целевыми, нецелевыми и поверхностно-модифицированными дендримерами, пример 67. По вертикальной оси отложено процентное увеличение плазмидного контроля, а по горизонтальной оси - различные комплексы ДНК-дендример. Незаштрихованные столбцы соотношение зарядов ДНК:дендример = 1:1; затушеванные столбцы - соотношение зарядов ДНК:дендример = 1:5; и заштрихованные по диагонали столбцы - соотношение зарядов ДНК:дендример = 1:10.
На фиг. 44 представлена эффективность трансфекции для комплексов ДНК с дендримерами, где определяется экспрессия трансфекционных ДНК, пример 68. По вертикальной оси отложены относительные световые единицы на мкг протеина; а по горизонтальной оси - различные комплексы ДНК-дендример. Столбцы представляют время (часы) между трансфекцией и сбором выросших клеток. Незаштрихованные столбцы представляют 21 час, столбцы, заштрихованные по диагонали сверху вниз слева направо, представляют 45 часов; столбцы, заштрихованные сверху вниз справа налево, представляют 69 часов; а затушеванные столбцы представляют 141 час.
На фиг. 45 представлена цитотоксичность в клеточной линии RAT-2 G8 (NH3)дендримеров и G8 (ЭДА) дендримеров с и без ДНК и с и без присутствия DEAE-декстрана, пример 69. По вертикальной оси отложено процентное содержание мертвых клеток; а по горизонтальной оси - концентрация дендримера на левом сегменте и концентрация дендример-DEAE-декстрана на правом сегменте. Незаштрихованные столбцы представляют G8 (ЭДА) дендример, а заштрихованные по диагонали столбцы представляют G8 (NH3) дендример.
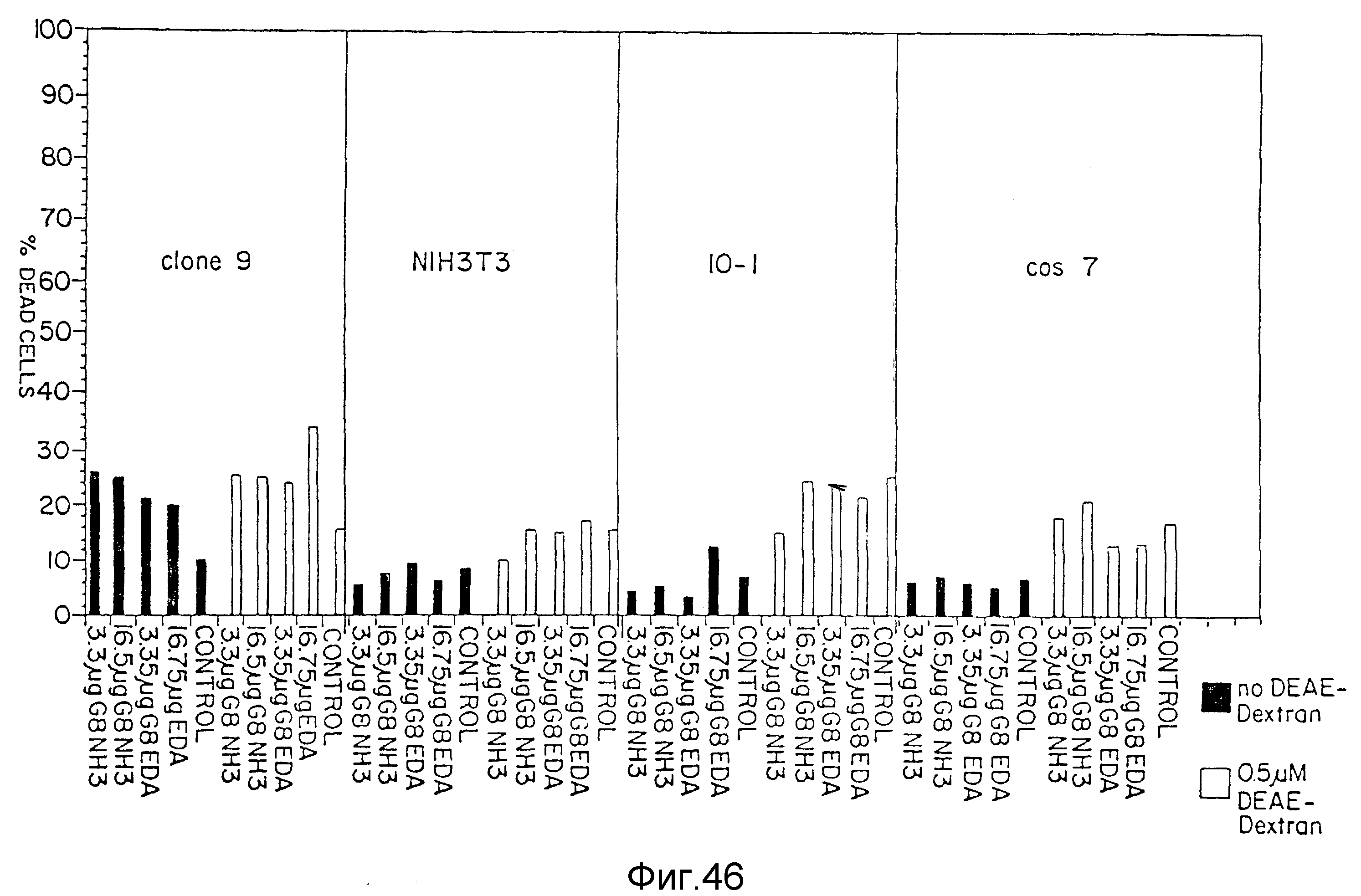
На фиг. 46 представлена цитотоксичность G8 (NH3) дендримеров и G8 (ЭДА) дендримеров в различных клеточных линиях, пример 69. На вертикальной оси отложено процентное содержание отмерших клеток, а на горизонтальной оси - концентрация различных испытываемых дендримеров. Незатушеванные столбцы представляют не-DEAE-декстран, а затушеванные столбцы представляют 0,5 мкМ DEAE-декстран. Используемыми клеточными линиями (смотри сегменты слева направо) являются Clone9, NlH 3T3, 10-1 и COS7.
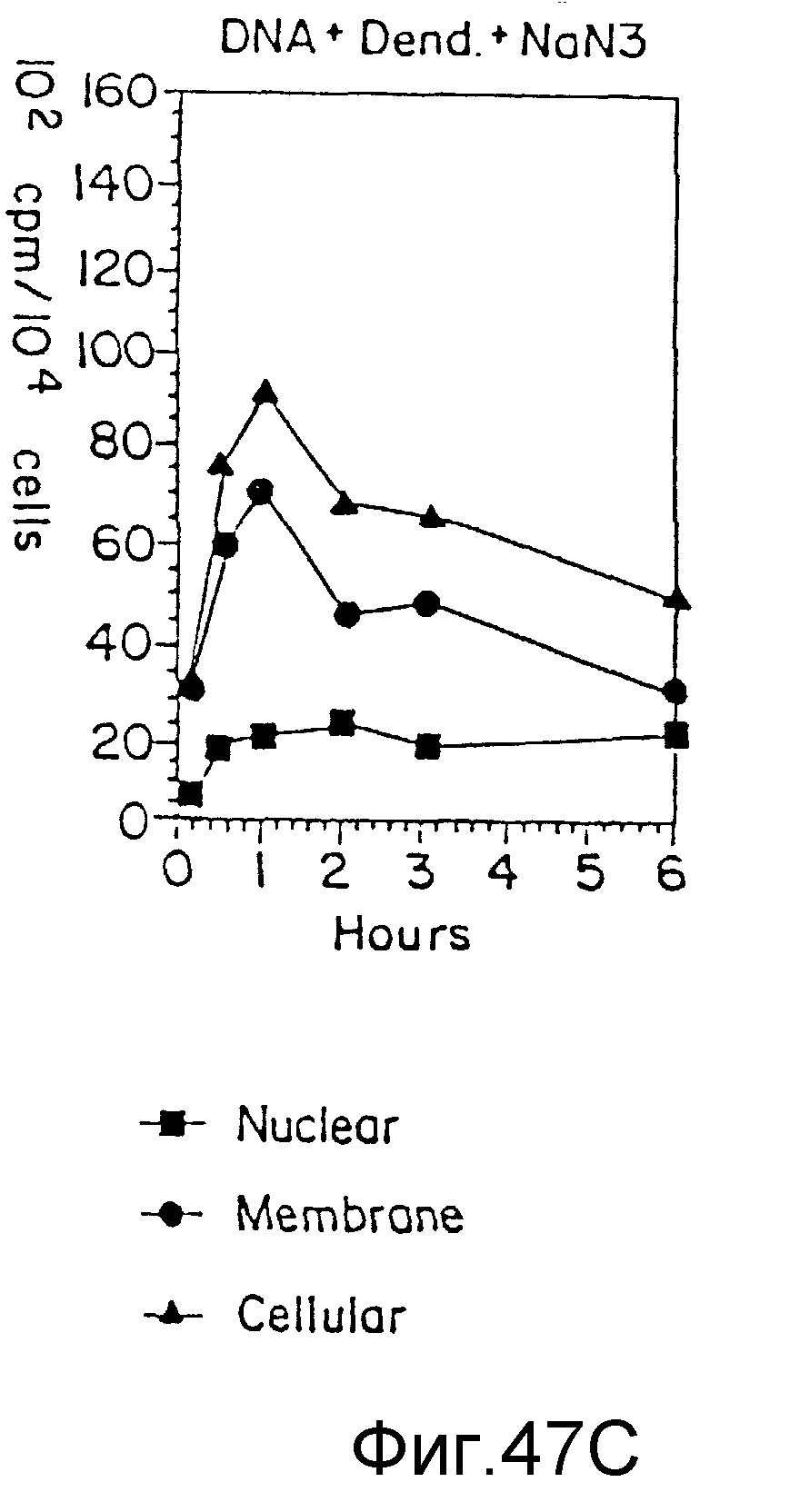
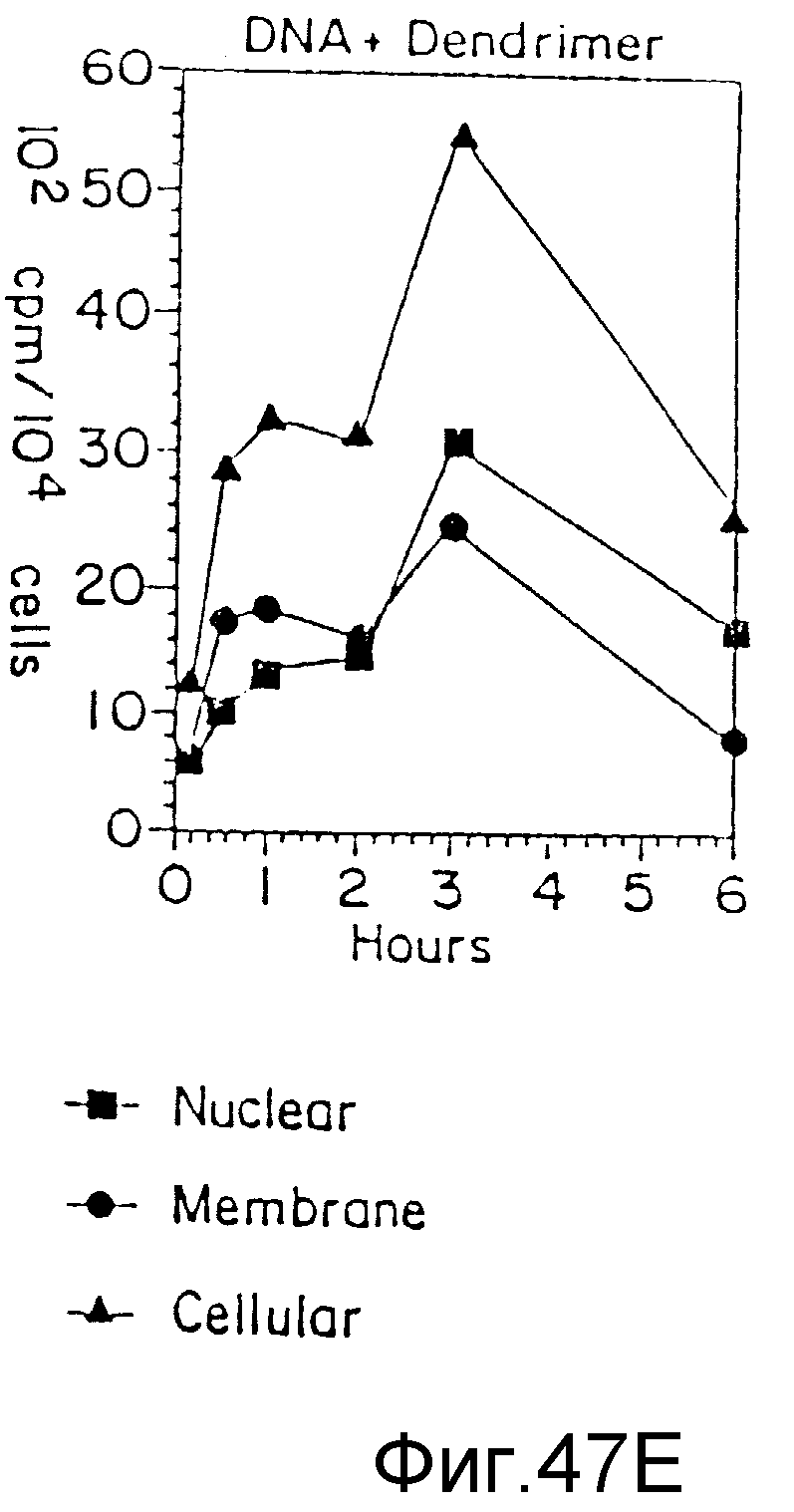
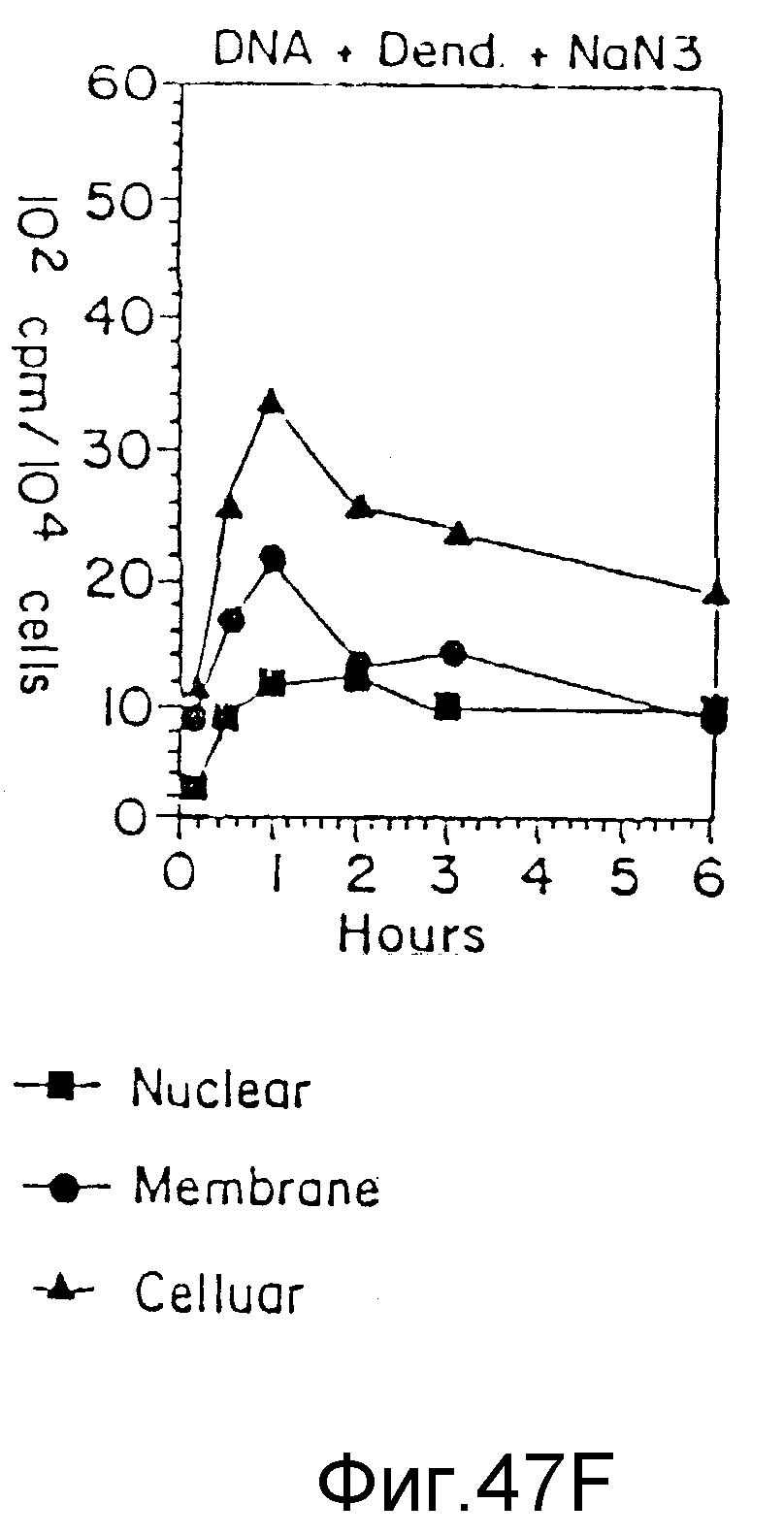
На фиг. 47 (A) - (F) представлено клеточное поглощение и локализация ДНК в двух различных клеточных линиях, часть из которых была трансфекцирована без дендримера, часть - с дендримером, а часть с дендримером в присутствии азида натрия, пример 70. На вертикальной оси все цифры указывают клеточное поглощение в 102 спм/104 клеток, а на нижней горизонтальной оси - время (часы). На фигурах (A) - (C) представлены случаи с использованием U937-клеток, а на фигурах (D) - (F) - клетки PAT-2. Верхняя горизонтальная ось на фигурах (A) и (D) - только ДНК; на фигурах (B) и (E) - ДНК + дендример, а на фигурах (C) и (F) - ДНК + дендример + азид натрия. Затушеванные квадраты представляют ядро, затушеванные кружки представляют мембрану, а затушеванные треугольники - клеточные фракции.
На фиг. 48 (A) и (B) представлены фотографии клеток, часть из которых успешно транфекцирована RSV-IacZ. ДНК, что выражает β- галактозидазаэнзим, пример 71.
Фиг. 49 аналогична фиг. 48, за исключением того, что представляет увеличенную фотографию и используется 3 мкг/испытат. гнездо RSV-IacZ-плазмиды, пример 71.
Фиг. 50 (A) и (B) аналогична фиг. 48, за исключением того, что используются фибробластовые клетки RAT-2, и сравниваются трансфекцированные клетки при (A) с нетрансфекцированными клетками при (B), пример 71.
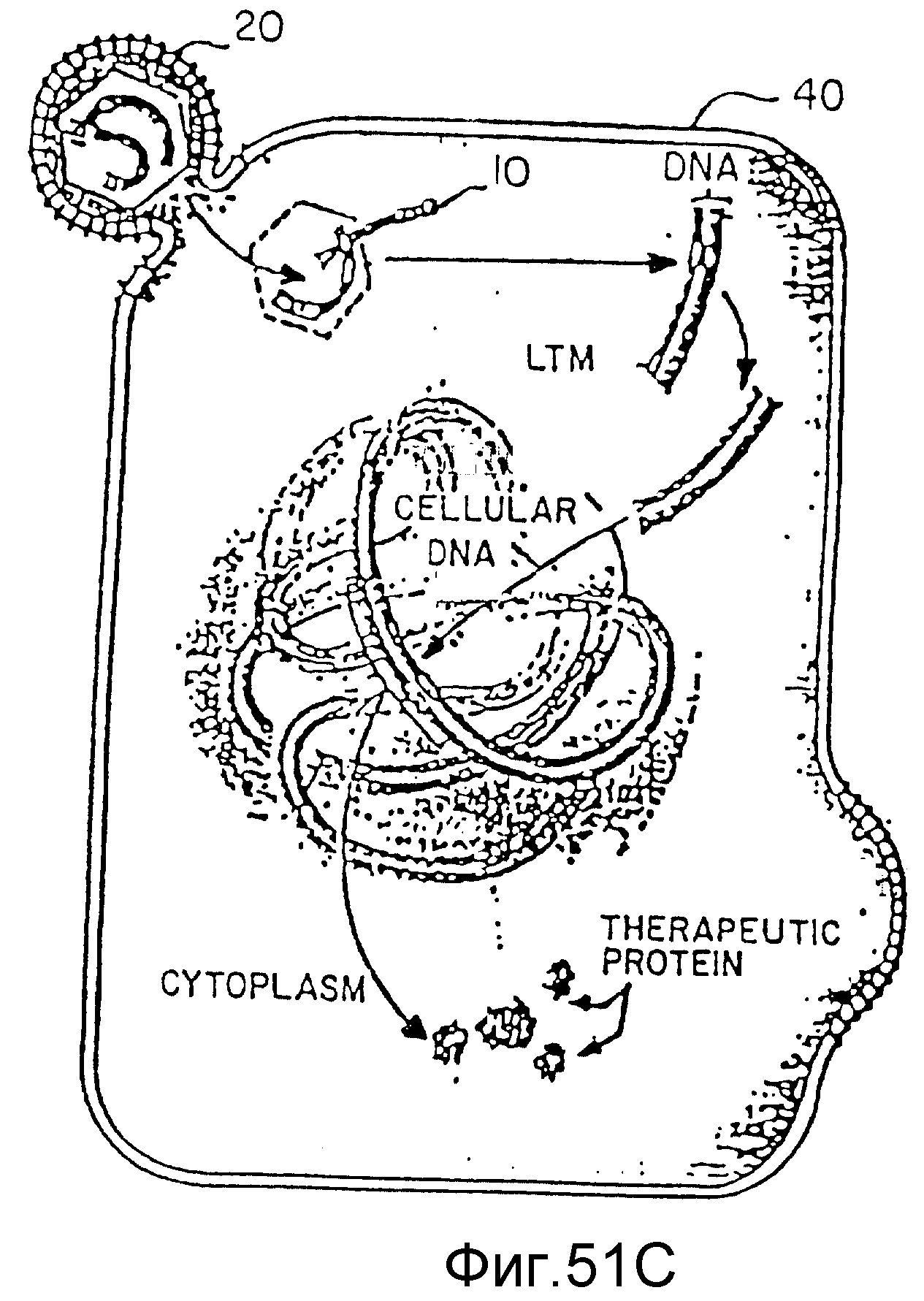
На фиг. 51 (A) - (C) показан процесс трансфекции генетического материала.
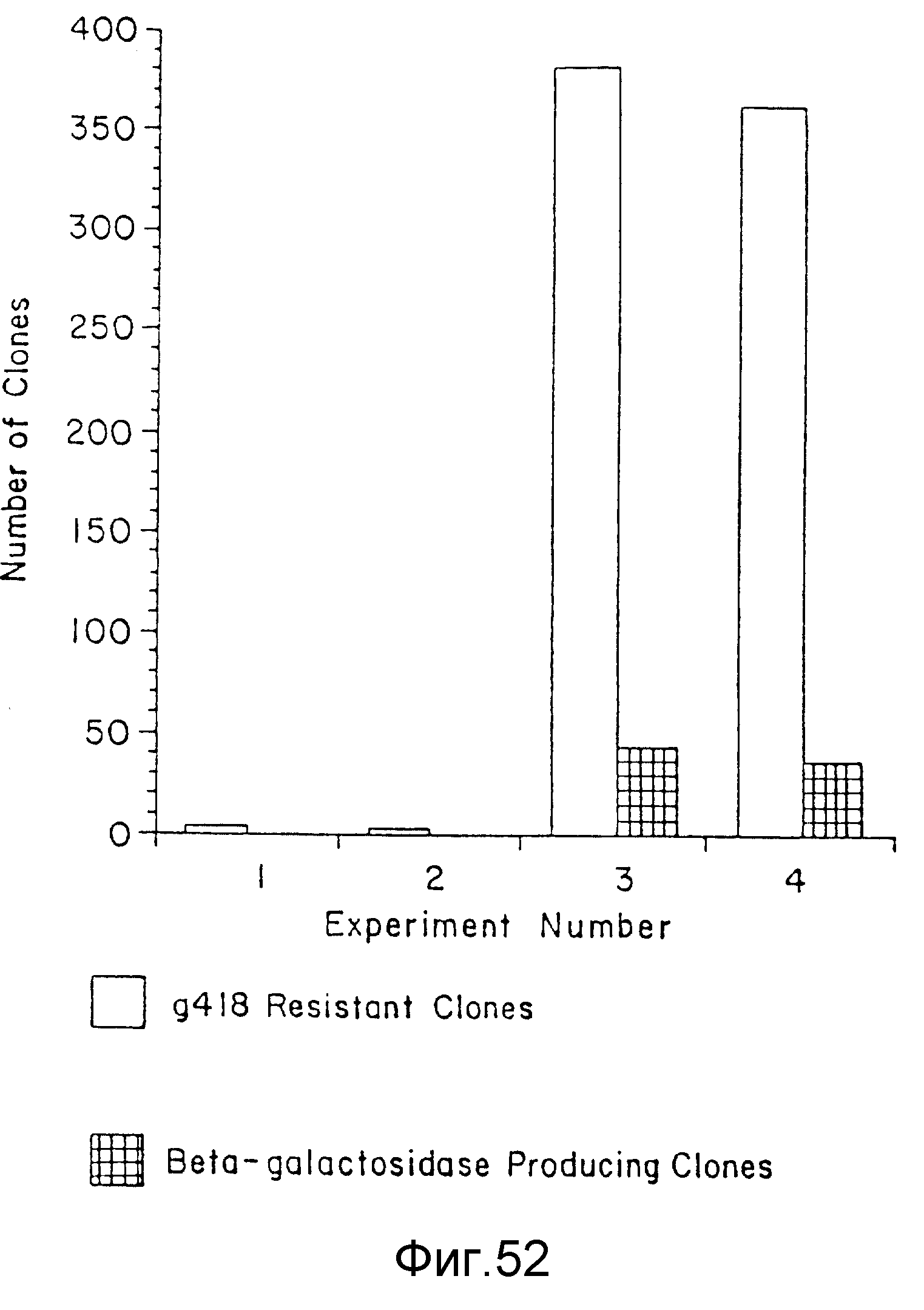
На фиг. 52 представлен ряд клонов, полученных из D5-клеток, трансфекцированных RSV-β-gal-NEO- плизмидой. Невосприимчивые клеточные клоны были отобраны генетицин (G418)-антибиотиком (Gibco/BRL), после чего была осуществлена трансфекция с использованием нескольких различных способов, включая заявленный в данном изобретении, пример 72. На вертикальной оси указаны номера клонов, а числа на горизонтальной оси являются числами из примера 72, идентифицирующими количества ДНК и условия трансфекции для таких образцов. Незаштрихованные столбцы представляют невосприимчивые G418-клоны; а заштрихованные столбцы представляют продуцирующие β - галактозидазаэнзим клоны.
На фиг. 53 сравнивается ряд клонов, полученных из клеток RAT-2, трансфекцированных RSV-β-gal-NEO- плазмидой, с использованием нескольких различных способов, включая заявленный в данном изобретении, пример 72. Клоны были отобраны генетицином (G-418) на невосприимчивость к неомицину, и затем была определена их β- галактозидаза-активность. На вертикальной оси указаны номера клонов, а числа на горизонтальной оси являются номерами образцов из примера 72 для количества ДНК и условий трансфекции для таких образцов. Незаштрихованные столбцы представляют G418 невосприимчивые клоны; а заштрихованные по диагонали столбцы β - галактозидаза-выражающие клоны.
На фиг. 54 показано получение постоянно трансфекцированных MSU 1,2 клетки EBV-A ДНК-плазмидой. На вертикальной оси показаны невосприимчивые к гигромицину B колонии на 1• 106 клеток, а по горизонтальной оси - номера образцов (как представлено в примере 72).
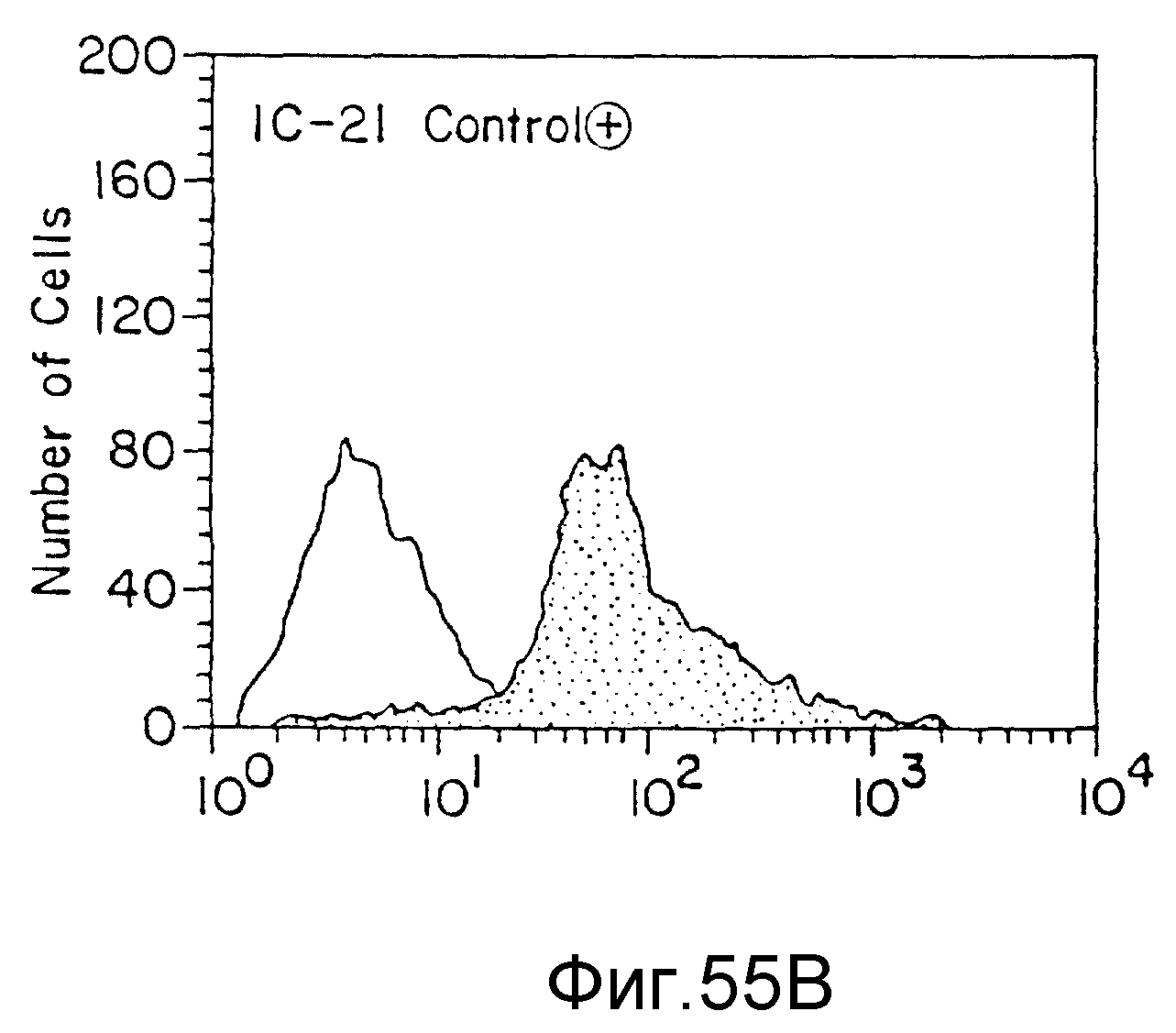
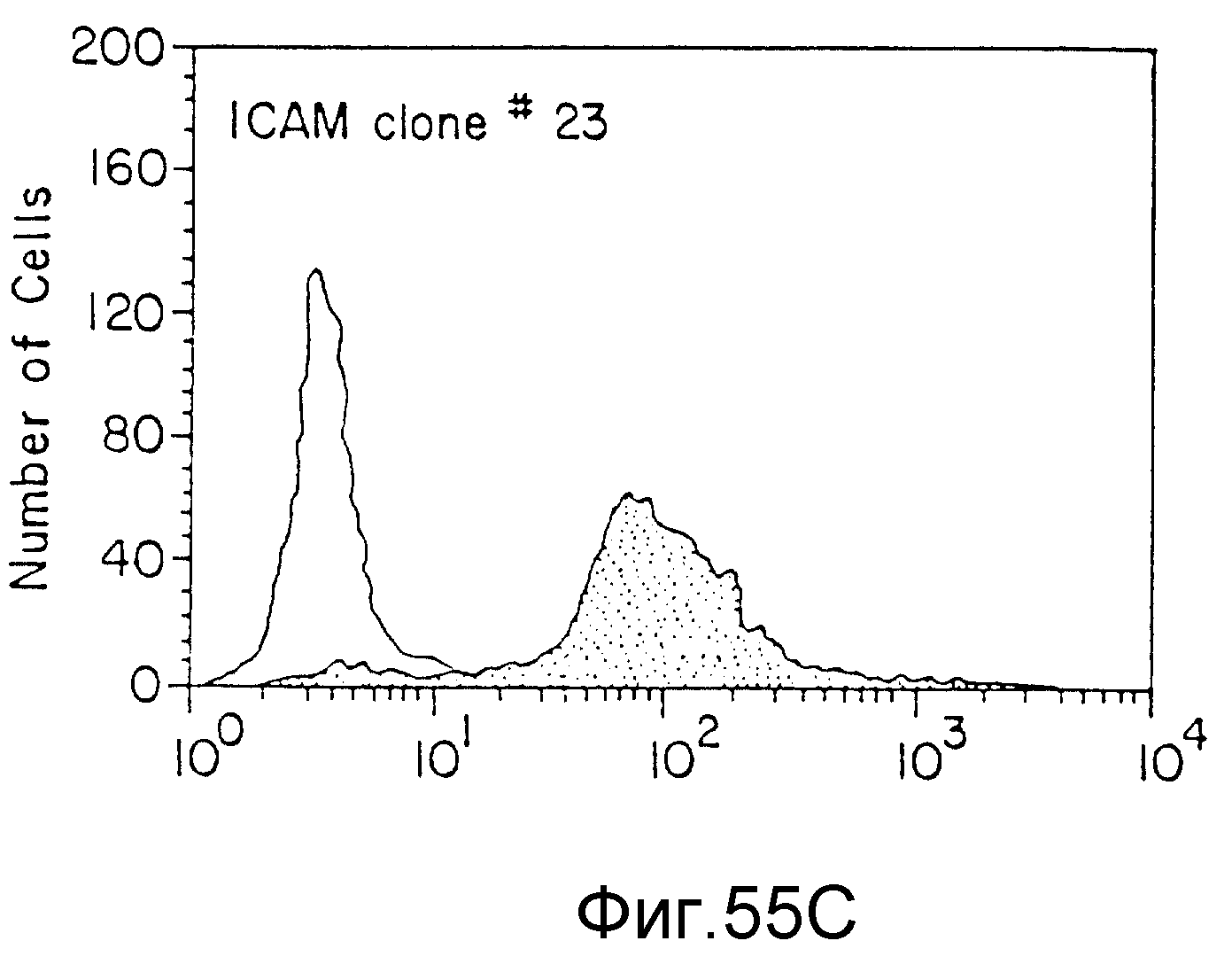
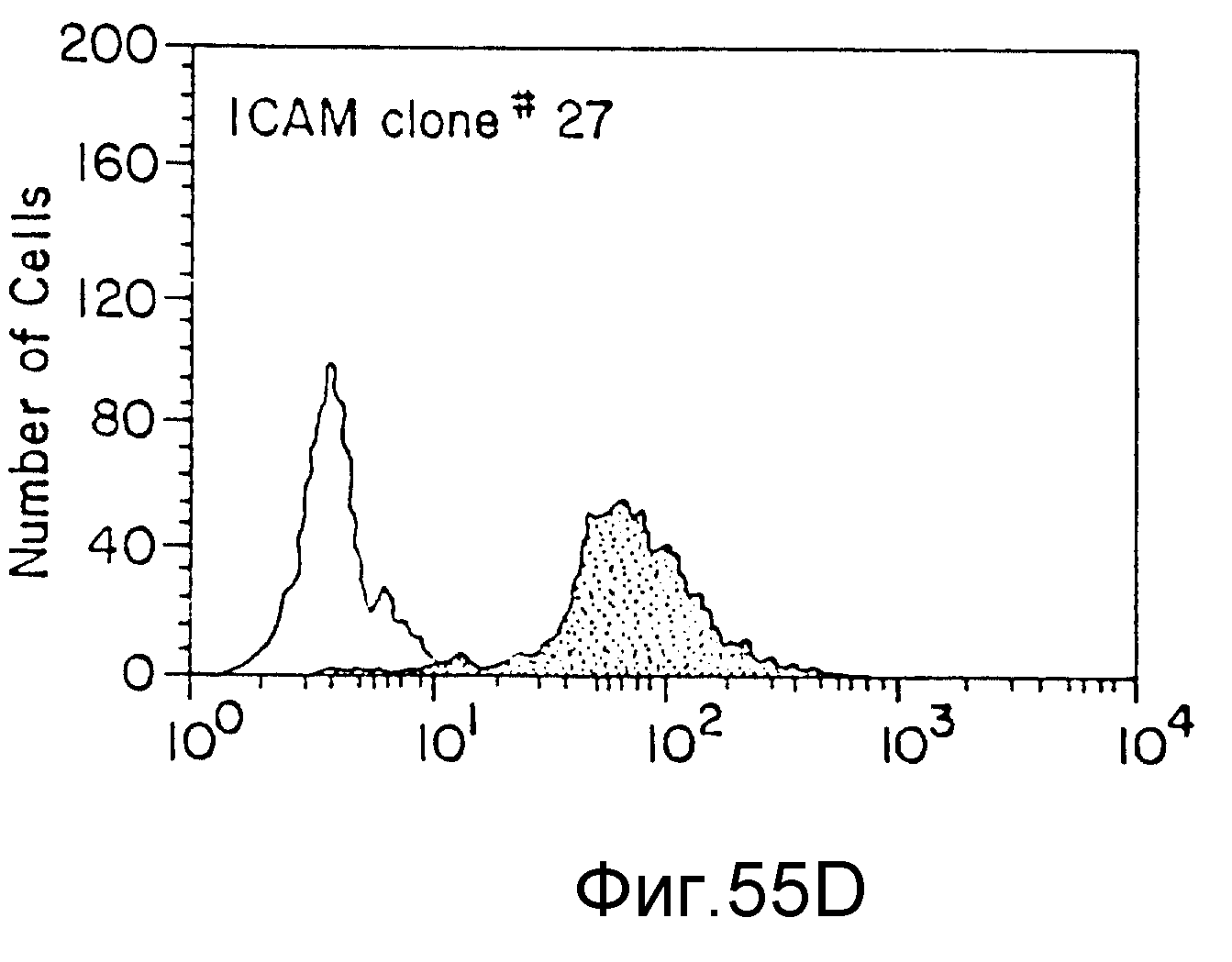
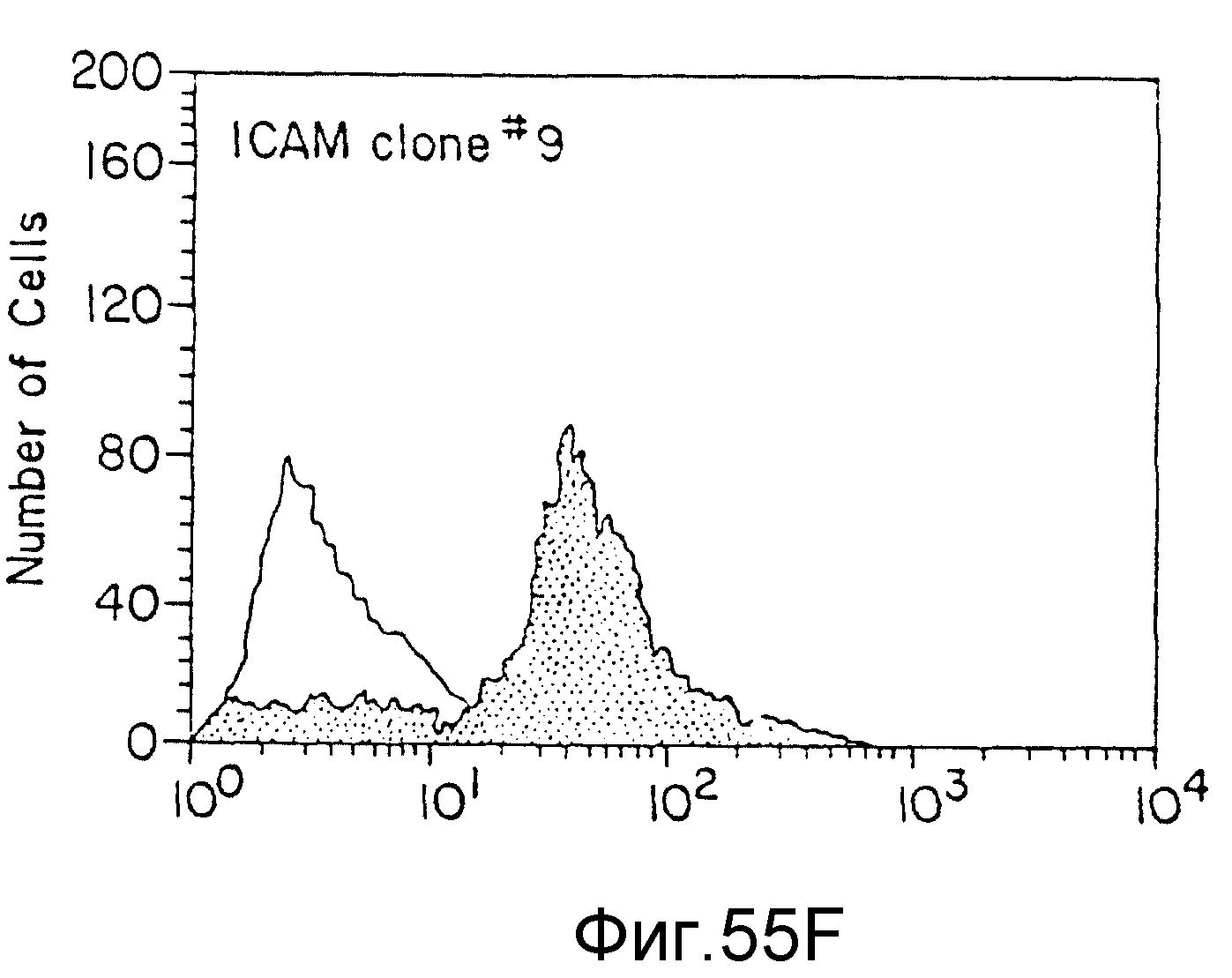
На фиг. 55 представлены данные FACS-анализа (флюоресценция) различных клеточных клонов, трансфекцированных JCAM-экспрессия-плазмидой. На всех фигурах по вертикальной оси указано число клеток, а по горизонтальной оси - количество выраженных JCAM (флюоресценция), пример 72.
На фиг. 56 показана ЛЮЦИФЕРАЗА (LUCIFERASE) - активность в клетках RAT-2 после трансфекции pH -контролируемым дендримерным агрегатом при соотношении зарядов ДНК: дендример = 1:10. По вертикальной оси отложены относительные световые единицы на мкг протеина. На горизонтальной оси указаны номера образцов, использованных в опыте, пример 74.
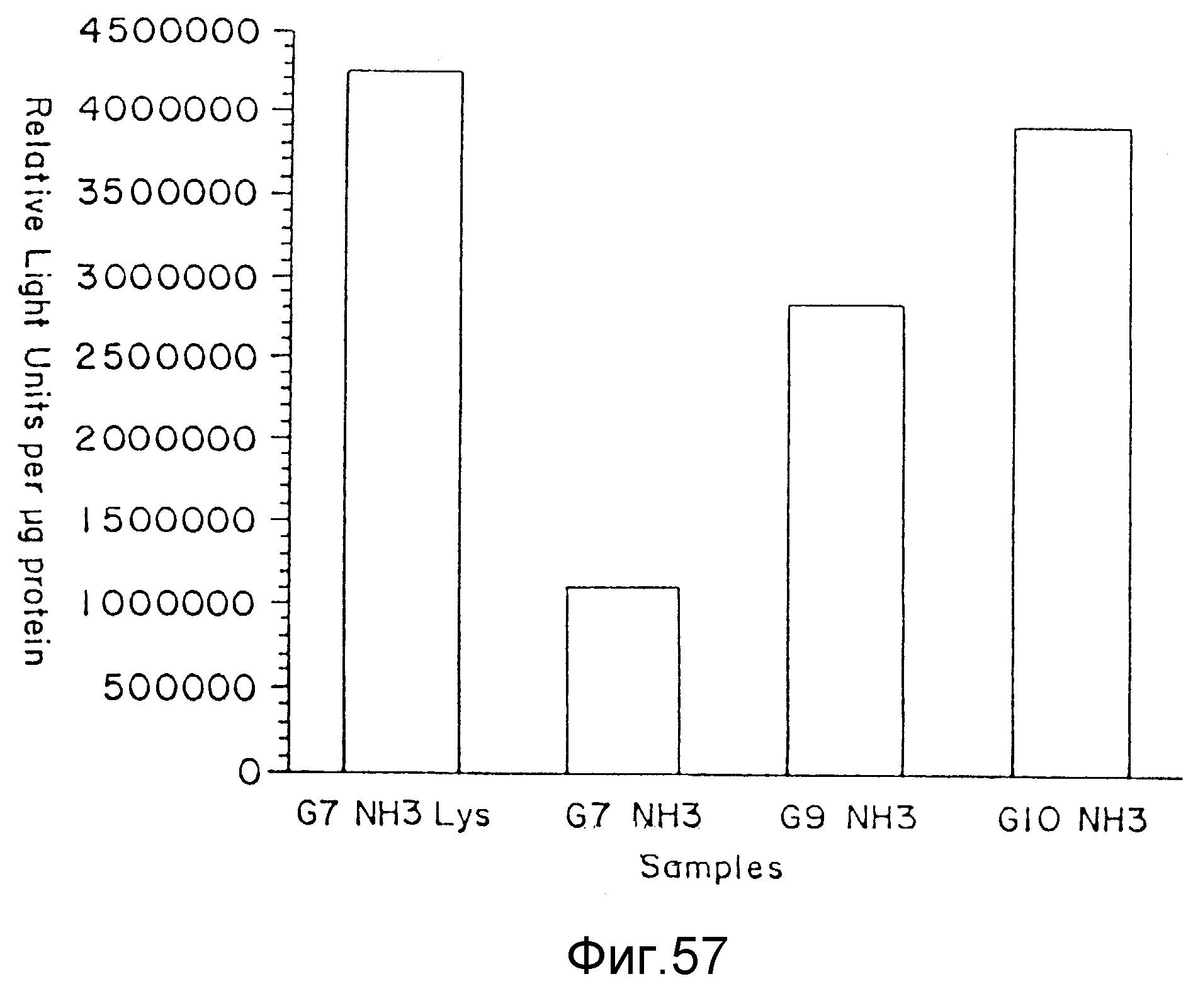
На фиг. 57 показана ЛЮЦИФЕРАЗА (LUCIFERASE) - активность в клетках RAT-2 после трансфекции с использованием лизин-модифицированных дендримеров и немодифицированных дендримеров, в обоих случаях в присутствии DEAE-декстрана при соотношении зарядов ДНК:дендример = 1:10. На вертикальной оси отложены относительные световые единицы на мкг протеина, а на горизонтальной оси указаны образцы, использованные в опыте, пример 75.
На фиг. 58 представлены результаты трансфекции для двух линий клеток (COS2 и RAT2), трансфекцированных различными дендримерами, полидисперсными дендримерами и другими трансфекцирующими агентами. На вертикальной оси указаны относительные световые единицы на 3 мкг клеточного протеина, а на горизонтальной оси - номера образцов и соотношения зарядов для различных использованных трансфекцирующих агентов, пример 76.
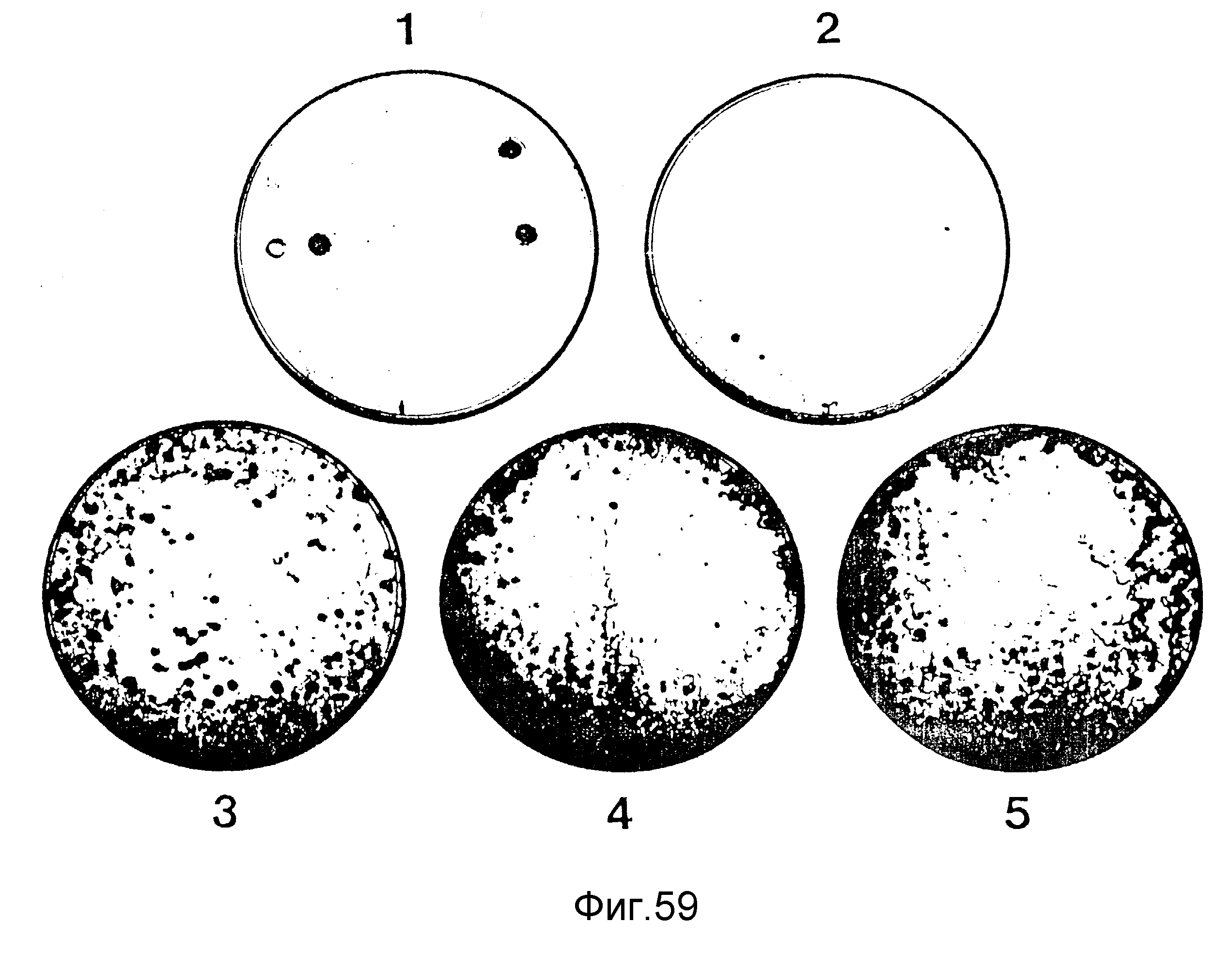
На фиг. 59 представлены
фотографии культур окрашенных клеток из 5 клеток меланомы мыши, родительские клетки
которых были
трансфекцированы RSV-β-gal- плазмида-ДНК. Устойчивые трансформанты (колонии) отбираются с
использованием G418 (пример 72). Носителями трансфекции, использованными в родительских
клетках, в
каждой из перечисленных культур являются:
1. 10 мкмг ДНК с фосфатом кальция,
2. 10
мкг ДНК с DEAE-декстраном,
3. 5 мкг ДНК с 0,5 мкМ G8 (NH3),
4. 10
мкг ДНК с 0,5 мкМ G8 (NH3),
5. 5 мкг ДНК с 0,2 мкМ G8 (NH3).
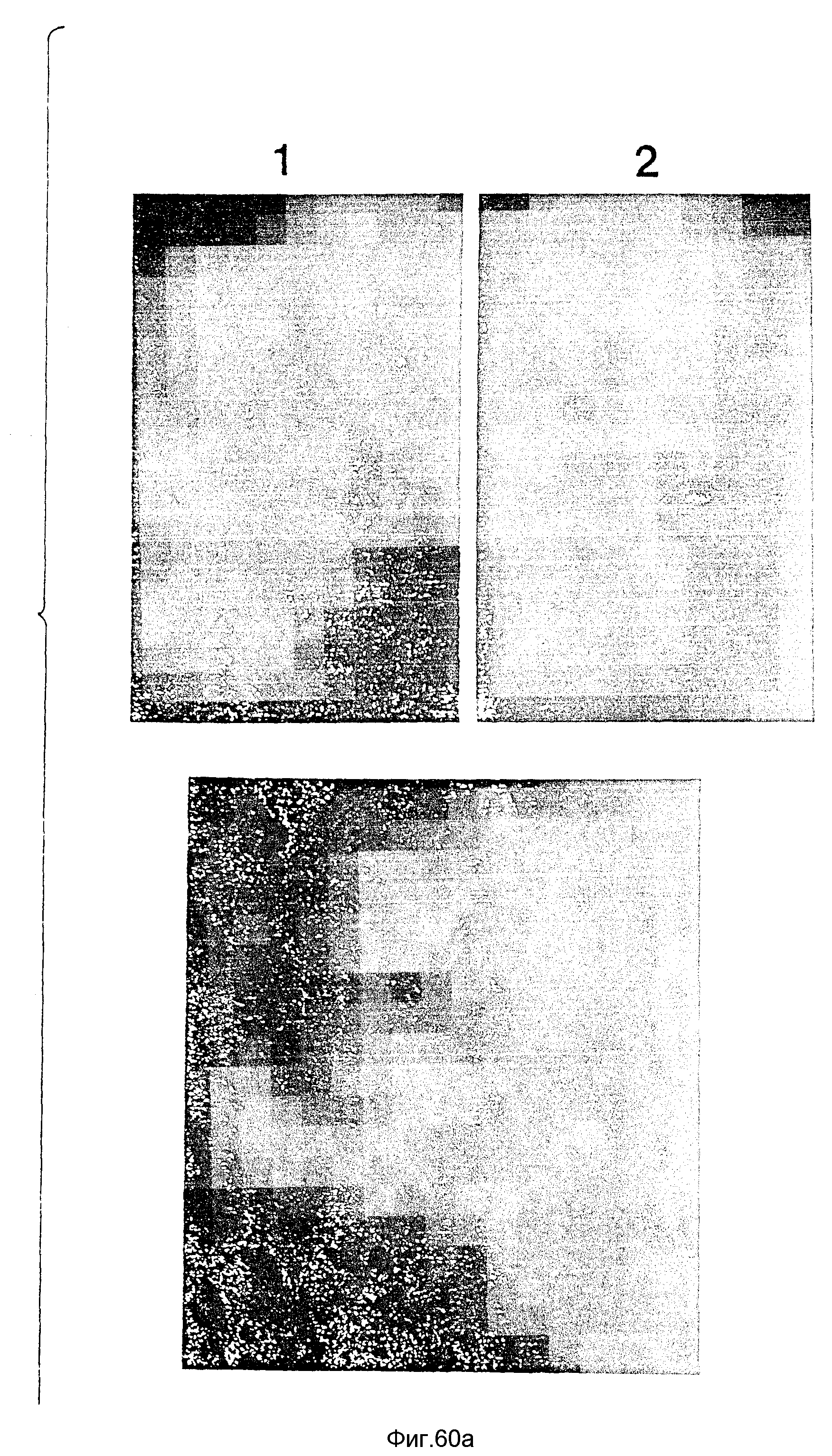
На фиг. 60 представлены различные нижеперечисленные снимки.
Снимок 1 является микрофотографией срезов ткани D5 опухоли меланома мыши, инъецированных in vivo 10 мкг RSV-β-gal плазмида-ДНК в комплексе с G11 (ЭДА) дендримером при соотношении зарядов ДНК:дендример = 1:10. Успешная трансфекция опухолевых клеток осуществляется в присутствии D5 клеток, выражающих β-gal, что подтверждается темной (голубой) окраской, видимой на снимке 1, пример 77.
Снимок 2 является микрофотографией контрольного образца ткани со снимка 1, где D5 опухоль меланомы мыши была инъецирована только G11 (ЭДА) дендримером, пример 77.
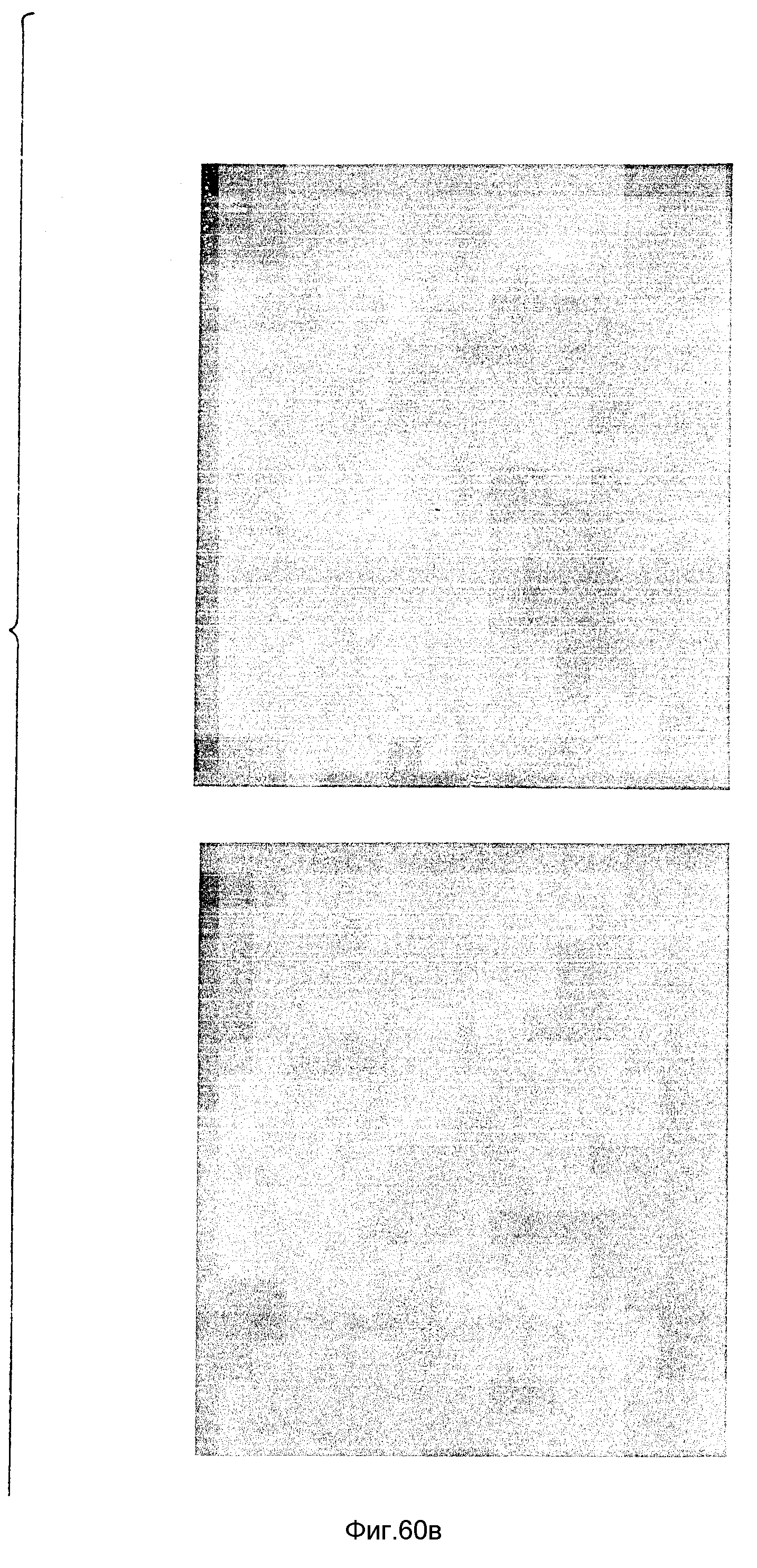
Снимки 3, 4 и 5 являются электронными микрофотографиями следующих ДНК: дендример-комплексов, пример 43.
Снимок 3 - ДНК с G11 (ЭДА) дендримером при соотношении зарядов ДНК:дендример = 1:10.
Снимок 4 - такой же, как снимок 3, но с последующим присоединением DEAE-декстрана.
Снимок 5 - ДНК с полидисперсного размера смесью дендримеров при соотношении зарядов ДНК:дендример = 1:10.
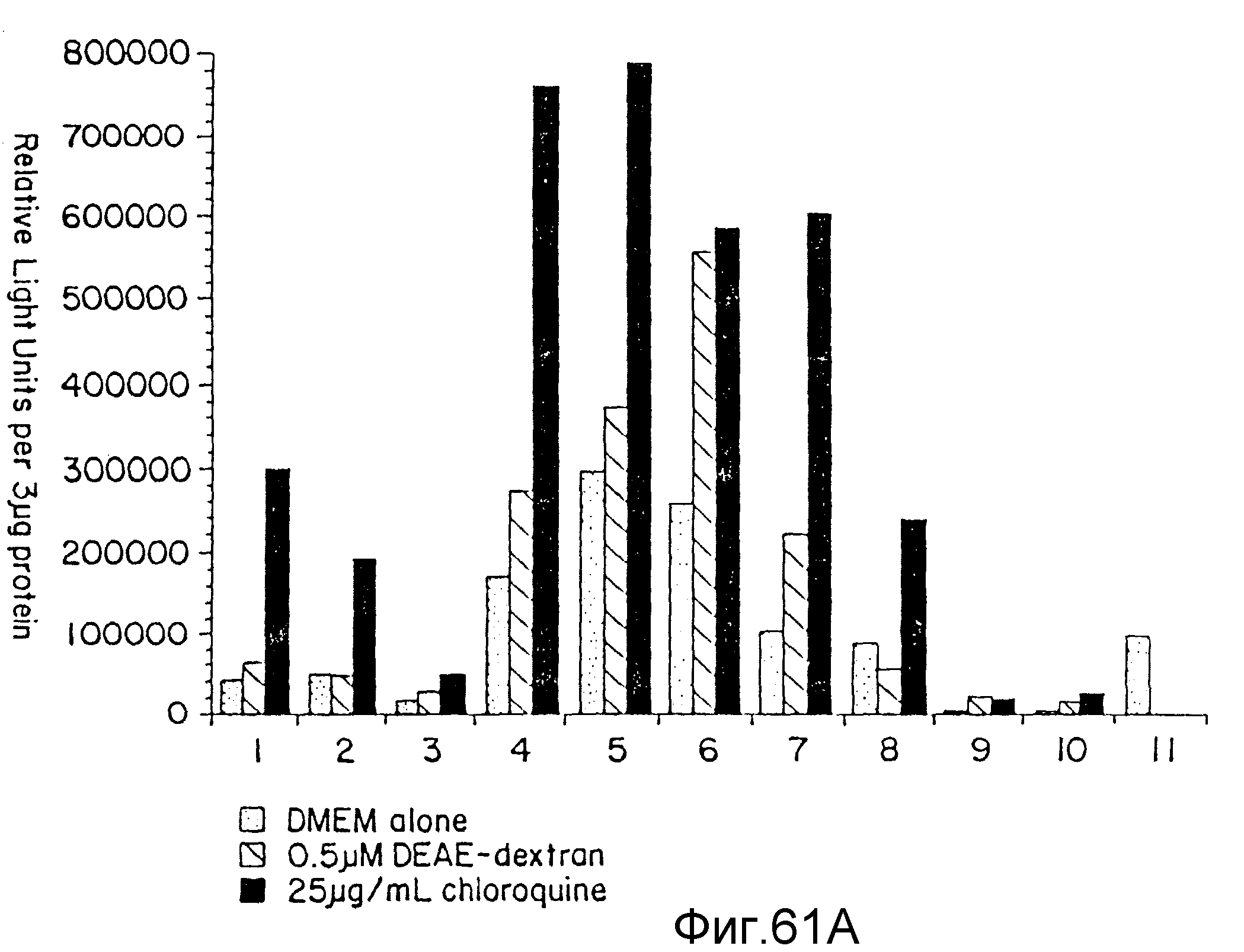
На фиг. 61A и 61B дается сравнение трансфекции при использовании плотных звездчатых дендримеров или их комбинаций при различных соотношениях и при трех различных условиях: трансфекции с использованием только одного комплекса генетический материал:дендример (столбцы в крапинку); те же самые комплексы генетический материал:дендример в присутствии EAE-декстрана (столбцы с диагональной, штриховкой); и те же комплексы генетический материал:дендример в присутствии хлорохина (затушеванные столбцы). Представленные на фиг. 61A данные показывают, что COS1-клетки были трансфекцированы RAT2-клетки. На вертикальной оси указаны относительные световые единицы на 3 мкг протеина. Цифры на горизонтальной оси указывают номера образцов комплексов генетический материал:дендример из примера 73.
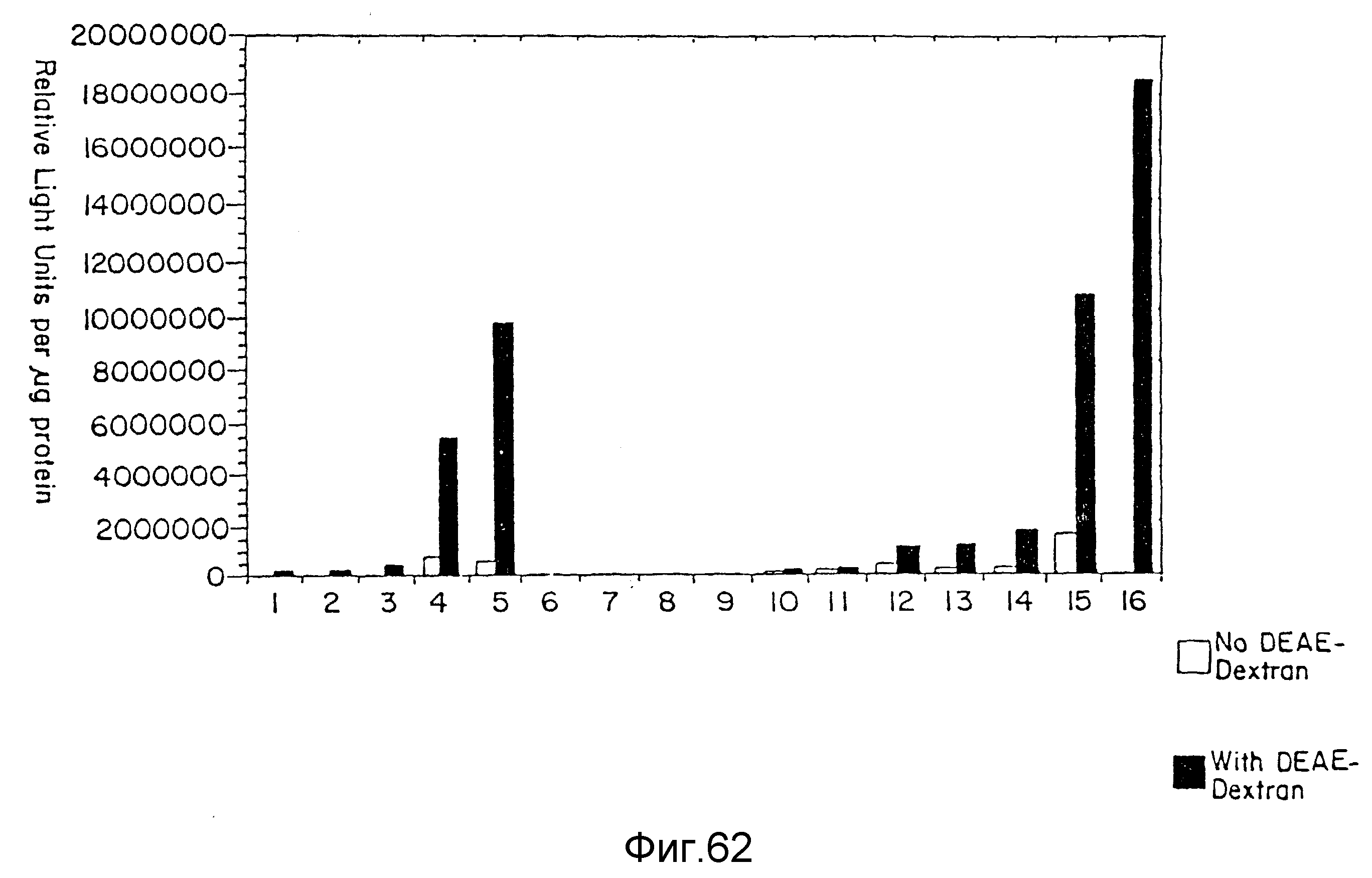
На фиг. 62 дается сравнение трансфекции с использованием несимметрично разветвленных дендримеров на основе лизина с трансфекцией с использованием плотных звездчатых дендримеров, пример 78. На вертикальной оси указаны относительные световые единицы на мкг протеина, а на горизонтальной оси - использованный дендример. Незатушеванные столбцы представляют образцы без DEAE-декстрана, а затушеванные образцы с DEAE-декстраном.
Подробное описание изобретения
Плотные звездчатые полимеры
иллюстрируются фиг. 1, где 1 в
кружке (здесь "ядро (1)") представляет ядро инициатора (на данной
фигуре ядро трехфункционального инициатора показано на рисунке слева); Z - представляет концевую
группу в первом случае вторым
рисунком слева, что относится к звездчатому разветвленному олигомеру; A,
B, C, D и E представляют частные молекулярные генерации плотных звездчатых дендримеров; а
(A)n, (B)n,
(C)n, (D)n и (E)n представляют плотные
звездчатые мостиковые дендримеры.
Плотные звездчатые дендримеры являются мономолекулярными сборными образованиями, которые имеют три различающихся признака строения, а именно, (a) ядро инициатора, (b) внутренние слои (генерации, G или Gen), состоящие из повторяющихся единиц, радиально присоединенных к ядру инициатора, и (c) наружная поверхность с концевой функциональностью (т.е., концевые функциональные группы), присоединенной к самой наружной генерации. Размер и форма молекулы плотного звездчатого дендримера и функциональные группы, имеющиеся в молекуле, могут регулироваться выбором ядра инициатора, числа генераций (т. е. , ярусной структуры, которая образуется каждой генерацией, когда она развивается раньше следующей генерации), используемый в создании дендримера, и выбором повторяющихся единиц, используемых при каждой генерации. Поскольку дендримеры могут быть выделены при любой конкретной генерации, предусматривается средство для получения дендримеров, имеющих требуемые свойства. Для того чтобы получить свойства плотного звездчатого дендримера, должны присутствовать все три вышеуказанные характеристики строения. Эти характеристики рассматриваются дополнительно в работе Petar R.Dvornic and Donald A.Tomalia, Chem. in Britain, 641-645, август 1994. Как используется в данной заявке, дендримеры могут обозначаться их числом генераций и используемым ядром инициатора, например G7 (ЭДА)дендример.
Выбор компонентов плотных звездчатых дендримеров влияет на свойства дендримеров. Тип ядра инициатора может влиять на форму дендримера, давая (в зависимости от выбора ядра инициатора), например, сфероидообразные дендримеры, цилиндрические или стержнеобразные дендримеры, эллипсоидообразные дендримеры или грибообразные дендримеры. Последовательное строение генераций (т. е. число генераций и размер и природа повторяющихся единиц) определяет размеры дендримеров и природу их внутреннего содержания.
Поскольку плотные звездчатые дендримеры являются разветвленными полимерами, содержащими дендритные ответвления, имеющие функциональные группы, распределенные по периферии ответвлений, они могут быть получены с целым рядом свойств. Например, макромолекулы, изображенные на фиг. 2A (такие как у Denkewalter Патент США 4289972), и настоящие плотные звездчатые дендримеры, такие как изображенные на фиг. 2B, имеют явно различающиеся свойства благодаря длине ветвей. Дендример типа, показанного на фиг. 2A, обладает несимметричными разветвленными соединениями (с неравными сегментами), наружными (т. е. поверхностными) группами (представленными Z') и внутренними остатками (представленными Z), но намного меньше внутренним свободным пространством (объемом). Предпочтительный тип дендримера, показанный на фиг. 2B, обладает симметричными (равносегментными) разветвленными соединениями с поверхностными группами (представленными Z'), двумя различными внутренними остатками (представленными, соответственно, X и Z) с внутренним свободным пространством (объемом), который изменяется как функция генерации (G). Дендримеры, такие, как показанные на фиг. 2B, могут развиваться через достаточное число генерации, чтобы иметь такой общий свободный объем, чтобы создать целое с предопределенной полой внутренней и высоко перекрытой поверхностью.
Это является ярусной структурой, которая является сущностью плотных звездчатых дендримеров в большей степени, чем элементарной композиции. Поэтому повторяющиеся единицы могут состоять из комбинации любых элементов, поскольку эти единицы обладают свойствами мультиплетности (множественности) и собираются в ярусную структуру, как описано здесь. Эти повторяющиеся единицы могут состоять полностью из элементов, которые обычно встречаются в полимерных структурах, таких как углерод, водород, кислород, сера, азот и кремний, или могут состоять из менее традиционных элементов, при условии, что эти повторяющиеся единицы обеспечивают создание (построение) стабильной разветвленной структуры. Например, известно в науке, что металлоиды и переходные металлы образуют стабильные ковалентные соединения и комплексы с органическими остатками. Эти стабильные ковалентные соединения и комплексы с органическими остатками могут существовать в виде разветвленных материалов, таких как, например, бораны, бораты, германы, станнаны и плюмбаны, или неразветвленных связей, таких как, например, диалкилцинк или ртутьдиалкил. Использование соответствующих лигандов может заставить переходный металл, такой как кобальт, функционировать как разветвляющая единица (при связывании трех отдельных лигандов) или неразветвленная связь (при связывании двух отдельных лигандов). Поэтому разветвленные структуры, соответствующие описанным здесь образцам и вводящие любой элемент, входят в объем настоящего изобретения.
Кроме того, плотные звездчатые дендримеры при развитии через достаточное число генераций имеют "плотную плотнозвездчатую упаковку", где поверхность дендримера содержит достаточно концевых остатков, так что поверхность дендримера становится перекрытой и закрывает свободный объем (поры) внутри дендримера. Это перекрытие может дать барьер молекулярного уровня, что может быть использовано для регулирования диффузии материалов внутрь и изнутри дендримера.
Химия поверхности дендримеров может регулироваться определенным образом выбором повторяющейся единицы, которая содержит нужную химическую функциональность, или химической модификацией всех или части поверхностных функциональностей с созданием новых поверхностных функциональностей. Например, эти поверхности могут быть либо нацеленными на отдельные участки, либо сделаться невосприимчивыми к поглощению отдельными органами или клетками, например клетками ретикулоэндогелия.
В альтернативном применении плотных звездчатых дендримеров дендримеры могут сами быть связаны вместе рядом способов (включенных в термин "ассоциированные") с созданием полидендритных остатков (плотнозвездчатые мостиковые дендримеры или дендримерные агрегаты) или агрегатов плотных звездчатых дендримеров, которые являются также пригодными в качестве носителей в конъюгатах.
Кроме того, дендримеры могут быть получены так, чтобы иметь отклонение от однородного разветвления в конкретных генерациях, обеспечивая, таким образом, средство придания дендримеру прерывистостей (т.е. отклонений от однородного разветвления конкретных местоположениях в дендримере) и различных свойств.
Плотные звездчатые полимеры, используемые в плотных звездчатых конъюгатах настоящего изобретения, могут быть получены известными в науке способами, например, согласно патенту США 4587329, содержание которого приводится поэтому в качестве ссылки. Полиаминные дендримеры могут быть получены взаимодействием аммиака или амина, имеющего множество первичных аминных групп или вторичных аминных групп, с N-замещенным азиридином, таким как N-тозил - или N-мезилазиридин, с образованием защищенной первой генерации полисульфонамида. Первая генерация полисульфонамида затем активируется кислотой, такой как серная, хлористоводородная, трифторуксусная, фторсульфоновая или хлорсульфоновая кислота, с образованием первой генерации полиамидной соли. Предпочтительно, десульфонирование выполняется с использованием сильной кислоты, которая является достаточно летучей, чтобы ее можно было удалить перегонкой, такая как хлористоводородная кислота. Первая генерация полиаминной соли затем может взаимодействовать дополнительно с N-защищенным азиридином с образованием защищенной второй генерации полисульфонамида. Последовательность может быть повторена с получением более высокой генерации полиаминов.
Полиамидоамины могут быть получены сначала взаимодействием аммиака (или амина, имеющего множество первичных и/или вторичных аминогрупп) с метилакрилатом в условиях, достаточных для осуществления присоединения Михаэля одной молекулы аммиака к трем молекулам метилакрилата с образованием аддукта ядра. После удаления непрореагировавшего метилакрилата это соединение взаимодействует с избытком этилендиамина в таких условиях, что одна аминогруппа молекулы этилендиамина реагирует с метилкарбоксилатными группами аддукта ядра с образованием аддукта первой генерации, имеющего три аминоаминных остатка. После удаления непрореагировавшего этилендиамина этот аддукт первой генерации затем реагирует с избытком метилакрилата в условиях присоединения Михаэля с образованием аддукта второй генерации, имеющего концевые метил (сложные эфирные) остатки. Аддукт второй генерации затем взаимодействует с избытком этилендиамина в условиях образования амида с получением требуемого полиамидоаминного дендримера, имеющего регулярные разветвления дендрита второй генерации с концевыми аминными остатками. Подобные дендримеры, содержащие амидоаминные остатки могут быть получены при использовании органических аминов в качестве соединения ядра, например этилендиамина, который дает дендример с четырьмя разветвлениями, или диэтилентриамина, который дает дендример с пятью разветвлениями.
Для получения безводных плотных звездчатых этиленаиминов, после кислотного расщепления сульфонамидных связей, может быть добавлен растворитель, который образует азеотроп с водой, такой как бензол, толуол, ксилол или мезитилен, предпочтительно, толуол, и полученный азеотроп вода/растворитель удаляется азеотропной дистилляцией, как при нагревании до температуры дефлегмации с удалением воды, выполненным с помощью ловушки Дин-Старка. Альтернативно, на стадии сушки могут быть использованы хлорированные растворители, в которых растворяется безводный полиэтиленимин, такие как хлороформ. Добавление хлорированного растворителя, который образует азеотроп с водой, позволяет избежать необходимости нагревать полимер при температурах, которые обугливают или деструктируют полимер. Безводные полиэтиленимины, в частности, используются в качестве носителей антигенных материалов (например, антител или фрагментов антител).
Могут быть получены дендримеры, имеющие высокооднородный размер и форму, и что наиболее важно, предусматривающие большее число функциональных групп на единицу поверхности дендримера, и могут иметь большее число функциональных групп на единицу молекулярного объема по сравнению с другими полимерами, которые имеют такую же молекулярную массу, такое же ядро и мономерные компоненты и такое же количество разветвлений ядра, как плотные звездчатые полимеры. Повышенная концентрация функциональных групп плотно упакованных плотных звездчатых полимеров может обеспечить большее количество переносимого материала на дендример. Так как число функциональных групп дендримера может регулироваться на поверхности и внутри, это обеспечивает средство регулирования, например, количество биологически активного агента, поставляемого на дендример. В особенно предпочтительном варианте настоящего изобретения плотные звездчатые полимеры, в частности, плотные звездчатые дендримеры, являются целевыми носителями биологически активных агентов, способными доставить биологически активные агенты к конкретному намеченному органу или к конкретному детерминанту или локусу намеченного организма.
Аналогия может быть проведена между плотными звездчатыми дендримерами ранней генерации (т. е. , генерация = 1 - 7) и классическими сферическими мицеллами. Аналогия между дендримерами и мицеллами проводится сравнением характеристик, которые они имеют сообща, таких как форма, размер и поверхностные характеристики.
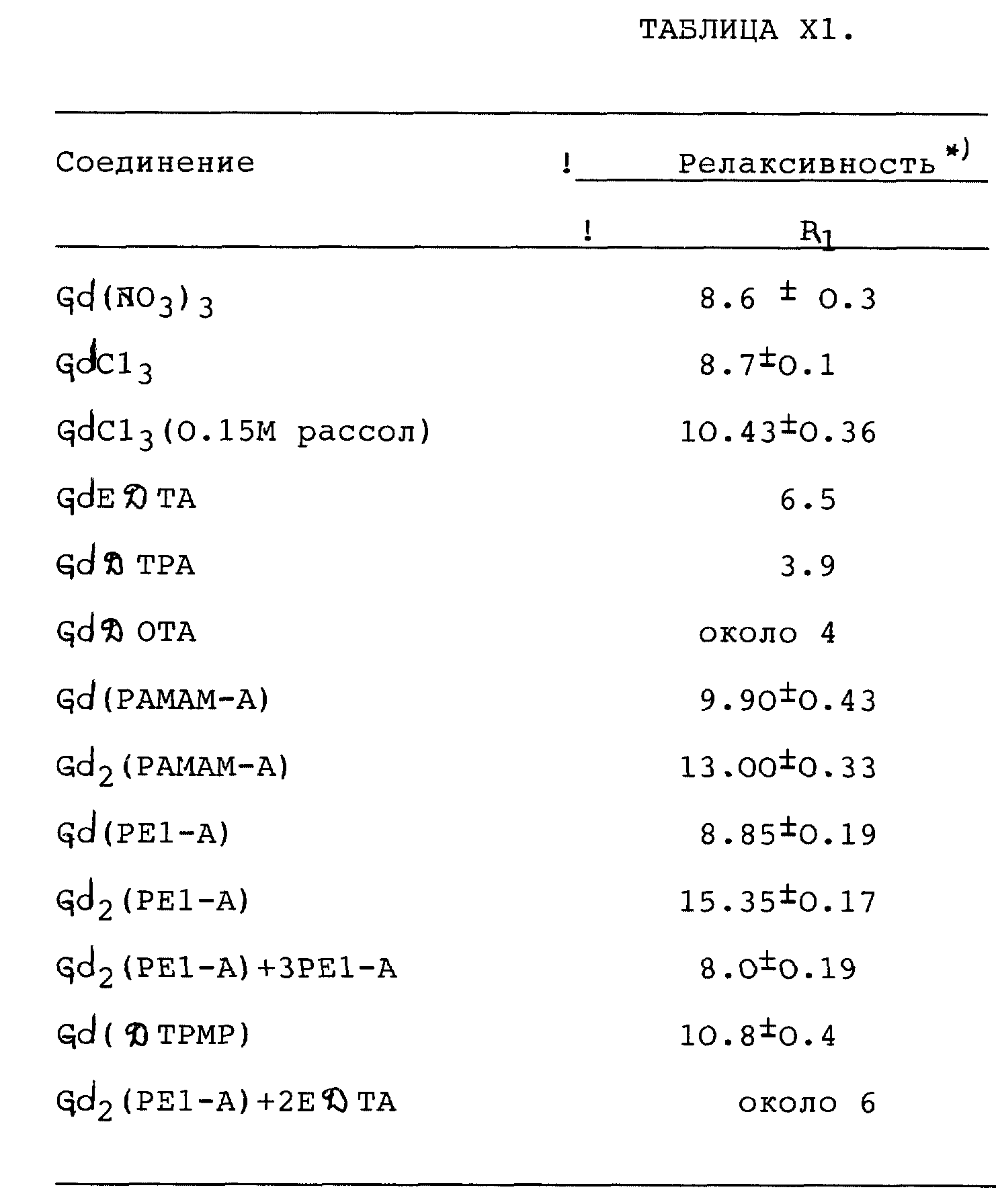
В таблице I форма была определена с помощью сканирующей просвечивающей электронной микроскопии (СПЭМ = STEM). Размер был определен с помощью измерения характеристической вязкости [η] и вытеснительной по размеру хроматографией (ВРХ = SEC). Количество поверхностных агрегаций было определено титриметрией и методом ЯМР высокой напряженности. Площадь/поверхностная группа была рассчитана гидродинамическими ВРХ-измерениями.
Первые пять генераций плотных звездчатых полиамидоаминных (ПАМАМ = РАМАМ) дендримеров являются микродоменами, которые очень близко имитируют классические сферические мицеллы почти во всех отношениях (т.е., форма, размер, число поверхностных групп и отношение поверхность/поверхностные группы). Главное различие, однако, заключается в том, что они являются ковалентно фиксированными и прочными по сравнению с динамически равновесной природой мицелл. Эта разница является значительным преимуществом при использовании этих микродоменов в качестве капсулированных устройств.
Когда присоединяется свыше пяти дополнительных концентрических генераций, имеет место перекрытие поверхности. Это перекрытие может привести к увеличенным барьерным характеристикам на поверхности и проявляется в виде меньшей площади поверхности на головную (поверхностную) группу, как показано в таблице II.
Например, генерация с концевыми аминогруппами 5,0, 6,0, 7, 0, 8,0 и 9,0 имеют уменьшенную площадь поверхности 104, 92, 73, 47 и 32
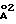
Если имеет место это перекрытие поверхности, то при увеличении номера генерации от промежуточных (G6 - G8) к более развитым (G9 или G10) должно наблюдаться изменение физических характеристик и морфологии. Электронные микрофотографии методом СПЭМ (STEM) были получены для генераций (G) = 7,0, 8,0 и 9,0 после удаления метанолового растворителя из каждого из образцов с получением бесцветных светло-желтых твердых пленок и последующим восстановлением тетраокисью осмия. Предсказанное морфологическое изменение имело место на стадии генерации (G9). Измеренная при G = 9,0 внутренняя пора имеет 63

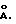



Поскольку число функциональных групп на дендримерах может регулироваться как на поверхности, так и внутри, это обеспечивает средство регулирования количества переносимого материала, приходящегося на дендример. В одном варианте дендримеры являются целевыми носителями агентов, способными поставлять переносимый материал, например биологически активный агент, например, к растению или вредителю, или конкретному детерминанту, или локусу в организме-цели.
Дендримеры, пригодные для применения в конъюгатах настоящего изобретения, включают в себя плотные звездчатые полимеры или плотные звездчатые полимеры, описанные в патентах США 4507466, 4558120, 4568737 и 4587329, которые поэтому приводятся в качестве ссылок.
В
частности, предпочтительный вариант включает плотный звездчатый конъюгант, который
содержит по крайней мере один плотный звездчатый полимер, связанный по крайней мере с
одним переносимым
сельскохозяйственным, фармацевтическим или другим материалом. Плотные звездчатые конъюгаты,
входящие в объем настоящего изобретения, включают в себя конъюгаты, представленные общей
формулой (1):
(P)x*(M)y, (1)
в которой каждый P представляет дендример;
x представляет целое число 1 или более; каждый M представляет единицу (например,
молекулу,
атом, ион и/или другую основную единицу) переносимого материала, причем переносимый материал может
быть тем же переносимым материалом или другим (различным) переносимым материалом,
предпочтительно
переносимым материалом является
биологически активный агент;
y представляет целое число 1
или более; и
* указывает, что переносимый материал ассоциирован с
дендримером; и при
условии, что переносимый материал сохраняет свою эффективность.
В вышеуказанной формуле (1) P может быть плотным звездчатым полимером или дендритным полимером, переносимым материалом является биологический модификатор, особенно, генетический материал.
Предпочтительными плотными звездчатыми конъюгатами общей формулы (1) являются такие, в которых M - лекарство, пестицид, радионуклид, хелант, хелатированный металл, токсин, антитело, фрагмент, антиген, генератор сигналов, например флюоресцирующие объекты, рефлектор сигналов, например парамагнитные объекты, или поглотитель сигналов, например гасители электронного пучка, душистое вещество, феромоны или красители. Термин "генераторы сигналов" и "поглотители сигналов" известны специалистам. Генератор сигналов может быть определен как объект, который способен испускать определенное количество энергии в виде электромагнитного излучения (такого как рентгеновское, УФ-излучение, ИК-излучение, видимое излучение и т.д.) и включает в себя фосфоресцирующие и флюоресцирующие объекты, например луциферазу и щелочную фосфатазу и биолюминесцентные маркеры, и источники гамма- и рентгеновского излучения, или материи (такие, как нейтроны, позитроны, β- частицы, α- частицы и т. д. ) и включают радионуклиды, источники позитронов и т.п. Поглотитель сигналов может быть определен как объект, который поглощает определенное количество энергии в виде электромагнитного излучения или материи. Некоторыми примерами являются красители, контрастирующие агенты и борон (который поглощает нейтроны). Данный объект может быть как поглотителем сигналов, так и генератором сигналов, т.е. флюоресцентные или фосфоресцентные вещества могут поглощать свет и/или испускать свет, иногда после выдержки на свету, такие как фторсодержащие метки, используемые для секвенирования ДНК; борон поглощает нейтроны и испускает излучение; парамагнитные частицы могут быть использованы для захвата меченых молекул и излучения энергии, и много других таких примеров. Термин феромон известен специалистам и определяется, например, в работах McGraw - Hill Encyclopedia Science & Technology, 7 th ed., т. 13, стр. 360-361; и "Incect Pheromone Technology: Chemistry and Applications", ACS Symposium Series 190 (1982). Примеры пригодных душистых веществ, такие как духи и карригенты, хорошо известны специалистам и иллюстрируются и определяются дополнительно в Perfume and Flavor Chemicals, Vols. I and II, by Steffen Arctanter, pub. Montcbair, NJ (1969). Красители и остатки красителей хорошо известны специалистам и иллюстрируются и определяются, например, в Webster's Third New International Dictionary стр. 706-710, pub. G.C.Merriam Company (1981); Kipk-Othmer Encyclopedia of Chemical Technology, т. 8, стр. 151-406, 3 rd ed., pub. John Wiley & Sons (1979). Особенно предпочтительно, чтобы x = 1 и y = 2 или более.
Также включенными являются плотные звездчатые конъюгаты общей формулы (1), где плотные звездчатые дендримеры ковалентно соединены вместе, плотные звездчатые мостиковые дендримеры, необязательно, через соединительные группы, так что образуются полидендримерные сообщества (т.е. где x > 1). Применение этих плотных звездчатых мостиковых дендримеров включают локально регулируемые высвобождающиеся агенты, радиационную синовэктомию и другие.
Используемый здесь термин "ассоциированный с" означает,
что переносимый материал(-ы) может быть физически капсулирован
или уловлен в ядро
дендримера, диспергирован частично или полностью через дендример, или присоединен, или связан с дендримером, или
любая комбинация этого, поэтому присоединение или связь является
средством ковалентного
соединения, водородного соединения, адсорбции, металлического соединения, сил Ван-дер-Ваальса или ионного
соединения, или любой их комбинации. Ассоциация переносимого
материала(-ов) и дендримера(-ов)
может, необязательно, играть роль соединителей и/или спейсеров для облегчения получения или применения
плотных звездчатых конъюгатов. Пригодными соединительными
группами являются группы, которые
соединяют указатели цели (т.е. T) с дендримером (т.е. P), без значительного снижения эффективности
указателя цели или эффективности любого другого переносимого
материала(-ов) (т.е. M),
присутствующего/-их/ в плотном звездчатом конъюгате. Эти соединительные группы могут быть расщепляющимися и
нерасщепляющимися и обычно используются для того, чтобы избежать
стерического затруднения
между указателем цели и дендримером, предпочтительно соединительные группы являются стабильными (т.е.
нерасщепляющимися). Поскольку размер, форма и концентрация
функциональных групп плотных звездчатых
дендримеров могут точно регулироваться, имеется много путей, которыми переносимый материал может
быть ассоциирован с дендримером. Например,
(a) может
иметься ассоциация ковалентного,
фарадеевского, гидрофобного или хелатного типа между переносимым материалом(-ами) и объектами, обычно
функциональными группами, расположенными на или вблизи
поверхности дендримера;
(b) может
иметься ассоциация ковалентного, фарадеевского, гидрофобного или хелатного типа между переносимым
материалом(-ами) и остатками, расположенными внутри
дендримера;
(c) может быть получен
дендример, который является преимущественно полым, что обеспечивает улавливание (например, физически в
или при ассоциации с внутренними остатками плотного
звездчатого дендримера) переносимых
материалов внутри (свободный объем), (например, магнитные или парамагнитные ядра или домены, созданные
хелатированием или восстановлением ионов металлов до
состояния нулевой валентности в дендримере),
эти дендримеры, содержащие магнитное внутреннее содержание, могут быть использованы для соединения
различных биологически активных агентов, которые могут
образовать комплексы с различными
дендримерными поверхностями при использовании магнитов и т.п., где высвобождение переносимого материала может,
необязательно, регулироваться перекрытием поверхности
дендримера остатками, регулирующими
диффузию; или
(d) могут быть использованы различные комбинации вышеуказанных явлений.
Дендримеры, представленные здесь по "P", включают в себя плотные звездчатые полимеры, описанные в Патентах США 4507466, 4558120, 4568737 или 4587329.
В предпочтительном
варианте переносимые материалы, представленные здесь под "M",
являются фармацевтическими
материалами. Такие материалы, которые являются пригодными для использования в плотных звездчатых конъюгатах,
включают в себя любые материалы для применения in vivo, ex
vivo или in vitro для
диагностических исследований или терапевтического лечения млекопитающих, которые могут быть ассоциированы с плотным
звездчатым дендримером без заметного нарушения целостности
дендримера, например, но
не ограничиваются этим:
лекарства, такие как (но не ограничиваясь этим) антибиотики, аналгетики,
гипотензивные (снижающие артериальное давление) средства,
кардиостимуляторы и т. п.; примерами
являются ацетаминофен, ацикловир, алкеран, амикацин, ампицилин, аспирин, бизатрен, блеомицин,
неокардиостатин, хлорамбуцил, хлорамфеникол, цитарабин, дауномицин,
доксорубицин, фторурацил, гентамицин,
ибупрофен, канамицин, мепробамат, метотрексат, новантрон, нистатин, онковин, фенобарбитал,
полимиксин, пробукол, прокарбазин, рифампин, стрептомицин, симметрел,
тиогуанин, тобрамицин, триметоприм и
валбан;
токсины, такие как (но не ограниченные этим) токсин дефтерии, гелонин,
эксотоксин A, абрин, модекцин, рицин или их токсичные фрагменты;
ионы металлов, таких как (но не
ограниченных этим) металлы следующих групп периодической системы элементов: VIIIA (Fe, Co, Ni,
Ru, Rh, Pd, Os, Ir, Pt), IVB (Pb, Sn, Ge), IIIA (Se, Y, лантаниды и
актиниды), IIIB (B, Al, Ga, In, Tl),
IA щелочные металлы (Li, Na, K, Rb, Cs, Fr) и IIA цепочно-земельные металлы (Be, Mg, Ca, Sr,
Ba, Ra) и переходные металлы;
радионуклиды, такие как (но
не ограниченных этим) генерированные из
актинидов или лантанидов, или других подобных переходных элементов или других элементов,
таких как47Sc,67Cu,67Ga,82Rb,89Sr,88Y,90Y,99mTc,105Rh,109Pd,111In,115mIn,125I,131I,140Ba,140La,149Pm,153Sm,159Gd,166Ho,175Yb,177Lu,186Re,188Re,194Ir и199Au, предпочтительно88Y,90Y,99mTc,125J,131I,153Sm,166Ho,177Lu,186Re,67
Ga,111In,115mIn и140La;
генераторы сигналов, которые включают в себя все, что дает
определяемое и измеряемое возмущение (расстройство) системы благодаря
их присутствию. Генератор сигналов может быть
определен как объект, который испускает определенное количество энергии в виде
электромагнитного излучения (такого как рентгеновские лучи,
ультрафиолетовое (УФ) излучение, инфракрасное (ИК) излучение
и т. п. и включает в себя фосфоресцентные и флюоресцентные объекты и источники
гаммаизлучения и рентгеновских лучей, или материи (такой
как нейтрон, позитрон, β- частицы, α- частицы и
т.п.) и включают в себя радионуклиды, источники позитронов и т. п. , такие как
(но не ограничиваются этим) флюоресцентные объекты,
фосфоресцирующие объекты излучения, такие как радионуклиды, частицы и
источники излучения, и нуклеотиды, токсины или лекарства, меченые одним или
более из указанных выше, включая (но не
ограничиваясь этим) генераторы сигналов;
рефлекторы сигналов, такие как (но
не ограничивающиеся этим) парамагнитные или магнитные объекты, например,
Fe, Cd или Mn, нитроксил-радикалы, ЯМР
сдвиговые реагенты, такие как соли n или Pr;
хелатированный металл, такой как
(но не ограничивающиеся этим), любые металлы, или их ионы, приведенные
выше, где они являются или не являются
радиоактивными, т.е. контрастирующие агенты, парамагнитные или магнитные объекты, ионы
металлов, ассоциированные с хелантом;
поглотители сигналов могут
быть определены как объекты, которые
поглощают определяемое количество энергии в виде электромагнитного излучения или материи.
Некоторыми примерами являются красители, контрастирующие агенты,
гасители электронного пучка, ИФ-поглотитель
душистых веществ и борон (который поглощает нейтроны). Данный объект может быть как
поглотителем сигналов, так и генератором сигналов, т.е. флюоресцентные
и фосфоросцентные вещества могут поглощать
свет и испускать свет; борон поглощает нейтроны и испускает излучение, и многие другие
такие примеры; например, такие как (но не ограничивающиеся этим)
контрастирующие агенты, например, Gd, Mn или
Fe, и гасители электронного пучка, такие как Pb или Fe;
антитела, включая
моноклональные антитела и антитела антиидио-типа;
фрагменты
антител;
гормоны;
биологические модификаторы, т.е. биологически активные агенты, которые изменяют реакцию
организма на стимулы (раздражители), такие как (но не ограничивающиеся
этим) интерлейкины, интерфероны, фактор
некроза опухоли, фактор, стимулирующий гранулоцитные колонии, вирусы, вирусные фрагменты
и другие генетические материалы;
диагностические глушители,
такие как указанный выше поглотитель
сигналов, биологические краски и т.п.; флюоресцентные остатки; и
удаляющие агенты,
такие как хеланты, антигены, антитела или любые остатки (частицы),
способные селективно удалять
(извлекать) терапевтические или диагностические агенты.
В другом варианте переносимые
материалы, представленные здесь "M" являются сельскохозяйственными
материалами. Такие материалы,
которые являются пригодными для использования в плотных звездчатых конъюгатах, включают в себя любые
материалы для in vivo, ex vivo или in vitro лечения, диагноза или
применения к растениям или
немлекопитающим (включая микроорганизмы), которые могут быть ассоциированы с плотным звездчатым дендримером
без заметного нарушения физической целостности дендримера.
Например, переносимыми
материалами могут быть
токсины, такие как (но не ограничивающиеся этим) токсин дифтерии, гелонин, экзотоксин
A, абрин, модексин, рицин, или их токсичные фрагменты;
ионы металлов,
таких как описанные выше для фармацевтических переносимых материалов;
радионуклиды, такие как генерируемые из
актинидов или лантанидов или других подобных элементов,
таких как47
Sc,67Cu,67Ga,82Rb,89Sr,88Y,90Y,99mTc,105Rh,109Pd,111In,115mIn,131I,125I,140Ba,140La,149Pm,153Sm,159Gd,166Ho,175Yb,177Lu,186Rb,188Re,194Ir и199Au таких, как описаны выше для фармацевтических переносимых материалов;
генераторы сигналов, которые включают в себя все,
что дает
определяемое и измеряемое возмущение (нарушение) системы благодаря их присутствию, такие как флюоресцирующие объекты, фосфоресцирующие
объекты и излучение, или то, что описано выше для
фармацевтических переносимых материалов;
рефлекторы сигналов, такие как парамагнитные объекты, например Fe, Gd или Mn, или те, которые
описаны выше для фармацевтических переносимых
материалов;
поглотители сигналов, такие как контрастирующие агенты и глушители электронного пучка, например Fe, Gd или Mn, или те, которые
описаны выше для фармацевтических переносимых
материалов;
феромоны или гормоны;
биологические модуляторы, такие как интерлейкины, интерфероны, вирусы, вирусные фрагменты и другие
генетические материалы;
пестициды,
включая антимикробные, алгициды, антелминтики, акарициды, инсектициды, атрактанты, репелленты, гербициды и/или фунгициды, такие как ацефат, ацифторфен,
алахлор, атразин, беномил, бентазон, каптан,
карбофуран, хлорпикрин, хлорпирифос, флорсульфурон, цианазин, цигексатин, ципермесрин, 2,4-дихлорфенокси-уксусная кислота, далапон, дикамба, диклофопметил,
дифлубензурон, диносеб, эндофалл, фербам,
флуазифоп, глифосат, галоксифоп, малатион, напталам, пендиметалин, перметрин, пиклорам, пропахлор, пропанил, сетоксидим, темефос, тербуфос, трифлуралин,
трифорин, зинеб и т.п.; и
удаляющие
агенты, такие как хеланты, хелатированный металл (радиоактивный или нерадиоактивный) или любые остатки (частицы), способные селективно удалять (выводить)
терапевтические или диагностические
агенты.
В другом варианте переносимым материалом, представленным здесь "M", являются иммуно-усиливающие агенты. Такие материалы, которые являются пригодными для использования плотных звездчатых конъюгатах, включают в себя любой антиген, гаптен, органический остаток или органические или неорганические соединения, которые увеличивают иммунную реакцию, которые могут быть ассоциированы с плотными звездчатыми дендримерами без заметного нарушения физической целостности дендримеров. Например, переносимыми материалами могут быть синтетические пептиды, используемые для получения вакцин против малярии (Патент США 4735799), холеры (Патент США 4751064) и инфекции мочевого тракта (Патент США 4740585), бактериальные полисахариды для получения антибактериальных вакцин (Патент США 4695624) и вирусные протеины или вирусные частицы для получения противовирусных вакцин для предупреждения болезней, таких как СПИД и гепатиты.
Применение плотных звездчатых конъюгатов в качестве носителей иммуно-усиливающих агентов позволяет избежать недостатков неопределенности в функциональной активности и структуре, связанной с традиционно известными и синтетическими полимерными конъюгатами, используемыми для получения макромолекулярной структуры для носителя антигена. Применение плотных звездчатых дендримеров в качестве носителей иммуноусиливающих агентов позволяет регулировать размер, форму и состав поверхности конъюгатов. Этот выбор позволяет оптимизировать воспроизведение антигена в организме, получая, таким образом, антитела, имеющие большую селективность и большее сродство, чем применение традиционных адъювантов. Может также потребоваться соединить мультиплетные антигенные пептиды или группы с плотным звездчатым дендримером, такие как, например, присоединение как T-, так и B-клеточные эпитопы. Такое построение приводит к улучшенным вакцинам.
Может также потребоваться конъюгировать с плотным звездчатым дендримером пестициды или загрязняющие вещества, способные вызывать иммунную реакцию, такие как содержащие карбамат, триазин или органофосфат компоненты. Антитела, получаемые для требуемого пестицида или загрязняющего вещества, могут быть очищены стандартными методами, закреплены на соответствующей подложке и использованы для последующего определения пестицида или загрязняющего вещества в окружающей среде или организме.
В другом варианте переносимые материалы, определенные здесь "M", которые являются пригодными для использования в плотных
звездчатых конъюгатах,
включают в себя любые материалы, отличные от сельскохозяйственных или фармацевтических материалов, которые могут быть ассоциированы с плотным звездчатым дендримером без
заметного нарушения физической
целостности дендримера, например:
ионы металлов, таких как щелочные и щелочно-земельные металлы, магнитные внутренние частицы, или как для фармацевтических
переносимых материалов, как
определено ранее;
генераторы сигналов, которые включают в себя все, что дает определяемое и измеряемое возмущение (нарушение) системы благодаря их присутствию,
такие как флюоресцирующие
объекты, фосфоресцирующие объекты и источники излучения, или как для фармацевтического переносимого материала, как определено ранее;
рефлекторы сигналов, такие как
парамагнитные объекты,
например Fe, Gd или Mn, или как для фармацевтического переносимого материала, как определено ранее;
поглотители сигналов, такие как контрастирующие агенты и глушители
электронного пучка,
например Fe, Gd или Mn; остатки феромонов, или как для фармацевтического переносимого материала, как определено ранее,
фрагранс-остатки;
остатки красителей; и
т.п.; и
очищающие (выводящие) агенты, такие как хеланты или любые остатки (частицы), способные селективно выводить множество агентов.
Предпочтительно переносимыми материалами являются биологически активные агенты. Используемый здесь термин "биологически активный" относится к активному объекту (единице), такому как молекула, атом, ион и/или другой объект, который способен определять, и идентифицировать, регулировать, убивать, увеличивать или модифицировать намеченный объект, такой как протеин, ген, гликопротеин, липопротеин, липид, мишень - клетка, мишень - орган, мишень - организм, например микроорганизм, растение или животное (включая млекопитающие, таких как, например, человек)) или другой мишень - остаток.
Плотные звездчатые конъюгаты общей формулы (1) получаются взаимодействием P с M, обычно в соответствующем растворителе, при температуре, которая облегчает ассоциацию переносимого материала (M) с плотным звездчатым дендримером (P).
Пригодными растворителями являются растворители, в которых P и M являются по крайней мере частично смешивающимися, и растворители являются инертными к образованию конъюгата. Если P и M являются по крайней мере частично смешивающимися, то растворитель может не потребоваться (например, реакция является чистой). Если требуется, то могут использоваться смеси соответствующих растворителей. Примерами таких соответствующих растворителей являются вода, метиловый спирт, этиловый спирт, хлороформ, ацетонитрил, толуол, диметилсульфоксид и диметилформамид.
Условия реакции для образования плотного звездчатого конъюгата общей формулы (1) зависят от конкретного дендримера (P), переносимого материала (M) и природы образуемой связи (*). Например, если P является ПЭИ (PEI) (полиэтиленимин) плотным звездчатым дендримером с алкилен (например, метилен) карбоксилатной поверхностью, M является радионуклидом, например иттрием, то реакция проводится в воде при комнатной температуре. Однако, если P является полиамидоаминным (ПАМАМ= РАМАМ) с сложноэфирной концевой группой плотным звездчатым дендримером, а M - аспирин, тогда реакция проводится при комнатной температуре в хлороформе. Обычно, температура может изменяться от комнатной до температуры дефлегмации. Выбор конкретного растворителя и температуры является очевидным для специалиста.
Соотношение M:P зависит от размера дендримера и количества переносимого материала. Например, мольное отношение (отношение молей) любого ионного M к P обычно составляет (0,1-1000): 1, предпочтительно (1-50):1 и более предпочтительно (2-6): 1. Массовое отношение любого лекарства, пестицида, органического вещества или токсина M к P обычно составляет (0,1-5):1 и предпочтительно (0, 5-3):1.
Когда M является радионуклидом, имеются три пути, по которым может быть получен плотный звездчатый конъюгат, а именно:
(1)
P может быть использован в качестве
хеланта. Например, ПЭИ или ПАМАМ с метиленкарбоксилатной поверхностью будет хелатировать металл, такой как иттрий или индий.
(2) Хелат может быть ковалентно связан с P. Например, плотный звездчатый (ПЭИ с концевой аминогруппой) дендример может взаимодействовать с 1-(p-изотиоцианатобензил)диэтилентриаминпентауксусной кислотой и затем хелатируется, или может взаимодействовать с комплексом, таким как хлорид родия, хелатированный изотиоцианатобензил-2,3,2-тет (т.е. 6-[4-(изотиоцианобензил)] -1,4,8,11- тетраазаундеканом, рассмотренным в опубликованной Заявке на Европейский патент 0296522.
(3) Предварительно хелатированный радионуклид может быть ассоциирован с P путем гидрофобного или ионного взаимодействия.
Другими плотными звездчатыми
конъюгатами, которые являются особенно предпочтительными для использования с фармацевтическими материалами, являются такие конъюгаты,
которые содержат указатель цели (обозначенный здесь как: "T"), и
которые представлены общей формулой (II):
(Te)*(P)x*(M)y
в которой каждый T представляет
указатель цели (мишени);
e представляет целое число 1 или
более; и
P, x, M, и y являются такими, как определено ранее; и при условии, что M сохраняет свою эффективность.
Среди плотных звездчатых конъюгатов общей формулы (II) предпочтительными являются такие, в которых M - лекарства, пестицид, радионуклид, хелатирующий агент, хелатированный металл, токсин, генератор сигналов, регулятор сигналов или поглотитель сигналов. Также предпочтительными являются такие конъюгаты, у которых e= 1 или 2; и такие, у которых x = 1 и y = 2 или более. Особенно предпочтительными конъюгатами являются такие, у которых x = 1, e = 1, y = 2 или более, а M и T ассоциируются с полимером через одинаковые или различные соединители.
К тому же, T и/или M в общей формуле (II) могут быть покрыты или защищены для предотвращения иммуногенности или RES-реакции, например, печени. Агенты, которые могут быть использованы для этой цели, включают полиэтиленгликоль (ПЭГ=PEG) и другие известные в науке.
Плотные звездчатые коньюгаты общей формулы (II) получаются либо образованием T + P и затем присоединением M или образованием P * M и затем присоединением T. Любая реакционная схема проводится в условиях, которые не являются вредными для конкретного конъюгата (такие как конкретное значение pH, температуры или концентрации солей), и в присутствии соответствующего растворителя, если требуется. Для регулирования pH используются буферы или добавление соответствующей кислоты или основания. Условия реакции зависят от типа образуемой ассоциации *, используемого плотного звездчатого дендримера (P), переносимого материала (M) и указателя цели-мишени (T). Например, когда T является моноклональным антителом, а M - хелатированным радионуклидом, ассоциация T + P осуществляется через функциональную группу, такую как изотиоцианат в воде или воде с органическим модификатором, таким как ацетонитрил или диметилформамид. Обычно конъюгация осуществляется в буфере при pH 7 - 10, предпочтительно pH 8,5 - 9,5. Образованный конъюгат затем хелатируется радионуклидом, таким как ацетат иттрия предпочтительно при комнатной температуре. Альтернативно, P и M могут быть хелатированы, обычно в воде, перед конъюгацией с T. Конъюгат с T выполняется в соответствующем буфере.
Мольное соотношение T:P составляет предпочтительно 1:1, особенно, когда T является антителом или фрагментом антитела. Мольное соотношение M:P является таким, как указано ранее.
Указатели цели, способные нацеливать плотные звездчатые конъюгаты, являются объекты, которые при использовании в плотных звездчатых конъюгатах настоящего изобретения приводят к тому, что по крайней мере часть плотных звездчатых конъюгатов доставляется к желаемой цели (мишени) (например, протеин, ген, гликопротеин, липопротеин, липид, клетка-мишень, орган-мишень, организм-мишень или другой остаток-мишень) и включает в себя антитело, предпочтительно моноклональные антитела, фрагменты антител, такие как Fab, Fab', F(ab')2 фрагменты или другие фрагменты антител, имеющие требуемую специфичность цели, гормоны, биологические модификаторы, эпитопы химические функциональности, показывающие специфичность цели и т.п.
Антитела или фрагменты антител, которые могут быть использованы в предпочтительных звездчатых конъюгатах, описанных здесь, могут быть получены методами, хорошо известными в науке. Примером пригодных антител являются иммуноглобулины, такие как lgG, lgM, lgA, lgD и lgE. Моноклональные антитела с высокой специфичностью могут быть получены методами гибридизации, хорошо известными в науке, смотри например, Kohler and Milstein (1975, Nature 256: 495: 497; и 1976, Eur. J. Immunol 6:511-519). Такие антитела обычно могут иметь высокую удельную реакционноспособность.
В направляемых антителами плотных звездчатых конъюгатах могут быть использованы антитела, направленные против любого антигена или гаптена. Хотя могут использоваться традиционные поликлональные антитела, моноклональные антитела обладают некоторыми преимуществами. Выбранные моноклональные антитела являются высоко специфичными для единичного эпитопа. К тому же, большие количества каждого моноклонального антитела могут быть получены тканевой культурой (например, клеточная линия гибридомы). Антитела, используемые в настоящем изобретении, могут быть направлены против, например, опухолей, бактерий, грибков, вирусов, паразитов, микоплазмы, дифференцировки и других клеточномембранных антигенов, полинуклеиновые кислоты, такие как ДНК или РНК, антигены с патогенной поверхностью, токсины, ферменты, аллергены, лекарства и любые биологически активные молекулы. Более полный перечень антигенов указан в Патенте США 4193983.
Может потребоваться конъюгировать большое количество антител или фрагментов к дендримеру, и в конкретных случаях использовать антитела различной специфичности. Например, может быть сконструирован бифункциональный конъюгат, который имеет способность локализоваться и связываться с опухолью и затем вывести циркулирующие цитоксичные, диагностические или биостатические соединения.
При отсутствии указателя цели (или в присутствии указателя цели, если требуется), благодаря ряду функциональных групп, которые могут быть расположены на или вблизи поверхности дендримера, все (или значительная часть) функциональные группы могут быть выполнены анионными, катионными, гидрофобными или гидрофильными, чтобы эффективно помогать доставлять плотный звездчатый конъюгат к нужной мишени противоположного заряда или к гидрофобному или гидрофильному совместимому объекту-мишени.
Получение конъюгатов общей формулы (II) с использованием P с защитой (S) также подразумевается как способ получения конъюгатов общей формулы (II).
Схема реакции показана ниже.
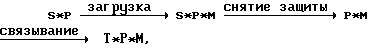
где S * P представляет защищенный дендример;
S * P * M представляет защищенный дендример, конъюгированный с M;
P * M представляет дендример со снятой защитой, конъюгированный с M (плотный звездчатый конъюгат);
T * P * M представляет плотный звездчатый конъюгат, связанный с указателем цели (мишени).
Могут быть использованы соответствующие растворители, которые не оказывают отрицательного влияния на P * M. Например, если S - t-бутоксикарбонил, а P * M является стабильным в водном растворителе, S может быть удален водным раствором кислоты.
Также, если переносимыми материалами являются фармацевтические материалы, предпочтительными
являются плотные звездчатые конъюгаты, в которых полимер
ассоциируется прямо или через соединители; эти
плотные звездчатые конъюгаты представляются общей формулой (III):
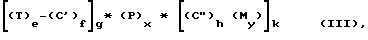
в которой каждый C' представляет одинаковые или различные соединительные группы;
каждый C'' представляет одинаковые или различные соединительные группы;
g и k каждый в отдельности представляет целое число 1 или более;
f и h каждый в отдельности представляет целое число 0 или более;
- указывает ковалентную связь в случаях, где присутствует соединительная группа; и
P, x, *, M, y, T и e - такие, как указано ранее; и при условии, что M сохраняет свою эффективность.
Среди плотных звездчатых конъюгатов общей формулы (III) предпочтительными являются такие, у которых M - радионуклид, лекарство, токсин, генератор сигналов, рефлектор сигналов или поглотитель сигналов. Также предпочтительными являются такие конъюгаты, у которых x = 1. Особенно предпочтительными являются конъюгаты, у которых x, e, f, h и y каждый равен 1, g = 1 или более, а k = 2 или более. Наиболее предпочтительными являются конъюгаты, у которых x, e, f, h, y и g каждый равен 1, а к = 2 или более. Также особенно предпочтительными являются такие плотные звездчатые конъюгаты, y которых M представляет биологически активный агент, такой как радионуклид, лекарство или токсин.
Соответствующими соединительными группами, которые представлены "C", являются группы, которые связывают переносимый материал с дендримером без значительного ухудшения эффективности переносимого материала или эффективности указателя(ей) цели, присутствующего в плотном звездчатом конъюгате. Эти соединители должны быть стабильными (т.е. нерасщепляемыми) или расщепляемые в зависимости от вида активности переносимого материала и обычно используются для того, чтобы избежать стерического затруднения между переносимым материалом и полимером.
Наиболее предпочтительными являются конъюгаты, у которых дендример
ассоциирован прямо или через соединительную группу(-ы) с антителом или
фрагментом антитела. Полимер в этих предпочтительных
конъюгатах может дополнительно быть, необязательно, ассоциирован либо прямо,
либо через соединительную группу (-ы) с одним и более другим
переносимым материалом(-ами), предпочтительно радиоизотопом.
Такие плотные звездчатые конъюгаты представляются общей формулой (IV):

в которой:
каждое антитело представляет антитело (или фрагмент антитела), способное взаимодействовать с нужным эпитопом; - указывает ковалентную или фарадеевскую связь в случаях, где присутствует соединительная группа; и P, x, *, M, T, e, y, C', C'', g, k, f и h - такие же, как определено ранее; и при условии, что M сохраняет свою эффективность.
Для указанного выше синтеза плотных звездчатых дендримеров (P), которые имеют функциональную группу, способную связать (C' или C'') с указателем цели (мишени) (T), предпочтительный способ требует, чтобы реакционная функциональность была защищена как синтетический предшественник. Эта защита является предпочтительной, потому что она обеспечивает синтез дендримера или конъюгата очень высокого качества. Этот способ позволяет химически связать единицу переносимого фармацевтического материала (M) с концевыми функциональными группами плотного звездчатого дендримера (P) такими способами, которые в противном случае приводят к реакции с соединительной функциональной группой, делая, таким образом, невозможным присоединение к указателю цели (T). Последовательное снятие защиты или превращение при синтезе в требуемую соединительную функциональную группу, таким образом, обеспечивает то, что плотный звездчатый конъюгат соединяется с указателем цели (мишени).
Одной из предпочтительных "функциональных групп для соединения" (названный здесь как "рукоятка") является анилиновый остаток. Эта группа является предпочтительной потому, что она может быть использована прямо для соединения с указателем цели, или она может быть легко модифицирована в другие функциональные группы, пригодные для реакции с указателем цели, например изотиоцианат, изоцианат, семитиокарбазид, семикарбазид, бромацетамид, иодацетамид и малеинимид. Анилиновый остаток является также предпочтительным в качестве "рукоятки" для соединения с укателями цели, т.к. он может быть легко защищен для использования в синтезе плотных звездчатых дендримеров, или нитрогруппа может быть использована в качестве предшественника, который может быть превращен в желаемую аминофункцию в конце синтеза.
Имеется ряд защитных групп, которые являются пригодными для защиты анилино-аминной функциональности в процессе синтеза плотных звездчатых дендримеров (смотри - Theodora W.Green Protective Groups in Organic Synthesis Pub. John. Wiley & Son New-York 1981). Предпочтительным классом защитных групп являются карбаматы, показанные ниже, где R' представляет дендример.

Многие карбаматы используются для защиты аминов. Наиболее предпочтительными карбаматами для синтеза STARBURSTTM -дендримера является t-бутоксикарбамат, R = - C(CH3)3. Снятие защиты достигается мягким кислотным гидролизом. Также предпочтительной является бензилкарбаматная защитная группа, общей формулы:

которая является предпочтительной, когда дендример является чувствительным к кислотному гидролизу. Снятие защиты достигается каталитическим гидрированием.
Другие защитные группы, которые
можно использовать для защиты
реакционноспособных остатков на нужном уровне
генерации включают 9-фторенилметилкарбамат

и фталимидную защитную группу
Другие защитные группы, используемые для аминов, которые являются хорошо известными в литературе, также могут быть использованы в этой схеме синтеза. Приведенные выше предпочтительные варианты даются только как иллюстрационные примеры, но не являются защитными группами, которые только одни могут быть использованы. Может быть использована любая защитная группа, которая является стабильной в условиях реакции и может быть удалена без нарушения целостности плотного звездчатого дендримера.
Альтернативный способ включает в себя реакцию активированного арилгалоида, например 4-нитрофторбензола, 2,
4-динитрофторбензола, с
амино-функцией на агенте для конъюгации, например, плотных
звездчатых полиэтилениминах (ПЭИ= PEI), и последующее каталитическое гидрирование нитрогруппы до анилиновой
функциональности для
последующей конъюгации. Это, в частности, используется для агентов,
например полиаминов, которые нуждаются в дополнительной модификации перед использованием, благодаря
относительной химической
инертности нитрофенильной функциональности ко всем невосстановительным
условиям реакции. Различные спаривающиеся реагенты, пригодные для реакции конъюгации, являются хорошо
известными в науке, такие,
например, как те, которые рассматриваются в опубликованной заявке на
Европейский патент 0430863, опубликованный 5 июня 1991 г. Более общие бифункциональные соединительные
агенты, например активные
сложные эфиры или диизоцианаты, которые являются реакционноспособными в
широком интервале реакционных условий и которые превращаются в применимые для конъюгации, включают в
себя соединения следующих
структурных формул:

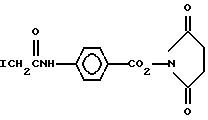

Изобретение также включает в себя использование нитрозамещенных арилсульфонилгалоидов с получением сульфонамидов, например, общей формулы

Преимущество данного способа по сравнению с известными способами введения аминофенильной группы для конъюгации заключается в том, что она имеет место на последней стадии синтеза.
Патент США 4472509, в его способе, вводил нитрофенильную группу на первой стадии длительного процесса синтеза, в результате чего имел ограничения в доступной химии.
Данный способ также вводит "рукоятку", которая явно отличается от остатка молекулы. Manabe et al рассматривали, что раскрытие кольца сукцинового ангидрида остаточными аминами дает спаривающую группу, через которую была возможна конъюгация с антителом. Этот способ однако не дает средства дифференции между любыми нехелатированными участками на полимере, так как хелатирующие группы были теми же, что и соединительная группа. Указанный выше способ может ввести аминофенильную функциональность в любой агент, содержащий аминогруппу, который затем конъюгируется с биологически активным агентом, например моноклональным антителом или ферментом. Агент может быть конъюгирован окислительным сопряжением (спариванием) с карбогидратами на биологически активном агенте, например антителе. Аминофенильная группа также может быть превращена в изотиоцианат или изоцианат для последующей реакции с боковыми аминогруппами остатков лизина на биологически активном агенте.
Настоящий способ также дает прямое хелатирование лантанидов STARBURST -дендримерами, предпочтительно ПЭИ (PEI)-ацетатным дендримером. Напротив, Denkewalter, Патента США 4289872, установил, что работает даже намазка ацетатов на поверхности его полимера. Однако, настоящая реакция показывает, что ПЭИ (PEI)-ацетат работает намного лучше, чем ПАМАМ (PAMAM), т.е. поверхность иминодиацетатов является только частью истории, природы главной цепи, а также очень важным является разветвление. ПЭИ (PEI)-ацетат имеет более лучшие хелатирующие свойства, чем ПАМАМ (PAMAM)-ацетат.


Среди плотных звездчатых конъюгатов общей формулы (IV) предпочтительными являются такие, у которых M - радионуклид, лекарство, токсин, генератор сигналов, рефлектор сигналов или поглотитель сигналов. Также предпочтительными являются такие конъюгаты, у которых x = 1. Особенно предпочтительными являются такие конъюгаты, у которых x, e, f, h, и y равняется 1 каждый, g = 1 или более и k является отдельно равным 2 или более. Наиболее предпочтительными являются такие конъюгаты, у которых x, e, f, h, y и g каждый равняется 1, а k = 2 или более. Также особенно предпочтительными являются такие конъюгаты, y которых T представляет моноклональное антитело или его эпитопсвязывающий фрагмент; и особенно предпочтительными являются такие, у которых M представляет биологически активный агент, такой как радионуклид, лекарство или токсин, а T является указателем цели, таким как антитело, моноклональное антитело или фрагмент антитела, вирусный фрагмент, одноцепочечная ДНК, полинуклеиновая кислота или фрагмент гена, или T отсутствует.
Плотные звездчатые конъюгаты могут быть использованы для ряда in vitro или in vivo диагностических применений, таких как радиоиммунный анализ, электронная микроскопия, иммуносорбентный анализ с ферментной меткой, ядерно-магнитная резонансная (ЯМР) спектроскопия, контрастная визуализация и иммуносцинтография, в аналитических применениях, и в терапевтических применениях - в качестве носителя антибиотиков, лекарств и других агентов, пригодных для использования в лечении заболеваний, таких как рак, аутоаллергическая (аутоиммунная) болезнь, генетические дефекты, расстройства центральной нервной системы, инфекционные заболевания и сердечные расстройства; в биологических регулирующих применениях - качестве средства доставки пестицидов, таких как гербициды, фунгициды, репелленты, аттрактанты, антимикробные или другие токсины; или использованы в качестве исходных материалов для получения других полезных агентов.
Настоящее изобретение также направлено на композиции плотных звездчатых конъюгатов, в которых плотные звездчатые конъюгаты образуют рецептуру с другими соответствующими наполнителями. Композиции плотных звездчатых конъюгатов могут, необязательно, содержать другие активные ингредиенты, добавки и/или разбавители. Инъецируемые композиции настоящего изобретения могут находиться либо в еще суспензии, либо в виде раствора. В растворной форме комплекс растворяется в физиологически приемлемом носителе. Такие носители содержат соответствующий растворитель, консерванты, такие как бензиловый спирт, если требуется, и буферы. Используемые растворители включают в себя, например, воду, водные спирты, гликоли и фосфонатные или карбонатные сложные эфиры. Конъюгат дендример-лекарство также может быть введен в наполнители или липосомы. Кроме того, конъюгат может быть капсулирован в полимерную систему-хозяин, которая может быть либо разрушаемой (например, сополимеры молочной и гликолевой кислоты или полиангидридный полимер) или неразрушаемой (сополимер этилена с винилацетатом). Также конъюгат может быть введен в гидрогельную матрицу, содержащую либо поли(гидроксиэтилметакрилат), либо поливиниловый спирт. Для того, чтобы помочь конъюгату дендример-лекарство пройти через желудок, может быть применен целый ряд систем с энтеросомобильным покрытием.
Конъюгат дендример-лекарство может входить в рецептуру таблетки, использующей связующие, известные специалистам. Такие дозированные формы описаны в Remington's Pharmacentical Sciences, 18th edition, 1990, Mack Publishing Company, Easton, Pensylvania. Соответствующие таблетки включают в себя прессованные таблетки, таблетки с сахарным покрытием, таблетки с пленочным покрытием, таблетки с энтеросомобильным покрытием, составные прессованные таблетки, таблетки с регулируемым высвобождением и т.п.
Таблетки с энтеросомобильным покрытием являются особенно преобладающими в практике настоящего изобретения. Энтеросомобильные покрытия являются такими, которые остаются нетронутыми в желудке, но будучи растворенными и высвободив содержимое дозированной формы, сразу достигают тонкой кишки. Целью энтеросомобильных покрытий является замедление высвобождения лекарств, которые инактивируются содержимым желудка или могут вызвать тошноту или кровотечение при раздражении слизистой оболочки желудка. Кроме того, такие покрытия могут быть использованы, чтобы дать простой повторный эффект, когда дополнительное лекарство, которое было применено сверх энтеросомобильного покрытия, высвобождается в желудке, тогда как остаток, будучи защищенным покрытием, высвобождается дальше вниз по желудочно-кишечному тракту.
Действие энтеросомобильных покрытий зависит от различия в составе соответствующей кишечной и желудочной среды, с точки зрения pH и энзиматических (ферментативных) свойств. Несмотря на то, что повторяются попытки получить покрытие, которое является объектом кишечного ферментативного расщепления, этот подход является непопулярным, т.к. ферментативное разложение пленки является слишком медленным. Таким образом, большинство используемых сейчас энтеросомобильных покрытий является такими, которые остаются недиссоциированными в желудке в среде с низким pH желудка, но легко ионизуются, когда pH достигает примерно 4 или 5. Наиболее эффективными энтеросомобильными полимерами являются поликислоты, имеющие pH от 3 до 5.
Для получения таблеток с энтеросомобильным покрытием используются полимеры, которые включают в себя ацетатфталат целлюлозы, поливинилацетатфталат, фталат гидроксипропилметилцеллюлозы, сополимеры сложных эфиров метакриловой кислоты и т.п.
В варианте осуществления изобретения в сельскохозяйственных материалах, плотные звездчатые конъюгаты могут входить в рецептуру с соответствующими наполнителями, используемыми в сельском хозяйстве, например, для обработки культурной или залежной земли, или в качестве пестицидов, или для лечения in vivo или in vitro животных. Приемлемый для сельского хозяйства носитель или разбавитель, который также может присутствовать с одним или более плотными звездчатыми конъюгатами настоящего изобретения, включает в себя такие носители или разбавители, обычно используемые в гранулированных рецептурах, эмульгируемых концентратах, растворах или суспензиях, такие как, например, толуол, ксилол, бензол, фенол, вода, метан, углеводороды, нафталин и т.п.
Предпочтительным
плотным
звездчатым полимером для использования в плотных звездчатых
конъюгатах настоящего изобретения является полимер, который может быть описан как плотный звездчатый полимер, имеющий по крайней
мере одно
ответвление (называемое далее ответвлением ядра),
предпочтительно два или более ответвлений, исходящих из ядра, причем указанное ответвление имеет по крайней мере одну концевую группу, при
условии,
что
(1) отношение концевых групп к
ответвлениям ядра больше 1, предпочтительно 2 или более,
(2) концентрация концевых групп на единицу объема в полимере является не менее,
чем в 1,5
раза больше, чем у традиционного
растянутого звездчатого полимера, имеющего подобное ядро и мономерные остатки и сравнимую молекулярную массу и число ответвлений ядра, причем каждое из таких
ответвлений традиционного растянутого
звездчатого полимера несет только одну концевую группу, и
(3) молекулярный объем, который составляет не более, чем примерно 80% молекулярного объема
указанного традиционного растянутого
звездчатого полимера, как определено исследованиями размеров с использованием молекулярных моделей со шкалой Corey-Panling-Koltun (CPK). Используемый здесь термин
"плотный", т.к. он модифицирует
"звездчатый полимер" или "дендример", означает, что он имеет меньший молекулярный объем, чем традиционный растянутый звездчатый полимер, имеющий такую же молекулярную
массу. Традиционный растянутый
звездчатый полимер, который используется в качестве базы для сравнения с плотным звездчатым полимером, является полимером, который имеет такую же молекулярную массу,
такие же ядро и мономерные
компоненты и такое же число ответвлений ядра, как плотный звездчатый полимер. Под "растянутым" подразумевается то, что отдельные ответвления традиционного звездчатого
полимера являются растянутыми
или вытянутыми до их максимальной длины. К тому же в то время, как число концевых групп является большим для молекулы плотного звездчатого полимера, чем в молекуле
традиционного звездчатого полимера,
химическая структура концевых групп является одной и той же.
Дендримеры, используемые в конъюгатах настоящего изобретения, могут быть получены способами, известными в науке. Указанные выше дендримеры, различные составные части ядра и соединения ядра и способ их получения могут быть такими, как определено в Патенте США 4587329. Например, соединениями ядра могут быть все, на которые могут быть присоединены дополнительные группы (фиг. 1 и 2 (B)).
Дендримеры для использования в конъюгатах настоящего изобретения могут иметь концевые группы, которые являются достаточно реакционноспособными для того, чтобы претерпеть реакции присоединения или замещения. Примеры таких концевых групп включают в себя амино, гидрокси, меркапто, карбокси, алкенил, нитрил, аллил, винил, амидо, галоид, уреа, оксиранил, азиридинил, оксазолинил, имидазолинил, сульфонато, силанил, фосфонато, крон-эфиры, бипиридины, хлорметилфенил, изоцианато и изотиоцианато. Концевые группы могут быть модифицированы, чтобы сделать их биологически инертными, например сделать их неиммуногенными, или чтобы избежать неспецифического поглощения в печени, селезенке или другом органе, например, при использовании полиэтиленгликольных (ПЭГ= PEG) или полиацилполиалкилениминных (т.е., полиацилполиэтиленимина) групп различной длины, которые присоединяются к поверхности дендримера. Дендримеры отличаются от традиционных звездчатых или звездчато-разветвленных полимеров тем, что дендримеры имеют большую концентрацию концевых групп на единицу молекулярного объема, чем традиционные растянутые звездчатые полимеры, имеющие равное число ответвлений ядра и равную длину ответвлений ядра. Так, плотность (концентрация) концевых групп на единицу объема в дендримере обычно по крайней мере в 1,5 раза больше, чем плотность (концентрация) концевых групп в традиционном растянутом звездчатом полимере, предпочтительно не менее 5 раз, более предпочтительно не менее 10 раз, наиболее предпочтительно от 15 до 50 раз. Отношение концевых групп на ответвление ядра в плотном полимере составляет предпочтительно не менее 2, более предпочтительно не менее 3, наиболее предпочтительно для данной молекулярной массы полимера молекулярный объем плотного звездчатого полимера составляет менее 70 объемных %, более предпочтительно от 16 до 60, наиболее предпочтительно от 7 до 50 объемных % молекулярного объема традиционного растянутого звездчатого полимера.
Предпочтительные дендримеры для использования в конъюгатах
настоящего
изобретения
характеризуются как имеющие одновалентное или поливалентное ядро, которое ковалентно связано с дендритными ответвлениями. Такое упорядоченное ответвление может быть
иллюстрировано
следующей
последовательностью, где G указывает номер генерации:

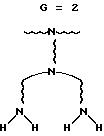

Математически точное секвенирование, включенное в получение дендримеров, приводит к точной предсказуемой стехиометрии в каждой молекуле дендримера. Например, число повторяющихся единиц в дендримере зависит от номера генераций (G), многократности повторяющейся единицы (Nr) и многократности молекулы ядра или атома ядра (Nc). В гомополимерном дендримере, где та же самая повторяющаяся единица используется в молекуле, общее число повторяющихся единиц в дендримере, его степень полимеризации (СП = DP) дается как:
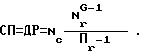
Общая валентность или число концевых остатков на дендримере (Y) дается как
Y = NcNrG.
Часто
более удобно или
интуитивно считать число концевых групп на дендримере (Z), потому что каждая группа может содержать многократность валентности или число валентностей, которые
изменяются в последующий
химических
модификациях. Поэтому число концевых групп определяется как
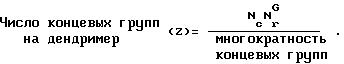
Это может иллюстрироваться концевой аминогруппой, которая имеет многократность 2 в синтезе полиамина. В этом случае

Для последующих модификаций дендримеров, это число является более удобным, т. к. валентность аминогруппы зависит от примененной химии. Например, концевая первичная аминная группа реагирует легко только с одной молекулой сложного эфира с образованием амида, с двумя молекулами алкилирующего агента (в мягких условиях, например, реакции Эшвайлера-Кларка) с образованием третичного амина, или с тремя молекулами алкилирующего агента (в более жестких условиях, например, реакция с алкилсульфонатами) с образованием четвертичной аминной соли.
Таким образом,
дендримеры данного
изобретения могут быть представлены в частях их компонентов следующим образом:

где ядро (I) является молекулой или атомом инициатора; концевой остаток - атом, молекула или функциональная группа, которая занимает соединительный участок повторяющейся единицы, например, водород или метоксигруппа сложного эфира; G и Nc - такие, как определено ранее; и повторяющаяся единица имеет валентность или функциональность Nr + 1, где Nr - такой, как определено ранее.
Сополимерный дендример, который является предпочтительным дендримером для целей данного изобретения, является уникальным соединением, построенным из полифункциональных мономерных единиц в высоко разветвленном (дендритном) ряду. Молекула дендримера получается из полуфункциональных единиц инициатора (соединение ядра, ядро (I), полуфункциональных повторяющихся единиц и концевых единиц, которые могут быть одинаковыми с повторяющимися единицами или отличных от них. Соединение ядра соответствует общей формуле

В молекуле дендримера повторяющиеся единицы являются одинаковыми в одной генерации i, но могут
отличаться
от генерации к
генерации. В повторяющейся единице X1Y1(Z1)N1 X1 представляет монофункциональную концевую часть повторяющейся единицы
первой
генерации, Y1представляет остаток, составляющий первую генерацию, Z1 представляет соединительный участок полифункциональной повторяющейся единицы первой генерации и может
быть
одинаковым или
отличаться от соединительных участков соединения ядра или другой генерации; а N1 - число 2 или более, наиболее предпочтительно 2, 3 или 4, которое представляет
мультиплетность
полифункциональной головки повторяющейся единицы в первой генерации. Обычно, повторяющаяся единица соответствует общей формуле

где "i" представляет конкретную генерацию от первой до (t-1) генерации.
Таким образом, в молекуле предпочтительного дендримера, каждый Z1 повторяющейся единицы первой генерации соединяется с X2 повторяющейся единицы второй генерации и т.д. через генерацию, так что каждая Zi-группа повторяющейся единицы




в которой i = от 1 до t - 1; символы имеют значения, определенные ранее. П функция является произведением всех значений между их определенными пределами. Таким образом,

что является числом повторяющихся единиц,
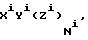
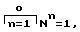
В сополимерных дендримерах повторяющаяся единица одной генерации отличается от повторяющейся единицы по крайней мере в одной другой генерации. Предпочтительные дендримеры являются очень симметричными, как показано в структурных формулах, описанных далее. Предпочтительные дендримеры могут быть превращены в функционализированные дендримеры при контакте с другим реагентом. Например, превращение гидроксила в концевой слой или ярус для сложного эфира реакцией с кислотным хлоридом дает функционализированный дендример с концевой сложноэфирной функциональной группой. Нет необходимости в том, чтобы эта функционализация выполняется до теоретического максимума, как определено числом имеющихся в наличии функциональных групп и, таким образом, функцонализированный дендример может не иметь высокой симметрии или точно определенную молекулярную формулу, как в случае с предпочтительным дендримером.
В гомополимерном дендримере все повторяющиеся единицы,
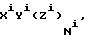

где i = от 1 до t - 1.
Эта форма еще показывает различие между разными генерациями i, каждая из которых состоит NcNr(i -1) повторяющихся единиц,


или

где Xr Yr(Zr)Nr - повторяющаяся единица, которая используется во всех генерациях i.
Эта формула, по существу, является такой же, как на странице 39, строка (подлинника) при G = t - 1.
Следовательно, если полимерное соединение будет подходить к этим вышеуказанным формулам, тогда полимер является плотным звездчатым полимером. Напротив, если полимерное соединение не будет подходить под эти вышеуказанные формулы, тогда полимер не является плотным звездчатым полимером. К тому же, для того, чтобы определить, является ли полимер плотным звездчатым полимером, нет необходимости знать способ, которым он был получен, а только соответствует ли он формуле. Формулы также показывают генерации (G) или ярусность (рядность) дендримеров.
Вышеприведенные математические формулы основаны на отношении к первой итерации (повторении) реакций около реактанта ядра как генерации 1. Таким образом, для полиамидоаминного плотного звездчатого дендримера продукт реакции метилакрилата с аммиачным ядром будет относиться к генерации 0,5, а продукт последующей реакции ЭДА с метилакрилатом будет относится к генерации 1,0.
В варианте по этой системе первая итерация относится как генерация 0 вместо генерации 1. Продукт реакции метилакрилата с аммиачным ядром будет генерацией 0,5, а продукт последующей реакции ЭДА с метилакрилатом будет генерацией 0. По этой альтернативной системе все номера генераций, использованные в другом месте в данной заявке, сводятся к 1.
По этой уточненной системе
формула для степени полимеризации (СП = DP) становится следующей
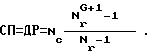
Формула для числа концевых остатков на дендримере (Y) является следующей
Y = NcMrG.
где Y может быть превращен в Z (число концевых групп/дендример) делением на многократность концевой группы, как описано ранее.
Число клеток ответвлений дендримера (NBC)
выражается следующим образом:

Теоретическая мольная масса (M) может быть выражена как:
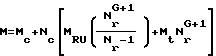
или

где Mc - мольная масса ядра инициатора;
MRU - мольная масса повторяющихся единиц;
MBC - мольная масса клетки ответвления;
Mt - мольная масса концевых единиц.
Ясно, что имеется несколько путей определения отношения агента (M) к дендримеру (P), которое зависит от того, как и где имеет место ассоциация P * M. Когда это имеет место внутри капсулирования, массовое отношение М:Р обычно составляет 10: 1, предпочтительно 8:1, более предпочтительно 5:1, наиболее предпочтительно 3: 1. Соотношение может быть таким низким, как от 0,5:1 до 0,1:1.
Если используется внутренняя стехиометрия, то массовое соотношение M:P является таким же, как для внутреннего капсулирования.
Когда определяется наружная стехиометрия, мольное соотношение
M:P дается следующими формулами:
M:P
(A) 5 NcNtNrt-1 - 1
(B) 3 NcNtNrt-1 - 1
(C) 1 NcNtNrt-1 - 1
где Nc означает многократность ядра;
Nt означает среднюю
многократность концевой группы;
Nr означает многократность узлов разветвлений.
Термин NcNtN приводит в результате к ряду концевых остатков. Так, например, вышеуказанный случай (A) получается, когда протеины, ферменты или высокозаряженные молекулы находятся на поверхности; указанный выше случай (B) - когда аспирин, 2,4 - D или октановая кислота; указанный выше случай (C) при превращении поверхностных сложноэфирных групп в карбоксилатные ионы или группы.
Конечно, другие структуры разных размеров могут быть легко получены специалистом при соответствующем изменении компонентов дендримера и числа используемых генераций. Грубое сравнение трех разных рядов дендримеров относительно lg G антитела показано на фиг. 3. Ряд рисунков, представленных на фиг. 3 (B) I показывает плотные звездчатые полиамидоамины (ПАМАМ = PAMAM); II показывает плотные звездчатые полиэфиры (ПЭ = РЕ); и III показывает плотные звездчатые полиэтиленимины (ПЭИ=PEI). Аналогично фиг. 1 все три ряда (I, II, III) имеют слева рисунок, показывающий ядро инициатора, следующий рисунок слева, показывающий звездчатый разветвленный олигомер, и оставшиеся рисунки, показывающие плотные звездчатые олигомеры и соответствующие плотные звездчатые мостиковые дендримеры. Можно видеть из этих рядов масштабных рисунков, что размеры дендримера являются близкими и действительно меньше, чем размеры, отмеченные для целого lg G антитела фиг. 3 (A). lgG антитело показано слева на фиг. 3. Масштаб составляет 1 мм = 3,5

35-40
(2) 70

(3) 60

Эти размерные характеристики являются предпочтительными для случая, когда нацеливание включает выход из сосудистой системы. Поэтому частицы дендримера с диаметром 125

Дендримеры являются желательными для доставки радионуклидов или ионов сильно парамагнитных металлов к участкам опухоли благодаря их способности хелатировать ряд ионов металлов в небольшом объеме пространства. Спаривание с антителами или фрагментами антител, которые являются специфичными для опухолей, может доставить ряд металлов на антитело, только с одной модификацией для антитела.
Соединение указателей цели с дендримерами является
другим аспектом настоящего изобретения. В предпочтительных вариантах настоящего изобретения, особенно,
когда желательно использовать антитело в
качестве указателя цели удобно могут быть использованы
на дендримере реакционноспособные функциональные группы, такие как карбоксил, сульфидрил,
реакционноспособный альдегид, реакционноспособное
олефиновое производное, изотиоцианато, изоцианато, амино,
реакционноспособный арилгалоид или реакционноспособный алкилгалоид. Реакционноспособные
функциональные группы могут быть введены в дендример
с использованием известных методов, например:
(1)
Использование гетерофункционального инициатора (в качестве исходного материала для
синтезирования дендримера.), который вводится в его
функциональные группы различной реакционноспособности. В таком
гетерофункциональном инициаторе по крайней мере одна из функциональных групп служит
участком инициирования образования дендримера, и по
крайней мере одна из других функциональных групп способна
соединяться с указателем цели, но не способна инициировать синтез дендримера. Например,
использование защищенного анилина позволяет
осуществить дополнительную модификацию NH2-групп в
молекуле без реагирования анилиновой NH2.
Функциональная группа,
которая является пригодной для соединения с
указателем цели, может быть частью молекулы инициатора в любой
одной из трех форм, а именно:
(a) в форме, в которой он используется для соединения
с указателем цели. Это возможно, когда ни
одна из стадий, включенных в синтез дендримера, не может
получаться в реакции при этом
(b) когда функциональная группа, используемая для соединения с
указателем цели, является
реакционноспособной в синтетических стадиях, включенных в синтез
дендримера, она может быть защищена использованием защитной группы, которая делает группу
нереакционноспособной к включенным
синтетическим процессам, но может быть сама легко удалена способом,
который не нарушает целостность остатка макромолекулы.
(c) в том случае, когда непростая защитная группа может быть образована для реакционноспособной функциональности, предназначенной для соединения с указателем цели, может быть использован синтетический предшественник, который является нереакционноспособным во всех синтетических процессах, используемых в синтезе дендримера. При завершении синтеза эта функциональная группа должна быть легко превращаемой в желаемую соединительную группу способом, который не нарушает целостность остатка макромолекулы.
(2) При соединении (ковалентно) желаемой реакционноспособной функциональной группы с
предварительно
образованным дендримером используемый реагент должен содержать функциональность, которая
легко взаимодействует с концевыми функциональными группами дендримера. Функциональная группа,
используемая в
конечном счете для соединения с указателем цели, может быть в ее окончательной форме, как
защищенная функциональность, или как синтетический предшественник. Форма, в которой
используется эта
соединительная функциональность, зависит от ее целостности в ходе используемого процесса синтеза и
способности конечной макромолекулы выдерживать любые условия, необходимые для того,
чтобы сделать
эту группу способной для соединения. Примеры соответствующих соединительных агентов могут быть
найдены в науке, например, в опубликованной Заявке на Европейский патент 0430863,
опубликованный 5 июня
1991 г. Например предпочтительный путь для ПЭИ использует

Примеры гетерофункциональных инициаторов для использования в указанном выше (1) включают в себя следующие иллюстративные примеры:


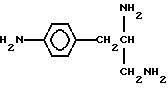
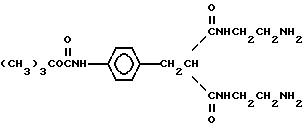
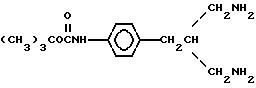


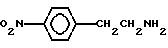
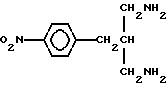

Имеется несколько химий особой важности:
1) химия плотных звездчатых или STARBURST "полиамидоаминов" ("ПАМАМ" = "PAMAM");
2) химия плотных звездчатых или STARBURST "полиэтилениминов" ("ПЕЭ" = "PEI");
3) химия соединения плотного звездчатого или STARBURST ПЭИ (PEI) с поверхностью ПАМАМ (PAMAM);
4) химия плотного звездчатого или STARBURST "полиэфира" ("ПЭ" = "PE").
Модификации функциональностей
поверхности дендримеров могут дать
другие пригодные функциональные группы, такие как следующие: -OPO3H2,
-PO3H2, -PO3H(-1), -PO

ацетат
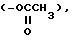



где R представляет алкил, арил или водород;
R1 представляет алкил, арил, водород или

R2 представляет алкил, арил или

R3 представляет -OH, -SH, -CO2H, - SO2H или -SO3H;
R4представляет алкил, арил, алкокси, гидроксил, меркапто, карбоксил, нитро, водород, бромо, хлоро, иодо или фторо; R5 представляет алкил,
X представляет NR, O или S;
n представляет целое число 1,2 или 3;
полиэфиры; или другие иммунонечувствительные остатки, где во всех указанных выше случаев алкил является линейным или разветвленным C1-18-углеводородом, а арил является бензилом или нафтилом, который может быть замещен одним или более C1-4 -алкилом, бром, хлоро, йодо, фторо или трифторметилостатками.
Выбор функциональной группы зависит от конкретного применения, для которого предназначается дендример. Например, дендример, имеющий 1, 4,7,10-тетрааза-цикодекан-1,4,7,10-тетрауксусную кислоту (ДОТА-DOTA) или 1,4,7-трис(карбометоксиметил)-1, 4,7,10- тетраазилциклодекан (ДОЗА метилэфир) в качестве функциональной группы, может быть использован в качестве носителя магнитно-резонансной визуализации или в качестве ядерно-магнитно-резонансных реагентов.
Эти функционализированные дендримеры получаются, например, взаимодействием функционализирующей группы, такой как ДОЗА метилэфир, с эпоксидной или эпоксидзамещенной C1-18-алкилом группой с образованием гидроксиэтилированного продукта. Гидроксиэтилированный продукт взаимодействует с соединительным агентом, таким как дициклогексилкарбодиимид (ДЦК = DCC), и затем взаимодействует с плотным звездчатым ПАМАМ-полимером. Дендример, имеющий ДОТА в качестве функциональной группы, может быть получен при использовании изоцианатного производного ДОТА, такого как 1-[1-карбокси-3-(4'-изотиоцианатофенил)пропил] -4,7, 10- трис(карбоксиметил)-1,4,7,10-тетраазациклодекан с плотным звездчатым ПАМАМ-полимером. Другие соответствующие хелаты могут быть присоединены известными способами. При необходимости, ион лантанида или ион псевдолантанида может быть введен традиционными методами.
Соединение антитела с дендримерами является другим аспектом настоящего изобретения. Обычно антитела или фрагменты антител соединяются с дендримером хорошо известными в науке способами, такими как присоединение между функциональной группой на дендримере и остатками, такими как карбогидрат, амино, карбоксил или сульфидрилфункциональности, имеющиеся в антителе или фрагментах антител. В некоторых случаях соединительные группы могут быть использованы в качестве соединителей или спейсеров между дендримером и антителом или фрагментом антитела. Присоединение дендримера к антителу или фрагменту антитела должно быть осуществлено таким образом, что бы не сделать значительного изменения иммунореакционноспособности антитела или фрагмента антитела, т.е. при соединении антитела или фрагмента антитела через функциональность в антителе или фрагменте антитела, который не является частью участка антигенного распознавания и соединения.
Переносимый генетический материал и трансфекция
1. Введение
Перенос
генетического материала в клетки имеет много
возможных применений в качестве терапевтических и/или диагностических агентов для болезней человека. Генетический материал может быть трансфекцирован и
последовательно транскрибирован и выражен,
чтобы
получить новые протеины в клетках, заменяя либо аберрантные (отклоняющиеся от нормы), либо отсутствующие протеины, что обусловлено генетическими
дефектами. К тому же, более мелкие частицы
генетического материала, включая либо ДНК, либо РНК, могут быть трансфекцированы в клетки, чтобы действовать как ферменты, которые могут изменить функцию
клетки или создать специальный переносчик
РНК
для исправления других типов генетических дефектов. Синтетический генетический материал, такой как модифицированные формы антисмысловых олигонуклеотидов,
может быть перенесен в клетки для
блокирования
выработки специальных протеинов. Это может быть использовано в подавлении клеток, которые растут аномально, таких как раковые клетки, или для изменения
обычных функций клеток, таких как
подавление
иммунитета для трансплантации органов. Маленькие частицы генетического материала, такие как аптимеры, могут также функционировать как лекарства, и перенос
этих форм нуклеиновых кислот
может, в
частности, изменить клеточные функции подобно фармацевтическому способу.
Наиболее важной частью геннопереносной терапии является носитель или способ, которым генетический материал переносится в клетки. Перенос является сложным процессом, состоящим из ряда различных стадий. Первой функцией носителя является связывание и защита ДНК от гидролиза или ферментации. Носитель должен затем облегчать перенос генетического материала в клетку. Сразу в клетке носитель должен защищать ДНК от разложения в эндосомах и направлять материал в специальные компартменты в клетке. Эти компартменты (участки) могут включать ядро, либо для введения генетического материала в хромосомы, либо для временной экспрессии переносимого генетического материала через транскрипцию и трансляцию. Напротив, может потребоваться перенос к цитоплазматической эндоплазматической сети для функций, таких как рибосомное редактирование или прекращение выработки протеинов через антисмысловое ингибирование. Сразу в соответствующем компартменте генетический материал также должен быть высвобожден из носителя для того, чтобы он смог функционировать. Таким образом, способность к защите, переносу и обеспечению функционирования генетического материала являются критическими характеристиками соответствующего носителя для генной терапии.
Кроме многих активностей, которые должен обеспечить носитель генетического материала, имеются некоторые моменты, которых важно избежать в носителе. Носитель не должен быть иммуногенным и не должен индуцировать иммунную реакцию для переносимой ДНК, в случае применения in vivo. К тому же он не должен образовывать нерастворимые комплексы с ДНК, что предотвращает их применение или способность эффективно достигать их клеточную мишень, или в тканевой культуре, или отдельно. Важно, чтобы носитель был нетоксичным для клеток in vitro или для организмов in vivo, так как это будет заметно снижать количество материала, которое может быть применено и может быть потенциально опасным.
Имеются две основные формы переноса генетического материала. Как требуемое связывание, так и защита генетического материала, перенос генетического материала в клетку и высвобождение материала для функциональной активности. Однако, имеется главное различие между двумя формами переноса. Одна форма использует носитель, который соединяется неспецифически с клетками через заряд или другое взаимодействие и переносят ДНК, в основном, во все клетки, с которыми он контактирует. Это может иметь место in vitro или in vivo в замкнутом пространстве, таком как сустав. Наполнитель этого типа является особенно важным в терапии, где клетки трансфектируются в тканевую культуру и повторно вводятся в индивидуум. Эта "ex vivo" терапия, широко используется в ряде различных заболеваний, устанавливает и требует, чтобы наполнитель был высоко эффективным в связывании и транспортировании генетического материала почти во все клетки, с которыми он взаимодействует. Другой тип носителя, специфически нацеливается только на некоторые типы клеток. Указатель цели (направитель), связанный с этим носителем, облегчает специфическое взаимодействие между мишенью на клетке и комплексом ДНК-носитель, что облегчает поглощение в мишенях-клетках. При использовании этого носителя неспецифическая трансфекция клеток является нежелательной в качестве экспрессии, или действие трансфекцированного генетического материала в нецелевых клетках может быть вредным для здоровья. Указатель цели (мишени) может также увеличить трансфекцию клеток in vitro для ex vivo терапевтических или диагностических целей через усиление соединения и переноса в клетках. В этом случае вредное воздействие неспецифической трансфекции отсутствует, так как все клетки в культуре являются целевыми.
Искусство генной терапии развивается большими темпами, написаны многочисленные статьи и книги, описывающие методику генной терапии. Одной из таких книг является Recombinat DNA, second edition, by James D. Waston et al. 1992, distributed by W.H. Freeman and Company. New-York.
Плотные звездчатые полимеры настоящего изобретения могут образовать комплекс с генетическим материалом и быть использованными для генной терапии в организмах млекопитающих, например людей. Способ предотвращения или лечения заболеваний содержит трансфекцию клеток млекопитающего плотным звездчатым полимером, образующим комплекс с генетическим материалом. Как рассматривалось ранее, генетический материал может быть трансфекцирован в клетки по целому ряду причин, включая получение протеинов в клетках, изменение функций клеток, исправление генетических дефектов, действие в качестве лекарств и т. п. Таким образом, генетические заболевания или условия, в частности, могут быть предупреждены или излечены при использовании комплекса плотного звездчатого полимера и генетического материала настоящего изобретения.
Количество генетического материала, используемого в растворе комплекса, генетический материал : дендример, является достаточным для достижения требуемого профилактического, терапевтического или диагностического эффекта. Это количество будет изменяться как функция искомого эффекта, легкости, с которой мишени-клетки успешно трансфекцируются, эффективности всякого указателя цели, присоединенного к дендримеру, и способ применения комплекса, т. п. in vitro, in vivo и, если in vivo внутривенной, локальной или прямой инъекции в конкретную опухоль, орган, железу или другую ткань.
Раз количество генетического материала и его заряд определены, затем определяется количество используемого дендримера как функция выбранного соотношения зарядов генетический материал : дендример. Достаточное количество дендримера используется в растворе, чтобы дать желаемое соотношение зарядов. Выбранное соотношение зарядов изменяется как функция одинаковых переменных, которые влияют на концентрацию раствора генетического материала, а также независимо от того, DEAE-декстран или глицерин используется для синергического усиления трансфекции. Вообще говоря, соотношение зарядов генетический материал:дендример может быть от примерно 10:1 до примерно 1:10000 (возможно даже ниже), но более предпочтительно от примерно 3:1 до 1:1000, от 1:1 до 1: 100, от 1:1 до 1:15 или от 1:5 до 1:10, как функция от вышеуказанных переменных.
Способ введения человеческих генов в клетки млекопитающих, чтобы избежать значительной перегруппировки генов или других изменений, которые могут влиять на экспрессию генов, может осуществляться путем трансфекции клетки млекопитающего дендритным полимером(ами), предпочтительно плотным звездчатым дендримером, образующим комплекс с генетическим материалом.
Перенос генов может быть эффективен при трансфекции целого ряда типов клеток, таких как кроветворные клетки, фибробласты кожи, гепатоциты и т.п. Таким образом, способ предупреждения или лечения генетических расстройств может содержать трансфекцию плотного звездчатого полимера, образующего комплекс с генетическим материалом в кроветворную стволовую клетку, каждую фибробластовую клетку, гепатоцит и т.п., введение трансфекцированной клетки в организм млекопитающего и экспрессию указанной клетки для получения профилактического или терапевтического эффекта.
Трансфекция, как рассматривается в настоящем изобретении, может быть использована для целого ряда целей, включая in vitro, in vivo и ex vivo применения. Кроме того, in vitro применение комплекса плотных звездчатых полимеров и генетического материала настоящего изобретения может быть использовано для определения или диагнозирования различных состояний. Способ диагнозирования заболевания или состояния организма млекопитающего может быть определен и диагнозирован при использовании комплекса плотного звездчатого полимера и генетического материала настоящего изобретения.
Описанный здесь комплекс дендример-генетический материал может также означать "конъюгат" настоящего изобретения, как широко используемый здесь термин. Дендример (или плотный звездчатый полимер, P) ассоциируется с переносимым биологическим модификатором, который является биологически активным материалом, и, в данном случае, генетическим материалом, с образованием конъюгата настоящего изобретения. Может также присутствовать целеуказатель (направитель), T. Это изобретение непосредственно доставляет генетический материал к определенным клеткам, и эти уникальные характеристики рассматриваются далее дополнительно.
Функция дендримеров в качестве носителя для переноса генетического материала рассматривается ниже. Приводятся примеры как для неспецифической трансфекции клеток, так и специфически направленной трансфекции. Малая токсичность или иммуногенность наблюдается в любом применении. Таким образом дендримерные носители могут охватывать все типы необходимых носителей, требуемых для генетической терапии.
Как указано ранее, плотные звездчатые полимеры настоящего изобретения могут быть использованы как носители для сельскохозяйственных материалов, включая генный перенос.
Имеется целый ряд известных способов трансфекции генетического материала в клетки растений. Один способ включает применение Agrobacterium. В типичном процессе ген вводится в растительные клетки при помощи первой вставки в участок клонирования плизмиды, который может воспроизвести в E.coli и содержит сегмент T-ДНК (ДНК найдена в Ti-плазмидах, обычно имеющихся в агробактерии). Результирующий промежуточный вектор-челнок затем вводится в E.coli-клетки, и трансформанты выбираются по устойчивости к ампицилину, кодированному в pBR 322-последовательностях. Затем плазмида переносится от E.Coli-клетки к Agrobacterium-клетке скрещиванием. Сразу внутри Agrobacterium плазмида интегрирует в Ti -плазмиду с помощью гомологической рекомбинации Т-ДНК-последовательностей на двух плазмидах. Этот способ помещает всю интегрированную плазмиду (плазмиду, интегрированную в Ti-плазмиду) между левой и правой границами T-ДНК. Плазмиды, которые не в состоянии интегрировать, не аккумулируют, потому что они испытывают нехватку репликатора для Agrobacterium. Агробактерии, содержащие рекомбинационную Ti-плазмиду, отбираются и используются для заражения клеток растения. Клетки растения, которые присоединяют T-ДНК, идентифицируются по растению, отбираемому маркером NРТП, обладающему сопротивляемостью к канамицину. Эти клетки также содержат интересующий клонированный ген.
Кроме того, генетический материал трансфекцируется в клетки растения через вирусные векторы. Вирусные векторы являются вирусами, которые эволюционно приспособлены для распределения генов по всему зараженному растению. Если вирусный геном включает посторонний ген, тогда тот тоже будет систематически распространяться по всему растению. Вирусные векторы могут обойти проблемы доставки генов к однодольным растениям, которые являются менее восприимчивыми к агробактериям. Генетический материал может заменить зону кодирования с протеиновой оболочкой в A компоненте генома геминивируса (например, мозаичного вируса золотого томата). Имеются ДНК-вирусы с геномами, выполненными из двух одноцепочечных молекул ДНК, каждая из которых проходит через двуцепочечную репликативную форму. A-молекула в отдельности может воспроизвестись в клетках растения, но B-молекула требуется для инфективности. Как A, так и B гены должны присутствовать в клетке для продуктивной вирусной инфекции.
Другие способы трансфекции генетического материала в клетки растений включают введение генетического материала непосредственно в клетки с использованием физических средств. Один физический способ введения генетического материала в клетку растения использует электропорацию. Обычно, высокая концентрация плазмида-ДНК/содержащего генетического материала доставляется к суспензии протопластов, и смесь подвергается воздействию электрического поля при 200-600 В/см. Под действием электроporation протопласты растут в тканевой культуре в течение 1-2 недель перед началом селекции клеток, которые присоединяют ДНК. Обычно, этот способ достигает эффективности 0,1-1%.
Другой способ физического введения генетического материала в клетки растений включает использование мельчайших шариков металла (такого как вольфрам), покрытых соответствующей ДНК. Эти шарики, т.е. микросферы 1 мкм в диаметре, впрыскиваются непосредственно в клетки. ДНК просто осаждается на поверхности шариков, которые выстреливаются из "пушки" со скоростью 430 м/сек. Мишени могут включать в себя суспензионные культуры эмбриональных клеток, осажденных на фильтрах, неповрежденные листья и семена. Клетки на прямой линии огня являются погибшими, но имеется концентрическая зона клеток, где шарики проникают в клетки без их гибели. Морфологический анализ листьев, подвергнутых бомбардировке вектором генов β- глюкоронидазы (GUS), показывает, что частицы вольфрама могут проникать по крайней мере через один слой ткани, эпидермис листьев, с достижением мезофилла. Покрытые ДНК микросферы также используются для введения генетического материала в хлоропласты.
Дендритные полимеры и, особенно, плотные звездчатые полимеры настоящего изобретения обладают значительными преимуществами при использовании в трансфекции генетического материала в клетки растений. Известные способы, например, могут быть модифицированы, чтобы позволить плотному звездчатому полимеру (например, плотному звездчатому дендримеру) вместе с генетическим материалом трансфекцировать клетку, обеспечивая в результате преимущества, установленные выше. В частности электропорация или мельчайшие металлические шарики могут быть использованы, чтобы обеспечить трансфекцию плотного звездчатого полимера и генетического материала в клетки растений.
B. Дендример.
Настоящее изобретение содержит, в одном аспекте, понятие переноса генетического материала на дендритных полимерах, и/или осуществления трансфекции такими комплексами. В более широких аспектах используемый здесь термин "дендритный полимер" не предназначен для ограничения его плотными звездчатыми полимерами. "Дендритным полимером" является полимер, имеющий регулярное дендритное разветвление, образованное последовательным или генерационным присоединением разветвленных слоев к ядру или от ядра. Термин "дендритный полимер" охватывает "дендримеры", которые характеризуются ядром по крайней мере одним внутренним разветвленным слоем и поверхностным ответвленным слоем. (Смотри Petar R.Dvornic and Donald A.Tomalia in Chem. in Britain, 641-645, август 1994). "Дендран" является разновидностью дендримера, имеющего ответвления, исходящие от фокальной точки, которая является или может быть соединена с ядром, либо прямо, либо через соединительный остаток с образованием дендримера. Многие дендримеры содержат два или более дендронов, соединенных с общим ядром. Однако термин дендример используется широко с охватом единичного дендрона.
Дендритный полимер включает в себя, но не ограничивается этим, симметричные и несимметричные разветвленные дендримеры, каскадные молекулы, арборолы и т.п., хотя наиболее предпочтительными дендритными полимерами являются плотные звездчатые полимеры. Рассмотренные здесь плотные звездчатые ПАМАМ (PAMAM)- дендримеры являются симметричными, в которых ветви разветвления являются равной длины. Разветвление имеет место при водородных атомах концевой NH2-группы на разветвлении предшествующей генерации. Лизин-разветвленные дендримеры из Примера 78 являются несимметричными, у которых ветви разветвления являются различной длины. Одно ответвление имеет место при ε-N молекулы лизина, тогда как другое ответвление имеет место при α-N, смежным с реакционноспособной карбоксигруппой, которая присоединяет ответвление к ответвлению предыдущей генерации.
Несмотря на то, что даже будучи образованными регулярным последовательным присоединением разветвленных слоев, гиперразветвленные полиолы могут быть эквивалентными дендритному полимеру, где образец разветвления имеет степень регулярности, близкой к степени регулярности дендримера.
Дендритные полимеры включают в себя мостиковые дендримеры и дендримерные агрегаты. Дендритные полимеры охватывают как генерационно монодисперсные, так и генерационно полидисперсные растворы дендримеров. Дендримеры в монодисперсном растворе являются фактически все одной генерации, а значит однородного размера и формы. Дендримеры в полидисперсном растворе содержат распределение дендримеров различных генераций. В предпочтительном варианте полидисперсные дендритные полимеры содержат по крайней мере три различных генерации размером от примерно 22 до примерно 110

Дендритные полимеры также охватывают поверхностно-модифицированные дендримеры. Например, поверхность ПАМАМ-дендримера может быть модифицирована присоединением аминокислоты, например лизина.
Необходимо понимать, что ссылка на любой конкретный тип дендритного полимера, как "полимер", например, "плотный звездчатый полимер" и "несимметричный дендритный полимер", "каскадный полимер", также предназначена для того, чтобы охватить мостиковые дендримеры этого типа, дендримерные агрегаты этого типа, полидисперсные дендримеры этого типа и поверхностно-модифицированные дендримеры этого типа.
Когда переносимым материалом является генетический материал, поверхность дендримера предпочтительно содержит преобладание положительно заряженных функциональных групп. Более предпочтительно такая положительная функциональность достигается обеспечением концевых аминогрупп на поверхности дендримера. Положительно заряженные функциональные группы могут быть также введены на поверхность химически (например, четвертичные амины). Такая аминофункциональность обеспечивается полиаминным, полиамидоаминным и полиалкилениминным (например, полиэтиленаминным и полипропилениминным) дендримерами, описанными выше, хотя она может достигаться другими путями.
В широком плане дендримеры, используемые для переноса генетических материалов, являются сферической, эллипсоидной или стержнеподобной конфигурации. Их наименьший диаметр(ы) поперечного сечения составляет предпочтительно не менее 50


Дендримеры с меньшими диаметрами также могут быть использованы для трансфекции клеток генетическим материалом, однако, наилучшие результаты получаются, если меньший комплекс ДНК:дендример последовательно ассоциируется с, большими дендримерами, которые имеют диаметр около 50


Предполагается, что при использовании в такой последовательности меньшие дендримеры могут иметь их наименьшие диаметры ниже примерно 22

Комбинации двух дендримеров различного диаметра, образующих комплекс с ДНК, также могут усилить трансфекцию. Это особенно справедливо, когда смесь дендримеров является полидисперсной по размеру, т.е., когда размеры частиц находятся в интервале от примерно 22 до примерно 110

Сфероидальный дендример может быть получен при использовании в качестве начальной генерационной реакционной последовательности, обычно, со сферическим инициатором или материалом ядра, наиболее предпочтительно имеющим три реакционноспособных участка, отходящих от ядра, обычно, на равном расстоянии друг от друга, например, аммиака. (Смотри, например, публикацию Европейского патента 0115771 и Патенты США 4507466, 4558120, 4568737, 4631337, 4587329 и 4737550). Дендример может быть удлиненной эллипсоидальной или стержнеподобной конфигурации вначале с удлиненным полимерным ядром, имеющим множество реакционноспособных участков, отходящих радиально от ядра в разных точках по его длине, например, полиэтиленамин. (Смотри, например, публикацию Европейского патента 0234408 и Патент США 4694064). Эллипсоидальный дендример стартует с материалом более короткого ядра, чем ядро, используемое для стержнеподобного дендримера, например этилендиамином (ЭДА).
В сферическом дендримере диаметр сферы предпочтительно лежит в описанных выше предпочтительных интервалах диаметра. В эллипсоидальном дендримере или стержнеобразном дендримере диаметр истинного поперечного сечения эллипсоида или стержня предпочтительно имеет указанный выше предпочтительный диаметр(ы). Истинное поперечное сечение не является идеальным кругом и может иметь диаметры разной длины в зависимости от того, где берется поперечное сечение. Предполагаются длины до 1000

Мостиковые дендримеры также могут быть использованы для переноса генетического материала. Эти структуры могут значительно отличаться по форме, но, в основном, они образуются при ассоциировании смежных плотных звездчатых дендримеров друг с другом, особенно, через ковалентную связь, но нековалентное взаимодействие также является возможным. Четыре или пять небольших сферических, эллипсоидных или стержнеобразных дендримеров могут быть сшиты вместе с образованием агрегатной мономолекулярной структуры, которая имеет эффективность трансфекции дендримера более высокой генерации.
Интересная разновидность понятия мостиковых дендримеров включает в себя образование макромолекулярных пучков, где материал ДНК или РНК служит в качестве нековалентной сетки между отдельными дендримерами, где образуется сетка, например, на базе электростатического взаимодействия. Эта модель, по-видимому, апроксимирует комплекс из примера 46, рассмотренный выше, в котором ДНК сначала образует комплекс с меньшим дендримером (например, G5), после чего комплексы ДНК:дендример последовательно смешиваются с дендримером большего диаметра (например G9), как на фиг. 15 и 16.
Агрегаты дендримеров большого диаметра образуются в результате притяжения дендримером с концевыми аминогруппами вокруг ядра дендримеров с концевыми карбоксилатными группами. В зависимости от соотношения двух классов дендримеров, используемых в рецептуре, а также концентрации, при которой они получают, образуются различные типы агрегатов дендримеров. Эффективность трансфекции оказывается наибольшей, когда в дендримере присутствуют дендример с аминным окончанием и дендример с карбоксилатным окончанием; при соотношении положительного заряда дендримера и отрицательного заряда дендримера, предпочтительно от примерно 25:1 до примерно 100:1, что приводит к образованию агрегатов, которые имеют общий положительный заряд (пример 74). При использовании соответствующих соотношений эффективность трансфекции может быть больше, чем эффективность, которая наблюдается для родительского дендримера с аминным окончанием, использующегося при том же соотношении ДНК: дендример и в присутствии DEAE-декстрана (который также увеличивает эффективность трансфекции).
Дендримеры полной генерации (с аминным окончанием) и дендримеры половинной генерации с карбоксилатным окончанием образуют агрегаты дендримеров при pH около 6-9, в зависимости от соотношения дендримеров с аминным окончанием и карбоксилатным, а также от концентраций образцов. При pH > 9 протонированные первичные амины дендримеров полной генерации начинают депротонировать с разрушением, таким образом, агрегатов. При pH > 6 карбоксилаты и внутренние третичные амины дендримеров половинной генерации протонируются, что приводит к образованию цвиттерионов (аморфных ионов) в дендримерах половинной генерации и, таким образом, также диссоциируются агрегаты. Насколько нам известно, агрегат ПАМАМ-дендримеров является единственным материалом, который обладает этим уникальным свойством.
Известно, что pH снаружи клетки составляет 7,2, а внутри клетки около 5,0. Поэтому, целесообразно конструировать и получать агрегаты дендримеров с более высокой молекулярной массой из дендримеров более низкой генерации при pH 7,4 так, что размеры агрегатов дендримеров являются большими, достаточными для эффективного комплексообразования молекул ДНК. Однако, для того, чтобы связать ДНК, эти агрегаты дендримеров должны нести чистые положительные заряды, что означает, что дендримеры полной генерации должны быть в большом избытке по сравнению с дендримерами половинной генерации. Одной из интересных характеристик системы доставки является то, что после того, как комплекс поступает в клетку, агрегаты дендримеров разрушаются благодаря более низкому значению pH внутри клетки. Эта диссоциация также может увеличить эффективность трансфекции.
Ковалентная модификация аминогрупп поверхности ПАМАМ-дендримеров аминокислотой, лизином, показала неожиданное и уникальное увеличение эффективности трансфекции (пример 75, фиг. 57). Использование модифицированного лизином G7 (NH3) дендримера, образующего комплекс с плазмидой, дает значительно увеличенную экспрессию гена люциферазы по сравнению с немодифицированным G7 (NH3) дендримером, и, кроме того, комплексы, образованные модифицированным лизином G7 (NH3 ) дендримером, показывают трансфекцию, эквивалентную трансфекции G10 (NH3 )дендримера (все эксперименты были проведены при зарядном соотношении ДНК: дендример = 1:10 и в присутствии DEAE-декстрана). Этот эксперимент предполагает, что увеличение плотности заряда дендримеров влияет на процесс трансфекции, т.к. pKa ε - аминогруппы составляет 10,53 по сравнению с приблизительным pKa 9 для концевых аминогрупп ПАМАМ-дендримера. Могут ожидаться другие модификации поверхности для увеличения трансфекции в такой же или в большей степени.
C. Описание
активностей неспецифической трансфекции дендримеров
Точный механизм
неспецифической (т.е. нецеленаправленной) трансфекции клеток комплексами
ДНК: дендример является неизвестным, однако,
некоторые моменты являются очевидными. Не желая быть связанными с какой либо
теорией, мы предполагаем, что ДНК связывается с дендримером на основе
взаимодействия зарядов, и что наиболее эффективная
трансфекция имеет место, когда комплекс образуется в избытке положительного
заряда. Взаимодействие между комплексом ДНК: дендример и клеткой
является, вероятно, благодаря связыванию положительно
заряженного комплекса с отрицательно заряженными фосфолипидами на поверхности
клеток. Трансфекция в присутствии сыворотки или недостаточной
отмывки сыворотки от поверхности клеток, по-видимому,
предотвращает трансфекцию в результате нейтрализации зарядов клетки-поверхности,
предотвращая тем самым сцепление комплексов с клетками.
Интересно, что некоторые типы комплексов ДНК:дендример работают
лучше для неспецифической трансфекции конкретных клеток. Эта находка
предполагает, что имеются различия в поверхности клеток, что
облегчает взаимодействие с некоторыми типами комплексов ДНК-дендример.
Возможно, различные дендримеры могут быть использованы или
разработаны для наиболее эффективной трансфекции различных типов
клеток.
Также возможно, что данные замеченные различия в размере форм генетического материала, используемого в генопереносной терапии, разные размеры и плотности зарядов дендримеров могут быть необходимыми для эффективной неспецифической трансфекции различных форм генетического материала. В теории комплекс генетический материал:дендример, который эффективно связывается с клетками на базе взаимодействия зарядов, может очень отличаться от небольших частиц генного материала, такого как олигонуклеотиды только нескольких оснований в длину, и более крупных частиц генетического материала, такого как большие ДНК-плазмиды. Вообще, требуется, чтобы генетический материал образовывал небольшой комплекс, который имел бы на своей поверхности положительный заряд высокой плотности, для трансфекции на основе взаимодействия зарядов. В этой области использование меньших дендримеров, за которыми следуют большие дендримеры, или использование полидисперсных дендримеров может быть важным для формования уникальных комплексов, которые являются наиболее эффективными для переноса ДНК. Также добавление DEAE-декстрана или глицерина к трансфекционному буферу после образования комплекса ДНК:дендример показывает удивительное и неожиданное увеличение клеточной трансфекции. Добавление в трансфекционные буферы других агентов, таких как хлорохин, которые могут либо помогать в высвобождении ДНК из эндосом, либо предотвращать их разложение в эндосомах, также может иметь значение для увеличения трансфекции комплексами дендримеров. Однако, эти находки могут быть уникальными для неспецифической трансфекции in vitro с различными условиями или комбинациями материалов, таких как фузогенные пептиды, являющимися более эффективными для увеличения трансфекции in vivo или с целенаправленными дендримерными носителями.
D.
Генетический материал и его комплексообразование с
дендримером с образованием конъюгатов
Генетическими
материалами являются материалы на основе нуклеотидов, включая без ограничения, вирусы и
вирусные фрагменты, плазмиды, фаги, космиды, гены
и фрагменты генов (т.е. экзоны, интроны),
дезоксирибонуклеиновую кислоту (ДНК), как одно-, так и двуцепочечную, рибонуклеиновую кислоту (РНК),
рибосомную РНК (рРНК), каталитическую РНК (кРНК),
ядрышковую РНК (яшРНК), информационную РНК
(иРНК), транспортную РНК (тРНК), ДНК- и РНК-олигонуклеотиды (как одно-, так и двуцепочечные), или олигомеры
и (антисмысловые)олигонуклеотиды,
протеиннуклеиновые кислоты (ПНК=PNK) и замещенные
олигонуклеотиды нуклеиновых кислот. Генетический материал, особенно вирусы и вирусные фрагменты, может образовать
комплекс или соединиться с частью
протеина. Термин "генетический материал"
предназначается также для включения "модифицированных нуклеотидов", как описано более полно ниже. Нуклеотиды могут быть
модифицированы для того, чтобы
сделать их более устойчивыми к ферментативному
разложению, увеличить клеточное поглощение или для других целей. Для того чтобы улучшить поглощение клетками и/или
устойчивость к ферментативному
разложению, ученые заменили отрицательный кислород на
фосфодисложноэфирной главной цепи метилом или серой, получая метилфосфонаты или фосфорилтиоаты. Это дает в
результате цепь
ферментативноустойчивого производного синтетического нуклеотида, обладающего
постоянной целосностью при смешивании с клеточным биологическим материалом. Нуклеазастойкие цепи могут быть
также
получены при введении 2'-O-аллилгрупп в синтетические олигоцепи. Также создаются
фосфорилдитиоаты. Модификация достигается созданием осфат(сложных эфиров) и фосфориламидатов.
Другим типом модификации, который был исследован, является замещение фосфодисложноэфирного мостика между нуклеотидами полностью отличающимися группами, такими как силоксановый мостик, карбонатный мостик, карбоксиметил (сложный эфир)ный мостик, ацетамидный мостик, карбаматный мостик, тио(простой эфир)ный мостик и пептидный мостик. Кроме замещения фосфатного мостика, можно заместить сахарный и фосфатный остатки синтетическим полимером и получить таким образом полимер ДНК. Нуклеозидные единицы сами могут быть модифицированы.
Используемый по всему тексту термин "генетический материал" предназначается для охватывания сегментов нуклеотидов, модифицированных по любому из предложенных выше путей и другими путями. В общем, в последующем описании изобретения термин "олигонуклеотид" применяется ко всем коротким формам генетического материала.
Генетические материалы (т.е. нуклеиновые кислоты) могут резко изменяться по длине от трех оснований (около 10

Конъюгаты генетического материала и дендримера называются комплексами. Используемый здесь термин "комплекс" относится к типу конъюгата дендримера и переносимого материала, в котором ассоциация между переносимым материалом и дендримером осуществляется через ионную связь, Ван-дер-Ваальс(овые) силы, водородную связь, металлическую связь или любую из комбинацию. В комплексе переносимый материал является неассоциированным с дендримером через ковалентную связь.
Захват комплексов ДНК:дендример клетками демонстрируется для одноцепочечных ДНК-нуклеидов относительно низкой молекулярной массы (пример 47, фиг. 20 и 21), так же как и для ДНК с высокой молекулярной массой. Перенос и экспрессия гена также показаны на фиг. 22 для круговой или сверхскрученной ДНК и линейной ДНК (пример 48, фиг. 22) и в других экспериментах и других фигурах для целых генов и более длинных сегментов ДНК (например, 6,5 кб). Этот захват, который наблюдается с ДНК:дендримером, облегчается через клеточный вход, что имеет место с одной ДНК и является активным зависящим от энергии процессом целевой (мишени) клетки (пример 47).
Для того чтобы присоединить генетический материал к дендримеру, дендример, предпочтительно уже нацеленный для in vivo использования описанным ниже образом, смешивается с генетическим материалом в водном растворе при комнатной температуре (20 - 40oC) при pH от примерно 5 до примерно 10. Отрицательно заряженная нуклеиновая кислота образует комплекс с положительно заряженными поверхностями макромолекул дендримера, который имеет сетчатую структуру.
Генетический материал, такой как ДНК, образует стабильные комплексы с дендримерами при соотношении зарядов генетический материал:дендример около 10:1, с большим комплексообразованием, имеющим место при соотношении зарядов около 2:1 и ниже. (В примере 42 эффективная трансфекция видна для образца 4 при зарядном соотношении 1:0,6; смотри таблицу XIV, фиг. 18 и 32. (Это зарядное соотношение также позволяет осуществить полное комплексообразование ДНК при испытании в агарозном гене). При более низких зарядных соотношениях, например 1: 10 или 1:100, комплексы продолжают быть очень стабильными (смотри пример 49, фиг. 23), и трансфекция наблюдается даже в отсутствие DEAE-декстрана (пример 56 и фиг. 30). Комплексообразование является минимальным при зарядных соотношениях ДНК:дендример выше примерно 40:1, как указано в примере 49, фиг. 23(А)-(Д). На другом конце ряда зарядных соотношений хорошие результаты трансфекции наблюдаются для некоторых дендримеров при зарядных соотношениях ДНК:дендримеров от примерно 1:1000 и до таких низких как 1:1000 (пример 56, фиг. 30). Возможно, что с другими системами дендримеров такие низкие зарядные соотношения как 1:1000000, могут быть эффективными в трансфекции с посредником.
Соотношение зарядов оказывается определяющим фактором в образовании комплексов ДНК:дендример, как показано в примере 50, фиг. 24, где при том же мольном соотношении 1:16 G11 (ЭДА)дендример, имеющий больший поверхностный заряд, чем G8 (NH3 )дендример, образует стабильный комплекс с ДНК, в то время как G8 (NH3 )дендример, смешенный с ДНК при том же мольном соотношении, комплекс не образует. Это указывает на то, что образование комплекса больше зависит от зарядного соотношения, чем от мольного соотношения.
Комплексы ДНК:дендример являются заметно стабильными и водорастворимыми в довольно широком интервале pH , т.е. 5,2- 9,8 (пример 51, фиг. 25) и в широком интервале солевых концентраций, т.е.0,1-5 M (пример 52, фиг. 26). Комплексообразование генетического материала с дендримером защищает его от усвоения в присутствии либо ферментов ограничения эндонуклеазы, либо клеточных нуклеаз (пример 53, фиг. 27, пример 54, фиг. 28). Это делает эти комплексы стабильными для трансфекции клеток in vivo.
Количество генетического материала на клетку, которая может быть трансфекцирована с использованием комплексов ДНК:дендример, может изменяться и до точки, когда увеличение концентрации генетического материала имеет тенденцию к увеличению степени трансфекции (пример 55, фиг. 29). При данном зарядном соотношении трансфекция проявляется лучше при 5 мкг плазмида-ДНК на ячейку культуры (около 200000 клеток), чем при 2 мкг плазмида-ДНК, хотя этот эффект проявляется в плато при 10 мкг плазмида-ДНК на ячейку.
Считается, что растворы комплексов генетический материал:дендример, в которых концентрация генетического материала составляет от примерно 1,0 до примерно 10,0 мкг/мл, используется in vitro и in vivo. Используемая in vivo концентрация будет, конечно, изменяться как функция способа введения. Более концентрированный раствор будет использоваться для внутривенной инъекции при условии разбавления, которое будет иметь место в кровотоке. Более разбавленный раствор может быть использован для специального локального введения, например для инъекции в опухоль или орган.
Таким образом, достаточное количество генетического материала с получением конечной концентрации от примерно 1,0 до примерно 10 мкг/мл смешивается в воде с достаточным количеством дендритного полимера, имеющего, по существу, положительную поверхностную функциональность с получением соотношения зарядов генетический материал: дендритный полимер от примерно 10:1 до примерно 1:10000, более предпочтительно от примерно 3:1 до примерно 1:1000, или более предпочтительно от примерно 1,5:1 до примерно 1:100, или от примерно 1:1 до примерно 1:15, или от примерно 1:5 до примерно 1:10, как функция рассмотренных выше переменных. Смешение проводится при pH от примерно 5 до примерно 10 и температуре от примерно 20 до примерно 40oC.
Вообще говоря, соотношение зарядов генетический материал:дендример может быть от примерно 10: 1 до примерно 1:10000 (возможно даже ниже), но более предпочтительно между примерно 5: 1 или даже 3:1 до 1:10000. Соотношение, выбранное в этом интервале, может изменяться как функция того, используется или нет усиливающий агент, такой как DEAE-декстран, глицерин или хлорохин, или когда используется целеуказатель (направитель). Хотя вышеуказанные широкие пределы являются еще применимыми, предпочтительный интервал соотношения зарядов, когда не используется усилитель, составляет от примерно 1:5 до примерно 1: 10000, более предпочтительно 1:10 до примерно 1:10000. Аналогично, если используется усилитель, предпочтительный интервал соотношения зарядов составляет от примерно 5:1 до примерно 1:10000, предпочтительно от примерно 1: 1 до примерно 1:100, более предпочтительно от примерно 1:1 до примерно 1:15, и наиболее предпочтительно от примерно 1:1 до примерно 1:10. Наконец, когда используется целеуказатель (направитель), считается, что могут быть использованы более высокие зарядные соотношения с лучшим эффектом, чем для ненаправленной трансфекции. Таким образом считается, что предпочтительный интервал составляет от примерно 10:1 до примерно 1:10, более предпочтительно от примерно 3:1 до примерно 1:10, более предпочтительно от примерно 1: 1 до примерно 1:10 и, в некоторых обстоятельствах наиболее предпочтительно примерно 1:1. Эти пределы рассматриваются более полно ниже.
Обычно, комплексы первоначально смешиваются при концентрациях генетического материала от примерно 1,0 до примерно 10,0 мкг на 20 мкл и затем разбавляются в 50 раз к конечной концентрации от 1,0 до 10,0 мкг генетического материала на мл. Растворы комплексов генетический материал: дендримерный полимер, либо с начальной более высокой концентрацией, либо с конечной концентрацией, могут быть упакованы как соответствующие диагностические или фармацевтические композиции.
E. Усиление трансфекции
Можно
осуществить трансфекцию клетки генетическим материалом, используя только дендритные полимеры,
но сначала большими (> G8) дендримерами при более низком соотношении зарядов генетический
материал:дендример, например примерно 1:5 и ниже, предпочтительно ниже примерно 1:10. (пример 56, фиг.
30 и 31). Трансфекция, использующая дендример и только генетический материал, может быть
усилена
первым комплексообразованием генетического материала с более низкой генерацией дендримера, например G5,
с последующим присоединением большего дендримера, например G9, как рассматривается
выше (пример
46, фиг. 15 и 16). Первый дендример и образующий с ним комплекс генетический материал используются при
концентрациях, достаточных для комплекса, примерно 1 мкг генетического материала
на испытательную
ячейку.
Комплексы, неспецифически трансфекцирующие клетки, должны достигать две противоположных цели; первой является получить ДНК как можно более плотной и, в то же самое время, иметь большую плотность положительного заряда на поверхности комплекса для того, чтобы передать связь к отрицательно заряженным фосфолипидам на клеточных мембранах. Это требование двойной активности предполагает, что смесь дендримеров полидисперсных размеров может быть ценной в неспецифической трансфекции с помощью меньших дендримеров для уплотнения ДНК, тогда как большие дендримеры передают связь к клеткам. Это также может помочь созданию меньших размеров комплексов ДНК:дендример, так как дендримеры более низкой генерации будут разрушать регулярную сетку (решетку), образованную большими дендримерами и ДНК. Такие, как эти концепции подтверждаются данными, установленными электронной микрофотографией (т. е. фиг. 60, снимки 3, 4 и 5), которые демонстрируют небольшие компактные ДНК-комплексы, когда используются дендримеры с полидисперсными размерами, по сравнению с массивными комплексами ДНК:дендример, полученными только с большими дендримерами.
Трансфекция может быть также усилена через добавление целого ряда агентов к трансфекционному буферу. Неожиданно получаются результаты усиления трансфекции, когда в трансфекционном буфере присутствует DEAE-декстран с комплексом генетического материала и дендримера. Соотношение зарядов генетический материал: дендример составляет от примерно 5:1 до примерно 1:10000, предпочтительно примерно от 1:1 до 1:100, более предпочтительно от примерно 1:1 до примерно 1:15, и наиболее предпочтительно от примерно 1:5 до примерно 1: 10 (пример 56, фиг. 30; пример 57, фиг. 32; пример 58, фиг; пример 59, фиг. 34; пример 42, фиг. 17). Концентрация DEAE-декстрана должна находиться в относительно узком ряду от примерно 0,125 до 2 микромолей и более предпочтительно от примерно 0,25 до примерно 1 микромоля (пример 60, фиг. 35). Генетический материал должен образовать комплекс с дендримером перед помещением в раствор DEAE-декстран для того, чтобы имело место усиление трансфекции. Когда это выполняется, трансфекция комплексов ДНК:дендример в присутствии DEAE-декстрана при соотношении зарядов от примерно 1:1 до примерно 1: 100, более предпочтительно от примерно 1:5 до примерно 1:10, является более эффективной на порядки по величине, чем трансфекция одними комплексами ДНК: дендример в широком ряду различных типов клеток (пример 61, фиг. 36). Это справедливо даже в трудных для трансфекции линиях клеток (пример 62, фиг. 37). Она является также более эффективной, чем трансфекция при использовании других агентов, таких как ЛИПОФЕКТИН и ЛИПОФЕКТАМИН (примеры 61 - 63, фиг. 36 - 38).
Обычно, комплекс генетический материал:дендример оставляют стоять 3-5 минут после образования перед соединением с DEAE-декстраном. Хотя DEAE-декстран может быть добавлен либо к более концентрированному раствору комплекса (т. е. 1 - 10 мкг генетического материала на 20 мкл раствора), либо к трансфекционному буферу, предпочтительно, чтобы он добавлялся к последнему, которым затем разбавляется более концентрированный комплекс генетический материал:дендример.
Известно, что in vitro трансфекция усиливается при использовании традиционного ингредиента возмущения клетки. В настоящем изобретении DEAE-декстран проявляет себя более активным, чем агент клеточного возмущения, как можно видеть из примера 64, фиг. 39, в котором сравниваются эффекты DEAE-декстрана и агента клеточного возмущения ДМСО. Один ДМСО проявляет незначительное воздействие на трансфекцию комплексами ДНК:дендример по сравнению с воздействием DEAE-декстрана. Интересно, что ДМСО показывает синергический эффект DEAE-декстрана, когда оба используются вместе, что предполагает, что DEAE-декстран оказывает воздействие иное, чем клеточное возмущение.
Поскольку было показано, что добавление DEAE-декстрана или других агентов к комплексу ДНК:дендример (после его образования) является эффективным в усилении трансфекции в одинаковой манере, был проведен другой вид эксперимента для дополнительного понимания роли этого агента в усилении неспецифической трансфекции. Были сделаны электронные микрофотографии комплексов ДНК:дендример с добавлением и без добавления DEAE-декстрана. Добавление DEAE-декстрана или использование полидисперсных смесей дендримеров резко снижает размер комплексов ДНК:дендример (т.е. фиг. 60, снимки 3,4 и 5). Это обеспечивает разумное толкование, почему эти агенты усиливают трансфекцию, т.к. это является похожим на то, что комплексы меньшего размера, который достигается с этими агентами, делаются намного более пригодными для доступа в клетки и осуществления трансфекции. Комплексы ДНК:дендример должны содержать электроплотный положительно заряженный материал для действия в виде фокальной точки для связи с отрицательно заряженными фосфолипидами на поверхности клеток. Это достигается лучше при использовании дендримеров более высокой генерации, которые имеют более высокую плотность поверхностного заряда. К сожалению эти дендримеры имеют тенденцию к комплексообразованию ДНК в большие агрегаты или макросетки от примерно 2000 до 5000

DEAE-декстран действует как диспергатор, который превращает большой агрегат в меньшие комплексы, которые еще сохраняют дендример с плотностью заряда на их поверхности для связи с клетками. Полидисперсные дендритные полимеры, т.е. смеси частиц разных диаметров от примерно 22 до примерно 110

Удивительно, что глицерин подобно DEAE-декстрану, также, по-видимому, усиливает трансфекцию генетического материала в комплексах генетический материал: дендритный полимер. Концентрация трансфекционного раствора глицерина составляет предпочтительно от примерно 2 до 10% по массе, более предпочтительно от примерно 2 до примерно 5%. Это по-видимому, служит диспергирующей функцией, сравнимой с функцией DEAE-декстрана.
Хлорохин также усиливает трансфекцию и с удивительной синергией при использовании только одного в качестве усилителя или в сочетании с DEAE-декстраном. Хотя нет стремления связываться с какой-либо специальной теорией, предполагается, что хлорохин действует в полностью отличной манере от DEAE-декстрана. Предполагается, что хлорохин нейтрализует эндосомы, предотвращая в результате секвестрацию и быстрое разрушение комплексов генетический материал:дендример. Это позволяет осуществить транскрипцию и трансляцию генетического материала в большей степени, чем это осуществляется трансфекцией либо в отдельности, либо исключительно в присутствии DEAE-декстрана без добавления хлорохина (смотри фиг. 61А и 61В и пример 73). Поскольку имеются различия между клетками в их способности улавливать комплексы в эндосомы, усиливающий эффект хлорохина значительно меняется среди разных клеточных линий, как это иллюстрируется разницей в результатах трансфекции COSI - клеток (фиг. 61A) и RAT2-клеток (фиг. 61B).
Введение беспорядочной отрицательной функциональности на поверхности плотных звездчатых полимеров также влияет на трансфекцию (пример 67, фиг. 43). Такая отрицательная функциональность достигается беспорядочным усеиванием преимущественно положительно заряженной поверхности (например, имеющую аминную поверхностную функциональность) карбоксигруппами. Дендримеры как с положительной (катионной) так и отрицательной (анионной) функциональностью иногда называются здесь дендримерами с цвиттерионными поверхностями. Снижение общего положительного поверхностного заряда, в общем, по-видимому, снижает эффективность трансфекции, за исключением, возможно, трансфекции при низких соотношениях зарядов, например 1:10, по сравнению с 1:5 или 1:1 (фиг. 43).
F. Целенаправленная трансфекция
Введение целеуказателей (направителей) в
комплекс дендример-генетический материал не только направляет комплекс к нужной
клетке, но также может усилить трансфекцию клеток остатком указателя цели
(пример 65, фиг. 40). Достаточное количество
целеуказателя присоединяется к макромолекуле для притягивания и присоединения ее
к рецепторным участкам на клеточном материале, который должен
трансфекцироваться, но без снижения поверхностного
заряда в точке, в которой комплексообразование ДНК не имеет места. В результате
присоединения целеуказателя по такому пути или в таких
пропорционально малых количествах относительно функциональных
групп на поверхности макромолекулы, что целеуказатель незначительно мешает
катионному характеру поверхности дендритного полимера. Отсюда
способность дендримера к образованию стабильных комплексов с
ДНК (при указанных ранее соотношениях зарядов) и отсутствию ухудшения в
присутствии целеуказателя (пример 65, фиг. 41).
Использование целеуказателей в сочетании с конъюгатом дендример-генетический материал является одним из наиболее важных предпочтительных аспектов изобретения. То, что нецелевая трансфекция не имеет места так эффективно, как при указанных выше соотношениях зарядов ДНК:дендример около 1:10 или 1:5 без усиления, может быть обусловлено тем, что эти комплексы не имеют достаточного положительного заряда для связывания с отрицательно заряженными фосфолипидами на поверхности клеток. Важно, что комплекс, образованный при этих более высоких соотношениях зарядов генетический материал:дендример (т.е. от 1: 10 до 1: 1 или можно даже 3:1, или до 10:1), может быть еще нацелен для трансфекции заданных клеток целеуказателем (направителем). Непредназначенной трансфекции случайно встретившихся клеток (которая может быть нежелательной по многим соображениям) удается избежать, если комплексы ДНК:дендример получаются данным способом при этих более высоких соотношениях зарядов, или когда присутствует сыворотка (пример 66, фиг. 42). При использовании целеуказателя зарядное соотношение 1: 1 может быть предпочтительным во многих применениях.
Использование целеуказателя является очень важным для in vivo трансфекции генетического материала в клетки DEAE-декстран, нетоксичный для целей in vivo применения, не будет пригодным для in vivo применения в качестве усилителя. Комплексы дендример-генетический материал с усиливающим агентом и без него не производят значительной трансфекции клеток в присутствии сыворотки (пример 66, фиг. 42). Целеуказатель, промотирующий связывание комплекса генетический материал:дендример со специально выбранными клетками, облегчает трансфекцию генетического материала в такие клетки даже в присутствии сыворотки.
Целеуказатели или модифицированные поверхности дендримеров могут также быть использованы с комплексом дендример-генетический материал в присутствии DEAE-декстрана in vitro для усиления трансфекции. Присутствие целеуказателей, таких как трисахарид галактозы, на дендримерах, по-видимому, значительно усиливает трансфекцию генетического материала в клетках, выражающие рецептор для этого сахара. Это сравнивается с трансфекцией, осуществленной с использованием неконъюгированного G11 (ЭДА) ПАМАМ-дендримера (фиг. 40).
Соответствующие целеуказатели (направители) включат в себя любой материал, который связывает со специфичностью и высоким сродством, такой как, например, антитела, фрагменты антител, такие как Fab-, Fab'-, F(ab')2- фрагменты, одноцепочечные антитела или фрагменты любых других антител, имеющие требуемую избирательность, гликопротеины, протеины, гликолипиды, гормоны, дополнительные биологические модуляторы, эпитопы, клеточные питательные вещества, химические функциональности, обладающие специфичностью клетки-мишени (выбранной клетки) и т.п. Целый ряд путей известен специалистам для связывания целеуказателя (направителя) с дендримером.
Один способ присоединения предпочтительного целеуказателя (направителя), биотина, к дендримеру,
имеющему аминофункциональную поверхность, иллюстрируется
схематически ниже:

Присоединение пировиноградной кислоты, другого потенциального целеуказателя (направителя) к дендримеру, имеющего аминофункциональную поверхность, осуществляется в соответствии со следующей реакцией, показывающей спаривание G4-пируватов с G5-дендримерами

Степень функционализации дендримера целеуказателем (направителем) является минимальной для того, чтобы минимизировать влияние целеуказателя на общий катионный характер поверхности дендримера. Так, стехиометрическое отношение целеуказателя (направителя) к молекуле дендримера составляет от примерно 1: 1 до примерно NcN
Точно также, как отдельные молекулы дендримера могут дифференциироваться присоединением остатка указателя цели, точно также могут дифференциироваться такие агрегаты. Можно присоединить остаток указателя цели ко всем дендримерам в агрегате, или только к одному или части из них, которые затем агрегируются с другими недифференциированными дендримерами. После смешения двух типов в мягких физиологических условиях (т.е. pH 7,4) два типа будут ассоциироваться вместе на основе электростатического взаимодействия. Этот новый способ предлагает не только новый путь синтеза дифференцируемых дендримерных агрегатов, но также обеспечивает систему, которая может доставлять остатки указателя цели (направителя) в физиологических условиях.
G. Использование конъюгатов генетический материал-дендример.
Конъюгаты генетический материал-дендример настоящего изобретения могут применяться для переноса ДНК либо in vivo либо in vitro. Применение in vivo включает введение конъюгата в кроветок для достижения клетки-мишени, как, например, комплексов ДНК:дендример, инъецированных в воротную вену для достижения гепатоцитов. Также комплексы могут быть инъецированы в конкретные локализованные интересующие области, такие как пространство сустава или брюшинная полость, для локальной трансфекции клеток. Может быть также использовано трансдермальное введение конъюгата в тело и, как с другими способами может быть использовано в манере, аналогичной введению в тело фармацевтических препаратов.
Целеуказатель (направитель) на дендримере облегчает направление и связывание конъюгата с рецептором поверхности клеток и последующую его трансфекцию через эндоцитоз. Фиг. 51 иллюстрирует гипотетический процесс участия целевого (направленного комплекса ДНК:дендример в трансфекции клетки. На фиг. 51 "A" ДНК (10) образует комплекс и уплотняется с рядом плотных звездчатых дендримеров (20) с присоединенным целеуказателем (направителя) (30). На фиг. 51 "B" конъюгат (10-20-30) присоединяется к клетке (40) по рецепторам (50) через целеуказатель (направитель) (30). На фиг. 51"C" имеет место трансфекция, так как иллюстрируется диссоциация ДНК (10) от дендримера (20), что облегчает последующую транскрипцию и трансляцию.
Радионуклидные исследования показывают, что достаточная часть трансфецированного генетического материала входит в ядро эукариотных клеток (пример 70, фиг. 47 A-F). Продукт дендримерного трансфекцированного генетического материала показывает превосходное постоянство (пример 68, фиг. 44). Ферментативная активность ЛЮЦИФЕРАЗЫ (LUCEFERASE) является явно выраженной через 21 час, является еще достаточной через 45 часов после трансфекции, и частичная активность еще сохраняется даже через 69 часов. Экспрессия lacZ гена, доставленного в клетки RSV-β-gal- плазмидой и дендримером, показана на фотографии на фиг. 48, 49 и 50 (смотри также пример 71). Клеточная экспрессия lacZ гена имеется в клетках, которые затемнены на рисунках. В соответствующих условиях почти каждая клетка окрашивается, подтверждая, что трансфекция имеет место почти в каждой клетке в культуре.
Комплексы ДНК: дендример per se (сами по себе) имеют очень узкую цитотоксичность (пример 69, фиг. 45 и 46). Нормальная гибель клеток в культуре составляет примерно 5 - 10%. Добавление комплексов ДНК:дендример к клеточной культуре не дает значительного увеличения скорости истощения. Добавление DEAE-декстрана с комплексом ДНК:дендример дает увеличение токсичности, но недостаточное для предотвращения его использования in vitro (фиг. 45 и 46). Вышесказанное было продемонстрировано для целого ряда различных типов клеток (ibid = там же).
Генетический материал, трансфецированный в соответствии с настоящим изобретением, может быть перманентно введен в хромосомную ДНК клетки, успешно репродуцирован и перенесен дальше в клоны последующей генерации (пример 72, фиг. 52 и 53). Гены, проявляющие невосприимчивость к G418 (неомицин) и β- галактозидазе, были успешно трансфекцированы в линии клеток D5 и RAT2 с использованием способов настоящего изобретения. Оба вида генов были доставлены на единичной RSV-β-gal-NEO- плазмиде. Эти линии клеток воспроизводились каждые 24 часа. Четыре недели спустя после трансфекции вновь генерированные клоны продолжали выражать неомициновую устойчивость и устойчивость к β- галактозидазе. Результаты, полученные с использованием способа настоящего изобретения, являются поразительно высокими по сравнению с известными способами, такими как опосредование трансфекции фосфатом кальция или DEAE-декстраном в отдельности.
Подобные результаты получаются, когда гены-корреспонденты от плазмид различных экспрессии являются совместно трансфекцированы (например, неомицин или β- галактозидаза).
Трансфекция генетического материала, которая может быть также достигнута при использовании других типов дендритных полимеров, отличных от плотных звездчатых полимеров, т.е. несимметрично разветвленного дендримера на основе лизина, показана в примере 73 (фиг. 54). Все условия в предшествующем рассмотрении трансфекции плотными звездчатыми полимерами также определяют трансфекцию с использованием других типов дендритных полимеров. Например, DEAE-декстран также синергически усиливает такую трансфекцию асимметричным лизиновым дендримером при соотношении зарядов ДНК:дендример от 1:5 до 1:10.
ПРИМЕРЫ.
Последующие примеры дополнительно иллюстрируют изобретение, но не должны использоваться как ограничение объема изобретения. Обозначенные буквами примеры содержат получение исходных материалов; пронумерованные примеры содержат получение продуктов настоящего изобретения.
В последующих примерах были использованы следующие термины и условия, если не оговорено особо.
СЛОВАРЬ:
Окружающая температура означает комнатную температуру или около 20-25oC.
ASGPR означает азиалогликопротеиновый рецептор (АЗГПР).
BHA = БГА означает бензгидриламин.
β-gal означает RSV-lacZ.
Связующий буфер означает специальный буферный раствор, как описано далее в Протоколе для дендример-декстрановой трансфекции, 2-й день, стадия 1, рассмотрение при получении раствора.
BOC = БОК означает t-бутоксикарбонил.
Conc. = концентрированный (конц.).
Cytc означает протеин, цитохром c.
DCC = ДЦК означает дициклогексилкарбодиимид.
DEAE-декстран означает диэтиламиноэтиловый эфир декстрана, электроположительно заряженный полимер.
DMEM = МОСД означает модифицированная орлиная среда Dulbecco
DMF = ДМФ означает диметилформамид.
DMSO = ДМСО означает диметилсульфоксид.
DOZA означает 1,4,7,10-тетраазациклододекан-1,4,7-триуксусную кислоту.
DOTA означает 1,4,7,10-тетраазациклододекан-1,4,7, 10- тетрауксусную кислоту.
DTAF означает дихлортриазинилфлуоресцеин (ДТАФ).
DTPA означает диэтилентриаминпентауксусную кислоту.
DTPMP означает диэтилентриаминпентаметиленфосфониевую кислоту.
DTT означает 1,4-дитиотрейтол. (ДТТ).
EBV означает вирус Эпштейна-Барра.
EBV-A означает выражение плазмида-продуцирующий гигромицин B фосфотрансферазапротеин, который инактивирует антибиотик ГИГРОМИЦИН (HYGROMYCYN B) кинез - гена, производного EBV промотора.
EDA = ЭДА означает этилендиамин.
EDAC - означает 1-этил-3-(3-диметиламинопропил)карбодиимид.
EDC означает 1- (3-диметиламинопропил)-3-этилкарбодиимид.
EDTA означает этилендиаминтетрауксусную кислоту.
FACS - анализ означает метод сортировки клеток с возбуждением флюоресценции.
FYTS означает флюоресцеинизотиоцианат (ФИТЦ).
G или Gen означает генерацию дендримера.
GC = ГХ означает газовую хроматографию.
GGE означает градиент-гель-электрофорез (ГГЭ).
HBS означает солевой раствор Хенкса (СРХ).
HEPES = N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота.
HOBT означает N-гидроксибензотриазол (ГОБТ).
HPLC = ЖХВР означает жидкостную хроматографию высокого разрешения.
HRP означает пероксидазу хрена.
ГИГРОМИЦИН В (HYGROMYCYN B) является аминогликозидным антибиотиком,
полученным Streptomyces hygroscopicus
ICAM означает молекулу с межклеточной адгезией клеток.
Иммуноглобулины означают lgG, lgM, lgA, lgD, lgE, включая Fab, F(ab') и другие фрагменты.
LC = ЖХ означает жидкостную хроматографию.
ЛЮЦИФЕРАЗА (LUCIFERASE) означает фермент, полученный из гена луциферазы светлячков, фермент поставляемый фирмой Promega, Madison WI. U. S.
LUCIFEREN означает субстрат для измерения ферментативной активности (LUCIFERASE) ЛЮЦИФЕРАЗЫ.
MB+ означает катионную форму красителя, метиленголубого. NHS-LC-биотин означает стандартный спейсер с линкером (сшивкой), используемым с биотином.
NMP означает N-метилпирролидинон.
Всю ночь (до утра) означает примерно от 9 до 18 часов.
PAMAM = ПАМАМ означает полиамидоамин.
PBS = ФБР означает фосфорный буферный рассол (приобретенный у фирмы Sigma Chemical) содержащий 120 мМ Nacl, 2,7 мМ KCl и 10 мМ фосфорного буфера pH 7,4.
PEI = ПЭИ означает полиэтиленимин.
Pi означает неорганический фосфат (используется в буферах).
PTFE = ПТФЭ означает политетрафторэтилен.
RSV- β -gal-NEO означает выражение плазмида, продуцирующая β- галактозидаза-протеин от lacZ гена и аминогликозидфосфотрансфераза-протеин из АРН-гена (NEO), производного RSV - промотора.
RSV-lac означает выражение плазмида, продуцирующая β- галактозидаза-протеин от lacZ-гена, производного промотора.
RSV-luc означает корреспондент-плазмида, выражающая ген луциферазы из светлячков, производный RSV - промотора.
SDS означает натрийдодецилсульфат.
SP - Sephadex C-25 смола является катионообменной смолой, имеющей сульфокислотную функциональность (поставляемый фирмой Pharmacia Inc.)
TREN означает
трис-(2-аминоэтил) амин.
THF = ТГФ означает тетрагидрофуран.
TLC = ТСХ означает тонкослойную хроматографию.
TMB = ТМБ означает 3,3', 5,5' -тетраметилбензидин.
TRIS - glycine (глицин) означает N-2-гидрокси-1,1-бис(гидроксиметил)-этилглицин.
TRIS означает трис-аминный буфер, т.е. трис(гидроксиметил)аминометан.
Тритон X-100 означает октоксинол-9, т.е. этоксилировнный алкилфенол, который отвечает формуле C8H17C6H4 (OCH2CH2)OH, где n - среднее значение 9 (приобретаемый от фирмы Rohm and Hass), поверхностно-активное вещество.
X-gal означает 5-бромо-4-хлоро-3-индол -β -D- галактозид.
Общая экспериментальная часть.
Масс-спектры были получены или на Finnigan TSQ масс-спектрометре (модель QMS) или на масс-спектрометре высокого разрешения VGZAMB-MS (бомбардировка быстрыми атомами с ксеноном, при использовании 3:1 дитиотрейтол:дитиоэфитрейтол).
1H и13C-ЯМР-спектры были получены с использованием установки Varian VXR-300, Bruker APC 300, IBM/Bruker NR-80 или спектрометр Jeol FX 400. Все спектры были получены при 30oC, если не указано особо.1H-ЯМР-анализ был сделан при 300 МГц, 80 МГц или 400МГц, применительно к указанному выше оборудованию;13C-ЯМР-анализ был проведен при 75 МГц, 20 МГц или 100 МГц, применительно к указанному выше оборудованию. Значение для ЯМР являются δ как функция от TMS (тетраметилсилан) или, когда растворитель D2O, функция от DSS (2,2-диметил-2-силанпентан-5-сульфокислота, натриевая соль).
Инфракрасные спектры (ИКС) были записаны на приборе Nicolet 5S XFT/IR.
Для хроматографических исследований большинство растворителей были реактивами Фишера для ГХВР. Ацетат аммония приобретался от Aldrich. Вода были очищена с использованием водофильтрационной системы Barnstead NANOpure. Препаративная хроматография органических соединений выполнялась либо обычной гравитационной хроматографией с использованием стандартных методик, либо испарительной хроматографией, как описано в работе C.W. Stil et al., J. Org. Chem. 42, 2923-24 (1978).
Значения TCX и Rf получаются с использованием этих систем растворителей и коммерчески доступных, нормальнофазных SiO2-TCX-пластин [GH1 F 250 мкм, Analtech Inc. или Merck Kiesel-gel 60 F254]. Препаративная хроматография на колонках выполнялась с использованием силикагеля Merck grade 60, 60
Все проценты даются по массе, если не установлено особо.
pH-стат является механическим устройство, которое измеряет и регулирует pH раствора до предопределенного нужного значения при добавлении соответствующего количества предварительно выбранной кислоты и/или основания.
Часть твердых веществ сушилась с использованием роторного испарителя (Buchi 461) и/или вакуумного термошкафа при температуре около 55 - 60oC в течение нескольких часов. Кроме того, автоматическая вымораживающая сушилка Virtis модель 10-010 или концентратор Speed Vac использовались для удаления растворителя.
Используемыми ГХВР-колонками были: Hand-pached Q-Sepharose(Pharmacia) 1,5 x 25 см или 2,5 x 25 см; Zorbax Bio Seriss GF-250 (9,4 мм x 25 см, фирмы DuPont Instruments Vydac (торговая марка фирмы The Separations Group Hesperia CA), протеин C-4 (4,6 x 25 см) той же фирмы Mono-Q и SP-Sephadex (торговая марка фирмы Pharmacia Biotechnology Products) от Pharmacia; Sep-Pak (торговая марка фирмы Waters Asso-ciates) C-18-катридж был приобретен от Water Aseociates (Milford M.A.). Sephadex G-25 заменяемые колонки (2,2 мл) то Isolab Inc. (Akron OH); Centricon 30 (торговая марка Amicon Division W.R. Gerace & Co. , Danver M.A.); концентраторы от Amicon; и Spherisorb ODS-I (торговая марка Phase Separations, Itd.
Для центрифугирования и концентрирования использовалась рефрижераторная центрифуга Sorvale RT 6000 В (Du Pont). Для удаления летучих растворителей
применяется
концентратор Speed Vac (Savant Instruments Inc. Hicksville N.Y.)
ПРИМЕР A.
Получение 2-карбоксамидо-3-(4'-нитрофенил)пропанамида
p-Нитробензилмалонатдиэтилэфир (2,4
г, 8,13 ммоля) растворяется в 35 мл метилового спирта. Раствор нагревается до 50-55oC с перемешиванием, и поток безводного аммиака барботируется через
раствор в течение 64 часов. Раствор
охлаждается, и белый хлопьевидный продукт отфильтровывается и перекристаллизовывается из 225 мл кипящего метилового спирта с получением 1,85 г (7.80 ммоля)
бис-амида с 96% выходом. Т.пл =
235,6oC (P). Указанная структура подтверждается MC,1H и13C ЯМР-спектроскопией.
Анализ: Расч. для C10H11O4N3
Теор. C 50,63 H 4,69 N 17,72.
Экспер. C 50,75 H 4,81 N 17,94.
ПРИМЕР B.
Получение
1-амино-2(аминометил)3-(4'-нитрофенил)пропана
2-карбоксамидо-3-(4'-нитрофенил)пропанамид (2,0 г, 8,43 ммоля) суспендируется в 35 мл сухого ТГФ в атмосфере азота с перемешиванием. К этой
смеси
шприцем добавляется комплекс боран/ТГФ (106 мл,
106 ммолей). Реакционная смесь затем нагревается с обратным холодильником в течение 48 часов, причем за это время суспендированный амид
растворяется.
Раствор охлаждается, и ТГФ удаляется в вакууме с
использованием роторного испарителя. Сырой продукт и остаток борана растворяются в 50 мл этилового спирта, и этот раствор продувается
безводным
газообразным хлористым водородом. Раствор кипятится с
обратным холодильником в течение 1 часа, и растворитель удаляется в вакууме. Сырая хлористоводородная соль растворяется в 15 мл
деионизованной
воды и экстрагируется двумя 50 мл порциями
метиленхлорида. Водный слой охлаждается на ледяной бане в атмосфере аргона, и к нему медленно добавляется 50% гидроокись натрия до pH 11,7.
Водно-щелочной
слой экстрагируется четырьмя 25 мл порциями
метиленхлорида, и эти объективные экстракты испаряются с использованием роторного испарителя с получением 1,45 г масла янтарного цвета. Это
масло
перетирается с диэтиловым эфиром (50 мл) и фильтруется
под давлением через короткую колонку с силикагелем (grade 62 Aldrich). Колонка промывается 100 мл эфира, и объединенные фильтры
испаряются под
вакуумом с получением 1,05 г (5,02 ммоля) указанного в
заголовке диамина в виде прозрачного масла [Tпл= 275-278oC (P) бис-HCl соль]. Указанная в заголовке
структура
подтверждается MC,1H и13
C-ЯМР-спектроскопией.
Анализ: Расч. для C10H17N3O2Cl2
Теор.
C 42,57 H
6,07 N 14,89
Экспер. C 43,0 H 6,14 N 15,
31
ПРИМЕР C.
Получение 1-амино-2-(аминометил)-3-(4'-аминофенил)-пропана.
Раствор борана/ТГФ (70 мл, 70 ммолей) добавляется в атмосфере азота через иглу канули в колбу, содержащую 4-аминобензилмалонамида (1,5 н, 7,24 ммоля), с перемешиванием. Раствор кипятится с обратным холодильником в течение 40 часов. Бесцветный раствор охлаждается, и избыток ТГФ удаляется ротационным испарением, оставляя прозрачное гелеобразное масло. Метиловый спирт (50 мл) осторожно добавляется к маслу с заметным газовыделением. Сухой хлористый водород барботируется через суспензию для усиления растворения, и раствор затем кипятится с обратным холодильником в течение 1 минуты. Раствор метанол/HCl удаляется ротационным испарением, и полученная гидрохлоридная соль растворяется в 10 мл воды и охлаждается на ледяной бане в атмосфере аргона. Конц. (50%) гидроокись натрия добавляется медленно с перемешиванием до pH 11. Водная часть затем экстрагируется порциями 2 x 100 мл хлороформа, экстракты объединяются и фильтруются через короткие силикагельные набивки без сушки. Растворитель удаляется в вакууме (роторный испаритель) с получением названного соединения (0,90 г, 5,02 ммоля) с 70% выходом (Rf = 0,65 CHCl3/MeOH/NH4OH конц. -2/2/1). Названная структура подтверждается1H и13C-ЯМР-спектроскопией, и продукт используется без дополнительной очистки.
ПРИМЕР D.
Получение 6-(4-аминобензил)-1,4,8,
11-тетрааза-5,7-диоксоундекана
4-аминобензилмалонатдиметилэфир (2,03 г,
8,43 ммоля) растворяется в 10 мл метилового спирта. Этот раствор добавляется по каплям к перемешиваемому раствору
свежеперегнанного этилендиамина (6,00 г, 103,4 ммоля) в 10 мл метилового спирта в
атмосфере азота за время более 24 часов. Прозрачный раствор перемешивается в течение 4 дней, и ТСХ-анализом
подтверждается общее превращение диэфира (Rf = 0,91) и бис-амид (Rf =
0,91) в бис-амид (Rf = 0,42 - 20% конц. NH4OH/80% этиловый спирт). Этот материал
является сильно нингидрин-положительным. Метиловый спирт и избыток диамина удаляются на роторном
испарителе, а получаемое белое твердое вещество сушится под вакуумом (10-1 мм, 50oC) всю ночь с получением сырого продукта 2,45 г, 8,36 ммоля) с выходом 99%. Образец для анализа
перекристаллизовывается из смеси хлороформ/гексан. Тпл=160-161oС.
Структура указанного в заголовке соединения подтверждается данными масс-спектрального анализа, методов1H- и13C-ЯМР.
ПРИМЕР E.
Реакция мезилазиридина с 1-амино-2-(аминометил)- 3-(4-нитрофенил)пропаном.
1-амино-2-(аминометил)-3-(4-нитрофенил)пропан (400 мг, 1,91 ммоля, чистота > 96%) растворяется в 10,5 мл абсолютного этилового спирта в атмосфере азота. Мезилазиридин (950 мг, 7,85 ммоля) добавляется к перемешиваемому раствору в твердом виде. Реакционная смесь перемешивается при 25oC в течение 14 часов с использованием магнитной мешалки, и за этот промежуток времени на стенках колбы образуется белый липкий осадок. Этиловый спирт декантируется, а остаток перетирается с другой 15 мл порцией этилового спирта для удаления любого количества непрореагировавшего азиридина.
Продукт сушится под вакуумом (10-1 мм, 25oC) с получением тетракис-метилсульфонамида (1,0 г, 1,44 ммоля) с выходом 75% (Rf = 0,74 - NH4OH/этонол-20/80). Указанная в заголовке структура подтверждается1H и13 C-ЯРМ-спектроскопией.
ПРИМЕР F.
Получение 2-(4-нитробензил)-1, 3-(бис-N,N-2-аминоэтил)-диаминопропана.
Сырой метилсульфамид из примера E (650 мг, 0694 ммоля) растворяется в 5 мл конц. (98%) серной кислоты, барботируемой азотом. Этот раствор выдерживается в атмосфере азота и нагревается до 143-146oC в течение 27 минут с сильным перемешиванием. Отмечается слабое потемнение, и охлажденный раствор выливается в перемешиваемый раствор эфира (60 мл). Белый осадок соли на фильтре отфильтровывается и сразу растворяется в 10 мл деионизованной воды. Значение pH раствора регулируется до pH 11 добавлением 50% NaOH в атмосфере аргона с охлаждением. Полученный раствор смешивается с 90 мл этилового спирта, и высадившиеся неорганические соли отфильтровываются. Растворитель удаляется из сырого амина при пониженном давлении, и к полученному светло-коричневому маслу добавляется 190 мл толуола в атмосфере азота. Смесь энергично перемешивается, и вода удаляется азеотропной дистилляцией (ловушки Дин-Старка) до тех пор, пока остающийся толуол не приобретает светло-желтый цвет (30 - 40 мл остается в чаше). Толуол охлаждается и декантируется с темных труднообрабатываемых остатков и соли. Этот раствор освобождается от растворителя в вакууме, и полученное светло-желтое масло сушится под вакуумом (0,2 мм, 35oC) всю ночь с получением 210 мг (60% выход) указанного в заголовкепродукта, характеристикикоторогоопределяютсяMC,1Hи13C-ЯРМ-спектроскопией.
ПРИМЕР C.
Получение STARBURST-полимера (содержащего анилиновое производное)
половинной генерации, представленное следующей схемой:

Метилакрилат (2,09 г, 24 ммоля) растворяется в метиловом спирте (15 мл). Соединение 6-(4-аминобензил)-1,4,8,11-тетрааза-5,7-диоксоундекан (1, 1 г, 3,8 ммоля) (т. е. соединение N 1, получение этого соединения представляется в примере D) растворяется в метиловом спирте (10 мл) и медленно добавляется в течение 2-х часов с тщательным перемешиванием к раствору метилакрилата. Реакционная смесь перемешивается в течение 48 часов при комнатной температуре. Растворитель удаляется на роторном испарителе с поддержанием температуры ниже 40oC. Сложный эфир (соединение N 2) получается в виде желтого масла (2,6 г). Карбоксиэтилирование анилиновой функции не наблюдается.
ПРИМЕР H.
Получение
STARBURST-полимера (содержащего анилиновый остаток) одной генерации, представленное
следующей схемой:

Сложный эфир (соединение N 2) (2,6 г, 3,7 ммоля) растворяется в этиловом спирте (100 мл). Раствор аккуратно добавляется к энергично перемешиваемому раствору этилендиамина (250 г, 4,18 моля) и метанола (100 мл) с такой скоростью, что температура не поднимается выше 40oC. После завершения добавления реакционная смесь перемешивается в течение 28 часов при 35 - 40oC (нагревающий кожух). После 28 часов сложноэфирные группы не определяются инфракрасной спектроскопией. Растворитель удаляется на роторном испарителе при 60oC. Избыток этилендиамина удаляется с использованием тройной азеотропной смеси толуол-метанолэтилендиамин. В конце образуется азеотропная смесь всего остаточного толуола с метиловым спиртом. После удаления всего метанола получается 3,01 г указанного в заголовке продукта (соединение N 3) в виде оранжевого стекловидного твердого вещества.
ПРИМЕР I.
Получение
STARBURST-полимера
(содержащего анилиновый остаток) полуторной генерации, представленное следующей схемой:

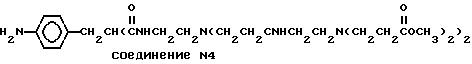
Амин (содержание N 3) (2,1 г, 3,6 ммоля) растворяется в метиловом спирте (7 мл) и медленно добавляется в течение 1 часа к перемешиваемому раствору метилакрилата (3,8 г, 44 моля) в метиловом спирте (15 мл) при комнатной температуре. В процессе добавления наблюдается слабое нагревание раствора. Раствор перемешивается при комнатной температуре в течение 16 часов. Растворитель удаляется на роторном испарителе при 40oC. После удаления всего растворителя и избытка метилакрилата получается сложный эфир (соединение N 4) с выходом 4,7 г в виде оранжевого масла.
ПРИМЕР J.
Получение STARBURST-полимера (содержащего
анилиновый остаток) половинной генерации,
представленное следующей схемой:

Триамин (соединение N 5, получение этого соединения представляется в примере C) (0,42 г, 2,3 ммоля) растворяется в метиловом спирте (10 мл) и добавляется по каплям в течение 1 часа к метилакрилату (1,98 г, 23 ммоля) в метиловом спирте (10 мл). Смесь перемешивается при комнатной температуре в течение 48 часов. Растворитель удаляется на роторном испарителе, с поддержанием температуры не выше 40oC. Избыток метилакрилата удаляется повторной азеотропной дистилляцией с метанолом. Указанный в заголовке сложный эфир (соединение N 6) выделяется в виде оранжевого масла (1,24 г.)
ПРИМЕР K.
Получение
STARBURST-полимера (содержащего анилиновый остаток) одной генерации, представленное следующей схемой:
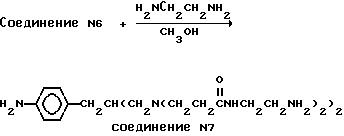
Сложный эфир (соединение N 6) (1,24 г, 2,3 ммоля) растворяется в метиловом спирте (50 мл) и добавляется по каплям в течение 2 часов к этилендиамину (73,4 г, 1,22 моля) в метиловом спирте (100 мл). Отмечается незначительная экзотермия, поддерживается энергичное перемешивание. Раствор остается перемешиваться при комнатной температуре в течение 72 часов. Растворитель удаляется на роторном испарителе при 60oC. Избыток этилендиамина удаляется с использованием тройной азеотропной смеси толуол-метиловый спирт-этилендиамин. В конце весь остаточный толуол удаляется с метиловым спиртом, и затем откачивается вакуумным насосом в течение 48 часов с получением указанного в заголовке амина (соединение N 7) (1,86 г) в виде желто-оранжевого масла.
ПРИМЕР L.
Получение STARBURST-полимера (содержащего анилиновый остаток) полуторной генерации (G1,5),
представленное
следующей схемой:
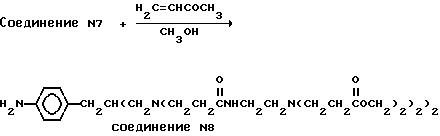
Амин (соединение N 7) (1,45 г, следы остаточного метилового спирта) растворяется в метиловом спирте (100 мл) и добавляется медленно в течение 2,5 часа к перемешиваемому раствору метилакрилата (5,80 г) в метиловом спирте (120 мл). Раствор перемешивается в течение 24 часов при комнатной температуре. Удалением растворителя повторной азеотропной дистилляцией с метиловым спиртом обеспечивается удаление всего избытка метилакрилата. После откачки вакуумным насосом в течение 48 часов указанный в заголовке сложный эфир (соединение N 8) выделяется в виде оранжевого масла (2,50 г, 1,8 ммоля).
ПРИМЕР M.
Гидролиз (G4, 5)
дендримера и
получение кальциевой соли
ПАМАМ 4,5 генерации (с
сложноэфирной концевой группой, инициированный NH3) (2,11 г, 10,92 мэк) растворяется в 25 мл метилового спирта, после
чего
добавляется 10% NaOH (4,37 мл, 10,92 мэк) (pH 11,5-12). После 24
часов при комнатной температуре pH равняется примерно 9,5. Еще через 20 часов растворитель удаляется с использованием роторного
испарителя, добавляется 50 мл толуола, и растворитель испаряется
снова.
Полученное масло растворяется в 25 мл метилового спирта и осаждается в виде белой смолы при добавлении 75 мл диэтилового эфира. Жидкость декантируется, и смола ротационно испаряется с получением очень мелкого беловатого порошка, после дополнительной сушки которого получается 2,16 г продукта (98% выход). Методами ЯМР и ИКС наличие сложноэфирных групп не обнаруживается.
Натриевая соль ПАМАМ 4,5 генерации (сложноэфирные концевые группы, NH3-инициатор) замещается кальциевой солью с помощью диализа. Натриевая соль (1,03 г) растворяется в 100 мл воды и пропускается через систему полых волокнистых труб для диализа (отсечка = 5000) при 3 мл/мин. Система труб снаружи омывается 5% раствором CaCl2. Операция затем повторяется.
Полученный раствор снова диализуется, на этот раз против воды, затем диализ повторяется еще два раза.
После испарения получается 0,6 г влажного твердого вещества, которое берется в метиловом спирте (совсем нерастворимый) и сушится с получением 0,45 г указанного в заголовке продукта в виде не совсем белых кристаллов.
C369
H592N91Ca24 MM=9526,3
Теор. C 46,5 H 6,32 N 13,38 Ca 10,10
Экспер. C 47,34 H7,0 N 13,
55
Ca 8,83
ПРИМЕР N.
Получение
дендримеров с концевыми карбоксилатными группами
STARBURST-полиамидоамины половинной генерации гидролизуются для превращения их
концевых
метилсложноэфирных групп в карбоксилаты. Генерируются
сфероидальные молекулы с отрицательными зарядами, распределенными на периферии. Гидролизуемые дендримеры находятся в ряду от 0,5
генерации (3
карбоксилата) до 6,5 генераций (192 карбоксилата).
Продукты могут генерироваться в виде Na+, K+, Cs+ или Rb+ солей.
ПРИМЕР O.
Н-t-бутоксикарбонил-4-аминобензилмалонат-диметил-(сложный эфир).
4-аминобензилмалонат-диметил(сложный эфир) (11,62 г, 49 ммолей) растворяется в 50 мл смеси t-бутанол:вода (60:40 по объему) с перемешиванием. Добавляется ди-t-бутоксидикарбонат (19,79 г, 90 ммолей), и реакционная смесь перемешивается до утра. Бутанол удаляется на роторном испарителе с получением желтой суспензии продукта в воде. После экстракции в метиленхлориде, сушки (MgSO4) и испарения получается желтое масло (21,05 г, с примесью ди-t-бутоксидикарбоната). В результате перекристаллизации из смеси 2-пропанол: вода (75: 25) получаются бледно-желтые кристаллы (11,1 г, 33 ммоля, 67%) указанного в заголовке продукта. Структура подтверждается13 C-ЯМР-спектроскопией, а чистота - методом ГХВР (Spherisorb ODS-1 0,05 M H3PO4 (pH3):CH3CN 55:45). Материал используется без дополнительной очистки.
ПРИМЕР P.
N-t-бутоксикарбонил-6-(4-аминобензил)-1,4,8,11-тетрааза-5, 7-диоксоундекан.
N-t-бутоксикарбонил-4-аминобензилмалонат-диметил (сложный эфир) (8,82 г, 26 ммолей), полученный в примере O, растворяется в 50 мл метилового спирта. Этот раствор добавляется по каплям (2 часа) к раствору свежеперегнанного этилендиамина (1,88 г, 3,13 ммоля) в 20 мл метилового спирта в атмосфере азота. Раствор перемешивается в течение 24 часов. Этилендиамин/метанольный растворитель удаляется на роторном испарителе. Остаток растворяется в метаноле, и добавляется толуол. Растворитель удаляется на роторном испарителе с получением сырого продукта в виде белого твердого вещества (10,780 г с примесью этилендиамина). Образец разделяется на два образца для очистки. В результате азеотропного удаления этилендиамина с толуол, с использованием сокслет-экстрактора с сульфонированными ионообменными шариками в экстракционной гильзе для улавливания этилендиамина, получается частичное разложение продукта с получением коричневого масла. Оставшийся продукт выделяется в виде белого твердого вещества из толуола при охлаждении (2,3 г, приблизительно 50%). Анализом 10% раствора в метаноле методом ГХ (колонка Tenax 60/80) в образце этилендиамин не обнаруживается (0,1%). Вторая фракция растворяется в метиловом спирте с получением 10% раствора (по массе) и очищается от этилендиамина обратным осмосом, с использованием метилового спирта в качестве растворителя (мембрана Filmtec FT-30 и тонкоканальный сепаратор Amicon TC IR; ЭДА, проходящий мембрану). Продукт выделяется в виде белого твердого вещества (2,7 г), в котором методом ГХ не обнаруживаются определяемые количества этилендиамина. Указанная в заголовке структура подтверждается результатами исследования продукта методами13C-ЯМР и ГХВР (Spherisorb ODS-1, 0,05 M H3PO4 pH:CH3CN 55:45). Продукт используется без дополнительной очистки.
ПРИМЕР Q.
Получение STARBURST-дендримера половинной генерации (G 0,5) из
N-t-бутоксикарбонил-6(4-аминобензил)-1,4,8,11-тетрааза-5,7-диоксоундекана
N-t-бутоксикарбонил-6-(4-аминобензил)-1,4,8,
11-тетрааза-5,7- диоксоундекан (5,0 г, 13 ммолей), полученный в примере
P, растворяется в 100 мл метилового спирта. Добавляется метилакрилат (6,12 г, 68
ммолей), и раствор перемешивается при
комнатной температуре в течение 72 часов. Реакция контролируется методом ГХВР
(Spherisorb ODS-1, ацетонитрил:0,04 М ацетат аммония 40: 60) для оптимизации
превращения в желаемый продукт. Раствор
концентрируется до 30% твердого вещества, и добавляется метилакрилат (3,0 г, 32
ммоля). Реакционная смесь перемешивается при комнатной температуре до тех пор,
пока не перестанут обнаруживаться
методом ГХВР частично алкилированные продукты (24 часа). После удаления растворителя
при 30oC при использовании роторного испарителя и откачки вакуумным
насосом при 1 мм рт.ст. в течение
24 часов получается продукт в виде желтого густого масла с выходом 7,81 г. Данными13C-ЯМР-спектроскопии подтверждается указанная в заголовке структура.
Продукт используется без
дополнительной очистки.
ПРИМЕР R.
Получение
STARBURST-дендримера одной полной генерации (G1,0) из N-t-бутоксикарбонил-6-(4-аминобензил)-1,4,8,
11-тетрааза-5,
7-диоксоундекана
Продукт половинной генерации (пример Q) (7,70 г, 10,45
ммоля) растворяется в 75 мл метилового спирта и добавляется по каплям в течение 2 часов к перемешиваемому
раствору
этилендиамина (400 мл, 7,41 моля) и метилового спирта (50 мл). Реакционная смесь
перемешивается при комнатной температуре в течение 48 часов. Этилендиамин и метиловый спирт удаляются роторным
испарителем с получением желтого масла (11,8 г с примесью этилендиамина). Продукт
растворяется в 90 мл метилового спирта и очищается от этилендиамина обратным осмосом (Filmtec FT-30-мембрана и
тонкоканальный сепаратор Amicon TC IR, метиловый спирт в качестве растворителя). Через
48 часов этилендиамин методом ГХ (колонка Tenax 60/80) не определяется. После удаления растворителя на роторном
испарителе с последующей откачкой на вакуумной линии в течение 24 часов получается
желтый стекловидный твердый продукт (6,72 г). Результатами анализов методами ГХВР (PL RP-S колонка, ацетонитрил:0,
015
М NaOH, 10-20% градиент за 20 мин) и13C-ЯМР подтверждается указанная
в заголовке структура.
ПРИМЕР S.
Получение STARBURST-полимера полуторной
генерации (G
1,5) из N-t-бутоксикарбонил-6-(4-аминобензил-1,4,8,11-тетрааза-5,
7-диоксоундекана
Одногенерационный продукт (пример R) (2,14 г, 25 ммолей) растворяется в 12,5 мл метилового
спирта и
добавляется метилакрилат (3,5 г, 39 ммолей) в 5 мл метилового спирта.
Раствор перемешивается при комнатной температуре в течение 48 часов с контролем хода реакции методом ГХВР (Spherisorb
ODS-1,
ацетонитрил 0,04 М ацетат аммония 60:40). Добавляется вторая аликвота
метилакрилата (3,5 г, 39 ммолей), и реакционная смесь перемешивается при комнатной температуре еще 72 часа. После удаления
растворителя на роторном испарителе и откачки вакуумным насосом всю ночь
получается указанный в заголовке продукт в виде желтого масла (3,9 г). Продукт используется без дополнительной очистки.
ПРИМЕР T.
Получение STARBURST-полимера двух
полных генераций (G 2,0) из N-t-бутоксикарбонил-6-(4-аминобензил)-1,4,8,11-тетрааза-5,7-диоксоундекана
Продукт
полуторной генерации (пример S) (3,9 г, 2,5 ммоля) растворяется в 50 мл
метилового спирта и добавляется по каплям в течение 2 часов к перемешиваемому раствору этилендиамина (600 г, 20 молей) и
метилового спирта (50 мл). Раствор перемешивается при комнатной температуре в
атмосфере азота в течение 96 часов. Этилендиамин/метиловый спирт удаляется на роторном испарителе с получением желтого
твердого стекловидного вещества (4,4 г, с примесью этилендиамина). Готовится
10% раствор продукта в метиловом спирте, который очищается от этилендиамина обратным осмосом (мембрана Filmtec FT-30 и
тонкоканальный сепаратор Amicon TC IR) до тех пор, пока этилендиамин не
перестанет определяться методом ГХ (колонка типа Tenax 60/80). После удаления растворителя получается продукт в виде желтого
твердого стекловидного вещества (3,52 г). Указанная в заголовке структура
подтверждается данными анализа методами13C-ЯМР и ГХВР (PL RP-S колонка, ацетонитрил:0,015 М NaOH, 10 - 20%
градиент за 20 мин).
ПРИМЕР U.
Реакция
двухгенерационного (G 2) STARBURST-полимера с бромуксусной кислотой с получением STARBURST-дендримера с метиленкарбоксилатными
концевыми группами
Продукт второй генерации (пример T) (0,22 г,
0,13 ммоля) растворяется в 15 мл деионизованной воды при уравновешенной температуре 40,5oC. Бромуксусная кислота (0,
48 г, 3,5 ммоля) и гидроокись лития (0,13 г, 3,3 ммоля) растворяется в
5 мл деионизованной воды и добавляется к реакционной смеси. Значение pH реакции тщательно поддерживается при 9 с использованием
pH-стата (титрование 0,1 N NaOH) при 40,5oC всю ночь.
Контролем методом ГХВР с обращенной фазой (Spherisorb ODS-1 колонка, элюент 0,25 М H3PO4 (pH )NaOH: ацетонитрил
85:15) подтверждается синтез определенно одного компонента.
ПРИМЕР V.
Получение изотиоцианато-функционализированного второй генерации (G 2,0) STARBURST-дендримера с метиленкарбоксилатными концевыми группами.
5 мл 2,8 мМ раствора второй генерации STARBURST-дендримера с метиленкарбоксилатными концевыми группами (пример U) разбавляется 20 мл воды, и pH регулируется до 0,5 конц. хлористоводородной кислотой. Через 1 час при комнатной температуре смесь анализируется методом ГХВР для контроля удаления бутоксикарбонильной группы и затем обрабатывается 50% гидроокисью натрия с доведением pH до 7. Для поддержания pH при 7 используется pH-стат (титрование 0,1 N NaOH), и добавляется 225 мкл тиофосгена. Через 15 минут при комнатной температуре pH смеси доводится до 5 с помощью 1 N HCl. Смесь промывается хлороформом (20 мл x 2) и затем концентрируется на роторном испарителе при комнатной температуре. Извлеченный остаток, 0,91 г, является смесью изотиоцианата и солей.
ПРИМЕР W.
Получение STARBURST-полиэтилениминметансульфамида второй генерации (G 2)
К раствору 125 г
N-метансульфонилазиридина в 50 мл
этилового спирта добавляется 25,0 г
трис(2-аминоэтил)амина. Раствор перемешивается при комнатной температуре в течение 4 дней. Вода добавляется к реакционной смеси,
когда необходимо поддерживать
гомогенность раствора. Растворитель
удаляется перегонкой в вакууме с получение STARBURST-ПЭИ-метансульфамида второй генерации в виде желтого стекла (161 г).
ПРИМЕР X.
Расщепление метансульфамидов с
образованием STARBURST-полиэтиленимина второй генерации (G 2,0)
Раствор 5,0 г STARBURST-ПЭИ-метансульфамида второй
генерации из примера W в 20 мл 38% HCl
герметизируется в стеклянной
ампуле. Ампула нагревается при 160oC в течение 16 часов, затем охлаждается на ледяной бане и вскрывается. Растворитель
удаляется перегонкой в вакууме, и остаток
растворяется в воде. После
регулирования pH ≥ 10 с помощью 50% NaOH растворитель удаляется перегонкой в вакууме. К остатку добавляется толуол (150 мл),
и смесь нагревается с обратным
холодильником и ловушкой
Дина-Старка до полного удаления воды. Раствор фильтруется с удалением солей, и фильтрат концентрируется в вакууме с получением 1,9 г
STARBURST-ПЭИ второй генерации в виде
желтого масла.
ПРИМЕР Y.
Получение STARBURST-полиэтиленимин-метансульфамида третьей генерации (G 3,0).
К раствору 10,1 г STARBURST-ПЭИ второй генерации из примера X в 100 мл этилового спирта добавляется 36,6 г N-метансульфонилазиридина. Раствор перемешивается при комнатной температуре в течение 1 недели. Вода добавляется при необходимости сохранить гомогенность раствора. Растворитель удаляется под вакуумом с получением STARBURST-ПЭИ-метансульфамида третьей генерации в виде желтого стекла (45, 3 г).
ПРИМЕР Z.
Расщепление
метансульфамидов с образованием STARBURST-полиэтиленимина 3-ей генерации (G 3,0)
Метансульфамидные группы
STARBURST-ПЭИ-метансульфамида третьей генерации (5, О г) из
примера Y удаляются тем
же способом, который описывается для материала второй генерации в примере X, с получением 2,3 г STARBURST-ПЭИ 3-ей
генерации в виде желтого масла.
ПРИМЕР AA.
Реакция STARBURST-полиэтиленимина третьей генерации (G 3) с (4-фтор)-нитробензолом
STARBURST-полиэтиленимин
третьей генерации (пример Z) (1,06 г, 1,2 ммоля) растворяется
в 12 мл абсолютного
этилового спирта. Добавляется (4-фтор)-нитробензол (120 мкл, 1,2 ммоля) и реакционная смесь кипятится с обратным
холодильником всю ночь. Растворитель удаляется на роторном
испарителе, и ярко-желтое
масло растворяется в воде. Водный раствор промывается хлороформом с удалением всего непрореагировавшего
(4-фтор)-нитробензола. После удаления воды получается продукт в виде
масла интенсивного
желтого цвета (0,80 г). Спектрами13C-ЯМР подтверждается указанная в заголовке структура. (Попытки
определить природу статистического распределения не делались). Продукт
используется без
дополнительной очистки.
ПРИМЕР BB.
Реакция нитрофенилпроизводного
STARBURST-полиэтиленимина третьей генерации (G 3,0) с гликолонитрилом
Нитрофенилпропизводное STARBURST-полиэтиленимина 3-ей генерации (пример AA) (0,80 г) растворяется в 20 мл деионизованной
воды. Гидроокись натрия (2,80 г, 50% по массе) добавляется к перемешиваемому
раствору, и раствор барботируется азотом, вентилируемым через скруббер гидроокиси натрия. Гликолонитрил (2,85 мл 70%
водного раствора) добавляется при комнатной температуре. Через несколько минут
наблюдается образование желтого осадка. Через 2 часа температура медленно увеличивается до температуры дефлегмации, и
раствор поддерживается при этой температуре с продувкой азотом в течение 24
часов.
После удаления воды получается продукт в виде твердого желтого вещества с примесью гликолевой кислоты и гидроокиси
натрия. Указанная в заголовке структура подтверждается13
C-ЯМР-спектрами.
Продукт используется без дополнительной очистки.
ПРИМЕР CC.
Гидрирование нитрофенил-производного STARBURST-полиэтиленимина третьей генерации с аминофенил-метиленкарбоксилатными концевыми группами.
Твердое желтое вещество из примера BB (1,7 г) растворяется в 10 мл деионизованной воды, причем конечный pH раствора равняется примерно 11. Палладий на углероде (200 мг 5% Pd/C) добавляется в реакционную смесь в стеклянной колбе Парра. Реакционная смесь помещается под давление водорода 40 фунт/дюйм2 (275 кПа) и встряхивается при комнатной температуре в аппарате гидрирования Парра в течение 6 часов. Реакционная смесь затем фильтруется через 0,5 мкм Millipore фильтр с удалением Pd/C и удалением растворителя в вакууме, после чего гель фильтруется через смолу Biogel P2 (25 г набухших в воде). После подкисления HCl получается темно-оранжевый раствор, через который продувается азот всю ночь. После удаления растворителя в вакууме получается указанный в заголовке продукт в виде хлористоводородной соли, которая является светло-коричневым твердым вещество (3,98 г с примесью NaCl и гликолевой кислоты, максимальное теоретическое количество продукта 1,15 г). Продукт используется без дополнительной очистки.
ПРИМЕР DD.
Получение
STARBURST-полиэтиленимина третьей генерации с 4-изотиоцианатофенилметиленкарбоксилатными концевыми группами
Продукт из примера
CC (3,98 г) растворяется в 15 мл деионизованной воды, и
аликвота
(2,5 мл) этого раствора разбавляется 10 мл воды. pH раствора доводится гидроокисью натрия до 7. Для поддержания pH используется
pH-стат (титрование 1 N NaOH, и добавляется 200 мкл
тиофосгена. Через 10
минут pH смеси доводится до 4 с помощью хлористоводородной кислоты. Вода удаляется на роторном испарителе при пониженном
давлении (небольшое количество n-бутанола добавляется
для предотвращения
вспенивания). Остаток промывается метиленхлоридом и затем сушится. Указанный в заголовке сырой продукт (0,95 г), смесь
изотиоцианата (0,14 г) и соли используются без
дополнительной очистки.
ПРИМЕР EE.
Получение STARBURST-полиамидоамина (инициированного аммиаком) второй генерации (G 2,
0) с метиленкарбоксилатными концевыми
группами
STARBURST-полиамидоамин второй генерации (2,71 г, 2,6 ммоля) и бромуксусная кислота (4,39 г, 31,6 ммоля) растворяются в 30 мл деионизованной
воды, и pH регулируется до 9,7 с
помощью 5 N NaOH с
использованием pH-стата. Реакция поддерживается при этом pH в течение получаса, температура медленно увеличивается до 60oC, и реакция
выдерживается при 60oC
в течение 3-х часов
при постоянном pH. Затем pH увеличивается до 10,3, и реакционная смесь остается под контролем pH-стата при комнатной температуре всю ночь. В
результате удаления растворителя и
азотропной дистилляции
последних следов воды с метиловым спиртом получается указанный в заголовке продукт в виде бледно-желтого порошка (8,7 г с примесью
бромистогонатрия). Указанная в заголовке
структура подтверждается13C-ЯМР-спектрами (с некоторым загрязнением благодаря небольшому количеству дефектного материала как результата частичного
моноалкилирования).
ПРИМЕР FF.
Получение STARBURST-полиэтиленимина (инициированного аммиаком) второй генерации (G 2,0) с метиленкарбоксилатными концевыми группами.
STARBURST-полиэтиленимин второй генерации (2,73 г 6,7 ммоля) из примера X, и бромуксусная кислота (11,29 г, 81 ммоль) растворяются в 30 мл деионизованной воды. Значение pH медленно увеличивается до pH 9,5 с поддержанием температуры ниже 30o C. Температура медленно поднимается до 55oC, pH реакционной смеси поддерживается при 9,5 в течение 6 часов с помощью pH-стата (титрование 5 N NaOH). Затем pH увеличивается до pH 10,2 и поддерживается при этом значении всю ночь. В результате удаления растворителя на роторном испарителе и азеотропной дистилляции последних следов воды с использованием метилового спирта получается указанный в заголовке продукт в виде желтого порошка (17,9 г, с примесью бромистого натрия). Указанная в заголовке структура подтверждается13C-ЯМР-спектрами (с некоторым загрязнением благодаря небольшому количеству дефектного материала как результата частичного моноалкилирования).
ПРИМЕР GG.
Получение STARBURST-ПАМАМ 3,5, 4,5, 5,5 и 6,5
генераций
К 2,46 г 10% по массе метанольного раствора STARBURST-ПАМАМ третьей генерации добавляется 2,32 г
метилакрилата. Эта смесь остается
стоять при комнатной температуре в течение 64
часов. После удаления растворителя и избытка метилакрилата извлекается 4,82 г (105% от теоретического выхода)
указанного в заголовке продукта (G 3,
5).
Получение STARBURST-ПАМАМ более высокой половинной генерации: генерации 4,5, 5,5, и 6,5 получаются, как описано выше, но с незначительными различиями в концентрациях реагентов, мольных соотношениях реагентов или реакционном времени.
ПРИМЕР HH.
Получение STARBURST-ПАМАМ 4,5 и 6 генераций.
К 2000 г предварительно перегнанного этилендиамина добавляется 5,4 г STARBURST-ПАМАМ 4,5 генерации в виде 15% по массе раствора в метиловом спирте. Реакционная смесь остается стоять при комнатной температуре в течение 48 часов. Метиловый спирт и большая часть избытка этилендиамина удаляются ротационным испарением под вакуумом при температуре менее 60oC. Извлекается продукт общей массой 8,07 г. В этот момент методом ГХ устанавливается, что в продукте еще содержится 34% по массе этилендиамина. Порция 5,94 г этого продукта растворяется в 100 мл метилового спирта и подвергается ультрафильтрации с удалением остаточного этилендиамина. Ультрафильтрация проводится с использованием тонкоканального рециркулирующего сепаратора Amicon TC IR, оборудованного мембраной Amicon YM2. В линии давления используется предохранительный клапан для поддержания давления на мембране 55 фунт/дюйм2 (380 кПа). 100 мл сначала концентрируются до 15 мл прокачкой растворителя исключительно через мембрану. После этого начального концентрирования остаток превращается в постоянно рециркулируемый объем ретентата в течение 18 часов. После этого времени 60 мл метилового спирта пропускается над мембраной для извлечения дополнительного продукта в блоке и присоединенном комплексе труб. Продукт отделяется от растворителя, и извлекается 2,53 г STARBURST-ПАМАМ пятой генерации (G 5,0). Методом ГХ определяется, что в продукте содержится 0,3% остаточного этилендиамина.
Получение генераций 4 и 6 проводится, как указано выше, только имеется различие в массовом соотношении этилендиамина и исходного материала. Для получения 4-ой генерации это соотношение равняется 20:1, а для получения 6-ой генерации - 730:1.
ПРИМЕР II.
Модификация
полиамидоаминных дендримеров реакцией с эпоксиоктаном
К раствору 0,80 г ПАМАМ
6-ой генерации в 5 мл метилового спирта добавляется 0,56 г эпоксиоктана. Через 6 дней выдержки при
комнатной
температуре растворитель испаряется под вакуумом с получением 0,80 г бесцветного масла.
Материал растворяется в хлороформе, толуоле или метиловом спирте, но не растворяется в воде. Спектры13C-ЯМР согласуются со спектром дендримера с C-8-алкилгруппами, присоединенными к их
концевым аминам.
ПРИМЕР JJ.
Модификация полиамидоаминных дендримеров реакцией с t-бутилглицидиловым эфиром.
К раствору 0,50 г ПАМАМ 6-ой генерации (G 6,0) в 5 мл метилового спирта добавляется 0,57 г t-бутилглицидилового эфира. Через 6 дней выдержки при комнатной температуре растворитель испаряется в вакууме с получением 1,0 бесцветного масла. Материал растворяется в хлороформе, толуоле или метаноле, но не растворяется в воде. Спектры13C-ЯМР согласуются со спектрами дендримера с 3-(t-бутокси)-1-пропан-2-ол-группами, присоединенными к их концевым аминам.
ПРИМЕР KK.
Модификация
полиамидоаминных дендримеров реакцией с эпоксиоктадеканом
К раствору 0,50 г ПАМАМ шестой
генерации (G 6,0) в 25 мл метилового спирта добавляется 1,1 г эпоксиоктадекана. Раствор кипятится с
обратным холодильником в течение 5 дней. В процессе кипячения бесцветное вязкое масло высаждается из
раствора. Растворитель испаряется под вакуумом с получением 1,6 г белой пены. Материал
растворяется в хлороформе или толуоле, но не растворяется в воде или метиловом спирте. Спектры13C-ЯМР
согласуются со спектрами дендримера с C-18-алкильными группами, присоединенными к
его
концевым аминам.
ПРИМЕР LL.
Реакция STARBURST-ПЭИ с гидрофобным эпоксидом
В колбу, оборудованную магнитной мешалкой, добавляется 0,397 г (2•
10-4 молей) четвертой генерации ПЭИ (NH3-ядро; ММ = 1955) и 2,1 г (9,6•10-3
молей) метил-10,11-оксоундеканоата (ММ = 214,3) в 5 мл метилового спирта.
Реакционная
смесь перемешивается при комнатной температуре в течение 1 дня и затем нагревается при 80oC в течение 8
часов с получением коричневого вязкого сиропа. Полнота реакции
получения гидрофобных
дендримеров с концевыми карбометоксигруппами подтверждается анализом методом ЯМР и сравнением модельных систем.
Указанные выше гидрофобные дендримеры превращаются в водорастворимую форму простым комбинированием эквивалентной массы продукта с гидроокисью натрия в воде и нагреванием в течение 30-60 минут. Получается гомогенный раствор, в котором отсутствуют определяемые карбометоксигруппы. При добавлении избытка NaOH или NaCl натриевая карбоксилатная соль становится комковатой и выделяется в фазу в виде масла.
ПРИМЕР MM.
Модификация ПАМАМ-дендримеров акриловой кислотой. 2:1 = акрилат:амин (реакция A).
Акриловая кислота в количестве 3,84 г смешивается с 3,84 г метилового спирта и охлаждается на ледяной бане в течение 10 минут. Затем 18,72 г 26,7% (по массе) раствора G 6 (NH3) ПАМАМ добавляется при перемешивании раствора акриловой кислоты. Реакционная смесь поддерживается при 4oC в течение 15 минут, создается атмосфера азота, блокируется и оставляется реагировать при комнатной температуре на 5 дней.
1:1 = акрилат:амин
(реакция B)
Акриловая кислота в
количестве 1,6 г смешивается с 1,6 г метилового спирта и охлаждается на ледяной бане в течение 10 минут. Затем к перемешиваемому
раствору акриловой кислоты
добавляется 18,72 г, 26,7% (по массе)
раствора G6 ПАМАМ. Реакционная смесь выдерживается при 4oC в течение 15 минут покрывается азотной оболочкой, блокируется и
оставляется при комнатной
температуре на 5 дней.
0,5:1 = акрилат:амин (реакция C).
Акриловая кислота в количестве 0,80 г смешивается с 0,8 г метилового спирта и охлаждается на ледяной бане в течение 10 минут. Затем 18,72 г 26,7% (по массе) раствора G 6(NH3) ПАМАМ добавляется при перемешивании раствора акриловой кислоты. Реакционная смесь выдерживается при 4oC в течение 15 минут, покрывается азотной оболочкой, блокируется и оставляется реагировать, при комнатной температуре на 5 дней.
0,25:1 = акрилата:амин (реакция D).
Акриловая кислота в количестве 0,40 г смешивается с 0,4 г метилового спирта и охлаждается на ледяной бане в течение 10 минут. Затем 18,72 г 26,7% (по массе) раствора G6 (NH3) ПАМАМ добавляется при перемешивании раствора акриловой кислоты. Реакционная смесь выдерживается при 4oC в течение 15 минут, покрывается оболочкой азота, блокируется и оставляется реагировать при комнатной температуре на 5 дней.
Ультрафильтрация и сушка.
Растворитель удаляется из реакционной смеси на роторном испарителе, и извлеченное твердое вещество повторно растворяется приблизительно в 150 мл воды. 150 мл раствора ультрафильтруется на УМЗ (ММСО = 3000) мембране до тех пор, пока не соберется 4 л пермеата. Ретентат отделяется от воды на роторном испарителе до тех пор, пока не останется твердое вещество или вязкая жидкость. Полусухое твердое вещество на всю ночь помещается под глубокий вакуум для удаления оставшейся воды.
Заключение
В результате реакции
дендримера с аммиачным ядром G 6 (NH3) ПАМАМ с акриловой кислотой при различных соотношениях получаются ожидаемые
продукты. Зарядные
характеристики продуктов являются соответствующими
добавляемому количеству акриловой кислоты. При добавлении избыточного количества акриловой кислоты достигается продукт, который
получается в
традиционном синтезе ПАМАМ-карбоксилатных солей половинной
генерации. Когда количество добавляемой кислоты снижается, данными анализа подтверждается соответствие материала положительно
заряженному
дендримеру с частично отрицательно заряженными поверхностными
группами или амфотерной поверхностью.
ПРИМЕР NN.
Конъюгирование плотных звездчатых дендримеров с целеуказателями, такими как биотин, инсулин и авидин, а также включение переносимого материала (флюоресцеина).
Материалы.
Получаются G 4 (NH3 ) ПАМАМ STARBURST-дендример и STARBURST-дендример генерации 6,0. Флуоресцеин-5-изоцианат (изомер D) (FITC) получается из молекулярных проб. Дансилхлорид получается от Aldrich Chemical Co NHS-LC-биотин и авидин получаются от Pierce Дихлортриазинилфлуоресцеин (I) и инсулин получаются от Sigma Chemical. Все реагенты используются без дополнительной очистки.
1. Биотин/дендримерное
конъюгационное спаривание:
A. Получение конъюгатов
биотин-дендример.
Сырьевой раствор G 6 (NH3) ПАМАМ готовится с концентрацией 1,8 мг/мл в 100 мМ фосфатном буфере с pH 7,0. Другой сырьевой раствор G 6 (NH3) готовится с концентрацией 1,9 мг/мл в H2O. Из каждого раствора отбирается аликвота 1 мл, и к каждому раствору добавляется 5 мг твердого NHS-LC-биотина. Ампулы сильно встряхиваются в течение 5 минут для растворения биотина. Инкубация проводится при комнатной температуре в течение 18 часов. Подобные реакции осуществляются с растворами G 4 (NH3) как в фосфатном буфере, так и в H2O. Концентрация сырьевых растворов G 4 (NH3) является равной 2,0 мг/мл, и 5 мг NHS-LC-биотина добавляется к 1 мл аликвоте каждого.
Другие конъюгации осуществляются с меньшими соотношениями лиганд:амин. Например, в попытке конъюгировать 20 биотинов G 7 (NH3) ПАМАМ-дендримеру 844 мкл аликвота 11,85% G 7-дендримера добавляется к 0,0244 г NHS-LC-биотина в 5 мл боратного буфера с pH 9. Через 3 часа реакционная смесь диализуется по отношению к деионизованной воде для удаления непрореагировавшего биотина.
Электрофорез.
Через 18 часов 100 мкл каждой реакционной смеси и каждого сырьевого раствора полной генерации подвергается
электрофоретическому анализу. 10 мкл 0,1% MB + 50% сахароза
добавляется к каждому раствору, и образцы подвергаются электрофорезу на 5 - 50% T градиент Hylinx геле (полученном от Gradipore).
Используется буфер 90 мМ Tris, 80 мМ борная кислота и 2 мМ EDTA с pH
8,3. 10 мкл каждого образца наносится на гель. Гель выдерживается 30 мин при 200 В (пост.). Распределение прохода указывается
ниже:
1. G 7 (NHp3)
2. G 6 в Pi,
(NH3)
3. G 6 (NH3) ω /биотин в Pi
4. G 4 в Pi, (NH3)
5. G 4 (NH3) ω /биотин в Рi
6. G 6 в H2O, (NH3)
7. G 6 (NHH3) ω /биотин в H2O
8. G 4 в H2O (NH3)
9. G 4 (NH3
) ω /биотин в H2O
10. G 4 (NH3)
11. Cyt c/G 3,5 (NH3)
12. G 5 (NH3).
Результаты и обсуждение.
Электрофорез ясно показывает замедленную подвижность дендримеров, обработанных биотином, по сравнению с дистанцией миграции немодифицированных дендримеров. Молекулярная масса увеличивается благодаря ковалентному присоединению молекул биотина к поверхности дендримеров. Это заставляет дендример мигрировать на более короткое расстояние благодаря ситовому эффекту GGЕ, который задерживает молекулы с большей молекулярной массой.
Число молекул биотина, присоединенных к дендримеру сейчас не является известным. Распределение молекул биотина на дендримере является статистическим, и испытываемые образцы не являются одиночными частицами.
Некоторые реакции были осуществлены так, что, теоретически, все поверхностные группы на дендримере (Z на фиг 1; Z' на фиг. 2) являются биотинилированы. Нет заметно нерастворимого вещества, образованного в ходе этих реакций.
B. Получение конъюгатов дендример-флуоресцеин (FITC).
5 мл метанольного раствора 12,7% (по массе) G 4 (NH3)- ПАМАМ-дендримера сушится под вакуумом на роторном испарителе. Приблизительно 40 мг (7,4 мкмоля) высушенного дендримера удаляется и растворяется в 5 мл 0,1 М фосфатного буфера с pH 9,0.
Флуоресцеинизотиоцианат (FITCI) (14,5 мг, 37 мкмолей) растворяется в 2 мл ДМСО в темноте. Раствор FITCI добавляется к перемешиваемому раствору дендримера по каплям в течение 1-2 минут. Реакционная смесь защищена от света и перемешивается при комнатной температуре в течение 15-20 часов. Раствор является окрашенным в темно-бордовый цвет.
После перемешивания реакционная смесь помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 3000 дальтонов), и подвергается ультрафильтрации с удалением любого количества непрореагировавшего FITCI. В процессе фильтрации добавляются 3 порции по 2 мл 0,1 М фосфатного буфера. После ультрафильтрации из ретентата извлекаются конъюгированный FITCI-дендример четвертой генерации (аммиачное ядро).
C. Получение
биотинилированных
дендример-FITCI-конъюгатов
При использовании 20 мг/мл исходного раствора
G 4 (NH3) ПАМАМ Starburst-дендример FITCI (полученного в предыдущем разделе), 1 мл
исходного раствора
дендример-FITCI отбирается и добавляется к 3 мл 0,1 М фосфатного буфера (pH 9,0),
10,0 мг (18 ммолей) NHS-LC-биотина добавляется к 0,5 мл ДМСО и встряхивается для
растворения.
Раствор NHS-LC-биотина добавляется к раствору дендримера в течение 30 секунд, и реакционная смесь оставляется перемешиваться при комнатной температуре, в темноте, на 4 часа. Затем реакционная смесь удаляется из емкости для перемешивания и переносится в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 3000 дальтонов) и подвергается ультрафильтрации для удаления несвязанного биотина. Для того чтобы облегчить очистку, в процессе ультрафильтрации добавляется 8 раз по 2 мл 0,1 М фосфатного буфера с pH 9,0.
D. Образование комплекса биотинированный G 4-дендример-FITCI/авидин.
Авидин в количестве 3,0 мг (45 мкмолей) растворяется в 1 мл 10 мМ фосфатного буфера (pH 7,1).
Биотинилированный G 4 (NH3 )дендример-FITCI (полученный предварительно) в количестве 300 мкл (10 мг/мл, 450 мкмолей) добавляется к раствору авидина и слабо перемешивается при комнатной температуре в течение 4 часов. Реакционная смесь затем помещается в пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 3000 дальтонов) и подвергается ультрафильтрации для удаления избытка биотинилированного дендримера. Для того чтобы облегчить очистку, в процессе ультрафильтрации добавляется 8 раз по 2 мл 10 мМ фосфатного буфера с pH 7,1. Полученный комплекс биотин-дендример/авидин удаляется из трубок микроконцентратора и хранится при -10oC.
E. Получение дендример/дихлортриазинилфлуоресцеина (I).
Приблизительно 300 мл Starburst G 6 (ЭДА) ПАМАМ-дендримера (21,5% твердого вещества) добавляется к 700 мкл деионизованной воды и диспергируется (64,5 мг, 2,24 мкмоля). Дополнительные 4 мл деионизованной воды добавляются для разбавления дендримера до концентрации 12,9 мг/мл.
Дихлортриазинилфлуоресцеин (изомер I) гидрохлорид [DTAF(I)] (6,0 мг, 11,3 мкмоля) растворяется в 0,5 мл метилового спирта в темноте, и добавляются две капли триэтиламина. Раствор DTAF (I) добавляется по каплям в перемешиваемый раствор дендримера в течение 30 секунд. Реакционная смесь защищается от света и перемешивается при комнатной температуре в течение 15-20 часов. В течение всей реакции раствор остается прозрачным и оранжевого цвета. После перемешивания реакционная смесь помещается в две пробирки Centricon микроконцетратора (молекулярная масса отсечки: 10000 дальтонов) и подвергается ультрафильтрации для удаления непрореагировавшего DTAF (I). Для того, чтобы облегчить очистку в процессе ультрафильтрации добавляется 15 раз по 2 мл 0,1 М фосфатного буфера с pH 9,0. После очистки извлекается приблизительно 3 мл конъюгированного G 6 (ЭДА) дендример - DTAF (I).
F. Получение конъюгатов мультибиотинилированный дендример-DTAF (I).
Используется 20 мг/мл исходный раствор Starburst G 6 (ЭДА)ПАМАМ-дендример-DTAF (I) (полученный в предыдущем разделе). 0,425 мл (8,5 мг, 0,0003 ммоля) исходного раствора дендример-DTAF (I) отбирается и добавляется к 0,575 мл 0,1 М фосфатного буфера (pH 9,0).
NHS-LC-биотин в количестве 8,1 мг (0,029 ммоля) добавляется к 0,3 мл МДСО и встряхивается для растворения.
Раствор NHS-LC-биотин добавляется к раствору дендримера в течение 30 секунд, и реакционная смесь перемешивается при комнатной температуре в течение 4 часов в темноте.
Через 4 часа реакционная смесь удаляется из емкости для перемешивания, переносится две пробирки Centricon микроконцентратора (молекулярная масса отсечки: 10000 дальтонов) и подвергается ультрафильтрации для удаления несвязанного биотина. Для того, чтобы облегчить очистку в процессе ультрафильтрации добавляется 8 раз по 2 мл 0,1 М фосфатного буфера с pH 9,0.
II. Конъюгированное спаривание
инсулин/дендример
A. Получение
дансилированного дендримерного
конъюгата
5 мл метанольного 12,7% (по массе) раствора G 4 (NH3) ПАМАМ-дендримера сушится под вакуумом на
роторном испарителе. Приблизительно 40 мг
(7,4 мкмоля) высушенного
дендримера отбирается и растворяется в 5 мл 0,1 М фосфатного буфера с pH 9,0.
10 мг (0,037 ммоля) дансилхлорида добавляется к 5 мл ацетона и встряхивается в течение 5-10 минут. (Этот раствор является темно-желтого цвета, и в нем содержатся следы твердого вещества).
Раствор дансилхлорида добавляется к раствору дендримера в течение 30 секунд, и реакционная колба помещается на водяную баню при 40oC на 90 минут. В процессе нагревания реакционная смесь периодически встряхивается. (Отмечается, что цвет раствора постепенно меняется от ярко- до бледно-желтого).
Через 90 минут реакционная колба снимается с бани и остается охлаждаться до комнатной температуры, (реакционная смесь кажется слегка помутневшей). Меченый дендример затем очищается при выдерживании в растворе. Реакционная смесь помещается на роторный испаритель, и ацетон удаляется под вакуумом при 30 - 35oC. В результате раствор становится практически прозрачным. Реакционная смесь затем переносится в две трубки центрифуги и центрифугируется со скоростью 5000 об/мин в течение 30 минут. Дополнительное осаждение после центрифугирования не наблюдается.
Раствор дансилированного дендримера четвертой генерации затем помещается в две пробирки Centricon микроконцентратора (молекулярная масса отсечки: 3000 дальтонов) и подвергается ультрафильтрации для удаления всего несвязанного дансилхлорида. Ультрафильтрация контролируется на степень чистоты с помощью тонкослойной хроматографии для того, чтобы обеспечить удаление всего непрореагировавшего дансилхлорида. Фильтрат отбирается и испытывается методом ТСХ следующим образом: 60 пластин силикагеля (E.Merck) используются с этилацетатной (100%) системой растворителей (визуализация УФ-светом). В то время, как меченый дендример остается в исходном состоянии, оставшийся дансилхлорид вымывается около Rf = 0,3. Извлекается приблизительно 1-2 мл раствора исследуемого дансилированного дендримера.
B. Получение конъюгата инсулин/дансилированный дендример.
В двухдрахмовой ампуле 0,5 мл дансилированного дендримера (полученного предварительно) добавляется к 1,5 мл деионизованной воды для 10 мг/мл раствора. Отбирается 1 мл (10,0 мг, 0,0019 ммоля) и используется для связывания (спаривания) с инсулином.
Во второй ампуле 12,3 мг (0,0020 ммоля) инсулина (из бычьей поджелудочной железы) растворяется в 2 мл деионизованной воды. Полученный раствор является мутным, поэтому pH снижается до 4 добавлением 1 капли 1 N хлористоводородной кислоты для растворения твердой составляющей.
В третьей ампуле 88,7 мг (0,46 ммоля) EDAC растворяется в 1 мл деионизованной воды.
Раствор инсулина добавляется к перемешиваемому раствору дендримера в течение 1-2 минут и немедленно становится мутным. Затем pH корректируется от 7,0 до 4,0 с использованием 1 N хлористоводородной кислоты. (Раствор становится прозрачным вблизи pH 4,2). При непрерывном перемешивании раствор EDAC добавляется в 200 - 300 мкл инкрементов каждый 10 - 15 минут (в течение 1 часа). С помощью 1 N хлористоводородной кислоты pH реакционной смеси поддерживается между 3,90 и 4,2. После завершения добавления EDAC реакционная смесь перемешивается всю ночь при комнатной температуре (15 - 20 часов).
Реакционная смесь помещается в пробирки Centricon микроконцентратора (молекулярная масса отсечки: 3000 дальтонов) и подвергается ультрафильтрации деионизованной водой (которая образует осадок), но затем повторно суспендируется при добавлении 1 капли 1 N хлористоводородной кислоты. Этот процесс повторяется 2-3 раза, и конъюгат дансилированный дендример/инсулин повторно растворяется. После ультрафильтрации извлекается приблизительно 1 мл конъюгата дансилированный дендример/инсулин.
C. Получение
инсулин/дидхлортриазинилфлуоресцеин (I)
В двухдрахмовой ампуле 9,3 мг (0,002 ммоля) инсулина (из бычьей поджелудочной железы) растворяется в 2 мл 0,1 фосфатного буфера (pH 9,0).
Дихлортриазинилфлуоресцеин(изомер 1) гидрохлорид[DTAF (1)] (4,1 мг, 0,008 ммоля) растворяется в 0,5 мл метилового спирта, в темноте, и туда добавляется 2 капли триэтиламина.
Раствор DTAF (1) добавляется к перемешиваемому раствору инсулина по каплям в течение 2 минут. Реакционная смесь защищается от света и перемешивается при комнатной температуре в течение 6 часов, затем помещается при 2-8oC на всю ночь. (Раствор остается прозрачным и оранжевым в течение всей реакции).
На следующее утро реакционная смесь помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 3000 дальтонов) и подвергается ультрафильтрации для удаления всего непрореагировавшего DTAF (1). Для того чтобы облегчить очистку, в процессе ультрафильтрации добавляется 10 раз по 2 мл 0,1 М фосфатного буфера с pH 9,0. После очистки извлекается приблизительно 2 мл инсулин-DTAF (1).
D. Получение конъюгата инсулин-DTAF(1)/дендример.
В двухдрахмовую ампулу добавляется 1 мл (7:05 мг, 0,0014 ммоля) G 4 (NH3)дердримера, и pH корректируется до 4,5 с использованием 1 N хлористоводородной кислоты. К перемешиваемому дендримеру добавляется 1 мл (10,1 мг, 0,0020 ммоля) инсулин-DTAF (полученного предварительно), и pH корректируется до 4,0 с использованием 1 N хлористоводородной кислоты.
Во второй ампуле 54,3 мг (0,28 ммоля) EDAC растворяется в 0,5 мл деионизованной воды.
Раствор EDAC добавляется к реакционной смеси в 100 мкл инкрементов каждые 10 - 15 минут (в течение 1 часа). Значение pH реакционной смеси поддерживается между 3,9 и 4,2 с помощью 1 N хлористоводородной кислоты. После завершения добавления EDAC реакция продолжается при комнатной температуре в течение 6 часов, затем помещается при 2- 8oC на всю ночь.
Реакционная смесь затем помещается в пробирки Centricon микроконцентратора (молекулярная масса отсечки: 10000 дальтонов) и подвергается ультрафильтрации с деионизованной водой, с поддержанием pH между 4 и 5 с помощью 1 N хлористоводородной кислоты. Этот процесс повторяется 2-3 раза, и конъюгат инсулин- DTAF(1)/дендример собирается с получением прозрачной оранжевой жидкости.
III. Конъюгированное связывание (спаривание) дендример/авидина.
A. Получение конъюгатов дендример/авидин.
В двухдрахмовой ампуле G 7 (ЭДА) дендример (21,9% твердого вещества) добавляется к 0,8 мл деионизованной воды. Разбавленный дендример, 0,5 мл, отбирается и добавляется к 4,5 мл деионизованной воды для 2,6 мг/мл раствора.
Во второй ампуле 3,0 мг (0,045 ммоля) EDAC растворяется в 0,5 мл деионизованной воды.
Раствор авидина добавляется к перемешиваемому раствору дендримера в течение 1-2 минут и остается прозрачным. Затем с помощью 1 N хлористоводородной кислоты pH корректируется до 4,0. С непрерывным перемешиванием раствор EDAC добавляется в 100 мкл инкременты каждые 10 - 15 минут (свыше 1 часа). Значение pH реакционной смеси поддерживается между 4,5 и 5,5 с помощью 1 N хлористоводородной кислоты. После завершения добавления EDAC реакционная смесь перемешивается при комнатной температуре всю ночь (15 - 20 часов).
Реакционная смесь помещается в пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 100000 дальтонов) подвергается ультрафильтрации с 10 мМ фосфатного буфера для удаления всего несвязанного дендримера или авидина. Для того, чтобы облегчить очистку в процессе ультрафильтрации добавляется 8 раз по 2 мл 10 мМ фосфатного буфера с pH 7,1.
ПРИМЕР OO.
Нацеливание плотных
звездчатых дендримеров натриевой солью пировиноградной кислоты
0,5 г EDC смешивается с 0,0065 г натриевой соли пировиноградной кислоты в 2 мл воды. Значение
pH раствора корректируется до 5,0
(как определяется pH-бумагой), и раствор перемешивается в течение 5 минут. Затем 62 мкл (20 мг) G 6 (NH3) дендримера (32,45% в твердом виде) добавляется
к реакционной смеси, и раствор
встряхивается в течение 21 часа. Очистка для освобождения раствора от избытка EDC осуществляется на концентраторе Amicon Microcon-10.
Фактор разбавления равняется 57•106. На спектре13C-ЯМР наблюдается небольшой резонанс для метильной группы пирувата, конъюгированного с G 6 дендримером; для конъюгата также наблюдается уникальный пик капиллярного электрофореза.
В получении конъюгатов данного изобретения используются исходные материалы, описанные выше, или исходные материалы, которые получаются аналогичным образом, или исходные материалы, описанные в науке, или исходные материалы, которые являются доступными.
ПРИМЕР 1.
Введение 2-(ацетилокси)бензойной кислоты (аспирина) в STARBURST-дендримеры.
Общепринятым способом установления, когда "молекула-зонд" входит внутрь мицеллы, является сравнение углерод-13-спин-времени релаксации (T1) ее решетки в мицеллированной и немицеллированной среде. Значительное снижение T1 для мицеллированной среды указывает на вхождение молекулы-зонда в мицеллу. Поскольку STARBURST-дендримеры являются "ковалентно фиксированными" аналогами мицелл, этот метод времени релаксации T1 используется для установления уровня/степени, с которой различные молекулы фармацевтического типа ассоциируются с STARBURST-полиамидоаминами. В последующих примерах значение T1 для 2-(ацетилокси)бензойной кислоты (1) (аспирина) определяются в растворителе (CDCl3) и затем сравниваются с значениями T1 в CDCl3 при разных мольных соотношениях [l: дендример].
Включение аспирина (1) в различные STARBURST-полиамидоаминные дендримеры как функция генерации.
Различные STARBURST-полиамидоаминные дендримеры (с сложноэфирными концевыми группами, инициированные NH3) половинных генераций (G=0,5__ →5,5) комбинируются с 2-(ацетилокси)бензойной кислотой в CDCl3 получением соотношения кислота : третичный амин = 1,0. График значений T1 для 2-(ацетилокси)бензойной кислоты по отношению к генерации присоединенного STARBURST-дендримера (смотри фиг. 4, где затушеванные кружки представляют C-4, незатушеванные квадраты представляют C-6, а незатушеванные кружки представляют C-5) показывает, что T1 достигает минимума по ряду генераций 2,5__→5,5 для C-4, C-5 и C-6 в 2-(ацетилокси)бензойной кислоте. Это демонстрирует внутреннюю ассоциацию 2-(ацетилокси)бензойной кислоты в дендримерах (G=2,5__→5,5) и, кроме того, подтверждает, что полиамидоаминные дендримеры (G = 2,5 или более) могут функционировать в качестве молекул носителя.
ПРИМЕР 2.
Высвобождение псевдоэфедрина из
STARBURST-дендример-ПАМАМ
Псевдоэфедрин (0,83 мг/моль) и STARBURST-ПАМАМ-дендример (1,0
мг/мл; G = 6,5; концевая группа (Z)=192 (метилсложный эфир)) растворяются в деионизованной
дистиллированной воде, pH донорной фазы корректируется до 9,5 с помощью раствора гидроокиси натрия, и
хранится при комнатной температуре около 12 часов. Раствор одного псевдоэфедрина обрабатывается
таким же образом (контрольный образец). Раствор лекарства-дендримера хранится при 40oC в
течение 8 часов после первого эксперимента, и осуществляется динамический диализ. Используется
диализная мембрана SpectaSpor 7, ММСО 1000, диаметр 28,6 мм в отдельных спектральных ячейках (половина
объема ячейки 5 и 10 мл, размеры ячейки: диаметр 38 мм для обеих ячеек, глубина 10 и 20 мм для
5 и 10 мм ячеек, соответственно).
Образцы анализируются методом ГХВР, разработанного
для
условий псевдоэфедрина, которые являются следующими:
Колонка: Микро Bondapak
C-18
Скорость потока: 0,3 мл/мин
Определение: УФ при 210 нм
Время удерживания: 13,
3
мин
Диализные мембраны промываются водой и выдерживаются набухшими в
рецепторной фазе не менее 12 часов перед применением. Диализная мембрана устанавливается между донорным и рецепторным
отсеками, и донорный отсек перемешивается небольшим магнитным вращающимся
стержнем. Известные объемы донорного и рецепторного объемов вводятся в соответствующие отсеки, и перенос псевдоэфедрина в
рецепторный отсек исследуется как функция от времени. Для поддерживания
условий стока вся рецепторная фаза периодически (каждые 30 минут) удаляется и заменяется свежей рецепторной фазой. В
рецепторной
фазе образца определяется количество эфедрина. Эксперименты
проводятся при комнатной температуре (22oC). Рецепторной фазой является обычная деионизованная дистиллированная
вода.
Результаты динамического анализа показаны на фиг. 5. На фиг. 5 затушеванные кружки представляют только псевдоэфедрин (контрольный образец),


Эксперимент повторяется при более низких концентрациях (отношение числа молекул лекарства к числу концевых групп сохраняется тем же). G 6,5 дендример 120 мкг/мл псевдоэфедрин 100 мкг/мл (122 мкг/мл соль).
Динамический диализ псевдоэфедрина (в отдельности) при низких концентрациях является почти идентичным анализу при более высокой концентрации. На фиг. 6 представлены результаты этого эксперимента, где затушеванные кружки представляют только псевдоэфедрин (контрольный образец), а незатушеванные кружки представляют псевдоэфедрин плюс дендример.
ПРИМЕР 3.
Повторяется методика примера 2 с использованием изменений, приведенных ниже.
Рецепторная фаза:
фосфатный буфер с pH 7,4,
Донорная фаза: фосфатный буфер с pH 7,4 плюс лекарство и дендример в следующих соотношениях:
1. G 6,
5:лекарство = 1:192.
2. G 5, 5:лекарство = 1:96.
3. G 4,5:лекарство = 1:48.
4. G 6,5H:лекарство = 1:192.
5. G 5,5H:лекарство = 1: 96.
6. G 4,5H:лекарство = 1: 48.
Указанные выше донорные фазы плюс эфедрин подвергаются динамическому диализу. Буквой "H" после номера генерации дендримера обозначается гидролизованный дендример. Гидролиз выполняется, как описано в примерах M и N.
Результаты этих экспериментов приводятся на фиг. 7, где в донорном и рецепторном отсеках содержится фосфатный буфер с pH 7,4. Для одного псевдоэфедрина (P) представляется кривая трех экспериментов (сплошная линия), и представляется один типичный опыт из других экспериментов. На фиг. 7 используются символы, представляющие дендример указанной генерации (см. табл. III).
Псевдоэфедрин не показывает сильной ассоциации с дендримером с сложноэфирными концевыми группами при pH 7,4. Гидролиз концевых функциональных групп в карбоксилатную форму имеет разное влияние на скорость диализа (снижение). Число генераций не оказывает влияние на скорость диализа.
ПРИМЕР 4.
Исследование
взаимодействия салициловой кислоты с STARBURST-ПАМАМ-дендримерами
В данном примере определяются характеристики взаимодействия салициловой
кислоты с
STARBURST-ПАМАМ-дендримерами. Эти
дендримеры являются дендримерами, состоящими из аммиаком инициированного ядра с повторяющимися единицами, производными от N-(2-аминоэтил)акриламида. В
исследование
включаются полимеры как полной
(аминные концевые функции), так и половинной (сложноэфирные концевые группы) генерации. Отношение салициловой кислоты к STARBURST-дендримерам,
использованным в
экспериментах, берется равным
приблизительно одна молекула салициловой кислоты к одной концевой функциональной аминной группе для полимера полной генерации. При исследовании
полимеров половинной
генерации используется то же
соотношение с корректированием для более высокомолекулярного полимера.
Эксперименты проводятся при комнатной температуре с использованием равновесной статической диализной ячейки методики. Для всех экспериментов используется набор статических диализных ячеек (половина объема ячейки 10 мл), разделенных 6 мембранами SpectraPor (молекулярная масса отсечки = 1000). Перенос салициловой кислоты контролируется как функция от времени при удалении аликвот из соответствующих ячеечных отсеков и проведении анализа методом ГХВР с использованием УФ детектора при 296 нм (Bondapak C-18-колонка, вымывающая подвижная фаза: ацетонитрил/0,1 М фосфатный буфер (pH 3,2) при соотношении 20:80 (по объему), скорость потока 30 мл/час).
10 мл раствора, содержащего 1 мг/мл салициловой кислоты и 2,5 мг/мл STARBURST-полимера (Gen= 4,0), причем pH раствора корректируется до 6,65 и 5,0 с помощью раствора HCl, помещается в донорный отсек диализной ячейки, а равный объем очищенной воды с pH, откорректированным до того же pH , помещается в рецепторный отсек. Контролируется перенос салициловой кислоты в рецепторный отсек. Результаты приводятся на фиг. 8, на котором затушеванный маленький кружок относится к свободной кислоте, незатушеванный большой кружок - кислоте + дендример генерации 4,0 (pH 6,65), незатушеванный квадрат относится к кислоте + дендример генерации 4,0 (pH 5,00).
Благодаря более низкому проценту ионизации аминогрупп на полимере при pH 6, более высокая степень взаимодействия с салициловой кислотой может оказаться при pH 5, что дает меньше соединения, переносимого при более низком pH. Результаты, приведенные на фиг. 8, показывают намного более низкое процентное содержание салициловой кислоты, перенесенной в присутствии полимера при обоих исследуемых значениях pH по сравнению с контрольным образцом салициловой кислоты. Также наблюдается, что больше салициловой кислоты переносится при pH 6, 65, чем при pH 5, как ожидалось. Данные демонстрируют взаимодействие STARBURST-дендримера с салициловой кислотой, которое может регулироваться с помощью pH. Устойчивые характеристики высвобождения также подразумеваются этими данными, так как уровни содержания салициловой кислоты в присутствии полимера продолжают расти после точки примерно 12 часового равновесия, наблюдаемого в контрольном опыте.
Для дальнейшего изучения характеристики взаимодействия салициловой кислоты с STARBURST-полимерами (Gen= 4,0) проводится эксперимент при pH 8,0. Отличие от ранее описанного значения в том, что раствор салициловой кислоты (1 мг/мл), с pH , скорректированным до 8,0, помещается в донорный отсек, а раствор полимера (2,5 мг/мл) помещается в рецепторный отсек. Уход салициловой кислоты из донорного отсека контролируется, как описано ранее. Результаты эксперимента даются на фиг. 9, на котором маленький затушеванный кружок относится к свободной кислоте, а незатушеванный треугольник относится к кислоте плюс дендример генерации 4,0 при pH 8,0.
Как показано на фиг. 9, характеристики равновесия салициловой кислоты в донорном отсеке с STARBURST-полимерами в рецепторном отсеке отличаются от контрольного испытания салициловой кислоты. На основе ионизации молекул при pH 8 ожидается 6 - 7% взаимодействие. Наблюдаемый избыток взаимодействия является порядка 4/5%. Наблюдаемая более низкая ассоциация может быть обусловлена экспериментальным различием или для постоянной ионизации < 1.
Эксперимент показывает поглощение или удаление свободной салициловой кислоты из дисперсной среды системы полимером. Этот тип действия может привести к подавлению реакционной способности молекул, предполагающей возможное хелатирование или тип молекулярной ассоциации свойства, связанного с полимерами.
Исследуются характеристики взаимодействия салициловой кислоты при pH 6,6 с STARBURST-полимером половинной генерации (Gen=4,5), имеющим концевые сложноэфирные функциональные группы. Салициловая кислота (1 мг/мл) комбинируется с STARBURST-полимером (Gen=4, 5) (3,6 мг/мл) при pH 6,6. 10 мл раствора помещается в донорный отсек, и перенос из донорного отсека контролируется, как описано ранее. Результаты приводятся на фиг. 10; на котором затушеванный маленький кружок относится к свободной кислоте, а незатушеванных кружок относится к кислоте плюс полимер.
В этих экспериментальных условиях взаимодействие зарядов не предсказывается, т.к. третичные аминные группы не ионизируются при pH 6,6. Как указывается на фиг. 10, потери салициловой кислоты в присутствии полимера (Gen 4,5) в первые 10 часов диализа являются фактически идентичными потерями салициловой кислоты в контрольном испытании.
Следующие наблюдения делаются по данным, представленным в этом примере:
(1) STARBURST-ПАМАМ-полимеры полной
генерации
функционируют как
носитель салициловой кислоты.
(2) STARBURST-ПАМАМ-полимеры полной генерации имеют устойчивую функциональность высвобождения салициловой кислоты.
(3) Свойства STARBURST-ПАМАМ-полимеров полной генерации в качестве носителя салициловой кислоты могут регулироваться с помощью pH.
ПРИМЕР 5.
Демонстрация
многократного
хелатирования железа STARBURST-полиамидоамином шестой генерации с концевыми натрийпропионатными группами
Полиамидоамин (инициированный аммиаком) шестой генерации с
натрийпропионатными
концевыми группами, полученный, как в примерах M и N (97,1 мг, 2,45 моля), растворяется в 1,5 мл деионизованной воды. Добавлением 0,5 мл 0,5 N HCl pH корректируется до 6,5.
Добавляется хлорид железа
(0,5 мл 1,2 М раствора, 0,051 ммоля) с получением светло-коричневого студенистого осадка. При нагревании при 60oC в течение 0,5 часа студенистый осадок
становится
растворимым, превращаясь в
гомогенный оранжевый раствор. Раствор фильтруется через Biogel P2-акриламидный гель (10 г, дважды), отделяющий оранжевую полосу (свободную от галоидного
загрязнения). После
удаления растворителя в
вакууме получается продукт в виде оранжевой пленки (30 мг). Анализом подтверждается хелатирование приблизительно 20 молей трехвалентного железа на 1 моль
STARBURST-дендримера
Эти результаты,
представленные в табл. IV, подтверждают хелатирование 20 ± 2 молей трехвалентного железа на 1 моль STARBURST-дендримера.
ПРИМЕР 6.
Получение продукта,
содержащего более одного атома родия на STARBURST-полимер
2,5 GenПАМАМ (с концевыми сложноэфирными группами, инициированный NH3),
полученный, как в примере GG, (0,18 г, 0,087
ммоля) и Rh Cl3•3H2O (0,09 г, 0,3 ммоля) смешиваются в диметилформамиде (ДМФ) (15 мл) и нагреваются в течение 4 часов при
70oC. Раствор становится малиновым, и
большая часть родия поглощается. Непрореагировавший родий удаляется фильтрацией, и растворитель удаляется на роторном испарителе. Образовавшееся
масло
является растворимым в хлороформе. Оно
промывается водой и сушится (MgSO4) перед удалением растворителя с получением красного масла (0,18 г). На записанных ЯМР-спектрах в CDCl3
отмечаются только минимальные различия
между хелатированным и нехелатированным STARBURST. После разбавления части этого CDCl3-раствора этиловым спиртом с последующим добавлением
NaBH4 осаждается родий. Rh Cl3•3H2O растворяется в хлороформе и в хлороформном растворе STARBURST, подтверждается тем самым хелатирование.
ПРИМЕР 7.
Получение продукта, содержащего Pd, хелатированный с STARBURST-полимером.
ПАМАМ (с сложноэфирными концевыми группами, инициированный NH3) 3,5 генерации, полученный в примере GG, (1,1 г, 0,24 ммоля) растворяется с перемешиванием в ацетонитриле (50 мл). Добавляется хлорид палладия (0,24 г, 1,4 ммоля), и раствор нагревается при 70-75oC (водяная баня) всю ночь. PdCl2 поглощается STARBURST. После удаления растворителя методом ЯМР в CDCl3 подтверждается состоявшееся хелатирование. В результате разбавления CDCl3-раствора этиловым спиртом и добавления NaBH4 осаждается палладий. Хелатированный продукт (1,23 г) выделяется в виде коричневого масла.
ПРИМЕР 8.
Демонстрация многократного
хелатирования иттрия STARBURST-полиэтиленимином второй генерации с концевыми метиленкарбоксилатными группами при трансхелатировании от ацетата иттрия
Материал STARBURST-полиэтиленимин с
концевыми метиленкарбоксильными группами (0,46 г, 52,5% активной составляющей, остаток бромида натрия, 0,18 ммоля активного STARBURST дендримера) из примера
FF
растворяется в 4,5 мл окиси дейтерия.
Получается значение pH 11,5-12. Раствор ацетата иттрия получается растворением хлорида иттрия (0,15 г, 0,5 ммоля) и ацетата натрия (0,41 г, 0,5 ммоля) в 1,5
мл
окиси дейтерия (2,9 молей иттрия на моль
дендримера). К раствору дендримера добавляются аликвоты 0,5 мл раствора ацетата иттрия,13C-ЯМР-спектры записываются при 75,5 МГц.
На13C-ЯМР-спектрах ацетата иттрия имеются два резонанса, 184,7 частей на млн для карбоксилуглерода и 23,7 частей на млн для метилуглерода, по сравнению с 182,1 и 24,1 частей на млн для ацетата натрия и 177,7 и 20,7 частей на млн для уксусной кислоты (Sadtler13C NMR Standart Spectra). Контроль положений этих полос указывает степень хелатирования STARBURST-дендримером. Наиболее информативным сигналом для STARBURST-дендримера, который указывает на хелатирование, является α-CH2 (из метиленкарбоксилатной группы, включенной в хелатирование), который появляется при 58,4 частей на млн в нехелатированном дендримере, и при 63,5 частей на млн в хелатированном дендримере. При хелатировании иттрием время спин-релаксации решетки укорачивается α -CH2, как ожидается, с 0, 24±0,01 сек до 0,14±0,01 сек, указывает на хелатирование.
После добавления 0,5 мл раствора ацетата иттрия к STARBURST-дендримеру весь иттрий, по-видимому, хелатируется дендримером, что подтверждается сигналами для ацетата, являющимися сигналами ацетата натрия. Такое наблюдение не отмечается для добавления второй 0,5 мл аликвоты раствора ацетата иттрия. При добавлении третьей аликвоты ацетата иттрия наблюдается, что не весь иттрий поглощается в виде STARBURST-хелата, ацетаткарбоксильный резонанс наблюдается со сдвигом к 183,8 частей на млн, указывая на то, что часть иттрия ассоциируется с ацетатом. Интегрированная область хелатированных CH2-групп на дендримере увеличивается, указывая, что часть трехмольного эквивалента добавленного иттрия действительно является хелатированной дендримером. Этими результатами иллюстрируется, что дендримером может хелатироваться 2-3 иона иттрия на молекулу дендримера (генерация = 2,0).
ПРИМЕР 9.
Демонстрация многократного хелатирования иттрия STARBURST-полиамидоамином второй генерации с концевыми
метиленкарбоксилатными
группами при трансхелатировании от ацетата
иттрия
Для данного исследования используются экспериментальные методики из примера 8. STARBURST-полиамидоамин с концевыми
метиленкарбоксилатными
группами (0,40 г 62,5% активного вещества,
остаток бромида натрия, 0,12 ммоля) растворяется в 4 - 5 мл окиси дейтерия. Получается pH 11,5-12, который снижается до 9,4 с
помощью 6 N HCl до
эксперимента. Раствор ацетата иттрия получается
растворением хлорида иттрия (0,1125 г, 0,37 ммоля) и ацетата натрия (0,0915 г, 1,1 моля) в 1,5 мл окиси дейтерия, таким образом, в
каждых 0,5 мл
раствора содержится один моль-эквивалент металла.
Первые 2-моль-эквивалента добавленного ацетата иттрия полностью хелатируются STARBURST-полиамидоамином. При добавлении третьего моль-эквивалента иттрия наблюдается осаждение продукта, и по существу данные методом ЯМР не получаются. Сигналами, дающими наибольшую информацию о хелатировании STARBURST-дендримером, являются сигналы двух углеродов, смежных с хелатирующим азотом. Химические сдвиги этих углеродов в нехелатированном дендримере имеются при 59,1 частей на млн для α-CH2 и 53,7 частей на млн для первого метиленуглерода главной цели. При хелатировании эти два резонанса наблюдаются со сдвигом к 60,8 и 55,1 частей на млн соответственно. Трансхелатированием подтверждается, что два иона металла могут легко хелатироваться на молекулу дендримера, однако при хелатировании некоторой неизвестной части третьего моль-эквивалента продукт высаждается из раствора.
ПРИМЕР
10:
Демонстрация многократного хелатирования90Y
STARBURST-полиэтиленимином второй генерации с концевыми метиленкарбоксилатными группами
Получаются стандартный
раствор
хлорида иттрия (3•10-2 М, скрепленный без носителя
добавленным90Y) и STARBURST-полиэтиленимина второй генерации с концевыми метиленкабоксилатными группами из
примера FF
(6•10-2М). Проводится их реакция при разных
соотношениях металл: STARBURST в HEPES-буфере. Выход комплекса определяется ионообменной хроматографией с использованием
ионообменных
шариков Sephadex G 50, с вымыванием 10% NaCl:NH4OH= 4:1
при pH 10. Не образующий комплекс металл удаляется на колонке, металл, образующий комплекс, вымывается. Выходы
получаются при
сравнении вымытой радиоактивности с радиоактивностью на колонке с
использованием счетчика. С точностью экспериментов получаются результаты, показывающие, что (G 2,5)
STARBURST-ПЭИ-АЦЕТАТОМ может
хелатироваться 2-3 металла на дендример с получением растворимого
комплекса (см. табл.V).
Все объемы в таблице V даются в микролитрах.
ПРИМЕР 11.
Конъюгация STARBURST-полиэтиленимина третьей генерации с концевыми
4-изотиоцианатофенилметиленкарбоксилатными группами с lgG-моноклональным антителом
Изотиоцианат, 10 мг (50 мкмолей), из
примера DD, растворяется в 500 мкл 3 мМ хлорида индия, который пронизан
радиоактивным хлоридом индия-III, и pH корректируется до 9 с помощью 660 мкл 1 N NaOH.
Аликвоты целого моноклонального антитела
lg GCC-46 затем смешиваются с аликвотами хелатированного STARBURST.
Смеси затем встряхивают и затем оставляют на 18 часов. Смеси затем анализируются методом
ГХВР (колонка Dupont Zorbax Biasphere
GF-250; элюент 0,25 М ацетат натрия, pH 6) и УФ-детектором при 254 нм и
радиоактивным детектором. Результаты приводятся в таблице VI.
ПРИМЕР 12.
Конъюгация STARBURST-полиэтиленимина третьей генерации с концевыми 4-изотиоцианатофенилметиленкарбоксилатными группами с lg G-моноклональным антителом.
Изотиоцианат из примера DD, 4 мг (20 мкмолей), смешивается с 200 мкл 3 мМ хлорида индия (60 мкмолей). 20 мкл аликвота раствора затем пронизывается радиоактивным хлоридом индия-III, и pH корректируется до 9 добавлением 30 мкл 1 N NaOH и 10 мкл 0,1 N HCl. Хелат индия смешивается с 150 мкл CC-49 целевого антитела lg G, 10 мг/мл в 50 мМ HEPES-буфера при pH 9,5. Через 18 часов при комнатной температуре антитело препаративной ГХВР (колонка Dupont Zorbax Bioephere GF-250; элюент 0,25 М ацетат натрия, pH 6); и УФ-детектором при 254 нм и радиоактивным детектором. Извлеченное антитело концентрируется на Amicon - мембране и подвергается обмену в PBS-буфере (фосфатный рассол с pH 7,4, который содержит 0,12 M NaCl, 2,7 мМ KCl и 10,0 мМ фосфата) при pH 7,4. Извлеченное антитело характеризуется удельной активностью приблизительно 0,5 мкКи/100 мкг.
ПРИМЕР 13.
In vivo локализацияIIIIn-меченого конъюгата STARBURST-антитело.
Применимость меченого конъюгата STARBURST-антитело, полученного в примере 12, демонстрируется определением потребления материала in vivo ксенотрансплантатом опухоли человека в атимичной мыши. Атимичные мыши-самки инокулируются подкожно линией клеток рака толстой кишки человека LS 174T (приблизительно 4•106 клеток/животное). Приблизительно через две недели после инокуляции каждое животное инъецируется через хвостовую вену. Мыши умерщвляются через 17 и 48 часов (по 5 животных в каждый момент времени). Опухоль и отобранные ткани иссекаются и взвешиваются, а радиоактивность измеряется счетчиком γ- частиц. Через 17 часов 13,5% инъецированной дозы на 1 г ткани локализуется в опухоли. Через 48 часов 21, 6% инъецированной дозы на 1 г ткани локализуется в опухоли.
ПРИМЕР 14.
Прикрепление гербицидных молекул (2,4-D) к поверхности STARBURST-дендримеров.
ПАМАМ (ядро инициатора = NH3) третьей генерации (2,0 г, 0,8 ммоля) растворяется в воде (10 мл) и комбинируется с толуолом (20 мл). Двухфазная система затем перемешивается и охлаждается на ледяной бане в течение 30 минут. За время охлаждения кислый хлорид 2, 4-D[2,4-дихлорфенокси)-уксусной кислоты] (2,4 г, 12 эквив.), растворенный в толуоле (10 мл), добавляется в систему по каплям. В конце добавления добавляется NaOH (0,5 г, 12,5 ммоля, 50% раствор по массе), и раствор перемешивается еще 2 часа. Реакционная смесь затем испаряется до сухости, и полученный твердый остаток повторно берется в смеси 1: 1 по объему CHCl3:MeOH и фильтруется. Желтовато-коричневое твердое вещество является совсем нерастворимым в CHCl3 и оказывается растворимым в воде; однако, при добавлении ацетона растворение облегчается. Желтовато-коричневое твердое вещество перемешивается в хлороформе в течение 24 часов, и раствор фильтруется (получается клейкое желтовато-коричневое твердое вещество). После сушки над MgSO4 фильтрат концентрируется с получением вязкого оранжевого масла, которое становится твердым при стоянии. Данными13 C-ЯМР-анализа подтверждается частичное амидирование на поверхности 2,4-D и осуществление ассоциации 2,4-D с STARBURST-полимером.
ПРИМЕР 15.
Включение 2, 4-дихлорфеноксиуксусной кислоты (2,4-D) в STARBURST-дендримеры.
Общепринятый способ распознавания, когда "молекула-зонд" включается внутрь мицеллы, сравнивается с временем13C-спин-релаксации (T1) в немицеллированной по отношению к мицеллированной среде. Значительное снижение T1 для мицеллированной среды является показателем включения "молекулы зонда" в мицеллу. Так как STARBURST-дендримеры являются "ковалентно фиксированными" аналоги мицелл, этот метод времени релаксации T1 используется для установления уровня/степени, с которой молекулы гербицидов различного типа ассоциируются с STARBURST-полиамидоаминами. В последующих примерах значение T1 для 2,4-дихлорфеноксиуксусной кислоты (1) (2,4-D) определяются в растворителе (CDCl3) и затем сравниваются с значениями T1 в CDCl3 при различных мольных соотношениям 1:дендример.
Включение 2,4-D в различные STARBURST-полиамидоаминные дендримеры как функция генерации.
Различные STARBURST-полиамидоаминные дендримеры с концевыми сложноэфирными группами, NH3-инициатор) половинных генераций (генерация (Gen)= 0,5, 1,5, 2,5, 3,5, 4, 5 и 5,5) комбинируются с 2,4-дихлорфеноксиуксусной кислотой (1) в CDCl3 с получением соотношений кислота:третичный амин = 1:3, 5 и мольных соотношений кислота: дендример = 1:86, как указывается в таблице VII. Времена релаксации (T1), полученные для разных атомов углерода в 2, 4- дихлорфеноксиуксусной кислоте и генерации = 3,5 STARBURST-ПАМАМ-дендримеров, приводятся в таблице VIII, как для соотношений кислота:амин = 1:1, так и для насыщенных растворов 2,4-D.
Эти данные показывают, что
большие стехиометрические количества 2,4-дихлорфеноксиуксусной
кислоты (т.е. [(1): Gen = 3,5 дендример] = 67) используются без увеличения T1 в любом случае в
насыщенном состоянии (смотри
колонки (A) и (B) в таблице VIII). Действительно, времена
релаксации T1 в колонке (B) слегка снижаются, таким образом указывая, что стехиометрические количества
2,4-дихлорфеноксиуксусной
кислоты могут быть включены внутрь дендримера. Например,
любое соотношение
[(1):Gen=2,5] = 34, тогда как [(1):Gen=3,5 дендример] = 67
(смотри колонку D в
таблице VII).
Фиг. 11 является графиком значений T1 для углеродов - 3,5 и 6 в 2,4-дихлорфеноксиуксусной кислоте как функции от генерации дендримера (т.е., 0,5 _ _→ 5,5). Нижняя штриховая линия (---) предназначается для углеродов 3 и 6, а верхняя сплошная линия - для углерода 5. Минимум для T1 достигается во всех случаях для генерации 2,5 __ → 5,5, указывая тем самым на осуществление введения в этом ряду генераций. На фиг. 11 также приводятся значения T1 для 2,4-D в присутствии триэтиламина [N(ε t)3] (точки B1 и B2) и N (εt)3 + N-метилацетамид (точки A1 и A2). Можно видеть, что эти значения намного больше значений для дендримеров G=1, 5 __→ 5,5, таким образом, дополнительно подтверждается молекулярное введение в молекулу дендримера.
ПРИМЕР 16:
Получение продукта,
содержащего
флуоресцеин с STARBURST-полимером
Образцы
5-карбоксифлуоресцеина (0,996 г) и STARBURST-полиэтиленимина (Gen= 2,0, с концевыми аминными группами, NH3-инициатор) (0,202
г)
смешиваются в 10 мл метиленхлорида и 5 мл метилового спирта
и кипятятся с обратным холодильником в течение 10 минут. После фильтрации получается нерастворимый красный порошок (0,37 г) (Большей
частью непрореагировавший 5-карбоксифлуоресцеин). Из фильтрата
выделяется 0,4 г блестящего красного твердого вещества с точкой размягчения 98 - 103oC, которое плавится при 175-180oC с образованием блестящего красного расплава с вспениванием;
ЯМР-спектры (D2O) этого продукта являются совпадающими со спектрами дендримера, имеющего флуоресцеин, связанный с
поверхностью.
ПРИМЕР 17.
Используется методика, описанная в примере 16. В результате взаимодействия STARBURST-полиэтиленимина (Gen = 2,0, концевые аминные группы, NH3-инициатор) с флуоресцеинизотиоцианатом получается блестящее красное радужное твердое вещество, которое является пригодным для использования флуоресцеин-маркирующего реагента.
ПРИМЕР 18.
Капсулирование R (+)-лимонена в STARBURST-полиамидоаминные дендримеры.
5-50 массовых % раствора твердых веществ в метаноле STARBURST-ПАМАМ-дендримера (ММ около 175000; генерация = 9,0) добавляется по каплям к R (+)-лимонену в метаноле до насыщения. Раствор перемешивается при комнатной температуре (около 25oC) в течение нескольких часов и затем испаряется на роторном испарителе при комнатной температуре с получением твердого продукта. В результате нагревания при температурах выше 80oC получаются нерастворимые в растворителях продукты, в которых удерживается достаточное количество (R+) лимонена в капсулированной форме. Эти продукты являются превосходными прототипами для медленного высвобождения (R+) лимонена в качестве душистого и дезодорирующего продукта.
ПРИМЕР 19.
Капсулирование солей тяжелых металлов в STARBURST-полиамидоаминные дендримеры.
5-50 массовых % раствора в воде STARBURST-ПАМАМ-дендримера (ММ около 350000; генерация = 10,0) перемешивается, когда по каплям добавляется насыщенный раствор ацетата свинца Pb(C2H3O2)2. Раствор перемешивается при комнатной температуре (около 25oC) в течение нескольких часов и затем испаряется на роторном Buchi - испарителе с получением твердых продуктов. Сканирующей проникающей электронной спектроскопией подтверждается, что эти соли тяжелого металла Pb капсулируются внутри дендримеров. Эти пленки, содержащие соли тяжелого металла, используются как защитные экраны для поглощения электромагнитного излучения.
ПРИМЕР 20.
Капсулирование флуоресцеинового (водорастворимого) красителя в полиамидоаминных STARBURST-дендримерах.
5-50% (по массе твердых веществ) раствор (H2O/CH3OH) STARBURST-ПАМАМ-дендримера (ММ около 175000; генерация = 9,0) перемешивается пока флуоресцеин (динатровая соль, желтый кислый 73, C1, 453000; Уранин; поставляемый Aldrich Chemical Co, Milwaukee, W.I.) добавляется до насыщения. Раствор перемешивается при комнатной температуре в течение нескольких часов и затем испаряется при комнатной температуре с получением окрашенного твердого продукта. Эти окрашенные капсулированные дендримеры являются превосходными пробами (зондами) сравнения для калибрования мембран ультрафильтрации.
ПРИМЕР 21.
Получение дендримеров с концевыми флуоресцентными группами.
A. Реакция дендримера с концевыми аминными группами с N-дансил-азиридином.
Образец (1,5 г, 1,6•10-3 моля) STARBURST-полиэтиленимина (ПЭИ, G = 3,0, концевые группы (Z)= 12, ММ = 920) растворяется в 20 мл метилового спирта. Раствор перемешивается, и 0,884 г (3,84•10-2 моля) раствора N-дансилазиридина (ICN Biomedicals, Costa Mesa CA) добавляется по каплям в течение 20 минут. Реакционная смесь перемешивается при комнатной температуре всю ночь. После удаления растворителя под вакуумом получается твердый продукт. Данными ЯМР- и ИКС-анализа подтверждается, что на поверхности дендримера имеются ковалентно связанные дансилгруппы.
B. Реакция дендримеров с концевыми аминными группами с дансилхлоридом.
Раствор STARBURST-полиамидоамина (1,0 г, 1,9• 10-4) (инициированный аммиаком, G=4,0, концевые группы (Z)=24, ММ=5147) в 30 мл воды перемешивается в 3-х горлой колбе с 80 мл толуола в то время, как раствор дансилхлорида (1,23 г, 4, 5•10-3 моля) (5-диметиламино-1-нафталинсульфонилхлорид, от Aldrich Chemical Co, Milwaukee, W.I.) в 40 мл толуола добавляется по каплям при охлаждении льдом. Одновременно 10% раствор NaOH (13,3 моля, 10% избыток) добавляется к реакционной смеси с получением маслянистого шарика. Сырой продукт промывается водой, растворяется в метиловом спирте и осаждается диэтиловым эфиром с получением твердого продукта. Данными ЯМР - и ИКС-анализов подтверждается наличие ковалентно связанных дансилгрупп на поверхности дендримера.
ПРИМЕР 22.
Получение плотного звездчатого Mn-ПАМАМ-полимера.
Полиамидоаминный
плотный звездчатый полимер третьей генерации
с концевыми сложноэфирными группами получается в соответствии с методикой из
примера 1 Патента США N 4587329. Сложноэфирные остатки гидролизуются до
формы натриевой соли при растворении плотного
звездчатого полимера в 0,1 N NaOH. 131 мг порция (0,496 ммоля) полученной сырой
натриевой соли плотного звездчатого полимера растворяется в воде (1 мл,
pH 11,4) и нейтрализуется до pH 7,0 добавлением
0,5 М HCl. 26 мг (2 эквивалента) порция MnCl2•4H2O
добавляется к нейтрализованному раствору, и раствор нагревается при
55oC в течение 2-х дней. Полученный
светло-желтый раствор очищается с использованием колонки Bio-GellP2 (15,0 г, длина
150 мкм x диаметр 25 мм), промывается водой с выделением цветной
полосы. Испытанием на нитрат серебра подтверждается,
что продукт является свободным от хлоридов (например, NaCl, MgCl2).
Элюат отбирается до сухости с получением прозрачного геля, который
сушится под высоким вакуумом с выходом 45 мг желаемого
комплекса плотного звездчатого полимера, имеющего следующий, элементарный
состав [NaMn2H7][C69H105
N19O33]:
Рассч.: Na 1,23 Mn
5,88 C 44,35 H 5,66 N 14,24
Экспер.: Na 1,42 Mn 4,80 C 43,33 H
7,91 N 14,72
В соответствии с аналогичной методикой с
использованием плотного звездчатого полиаминоаминного полимера
седьмой генерации с концевыми натрийкарбоксилатными группами получается
дополнительный марганцевый комплекс плотного звездчатого
полимера, имеющий следующий элементарный состав [Na30H354][Mn10C3057H4965O1149]
Рассч.: Mn 0,759 C 50,72 H 7,41 N 14,76
Экспер.: Mn 0,72 C 46,34 H 7,91 N 14,72
Релаксивности для
вышеуказанных комплексов определяются в воде, и результаты
приводятся в таблице IX. В целях сравнения, релаксивности
комплексов марганца с двумя известными коплексообразующими агентами рассчитываются
по соответствующим временам релаксации, определенным
методом ЯМР. Результаты приводятся в таблице IX.
ПРИМЕР 23.
В соответствии с методикой примера 22 получаются
комплексы плотных звездчатых полимеров железа. В одном
варианте натриевая соль кислой формы полиамидоамина
шестой генерации получается растворением сложноэфирной формы полиамидоамина, полученной в
соответствии со способом избытка реагента из Патента США
N 4587329 в 1 N NaOH. Натриевая соль (7 мг, 2,
4•10-3 ммоля) затем растворяется в 2 мл воды, и раствор (pH 11,3)
нейтрализуется до pH 7 с помощью 0,5 MnHCl. К этому нейтрализованному
раствору добавляется водный раствор FeCl3 (0,102 М, pH 1,4, 0,5 мл, 0,051 ммоля, 21,6 эквив.). Полученный
густооранжевый раствор (pH 4,9) нагревается при 55oC в течение 23
часов. Раствор охлаждается до комнатной
температуры и фильтруется гель-фильтрационной хроматографией (колонка Biogel P2,
175х25 мм). Оранжевый элюат испаряется до сухости под вакуумом при 50oC с выходом 45 мг оранжевого
твердого вещества, имеющего следующую молекулярную формулу:
[Na5H127] {Fe20 [ПАМАМ-P(6,5 G)]},
где ПАМАМ-P
представляет плотный звездчатый
полиамидоамин с концевыми пропионатными группами. Анализом подтверждается, что это оранжевое твердое
вещество является комплексом железа и полиамидоаминного плотного
звездчатого полимера,
представленным общей формулой
Na5H127Fe20 (C1521H2469N379O573).
Рассч.: Na
0.31 F 3.05 C 49.84
H 7.30 N 14.48
Экспер. Na 0.31 F 3.12 C 47.11 H 7.33 N 14.81
С использованием вышеуказанной
методики получаются аналогичные комплексы железа и полиамидоаминных
плотных звездчатых
полимеров с ацетатными концевыми группами или полиэтилениминных плотных звездчатых полимеров с концевыми
ацетатными группами, имеющих от 2 до 6 генераций. Времена релаксации для
этих комплексов
измеряются с помощью метода ЯМР, и соответствующие релаксивности рассчитываются и приводятся в таблице X.
ПРИМЕР 24.
С использованием методики примера 22 получаются комплексы гадолиния и полиамидоаминных и полиэтилениминных плотных завездчатых полимеров, описанных в примере 23. Их времена релаксации измеряются, а релаксивности рассчитываются с результатами, показанными в таблице XI. Как иллюстрация получения гадолиниевого комплекса, 0,40 г (0,16 ммоля) натрийацетатной формы полиэтилениминного плотного звездчатого полимера (вторая генерация) получается, как в примере 6 из Патента США 4587329, и после реакции с избытком бромуксусной кислоты с pH 9 при 40oC растворяется в 5 мл воды. Значение pH полученного раствора снижается до 9,2*)(см. примечание к табл. XI) с помощью 0,5 N HCl, и добавляется 3,3 мл водного раствора GdCl3 (0,31 ммоля). Значение pH полученного раствора увеличивается с 4,1 до 8,3 с помощью 1 N NaOH, и раствор остается стоять на 24 часа. Летучие затем удаляются из раствора в вакууме, и остаток дважды хроматографируется в chelex смоле. Определяется, что полученное светло-желтое твердое вещество характеризуется атомным соотношением Gd:N = 2:1.
В соответствии с вышеуказанной методикой получаются аналогичные комплексы гадолиния и полиамидоаминных плотных звездчатых полимеров с ацетатными концевыми группами или полиэтилениминных плотных звездчатых полимеров с ацетатными концевыми группами от 2-ой до 6-ой генерации. Времена релаксации этих комплексов измеряются методом ЯМР, и соответствующие релаксивности рассчитываются и приводятся в таблице XI.
ПРИМЕР 25.
Получение STARBURST-полиамидоаминного конъюгата с Брадикинином C.
Потенцирующее средство Брадикинин C (Sigma Chemical Company) в количестве 4,7 мг берется в 90 мкл N-метилпирролидинона (NMP), содержащего 7,1 мг/мл N-гидроксибензотриазола (НОБТ) и смешивается с 33 мкл свежеприготовленного раствора дициклогексилкарбодиимида (ДСС) (28 мг/л ЯМР). Через 4 часа при комнатной температуре 60 мкл ПАМАМ пятой генерации (G 5) в NMP (13,4 мг/мл) добавляется к смеси БРАДИКИНИНА. Через 72 часа при комнатной температуре добавляется 1,5 мл 17 мМ уксусной кислоты. Смеси нейтрализуются, раствор декантируется с твердого вещества, и твердое вещество затем промывается 1,5 мл разбавленной уксусной кислоты. Раствор и промывки объединяются и фильтруются через 25 мм ПТФЭ 0,45 мк фильтр шприца. Непрореагировавший пептид НОВТ и растворитель отделяются от конъюгата ультрафильтрацией с использованием двух Centricon-10 микроконцентраторов. Конъюгат промывают 2 мл 17 мМ уксусной кислоты, затем 2 мл PBS буфера. Конъюгат извлекается в 450 мкл ретентата и разбавляется до 750 мкл свежим PBS-буфером.
Четыре аликвоты конъюгата гидролизуются конц. HCl при 115oC в течение 20 часов и анализируется для глутаминовой кислоты. Определяется количество глутаминовой кислоты как o-фталальдегид / 2-меркаптоэтанол-производного с использованием ГХВР с обращенной фазой с флуоресцентным детектором (колонка Whatman, Partisil 5CCS /C8 (10 см); Gilson Spectra/Glo detector. тирозин в качестве внутреннего эталона; элюент - 50 мМ ацетат натрия и метанол; градиент: 12% до 30% метанола за 5 мин, выдержка 1 мин при 30%, затем увеличение до 80% метанола за 14 мин и выдержка при 80% в течение 5 мин). о-Фталальдегидное производное получается смешением 25 мкл раствора аминокислоты с 50 мкл раствора фторальдегидного реагента (Pierce), смешивается в течение 1 минуты и затем разбавлением 0,05 мл PBS-буфера (фосфатный буферный рассол; 120 мМ хлорид натрия, 2,7 мМ хлорид калия, 10 мМ соли фосфатного буфера, pH 7,4). Для 25 мкл аликвоты конъюгата определяется 58 нмолей глутаминовой кислоты, это является соответствующим 1,74 мкмолей Брадикинина C на конъюгате.
ПРИМЕР 26.
Получение STARBURST-полиамидоаминного конъюгата с BOC PheLeuPheLeuPhe.
N-t-бутоксикарбонил-L-фенилаланил-D-лейцил-L-фенилаланил-D-лейцил-L -фенилаланин (BOCPheLeuPheLeuPhe), 4,1 мг (Signa Chemical Company) берется в 100 мкл NMP, содержащем 7,1 мг/мл НОВТ, и смешивается с 30 мкл свежеприготовленного раствора ДСС (36 мг/мл) в NMP. Через 90 минут при комнатной температуре добавляется 60 мкл раствора (5 G) ПАМАМ в NMP (13,4 мг/мл). Через 72 часа при комнатной температуре выделяется конъюгат с использованием методики из примера 24. Конъюгат извлекается в 750 мкл ретентата.
Четыре аликвоты конъюгата гидролизуются конц. HCl при 115oC в течение 20 часов и анализируются на фенилаланин. Фенилаланин определяется количественно как о-фталальдегид/2- меркаптоэтанол-производное с использованием ГХВР с обращенной фазой с флуоресцентным детектором (условия ГХВР являются такими, как в примере 23, за исключением того, что градиент элюента равняется 12% до 80% метанол за 20 минут и затем выдержка при 80% в течение 5 мин), о-фталальдегидное производное получается, как в примере 24. Для 25 мкл аликвоты конъюгата определяется 26 нмолей фенилаланина. Это является соответствующим 0,26 мкмоля ВОС PheLeuPheLeuPhe. на конъюгате.
ПРИМЕР 27.
К метанольному раствору 1,4, 7- трис(карбоксиметоксиметил)-1,4,7,10-тетраазациклододекана (ДОЗА метил (сложный эфир)) добавляется 1,0 эквивалент свежеприготовленного безводного метилата натрия, и раствору перемешивается в течение нескольких часов. К этому раствору добавляется 1 эквивалент 10,11-эпоксиундекановой кислоты, и раствор кипятится с обратным холодильником всю ночь. Растворитель удаляется в вакууме с получением сырого гидроксиэтилированного продукта 1,4,4-трис(карбометоксиметил)-10-2'-гидрокси-10'-карбокси(децил)- 1,4,7, 10-тетраазациклододекана. 2-5 эквивалентов этого продукта растворяются в диметилформамиде (ДМФ), и добавляются соответствующие эквиваленты дициклогексилкарбодиимида (ДСС) и N-гидроксисукцинимида с перемешиванием всю ночь. К этому раствору добавляется 1 эквивалент ПАМАМ второй генерации, и перемешивание продолжается еще 24 часа. Соответствующий ДОЗА-метил(сложный эфир) конъюгат селективно гидролизуется обработкой водной гидроокисью натрия в метиловом спирте. В результате обработки ДОЗА-конъюгата избытком гадолиний (III)-ацетата [Gd(OAC)3 обработанный буфером до pH 6], с последующей инкубацией с избытком диэтилентриаминпентауксусной кислоты (ДТРА) и очисткой конъюгата с использованием препаративной ГХВР с обращенной фазой получается продукт гидроксиэтил-ДОЗА-ПАМАМ-STARBURST-конъюгат, содержащий 2-5 эквивалентов гадолиния, который не удаляется дополнительными контрольными заражениями избытком ДТРА.
ПРИМЕР 28.
К водному раствору ПАМАМ второй генерации, который доводится буфером до pH 9,0, добавляется 2-5 эквивалентов 1-[1-карбокси-3(4'-изотиоцианатофенил)пропил] -4,7,10- трис(карбоксиметил)-1,4,7, 10-тетраазациклододекана, полученного способом, описанным в опубликованной Заявке на Европейский патент 0353450, опубликованной 7 февраля 1990 г. Раствор перемешивается всю ночь при комнатной температуре. В результате обработки избытком Gd(OAC)3 при pH 6,0 образуется конъюгат (связанная тиомочевина)-ДОТА-ПАМАМ-STARBURST, содержащий 2,5 эквивалентов инертно связанного гадолиния, который не удаляется контрольным заражением ДТРА.
ПРИМЕР 29.
Получение конъюгата lgG/дендример-FITCI.
A. Получение ПАМАМ-дендримера, конъюгированного с флуоресцеинизотиоцианатом.
2,2 мл метанольного раствора G 9 (ЭДА)-ПАМАМ-дендримера сушится под вакуумом на роторном испарителе. Приблизительно 300 мг (7,4 мкмоля) высушенного дендримера быстро отбираются и растворяются в 1 мл деионизованной воды с образованием исходного (сырьевого) раствора дендримера. Смешением 200 мкл исходного раствора дендримера с добавлением его к 800 мкл деионизованной воды получается 60 мг/мл раствора. К последнему добавляется 5 мл 0,1 М фосфатного буфера (pH 9,0) с получением конечной концентрации дендримера 10 мг/мл (конечный раствор дендримера). Конечный раствор дендримера, 3 мл, переносится в двухдрахмовую ампулу (30 мг, 0,13 мкмоля).
Флуоресцеинизотиоцианат (FITCI, молекулярные пробы), 5 мг, растворяется в 1 мл ДМСО в темноте. Раствор флуоресцеинизотиоцианата (200 мкл, 2,57 мкмоля) добавляется к перемешиваемому раствору дендримера. Полученная реакционная смесь защищается от света и перемешивается при комнатной температуре в течение 15-20 часов. Раствор остается прозрачным и янтарным по внешнему виду. После перемешивания реакционная смесь помещается в две пробирки Centricon- микроконцентратора (молекулярная масса отсечки: 10000 дальтонов) и подвергается ультрафильтрации для удаления всего непрореагировавшего FITCI. В процессе ультрафильтрации добавляется 10 раз по 2 мл 0,1 М фосфатного буфера с pH 9,0 для облегчения очистки. Для гарантии удаления всего непрореагировавшего FITCI ультрафильтрация контролируется на чистоту методом тонкослойной хроматографии (ТСХ). При проведении ТСХ используются 60 пластин (Merck) силикагеля, использующего этилацетатную (100%) систему растворителей. В то время как меченый дендример остается без изменения, оставшийся FITCI вымывается при Rf = 0,7. После очистки извлекается приблизительно 2 мл конъюгированного G 9-ПАМАМ-дендример-FITCI.
B. Получение ПАМАМ-дендримера, конъюгированного с флуоресцеинизотиоцианатом и lgG.
Иммуноглобулин кролика (lg G Sigma Chemical Co), 9,8 мг, растворяется в 1 мл 30 мМ ацетата натрия и 150 мМ натрийхлоридном буфере (pH 5,5). К раствору lgG добавляется 1,5 мг периодата натрия с слабым перемешиванием до растворения. Смесь защищается от света и слабо перемешивается при комнатной температуре в течение 15 - 18 часов. После перемешивания реакционная смесь помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 10000 дальтонов) и подвергается ультрафильтрации в 20 мМ фосфатного буфера с pH 6,0 (4 x 2 мл). После очистки извлекается приблизительно 1-2 мл lgG-диальдегидного раствора.
Аликвота раствора меченый дендример-FITCI 3 со стадии A (0,88 мл, 17,6 мг, 0,075 мкмоля) добавляется по каплям к lgG -диальдегидному раствору. (Это равняется примерно соотношению 1,15:1 меченого дендримера к антителу). При добавлении первой капли раствора меченого дендримера реакционная смесь осаждается. Добавляются дополнительные 3 мл 20 мМ фосфатного буфера (pH 6,0) но твердые вещества не растворяются.
Конъюгат lgG/дендример-FITCI защищается от света и перемешивается при комнатной температуре в течение 1 часа. Через час добавляется 1,7 мг натрийцианборгидрида, и реакционная смесь перемешивается всю ночь (15 - 20 часов) при комнатной температуре. Раствор является флуоресцентно-оранжевым с некоторым осадком. Продукт реакции, включая осадок, помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 100000 дальтонов) и ультрафильтруется. Шесть дополнительных объемов 20 мМ фосфатного буфера (pH 6,0) вводится в ходе процесса для удаления всего несвязанного дендример-FITCI. Конъюгат lgG/дендример-FITCI извлекается и переносится в янтарную стеклянную ампулу для хранения при -10oC.
ПРИМЕР 30.
Получение конъюгата lgG/дендример-дансил.
A. Получение конъюгата G 9-ПАМАМ-дендример-дансил.
При использовании 200 мкл исходного раствора дендримера, полученного в примерах 29 A, и добавлении 800 мкл деионизованной воды получается 60 мг/мл раствор. Для получения конечной концентрации дендримера 10 мг/мл к 60 мг/мл раствору добавляется 5 мл 0,1 М фосфатного буфера (pH 9,0).
Дансилхлорид (13,9 мг, 0,052 ммоля, Aldrich Chemical Co) добавляется к 5 мл ацетона и встряхивается в течение 5 - 10 мин. (Этот раствор является густо-желтого цвета, и в нем имеются следы присутствия твердого вещества). Раствор дансилхлорида добавляется к раствору дендримера в течение 30 минут, и реакционная колба помещается на водяную баню при 40oC на 90 минут. В процессе нагревания реакционная смесь периодически встряхивается. Реакционная смесь является слегка мутной, и цвет меняется от густо-желтого до бледно-желтого. Через 90 минут реакционная колба снимается с бани и остается охлаждаться до комнатной температуры. Реакционная смесь помещается затем на роторный испаритель под вакуумом при 30 - 35oC для удаления ацетона. Продукт реакции помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 100000 дальтонов) и ультрафильтруется для удаления всего несвязанного дансилхлорида. В ходе фильтрации добавляется 10 раз по 2 мл 0,1 М фосфатного буфера (pH 9,0).
Ультрафильтрация контролируется на чистоту методом ТСХ для того, чтобы гарантировать полное удаление непрореагировавшего дансилхлорида. Тонкослойная хроматография проводится с использованием силикагельных 60 пластин (Merck) с использованием этилацетатной (100%)системы растворителей (визуализация УФ-светом). В то время как меченый дендример остается без изменения, оставшийся дансилхлорид вымывается при Rf = 0,3. После очистки извлекается приблизительно 1 - 2 мл конъюгата G 9-ПАМАМ-дендример-дансил.
B. Получение ПАМАМ-дендримера, конъюгированного с дансилом и lgG.
Иммуноглобулин кролика (lgG, Sigma Chemical Co), 9,8 мг, растворяется в 1 мл 30 мМ ацетата натрия и 150 мМ натрийхлоридного буфера (pH 5,5). К раствору lgG добавляется 1,5 мг периодата натрия с слабым перемешиванием до растворения. Смесь защищается от света и слабо перемешивается при комнатной температуре в течение 15 - 18 часов. После перемешивания реакционная смесь помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 100000 дальтонов) и ультрафильтруется в 20 мМ фосфатном буфере с pH 6,0 (4 х 2 мл). После очистки извлекается приблизительно 1,9 мл lgG-диальдегидного раствора.
Аликвота, 1,25 мл, раствора комплекса меченый дендример-дансил со стадии A (14,1 мг/мл) добавляется по каплям к lgG-диальдегидному раствору. (Это равняется примерно 1,15: 1 отношению меченого дендримера к антителу). При добавлении первой капли раствора меченого дендримера реакционная смесь осаждается.
Конъюгат lgG/дендример-дансил защищается от света и перемешивается при комнатной температуре в течение 1 часа. После этого добавляется 1,7 мг цианборгидрида натрия, и реакционная смесь перемешивается всю ночь (15 - 20 часов) при комнатной температуре. Продукт реакции, включая осадок, помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 100000 дальтонов) и ультрафильтруется. В ходе процесса добавляется 6 дополнительных объемов по 2 мл 20 мМ фосфатного буфера (pH 6,0) для удаления всего несвязанного дендример-дансила. Конъюгат lgG/дендример-дансил извлекается и переносится в янтарную стеклянную ампулу для хранения при -10oC.
ПРИМЕР 31.
Получение ПАМАМ-дендримера, конъюгированного с HRP и lgG.
A. Получение ПАМАМ-дендримера, конъюгированного с lgG.
Иммуноглобулин кролика (lgG, Sigma Chemical Co), 9,6 мг, растворяется в 1 мл 30 мМ ацетата натрия и 150 мМ натрийхлоридного буфера (pH 5,5). К раствору lgG добавляется 1,5 мг периодата натрия с слабым перемешиванием до растворения. Смесь защищается от света и слабо перемешивается при комнатной температуре в течение 15 - 18 часов. После перемешивания реакционная смесь помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 100000 дальтонов) и ультрафильтруется в 20 мМ фосфатном буфере с pH 6,0 (4 х 2 мл). После очистки извлекается приблизительно 1,5 мл lgG-альдегидного раствора.
Аликвота, 100 мкл, исходного раствора дендримера со стадии A примера 29, добавляется к 100 мкл деионизованной воды с получением 150 мг/мл раствора. Конечная концентрация 15 мг/мл достигается при дополнительном разбавлении 100 мкл раствора дендримера добавлением 900 мкл деионизованной воды. Конечный раствор дендримера, 1 мл, добавляется по каплям к lgG-альдегидному раствору, и смесь перемешивается в течение 1 часа при комнатной температуре. Образуется осадок. Через час добавляется 1,7 мг цианборгидрида, и реакционная смесь перемешивается всю ночь (15 - 20 часов) при комнатной температуре. Продукт реакции, включая осадок, помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 100000 дальтонов) и ультрафильтруется. Четыре дополнительных объемов по 2 мл 20 мМ фосфатного буфера (pH 6,0) добавляется в процессе ультрафильтрации для удаления всего несвязанного дендример-lgG. Конъюгат lgG-дендример извлекается и переносится в 2-драхмовую ампулу.
B. Получение конъюгата ПАМАМ-дендример/lgG-HRP.
Пероксидаза ложечницы приморской (HRP, 2,6 мг, Pierce) растворяется в 0,5 мл деионизованной воды с образованием HRP-раствора. Периодат натрия, 10,7 мг, растворяется в 5 мл 10 мМ фосфата натрия (pH 7,0). Приблизительно 1, 6 мл раствора периодата добавляется к HRP-раствору при комнатной температуре. Ферментная реакционная смесь защищается от света и слабо перемешивается при комнатной температуре в течение 30 минут. Окисленный HRP-продукт помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 10000 дальтонов) и ультрафильтруется. В процессе ультрафильтрации добавляются четыре дополнительных объема по 2 мл 30 мМ ацетата натрия/150 мМ натрийхлоридного буфера (pH 5,5).
Окисленный ферментный раствор добавляется к ПАМАМ-дендример-lgG-конъюгатной смеси с перемешиванием. Несмотря на оставшийся осадок, смесь перемешивается 2 часа при комнатной температуре. Через 2 часа 2,1 мг боргидрида натрия растворяется в 1 мл деионизованной воды, и 100 мкл раствора боргидрида добавляется к смеси ПАМАМ-дендример-lgG-HRP. Реакционная смесь перемешивается всю ночь (15-20 часов) при 2-8oC.
Продукт реакции, включая осадок, помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 100000 дальтонов) и ультрафильтруется. Четыре дополнительных объема по 2 мл 20 мМ фосфатного буфера (pH 6,0) добавляется в ходе процесса. Конъюгат lgG/дендример/HRP извлекается и переносится в 2-драхмовую ампулу для хранения при -10oC.
ПРИМЕР 32.
Получение конъюгата lgG/дансилированный ПАМАМ-дендример/HRP.
A. Получение HRP-раствора.
Пероксидаза ложечницы приморской (HRP, 2,6 мг, Pierce) растворяется в 0,5 мл деионизованной воды с образованием HRP-раствора. Периодат натрия, 10,7 мг, растворяется в 5 мл 10 мМ фосфата натрия (pH 7,0). Приблизительно 1,6 мл раствора периодата натрия добавляется к HRP-раствору при комнатной температуре. Ферментная реакционная смесь защищается от света и слабо перемешивается при комнатной температуре в течение 30 минут. Окисленный HRP-продукт помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 10000 дальтонов) и ультрафильтруется. Четыре дополнительных объема по 2 мл 30 мМ ацетата натрия/150 мМ натрийхлоридного буфера (pH 5, 5) добавляются в ходе процесса. Раствор окисленного фермента извлекается и помещается в 2-драхмовую стеклянную ампулу.
B. Получение раствора дансил-G4-ПАМАМ-дендримера
5
мл
метанольного раствора 12,7% (по массе) G 4 (NH3)-ПАМАМ-дендримера (NH3-ядро) получается и сушится под вакуумом на роторном испарителе. Приблизительно 40 мг (7,4 мкмоля)
высушенного дендримера отбирается и растворяется в 5 мл 0,1 М фосфатного буфера (pH 9,0).
10 мг (0,037 ммоля) дансилхлорида добавляется к 5 мл ацетона и встряхивается 5-10 минут. Раствор является густо-желтым, и в нем содержатся следы твердого вещества. Раствор дансилхлорида добавляется к раствору дендримера в течение 30 секунд, и реакционная колба помещается на водяную баню при 40oC на 90 минут. В процессе нагревания реакционная смесь периодически встряхивается. Цвет раствора является светло-желтым. Через 90 минут реакционная колба снимается с бани и остается охлаждаться до комнатной температуры. Реакционная смесь является слегка мутной.
Реакционный раствор испаряется для удаления ацетона с использованием роторного испарителя под вакуумом при 30-35oC. В результате раствор становится прозрачным. Реакционная смесь затем переносится в две пробирки центрифуги и центрифугируется при 5000 об/мин в течение 30 минут. Раствор дендримера помещается затем в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 3000 дальтонов) и ультрафильтруется 4 раза из объема 2 мл для удаления всего несвязанного дансилхлорида. Извлекается приблизительно 1 - 2 мл раствора дансилированного дендримерного продукта.
C. Получение раствора lgG/дансил-G 4-ПАМАМ-дендримера
6,9 мг
иммуноглобулина кролика (lgG) растворяется в 1 мл 50 мМ фосфатного буфера (pH 7,2). Добавляется 14,8 мг периодата натрия, и в смеси образуется завихрение до растворения твердого вещества. Смесь
защищается от света и перемешивается дополнительные 30 минут при комнатной температуре. Раствор затем помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 3000
дальтонов) и ультрафильтруется 4 раза из объема 2 мл с использованием каждый раз 50 мМ фосфатного буфера (pH 7,2) для обеспечения удаления всего непрореагировавшего периодата натрия. Приблизительно
1
мл диальдегидного раствора извлекается и переносится в ампулу для получения спаривания с дансилированным дендримером.
Аликвота меченого дансилдендримера из части В отбирается из исходного раствора и разбавляется до конечной концентрации дендримера 3,0 мг/мл. 100 мкл объем разбавленного дансилированного дендримера добавляется к lgG-диальдегидному раствору и диспергируется. Это равняется соотношению меченый дендример: lgQ около 1,2: 1.
Конъюгат lgG/дансилированный дендример защищается от света и перемешивается при комнатной температуре в течение 1 часа. После этого времени добавляется 1,4 мг цианборгидрид натрия, и реакционная смесь перемешивается всю ночь (15-20 часов) при комнатной температуре. Раствор является прозрачным. Отбирается образец для электрофореза, 200 мкл, а остаток раствора помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 100000 дальтонов) и ультрафильтруется. Четыре дополнительных объема по 2 мл 50 мМ фосфатного буфера (pH 7,2) добавляются в ходе процесса для удаления всего несвязанного дансил-дендримера. Требуемый конъюгат извлекается.
D. Получение конъюгата G4-ПАМАМ-дендример/дансил/ lgG-HRP.
К 650 мкл (10,1 мг) раствора lgG/дансил G4-ПАМАМ-дендримера (полученного в части C) добавляется 2,6 мг окисленной HRP. Конъюгат lgG/дансил-дендример/HRP защищается от света и перемешивается при комнатной температуре в течение 2 часов. Через 1 час 2,1 мг боргидрида натрия растворяется в 1 мл деионизованной воды, 100 мкл боргидридного раствора добавляется к ПАМАМ-дендример-lgG-HRP-смеси. Реакционная смесь перемешивается всю ночь (15-20 часов) при 2-8oC. Смесь является прозрачной янтарной жидкостью.
Продукт реакции помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 100000 дальтонов) и ультрафильтруется. Четыре дополнительных объема по 2 мл 20 мМ фосфатного буфера (pH 6,0) добавляется в ходе процесса. Конъюгат lgG/дансил/дендример/HRP извлекается и переносится в янтарную стеклянную ампулу для хранения при -10oC.
E. Исследование конъюгата G 4 ПАМАМ дендример/дансил/ lgG-HRP.
Аликвоты конъюгатов lgG/дендример/HRP оцениваются на присутствие HRP-фермента с использованием 3,3'-5, 5'-тетраметилбензидина (ТМБ=TMB). HRP катализирует перекисноводородное окисление субстратов, таких как ТМБ, при переносе электронов от ТМБ к перекиси с получением цветного продукта. Поэтому потеря одного электрона дает голубой цвет, а потеря двух электронов дает желтый цвет.
Следующие конъюгаты дендример/дансил/ lgG-HRP получаются для подтверждения присутствия
HRP-фермента:
(1) 0,1 мг/мл lgG/дансил/G4 ПАМАМ-дендример.
(2) 0,1 мг/мл lgG/дансил/G4-ПАМАМ-дендример/HRP.
(3) 0,1 мг/мл lgG/G9 ПАМАМ-дендример/HRP.
(4) Ультрафильтрат из lgG/G9 ПАМАМ-дендример/HRP, содержащий несвязанный HRP.
Раствор ТМБ-субстрата получается при использовании ТМБ-дигидрохлорида. Каждый из указанных выше разбавленных образцов, 200 мкл, добавляется к 200 мкл раствора ТМБ-субстрата. Два HRP-конъюгата (N 2 и N 3) немедленно становятся зелеными, затем желтыми. Ультрафильтрат (N 4) становится ярко-желтым. lgG/дендример (N 1) остается бесцветным. Все четыре образца инкубируются при комнатной температуре в течение 30 минут, затем блокируются 200 мкл 1 N серной кислоты. Желтый цвет ферментных конъюгатов (N 2 и N 3) становится более интенсивным, lgG/дендример (N 1) является светло-зеленым и флуоресциирующим под УФ-светом.
Аликвоты всех конъюгатов анализируются
с помощью электрофореза
в геле
полиакриламида. Концентрации образцов приблизительно 1 мг/мл получаются для электрофореза, что равняется примерно 10 мг образца для электрофореза. Гель Amicon
Gradipore (Hylinx) с 5:50% T
градиентом
используется в комбинации с 0,05 натрийацетатным буфером (0,025% в азиде натрия) с pH 4,0. Гель испытывается при постоянном напряжении 200 В в течение 2
часов. Конъюгаты, содержащие осадок,
центрифугируются до электрофорезного анализа. Испытанными являются следующие образцы:
(1) G9 ПАМАМ дендример.
(2) Дансилированный G9-ПАМАМ-дендример.
(3) G9-ПАМАМ-дендример-FITCI.
(4) lgG (контрольный образец).
(5) lgG/дансил/G9-ПАМАМ-дендример.
(6) lgG/G9-ПАМАМ-дендример-FITCI.
(7) lgG/G9-ПАМАМ-дендример/HRP.
(8) HRP (контрольный образец).
(9) lgG/дансил G4 (NH3) ПАМАМ-дендример/HRP.
(10) не занят.
(11) повтор N 7.
(12) повтор N 9.
До окрашивания гель помещается под УФ-свет для идентификации любой флуоресценции. Только образцы N N 2, 3 и 6 являются флуоресцентными.
Наблюдается визуализация геля всегда за ТМБ, но до окраски показываемой образцами N 7, 8, 9, 11 и 12, чем подтверждается присутствие фермента при более высоких молекулярных массах на геле.
Гель практически окрашивается с помощью 0,025% Coomassie Blue Stain всю ночь в 5% уксусной кислоте и 7% метиловом спирте. Образец N 10 является только неокрашенным на геле. Образцы N 4 и 8 находятся при более низких молекулярных массах. Всеми другими образцами демонстрируются более высокие молекулярные массы без какого-либо присутствия более низких молекулярных масс.
ПРИМЕР 33.
Получение G6-ПАМАМ-дендример/дихлортриазинилфлуоресцеина
G6(ЭДА)ПАМАМ-дендример, 300 мкл (21,5% твердых веществ) добавляется к
700 мкл деионизованной воды и диспергируется (64,5 мг, 2,24 мкмоля). Дендример дополнительно разбавляется 4 мл деионизованной
воды до концентрации 12,9 мг/мл.
Дихлортриазинилфлуоресцеингидрохлорид DTAFI (поставляемый Sigma), 6,0 мг (11,3 мкмоля) растворяется в 0,5 мл метилового спирта, и добавляется 2 капли триэтиламина. Раствор DTAFI добавляется по каплям к перемешиваемому раствору дендримера в течение 30 секунд. Реакционная смесь защищается от света и перемешивается при комнатной температуре в течение 15-20 часов. Во время реакции раствор остается прозрачным и оранжевым. После перемешивания реакционная смесь помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 10000 дальтонов) и ультрафильтруется для удаления непрореагировавшего DTAFI. В ходе ультрафильтрации добавляется 15 раз по 2 мл 0,1 М фосфатного буфера (pH 9,0). Извлекается приблизительно 3 мл конъюгированного (ЭДА) ПАМАМ-дендример/DTAFI.
ПРИМЕР 34.
Получение G 5,5-ПАМАМ-дендример/ аминометилфлуоресцеина.
G 5,5 (NH3) ПАМАМ-дендример, 1 мл раствора (4,2% твердых веществ, 4,2 мг, 1, 7 мкмоля) загружается в 2-драхмную ампулу.
В отдельной ампуле 6,6 мг (1,7 мкмолей) 4'-аминометилфлуоресцеина (АМФ= AMF) растворяется в 0,5 мл деионизованной воды. Значение pH корректируется до 9 добавлением 2-х капель триэтиламина.
В третьей ампуле 63,8 мг 1-этил-3- (3-диметиламинопропил)-карбодиимида (ЭДАК=EDAC) растворяется в 1 мл деионизованной воды.
Раствор АМФ добавляется к перемешиваемому раствору дендримера в течение 1-2 минут при комнатной температуре. Значение pH раствора дендример-АМФ корректируется до 4,5-5,5 использованием 1 N хлористоводородной кислоты. Раствор остается прозрачным. При непрерывном перемешивании к смеси добавляется раствор ЭДАК в 200 - 300 мкл инкрементах при 15 - 20 минутных интервале в течение 1 часа. Значение pH реакционной смеси поддерживается в интервале 4,5-5,5 при использовании 1 N хлористоводородной кислоты. Реакционная смесь защищается от света и перемешивается при комнатной температуре в течение 15 - 20 часов. Раствор является прозрачным и оранжевым.
После перемешивания реакционная смесь помещается в две пробирки Centricon-концентратора (молекулярная масса отсечки: 10000 дальтонов) и ультрафильтруется для удаления всего непрореагировавшего АМФ. В процессе ультрафильтрации добавляется 15 раз по 2 мл 0,1 М фосфатного буфера (pH 9,0). Извлекается приблизительно 2 мл конъюгированного G5,5-ПАМАМ-дендример/АМФ.
ПРИМЕР 35.
Получение конъюгата G 3 ПАМАМ/изатиновый ангидрид
G3 ПАМАМ, 2 г, растворяется в
метиловом спирте и
охлаждается на ледяной бане. К этому раствору добавляется 0,01 г изатинового
ангидрида. Смесь перемешивается в течение двух часов, баня отепливается до комнатной температуры, и
перемешивание
продолжается в течение нескольких дней. Метиловый спирт удаляется на роторном
испарителе, и продукт берется в воде. Раствор затем подвергается диализу с использованием мембраны
Spectrapor N 1. Раствор
затем концентрируется до 38 мл и снимается его флуоресцентный спектр при
использовании облучения при 340 нм и определении при 420 нм. Флуоресценция еще обнаруживается после
10000 разового разбавления,
и характеристика (ответ) является линейной для разбавлений 100 и
1000.
ПРИМЕР 36.
Получение конъюгата G4-ПАМАМ-дендример /DTPA/Gd.
A. Получение
G4-ПАМАМ-дендримера, с концевыми метил сложноэфирными группами
G 3,5-ПАМАМ-дендример с концевыми метилсложноэфирными группами получается последовательной реакцией с
метилакрилатом и
этилендиамином. Затем к 1000 г предварительно перегнанного этилендиамина
добавляется около 5 г G 3,0-ПАМАМ-дендримера с концевыми метилсложноэфирными группами в виде 15% (по массе)
раствора в
метиловом спирте. Раствор выдерживается при комнатной температуре в течение 48
часов. Метиловый спирт и большая часть этилендиамина удаляется ротационным испарением под вакуумом при
температуре не
выше 60oC. Всего извлекается около 7,5 г продукта. Для удаления
незахваченного этилендиамина продукт растворяется в 100 мл метилового спирта и ультрафильтруется на
двухпробирочном
Centricon-микроконцентраторе (молекулярная масса отсечки: 2000 дальтонов). После
того, как большая часть раствора пропускается через мембрану, добавляется несколько дополнительных
порций метилового
спирта, и процесс ультрафильтрации повторяется. Ретентат переносится в
круглодонную колбу, фильтровальная чашка промывается повторно метиловым спиртом, и промывки объединяются с
ретентатом. Летучие
растворители удаляются из ретентатного раствора ротационным испарением
под вакуумом. Извлекается около 6 г G 4-ПАМАМ (ММ 5147 дальтонов, 24 концевые аминогруппы).
B. Получение
конъюгата G 4-ПАМАМ-дендример/DTPA-ангидрид
Раствор ПАМАМ (4 г, 7,
6•10-4 моля) в 300 мл воды перемешивается в трехгорлой колбе. В течение следующего часа 29 г
(72•
10-3 моля) твердых веществ, N3-(2,
6- диоксоморфолиноэтил-N6-этоксикарбонилметил-3,6- диазооктановая дикислота (DTPA ангидрид) добавляется по частям
(порциями). В
процессе добавления pH поддерживается при 8,8-9,2
добавлением 1 N водного раствора гидроокиси натрия. После завершения добавления раствор перемешивается еще 30 минут. Значение pH
раствора
корректируется до pH 7 добавлением ионообменной смолы (в
H+-форме), и полученная суспензия фильтруется при разряжении для удаления ионообменной смолы. Фильтрат переносится в две
пробирки
Centricon-микроконцентратора (молекулярная масса отсечки:
5000 дальтонов) и ультрафильтруется. Фильтрат отбирается и сушится вымораживанием. Получается около 12 г бесцветного чешуйчатого
порошка.
Продукт является полиамидоамидом (24 концевые аминогруппы),
имеющим каждую концевую группу, связанную амидной связью с одной из карбоксильных групп DTPA.
C. Получение конъюгата G4 ПАМАМ-дендример/DTPA/Gd.
Около 10 г хелатирующего агента, описанного выше, растворяется в 600 мл воды и смешивается с 2,8 г Gd2O3. Суспензия перемешивается около 90 минут при 80oC. После охлаждения до комнатной температуры pH раствора корректируется до 7 добавлением анионообменной смолы. Полученная суспензия фильтруется при разряжении для удаления ионообменной смолы. Фильтрат переносится в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 5000 дальтонов) и ультрафильтруется. Фильтрат собирается и сушится при вымораживании, получается около 12 г бесцветного чешуйчатого лиофилизата, содержащего Gd, что подтверждается атомным абсорбционным спектроскопическим анализом.
ПРИМЕР 37.
Получение конъюгата G 3,0-дендример с концевыми аминогруппами /DTPA/Gd.
A. Получение G 3-дендримера с концевыми гидроксигруппами.
Дендример третьей генерации с концевыми гидроксильными группами получается из пентаэритритилтетрабромида и 4-гидроксиметил-2,6,7-триоксибицикло[2,2,2]октана, как описывается в Патенте США 4587329, пример 11. В соответствии с методикой стадии C из примера 11 Патента США 4587329 полиэфирный дендример второй генерации с концевыми гидроксильными группами превращается в соответствующий пербромид. Затем в соответствии с методиками стадий A и B из указанного примера 11 бромированное производное со стадии C реагирует сначала с 4-гидроксиметил-2,6,7-триоксабицикло[2,2,2]октаном и затем демаскируется водой с образованием требуемого дендримера третьей генерации.
B. Получение дендримера третьей генерации с хлоридными концевыми группами.
В 500 мл 3-х горловую колбу, оборудованную мешалкой, холодильником и капельной воронкой, загружают 0,1 моля дендримера третьей генерации из раздела A и 15 молей свежеперегнанного тионилхлорида со скоростью, обеспечивающей поддержание температуры ниже 45oC. При завершении добавления раствор нагревается до примерно 50oC и поддерживается при этой температуре около 4-х часов. Избыточный тионилхлорид удаляется под вакуумом. Этим способом гидроксильные группы превращаются в хлоридные остатки.
C. Получение дендримера третьей генерации с концевыми аминогруппами.
Дендример с концевыми хлоридными группами из раздела B переносится в большую полиолефиновую бутыль, и туда добавляется большой избыток раствора гидроокиси аммония. Бутыль герметизируется, и содержимое хранится при температуре примерно 55oC в течение нескольких дней. Из раствора образуется остаточное масло, которое повторно растворяется в небольшом объеме воды, pH корректируется до 8 добавлением бикарбоната натрия, и требуемый амин экстрагируется хлороформом. Экстракт хлороформа сушится над безводным сульфатом магния, фильтруется и концентрируется до получения остаточного масла. Этим способом дендример с концевыми хлоридными группами превращается в дендример с концевыми аминогруппами.
D. Получение дендримера третьей генерации с концевыми аминогруппами.
Альтернативно, дендример с концевыми гидроксильными группами из раздела A растворяется в ДМФ (диметилформамиде), и к нему добавляется избыток метансульфохлорида. Полученный сложный эфир тозилата выделяется при разбавлении ДМФ водой и экстракцией хлороформом. Экстракт хлороформа промывается разбавленным раствором бикарбоната натрия и водой, затем сушится над безводным сульфатом магния. После фильтрации для удаления всех твердых веществ фильтрат концентрируется до сухости. Оставшийся в виде масла требуемый сложный эфир полиметансульфоната, используемый без дополнительной очистки, переносится в большую полиолефиновую бутыль, и в нее добавляется большой избыток раствора гидроокиси аммония. Бутыль герметизируется, и содержимое хранится несколько дней при температуре около 55oC. Дендример с концевыми аминогруппами выделяется, как описано выше в разделе C.
E. Получение конъюгата дендример 3-ей генерации с концевыми аминогруппами/DTPA.
Смешанный ангидрид DTPA получается реакцией диэтилентриаминпентауксусной кислоты (DTPA) и изобутилхлороформиата. Ангидрид (1 моль) растворяется в ДМФ, и раствор добавляется к раствору дендримера с концевыми аминогруппами (либо из раздела C, либо из раздела D) в том же растворителе. К раствору добавляется 2,6-лутидин, когда необходимо поддержать щелочную среду. Таким образом между аминным окончанием дендримера и карбоксильной группой DTPA образуются ковалентные связи.
F. Получение конъюгата дендример 3-ей генерации с концевыми аминогруппами/DTPA.
Альтернативно, 1 ммоль дендримера с аминным окончанием (либо из раздела C, либо из раздела D растворяется в 300 мл воды. В течение 2 часов 150 ммолей твердой формы N3-(2,6-диоксоморфолиноэтил)-N6 -этоксикарбонилметил- 3,6-диазаоктандикислоты добавляется порциями к раствору. Добавлением 1N гидроокиси натрия pH поддерживается около 9,0. Раствор перемешивается еще 30 минут, pH корректируется до 7 анионообменной смолой (H+-форма), и затем суспензия фильтруется для удаления ионообменной смолы. Раствор помещается в две пробирки Centricon-микроконцентратора (молекулярная масса отсечки: 5000 дальтонов) и ультрафильтруется. Фильтрат собирается и супится вымораживанием. DTPA-конъюгированный дендример получается в виде бесцветного чешуйчатого порошка.
G. Получение конъюгата G 3,0 дендример с концевыми аминогруппами /DTPA/Gd.
Около 10 DTPA-конъюгированного дендримера растворяется в 600 мл воды для инъекции и смешивается с приблизительно 3 г Gd2O3. Суспензия смешивается около 90 минут при 80oC. После охлаждения pH раствора корректируется до pH 7 добавлением ионообменной смолы. Раствор фильтруется для удаления ионообменной смолы и затем ультрафильтруется, как описано выше. Фильтрат собирается и супится вымораживанием, Gd/DTPA-конъюгированный дендример получается в виде бесцветного чешуйчатого лиофилизата, содержащего Gd, по данным атомного абсорбционного спектроскопического анализа.
ПРИМЕР 38.
Никель нулевой валентности в дендримерах.
К 10 г 1% NiCl2 (водный) добавляется 177 мг STARBURST-дендримера (форма Na-соли) 0,5 генерации с диэтилентриаминным (ДЭТА = DETA) ядром. Раствор становится бледно-голубым. К этому раствору добавляется 0,5 мл 28% водного раствора гидроокиси аммония с превращением раствора в темно-голубой. В результате добавления к раствору 12 г 2,78% водного раствора гипофосфита натрия и затем нагревания раствора до кипения получается осадок металлического никеля с находящимся над ним голубым раствором. Надосадочный раствор концентрируется в вакууме с получением металлизированного дендримера в виде смеси с избытком фосфитов (0,6 г). Очистка производится ультрафильтрацией на фильтрационной установке с полыми волокнами (The Dow Chemical Company).
(В результате контрольной реакции, выполненной, как указано выше, за исключением того, что дендример не добавляется, получается бесцветный раствор с полным осаждением металлического никеля после кипячения).
ПРИМЕР 39.
Никель нулевой валентности в дендримерах
К 10 г 1% водн. NiCl2 добавляется 270 мг
STARBURST-дендример (натрийкарбоксилатная форма)
генерации 1,5 с линейным
полиэтиленимином (ПЭИ= PEI) в качестве ядра. Раствор становится более темно-зеленым, чем контрольная смесь (без STARBURST).
После добавления 0,5 мл концентрированной
гидроокиси аммония контрольный
образец становится голубым, а STARBURST-содержащий раствор остается еще зеленым. В результате добавления 12 г 2,78% водного
раствора гипофосфита натрия и нагревания до
кипения в контрольном образце
осаждается черный металлический никель и получается бесцветный раствор. В случае STARBURST-содержащего раствора в тех же
условиях получается бледно-зеленая суспензия.
Бледно-зеленая суспензия
центрифугируется для удаления небольшого количества твердой составляющей (50 мг) и концентрируется в вакууме с получением 500 мг
бледно-зеленого порошка. Ультрафильтрация
водного раствора этой смеси
металлизированного дендримера и фосфитов с использованием мембраны Amicon УМ2 продолжается до исчезновения зеленой окраски в
фильтрате. В результате концентрации в
вакууме зеленого раствора ретентата
получается приблизительно 100 мг темно-зеленого стекла.
ПРИМЕР 40.
Получение эпоксиоктанмодифицированного G 5,0 ПАМАМ-дендримера.
G 5,0 ПАМАМ-дендример, 0,30 г (2,7 мэк), растворяется в 10 мл метилового спирта. К раствору добавляется 0,5 г эпоксиоктана (Aldrich 3,9 ммоля). Раствор затем нагревается при 40oC на масляной бане в течение 3 дней. Растворитель удаляется перегонкой в вакууме, затем из остатка удаляются летучие в глубоком вакууме при комнатной температуре с получением 0,60 г (93% от теории) модифицированного дендримера в виде бесцветного масла. Спектрами13C- и1H-ЯМР подтверждается прикрепление к поверхности эпоксиоктана и существование ассоциации эпоксиоктанового дендримера.
При повторении указанной выше методики с использованием ПАМАМ-дендримера генераций 2,0, 3,0, 4,0, 6, 0 или 7,0 образуются соответствующие конъюгаты.
ПРИМЕР 41.
Получение G 4,5-ПАМАМ-дендримера, модифицированного абсцизовой кислотой
Водный раствор
ПАМАМ-дендримера генерации 4,5
гидролизуется NaOH/MeOH (1 мМ, 10 мл) и pH корректируется до
11 при помощи NaOH/HCl. К раствору добавляется большой избыток твердой абсцизовой кислоты. Раствор
интенсивно перемешивается при
комнатной температуре. Через 1, 2, 6 и 24 часа 500 мкл раствора
отбирается в пробирку Эппендорфа (1,5 мл пробирка микроцентрифуги), и вся нерастворенная абсцизовая
кислота удаляется
центрифугированием при 15000 об/мин за 1 минуту. Концентрация асбцизовой кислоты
рассчитывается по поглощению надосадочной жидкости (λ=260 нм, ε=19400).
При
повторении
процесса с использованием различных генераций ПАМАМ-дендримеров более высокой генерации
растворяется большее количество абсцизовой кислоты. В случае дендримеров генерации 5 и 6 кислоты
растворяется
больше, чем в случае генерации 4. При pH 7 только 0,004 М абсцизовой кислоты растворяется
в воде и β-CD- растворе, тогда как в растворах дендримеров растворяется 0,02-0,08 М. В
случае
дендримеров половинных генераций растворяются такие же количества кислоты, как в случае целых
генераций. Таким образом, считается, что абсцизовая кислота поглощается внутрь дендримера.
Когда вышеуказанная методика используется с нифедипином (ε=8300 в хлороформе), требуется много времени для растворения нифедипина в воде, но отмечается очень быстрое попадание растворенного нифедипина внутрь дендримера.
Протокол (методика) трансфекции
дендример-декстрана
Протокол (методика) трансфекции, в основном, является следующим:
ДЕНЬ 1: Засевают 6-гнездные планшеты приблизительно 200000 клеток на гнездо (в зависимости от
характеристик роста)
ДЕНЬ 2: Стадия 1: готовят следующие растворы:
A. Дендримером
разбавленный буфер
20 мМ HEPES pH 7,9
100 мМ KCl
0,2 мМ ЭДТА (EDTA)
0,5 мМ ДТТ
20% (по объему) глицерин
B. 10X Связывающий буфер
10 мМ
ЭДТА
40% (по объему) глицерин
50 мМ ДТТ
100 мМ TRIS HCl pH 7,5
1000 мМ NaCl
Смесь и фильтр стерилизуют,
C. Раствор 1 (используемый в ряде
примеров)
25 мГ DEAE-декстран (Pharmacia или Sigma Chemical)
5,0 мл 1 М TRIS pH 7,4
95 мл безсывороточн. DMEM
Смесь в шейкере при 37oC в течение 30
минут,
фильтр стерилизуют (1 мл раствора требуется на каждое гнездо).
D. Раствор 2 (используется в ряде примеров).
10% ДМСО в PBS pH 7,4
Смесь и фильтр
стерилизуют (2 мл Раствора 2 требуется на каждое гнездо).
Стадия 2: Готовят комплексы
ДНК/дендример:
(20 мкл комплекса требуется на каждое гнездо). Помещают соответствующий
объем 10X связующего буфера и H2O в стерильную пробирку Эппендорфа.
Добавляют разбавленный дендример, за которым следует ДНК.
(Конц. исходные дендримеры должны быть суспендированы в воде, свободные от метилового спирта, если возможно. Разбавляют дендримеры буфером разбавления до концентрации приблизительно 10X конечная концентрация перед добавлением связующего буфера.
Хотя комплексы, по-видимому, образуются непосредственно при смешении, смесь должна выстояться в течение 3-15 минут для образования комплексов.
ПРИМЕР комплексообразования ДНК/дендример RSV -1ис ДНК и G 10 (ЭДА) дендример.
7,2 т. п. н. (тысяч пар нуклеотидов) RSV -1ис плазмида ДНК имеет 1,71 • 1015 (-) зарядов на мкг. G 10 (ЭДА) дендример имеет 2,64 • 1015 (+) зарядов на мкг. Поэтому отношение зарядов 1:10 требует отношение 1 мкг к 6,5 мкг дендримера. Исходный G 10 (ЭДА) имеет концентрацию 236,4 мкг/мкл. Разбавление 1: 364 в буфере разбавления дает 0,65 мкг/мкл. Для приготовления 20 мкл комплексов (достаточных для трансфекции 1 мкг ДНК в одно гнездо клеток в 6-гнездного планшета) комбинируют 2 мкл 10X связующего буфера, 7 мкл стерильной H2O, 10 мкл разбавленного дендримера и 1 мкл ДНК (при 7 мкг/мкл). При необходимости трансфекции более одного гнезда или использования больших количеств ДНК, просто получают больший объем комплексов, используя те же пропорции связующего буфера, дендримера и ДНК.
Стадия 3: Промывают клетки 2 х 2 мл среды, свободной от сыворотки.
Стадия 4: Добавляют 1 мл Раствора 1 в каждое гнездо.
Стадия 5: Добавляют 20 мкл комплексов ДНК/дендример в каждое гнездо. Смешивают осторожным встряхиванием планшета.
Стадия 6: Инкубируют в течение 3 часов при 37o C.
Стадия 7: Промывают 1 х 2 мл DMEM без сыворотки.
Стадия 8: Шокируют клетки Раствором 2, 2 мл на гнездо, в течение 2 минут.
Стадия 9: Промывают клетки DMEM без сыворотки.
Стадия 10: Заменяют среду на DMEM с 5% сыворотки. Инкубируют всю ночь при 37oC.
ДЕНЬ 3: Получают следующие растворы:
Раствор 4 Лизис (распад) клеточной культуры 1 х Реагент
25 мМ TRIS-фосфат
pH 7,8
2 мл - DTT
2 мМ 1, 2-диаминоциклогексан-N,N,N'N'-тетрауксусная кислота
10%
глицерин
1% Тритон Х-100
Раствор 5 Реагент пробы на люциферазу
2 мМ TRIS-глицин
1,07 мМ (MgCO3)Mg(OH)2•5H2O
2,67 мМ
MgSO4
0,1 мМ ЭДТА (EDTA)
33,3 мМ DTT
270 мкМ
кофермент A
40 мкМ люциферин
530 мкМ АТР, корректировка до конечного pH 7,8
Стадия 1:
Ополаскивают клетки 2 х 2 мл 1 х PBS pH 7,4
(Mg++, Ca++
свободн.)
Стадия 2: Добавляют 200 мкл Раствора 4 в каждое гнездо и оставляют на 15 минут при 27oC.
Стадия 3: Соскабливают клетки и собирают в пробирки Эппендорфа.
Стадия 4: Определяют концентрацию протеина лизата каждой клетки.
Стадия 5: Отбирают не более 20 мкл лизата каждой клетки в пробирки Эппендорфа.
Стадия 6: Добавляют 80 мкл Раствора 5 и сразу определяют хемилюминисценцию
В пробирках используют
несколько разных типов генетического материала. Если не указывается специально,
используемой ДНК является плазмида бактериальной экспрессии RSV -1ис, в которой содержится ген фермента люциферазы,
который выражается промотором Респираторного Синтетического вируса (RSV).
Концентрация генетического материала по отношению к дендримеру определяется либо на основе требуемого отношения зарядов
ДНК:дендример, либо на основе мольного соотношения, как указано в конкретном
примере. В примерах трансфекции используется достаточное количество комплекса ДНК:дендример, так что 1 микрограмм (мкг) ДНК
добавляется на испытательное гнездо (примерно 200000 клеток), если не
указывается особо.
В большинстве примеров используются плотные звездчатые ПАМАМ-дендримеры. Генерация, а, следовательно, диаметр дендримеров, варьируется, а также ядра, и в ряде случаев также поверхностные функциональности. Успешно трансфекцируются несколько различных линий клетки. Если в примере не указывается особо, трансфекцируются клетки крысы RAT 2.
Если в примерах используется DEAE-декстран, концентрация является равной 0,5 мкМ, если не указывается особо. Также, если не указывается особо, используемое количество ДНК в комплексе ДНК:дендример является равным 1,0 мкг на испытательное гнездо.
ЭЛЕКТРОФОРЕЗ
Используемые в электрофорезе гели
агарозы помещаются в электрическое поле с катодом сверху геля (как
указывается на фигурах) и анодом снизу геля (как указывается на фигурах). Гели подкрашиваются этидиумбромидом, который соединяется с
ДНК с флуоресцированием, указывающим на степень миграции ДНК в
гель. В ряде примеров полосы начинаются как в верху планшета геля, так и в его середине с миграцией к нижней части рисунка в каждом
случае. Предполагается, что образование комплекса и нейтрализация
ДНК осуществляются, когда миграция к аноду замедляется.
В примерах используются экспериментальные методы, известные специалистам и доступные в литературе, поэтому дополнительное их описание не требуется.
ПРИМЕР 42.
Получение дендримерных конъюгатов с генетическим материалом и эксперименты (фиг. 17-19).
В этих сериях экспериментов получаются комплексы различных дендритных полимеров с ДНК и осуществляется их трансфекция в различных условиях. ДНК, образовавшей комплекс с дендримером, является RSV-1ис-плазмида двойной очистки на колонке с градиентом цезия. Трансфекция экспрессии плазмиды ДНК выражается в успешной транскрипции и трансляции гена люциферазы. Получается протеин люциферазы, ферментом которого катализируется расщепление люциферина (LUCIFERIN) с выработкой определенного света. Определение количества света является мерой степени осуществления трансфекции этого гена.
Испытанными дендримерами являются следующие:
A. G8(NH3) плотный звездчатый дендример с молекулярной массой (ММ)
приблизительно 87342 и диаметром приблизительно 76

B. G6(NH3) плотный звездчатый дендример, имеющий ММ приблизительно 21591 и диаметр приблизительно 53

C. G5(NH3) плотный звездчатый дендример, имеющий ММ приблизительно 10633 и диаметр приблизительно 40

D. G7(NH3) плотный звездчатый дендример, имеющий молекулярную массу приблизительно 43508 и диаметр приблизительно 67

E. G3(NH3) плотный звездчатый дендример, имеющий ММ приблизительно 2414 и диаметр приблизительно 22

F. G4(NH3) плотный звездчатый дендример, имеющий ММ приблизительно 5154 и диаметр приблизительно 31

G. G2(NH3) плотный звездчатый дендример, имеющий ММ приблизительно 1044 и диаметр приблизительно 15,8

H. G1(NH3) плотный звездчатый дендример, имеющий ММ приблизительно 359 и диаметр приблизительно 10,4

I. G1(ЭДА) плотный звездчатый дендример, имеющий ММ приблизительно 517 и диаметр приблизительно 14

J. G2(ЭДА) плотный звездчатый дендример, имеющий ММ приблизительно 1430 и диаметр приблизительно 19

K. G3(ЭДА) плотный звездчатый дендример, имеющий ММ приблизительно 3256 и диаметр приблизительно 26
L. G4(ЭДА) плотный звездчатый дендример, имеющий ММ приблизительно 6909 и диаметр приблизительно 36

M. G5(ЭДА) плотный звездчатый дендример, имеющий ММ приблизительно 14215 и диаметр приблизительно 44

N. G6(ЭДА) плотный звездчатый дендример, имеющий ММ приблизительно 28826 и диаметр приблизительно 57

O. G7(ЭДА) плотный звездчатый дендример, имеющий ММ приблизительно 58048 и диаметр приблизительно 72

P. Смесь плотных звездчатых дендримеров следующего процентного содержания:
1. G6(NH3) 58,8%
2. G5(NH3) 30,5%
3. G2(ЭДА) 1,86%
4. G2(NH3) 1.10%
5. G1(ЭДА) 3,37%
6. G1(NH3) 4,41%
Q. Смесь плотных звездчатых дендримеров следующего процентного содержания:
1. G6 (NH3) 60, 0%
2. G5(NH3) 31,1%
3. G2(ЭДА) 1,90%
4. G2(NH3) 1,12%
5. G1(ЭДА) 1,30%
6. G1(NH3) 4,50%
R. G6(NH3) частично деструктированный плотный звездчатый дендример.
S. G7(NH3) частично деструктированный плотный звездчатый дендример.
Основные данные по этим дендримерам приводятся в таблице XII.
Данными таблицы XII демонстрируется, что со всеми дендримерами, имеющими отличное от NH3 ядро, генераций, меньших G4 (G, H, I), соединяется с образованием комплекса ДНК нейтрального заряда.
Для определения способности дендримеров образовывать комплекс с ДНК,
предназначенное для трансфекции,
выполняются
эксперименты в различных условиях
Фигурой 17 иллюстрируются результаты трансфекции образцов в RAT2-клетки световыми единицами, измеренными на 1
мкг клеточного протеина для
каждого из
различных условий, причем образцы обозначаются номерами с 1 по 18, как указывается в таблице XIII.
Образцы 6, 12 и 18 являются контрольными. Образец 6 является нетрансфекцированными RAT2-клетками. Образец 12 является подобным образцу 6, но с присоединением DEAE-декстрана. В образце 18 предпринимается трансфекция с использованием вектора и ДНК спермы сельди в присутствии DEAE-декстран. Как подтверждается данными таблицы XIII, дендримеры генераций более низкой, чем G8, не подвергаются трансфекции, пока комплексы ДНК:дендример не помещаются в DEAE-декстрана.
Для подтверждения этих результатов с использованием широкого ряда зарядных отношений ДНК:дендример проводятся исследования, показанные на фиг. 18. Параметры испытаний являются представленными в таблице XIV.
Контрольные образцы 21-24 относятся к вектору в DEAE-декстране, вектору и ДНК спермы сельди в декстране, DEAE-декстрану и HBS соответственно.
Результатами иллюстрируется, что комплексы ДНК-дендример являются неожиданно более эффективными в трансфекции клеток в присутствии DEAE-декстрана. Также, предполагается, что для чистых дендримеров, имеющих поверхностную аминофункциональность (с положительным зарядом), только комплексы с избыточными положительными зарядами дендримеров являются способными к эффективной трансфекции. (смотри полосу 4, фиг. 18).
Трансфекционная способность для широкого спектра различных дендримеров демонстрируется (A-S) на фиг. 19. Приводится столбцовая диаграмма относительных световых единиц на мкг протеина, из клеток, трансфекцированных ДНК, образующих комплексы с различными дендримерами (A-S) в присутствии DEAE-декстрана. Используются три различных соотношения зарядов ДНК:дендример, а именно 1:2, 1:10 и 1:20 в удвоенном количестве. Таким образом, имеется шесть столбцов для каждого дендримера A-S на фиг. 19: первые два показывающие трансфекцию при зарядном соотношении ДНК:дендример = 1:2, вторая пара - при 1:10 и третья пара - при 1:20. Контрольные образцы (RSVa) относятся к трансфекции плазмидной ДНК в присутствии DEAE-декстрана. Обнаруживается зависимость различных соотношений ДНК:дендример, успешной трансфекции, транскрипции и трансляции от некоторых типов используемых дендримеров.
ПРИМЕР 43.
Электронная микроскопия комплексов ДНК: дендример в присутствии и при отсутствии DEAE-декстрана (фиг. 60, снимки 3, 4 и 5)
Добавление DEAE-декстрана
или других агентов к
комплексу
ДНК:дендример после его образования является эффективным в увеличении трансфекции уникальным образом. Для того, чтобы лучше понять роль этих агентов в повышении
неспецифической трансфекции
делаются
электронные микрофотографии комплексов ДНК:дендример с и без добавления DEAE-декстрана. В этих примерах между ДНК и дендримером образуется комплекс, что
иллюстрируется фиг. 60.
Снимок 3 - ДНК-G11(ЭДА)дендример при отношении зарядов 1:10.
Снимок 4 - ДНК:G11 (ЭДА)дендример в 0,5 мкМ DEAE-декстране
Снимок 5
- ДНК, образовавшая комплекс с
полидисперсной
смесью дендримеров (соединение B) при соотношении зарядов 1:10.
На фиг. 60 снимки 3, 4 и 5 являются электронными микрофотографиями комплексов ДНК: дендример. Комплекс ДНК с G11 (ЭДА)-дендримером образуется при соотношении зарядов 1:10 в 1 мМ TRIS pH 7,8. Электронной микроскопией в этих условиях подтверждается больших неправильных агрегатов комплексами ДНК:дендример (фиг. 60, снимок 3), что не наблюдается в случае одного дендримера. В результате добавления DEAE-декстрана до конечной концентрации 0,5 мкМ размер комплексов ДНК: дендример резко снижается (фиг. 60, снимок 4). Комплексы меньшего размера (и полное отсутствие крупных агрегатов) наблюдаются, когда образуется комплекс ДНК с полидисперсными смесями дендримеров (например, описанных как соединение B) при соотношении зарядов 1:10. Этот результат является основной причиной, почему улучшается трансфекция этими агентами. С желанием не быть связанным с какой-либо теорией, представляется, что меньшим размером комплексов, который обеспечивается этими агентами, объясняется более легкий доступ к клеткам и обеспечение трансфекции.
ПРИМЕР 44.
Сравнение связывающей с ДНК и трансфекционной способности дендримеров с и без поверхностных заместителей при различных соотношениях заряда ДНК:дендример. Фиг. 12 и 13.
Для того чтобы определить влияние снижения поверхностного заряда дендримера на эффективность трансфекции, проводится следующий эксперимент. Получаются комплексы ДНК:дендример в указанных соотношениях зарядов для различных дендримеров, представленных в таблице XV. Как и ранее, числом G обозначается генерация дендримера; а "NH3" и "ЭДА" - являются ядром дендримера. Замещенные дендримеры представляются в виде образцов 26-31 на фиг. 12 и полос (линий) 26-31 на фиг. 13. У замещенных дендримеров имеются поверхностные положительно заряженные амины, модифицированные реакцией с акриловой кислотой. Поэтому у этих замещенных дендримеров число поверхностных групп снижается. Так, у на 25% замещенного G6 (NH3) дендримера теоретически имеется 25% его поверхностных аминогрупп, взаимодействовавших с карбоксильными группами акриловой кислоты. В замещенном на 100% G6-дендримере каждая поверхностная аминогруппа является взаимодействовавшей с карбоксильной группой. Поэтому функциональный положительный заряд, который имеется в наличии для взаимодействия с отрицательно заряженной ДНК, снижается. Номера 1 и 32 в таблице XV являются "контрольными плазмидами", или, другими словами: только ДНК.
Образцы комплексов ДНК: дендример в растворе добавляются к клеткам для трансфекции в соответствии с Протоколом трансфекции дендримеров, описанным выше, в присутствии DEAE-декстрана при концентрации 0, 5 мкМ. По данным фиг. 12 отмечается, что G6-дендримеры являются более эффективными (сравниваются столбцы 8-19 с столбцами 2-7 и столбцами 20-25). Когда поверхность дендримера является 25% замещенной с отрицательной функциональностью, является необходимым снизить отношение зарядов ДНК:дендример.
Образцы дендримерных комплексов и контрольные 1-32, представленные в таблице XV, помещаются в агарозных гелях для электрофореза (фиг. 13), Полосами 1 и 32 демонстрируется степень, до которой осуществляется миграция ДНК в отдельности через гель (фиг. 13). Полосы 2-18 относятся к отсутствию миграции, показывая, что образуется комплекс ДНК с дендримером, и в результате миграция через гель задерживается. Однако, миграция наблюдается для полос 29-31, где у дендритных полимеров имеется функциональность со сниженным положительным зарядом. Частичная остаточная положительно заряженная активность проявляется даже в 100% замещенных дендримерах, потому что запаздывание наблюдается при более низких отношениях ДНК:дендример (полосы 30-31). Результатами, представленными на фиг. 12 и 13, указывается, что плотность положительного поверхностного заряда в дендримере является важной в связывании, комплексообразовании и трансфекции ДНК.
ПРИМЕР 45.
Увеличение эффективности трансфекции ДНК как функции генерации дендримеров по сравнению с DEAE-декстрановым контролем (фиг. 14).
В этом примере получаются комплексы ДНК и дендримера с использованием (G2-G8) (NH3) -дендримеров и (G3-G11) (ЭДА)-дендримеров. Их способность к трансфекции ДНК в RAT2-клетки в присутствии DEAE-декстрана, сравнивается со степенью трансфекции, достигнутой при использовании только ДНК и DEAE-декстрана. Процентное увеличение трансфекции для каждого из дендримеров по сравнению с ДНК/DEAE-декстрановым контролем демонстрируются на фиг. 14. Эта фигура подтверждает, что эффективность трансфекции увеличивается экспоненциально, когда генерация дендримера увеличивается от генерации 5 до генерации 10. Поэтому предполагается, что увеличение площади поверхности и заряда дендримеров увеличивает эффективность трансфекции.
ПРИМЕР 46.
Определение влияния последовательного добавления G9 и G5 дендримеров на эффективность трансфекции в RAT2-клетки при
отсутствии DEAE-декстрана (фиг. 15 и 16)
В этом примере либо
1.
Сначала образуется комплекс ДНК с G9 дендримером, а затем добавляется G5 дендример, содержащий раствор; либо
2. Сначала образуется комплекс ДНК с G5
дендримером, а затем добавляется
G9-дендример-содержащий раствор.
Представленные на фиг. 15 результаты относятся к использованию дендримеров с ЭДА-ядром, а результаты, представленные на фиг. 16, относятся к использованию дендримеров с NH3-ядром. На обеих фигурах концентрация второго дендримера, добавляемого к комплексу, указывается на абсциссе столбцовой диаграммы. В первом столбце "нулевая" концентрация является контрольным образцом, когда второй дендример не используется.
В обоих случаях начальные дендримеры G9 и G5 генераций добавляются до достижения концентрации 0,5 мкМ и 20,0 мкМ, соответственно. В каждом случае диаметр G5-дендримера равняется приблизительно около 40
ПРИМЕР 47.
Сравнение комплексообразующих свойств и
трансфекционной способности нескольких (NH3)-дендримеров с
ДНК-фрагментами.
Фиг. 20 и 21
В этих примерах образуются комплексы относительно небольших фрагментов ДНК с различными
дендримерами. В данных, показанных на фиг. 20, образуются комплексы
15-нуклеотидной
синтетической одноцепочечной ДНК с (G2-G7) (NH3)-дендримерами при соотношениях зарядов ДНК: дендример,
указанных в таблице XVI:
На фиг. 20 иллюстрируется
электрофорез в геле
агарозы различных комплексов. В столбцах 1,4,7 и 10 наблюдается значительная миграция олигонуклеотида. Этим указывается
на то, что стабильные комплексы не образуются при зарядном
соотношении
ДНК:дендример = 6:1. Однако, отсутствием нуклеотидной миграции в столбцах 2, 3, 5, 6, 8, 9, 11 и 12 указывается на то, что
образуются стабильные комплексы синтетической ДНК с (G3-G7)
(NH3
) -дендримерами при соотношениях зарядов 1:1 и 1:5. Столбцами 13-15 указывается на то, что стабильные комплексы
олигонуклеотидов не образуются при любом зарядном соотношении с G2
(NH3
)дендримерами.
Рисунком 21 иллюстрируется успешный перенос двуцепочечного длиною в 23 пары оснований олигонуклеотида с введенной радиоактивной меткой, образовавшего комплекс с G8 (NH3)дендримером (при соотношении зарядов 1:10). Так как олигомер не является функциональным корреспондентом гена, успешный перенос определяется поглощением радиомеченой ДНК. Радиоактивный счет в клетках после переноса откладывается на ординате фиг. 21 по отношению к времени последующего инициирования переноса на абсциссе.
Находка, что поглощение ДНК-дендримера в клетке является энергозависимым, подтверждается данными, показывающими, что при добавлении азида натрия к комплексу значительно снижается степень переноса, почти до уровня, достигнутого для олигонуклеотида в отдельности. Этим указывается на то, что дендримерами облегчается поглощение клетками низкомолекулярных нуклеиновых кислот.
ПРИМЕР 48.
Трансфекция круговой (сверхскрученной) и линейной RSV-1ис в RAT2-клетки с использованием G8(NH3)-дендримеров и G11(ЭДА)дендримеров с и без DEAE-декстрана (фиг. 22).
В этом примере образуется комплекс с G8(NH3) и G11 (ЭДА) дендримерами RSV -1ис-гена либо в круговой (сверхскрученной) форме, либо в линейной форме. Выстраивание в линию достигается использованием одноучастковой специфически затрудненной эндонуклеазы. На фиг. 22 по горизонтальным осям указываются столбцы, пронумерованные 1, 3, 5 и 7, представляющие плазмиду в линейной форме, тогда как столбцы под номерами 2, 4, 6 и 8 относятся к плазмиде в круговой форме ДНК. На фиг. 22 демонстрируется, что трансфекция как линейной, так и круговой формы ДНК достигается при использовании либо G8(NH3)- либо G11(ЭДА)- дендримера, и что трансфекция усиливается во всех случаях при использовании DEAE-декстрана.
ПРИМЕР 49.
Уникальные связывающие свойства дендримеров (фиг. 23).
В этом примере определяются предпочтительные отношения зарядов
ДНК: дендример и условия связывания для эффективного
образования
стабильных комплексов ДНК-дендример. Комплексы ДНК:дендример образуются при отношениях зарядов от примерно 40:1 до 1:50 (фиг. 23 и
таблица XVII):
На фиг. 23 (A-D)
демонстрируется электрофорез
этих комплексов в гелях. Полоса 1 в каждом из электрофоретических гелей является маркером размера ДНК, а полоса 2 является
контрольным образцом ДНК, т.е. без дендримера.
В гелях A и B на фиг. 23 для
комплексообразования с ДНК используется G8(NH3) дендример. В гелях C и D на фиг. 23 используется G8
(ЭДА)- дендример. На верхних снимках (23 A и C) комплексы
образуются в присутствии (ДТТ =
DTT), в результате чего удаляются (восстановлением дисульфидных связей) любые протеиновые примеси, и
выдерживаются с ЭДТА, образующей комплекс с любыми
присутствующими катионами, вызывающими осаждение
ДНК. Это является двумя стадиями удаления загрязнений, что может ошибочно относиться к комплексам
ДНК-дендример. Результатами, кроме того,
указывается на то, что для комплексообразования не требуется
восстановительных условий или присутствия ионов металлов. Результаты на снимках A и C
сравниваются с результатами на снимках B и D. При
соотношениях зарядов 20:1 или более не образуется стабильных
комплексов ДНК:дендример (смотри столбцы 2-5 на снимках A-D на фиг. 23). Замедление
комплексов ДНК:дендример начинается при соотношении
зарядов ДНК: дендример 2:1 и продолжается до соотношения зарядов
1:50 (смотри полосы 6-12 на каждом из снимков a-d Рисунка 23). Этим указывается на
то, что комплексообразование ДНК с дендримером
продолжается даже при низких соотношениях зарядов ДНК:дендример.
ПРИМЕР 50.
Связующие с ДНК свойства дендримеров являются, главным образом, функцией соотношения зарядов (фиг. 24).
В этом примере образуется комплекс из 2 мкг плазмидной ДНК (2,9 тысяч оснований) и G8(NH3) - и G11(ЭДА) дендримеров, мольное соотношение которых указывается в таблице XVIII, причем с полосы 1 начинается не образующий комплекс маркер размера ДНК.
На фиг. 24 приводятся результаты электрофореза этих комплексов в агарозном геле. При мольных соотношениях 1:0,32, 1:3,2, и 1:16 не наблюдается (смотри полосы 2-4 на фиг. 32) образование комплекса ДНК с G8(NH3) дендримером. Напротив, только при мольных соотношениях 1:0, 32 и 1:3,2 (полосы 8 и 9) не образуются комплексы ДНК с G11(ЭДА)-дендримеров. Этим указывается на то, что больший G11(ЭДА) дендример, у которого имеется значительно большая плотность поверхностного заряда, чем у G8(NH3)-дендримера, является способным образовывать комплекс при более низких мольных соотношениях ДНК:дендример. Таким образом, более важным параметром комплексообразования ДНК дендримером является соотношение зарядов.
Стабильные комплексы, показанные полосами 5-7 и 11-13 на фиг. 24, все образуются при отношении зарядов ДНК:дендример менее 5:1.
ПРИМЕР 51.
Стабильность комплекса ДНК: дендример в широком
ряду значений pH (фиг. 25)
В
данном примере комплексы ДНК с G8(NH3)- и
G8(ЭДА)- дендримерами при соотношении зарядов 10:1 и 1:5 получаются с буфере, содержащим 100 мМ хлористого
натрия и 10 мМ TRIS при различных
значениях pH, указанных в таблице XIX.
Проводится электрофорез полученных комплексов в агарозном геле, и результаты приводятся на фиг. 25.
Полосы 1-5 относятся к образованию комплекса в стандартных условиях (pH 7,4). Как ожидалось, не образуется комплекса ДНК с дендримером при соотношении зарядов 10: 1 (полосы 1, 3, 6-8 и 12-14) и как в случае контрольного электрофореза ДНК без дендримера (полосы 5 и 18-20), наблюдается мигрирование в гель. Частичное комплексообразование ДНК при соотношении зарядов 10: 1 (подтверждается размытостью полос 1, 3, 6-8 и 12-14) также не затрагивается измерением pH. С другой стороны, наблюдается стабильность комплекса ДНК, образованного при соотношении зарядов 1:5, в интервале значений pH от 5,2 до 9,8, и не наблюдается его миграции в гель (полосы 9-11 и 15-17). Полосы 9 и 15 относятся к образованию комплекса при pH 5,2, тогда как полоса 17 относится к диссоциации комплекса при pH 9,8. Таким образом, при pH 9,8, полученные с G8(NH3) дендримерами комплексы являются стабильными, а полученные с G8(ЭДА)дендримерами являются нестабильными. Предполагается, что зарядные характеристики этих двух дендримеров являются различными, поэтому в некоторых условиях может меняться их способность связывать ДНК.
ПРИМЕР 52.
Связь ДНК-дендример при увеличивающихся концентрациях хлористого натрия (фиг. 26 A и B).
В примере 52 образуются комплексы ДНК при соотношениях заряда 5:1 и 1:5 как с G8(NH3)-, так и с G8(ЭДА)- дендримерами при увеличении концентрации хлористого натрия, как указывается ниже в таблице XX.
На фиг. 26A и 26B приводятся результаты электрофореза этих комплексов; фиг. 26A относится к комплексам ДНК-G8(NH3)дендример; а фиг. 26B - к комплексам ДНК-G8(ЭДА)-дендример. Полные комплексы ДНК:дендример не образуются при соотношении зарядов 5:1 в любых условиях использования, и в результате имеется миграция ДНК в гель (полосы 2-9 на фиг. 26A и 26B). С другой стороны комплексы ДНК: дендример образуются и являются стабильными при соотношении зарядов 1: 5 в хлориде натрия с концентрацией от 0 (полосы 2 и 10) до 1,5-мольной (полосы 9 и 17). Таким образом, образование комплекса ДНК:дендример имеется в зависимости от ионной силы буфера.
ПРИМЕР 53.
Стабильность комплекса ДНК с дендримером в присутствии рестриктаз (фиг. 27).
В этих примерах 0,2 мкг плазмидной pRSV-lac-ДНК комплекс образуется с G8(NH3)- или G11(ЭДА)-дендримерами при соотношении зарядов 1:10 и инкубируется с Hind III или EcoR1 рестриктазными ферментами в течение 1 часа при 37oC. Образцы затем обрабатываются SDS до отделения ДНК от дендримера, и проводится электрофорез в агарозном геле (фиг. 27, полосы, как указывается в таблице XXI).
Плазмидная ДНК, необразующая комплекс, разлагается либо Hind III, либо EcoRI, мигрировавшими в фрагменты, состоящие из ряда рестрикционных участков в плазмиде (сравните полосы 3 и 6 с разложенной ДНК в полосе 2, фиг. 27). Напротив, образующийся комплекс ДНК остается, главным образом, неразложившимся (полосы 4,5,7 и 8), что указывает на то, что ДНК защищается комплексообразующим дендримером от разложения эндонуклеазой.
ПРИМЕР 54.
Стабильность комплексов ДНК-дендример в
присутствии клеточных нуклеаз (фиг. 28)
Пример 54 является аналогичным примеру 53, за исключением того, что
клеточные нуклеазы, полученные из
цитоплазмы клеток U937, используются для
неспецифического разложения ДНК. Плазмидной ДНК (2,9 тысяч оснований) образуется комплекс с G8(ЭДА) дендримером при
соотношениях зарядов, при которых
полностью (1: 5) или неполностью (5:1)
образуется комплекс ДНК. Комплексы ДНК-дендример затем инкубируются с клеточным экстрактом в течение 4-х часов при 37oC, затем добавляется SDS для
отделения ДНК от дендримера, и образцы
подвергаются электрофорезу в агарозном геле (фиг. 28) с полосами, идентификация которых приводится в таблице XXII.
Полоса 2 относится к миграции нетронутой плазмиды, тогда как полоса 3 относится к плазмиде, разложенной клеточной нуклеазой. Сравнением полосы 3 с полосой 2 показывается, что в результате выдержки ДНК с клеточными нуклеазами ДНК разлагается на небольшие фрагменты разного размера (на что указывается пятном, видимым на полосе 3).
Полоса 4 относится к электрофорезу комплекса ДНК:дендример с соотношением зарядов 1: 5, который не выдерживается ни с клеточным экстрактом, ни с SDS. Миграция, которая ожидается для стабильного комплекса ДНК:дендример, не наблюдается.
Полоса 5 относится к такому же комплексу с соотношением зарядов 1:5, который выдерживается с клеточным экстрактом (5 мкг), затем диссоциируется с помощью SDS и затем подвергается электрофорезу. Плазмида остается, в основном, нетронутой, что наблюдается из сравнения полосы 5 с полосами 3 и 4. Этим указывается на то, что имеется небольшое или отсутствует разложение ДНК, если ею образуется комплекс с дендримером.
Полоса 6 относится к комплексу ДНК:дендример с отношением зарядов 5:1, который не выдерживается с клеточным экстрактом, но подвергается электрофорезу. Как ожидается, комплекс является нестабильным, и имеется миграция ДНК в гель. Полоса 7 относится к такому же комплексу, который выдерживается с 5 мкг клеточного экстракта, затем обрабатывается SDS для высвобождения ДНК из дендримера и подвергается электрофорезу. Так как комплекс является нестабильным, ДНК почти полностью разлагается, и наблюдается различная миграция различных разложенных фрагментов, что подтверждается полосой 7 фиг. 28. Этим показывается, что при полном комплексообразовании ДНК с дендримером ДНК защищается дендримером от нуклеазного разложения.
ПРИМЕР 55.
Трансфекция ДНК в комплексе с G8(NH3 )дендримерами с и без DEAE-декстрана по сравнению с трансфекцией с использованием липофектина (LIPOFECTIN) (фиг. 29).
В данном примере ДНК образуются комплексы с G8(NH3 )дендримерами при различных соотношениях зарядов ДНК:дендример (от 1:100 до 1:1). Затем различные количества ДНК (1,5 и 10 мкг) трансфекцируются в присутствии DEAE-декстрана. Указанные количества ДНК трансфекцируются также с 20 мкг липофектина (LIPOFECTIN).
Результаты этих трансфекций, на что указывается получением люминесценции (в световых единицах на мкг протеина), приводятся на фиг. 29. Очень незначительная трансфекция получается для контрольных образцов, т.е. ДНК в присутствии DEAE-декстрана или ДНК в отдельности. Значительная трансфекция достигается комплексами ДНК:дендример, полученными с 10 мкг, 5 мкг и 1 мкг ДНК на гнездо при отношениях зарядов от 1:100 до 1:1 (ДНК:дендример) в присутствии DEAE-денкстрана. Значительная трансфекция достигается также комплексами ДНК: дендример даже при отсутствии DEAE-декстрана, когда большие количества ДНК комплексообразуются при более низких соотношениях зарядов. При отсутствии DEAE-декстрана трансфекция комплексами ДНК:дендример имеется только с дендримерами более высокой генерации (> G7).
В случае, когда трансфекция является значительной, результаты успешно сравниваются с результатами с использованием агента трансфекций на основе липида липофектина (LIPOFECTIN).
ПРИМЕР 56.
Трансфекция ДНК в комплексах с различными дендримерами в присутствии или при отсутствии DEAE-декстрана (фиг. 30 и 31).
В этих примерах приводятся графически результаты трансфекции ДНК, образовавшей комплекс с G9(ЭДА), G9(NH3) (фиг. 30), G8(NH3) и C11(ЭДА) (фиг. 31). Трансфекция ДНК в присутствии DEAE-декстрана значительно увеличивается, когда соотношение зарядов ДНК:дендример меняется от примерно 1:5 (0,2) до примерно 1:100 (0,01) (фиг. 30 и 31). Даже при соотношении зарядов таких высоких, как примерно 4:1 (4,0), и таких низких, как примерно 1510000 (0,0001), наблюдается некоторая трансфекция. Трансфекция при отсутствии DEAE-декстрана является значительной только при соотношении зарядов ДНК:дендример меньше 1: 5 и стремится к увеличению, когда она проводится при соотношениях зарядов ниже 1:1000 и даже при 1:10000 для G9(NH3) (фиг. 30). Отсюда предполагается, что более низкие соотношения зарядов генетический материал: дендример могут использоваться вместо повышающего эффекта DEAE-декстрана.
ПРИМЕР 57.
Трансфекция ДНК в комплексе с G7(NH3) дендримером в DEAE-декстране в сравнении с HBS (фиг. 32).
В данном примере комплексы ДНК: дендример при соотношениях зарядов, указанных на абсциссе на фиг. 32, трансфектируются в RAT2-клетки либо в присутствии DEAE-декстрана, либо в присутствии HBS. Результаты трансфекции измеренные люминесценцией в относительных световых единицах на 1 мкг клеточного протеина, приводятся на фиг. 32. Отмечается, что в присутствии DEAE-денкстрана значительно увеличивается трансфекция для комплексов, где соотношение зарядов изменяется от примерно 1:15 до примерно 1:1, особенно 1: 0,6. Трансфекция по существу не достигается в HBS (буферный раствор Хенкса), чем подтверждается, что для трансфекции с дендримерами генерация 7 и ниже требуется добавление DEAE-декстрана.
ПРИМЕР 58.
Влияние генерации дендримера и соотношение зарядов ДНК:дендример на эффективность трансфекции (фиг. 33).
В данном примере ДНК, образовавшая комплекс с (G4-G8) (NH3)плотными звездчатыми дендримерами при соотношении зарядов ДНК:дендример 1:1, 1:5 и 1: 10, тренсфекцируется в RAT2-клетки в присутствии DEAE-декстрана. Процентное увеличение трансфекции по сравнению с контрольной смесью приводится для каждого из полученных комплексов на фиг. 33. Значительное увеличение по сравнению с контрольным образом наблюдается для G6-, G7- и G8-дендримеров при всех соотношениях зарядов, причем диаметр этих дендримеров равняется более 50
ПРИМЕР 59.
Влияние DEAE-декстрана на трансфекцию по отношению к широкому варьированию отношений зарядов ДНК:дендример (фиг. 34).
В данном примере ДНК комплексуется с G8(NH3)дендримерами при соотношениях зарядов, изменяющихся от 1:1 до 1:3805. Результаты трансфекции с и без присутствия DEAE-декстрана приводятся на фиг. 34 как достигнутая степень люминесценции в относительных единицах на мкг протеина. Для соотношений зарядов 1:1 и 1:100 минимальная трансфекция достигается либо с, либо без DEAE-декстрана. Однако при соотношениях зарядов 1:5 и 1:10 трансфекция снова синергически увеличивается при использовании DEAE-декстрана. Таким образом, в присутствии DEAE-декстрана трансфекция увеличивается только для комплексов ДНК-дендример при соответствующих соотношениях зарядов.
ПРИМЕР 60.
Влияние изменения концентрации DEAE-декстрана на эффективность трансфекции (фиг. 35).
В данном примере комплексы ДНК: G11(ЭДА) дендример, образованные при зарядных соотношениях 1:1-1:100, используются для трансфекции RAT2-клеток в присутствии различных концентраций DEAE-декстрана (от 0 до 2 мкМ). Результаты трансфекции, измеренные как люминесценция в относительных световых единицах на мкг клеточного протеина, приводится на фиг. 35. Частичная трансфекция наблюдается при всех условиях, а при концентрациях DEAE-декстрана от 0,125 до 2 мкМ трансфекция стремится к увеличению. Наиболее заметным увеличение является при концентрации DEAE-декстрана от 0,25 до 1 мкМ и при соотношении зарядов ДНК:дендример = 1:5 или 1:10. Этим указывается на то, что как соотношение зарядов, так концентрация DEAE-декстрана должны оптимизироваться для получения синергического улучшения трансфекции.
ПРИМЕР 61.
Трансфекция ДНК с использование дендримеров по сравнению с липофектином (LIPOFECTIN).
В данном примере ДНК (5 мкг) образуется комплекс с G8(NH3) дендримерами при соотношении зарядов 1:5 и используется для трансфекции пяти различных линий клеток. Трансфекция пяти типов клетки, указанных на фиг. 36, сравнивается с трансфекцией посредством липофектина (LIPOFECTIN). К тому же, Трансфекция комплекса ДНК:дендример увеличивается DEAE-декстраном по сравнению с трансфекцией с использованием только одного комплекса. На фиг. 36 трансфекцирующие агенты идентифицируются следующими номерами: 1 - липофектин при двух различных концентрациях (20 мкг и 2 мкг); 2 - дендример и DEAE-декстран; 3 - дендример в отдельности; 4 - DEAE-декстран в отдельности в качестве контрольного образца; и 5 - плазмидный контрольный образец.
Фиг. 36 иллюстрируется, что трансфекция с использованием комплекса ДНК: дендример в присутствии DEAE-декстрана является более высокой, чем достигнутая липофектином (LIPOFECTIN) при либо 2, либо 20 мкг на испытательное гнездо, во всех клетках, за исключением HMEC-1-клеток человека. Трансфекция комплексов ДНК:дендример в присутствии DEAE-декстрана является также лучшей, чем полученная с использованием только одного комплекса ДНК:дендример. В некоторых клетках, например, крыса:C1one9, мышь NIH3T3 и мышь:10-1, трансфекция с использованием в отдельности комплексов ДНК:дендример является выше, чем трансфекция, достигнутая с использованием липофектина при либо 2, либо 20 мкг. Этим показывается, что комплексы ДНК:дендример могут использоваться для трансфекции широкого ряда клеток; однако, предполагается, что эффективность трансфекции является различной для различных типов клеток.
ПРИМЕР 62.
Трансфекция дополнительных линий клеток, которые являются трудными для трансфекции доступными в настоящее время агентами трансфекции (фиг. 37).
Трансфекция дополнительных линий клеток, которые оказываются особенно трудными для трансфекции другими методами, осуществляется комплекс ДНК: дендример. ДНК образуется комплекс с G8(NH3) дендримером при соотношении зарядов ДНК: дендример=1,5, и степень, до которой комплексами ДНК:дендример трансфекцируются линии клеток HRK52E и YB2, сравниваются с трансфекцией тех же клеток коммерчески доступным агентом трансфекции липофектином (LIPOFECTIN) при 20 мкг или 2 мкг. На фиг. 37 агенты являются пронумерованными, как на фиг. 36.
Результаты трансфекции приводятся в виде люминесценции в относительных световых единицах на мкг протеина на фиг. 37. Наилучшие результаты в любой клетке достигаются при использовании комплекса ДНК-дендример в сочетании с DEAE-декстраном. В то время, как наблюдается эффективная трансфекция липофектина в линии клеток NRK52E, она не наблюдается в линии клеток YB2, где характеристики комплекса ДНК: дендример в DEAE-декстране являются довольно высокими. Снова отмечается, что общая эффективность трансфекции в различных типах клеток является различной.
ПРИМЕР 63.
Сравнение трансфекции ДНК с использованием дендримеров с трансфекцией двумя различными липидными агентами липофектин (LIPOFECTIN) и липофектамин (LIPOFECTAMIN) (фиг. 38).
В данном примере линии RAT2-клеток трансфекцируются комплексами RSV-1ис-ДНК с G8(NH3) дендримером или с G11(ЭДА)-дендримером. Исследуются соотношения зарядов ДНК:дендример 1:1, 1:5, 1:10. В некоторых случаях для увеличения трансфекции используется DEAE-декстран. Результаты трансфекции сравниваются с трансфекцией с использованием 2, 10 и 20 мкл липофектина или 2, 12,5 и 25 мкл липофектамина.
Представленными на фиг. 38 результатами демонстрируется исключительная степень, до которой трансфекцируется ДНК в случае ее комплексообразования с дендримером при соотношении зарядов ДНК:дендример 1:5 или 1:10 в присутствии DEAE-декстрана. С помощью липофектамина достигается трансфекция, но является эффективной в очень ограниченных пределах концентраций. В этой линии клеток липофектином проявляется минимальная активность.
ПРИМЕР 64.
Влияние проницаемости клеточных мембран по отношению к ДМСО на эффективность трансфекции по сравнению с DEAE-декстраном (фиг. 39).
Для проверки предпосылки, что DEAE-декстран является действующим только в качестве агента возмущения или проникающим агентом, трансфекция RAT2-клеток ДНК, образовавшей комплекс с G9(NH3) дендримером, сравнивается для случаев присутствия и отсутствия обработки клеток ДМСО. По результатам, представленным на фиг. 39, отмечается 3-х-кратное увеличение трансфекции с использованием DEAE-декстрана по сравнению с трансфекцией без декстрана. Действительно, не отмечается воздействия ДМСО на трансфекцию при отсутствии DEAE-декстрана. Однако, увеличение трансфекции от DEAE-декстрана объясняется не только возмущением или проницаемостью клеток.
Интересно, что сочетание ДМСО и DEAE-декстрана проявляется в дополнительном синергизме трансфекции ДНК, образовавшей комплекс с дендримером, в частности, при соотношениях зарядов ДНК:дендример 1:5 и 1:10. Этим предполагается действие этих двух агентов по различным механизмам.
ПРИМЕР 65.
Применение конъюгированных дендримеров для трансфекции клеток (фиг. 40 и 41).
Конъюгация целеуказателя (трисахарид галактозы) к дендримерам не является препятствием образования стабильного комплекса ДНК:дендример (фиг. 41) и может использоваться для увеличения эффективности трансфекции (фиг. 40). В данном примере G11(ЭДА) дендример конъюгируется с трисахаридом галактозы. ДНК затем образуется комплекс с меченым дендримером, и комплекс используется для трансфекции RAT2, HepG2, N9H3T3 и AL-клеток. Неконъюгированные дендримеры также комплексуются с ДНК и используются в качестве контрольных. Результатами, представленными на фиг. 40, иллюстрируется увеличение трансфекции HepG2 и AL-клеток за счет присоединения целеуказателя, что выражает рецептор для трисахарида галактозы.
Комплексы ДНК:дендример также подвергаются электрофорезу. На фиг. 41 ДНК (1 мкг) образуется комплекс с G11(ЭДА)дендримером с и без целеуказателя, как приводится в таблице XXIII.
При очень низких концентрациях дендримеры, т.е. высоком соотношении зарядов ДНК:дендример, стабильные комплексы не образуются (как ожидалось) либо с нецелевым, т.е. неконъюгированным дендримером, либо с дендримером, конъюгированным с трисахаридом галактозы (смотри полосы 3, 4, 6 и 7). Однако стабильные комплексы образуются либо с неконъюгированными, либо с конъюгированными дендримерами при соответствующих соотношениях зарядов (смотри полосы 2 и 5 на фиг. 41). Этим указывается на возможность использования конъюгированных дендримеров в целевой трансфекции.
ПРИМЕР 66.
Влияние сыворотки на целевую трансфекцию (фиг. 42).
В данном примере иллюстрируется необходимость целеуказателя in vivo? где трансфекция достигается при использовании комплексов ДНК:G8(NH3)дендример в различных концентрациях сыворотки. Результатами, показанными на фиг. 42, демонстрируется, что в результате увеличения концентраций сыворотки ингибируется трансфекция RAT2-клеток комплексами ДНК:дендример даже в присутствии DEAE-декстрана. Таким образом, другой метод, такой как целеуказатель, должен использоваться для осуществления сцепления комплексов ДНК:дендример к клеткам in vivo.
ПРИМЕР 67.
Влияние потенциальных целеуказателей и других модификаций поверхности дендримера на эффективность трансфекции (фиг. 43).
В данном примере G5 и G6(NH3) дендримеры конъюгируются с 20 биотинами на дендример, 100 пируватами на дендример или 64 пируватами на дендример, или альтернативно, модифицируется их поверхность реакцией 25% их поверхностных функциональных аминогрупп с акриловой кислотой. Дендримеры затем используются для образования комплекса с RSV-1ис-плазмидной ДНК и трансфекции RAT2- клеток. Степень трансфекции указывается в относительных световых единицах на мкг протеина. Все достигнутые трансфекции осуществляются в присутствии DEAE-декстрана. Соотношение зарядов на замещенных дендримерах определяются так, как если бы не было замещения отрицательной функциональности. Результатами, показанными на фиг. 43, подтверждается отсутствие отрицательного влияния поверхностной модификации на трансфекцию по сравнению с трансфекцией с использованием немодифицированного G6(NH3)дендримера.
ПРИМЕР 68.
Устойчивость активности люциферазы (LIPOFERASE) после трансфекции посредством дендримера (фиг. 44).
В данном примере определяется время активности люциферазы (LIPOFERASE) в RAT2-клетках, трансфекцированных с использованием комплексов ДНК:дендример с и без DEAE-декстрана. Активность измеряется через 21 час, 45 часов, 69 часов и 141 час. Результаты приводятся на фиг. 44.
Как с DEAE-декстраном, так и без него степень трансфекции является значительно большей, в частности, через 21 и 45 часов, для ДНК, образовавшей комплекс с дендримером, чем для ДНК, трансфекцированной одной ДНК (плазмидный контрольный образец). Зарядное соотношение каждого комплекса равняется 1: 10. Результаты являются особенно поразительными для ДНК:дендримерной трансфекции в присутствии DEAE-декстрана через 21 и 45 часов. Этим предполагается, что гены выражаются в течение длительных периодов времени при трансфекции дендримерами.
ПРИМЕР 69.
Цитотоксичность (фиг. 45 и 46).
В данном примере проводятся испытания по
определению токсичности комплексов ДНК:
дендример с и без
DEAE-декстрана на ряде различных типов клеток: RAT2-клетки (фиг. 45), C1one9-клетки, NIH3T3-клетки, 10-1-клетки и COS7-клетки (фиг. 46). На
фиг. 46 разными цифрами на столбцовой
диаграмме
обозначаются:
1 - контрольная среда;
2 - контрольная среда с ДНК;
3 - дендример;
4 - дендример с ДНК;
5
- DEAE-декстрановый контрольный образец;
6
- DEAE-декстрановый контрольный образец с ДНК;
7 - дендример с DEAE-декстраном;
8 - дендример с ДНК с DEAE-декстраном.
Обычная жизнеспособность клеток в культуре является 90 - 95%. Имеется незначительное или нулевое воздействие комплексов ДНК:дендример на жизнеспособность клеток, за исключением линии клеток C1one9, где степень истощения приблизительно вдвойне больше с комплексами ДНК:дендример. При добавлении DEAE-декстрана цитотоксичность отчасти увеличивается, но недостаточно для того, чтобы воздержаться от исключительной полезности этой комбинации.
ПРИМЕР 70.
Поглощение и клеточная локализация ДНК с введенной радиоактивной меткой, трансфекцированной дендримером (фиг. 47).
В данном примере ДНК (2,9 тысяч оснований) с введением радиоактивной меткой переносится в RAT2- и U937-клетки с использованием G8(NH3)дендримера. Указанный выше перенос является записанным на фиг. 47A-F вместе с результатами локализации, полученными фракционированием клеток в мембрану, ядро и цитоплазматически ассоциированные фракции. Количество ДНК с введенной радиоактивной меткой во фракциях ядра и мембраны определяются, таким образом, отдельно.
На фиг. 47A-C трансфекцируются U937-клетки с использованием только ДНК (фиг. 47A), ДНК + дендример (фиг. 47B), и ДНК + дендример + азид натрия (фиг. 47C). Такая же серия трансфекций осуществляется для RAT2-клеток (фиг. 47D, 47E, 47F соответственно).
Результатами иллюстрируется не только значительное клеточное поглощение при использовании ДНК и дендримера, но также значительное поглощение ядром (фиг. 47B и 47E). Энергозависимость модулированной трансфекций ДНК демонстрируется при добавлении азида натрия (фиг. 47C и 47F), при котором степень поглощения ДНК снижается приблизительно до той, которая наблюдается, когда ДНК инкубируется с клетками в отдельности (фиг. 47A и 47D).
ПРИМЕР 71.
Микрофотографии трансфекцированных клеток (фиг. 48A, 48B, 49, 50A и 50B).
В данном примере получаются микрофотографии фибробластовых клеток D5 меланомы мыши и RAT2-крысы, трансфекцированных RSV-β-gal- плазмидной ДНК с использованием G11(ЭДА) плотных звездчатых дендримеров и G8(NH3) плотных звездчатых дендримеров соответственно. Успешно трансфекцированные клетки демонстрируются в виде темных (голубых) клеток на фиг. 48-50.
На фиг. 48А трансфекция D5-клеток осуществляется с использованием комплексов ДНК-дендример, содержащих 1 мкг генетического материала на гнездо. На фиг. 48B демонстрируется, что большая часть клеток трансфекцируется, когда количество ДНК в комплексе увеличивается до 5 мкг на гнездо. На фиг. 49 демонстрируются с увеличением некоторые трансфекционные клетки, где используется 3 мкг генетического материала на гнездо.
Фиг. 50A является микрофотографией фибробластовых RAT2- клеток крысы, трансфекцированных 3 мкг генетического материала на гнездо. Фиг. 50B является контрольным, показывающим нетрансфекцированные клетки. Этими исследованиями подтверждается, что когда используются комплексы ДНК:дендример громадное большинство клеток в культуре (50-95%) трансфекцируется.
ПРИМЕР 72.
Сравнение
различных способов получения устойчиво
трансфекцированных линий клеток D5, RAT2, MSU 1,2 (фиг. 52, 53, 54, 55 и 59)
В данном примере
трансфекции линий клеток D5, RAT2, MSU 1,2 осуществляется
при использовании 5 или 10 мкг на
гнездо культуры плазмиды, содержащей гены, устойчивые к воздействию G418 антибиотика (неомицина), и
β- галактозидазы, или к воздействию гигромицина B. На фиг.
52 сравниваются следующие способы
трансфекции с использованием линии клеток D5 и указанных количеств RSV- β-gal- плазмидной
ДНК на гнездо:
1. 10 мкг в присутствии 0,125 М фосфата
кальция;
2. 10 мкг в
присутствии 0,5 мкМ DEAE-декстрана;
3. 5 мкг в комплексе с 0,5 мкМ G8(NH3)
дендримера при соотношении зарядов ДНК:дендример 1:13; и
4. 10
мкг в комплексе с 0,5 мкМ
G8(NH3) дендримера при соотношении зарядов ДНК:дендример 1:7.
На фиг. 53
сравниваются следующие способы трансфекции с использованием линии клеток
RAT2 и указанных количеств
плазмидной ДНК на гнездо:
1. 10 мкг в присутствии 0,125 М фосфата кальция;
2. 10
мкг в присутствии 0,5 мкМ DEAE-декстрана;
3. 5 мкг в комплексе с
0,2 мкМ G8(NH3)
дендримера при соотношении зарядов ДНК:дендример 1:6;
4. 10 мкг в комплексе с 0,2 мкМ
G9(NH3) дендримера при соотношении зарядов ДНК:дендример 1:3;
5. 5 мкг в комплексе с
0,5 мкМ G8(NH3) дендримера при соотношении зарядов ДНК:дендример 1:13; и
6. 10 мкг в комплексе с 0,5 мкМ G8(NH3) дендримера при соотношении
зарядов ДНК:дендример 1:7.
DEAE-декстран, 0,5 мкМ, добавляется в трансфекционную среду после того, как образуется комплекс генетического материала с дендримером.
Клетки помещаются в среду, содержащую либо G418- антибиотик, либо гигромицин B. Имеется 24-часовой цикл дублирования клеток (т.е. воспроизведение каждые 24 часа). Через 4 недели проводится испытание культур на ряд клонов, выражающих G418-резистивность и β- галактозидаза- и/или гигромицин-резистивность.
На фиг. 54 сравниваются следующие способы трансфекции с использованием
линии клеток MSU 1,2, и
указанных количеств EBV-A-гигромицин-плазмидной ДНК на гнездо:
1. 5 мкг в
присутствии 0,5 мкМ DEAE-декстрана;
2. 5 мкг в присутствии 0,125 мкМ фосфата
кальция;
3. 5 мкг в
комплексе с G11(ЭДА)дендримером при соотношении зарядов ДНК: дендример 1:2;
4. 5 мкг в комплексе с G11(ЭДА)дендримером при соотношении зарядов ДНК: дендример 1:5;
5. 5 мкг в
комплексе с G11(ЭДА)дендримером при соотношении зарядов ДНК: дендример 1:10;
6. 5
мкг в комплексе с G11(ЭДА) дендримером при соотношении зарядов ДНК: дендример 1:20;
7. 5 мкг в
комплексе с 10 мкг липофектамина (LIPOFECTAMIN).
Этим указывается, что трансфекция с использованием комплекса ДНК:дендример является более эффективной, чем с использованием липофектамина в получении стабильного трансфекцированных линий клеток.
На фиг.
59 иллюстрируются трансфекции, представленные на фиг. 52. Сравниваются следующие способы
трансфекции с
использованием линии клеток D5 и указанными количествами RSV-β-gal- плазмидной ДНК на
гнездо:
1. 10 мкг в присутствии 0,125 М фосфата кальция;
2. 10 мкг в
присутствии 0,5 мкМ
DEAE-декстрана;
3. 5 мкг в комплексе с 0,5 мкМ G8(NH3) дендримера при
соотношении зарядов ДНК:дендример 1:13;
4. 10 мкг в комплексе с 0,5 мкМ
G8(NH3) дендримера
при соотношении зарядов ДНК:дендример 1:7;
5. 5 мкг в комплексе с 0,2 мкМ
G8(NH3) дендримера при соотношении зарядов ДНК:дендример 1:6.
Отмечается увеличение числа клонов, полученных дендримерной трансфекцией.
На фиг. 55 иллюстрируется трансфекция линии клеток D5 с использованием ICAM-выражающией плазмиды и G11(ЭДА)дендримера при соотношении зарядов ДНК: дендример 1: 10. Клоны, выражающиеICAM-ген, сначала отбираются по резистивности к неомицину. Клоны с резистивностью к неомицину далее анализируются методом FACS (клеточное сортирование с возбуждением флуоресценции) с использованием анти-ICAM-антитела, конъюгированного с флуоресцеином.
Сравниваются следующие линии клеток и
клоны:
1. Линии клеток D5,
отрицательная (неконтрастная) для анти-ICAM-антитела.
2. Линия клеток IC-21, положительно контрастированная анти-ICAM-антителом.
3. Клон N 23 после трансфекции 15 мкг ДНК с G11(ЭДА)дендримером при соотношении зарядов ДНК:дендример 1:10.
4. Клон N 27, полученный, как описано ранее.
5. Клон N 31, полученный, как описано ранее.
6. Клон N 9, полученный, как описано ранее.
Профили положительно контрастированных клеток (в крапинку накладываются на профиль линии клеток D5 ICAM-отрицательного контроля (фиг. 55A), использованных для трансфекции. Этим подтверждается способность ДНК-дендримерной трансфекции производить перманентные линии клеток, чем выражаются высокие уровни ICAM от трансфекцированных генов.
Как наблюдается на фиг. 52, 53, 54, 55 и 59, ряд клонов, продолжающих выражать как G418-резистивный и β - галактозидаза-устойчивый ген, невосприимчивость к гигромицину, так и ген для ICAM, через четыре недели оказывается заметным, когда достигается трансфекция в соответствии с настоящим изобретением, т.е. при комплексообразовании генетического материала с дендритными полимерами, по сравнению с предпринимающейся попыткой трансфекции только в присутствии фосфата кальция или DEAE-декстрана или липофектамина. Этим доказывается более высокая эффективность трансфекции клеток комплексом ДНК:дендример по сравнению с другими способами в получении стабильно трансфекцированных линий клеток.
ПРИМЕР 73.
Сравнение трансфекции COS1- и RAT2-клеток с использованием различных дендримеров и комбинаций дендримеров при различных соотношениях зарядов и при трех различных условиях (фиг. 61A и 61B).
В данном примере образуется комплекс 1 мкг RSV-1ис на испытательное гнездо с указанными дендримерами или контрольными при указанных соотношениях зарядов, приведенных в таблице XXVI.
Приведенные комбинации используются для трансфекции как COS 1 (фиг. 61A), так и RAT2 (фиг. 61B) клеток в трех различных условиях. DMEM является основной используемой средой. В примерах (фиг. 61A и 61B) используются следующие способы трансфекции: только комплексы генетический материал:дендример (столбцы в крапинку), те же комплексы в присутствии 0,5 мкМ DEAE-декстрана (диагонально заштрихованные столбцы), те же комплексы в присутствии 25 мкг/мл хлорохина (затушеванные столбцы).
Результатами эксперимента демонстрируется, что эффективность хлорохина является функцией трансфекцируемой клетки (фиг. 61B); и что по крайней мере в некоторых клетках в результате использования хлорохина получается поразительно высокая эффективность трансфекции (фиг. 61A).
ПРИМЕР 74.
Получение агрегатов дендримеров в регулируемым pH и применение этих агрегатов для исследования
трансфекции
Агрегаты дендримеров получаются из растворов
дендримеров с концевыми аминогруппами
и дендримеров с натрийкарбоксилатными группами. Соотношение различных дендримеров, используемых
в данном примере, приводится в таблице XXIV.
Номер генерации "п, 5" (например, относится к дендримерам половинной генерации (в данном случае, ПАМАМ-дендримерам половинной генерации). В ряду половинной генерации эти дендримеры являются дендримерами с карбоксилатными концевыми группами, тогда как в ряду полной генерации они являются дендримерами с концевыми аминогруппами.
Типичный состав дендримерных агрегатов рассматривается ниже. Исходные растворы получаются из G8,5(NH3) дендримера (2,34 мас.% и G8(NH3)дендримера (2,28 мас.%) в TRIS-буфере (pH 7,4). Для получения дендримерных агрегатов с соотношением зарядов 50:1 8,8 мг раствора G8,5(NH3)дендримера смешивается с 15,4 мг раствора G8(NH3)дендримера. Полученный раствор затем разбавляется до общей массы раствора 2,0689 г TRIS-буфером. Общая концентрация раствора равняется 0,74 мас. %. На фиг. 56 демонстрируется активность люциферазы в RAT-2-клетках после трансфекции дендримерными агрегатами. В случае использования агрегатов, образованных между G6,5(NH3)- и G8(NH3)дендримерами, а также полученных из G8, 5(NH3)- и G8(NH3)дендримерами, реализуется значительно увеличенная эффективность трансфекции по сравнению с самими дендримерами родительской полной генерации, если в рецептуре агрегатов используется соответствующее соотношение дендримеров с концевыми аминогруппами и дендримеров с концевыми карбоксилатными группами.
ПРИМЕР 75.
Получение лизин-модифицированных дендримеров и изучение трансфекции с использованием векторов модифицированных дендримеров (фиг. 57).
Раствор G7(NH3) (0,50 г, 11 мкмолей) в безводном ДМФ интенсивно перемешивается в процессе быстрого добавления p-нитрофенилового (сложного) эфира N, N'-ди-t-бутоксикарбонил-L-лизина. Примерно через 5 минут pH смеси корректируется до примерно 8,5 триэтиламином. Смесь перемешиванием в течение 24 часов, затем медленно добавляется к воде с интенсивным перемешиванием. Затем к водной смеси добавляются триэтиламин (0,6 мл) и насыщенный NaCl (35 мл), после чего смесь перемешивается в течение 2 дней. Надосадочная жидкость декантируется, а извлеченный сырой продукт сушится под вакуумом при 40oC в течение 12 часов. Высушенный сырой продукт интенсивно перемешивается в диэтиловом эфире и затем фильтруется с промывкой продукта дополнительным количеством диэтилового эфира. Данные анализа методом ЯМР сухого твердого продукта (0,96 г, 78% выход) согласуются с присоединением групп N, N'-ди-t-бутоксикарбонил-L-лизина к поверхности дендримера.
Защитные t-бутоксикарбонильные группы удаляются с лизиновых остатков растворением продукта (0,35 г, 3,3 мкмоля) в безводном метиленхлориде и последующим медленным добавлением трифторуксусной кислоты (3 мл) к смеси. Выделяющиеся газы уносятся из колбы потоком азота. Через 3 часа смесь концентрируется в потоке азота (40oC), а затем образец сушится под вакуумом. Сырой продукт очищается диализом (мембрана с молекулярной массы отсечки 10000) в течение 24 часов по отношению к 1 л воды. После удаления твердых макрочастиц фильтрацией и концентрирования под вакуумом собирается бесцветное твердое вещество (0,26 г, 69% выход). Данными1-H- и13C-ЯМР-спектроскопии, размерной вытеснительной хроматографии, капиллярного электрофореза и электрофореза в полиакриламидном геле подтверждается правильная структура.
На фиг. 57 в относительных световых единицах на мкг протеина сравнивается трансфекция в RAT-2-клетках с использованием лизин-модифицированного G7(NH3)дендримера и с использованием немодифицированных (G7(NH3 )-G1O(NH3))дендримеров (у всех соотношение зарядов ДНК:дендример = 1: 10 и в присутствии DEAE-денкстрана. Наблюдается удивительно высокая эффективность трансфекции лизин-модифицированным дендримером по сравнению с немодифицированным дендримером той же генерации, и действительно эффективность трансфекции является эквивалентной эффективности трансфекции немодифицированного G10(NH3)дендримера.
ПРИМЕР 76.
Эффективность трансфекции в линиях клеток COS1 и RAT2 с использованием полидисперсных смесей дендримеров (фиг. 58).
В данном примере ДНК образуется комплекс с G11(ЭДА)дендримером, смесью G11-, G3-, G2- и G1(ЭДА)дендримеров и полидисперсной смесью дендримеров, как указывается в таблице XXV.
Полученные результаты демонстрируются на фиг. 58. В COSI-клетках эффективность трансфекции полидисперсной смесью является намного более высокой, чем эффективность трансфекции с использованием G11(ЭДА), смеси G11-, G1-, G2- и G3(ЭДА) или ЛИПОФЕКТАМИНА. Это различие является особенно значительным при соотношениях зарядов ДНК:дендримеров 1:10 и 1:20. Однако при сравнении результатов в линиях клеток COSI и RAT2 наблюдается различие в эффективности трансфекции в двух клетках с использованием препаратов дендримеров одного типа. Например, в случае полидисперсной смеси (дендример Q из примера 42) эффективность трансфекции RAT2 клеток оказывается меньше меньше эффективности трансфекции COS-I-клеток. Это свойство может быть использовано в генном переносе.
ПРИМЕР 77.
(фиг. 60, снимки 1 и 2).
Для определения возможности использования комплексов ДНК:дендример для трансфекции клеток in vivo клетки D5-меламона вводятся подкожно сингенетическим мышам. Развиваются опухоли приблизительно 0,5 см в диаметре и непосредственно инъецируются с RSV-β-gal- ДНК либо в отдельности, либо с образованием комплекса с G11(ЭДА)дендримером и дендримером в отдельности в качестве контрольного образца. Через 24 часа животные умерщвляются, опухоли фиксируются в формалине, рассекаются на части и окрашиваются X-gal для определения экспрессии β - галактозидаза-фермента. На фиг. 60, снимок 1 у значительного числа клеток наблюдается доказательство трансфекции (X-gal-контрастирование) в опухоли, инъецированной комплексом ДНК:дендример, по сравнению с основным (фоновым) контрастированием (опухоль, инъецированная дендримером, снимок 2). Ни в какой опухоли не отмечается признаков токсичности или повреждения ткани. В случае инъекции ДНК в отдельности наличие экспрессии окраски опухоли не подтверждается, чем доказывается увеличение трансфекции in vivo при использовании комплексов ДНК:дендример.
ПРИМЕР 78.
Сравнение активности ЛЮЦИФЕРАЗЫ в RAT2-клетках после трансфекции несимметрично разветвленными дендримерами на основе лизина и G8(NH3)- и G11(ЭДА)-плотными звездчатыми дендримерами (фиг. 62).
В данном примере сравнивается трансфекционная способность несимметрично разветвленных дендримеров на основе лизина и плотных звездчатых дендримеров. Дендримеры на основе лизина получаются, в основном, в соответствии с методиками Патентов США 4289872, 4360646 и 4410688. Трансфекция осуществляется в присутствии DEAE-декстрана и без него. Во всех случаях соотношение зарядов ДНК:дендример является равным 1:5. Используется количество комплекса ДНК:дендример, достаточное для получения 1 мкг ДНК на испытательное гнездо.
Используются
следующие по порядку 1-16 дендримеры:
1. G1(TREN-ядро) на основе лизина
несимметрично разветвленный дендример;
2. G2(TREN-ядро)
на основе лизина несимметрично разветвленный дендример;
3. G3(TREN-ядро) на основе лизина несимметрично разветвленный
дендример;
4. G4(TREN-ядро) на основе лизина несимметрично
разветвленный дендример;
5. G5(TREN-ядро) на основе
лизина несимметрично разветвленный дендример;
6. G1(BHA-ядро)
на основе лизина несимметрично разветвленный дендример,
трифторуксусная соль;
7. G2(BHA-ядро) на основе лизина
несимметрично разветвленный дендример, трифторуксусная соль.
8. G3(BHA-ядро) на основе лизина несимметрично
разветвленный дендример, трифторуксусная соль;
9. G4(BHA-ядро) на
основе лизина несимметрично разветвленный дендример, трифторуксусная соль;
10. G5(BHA-ядро) на основе лизина
несимметрично разветвленный дендример, трифторуксусная соль;
11.
G6(BHA-ядро) на основе лизина несимметрично разветвленный дендример, трифторуксусная
соль;
12. G7(BHA-ядро) на
основе лизина несимметрично разветвленный дендример, трифторуксусная соль;
13. G8(BHA-ядро) на основе лизина несимметрично разветвленный дендример,
трифторуксусная соль;
14.
G8(BHA-ядро) на основе лизина несимметрично разветвленный дендример, свободный амин,
без трифторуксусной соли;
15. Плотный звездчатый G8(NH3)
дендример; и
16. Плотный
звездчатый G11(ЭДА)дендример.
На фиг. 62 наблюдается значительная трансфекция в начале с использованием несимметричных разветвленных дендримеров на основе лизина при G4 и G5 по крайней мере с TREN-ядром. Трифторуксусные соли несимметрично разветвленных дендримеров оказываются относительно ингибирующими трансфекцию в случае дендримеров с BHA-ядром. Трансфекция с использованием G8(BHA-ядро)дендримера при отсутствии трифторуксусной соли является хорошей.
Отмечается превосходная трансфекция при использовании плотных звездчатых дендримеров и несимметрично разветвленных дендримеров на основе лизина при соотношении зарядов ДНК:дендример 1:5 в присутствии DEAE-декстрана.
Другие варианты изобретения оказываются очевидными для специалиста из содержания данного описания или рассмотренной здесь практики осуществления изобретения. Подразумевается, что описание и примеры являются только иллюстративными, и что истинный объем и дух изобретения приводятся в последующей формуле изобретения.
Реферат
Изобретение относится к дендримерным полимерным конъюгатам, содержащим по крайней мере один плотный звездчатый полимер, ассоциированный по крайней мере с одной единицей по крайней мере одного биологического модификатора ответа. Конъюгат может иметь указатель цели (мишени), являясь при этом биологически активным агентом. Плотные звездчатые полимеры используются в качестве носителей с/х, фармацевтических и др. материалов. 14 с. и 118 з.п. ф-лы, 62 ил., 25 табл.

Формула
(P)x * (M)y,
в котором Р - по крайней мере один плотный звездчатый полимер;
М - одна единица по крайней мере одного биологического модификатора ответа;
X и Y независимо представляет собой целое число 1 и более;
* указывает, что биологический модификатор ответа ассоциирован с плотным звездчатым полимером.
(T)e * (P)x * (M)y,
в которой каждый P представляет плотный звездчатый полимер;
x представляет целое число 1 или более;
каждый M представляет по крайней мере одну единицу биологического модулятора ответа, причем указанный биологический модулятор ответа может быть одинаковым биологическим модулятором или различным биологическим модулятором;
y представляет целое число 1 или более;
каждый T представляет один или более указателей (направителей) цели;
e представляет целое число 1 или более;
* указывает, что биологический модулятор ответа является ассоциированным с плотным звездчатым полимером, при условии, что биологический модулятор ответа сохраняет свою эффективность.
[(T)e - (C')f]g * (P)x * (C'')h - (M)y]k,
в которой каждый C' представляет одинаковую или различную соединительную группу;
каждый C'' представляет одинаковую или различную соединительную группу;
g и k каждый в отдельности представляет целое число 1 или более;
е представляет целое число 1 или более;
f и h каждый в отдельности представляет целое число 0 или более;
- указывает ковалентную связь в случаях, когда присутствует соединительная группа;
каждый P представляет плотный звездчатый полимер;
x представляет целое число 1 или более;
T представляет указатель (направитель) цели;
каждый M представляет по крайней мере одну единицу биологического модулятора ответа;
y представляет целое число 1 или более; и
* указывает, что переносимый биологический модулятор ответа ассоциирован с полимером, при условии, что переносимый биологический модулятор сохраняет свою эффективность.





73. Композиция по п.72, в которой один или оба указанных первый и второй дендритных полимера имеют сферическую форму.



104. Способ по п.97, в котором указанный дендритный полимер представляет собой дисперсию частиц дендримера различного размера, в пределах от частиц, имеющих малый диаметр около 20


106. Способ по п. 97, в котором указанный дендритный полимер является плотным звездчатым полимером, имеющим аминокислоты на значительной части своей поверхности и, в основном, только на поверхности.


114. Способ получения концентрированного комплекса генетический материал : дендритный полимер с последующим разбавлением при использовании, заключающийся в смешении в воде генетического материала в количестве, достаточном для получения концентрации от примерно 1 до примерно 10 мкг на 20 мкл, с достаточным количеством дендритного полимера, имеющего положительную поверхностную функциональность, с получением соотношения зарядов генетический материал : дендритный полимер от примерно 4:1 до примерно 1:10000, причем смешение осуществляют при pH от примерно 5 до примерно 10 и температуре от примерно 20 до примерно 40oC.


119. Способ по п.114, в котором указанный дендритный полимер представляет собой дисперсию дендримерных частиц различного размера, в пределах от частиц, имеющих такой небольшой диаметр, как примерно 20



121. Способ по п.114, в котором указанный дендритный полимер является плотным звездчатым полимером, имеющим аминокислоты на значительной части своей поверхности и, в основном, только на поверхности.
07.03.94 - по пп.1 - 11, 6, 7, 53, 59, 85, 89, 90, 125, 13 - 37 и 40 - 42;
30.09.94 - по пп.12, 38, 44, 47, 48, 51, 55, 57, 58, 62, 63, 70, 78, 79, 81, 91 - 96, 102, 103 и 129 - 132.

Комментарии