Рекомбинантный белок шелка пауков, кодирующая его нуклеиновая кислота, вектор и клетка-хозяин, подходящие для его экспрессии, способ его агрегации, способ получения материала из него, содержащий его продукт и применение - RU2415938C2
Код документа: RU2415938C2
Чертежи


























































Описание
Настоящее изобретение направлено на рекомбинантные белки шелка пауков, нуклеиновые кислоты, кодирующие эти рекомбинантные белки шелка пауков, а также на хозяев, подходящих для экспрессии этих нуклеиновых кислот. Кроме того, настоящее изобретение направлено на способ агрегации белков шелка пауков и на применение данных белков в области биотехнологии и/или медицины и в других областях промышленности, в частности в изготовлении автозапчастей, в авиастроении, в обработке текстильных изделий и кожи, а также в изготовлении и обработке бумаги, косметических средств, пищи, электронных устройств, в доставке лекарств и тому подобном.
В данной заявке на патент будут использованы следующие сокращения:
NR, не имеющий повторяющихся последовательностей; Арr, ген устойчивости к ампициллину; IPTG, изопропил-β-D-тиогалактозид; GdmCl, гуанидиния хлорид; GdmSCN, гуанидиния тиоцианат; SDS, додецилсульфат натрия; PAGE, электрофорез в полиакриламидном геле; Tris, трис(гидроксиметил)аминометан; CD, циркулярный дихроизм; rер-белки, белки с повторяющимися последовательностями; Да, Дальтон; cps, число импульсов в секунду; MRW, средняя масса остатка; н.о., не определен.
Шелка пауков представляют собой белковые полимеры, которые проявляют удивительные физические свойства (1). Среди различных типов шелков пауков канатные шелка исследованы наиболее интенсивно. Канатные шелка используются пауками-кругопрядами для создания остова и радиусов их паутин и в качестве страховочных канатов, которые постоянно тянутся позади них. Для этих целей требуются высокая прочность на разрыв и эластичность. Комбинация таких свойств приводит к прочности, которая выше, чем прочность большинства других известных материалов (1; 2). Канатные шелка обычно состоят из двух главных белков, первичные структуры которых имеют общую структуру с повторяющимися последовательностями (3; 4).
Вариации одиночной повторяющейся единицы, которая может содержать вплоть до 60 аминокислот, повторяются несколько раз, представляя самую большую часть последовательности канатного шелка. Эти повторяющиеся единицы включают ограниченный набор отдельных аминокислотных мотивов. Один мотив, обнаруженный во всех повторяющихся единицах канатного шелка, представляет собой блок, обычно состоящий из 6-9 остатков аланина. В шелковых нитях несколько полиаланиновых мотивов образуют кристаллические стопки β-складчатых конформаций, приводящие к прочности на разрыв (5; 6).
Обогащенные глицином мотивы, такие как GGX или GPGXX, принимают форму гибких спиральных структур, которые соединяют кристаллические участки и придают нити эластичность (7).
Кроме того, все исследованные белки канатного шелка содержат на их карбоксильных концах участки, которые не показывают очевидной картины с повторяющимися последовательностями (участки, не имеющие повторяющихся последовательностей или NR-участки). До сих пор этим участкам в конечной нити не могли приписать функции.
Сборка шелка in vivo представляет собой примечательный процесс. Белки канатного шелка пауков хранятся в концентрациях вплоть до 50% (масс./об.) (8) в так называемой главной ампуловидной железе. Несмотря на то, что для белков в главной ампуловидной железе предложили «динамическую рыхлую спиральную структуру» (8), более новые данные говорят о случайной спиральной конформации для белков так называемой А-зоны, которая представляет собой самую большую часть данной железы (9; 10). Высококонцентрированный белковый раствор образует шелковую пасту (прядильный раствор), которая проявляет свойства жидкого кристалла (11-13).
Сборка нити инициируется на протяжении прохождения данной пасты через прядильный канал, что сопровождается экстракцией воды, натрия и хлорида (14; 15). В то же время концентрации более лиотропных ионов калия и фосфата увеличиваются, и рН падает от 6,9 до 6,3 (14-16). Наконец, сборка запускается механическим напряжением, которое вызвано выталкиванием нити из брюшка паука (17).
Для нескольких целей нити природного шелка не могут использоваться непосредственно, а должны быть растворены и повторно собраны в другие структуры, такие как пленки, пены, сферы, нанофибриллы, гидрогели и тому подобное.
Большинство исследований, касающихся пленок, сделанных из белков шелка, проводили с фиброином шелка, главным белковым компонентом шелка из тутового шелкопряда Bombyx mori. Пленки фиброина шелка можно отлить из водных растворов или из растворов, содержащих гексафторизопропанол (HFIP), муравьиную кислоту и трифторуксусную кислоту. В растворе фиброины шелка имеют тенденцию принимать спиральную или случайную спиральную конформацию в зависимости от используемого растворителя. При отливке в пленки белки либо сохраняют конформацию растворимого состояния, либо принимают конформацию, более обогащенную β-складками. В большинстве случаев обработка пленок метанолом приводит к дальнейшему увеличению содержания β-складок и кристалличности. Помимо фиброина шелка для отливки пленок также использовали другие белки шелка. Vollrath и соавторы исследовали пленки, сделанные из белков, экстрагированных из главной ампуловидной железы паука Nephila senegalensis. В литом состоянии при получении из водного раствора пленки главным образом содержали белки в случайной спиральной конформации. Их структура менялать на β-складчатую при добавлении хлорида калия. Кроме того, пленки делали из белка синтетического шелка, полученного из белка MaSp1 канатного шелка паука Nephila clavipes, используя в качестве растворителя HFIP. В растворе данный белок принимал α-спиральную структуру, меняющуюся на более обогащенную β-складками конформацию при отливке в пленку.
К сожалению, получение функциональных пленочных материалов из природного фиброина шелка ограничено его аминокислотной последовательностью. Избирательные химические модификации фиброина шелка возможны только в очень ограниченной степени из-за малого количества (<1,5%) химически активных боковых цепей аминокислот, которые содержат тиольные, амино- или карбоксильные группы. Кроме того, генетическая модификация в природном хозяине для изменения свойств белков шелка и, таким образом, свойств пленки является трудоемкой.
В то время как были выявлены некоторые структурные аспекты белков шелка пауков, все еще мало известно о вкладе отдельных белков шелка и их первичных структурных элементов в процесс сборки. Сравнительные исследования двух главных белков канатного шелка паука-кругопряда Araneus diadematus, ADF-3 и ADF-4, выявили, что хотя их аминокислотные последовательности и являются довольно сходными (4), они показывают примечательно разную растворимость и особенности сборки: в то время как ADF-3 является растворимым даже при высоких концентрациях (18), ADF-4 является фактически нерастворимым и подвергается самосборке в нитевидные структуры в конкретных условиях (неопубликованные результаты).
Научный и коммерческий интерес инициировал исследование производства шелка пауков в промышленном масштабе. Получение природного шелка паука не является практичным из-за каннибализма пауков, а искусственное получение столкнулось с проблемами достижения как достаточного выхода белка, так и качества сборки нитей. Бактериальная экспрессия давала низкие уровни белка, что, вероятно, было вызвано различным использованием кодонов у бактерий и у пауков. Синтетические гены с использованием кодонов, адаптированных к экспрессии в хозяине, приводили к более высоким выходам, но белки, синтезированные на их основе, показывали отличные характеристики по сравнению с природными шелками пауков. Экспрессия частичных кДНК канатного шелка в линиях клеток млекопитающих действительно давала белки шелка (например, ADF-3), которые могли быть искусственно сплетены в «шелковые» нити, хотя они до сих пор имеют плохое качество.
WO 03060099 относится к способам и устройствам для прядения бионитевидных белков в волокна. Это изобретение является особенно полезным для прядения рекомбинантных белков шелка из водных растворов, увеличения прочности волокон и практичности их изготовления таким образом, чтобы сделать осуществимым промышленное производство и применение таких волокон. В указанном документе раскрыта экспрессия белков шелка паука в клетках млекопитающих, например в трансгенных клетках молочной железы козы.
Экспрессия аутентичных генов шелка пауков в бактериальных хозяевах, как было отмечено выше, неэффективна (24), поскольку некоторые участки гена содержат кодоны, которые неэффективно транслируются у бактерий. Кроме того, манипуляция с генами и амплификация посредством ПЦР являются затруднительными из-за повторяющейся природы шелков. Для того чтобы исследовать свойства белков шелка пауков, использовали стратегии клонирования с применением модулей синтетической ДНК с использованием кодонов, адаптированных для соответствующего хозяина экспрессии. Получали синтетические гены, которые кодировали белки, имеющие сходство с повторяющимися участками шелков пауков (25-28). Однако конструкция ни одного из этих белков не включала NR-участки карбоксильного конца, которые обнаружены во всех канатных шелках.
Следовательно, задачей, лежащей в основе настоящего изобретения, является предложение рекомбинантных белков шелка пауков, имеющих улучшенные характеристики, как например, в частности, улучшенную способность экспрессироваться с высоким выходом и повышенную прочность и гибкость, то есть лучшее качество. Кроме того, в задачу настоящего изобретения входит предложение рекомбинантных белков шелка пауков, которые можно с удобством экспрессировать в уже известных системах экспрессии. В задачу данного изобретения также входит предложение улучшенного способа агрегации белков шелка пауков и способа образования нитей, сделанных из этих белков. Кроме того, в задачу настоящего изобретения входит предложение улучшенных продуктов из бумаги, текстиля или кожи. В задачу настоящего изобретения также входит предложение новых белков и других материалов на основе белков шелка пауков, таких как сферы, нанофибриллы, гидрогели, нити, пены, пленки для применения в биотехнологии, медицине, для применений в фармацевтике и пищевой промышленности, в косметике, в электронных устройствах и в других коммерческих целях.
Эта задача решена посредством объекта независимых пунктов формулы изобретения. Предпочтительные воплощения изложены в зависимых пунктах формулы изобретения.
Настоящий подход по инженерии белка, который дает рекомбинантные белки шелка пауков, включающие или состоящие из синтетических повторяющихся последовательностей белков шелка пауков и/или аутентичных неповторяющихся (NR) участков, выявляет, что белки, имеющие близкое сходство с аутентичными белками шелка, можно получить с высокими выходами. Конкретно, предложенные здесь бактериальная система экспрессии, а также простой и дешевый способ очистки, которые можно легко увеличить в масштабе, дают основу для рентабельного производства в промышленном масштабе шелкоподобных белков пауков.
Белки шелка пауков главным образом исследовали в отношении их вклада в механические свойства шелковой нити. Однако мало известно о молекулярных механизмах сборки шелка. В качестве первой стадии на пути к описанию этого процесса авторы данного изобретения идентифицировали первичные структурные элементы главных белков канатного шелка паука-кругопряда (Araneus diadematus), ADF-3 и ADF-4, которые определяют растворимость белка. Кроме того, исследовали влияние на агрегацию белка условий, участвующих в опосредовании сборки природной нити. Получили гены, кодирующие шелкоподобные белки паука, используя недавно разработанную стратегию клонирования, которая основана на комбинации модулей синтетической ДНК и последовательностей аутентичных генов, амплифицированных ПЦР. Сравнение вторичной структуры, растворимости и свойств агрегации синтезированных белков выявило, что одиночные первичные структурные элементы имеют различные влияния на характеристики белков. Повторяющиеся участки, представляющие собой самую большую часть белков канатного шелка, определяли растворимость синтетических белков, которая значительно отличалась между конструктами, происходящими из ADF-3 и ADF-4. Такие факторы, как подкисление и увеличение концентрации фосфата, которые стимулируют сборку шелка in vivo, обычно снижали растворимость белков шелка in vitro. Удивительно то, что этот эффект был отчетливым в белках, полученных при помощи генной инженерии, включающих карбоксиконцевые неповторяющиеся участки ADF-3 или ADF-4, указывая на то, что эти участки играют важную роль в инициации сборки белков шелка пауков.
Согласно первому аспекту настоящее изобретение направлено на рекомбинантный белок шелка паука, включающий:
а) одну или более чем одну синтетическую повторяющуюся последовательность белка шелка паука и/или
б) одну или более чем одну аутентичную неповторяющуюся последовательность белка шелка паука.
Термин «синтетическая повторяющаяся последовательность», как он здесь используется, следует понимать как последовательность рекомбинантного белка, которую нельзя обнаружить в природе, которая, однако, происходит из повторяющихся единиц, которые встречаются в белках шелка пауков в природных условиях. Как указано выше, эти повторяющиеся последовательности включают одну или более чем одну одиночную повторяющуюся единицу, которая содержит вплоть до 60 аминокислот. Встречающиеся в природе повторяющиеся единицы охватывают ограниченный набор различных аминокислотных мотивов. Эти повторяющиеся единицы, среди прочего, придают нити, которая позднее может образоваться из белка шелка паука, прочность на разрыв и эластичность.
Различные типы повторяющихся единиц, которые могут формировать основу синтетических повторяющихся последовательностей по изобретению, будут подробно описаны ниже.
Второй компонент рекомбинантного белка шелка паука по изобретению, который может присутствовать помимо синтетических повторяющихся последовательностей или по одиночке, включает одну или более чем одну аутентичную неповторяющуюся последовательность белка. Эти наповторяющиеся последовательности играют важную функциональную роль в сборке нити.
Следует заметить, что в настоящем изобретении также рассматриваются рекомбинантные белки шелка пауков, которые содержат только синтетические повторяющиеся последовательности. Несмотря на то, что рекомбинантные белки по изобретению, показывающие оба компонента, то есть синтетические повторяющиеся последовательности, а также аутентичные неповторяющиеся последовательности, имеют более широкий диапазон применения и могут быть получены в больших количествах (см. главу, относящуюся к примерам, ниже), рекомбинантные белки шелка пауков, имеющие только включенные синтетические повторяющиеся последовательности, можно использовать для некоторых конкретных применений.
Этими применениями являются, среди прочих, запчасти автомобилей и самолетов, защитные покрытия, а также системы ушивания ран и повязки на раны. Или, другими словами, применения, в которых не требуются нитчатые структуры белков шелка пауков.
Термин «аутентичный», как он здесь используется, означает, что лежащие в основе последовательности нуклеиновых кислот выделяют из их природной среды без проведения существенных исправлений в самой последовательности. Единственной модификацией, присутствие которой приемлемо, является модификация, где аутентичная неповторяющаяся последовательность нуклеиновой кислоты модифицирована для того, чтобы адаптировать указанную последовательность для экспрессии у хозяина без изменения кодируемой аминокислотной последовательности. Предпочтительными последовательностями являются NR3 (SEQ ID NO:10; происходящая из ADF-3) и NR4 (SEQ ID NO:11; происходящая из ADF-4). В обеих последовательностях кодон AGA (Arg), который редко транслируется в E.coli, для более эффективной трансляции мутировали в CGT (Arg) с использованием ПЦР мутагенеза.
Предпочтительные аутентичные неповторяющиеся последовательности жгутиковидных белков представляют собой аминокислотную последовательность и последовательность нуклеиновой кислоты FlagN-NR (SEQ ID NOs:31 и 31) и FlagC-NR (SEQ ID NOs:33 и 34).
Согласно предпочтительному воплощению, рекомбинантные белки шелка пауков по изобретению обычно происходят из белков канатного шелка пауков из главной ампуловидной железы пауков и/или из белков, происходящих из жгутиковидной железы.
Согласно другому предпочтительному воплощению, аутентичные неповторяющиеся последовательности происходят из аминоконцевого неповторяющегося участка (жгутиковидные белки) и/или из карбоксиконцевого неповторяющегося участка (жгутиковидные и канатные белки) встречающегося в природе белка шелка пауков. Предпочтительные примеры этих белков будут указаны ниже.
Обычно предпочтительным является выбор канатных и/или жгутиковидных последовательностей из канатных или жгутиковидных белков пауков-кругопрядов (Araneidae и Araneoids).
Более предпочтительно канатные белки и/или жгутиковидные белки происходят из одного или более чем одного из следующих пауков: Arachnura higginsi, Araneus circulissparsus, Araneus diadematus, Argiope picta, Banded Garden Spider (Argiope trifasciata), Batik Golden Web Spider (Nephila antipodiana), Beccari's Tent Spider (Cyrtophora beccarii), Bird-dropping Spider (Celaenia excavata), Black-and-White Spiny Spider (Gasteracantha kuhlii), Black-and-yellow Garden Spider (Argiope aurantia), Bolas Spider (Ordgarius furcatus), Bolas Spiders-Magnificent Spider (Ordgarius magnificus), Brown Sailor Spider (Neoscona nautica), Brown-Legged Spider (Neoscona rufofemorata), Capped Black-Headed Spider (Zygiella calyptrata), Common Garden Spider (Parawixia dehaani), Common Orb Weaver (Neoscona oxancensis), Crab-like Spiny Orb Weaver (Gasteracantha cancriformis (elipsoides)), Curved Spiny Spider (Gasteracantha arcuata), Cyrtophora moluccensis, Cyrtophora parnasia, Dolophones conifera, Dolophones turrigera, Doria's Spiny Spider (Gasteracantha doriae), Double-Spotted Spiny Spider (Gasteracantha mammosa), Double-Tailed Tent Spider (Cyrtophora exanthematica), Aculeperia ceropegia, Eriophora pustulosa, Flat Anepsion (Anepsion depressium), Four-spined Jewel Spider (Gasteracantha quadrispinosa), Garden Orb Web Spider (Eriophora transmarina), Giant Lichen Orbweaver (Araneus bicentenarius), Golden Web Spider (Nephila maculata), Hasselt's Spiny Spider (Gasteracantha hasseltii), Tegenaria atrica, Heurodes turrita, Island Cyclosa Spider (Cyclosa insulana), Jewel or Spiny Spider (Astracantha minax), Kidney Garden Spider (Araneus mitificus), Laglaise's Garden Spider (Eriovixia laglaisei), Long-Bellied Cyclosa Spider (Cyclosa bifida), Malabar Spider (Nephilengys malabarensis), Multi-Coloured St Andrew's Cross Spider (Argiope versicolor), Ornamental Tree-Trunk Spider (Herennia ornatissima), Oval St. Andrew's Cross Spider (Argiope aemula), Red Tent Spider (Cyrtophora unicolor), Russian Tent Spider (Cyrtophora hirta), Saint Andrew's Cross Spider (Argiope keyserlingi), Scarlet Acusilas (Acusilas coccineus), Silver Argiope (Argiope argentata), Spinybacked Orbweaver (Gasteracantha cancriformis), Spotted Orbweaver (Neoscona domiciliorum), St. Andrews Cross (Argiope aetheria), St. Andrew's Cross Spider (Argiope Keyserlingi), Tree-Stump Spider (Poltys illepidus), Triangular Spider (Arkys clavatus), Triangular Spider (Arkys lancearius), Two-spined Spider (Poecilopachys australasia), виды рода Nephila, например Nephila clavipes, Nephila senegalensis, Nephila madagascariensis и многие другие (относительно других видов пауков, также смотрите ниже). Наиболее предпочтительно канатные белки происходят из Araneus diadematus, и жгутиковидные белки происходят из Nephila clavipes.
В контексте этого изобретения должно быть очевидным, что рекомбинантный белок шелка паука может включать не только белковые последовательности из одного вида, но также может содержать последовательности, происходящие из различных видов пауков. В качестве примера, одна или более чем одна синтетическая повторяющаяся последовательность белка шелка паука может происходить из одного вида, одна или более чем одна аутентичная неповторяющаяся последовательность белка шелка паука - из другого. В качестве дополнительного примера, также возможно сконструировать рекомбинантный белок шелка паука, который содержит более чем один тип повторяющейся последовательности, где разные типы происходят из разных видов.
Согласно одному предпочтительному воплощению, канатный белок представляет собой ADF-3, ADF-4, MaSp I, MaSp II дикого типа, и жгутиковидный белок представляет собой FLAG. Термин ADF-3/-4 используют в контексте белков MaSp, продуцируемых Araneus diadematus (фиброин-3/-4 Araneus diadematus). Оба белка, ADF-3 и -4, принадлежат к классу белков MaSp II (спидроин II главной ампуловидной железы).
Волокно шелка имеет кристаллические β-складчатые участки, разбросанные вместе с эластичными аморфными отрезками, сходными с жидкокристаллическими полимерами. Эти два отрезка представлены двумя разными классами белков, MaSp I (спидроин I главной ампуловидной железы) и MaSp II (спидроин II главной ампуловидной железы), кодируемых разными генами.
В другом воплощении предложенной последовательностью нуклеиновой кислоты является ADF-3 (SEQ ID NO:1) и/или ADF-4 (SEQ ID NO:2) или ее вариант.
Следует заметить, что в этом изобретении рассматриваются два разных типа кодирующих последовательностей и белков ADF-3 и ADF-4: во-первых, уже опубликованные последовательности ADF-3 и ADF-4 (здесь: последовательность дикого типа) и, во-вторых, их вариант, кодируемый SEQ ID NO:1 (ADF-3) и 2 (ADF-4). Последовательности дикого типа уже были опубликованы и являются доступными под номерами доступа U47855 и U47856 (SEQ ID NO:8 и 9).
Другими белками шелка пауков, которые можно использовать в этом изобретении (например по одиночке или в комбинации с другими белками), и их номерами доступа в базе данных являются:
спидроин 2 [Araneus bicentenarius]gi|2911272
белок-1 канатного шелка главной ампуловидной железы [Araneus ventricosus]gi|27228957
белок-2 канатного шелка главной ампуловидной железы [Araneus ventricosus]gi|27228959
спидроин 1 ампуловидной железы [Nephila madagascariensis]gi|13562006
спидроин 1 главной ампуловидной железы [Nephila senegalensis]gi|13562010
спидроин 1 главной ампуловидной железы [Latrodectus geometricus]gi|13561998
спидроин 1 главной ампуловидной железы [Argiope trifasciata]gi|13561984
спидроин 1 главной ампуловидной железы [Argiope aurantia]gi|13561976
спидроин 2 белка канатного шелка [Nephila clavata]gi|16974791
спидроин 2 главной ампуловидной железы [Nephila senegalensis]gi|13562012
спидроин 2 главной ампуловидной железы [Nephila madagascariensis]gi|13562008
спидроин 2 главной ампуловидной железы [Latrodectus geometricus]gi|13562002.
Согласно другому предпочтительному воплощению, жгутиковидным белком является SEQ ID NO:6 (Flag-N) и/или SEQ ID NO:7 (Flag-C) или его вариант, который составляет новые последовательности, полученные авторами данного изобретения.
Однако здесь также можно использовать уже известные и опубликованные последовательности жгутиковидных белков, в частности следующие:
частичный cds белка жгутиковидного шелка [Nephila clavipes]gi|2833646
частичный cds белка жгутиковидного шелка [Nephila clavipes]gi|2833648.
В одном предпочтительном воплощении рекомбинантный белок шелка паука включает одну или более чем одну синтетическую повторяющуюся последовательность, содержащую одну или более чем одну консенсусную последовательность, содержащую полиаланин. Эти полиаланиновые последовательности могут содержать от 6 до 9 остатков аланина. См., например, SEQ ID NO:1, содержащую несколько полиаланиновых мотивов из 6 остатков аланина.
Предпочтительно консенсусная последовательность, содержащая полиаланин, происходит из ADF-3 и имеет аминокислотную последовательность SEQ ID NO:3 (модуль А) или ее вариант. Модуль А содержит полиаланин, имеющий 6 остатков аланина. Другая предпочтительная консенсусная последовательность, содержащая полиаланин, происходящая из ADF-4, представляет собой модуль С (SEQ ID NO:5), содержащий 8 остатков аланина.
Согласно другому предпочтительному воплощению, синтетическая повторяющаяся последовательность в рекомбинантном белке шелка паука по изобретению происходит из ADF-3 и включает один или более чем один повтор аминокислотной последовательности SEQ ID NO:4 (модуль Q) или ее вариант.
В общих чертах, синтетическая повторяющаяся последовательность также может содержать общие мотивы: GGX или GPGXX, то есть обогащенные глицином участки. Как было упомянуто выше, эти участки будут придавать гибкость белку и, таким образом, нити, образующейся из рекомбинантного белка шелка паука, содержащего указанные мотивы.
Следует отметить, что конкретные модули синтетической повторяющейся последовательности по изобретению также можно объединять друг с другом, то есть модули (повторяющиеся единицы), объединяющие А и Q, Q и С и так далее, также охвачены настоящим изобретением. Несмотря на то, что число модулей, которые будут введены в белок шелка паука, является неограниченным, для каждого рекомбинантного белка предпочтительно использовать число модулей синтетической повторяющейся последовательности, предпочтительно варьирующее от 5 до 50 модулей, более предпочтительно 10-40 и наиболее предпочтительно от 15 до 35 модулей.
Синтетическая повторяющаяся последовательность предпочтительно содержит один или более чем один (AQ) и/или (QAQ) в качестве повторяющихся единиц. Даже более предпочтительно, синтетическая повторяющаяся последовательность представляет собой (AQ)12, (AQ)24, (QAQ)8 или (QAQ)16.
Всякий раз, когда синтетическая повторяющаяся последовательность происходит из ADF-4, она предпочтительно может включать один или более чем один повтор аминокислотной последовательности SEQ ID NO:5 (модуль С) или ее вариант, как упомянуто выше, где вся синтетическая повторяющаяся последовательность представляет собой C16 или С32.
Предпочтительными воплощениями для целых рекомбинантных белков шелка пауков по изобретению являются (QAQ)8NR3, (QAQ)16NR3, (AQ)12NR3, (AQ)24NR3, C16NR4 и С32NR4, то есть белки, которые содержат или состоят из указанных последовательностей.
Следует отметить, что указанная выше конфигурация синтетической повторяющейся последовательности (используя систему A, Q и С) также приложима ко всем другим повторяющимся единицам, раскрытым выше, например, все последовательности, содержащие полиаланин, можно принять за А и/или С, и все последовательности, обогащенные глицином, можно использовать как Q.
Новыми модулями для синтетических повторяющихся последовательностей, происходящих из жгутиковидных последовательностей, являются модули К (SEQ ID NO:35 и 36), sp (SEQ ID NO:37 и 38), X (SEQ ID NO:39 и 40) и Y (SEQ ID NO:41 и 42).
Синтетическая повторяющаяся последовательность также предпочтительно содержит или состоит из Y8, Y16, X8, X16, K8, K16.
Кроме того, также возможно объединить последовательности, происходящие из ADF-3, ADF-4 и Flag, в одной рекомбинантной последовательности.
Как было описано выше, раскрытые здесь аминокислотные последовательности не ограничиваются точными последовательностями, предложенными в SEQ ID NOs. Указанные здесь аминокислотные последовательности также включают варианты. Таким образом, аминокислотные последовательности белков по настоящему изобретению также охватывают все последовательности, отличающиеся от раскрытых здесь последовательностей аминокислотными вставками, делециями и заменами.
Предпочтительно аминокислотные «замены» представляют собой результат замены одной аминокислоты другой аминокислотой, имеющей сходные структурные и/или химические свойства, то есть консервативные аминокислотные замены. Аминокислотные замены можно сделать на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы участвующих остатков. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; и отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту.
«Вставки» или «делеции» типично имеют интервал от 1 до 5 аминокислот, предпочтительно около 1, 2 или 3 аминокислот. Аминокислотные добавки обычно не превышают 100, предпочтительно не более 80, более предпочтительно не более 50, наиболее предпочтительно не более 20 аминокислот, которые добавляют и/или вставляют в белки по настоящему изобретению. Следует отметить, что в данном изобретении рассматриваются только те добавки, которые не оказывают негативного воздействия на желаемые характеристики раскрытых здесь белков.
Разрешенные вариации можно экспериментально установить путем систематического создания вставок, делеции или замен аминокислот в белке, используя технологию рекомбинантных ДНК и анализируя образующиеся рекомбинантные варианты на активность. Для квалифицированного специалиста это не требует проведения экспериментов более сложных, чем обычные.
Согласно второму аспекту, настоящее изобретение направлено на последовательность нуклеиновой кислоты, кодирующую рекомбинантный белок шелка паука, как раскрыто выше. Предпочтительные последовательности, кодирующие предпочтительные белки, представляют собой SEQ ID NO:12 (ADF-3), 13 (ADF-4), 14 (NR3), 15 (NR4), 16 (FLAG-NT), 17 (FLAG-CT), 32 (FlagN-NR), 34 (FlagC-NR).
Данное изобретение также охватывает варианты этих нуклеиновых кислот. Каждый из этих вариантов определен, как имеющий одну или более чем одну замену, вставку и/или делецию, по сравнению с последовательностями SEQ ID NO:12-17, 32 и 34, при условии, что указанные варианты при умеренно строгих условиях гибридизируются с нуклеиновой кислотой, которая содержит последовательность SEQ ID NO:12-17, 32 и 34, или при условии, что указанные варианты содержат замены в нуклеиновой кислоте из-за вырожденности генетического кода, которые кодируют ту же самую или функционально эквивалентную аминокислоту, что и последовательность нуклеиновой кислоты SEQ ID NO:12-17, 32 и 34.
Термин «последовательность нуклеиновой кислоты» относится к гетерополимеру нуклеотидов или к последовательности этих нуклеотидов. Термины «нуклеиновая кислота» и «полинуклеотид» используются здесь взаимозаменимо, чтобы назвать гетерополимер из нуклеотидов.
Термин «строгость гибридизации», как он здесь используется, относится к условиям, при которых полинуклеотидные дуплексы являются стабильными. Как известно специалистам в данной области, стабильность дуплекса является функцией концентрации ионов натрия и температуры (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual 2nd Ed. (Cold Spring Harbor Laboratory, (1989)). Уровни строгости, используемые для гибридизации, легко могут быть изменены специалистами в данной области.
Фраза «умеренное строгие условия», как она здесь используется, относится к условиям, которые позволяют ДНК связываться с комплементарной нуклеиновой кислотой, которая имеет примерно 60% идентичности, предпочтительно примерно 75% идентичности, более предпочтительно, примерно 85% идентичности с данной ДНК; причем идентичность с указанной ДНК, большая чем примерно 90%, является особенно предпочтительной. Предпочтительно умеренно строгими условиями являются условия, эквивалентные гибридизации в 50%-ном формамиде, 5 × растворе Денхарта (Denhart), 5×SSPE, 0,2%-ном SDS при 42°С, с последующей промывкой в 0,2×SSPE, 0,2%-ном SDS при 65°С.
Согласно третьему аспекту, предложен вектор, который включает вышеупомянутые нуклеиновые кислоты. Предпочтительно предложен вектор экспрессии, который содержит указанные нуклеиновые кислоты. Этот вектор экспрессии предпочтительно содержит одну или более чем одну регуляторную последовательность. Термин «вектор экспрессии» обычно относится к плазмиде, или фагу, или вирусу, или вектору, для экспрессии полипептида/белка с последовательности ДНК (РНК). Вектор экспрессии может содержать транскрипционную единицу, включающую совокупность: (1) генетического элемента или элементов, имеющих регуляторную роль в экспрессии генов, например, промоторов или энхансеров, (2) структурной или кодирующей последовательности, которая транскрибируется в мРНК и транслируется в белок и (3) подходящих последовательностей инициации и терминации транскрипции. Структурные единицы, намеченные для применения в дрожжевых или эукариотических системах экспрессии, предпочтительно включают лидерную последовательность, дающую возможность внеклеточной секреции транслированного белка клеткой-хозяином. В качестве альтернативы, когда рекомбинантный белок экспрессируется без лидерной или транспортной последовательности, он может включать аминоконцевой остаток метионина. Этот остаток затем может или не может быть отщеплен от экспрессируемого рекомбинантного белка с получением конечного продукта.
Согласно предпочтительному воплощению, данный вектор представляет собой плазмидный или вирусный вектор, который предпочтительно представляет собой бакуловирусную систему или векторную систему на основе вируса коровьей оспы. В данном изобретении также можно использовать дополнительные вирусные векторные системы. От случая к случаю может понадобиться модификация вектора. Примерами дополнительных вирусных векторов являются аденовирусы и все РНК-вирусы с минус цепью (negative-strand RNA-viruses), например вирус бешенства, кори, RSV и так далее.
Согласно предпочтительному воплощению, вектор представляет собой вектор для клонирования pAZL, как определено на Фиг.6 или в SEQ ID NO:55, или его вариант, как определено выше. Этот вектор показывает следующие свойства и преимущества:
1) активная амплификация (более активная, чем у других векторов для клонирования);
2) позволяет осуществлять контролируемое и бесшовное конструирование синтетических генов (другие векторы, которые дают эту возможность, не известны).
Четвертый аспект данного изобретения включает хозяина, которого трансформировали вектором, как определено выше.
Хозяин может быть прокариотической клеткой. В этом случае предпочтительными являются E.coli или Bacillus subtilis.
Кроме того, хозяин может быть эукариотической клеткой, предпочтительно клеткой млекопитающего, растительной клеткой, дрожжевой клеткой или клеткой насекомого.
Клетка млекопитающего предпочтительно представляет собой клетку СНО (яичник китайского хомячка), COS, HeLa, 293T, НЕН или ВНК.
Также предпочтительным является использование в качестве клетки-хозяина дрожжевой клетки, которая предпочтительно представляет собой Saccharomyces cerevisiae, Schizosaccharomyces pombe, Pichia pastoris, Candida albicans или Hansenula polymorpha.
В качестве клеток насекомых предпочтительно можно использовать клетки насекомых Lepidoptera, более предпочтительно клетки от Spodoptera frugiperda и от Trichoplusia ni. Наиболее предпочтительно клеткой насекомых является Sf9, Sf21 или клетка "high five".
Одно преимущество системы экспрессии на основе клетки насекомого, например, по отношению к бактериальным системам состоит в том, что продуцируемые белки являются гликозилированными, являясь посредством этого мишенью для деградации микроорганизмами. Это свойство может быть важным, например, в области медицины, всякий раз когда белки шелка предназначены для применения in vivo, при котором биологическая деградация является желательной. Эта характеристика может, в частности, найти применение в шовных материалах и в системах ушивания и покрытия ран.
Всякий раз, когда хозяином является растительная клетка, растительная клетка предпочтительно происходит из табака, картофеля, кукурузы и томата.
Согласно пятому аспекту предложен способ агрегации белков шелка паука, включающий следующие стадии:
а) получение белкового раствора, содержащего неориентированные белки шелка паука, как здесь определено;
б) подвергание раствора, полученного в (а), воздействию триггера агрегации; и
в) выделение осажденных белков шелка паука.
Предпочтительно белки шелка паука, используемые на стадии (а), продуцируют путем трансформации подходящего хозяина, как определено выше, вектором или нуклеиновой кислотой, раскрытыми здесь, и экспрессии гена шелка паука в подходящих условиях.
Триггер агрегации предпочтительно выбран из подкисления, предпочтительно до рН около 1, фосфата калия и механического напряжения, предпочтительно вращения белкового раствора и приложения сдвигающего усилия. Оказалось, что стадия стимуляции триггером является существенной для выполнения способа по данному изобретению.
Авторами данного изобретения неожиданно было показано, что конкретно вышеупомянутые триггерные факторы усиливали агрегацию белков шелка пауков, которая является весьма желательным результатом, особенно с промышленной точки зрения. В связи с этим делается ссылка на главу «Результаты», приведенную ниже, в которой объяснено влияние этих триггерных факторов на рекомбинантные белки шелка пауков по изобретению: влияние каждого триггерного фактора может варьировать между различными рекомбинантными белками шелка пауков по данному изобретению, однако, в качестве общей идеи, можно увидеть, что эти триггерные факторы показывают неожиданно высокое влияние на все рекомбинантные белки in vitro, которые содержат компоненты по настоящему изобретению, то есть повторяющиеся и/или неповторяющиеся участки. Кроме того, из приведенных здесь результатов можно вывести, что не только одиночный триггерный фактор, но также и их комбинации могут приводить к лучшему способу агрегации белков шелка паука по изобретению.
Однако следует отметить, что этот способ не ограничивается белками шелка пауков по настоящему изобретению, но также может применяться ко всем другим доступным белкам шелка пауков, встречающимся в природе или синтетическим.
Данный способ дополнительно предпочтительно включает стадию прядения указанных белков, полученных на стадии (а) или выделенных на стадии (в), в филаменты, нанофибриллы и нити подходящим способом.
Для этой цели можно использовать способы прядения, которые известны в данной области как таковые. Например, раствор пасты белка шелка паука выдавливают через прядильный механизм с образованием биофиламента. Образующийся биофиламент можно вытягивать или растягивать. Всякий раз, когда в биофиламентах существуют как кристаллические, так и аморфные структуры молекул, вытягивание или растягивание будут прилагать напряжение сдвига, достаточное для ориентации молекул таким образом, чтобы сделать их более параллельными стенкам данного филамента и увеличить прочность на разрыв и прочность биофиламента.
Раствор пасты может содержать рекомбинантные белки шелка по изобретению и/или аутентичные белки шелка из одного или более чем одного вида пауков, или белки шелка из разных родов, продуцирующих шелк, например смесь белков шелка от пауков и В.mori. В наиболее предпочтительных воплощениях белки шелка представляют собой канатные и/или жгутиковидные шелка из N.clavipes или A.diadematus, конкретно белки MaSpI, MaSpII, ADF-3, ADF-4 и Flag. В альтернативных воплощениях раствор пасты содержит смесь белков шелка и одного или более чем одного синтетического полимера или природных или синтетических биофиламентных белков.
Предпочтительно раствор пасты содержит по меньшей мере 1%, 5%, 10%, 15% масс./об. белка шелка. Более предпочтительно, раствор пасты содержит 20%, 25%, 30%, 35%, 40%, 45% или 50% масс./об. белка шелка. В предпочтительных воплощениях раствор пасты содержит по существу чистый белок шелка паука. В предпочтительных воплощениях паста имеет рН примерно 6,9.
Под «раствором пасты» подразумевают любую жидкую смесь, которая содержит белок шелка и поддается выдавливанию для образования биофиламента или отливки пленки. Растворы пасты также могут содержать помимо белковых мономеров агрегаты более высоко порядка, включающие, например, димеры, тримеры и тетрамеры. Обычно растворы пасты представляют собой водные растворы с рН 4,0-12,0, имеющие менее 40% органических веществ или разобщающих агентов (масс./об.). Предпочтительно растворы пасты не содержат каких-либо органических растворителей или разобщающих агентов, однако могут включать добавки для увеличения сохранности, стабильности или обрабатываемости раствора.
Под «филаментом» подразумевают волокно неограниченной длины, варьирующей от наномасштаба и микроскопической длины до длин в милю (1609 м) или более. Шелк представляет собой природный филамент, тогда как нейлон и полиэстер представляют собой, в качестве примера, синтетические филаменты.
Дополнительную информацию относительно того, как прясть волокна белка шелка пауков, можно найти в WO 03060099 (Karatzas et al.), опубликованной 24 июля 2003, которая включена в данную заявку на патент посредством ссылки.
Кроме того, белки шелка паука по настоящему изобретению можно получить в виде пленок или тому подобного, то есть как продукт белка шелка паука, для которого не требуется стадия прядения.
Для более подробного описания способа получения пленок ссылаются на главу "Примеры".
Кроме того, способ по настоящему изобретению может предпочтительно включать на стадии (а) и/или (в) способ очистки, включающий подвергание экспрессируемых белков шелка пауков денатурации нагреванием при 60-90°С, предпочтительно при 70-80°C с последующим добавлением 600-1400 мМ сульфата аммония, предпочтительно 800-1200 мМ.
Как уже объяснялось выше, белки/нити такие, как определено здесь, можно использовать в области биотехнологии и/или медицины, предпочтительно для изготовления систем ушивания или покрытия ран, шовных материалов для применения в нейрохирургии или глазной хирургии.
Кроме того, белки/нити можно предпочтительно использовать для изготовления замещающих материалов, предпочтительно материалов искусственных хрящей или сухожилий.
Кроме того, нити/волокна по изобретению можно использовать в изготовлении медицинских приспособлений, таких как медицинские липкие пластыри, кожные трансплантаты, заменители связок и хирургическая сетка; и в широком диапазоне промышленных и коммерческих продуктов, таких как ткань для одежды, подкладка для пуленепробиваемого бронежилета, упаковочный материал, ремни для сумок и бумажников, канаты, тросы, адгезивное связующее вещество, неадгезивное связующее вещество, обвязочный материал, автомобильные покрытия и запчасти, материал для авиастроения, герметичный материал, гибкий перегородочный материал, спортивное оборудование; и, на самом деле, почти при любом применении волокна или ткани, желательными характеристиками для которых являются высокая прочность на разрыв и эластичность. Настоящим изобретением также рассматривается адаптируемость и применение стабильного волокнистого продукта в других формах, таких как сухое напыляемое покрытие, четковидные частицы или применение в смеси с другими композициями.
Ясно отмечается, что большинством предпочтительных применений белков шелка паука по настоящему изобретению является изготовление и обработка ткани для одежды (текстиля) и кожи, автомобильных покрытий и запчастей, материалов для авиастроения, а также изготовление и обработка бумаги.
Рекомбинантные белки шелка пауков по настоящему изобретению можно добавлять к целлюлозным, кератиновым и коллагеновым продуктам и, таким образом, настоящее изобретение также направлено на бумажный продукт или продукт по уходу за кожей и волосами, содержащий целлюлозу, и/или кератин, и/или коллаген и белки шелка пауков по настоящему изобретению. Бумажные продукты и продукты по уходу за кожей и волосами, в которые включены белки по настоящему изобретению, показывают улучшенные характеристики, в частности повышенную прочность на разрыв или прочность при отрыве.
Кроме того, рекомбинантные белки шелка паука по изобретению можно использовать в качестве покрытия для текстильных или кожаных изделий, придавая покрытому изделию посредством этого стабильность и долговечность. Белки шелка конкретно показывают применимость для покрытия кожаных продуктов, так как в этом случае можно избежать или по меньшей мере снизить дубление и его отрицательное влияние на окружающую среду.
Если не определено иначе, все технические и научные термины, использованные здесь, имеют те же самые значения, что и значения, обычно понятные рядовому специалисту в данной области, к которой относится это изобретение. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые здесь, являются включенными в данное описание изобретения во всей их полноте посредством ссылки. В случае конфликта настоящее описание изобретения и формула изобретения, включая определения, будут контролировать. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для того, чтобы быть ограничивающими.
Данное изобретение теперь дополнительно иллюстрируется примерами и сопровождающими рисунками, которые показывают следующее.
Фиг.1 Стратегия клонирования для конструирования синтетических генов шелка пауков. (А) Кассета клонирования, содержащая сайты рестрикции, требующиеся для мультимеризации модуля (BsgI и BseRI) и для вырезания собранных генов (Ncol, BamHI, HindIII). Во время конструирования гена спейсерный участок заменяли модулями и мультимерами модулей. (Б) Сайт-направленное соединение двух модулей выполняли путем лигирования двух подходящих фрагментов плазмиды. Воссоздали ген устойчивости к ампициллину вектора (Ap'). (В) Нуклеотиды, требующиеся для связывания двух модулей, были ограничены пределами первого кодона каждого модуля. (Г) Мультимеры модулей соединяли подобно одиночным модулям, что приводило к контролируемой сборке синтетических генов. (Д) Аминокислотные последовательности сконструированных модулей шелка получали из белков канатного шелка ADF-3 и ADF-4.
Фиг.2 Анализ белков шелка паука. (А) Т7-метки рекомбинантных белков шелка определяли после вестерн-блоттинга с антителом против Т7-метки. (Б) Белки подвергали SDS-PAGE с последующим окрашиванием серебром. Из-за слабого окрашивания (AQ)12 и (QAQ)8 контраст изображения увеличивали электронно. (В) Флуоресцентные спектры испускания очищенного C16NR4 показаны с длинами волн возбуждения 280 нм (прямая линия) или 295 нм (пунктирная линия), соответственно.
Фиг.3 Вторичная структура и температурные переходы белков шелка паука. (А) CD-спектры rep-белков (прямые линии), repNR-белков (пунктирные линии) и NR-белков (длинные штрихи) записывали при 20°С. (Б) Эллиптичности средней массы остатка (MRW) растворимых белков шелка паука измеряли при 220 нм во время нагревания синтетических белков шелка до 90°С (прямая линия) с последующим охлаждением до 20°С (пунктирная линия).
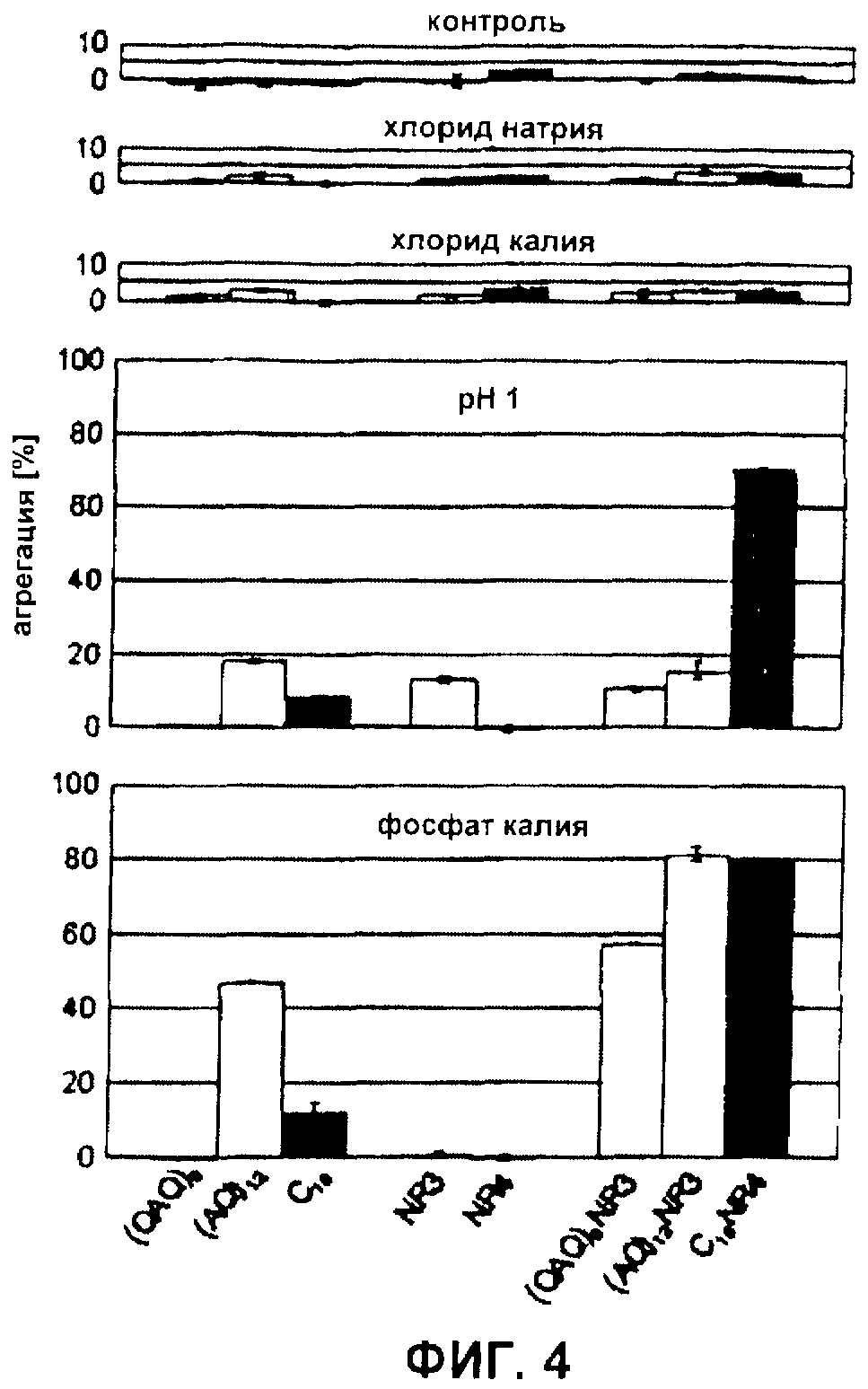
Фиг.4 Агрегация синтетических белков шелка паука. Агрегацию белков определяли после инкубации в течение 1 часа в буфере (контроль) в присутствии 300 мМ NaCl или 300 мМ KCl при рН 1 или в присутствии 300 мМ фосфата калия. Столбики для белков, происходящих из ADF-3: светло-серые; из ADF-4: темно-серые.
Фиг.5 Стратегия клонирования для конструирования синтетических генов жгутиковидного шелка пауков (см. Фиг.1). Одиночные модули соединяли до гомомультимеров (а), а также гетеромультимеров (б). (в) Показывает аминокислотные последовательности сконструированных модулей жгутиковидного шелка, происходящих из жгутиковидного белка шелка (Flag) из Nephila clavipes.
Фиг.6 показывает рестрикционную карту вектора pAZL.
Фиг.7 Формы сборки белков шелка пауков. (А) Сферы, образованные C16, визуализированные сканирующей электронной микроскопией (SEM). (Б) Нанофибриллы, образованные C16NR4, визуализированные атомно-силовой микроскопией (информация по высоте). (В, Г) Микрофибриллы, образованные (AQ)24NR3, исследованные SEM (В). Для разрезания фибриллы и последующей визуализации поперечного среза использовали сфокусированный пучок ионов Ga+ (Г). (Д) Пена, полученная из раствора (AQ)24NR3. (E) Пена, полученная из раствора C16NR4. (Ж) Поперечно связанный гель, образованный нанофибриллами C16NR4.
Фиг.8 CD-спектры синтетических белков шелка (AQ)24NR3 и C16, растворенных в 6 М гуанидиния тиоцианате с последующим диализом против 5 мМ фосфата калия рН 8,0 (прямая линия) или растворенных в HFIP (пунктирная линия).
Фиг.9 Пленка C16, отлитая из 2%-ного масс./об. раствора С16 в HFIP.
Фиг.10 CD-спектры белковых пленок, сделанных из (AQ)24NR3 и C16. Пленки отливали из белкового раствора в HFIP непосредственно на обычном кварцевом стекле и анализировали CD-спектроскопией (пунктирная линия). Данную пленку далее обрабатывали 1 М фосфатом калия и анализировали повторно. Из-за неточностей при определении толщины пленок не мог быть определен □ ΘMRW.
Фиг.11 Модификация пленок C16, отлитых из раствора HFIP и обработанных фосфатом калия. (А) Эффективное связывание флуоресцеина (желтый цвет) случалось. только когда карбоксильные группы С16 активировали (+), используя EDC. Напротив, только малое количество флуоресцеина связывалось с пленками без активации
EDC (-). (Б) Активность связанной β-галактозидазы отслеживали с использованием X-Gal в качестве субстрата. Появление синего осадка указывало на ферментативную активность только на пленках, которые активировали EDC (+), тогда как неактивированные пленки показывали только остаточную ферментативную активность (-).
Фиг.12 AFM-изображение нановолокон C16.
Фиг.13 Гидрогели, полученные из нановолокон C16.
Фиг.14 Поведение напряжение/деформация поперечно связанных и несвязанных поперечно гидрогелей при концентрации 10 мг/мл.
Фиг.15 Зависимость от частоты динамического модуля упругости (G') и модуля потерь (G") как для поперечно связанных, так и для несвязанных поперечно сетей волокон при концентрации 20 мг/мл.
Фиг.16 Концентрационная зависимость динамического модуля упругости при частоте 0,5 Гц как для поперечно связанных, так и для несвязанных поперечно гидрогелей. Обе сети имеют динамические модули упругости, которые являются пропорциональными квадрату концентрации [с]2.
Примеры
Экспериментальные методики
Материалы. Химические реактивы приобретали у Merck KGaA (Darmstadt, Germany), если не определено иначе. Манипуляции с ДНК и модификацию ДНК проводили, как описано ранее (19). Ферменты рестрикции приобретали у New England Biolabs (Beverly, MA, USA) и лигазу - у Promega Biosciences (San Luis Obispo, CA, USA). Очистку ДНК проводили, используя наборы от Qiagen (Hilden, Germany). Синтетические олигонуклеотиды приобретали у MWG Biotech AG (Ebersberg, Germany). Все стадии клонирования проводили в штамме DH10B Е.coli от Novagen (Madison, WI, USA).
Конструирование вектора для клонирования pAZL. Кассету клонирования с липкими концами, комплементарными концам, генерированным BgIII и HindIII, создавали путем отжига двух синтетических олигонуклеотидов СС1
(GATCGAGGAGGATCCATGGGACGAATTCACGGCTAATGAAAGCTTACTGCAC) (SEQ ID NO:18) и СС2 (AGCTGTGCAGTAAGCTTTCATTAGCCGTGAATTCGTCCCATGGATCCTCCTC) (SEQ ID NO:19). Отжиг проводили путем снижения температуры 50 пмоль/мкл (каждого) раствора олигонуклеотида от 95°С до 20°C с инкрементом 0,1°С/с. Ошибочно спаренные двойные цепи денатурировали при 70°C с последующим другим снижением температуры до 20°С. После повторения цикла 20°С-70°С-20°С десять раз проводили десять дополнительных циклов с температурой денатурации 65°С. Образующуюся кассету клонирования лигировали с вектором pFastbacl (Invitrogen, Carlsbad, California, USA), расщепленным BgIII и HindIII. При этой стадии клонирования разрушали обе последовательности для распознавания рестрикционными ферментами. Образующийся новый вектор для клонирования называли pAZL.
Клонирование модулей шелка и NR-участков в векторе pAZL. Три аминокислотных модуля, происходящих из белков канатного шелка ADF-3 и ADF-4 (Фиг.1Д), транслировали обратно в последовательность ДНК, принимая во внимание использование бактериальных кодонов. Соответствующие олигонуклеотиды комплементарных ДНК А1 (TCCGTACGGCCCAGGTGCTAGCGCCGCAGCGGCAGCGGCTGGTGGCTACGG TCCGGGCTCTGGCCAGCAGGG) (SEQ ID NO:20) и А2 (CTGCTGGCCAGAGCCCGGACCGTAGCCACCAGCCGCTGCCGCTGCGGCGCTA GCACCTGGGCCGTACGGACC) (SEQ ID NO:21), Q1 (TCCGGGCCAGCAGGGCCCGGGTCAACAGGGTCCTGGCCAGCAAGGTCCGGG CCAGCAGGG) (SEQ ID NO:22) и Q2 (CTGCTGGCCCGGACCTTGCTGGCCAGGACCCTGTTGACCCGGGCCCTGCTGG CCCGGACC) (SEQ ID NO:23), C1 (TTCTAGCGCGGCTGCAGCCGCGGCAGCTGCGTCCGGCCCGGGTGGCTACGG TCCGGAAAACCAGGGTCCATCTGGCCCGGGTGGCTACGGTCCTGGCGGTCCG GG) (SEQ ID NO:24) и С2 (CGGACCGCCAGGACCGTAGCCACCCGGGCCAGATGGACCCTGGTTTTCCGGA CCGTAGCCACCCGGGCCGGACGCAGCTGCCGCGGCTGCAGCCGCGCTAGAAC C) (SEQ ID NO:25) синтезировали и отжигали, как описано выше, и лигировали с вектором pAZL, расщепленным BsgI и BseRI. NR-участки генов шелка паука adf-3 (gi|1263286) и adf-4 (gi|1263288) (полученные от профессора Gosline, Vancouver, Canada) амплифицировали посредством ПЦР, используя следующие праймеры: NR3f (GAAAAACCATGGGTGCGGCTTCTGCAGCTGTATCTG) (SEQ ID NO:26), NR3r (GAAAAGAAGCTTTCATTAGCCAGCAAGGGCTTGAGCTACAGATTG) (SEQ ID NO:27), NR4f (GAAAAACCATGGGAGCATATGGCCCATCTCCTTC) (SEQ ID NO:28) и NR4r (GAAAAGAAGCTTTCATTAGCCTGAAAGAGCTTGGCTAATCATTTG) (SEQ ID NO:29).
Что касается последовательностей Flag, можно использовать следующие праймеры и кассеты:


Продукты ПЦР и вектор pAZL лигировали после расщепления NcoI и HindIII. Клонирование синтетических модулей, а также продуктов ПЦР приводило к замещению спейсера кассеты клонирования, предохраняя структуру ее элементов. Для более эффективной трансляции кодон AGA (Arg), который редко транслируется у E.coli, мутировали до CGT (Arg) в NR3 и NR4, используя ПЦР мутагенез (19).
Конструирование синтетических генов шелка пауков. Соединение двух фрагментов гена, например, одиночных модулей, мультимеров модулей или NR-участков представляло собой основную стадию стратегии клонирования. Для этой цели вектор pAZL, содержащий обозначенный 5'-концевой фрагмент гена, расщепляли BsaI и BsgI, тогда как вектор, содержащий 3'-концевой фрагмент гена, расщепляли, соответственно, BseRI и BsaI (Фиг.1Б). Лигирование подходящих фрагментов плазмиды давало соединение двух фрагментов гена и приводило к воссозданию гена устойчивости к ампициллину (Ap') вектора pAZL, который облегчал идентификацию правильных конструктов.
Для конструирования гена одиночные модули сначала соединяли с получением повторяющихся единиц (Фиг.1Г+Фиг.5). Их постепенно мультимеризовали и возможно связывали с NR-участками. Наконец, синтетические генные конструкты, а также NR-участки вырезали из вектора pAZL с помощью BamHI и HindIII и лигировали с бактериальным вектором для экспрессии рЕТ21а (Novagen), расщепленным подобным образом, получая кодирующую последовательность Т7-метки (MASMTGGQQMGR) (SEQ ID NO:30) (20). Правильность всех конструктов подтверждали секвенированием ДНК.
Экспрессия генов. Все гены шелка экспресировали в штамме BLR [DE3] Е.coli (Novagen). Клетки выращивали при 37°С в среде LB (Луриа-Бертани) до OD600=0,5. Перед индукцией 1 мМ IPTG (изопропил-β-D-тиогалактозид) клетки переводили на 30°С, в случае (AQ)12, (AQ)12NR3, (QAQ)8 и (QAQ)8NR3, и на 25°С, в случае C16, C16NR4, NR3 и NR4, соответственно. В качестве альтернативы, клетки выращивали в ферментаторе до OD600=40-50, используя комплексную среду (21) и методику подпитки порциями (22). Опять, перед индукцией 1 мМ IPTG клетки переводили на 25°С или 30°С, соответственно. Клетки, экспрессирующие (AQ)12, (AQ)12NR3, (QAQ)8, (QAQ)8NR3, C16 и C16NR4, собирали после 3-4 часов индукции, тогда как клетки, экспрессирующие NR3 и NR4, собирали через 16 часов.
Очистка белка. Клетки ресуспендировали 5 мл/г буфера, содержащего 20 мМ N-(2-гидроксиэтил)пиперазин-N'-(2-этансульфоновую кислоту) (HEPES) рН 7,5, 100 мМ NaCl, 0,2 мг/мл лизоцима (Sigma-Aldrich, St. Louis, МО, USA) и инкубировали в течение 30 мин при 4°С. Клетки лизировали обработкой ультразвуком, используя ультразвуковую установку HD/UW2200/KE76 (Bandelin, Berlin, Germany), и расщепляли геномную ДНК путем инкубации лизатов клеток с 0,1 мг/мл ДНКазой I (Roche, Mannheim, Germany) и 3 мМ MgCl2 при 4°С в течение 60 мин. Нерастворимые фрагменты клеток осаждали при 50000×g и 4°С в течение 30 мин. Растворимые белки лизатов E.coli, содержащие (AQ)12, (AQ)12NR3, (QAQ)8, (QAQ)8NR3, C16 и C16NR4, осаждали путем денатурации нагреванием при 80°С в течение 20 мин, тогда как лизаты, содержащие NR3 и NR4, нагревали до 70°С в течение того же самого промежутка времени. Осажденные белки удаляли седиментацией при 50000×g в течение 30 мин. Белки шелка, которые оставались растворимыми на протяжении денатурации нагреванием, осаждали 20%-ным сульфатом аммония (800 мМ) ((AQ)12, (AQ)12NR3, (QAQ)8, (QAQ)8NR3, C16 и C16NR4) или 30%-ным сульфатом аммония (1200 мМ) (NR3 и NR4) при комнатной температуре и собирали центрифугированием при 10000×g в течение 10 мин. Осадки (AQ)12, (AQ)12NR3, (QAQ)8, (QAQ)8NR3, NR3 и NR4 промывали раствором, содержащим ту же самую концентрацию сульфата аммония, что и использованная для осаждения, и растворяли в 6 М гуанидиния хлориде (GdmCl). Напротив, C16 и C16NR4 промывали 8 М мочевиной и растворяли в 6 М гуанидиния тиоцианате (GdmSCN). Все белки диализировали против 10 мМ NH4HCO3. Осадки, образующиеся во время диализа, удаляли седиментацией при 50000×g в течение 30 мин и остальные растворимые белки шелка лиофилизировали. Перед анализом лиофилизированный белок растворяли в 6 М GdmSCN с последующим диализом против подходящих буферов. Агрегаты удаляли седиментацией при 125000×g в течение 30 мин. Концентрации белка определяли фотометрически в кюветах с длиной пути 1 см при 276 нм, используя рассчитанные коэффициенты экстинкции (таблица 1) (23). Идентичность белков подтверждали электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE; 10%-ные Tris-глициновые гели для белков >20 кДа и 10-20%-ные Tris-трициновые гели (Invitrogen) для белков <20 кДа) с последующим блоттингом на поливинилиденфторидных (PVDF) мембранах (Millipore, Billerica, MA, USA) и определением с использованием мышинного моноклонального антитела против Т7 (Novagen, 1:10000), в качестве первичного, и антимышинного конъюгата IgG-пероксидаза (Sigma-Aldrich, 1:5000), в качестве вторичного антитела. Пероксидазную активность визуализировали, используя набор для выявления вестерн-блотов ECLplus от Amersham Biosciences (Piscataway, NJ, USA).
Флуоресценция. Спектры флуоресценции записывали на спектрофлуориметре FluoroMax (Jobin Yvon Inc, Edison, NJ, USA). Спектры получали, используя концентрацию белка 100 мкг/мл в 10 мМ трис(гидроксиметил)аминометане (Tris)/HCl (рН 8,0) при комнатной температуре. Время интегрирования составляло 1 с, размер шага составлял 0,5 нм, и ширина полос составляла 5 нм (возбуждение) и 5 нм (испускание), соответственно.
Анализ вторичной структуры. Спектры циркулярного дихроизма (CD) в дальнем УФ получали, используя спектрополяриметр Jasco 715, оснащенный тепловизором (Jasco International Co. Ltd., Tokyo, Japan). Все спектры получали при концентрации белка 150 мкг/мл в 5 мМ Tris/HCl (рН 8,0) в кварцевой кювете с длиной пути 0,1 см при 20°С. Скорость сканирования составляла 20 нм/мин, размер шага составлял 0,2 нм, время интегрирования было установлено на 1 с, и ширина полосы составляла 1 нм. Четыре сканирования усредняли и исправляли для буфера. Тепловые переходы анализировали с инкрементом нагревания/охлаждения 1°С/мин при 220 нм.
Анализ растворимости. Для определения максимальной концентрации растворимых белков раствор с концентрацией 1 мг/мл (=0,1% (масс./об.)) в 10 мМ Tris/HCl рН 8,0 концентрировали ультрафильтрацией, используя полиэфирсульфоновую мембрану с порогом отсечения молекулярной массы 10000 Да (Vivascience AG, Hannover, Germany). С определенными интервалами отбирали пробы из раствора, пока белок не начинал выпадать в осадок. Пробы разводили в 10 мМ Tris рН 8,0 для фотометрического определения концентрации белка.
Анализ агрегации. Все пробы доводили до концентрации 1 мг/мл в 10 мМ Tris/HCl рН 8,0. Для тестирования эффектов ионов на агрегацию белков шелка добавляли соли до конечных концентраций 300 мМ. Эффект подкисления исследовали путем добавления HCl до конечной концентрации 100 мМ (рН 1). Все пробы инкубировали при комнатной температуре в течение 1 часа. Белковые осадки удаляли из всех проб седиментацией при 125000×g в течение 25 мин, и количество остающегося растворимого белка определяли фотометрически. Поскольку сумма растворимого и агрегированного белков должна была быть равна исходному количеству растворимого белка, процентное содержание агрегированного белка могло быть рассчитано путем вычитания количества растворимого белка из первоначально использованного количества белка.
Результаты
Стратегия клонирования для разработки шелкоподобных белков. Экспрессия аутентичных генов шелка пауков в бактериальных хозяевах является неэффективной (24), поскольку некоторые отрезки генов содержат кодоны, которые неэффективно транслируются в бактериях. Кроме того, манипуляция с генами и амплификация посредством ПЦР является затруднительной из-за повторяющейся природы шелков. Для того чтобы исследовать свойства белков шелка пауков, применяли стратегии клонирования с использованием синтетических модулей ДНК с использованием кодонов, адаптированных для соответствующего хозяина экспрессии. Получили синтетические гены, которые кодировали белки, сходные с повторяющимися участками шелков пауков (25-28). Важно то, что ни одна конструкция этих белков не включала карбоксиконцевых NR-участков, которые обнаружены во всех канатных шелках.
Авторы данного изобретения разработали бесшовную стратегию клонирования (29), которая делала возможным контролируемое объединение различных модулей синтетической ДНК, а также фрагментов аутентичного гена. Разработали вектор для клонирования pAZL, содержащий кассету клонирования со спейсером, действующим в качестве заполнителя для синтетических генов, и сайты распознавания для ферментов рестрикции BseRI и BsgI (Фиг.1А). Поскольку сайты распознавания и расщепления этими ферментами находятся на расстоянии 8 (BseRI) или 12 (BsgI) нуклеотидов друг от друга, кодоны начала трансляции и стоп-кодоны, а также дополнительные рестрикционные сайты, требующиеся для вырезания собранных генов, могли быть размещены близко к спейсеру.
На первой стадии клонирования спейсерный участок pAZL замещали синтезированным модулем ДНК (что касается конструкции модуля, см. ниже). Затем два модуля могли быть соединены сайт-направленным способом (см. материалы и способы и Фиг.1Б). Для соединения двух модулей использовали комплементарные 3'-одноцепочечные удлиняющие сегменты GG (смысловая) и СС (антисмысловая), полученные расщеплением BsgI и BseRI (Фиг.1В). Таким образом, последовательность ДНК, требующаяся для связывания двух модулей, была ограничена кодоном глицина (GGX). В белках шелка пауков в природе глицин присутствует в больших количествах (~30%), следовательно, можно было бы разработать модули без необходимости поиска сайтов распознавания эндонуклеазами рестрикции, которые после трансляции соответствуют аутентичным аминокислотным последовательностям. Поскольку при клонировании и мультимеризации структура элементов кассеты клонирования оставалась неизменной, можно было сконструировать множество комбинаций модулей (Фиг.1Г).
Конструирование, синтез и очистка синтетических шелков пауков. Авторы изобретения выбрали белки канатного шелка ADF-3 и ADF-4 (3) из паука-кругопряда Araneus diadematus в качестве матриц для синтетических конструктов. Частично установленная первичная структура ADF-3 главным образом состоит из повторяющихся единиц, которые все содержат консенсусную последовательность, включающую полиаланиновый мотив. Длина отдельных повторяющихся единиц определяется варьирующим числом мотива GPGQQ. Для имитации повторяющейся последовательности ADF-3 авторы изобретения разработали два модуля. Один модуль, названный А, получали из консенсусной последовательности, содержащей полиаланин (Фиг.1Д). Второй модуль, названный Q, содержал четыре повтора мотива GPGQQ. Для исследования повторяющихся единиц разной длины один или два модуля Q объединяли с одним модулем А с получением (AQ) или (QAQ). Эти повторяющиеся единицы мультимеризовали с получением синтетических генов, кодирующих белки с повторяющимися последовательностями (гер-белки) (AQ)12 и (QAQ)8.
Повторяющаяся часть ADF-4 обычно состоит из одиночной консервативной повторяющейся единицы, проявляющей лишь небольшие вариации. Авторы изобретения объединили эти вариации и сконструировали один консенсусный модуль, названный С (Фиг.1Д), который авторы изобретения мультимеризовали с получением rep-белка C16. Число повторов модуля во всех синтетических генах было выбрано так, чтобы кодировать белки со сходной молекулярной массой (~50 кДа).
И ADF-3, и ADF-4 показывают гомологичные NR-участки на их карбоксильных концах, содержащие, соответственно, 124 и 109 аминокислот. Последовательности генов, кодирующие эти участки, амплифицировали с помощью ПЦР, и кодоны, затруднительные для бактериальной экспрессии, заменяли на более подходящие кодоны путем сайт-направленного мутагенеза (см. материалы и способы). Следовательно, все использованные синтетические гены могли быть объединены с подходящими аутентичными NR-участками с получением генов, кодирующих repNR-белки (AQ)12NR3, (QAQ)8NR3 и C16NR4. Кроме того, NR3 и NR4 могли быть экспрессированы по одиночке.
После бактериального синтеза белки шелка очищали стадией нагревания с последующим осаждением сульфатом аммония. Идентичность данных белков подтверждали иммуноблоттингом, используя антитела, направленные против последовательностей Т7 пептидных меток, присоединенных к аминотерминальному концу всех белков шелка (Фиг.2А). Несмотря на то, что все rep-белки и все repNR-белки имели сходные молекулярные массы (таблица 1), они показывали различные скорости миграции, когда их подвергали SDS-PAGE. Этот эффект может быть вызван отклоняющимся от нормы связыванием додецилсульфата с данными белками из-за различного аминокислотного состава, приводящего к изменению результирующих зарядов белков. Помимо белков с полной длиной, иммуноблоттинг выявлял в препаратах repNR-белков следы белков с меньшими молекулярными массами. Связывание с этими белками антитела против Т7-метки идентифицировало их как белки шелка, не имеющие части их карбокситерминального конца. При проведении анализа каждого очищенного белка с помощью SDS-PAGE и окрашивания серебром во всех белковых препаратах не было обнаружено дополнительных белков (Фиг.2Б). Чистоту белка дополнительно определяли путем измерения испускания флуоресценции. Падающий свет с длиной волны 280 нм приводит к возбуждению и испусканию флуоресценции остатками тирозина и триптофана, тогда как свет с длиной волны 295 нм возбуждает исключительно последние. Поскольку ни один из сконструированных белков шелка пауков не содержал остатков триптофана, испускание флуоресценции при возбуждении 295 нм указывало бы на загрязняющие белки E.coli, которые в среднем содержат 1,5% триптофана (30). Измерения флуоресценции всех препаратов белка шелка выявили спектры испускания, похожие на спектр тирозина, который в больших количествах присутствует в белках шелка. Напротив, не могли определить флуоресценцию триптофана, что указывает на высокую чистоту белковых препаратов (в качестве примера данные показаны для C16NR4 на Фиг.2Б).
Продуцирование бактериями белков синтетического шелка в колбах Эрленмейера давало сходные количества белка для всех конструктов. Выходы отдельных препаратов варьировали от 10 до 30 мг очищенного белка на литр культуральной среды. Применяли ферментацию клеток для того, чтобы исследовать возможность увеличения масштаба синтеза белка. Выходы (QAQ)8NR3 и C16NR4, таким образом, могли быть увеличены до 140 и 360 мг/л, соответственно.
RepNR-белки состоят из слабо структурированного повторяющегося участка и высокоструктурированного неповторяющегося домена. Вторичную структуру исследовали CD спектроскопией. Rep-белки открывали спектры, типичные для внутренне неструктурированных белков. Напротив, NR-белки показывали спектры, свидетельствующие о высоком содержании вторичной структуры. Эти участки, по-видимому, независимо представляют собой складчатые домены белка. Спектры repNR-белков грубо соответствовали комбинации rep- и NR-спектров, взвешенных согласно их доле в repNR-белках. Несмотря на то, что нельзя исключить минорного структурного изменения в rep-участках или NR-доменах при взаимном связывании, вероятно, что repNR-белки состоят из участка, показывающего главным образом случайную спиральную структуру, и карбоксиконцевого складчатого домена белка. Удивительно то, что спектры repNR-белков были сходными с CD-спектрами, полученными от пасты шелка главной ампуловидной железы, экстрагированной непосредственно из пауков (Nephila clavipes) (9).
Белки шелка вновь сворачиваются после термической и химической денатурации. При исследовании структурных изменений при нагревании посредством CD-спектроскопии для rep-белков не наблюдали кооперативных температурных переходов от 20°С до 90°С, эффекта, который также наблюдали для других внутренне несвернутых белков (31; 32) (Фиг.3). Поскольку repNR-белки были по меньшей мере частично структурированными, термическое разворачивание структурированного участка должно было быть определимым при повышенных температурах. Соответственно, наблюдали кооперативные тепловые переходы. Средние точки температурных переходов составляли 67°С ((QAQ)8NR3), 66°С ((AQ)12NR3) и 72°С (C16NR4), соответственно (Фиг.3Б и Таблица 1). Кроме того, все тепловые переходы были полностью обратимыми. Обратимость структурных изменений при нагревании объясняла высокий выход растворимых белков шелка после стадии нагревания, применяемой во время очистки белка. Для забуферивания всех растворов, исследованных CD-спектроскопией, использовали Tris из-за его хороших спектральных характеристик и слабой способности стимулировать агрегацию белка шелка. Из-за сильной температурной зависимости растворов, забуференных Tris, ожидали, что рН проб сместится от рН 8 до рН 6 при нагревании от 20°С до 90°С (19). Однако температурные переходы белков шелка в фосфатном буфере при рН 8, показывающем независимую от температуры величину рК, выявили равные температуры средней точки (данные не показаны), несмотря на то, что они не были полностью обратимыми, возможно, из-за агрегации белка (см. ниже). Это указывало на то, что тепловые переходы белков шелка не были подвержены влиянию индуцированных теплотой изменений рН растворов, забуференных Tris.
Эффект химической де- и ренатурации на вторичную структуру исследовали путем измерения циркулярного дихроизма repNR-белков в Tris буфере после диализа против 6 М GuaHCl и ренатурации путем диализа против Tris буфера. Идентичные спектры исходных и повторно свернутых белков указывали на то, что химическая денатурация является обратимой (данные не показаны)
Растворимость белков шелка определяется их повторяющимися последовательностями. Для того чтобы получить высокие концентрации белка в пасте, белки шелка должны быть высокорастворимыми. Авторы изобретения тестировали максимальные концентрации, при которых rep- и repNR-белки оставались растворимыми, для идентификации элементов первичной структуры, определяющих растворимость. Все белки, содержащие модули А и Q, могли быть сконцентрированы ультрафильтрацией до содержания более чем 30% масс./об. без образования видимых агрегатов, независимо от присутствия NR-домена. Напротив, белки, содержащие модуль С, могли быть сконцентрированы только до 8% масс./об. (C16) и 9% масс./об. (C16NR4), соответственно (Таблица 1). Оба белка формировали гелеподобное твердое вещество при дальнейшем концентрировании (данные не показаны). Таким образом, растворимость белков шелка определялась исключительно их повторяющимися последовательностями и не подвергалась влиянию NR-домена.
Калий не стимулирует агрегацию синтетических белков шелка, независимо от их первичной структуры. рН, ионы, такие как калий и фосфат, и механическое напряжение участвуют в сборке природного шелка. Здесь авторы изобретения хотели исследовать, как эти факторы стимулируют сборку синтетических белков шелка. Поскольку авторы изобретения не смогли имитировать подлинный процесс сборки, который требует предварительной ориентации участвующих белков, как было обнаружено в жидкокристаллической пасте (33), они провели анализ агрегации, начиная с белковых растворов, не показывающих упорядоченной ориентации. Ни один из протестированных rep-, repNR- и NR-белков не показывал значимой агрегации (<5%) при инкубации в буфере, указывая на то, что все белки были в действительности растворимыми при тестируемых условиях (Фиг.4). Для исследования, вызывало ли добавление ионов агрегацию путем увеличения ионной силы, инкубировали белки с хлоридом натрия. Однако не наблюдали агрегации. Ранее сообщали, что в отличие от натрия калий специфически стимулирует агрегацию шелка (34). Тем не менее, хлорид калия также не демонстрировал влияния на растворимость синтетических белков шелка (Фиг.4).
Подкисление и добавление фосфата инициирует агрегацию rep-белков в зависимости от их первичной структуры. Точная функция подкисления во время сборки шелка пауков до сих пор не была определена. Однако кажется вероятным, что отрицательно заряженные группы (например, фосфорильные группы) протонируются, снижая, таким образом, результирующий заряд и отталкивание белков шелка пауков. Поскольку синтетические белки шелка не содержали химических групп, демонстрирующих значение рКA в пределах интервала сдвига рН, наблюдаемого во время процесса прядения, авторы изобретения стремились имитировать этот эффект путем протонирования всех концевых карбоксильных групп и карбоксильных групп боковых цепей. (QAQ)8 и (AQ)12, демонстрирующие только концевую карбоксильную группу, не показывали (<5%) и показывали слабую (18%) агрегацию при рН 1. Интересно, что протонирование 16 глутаматных остатков C16 также вызывало только слабую агрегацию (8%) (Фиг.4). Фосфат, который, как было описано, добавляют к пасте во время процесса прядения, не вызывал агрегации (QAQ)8 и вызывал слабое осаждение C16 (12%). Напротив, (AQ)12 показывал повышенную тенденцию к агрегации (47%) после обработки фосфатом калия. Сходные результаты получили с использованием фосфата натрия, что указывает на то, что эффект специфически вызван фосфатными ионами (данные не показаны).
NR-домены усиливают реакцию на факторы, которые стимулируют агрегацию. Для исследования влияния NR-доменов тестировали агрегацию repNR-белков, а также NR-белков при низком рН и при обработке фосфатом. Подкисление (QAQ)8NR3 и (AQ)12NR3, а также NR3 вызывало слабую агрегацию (10%, 15% и 13%), которая находилась в интервале, демонстрируемом соответствующими rep-белками. Интересно то, что хотя NR4-домен и не осаждался при рН 1 (0%), C16NR4 показывал сильную агрегацию при рН 1 (70%). Таким образом, комбинация повторяющегося C16 и NR4-домена, которые значимо не агрегируют при подкислении, приводила к образованию белка, высокочувствительного к этому фактору, стимулирующему агрегацию. Сходные результаты получили для добавления фосфата. В то время как ни NR3, ни NR4 не показывали агрегации в присутствии фосфата (1% и 0%), добавление NR-доменов к повторяющимся участкам вызывало повышенную агрегацию repNR-белков по сравнению с rep-белками ((QAQ)8NR3: 57%, (AQ)12NR3: 81%, C16NR4: 80%).
С использованием стратегии клонирования, которая делает возможной бесшовную и контролируемую сборку модулей ДНК, сконструировали синтетические гены, кодирующие шелкоподобные белки пауков. Конструирование белков давало различные комбинации повторяющихся единиц и встречающихся в природе NR-участков для систематического тестирования свойств таких одиночных элементов первичной структуры. Структурный анализ путем CD-спектроскопии выявил, что повторяющиеся участки являются главным образом неструктурированными в их растворимом состоянии, демонстрируя свойства, обычные для других внутренне несвернутых белков (31; 32). То же самое конформационное состояние было предложено для большей части содержимого главной ампуловидной железы (10), в котором доминируют повторяющиеся белковые последовательности. Напротив, обнаружили, что NR-участки независимо представляют собой сворачивающиеся домены белка, которые принимают их конформацию после денатурации нагреванием, а также обработки разобщающими агентами. Из-за их относительно малого размера по сравнению с повторяющимися участками данное влияние на общие структурные свойства в repNR-белках было слабым.
В природных шелках пауков, демонстрирующих повторяющиеся участки размером в несколько сотен кДа, можно ожидать, что структурный вклад NR-участков будет даже меньшим, что объясняет отсутствующее доказательство их наличия в исследованиях содержимого главной ампуловидной железы. Из-за обратимости термической и химической денатурации repNR-белков и сходства CD данных, представленных в этой работе и полученных от пасты природного шелка, можно предположить, что даже после обработки нагреванием и разобщающими реагентами во время очистки и получения проб все исследованные компоненты шелка пауков в водных растворах находились в конформационном состоянии, сравнимом с конформационным состоянием природных белков шелка в пасте.
Согласно Uversky et al., внутреннее разворачивание белков можно предсказать на основании их результирующего заряда и средней гидропатичности (hydropathicity). Результирующий заряд белка используют для расчета «границы» гидропатичности. Если средняя гидропатичность белка находится ниже значения «границы», предсказывают, что белок является внутренне развернутым (35; 36). Согласно представленным результатам предсказывается, что повторяющиеся последовательности (QAQ)8 и (AQ)12 являются внутренне развернутыми (Таблица 1). Внутреннее развертывание белка означает, что взаимодействия аминокислотных остатков с окружающим растворителем являются более благоприятными, чем с аминокислотами той же самой или других полипептидных цепей. Соответственно, (QAQ)8 и (AQ)12 являются растворимыми даже при высоких концентрациях. Напротив, C16 демонстрирует гидропатичность немного выше пограничного значения. В то время как все еще проявляются свойства внутренне развернутых белков, взаимодействия между полипептидными цепями становятся более благоприятными при высоких концентрациях, приводя к агрегации белка и приводя к меньшей растворимости по сравнению с (QAQ)8 и (AQ)12 (Таблица 1).
Поскольку повторяющиеся последовательности составляют большую долю белков шелка пауков, они, вероятно, определяют многие свойства данных белков. Соответственно, растворимости repNR-белков не отличаются значительно от rep-белков. Растворимость и расчетная гидропатичность (QAQ)8 и (AQ)12 хорошо кореллируют со значениями аутентичного ADF-3 (Таблица 1). И C16, и ADF-4 демонстрируют меньшую растворимость, хотя C16 и не имеет высокой внутренней нерастворимости ADF-4. Это различие можно объяснить большей гидропатичностью и меньшим результирующим зарядом ADF-4 по сравнению с С16.
В отличие от повторяющихся участков, NR-домены представляют собой только малую долю белков шелка пауков. Оба NR-домена показали структуру, обогащенную α-спиралями. Благодаря высокому сходству между NR-доменами ADF-3 и ADF-4 (81%-ное сходство и 67%-ная идентичность), можно предположить, что они оба могут выполнять родственные функции. Дополнительную информацию о функции NR-доменов получили при исследовании агрегации белков шелка при обработке факторами, для которых известно, что они индуцируют сборку белков шелка in vivo. Ожидали, что снижение отрицательных зарядов путем протонирования карбоксильных групп белков шелка главным образом оказывает влияние на белки, содержащие модуль С. Соответственно, белки, состоящие из модулей А и Q, которые не содержат аспартатных или глутаматных остатков, не показывали ничего большего, чем слабая агрегация. C16 оставался предельно растворимым даже после нейтрализации его 16 отрицательных зарядов. Удивительно то, что комбинация NR4-домена, который сам не показывает какой-либо реакции на подкисление, и слабо агрегирующего C16 приводила к образованию белка, высокочувствительного к протонированию. Таким образом, для эффективной агрегации требуется снижение заряда повторяющегося участка и присутствие NR-домена. Аналогичные результаты получили, когда к белковым растворам добавляли фосфат. Известно, что фосфат, подобно другим лиотропным ионам, увеличивает поверхностное натяжение воды, стимулируя гидрофобные взаимодействия (37). В случае белков шелка пауков вероятным является то, что добавление фосфата инициирует взаимодействия между гидрофобными полиаланиновыми мотивами, вызывая агрегацию белков. Соответственно, агрегация (AQ)12 была более сильной, чем агрегация (QAQ)8, который содержит на треть меньше полиаланиновых мотивов, чем (AQ)12. C16, демонстрирующий наибольшее число полиаланиновых мотивов, которые являются самыми длинными, однако, не показывал самой сильной агрегации при обработке фосфатом. Возможным объяснением этого неожиданного результата может быть отталкивание отрицательно заряженных глутаматных боковых цепей и фосфатных ионов, приводящее к их исключению из окружающего растворителя и к ослаблению их лиотропного эффекта. Хотя оба NR-домена не реагировали на добавление фосфата, их добавление к rep-белкам сильно увеличивало чувствительность к фосфату. Несмотря на то, что представленные данные не являются достаточными для того, чтобы сделать окончательное заключение, кажется вероятным, что NR-домены функционируют в качестве неспецифических усилителей чувствительности к факторам, стимулирующим агрегацию. Для эффективной агрегации их присутствие является таким же важным, как и способность повторяющихся участков отвечать на эти факторы.
Механизм этого усиления может включать изменения в олигомерном статусе белков шелка. Обнаружили, что NR-домены образуют димеры, связанные дисульфидными мостиками (38). Дальнейшая олигомеризация может приводить к повышенным локальным конентрациям полипептидных последовательностей, требующихся для инициации агрегации, которой содействуют условия в растворителе, благоприятствующие образованию межмолекулярных взаимодействий.
Настоящий подход по белковой инженерии, который объединяет синтетические повторяющиеся последовательности с аутентичными NR-участками, выявляет, что белки, имеющие близкое сходство с аутентичными белками шелка, можно получить с высокими выходами. Бактериальная система экспрессии, а также простой и дешевый способ очитки, масштаб которого можно легко увеличить, дают основу для экономически эффективного производства шелкоподобных белков пауков в промышленном масштабе. На основе настоящих исследований можно дополнительно исследовать молекулярные механизмы сборки шелка пауков, что даст знание, необходимое для искусственного прядения шелковых нитей из рекомбинантных белков и для получения новых материалов для биотехнологических и медицинских применений.
Сборка белков, происходящих из шелка пауков
Провели следующие эксперименты для того, чтобы продемонстрировать, что белки, происходящие из последовательностей ADF-3 (SEQ ID NO:1) или ADF-4 (SEQ ID NO:2) шелка паука можно собрать в отдельные морфологические формы. Белки (AQ)24NR3 и C16NR4 сконструировали, продуцировали и приготовили в водных растворах, как описано в Biochemistry 2004 Vol.43 pp.13604-11362. Если не упомянуто иначе, белковые растворы содержали 10 мМ Трис-(гидроксиметил)-аминометан (Tris) pH 8,0.
1. Сферы
Белковые сферы, демонстрирующие диаметры, варьирующие от 0,5 до 2 мкм (Фиг.7а), генерировали путем добавления 0,8 М сульфата аммония к 0,2%-ному (масс./об.) раствору C16.
2. Нанофибриллы
Нанофибриллы, демонстрирующие диаметры от 0,7 до 4 нм (Фиг.7б), образовали путем инкубации 1%-ного (масс./об.) раствора C16NR4 при комнатной температуре в течение 2 недель.
3. Микрофибриллы
Для образования микрофибрилл 5-10 мкл 25%-ного (масс./об.) раствора (AQ)24NR3 медленно инъецировали в 0,5 М фосфат калия, pH 8,0, с образованием стабильной капли белкового раствора. После инкубации в течение 1 мин белковую каплю удаляли из раствора, используя пинцет. После дополнительного времени инкубации продолжительностью 1 мин на воздухе могли вытянуть белковую фибриллу из белковой капли со скоростью приблизительно 2 см/с, используя второй набор пинцетов. Данные фибриллы демонстрировали круглый поперечный срез с диаметром 4 мкм (Фиг.7в, г).
4. Пены
Белковые пены (Фиг.7д, е) генерировали из растворов, содержащих 2,5 мМ пероксодисульфат аммония (APS), 100 мкМ трис(2,2'-бипиридил)дихлоррутений(II) (Rubpy) и 10%-ный (масс./об.) (AQ)24NR3 или 2%-ный (масс./об.) C16NH4. Белковые растворы вспенивали с воздухом. Для стабилизации образующейся структуры пены белки поперечно связывали путем воздействия видимого света от вольфрамовой лампы в течение 1 мин (Protocol: PNAS 1999 Vol.96 pp.6020-6024). Затем высушивали пены при 95°С.
5. Гели
Нанофибриллы C16NR4 в концентрации 1% (масс./об.) демонстрировали гелеподобный вид, который можно было легко нарушить встряхиванием или сдвигом. Для улучшения механических свойств геля APS и Rubpy давали войти в данный гель путем диффузии с получением конечных концентраций 10 мМ APS и 100 мкМ Rubpy. После поперечного связывания, индуцированного светом (см. раздел 4), можно было получить стабильные по размерам гели (Фиг.7ж).
6. Пленки
6.1 Растворимое состояние белков шелка пауков
Для того чтобы отлить пленки, авторы данного изобретения использовали два синтетических белка шелка, (AQ)24NR3 и C16, которые происходят из белков канатного шелка ADF-3 и ADF-4 паука-кругопряда Araneus diadematus (также см. выше для дополнительных объяснений). Авторы изобретения выбрали эти два различных белка на основании предыдущих наблюдений того, что ADF-3 и ADF-4, а также их производные демонстрируют явно разное поведение, касающеся растворимости и сборки. Водные растворы обоих белков могли быть получены путем растворения лиофилизированных белков в 6 М гуанидиния тиоцианате и последующего удаления данной соли путем диализа против буфера с низкой концентрацией соли, такого как 5 мМ фосфат калия, рН 8,0. Лиофилизированные белки также могли быть непосредственно растворены в HFIP. Измерение циркулярного дихроизма (CD) белковых растворов выявило различное влияние двух данных растворителей на вторичную структуру. В водном растворе оба белка демонстрировали CD-спектр с одним минимумом при длине волны менее 200 нм, который свидетельствует главным образом о белке со случайной спиралью (Фиг.8). Напротив, спектры обоих белков в HFIP демонстрировали один минимум при 201-202 нм и дополнительный минимум ((AQ)24NR3) или плечо (С16) при 220 нм, которое свидетельствует о повышенном содержании α-спирали (Фиг.8).
6.2 Образование пленки
Пленки отливали на полистирольной поверхности (или на кварцевом стекле для измерений CD) из растворов HFIP, содержащих 2% масс./об. белка. После выпаривания растворителя и (AQ)24NR3, и C16 образовали прозрачные пленки, которые можно было легко снять с поверхности (Фиг.9 и непоказаные данные). Предполагая полное выпаривание растворителя и то, что плотность белковой пленки является идентичной сообщавшемуся для канатного шелка пауков значению 1,3 г/см3, рассчитали, что толщина пленок варьирует от 0,5 до 1,5 мкм. В виде отливки (свежеприготовленной) пленки делают из любого белка, растворяющегося при контакте с водой. Поскольку нерастворимость в воде является предварительным условием для большинства применений белковых пленок, авторы изобретения искали способ обработки для того, чтобы сделать пленки нерастворимыми. Было известно, что фосфат калия индуцирует агрегацию и образование химически стабильных структур используемых белков шелка. Соответственно, обработка (проведение инкубации) отлитых пленок 1 М фосфатом калия приводила к превращению пленок в водонерастворимое состояние.
6.3 Вторичная структура
Для изучения структурных свойств белковых пленок исследовали их вторичную структуру путем CD-спектроскопии. В литом виде пленки показывали спектр с двумя минимумами при 208 нм и 220 нм, свидетельствующий о высоком содержании α-спиралей (Фиг.10). После обработки 1 М фосфатом калия пленки показывали спектры с одиночным минимумом при 218 нм, который является типичным для структуры, обогащенной β-складками. Таким образом, переход от растворимости в воде к нерастворимости в воде происходил параллельно превращению вторичной структуры белка от α-спирали к β-складкам.
6.4 Химическая стабильность
Для тестирования химической стабильности пленки подвергали воздействию 8 М мочевины, 6 М гуанидиния гидрохлорида и 6 М гуанидиния тиоцианата (Таблица 2). Отлитые пленки обоих белков, а также обработанные пленки (AQ)24NR3 были растворимыми в этих денатурирующих агентах. Напротив, обработанные пленки C16 могли быть растворены только в гуанидиния тиоцианате. Эта замечательная химическая стабильность пленок C16 является идентичной стабильности полученного рекомбинантно и собранного ADF-4 и стабильности природного канатного шелка. Предыдущие исследования установили связь свойств сборки и стабильности собранных структур непосредственно с аминокислотными последовательностями белков шелка. Следовательно, можно заключить, что свойства пленок шелка пауков можно непосредственно модифицировать путем изменения первичной структуры белка шелка через манипуляцию с соответствующим геном шелка.
6.5 Модификация пленки
Многие применения белковых пленок требуют присутствия конкретных функциональных групп на поверхности пленки. Для того чтобы продемонстрировать, что пленки белков шелка пауков, полученные авторами изобретения, можно модифицировать небольшими органическими молекулами, а также биологическими макромолекулами, подобными белкам, с обработанными пленками C16 химически связали хромофор флуоресцеин и фермент β-галактозидазу. Связывания добились путем активации экспонированных на поверхности карбоксильных групп С16, используя 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC) (относительно деталей реакции, см. дополнительный материал, указанный ниже). Затем инкубировали пленки с этилендиамином, что приводило к образованию амида. Остающуюся свободную аминогруппу этилендиамина затем связывали с флуоресцеинизотиоцианатом, что приводило к эффективной ковалентной связи флуоресцеина (Фиг.11А) через образование стабильного производного тиомочевины. Аналогичным образом, инкубация β-галактозидазы с пленками C16, активированными EDC, приводила к образованию амидных связей между карбоксильными группами C16 и первичными аминами (например, из остатков лизина) β-галактозидазы, которые были доступными на поверхности фермента. После многократных промывок таких модифицированных пленок активность β-галактозидазы можно было определить, используя 5-бром-4-хлор-3-индолил-β-D-галактопиранозид (X-Gal) в качестве субстрата (Фиг.11Б).
6.6 Заключение
Здесь можно было продемонстрировать, что белковые пленки можно получить из синтетических белков шелка пауков. Данные пленки, которые первоначально были водораствормыми, можно обработать фосфатом калия, приводящим к нераствормости в воде, что является главным требованием для многих применений. Сравнение химических стабильностей пленок, сделанных из двух разных синтетических белков шелка паука, наводит на мысль о том, что свойства пленок основаны на первичной структуре белков. Таким образом, будет возможно генерировать белки шелка, которые образуют пленки, демонстрирующие специфические свойства. Поскольку к поверхности пленки можно ковалентно присоединить различные функциональные молекулы, в будущем можно будет приблизиться к огромному разнообразию технических и медицинских применений.
6.7 Дополнительные материалы и результаты
Получение белковых растворов
Производство и очистку белков проводили, как было описано ранее. Для получения водных растворов (AQ)24NR3 и C16 лиофилизированный белок растворяли в 6 М гуанидиния тиоцианате в концентрации 10 мг/мл и затем диализировали против 5 мМ фосфата калия рН 8,0. Агрегаты удаляли седиментацией при 15000×g в течение 10 мин. Концентрации белка определяли фотометрически в кювете с длиной пути 1 см при 276 нм, используя расчетные коэффициенты экстинкции 73950 М-1см-1 для (AQ)24NR3 и 46400 М-1см-1 для С16. В качестве альтернативы, лиофилизированные белки шелка непосредственно растворяли в гексафторизопропаноле (HFIP).
Анализ вторичной структуры
Спектры циркулярного дихроизма (CD) дальнего УФ получали, используя спектрополяриметр Jasco 715 (Jasco International Co. Ltd., Tokyo, Japan). Спектры растворимых белков получали при концентрации белка 200 мкг/мл в 5 мМ фосфате калия (рН 8,0) или в HFIP в кварцевой кювете с длиной пути 0,1 см при 20°С. Для измерения пленок 100 мкл белкового раствора в концентрации 2 мг/мл в HFIP распределяли на простом кварцевом стекле площадью 4 см2 и сушили воздухом перед измерением CD. Скорость сканирования составляла 20 нм/мин, размер шага составлял 0,2 нм, время интегрирования было установлено на 1 с, и ширина полосы составляла 1 нм. Четыре сканирования были усреднены.
Модификация пленки
1. Связывание флуоресцеина с поверхностями пленки C16
Пленки получали путем распределения 15 мкл на лунку раствора C16 в HFIP в концентрации 20 мг/мл на дне 24-луночного планшета. После выпаривания HFIP пленки инкубировали в течение 5 минут с 1 М фосфатом калия. После промывания водой активировали карбоксильные группы путем инкубации в течение 15 мин со 100 мМ 2-(N-морфолино)этансульфоновой кислотой (MES) рН 5,0, 100 мМ 1-этил-3-(3-диметиламинопропил)карбодиимидом (EDC) и 20 мМ N-гидроксисульфосукцинимидом (NHS). Затем добавляли этилендиамин с получением конечной концентрации 500 мМ. Через 2 ч инкубации пленки тщательно промывали водой. Наконец, пленки инкубировали в течение 1 ч с 1 мг/мл флуоресцеинизотиоцианатом в 100 мМ карбонате натрия рН 9,0, с последующей промывкой водой и сушкой воздухом.
2. Связывание β-галактозидазы с поверхностями пленки C16
Пленки получали и активировали, как описано выше. Через 15 мин инкубации с EDC/NHS пленки промывали водой и далее инкубировали в течение 2 ч с раствором, содержащим 100 мкг/мл β-галактозидазы, 4 мМ KН2РO4, 16 мМ Na2HPO4, 115 мМ NaCl (PBS). После тщательного промывания PBS тестировали ферментативную активность на поверхности пленки.
Анализ β-галактозидазы
Пленки со связанной β-галактозидазой инкубировали в течение 16 ч при комнатной температуре с раствором, содержащим 100 мМ фосфат натрия, рН 7,0, 10 мМ хлорид калия, 1 мМ сульфат магния, 50 мМ β-меркаптоэтанол и 2 мг/мл 5-бром-4-хлор-3-индолил-β-D-галактопиранозид (X-Gal).
7. Дополнительные гидрогели
Часть ADF-4 с повторяющимися последовательностями обычно состоит из одной консервативной повторяющейся единицы, демонстрирующей только слабые вариации. Авторы данного изобретения объединили эти вариации и сконструировали один консенсусный модуль, названный С (GSSAAAAAAAASGPGGYGPENQGPSGPGGYGPGGP) (SEQ ID NO:5), который мультимеризовали с получением rep-белка C16, который приведет к белку с молекулярной массой 48 кДа.
Ген шелка C16 экспрессировали в штамме BLR [DE3] Е.coli (Novagen). Клетки выращивали при 37°С в среде LB до OD600=0,5. Перед индукцией 1 мМ IPTG (изопропил-β-D-тиогалактозид) клетки переводили на 25°С. Собирали клетки через 3-4 часа индукции.
Белок С16 очищали, как описано в Huemmerich et al (40). Осадки C16 промывали 8 М мочевиной и растворяли в 6 М гуанидиния тиоцианате (GdmSCN) перед диализом против 10 мМ NH4HCO3. Осадки, образующиеся во время диализа, удаляли седиментацией при 50000×g в течение 30 мин и лиофилизировали остающиеся растворимые белки шелка. Перед анализом лиофилизированный белок растворяли в 6 М GdmSCN с последующим диализом против 10 мМ Tris/HCl. Агрегаты удаляли седиментацией при 125000×g в течение 30 мин. Концентрации белка определяли фотометрически в кюветах с длиной пути 1 см при 276 нм, используя расчетный коэффициент экстинкции (40).
C16 подвергался самосборке в нановолокна в концентрациях от 5 до 30 мг/мл после добавления 10%-ного масс./об. метанола (Фиг.12). Удивительно, что при использованных концентрациях нановолокна приводили к образованию сети волокон, представляющих собой гидрогели. Гидрогели C16 могли быть легко разрушены путем встряхивания или сдвига. Для улучшения механических свойств геля пероксодисульфату аммония (APS) и Трис(2,2'-бипиридил)дихлоррутению(II) (Rubpy) давали войти в гель путем диффузии с получением конечных концентраций 10 мМ APS и 100 мкМ Rubpy. Для получения гелей стабильных размеров поперечно связывали белки путем воздействия видимого света от вольфрамовой лампы в течение 1 мин (IV) (Фиг.13).
Динамические реологические измерения поперечно связанных и несвязанных поперечно гидрогелей проводили с использованием Physica MCR 301 с 25 мм геометрией Plate-Plate. Щель между верхней пластинкой и чашкой для пробы устанавливали путем первоначального придвигания верхней пластины приблизительно на расстояние 2 мм над поверхностью пробы. Верхнюю пластину очень медленно опускали (5 мкм/с), отслеживая нормальную силу, и останавливали на предельной нормальной силе 0,1 Н.
После нахождения адекватного размера щели для проб осуществляли сдвиг проб с частотой 0,5 Гц и деформацией 1%, пока нормальная сила не уравновешивалась до постоянного значения. Динамические реологические измерения выполняли при комнатной температуре путем приложения к пробе постоянного напряжения. Реологические измерения проводили на пробах с концентрациями белка, варьирующими от 5 до 30 мг/мл.
Изображения высушенных гидрогелей, полученные AFM, показывают, что нановолокна имеют диаметр примерно 3 нм и, по-видимому, являются полугибкими с персистентной длиной того же самого порядка величины, что и их длина (Фиг.12). Многие из нановолокон также, по-видимому, имеют разветвленную структуру. Из изображений, полученных AFM, нельзя было определить, являются ветвеподобные структуры физическими разветвлениями в каждом полимерном волокне или происходят в результате связывания нанофибрилл.
Аналогично самым концентрированным полимерным сетям гидрогель рекомбинантного белка шелка паука C16 демонстрирует вязкоэластичное поведение. Когда к вязкоэластичным сетям шелка С16 прилагают напряжение, деформация медленно изменяется во времени и является пропорциональной приложенному напряжению. На Фиг.14 показано поведение напряжение/деформация поперечно связанных и несвязанных поперечно гидрогелей в концентрации 10 мг/мл. Несвязанный поперечно гидрогель шелка C16 имеет исходный модуль сдвига 38 Па. Однако по мере увеличения напряжения несвязанный поперечно гидрогель показывает более сильную деформацию в ответ на напряжение, и после деформации 20% реакция является относительно линейной. По мере увеличения напряжения данная сеть продолжает деформироваться до достижения деформации 90%, когда несвязанный поперечно гидрогель разрывается и течет. В отличие от несвязанных поперечно сетей волокон поперечно связанные сети показывают линейную вязкоэластичную реакцию для всех деформаций, имеют значительно более высокий модуль сдвига 820 Па и разрываются при меньшей деформации 30%.
Динамические вязкоэластичные измерения несвязанных поперечно сетей волокон с концентрацией полимера 20 мг/мл выявляют, что динамический модуль упругости (G') и модуль потерь (G") являются очень зависимыми от частоты колебаний (ω) как в диапазоне высокой ω, так и низкой ω (Фиг.15). Данная сеть демонстрирует вязкостное поведение при малых частотах и эластическое поведение при умеренных частотах с переходом при 0,49 Гц. Наблюдаемое поведение гидрогеля является сходным с поведением, ожидаемым для сети переплетенных полимеров, и несходным с тем, которое ожидали бы у жидкокристаллического раствора или вязкой жидкости.
Несвязанный поперечно гидрогель шелка C16 также демонстрирует динамическое вязкоэластичное поведение, которое значительно отличается от поведения, которое наблюдают в химически поперечно связанных гидрогелях (Фиг.15). В отличие от поведения несвязанной поперечно сети волокон динамический модуль упругости поперечно связанной сети волокон является практически постоянным при всех частотах, за исключением самых высоких протестированных частот. Поперечно связанный гидрогель шелка C16 также демонстрирует более высокий динамический модуль упругости и более низкий модуль потерь, чем динамический модуль упругости и модуль потерь, которые наблюдают в несвязанной поперечно сети.
Как ожидалось бы, динамический модуль упругости поперечно связанного гидрогеля выше, чем динамический модуль упругости несвязанной поперечно сети для всех протестированных концентраций (Фиг.16). Однако, неожиданно, динамические модули упругости и поперечно связанной, и несвязанной поперечно сети возрастают с концентрацией [с] и имеют зависимость [с2]. В случае поперечно связанных линейных полугибких биополимерных сетей, где персистентная длина больше, чем размер ячейки, ожидается, что динамический модуль упругости полимерной сети имеет зависимость [с], которая близка к зависимости поперечно связанного гидрогеля шелка C16. В случае линейных полугибких биополимерных сетей, которые являются переплетенными, но не поперечно связанными, ожидается, что динамический модуль упругости имеет значительно более низкую концентрационную зависимость [с]. Было показано, что такая зависимость является справедливой для других биополимеров, таких как F-актин, но не описывает зависимость несвязанного поперечно гидрогеля шелка.
Это расхождение можно было бы объяснить, если ветевеподобные структуры, наблюдаемые на AFM-изображениях, являлись бы реальными физическими ветвями в полимерной сети. Ожидалось бы, что динамический модуль упругости сети разветвленного полугибкого полимера показал бы концентрационную зависимость между концентрационными зависимостями, которые ожидались бы у поперечно связанной и несвязанной поперечно полимерной сети.
AFM-изображения и реологические данные согласуются с данными модели сети разветвленного полугибкого полимера. Однако поведение при масштабировании динамического модуля упругости гидрогелей нельзя объяснить в рамках самых общепринятых моделей сетей линейных полугибких полимеров.
7. Покрытие для имплантатов молочной железы
Электронно-микроскопические фотографии силиконового имплантата
На Фиг.17 показана поверхность необработанной (непокрытой) текстурированной поверхности силиконового имплантата. В сравнении, на Фиг.18 показана гладкая поверхность силиконового имплантата, покрытого С16.





Реферат
Изобретение относится к области биотехнологии, конкретно к получению рекомбинантных белков шелка паука, и может быть использовано в медицине. Рекомбинантным путем получают белки, состоящие из комбинации модулей С, Q и А белков шелка паука. Полученные белки агрегируют и используют для получения различных материалов: сфер, нано- и микрофибрилл, пен, пленок, гелей и покрытий. Изобретение позволяет получить нити из рекомбинантных белков шелка паука, обладающие высокой прочностью на разрыв и эластичностью. 13 н. и 14 з.п. ф-лы, 2 табл., 18 ил.
Формула
а) одну или более чем одну синтетическую повторяющуюся последовательность белка шелка паука, где указанная синтетическая повторяющаяся последовательность содержит от 10 до 50 повторяющихся единиц, и где:
1) повторяющаяся единица состоит из аминокислотной последовательности SEQ ID NO:5 (модуль С) или ее вариантов,
2) повторяющаяся единица состоит из аминокислотной последовательности SEQ ID NO:4 (модуль Q) или ее вариантов и объединена с повторяющейся единицей, состоящей из аминокислотной последовательности SEQ ID NO:5 (модуль С) или ее вариантов,
3) повторяющаяся единица состоит из аминокислотной последовательности SEQ ID NO:3 (модуль А) или ее вариантов и объединена с повторяющейся единицей, состоящей из аминокислотной последовательности SEQ ID NO:4 (модуль Q) или ее вариантов, или
4) повторяющаяся единица состоит из аминокислотной последовательности SEQ ID NO:4 (модуль Q) или ее вариантов и объединена с повторяющейся единицей, состоящей из аминокислотной последовательности SEQ ID NO:3 (модуль А) или ее вариантов, и объединена с повторяющейся единицей, состоящей из аминокислотной последовательности SEQ ID NO:4 (модуль Q) или ее вариантов,
где указанные варианты в каждом случае содержат 1 аминокислотную замену, 1-5 аминокислотных делеций и/или не более 20 аминокислотных добавлений/вставок, которые не оказывают отрицательного влияния на прочность на разрыв и эластичность нити, образованной из рекомбинантного белка шелка паука,
и возможно
б) одну или более чем одну аутентичную неповторяющуюся последовательность белка шелка паука.
а) получение белкового раствора, содержащего неориентированные рекомбинантные белки шелка паука, как определено в любом из пп.1-6;
б) подвергание раствора, полученного в (а), воздействию триггера агрегации; и
в) выделение осажденных рекомбинантных белков шелка паука.

Комментарии