Модифицированный фиброин - RU2769982C2
Код документа: RU2769982C2
Чертежи


Описание
Область техники
[0001] Настоящее изобретение относится к модифицированному фиброину. Более конкретно, настоящее изобретение относится к модифицированному фиброину, имеющему пониженное содержание глициновых остатков. Настоящее изобретение также относится к нуклеиновой кислоте, кодирующей модифицированный фиброин; к экспрессионному вектору, включающему указанную последовательность нуклеиновой кислоты; к хозяину, трансформированному экспрессионным вектором; и к продукту, изготовленному из модифицированного фиброина.
Предшествующий уровень техники
[0002] Фиброин является одним из типов нитчатых белков и содержит до 90% глициновых, аланиновых и сериновых остатков, образующих β-складку (Непатентный документ 1). Белки (белки шелка, белки шелка шершня и белки шелка паука) и т.п., составляющие паутину, сплетенную насекомыми и пауками, известны как фиброин.
[0003] Белки шелка обладают превосходными механическими свойствами, гигроскопическими свойствами и дезодорирующими свойствами и широко используются как сырье для пошива одежды. Кроме того, шелковая пряжа представляет собой иммунологически толерантное натуральное волокно и обладает высокой биосовместимостью, а поэтому также используется для наложения хирургических швов.
[0004] У паука имеется до семи типов шелкоотделительных желез, каждая из которых продуцирует фиброин (белок шелка паука) с различными свойствами. В зависимости от органа-источника, белки шелка паука называются: мажорным белком паука, имеющим бутылочнообразную форму (MaSp) с высокой ударной вязкостью; минорным белком паука, имеющим бутылочнообразную форму (MiSp) с высокой степенью растяжимости; и белками паука, имеющими нитевидную форму (Flag), трубчатую форму, агрегированную форму, дольчатую форму и грушевидную форму. В частности, были проведены интенсивные исследования структуры мажорного белка паука, имеющего бутылочнообразную форму, и эти исследования указывали на высокую ударную вязкость, обусловленную высокой прочностью (прочностью при нагрузке и ударной вязкостью) и растяжимостью (Патентные документы 1 и 2).
[0005] Что касается конкретной структуры фиброина, то известна структура, в которой повторяются аминокислотные мотивы, классифицированные как GPGXX, удлиненная область, богатая аланиновыми остатками ((A)n или (GA)n), GGX и спейсер (Непатентный документ 2). Кроме того, сообщалось, что замена мотива (GA)n на мотив (A)n приводит к уменьшению растяжимости, но к увеличению предела прочности при растяжении, при этом, увеличение числа мотивов GPGXX приводит к увеличению растяжимости, а замена нескольких мотивов GPGXX на мотивы (A)nприводит к увеличению предела прочности при растяжении (Патентный документ 2). Кроме того, считается, что мотивы GGX и GPGXX имеют жесткую спиральную структуру, которая сообщает пряже эластичность (Патентный документ 3).
[0006] Рекомбинантные белки шелка паука и рекомбинантные белки шелка продуцируются несколькими гетерологичными системами продуцирования белка. Так, например, для этого используются трансгенные козы, трансгенные шелковые черви или рекомбинантные клетки растений или млекопитающих (Непатентный документ 3). Однако, эти системы продуцирования имеют низкую скорость продуцирования и не могут быть использованы для промышленного получения продукции, удовлетворяющей коммерческим требованиям (Патентный документ 4 и Патентный документ 5). Хотя сообщалось о множестве случаев продуцирования рекомбинантного фиброина такими организмами, как дрожжи, плесень, грамотрицательные бактериии и грамположительные бактерии, используемые в качестве системы для крупномасштабного продуцирования, и в этой области были достигнуты некоторые результаты, однако, эта система все же не позволяет осуществлять промышленное производство рекомбинантного фиброина, который обладал бы превосходной растяжимостью и имел бы высокий предел прочности при растяжении (Патентный документ 5).
Список цитируемых документов
Патентные документы
[0007] [Патентный документ 1] Публикация нерассмотренной заявки на патент Японии No. 2012-55269
[Патентный документ 2] Публикация нерассмотренной заявки на патент Японии No. 2005-502347
[Патентный документ 3] Публикация нерассмотренной заявки на патент Японии No. 2009-505668
[Патентный документ 4] Публикация нерассмотренной заявки на патент Японии No. 2014-502140
[Патентный документ 5] Публикациия Международной патентной заявки WO 2015/042164
Непатентная литература
[0008] [Непатентный документ 1] Asakura et al., Encyclopedia of Agricultural Science, Academic Press: New York, NY, in 1994, Vol. 4, pp. 1-11
[Непатентный документ 2] Microbial Cell Factories, 2004, 3:14
[Непатентный документ 3] Science, 2002, Vol. 295, pp. 472-476
Сущность изобретения
Проблемы, которые могут быть решены с помощью настоящего изобретения
[0009] Благодаря своим превосходным свойствам, фиброин привлекает внимание как новый материал, используемый в различных областях промышленности, таких как медицинская, авиационная и текстильная промышленность. Однако, для получения фиброина в количестве, которое удовлетворяло бы коммерческим требованиям, необходимо еще больше повысить продуктивность фиброина.
[0010] Целью настоящего изобретения является получение модифицированного фиброина, обладающего повышенной продуктивностью при сохранении своей прочности и растяжимости.
Средства для решения проблемы
[0011] В результате различных исследований методов, позволяющих получать продукт в промышленном масштабе, авторами настоящего изобретения было неожиданно обнаружено, что продуктивность фиброина может быть повышена с сохранением прочности (прочности при нагрузке и ударной вязкости) и растяжимости путем модификации мотива GGX или мотива GPGXX, который рассматривается как мотив, способствующий растяжению фиброина, в целях снижения содержания глициновых остатков. Эти новые результаты были положены в основу настоящего изобретения.
[0012] Таким образом, настоящее изобретение относится, например, к каждому из нижеследующих объектов изобретения, таких как:
[1] Модифицированный фиброин, включающий:
последовательность домена, представленную формулой 1: [мотив (A)n-REP]m,
где последовательность домена имеет аминокислотную последовательность с пониженным содержанием глициновых остатков, эквивалентную аминокислотной последовательности, в которой по меньшей мере один или множество глициновых остатков в REP заменены другим аминокислотным остатком по сравнению с природным фиброином.
[В формуле 1, мотив (A)nпредставляет собой аминокислотную последовательность, состоящую из 4-20 аминокислотных остатков, а число аланиновых остатков составляет 83% или более от общего числа аминокислотных остатков в мотиве (A)n, REP представляет собой аминокислотную последовательность, состоящую из 10-200 аминокислотных остатков, m равно целому числу от 8 до 300, множество мотивов (A)n может представлять собой одну и ту же аминокислотную последовательность или различные аминокислотные последовательности, а множество REP может представлять собой одну и ту же аминокислотную последовательность или различные аминокислотные последовательности].
[2] Модифицированный фиброин в соответствии с [1], где последовательность домена имеет аминокислотную последовательность, эквивалентную аминокислотной последовательности, в которой по меньшей мере в одной последовательности мотива, выбранной из GGX и GPGXX (где X представляет собой аминокислотный остаток, не являющийся глицином) в REP, один глициновый остаток в одной или во множестве последовательностей мотивов был заменен другим аминокислотным остатком по сравнению с природным фиброином.
[3] Модифицированный фиброин в соответствии с [2], где отношение последовательностей мотива, в которых глициновый остаток заменен другим аминокислотным остатком, составляет 10% или более от всей последовательности мотива.
[4] Модифицированный фиброин, включающий:
последовательность домена, представленную формулой 1: [мотив (A)n-REP]m,
где z/w составляет 50,9% или более в случае, когда общее число аминокислотных остатков в аминокислотной последовательности, состоящей из XGX (где X представляет собой аминокислотный остаток, не являющийся глицином), содержащегося во всех REP в последовательности, за исключением последовательности мотива (A)n, расположенного, в основном, с C-концевой стороны по отношению к С-концу последовательности домена, определено как z, а общее число аминокислотных остатков в последовательности, за исключением последовательности мотива (A)n, расположенного, в основном, с C-концевой стороны по отношению к С-концу последовательности домена, определено как w.
[В формуле 1, мотив (A)nпредставляет собой аминокислотную последовательность, состоящую из 4-20 аминокислотных остатков, а число аланиновых остатков составляет 83% или более от общего числа аминокислотных остатков в мотиве (A)n, REP представляет собой аминокислотную последовательность, состоящую из 10-200 аминокислотных остатков, m равно целому числу от 8 до 300, множество мотивов (A)n может представлять собой одну и ту же аминокислотную последовательность или различные аминокислотные последовательности, а множество REP может представлять собой одну и ту же аминокислотную последовательность или различные аминокислотные последовательности].
[5] Модифицированный фиброин в соответствии с любым из [1]-[4], где фиброин, помимо аминокислотной последовательности с заменой одного или множеста глициновых остатков в REP на другой аминокислотный остаток, имеет аминокислотную последовательность с заменой, делецией, инсерцией и/или добавлением одного или множества аминокислотных остатков по сравнению с природным фиброином.
[6] Модифицированный фиброин в соответствии с [5], где природным фиброином является фиброин, происходящий от насекомых или пауков.
[7] Модифицированный фиброин в соответствии с [5], где природным фиброином является мажорный белок паука, имеющий бутылочнообразную форму (MaSp), или минорный белок паука, имеющий бутылочнообразную форму (MiSp).
[8] Модифицированный фиброин в соответствии с любым из [5]-[7], где последовательность домена имеет аминокислотную последовательность, эквивалентную аминокислотной последовательности, в которой по меньшей мере в одной последовательности мотива, выбранной из GGX и GPGXX (где X представляет собой аминокислотный остаток, не являющийся глицином) в REP, один глициновый остаток в одной или во множестве последовательностей мотивов был заменен другим аминокислотным остатком по сравнению с природным фиброином, и где отношение последовательностей мотива, в которых глициновый остаток заменен другим аминокислотным остатком, составляет 10% или более от всей последовательности мотива.
[9] Модифицированный фиброин в соответствии с [8], где другим аминокислотным остатком является аминокислотный остаток, выбранный из группы, состоящей из глутаминового (Q) остатка, валинового (V) остатка, лейцинового (L) остатка, изолейцинового (I) остатка, метионинового (M) остатка, пролинового (P) остатка, фенилаланинового (F) остатка, триптофанового (W) остатка, аспарагинового (N) остатка, серинового (S) остатка, лизинового (K) остатка и остатка глутаминовой кислоты (E).
[10] Модифицированный фиброин в соответствии с [8], где другим аминокислотным остатком является глутаминовый (Q) остаток.
[11] Модифицированный фиброин в соответствии с любым из [1]-[10], где последовательность домена также имеет аминокислотную последовательность с пониженным содержанием мотива (A)n, эквивалентную аминокислотной последовательности, в которой по меньшей мере один или множество мотивов (A)n были делетированы по сравнению с природным фиброином.
[12] Модифицированный фиброин в соответствии с [11], где последовательность домена имеет аминокислотную последовательность, эквивалентную аминокислотной последовательности, в которой по меньшей мере один мотив (A)n на 1-3 мотива (A)n,расположенных с N-концевой стороны до С-концевой стороны, был делетирован по сравнению с природным фиброином.
[13] Модифицированный фиброин в соответствии с [11], где последовательность домена имеет аминокислотную последовательность, эквивалентную аминокислотной последовательности, в которой по меньшей мере два последовательно расположенных мотива (A)n с делециями и один мотив (A)n с делецией повторяются в указанном порядке от N-концевой стороны до C-концевой стороны по сравнению с природным фиброином.
[14] Модифицированный фиброин в соответствии с любым из [11]-[13], где максимальная величина x/y составляет 20% или более, в случае, если ряд аминокислотных остатков в REP, состоящем из двух смежных звеньев [мотив (A)n-REP], расположен последовательно от N-концевой стороны до C-концевой стороны, а число аминокислотных остатков в REP, имеющем наименьшее число аминокислотных остатков, было определено как 1; общее число аминокислотных остатков в двух смежных звеньях [мотив (A)n-REP], где отношение числа аминокислотных остатков в другом REP составляет 1,8-11,3, было определно как x, а общее число аминокислотных остатков последовательности домена было определено как y.
[15] Модифицированный фиброин, включающий аминокислотную последовательность, представленную в SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 10, или аминокислотную последовательность, которая на 90% или более идентична аминокислотной последовательности, представленной в SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 10.
[16] Модифицированный фиброин в соответствии с любым из [1]-[15], также включающий последовательность метки у N-конца или у C-конца или у обоих концов.
[17] Модифицированный фиброин в соответствии с [16], где последовательность метки включает аминокислотную последовательность, представленную в SEQ ID NO: 5.
[18] Модифицированный фиброин, включающий аминокислотную последовательность, представленную в SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 11, или аминокислотную последовательность, которая на 90% или более идентична аминокислотной последовательности, представленной в SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 11.
[19] Нуклеиновая кислота, кодирующая модифицированный фиброин в соответствии с любым из [1]-[18].
[20] Нуклеиновая кислота, которая гибридизуется с комплементарной цепью нуклеиновой кислоты в соответствии с [19] в жестких условиях и кодирует модифицированный фиброин, включающий последовательность домена, представленную формулой 1: [мотив (A)n-REP]m.
[В формуле 1, мотив (A)nпредставляет собой аминокислотную последовательность, состоящую из 4-20 аминокислотных остатков, а число аланиновых остатков составляет 83% или более от общего числа аминокислотных остатков в мотиве (A)n, REP представляет собой аминокислотную последовательность, состоящую из 10-200 аминокислотных остатков, m равно целому числу от 8 до 300, множество мотивов (A)n может представлять собой одну и ту же аминокислотную последовательность или различные аминокислотные последовательности, а множество REP может представлять собой одну и ту же аминокислотную последовательность или различные аминокислотные последовательности].
[21] Нуклеиновая кислота, имеющая последовательность, которая на 90% или более идентична нуклеиновой кислоте в соответствии с [19], и кодирующая модифицированный фиброин, включающий последовательность домена, представленную формулой 1: [мотив (A)n-REP]m.
[В формуле 1, мотив (A)nпредставляет собой аминокислотную последовательность, состоящую из 4-20 аминокислотных остатков, а число аланиновых остатков составляет 83% или более от общего числа аминокислотных остатков в мотиве (A)n, REP представляет собой аминокислотную последовательность, состоящую из 10-200 аминокислотных остатков, m равно целому числу от 8 до 300, множество мотивов (A)n может представлять собой одну и ту же аминокислотную последовательность или различные аминокислотные последовательности, а множество REP может представлять собой одну и ту же аминокислотную последовательность или различные аминокислотные последовательности].
[22] Экспрессионный вектор, включающий последовательность нуклеиновой кислоты в соответствии с любым из [19]-[21] и одну или множество регуляторных последовательностей, функционально присоединенных к этой последовательности.
[23] Экспрессионный вектор в соответствии с [22], который представляет собой плазмидный вектор или вирусный вектор.
[24] Хозяин, трансформированный экспрессионным вектором в соответствии с [22] или [23].
[25] Хозяин в соответствии с [24], который является прокариотом.
[26] Хозяин в соответствии с [25], где прокариотом является микроорганизм, принадлежащий к роду, выбранному из группы, состоящей из Escherichia, Brevibacillus, Serratia, Bacillus, Microbacterium, Brevibacterium, Corynebacterium и Pseudomonas.
[27] Хозяин в соответствии с [24], который является эукариотом.
[28] Хозяин в соответствии с [27], где эукариотом являются клетки дрожжей, нитчатых грибов или насекомых.
[29] Хозяин в соответствии с [28], где дрожжами являются дрожжи, принадлежащие к роду, выбранному из группы, состоящей из Saccharomyces, Schizosaccharomyces, Kluyveromyces, Trichosporon, Schwanniomyces, Pichia, Candida, Yarrowia и Hansenula.
[30] Хозяин в соответствии с [29], где дрожжами, принадлежащими к роду Saccharomyces, являются Saccharomyces cerevisiae, дрожжами, принадлежащими к роду Schizosaccharomyces, являются Schizosaccharomyces pombe, дрожжами, принадлежащими к роду Kluyveromyces, являются Kluyveromyces lactis, дрожжами, принадлежащими к роду Trichosporon, являются Trichosporon pullulans, дрожжами, принадлежащими к роду Schwanniomyces, являются Schwanniomyces alluvius, дрожжами, принадлежащими к роду Pichia, являются Pichia pastoris, дрожжами, принадлежащими к роду Candida, являются Candida albicans, дрожжами, принадлежащими к роду Yarrowia, являются Yarrowia lipolytica, а дрожжами, принадлежащими к роду Hansenula, являются Hansenula polymorpha.
[31] Хозяин в соответствии с [28], где нитчатыми грибами являются нитчатые грибы, принадлежащие к роду, выбранному из группы, состоящей из Aspergillus, Penicillium и Muсor.
[32] Хозяин в соответствии с [31], где нитчатыми грибами, принадлежащими к роду Aspergillus, являются Aspergillus oryzae; нитчатыми грибами, принадлежащими к роду Penicillium, являются Penicillium chrysogenum, а нитчатыми грибами, принадлежащими к Muсor, являются Muсor fragilis.
[33] Хозяин в соответствии с [28], где клетками насекомых являются клетки насекомых отряда Жесткокрылых.
[34] Хозяин в соответствии с [28], где клетками насекомых являются клетки насекомых, происходящих от Spodoptera frugiperda или клетки насекомых, происходящих от Trichoplusia ni.
[35] Продукт, включающий модифицированный фиброин по любому из [1]-[18] и выбранный из группы, состоящей из волокна, пряжи, нитей, пленки, пены, сферы, нанофибрилл, гидрогеля, смолы и их эквивалентов.
Эффекты изобретения
[0013] В соответствии с настоящим изобретением может быть получен модифицированный фиброин, имеющий более высокую продуктивность при сохранении прочности и растяжимости фиброина. Поскольку считается, что мотив GGX и мотив GPGXX фиброина способствуют растяжимости волокна фиброина, то было высказано предположение, что замена глицинового остатка (G) в этих мотивах на другой аминокислотный остаток, будет значительно влиять на растяжимость этого волокна фиброина. Однако, авторами настоящего изобретения было обнаружено, что замена одного G в мотиве GGX и в мотиве GPGXX другой аминокислотой не влияет на растяжимость волокна фиброина при сохранении другого оставшегося G, что также может значительно повысить количество продукта в рекомбинантной системе продуцирования белка. Такой неожиданный эффект был обнаружен при осуществлении настоящего изобретения.
Краткое описание чертежей
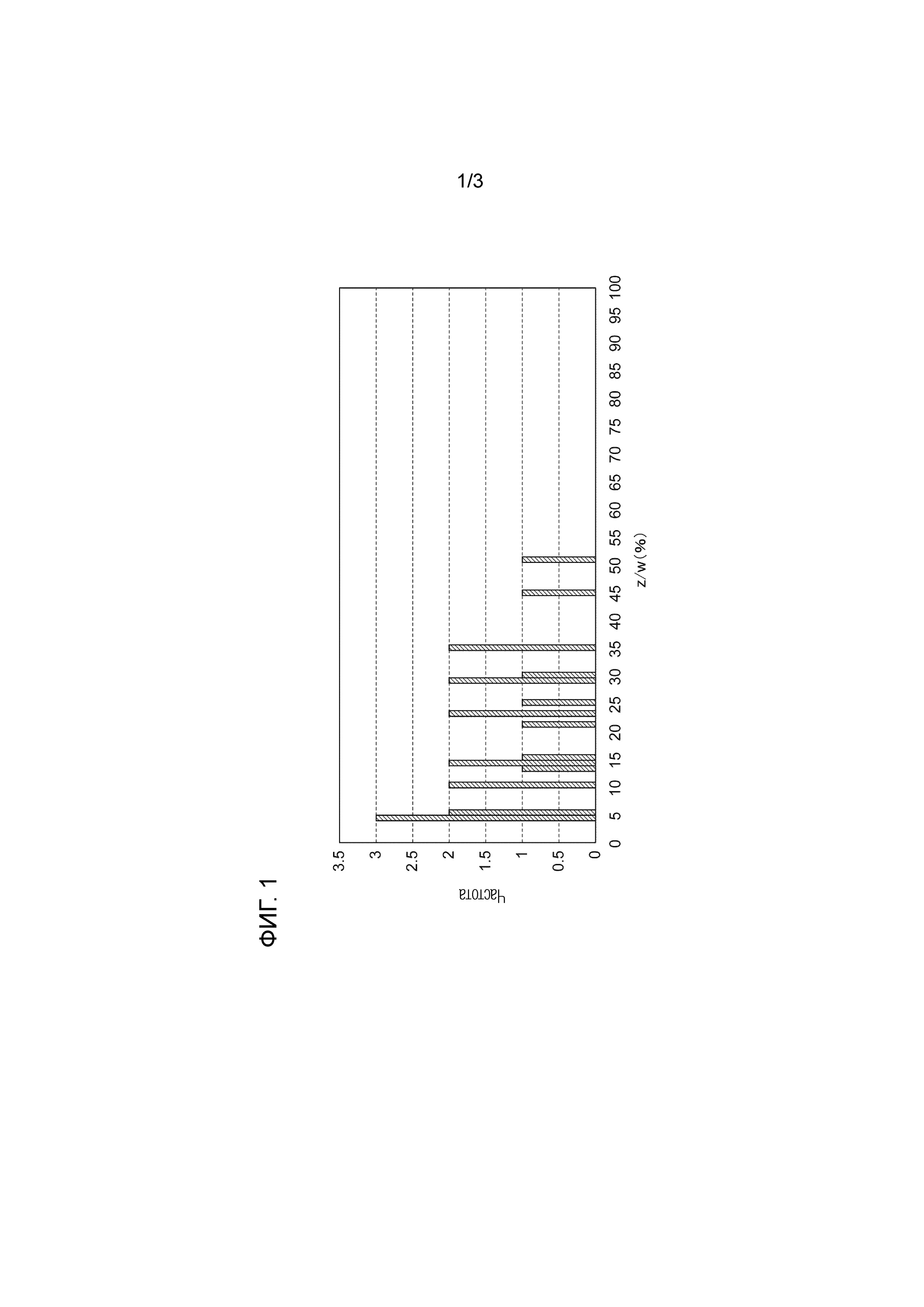
[0014] На фиг. 1 представлена диаграмма, иллюстрирующая распределение величин z/w (%) природного фиброина.
На фиг. 2 схематически представлена диаграмма, на которой показана последовательность домена модифицированного фиброина.
На фиг. 3 представлена диаграмма, иллюстрирующая распределение величин x/y (%) природного фиброина.
Варианты осуществления изобретения
[0015] Ниже подробно описаны варианты осуществления настоящего изобретения. Однако, настоящее изобретение не ограничивается этими вариантами.
[0016] [Модифицированный фиброин]
Модифицированный фиброин согласно изобретению представляет собой белок, включающий последовательность домена, представленную формулой 1: [мотив (A)n-REP]m. В модифицированном фиброине, аминокислотная последовательность (N-концевая последовательность и С-концевая последовательность) может быть также присоединена к N-концевой стороне или к С-концевой стороне последовательности домена или к обеим сторонам. N-концевая последовательность и С-концевая последовательность обычно представляют собой, хотя и не ограничиваются ими, области, которые не имеют повторяющихся аминокислотных мотивов, характерных для фиброина, и состоят приблизительно из 100 аминокислотных остатков.
[0017] Используемый здесь термин «модифицированный фиброин» означает фиброин, в котором последовательность домена отличается от аминокислотной последовательности природного фиброина. Используемый здесь термин «природный фиброин» также означает белок, включающий последовательность домена, представленную формулой 1: [мотив (A)n-REP]m.
[0018] «Модифицированный фиброин» может представлять собой фиброин, аминокислотная последовательность которого была модифицирована на основе природного фиброина (например, фиброин, аминокислотная последовательность которого была модифицирована путем модификации генной последовательности клонированного природного фиброина), или фиброин, сконструированый искусственно и синтезированный независимо от природного фиброина (например, фиброин, имеющий нужную аминокислотную последовательность и полученный путем химического синтеза нуклеиновой кислоты, кодирующей сконструированную аминокислотную последовательность), при условии, что такой фиброин будет иметь аминокислотную последовательность, входящую в объем настоящего изобретения.
[0019] Используемый здесь термин «последовательность домена» означает аминокислотную последовательность, продуцирующую кристаллическую область (которая обычно соответствует мотиву (A)n аминокислотной последовательности) и аморфную область (которая обычно соответствует REP аминокислотной последовательности), характерную для фиброина, и означает аминокислотную последовательность, представленную формулой 1: [мотив (A)n-REP]m. В настоящей заявке, мотив (A)n представляет собой аминокислотную последовательность, состоящую из 4-20 аминокислотных остатков, а число аланиновых остатков составляет 83% или более от общего числа аминокислотных остатков в мотиве (A)n. REP представляет собой аминокислотную последовательность, состоящую из 10-200 аминокислотных остатков. m равно целому числу от 8 до 300. Множество мотивов (A)n может представлять собой одну и ту же аминокислотную последовательность или различные аминокислотные последовательности. Множество REP может представлять собой одну и ту же аминокислотную последовательность или различные аминокислотные последовательности.
[0020] Мотив (A)n может быть сконструирован так, чтобы число аланиновых остатков составляло 83% или более от общего числа аминокислотных остатков в мотиве (A)n, а предпочтительно, 86% или более, более предпочтительно, 90% или более, еще более предпочтительно, 95% или более, а наиболее предпочтительно, 100% (это означает, что мотив (A)n состоит только из аланиновых остатков). При этом, предпочтительно, чтобы по меньшей мере семь мотивов из множества мотивов (A)n в последовательности домена состояли только из аланиновых остатков. Выражение «состоит только из аланиновых остатков» означает, что мотив (A)n имеет аминокислотную последовательность, представленную (A)n (где A представляет собой аланиновый остаток, а n равно целому числу от 4 до 20, а предпочтительно, целому числу от 4 до 16).
[0021] Модифицированный фиброин согласно одному из вариантов осуществления изобретения имеет аминокислотную последовательность, где последовательность домена имеет пониженное содержание глициновых остатков по сравнению с природным фиброином. Можно сказать, что модифицированный фиброин имеет аминокислотную последовательность, эквивалентную аминокислотной последовательности, в которой по меньшей мере один или множество глициновых остатков в REP заменены другим аминокислотным остатком по сравнению с природным фиброином.
[0022] В модифицированном фиброине согласно одному варианту осуществления изобретения, предпочтительно, чтобы последовательность домена имела аминокислотную последовательность, эквивалентную аминокислотной последовательности, в которой по меньшей мере в одной последовательности мотива, выбранной из GGX и GPGXX (где X представляет собой аминокислотный остаток, не являющийся глицином) в REP, один глициновый остаток в одной или во множестве последовательностей мотивов был заменен другим аминокислотным остатком по сравнению с природным фиброином. При такой конфигурации, эффект настоящего изобретения является более выраженным.
[0023] В модифицированном фиброине согласно одному варианту осуществления изобретения, более предпочтительно, чтобы отношение последовательностей мотива, в которых глициновый остаток был заменен другим аминокислотным остатком, составляло 10% или более от всей последовательности мотива. Это позволяет достичь более стабильного эффекта согласно изобретению, при котором количество продуцируемого фиброина в рекомбинантной системе продуцирования белка может быть значительно повышено без снижения растяжимости.
[0024] Модифицированный фиброин согласно варианту осуществления изобретения может также иметь, помимо модификации глицинового остатка в REP, описанном выше, модификации в аминокислотной последовательности, а именно, замену, делецию, инсерцию и/или добавление одного или множества аминокислотных остатков по сравнению с природным фиброином.
[0025] Модифицированный фиброин согласно варианту осуществления изобретения может быть получен, например, путем замены одного или множества глициновых остатков в REP другим аминокислотным остатком в генной последовательности клонированного природного фиброина. Кроме того, например, модифицированный фиброин согласно варианту осуществления изобретения может быть также получен путем конструирования аминокислотной последовательности с заменой одного или множества глициновых остатков в REP другим аминокислотным остатком в аминокислотной последовательности природного фиброина, и путем химического синтеза нуклеиновой кислоты, кодирующей сконструированную аминокислотную последовательность. В любом случае, помимо модификации, а именно, замены одного или множества глициновых остатков в REP другим аминокислотным остатком в аминокислотной последовательности природного фиброина, в эту аминокислотную последовательность могут быть введены и другие модификации, а именно, замена, делеция, инсерция и/или добавление одного или множества аминокислотных остатков. Замена, делеция, инсерция и/или добавление аминокислотных остатков могут быть осуществлены хорошо известными методами, такими как сайт-направленный мутагенез. В частности, это может быть осуществлено методом, описанным в литературе, например, в публикациях Nucleic Acid Res. 10, 6487 (1982) и Methods in Enzymology, 100, 448 (1983).
[0026] Природный фиброин представляет собой белок, включающий последовательность домена, представленную формулой 1: [мотив (A)n-REP]m, а в частности, например, фиброин, продуцируемый насекомыми или пауками.
[0027] Примерами фиброина, продуцируемого насекомыми, являются белки шелка, продуцируемые шелковыми червями, такими как Bombyx mori, Bombyx mandarina, Antheraea yamamai, Anteraea pernyi, Eriogyna pyretorum, Pilosamia Cynthia ricini, Samia cynthia, Caligura japonica, Antheraea mylitta и Antheraea assama; и белки шелка шершня, продуцируемые личинками Vespa simillima xanthoptera.
[0028] Более конкретным примером фиброина, продуцируемого насекомыми, может быть L-цепь фиброина шелковых червей (GenBank рег. № M76430 (нуклеотидная последовательность), AAA27840.1 (аминокислотная последовательность)).
[0029] Примерами фиброина, продуцируемого пауками, являются белки шелка паука, продуцируемые пауками, принадлежащими к роду Araneus, такими как Araneus ventricosus,Araneus diadematus, Araneus pinguis, Araneus pentagrammicus и Araneus nojimai; пауками, принадлежащими к роду Neoscona, такими как Neoscona scylla, Neoscona nautica, Neoscona adianta и Neoscona scylloides; пауками, принадлежащими к роду Pronus, такими как Pronous minutes; пауками, принадлежащими к роду Cyrtarachne, такими как Cyrtarachne bufo и Cyrtarachne inaequalis; пауками, принадлежащими к роду Gasteracantha, такими как Gasteracantha kuhli и Gasteracantha mammosa; пауками, принадлежащими к роду Ordgarius, такими как Ordgarius hobsoni и Ordgarius sexspinosus; пауками, принадлежащими к роду Argiope, такими как Argiope amoena,Argiope minuta и Argiope bruennich; пауками, принадлежащими к роду Arachnura, такими как Arachnura logio; пауками, принадлежащими к роду Acusilas, такими как Acusilas cocciens; пауками, принадлежащими к роду Cytophora, такими как Cyrtophora moluccensis, Cyrtophora exanthematica и Cyrtophora unicolor; пауками, принадлежащими к роду Poltys, такими как Poltys illepidus; пауками, принадлежащими к роду Cyclosa, такими как Сyclosa octotuberculata, Cyclosa sedeculata, Cyclosa vallata и Cyclosa atrata; и пауками, принадлежащими к роду Chorizopes, такими как Chorizopes nipponicus; и белки шелка паука, продуцируемые пауками, принадлежащими к роду Tetragnatha, такими как Tetragnatha praedonia, Tetragnatha maxillosa, Tetragnatha extensa и Tetragnatha squamata; пауками, принадлежащими к роду Leucauge, такими как Leucauge magnifica, Leucauge blanda и Leucauge subblanda; пауками, принадлежащими к роду Nephila, такими как Nephila clavata и Nephila pilipes; пауками, принадлежащими к роду Menosira, такими как Menosira ornata; пауками, принадлежащими к роду Dyschiriognatha, такими как Dyschiriognatha tenera; пауками, принадлежащими к роду Latrodectus, такими как Latrodectus mactans, Latrodectus hasseltii, Latrodectus geometricus и Latrodectus tradecimguttatus, и пауками, принадлежащими к семейству Tetragnathidae, такими как пауки, принадлежащие к роду Euprosthenops. Примерами белков шелка паука являются белки волокна, используемого пауком для перемещения, такие как MaSp (MaSpI и MaSp2), ADF (ADF 3 и ADF 4) и MiSp (MiSp1 и MiSp2).
[0030] Более конкретными примерами фиброина, продуцируемого пауками, являются фиброин-3 (adf-3) [происходящий от Araneus diadematus] (GenBank рег. № AAC47010 (аминокислотная последовательность), U47855 (нуклеотидная последовательность), фиброин-4 (adf-4) [происходящий от Araneus diadematus] (GenBank рег. № AAC47011 (аминокислотная последовательность), U47856 (нуклеотидная последовательность), белок спидроин шелка для перемещения 1 [происходящий от Nephila clavipes] (GenBank рег. № AAC04504 (аминокислотная последовательность), U37520 (нуклеотидная последовательность), мажорный углообразный спидроин 1 [происходящий от Latrodectus hesperus] (GenBank рег. № ABR68856 (аминокислотная последовательность)), EF595246 (нуклеотидная последовательность)), белок спидроин шелка для перемещения 2 [происходящий от Nephila clavata (GenBank рег. № AAL32472 (аминокислотная последовательность), AF441245 (нуклеотидная последовательность)), мажорный бутылочнообразный спидроин 1 [происходящий от Euprosthenops australis] (GenBank рег. № CAJ00428 (аминокислотная последовательность), AJ973155 (нуклеотидная последовательность)) и мажорный бутылочнообразный спидроин 2 [Euprosthenops australis] (GenBank рег. № CAM32249.1 (аминокислотная последовательность), AM490169 (нуклеотидная последовательность)), минорный бутылочнообразный белок 1 [Nephila clavipes] (GenBank рег. № AAC14589.1 (аминокислотная последовательность)), минорный бутылочнообразный белок 2 [Nephila clavipes] (GenBank рег. № AAC14591.1 (аминокислотная последовательность)) и белок, подобный минорному бутылочнообразному спидроину [Nephilengys cruentata] (GenBank рег. № ABR37278.1 (аминокислотная последовательность)).
[0031] В качестве более конкретного примера природного фиброина может быть также упомянут фиброин, имеющий последовательность, информация о которой имеется в NCBI GenBank. Так, например, эта информация может быть подтверждена путем извлечения последовательности, в которой спидроин, бутылочнообразный белок, фиброин, «шелк и полипептид» или «шелк и белок» определены как ключевое слово в файле DEFINITION для последовательностей, содержащих INV в качестве раздела DIVISION для получения информации о последовательности, зарегистрированной в NCBI GenBank, то есть, о последовательностях, в которых конкретная строка символов для продуктов взята из CDS, или о последовательностях, в которых конкретная строка символов взята из SOURCE для TISSUE TYPE.
[0032] Модифицированный фиброин согласно другому варианту осуществления изобретения включает последовательность домена, представленную формулой 1: [мотив (A)n-REP]m, и имеет аминокислотную последовательность, где z/w составляет 50,9% или более в случае, когда общее число аминокислотных остатков в аминокислотной последовательности, состоящей из мотива XGX (где X представляет собой аминокислотный остаток, не являющийся глицином), содержащегося во всех REP в последовательности, за исключением последовательности мотива (A)n, расположенного, в основном, с C-концевой стороны по отношению к С-концу последовательности домена, определено как z, а общее число аминокислотных остатков в последовательности, за исключением последовательности мотива (A)n, расположенного, в основном, с C-концевой стороны по отношению к С-концу последовательности домена, определено как w. Поскольку содержание глициновых остатков в модифицированном фиброине согласно варианту осуществления изобретения снижается, то отношение, при котором величина z/w, соответствующая отношению содержания аминокислотной последовательности, состоящей из XGX, входит в определенные выше интервалы, является высоким.
[0033] В модифицированном фиброине согласно варианту осуществления изобретения, предпочтительно, чтобы отношение содержания аминокислотной последовательности, состоящей из XGX, было увеличено путем замены одного глицинового остатка мотива GGX другим аминокислотным остатком. В модифицированном фиброине согласно варианту осуществления изобретения, отношение содержания аминокислотной последовательности, состоящей из GGX в последовательности домена, составляет, предпочтительно, 6% или менее, более предпочтительно, 4% или менее, а еще более предпочтительно, 2% или менее. Отношение содержания аминокислотной последовательности, состоящей из GGX в последовательности домена, может быть вычислено таким же методом, как и метод вычисления отношения содержания (z/w) аминокислотной последовательности, состоящей из мотива XGX, описанного ниже.
[0034] Метод вычисления z/w более подробно описан ниже. Сначала, аминокислотную последовательность, состоящую из XGX, выделяют из всех REP, содержащихся в последовательности, за исключением последовательности мотива (A)n, расположенного, в основном, с C-концевой стороны по отношению к С-концу последовательности домена. Общее число аминокислотных остатков, составляющих XGX, равно z. Так, например, в случае, когда было выделено 50 аминокислотных последовательностей, состоящих из XGX (неперекрывающихся), z равен 50 × 3=150. Кроме того, например, в случае, когда X (центральный X), содержащийся в двух XGX, является таким же, как и в случае аминокислотной последовательности, состоящей из XGXGX, то эту величину вычисляют путем вычитания перекрывающейся части (в случае XGXGX, это число равно 5 аминокислотным остаткам). w означает общее число аминокислотных остатков, содержащихся в последовательности, за исключением последовательности мотива (A)n, расположенного, в основном, с C-концевой стороны по отношению к С-концу последовательности домена. Так, например, в случае последовательности домена, представленной на фиг. 2, w равно 4+50+4+100+4+10+4+20+4+30=230 (за исключением последовательности мотива (A)n, расположенного, в основном, с C-концевой стороны). Затем, z/w (%) может быть вычислено путем деления z на w.
[0035] Ниже будет описано отношение z/w в природном фиброине. Сначала, как описано выше, 663 типа фиброина (415 типов фиброина, происходящих, среди прочих, от пауков) были выделены после подтверждения информации об аминокислотной последовательности фиброинов, имеющейся в NCBI GenBank, репрезентативным методом. z/w вычисляли вышеописанным методом вычисления для аминокислотных последовательностей природного фиброина, которые включают последовательность домена, представленную формулой 1: [мотив (A)n-REP]m, и в которых отношение содержания аминокислотных последовательностей, состоящих из GGX, в фиброине, составляет 6% или менее от общего числа выделенных фиброинов. Результаты представлены на фиг. 1. На фиг. 1, горизонтальная ось соответствует z/w (%), а вертикальная ось соответствует частоте. Как видно на фиг. 1, z/w в природном фиброине составляет менее, чем 50,9% (наибольшая величина 50,86%).
[0036] В модифицированном фиброине согласно варианту осуществления изобретения, z/w предпочтительно, составляет 50,9% или более, более предпочтительно, 56,1% или более, еще более предпочтительно, 58,7% или более, еще более предпочтительно, 70% или более, а особенно предпочтительно, 80% или более. Верхний предел z/w не имеет конкретных ограничений, но обычно, он составляет, например, 95% или менее.
[0037] Модифицированный фиброин согласно варианту осуществления изобретения может быть получен, например, путем замены и модификации по меньшей мере части нуклеотидной последовательности, кодирующей глициновый остаток в генной последовательности клонированного природного фиброина так, чтобы эта последовательность кодировала другой аминокислотный остаток. В этом случае, один глициновый остаток в мотиве GGX и в мотиве GPGXX может быть выбран как модифицированный глициновый остаток, а замена может быть осуществлена так, чтобы z/w составляло 50,9% или более. Альтернативно, модифицированный фиброин согласно варианту осуществления изобретения может быть также получен, например, путем конструирования аминокислотной последовательности, удовлетворяющей каждому из вышеуказанных вариантов, из аминокислотной последовательности природного фиброина, и химического синтеза нуклеиновой кислоты, кодирующей сконструированную аминокислотную последовательность. В любом случае, помимо модификации, а именно, замены глицинового остатка в REP другим аминокислотным остатком в аминокислотной последовательности природного фиброина, в эту аминокислотную последовательность могут быть введены и другие модификации, а именно, замена, делеция, инсерция и/или добавление одного или множества аминокислотных остатков.
[0038] Другие вышеупомянутые аминокислотные остатки не имеют конкретных ограничений, при условии, что такой аминокислотный остаток не является глициновым остатком, а предпочтительно, таким остатком являются гидрофобный аминокислотный остаток, такой как валиновый (V) остаток, лейциновый (L) остаток, изолейциновый (I) остаток, метиониновый (M) остаток, пролиновый (P) остаток, фенилаланиновый (F) остаток, или триптофановый (W) остаток, или гидрофильный аминокислотный остаток, такой как глутаминовый (Q) остаток, аспарагиновый (N) остаток, сериновый (S) остаток, лизиновый (K) остаток, или остаток глутаминовой кислоты (E), из которых более предпочтительными являются валиновый (V) остаток, лейциновый (L) остаток, изолейциновый (I) остаток или глутаминовый (Q) остаток, а еще более предпочтительным является глутаминовый (Q) остаток.
[0039] В модифицированном фиброине согласно изобретению, предпочтительно, чтобы последовательность домена имела аминокислотную последовательность, в которой, помимо снижения содержания глициновых остатков, было также снижено содержание мотива (A)n по сравнению с природным фиброином. При такой конфигурации, эффект настоящего изобретения является более выраженным. Можно сказать, что последовательность домена модифицированного фиброина имеет аминокислотную последовательность, эквивалентную аминокислотной последовательности, в которой один или множество мотивов (A)n были делетированы, а также по меньшей мере один или множество глициновых остатков в REP были заменены другим аминокислотным остатком по сравнению с природным фиброином.
[0040] Ниже описан конкретный вариант последовательности домена, в которой было снижено содержание мотива (A)n.
Хотя из описания настоящей заявки было исключено описание снижения содержания глициновых остатков, однако, каждый из вышеуказанных вариантов относится к такому снижению содержания глициновых остатков, и каждый из последующих вариантов относится к снижению содержания мотива (A)n, которые могут быть произвольно объединены.
[0041] В модифицированном фиброине согласно одному из вариантов осуществления изобретения, последовательность домена имеет аминокислотную последовательность, эквивалентную аминокислотной последовательности, в которой по меньшей мере один мотив (A)n на 1-3 мотива (A)n,расположенных от N-концевой стороны до С-концевой стороны, был делетирован по сравнению с природным фиброином.
[0042] В модифицированном фиброине согласно другому варианту осуществления изобретения, последовательность домена имеет аминокислотную последовательность, эквивалентную аминокислотной последовательности, в которой по меньшей мере два последовательно расположенных мотива (A)n с делециями и один мотив (A)n с делецией повторяются в указанном порядке от N-концевой стороны до C-концевой стороны по сравнению с природным фиброином.
[0043] В модифицированном фиброине согласно другому варианту осуществления изобретения, последовательность домена имеет аминокислотную последовательность, эквивалентную аминокислотной последовательности, в которой по меньшей мере мотив (A)n через каждые два положения был делетирован от N-концевой стороны до C-концевой стороны.
[0044] Поскольку считается, что мотив (A)n фиброина тесно ассоциируется с прочностью (прочностью при нагрузке и ударной вязкостью) фиброина, то были проведены дополнительные исследования и разработки по изучению повышения содержания мотива (A)n, и было высказано предположение, что прочность значительно снижается по мере снижения мотивов (A)n. Однако, авторами настоящего изобретения было обнаружено, что даже в случае снижения содержания мотивов (A)n, прочность при нагрузке существенно не снижается, а количество продукта в рекомбинантной системе продуцирования белка может значительно увеличиваться одновременно с повышением ударной вязкости и растяжимости. Такой неожиданный эффект был также обнаружен для модифицированного фиброина согласно варианту осуществления изобретения.
[0045] В одном из вариантов осуществления изобретения, последовательность домена модифицированного фиброина может имть аминокислотную последовательность, эквивалентную аминокислотной последовательности, в которой было делетировано 10-40% мотива (A)n по сравнению с природным фиброином. В случае, если снижение содержания мотивов (A)n находится в этом интервале, то могут наблюдаться стабильные эффекты, то есть, количество продуцирования фиброина в рекомбинантной системе продуцирования белка может значительно повышаться без существенного снижения прочности при нагрузке, и может также повышаться ударная вязкость и растяжимость.
[0046] В другом варианте осуществления изобретения, модифицированный фиброин имеет аминокислотную последовательность, в которой максимальная величина x/y равна 20% или более, в случае, если ряд аминокислотных остатков в REP, состоящем из двух смежных звеньев [мотив (A)n-REP], расположен последовательно от N-концевой стороны до C-концевой стороны, а число аминокислотных остатков в REP, имеющем наименьшее число аминокислотных остатков, было определено как 1; общее число аминокислотных остатков в двух смежных звеньях [мотив (A)n-REP], где отношение числа аминокислотных остатков в другом REP составляет 1,8-11,3, было определено как x, а общее число аминокислотных остатков последовательности домена было определено как y.
[0047] Метод вычисления x/y будет более подробно описан со ссылкой на фиг. 2. На фиг. 2 представлена последовательность домена, за исключением N-концевой последовательности и C-концевой последовательности модифицированного фиброина. Эта последовательность домена имеет последовательность «мотив (A)n -первый REP (50 аминокислотных остатков)- мотив (A)n-второй REP (100 аминокислотных остатков)-мотив (A)n-третий REP (10 аминокислотных остатков)- мотив (A)n-четвертый REP (20 аминокислотных остатков)- мотив (A)n-пятый REP (30 аминокислотных остатков)-мотив (A)n с N-концевой стороны (с левой стороны).
[0048] Два смежных звена [(мотив (A)n-REP] последовательно отбирали с N-концевой стороны до C-концевой стороны так, чтобы они не перекрывались. При этом, может присутствовать неотобранное звено [(мотив (A)n-REP]. На фиг. 2 показан паттерн 1 (сравнение между первым REP и вторым REP и сравнение между третьим REP и четвертым REP), паттерн 2 (сравнение между первым REP и вторым REP и сравнение между четвертым REP и пятым REP), паттерн 3 (сравнение между вторым REP и третьим REP и сравнение между четвертым REP и пятым REP), и паттерн 4 (сравнение между первым REP и вторым REP). Помимо этих методов отбора могут быть также применены и другие методы отбора.
[0049] Затем, для каждого паттерна сравнивают число аминокислотных остатков каждого REP в выбранных двух смежных звеньях [(мотив (A)n-REP]. Сравнение осуществляют путем вычисления отношения числа аминокислотных остатков другого REP в случае, когда один REP, имеющий меньшее число аминокислотных остатков, принимается за 1. Так, например, в случае сравнения первого REP (50 аминокислотных остатков) и второго REP (100 аминокислотных остатков), отношение числа аминокислотных остатков второго REP составляет 100/50=2 в случае, когда первый REP, имеющий меньшее число аминокислотных остатков, принимается за 1. Аналогичным образом, в случае сравнения четвертого REP (20 аминокислотных остатков) и пятого REP (30 аминокислотных остатков), отношение числа аминокислотных остатков пятого REP составляет 30/20=1,5 в случае, когда четвертый REP, имеющий меньшее число аминокислотных остатков, принимается за 1.
[0050] На фиг. 2, серия звеньев [(мотив (A)n-REP], где отношение числа аминокислотных остатков другого REP составляет от 1,8 до 11,3 в случае, когда один REP, имеющий меньшее число аминокислотных остатков, принимается за 1, показана сплошной линией. Далее, такое отношение будет называться отношением Гиза. Серия звеньев [(мотив (A)n-REP], где отношение числа аминокислотных остатков другого REP составляет менее, чем 1,8 или более, чем 11,3, в случае, когда один REP, имеющий меньшее число аминокислотных остатков, принимается за 1, показана пунктирной линией.
[0051] В каждом паттерне, число всех аминокислотных остатков двух смежных звеньев [(мотив (A)n-REP], показанных сплошными линиями (включая не только число аминокислотных остатков REP, но также и число аминокислотных остатков мотива (A)n), было объединено. Затем, объединенные таким образом общие величины сравнивают, а общую величину паттерна, где общая величина является максимальной (максимальная величина от общей величины) определяют как x. В примере, представленном на фиг. 2, общая величина паттерна 1 является максимальной.
[0052] Затем отношение x/y (%) может быть вычислено путем деления x на общее число y аминокислотных остатков последовательности домена.
[0053] Далее будет описано x/y в природном фиброине. Сначала, как описано выше, 663 типа фиброина (415 типов фиброина, происходящих, среди прочих, от пауков) были выделены после подтверждения информации об аминокислотной последовательности фиброинов, имеющейся в NCBI GenBank, репрезентативным методом. x/y вычисляли вышеописанным методом вычисления для аминокислотных последовательностей природного фиброина, которые включают последовательность домена, представленную формулой 1: [мотив (A)n-REP]m, и в которых по меньшей мере семь из множества мотивов (A)n в последовательности домена состоят только из аланиновых остатков по сравнению со всеми другими выделенными фиброинами. На фиг. 3 представлены результаты, полученные в случае, когда отношение Гиза составляет от 1:1,9 до 4,1. На фиг. 3, горизонтальная ось соответствует x/y (%), а вертикальная ось соответствует частоте. x/y в природном фиброине составляет менее, чем 64,2% (наибольшая величина 64,14%). В природном фиброине, который включает последовательность домена, представленную формулой 1: [(мотив (A)n-REP], и в котором по меньшей мере семь из множества мотивов (A)n в последовательности домена состоят только из аланиновых остатков (как описано выше, z/w в природном фиброине составляет менее, чем 46,4%), эффект наблюдается в случае, когда x/y составляет 20% или более.
[0054] В модифицированном фиброине согласно варианту осуществления изобретения, x/y может составлять 20% или более. x/y предпочтительно, составляет 40% или более, более предпочтительно, 50% или более, еще более предпочтительно, 60% или более, еще более предпочтительно, 64,2% или более, еще более предпочтительно, 70% или более, особенно предпочтительно, 75% или более, а наиболее предпочтительно, 80% или более. Верхний предел x/y не имеет конкретных ограничений, но он может составлять 100% или менее.
[0055] Модифицированный фиброин, включающий последовательность домена с пониженным содержанием мотивов (A)n, может быть получен, например, из генной последовательности клонированного природного фиброина путем делеции одной или множества последовательностей, кодирующих мотив (A)n так, чтобы отношение x/y составляло 20% или более. Кроме того, модифицированный фиброин, включающий последовательность домена с пониженным содержанием мотивов (A)n, может быть также получен, например, путем конструирования аминокислотной последовательности с делецией одного или множества мотивов (A)n из аминокислотной последовательности природного фиброина так, чтобы отношение x/y составляло 20% или более, и химического синтеза нуклеиновой кислоты, кодирующей сконструированную аминокислотную последовательность.
[0056] Более конкретным примером модифицированного фиброина согласно изобретению может быть модифицированный фиброин, включающий (i) аминокислотную последовательность, представленную в SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 10, или (ii) аминокислотную последовательность, которая на 90% или более идентична аминокислотной последовательности, представленной в SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 10.
[0057] Модифицированный фиброин (i) будет описан ниже. Аминокислотная последовательность, представленная в SEQ ID NO: 3, представляет собой аминокислотную последовательность, в которой все GGX в REP аминокислотной последовательности, представленной в SEQ ID NO: 1, соответствующей природному фиброину, были заменены на GQX. Аминокислотная последовательность, представленная в SEQ ID NO: 4, представляет собой аминокислотную последовательность, в которой мотив (A)n через каждые два положения от N-концевой стороны до С-концевой стороны был делетирован из аминокислотной последовательности, представленной в SEQ ID NO: 3, а перед С-концевой последовательностью был встроен один дополнительный [(мотив (A)n-REP]. Аминокислотной последовательностью, представленной в SEQ ID NО: 10, является аминокислотная последовательность, в которой два аланиновых остатка встроены с С-концевой стороны каждого мотива (A)n аминокислотной последовательности, представленной в SEQ ID NO: 4, и в которой другая часть глутаминовых остатков (Q) была заменена сериновым (S) остатком, а часть аминокислот с N-концевой стороны была делетирована так, чтобы их молекулярная масса была почти такой же, как молекулярная масса SEQ ID NО:4. Кроме того, аминокислотной последовательностью, представленной в SEQ ID NО: 2, является аминокислотная последовательность, в которой мотив (A)n через каждые два положения от N-концевой стороны до С-концевой стороны был делетирован из аминокислотной последовательности, представленной в SEQ ID NO: 1.
[0058] Величина z/w в аминокислотной последовательности, представленной в SEQ ID NO: 1 (соответствующей природному фиброину), составляет 46,8% (см. Таблицу 1). Величины z/w в аминокислотной последовательности, представленной в SEQ ID NO: 3, в аминокислотной последовательности, представленной в SEQ ID NO: 4, и в аминокислотной последовательности, представленной в SEQ ID NO: 10, составляют, соответственно, 58,7%, 70,1% и 66,1% (см. Таблицу 1). Кроме того, величины x/y в отношении Гиза от 1:1,8 до 11,3 для аминокислотных последовательностей, представленных в SEQ ID NN: 1, 3, 4 и 10, составляют, соответственно, 15,0%, 15,0%, 93,4% и 92,7% (см. Таблицы 2-5).
[0059] [Таблица 1]
[0060] [Таблица 2]
[0061] [Таблица 3]
[0062] [Таблица 4]
[0063] [Таблица 5]
[0064] Модифицированный фиброин (i) может состоять из аминокислотной последовательности, представленной в SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 10.
[0065] Модифицированный фиброин (ii) включает аминокислотную последовательность, которая на 90% или более идентична аминокислотной последовательности, представленной в SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 10. Модифицированный фиброин (ii) также представляет собой белок, включающий последовательность домена, представленную формулой 1: [мотив (A)n-REP]m. Идентичность последовательностей составляет, предпочтительно, 95% или более.
[0066] Предпочтительно, чтобы модифицированный фиброин (ii) был на 90% или более идентичен аминокислотной последовательности, представленной в SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 10, а z/w составляло 50,9% или более в случае, когда общее число аминокислотных остатков в аминокислотной последовательности, состоящей из мотива XGX (где X представляет собой аминокислотный остаток, не являющийся глицином), содержащегося в REP, было определено как z, а общее число аминокислотных остатков REP в последовательности домена было определено как w.
[0067] Вышеупомянутый модифицированный фиброин может включать последовательность метки у N-конца или у С-конца или у обоих концов. Это может быть осуществлено в целях выделения, иммобилизации, детектирования и визуализации модифицированного фиброина.
[0068] Последовательностью метки может быть, например, аффинная метка со специфической аффинностью (способностью к аффинному связыванию) к другой молекуле. В качестве конкретного примера аффинной метки можно упомянуть гистидиновую метку (His-метку). His-метка представляет собой короткий пептид, в котором присутствует приблизительно 4-10 гистидиновых остатков в соответствующем порядке, и который специфически связывается с ионом металла, такого как никель, а поэтому, эта метка может быть использована для выделения модифицированного фиброина с помощью хроматографии посредством хелатного связывания с металлом. Конкретным примером последовательности метки может быть аминокислотная последовательность, представленная в SEQ ID NO: 5 (аминокислотная последовательность, включающая His-метку).
[0069] Кроме того, может быть также использована последовательность метки, такая как глутатион-S-трансфераза (GST), которая специфически связывается с глутатионом, или белок, связывающийся с мальтозой (MBP), который специфически связывается с мальтозой.
[0070] Кроме того, может быть также использована «эпитопная метка», участвующая в реакции «антиген-антитело». При добавлении пептида (эпитопа) в качестве последовательности метки, обладающей антигенными свойствами, антитело может связываться с эпитопом. Примерами эпитопных меток являются метка HA (пептидная последовательность гемаглютинина вируса гриппа), метка myc и метка FLAG. Модифицированный фиброин может быть легко очищен с использованием эпитопной метки с высокой специфичностью.
[0071] Может быть также использована последовательность метки, которая может быть расщеплена под действием специфической протеазы. Для выделения модифицированного фиброина, отщепленного от последовательности метки, может быть также проведена обработка белка, адсорбированного на последовательности метки, протеазой.
[0072] Более конкретным примером модифицированного фиброина, включающего последовательность метки, может быть модифицированный фиброин, включающий (iii) аминокислотную последовательность, представленную в SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 11 или (iv) аминокислотную последовательность, которая на 90% или более идентична аминокислотной последовательности, представленной в SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 11.
[0073] Аминокислотными последовательностями, представленными в SEQ ID NOs: 6, 7, 8, 9 и 11, являются аминокислотные последовательности, в которых аминокислотную последовательность, представленную в SEQ ID NO: 5 (включая His-метку), присоединяют у N-конца аминокислотных последовательностей, представленных в SEQ ID NOs: 1, 2, 3, 4 и 10, соответственно.
[0074] Модифицированный фиброин (iii) может состоять из аминокислотной последовательности, представленной в SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 11.
[0075] Модифицированный фиброин (iv) включает аминокислотную последовательность, которая на 90% или более идентична аминокислотной последовательности, представленной в SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 11. Модифицированный фиброин (iv) также представляет собой белок, включающий последовательность домена, представленную формулой 1: [мотив (A)n-REP]m. Идентичность последовательностей, предпочтительно, составляет 95% или более.
[0076] Предпочтительно, чтобы модифицированный фиброин (iv) был на 90% или более идентичен аминокислотной последовательности, представленной в SEQ ID NO: 8, SEQ ID NO: 9 или SEQ ID NO: 11, а z/w составляло 50,9% или более в случае, когда общее число аминокислотных остатков в аминокислотной последовательности, состоящей из мотива XGX (где X представляет собой аминокислотный остаток, не являющийся глицином), содержащегося в REP, было определено как z, а общее число аминокислотных остатков REP в последовательности домена было определено как w.
[0077] Вышеупомянутый модифицированный фиброин может включать секреторный сигнал для высвобождения белка, продуцируемого в рекомбинантной системе продуцирования белка, во внешнюю среду хозяина. Последовательность секреторного сигнала может быть соответствующим образом выбрана в зависимости от типа хозяина.
[0078] [Нуклеиновая кислота]
Нуклеиновая кислота согласно изобретению кодирует модифицированный фиброин согласно изобретению. Конкретными примерами нуклеиновых кислот являются нуклеиновые кислоты, кодирующие модифицированный фиброин, включающий аминокислотную последовательность, представленную в SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 10, или белок, имеющий аминокислотную последовательность (последовательность метки), представленную в SEQ ID NO: 5 и присоединенную к N-концу или C-концу или к обоим концам этих аминокислотных последовательностей или т.п.
[0079] Нуклеиновой кислотой согласно одному из вариантов осуществления изобретения является нуклеиновая кислота, которая гибридизуется с комплементарной цепью нуклеиновой кислоты, кодирующие модифицированный фиброин согласно изобретению в жестких условиях, и которая кодирует модифицированный фиброин, включающий последовательность домена, представленную формулой 1: [мотив (A)n-REP]m, где z/w составляет 50,9% или более в случае, когда общее число аминокислотных остатков в аминокислотной последовательности, состоящей из мотива XGX (где X представляет собой аминокислотный остаток, не являющийся глицином), содержащегося в REP, было определено как z, а общее число аминокислотных остатков REP в последовательности домена было определено как w.
[0080] Термин «жесткие условия» означает условия, при которых образуется так называемый специфический гибрид, а неспецифический гидрид не образуется. «Жесткими условиями» могут быть любые условия, а именно, условия низкой жесткости, умеренной жесткости и высокой жесткости. Термин «условия низкой жесткости» означает, что гибридизация происходит только в случае, когда идентичность этих последовательностей составляет по меньшей мере 85% или более, и такими условиями являются, например, условия гибридизации при 42°C с использованием 5×SSC, содержащего 0,5% ДСН. Термин «условия умеренной жесткости» означает, что гибридизация происходит только в случае, когда идентичность этих последовательностей составляет по меньшей мере 90% или более, и такими условиями являются, например, условия гибридизации при 50°C с использованием 5×SSC, содержащего 0,5% ДСН. Термин «условия высокой жесткости» означает, что гибридизация происходит только в случае, когда идентичность этих последовательностей составляет по меньшей мере 95% или более, и такими условиями являются, например, условия гибридизации при 60°C с использованием 5×SSC, содержащего 0,5% ДСН.
[0081] Нуклеиновой кислотой согласно одному из вариантов осуществления изобретения является нуклеиновая кислота, последовательность которой на 90% или более идентична последовательности нуклеиновой кислоты, кодирующей модифицированный фиброин согласно изобретению, и которая кодирует модифицированный фиброин, включающий последовательность домена, представленную формулой 1: [мотив (A)n-REP]m, где z/w составляет 50,9% или более в случае, когда общее число аминокислотных остатков в аминокислотной последовательности, состоящей из мотива XGX (где X представляет собой аминокислотный остаток, не являющийся глицином), содержащегося в REP, было определено как z, а общее число аминокислотных остатков REP в последовательности домена было определено как w. При этом, предпочтительно, чтобы идентичность последовательностей составляла 95% или более.
[0082] [Хозяин и экспрессионный вектор]
Экспрессионный вектор согласно изобретению имеет последовательность нуклеиновой кислоты согласно изобретению и одну или множество регуляторных последовательностей, функционально присоединенных к этой последовательности. Регуляторной последовательностью являтся последовательность (например, промотор, энхансер, последовательность, связывающаяся с рибосомой, или последовательность терминации транскрипции), которая регулирует экспрессию рекомбинантного белка в хозяине и может быть соответствующим образом выбрана в зависимости от типа хозяина. Тип экспрессионного вектора может быть соответствующим образом выбран в зависимости от типа хозяина, и такими векторами являются плазмидный вектор, вирусный вектор, космидный вектор, фосмидный вектор или искусственный хромосомный вектор.
[0083] Хозяином согласно изобретению является хозяин, который был трансформирован экспрессионным вектором согласно изобретению. В качестве хозяев могут быть использованы прокариоты и эукариоты, такие как дрожжи, нитчатые грибы, клетки насекомых, клетки животных и клетки растений.
[0084] Подходящим экспрессионным вектором может быть экспрессионный вектор, который может автономно реплицироваться в клетке-хозяине, либо он может быть введен в хромосому хозяина, и такой вектор содержит промотор в положении, в котором может транскрибироваться нуклеиновая кислота согласно изобретению.
[0085] В случае, когда в качестве хозяина используется прокариот, такой как бактерия, то предпочтительным экспрессионным вектором согласно изобретению является вектор, способный автономно реплицироваться в прокариоте, и такой вектор включает промотор, последовательность, связывающуюся с рибосомой, нуклеиновую кислоту согласно изобретению и последовательность терминации транскрипции. Может быть также включен ген, который находится под контролем промотора.
[0086] Примерами прокариотов являются микроорганизмы, принадлежэащие к роду Escherichia, Brevibacillus, Serratia, Bacillus, Microbacterium, Brevibacterium, Corynebacterium и Pseudomonas.
[0087] Примерами микроорганизмов, принадлежащих к роду Escherichia, являются Escherichia coli BL21 (Novagen, Inc.), Escherichia coli BL21 (DE3) (Life Technologies Corporation), Escherichia coli BLR (DE3) (Merck KGaA), Escherichia coli DH1, Escherichia coli GI698, Escherichia coli HB101, Escherichia coli JM109, Escherichia coli K5 (ATCC 23506), Escherichia coli KY3276, Escherichia coli MC1000, Escherichia coli MG1655 (ATCC 47076), Escherichia coli No. 49, Escherichia coli Rosetta (DE3) (Novagen, Inc.), Escherichia coli TB1, Escherichia coli Tuner (Novagen, Inc.), Escherichia coli Tuner (DE3) (Novagen, Inc.), Escherichia coli W1485, Escherichia coli W3110 (ATCC 27325), Escherichia coli XL1-Blue и Escherichia coli XL2-Blue.
[0088] Примерами микроорганизмов, принадлежащих к роду Brevibacillus, являются штаммы Brevibacillus agri, Brevibacillus borstelensis, Brevibacillus centrosporus, Brevibacillus formosus, Brevibacillus invokatus, Brevibacillus laterosporus, Brevibacillus limnophilus, Brevibacillus parabrevis, Brevibacillus reuszeri, Brevibacillus theramoruber, Brevibacillus brevis 47 (FERM BP-1223), Brevibacillus brevis 47K (FERM BP-2308), Brevibacillus brevis 47-5 (FERM BP-1664), Brevibacterium Bacillus brevis 47-5Q (JCM8975), Brevibacillus choshinensis HPD31 (FERM BP-1087), Brevibacillus choshinensis HPD31-S (FERM BP-6623), Brevibacillus choshinensis HPD31-OK (FERM BP-4573) и Brevibacillus choshinensis SP3 (полученные от Takara Bio., Inc.).
[0089] Примерами микроорганизмов, принадлежащих к роду Serratia, являются Serratia liquefaciens ATCC 14460, Serratia entomophila, Serratia ficaria, Serratia fonticola, Serratia grimesii, Serratia proteamaculans, Serratia odorifera, Serratia plymuthica и Serratia rubidaea.
[0090] Примерами микроорганизмов, принадлежащих к роду Bacillus, являются Bacillus subtilis и Bacillus amyloliquefaciens.
[0091] Примерами микроорганизмов, принадлежащих к роду Microbacterium, является Microbacteriumammoniaphilum ATCC 15354.
[0092] Примерами микроорганизмов, принадлежащих к роду Brevibacterium, являются Brevibacterium divaricatum (Corynebacterium glutamicum) ATCC 14020, Brevibacterium flavum (Corynebacterium glutamicum ATCC 14067) ATCC 13826, ATCC 14067, Brevibacterium immariophilum ATCC 14068, Brevibacterium lactofermentum (Corynebacterium glutamicum ATCC 13869) ATCC 13665, ATCC 13869, Brevibacterium roseum ATCC 13825, Brevibacterium saccharolyticum ATCC 14066, Brevibacterium tiogenitalis ATCC 19240, Brevibacterium album ATCC 15111 и Brevibacterium cerinum ATCC 15112.
[0093] Примерами микроорганизмов, принадлежащих к роду Corynebacterium, являются Corynebacterium ammoniagenes ATCC 6871, ATCC 6872, Corynebacterium glutamicum ATCC 13032, Corynebacterium acetoacidophilum ATCC 13870, Corynebacterium acetoglutamicum ATCC 15806, Corynebacterium alkanolyticum ATCC 21511, Corynebacterium kallunae ATCC 15991, Corynebacterium glutamicum ATCC 13020, ATCC 13032, ATCC 13060, Corynebacterium lilium ATCC 15990, Corynebacterium melassecola ATCC 17965, Corynebacterium thermoaminogenes AJ12340 (FERM BP-1539) и Corynebacterium herculis ATCC 13868.
[0094] Примерами микроорганизмов, принадлежащих к роду Pseudomonas, являются Pseudomonas putida, Pseudomonas fluorescens, Pseudomonas Brassicasearum, Pseudomonas fulva и Pseudomonas sp. D-0110.
[0095] Методом введения экспрессионного вектора в вышеупомянутую клетку-хозяина может быть любой метод, при условии, что он может быть применен для введения ДНК в клетку-хозяина. В качестве примера могут служить метод с использованием ионов кальция [Proc. Natl. Acad. Sci. USA, 69,2110 (1972)], метод протопластов (Публикация нерассмотренной заявки на патент Японии No. S63-248394) или метод, описанный в публикации Gene, 17, 107 (1982) или Molecular & General Genetics, 168, 111 (1979).
[0096] Трансформация микроорганизмов, принадлежащих к роду Brevibacillus, может быть осуществлена, например, методом Takahashi et al. (J. Bacteriol, 1983,156: 1130-1134), методом Takagi et al. (Agric. Biol.Chem, 1989,53: 3099-3100), или методом Okamoto et al. (Biosci.Biotechnol.Biochem, 1997,61: 202-203).
[0097] Примерами вектора, в который может быть введена нуклеиновая кислота согласно изобретению (далее называемого просто «вектором»), являются pBTrp2, pBTac1, pBTac2 (все они были закуплены у Boehringer Mannheim GmbH), pKK233-2 (полученный от Pharmacia Corporation), pSE280 (полученный от Invitrogen Corporation), pGEMEX-1 (полученный от Promega Corporation), pQE-8 (полученный от QIAGEN Corporation), pKYP10 (Публикация нерассмотренной заявки на патент Японии No. S58-110600), pKYP200 [Agric. Biol. Chem., 48, 669 (1984)], pLSA1 [Agric. Biol. Chem., 53,277 (1989)], pGEL1 [Proc. Natl. Acad. Sci. USA, 82,4306 (1985)], pBluescript II SK(-) (полученный от Stratagene Corporation), pTrs30 (сконструированный из Escherichia coli JM109/pTrS30 (FERM BP-5407)), pTrs32 [сконструированный из Escherichia coli JM109/pTrS32 (FERM BP-5408)], pGHA2 [сконструированный из Escherichia coli IGHA2 (FERM B-400), Публикация нерассмотренной заявки на патент Японии No. S60-221091], pTerm2 (US 4686191, US 4939094, US 5160735), pSupex, pUB110, pTP5, pC194, pEG400 [J. Bacteriol., 172,2392 (1990)], pGEX (полученный от Pharmacia Corporation) и pET (полученный от Novagen, Inc.).
[0098] В случае использования Escherichia coli в качестве хозяина, подходящим вектором может быть pUC18, pBluescriptII, pSupex, pET22b, pCold или т.п.
[0099] Конкретными примерами векторов, подходящих для микроорганизмов, принадлежащих к роду Brevibacillus, являются pUB110 или PHY500 (Публикация нерассмотренной заявки на патент Японии No. H2-31682), pNY700 (Публикация нерассмотренной заявки на патент Японии No. H4-278091), pHY4831 (J. Bacteriol, 1987,1239-1245), pNU200 (UDAKA Shidezou, Journal of the Agricultural Chemical of Japan 1987,61: 669-676), pNU100 (Appl.Microbiol.Biotechnol, 1989,30:75-80), pNU211 (J.Biochem, 1992,112:. 488-491), pNU211R2L5 (Публикация нерассмотренной заявки на патент Японии No. H7-170984), pNH301 (Appl. Environ. Microbiol, 1992,58: 525-531), pNH326, pNH400 (J. Bacteriol, 1995,177:745-749), pHT210 (Публикация нерассмотренной заявки на патент Японии No. H6-133782), pHT110R2L5 (Appl. Microbiol. Biotechnol, 1994,42: 358-363), которые известны как векторы Bacillus subtilis; и pNCO2 (Публикация нерассмотренной заявки на патент Японии No. 2002-238569), который представляет собой челночный вектор между Escherichia coli и микроорганизмом, принадлежащим к роду Brevibacillus.
[0100] Промоторы не имеют конкретных ограничений, при условии, что они могут функционировать в клетке-хозяине. Примерами являются промоторы, происходящие от Escherichia coli или фага, такие как промотор trp (Ptrp), промотор lac, промотор PL, промотор PR и промотор T7. Кроме того, могут быть также использованы промоторы, которые были искусственно сконструированы и модифицированы, такие как промотор (Ptrp× 2), в котором два Ptrp присоединены друг к другу последовательно; промотор tac, промотор lacT7 и промотор let I.
[0101] При этом предпочтительно, использовать плазмиду, где расстояние между последовательностью Шайна-Дальгарно, которая представляет собой последовательность связывания с рибосомой, и инициирующим кодоном, можно скорректировать до определенного размера (например, на 6-18 оснований). В экспрессионном векторе согласно изобретению, последовательность терминации транскрипции не всегда необходима для экспрессии нуклеиновой кислоты согласно изобретению, однако, предпочтительно, использовать последовательность терминации транскрипции, расположенную сразу за структурным геном.
[0102] Примерами эукариотических хозяев являются клетки дрожжей, нитчатых грибов (плесени и т.п.) и насекомых.
[0103] Примерами дрожжей являются дрожжи, принадлежащие к роду Saccharomyces, Schizosaccharomyces, Kluyveromyces, Trichosporon, Schwanniomyces, Pichia, Candida, Yarrowia, Hansenula и т.п. Более конкретными примерами дрожжей являются Saccharomyces cerevisiae, Schizosaccharomyces pombe, Kluyveromyces lactis, Kluyveromyces marxianus, Trichosporon pullulans, Schwanniomyces alluvius, Schwanniomyces occidentalis, Candida utilis, Pichia pastoris, Pichia angusta, Pichia methanolica, Pichia polymorpha, Pichia stipitis, Yarrowia lipolytica и Hansenula polymorpha.
[0104] Предпочтительно, чтобы, в случае использования дрожжей в качестве клетки-хозяина, экспрессионный вектор включал ориджин репликации (если необходима амплификация в хозяине), селективный маркер для размножения вектора в Escherichia coli, промотор и терминатор для экспрессии рекомбинантного белка в дрожжах, и маркер отбора на дрожжи.
[0105] В случае, если экспрессионным вектором является неинтегрирующийся вектор, то предпочтительно, чтобы этот вектор также включал автономно реплицирующуюся последовательность (ARS). Это позволяет повысить стабильность экспрессионных векторов в клетках (Myers, A. M., et al. (1986) Gene 45: 299-310).
[0106] Если в качестве хозяина используются дрожжи, то примерами векторов являются YEP13 (ATCC37115), YEp24 (ATCC37051), YCp50 (ATCC37419), YIp, pHS19, pHS15, pA0804, pHIL3Ol, pHIL-S1, pPIC9K, pPICZα, pGAPZα и pPICZ B.
[0107] Промоторы не имеют конкретных ограничений, при условии, что они могут экспрессироваться в дрожжах. Примерами промоторов являются промотор гликолитических генов, таких как ген гексозо-киназы, промотор PHO5, промотор PGK, промотор GAP, промотор ADH, промотор gal 1, промотор gal 10, промотор полипептида теплового шока, промотор MFα1, промотор CUP 1, промотор pGAP, промотор pGCW14, промотор AOX1 и промотор MOX.
[0108] В качестве метода введения экспрессионного вектора в дрожжи может быть применен любой метод, при условии, что он позволяет вводить ДНК в дрожжи. Примерами являются метод электропорации (Methods Enzymol., 194,182 (1990), метод сферопластов (Proc. Natl. Acad. Sci., USA, 81,4889 (1984)), метод с использованием ацетата лития (J. Bacteriol., 153,163 (1983)) и метод, описанный в Proc. Natl. Acad. Sci. USA, 75,1929 (1978).
[0109] Примерами нитчатых грибов являются грибы, принадлежащие к роду Acremonium, Aspergillus, Ustilago, Trichoderma, Neurospora, Fusarium, Humicola, Penicillium, Myceliophthora, Botrytis, Magnaporthe, Mucor, Metarhizium, Monascus, Rhizopus и Rizomucor.
[0110] Конкретными примерами нитчатых грибов являются Acremonium alabamense, Acremonium cellulolyticus, Aspergillus aculeatus, Aspergillus awamori, Aspergillus oryzae, Aspergillus sake, Aspergillus sojae, Aspergillus tubigensis, Aspergillus niger, Aspergillus nidulans, Aspergillus parasiticus, Aspergillus ficuum, Aspergillus phoeicus, Aspergillus foetidus, Aspergillus flavus, Aspergillus fumigatus, Aspergillus japonicus, Trichoderma viride, Trichoderma harzianum, Trichoderma reseei, Chrysosporium lucknowense, Thermoascus, Sporotrichum, Sporotrichum cellulophilum, Talaromyces, Thielavia terrestris, Thielavia, Neurospora crassa, Fusarium oxysporus, Fusarium graminearum, Fusarium venenatum, Humicola insolens, Penicillium chrysogenum, Penicillium camembert, Penicillium canescens, Penicillium emersonii, Penicillium funiculosum, Penicillium griseoroseum, Penicillium purpurogenum, Penicillium roqueforti, Myceliophtaora thermophilum, Mucor ambiguus, Mucor circinelloides, Mucor fragilis, Mucor hiemalis, Mucor inaequisporus, Mucor oblongiellipticus, Mucor racemosus, Mucor recurvus, Mucor saturninus, Mucor subtilissmus, Ogateae polymorpha, Phanerochaete chrysosporium, Rhizomucor miehei, Rhizomucor pusillus и Rhizopus arrhizus.
[0111] В случае, когда хозяином являются нитчатые грибы, то промотором может быть любой промотор гена, ассоциированного с гликолитической системой, гена, ассоциированного с конститутивной экспрессией, гена фермента, ассоциированного с гидролизом и т.п. Конкретными примерами являются гены amyB, glaA, agdA, glaB, TEF1, xynF1 танназы, No. 8AN, gpdA, pgkA, enoA, melO, sodM, catA и catB.
[0112] Введение экспрессионного вектора в нитчатые грибы может быть осуществлено известным стандартным методом. Примерами являются метод Cohen et al. (метод с использованием хлорида кальция) [Proc. Natl. Acad. Sci. USA, 69: 2110 (1972)], метод протопластов [Mol. Gen. Genet., 168: 111 (1979)], метод с использованием компетентных клеток [J. Mol. Biol., 56: 209 (1971)] и метод электропорации.
[0113] Клетками насекомых являются, например, клетки Жесткокрылых, а более конкретно, клетки насекомых, происходящих от Spodoptera frugiperda, такие как Sf9 и Sf21, и клетки насекомых, происходящих от Trichoplusia ni, такие как High 5.
[0114] В случае, когда в качестве хозяев используются клетки насекомых, примерами векторов являются бакуловирусы, такие как вирус ядерного полиэдроза Autographa californica, который представляет собой вирус, инфицирующий насекомых, принадлежащих к семейству Noktuidae (Baculovirus Expression Vectors, A Laboratory Manual, W.H.Freeman and Company, New York (1992)).
[0115] В случае, когда в качестве хозяев используются клетки насекомых, полипептид может быть экспрессирован методом, описанным, например, в руководстве Current Protocols in Molecular Biology, Baculovirus Expression Vectors, A Laboratory Manual, W. H. Freeman and Company, New York (1992), Bio/Technology, 6,47 (1988). То есть, вектор для переноса рекомбинантного гена и бакуловирус совместно вводят в клетку-хозяина с получением рекомбинантного вируса (экспрессионного вектора) в супернатанте культуры клеток насекомых, а затем рекомбинантный вирус снова вводят в клетку насекомого, в результате чего может экспрессироваться полипептид. Примерами векторов для переноса генов, используемых в вышеописанном методе, являются pVL1392, pVL1393 и pBlueBacIII (все они были получены от Invitorogen Corporation).
[0116] В качестве метода совместного введения рекомбинантного вектора для переноса генов и бакуловируса в клетки насекомых в целях конструирования рекомбинантного вируса может быть применен, например, метод с использованием фосфата кальция (Публикация нерассмотренной заявки на патент Японии No. Н2-227075), метод липофекции (Proc. Natl. Acad. Sci. USA, 84,7413 (1987)) или т.п.
[0117] Рекомбинантный вектор согласно изобретению также, предпочтительно, содержит селективный маркерный ген для отбора трансформанта. Так, например, в Escherichia coli, в качестве селективных маркерных генов могут быть использованы гены резистентности к различным лекарственным средствам, таким как тетрациклин, ампициллин и канамицин. Может быть также использован рецессивный селективный маркер, способный комплементировать генетическую мутацию, приводящую к ауксотрофии. В дрожжах, в качестве селективного маркерного гена может быть использован ген резистентности к генетицину, и может быть также использован ген, способный комплементировать генетическую мутацию, приводящую к ауксотрофии, или селективный маркер, такой как LEU2, URA3, TRP1 или HIS3. Примерами селективных маркерных генов нитчатых грибов являются маркерные гены, выбранные из группы, состоящей из гена niaD (Biosci. Biotechnol. Biochem., 59,1795-1797 (1995)), гена argB (Enzyme Microbiol. Technol, 6,386-389, (1984)), гена sC (Gene, 84,329-334, (1989)), гена ptrA (BiosciBiotechnol Biochem, 64,1416-1421, (2000)), гена pyrG (BiochemBiophys Res Commun, 112,284-289, (1983)), гена amdS (Gene, 26, 205-221, (1983)), гена резистентности к ауробазидину (Mol. Gen. Genet., 261,290-296, (1999)), гена резистентности к беномилу (Proc. Natl. Acad. Sci. USA, 83,4869-4873, (1986)), гена резистентности к гигромицину (Gene, 57,21-26, (1987)) и гена, комплементирующего ауксотрофию в присутствии лейцина. Кроме того, в случае, если хозяином является ауксотрофный мутантный штамм, то в качестве селективного маркерного гена может быть также использован ген дикого типа, комплементирующий ауксотрофию.
[0118] Отбор хозяина, трансформированного экспрессионным вектором согласно изобретению, может быть осуществлен с помощью гибридизации бляшек и гибридизации колоний с использованием зонда, который селективно связывается с нуклеиновой кислотой согласно изобретению. В качестве зонда может быть использован зонд, полученный путем модификации фрагмента неполной ДНК, амплифицированного ПЦР-методом на основе информации о последовательности нуклеиновой кислоты согласно изобретению, радиоизотопом или дигоксигенином.
[0119] (Продуцирование модифицированного фиброина)
В хозяине, трансформированном экспрессионным вектором согласно изобретению, модифицированный фиброин согласно изобретению может быть продуцирован посредством экспрессии нуклеиновой кислоты согласно изобретению. Что касается метода экспрессии, то продуцирование секреторного белка, экспрессия гибридного белка или т.п. могут быть осуществлены, помимо прямой экспрессии, методом, описанным в Molecular Cloning, 2-е издание. В случае экспрессии с использованием клеток дрожжей, клеток животных или клеток насекомых, модифицированный фиброин может быть получен в виде полипептида, к которому присоединены сахар или сахарная цепь.
[0120] Модифицированный фиброин согласно изобретению может быть получен, например, путем культивирования хозяина, трансформированного экспрессионным вектором согласно изобретению в культуральной среде, с последующим продуцированием и аккумуляцией модифицированного фиброина согласно изобретению в культуральной среде, и сбором модифицированного фиброина из культуральной среды. Культивирование хозяина согласно изобретению в культуральной среде может быть осуществлено методом, обычно применяемым для культивирования хозяина.
[0121] В случае, когда хозяином согласно изобретению является прокариот, такой как Escherichia coli, или эукариот, такой как дрожжи, то в качестве культуральной среды для хозяина согласно изобретению может быть использована любая природная среда и синтетическая среда, при условии, что такая среда будет содержать источник углерода, источник азота, неорганические соли и т.п., которые могут усваиваться хозяином, а поэтому являются эффективными для культивирования хозяина.
[0122] В качестве источника углерода может быть использован любой источник углерода, который может усваиваться хозяином. Примерами источников углерода, которые могут быть использованы, являются углеводы, такие как глюкоза, фруктоза, сахароза и мелассы, а также крахмал и гидролизаты крахмала, содержащие такие углеводы; органические кислоты, такие как уксусная кислота и пропионовая кислота, и спирты, такие как этанол и пропанол.
[0123] Примерами источников азота, которые могут быть использованы, являются аммониевые соли неорганических или органических кислот, такие как аммиак, хлорид аммония, сульфат аммония, ацетат аммония и фосфат аммония; другие азот-содержащие соединения, пептон, мясной экстракт, дрожжевой экстракт, жидкий кукурузный сироп, гидролизат казеина, соевые лепешки и их гидролизат; различные ферментированные микробные клетки и продукты их гидролиза.
[0124] Примерами неорганических солей, которые могут быть использованы, являются дигидрофосфат калия, бифосфат калия, фосфат магния, сульфат магния, хлорид натрия, сульфат железа (3), сульфат марганца, сульфат меди и карбонат кальция.
[0125] Культивирование прокариота, такого как Escherichia coli, или эукариота, такого как дрожжи, может быть осуществлено в аэробных условиях, таких как культивирование в шейкерной культуре или культивирование при перемешивании и при глубокой аэрации. Температура культивирования составляет, например, от 15°C до 40°C. Время культивирования обычно составляет от 16 часов до 7 дней. При этом предпочтительно, чтобы pH культуральной среды во время культивирования составлял от 3,0 до 9,0. pH культуральной среды может быть скорректирован с использованием неорганической кислоты, органической кислоты, щелочного раствора, мочевины, карбоната кальция, аммиака или т.п.
[0126] Кроме того, во время культивирования, в культуральную среду могут быть добавлены, если это необходимо, антибиотики, такие как ампициллин и тетрациклин. В случае культивирования микроорганизма, трансформированного экспрессионным вектором с использованием индуцибельного промотора в качестве промотора, в среду, при необходимости, может быть добавлен индуктор. Так, например, в случае культивирования микроорганизма, трансформированного экспрессионным вектором с использованием промотора lac, в среду вводят изопропил-β-D-тиогалактопиранозид или т.п., а в случае культивирования микроорганизма, трансформированного экспрессионным вектором с использованием промотора trp, в культуральную среду может быть добавлена индолакриловая кислота или т.п.
[0127] В качестве культуральной среды для клеток насекомых может быть использована среда TNM-FH (полученная от Pharmingen Inc.), среда Sf-900 II SFM (полученная от Life Technologies, Corporation), среда ExCell 400 и ExCell 405 (обе эти среды были получены от JRH Biosciences, Inc.), среда для культивирования клеток насекомых Грейса (Nature, 195,788 (1962)) или т.п.
[0128] Культивирование клеток насекомых может быть осуществлено, например, в течение 1-5 дней при pH культуральной среды 6-7 и при температуре культивирования от 25°C до 30°C. Кроме того, во время культивирования, в культуральную среду, при необходимости, может быть добавлен антибиотик, такой как гентамицин.
[0129] В случае, если хозяином является клетка растения, то клетка трансформированного растения может быть культивирована либо непосредственно, либо она может быть дифференцирована с получением из нее органа растения с последующим культивированием. В качестве культуральной среды для культивирования клетки растения может быть использована обычно применяемая среда Мурашига и Скуга (MS), среда Уайта или среда, в которую добавляют растительный гормон, такой как ауксин или цитокинин.
[0130] Культивирование клеток животных может быть осуществлено, например, в течение 3-60 дней при pH культуральной среды 5-9 и при температуре культивирования от 20°C до 40°C. Кроме того, во время культивирования, в культуральную среду, при необходимости, может быть добавлен антибиотик, такой как канамицин или гигромицин.
[0131] В качестве метода продуцирования модифицированного фиброина с использованием хозяина, трансформированного экспрессионным вектором согласно изобретению, может быть применен метод продуцирования модифицированного фиброина в клетке-хозяине, метод секреции модифицированного фиброина за пределы клетки-хозяина и метод продуцирования модифицированного фиброина на внешней мембране клетки-хозяина. Каждый из этих методов может быть выбран путем модификации используемой клетки-хозяина и структуры продуцируемого модифицированного фиброина.
[0132] Так, например, в случае, когда модифицированный фиброин продуцируют в клетке-хозяине или на внешней мембране клетки-хозяина, метод продуцирования может быть модифицирован для активной секреции модифицированного фиброина за пределы клетки-хозяина в соответствии с методом Paulson et al. (J.Biol.Chem., 264,17619 (1989)), методом Lowe et al. (Proc. Natl. Acad. Sci. USA, 86,8227 (1989), Genes Develop., 4,1288 (1990)), или методами, описанными в Публикации нерассмотренной заявки на патент Японии No. H5-336963, в Публикации Международной заявки No. WO94/23021, и т.п. То есть, модифицированный фиброин может быть активно секретирован за пределы клетки-хозяина посредством экспрессии модифицированного фиброина в форме, при которой сигнальный пептид добавляют к полипептиду, содержащему активный сайт модифицированного фиброина с применением метода генетической рекомбинации.
[0133] Модифицированный фиброин, продуцируемый хозяином, трансформированным экспрессионным вектором согласно изобретению, может быть выделен и очищен методом, обычно применяемым для выделения и очистки белка. Так, например, в случае, когда модифицированный фиброин экспрессируется в клетках в растворенном виде, клетки-хозяева выделяют путем центрифугирования после завершения культивирования, путем суспендирования в водном буферном растворе и путем дизрупции с применением ультразвука, на Френч-прессе, на гомогенизаторе Мэнтона-Голина, на мельнице Dyno-Mill или т.п. с получением бесклеточного экстракта. Очищенный препарат может быть получен из супернатанта, выделенного путем центрифугирования бесклеточного экстракта, методом, обычно применяемым для выделения и очистки белка, то есть, методом экстракции растворителем, методом высаливания с использованием сульфата аммония или т.п., методом обессоливания, методом преципитации с использованием органического растворителя, методом анионообменной хроматографии с использованием смолы, такой как диэтиламиноэтил (DEAE)-сефароза или DIAION HPA-75 (изготавляваемые компанией Mitsubishi Kasei Kogyo Kabushiki Kaisha), методом катионообменной хроматографии с использованием смолы, такой как S-сефароза FF (Pharmacia Corporation), методом гидрофобной хроматографии с использованием смолы, такой как бутилсефароза или фенилсефароза, методом гель-фильтрации на молекулярных ситах, методом аффинной хроматографии, методом хроматофокусирования, методом электрофореза, таким как изоэлектрическое фокусирование или т.п., отдельно или в комбинации.
[0134] Предпочтительной хроматографией является колоночная хроматография с использованием фенил-TOYOPEARL (от Tosoh Corporation), DEAE-TOYOPEARL (от Tosoh Corporation) и сефадекса G-150 (от Pharmacia Biotech Inc.).
[0135] В случае, когда модифицированный фиброин экспрессируется посредством образования нерастворимого вещества в клетке, то аналогичным образом, клетки-хозяева выделяют, подвергают дизрупции и центрифугируют для выделения нерастворимого модифицированного фиброина в виде осажденной фракции. Выделенный нерастворимый модифицированный фиброин может быть солюбилизирован агентом для денатурации белка. После этой процедуры, очищенный препарат модифицированного фиброина может быть получен тем же самым методом выделения и очистки, описанным выше.
[0136] В случае, когда модифицированный фиброин или его производное, в которые была добавлена сахарная цепь, секретируется за пределами клеток, то модифицированный фиброин или его производное могут быть выделены из супернатанта культуры. То есть, супернатант культуры получают путем обработки культуры таким методом, как центрифугирование, а очищенный препарат может быть выделен из супернатанта культуры методом выделения и очистки, описанным выше.
[0137](Формование)
Модифицированный фиброин согласно изобретению может быть подвергнут дополнительному формованию после получения и очистки, как описано выше. Модифицированный фиброин согласно изобретению может быть подвергнут формованию методом, обычно применяемым для формования фиброина. Так, например, волокно, образованное из модифицированного фиброина согласно изобретению, может быть получено путем формования прядильного раствора (раствора-затравки), где модифицированный фиброин согласно изобретению растворяют в растворителе.
[0138] Прядильный раствор получают путем добавления растворителя к модифицированному фиброину и доведения этого раствора до формуемой вязкости. Растворителем может быть любой растворитель, при условии, что он может растворять модифицированный фиброин. Примерами растворителей являются гексафторизопропанол (HFIP), гексафторацетон (HFA), диметилсульфоксид (ДМСО), N,N-диметилформамид (ДМФ), муравьиная кислота, водные растворы, содержащие мочевину, гуанидин, додецилсульфат натрия (ДСН), бромид лития, хлорид кальция и тиоцианат лития.
[0139] При необходимости, в прядильный раствор может быть добавлена неорганическая соль. Неорганической солью может быть, например, неорганическая соль, состоящая из кислоты Льюиса и основания Льюиса, как показано ниже. Примерами оснований Льюиса являются ион оксокислоты (ион нитрата, ион перхлората или т.п.), ион оксокислоты, связанный с металлом (ион перманганата или т.п.), ион галогенида, ион тиоцианата и ион цианата. Примерами кислоты Льюиса являются ион металла, такой как ион щелочного металла или ион щелочноземельного металла, многоатомный ион, такой как ион аммония и комплексный ион. Конкретными примерами неорганической соли, состоящей из кислоты Льюиса и основания Льюиса, являются соли лития, такие как хлорид лития, бромид лития, иодид лития, нитрат лития, перхлорат лития и тиоцианат лития; соли кальция, такие как хлорид кальция, бромид кальция, иодид кальция, нитрат кальция, перхлорат кальция и тиоцианат кальция; соли железа, такие как хлорид железа, бромид железа, йодид железа, нитрат железа, перхлорат железа и тиоцианат железа; соли алюминия, такие как хлорид алюминия, бромид алюминия, иодид алюминия, нитрат алюминия, перхлорат алюминия и тиоцианат алюминия; соли калия, такие как хлорид калия, бромид калия, иодид калия, нитрат калия, перхлорат калия и тиоцианат калия; соли натрия, такие как хлорид натрия, бромид натрия, иодид натрия, нитрат натрия, перхлорат натрия и тиоцианат натрия; соли цинка, такие как хлорид цинка, бромид цинка, иодид цинка, нитрат цинка, перхлорат цинка и тиоцианат цинка; соли магния, такие как хлорид магния, бромид магния, иодид магния, нитрат магния, перхлорат магния и тиоцианат магния; соли бария, такие как хлорид бария, бромид бария, иодид бария, нитрат бария, перхлорат бария и тиоцианат бария; и соли стронция, такие как хлорид стронция, бромид стронция, иодид стронция, нитрат стронция, перхлорат стронция и тиоцианат стронция.
[0140] Вязкость прядильного раствора может быть соответствующим образом установлена в зависимости от метода формования, например, она может составлять от 100 до 15000 сантипуаз (сП) при 35°C. Вязкость прядильного раствора может быть измерена, например, с использованием «вискозиметра EMS» (торговый знак устройства, изготавливаемого Kyoto Electronics Manufacturing Co., Ltd.).
[0141] Метод формования не имеет конкретноых ограничений, при условии, что он позволяет осуществлять формование модифицированного фиброина согласно изобретению, и примерами такого метода являются сухое формование, формование из расплава и мокрое формование. В качестве предпочтительного метода формования может быть упомянуто мокрое формование.
[0142] При мокром формовании, растворитель, в котором растворяется модифицированный фиброин, подвергают экструзии из фильеры (сопла) в коагулирующую жидкость (резервуар с коагулирующей жидкостью), а затем модифицированный фиброин отверждают в этой коагулирующей жидкости с получением невытянутой пряжи в форме нитей. Коагулирующей жидкостью может быть раствор для десольватации, и примерами такой жидкости являются низшие спирты, имеющие от 1 до 5 атомов углерода, такие как метанол, этанол и 2-пропанол, и ацетон. К коагулирующей жидкости может быть соответствующим образом добавлена вода. Температура коагулирующей жидкости, предпочтительно, составляет от 0 до 30°C. В случае, если в качестве фильеры используется шприцевой насос, имеющий сопло диаметром от 0,1 до 0,6 мм, то скорость экструзии, предпочтительно составляет от 0,2 до 6,0 мл/час, а более предпочтительно, от 1,4 до 4,0 мл/час на отверстие. Резервуар с коагулирующей жидкостью может иметь любую длину, при условии, что будет осуществляться эффективная десольватация, и такая длина составляет, например, от 200 до 500 мм. Скорость снятия невытянутой пряжи может составлять, например, 1-20 мл/мин, а предпочтительно 1-3 мл/мин. Время пребывания может составлять, например, от 0,01 до 3 минут, а предпочтительно от 0,05 до 0,15 минут. Кроме того, формование (предварительное формование) может быть осуществлено в коагулирующей жидкости. Для предотвращения испарения низшего спирта, коагулирующая жидкость может поддерживаться при низкой температуре, а пряжа может быть снята в невытянутом состоянии. Резервуар с коагулирующей жидкостью может быть многофункциональным, а формование может быть осуществлено, если это необходимо, в каждой стадии или в какой-либо конкретной стадии.
[0143] Невытянутая пряжа (или предварительно сформованная пряжа), полученная вышописанным методом, может быть превращена в вытянутую пряжу (волокно фиброина) в стадии вытягивания. Методом формования может быть метод мокрого формования с нагреванием, сухого формования с нагреванием и т.п.
[0144] Мокрое формование с нагреванием может быть осуществлено в теплой воде, в растворе, полученном путем добавления органического растворителя или т.п. в теплую воду, или во время нагревания паром. Температура может составлять, например, от 50°C до 90°C, а предпочтительно от 75°C до 85°C. При мокром формовании с нагреванием, невытянутая пряжа (или предварительно сформованная пряжа) может быть растянута, например, в 1-10 раз, а предпочтительно, в 2-8 раз.
[0145] Сухое формование с нагреванием может быть осуществлено с использованием электрической трубчатой печи, сухой горячей пластины или т.п. Температура может составлять, например, от 140°C до 270°C, а предпочтительно от 160°C до 230°C. При сухом формовании с нагреванием, невытянутая пряжа (или предварительно сформованная пряжа) может быть растянута, например, в 0,5-8 раз, а предпочтительно, в 1-4 раза.
[0146] Мокрое формование с нагреванием и сухое формование с нагреванием могут быть осуществлены отдельно, либо они могут быть осуществлены в несколько стадий или в комбинации друг с другом. То есть, мокрое формование с нагреванием и сухое формование с нагреванием могут быть осуществлены в соответствующей комбинации так, чтобы в первой стадии осуществлялось мокрое формование с нагреванием, а во второй стадии осуществлялось сухое формование с нагреванием, либо в первой стадии осуществлялось мокрое формование с нагреванием, во второй стадии осуществлялось мокрое формование с нагреванием, а в третьей стадии дополнительно осуществлялось сухое формование с нагреванием.
[0147] Конечная степень вытянутой пряжи на стадии вытягивания составляет, например, в 5-20 раз, а предпочтительно, в 6-11 раз по сравнению с невытянутой пряжей (или предварительно сформованной пряжей).
[0148] Модифицированный фиброин согласно изобретению может иметь химически сшитые полипептидные молекулы в волокне фиброина после его формования. Примерами функциональных групп, которые могут быть перекрестно сшитыми, являются аминогруппа, карбоксильная группа, тиоловая группа и гидроксильная группа. Так, например, аминогруппа лизиновой боковой цепи, содержащейся в полипептиде, может быть перекрестно сшита с карбоксильной группой боковой цепи глутаминовой кислоты или аспарагиновой кислоты посредством амидной связи после реакции дегидратации-конденсации. Реакция перекрестного сшивания может быть осуществлена посредством дегидратации-конденсации при нагревании в вакууме, либо она может быть осуществлена с использованием агента для дегидратации-конденсации, такого как карбодиимид.
[0149] Перекрестное сшивание полипептидных молекул может быть осуществлено с использованием перекрестно-сшивающего агента, такого как карбодиимид или глутаральдегид, либо оно может быть осуществлено с использованием фермента, такого как трансглутаминаза. Карбодиимидом является соединение общей формулы R1N=C=NR2 (где каждый из R1 и R2 независимо представляет собой органическую группу, включая алкильную группу или циклоалкильную группу, имеющую от 1 до 6 атомов углерода). Конкретными примерами карбодиимида являются гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC), N,N'- дициклогексилкарбодиимид (DCC), 1-циклогексил-3-(2-морфолиноэтил)карбодиимид и диизопропилкарбодиимид (DIC). Из них, особенно предпочтительными являются EDC и DIC, поскольку они обладают хорошей способностью образовывать амидную связь между полипептидными молекулами и облегчать реакцию перекрестного сшивания.
[0150] Реакцию перекрестного сшивания, предпочтительно, осуществляют путем обработки волокна фиброина перекрестно-сшивающим агентом с последующим проведением перекрестного сшивания путем сушки при нагревании в вакууме. К волокну фиброина может быть добавлен чистый продукт в качестве перекрестно-сшивающего агента. Альтернативно, перекрестно-сшивающий агент может быть добавлен к волокну фиброина путем разведения чистого продукта низшим спиртом, имеющим от 1 до 5 атомов углерода, и буферным раствором или т.п. до концентрации от 0,005 до 10% по массе. Реакцию перекрестного сшивания, предпочтительно, осуществляют при температуре от 20°C до 45°C в течение 3-42 часов. При проведении реакции перекрестного сшивания, волокну фиброина может быть сообщена более высокая прочность (при растяжении).
[0151] [Продукт]
Волокно фиброина, сформованное из модифицированного фиброина согласно изобретению, может быть использовано в виде волокна или пряжи для изготовления тканой ткани, трикотажной ткани, их комбинаций, нетканой ткани или т.п. Такое волокно фиброина может быть также использовано для изготовления материалов высокой прочности, таких как канаты, материалы для хирургических швов, жесткие изоляторы для электрических деталей и физиологически активные материалы для имплантации (например, искусственная лигатура и повязки на аорты).
[0152] Модифицированный фиброин согласно изобретению может быть также использован для получения нитей, пленок, пен, сфер, нанофибрилл, гидрогелей, смол и их эквивалентов, которые могут быть получены методом, описанным в Публикации нерассмтренной заявки на патент Японии № 2009-505668, в Публикации нерассмтренной заявки на патент Японии № 2009-505668, в Японском патенте № 5678283, в Японском патенте № 4638735 или т.п.
Примеры
[0153] Настоящее изобретение более подробно описано ниже со ссылкой на конкретные примеры. Однако, настоящее изобретение не ограничивается этими примерами.
[0154] [(1) Синтез нуклеиновой кислоты, кодирующей модифицированный фиброин, и конструирование экспрессионного вектора]
Исходя из нуклеотидной последовательности и аминокислотной последовательности Nephila clavipes (GenBank рег. № P46804.1, GI: 1174415), которые являются последовательностями природного фиброина, были сконструированы фиброины и модифицированные фиброины, имеющие аминокислотные последовательности, представленные в SEQ ID NN: 1-4 и 6-11. Аминокислотной последовательностью, представленной в SEQ ID NO: 1 (Met-PRT313), является последовательность, полученная путем делеции аланиновых остатков аминокислотной последовательности, в которой аланиновые остатки в мотиве (A)n природного фиброина расположены так, что число смежных аланиновых остатков равно 5; а аминокислотной последовательностью (PRT313), представленной в SEQ ID NO: 6, является последовательность, полученная путем присоединения аминокислотной последовательности (последовательности метки и шарнирной последовательности), представленной в SEQ ID NO: 5, к N-концу аминокислотной последовательности, представленной в SEQ ID NO: 1 (Сравнительные примеры 1 и 2). Аминокислотной последовательностью (Met-PRT399), представленной в SEQ ID NO: 2, является последовательность, полученная путем делеции мотива (A)n ((A)5) через каждые два положения от N-конца до С-конца аминокислотной последовательности, представленной в SEQ ID NO: 1, и инсерции одного [(мотив (A)n-REP] перед C-концевой последовательностю; а аминокислотной последовательностью (PRT399), представленной в SEQ ID NO: 7, является последовательность, полученная путем присоединения аминокислотной последовательности (последовательности метки и шарнирной последовательности), представленной в SEQ ID NO: 5, к N-концу аминокислотной последовательности, представленной в SEQ ID NO: 2 (Сравнительные примеры 1 и 2). Аминокислотной последовательностью (Met-PRT380), представленной в SEQ ID NO: 3, является последовательность, полученная путем замены всех GGX на GQX в REP аминокислотной последовательности, представленной в SEQ ID NO: 1; а аминокислотной последовательностью (PRT380), представленной в SEQ ID NO: 8, является последовательность, полученная путем присоединения аминокислотной последовательности (последовательности метки и шарнирной последовательности), представленной в SEQ ID NO: 5, к N-концу аминокислотной последовательности, представленной в SEQ ID NO: 3 (Примеры 1 и 4). Аминокислотной последовательностью (Met-PRT410), представленной в SEQ ID NO: 4, является последовательность, полученная путем замены всех GGX на GQX в REP аминокислотной последовательности, представленной в SEQ ID NO: 2; а аминокислотной последовательностью (PRT410), представленной в SEQ ID NO: 9, является последовательность, полученная путем присоединения аминокислотной последовательности (последовательности метки и шарнирной последовательности), представленной в SEQ ID NO: 5, к N-концу аминокислотной последовательности, представленной в SEQ ID NO: 4 (Примеры 2 и 5). Аминокислотной последовательностью (Met-PRT468), представленной в SEQ ID NO: 10, является последовательность, полученная путем инсерции двух аланиновых остатков с С-концевой стороны каждого мотива (A)n аминокислотной последовательности, представленной в SEQ ID NO: 4, с последующей заменой части глутаминовых (Q) остатков на сериновый (S) остаток для делеции части аминокислот с N-концевой стороны так, чтобы их молекулярная масса была почти такой же, как молекулярная масса SEQ ID NO: 4; а аминокислотной последовательностью (PRT468), представленной в SEQ ID NO: 11, является последовательность, полученная путем присоединения аминокислотной последовательности (последовательности метки и шарнирной последовательности), представленной в SEQ ID NO: 5, к N-концу аминокислотной последовательности, представленной в SEQ ID NO: 10 (Пример 3).
[0155] Была синтезирована каждая нуклеиновая кислота, кодирующая белки, имеющие аминокислотные последовательности, представленные в SEQ ID NO: 6-9 и 11, где последовательность His-метки и шарнирная последовательность (SEQ ID NO: 5) были присоединены к N-концу каждой сконструированной аминокислотной последовательности, представленной в SEQ ID Nо: 1-4 и 10. В нуклеиновой кислоте, NdeI-сайт был присоединен к 5'-концу, а EcoRI-сайт был присоединен ниже стоп-кодона. Эти четыре вида нуклеиновых кислот были клонированы в клонирующий вектор (pUC118). Затем эту нуклеиновую кислоту расщепляли путем обработки рестриктирующими ферментами NdeI и EcoRI, после чего подвергали рекомбинации в вектор для экспрессии белка pET-22b(+) с получением экспрессионного вектора.
[0156] [(2) Экспрессия белка]
Escherichia coli BLR (DE3) трансформировали экспрессионным вектором pET22b(+), включающим каждую нуклеиновую кислоту, кодирующую белки, имеющие аминокислотные последовательности, представленные в SEQ ID NN: 6-9 и 11. Трансформированную Escherichia coli культивировали в 2 мл среды LB, содержащей ампициллин, в течение 15 часов. Культуральный раствор добавляли к 100 мл среды для посевной культуры (Таблица 6), содержащей ампициллин, так, чтобы OD600 составляла 0,005. Температуру культурального раствора поддерживали при 30°C, и осуществляли культивирование в колбе (приблизительно в течение 15 часов) до OD600=5 с получением раствора посевной культуры.
[Таблица 6] Среда для посевной культуры
[0157] Раствор посевной культуры добавляли в резервуарный ферментер, в который добавляли 500 мл среды для продуцирования (Таблица 7) так, чтобы OD600 была равна 0,05. Культивирование осуществляли при температуре культурального раствора 37°C и при постоянном рН 6,9. Кроме того, концентрацию растворенного кислорода в культуральном растворе поддерживали на уровне 20% от концентрации растворенного кислорода для насыщения.
[Таблица 7] Среда для продуцирования
[0158] Сразу после полного израсходования глюкозы в среде для продуцирования добавляли питающий раствор (455 г/1 л глюкозы и 120 г/1 л дрожжевого экстракта) со скоростью 1 мл/мин. Культивирование осуществляли при температуре культурального раствора 37°C и при постоянном рН 6,9. Кроме того, концентрацию растворенного кислорода в культуральном растворе поддерживали на уровне 20% от концентрации растворенного кислорода для насыщения и проводили культивирование в течение 20 часов. Затем, к культуральному раствору добавляли 1 M изопропил-β-тиогалактопиранозид (IPTG) до конечной концентрации 1 мМ для индуцирования экспрессии белка-мишени. Через двадцать часов после добавления IPTG, культуральный раствор центрифугировали для выделения бактериальных клеток. Электрофорез в ДСН-ПААГ осуществляли с использованием бактериальных клеток, полученных из культурального раствора перед добавлением и после добавления IPTG, и экспрессию белка-мишени подтверждали по появлению полосы белка-мишени, размер которого зависел от добавления IPTG.
[0159] [(3) Очистка белка]
Бактериальные клетки, выделенные через 2 часа после добавления IPTG, промывали 20 мМ буферного раствора Трис-HCl (pH 7,4). После промывки, бактериальные клетки суспендировали в 20 мМ буферного раствора Трис-HCl (pH 7,4), содержащего приблизительно 1 mM PMSF, и клетки подвергали дизрупции на гомогенизаторе высокого давления (поставляемого от GEA Niro Soavi SpA). Подвергнутые дизрупции клетки центрифугировали с получением осадка. Полученный осадок промывали 20 мМ буферного раствора Трис-HCl (pH 7,4) до достижения высокой степени чистоты. После промывки, осадок суспендировали в 8 M буферного раствора гуанидина (8 M гидрохлорида гуанидина, 10 мМ дигидрофосфата натрия, 20 мМ NaCl, 1 мМ Трис-HCl, pH 7,0) до концентрации 100 мг/мл, и растворяли путем перемешивания с помощью мешалки при 60°C в течение 30 минут. После растворения проводили диализ в воде с использованием диализной трубки (целлюлозной трубки 36/32, изготовленной Sanko Junyaku Co., Ltd.). Белый агрегированный белок, полученный после диализа, выделяли путем центрифугирования, а затем воду удаляли на лиофилизаторе и получали лиофилизованный порошок.
[0160] Степень очистки белка-мишени в полученном таким образом лиофилизованном порошке подтверждали с помощью визуализирующего анализа, а именно, электрофореза в полиакриламидном геле для порошка с использованием TotalLab (Nonlinear Dynamics Ltd.). В результате, чистота каждого белка составляла приблизительно 85%.
[0161] [(4) Получение прядильного раствора (раствора-затравки)]
С использованием ДМСО в качестве главного растворителя, в котором было предварительно растворено 4 масс.% хлорида лития, используемого в качестве добавки, каждый из лиофилизованных порошков белков PRT313 (SEQ ID NO: 6: Сравнительный пример 1), PRT399 (SEQ ID NO: 7: Сравнительный пример 1), PRT380 (SEQ ID NO: 8: Пример 1), PRT410 (SEQ ID NO: 9: Пример 2) и PRT468 (SEQ ID NO: 11: Пример 3), полученных как описано выше, добавляли к главному растворителю до концентрации 24 масс.%. Лиофилизованный порошок растворяли в ротационном шейкере при 90°С в течение 1 часа и при 80°C в течение 15 часов, а затем фильтровали через металлический фильтр из спеченного стекла для удаления пыли. Затем фильтрат оставляли на 1 час для удаления пены и получали прядильный раствор (раствор-затравку). Хотя вязкость прядильного раствора в некоторой степени варьируется в зависимости от типа белка и температуры, однако, в случае PRT410, она составляла 5000 сП (сантипуаз) при 35°C.
[0162] [(5) Формование]
Прядильный раствор заливали в резервный чан и выгружали из сопла со множеством отверстий диаметром 0,1 или 0,2 мм до концентрации 100% по массе коагулирующей бани с метанолом с помощью шприца с приводом. Количество выгружаемого продукта корректировали до 3-6 мл/мин. После коагуляции проводили промывку и формование до концентрации 100% по массе коагулирующей бани с метанолом. После промывки и формования, продукт сушили на горячей сухой пластине и получали исходную расплетенную пряжу (волокно).
[0163] [Оценка физических свойств]
Физические свойства полученной исходной пряжи измеряли следующим образом:
(A) Диаметр волокна определяли с использованием оптического микроскопа.
(B) Прочность, исходный модуль упругости и растяжимость (смещение при разрыве, смещение) волокна измеряли при температуре 20°C и относительной влажности 65% с использованием тестера для оценки упругости (INSTRON 3342), а ударную вязкость вычисляли по нижеследующей формуле. В этом тесте на упругость, волокно измеряли с интервалами 10 мс. Каждый образец прикрепляли к форме, изготовленной из картона, где расстояние между зажимами составляло 20 мм, а скорость вытягивания составляла 10 мм/мин. Емкость датчика нагрузки была равна 10, а фиксирующее устройство представляло собой устройство типа зажима. Измеренная величина представляет собой среднюю величину для образцов, где n=5.
[0164] Ударную вязкость вычисляли по следующей формуле:
Ударная вязкость=[E/(r2× π × л)×1000] (единица: MДж/м3),
где:
E: Энергия разрыва (единица: Дж)
r: Радиус волокна (единица: мм)
π: Пи
L: Расстояние между зажимами во время испытаний на разрыв: 20 мм
[0165] Затем измеряли количество продуцируемого замороженного порошка каждого белка, а также прочность, ударную вязкость и растяжимость каждой исходной пряжи, и результаты были представлены в Таблице 8 как относительные величины в случае, когда величина PRT313 (SEQ ID NO: 6: Сравнительный пример 1) составляла 100.
[Таблица 8]
[0166] Модифицированный фиброин с пониженным содержанием глициновых остатков в REP обнаруживал значительно более высокую продуктивность (Пример 1). Модифицированный фиброин с пониженным содержанием мотивов (A)n, а также с пониженным содержанием глициновых остатков в REP обнаруживал значительно более высокую продуктивность и более высокую ударную вязкость и растяжимость (Примеры 2 и 3).
[0167] Затем, условия формования модифицировали как описано ниже, и очищенные белки PRT313 (SEQ ID NO: 6: Сравнительный пример 2), PRT399 (SEQ ID NO: 7: Сравнительный пример 2), PRT380 (SEQ ID NO: 8: Пример 4) и PRT410 (SEQ ID NO: 9: Пример 5), полученные как описано выше, подвергали формованию. Физические свойства белков измеряли и сравнивали методом, описанным выше.
[0168] Прядильный раствор получали методом, описанным в вышеупомянутом разделе «(4) Получение прядильного раствора (раствора-затравки)». Полученный прядильный раствор заливали в резервный чан и выгружали из сопла со множеством отверстий диаметром 0,2 мм до концентрации 100% по массе коагулирующей бани с метанолом с помощью шприца с приводом. Количество выгружаемого продукта корректировали до 0,050-0,052 мл/мин. После коагуляции проводили промывку до концентрации 100% по массе коагулирующей бани с метанолом, и осуществляли 3-кратное формование в бане с горячей водой при 50°C. После промывки и формования, продукт сушили на горячей роллерной пластине при 60°C, и получали исходную расплетенную пряжу (волокно).
[0169] Результаты оценки прочности, ударной вязкости и растяжимости каждой исходной пряжи представлены в Таблице 9 как относительные величины в случае, когда величина PRT313 (SEQ ID NO: 6: Сравнительный пример 2) составляла 100.
[Таблица 9]
[0170] Модифицированный фиброин с пониженным содержанием глициновых остатков в REP сохранял прочность (прочность на разрыв и ударную вязкость) и растяжимость (Пример 4). Модифицированный фиброин с пониженным содержанием мотивов (A)n, а также с пониженным содержанием глициновых остатков в REP обнаруживал более высокую ударную вязкость и растяжимость, а также сохранял прочность на разрыв (Пример 5).
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Spiber Inc.
KOJIMA INDUSTRIES CORPORATION
<120> Модифицированный фиброин
<130> FP17-0267-00
<160> 11
<170> PatentIn version 3.5
<210> 1
<211> 597
<212> PRT
<213> Искусственная последовательность
<220>
<223> Met-PRT313
<400> 1
Met Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala
1 5 10 15
Ala Ala Ala Gly Gly Asn Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly
20 25 30
Gly Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Pro Gly Gly Gln Gly
35 40 45
Pro Gly Gln Gln Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Pro
50 55 60
Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro Ser Ala Ser Ala Ala Ala
65 70 75 80
Ala Ala Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Ala Ser Ala Ala
85 90 95
Ala Ala Ala Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro Gly Gln Gln
100 105 110
Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Ser Gly
115 120 125
Pro Gly Gln Gln Gly Pro Tyr Gly Ser Ala Ala Ala Ala Ala Gly Pro
130 135 140
Gly Ser Gly Gly Tyr Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala
145 150 155 160
Ala Ala Ala Ala Gly Pro Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro
165 170 175
Ser Ala Ser Ala Ala Ala Ala Ala Gly Ser Gly Gln Gln Gly Pro Gly
180 185 190
Gly Tyr Gly Pro Tyr Ala Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly
195 200 205
Ser Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gly Ser Ala Ala
210 215 220
Ala Ala Ala Gly Ser Gly Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr
225 230 235 240
Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly Gly Gln Gly Pro Tyr Gly
245 250 255
Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Tyr Gly Pro
260 265 270
Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala
275 280 285
Gly Gly Asn Gly Pro Gly Ser Gly Gly Tyr Gly Pro Gly Gln Gln Gly
290 295 300
Pro Gly Gly Ser Ala Ala Ala Ala Ala Gly Pro Gly Gly Gln Gly Pro
305 310 315 320
Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Pro
325 330 335
Gly Gly Gln Gly Pro Gly Gly Tyr Gly Pro Gly Ser Ser Ala Ala Ala
340 345 350
Ala Ala Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ser Ser Ala
355 360 365
Ala Ala Ala Ala Gly Gly Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly
370 375 380
Pro Gly Gly Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gln Gln Gly Pro
385 390 395 400
Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala
405 410 415
Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala
420 425 430
Ala Ala Gly Pro Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro Ser Ala
435 440 445
Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Ser Gly Pro Gly Gly Tyr
450 455 460
Gly Pro Tyr Gly Pro Gly Gly Ser Ala Ala Ala Ala Ala Gly Pro Gly
465 470 475 480
Ser Gly Gln Gln Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala
485 490 495
Ala Ala Ala Gly Gly Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro
500 505 510
Gly Gly Ser Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly Gly Tyr Gly
515 520 525
Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gly Asn Gly Pro Gly Ser
530 535 540
Gly Gly Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gly Ser Ala Ala Ala
545 550 555 560
Ala Ala Gly Gly Tyr Gln Gln Gly Pro Gly Gly Gln Gly Pro Tyr Gly
565 570 575
Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Gln
580 585 590
Gly Pro Gly Ala Ser
595
<210> 2
<211> 590
<212> PRT
<213> Искусственная последовательность
<220>
<223> Met-PRT399
<400> 2
Met Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala
1 5 10 15
Ala Ala Ala Gly Gly Asn Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly
20 25 30
Gly Ser Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro Gly Gln Gln Gly
35 40 45
Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Pro Gly Gly Tyr Gly Pro
50 55 60
Gly Gly Gln Gly Pro Ser Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly
65 70 75 80
Ser Gly Gln Gln Gly Pro Gly Ala Ser Gly Gly Tyr Gly Pro Gly Gly
85 90 95
Gln Gly Pro Gly Gln Gln Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala
100 105 110
Gly Gly Tyr Gly Ser Gly Pro Gly Gln Gln Gly Pro Tyr Gly Ser Ala
115 120 125
Ala Ala Ala Ala Gly Pro Gly Ser Gly Gly Tyr Gly Gln Gly Pro Tyr
130 135 140
Gly Pro Gly Ala Ser Gly Pro Gly Gly Tyr Gly Pro Gly Gly Gln Gly
145 150 155 160
Pro Ser Ala Ser Ala Ala Ala Ala Ala Gly Ser Gly Gln Gln Gly Pro
165 170 175
Gly Gly Tyr Gly Pro Tyr Ala Ser Ala Ala Ala Ala Ala Gly Gly Tyr
180 185 190
Gly Ser Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gly Ser Gly
195 200 205
Ser Gly Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr Ala Ser Ala Ala
210 215 220
Ala Ala Ala Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ser Ser
225 230 235 240
Ala Ala Ala Ala Ala Gly Gly Tyr Gly Tyr Gly Pro Gly Gly Gln Gly
245 250 255
Pro Tyr Gly Pro Gly Ala Ser Gly Gly Asn Gly Pro Gly Ser Gly Gly
260 265 270
Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gly Ser Ala Ala Ala Ala Ala
275 280 285
Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala
290 295 300
Ala Ala Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro Gly Gly Tyr Gly
305 310 315 320
Pro Gly Ser Ser Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ser
325 330 335
Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Pro Gly Gln Gln Gly Pro
340 345 350
Tyr Gly Pro Gly Gly Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gln Gln
355 360 365
Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Gly Pro Gly
370 375 380
Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly
385 390 395 400
Pro Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro Ser Ala Ser Ala Ala
405 410 415
Ala Ala Ala Gly Gly Tyr Gly Ser Gly Pro Gly Gly Tyr Gly Pro Tyr
420 425 430
Gly Pro Gly Gly Ser Gly Pro Gly Ser Gly Gln Gln Gly Gln Gly Pro
435 440 445
Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Pro
450 455 460
Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gly Ser Ala Ala Ala Ala Ala
465 470 475 480
Gly Pro Gly Ser Gly Gly Tyr Gly Pro Gly Ala Ser Gly Gly Asn Gly
485 490 495
Pro Gly Ser Gly Gly Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gly Ser
500 505 510
Ala Ala Ala Ala Ala Gly Gly Tyr Gln Gln Gly Pro Gly Gly Gln Gly
515 520 525
Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly
530 535 540
Ser Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gly Ser Gly Ser
545 550 555 560
Gly Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr Ala Ser Ala Ala Ala
565 570 575
Ala Ala Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Ala Ser
580 585 590
<210> 3
<211> 597
<212> PRT
<213> Искусственная последовательность
<220>
<223> Met-PRT380
<400> 3
Met Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala
1 5 10 15
Ala Ala Ala Gly Gln Asn Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly
20 25 30
Gln Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Pro Gly Gln Gln Gly
35 40 45
Pro Gly Gln Gln Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Pro
50 55 60
Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Ser Ala Ser Ala Ala Ala
65 70 75 80
Ala Ala Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Ala Ser Ala Ala
85 90 95
Ala Ala Ala Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Gln
100 105 110
Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Ser Gly
115 120 125
Pro Gly Gln Gln Gly Pro Tyr Gly Ser Ala Ala Ala Ala Ala Gly Pro
130 135 140
Gly Ser Gly Gln Tyr Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala
145 150 155 160
Ala Ala Ala Ala Gly Pro Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro
165 170 175
Ser Ala Ser Ala Ala Ala Ala Ala Gly Ser Gly Gln Gln Gly Pro Gly
180 185 190
Gln Tyr Gly Pro Tyr Ala Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly
195 200 205
Ser Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gln Ser Ala Ala
210 215 220
Ala Ala Ala Gly Ser Gly Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr
225 230 235 240
Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly Gln Gln Gly Pro Tyr Gly
245 250 255
Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Tyr Gly Pro
260 265 270
Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala
275 280 285
Gly Gln Asn Gly Pro Gly Ser Gly Gln Tyr Gly Pro Gly Gln Gln Gly
290 295 300
Pro Gly Gln Ser Ala Ala Ala Ala Ala Gly Pro Gly Gln Gln Gly Pro
305 310 315 320
Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Pro
325 330 335
Gly Gln Gln Gly Pro Gly Gln Tyr Gly Pro Gly Ser Ser Ala Ala Ala
340 345 350
Ala Ala Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ser Ser Ala
355 360 365
Ala Ala Ala Ala Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly
370 375 380
Pro Gly Gln Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gln Gln Gly Pro
385 390 395 400
Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala
405 410 415
Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala
420 425 430
Ala Ala Gly Pro Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Ser Ala
435 440 445
Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Ser Gly Pro Gly Gln Tyr
450 455 460
Gly Pro Tyr Gly Pro Gly Gln Ser Ala Ala Ala Ala Ala Gly Pro Gly
465 470 475 480
Ser Gly Gln Gln Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala
485 490 495
Ala Ala Ala Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro
500 505 510
Gly Gln Ser Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Tyr Gly
515 520 525
Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gln Asn Gly Pro Gly Ser
530 535 540
Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Ser Ala Ala Ala
545 550 555 560
Ala Ala Gly Gln Tyr Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr Gly
565 570 575
Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Gln
580 585 590
Gly Pro Gly Ala Ser
595
<210> 4
<211> 590
<212> PRT
<213> Искусственная последовательность
<220>
<223> Met-PRT410
<400> 4
Met Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala
1 5 10 15
Ala Ala Ala Gly Gln Asn Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly
20 25 30
Gln Ser Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Gln Gly
35 40 45
Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Pro Gly Gln Tyr Gly Pro
50 55 60
Gly Gln Gln Gly Pro Ser Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly
65 70 75 80
Ser Gly Gln Gln Gly Pro Gly Ala Ser Gly Gln Tyr Gly Pro Gly Gln
85 90 95
Gln Gly Pro Gly Gln Gln Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala
100 105 110
Gly Gln Tyr Gly Ser Gly Pro Gly Gln Gln Gly Pro Tyr Gly Ser Ala
115 120 125
Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Tyr Gly Gln Gly Pro Tyr
130 135 140
Gly Pro Gly Ala Ser Gly Pro Gly Gln Tyr Gly Pro Gly Gln Gln Gly
145 150 155 160
Pro Ser Ala Ser Ala Ala Ala Ala Ala Gly Ser Gly Gln Gln Gly Pro
165 170 175
Gly Gln Tyr Gly Pro Tyr Ala Ser Ala Ala Ala Ala Ala Gly Gln Tyr
180 185 190
Gly Ser Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gln Ser Gly
195 200 205
Ser Gly Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr Ala Ser Ala Ala
210 215 220
Ala Ala Ala Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ser Ser
225 230 235 240
Ala Ala Ala Ala Ala Gly Gln Tyr Gly Tyr Gly Pro Gly Gln Gln Gly
245 250 255
Pro Tyr Gly Pro Gly Ala Ser Gly Gln Asn Gly Pro Gly Ser Gly Gln
260 265 270
Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Ser Ala Ala Ala Ala Ala
275 280 285
Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala
290 295 300
Ala Ala Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Tyr Gly
305 310 315 320
Pro Gly Ser Ser Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ser
325 330 335
Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro
340 345 350
Tyr Gly Pro Gly Gln Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gln Gln
355 360 365
Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala Ser Gly Pro Gly
370 375 380
Gln Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly
385 390 395 400
Pro Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Ser Ala Ser Ala Ala
405 410 415
Ala Ala Ala Gly Gln Tyr Gly Ser Gly Pro Gly Gln Tyr Gly Pro Tyr
420 425 430
Gly Pro Gly Gln Ser Gly Pro Gly Ser Gly Gln Gln Gly Gln Gly Pro
435 440 445
Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Pro
450 455 460
Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gln Ser Ala Ala Ala Ala Ala
465 470 475 480
Gly Pro Gly Ser Gly Gln Tyr Gly Pro Gly Ala Ser Gly Gln Asn Gly
485 490 495
Pro Gly Ser Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Ser
500 505 510
Ala Ala Ala Ala Ala Gly Gln Tyr Gln Gln Gly Pro Gly Gln Gln Gly
515 520 525
Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly
530 535 540
Ser Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gln Ser Gly Ser
545 550 555 560
Gly Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr Ala Ser Ala Ala Ala
565 570 575
Ala Ala Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Ala Ser
580 585 590
<210> 5
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> His-метка
<400> 5
Met His His His His His His Ser Ser Gly Ser Ser
1 5 10
<210> 6
<211> 608
<212> PRT
<213> Искусственная последовательность
<220>
<223> PRT313
<400> 6
Met His His His His His His Ser Ser Gly Ser Ser Gly Pro Gly Gly
1 5 10 15
Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gly
20 25 30
Asn Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Gly Ser Ala Ala Ala
35 40 45
Ala Ala Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro Gly Gln Gln Gly
50 55 60
Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Pro Gly Gly Tyr Gly Pro
65 70 75 80
Gly Gly Gln Gly Pro Ser Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly
85 90 95
Ser Gly Gln Gln Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gly
100 105 110
Tyr Gly Pro Gly Gly Gln Gly Pro Gly Gln Gln Gly Pro Gly Ser Ser
115 120 125
Ala Ala Ala Ala Ala Gly Gly Tyr Gly Ser Gly Pro Gly Gln Gln Gly
130 135 140
Pro Tyr Gly Ser Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly Gly Tyr
145 150 155 160
Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly
165 170 175
Pro Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro Ser Ala Ser Ala Ala
180 185 190
Ala Ala Ala Gly Ser Gly Gln Gln Gly Pro Gly Gly Tyr Gly Pro Tyr
195 200 205
Ala Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Ser Gly Pro Gly Gln
210 215 220
Gln Gly Pro Tyr Gly Pro Gly Gly Ser Ala Ala Ala Ala Ala Gly Ser
225 230 235 240
Gly Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr Ala Ser Ala Ala Ala
245 250 255
Ala Ala Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ser Ser Ala
260 265 270
Ala Ala Ala Ala Gly Gly Tyr Gly Tyr Gly Pro Gly Gly Gln Gly Pro
275 280 285
Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gly Asn Gly Pro
290 295 300
Gly Ser Gly Gly Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gly Ser Ala
305 310 315 320
Ala Ala Ala Ala Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ala
325 330 335
Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro
340 345 350
Gly Gly Tyr Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Pro Gly
355 360 365
Gly Gln Gly Pro Tyr Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly
370 375 380
Gly Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gly Ser Ala
385 390 395 400
Ala Ala Ala Ala Gly Gly Tyr Gln Gln Gly Pro Gly Gly Gln Gly Pro
405 410 415
Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly Gly Gln
420 425 430
Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly
435 440 445
Gly Tyr Gly Pro Gly Gly Gln Gly Pro Ser Ala Ser Ala Ala Ala Ala
450 455 460
Ala Gly Gly Tyr Gly Ser Gly Pro Gly Gly Tyr Gly Pro Tyr Gly Pro
465 470 475 480
Gly Gly Ser Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Gln Gly
485 490 495
Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gly
500 505 510
Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gly Ser Ala Ala
515 520 525
Ala Ala Ala Gly Pro Gly Ser Gly Gly Tyr Gly Pro Gly Ala Ser Ala
530 535 540
Ala Ala Ala Ala Gly Gly Asn Gly Pro Gly Ser Gly Gly Tyr Gly Pro
545 550 555 560
Gly Gln Gln Gly Pro Gly Gly Ser Ala Ala Ala Ala Ala Gly Gly Tyr
565 570 575
Gln Gln Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala
580 585 590
Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Ala Ser
595 600 605
<210> 7
<211> 601
<212> PRT
<213> Искусственная последовательность
<220>
<223> PRT399
<400> 7
Met His His His His His His Ser Ser Gly Ser Ser Gly Pro Gly Gly
1 5 10 15
Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gly
20 25 30
Asn Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Gly Ser Gly Gly Tyr
35 40 45
Gly Pro Gly Gly Gln Gly Pro Gly Gln Gln Gly Pro Gly Ser Ser Ala
50 55 60
Ala Ala Ala Ala Gly Pro Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro
65 70 75 80
Ser Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Gln Gly
85 90 95
Pro Gly Ala Ser Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro Gly Gln
100 105 110
Gln Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Ser
115 120 125
Gly Pro Gly Gln Gln Gly Pro Tyr Gly Ser Ala Ala Ala Ala Ala Gly
130 135 140
Pro Gly Ser Gly Gly Tyr Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser
145 150 155 160
Gly Pro Gly Gly Tyr Gly Pro Gly Gly Gln Gly Pro Ser Ala Ser Ala
165 170 175
Ala Ala Ala Ala Gly Ser Gly Gln Gln Gly Pro Gly Gly Tyr Gly Pro
180 185 190
Tyr Ala Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Ser Gly Pro Gly
195 200 205
Gln Gln Gly Pro Tyr Gly Pro Gly Gly Ser Gly Ser Gly Gln Gln Gly
210 215 220
Pro Gly Gln Gln Gly Pro Tyr Ala Ser Ala Ala Ala Ala Ala Gly Pro
225 230 235 240
Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala
245 250 255
Gly Gly Tyr Gly Tyr Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly
260 265 270
Ala Ser Gly Gly Asn Gly Pro Gly Ser Gly Gly Tyr Gly Pro Gly Gln
275 280 285
Gln Gly Pro Gly Gly Ser Ala Ala Ala Ala Ala Gly Pro Gly Gly Gln
290 295 300
Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gly Tyr
305 310 315 320
Gly Pro Gly Gly Gln Gly Pro Gly Gly Tyr Gly Pro Gly Ser Ser Gly
325 330 335
Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly Ser Ser Ala Ala Ala Ala
340 345 350
Ala Gly Gly Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gly
355 360 365
Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gln Gln Gly Pro Gly Gly Gln
370 375 380
Gly Pro Tyr Gly Pro Gly Ala Ser Gly Pro Gly Gly Gln Gly Pro Tyr
385 390 395 400
Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly Gly Tyr Gly
405 410 415
Pro Gly Gly Gln Gly Pro Ser Ala Ser Ala Ala Ala Ala Ala Gly Gly
420 425 430
Tyr Gly Ser Gly Pro Gly Gly Tyr Gly Pro Tyr Gly Pro Gly Gly Ser
435 440 445
Gly Pro Gly Ser Gly Gln Gln Gly Gln Gly Pro Tyr Gly Pro Gly Ala
450 455 460
Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Pro Gly Gln Gln Gly Pro
465 470 475 480
Tyr Gly Pro Gly Gly Ser Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly
485 490 495
Gly Tyr Gly Pro Gly Ala Ser Gly Gly Asn Gly Pro Gly Ser Gly Gly
500 505 510
Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gly Ser Ala Ala Ala Ala Ala
515 520 525
Gly Gly Tyr Gln Gln Gly Pro Gly Gly Gln Gly Pro Tyr Gly Pro Gly
530 535 540
Ala Ser Ala Ala Ala Ala Ala Gly Gly Tyr Gly Ser Gly Pro Gly Gln
545 550 555 560
Gln Gly Pro Tyr Gly Pro Gly Gly Ser Gly Ser Gly Gln Gln Gly Pro
565 570 575
Gly Gln Gln Gly Pro Tyr Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly
580 585 590
Ser Gly Gln Gln Gly Pro Gly Ala Ser
595 600
<210> 8
<211> 608
<212> PRT
<213> Искусственная последовательность
<220>
<223> PRT380
<400> 8
Met His His His His His His Ser Ser Gly Ser Ser Gly Pro Gly Gln
1 5 10 15
Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gln
20 25 30
Asn Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Gln Ser Ala Ala Ala
35 40 45
Ala Ala Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Gln Gly
50 55 60
Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Pro Gly Gln Tyr Gly Pro
65 70 75 80
Gly Gln Gln Gly Pro Ser Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly
85 90 95
Ser Gly Gln Gln Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gln
100 105 110
Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Gln Gly Pro Gly Ser Ser
115 120 125
Ala Ala Ala Ala Ala Gly Gln Tyr Gly Ser Gly Pro Gly Gln Gln Gly
130 135 140
Pro Tyr Gly Ser Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Tyr
145 150 155 160
Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly
165 170 175
Pro Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Ser Ala Ser Ala Ala
180 185 190
Ala Ala Ala Gly Ser Gly Gln Gln Gly Pro Gly Gln Tyr Gly Pro Tyr
195 200 205
Ala Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Ser Gly Pro Gly Gln
210 215 220
Gln Gly Pro Tyr Gly Pro Gly Gln Ser Ala Ala Ala Ala Ala Gly Ser
225 230 235 240
Gly Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr Ala Ser Ala Ala Ala
245 250 255
Ala Ala Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ser Ser Ala
260 265 270
Ala Ala Ala Ala Gly Gln Tyr Gly Tyr Gly Pro Gly Gln Gln Gly Pro
275 280 285
Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gln Asn Gly Pro
290 295 300
Gly Ser Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Ser Ala
305 310 315 320
Ala Ala Ala Ala Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala
325 330 335
Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro
340 345 350
Gly Gln Tyr Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Pro Gly
355 360 365
Gln Gln Gly Pro Tyr Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly
370 375 380
Gln Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gln Ser Ala
385 390 395 400
Ala Ala Ala Ala Gly Gln Tyr Gln Gln Gly Pro Gly Gln Gln Gly Pro
405 410 415
Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly Gln Gln
420 425 430
Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly
435 440 445
Gln Tyr Gly Pro Gly Gln Gln Gly Pro Ser Ala Ser Ala Ala Ala Ala
450 455 460
Ala Gly Gln Tyr Gly Ser Gly Pro Gly Gln Tyr Gly Pro Tyr Gly Pro
465 470 475 480
Gly Gln Ser Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Gln Gly
485 490 495
Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gln
500 505 510
Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gln Ser Ala Ala
515 520 525
Ala Ala Ala Gly Pro Gly Ser Gly Gln Tyr Gly Pro Gly Ala Ser Ala
530 535 540
Ala Ala Ala Ala Gly Gln Asn Gly Pro Gly Ser Gly Gln Tyr Gly Pro
545 550 555 560
Gly Gln Gln Gly Pro Gly Gln Ser Ala Ala Ala Ala Ala Gly Gln Tyr
565 570 575
Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala
580 585 590
Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Ala Ser
595 600 605
<210> 9
<211> 601
<212> PRT
<213> Искусственная последовательность
<220>
<223> PRT410
<400> 9
Met His His His His His His Ser Ser Gly Ser Ser Gly Pro Gly Gln
1 5 10 15
Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gln
20 25 30
Asn Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Gln Ser Gly Gln Tyr
35 40 45
Gly Pro Gly Gln Gln Gly Pro Gly Gln Gln Gly Pro Gly Ser Ser Ala
50 55 60
Ala Ala Ala Ala Gly Pro Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro
65 70 75 80
Ser Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Gln Gly
85 90 95
Pro Gly Ala Ser Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln
100 105 110
Gln Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Ser
115 120 125
Gly Pro Gly Gln Gln Gly Pro Tyr Gly Ser Ala Ala Ala Ala Ala Gly
130 135 140
Pro Gly Ser Gly Gln Tyr Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser
145 150 155 160
Gly Pro Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Ser Ala Ser Ala
165 170 175
Ala Ala Ala Ala Gly Ser Gly Gln Gln Gly Pro Gly Gln Tyr Gly Pro
180 185 190
Tyr Ala Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Ser Gly Pro Gly
195 200 205
Gln Gln Gly Pro Tyr Gly Pro Gly Gln Ser Gly Ser Gly Gln Gln Gly
210 215 220
Pro Gly Gln Gln Gly Pro Tyr Ala Ser Ala Ala Ala Ala Ala Gly Pro
225 230 235 240
Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala
245 250 255
Gly Gln Tyr Gly Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly
260 265 270
Ala Ser Gly Gln Asn Gly Pro Gly Ser Gly Gln Tyr Gly Pro Gly Gln
275 280 285
Gln Gly Pro Gly Gln Ser Ala Ala Ala Ala Ala Gly Pro Gly Gln Gln
290 295 300
Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Gln Tyr
305 310 315 320
Gly Pro Gly Gln Gln Gly Pro Gly Gln Tyr Gly Pro Gly Ser Ser Gly
325 330 335
Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ser Ser Ala Ala Ala Ala
340 345 350
Ala Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gln
355 360 365
Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gln Gln Gly Pro Gly Gln Gln
370 375 380
Gly Pro Tyr Gly Pro Gly Ala Ser Gly Pro Gly Gln Gln Gly Pro Tyr
385 390 395 400
Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly Gln Tyr Gly
405 410 415
Pro Gly Gln Gln Gly Pro Ser Ala Ser Ala Ala Ala Ala Ala Gly Gln
420 425 430
Tyr Gly Ser Gly Pro Gly Gln Tyr Gly Pro Tyr Gly Pro Gly Gln Ser
435 440 445
Gly Pro Gly Ser Gly Gln Gln Gly Gln Gly Pro Tyr Gly Pro Gly Ala
450 455 460
Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro
465 470 475 480
Tyr Gly Pro Gly Gln Ser Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly
485 490 495
Gln Tyr Gly Pro Gly Ala Ser Gly Gln Asn Gly Pro Gly Ser Gly Gln
500 505 510
Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Ser Ala Ala Ala Ala Ala
515 520 525
Gly Gln Tyr Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly
530 535 540
Ala Ser Ala Ala Ala Ala Ala Gly Gln Tyr Gly Ser Gly Pro Gly Gln
545 550 555 560
Gln Gly Pro Tyr Gly Pro Gly Gln Ser Gly Ser Gly Gln Gln Gly Pro
565 570 575
Gly Gln Gln Gly Pro Tyr Ala Ser Ala Ala Ala Ala Ala Gly Pro Gly
580 585 590
Ser Gly Gln Gln Gly Pro Gly Ala Ser
595 600
<210> 10
<211> 565
<212> PRT
<213> Искусственная последовательность
<220>
<223> Met-PRT468
<400> 10
Met Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala
1 5 10 15
Ala Ala Ala Ala Ala Gly Ser Asn Gly Pro Gly Ser Gly Gln Gln Gly
20 25 30
Pro Gly Gln Ser Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln
35 40 45
Gln Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala Ala Ala Gly Pro Gly
50 55 60
Gln Tyr Gly Pro Gly Gln Gln Gly Pro Ser Ala Ser Ala Ala Ala Ala
65 70 75 80
Ala Ala Ala Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Ala Ser Gly
85 90 95
Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Gln Gly Pro Gly Ser
100 105 110
Ser Ala Ala Ala Ala Ala Ala Ala Gly Ser Tyr Gly Ser Gly Pro Gly
115 120 125
Gln Gln Gly Pro Tyr Gly Ser Ala Ala Ala Ala Ala Ala Ala Gly Pro
130 135 140
Gly Ser Gly Gln Tyr Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Gly
145 150 155 160
Pro Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Ser Ala Ser Ala Ala
165 170 175
Ala Ala Ala Ala Ala Gly Ser Gly Gln Gln Gly Pro Gly Gln Tyr Gly
180 185 190
Pro Tyr Ala Ser Ala Ala Ala Ala Ala Ala Ala Gly Ser Tyr Gly Ser
195 200 205
Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Gln Ser Gly Ser Gly
210 215 220
Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr Ala Ser Ala Ala Ala Ala
225 230 235 240
Ala Ala Ala Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ser Ser
245 250 255
Ala Ala Ala Ala Ala Ala Ala Gly Ser Tyr Gly Tyr Gly Pro Gly Gln
260 265 270
Gln Gly Pro Tyr Gly Pro Gly Ala Ser Gly Gln Asn Gly Pro Gly Ser
275 280 285
Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Pro Ser Ala Ala Ala
290 295 300
Ala Ala Ala Ala Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala
305 310 315 320
Ser Ala Ala Ala Ala Ala Ala Ala Gly Ser Tyr Gly Pro Gly Gln Gln
325 330 335
Gly Pro Gly Gln Tyr Gly Pro Gly Ser Ser Gly Pro Gly Gln Gln Gly
340 345 350
Pro Tyr Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala Ala Ala Gly Ser
355 360 365
Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Pro Ser Ala Ala
370 375 380
Ala Ala Ala Ala Ala Gly Ser Tyr Gln Gln Gly Pro Gly Gln Gln Gly
385 390 395 400
Pro Tyr Gly Pro Gly Ala Ser Gly Pro Gly Gln Gln Gly Pro Tyr Gly
405 410 415
Pro Gly Ala Ser Ala Ala Ala Ala Ala Ala Ala Gly Pro Gly Gln Tyr
420 425 430
Gly Pro Gly Gln Gln Gly Pro Ser Ala Ser Ala Ala Ala Ala Ala Ala
435 440 445
Ala Gly Ser Tyr Gly Ser Gly Pro Gly Gln Tyr Gly Pro Tyr Gly Pro
450 455 460
Gly Gln Ser Gly Pro Gly Ser Gly Gln Gln Gly Gln Gly Pro Tyr Gly
465 470 475 480
Pro Gly Ala Ser Ala Ala Ala Ala Ala Ala Ala Gly Ser Tyr Gly Pro
485 490 495
Gly Gln Gln Gly Pro Tyr Gly Pro Gly Pro Ser Ala Ala Ala Ala Ala
500 505 510
Ala Ala Gly Pro Gly Ser Gly Gln Tyr Gly Pro Gly Ala Ser Gly Gln
515 520 525
Asn Gly Pro Gly Ser Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly
530 535 540
Pro Ser Ala Ala Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Gln
545 550 555 560
Gly Pro Gly Ala Ser
565
<210> 11
<211> 576
<212> PRT
<213> Искусственная последовательность
<220>
<223> PRT468
<400> 11
Met His His His His His His Ser Ser Gly Ser Ser Gly Pro Gly Gln
1 5 10 15
Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala Ala Ala Ala
20 25 30
Gly Ser Asn Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Gln Ser Gly
35 40 45
Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Gln Gly Pro Gly Ser
50 55 60
Ser Ala Ala Ala Ala Ala Ala Ala Gly Pro Gly Gln Tyr Gly Pro Gly
65 70 75 80
Gln Gln Gly Pro Ser Ala Ser Ala Ala Ala Ala Ala Ala Ala Gly Pro
85 90 95
Gly Ser Gly Gln Gln Gly Pro Gly Ala Ser Gly Gln Tyr Gly Pro Gly
100 105 110
Gln Gln Gly Pro Gly Gln Gln Gly Pro Gly Ser Ser Ala Ala Ala Ala
115 120 125
Ala Ala Ala Gly Ser Tyr Gly Ser Gly Pro Gly Gln Gln Gly Pro Tyr
130 135 140
Gly Ser Ala Ala Ala Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Tyr
145 150 155 160
Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Gly Pro Gly Gln Tyr Gly
165 170 175
Pro Gly Gln Gln Gly Pro Ser Ala Ser Ala Ala Ala Ala Ala Ala Ala
180 185 190
Gly Ser Gly Gln Gln Gly Pro Gly Gln Tyr Gly Pro Tyr Ala Ser Ala
195 200 205
Ala Ala Ala Ala Ala Ala Gly Ser Tyr Gly Ser Gly Pro Gly Gln Gln
210 215 220
Gly Pro Tyr Gly Pro Gly Gln Ser Gly Ser Gly Gln Gln Gly Pro Gly
225 230 235 240
Gln Gln Gly Pro Tyr Ala Ser Ala Ala Ala Ala Ala Ala Ala Gly Pro
245 250 255
Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ser Ser Ala Ala Ala Ala Ala
260 265 270
Ala Ala Gly Ser Tyr Gly Tyr Gly Pro Gly Gln Gln Gly Pro Tyr Gly
275 280 285
Pro Gly Ala Ser Gly Gln Asn Gly Pro Gly Ser Gly Gln Tyr Gly Pro
290 295 300
Gly Gln Gln Gly Pro Gly Pro Ser Ala Ala Ala Ala Ala Ala Ala Gly
305 310 315 320
Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala Ala Ala Ala
325 330 335
Ala Ala Ala Gly Ser Tyr Gly Pro Gly Gln Gln Gly Pro Gly Gln Tyr
340 345 350
Gly Pro Gly Ser Ser Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly
355 360 365
Ser Ser Ala Ala Ala Ala Ala Ala Ala Gly Ser Tyr Gly Pro Gly Gln
370 375 380
Gln Gly Pro Tyr Gly Pro Gly Pro Ser Ala Ala Ala Ala Ala Ala Ala
385 390 395 400
Gly Ser Tyr Gln Gln Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly
405 410 415
Ala Ser Gly Pro Gly Gln Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala
420 425 430
Ala Ala Ala Ala Ala Ala Gly Pro Gly Gln Tyr Gly Pro Gly Gln Gln
435 440 445
Gly Pro Ser Ala Ser Ala Ala Ala Ala Ala Ala Ala Gly Ser Tyr Gly
450 455 460
Ser Gly Pro Gly Gln Tyr Gly Pro Tyr Gly Pro Gly Gln Ser Gly Pro
465 470 475 480
Gly Ser Gly Gln Gln Gly Gln Gly Pro Tyr Gly Pro Gly Ala Ser Ala
485 490 495
Ala Ala Ala Ala Ala Ala Gly Ser Tyr Gly Pro Gly Gln Gln Gly Pro
500 505 510
Tyr Gly Pro Gly Pro Ser Ala Ala Ala Ala Ala Ala Ala Gly Pro Gly
515 520 525
Ser Gly Gln Tyr Gly Pro Gly Ala Ser Gly Gln Asn Gly Pro Gly Ser
530 535 540
Gly Gln Tyr Gly Pro Gly Gln Gln Gly Pro Gly Pro Ser Ala Ala Ala
545 550 555 560
Ala Ala Ala Ala Gly Pro Gly Ser Gly Gln Gln Gly Pro Gly Ala Ser
565 570 575
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к модифицированному фиброину, включающему последовательность домена, представленную формулой: [мотив (A)n-REP]m. Модифицированный фиброин, в котором по меньшей мере один или множество глициновых остатков в REP заменены другим аминокислотным остатком по сравнению с природным фиброином, сохраняет прочность и растяжимость природного фиброина и может быть использован для получения волокон. 16 н. и 24 з.п. ф-лы, 3 ил., 9 табл., 5 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ получения полимерсодержащих волокон

Комментарии