Антибактериальные цефалоспорины, фармацевтическая композиция на их основе и способ лечения - RU2183212C2
Код документа: RU2183212C2
Чертежи



































Описание
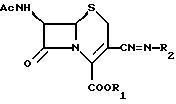
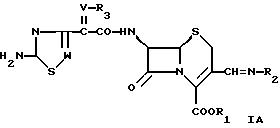
Изобретение относится к антибактериальным соединениям, которые являются 7-ациламино-3-(имино)метил цефалоспоринами.
В частности в настоящем изобретении
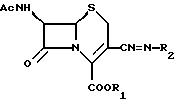
предлагается соединение формулы
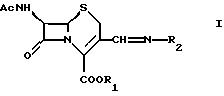
где R1 обозначает водород или эфирную составляющую,
R2 обозначает группу формулы
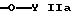
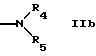
или
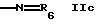
где Y обозначает водород, алкил, алкенил, ацил, карбамоил или арил,
R4 обозначает водород, алкил, алкенил, циклоалкил, арил, ацил или гетероциклил,
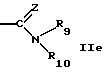
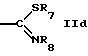
R5 обозначает водород, алкил, алкенил, циклоалкил, арил, гетероциклил или группу формулы
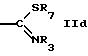
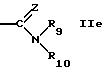
или
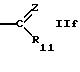
где R7 обозначает алкил или арил,
R8 обозначает водород, циклоалкил или алкил,
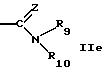
R9 обозначает водород или алкил,
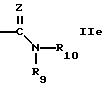
R10 обозначает водород, алкил, гидрокси, амино, фенил, алкенил, циклоалкил, арил, гетероциклил или группу формулы
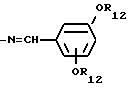
-N=CH-Phe
где Рhе обозначает арил,
R9 и R10 вместе с атомом азота обозначает гетероциклил,
Z обозначает кислород, серу или N-R13, где
R13 обозначает водород, алкил или циклоалкил,
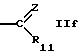
R11 обозначает водород, алкил, арил, циклоалкил или гетероциклил, или
R4 и R5 вместе с атомом азота обозначают гетероциклил,
R6 обозначает гетероциклил и
Ас обозначает
(1) группу
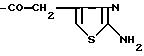
(2) группу формулы
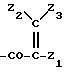
или

где В обозначает N или СН,
Z1 обозначает арил, циклоалкил, 1,4-циклогексадиенил или гетероциклил,
Z2 обозначает водород, алкил или -CH2COOZ5,
где Z5 обозначает водород, алкил или циклоалкил,
Z3 обозначает водород или алкил,
Z4 обозначает водород или органический радикал,
D обозначает кислород или СН2.
Подгруппа по изобретению включает в себя любые из индивидуальных групп со значениями, указанными здесь.
R1 может быть водородом или эфирной составляющей. Эфирная составляющая включает в себя алкил, предпочтительно С1-6алкил; арилалкил, например бензил, алкоксибензил, такой как 4-метоксибензил; инданил, фталидил, алкоксиметил, например метоксиметил; (С1-6)алканоилокси(С1-6)алкил, (C1-6)алкоксикарбонил-окси(С1-6)алкил, глицилоксиметил, фенилглицилоксиметил, (5-метил-2-оксо-1, 3-диоксолен-4-ил)метил и эфирные составляющие, которые образуют с СОО-группой физиологически гидролизуемый и приемлемый сложный эфир, например известный среди гидролизуемых эфирных групп в области цефалоспоринов. Соединение формулы I может, следовательно, быть в форме физиологически гидролизуемого и физиологически приемлемого сложного эфира. Под физиологически гидролизуемыми и физиологически приемлемыми эфирами здесь подразумевается сложный эфир, в котором группа СОО-этерифицирована и который может гидролизоваться в физиологических условиях с образованием кислоты, которая сама по себе является физиологически приемлемой в рекомендуемых дозах. Этот термин, таким образом, следует понимать как определенные регулярные пролекарственные формы. Эфирная составляющая может быть предпочтительно составляющей, которая является легко гидролизуемой в физиологических условиях. Такие эфиры могут вводиться предпочтительно перорально. Парентеральное введение может быть показано, если эфир per se является активным соединением или если гидролиз происходит в крови.
Y может быть предпочтительно водородом, незамещенным алкилом или алкилом, замещенным, например, гидроксилом или предпочтительно остатком карбоновой кислоты. Остаток карбоновой кислоты включает в себя остаток карбоновой кислоты в свободной форме или в форме соли, остаток эфира карбоновой кислоты и амида карбоновой кислоты. Карбоновая кислота представляет собой, например, С1-7карбоновую кислоту, предпочтительно C1-5алифатическую карбоновую кислоту, алкильная часть которой включает низший алкил. Алкокси группа эфира карбоновой кислоты включает C1-6, предпочтительно С1-4 алкокси группу. Алкил представляет собой предпочтительно низший алкил. Алкильная группа является предпочтительно незамещенной или замещенной остатками карбоновых кислот.
R4 может быть предпочтительно водородом или алкилом, например низшим алкилом.
R5 может быть предпочтительно водородом; незамещенным алкилом; алкилом, замещенным, например, оксо, алкил или галогенированными алкил группами; амино; одно- или более чем однократно замещенным гетероциклилом; или группой формул IId, IIе, IIf. Гетероциклил включает в себя ненасыщенный или насыщенный гетероциклил, имеющий, например, 5 или 6 членов в кольце и, например, 1-3 гетероатома, таких как N, О, S, предпочтительно N, или конденсированный гетероциклил, такой как бензотиазолил.
R4 и R5 вместе с атомом азота могут быть гетероциклилом, имеющим предпочтительно 5 или 6 членов в кольце и имеющим предпочтительно 1-3 гетероатома, например атома азота; который может быть незамещенным гетероциклилом или одно- или более чем однократно замещенным гетероциклилом, например замещенным оксо, амино, алкил группами.
R6 может быть насыщенным или ненасыщенным гетероциклилом, имеющим предпочтительно 5 или 6 членов в кольце и имеющим, например, 1 или 2 азотных гетероатома; например незамещенным гетероциклилом; или одно- или более чем однократно замещенным гетероциклилом, например амино, алкил или тионо группами.
R7 может быть предпочтительно алкилом.
R8 может быть предпочтительно алкилом или циклоалкилом.
R9 может быть предпочтительно водородом или низшим алкилом.
R13 может быть предпочтительно алкилом.
R10 может быть предпочтительно водородом; арилом;
алкенилом; циклоалкилом; незамещенным алкилом; замещенным
алкилом, например группами гидрокси, галоген, гетероциклил, таким как пиридил, амино, например Н(алкил)2 или N+
(алкил)3; или может быть группой
-N=CH-Ar
где Аr обозначает гетероциклил; незамещенный арил или замещенный арил, например гидрокси или алкокси группами; предпочтительно
арил, который может быть предпочтительно фенилом.
R9 и R10 вместе с атомом азота могут быть гетероциклилом, имеющим предпочтительно 5 или 6 членов в кольце и 1-3 гетероатома, таких как N, S, О, например N, О; предпочтительно насыщенным гетероциклилом. Гетероциклил включает в себя незамещенный гетероциклил или замещенный гетероциклил, например группами ацил, формил, алкил, например низший алкил. Примеры включают в себя пирролидин, морфолин, пиперазин, предпочтительно пиперазин.
R11 может быть предпочтительно водородом; незамещенным алкилом; замещенным алкилом, например группами аминоалкил, диаминоалкил, триаминоалкил; арилом, таким как дигидроксифенил; циклоалкилом; или незамещенным гетероциклилом; или замещенным гетероциклилом, например группами алкил, тионогетероциклил; гетероциклилом, имеющим предпочтительно 5 или 6 членов в кольце и 1-3 гетероатома, предпочтительно N атома.
Если не указано иначе, здесь любая углеродсодержащая группа может содержать до 20 атомов углерода, например алкил включает в себя C1-20, например С1-8алкил. Низший алкил включает в себя, например, С1-4алкил, предпочтительно С1-2 алкил. Алкенил включает в себя C2-20, например С2-8алкенил. Низший алкенил включает, например, С3-5 алкенил, предпочтительно С3алкил. Циклоалкил включает в себя, например, С3-6циклоалкил, конкретно С3, C5 или С6циклоалкил. Алкил, алкенил и циклоалкил включают в себя незамещенный алкил, алкенил или циклоалкил и замещенный алкил, алкенил или циклоалкил, например галогеном, производным сульфоновой кислоты, таким как SO3Н, СF3, гидрокси, алкокси, ацил, алкиламино, пиридил группами. Циклоалкил предпочтительно незамещенный. Ацил включает в себя C1-12, например С1-6ацил, особенно С1-4 ацил. Ацил включает незамещенный ацил и замещенный ацил, например гидрокси, алкокси, амино группами. Арил включает в себя фенил. Арил может быть незамещенным арилом или замещенным арилом, например алкил, алкоксил, ацил группами, галогеном, гидрокси, незащищенной или защищенной амино группой. Алкоксил включает в себя алкоксил, в котором алкильная часть такая же, как определено выше.
Гетероциклил включает в себя гетероциклил, имеющий 5 или 6 членов в кольце и 1-3 гетероатома азота, серы и/или кислорода, включая, например, конденсированный гетероциклил, такой как, например, бензтиазолил. Гетероциклил далее включает в себя незамещенный гетероциклил и замещенный гетероциклил, например оксо, алкокси, гидрокси, тионо, меркапто, алкилтио, имино, алкиламино, алкилимино, амино, галоген, ацил, СF3, СНО, алкил, циклоалкил группами.
Карбамоил включает в себя карбамоильную группу или карбомоил, имеющий алкильные или арильные остатки.
Z1 обозначает незамещенный циклоалкил, 1, 4-циклогексадиенил, гетероциклил или арил и одно- или более чем однократно замещенный циклоалкил, 1,4-циклогексадиен, гетероциклил или арил, например карбокси, амино, нитро, циано группами, низшим алкилом, низшей алкокси, гидрокси группами, галогеном, -CO-N(Z5Z6), -N(Z6)-COOZ7, Z6CO-, Z6OCO-, Z6COO-группами.
Z2 обозначает водород; CH2COOZ5; незамещенный низший алкил; одно- или более чем однократно замещенный низший алкил, например карбоксил, амино, нитро, циано, низшей алкил, низшей алкокси, гидрокси, галоген, -COZ5Z6, -N(Z6)-COOZ7, Z6CO-, Z6OCO- или Z6COO- группами.
Z3 обозначает водород или низший алкил.
Z4 обозначает водород или органический
радикал, предпочтительно водород; низший алкил; циклоалкил; аралкил; ацил;
карбоксиалкил; Z6CO- C(Z7Z8)COOZ6 или предпочтительно в том случае, когда Z1 в группе
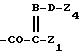
обозначает группу 2-аминотиазол-4ил или 2-аминотиа-3,5-диазол-4ил, Z4 обозначает группу формулы
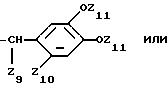
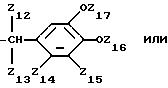



где Z9 и Z10 независимо один от другого обозначают водород или защищенный или незащищенный карбоксил,
Z11 обозначает водород или ацетил,
Z12 обозначает незащищенный или защищенный карбоксил,
Z13 обозначает водород или метил,
Z14 обозначает водород; хлоро; незащищенный или защищенный карбоксил; метил; изопропил; гидрокси; метокси; ацетокси,
Z15 и Z16 обозначают независимо друг от друга водород, гидрокси, метокси, этокси, 2-метокиэтоксиметокси, ацетокси, хлороацетокси, буганоилокси, метансульфонилокси, п-толуолсульфонилокси, амино, ацетиламино, бензилоксикарбониламино или метансульфонил группу; или
Z15 и Z16 обозначают вместе этилендиокси или карбонилдиокси группу,
Z17 обозначает водород, гидрокси, ацетокси, метил, метокси, хлороацетокси группу при условии, что не все Z14, Z15, Z16 и Z17 обозначают водород,
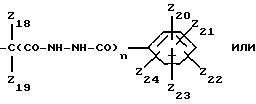
Z18 и Z19 обозначают независимо друг от друга водород или метил,
Z20, Z21, Z22, Z23 и Z24 обозначают независимо друг от друга водород, галоген или гидроксильную группу,
Z25 и Z26 обозначают независимо друг от друга водород; С1-5алкил; незамещеннй фенил или замещенный фенил,
Z27 обозначает незамещенный низший алкил или замещенный низший алкил,
Z28 и Z29 обозначают независимо друг от друга водород или гидроксильную группу, и
n обозначает 0 или 1,
Z5 обозначает водород, алкил, предпочтительно низший алкил,
Z6 и Z7 обозначают независимо друг от друга водород или алкил, предпочтительно низший алкил,
Z6 и Z7 вместе с атомом углерода обозначают циклоалкил и
Z5 и Z6 вместе обозначают циклоалкил.
Z4 может быть выбран из следующих групп:
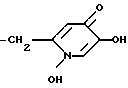
или
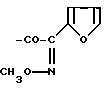
Например, Ас может обозначать группу формулы
или
Предпочтительно Ас обозначает соединение формулы
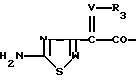
где W обозначает СН или N,
V обозначает СН или N-O и
R3 обозначает водород, ацил, карбоксил или алкил.
Конфигурация R3 в группе -C=V-R3 может быть син[(Z)] или анти[(Е)] и предпочтительно син[(Z)].
Если R3 обозначает алкил, то R3 включает в себя незамещенный алкил или замещенный алкил, например галогеном, карбоксилом. Предпочтительно W обозначает СН.
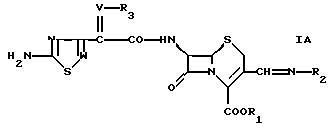
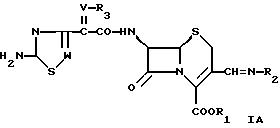
В другом аспекте в настоящем изобретении предлагается соединение формулы
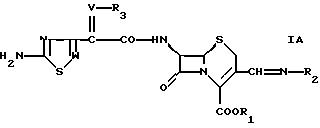
где W обозначает СН или N,
V обозначает СН или N-O,
R1 обозначает водород или эфирную группу,
R2 обозначает группу формулы
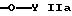

или
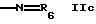
где Y обозначает водород; незамещенный низший алкил или замещенный низший алкил остатком карбоновой кислоты, эфира карбоновой кислоты или амида карбоновой кислоты,
R4 обозначает водород, фенил, циклоалкил или низший алкил,
R5 обозначает водород, низший алкил, гетероциклил или группу формул
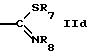

или

где R7 обозначает низший алкил,
R8 обозначает водород, циклоалкил или низший алкил,
R9 обозначает водород или низший алкил,
R10 обозначает водород, гидроксил; амино; фенил; алкенил; циклоалкил; гетероциклил; незамещенный алкил; замещенный алкил СF3, ОН, алкокси, карбоксилом, галогеном, амино, моноалкиламино, диалкиламино, триалкиламино группой, пиридилом или остатком сульфоновой кислоты; группу формулы

где R12 обозначает водород или низший алкил,
Z обозначает кислород, серу или N-R13,
где R13 обозначает водород или низший алкил и
R11 обозначает водород; дигидроксифенил; циклоалкил; гетероциклил; незамещенный низший алкил; замещенный низший алкил пиридилом или моноалкиламино, диалкиламино или триалкиламино группами;
R4 и R5 и/или R9 и R10 независимо друг от друга вместе с азотом обозначают гетероциклил,
R6 обозначает гетероциклил и
R3 обозначает водород; ацил; карбоксил; незамещенный алкил; замещенный алкил галогеном или карбоксилом.
В другом
аспекте в
настоящем изобретении предлагается соединение формулы

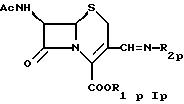
где R1p такой же, как R1 в формуле I,
Ас такой, как определено в формуле I,
R2p обозначает группу формул
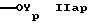
или
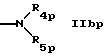
где Yp такой же, как Y в формуле IА,
R4p такой же, как R4 в формуле IА, и
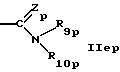
R5p обозначает водород, циклоалкил, низший алкил или группу формулы
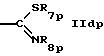
или
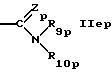
где R8p такой же, как R8 в формуле IА,
Zp такой же, как Z в формуле IА,
R9p такой же, как R9 в формуле IА,
R7p обозначает метил,
R10p обозначает водород, низший алкил или гидрокси и
R4p и R5p и/или R9p и R10p независимо друг от друга вместе с азотом обозначают гетероциклил и
соединений формул IIbр, IIdр и IIер обозначают любую таутомерную форму в свободной форме или, если такая форма существует, в форме соли присоединения кислоты, внутренней соли, четвертичной соли или их гидрата.
В другом аспекте в настоящем изобретении предлагается соединение формулы

где Ас такой же, как определено в формуле I,
R1q такой же, как R1 в формуле IА, и
R2q обозначает группу формулы
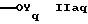
или

где Yq такой же, как Y в формуле IА,
R4q такой же, как R4 в формуле IА, и
R5q обозначает водород, циклоалкил, низший алкил или группу формул
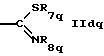
или
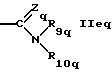
где R7q такой же, как R7 в формуле IА,
R8q такой же, как R8 в формуле IА,
Zq такой же, как Z в формуле IА,
R9q такой же, как R9 в формуле IА,
R10q обозначает водород, низший алкил или гидрокси и
R4q и R5q и/или R9q и R10q независимо друг от друга вместе с азотом обозначают гетероциклил и
соединение формул IIbр, IIdр и IIер обозначают любую таутомерную форму в свободной форме или, если такая форма существует, в форме соли присоединения кислот, внутренней соли, четвертичной соли или их гидрата.
В
дальнейшем аспекте в настоящем изобретении предлагается соединение формулы
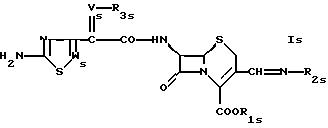
где R1s такой же, как R1 в формуле IА,
Vs такой же, как V в формуле IА,
Ws такой же, как W в формуле IА,
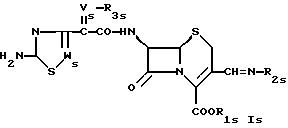
R3s обозначает водород, низший ацил; незамещенный алкил; замещенный низший алкил карбоксилом и/или фтором и
R2s обозначает группу формулы
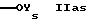
или
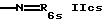
где Ys обозначает водород; незамещенный низший алкил или замещенный алкил карбоксилом,
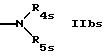
R4s обозначает водород или низший алкил и
R5s обозначает водород; насыщенный или ненасыщенный незамещенный гетероциклил, имеющий 5 или 6 членов в кольце и 1-3 гетероатома азота; насыщенный или ненасыщенный, одно- или более чем однократно замещенный гетероциклил оксо-группой, низшим алкилом, аминогруппой или CF3, имеющий 5 или 6 членов в кольце и 1-3 гетероатомов азота; бензотиазолил или группу формулы
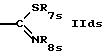
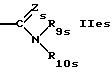
или

где Zs такой же, как Z в формуле I,
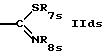
R7s обозначает низший алкил,
R8s обозначает водород, циклоалкил или низший алкил,
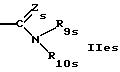
R9s обозначает водород или низший алкил,
R10s обозначает водород; фенил; аллил; циклоалкил; незамещенный алкил; замещенный алкил группой СF3, диалкиламино, триалкиламино, гидрокси, пиридилом или SО3Н, и
R11s обозначает водород; пиридил; циклоалкил; незамещенный низший алкил; замещенный низший алкил пиридилом или триалкиламино; насыщенный или ненасыщенный гетероциклил, имеющий 5 или 6 членов в кольце и 1-3 гетероатома азота; или одно- или более чем однократно замещенный гетероциклил низшим алкилом и/или группой тионо, имеющий 5 или 6 членов в кольце и 1-3 гетероатома азота;
R4s и R5s вместе с атомом азота обозначают гетероциклил, выбранный из насыщенного незамещенного гетероциклила, имеющего 5 или 6 членов в кольце и 1 или 2 гетероатома азота; насыщенного, одно- или более чем однократно замещенного гетероциклила оксогруппой или низшим алкилом, имеющего 5 или 6 членов в кольце и 1 или 2 гетероатома азота и/или
R9s и R10s вместе с атомом азота обозначают насыщенный незамещенный гетероциклил, имеющий 5 или 6 членов в кольце и 1 или 2 гетероатома азота и/или кислорода; ненасыщенный, одно- или более чем однократно замещенный гетероциклил группой СНО или низшим алкилом, имеющий 5 или 6 членов в кольце и 1 или 2 гетероатома азота и/или кислорода.
В другом аспекте в настоящем
изобретении
предлагается соединение формулы
где W обозначает СН или N.
V
обозначает СН
или N-O,
R1 обозначает водород или эфирную группу и
R2 обозначает группу формулы
-N (R4R5) IIb
где R4 такой,
как обозначено в п.1, и
R5 обозначает группу формулы
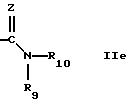
где Z обозначает -N-R13, где
R13 такой, как обозначено в п.1, и
R9 и R10 вместе с атомом азота обозначают гетероциклил, который является пиперазинилом.
В другой аспекте в настоящем изобретении предлагается соединение, выбранное из
7-[[(2-амино-4-тиазолил)-(Z)-(гидроксиимино)ацетил]амино]-3-[[(аминоиминометил)гидразоно]метил]-3-цефем-4-карбоновой кислоты (соединение Примера 2).
7-[[(2-амино-4-тиазолил)-(Z)-(гидроксиимино)ацетил]-амино]-3-[[(пиперазиноиминометил)гидразоно] метил] -3-цефем-4-карбоновой кислоты (соединение примера 96),
7-[[(5-амино-1,2,
4-тиадиазол-3-ил)-(Z)-(фторметоксиимино)ацетил] амино] -3-[[(пиперазиноиминометил)гидразоно] метил] -3-цефем-4-карбоновой кислоты (соединение примера 139).
Соединение формул I, IА, Iр, Iq, Is, IVi, IVa и VIa может существовать в равновесии с таутомерными формами. Настоящее изобретение включает соединение формул I, IA, Ip, Iq, Is, IVi, IVa и VIa в любой таутомерной форме, в которой оно может существовать.
В другом аспекте в настоящем изобретении предлагается способ для производства соединения формулы I взаимодействием соединения формулы

где Ас такой, как определено в формуле I и
a) либо
α) Rb обозначает гидрокси, a Rc и Rd вместе образуют связь, либо
β) Rd обозначает водород, катион, эфиробразующую группу или силилгруппу, а Rb и Rc вместе обозначают оксо в свободной форме или в форме соли присоединения кислоты с группой формулы
H2N-R2
где R2 такой, как определено в формуле I, или
b) взаимодействием соединения формулы
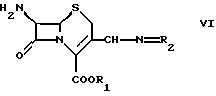
где R1 и R2 такие, как определено в формуле I, с соединением формулы
Ac-X'
где Ас такой, как определено в формуле I, a X' обозначает уходящую группу.
По желанию, реакционные группы могут быть защищены защитными группами, которые могут быть теми, которые отщепляются либо в условиях реакции, либо после окончания реакции, описанной выше. Соединение формулы I, где R1 обозначает водород, может быть превращено в соединение формулы I, где R1 обозначает группу эфира карбоновой кислоты. Соединение формулы I может быть выделено из реакционной смеси обычным способом.
Способ а) может быть проведен следующим образом.
Соединение формулы III в растворителе, который является инертным в условиях реакции, такой как вода, смесь воды и низшего спирта и/или диоксана или диполярный дегидрогенизированный растворитель, например диметилформамид или диметилсульфоксид, возможно смешанный со спиртом или водой, подвергают взаимодействию с соединением формулы IV при температуре примерно -20-50oС. Оптимальный рН может быть достигнут путем добавления неорганической или органической кислоты или основания. Соединение формулы I, полученное таким образом, может быть выделено обычным способом, например добавлением антирастворителя или хроматографическими методами.
Способ b) может быть осуществлен следующим образом.
Реакцию проводят стандартно, например соединение формулы I может быть подвергнуто взаимодействию с соединением формулы VII в растворителе, например растворением или суспендированием в смеси ацетон/вода, например при комнатной температуре.
Реактивные группы могут быть защищены, предпочтительно путем технологии силилзащитных групп. Подходящие растворители включают растворители, которые являются инертными в реакционных условиях, такие как хлорированные углеводы, нитрилы, такие как ацетонитрил, эфиры, такие как тетрагидрофуран, или смесь таких растворителей. Далее, подходящие растворители включают диполярные дегидрогенизированные растворители, например N,N-диметилформамид. Защитные группы могут быть отщеплены традиционным способом.
Исходное соединение формулы II, например, может быть получено
а) реакцией соединения формулы

где либо
α) Ra обозначает соль -NH2 с неорганической или органической кислотой, R'b обозначает гидрокси, и R'c и R'd вместе обозначают связь, либо
β) Ra обозначает NH2, R'd обозначает водород, и R'b и R'c вместе обозначают оксо, с агентом силилирования и,
соединение, полученное в стадии а) формулы
где Sil обозначает силил группу, и либо
α) R''b обозначает -Osil, и R''c и R''d вместе обозначают связь, либо
β) R''d обозначает Sil, и R''b и R''c вместе обозначают оксо,
ацилируют либо непосредственно в реакционной смеси, либо после выделения из реакционной смеси.
Ацилирование можно проводить стандартным способом.
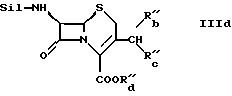
Соединение формулы IIIc может быть получено
а) для производства соединения формулы
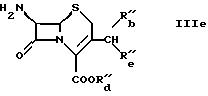
в форме соли неорганической или органической кислоты, и где R'''b обозначает гидрокси, и R'''c и R'''d вместе обозначают связь,
путем взаимодействия соли органической или неорганической кислоты соединения формулы
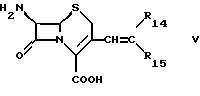
где R14 и R15 являются одинаковыми или разными и каждый обозначает водород или органический остаток в органическом растворителе, иногда в присутствии воды, с озоном;
b) для производства соединения формулы

путем обработки соединения формулы IIIе, где R'''b, R'''e и R'''d такие, как определено выше,
основанием.
Соединения формулы IV являются частично новыми и могут быть получены аналогично стандартным методам, или как описано в примерах.
В другом аспекте в настоящем изобретении
предлагается соединение формулы
H2N-R2i IVi
где R2i обозначает группу формулы
-N (R4iR5i) IIbi
где R4i такой же, как R4 в формуле I, и обозначает
водород или алкил и
R5i обозначает группу формулы

где Zi обозначает N-R13i,
где R13i такой же, как R13 в формуле I, и обозначает предпочтительно водород или алкил, или
R9i и R10i вместе с атомом азота обозначают гетероциклил, который является пиперазинилом; или
R4i такой же, как R4 в формуле I, и обозначает предпочтительно водород и
R5i обозначает группу формулы
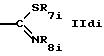
где R8i обозначает алкил, предпочтительно по меньшей мере С2алкил;
или циклоалкил, предпочтительно циклопропил и
R7i обозначает алкил, предпочтительно метил; или
R4i такой же, как R4 в формуле I, и обозначает предпочтительно водород или алкил и
R5i обозначает группу формулы
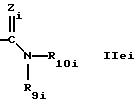
где Zi обозначает N-R13i,
где R13i обозначает водород, алкил или циклоалкил, предпочтительно водород или алкил,
R9i обозначает водород и
R10i обозначает CH2CF3, С(СН3)3, ОН или алкильную группу, имеющую по крайней мере 2 атома углерода, которые замещены диалкиламином или триалкиламмонием, гидрокси; или
R4i такой же, как R4 в формуле I, и обозначает предпочтительно водород;
R5i обозначает группу формулы

где Zi обозначает N-R13i,
где алкил R13i обозначает алкил или циклоалкил, предпочтительно алкил, и
R9i и R10i вместе с атомом азота обозначают гетероциклил, который является морфолилом или пирролидинилом; или
R4i такой же, как R4 в формуле I, и обозначает предпочтительно водород,
R5i обозначает группу формулы
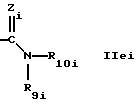
где Zi обозначает N-R13i,
где R13i обозначает водород, алкил или циклоалкил, предпочтительно водород,
R9i обозначает водород,
R10i обозначает циклоалкил, предпочтительно циклопропил; или
R4i такой же, как R4 в формуле I, и обозначает предпочтительно водород;
R5i обозначает группу формулы
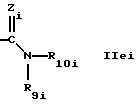
где Zi обозначает N-R13i,
где R13i такой же, как R13 в формуле I, и обозначает предпочтительно водород,
R9i обозначает водород или алкил, предпочтительно водород, и
R10i обозначает группу
-N = CH-Phe
где Phe обозначает фенил, предпочтительно дигидроксифенил, или
R4i такой же, как R4 в формуле I, и обозначает предпочтительно водород,
R5i обозначает группу формулы
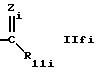
где Zi обозначает N-R13i,
где R13i обозначает водород, алкил или циклоалкил, предпочтительно водород,
R11i обозначает дигидроксифенил или пирролидил, замещенный алкилом; или
Zi обозначает кислород и
R11i обозначает группу формулы
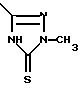
В другом аспекте в настоящем изобретении предлагается соединение формулы
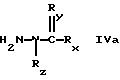
где Rx представляет собой группу формулы
-NH-C(CH3 )3
или
-NH-CH2CF3
или
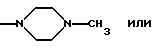
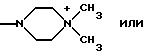
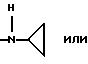

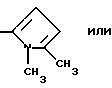

Ry представляет собой NH и
Rz представляет собой водород; или
Rx представляет собой группу формулы
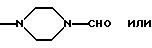
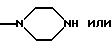

Ry представляет собой NН и
Rz представляет собой СН3; или
Rx представляет собой -SСН3,
Ry представляет собой группу формулы
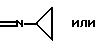
= N-C4H9
и
Rz представляет собой водород; или
Rx представляет собой группу формулы
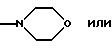
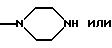
-NHOH или
-NH-CH2-CH2-OH
Ry представляет собой N-СН3 и
Rz представляет собой водород; или
Rx представляет собой группу
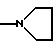
Ry представляет собой N-C2H5 и
Rz представляет собой водород; или
Rx представляет собой группу

Ry представляет собой кислород и
Rz представляет собой водород.
Соединения формулы VI частично новые и могут быть получены аналогично стандартным методам или как описано в примерах.
В другом аспекте в настоящем
изобретении предлагается соединение формулы

где R1 такой, как определено в формуле I, и
Rxx обозначает группу
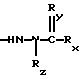
где Rx, Ry и Rz такие, как определено выше.
В этой спецификации, если не обозначено иначе, такие термины как "соединение формулы I, IА, Is Ip, Iq, IVi, IVa и VIa" включают соединение в любой форме, например в форме соли или в форме свободного основания. Настоящее изобретение, следовательно, включает соединение в свободной или основной форме или, где такая форма существует, в форме соли, например в форме соли присоединения кислоты, внутренней соли, четвертичной соли и/или в сольватной форме, например в форме гидрата. Соль может быть фармацевтически приемлемой солью формул I, IА, Is Iр, Iq, такой как соль металла или аминная соль. Соли металлов включают, например, соли натрия, калия, кальция, бария, цинка, алюминия, предпочтительно соли натрия или калия. Аминные соли включают, например, соли триалкиламина, новокаина, дибензиламина и бензиламина. Свободная форма соединения формул I, IА, Is Ip, Iq, IVi, IVa и VIa может быть превращена в соль и наоборот.
В следующем аспекте в настоящем изобретении предлагаются соединение формул I, IА, Is Iр, Iq, IVi, IVa и VIa в свободной форме или в форме соли, например в форме соли присоединения кислоты или в форме соли металла; и соединение формул I, IА, Is Iр, Iq, IVi, IVa и VIa в форме сольвата.
Соединение формулы I также может быть получено аналогично другим способам, традиционным в химии β-лактама.
Соединения формулы I, здесь и далее обозначенные как "активное соединение(я) по изобретению" проявляют фармакологическую активность и, следовательно, полезны как фармацевтические препараты. В частности активные соединения по изобретению показывают противомикробную, например антибактериальную активность против грамотрицательных и грамположительных бактерий, таких как Pseudbmonas, например Pseudomonas aeruginosa, Pseudomonas fluorescens; Enterobacter, например Enterobacter cloacae; Enterococcus, например Enterococcus faecalis; Моrахеllа, например Moraxella catarrhalis; Haemophilus, например Наеmорhilus influenza; Klebsiella, например Klebsiella edvardsii, Klebsiella pneumoniae; Streptococcus, например Strepfococcus pneumoniae, Streptococcus durans, Streptococcus faecium, Streptococcus pyogenes; Staphylococcus, например Staphylococcus aureus, Staphylococcus pyogenes; Escherichia, например Escherichia соli; и Proteus, например Proteus mirabilis, in vitro в Тесте разведения агара согласно National Committee for Clinical Laboratory Standards (NCCLS) 1993, Document M7-A3 Vol.13, No. 25: "Methods for dillution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically - Third Edition, Approved Standart" и in vivo на модели септической мыши. Активные соединения по изобретению показывают активность на мышах, когда вводятся в дозах примерно от 0,05 до 50 мг/кг веса тела (значение дозы агента, приводящей к 50% эффекту, ED50) Активные соединения проявляют значения МНК (мкг/мл) в Тесте разведения агара от приблизительно 0,005 до примерно 50. Активные соединения по изобретению проявляют удивительно всеохватывающий спектр активности.
Например, было определено, что значения МНК (мкг/мл) соединения Примера 139 против, например, Enterococcus faecalis, штаммы АТТС 29212 или АТСС 51299, составляют примерно 0,08-0,25; против Staphylococcus aureus, штаммы АТСС 29213 или АТСС 9144, составляют примерно 0,2-0,4 и против Pseudomonas aeruginosa, штамм 27853, примерно 0,8.
Активные соединения по изобретению, следовательно, полезны для лечения микробных, например бактериальных, заболеваний.
В другом аспекте в настоящем изобретении предлагается соединение по п.1 для применения в качестве лекарственного, предпочтительно противомикробного агента, такого как антибиотик.
В следующем аспекте в настоящем изобретении предлагается соединение по п.1 для применения в приготовлении медикамента для лечения микробных заболеваний, например заболеваний, вызываемых бактериями, такими как Pseudomonas, Enterobacter, Enterococcus, Моrахеllа, Haemophilus, Klebsiella, Streptococcus, Staphylococcus, Escherichia и Proteus.
В следующем аспекте в настоящем изобретении предлагается способ лечения микробных заболеваний, при котором на субъект, нуждающийся в таком лечении, воздействуют эффективным количеством соединения формулы I.
При таком показании подходящая доза будет варьироваться в зависимости от, например, используемого соединения формулы I, хозяина, режима воздействия и природы и серьезности патсостояний, предназначенных для лечения. Однако в общем для удовлетворительных результатов для крупных млекопитающих, например человека, предписываемая суточная доза составляет в пределах примерно от 0,05 до 5 г, например от 0,1 до примерно 2,5 г, активного соединения по изобретению, которое вводят стандартно, например в разделенных дозах до четырех раз в день.
Активное соединение по изобретению можно вводить любым стандартным путем, например перорально, например в форме таблеток или капсул, или парентерально в форме растворов или суспензий для инъекций, например способом, аналогичным для цефотаксима.
Соединение 7-[[(5-амино-1,2,4-тиадиазол-3-ил)-(Z)-(фторметоксиимино)-ацетил] амино] -3-[[(пиперазиноиминометил)гидразоно]-метил]-3-цефем-4-карбоновая кислота (соединение Примера 139) является предпочтительным соединением по изобретению для применения в качестве противомикробного агента.
Было, например, определено, что значение МНК (мкг/мл) соединения Примера 139 (тестированного в форме тригидрохлорида) против, например, Streptococcus pneumoniae, штамм АТСС 49619, составляет примерно 0,01, тогда как, например, цефтриаксон показывает значение МНК (мкг/мл) примерно 0,02. Следовательно показано, что для лечения микробных заболеваний, например бактериальных заболеваний, предпочтительные соединения по изобретению можно вводить крупным млекопитающим, например людям, аналогичными способами введения в аналогичных дозах, какие стандартно используют для цефтриаксона.
Соединения формулы I можно вводить в форме фармацевтически приемлемой соли, например в форме соли присоединения кислоты или соли присоединения основания, или соответствующих свободных формах, возможно в форме сольвата. Такие соли показывают такой же порядок активности, как и свободные формы.
В настоящем изобретении также предлагаются фармацевтические композиции, содержащие соединение формулы I в форме фармацевтически приемлемой соли или в свободной форме в комбинации с по меньшей мере одним фармацевтическим носителем или разбавителем.
Такие соединения могут производиться стандартным способом.
Форма стандартной дозы может содержать, например, от 10 мг до приблизительно 1 г, например от 10 мг до приблизительно 700 мг.
В следующих примерах температуры указаны в градусах Цельсия.
Пример 1
Дигидрохлорид
7-[(2-амино-4-тиазолил)-(Z)-(метоксмимино)ацетил]-амино-3-[[(аминоиминометил)гидразоно]метил]-3-цефем-4-карбоновой кислоты
(Способ а)
1,24 г
гидрокарбоната аминогуанидина растворяют
в 9,15 мл 2н. НСl и добавляют при перемешивании к раствору 3,2 г трифторацетата амида N-(1,4,5а, 6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азето[2,1-b] фуро[3,
4-d][1,
3]-тиазин-6-ил)-2-(2-аминотиазол-4-ил)-(Z)-2-метоксиимино уксусной кислоты в 125 мл 4%-ного водного ацетонитрила. Через 90 минут осажденный дигидрохлорид
7-[(2-амино-4-тиазолил)(метоксиимино)ацетил]амино-3-[[(аминоиминометил)гидразоно] метил] -3-цефем-4-карбоновой кислоты отфильтровывают, промывают ацетонитрилом и сушат.
Пример 2
Дигидрохлорид 7-[[(2-амино-4-тиазолил)-(Z)-(гцдроксиимино)-ацетил] -амино]-3-[[(амммоиминометил)гидразоно]метил]-3-цефем-4-карбоновой кислоты
(Способ а)
a) 10 г гидрохлорида
амида Н-(1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азето[2,1-b]фуро[3,4-d][1,3]-тиазин-6-ил)-2-(2-аминотиазол-4-ил)-(Z)-2-(ацетоксиимино) уксусной кислоты суспендируют в 160 мл ацетонитрила и
обрабатывают 53 мл воды и 11 мл 8н. НСl. Реакционную смесь перемешивают в течение 14 часов при комнатной температуре. Получают чистый раствор, в котором ацетоксииминогруппа гидролизуется с
образованием гидроксииминогруппы.
b) 3 г гидрокарбоната аминогуанидина растворяют в 11 мл 1 н. НСl и добавляют по каплям к раствору, полученному в стадии а), который охлаждают до 0oС. Через 30 минут реакционную смесь нагревают до комнатной температуры и перемешивают еще 2,5 ч. Осадок дигидрохлорида 7-[(2-амино-4-тиазолил)-(Z)-(гидрокси-имино)ацетил] амино]-3-[[(аминоиминометил)гидразоно]метил]-3-цефем-4-карбоновой кислоты отфильтровывают, промывают смесью ацетонитрила и воды, ацетонитрилом и эфиром и сушат.
Пример 3
Натриевая соль 7-[(2-амино-4-тиазолил)(метоксиимино)-ацетил] амино-3-[(метоксиимимо)метил]-3-цефем-4-карбоновой кислоты
(Способ b)
0,5 г 7-амино-3-[(метоксиимино)метил]
-3-цефем-4-карбоновой кислоты и 0,75 г меркаптобензтиазолилового эфира (2-амино-4-тиазолил)(метоксиимино)уксусной кислоты суспендируют в смеси 2,4 мл воды и 4,8 мл ацетона. 1,8 мл 2н. раствора
гидроксида натрия добавляют по каплям таким образом, чтобы достигнуть рН 8. Реакционную смесь перемешивают при 20o в течение 1 ч. По каплям добавляют 2,4 мл ацетона. Чистый раствор
получают
в течение 3 часов. Медленно добавляют 120 мл ацетона. Полученную суспензию охлаждают до 0oС. Через 5 часов образовавшийся осадок отфильтровывают и заново растворяют в 4 мл воды.
Чистый
раствор обрабатывают 0,2 г активированного угля и перемешивают в течение 15 минут. Активированный уголь отфильтровывают и добавляют 100 мл ацетона за период в 1 ч при 0oС. Натриевую
соль
7-[(2-амино-4-тиазолил)(метоксиимино)ацетил] амино-3-[(метоксиимино)метил]-3-цефем-4-карбоновой кислоты получают в виде бесцветных кристаллов, которые отфильтровывают, промывают 5 мл ацетона и
сушат.
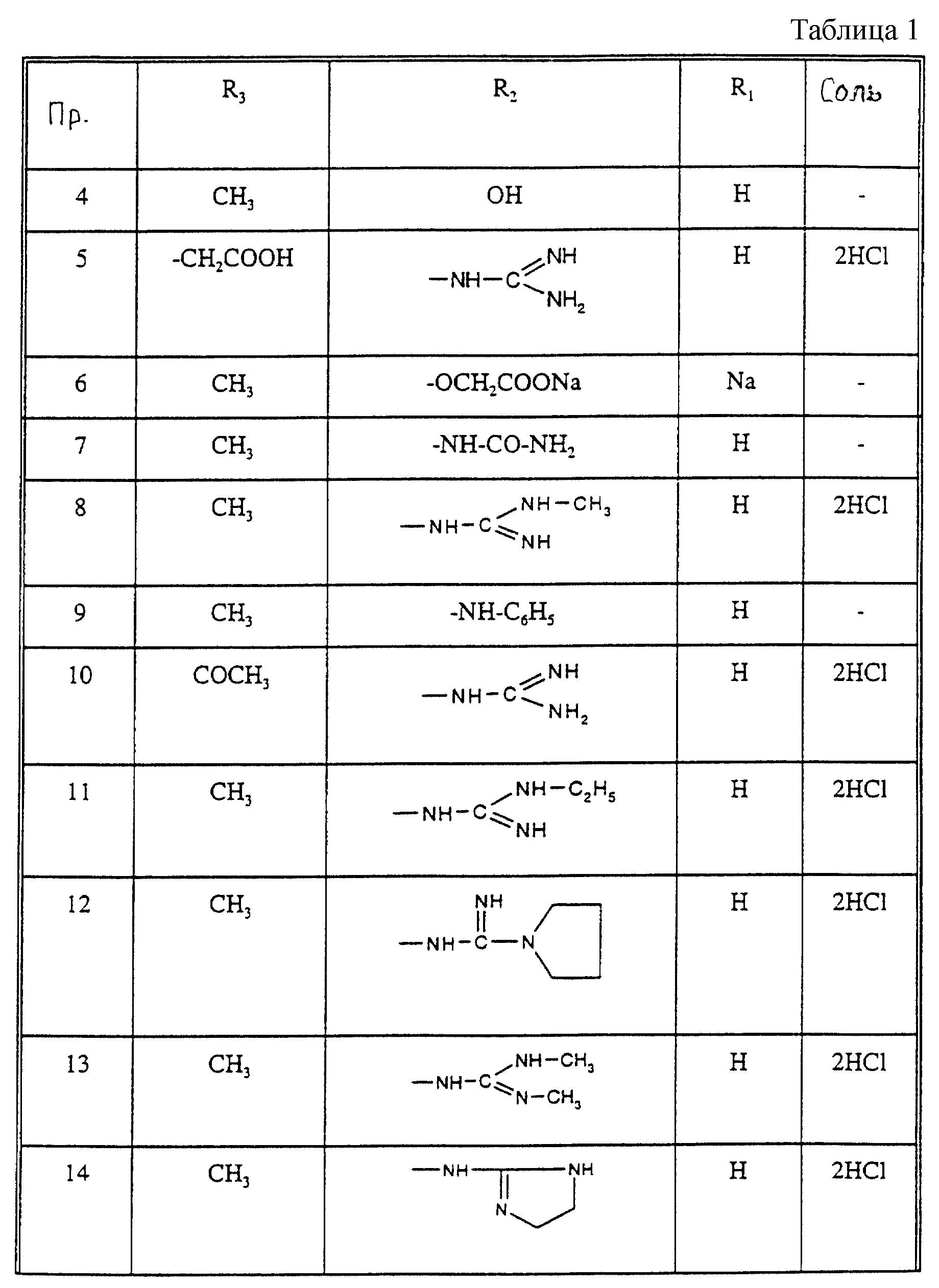
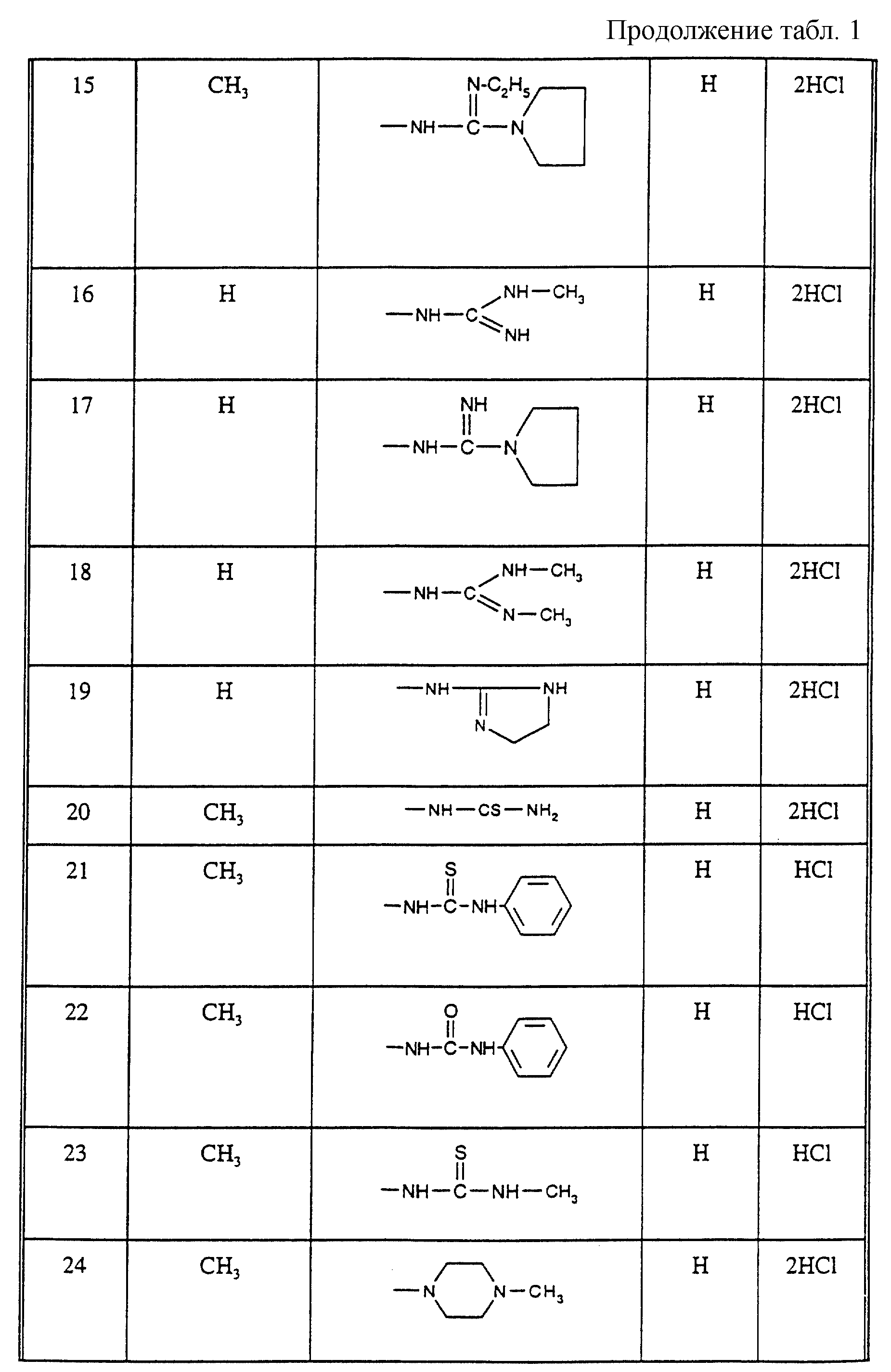
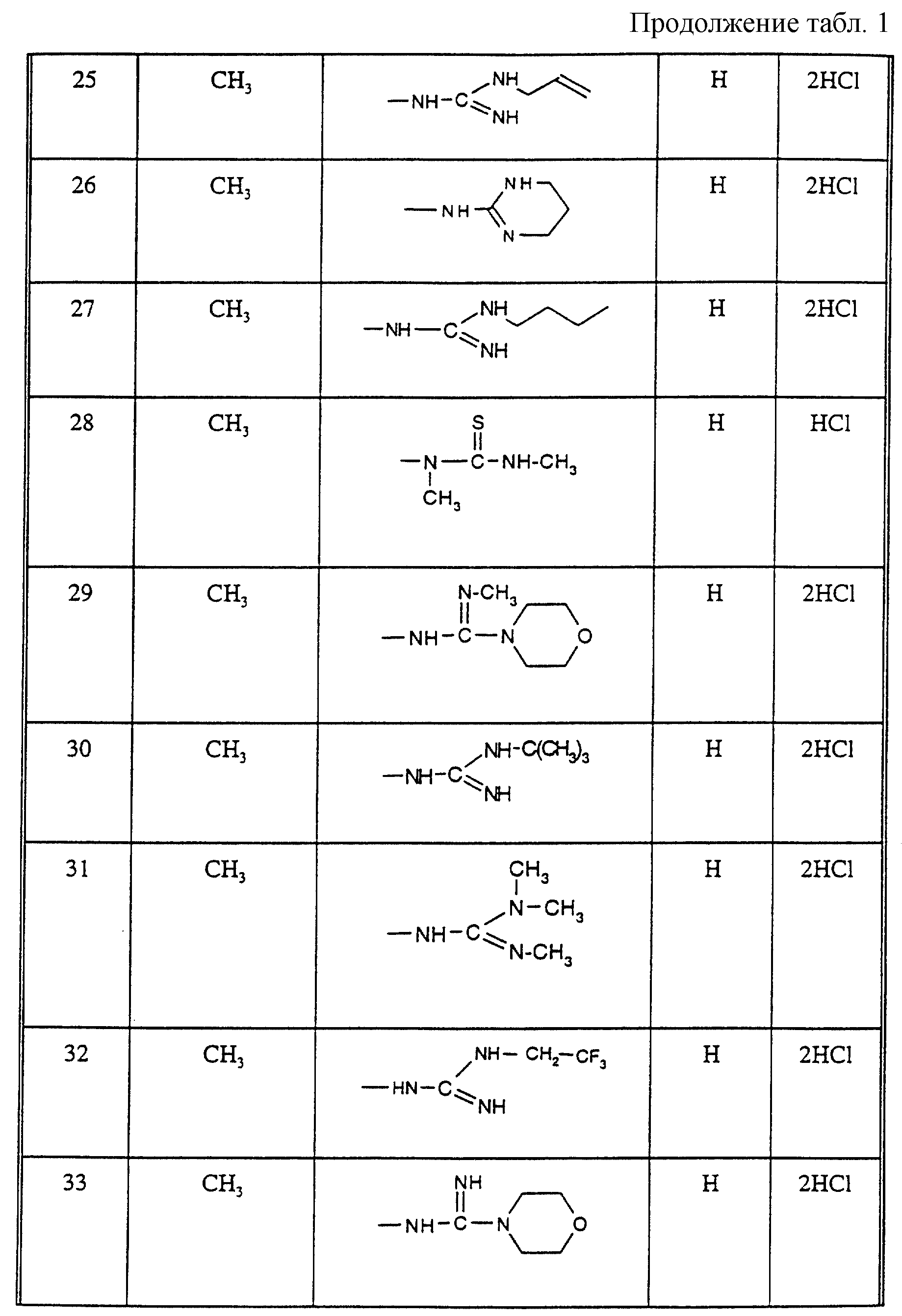
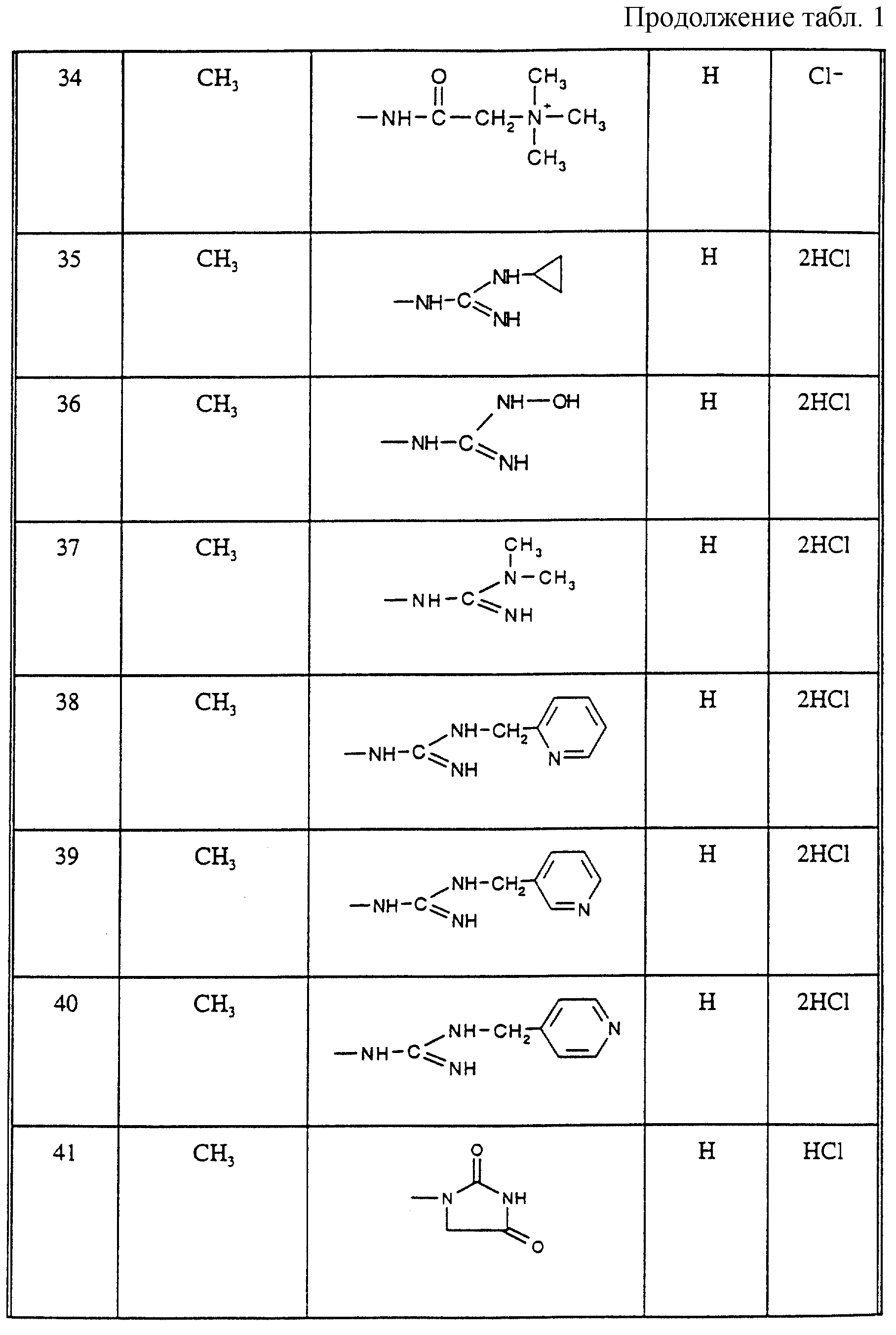
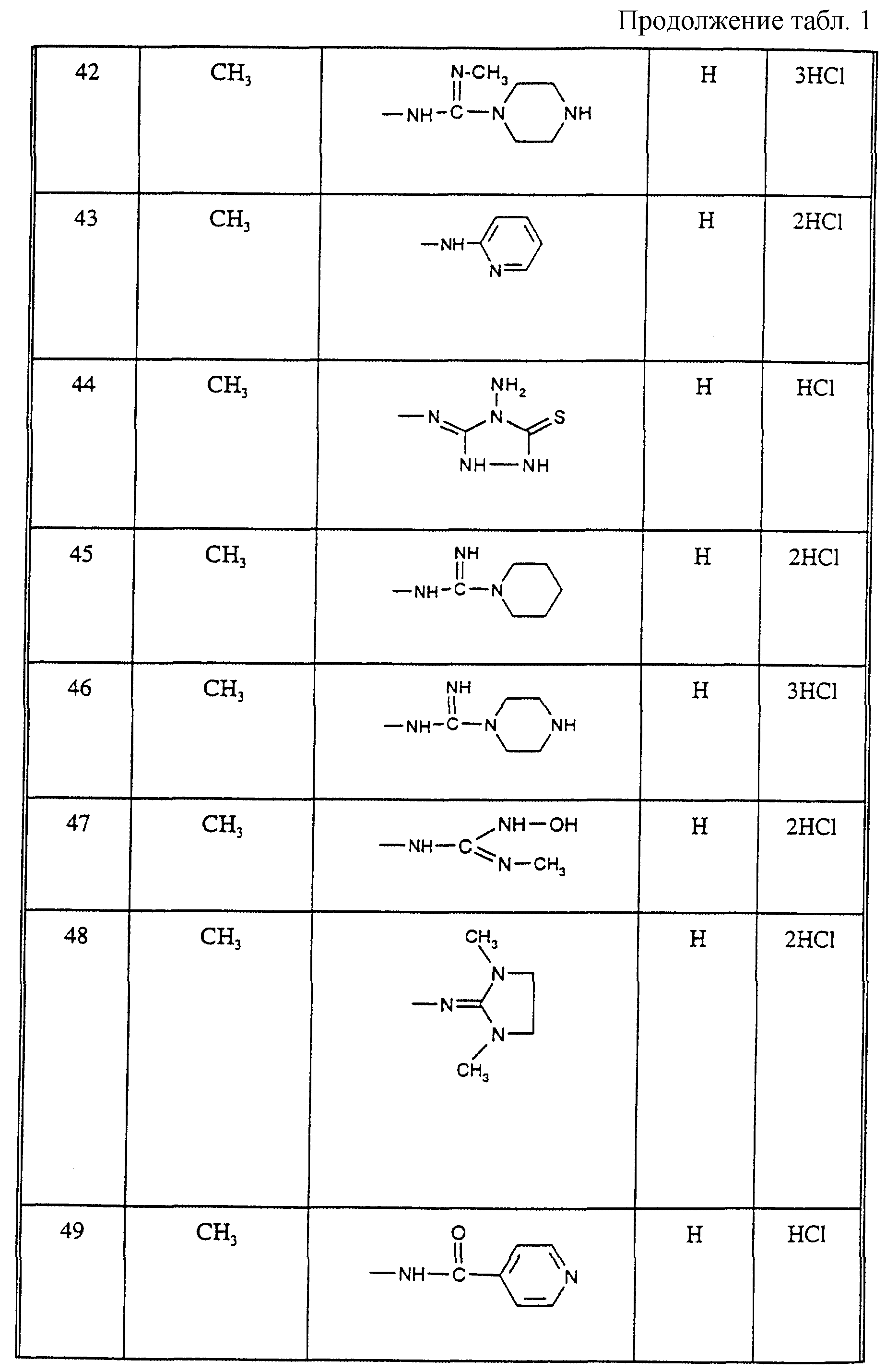
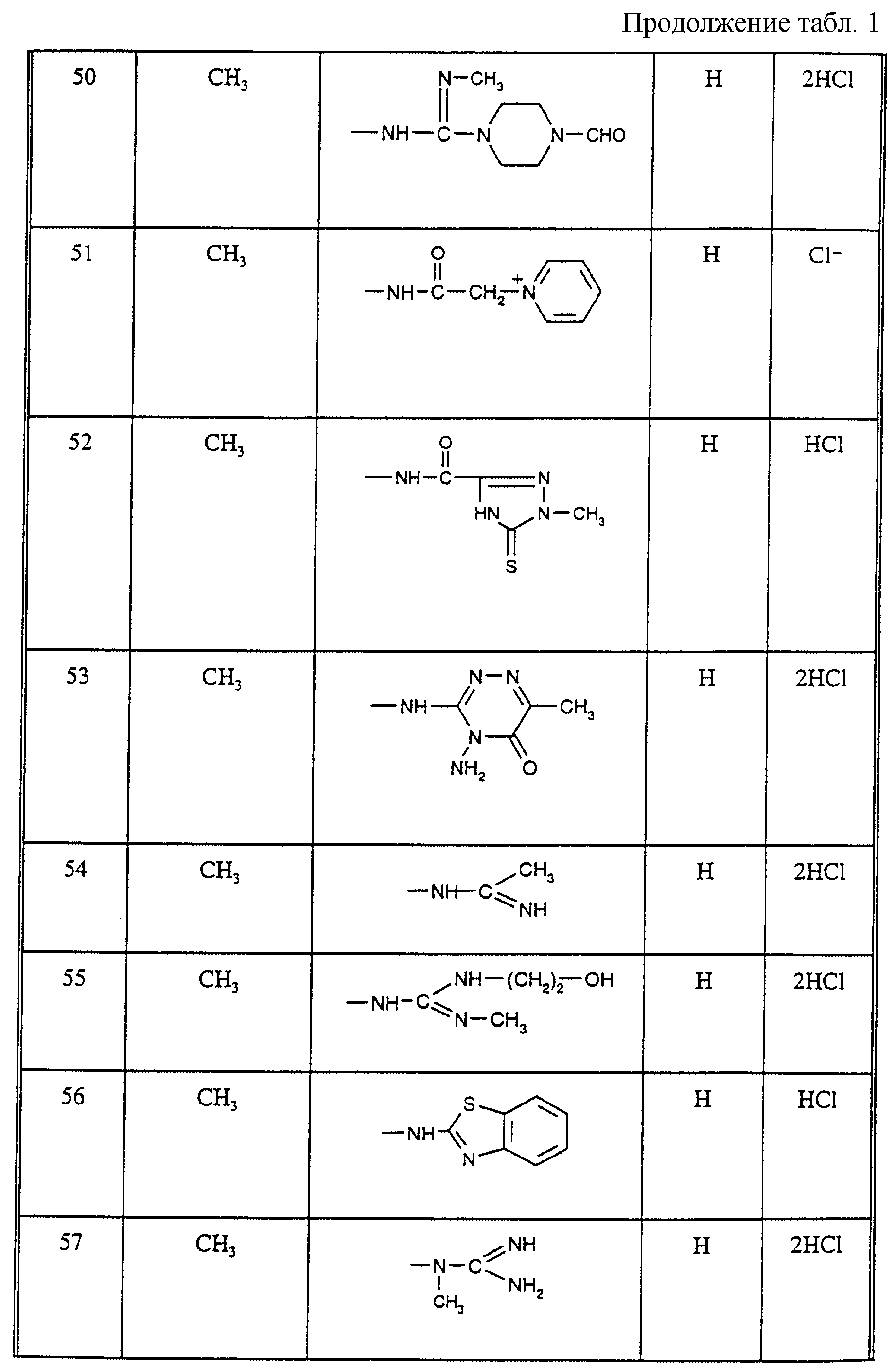
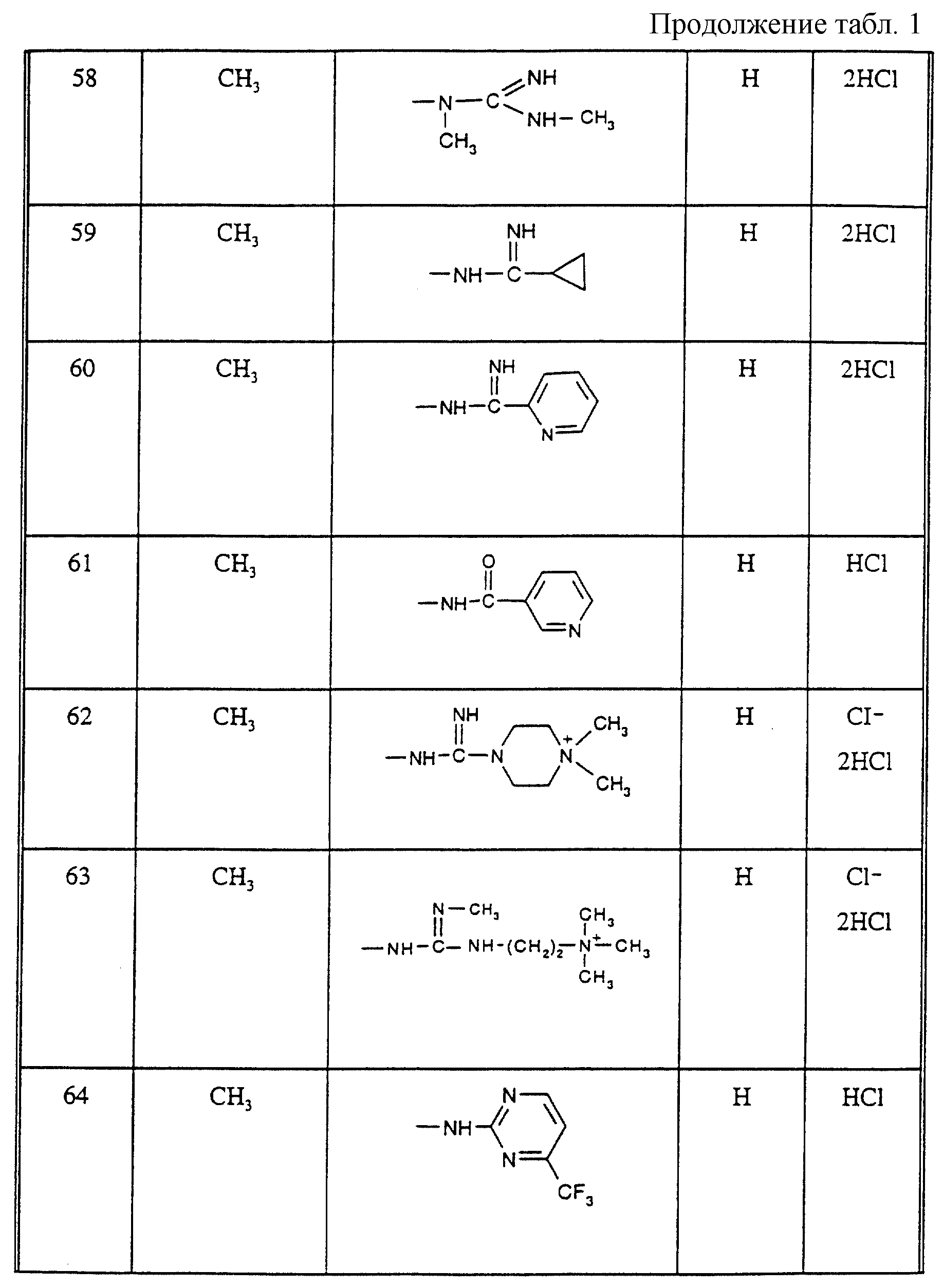
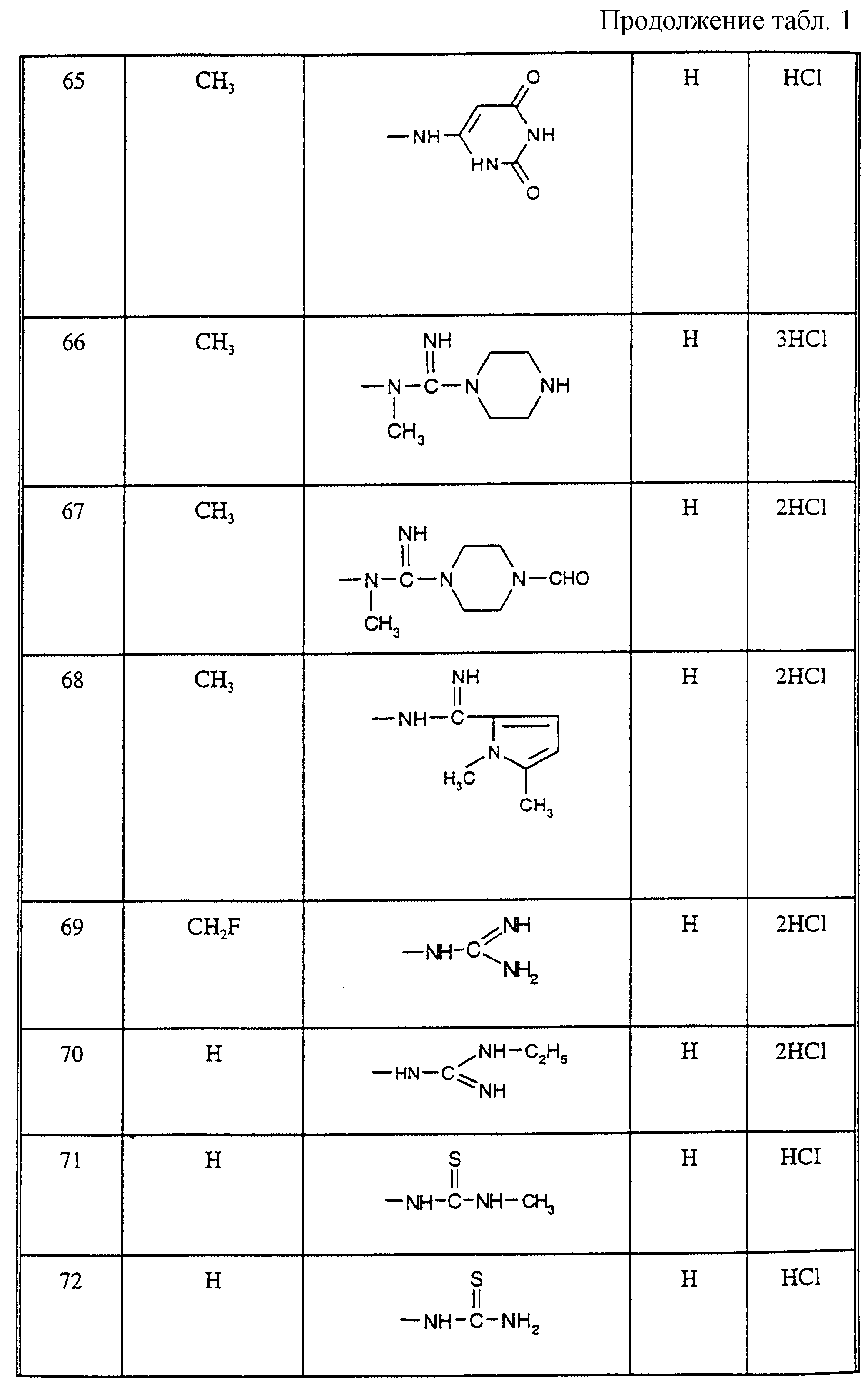
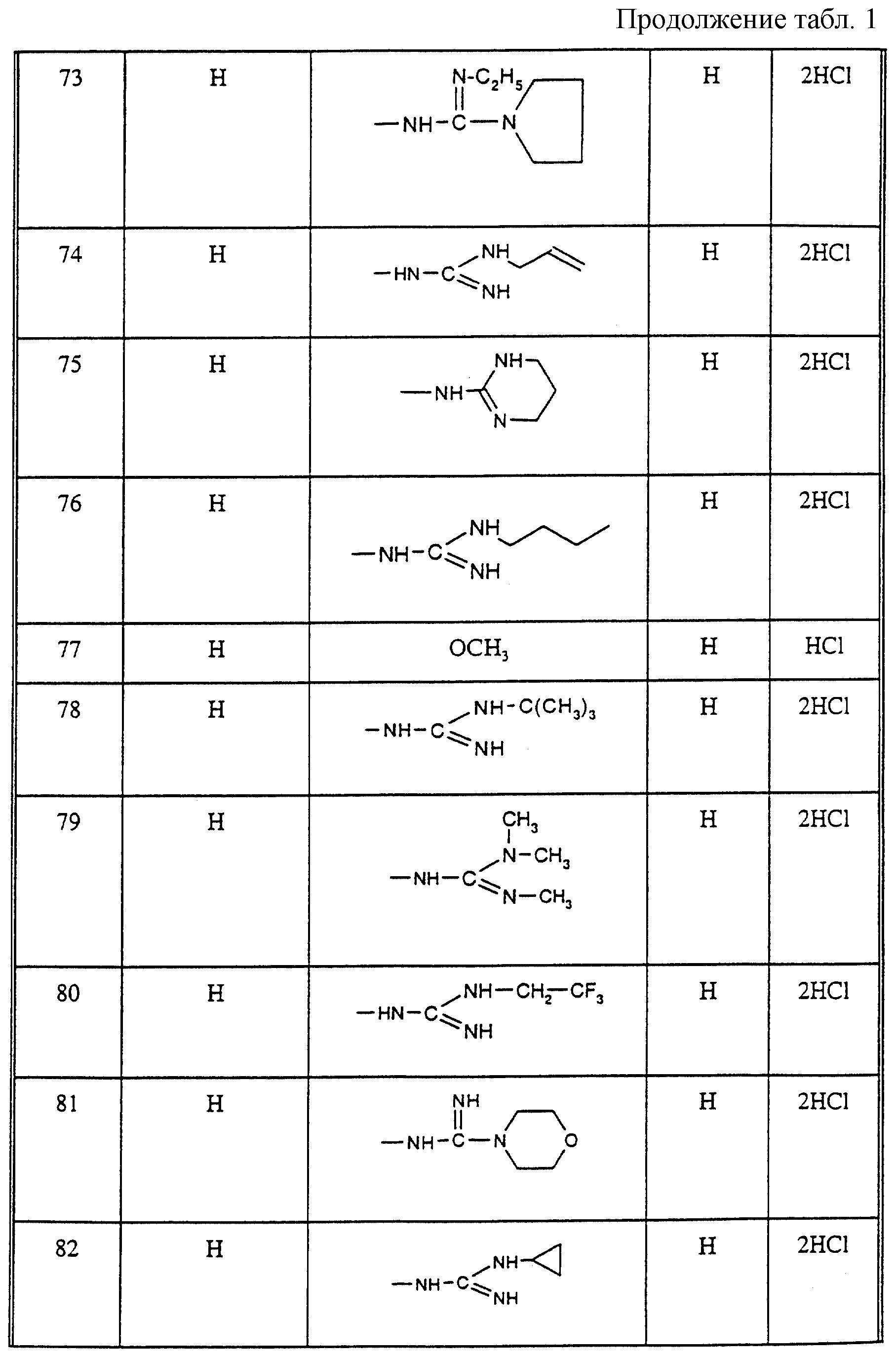
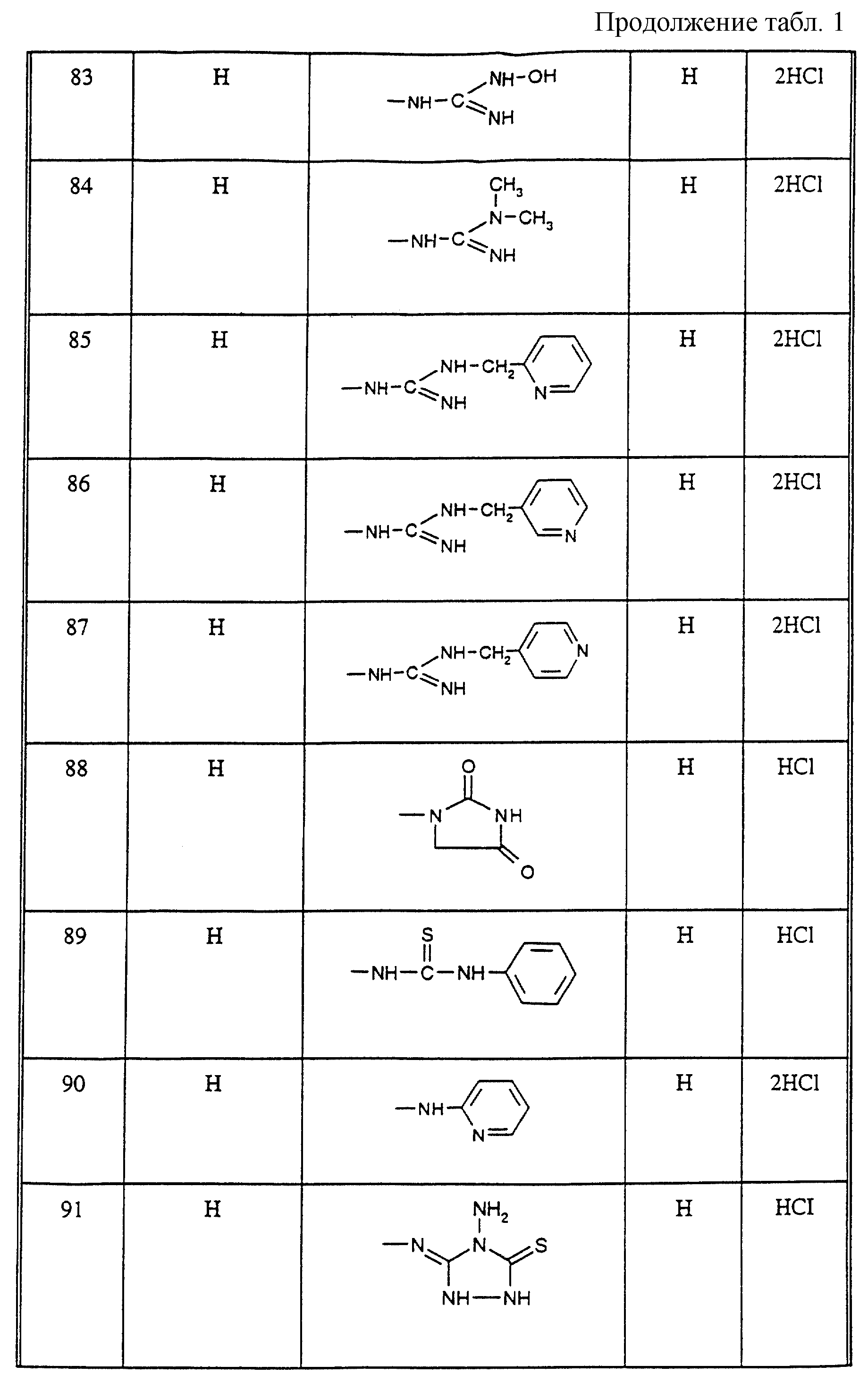
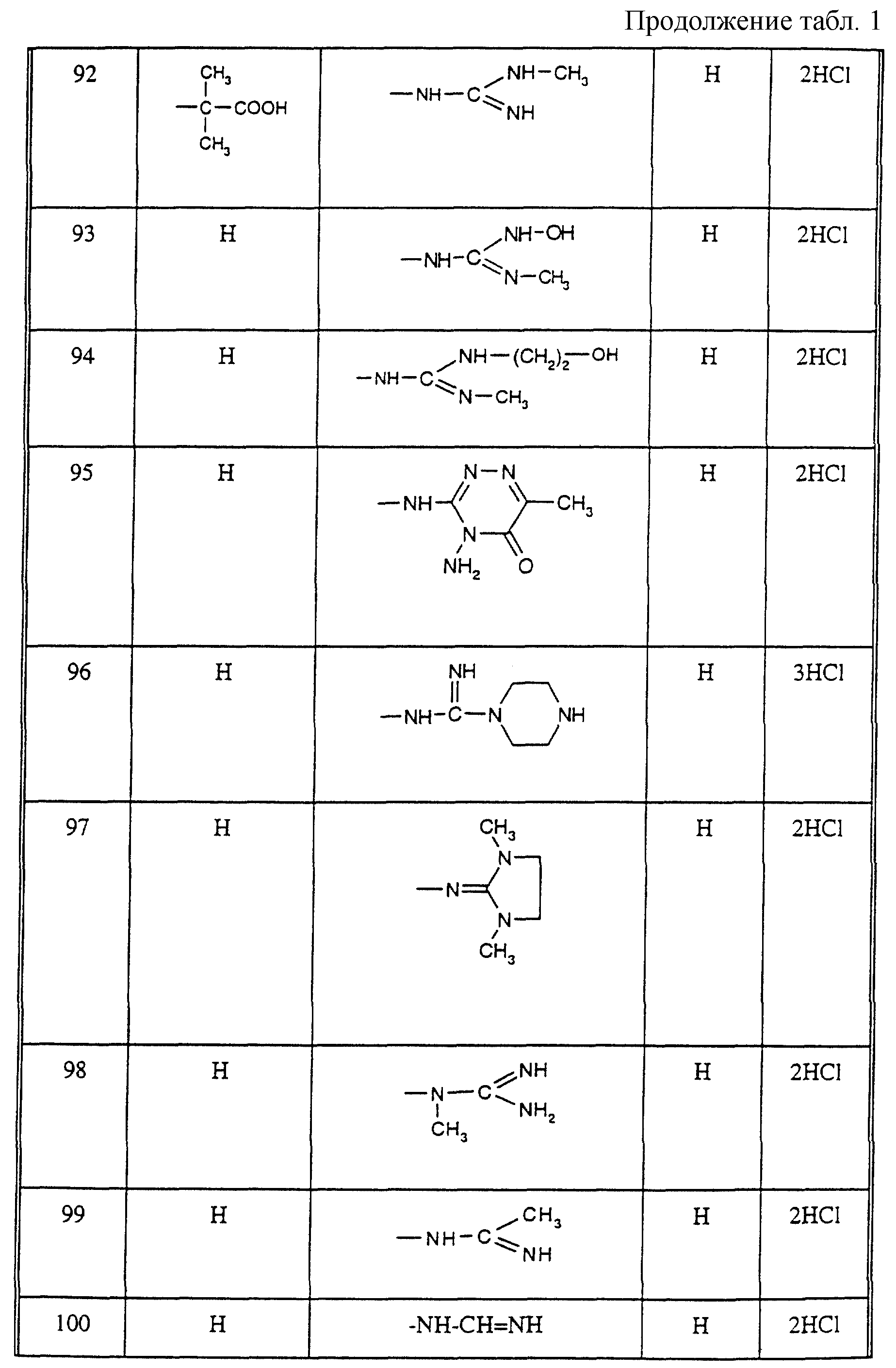
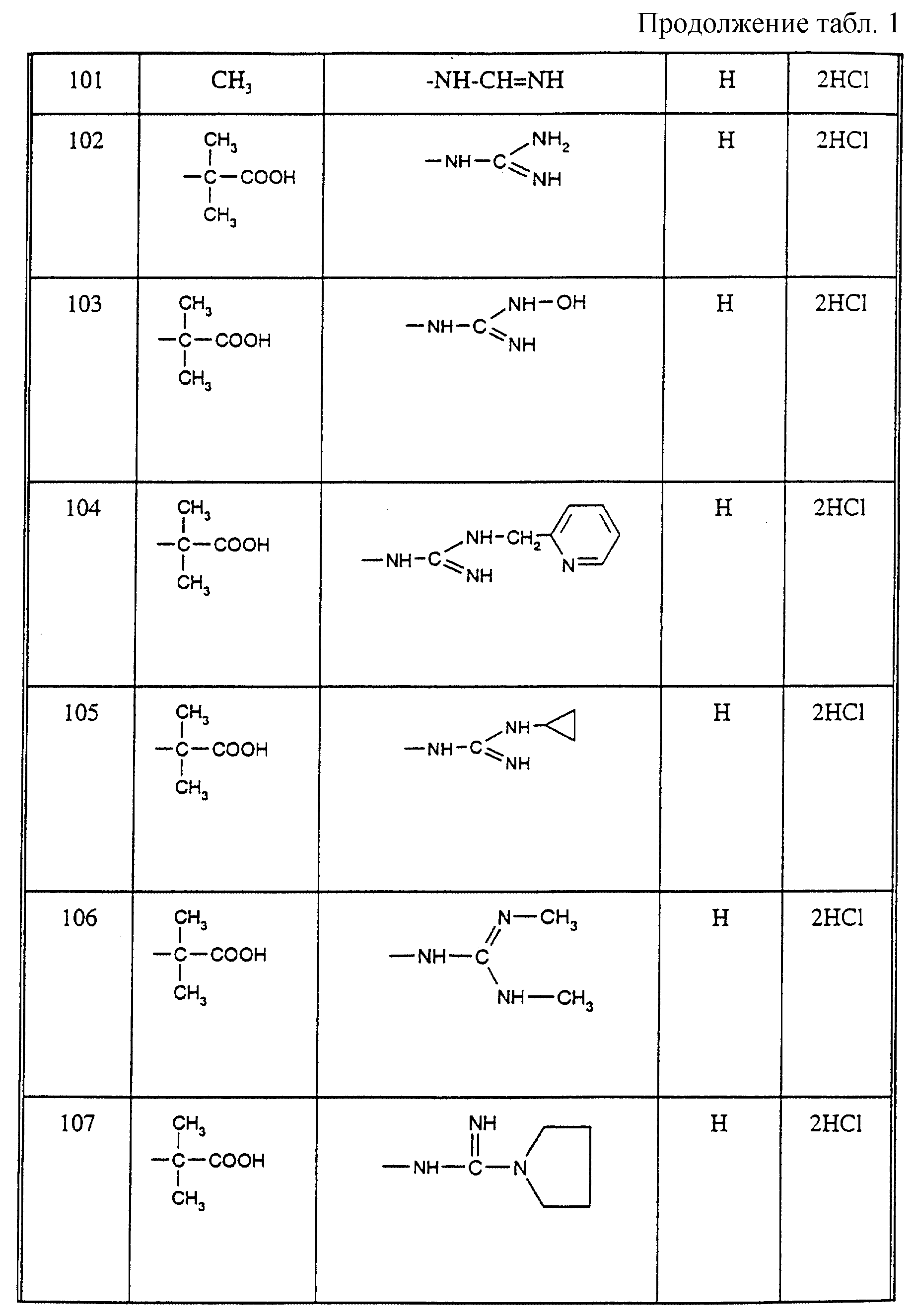
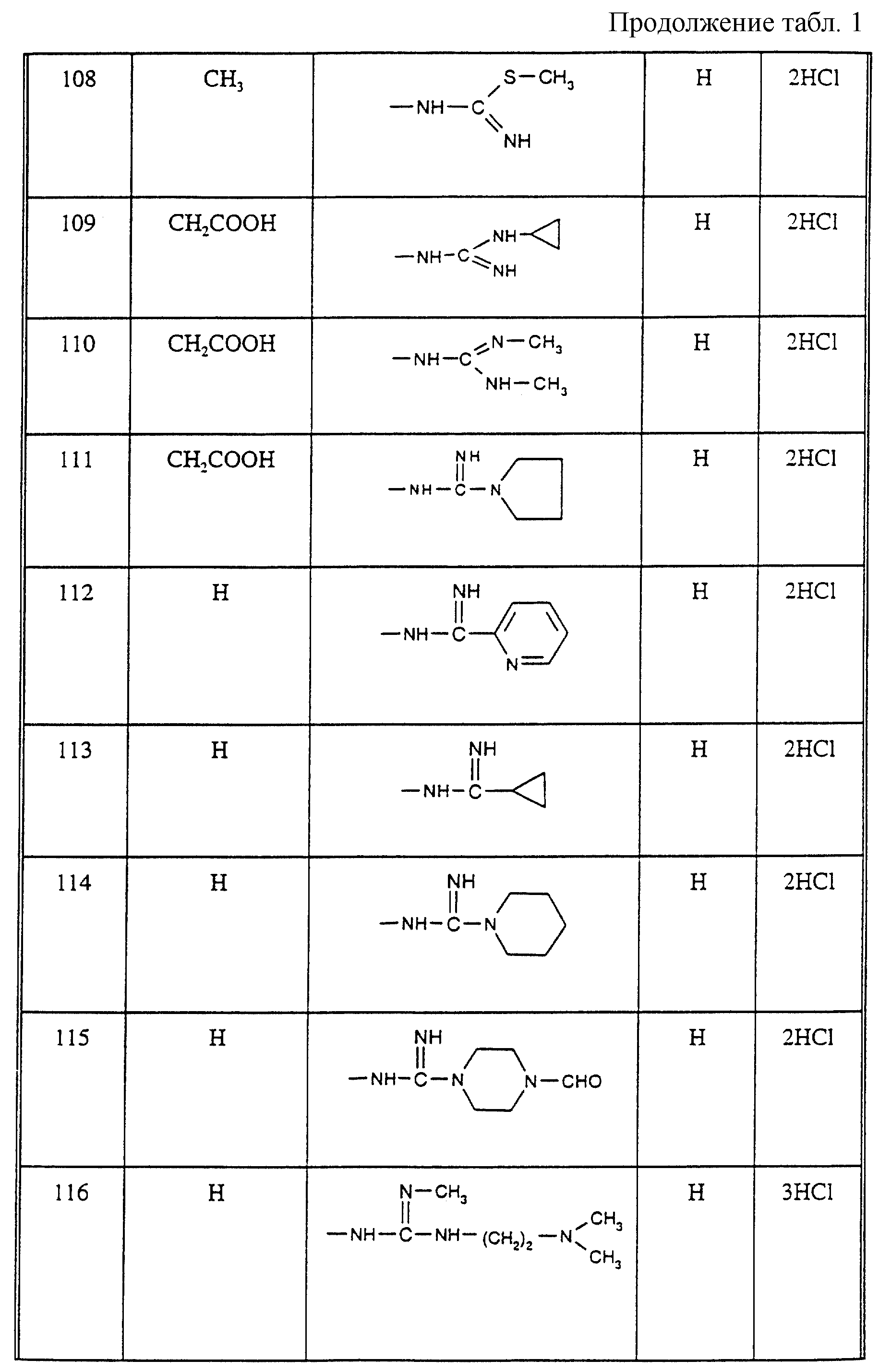
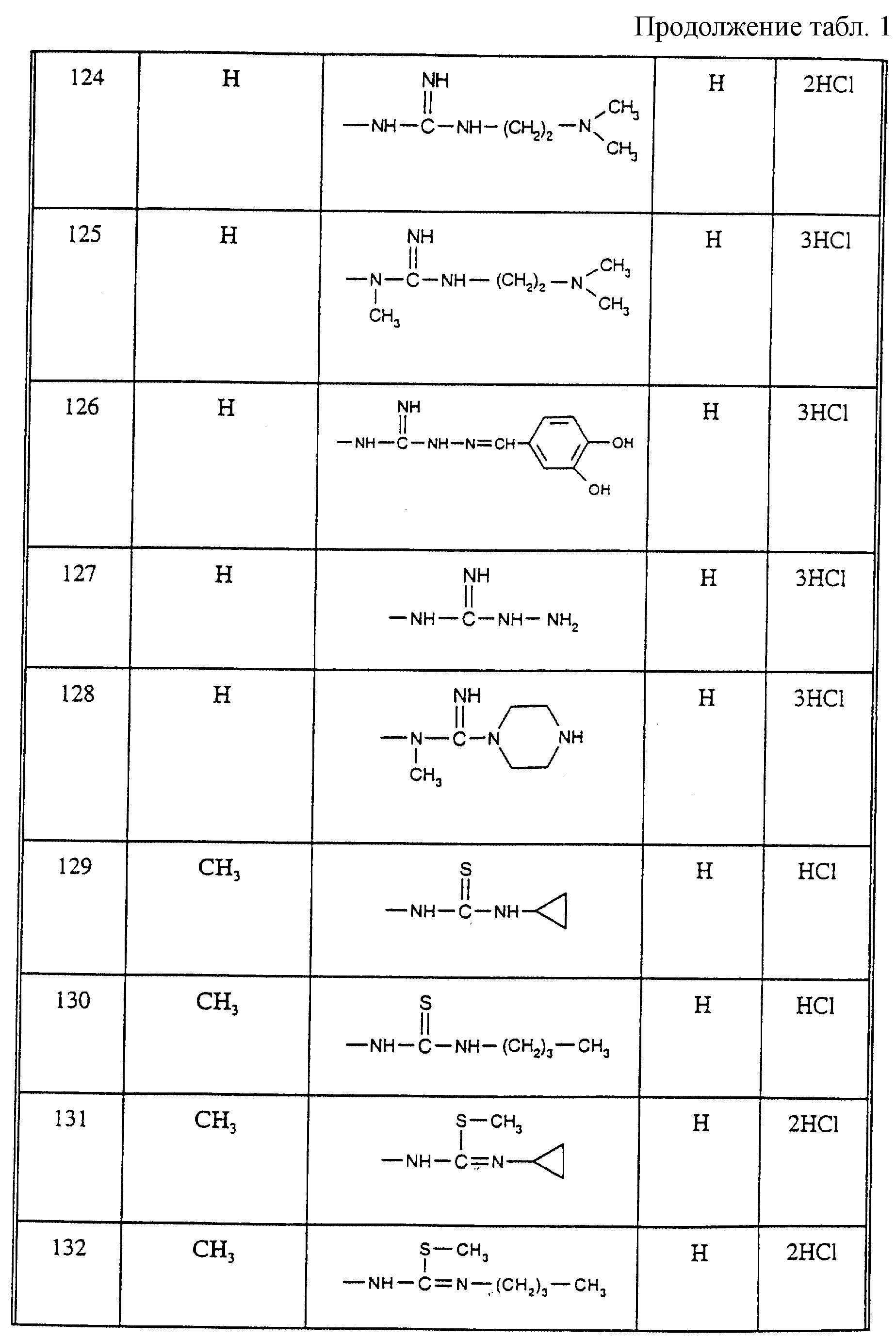
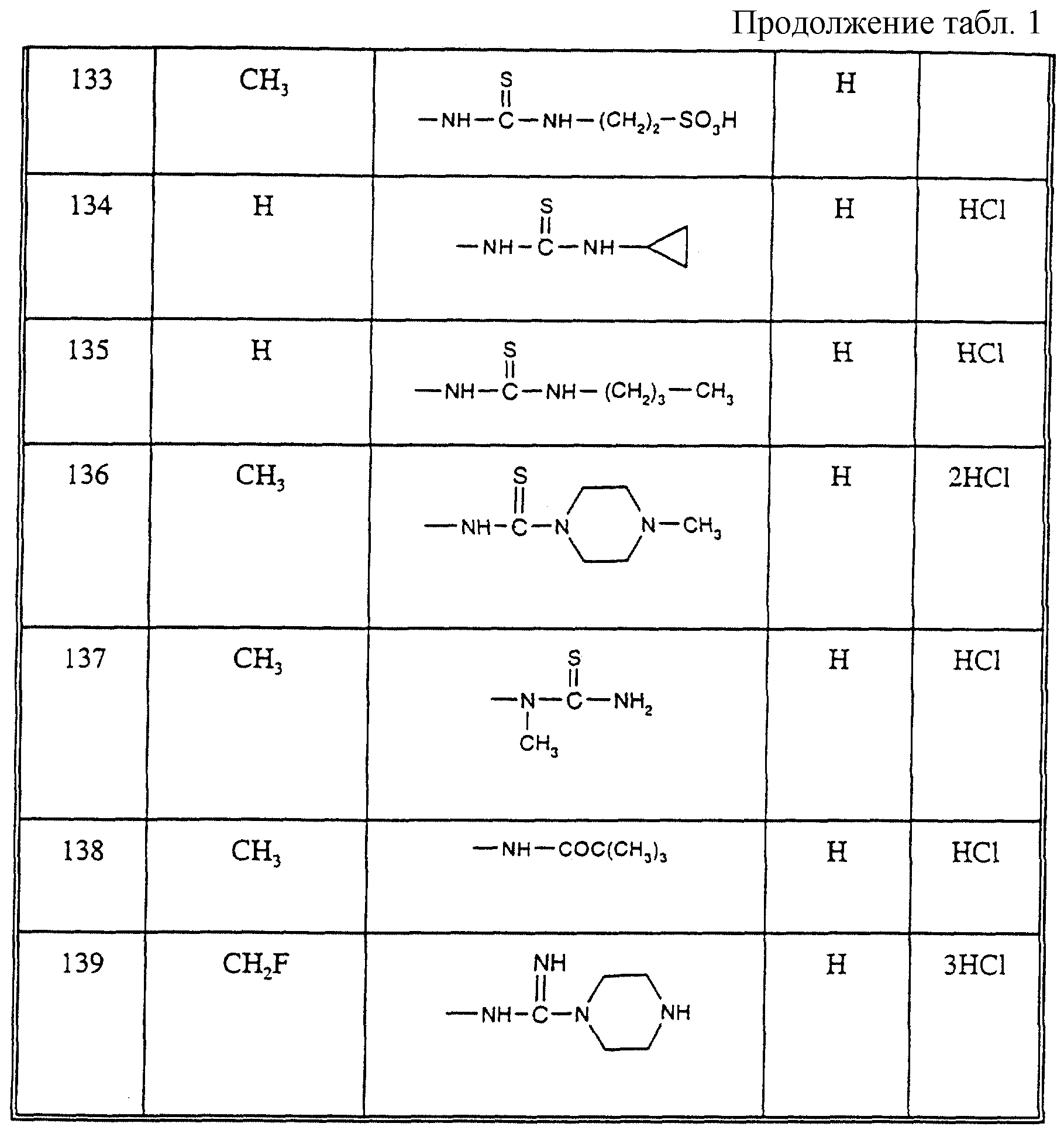
Соединения из таблицы 1 формулы IА (V представляет собой =N-O- во всех Примерах; и W представляет собой СН в Примерах 4-68 и 70-138; и W представляет собой N в Примерах 69-139 таблицы 1) могут быть получены аналогичным способом, как описано в Примерах 1-3. Приведены солевые формы. Конфигурация R3 в группе -С=N-R3 является конфигурацией син[(Z)].
Пример 140
Дигидрохлорид 7-[2-(2-аминотиазол-4-ил)-(Z)-2-пентемоиламино] -3-[[(аминоиминометил)гидразоно]метил]-3-цефем-4-карбоновой кислоты
1 г амида N-(1,4,5а,
6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азето[2,1-b] фуро[3,4-d] [1,3] -тиазин-6-ил)-2-[2-(трет. -бутоксикарбониламино)тиазол-4-ил)-(Z)-2-пентеновой кислоты растворяют в смеси 30 мл метанола и 30
мл
ацетонитрила, и добавляют 0,3 г гидрокарбоната аминогуанидина. рН 2,0 достигают добавлением метанольного раствора НСl. Перемешивание продолжают при комнатной температуре. В течение 30 минут
образуется
светлый осадок, который отфильтровывают через 3 часа, промывают ацетонитрилом и эфиром и сушат. Дигидрохлорид 7-[2-(2-аминотиазол-4-ил)-(Z)-2-пентеноиламино] -3-{
[(аминоиминометил)гидразоно] метил}
-3-цефем-4-карбоновой кислоты получают в форме светло-желтого порошка.
Пример 141
Трифторацетат
7-[(2-амино-4-тиазолил)-(Z)- (метоксиимино)ацетил]
-амино-3-(гидразонометил)-3-цефем-4-карбоновой кислоты
Суспензию 3 г 7-[(2-амино-4-тиазолил)-(Z)-(метоксиимино)-ацетил]-амино-3-[[2-(1,
1-диметилэтокси)-2-оксоэтокси] гидразонометил]
-3-цефем-4-карбоновой кислоты в 75 мл метиленхлорида обрабатывают при 0oС 0,6 мл анизола. При перемешивании по каплям добавляют 10 мл
трифторуксусной кислоты. Полученный раствор
перемешивают еще 3 часа при 0oС. Реакционную смесь вливают в 600 мл эфира. Осадки трифторацетат
7-[(2-амино-4-тиазолил)-(Z)-(метоксиимино)ацетил]
амино-3-(гидразонометил)-3-цефем-4-карбоновой кислоты отфильтровывают и сушат.
Пример 142
Гидробромид
7-[(2-амино-4-тиазолил)-(Z)-(метоксиимино)ацетил]-амино-3-[(4-метилтиазол-2-ил)гидразонометил]-3-цефем-4-карбоновой кислоты
1 г
7-[(2-амино-4-тиазолил)-(Z)-(метоксиимино)ацетил]амино-3-[(аминотиоксометил)гидразонометил]-3-цефем-4-карбоновой кислоты суспендируют в 30 мл ацетонитрила и перемешивают после добавления 2,5 мл N,
O-бистриметилсилилацетамида в течение 20 минут. Полученный чистый раствор обрабатывают 0,6 г бромацетона и перемешивают в течение ночи. Добавляют 1 мл воды. Осадок отфильтровывают и сушат.
Гидробромид
7-[(2-амино-4-тиазолил)-(Z)-(4-метоксиимино)ацетил] амино-3[(4-метилтиазол-2-ил)гидразонометил] -3-цефем-4-карбоновой кислоты получают в виде желтого твердого вещества.
Пример 143
Гидробромид 7-[(2-амино-4-тиазолил)-(Z)-(метоксиимино)ацетил]-амино-3-[(4-метилтиазол-2-ил)метилгидразонометил]-3-цефем-4-карбононой кислоты
1 г
7-[(2-амино-4-тиазолил)-(Z)-(метоксиимино)ацетил]амино-3-[(аминотиоксометил)метилгидразонометил] -3-цефем-4-карбоновой кислоты обрабатывают аналогичным способом, как описано в Примере 142, N,
O-бистриметилсилилацетамидом и бромацетоном. Гидробромид 7-[(2-амино-4-тиазолил)-(Z)-(метоксиимино)ацетил] амино-3-[(4-метилтиазол-2-ил)метилгидразонометил] -3-цефем-4-карбоновой кислоты получают в
виде желтого твердого вещества.
Пример 144
Дигидрат 6R-транс (Z)-7-[(2-амино-4-тиазолил)(метоксиимино)-ацетил]-амимо-3-[[(имино(метиламино)метил)гидразоно]
метил]-3-цефем-4-карбононой кислоты
1,1 г дигидрохлорида, полученного согласно Примеру 8, растворяют в 25 мл воды, обрабатывают 0,5 г активированного угля и перемешивают в течение 5 минут.
Почти бесцветный фильтрат вливают в 5 мл воды при перемешивании. рН около 7 поддерживают добавлением 2,5% водного аммиака. Полученный осадок отфильтровывают и сушат. Дигидрат 6R-транс
(Z)-7-[(2-амино-4-тиазолил)(метоксиимино)ацетил]амино-3-[[(имино(метиламино)-метил)гидразоно]метил] -3-цефем-4-карбоновой кислоты получают в виде желтоватого порошка.
Пример 145
1-(Изопропоксикарбонилокси)этиловый эфир 6R-транс (Z)-7-[(2-амино-4-тиазолил)(метоксиимино)ацетил]амино-3-[[(имино(метиламино)-метил)-гидразоно] метил]-3-цефем-4-карбоновой кислоты
5,5
г дигидрата, полученного согласно Примеру 144, растворяют в 55 мл диметилацетамида при добавлении 1,43 мл тетраметилгуанидина. Этот раствор охлаждают до 0oС, обрабатывают раствором 4,4 г
1-иодоэтилизопропилкарбоната в 30 мл толуола и перемешивают в течение 90 минут при 0oС. Реакционную смесь вливают в 1 л диэтилового эфира. Полученный осадок отфильтровывают и перемешивают
дважды, каждый раз добавляя 500 мл ацетонитрила. Ацетонитриловые фазы объединяют, фильтруют и выпаривают до объема 10 мл. Маслянистый остаток обрабатывают 400 мл воды. Образовавшийся осадок
отфильтровывают и сушат. Осадок перемешивают с 700 мл этилацетата. После выпаривания этилацетата получают 1-(изопропоксикарбонилокси)этиловый эфир 6R-транс
(Z)-7-[(2-амино-4-тиазолил)-(метоксиимино)ацетил] амино-3-[[(имино(метиламино)метил)гидразоно] -метил] -3-цефем-4-карбоновой кислоты желтого цвета в форме диастереомерной смеси в соотношении 1:1.
Пример 146
1-(Изопропоксикарбонилокси)этиловый эфир 6R-транс (Z)-7-[((ацетоксиммино)-2-амино-4-тиазолил)ацетил]амино-3-[[(аминоиминометил)гидразоно]метил-3-цефем-4-карбоновой
кислоты
0,72 г гидрокарбоната аминогуанидина растворяют в 5,2 мл 2н. НСl. Этот раствор добавляют к раствору 2 г 1-(изопропоксикарбонилокси)этилового эфира 6R-транс
(Z)-7-[((ацетоксиимино)-2-амино-4-тиазолил)ацетил]амино-3-формил-3-цефем-4-карбоновой кислоты в 14 мл ацетонитрила, содержащего 1,3 мл воды. Реакционную смесь перемешивают в течение 45 минут при
комнатной температуре и вливают в 100 мл ацетонитрила. Образовавшийся осадок отфильтровывают и растворяют в 100 мл воды. рН полученного раствора доводят до 7 добавлением 0,5н. водного раствора
гидрокарбоната натрия. Полученную желтую суспензию экстрагируют дважды смесью 200 мл этилацетата и 40 мл ацетонитрила. Органические фазы объединяют, сушат над Na2SO4 и
выпаривают. 1-(Изопропоксикарбонилокси)этиловый эфир 6R-транс (Z)-7-[((ацетоксиимино)-2-амино-4-тиазолил)ацетил] амино-3-[[(аминоиминометил)гидразоно] метил] -3-цефем-4-карбоновой кислоты получают в
форме желтой диастереомерной смеси в соотношении 1:1.
Пример 147
Дитосилат (изопропоксикарбонилокси)этилового эфира 6R-транс
(Z)-7-[(2-амино-4-тиазолил)(гидроксиимино)ацетил]-амино-3-[[(аминоиминометил)гидразоно]метил]-3-цефем-4-карбоновой кислоты.
Раствор 0,6 г соединения, полученного согласно Примеру 146, в смеси 50 мл ацетонитрила и 20 мл изопропанола обрабатывают 0,66 г моногидрата толуол-4-сульфоновой кислоты и перемешивают в течение ночи при 25oС. Реакционную смесь вливают в 150 мл трет.-бутилметилового эфира. Полученный осадок отфильтровывают, промывают трет. -бутилметиловым эфиром и сушат. Дитосилат (изопропоксикарбонилокси)этилового эфира 6R-транс (Z)-7-[(2-амино-4-тиазолил)(гидроксиимино)ацетил] амино-3-[[(аминоиминометил)гидразоно] метил] -3-цефем-4-карбоновой кислоты получают в виде светлоокрашенной диастереомерной смеси в соотношении 1:1.
Пример 148
Дигидрохлорид 7-[[(2-амино-4-тиазолил)-(Z)-[(карбоксиметокси)-имино]актил] амино] -3-[[(аминоиминометил)-гидразоно]метил]-3-цефем-4-карбоновой кислоты
(Соединение из Примера 5)
а) Дигидрохлорид 7-амино-3-[[(аминоиминометил)гидразоно] -метил]-3-цефем-4-карбоновой кислоты
К 1,0 г 7-амино-3-формил-3-цефем-4-карбоновой кислоты в
смеси
50 мл ацетонитрила и 5 мл 2н. НСl добавляют по каплям 0,6 г гидрокарбоната аминогуанидина, растворенного в 2,2 мл 2н. НСl. Осадок дигидрохлорида 7-амино-3-[[(аминоиминометил)гидразоно] -метил]
-3-цефем-4-карбоновой кислоты отфильтровывают, промывают ацетонитрилом и сушат.
b) Гидрохлорид 7-[[(2-амино-4-тиазолил)-(Z)-[[2-(1,1-диметилэтокси)-2-оксоэтокси] имино] ацетил]
амино]-3-[[(аминоиминометил)-гидразоно]метил]-3-цефем-4-карбоновой кислоты
4 г дигидрохлорида 7-амино-3-[[(аминоиминометил)гидразоно]-метил]-3-цефем-4-карбоновой кислоты растворяют в 80 мл
метанола.
Раствор охлаждают до 0oС и обрабатывают раствором 7 г S-бензотиазолового эфира (2-амино-4-тиазолил)-(Z)-[2-(1,1-диметилэтокси)-2-оксоэтокси] имино] тиоуксусной кислоты в 50 мл
метиленхлорида. Реакционную смесь перемешивают в течение 2,5 ч при 20oС. Примерно треть растворителя выпаривают и к остатку добавляют 120 мл эфира. Осадок гидрохлорида
7-[[(2-амино-4-тиазолил)-(Z)-[[2-(1,1-диметилэтокси)-2-оксоэтокси] имино] -ацетил] -амино-3-[[(аминоиминометил)-гидразоно] метил] -3-цефем-4-карбоновой кислоты отфильтровывают, промывают эфиром и
сушат.
c) Дигидрохлорид 7-[[(2-амино-4-тиазолил)-(Z)-[(карбоксиметокси)имино] актил] амино] -3-[[(аминоиминометил)гидразоно] -метил] -3-цефем-4-карбоновой кислоты
3,5 г
гидрохлорида 7-[[(2-амино-4-тиазолил)-(Z)-[[2-(1,1-диметилэтокси)-2-оксоэтокси] имино] ацетил]амино-3-[[(аминоиминометил)гидразоно]-метил] -3-цефем-4-карбоновой кислоты растворяют в 20 мл
трифторуксусной кислоты при 0oС. Раствор перемешивают в течение 15 минут при 0oС и в течение 1 ч при 20oС. Реакционную смесь обрабатывают 40 мл эфира. Образовавшийся
осадок отфильтровывают, промывают эфиром, сушат, растворяют в 15 мл 2н. НСl и перемешивают в течение 1 ч при 20oС. Получают светлый коричневатый осадок дигидрохлорида
7-[[(2-амино-4-тиазолил)-(Z)-[(карбоксиметокси)-имино]актил]амино] -3-[[(аминоиминометил)-гидразоно] метил] -3-цефем-4-карбоновой кислоты, который отфильтровывают и сушат.
Соединения Примеров 1-146 могут быть получены, как описано в Примере 147, с использованием подходящего исходного материала.
Соединения, используемые в качестве исходного материала могут быть получены следующим образом.
Пример А)
Трифторацетат амида N-(1,4,5а, 6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азото[2,1-b] фуро[3,4-d][1,
3]-тиазин-6-ил)-2-(2-аминотиазол-4-ил)-(Z)-2-метоксииминоуксусной кислоты
а) Гидрохлорил 6-амино-1,4,5а, 6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азето[2,1-b] фуро[3,4-d] [1,3] тиазин
(гидроксилактон гилрохлорила 7-аминоформил-3-цефем-4-карбоновой кислоты)
13,8 г гидрохлорида 7-амино-3-[(Z/Е)-проп-1-ен-1-ил]-3-цефем-4-карбоновой кислоты растворяют в 200 мл метанола.
Раствор охлаждают до -50oС и 8 л O2, содержащего 2 % объем/объем•мин озона вводят при перемешивании при этой температуре. Через 20 минут 6-амино-1,4,5а,
6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азето[2,1-b]фуро[3,4-d][1,3]тиазин практически количественно образуется, и озонолиз заканчивают, определяя его окончание методом HPLC (жидкостная
хроматография высокого давления). Затем через реакционную смесь пропускают 8 л N2 в течение 2 минут. Слегка мутный раствор вливают в 1400 мл трет.-бутилметилового эфира. Осадок
отфильтровывают в атмосфере N2, промывают небольшим количеством трет.-бутилметилового эфира и ацетонитрила и сушат. Гидрохлорид 6-амино-1,4,5а, 6-тетрагидро-3-гидрокси-1,7-диоксо-3Н,
7Н-ацето[2,1-b] фуро[3,4-а][1,3]тиазина получают в виде белого порошка (HPLC содержание более 95%).
b) (6R-транс)-7-амино-3-формил-8-оксо-5-тиа-1-азабицикло[4.2.0]
окт-2-ен-2-карбоновая кислота (7-амино-3-формил-3-цефем-4-карбоновая кислота)
2,64 г гидрохлорида 6-амино-1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н,7Н-ацето[2,1-b]фуро[3,4-d][1,3]тиазина
растворяют в 50 мл метанола. К этому раствору по каплям добавляют раствор 0,78 г пиридина в 10 мл метанола при перемешивании и охлаждении на льду. Полученный осадок отфильтровывают в атмосфере сухого
азота, промывают небольшим количеством метанола и сушат. (6R-транс)-7-амино-3-формил-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновую кислоту получают в виде светлого коричневатого порошка.
ИК (КВr): 1799 см-1 (β-лактам), 1672 см-1 (СНО), 1606 и 1542 см-1 (карбоксилат)
УФ-Спектр: λmax в H2O =
302нм.
c) Амид N-(1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н,7Н-азето[2,1-b] фуро[3,4-d] [1,3] -тиазин-6-ил)-2-(2-тритиламинотиазол-4-ил)-(Z)-2-метоксииминоуксусной кислоты
10 г
7-амино-3-формил-3-цефем-4-карбоновой кислоты в 200 мл смеси ацетонитрил: метиленхлорид (1:1) обрабатывают 37,4 мл N,O-бис(триметилсилил)ацетамидом при комнатной температуре в течение 5 минут. Через
30 минут реакционную смесь охлаждают до -10oС и в три приема добавляют 21 г хлорид 2-(2-тритиламинотиазол-4-ил)-(Z)-2-метоксииминоуксусной кислоты. Температура возрастает до -5o
С. Через 45 минут реакционную смесь обрабатывают 4 мл воды. Температура возрастает до 20oС. Реакционную смесь перемешивают в течение 10 минут и фильтруют. 15 г активированного угля
добавляют к этому фильтрату и перемешивают в течение 10 минут. После фильтрации растворитель из полученного фильтрата выпаривают. Остаток от выпаривания обрабатывают трет.-бутилметиловым эфиром.
Получают кристаллический почти бесцветный осадок, который отфильтровывают и сушат. Кристаллический амид N-(1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н,7Н-азето[2,1-b]фуро[3,4-d][1,
3]-тиазин-6-ил)-2-(2-тритиламинотиазол-4-ил)-2-метоксииминоуксусной кислоты получают в виде диастереомерной смеси в соотношении 1:1.
d) Трифторацетат амида N-(1,4,5а,
6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азето[2,1-b] фуро[3,4-d][1,3]-тиазин-6-ил)-2-(2-аминотиазол-4-ил)-(Z)-2-метоксииминоуксусной кислоты
5 г амида N-(1,4,5а, 6-тетрагидро-3-гидрокси-1,
7-диоксо-3Н, 7Н-азето[2,1-b] фуро[3,4-а] [1,3]-тиазин-6-ил)-2-(2-аминотиазол-4-ил)-(Z)-2-метоксииминоуксусной кислоты вводят в 20 мл трифторуксусной кислоты при 0oС. Температура
увеличивается до 10oС. Реакционную смесь перемешивают в течение 30 минут при 0oС и добавляют по каплям в 200 мл диэтилового эфира. Полученную смесь перемешивают в течение 5
минут
и фильтруют. Кристаллическую диастереомерную смесь трифторацетата амида N-(1,4,5a,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азето[2,1-b] фуро[3,4-d] [1,
3]-тиазин-6-ил)-2-(2-аминотиазол-4-ил)-(Z)-2-метоксииминоуксусной кислоты получают в соотношении 1:1.
Пример В)
Трифторацетат амида N-(1,4,5а, 6-тетрагидро-3-гидрокси-1,
7-диоксо-3Н, 7Н-азето[2,1-b] фуро[3,4-d][1,3]-тиазин-6-ил)-(Z)-2-(2-аминотиазол-4-ил)-2-(гидроксиимино)уксусной кислоты
получают в виде светло-желтого порошка аналогично тому, как описано в
Примере А) стадии с) - d), но используя на стадии с) хлорид 2-(2-тритиламинотиазол-4-ил)-(Z)-2-гидроксииминоуксусной кислоты вместо хлорида 2-(2-тритиламинотиазол-4-ил)-(Z)-2-метоксииминоуксусной
кислоты.
Пример С)
Гидрохлорид амида N-(1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н,7Н-азето[2,1-b] фуро[3,4-d] [1,3] -тиазин-6-ил)-2-(5-амино-1,2,
4-тиадиазол-3-ил)-(Z)-2-(фторметоксиимино)уксусной кислоты
Суспензию 3,73 г 7-амино-3-формил-3-цефем-4-карбоновой кислоты в смеси 80 мл метиленхлорида и 30 мл ацетонитрила перемешивают при
0oС с 16 мл N, O-бис(триметилсилил)ацетамида. За период в 15 минут получают чистый раствор, к которому добавляют 3,9 г хлорида (5-амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоуксусной
кислоты, полученного например, как описано в Примере 1 Европейского патента ЕР 0590681. Реакционную смесь перемешивают в течение 1 ч при 0oС. Добавляют 500 мл ацетонитрила, содержащего 10
г
воды и смесь фильтруют, чтобы удалить нерастворимые частицы. Фильтрат выпаривают. Остаток обрабатывают 500 мл ацетонитрила, смесь фильтруют и фильтрат выпаривают. Полученное твердое вещество
обрабатывают трет.-бутилметиловым эфиром и сушат. Гидрохлорид амида N-(1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азето[2,1-b] фуро[3,4-d][1,3]-тиазин-6-ил)-2-(5-амино-1,2,
4-тритиазол-3-ил)-(Z)-2-(фторметоксиимино)уксусной кислоты получают в форме светло-коричневатого порошка.
Пример D)
Гидрохлорид амида N-(1,4,5а,6-тетрагидро-3-гидрокси-1,
7-диоксо-3Н,7Н-азето[2,1-b] фуро[3,4-d] [1,3] -тиазин-6-ил)-2-(2-амимотиазол-4-ил)-(Z)-2-(ацетоксиимино)уксусной кислоты
40 г 7-амино-3-формил-3-цефем-4-карбоновой кислоты суспендируют в
1500
мл ацетонитрила и охлаждают до 0oС. За период в 20 минут добавляют 170 мл N, O-бис(триметилсилил)ацетамида при перемешивании. За период в 15 минут при 0oС получают чистый
раствор,
который охлаждают до -10oС, и к которому порциями добавляют 48 г хлорида (2-аминотиазол-4-ил)-(Z)-(ацетоксиимино)уксусной кислоты таким образом, чтобы температура реакционной
смеси не
превышала -8oС. Перемешивание продолжают в течение 60 минут при -10oС и добавляют 168 мл воды. Перемешивание продолжают еще 20 минут при 0oС и 2 часа при
комнатной
температуре. Образовавшийся кристаллический осадок отфильтровывают, промывают 350 мл ацетонитрила и 100 мл эфира и сушат. Гидрохлорид амида N-(1,4,5а, 6-тетрагидро-3-гидрокси-1,7-диоксо-3Н,
7Н-азето[2,
1-b] фуро[3,4-d] [1,3]-тиазин-6-ил)-2-(2-аминотиазол-4-ил)-(Z)-2-(ацетоксиимино)уксусной кислоты получают в форме диастереомерной смеси в соотношении 1:1.
Пример Е)
Гидрохлорид амида N-(1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо- 3Н,7Н-азето[2,1-b] фуро[3,4-d] [1,3] -тиазин-6-ил)-2-(2-амииотиазол-4-ил)-(Z)-2-(гидроксиимино)уксусной кислоты
10 г
гидрохлорида амида N-(1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азето[2,1-b] фуро[3,4-d][1,3]-тиаэин-6-ил)-2-(2-аминотиаэол-4-ил)-(Z)-2-(ацетоксиимино)уксусной кислоты суспендируют в 160 мл
ацетонитрила и обрабатывают 53 мл воды и 11 мл 8н. НСl. Реакционную смесь перемешивают в течение 14 ч при комнатной температуре. Получают чистый раствор, который растворяют в безводном ацетонитриле с
получением 3-кратного объема. Растворитель удаляют выпариванием с получением объема 10 мл, который обрабатывают 200 мл ацетонитрила. Образовавшийся осадок обрабатывают эфиром, отфильтровывают и
сушат.
Гидрохлорид амида N-(1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азето[2,1-b] фуро[3,4-d][1,3]-тиазин-6-ил)-2-(2-аминотиазол-4-ил)-(Z)-2-(гидроксиимино)уксусной кислоты получают в виде
вещества
желтоватого цвета.
Пример F)
Трифторацетат амида N-(1,4,5а, 6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азето[2,1-b] фуро[3,4-d][1,
3]-тиазин-6-ил)-2-(2-аминотиазол-4-ил)-(Z)-2-[(1-карбокси-1-метилэтокси)имино]уксусной кислоты
получают в виде светло-коричневатого порошка аналогично тому, как описано в Примере А) в
стадиях
а) - с), с использованием на стадии с) хлорида 2-(2-тритиламинотиазол-4-ил)-(Z)-2-[(1-карбокси-1-метилэтокси)имино] -уксусной кислоты вместо хлорида
2-(2-тритиламинотиазол-4-ил)-(Z)-2-метоксииминоуксусной кислоты.
Пример G)
Амид N-(1,4,5а, 6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7Н-азето[2,1-b] фуро-[3,4-d][1,
3-тиазин-6-ил)-2-[2-(трет.-бутоксикарбониламино)-тиазол-4-ил] -(Z)-2-пентеновой кислоты
получают в виде светлого коричневатого порошка аналогично тому, как описано в Примере А) на стадиях с)
- d), с использованием на стадии с) хлорида 2-(2-трет. -бутоксикарбониламино)тиазол-4-ил)-(Z)-2-пентеновой кислоты вместо хлорида 2-(2-тритиламинотиазол-4-ил)-(Z)-2-метоксииминоуксусной кислоты.
Пример Н)
Дигидрохлорид 1-(гидразиноиминометил)пиперазина
а) Гидроиодид 4-формил-1-[имино(метилтио)метил]пиперазина
25,5 г 4-формил-1-пиперазинкарботиоамида
суспендируют в 80 мл метанола, обрабатывают 22 г метилиодида и нагревают с обратным холодильником. За период в 10 минут получают чистый раствор. Смесь охлаждают до комнатной температуры. Растворитель
выпаривают. Получают кристаллический гидроиодид 4-формил-1-[имино(метилтио)метил]пиперазина.
b) Гидрохлорид 4-формил-1-(гидразиноиминометил)пиперазина
48,1 г гидроиодида
4-формил-1-[имино(метилтио)метил]пиперазина растворяют в 100 мл воды, прогоняют через колонку, заполненную 800 мл сильного основного ионообменника в форме хлорида и элюируют 850 мл воды. Растворитель
выпаривают с получением объема 100 мл, который обрабатывают 7,35 г гидразингидрата. Реакционную смесь перемешивают в течение 1 ч при комнатной температуре и растворитель выпаривают. Маслянистый
гидрохлорид 4-формил-1-(гидразиноиминометил)пиперазина кристаллизуется при высушивании.
с) Дигидрохлорид 1-(гидразиноиминометил)пиперазина
11 г гидрохлорида
4-формил-1-(гидразиноиминометил)-пиперазина растворяют в 400 мл метанола и обрабатывают 50 мл НClконц. Реакционную смесь перемешивают в течение 14 ч при комнатной температуре. Образуется
белый осадок, который отфильтровывают, промывают метанолом и эфиром, сушат и перекристаллизовывают из смеси вода/этанол. Дигидрохлорид 1-(гидразиноиминометил)пиперазина получают в кристаллической
бесцветной форме.
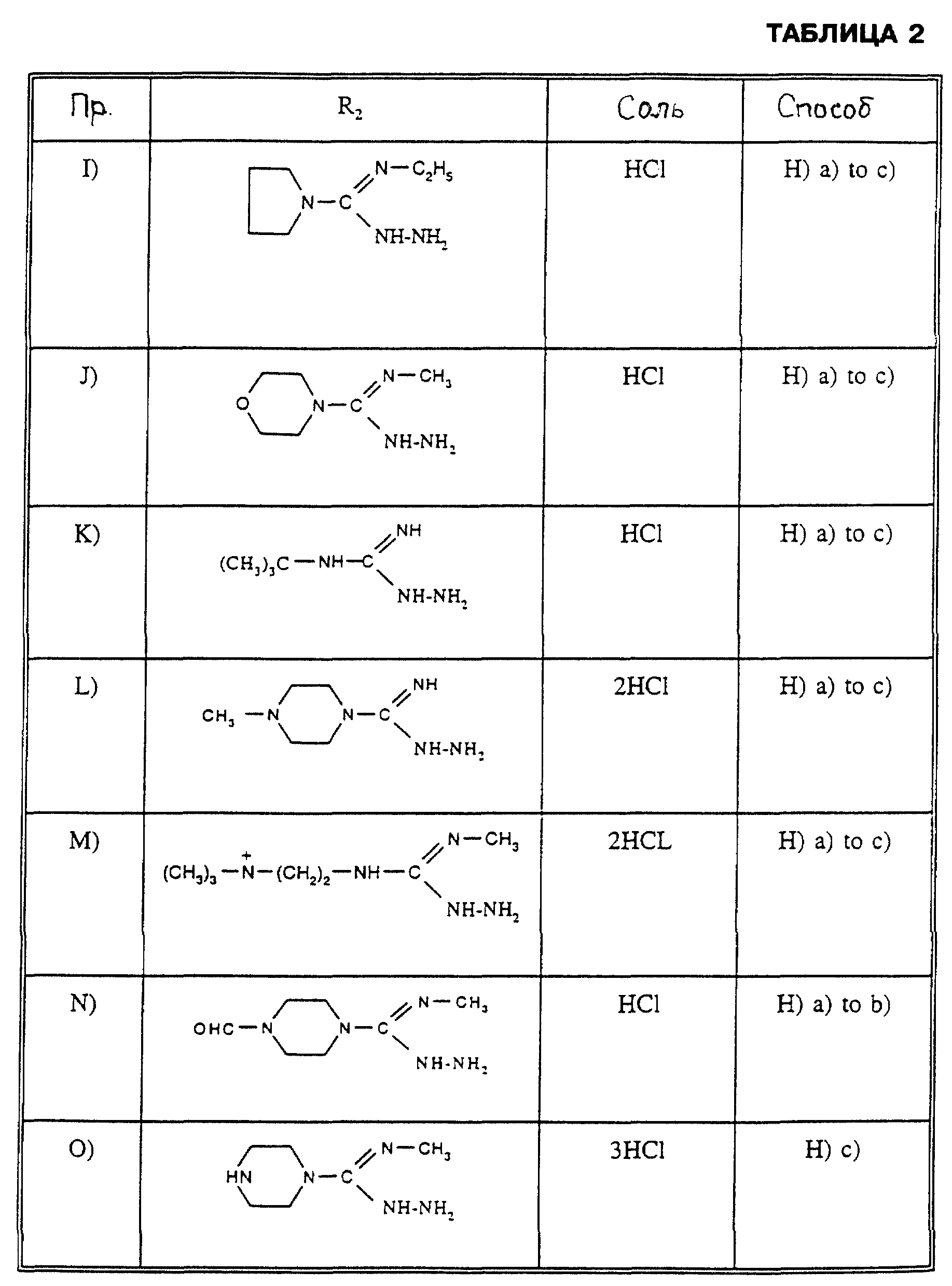
Соединения формулы IV из таблицы 2 могут быть получены аналогично способу, описанному в Примере Н).
Пример Р)
1-амино-3-(2-гидроксиэтил)-4-метилгуанидин
12,7 г 2-метиламино-2-оксазолина растворяют в 50 мл воды, обрабатывают 3 г гидразингидрата и перемешивают в течение 17 ч при комнатной температуре.
Растворитель выпаривают и получают 1-амино-3-(2-гидроксиэтил)-4-метилгуанидин в виде маслянистого остатка, который кристаллизуется по охлаждении.
Пример Q)
Гидрохлорид 1,
1-диметил-4-(гидразиноиминометил)пиперазинияхлорида
а) Гидроиодид 1,1-диметил-4-[имино(метилтио)метил]-пиперазинияиодида
3,2 г 4-метил-1-пиперазинкарботиоамида суспендируют в 100 мл
метанола. Добавляют 6,2 г метилиодида и смесь нагревают с обратным холодильником в течение 2 часов и охлаждают до 20oС. Осадок гидроиодида 1,
1-диметил-4-[имино(метилтио)метил]-пиперазинияиодида отфильтровывают и сушат.
b) Гидрохлорид 1,1-диметил-4-(гидразиноиминометил)пиперазинияхлорида
6,57 г гидроиодида 1,
1-диметил-4-[имино(метилтио)метил]-пиперазинияиодида растворяют в 70 мл воды, прогоняют через колонку, заполненную 150 мл сильного основного ионообменника в форме хлорида, и элюируют 250 мл воды.
Воду
выпаривают из элюата до получения объема 50 мл, который обрабатывают 0,9 мл гидразингидрата и перемешивают в течение ночи. Растворитель выпаривают и полученный остаток обрабатывают н-гексаном.
Получают гидрохлорид 1,1-диметил-4-(гидразиниминометил)-пиперазинияхлорида.
Пример R)
Тригидрохлорид 1-[гидразино(метилимимо)метил]пиперазина
а) Гидрохлорид
3-метил-2-метилизотиосемикарбазила
Раствор 239,8 г гидроиодида S-метил-2-метилизотиосемикарбазида в 100 мл воды прогоняют через колонку, заполненную 1500 мл сильного основного ионообменника
в
форме хлорида, и элюируют водой. Элюат лиофилизируют и лиофилизированный остаток обрабатывают эфиром. Осадок отфильтровывают и сушат. Гидрохлорид 3-метил-2-метилизотиосемикарбазида получают в виде
белого твердого вещества.
Тпл.116oС.
b) Гидрохлорил 4-формил-1-[гидразино(метилимино)метил]-пиперазина
Смесь 20 г свежеперегнанного
формилпиперазина и 27,3 г гидрохлорида 3-метил-2-метилизотиосемикарбазида в 200 мл этанола нагревают с обратным холодильником в течение ночи и растворитель выпаривают. Маслянистый остаток растворяют
в
70 мл горячего изопропанола и раствор медленно охлаждают до 20oС. Образуется осадок, и смесь оставляют стоять в течение 2 ч при 4oС. Гидрохлорид
4-формил-1-[гидразино(метилимино)метил]пиперазина отфильтровывают и перекристаллизовывают из изопропанола.
c) Тригидрохлорид 1-[гидразино(метилимино)метил]пиперазина
10 г
гидрохлорида 1-формил-4-[гидразино(метилимино)-метил] пиперазина растворяют в 250 мл метанола. Добавляют 50 мл НСlконц, полученную смесь перемешивают в течение ночи и растворитель
выпаривают. Получают твердый остаток, который сушат над твердым КОН. Тригидрохлорид 1-[гидразино(метилимино)-метил]пиперазина получают в виде белого продукта.
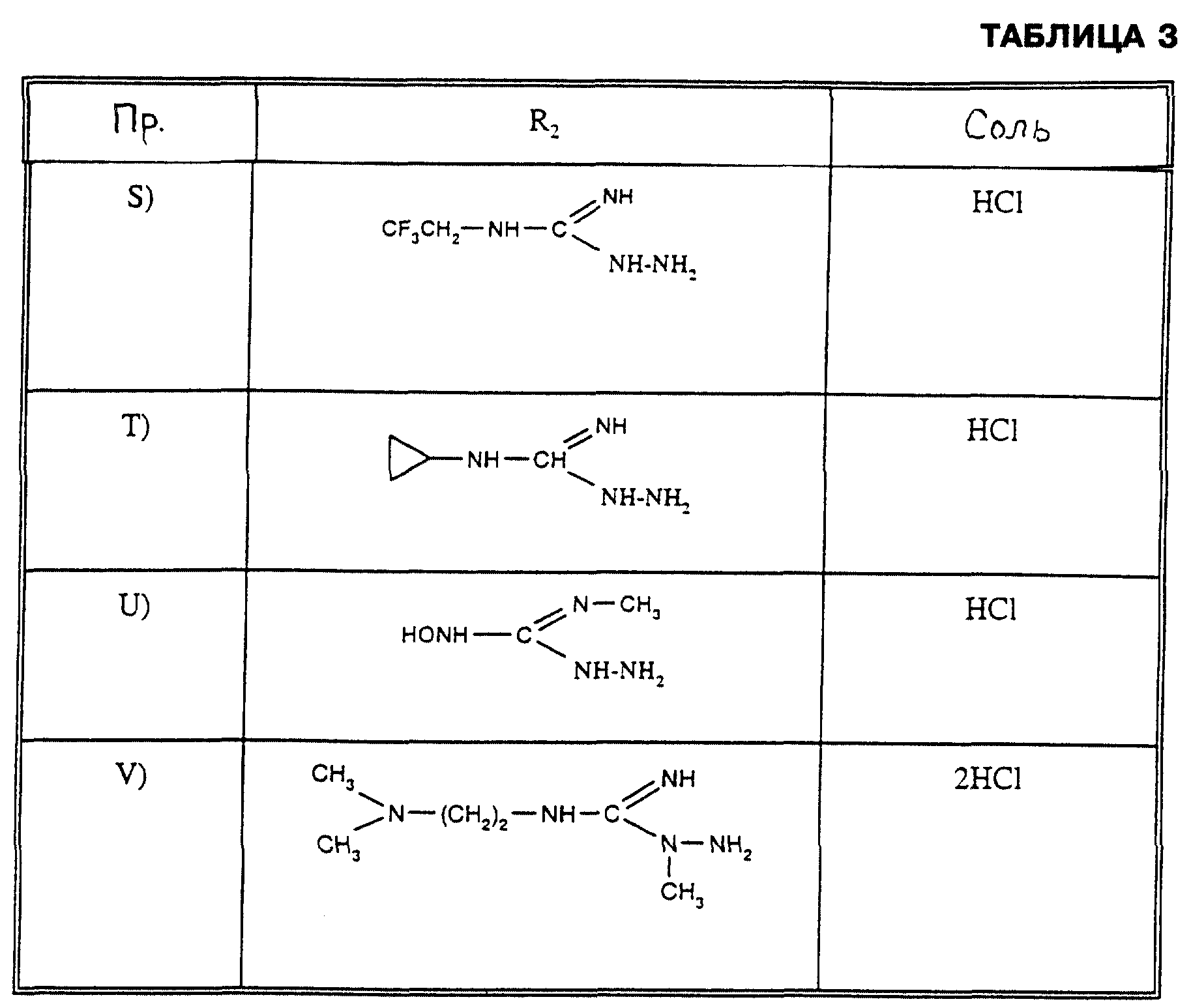
Аналогично способу, описанному в Примере R), но взаимодействием гидрохлорида S-метилизотиосемикарбазида, или гидрохлорида S-метил-2-метилизотиосемикарбазида, или гидрохлорида S-метил-4-метилизотиосемикарбазида с соответствующими аминами могут быть получены соединения формулы IV из таблицы 3.
Пример W)
Гидрохлорид 1-амино-3-(3,4-дигидроксибензилиденамино)-гуанидина
1 г
гидрохлорида диаминогуанидина растворяют в 10 мл 4н. НСl и разводят 20 мл метанола. Этот раствор быстро обрабатывают раствором 1 г 3,4-дигидроксибензальдегида в 40 мл метанола. Реакционную смесь
перемешивают в течение нескольких минут при комнатной температуре и растворитель выпаривают. Остаток суспендируют в 50 мл ацетонитрила. Образовавшийся осадок отфильтровывают и выпаривают. Получают
гидрохлорид 1-амино-3-(3,4-дигидроксибензилиденамино)гуанидина.
Пример X)
Гидроиодид S-метил-4-циклопропилтиосемикарбазида
295 мг 4-циклопропилтиосемикарбазида
растворяют в 5 мл сухого метанола и обрабатывают 154 мл метилиодида. Смесь перемешивают при 40oС в атмосфере азота в течение 5 часов, охлаждают и обрабатывают диэтиловым эфиром.
Образовавшийся бесцветный осадок гидроиодида S-метил-4-циклопропилтиосемикарбазида отфильтровывают, промывают диэтиловым эфиром и сушат.
Пример Y)
Гидроиодид
S-метил-4-н-бутилтиосемикарбазида
147 мг 4-н-бутилтиосемикарбазида в 2,5 мл сухого метанола обрабатывают 149 мг метилиодида. Смесь перемешивают в атмосфере азота в течение 5 ч, охлаждают и
обрабатывают диэтиловым эфиром. Образовавшийся бесцветный осадок гидроиодида S-метил-4-н-бутилтиосемикарбазида отфильтровывают, промывают диэтиловым эфиром и сушат.
Пример Z)
Гидразид 1-метил-5-меркапто-1,2,4-триазол-3-карбоновой кислоты
0,48 г метилового эфира 1-метил-5-меркапто-1,2,4-триазол-3-карбоновой кислоты растворяют в 10 мл метанола, обрабатывают 450
мкл
гидразингидрата и перемешивают в течение 2 ч при 20oС. Полученный осадок гидразида 1-метил-5-меркапто-1,2,4-триазол-3-карбоновой кислоты отфильтровывают, промывают метанолом и
сушат.
ИК (КВr): 1669 см-1, 1608 см-1, 1517 см-1.
13С-ЯМР (300 МГц, DMSO-d6): 35,4 (NCH3); 143,3, 154, 3 и 166, 7.
Пример АА)
Гидроиодид 1,5-диметил-2-(гидразиноиминометил)пиррола
а) 1,5-диметилпиррол-2-карботиоамид
5 г 2-циано-1,5-диметилпиррола растворяют в
40 мл
этанола и обрабатывают 10 мл триэтиламина. Добавляют 50 мл этанольного раствора H2S (3,8 г/100 мл) и смесь нагревают в течение 15 ч в автоклаве при 70oС. Реакционную смесь
охлаждают и растворитель выпаривают до получения четверти от ее объема. 1,5-Диметилпиррол-2-карботиоамид кристаллизуется по охлаждении при 0oС в виде светло-желтого осадка.
b) Гидроиодид 1,5-диметил-2-[имино(метилтио)метил]пиррола
1 г 1,5-диметилпиррол-2-карботиоамида растворяют в 20 мл метанола и обрабатывают 1,7 г метилиодида. Реакционную смесь перемешивают
в
течение 5 ч при комнатной температуре. Растворитель выпаривают до тех пор, пока не начнется кристаллизация. Остаток охлаждают до 0oС. Кристаллический гидроиодид 1,
5-диметил-2-[имино(метилтио)метил] -пиррола отфильтровывают, промывают метанолом и сушат.
с) Гидроиодид 1,5-диметил-2-(гидразиноиминометил)пиррола
1,3 г гидроиодида 1,
5-диметил-2-[имино(метилтио)метил]-пиррола растворяют в 20 мл метанола. Добавляют 0,28 г гидразингидрата. Реакционную смесь перемешивают в течение 3 ч, растворитель выпаривают и остаток
перекристаллизовывают из смеси ацетонитрил/эфир. Получают гидроиодид 1,5-диметил-2-(гидразиниминометил)пиррола.
Пример АВ)
Гидроиодид 3,
4-дигидрокси-2-(гидразиноиминометил)бензола
получают аналогично способу, описанному в Примере АА), но с использованием 3,4-дигидрокситиобензамида вместо 1,5-диметилпиррол-2-карботиамида.
Пример АС)
7-амино-3[[(карбометокси)имино]метил]-3-цефем-4-карбоновая кислота
Раствор 1,86 г гидрохлорида аминооксиуксусной кислоты в 20 мл воды обрабатывают при
перемешивании при 0oС 3,16 г гидрохлорида 6-амино-1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н,7Н-азето[2,1-b]фуро[3,4-d][1,3]-тиазина. Смесь перемешивают в течение 8 ч при 0oС.
7-Амино-3-[[(карбокси-метокси)имино] метил] -3-цефем-4-карбоновая кислота осаждается в виде бесцветных кристаллов, которые отфильтровывают, промывают 5 мл холодной воды и 5 мл ацетона и сушат.
Пример AD)
7-Амино-3-[(метоксиимино)метил]-3-цефем-4-карбоновая кислота
Раствор 0,5 г гидрохлорида O-метилгидроксиламина в 10 мл воды обрабатывают при перемешивании при
0oС 1,38 г 7-амино-3-формил-3-цефем-4-карбоновой кислоты и перемешивают в течение 8 ч при 0oС. 7-амино-3-[(метоксиимино)метил] -3-цефем-4-карбоновая кислота осаждается в виде
почти белых кристаллов, которые отфильтровывают, промывают 5 мл холодной воды и 5 мл ацетона и сушат.
Пример АЕ)
7-Амино-3-[(гироксиимино)метил]-3-цефем-4-карбомидная
кислота
a) Раствор 1,26 г гидрохлорида гидроксиламина в 7,5 мл воды обрабатывают при перемешивании при 0oС 4,74 г гидрохлорида 6-амино-1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н,
7Н-азето[2,1-b]фуро[3,4-d][1,3]-тиазина и перемешивают в течение 8 ч при 0oС в атмосфере азота. рН реакционной смеси доводят до 3,5 с использованием твердого гидрокарбоната натрия.
7-Амино-3-[(гидроксиимино)метил]-3-цефем-4-карбоновая кислота осаждается в виде бесцветных кристаллов, которые отфильтровывают, промывают 5 мл холодной воды и 5 мл ацетона и сушат.
b) Суспензию 0,79 г гидрохлорида 6-амино-1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н,7Н-азето[2,1-b]фуро[3,4-d][1,3]тиазина в 10 мл дихлорметана обрабатывают при перемешивании при 4oС 2, 67 г N,O-бис-(триметилсилил)ацетамида. Чистый раствор получают за период в 10 минут. Добавляют 0,21 г гидрохлорида гидроксиламина. Реакционную смесь перемешивают в течение 2 ч в атмосфере азота при 4oС, и растворитель выпаривают. Остаток обрабатывают 10 мл изопропилового спирта, предварительно охлажденного до 1oС. 7-Амино-3-[(гидроксиимино)метил]-3-цефем-4-карбоновая кислота осаждается в виде почти бесцветных кристаллов, которые отфильтровывают, промывают 5 мл ацетона и сушат.
Аналогично тому, как описано в Примерах от АС) до АЕ), могут быть получены соединения формулы V) из таблицы 4.
1Н-ЯМР-Спектры соединений, полученных согласно Примерам (Пр.), см. в конце описания.
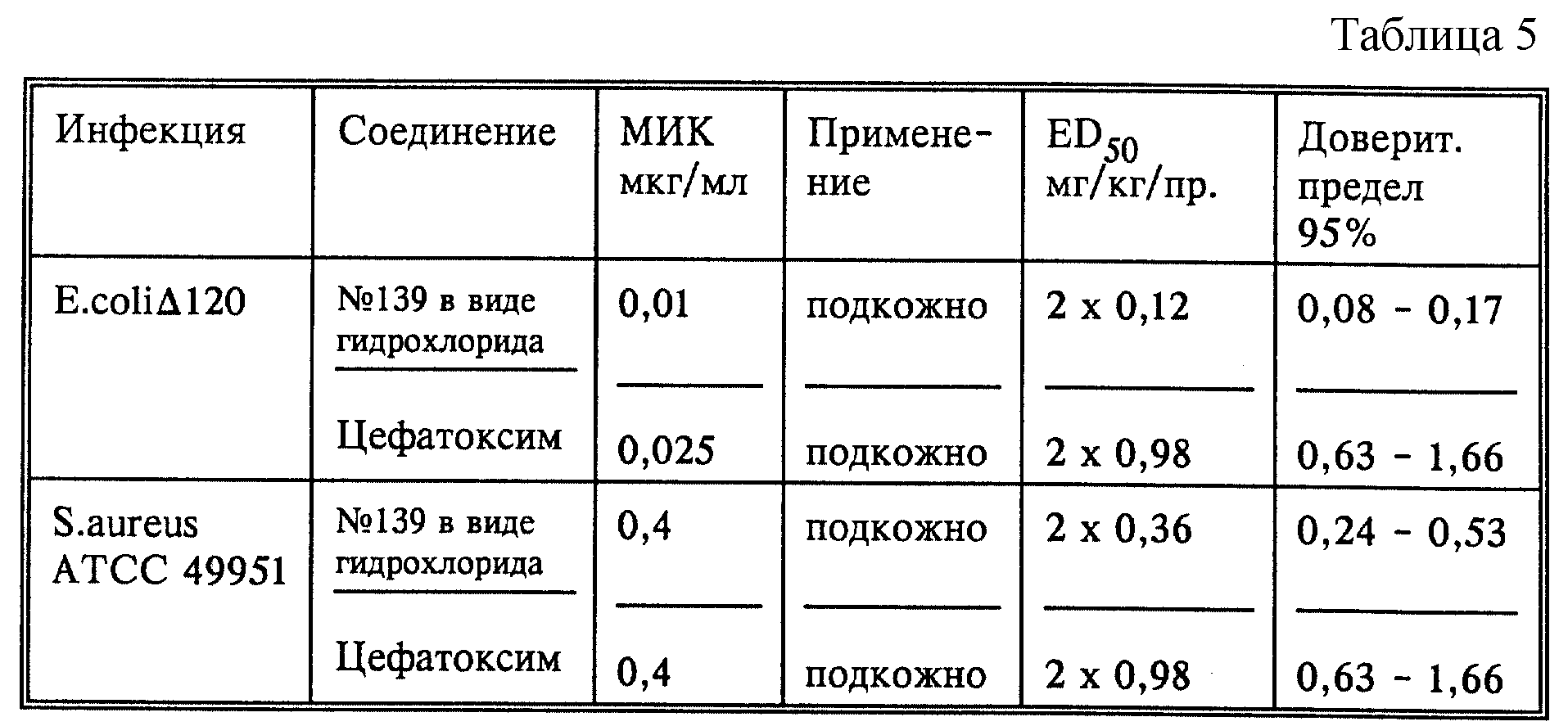
Результаты исследования in vivo антибактериальной активности против системных инфекций у мышей для соединения из примера 139 по сравнению с цефатоксимом.
Антибактериальная активность in vivo была исследована на септических инфекциях (NMRI) у аутбредных мышей. Мышей произвольно распределяли на группы по 8 животных на дозу и помещали в макролоновые клетки (тип III). Контрольную группу не подвергали инфицированию.
Штаммы бактерий, предназначенные для инфицирования, представляют собой E. coliΔ120 (Novartis culture coolection) и Staphylococcus aureus (Smith) (штамм ATCC 49951). Бактерии культивировали в течение 16 часов в среде Mueller-Hinton Broth и разводили физиологическим раствором до инокуляционной концентрации, которая убивает всех мышей после интрапарентерального инфицирования (0,3 мл/мышь) через 24-48 часов после инфицирования. Исследуемые соединения разводили физиологическим раствором и вводили подкожно в различных дозировках каждой группе.
В случае E.coli инфицирования обработку исследуемыми соединениями проводили одновременно через 5 часов после инфицирования, в случае S.aureus инфицирования через 1 и 4 часа после инфицирования.
Умерщвленных мышей ежедневно протоколировали до 10 дня после инфицирования. Величины ED50, рассчитанные пробит-анализом, результаты и доверительные пределы представлены в табл. 5.
Примеры фармацевтических композиций
Таблетки
120 мг соединения, полученного в примере 139, смешивают с 192 мг дикальцийфосфата, 190
мг лактозы и 6 мг кукурузного крахмала. К полученной смеси добавляют еще 6 мг кукурузного крахмала, гранулируют и грубо просеивают. Затем сушат в глубоком вакууме и вновь просеивают через сито с
размером отверстий 1,00 мм. Добавляют еще 6 мг кукурузного крахмала и 292 мг стеарата магния и прессуют в таблетки весом 800 мг и диаметром около 1,27 см.
Ампулы
В имеющую
отверстие ампулу, содержащую 500 мг соединения, полученного в примере 139, в виде моногидрохлорида, вводят шприцем 10 мл стерилизованной воды из отдельной ампулы непосредственно перед введением
пациенту. Растворенный таким образом продукт смешивают с 30 мл физиологического раствора хлорида натрия и полученный раствор используют для внутривенной инъекции в течение 20-30 минут.
Реферат
Изобретение относится к новым производным цефалоспорина общей формулы I, в которой R1 обозначает водород или сложноэфирную группу, R2 обозначает группу формулы (IIа, IIb, IIс), Y обозначает водород, алкил, замещенный алкил или ацил, R4 обозначает водород, фенил, циклоалкил или алкил, R5 обозначает водород, фенил, циклоалкил, низший алкил, насыщенный или ненасыщенный 5-6-членный гстероциклил, необязательно замещенный алкилом, трифторалкилом, оксо или аминогруппой, бензотиазолил или группу формулы (IId, IIe, IIf), R7 обозначает алкил, R8 обозначает водород, циклоалкил или алкил, R9 обозначает водород или алкил, R10 обозначает водород, алкил, замещенный алкил, где заместитель выбран из трифторалкила, пиридила, гидрокси, алкокси, галогена, амино или остатка сульфоновой кислоты; гидрокси, амино, фенил, алкенил, циклоалкил или группу формулы -N=CH-Phe, где Phe обозначает фенил, замещенный гидрокси, или R9 и R10 вместе с атомом азота обозначают насыщенный, ненасыщенный или замещенный 5-6-членный гетероциклил, содержащий один или два атома азота или кислорода, причем заместитель выбирают из формила или алкила и т.д. Соединение формулы IVa, Rx представляет собой группу формулы -NН-С(СН3)3 и т.д., Ry представляет собой NH, и Rz представляет собой водород и т. д. Фармацевтическая композиция, предназначенная для лечения заболеваний, вызванных бактериями, содержит соединение формулы I в форме фармацевтически приемлемой соли или в свободной форме в комбинации с по меньшей мере одним фармацевтическим носителем или разбавителем. Способ лечения заболеваний, вызванных микробами, заключается в введении субъекту, нуждающемуся в таком лечении, эффективного соединений формулы I. Технический результат - получение новых антибактериальных цефалоспоринов. 4 с. и 9 з.п. ф-лы, 5 табл.
-O-Y IIa
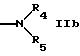
-N=R6 IIc



Формула
где R1 обозначает водород или сложноэфирную группу;
R2 обозначает группу формулы
-O-Y- IIa
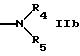
или
-N= R6 IIc
где Y обозначает водород, алкил, замещенный алкил или ацил;
R4 обозначает водород, фенил, циклоалкил или алкил;
R5 обозначает водород, фенил, циклоалкил, низший алкил, ненасыщенный или насыщенный пяти- или шестичленный гетероциклил, необязательно замещенный алкилом, трифторалкилом, оксо или аминогруппой, бензотиазолил или группу формулы
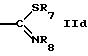
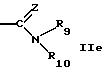
или
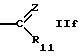
где R7 обозначает алкил;
R8 обозначает водород, циклоалкил или алкил;
R9 обозначает водород или алкил;
R10 обозначает водород, алкил, замещенный алкил, где заместитель выбран из трифторалкила, пиридила, гидрокси, алкокси, карбокси, галогена, амино или остатка сульфоновой кислоты; гидрокси, амино, фенил, алкенил, циклоалкил или группу формулы
-N= CH-Phe
где Phe обозначает фенил, замещенный гидрокси,
или R9 и R10 вместе с атомом азота обозначают насыщенный, ненасыщенный или замещенный пяти- или шестичленный гетероциклил, содержащий один или два атома азота или кислорода, причем заместитель выбирают из формила или алкила;
Z обозначает кислород, серу или N-R13, где R13 обозначает водород или алкил;
R11 обозначает водород, дигидроксифенил, алкил, замещенный алкил, где заместитель выбирают из амино или пиридила; циклоалкил, пиридил, незамещенный или замещенный пяти- или шестичленный гетероциклил, содержащий от одного до трех атомов азота, где заместитель выбирают из алкила, тионо, формила или гидрокси,
или R4 и R5 вместе с атомом азота обозначают пяти- или шестичленный гетероциклил, содержащий один или два атома азота и необязательно замещенный одним или несколькими заместителями, выбранными из алкила или оксо;
R6 обозначает пятичленный гетероциклил, имеющий два или три атома азота и замещенный одним или несколькими заместителями, выбранными из амино, алкила или тионо;
Ас обозначает группу формулы
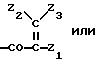
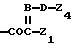
где В обозначает N или СН;
Z1 обозначает пятичленный гетероциклил, содержащий один атом серы и один или два атома азота и замещенный амино;
Z2 обозначает водород или алкил;
Z3 обозначает водород или алкил;
Z4 обозначает водород, ацил, алкил или алкил, замещенный галогеном или карбонилом, карбокси;
D обозначает кислород или СН2
в любой возможной таутомерией форме, в свободном виде, в форме соли, сольвата или гидрата.
где W обозначает СН или N;
V обозначает СН или N-O;
R1 обозначает водород или сложноэфирную группу;
R2 обозначает группу формулы
-O-Y IIa
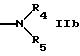
или
-N= R6 IIc
где Y обозначает водород; незамещенный низший алкил; или низший алкил, замещенный остатком карбоновой кислоты, эфира карбоновой кислоты или амида карбоновой кислоты;
R4 обозначает водород, фенил, циклоалкил или низший алкил;
R5 обозначает водород, низший алкил, ненасыщенный или насыщенный пяти- или шестичленный гетероциклил, необязательно замещенный алкилом, трифторалкилом, оксо или аминогруппой, или группу формул
или
где R7 обозначает низший алкил;
R8 обозначает водород, циклоалкил или низший алкил;
R9 обозначает водород или низший алкил;
R10 обозначает водород, гидрокси; амино; фенил; алкенил; циклоалкил; гетероциклил; незамещенный алкил; алкил, замещенный группами CF3, ОН, алкокси, карбокси, галогеном, группами амино, моноалкиламино, диалкиламино, триалкиламино, пиридилом или остатком сульфоновой кислоты; группу формулы
где R12 обозначает водород или низший алкил;
Z обозначает кислород, серу, или N-R13, где R13 обозначает водород или низший алкил;
R11 обозначает водород; дигидроксифенил; циклоалкил; незамещенный или замещенный пяти- или шестичленный гетероциклил, содержащий от одного до трех атомов азота, где заместитель выбирают из алкила, тионо, формила или гидрокси; незамещенный низший алкил; низший алкил, замещенный пиридилом или группами моноалкиламино, диалкиламино, триалкиламино;
R4 и R5 и/или R9 и R10 независимо друг от друга вместе с азотом обозначают гетероциклил;
R6 обозначает пятичленный гетероциклил, имеющий два или три атома азота и замещенный одним или несколькими заместителями, выбранными из амино, алкила или тионо;
R3 обозначает водород; ацил; карбокси; незамещенный алкил; замещенный алкил галогеном или карбокси,
в любой возможной таутомерией форме, в свободном виде, в форме соли, сольвата или гидрата.
где R1s такой же, как R1 в формуле IА;
Vs такой же, как V в формуле IА;
Ws такой же, как W в формуле IА;
R3s обозначает водород, низший ацил; незамещенный алкил; низший алкил, замещенный карбоксигруппой и/или фтором;
R2s обозначает группу формулы
-OYs IIas
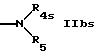
или
-N= R6s IIcs
где Ys обозначает водород; незамещенный низший алкил; или алкил, замещенный карбоксигруппой;
R4s обозначает водород или низший алкил;
R5s обозначает водород; насыщенный или ненасыщенный незамещенный пяти- или шестичленный гетероциклил, имеющий 1-3 атома азота; насыщенный или ненасыщенный пяти- или шестичленный гетероциклил, имеющий 1-3 атома азота, замещенный одной или несколькими группами, такими, как оксо, низший алкил, амино или CF3; бензотиазолил; или группу формулы
или
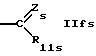
где Zs такой же, как Z в формуле I;
R7s обозначает низший алкил;
R8s обозначает водород, циклоалкил или низший алкил;
R9s обозначает водород или низший алкил;
R10s обозначает водород; фенил; аллил; циклоалкил; незамещенный алкил; алкил, замещенный группами CF3, диалкиламино, триалкиламино, гидрокси, пиридил или SO3H;
R11s обозначает водород; пиридил; циклоалкил; незамещенный низший алкил; низший алкил, замещенный пиридилом или группой триалкиламино; насыщенный или ненасыщенный пяти- или шестичленный гетероциклил, имеющий 1-3 атома азота; или пяти- или шестичленный гетероциклил, имеющий 1-3 атома азота, замещенный одной или несколькими группами, такими, как низший алкил и/или тионо;
R4s и R5s вместе с атомом азота обозначают гетероциклил, выбранный из насыщенного незамещенного пяти- или шестичленного гетероциклила, имеющего 1 или 2 атома азота; насыщенного пяти- или шестичленного гетероциклила, имеющего 1 или 2 атома азота, замещенного одной или несколькими группами, такими, как оксо или низший алкил;
и/или R9s и R10s вместе с атомом азота обозначают насыщенный незамещенный пяти- или шестичленный гетероциклил, имеющий 1 или 2 гетероатома азота и/или кислорода; ненасыщенный пяти- или шестичленный гетероциклил, имеющий 1 или 2 гетероатома азота и/или кислорода, замещенный одной или несколькими группами, такими, как СНО или низший алкил,
в любой возможной таутомерией форме, в свободном виде, в форме соли, сольвата или гидрата.
где W обозначает СН или N;
V обозначает СН или N-O;
R1 обозначает водород или сложноэфирную группу;
R2 обозначает группу формулы
-N(R4R5) IIb
где R4 такой же, как определено в п. 1;
R5 обозначает группу формулы
где Z обозначает -N-R13, где R13 такой, как определено в п. 1;
R9 и R10 вместе с атомом азота обозначают гетероциклил, который является пиперазинилом,
в любой возможной таутомерией форме, в свободном виде, в форме соли, сольвата или гидрата.
7-[[(2-амино-4-тиазолил)-(Z)-(гидроксиимино)ацетил] амино] -3-[[(аминоиминометил)гидразоно] метил] -3-цефем-4-карбоновая кислота;
7-[[(2-амино-4-тиазолил)-(Z)-(гидроксиимино)ацетил] амино] -3-[[(пиперазиноиминометил)гидразоно] метил] -3-цефем-4-карбоновая кислота;
7-[[(5-амино-1,2,4-тиадиазол-3-ил)-(Z)-(фторметоксиимино)ацетил] амино] -3-[[(пиперазиноиминометил)гидразоно] метил] -3-цефем-4-карбоновая кислота;
в любой возможной таутомерией форме, в свободном виде, в форме соли, сольвата или гидрата.
где R1p такой же, как R1 в формуле I;
Ас такой, как определено в формуле I;
R2p обозначает группу формул
-OYp IIap
или
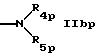
где Yp такой же, как Y в формуле IА;
R4p такой же, как R4 в формуле IА;
R5p обозначает водород, циклоалкил, низший алкил или группу формулы

или
где R8p такой же, как R8 в формуле IА;
Zp такой же, как Z в формуле IА;
R9p такой же, как R9 в формуле IА;
R7p обозначает метил;
R10p обозначает водород, низший алкил или гидрокси;
R4p и R5p и/или R9p и R10p независимо друг от друга вместе с азотом обозначают гетероциклил,
и группы формул IIbp, IIdp и IIер обозначают любую таутомерную форму, в свободной форме или, если такая форма существует, в форме кислотно-аддитивной соли, внутренней соли, четвертичной соли или их сольвата или гидрата.
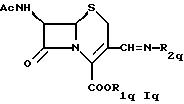
где Ac такой, как определено в формуле I;
R1q такой же, как R1 в формуле IА;
R2q обозначает группу формулы
-OYq IIaq
или

где Yq такой же, как Y в формуле IА;
R4q такой же, как R4 в формуле IА;
R5q обозначает водород, циклоалкил, низший алкил или группу формул
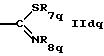
или

где R7q такой же, как R7 в формуле IА;
R8q такой же, как R8 в формуле IА;
Zq такой же, как Z в формуле IА;
R9q такой же, как R9 в формуле IА;
R10q обозначает водород, низший алкил или гидрокси;
R4q и R5q и/или R9q и R10q независимо друг от друга вместе с азотом обозначают гетероциклил,
и группы формул IIbp, IIdp и IIер обозначают любую таутомерную форму, в свободной форме или, если такая форма существует, в форме кислотно-аддитивной соли, внутренней соли, четвертичной соли или их сольвата или гидрата.
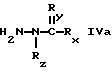
где (i)
Rx представляет собой группу формулы
-NH-C(CH3)3 или
-NH-CH2CF3 или
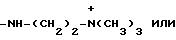
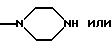

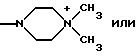

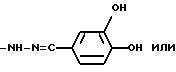


Ry представляет собой NH;
Rz представляет собой водород; или
(ii) Rx представляет собой группу формулы -NH-(CH2)2-N(CH2)2;
Ry представляет собой NH;
Rz представляет собой CH3; или
(iii) Rx представляет собой -SCH3;
Ry представляет собой группу формулы
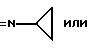
= N-C4H9
Rz представляет собой водород; или
(iv) Rx представляет собой группу формулы
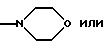
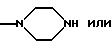
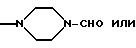

-NHOH или
-NH-CH2-CH2-OH
Ry представляет собой N-CH3;
Rz представляет собой водород; или
(v) Rx представляет собой группу
Ry представляет собой N-C2H5;
Rz представляет собой водород; или
(vi) Rx представляет собой группу
Ry представляет собой кислород;
Rz представляет собой водород;
в любой возможной таутомерной форме, в свободной форме или, если такая форма существует, в форме кислотно-аддитивной соли, внутренней соли, четвертичной соли или их сольвата или гидрата.
11.05.1995 по пп. 1-13;
12.06.1995 по пп. 1-13;
17.04.1996 по пп. 1-13;
23.04.1996 по пп. 1-13;

Комментарии