Дициановые фумиганты и способ фумигации с использованием дициана - RU2194390C2
Код документа: RU2194390C2
Чертежи


































































Описание
Изобретение относится к фумигантам, в частности к фумигантам, применяемым в виде газа или раствора, которые включают дициан (С2N2), а также к способам окуривания с помощью таких газообразных фумигантов или их растворов.
Фумиганты широко применяются для дезинсекции и защиты товаров и предметов потребления от заражения, что, как правило, необходимо для предохранения сыпучих продуктов (например, зерна) и другой продукции, отданной для хранения на складе (включая как продукты долговременного хранения, так и скоропортящиеся пищевые продукты), пористых объемных материалов (например, грунта и лесоматериалов), свободного пространства (обычно пустых зданий). Идеальный фумигант должен быть токсичным по отношению к насекомым, клещам, бактериям, грибам и их спорам, вирусам и плесени, а также к другим паразитам, быть эффективным при применении в низких концентрациях и обладать исключительно низким поглощением материалами в фумигационной области. Он также должен иметь низкую хроническую токсичность для млекопитающих и либо не давать остаточных количеств, либо присутствовать в виде инертных остатков. Кроме того, идеальный фумигант не должен создавать трудности в решении проблемы безопасного обращения и оказывать отрицательного воздействия на готовую продукцию или свободное пространство, которые подвергают окуриванию.
Не существует фумигантов, которые бы удовлетворяли всем этим идеальным критериям. Два фумиганта, наиболее широко используемые для окуривания зерна и других сыпучих продуктов, а также фруктов и древесины, представляют собой фосфин и метилбромид, хотя в качестве альтернативы недавно был предложен карбонилсульфид (Международная заявка PCT/AU93/00018, международная публикация WIPO No.93/13659).
Фосфин является предпочтительным фумигантом, применяемым при хранении зерна и аналогичных продуктов, поскольку он эффективен против зерновых вредителей и присутствует в продукте в низких остаточных количествах, которые представляют собой по существу безвредные фосфаты. Однако фосфин способен самопроизвольно воспламеняться, когда его концентрация превышает сравнительно низкую величину, и, кроме того, он неспособен при использовании в приемлемых концентрациях уничтожать все фазы насекомых в течение короткого периода времени.
Метилбромид более токсичен к зерновым вредителям, по сравнению с фосфином, при непродолжительном окуривании, однако фосфин более эффективен против зерновых вредителей при длительной обработке. Метилбромид обладает меньшей воспламеняемостью, чем фосфин, однако недавняя работа показала, что метилбромид истощает озоновый слой. Поэтому, в соответствии с Монреальским протоколом метилбромид как фумигант постепенно выводят из обращения.
Карбонилсульфид (сероокись углерода) в настоящее время проходит интенсивные испытания и еще не нашел одобрения для использования в качестве фумиганта, несмотря на некоторые очевидные преимущества, по сравнению как с метилбромидом. так и фосфином. К другим фумигантам, применяемым против зерновых вредителей, относятся акрилонитрил, сероуглерод, четыреххлористый углерод, хлорпикрин, дибромэтан, дихлорэтан, цианистый водород и фтористый сульфурил. Следует отметить, что галоген присутствует во всех традиционных фумигантах, а также то, что ни один из этих продуктов не обладает свойствами идеального фумиганта.
В течение многих лет идет постоянный поиск новых фумигантов и нет сомнений в том, что он будет продолжаться.
Настоящее изобретение относится к новому фумиганту, обладающему свойствами, которые делают его реальной альтернативой традиционным фумигантам, в особенности для уничтожения насекомых, клещей, нематод, грибов и их спор, бактерий, вирусов, плесени и других биопаразитов.
В своем широком определении в объем настоящего изобретения входит фумигант, включающий цианоген (циан) (C2N2) в растворе или в смеси с газом-носителем, где концентрация циана находится в интервале от 0,01 мг/л до 160 мг/л.
Предпочтительно, газ-носитель представляет собой инертный газ с низким содержанием кислорода. Кроме того, газ-носитель содержит предпочтительно углекислый газ.
Согласно другому примеру осуществления изобретения фумигант находится в растворе, предпочтительно в водном.
В своем широком определении в изобретении предложен способ окуривания, включающий применение циана (С2N2) в газообразном виде на предметах потребления и/или конструкциях, где концентрация циана находится в интервале от 0,01 мг/л до 160 мг/л, или применение циана в водном растворе на предметах потребления и/или конструкциях таким образом, что концентрация циана, усредненная по объему внутри ограждения и/или конструкции, находилась в интервале от 0,01 мг/л до 160 мг/л.
Предпочтительно, к готовой промышленной продукции относится зерно, семена, мясо, фрукты, овощи, древесина, растения, срезанные цветы и почва (грунт).
Предпочтительно также, чтобы готовая продукция включала строения, такие как силосные ямы, башни или подобные конструкции для хранения или содержания насыпного зерна (например, пшеницы) или аналогичной продукции, помещения, дома с прилегающими постройками и участком, а также зубоврачебное оборудование и принадлежности, используемые в общей медицине и/или ветеринарии.
В предпочтительном варианте заявленный фумигант способен уничтожать один и более биовредителей из числа вирусов, насекомых, паукообразных, клещей, нематод, бактерий, плесени, грибов и их спор и грызунов.
В другом варианте изобретения указанный фумигант включает определенную среду и/или применяется в среде, содержащей углекислый газ (CO2).
Предпочтительно, чтобы влажность и/или давление в среде, где применяется фумигант, можно было регулировать для контроля за его свойствами (например, увеличением токсичности и/или наличием синергических эффектов).
В своем предпочтительном варианте способ окуривания включает обработку материала в газовой фазе с низкой скоростью потока, фумигацию в газовой фазе под низким и под высоким давлением, распыление фумиганта в виде газа или в виде раствора и/или вымачивание изделия в газообразном или жидком растворенном фумиганте.
Изобретение более подробно илюстрируется описанием с приведением наиболее предпочтительных примеров его осуществления, которые никоим образом не
служат
ограничением заявленного изобретения, при этом разнообразные методики эксперимента сопровождаются чертежами 1-47, где
фиг.1 и 2 представляют собой графическую иллюстрацию результатов
анализа
C2N2 в газовой фазе и жидкости;
фиг.3-7 представляют собой графическую иллюстрацию результатов различных методик по удалению C2N2 из
газовых
потоков;
фиг.8 и 9 представляют собой графическую иллюстрацию результатов различных методик по удалению С2N2 из воздуха или жидкостей способами, отличными от
обычного
проветривания или вентиляции;
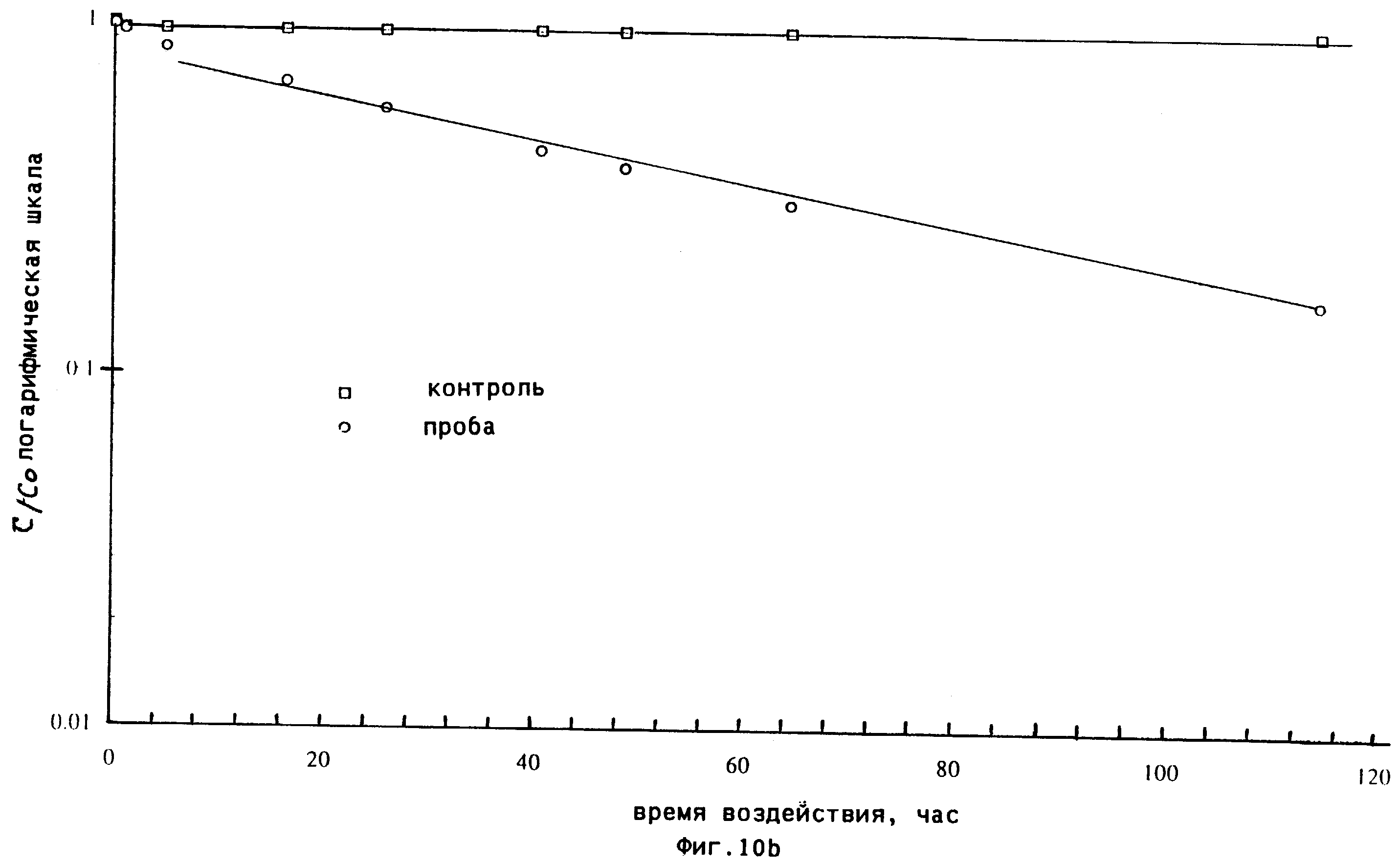
фиг.10(а) и (b) иллюстрируют сорбцию С2N2 пшеницей;
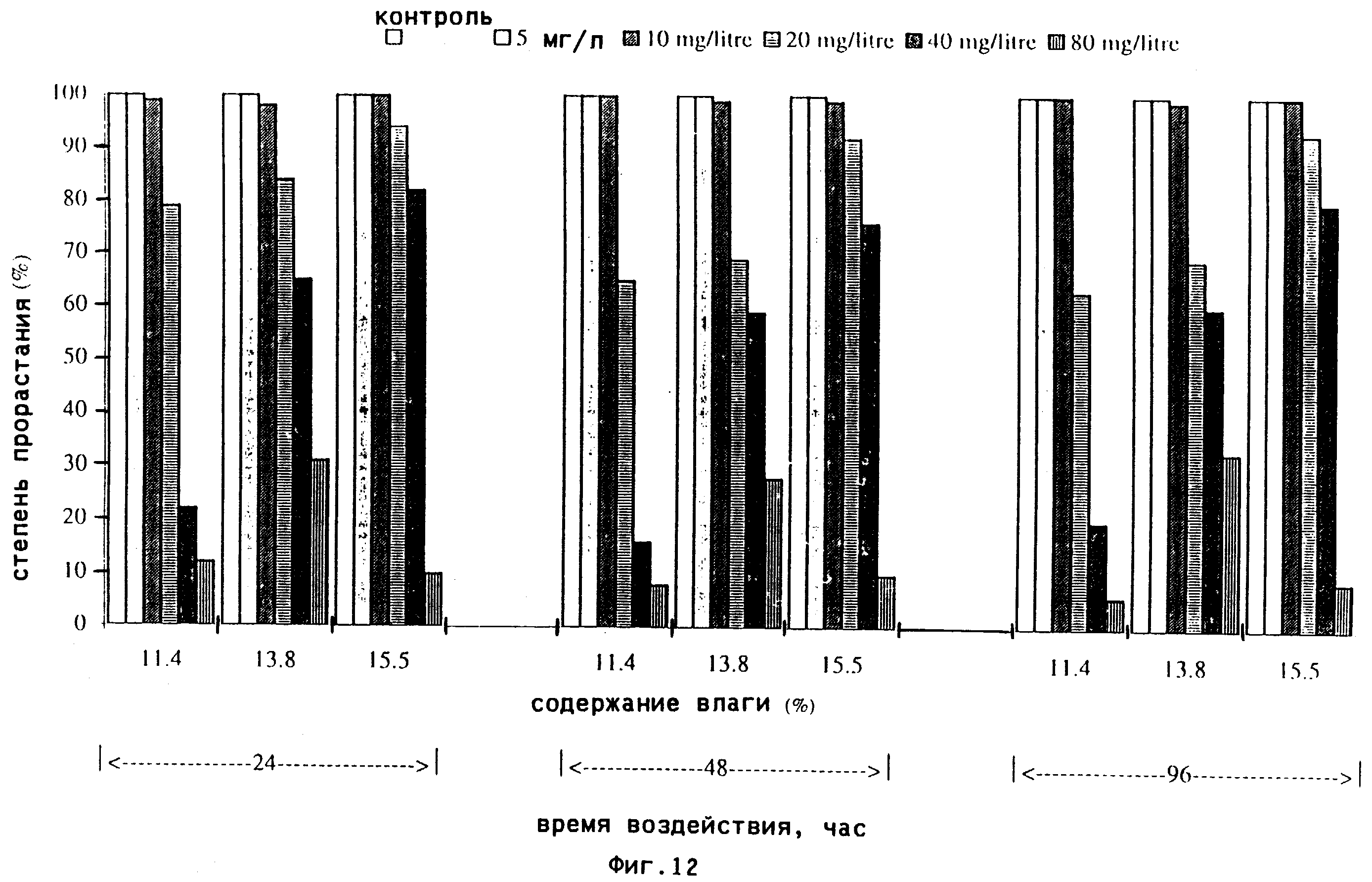
фиг.11, 12 и 13(a)-(d) иллюстрируют результаты, достигнутые для
пшеницы,
обработанной С2N2;
фиг. 14(а)-(с) демонстрируют токсичность С2N2 по отношению к плесени, имеющейся на зернах пшеницы;
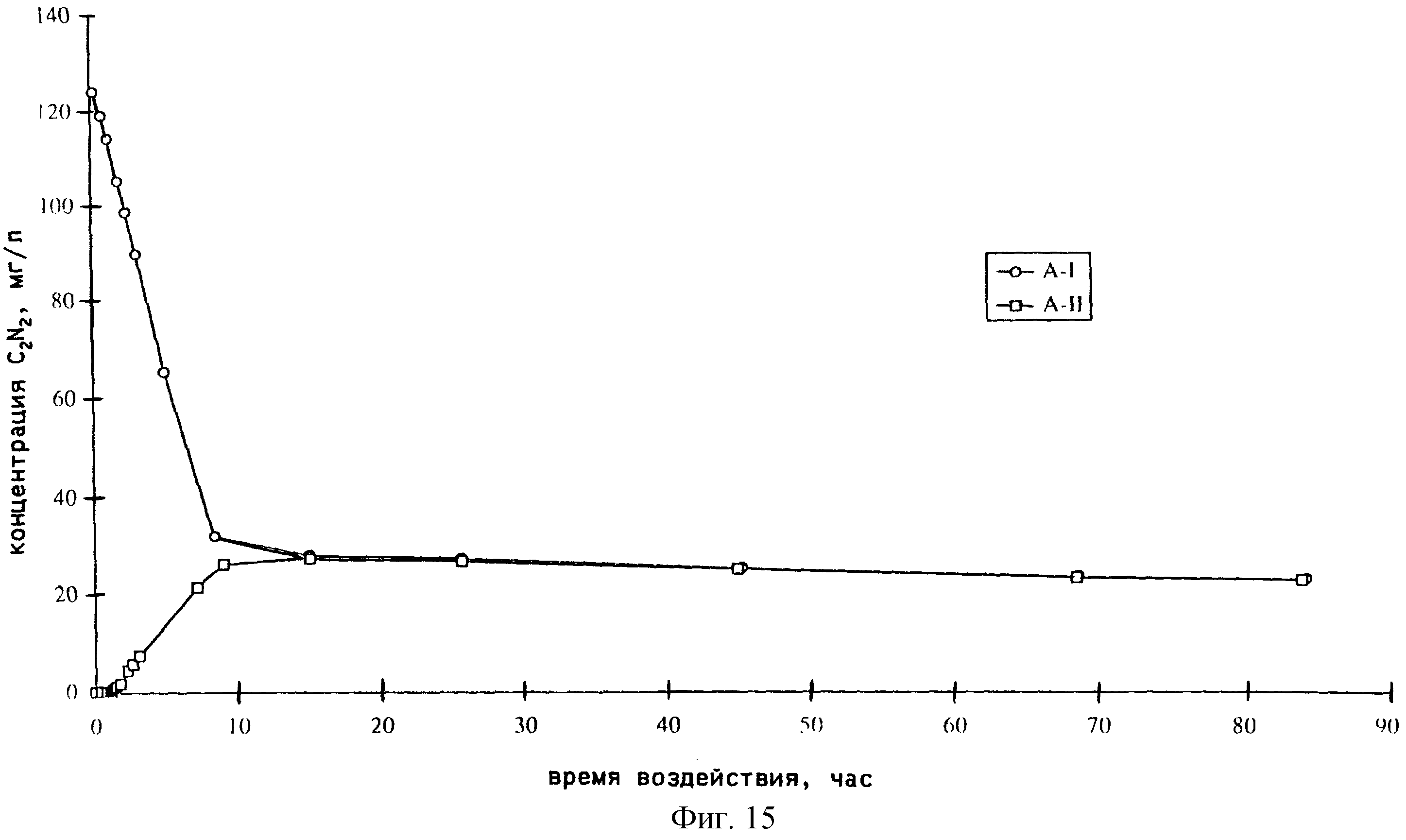
фиг.15-17
демонстрируют прохождение С2N2 через воду;
фиг.18-23 иллюстрируют скорость сорбции С2N2 для пшеницы;
фиг. 24 представляет собой
графическую иллюстрацию результатов измерения концентрации С2N2 в воде;
фиг. 25 и 26 демонстрируют остаточные количества С2N2 в пшенице, к которой
был добавлен газообразный или жидкий фумигант непосредственно перед экстракцией;
фиг. 27 демонстрирует прохождение С2N2 и других газов через колонку с пшеницей;
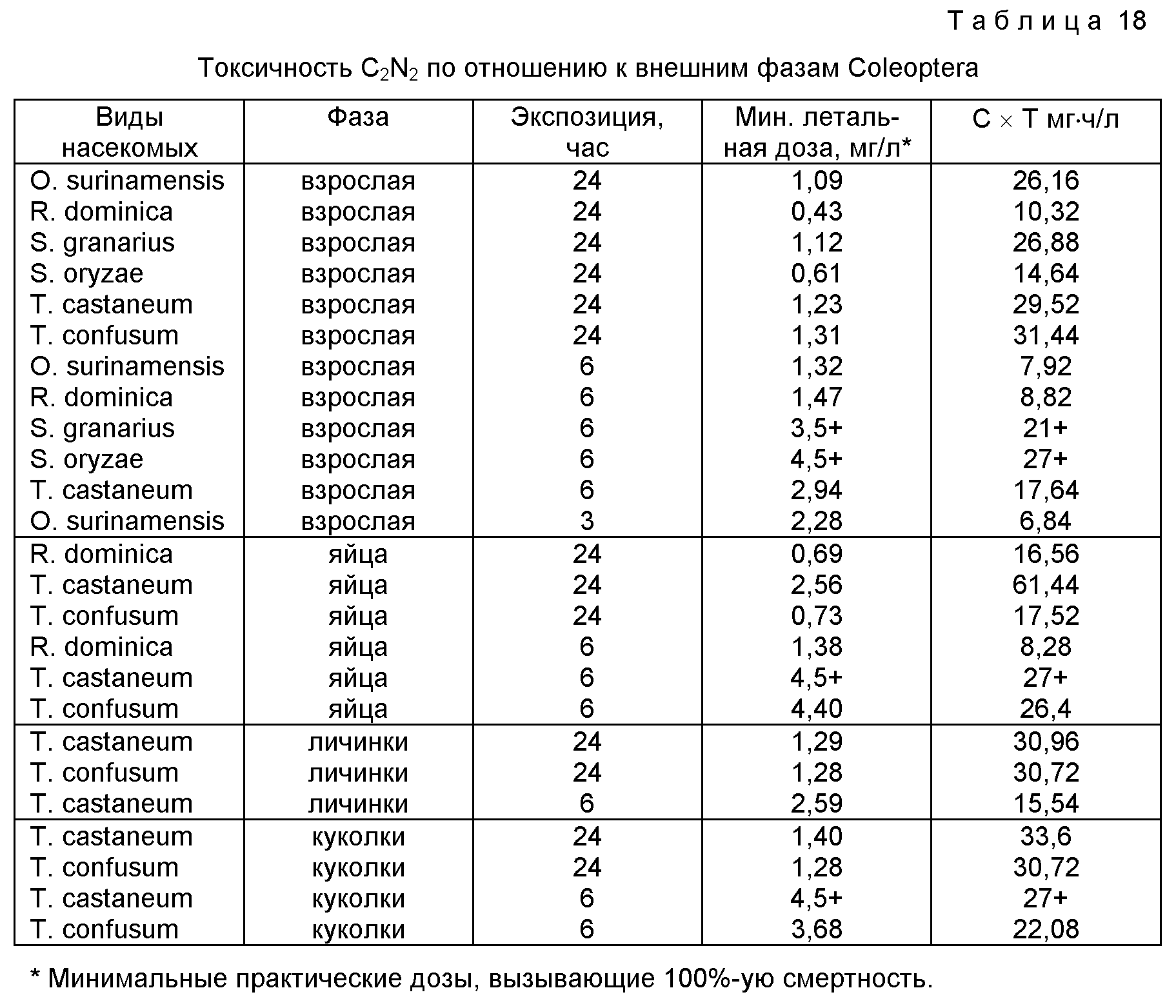
фиг. 28-30 демонстрируют данные по токсичности С2N2 на двух типах Coleoptera;
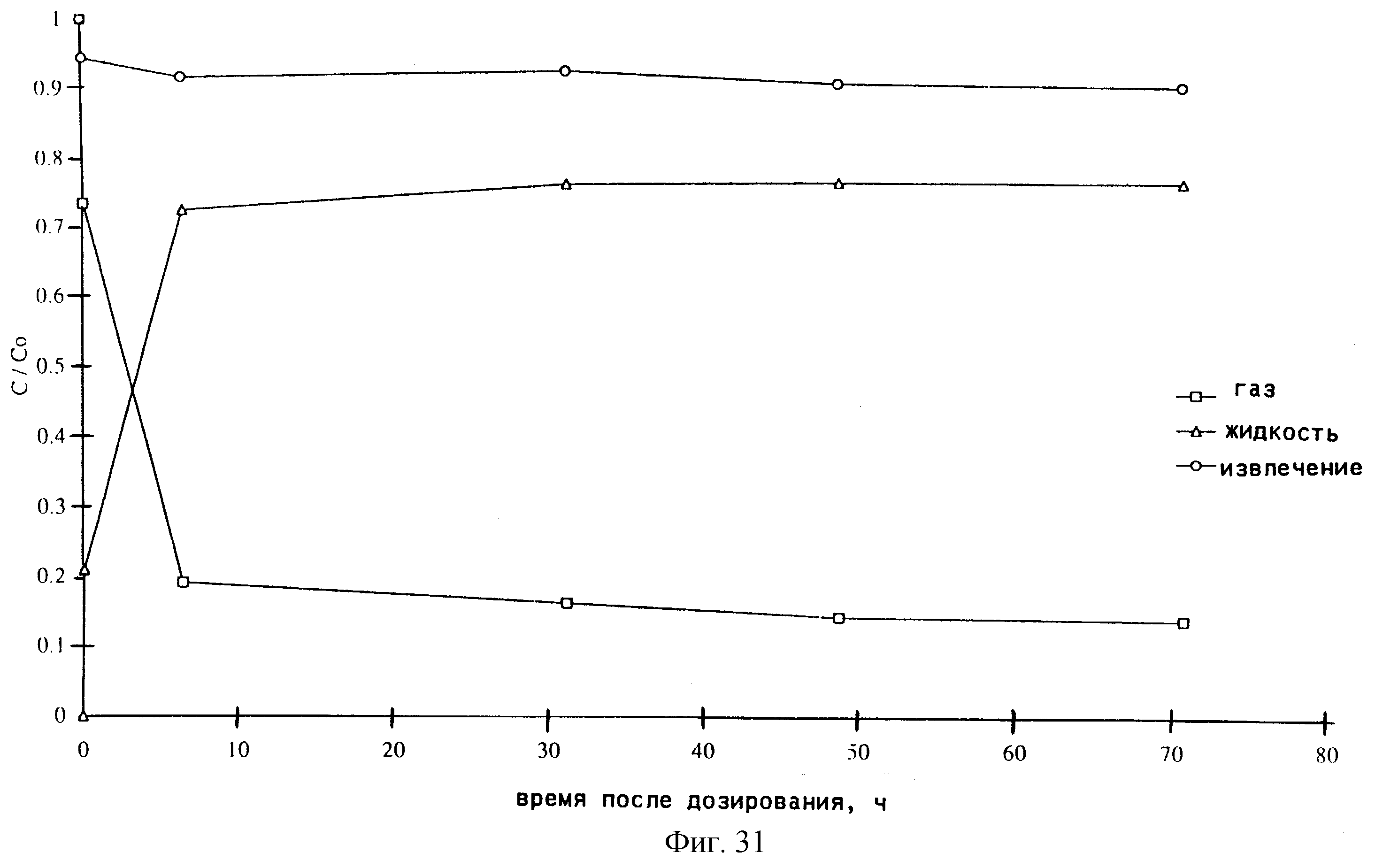
фиг. 31-36 иллюстрируют стабильность и фазовое равновесие С2N2 в
различных растворителях;
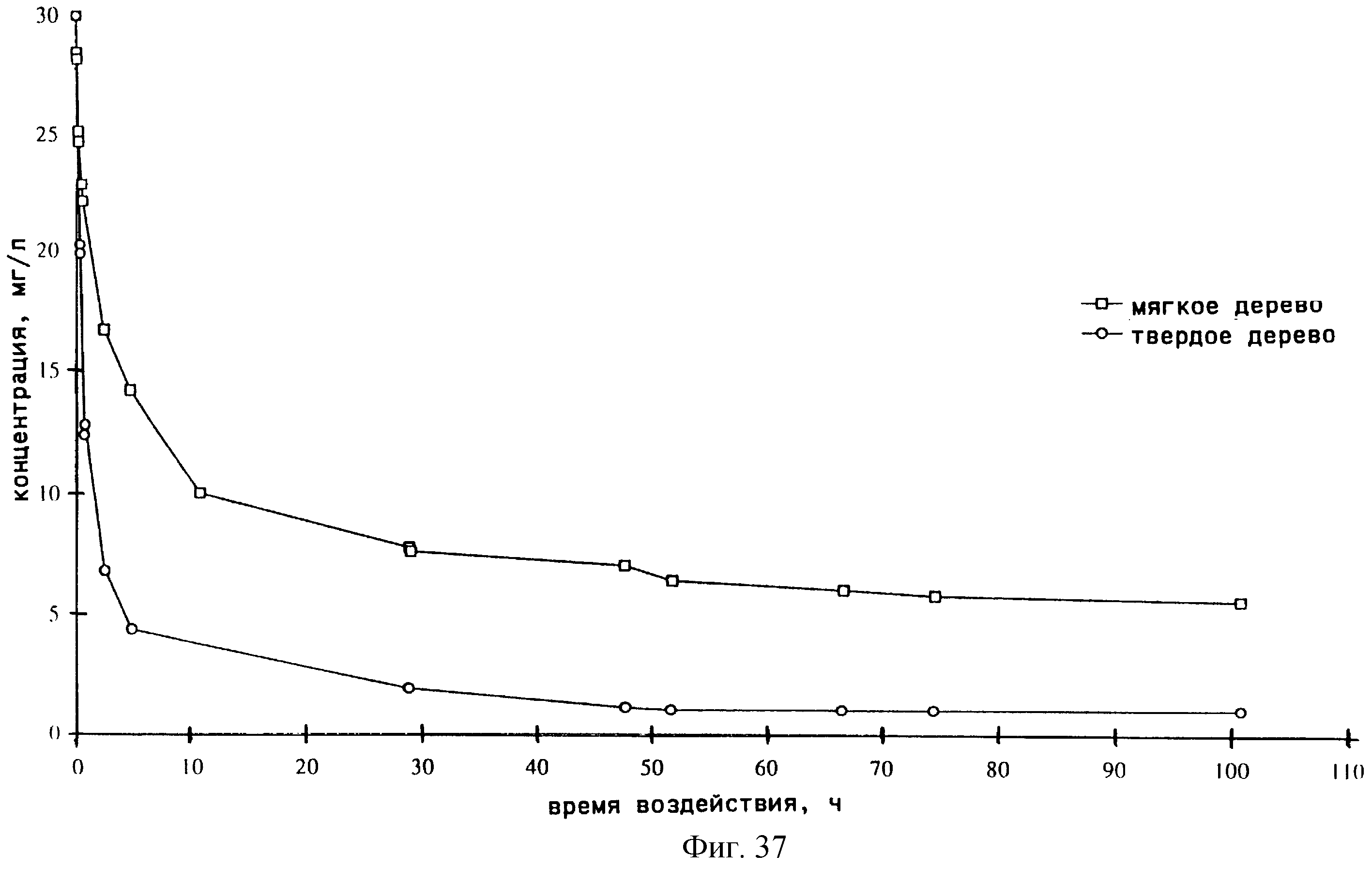
фиг. 37-41 демонстрируют сорбцию С2N2 древесиной по сравнению с сорбцией метилбромида;
фиг. 42-44 демонстрируют данные по токсичности
С2N2 на двух типах древесных термитов;
фиг.45 иллюстрирует сорбцию С2N2 образцами срезанных цветов;
фиг.46 демонстрирует фумигационное
устройство, применяемое для измерения влияния высокого и низкого давления на токсичность С2N2 по отношению к насекомым.
Следует отметить, что в описании и формуле изобретения термин "цианоген" определяют как газ (при нормальных условиях) или раствор цианогена (дициана) С2N2, в основном свободного от цианистого водорода и других цианогенных соединений (то есть соединений, способных приводить к образованию цианистого водорода). Следовательно, цианоген, используемый в настоящем изобретении, представляет собой продукт, получаемый в промышленности и имеющийся на рынке, который не содержит заметных количеств других химических соединений, таких как хлористый циан или цианистый водород.
Возможно также, однако, что в процессах окуривания вместо циана или в сочетании с ним использовать и другие соединения, которые способны выделять цианистый водород.
Цианоген, который называют также дицианом или оксалонитрилом (динитрилом щавелевой кислоты), можно представить формулами (CN)2, С2N2 или NC-CN. Дициан присутствует в природной атмосфере, генерируется растениями и с помощью света. Он присутствует также и в других галактиках, а линии его спектра используют в определениях сдвига красной линии при оценке скорости движения различных галактик.
При изучении уровня техники авторы изобретения сознавали трудности, возникающие из-за терминологии, используемой в старой научной и патентной литературе. Проблема состояла в том, что в старой научной литературе любое соединение, способное давать цианистый водород (включая и те соединения, которые взаимодействуют с нецианогенными веществами для получения цианистого водорода) называли "цианогеном" (или "цианом"), тогда как соединение, которое называют так в настоящее время, по существу носит название "дицианоген" или "дициан". Любому обозревателю соответствующего уровня техники необходимо осознать такую неоднозначность в терминологии.
Цианоген (циан, дициан) обладает высокой острой токсичностью по отношению к человеку и другим теплокровным, но его
хроническая
токсичность незначительна (то есть, малые дозы, заражение которыми происходило во времени, не являются кумулятивными). В своей статье, озаглавленной "Синтез и химия циана", опубликованная
в Chemical
Reviews, v.59, pp. 841-883, 1959, авторы Бразертон и Линн (T.K. Brotherton and J.W. Lynn) с ссылкой на более раннюю работу Элкинса (A.B. Elkins) заявляют:
"Циан представляет собой
чрезвычайно
ядовитое вещество высокой токсичности, сравнимой с токсичностью цианистого водорода. Его максимальная допустимая концентрация (пары) составляет 10-3 г/л (10 ppm)".
Примерно в 1913 году Буркхардт (J.L. Burckhardt), в статье о токсичности циана делает вывод, что (1) только дозы менее 0,1 мг/л (СN)2 в воздухе можно считать безопасными для кошек; (2) доза в 0,2 мг/л (СH)2 является смертельной для кошек в течение нескольких часов; однако (3) кролики способны хорошо переносить концентрации 0,4 мг/л, причем смертельным интервалом доз для них является интервал 0,6-0,8 мг/л (CN)2.
В описании к патенту США 1399829, датированному 13 декабря 1921 года, Ваn Метер (J.W. Van Meter) заявляет, что циан, хлор и мышьяк в газообразном состоянии с большим или меньшим успехом применяют в отдельности в качестве фумигантов, бактерицидных агентов, дезинфицирующих средств, дезодорантов и средств для истребления насекомых и животных. Однако Ван Метер не приводит доказательств такого утверждения, и авторы настоящего изобретения не обнаружили какой-либо ссылки (или более недавней публикации), которые подтвердили такое заявление Ван Метра. Последний действительно утверждает в этом описании, что "газообразный циан представляет собой смертельный яд для тли и личинок, действующих на цитрусовые и фруктовые деревья..., при этом он является безвреденым для листвы." Его изобретение фактически представляет собой "комбинацию или смесь вышеуказанных газов" и хотя Ван Метер утверждал о своей способности пропустить ограниченное количество хлора через раствор цианистого калия, содержащего железо, для "высвобождения циана", он отметил, что этот газ легче воздуха, а это свидетельствует в пользу того, что он фактически получил газ, богатый цианистым водородом, поскольку циан обладает более высокой плотностью, чем воздух.
В патенте Великобритании 237244, датированном 24 апреля 1924 года и озаглавленном "Циановые фумиганты", описано применение цианистого водорода (HCN) и других цианидных производных, нанесенных на кизельгур или другие пористые носители, с серной или щавелевой кислотой, добавленной для предупреждения разложения цианида. Однако сам циан не включен в перечень циановых фумигантов из указанного патента Великобритании.
Следует также отметить, что в вышеупомянутой статье Бразертона и Линна нет ссылки на возможность применения циана в качестве фумиганта.
Несмотря на широкое изучение имеющегося уровня техники, авторы настоящего изобретения не обнаружили какого-либо примера использования циана в качестве фумиганта. Полагают, что его показатели стабильности (было сделано утверждение, что С2N2 легко разлагается в присутствии воды) и токсичности привели к выводу о том, что циан по своей природе не пригоден для применения в качестве фумиганта.
Авторы настоящего
изобретения убедились
в том, что такой вывод является необоснованным и что дициан (далее в тексте согласно данному выше пояснению будет использован именно этот термин), при условии надлежащего с ним
осторожного обращения,
можно использовать в виде газа и растворов для получения фумигантов, которые обладают значительными преимуществами, по сравнению с применяемыми в настоящее время
предпочтительными фумигантами. В
частности,
а) дициан можно смешать с другими газами для осуществления окуривания в газовой фазе и в качестве газа-носителя при этом использовать воздух или
другой газ, богатый кислородом.
Кроме того, отсутствует риск возникновения взрыва при условии, что концентрация С2N2 составляет менее 6,6%, но даже при превышении этой величины
необходимо наличие искры или
пламени для того, чтобы вызвать возгорание кислородно-дициановой смеси;
б) дициан растворим в воде (и других растворителях) и его можно применять на товарах или
конструкциях в виде водных
растворов с низкой концентрацией путем распыления или простого налива раствора на изделие или конструкцию;
в) хотя дициан легко абсорбируется зерном и другими
сыпучими продуктами или
продуктами питания, предназначенными для хранения, его идеально подходит для быстрого окуривания насыпного зерна и подобной ему продукции либо путем использования в виде газа
со значительным уровнем
содержания СО2 в качестве носителя (что уменьшает поглощение), либо путем использования фумиганта с высоким содержанием дициана методом распыления или пропусканием
через зерно с высокой
скоростью потока;
г) показано, что окуривание семян пшеницы и других злаков эффективными количествами дициана не влияет на скорость прорастания семян (однако следует
отметить, что когда
концентрация дициана составляет 180 мл/л и выше, газ, содержащий фумигант, действует как гербицид, который ингибирует прорастание некоторых видов семян);
д) остатки
дициана на обработанных им
изделиях очень малы, поскольку он быстро разлагается с превращением в цианид не доминирующим путем, в противоположность способу применения фумигантов, содержащих цианистый
водород, которые приводят к
высоким остаточным количествам;
е) дициан можно продуть из сыпучих изделий в конце периода окуривания путем пропускания потока воздуха через сыпучий продукт;
ж) дициан можно удалить
из воздушного потока путем простого охлаждения потока воздуха до температуры ниже точки сжижения дициана, которая составляет -21,17oС при нормальных условиях;
з) дициан способен
уничтожать множество вредителей, в том числе насекомых, клешей, грибов и их спор, бактерий, вирусов и грызунов;
и) окуривание дициансодержащими фумигантами
позволяет осуществлять
долговременное хранение зерна с высоким содержанием влаги в отсутствие порчи;
к) дициан оказывает системное действие на растение и поэтому его можно использовать для
системного уничтожения
насекомых и борьбы с болезнями растений;
л) дициан активен как в водных растворах, так и в виде газа, и способен проходить через воду, уничтожая бактерии, грибы и
вирусы во множестве
практических случаев при обработке помещений и оборудования научных учреждений, больниц, ветеринарных клиник, зубоврачебных кабинетов; и
м) дициан используется для
хранения мяса, фруктов и
овощей.
Авторы настоящего изобретения обнаружили, что смесь дициана и двуокиси углерода усиливает токсическое действие дициана. В настоящее время нет объяснения наблюдаемому синергическому эффекту от смешения дициана и двуокиси углерода. Авторы изобретения выдвигают гипотезу, что двуокись углерода увеличивает скорость дыхания у насекомых и остальных вредителей, а это, в свою очередь, увеличивает скорость проникания дициана в респираторную систему насекомых. Однако такое суждение представляет собой лишь неподтвержденную гипотезу и поэтому лишь предположительно может служить объяснением наблюдаемого синергического эффекта.
Таким образом, в настоящем изобретении предлагается фумигант, который включает дициан и газ-носитель, причем концентрация дициана обычно находится в интервале от 0,01 до 160 мг/л.
Газ-носитель может представлять собой инертный газ, при этом газ-носитель имеет низкое содержание кислорода (например, газ печи обжига). Предпочтительно, чтобы он содержал двуокись углерода.
Кроме того, в настоящем изобретении предлагается фумигационная жидкость, включающая дициан в водном растворе (или другой жидкости).
Настоящее изобретение также включает способ окуривания, который предусматривает применение газообразного или жидкого фумиганта на изделии в течение необходимого времени фумигации.
Согласно изобретению предложенный способ включает окуривание в газовой фазе с низкой скоростью потока, окуривание в газовой фазе под низким и под высоким давлением, распыление фумиганта в растворе и вымачивание изделия в растворе фумиганта, причем данный список не является исчерпывающим.
При окуривании с низкой скоростью потока воздух или другой газ-носитель, содержащий заранее заданнное количество дициана, медленно пропускают через сыпучий материал методом, аналогичным способу окуривания с применением фосфина, который описан в Международных заявках PCT/AU90/00268 и PCT/AU94/00324. Концентрация дициана в фумигантсодержащем газе зависит от сорбции и времении выдерживания, но предпочтительно находится в интервале от 0,01 до 5 мг/л. Как уже было отмечено выше, предпочтительный газ-носитель содержит двуокись углерода, так как усиленная токсичность смеси дициана и двуокиси углерода позволяет применять низкие концентрации дициана не в ущерб эффективности самого процесса окуривания.
Окуривание складированной продукции под низким давлением проводят с помощью газообразного дицианового фумиганта в тех случаях, когда продукция подлежит хранению в герметичной для газа камере. Из камеры откачивают воздух, а затем впускают дициансодержащий газ. Такая техника обеспечивает распределение газа по всей камере, тем самым устанавливая заранее заданный режим окуривания (исходя из токсикологических характеристик) для складированной продукции в целом. Авторы изобретения определили, что при окуривании под низким давлением фумигант может достигнуть того же конечного уровня токсичности, как если бы этот процесс протекал при нормальных условиях (хотя время выдерживания, возможно, следовало было изменить), снижая тем самым до минимума количество фумиганта, необходимого для достижения токсического эффекта.
Окуривание складированной продукции под высоким давлением также возможно, когда продукция подлежит хранению в герметичной для газа камере. После необязательной операции откачки впускают газ, содержащий дициан (предпочтительно содержащий двуокись углерода) до тех пор, пока в камере не установится предварительно заданное значение избыточного давления газа. Если камеру затем герметизировать, то процесс окуривания будет протекать до тех пор, пока камеру не откроют и дициансодержащий газ не продуют из нее.
При окуривании складированной продукции под высоким давлением насекомые уничтожаются быстрее, чем при низком давлении или в условиях слабого потока газа. Так как в этом случае необходима установка дополнительного оборудования, эта технология требует больших затрат и поэтому в основном применяется для быстрой дезинфекции очень дорогого товара.
В каждом из перечисленных выше способов окуривания дициан, используемый в процессе, можно улавливать либо путем охлаждения дициансодержащего газа, покидающего аппарат или камеру, где хранится обрабатываемая продукция, либо путем химического разложения или абсорбции дициана (который включает пропускание газа, содержащего дициан, через химическое вещество, например амин, или через поглотитель).
Показатели растворимости дициана в воде и выбор других жидкостей приведен в табл. 2 упомянутой выше статьи Бразертона и Линна. Жидкую фумигацию, как отмечалось выше, осуществляют путем опрыскивания продукции с помощью жидкости (обычно воды), содержащей дициан в заранее заданной низкой концентрации (выбранной в соответствии с токсикологическими характеристиками). Согласно другому варианту дициансодержащую жидкость просто выливают на изделие, покрывая его раствором, либо дают раствору стекать по нему тонкой струйкой. Контакт с жидким фумигантом поддерживают путем постоянного или прерывистого (но в то же время периодического) нанесения фумиганта на изделие, поддерживая тем самым процесс обработки в течение необходимого времени. В конце процесса фумигации жидкость, содержащую дициан, удаляют из изделия либо а) путем промывки водой с последующей (при необходимости) сушкой потоком чистого воздуха, либо б) путем продувки изделия потоком чистого воздуха, который как бы поглощает как жидкий носитель, так и дициан из фумигационной жидкости.
Дициан поставляют в цилиндрических сосудах, наполненных сжатым С2N2. Такие цилиндры используют в качестве источника дициана для получения газообразного и жидкого фумиганта, предложенных в настоящем изобретении. Однако вместо промышленных цилиндров могут быть использованы и стационарные генераторы дициана. К ним относятся такие генераторы, в которых подвергают реакции смесь азота и двуокиси углерода с необязательной рециркуляцией непрореагировавших N2 и СО2, и такие, где используют нагревание углеродной нити в атмосфере азота до температуры около 2200oС. К другим альтернативным источникам дициана относятся газовые цилиндры, содержащие сжатую смесь дициана и двуокиси углерода в присутствии низкого содержания кислорода, а также сорбенты, содержащие дициан, который при необходимости может быть выделен.
Примеры
Для демонстрации эффективности использования дициана (С2N2) в качестве фумиганта были
поставлены многочисленные эксперименты, которые иллюстрируются приводимыми ниже
примерами.
Пример 1
Анализ С2N2 в газовой фазе и жидкостях
Цель. Определить концентрацию С2N2 в воздухе.
Материалы и методы
С2N2 определяют методом газожидкостной хроматографии (ГЖХ) на
газовом хроматографе фирмы Вариан 3300 (Varian), снабженном специфическим
термоионизационным детектором, селективным на определение азота и фосфора. Используют колонки из мегабора с внутренним
диаметром 0,53 мм типа DBwax (J & W 127-7012) при изотермической
температуре 60oС или типа ВР624 (SGE 50QC5/BP624) при изотермической температуре 110oС.
Методика отбора проб на воздухе
Стандартные пробы газа,
определенные по газовому плотномеру Гоу-Мака, разбавляют с методом известных объемов в колбы на 120 мл, снабженные клапаном Мининерт и
содержащие два стеклянных шарика. После встряхивания и
последующего выдерживания в течение часа в хроматограф вводят аликвоты по 20 мкл и регистрируют отклик, строя график в зависимости от
концентрации.
Методика отбора проб в воде и других
растворителях
Воду (10 мл) вносят пипеткой в колбы Эрленмейера известного объема (обычно 11,5 мл), снабженные клапаном
Мининерт, а затем в воду инжектируют с помощью воздухонепроницаемого
шприца известные количества газа, оставляя колбы при 25oС в течение 1 ч. В хроматограф инжектируют аликвоты жидкости (1
мкл) и газа из верхнего свободного пространства (20 мкл) и далее
регистрируют отклик, строя график в зависимости от добавленных концентраций.
Результаты
График зависимости
площади пика (в произвольных единицах) от концентрации С2
N2 представлен на фиг.1 для инжекции в 30 мкл и колонки DBwax. Кривая имеет линейный вид в интервале концентраций 0-35
мг/л, однако ее экстраполяция к более высоким концентрациям приводит к
недооценке полученного отклика. Отношение сигнал-шум при 20 мкг/л (приблизительно 10-3 об.% или 10 ppm) составляет
240. Метод достаточно чувствителен для обнаружения концентрации ниже
величины порогового предела (порогового значения), равного 10-3 об.% (Сакс и Льюис, 1989).
Водные растворы С2N2 также дают линейный отклик в исследуемом интервале концентраций (0-8 мг/л) для инжекций 1мкл на колонках DBwax (фиг.2). В этом случае вода хроматографируется после фумиганта.
Выводы
Измерение С2
N2 как в воде, так и в воздухе не испытывает трудностей и является возможным в области концентраций ниже порогового
значения.
Пример 2
Эффективность С2
N2 в смесях воздуха и двуокиси углерода
Цель. Определить эффективность С2N2 в смесях,
содержащих воздух и двуокись углерода, также возможность последней
оказывать синергический эффект.
Материалы и методы
В мешке Тедлара составляют смесь из двуокиси углерода
(40 об.%) и воздуха и для компенсации сухости источника двуокиси
углерода добавляют воду (10 мкл). Насекомые к этому источнику собирают в склянку Дрекселя и процесс окуривания проводят по методике
пропускания газового потока.
В других экспериментах колбы Эрленмейера (270 мл) продувают смесью двуокиси углерода (40%) в воздухе. Аппарат состоит из мгновенного соединителя с краником для впуска смеси и стеклянным отводным патрубком. После продувки краник закрывают и в выходное отверстие для газа вставляют прокладку для ввода фумиганта, содержащего С2N2, и для отбора пробы для его анализа. В боковое отверстие колб дополнительно вставляют влажную фильтровальную бумажку. Испытания проводят также в колбах с воздухом без добавки двуокиси углерода. Все параметры биотестов, включая дозировки, температуры, интервалы между дозировками и оценка степени поражения были идентичными, с одним лишь отличием в содержании двуокиси углерода в атмосфере камеры окуривания.
Насекомое, подвергаемое испытанию, представляет собой взрослую особь Rhyzopertha dominica (F.), штамм CRD2.
Концентрации фумиганта определяют на газовом хроматографе фирмы Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм.
Результаты
Во время эксперимента в потоке при экспозиции в среде С2N2 в
течение 1 ч при концентрации 0,83 мг/л смертность достигает 100% как при оценке в конце экспозиции, так и
после периода восстановления в 1 неделю. Однако при низких дозах явная острая смертность была
ниже, чем неделю спустя. Экспозиция в течение 45 мин приводит к уровню смертности в 5,4%.
В статических экспериментах смертность после 48-часового периода выдерживания и после 23-часовой экспозиции в среде с концентрацией 0,125 мг/л составила 97% в случае СO2 против 1% для воздуха. Для 2-часовой экспозиции в среде с концентрацией 0,5 мг/л смертность составила 80% в случае С2N2 против 2,5% для воздуха. При этом во всех случаях некоторое количество насекомых после восстановительного периода в 48 ч было поражено и смертность через 2 недели могла быть выше.
Обсуждение
Дициан С2N2 можно
применять в двуокиси углерода либо по методике в потоке, либо в статическом режиме. Показан
синергический эффект с СO2. Совместное применение с CO2 возможно, например, при
способе хранения газа в цилиндрах для облегчения процесса приготовления фумиганта в силосных
башнях, для снижения опасности возгорания и для контроля рН воды в условиях, когда в ней могут
присутствовать бактерии и плесень.
Синергический эффект от присутствия СО2 при увеличенном давлении показан в примере 45.
Пример 3
Анализ остатков
С2N2 путем отбора пробы из свободного пространства над размолотым зерном
Цель. Определить остаточное количество С2N2 по стандартной методике после
окуривания пшеницы и установить вероятное количество фумиганта, которое будет выделяться во время помола
пшеницы.
Материалы и методы
Пробу австралийской стандартной пшеницы
преднамеренно обрабатывают высокой дозой фумиганта путем добавления его в количестве 5 мл к 25 г пшеницы в
сосуде на 120 мл, на который герметично надет клапан Мининерт. Первоначально рассчитанная
концентрация из свободного пространства над зерном составляет 4 об.% (40000 ppm), при этом фумигант применяют
при норме расхода 420 г/г (420 ppm, W/W). После хранения в течение 10 сут при 30oС в герметичном контейнере пшеницу (20 г) немедленно переносят герметичный смеситель и размалывают в течение
20 с. Газ из верхнего пространства (50 мкл) инжектируют в газовый хроматограф.
Вариан 3300 со специфическим термоионизационным детектором с разделением на колонке DBwax с внутренним диаметром 0,53 мм.
Отклик сравнивают с аналогичным сигналом, полученным от цианистого водорода и
дициана (С2N2).
Результаты
На хроматограмме пробы свободного пространства
для обработанной и контрольной пшеницы отмечают два пика, ни один из которых
не соответствует С2N2. Пределы обнаружения таковы, что остатки в пшенице составляют менее 6х10-11г/г на зерно.
Один из пиков получен при совместной хроматографии с цианистым водородом. Уровень измеряемых содержаний соответствует средней величине 5x10-8г/г для контрольной пробы пшеницы и 5,6 x 10-8г/г для обработанной. Расхождение между этими двумя величинами было незначительным.
Пик на хроматограмме, полученный перед C2 N2, не идентифицирован и лишь предназначен для того, чтобы показать, что он имеет более короткое время удерживания, чем фосфин. Исследуемое предположение состоит в том, что этот пик соответствует цианистой кислоте. Если это так, то предполагая тот же сигнал детектора, что и для цианистого водорода, остаточные количества в пробах контрольной и обработанной пшеницы составляют 2х10-8-3x10-8 г/г.
Обсуждение
Методика анализа зерна на определение остатков фумиганта используется достаточно широко: результаты соответствуют данным,
приведенным в примере 26. Другими словами, С2N2 быстро
разлагается на пшенице, находящейся в герметичных контейнерах. Остаток в менее чем 6х10-11г/г от применения дозы
препарата в 420 г/г соответствует огромным потерям, причем такой уровень
потерь никогда не был прежде продемонстрирован для любого инсектицида, использованного для обработки зерна.
Концентрация как С2N2, так и цианистого водорода в герметичном контейнере над молотым зерном в каждом случае была значительно ниже, чем пороговая концентрация, составляющая 10-3 об.%, несмотря на большое количество применяемого дициана. Следовательно, работники мукомольных предприятий не будут подвергаться воздействию неустановленных законом опасных концентраций фумиганта при помоле пшеницы, предварительно обработанной дицианом С2N2 (подчиняясь ограничительным периодам, которые будут определены соответствующими законодательными органами).
Пример 4
Эффективность С2
N2 при борьбе с плесенью
Цель. Определить эффективность С2N2 против
плесени
Материалы и методы
Влажная пшеница
Пшеницу
кондиционируют в среде с 30%-ой влажностью (% вес.) и помещают в колбы на 270 мл в количестве 30 г пшеницы на колбу. Колбы
снабжают прокладками для ввода газа и выдерживают при температуре 30oС, а затем вводят С2N2 в дозируемом количестве 0, 20, 40 и 80 мг/л. Через 24 ч пшеницу удаляют из
колб и помещают в стерильные сосуды, покрытые фильтровальной бумагой.
Каждый эксперимент выполняют четырехкратно.
Плесень, присутствующую на пшенице, идентифицируют по методике автора Dr. Alisa Hocking. CSIRO Division of Food Science and Technology. В процентном отношении зерно было заражено следующим образом: 78% Alternaria infectoria. 17% Alternaria alternata, 4% Epicoccum nigrum и no 1% каждого из Dreschlera sp., Fusarium sp. и Penicillium sp.
Сухая пшеница
Пшеницу с содержанием влаги 11,6% окуривают по методике, описанной в предыдущем разделе. После
24-часовой обработки пшеницу помещают на пищевой агар и
инкубируют при 25oС в течение 7 сут.
Результаты
Влажная пшеница
Пшеница в контрольных сосудах
быстро покрывается плесенью, при этом индивидуальные зерна
слипаются в твердые комки. Ни в одном из обработанных сосудов плесень обнаружена не была. Зерно, прошедшее окуривание, выдерживали в течение
4 недель при 30oС без какого либо появления
плесени.
Сухая пшеница
Пшеница не плесневеет. Образцы на пищевом агаре покрываются плесенью, однако при дозах 20, 40 и
80 мг/л плесень не обнаруживается. Наблюдают рост
плесени при дозе 10 мг/л, но она меньше, чем у контрольных образцов. Плесень, отмеченная у контрольных проб, соответствует Alternaria sp. и
Penicillium sp., которые присутствуют до окуривания, и
поэтому не является случайностью, вызванной условиями опыта.
Обсуждение
Делается ссылка на пример 21. Настоящий пример и
пример 21 являются по существу повторами,
выполненными различными исследователями.
Эти результаты в сочетании с полностью независимыми результатами из примера 21 свидетельствуют о том, что С2N2 является высокоэффективным средством для борьбы с плесенью. Длительный период защиты, обеспечиваемый этим фумигантом, говорит о том, что он убивает споры и оказывает не только фунгистатическое действие.
Потенциальное применение С2N2 для уничтожения плесени достаточно велико. Например, его можно использовать в качестве альтернативного средства при сушке в тех случаях, когда имеют дело с влажным зерном, или когда нужно выдержать зерно в течение некоторого периода времени, чтобы увеличить полезный период действия осушителей. Использование С2N2 для уничтожения плесени уменьшает прорастание зерна, при этом он не предлагается как средство многоцелевого назначения. Однако в настоящее время для борьбы с плесенью кормового зерна широко применяют фунгистатическую пропионовую кислоту, и в таких ситуациях С2N2 смог бы получить потенциальную возможность для применения.
Способность С2N2 к применению в виде раствора и газа открывает возможности для борьбы с плесенью, например, при машинной дезинфекции продуктовых помещений, и, естественно, не только их, но при дезинфекции других построек.
Плесень была уничтожена как в сухой, так и во влажной пшенице. Обычно полагаются на сухость помещения для борьбы с плесенью на сухом зерне, однако в некоторых случаях пространства, склонные к миграции влаги, такие как верхняя часть силосной башни, подвергают окуриванию для уничтожения спор плесени в качестве предупредительной меры. Способность к уничтожению спор плесени при высокой и низкой влажности полезна при дезинфекции от спор в зданиях и на машинном оборудовании.
Уничтожаемая плесень включает представители следующих основных родов: Alternaria, Fusarium, Penicillium, Dreschlera и Coelomycetе.
Способность С2N2 действовать как в паровой, так и в жидкой фазе для дезинфекции плесени на машинном оборудовании и в зданиях, а также проникать в воду чрезвычайно полезна, поскольку отвечает его способности уничтожать бактерии и насекомые. Следовательно, он представляет собой обычный стерилизующий агент. В противоположность дициану этиленоксид плохо растворяется в воде, а формальдегид имеет низкое давление паров. Кроме того, каждый из них является предлагаемым канцерогеном (Сакс и Льюис, 1989). Пороговая концентрация для этиленоксида составлет 0,1 мг/л (0,1 ppm), а для формальдегида - "l мг/л (1 ppm): предлагаемый канцероген" (данные ACGIIH - Американской Конференции гигиенистов промышленных предприятий). Пороговая концентрация для дициана составляет 10 мг/л (10 ppm).
Пример 5
Эффективность С2N2; для сохранения качества мяса.
Цель. Определить эффективность С2N2 для предохранения мяса
Материалы и методы
Свежее (незамороженное) мясо покупают на местных супермаркетах и
нарезают на ломтики. Срезы, которые представляют собой около 20 г печени ягненка, помещают в сосуды на 750 мл, снабженные
крышками с прокладками. После этого вводят С2N2 в
дозируемом количестве, равном 0, 20, 40 и 80 мг/л, и сосуды выдерживают при температуре 37oС в течение 48 ч и
дополнительно при 30oС.
Результаты
Контрольные пробы печени быстро теряют цвет, портясь и приобретая запах в течение нескольких часов, при этом никакого видимого
эффекта в любой из проб печени, прошедшей окуривание в течение 48 ч, не
наблюдается. Изменение цвета отмечают, начиная от 2 суток при окуривании с концентрацией 20 мг/л, и от 3 сут при окуривании с
концентрацией 80 мг/л. Также эффект изменения цвета отсутствует на 8
сутки после окуривания наивысшей дозой испытуемого газа.
Обсуждение
Способность С2N2
уничтожать бактерии, плесень и насекомых в условиях высокой
влажности и быстро разлагаться являются желаемыми характеристиками для хранения мяса. Потенциальная возможность для этой цели у этого газа
велика. Например, мясо можно стерилизовать внутри
пластиковых пакетов, стеклянных контейнеров или в больших емкостей и при этом все бактериальные загрязнения разрушаются. Применение препарата возможно
для обработки помещений для оптовой и розничной
продажи мяса, а также для использования в местах, где отсутствуют холодильники (например, войсковые помещения, туристические домики на колесах и
др.).
Перекрестные ссылки
Перекрестная ссылка делается на примеры 4, 21, 19, 28, 16 и 6.
Пример 6
Эффективность С2N2 для
сохранения качества фруктов
Цель. Определить
эффективность С2N2 для предохранения фруктов и овощей
Материалы и методы
Испытанию подвергают плоды киви,
мандарины и грибы. По паре каждого вида помещают в
стеклянные контейнеры вместимостью 750 мл, снабженные крышками с прокладками, причем каждый вид находится в отдельной камере. В каждый контейнер
вводят фумигант для получения концентраций, равных 0,
10, 20, 40 и 80 мг/л, после чего продукты выдерживают при температуре 37oС в течение 8 суток, а затем удаляют. Качество оценивают
визуально в момент открытия и после 2 суток хранения при
25oС. Каждый опыт дублируют.
Результаты
Необработанные (контрольные) киви становятся мягкими. На 8 и 10
сутки цвет меняется на желто-зеленый, плоды становятся еще
более мягкими и свободная вода изнутри улетучивается. Плоды, обработанные при 10 и 20 мг/л, обнаруживают некоторые из этих изменений, но в
меньшей степени. Плоды, обработанные при 40 мг/л, сохраняют
свой первоначальный цвет и консистенцию. Однако плоды после окуривания при наивысшей дозе фумиганта демонстрируют некоторое побурение.
Плоды, обработанные при каждой из доз, остаются твердыми. Какого-либо другого воздействия на качество продукции не отмечено.
Необработанные мандарины покрываются плесенью. Через 8 и 10 суток свежие цитрусы становятся очень мягкими и уже трудно отделить сегмент как от кожуры, так и от других сегментов плода. На мандаринах, обработанных двумя самыми высокими концентрациями фумиганта, плесень не наблюдается, а качество плодов после обработки двумя более низкими концентрациями было выше, чем у контрольных (необработанных) цитрусов. Однако цвет кожуры меняется при обработке для всех режимов, хотя на цвет мякоти она не влияет. Наименьшее влияние на цвет кожуры наблюдается при дозе фумиганта 40 мг/л.
Необработанные грибы также плесневеют. Через 8 и 10 суток было трудно узнать в остатках темного цвета то, что первоначально было грибами. Продукт, обработанный фумигантом с концентрацией 10 мг/л, напоминает контрольный образец через 8 суток. Обработка при 20 мг/л сохраняет первоначальную форму, но приводит к потере свободной воды, присутствующей в грибах. Продукт, обработанный любой из двух более высоких концентраций фумиганта, сохраняют свой цвет и форму, включая белый цвет шляпки грибов. После окуривания при дозе фумиганта 40 и 80 мг/л видимого образования плесени на обработанных грибах не наблюдается, хотя грибы теряют некоторое количество свободной воды.
Обсуждение
Качество фруктов и овощей ухудшается благодаря действию плесени и бактерий, а также атаке насекомых. В других
примерах было показано, что С2N2 эффективен
против плесени, бактерий и насекомых, а также может быть эффективным в условиях высокой влажности, которая имеет место при хранении
фруктов и овощей. Кроме того, основным метаболитом С2
N2 является щавелевая кислота, которая широко присутствует в растительном мире.
Результаты свидетельствуют о потенциальной возможности применения дициана для хранения фруктов и овощей.
Использование С2N2 для этой цели требует соответствующего контроля применяемой дозы этого фумиганта, причем как низкие, так и избыточные дозы могут нанести вред.
Потенциал применяемого фумиганта огромен и включает расфасованную продукцию в помещениях для оптовой и розничной торговли, обработку фруктов перед отправкой и упаковку для доставки в те места, где охлаждение невозможно (например, кемпинги, армейские подразделения и т.д.).
Перекрестные
ссылки
Читатель отсылается к примерам 4, 21, 19,
28, 33 и 15.
Пример 7
Токсичность С2N2 по отношению к долгоносику бахромчатому в почве и
сорбция дициана на почве.
Цель. Определить эффективность С2N2 в качестве почвенного фумиганта, измерить его сорбцию на почве и провести испытание его эффективности при применении в виде газа и в водном растворе.
Материалы и методы
К изучаемому виду относится долгоносик бахромчатый или Graphognatus leucoloma (Boheman),
который является серьезным почвенным вредителем для пастбищ и некоторых
культур, таких как картофель. Образец почвы был взят с территории западной Австралии, где G. leucoloma считается основным
вредителем. Пробы почвы и насекомые были предоставлены Джоном Матиссоном
(John Mathiesson) из CSIRO Division of Entomology.
Испытания в отсутствие почвы
Для испытаний против
насекомых были взяты 50 личинок, находящихся на первой возрастной стадии,
и помещены в колбы Эрленмейера вместимостью 138,5 мл, снабженные прокладками для ввода газа. Вводят газообразный фумигант и
затем колбы выдерживают при температуре 20oС в течение 24 ч.
Колбы откупоривают и оценивают смертность насекомых после стояния колб в течение ночи. Методика идентична той, что была
использована для оценки эффективности других фумигантов, в частности бромистого
метила и сероуглерода (Mathiesson, Desmarchelier, Vu and Shackleton, неопубликованные результаты).
Концентрации дициана определяют на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором с разделением на колонке DBwax, имеющей внутренний диаметр 0,53 мм. Определение проводят через 1 ч после ввода и за 1 ч до откупоривания колб. Средние значения концентрации представляют в виде таблицы. Величина ее снижается на 12% в течение всего периода измерения, составляющего около 22 ч.
Испытания на почве
При испытании на почве
50 личинок, находящихся на первой возрастной стадии, помещают в герметизированные колбы. Вводят фумигант в виде газа или
водного раствора. После 24-часовой экспозиции, в течение которой измеряют
вводимый фумигант, колбы аэрируют в течение ночи. После флотации личинок в воде с помощью микроскопа подсчитывают количество
живых и мертвых единиц и их смертность в обработанной почве сравнивают с
контрольными насекомыми. Насекомые, способные двигаться, классифицируются как живые.
a) Фумигант, применяемый
в воде
Для испытаний против насекомых в почве колбы
вместимостью 138,5 мл наполняют почвой примерно наполовину (30 г) и в каждую из них помещают 50 личинок, находящихся на первой возрастной
стадии. Фумигант применяют в водном растворе (2 или 4 мл).
б) Фумигант, применяемый в виде газа
Фумигант в виде газа при наполнении колб применяют в том же количестве, что
при использовании его в воде. Колбы имеют вместимость 29,5 мл и
снабжены клапаном Мининерта. Использовано для испытания три типа почв (6,4 г), а именно суглинок Pemberton, торфяник Sadie и песчаная
почва Myaluys.
Результаты
Токсичность в
камерах, свободных от почвы
Токсичность фумиганта, применяемого в виде газа к насекомым в колбах Эрленмейера в отсутствие
почвы, приведена в табл. 1. Полной смертности (100%) достигают для
средних концентраций выше или равных 1,5 мг/л. Ниже этой величины смертность снижается и при концентрации 0,59 мг/л составляет 56%.
Произведение концентрации на время для уничтожения 95% личинок
составляет около 26 мг•ч/л, что слегка ниже значения, полученого для бромистого метила в сравнительных тестах (Mathiesson,
Desmarchelier, Vu and Shackleton, неопубликованные результаты). С2N2 значительно более токсичен против G. leucoloma, чем сероуглерод, который также является фумигантом, широко
используемым для окуривания почвы.
Токсичность на
почве для фумиганта, применяемого в воде
Смертность личинок, находящихся на первой возрастной стадии, после обработки
дицианом (C2N2) на почве иллюстрируется в табл. 2
вместе с применяемым количеством фумиганта и концентрацией C2N2 в свободном пространстве, которая
присутствует через 23 ч после прибавления фумиганта. Полная смертность в данном
случае была достигнута.
Токсичность на почве для фумиганта, прибавляемого в виде газа
Токсичность фумиганта, вводимого в виде газа, иллюстрируется в табл. 3. Для суглинка
Pemberton смертность личинок составляет 100% и усредненная концентрация C2N2 в свободном
пространстве через 23 ч после применения фумиганта составляет 1,11 мг/л. Для песчаной
почвы Myaluys уровень смертности составляет 99% и усредненная концентрация С2N2 в свободном
пространстве через 23 ч после применения фумиганта равна 0,89 мг/л. Для торфяника
смертность личинок оказалась нулевой, а через 23 ч после применения фумиганта его присутствие обнаружено не было.
Обсуждение
Доказана эффективность С2N2
против основного почвенного вредителя. Эффективность подтверждена независимо от того, применяется фумигант в виде
газа или в водном растворе.
Способность дициана к применению на почве очень важна, поскольку окуривание почвы с помощью бромистого метила является основной причиной выделения этого газа в атмосферу.
Пример 8
Применение С2N2 методом воздушного потока
Цель. Определить токсичность непрерывного потока С2N2
в воздухе против насекомых
Методы и материалы
Соединяют
последовательно следующие четыре устройства:
1 - газовый мешок Тедлара емкостью 100 л;
2 - аквариумный
насос;
3 - газовый счетчик/ротаметр;
4 - пучок трубок
(камеры для насекомых), взаимосвязанных посредством насадок Дрекселя и полиэтиленовых соединительных трубок.
Расход воздуха через мешок Тедлара и затем через камеры с насекомыми составляет 50 мл/мин.
Насекомые включают следующие особи: Rhyzopertha dominica (F.), штамм CRD2, Oryzaephilus Surinamensis (L. ), штамм NOS405 и Tribolium castaneum (Herbst), штамм СТС4.
Мешок Тедлара наполняют воздухом и в него инжектируют C2N2 через прокладку для ввода газа, создавая в воздухе некоторую концентрацию (следует отметить, что мешок Тедлара имеет только одно отверстие для заполнения или опорожнения и мембранное уплотнение.
Трубку от газового мешка подсоединяют к входу насоса, а выход насоса соединяют со входом ротаметра. Выход ротаметра, в свою очередь, соединяют с пучком трубок. Последняя трубка сообщается с наружной атмосферой.
Опыты проводят при комнатной температуре (22-25oС). В конце периода экспозиции камеры с насекомыми отсоединяют и сначала немедленно оценивают уровень смертности (так называемую "острую" смертность), а затем через определенное время (период выдержки) при 30oС в течение 1 недели производят аналогичную оценку смертности на пшенице.
Концентрацию фумиганта определяют методом газовой хроматографии на хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм.
Концентрации, используемые для расчета доз, представляют собой измеренные концентрации.
Результаты
Результаты приведены в табл. 4. Фумигант эффективен
для уничтожения насекомых методом обработки в потоке, благодаря
которому его применяют в режиме воздушного потока, который сообщается с атмосферой.
Обсуждение
Методику
применения токсичных газов в воздушном потоке, который сообщается с
атмосферой, используют для обработки зерна посредством аммиака и фосфина. Такую методику в режиме медленного газового потока можно
также применить и в случае дициана С2N2.
Пример 9
Эффективность С2N2 против мушек psocids (Pscoptera)
Цель. Оценить
токсичность С2N2 против мушек Psocids
Материалы и методы
Испытанию подвергают два вида мушек: Liposcelis bostrichophila (Badonel) и Liposcelis entomophila
(Enderlein). Первый вид является партеногенетическим, его получают из
зоны заражения в доме из провинции Канберра. Вид L. entomophila является половым, его получают из промышленного хранилища для
пшеницы в западной Австралии.
Насекомых снимают с помощью полосок фильтровальной бумаги в маленькие кристаллизаторы, затем подсчитывают их количество по мере того, как их помешают в испытательные камеры. Камеры представляют собой колбы Эрленмейера вместимостью 11,5 мл, снабженные клапаном Мининерт для ввода газа и отбора проб.
В других экспериментах насекомых помещают на бумаге в камеры, которые затем окуривают. Эти опыты проводят, поскольку мушки psocids являются не только вредителями зерновых хранилищ и жилых домов, а также паразитами, которые разводятся в библиотеках, музеях и т.д., так как в общем их именуют как "книжная тля".
До введения насекомых и герметизации колб на их внутреннюю поверхность добавляют несколько капель воды.
Результаты
Уровень смертности L.
bostrichophila показан в табл. 5. Быстрое полное (100%) уничтожение насекомых достигается при очень низких значениях произведения (СхТ),
составляющих 0,25 мг•ч/л.
Часовая экспозиция в концентрации, равной 0,25 мг/л, приводит к уничтожению 95% взрослых насекомых L.entomophi1а и 100%-ого уничтожения достигают здесь при часовой экспозиции для концентрации, составляющей 0, 5 мг/л.
В то же время двухчасовая экспозиция при концентрации, равной 0,5 мг/л, приводит к уничтожению L. bostrlchophila на бумаге, причем день спустя при конечном подсчете в конце экспозиции взрослая смертность этого вида достигает 100%. При конечном подсчете смертность в контрольной группе составила 12%.
Как показывает оценка уровня смертности в конце экспозиции, при выдерживании в течение 1 ч для каждой из концентраций 0,5, 1,0 и 1,5 мг/л наблюдается 100%-ная взрослая смертность для L. entomophila.
Обсуждение
Фумигант
С2N2 является эффективным средством для уничтожения мушек psoсids во многих ситуациях, например при наличии пустых
пространств и помещений, где находится бумага. Следовательно,
дициан может быть эффективным в публичных зданиях, библиотеках, музеях, помещениях, где находятся гербарии т. д., а также там, где
производится хранение длительных или скоропортящихся продуктов.
Мушки psoсids предпочитают высокие влажности и способность С2N2 действовать в таких условиях является ценным
качеством.
Пример 10
Применение С2N2 при рециркуляции и действие на насекомых.
Цель. Определить способность С2N2 применяться в системе рецилькуляции, а также обладает ли дициан более высокой токсичностью против насекомых при применении в непрерывном потоке газа по сравнению с использованием его в статическом режиме.
Материалы и методы
Установленная
система рециркуляции включает насос, газовый резервуар (стеклянный сосуд вместимостью 20 л, снабженный магнитной мешалкой), мембрана
для ввода фумиганта и для отбора газовых проб определяемой
концентрации и 6 трубок Дрекселя, каждая емкостью 20 мл. Насекомых (20 взрослых особей) помещают в каждую трубку и в систему инжектируют
фумигант при работающем насосе. После того, как с помощью
рециркуляции достигают усредненной концентрации в системе, три из шести камер с насекомыми отсоединяют и немедленно закупоривают. Оставшиеся
три камеры оставляют в режиме рециркуляции. Отсоединенные
камеры выдерживают в статических условиях и подвергают воздействию рециркуляционного газа заданной концентрации, дозируемой в равные
промежутки времени при одинаковой температуре (22-24o
С).
Насекомые включают следующие взрослые особи: Rhyzopertha dominica (F.), штамм CRD2 и Tribolium castaneum (Herbst), штамм CTC4.
Уровень смертности оценивают в конце периода экспозиции, получая показатель "острой" смертности, и через 2 недели после периода выдержки на пшенице при температуре 30oС, влажности 55%, получая показатель "конечной" смертности. Насекомые классифицируются как мертвые, если они не оказывают признаков жизни (движения) при любом описании.
Результаты и обсуждение
Результаты представлены в
табл. 6. Уровень смертности выше в камерах, дозируемых в режиме потока для каждого вида насекомых. Расхождение между результатами,
достигнутыми в режиме рециркуляции и при статической экспозиции,
было, однако, невелико.
Обсуждение
Фумигант С2N2 можно применять в условиях
рециркуляции. Результаты показывают, что он распределяется в потоке воздуха
и токсичен, независимо от того, прекращают принудительную рециркуляцию, или нет. Следовательно, рециркуляция, непрерывная
или периодическая, увеличивает возможности для борьбы с насекомыми и другими
вредителями. Токсическая концентрация при 22-часовой экспозиции против R. dominica соответствует низкому значению, равному
0,04 мг/л (около 20 ppm). Это лишь в два раза превышает пороговое значение
для рабочей экспозиции. Таким образом, соотношение между токсической дозой для насекомых и пороговой концентрацией оказалось
неожиданно малым.
Пример 11
Влияние влажности на
токсичность С2N2 по отношению к насекомым
Цели.
1. Определить влияние относительной влажности на токсичность C2N2 по отношению к насекомым.
2. Отметить токсичность С2N2 в водном растворе, а также в газообразном виде.
Материалы и методы
Метод 1
В колбах
на 275 мл до введения насекомых создают различные уровни влажности. После этого колбы герметизируют с помощью
мембраны для впуска газа и дозируют идентичные количества С2N2.
Токсичность определяют в идентичных условиях (времени экспозиции, температуре и т.д.) с одной лишь переменной,
которая представляет собой относительную влажность в колбах.
Опыты проводят при трех значениях влажности. По одной из методик колбы оставляют в комнате с 30%-ной, а по второй - с 60%-ной влажностью. По третьей методике кусочек влажной фильтровальной бумаги (Ватман No.l) прикрепляют к боковой стенке колбы таким образом, чтобы видимую воду можно было наблюдать в течение всего эксперимента, но насекомые не контактировали с водой.
Метод 2
По этому методу С2N2; применяют к насекомым на пшенице (20 г), вводя его двумя способами.
Образцы находятся в колбах Эрленмейера на 270 мл, которые предварительно выдерживают
открытыми на воздухе в комнате. По одному способу фумигант применяют в виде газа, по другому - в виде водного
раствора (0,1 мл). Все биологические условия, кроме способа применения, были
идентичными.
Количество применяемого фумиганта определяют на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм.
В качестве исследуемого насекомого используют Rhyzopertha dominica, штамм CRD2. Смертность оценивают после двухнедельной экспозиции на муке при 30oС по методу 1 и через 1 неделю по методу 2.
Результаты
Метод 1
Влияние влажности
на токсичность С2N2 по отношению к взрослым R.
dominica показано в табл. 7. Токсичность увеличивается при более высоких значениях влажности. Этот эффект наблюдают в широком
интервале концентраций и времени экспозиции.
Метод 2
Эффект способа применения показан в табл. 8. Фумигант токсичен, независимо от того, применяют его в виде газа или в
растворе.
Обсуждение
Усиление активности фумиганта
при более высоких значениях влажности представляет собой неожиданный эффект, в особенности это касается величины этого
эффекта. Высокие относительные влажности оказывают синергический эффект на
фумигант, причем в качестве синергиста можно рассматривать воду.
Способность фумиганта к применению как в виде газа, так и в виде водного раствора не была ранее известна. Это частично оказывает влияние на растворимость фумиганта в воде. Она высока и справочник Merck Index говорит о том, что 1 объем воды растворяет приблизительно 4 объема газа. Это обычно создает концентрацию С2N2 в воде около 8 мг/л. Насыщенный раствор соответствует концентрации приблизительно в 0,15М. Токсичность С2N2 в воде, кроме того, частично зависит от того факта, что газ проявляет токсичность при высокой влажности. Это имеет место, поскольку применение в воде, как правило, имеет эффект возрастания относительной влажности.
Таким образом, имеется два неожиданных эффекта, а именно, усиление активности фумиганта в присутствии воды и способность его к применению в воде.
Первый эффект полезен при использовании в ряде мест, в особенности там, где относительная влажность высока, куда относятся теплицы, закрытые участки, содержащие овощи и срезанные цветы, зоны тропического климата и другие области с высокой влажностью.
Способность к применению фумиганта в водном растворе полезна для многих мест. Например, его можно наносить распылением на продукты долговременного и непродолжительного хранения, растения, стерилизационные камеры и пустые помещения. Он дает возможность применять его посредством насосов при больших расходах или с помощью шприцев при малых количествах, либо другими способами, где объем жидкости можно точно измерить, исходя из измеренного объема газа, что представляет собой более сложную процедуру.
Высокая растворимость С2N2 в воде, кроме того, облегчает его количественное определение химическими методами, поскольку не требует применения дорогостоящего оборудования, такого как газовый хроматограф.
Пример 12
Токсичность С2N2 против Bactocera (прежде Dacus) tyroni (Froggart)
Цель.
Определить летальные дозы С2N2 против Bactocera Tyroni (Froggart) (дрозофипы Queensland)
Метод и материалы
Ранние личинки (20) помещают на влажную полоску
фильтровальной бумаги с подложкой из перспекса.
Эту полоску помещают в колбу Эрленмейера, закрытую герметично притертой стеклянной крышкой с мембраной, через которую производят впуск газообразного
С2N2. После экспозиции
крышку удаляют и колбу продувают потоком воздуха в течение 30 с, а затем оставляют на воздухе на 30 мин перед уплотнением с помощью бумаги.
Результаты
Результаты
представлены в табл. 9. Полного уничтожения насекомых достигают при дозе 1,5 мг/л, подаваемой в течение 2 ч. Величина произведения (СхТ) была низкой и составила 3
мг•ч/л.
Обсуждение
Дрозофила Queensland является особым вредителем фруктовых садов и подвергается карантину в Австралии и во многих странах-импортерах фруктов. Она,
кроме того, является
представителем двукрылых насекомых (Diptera). Полученные результаты также демонстрируют эффективность С2N2 в среде с высокой влажностью.
Перекрестные ссылки делаются на пример 11, где описаны дополнительные данные и результаты применения С2N2 в виде жидкости.
Пример 13
Удаление С2N2 из
газовых потоков
Цель. Определить методики для удаления С2N2 из газовых потоков.
Материалы и методы
Установка включает
3-горлую колбу (500 мл);
одна горловина снабжена мембраной для ввода фумиганта, другая соединена с источником газа, например азота, третья (для отсоса фумиганта) соединена со стеклянной трубкой
внутреннего диаметра 6 мм с
мембраной для отбора проб, установленной перед ловушкой (мембрана для ввода газа), ловушку и вторую мембрану для отбора проб, установленную после ловушки (мембрана для
выхода газа).
Испытуемые ловушки представляют собой стеклянные трубки с внутренним диаметром 6 мм, заполненные гранулированным активированным (древесным) углем на длину 157 мм и 530 мм, 5%-ный водный раствор этаноламина, небольшая ловушка только из древесного угля (55 мм), окруженная сухим льдом, и собственно сухой лед без какого-либо химического поглотителя. Для ловушки в виде сухого льда выходящий газ направляют в склянку Дрекселя, также окруженную сухим льдом с установлеными на входе и выходе мембранами для отбора проб.
Небольшое количество фумиганта (0,5 мл, около 1 мг) инжектируют в 3-горлую колбу. Пробы газа (50 мкл) отбирают через входную мембрану и вводят в газовый хроматограф. Аналогичную методику используют для проб, отбираемых через выходную мембрану. Концентрацию фумиганта определяют на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм.
Результаты
Для ловушки длиной 157 мм (см. фиг.3 - С2N2, улавливаемый на короткой стеклянной колонке, заполненной гранулированным древесным углем) небольшое
количество
фумиганта обнаруживают в точке отбора пробы на выходе. Эта небольшая ловушка поглощает большинство, но не все количество фумиганта. Ловушка большей длины (530 мм) поглощает весь фумигант
(см. фиг.4
- С2N2, улавливаемый на длинной стеклянной колонке, заполненной гранулированным древесным углем). Раствор этаноламина в воде также является полностью эффективным
поглотителем
(см. фиг.5-С2N2, улавливаемый 5%-ным по объему раствором этаноламина в воде). Для этого поглотителя, как и в случае с угольной ловушкой большой длины, фумигант не
обнаруживают
даже при продолжительной продувке. Ловушка из сухого льда полностью эффективна при продолжительности ее действия 150 мин. При удалении сухого льда система не поглощает фумигант (см. фиг.
6 - С2N2, улавливаемый сухим льдом в отсутствие химического поглотителя). Маленькая ловушка из активированного угля с сухим льдом также обладает полной эффективностью даже после
удаления
сухого льда (см. фиг. - С2N2, улавливаемый на маленькой колонке из активированного угля, окруженной сухим льдом). Однако после удаления сухого льда и системы впуска газа
некоторое количество фумиганта перешло из ловушки именно к входной, а не выходной точке отбора пробы.
Обсуждение
Полученные результаты по оценке поглощения фумиганта не
являются неожиданными и полностью соответствуют его известным свойствам. Таким образом, следует ожидать, что этот газ способен к улавливанию обычным способом при температуре ниже его точки кипения,
причем известно, что С2N2 быстро реагирует с аминами (в данном случае с этаноламином) таким образом, что химическое вещество при этом быстро разлагается. Кроме того, улавливание
на активированном (древесном) угле является обычной процедурой и, как обстоит дело в случае сорбции, такой параметр, как количество сорбента, должен быть откорректирован в соответствии с условиями,
которые обусловлены скоростью потока, количеством фумиганта и др. Однако весьма полезно обладать возможностью улавливать фумигант в газовом потоке и при этом производить это таким образом, чтобы либо
способствовать его разложению, либо обеспечить возможность его рекуперации, в зависимости от того, что является предпочтительным.
Перечень применяемых ловушек не является исчерпывающим, а сама по себе методика улавливания не обладает новизной, чтобы быть заявленной в настоящем изобретении. Способность к улавливанию является частью упаковки.
Пример
14
Методы удаления С2N2 из воздуха или из водных и других растворов после окуривания помимо способов, включающих удаление воздуха и воды
Цель. Обеспечить
быстрые и безопасные методы удаления С2N2 из воздуха или жидкостей методами, отличными от обычной вентиляции или проветривания.
Материалы и методы
Фумигант помещают в герметичные колбы, подобно тем, что снабжены клапанами Мининерт, или колбам Эрленмейера с мембранами для впуска газа. В эти колбы вносят обычные бытовые химические реактивы, такие
как раствор аммиака, этиловый спирт или отбеливатель (перекись водорода). Разложение фумиганта измеряют во времени.
В альтернативных экспериментах растворы аминов в воде (20 мл) помещают в колбы на 270 мл, снабженные мембраной для впуска газа и магнитной мешалкой. Фумигант инжектируют через мембрану и регистрируют его разложение. Все измерения проводят на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм.
Результаты
Исчезновение фумиганта
из свободного
пространства иллюстрирует фиг.8, на которой представлен график зависимости концентрации фумиганта от времени после дозирования. На фиг.9 эти потери представлены в виде графика, который
соответствует
реакции разложения первого порядка (Уравнение 1). На вертикальной оси отмечены величины логарифмов отношения концентрации С в момент времени t к начальной концентрации Сo.
Истощение
охватывает интервал величины е7 (приблизительно 1000).
Добавление 0,5 мл водного аммиака (31% объемн.) к С2N2 при концентрации 11,6 мг/л приводит к быстрой потере фумиганта. Концентрация С как доля применяемой концентрации С* экспоненциально снижается со временем t (мин) в соответствиии с уравнением 1, причем величина r2 составляет 0, 9966. Полупериод данной реакции, то есть время протекания химической реакции первого порядка, за которое начальная концентрация реагирующего вещества уменьшается вдвое, составляет 59 сек. Концентрация С2N2 падает ниже порогового значения, равного 10-3% 10 ppm (V/V) через 11 мин.
1n (C/C0) - 4,4 - 0,699t Уравнение 1
Добавление
газообразного С2N2 (5 мл) в колбу на 120 мл, содержащую 25 мл 0,4М раствора бензиламина в метаноле, сопровождается очень быстрой потерей фумиганта, которое
составляет более 99%
от его прежней потери. Проведение измерения возможно в течение 15 секунд. Концентрация газа в течение 8 минут снижается от 40000 ppm no объему (или 4%) (теоретически применяемое
количество) до
величины, меньшей, чем пороговая концентрация, которая составляет 10 ppm (10-3%)Концентрация газа над 0,2М раствором карбоната натрия (стиральная сода) снижается на ту же
величину в течение
26 мин.
Когда концентрация в верхнем свободном пространстве снижается до величины ниже порогового значения, концентрация газа в жидкости не поддается обнаружению. Следовательно, быстрое исчезновение газа из верхнего свободного пространства колбы обусловлено разложением, а не только абсорбцией.
Добавление 5 мл перекиси водорода в воде (3 об.%) в колбу на 270 мл, содержащую 2960 ppm (около 0,3%) цианистого водорода, приводит к быстрой его потере в верхнем свободном пространстве колбы. Разложение примерно протекает по экспоненциальной кривой с полупериодом реакции в 1,8 мин. Концентрация падает ниже порогового значения, которое составляет 10 ppm (10-3%)через 14,2 мин. Концентрация С2N2 над перекисью водорода была относительно стабильной.
Обсуждение
Взаимодействие С2N2 с аминами было хорошо изучено с точки зрения образующихся продуктов реакции
(Бразертон и Линн,
1959). Но даже в этом случае наблюдаемая скорость реакции была удивительной. Новизна этой методики состоит в ее использовании как части общей процедуры, то есть фумигант можно
вводить и поддерживать в
закрытой камере, но концентрация его быстро падает благодаря добавлению такого химического соединения, как аммиак. Таким образом, С2N2 можно устранить
не только улавливанием (см.
пример 13), но также путем добавления обычных химических веществ, которые удаляют его из закрытых пространств без необходимости проведения вентиляции.
Быстрое разложение С2 N2 в газовой фазе путем взаимодействия с раствором амина было также продемонстрировано в разделе по удалению С2N2 из газовых потоков. Там было показано, что простая процедура пробулькивания газа через водный раствор этаноламина разлагает фумигант (см. пример 13).
Методика обладает возможностью применения в различных областях. Например, ее можно использовать для приведения в безопасное состояние для людей закрытых помещений после окончания окуривания, а также в больших и малых камерах окуривания, в стеклянных теплицах или других помещениях, где желательно быстро снизить содержание С2N2.
Способность быстро разлагать фумигант определенной концентрации способом, отличным от обычной ловушки и добавки таких известных химических веществ, как аммиак, является новым свойством, ранее не используемым для других фумигантов, хотя такие фумиганты разлагаются с помощью более сложных методик. Практически осуществимо разложение цианистого водорода аналогичными методами, однако не существует простого способа с использованием бытовых химических веществ для разрушения таких фумигантов, как бромистый метил или фосфин. Использование комбинации реагентов, таких как стиральная сода и перекись, удаляет и разлагает как дициан, так и любой фумигант, содержащий цианистый водород.
Пример 15
Химия пиниана и его возможных метаболитов
Обзор химии дициана был сделан Бразертоном и Линном в 1959 году. Ряд описанных ими реакций,
т.е. тех, которые протекают при высокой температуре,
почти не имеет прямого отношения к метаболизму, который существует в зерне или в организме млекопитающих. Однако некоторые реакции протекают при
комнатной температуре в воде или в смешивающихся в ней
растворителях, таких как этанол.
1. Процессы, возможно, относящиеся к метаболизму в зерне
Основная реакция
представляет собой присоединение по тройной CN-связи. Это приводит
к производному формулы I. Второе присоединение дает производное формулы II. Соединения, которые реагируют с дицианом, включают
первичные и вторичные амины, спирты, атомы активного водорода (например,
смежные с карбонильной или сложноэфирной группой) и альдегиды с α-атомом водорода, т. е. те, которые реагируют в
енольной форме.
NC-C(R)=NH (I)
HN=C(R)-(CR)=NH (II)
Можно ожидать, что соединения формулы I и II с радикалом R, образованным из амина, спирта или активного углерода
способны к дополнительному биоразложению. Промежуточные соединения (I)
расщепляются на HCN и одно углеродное звено (производные формиата) и это происходит в разбавленном растворе гидроокиси натрия
(Науманн, 1910)(Naumann). Промежуточные соединения (II), возможно,
окисляются до двух углеродных звеньев (производные оксалата).
Данные Матисона (Matheson) говорят о том, что в дополнение к более сложному соединению, азульминовой кислоте, дициан постепенно разлагается при стоянии до смеси оксалата аммония, формиата аммония, цианистого водорода и мочевины. Справочник Merck Index (1989) свидетельствует о том, что он медленно гидролизуется в водном растворе до щавелевой кислоты и аммиака. Таким образом, в воде разложение сопровождается как по пути образования формиата, так и оксалата, причем последний является доминирующим. Муравьиная и щавелевая кислоты являются широко распространенными природными составляющими. Например, щавелевая кислота входит в состав обычной мочи, причем среднее количество ее, выделяемое человеком с мочой, составляет 20-50 мг/сут (Осер, 1966) (Oser), хотя при некоторых заболеваниях (оксалурия) ее количество может возрастать. Муравьиная кислота также присутствует в моче (Осер, 1966), а также в сухих фруктах и зерне в количестве до 0,1% (неопубликованные результаты лаборатории авторов изобретения). Щавелевая кислота присутствует в большинстве зеленых овощей, особенно в шпинате (0,0-0,9%) и листьях ревеня (1,2%).
Метаболизм дициана в зерне должен быть окончательно изучен с помощью меченых материалов. Однако, возможно, что соединения формулы (I) и (II) будут образовываться вместе с продуктами их дополнительного разложения. Количество образующегося цианида будет свидетельствовать об объеме продуктов метаболизма, протекающему по формиатному пути, при этом его можно измерить с помощью стандартных методик.
2. Процессы, относящиеся к стабильности при транспортировке и хранении
Стабильность дициана была изучена Велчером с сотрудниками (1957) (Welcher
et a1.), которые сделали вывод о том, что дициан быстро не разлагается и не полимеризуется при умеренных температурах и
его можно безопасно хранить в цилиндрах из монеля (сплав) или нержавеющей стали
в отсутствие стабилизатора. Спецификация, составленная Матисоном по дициану, определяет, что эмалированное оборудование
подходит для транспортировки или
химической переработки дициана, как и
нержавеющая сталь, монель и инконель, до температур 65oС.
Отгрузка цилиндров с дицианом одобрена в США при нанесении на них соответствующей маркировки (см. пример 23).
Дициан обладает большим количеством латентной энергии (такого же порядка, что и ацетилен) и способен реагировать со взрывом при смешении с окислителями, такими как фтор.
Согласно спецификации Матисона, воспламеняемость дициана на воздухе составляет 6-32% (объемн.)(Сакс и Льюис, 1989).
Перекрестные ссылки
Исследования in vitro были проведены
для бензиламина и дициана (пример 37), которые показали, что "модельный" амин разлагает дициан, сам при этом
не подвергаясь разложению. Другими словами, он действует как катализатор. Исследования на
пробах зерна при высоких дозах показали, что разложение С2N2; до цианистого водорода
является второстепенным метаболическим путем (примеры 3 и 38).
Пример 16
Сорбция С2N2 на пшенице и стабильность в герметичных стеклянных контейнерах
Цель. Определить сорбцию С2N2 на пшенице в условиях, принимаемых
для изучения жизнеспособности, в некоторых исследованиях по токсичности к насекомым и в некоторых
исследованиях по метаболическому пути остатков, определяемых в полностью герметизированных
системах.
Материалы и методы
Образец австралийской стандартной белой пшеницы (20
г) с содержанием влаги 11,6% помещают в колбу Эрленмейера, снабженную мембраной. Фумигант
вводят в рабочую колбу и эквивалентную контрольную, не содержащую пшеницы. Эту пустую колбу используют для
расчета применяемой концентрации С0. В течение 110 ч с интервалами измеряют
концентрацию С2N2 в верхнем свободном пространстве колбы. Концентрацию фумиганта
определяют на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором
после разделения на колонке ВР-624 с внутренним диаметром 0,53 мм.
Применяемую концентрацию измеряют для каждого заданного интервала отбора проб и полученные значения сравнивают с концентрацией эквивалентного стандарта, приготовленного для каждого заданного интервала.
Строят график зависимости концентрации в верхнем свободном пространстве от времени отбора пробы; отмечаемые концентрационные потери и есть выражение величины сорбции.
Результаты
Разложение фумиганта в верхнем свободном пространстве показано на фиг. 10а, где она
выражается в виде отношения применяемых концентраций. Кривая демонстрирует типичную картину
быстрого начального падения концентрации в верхнем свободном пространстве с последующим разложением продукта,
которое протекает приблизительно по экспоненциальному закону (фиг. 10b). В этом
"экспоненциальном" разложении полупериод реакции, то есть время, за которое начальная концентрация уменьшается вдвое,
составляет примерно 43 ч.
Контрольная проба показала отсутствие фумиганта в течение периода, превышающего 100 ч. Таким образом, С2N2 стабилен в воздухе в герметичных стеклянных контейнерах.
Обсуждение
Характер
сорбции (то есть концентрационные потери в верхнем свободном пространстве) не является необычным для фумиганта.
Рассчитанную дозу можно откорректировать при желании с учетом пространства, занимаемого
пшеницей. Это бы дало эффект увеличения концентрации С0 на 3,7% и эффект постоянства без какого-либо
влияния на полупериод реакции.
Стабильность С2N2 в воздухе в указанных условиях является благоприятным результатом. Этот факт, конечно, облегчает экспериментальные процедуры, включая и изучение токсичности или определение остатков. Стабильность в воздухе в герметичных стеклянных контейнерах, кроме того, оправдывает выводы от том, что сорбция на пшенице обусловлена самим продуктом, а не утечкой газа и разложением на стекле.
Стабильность фумиганта в контролируемых условиях обладает возможностью применения для специализированных методов окуривания. Таким методом является, например, стерилизация, которая требует длительной экспозиции. В тех местах, где происходит разложение фумиганта, продолжительной экспозиции достигают посредством метода окуривания в потоке или путем рециркуляции в присутствии фумиганта, добавляемого для того, чтобы поддержать соответствующую или желаемую концентрацию. В других случаях стабильность фумиганта в воздухе может быть полезным инструментом для процесса окуривания, сохранения стерильности и т.д.
Другие сорбционные исследования проведены для пшеницы (пример 26), почвы (пример 42) и древесины (пример 33).
Стабильность С2N2 в воздухе в герметичном стеклянном контейнере не имеет прямого отношения к его стабильности в атмосфере из-за присутствия других химических веществ, включая воду, в атмосфере, солнечного света и других факторов.
Пример 17
Водный С2N2 как протрава для уничтожения заражения, вызываемого насекомыми на растениях
Цель. Оценить
эффективность С2N2 при использовании в качестве протравы для
уничтожения насекомых на растениях
Материалы и методы
Два типа горшечных растений, зараженных
природными насекомыми-вредителями, были получены из местного питомника: плющ Германский
(German Ivy)(Senecio mikanoides)(GI), зараженный тлей (семейство Aphididae) и мучнистым червецом (семейство
Pseudococcidae), и China Doll (Radermachia sinica)(CD), зараженная мучнистым червецом.
Растения нарезают на короткие кусочки (длиной примерно 5 см) таким образом, чтобы каждый из них содержал
представительную пробу насекомых, и после этого погружают в растворы чистой водопроводной воды,
водопроводной воды с дицианом, водопроводной воды, содержащей смачивающий агент общего назначения и
водопроводной воды, содержащей и смачивающий агент и дициан.
Смертность насекомых оценивают через 2 ч следующим образом. Мучнистый червец тщательно удаляют тонкой щеткой и регистрируют у этих насекомых движение лапок, а для тли отмечают просто наличие их движения, отсуствие которого свидетельствует о летальном исходе.
Применяемый смачивающий агент представляет собой продукт Teric 215 (фирма Ай-Си-Ай, Австралия) с нормой расхода 1 мл на 400 мл водопроводной воды. Растворы дициана готовят пропусканием 4 мл газообразного С2N2 с концентрацией около 80% в 40 мл воды или в раствор смачивающего агента в воде в сосуде (вместимостью около 130 мл) с последующим энергичным встряхиванием в течение 2 мин.
Результаты
Растения не обнаруживают наличия какого-либо болезнетворного эффекта,
обусловленного различной обработкой. Насекомые-представители этих двух основных отрядов были уничтожены.
Смертность в воде в присутствии или в отсутствие смачивающего агента равнялась нулю. (см.
табл.10)
Обсуждение
Водные растворы, содержащие С2N2, обладают
возможностью для использования в качестве протравы для уничтожения насекомых на растениях.
Требуемая концентрация для этой цели еще не установлена, но она несомненно будет изменяться в зависимости от
объема зоны заражения и количества насекомых, подлежащих уничтожению. Кроме того, очевидно,
что применение смачивающего агента усиливает эффективность С2N2 как инсектицидной
протравы. Перекрестная ссылка делается для борьбы с другими насекомыми (например, пример 36) и
для фумиганта, применяемого в воде (например, пример 7). Фумигант уничтожает насекомых из семейства
Aphididae и Pseudococcidae.
Пример 18
Влияние С2N2
на всхожесть пшеницы и на липидный состав
Цель. Оценить влияние С2N2
на жизнеспособность пшеницы и на ее липидный состав.
Материалы и методы
Используют свободные от инсектицида образцы австралийской стандартной белой пшеницы (Australian
Standard White)(ASW) с содержанием влаги около 11,4 об.%. в расчете на воду. Порции пшеницы
кондиционируют для приведения в равновесие после добавления соответствующего количества воды. Через неделю
выдержки при температуре 25±1oС устанавливают, что пробы содержат влагу в
количестве 11,4, 13,8 и 15,5% с соответствующей равновесной относительной влажностью (р.о.в.)(e.r.h.),
равной 46,9, 69,3 и 79,6%. Содержание влаги (в расчете на воду) определяют, исходя из массовых
потерь для размолотых проб при сушке в печи в течение 2 ч при температуре 130oС. Величину
р.о.в. рассчитывают из измеренной равновесной точки росы, отмечаемой на зеркальном
температурно-конденсационном влагомере, установленном в замкнутой петле с образцом пшеницы массой 1 кг.
Кондиционированные образцы пшеницы (30 г) помещают в колбы Эрленмейера на 270 мл (заполненные примерно на 10% по объему), снабженные мембранами для впуска газа. Фумигант инжектируют в свободное пространство колб в режиме пяти концентраций (5, 10, 20, 40 и 80 мг/л) при использовании также и контрольной пробы. Такой режим инжекции применяют для каждой из четырех образцов пшеницы с различным содержанием влаги при трех периодах экспозиции (24, 48 и 96 ч) при температуре 25±1oС. Перед прорастанием пшеницу переносят в чашки Петри и оставляют на воздухе в течение 24 ч.
Испытания на всхожесть проводят в соответствии с методикой, приведенной в руководстве "Методы Международной ассоциации по испытанию семян" (International Seed Testing Association Methods). Пятьдесят семян насыщают с помощью примерно 40 мл дистиллированной воды и заворачивают в 2 скрученных куска крепированной фильтровальной бумаги (размером 500х300 мм каждый). Семена размещают на расстоянии 3 см на верхней половины листа (т.е. на площади 250х330 мм), используя доску для подсчета семян, и этот участок закрывают путем складывания над ними нижней половины. Каждый двойной лист насыщают водой и неплотно свертывают от одной стороны к другой перпендикулярно к основанию. После этого закрепляют вместе с помощью резинки и размещают в вертикальном положении в герминативной камере при 20oС. Число проросших семян подсчитывают через 4 суток (тест на мощность проростков) и через 8 суток (общий тест на всхожесть). Каждый эксперимент повторяют 4 раза.
Чтобы измерить влияние С2N2 на липидный состав, 40 г австралийской стандартной белой пшеницы (Australian Standard White)(ASW) с содержанием влаги около 11, 4% объемн. (в расчете на воду) окуривают дицианом с концентрацией 100 мг/л в течение 48 ч в стеклянном сосуде на 750 мл с нарезной крышкой, снабженной мембраной. Липиды экстрагируют смесью петролейного эфира и бутанола в соотношении 2:1 (по объему) или бутанолом, насыщенным горячей водой. Кроме того, липиды экстрагировали из пшеницы по методу Сокслета с помощью гексана и промышленное масло, полученное из зародышей (семян) пшеницы, обрабатывали С2 N2 при очень высоких концентрациях, а затем 1 г полученного масла окуривали фумигантом (100 мг/л) в колбе Эрленмейера на 270 мл в течение 48 ч при 20 и 30oС. Липидный состав определяют как посредством УФ-спектроскопии, так и методом ИК-спектроскопии с преобразованием Фурье. При УФ-методе поглощение измеряют при 340 нм, а в случае ИК-спектров, снимаемых в четыреххлористом углероде, охватывающем интервал волновых чисел 1000-4000, количественные определения проводят при волновых числах, равных 1740, 2850, 2930 и 3000.
Результаты
Влияние С2N2 на мощность проростков иллюстрирует фиг.11. Эффект влияния для концентрации 5 мг/л не
наблюдается. Эта величина соответствует норме расхода фумиганта, равной 45 мг/кг пшеницы.
Имеет место слабое уменьшение прорастания при более высокой концентрации (10 мг/л), хотя этот эффект был
отмечен только для одного из трех значений исследуемой влажности.
Влияние С2N2 на всхожесть пшеницы иллюстрирует фиг.12. Эффект влияния для концентрации 10 мг/л не наблюдается. Эта величина соответствует норме расхода фумиганта, равной 90 мг/кг пшеницы. Концентрация, равная 40 мг/л или выше (180 мг/кг) заметно ухудшает всхожесть пшеницы.
Результаты, представленные на фиг.11 и 12, обнаружили две неожиданные особенности. Во-первых, увеличение времени экспозиции с 24 ч до 48 или 96 ч почти не оказывает влияние на всхожесть; во-вторых, влияние содержания влаги на потери при прорастании противоречат ожидаемым результатам в том, что оно оказалось меньшим для влажного, чем для сухого зерна.
Эффект влияния на липидный состав не отмечен при окуривании пшеницы или масла (результаты анализа методами УФ- или ИК-спектроскопии с преобразованием Фурье) (фиг. 13). При обработке масла количество фумиганта составило 27,000 мг на 1 кг масла. Это составляет, приблизительно, 0,1 моль фумиганта на моль липида, в расчете на моноглицерид, или примерно в три раза большую величину для липида в расчете на триглицерид.
Обсуждение
Хотя концентрацию фумиганта в этих экспериментах не
определяют, ее можно оценить из данных, полученных в аналогичных условиях. Таким образом, на пшенице с влажностью 11,
4% и применяемой концентрацией фумиганта 10 мг/л, величина произведения (СхТ)
близка к 9000 мг•ч/л. Эта величина на несколько порядков выше доз, необходимых для уничтожения большинства видов
насекомых и их фаз. Таким образом, в соответствии с дополнительными испытаниями
результаты по оценке всхожести находятся в соответствии с умением использовать фумигант без его влияния на качество
зерна.
Эксперимент по оценке влияния С2N2 на липидный состав, который проводят при чрезвычайно высоких концентрациях, после проведения на пшенице для более практических содержаний фумиганта, показал отсутствие какого-либо эффекта. Он не был отмечен даже при исключительно высоких концентрациях.
пример 19
Борьба с бактериями с
помощью С2N2
Цель. Определить эффективность С2
N2 против бактерий, в особенности важных для медицины, и определить его эффективность как в водной,
так и неводной среде.
Материалы и методы
Все процедуры проводят
с использованием стерильного оборудования и реактивов.
Испытанию подвергают три штамма бактерий: Bacillus cereus, Pseudomonas aeruginosa и Staphylococcus aureus. Штаммы были получены из Школы биомедицинских исследований университета г. Канберра (Австралия) и выбраны из-за их важной роли при инфекционном заболевании, трудностей борьбы с ними с помощью других методов и их различных мест обитания.
Для определения эффективности фумиганта против бактерий в воде инокулят помещают в 2 мл дистиллированной воды, налитой в склянки вместимостью 5 мл. Обе склянки помещают, в свою очередь, в стеклянный сосуд на 700 мл с нарезной крышкой, которая снабжена мембраной. Фумигант вводят через мембрану в концентрациях 0, 20, 40, 80, 120 и 160 мг/л и сосуд выдерживают при температуре 35oС в течение 20 и 40 ч. Крышку после этого удаляют и сосуд оставляют на воздухе в течение 4 ч перед внесением 2 мл питательного бульона. Перед оценкой живых бактерий бульон инкубируют при 37oС в течение 24 ч.
Для определения эффективности фумиганта против бактерий в неводной среде 7 мл питательного агара помещают в склянку на 10 мл и на наклонную поверхность помещают инокулят бактерий. Методика дозировки фумиганта описана выше для определения в водной среде.
Эффективность фумиганта против бактерий в водной среде
оценивают 3 способами:
1) по цвету воды перед добавлением питательного бульона;
2) по прозрачности смеси воды и бульона после инкубации;
3) количественным подсчетом бактерий
перед высевом на агар в чашке Петри с проведением серийных разведений. В этом случае
первоначальный инокулят разбавляют в ряд специальных пробирок. В экспериментах авторов каждая пробирка в ряду
последовательного разведения содержала лишь 10% от числа бактерий в предшествующей
пробирке. То есть, 20 мкл пробы переносили в пробирку, содержащую 180 мкл стерильной воды.
Для определения эффективности в неводной среде используют лишь третий способ (количественный подсчет бактерий перед высевом на агар).
Результаты
Водная среда
При наличии
бактерий в воде в контрольной пробе питательный бульон был мутным,
однако для всех содержаний фумиганта в присутствии Pseudomonas aeruginosa он был прозрачным со слегка желтоватым цветом. Таким
образом, этот штамм уничтожается при дозах 20 мг/л и выше в течение 20
ч. В случае Bacillus cereus раствор был лакже прозрачен и имел желтый цвет при концентрациях 120 мг/л и выше.
Визуальная оценка перед добавлением питательного бульона дает неожиданно хороший индикатор степени уничтожения бактерий. Там, где смертность бактерий была полной, водный раствор желтеет, в то время как он остается мутным и не желтеет в тех случаях, когда бактерии не уничтожаются.
Результаты количественной оценки после посчета приведены в табл. 11.
Неводная
среда
Результаты количественной оценки приведены в табл. 12.
Обсуждение
Фумигант уничтожает важные штаммы бактерий как в водных, так в неводных средах. Этот факт
также отражает его способность быть активным как в воздухе, так и в воде,
которая основана на растворимости фумиганта в воде и в фазе, равновесной между водой и воздухом. Эта способность оказывать
действие в обеих фазах очень полезна при стерилизации лабораторий, больниц,
зубоврачебных и ветеринарных кабинетов, пищевых помещений и во всех ситуациях, где бактерии могут присутствовать в водной
или неводной среде, а также в их комбинации.
Испытуемые бактерии включают вид Pseudomonas, которые являются подвижными, аэробными и грамотрицатепьными бактериями, а также вид Staphylococcus, неподвижными, анаэробными и грамположительными бактериями (Блэкистон, 1979)(Blakiston). Bacillus cereus представляет собой род бактерий, вызывающий пищевое отравление, которые являются аэробными и грамположительными (Миллер и Киан, 1983) (Miner and Keane). Они же описывают род Pseudomonas как грамотрицательные, строго анаэробные бактерии, некоторые виды которых являются патогенными для растений и позвоночных. Р. aeruginosa вызывает заболевание "синий гной" и различные заболевания у человека, а Р. mallei вызывает сап, заболевание лошадей, которое передается человеку контактным путем (Миллер и Киан, 1983, с.929). Род Staphylococcus является наиболее общей причиной локализованных гнойных инфекций (Миллер и Киан, 1983, с. 1057). Согласно Блакистону (1979) S. aureus вызывает различные клинические нарушения у человека и животных, такие как абцессы, эндокардит, пневмония, остеомелит и сепсис (там же, с.1288), а Р. aeruginosa является возбудителем различных гнойных инфекций у человека.
Из других работ в других источниках следует, что дициан можно использовать при общей дезинсекции для уничтожения плесени и безпозвоночных.
Перекрестные
ссылки
Перекрестные ссылки делаются на пример 5,
касающийся хранения мяса, и пример 6, касающийся хранения фруктов. Способность проявлять активность в воде раскрывается в других примерах, к
этой же проблеме имеет отношение и прохождение через воду
(пример 22).
Пример 20
Эффективность С2N2 против нематод
Цель. Определить
эффективность С2N2 против нематод.
Материалы и методы
Нематоды, находящиеся в 2 мл воды, помещают в колбу Эрленмейера вместимостью 11,5 мл, снабженную
клапаном Мининерт. В колбу инжектируют дициан (С2
N2) заданной концентрации, как правило близкой к 90% (объемн.), и свободный от цианистого водорода (менее 0,5%). По другому
варианту в колбу вводят 0,2 мл С2N2 в
водном растворе. Колбу оставляют при комнатной температуре в помещении, в котором поддерживают температуру 20-22oС. В качестве
нематод для эксперимента используют инфекционные молодые
особи вида Steinernema carpocapsae, штамм BW.
В эксперименте 1 концентрацию газа в воздухе над водой измеряют через определенные промежутки времени на хроматографе со специфическим термоионизационным детектором после разделения на колонке с мегабором ВР-624. Строят график зависимости концентрации от времени после введения газа и вручную измеряют площадь под кривой для оценки величины произведения (СхТ), соответствующей свободному пространству в колбе.
После 22-часовой экспозиции колбы открывают и подвергают вентиляции. Смертность оценивают с помощью микроскопа через 24 ч после начального добавления фумиганта.
Результаты
Концентрация газа в свободном
простанстве в колбе через 5 мин после добавления газа как правило
составляет одну треть от номинальной величины, рассчитанной в предположении, что поглощение в воде отсутствует. Это соответствует
другим результатам по распределению С2N2 между
водой и воздухом, которые свидетельствуют о сильной сорбции в воде. Например, для номинальной концентрации в 3,46 мг/л содержание
газа в свободном простанстве через 5 мин после добавления фумиганта
составляет 0,85 и 0,58 мг/л для полностью дублированных экспериментов. Концентрация в свободном пространстве быстро снижается по
экспоненциальному закону. Например, полупериод жизни фумиганта при
номинальной концентрации, равной 3,48 мг/л, 8,7 мг/л и 17,4 мг/л, составил, соответственно, 0,94 ч, 2,7 ч и 5,2 ч. Таким образом,
концентрация газа в свободном пространстве над водой и величина
произведения (СхТ) меняется неожиданным образом. Этот факт иллюстрируется в табл. 13.
Нематоды быстро погибают после экспозиции в С2N2, как показано в табл. 14. Например, номинальная концентрация, равная 3,48 мг/л, уничтожает нематоды вида S. carpocapsae (404/404), по сравнению с смертностью контрольной группы только 5/462.
Пример 21
Применение C2N2 для борьбы с плесенью
Цель. Определить токсичность C2N2 по
отношению к плесени на пшенице
Материалы и методы
Пшеница, разновидность розелла, нестирилизованная с содержанием влаги 16 и 22%; колбы газонепроницаемые на 120 мл с клапанами
Мининерт на винтовых крышках; стерилизованные чашки Петри, содержащие
питательный агар Оксойда; большие стеклянные эксикаторы.
Для каждого влагосодержания 20 г пшеницы взвешивают в каждую колбу на 120 мл, колбы герметизируют с помощью указанных выше клапанов и дозируют дициан, обеспечивая последовательно концентрации 18, 35 и 70 мг/л. Контрольные колбы, куда фумигант не вводят, герметизируют аналогичным образом. Все сосуды оставляют при температуре 25oС в течение 6 и 24 ч. Каждую обработку, также как и общую процедуру, полностью дублируют.
Концентрацию фумиганта определяют методом газовой хроматографии на хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм с изотермической температурой колонки 60oС. При окончании экспозиции колбы открывают и пшеницу аэрируют в течение нескольких минут. Пробы в 10 г из каждой колбы затем асептически переносят в чашки с агаровой средой, которые выдерживают в эксикаторе при 25oС в присутствии сосуда с водой в течение 4 суток. После этого чашки с агаром удалают и производят оценку на рост плесени на зерне и всхожесть.
Плесень, которая имеется на контрольном образце пшеницы, показывает, что грибки, присутствующие на пшенице, и уровень загрязнения ими типичны для многих образцов австралийской пшеницы, причем преобладающую флору составляют Altenaria infectoria (не являющийся продуцентом микотоксина) и A. alternata (являющийся потенциально микотоксигенным). В процентном отношении загрязнение грибками A. infectoria составляет 78%, A. alternata - 17%, Epicoccum nigrum - 4% и по 1% для каждого из Drechslera sp., Cladosporum sp. и Реnicillum sp.
Результаты
Влияние экпозиции в 6 и 24 ч
иллюстрирует фиг.14(а) и 14 (b). Концентрация в 70 мг/л дициана на 20 г зерна пшеницы уничтожает плесень и, кроме того, заметно снижает
способность к прорастанию семян. Концентрация в 35 мг/л дициана
уничтожает 90% плесени на зерне, но лишь слегка уменьшает способность к прорастанию семян. Концентрация в 18 мг/л дициана уничтожает
более половины присутствующей плесени и не оказывает влияния на
всхожесть. Различное содержание влаги (16 и 22%) оказывает не очевидный эффект на токсичность C2N2 при этих
концентрациях. Нет также влияния и различного времени экспозиции (6 и
24 ч). Влияние меньшей продолжительности по отношению к концентрации 55 мг/л показано на фиг.14(с).
Обсуждение
Фумигант дициан можно использовать для борьбы с плесенью
различными способами взависимости от желаемого эффекта. Таким образом, он способен полностью уничтожить плесень на влажном зерне, но за
счет уменьшения всхожести, или заметно подавить имеющуюся
плесень без снижения прорастания семян. При этом в определенных условиях был бы желателен каждый вариант. Например, полное подавление было бы
желательно для зерна, которое подлежит обработке в
течение продолжительного времени. Частичное уничтожение плесени было бы полезно в тех случаях, когда необходимо провести быструю консервацию, чтобы
обеспечить возможность длительного хранения перед
сушкой или охлаждением.
Пример 22
Прохождение C2N2 через воду
Цель. Определить способность
прохождения дициана через воду для того, чтобы
определить способность его применения с одной стороны водной ловушки и движения к другой стороне.
Материалы и методы
Устройство
включает стеклянную U-образную трубку высотой
140 мм и внутренним диаметром 18 мм, снабженную на каждом конце мембраной для отбора проб. В U-образную трубку помещают воду на глубину 30 мм таким
образом, чтобы вода покрывала дно и часть боковых
ответвлений. В одно из них (названное А-1) инжектируют C2N2 (1,5 мл, 80%) после удаления эквивалентного объема газа. Измеряют
количество фумиганта в определенные промежутки
времени, используя каждую из мембран в каждом ответвлении (А-1 или А-2) U-образной трубки.
40 мл воды помещают в колбу Эрленмейера на 270 мл, снабженную мембраной для ввода газа и в свободное пространство инжектируют (C2N2) (2 мл, 80%). Измеряют количество фумиганта в определенные промежутки времени, как в свободном пространстве, так и в воде. Через 90 ч воду из обеих колб переносят в две мерные колбочки на 100 мл, содержимое одной из них перемешивают, отбирают пробы воды со дна колбочек и измеряют концентрацию, как в свободном пространстве, так и в воде.
Опыт проводят в помещении с кондиционированным воздухом при средней температуре около 22oС.
Концентрацию фумиганта определяют методом газовой хроматографии на хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм.
Результаты
Прохождение C2N2 через воду осуществляется быстро. Система приходит к равновесию примерно через 10 ч (фиг.15). Концентрация фумиганта в
свободном пространстве каждого
ответвления U-образной трубки составляет в равновесном состоянии 27 мг/л. Результаты на фиг.15 показывают, что увеличение времени экспозиции до 90 ч почти не оказывает
влияния на концентрацию.
Рассчитанное количество применяемого C2N2 составляет 2,78 мг. Содержание в воде составляет 1,3 мг при 90 ч, а в свободном пространстве каждого ответвления U-образной трубки составляет 1,1 мг при той же продолжительности. Таким образом, фумигант является относительно стабильным в дистиллированной воде.
Распределение C2N2 в воде показано на фиг.16. Через 10 ч система приходит в равновесное состояние. Во время опыта суммарное извлечение составило более 90%.
В экспериментах, где C2N2 в воде быстро переносили в контейнер, происходит очень быстрое выделение его из воды (фиг.17), особенно в тех случаях, когда воду перемешивали.
Концентрация фумиганта в свободном пространстве над водой и в воде становится очень низкой после перемешивания в течение 0,2 ч (менее 5 ppm в свободном пространстве) и достаточно низкой (менее 10 ppm в свободном пространстве) после перемешивания в течение 2 ч. Высвобождение фумиганта из воды было количественным (более 90%).
Обсуждение
Движение C2N2
через воду для установления
токсичной концентрации по другую сторону водной ловушки является новым применением газообразного фумиганта. Оно опирается на растворимость и его относительную стабильность
в воде. Эти вопросы
обсуждаются в примере 31.
Новый метод применения очень важен в ситуациях, где доступ может быть затруднен, в особенности там, где имеется водный барьер для прохождения воздуха и газа. Это вполне стандартная ситуация, которая имеет место в воде и сточных (канализационных) трубах, содержащих водяные ловушки, как правило в форме, напоминающей U-образную трубку с ответвлениями обычно неэквивалентной длины. Новизна метода состоит в способности проходить через воду, достигая высоких концентраций фумиганта.
Способность проходить через воду в особенности важно для борьбы с бактериями и вирусами в воде и сточных системах, а также в других местах, где имеется водяной барьер. Это могут быть шприцы и иглы, содержащие такое препятствие движению газа, система трубок, используемая при диализе, катетеры и различное медицинское, зубоврачебное, ветеринарное и научное оборудование.
Высвобождение дициана из воды в открытом сосуде можно использовать при применении фумиганта в воде внутри герметичного пространства, что впоследствии будет приводить к высвобождению фумиганта в виде газа.
Пример 23
Токсичность
дициана к млекопитающим
Итоги изучения токсичности дициана подведены Саксом и Льюисом (1989). Имеются также данные Фуллера, например в документах Национального института проблем
профессиональной безопасности и здравоохранения (США).
Дициан имеет концентрационный предел для безопасной работы с ним (так называемая величина порогового предела или пороговой концентрации), равный 10 ppm (10-3% или 22 мг/м3) как в США, так и в Германии. Кроме того, он имеет номер, присвоенный государственным Департаментом перевозок США (1026), получивший международное признание.
Сакс и Льюис подвели итоги изучения токсичности следующим образом: "Подкожный яд, возможно попадающий в организм другими путями, обладает умеренной токсичностью при вдыхании. Организм человека поддается воздействию ингаляции: повреждение обонятельного нерва и раздражение конъюнктивы." Очевидно, что раздражение глаз является первым симптомом воздействия дициана, при этом наименьший эффект наблюдается после 6-минутного воздействия концентрации в 16 ppm. Такое раздражение при низких концентрациях возможно даже было бы полезным как предупредительный сигнал, однако единственный безопасный способ - это поддержание в рабочей зоне концентрации ниже порогового значения.
Пороговая концентрация для дициана в 33 раза выше, чем для фосфина, однако обычная доза не будет превышать ее также в 33 раза и продолжительность воздействия для дициана значительно короче, чем для фосфина. При условии тщательной проверки его присутствия в рабочей зоне представляется, что процедуры, которые позволяют проводить безопасные работы с фосфином, будут также пригодны и для дициана.
Дициан обладает высокой патентной тепловой энергией и в этом отношении он подобен ацетилену. Он потенциально взрывоопасен в смеси с сильными окислителями и поэтому нельзя, чтобы в цилиндры с этим газом попадали реакционноспособные химические вещества. Однако наименьшая предельная взрывоопасная концентрация на воздухе составляет 6,6% (объемн.)(приблизительно 150 г/м3), которая значительно выше применяемых содержаний фумиганта.
Пример 24. Скорость сорбции на пшенице
Цель. Определить скорость сорбции С2N2 в зерне при различной степени
заполнения
пор и различном содержании влаги.
Материалы и методы
В опытах по определению скорости сорбции при степени заполнения пор 25, 50 и 95% используют образцы
австралийской мягкой
стандартной пшеницы (Rose11а) с содержанием влаги 11,6% (в пересчете на влажную массу). Эту величину подгоняют таким образом, чтобы получить исходное сырье с влагосодержанием 10,
12 и 14%. Полученные
образцы пшеницы оставляют по меньшей мере на две недели для доведения до равновесного состояния перед окуриванием.
Дициан вносят в колбы на 120 мл, снабженные крышками с клапанами Мининерт и создают в них концентрации газа в 6,73, 13,38 и 12,62 мг/л для степени заполнения пор соответственно 25, 50 и 95%. Для образцов с содержанием влаги 10, 12 и 14% используют концентрации, равные 13,94,13,46 и 13,96 мг/л соответственно. Все опытные образцы готовят в трех экземплярах и определяют концентрацию фумиганта через небольшие промежутки времени методом газовой хроматографии на хроматографе Вариан 3300 со специфическим термоионизационным детектором путем инжекции аликвоты 20 мкл и разделения на колонке DBwax с внутренним диаметром 0,53 мм.
Результаты
Скорость сорбции регистрируют в виде зависимости логарифма остаточной концентрации (%) от времени. Цициан все еще можно обнаружить через 24 ч после его применения на
образцах с 25%-ным заполнением
пор (фиг.18), хотя его степень истощения оставалась линейной. Концентрации C2N2 в образцах с 50%-нм и 95%-ным заполнением пор также демонстрируют
линейную зависимость степени
истощения газа, которые увеличиваются с увеличением степени заполнения. При 95%-ном заполнении происходит падение значения ниже предела обнаружения в пределах 6 ч после
начала применения фумиганта.
Степень истощения, по-видимому, строго коррелируется с увеличением содержания влаги в пшенице. Проба с 10%-ным влагосодержанием демонстрирует 10-кратное уменьшение после 11 ч окуривания (фиг.21), в то время как аналогичного снижения достигают за 2 ч для пшеницы с содержанием влаги 12% (фиг. 22) и примерно за 1 ч для пшеницы с содержанием влаги 14% (фиг.23). Начальная скорость сорбции носит линейный характер для всех влажных образцов, хотя эта линейная зависимость исчезает примерно через 2 ч для пшеницы с содержанием влаги 12 и 14%.
Обсуждение
Быстрая
степень истощения C2N2 в образцах пшеницы с высоким содержанием влаги коррелируется с высокой растворимостью дициана в воде. Однако,
остатки дициана и цианистого водорода в
пшенице, которая сорбирована дициан, как оказалось, были незначительны (примеры 3, 26), свидетельствуя о том, что сорбированный дициан претерпевает быстрое
химическое разложение, которое, возможно,
способствует росту скорости сорбции C2N2 с соответствующим сдвигом равновесия.
Пример 25
Метод измерения и
расчета концентрации C2N2 в воде
Введение и цель
Дициан растворяется в воде в соотношении 4:1 (по справочнику Merck Index). Было бы желательно уметь применять
его в виде жидкости или газа. Настоящее
исследование было проведено для того, чтобы определить эффективный способ борьбы с дрозофилой Queensland, Dacus tyroni или другими насекомыми с помощью C2N2, растворенного в воде,
и измерить концентрации газообразного и жидкого фумиганта. Кроме того, это исследование направлено на оценку метода определения концентрации фумиганта в
воде.
Материалы и методы
1 и 4 мл 82%-ного дициана постепенно вводят в два сосуда вместимостью 16 мл, снабженные винтовыми крышками Мининерт и содержащие 10 мл 0,01М соляной
кислоты. Эти объемы соответствуют
концентрациям 190 мг/л (проба 1) и 761 мг/л (проба 2), соответственно. После 30-минутного выжидания для того чтобы дать фумиганту полностью раствориться в растворе,
0,1 мл каждого раствора смеси C2N2/HCl инжектируют через резиновую прокладку в раздельные колбы Эрленмейера на 275 мл, снабженные винтовыми коническими переходниками. Это
соответствует концентрациям 0,069 мг/л
(проба 3) и 0,276 мг/л (проба 4) соответственно. Кроме того, для определения содержания проб в колбах Эрленмейера на 1,2 л готовят три стандартные концентрации
газа, равные 0,4, 0,8 и 1,48 мг/л.
Измерения концентрации газа и жидкости проводят на газовом хроматографе Вариан с электронозахватным детектором и колонкой DBwax (мегабор). Температуру колонки устанавливают при 60oС, температуру инжектора - при 100oС, температуру детектора - при 228oС. Газовые пробы в объеме 10 мкл инжектируют с помощью микрошприца Pressure Lock на 100 мкл, а жидкие пробы в объеме 0,1 мкл инжектируют с помощью микрошприца SGE на 5 мкл.
Результаты
Для каждой пробы и стандарта производят 10
инъекций и полученные площади усредняют.
Стандарты используют для расчета истинных коцентраций в каждой из проб после поправки на объем введенной пробы.
Стандартные площади наносили на график в зависимости от концентрации (фиг.24) для проверки того, что газовый хроматограф работает в линейной области по всему концентрационному диапазону. Регрессионный анализ показал, что отклик подчиняется линейному закону (R=0,99).
Табл. 15 показывает, что измеренные концентрации как в газообразных, так и в жидких пробах вплоть до 21% ниже, чем рассчитанные. Обе жидкие пробы имеют потери, равные 11%, которые могут быть обусловлены некоторым остаточным количеством дициана в свободном пространстве и нерастворением в соляной кислоте. Слегка более высокие расхождения (потери) между вычисленными и измеренными концентрациями в пробах 3 и 4 могут быть обусловлены суммарными ошибками определения более низких, по сравнению с ожидаемыми, концентраций в жидкости, неполным испарением дициана из 0,1 мл раствора смеси C2N2/НС1 и погрешностью отбора пробы.
Обсуждение
В тех случаях, когда фумигант растворяют в 10 мл
0,01М HС1, имеет место на 11% более низкая
концентрация C2N2, по сравнению с вычисленной, из-за фазового равновесия между водной и газовой фазой. Количество фумиганта в газовой
фазе будет зависеть от правила фаз и от
объемов жидкости и газа. Чтобы свести к минимуму ошибку, пробы раствора смеси C2N2/НС1 следует анализировать на газовом хроматографе до
введения D. tyroni или других насекомых.
Это позволит более точно предсказать целевые концентрации.
Таким образом, проведенные исследования обеспечивают методику измерения C2N2 в жидкой фазе и точного расчета доз.
Пример 26
Остатки C2N2 и методы из определения в пшенице
Цели: определить остатки
C2N2 в пшенице,
обработанной методом окуривания; получить результаты по анализу остатков.
Масштабы распространения остатков дициана и их конверсии в цианистый водород представляют собой очень важную проблему при использовании дициана в качестве зернового фумиганта. Авторы изобретения несколько скептически относятся к методологии, используемой для определения остатков фумиганта, и поэтому их оценка была произведена с помощью целого ряда методик (пример 3).
Материалы и методы
Используют образцы австралийской
стандартной пшеницы с содержанием влаги 11,6% (в
пересчете на влажную массу), которые помещают в колбы на 120 мл, снабженные клапанами Мининерт. Используют также три степени заполнения пор, равные 25,
50 и 95%; например, колбы наполняют на 25%
пшеницей и на 75% воздухом, чтобы получить заполнение, равное 25%.
Для анализа пшеницы на содержание дициана 20 г пшеницы помешают в колбу на 120 мл, снабженную клапаном Мининерт, добавляют 20 мл химически чистого тетрагидрофурана и смесь оставляют до утра. Фумигант определяют как в жидкой фазе (путем инжекции аликвот в 2 мкл), так и в свободном пространстве над жидкостью (путем инжекции аликвот в 100 мкл). Концентрацию фумиганта определяют методом газовой хроматографии на хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм.
Вводят фумигант для создания концентраций 6,73, 13,38 и 12,94 мг/л и достижения степени заполнения, соответственно в 25, 50 и 95%. Это, в свою очередь, соответствует остаткам в 35,1, 34,2 и 17,3 мг/кг. Содержание остатков определяют через определенные промежутки времени после применения. Все определения остаточных количеств повторяют с тремя параллельными, общая аналитическая процедура дублируется.
Результаты
Метод анализа
Отклик
детектора регистрируют в зависимости от количества C2N2 в виде газа (фиг. 26). Отклик отвечает линейной зависимости от применяемой концентрации и обладает воспроизводимостью.
Предел обнаружения, определяемый как двойное соотношение сигнал/шум,
измеряют на основании инжекций в свободное пространство и жидкостных инжекций. Исходя из методики анализа в свободном пространстве,
он соответствует остаточной концентрации в зерне, равной 4,3х10-3 мг/кг (или 4,3 ppb, W/W) в пшенице, и 0,037 мг/кг (или 37 ppb, W/W), исходя из инжекции жидкости. Основная причина такого
расхождения в пределах обнаружения состояла в мешающем влиянии
растворителя, то есть в регистрации в растворителе сигналов, которые соответствовали C2N2.
Экстракция необработанной пшеницы в тетрагидрофуране не меняла пределы обнаружения. Их идентичность с пределами обнаружения в растворителе указывает на то, что уровни содержания C2N2 в необработанной пшенице были чрезвычайно малы. Однако предел обнаружения, установленный по методике анализа свободного пространства, возрастает до величины, соответствующей 0,036 мг/кг.
Остатки
Данные по анализу остатков описаны в
табл. 16. Уменьшение остатков в полностью герметичной системе было значительным. Оно колебалось около среднего значения в 98% через
3 суток и превышало 99% через 14 сут.
Для пшеницы, обработанной фумигантом с концентрацией 35,1 мг/кг при степени заполнения 25% и выдержке в течение 14 суток при 22oС, остаточное количество, определяемое по методике для анализа в свободном пространстве, колебалось около среднего значения в 0,081 мг/кг (СКО=0,009 мг/кг). По методике жидкостной инжекции содержание остатков в пшенице колебалось около среднего значения в 0,21 мг/кг (СКО=0, 083 мг/кг). Для пшеницы в контейнере с 95%-ным наполнением, обработанной фумигантом с концентрацией 17,3 мг/кг, содержание остатков, определенное по методике для анализа в свободном пространстве после периода выдерживания в 3 суток, составило 0,52 мг/кг (СКО= 0,24 мг/кг). В этом случае остатки не определяют методом жидкостной инжекции.
Для пшеницы, обработанной фумигантом с концентрацией 34,2 мг/кг и выдержке в течение 14 суток при 22oС, остаточное количество, определяемое по методике для анализа в свободном пространстве, в одном из параллельных определений было ниже, чем в контрольной пробе, и ниже предела чувствительности (обнаружения), определяемого как двойное отношение сигнал/шум. Расхождение между результатом анализа рабочей и контрольной проб соответствовало остаточному количеству фумиганта в пшенице, равному 0,003 мг/кг. В случае жидкостной инжекции это количество было опять ниже предела обнаружения, определяемого как двойное отношение сигнал/шум. Расхождение между результатом анализа рабочей и контрольной проб соответствовало остаточному количеству фумиганта в пшенице, равному 0,013 мг/кг (СКО=0,005 мг/кг). Таким образом, остаточные количества наилучшим образом характеризуются как "возможные следы", но по величине меньшие, чем предел количественного обнаружения.
Обсуждение
Остаточные
количества дициана можно обнаружить в зерне в количестве вплоть до нижних пределов обнаружения, исходя из анализа
свободного пространства или по методу жидкостных инжекций. Снижение остаточных
количеств происходит очень быстро. Такое быстрое снижение повторяется и в других экспериментах, о которых сообщается в
примерах 3 и 43. Присутствие некоторого количества цианистого водорода было
отмечено для каждого метода обнаружения, что рассматривается в отдельном документе (пример 43).
Пример
27
Токсичность C2N2 по отношению к личинкам
Ephestia cautella
Цель. Оценить токсичность C2N2 по отношению к личинкам вида Lepidopteran, в
частности Ephestia cautella (Walker).
Материалы и
методы
Две параллельные пробы личинок Е. cautella, находящихся на возрастной стадии 15 лет, и тонкую полоску гофрированного
картона переносят в стеклянные сосуды на 120 мл, снабженные
крышками с клапаном Мининерт. Сосуды герметизируют и перед введением дициана удаляют из них соответствующие объемы воздуха. Пробы после
окуривания выдерживают при 30oС, исключая их
кратковременное удаление на хроматографический анализ.
Концентрации дициана определяют путем ввода определенных аликвот пробы в газовый хроматограф Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм. Хроматограммы снимают в пределах 2 ч после применения дициана как для 6-часовой, так и 24-часовой экспозиции. Второй набор хроматограмм делают в течение 24-часовой экспозиции приблизительно за 2 ч до окончания окуривания.
Результаты
Результаты, полученные для всех
вариантов обработки личинок, приведены в табл. 17.
Обсуждение
C2N2 вызывает 100%-ную смертность у
личинок Ephestia cautella вида Lepidopteran в пределах
6-часовой экспозиции при концентрации 2,59 мг/л. Результаты настоящего исследования показывают, что увеличение времени экспозиции личинок в
фумиганте не приводит к значительному росту смертности при
более низких дозах.
Пример 28
Хранение C2N2 в мешках Тедлара
Цель. Определить
возможность хранения C2N2 в мешках Тедлара
и других пластиковых контейнерах и обеспечить удобный метод хранения фумиганта, в особенности при маломасштабном использовании.
Материалы и методы
Используют промышленные
газовые мешки Тедлара, поставляемые фирмой SKC Inc. (США). Они представляют собой пластиковые мешки, снабженные инжекционной системой
для ввода и удаления газа. Поставляемые мешки в основном свободны
от воздуха. Фумигант C2N2 инжектируют в мешки с помощью воздухонепроницаемого шприца. Концентрацию C2
N2 измеряют через определенные промежутки времени на
газовом хроматографе Тракор МТ150 (Тrасоr), снабженный детектором по плотности Гоу-Мак (Gow-Mac). Кроме того, содержание цианистого
водорода определяют на газовом хроматографе Вариан 3300 со
специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм. Стандартные образцы цианистого
водорода готовят путем
взаимодействия соли цианида с
кислотой, определяя концентрацию с помощью плотномера для газов и последующего разведения в герметичные колбы.
Разбавленные концентрации C2N2 в воздухе готовят также в мешках Тедлара и определяют их через определенные промежутки времени на газовом хроматографе Вариан 3300.
Мешки оставляют в лаборатории с кондиционированием воздуха при типичной температуре 22oС. Какие либо специальные условия для защиты от световых лучей отсутствуют.
Результаты
На протяжении 4 недель, в течение которых производят
еженедельное измерение концентрации, содержание C2N2 находится в интервале между 82 и 83% (объемн.) при отсутствии
какой-либо явной тенденции. Концентрация цианистого водорода
всегда находилась между 0,35 и 0,45% (объемн.). Таким образом, этот фумигант обладает стабильностью в газовых мешках Тедлара.
Более низкие концентрации также устойчивы в системе. Например, концентрация, равная 0,66 мг/л, остается постоянной в пределах ошибки эксперимента на всем его протяжении, составляющем 3 суток.
Обсуждение
Стабильность C2N2 в стеклянном сосуде и воде с определенной величиной рН и в растворителях описана в других документах (например,
фазовому равновесию (phase.doc.), документ 33 (document 33);
поведению в воде (water.doc.), документ 23. Стабильность продукта в газовых цилиндрах представлена номером, присвоенным Государственным
Департаментом перевозок (документ по безопасной транспортировке
(safety. doc.), документ 24). Стабильность в мешках Тедлара позволяет предложить альтернативный способ хранения и дозировки фумиганта,
который очень удобен во многих случаях его применения. Плотность
паров C2N2 составляет 2,3 мг/л, и таким образом 23 г этого продукта можно хранить в мешке на 101 л, а его
пропорциональные количества, соответственно, в контейнерах большего или
меньшего объема. Этот способ хранения удобен в ситуациях, когда количество измеряют не в килограммах, а в миллиграммах или
граммах, что, как правило, имеет место в хирургических отделениях больниц и
т.д. Единственным необходимым оборудованием здесь является газонепронецаемый шприц соответствующего объема и газовый мешок,
содержащий фумигант. Как и в случае всех других способов хранения токсичных
газов, как правило необходимы соответствующие методики безопасности при хранении, причем такие методики могли бы включать
количества, подлежащие хранению, посредством указания колебаний размеров
контейнера и начальной концентрации фумиганта. Возможны и другие варианты используемых контейнеров для хранения фумиганта.
Пример 29
Прохождение C2N2 и
других газов через колонну с пшеницей
Цель. Определить способность прохода C2N2 через колонну
с пшеницей.
Материалы и методы
Применяемая
методика была точно описана у Демаршелье, 1994 (Desmarchelier). Фумигант продувают через столб пшеницы высотой 1,1 м в количестве
7,9 л при скорости воздушного потока 200 мл/мин. Фумигант вводят в
колонну посредством колбы вместимостью 200 мл, расположенной у дна колонны, и затем измеряют его содержание наверху колонны.
Эксперименты проводят с фосфином, бромистым метилом, дицианом и цианистым
водородом. В одном из опытов фумиганты применяют одновременно, в другом используют только дициан (C2N2),
как был использован только цианистый водород в дополнительном
эксперименте.
Содержание фумигантов определяют на газовом хроматографе Вариан 3300. Фосфин и C2N2 анализируют со специфическим термоионизационным детектором после разделения на колонке ВР624 с внутренним диаметром 0,53 мм. Бромистый метил анализируют с помощью эпектронозахватного детектора после разделения на колонке GSQ с внутренним диаметром 0,53 мм.
Концентрацию фумиганта в выходящем газе иллюстрирует фиг.27. Дициан двигается через пшеницу аналогично обоим, наиболее широко используемым фумигантам, фосфину и бромистому метилу. Результаты, полученные для этих продуктов, применяемых одновременно, совпадают с результатами, которые получены при их индивидуальном применении (Демаршелье, 1994). В условиях испытания цианистый водород не способен проходить через пшеницу и поэтому он не был обнаружен в выходящем газе.
Обсуждение
Ввиду того, что
C2N2 способен проходить через
столб пшеницы в потоке воздуха, его можно применять методом воздушного потока и системах рециркуляции воздуха. Токсичность фумиганта к насекомым
для каждого случая показана в примерах 2, 8 и 10.
Пример 30
Токсичность C2N2 по отношению к двум видам Coleoptera
Цель. Определить токсичность
C2N2 по отношению к двум видам
вредителей Coleoptera в продуктах, подлежащих хранению, и оценить зависимость "доза-отклик" с помощью пробит-анализа.
Материалы и
методы
Взятые для испытания насекомые
включают: Tribolium confusum (du Va1) и Rhyzopertha dominica (F). Насекомых (50 шт.) помещают в стеклянные сосуды на 120 мл при относительной влажности
55% и выдерживают при температуре 25o
С. Сосуды были снабжены клапанами Мининерт, через которые инжектируют фумигант. На насекомых воздействуют в течение 6 ч, а затем переносят в сосуды с
мукой, имеющей 12%-ную влажность (вес.). Через 7 и
28 ч производят подсчет насекомых. Смертность оценивают методом пробит-анализа, используя данные 6 параллельных определений для каждой дозы, и
делают соответствующую поправку по формуле Эббота
(Abbot).
Концентрации C2N2 определяют из применяемых количеств фумиганта и подтверждают анализом на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм.
Результаты
После начального
воздействия наблюдалась некоторая очевидная
регенерация после первоначального "нокдауна", однако в течение 1-4 недель смертность увеличивалась. В этом отношении поведение C2N2
было аналогично фосфину в том, что некоторое
количество насекомых погибает медленно и кратковременная выдержка после фумигации может привести к недооценке конечного уровня смертности.
Фиг.28 иллюстрирует зависимость уровня смертности от концентрации. Кривые для каждого вида насекомых имеют характерную S-образную форму.
Фиг. 29 иллюстрирует зависимость пробит-смертности от логарифма концентрации для Т. confusum. Кривая имеет линейный характер, указывая на то, что отклик подчиняется предполагаемой линейной корреляции между пробит-смертностью и величиной "log. концентрации". Аналогичная зависимость для R. dominica представлена на фиг.30.
При 6-часовой экспозиции значения LC50 для Т. confusum и R. dominica соответственно равны 1,41 и 0,141 мг/л.
Монро (1969)(Monro) перечисляет значения L(CxT)99 для 9 фумигантов, определенные при 5- или 6-часовой экспозиции против R. dominica, и значения L(CxT)99 для 10 фумигантов против Т. confusum при 25oС. Дициан C2N2 оказался токсичнее любого из фумигантов против R. dominica и токсичнее любого из фумигантов, за исключением цианистого водорода, против Т. confusum. Список фумигантов включал дибромэтан, хлорпикрин и бромистый метил. Токсичность фосфина была также отмечена, но только для 24-часовой экспозиции при 27oС.
Обсуждение
C2N2 является высокотоксичным продуктом по отношению к насекомым, взятым для испытания. Он
более токсичен, чем бромистый метил или дибромэтан, и
приблизительно эквитоксичен с цианистым водородом. Линейность зависимости пробит-смертности от логарифма концентрации помогает при расчете
необходимой дозы для достижения желаемого уровня летального
исхода насекомых.
Пример 31
Фазовое распределение C2N2 между растворителями и воздухом в
герметичных контейнерах и и его стабильность в растворителях
Цель. Определить стабильность C2N2 в различных растворителях и его распределение между жидкой и газовой
фазой. Это является полезной информацией для определения доз
фумиганта и проведения анализа.
Материалы и методы
Растворители (25 мл) помещают в колбы Эрленмейера
вместимостью 270 мл, снабженные герметичной прокладкой. Фумигант с
чистотой 80-82% (объемн.) в количестве 2 мл инжектируют в колбу, содержимое которой перемешивают с помощью магнитной мешалки. Через
определенные промежутки времени из паровой фазы отбирают аликвоты
объемом 50 мкл, а из жидкой фазы - объемом 1 мкл. Аликвоты вводят в газовый хроматограф Вариан 3300, снабженный специфическим
термоионизационным детектором, и C2N2 отделяют от
растворителей на колонке DBwax с внутренним диаметром 0,53 мм.
В экспериментах используют химически чистые растворители и дистиллированную воду.
Концентрации в каждой фазе определяют относительно стандарта, который готовят ежедневно. Концентрации, по которым строят кривые зависимости, представляют собой средние значения трех параллельных определений.
Результаты
Распределение C2N2 в 0,1М растворе соляной кислоты показано на фиг.31.
Стабильное распределение достигается между фазами через 8 ч после
дозирования фумиганта и это распределение вместе с общим количеством C2N2 остаются стабильными во время
эксперимента (70 ч). В других опытах показано, что C2N2 также обнаруживает стабильность и в растворах 0,01М соляной кислоты.
В воде (фиг.32) дициан сохраняет относительную стабильность. но в других экспериментах он очень неустойчив при высоких рН (например, при рН 8,0 и 10,5). Он также нестабилен в среде 50% уксусной кислоты (50% воды).
В диоксане (фиг.34) распределение между фазами и общая стабильность остаются неизменными приблизительно в течение 3 суток (продолжительность эксперимента). Аналогичные результаты получены для тетрагидрофурана. Очень хорошее распределение между фазами и общая стабильность были отмечены для толуола (фиг.35) и ацетоне (фиг.36). Последний результат в особенности благоприятен с точки зрения аналитической химии, поскольку ацетон является широко используемым растворителем в анализе многочисленных остатков пестицидов.
Обсуждение
Стабильность в водных и неводных
средах является полезным свойством во многих случаях, например при поставке фумиганта,
растворенного в жидкости, которую можно легко измерить в соответствующих дозировочных камерах.
Такая стабильность, кроме того, очень полезна в аналитической химии, когда фумигант экстрагируют из продукта в растворитель, такой как ацетон, толуол или воду с соответствующим значением рН. Это дает возможность производить анализ остатков в жидкой фазе, а также ввиду фазового равновесия, определять содержание фумиганта в свободном пространстве, например в паровой фазе. Как и во всех аналитических процедурах необходима соответствующая тщательность в приготовлении стандартов и обогащенных продуктов.
В разделе по удалению дициана было показано, что его можно быстро разложить путем взаимодействия с аминами или спиртами. В других разделах было показано, что он устойчив в некоторых типах пластиковых мешков и стеклянных сосудах. Таким образом, устойчивость фумиганта, находящегося в виде газа или жидкости, можно, при необходимости, либо сохранить, или подходящим образом нарушить.
Пример 32
Проникновение C2N2 в древесину и сорбция C2N2 древесиной
Цель. Определить степень
поглощения C2N2 древесиной и скорость, с которой он проникает в нее, и в
результате, на основании данных биологических испытаний против термитов оценить его пригодность как
фумиганта для древесины.
Материалы и методы
Из двух образцов древесины
изготавливают деревянные кубики размером 100х100 мм. Они соответствуют собой образцам мягкой древесины
Орегон (Oregon) и тропической твердой породы Мербен (Меrben).
Для определения сорбции изготовленные кубики помещают в эксикаторы емкостью 2,5 л, снабженные мембраной для ввода газа и магнитной мешалкой. Перед окуриванием образцы древесины оставляют при 30oС в условиях относительной влажности 55% в течение 5 месяцев для того, чтобы достигнуть равновесной величины относительной влажности. Содержание влаги, измеренное по стандартной методике (Сборник американских стандартов ASTM, 1983), составило 11,2% в случае твердой древесины и 10,6% для мягкой. Фумигант инжектируют в свободное пространство, содержание в котором определяют на протяжении 100 ч после дозирования с рассчитанной концентрацией в 30 мг/л.
Содержание фумиганта определяют на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм.
Для определения степени проникания газа через древесину стороны кубика, параллельные волокнам, герметизируют тонким слоем силиконовой грунтовки, сушат и затем наносят более толстый слой герметика. После этого кубики заворачивают внахлестку в алюминиевую фольгу, перекрывая поверхность граней на 5 мм, и закрепляют на древесине слоем силикона. Образцы далее сушат на воздухе в течение 24 ч. После этого к деревянным кубикам прикрепляют с помощью силикона камеры, изготовленные из пластин прозрачного поливинилхлорида размером 200 х 105 х 2 мм. Камеры имеют мембраны для ввода и отбора проб на каждом конце и герметизированы с помощью силикона. Фумигант инжектируют через входную мембрану с одной стороны кубика и отбирают пробу через выходную мембрану с другой.
Результаты
Поглощение дициана мягкой
и твердой породой древесины показано на фиг. 37, на которой представлены графики
зависимости содержания C2N2 в свободном пространстве для обеих пород. Фумигант быстрее
сорбируется твердым деревом, чем мягким (аналогичные результаты получены и для бромистого
метила). Величина произведения (СхТ) заметно превосходит для каждого типа древесины эту же величину,
необходимую для уничтожения трех видов древесных термитов (см. пример 36).
Проникновение C2N2 через мягкую древесину показано на фиг.38. После 20-часового воздействия концентрации в каждой камере находятся в состоянии равновесия с величиной около 10 мг/л. Проникновение через твердую древесину (фиг. 39) происходит медленнее и равновесная концентрация была ниже (2,5 мг/л).
Данные для бромистого метила, полученные в сравнимых условиях, приведены на фиг. 40 и 41. Как в случае твердого, так и мягкого дерева, дициан проникает сквозь древесину быстрее, чем бромистый метил, и его концентрация в паровой фазе выше. Кроме того, C2N2 более токсичен по отношению к древесным термитам, чем бромистый метил (см. пример 36).
Пример 33
Влияние окуривания с помощью C2N2 на продолжительность стояния в вазе срезанных цветов
Цель. Оценить стабильность C2
N2 в качестве фумиганта для срезанных цветов.
Материалы и
методы
Для испытаний используют полевые гвоздики и льюкадендроны, покупаемые в местных цветочных
магазинах.
Обработку осуществляют в герметичных барабанах вместимостью 63,5 л с помощью C2N2 с концентрацией 1,8 мг/л в течение 2 ч и бромистого метила с концентрацией в 32 мг/л в течение 2 ч (доза, рекомендованная Службой карантинной инспекции Австралии для организаций, занимающихся экспортом цветов) с контрольной пробой в отсутствие фумиганта.
Используемые барабаны каждый снабжают портом для отбора проб и фиттингами для насоса. После дозирования газообразное содержимое барабана подвергают принудительной циркуляции посредством насоса в течение 15 мин для того, чтобы получить равномерное распределение фумиганта по всему барабану.
Соответствущей концентрации фумиганта достигают путем удаления определенного количества воздуха из барабана и введения того же количества концентрированного газа.
Концентрации в барабанах определяют относительно стандартов, приготавливаемых в колбах Эрленмейера вместимостью 1 л, снабженных защелкиваемыми крышками с мембраной, причем дициан анализируют на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм, а бромистый метил - на хроматографе Шимадзу 6АМ с пламенно-ионизационным детектором и с 20% OV101 на колонке Gas Chrom Q.
Содержание каждого фумиганта проверяют трижды - в начале обработки, через 1 ч и непосредственно перед окончанием процесса окуривания.
Через 2 ч барабаны открывают под тягой для доступа воздуха, цветы удаляют из барабанов, стебли подрезают и в пучках помещают в воду, составляя на воздухе под тягой на 2 ч, после чего переносят в холодную комнату.
Оценку фитотоксичности фумиганта производят через 1 неделю нахождения на холоде.
Результаты
Полученные фактические концентрации фумигантов составляют 30 мг/л МеВr и 1,8 мг/л C2N2. При обработке в течение 2 ч наблюдается 33%-ное падение концентрации C2
N2 из-за сорбции или его разложения цветами (фиг.42). В противоположность такому
поведению содержание бромистого метила остается относительно неизменным на всем протяжении окуривания.
Оценка фитотоксичности по 10-балльной шкале была произведена группой из 6 человек, которые были опрошены независимо друг от друга (где 10 - наивысшая оценка и 1 - неподдающийся продаже), для каждого цветка и каждой обработки. Приведеные в табл.17А цифры являются усредненными.
Обсуждение
C2N2 сравним по своим свойствам с МеВr при
использовании его в качестве газообразного фумиганта для срезанных цветов.
Эффективность дициана против насекомых, обнаруженных в срезанных цветах, описана в примере 46.
Пример 34
Токсичность C2N2 по отношению к наружной фазе
вредителей складированного зерна отряда Coleoptera
Цель. Определить токсичность C2N2 к
наружным фазам разнообразных вредителей отряда Coleoptera, присутствующих в зерне,
которое находится на хранении.
Материалы и методы
Получение и анализ C2N2
C2N2 выпускается промышленностью в виде
сжиженного газа, поставляемого в цилиндрах. Однако имеется возможность выбора, чтобы получить его из исходного сырья на
день проведения предварительных испытаний. Около 50 г CuSO4•
5H2O (х.ч.) прибавляют к 500 мл дистилированной воды, полученный раствор нагревают примерно до 90oС
и немедленно снимают с плитки. В раствор погружают трубку колокольного типа,
снабженную крышкой с мембраной и удаляют воздух через трубку в шприц. В трубку добавляют около 10 мл насыщенного раствора
цианистого калия. Выделяющийся C2N2 оставляют для
стояния перед отбором не менее чем на 10 мин.
Чистоту дициана определяют с помощью детектора плотности газов Gow-Mac, модель 40-001. Величина ее находится как правило в интервале 65-85% в присутствии СО2 как основной примеси.
Содержание C2N2 в стеклянных сосудах определяют с помощью газового хроматографа Вариан 3300 со специфическим термоионизационным детектором и колонкой DBwax мегабор, имеющей внутренний диаметр 0,53 мм. Для всех газовых проб температура инжекции составляет 125oС, температура колонки - 80oС и температура детектора - 300oС.
Виды насекомых
На испытания были взяты
следующие виды насекомых: Oryzaephilus surinamensis (L.), штамм NOS405;
Rhyzopertha dominica (F.), штамм RD2; Sitophilus granarius (L. ), штамм SG4; Sitophilus oryzae (L.), штамм CSO418; Tribolium
castaneum (Herbst), штамм ТС4 и Tribolium confusum (Duv.), штамм ТСO37. Все
насекомые культивировали при 30oС и относительной влажности 60%, за исключением тех случаев, где было указано
иначе.
Все наружные фазы насекомых, которые были взяты для испытаний, соответствуют фазам взрослого насекомого для всех видов, в частности, куколки Т. castaneum и Т. confusum, личинки Т. castaneum и Т. confusum и яйца R. dominica, Т. castaneum и Т. confusum.
Методика биологических испытаний
Испытания проводят в стеклянных сосудах на 120 мл,
снабженные крышками с клапанами Мининерт (фирмы Оптек Ассошиэйтс) (Alltech
Associates). Испытания проводят для двух параллельных определений, используя от 15 до 30 насекомых, находящихся на различных
стадиях роста. Количество воздуха, равное объему добавленного газа, удаляют
из сосудов перед добавлением фумиганта. Отбирают пробы на анализ примерно через час после ввода C2N2
и примерно за два часа до его удаления. После обработки насекомые помещают на
небольшое количество культурной среды и оставляют при 30oС и относительной влажности 60% на 1 неделю перед их
подсчетом.
Результаты
Токсичность C2N2 по отношению к наружной фазе вредителей отряда Coleoptera
Данные по токсичности С2N2 по отношению к наружной фазе шести видов вредителей отряда Coleoptera
приведены в табл. 18.
Представленные минимальные летальные дозы являются избыточными и дополнительные биологические эксперименты, вероятно, демонстрируют летальные дозы, которые могут быть значительно ниже. Приведенные значения произведения (СхТ) значительно ниже значений, полученных для большинства других фумигантов. Например, взрослые насекомые R. dominica можно уничтожить с помощью дициана, для которого СхТ составляет 8,82 мг•ч/л (6 ч, 30oС), про сравнению с СхТ, которое равно 33,0 мг•ч/л для бромистого метила, 294 мг•ч/л для сероуглерода, 15,6 мг•ч/л для цианистого водорода, 636 мг•ч/л для дихлорэтана (Монро, 1967) и 68,7 мг•ч/л для сероокиси углерода (Демаршелье, 1994).
Увеличение периода экспозиции в 4 раза до 24 ч позволяет снизить дозу приблизительно от 2 (например, на личинках Т.castaneum) до 6 раз (например, на яйцах Т. confusum). Усредненный коэффициент составил 3,2 для взрослых насекомых, 2,0 для личинок, 3,0 для куколок и 3,3 для яиц.
Обсуждение
C2N2 эффективен против всех фаз для всех насекомых вида Coleoptera. Количество
фумиганта, необходимое для уничтожения насекомых, меняется со временем экспозиции, как показано в примере 35 для
различного периода воздействия.
Пример 35
Токсичность C2N2 при кратковременном и длительном воздействии
Цель. Определить токсичность C2N2 для кратковременных и длительных экспозиций.
Материалы и методы
На насекомых в количестве 20 шт., помещенных в колбы Эрленмейера на 275 мл, снабженные
газовыми впускными мембранами, воздействуют фумигантом, вводимым методом инжекции.
Время воздействия составляет от 5 минут до 14 суток. После экспозиции насекомых переносят в сосуды, содержащие 20 г
пшеницы и выдерживают при температуре 30oС и относительной влажности 55%
в течение 2 недель перед оценкой уровня смертности насекомых.
К насекомым, взятым для испытания, относятся: Rhyzopertha dominica (F.), штамм CRD2; Oryzaephilus surinamensis (L.), штамм NOS405 и Tribolium castaneum (Herbst), штамм СТС4.
Результаты
Смертность в конце
периода воздействия (острую) и после 2-недельной выдержки представлена в табл. 19.
Значительный уровень смертности был достигнут лишь после 5-минутной, а 100%-ной смертности насекомых достигли после
10-минутной экспозиции. В противоположность этому, длительное воздействие при низкой
концентрации приводит к 100%-ной смертности насекомых в системе, где имеется увеличение концентрации двуокиси
углерода.
Обсуждение
Фумигант C2N2
способен исключительно быстро уничтожать насекомых при низких дозах и продолжительном периоде воздействия. Поэтому
его можно использовать в различных ситуациях. Полученные результаты указывают также
на то, что нет четкой зависимости между острой смертностью (или шоком) и конечной смертностью (см. пример 30).
Пример 36
Оценка токсичности дициана C2N2
и фосфина против древесных термитов в условиях сухой древесины по сравнению с бромистым метилом
Цель.
Оценить токсичность дициана C2N2 и фосфина как потенциальных
заменителей бромистого метила против трех видов древесных термитов в сухой древесине, а именно Cryptotermes brevis,
Cryptotermes cyanocephalos и Cryptotermes domesticus.
Материалы и
методы
Термитов получают из культур, поддерживаемых при температуре 30oС и относительной
влажности 80%. Насекомых переносят в склянки на 120 мл, снабженные крышками с клапанами
Мининерт и заполненные фанерной щепкой в количестве 325 мг, и герметизируют при данных условиях. Окуривание
производят для двух параллельных опытов на 10-11 насекомых вида С. brevis, 25 насекомых вида
С. cyanocephalos и 22 насекомых С. domesticus. Перед обработкой фумигантом из склянок с насекомыми удаляют
соответствующий объем воздуха. Пробы анализируют методом газовой хроматографии для того,
чтобы гарантировать определение концентрации фумиганта в том виде, как они были предсказаны. Второй набор
хроматограмм снимают перед аэрированием для того, чтобы гарантировать определение концентраций
фумиганта, которые оставались статическими во время экспозиции. Все процессы окуривания фумигантами
проводили при 30oС в течение 24 ч, за исключением того момента, когда пробы подвергали
газохроматографическому анализу, выполняемому при 25oС.
Концентрации дициана определяют на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax с внутренним диаметром 0,53 мм, фосфина - на хроматографе Шимадзу 6АМ с пламенно-фотометрическим детектором, а бромистого метила - на хроматографе Шимадзу 6АМ с пламенно-ионизационным детектором после разделения на колонке GasChromQ с 20% OV101.
После 24-часового воздействия термиты и фанерную щепку переносят в пластиковые чашки Петри, каждая из которых содержит большой кусок фанеры. Далее отмечают степень выживания насекомых как начальную, так и спустя 1 неделю.
Результаты
Результаты обработки для С. domesticus,
С. brevis и С. cyanocephalos приведены на фиг. 42-44 соответственно на основе оценки
степени выживания спустя 1 неделю.
Для С. domesticus достигают 100%-ной смертности после 24-часового окуривания посредством C2N2 с концентрацией, равной 0,87 мг/л, фосфина с концентрацией, равной 0,22 мг/л и метилбромида с концентрацией, равной 4,35 мг/л (фиг.42).
Для С. brevis достигают 100%-ной смертности после 24-часового окуривания
посредством C2N2 с концентрацией, равной 0,43 мг/л, фосфина с концентрацией, равной 0,43
мг/л и метилбромида с концентрацией, равной 1,74 мг/л (фиг.43)
Для С.
cyanocephalos достигают 100%-ной смертности после 24-часового окуривания посредством C2N2 с
концентрацией, равной 1,74 мг/л, фосфина с концентрацией, равной 0,43 мг/л и
метилбромида с концентрацией, равной 3,47 мг/л (фиг.44).
Обсуждение
Проведенные исследования
показали, что фумиганты С2N2 и фосфин обладают более
высокой токсичностью, по сравнению с бромистым метилом по крайней мере для трех видов древесных термитов для сухой древесины
и являются надежными заменителями бромистого метила для борьбы с этим
типом насекомых.
Из возможных альтернатив бромистому метилу для обработки древесины фосфин требует более длительного воздействия для уничтожения всех фаз Coleoptera, хотя и не требует этого при борьбе с термитами. Фтористый сульфурил сравнительно неэффективен против яиц большинства испытуемых видов. В противоположность этим выводам, как показано в других примерах, и особенно в примерах 34 и 35, дициан действует быстро и уничтожает яйца и все другие фазы Coleoptera и других отрядов насекомых. Пример 32 показывает, что концентрация C2N2, применяемая в камерах, содержащих твердую или мягкую древесину, дает величины произведения (СхТ), значительно превышающие величины, необходимые при борьбе с термитами.
Пример 37
Взаимодействие аминов с C2N2
Цель. Определить, является ли обратимой реакция C2N2 с аминами, т.е. можно ли рассматривать амин как
катализатор, способный к регенерации без изменений. Настоящая работа относится к возможным потерям питательной ценности аминов, например
лизина.
Материалы и методы
В
качестве модельного амина используют бензиламин, частично из-того, что лизин невозможно определить методом высокоэффективной жидкостной
хроматографии (ВЭЖХ) с помощью УФ-детектора.
Бензиламин (0,04М) в метаноле (20 мл) помещают в колбы Эрленмейера на 275 мл, снабженные газовыми мембранами, и вводят фумигант C2N2 (0,5 мл). Бензиламин определяют методом ВЭЖХ через определенные промежутки времени после введения фумиганта. После этого водят дополнительное количество дициана (5 мл) и процедуру повторяют.
Анализ проводят на колонке Олтек Ультима С18 (250 х 4,6 мм) (Alltech Ultima) с системным регулятором Шимадзу SC1-61A и программируемым мультидлинноволновым детектором. Подвижная фаза представляла собой 20% ацетонитрил, 80% воды к 100% ацетонитрила в течение 20 мин, скорость потока составляла 1 мл/мин.
Результаты
На хроматограмме через 26 ч
после введения 0,5 мл C2N2 присутсвуют
3 ярко выраженных пика. Они исчезали после 47,5 ч и вновь появлялись через 53,5 ч. На каждом из этих промежутков времени хроматограмма
продукта соответствовала безиламину. Эта картина противоречит
взаимодействию безиламина с другим фумигантом, серуглеродом, где лабильные пики были идентифицированы, но бензиламин при этом не
извлекался.
После же добавления 5 мл дициана отмечалось количественное извлечение бензиламина.
0,5 мл C2N2 содержит 2,2 х 105 молекул фумиганта, а число молекул бензиламина в 36 раз превосходило эту величину. Это соотношение уменьшается до 3,6 при добавлении 5 мл фумиганта. Поскольку две молекулы дициана способны реагировать с одной молекулой бензиламина, используемое молярное соотношение было более, чем адекватным для того, чтобы обнаружить необратимые изменения.
Обсуждение
Быстрая реакция аминов с
C2N2 обсуждалась в примерах 14 и 15.
Обратимый характер взаимодействия аминов (например, лизина) с C2N2 свидетельствует о том, что такие биологические
реагенты при этом не разрушаются, не приводя в результате к
потерям питательной ценности продукта.
Пример 38
Использование C2N2 в качестве фумиганта для
срезанных цветов и связанные с этом возможные
применения
Цель. Оценить способность C2N2 действовать в качестве фумиганта против
насекомых, обнаруженных на срезанных
цветах.
Материалы и методы
Насекомых собирают на свежесрезанных цветах (Protea и Thryptomene), помещают в стеклянные сосуды вместимостью около 8 мл и герметично закрывают
крышками, снабженными мембранами. Сосуды с
представителями каждого отряда насекомых используют в качестве контрольных, остальные же обрабатывают 1 мл C2N2 с концентрацией 92 мг/л,
получая конечную концентрацию, равную
около 11,5 мг/л. Сосуды оставляют при температуре окружающей среды (около 18oС) в течение 2 ч. По окончании этого срока насекомых проверяют на наличие
у них признаков жизни, аэрируют и
сохраняют для последующей идентификации.
Результаты
Контрольные сосуды показали отсутствие смертности на протяжении 2 ч, в то время как все
насекомые, клещи и паукообразные,
подвергнутые воздействию дициана, были мертвы после 2-часовой экспозиции (см. табл. 19А).
Обсуждение
Предварительные результаты показывают,
что C2N2
уничтожает насекомых, паукобразных и клещей этих видов, найденных на срезанных цветах, растущих растениях и в других местах. Уничтожаемые насекомые принадлежат отрядам
Thysanoptera, Coleoptera,
Colembola, Lepidoptera и Diptera. К другим основным отрядам относятся Aracina (клещи) и Arachnida (паукообразные). Перекрестная ссылка делается на борьбу с отрядами
Coleoptera (примеры 30 и 34),
Lepidoptera (пример 27), Diptera (пример 12) и Acarina (пример 40).
Пример 39
Влияние C2N2 на насекомых при различном
атмосферном давлении
Цель. Определить влияние высокого и низкого давления на токсичность C2N2. Два различных вредителя хранимых продуктов, а именно, Sitophilus oryzae и
Rhyzoperta dominica,
обрабатывают дицианом в резервуарах из нержавеющей стали, внутри которых поддерживают 1) давление окружающей среды, 2) давление, которое на одну атмосферу выше окружающего, и 3)
давление, которое на
пол-атмосферы ниже окружающего. Уровень конечной смертности определяют для этих двух видов насекомых после 24-часового воздействия определенной дозой C2N2
при трех указанных
выше величинах давления.
Материалы и методы
Окуривание проводят в цилиндрах из нержавеющей стали диаметром около 100 мм и длиной 353 мм. Цилиндры снабжены
торцовыми крышками,
которые закреплены болтами и герметизированы круглыми резиновыми прокладками. Каждая крышка имеет четвертьдюймовую впускную (или выпускную) трубку, которая соединена с трехходовым
краном или портом
с резиновой мембраной для отбора проб. Соответствующий аппарат изображен на фиг.46. Объем цилиндра вычисляют из высоты воды в наполненном сосуде.
Смешанные взрослые особи насекомых получают из лабораторных культур Sitophilus oryzae (штамм LS2) и Rhyzoperta dominica (штамм CPD2). Их помещают (в количестве 20 шт. на контейнер) в небольшие стеклянные трубки (диаметром 25 мм и длиной 25 мм), закрытые с обоих концов сеткой из нержавеющей стали с мелкими отверстиями. Три контейнера с насекомыми каждого вида (т.е. 6 контейнеров, 120 насекомых) помешают в цилиндр из нержавеющей стали, который затем закрывают. Цилиндры, в которые дозируют фумигант при атмосферном давлении или выше него, частично вакуумируют (давление снижают на 5-10 мм Нg), измеряют количество фумиганта, вводимого инжекцией через мембрану, и после этого давление выравнивают с атмосферным. Повышенного давления достигают посредством соединения с цилиндром воздуха до достижения необходимой величины. В цилиндрах низкого давления создают требуемый вакуум и перед подачей фумиганта измеряют его ртутным манометром. При нагрузке или разгрузке цилиндров все изменения давления осуществляют на протяжении по крайней мере одной минуты для того, чтобы избежать нанесения ущерба насекомым в результате быстрой смены давления (Ульрихс, 1994; Накакита и Кавашима, 1994) (Ulrichs; Nakakita and Kawashima). Абсолютное количество применяемого C2N2 составило 0,94, 0,4, 0,2 или 0,1 мг на литр объема цилиндра. После 24-часового окуривания концентрацию фумиганта в цилиндре проверяют методом газовой хроматографии, насекомых удаляют из зоны обработки и подсчитывают количество выживших организмов. Насекомых выдерживают до тех пор, пока можно определить уровень конечной смертности.
Результаты
Результаты исследования приведены в табл. 20. R. dominica более чувствительны к C2N2 и поэтому 100%-ной смертности
достигают
почти при всех дозах. При дозе 0,1 мг/л она составляет 63%. Установлено также, что токсичность C2N2 для менее чувствительного S. oryzae зависит от концентрации
фумиганта,
выраженной в виде дозы при нормальных температуре и давлении (нормальные условия). То есть, для одной и той же дозы (мг) на контейнер, как было установлено, токсичность ниже при более
высоком
давлении. Либо наоборот, исходя из абсолютных количеств фумиганта, его токсичность возрастает с уменьшением давления. С другой стороны, в тех случаях, когда дозу выражают в виде величины,
определяемой при нормальных условиях, установлено, что эквивалентные дозы фумиганта имеют один и тот же уровень токсичности (см. табл. 20).
Обсуждение
Данные табл. 20
говорят
о том, что токсичность дициана усиливается благодаря снижению давления в камере окуривания. Причина этого явления не доказана, однако возможно, что отмечаемые уровни токсичности отражают
практические
соотношения между C2N2 и кислородом (O2). Когда на дозы и давления сделаны поправки на на те же параметры, но определенные при нормальных условиях (табл.
1), то
становится очевидно, что давление само по себе не является определяющим параметром, поскольку эквивалентные дозы (при нормальных температуре и давлении) дают отклики, близкие к эквивалентным.
Перемена
в величине атмосферного давления, при постоянстве дозы фумиганта, эффективно изменяет соотношение между C2N2 и O2. То есть, для одной и той же дозы
окуриванию при
высоком давлении соответствует более низкое соотношение C2N2/O2, чем при низком, и уровень смертности при высоком давлении, соответственно, ниже, чем в
условиях
низкого давления. Полученные результаты противоречат данным Бонда (1962) (Bond), который предположил, что экспозиция в условиях повышенного содержания кислорода увеличивает токсичность
цианистого
водорода по отношению к насекомым.
Данные, иллюстрирующие способность C2N2 к применению при высоких или при низких давлениях, приведены в табл. 20.
Пример 40
Борьба с клещами с помощью C2N2
Цель. Определить эффективность C2N2 против клещей.
Материалы и
методы
Клещей помещают а колбы Эрленмейера на 270 мл, содержащие небольшое количество корма, выдержанного при 65%-ной влажности. Корм представляет собой шарики из риса,
выращенного без
применения химикатов, и дрожжи. Фумигант вводят через специальную мембрану.
Смертность от "нокдауна" наблюдают через определенные промежутки времени, то есть сначала производят оценку состояния неподвижности. После этого оценивают уровень смертности насекомых в конце периода воздействия, и затем снова после выдерживания на корме, кондиционированном при 65%-ной относительной важности.
Тестируемые виды насекомых включают Tyrophagus putrecentiae (широкораспространенный по земному шару детритный фидер) подотряда Astigmata.
Результаты
Результаты исследования приведены в табл. 21. Полного "нокдауна" достигают при низких значениях произведения (СхТ). Клещи полностью погибают путем воздействия на них концентрацией
1 мг/л. При малой
экспозиции, например, при 1 мг/л в течение 6 ч, мертвые клещи выглядели обычно, но не двигались. При высоких концентрациях или при более продолжительном периоде воздействия клещи
принимали сморщенный
вид.
Обсуждение
Уничтожение клещей в камерах окуривания коррелируется с их уничтожением при обработке цветов (см. пример 38) в режиме, при котором
фосфин не давал
результатов. Умение уничтожать как клещей, так и насекомых весьма важно во многих случаях, включая обработку помещений для хранения скоропортящихся продуктов и продуктов длительного
хранения, музеи и
другие объекты.
Пример 41
Борьба с заболеваниями растений с помощью C2N2
Цель. Определить эффективность C2N2 против
заболеваний растений.
Материалы и методы
Стандартную среду для размножения грибов растительного происхождения, пластины из картофельного агара с декстрозой и
глюкозой,
готовят в колбах Эрленмейера вместимостью 275 мл, снабженные пружинным соединением с мембраной для отбора проб. Все оборудование, включая крышки, были предварительно стерилизованы при
130o
С. Центр каждой агаровой пластинки засевают растительным грибом. К используемым видам относятся грибы, вызывающие такое заболевание растений, как выпревание: Gauemannomyces graminis,
разновидность
tritici, и Rhizoctonia solani.
Первый из двух видов является основной причиной потерь урожая пшеницы, а второй представляет собой общую причину потерь урожая во многих ситуациях.
Фумигант C2N2 добавляют в колбы через мембрану для отбора проб. Рассчитанные практические концентрации в опытах по уничтожению G. graminis составляют 0,6, 2,4, 6 и 15 мг/л вместе с контрольной пробой. Колбы оставляют при 22oС, через 24 ч крышки снимают, давая доступ воздуха к любому остатку фумиганта, а затем заменяют. Рассчитанные практические концентрации в опытах по уничтожению R. solani равны 0,78, 1,56, 3,1 и 12,5 мг/л, однако начальные измеренные содержания составили только 0,50, 1,0, 2,15 и 8,7 мг/л.
Все проводимые эксперименты дублируют.
Результаты
G.qraminis
Через 48 ч рост грибов ясно наблюдается в контрольных пробах, однако он отсутствует в любой из проб,
прошедших
обработку. В каждые из 3 последующих суток рост грибов в контрольной пробе прогрессировал, однако он также отсутствовал в любой из проб, содержащей грибы после окуривания.
Для R. so1ani диаметр колонии во время дозирования составляет 10-12 мм во всех случаях и эта величина регистрируется. Через сутки после дозирования фумиганта (24 ч) диаметр колоний в обработанных пробах не менялся, тогда как в контрольной пробе он увеличивался до 29 мм. Через 72 ч отмечался некоторый рост диаметра колонии до 27,5 мм в пробах, обработанных фумигантом с рассчитанной концентрацией 0,8 мг/л, в то время как при более высоких концентрациях никакого роста не наблюдалось. В результате средний диаметр колоний в контрольных пробах равнялся 61 мм.
Обсуждение
Борьба с
патогенами растений является важнейшей областью садоводства и сельского хозяйства и составляет основную причину применения в настоящее время на почве бромистого
метила.
Перекрестные
ссылки
В примерах 7 и 42 обсуждается сорбция в почве и эффективность применения фумиганта на почве. Также имеет отношение борьба с плесенью на пшенице
(примеры 21 и 41). Фумигант можно
применять в виде газа или раствора, причем каждый способ находит потенциальное применение для окуривания почвы.
Пример 42
Сорбция C2N2 почвой
Цель. Определить сорбцию C2N2 почвой с использованием образцов, взятых из предыдущих исследований с другими фумигантами (неопубликованные
результаты Матиссона, Демаршелье,
Шэклтона и By), при изучении токсичности дициана по отношению к долгоносику бахромчатому (см. пример 7).
Материалы и методы
Испытанию
подвергали почвы трех типов: суглинок
Pemberton, песчаная почва Myaluys и торфяник Sadie.
Почву (50 г) помещают в колбы Эрленмейера вместимостью 138,5 мл, герметизированные прокладками для ввода газа. Фумигант дозируют двумя путями. Первый - в виде газа путем инжекции 1 или 5 мл. Другой - то же самое количество в виде водного раствора, полученного добавлением 10 мл газообразного фумиганта к 20 мл 0,01М раствора соляной кислоты в колбы Эрленмейера на 25 мл.
Концентрацию фумиганта в свободном пространстве определяют на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке DBwax, имеющей внутренний диаметр 0,53 мм.
Все эксперименты дублируют с регистрацией среднего результата из двух параллельных определений.
Результаты
Результаты приведены в табл. 2.2. Для каждого способа применения концентрация фумиганта в свободном пространстве
быстрее падает на торфянистой почве, чем на почве других
типов. При этом начальная концентрация фумиганта в свободном пространстве была выше при добавлении его в виде газа, чем в виде водного
раствора.
Обсуждение
Эти результаты
вместе с данными, полученными в примере 7, согласуются с возможностью использования дициана в качестве почвенного фумиганта, независимо
от того, применяют его в виде газа или в виде жидкости. Такая
способность C2N2 к применению в двух различных состояниях является необычным свойством этого фумиганта.
Потери C2N2 на почве, измеренные благодаря его сорбции, допустимы с точки зрения уменьшенного его выделения в окружающую среду, хотя и затрудняют борьбу с насекомыми.
Величины произведения (СхТ), достигаемые на суглинке и песчаной почве, превышают те величины, которые необходимы для уничтожения грибов, вызывающих такое заболевание, как выпревание злаков (см. пример 41), хотя этот факт является исключительно показательным, ввиду различий в условиях проведения биологических испытаний.
Пример 43
Степень
конверсии C2N2 в цианистый водород в пшенице
Цель. Изучить с какой степенью происходит превращение дициана в цианид в зерне
Введение
В примере 15,
исходя из обзора литературных данных, было показано, что дициан может
разлагаться двумя путями: первый - до формиата и цианида, преобладающий при низких или высоких рН, и второй - до оксалата без
цианида, преобладающий при нейтральных значениях рН.
Материалы и методы
Цианид в пшенице определяют методом By и Демаршелье. Метод предусматривает стандартную процедуру,
разработанную Американской ассоциацией зерновых химиков (American
Association of Cereal Chemists, 1983), по удалению цианида из пшеницы путем дистилляции над водой и улавливания в разбавленной
щелочи. Она захватывает десорбированный цианистый водород в герметичной
колбе, содержимое которой затем подкисляют для того, чтобы получить возможность определить цианид в свободном пространстве
колбы. Следует отметить, что эта методика позволяет определить на практике
все компоненты, которые могут разлагаться с образованием цианида при определенных условиях, и рассчитать содержание таких
соединений, как цианистый водород.
Кроме того, уровень содержания цианида в зернах и бобах определяют по той же методике, исходя из среднего значения пяти параллельных определений.
Образец австралийской белой стандартной пшеницы с влажностью 11,6% помещают в колбы на 120 мл, заполненные зерном на 95% и снабженные герметичными клапанами Мининерт. В колбы инжектируют фумигант и обработанную пшеницу оставляют на хранение на различные периоды времени. Кроме того, обработанной пшенице дают взойти для оценки прорастания на присутствие остатков цианистого водорода.
Содержание как цианистого водорода, так и дициана определяют на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором после изотермического разделения на колонке DBwax при 60oС.
Результат оценивают по среднему значению, полученному из трех параллельных определений.
Результаты
Остатки цианида в различных зернах составляют в среднем 0,046 мг/кг для пшеницы, 0,11
мг/кг для canola, 0,058 мг/кг для гороха огородного, 0,125 мг/кг для ячменя и 1,1 мг/кг для
сорго.
Остатки цианида после окуривания с помощью C2N2 приведены в табл. 23. Полученные результаты показывают, что преобладающие потери C2N2 происходят не из-за разложения до цианида, однако такое разложение действительно имеет место. Сходимость параллельных определений процентной величины конверсии не очень хорошая и поэтому сам процесс превращения в цианид требует дополнительных исследований.
Обсуждение
Дициан
интенсивно не разлагается на пшенице до цианида. Таким образом, его эффективность не
основана на том, что является предшественником цианида. Цианистый водород не был идентифицирован и в примере 3.
Пример 44
Инактивация вируса с помощью раствора C2
N2
Цель. Произвести оценку антивирусной активности C2N2
Введение
Для того чтобы оценить антивирусную активность дициана авторы выбрали для
рассмотрения две системы "вирус-клетка хозяина". Первая включает нуклеарный полигедронный вирус (HПB)(NPV) и
его чешуйчато-крылого хозяина Helicoverpa armigera, и вторая - небольшой РНК-содержащий
вирус, первоначально выделенный из сверчков, а именно вирус, вызывающий у них паралич (Cricket Paralysis Virus
- CrPV), и толерантную клеточную линию Drosophila melanogaster (Скотт, 1972) (Scott).
Нуклеарные полигедронные вирусы представляют собой вирусы, содержащие большие двухцепочечные ДНК, с кольцевыми геномами в области 120-150 тыс. комплементарных пар (гетероциклических оснований нуклеиновой кислоты) (мера молекулярной массы). Они составляют одну из трех групп инсектицидных вирусов (две другие представляют собой цитоплазмические полигедронные вирусы и энтомофоксвирусы), которые характеризуются созревшими вирусными частицами, внедренными в большую псевдокристаллическую протеиновую матрицу, известную как полигедральные тельца включений (или полигедральные вирусные включения) (ПТВ)(Р1В). ПТВ как правило составляют свыше микрона в диаметре и содержат от 20 до нескольких сотен вирусных частиц, внедренных в протеиновую матрицу. Обычно нуклеарные полигедронные вирусы инициируют инфекцию в насекомом-хозяине после заглатывания им ПТВ. В щелочных условиях передней кишки насекомого ПТВ растворяются, высвобождая частицы вируса для установления инфекции в восприимчивой клетке (обычно базальные цилиндрические клетки у апекса средней кишки). После первоначальной репликации вирус продолжает заражать большое число тканей в насекомом-хозяине, что в результате приводит к его смерти в интервале 4-8 сут (в зависимости от температуры и начальной дозы заражения).
Небольшой РНК-содержащий вирус, вызывающий паралич у сверчков (CrPV), был первоначально выделен из них, хотя впоследствии его стали получать из разнообразных видов насекомых, и, как было установлено, он полностью повторяет свойства оригинала (Крисчен и Скотти, 1994) (Christian and Scotti). В противоположность вирусу NPV, вирус CrPV имеет геном из одноцепочечной ДНК массой около 8 килобаз (8 тысяч гетероциклических оснований нуклеиновой кислоты) и кодирует только четыре основных структурных белка и реплику. CrPV, как было установлено, легко воспроизводится в клеточных линиях, полученных из плодовой мушки Drosophila melanogastеr (Скотти, 1976) и эта толерантная клеточная система используется для рутинных исследований при оценке титра вируса.
Материалы
1) Стандартная суспензия, содержащая нуклеарный
полигедронный вирус Helicoverpa armigera (HaNPV) с числом полигедральных вирусных включений (PIBs) 1,8xl07,
хранимая при температуре 4oС.
2) Вирус, вызывающий паралич у сверчков (Cricket Paralysis Virus) (CrPVvic/Gm/D22) (Teleogryllus commodus, Виктория, Австралия)(Крисчен и Скотти, 1994). Нетитрованный стандартный раствор, хранимый при -20oС.
3) Клеточные линии 2(DL2) Drosophila melanogaster из поддерживающей среды Шнайдера (Schneider, 1972) с добавкой 10% фетальной телячьей сыворотки.
4) Стандартная питательная среда для Helicoverpa (Шори и Хейл, 1960) (Shorey and Hale) без формалина, распределенная на аликвоты по 4 мл в студневидных лотках J2 (Nu-тренд контейнеры, Джексонвилл, шт.Флорида, США).
5) Стандартный раствор фумиганта C2N2; в дважды дистиллированной воде с конечной концентрацией 2 мг/мл. Раствор получают путем добавления 59 мл газа в 15 мл воды в колбе Эрленмейера с измеренной вместимостью 27,5 мл и определения коцентрации в воздухе и воде.
6) Дважды дистиллированная вода.
7) Склянки Маккартни (McCartney) на 5 мл с пробками из неопрена. Фактическая измеренная емкость составляет 6,8 мл.
8) Стандартный плоскодонный титрационный микропланшет с 96 лунками (фирма Краун Корнинг, Корнинг, Нью-Йорк)(Crown Corning).
9) Теплоизолирующий материал Милартм (фирма Дюпон Австралия Птд., Бейсуотер, Виктория)(DuPont Australia Ltd.).
Методы
Обработка проб вируса
1. Две аликвоты (100 мкл HaNPV или CrPV) распределяют
в склянки Маккартни (McCartney) на 5 мл с фактической емкостью 6,8 мл. К одной
аликвоте добавляют 900 мкл дважды дистиллированной воды (необработанная контрольная проба), а ко второй 900 мкл
стандартного раствора дициана (обработанный раствор). В пятую склянку помещают холостой
раствор C2N2 (1 мл раствора дициана).
2. Все склянки плотно закупоривают и оставляют на ночь (16 ч) при температуре 4oС.
3. Перед биотестом концентрацию C2N2 измеряют в газовой фазе над пробами. Определения проводят на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором после изотермического разделения на колонке DBwax с внутренним диаметром 0,53 мм при 60oС.
Биотест с HaNPV
1) Пробы HaNPV разбавляют в соотношении 1:10 дважды
дистиллированной водой с получением предлагаемой конечной концнтрацией 1.1,8x108PlBs/мл.После этого серию
разведении делают как для необработанной, так и обработанной пробы, для которой
предлагаемые конечные концентрации составляют 7,2х104, 1,8х104, 7,2х103, 1,8х103 и 7,2х102 PIBs/мл.
2) 100 мкл каждого разведения, содержащего вирус, разливают в каждую из 25 лунок студневидных лотков J2, содержащую 4 мл стандартного питательного рациона (среды) для Helicoverpa; суспензию размазывают по поверхности среды с помощью стеклянной палочки. В промежутках между внесением отдельных разведений стеклянную палочку стерилизуют в пламени горелки.
3) После высушивания лотков с лунками на воздухе в течение 15-30 мин в каждую лунку индивидуально помещают личинку HeUcoverpa armigera возрастом 24 ч (поддерживаемую при 25oС - средняя или первая возрастная стадия), накрывают перфорированными пластинками из Милара для движения газа и потки штабелируют, разделяя их сеткой из металлической проволоки.
4) Для того чтобы отделить действие дициана на вирус от его возможного действия на насекомых, пробу из 25 насекомых обрабатывают по описанной выше методике, но с добавлением к питательной среде перед сушкой стандартного раствора C2N2 (холостого), разбавленного в соотношении 1:10, а также сохраняют в необработанном виде группу из 50 личинок.
5) Насекомых выдерживают при 30oС и относительной влажности 70% и производят подсчет на третьи и десятые постинфекционные сутки. Личинки, погибающие в течение 3 суток, рассматривались как погибшие по другой причине, отличной от вируса NPV, и исключались из последующего анализа.
Биотест с СrРУ
1) Клетки субкультивируют из
конфлюентного монослоя клеток DL2 при разведении 1/100.
2) 40 мкл этой клеточной суспензии разливают в каждую из 96 лунок титрационного микропланшета и клеткам дают закрепиться в течение 1 ч.
3) Пробы вируса CrPV разводят дистиллированной водой (1:10) и большие осколки удаляют центрифугированием в течение 2 минут при скорости вращения 14000 об/мин на вертикальной центрифуге.
4) Готовят серию десятикратных разведений для вируса в стерильной среде Шнайдера с добавлением фетальной телячьей сыворотки и аликвоту в 50 мкл каждого разведения вносят в каждую из 8 лунок титрационного микропланшета, содержащую закрепленные клетки DL2.
5) В дополнение к двум пробам вируса (необработанная контрольная и обработанная проба) аналогичным образом титруют и холостой раствор C2N2.
6) Клетки
выдерживают при 27oС и производят подсчет через 7 суток на наличие видимого
цитопатического эффекта (С.Р.Е.)
Результаты
Измерение C2N2
Теоретическое количество добавленного C2N2 на одну склянку составляет
1,8 мг. Коэффициент распределения был измерен как 1,1, то есть вес фумиганта в воздухе (на мл) был в 1,1
раза выше, чем его вес в воде (на мл). Поэтому концентрация его в воде составила около 0,25
мг/мл. Таким образом, масса в 1,8 мг в склянке на 6,8 мл приводит в исследуемой системе к теоретической
концентрации в водной фазе, равной 0,25 мг/мл.
Концентрацию в стандартном растворе C2N2 оценивают перед дозированием (2 мг/мл) и затем измеряют через 2 недели после него. Как было установлено, она равнялась 1,6 мг/мл. Концентрацию в склянке Маккартни, имеющую непосредственное отношение к проводимой оценке, также измеряли путем быстрого удаления крышки, отбора пробы с помощью воздухонепроницаемого шприца и повторной герметизации. Определенное по этой методике количество добавленного C2N2 составило лишь 25% от теоретического для HaNPV и 23% для CrPV. Столь низкий выход, вероятно, обусловлен сочетанием как низкой дозы, так и методикой отбора проб, которые привели к недооценке реального содержания газа.
Биотест с HaNPV
1) Показатели смертности, определенные через 10 суток в тест-группах на вирус
(необработанная контрольная и обработанная проба) приведены в табл. 24.
2) Используя данные таблицы и компьютерную программу POLO, проводят соответствующий пробит-анапиз. Концентрацию вируса выражают в виде PIBs/мм2 (площадь поверхности рациона в каждой лунке лотка J2 составляет 770 мм2). Для необработанной контрольной пробы интервал верхнего и нижнего значений при доверительной вероятности 95% составляет 1,094-1,571 PIBs/мм2; оценка величины LC50-1,960 PIBs/мм2. Для обработанной пробы величину LC50 оценить было невозможно.
3) Отсутствуют видимые расхождения между результатами для насекомых, поддерживаемых на рационе, обработанном перед сушкой раствором C2N2 с концентрацией 0,025 мг/мл, и результатами для насекомых, оставшихся необработанными.
Биотест с СrРV
1) Титры и стандартные отклонения вируса в двух пробах оценивают методом
Рида и Мюнша (Reed and Muench)(cм. Дэвис с сотр., l968)(Davis еt а1.).
2)
Титры обеих проб составляют:
Необработанная контрольная проба - 1,38х108 IU*/мл(+/-4,
36х107)
Обработанная проба - 2,21х105 IU/мл(+/-6.98х104)
* IU - инфекционные единицы
3) Титрование холостого раствора C2N2 показало, что дициан обладает высокой цитотоксичностью по отношению к клеткам DL2
при концентрации 0,4 мг/мл в воде, однако для концентрации на порядок меньшей (1/10 от этой величины) эффекта
не наблюдается.
Обсуждение
Инактивация HaNPV раствором C2N2
1) Из представленных данных следует, что C2N2 в растворе с
конечной концентрацией 0,25 мг/мл инактивирует вирус HaNPV, по крайней мере в 240 раз
через 16 ч при температуре 40oС, то есть наивысшая предлагаемая концентрация вируса в обработанной
пробе (1,8х105 PIBs/мл) не приводит к смертельному исходу, наблюдаемому при
наинизшей концентрации (7,2х102 PIBs/мл) в необработанной контрольной пробе.
Инактивация СrРV
1) Из представленных данных следует, что C2N2
в растворе с концентрацией 0,25 мг/мл инактивирует вирус CrPV в 640 раз после обработки при 4oС
с вечера (и в течение всей ночи).
Обсуждение
Способность бороться
с вирусами имеет огромное значение при обработке целого ряда зон, к которым относятся медицинские,
зубоврачебные, ветеринарные и научно-исследовательские помещения и находящееся в них оборудование.
Это свойство дициана является дополнением к его способности для борьбы с бактериями (пример 19), с
плесенью (пример 21) и грибковыми заболеваниями (пример 41). Его способность проходить через воду
(пример 22) и его активность, проявляемая как в паровой фазе, так и в растворе, представляет собой
важный и новый аспект борьбы с вирусными инфекциями, бактериями и другими организмами, которые
составляют важную проблему для здоровья человека и животных.
Пример 45
Влияние
кислорода при различных концентрациях и влияние углекислого газа при различном давлении на
токсичность C2N2
Цель. Определить эффект различного содержания кислорода и
различного давления углекислого газа на токсичность C2N2.
Материалы и методы
Фумигацию проводят в цилиндрах из нержавеющей стали, описанных в примере
39. Взрослые особи SitophiIus oryzae обрабатывают дицианом в сосудах из нержавеющей
стали, в которых содержание кислорода доводят до 60, 20 или 10%. Аналогичным образом взрослые особи Sitophilus
oryzae обрабатывают дицианом в присутствии 50 и 30% углекислого газа при давлении, на 1
атм выше окружающего, а также в присутствии 30% углекислого газа при атмосферном давлении. Конечный уровень
смертности определяют после 24-часового воздействия при заданной концентрации дициана.
Смешанные взрослые особи насекомых отбирают из лабораторных культур Sitophilus oryzae (штамм LS2) и помещают (в количестве 20 шт. на контейнер) в маленькие стеклянные трубки (диаметром 25 мм и длиной 25 мм), закрытые с обеих концов проволочными сетками из нержавеющей стали. Три контейнера помещают в цилиндр из нержавеющей стали, который затем закрывают. Различные концентрации O2 создают путем нагнетания в цилиндр под давлением кислорода или азота из баллонов до тех пор, пока не будет достигнуто необходимое кислородное соотношение в смеси, а затем снижают давление до атмосферного посредством выпуска газа в атмосферу. Различные концентрации углекислого газа создают аналогичным образом. При нагрузке или разгрузке цилиндров все изменения в давлении осуществляют по крайней мере в течение одной минуты для того, чтобы избежать нанесения ущерба насекомому, возможного из-за быстрой смены давления в системе (Ульрихс, 1994; Накакита и Кавашима, 1994). Абсолютное количество используемого C2N2 составило 0,94, 0,4, 0,2 или 0,1 мг/л. Для каждого рабочего цилиндра (с обработкой) создают контрольный вариант (холостой опыт). После 24-часового окуривания концентрацию фумиганта в цилиндрах определяют методом газовой хроматографии, насекомых удаляют из рабочих и контрольных цилиндров и подсчитывают выжившие организмы. Насекомых сохраняют до окончательной возможности определения уровня смертности.
Результаты
Полученные результаты представлены в табл. 25 и 26. Уменьшение кислорода ниже уровня его нормального
содержания (но все же выше того уровня,
когда можно ожидать аноксии), почти не оказывает влияния
на токсичность C2N2. Однако имеется доказательство в пользу того, чтобы
предположить, что высокие содержания кислорода снижают токсичность фумиганта при низкой концентрации C2N2 (табл. 25).
Присутствие увеличенного содержания углекислого газа, как было установлено, усиливает токсичность C2N2. Для 30% CO2 при давлении выше окружающего на 1 атм достигают уровня смертности в 75%, причем последний возрастает до 100% в присутствии лишь 0,1 мг/л C2N2 (табл. 26).
Обсуждение
Токсичность C2N2 снижается благодаря
присутствию кислорода в количестве, превышающем его содержание в окружающей среде, но не поддается влиянию со стороны
более низких концентраций (предполагая, что содержание кислорода выше того уровня,
при котором наблюдается аноксия). Двуокись углерода усиливает токсичность C2N2 (см. пример 2),
причем эффект усиливается при увеличении давления (пример 39). Использование
двуокиси углерода и повышенного давления является существенным при обработке ценной продукции в герметизированных камерах
окуривания.
Пример 46
Использование C2
N2 в качестве фумиганта для срезанных цветов и связанные с этом возможные применения
Цель. Оценить
способность C2N2 действовать в качестве фумиганта против
насекомых, как правило обнаруживаемых на срезанных цветах.
Материалы и методы
Насекомых
собирают на свежесрезанных цветах (Ргоtеа и Thryptomene), помещают в стеклянные
сосуды вместимостью около 8 мл и герметично закрывают крышками, снабженными мембранами. Сосуды с представителями каждого
отряда насекомых используют в качестве контрольных, остальные же обрабатывают
1 мл C2N2 с концентрацией 92 мг/л, получая конечную концентрацию, равную около 11,5 мг/л. Сосуды
оставляют при температуре окружающей среды (около 18oС) в течение 2
ч. По окончании этого срока насекомых проверяют на наличие у них признаков жизни, аэрируют и сохраняют для последующей
идентификации.
Результаты
Контрольные сосуды показали
отсутствие смертности на протяжении 2 ч, в то время как все насекомые, клещи и паукообразные, повергнутые воздействию
дициана, были мертвы после 2-часовой экспозиции (см. табл.26А).
Обсуждение
Предварительные результаты показывают, что C2N2 уничтожает насекомых,
паукобразных и клещей указанных видов, найденных на срезанных цветах, растущих
растениях и в других местах. Уничтожаемые насекомые принадлежат отрядам Thysanoptera, Coleoptera, Colembola, Lepidoptеrа
и Diptera. К другим основным отрядам относятся Aracina (клещи) и Arachnida
(паукообразные). Перекрестная ссылка делается на борьбу с отрядами Coleoptera (примеры 30 и 34), Lepidoptera (пример 27),
Diptеrа (пример 12) и Acarina (пример 40).
Пример 47
Смертность яиц Dacus tyroni (дрозофилы Queensland), обработанных C2N2
Цель. Определить
токсичность водного раствора C2N2 против насекомых вида
Dipteran, яиц Dacus tyroni (дрозофилы Queensland) и концентрацию газа в течение периода воздействия для расчета величины
произведения "концентрация х время".
Материалы и методы
Яйца D. tyroni обрабатывают при 25oС в течение 2 ч при двух параллельных опытах семью различными
концентрациями (включая контрольный опыт) C2N2, растворенного в
0,01М растворе соляной кислоты. 10 мл 0.01М раствора НС1 помещают в семь сосудов на 16 мл, снабженных
газонепроницаемыми клапанами Мининерт, и очень медленно инжектируют в каждый сосуд 0; 0,45; 4,5;
9,0; 18,0; 27,0 или 36,0 мл чистого 72%-ого газообразного C2N2. Это отвечает
содержанию 0,68; 684; 1369; 2738; 4106 и 5475 мг/л C2N2 в растворе
соответственно.
Яйца приблизительно в возрасте 200±10 дней помешают на увлажненные полоски фильтровальной бумаги размером 7 х 1 см, которые прикрепляют с помощью ленты к пластинкам из нержавеющей стали размером 14,11 х 1 см. Каждую пластинку помещают в колбу Эрленмейера, закрытую герметично притертой стеклянной крышкой с мембраной. 0,1 мл каждого раствора C2N2 вводят в две колбы с помощью шприца для жидких проб фирмы Пресижн Сэмппинг Корп. (Precision Sampling Corp.), проявляя осторожность во избежание соприкосновения яиц с раствором. Эта операция соответствует получению концентраций, приблизительно равных 0,025; 0,25; 0,5; 1,0; 1,5 и 2,0 мг/л газообразного C2N2 в параллельных колбах. Кроме того, готовят контрольные лабораторные пробы (также две параллельные) на увлажненной фильтровальной бумаге в чашках Петри, заполненных питательной средой (сушеная морковь, дрожжи torula, нипагин, соляная кислота и вода), и выдерживают в помещении с контролируемой температурой при 25oС и относительной влажности 59% в течение всего периода воздействия.
Концентрации C2N2 в свободном пространстве каждой колбы измеряют на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором на колонке с DBwax мегабор. Температура колонки - 60oС, инжектора - 100oС и детектора - 288oС. Расчет концентраций производят с использованием трех стандартов, содержащих 0,25, 0,4 и 1,51 мг/л C2N2 и приготовленных в колбах Эрленмейера на 1,2 л. Из полученных результатов расчитывают произведения "концентрация х время" (СхТ) для каждой из проб.
После 2-часового воздействия газа колбы аэрируют под тягой и бумажные полоски с яйцами помещают на увлажненные кружки фильтровальной бумаги диаметром 7 см в чашках Петри, содержащих питательную среду, и выдерживают при температуре 25oС и относительной влажности 59%. Оценку уровня смертности производят методом подсчета числа яиц, остающихся каждый день на протяжении 6 сут.
Результаты
Концентрации, измеренные произведения (СхТ) и уровень смертности в % приведены в табл. 27. Смертность
рассчитывают путем сравнения числа невыведенных яиц в рабочих пробах с числом яиц в контрольных
пробах (табл. 28). Колба и лабораторные контрольные пробы содержат в среднем 33 из 200 нерасплодившихся
яиц, поэтому, чтобы учесть этот факт, общее число обработанных яиц было уменьшено до 167. Пробы
1-4 показали более высокую степень расплода, чем контрольные (в среднем 183 при 0,025 мг/л и 186 при 0,
25 мг/л), свидетельствуя о том, что низкие концентрации C2N2 могли бы
оказать благотворное действие. Полагают, что эти пробы содержат выжившие организмы в 100%-ном количестве.
Полной смертности достигают при концентрациях более 1,5 мг/л в течение 2 ч (произведение СТ
равно 2,1 мг•ч/л), более чем 73%-ной смертности - при концентрации 1,0 мг/л (произведение СТ равно 1,
4 мг•ч/л), 5%-ной смертности - при 0,5 мг/л (произведение СТ равно 0,8 мг•
ч/л) и отсутствие смертности - при 0,25 мг/л и ниже (произведение СТ равно 0,38 мг•ч/л).
Кроме того, при 1,0 мг/л расплод задерживается на 24 ч, по сравнению с контрольными пробами и более низкими концентрациями.
Обсуждение
Полной смертности яиц D. tyroni
достигают при концентрациях фумиганта более 1,5 мг/л в течение 2 ч или при величине
произведения СТ, равного 2,1 мг•ч/л. Этот результат аналогичен результату, описанному в примере 12 при
изучении воздействия на личинки этого вида насекомых. Из полученных результатов можно
сделать следующие выводы:
- C2N2 эффективен при применении в виде водных растворов.
Соответствующая химия фазового распределения обсуждается в примерах 22 и 31;
- C2N2 эффективен против яиц, а также других фаз насекомых, как и продемонстрировано в
примере 34.
Пример 48
Свойства C2N2 как
системного пестицида
Цель. Определить возможность применения C2N2 как системного
пестицида на растениях способом нанесения водного раствора фумиганта.
Материалы и методы
Рассаду Freesia и Сineria, взятую из местного питомника, пересаживают из горшочков в
стеклянные сосуды на 60 мл и поверхность почвы герметизируют с помощью расплавленного
парафинового воска. Два сосуда с почвой от отброшенных растений также заливают парафином.
Водный раствор дициана готовят путем пропускания 10 мл 84% C2N2 в 60 мл водопроводной воды. Каждое растение и почву в стеклянных сосудах заливают 5 мл приготовленного водного раствора. Этот процесс осуществляют путем инжектирования раствора через слой парафина в почву каждого сосуда и последующей повторной заливки отверстия от прокола дополнительным количеством расплавленного парафина. Каждую пробу помещают внутрь стеклянного контейнера на 525 мл и герметично закрывают винтовой крышкой с мембраной. В два пустых 525 мл контейнера непосредственно вводят 5 мл водного раствора C2N2.
Концентрацию C2N2 в свободном пространстве измеряют на газовом хроматографе Вариан 3300 со специфическим термоионизационным детектором после разделения на колонке с DBwax с внутренним диаметром 0,53 мм.
Концентрацию C2N2 в верхнем свободном пространстве для каждого опыта выражают в виде его процентного содержания в свободном пространстве контрольных контейнеров (когда водный раствор C2N2 добавляют в пустой контейнер). Фиг. 47 иллюстрирует тот факт, что растения являются переносчиками C2N2 из почвы в свободное пространство контейнера. Контрольный образец почвы (парафиновый воск наливают поверх почвы) свидетельствует о том, что парафиновый герметик является относительно непроницаемым материалом для C2N2, и поэтому содержание последнего вверху контейнера можно приписать систематическому переносу дициана растениями.
Через 24 ч листву удаляют и взвешивают, а затем помешают в сосуд на 8 мл, снабженный винтовой крышкой с мембраной. Содержание C2N2 определяют путем добавления в каждый сосуд 2 мл тетрагидрофурана и последующего измерения концентрации C2N2 в верхнем свободном пространстве. Для сравнения 5 мкл 84% C2N2 добавляют к 2 мл тетрагидрофурана в аналогичном сосуде на 8 мл. Количество фумиганта, обнаруженного в листве, приведено в табл.28А.
Обсуждение
Как показывают данные о
количестве фумиганта, перенесенного в верхнее свободное пространство контейнеров,
а также обнаруженного в листве, поведение C2N2 в растениях носит системный характер. Такая
систематическая активность очень важна при борьбе с насекомыми и болезнями растений.
Перекрестная ссылка делается на пример 22, относящийся к прохождению C2N2 через воду.
Пример 49
Сравнительное поведение C2N2,
фосфина и бромистого метила на пшенице
Цель. Сравнить степень сорбции и десорбции C2N2,
фосфина и бромистого метила на пшенице.
Введение
Фумиганты абсорбируются изделиями в процессе окуривания, а после обработки способны десорбироваться из них. Этот факт имеет
большое значение для самого процесса и безопасного обращения с фумигантами
и изделиями, прошедшими обработку.
Материалы и методы
Пробы пшеницы (25 г) помещают в конические
колбы на 250 мл известного объема. Колбы закрывают газонепроницаемыми
пробками, содержащими резиновые прокладки для впуска газа, и дозируют дицианом (10 мг/л), фосфином (2 мг/л) или бромистым метилом
(32 мг/л). Через 2 ч измеряют концентрацию фумиганта в верхнем
свободном пространстве методом газовой хроматографии. Каждую колбу после этого открывают и пробу пшеницы быстро аэрируют путем высыпания
из одного контейнера в другой. После измельчения в
непроницаемой для газа канистре смесителя Уоринга (Waring), имеющей отверстие для отбора проб, количество оставшегося сорбированного фумиганта
оценивают по результатам анализа свободного верхнего
пространства на определение выделенного фумиганта.
Результаты
В свободном верхнем пространстве через 24 ч остается 91%
начального количества фосфина, 69% метилбромида и 10%
дициана, причем газовая хроматография показала, что 3% первоначального количества C2N2 превращается в HCN. Наибольшее
извлекаемое количество фумиганта в пробах пшеницы, как было
установлено, равно 11,78 ppm (вес.) для метилбромида, 0,48 ppm (вес.) для C2N2 и 0,05 ррm) (вес) для фосфина. Вместе с
извлеченным C2N2 присутствует около
1 ppm HCN.
Обсуждение
Применяемые дозы соответствуют рекомендуемому или возможно эффективному количеству, которое
необходимо для проведения эффективной обработки пшеницы.
Полученные результаты показывают, что количество C2N2, которое может десорбироваться из свежеобработаной пробы зерна, по
всей вероятности, не создает особых проблем для
безопасного обращения с обработанной продукцией (пример 3). Здесь достаточны обычные правила безопасности, связанные с практикой окуривания. Из общего
количества введенного C2N2
(около 2500 мкг) содержание его в пшенице составляет 10 мкг C2N2 и 20 мкг HCN; эти данные говорят о том, что конверсия дициана в
HCN является второстепенным метаболическим
путем.
Экспериментальная работа с фумигантом и его газообразными и жидкими препаративными формами показала, что его можно использовать в качестве инсектицида, фунгицида, бактерицида, гербицида, нематоцида, антисептика и в качестве ингибитора плесени, причем последнее применение в особенности ценно для влажного зерна. В качестве стерилизующего агента в некоторых случаях дициан является подходящей заменой для этиленоксида и других соединений, используемых для стерилизации в больницах, а также в зубоврачебных и ветеринарных помещениях. Фумиганты, описанные в настоящем изобретении, используются для обработки древесины и изделий из дерева, почвы, растений и срезанных цветов. Настоящее изобретение полезно при проведении окуривания складированного зерна, орехов и других сыпучих пищевых продуктов, растений, фруктов, овощей и мяса.
Реферат
Описывается фумигант, содержащий дициан в концентрации 0,01 - 160 мг/л в виде раствора либо в сочетании с газом-носителем. Описывается также способ фумигации готового продукта и/или конструкции. Технический результат - дициан дает очень низкие остаточные количества и легко удаляется из обработанных изделий. 2 с. и 10 з.п.ф-лы, 32 табл., 47 ил.


Комментарии