Применение бензоксаборолов в качестве антимикробных агентов для обработки мясных продуктов, растений или частей растений - RU2595157C1
Код документа: RU2595157C1
Чертежи


Описание
Предшествующий уровень техники
Ряд соединений, содержащих оксаборольное кольцо, был описан ранее. Однако, до сих пор не сообщалось, что эти оксабороловые соединения являются летучими антимикробными агентами. Кроме того, эти оксабороловые соединения не использовались в сельском хозяйстве.
Таким образом, необходимость в поиске новых сфер применений различных летучих антимикробных агентов и/или их комбинаций с летучим регулятором роста растений, в частности, в сельском хозяйстве, остается актуальной.
Описание сущности изобретения
Настоящее изобретение относится к применению летучего антимикробного соединения в целях уничтожения патогенов, поражающих мясные продукты, растения или части растений. Рассматриваемыми летучими антимикробными соединениями являются некоторые соединения оксаборола, например, бензоксаборолы. Настоящее изобретение относится к системам доставки, разрабатываемым с учетом летучей природы этих антимикробных соединений. В настоящем изобретении также раскрываются комбинации с летучим регулятором роста растений, например, с 1-метилциклопропеном (1-MCP).
В одном из своих аспектов, настоящее изобретение относится к способу применения летучего антимикробного соединения в целях уничтожения патогенов, поражающих мясные продукты, растения или части растений. Это способ включает контактирование мясных продуктов, растений или частей растений с эффективным количеством летучего антимикробного соединения, имеющего структуру формул (I), (II) или (III):
где q1 и q2 независимо равны 1, 2 или 3;
q3=0, 1, 2, 3 или 4;
M представляет собой водород, галоген, -OCH3 или -CH2-О-CH2-О-CH3;
M1 представляет собой галоген, -CH2OH или -OCH3;
X представляет собой O, S или NR1c, где R1cпредставляет собой водород, замещенный алкил или незамещенный алкил;
R1, R1a, R1b, R2 и R5 независимо представляют собой водород, OH, NH2, SH, CN, NO2, SO2, OSO2OH, OSO2NH2, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил;
R* представляет собой замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарил, замещенный или незамещенный гетероарилалкил, или замещенный или незамещенный винил;
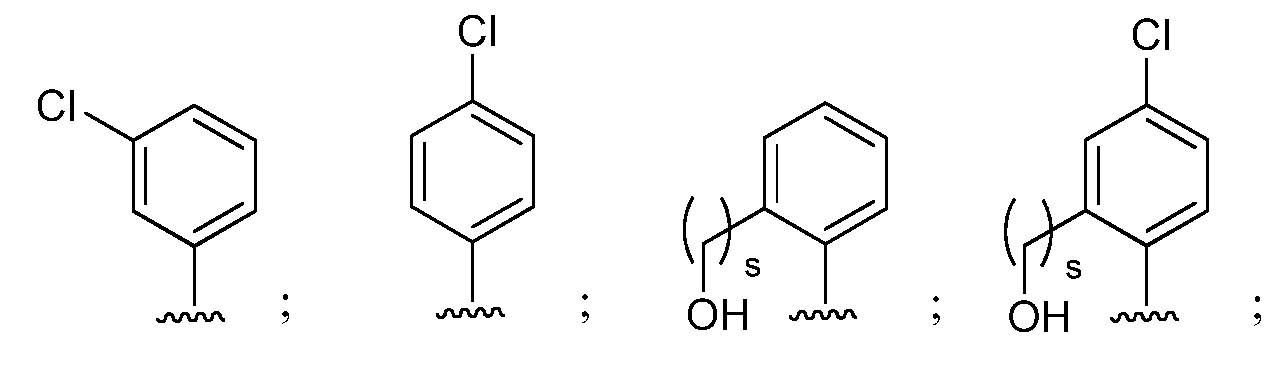
при условии, что если М представляет собой F, то R* не является членом, выбранным из:
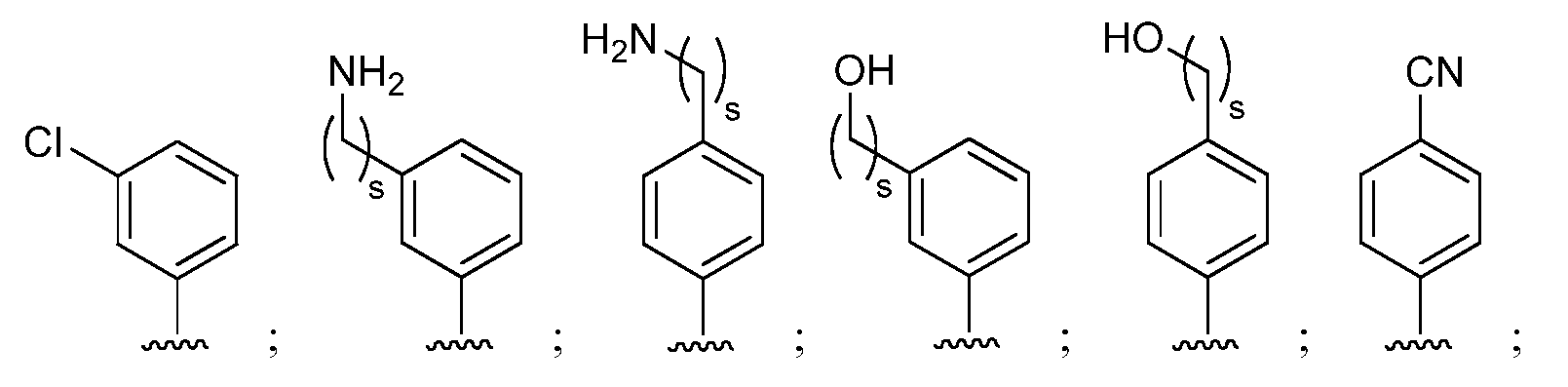
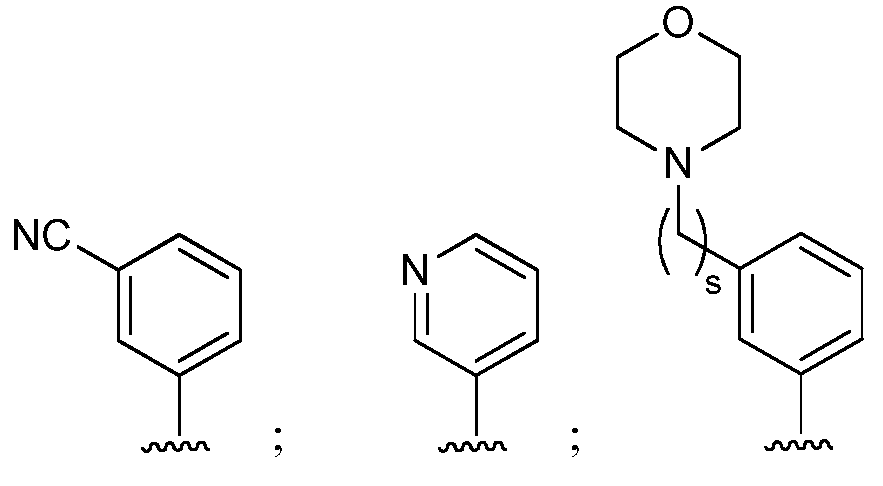
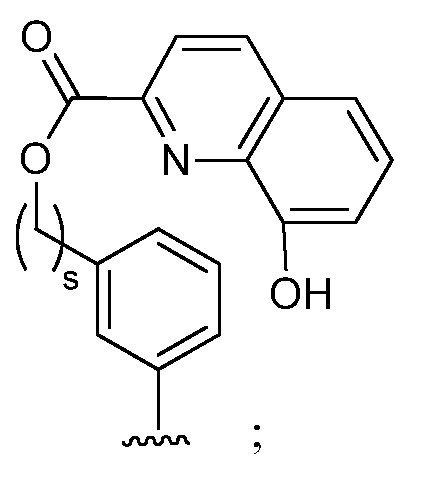
при условии, что если М представляет собой Cl, то R* не является членом, выбранным из:
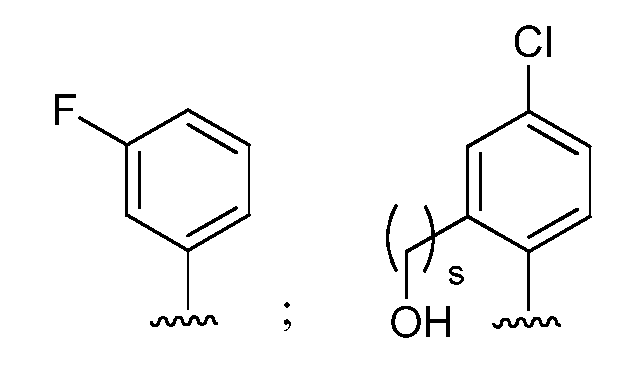
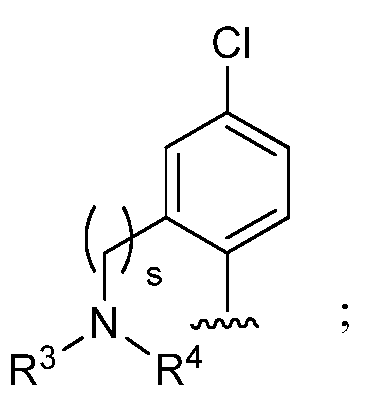
и при условии, что если М представляет собой водород, то R* не является членом, выбранным из:
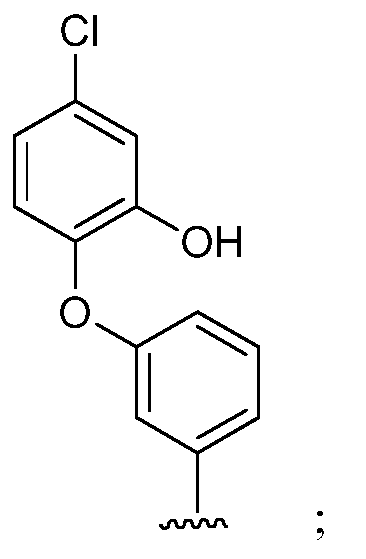
где s=1 или 2; и R3 и R4 независимо представляют собой метил или этил;
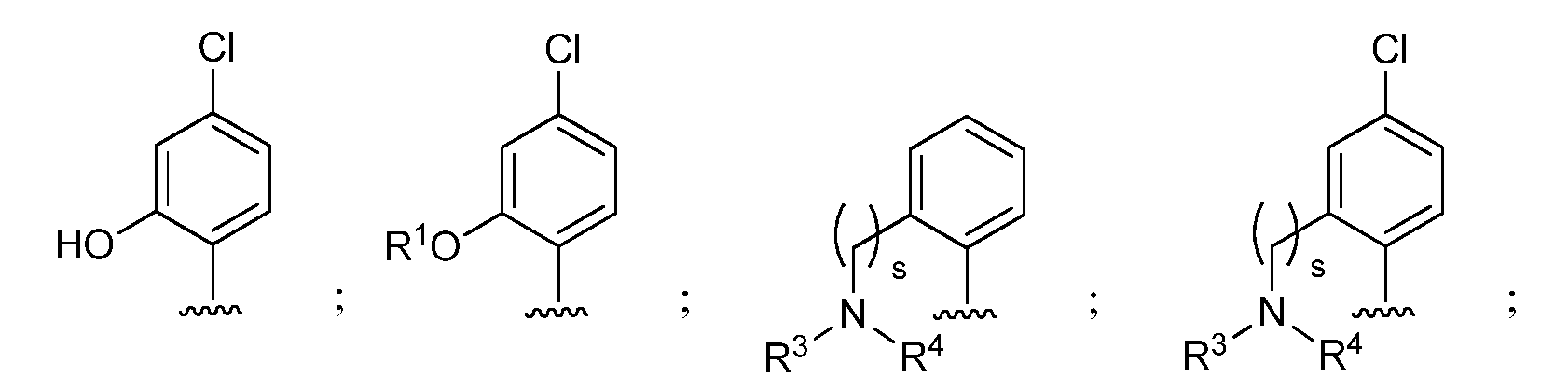
и при условии, что если М представляет собой OCH3, то R* не является членом, выбранным из:
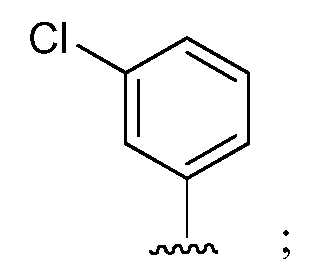
при условии, что если М1 представляет собой F, то R* не является членом, выбранным из:
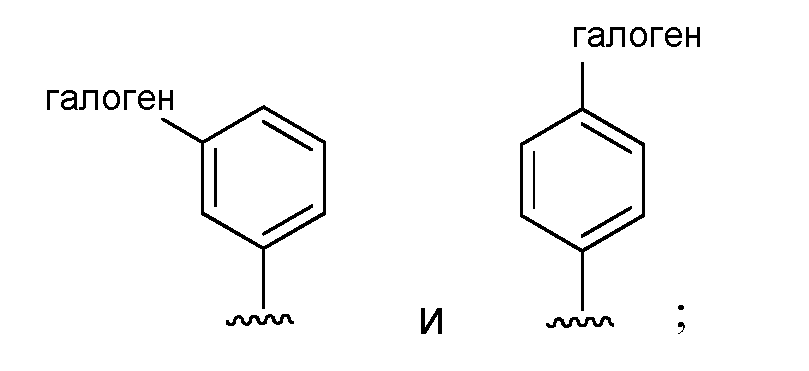
и его агрономически приемлемых солей.
В одном из вариантов способа согласно изобретению, патоген выбран из группы, состоящей из Alternaria spp., Aspergillus spp., Botryospheria spp., Botrytis spp., Byssochlamys spp., Colletotrichum spp., Diplodia spp., Fusarium spp., Geotrichum spp., Lasiodiplodia spp., Monolinia spp., Mucor spp., Penicillium spp., Pezicula spp., Phomopsis spp., Phytophthora spp., Pythium spp., Rhizoctonia spp., Rhizopus spp., Sclerotinia spp. и Venturia spp. В другом варианте осуществления изобретения, патоген выбран из группы, состоящей из Erwinia spp., Pectobacterium spp., Pseudomonas spp., Ralstonia spp., Xanthomonas spp., Salmonella spp., Escherichia spp., Listeria spp., Bacillus spp., Shigella spp. и Staphylococcus spp. В другом варианте осуществления изобретения, патоген выбран из группы, состоящей из Candida spp., Debaryomyces spp., Bacillus spp., Campylobacter spp., Clostridium spp., Cryptosporidium spp., Giardia spp., Vibrio spp. и Yersinia spp. В другом варианте осуществления изобретения, указанный способ включает обработку растений до снятия урожая или после снятия урожая. В другом варианте осуществления изобретения, обработка растений до снятия урожая выбрана из группы, состоящей из обработки семян и обработки саженцев. В другом варианте осуществления изобретения, обработка растений после снятия урожая выбрана из группы, состоящей из обработки, проводимой во время упаковки в полевых условиях, обработки во время упаковки в контейнеры, обработки в ящиках, обработки во время транспортировки и обработки во время хранения и/или поступления в торговую сеть.
В другом варианте осуществления изобретения, растениями или частями растений являются трансгенные растения или части трансгенных растений. В другом варианте осуществления изобретения, растения или части растений выбраны из группы, состоящей из кукурузы, пшеницы, хлопчатника, риса, сои и канолы. В другом варианте осуществления изобретения, растения или части растений выбраны из группы, состоящей из плодов, овощей, рассады для питомника, дерна и декоративных культур. В другом варианте осуществления изобретения, плоды выбраны из группы, состоящей из бананов, ананасов, цитрусовых, включая апельсин, лимон, лайм, грейпфрут и другие цитрусовые; винограда, арбуза, канталупской дыни, мускусной дыни и других дынь; яблок, персиков, груш, вишни, киви, манго, нектаринов, гуавы, папайи, хурмы, граната, авокадо, инжира и ягод, включая землянику, ежевику, малину, чернику, черную смородину и ягоды других видов. В другом варианте осуществления изобретения, овощные культуры выбраны из группы, состоящей из томатов, картофеля, батата, кассавы, перца, перца стручкового сладкого, моркови, сельдерея, кабачков, баклажанов, капусты, цветной капусты, брокколи, спаржи, съедобных грибов, лука, чеснока, лука-порея и лущильных сортов фасоли. В другом варианте осуществления изобретения, цветы иди их части выбраны из группы, состоящей из роз, гвоздик, орхидей, герани, лилий или других декоративных цветковых растений. В другом варианте осуществления изобретения, мясные продукты выбраны из группы, состоящей из говядины, мяса зубра, куриного мяса, оленины, козлятины, мяса индейки, свинины, баранины, рыбы, устриц, моллюсков или других мясных продуктов сухого посола.
В одном из вариантов осуществления изобретения, контактирование включает нанесение летучего антимикробного соединения способами, выбранными из группы, состоящей из опрыскивания, мелкокапельного орошения, термоорошения или нетермоорошения, дренирования, газовой обработки и их комбинаций. В другом варианте осуществления изобретения, газовая обработка выбрана из группы, состоящей из высвобождения из саше, высвобождения из синтетической или натуральной пленки, высвобождения из волокнистого материала и/или высвобождения из гофрированного материала или других упаковочных материалов; высвобождения из порошка, высвобождения из газораспределительного генератора, высвобождения из цилиндра со сжиженным или несжиженным газом; высвобождения из капелек, находящихся в ящиках, и их комбинаций. В другом варианте осуществления изобретения, указанный способ также включает контактирование мясных продуктов, растений и частей растений с летучим регулятором роста растений. В другом варианте осуществления изобретения, летучим регулятором роста растений является циклопропеновое соединение. В другом варианте осуществления изобретения, циклопропеновое соединение включает 1-метилциклопропен (1-MCP).
В другом своем аспекте, настоящее изобретение относится к способу применения летучего антимикробного соединения в целях уничтожения патогенов, поражающих мясные продукты, растения или части растений. Этот способ включает контактирование мясных продуктов, растений или частей растений с эффективным количеством летучего антимикробного соединения формулы (IV):
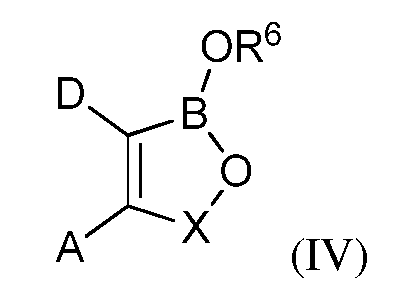
где A и D, взятые вместе с атомами углерода, с которыми они связаны, образуют 5-, 6- или 7-членное конденсированное кольцо, которое может быть замещено С1-С6-алкилом; С1-С6-алкокси; гидрокси; галогеном; нитро; нитрилом; амино; амино, замещенным одной или более С1-С6-алкильными группами; карбокси; ацилом; арилокси; карбонамидо; карбонамидо, замещенным С1-С6-алкилом; сульфонамидо или трифторметилом, или конденсированное кольцо, которое может связывать два оксаборольных кольца;
X представляет собой группу -CR7R8, где каждый из R7и R8независимо представляет собой водород; С1-С6-алкил; нитрил; нитро; арил; арилалкил; либо R7 и R8, взятые вместе с атомом углерода, с которым они связаны, образуют алициклическое кольцо; и
R6 представляет собой водород; С1-С18-алкил; С1-С18-алкил, замещенный С1-С6-алкокси; С1-С6-алкилтио; гидрокси; амино; амино, замещенный С1-С6-алкилом; карбокси; арил; арилокси; карбонамидо; карбонамидо, замещенный С1-С6-алкилом, арилом или арилалкилом; арилалкил; арил; гетероарил; циклоалкил; С1-С18-алкиленамино; С1-С18-алкиленамино; замещенный фенилом, С1-С6-алкокси или С1-С6-алкилтио; карбонилалкиленамино или радикал формулы (V):
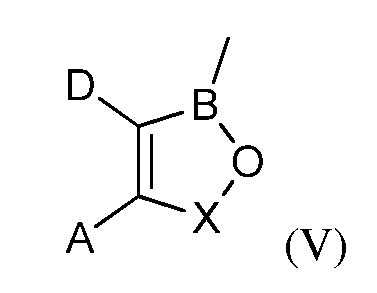
где A, D и X являются такими, как они были определены в описании настоящей заявки, за исключением фталида бора;
и его агрономически приемлемых солей.
В одном из вариантов способа согласно изобретению, патоген выбран из группы, состоящей из Alternaria spp., Aspergillus spp., Botryospheria spp., Botrytis spp., Byssochlamys spp., Colletotrichum spp., Diplodia spp., Fusarium spp., Geotrichum spp., Lasiodiplodia spp., Monolinia spp., Mucor spp., Penicillium spp., Pezicula spp., Phomopsis spp., Phytophthora spp., Pythium spp., Rhizoctonia spp., Rhizopus spp., Sclerotinia spp. и Venturia spp. В другом варианте осуществления изобретения, патоген выбран из группы, состоящей из Erwinia spp., Pectobacterium spp., Pseudomonas spp., Ralstonia spp., Xanthomonas spp., Salmonella spp., Escherichia spp., Listeria spp., Bacillus spp., Shigella spp. и Staphylococcus spp. В другом варианте осуществления изобретения, патоген выбран из группы, состоящей из Candida spp., Debaryomyces spp., Bacillus spp., Campylobacter spp., Clostridium spp., Cryptosporidium spp., Giardia spp., Vibrio spp. и Yersinia spp. В другом варианте осуществления изобретения, указанный способ включает обработку растений до снятия урожая или после снятия урожая. В другом варианте осуществления изобретения, обработка растений до снятия урожая выбрана из группы, состоящей из обработки семян и обработки саженцев. В другом варианте осуществления изобретения, обработка растений после снятия урожая выбрана из группы, состоящей из обработки, проводимой во время упаковки в полевых условиях, обработки во время упаковки в контейнеры, обработки в ящиках, обработки во время транспортировки и обработки во время хранения и/или поступления в торговую сеть.
В другом варианте осуществления изобретения, растениями или частями растений являются трансгенные растения или части трансгенных растений. В другом варианте осуществления изобретения, растения или части растений выбраны из группы, состоящей из кукурузы, пшеницы, хлопчатника, риса, сои и канолы. В другом варианте осуществления изобретения, растения или части растений выбраны из группы, состоящей из плодов, овощей, рассады для питомника, дерна и декоративных культур. В другом варианте осуществления изобретения, плоды выбраны из группы, состоящей из бананов, ананасов, цитрусовых, включая апельсин, лимон, лайм, грейпфрут и другие цитрусовые; винограда, арбуза, канталупской дыни, мускусной дыни и других дынь; яблок, персиков, груш, вишни, киви, манго, нектаринов, гуавы, папайи, хурмы, граната, авокадо, инжира и ягод, включая землянику, ежевику, малину, чернику, черную смородину и ягоды других видов. В другом варианте осуществления изобретения, овощные культуры выбраны из группы, состоящей из томатов, картофеля, батата, кассавы, перца, перца стручкового сладкого, моркови, сельдерея, кабачков, баклажанов, капусты, цветной капусты, брокколи, спаржи, съедобных грибов, лука, чеснока, лука-порея и лущильных сортов фасоли. В другом варианте осуществления изобретения, цветы иди их части выбраны из группы, состоящей из роз, гвоздик, орхидей, герани, лилий или других декоративных цветковых растений. В другом варианте осуществления изобретения, мясные продукты выбраны из группы, состоящей из говядины, мяса зубра, куриного мяса, оленины, козлятины, мяса индейки, свинины, баранины, рыбы, устриц, моллюсков или других мясных продуктов сухого посола.
В одном из вариантов осуществления изобретения, контактирование включает нанесение летучего антимикробного соединения способами, выбранными из группы, состоящей из опрыскивания, мелкокапельного орошения, термоорошения или нетермоорошения, дренирования, газовой обработки и их комбинаций. В другом варианте осуществления изобретения, газовая обработка выбрана из группы, состоящей из высвобождения из саше, высвобождения из синтетической или натуральной пленки, высвобождения из волокнистого материала и/или высвобождения из гофрированного материала или других упаковочных материалов; высвобождения из порошка, высвобождения из газораспределительного генератора, высвобождения из цилиндра со сжиженным или несжиженным газом; высвобождения из капелек, находящихся в ящиках, и их комбинаций. В другом варианте осуществления изобретения, указанный способ также включает контактирование мясных продуктов, растений и частей растений с летучим регулятором роста растений. В другом варианте осуществления изобретения, летучим регулятором роста растений является циклопропеновое соединение. В другом варианте осуществления изобретения, циклопропеновое соединение включает 1-метилциклопропен (1-MCP).
В другом своем аспекте, настоящее изобретение относится к способу применения летучего антимикробного соединения в целях уничтожения патогенов, поражающих мясные продукты, растения или части растений. Этот способ включает контактирование мясных продуктов, растений или частей растений с эффективным количеством летучего антимикробного соединения формулы (VI):
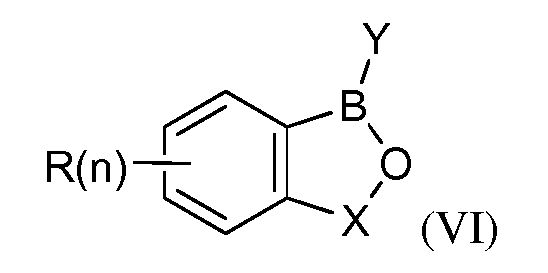
где каждый R независимо представляет собой водород, алкил, алкен, алкин, галогеналкил, галогеналкен, галогеналкин, алкокси, алкенокси, галогеналкокси, арил, гетероарил, арилалкил, арилалкен, арилалкин, гетероарилалкил, гетероарилалкен, гетероарилалкин, галоген, гидроксил, нитрил, амин, сложный эфир, карбоновую кислоту, кетон, спирт, сульфид, сульфоксид, сульфон, сульфоксимин, сульфилимин, сульфонамид, сульфат, сульфонат, нитроалкил, амид, оксим, имин, гидроксиламин, гидразин, гидразон, карбамат, тиокарбамат, мочевину, тиомочевину, карбонат, арилокси или гетероарилокси;
n=1, 2, 3 или 4.
B представляет собой бор;
X=(CR2)m, где m=1, 2, 3 или 4;
Y представляет собой алкил, алкен, алкин, галогеналкил, галогеналкен, галогеналкин, алкокси, алкенокси, галогеналкокси, арил, гетероарил, арилалкил, арилалкен, арилалкин, гетероарилалкил, гетероарилалкен, гетероарилалкин, гидроксил, нитрил, амин, сложный эфир, карбоновую кислоту, кетон, спирт, сульфид, сульфоксид, сульфон, сульфоксимин, сульфилимин, сульфонамид, сульфат, сульфонат, нитроалкил, амид, оксим, имин, гидроксиламин, гидразин, гидразон, карбамат, тиокарбамат, мочевину, тиомочевину, карбонат, арилокси или гетероарилокси;
при условии, что R не является арилокси или гетероарилокси, если Y является гидроксилом;
или его агрономически приемлемых солей.
В одном из вариантов осуществления изобретения, летучее антимикробное соединение имеет структуру формулы (VII):
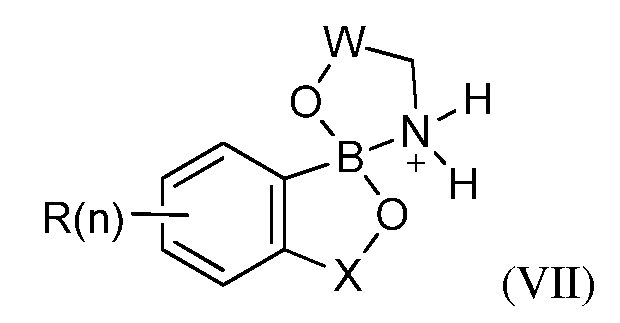
где W=(CH2)q, где q равно 1, 2 или 3.
В другом варианте осуществления изобретения, летучее антимикробное соединение имеет структуру:
В одном из вариантов способа согласно изобретению, патоген выбран из группы, состоящей из Alternaria spp., Aspergillus spp., Botryospheria spp., Botrytis spp., Byssochlamys spp., Colletotrichum spp., Diplodia spp., Fusarium spp., Geotrichum spp., Lasiodiplodia spp., Monolinia spp., Mucor spp., Penicillium spp., Pezicula spp., Phomopsis spp., Phytophthora spp., Pythium spp., Rhizoctonia spp., Rhizopus spp., Sclerotinia spp. и Venturia spp. В другом варианте осуществления изобретения, патоген выбран из группы, состоящей из Erwinia spp., Pectobacterium spp., Pseudomonas spp., Ralstonia spp., Xanthomonas spp., Salmonella spp., Escherichia spp., Listeria spp., Bacillus spp., Shigella spp. и Staphylococcus spp. В другом варианте осуществления изобретения, патоген выбран из группы, состоящей из Candida spp., Debaryomyces spp., Bacillus spp., Campylobacter spp., Clostridium spp., Cryptosporidium spp., Giardia spp., Vibrio spp. и Yersinia spp. В другом варианте осуществления изобретения, указанный способ включает обработку растений до снятия урожая или после снятия урожая. В другом варианте осуществления изобретения, обработка растений до снятия урожая выбрана из группы, состоящей из обработки семян и обработки саженцев. В другом варианте осуществления изобретения, обработка растений после снятия урожая выбрана из группы, состоящей из обработки, проводимой во время упаковки в полевых условиях, обработки во время упаковки в контейнеры, обработки в ящиках, обработки во время транспортировки и обработки во время хранения и/или поступления в торговую сеть.
В другом варианте осуществления изобретения, растениями или частями растений являются трансгенные растения или части трансгенных растений. В другом варианте осуществления изобретения, растения или части растений выбраны из группы, состоящей из кукурузы, пшеницы, хлопчатника, риса, сои и канолы. В другом варианте осуществления изобретения, растения или части растений выбраны из группы, состоящей из плодов, овощей, рассады для питомника, дерна и декоративных культур. В другом варианте осуществления изобретения, плоды выбраны из группы, состоящей из бананов, ананасов, цитрусовых, включая апельсин, лимон, лайм, грейпфрут и другие цитрусовые; винограда, арбуза, канталупской дыни, мускусной дыни и других дынь; яблок, персиков, груш, вишни, киви, манго, нектаринов, гуавы, папайи, хурмы, граната, авокадо, инжира и ягод, включая землянику, ежевику, малину, чернику, черную смородину и ягоды других видов. В другом варианте осуществления изобретения, овощные культуры выбраны из группы, состоящей из томатов, картофеля, батата, кассавы, перца, перца стручкового сладкого, моркови, сельдерея, кабачков, баклажанов, капусты, цветной капусты, брокколи, спаржи, съедобных грибов, лука, чеснока, лука-порея и лущильных сортов фасоли. В другом варианте осуществления изобретения, цветы иди их части выбраны из группы, состоящей из роз, гвоздик, орхидей, герани, лилий или других декоративных цветковых растений. В другом варианте осуществления изобретения, мясные продукты выбраны из группы, состоящей из говядины, мяса зубра, куриного мяса, оленины, козлятины, мяса индейки, свинины, баранины, рыбы, устриц, моллюсков или других мясных продуктов сухого посола.
В одном из вариантов осуществления изобретения, контактирование включает нанесение летучего антимикробного соединения способами, выбранными из группы, состоящей из опрыскивания, мелкокапельного орошения, термоорошения или нетермоорошения, дренирования, газовой обработки и их комбинаций. В другом варианте осуществления изобретения, газовая обработка выбрана из группы, состоящей из высвобождения из саше, высвобождения из синтетической или натуральной пленки, высвобождения из волокнистого материала и/или высвобождения из гофрированного материала или других упаковочных материалов; высвобождения из порошка, высвобождения из газораспределительного генератора, высвобождения из цилиндра со сжиженным или несжиженным газом; высвобождения из капелек, находящихся в ящиках, и их комбинаций. В другом варианте осуществления изобретения, указанный способ также включает контактирование мясных продуктов, растений и частей растений с летучим регулятором роста растений. В другом варианте осуществления изобретения, летучим регулятором роста растений является циклопропеновое соединение. В другом варианте осуществления изобретения, циклопропеновое соединение включает 1-метилциклопропен (1-MCP).
В другом своем аспекте, настоящее изобретение относится к способу применения летучего антимикробного соединения в целях уничтожения патогенов, поражающих мясные продукты, растения или части растения. Этот способ включает контактирование мясных продуктов, растений или частей растений с эффективным количеством летучего антимикробного соединения, имеющего структуру формулы (VIII):
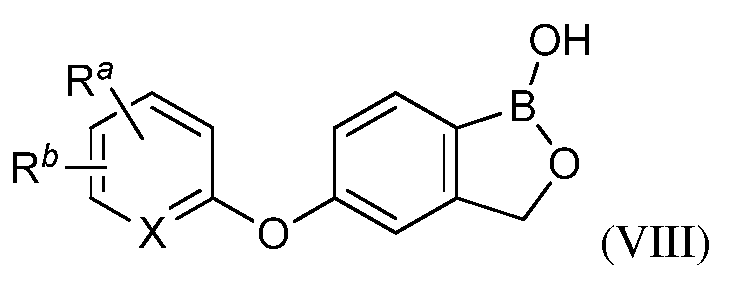
где Ra представляет собой CN, C(О)NR9R10 или C(O)OR11, где R11 представляет собой водород, замещенный алкил или незамещенный алкил;
X представляет собой N, CH и CRb;
Rb представляет собой галоген, замещенный или незамещенный алкил, C(O)R12, C(O)OR12, OR12, NR12R13, где R9, R10, R12 и R13 независимо представляют собой водород, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил;
при условии, что R9 и R10, взятые вместе с атомами, с которыми они связаны, образуют, но необязательно, 4-8-членное замещенное или незамещенное гетероциклоалкильное кольцо;
и при условии, что R12 и R13, взятые вместе с атомами, с которыми они связаны, образуют, но необязательно, 4-8-членное замещенное или незамещенное гетероциклоалкильное кольцо;
и его агрономически приемлемых солей.
В одном из вариантов способа согласно изобретению, патоген выбран из группы, состоящей из Alternaria spp., Aspergillus spp., Botryospheria spp., Botrytis spp., Byssochlamys spp., Colletotrichum spp., Diplodia spp., Fusarium spp., Geotrichum spp., Lasiodiplodia spp., Monolinia spp., Mucor spp., Penicillium spp., Pezicula spp., Phomopsis spp., Phytophthora spp., Pythium spp., Rhizoctonia spp., Rhizopus spp., Sclerotinia spp. и Venturia spp. В другом варианте осуществления изобретения, патоген выбран из группы, состоящей из Erwinia spp., Pectobacterium spp., Pseudomonas spp., Ralstonia spp., Xanthomonas spp., Salmonella spp., Escherichia spp., Listeria spp., Bacillus spp., Shigella spp. и Staphylococcus spp. В другом варианте осуществления изобретения, патоген выбран из группы, состоящей из Candida spp., Debaryomyces spp., Bacillus spp., Campylobacter spp., Clostridium spp., Cryptosporidium spp., Giardia spp., Vibrio spp. и Yersinia spp. В другом варианте осуществления изобретения, указанный способ включает обработку растений до снятия урожая или после снятия урожая. В другом варианте осуществления изобретения, обработка растений до снятия урожая выбрана из группы, состоящей из обработки семян и обработки саженцев. В другом варианте осуществления изобретения, обработка растений после снятия урожая выбрана из группы, состоящей из обработки, проводимой во время упаковки в полевых условиях, обработки во время упаковки в контейнеры, обработки в ящиках, обработки во время транспортировки и обработки во время хранения и/или поступления в торговую сеть.
В другом варианте осуществления изобретения, растениями или частями растений являются трансгенные растения или части трансгенных растений. В другом варианте осуществления изобретения, растения или части растений выбраны из группы, состоящей из кукурузы, пшеницы, хлопчатника, риса, сои и канолы. В другом варианте осуществления изобретения, растения или части растений выбраны из группы, состоящей из плодов, овощей, рассады для питомника, дерна и декоративных культур. В другом варианте осуществления изобретения, плоды выбраны из группы, состоящей из бананов, ананасов, цитрусовых, включая апельсин, лимон, лайм, грейпфрут и другие цитрусовые; винограда, арбуза, канталупской дыни, мускусной дыни и других дынь; яблок, персиков, груш, вишни, киви, манго, нектаринов, гуавы, папайи, хурмы, граната, авокадо, инжира и ягод, включая землянику, ежевику, малину, чернику, черную смородину и ягоды других видов. В другом варианте осуществления изобретения, овощные культуры выбраны из группы, состоящей из томатов, картофеля, батата, кассавы, перца, перца стручкового сладкого, моркови, сельдерея, кабачков, баклажанов, капусты, цветной капусты, брокколи, спаржи, съедобных грибов, лука, чеснока, лука-порея и лущильных сортив фасоли. В другом варианте осуществления изобретения, цветы иди их части выбраны из группы, состоящей из роз, гвоздик, орхидей, герани, лилий или других декоративных цветковых растений. В другом варианте осуществления изобретения, мясные продукты выбраны из группы, состоящей из говядины, мяса зубра, куриного мяса, оленины, козлятины, мяса индейки, свинины, баранины, рыбы, устриц, моллюсков или других мясных продуктов сухого посола.
В одном из вариантов осуществления изобретения, контактирование включает нанесение летучего антимикробного соединения способами, выбранными из группы, состоящей из опрыскивания, мелкокапельного орошения, термоорошения или нетермоорошения, дренирования, газовой обработки и их комбинаций. В другом варианте осуществления изобретения, газовая обработка выбрана из группы, состоящей из высвобождения из саше, высвобождения из синтетической или натуральной пленки, высвобождения из волокнистого материала и/или высвобождения из гофрированного материала или других упаковочных материалов; высвобождения из порошка, высвобождения из газораспределительного генератора, высвобождения из цилиндра со сжиженным или несжиженным газом; высвобождения из капелек, находящихся в ящиках, и их комбинаций. В другом варианте осуществления изобретения, указанный способ также включает контактирование мясных продуктов, растений и частей растений с летучим регулятором роста растений. В другом варианте осуществления изобретения, летучим регулятором роста растений является циклопропеновое соединение. В другом варианте осуществления изобретения, циклопропеновое соединение включает 1-метилциклопропен (1-MCP).
Краткое описание графического материала
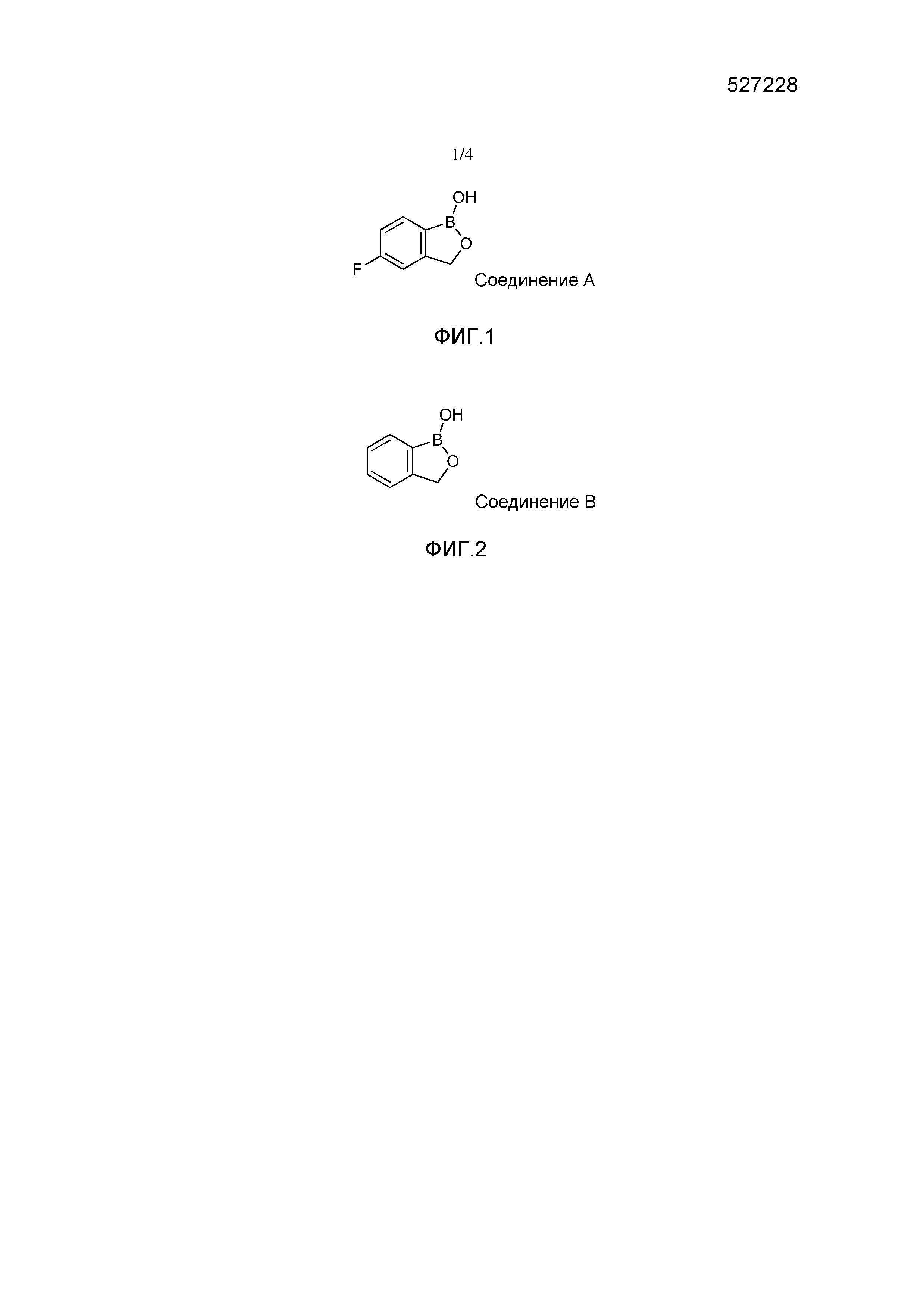
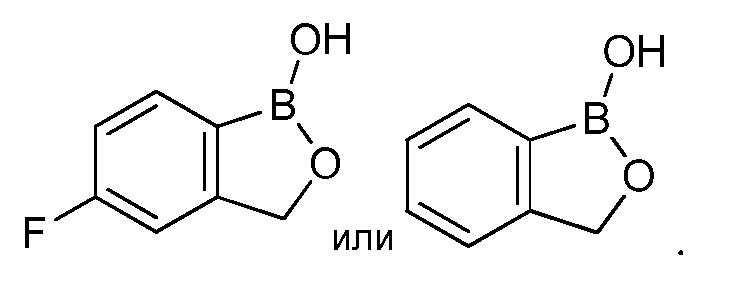
На фигуре 1 представлена химическая структура репрезентативного соединения А согласно изобретению.
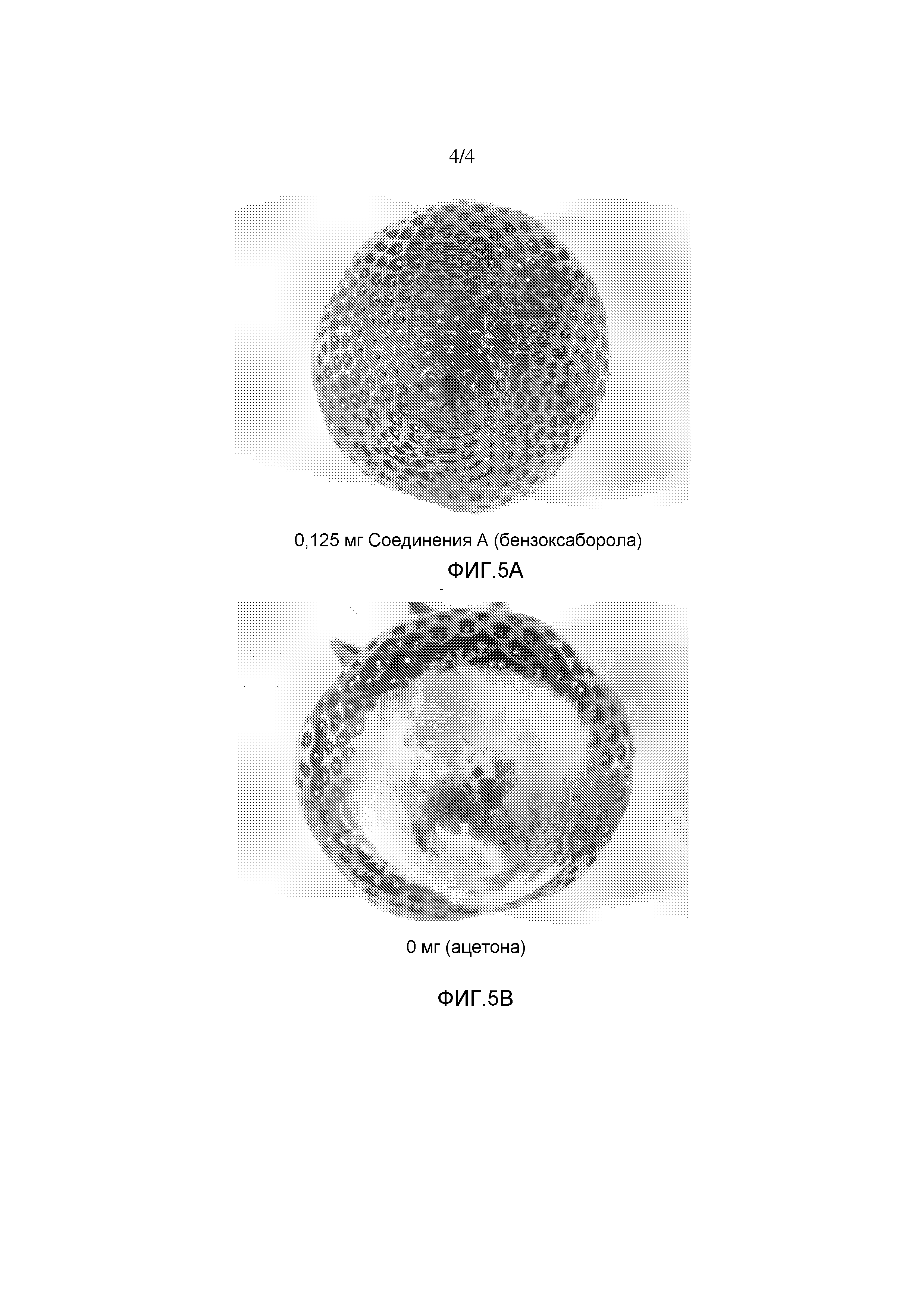
На фигуре 2 представлена химическая структура репрезентативного соединения В согласно изобретению.
На фигуре 3 представлены 14 соединений, протестированных в примере 2.
На фигуре 4 представлены репрезентативные фотографии, на которых проиллюстрированы результаты анализа на ингибирование in vivo, проводимого с использованием соединения А, где 0,04 мг соединения A давало 100% ингибирование, а 0,0024 мг соединения A не давало какого-либо ингибирования.
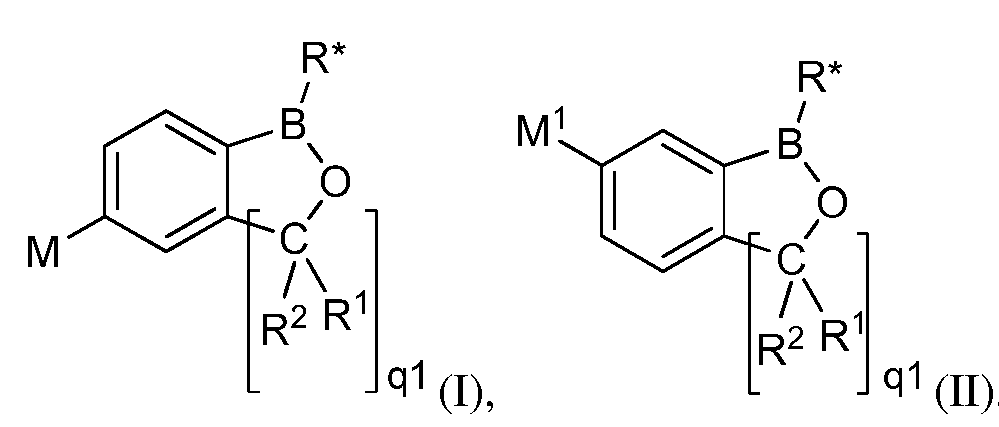
На фигуре 5 представлены репрезентативные фотографии, на которых проиллюстрированы результаты анализа на ингибирование бактерии Botrytis cinerea in vivo после 3-дневной обработки летучим соединением А при 21°C, с последующей обработкой этим соединением в течение еще 2 дней при 21°C.
Подробное описание изобретения
Если это не оговорено особо, нижеследующие термины, употребляемые в настоящей заявке, включая описание и формулу изобретения, имеют определения, представленные ниже. Следует отметить, что используемые в описании и в прилагаемой формуле изобретения формы в единственном числе, могут относиться и к формам во множественном числе, если это не противоречит контексту описания. Определение стандартных химических терминов можно найти в литературе, включая публикациию Carey & Sundberg, Advanced Organic Chemistry 4th Ed., Vols. A (2000) and B (2001), Plenum Press, New York, N.Y.
Используемый здесь термин «радикал» означает конкретный компонент или функциональную группу молекулы. Химическими радикалами являются хорошо известные химические частицы, включенные в молекулу или присоединенные к молекуле.
Используемые здесь термины «гетероатом» и «гетеро-» означают атомы, не являющиеся углеродом (C) и водородом (H). Примерами гетероатомов являются кислород (O), азот (N), сера (S), кремний (Si), германий (Ge), алюминий (Al) и бор (B).
Используемые здесь термины «галогено» и «галоген» являются синонимами и означают фтор (-F), хлор (-Cl), бром (-Br) и иод (-I).
Используемый здесь термин «алкил» означает незамещенную или замещенную углеводородную группу, которая может быть прямой, разветвленной, циклической, насыщенной и/или ненасыщенной. Хотя алкильная группа может представлять собой «ненасыщенную алкильную» группу, что означает, что она содержит по меньшей мере одну алкеновую или алкиновую группу, однако, обычно алкильная группа представляет собой «насыщенную алкильную» группу, что означает, что она не содержит каких-либо алкеновых или алкиновых групп. Аналогичнным образом, хотя алкильная группа может быть циклической, однако, обычно алкильная группа является ациклической. Таким образом, в некоторых вариантах осуществления изобретения, термин «алкил» означает необязательно замещенный насыщенный углеводородный монорадикал с прямой цепью или необязательно замещенный насыщенный углеводородный монорадикал с разветвленной цепью, имеющий приблизительно от одного до тридцати атомов углерода; в некоторых вариантах осуществления изобретения, приблизительно от одного до пятнадцати атомов углерода; а в других вариантах осуществления изобретения, приблизительно от одного до шести атомов углерода. Примерами насыщенных алкильных радикалов являются, но не ограничиваются ими, метил, этил, н-пропил, изопропил, 2-метил-1-пропил, 2-метил-2-пропил, 2-метил-1-бутил, 3-метил-1-бутил, 2-метил-3-бутил, 2,2-диметил-1-пропил, 2-метил-1-пентил, 3-метил-1-пентил, 4-метил-1-пентил, 2-метил-2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 2,2-диметил-1-бутил, 3,3-диметил-l-бутил, 2-этил-1-бутил, бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил и н-гексил, и более длинные алкильные группы, такие как гептил и октил. При этом следует отметить, что во всем описании настоящей заявки, численный интервал, такой как «1-6», означает каждое целое число, входящее в данный интервал, например, термин «1-6 атомов углерода» или «C1-6» или «С1-С6» означает, что алкильная группа может состоять из 1 атома углерода, 2 атомов углерода, 3 атомов углерода, 4 атомов углерода, 5 атомов углерода и/или 6 атомов углерода, хотя в представленное определение входит также термин «алкил», для которого численный интервал атомов углерода точно не указан.
Используемый здесь термин «замещенный алкил» означает определенную здесь алкильную группу, в которой один или более (приблизительно до пяти, а предпочтительно, приблизительно до трех) атомов водорода заменены заместителем, независимо выбранным из группы заместителей, определенных в настоящей заявке.
Используемые здесь термины «заместители» и «замещенный» относятся к группам на молекуле, которые могут быть использованы вместо другой группы. Эти группы известны специалистам-химикам, и такими группами могут быть, но не ограничиваются ими, одна или более из нижеследующих независимо выбранных групп или подгрупп, таких как: галоген, -CN, -OH, -NO2, -N3, =О, =S, =NH, -SO2, -NH2, -COOH, нитроалкил, амино, включая моно- и дизамещенные аминогруппы, цианато, изоцианато, тиоцианато, изотиоцианато, гуанидинил, О-карбамил, N-карбамил, тиокарбамил, урил, изоурил, тиоурил, изотиоурил, меркапто, сульфанил, сульфинил, сульфонил, сульфонамидил, фосфонил, фосфатидил, фосфорамидил, диалкиламино, диариламино, диарилалкиламино и их защищенные соединения. Защитные группы, которые могут входить в состав защищенных соединений, имеющих вышеуказанные заместители, известны специалистам и описаны в литературе, например, в публикациях Greene & Wuts, Protective Groups in Organic Synthesis, 3rd ed.; John Wiley & Sons, New York, N.Y. (1999) и Kocienski, Protective Groups; Thieme Verlag, New York, N.Y. (1994), которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Используемый здесь термин «алкокси» означает группу -O-алкил, где алкил определен в настоящем описании. В одном из вариантов осуществления изобретения, алкоксигруппами являются, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси, 1,2-диметилбутокси и т.п. Алкокси может быть незамещенным или замещенным.
Используемые здесь термины «циклический» и «n-членное кольцо» относятся к любой циклической структуре, включая алициклические, гетероциклические, ароматические, гетероароматические и полициклические конденсированные или неконденсированные циклические системы, описанные в настоящей заявке. Термин «n-членный» относится к числу атомов остова, составляющих данное кольцо. Так, например, пиридин, пиран и пиримидин представляют собой 6-членные кольца, а пиррол, тетрагидрофуран и тиофен представляют собой 5-членные кольца.
Используемый здесь термин «ароматический» относится к циклической или полициклической группе, имеющей сопряженную ненасыщенную электронную систему (4n+2)π (где n равно положительному целому числу), иногда называемую делокализованной электронной системой π.
Используемый здесь термин «арил» означает необязательно замещенный ароматический циклический углеводородный монорадикал, имеющий от шести и приблизительно до двадцати атомов на кольце, а предпочтительно, от шести и приблизительно до десяти атомов углерода, и включающий конденсированные или неконденсированные ароматические кольца. Конденсированный ароматический циклический радикал содержит от двух до четырех конденсированных колец, где указанным конденсированным кольцом является ароматическое кольцо, а другими отдельными кольцами, составляющими такое конденсированное кольцо, могут быть циклоалкил, циклоалкенил, циклоалкинил, гетероциклоалкил, гетероциклоалкенил, гетероциклоалкинил, ароматическая группа, гетероароматическая группа или любые их комбинации. Неограничивающим примером арильной группы с одним кольцом является фенил, примером арильной группы с конденсированными кольцами являются нафтил, антрил, азуленил, а примером би-арильной группы с неконденсированными кольцами является бифенил.
Используемый здесь термин «замещенный арил» означает определенную здесь арильную группу, в которой один или более (приблизительно до пяти, а предпочтительно, приблизительно до трех) атомов водорода заменены заместителем, независимо выбранным из группы заместителей, определенных в настоящей заявке (за исключением конкретно определенных арильных заместителей).
Используемый здесь термин «гетероарил» означает необязательно замещенный ароматический циклический монорадикал, содержащий приблизительно от пяти до двадцати атомов на кольце, а предпочтительно, от пяти и приблизительно до десяти атомов на кольце, и включающий конденсированные или неконденсированные ароматические кольца, в которых один или более (от одного до десяти, а предпочтительно, приблизительно от одного до четырех) атомов на кольце выбраны из атомов, не являющихся углеродом (то есть, гетероатомов), таких как, например, атомы кислорода, азота, серы, селена, фосфора или их комбинации. Термин «гетероарил» включает, но необязательно, замещенные конденсированные и неконденсированные гетероарильные радикалы, имеющие по меньшей мере один гетероатом. Конденсированный гетероарильный радикал может содержать от двух до четырех конденсированных колец, где указанным конденсированным кольцом является гетероароматическое кольцо, а другими отдельными кольцами, составляющими такую конденсированную систему колец, могут быть алициклическое, гетероциклическое, ароматическое, гетероароматическое кольцо или любые их комбинации. Термин «гетероарил» также включает конденсированные и неконденсированные гетероарилы, имеющие от пяти и приблизительно до двенадцати атомов на кольце, а также гетероарилы, имеющие от пяти и приблизительно до десяти атомов на кольце. Примерами гетероарильных групп являются, но не ограничиваются ими, акридинил, бензо[1,3]диоксол, бензимидазол, бензииндазолил, бензоизооксазолил, бензокизазолил, бензофуранил, бензофуразонил, бензопиранил, бензотиадиазолил, бензотиазолил, бензо[b]тиенил, бензотиофенил, бензотиопиранил, бензотриазолил, бензоксазолил, карбазолил, карболинил, хроменил, циннолинил, фуранил, фуразанил, фуропиридинил, фурил, имидазолил, индазолил, индолил, индолидинил, индолизинил, изобензофуранил, изоиндолил, изоксазолил, изохинолинил, изотиазолил, нафтилидинил, нафтиридинил, оксадимазолил, оксазолил, феноксазинил, фенотиазинил, феназинил, феноксатиинил, тиантренил, фенантридинил, фенатролинил, фталазинил, птеридинил, пуринил, путеридинил, пиразил, пиразолил, пиридил, пиридинил, пиридазинил, пиразинил, пиримидинил, пиримидил, пирролил, хиназолинил, хинолинил, хиноксалинил, тетразолил, тиадиазолил, тиазолил, тиенил, триазинил, (1,2,3,)- и (1,2,4)-триазолил и т.п. и их оксиды, если они присутствуют, например пиридил-N-оксид.
Используемый здесь термин «замещенный гетероарил» означает определенную здесь гетероарильную группу, в которой один или более (приблизительно до пяти, а предпочтительно, приблизительно до трех) атомов водорода заменены заместителем, независимо выбранным из группы заместителей, определенных в настоящей заявке.
Используемый здесь термин «уходящая группа» означает группу, хорошо известную специалистам в области химии органического синтеза, то есть, атом или группу, которые отщепляются в условиях проведения реакции замещения. Примерами уходящих групп являются, но не ограничиваются ими, галоген, алкан- или ариленсульфонилокси, такой как метансульфонилокси, этансульфонилокси, тиометил, бензолсульфонилокси, тозилокси и тиенилокси; дигалогенфосфиноилокси, необязательно замещенный бензилокси, изопропилокси, ацилокси и т.п. В некоторых вариантах осуществления изобретения, уходящей группой может быть HC(O)-COOH или RC(O)-COOH, где R представляет собой С1-С6-алкил или замещенный С1-С6-алкил.
Описанные здесь соединения согласно изобретению могут быть синтезированы стандартными методами синтеза, известными специалистам, или методами, известными специалистам, в комбинации с описанными здесь методами. Исходные вещества, используемые для синтеза описанных здесь соединений согласно изобретению, могут быть взяты из коммерчески доступных источников, таких как Aldrich Chemical Co. (Milwaukee, Wis.), Sigma Chemical Co. (St. Louis, Mo.), либо эти исходные вещества могут быть синтезированы. Описанные здесь соединения и другие родственные соединения, имеющие другие заместители, могут быть синтезированы с применением методов и материалов, известных специалистам, например, описанных в публикациях March, Advanced Organic Chemistry 4th Ed. (1992) John Wiley & Sons, New York, N.Y.; Carey & Sundberg, Advanced Organic Chemistry 4th Ed., Vols. A (2000) and B (2001) Plenum Press, New York, N.Y. и Greene & Wuts, Protective Groups in Organic Synthesis, 3rd Ed. (1999) John Wiley & Sons, New York, N.Y. (все эти публикации во всей своей полноте вводятся в настоящее описание посредством ссылки). Общие методы получения описанных здесь соединений могут быть разработаны на основе реакций, известных специалистам в данной области, и такие реакции могут быть модифицированы с использованием соответствующих известных реагентов в соответствующих условиях для введения различных групп, указанных в приведенных здесь формулах. Так, например, описанные здесь соединения могут быть модифицированы с использованием различных электрофилов или нуклеофилов с образованием новых функциональных группхз или с введением новых заместителей.
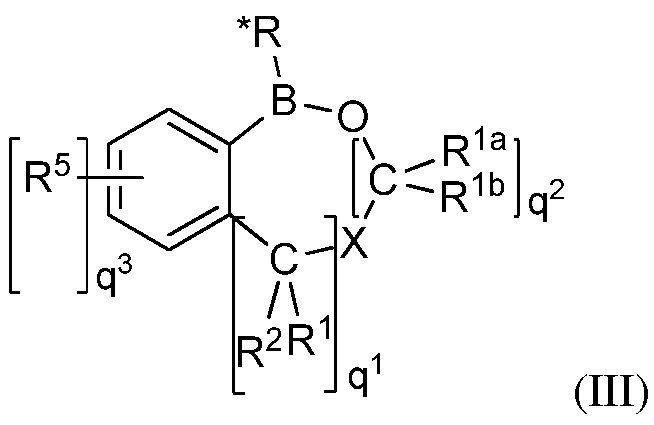
В некоторых вариантах осуществления изобретения, летучее антимикробное соединение согласно изобретению имеет структуру формулы (I), (II) или (III):
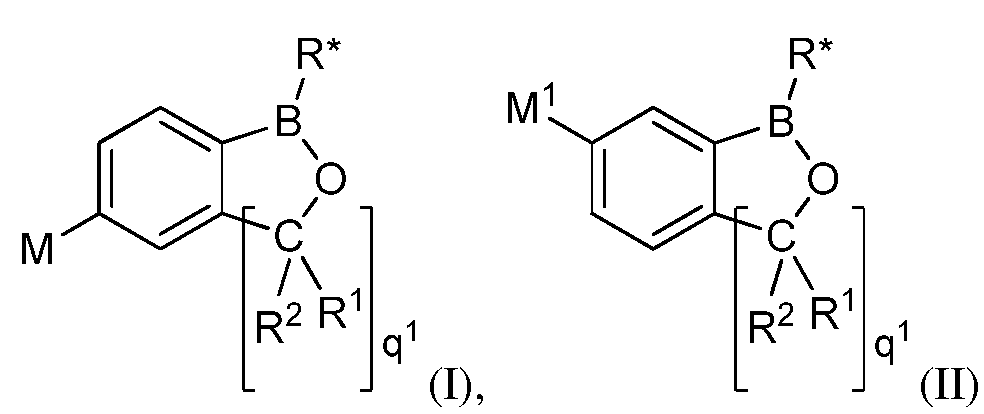
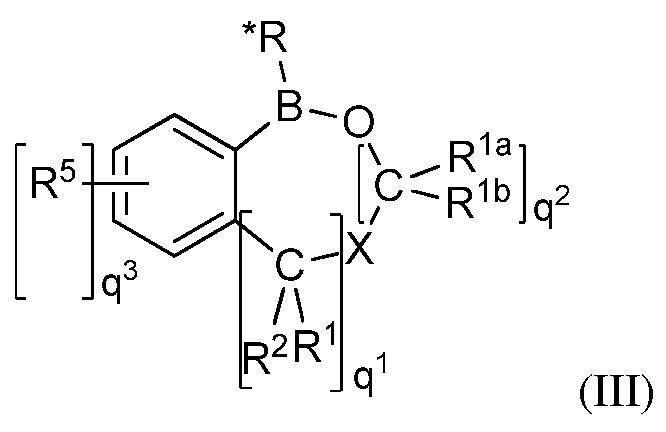
где q1 и q2 независимо равны 1, 2 или 3;
q3=0, 1, 2, 3, или 4;
M представляет собой водород, галоген, -OCH3 или -CH2-О-CH2-О-CH3;
M1 представляет собой галоген, -CH2OH или -OCH3;
X представляет собой O, S или NR1c, где R1cпредставляет собой водород, замещенный алкил или незамещенный алкил;
R1, R1a, R1b, R2 и R5 независимо представляют собой водород, OH, NH2, SH, CN, NO2, SO2, OSO2OH, OSO2NH2, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил;
R* представляет собой замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарил, замещенный или незамещенный гетероарилалкил, или замещенный или незамещенный винил;
при условии, что если М представляет собой F, то R* не является членом, выбранным из:
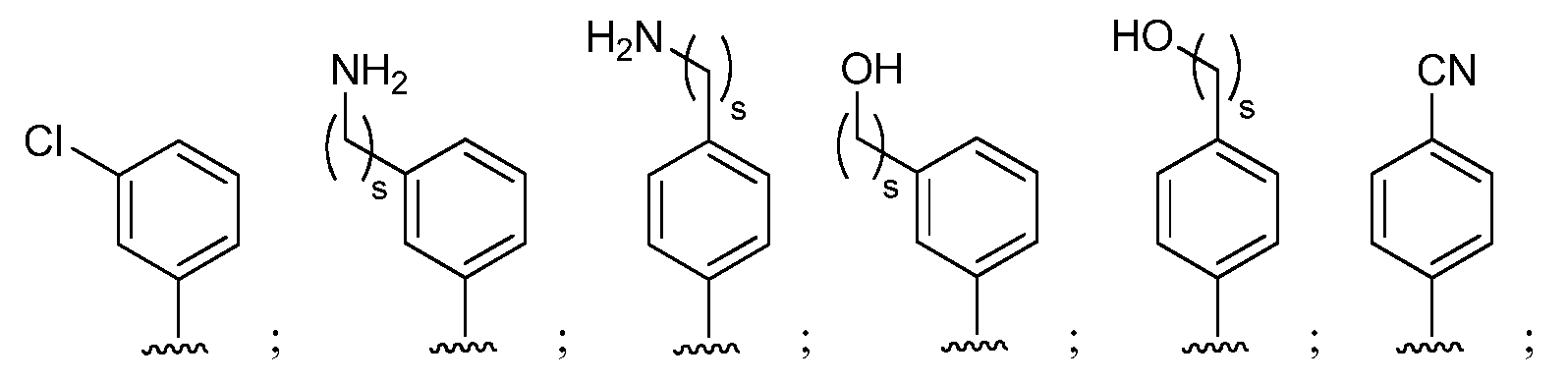
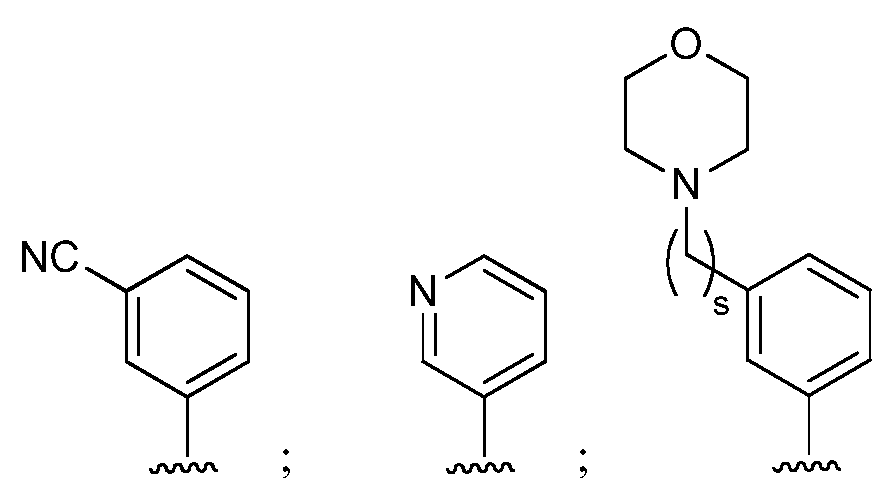
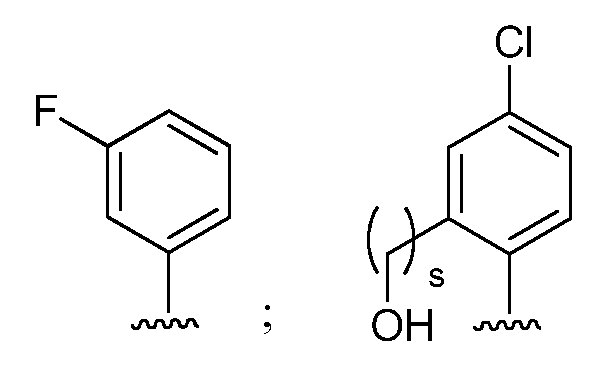
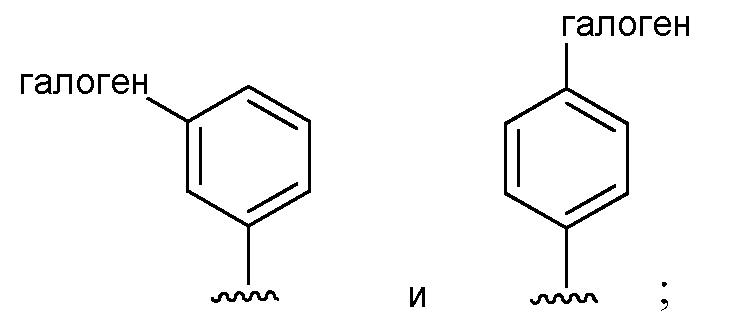
при условии, что если М представляет собой Cl, то R* не является членом, выбранным из:
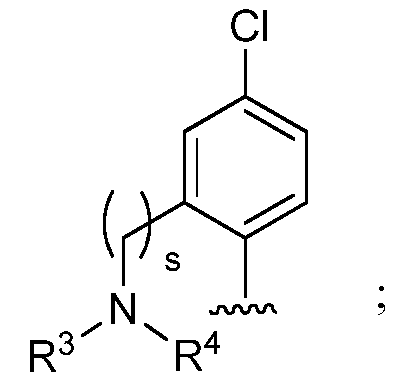
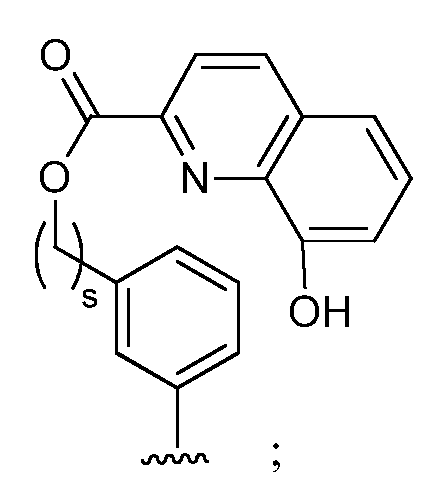
при условии, что если М представляет собой водород, то R* не является членом, выбранным из:
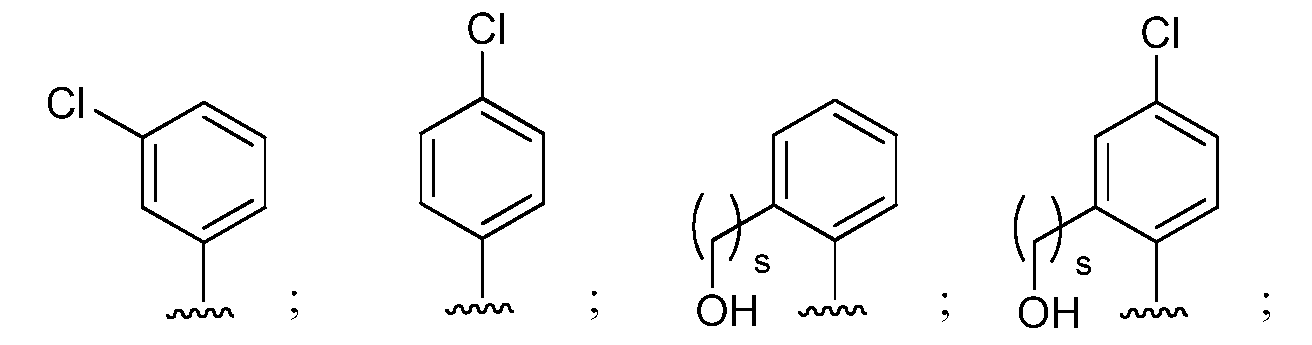
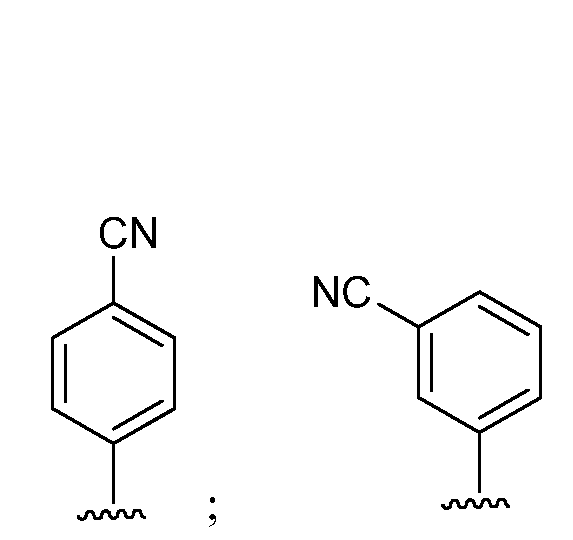
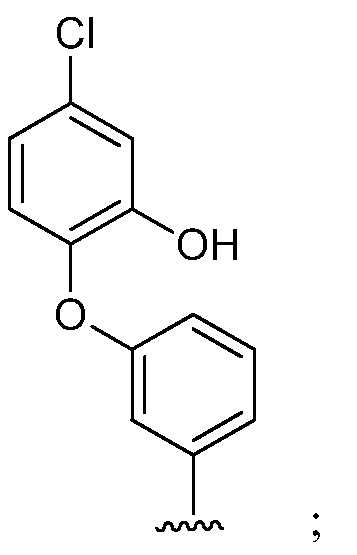
где s=1 или 2; и R3 и R4 независимо представляют собой метил или этил;
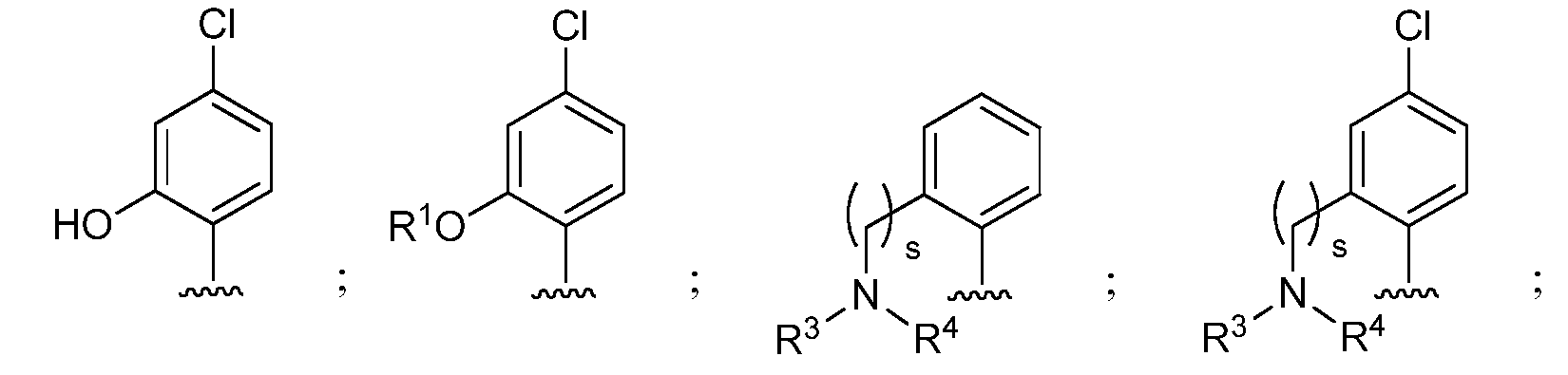
и при условии, что если М представляет собой OCH3, то R* не является членом, выбранным из:
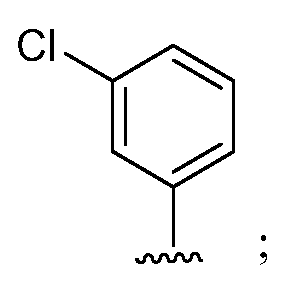
при условии, что если М1 представляет собой F, то R* не является членом, выбранным из:
и их агрономически приемлемых солей.
В одном из вариантов осуществления изобретения, R* имеет структуру, выбранную из:
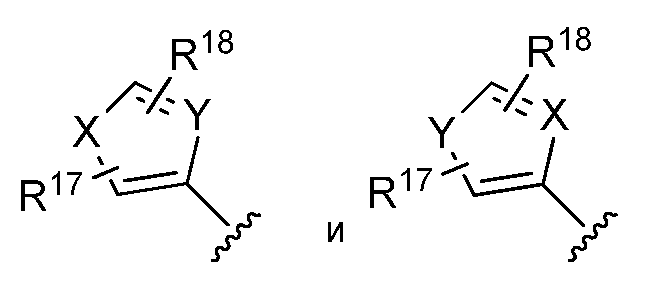
где: X представляет собой член, выбранный из CH=CH, N=CH, NR14, O и S;
R14 представляет собой член, выбранный из H, замещенного или незамещенного алкила, замещенного или незамещенного арила и замещенного или незамещенного арилалкила;
Y представляет собой член, выбранный из CH и N;
R17 и R18 представляют собой члены, независимо выбранные из H, замещенного или незамещенного алкила, замещенного или незамещенного арила, замещенного или незамещенного арилалкила, (CH2)vOH, (CH2)wNR15R16, CO2H, CO2-алкила, CONH2, S-алкила, S-арила, SO-алкила, SO-арила, SO2-алкила, SO2-арила, SO2H, SCF2, CN, галогена, CF3 и NO2;
R15 и R16 представляют собой члены, независимо выбранные из водорода, замещенного или незамещенного алкила и замещенного или незамещенного алканоила;
v=1, 2 или 3; и
w=0, 1, 2 или 3.
В другом варианте осуществления изобретения, R* имеет следующую структуру:
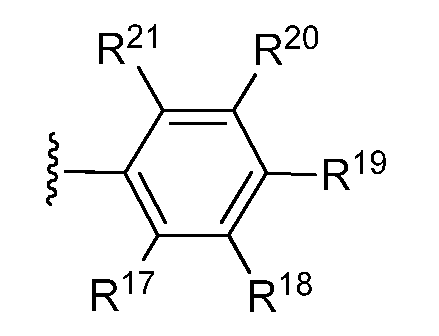
где R17, R18, R19, R20 и RZ1 независимо выбраны из H, замещенного или незамещенного алкила, замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного алкилокси, замещенного или незамещенного арилокси, замещенного или незамещенного оксазолидин-2-ила, (CH2)tOH, CO2H, CO2-алкила, CONH2, CONH-алкила, CON(алкил)2, OH, SH, S-алкила, S-арила, SO-алкила, SO-арила, SO2-алкила, SO2-арила, SO2H, SCF3, CN, галогена, CF3, NO2, (CH2)UNR22R23, SO2NH2, OCH2CH2NH2, OCH2CH2NH-алкила и OCH2CH2N(алкил)2;
где t=1, 2 или 3;
u=0, 1 или 2;
R22 и R23 независимо выбраны из H, замещенного или незамещенного алкила и замещенного или незамещенного алканоила.
В другом варианте осуществления изобретения, R* имеет следующую структуру:
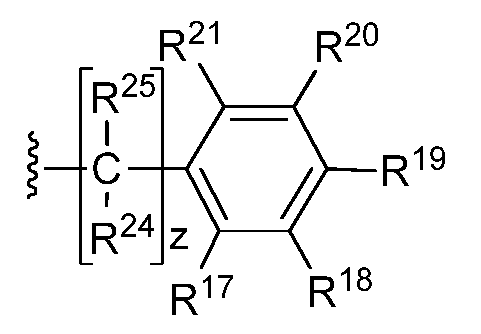
где R17, R18, R19, R20 и RZ1 независимо выбраны из H, замещенного или незамещенного алкила, замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного алкилокси, замещенного или незамещенного арилокси, замещенного или незамещенного оксазолидин-2-ила, (CH2)tOH, CO2H, CO2-алкила, CONH2, CONH-алкила, CON(алкил)2, OH, SH, S-алкила, S-арила, SO-алкила, SO-арила, SO2-алкила, SO2-арила, SO2H, SCF3, CN, галогена, CF3, NO2, (CH2)UNR22R23, SO2NH2, OCH2CH2NH2, OCH2CH2NH-алкила и OCH2CH2N(алкил)2;
где t=1, 2 или 3;
u=0, 1, или 2;
R22 и R23 независимо выбраны из H, замещенного или незамещенного алкила и замещенного или незамещенного алканоила;
R24 и R25 независимо выбраны из H, замещенного или незамещенного алкила, замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного алкилокси, замещенного или незамещенного арилокси, замещенного или незамещенного оксазолидин-2-ила, (CH2)tOH, CO2H, CO2-алкила, CONH2, CONH-алкила, CON(алкил)2, OH, SH, S-алкила, S-арила, SO-алкила, SO-арила, SO2-алкила, SO2-арила, SO3H, SCF3, CN, галогена, CF3, NO2, (CH2)UNR22R23, SO2NH2, OCH2CH2NH2, OCH2CH2NH-алкила и OCH2CH2N(алкил)2;
Z=1, 2, 3, 4, 5 или 6.
Другие антимикробные соединения были также описаны ранее в патенте США No. 8106031 и в Международной патентной заявке WO 2007/131072A2, содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки.
В некоторых вариантах осуществления изобретения, летучее антимикробное соединение согласно изобретению имеет структуру формулы (IV):
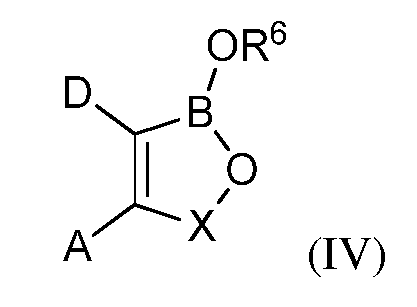
где A и D, взятые вместе с атомами углерода, с которыми они связаны, образуют 5-, 6- или 7-членное конденсированное кольцо, которое может быть замещено С1-С6-алкилом; С1-С6-алкокси; гидрокси; галогеном; нитро; нитрилом; амино; амино, замещенным одной или более С1-С6-алкильными группами; карбокси; ацилом; арилокси; карбонамидо; карбонамидо, замещенным С1-С6-алкилом, сульфонамидо или трифторметилом; или конденсированное кольцо, которое которое может связывать два оксаборольных кольца;
X представляет собой группу -CR7R8, где каждый из R7и R8независимо представляет собой водород, С1-С6-алкил, нитрил, нитро, арил, арилалкил, либо R7 и R8, взятые вместе с атомом углерода, с которым они связаны, образуют алициклическое кольцо; и
R6 представляет собой водород; С1-С18-алкил; С1-С18-алкил, замещенный С1-С6-алкокси; С1-С6-алкилтио; гидрокси; амино; амино замещенный С1-С6-алкилом; карбокси; арил; арилокси; карбонамидо; карбонамидо, замещенный С1-С6-алкилом, арилом или арилалкилом; арилалкил; арил; гетероарил; циклоалкил; С1-С18-алкиленамино; С1-С18-алкиленамино, замещенный фенилом; С1-С6-алкокси или С1-С6-алкилтио; карбонилалкиленамино или радикал формулы (V):
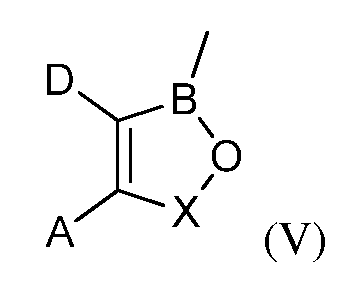
где A; D и X являются такими; как они были определены в описании настоящей заявки; за исключением фталида бора;
и их агрономически приемлемые соли.
В одном из вариантов осуществления изобретения; летучее антимикробное соединение согласно изобретению имеет структуру формулы (IX):
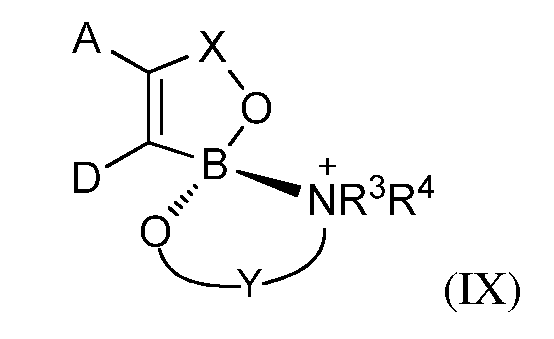
где A; D и X являются такими; как они были определены выше;
Y представляет собой двухвалентную алкиленовую линкерную группу; содержащую до 18 атомов углерода; или двухвалентную алкиленовую линкерную группу; содержащую до 18 атомов углерода; которые замещены фенилом; С1-С6-алкокси, С1-С6-алкилтио, карбонилалкиленамино; и
каждый из R3 и R4 независимо представляют собой водород; С1-С18-алкил или фенил; либо R3; взятый вместе с Y или частью Y; образуют 5-; 6- или 7-членное кольцо; содержащее атом азота.
В другом варианте осуществления изобретения; летучее антимикробное соединение согласно изобретению имеет структуру формулы (Х):
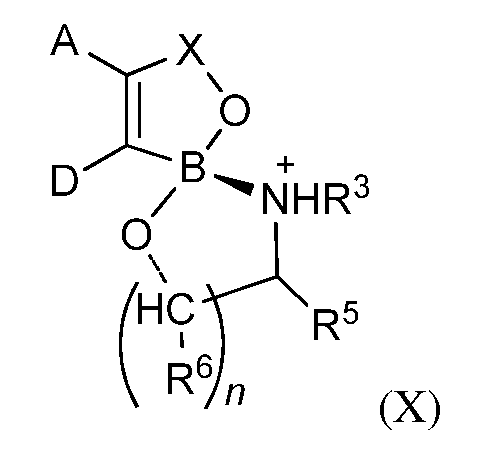
где A; D и X являются такими; как они были определены выше;
n равно 1; 2; или 3;
R3 представляет собой водород; С1-С6-алкил или фенил; и
каждый из R5 и R6 независимо представляет собой водород; алкил; содержащий всего до 16 атомов углерода; или фенил.
Другие антимикробные соединения были также описаны ранее в патенте США № 5880188; содержание которого во всей своей полноте вводится в настоящее описание посредством ссылки.
В другом своем аспекте; настоящее изобретение относится к способу применения летучего антимикробного соединения в целях уничтожения патогенов; поражающих мясные продукты; растения или части растений. Это способ включает контактирование мясных продуктов; растений или частей растений с эффективным количеством летучего антимикробного соединения формулы (VI):
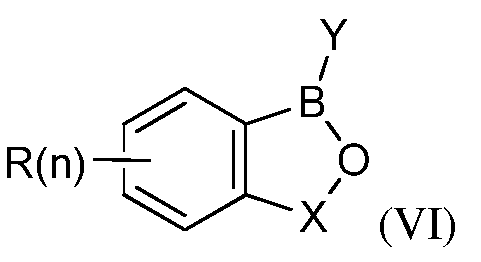
где каждый R независимо представляет собой водород; алкил; алкен; алкин; галогеналкил; галогеналкен; галогеналкин; алкокси; алкенокси; галогеналкокси; арил; гетероарил; арилалкил; арилалкен; арилалкин; гетероарилалкил; гетероарилалкен; гетероарилалкин; галоген; гидроксил; нитрил; амин; сложный эфир; карбоновую кислоту; кетон; спирт; сульфид; сульфоксид; сульфон; сульфоксимин; сульфилимин; сульфонамид; сульфат; сульфонат; нитроалкил; амид; оксим; имин; гидроксиламин; гидразин; гидразон; карбамат; тиокарбамат; мочевину; тиомочевину; карбонат; арилокси или гетероарилокси;
n=1; 2; 3 или 4;
B представляет собой бор;
X=(CR2)m; где m=1; 2; 3 или 4;
Y представляет собой алкил; алкен; алкин; галогеналкил; галогеналкен; галогеналкин; алкокси; алкенокси; галогеналкокси; арил; гетероарил; арилалкил; арилалкен; арилалкин; гетероарилалкил; гетероарилалкен; гетероарилалкин; гидроксил; нитрил; амин; сложный эфир; карбоновую кислоту; кетон; спирт; сульфид; сульфоксид; сульфон; сульфоксимин; сульфилимин; сульфонамид; сульфат; сульфонат; нитроалкил; амид; оксим; имин; гидроксиламин; гидразин; гидразон; карбамат; тиокарбамат; мочевину; тиомочевину; карбонат; арилокси или гетероарилокси;
при условии; что R не является арилокси или гетероарилокси; если Y является гидроксилом;
или его агрономически приемлемых солей.
В одном из вариантов осуществления изобретения; летучее антимикробное соединение имеет структуру формулы (VII):
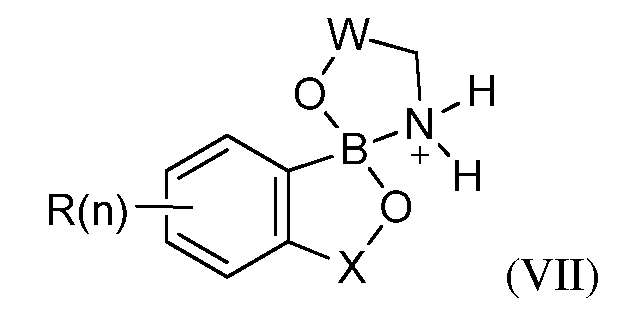
где W=(CH2)q; где q равно 1; 2 или 3.
В другом варианте осуществления изобретения; летучее антимикробное соединение имеет структуру:
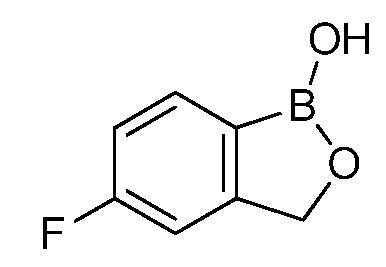
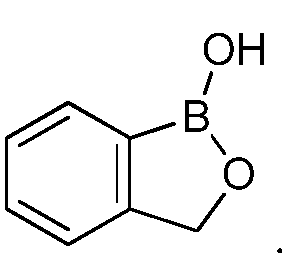
В одном из вариантов способа согласно изобретению, патоген выбран из группы, состоящей из Alternaria spp., Aspergillus spp., Botryospheria spp., Botrytis spp., Byssochlamys spp., Colletotrichum spp., Diplodia spp., Fusarium spp., Geotrichum spp., Lasiodiplodia spp., Monolinia spp., Mucor spp., Penicillium spp., Pezicula spp., Phomopsis spp., Phytophthora spp., Pythium spp., Rhizoctonia spp., Rhizopus spp., Sclerotinia spp. и Venturia spp. В другом варианте осуществления изобретения, патоген выбран из группы, состоящей из Erwinia spp., Pectobacterium spp., Pseudomonas spp., Ralstonia spp., Xanthomonas spp., Salmonella spp., Escherichia spp., Listeria spp., Bacillus spp., Shigella spp. и Staphylococcus spp. В другом варианте осуществления изобретения, патоген выбран из группы, состоящей из Candida spp., Debaryomyces spp., Bacillus spp., Campylobacter spp., Clostridium spp., Cryptosporidium spp., Giardia spp., Vibrio spp. и Yersinia spp. В другом варианте осуществления изобретения, указанный способ включает обработку растений до снятия урожая или после снятия урожая. В другом варианте осуществления изобретения, обработка растений до снятия урожая выбрана из группы, состоящей из обработки семян и обработки саженцев. В другом варианте осуществления изобретения, обработка растений после снятия урожая выбрана из группы, состоящей из обработки, проводимой во время упаковки в полевых условиях, обработки во время упаковки в контейнеры, обработки в ящиках, обработки во время транспортировки и обработки во время хранения и/или поступления в торговую сеть.
В другом варианте осуществления изобретения, растениями или частями растений являются трансгенные растения или части трансгенных растений. В другом варианте осуществления изобретения, растения или части растений выбраны из группы, состоящей из кукурузы, пшеницы, хлопчатника, риса, сои и канолы. В другом варианте осуществления изобретения, растения или части растений выбраны из группы, состоящей из плодов, овощей, рассады для питомника, дерна и декоративных культур. В другом варианте осуществления изобретения, плоды выбраны из группы, состоящей из бананов, ананасов, цитрусовых, включая апельсин, лимон, лайм, грейпфрут и другие цитрусовые, винограда, арбуза, канталупской дыни, мускусной дыни и других дынь, яблок, персиков, груш, вишни, киви, манго, нектаринов, гуавы, папайи, хурмы, граната, авокадо, инжира и ягод, включая землянику, ежевику, малину, чернику, черную смородину и ягоды других видов. В другом варианте осуществления изобретения, овощные культуры выбраны из группы, состоящей из томатов, картофеля, батата, кассавы, перца, перца стручкового сладкого, моркови, сельдерея, кабачков, баклажанов, капусты, цветной капусты, брокколи, спаржи, съедобных грибов, лука, чеснока, лука-порея и лущильных сортов фасоли. В другом варианте осуществления изобретения, цветы иди их части выбраны из группы, состоящей из роз, гвоздик, орхидей, герани, лилий или других декоративных цветковых растений. В другом варианте осуществления изобретения, мясные продукты выбраны из группы, состоящей из говядины, мяса зубра, куриного мяса, оленины, козлятины, мяса индейки, свинины, баранины, рыбы, устриц, моллюсков или других мясных продуктов сухого посола.
В одном из вариантов осуществления изобретения, контактирование включает нанесение летучего антимикробного соединения способами, выбранными из группы, состоящей из опрыскивания, мелкокапельного орошения, термоорошения или нетермоорошения, дренирования, газовой обработки и их комбинаций. В другом варианте осуществления изобретения, газовая обработка выбрана из группы, состоящей из высвобождения из саше, высвобождения из синтетической или натуральной пленки, высвобождения из волокнистого материала и/или высвобождения из гофрированного материала или других упаковочных материалов, высвобождения из порошка, высвобождения из газораспределительного генератора, высвобождения из цилиндра со сжиженным или несжиженным газом, высвобождения из капелек, находящихся в ящиках, и их комбинаций. В другом варианте осуществления изобретения, указанный способ также включает контактирование мясных продуктов, растений и частей растений с циклопропеновым соединением. В другом варианте осуществления изобретения, циклопропеновое соединение включает 1-метилциклопропен (1-MCP).
В другом своем аспекте, настоящее изобретение относится к способу применения летучего антимикробного соединения в целях уничтожения патогенов, поражающих мясные продукты, растения или части растений. Это способ включает контактирование мясных продуктов, растений или частей растений с эффективным количеством летучего антимикробного соединения формулы (VIII):
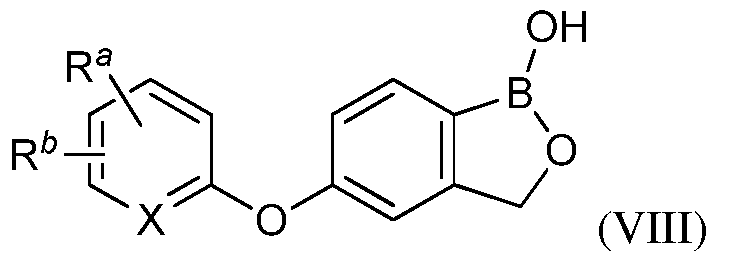
где Ra представляет собой CN, C(О)NR9R10 или C(O)OR11, где R11 представляет собой водород, замещенный алкил или незамещенный алкил,
X представляет собой N, CH и CRb,
Rb представляет собой галоген, замещенный или незамещенный алкил, C(O)R12, C(O)OR12, OR12, NR12R13, где R9, R10, R12 и R13 независимо представляют собой водород, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил,
при условии, что R9 и R10, взятые вместе с атомами, с которыми они связаны, образуют, но необязательно, 4-8-членное замещенное или незамещенное гетероциклоалкильное кольцо,
и при условии, что R12 и R13, взятые вместе с атомами, с которыми они связаны, образуют, но необязательно, 4-8-членное замещенное или незамещенное гетероциклоалкильное кольцо,
и его агрономически приемлемых солей.
В одном из вариантов осуществления изобретения, летучее антимикробное соединение согласно изобретению имеет структуру формулы (XI):
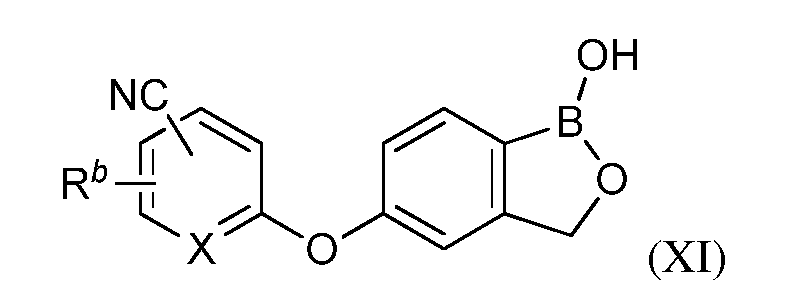
В другом варианте осуществления изобретения, летучее антимикробное соединение согласно изобретению выбрано из:
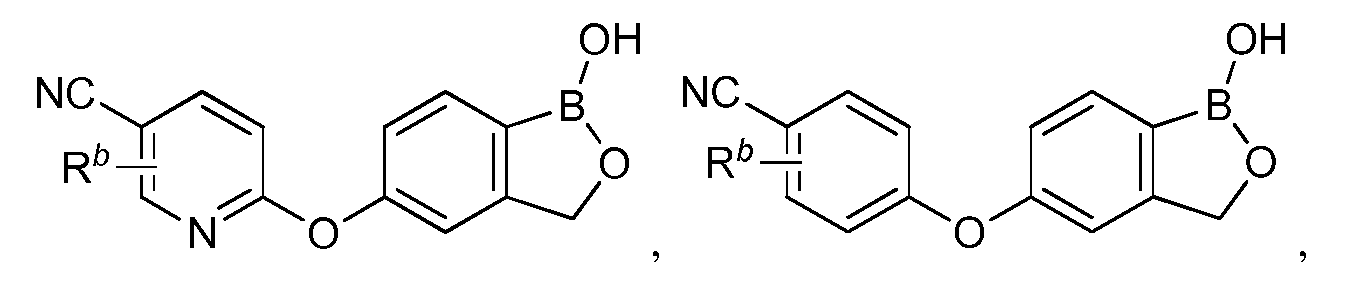
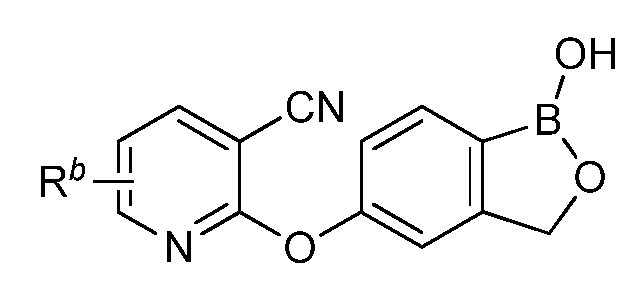
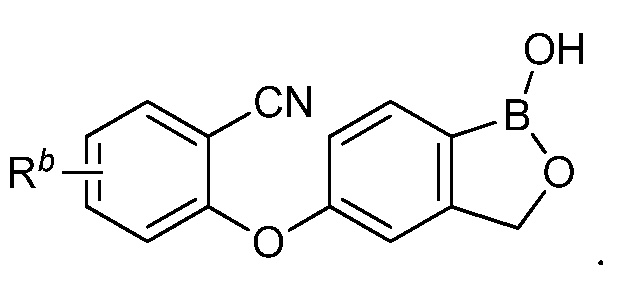
В другом варианте осуществления изобретения, летучее антимикробное соединение согласно изобретению выбрано из:
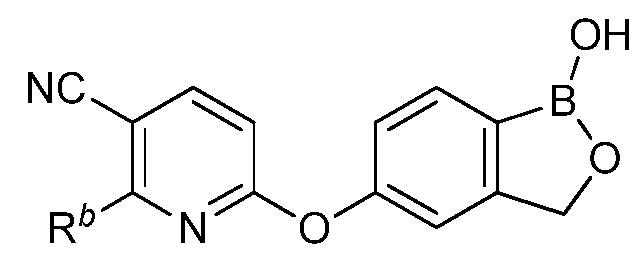
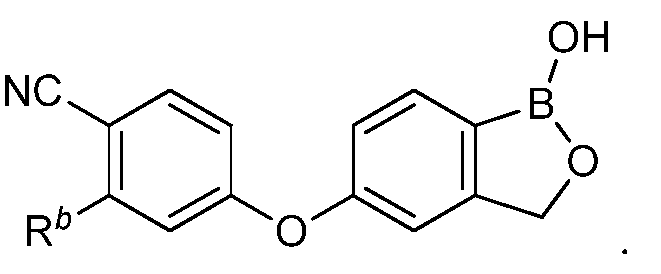
В другом варианте осуществления изобретения, летучее антимикробное соединение согласно изобретению выбрано из:
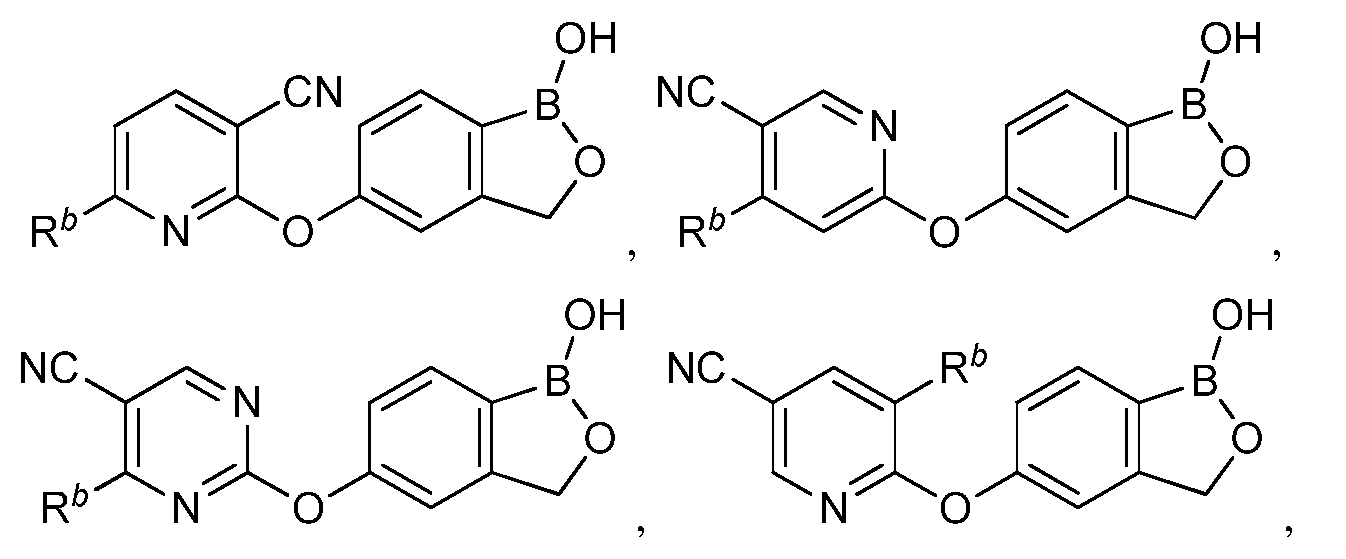
и
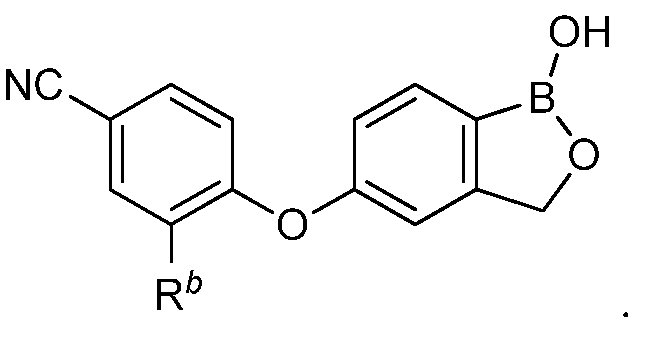
В одном из вариантов осуществления изобретения, летучее антимикробное соединение согласно изобретению имеет структуру формулы (XII):
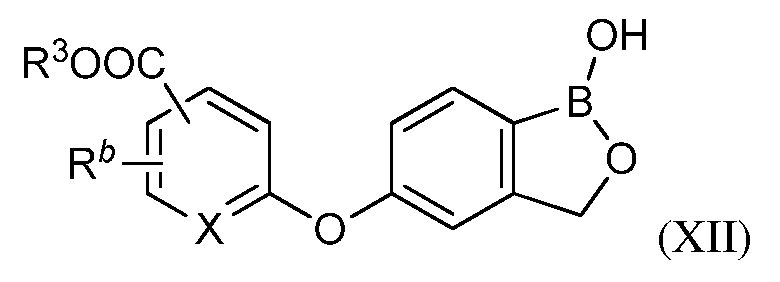
В другом варианте осуществления изобретения, летучее антимикробное соединение согласно изобретению выбрано из:
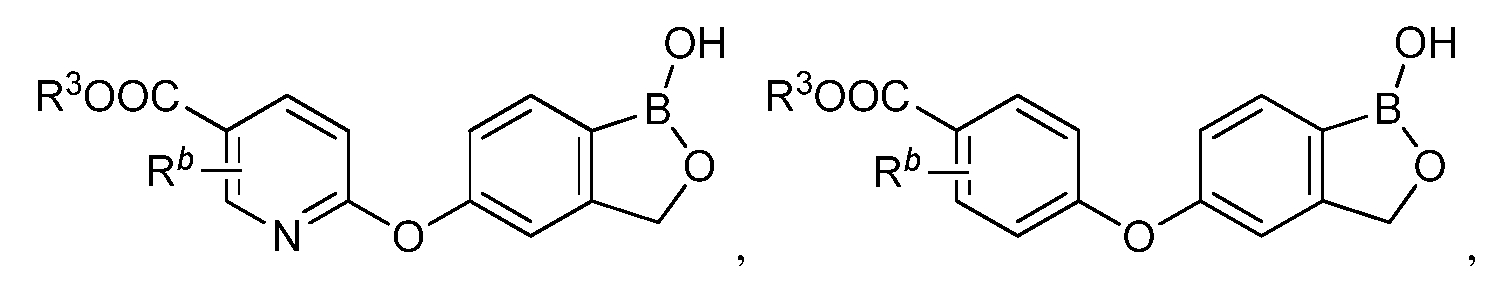
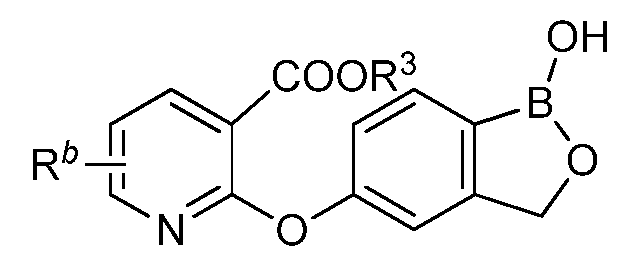
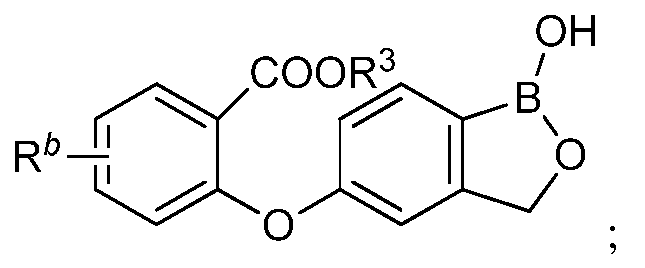
где R3 представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный гетероалкил.
В другом варианте осуществления изобретения, летучее антимикробное соединение согласно изобретению выбрано из:
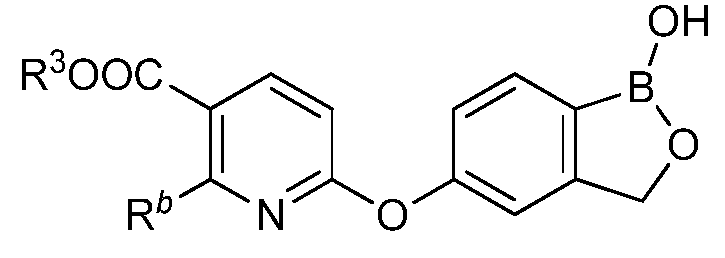
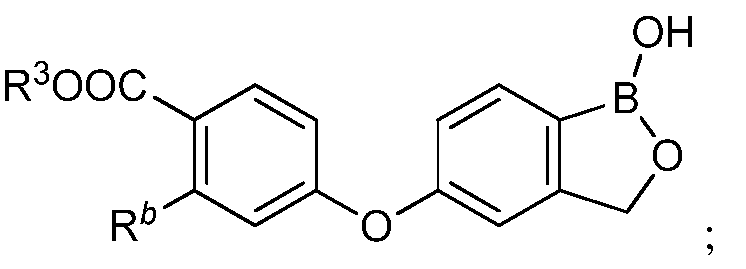
где R3 представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный гетероалкил.
В другом варианте осуществления изобретения, летучее антимикробное соединение согласно изобретению выбрано из:
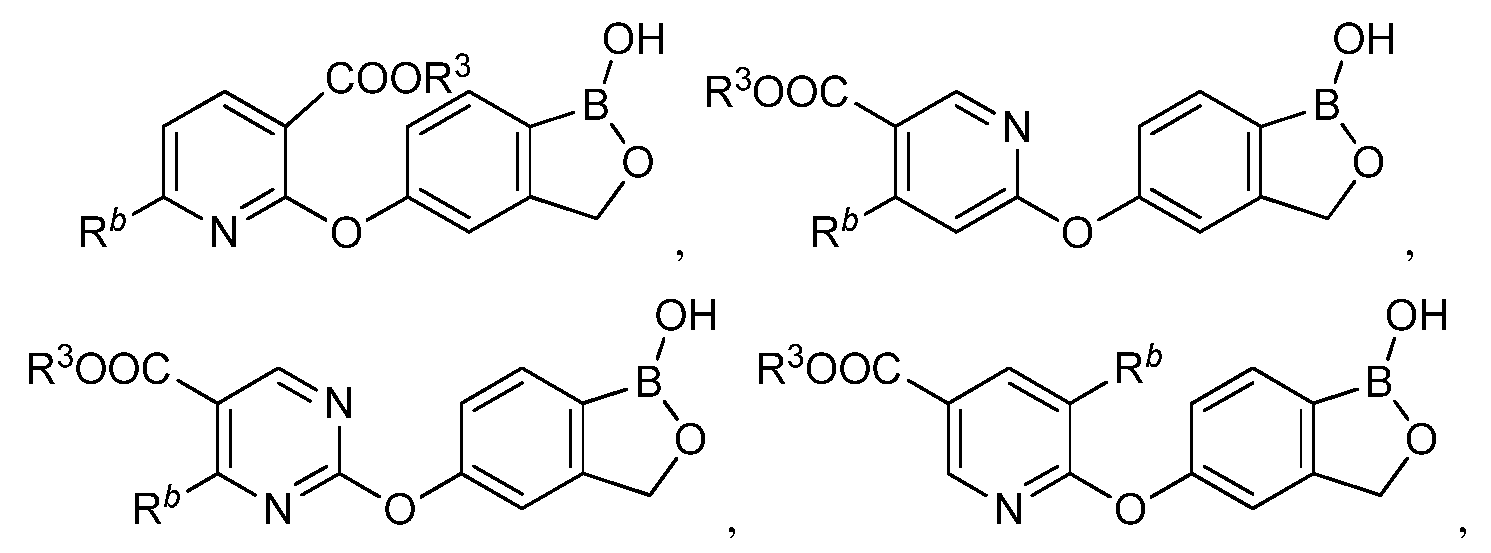
и
где R3 представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный гетероалкил.
В одном из вариантов осуществления изобретения, летучее антимикробное соединение согласно изобретению имеет структуру формулы (XIII):
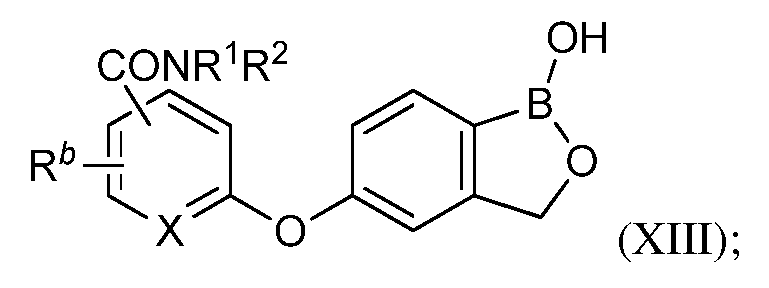
где каждый из R1 и R2 независимо представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный гетероалкил.
В другом варианте осуществления изобретения, летучее антимикробное соединение согласно изобретению выбрано из:
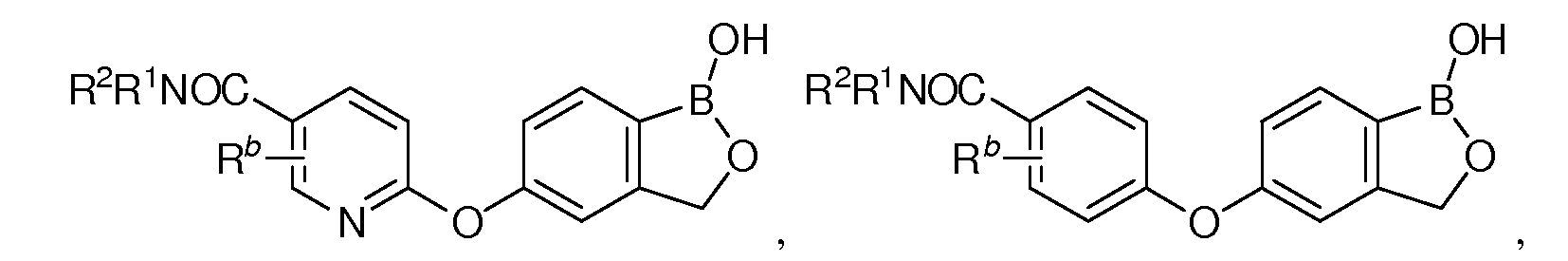
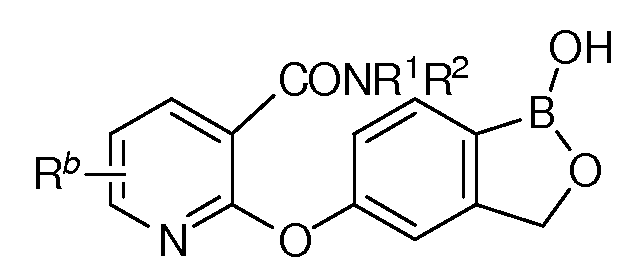

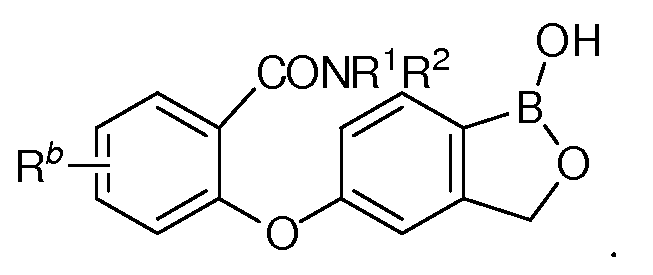
В другом варианте осуществления изобретения, летучее антимикробное соединение согласно изобретению выбрано из:
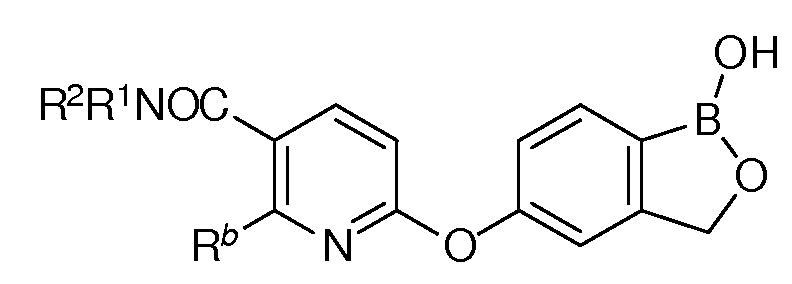
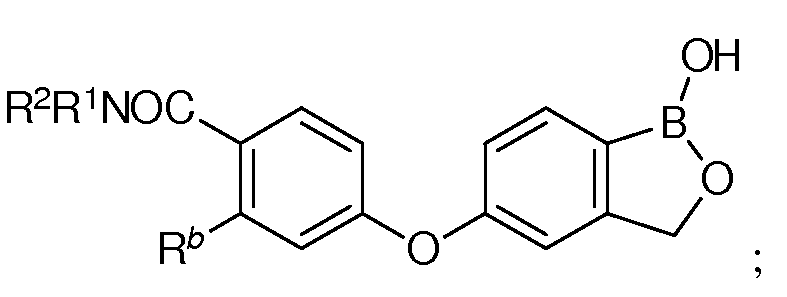
где каждый из R1 и R2 независимо представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный гетероалкил.
В другом варианте осуществления изобретения, летучее антимикробное соединение согласно изобретению выбрано из:
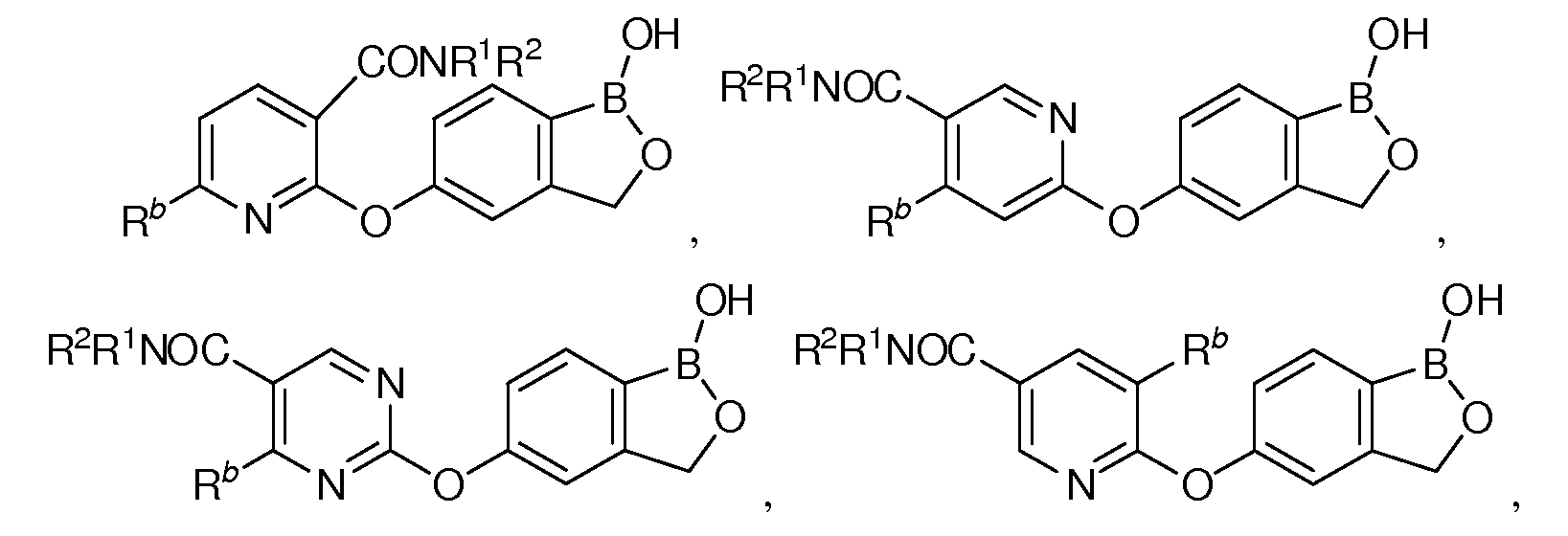
и
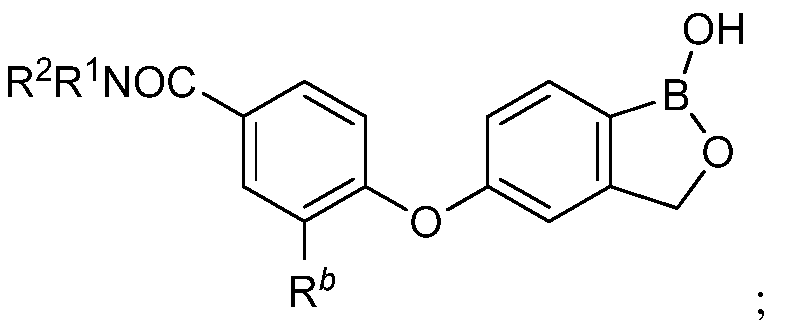
где каждый из R1 и R2 независимо представляет собой водород, замещенный или незамещенный алкил или замещенный или незамещенный гетероалкил.
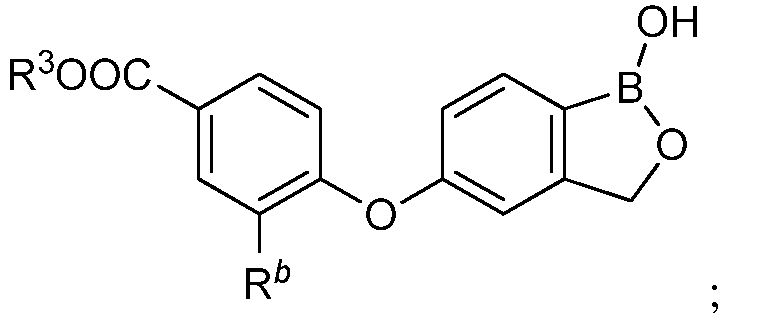
В одном из вариантов осуществления изобретения, Rb выбран из фтора и хлора. В другом варианте осуществления изобретения, Rb выбран из OR26 и NR27R28. В другом варианте осуществления изобретения, если Rb представляет собой OR26, то R26 выбран из H, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила и замещенного или незамещенного гетероарила. В другом варианте осуществления изобретения, если Rb представляет собой OR26, то R26 выбран из H, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила и замещенного или незамещенного циклоалкила. В другом варианте осуществления изобретения, если Rb представляет собой OR26, то R26 представляет собой незамещенный С1-С6-алкил. В другом варианте осуществления изобретения, если Rb представляет собой OR26, то R26 представляет собой незамещенный циклоалкил. В другом варианте осуществления изобретения, если Rb представляет собой OR26, то R26 представляет собой алкил, замещенный членом, выбранным из замещенного или незамещенного С1-С6-алкокси. В другом варианте осуществления изобретения, если Rb представляет собой OR26, то R26 представляет собой алкил, замещенный по меньшей мере одним галогеном. В другом варианте осуществления изобретения, если Rb представляет собой OR26, то R26 представляет собой алкил, замещенный по меньшей мере одной оксогруппой.
В другом варианте осуществления изобретения, если Rb представляет собой OR26, то R26 представляет собой член, выбранный из -CH3, -CH2CH3, -(CH2)2CH3, -CH(CH3)2, -CH2CF3, -CH2CHF2, -CH2CH2(OH), -CH2CH2(OCH3), -CH2CH2(OC(CH3)2), -C(O)CH3, -CH2CH2OC(O)CH3, -CH2C(O)OCH2CH3, -CH2C(O)OC(CH3)3, -(CH2)3C(O)CH3, -CH2C(O)OC(CH3)3, циклопентила, циклогексила,
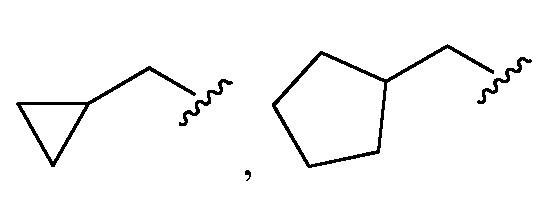
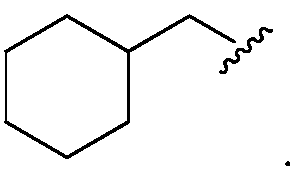
В другом варианте осуществления изобретения, если Rb представляет собой NR27R28, то R27и R28представляют собойчлены, независимо выбранные из H, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила и замещенного или незамещенного гетероарила. В другом варианте осуществления изобретения, если Rb представляет собой NR27R28, то R27представляет собой Н или незамещенный алкил, а R28представляет собойнезамещенный алкил или алкил, замещенный членом, выбранным из гидроксила, фенила, незамещенного алкокси и алкокси, замещенного фенилом. В другом варианте осуществления изобретения, если Rb представляет собой NR27R28, то R27представляет собой Н или CH3.
В другом варианте осуществления изобретения, если Rb представляет собой NR27R28, то R27и R28независимо выбраны из замещенного или незамещенного алкила. В другом варианте осуществления изобретения, если Rb представляет собой NR27R28, то R27представляет собой незамещенный алкил, а R28 представляет собой замещенный или незамещенный алкил. В другом варианте осуществления изобретения, если Rb представляет собой NR27R28, то R27представляет собой незамещенный алкил, а R28 представляет собой алкил, замещенный членом, выбранным из замещенного или незамещенного алкокси и гидроксила. В другом варианте осуществления изобретения, если Rb представляет собой NR27R28, то R27представляет собой незамещенный алкил, а R28 представляет собой алкил, замещенный незамещенным алкокси. В другом варианте осуществления изобретения, если Rb представляет собой NR27R28, то R27представляет собой незамещенный алкил, а R28 представляет собой алкил, замещенный алкокси, который замещен фенилом. В другом варианте осуществления изобретения, если Rb представляет собой NR27R28, то R27представляет собой алкил, а R28 представляет собой алкил, замещенный незамещенным алкокси. В другом варианте осуществления изобретения, если Rb представляет собой NR27R28, то R27 и R28, взятые вместе с атомом азота, с которым они связаны, образуют 4-8-членное замещенное или незамещенное гетероциклоалкильное кольцо. В другом варианте осуществления изобретения, если Rb представляет собой NR27R28, то R27 и R28, взятые вместе с атомом азота, с которым они связаны, образуют 5-или 6-членное замещенное или незамещенное гетероциклоалкильное кольцо.
В другом варианте осуществления изобретения, Rb выбран из N(CH3)2, N(CH3)(CH2CH2(OCH3)), N(CH3)(CH2CH2OH), NH2, NHCH3, NH(CH2CH2(OCH3)), NH(CH2CH2(OCH2Ph), NH(CH2Ph), NH(C(CH3)3) и NH(CH2CH2OH). В другом варианте осуществления изобретения, Rb выбран из
Другие антимикробные соединения были также описаны ранее в патенте США № 8039450 и в публикации патентной заявки US 2009/0291917, содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Практическое осуществление настоящего изобретения включает применение одного или более циклопропеновых соединений. Используемым здесь циклопропеновым соединением является любое соединение формулы:
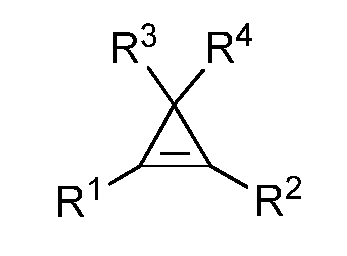
где каждый из R1, R2, R3 и R4 независимо выбран из группы, состоящей из H и химической группы формулы:
-(L)n-Z
где n равно целому числу от 0 до 12. Каждый L представляет собой двухвалентный радикал. Подходящими группами L являются, например, радикалы, содержащие один или более атомов, выбранных из H, B, C, N, O, P, S, Si или их смесей. Атомы в группе L могут быть связаны друг с другом простыми связями, двойными связями, тройными связями или их комбинациями. Каждая группа L может быть прямой, разветвеленной, циклической или комбинированной. В любой одной группе R (то есть любой из R1, R2, R3 и R4), общее число гетероатомов (то есть атомов, которые не являются ни H, ни C) составляет от 0 до 6. Независимо, в любой одной группе R, общее число неводородных атомов составляет 50 или менее. Каждый Z представляет собой одновалентный радикал. Каждый Z независимо выбран из группы, состоящей из водорода, галогена, циано, нитро, нитрозо, азидо, хлората, бромата, иодата, изоцианато, изоцианидо, изотиоцианато, пентафтортио и химической группы G, где G представляет собой 3-14-членную циклическую систему.
Группы R1, R2, R3 и R4 независимо выбраны из подходящих групп. Из этих групп, подходящими группами для их использования в качестве одной или более R1, R2, R3 и R4, являются, например, алифатические группы, алифатические оксигруппы, алкилфосфонатогруппы, циклоалифатические группы, циклоалкилсульфонильные группы, циклоалкиламиногруппы, гетероциклические группы, арильные группы, гетероарильные группы, галогены, силильные группы и другие группы, а также их смеси и комбинации. Группы, которые являются подходящими для их использования в качестве одной или более R1, R2, R3 и R4, могут быть замещенными или незамещенными.
Подходящими группами R1, R2, R3 и R4 являются, например, алифатические группы. Некоторыми подходящими алифатическими группами являются, например, алкильные, алкенильные и алкинильные группы. Подходящие алифатические группы могут быть прямыми, разветвленными, циклическими или комбинированными. Независимо, подходящие алифатические группы могут быть замещенными или незамещенными.
Используемая здесь и представляющая интерес химическая группа считается «замещенной», если один или более атомов водорода в представляющей интерес химической группе заменен заместителем.
Подходящими группами R1, R2, R3 и R4 являются, например, замещенные и незамещенные гетероциклильные группы, которые связаны с циклопропеновым соединением посредством промежуточной оксигруппы, аминогруппы, карбонильной группы или сульфонильной группы, и примерами таких групп R1, R2, R3 и R4 являются гетероциклилокси, гетероциклилкарбонил, дигетероциклиламино и дигетероциклиламиносульфонил.
Подходящими группами R1, R2, R3 и R4 являются, например, замещенные и незамещенные гетероциклильные группы, которые связаны с циклопропеновым соединением посредством промежуточной оксигруппы, аминогруппы, карбонильной группы, сульфонильной группы, тиоалкильной группы или аминосульфонильной группы, и примерами таких групп R1, R2, R3 и R4 являются дигетероариламино, гетероарилтиоалкил и дигетероариламиносульфонил.
Подходящими группами R1, R2, R3, и R4 являются, например, водород, фтор, хлор, бром, иод, циано, нитро, нитрозо, азидо, хлорато, бромато, иодато, изоцианато, изоцианидо, изотиоцианато, пентафтортио, ацетокси, карбоэтокси, цианато, нитрато, нитрито, перхлорато, алленил, бутилмеркапто, диэтилфосфонато, диметилфенилсилил, изохинолил, меркапто, нафтил, фенокси, фенил, пиперидино, пиридил, хинолил, триэтилсилил, триметилсилил и их замещенные аналоги.
Используемая здесь химическая группа G представляет собой 3-14-членную циклическую систему. Циклические системы, подходящие для их использования в качестве химической группы G, могут быть замещенными или незамещенными, и эти системы могут быть ароматическими (включая, например, фенил и нафтил) или алифатическими (включая ненасыщенные алифатические, частично насыщенные алифатические или насыщенные алифатические группы), а также карбоциклическими или гетероциклическими. В гетероциклических группах G, некоторыми подходящими гетероатомами являются, например, атомы азота, серы, кислорода и их комбинации. Циклические системы, подходящие для их использования в качестве химической группы G, могут представлять собой моноциклические, бициклические, трициклические и полициклические группы, а также спирогруппы или конденсированные группы, причем, в подходящих циклических системах, используемых в качестве химической группы G и являющихся бициклическими, трициклическими или конденсированными, различные кольца в одной химической группе G могут принадлежать к одному и тому же типу или к двум или более типам (например, ароматическое кольцо может быть конденсировано с алифатическим кольцом).
В одном из вариантов осуществления изобретения, один или более из R1, R2, R3 и R4 представляют собой водород или С1-С10-алкил. В другом варианте осуществления изобретения, каждый из R1, R2, R3 и R4 представляет собой водород или С1-С8-алкил. В другом варианте осуществления изобретения, каждый из R1, R2, R3 и R4 представляет собой водород или С1-С4-алкил. В другом варианте осуществления изобретения, каждый из R1, R2, R3 и R4 представляет собой водород или метил. В другом варианте осуществления изобретения, R1 представляет собой С1-С4-алкил, а каждый из R2, R3 и R4 представляет собой водород. В другом варианте осуществления изобретения, R1 представляет собой метил, каждый из R2, R3 и R4 представляет собой водород, а циклопропеновое соединение называется здесь 1-метилциклопропеном или «1-MCP».
В другом варианте осуществления изобретения, циклопропен представляет собой соединение формулы:
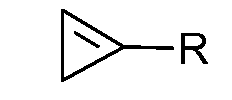
где R представляет собой замещенную или незамещенную алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкилалкильную, фенильную или нафтильную группу, где заместителями независимо являются галоген, алкокси или замещенный или незамещенный фенокси. В одном из вариантов осуществления изобретения, R представляет собой С1-С8-алкил. В другом варианте осуществления изобретения, R представляет собой метил.
В другом варианте осуществления изобретения, циклопропен представляет собой соединение формулы:
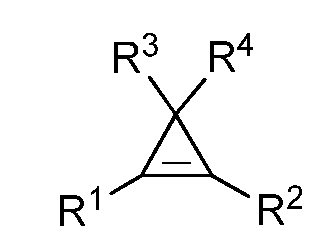
где R1 представляет собой замещенную или незамещенную С1-С4- алкильную, С1-С4-алкенильную, С1-С4-алкинильную, С1-С4-циклоалкильную, циклоалкилалкильную, фенильную или нафтильную группу, а R2, R3 и R4 представляют собой водород. В другом варианте осуществления изобретения, циклопропен представляет собой 1-метилциклопропен (1-MCP).
Используемый здесь термин «трансгенный вектор» означает вектор, который содержит встроенный сегмент дезоксирибонуклеиновой кислоты (ДНК), где «трансген» транскрибируется в матричную рибонуклеиновую кислоту (мРНК) или реплицируется как рибонуклеиновая кислота (РНК) в клетке-хозяине. Термин «трансген» означает не только часть встроенной ДНК, которая превращается в РНК, но также и части вектора, которые являются необходимыми для транскрипции или репликации РНК. Трансген обычно содержит представляющий интерес ген, который включает, но необязательно, полинуклеотидную последовательность, содержащую открытую рамку считывания, способную продуцировать белок.
Мясные продукты, растения или части растений могут быть обработаны способом согласно изобретению. Одним из примеров является обработка целых растений, а другим примером является обработка целых растений, которые высаживают в почву до сбора подходящих частей растений.
Любые растения, от которых могут быть получены подходящие части, могут быть обработаны способом согласно изобретению. Примерами являются плодовые, овощные и зерновые культуры.
Используемый здесь термин «растение» включает двудольные и однодольные растения. Примерами двудольных растений являются табак, резушка Таля (Arabidopsis), соя, томаты, папайя, канола, подсолнечник, хлопчатнимк, люцерна, картофель, виноград, голубиный горох, горох, капуста (Brassica), нут, сахарная свекла, рапс, арбуз, дыня, перец, арахис, тыква, редька, шпинат, кабачок, брокколи, капуста кочанная, морковь, цветная капуста, сельдерей, китайская капуста, огурец, баклажан и латук. Примерами однодольных растений являются кукуруза, рис, пшеница, сахарный тростник, ячмень, рожь, сорго, орхидеи, бамбук, банан, рогоз, лилии, овес, лук, просо и тритикале. Пимерами плодов являются банан, ананас, апельсин, виноград, грейпфрут, арбуз, дыня, яблоки, персики, груши, киви, манго, нектарины, гуава, хурма, авокадо, лимон, инжир и ягоды.
Исходя из представленного здесь описания, специалисту в данной области будет очевидно, что в настоящее изобретение могут быть внесены некоторые изменения. Таким образом, нижеследующие примеры приводятся лишь в целях иллюстрации настоящего изобретения и не должны рассматриваться как ограничение объема изобретения или формулы изобретения.
ПРИМЕРЫ
Пример 1
12-луночные (7-миллилитровые (мл объема на лунку) микротитрационные планшеты использовали для in vitro анализа на ингибирование, осуществляемого с применением летучих антимикробных соединений. В каждую лунку добавляли 3 мл объема полного картофельного агара с декстрозой (PDA). После охлаждения, 1 микролитр (мкл) суспензии 1×106 спор Botrytis cinerea на мл пипетировали пятнами в центральную часть агара. В первом эксперименте, инокулированные планшеты оставляли на 5 дней при 4°C для прорастания спор. Во втором эксперименте, планшеты инокулировали непосредственно перед обработкой летучим фунгицидом. Небольшие фильтровальные диски Whatman #1 (Cat. No. 1001-0155) помещали, в дубликате, на внутреннюю сторону полиэтиленовой пленки, которой герметично покрывали ПЦР-планшет.
Для определения минимальной ингибирующей концентрации (MIC), Соединение A (бензоксаборол, фигура 1) разводили в ацетоне, и соответствующее количество соединения добавляли на диски в зависимости от дозы (1,25-0,0006 миллиграммов на диск (мг/диск)). Диски оставляли на 5 минут для испарения ацетона. Затем, пространство над инокулятом Botrytis cinerea, содержащимся в лунке, герметично закрывали пленкой с прикрепленным к ней диском, содержащим фунгицид. Планшеты переворачивали так, чтобы их содержимое находилось над обработанными дисками и герметично закрывали для предотвращения утечки любого химического вещества с диска и его попадания на инокулированный агар. После хранения в течение 14 дней при 4°C, культуры оценивали на процент роста по сравнению с контролем. Независимо от того, наблюдалось ли прорастание спор в течение 5 дней, или обработка проводилась сразу после инокуляции планшетов (~15 минут), 100% уничтожение грибкового патогена достигалось при снижении нормы внесения до 0,005 мг. Результаты эксперимента систематизированы в таблице 1. Полученные результаты дают основание предположить, что соединение A способно уничтожать споры Botrytis cinerea и ингибировать рост мицелия при той же самой концентрации. Таким образом, эффективность Соединения А (фигура 1) в ингибировании роста грибков in vitro при норме внесения 0,005 мг/диск составляла 100%.
Пример 2
Было протестировано всего 14 антимикробных соединений в анализе на ингибирование in vitro, описанном в примере 1. Все 14 соединений наносили в дубликате на диски Whatman в зависимости от дозы (0,31-0,0006 мг/диск). Результаты показали, что Соединение А обнаруживало наилучшее уничтожение Botrytis cinerea, то есть, 100% уничтожение при норме внесения до 0,005 мг/диск. Другие соединения, такие как Соединение C, Соединение D и Соединение E, давали 100% уничтожение при норме внесения до 0,023, 0,04 и 0,08 мг/диск, соответственно. Тестируемые соединения представлены на фигуре 3. Результаты для девяти соединений представлены в таблице 2, а другие пять соединений не обладали какой-либо детектируемой активностью в тестируемых интервалах.
Пример 3
Соединение B (фигура 2, циклический моноэфир 2-(гидроксиметил)фенилбороновой кислоты, дефторированный аналог Соединения A) оценивали методом, аналогичным методу, описанному выше в примерах 1 и 2. Это соединение наносили на фильтровальную бумагу Whatman при норме внесения 0,5 мг - 0,0039 мг/диск. Результаты показали, что Соединение B на 100% ингибирует Botrytis cinerea при норме внесения 0,0078 мг/диск.
Пример 4
Для оценки in vivo активности летучих антимикробных соединений был разработан биоанализ на активность летучих соединений, проводимый с использованием столовых сортов зеленого винограда. Плоды помещали отдельно в 20-миллилитровый сцинтилляционный сосуд срезанным стеблем верх. Поверхность от свежесрезанного стебля инокулировали 10 мкл суспензии 1×106 спор Botrytis cinerea на мл. Фильтровальную бумагу Whatman (Cat. No. 1822-024) помещали на внутренние стороны крышек сосудов в дубликате. Для определения MIC, Соединение A (фигура 1) разводили в ацетоне, и на диски добавляли соответствующее количество соединения в зависимости от дозы (2,5-0,0024 мг/диск). Сосуды оставляли на 5 минут для испарения ацетона. Затем сосуды закрывали крышками, содержащими фунгицид, и оставляли на 14 дней при 4°C. После хранения, плоды оценивали на наличие поражения и на фитотоксичность. Результаты были систематизированы в таблице 3, и эти результаты показали, что 100% уничтожение Botrytis cinerea наблюдалось при норме внесения до 0,04 мг/диск, но, при этом, не наблюдалось какой-либо фитотоксичности при любых оцениваемых нормах внесения. Фотографии репрезентативных результатов анализов на ингибирование in vivo, проводимых с использованием Соединения A, представлены на фигуре 4, где 0,04 мг Соединения A давало 100% ингибирование, а 0,0024 мг Соединения A не давало какого-либо ингибирования.
Пример 5
Для оценки in vivo активности летучих антимикробных соединений был разработан биоанализ, проводимый на ягодах земляники. Два плода помещали в 240-миллилитровый контейнер, чашечками вниз. Свежий срез инокулировали 20 мкл суспензии 1×106 спор Botrytis cinerea на мл. Фильтровальную бумагу Whatman (Cat. No. 1822-024) помещали на внутренние стороны крышек контейнеров в дубликате. Для определения MIC, Соединение A (бензоксаборол, фигура 1) разводили в ацетоне, и на диски добавляли соответствующее количество соединения в зависимости от дозы (2,5-0,005 мг/диск). Для определения MIC, Соединение В (бензоксаборол, фигура 2) разводили в ацетоне, и на диски добавляли соответствующее количество соединения в зависимости от дозы (2,5-0,005 мг/диск). Контейнеры оставляли на 5 минут для испарения ацетона. Затем контейнеры закрывали крышками, содержащими фунгицид, и оставляли на 5 дней при 4°C. После хранения, плоды оценивали на наличие и тяжесть поражения и на фитотоксичность. Результаты были систематизированы в таблице 4. Эти результаты показали, что 100% уничтожение Botrytis cinerea наблюдалось при норме внесения до 0,016 мг/диск для Соединения A, и при норме внесения до 0,32 мг/диск для Соединения B, при этом, какой-либо фитотоксичности при любых оцениваемых нормах внесения не наблюдалось.
Пример 6
Для оценки in vivo активности летучих антимикробных соединений в зависимости от дозы и времени был разработан биоанализ, проводимый на ягодах земляники. Два плода помещали в 240-миллилитровый контейнер, чашечками вниз. Свежий срез инокулировали 20 мкл суспензии 1×106 спор Botrytis cinerea на мл. Фильтровальную бумагу Whatman (Cat. No. 1822-024) помещали на внутренние стороны крышек контейнера в дубликате. Соединение A (бензоксаборол, фигура 1) разводили в ацетоне, и на диски добавляли соответствующее количество соединения при двух нормах внесения 0,008 или 0,125 мг. Контейнер оставляли на 5 минут для испарения ацетона. Затем контейнеры закрывали крышками, содержащими фунгицид, и инкубировали с летучим фунгицидом в течение 1, 3, 6, 24 или 72 часов. После инкубирования, крышки, содержащие диск с Соединением A, заменяли новыми крышками, на которых отсутствовало Соединение A. Все образцы хранили в течение 3 дней при 21°C, а затем крышки снимали, и образцы хранили еще 48 часов при относительной влажности (R.H.) 90%. Плоды оценивали на наличие и тяжесть поражения и на фитотоксичность. Результаты были систематизированы в таблице 5. Эти результаты показали, что 100% уничтожение Botrytis cinerea наблюдалось при норме внесения 0,125 мг/диск для Соединения A после 6-часовой обработки, при этом, в данном случае какой-либо фитотоксичности не наблюдалось. 0,125 мг Соединения A давало 100% ингибирование in vivo по сравнению с контролем, который содержал только ацетон. Репрезентативные результаты также представлены на фигуре 5.
Тяжесть:
0 = отсутствие роста грибков
1 = слабое инфицирование (диаметр <5 миллиметров (мм))
2 = умеренное инфицирование (диаметр <1 сантиметра (см))
3 = высокая степень инфицирования (диаметр >1 см)
4 = очень высокая степень инфицирования (> половины длины плода)
Пример 7
12-луночные (7 мл объема на лунку) микротитрационные планшеты использовали для in vitro анализа на ингибирование, осуществляемого с применением летучих антимикробных соединений. В каждую лунку добавляли 3 мл объема полного агара LB. После охлаждения, 15 мкл Escherichia coli, доведенной до оптической плотности 0,02-0,035, а затем разведенной 1/10, пипетировали в центральную часть агара, и планшеты переворачивали для однородного распределения. Небольшие фильтровальные диски Whatman #1 (Cat. No. 1001-0155) помещали, в дубликате, на внутреннюю сторону полиэтиленовой пленки, которой герметично покрывали планшет для полимеразной цепной реакции (ПЦР). Для определения минимальной ингибирующей концентрации (MIC), Соединение A (бензоксаборол, фигура 1) разводили в ацетоне, и 5 мг этого соединения наносили на диски. Диски оставляли на 5 минут для испарения ацетона. Затем, пространство поверх инокулята Escherichia coli, содержащегося в лунке, герметично закрывали пленкой с прикрепленным к ней диском, содержащим фунгицид. Планшеты переворачивали так, чтобы содержимое находилось над обработанными дисками, и герметично закрывали для предотвращения утечки любого химического вещества с диска и его попадания на инокулированный агар. После хранения в течение 3 дней при 4°C, культуры хранили еще 2 дня при 23°C, а затем оценивали на рост колоний по сравнению с контролем. Результаты эксперимента систематизированы в таблице 6. Полученные результаты дают основание предположить, что соединение A способно ингибировать Escherichia coli.
Оценка колоний:
0 = Отсутствие колоний
1 = Микроколонии без слияния
2 = Небольшие колонии с некоторым слиянием
3 = Крупные колонии со слиянием
Пример 8
12-луночные (6,5 мл объема на лунку) микротитрационные планшеты использовали для in vitro анализа на ингибирование, осуществляемого с применением летучих антимикробных соединений. В каждую лунку добавляли 3 мл объема полного картофельного агара с декстрозой (PDA). После охлаждения, 1 мкл суспензии 1×105 спор Botrytis cinerea, Penicillium expansum, Alternaria alternata, Monilinia fructicola или Glomerella cingulata на мл пипетировали пятнами в центральную часть агара. Планшеты инокулировали непосредственно перед обработкой летучим фунгицидом. Фильтровальный диск Whatman #1 (Cat. No. 1001-0155) помещали в дубликате на внутреннюю сторону полиэтиленовой пленки, которой герметичного покрывали ПЦР-планшет. Для определения минимальной ингибирующей концентрации (MIC), соединения разводили в ацетоне, и на диски наносили соответствующее количество этого соединения в зависимости от дозы до достижения конечной концентрации в верхнем пространстве 1142,9-0,6 мг/л. Затем, диски оставляли на 5 минут для испарения ацетона. После этого, пространство над инокулятом, содержащимся в лунке, герметично закрывали пленкой с прикрепленным к ней диском, содержащим фунгицид, и переворачивали, так чтобы так, чтобы их содержимое находилось над обработанными дисками, и герметично закрывали для предотвращения утечки любого химического вещества с диска и его попадания на инокулированный агар. После хранения в течение 3 дней при 23°C, культуры оценивали на процент роста колоний по сравнению с контролем путем измерения диаметра колоний грибковых патогенов. Результаты эксперимента систематизированы в таблице 7. Полученные результаты указывают на то, что бензоксабороловые соединения обладают превосходной активностью in vitro, направленной против пяти выбранных грибковых патогенов растений.
BOTRCI = Botrytis cinerea (серая плесень)
PENIEX = Penicillium expansum (голубая плесень яблок)
ALTEAL = Alternaria alternata (коричневая пятнистость табака)
MONIFC = Monilinia fructicola (коричневая гниль яблок)
GLOMCI = Glomerella cingulata (антракноз перца)
Пример 9
12-луночные (6,5 мл объема на лунку) микротитрационные планшеты использовали для in vitro анализа на ингибирование, осуществляемого с применением летучих антимикробных соединений. В каждую лунку добавляли 3 мл объема полного картофельного агара с декстрозой (PDA). После охлаждения, 1 мкл суспензии 1×105 спор Botrytis cinerea и Penicillium expansum на мл пипетировали пятнами в центральную часть агара. Планшеты инокулировали непосредственно перед обработкой летучим фунгицидом. Фильтровальный диск Whatman #1 (Cat. No. 1001-0155) помещали в дубликате на обратную сторону полиэтиленовой пленки, которой герметично покрывали ПЦР-планшет. Для определения минимальной ингибирующей концентрации (MIC), соединения разводили в ацетоне, и на диски наносили соответствующее количество этого соединения в зависимости от дозы до достижения конечной концентрации в верхнем пространстве 35,7-0,03 мг/л. Затем, диски оставляли на 5 минут для испарения ацетона. После этого, пространство поверх инокулята, содержащегося в лунке, герметично закрывали пленкой пленкой с прикрепленным к ней диском, содержащим фунгицид, и переворачивали, так, чтобы ее содержимое находилось над обработанными дисками, а затем герметично закрывали для предотвращения утечки любого химического вещества с диска и его попадания на инокулированный агар. После хранения в течение 3 дней при 23°C, культуры оценивали на процент роста колоний по сравнению с контролем путем измерения диаметра колоний грибковых патогенов. Результаты эксперимента систематизированы в таблице 8. Полученные результаты указывают на то, что многие бензоксабороловые соединения обладают превосходной активностью in vitro, направленной против двух выбранных грибковых патогенов растений.
BOTRCI = Botrytis cinerea (серая плесень)
PENIEX = Penicillium expansum (голубая плесень яблок)
Пример 10
12-луночные (6,5 мл объема на лунку) микротитрационные планшеты использовали для in vitro анализа на ингибирование, осуществляемого с применением летучих антимикробных соединений А и В, обладающих активностью, направленной на уничтожение множества грибковых патогенов растений. В каждую лунку добавляли 3 мл объема полного картофельного агара с декстрозой (PDA). После охлаждения, 1 мкл суспензии 1 x 105 спор Botrytis cinerea, Penicillium expansum, Alternaria alternata, Glomerella cingulata, Penicillium digitatum, Monilinia fruticola, Aspergillus brasiliensis, Colletotrichum acutatum, Fusarium sambucinum, Phytophthora capsici, Geotrichum candidum, Aspergillus niger, Diplodia gossypina или Diaporthe citrii на мл пипетировали пятнами в центральную часть агара. Фильтровальный диск Whatman #1 (Cat. No. 1001-0155) помещали, в дубликате, на обратную сторону полиэтиленовой пленки, которой герметично покрывали ПЦР-планшет. Для определения минимальной ингибирующей концентрации (MIC), тестируемые соединения разводили в ацетоне, и на диски наносили соответствующее количество этих соединений в зависимости от дозы до достижения конечной концентрации в верхнем пространстве 35,7-0,03 мг/л. Затем, диски оставляли на 5 минут для испарения ацетона. После этого, пространство поверх инокулята, содержащегося в лунке, герметично закрывали пленкой с прикрепленным к ней диском, содержащим фунгицид, и переворачивали, так, чтобы их содержимое находилось над обработанными дисками, а затем герметично закрывали для предотвращения утечки любого химического вещества с диска и его попадания на инокулированный агар. После хранения в течение 3 дней при 23°C, культуры оценивали на процент роста колоний по сравнению с контролем. Результаты, представленные в таблице 9, указывают на то, что бензоксабороловые соединения А и В, обладающие летучими свойствами, способны ингибировать рост многих грибковых патогенов растений.
Пример 11
12-луночные (6,5 мл объема на лунку) микротитрационные планшеты использовали для in vitro анализа на ингибирование, осуществляемого с применением летучего антимикробного Соединения А (фигура 1), направленного против множества бактериальных патогенов. В каждую лунку добавляли 3 мл объема питательного агара, и эти лунки оставляли для сушки перед введением патогена. Суспензии клеток Escherichia coli, Pectobacterium carotovorum, Xanthomonas axonopodis и Salmonella enterica доводили до оптической плотности 0,2-0,35, а затем разводили 1/10, и 15 мкл пипетировали в центральную часть лунок и переворачивали для однородного распределения. Фильтровальную бумагу Whatman #1 (Cat. No. 1001-0155) помещали, в дубликате, на внутреннюю сторону полиэтиленовой пленки, которой герметично покрывали планшет для полимеразной цепной реакции (ПЦР). Для определения минимальной бактерицидной концентрации (MBC), Соединение A разводили в ацетоне, и 50 мкл этого соединения наносили на диски в дубликате в зависимости от дозы до достижения конечной концентрации в верхнем пространстве 71,4-0,03 мг/л. Лунки оставляли на 5 минут для испарения ацетона. Затем, пленки с обработанными дисками покрывали поверх инокулированных планшетов и герметично закрывали. Планшеты переворачивали и инкубировали при 23°C в течение 48 часов. После инкубирования, бактериальные колонии помещали в стерильную воду, содержащую твин-80 (0,001%), и определяли оптическую плотность (OD, 600 нм). Результаты были систематизированы в таблице 10, где указана концентрация в верхнем пространстве, необходимая для ингибирования роста бактерий по меньшей мере на 80%. В этом анализе in vitro, Соединение A обладало хорошей антимикробной активностью, направленной против множества бактерий.
Пример 12
Для оценки in vivo активности летучего антимикробного Соединения А был разработан биоанализ на активность летучих соединений, направленную на уничтожение бактерий Escherichia coli и Salmonella enterica, присутствующих на свежей говядине. Говядину промывали для удаления какого-либо природного инокулята путем ее ополаскивания в теплой воде в течение 2 минут. Две полоски в один слой помещали в стерильный воздухонепроницаемый контейнер SnapWare на 10,8 стаканов (2,5 л) (Model # 109842).
Каждую полоску инокулировали путем помещения на ее поверхность 20 мкл суспензий клеток E. coli или S. enterica, которые доводили до оптической плотности 0,35 (600 нм), а затем разводили 1/10. Для определения эффективности, порошкообразное Соединение A вводили в контейнер с сублиматором (медной трубкой, нагретой до 200°C, в которую подается охлажденный воздух со скоростью потока 0,5 литров в минуту (л/мин)) при норме внесения, необходимой для достижения конечной концентрации в верхнем пространстве 100 мг/л. Затем содержимое контейнеров инкубировали в течение 2 дней при 21°C. После обработки, говядину промывали, а затем промывку собирали, подвергали серийному разведению, наносили на питательный агар и инкубировали еще 24 часа при 37°C. Бактериальные колонии подсчитывали, и результат выражали в колониеобразующих единицах (к.о.е./мл), после чего вычисляли log снижения числа колоний по отношению к контролю. Результаты, представленные в таблице 11, показали, что в этом анализе in vivo, проводимом с использованием говядины, Соединение А обладало хорошей антимикробной активностью, направленной против E. coli и S. enterica. Соединение А давало log снижения = 3,17 (>99,9%) для E. coli и log снижения = 2 для S. enterica.
Пример 13
Для оценки in vivo активности летучего антимикробного Соединения А в отношении уничтожения бактерии Botrytis cinerea на декоративных цветковых растениях, был разработан биоанализ с использованием летучего соединения, проводимый на белых гвоздиках.
Пять гвоздик помещали в 800-миллилитровый сосуд, содержащий 200 мл стандартного коммерчески доступного консерванта для хранения цветов. Затем пять сосудов помещали в 117-литровый ящик для хранения Rubbermaid (Cat #2244). Лепестки подвергали равномерной инокуляции путем их опрыскивания 5 мл 1×105 спор/мл суспензии Botrytis cinerea. Ящик плотно закрывали. Для проведения обработки, Соединение А растворяли в водном растворе 1,2-пропиленгликоля (3:1), и 5 мл этого раствора впрыскивали в контейнер с использованием системы ES-100-H SmartFog (Reno, NV) через 1/2-дюймовое боковое отверстие, которое герметично закрывали сразу после обработки. Цветки инкубировали в течение 3 дней при 21°C. После хранения, цветки оценивали на поражение лепестков по сравнению с необработанным контролем в течение 8 дней при 21°C, и результаты систематизировали в таблице 12. Через 2 дня после окончания обработки, Соединение A при норме внесения 1 мг/л не давало никакого эффекта (0%), и только через 8 дней оно давало 16% уничтожение бактерий, но, в основном, в этом анализе на инфицирование декоративных цветковых растений, данное летучее соединение продемонстрировало хорошую антимикробную активность, направленную против Botrytis cinerea.
Пример 14
Тест, аналогичный описанному выше, также осуществляли на белых гвоздиках (необработанных или обработанных коммерчески доступным тиосульфатом серебра, нейтрализующим этилен, STS) с использованием природного инокулята. Соединение A либо растворяли в водном растворе 1,2-пропиленгликоля (3:1), и 5 мл этого раствора впрыскивали в контейнер с использованием системы ES-100-H SmartFog (Reno, NV) через 1/2-дюймовое боковое отверстие, которое герметично закрывали сразу после обработки, либо растворяли в ацетоне и наносили на 42,5-миллиметровый (мм) фильтровальный диск Whatman #1 (Cat. No. 1001-042), а затем этот диск помещали на 5 минут на часовое стекло для испарения ацетона. После этого, цветки инкубировали в течение 3 дней при 21°C. После хранения, цветки осматривали еще 8 дней для определения тяжести поражения по числу повреждений, имеющихся на лепестках и чашелистиках. Результаты, представленные в таблице 13, указывали на хорошую антимикробную активность, направленную против Botrytis cinerea, в этом анализе in vivo.
Пример 15
Тест, аналогичный описанному выше, также осуществляли на белых розах с использованием природного инокулята. Пять белых роз помещали в 800-миллилитровый сосуд, содержащий 200 мл стандартного коммерчески доступного консерванта для хранения цветов.
Три сосуда помещали в 117-литровый ящик для хранения Rubbermaid (Cat #2244). Два небольших вентилятора устанавливали с противоположных концов контейнера для облегчения распределения летучего Соединения А. Сосуд плотно закрывали, а затем Соединение А разводили в ацетоне и пипетировали на хлопчатобумажную полоску размером 1,5×1 дюйм. После этого, сосуд оставляли на пять минут для испарения ацетона. Затем, Соединение A вводили в контейнер с сублиматором (медной трубкой, нагретой до 200°C, в которую подается охлажденный воздух со скоростью потока 0,5 л/мин) при норме внесения, необходимой для достижения конечной концентрации в верхнем пространстве 0,04, 0,2, 1 мг/л, через 1/2-дюймовое боковое отверстие, которое герметично закрывали сразу после обработки. Альтернативно, Соединение А пипетировали на 42,5-миллиметровый фильтровальный диск Whatman #1 (Cat. No. 1001-042), закрепленный на часовом стекле, после чего, контейнер, перед его герметичным закрытием, оставляли на пять минут для испарения ацетона. Цветки инкубировали в течение трех дней при 21°C. После обработки, цветки оценивали еще два дня на наличие и тяжесть поражения лепестков. После обработки путем сублимации при норме внесения 1 мг/л не наблюдалось какого-либо поражения (0%). На лепестках роз, после их обработки Соединением А, не наблюдалось какого-либо поражения, то есть, белый цвет сохранялся и лепестки не опадали. Результаты, представленные в таблице 14, показали, что это соединение обладает хорошей антимикробной активностью, направленной против инфицирования белых роз патогеном Botrytis cinerea, и что повышение нормы опрыскивания посредством сублимации давало еще более эффективное предотвращение поражения.
Пример 16
Для оценки эффекта Соединения A (фигура 1) на овощных культурах, картофель, лук и кабачки закупали в соседнем супермаркете, и их поверхности стерилизовали 0,825%-ым гипохлоритом натрия (NaOCl). Ломтик картофеля или две стрелки лука помещали в стерильную чашку Петри, а целый кабачок помещали в стерильный воздухонепроницаемый контейнер SnapWare на 10,8 стаканов (Model # 109842). Каждый ломтик картофеля инокулировали 20 мкл 1×105 спор/мл суспензии Fusarium sambucinum, а лук инокулировали 20 мкл 1×106 спор/мл суспензии Botrytis cinerea. Для инокуляции кабачка, небольшую сердцевину удаляли, после чего вводили слой мицелия Phytophthora capsici и сердцевину возвращали на место. Соединение A разводили в ацетоне и наносили на фильтровальный 42,5 мм-диск Whatman #1 (Cat. No. 1001-042), прикрепленный к внутренней стороне крышки, при норме внесения, необходимой для достижения конечной концентрации в верхнем пространстве 10 мг/л. Затем чашки оставляли на 5 минут для испарения ацетона, после чего их герметично закрывали парафильмом или помещали в закрытые воздухонепроницаемые контейнеры. Овощи инкубировали при 21°C в течение 3 дней и оценивали на рост мицелия, сухую гниль и появление воды (диаметр в мм), и результаты систематизировали в таблице 13. В данном анализе in vivo, Соединение A обнаруживало хорошую фунгицидную активность, направленную против 3 растительных патегенов для 3 различных овощных культур.
Пример 17
Для оценки эффекта Соединения A в отношении уничтожения бактериальных патогенов овощных культур, картофель, лук и морковь нарезали небольшими кубиками, и их поверхность стерилизовали 0,825%-ым NaOCl и оставляли для сушки. Четыре небольших кубика (приблизительно 1 квадратный сантиметр (см2)) каждого овоща помещали в стерильную чашку Петри. Каждый кубик инокулировали 25 мкл бактерии Pectobacterium carotovorum (бактериальная концентрация OD 1,0, 600 нм). Для определения эффективности, Соединение A разводили в ацетоне, и соответствующий объем, необходимый для достижения конечной концентрации в верхнем пространстве 50 мг/л, наносили на фильтровальный 42,5 мм-диск Whatman #1 (Cat. No. 1001-042), прикрепленный к внутренней стороне крышки. Затем чашки оставляли на пять минут для испарения ацетона, после чего их закрывали и герметично запаивали парафильмом. Овощи инкубировали при 10°C в течение четырех дней. Результаты, представленные в таблице 16, продемонстрировали антимикробную активность, направленную против P. carotovorum на луке (log снижения = 2,14), моркови (log снижения = 0,29) и картофеле (log снижения = 0,84), в данном анализе in vivo.
Пример 18
Для оценки активности in vivo летучего антимикробного Соединения А был разработан биоанализ, проводимый на ягодах земляники, винограда и ежевики. 8 ягод земляники, 16 ягод винограда или 30 ягод ежевики (для каждого повторного теста) помещали в коммерчески доступный грейфер PET определенного размера, стеблевым концом вверх для ежевики и винограда, и стеблевым концом вниз для земляники. Свежий срез инокулировали 20 мкл (для земляники и винограда) или 10 мкл (для ежевики) суспензии 1×106 спор Botrytis cinerea на мл. Грейферы помещали вовнутрь воздухонепроницаемого контейнера SnapWare на 10,8 стаканов (Model # 109842). Фильтровальный 42,5 мм-диск Whatman #1 (Cat. No. 1001-042) помещали на часовое стекло. Соединение A растворяли в ацетоне и наносили на диски в зависимости от дозы, необходимой для достижения конечной концентрации в верхнем пространстве 0,4, 2 или 10 мг/л. Контейнеры оставляли на пять минут для испарения ацетона. Затем контейнеры закрывали крышками и оставляли на три дня при 21°C. После хранения, плоды оценивали на наличие и тяжесть поражения (0-4) в течение еще трех дней при 21°C, и результаты систематизировали в таблице 17. Эти результаты продемонстрировали хорошую антимикробную активность летучего соединения in vivo в отношении уничтожения патогенов Botrytis cinerea, при которой достигалось приблизительно 50%-ное снижение поражения и резкое снижение тяжести поражения для ягод земляники, винограда и ежевики после хранения в течение трех дней.
Пример 19
Для оценки активности in vivo летучего антимикробного Соединения А был разработан биоанализ на активность летучих соединений, проводимый на плодах апельсина. Два апельсина помещали вовнутрь грейфера PET. Три свежих среза апельсина инокулировали 30 мкл суспензии 1×106 спор Penicillium digitatum на мл. Грейферы помещали вовнутрь воздухонепроницаемого контейнера SnapWare на 10,8 стаканов (Model # 109842). Фильтровальный 42,5 мм-диск Whatman #1 (Cat. No. 1001-042) помещали на часовое стекло. Соединение A растворяли в ацетоне и наносили на диски в зависимости от дозы, необходимой для достижения конечной концентрации в верхнем пространстве 2, 10 или 50 мг/л. Контейнеры оставляли на пять минут для испарения ацетона. Затем контейнеры закрывали крышками и оставляли на три дня при 21°C. После хранения, плоды оценивали на наличие поражения (диаметр гнили в мм) и на споруляцию патогена (диаметр в мм) на поверхности плодов в течение еще двух дней при 21°C, и результаты систематизировали в таблице 18. Эти результаты продемонстрирвали хорошую антимикробную активность летучего соединения in vivo в отношении уничтожения патогена P. digitatum в инокулированном апельсине, в частности, при нормах внесения выше 10 мг/л.
Пример 20
Для оценки активности in vivo летучего антимикробного Соединения А был разработан биоанализ, проводимый на яблоках. Два яблока помещали вовнутрь грейфера PET. Три свежих надреза яблока инокулировали 30 мкл суспензии 1×106 спор Penicillium expansum на мл. Грейферы помещали вовнутрь воздухонепроницаемого контейнера SnapWare на 10,8 стаканов (Model # 109842). Фильтровальный 42,5 мм-диск Whatman #1 (Cat. No. 1001-042) помещали на часовое стекло. Соединение A растворяли в ацетоне и наносили на диски в зависимости от дозы, необходимой для достижения конечной концентрации в верхнем пространстве 50 мг/л. Контейнеры оставляли на пять минут для испарения ацетона. Затем контейнеры закрывали крышками и оставляли на три дня при 21°C. После хранения, плоды оценивали на наличие поражения (диаметр гнили в мм) и на споруляцию патогена (диаметр в мм) на поверхности плодов в течение еще трех дней при 21°C, и результаты систематизировали в таблице 19. Эти результаты показали, что после обработки летучим антимикробным соединением in vivo в течение 3 дней, уничтожение гнили яблок, вызываемой Penicillium expansum, составляло 100%.
Пример 21
Для оценки активности in vivo летучего антимикробного Соединения В был разработан биоанализ, проводимый на плодах апельсина. Два апельсина на дубликат помещали вовнутрь грейфера. Три свежих надреза на апельсинах инокулировали 30 мкл суспензии 1×106 спор Penicillium digitatum на мл. Грейферы помещали в воздухонепроницаемый контейнер SnapWare на 10,8 стаканов (Model # 109842). Затем, порошкообразное Соединение В вводили в контейнеры с сублиматором (медной трубкой, нагретой до 200°C, в которую подается охлажденный воздух со скоростью потока 0,5 л/мин) при норме внесения, необходимой для достижения конечной концентрации в верхнем пространстве 0,4, 2, 10 или 50 мг/л. Затем контейнеры закрывали крышками и оставляли на три дня при 21°C. После хранения, плоды оценивали на наличие поражения (диаметр гнили в мм) и на споруляцию патогена (диаметр в мм) на поверхности плодов в течение еще трех дней при 21°C, и результаты систематизировали в таблице 20. Эти результаты указывали на хорошее ингибирование P.digitatum в плодах апельсинов под действием летучего соединения in vivo при норме внесения 0,4 мг/л и полное ингибирование при норме внесения 10 мг/л.
Пример 22
Для оценки активности in vivo летучего антимикробного Соединения А (фигура 1) в плодах был разработан биоанализ, проводимый на плодах яблок, груш, апельсинов, земляники, винограда и ежевики. Два яблока, 2 апельсина, 2 груши, 8 ягод земляники, 16 ягод винограда или 30 ягод ежевики (для каждого повторного теста) помещали в грейфер стеблевым концом вверх для всех плодов, кроме земляники (то есть, землянику помещали стеблевым концом вниз). Свежий надрез инокулировали 20 мкл суспензии 1×106 спор Penicillium expansum на мл (для яблок и груш), 20 мкл суспензии 1×106 спор Penicillium digitatum на мл (для апельсинов) и 20 мкл суспензии 1×106 спор Botrytis cinerea на мл (для земляники и винограда) или 10 мкл суспензии 1×106 спор Botrytis cinerea на мл (для ежевики). Грейферы помещали в 117-литровый ящик для хранения Rubbermaid (Cat #2244) с закрытыми крышками. Соединение A растворяли в ацетоне и пипетировали на хлопчатобумажную полоску, которую затем оставляли на пять минут для испарения ацетона, после чего загружали в контейнер с сублиматором (медной трубкой, нагретой до 200°C, в которую подается охлажденный воздух со скоростью потока 0,5 л/мин) при норме внесения, необходимой для достижения конечной концентрации в верхнем пространстве 10 мг/л. Затем контейнеры оставляли на три дня при 21°C. После обработки, плоды хранили еще три дня при 21°C, а затем оценивали на наличие поражения (диаметр побурения или водянистых поражения в мм) и на споруляцию патогена (диаметр в мм) для яблок, груш и апельсинов, а также на наличие поражения (%) и на тяжесть поражения патогеном Botrytis cinerea (0-4) для земляники, винограда и ежевики, и полученные результаты систематизировали в таблице 21. Эти результаты продемонстрирвали хорошую антимикробную активность летучего фунгицида in vivo в отношении уничтожения по меньшей мере трех грибковых патогенов по меньшей мере на шести различных хозяевах.
Пример 23
Для сравнения способности Соединения A активно испаряться под действием различных механизмов проводили анализ in vivo на ягодах земляники. Восемь ягод земляники помещали в грейфер стеблевым концом вниз. Свежий надрез инокулировали 20 мкл суспензии 1×105 спор Botrytis cinerea на мл. Грейфер помещали вовнутрь воздухонепроницаемого контейнера SnapWare на 10,8 стаканов (Model # 109842) и закрывали крышками. Соединение A растворяли в ацетоне и впрыскивали в контейнер с использованием системы ES-100-H SmartFog (Reno, NV) через 1/2-дюймовое боковое отверстие. Альтернативно, Соединение A растворяли в ацетоне, пипетировали на хлопчатобумажную полоску, которую затем оставляли на пять минут для испарения ацетона, после чего загружали в контейнер с сублиматором (медной трубкой, нагретой до 200C, в которую подается охлажденный воздух со скоростью потока 0,5 л/мин) при норме внесения, необходимой для достижения конечной концентрации в верхнем пространстве 10 мг/л. Затем плоды хранили три дня при 21°C. После трехдневной обработки, плоды хранили еще три дня при 21°C, а затем оценивали на наличие поражения (%) и тяжесть поражения (0-4). Результаты, систематизированые в таблице 22, показали, что в этом анализе in vivo, данное соединение обладает хорошей антимикробной активностью, направленной против Botrytis cinerea, что указывает на то, что Соединение А является эффективным летучим антимикробным агентом.
Пример 24
Анализ in vivo проводили для оценки способности Соединения А испаряться из различных материалов и уничтожать грибковые патогена. Восемь ягод земляники помещали в грейфер стеблевым концом вниз. Свежий надрез инокулировали 20 мкл суспензии 1×106 спор Botrytis cinerea на мл. Затем, грейферы помещали вовнутрь воздухонепроницаемого контейнера SnapWare на 10,8 стаканов (Model # 109842). Соединение A растворяли в ацетоне, а затем равномерно распределяли по целлюлозной бумаге и ткани Tyvek® при норме внесения 200 миллиграммов на квадратный метр (мг/м2). Затем ацетон выпаривали. Аналогичнным образом, Соединение A растворяли в пропиленгликоле и равномерно распределяли по целлюлозной бумаге и ткани Tyvek®. В этом случае, пропиленгликоль не выпаривали.
Материал разрезали на кусочки соответствующего размера, необходимого для достижения конечной концентрации в верхнем пространстве 0,4, 2 или 10 мг/л. Контейнеры закрывали и оставляли на три дня при 21°C. После обработки, плоды хранили еще два дня при 21°C, а затем оценивали на наличие поражения (%) и тяжесть поражения (0-4), и результаты систематизировали в таблице 23. Полученные результаты продемонстрировали хорошую антимикробную активность Соединения А in vivo, направленную против Botrytis cinerea, где указанная активность приводила к снижению поражения и тяжести поражения при всех нормах внесения в зависимости от дозы, и эти результаты показали, что указанное летучее соединение может высвобождаться из различных материалов.
Пример 25
Для оценки способности Соединения A испаряться из различных материалов и уничтожать грибковые патогены был проведен анализ in vivo. Восемь ягод земляники помещали в грейфер стеблевым концом вниз. Свежий надрез инокулировали 20 мкл суспензии 1×105 спор Botrytis cinerea на мл. Затем, грейферы помещали вовнутрь воздухонепроницаемого контейнера SnapWare на 10,8 стаканов (Model # 109842). В качестве субстрата для соединения A использовали либо Фильтровальный 42,5 мм-диск Whatman #1 (Cat. No. 1001-042), помещенный на часовое стекло, либо куски картона размером 10 см2, которые обычно применяются для упаковки земляники. Соединение А растворяли в ацетоне и либо пипетировали на диск, либо наносили на картон при норме внесения, необходимой для достижения конечной концентрации в верхнем пространстве 0,4, 2 или 10 мг/л. Затем контейнеры оставляли на пять минут для испарения ацетона. После этого, контейнеры закрывали и оставляли на три дня при 21°C. После обработки, плоды хранили еще два дня при 21°C, а затем оценивали на наличие поражения (%) и тяжесть поражения (0-4), и результаты систематизировали в таблице 24. Полученные результаты продемонстрировали хорошую антимикробную активность in vivo Соединения А, направленную против Botrytis cinerea, которая приводила к устранению поражения и снижению тяжести поражения при всех нормах внесения в зависимости от дозы, и эти результаты показали, что данное летучее соединение может высвобождаться из различных материалов.
Пример 26
Для оценки способности Соединения A (фигура 1) испаряться из различных материалов и уничтожать грибковые патогены был проведен анализ in vitro.
Стекловолокно, покрытое PTFE (8577K81), стекловолокно (8816kl), двуокись кремния (8799K3), арамид и стекловолокно (8821K4), полиэфир, покрытый винилом (8843K31), стекловолокно, покрытое акриловой кислотой (8838K2), втекловолокно, покрытое кремнием (87815K1), арамид (McMaster-Carr, Santa Fe Springs, CA-1206T1), полиэтиленовую пленку для герметизации ПЦР-планшетов, целлюлозу (Whatman #1, Cat No. 1001-0155) и картон разрезали на диски диаметром 15 мм. Анализ in vitro на ингибирование патогенов летучими антимикробными соединениями проводили на 12-луночных (объем 6,5 мл на лунку) микротитрационных планшетах. В каждую лунку добавляли 3 мл объема полного картофельного агара с декстрозой (PDA). После охлаждения, 1 мкл суспензии 1×105 спор Botrytis cinerea на мл пипетировали пятнами в центральную часть агара. Планшеты инокулировали непосредственно перед обработкой летучим фунгицидом. Различные материалы помещали в дубликате на внутреннюю сторону полиэтиленовой пленки, используемой для герметизации ПЦР-планшетов. Для определения минимальной ингибирующей концентрации (MIC), соединения разводили в ацетоне, и соответствующее количество этих соединений добавляли на указанные материалы в зависимости от дозы до достижения конечной концентрации в верхнем пространстве 35,7-0,03 мг/л. Диски оставляли на пять минут для испарения ацетона. Затем, пространство поверх инокулята Botrytis cinerea, содержащегося в лунке, герметично закрывали пленкой с прикрепленным к ней диском, содержащим фунгицид. Планшеты переворачивали, так, чтобы их содержимое находилось над обработанными дисками и герметично закрывали для предотвращения утечки любого химического вещества с диска и его попадания на инокулированный агар. После хранения в течение трех дней при 23°C, культуры оценивали на процент роста по сравнению с контролем путем измерения диаметра грибковых колоний. Результаты эксперимента систематизированы в таблице 25. Полученные результаты показали, что соединение A может испаряться из различных материалов и ингибировать рост Botrytis cinerea in vitro на таком же уровне, как и контроль.
Пример 27
Для оценки способности Соединения A подавлять рост грибковых патогенов в семенах был проведен анализ in vivo.
Поверхность зерна, состоящего из зерен кукурузы, пшеницы, риса, ржи, проса и ячменя, стерилизовали 0,825% NaOCl в течение 1 минуты и три раза промывали стерильной дистиллированной водой. Зерно инокулировали путем его пропитки суспензией 1×106 спор Aspergillus brasiliensis на мл в течение 1 минуты. Избыток инокулята наносили пятнами на стерильное бумажное полотенце, а затем пять семян высевали в чашки Петри, содержащие 25 мл PDA. Для определения эффективности, Соединение A разводили в ацетоне и добавляли на фильтровальные 42,5 мм-диски Whatman #1 (Cat. No. 1001-042), прикрепленные к внутренней стороне крышки, в зависимости от дозы, необходимой для достижения конечной концентрации в верхнем пространстве 0,4, 2 или 10 мг/л. Чашки оставляли на пять минут для испарения ацетона, а затем их закрывали и герметично запаивали парафильмом. Чашки инкубировали при 23°C в течение трех дней. После хранения, зерно оценивали для определения диаметра колонии мицелия (мм), и результата систематизировали в таблице 26. Эти результаты указывали на 100% уничтожение Aspergillus brasiliensis в этом анализе in vivo.
Пример 28
Для оценки эффекта комбинированной обработки Соединением А и 1-метилциклопропеном (1-MCP) проводили эксперимент in vivo на белых розах.
Пять белых роз помещали в 800 мл-сосуд, содержащий 200 мл стандартного коммерчески доступного консерванта для цветов. Затем, три сосуда помещали в 117-литровый ящик для хранения Rubbermaid (Cat #2244). Два небольших вентилятора устанавливали с противоположных концов контейнера для облегчения распределения двух летучих соединений. Затем проводили обработку соединением 1-MCP, взятым в количестве 500 частей на миллиард (млд.д.) по объему (об/об) (AgroFresh, Springhouse, PA), в течение 24 часов при 21°C. После завершения 1-MCP-обработки, контейнеры продували, и добавляли Соединение A в виде порошка в зависимости от дозы, необходимой для достижения конечной концентрации в верхнем пространстве 0,2, 0,04 или 0,008 мг/л, с помощью сублиматора (медной трубки, нагретой до 200°C, в которую подается охлажденный воздух со скоростью потока 0,5 л/мин) так, чтобы конец трубки проходил через 1/2-дюймовое боковое отверстие контейнера, которое сразу герметично закрывали после обработки. Цветки инкубировали в течение трех дней при 21°C. После обработки, цветки оценивали еще семь дней при 21°C на наличие и тяжесть поражения лепестков. Результаты, представленные в таблице 27, показали, что это соединение обладает хорошей антимикробной активностью, направленной против инфицирования белых роз патогеном Botrytis cinerea, и что повышение нормы опрыскивания посредством сублимации давало еще более эффективное предотвращение поражения. После 1-МСР-обработки также наблюдалось снижение числа опавших лепестков, что отражалось на оценке тяжести поражения.
Пример 29
Для оценки эффекта комбинированной обработки Соединением А и 1-метилциклопропеном (1-MCP) проводили эксперимент in vivo на брокколи.
Цветки брокколи инокулировали 1×106 спорами Alternaria alternata на мл, а затем помещали в 117-литровый ящик для хранения Rubbermaid (Cat #2244) с двумя небольшими вентиляторами, установленными с противоположных концов контейнера. После этого проводили обработку соединением 1-MCP, взятым в количестве 500 частей на миллиард (млд.д.) по объему (об/об) (AgroFresh, Springhouse, PA), в течение 24 часов при 1°C. После завершения 1-MCP-обработки, головки брокколи удаляли и помещали вовнутрь воздухонепроницаемого контейнера SnapWare на 10,8 стаканов (Model # 109842). Соединение A в виде порошка добавляли в зависимости от дозы, необходимой для достижения конечной концентрации в верхнем пространстве 2 или 0,4 мг/л, с помощью сублиматора (медной трубки, нагретой до 200°C, в которую подается охлажденный воздух со скоростью потока 0,5 л/мин), так, чтобы конец трубки проходил через 1/2-дюймовое боковое отверстие контейнера, которое сразу герметично закрывали после обработки. Головки инкубировали в течение пяти дней при 10°C или в течение трех дней при 21°C, а затем оставляли еще на пять дней при 21°C для оценки на наличие и тяжесть поражения. Результаты, представленные в таблице 28, показали, что это соединение обладает хорошей антимикробной активностью, направленной против инфицирования патогеном Alternaria alternata.
Пример 30
Для оценки эффекта комбинированной обработки Соединением А и 1-метилциклопропеном (1-MCP) проводили эксперимент in vivo на томатах. Каждый плод томата три раза надрезали, а затем инокулировали 1×106 спорами Alternaria alternata на мл и помещали в 117-литровый ящик для хранения Rubbermaid (Cat #2244) с двумя небольшими вентиляторами, устанавленными с противоположных концов контейнера. Затем проводили обработку соединением 1-MCP, взятым в количестве 1000 частей на миллиард (млд.д.) по объему (об/об) (AgroFresh, Springhouse, PA), в течение 24 часов при 21°C. После завершения 1-MCP-обработки, томаты вынимали и помещали вовнутрь воздухонепроницаемого контейнера SnapWare на 10,8 стаканов (Model # 109842). Соединение A в виде порошка добавляли в зависимости от дозы, необходимой для достижения конечной концентрации в верхнем пространстве 2 или 0,4 мг/л, с помощью сублиматора (медной трубки, нагретой до 200°C, в которую подается охлажденный воздух со скоростью потока 0,5 л/мин), так, чтобы конец трубки проходил через 1/2-дюймовое боковое отверстие контейнера, которое сразу герметично закрывали после обработки. Томаты инкубировали в течение трех дней при 21°C, а затем оставляли еще на пять дней при 21°C для оценки на наличие и тяжесть поражения. Результаты, представленные в таблице 29, показали, что это соединение обладает хорошей активностью, направленной против инфицирования томатов патогеном Alternaria alternata.
Пример 31
Для оценки активности in vivo летучих антимикробных Соединений А и В (фигура 1) в плодах был разработан биоанализ, проводимый на плодах яблок, груш и апельсинов, и на ягодах земляники, винограда и ежевики.
Два яблока, 2 апельсина, 2 груши, 8 ягод земляники, 16 ягод винограда или 30 ягод ежевики (для каждого повторного теста) помещали в грейфер стеблевым концом вверх для всех плодов, кроме земляники (то есть, землянику помещали стеблевым концом вниз). Свежий надрез инокулировали 20 мкл суспензии 1×106 спор Penicillium expansum на мл (для яблок и груш), 20 мкл суспензии 1×106 спор Penicillium digitatum на мл (для апельсинов) и 20 мкл суспензии 1×106 спор Botrytis cinerea на мл (для земляники и винограда) или 10 мкл суспензии 1×106 спор Botrytis cinerea на мл (для ежевики). Грейферы помещали в 117-литровый ящик для хранения Rubbermaid (Cat #2244) с закрытыми крышками. Соединения A и В в виде порошка загружали в контейнер с сублиматором (медной трубкой, нагретой до 200°C, в которую подается охлажденный воздух со скоростью потока 0,5 л/мин) при норме внесения, необходимой для достижения конечной концентрации в верхнем пространстве 1 мг/л. Затем контейнеры оставляли на три дня при 21°C. После обработки, плоды хранили еще три дня при 21°C, а затем оценивали на наличие поражения (диаметр побурения или водянистого поражения в мм) и на споруляцию патогена (диаметр в мм) для яблок, груш и апельсинов, а также на наличие поражения (%) и на тяжесть поражения патогеном Botrytis cinerea (0-4) для земляники, винограда и ежевики, и полученные результаты систематизировали в таблице 30. Эти результаты продемонстрирвали 100% антимикробную активность Соединений А и В, используемых в качестве летучих фунгицидов in vivo для уничтожения B. cinerea и P. digitatum на различных хозяевах.
Пример 32
Для оценки активности Соединения A, используемого в качестве контактного фунгицида, был разработан анализ in vitro. Были использованы чашки Петри диаметром 6 см. К Соединению A добавляли полный картофельный агар с декстрозой (PDA) до конечной концентрации раствора 10, 2, 0,4 или 0,08 мг/л, и этот раствор в объеме 15 мл добавляли в каждую чашку. После охлаждения, 1 мкл суспензии 1×105 спор Penicillium expansum или Penicillium digitatum на мл пипетировали пятнами в центральную часть агара.
Чашки герметично запаивали парафильмом и помещали в инкубатор для хранения при 23°C. После хранения в течение трех дней, культуры оценивали на процент роста по сравнению с контролем путем измерения диаметра грибковых колоний. Результаты эксперимента были систематизированы в таблице 31. Эти результаты показали, что Соединение A, используемое в качестве контактного фунгицида, обладает активностью, направленной на уничтожение грибковых патогенов растений в анализе in vitro.
Пример 33
Для оценки активности Соединения A (фигура 1), используемого в качестве контактного фунгицида для опрыскивания, был разработан анализ in vivo. Два яблока или 2 апельсина (на повторность, в дубликате) помещали в грейфер, и возле экваториальной области каждого плода делали три свежих надреза. Соединение A растворяли в воде до достижения конечной концентрации раствора 250, 50 или 10 мг/л. Затем плоды погружали на 1 минуту в раствор Соединения А и оставляли на 1 час для сушки. После этого, надрезы плода инокулировали 30 мкл суспензии 1×106 спор Penicillium expansum (для яблок) или Penicillium digitatum (для апельсинов) на мл. Грейферы помещали вовнутрь воздухонепроницаемого контейнера SnapWare на 10,8 стаканов (Model # 109842), и содержимое инкубировали в течение 3 дней при 21°C. После обработки, плоды оставляли еше на 3 дня при 21°C, а затем оценивали на наличие поражения (диаметр побурения или водянистого поражения в мм) и на споруляцию патогена (диаметр в мм), и результаты систематизировали в таблице 32. Эти результаты продемонстрировали хорошую антимикробную активность контактного фунгицида in vivo в отношении уничтожения 2 грибковых патогенов на 2 различных хозяевах.
Пример 34
Для оценки активности Соединения A, используемого в качестве летучего фунгицида, был разработан анализ in vitro на прорастание спор. 2 мл водного агара выливали в чашки Петри размером 3,5 см. Соединение A растворяли в ацетоне до конечной концентрации раствора 0,14, 0,07 или 0,035 мг/л. Чашки инокулировали 1 мкл суспензии 1×106 спор Botrytis cinerea и Penicillium expansum на мл. Затем чашки инкубировали либо в течение одного дня при 0°C, либо в течение пяти дней при 0°C, либо в течение пяти дней при 0°C и еще одного или двух дней при 21°C. После этого, в каждый период времени брали чашки и 100 спор подсчитывали на процент прорастания, где прорастание определяли как проростковую трубочку, которая прорастала на расстояние, превышающее длину спор. Результаты систематизированы в таблице 33. При всех концентрациях и всех температурных режимах обработки, Соединение A полностью ингибировало прорастание тестируемых спор грибковых патогенов.
Пример 35
Для оценки активности Соединения A, используемого в качестве летучего фунгицида, был разработан анализ in vitro на прорастание спор. Чашки Петри размером 3,5 см заполняли 2 мл водного агара. После охлаждения, 1 мкл суспензии 1×105 спор Botrytis cinerea на мл наносили пятнами в центральную часть чашек. Чашки инокулировали непосредственно перед обработкой летучим фунгицидом. Фильтровальный диск Whatman #1 (Cat. No. 1001-0155) помещали, в дубликате, на обратную сторону крышки чашек. Для определения минимальной ингибирующей концентрации (MIC), соединений разводили в ацетоне, и соответствующее количество соединения добавляли на диски в зависимости от дозы до достижения конечной концентрации в верхнем пространстве 142,9-0,07 мг/л. Чашки оставляли на пять минут для испарения ацетона, а затем закрывали крышками и запаивали парафильмом. После хранения в течение 24 часов при 23°C, 100 спор подсчитывали на процент прорастания, где прорастание определяли как проростковую трубочку, которая прорастала на расстояние, превышающее длину спор. После подсчета, обработку прекращали, и чашки снова запаивали. Еще через 24 часа, 100 спор снова подсчитывали. После этого, слои спор переносили в чистые чашки, содержащие полный PDA, и эти чашки оставляли еще на три дня для инкубирования при 23°C. После инкубирования определяли рост мицелия (диаметр в мм), и данные систематизировали в таблице 34. Через 24 часа, 100% контрольных спор прорастали, тогда как обработка Соединением A в этом анализе in vitro, проводимом с использованием летучего соединения, при всех нормах внесения давала 100% ингибирование прорастания. Полученные результаты показали, что Соединение A обладает не фунгистатическим, а фунгицидным действием, то есть, обработанные споры не прорастают и не образуют мицелий даже после удаления данного соединения.
Реферат
Изобретение относится к сельскохозяйственной отрасти промышленности. Настоящее изобретение относится к применению летучего антимикробного соединения в целях уничтожения патогенов, поражающих мясные продукты, растения или части растений. Рассматриваемыми летучими антимикробными соединениями являются некоторые оксабороловые соединения, например бензоксаборолы общей формулы:и.Настоящее изобретение относится к системам доставки, разрабатываемым с учетом летучей природы этих антимикробных соединений. В настоящем изобретении также раскрываются комбинации с летучим регулятором роста растений, например с 1-метилциклопропеном. 11 з.п. ф-лы, 34 табл., 6 ил., 35 пр.
Формула
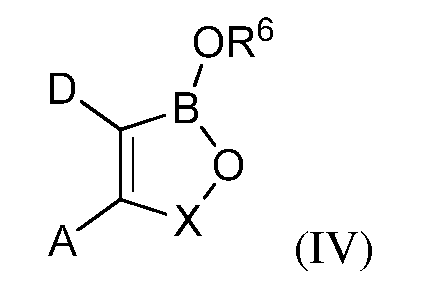
где A и D, взятые вместе с атомами углерода, с которыми они связаны, образуют 5-, 6- или 7-членное конденсированное кольцо, которое может быть замещено С1-С6-алкилом; С1-С6-алкокси; гидрокси; галогеном; нитро; нитрилом; амино; амино, замещенным одной или более С1-С6-алкильными группами; карбокси; ацилом; арилокси; карбонамидо; карбонамидо, замещенным С1-С6-алкилом; сульфонамидо или трифторметилом, или конденсированное кольцо, которое может связывать два оксаборольных кольца;
X представляет собой группу -CR7R8, где каждый из R7 и R8 независимо представляет собой водород; С1-С6-алкил; нитрил; нитро; арил; арилалкил; либо R7 и R8, взятые вместе с атомом углерода, с которым они связаны, образуют алициклическое кольцо; и
R6 представляет собой водород; С1-С18-алкил; С1-С18-алкил, замещенный С1-С6-алкокси; С1-С6-алкилтио; гидрокси; амино; амино, замещенный С1-С6-алкилом; карбокси; арил; арилокси; карбонамидо; карбонамидо, замещенный С1-С6-алкилом, арилом или арилалкилом; арилалкил; арил; гетероарил; циклоалкил; С1-С18-алкиленамино; С1-С18-алкиленамино, замещенный фенилом, С1-С6-алкокси или С1-С6-алкилтио; карбонилалкиленамино или радикал формулы (V):
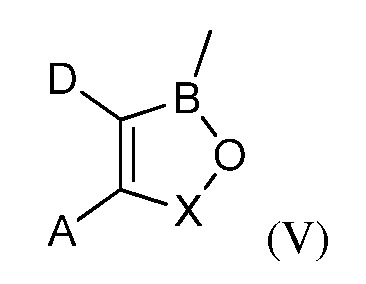
где A, D и X являются такими, как они были определены в описании настоящей заявки, за исключением фталида бора;
и его агрономически приемлемых солей;
и контактирование мясных продуктов, растений или частей растений с эффективным количеством указанного летучего антимикробного соединения в газообразной форме.
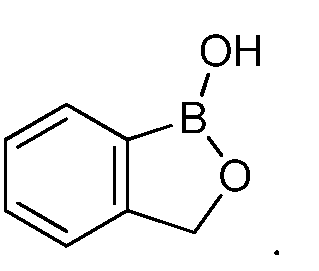
Документы, цитированные в отчёте о поиске
Борсодержащие малые молекулы
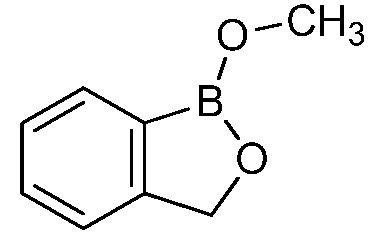
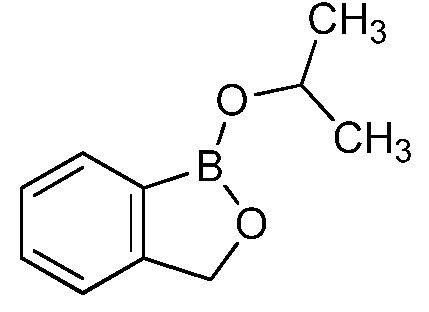
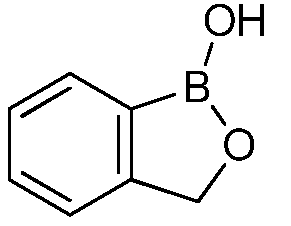
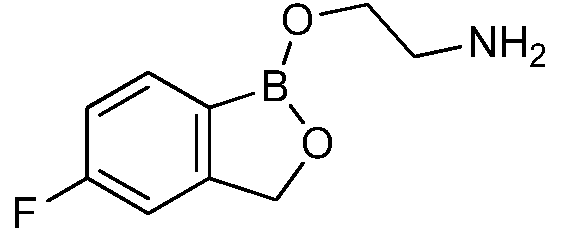
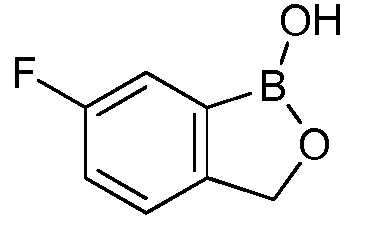
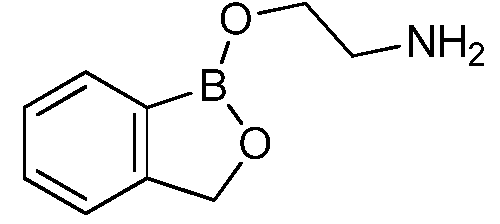
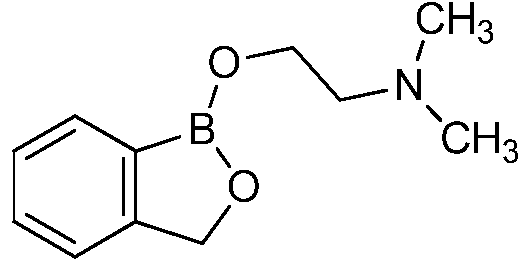
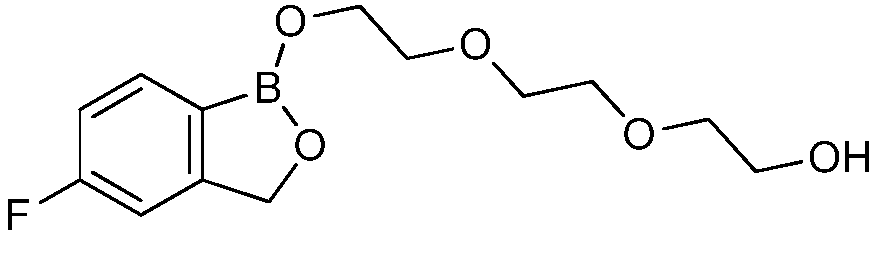
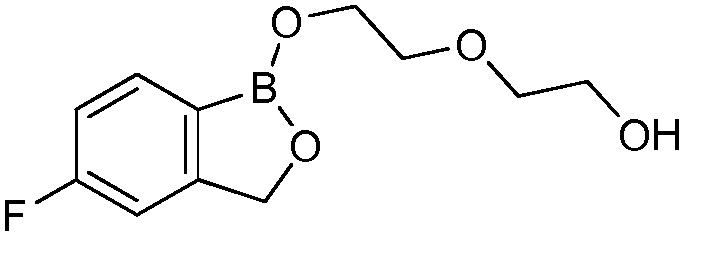
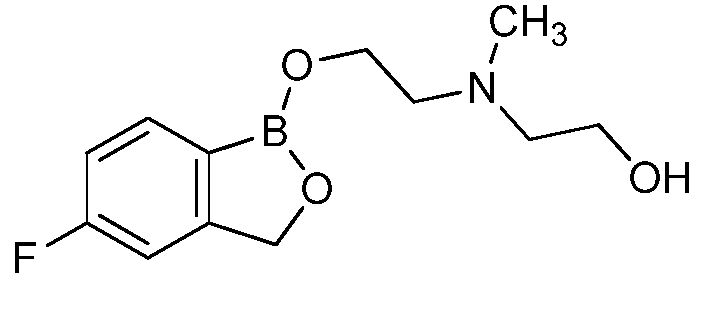
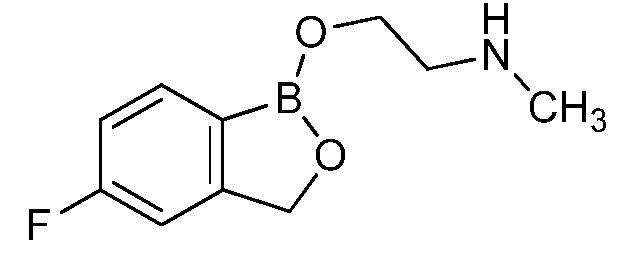
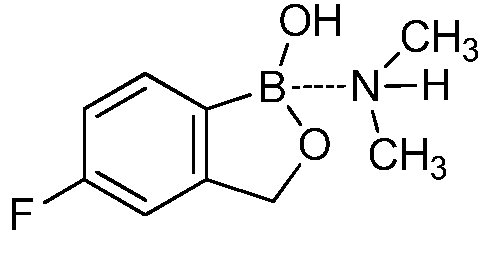
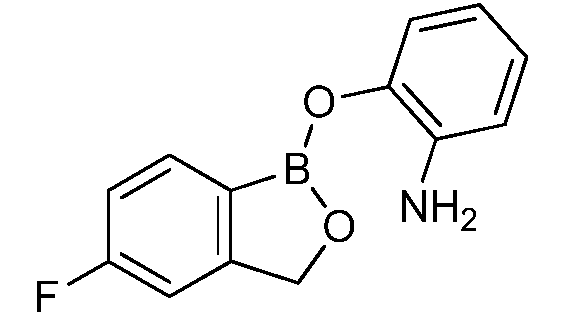
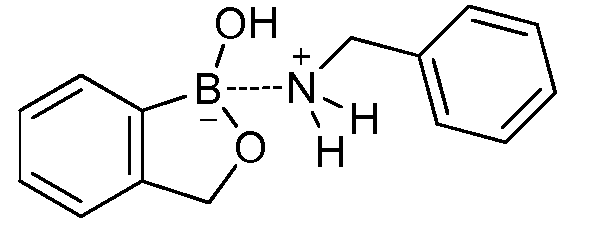
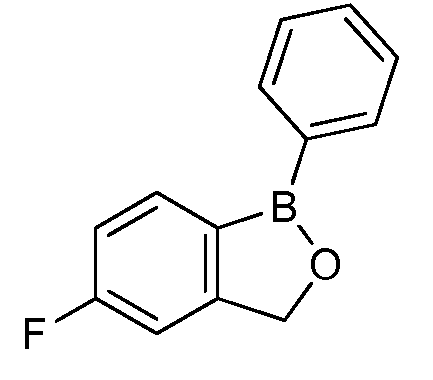
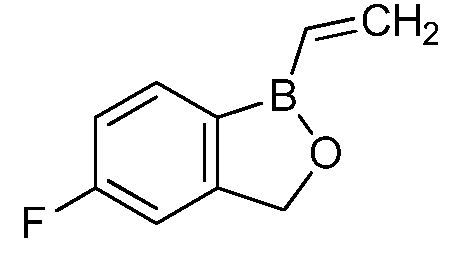
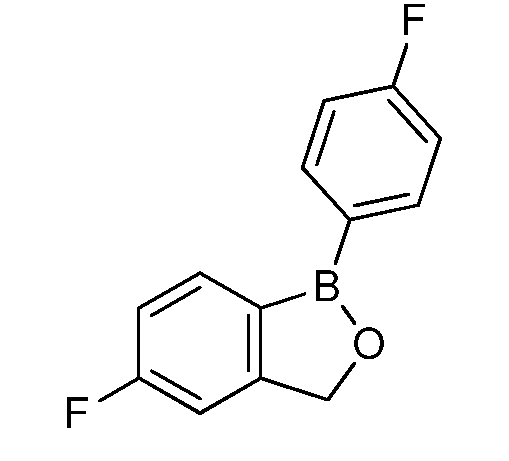
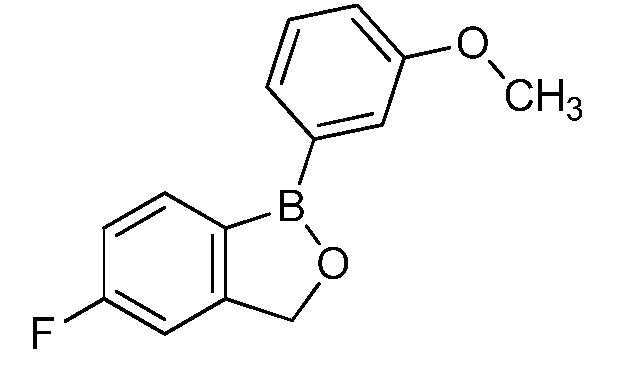
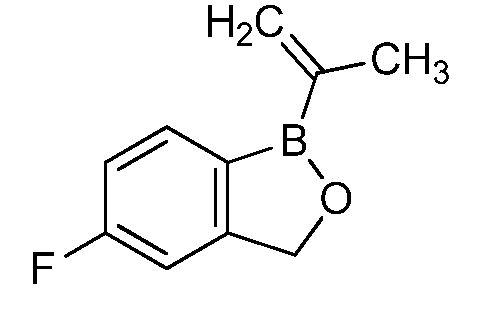
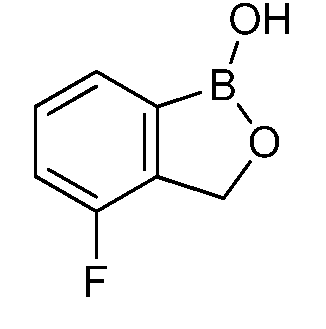

Комментарии