Каталитическая система для восстановления оксидов азота из выхлопных газов, применение указанной каталитической системы для обработки выхлопных газов и способ восстановления оксидов азота до азота - RU2540965C2
Код документа: RU2540965C2
Чертежи






Описание
Настоящее изобретение относится к области обработки выхлопных газов, в особенности к каталитической системе для восстановления оксидов азота из выхлопных газов, а также к применению указанной каталитической системы для обработки выхлопных газов, кроме того, настоящее изобретение относится к способу восстановления оксидов азота до азота.
Настоящее изобретение относится к способу и каталитической системе для восстановления оксидов азота из выхлопных газов с применением восстанавливающего агента, такого как аммиак и мочевина.
В частности, изобретение относится к каталитической системе с двойным слоем для восстановления оксидов азота, применяя восстанавливающий агент, в которой первый слой катализатора представляет собой железо-бета-цеолит (Fe-бета-цеолит), а второй слой катализатора, лежащий ниже по ходу потока, представляет собой серебро, нанесенное на оксид алюминия (Ag/Аl2О3). Более точно, настоящее изобретение относится к способу и каталитической системе для конверсии NOx до азота в выхлопном газе из двигателей внутреннего сгорания, работающих на обедненных смесях путем добавления смеси водорода и аммиака к выхлопному газу и последующего пропускания этого газа над соответствующим двойным слоем катализатора, в котором первый слой катализатора представляет собой железо-бета-цеолит (Fe-бета-цеолит), а второй слой катализатора, лежащий ниже по ходу потока, представляет собой серебро, нанесенное на оксид алюминия (Ag/Аl2О3).
Эмиссия оксидов азота выхлопными газами в стационарных и автомеханических применениях долго была главной проблемой окружающей среды. Вредные влияния оксидов азота (NOx) хорошо известны, и, следовательно, проводится интенсивное исследование, чтобы найти способы и каталитические системы, которые способны соответствовать более строгим требованиям безопасности для окружающей среды. Обычные катализаторы для восстановления NOx содержат ванадий; однако эти катализаторы становятся все меньше и меньше приемлемыми в соответствии с требованиями безопасности для окружающей среды, и ожидается запрет их применения. В автомобильном бизнесе, в особенности в выхлопных газах от двигателей для сжигания обедненной топливной смеси, восстановление NOx до азота (N2) обычно проводят с применением аммиака или мочевины в качестве восстановителя над подходящим катализатором при так называемом селективном каталитическом восстановлении (СКВ).
Установлено, что как для стационарных, так и для автомеханических применений могут быть применены системы, использующие селективное каталитическое восстановление (СКВ) NOx аммиаком (водный раствор мочевины также может быть использован в качестве источника аммиака), чтобы удалять NOx из выхлопных газов в процессах сгорания обедненной топливной смеси.
В некоторых применениях, в особенности, в автомеханических применениях, при использовании коммерческих катализаторов СКВ, подобных V/W/TiO2 и Fe-цеолитам, стандартная реакция СКВ (4NO+4NH3+O2=4N2+6Н2O) не является достаточно быстрой при низких температурах (около 200°С), чтобы выполнять требования конверсии NOx, в соответствии с законодательством в некоторых странах. Один способ получения более высокой конверсии NOx при этих низких температурах состоит в том, чтобы пользоваться преимуществом так называемой быстрой реакции СКВ (NO+NO2+2МН3=2N2+3Н2O). При нормальных условиях основная часть NOx в выхлопных газах при сгорании обедненной топливной смеси представляет собой NO. Следовательно, чтобы получать соотношение NO:NO2, близкое к 1:1, требуемое для быстрой СКВ реакции катализатора окисления NO до NO2 обычно применяется выше по ходу потока катализатора СКВ. Это решение имеет некоторые недостатки: 1) катализатор окисления, необходимый для окисления NO, требует высокой загрузки дорогостоящей Pt; 2) катализатор окисления значительно дезактивируется через какое-то время, приводя к изменению активности СКВ, что затрудняет регулирование дозировки МН3/мочевина; 3) невозможно получать оптимальное соотношение NO:NO2 1:1 во всем эксплуатационном температурном интервале.
Высокая активность СКВ может быть достигнута на материалах Cu-цеолит без преимущества быстрой реакции СКВ; однако Cu-цеолиты более склонны к гидротермической дезактивации, чем Fe-цеолиты, что ограничивает их применение во многих случаях
Патент США 6689709 раскрывает применение железо-бета-цеолитов для селективного восстановления оксидов азота аммиаком при высоких температурах (425, 550°С). При предварительном пропаривании катализаторов при температуре от 600 до 800°С в течение от 0,25 до 8 ч катализаторы показывают гидротермическую стабильность.
Richter at al. (Catalysis Letters, Т. 94, номера 1-2, страница 115, апрель 2004) показали, что некоторые катализаторы на основе Ag/Аl2О3 функционируют хорошо в качестве катализатора СКВ при применении смеси Н2 и NH3 в качестве восстанавливающего агента. В газе с мольным отношением NH3:H2:NO 1:10:1 и избытком кислорода (6 объемных % О2) достигается почти полная конверсия NO при температуре столь низкой, как 200°С. Однако если водород удаляют из газа, конверсия NO становится более ограниченной при всех температурах в интервале от 150 до 450°С. В газе с мольным отношением NH3:Н2:NO 1:2,5:1, то есть при пониженном количестве водорода и избытке кислорода (6 объемных % O2), достигают конверсию NO более 90% при 300°С. Конверсии NOх, близкие к 80%, получают при 300°С в газе с мольным отношением NH3:Н2:NO 1:1,5:1. Другими словами, восстановление 1 моля NO требует от 1,5 до 2,5 или большего количества молей водорода. Применение одного такого катализатора требовало бы значительного количества водорода, которое нужно использовать, чтобы получать приемлемую конверсию NOх при более широком интервале температур, то есть от 150 до 550°С.
Наши собственные изучения производительности катализатора Ag/Аl2О3 в удалении СКВ с помощью Н2 с аммиаком (или мочевиной) показывают, что этот катализатор в присутствии приемлемого количества водорода (1000 частей на миллион) обеспечивает очень перспективную конверсию NOх в отношении удаления NOx с помощью NH3 из газа с мольным отношением NH3:Н2:NO около 1:3:1 при низких температурах от 175 до 250°С.Однако в отсутствие водорода, которое желательно, чтобы снижать затраты, катализатор не активен при удалении СКВ с помощью аммиака или мочевины. Наши изучения этого катализатора также показали, что восстановление 1 моля NO требует значительного количества водорода, а именно от 1,5 до 2 молей водорода. Более того, катализатор дезактивируется после повторных каталитических циклов вследствие присутствия SO2 в подаваемом газе, особенно, когда его подвергают действию высокого содержания SO2 в газе в течение коротких периодов (например, 30 частей на миллион в течение 2 ч), по сравнению с низким содержанием SO2в газе в течение более длинного периода времени (например, 8 частей на миллион в течение 8 ч).
Задача настоящего изобретения состоит в том, чтобы увеличить технологические возможности удаления NOx из выхлопных газов.
Техническое решение данной задачи состоит в применении предложенной каталитической системы для восстановления оксидов азота из выхлопных газов, содержащей, по меньшей мере, два слоя катализатора, в которой первый слой катализатора представляет собой железо-бета-цеолит, а второй слой катализатора, лежащий ниже по ходу потока, представляет собой серебро, нанесенное на оксид алюминия, а также предложенного способа восстановления оксидов азота до азота в выхлопном газе, содержащего пропускание выхлопного газа в присутствии восстанавливающего агента через каталитическую систему, содержащую, по меньшей мере, два слоя катализатора, в которой первый слой катализатора представляет собой железо-бета-цеолит, а второй слой катализатора, лежащий ниже по ходу потока, представляет собой серебро, нанесенное на оксид алюминия.
Первоначально изобретатели намеревались получать высокую конверсию NOх при низкой температуре (около 200°С), просто механически смешивая катализатор Ag/Аl2О3 с Fe-бета-цеолитом, с целью обеспечения возможности окисления NO до NO2 в присутствии аммиака, для того чтобы способствовать быстрой реакции СКВ, которая описана выше. Однако это исследование дало неожиданные результаты: изобретатели обнаружили, что при сочетании железо-бета-цеолита и серебра, нанесенного на оксид алюминия, в этом соответствующем порядке и в форме слоистой каталитической системы, и где восстанавливающий агент содержит смесь аммиака и водорода, расход водорода понижается по сравнению с ситуацией, где используется только серебро, нанесенное на оксид алюминия. Обнаружили хорошую каталитическую активность СКВ в широком интервале температур от 250 до 550°С даже в газе с мольным отношением NH3:Н2:NO около 1:0,3:1, то есть восстановление 1 моля NO требует менее 1 моля водорода. Также обнаружили, что сочетание железа-бета-цеолита и серебра, нанесенного на оксид алюминия, в этом соответствующем порядке и в форме слоистой каталитической системы (каталитическая система с двойным слоем) приводит к значительно более высокой устойчивости к дезактивации. Следовательно, не только сохраняется активность катализатора на желательных уровнях по всему интервалу температур от 150 до 550°С, но также и водород для получения конверсии NOх по всему интервалу температур требуется только при самых низких температурах от 150 до 200°С, причем количество применяемого водорода ниже, чем при использовании одного катализатора, представляющего собой серебро на оксиде алюминия.
Как применяется здесь, термин "двойной слой" означает каталитическую систему, содержащую, по меньшей мере, два слоя катализатора, то есть, верхний слой (первый слой катализатора) и последующий слой ниже по ходу потока (вторая каталитическая система). Термин "двойной слой" не исключает применение третьего слоя ниже по ходу потока второго слоя катализатора.
Соответственно первый объект изобретения представляет собой способ восстановления оксидов азота до азота в выхлопном газе, содержащий пропускание выхлопного газа в присутствии восстановителя через каталитическую систему, содержащую, по меньшей мере, два слоя катализатора, в которой первый слой катализатора представляет собой железо-бета-цеолит, а второй слой катализатора, лежащий ниже по ходу потока, представляет собой серебро, нанесенное на оксид алюминия.
Таким образом, очевидно, что вместо простого механического смешивания Ag/Al2O3 и Fe-бета-цеолита два катализатора становятся наслоенными и тем самым физически разделенными. Производительность каталитической системы по изобретению с отдельными слоями из железо-бета-цеолита и лежащего ниже по ходу потока Ag/Аl2О3, как было обнаружено, превосходит производительность смешанных Ag/Аl2Оз3 и железо-бета-цеолита. Слоистый катализатор демонстрирует стабильную производительность и отсутствие тенденции к дезактивации после периодически повторяющихся каталитических циклов.
Предпочтительно, восстанавливающий агент выбирается из аммиака, мочевины, водорода, алканов, таких как С6Н14, алкенов и их смесей. Более предпочтительно, восстанавливающий агент представляет собой смесь водорода и аммиака. Такие восстанавливающие агенты также могут быть использованы в сочетании с одним или несколькими из описанных ниже вариантов выполнения изобретения.
Предпочтительно, в сочетании с одним или несколькими из описанных выше и ниже вариантов выполнения изобретения, молярное соотношение NH3:Н2:NO в газе составляет 1:0,3-3:1, и температура реакции находится в интервале от 150 до 550°С.
В одном варианте выполнения изобретения, в сочетании с одним или несколькими описанными выше или ниже вариантами выполнения изобретения, количество серебра во втором слое катализатора (загрузка серебра) составляет от 0,5 до 5 мас.%; более предпочтительно, количество серебра составляет 1 мас.%.
Серебро может быть загружено путем импрегнирования во влажном состоянии.
Оксид алюминия представляет собой, предпочтительно, γ-оксид алюминия, такой как коммерческий оксид алюминия от SASOL (SASOL N1, площадь поверхности по Брунауэру-Эммету-Теллеру (БЭТ): 150 м2/г).
Обнаружили, что при концентрациях водорода, применяемых по этому способу, загрузка серебра оказывает влияние на конверсию NO. Более конкретно, изобретатели обнаружили, что при загрузке серебра 1 мас.% получают как высокую конверсию NOx, так и высокую конверсию NH3 при широком интервале температур. Конверсии NOx около 95% получают в интервале температур от 150 до 400°С, в то время как проскакивание NH3 сохраняется низким, поскольку конверсия NH3 составляет около 95% по всему интервалу температур от 150 до 550°С. В отличие от этого, более высокая загрузка серебра, такая как 2 и 5 мас.% на катализатор, приводит как к низкой конверсии, так и высокому проскакиванию аммиака. Например, при 175°С конверсия NOx при 2 и 5 мас.% составляет около 80% и 70%, соответственно, и затем резко уменьшается при увеличении температур. Вероятно, высокая конверсия NO и NH3 при 1 мас.% загрузки серебра происходит из-за низкой активности окисления образцов тонко измельченного Ag, в то время как более высокая загрузка Ag может вызывать незначительную агломерацию образцов Ag. Этот второй катализатор, имеющий 1 мас.% серебра, фактически не активен при окислении аммиака, тогда как при более высоком содержании серебра, например, 5 мас.% серебра, происходит значительное окисление аммиака, и оно приводит к формированию NO.
В другом варианте выполнения изобретения, в сочетании с одним или несколькими из указанных выше или ниже вариантов выполнения изобретения, оксид алюминия представляет собой бемит. Обнаружили, что когда серебро загружено на этот специфический тип оксида алюминия, предпочтительно, импрегнированием во влажном состоянии, конверсия NOx и NH3 возрастает, в особенности, когда количество серебра в этом втором катализаторе составляет более 1 мас.%, особенно, когда количество серебра во втором катализаторе составляет от 2 до 5 мас.%, более конкретно, 2, 3 и 5 мас.%. Например, когда второй катализатор из серебра на оксиде алюминия содержит 2 мас.% Ag, и оксид алюминия представляет собой бемит, конверсия NOx при 300°С увеличивается от около 60% при использовании 2 мас.% Ag на коммерческом оксиде алюминия (γ-оксид алюминия, SASOL N1, площадь по БЭТ 150 м2/г) до около 80% при использовании бемита. Вероятно, образцы Ag взаимодействуют сильнее с поверхностью этого оксида алюминия, тем самым уменьшая их агломерацию, и в то же время подавляют нежелательное окисление водорода и аммиака.
В еще одном варианте выполнения изобретения, в сочетании с одним или несколькими из указанных выше или ниже вариантов выполнения изобретения, этот способ, кроме того, содержит обеспечение, по меньшей мере, одного слоя инертного материала между первым и вторым слоями катализатора. Материал инертного слоя представляет собой, предпочтительно, кварц (SiO2), который обеспечивает тонкий слой, такой как слой кварца 5 мм. Прослаивание слоем из инертного материала между слоями катализатора из Fe-бета-цеолита и серебра на оксиде алюминия дает возможность полного разделения этих активных слоев. Другими словами, избегают смешивания катализатора из Fe-бета-цеолита с катализатором из серебра на оксиде алюминия, в особенности на поверхности раздела слоев катализатора, которое может вызывать нежелательное локальное падение каталитической активности восстановления NOx.
Аммиак может быть подан в форме раствора аммиака или мочевины. Когда аммиак подают в чистой форме, он может храниться в виде жидкого аммиака в герметичном резервуаре или в твердой форме в виде металлической соли амина, где аммиак освобождают из соли, например, путем нагревания или другими средствами, как, например, описано в международной заявке WO-A-07000170. Следовательно, по одному следующему варианту выполнения изобретения, в сочетании с одним или несколькими из указанных выше или ниже вариантов выполнения изобретения, аммиак подается из средств хранения аммиака в форме твердого амина металла, из которого аммиак высвобождается, а водород подается посредством разложения аммиака в реакторе разложения аммиака. В таком устройстве требуемые потоки аммиака и водорода могут быть достигнуты путем отдельного управления двумя потоками аммиака; один поток направляется прямо к выхлопному газу, а другой течет через реактор разложения аммиака к выхлопному газу - как показано в установке, изображенной на фиг.1.
Альтернативно можно контролировать только один поток аммиака, и отношение аммиака и водорода варьируется путем контроля температуры в реакторе разложения аммиака, как показано на Фиг.2. Последнее требует реактора разложения аммиака, где температура может быть изменена достаточно быстро, чтобы следовать за быстрыми изменениями рабочих условий, имеющихся в автомеханических применениях; следовательно, это должен быть некоторый микрореактор с низкой тепловой массой. Часть водорода или он весь можно подавать через управление двигателем, если это удобно. Реактор разложения аммиака, преимущественно, загружают катализатором разложения аммиака. Такой катализатор может быть основан на активном металле, подобном Fe, Co, Ni, Ru или их сочетаниях. Однако применим любой материал, который может катализировать реакцию разложения аммиака.
Водород может быть подан из бака-хранилища водорода или путем реформинга части топлива, применяемого в процессе сгорания, например, дизельного топлива.
В еще одном варианте выполнения изобретения, в сочетании с одним или несколькими из указанных выше или ниже вариантов выполнения изобретения, этот способ, кроме того, содержит слой катализатора окисления аммиака, лежащий ниже по ходу потока второго слоя катализатора, предпочтительно, катализатора, содержащего платину. Такой катализатор превращает путем окисления аммиак, проскочивший из СКВ, и также дает возможность реакции Н2-СКВ происходить при очень низкой температуре с высокой конверсией NOх до 150°С или даже ниже.
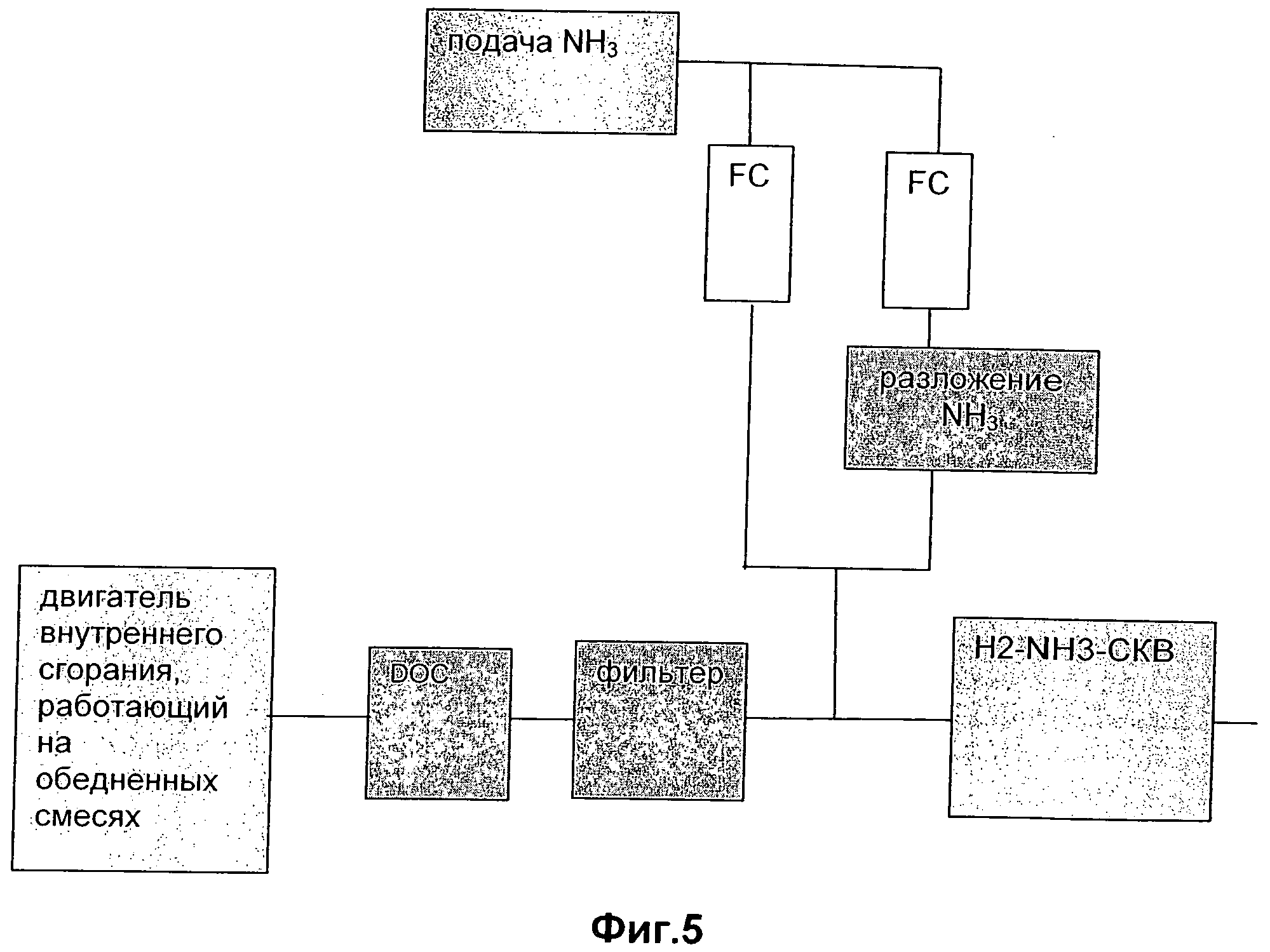
Для того чтобы иметь систему обработки выхлопных газов в автомеханических применениях, которая отвечает всем требованиям к эмиссии, катализатор СКВ часто устанавливают в выхлопной системе с другими элементами, которые снижают содержание СО, углеводородов и эмиссии частиц до приемлемого уровня. Катализатор окисления превращает СО и углеводороды путем окисления, с формированием CO2 и Н2O. Материал в виде частиц (главным образом, сажу) улавливают в фильтре очистки от микрочастиц, который, потенциально, может катализировать, чтобы помогать регенерации. Как показано на Фиг.3-5, эти элементы могут быть размещены различными способами. Наиболее оптимальная конфигурация зависит от конкретного двигателя и применения. Таблица показывает преимущества, неудобства и возможности, предлагаемые различными системами.
Регенерация фильтра (устраняющего сажу окислением) также представляет собой уместный объект проектирования наиболее оптимальной системы. Регенерация может быть достигнута до некоторой степени пассивными средствами в ходе нормальной работы. Наиболее часто это основано на фильтре, покрытом катализатором окисления сажи, и/или на относительно более высокой активности NO2 при окислении сажи по сравнению с O2. Окисление сажи посредством NO2 начинается уже при 200°С. Оба метода применимы в системах, показанных на Фиг.3-5. В системах, где фильтр размещен после катализатора СКВ, NO2 не может быть использован в качестве окислителя сажи, если временами не выключают поток NH3, что, потенциально, может быть сделано.
Если пассивная регенерация не достаточна для поддержания фильтра чистым, требуется время от времени активная регенерация. Это достигается нагреванием фильтра до температуры, при которой захваченная сажа сгорает в атмосфере, богатой кислородом. Обычно требуемая температура составляет 650°С за период 10 минут для полной регенерации, когда вся сажа в фильтре окисляется. В дизельных применениях такой высокой температуры выхлопных газов наиболее часто достигают последующим впрыскиванием дизельного топлива в двигатель в сочетании с катализатором окисления дизельного топлива в выхлопной системе, чтобы сжигать относительные высокие концентрации несгоревшего дизельного топлива при такой работе двигателя. Однако также возможны другие способы, подобные электрическому нагреванию фильтра и применению отдельной горелки для топлива перед фильтром.
Активные компоненты катализатора для большинства применений наносятся на монолитную подложку. Предпочтительно, в сочетании с одним или несколькими из указанных выше или ниже вариантов выполнения изобретения, катализаторы железо-бета-цеолит и серебро на оксиде алюминия наносятся на каждый конец монолитной подложки, чтобы получать не только необходимое физическое разделение Fe-бета-цеолита и Ag/Аl2О3 ниже по ходу потока, но также и общий, механически устойчивый, каталитический элемент с низким падением давления в выхлопной системе. Монолитная подложка может быть основана на экструдированном кордиерите или складчатой структуре материалов из металла или волокон.
Катализаторы также могут быть отдельно нанесены в виде покрытия на фильтр очистки от микрочастиц, чтобы интегрировать функциональные возможности фильтра и СКВ в системе, показанной в Фиг.3.
Второй объект изобретения состоит в обеспечении каталитической системы для восстановления оксидов азота из выхлопных газов, содержащей, по меньшей мере, два слоя катализатора, в которой первый слой катализатора представляет собой железо-бета-цеолит, а второй слой катализатора, лежащий ниже по ходу потока, представляет собой серебро, нанесенное на оксид алюминия. В другом варианте выполнения изобретения каталитическая система может, кроме того, содержать, по меньшей мере, один инертный слой материала между первым и втором слоями катализатора. Это дает возможность, как объяснено выше, полного разделения железо-бета-цеолита и серебра на оксиде алюминия, тем самым снижая потенциальные локальные падения производительности, в особенности, на поверхности раздела обоих катализаторов. Каталитическая система по изобретению может, кроме того, содержать слой катализатора окисления аммиака, лежащий ниже по ходу потока, чем второй слой катализатора, чтобы не только удалять любой остающийся аммиак в газе, но также и поддерживать высокую производительность (высокую конверсию NO) при очень низких температурах, то есть температурах ниже 150°, таких как 100°С.
Каталитическую систему по изобретению применяют в присутствии восстанавливающего агента, предпочтительно, восстанавливающего агента, выбранного из аммиака, мочевины, водорода, алканов, алкенов и их смесей, более предпочтительно, смеси водорода и аммиака, наиболее предпочтительно, смеси водорода и аммиака, подаваемых в эквимолярных концентрациях.
Это изобретение охватывает также применение указанной каталитической системы для обработки выхлопных газов из двигателей внутреннего сгорания, работающих на обедненных смесях, газовых турбин и испарителей.
Теперь обратимся к Фигурам. Фиг.1 показывает общий вариант выполнения способа по изобретению, в котором аммиак и водород подаются в отдельных линиях перед объединением потоков и контактом с системой катализатора СКВ в выхлопном газе.
Фиг.2 показывает вариант выполнения способа по изобретению, в котором аммиак и водород подаются через однопутную линию, где водород производят путем пропускания через реактор разложения аммиака перед контактом с системой катализатора СКВ в выхлопном газе.
Фигуры 3-5 показывают более конкретные варианты выполнения общего варианта выполнения изобретения, приведенного на фигуре 1, включая различные локализации катализатора окисления и фильтра частиц относительно каталитической системы СКВ в выхлопном газе.
Фиг.6 показывает влияние концентрации Н2 на производительность 1 мас.% Ag/оксид алюминия в СКВ NH3. Верхняя часть показывает конверсию NOх, а нижняя часть остающийся процент NH3.
Фиг.7 показывает влияние концентрации Н2 на входе на производительность катализатора по изобретению, состоящего из слоистого железо-бета-цеолита и 1 мас.% Ag/оксид алюминия в СКВ NH3. Верхняя часть показывает конверсию NOx, а нижняя остающийся процент NH3.
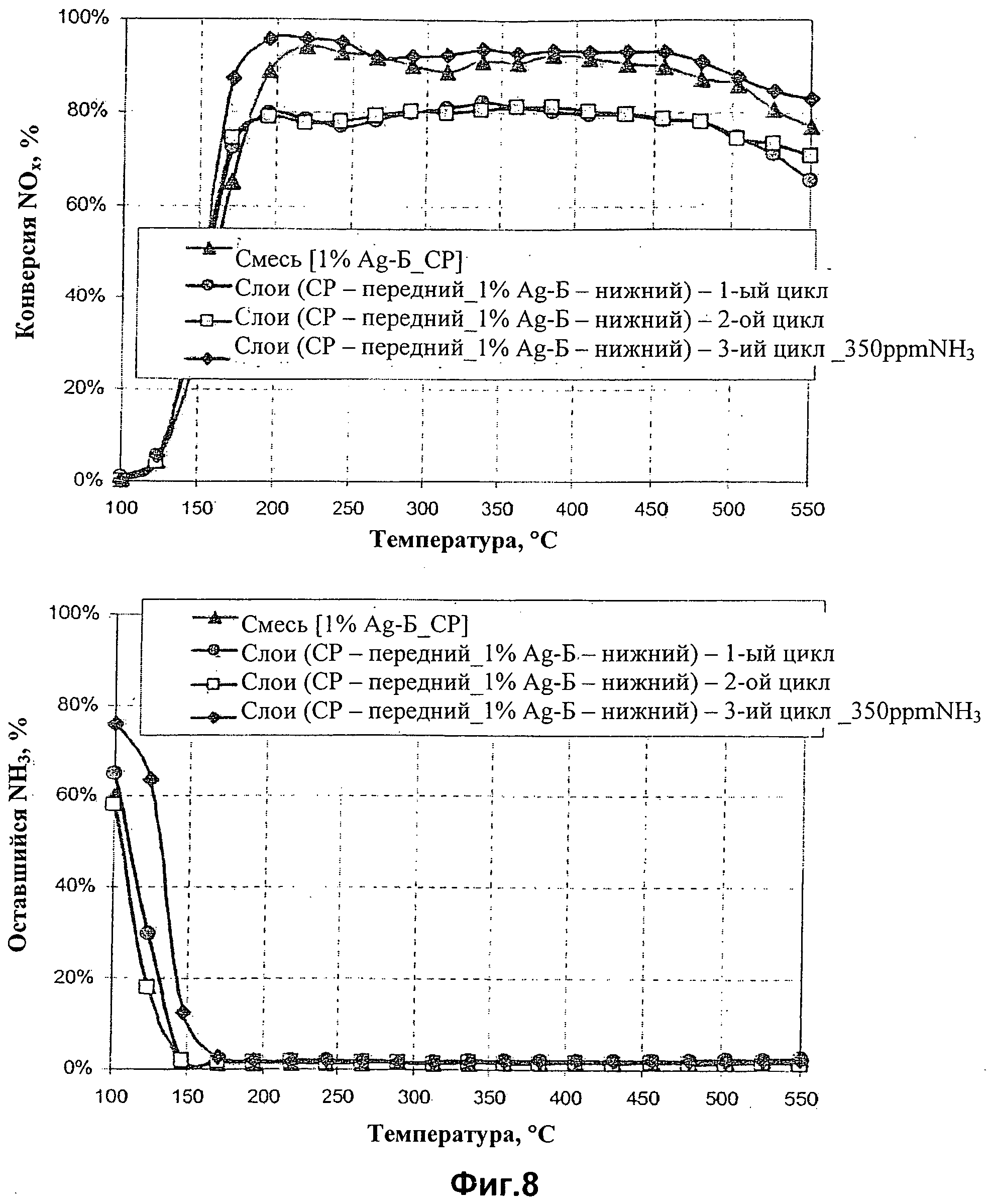
Фиг.8 показывает сравнительное изучение на основе дезактивации простой механической смеси железо-бета-цеолита и серебра на оксиде алюминия по отношению к катализатору в виде двух слоев, состоящему из железо-бета-цеолита и серебра на оксиде алюминия. Верхняя часть показывает конверсию NOx, а нижняя часть показывает остающийся процент NH3.
Пример 1 (сравнительный)
Эксперименты проводили, чтобы оценить производительность 1% Ag-А12O3(1 мас.%) при удалении NOx из NH3, при изменении концентрации Н2 от 100 до 1600 частей на миллион. Эти эксперименты позволяют оценить эффективность всего процесса удаления NOx из NH3 с одновременной подачей Н2, исходя из количества Н2, требуемого для высокой конверсии NOx.
Катализатор, содержащий 1 мас.% Ag/Аl2О3 (SASOL 1, площадь поверхности по БЭТ=150 м2/г) получали импрегнированием во влажном состоянии, где 3,0 г А12O3 (SASOL N1) загружали с 1 мас.% Ag, путем импрегнирования по влажном состоянии водным раствором AgNO3 (2,2 мл), содержащим 0,014 г Ag/мл. Продукт высушивали за ночь при комнатной температуре на воздухе. Полученный материал прокаливали при 600°С (4 ч) в потоке воздуха (~ 300 мл/мин). Температуру повышали от комнатной температуры до 600°С со скоростью 0,5°С/мин.
На Фиг.6, верхняя часть, показана производительность 1% Ag-Аk2О3 при удалении NOх из NH3, при различных концентрациях H2. Условия реакции: среднечасовая скорость подачи газа=72000 ч-1, состав подаваемого газа: 345 частей на миллион NH3, 300 частей на миллион NO, от 100 до 1600 частей на миллион H2, 7% О2, 4,5% Н2О, 10% CO2, остальное N2. Полная объемная скорость потока: 500 мл/мин. Загрузка катализатора: 0,36 г 1% Ag/Al2O3(Sasol#1).
Конверсия NOx быстро возрастает с увеличением содержания Н2 от 100 до 750 частей на миллион, и дальнейшее увеличение содержания Н2 до 1000 и 1600 частей на миллион заметно не улучшает конверсию NOx. Анализ зависимости количества NH3, остающегося в выхлопном газе, также показывает, что увеличение содержания Н2 от 100 до 750 частей на миллион приводит к быстрому уменьшению в проскакивании NH3, в то время как дальнейшее увеличение содержания Н2, по существу, не изменяет этот параметр.
Заслуживает внимания изменение конверсии NOx с температурой реакции, когда содержание водорода ниже оптимума (например, при величине от 500 до 250 частей на миллион). Конверсия NOx остается, по существу, постоянной при температуре от 250 до 450°С и слегка уменьшается с дальнейшим увеличением температуры реакции. Это показывает, что скорость реакции фактически не изменяется с температурой реакции в пределах широкого диапазона температур. Подобная тенденция может быть показана анализом количества NH3, остающегося в выхлопном газе (Фиг.6, нижняя часть).
Эти данные означают, что скорость реакции, по существу, независима от температуры реакции в пределах широкого диапазона температур.
Возможно, что водород участвует в некоторых стадиях общего механизма реакции, и имеется стехиометрическое соотношение между количеством водорода, который подают на катализатор, и количеством превращенных NOх. Таким образом, конверсия NOх над Ag/Аl2О3 при удалении NOx из NH3, как оказалось, очень чувствительна к содержанию водорода. Восстановление 1 молекулы NO требует, по меньшей мере, от 1,5 до 2 молекул водорода.
Пример 2 (изобретение):
Была исследована производительность слоистого Fe-бета-цеолита (коммерческий СР7124) и 1% Ag-Аl2О3(1 мас.%) в удалении NOx из NH3при различных концентрациях Н2. Количество H2, добавляемого в реакционную смесь, изменяли от 100 частей на миллион до 1600 частей намиллион, и производительность катализатора оценивали при 100-550°С. Условия реакции: Состав подаваемого газа: 340 частей на миллион NH3, 300 частей на миллион NO, 100-1600 частей на миллион Н2, 7% О2, 4,5% Н2О, 10% CO2, остальное N2. Полная объемная скорость потока: 500 мл/мин. Загрузка катализатора: 0,12 г Fe-бета-цеолита (передний слой)+0,36 г 1% Ag/А120з (слой ниже по ходу потока).
Слоистый катализатор состоял из 0,12 г верхнего слоя (0,2 см3) Fe-бета-цеолита, фракция от 0,4 до 1,0 мм и 0,36 г нижнего слоя (0,5 см3) 1 мас.% Ag/Al2O3(SASOL1).
Слоистый катализатор получали импрегнированием во влажном состоянии, где 5,0 г Аl2О3 (SASOL N1) загружали с 1 мас.% Ag, путем импрегнирования во влажном состоянии водным раствором AgNO3 (3,7 мл), содержащим 0,014 г Ag/мл. Продукт высушивали за ночь при комнатной температуре на воздухе. Полученный материал прокаливали при 550°С (4 ч) в потоке воздуха (около 300 мл/мин). Температуру увеличивали от комнатной температуры до 550°С со скоростью 0,5°С/мин.
Верхний слой: 0,12 г (0,2 см3) СР7124 (Fe-бета), фракция от 0,4 до 1,0 мм.
Нижний слой: 0,36 г (0,5 см3) 1 мас.% Ag/Аl2О3 (SASOL 1), полученный, как описано выше, фракция от 0,4 до 1,0 мм.
Производительности слоистого (двойной слой) Fe-бета-цеолит и 1% Ag-Аl2О3 при различных концентрациях Н2 сравниваются на фигуре 7, верхняя часть. Увеличение концентрации Н2 от 100 до 525 частей на миллион приводит к быстрому улучшению производительности катализатора в диапазоне температур от 150 до 300°С. Дальнейшее увеличение концентрации Н2 до 750, 1000 и 1600 частей на миллион, соответственно, приводит к незначительному улучшению производительности катализатора, которое является особенно очевидным при температуре от 120 до 170°С. Наиболее явное улучшение производительности катализатора наблюдается после увеличения содержания Н2 до величины от 500 до 600 частей на миллион.
Согласно примеру 1, мы обнаружили с катализатором Ag/Аl2О3, что восстановление 1 моля NO требует от 1,5 до 2 молей Н2. Принимая во внимание, что концентрация NO на входе составляет около 300 частей на миллион, и часть ее понижается над передним Fe-бета-цеолитом, 500 частей на миллион Н2 могло бы быть достаточными для эффективного восстановления остаточного NOx.
Слоистый катализатор Fe-бета-цеолит/1% Ag-Аl2О3 демонстрирует аналогичную зависимость производительности от содержания Н2 по сравнению с катализатором Ag-Аl2О3 (пример 1). С другой стороны, присутствие катализатора Fe-бета-цеолит обеспечивает хорошую каталитическую активность при температуре от 250 до 550°С, даже при содержании Н2 столь низком, как 100 частей на миллион. В пределах температур от 150 до 250° значительное улучшение производительности катализатора может быть достигнуто увеличением концентрации Н2 до 525 частей на миллион, в то время как дальнейшее увеличение до 750-1600 частей на миллион приводит к незначительному улучшению конверсии NOх. Эти данные показывают, что слоистая каталитическая система более эффективна, исходя из расхода H2 по сравнению с Ag-Аl2О3, вследствие синергетического действия компонентов Ag-Аl2О3 и Fe-бета-цеолит. Более конкретно, расход водорода снижается по сравнению с ситуацией, когда применяется только серебро, нанесенное на оксид алюминия. Хорошая каталитическая активность СКВ (около 60% конверсии NOx уже при 250°С) обнаружена при широком диапазоне температур от 250 до 550°С, даже в газе с мольным соотношением NH3:Н2:NO около 1:0,3:1, то есть восстановление 1 моля NO требует менее 1 моля водорода.
Пример 3
Производительность простой механической смеси Fe-бета-цеолита с Ag/Аl2О3 сравнивали с двойным слоем Fe-бета-цеолит и Ag/Аl2О3, в котором есть пространственное разделение обоих катализаторов, причем Fe-бета-цеолит является передней частью катализатора.
Механически смешанная каталитическая система: 0,31 г (0,5 см3) 1 мас.% Ag/Аl2О3 (бемита), полученного, как описано ниже, смешивали с 0,12 г (0,2 см3) Fe-бета-цеолита (СР 7124), полностью измельчали до порошка и прессовали фракцию от 0,4 до 1,0 мм. 1 мас.% Ag/Аl2О3 (бемита) получали импрегнированием во влажном состоянии, где 3,0 г бемита загружали с 1 мас.% Ag импрегнированием во влажном состоянии водным раствором AgNO3 (2,2 мл), содержащим 0,014 г Ag/мл. Продукт высушивали за ночь при комнатной температуре на воздухе, и полученный материал прокаливали при 600°С (4 ч) в потоке воздуха (~ 300 мл/мин). Температуру увеличивали от комнатной температуры до 600°С со скоростью 0,5°С/мин. Полученная каталитическая композиция смеси состояла из: 1 мас.% Ag/Аl2О3 (бемит) (0,31 г)+Fe-бета-цеолит (0,12 г).
Слоистый (двойной слой) катализатор: получали каталитическую систему из слоистого Fe-бета-цеолита+1 мас.% Ag/Al2O3 (бемита).
Верхний слой состоял из 0,12 г (0,2 см3) Fe-бета-цеолита (СР7124), фракция от 0,4 до 1,0 мм. Нижний слой состоял из 0,31 г (0,5 см3) 1 мас.% Ag/Аl2О3 (бемита) (полученного, как описано выше), фракция от 0,4 до 1,0 мм. Готовая каталитическая композиция слоистого катализатора состояла из: Fe-бета-цеолит (0,12 г)+1 мас.% Ag/Al2O3 (бемита) (0,31 г).
Полученные данные показывают сильную дезактивацию смешанного катализатора, возможно, при нагревании катализатора после остывания в реакционной смеси. На Фиг.8 сравнивают стабильность смешанных и слоистых каталитических систем при повторных каталитических циклах.
Дезактивация слоистого катализатора (круги и квадраты) в ходе второго цикла и в последующих каталитических циклах не наблюдается. Стабильность слоистого катализатора, как оказалось, значительно выше по сравнению со смешанным катализатором (треугольники), для которого показана производительность после 1 цикла.
Было обнаружено, что неполная конверсия NOх (Фиг.8, верхняя часть) является результатом пониженной концентрации аммиака в подаваемом газе. После увеличения содержания аммиака до величины от 340 до 350 частей на миллион, конверсия NOх над слоистым катализатором после 3 циклов (ромбы), по существу, идентична той, которая наблюдалась над недавно полученным смешанным катализатором после 1 цикла (треугольники). Эта фигура показывает, что производительность слоистого катализатора Fe-бета-цеолит+Ag-Аl2О3, содержащего разделенные слои Fe-бета-цеолит (передний) и Ag-Аl2О3 (нижний), как было обнаружено, превосходит производительность смешанного катализатора Ag-Аl2О3+Fe-бета-цеолит. Этот катализатор демонстрирует стабильную производительность и не имеет тенденции к дезактивации после повторных каталитических циклов.
Реферат
Изобретение относится к каталитической системе для восстановления оксидов азота из выхлопных газов, содержащей, по меньшей мере, два слоя катализатора, в которой первый слой катализатора представляет собой железо-бета-цеолит, а второй слой катализатора, лежащий ниже по ходу потока, представляет собой серебро, нанесенное на оксид алюминия, а также к применению указанной каталитической системы для обработки выхлопных газов из двигателей внутреннего сгорания, работающих на обедненных смесях, газовых турбин и испарителей. Кроме того, изобретение относится к способу восстановления оксидов азота до азота в выхлопном газе, включающему пропускание выхлопного газа в присутствии восстанавливающего агента через каталитическую систему, содержащую, по меньшей мере, два слоя катализатора, в которой первый слой катализатора представляет собой железо-бета-цеолит, а второй слой катализатора, лежащий ниже по ходу потока, представляет собой серебро, нанесенное на оксид алюминия. Технический результат заключается в увеличении технологических возможностей удаления NOиз выхлопных газов. 3 н. и 11 з.п. ф-лы, 8 ил., 3 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ удаления nox и n2o и устройство для его осуществления
Патенты аналоги
Способ удаления nox и n2o и устройство для его осуществления

Комментарии