Способ криоконсервации заготовленной ткани млекопитающих или культивированного эквивалента ткани и устройство для его осуществления - RU2178865C2
Код документа: RU2178865C2
Чертежи



Описание
Данное изобретение относится к криоконсервации как заготовленных тканей, так и культивированных эквивалентов тканей, изготовленных при использовании технологии in vitro.
Это изобретение относится также к устройству для криоконсервации как заготовленной ткани млекопитающих, так и культивированных эквивалентов тканей, которое эффективно с точки зрения цены и удобно в применении, а также позволяет сохранить максимальную жизнеспособность тканей или эквивалентов тканей, которые должны храниться при криогенной температуре.
При использовании технологии хранения при криогенной температуре и заготовленные ткани и культивированные ткани могут храниться до использования в течение неограниченного периода времени.
Культивированная ткань является in vitro моделью эквивалентной человеческой ткани, которая по прекращении хранения может использоваться для трансплантации или имплантации in vivo, или для сортировки соединений in vitro.
С помощью технологии in vitro были получены эквиваленты тканей для тестирования in vitro или пересадки in vivo для заживления ран. Способы получения таких эквивалентов тканей изложены в патентах США 4485096, 4604346, 4835102 и 5374515 и в заявках США 08/193809 и 08/337830; все эти материалы приведены в качестве ссылок.
Срок хранения живых тканей ограничен, и, следовательно, их можно использовать в течение короткого интервала времени, что приводит к большому количеству отходов. Необходимо законсервировать такие ткани на продолжительные интервалы времени, например для перевозки и хранения, до их использования. Совершенствование как способа криоконсервации, так и устройства для криоконсервации и хранения неограниченно увеличивает срок использования, облегчает транспортировку и позволяет поддерживать запасы. Желательно также иметь возможность поддерживать запасы тканей в ожоговых центрах и больницах. Другим преимуществом является возможность отбора проб на различных стадиях цикла изготовления для архива контроля качества и изготовления более значительных партий продукции, так как ее можно сохранять в замороженном состоянии.
В настоящее время срок хранения клеточных биологических материалов расширен путем охлаждения до "криогенных" температур. Переход из жидкого в твердое состояние путем снижения температуры системы происходит или в виде кристаллизации (льда), включающей упорядочивание молекул воды, или же в виде витрификации или аморфизации (образование стеклообразной фазы) при отсутствии упорядочивания кристаллической фазы. Задачей криобиологов является довести клетки до криогенных температур, а затем вернуть их к физиологическим условиям без повреждения их.
Имеется два основных подхода к криоконсервации клеток и тканей: замораживание-оттаивание и витрификация. В способе замораживания-оттаивания межклеточный раствор заморожен (то есть находится в кристаллической форме), но принимаются меры для сведения к минимуму образования льда внутри клеток. В процессе витрификации делается попытка избежать образования льда в образце в целом. Первый подход является проблематичным, поскольку, если кристаллы льда образуются внутри клеток, это может повредить жизнеспособности клеток при таянии. Однако клетки могут пережить цикл замораживания-таяния, если они охлаждаются с контролируемой скоростью в присутствии криопротекторов в нетоксичных количествах. Во втором подходе - витрификации сделана попытка избежать потенциально опасных последствий образования льда внутри и вне клеток, используя очень высокие концентрации растворенных веществ и/или полимеров. Однако опасность для клеток может возникать из-за длительного контакта с добавками, необходимыми для проведения витрификации, при токсичных уровнях концентрации.
Криопротекторы защищают живые клетки от стрессов, возникающих в процессе замерзания. Одним из способов защиты клетки криопротектором является разбавление соли, концентрация которой в жидкой фазе постоянно возрастает по мере перехода воды в лед. Количество льда определяется температурой и начальным составом раствора, в то время как количество незамерзшей фракции является только функцией температуры. Криоконсерванты имеют и ряд других функций. Существенным является то, что они обычно снижают температуру образования льда в межклеточном пространстве. Другой функцией является стабилизация мембран и протеинов.
Все растворы переохлаждаются ниже их точки замерзания, пока не будут обнаружены случайные точки зародышеобразования для начала формирования кристаллов. В случае криоконсервации методом замораживания-таяния образование льда во внеклеточной среде следует преднамеренно инициировать путем формирования зародышей при низких степенях переохлаждения. Если образование льда не инициируется внесением зародышей, он будет формироваться спонтанно, при достаточно сильном охлаждении раствора относительно к его равновесной точке замерзания. Поскольку этот процесс по природе является вероятностным, образование льда будет происходить при случайных, непредсказуемых температурах; следовательно, в ходе параллельных опытов при одинаковом протоколе замораживания вероятность выживания будет весьма различной. Кроме того, особенно быстрая кристаллизация, которая происходит при образовании льда в сильно переохлажденном растворе, может быть опасной для клеток и тканей. Более того, было показано, что если образование льда в межклеточном пространстве было инициировано при высоких степенях переохлаждения, резко увеличивается вероятность образования льда внутри клеток. Это явление проистекает из замедленного наступления вызванной замораживанием дегидратации клетки, что приводит к повышенному удерживанию внутриклеточной воды и, таким образом, к более высокой вероятности образования льда в клетке.
Когда образованы зародыши льда во внеклеточном пространстве, и образец окружен фазой льда, необходимо охладить образец до состояния криоконсервации. Эта стадия охлаждения является одной из наиболее критических в протоколе замораживания-таяния. Из-за образования льда, то есть чистой воды, частично замороженный внеклеточный раствор является более концентрированным, чем внутриклеточный. Вследствие этого клетка будет дегидратироваться, теряя воду при попытке восстановить термодинамическое равновесие. По мере охлаждения системы образуется все больше внеклеточного льда, концентрация раствора повышается, что заставляет клетки все больше дегидратироваться.
Имеется три характеристики клеток, которые контролируют их скорость дегидратации. Одна из них - проницаемость клеточной мембраны по воде: чем ниже проницаемость по воде, тем больше времени требуется клеткам для дегидратации. Другой является температурная зависимость проницаемости клеточной мембраны по воде: у всех клеток проницаемость по воде снижается с уменьшением температуры. Последней является размер клетки: большим клеткам требуется больше времени для дегидратации, чем меньшим. Принимая, что каждый тип клеток может обладать совершенно различными характеристиками, оптимальные условия криоконсервации для различных типов клеток могут изменяться на порядки по величине.
Хотя точные механизмы разрушения клетки во время криоконсервации еще полностью не выяснены, характерные показатели жизнеспособности, полученные измерением выживания клеток в зависимости от скорости охлаждения, по-видимому, качественно близки для всех типов клеток и представляют собой кривую в форме перевернутой буквы U. Выживание клеток низко при очень медленных и очень быстрых скоростях охлаждения, и имеется промежуточная скорость охлаждения, дающая оптимальное выживание. Если даже оптимальная скорость охлаждения и ширина кривой могут существенно изменяться для различных типов клеток, качественное поведение, по-видимому, является универсальным. Более быстрые скорости охлаждения не дают клеткам достаточно времени для дегидратации, и лед образуется внутри клеток. Повреждение клеток при быстрых скоростях охлаждения приписывается образованию льда внутри клеток. При медленных скоростях охлаждения повреждение клеток, как предполагают, является результатом контакта с более высокими концентрациями солей и криопротектора внутри и вне клетки, или же механических взаимодействий между клетками и льдом вне клетки.
Необходимо дегидратировать клетки как можно сильнее до того, как будет пересечена кривая зародышеобразования льда внутри клетки. Именно в этой точке практически вся вода, оставшаяся в клетке, будет образовывать зародыши и формировать лед. Невозможно определить точную температуру, где это произойдет, но приблизительно между -40o С и -50o С клетки медленно замерзают в присутствии 1М-2М концентрации криопротектора. Важно отметить, что количество воды, превращающееся в лед внутри клетки в этой точке, не может оказать вредного воздействия при замерзании, но если ее не разморозить достаточно быстро, она может расшириться и убить клетку при таянии. (The Biophysics of Organ Cryopreservation, Pg. 117-140, ed. David E. Pegg and Armand M. Karow, Jr. NATO ASI Series A: Life Sciences Vol. 147, 1987 Peenum Press, New York 233Spring St. , New York, NY 10013).
До того как был разработан коммерческий жизнеспособный эквивалент кожи, для целей пересадки использовали кожу трупов. Были разработаны протоколы криоконсервации таким образом, чтобы ожоговые центры и больницы могли поддерживать запасы кожи. Большое количество различных протоколов было разработано с использованием различных криопротекторов, скоростей замораживания, устройств для криоконсервации и условий хранения.
Большинство исследователей согласились с быстрым протоколом таяния. Успех или неудача протокола определялись или удачной пересадкой, или испытаниями на жизнеспособность клеток.
В патенте США 3842841 (Beisang) описан способ криоконсервации кусков кожи трупа. Этот способ включает фиксацию кожи трупа на рыхлой сетке или подложке; перед замораживанием кусок кожи и подложка скручивались вместе. Криопротектор не использовался, хотя изобретатель предполагает использование простого эфира глицерина или ДМСО. Протокол замораживания использует быстрое неконтролируемое (при фиксированной температуре) замораживание до криогенной температуры около -70oС.
May SR и FA DeClement (Scin Banking Methodology, 17, 33-45 (1980)) изучили геометрию устройства и скоростей охлаждения и нагревания при использовании иссеченной кожи трупа. Результаты показали, что кожа трупа должна быть плоской, а не свернутой, и что следует применять более медленную контролируемую скорость замораживания.
В патенте США 5040677 (Tubo) описан газонепроницаемый герметичный контейнер для индивидуальных трансплантатов или пластов клеток эпителия. Этот контейнер требует, чтобы пласт клеток эпителия был прикреплен к липкому субстрату или продублирован с использованием зажимов.
Патент США 5145770 (Tubo) описывает способ криоконсервации для пластов кератиноцитов, который использует криоконсервант из не проникающего в клетки агента, такого как декстран, и проникающего в клетки агента, такого как глицерин, при скорости охлаждения около -1oС/мин. Подобным образом ЕР 0364306 (Chao и др. ) описывает способ криоконсервации пласта живых культивированных эпителиальных клеток, но используя в качестве криоконсерванта ДМСО и глицерин при протоколе замораживания предпочтительно -1oС/мин.
В патенте США 5298417 (Cancedda и др. ) описан способ криоконсервации, разработанный для однослойных систем, таких как пласты эпителия, приготовленные в соответствии с патентами США 4016036, 4304866 и 4456687. Пласты эпидермы были термостатированы с криоконсервантом (8-15% глицерин или ДМСО) и подвергнуты криоконсервации при использовании протокола с регулируемой скоростью, где скорость охлаждения в начале была медленнее, чем в конце процесса, и отличительной особенностью являлось увеличение температуры перед кульминацией процедуры замораживания.
Способ криоконсервации фибробластов кожи в коллагеновом геле был исследован Teasdale и др. , Burns, 19 (5) 406-410 (1993). Teasdale определил, что оптимальную жизнеспособность клеток можно получить при замораживании со скоростью -0,5oС/мин с использованием ДМСО в качестве криоконсерванта.
Nanchahal и др, "Cultured composite skin grafts: Biologocal skin equivalents permitting massive expansion", The Lancet, 2 (8565), 191-193 (July 22, 1989) обсуждает способ хранения трансплантатов сложной культивированной ткани с использованием криопротектора, содержащего 15% глицерина и 10% FCS в среде 199. Образцы и криоконсервант были термостатированы при 37oС в течение двух часов, а затем заморожены при -1oС в минуту до -70oС, а затем хранились в жидком азоте. После быстрого размораживания образцов их жизнеспособность была определена культивированием в течение двух недель и пересадкой безволосым мышам. Окончательная оценка была произведена путем пересадки трем пациентам, перенесшим иссечение татуировки.
Johnstone и др. "Cryopreservation of Rabbit and Cat Corneas at -18o to -24oC", Cornea, 11 (3): 211-220 (1992), описывают простую процедуру криоконсервации роговой оболочки глаза кроликов и кошек, которая использует домашний холодильник, а не жидкий азот или холодильные установки, дающие очень низкие температуры. Перфузию криоконсерванта проводили путем последовательного помещения роговых оболочек в растворы 50% сыворотки из зародыша теленка и среды McCarey-Kaufman с увеличенным содержанием глицерина и глюкозы.
Используя ранее существующие методы, нельзя сохранить при криогенных температурах культивированные эквиваленты тканей, в частности потому, что они относительно толсты и состоят из гетерогенных слоев клеток. Одной из функций этих тканей in vivo является обеспечение барьера проницаемости. Функции тканей следует рассматривать при разработке протокола криоконсервации.
Согласно настоящему изобретению разработан способ криоконсервации и, в частности, устройство для криоконсервации, которое применимо к ряду культивированных эквивалентов тканей и к коже млекопитающих; эта конструкция является удивительно эффективной и коммерчески целесообразной для криоконсервации культивированных эквивалентов тканей.
В данном изобретении предложен способ успешной криоконсервации культивированных эквивалентов тканей при очень низких температурах, который позволяет избежать образования опасных кристаллов льда внутри клеток, сводит к минимуму эффективную концентрацию потенциально опасных химикатов и позволяет осуществить быстрое введение и удаление криоконсервантов при подходящих температурах с использованием программируемого холодильного оборудования.
Данное изобретение предусматривает также новое устройство, разработанное для криоконсервации, хранения и транспортировки культивированных эквивалентов тканей. Эта новая конструкция имеет многочисленные преимущества перед существующими устройствами. В настоящее время в продаже не имеется сохраняемых при криогенных температурах культивированных эквивалентов тканей, следовательно, отсутствует устройство для хранения в нестационарных условиях. Конструкция нового устройства позволяет обеспечить лучшее соответствие температуры внутри устройства и температуры морозильной камеры вне устройства благодаря более эффективному теплообмену. Улучшенная интенсивность теплообмена позволяет обеспечить более контролируемый процесс; так, равномерные скорости охлаждения и нагревания культивированных эквивалентов тканей позволяют снизить изменчивость жизнеспособности клеток.
Согласно изобретению разработан способ криоконсервации культивированных эквивалентов тканей, выполненных с помощью технологии in vitro, так что эти ткани сохраняют их жизнеспособность и ценность как эквиваленты тканей человека. Данное изобретение включает использование перемешивания для улучшения проникновения эффективного количества криоконсерванта. Данный способ обеспечивает криоконсервацию как заготовленных тканей, так и культивированных эквивалентов тканей таким образом, чтобы сохранить структурную целостность и жизнеспособность клеток.
Способ по данному изобретению
включает:
а) погружение заготовленной ткани или культивированного эквивалента ткани в раствор криоконсерванта и перемешивание этого раствора криоконсерванта и указанной погруженной ткани для
достижения эффективного проникновения раствора криоконсерванта в указанную ткань (перфузии ткани) с получением перфузированной ткани,
б) внесение зародышей льда во внеклеточное пространство
криоконсерванта и перфузированной ткани,
в) охлаждение указанной перфузированной ткани, полученной в операции б), до криоконсервированного состояния путем замораживания указанной ткани при
небольшой скорости замораживания до температуры, составляющей по меньшей мере примерно -70oС или ниже, более предпочтительно -120oС, еще более предпочтительно -140o, и
наиболее предпочтительно -196oС,
г) хранение криоконсервированной ткани при температуре по меньшей мере около -70oС или ниже.
Будучи замороженной, ткань может храниться в течение неопределенного периода времени при температурах между -120oС и -196oС (температура жидкого азота).
Оттаивание хранящейся при криогенной температуре ткани осуществляется путем нагревания замороженной ткани с высокой скоростью, что занимает от 1 до 2 минут. Замороженная ткань может быть оттаяна путем прямого наложения нагретой питательной среды или физиологического буферного раствора, или же другим быстрым методом нагрева. Конструкция устройства позволяет оттаивать ткань путем погружения этого устройства в водяную баню, поскольку устройство обеспечивает как высокую скорость нагрева, так и контролируемую температурную однородность при поддержании стерильности в процессе процедуры оттаивания.
Перед использованием в качестве эквивалента ткани человека для пересадки или испытаний in vitro размороженную культивированную ткань ополаскивают для удаления раствора криоконсерванта. Раствор криоконсерванта может быть удален ополаскиванием, например, изотоническим буферным раствором при физиологическом рН. Затем культивированный эквивалент ткани может храниться в течение некоторого времени в таком буферном растворе, или же может быть рекультивирован в подходящей клеточной среде перед использованием.
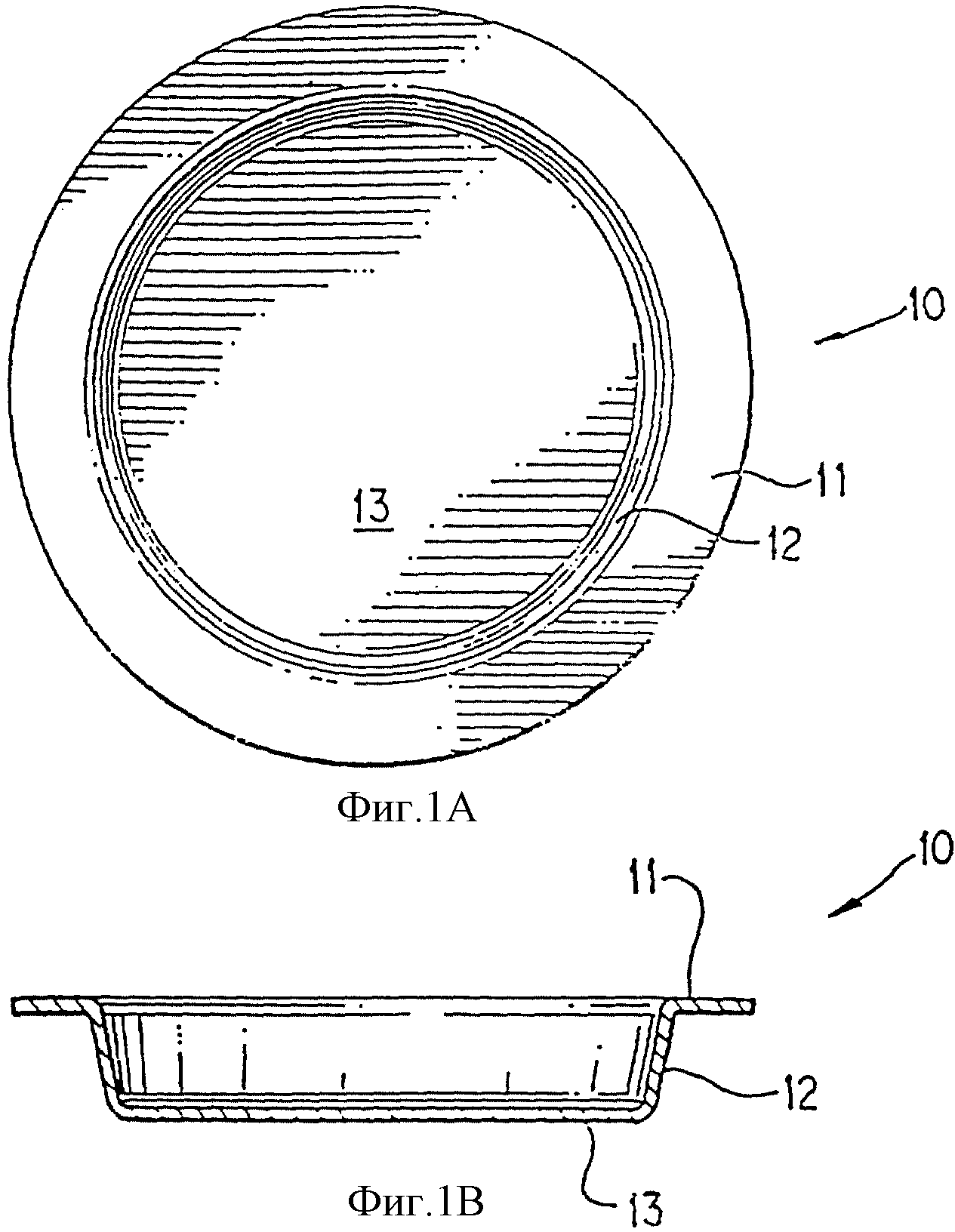
На фиг. 1А и 1В изображен вид крышки.
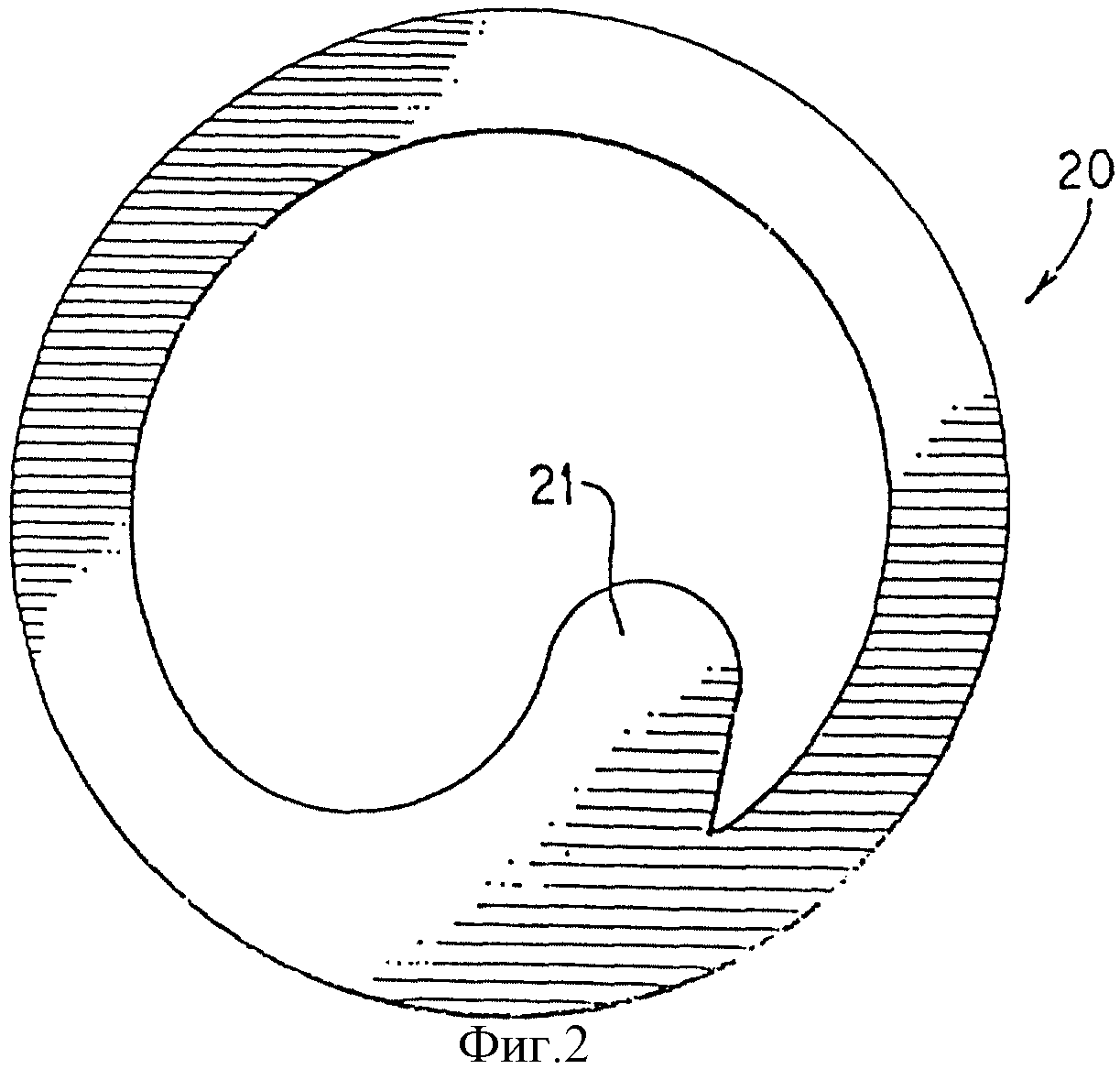
На фиг. 2 изображен вид сверху на уплотнение.
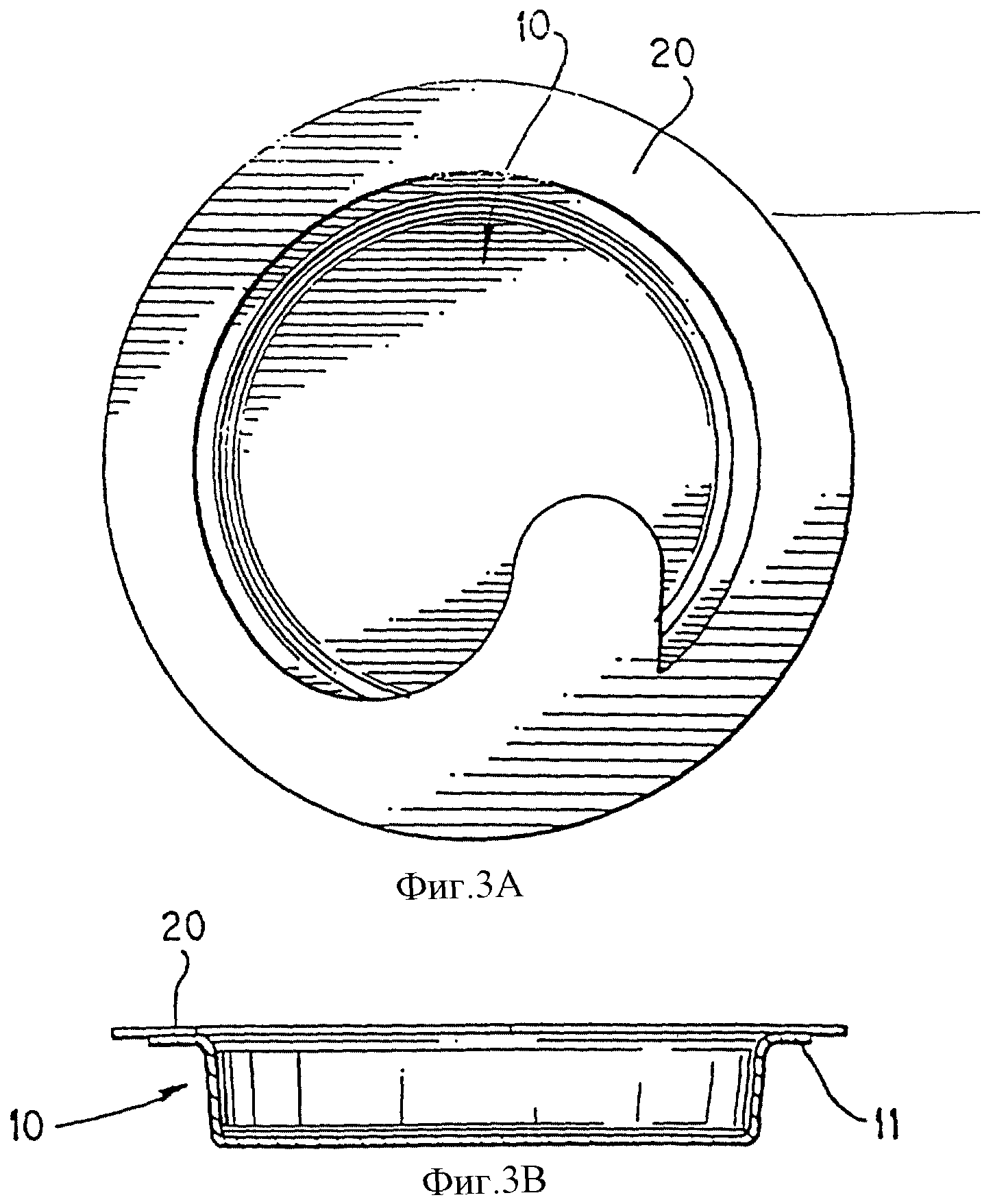
На фиг. 3А и 3В изображено уплотнение, наложенное на крышку.
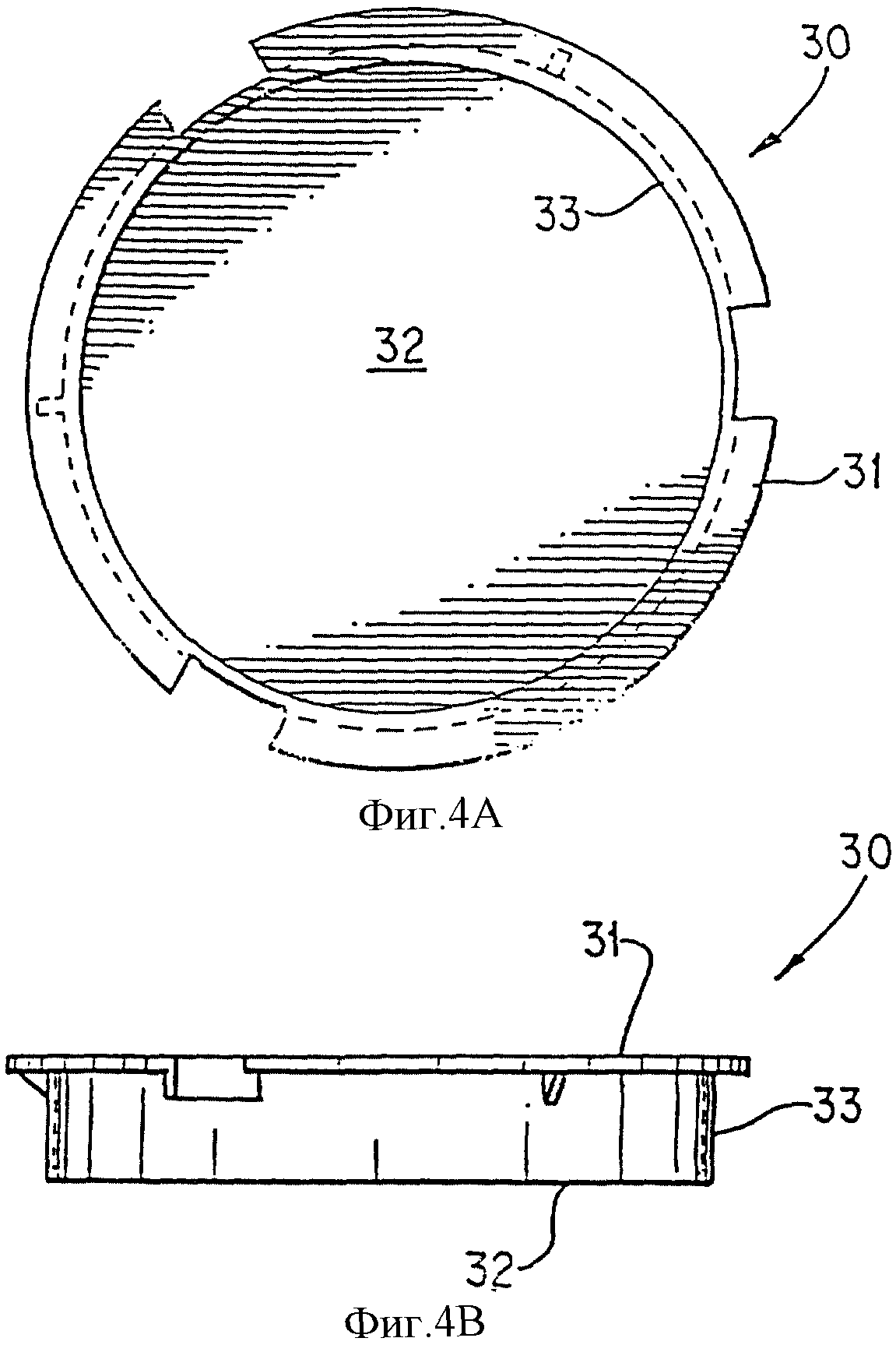
На фиг. 4А и 4В изображен носитель.
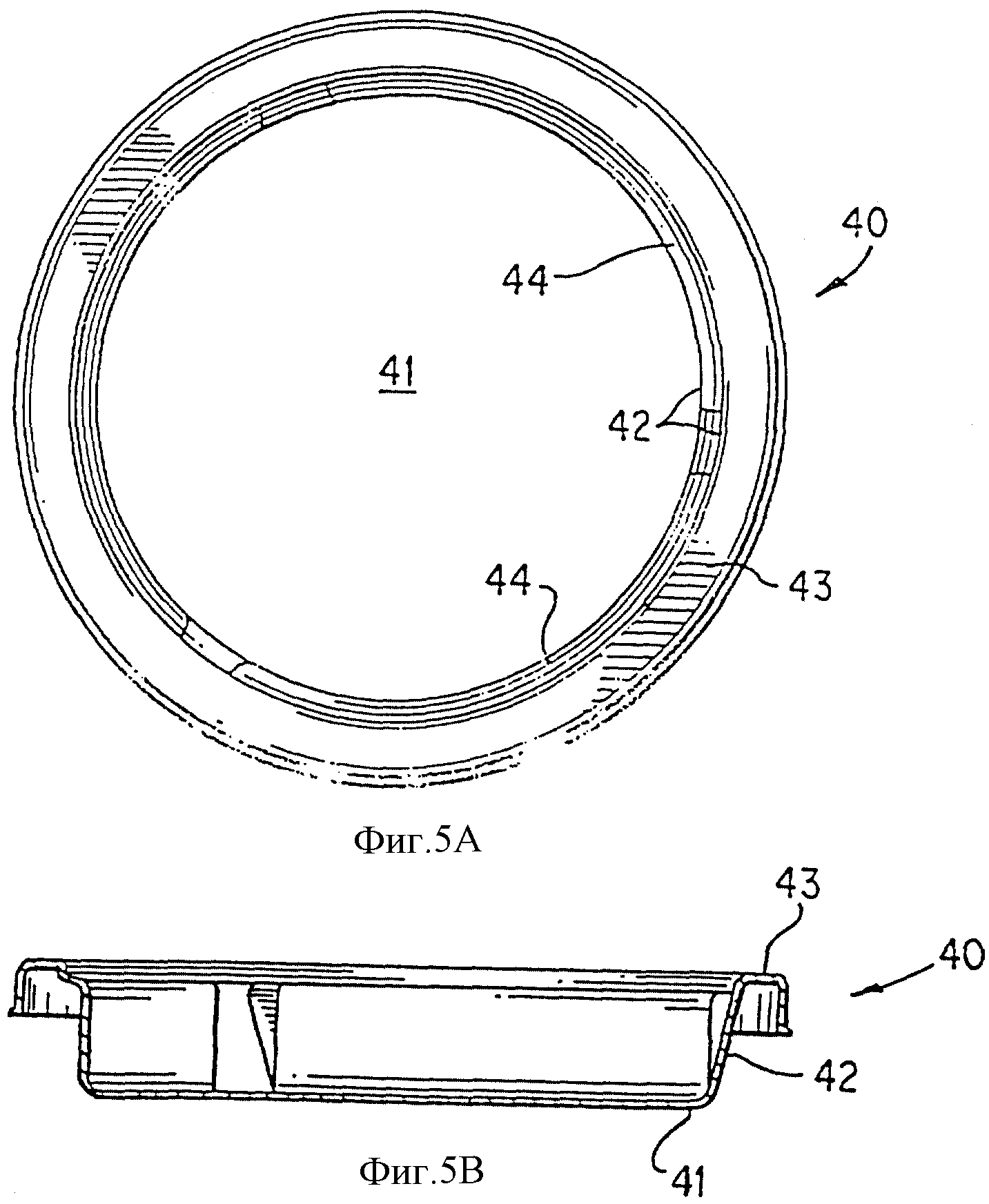
На фиг. 5А и 5В изображен поддон.
На фиг. 6А и 6В изображен комплект (детали и в собранном состоянии).
На фиг. 7 представлен вид комплекта в закрытом состоянии.
На фиг. 8 представлен вид сверху сборки в собранном виде.
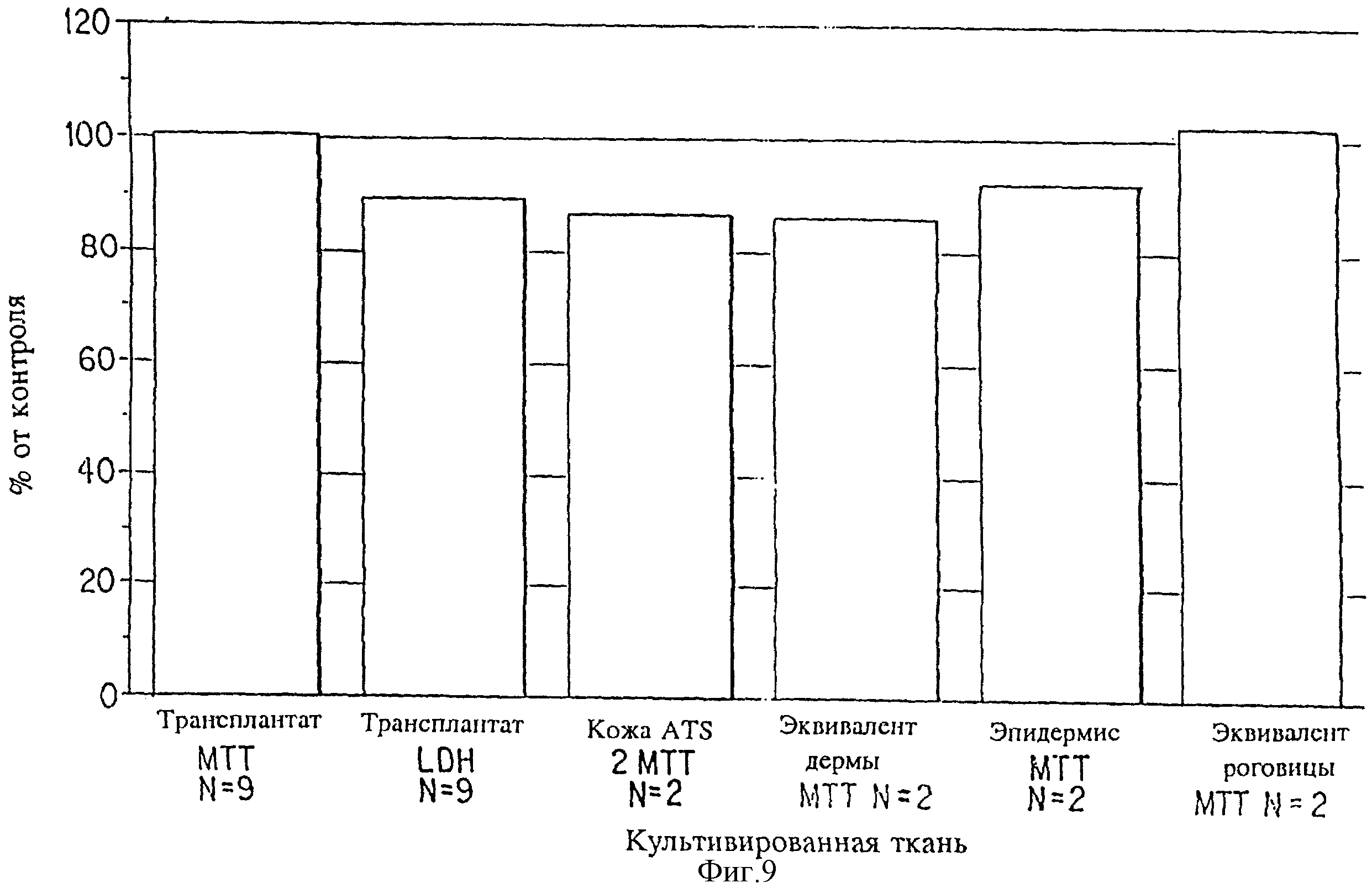
На фиг. 9 представлен вид зависимости жизнеспособности хранившихся при криогенной температуре культивированных тканей по сравнению с не хранившимися при криогенной температуре культивированными тканями. Показана жизнеспособность хранившихся при криогенной температуре культивированных тканей, измеренная методом МТТ. На ЭЖК дополнительно проводили измерения методом ДГЛ. Все культивированные ткани сравнивали с не подвергавшимися криоконсервации контрольными образцами такого же срока хранения, и результаты измерений выражали в процентах от контрольной величины.
Искусственное выращивание тканей - это новая область, в которой используют культивированные клетки тканей для конструирования эквивалентов тканей, которые могут применяться для изучения реакции на повреждение химическими агентами или фармацевтическими соединениями. Культивированные ткани могут также использоваться для получения пригодной для пересадки человеческой ткани.
Эквиваленты тканей описаны во многих патентах, включая патенты США 4485096; 4485097; 4539716; 4546500; 4604346; 4837379 и 5374515, которые приведены здесь в качестве ссылок. Одна из успешных реализации эквивалента тканей, называемая "Эквивалентом живой кожи", имеет морфологию, сходную с морфологией настоящей человеческой кожи. Эквивалент живой кожи (ЭЖК) состоит из двух слоев: верхняя часть сделана из дифференцированных и расположенных слоями кератиноцитов эпидермы, которые покрывают нижележащий слой фибробластов кожи человека в коллагеновой матрице. Parenteau и др. , "Epidermis Generated In Vitro: Practical Considerations and Applications", J. of Cellular Biochemistry, 45: 245-251 (1991); Parenteau и др. , "The organotypic culture of human skin keratinocytes and fibroblasts to achieve form and function", Cytotechnology, 9: 163-171 (1992); и Bell и др. , "The living Skin Equivalent: Its Manufacture, Its Organotypic Properties and Its Responses to Irritants", Toxic in Vitro, 5: 591-596 (1991). ЭЖК для пересадок находится в процессе клинических исследований возможности ее использования для лечения частичных или на полную толщину повреждений кожи: для операций иссечения, ожогов, язв на почве венозного застоя, диабетических язв, пролежней и хронических воспалительных язв. ЭЖК представляет собой двухслойную, выращенную in vitro кожную ткань полной толщины.
Полученный in vitro эквивалент роговой оболочки глаза был разработан в соответствии с патентом США 5374515, включенным в список ссылок. Эквивалент ткани роговой оболочки имеет три выраженных слоя клеток: внешний слой - слоистый чешуйчатый эпителий; средний слой волокон коллагена и клеток стромы; и внутренний слой - простой чешуйчатый эпителий, называемый также эндотелием роговицы. Полученный in vitro эквивалент роговицы можно использовать для проб на токсичность in vitro; он может служить точными и недорогими предсказуемыми моделями неживотного происхождения глаза in vivo и потенциала раздражения кожи для многих типов продуктов и сырья.
Задачей криоконсервации является сохранение структурной целостности и жизнеспособности биологических материалов на неограниченный период времени, так чтобы эти материалы были доступны и могли использоваться по мере надобности. Сложные ткани с ограниченным сроком жизни требуют криоконсервации для расширения возможностей использования продукта. Однако история криоконсервации биологических материалов показала, что оптимизация протокола криоконсервации для конкретного типа клетки не всегда дает хорошие результаты при использовании с клетками другого типа или с другими клетками в ткани. Требовалась разработка более специализированных методов из-за различия плотности клеток, содержания воды и уровня структурной организации эквивалентов ткани на всю толщину. Протоколы криоконсервации данного изобретения неожиданно применимы к однослойной эпидерме и дерме, двухслойным эквивалентам тканей, трехслойным эквивалентам роговой оболочки глаза и заготовленной коже млекопитающих. Разработка дизайна упаковки делает криоконсервацию этих тканей применимой для процессов на промышленном уровне.
Здесь подразумевается, что термин "культивированные эквиваленты тканей" означает эквиваленты тканей млекопитающих, сделанные методом in vitro, что включает однослойные эквиваленты кожи (как эквивалент дермы, так и эпидермы); двухслойные эквиваленты кожи, в частности ЭЖК; и трехслойные эквиваленты роговой оболочки глаза и кожи. Морфология культивированных эквивалентов тканей подобна морфологии тканей in vivo органов млекопитающих, особенно органов человека. Для иллюстрации, морфология ЭЖК имеет много общего с человеческой кожей. Метаболически и митотически активные фибробласты кожи человека (ФКЧ) обнаружены по всему слою дермы системы, и было показано, что коллаген и другие компоненты матрицы выделяются в сетку. Эпидермис состоит из базового слоя, который, как было показано, делится с митотической скоростью, близкой к скорости деления человеческой кожи. Надбазальный эпидермис имеет те же слои, как и кожа in vivo, с хорошо выраженными спинальным и гранулярным слоями, содержащими кератогиалин и чешуйчатые гранулы, покрытые роговым слоем. Иммуногистохимия показывает наличие внеклеточных компонентов матрицы, которые обычно находят на границе дермы и эпидермы в нормальной человеческой коже, такие как ламинин, коллаген типа IV и каланин (GB3).
В культивированных эквивалентах тканей, полученных органотипическими способами культивирования, таких как эквивалент живой кожи (ЭЖК), используют носитель в виде сетки, на которой и формируется эквивалент. Культивированные эквиваленты тканей изготовляются на носителе, который позволяет манипуляции с изделием в процессе изготовления, транспортировки и окончательного использования без прямого контакта с эквивалентом. Методы получения культивированных эквивалентов тканей на носителе описаны в патентах США 5374515 и заявках США 08/193809 и 08/337830.
Носитель содержит плоскую проницаемую мембрану, которая прикреплена к одной из сторон трубчатой подложки. Другой конец трубчатой подложки включает обращенный наружу фланец, который, в свою очередь, имеет край, который может нависать над верхним краем углубления чашки, где происходит выращивание ткани, и в устройстве данного изобретения. Сборка мембрана - подложка имеет такой размер, чтобы ее можно было использовать с чашкой для культивирования, имеющей по меньшей мере одно углубление определенного размера, так, чтобы обеспечить соответствующую чистоту подложки и использовать верхнюю часть углубления. Сборка мембрана - подложка может изготовляться различных размеров так, чтобы использоваться с чашками для культивирования и устройством для криоконсервации и хранения различных размеров. Примером таких носителей является TRANSWELL®(Costar), как описано в патенте США 5466602. Специалисты могут модифицировать устройство, чтобы приспособить подобные носители, которые используют различные средства для поддержки и заполнения в сосуде для культивирования. Подобные носители описаны в патентах США 5358871 и 5366893 или в патенте США 4871674.
Согласно настоящему изобретению предлагается устройство для криоконсервации
заготовленной ткани млекопитающих или культивированного эквивалента ткани, содержащее
поддон, содержащий поверхность дна, смежную с боковой стенкой, и фланец, при этом боковая стенка имеет
направленные внутрь выступы, отходящие от боковой стенки и составляющие с ней одно целое,
носитель, содержащий плоскую проницаемую мембрану, прикрепленную к одному концу трубчатой подложки, и
край противоположного конца указанной трубчатой подложки, при этом указанный край поддерживается указанными направленными внутрь выступами указанного поддона,
крышку, включающую плоскую
поверхность дна, смежную с боковой стенкой, и фланец, при этом указанный фланец находится в тесном контакте с фланцем указанного поддона,
и уплотнение между указанным поддоном и указанной
крышкой.
Предпочтительное устройство данного изобретения включает несущую сетку и определяет пространство вокруг эквивалента ткани, чтобы можно было контролировать заданные параметры. В данном изобретении используются материалы, предпочтительно имеющие медицинскую чистоту и устойчивые в широком интервале температур. Эти материалы отливают в виде поддона и крышки, которые могут быть герметично соединены друг с другом с помощью средств уплотнения. Новое устройство сконструировано так, что оно содержит подложку носителя, на которой образуется эквивалент ткани.
Новое устройство включает поддон, крышку и уплотнение между ними. Поддон и крышка сконструированы таким образом, чтобы подходить к существующему носителю, содержащему прикрепленный к нему эквивалент ткани. Носитель с прикрепленным к нему эквивалентом ткани помещается в поддон, куда добавляют раствор криоконсерванта. Затем крышка помещается на поддон, и эти две части герметично соединяются вместе, образуя герметичное уплотнение между внутренним и внешним по отношению к устройству пространством.
Такая конструкция упаковки позволяет равномерно распределить криоконсервант ниже носителя и выше поверхности эквивалента ткани при поддержании контакта криоконсерванта с эквивалентом ткани, а также с поддоном и с крышкой. Конструкция упаковки основана на том, что контролируемую скорость охлаждения и замораживания можно поддерживать при равном объеме криоконсерванта, с одинаковой геометрией расположения выше и ниже культивированной ткани, подлежащей криоконсервации. Такая организация обеспечивает однородные расстояния от верхней и нижней поверхностей культивированного эквивалента ткани до наружной стенки упаковки (с условием, что упаковка имеет также однородную толщину). Эта однородность должна обеспечить однородную передачу тепла от эквивалента ткани к морозильной камере при охлаждении, и от внешней среды к эквиваленту ткани при таянии.
Поддон включает поверхность дна, смежную с боковой стенкой и фланцем. Фланец обеспечивает плоскую поверхность для герметичного соединения поддона с крышкой. Боковая стенка поддона имеет один сплошной выступ или ряд дискретных выступов, направленных внутрь от боковой стенки и составляющих с ней одно целое. Носитель, содержащий культивированный эквивалент ткани, при расположении в поддоне подвешивается на этих выступах. Между подвешенным носителем и дном поддона образуется пространство, имеющее толщину около 1,0 мм и площадь, примерно соответствующую размеру эквивалента ткани.
Крышка включает плоскую поверхность дна, смежную с боковой стенкой и фланцем. Диаметр фланца крышки несколько меньше, чем диаметр фланца поддона. Фланец крышки при помещении его на содержащий носитель поддон остается на носителе так, чтобы поверхности фланцев как поддона, так и крышки находились в контакте, ориентированные (или приблизительно ориентированные) в одной и той же плоскости. Второе пространство определяется крышкой и поверхностью культивированного эквивалента ткани и имеет толщину также около 1,0 мм при площади примерно равной площади эквивалента ткани.
Эта конструкция позволяет создать расстояние в целом около 1 мм между поддоном и донной частью носителя, содержащего расположенный на нем эквивалент ткани, и расстояние около 1 мм между крышкой и эквивалентом ткани; криоконсервант находится выше и ниже эквивалента ткани в контакте как с крышкой, так и с поддоном. Когда крышка помещается в поддон, содержащий среду, она вытесняет весь воздух, находящийся в упаковке, к периферийному пространству, содержащему трубчатую подложку носителя. Между указанным поддоном и крышкой имеется уплотнение.
Крышка герметично соединяется с поддоном по плоскости, созданной поверхностями фланцев поддона и крышки. Герметизация может осуществляться путем нагревания, с использованием клейкого вещества или другими известными способами. Герметизация крышки с поддоном препятствует утечке криоконсерванта и поддерживает стерильность внутреннего пространства элемента. Предпочтительно используют кольцевое уплотнение из состава, который при нагревании герметично сцепляется как с фланцем поддона, так и с фланцем крышки, на которых оно находится. Этот герметизирующий состав предпочтительно имеет петлю, за которую его можно удалить, таким образом нарушив герметичность между крышкой и поддоном, и получить доступ к эквиваленту ткани. В другом исполнении крышка с фланцем примерно такого же диаметра, как и фланец поддона, помещается на поддон с размещенным в нем носителем таким образом, чтобы обращенная вниз поверхность фланца крышки тесно прилегала к обращенной вверх поверхности фланца поддона. Затем эти фланцы герметично соединяются друг с другом с помощью соответствующего средства.
Фиг. 1А и 1В изображают крышку 10, фланец крышки 11, боковую стенку крышки 12 и донную поверхность 13. Фланец крышки 11, боковая стенка крышки 12 и поверхность дна 13 образуют сплошную поверхность.
Фиг. 2 изображает кольцевое уплотнение 20 и петлю 21.
Фиг. 3А и 3В изображают уплотнение 20, крышку 10, фланец крышки 11. Уплотнение 20 положено на фланец 11 крышки 10 перед использованием, чтобы облегчить выравнивание уплотнения в процессе герметизации.
Фиг. 4А и 4В изображают носитель 30, край носителя 31, проницаемую мембрану 32 и трубчатую подложку 33. Проницаемая мембрана 32 содержит культивированный эквивалент ткани, расположенный на ней, окруженный трубчатой подложкой 33. Носитель 30 позволяет перемещать эквивалент ткани без контакта с ним или удалять эквивалент ткани в ходе процесса криоконсервации.
Фиг. 5А и 5В изображают поддон 40, поверхность дна поддона 41, боковую стенку поддона 42, фланец поддона 43 и подложку носителя 44. Поверхность дна поддона 41, боковая стенка поддона 42 и подложка носителя 44 образуют единую поверхность. Подложка носителя 44 контактирует с носителем и поддерживает его внутри поддона.
Фиг. 6А и 6В показывают уплотнение 20, крышку 10, носитель 30 и поддон 40. Носитель 30, на котором находится эквивалент ткани, расположен в поддоне 40 и подвешен внутри поддона. Крышка 10 с уплотнением 20 помещена над носителем 30 и подвешена над носителем.
Фиг. 7 изображает уплотнение 20, фланец крышки 11, крышку 10, носитель 30, край носителя 31, подложку носителя 44 и поддон 40. Носитель 30, на котором находится эквивалент ткани, расположен в поддоне 40 и подвешен в нем за счет контакта донной поверхности края носителя 31 с направленными вверх поверхностями подложек носителя 44. Крышка 10 с уплотнением 20 помещена на носитель 30 и подвешена над носителем за счет контакта донной поверхности фланца крышки 11 с направленной вверх поверхностью края носителя 31. Поверхности фланца крышки 11 и фланца поддона 43 образуют плоскую поверхность для уплотнения 20.
Фиг. 8 изображает вид сверху на сборку.
Поддон и крышка могут быть изготовлены из таких жестких или полугибких термопластичных материалов, которые при нагревании могут быть отформованы вакуумным литьем или литьем под давлением (например, политетрафторэтилен (ПТФЭ) или полиэтиленгликольтерефталат (ПЭГТ)). Поддоны и крышки устройства предпочтительно стерилизовать перед употреблением с помощью известных способов стерилизации. Способ стерилизации, который может быть использован, определяется материалами, применяемыми для изготовления поддона и крышки. Для стерилизации ПТФЭ или ПЭГТ предпочтительно использовать гамма-излучение от 2,5 до 3,0 мегарад. В других случаях могут использоваться известные специалистам электрические и химические способы стерилизации.
Культивированные эквиваленты тканей включают в себя эквивалент дермы из гидратированной коллагеновой сетки, уплотненной каким-либо агентом, предпочтительно фибробластами. В одном из исполнений слой клеток эпидермы выращивают на поверхности эквивалента дермы. В другом исполнении гидратированная коллагеновая сетка, уплотненная кератиноцитами, расположена на слое клеток эндотелия роговицы со слоем клеток эпителия роговицы, выращенным на поверхности этой сетки. В другом случае могут быть выращены только клетки эпидермы, а затем индуцирован процесс расслаивания с образованием пласта эпидермы. Культивированный эквивалент ткани образуется или на пористой мембране носителя, или на геле коллагена, который находится в тесном контакте с пористой мембраной на поверхности носителя, обращенной к дну. Кроме того, и другие культивированные эквиваленты тканей можно хранить при криогенной температуре в соответствии со способами данного изобретения, включая, но не ограничиваясь этим, любые культивированные пласты эпидермы, любые культивированные эквиваленты дермы, любые культивированные эквиваленты роговой оболочки глаза, или же заготовленную кожу млекопитающих.
Теперь данное изобретение будет описано с использованием эквивалентов тканей и предпочтительного дизайна устройства в качестве иллюстрации. Специалистам ясно, что описанный способ может быть модифицирован не выходя за пределы области данного изобретения.
Перфузия эквивалента ткани раствором криоконсерванта осуществляется погружением предпочтительно при начальной температуре около 20oС эквивалента ткани и контактирующего с ним носителя в объем раствора криоконсерванта, достаточный для того, чтобы погрузить образец и иметь при этом равные объемы раствора криоконсерванта выше и ниже эквивалента ткани. В 100 мм чашку Петри, содержащую эквивалент ткани и носитель, добавлено 25 мл 2М глицерина в DMEM на период времени, достаточный для полной перфузии образца, предпочтительно между одним и двумя часами, но более предпочтительно около одного часа. Продолжительное нахождение ткани в растворе криоконсерванта приводит к снижению ее жизнеспособности, в то время как слишком короткий интервал времени не гарантирует полного проникновения криоконсерванта в ткань. Монослойные системы обычно требуют меньшего времени для перфузии, поскольку они имеют меньше слоев клеток и сниженные барьерные функции. В течение этого часа проникновение раствора криоконсерванта улучшается путем перемешивания образца и раствора криоконсерванта, обычно путем встряхивания чашки Петри на орбитальном шейкере (Bellco) при 70 оборотах в минуту в газовой камере с 10% СО2. Атмосфера 10% СО2, такая же как газовая среда, в которой эквивалент ткани был изготовлен, предохраняет среды от дегазирования, поддерживая таким образом рН основного компонента среды криоконсерванта. Перемешивание позволяет быстрее и более полно осуществить перфузию криоконсерванта в эквивалент ткани и получить лучшую воспроизводимость результатов для замороженных эквивалентов тканей. Можно заменить орбитальный шейкер установкой, которая осуществляет перемешивающее движение в других пространственных плоскостях. Кроме того, другие способы механического улучшения перфузии включают (но не сводятся к ним) покачивание системы в сосуде с криоконсервантом на платформе или центрифугирование системы с криоконсервантом, а также заполнение системы криоконсервантом с использованием насоса.
Температуру погружения предпочтительно поддерживают постоянной в течение времени, достаточного для установления физического и биологического равновесия указанного раствора криоконсерванта в указанной ткани.
Носитель и прикрепленный к нему эквивалент ткани помещают в поддон и добавляют в целом около 16,0 мл криоконсерванта. Устройство позволяет криоконсерванту распределиться равномерно: около 8,0 мл ниже носителя и около 8,0 мл на поверхности эквивалента ткани. Затем на поддон помещают крышку и эти две части герметично соединяют при нагревании предпочтительно с помощью герметизирующего состава.
Затем устройство с эквивалентами тканей помещают в программируемую морозильную камеру (Cryomed или Planar), установленную на начальную температуру, близкую к комнатной, предпочтительно на 20, 0oС. Морозильная камера, содержащая упакованные эквиваленты тканей, охлаждается со скоростью -10,0oС/мин до температуры равновесия жидкой и твердой фазы для криоконсерванта, которая обычно составляет около 6oС (для 2,0 М глицерина в DMEM между -5,3oС и -6,0oС). Температура равновесия между жидкой и твердой фазами является температурой, необходимой для образования зародышей льда в криоконсерванте. Температура в камере поддерживается в течение некоторого времени для достижения равновесия между температурой внутри устройства с эквивалентами тканей и температурой в камере. Скорость охлаждения, используемая для получения температуры образования зародышей, не является существенной. Время выдержки около 40 минут достаточно для того, чтобы гарантировать установление термического равновесия, но это время будет изменяться в зависимости от размеров камеры, циркуляции воздуха в камере и количества устройств, которые должны быть заморожены. Обычно необходимо по меньшей мере 30 минут, но для того, чтобы быть уверенным в наступлении равновесия, может потребоваться время до часа. После этого времени выдержки инициируется образование льда во внеклеточном пространстве путем внесения зародышей льда во внеклеточное пространство криоконсерванта и перфузионной ткани.
Внесение зародышей льда определяется как способ инициирования образования льда в криоконсерванте вне клеток. Одним из предпочтительных способов внесения зародышей льда является прикосновение охлаждаемого зонда к боковой стенке поддона, содержащего ткань (таким зондом может быть охлаждаемый жидким азотом (-196oС) стальной стержень). Точка контакта этого стержня с упаковкой должна быть ниже уровня среды криоконсерванта в устройстве. Другим предпочтительным методом является прямой выпуск расширяющихся газов, таких как фреон или СО2, к внешней стороне устройства. Образование льда может быть инициировано с помощью температурного всплеска внутри камеры, когда температура в камере понижается и повышается в пределах интервала, достаточного для образования кристаллов льда. Могут использоваться и другие известные способы внесения зародышей льда.
После того как во все эквиваленты тканей внесены зародыши льда, ячейки выдерживаются дополнительно один час для достижения термодинамического равновесия и распространения зародышей льда по всему криоконсерванту. Затем возобновляется охлаждение со скоростью предпочтительно между -0,02 и -0,3oС/мин; более предпочтительно между -0, 05 и -0,1oС/мин; и наиболее предпочтительно при -0,07oС/мин до окончательной температуры, предпочтительно по меньшей мере -70oС или ниже; более предпочтительно при -120oС; еще более предпочтительно при -140oС и наиболее предпочтительно при -196oС. По мере приближения конечной температуры замерзания к температуре перехода в стекловидное состояние для воды (-120oС) все менее вероятно, что возникнут опасные флуктуации температуры при перемещении в место окончательного хранения.
Предпочтительно после внесения зародышей льда проводить замораживание со скоростью -1oС/мин до температуры около -8oС и затем эту температуру поддерживают в течение времени, достаточного для установления физического и биологического равновесия указанного раствора криоконсерванта в указанной ткани.
Затем охлаждение продолжают при скорости -0,3oС до -0,02oС/мин до температуры около -70oС или ниже.
Криоконсервированные эквиваленты тканей переносят до их использования из программируемой морозильной камеры в емкость для хранения в паровой фазе жидкого азота (Dewar) при температуре между около -120oС и -150oС, или же в жидкий азот при температуре -196oС.
Для оттаивания криоконсервированные культивированные эквиваленты тканей удаляют из места хранения в паровой фазе жидкого азота и переносят в сухой лед, чтобы нагреть до приблизительно -75oС. После достижения равновесия при -75oС культивированные эквиваленты тканей переносят в среду, предпочтительно в водяную баню, предпочтительно установленную на 37oС; или более предпочтительно на 4oС; или наиболее предпочтительно установленную на комнатную температуру. Когда становится очевидным, что вся среда криоконсерванта перешла в жидкую фазу, упаковку культивированного эквивалента ткани предпочтительно переносят в асептический шкаф или другое асептическое помещение и обрабатывают этанолом. Крышка упаковки удаляется путем стягивания или срезания герметика со дна ячейки. Затем каждый из носителей, содержащих культивированные эквиваленты тканей, переносится в чашку Петри, давая стечь избытку криоконсерванта. Для того, чтобы отмыть эквивалент культивированной ткани от остатков криоконсерванта, 25 мл раствора для отмывки, предпочтительно DMEM при комнатной температуре, добавляют в чашку Петри, содержащую культивированный эквивалент ткани, примерно на 30 минут. Специалисты могут применять другие агенты для отмывки, предпочтительно физиологические растворы, такие как культурная среда клеток или фосфатный буферный солевой раствор. Раствор для отмывки обменивается с тканью второй раз еще 30 минут. Время отмывки может изменяться в зависимости от сложности ткани.
Элемент культивированного эквивалента ткани можно затем перенести обратно в его исходную чашку для культивирования и снова вырастить в культурной среде при 37oС/10% СО2. В других случаях этот эквивалент может быть пересажен пациенту или испытан на реакцию на контакт с каким-либо веществом, как описано в патенте США 4835102.
Последующие примеры приведены для лучшего освещения практики данного изобретения и в любом случае должны быть интерпретированы для определения области данного изобретения. Специалисты должны понимать, что в описанный здесь способ могут быть внесены различные изменения, что не влияет на суть и область данного изобретения.
Примеры 1-3 описывают способы криоконсервации и оттаивания согласно данному изобретению с предпочтительной конструкцией устройства.
Пример 1. Криоконсервация эквивалента живой кожи (ЭЖК) в упаковке.
Системы эквивалента живой кожи (ЭЖК) были получены в соответствии с заявкой на изобретение США 08/193809. ЭЖК и закрепленные 75 мм вставки носителя (TRANSWELL, Costar, Cambridge) на 9-10 день после воздушного барботажа были помещены в чашки Петри диаметром 100 мм (Costar). Системы ЭЖК были заполнены криоконсервантом путем погружения систем и вставок носителя с 25 мл среды криоконсерванта, 2М глицерин в DMEM, в 100 мл чашку Петри на один час. В процессе перфузии системы подвергали перемешиванию в течение одного часа на орбитальном шейкере (Bellco) при 70 об/мин в 10% СО2. Перемешивание позволяет провести более полную перфузию и получить лучшую воспроизводимость для способа криоконсервации. После того как ЭЖК были заполнены, чашки Петри, содержащие ЭЖК, вставки носителей и внеклеточную замораживаемую среду (2М глицерин и DMEM), были помещены в устройство для криоконсервации и загерметизированы при нагревании.
Программируемая морозильная камера (Planar) удовлетворяла описанному здесь изобретению. Камера была установлена на начальную температуру 20,0oС. Для удаления воздуха из трубопроводов линии были прочищены фреоном, поданным на одну секунду. Упакованные элементы ЭЖК были надежно размещены в стойках, каждая из которых предназначена для восьми элементов. Эти стойки с помощью направляющих штырей были помещены вблизи распылителей. Дверца морозильной камеры была закрыта, чтобы герметично отделить камеру от внешней среды.
Элементы ЭЖК были охлаждены при -10oС/мин до -6oС, и температуру в камере держали на -6oС в течение 40 минут, чтобы привести криоконсервант и пропитанные им системы в равновесие с камерой. После 40-минутной выдержки инициировали образование льда в межклеточном пространстве путем прямого выпуска фреона в течение одной секунды вблизи стенки упаковки. Фреон, испаряясь с поверхности упаковки, вызывает на поверхности контакта с ним падение температуры, достаточное для начала образования льда в межклеточном пространстве.
После того как во всех элементах ЭЖК образованы зародыши льда, элементам дали возможность прийти в равновесие в течение одного часа при -6oС. Затем температура камеры была снижена при скорости -0,07oС/мин до конечной температуры -20oС. Затем камеру охладили при скорости -0,5oС/мин до конечной температуры -70oС. После того как элементы ЭЖК были криоконсервированы, их перенесли в емкость для хранения в паровой фазе (дьюар) при температуре от -120oС до -150oС.
Пример 2. Оттаивание криоконсервированных ЭЖК.
Криоконсервированные ЭЖК были удалены из места хранения в паровой фазе жидкого азота и перенесены в сухой лед, чтобы нагреть их примерно до -75oС. После установления равновесия при -75oС культивированный эквивалент ткани перенесли в водяную баню с температурой предпочтительно 37oС; или более предпочтительно 4oС; или наиболее предпочтительно установленную на комнатную температуру. После того как вся среда криоконсерванта визуально перешла в жидкую фазу, элементы упаковки культивированного эквивалента ткани переносят предпочтительно в асептический шкаф или другое асептическое помещение и подвергают обработке этанолом. Крышки чашей удаляются после снятия или срезания герметизирующего состава со дна элемента. Носители, содержащие культивированные эквиваленты тканей, переносят затем в чашки Петри, слив избыток криоконсерванта. Для отмывки культивированного эквивалента ткани от остаточного криоконсерванта, 25 мл промывного раствора (при комнатной температуре), предпочтительно ДМЕМ, добавляют в чашку Петри, содержащую культивированный эквивалент ткани, приблизительно на 30 минут. Специалисты могут применять и другие подходящие физиологические промывные растворы, такие как другие культурные среды клеток или фосфатный буферный солевой раствор. Обмен с промывным раствором происходит во второй раз еще в течение 30 минут.
Оттаявшие криоконсервированные и контрольные образцы обрабатывали гистологическими методами и оценивали с помощью оптического микроскопа их морфологическую организацию и жизнеспособность; они показали почти 100% жизнеспособность и были почти неотличимы от контрольных.
Пример 3. Оценка конструкции упаковки для криоконсервации по скорости нагрева и термической однородности.
Устройство для криоконсервации по данному изобретению было оценено с позиций однородности теплопереноса. К мембране носителя (без культивированного эквивалента ткани) были прикреплены пять термопар, одна в центре и четыре на одинаковом расстоянии (1,0 мм) от внешней стенки носителя. Провода термопар выходили из устройства между фланцами крышки и поддона и шли на регистратор температуры (Azonix Scanner Plus). Устройство заполнили 17 мл криоконсерванта и загерметизировали при нагревании. Устройство привели к равновесию при -70oС и затем перенесли в водяную баню, установленную на 20oС. Регистратор температуры записывал температуру на каждой термопаре каждые 1-2 секунды в процессе нагревания. Упаковку сначала нагревали со скоростью 700oС/мин, а затем по мере приближения к точке плавления раствора криоконсерванта скорость нагревания снижали. Термическая однородность составляла между 2oС и 6oС по средней температуре термопар при нагревании с максимальной скоростью и приблизилась к 8oС по мере приближения к точке плавления раствора.
Примеры 4-12 демонстрируют способ криоконсервации по данному изобретению для различных тканей.
Пример 4. Криоконсервация пластов эпидермы.
Пласты эпидермы были извлечены из готового ЭЖК через 12 дней после воздушного барботажа. Удаление пласта эпидермы сопровождалось отделением дермального слоя субстрата от эпидермального слоя с помощью пинцета и выбрасыванием слоя дермы. Каждый пласт был разрезан на три эквивалентные части. Одна часть каждого пласта была зафиксирована в качестве контрольного образца. Две оставшихся части от каждого пласта были помещены на 75 мм поликарбонатную (Transwell) мембрану (Costar) в 100 мм чашке для культивирования (Costar). Каждый кусок был пропитан 25 мл ДМЕМ и 2М глицерином в течение одного часа. Чашки, содержащие системы, были помещены на орбитальный шейкер (Bellco) при 70 об/мин на один час в газовой камере с 10% СО2. После пропитки слоя эпидермы чашка Петри, содержащая пласт эпидермы, носитель и внеклеточную среду для замораживания (2М глицерин и ДМЕМ), была помещена в оболочку и загерметизирована в вакууме (AUDIOVOX) по программе: время вакуумирования - 5 сек; время герметизации - 3,9 сек.
Упакованные пласты эпидермы были помещены в программируемый холодильник (Planar) с начальной температурой 20,0oС. Пласты эпидермы охлаждали при -10, 0oС/мин до -6,0oС. При -6,0oС температуру выдерживали в течение 20 минут для достижения равновесия с камерой. После 20-минутной выдержки было инициировано образование внеклеточного льда посредством прикосновения охлаждаемого жидким азотом зонда с внешней стороны оболочки ниже уровня замораживаемой среды. После того как во все пласты эпидермы были внесены зародыши льда, температуру держали еще дополнительно 5 минут на -6,0oС. Затем камеру охладили при -1,0oС/мин до -8,0oС. Затем температуру выдерживали в течение 30 мин при -8, 0oС, чтобы лед мог равномерно распространиться по образцу. Затем камеру охладили при -0,1oС/мин до конечной температуры -70oС.
Криоконсервированные пласты эпидермы были удалены из холодильника, с чашки Петри была срезана оболочка и крышки удалены. Для проведения таяния в каждую чашку Петри было налито с соблюдением правил асептики 40 мл нагретого (37oС) ДМЕМ. Через 45 секунд вся жидкость была удалена из чашек, и в каждую чашку была добавлена на две минуты дополнительная аликвота 40 мл. После того как весь лед растаял, пласты эпидермы были промыты 25 мл ДМЕМ в течение 30 минут. Среду сменили во второй раз еще на 30 минут. Затем пласты эпидермы были термостатированы в питательной среде при 37oС/10% СО2 в течение 24 часов перед анализом. Время термостатирования позволяло снять заторможенность реакции, обычно наблюдаемую для замороженных клеток.
Из двух оставшихся кусков из каждого пласта эпидермы один был обработан для гистологии, а второй был испытан в соответствии с протоколом испытания МТТ. Сравнение микрофотографий некриоконсервированного пласта эпидермы и криоконсервированного пласта эпидермы примера 4 показало, что три основных особенности эпидермы: базальный слой эпидермы, надбазальный слой эпидермы и роговой слой эпидермы были сохранены этим способом. Все слои были неповрежденными, и в целом морфология криоконсервированного пласта эпидермы была идентична морфологии некриоконсервированного пласта эпидермы.
Пример 5. Криоконсервация эквивалента дермы.
Эквиваленты дермы, использованные в данном исследовании, представляли собой не покрытый эпидермой компонент ЭЖК. Эквиваленты дермы были заморожены на восьмой день после формовки. Эквиваленты дермы были пропитаны криоконсервантом путем погружения эквивалентов дермы, прикрепленных к 75 мм носителю (Costar), помещенных в 100 мм чашки Петри (Costar) с 25 мл ДМЕМ и 2М глицерином на один час. Чашки Петри были помещены на орбитальный шейкер (Bellco) при 70 об/мин на один час в газовой среде 10% СО2. После того как эквиваленты дермы были пропитаны, чашки Петри, эквиваленты дермы, носители и внеклеточная замерзающая среда были помещены в программируемый холодильник (Planar) при начальной температуре 20,0oС. Затем камеру охладили при -10,0oС/мин до -6,0oС. Эту температуру держали в течение 20 минут, чтобы достигнуть равновесия с камерой. После 20-минутной выдержки было инициировано образование внеклеточного льда путем прикосновения охлаждаемого жидким азотом зонда к внешней стороне чашек ниже уровня среды замерзания. После того как во все эквиваленты дермы были внесены зародыши кристаллов льда, температуру держали дополнительно 5 минут при -6,0oС. Затем камеру охладили при -1,0oС/мин до -8,0oС. Температуру в камере снова выдержали на -8,0oС в течение 30 минут, чтобы дать возможность льду равномерно распространиться по образцу. Ячейки с эквивалентами дермы затем были охлаждены при -0,1oС/мин до конечной температуры -70,0oС.
Криоконсервированные эквиваленты дермы были затем удалены из холодильника, и крышки с чашек были удалены. Для таяния в каждую чашку было налито с соблюдением условий асептики 40 мл подогретого (37oС) ДМЕМ. Через 45 секунд вся жидкость была удалена из чашек, и еще аликвота 40 мл была добавлена в чашки на две минуты. После того как весь лед растаял, эквиваленты дермы были обмыты 25 мл ДМЕМ в течение 30 минут. Среду сменили во второй раз еще на 30 минут. Эквиваленты дермы, еще прикрепленные к носителям, были перенесены снова в чашки для культивирования и термостатированы в питательной среде при 37oС/10% СО2 в течение 24 часов перед анализом. Время термостатирования позволяло снять заторможенность реакции, обычно наблюдаемую для замороженных клеток. Образцы были испытаны с использованием протокола испытаний МТТ.
Пример 6. Криоконсервация эквивалентов роговой оболочки глаза.
Эквиваленты роговой оболочки глаза, закрепленные на 24 мм носителях для культивирования (Costar), через 9 дней после барботажа влажным воздухом были помещены в чашку для групповой обработки с шестью углублениями (Costar). Способ перфузии эквивалентов роговой оболочки глаза криоконсервантом состоял в погружении каждого эквивалента роговой оболочки глаза и носителя с 4 мл внеклеточной среды замораживания (2М глицерин в ДМЕМ) в чашку для групповой обработки с шестью углублениями на один час. Чашка для групповой обработки с шестью углублениями, содержащая системы роговой оболочки глаза, встряхивалась в течение одного часа на орбитальном шейкере (Bellco) при 70 об/мин в газовой среде 10% СО2. После того как эквиваленты роговой оболочки глаза были пропитаны, чашки Петри, содержащие эквиваленты роговой оболочки глаза, носители и внеклеточную среду замораживания, были помещены в программируемый холодильник (Planar) при начальной температуре 20,0oС. Эквиваленты роговой оболочки глаза были охлаждены при -10,0oС/мин до -6,0oС. Температуру выдерживали в течение 20 минут, чтобы установилось равновесие с камерой. После 20-минутной выдержки было инициировано образование внеклеточного льда путем прикосновения охлаждаемого жидким азотом зонда к внешней стороне каждого из углублений в чашке ниже уровня среды замораживания. После того как во все эквиваленты роговой оболочки глаза были внесены зародыши кристаллов льда, температуру держали дополнительно на уровне -6,0oС в течение 5 минут перед тем, как охладить со скоростью -1,0oС/мин до -8,0oС. Температуру держали на уровне -8,0oС еще в течение 30 минут, чтобы дать возможность льду равномерно распространиться в образце. Затем эквиваленты роговой оболочки глаза были охлаждены при -0,1oС/мин до конечной температуры -70,0oС.
Криоконсервированные эквиваленты роговой оболочки глаза были удалены из холодильника. Крышку чашки удалили. Для оттаивания 6 мл нагретого (37oС) ДМЕМ добавили с соблюдением правил асептики в каждое углубление пластины для групповой обработки. Через 45 секунд всю жидкость удалили из чашки и в чашку добавили на две минуты дополнительную аликвоту 6 мл. Эквиваленты роговой оболочки глаза и прикрепленные к ним носители были перенесены с использованием стерильного пинцета в новую чашку для групповой обработки. Для промывки в каждое углубление было добавлено 4 мл ДМЕМ на 30 минут. Среду заменили во второй раз еще на 30 минут. Затем элементы роговой оболочки глаза были перенесены обратно в ту же чашку для культивирования и термостатированы в питательной среде при 37oС/10% СО2 в течение 24 часов перед анализом. Время термостатирования позволяло снять заторможенность реакции, обычно наблюдаемую для замороженных клеток. Затем образцы были испытаны с использованием протокола испытаний МТТ.
Пример 7. Криоконсервация заготовленной кожи мышей.
Дикие мыши, линия B6CB6YF1, были усыплены передозировкой нембутала. Кожа была снята в асептических условиях. Избыточные кровеносные сосуды, жир и соединительная ткань были удалены с кожи. Кожа мышей была нарезана на прямоугольные куски 1 см•2 см. Куски кожи мышей были затем помещены на 75 мм носитель (Costar) в 100 мм чашке Петри (Costar). Кожа мышей была пропитана криопротектором путем погружения в 25 мл 2М глицерина в ДМЕМ в 100 мм чашке Петри в течение одного часа. Во время перфузии чашки Петри, каждая из которых содержала кожу мышей и носитель, встряхивали в течение одного часа на орбитальном шейкере (Bellco) при 70 об/мин в газовой среде 10% СО2. Контрольная некриоконсервированная кожа мышей хранилась в питательной среде при 4oС в продолжение процессов криоконсервации и оттаивания (2 дня) перед пересадкой кожи.
После перфузии кожи мышей чашка Петри, содержащая кожу мышей, носитель и внеклеточную среду замораживания, была помещена в программируемый холодильник Planar при начальной температуре 20,0oС. Кожа мышей была охлаждена при -10, 0oС/мин до -6,0oС и затем выдержана при -6,0oС в течение 20 минут для приведения в равновесие с камерой. После 20-минутной выдержки было инициировано образование внеклеточного льда путем прикосновения охлаждаемого жидким азотом зонда к внешней стороне чашки. Точка контакта должна быть ниже уровня среды замораживания. После того как во всю кожу мышей были внесены зародыши кристаллов льда, температуру дополнительно держали в течение 5 минут при -6,0oС перед тем, как охладить со скоростью -1,0oС/мин до -8,0oС. Температуру держали еще в течение 30 минут на -8,0oС для равномерного распространения льда в образце. Затем элементы были охлаждены при -0,1oС/мин до конечной температуры -70,0o С.
Криоконсервированная кожа мышей была удалена из холодильника, и крышка чашки была снята. Для оттаивания 40 мл нагретого (37oС) ДМЕМ было добавлено с соблюдением условий асептики в чашки Петри. Через 45 секунд вся жидкость была удалена из чашек, и дополнительная аликвота 40 мл была добавлена в чашки на две минуты. После того как весь лед растаял, кожа мышей была промыта в этих чашках 25 мл ДМЕМ в течение 30 минут. Среду сменили еще раз дополнительно на 30 минут.
Криоконсервированные образцы после оттаивания и контрольные образцы были обработаны для гистологии или пересажены мышам. Микрофотографии некриоконсервированной кожи мышей по сравнению с криоконсервированной показали, что этим способом сохраняются четыре основных характерных особенности кожи мышей: дерма с фибробластами, базальный слой эпидермиса, надбазальный слой эпидермиса и роговой слой эпидермиса. Все слои были неповрежденными, и в целом морфология криоконсервированной кожи мышей была идентичной морфологии некриоконсервированной кожи мышей.
Пример 8. Криоконсервация ATS SKIN2ТМ.
SKIN2TM, модель ZK 1300 (Перспективные научные исследования тканей, La Jolla, CA) была извлечена из упаковки в соответствии с руководством и помещена в чашку для культивирования (Costar). Вставки носителя были помещены на SKIN2TM, чтобы система оставалась погруженной. SKIN2TM была пропитана криоконсервантом путем погружения SKIN2TM в 2М глицерин в ДМЕМ в чашке для культивирования на один час. Во время перфузии чашку для культивирования, содержащую систему кожи и носитель, встряхивали в течение одного часа на орбитальном шейкере (Bellco) при 70 об/мин в газовой атмосфере 10% СО2.
После перфузии SKIN2TM элементы были помещены в программируемый холодильник (Planar) при начальной температуре 20,0oС. Элементы SKIN2TM охлаждали при -10,0oС/мин до -6,0oС и выдерживали при -6,0oС в течение 20 минут, чтобы привести их в равновесие с камерой. После 20-минутной выдержки инициировали образование льда во внеклеточном пространстве прикосновением охлаждаемого жидким азотом зонда к внешней стороне чашек ниже уровня среды замораживания. После того как во все образцы SKIN2TM внесены зародыши кристаллов льда, температуру поддерживали равной -6,0oС еще 5 минут. Затем температуру в камере снижали со скоростью -1,0oС/мин до -8, 0oС. Элементы SKIN2TM выдерживали в течение 30 минут при -8,0oС, чтобы достичь равномерного распределения льда в образце. Затем элементы SKIN2TM охлаждали при -0,1oС/мин до конечной температуры -70,0oС.
Криоконсервированные SKIN2TM удаляли из холодильника, снимали крышки с чашек и в каждую чашку для
культивирования наливали с соблюдением правил асептики подогретый (37oС) ДМЕМ. Через 45 секунд жидкость удаляли из чашек и в каждую чашку добавляли на две минуты дополнительную порцию ДМЕМ.
После оттаивания элементы SKIN2TM вместе с носителями переносили в новые чашки для культивирования, используя стерильный пинцет. Чтобы отмыть SKIN2TM от криоконсерванта, в
каждую
чашку для культивирования, содержащую SKIN2TM, добавляли ДМЕМ на 30 минут. Среду заменяли во второй раз еще на 30 минут. Затем элемент SKIN2TM переносили обратно
в чашку для культивирования того же типа и термостатировали в питательной среде при 37oС/10% СО2 в течение 24 часов перед анализом. Время термостатирования позволяло снять
заторможенность реакции, обычно наблюдаемую для замороженных клеток.
Криоконсервированные и контрольные системы были испытаны согласно протоколу испытаний МТТ для SKIN2TM, модель ZK1300, приложенному к этому продукту, а также подвергались гистологической оценке. Микрофотографии некриоконсервированных SKIN2TM в сравнении с криоконсервированными SKIN2TM показали, что этим способом сохраняются все четыре основных характерных черты SKIN2TM: коллагеновая сетка с фибробластами, базальный слой эпидермы, надбазальный слой эпидермы и роговой слой эпидермы. Все слои были неповрежденными, и в целом морфология криоконсервированного SKIN2TM была сходной с морфологией некриоконсервированного SKIN2TM.
Пример 9. Исследование метаболической активности митохондрий (МТТ).
Замороженные и незамороженные (контрольные) ЭЖК, пласты эпидермы, эквиваленты дермы и эквиваленты роговой оболочки глаза были испытаны методом МТТ. (Системы SKIN2TM были испытаны согласно "Протоколу МТТ испытаний для использования с моделью ZK1300", приложенному к сопроводительным документам). Жизнеспособность клеток системы измеряли, используя колориметрический метод оценки изменения МТТ, разработанный для измерения роста и жизнеспособности клеток. Этот метод подробно описан в Gay и др. , "The Living Skin Equivalent as a Model In Vitro for Ranking the Toxic Potential of Dermal Irritants", Toxic, in Vitro, 6: 303-315 (1992). Метаболическое восстановление растворимой соли тетразолия до синего осадка формазана зависит от присутствия жизнеспособных клеток с неповрежденными функциями митохондрий. Этот метод используется для количественной оценки цитотоксичности в ряде типов клеток, включая культивированные кератиноциты человека.
В чашки для культивирования, содержащие ЭЖК, пласт эпидермы и эквивалент дермы, было добавлено 40 мл среды для испытания, а в углубления, содержащие эквиваленты роговой оболочки глаза, было добавлено 1,5 мл среды для испытания, содержащей 0,33 мг/мл МТТ (Sigma Chemical Co. , St. Louis, МО). Эквиваленты тканей были термостатированы в среде для испытаний МТТ в течение 3-4 часов. В конце периода превращения эквиваленты тканей были подвергнуты биопсии с использованием дерматома диаметром 8 мм. Взятые частицы тканей были затем экстрагированы в течение 2-3 часов при комнатной температуре в 0,3 мл изопропанола, подкисленного 0,04 N HCl. В конце периода экстракции 0,2 мл каждого экстракта перенесли в углубление на пластине с 96 углублениями, были измерены величины коэффициента поглощения при 570 нм с помощью считывающего устройства Dynatech относительно изопропанольного экстракта. Значения МТТ, полученные на криоконсервированных образцах после оттаивания, сравнивались с соответствующими контрольными образцами и были выражены в процентах от контрольной величины (фиг. 4).
Пример 10. Проба на дегидрогеназу лактозы (ДГЛ).
ДГЛ - это энзим, обычно обнаруживаемый в жизнеспособной клетке. В случае опасности для клетки этот энзим выделяется, и соответствующее снижение активности энзима фиксируется в ходе данного испытания.
Оттаявшие криоконсервированные и контрольные образцы ЭЖК были перфорированы дерматотом диаметром 8 мм. Из каждого образца ЭЖК было взято три образца. Образцы были помещены в 15 мм пробирки с 1 мл 0.1 М триэтаноламиновым буфером (на льду) и гомогенизированы электрическим гомогенизатором тканей в течение одной минуты. Затем образцы были центрифугированы при 1000g и 4,0oС. Верхний слой жидкости был подвергнут испытаниям. Смесь реагентов для ДГЛ была приготовлена путем смешивания следующих компонентов: 3,00 мл фосфатного буфера (0,1 моль/л; рН 7,0), 0,1 мл раствора натриевой соли пировиноградной кислоты (2,5 мг/мл) и 0,05 мл натриевой соли NADH (10 мг/мл). 100 мкл жидкости из верхнего слоя добавили к 900 мкл смеси реагентов и дали им возможность реагировать в течение двух минут. Через две минуты было зафиксировано изменение коэффициента поглощения. Среднюю величину из трех измерений на криоконсервированном образце ЭЖК сравнили с данными по незамороженным контрольным образцам. Значения по образцам были сравнены с соответствующими значениями для контрольных образцов и выражены в процентах от контроля (фиг. 4).
Пример 11. Биологическая эквивалентность криоконсервированных и некриоконсервированных ЭЖК.
Для того, чтобы продемонстрировать биологическую эквивалентность криоконсервированных и некриоконсервированных ЭЖК, были проведены опыты по пересадке их мышам, не имеющим вилочковой железы.
Элементы ЭЖК, криоконсервированные в соответствии со способом, описанным в примере 1, были подвергнуты оттаиванию за день до пересадки и хранились в питательной среде в течение двадцати четырех часов.
Было проведено четыре эксперимента, в которых 66 мышам линии B6CB6YF1/J-nu (Jackson Harbor Labs) были привиты как криоконсервированные ЭЖК (n= 43), так и некриоконсервированные (контрольные) ЭЖК (n= 23). Животные были анестезированы нембуталом. 2•2 см и полной толщины были иссечены из спин каждой мыши, сохраняя слой мышц. Трансплантаты ЭЖК, как контрольный, так и криоконсервированный, были помещены на рану и подогнаны по размеру. Все пересаженные участки были покрыты слоем пропитанной вазелином марли (Vendor) и двумя бандажами из пластыря (Vendor). Повязки были удалены на 7 день после пересадки.
На 14 день после пересадки все животные были усыплены и сфотографированы. Трансплантат затем был иссечен для гистологического анализа и оценки. Макро- и микрофотографии показывают отсутствие различий в приживлении контрольных образцов ЭЖК и образцов криоконсервированной ЭЖК после оттаивания. Не наблюдалось существенного различия и в скорости заживления раны между контрольным и криоконсервированным материалом для пересадки.
Пример 12. Изогенная пересадка криоконсервированной и контрольной кожи мышей.
Для демонстрации биологической эквивалентности криоконсервированной и некриоконсервированной кожи мышей было проведено исследование изогенной пересадки кожи.
Дикие мыши линии B6CB6YF1 были усыплены передозировкой нембутала. Кожа была снята в асептических условиях. Излишние кровеносные сосуды, жир и соединительная ткань были удалены с дермы в ходе подготовки к пересадке кожи. Кожа мышей была криоконсервирована и разморожена в соответствии со способом Примера 7. Контрольная, некриоконсервированная кожа мышей хранилась до пересадки в питательной среде при 4oС в продолжение процессов криоконсервации и оттаивания в целом около двух дней.
Шести мышам одной линии была произведена пересадка кожи: двум - контрольной, некриоконсервированной кожи мышей, а четырем - криоконсервированной кожи мышей после размораживания. Мыши были анестезированы нембуталом. Участок кожи размером 2•2 см и полной толщины был иссечен из спинки каждой мыши, сохраняя слой мышц. Трансплантаты кожи мышей, как контрольные, так и криоконсервированные, были помещены на раны и подогнаны по размерам. Все места пересадок были покрыты слоем пропитанной вазелином марли, а затем двумя липкими пластырями. Эти повязки были удалены на 7 день после пересадки.
На 13 день после пересадки все животные были усыплены и сфотографированы. Пересаженный участок был затем иссечен для гистологического анализа и оценки. Макро- и микрофотографии показали, что не было различия между приживлением контрольной кожи мышей и криоконсервированной кожи мышей после оттаивания. Не было обнаружено существенного различия в скоростях заживления ран для контрольного и криоконсервированного трансплантата.
Хотя предшествующее изобретение было подробно описано посредством иллюстраций и примеров с целью облегчения понимания, специалистам будет ясно, что могут быть внесены некоторые изменения и модификации в рамках прилагаемой формулы изобретения.
Реферат
Изобретение предназначено для использования при криоконсервации и хранении заготовленных тканей млекопитающих и живых культивированных эквивалентов тканей, сделанных по технологии in vitro, при криогенной температуре. Способ предусматривает погружение ткани млекопитающих или культивированного эквивалента ткани в раствор криоконсерванта, перемешивание раствора криоконсерванта и погруженной в него ткани для достижения эффективного проникновения раствора криопротектора в эту ткань. Затем осуществляют замораживание ткани при очень низкой скорости замораживания. В ходе операции замораживания образование льда во внеклеточном пространстве инициируется путем внесения зародышей льда. Криоконсервированная ткань может храниться до ее использования в течение неограниченного периода времени. Культивированный эквивалент ткани является in vitro моделью эквивалентной ткани человека, такой как кожа или роговая оболочка глаза, которая после возвращения из хранения может быть использована для трансплантации или имплантации in vivo или для сортировки соединений in vitro. Изобретение обеспечивает сохранение структурной целостности и жизнеспособности биологических материалов на неограниченный период времени. 2 с. и 8 з. п. ф-лы, 9 ил.

Комментарии