Раствор кровезаменителя на водной основе и способ его получения - RU2142282C1
Код документа: RU2142282C1
Чертежи





Описание
Данное изобретение относится к области водных растворов, таких как подобные плазме растворы, применимых для перфузии живого субъекта, нуждающегося в перфузии, и действующих в качестве эффективных кровезаменителей. Изобретение относится также к способам сохранения биологической целостности органов донорного организма млекопитающего (как показано превосходной анатомической целостностью криоконсервированных органов и тканей субъектов, перфузированных раствором этого изобретения) и к способам поддержания частично или по существу полностью обескровленного субъекта при температурах, значительно более низких, чем температуры, в норме поддерживаемые млекопитающим.
Предпосылки изобретения.
Известны два клинически применимых способа сохранения (консервирования) органов: (1) первоначальная перфузия в течение приблизительно 5 минут с последующим хранением на холоду (2oC), и (2) непрерывная перфузия растворами, содержащими альбумин или плазму.
Многие растворы, применяемые для первоначальной перфузии с последующим хранением на холоду, основаны на растворах Collins et al. (1969) Lancet 2: 1219 и Sacks et al. (1973) Lancet 1:1024. Ross et al., (1976) Transplantation 21: 498 сравнивали сохранение (консервирование) собачьих почек после промывания и хранения в течение 72 часов в различных растворах. Было обнаружено, что только почки, сохраняемые в гипертоническом растворе цитрата (HC) (содержащем 80 мМ К+, 55 мМ цитрата, 400 мОсмолей/кг, pH 7.1), выживали после 72 часов. Растворы Коллинза и Секса, в частности, содержали 115-126 мМ К+, 290-430 мОсмолей/кг, pH 7,0-7,3. Wall et al. (1977) Transplantation, 23: 210 сообщает о гипотермическом сохранении печени человека в течение приблизительно до 4 часов в растворе, в частности, содержащем 250 мг декстрозы и 15 мЭкв фосфата калия, Bishop & Ross (1978) Transplantation 25: 235 сообщили, что почечная функция сохранялась лучше всего в HC растворе Ross et al. (1976) Supra, по сравнению с другими доступными растворами. Fischer et al. (1985) Transplantation, 39: 122 нашли, что новый консервирующий раствор для гипотермического малокровного хранения (содержащий, в частности, 110 мМ Na+, 115 мМ К+, 400 мОсм/кг, растворитель D2O, 110 мМ HEPES) превосходит другие растворы в клиническом применении, в том числе растворы Коллинза, Секса и HC раствор.
Среди растворов, применяемых для непрерывной перфузии органов, Belzer et al. (1985) Transplantation 39: 118 сообщили о недавно разработанном растворе, который сохранял почечную функцию при перфузии почек в течение 48 часов и при хранении в течение 24 часов (содержащем, в частности, 80 мМ глюконат натрия, 22 мЭкв/л К+, 128 мЭкв/л Na+, 4,9 мМ аденозин, 10 мМ HEPES, 3,0 мМ глутатион, 3,75 г% альбумин, pH 7, 45). Kallerhoff et al. (1985) Transplantation 39: 485 исследовали влияние температуры на pH органов, непрерывно перфузируемых двумя различными растворами (buro-Collins; 10 мМ Na+, 115 мМ К+, 198 мМ глюкоза, 406 мОсм/л, pH 7,2 при 20oC; НТК; 15 мМ Na+, 10 мМ К+, 2,0 мМ триптофан, 180 мМ гистидин, 30 мМ маннит, 310 мМ мОсм/л, pH 7,3 при 8oC). При температурах инкубирования между 5 и 35oC НТК раствор поддерживал pH устойчиво при более высоких величинах, чем buro-Collins раствор. Klebanoff & Phillips (1969) Cryobiology 6: 121 описывают гипотермическую бескровную перфузию собак, перфузированных содержащим буфер раствором Рингера с лактатом при 7,1-16oC. Segall et al. (U.S. Patent N 4923422) описывают кровезаменитель, способный поддерживать субъекта и его органы при температурах ниже 20oC, с применением четырех различных растворов - основного раствора, индуцирующего кардиоплегию (остановку сердца) раствора, поддерживающего кардиоплегию раствора и возвращающего к норме раствора. Основной раствор содержит электролиты в физиологической концентрации, макромолекулярный онкотический агент, обычный биологический буфер, эффективный при физиологическом pH, сахар и К+ в пределах 4-5 мЭкв. Индуцирующий кардиоплегию раствор имел концентрацию К+ 25-45 мЭкв; поддерживающий кардиоплегию раствор имел концентрацию К+ 15-45 мЭкв; раствор для возвращения к норме имел концентрацию К+ 6-10 мЭкв. Segall et al. (U.S. Patent N 5130230) в дальнейшем описал включающую 4 раствора систему, в которой раствор для возвращения к норме содержит 0-10 мЭкв К+.
Краткое изложение существа изобретения.
Данное изобретение описывает способы применения одного раствора, пригодного для поддержания частично или по существу полностью обескровленного субъекта живым при нормальных температурах или при температурах, существенно более низких, чем температуры, поддерживаемые в норме млекопитающим, обычно ниже 37-38oC и более чем -2oC, причем этот раствор содержит суб- и/или физиологические уровни К+ и Mg++, физиологические уровни Na+, Ca++, Cl-, макромолекулярный онкотический агент, органическую карбоновую кислоту, или ее соль, и сахар.
Раствор этого изобретения можно использовать в качестве плазмозаменителя при нормальной температуре тела. Раствор этого изобретения применим также для поддержания жизни или биологической целостности перфузируемого субъекта и/или его органов во время экспозиции при глубоких гипотермических условиях или после нее. Этот раствор можно использовать также для поддержания субъекта с нормальной температурой в герметизированной среде с повышенной концентрацией кислорода до 100% O2 в течение периодов времени, достаточных для адекватного восстановления компонентов крови этого субъекта.
Раствор данного изобретения можно использовать для перфузии и охлаждения млекопитающего субъекта до температур, глубоко гипотермических по отношению к нормальной температуре этого субъекта. Раствор можно использовать для поддержания субъекта в глубокой гипотермии в течение длительных периодов времени, обычно превышающих час, после чего неповрежденный субъект может возвращаться к норме без видимых долговременных побочных действий.
Важной особенностью раствора данного изобретения является то, что он не требует применения множества растворов для того, чтобы быть эффективно введенным субъекту для замены крови или для поддержания субъекта при низкой температуре.
Раствор этого изобретения можно использовать во всех фазах замены плазмы или замены крови.
Другой важной особенностью раствора данного изобретения является субфизиологическое количество К+ на всех стадиях введения. Это требование снижает опасность индуцируемой гиперкалиемией сердечной недостаточности, возникающей при переливании крови у приматов и человека.
Другой важной отличительной чертой раствора данного изобретения является отсутствие общепринятого биологического буфера. Отсутствие общепринятого буфера в этом растворе дает важное медицинское преимущество, позволяя стерилизовать раствор нагреванием без разрушения компонентов раствора.
Раствор данного изобретения требует присутствия органической карбоновой кислоты, соли или эфиров с короткой цепью этой кислоты. Органическая карбоновая кислота, ее соль или эфир является компонентом динамической буферной системы этого раствора, способной поддерживать биологически приемлемый диапазон pH при применении млекопитающим.
Раствор данного изобретения требует присутствия макромолекулярного онкотического агента, достаточного для поддержания физиологического осмотического давления. Макромолекулярный онкотический агент, применимый в растворе данного изобретения, может представлять собой белок (белки) или крахмал (крахмалы).
Преимуществом этого раствора является то, что его можно использовать в субъекте-млекопитающем во время всех фаз замещения крови от исходного вымывания крови субъекта до полной замены всей или почти всей циркулирующей крови.
Отличительным признаком этого изобретения является то, что его можно применять для поддержания млекопитающего без крови, а также во время перфузии с кровью.
Подробное описание предпочтительных вариантов.
Следует отметить, что в применении здесь и в прилагаемой формуле изобретения формы единственного числа включают также и множественное число, если контекст не дает четко других указаний. Так, например, ссылка на "препарат" включает в себя смеси различных препаратов, а ссылка на "способ лечения" является также ссылкой на равноценные стадии и способы, известные специалистам в этой области, и т.д.
Если нет других указаний, все технические и научные термины, примененные здесь, имеют значение, обычно понимаемое при использовании этих терминов специалистами в области, к которой относится это изобретение. Хотя любые способы и материалы, сходные с описываемыми здесь или равноценные им, могут быть использованы в практике или испытании этого изобретения, сейчас будут описаны предпочтительные способы и материалы. Все публикации, упомянутые здесь, включены здесь ссылками для описания и раскрытия той информации, в связи с которой цитируются ссылки.
Эритроциты приматов содержат высокие концентрации иона калия (К+). При хранении крови приматов (как это имеет место с фактически всей кровью, получаемой из банков крови) даже низкие уровни лизиса эритроцитов, как правило, приводят к высоким концентрациям иона калия. Это обусловлено высвобождением иона калия из лизированных эритроцитов приматов в плазму, окружающую эти клетки. Поэтому при инфузии кровь будет гиперкалиеимической. Этот повышенный уровень калия может рассеиваться путем диффузии, если кровь вливают в больных с достаточным количеством циркулирующей крови, поскольку происходит разбавление высокой концентрации иона калия. Однако эта проблема увеличивается, если кровь приматов вливают в поддерживающий раствор такого типа, который описан в U.S. Patent 4924442, который содержит высокие концентрации калия. Концентрация иона калия во вливаемой крови не будет разбавляться до безопасных уровней. В результате может возникать и действительно часто возникает сердечная недостаточность. Гиперкалиемия также возникает при повреждении тканей при ожогах, несчастных случаях, хирургии, химиотерапии и других физических травмах. Из предшествующего уровня известно, что сохранение органов при низких температурах требует присутствия высоких концентраций иона калия для сохранения целостности ткани.
Раствор в соответствии с данным изобретением содержит субфизиологическое количество калия (т.е. ниже его физиологического содержания). Поэтому этот раствор делает возможным разбавление концентрации ионов калия в хранящейся для переливания крови. В результате можно более легко контролировать высокие концентрации иона калия и потенциальную сердечную недостаточность и аритмии сердца. Раствор, содержащий субфизиологическое количество калия, может быть также применим для целей замены крови и низкотемпературного поддержания субъекта. Под "субфизиологическим количеством калия" понимают 0-5 мЭкв/л K+ (0-5 мМ), предпочтительно 2-3 мЭкв/л К+ (2- 3 мМ).
Раствор данного изобретения содержит смесь веществ, которые при помещении в водный раствор могут быть использованы для перфузии субъекта, нуждающегося в ней. Хотя эти вещества могут быть обеспечены в виде сухой смеси, к которой воду добавляют перед горячей стерилизацией, предпочтительно раствор готовится в виде стерильного водного раствора.
Раствор данного изобретения можно применять в виде единственного раствора для всех фаз процедур удаления крови и ее замены или при охлаждении субъекта. Такие фазы включают гемодилюцию или замену плазмы при нормальных температурах, замещение крови и обмен при гипотермических температурах тела, замещение крови при фактически гипотермических температурах тела и согревание субъекта. "Гипотермическими температурами тела" называют температуры на 4-5oC ниже нормы 37- 38oC. Другими словами, гипотермические условия начинаются при температурах тела приблизительно 32-35oC. "Фактически гипотермическими температурами тела" считают температуры тела немного ниже точки замерзания (-2oC), приблизительно 10oC. Таким образом, термин "гипотермическая температура тела" или "гипотермия" в применении здесь охватывает температуры тела от приблизительно -2-3oC до приблизительно 32-35oC.
Раствор данного изобретения не содержит общепринятый биологический буфер. Под "общепринятым буфером" подразумевают соединение, которое в растворе in vitro поддерживает pH в определенном диапазоне. "Общепринятым биологическим буфером" считают соединение, которое в бесклеточной системе поддерживает pH в биологическом диапазоне 7-8. Примеры общепринятых биологических буферов включают N-2- гидроксиэтилпиперазин-N'-2-гидроксипропансульфоновую кислоту (HEPES), 3-(N-морфолино)-пропансульфоновую кислоту (MOPS), 2- ([2-гидpoкcи-1,1-биc-(гидроксиметил)этил] амино)этансульфоновую кислоту (TES), 3-[N- тpиc(гидpoкcимeтил)мeтилaминo]-2-гидроксиэтил]-1- пиперазинпропансульфоновую кислоту (EPPS), трис[гидpoмeтил] - аминометан (THAM) и трис[гидроксиметил] метиламинометан (TRIS). Общепринятые биологические буферы действуют независимо от нормальных биологических процессов, например общепринятый буфер не метаболизируется in vivo, и наиболее сильны в бесклеточных системах.
Раствор данного изобретения использует обычные биологические компоненты для поддержания in vivo биологических pH, т.е. соответствующие понятию, названному "динамической буферной системой". Понятие "динамическая буферная система" основывается на открытии авторов этого изобретения, что соединения, не имеющие внутренней буферной способности в биологическом диапазоне, такие как лактат, способные метаболизироваться in vivo, действуют с другими компонентами раствора таким образом, что они поддерживают биологически приемлемый pH в животном даже при гипертермических температурах и при по существу бескровных условиях. Динамическая буферная система данного изобретения зависит, в частности, от оксигенации и удаления диоксида углерода (CO2) и допускает (но не требует) присутствие дополнительно бикарбоната (NaHCO3). Динамический буфер этого изобретения не способен или практически не способен действовать в качестве буфера вне биологической системы, т.е. динамический буфер поддерживает pH в биологическом диапазоне in vivo но не в бесклеточной среде. Компонент динамической буферной системы этого изобретения включает карбоновую кислоту, ее соль или эфир. Под карбоновой кислотой, ее солью или эфиром понимают соединение, имеющее общую формулу RCOOX, где R, обозначает алкил, алкенил или арил, с разветвленной или прямой цепью, содержащие 1-30 атомов углерода, которые могут быть замещенными, и предпочтительно одну из углеродных цепей, являющихся углеродными цепями лактата, ацетата, цитрата, пирувата или других биологических метаболитов; и X обозначает водород или натрий или иной биологически совместимый ионный заместитель, который может быть присоединен при положении кислорода, или прямой или разветвленный алкил с короткой цепью, содержащий 1-4 атомов углерода, например -CH3, -CH2CH3.
Типичный общепринятый буферный раствор (25 мМ TRIS), имеющий исходный pH приблизительно 7,7, поддерживает pH выше 7,2 при добавлении вплоть до 0,12 мл 1,25 М раствора HCl. В противоположность этому, pH раствора HLB. (исходный pH 7,7) падает ниже 7,2 при добавлении приблизительно 0,01 мл 1,25 М раствора HCl.
При применении раствора данного изобретения в качестве кровезаменителя при гипотермических температурах к стерилизованному нагреванием раствору (HL раствору) добавляют стерильный NaHCO3 медицинской чистоты. Раствор, содержащий NaHCO3, называют HLB раствором.
При in vivo условиях с оксигенацией показано, что HLB раствор поддерживает pH выше 7,3 в пределах температур 1,6 - 36,1oC (таблицы 1 и 2).
При использовании раствора этого изобретения в качестве плазмозаменителя при нормальных температурах тела in vivo, pH поддерживается в биологическом диапазоне без добавления NaCHO3.
Отсутствие общепринятого (стандартного) биологического буфера в растворе этого изобретения является важным медицинским преимуществом, поскольку это позволяет окончательно стерилизовать этот раствор нагреванием. Как правило, предпочтительно окончательно стерилизовать медицинские растворы нагреванием перед их применением в больном. Термин "окончательно стерилизованный нагреванием" или "стерилизованный нагреванием" в применении здесь относится к процессу, предусматривающему нагревание раствора до 120oC в течение 15 минут под давлением, т. е. при поддержании нагрева и давления в течение периода времени, достаточного для убивания всех или практически всех бактерий и для инактивации всех или практически всех вирусов в растворе. Эту процедуру обычно проводят в автоклаве, и она также известна как "автоклавирование". Целью стерилизации нагреванием является убивание возможных инфекционных агентов, присутствующих в растворе. Известно, что инфекционные агенты выдерживают температуру вплоть до 100oC. Как правило, в данной области считают, что нагревание раствора под давлением до 120oC в течение примерно 15 минут достаточно для обеспечения стерильности.
Все растворы для трансплантатов или растворы кровезаменителей, известные авторам этого изобретения, не могут выдерживать окончательную (терминальную) стерилизацию нагреванием. Известно, что стерилизация нагреванием раствора, имеющего pH более 7,0, приводит к существенной деградации других компонентов раствора.
В противоположность этому, раствор данного изобретения предназначен для того, чтобы его можно было стерилизовать нагреванием с минимальной деградацией других компонентов раствора, таких как сахар. Раствор HL стерилизуют нагреванием перед использованием. Если желательно добавление NaHCO3 для образования HLB раствора, то NaHCO3 добавляют в виде коммерчески доступного стерильного 1 М раствора к стерильному HL, раствору. Обычно добавляют 5 мл 1 М раствора NaHCO3 на литр HL раствора, получая 1 л HLB раствора. Однако можно добавить больше NaHCO3.
HLB раствор данного изобретения или его буферные органические кислоты и соли можно также применять для поддержания культивируемых тканей и клеток in vitro. Динамическая буферная система этого раствора поддерживает культивируемые ткани и клетки при подходящем биологическом pH. Мы показали, что добавление лактата и бикарбоната к культивируемым клеткам является достаточным для поддержания нормальных роста и морфологии клеток.
Раствор данного изобретения содержит органическую карбоновую кислоту или ее соль. Термин "органическая карбоновая кислота или ее соль" включает любую карбоновую кислоту или производное карбоновой кислоты, способные метаболизироваться млекопитающим. Примеры карбоновых кислот и солей карбоновых кислот, пригодных для использования в этом растворе данного изобретения, включают лактат и лактат натрия, пируват и пируват натрия, сукцинат и сукцинат натрия, цитрат и цитрат натрия, глюконат и глюконат натрия, ацетат и ацетат натрия (лактат, пируват, сукцинат, цитрат, глюконат и ацетат употреблены в значении кислот: молочной, пировиноградной, янтарной, лимонной, глюконовой и уксусной, соответственно). В следующих далее примерах, описывающих применение HLB раствора, использовали лактат натрия. При метаболизации in vivo лактат помогает поддерживать уровни бикарбоната и, следовательно, действует как компонент динамической буферной системы раствора, поддерживая in vivo биологический pH.
Для целей дальнейшего описания изобретения смесь данного изобретения будет обсуждаться как водный раствор. Из дальнейшего описания изобретения ожидается, что средний специалист в этой области будет способен обеспечить эту смесь в виде сухой смеси и приспособить количества хлорида натрия и органической соли натрия таким образом, чтобы согласовать их с количеством хлорида натрия в нормальном солевом растворе, который может быть использован в качестве разбавителя для сухой смеси согласно этому изобретению.
Количество органических солей натрия рассчитывают таким образом, чтобы учесть концентрацию ионов натрия, присутствующих в крови субъекта, а также концентрацию хлорида натрия того или иного раствора, к которому добавляют сухие компоненты. Количество добавляют таким образом, что концентрация иона натрия, получаемая от добавления органической соли натрия, является достаточной для доведения концентрации иона натрия в растворе до концентрации иона натрия физиологически нормальной плазмы. Таким образом, с учетом количества или концентрации иона натрия, полученного из органической соли натрия и хлорида натрия, концентрация иона натрия в растворе равна приблизительно концентрации иона натрия, обнаруживаемой в физиологически нормальной плазме.
Раствор также включает концентрацию ионов кальция, натрия и магния, которая находится в пределах нормальных физиологических концентраций этих ионов в плазме. Обычно желаемую концентрацию этих ионов получают из растворенных солей, а именно, хлоридов кальция, натрия и магния и, в случае натрия, из растворенной органической соли натрия, которая также присутствует в растворе.
Концентрация иона натрия находится предпочтительно в пределах от 70 мМ до приблизительно 160 мМ и более предпочтительно в пределах от приблизительно 130 до 150 мМ.
Концентрация иона кальция находится в пределах от приблизительно 0,5 мМ до 4,0 мМ, и предпочтительно в пределах от приблизительно 2,0 мМ до 2,5 мМ.
Концентрация ионов магния находится в пределах от 0 до 10 мМ, и предпочтительно в пределах от приблизительно 0,3 мМ до 0,45 мМ. Важно не включать избыточные количества иона магния в раствор данного изобретения, т.к. высокие концентрации иона магния отрицательно влияют на сократительную активность сердца. В предпочтительном варианте изобретения раствор содержит субфизиологические количества Mg++ .
Концентрация ионов хлорида находится в пределах от 70 мМ до 160 мМ, предпочтительно в пределах 110-125 мM Mg Cl-.
Раствор также содержит некоторое количество простого гексозного сахара, такого как глюкоза, фруктоза и галактоза, из которых предпочтительна глюкоза. В предпочтительном варианте изобретения используют пищевые гексозные сахара и можно использовать смесь сахаров. Обычно концентрация сахара находится в пределах между 2 мМ и 10 мМ и предпочтительна глюкоза с концентрацией 5 мМ. Иногда желательно увеличить концентрацию гексозы для уменьшения удерживания жидкости в тканях субъекта. Поэтому диапазон концентраций гексозного сахара может быть расширен до приблизительно 50 мМ, если необходимо, для предотвращения или ограничения отека подвергаемого лечению субъекта.
Онкотический агент включает молекулы, размер которых достаточен для предотвращения их потери из кровотока путем прохождения через фенестрации капиллярного русла в интестициальные пространства тканей тела. В качестве группы, примерами онкотических агентов являются заменители плазмы крови.
Человеческий сывороточный альбумин является белком плазмы крови, применяемым для увеличения объема плазмы. Также известны полисахариды, обычно характеризуемые как полимеры глюкана, которые используют в качестве плазмозаменителей. Обычно предпочтительно, чтобы полисахарид не был антигенным.
Гетакрахмал (Mc Gaw, Inc.) представляет собой искусственный коллоид, полученный из похожего на воск крахмала, состоящего почти, целиком из амилпектина с гидроксиэтиловыми эфирными группами, введенными в альфа (1---4) соединенные глюкозные единицы. Коллоидные свойства 6% раствора (мас./мас.) гетакрахмала приближаются к коллоидным свойствам человеческого сывороточного альбумина. Другие производные полисахаридов могут быть пригодны в качестве онкотических агентов согласно этому изобретению, в том числе гидроксиметил альфа (1---4) или (1---6)-полимеры. Циклодекстрины являются пригодными онкотическими агентами.
Можно использовать полимеры D-глюкозы. Например декстран, который является D-глюкозой, соединенной преимущественно в альфа (1----6)-связи, может быть использован в качестве онкотического агента в растворе этого изобретения. Предпочтительны полисахариды, такие как декстран, в диапазоне мол. мас. 30000-50000 дальтон. Наиболее предпочтителен декстран 40, имеющий мол. массу приблизительно 40000 дальтон.
Высокомолекулярные полисахариды, такие как декстран 70, имеющий мол. массу приблизительно 70000 дальтон, обычно менее предпочтительны, т.к. они увеличивают вязкость коллоидного раствора, ослабляя высокие скорости течения. Однако для некоторых применений предпочтительны растворы высокомолекулярного декстрана, поскольку они более эффективны в предотвращении набухания тканей, благодаря более низким скоростям их вытекания из капилляров. Поэтому такие растворы высокомолекулярного декстрана особенно применимы в лечении церебральной ишемии при повышенных давлениях кислорода и в эффективном устранении отека мозга. В таких обстоятельствах может быть желательным использование высокомолекулярных полисахаридов, таких как декстран, в диапазоне мол.мас. 50000-70000 дальтон.
При использовании декстрана 40 в растворах данного изобретения применяют приблизительно 8% декстран 40 (мас./мас.) или примерно 80 г/л волы. Молярность кровезаменителя в соответствии с данным изобретением будет в диапазоне приблизительно 290-330 мМ, предпочтительно 300 мМ. Наиболее предпочтительна конечная молярность приблизительно 298 мМ.
Концентрация полисахарида достаточна для достижения (вместе с хлоридами натрия, кальция и магния и органическим ионом из органической соли натрия и гексозным сахаром, обсуждаемыми выше) коллоидного осмотического давления, приближающегося к осмотическому давлению сыворотки человека, приблизительно 28 мм Hg.
Этот раствор может быть применен в качестве циркулирующего раствора в соединении с кислородом или гипербарическим кислородом при нормальной температуре тела или с гипербарическим кислородом или без него в субъектах во время процедур. Раствор также может быть применен в качестве циркулирующего раствора в субъектах во время процедур, когда температура тела субъекта снижена значительно ниже нормальной температуры субъекта. При выдерживании теплокровных субъектов в условиях низких температур во время хирургических процедур при получении донорного органа трупа при низкой температуре обычно желательно вытеснение крови субъекта холодным циркулирующим раствором этого изобретения или раствором, циркулирующим в течение времени, предназначенного для перфузии и поддержания субъекта и его органов интактными во время этой процедуры.
Раствор данного изобретения можно вводить внутривенно или внутриартериально эутермическому субъекту (с нормальной температурой), помещенному в атмосферу с увеличенной концентрацией кислорода вплоть до 100% кислорода, или субъекту, подвергающемуся процедуре, во время которой температуру тела субъекта снижают значительно ниже нормальной температуры тела субъекта, с применением гипербарического кислорода или без него. Во время введения раствора субъекту и во время циркуляции раствора через тело субъекта различные агенты, такие как кардиоплегические агенты, могут вводиться непосредственно в систему циркуляции субъекта, в миокард субъекта или добавляться к циркулирующему раствору данного изобретения. Эти компоненты добавляют для достижения желаемых физиологических эффектов, таких как поддержание нормальной сократительной активности сердца, остановка фибрилляции сердца или полное ингибирование сократительной активности миокарда, или мышцы сердца.
Кардиоплегические агенты являются веществами, вызывающими прекращение сокращения сердечной мышцы, и включают анестетики, такие как лидокаин, прокаин и новокаин, и одновалентные катионы, такие как ион калия, в концентрациях, достаточных для достижения ингибирования сокращений миокарда. Концентрации иона калия, достаточные для достижения этого эффекта, обычно более 15 мМ.
Во время реанимации субъекта (после периода субнормальной температуры или криогенного выдерживания с применением раствора данного изобретения для поддержания субъекта) субъект может быть повторно инфузирован смесью раствора этого изобретения вместе с кровью, сохраненной при вытеснении из субъекта, или полученной от донора. После согревания субъекта ему вливают цельную кровь до тех пор, пока не достигается приемлемое гематокритное число, обычно более приблизительно 30%. По достижении приемлемого гематокритного числа перфузию прерывают и субъекта реанимируют после закрытия хирургических ран при помощи общепринятых процедур.
Обычно раствор данного изобретения вводят с применением системы для внутривенного вливания (когда субъект находится при нормальной температуре) или раствор вводят охлажденному субъекту с применением установки для создаваемой насосом циркуляции, такой как центробежный насос, ротационный насос, перистальтический насос или иной известный и доступный циркуляционный насос. Циркуляционное устройство соединяют с субъектом через канюлю, вставленную хирургически в подходящие для этого вены и артерии. При введении раствора охлажденному субъекту его обычно вводят через артериальную канюлю и удаляют из субъекта через венозную канюлю, после чего выбрасывают или хранят.
Раствор можно использовать во многих хирургических установках и процедурах. Его можно применять в тонкой нейрохирургии, когда необходимым требованием является чистое операционное поле и может быть желательна пониженная активность центральной нервной системы, что достигается проведением процедуры на больном, внутренняя температура которого и/или температура мозга была существенно понижена.
Раствор может быть использован для поддержания субъекта (который потерял значительную часть крови, например 20%-98% его крови) при нормальных температурах тела в герметизированной среде под давлением при повышенной концентрации кислорода выше атмосферного давления кислорода, вплоть до 100% кислорода. Субъект выдерживают при высокой концентрации кислорода до тех пор, пока субъект не сможет синтезировать достаточно компонентов крови для поддержания жизни при атмосферном давлении и при атмосферной концентрации кислорода. Раствор данного изобретения можно применять для поддержания субъекта при температурах, более низких, чем нормальная температура тела, и при сниженной скорости метаболизма после травматического опасного для жизни повреждения до тех пор, пока не будут проведены соответствующие или корректирующие хирургические процедуры. Кроме того, раствор можно применять для поддержания больного с редкой группой крови или редким типом ткани до тех пор, пока не будет найден подходящий донор или пока не будут получены необходимые кровезаменители или другой орган.
Неожиданно было обнаружено, что можно вытеснять практически всю циркулирующую кровь субъекта-млекопитающего раствором данного изобретения и поддерживать субъекта живым без переливания крови в него. Считается, что практически вся циркулирующая кровь субъекта-млекопитающего вытеснена, когда гематокритное число субъекта падает ниже 10%. Гематокритное число может быть ниже 10%, если субъекту дают кислород, и значительно ниже 10% в гипербарической O2-камере. Раствор этого изобретения можно, конечно, применять для поддержания субъекта, имеющего гематокритное число, превышающее 10%.
Процедуру вытеснения практически всей циркулирующей крови субъекта-млекопитающего можно проводить с сохранением температуры тела субъекта на уровне его нормальной температуры. Кроме того, эту процедуру можно проводить с охлаждением субъекта и снижением температуры тела субъекта ниже его нормальной температуры. Охлаждение можно проводить при помощи ледяной бани, смеси льда с солью или с применением одеяла для охлаждения (гипотермии). Далее субъект может быть охлажден путем охлаждения раствора данного изобретения для перфузирования субъекта этим раствором.
В процедуре данного изобретения для замещения практически всей циркулирующей крови субъекта- млекопитающего предпочтительно, чтобы субъект был охлажден и перфузирован раствором с применением артериального катетера для доставки раствора в систему циркуляции и венозного катетера для удаления крови и перфузата из субъекта. Фактически вся циркулирующая кровь субъекта удаляется этим способом, как определено измерением гематокритного числа эффлюента (вытекающей жидкости) из венозного катетера. После удаления фактически всей циркулирующей крови субъекта перфузию останавливают.
Кроме того, процедуру замены фактически всей крови субъекта можно выполнять при помощи гипербарического O2. Субъекта помещают в гипербарическую камеру с повышенным давлением, создаваемым кислородом при концентрациях, превышающих 20%, предпочтительно при 100% кислорода. Давление этой камеры поддерживают во время большей части процедуры в диапазоне между 0,5 фунтов на дюйм квадратный (35,5 г/см2) выше атмосферного давления и давлениями, превышающими атмосферное давление, до приблизительно превышения в 2 раза. В одном варианте процедуру проводят с субъектом в гипербарической камере при давлениях приблизительно на 0,07 - приблизительно на 2 атм выше давления окружающей среды (0,5-30 фунтов/дюйм2 = 35,5-2109 г/см2) с 100% кислорода. Если необходимо, давление в камере может быть снижено до атмосферного давления во время закрытия ран. Затем субъекта выдерживают при сверхатмосферном давлении при высокой концентрации кислорода. Давление постепенно понижают до более низкого давления, но все еще гипербарического (выше атмосферного). Предпочтительно давление сохраняют ниже 10 ps: до примерно 5 ps: (703 г/см2 -351,5 г/см2) в течение периода от нескольких часов до нескольких дней. Затем давление опять постепенно понижают ниже 1 ps: (70,3 г/см2) и предпочтительно до приблизительно 0,5 ps: (35,5 г/см2) и поддерживают это давление в течение дополнительного периода времени до 1 дня или более.
Раствор можно применять также для поддержания физиологической целостности субъекта, являющегося донором органа, сразу же после смерти мозга. Субъекта можно охладить, кровь из него удаляют и заменяют циркулирующим раствором, поддерживаемым ниже 37oC, или циркулирующим холодным раствором согласно этому изобретению. Такое применение этого раствора сводит к минимуму малокровие жизненно важных органов. При помощи циркуляции холодного раствора данного изобретения через циркуляторную систему субъекта при низкой температуре с помещением субъекта в гипербарическую камеру с кислородом или без него жизненно важные органы могут сохраняться в течение более продолжительных периодов времени, максимально увеличивая число органов, которые могут быть эффективно использованы, из одного донора для потенциальных реципиентов трансплантатов.
В другом аспекте этого изобретения было обнаружено, что посредством применения определенных аддуктов, в частности пропандиола и высокой концентрации глюкозы, для добавления к раствору можно уменьшить температуру органов донора, и в частности сердец доноров, ниже точки замерзания воды (0oC) и восстановить их из замороженного состояния в приходное для использования состояние, т.е. в состояние, способное поддерживать координированное сокращение сердца. Более того, путем применения раствора данного изобретения с такими добавками можно понизить температуру интактных доноров млекопитающих ниже точки замерзания воды (0oC) и восстановить их из замерзания в состояние, способное поддерживать координированное сокращение сердца. Авторы уверены, что другие системы органов также сохраняются с высокой степенью биологической целостности, т.е. в физиологическом состоянии, способном поддерживать жизнь.
Добавки к раствору включают низкомолекулярные алифатические полиспирты. Предпочтительны диолы, такие как этилендиол, пропандиол и бутандиол. Из этих диолов особенно предпочтителен пропандиол. Другими полиспиртами, которые могут быть пригодны в качестве добавок для низкотемпературного (ниже 0oC) сохранения органов и субъектов, являющихся донорами органов, являются низкомолекулярные полиэтиленгликоли. Предпочтительно, в этом аспекте изобретения, чтобы добавка добавлялась к раствору до конечной концентрации в пределах приблизительно 0,2 М - 1 М. Для пропандиола, в частности, предпочтителен диапазон концентраций 0,2 М - 0,6 М. Наиболее предпочтительна концентрация пропандиола 0,4 М. 1,2-пропандиол предпочтителен в качестве аддукта (добавки) к раствору, применяемому для низкотемпературного сохранения органов и доноров в соответствии с этим изобретением, хотя можно применять и 1,3-пропандиол.
Концентрация глюкозы в растворе, применимом для сохранения органов и доноров органов (ниже 0oC), находится между приблизительно 0,6 М и приблизительно 1,4 М. Предпочтительна концентрация приблизительно 1 М глюкозы.
Другой добавкой, применимой в растворе для низкотемпературного и < 0oC-сохранения органов и тканей органов доноров, является оксид триметиламина (ТМАО). ТМАО может быть добавлен к описанному раствору до конечной концентрации между 0,2 М и 7 М. Раствор, включающий в себя ТМАО, при перфузии в субъекта приводит к улучшенной биологической целостности тканей субъекта, как показано лучшим анатомическим сохранением тканей.
Следующие далее примеры предназначены для иллюстрации этого изобретения и его применения, но не для ограничения авторами изобретения данного изобретения.
Примеры.
Следующий пример представлен, чтобы дать специалистам обычной квалификации в этой области полное описание и раскрытие проведения приготовления растворов, применяемых в дальнейших примерах, и не ограничивает сферу данного изобретения. Были предприняты усилия для обеспечения точности использования чисел (например, количеств, температуры и т.д.), но следует считаться с возможностью некоторых ошибок и отклонений. Если нет других указаний, части являются весовыми частями, мол.масса представляет собой среднемассовую мол. массу, температура дана в градусах по стоградусной шкале (шкале Цельсия) и давление является атмосферным или близким к атмосферному.
Пример 1. Приготовление растворов
Приготовление 10 л раствора A. В подходящий контейнер добавляют 80 г/л (или 800 г для 10 л)
апирогенного декстрана 40 (Pharmachem или Pharmacia). При помощи деионизированной воды доводят объем до 6-9 литров. Декстран 40 растворяют полностью встряхиванием. Следующие компоненты можно добавлять
в любом порядке с полным растворением каждого компонента перед добавлением следующего. Следующие реагенты можно получить из фирм, поставляющих химикалии; в этом примере перечисленные реагенты были
получены из Sigma:NaCl (5,2 г/л), CaCl2 (0,29 г/л), MgCl2 (0,40 г/л), глюкоза (0,9 г/л), Трис (3,03 г/л), глюконат натрия (6,54 г/л).
Затем раствор доводят до pH 7,80 при комнатной температуре добавлением по каплям 0,25 М HCl при встряхивании и наблюдении pH при помощи pH-метра. Затем раствор доводят до конечного желаемого объема (т.е. 10 л) добавлением дополнительного количества деионизированной воды.
Наконец, раствор фильтруют с применением насоса через фильтр 0,2 мкм (Gelman, Whatman или лучше всего Pall filter units могут быть использованы) в стерильные контейнеры или мешочки. Разлитый в склянки и закрытый крышками раствор хранят на льду до применения.
Раствор может быть затем приготовлен в виде стерильного сухого порошка в контейнерах, пригодных для приготовления стерильных IV раствором (растворов для внутривенного вливания), после лиофилизации при соответствующих условиях.
Приготовление раствора HL. Для приготовления 50 л раствора L (BioTime HextendTM-лактата) 3,0 кг высокомолекулярного гетакрахмала (HES) добавляют к 25 л воды. NaCl добавляют в количестве, достаточном для получения конечной концентрации NaCl 6,72 г/л. Раствор перемешивают до полного растворения HES и NaCl. Если требуется, раствор можно нагреть до 50oC. Общий объем раствора доводят до 45 л и следующие компоненты добавляют и смешивают до полного растворения: CaCl2•2H2O 18,5 г; MgCl2•6H2O 4,5 г; KCl 11,0 г; глюкозу 45,0 г; лактат натрия 4,03 мл 60% (вес/вес) раствора. Раствор доводят до объема 50 л. Раствор фильтруют для удаления нерастворившегося материала и помещают в автоклавируемые контейнеры и нагревают в автоклаве до температуры 120oC в течение 15 минут.
Раствор HLB. К каждому стерилизованному нагреванием литру HL раствора добавляют 5 мл стерильного 1 М раствора NaHCO3, медицинской чистоты, получая раствор HLB (BioTime HextendTM- лактат-бикарбонат).
Раствор L. Раствор L готовят, как описано для HL раствора выше, но без добавления гетакрахмала (HES).
Пример 2. Хомячок, реанимированный после 1 часа кровезамещения при охлаждении льдом
Самку золотистого (сирийского) хомячка (Mesocricetus auratus) весом 41
г в возрасте 1 месяц инъецировали i.m. (внутримышечно) 0,04 мл Velatar, раствора 100 мг/мл анестезирующего кетамина. Животное упаковывали в раздробленный лед и охлаждали до тех пор, пока его
ректальная температура не достигала 10oC. Животное вынимали из раздробленного льда и помещали брюшком вверх на столик обычной конструкции, расположенный таким образом, чтобы можно было
определенные части животного наблюдать через стереоскопический микроскоп во время хирургии. Его конечности закрепляли и животное снабжали отведениями для электрокардиограммы и зондом ректального
телетермометра.
Разрез делали в правой паховой области и правую бедренную вену, а затем правую бедренную артерию канюлировали с применением специально сконструированных микроканюль, заполненных раствором A. После канюлирования 0,02 мл гепарина (1000 Е/мл) в растворе A инъецировали в животное через венозную канюлю, которую затем закрыли.
После канюлирования бедренной артерии эту канюлю соединяли со снабженным люэровским наконечником сегментом стерильной пластиковой трубки, которая была соединена с запорным краном, закрепленным на хирургическом столике. Запорный кран соединяли с другим сегментом трубки, которую в свою очередь соединяли с более широким, более толстым и более гибким сегментом трубки, проходящим через головку ротационного (роллерного) насоса. Конец этого более широкого сегмента трубопровода содержал трубку для высасывания жидкости из резервуара. Эта трубка для отсасывания жидкости из резервуара, называемая здесь "pick-up", была сделана из люэровского наконечника иглы для подкожных инъекций калибра 18. Этот "pick-up "(трубка для отсасывания жидкости) был покрыт фильтрующим кровь материалом, закрепленным небольшим резиновым "O"-кольцом. "Pick-up" вставляли в резервуар с раствором А, содержащимся в центрифужной пробирке, погруженной в раздробленный лед; 0,06 мл 1 М KCl добавляли к раствору (15 мл), получая молярную концентрацию KCl приблизительно 4 мМ. Систему закрывали при помощи запорного крана для предотвращения обратного кровотечения в артериальную канюлю.
Хомячка окружали раздробленным льдом и охлаждали до 4oC. Затем 0,2 мл 1 М KCl вводили в запорный кран, который открывали, чтобы позволить введенному раствору течь в систему, соединяющую с артериальной канюлей, и из нее в бедренную артерию животного. Сердце хомячка останавливалось. Животное охлаждали далее и перфузировали через артериальную канюлю 8 мл раствора A с 4 мМ KCl. Вытекающую жидкость, содержащую большую часть крови хомячка, собирали из венозной канюли. После снижения гематокритного числа ниже 5, роллерный насос выключали на 67 минут.
Затем хомячка перфузировали через артериальную канюлю 8 мл раствора A без KCl, а затем 8 мл гепаринизированной крови, взятой из других хомячков пункцией сердца. Равное количество вытекающей жидкости собирали из венозной канюли. После достижения гематокритного числа 40% перфузию цельной кровью заканчивали и канюли удаляли.
Хомячка согревали настольной лампой, пока он не начинал реагировать на раздражители. Канюли удаляли, открытые кровеносные сосуды лигировали и разрезы закрывали. Согревание продолжали далее. Животное полностью возвращалось к норме и продолжало жить в течение недель после эксперимента.
Пример 3. Сохранение сердца после хранения ниже 0oC
Подвергнутую голоданию (в течение ночи) самку хомячка весом 40 г инъецировали внутримышечно 0,02 мл анестетического кетамина
(100 мг/мл). Хомячка погружали в раздробленный лед и держали в нем, пока температура его тела не понижалась до +14oC. Затем его помещали на хирургический столик и присоединяли отведения для
ЭКГ и ректальный температурный зонд. Сонную артерию и яремную вену обнажали хирургически, поддерживая температуру тела животного между 10o и 14oC, и вставляли канюли в артерию и
вену. Артериальную канюлю присоединяли к трубопроводу, соединенному с перистальтическим насосом. Трубки заполняли раствором A, содержащим также 20 мМ KCl. Венозная канюля была закрыта до тех пор, пока
температура тела животного не снижалась до 5oC раздробленным льдом, и столик с контролируемой температурой устанавливали на -1,0oC.
Животное переставало дышать само, когда температура его тела падала ниже 10oC. Дыхание индуцировали 100% O2. При 5oC венозную канюлю удаляли и 3,5 мл раствора A накачивали в артерию при скорости течения приблизительно 0,3 мл/мин. После этого вливали 4,5 мл криопротекторного раствора, состоящего из раствора A и, кроме того, 4 мМ KCl, 1,0 М глюкозы, 4% пропандиола (т.е. 1,8 г глюкозы +0,4 г пропандиола на 10 мл раствора). Во время перфузии собирали вытекающую из вены жидкость. Температура животного понижалась постепенно до 0oC во время перфузии. Дыхание было отключено через 5 минут после начала перфузии. К этому времени было удалено более 30% всего объема крови животного. Сердце продолжало сокращаться, пока оно не остановилось со временем. После перфузии криопротекторным раствором, описанным в предшествующем параграфе, животное помещали в вязкий раствор NaCl (0,6 М) при температуре ниже 0oC, который помещали в морозильную камеру на ночь. Температуру морозильной камеры поддерживали в среднем при -5oC. Через 15 минут после помещения животного в морозильную камеру его ректальная температура снижалась от 0o до -1,0oC. Спустя 12 часов ректальная температура животного была -2,5oC. Затем животного согревали до температуры приблизительно 2,5oC в кухонной микроволновой печи Quasar при помощи 7-секундных импульсов с установкой на тепло. Импульсы генерировались с интервалом 1 мин. Для оттаивания животного требовалось 18 импульсов.
Затем это животное опять помещали на хирургический столик и подсоединяли отведения для ЭКГ и зонд ректального телетермометра. 3,5 мл раствора A перфузировали в сонную артерию при скорости течения приблизительно 0,2 мл/мин. Температура тела животного поддерживалась ниже 5oC. Затем хомячка перфузировали цельной кровью и постепенно согревали.
После вливания 2 мл крови и повышения температуры тела животного до 13oC обнаружили ритмичные сигналы ЭКГ. При продолжении перфузии и согревания амплитуда сигналов становилась больше и они становились более частыми. После вливания 5,5 мл крови температура животного достигала 25oC, грудь животного открывали и наблюдали непрерывные сердечные сокращения.
Пример 4. Кровезаменители в виде синтетических растворов в
камере с повышенным давлением (гипербарической камере)
Хомячка весом 40 г, предварительно голодавшего в течение ночи, инъецировали 0,03 мл кетамина (100 мг/мл) внутримышечно. Хомячка помещали
в раздробленный лед и держали в нем, пока температура его тела не падала ниже 15oC. Хомячка вынимали из раздробленного льда и помещали вверх брюшком на столик с контролируемой температурой,
расположенный для микрохирургии ниже стереоскопического микроскопа. Температуру хомячка поддерживали при 12-15oC.
После разрезания в паховой области обнажали правую вену бедра и бедренную артерию. Бедренную вену канюлировали, вводили 0,1 мл гепарина (1000 Е/мл) и канюлю закрывали для предотвращения кровотечения.
Правую бедренную артерию канюлировали и канюлю быстро соединяли с трубкой, заполненной раствором A. Трубку вставляли через головку перистальтического насоса. Небольшой объем раствора (приблизительно 0,3 мл) вливали для того, чтобы артериальная канюля не содержала крови. Как венозную, так и артериальную канюлю закрепляли на животном хирургическим швом.
Артериальную канюлю закрывали и животное переносили на столик в гипербарическую кислородную камеру (НВО). В прямую кишку вставляли температурный зонд.
Артериальную канюлю соединяли с трубкой, которая проходила через перистальтический насос и в резервуар. Трубку и резервуар заполняли раствором А, содержащим 4 мМ KCl.
С венозной канюли снимали крышечку и камеру HBO закрывали и создавали в ней повышенное давление. Включали перистальтический насос и животное перфузировали раствором, который вытеснял большую часть крови животного. Эта кровь вытекала из животного в виде вытекающей из вены жидкости. Конечное давление в камере было на 1,5 атм выше давления окружающей среды и его поддерживали на постоянном уровне. Скорость течения раствора в животное была приблизительно 0,3 мл/мин. Хомячка поддерживали при 14o-16oC при помощи столика с регулируемой температурой, на котором он был помещен в камеру.
Сердечная активность и дыхание сохранялись в течение всего периода во время перфузии. После перфузии в хомячка 15 мл раствора A, содержащего 4 мМ KCl, для вытеснения крови в камере постепенно снижали давление.
Затем камеру открывали и брали пробу на гематокритное число. Гематокритное число было 5%. Венозную и артериальную канюли закрывали крышками и камеру закрывали и повышали давление до давления на 1,5 атм выше давления окружающей среды.
Животное продолжало дышать самостоятельно в камере в течение 4 часов после удаления его крови. После этого периода в камере постепенно снижали давление. Одновременно животное охлаждали до 12oC. Камеру открывали и животное переносили на другой хирургический столик. На животное помещали лед и цельную кровь перфузировали в животное при скорости течения 0,2 мл/мин, в то время как раствору давали вытекать в виде венозного эффлюента.
После вливания 1 мл крови лед удаляли. Температура тела хомячка была 4oC, затем животному давали постепенно согреться, повышая гематокритное число непрерывным вливанием крови.
Искусственное дыхание стимулировали после введения обратно 1 мл крови. Сердце животного не прекращало ритмических сокращений. При 21oC животное равномерно дышало самостоятельно. Искусственное дыхание прекращали и согревание и инфузию крови продолжали, пока температура животного не поднималась до 25oC. Измеренное гематокритное число было 40%. Перфузию прекращали, канюли удаляли, кровеносные сосуды лигировали и хирургические разрезы закрывали.
Спустя 1 час после этой процедуры животное было очень активным и проворным. Спустя 4 часа после эксперимента животное ело и пило. Через 24 часа после завершения описанной выше процедуры оно казалось полностью нормальным в отношении позы и поведения и продолжало жить в течение недель после эксперимента.
Пример 5. Замена крови хомячка при охлаждении льдом
Хомячка весом 46 г в возрасте
приблизительно 1 месяца инъецировали внутримышечно 0,02 мл Vetalar, 100 мг/мл раствором кетамина. Животное обкладывали раздробленным льдом и держали, пока его ректальная температура не снижалась до
12oC. Затем животное удаляли из льда и помещали брюшком вверх на операционный столик с регулируемой температурой, чтобы животное оставалось охлажденным, причем столик помещали под
стереоскопический микроскоп. Конечности хомячка закрепляли и животное подсоединяли к отведениям для ЭКГ и в него вводили зонда телетермометра.
Разрез делали в правой паховой области. Канюлю помещали в правую бедренную вену и 0,02 мл раствора гепарина (250 Е/мл) вводили в животное через канюлю, которую затем закрывали. Затем канюлировали правую бедренную артерию. Эту канюлю соединяли со снабженным люэровским наконечником пластическим тюбингом, который проходил через перистальтический роллерный насос, и в резервуар, содержащий раствор А, включающий также 0,05 М глюкозу. На этом конце трубки была вставлена игла для подкожных инъекций 18 размера, к которой был прикреплен фильтрующий кровь материал на поршне при помощи резинового "0"- кольца. Насос включали и жидкость из резервуара накачивалась через систему трубок в бедренную артерию животного. Когда температура животного падала ниже 9oC, дыхание (при 20 вдохов/мин) стимулировали 100% кислородом. Животное охлаждали далее до ректальной температуры 4oC, и 0,1 мл 0,2 М KCl инъецировали в ангиокатетер 24 размера, который вставляли в бедренную вену. Эта инъекция останавливала сердце и сигналы ЭКГ прекращались. Насос включали и раствор А перфузировали в артерию при скорости приблизительно 0,2 мл/мин, собирая вытекающую из вены жидкость. Во время перфузии температура животного падала почти до 1oC. После перфузии 4 мл раствора в животное насос выключали и животное держали в раздробленном льду при остановке циркуляции в течение 2 часов. Затем животное перфузировали приблизительно 7 мл цельной крови (которую собирали из других хомячков-доноров), согревая животное постепенно при помощи настольной лампы. Во время перфузии собирали венозный эффлюент. Тот же самый объем, равный объему накачанной в артерию крови, собирали в виде венозного эффлюента. При 10oC, после того как животное оставалось с остановленным сердцем в течение 3 часов и 11 минут, сердечные сокращения наблюдали при мониторинге сигналов ЭКГ. Затем дыхание (6 вдохов/мин) животного стимулировали 100% кислородом. Когда животное было согрето далее и сердечные сокращения стали сильнее и быстрее, эту скорость увеличивали до 15 вдохов/мин. Когда температура животного достигла более 28oC, животное начало дышать самостоятельно и стало отвечать на раздражители. Перфузию прекращали (гематокритное число было 44%) и канюли удаляли и закрывали хирургические раны. Этот хомячок оставался живым и в явно нормальном состоянии здоровья в течение многих недель после эксперимента.
Пример 6. Восстановление сердечных сокращений в охлажденном льдом хомячке
Голодавшую (в течение ночи) самку хомячка весом 45 г инъецировали внутримышечно 0,03
мл кетаминового анестетика (100 мг/мл). Хомячка погружали в раздробленный лед и держали в нем, пока его температура тела не снижалась приблизительно до 14oC. Затем животное помещали на
хирургический столик и соединяли с отведениями для ЭКГ и ректальным температурным зондом. Сонную артерию и яремную вену обнажали хирургически с применением стереоскопического микроскопа. Температуру
тела животного поддерживали при 10o-14oC. Канюли вставляли в сонную артерию и яремную вену. Артериальную канюлю соединяли с тюбингом, проходящим через перистальтический насос в
резервуар, содержащий криопротекторный раствор, состоящий из раствора A, содержащего кроме того 11 мМ KCl, 1,0 М глюкозу и 4% пропандиол. Венозную канюлю сначала закрывали, пока температура тела
животного не понижалась до 5oC при помощи раздробленного льда, а температуру платформы с регулируемой температурой устанавливали около -1,0oC.
Животное переставало дышать самостоятельно, когда температура тела падала ниже 10oC. В это время животное получало стимуляцию дыхания при 15 вдохах/мин 100% кислородом. Когда температура животного падала до 5oC, венозную крышечку удаляли и включали насос при скорости течения 0,20 мл/мин. Спустя 21 минуту сердце животного переставало биться и искусственное дыхание прекращали через 5 минут после начала перфузии. Во время перфузии кровь собирали в виде эффлюента из вены. Приблизительно 4 мл криопротекторного раствора А вливали в животное. Затем животное окружали смесью соли со льдом, температура которой была -2,0oC. Контейнер, в котором находилась эта суспензия с животным, помещали в температурную баню, установленную при -5oC. Ректальная температура животного постепенно снижалась до -3,4oC к утру (через 18 часов после помещения животного в охлаждающую баню). Контейнер удаляли из бани. Суспензия была замерзшей до твердого состояния. Ее расплавляли при помощи охлажденной льдом воды. После удаления "суспензии" животное казалось замороженным. Затем животное помещали в кухонную микроволновую печь. Печь устанавливали на тепло в течение 7 секунд. Животное выдерживали в течение приблизительно 20 7-секундных циклов нагревания в течение периода 20 минут. Это приводило к оттаиванию животного и повышало его ректальную температуру приблизительно до 2oC.
Животное опять помещали на хирургическую платформу и вливали в сонную артерию раствор A. Криозащитный раствор собирали в виде вытекающей из вены жидкости. Примерно 3 мл раствора A перфузировали в животное при скорости течения 0,15 мл/мин. Затем при той же самой скорости перфузировали кровь, собранную из хомячков-доноров крови. После перфузии 2 мл крови в артерию хомячка его нагревали медленно при помощи настольной лампы. При перфузии крови и продолжающемся согревании температура животного повышалась выше 15oC и были зарегистрированы сильные ритмичные сигналы ЭКГ. При хирургической торакотомии можно было наблюдать настоящие сокращения сердца.
Пример 7. Синтетические растворы в качестве
кровезаменителей в гипербарической кислородной камере
Самку хомячка весом 43 г (голодавшую в течение ночи) инъецировали внутримышечно 0,02 мл кетамина (100 мг/мл). Хомячка помещали в
раздробленный лед и держали в нем, пока температура его тела не падала приблизительно до 14oC. Затем хомячка помещали брюшком вверх на столик с регулируемой температурой, расположенный для
микрохирургии под стереоскопическим микроскопом. Температуру хомячка поддерживали при 12 - 15oC. После разреза в правой паховой области обнажали правую бедренную вену и правую бедренную
артерию. Бедренную вену канюлировали, вводили 0,1 мл гепарина (250 Е/мл) и канюлю закрывали для предотвращения кровотечения. Затем канюлировали правую бедренную артерию и канюлю соединяли с тюбингом,
проходящим через перистальтический насос в резервуар, наполненный раствором А. Небольшой объем раствора (т.е. 0,2 мл) вливали для того, чтобы артериальная система вливания была свободна от крови. Как
венозную, так и артериальную канюлю закрепляли на животном. Артериальную канюлю закрывали и животное переносили на столик с регулируемой температурой гипербарической кислородной камеры (HBO).
Температуру животного, измеряемую ректально, поддерживали при 13 - 18oC. Цель поддержания хомячка в этом диапазоне температур заключалась в поддержании низкой активности животного с
одновременным обеспечением самостоятельного дыхания животного и его реакции на раздражители.
Артериальную канюлю соединяли с трубкой, проходящей наружу камеры через перистальтический насос и в резервуар (находящийся вне камеры), который содержал раствор А и 2,5 мМ KCl. Крышечку удаляли из венозной канюли и насос включали при скорости течения приблизительно 0,2 мл/мин. Во время перфузии раствора в животное собирали вытекающую из вены кровь. Камеру быстро закрывали и постепенно повышали давление до 20-24 pSi (1406- 1687,2 г/см2) кислородом (100%). После приблизительно 1 часа перфузии под давлением в камере постепенно понижали давление в течение приблизительно 1 часа. Затем перфузию прерывали. В целом вливали приблизительно 13 мл раствора в животное. Канюли закрывали после того, как брали пробу венозного эффлюента для определения гематокритного числа. Животное опять помещали на хирургическую платформу и канюли вытаскивали, и раны закрывали. Это животное проявляло минимальную рефлекторную активность в течение этого времени, хотя оно имело мало крови и дышало комнатным воздухом. Животное быстро помещали в бокс вне камеры, в котором давление постепенно повышали примерно до 20 pSi (1406 г/см2). В эту камеру помещали корм и воду для хомячка. Нагревающую лампу применяли для согревания камеры и животного. Давление в камере постепенно понижали (в течение 1 часа) до 5 pSi (351,5 г/см2). Активность животного увеличивалась в течение часового периода, пока животное не становилось полностью активным. Животное выдерживали в этой камере приблизительно в течение 16 часов при 5 pSi (351,5 г/см2). Затем давление постепенно понижали до 0,5 pSi (35,15 г/см2) (100% кислород) и выдерживали при таком давлении в течение 24 часов. Затем животное вынимали из этой камеры и помещали в нормальную клетку. Животное казалось полностью нормальным в течение многих недель после эксперимента.
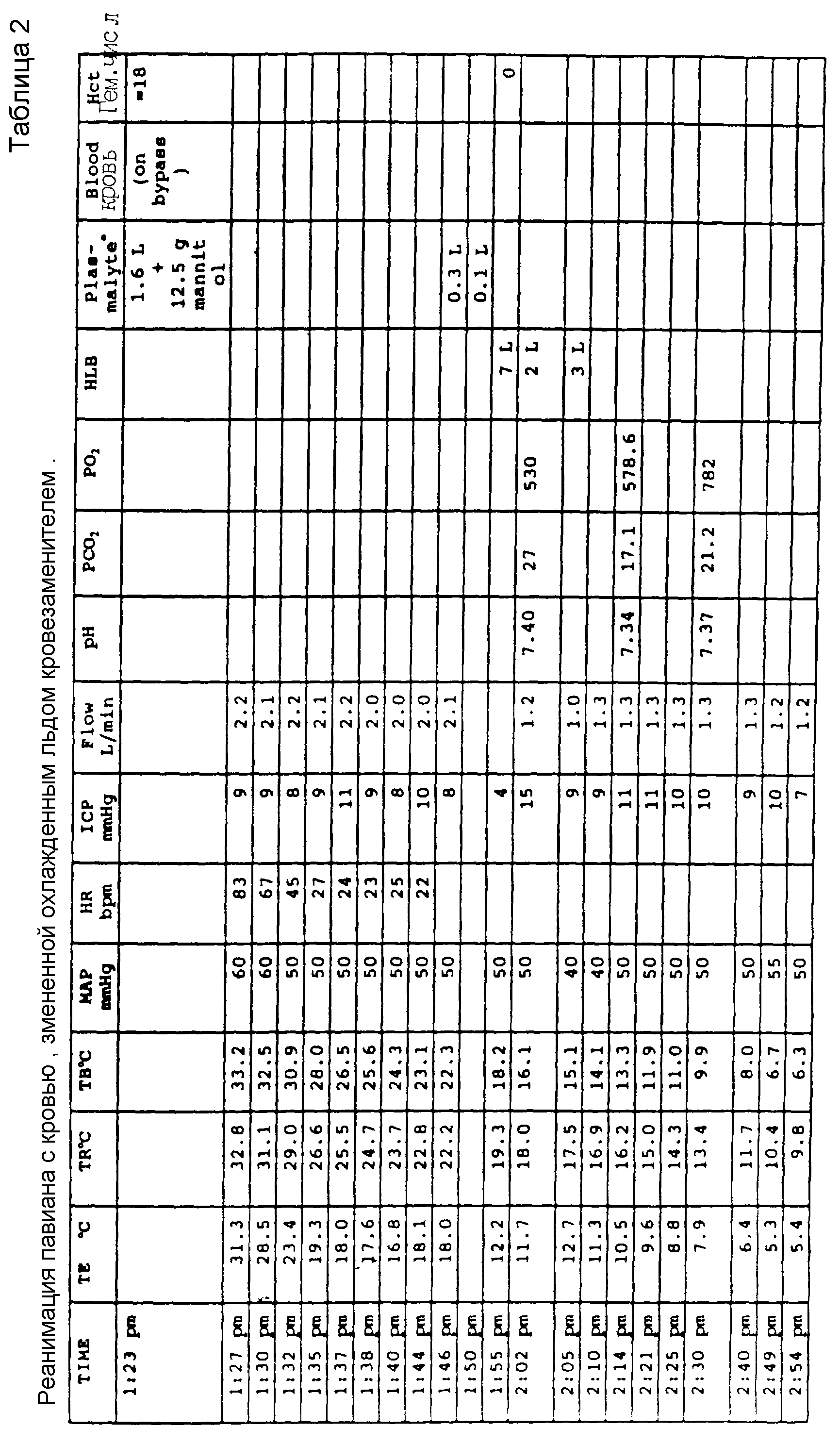
Пример 8. Применение раствора A, усиленного хлоридом калия, для кровезамещения у приматов
В этом примере молодого самца павиана вида Papio anubis весом 8 кг инъецировали
внутримышечно 60 мг кетамина. Катетер 22 размера 22G x1-1/4 дюйма (x2,54-0,635 см) вставляли в правую головную вену и вводили внутривенно 3 мл 2,5% пентотала. Затем животному приспосабливали
интубационную трубку, помещали его на хирургический стол и вентилировали легкие 0,7-2,5% смесью Флетчера в 100% O2, титрованной до активности животного. Глаза покрывали глазной мазью для
защиты.
Аппарат для искусственной вентиляции легких устанавливали на 18 вдохов в минуту (bpm), его объем хода был 240 мл и отношение вдох/выдох было 37%. Давление вдыхательных путях поддерживали приблизительно при 10 мм Hg, а объем, поставляемый с каждым вдохом, контролировали наблюдением записи на ленте самописца давления в дыхательных путях. Давление в дыхательных путях наблюдали с применением компьютерного управления записывающим устройством.
Животное брили и начинали капельное внутривенное вливание при скорости течения 1-3 мл/мин, причем скорость титровали до артериального кровяного давления животного. Вводили террамицин.
Экстракорпоральная цепь состояла из оксигенатора крови, резервуара с кровью и насоса и имела вторичный теплообменник, добавленный как можно ближе к животному. Кроме того, она имела наружный резервуар ледяной воды. Резервуар ледяной воды имел насос для подачи во встроенный в оксигенатор теплообменник и во вторичный теплообменник с циркулирующей ледяной водой. Вся система трубок, находящаяся в контакте с кровью или с кровезаменителем, была стерильной. Резервуар оксигенатора и цепь заполняли 2 л раствора A.
KCl (4 мл 2,0 М KCl) добавляли к 2 л раствора A в резервуаре оксигенатора и обходном пути, получая концентрацию KCl 4 мМ. 5F NIH катетер для мониторинга артериального давления вставляли в левую плечевую артерию. К нему присоединяли трехходовой запорный кран (чтобы брать пробы артериальной крови каждые 10-60 минут в ходе всей процедуры). Газы крови, pH, K+ и гематокритное число измеряли в каждой пробе, а в некоторых случаях также электролиты и ферменты. Катетер соединяли с датчиком кровяного давления. Датчик соединяли с компьютером для мониторинга центрального артериального давления (CAP). Другие параметры температуры и давления также измеряли под управлением подсоединенного к системе компьютера.
6F NIH катетер вставляли в дистальную ветвь левой плечевой вены для компьютеризированного мониторинга центрального венозного давления (CVP). Выполняли торакотомию и 6F коронарный катетер вставляли в левое предсердие для наблюдения давления левого предсердия.
10F артериальную канюлю помещали в левую бедренную артерию и 16F венозную канюлю помещали в левую бедренную вену. Вводили внутривенно метилпреднизолон (80 мг). Вставляли пищеводную трубку и вводили 3 мл Maalox. Вставляли в эзофагальную трубку термисторный зонд для регистрации глубокой эзофагальной температуры.
Вследствие интенсивных хирургических процедур павиан провел приблизительно 5 часов под анестезией. После того, как отведения для ЭКГ были на месте, животное помещали в сетчатые лямки и опускали в оборудованный изоляцией ледяной ящик. Затем его погружали в раздробленный лед. После 1 часа и 6 минут охлаждения в раздробленном льду температура тела падала до 23oC. Инфузию ниприда (25 мг нитропруссида в 500 мл 5% водной декстрозе) начинали при скорости 6 мл/час. Животное помещали на искусственное (экстракорпоральное) кровообращение спустя 17 минут, когда температура падала до 21oC.
В это время 200 мл цельной крови удаляли из павиана в виде вытекающей жидкости. Освобождали зажимы, которые изолировали циркуляционную систему обезьяны от цепи искусственного кровообращения и вливали 2 л раствора A, к которому добавляли 2 мл 2 М KCl (конечная концентрация 2 мМ KCl) для замены крови. После этого сердце останавливали внутривенным введением 15 мл 2 М KCl.
Смесь крови с кровезаменителем непрерывно удаляли в виде венозного эффлюента, пока 4 л раствора A (к которым были добавлены 22 мл 2 М KCl) не заменяли циркулирующий раствор. После 50 минут замещения охлажденным кровезаменителем температура примата уменьшалась до 3oC. Протекание через животное казалось хорошим и была небольшая тенденция увеличения давления в легочной артерии во время перфузии бедренной артерии. Причиной этого усиленного течения и относительно быстрого темпа снижения температуры может быть использование нитропруссида, а также относительно скудное использование анестетиков во время охлаждения, что привело к тому, что животное было несколько более активно, когда оно было охлаждено.
После замены крови животное помещали в состояние остановки циркуляции на 1 час и 40 минут. В конце периода остановки в систему добавляли 2 л охлажденного льдом раствора А для замены 2 л, удаленных в виде вытекающей из вены жидкости. Регистрируемая минимальная температура тела была 2,8oC. Затем начинали согревание. После 13 минут согревания температура тела достигала 10oC и к системе добавляли 800 мл смеси 1:3 крови и кровезаменителя, затем 450 мл 1:1 смеси и наконец приблизительно 1 л цельной крови, для замены раствора A.
Сразу же после введения крови в животное детектировали сердечные сокращения. В течение следующего часа и 22 минут вводили внутривенно 40 мл NaHCO3. Начинали искусственную вентиляцию легких и капельное внутривенное вливание допамина (200 мг в 250 мл) при скорости 30 мл/час. Также внутривенно вводили CaCl2 (50 мг). Спустя приблизительно 1 час, когда температура тела поднималась почти до нормальной, животное отсоединяли от искусственного кровообращения и давали внутривенное капельное вливание цельной крови. Газы крови животного и кровяное давление стабилизировались в нормальных пределах.
Спустя 1 час канюли удаляли. Поскольку катетеризацию проводили после торакотомии, было решено, что длительное постхирургическое лечение не требуется, из-за проблем поведения при сдерживании трудно укрощаемого павиана при обработке потенциальных грудных инфекций. При прекращении искусственной вентиляции легких еще после 1 часа у животного проявились агональные движения и сердце остановилось. Так как давления крови обезьяны и газовый состав крови стабилизировались, ясно, что животное имело потенциальную возможность выжить после кровезамещения при температуре ниже 10oC (глубокая пищеводная температура) в течение 2 часов и 30 минут.
Пример 9. Применение раствора А без усиления в замене крови приматов
В этом примере молодой самец павиана весом 8 кг
вида Papio anubis был охлажден и у него заменяли кровь при температуре ниже 10oC в течение 1 часа и 22 минут. Перед охлаждением и заменой крови катетер с клинообразным наконечником 4F 60 см
Swan-Ganz помещали в легочную артерию через правую бедренную вену. Это позволяло измерять давление легочной артерии без проведения торакотомии.
Поддерживая животное при легкой анестезии и используя нитропруссид, когда температура падала до 28oC, получали улучшенное течение через систему искусственного кровообращения.
Хотя вся процедура проходила гладко, внутривенное введение 50 мг хлорида кальция после введения содержащей цитрат крови во время согревания вызвало массивное образование сгустков и завершение эксперимента. В это время в сердечно-сосудистой системе не было гепарина.
Процедура. Павиана инъецировали внутримышечно 70 мг кетамина. Катетер 22 размера x1-1/4 дюйма (2,54-0,635 см) вставляли в левую головную вену и вводили внутривенно 3 мл 2,5% пентотал. Обезьяне вводили интубационную трубку и перемещали ее в комнату для рентгена. Животное помещали на стол для рентгена и вентилировали легкие 1% смесью изофлюорана (Flether) в 100% O2 и клинообразный катетер 4F 60 см имплантировали в легочную артерию через правую бедренную вену.
Аппарат искусственной вентиляции легких устанавливали на 20 вдохов в минуту, объем его такта (хода) был 200 мл и отношение вдоха/выдоха было 37%. Давление в воздуховоде поддерживали приблизительно при 10 мм Hg и объем, поставляемый с каждым вдохом, контролировали по сигналу давления в дыхательных путях на CRT или самописце с диаграммной лентой. Давление в дыхательных путях наблюдали при помощи подсоединенного для управления процессом компьютера.
Животное брили и начинали внутривенное капельное вливание лактата в растворе Рингера при скорости 1-3 мл/мин и скорость титровали до артериального кровяного давления животного.
Экстракорпоральная цепь была такой же, какая описана в предшествующем примере. Резервуар оксигенатора и цепь заполняли 2 л раствора A.
Гидромерный катетер 20G помещали в правую бедренную вену для компьютеризации мониторинга центрального венозного давления (CVP). Трехходовой кран помещали в системе для взятия проб. Гидромерный катетер 20G для мониторинга артериального давления вводили в правую плечевую артерию. К нему присоединяли трехходовой кран (для взятия проб артериальной крови каждые 10-60 минут в процессе всей процедуры). В каждой пробе измеряли газы крови, pH, K+ и гематокритное число, и в некоторых случаях электролиты и ферменты. Катетер соединяли с датчиком кровяного давления. Датчик кровяного давления соединяли с компьютером для мониторинга центрального артериального давления (CAP). Другие параметры температуры и давления также измеряли под управлением того же самого компьютера.
Венозную канюлю 14F помещали в левую бедренную вену и 10F артериальную канюлю помещали в левую бедренную артерию. После имплантирования венозной канюли вводили 2,6 мл гепарина внутривенно. Вставляли интубационную трубку и вводили 3 мл Maalox. Интубационная трубка была снабжена термисторным зондом для регистрации глубокой пищеводной температуры. Внутривенно вводили метилпреднизолон (80 мг). Глаза покрывали глазной мазью для защиты. Т.к. животное находилось при легкой анестезии, вводили внутривенно 1 мл пентотала.
Когда отведения для ЭКГ были на месте, животное помещали в сетчатую привязь и опускали в изолированный ящик для льда. Затем его погружали в раздробленный лед. После 29 минут охлаждения в раздробленном льду температура тела опускалась до 28oC. Животное поддерживали при легкой анестезии, отключая Flether, когда температура падала ниже 30oC. Вливание ниприда (нитропруссида натрия -25 мг в 500 мл 5% водной декстрозы) начинали при скорости 20 мл/час и затем скорость увеличивали до 40 мл/час. В течение следующих 20 минут вливание ниприда включали и выключали спорадически, когда кровяное давление и температура падали. Вливание отключали, когда животное подсоединяли к искусственному кровообращению спустя 27 минут, и температура снижалась до 23oC. В это время освобождали зажимы, изолирующие циркуляцию обезьяны от системы искусственного кровообращения, 2 л раствора A вливали для замещения крови животного и разбавленную кровь удаляли в виде венозного эффлюента и сохраняли для реанимации. После этого сердце останавливали внутривенным введением 10 мл 2 М KCl.
Смесь крови с кровезаменителем непрерывно удаляли в виде венозного эффлюента, пока 4 л раствора A не заменили циркулирующий раствор. После 39 минут замещения охлажденной крови температура примата снижалась ниже 4oC. Протекание через животное было быстрым. Давление в легочной циркуляции, которое без труда определяли, свидетельствовало о том, что циркуляция была хорошей и что клиновидный катетер для измерения давления был помещен хорошо.
После 50 минут кровезамещения при температуре ниже 10oC была зарегистрирована минимальная температура тела 2,9oC. Затем начинали согревание и после 28 минут согревания температура тела животного достигала 10oC, после чего 750 мл цельной крови добавляли в систему, заменяя раствор A.
Сокращение сердца обнаруживали через 8 минут после реинфузии крови в животное. В течение следующих 30 минут при одновременном согревании животного вводили 10 мл NaHCO3 внутривенно и CaCl2 (50 мг) инъецировали внутривенно, а также 80 мг метилпреднизолона. В течение нескольких минут добавления CaCl2 наблюдали массивное образование сгустков. Было предположено, что кровь, коагуляция которой предотвращалась цитратом, осаждалась в результате добавления CaCl2. После этого эксперимент прекращали.
В этом эксперименте скорость протекания кровезаменителя через животное и систему искусственного кровообращения была высокой, тогда как давление в левом предсердии оставалось приемлемо низким. Считают, что факторами, приводящими к такому результату, являются использование нитропруссида и поддержание состояния легкой анестезии во время процесса охлаждения. 1-2 мл гепарина следует добавлять к крови перед ее повторным введением в животное. Считают, что гепаринизация повторно вводимой крови исключит массивное образование сгустков, вызывающее неожиданную терминацию этого эксперимента.
Пример 10. Замена при охлаждении льдом крови собаки раствором HLB
Собаку весом 25-30 кг помещали на частичное искусственное
сердечно-легочное кровообращение. Проводили поверхностное и внутреннее охлаждение собаки почти до точки образования льда (1- 3oC). Кровь собаки заменяли раствором HLB в качестве
гипотермического кровезаменителя, описанным в примере 1. Кровь сохраняли для трансфузии во время согревания. Температуру тела животного снижали почти до точки образования льда (ниже 4oC) и
затем проводили согревание. Кровезаменитель заменяли кровью при одновременном согревании и реанимации животного.
Подготовка. Собаке вводят катетер в правую радиальную вену и вводят внутривенно пентотал. Затем вводят интубационную трубку и вентилируют легкие изофлюораном (или Flether) в 100% O2. Инициируют внутривенное капельное вливание лактата в растворе Рингера при скорости, титрованной до артериального кровяного давления собаки (приблизительно 40 мл/час внутривенно). Собаку помещают на охладительное одеяло, охлаждаемое рециркулирующей ледяной водой. Вводят катетер в правую сонную артерию для мониторинга кровяного давления (CAP) и добавляют трехходовой кран в систему для взятия проб артериальной крови каждые 10-60 минут в течение всей процедуры. Вставляют катетер-баллон Фолея для сбора мочи и измерения объема мочи во время всей процедуры. Имплантируют 2 lumen, 7F клинообразный катетер Swan Ganz (двухпросветный катетер) через правую яремную вену или правую бедренную вену, который подают через правое предсердие в легочную артерию. Дистальное отверстие используют для измерения давления легочной артерии (PAW), проксимальное отверстие используют для измерения центрального венозного давления (CVP). (Если требуется, CVP можно измерить при помощи катетера, вставленного в одну из плечевых вен). Обнажают левую бедренную артерию и вену и подготавливают для канюлирования. Гепаринизируют животное (приблизительно 5000 Е). Вставляют канюлю венозного возврата Biomedics - (15-19F) в бедренную вену и артериальную канюлю Biomedics (12-15F) в бедренную артерию. Измеряют время активированного свертывания крови (ACT) каждые 45 минут (до замещения крови) и доводят гепарин таким образом, чтобы время свертывания оставалось более 400 секунд. Присоединяют термопару примерно на середине к пищеводной трубке и вводят этот элемент таким образом, что трубка входит в желудок. Вторую термопару помещают в прямую кишку. Присоединяют отведения для ЭКГ. Добавляют Solu-Delta-Cortef (Upjohn, ветеринарный сукцинат натрия преднизолона) в количестве 80 мг внутривенной инъекцией. Глаза покрывают Терримицином (или Laerylube) и добавляют ДиГель (или Maalox, 20 мл) через пищеводную трубку.
Измерения. Измеряют газы артериальной крови, pH и гематокритное число в каждой пробе крови, а в некоторых случаях также электролиты, ферменты и другие химические соединения. Проводят мониторинг пищеводной и ректальной температуры, а также температур артериального впуска и венозного возврата. Проводят мониторинг CAP, PAW, CVP, ECG и давления дыхательных путей. Температуры изображаются в виде цифр и хранятся как функция времени в компьютеризованной системе сбора данных. Давления и ЭКГ должны быть выражены в форме сигнала реального времени или в виде числовых данных и храниться в компьютере.
Компоненты цепи искусственного кровообращения (шунтирования)
Цепь включает центробежный насос для крови Biomedics и
измеритель скорости кровотока (расходомер крови), оксигенатор с мембраной из пористых волокон Terumo с встроенным теплообменником, венозный резервуар Shilly с жесткими стенками с фильтром и вторичный
теплообменник с интегральной ловушкой для пузырьков газа (Electromcedics), помещенный как можно ближе к животному. Дренажный сегмент расположен вблизи выходного отверстия венозного резервуара и
заканчивается запорным клапаном. Это делает возможной быструю и эффективную смену крови/кровезаменителя. Имеется A-V шунтирующий сегмент, который делает возможной циркуляцию, когда животное не
находится на искусственном кровообращении.
Венозный резервуар может быть заполнен либо из 1-литровой разделительной воронки через отверстие для быстрого залива ("quick prime"), либо из двойных инфузионных мешков через одно из отверстий кардиотомии. Артериальная линия от оксигенатора к артериальной канюле и A-V-шунту сконструирована из трубок 1/4 дюйма (0,635 см); линии венозного возврата, дренирования и головки насоса из трубок 3/8 дюйма (0,9525 см). В этих сегментах, где может происходить серьезное сгибание трубок, используют более толстые трубки или трубки укреплены спиральной оберткой ("spiral wrap").
Петлю пациента с двойной оберткой и всю цепь (кроме стерилизованных на заводе резервуара, вторичного теплообменника и оксигенатора) стерилизуют газом оксидом этилена в виде шести основных секций (головка насоса, секция расходомера крови, центральная шунтирующая петля, воронка, инфузионная линия и линия фильтрования газа).
Поддержание системы искусственного кровообращения.
Ледяную воду, накачиваемую из одного из двух изолированных резервуаров на 10 галлонов (на 40,04 л), применяли для охлаждения оксигенатора и вторичных теплообменников. Другой резервуар обеспечивает охлаждающее одеяло. В начале хирургии ледяная вода циркулирует через охлаждающее одеяло. При подключении искусственного кровообращения через теплообменники цепи циркулирует вода комнатной температуры.
Температуру медленно снижают добавлением льда в этот резервуар в количествах, достаточных для поддержания 7 - 10oC-ной разницы между температурой пищевода и температурой кровотока. После замещения крови (т.е. до гематокритного числа менее приблизительно 4%) начинается течение полностью ледяной воды.
При согревании лед удаляют из резервуара и включается нагреватель. Температура согревающего потока ограничена максимумом, который на 10oC выше температуры венозного возврата, что достигается ручным регулированием термостата.
Оксигенатор снабжается стерильным фильтрованным 100% O2.
Замена крови. Цепь заливается 2 л раствора L (пример 1) и рециркулируется через A-V шунт для обеспечения температурно-газового равновесия. Канюли присоединяют к артериальной и венозной линиям аппарата искусственного кровообращения и линии остаются пережатыми при помощи зажимов. Охлаждающее одеяло обертывают вокруг пациента, который охлаждается поверхностно до тех пор, пока глубокая температура пищевода не достигнет 35oC.
Зажимы удаляют и начинают искусственное кровообращение с потоком разбавленной раствором L крови при комнатной температуре (приблизительно 25oC). При начале охлаждения газовая анестезия прекращается и собаке вводят 2,5% пентотал.
Поток крови постепенно охлаждают до тех пор, пока животное не будет иметь температуру пищевода 20oC, после чего кровь удаляют освобождением зажима венозного возврата при входном отверстии резервуара и дренированием из дренажного сегмента с одновременной инфузией раствора L. Во время этой замены добавляют еще 2 л раствора L в венозный резервуар и при падении уровня раствора L до 250 мл ступенчатым образом добавляют приблизительно 6 л HLB до тех пор, пока вся кровь не будет удалена (HCT менее 2%, визуальное наблюдение). Приблизительно 4 л смесей крови/кровезаменителя собирают в стерильные склянки и хранят для реинфузии. Очень разбавленную смесь крови (около 5 поллитровых объемов) выбрасывают.
После обмена 4 л (т.е. после добавления 2 л раствора L и 2 л раствора HLB) 20 мЭкв KCl вводят через запорный кран на втором теплообменнике для остановки сердца. Во время этого обмена впуск регулируется таким образом, что PAW поддерживается ниже 5 мм Hg и скорость вытекающего потока равна скорости втекающего потока, т.е. так близка к равенству объемов втекающей и вытекающей жидкостей, как это возможно. В конце обмена уровень конечного резервуара будет около 500 мл, PAW ниже 5 мм Hg и CVP менее 5 мм Hg. Течение регулируется таким образом, что поддерживается равенство объемов (постоянный уровень резервуара и указанные выше уровни давления, т.е. PAW менее 5 мм Hg и CVP менее 5 мм Hg).
При удалении почти всей крови (HCT менее 4%, визуальное наблюдение) температура охлаждающего потока может быть снижена до температуры ледяной бани (заполнением резервуара льдом) и собака быстро охлаждается до ее минимальной температуры. Если наблюдается, что HCT повышается в какое-либо время во время холодной перфузии, смесь крови может быть удалена обменом с 2-4 л раствора HLB по описанному выше способу.
Во время всей процедуры берут пробы артериальной крови и проводят мониторинг газов крови, pH, HCT и в некоторых случаях также электролитов и других химических компонентов крови.
После примерно 1-2 часов охлаждения кровезаменителем температура собаки будет приблизительно 1-4oC, после чего начинают согревание. Собаку согревают путем удаления льда из подающего резервуара и нагревания его содержимого нагревателем, который в свою очередь согревает одеяло. При достижении температуры пищевода 15oC 4 л раствора L с 25 г маннита обменивают с раствором HLB с последующей заменой 4 литрами собранной кровяной смеси. Вытекающую из вены жидкость выбрасывают.
Животное согревают осторожно, температурная разность кровотока менее 10oC и никогда не выше 40oC. Сердце начнет сокращаться спонтанно. Когда температуры животного (пищеводная и ректальная) достигнут приблизительно 35oC, физиологические параметры стабилизируются, собака сможет поддерживать себя и ее можно отсоединить от экстракорпоральной системы обеспечения.
Пример 11. Реанимация собаки с охлажденным на льду
кровезаменителем вместо крови
Самца собаки весом 26,8 кг анестезировали нембуталом и интубировали. Его перемещали в операционную комнату, вентилировали при помощи дыхательного аппарата и
проводили катетеризацию венозным катетером, катетером Фалея для дренирования мочи, артериальным катетером, катетерами Swan-Ganz и после внутривенного введения гепарина канюлировали правые бедренные
артерию и вену. Вставляли эзофагальную трубку и вводили антацидное средство. Температурные датчики помещали в пищевод и ректум. Внутривенно инъецировали метилпреднизолон.
Животное заворачивали в охлаждающее одеяло и начинали поверхностное охлаждение. Канюли животного соединяли с аппаратом искусственного дыхания, который состоял из вортексного насоса для крови, оксигенатора с встроенным теплообменником, вторичного теплообменника в линии и воронки для быстрого введения крови или кровезаменителя. Цельную кровь (225 мл) удаляли из собаки и сохраняли для согревания. Объем крови быстро заменяли раствором HLB. Систему искусственного обращения, содержащую 1,05 л раствора HLB, открывали для животного и начинали внутреннее охлаждение.
33 л кровезаменителя обменивали. Ко времени приближения к точке образования льда гематокритное число было значительно ниже 1%. Внутренняя пищеводная температура животного была ниже 10oC в течение 4 часов и 5 минут с минимальной зарегистрированной температурой 0,7oC (таблица 2).
После гипотермического периода животное согревали. Когда температура тела повышалась выше 10oC, собирали венозный эффлюент и возвращали в цепь собранную прежде цельную кровь, а также донорную кровь; гематокритное число увеличивалось с увеличением температуры. Вводили лидокаин и бикарбонат, сердце дефибриллировали, начинали вентилирование легких. Когда давление крови и температуры тела приближались к нормальным, животное отключали от аппарата искусственного кровообращения с оксигенатором и проводили инъекцию протамином и Lasix. Через несколько часов после согревания животное было в сознании и отвечало на раздражители. Это животное оставалось живым и чувствовало себя хорошо после этой процедуры.
Пример 12. Реанимация павиана с охлажденным на льду кровезаменителем вместо крови
Самца павиана весом 24 кг вида Papio anubis анестезировали
сначала кетамином и ацепромазином внутримышечно, а затем пентоталом внутривенно. Затем он был иммобилизован при помощи бромида панкурония. Его интубировали, вентилировали и обеспечили венозным,
артериальным катетером и катетером Фолея для дренирования мочевого пузыря. Животное обертывали в охлаждающее одеяло и инициировали поверхностное охлаждение. После введения гепарина внутривенно
канюлировали правую бедренную артерию и билатеральные бедренные вены павиана. Температурные датчики помещали в пищевод, ректум и мозг. К животному подсоединяли отведения для ЭКГ, соматосенсорных
вызванных потенциалов и электроэнцефалограммы (EEG). Внутривенно инъецировали дексаметазон.
Канюли животного соединяли с аппаратом искусственного кровообращения, который состоял из вортексного насоса для крови, оксигенатора со встроенным теплообменником и воронкой для быстрого введения крови и кровезаменителя. Цельную кровь (300 мл) удаляли из павиана и хранили для согревания. Этот объем быстро заменяли 300 мл физиологического солевого раствора. Систему искусственного кровообращения, содержащую 2 л Plasmalytl (коммерчески доступного раствора электролита), подключали к животному (снятием зажимов) и начинали внутреннее охлаждение.
После снижения глубокой пищеводной температуры ниже 13oC еще 2 л Plasmalytl, содержащего 12,5 г маннита, добавляли к цепи, заменяя смесь крови и Plasmalytl, которая перед этим заполняла цепь. Эту разбавленную кровь сохраняли для использования во время согревания. Сразу же после этого добавляли 10 л раствора HLB, замещая Plasmalytl. При достижении точки замерзания льда гематокритное число было значительно ниже 1%. Когда температура мозга животного достигала 3,4oC и глубокая эзофагальная температура достигала 2,8oC, насос для крови останавливали и животное поддерживали при условиях остановки циркуляции в течение 45 часов. После этого периода циркуляцию возобновляли.
После периода гипертермии 4,2 л раствора HLB добавляли к системе искусственного кровообращения и животное согревали. Когда температура тела достигала 15oC, 2 л Plasmalytl добавляли к цепи для замещения раствора HLB. К Plasmalytl в цепи добавляли маннит (6,25 г/л). Дополнительно венозный эффлюент и собранную ранее цельную кровь, а также донорные клетки крови и свежезамороженную плазму возвращали в цепь; гематокритное число животного увеличивалось с увеличением температуры тела. Еще 12,5 г маннита добавляли к цепи. Когда эзофагальная и ректальная температуры приближались к нормальной, сердце фибриллировало во время нагревания и начинало сокращаться. Начинали вентилирование легких. Когда кровяное давление и температуры тела становились нормальными, животное инъецировали внутривенно протамином, отключали от аппарата искусственного кровообращения, удаляли канюли и закрывали его разрезы.
Глубокая пищеводная температура животного была ниже 15oC в течение 3 часов и ниже 10oC в течение 2 часов 17 минут с минимальной зарегистрированной температурой 2,8oC (таблица 3). На следующее утро животное было способно сидеть прямо в клетке и хватать и есть кусочки бананов, а также пить яблочный сок. Оно оставалось живым и здоровым до тех пор, пока его не умерщвляли спустя более одной недели для гистологических исследований.
Описанное выше изобретение и прилагаемая формула изобретения описывают новые растворы, которые могут быть применимы в ряде процедур. Специалисты с обычной квалификацией в этой области способны с точки зрения принципов этой спецификации и формулы изобретения сделать определенные добавления или модификации к этому изобретению без отхода от существа описанного изобретения.
Реферат
Изобретение относится к водным растворам, применимым для перфузии и действующим в качестве кровезаменителей. Описан водный раствор, содержащий полисахаридный онкотический агент, физиологически совместимый буфер, простой гексозный сахар, растворенные соли соляной кислоты кальция, натрия и магния, и натриевую соль органической кислоты, и способ получения стерилизованного нагреванием кровезаменителя. Технический результат: растворы можно использовать для поддержания частично или фактически полностью обескровленного субъекта при нормальных температурах и при температурах, значительно более низких, чем температуры, в норме поддерживаемые млекопитающим, и их можно использовать в сочетании с условиями повышенного давления(гипербарическими условиями) для поддержания таких частично или полностью обескровленных субъектов живыми без вливания крови обратно в субъекта и могут быть использованы для сохранения биологической целостности органов в донорском организме млекопитающего. 2 с. и 6 з.п.ф-лы, 2 табл.
Формула
RCOOX,
где R обозначает алкил, алкенил или арил, имеющие разветвленную или прямую цепь, содержащую 1-30 атомов углерода, которые могут быть замещенными;
Х обозначает водород, или натрий, или другой биологически совместимый ионный заместитель, который может присоединяться в положении кислорода, или Х обозначает прямой или разветвленный алкил с короткой цепью, содержащей 1 - 4 атомов углерода.

Комментарии