Содержащее медь молекулярное сито из левина для селективного восстановления nox - RU2600565C2
Код документа: RU2600565C2
Чертежи








Описание
Настоящее изобретение относится к содержащему медь молекулярному ситу из левина, имеющему молярное отношение диоксида кремния к оксиду алюминия менее 30 и атомное отношение Cu:Al менее 0,45, отличающемуся тем, что молекулярное сито сохраняет по меньшей мере 60% его площади поверхности после воздействия температуры от около 750°С до около 950°С в присутствии до 10 об.% водяного пара в течение периода времени от около 1 до около 48 часов.
Из уровня техники хорошо известны синтетические и природные цеолиты и их использование для проведения определенных реакций, включая селективное восстановление оксидов азота аммиаком в присутствии кислорода. Цеолиты являются алюмосиликатными кристаллическими материалами, имеющими достаточно равномерные размеры пор, диаметр которых, в зависимости от типа цеолита, типа и количества катионов в решетке цеолита, составляет от 3 до 10 ангстрем. Левин (LEV) представляет собой цеолит с малыми порами, отверстия которых представляют собой 8-членные кольца (~4,8×3,6 ангстрем), доступные через 2-мерную пористость (по определению Международной ассоциации цеолита). Похожая на клетку структура возникает в результате соединения двойных шестиколечных конструктивных элементов 4 кольцами.
Левин может быть синтезирован с использованием различных шаблонных средств и источников ОН. Эти различные методы синтеза обеспечивают получение различных материалов типа левина с разными названиями, таких как левин (Levyne), LZ-132, LZ-133, Nu-3, ZSM-45, ZK20, SSZ-17. В US 3,459,676 впервые раскрыт синтез ZK-20 с отношением диоксида кремния к оксиду алюминия от 4 до 11 с использованием 1-метил-1-азониа-4-азабицикло[2.2.2]октана. В ЕР 91,048 и ЕР 91,049 описан синтез LZ-132 и LZ-133 с использованием метилхинуклидина. В ЕР 40,016 описан синтез Nu-3 (SiO2:Al2O3 от 10 до 300) с использованием 1-аминоадамантана или метилхинуклидина. В ЕР 107,370, US 4,485,303, US 4,086,186, US 5,334,367 описан синтез ZSM-45 (SiO2:Al2O3 от 10 до 80) с использованием солей диметилдиэтиламмония, холина и кобальтина. Caullett et al. описывают синтез левина с использованием хинуклидина и метиламина в Zeolites, 1995, 15, 139-147. Touto et al. описывают синтез левина с использованием метилхинуклидина в Materials Engineering, 1994, 175-182 и Microporous and Mesoporous Materials, 1998, 247-257. Inoue et al. описывают гидротермическое преобразование FAU в левин с использованием гидроксида холина в Microporous and Mesoporous Materials, 2009, 149-154.
Восстановление оксидов азота аммиаком с образованием азота и H2O может катализироваться активированными металлами цеолитами, чтобы реакция имела преимущество перед окислением аммиака кислородом или образованием нежелательных побочных продуктов, таких как N2O. Следовательно, процесс часто называют "селективным" каталитическим восстановлением (SCR) оксидов азота, а иногда просто SCR-процессом.
Катализаторы, используемые в SCR-процессе, в идеале должны сохранять хорошую каталитическую активность в широком диапазоне рабочих температур, например от 200°С до 600°С или выше, в гидротермических условиях и в присутствии соединений серы. Высокая температура и гидротермические условия часто встречаются на практике, например, во время регенерации каталитического фильтра сажи - компонента, необходимого для удаления частиц сажи в системах очистки выхлопных газов.
Известны активированные металлом цеолитные катализаторы, включающие, среди прочих, активированные железом и активированные медью цеолитные катализаторы для селективного каталитического восстановления оксидов азота аммиаком. Активированный железом бета-цеолит (US 4,961,917) является эффективным коммерческим катализатором для селективного восстановления оксидов азота аммиаком. К сожалению, было установлено, что в тяжелых гидротермических условиях, например в процессе регенерации каталитического фильтра сажи при температуре, локально превышающей 700°С, действенность многих активированных металлом цеолитов начинает снижаться. Это снижение часто связывают с деалюминированием цеолита и, как следствие, потерей содержащих металл активных центров в цеолите.
В WO 2008/106519 раскрыт катализатор, содержащий: цеолит, имеющий кристаллическую структуру СНА, молярное отношение диоксида кремния к оксиду алюминия более 15 и атомное отношение меди к алюминию свыше 0,25. Катализатор получают путем обмена меди и NH4+-формы СНА с использованием сульфата меди или ацетата меди. Катализатор, получаемый в результате ионного обмена сульфата меди, показывает превращение NOx от 45 до 59% при температуре 200°С и ~82% при 450°С. Обмен ацетата меди дает материал, показывающий превращение NOx после выдерживания 70% и 88% при 200 и 450°С соответственно. Эти материалы обеспечивают улучшение характеристик при низких температурах и гидротермической стабильности по сравнению с FeBeta. Однако шабазит все еще является дорогим материалом из-за стоимости триметиладамантил аммоний гидроксида, необходимого для его синтеза.
В WO 2008/132452 раскрыт ряд цеолитных материалов, которые могут быть загружены железом и/или медью для улучшения преобразования NOx по сравнению с Fe/Beta, Cu/Beta и Cu/ZSM-5. В примере 2 описан Cu/Nu-3 (материал типа левина) в качестве такого материала. Этот пример указывает на то, что обмен аммония проводили до водного обмена меди с использованием нитрата меди. В нем говорится о том, что несколько водных ионных обменов были проведены для достижения 3 мас.% Cu (3,76 мас.% CuO). Никаких сведений о ионообменных экспериментах не приведено. Кроме того, не приведено никаких данных о важных параметрах состава цеолита, таких как содержание SiO2:Al2O3 или щелочных металлов.
Как было указано выше, Nu-3 можно синтезировать с широким диапазоном SiO2:Al2O3 (от 10 до 300). Пример 6 показывает, что материал выдерживают при 750°С в 5% паре в течение 24 часов. На Фиг.5 и 6 иллюстрирует характеристики SCR Cu/Nu-3 в только что полученном и выдержанном состоянии по сравнению с другими материалами, такими как Cu/SAPO-34. На Фиг.6 показано, что после гидротермического выдерживания превращение NOx при 200 и 450°С значительно уступает SAPO-34 типа шабазита после выдерживания, с ~60% против ~75% превращения NOx при 200°С и с ~60% против ~80% превращения при 450°С. Тем не менее нет четкого изложения условий испытаний для Cu/Nu-3.
Briend at al. сообщают, что SAPO-34 был нестабилен во влажной среде при температуре ниже около 100°С, что выразилось в потере структуры (J. Phys. Chem., 1995, Vol.99, p. 8270-8276). Однако при температуре выше 100°С стабильность не является проблемой.
Poshusta et al. наблюдали неустойчивость к воздействию влаги при низкой температуре мембран SAPO-34 (J. Membrane Science, 2001, Vol.186, p. 25-40).
В WO 2008/118434 указано, что материал левин, который может сохранять по меньшей мере 80% площади его поверхности и объем микропор после гидротермического выдерживания при 900°С в 10% пара в течение от 1 до 16 часов, пригоден для применения в SCR. Однако данные о синтезе или катализаторе не раскрыты.
В WO 2010/043891 описаны цеолиты с малыми порами (с максимальным размером кольца - восемь тетраэдрических атомов), в том числе левин (LEV), в качестве улучшенных катализаторов для селективного каталитического восстановления NOx аммиаком. Раскрыты левинит, Nu-3, LZ-132 и ZK-20. Отмечено, что большой размер кристалла приводит к повышению стабильности катализатора. При этом каталитические данные приведены только для Cu/шабазита. О преобразовании NOx сообщено для 200°С и 400°С. Заявляется о кристаллах более 0,5 мкм.
В US 4,220,632 раскрыт процесс NH3-SCR с использованием цеолитов в Na- или Н-форме с размерами пор 3-10 ангстрем. Цеолит X, морденит и природный цеолит представлены в примерах.
Задача
Таким образом, существует задача по обеспечению экономически эффективных гидротермически стабильных катализаторов для применения в SCR. Желательными являются более дешевые катализаторы, обладающие свойствами SCR и стабильностью, аналогичными катализаторам SCR, известным из уровня техники. Кроме того, катализаторы должны демонстрировать высокую активность в широком диапазоне температур. Желательной является гидротермическая стабильность при температурах выше 750°С. Конкретные требования к гидротермической стабильности зависят от конфигурации каталитической системы, используемой для обработки выхлопов.
Неожиданно было обнаружено, что катализаторы Cu/LEV с более низким отношением SiO2:Al2O3 демонстрируют улучшенные характеристики, даже после суровой гидротермической обработки при тщательном контроле содержания Cu.
Cu/LEV обеспечивает значительное снижение затрат по сравнению с Cu/SSZ-13 в связи с использованием более дешевых шаблонов. Кроме того, для этой композиции на основе алюмосиликата не обнаруживали проблем со стабильностью при низких температурах, которые существуют для некоторых силикоалюмофосфатных композиций.
Продукт
Таким образом, настоящее изобретение относится к содержащему медь молекулярному ситу из левина, имеющему молярное отношение диоксида кремния к оксиду алюминия менее 30, предпочтительно менее 28, более предпочтительно менее 26, еще более предпочтительно менее 23 и атомное отношение Cu:Al менее 0,45, отличающемуся тем, что молекулярное сито из левина сохраняет по меньшей мере 60% его площади поверхности после воздействия температуры от около 750°С до около 950°С в присутствии до 10 об.% водяного пара в течение периода времени от около 1 до около 48 часов.
В предпочтительном варианте осуществления содержащее медь молекулярное сито из левина сохраняет по меньшей мере 70%, предпочтительно - 80%, более предпочтительно - 90% его площади поверхности после воздействия температуры от около 750°С до около 950°С в присутствии до 10 об.% водяного пара в течение периода времени от около 1 до около 48 часов.
Используемое в настоящем описании и формуле изобретения указание на единственное число предполагает указание и на множественное число, если только контекст четко не указывает на обратное. Так, например, упоминание "катализатора" включает в себя смесь двух или более катализаторов и т.д.
Молекулярное сито может быть цеолитным, цеолиты, или нецеолитным, цеолитные и нецеолитные молекулярные сита могут иметь кристаллическую структуру левина, которая также называется Международной ассоциации цеолита структурой LEV.
SiO2/Al2O3
Предпочтительно, содержащее медь молекулярное сито из левина имеет молярное отношение диоксида кремния к оксиду алюминия от около 4 до менее 30. Предпочтительно, содержащий медь левин имеет молярное отношение диоксида кремния к оксиду алюминия в диапазоне от около 10 до менее 30, предпочтительно в диапазоне от около 10 до около 28, более предпочтительно в диапазоне от около 15 до около 28, еще более предпочтительно в диапазоне от около 15 до около 26.
Cu/Al
Предпочтительно, атомное отношение меди к алюминию составляет от около 0,2 до менее чем около 0,45. Еще более предпочтительно, атомное отношение меди к алюминию составляет от около 0,25 до около 0,4.
Cu/Н
Предпочтительно, атомное отношение меди к протону составляет менее 7, более предпочтительно менее 4. Более предпочтительно, отношение находится в диапазоне от около 0,25 до около 4. Еще более предпочтительно, атомное отношение меди к протону составляет от около 0,25 до около 2. Содержание протонов в цеолите может быть рассчитано как количество молей Н минус количество молей (2·Cu2+).
Количество молей Cu на 100 г цеолита
Предпочтительно, количество молей Cu на 100 г цеолита (в расчете на моли) превышает 0,01. Более предпочтительно, количество молей Cu на 100 г цеолита находится в диапазоне от около 0,02 до около 0,046. Еще более предпочтительно, это значение находится в диапазоне от около 0,025 до около 0,04.
Повышенные температуры
Содержащее медь молекулярное сито из левина подвергается действию повышенных температур. Температура в соответствии с настоящим изобретением может составлять от около 750 до около 950°С, предпочтительно от 750 до 850°С.
Площадь поверхности при 750°С
Предпочтительно, площадь поверхности содержащего медь молекулярного сита из левина после воздействия температуры 750°С в присутствии до 10 об.% водяного пара в течение периода времени от около 1 до около 48 часов, предпочтительно в течение периода времени от около 6 до около 48 часов, более предпочтительно в течение периода времени от около 6 до около 24 часов, сохраняется на уровне не менее 60%, более предпочтительно не менее 65%, еще более предпочтительно не менее 70%, еще более предпочтительно не менее 75%, еще более предпочтительно не менее 80%, еще более предпочтительно не менее 85% от площади поверхности перед воздействием повышенной температуры.
Площадь поверхности при 850°С
Предпочтительно, площадь поверхности содержащего медь молекулярного сита из левина после воздействия температуры 850°С в присутствии до 10 об. % водяного пара в течение периода времени от около 1 до около 48 часов сохраняется на уровне максимально менее 80%, предпочтительно максимально менее 75% после воздействия температуры 850°С.
Площадь поверхности
Предпочтительно, площадь поверхности по Ленгмюру, определяемая в соответствии с DIN ISO 9277, содержащего медь молекулярного сита из левина находится в диапазоне от около 400 до около 900, более предпочтительно в диапазоне от около 600 до около 900.
Дифракционная рентгенограмма
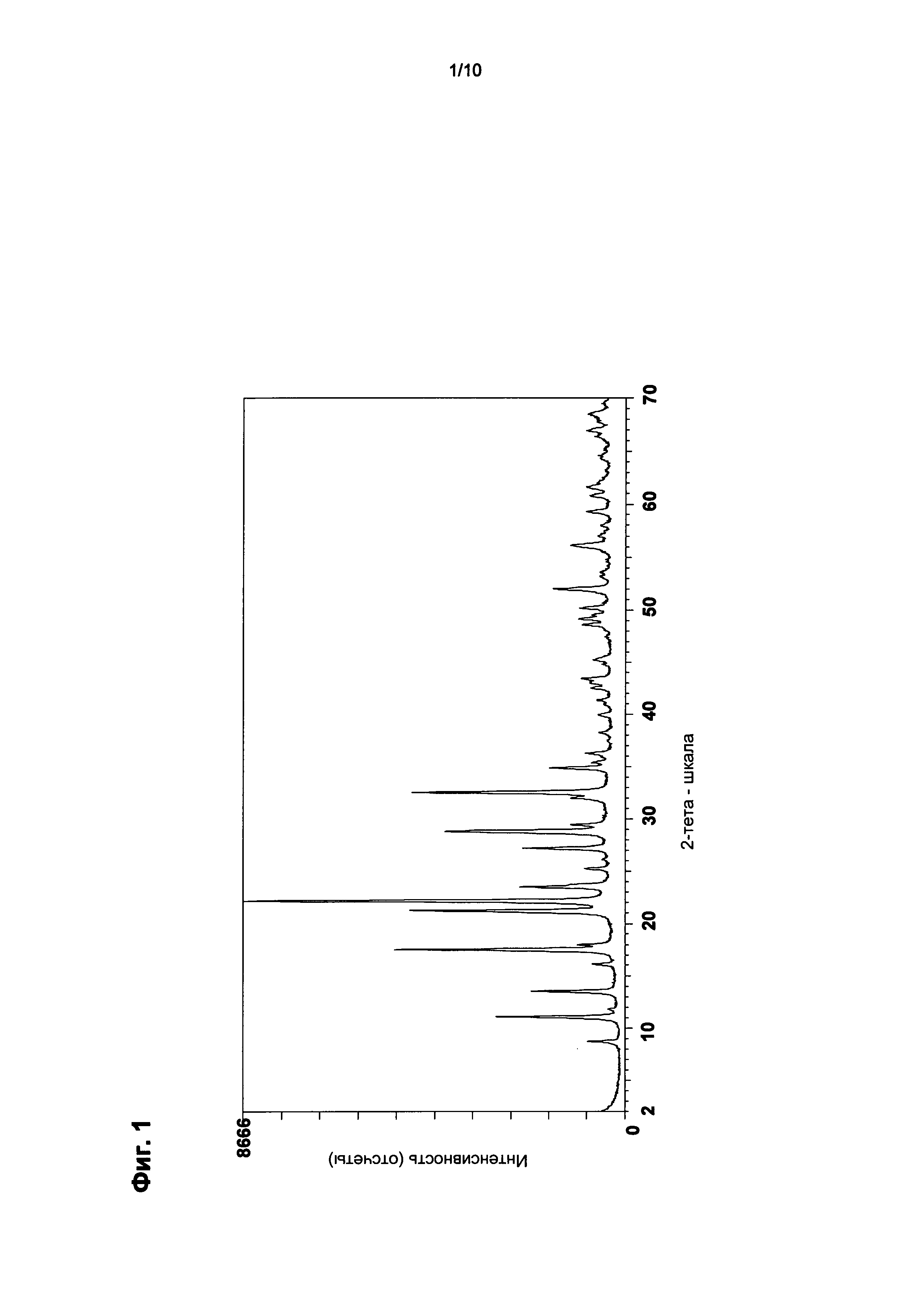
Дифракционную рентгенограмму получали на дифрактометре Bruker D 4 Endeavor с 4° щелями Соллера, щелями V20 с переменной дивергенцией и сцинтилляционным счетчиком в качестве детектора рентгеновского излучения. Для анализируемых образцов проводили измерения в диапазоне от 2° до 70° 2-тета с обычным шагом 0,02° и шагом по времени 2 секунды. Дифракционная рентгенограмма соответствовала топологии LEV, описанной в Сборнике смоделированных дифракционных порошковых рентгенограмм для цеолитов М.М. Treacy et al.
Мас.% меди
Содержание Cu в содержащем медь молекулярном сите из Левина, рассчитываемое как CuO, предпочтительно составляет по меньшей мере около 2 мас.% и более предпочтительно по меньшей мере около 2,5 мас.%, в каждом случае от общей массы кальцинированного молекулярного сита из левина. В еще более предпочтительном варианте содержание Си в молекулярном сите из левина, рассчитываемое как CuO, составляет до около 15 мас.%, более предпочтительно до около 4 мас.% и еще более предпочтительно до около 3,5 мас.%, в каждом случае от общей массы кальцинированного молекулярного сита из левина, определяемой без учета летучих веществ. Таким образом, предпочтительный диапазон содержания Cu в молекулярном сите из левина, рассчитываемого как CuO, составляет от около 2 до около 15 мас.%, более предпочтительно от около 2 до около 4 мас.%, еще более предпочтительно от около 2,5 до около 3,5 мас.%, еще более предпочтительно от около 2,5 до около 3,25 мас.%, в каждом конкретном случае от общей массы кальцинированного молекулярного сита из левина. Все значения мас.% приведены без учета летучих веществ.
Свободная медь
В дополнение к меди, которая подверглась обмену для повышения уровня меди, связанной с обменными центрами в структуре цеолита, в молекулярном сите из левина может присутствовать не подвергшаяся обмену медь в форме соли, так называемая свободная медь.
Содержание натрия
Предпочтительно, содержащее медь молекулярное сито из левина имеет содержание натрия (указываемое как содержание Na2O без летучих соединений) менее 30000 частей на миллион, более предпочтительно менее 5000 частей на миллион, еще более предпочтительно менее 1000 частей на миллион и наиболее предпочтительно менее 100 частей на миллион.
Дополнительный металл
Содержащее медь молекулярное сито из левина может содержать один или несколько переходных металлов. Предпочтительно молекулярное сито из левина может содержать переходные металлы, способные окислять NO в NO2 и/или сохранять NH3. Переходные металлы предпочтительно выбирают из группы, состоящей из Fe, Co, Ni, Zn, Y, Се, Zr и V. Как правило, могут использоваться все подходящие источники Fe, Co, Ni, Zn, Y, Се, Zr и V. В качестве примера можно упомянуть нитрат, оксалат, сульфат, ацетат, карбонат, гидроксид, ацетилацетонат, оксид, гидрат и/или соли, такие как хлорид, бромид, йодид.
Кроме того, содержащее медь молекулярное сито из Левина может содержать один или несколько лантаноидов. Предпочтительный источником лантаноидов (среди прочих) является нитрат лантана.
Кроме того, содержащее медь молекулярное сито из левина может содержать один или несколько драгоценных металлов (например, Pd, Pt).
TOC
Предпочтительно, кальцинированное содержащее медь молекулярное сито из левина имеет содержание ТОС (общего органического углерода) 0,1 мас.% или менее от общей массы молекулярного сита из левина.
Термостабильность
Предпочтительно, кальцинированное содержащее медь молекулярное сито из левина имеет термостабильность, определяемую путем дифференциального термического анализа или дифференциальной сканирующей калориметрии, в интервале от около 900 до около 1400°С, предпочтительно в диапазоне от около 1100 до около 1400°С, более предпочтительно в диапазоне от около 1150 до около 1400°С. Например, измерение термостабильности описано в РСТ/ЕР2009/056036 на стр.38.
LEV
Предпочтительно, содержащее медь молекулярное сито из левина содержит все материалы, описанные в структуре цеолита с кодом LEV. Предпочтительно, содержащее медь молекулярное сито из левина является алюмосиликатной композицией. Предпочтительно, содержащее медь молекулярное сито из левина является ZSM-45 или Nu-3. ZSM-45 предпочтительно кристаллизуется из шаблонных средств, полученных из солей холина или диметилдиэтиламмония.
SCR-активность
Выдержанное: 750°С
Содержащее медь молекулярное сито из левина, предпочтительно ZSM-45, выдерживается в гидротермических условиях. Типичные условия для такого гидротермического выдерживания: содержащее медь молекулярное сито из левина помещают в трубчатую печь в потоке газа, содержащего 10% Н2О, 10% О2, остаток N2, имеющего часовую объемную скорость 12500 ч-1, в течение 24 часов при 750°С. Предпочтительно превращение NO при выдержке при 750°С при температуре 200°С составляет не менее 70%, более предпочтительно не менее 75%, более предпочтительно не менее 80%, при измерении при часовой объемной скорости газа 30000 ч-1. Предпочтительно превращение NO при выдержке при 750°С при температуре 450°С составляет не менее 70%, более предпочтительно не менее 75%, еще более предпочтительно не менее 80%, при измерении при часовой объемной скорости газа 30000 ч-1.
Предпочтительно превращение NO при выдержке при 750°С при температуре 200°С составляет не менее 50%, более предпочтительно не менее 60%, еще более предпочтительно не менее 65%, при измерении при часовой объемной скорости газа 80000 ч-1. Предпочтительно превращение NO при выдержке при 750°С при температуре 450°С составляет не менее 65%, более предпочтительно не менее 70%, еще более предпочтительно не менее 75%, при измерении при часовой объемной скорости газа 80000 ч-1.
Выдержанное: 850°С
Содержащее медь молекулярное сито из левина, предпочтительно ZSM-45, выдерживается в гидротермических условиях. Типичные условия для такого гидротермического выдерживания: содержащее медь молекулярное сито из левина помещают в трубчатую печь в потоке газа, содержащего 10% H2O, 10% O2, остаток N2, имеющего часовую объемную скорость 12500 ч-1, в течение 6 часов при 850°С. Предпочтительно превращение NO при выдержке при 850°С при температуре 200°С составляет не менее 70%, более предпочтительно не менее 75%, более предпочтительно не менее 80%, при измерении при часовой объемной скорости газа 30000 ч-1. Предпочтительно превращение NO при выдержке при 850°С при температуре 450°С составляет не менее 70%, более предпочтительно не менее 75%, еще более предпочтительно не менее 80%, при измерении при часовой объемной скорости газа 30000 ч-1.
Предпочтительно превращение NO при выдержке при 850°С при температуре 200°С составляет не менее 50%, более предпочтительно не менее 60%, еще более предпочтительно не менее 65%, при измерении при часовой объемной скорости газа 80000 ч-1. Предпочтительно превращение NO при выдержке при 850°С при температуре 450°С составляет не менее 70%, более предпочтительно не менее 75%, еще более предпочтительно не менее 80%, при измерении при часовой объемной скорости газа 80000 ч-1.
Предпочтительно, содержащее медь молекулярное сито из левина после выдержки показывает превращение NOx при 200°С не менее 50%, как измерено при часовой объемной скорости газа 30000 ч-1. Предпочтительно, содержащее медь молекулярное сито из левина после выдержки показывает превращение NOx при 450°С не менее 70%, как измерено при часовой объемной скорости газа 30000 ч-1. Катализаторы выдерживали в гидротермических условиях в трубчатой печи в потоке газа, содержащего 10% H2O, 10% O2, остаток по объему N2, при часовой объемной скорости газа 12 500 ч-1 в течение 24 часов при температуре 750°С. Более предпочтительно превращение NOx после выдерживания составляет при 200°С по меньшей мере 60%, а при 450°С по меньшей мере 75% при измерении при часовой объемной скорости газа 30000 ч-1, еще более предпочтительно превращение NOx после выдерживания составляет при 200°С по меньшей мере 70%, а при 450°С по меньшей мере 80%, при измерении при часовой объемной скорости газа 30000 ч-1, наиболее предпочтительно превращение NOx после выдерживания составляет при 200°С по меньшей мере 80%, а при 450°С по меньшей мере 85%, при измерении при часовой объемной скорости газа 30000 ч-1.
Измерения SCR-активности описаны в литературе, например в WO 2008/106519.
Способ
Таким образом, настоящее изобретение относится к способу получения содержащего медь молекулярного сита из левина, имеющего молярное отношение диоксида кремния к оксиду алюминия менее 30 и атомное отношение Cu:Al менее 0,45, отличающемуся тем, что молекулярное сито из левина сохраняет по меньшей мере 60% его площади поверхности после воздействия температуры от 750°С в присутствии до 10 об.% водяного пара в течение периода времени от около 1 до около 48 часов. Предпочтительно, ацетат меди и/или аммиачные растворы ионов меди используются в качестве источника меди.
Аммиачные растворы ионов меди
Panias et al. (Oryktos Ploutos (2000), 116, 47-56) сообщают о двухвалентных ионах меди в водных аммиачных растворах. На практике аминокомплексы двухвалентной меди Cu(NH3)n2+ являются преобладающими формами, в которых встречается медь в растворах от слегка кислых до сильно щелочных аммиачных растворов. Ион Cu(NH3)42+ является наиболее важным ионом системы Cu2+-NH3-H2O. Они демонстрируют устойчивость в широком диапазоне от умеренно кислых растворов с рН 5 до сильно щелочных растворах с рН 14. Гидроксильные комплексы двухвалентной меди встречаются в системе Cu2+-NH3-H2O только в очень сильно щелочных растворах с рН более 12 и в разбавленных аммиачных растворах с общей концентрацией аммиака меньше 0,1. В аммиачных растворах медь встречается в виде свободных ионов Cu2+ только в очень кислых водных растворах.
Синтез Na+-LEV
Синтез Na+-цеолитов, имеющих структуру LEV, может осуществляться в соответствии с различными методами, известными в данной области (например, US 4,495,303, ЕР 91,048 и ЕР 91,049).
Концентрация
Молярная концентрация меди в жидком растворе меди, используемом в обмене ионов меди, предпочтительно находится в диапазоне от около 0,001 до около 1, более предпочтительно в диапазоне от около 0,01 до около 0,5, еще более предпочтительно в диапазоне от около 0,05 до около 0,3, еще более предпочтительно в диапазоне от около 0,05 до около 0,2.
Отношение жидкости: твердого вещества
Отношение жидкости к твердому веществу, определяемое здесь как соотношение между массой воды и соли меди, используемой для получения раствора Cu, к сухой массе исходного цеолита, используемого на этапе обмена меди, предпочтительно находится в диапазоне от около 0,1 до около 800, более предпочтительно в диапазоне от около 2 до около 80, еще более предпочтительно в диапазоне от около 2 до около 20, еще более предпочтительно в диапазоне от около 2 до около 10, еще более предпочтительно в диапазоне от около 4 до около 8.
Температура реакции
Температура реакции на этапе обмена меди предпочтительно находится в диапазоне от около 15 до около 100°С, более предпочтительно в диапазоне от около 20 до около 60°С. В случае использования аммиачных растворов ионов меди в качестве источника меди температура реакции предпочтительно находится в диапазоне от около 20 до около 35°С, более предпочтительно в диапазоне от около 20 до около 25°С
Порядок добавления реагентов
Реагенты цеолит, источник меди и вода могут быть добавлены в любом порядке. Цеолит может быть добавлен в готовый раствор соли или комплекса меди, который может иметь комнатную температуру или может быть предварительно нагрет до температуры ионного обмена. В альтернативном варианте цеолит может быть предварительное суспендирован в деионизированной воде с последующим добавлением соли или комплекса меди при комнатной температуре или при предварительном нагреве до температуры ионного обмена. Кроме того, порошок цеолита или осадок на фильтре может быть предварительно суспендирован в количестве воды, позволяющим переместить его в реакционный сосуд с помощью насоса, и добавлен к раствору ацетата меди. И вновь, эта операция может выполняться с предварительным нагревом или без него.
Время реакции
Время реакции на этапе ионного обмена предпочтительно находится в диапазоне от около 1 секунды до около 48 часов, более предпочтительно в диапазоне от около 30 секунд до около 8 часов, еще более предпочтительно в диапазоне от около 1 минуты до около 5 часов, еще более предпочтительно в диапазоне от около 10 минут до около 1 часа.
Условия реакции
Предпочтительно, водный раствор соответствующим образом перемешивают. Что касается перемешивания или вращения, типичные параметры находятся в диапазоне от 10 до 500 об/мин (оборотов в минуту). В целом, скорость перемешивания уменьшается по мере увеличения размеров реактора.
рН: использование кислых добавок
Предпочтительно, рН на этапе ионного обмена находится в диапазоне от около 1 до около 6, более предпочтительно в диапазоне от около 2 до около 6, еще более предпочтительно в диапазоне от около 3 до около 5,5. В случае использования аммиачного раствора ионов меди в качестве источника меди рН на этапе ионного обмена находится в диапазоне от около 5 до около 14, более предпочтительно в диапазоне от около 6 до около 12, еще более предпочтительно в диапазоне от около 8 до около 11.
В зависимости от используемых исходных материалов может быть необходимо отрегулировать рН водного раствора, чтобы рН имел значение, превышающее указанные выше. Предпочтительно, рН доводят до описанных выше значений с помощью уксусной кислоты или аммиака, добавляемых в виде водного раствора.
Cu:Al
При использовании ацетата меди соотношение Cu к Al в растворе меди для этапа обмена меди предпочтительно находится в диапазоне от около 0,25 до около 2, более предпочтительно в диапазоне от около 0,5 до 2, более предпочтительно в диапазоне от около 0,5 до 1,5, еще более предпочтительно в диапазоне от около 0,5 до около 1,2. При использовании аммиачных растворов ионов меди соотношение Cu к Al предпочтительно находится в диапазоне от около 0,001 до около 1, более предпочтительно в диапазоне от около 0,25 до около 0,8, более предпочтительно в диапазоне от около 0,25 до около 0,6, еще более предпочтительно в диапазоне от около 0,25 до около 0,5.
Повтор ионного обмена
Этап обмена меди может повторяться от 0 до 10 раз, предпочтительно от 0 до 2 раз.
Последующая обработка
После этапа обмена меди обменную суспензию, содержащую медьсодержащее молекулярное сито из левина согласно изобретению, соответствующим образом отделяют от исходного раствора. Перед отделением температура исходного раствора может быть соответствующим образом снижена до требуемого значения с использованием подходящей скорости охлаждения. Такое разделение может быть осуществлено всеми подходящими способами, известными специалистам в данной области. Молекулярное сито из левина может быть промыто по меньшей мере один раз подходящим промывочным средством, известным специалистам в данной области. После отделения и, необязательно, промывки содержащее медь молекулярное сито из левина может быть высушено и кальцифицировано.
Форма
Молекулярное сито из левина согласно настоящему изобретению может быть предоставлено в виде порошка или распыляемого материала. В целом порошок или распыляемый материал может быть сформирован без каких-либо других соединений, например путем подходящего прессования, чтобы получить формовки желаемой геометрии, например таблетки, цилиндры, сферы и т.п.
Например, порошок или распыляемый материал смешивают или покрывают подходящим огнеупорным связующим. Например, связующим может быть предшественник циркония. Необязательно, порошок или распыляемый материал после смешивания или покрытия подходящим огнеупорным связующим может быть сформированы в виде суспензии, например, с водой, которая наносится на подходящий огнеупорный носитель.
Молекулярное сито из левина согласно настоящему изобретению может также иметь форму экструдатов, гранул, таблеток или частиц любой другой подходящей формы для использования в качестве плотного слоя частиц катализатора или фасонных деталей, таких как пластины, седлообразные детали, трубы и т.п.
Катализатор
Таким образом, настоящее изобретение относится к катализатору, содержащему медьсодержащее молекулярное сито из Левина, расположенное на подложке.
Подложка может быть изготовлена из любого из материалов, обычно используемых для получения катализаторов, и, как правило, содержит керамический материал или металл с ячеистой структурой. Может использоваться любая подходящая подложка, такая как монолитная подложка с тонкими, параллельными каналами для потока газа, проходящими через нее от входного или выходного края подложки, так что указанные каналы открыты для потока среды через них (называются сотовыми подложками со сквозным потоком). Подложка может быть подложкой фильтра со стенным потоком, где каналы поочередно блокируются, позволяя газовому потоку входить в каналы в одном направлении (в направлении входа), чтобы протекать через стенки каналов и выходить из каналов в другом направлении (в направлении выхода). Кроме того, подходящие носители/подложки, а также подходящие процессы нанесения покрытия описаны в международной патентной заявке РСТ/ЕР2009/056036 и WO 2008/106519. РСТ/ЕР2009/056036 и WO 2008/106519 включены сюда путем ссылки.
SCR/система обработки выхлопных газов
В целом описанное выше содержащее медь молекулярное сито из левина может быть использовано в качестве молекулярного сита, адсорбента, катализатора, носителя или связующего катализатора. Особенно предпочтительным является его использование в качестве катализатора.
Кроме того, настоящее изобретение относится к способу катализации химической реакции, отличающемуся тем, что содержащее медь молекулярное сито из Левина согласно данному изобретению используется в качестве каталитически активного материала.
Среди прочего, указанный катализатор может использоваться в качестве катализатора для селективного восстановления (SCR) оксидов азота NOx; для окисления NH3, в частности для окисления NH3 в дизельных системах; для разложения N2O; для окисления сажи; для контроля за выбросами в усовершенствованных выхлопных системах, таких как используются в двигателях с воспламенением от сжатия однородной рабочей смеси (HCCl); в качестве добавки в процессах флюид-каталитического крекинга (FCC); в качестве катализатора в органических реакциях преобразования или в качестве катализатора в процессах со "стационарным источником". Для применения в реакциях окисления, предпочтительно, в медный шабазит добавляют компонент драгоценного металла (например, Pd, Pt).
Таким образом, настоящее изобретение также относится к способу селективного восстановления оксидов азота NOx путем контакта потока, содержащего NOx, с катализатором, содержащим медьсодержащее молекулярное сито из левина в соответствии с настоящим изобретением, в соответствующих условиях восстановления; к способу окисления NH3, в частности окисления NH3 в дизельных системах, путем контакта потока, содержащего NH3, с катализатором, содержащим медьсодержащее молекулярное сито из левина в соответствии с настоящим изобретением, в подходящих условиях окисления; к способу разложения N2O путем контакта потока, содержащего N2O, с катализатором, содержащим медьсодержащее молекулярное сито из левина в соответствии с настоящим изобретением, в подходящих условиях разложения; к способу контроля за выбросами в усовершенствованных выхлопных системах, таких как используются в двигателях с воспламенением от сжатия однородной рабочей смеси (HCCl), путем контакта потока выхлопов с катализатором, содержащим медьсодержащее молекулярное сито из левина, в подходящих условиях; к процессу флюид-каталитического крекинга (FCC), в котором медьсодержащее молекулярное сито из левина в соответствии с настоящим изобретением используется в качестве добавки; к способу преобразования органического соединения путем контакта указанного соединения с катализатором, содержащим медьсодержащее молекулярное сито из левина в соответствии с настоящим изобретением, в подходящих условиях преобразования; к процессу со "стационарным источником", в котором используемый катализатор содержит медьсодержащее молекулярное сито из левина в соответствии с настоящим изобретением.
В частности, селективное восстановление оксидов азота, при котором молекулярное сито из левина в соответствии с настоящим изобретением используется в качестве каталитически активного материала, осуществляется в присутствии аммиака или мочевины. В то время как аммиак является обычно используемым восстановителем для стационарных установок, мочевина обычно используется в качестве восстановителя в мобильных системах SCR. Как правило, системы SCR интегрированы в конструкции двигателя и автомобиля, а также, как правило, содержат следующие основные компоненты: SCR-катализатор, содержащий молекулярное сито из левина в соответствии с настоящим изобретением; бак для хранения мочевины; насос для мочевины; система дозирования мочевины; инжектор/сопло для мочевины, а также соответствующий блок управления.
Способ восстановления NOx
Таким образом, настоящее изобретение также относится к способу селективного восстановления оксидов азота NOx, в котором газовый поток, содержащий оксиды азота NOx, например выхлопные газы, образующиеся в производственном процессе или операции, предпочтительно также содержащие аммиак и/или мочевины, контактируют с молекулярным ситом из левина в соответствии с настоящим изобретением.
Термин оксиды азота (NOx), используемый в контексте настоящего изобретения, обозначает оксиды азота, в частности оксид азота (N2O), монооксид азота (NO), триоксид азота (N2O3), диоксид азота (NO2), тетраоксид азота (N2O4), пентаоксид азота (N2O5), пероксид азота (NO3).
Оксиды азота, которые восстанавливают с использованием катализатора, содержащего молекулярное сито из левина в соответствии с настоящим изобретением или молекулярное сито из левина, которое можно получить или которое получено в соответствии с настоящим изобретением, могут быть получены любым способом, например, в виде потока отходящих газов. Среди прочих могут быть упомянуты потоки отходящих газов, полученных в процессах производства адипиновой кислоты, азотной кислоты, производных гидроксиламина, капролактама, глиоксаля, метил-глиоксаля, глиоксиловой кислоты или в процессах горения азотистых материалов.
Особенно предпочтительным является использование катализатора, содержащего молекулярное сито из левина в соответствии с настоящим изобретением или молекулярное сито из левина, которое может быть получено или получено в соответствии с настоящим изобретением, для удаления оксидов азота NOx из выхлопных газов двигателей внутреннего сгорания, в частности дизельных двигателей, которые работают в условия сгорания с количеством воздуха, превышающим требуемое для стехиометрического сгорания, т.е. обедненных.
Таким образом, настоящее изобретение также относится к способу удаления оксидов азота NOx из выхлопных газов двигателей внутреннего сгорания, в частности дизельных двигателей, которые работают в условиях сгорания с количеством воздуха, превышающим требуемое для стехиометрического сгорания, т.е. обедненных условиях, отличающемуся тем, что катализатор, содержащий молекулярное сито из левина в соответствии с настоящим изобретением или молекулярное сито из левина, которое может быть получено или получено в соответствии с настоящим изобретением, используется в качестве каталитически активного материала. Селективное восстановление NOx означает, что N2 должен быть основным продуктом, в то время как количество побочных продуктов, такие как N2O, сведено к минимуму.
Система обработки выхлопных газов
Настоящее изобретение относится к системе обработки выхлопных газов, включающей поток выхлопных газов, необязательно содержащих аммиак и/или мочевину, и катализатор, содержащий медьсодержащее молекулярное сито из левина, которое может быть получено или получено в соответствии с описанным выше способом, расположенное на подложке, каталитический фильтр сажи и дизельный окислительный катализатор.
Каталитический фильтр сажи может располагаться выше или ниже по потоку от указанного катализатора. Дизельный окислительный катализатор предпочтительное расположен выше по потоку от указанного катализатора. Предпочтительно, дизельный окислительный катализатор и каталитический фильтр сажи расположены выше по потоку от указанного катализатора.
Предпочтительно, выхлопные газы, предпочтительно содержащие NOx, поступают из дизельного двигателя в положение ниже по течению в выхлопной системе, где происходит добавление восстановителя, и поток выхлопных газов с добавленным восстановителем передается к указанному катализатору.
Например, каталитический фильтр сажи, дизельный окислительный катализатор и восстановитель описаны в WO 2008/106519, включенной сюда путем ссылки.
Следующие примеры иллюстрируют способ и материалы согласно данному изобретению.
Примеры:
1. Гидротермический синтез образцов левина
1.1 Гидротермический синтез 31 SiO2:Al2O3
Левин кристаллизовали, как описано в US 4,495,303, используя диэтилдиметиламмония гидроксид в качестве шаблона, а гидроксид натрия в качестве дополнительного источника ОН. Материал собирали путем фильтрации и сушили, затем кальцинировали при 600°С для получения Na-формы левина (пример 1).
Химический анализ показал, что материал имеет 31 SiO2:Al2O3 и содержит 0,11 мас.% Na2O при определении без учета летучих веществ. Дифракционная рентгенограмма показала, что был получен чистый левин (см. фиг.1).
1.2 Гидротермический синтез 29 SiO2:Al2O3
Левин кристаллизовали, как описано в US 4,495,303, используя диэтилдиметиламмония гидроксид в качестве шаблона. Материал собирали путем фильтрации и сушили, затем кальцинировали при 600°С для получения Na-формы левина (пример 2).
Химический анализ показал, что материал имеет 29 SiO2:Al2O3 и содержит 0,88 мас.% Na2O при определении без учета летучих веществ. Дифракционная рентгенограмма показала, что был получен чистый левин (см. фиг.2).
1.3 Гидротермический синтез 26 SiO2:Al2O3
Левин кристаллизовали, как описано в US 4,495,303, используя диэтилдиметиламмония гидроксид в качестве шаблона. Материал собирали путем фильтрации и сушили, затем кальцинировали при 600°С для получения Н-формы левина (пример 3).
Химический анализ показал, что материал имеет 26 SiO2:Al2O3 и содержит <0,01 мас.% Na2O при определении без учета летучих веществ. Дифракционная рентгенограмма показала, что был получен чистый левин (см. фиг.3).
1.4 Гидротермический синтез 22 SiO2:Al2O3
Левин кристаллизовали, как описано в US 4,495,303, используя диэтилдиметиламмония гидроксид в качестве шаблона, а гидроксид натрия в качестве дополнительного источника ОН. Материал собирали путем фильтрации и сушили, затем кальцинировали при 600°С для получения Na-формы Левина (пример 4).
Химический анализ показал, что материал имеет 22 SiO2:Al2O3 и содержит 0,81 мас.% Na2O при определении без учета летучих веществ. Дифракционная рентгенограмма показала, что был получен чистый левин (см. фиг.4).
2. Ионный обмен аммония в примерах 1, 2 и 4
2.1 Подготовка реагентов и суспензии
Использовали следующие исходные материалы:
Нитрат аммония
Деионизированная вода
Натриевый левин согласно примерам 1, 2 и 4, описанный в разделах 1.1, 1.2 и 1.4 соответственно
2.2 Условия ионного обмена и химический анализ
Условия ионного обмена приведены в Таблице 1. 0,125 М раствор нитрата аммония готовили путем растворения соответствующего количества нитрата аммония в деионизированной воде и последующего нагревания до 60°С при перемешивании в 4 л стеклянном реакторе с рубашкой. Затем щелочную форму левина добавляли в водный раствор нитрата аммония. Суспензию перемешивали при 250 об/мин на протяжении всего эксперимента. Объем обменной суспензии поддерживали постоянным при отношении жидкость: твердое вещество 10:1, как было определено выше. Обменную суспензию выдерживали в течение 1 часа при 60°С, а затем фильтровали в горячем состоянии (без дополнительного охлаждения) через воронку Бюхнера с соответствующей фильтровальной бумагой. Осадок на фильтре промывали партиями 1 л деионизированной воды, пока проводимость промывочной воды не достигала 200 µСм см-1. Все образцы осадков на фильтре промывали промывочной водой, имеющей комнатную температуру. В таблице 1 приведены данные химического анализа и полученные продукты.
3 Обмен меди
3.1 Подготовка реагентов и суспензии
Использовали следующие исходные материалы:
Моногидрат ацетата меди
Деионизированная вода
NH4-левин (пример 1 - NH4, пример 2 - NH4 и пример 4 - NH4) и Н-левин (пример 3)
3.2 Условия ионного обмена и химический анализ
В Таблице 2 приведены важнейшие параметры синтеза для ионного обмена при получении соединений примеров a-p. Медьсодержащие вещества примеров а-f получали из соединения примера 4-NH4. Медьсодержащие вещества примеров g-k получали из H-левина, описанного в примере 3. Медьсодержащее вещество примера I было получено из соединения примера 2-NH4. Медьсодержащие вещества примеров m-p получали из соединения примера 1-NH4.
Раствор ацетата меди готовили, растворяя моногидрат ацетата меди в соответствующем количестве деионизированной воды в стеклянном реакторе с рубашкой. Этот раствор нагревали до 60°С при перемешивании, затем добавляли необходимое количество исходного NH4 или H-левина. Как правило, использовали соотношение между жидким и твердым веществом 20, за исключением примера Н, где соотношение между жидким и твердым веществом составляло 10. Температуру 60°С поддерживали в течение 1 часа. Через 1 час ионного обмена суспензию фильтровали в горячем состоянии на воронке Бюхнера. Осадок на фильтре промывали деионизированной водой, пока проводимость промывочной воды не достигала 200 µСм см-1. Образец промывали промывочной водой, имеющей комнатную температуру. Полученный порошок высушивали в печи при температуре 120°С в течение 16 часов. В таблице 2 приведены данные о содержании CuO и Na2O во всех получаемых продуктах. Все значения приведены без учета летучих веществ. Затем рассчитывали Cu:Al и Cu:Н.
Химический анализ, данные которого представлены в Таблице 2, указывает на некоторую изменчивость SiO2:Al2O3, проиллюстрированную в Таблице 4, которая влияет на характеристики катализатора.
4. Получение катализатора (Примеры катализатора А-Р)
Порошок вначале получали в виде экструдата перед тестированием. Типичный процесс получения включает добавление 18 г воды к 20 г сухого порошка в миксере Stephan-Werke GmbH (№модели: OZDe042/4s) со скоростью смешивания 80 оборотов в минуту. Перемешивание продолжали до получения однородной смеси. Для этого потребовалось около 10 минут. Затем добавляли 0,5 г полиэтиленоксида (РЕО) и перемешивание продолжали до получение однородной смеси, что заняло около 2 минут. В смесь добавляли 2,5 мас.% РЕО в качестве связующего. Затем медленно добавляли 2 г воды, и пасту перемешивали в течение около 5 минут до однородности. Пасту прессовали в самодельном прессе с экструзионным отверстием диаметром 2 мм и длиной 10 см. Полученные экструдаты сушили при 120°С в течение 5 часов и кальцинировали при 540°С в течение 5 часов. Экструдат формировали в гранулы и просеивали, чтобы отделить гранулы размером от 0,5 до 1 мм. Эту фракцию использовали для тестирования в реакторе. Используемое сито получали из компании Retsch (сито 500 мкм (серийный №04025277) и сито 1 мм (серийный №04009529), оба с диаметром 200 мм и высотой 25 мм). Полученные катализаторы называют свежеприготовленными, поскольку они не подвергались выдерживанию в гидротермических условиях.
Примеры катализаторов имеют такую же номенклатуру примеров, что и содержащие медь порошки, описанные в Таблице 2. Таким образом, Пример катализатора А в таблицах 3 и 4 является катализатором, полученным согласно описанию в разделе 4 примера а в Таблице 2. В Таблице 3 приведены данные площади поверхности, а в Таблице 4 - данные катализатора.
5. Выдерживание
Реактор для выдерживания состоял из стальной трубы толщиной 1 мм (марка 1.4841, поставляемая Buhlmann Group) высотой 500 мм и внутренним диаметром 18 мм. Печь с кожухом на основе никеля использовалась для нагрева реактора до целевой температуры реакции, которую контролировали с помощью внутренней термопары в месте расположения образца. Пар получали путем нагревания контролируемых количеств воды при 150°С через стальной предварительный парообразователь, прежде чем смешивать с остальными газами в статическом смесителе. Затем газы вместе с паром пропускали через подогреватель для достижения целевой температуры.
Экструдаты, полученные согласно разделу 4, выдерживали в гидротермических условиях в трубчатой печи в потоке газа, содержащего 10% Н2О, 10% О2, остаток - N2, имеющего часовую объемную скорость 12500 ч-1, в течение 24 часов при 750°С или 6 часов при 850°С. Выдерживание при 750°С считается обедненным гидротермическим выдерживанием. Выдерживание при 850°С считается суровым гидротермическим выдерживанием.
В Таблице 3 приведены значения площади поверхности для свежеприготовленного и выдержанного состояний катализатора согласно Примерам А-Р. В Таблице 4 приведены данные катализатора для свежеприготовленного и выдержанного состояний катализаторов тех же примеров.
6. Тестирование катализаторов (Примеры катализатора А-Р)
Образцы выдержанных катализаторов, полученных в разделах 4 и 5 (состояние после выдерживания при 750 и 850), оценивали с точки зрения селективного восстановления NOx, используя следующий реактор:
Реактор состоял из стальной трубы толщиной 1 мм (марка 1.4541, поставляемая Buhlmann Group) высотой 500 мм и внутренним диаметром 18 мм. Печь с кожухом на основе меди использовалась для нагрева реактора до целевой температуры реакции, которую контролировали с помощью внутренней термопары в месте расположения образца.
5 мл образца загружали в реактор и закрепляли пробкой из силикатной ваты на каждом краю образца. Высоту образца контролировали путем заполнения пустого объема реактора инертным материалом на основе оксида кремния (Ceramtek AG - продукт №1.080001.01.00.00; от 0,5 до 1 мм - 45 г на дне и 108 г в верхней части образца).
Газовую смесь на входе формировали со следующим составом: 500 частей на миллион NO, 500 частей на миллион NH3, 10% O2, 5% пара и остаток - Не. Пар получали путем нагревания контролируемых количеств воды при 150°С через стальной предварительный парообразователь (марка 1.4541 производства Buhlmann, внутренний диаметр 6 мм и длина 900 мм), прежде чем смешивать с остальными газами в статическом смесителе. Эту газовую смесь затем пропускали через подогреватель с установкой температуры 250°С и статический смеситель, а затем подавали в SCR-реактор, описанный в предыдущем абзаце.
Активность DeNOx измеряли в стационарных условиях путем измерения концентраций NOx, NH3, N2O на выходе с помощью спектрометра FTIR. Образцы тестировали при температурах реакции 200 и 450°С. Кроме того, их тестировали при часовой объемной скорости газа 30000 и 80000 ч-1. Превращение NO рассчитывали следующим образом: (концентрация NO на выходе (частей на миллион/концентрация NO на входе (частей на миллион)) × 100. Выход N2O также регистрировали в виде концентрации в частях на миллион.
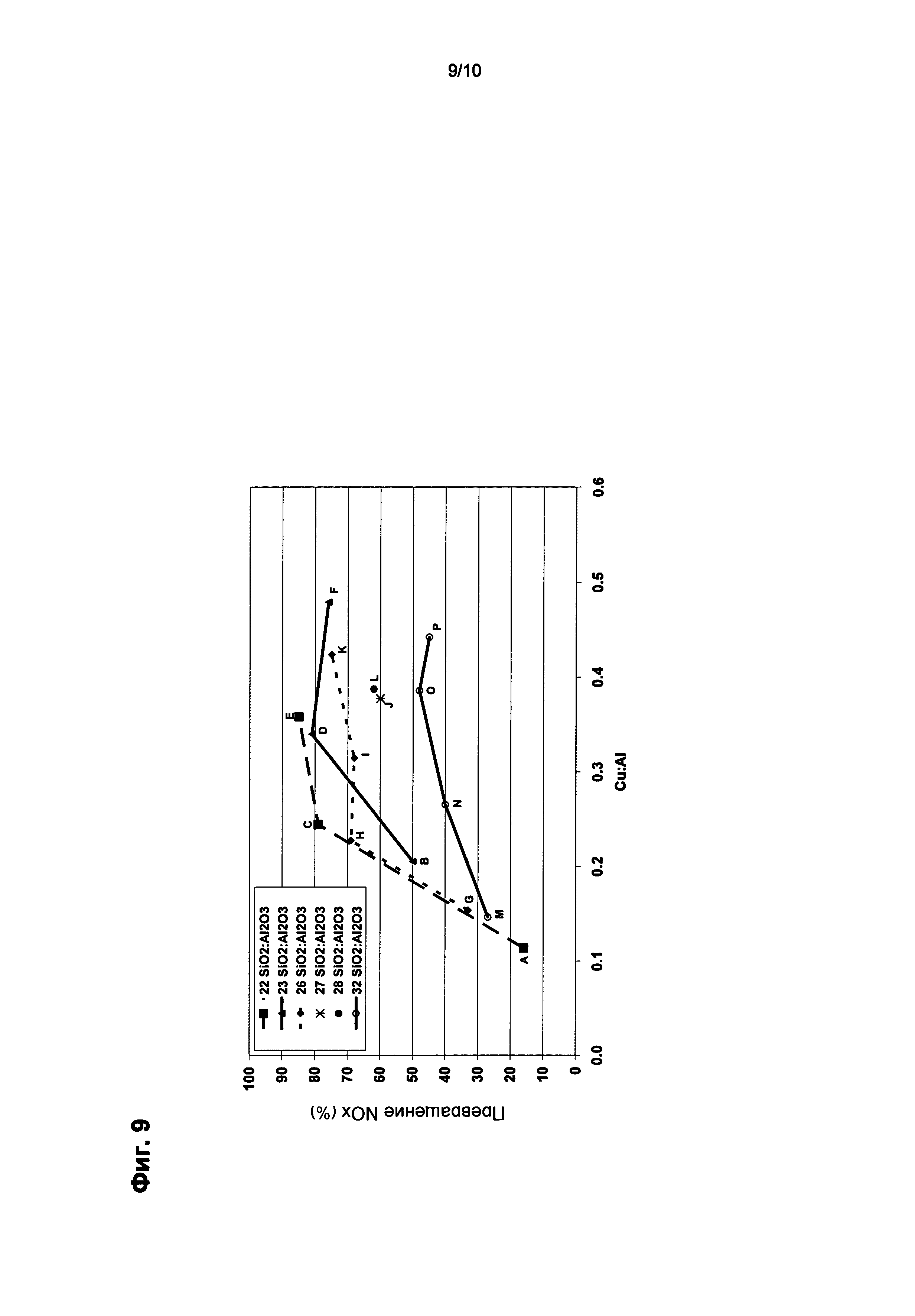
На Фиг.5-9 проиллюстрирована активность DeNOx катализаторов согласно Примерам А-Р после выдерживания при температуре реакции 200 и 450°С и указанных часовых объемных скоростях. Выход N2O для всех образцов был меньше 11 частей на миллион при 200°С и меньше 37 частей на миллион при 450°С.
На Фиг.5 проиллюстрирована активность DeNOx (%) выдержанного при 750°С катализатора в зависимости от содержания CuO (мас.%) при 200°С для катализаторов согласно Примерам А-Р, измеренная при часовой объемной скорости 30000 ч-1.
На Фиг.6 проиллюстрирована активность DeNOx (%) выдержанного при 850°С катализатора в зависимости от содержания CuO (мас.%) при 200°С для катализаторов согласно Примерам А-Р, измеренная при часовой объемной скорости 30000 ч-1.
На Фиг.7 проиллюстрирована активность DeNOx (%) выдержанного при 750°С катализатора в зависимости от содержания CuO (мас.%) при 450°С для катализаторов согласно Примерам А-Р, измеренная при часовой объемной скорости 30000 ч-1.
На Фиг.8 проиллюстрирована активность DeNOx (%) выдержанного при 850°С катализатора в зависимости от содержания CuO (мас.%) при 450°С для катализаторов согласно Примерам А-Р, измеренная при часовой объемной скорости 80000 ч-1.
На Фиг.9 проиллюстрирована активность DeNOx (%) выдержанного при 750°С катализатора в зависимости от Cu:Al при 200°С для катализаторов согласно Примерам А-Р, измеренная при часовой объемной скорости 30000 ч-1.
На Фиг.10 проиллюстрировано сохранение площади поверхности катализаторами согласно Примерам А-Р после выдерживания при 750°С в зависимости от содержания CuO (мас.%).
Сравнительный пример 1: коммерчески доступный FeBeta
В качестве материала для сравнения использовали коммерчески доступный FeBeta. Состав материала: ~36 SiO2: Al2O3 и ~1,9 мас.% Fe2O3.
Сравнительный пример 2: Cu/ZSM-5
ZSM-5 был получен коммерческим путем из компании Zeolyst и подвергся процессу обмена меди для использования в качестве материала для сравнения. Состав исходного материала CBV2314: 23 SiO2:Al2O3 и 0,05 мас.% Na2O. Процесс обмена меди проводили, как описано в разделе 3. Концентрация меди составила 0,1 М, а отношение жидкости к твердому веществу - 10:1. Полученный продукт имел следующий состав: 24 SiO2:Al2O3 с 3,28 мас.% CuO и <0,01 мас.% Na2O.
Сравнительный пример 3: Выдерживание
Катализаторы получали согласно сравнительным примерам 1 и 2, как описано в разделе 4, а затем подвергали гидротермическому выдерживанию, как описано в разделе 5. Оба катализатора выдерживали при 750°С, в 10% пара в течение 24 часов и при часовой объемной скорости 12500 ч-1.
Сравнительный пример 4: Тестирование катализаторов
Выдержанные катализаторы затем тестировали, как описано в разделе 6, при значениях часовой объемной скорости 30000 и 80000 ч-1. В Таблице 4 приведены данные активности DeNOx для выдержанных Fe/Beta и Cu/ZSM-5.
8. Сравнение с предыдущим уровнем техники
FeBeta является эффективным катализатором для селективного каталитического восстановления NOx аммиаком, но он не отвечает требованиям при низкой температуре и не обладает необходимой гидротермической стабильностью, чтобы соответствовать экологическим нормам, которые становятся все более строгими. WO 2008/106519, WO 2008/132452 и WO 2008/118434 раскрывают CuSSZ-13 в качестве катализатора SCR, обладающего улучшенными характеристиками при низких температурах и гидротермической стабильностью по сравнению с FeBeta. SSZ-13 соответствует технологии шабазита, в которой значительные затраты связаны с дорогостоящим шаблоном - триметиладамантиламмоний гидроксидом, необходимым для синтеза исходного цеолита перед модификацией с использованием Cu. Левин обеспечивает значительное снижение в связи с возможностью использования более дешевых шаблонов. WO 2008/132452 раскрывает материал CuNu-3 (левинового типа), обладающий улучшенными характеристиками по сравнению с FeBeta, но уступающий CuSSZ-13 с точки зрения превращения NOx при 200 и 450°С. Кроме того, Nu-3 не обеспечивает преимуществ по затратам, поскольку метил-хинуклидин является дорогостоящим шаблоном. Настоящее изобретение обеспечивает улучшение характеристик Cu-левина (CuLevyne), указанных в WO 2008/132452. Данное изобретение также обеспечивает сопоставимые с CuSSZ-13 каталитические свойства и долговечность с меньшими затратами за счет использования более дешевого шаблона (диэтилдиметиламмоний гидроксида).
Реферат
Настоящее изобретение относится к способу получения содержащего медь молекулярного сита из левина, к его применению в качестве катализатора для селективного восстановления оксидов азота NOи к способу селективного восстановления оксидов азота NOв присутствии полученного катализатора. Молекулярное сито имеет молярное отношение диоксида кремния к оксиду алюминия менее 30 и атомное отношение Cu:Al менее 0,45. Содержащее медь молекулярное сито из левина получено путем ионного обмена указанного молекулярного сита с аммиачным раствором ионов меди при температуре от около 20°С до около 35°С и рН от около 5 до около 14. Технический результат - сохранение по меньшей мере 60% площади поверхности молекулярного сита после воздействия температуры от около 750°С до около 950°С в присутствии до 10 об.% водяного пара в течение периода времени от около 1 до около 48 часов. 3 н. и 3 з.п. ф-лы, 10 ил., 4 табл., 4 пр.

Комментарии