Новое органическое соединение и включающее его органическое светоизлучающее устройство - RU2510390C1
Код документа: RU2510390C1
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым органическим соединениям и органическим светоизлучающим устройствам, включающим такие органические соединения.
Уровень техники
Органическое светоизлучающее устройство включает анод, катод и слой органического соединения, расположенного между ними. Когда два электрода вводят электроны и дырки в слой органического соединения, органическое соединение, содержащееся в нем, генерирует экситоны и излучает свет, когда экситоны возвращаются в основное состояние.
Органические светоизлучающие устройства называют также органическими электролюминесцентными (EL) устройствами.
До настоящего времени интенсивно проводили разработку новых люминесцентных органических соединений. Разработка таких соединений является важной для обеспечения получения высокопроизводительных органических светоизлучающих устройств.
В качестве примера такого органического соединения в PTL 1 описано примерное соединение 1-А:
[Хим. соед. 1]

В качестве другого примера такого органического соединения в PTL 2 описано примерное соединение 1:
[Хим. соед. 2]

Перечень ссылок
Патентная литература
PTL 1: выложенная заявка на патент Японии № 2008-235734
PTL 2: выложенная заявка на патент Японии № 2008-300753
Сущность изобретения
Органические соединения, описанные в PTL 1 и 2, сами почти не излучают свет. Оба из примерных соединений 1-А и 1, показанные в приведенных выше формулах, состоят из незамещенных конденсированных колец. Другими словами, эти органические соединения имеют основные конденсированные циклические системы, представленные указанными выше структурными формулами.
Соответственно этому данное изобретение предлагает новое органическое соединение, которое может излучать свет только своей основной циклической системой и которое может излучать свет в зеленой области.
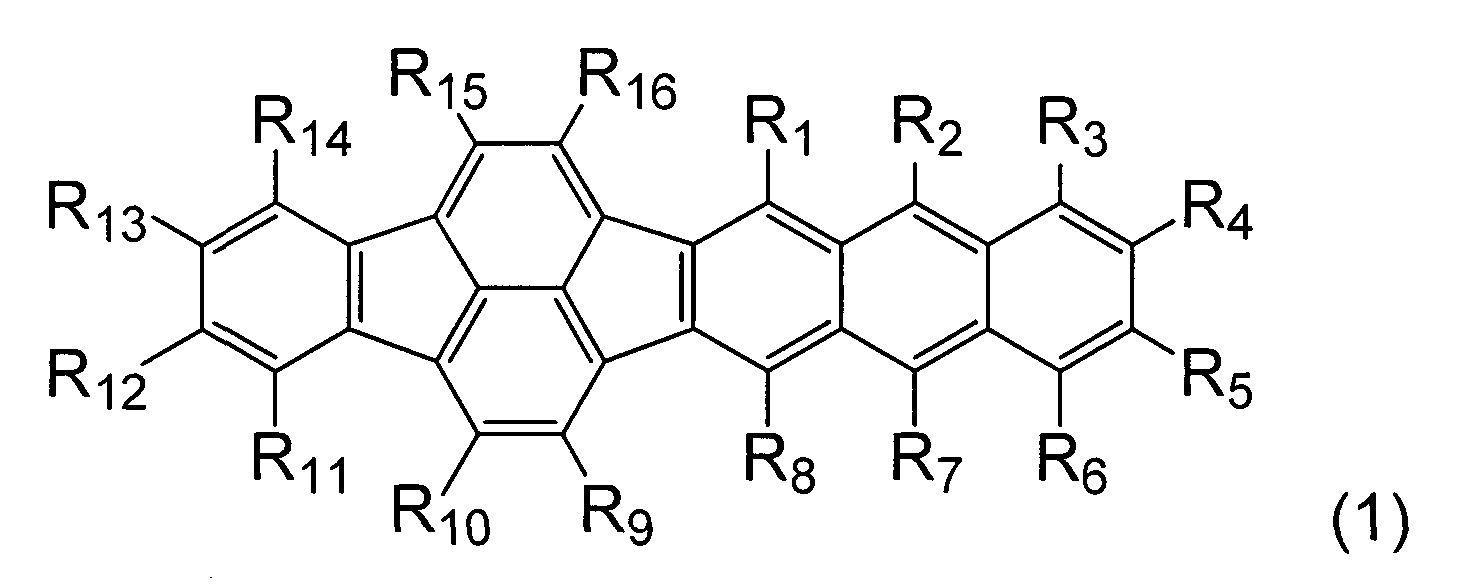
Согласно аспекту настоящего изобретения предложено органическое соединение, представленное общей формулой (1):
[Хим. соед. 3]

В формуле (I) каждый из R1 - R16 независимо выбран из атома водорода, атома галогена, замещенной или незамещенной алкильной группы, замещенной или незамещенной алкоксигруппы, замещенной аминогруппы, замещенной или незамещенной арильной группы и замещенной или незамещенной гетероциклической группы.
Согласно указанному выше аспекту настоящего изобретения может быть предложено новое органическое соединение, имеющее широкую запрещенную энергетическую зону и глубокий энергетический уровень LUMO (низшей незанятой молекулярной орбитали) только при наличии указанной выше основной конденсированной циклической системы. Таким образом, органическое соединение излучает свет в зеленой области только при наличии у него указанной основной циклической системы. Кроме того, введение заместителя в основную циклическую систему дает новое органическое соединение, способное излучать свет в красной области, а не в зеленой области. Кроме того, может быть предложено органическое светоизлучающее устройство, включающее такое новое органическое соединение.
Краткое описание чертежа
Фигура 1 представляет собой схематическое секционное изображение органических светоизлучающих устройств и переключающих устройств, соединенных с органическими излучающими свет устройствами.
Описание вариантов осуществления
Органическое соединение согласно варианту осуществления настоящего изобретения представлено общей формулой (1):
[Хим. соед. 4]

В формуле (1) каждый из R1 - R16 независимо выбран из атома водорода, атома галогена, замещенной или незамещенной алкильной группы, замещенной или незамещенной алкоксигруппы, замещенной аминогруппы, замещенной или незамещенной арильной группы и замещенной или незамещенной гетероциклической группы.
Арильная группа и гетероциклическая группа могут быть замещены алкильной группой.
Аминогруппа может быть замещена алкильной или арильной группой.
В формуле (1) алкильной группой может быть, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, октил, 1-адамантил или 2-адамантил.
В формуле (1) алкоксигруппой может быть, например, метокси, этокси, пропокси, 2-этилоктилокси, фенокси, 4-трет-бутилфенокси, бензилокси или тиенилокси.
В формуле (1) аминогруппой может быть, например, N-метиламино, N-этиламино, N,N-диметиламино, N,N-диэтиламино, N-метил-N-этиламино, N-бензиламино, N-метил-N-бензиламино, N,N-дибензиламино, анилино, N,N-дифениламино, N,N-динафтиламино, N,N-дифлуорениламино, N-фенил-N-толиламино, N,N-дитолиламино, N-метил-N-фениламино, N,N-дианизолиламино, N-метил-N-фениламино, N,N-димезитиламино, N-фенил-N-(4-трет-бутилфенил)амино или N-фенил-N-(4-трифторметилфенил)амино.
В формуле (1) арильной группой может быть, например, фенил, нафтил, инденил, бифенил, терфенил или флуоренил.
В формуле (1) гетероциклической группой может быть, например, пиридил, оксазолил, оксадиазолил, тиазолил, тиадиазолил, карбазолил, акридинил или фенантролил.
Авторы настоящего изобретения сосредоточили внимание на молекулах, состоящих только из основной конденсированной циклической системы, которая имеет длины волн пиковой эмиссии, находящихся в пределах области предполагаемой длины волны эмиссии. Основная конденсированная циклическая система согласно данному варианту осуществления представлена следующей структурной формулой:
[Хим. соед. 5]

Хотя известно, что основная конденсированная циклическая система соединения может быть замещена для достижения предполагаемой длины волны эмиссии, это может ослабить стабильность соединения. Поэтому ввиду стабильности соединения важно, чтобы молекула соединения состояла только из основной циклической системы и имела такую длину волны пиковой эмиссии, которая так близка предполагаемой длине волны эмиссии, как возможно.
В этом варианте осуществления предполагаемой областью длины волны эмиссии является зеленая область, особенно от 480 до 530 нм длины волны пиковой эмиссии.
Сравнение основной конденсированной циклической системы органического соединения согласно варианту осуществления с другими основными конденсированными циклическими системами
Основная конденсированная циклическая система органического соединения согласно данному варианту осуществления теперь будет сравниваться со следующими основными конденсированными циклическими системами:
[Хим. соед. 6]

[Хим. соед. 7]

Органическое соединение (с в таблице 1), полученное замещением основной конденсированной циклической системы органического соединения согласно данному варианту осуществления фенильными группами, органическое соединение (а в таблице 1), которое является незамещенной основной циклической системой, представленной формулой (А), и органическое соединение (b в таблице 1), полученное замещением основной циклической системы, представленной формулой (В), фенильными группами, сравнивали по характеристикам эмиссии. Символ “-“ в таблице означает, что никакую эмиссию не наблюдают в ультрафиолетовой и видимой областях.
Органическое соединение, обозначенное как а в таблице 1, почти не излучает свет в ультрафиолетовой и видимых областях. Поэтому квантовый выход не могли измерить. Органическое соединение, обозначенное как b в таблице 1, слабо излучает свет. Однако это соединение излучает желтый свет с длиной волны пиковой эмиссии 550 нм, поскольку интенсивность свечения является низкой при колебательном уровне для 0-0 и максимизируется при другом колебательном уровне. То есть это соединение имеет низкую интенсивность свечения и не излучает зеленый свет. Органическое соединение, обозначенное как с в таблице 1, согласно данному варианту осуществления имеет высокий квантовый выход и излучает зеленый свет с длиной волны пиковой эмиссии 516 нм.
Таким образом, сама основная циклическая система индено[1,2,3-cd]флуорантена, обозначенная как а в таблице 1, является неподходящей в качестве светоизлучающего вещества. Аналогично этому органическое соединение, обозначенное как b в таблице 1, которое имеет основную конденсированную циклическую систему, образованную конденсацией кольца бензола с указанной выше циклической системой, является неподходящим в качестве светоизлучающего вещества, поскольку оно излучает желтый свет и едва излучает свет. В противоположность этому органическое соединение, обозначенное как с в таблице 1, согласно данному варианту осуществления, которое имеет основную циклическую систему, образованную конденсацией кольца нафталина с основной циклической системой индено[1,2,3-cd]флуорантена в направлении, в котором сопряжение его удлиняется, излучает зеленый свет и имеет высокий квантовый выход.
Хотя предполагается, что увеличение числа конденсированных колец у удлиненного сопряжения обычно изменяет цвет от синего до зеленого, желтого и красного, связь между структурой, обозначенной как b в таблице 1, и структурой, обозначенной как с в таблице 1, согласно данному варианту осуществления противоречит указанному выше предположению. То есть предполагается, что соединение, обозначенной как с в таблице 1, излучает красный свет, т.е. цвет света, излучаемого от соединения, обозначенного как b в таблице 1; вопреки ожиданию авторами изобретения обнаружено, что соединение, обозначенное как с в таблице 1, излучает зеленый свет.
Кроме того, квантовый выход органического соединения, обозначенного как с в таблице 1, согласно данному варианту осуществления, по меньшей мере в десять раз выше, чем квантовый выход соединения, обозначенного как b в таблице 1:
[Хим. соед. 8]
Кроме того, основная конденсированная циклическая система органического соединения согласно данному варианту осуществления является такой плоской, что, вероятно, имеет место молекулярная упаковка, когда образуется пленка. Это приводит к более длинной волне эмиссии, чем длина волны самой молекулы. Для применения длины волны эмиссии только молекулы, когда образуется пленка, авторы данного изобретения считают, что важно ввести заместитель в основную конденсированную циклическую систему. Плоскость основной конденсированной циклической системы органического соединения согласно данному варианту осуществления может образовывать почти прямой двугранный угол с плоскостью введенного в него заместителя. В частности, эффективно вводить арильную группу по меньшей мере в один из R1, R2, R7 и R8.
Кроме того, органическое соединение согласно данному варианту осуществления имеет глубокий уровень энергии HOMO (высшей занятой молекулярной орбитали), поскольку оно имеет два пятичленных кольца в его основной конденсированной циклической системе. То есть органическое соединение согласно этому варианту осуществления имеет низкий потенциал окисления. Таким образом, органическое соединение согласно этому варианту осуществления является устойчивым к окислению.
Кроме того, органическое соединение согласно этому варианту осуществления не имеет гетероатома, такого как атом азота, в его основной циклической системе. Это также содействует низкому потенциалу окисления, то есть стойкости органического соединения к окислению.
Основная конденсированная циклическая система органического соединения согласно данному варианту осуществления имеет глубокий уровень энергии НОМО. Ввиду существования связи между уровнями энергии НОМО и LUMO и энергетическим интервалом это означает также, что уровень энергии LUMO является глубоким. Таким образом, органическое соединение согласно данному варианту осуществления легко акцептирует электроны.
Органическое соединение согласно этому варианту осуществления служит не только в качестве излучающего зеленый свет вещества, но также в качестве излучающего красный свет вещества, если основная конденсированная циклическая система имеет заместитель, который делает длину волны эмиссии более длинной. Это вещество с более длинной длиной волны является стабильным к окислению, поскольку оно имеет такую же основную конденсированную циклическую систему, как и органическое соединение согласно этому варианту осуществления.
Примеры заместителей для получения эмиссии с более длинной длиной волны включают триариламин и антрацен. Для регуляции длины волны эмиссии такой заместитель можно ввести по меньшей мере в один из радикалов R4, R5, R12 и R13 основной циклической системы органического соединения согласно данному варианту осуществления.
Органическое соединение согласно данному варианту осуществления можно применять в качестве “вещества-гостя” или “вещества-хозяина” для светоизлучающего слоя органического светоизлучающего устройства. Конкретно, органическое соединение можно применять в качестве “вещества-гостя” для светоизлучающего слоя, более конкретно, “вещества-гостя” для светоизлучающего слоя излучающего зеленый свет устройства.
Если органическое соединение согласно этому варианту осуществления применяют в качестве “вещества-гостя” для светоизлучающего слоя, применяемым “веществом-хозяином” может быть органическое соединение, имеющее более мелкий уровень LUMO, чем “вещество-гость”, другими словами, органическое соединение, уровень LUMO которого ближе к вакуумному уровню. Это позволяет “веществу-гостю” легче акцептировать электроны, поставляемые “веществу-хозяину”.
Термин “вещество-хозяин”, применяемый в контексте, относится к веществу, имеющему самую высокую весовую долю компонентов светоизлучающего слоя. Термин “вещество-гость”, применяемый в контексте, относится к веществу, имеющему более низкую весовую долю, чем “вещество-хозяин” среди компонентов светоизлучающего слоя, и ответственному за излучение света. Кроме того, термин “вещество-помощник”, применяемый в контексте, относится к веществу, имеющему более низкую массовую долю, чем вещество-хозяин среди компонентов светоизлучающего слоя, и помогающему веществу-гостю в излучении света.
Органическое соединение согласно данному варианту осуществления можно также применять в качестве вещества-хозяина для излучающего красный свет слоя.
Помимо этого, органическое соединение согласно данному варианту осуществления можно применять в качестве любого из слоев, другого, чем светоизлучающий слой, включая слой ввода дырок, слой переноса дырок, слой блокирования дырок/экситонов, слой переноса электронов и слой ввода электронов.
Примеры органических соединений согласно варианту осуществления
Примеры органических соединений согласно данному варианту осуществления включают, но не ограничиваются следующими соединениями:
[Хим. соед. 9]

[Хим. соед. 10]

[Хим. соед. 11]

Свойства группы примерных соединений
Из примерных соединений соединения группы А имеют низкий уровень энергии НОМО вследствие того, что целая молекула, а не только ее основная конденсированная циклическая система состоит только из углеводородных групп. Это означает, что эти органические соединения имеют низкий потенциал окисления и поэтому являются стабильными к окислению.
С другой стороны, если любой заместитель имеет гетероатом, как в группе соединений В, значительно изменяется потенциал окисления молекулы или изменяется межмолекулярное взаимодействие. Если любой заместитель имеет гетероатом, он может обеспечить более длинную длину волны максимального излучения. Кроме того, если любой заместитель имеет гетероатом, соединение можно использовать, например, для применений, в которых его применяют при высокой концентрации, приближающейся к 100%, в качестве вещества переноса электронов, вещества переноса дырок или светоизлучающего вещества дырочной ловушки.
Таким образом, примерные соединения показаны как соединения групп А и В. Эти соединения излучают зеленый свет только их основной конденсированной циклической системой. Кроме того, органическое соединение согласно данному варианту осуществления может излучать свет, имеющий более длинную длину волну, чем зеленый свет, особенно красный свет, если его основная циклическая система замещена.
В частности, органическое соединение согласно данному варианту осуществления может быть представлено общей формулой (2):
[Хим. соед. 12]
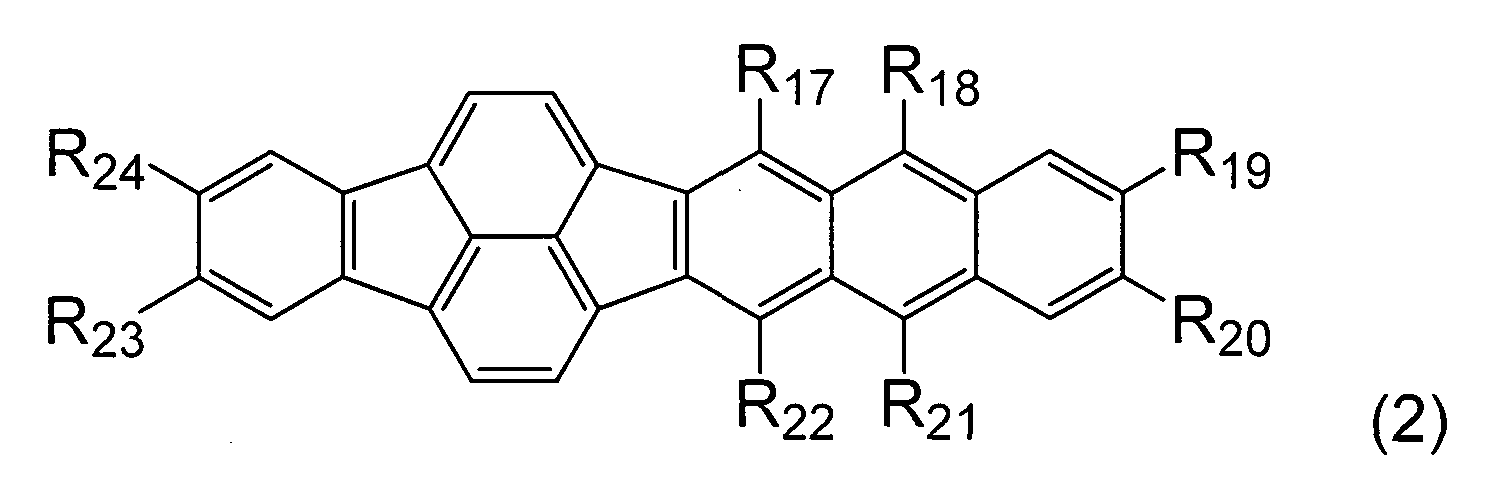
В общей формуле (2) каждый из R17 - R24 независимо выбран из алкильной группы, имеющей от одного до четырех атомов углерода, и арильной группы.
Арильная группа представляет собой фенил, нафтил, бифенил или терфенил.
Арильная группа может быть замещена алкильной группой, имеющей от одного до четырех атомов углерода.
Если любой из R17, R18, R21 и R22 представляет собой арильную группу, он образует большой двугранный угол с основной циклической системой органического соединения согласно данному варианту осуществления.
Это ингибирует образование молекулярной упаковки, тем самым обеспечивая сильное препятствие ослаблению концентрации.
Если R19, R20, R23 или R24 представляет собой заместитель, он может вызывать излучение с более длинной длиной волны. Если заместитель представляет собой арильную группу, он может вызывать излучение с еще более длинной длиной волны.
Описание пути синтеза
Теперь будет описан пример пути синтеза органического соединения согласно данному варианту осуществления. Формулы соединений реакций показаны ниже.
Для синтеза соединения, имеющего заместитель, введенный в заданное положение, атом водорода в заданном положении можно заменить другим заместителем. Примеры заместителей включают алкильную группу, атом галогена и фенильную группу:
[Хим. соед. 13]
Путь синтеза 1

[Хим. соед. 14]
Путь синтеза 2

Другие органические соединения и их исходные вещества
Различные органические соединения можно синтезировать изменением D1 - D6 в указанных выше формулах соединений реакций. В таблицах 2 и 3 показаны примеры синтезированных соединений.


Описание органического светоизлучающего устройства
Затем будет описано органическое светоизлучающее устройство согласно варианту осуществления настоящего изобретения.
Органическое светоизлучающее устройство согласно данному варианту осуществления включает по меньшей мере пару электродов, а именно анод и катод, и слой органического соединения, расположенного между ними. Слой органического соединения содержит органическое соединение согласно настоящему изобретению.
Если слой органического соединения является светоизлучающим слоем, он может быть образован только органическим соединением согласно настоящему изобретению или может содержать другой компонент.
Случай, когда светоизлучающий слой содержит другой компонент, означает случай, когда светоизлучающий слой содержит вещество-хозяин или вещество-помощник, а также компонент, ответственный за излучение света. Органическое соединение согласно настоящему изобретению может быть веществом-хозяином, веществом-гостем или веществом-помощником.
Если органическое соединение согласно настоящему изобретению применяют в качестве вещества-гостя, концентрация вещества-гостя в веществе-хозяине предпочтительно составляет от 0,01 до 20 масс.%, более предпочтительно от 0,5 до 10 масс.%.
В результате различных исследований авторы настоящего изобретения обнаружили, что устройство, образованное с применением органического соединения согласно настоящему изобретению в качестве вещества-хозяина или вещества-гостя светоизлучающего слоя, в частности вещества-гостя, обеспечивает оптический выход с высокой эффективностью и высокой яркостью и имеет очень высокую продолжительность срока службы.
Теперь будут описаны примеры органических светоизлучающих устройств, в которых применяют органические соединения согласно данному варианту осуществления.
Примером органического светоизлучающего устройства согласно данному варианту осуществления является устройство, включающее субстрат, на котором расположены анод, светоизлучающий слой и катод в указанном выше порядке. Другим примером является устройство, включающее анод, слой переноса дырок, слой переноса электронов и катод, расположенные в указанном выше порядке. Другие примеры включают устройство, включающее анод, слой переноса дырок, светоизлучающий слой, слой переноса электронов и катод, расположенные в указанном выше порядке; устройство, включающее анод, слой ввода дырок, слой переноса дырок, светоизлучающий слой, слой переноса электронов и катод, расположенные в указанном выше порядке; и устройство, включающее анод, слой переноса дырок, светоизлучающий слой, слой блокирования дырок/экситонов, слой переноса электронов и катод, расположенные в указанном выше порядке. Эти примеры, однако, являются только основными структурами устройств, и структуры органических светоизлучающих устройств согласно данному варианту осуществления не ограничиваются ими; можно применять различные слоистые структуры, включающие в себя, например, структуру, включающую разделяющий слой у поверхности раздела между электродом и слоем органического соединения, структуру, включающую адгезивный слой или разделяющий слой, и структуру, включающую слой переноса электронов или дырок, состоящий из двух слоев с разными потенциалами ионизации.
Помимо органического соединения согласно настоящему изобретению можно необязательно применять другие соединения, включающие известное, имеющее низкую молекулярную массу или полимерное соединение для ввода дырок или соединение переноса дырок, известное, имеющее низкую молекулярную массу или полимерное соединение-хозяин или люминесцентное соединение (вещество-хозяин) и известное, имеющее низкую молекулярную массу или полимерное соединение для ввода электронов или соединение переноса электронов.
Примеры таких соединений показаны ниже.
Применяемым соединением ввода дырок или переноса дырок может быть вещество, имеющее высокую подвижность дырок. Примеры имеющих низкую молекулярную массу или полимерных веществ со свойствами ввода дырок или свойствами переноса дырок включают, но не ограничиваются перечисленным, триариламины, фенилендиамины, стильбены, фталоцианины, порфирины, поливинилкарбазол, политиофен и другие обладающие проводимостью полимеры.
В таблице 4 показаны конкретные структурные формулы соединений-хозяев. В качестве соединения-хозяина можно применять соединения, имеющие структурные формулы, показанные в таблице 4. Другие примеры включают, но не ограничиваются перечисленным, соединения с конденсированными кольцами (такие как флуорены, нафталины, антрацены, пирены, карбазолы, хиноксалины и хинолины), алюминийорганические комплексы, такие как трис-(8-хинолинолато)алюминий, цинкорганические комплексы, трифениламины, и полимеры, такие как полифлуорены и полифенилены.

Применяемое соединение для ввода электронов или соединение для переноса электронов выбирают, принимая во внимание, например, уравновешивание против мобильности дырок соединения ввода дырок или соединения переноса дырок. Примеры соединений со свойствами ввода электронов или свойствами переноса электронов включают, но не ограничиваются перечисленным, оксадиазолы, оксазолы, пиразины, триазолы, триазины, хинолины, хиноксалины, фенантролины и алюминийорганические комплексы.
Применяемым материалом анода может быть материал, имеющий более высокую рабочую функцию. Примеры таких материалов включают металлы, такие как золото, платина, серебро, медь, никель, палладий, кобальт, селен, ванадий и вольфрам и их сплавы, и оксиды металлов, такие как оксид олова, оксид цинка, оксид индия, оксид индия-олова (ITO) и оксид индия-цинка (IZO). Можно также применять обладающие проводимостью полимеры, такие как полианилин, полипиррол и политиофен. Эти материалы электродов можно применять по отдельности или в комбинации. Анод может иметь либо однослойную структуру, либо многослойную структуру.
С другой стороны, применяемым материалом катода может быть материал, имеющий более низкую рабочую функцию. Примеры таких материалов включают щелочные металлы, такие как литий; щелочноземельные металлы, такие как кальций; и металлы, такие как алюминий, титан, марганец, серебро, свинец и хром. Можно также применять сплавы этих металлов, включающие сплавы магний-серебро, алюминий-литий и алюминий-магний. Кроме того, можно применять оксиды металлов, такие как ITO. Эти материалы электродов можно применять по отдельности или в комбинации. Катод может иметь либо однослойную структуру, либо многослойную структуру.
В органическом светоизлучающем устройстве согласно данному варианту осуществления слой, содержащий органическое соединение согласно настоящему изобретению, и слои других органических соединений обычно образуют вакуумным нанесением, нанесением с помощью ионов, распылением, нанесением с помощью плазмы или известным способом нанесения покрытия для образования тонкой пленки с применением подходящего растворителя (таким как нанесение покрытия с быстрым вращением, погружение, литье, нанесение методикой Langmuir-Blodgett (LB) или струйное нанесение). Если слои образуют вакуумным нанесением или нанесением покрытия раствором, они имеют лучшую стабильность на протяжении длительного периода времени вследствие того, что, например, у них не имеется тенденции к кристаллизации. Если слои образуют нанесением покрытия в комбинации с подходящей связующей смолой, можно получить слои в виде пленок.
Примеры связующих смол включают, но не ограничиваются перечисленным, поливинилкарбазоловые смолы, поликарбонатные смолы, сложные полиэфирные смолы, акрилонитрилбутадиенстирольные (ABS) смолы, акриловые смолы, полиимидные смолы, фенольные смолы, эпоксидные смолы, силиконовые смолы и карбамидные смолы. Эти связывающие смолы можно применять по отдельности в виде гомополимера или сополимера или можно применять в виде смеси двух или более смол. Кроме того, в комбинации с ними можно необязательно применять известные добавки, такие как пластификатор, антиоксидант и поглотитель ультрафиолетовых лучей.
Дисплейное устройство, включающее органические светоизлучающие устройства
Теперь будут описаны устройства, включающие органические светоизлучающие устройства согласно данному варианту осуществления.
Органическое светоизлучающее устройство согласно данному варианту осуществления можно применять для дисплейного устройства или устройства для освещения. Другие применения включают источники света для экспонирования для образующих электрофотографические изображения устройств и задней подсветки для дисплейных устройств на жидких кристаллах.
Дисплейное устройство включает блок отображения на экране дисплея, включающий органические светоизлучающие устройства согласно данному варианту осуществления. Блок отображения на экране дисплея имеет множество пикселей. Пиксели включают органические светоизлучающие устройства согласно данному варианту осуществления и тонкопленочные транзисторы (TFT), которые служат в качестве примера переключающих устройств. Аноды или катоды органических светоизлучающих устройств связаны со стоками или источниками TFT. Дисплейное устройство можно применять, например, в качестве устройства для визуального отображения информации для персональных компьютеров. Дисплейное устройство можно также сконструировать в виде устройства для ввода изображения, дополнительно включающего блок ввода изображения.
Устройство ввода изображения включает блок ввода изображения, установленный для ввода информации, например, из сенсора устройства с зональной зарядной связью (CCD), сенсора устройства с линейной зарядной связью или платы памяти, и блок отображения на экране дисплея, установленный для воспроизведения входной информации. Устройство ввода изображения можно также выполнить в виде устройства захвата изображения, такого как цифровая камера, дополнительно включающая оптическую систему захвата изображения. Для устройства захвата изображения или струйного принтера устройство отображения может иметь как функцию вывода изображения для отображения некоторого изображения на основе информации об изображении, введенной извне, для функционирования в качестве блока отображения, так и функцию ввода для ввода информации, на основе которой это изображение обрабатывается, для функционирования в качестве панели управления. Дисплейное устройство можно также применять в качестве устройства отображения многофункционального принтера.
Затем будет описано дисплейное устройство, включающее органические светоизлучающие устройства согласно данному варианту осуществления.
Фигура 1 представляет собой схематическое секционное изображение органических светоизлучающих устройств согласно данному варианту осуществления и TFT, которые служат в качестве примера переключающих устройств для управления включением/выключением силы света органических светоизлучающих устройств. На фигуре 1 показаны две пары органических светоизлучающих устройств и TFT. Хотя это и не показано, дисплейная аппаратура может включать транзисторы для управления силы света. Дисплейное устройство воспроизводит информацию включением и выключением органических светоизлучающих устройств посредством приведения в действие переключающих устройств на основе информации. Теперь будет описана детализированная структура.
Дисплейное устройство на фигуре 1 включает субстрат 1, такой как стеклянный субстрат, и защищающую от влаги пленку 2, расположенную на субстрате 1, для защиты TFT 8 и слоев органического соединения 12 и включает также металлические вентили 3, изоляторы вентилей 4 и слои полупроводников 5.
TFT 8 включают слои полупроводников 5, стоки 6 и источники 7. Изолирующая пленка 9 расположена на TFT 8. Аноды 11 органических светоизлучающих устройств соединяются с источниками 7 через контактные отверстия 10. Конструкция дисплейного устройства не ограничивается указанной выше конструкцией, но может быть любой конструкцией, в которой либо анод 11, либо катод 13 соединены либо с источниками 7, либо со стоками 6 TFT 8.
Каждый из слоев органических соединений 12 состоит из множества слоев органических соединений, хотя они показаны как единичные слои на фигуре 1 с целью иллюстрации. Первый защитный слой 14 и второй защитный слой 15 расположены на катодах 13 для ингибирования снижения эффективности органических светоизлучающих устройств.
Устройства переключения дисплейного устройства согласно данному варианту осуществления могут быть любого типа. Например, можно применять монокристаллические кремниевые субстраты, устройства типа металл-изолятор-металл (MIM) или аморфные кремниевые (а-Si) устройства.
ПРИМЕРЫ
Пример 1
Синтез примерного соединения А2
[Хим. соед. 15]
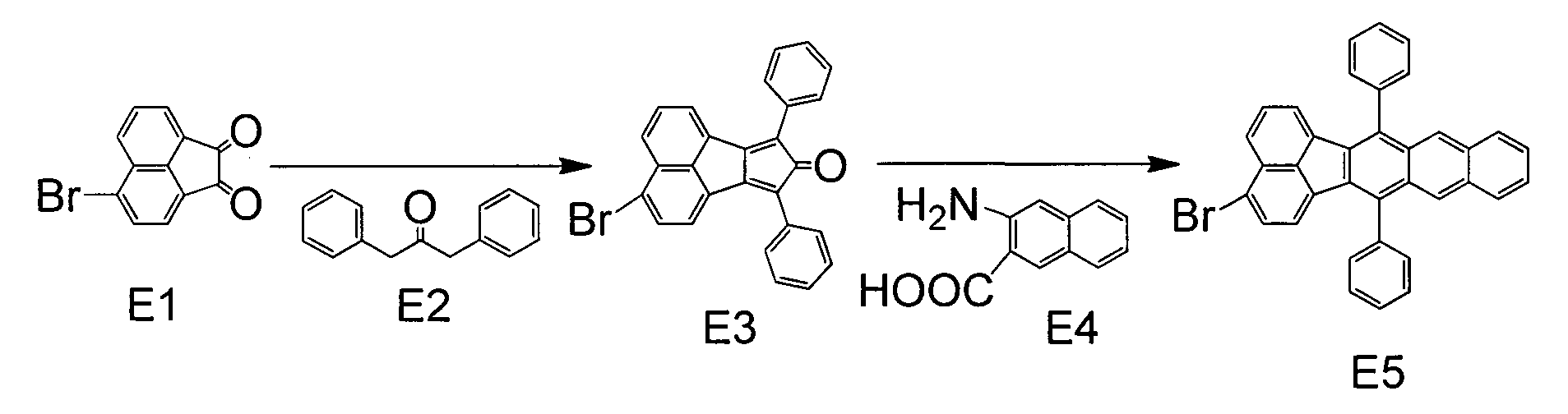
В 200 мл этанола помещали 10,6 г (50 ммоль) Е1 и 10,5 г (50 ммоль) Е2. После нагревания раствора до 60°С по каплям добавляли 20 мл 6 М водного раствора гидроксида натрия. После завершения добавления раствор нагревали до 80°С и перемешивали в течение 2 часов. После охлаждения осадок отделяли фильтрованием, промывали водой и этанолом и сушили нагреванием при 80°С и при пониженном давлении, получая при этом 18,7 г темно-зеленого твердого вещества Е3 (выход: 86%). Затем 8,71 г (20 ммоль) Е3 и 4,49 г (24 ммоль) Е4 помещали в 100 мл толуола. После нагревания раствора до 80°С по каплям медленно добавляли 2,81 г (24 ммоль) изоамилнитрита и раствор перемешивали при 110°С в течение трех часов. После охлаждения раствор промывали дважды 100 мл воды. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Раствор затем фильтровали и фильтрат концентрировали, получая при этом темно-коричневую жидкость. Ее очищали колоночной хроматографией (толуол/гептан, 2:3) и перекристаллизовывали из смеси хлороформ/метанол, получая при этом 7,47 г желтых кристаллов Е5 (выход: 70%).
[Хим. соед. 16]

В 40 мл ДМФА помещали 2,67 г (5 ммоль) Е5 и 1,60 г (8 ммоль) Е6. После добавления 0,25 г (0,5 ммоль) бис(трифенилфосфин)палладий(II)дихлорида и 2,28 г (15 ммоль) 1,8-диазацикло[5.4.0]ундец-7-ена в раствор, его нагревали до 150°С и перемешивали в течение четырех часов. После охлаждения осадок осаждали добавлением 30 мл метанола и смесь фильтровали, получая при этом желтое твердое вещество. Это твердое вещество очищали колоночной хроматографией (хлороформ/гептан, 1:3) и перекристаллизовывали дважды из смеси хлороформ/метанол, получая при этом 1,77 г желтых кристаллов примерного соединения А2 (выход: 67%).
Чистоту этого соединения, которая была не меньше 99%, определяли высокоэффективной жидкостной хроматографией (ВЭЖХ).
Эмиссионный спектр раствора в толуоле примерного соединения А2 с концентрацией 1×10-5 моль/л измеряли фотолюминесцентной спектроскопией при длине волны возбуждения 350 нм с применением спектрометра F-4500, доступного от Hitachi, Ltd. Полученный спектр имел максимум интенсивности при 516 нм.
Пример 2
Синтез примерного соединения А22
Примерное соединение А22 получали такой же реакцией и процедурой очистки, как в примере 1, за исключением того, что Е2, органическое соединение, применяемое в примере 1, заменяли на Е7:
[Хим. соед. 17]
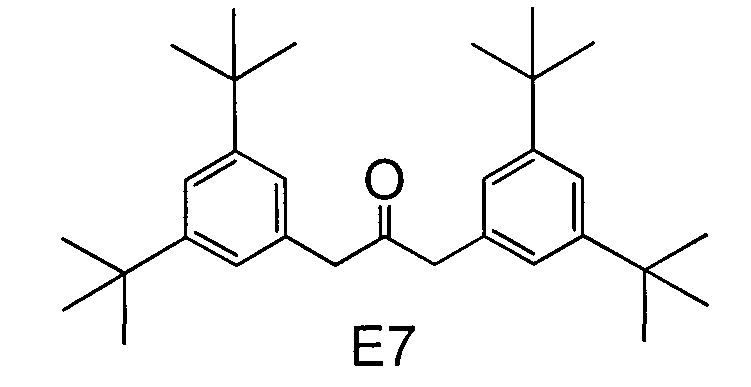
Чистота этого соединения, определенная ВЭЖХ, была не меньше 99,5%.
Кроме того, структуру этого соединения определяли спектроскопией ядерного магнитного резонанса (ЯМР).
1Н ЯМР (CDCl3, 400 МГц) δ (м.д.): 8,17 (с, 2Н), 7,84-7,82 (м, 2Н), 7,70-7,67 (м, 2Н), 7,65-7,63 (м, 2Н), 7,49 (с, 2Н), 7,48 (с, 2Н), 7,46 (д, 2Н, J=7,60 Гц), 7,39-7,37 (м, 2Н), 7,21-7,17 (м, 2Н), 6,40 (д, 2Н, J=7,20 Гц), 1,44 (с, 36Н).
Эмиссионный спектр раствора примерного соединения А22 в толуоле с концентрацией 1×10-5 моль/л измеряли фотолюминесцентной спектроскопией при длине волны возбуждения 350 нм с применением спектрометра F-4500, доступного от Hitachi, Ltd. Полученный спектр имел максимум интенсивности при 517 нм.
Пример 3
Синтез примерного соединения А3
[Хим. соед. 18]

В 100 мл толуола помещали 5,41 г (20 ммоль) Е8 и 5,18 г (24 ммоль) Е9. После нагревания раствора до 80°С постепенно, по каплям добавляли 2,81 г (24 ммоль) изоамилнитрита и раствор постепенно нагревали от 80°С и перемешивали при 100°С в течение трех часов. После охлаждения раствор промывали дважды 100 мл воды. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Раствор затем фильтровали и фильтрат концентрировали, получая при этом темно-коричневую жидкость. Ее очищали колоночной хроматографией (толуол/гексан, 2:3) и перекристаллизовывали из смеси толуол/этанол, получая при этом 3,77 г Е10 (выход: 46%).
Затем 4,1 г (10 ммоль) Е10 и 1,08 г (2 ммоль) Ni(dppp)2Cl2 помещали в 100 мл толуола и в раствор добавляли 3,03 г (30 ммоль) триэтиламина и 3,83 г (30 ммоль) Е11 и смесь перемешивали при 100°С в течение пяти часов. После охлаждения раствор фильтровали и промывали дважды 100 мл воды. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Раствор затем фильтровали и фильтрат концентрировали, получая при этом темно-коричневую жидкость. Ее очищали колоночной хроматографией (толуол/гептан, 5:1) и перекристаллизовывали из смеси толуол/гептан, получая при этом 3,19 г Е12 (выход: 70%).
[Хим. соед. 19]

В 50 мл ДМФА помещали 2,28 г (5 ммоль) Е12 и 2,86 г (10 ммоль) Е13. После добавления в раствор 0,25 г (0,5 ммоль) бис(трифенилфосфин)палладий(II)дихлорида и 2,28 г (15 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена смесь нагревали до 150°С и перемешивали в течение четырех часов. После охлаждения осаждали осадок добавлением 30 мл метанола и фильтровали, получая при этом желтое твердое вещество. Это твердое вещество очищали колоночной хроматографией (хлороформ/гептан, 1:5) и перекристаллизовывали дважды из смеси толуол/метанол, получая при этом 3,27 г желтых кристаллов Е14 (выход: 72%). Затем 3,18 г (7 ммоль) Е14 и 1,25 г (7 ммоль) Е15 помещали в 50 мл хлороформа и раствор нагревали до 60°С и перемешивали в течение восьми часов. После охлаждения раствор промывали дважды 50 мл воды. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом магния. Раствор затем фильтровали и фильтрат концентрировали. Концентрат очищали колоночной хроматографией (хлороформ/гептан, 1:2) и перекристаллизовывали из смеси толуол/этанол, получая при этом 3,17 г Е16 (выход: 85%).
[Хим. соед. 20]
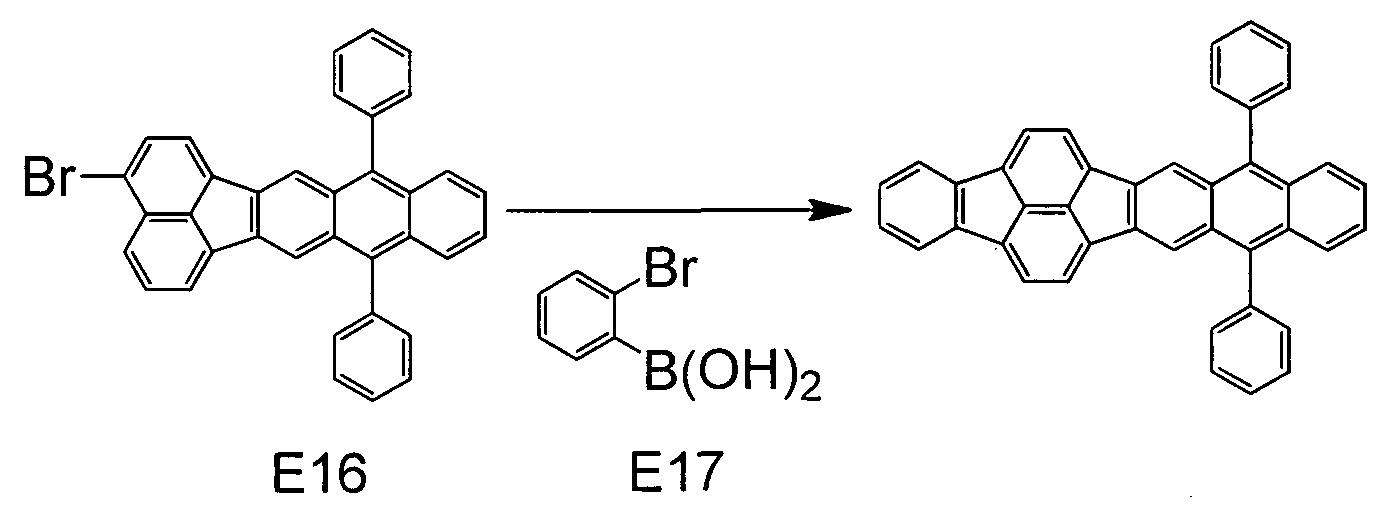
В 40 мл ДМФА помещали 2,42 г (5 ммоль) Е16 и 1,60 г (8 ммоль) Е17. После добавления в раствор 0,25 г (0,5 ммоль) бис(трифенилфосфин)палладий(II)дихлорида и 2,28 г (15 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена смесь нагревали до 150°С и перемешивали в течение четырех часов. После охлаждения осадок осаждали добавлением 30 мл метанола и фильтровали, получая при этом желтое твердое вещество. Это твердое вещество очищали колоночной хроматографией (хлороформ/гептан, 1:3) и перекристаллизовывали дважды из смеси хлороформ/метанол, получая при этом 1,90 г желтых кристаллов примерного соединения А3 (выход: 72%). Чистоту данного соединения определяли ВЭЖХ, она была не меньше 99%.
Эмиссионный спектр раствора примерного соединения А3 в толуоле с концентрацией 1×10-5 моль/л измеряли фотолюминесцентной спектроскопией при длине волны возбуждения 350 нм с применением спектрометра F-4500, доступного от Hitachi, Ltd. Полученный спектр имел максимальную интенсивность при 524 нм.
Пример 4
Синтез примерного соединения А23
Проводили такую же реакцию и процедуру очистки, как в примере 3, за исключением того, что органическое соединение Е8, применяемое в примере 3, заменяли на Е18.
[Хим. соед. 21]

Эмиссионный спектр раствора примерного соединения А23 в толуоле с концентрацией 1×10-5 моль/л измеряли фотолюминесцентной спектроскопией при длине волны возбуждения 350 нм с применением спектрометра F-4500, доступного от Hitachi, Ltd. Полученный спектр имел максимальную интенсивность при 525 нм.
Пример 5
Синтез примерного соединения А13
Примерное соединение А13 получали такой же реакцией и процедурой очистки, как в примере 1, за исключением того, что Е2, органическое соединение, применяемое в примере 1, заменяли на Е19.
[Хим. соед. 22]

Эмиссионный спектр раствора примерного соединения А13 в толуоле с концентрацией 1×10-5 моль/л измеряли фотолюминесцентной спектроскопией при длине волны возбуждения 350 нм с применением спектрометра F-4500, доступного от Hitachi, Ltd. Полученный спектр имел максимальную интенсивность при 517 нм.
Пример 6
Синтез примерного соединения А21
Проводили такую же реакцию и процедуру очистки, как в примере 1, за исключением того, что Е6, органическое соединение, применяемое в примере 1, заменяли на Е20.
[Хим. соед. 23]

Эмиссионный спектр раствора примерного соединения А21 в толуоле с концентрацией 1×10-5 моль/л измеряли фотолюминесцентной спектроскопией при длине волны возбуждения 350 нм с применением спектрометра F-4500, доступного от Hitachi, Ltd. Полученный спектр имел максимальную интенсивность при 523 нм.
Пример 7
Синтез примерного соединения А25
Проводили такую же реакцию и процедуру очистки, как в примере 1, за исключением того, что Е6, органическое соединение, применяемое в примере 1, заменяли на Е20 и Е2 заменяли на Е7.
Эмиссионный спектр раствора примерного соединения А25 в толуоле с концентрацией 1×10-5 моль/л измеряли фотолюминесцентной спектроскопией при длине волны возбуждения 350 нм с применением спектрометра F-4500, доступного от Hitachi, Ltd. Полученный спектр имел максимальную интенсивность при 520 нм.
Пример 8
В данном примере получали органическое светоизлучающее устройство, включающее анод, переносящий дырки слой, излучающий свет слой, слой, блокирующий дырки/экситоны, слой переноса электронов и катод, расположенные в указанном выше порядке. Сначала на стеклянном субстрате образовывали форму пленки ITO, имеющей толщину 100 нм. Следующие органические слои и слои электродов затем непрерывно образовывали на субстрате в вакуумной камере при давлении 10-5 Па вакуумным осаждением с применением нагрева сопротивлением, так чтобы электроды были обращены друг другу в пределах площади 3 мм2.
Слой переноса дырок (40 нм): G-1
Слой излучения света (30 нм): хозяин: соединение Н7 (98 масс.%); гость: примерное соединение А2 (2 масс.%)
Слой блокирования дырок/экситонов (10 нм): G-3
Слой переноса электронов (30 нм): G4
Первый металлический слой электрода (1 нм): LiF
Второй металлический слой электрода (100 нм): алюминий.
[Хим. соед. 24]


Вольтамперные характеристики органического светоизлучающего устройства измеряли с применением 4140В рА-метра, доступного от Hewlett-Packard Company, и интенсивность свечения измеряли с применением ВМ7, доступного от Topcon Corporation.
Примеры 9-20
В примерах 9-20 органические светоизлучающие устройства получали таким же способом, как в примере 8, за исключением того, что заменяли гость-вещество и хозяин-вещество, и оценивали аналогичным образом. Применяемыми хозяин-веществами были соединения, показанные в колонке “G-2” таблицы 5.
В таблице 5 показаны относительные световые эффективности и напряжения устройств из примеров 8-20.
Пример 21
В данном примере было получено органическое светоизлучающее устройство, включающее анод, слой ввода дырок, слой переноса дырок, излучающий свет слой, слой переноса электронов, слой ввода электронов и катод, расположенные в указанном выше порядке.
Органическое светоизлучающее устройство, которое имеет резонансную структуру, получали следующим способом.
Сплав алюминия (алюминий-неодим) наносили до толщины 100 нм на стеклянный субстрат, служащий в качестве носителя, напылением, получая при этом отражающий анод. ITO затем наносили до толщины 80 нм напылением, получая при этом прозрачный анод. Затем вокруг анода образовывали акриловую пленку, изолирующую устройство и имеющую толщину 1,5 мкм, и отверстие, имеющее радиус 3 мм. Субстрат подвергали ультразвуковой очистке ацетоном и затем изопропиловым спиртом (IPA) с последующим промыванием кипящим IPA и сушкой. Поверхность субстрата затем подвергали ультрафиолетовой/озоновой очистке.
Затем следующие органические слои непрерывно образовывали на субстрате в вакуумной камере при давлении 10-5 Па вакуумным осаждением с применением нагрева сопротивлением и IZO затем наносили до толщины 30 нм напылением, получая при этом прозрачный электрод, служащий в качестве катода. После образования катода устройство герметизировали в атмосфере азота.
Этим путем было получено органическое светоизлучающее устройство.
Слой ввода дырок (135 нм): G-11
Слой переноса дырок (10 нм): G-12
Излучающий свет слой (35 нм): хозяин: соединение Н7 (98 масс.%); гость: примерное соединение А13 (2 масс.%)
Слой переноса электронов (10 нм): G-14
Слой ввода электронов (70 нм): G-15 (80 масс.%), литий (20 масс.%).
[Хим. соед. 25]

Вольтамперные характеристики органического светоизлучающего устройства измеряли с применением 4140В рА-метра, доступного от Hewlett-Packard Company, и интенсивность свечения устройства измеряли с применением ВМ7, доступного от Topcon Corporation.
Примеры 22-26
В примерах 22-26 органические светоизлучающие устройства получали таким же способом, как в примере 21, за исключением того, что заменяли гость- и хозяин-вещества, и оценивали аналогичным образом. Применяемыми хозяин-веществами были соединения, показанные в колонке “G-13” таблицы 6.
В таблице 6 показаны относительные световые эффективности и напряжения устройств из примеров 21-26.
Результаты и обсуждение
Органические соединения согласно вариантам осуществления настоящего изобретения являются новыми соединениями, которые имеют высокий квантовый выход и излучают свет, подходящий в качестве зеленого света, и которые можно применять для получения органического светоизлучающего устройства, имеющего лучшие характеристики излучения.
Хотя настоящее изобретение было описано обращением к примерным вариантам осуществления, должно быть понятно, что изобретение не ограничивается описанными примерными вариантами осуществления. Объем следующей формулы изобретения должен соответствовать самой широкой интерпретации, так чтобы включать все такие модификации и эквивалентные структуры и функции.
Данная заявка заявляет приоритет заявки на патент Японии № 2010-129267, зарегистрированной 4 июня 2010 г., которая тем самым включена в контекст в качестве ссылки во всей ее полноте.
Список ссылочных обозначений
8 TFT
11 анод
12 слой органического соединения
13 катод
Реферат
Изобретение относится к органическому соединению формулы (1), в которой каждый из R- Rнезависимо выбран из атома водорода, метила, этила, н-пропила, изопропила, н-бутила, изобутила, вторбутила, третбутила, октила, 1-адамантила, 2-адамантила, незамещенной фенильной группы, фенильной группы, замещенной алкильной группой, и незамещенной бифенильной группы. Также изобретение относится к органическому светоизлучающему устройству, дисплейному устройству, устройству ввода изображения, устройству для освещения, а также источнику света для экспонирования для образующих электрографические изображения устройств на основе данного соединения. Данное соединение имеет высокий квантовый выход и излучают свет, подходящий в качестве зеленого света. 7 н. и 4 з.п. ф-лы, 26 пр., 6 табл., 1 ил.
Формула
[Хим. соед. 3]

в которой каждый из R1 - R16 независимо выбран из атома водорода, метила, этила, н-пропила, изопропила, н-бутила, изобутила, вторбутила, третбутила, октила, 1-адамантила, 2-адамантила, незамещенной фенильной группы, фенильной группы, замещенной алкильной группой, и незамещенной бифенильной группы.
[Хим. соед. 12]

в которой каждый из R17 - R24 независимо выбран из алкильной группы, имеющей от одного до четырех атомов углерода, и арильной группы, причем арильная группа представляет собой фенил или бифенил, причем фенильная группа необязательно замещена алкильной группой, имеющей от одного до четырех атомов углерода.
анод;
катод и
расположенный между анодом и катодом слой органического соединения, причем слой органического соединения содержит органическое соединение по п.1.
анод;
катод и
расположенный между анодом и катодом слой органического соединения, причем слой органического соединения содержит органическое соединение по п.3.
блок ввода изображения, сконструированный для ввода изображения, и
блок отображения на экране дисплея, сконструированный для отображения изображения, причем блок отображения на экране дисплея имеет множество пикселей, каждый из которых включает органическое светоизлучающее устройство по п.4 и переключающее устройство, соединенное с органическим светоизлучающим устройством.
Документы, цитированные в отчёте о поиске
Электролюминесцентный материал, содержащий органическое люминесцентное вещество




Комментарии