Новое конденсированное циклическое ароматическое соединение и содержащее его органическое светоизлучающее устройство - RU2422425C1
Код документа: RU2422425C1
Чертежи






Описание
Область техники
Настоящее изобретение относится к новому конденсированному циклическому ароматическому соединению и к органическому светоизлучающему устройству, содержащему конденсированное циклическое ароматическое соединение.
Уровень техники
Органическое светоизлучающее устройство представляет собой устройство со слоями тонкой пленки, включающей флуоресцирующее органическое соединение, между анодом и катодом. Кроме того, органическое светоизлучающее устройство излучает свет, когда экситон флуоресцирующего органического соединения образуется за счет привнесения электрона и удаления электрона каждым электродом, и этот экситон возвращается в основное состояние.
В последнее время наблюдается заметный прогресс в органических светоизлучающих устройствах и их характеристики включают, например, высокое значение яркости свечения при низком значении применяемой разности потенциалов, разнообразие длин волн излучаемого света, высокую скорость отклика и обеспечение светоизлучающему устройству тонкости и легкости. Исходя из этих характеристик предполагается возможность того, что органическое светоизлучающее устройство используется в широком диапазоне областей применения.
Тем не менее, органическое светоизлучающее устройство, имеющее более высокое значение оптического выхода свечения или более высокую эффективность преобразования, необходимо в современных условиях. Кроме того, органическое светоизлучающее устройство все еще имеет много проблем в отношении долговечности, таких как изменчивость со временем при использовании в течение длительного периода времени и повреждение из-за атмосферной газообразной среды, содержащей кислород, влагу или т.п.
Вследствие этого, вещество для создания органического светоизлучающего устройства, имеющего высокую эффективность излучения света и хорошую долговечность, настоятельно требуется в последние годы.
В качестве способа решения вышеуказанных проблем было предложено, что конденсированное циклическое ароматическое соединение применяется в качестве вещества для создания органического светоизлучающего устройства. Японская выложенная патентная заявка № 2001-102173, Патентная заявка США № 2004-0076853, японская выложенная патентная заявка № 2006-256979, японские выложенные патентные заявки №№ Н10-189247 и Н09-241629 раскрывают примеры применения конденсированного циклического ароматического соединения в качестве вещества для создания органического светоизлучающего устройства. Кроме того, J. Org. Chem. 64, 1650-1656, 1999 также раскрывает конденсированное циклическое ароматическое соединение.
Раскрытие сущности изобретения
Настоящее изобретение сделано для решения проблем предшествующего уровня техники, как описано выше. А именно, объектом настоящего изобретения является предоставление нового конденсированного циклического ароматического соединения для органического светоизлучающего устройства. Кроме того, другим объектом настоящего изобретения является предоставление органического светоизлучающего устройства, имеющего оптический выход высокой эффективности и высокое значение яркости свечения, и долговечность.
Настоящие изобретатели провели исследования для решения вышеуказанных проблем, которые в результате привели к окончательному оформлению настоящего изобретения. А именно, конденсированное циклическое ароматическое соединение настоящего изобретения представлено нижеследующей общей формулой [1]:

где каждый, от Х1 до Х16, независимо друг от друга, представляют собой атом водорода, атом галогена, замещенную или незамещенную алкильную группу, замещенную или незамещенную алкокси-группу, замещенную или незамещенную арилокси-группу, замещенную или незамещенную амино-группу, замещенную или незамещенную арильную группу, или замещенную или незамещенную гетероциклическую группу, и все они могут быть одинаковыми или различными; соседние группы соединяются друг с другом с образованием, по меньшей мере, одного цикла из выбранных групп от Х4 до Х7; соседние группы соединяются друг с другом с образованием, по меньшей мере, одного цикла из выбранных групп от Х12 до Х15.
Новое конденсированное циклическое ароматическое соединение настоящего изобретения имеет высокое значение квантового выхода. Вследствие этого, в соответствии с настоящим изобретением, органическое светоизлучающее устройство, имеющее оптический выход высокой эффективности и высокое значение яркости свечения, и долговечность, может быть предоставлено.
Кроме того, отличительный признак настоящего изобретения станет очевидным из нижеследующего описания иллюстративных примеров осуществления изобретения со ссылкой на прилагаемые чертежи.
Краткое описание чертежей
Фиг.1 представляет собой вид в поперечном разрезе, показывающий первый пример осуществления изобретения в виде органического светоизлучающего устройства настоящего изобретения;
Фиг.2 представляет собой вид в поперечном разрезе, показывающий второй пример осуществления изобретения в виде органического светоизлучающего устройства настоящего изобретения;
Фиг.3 представляет собой вид в поперечном разрезе, показывающий третий пример осуществления изобретения в виде органического светоизлучающего устройства настоящего изобретения;
Фиг.4 представляет собой вид в поперечном разрезе, показывающий четвертый пример осуществления изобретения в виде органического светоизлучающего устройства настоящего изобретения;
Фиг.5 представляет собой вид в поперечном разрезе, показывающий пятый пример осуществления изобретения в виде органического светоизлучающего устройства настоящего изобретения; и
Фиг.6 представляет собой графическое изображение, показывающее спектр фотолюминесценции (длина волны возбуждающего излучения: 351 нм) раствора в толуоле, представленного в качестве примера соединения Н-6 (1×10-5 моль/л).
Лучшие варианты осуществления изобретения
Конденсированное циклическое ароматическое соединение настоящего изобретения будет описано подробно. Конденсированное циклическое ароматическое соединение настоящего изобретения представлено нижеследующей общей формулой [1]:

где каждый, от Х1 до Х16, независимо друг от друга, представляют собой атом водорода, атом галогена, замещенную или незамещенную алкильную группу, замещенную или незамещенную алкокси-группу, замещенную или незамещенную арилокси-группу, замещенную или незамещенную амино-группу, замещенную или незамещенную арильную группу, или замещенную или незамещенную гетероциклическую группу, и все они могут быть одинаковыми или различными; соседние группы соединяются друг с другом с образованием, по меньшей мере, одного цикла из выбранных групп от Х4 до Х7; соседние группы соединяются друг с другом с образованием, по меньшей мере, одного цикла из выбранных групп от Х12 до Х15.
Кроме того, конденсированное циклическое ароматическое соединение настоящего изобретения представляет собой конденсированное циклическое ароматическое соединение, в соответствии с вышеуказанной общей формулой [1], представленное нижеследующей общей формулой [2]:

где каждый, от R1 до R20, независимо друг от друга, представляют собой атом водорода, атом галогена, замещенную или незамещенную алкильную группу, замещенную или незамещенную алкокси-группу, замещенную или незамещенную арилокси-группу, замещенную или незамещенную амино-группу, замещенную или незамещенную арильную группу, или замещенную или незамещенную гетероциклическую группу, и все они могут быть одинаковыми или различными.
Конкретные примеры заместителей, представленных в виде от X1 до X16 и от R1 до R20 в вышеуказанных общих формулах [1] и [2] соответственно, будут описаны ниже, но не ограничиваются только этими заместителями.
Примеры галогеновых атомов, представленных в виде от X1 до X16 и от R1 до R20, включают фтор, хлор, бром и йод.
Примеры алкильных групп, представленных в виде от X1 до X16 и от R1 до R20, включают метильную группу, этильную группу, нормальную пропильную группу, изопропильную группу, нормальную бутильную группу, трет-бутильную группу, втор-бутильную группу, нормальную пентильную группу, октильную группу, 1-адамантильную группу, 2-адамантильную группу, бензильную группу и фенетильную группу.
Примеры алкокси-групп, представленных в виде от X1 до X16 и от R1 до R20, включают метокси-группу, этокси-группу, пропокси-группу, 2-этил-октилокси-группу и бензилокси-группу.
Примеры арилокси-групп, представленных в виде от X1 до X16 и от R1 до R20, включают фенокси-группу, 4-трет-бутилфенилокси-групп и тиенилокси-группу.
Примеры амино-групп, представленных в виде от X1 до X16 и от R1 до R20, включают N-метиламино-группу, N-этиламино-группу, N-N-диметиламино-группу, N-N-диэтиламино-группу, N-метил-N-этиламино-группу, N-бензиламино-группу, N-метил-N-бензиламино-группу, N,N-дибензиламино-группу, анилино-группу, N,N-дифениламино-группу, N,N-динафтиламино-группу, N,N-дифторениламино-группу, N-фенил-N-толиламино-группу, N,N-дитолиламино-группу, N-метил-N-фениламино-группу, N,N-дианизолиламино-группу, N-мезитил-N-фениламино-группу, N,N-димезитиламино-группу, N-фенил-N-(4-трет-бутилфенил)амино-группу, N-фенил-N-(4-трифторметилфенил)амино-группу, N,N-ди(4-трет-бутилфенил)амино-группу, N-N-ди(3,5-диметилфенил)амино-группу, N-(9,9-диметил-фторенил)-N-фениламино-группу, N-(9,9-диметил-фторенил)-N-толиламино-группу, N-(9,9-диметил-фторенил)-N-(3,5-диметилфенил)амино-группу и N-(9,9-диметил-фторенил)-N-(2-нафтил)амино-группу.
Примеры арильных групп, представленных в виде от X1 до X16 и от R1 до R20, включают фенильную группу, нафтильную группу, пенталенильную группу, инденильную группу, азуленильную группу, антрильную группу, пиренильную группу, индаценильную группу, аценафтенильную группу, фенантрильную группу, феналенильную группу, фторантенильную группу, ацефенантрильную группу, ацеантрильную группу, трифениленильную группу, криценильную группу, нафтаценильную группу, периленильную группу, пентаценильную группу, бифенильную группу, терфенильную группу и фторенильную группу.
Примеры гетероциклических групп, представленных в виде от X1 до X16 и от R1 до R20, включают пиридильную группу, бипиридильную группу, пирролильную группу, оксазолильную группу, оксадиазолильную группу, тиазолильную группу, тиадиазолильную группу, хинолильную группу, изохинолильную группу, карбазолильную группу, акридинильную группу и фенанторильную группу.
Примеры заместителей, которые могут иметь вышеуказанную алкильную группу, арильную группу и гетероциклическую группу, включают алкильные группы, такие как метильная группа, этильная группа и пропильная группа; аралкильные группы, такие как бензильная группа; арильные группы, такие как фенильная группа и бифенильная группа; гетероциклические группы, такие как пиридильная группа и пирролильная группа; амино-группы, такие как диметиламино-группа, диэтиламино-группа, дибензиламино-группа, дифениламино-группа, дитолиламино-группа и дианизолиламино-группа; алкокси-группы, такие как метокси-группа, этокси-группа и пропокси-группа; арилокси-группы, такие как феноксильная группа; галогеновые атомы, такие как фтор, хлор, бром и йод; и циано-группы.
Конденсированное циклическое ароматическое соединение, представленное общими формулами [1] и [2], может быть синтезировано, например, способом, как показано на нижеприведенных схемах синтеза 1 и 2.
Схема синтеза 1
Конденсированное циклическое ароматическое соединение, представленное общей формулой [1], может быть синтезировано, например, путем использования производного дибромхризена и производного бороновой кислоты в качестве исходных веществ, как показано на нижеприведенной схеме синтеза 1, но способ синтеза не ограничивается этой схемой 1:

Конкретный способ по схеме синтеза 1 будет описан. Во-первых, дигидрокси-продукт синтезируют реакцией конденсации Сузуки-Мияура между производным дибромхризена и производным бороновой кислоты (например, Chem. Rev. 1995, 95, 2457-2483). Другой способ включает, например, способ Ямомото с использованием никелевого катализатора (например, Bull. Chem. Soc. Jpn. 51, 2091, 1978). После этого дитрифлат-продукт получают из синтезированного дигидрокси-продукта и подвергают его внутримолекулярной циклизации (например, J. Org. Chem. 68, 883-887, 2003). Таким образом, конденсированное циклическое ароматическое соединение, представленное общей формулой [1], может быть получено.
Схема синтеза 2
Конденсированное циклическое ароматическое соединение, представленное общей формулой [2], также может быть синтезировано, например, путем использования производного дибромхризена в качестве исходного вещества, как показано в нижеприведенной схеме синтеза 2.

Конкретный способ по схеме синтеза 2 будет описан.
Схема синтеза 2 особенно пригодна, когда различные заместители вводятся в случае от R4 до R9 или от R14 до R19 в общей формуле [2]. А именно, производное дибромхризена превращают в соединение CR-1, которое представляет собой соответствующий сложноэфирный продукт. Затем сложноэфирный продукт подвергают гидролизу с получением соединения CR-2, соединение CR-2 превращают в соединение CR-3, которое представляет собой соответствующий хлорангидрид кислоты, посредством следующего процесса. Соединение CR-3 далее подвергают внутримолекулярной циклизации (например, J. Am. Chem. Soc. 105, 7375, 1983), таким образом превращая его в кетонный продукт. Этот кетонный продукт превращают в дикетонный продукт (например, Bull. Chem. Soc. Jpn. 59, 3311, 1986). Этот дикетонный продукт используют как промежуточное соединение и различные заместители вводят в случае от R4 до R9 или от R14 до R19 посредством двух процессов реакции Кневенагеля (например, Eur. J. Org. Chem. 4185, 2002) и реакции Дильса-Альдера (например, J. Org. Chem. 62, 530, 1997).
Вещество, используемое для органического светоизлучающего устройства, имеет высокое значение квантового выхода, когда применяется как главное светоизлучающее вещество.
Соединение общей формулы [1] представляет собой соединение, полученное посредством образования конденсированного цикла в соединении А, имеющем высокое значение квантового выхода, показанном ниже.

Соединение А характеризуется высоким значением квантового выхода, составляющим 0,91 в растворе толуола (1×10-5 моль/л). Квантовый выход был рассчитан как относительный при использовании флуорантена в качестве контрольного соединения при измерении. Следует указать, что флуорантен в разбавленном растворе имеет значение квантового выхода 0,35 (Steven L. Murov., Handbook of Photochemistry, Second Edition, Revised and Exapanded, (1993)).
В соответствии с этим соединение, представленное общей формулой [1], достигает увеличенной силы осциллятора за счет расширения π-конъюгированной системы соединения А, и поэтому можно ожидать дополнительное улучшение квантового выхода.
Настоящие изобретатели рассчитали силы осциллятора для соединений, представленных соединением А и, представленного в качестве примера, соединения В-1, например, посредством модельного расчета, таким образом значения силы осциллятора 0,44 и 0,78, соответственно, были получены.
В данном случае модельный расчет осуществляли, используя B3LYP метод (Becke's Three parameter hybrid method using the Lee-Yang-Parr correlation (J. Chem. Phys. 98, 5648 (1993))), один из функциональных методов расчета плотности распределения из пакета программ Gaussian 03 (Gaussian, Inc.), который представляет собой программу расчета молекулярных орбиталей.
Кроме того, введение заместителя в какое-либо положение от Х1 до Х16 в общей формуле [1] может ослаблять ассоциацию молекул самих по себе, снижая эффективность преобразования светоизлучения. Действуя таким образом, можно ожидать дополнительного улучшения эффективности светоизлучения. А именно, когда заместитель вводится в Х1, Х4, Х7, Х8, Х9, Х12, Х15 или Х16, заместитель стремится к расположению в направлении, перпендикулярном плоскости соединения общей формулы [1] из-за стерического затруднения между соседними заместителями, и поэтому эффект снижения эффективности преобразования светоизлучения из-за молекулярной ассоциации является большим.
Примеры заместителя, самого по себе вызывающего стерическое затруднение в молекуле, включают алкильную группу, алкокси-группу, арилокси-группу, амино-группу, арильную группу и гетероциклическую группу, и предпочтительные примеры их включают амино-группу, арильную группу и гетероциклическую группу.
Когда соединение, представленное общей формулой [1], применяется в качестве светоизлучающего слоя, оно может быть использовано как вещество-хозяин или как вещество-гость. А именно, когда соединение, представленное общей формулой [1], применяется как вещество-хозяин светоизлучающего слоя, соединение, предпочтительно, представляет собой вещество, имеющее высокую температуру перехода в стеклообразное состояние, и для этой цели желательно, чтобы в положениях от Х1 до Х16 имелись заместители.
Предпочтительные примеры заместителей от Х1 до Х16 для повышения температуры перехода в стеклообразное состояние, включают амино-группу, арильную группу и гетероциклическую группу.
Кроме того, заместитель, введенный для использования соединения, представленного общей формулой [1], в качестве промежуточного соединения в процессе синтеза, включает, например, атом галогена. В этом случае йод, бром и хлор являются предпочтительными с точки зрения активности в реакции синтеза.
Соединение, применяемое в качестве вещества органического светоизлучающего устройства, желательно обладает сильным свойством инжекции электронных носителей заряда. Устройство может работать при низкой разности потенциалов за счет содействия инжекции электронных носителей заряда. Предпочтительные примеры заместителя, введенного для усиления свойства инжекции электронных носителей заряда, включают амино-группу и гетероциклическую группу. В этом случае, когда амино-группа введена в качестве заместителя, свойство инжекции недостатка электронов, как правило, улучшается. С другой стороны, когда гетероциклическая группа введена, улучшается свойство инжекции электронов.
Конкретные примеры соединения вышеуказанной общей формулы [1] показаны ниже. Хотя настоящее изобретение не ограничивается этими соединениями.

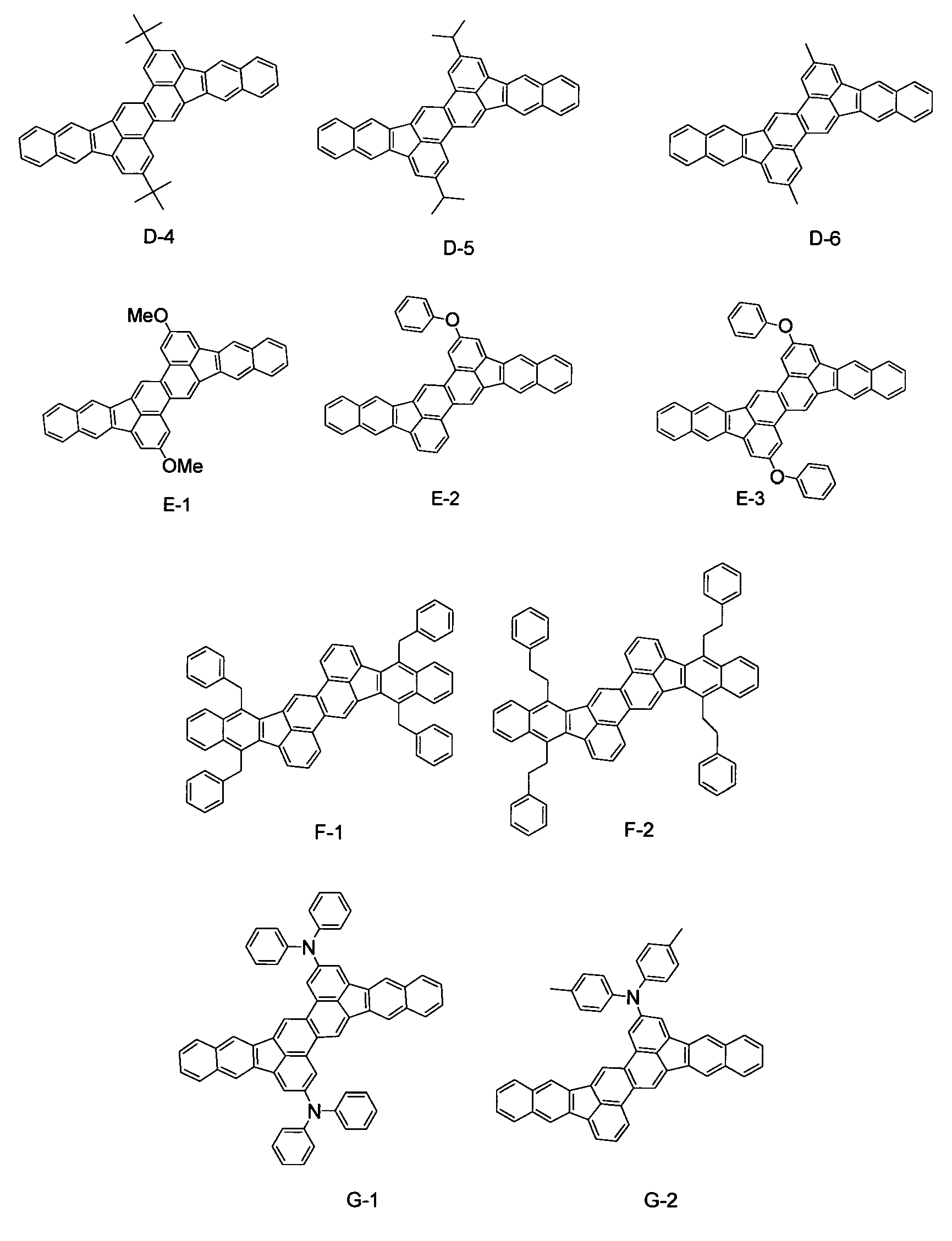

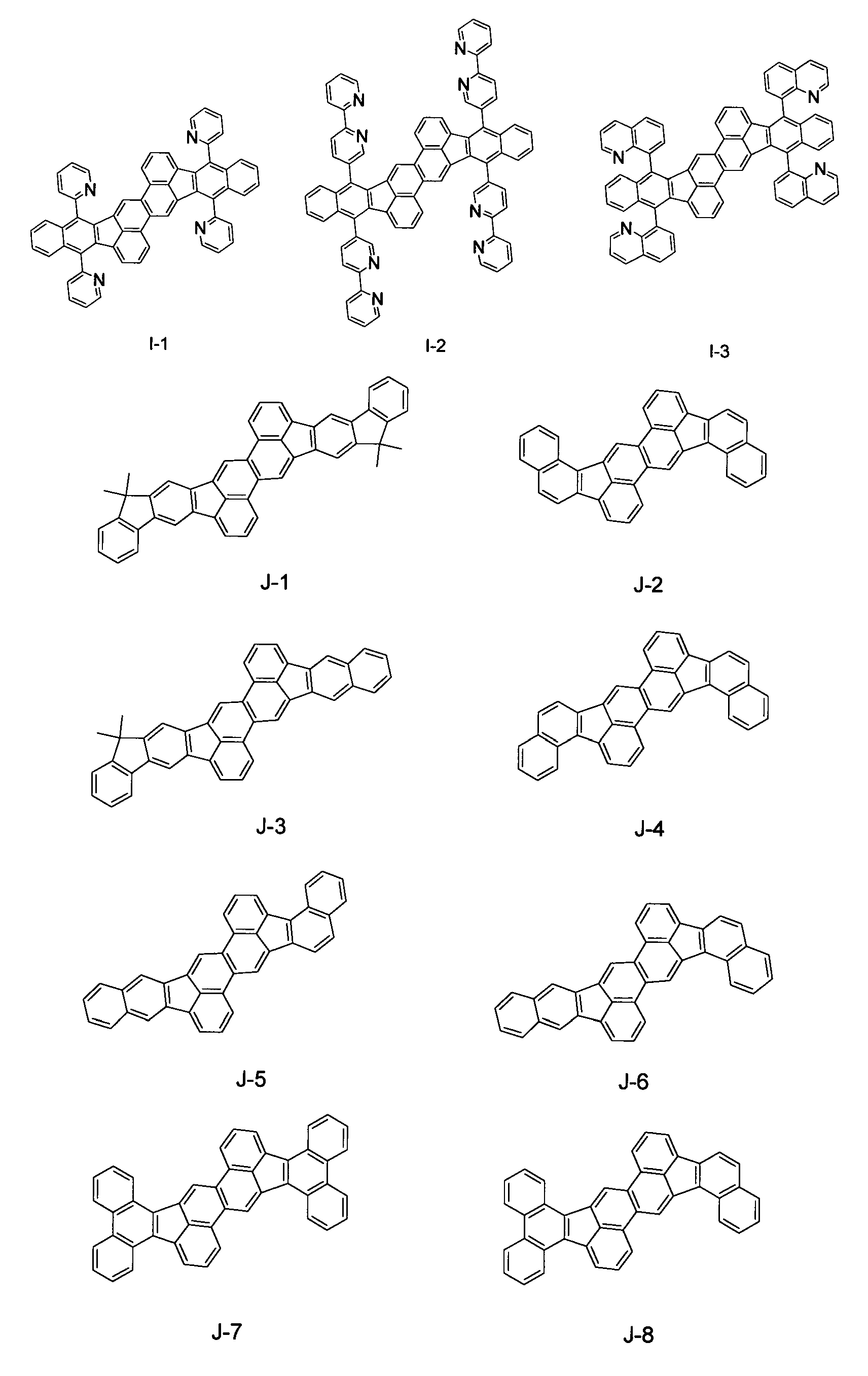
Далее органическое светоизлучающее устройство настоящего изобретения будет описано подробно.
Органическое светоизлучающее устройство настоящего изобретения включает анод, катод и слой, содержащий в своем составе органическое соединение (слой органического соединения), расположенный как прослойка между анодом и катодом. Кроме того, в органическом светоизлучающем устройстве настоящего изобретения слой, содержащий в своем составе органическое соединение, содержит конденсированное циклическое ароматическое соединение настоящего изобретения.
Органическое светоизлучающее устройство настоящего изобретения может включать другие слои органического соединения, отличающегося от слоя органического соединения, расположенного между анодом и катодом, которые представляют собой пару электродов. Другие слои органического соединения включают, например, инжектирующий недостаток электронов слой, переносящий недостаток электронов слой, блокирующий электроны слой, блокирующий недостаток электронов слой, переносящий электроны слой и инжектирующий электроны слой.
В дальнейшем в этом документе органическое светоизлучающее устройство настоящего изобретения будет описано подробно со ссылками на чертежи.
Во-первых, будут описаны ссылки на цифры в чертежах. Ссылка на цифру 1 обозначает подложку; 2 - анод; 3 - светоизлучающий слой; 4 - катод; 5 - переносящий недостаток электронов слой; 6 - переносящий электроны слой; 7 - инжектирующий недостаток электронов слой; 8 - недостаток электронов/экситон блокирующий слой для блокирования недостатка электронов и/или экситона; и 10, 20, 30, 40, 50 - органические светоизлучающие устройства.
Фиг.1 представляет собой вид в поперечном разрезе, показывающий первый пример осуществления изобретения в виде органического светоизлучающего устройства настоящего изобретения. В органическом светоизлучающем устройстве 10 на фиг.1 анод 2, светоизлучающий слой 3 и катод 4 последовательно расположены на подложке 1. Это органическое светоизлучающее устройство 10 применимо, когда светоизлучающий слой 3 включает в свой состав органическое соединение, имеющее все, что касается способности переноса недостатка электрона, способности переноса электрона и светоизлучающего действия. Кроме того, органическое светоизлучающее устройство 10 также применимо, когда светоизлучающий слой 3 включает в свой состав смесь органических соединений, каждое из которых обладает какой-либо одной характеристикой из способности переноса недостатка электрона, способности переноса электрона и светоизлучающего действия.
Фиг.2 представляет собой вид в поперечном разрезе, показывающий второй пример осуществления изобретения в виде органического светоизлучающего устройства настоящего изобретения. В органическом светоизлучающем устройстве 20 на фиг.2 анод 2, переносящий недостаток электронов слой 5, переносящий электроны слой 6 и катод 4 последовательно расположены на подложке 1. Это органическое светоизлучающее устройство 20 применимо, когда светоизлучающее органическое соединение, имеющее все, что касается свойства переноса недостатка электрона и свойства переноса электрона, применяется в комбинации с органическим соединением, обладающим только свойством переноса электрона или свойством переноса недостатка электрона. Кроме того, переносящий недостаток электрона слой 5 или переносящий электрон слой 6 также служит в качестве светоизлучающего слоя в органическом светоизлучающем устройстве 20.
Фиг.3 представляет собой вид в поперечном разрезе, показывающий третий пример осуществления изобретения в виде органического светоизлучающего устройства настоящего изобретения. Органическое светоизлучающее устройство 30 на фиг.3 представляет собой такое устройство, в котором светоизлучающий слой 3 помещен между переносящим недостаток электрона слоем 5 и переносящим электрон слоем 6 в органическом светоизлучающем устройстве 20 на фиг.2. Это органическое светоизлучающее устройство 30 обладает функцией переносчика заряда и светоизлучающей функцией, которые разделены одна от другой, и органические соединения, имеющие каждую из характеристик, касающихся свойства переноса недостатка электрона, свойства переноса электрона и светоизлучающего свойства, могут применяться в целесообразной комбинации. Вследствие этого, степень свободы в выборе вещества очень возрастает и различные органические вещества, имеющие различные длины волн излучаемого света, могут применяться, таким образом предоставляется возможность многообразия цветовых оттенков светоизлучения. Кроме того, органическое светоизлучающее устройство 30 также может быть предназначено для улучшения эффективности светоизлучения посредством эффективного вовлечения переносчика заряда или экситона в светоизлучающий слой 3 в центре.
Фиг.4 представляет собой вид в поперечном разрезе, показывающий четвертый пример осуществления изобретения в виде органического светоизлучающего устройства настоящего изобретения. Органическое светоизлучающее устройство 40 на фиг.4 представляет собой устройство, в котором инжектирующий недостаток электрона слой 7 помещен между анодом 2 и переносящим недостаток электрона слоем 5 в органическом светоизлучающем устройстве 30 на фиг.3. Это органическое светоизлучающее устройство 40 улучшает прочность сцепления между анодом 2 и переносящим недостаток электрона слоем 5 или свойство инжектирования недостатка электрона посредством размещения инжектирующего недостаток электрона слоя 7, и таким образом оно является эффективным для восстановления разности потенциалов.
Фиг.5 представляет собой вид в поперечном разрезе, показывающий пятый пример осуществления изобретения в виде органического светоизлучающего устройства настоящего изобретения. Органическое светоизлучающее устройство 50 на фиг.5 представляет собой устройство, в котором слой для предотвращения недостатка электрона или экситона, проходя через поверхность катода 4 (блокирующий недостаток электрона/экситона слой 8), помещен между светоизлучающим слоем 3 и переносящим недостаток электрона слоем 6 в органическом светоизлучающем устройстве 30 на фиг.3. Эффективность светоизлучения органического светоизлучающего устройства 50 улучшается за счет органического соединения, имеющего очень высокий потенциал ионизации, как и блокирующего недостаток электрона/экситона слоя 8.
Однако, вышеописанные с первого по пятый примеры осуществления изобретения имеют только структуры базового устройства и структура органического светоизлучающего устройства, использующего конденсированное циклическое ароматическое соединение настоящего изобретения, не ограничивается этими примерами осуществления изобретения. Там могут использоваться различные слоистые структуры, такие как, например, слоистая структура, в которой изолирующий слой, связующий слой или интерференционный слой размещены на промежуточной поверхности между электродом и органическим слоем, и слоистая структура, в которой переносящий недостаток электрона слой содержит в своем составе два слоя, имеющие различные потенциалы ионизации.
Конденсированное циклическое ароматическое соединение настоящего изобретения может быть использовано для любого, с первого по пятый, из примеров осуществления изобретения. Кроме того, когда конденсированное циклическое ароматическое соединение настоящего изобретения применяется, то может применяться одно соединение или множество соединений, может применяться в комбинации.
Кроме того, конденсированное циклическое ароматическое соединение настоящего изобретения содержится в слое, включающем в свой состав органическое соединение, например, какое-либо соединение светоизлучающего слоя 3, переносящего недостаток электрона слоя 5, переносящего электрон слоя 6, инжектирующего недостаток электрона слоя 7 и блокирующего недостаток электрона/экситон слоя 8 в примерах осуществления изобретения с первого по пятый. Оно предпочтительно содержится в светоизлучающем слое 3. Кроме того, один вид или два, или несколько видов конденсированного циклического ароматического соединения настоящего изобретения может содержаться в этих слоях.
Светоизлучающий слой 3 предпочтительно включает в свой состав вещества: хозяина и гостя. В этом документе, в случае, когда светоизлучающий слой 3 включает в свой состав хозяина и гостя, имеющие свойства переносчика заряда, основной процесс, приводящий к излучению света, включает какой-нибудь из нижеследующих процессов.
1. Перенос электрона и недостатка электрона в светоизлучающем слое.
2. Образование экситона хозяина.
3. Передача энергии возбуждения между молекулами хозяина.
4. Перенос энергии возбуждения от хозяина к гостю.
Желаемый перенос энергии или излучение света в каждом процессе осуществляются в конкуренции с различными процессами дезактивации.
Излишне говорить, что квантовый выход светоизлучения центрального светоизлучающего вещества самого по себе повышают с целью увеличения эффективности светоизлучения органического светоизлучающего устройства. Однако же, возникла серьезная проблема в том, как перенос энергии между хозяином и хозяином или между хозяином и гостем может эффективно осуществляться. Кроме того, несмотря на то, что причина ухудшения излучения света, связанная с энергией возбуждения, не понятна в настоящее время, предполагают, что причина связана с изменением внешнего окружения светоизлучающего вещества за счет, по меньшей мере, светоизлучающего центрального вещества самого по себе или его молекулярного окружения.
В этом документе, когда конденсированное циклическое ароматическое соединение настоящего изобретения применяется как хозяин или гость светоизлучающего слоя, эффективность светоизлучающего устройства, яркость свечения и долговечность устройства улучшаются.
Когда конденсированное циклическое ароматическое соединение настоящего изобретения применяется в качестве вещества светоизлучающего слоя для органического светоизлучающего устройства настоящего изобретения, светоизлучающий слой может быть составлен только из конденсированного циклического ароматического соединения настоящего изобретения. Кроме того, конденсированное циклическое ароматическое соединение настоящего изобретения может применяться как вещество-гость (допант) или как вещество-хозяин. Более того, конденсированное циклическое ароматическое соединение настоящего изобретения может применяться как вещество переносящего электрон слоя.
В этом документе, когда конденсированное циклическое ароматическое соединение настоящего изобретения применяется как вещество-гость, количество применяемого соединения составляет, предпочтительно, от 0,01% мас. до 20% мас., более предпочтительно, от 0,1% мас. до 15% мас., из расчета на вещество-хозяин. Если конденсированное циклическое ароматическое соединение настоящего изобретения применяется в этом диапазоне, то концентрационное тушение, существующее за счет перекрывания веществ-гостей друг другом в светоизлучающем слое, может быть соответствующим образом ослаблено.
Когда конденсированное циклическое ароматическое соединение настоящего изобретения применяется как вещество-гость, предпочтительно, чтобы дефицит энергии вещества-хозяина был бы больше, чем дефицит энергии вещества-гостя.
В настоящем изобретении конденсированное циклическое ароматическое соединение настоящего изобретения в особенности применимо в качестве вещества для создания светоизлучающего слоя, но также может быть использовано, если это необходимо, совместно с, например, переносящими недостаток электрона веществами на основе низкомолекулярных веществ и на полимерной основе, со светоизлучающими веществами или переносящими электрон веществами, которые традиционно известны.
Примеры переносящих недостаток электрона соединений включают производные триариламина, производные фенилендиамина, производные триазола, производные оксадиазола, производные имидазола, производные пиразолина, производные пиразолона, производные оксазола, производные флуоренона, производные гидразона, производные стильбена, производные фталоцианина, производные порфирина и поливинилкарбазол, полисилилен, политиофен и другие проводящие полимеры.
Примеры светоизлучающих соединений включают производные нафталина, производные фенантрена, производные флуорена, производные пирена, производные тетрацена, производные коронена, производные хризена, производные перилена, производные 9,10-дифенилантрацена, производные рубрена и т.п., производные хинакридона, производные акридона, производные кумарина, производные пирана, нильский красный, производные пиразина, производные бензимидазола, производные бензотиазола, производные бензоксазола, производные стильбена, органические металлокомплексы (например, органические алюминиевые комплексы, такие как трис(8-хинолинолат)алюминий, органические бериллиевые комплексы) и полимерные производные, такие как производные поли(фениленвинилена), производные поли(флуорена), производные поли(фенилена), производные поли(тиениленвинилена) и производные поли(ацетилена), в дополнение к конденсированному циклическому ароматическому соединению настоящего изобретения.
Примеры переносящих электрон соединений включают производные оксадиазола, производные оксазола, производные тиазола, производные тиадиазола, производные пиразина, производные триазола, производные триазина, производные перилена, производные хинолина, производные хиноксалина, производные флуоренона, производные антрона, производные фенантролина и органические металлокомплексы.
Примеры вещества, из которого состоит анод, включают металлические простые вещества, такие как золото, платина, серебро, медь, никель, палладий, кобальт, селен, ванадий и вольфрам, или сплав этих металлических простых соединений, оксиды металлов, такие как оксид олова, оксид цинка, оксид индия, оксид индия-олова (ITO) и оксид индия-цинка. Кроме того, вещество, из которого состоит анод, также включает, например, проводящие полимеры, такие как полианилин, полипиррол, политиофен и полифениленсульфид. Эти электродные вещества могут использоваться поодиночке или в комбинации из двух или нескольких из них. Кроме того, анод может иметь монослойную или мультислойную структуру.
Примеры вещества, из которого состоит катод, включают металлические простые вещества, такие как литий, натрий, калий, кальций, магний, алюминий, индий, рутений, титан, марганец, итрий, серебро, свинец, олово и хром. Альтернативно, вещество, из которого состоит катод, включает, например, один или несколько сплавов, таких как литий-индий, натрий-калий, магний-серебро, алюминий-литий, алюминий-магний или магний-индий сплавы, и также включает оксиды металла, такие как оксид индия-олова (ITO). Эти электродные вещества могут использоваться поодиночке или в комбинации из двух или нескольких из них. Кроме того, катод может иметь монослойную или мультислойную структуру.
Несмотря на то, что подложки, применяемые для органического светоизлучающего устройства настоящего изобретения, не ограничены особым образом, например, светопроницаемыми подложками, такие как металлическая подложка и керамическая подложка, и пропускающие свет подложки, такие как стекло, кварц и листовой пластик применяются.
Далее, цвет люминесценции также можно контролировать, используя для подложки, например, цветную пленку-фильтр, флуоресцентную светопреобразующую пленку-фильтр, диэлектрическую отражательную пленку. Кроме того, устройство также может быть изготовлено посредством образования тонкой пленки полупроводника (TFT) на подложке и соединением ее с устройством.
Далее, как и нижняя излучающая структура (структура, получающая свет с поверхности подложки), так и верхняя излучающая структура (структура, получающая свет с поверхности, противоположной подложке) могут применяться в отношении достижения цели получения света от устройства.
Примеры
В дальнейшем, настоящее изобретение будет более конкретно описано посредством примеров, но оно не должно ограничиваться этими примерами.
Пример 1
Синтез представленного в качестве примера соединения Н-6
(1-1) Синтез синтетического промежуточного соединения 1-2
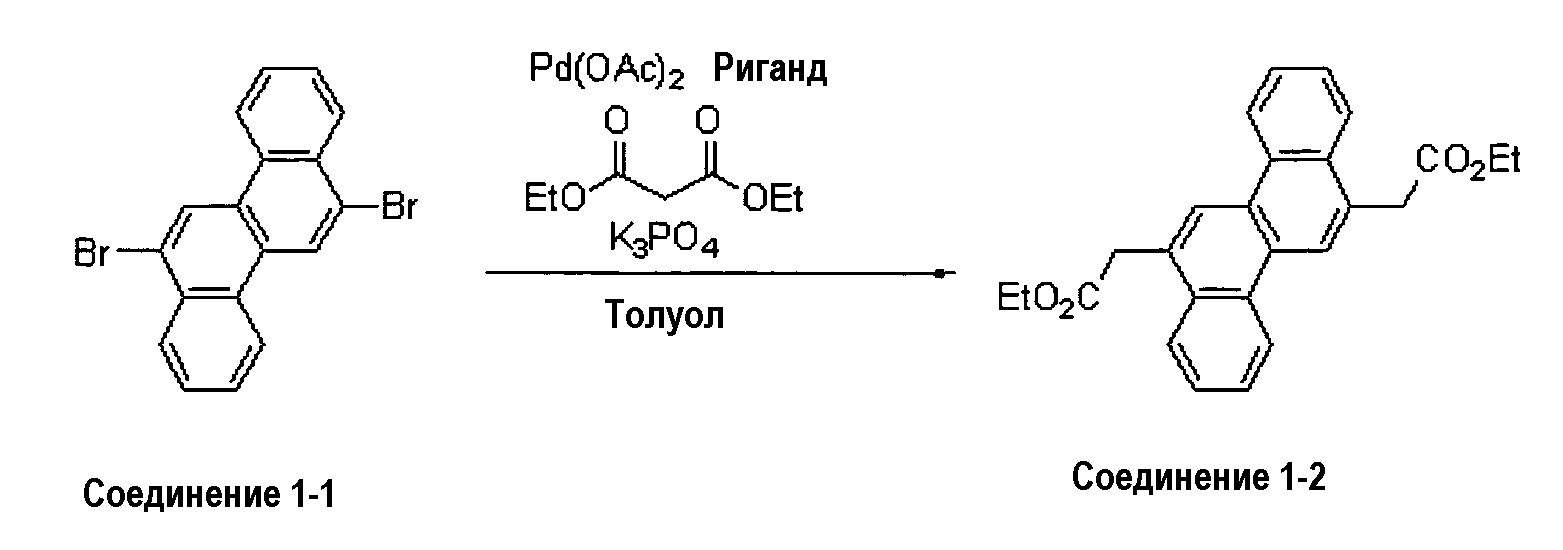
Реагенты и растворители, приведенные ниже, загружали в 300 мл реакционную колбу и перемешивали при 80°С в течение 18 часов в токе газообразного азота.
Соединение 1-1: 5,0 г (13,0 ммоль)
Этилацетоацетат: 6,74 г (51,8 ммоль)
Фосфат калия: 16,5 г (77,7 ммоль)
Ацетат палладия (II): 116 мг (0,52 ммоль)
2-(ди-трет-бутилфосфино)-2'-метилбифенил: 324 мг (1,04 ммоль)
Толуол: 100 мл
Этанол: 15 мл
После завершения реакции органический слой реакционной смеси отделяли при добавлении толуола и воды, и сушили над сульфатом магния, и затем растворитель отгоняли. Полученный в результате продукт очищали колоночной хроматографией на силикагеле (элюирующий растворитель: толуол/хлороформ=1/1), выделяя 2,87 г соединения 1-2 (выход: 55%).
(1-2) Синтез синтетического промежуточного соединения 1-3

Реагенты и растворители, приведенные ниже, загружали в реакционную колбу и перемешивали при 90°С в течение 24 часов.
Соединение 1-2: 3,76 г (89,6 ммоль)
Диоксан: 30 мл
Гидроксид лития моногидрат: 3,76 г (89,6 ммоль)
Концентрированную хлороводородную кислоту (20 мл) медленно добавляли к этой суспензии и полученную в результате смесь перемешивали при комнатной температуре в течение 5 часов. Затем воду (200 мл) добавляли к смеси и выпавшие кристаллы отделяли фильтрованием. Кристаллы последовательно промывали водой, метанолом и диэтиловым эфиром, и затем выдерживали и сушили в высоком вакууме, получая 2,87 г соединения 1-3 (выход: 93%).
(1-3) Синтез синтетического промежуточного соединения 1-5

Реагенты и растворители, приведенные ниже, загружали в реакционную колбу и перемешивали при 80°С в течение 2 часов.
Соединение 1-3: 2,87 г (6,36 ммоль)
Тионилхлорид: 50 мл
Диметилформамид: 300 мкл
Эту суспензию отгоняли при пониженном давлении и последовательно добавляли к полученному в результате остатку дихлорметан (50 мл) и хлорид алюминия (2,1 г, 15,9 ммоль), и смесь интенсивно перемешивали при комнатной температуре в течение 18 часов.
Концентрированную хлороводородную кислоту (180 мл) добавляли к полученной в результате суспензии и смесь выдерживали при перемешивании в течение 1 часа. Эту суспензию разделяли фильтрованием и фильтрат подвергали экстракции в аппарате Соксклета, используя хлороформ в качестве растворителя, и полученный в результате экстракт концентрировали. Экстракт очищали колоночной хроматографией на силикагеле (элюирующий растворитель: хлороформ/этилацетат=15/1), получая 1,2 г соединения 1-5 (выход: 61%).
(1-4) Синтез синтетического промежуточного соединения 1-6
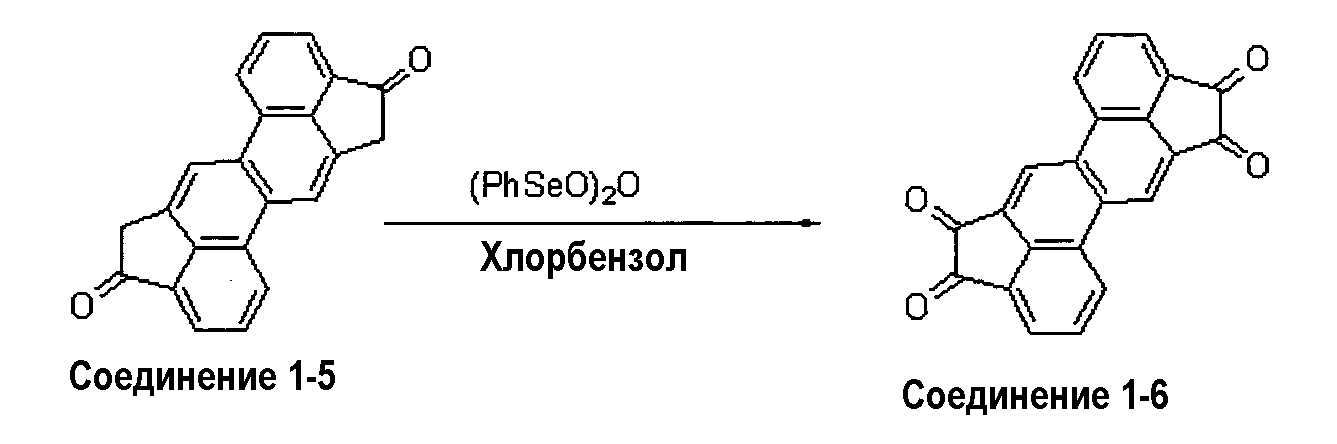
Реагенты и растворители, приведенные ниже, загружали в реакционную колбу и перемешивали при 130°С в течение 18 часов.
Соединение 1-5: 1,27 г (3,89 ммоль)
Бензолселенистый ангидрид: 4,4 г (8,56 ммоль)
Хлорбензол: 60 мл
Эту суспензию охлаждали до 100°С и выпавшие кристаллы, пока они еще горячие, отделяли фильтрованием. Полученные кристаллы промывали гексаном и сушили в высоком вакууме, получая 1,27 г соединения 1-6 (выход: 97%).
(1-5) Синтез синтетического промежуточного соединения 1-8

Реагенты и растворители, приведенные ниже, загружали в реакционную колбу и перемешивали при 80°С в течение 18 часов в токе газообразного азота.
Соединение 1-6: 37 мг (0,0046 ммоль)
Соединение 1-7: 40 мг (0,0092 ммоль)
Этанол: 2 мл
Толуол: 100 мл
6н Гидроксид калия: 300 мкл
После завершения реакции оставляли реакционную смесь для охлаждения до комнатной температуры, и полученные в результате кристаллы отделяли фильтрованием. Кристаллы промывали метанолом и IPE (изопропиловым эфиром), и сушили в высоком вакууме, получая 55 мг соединения 1-8 (выход: 99%).
(1-6) Синтез представленного в качестве примера соединения Н-6
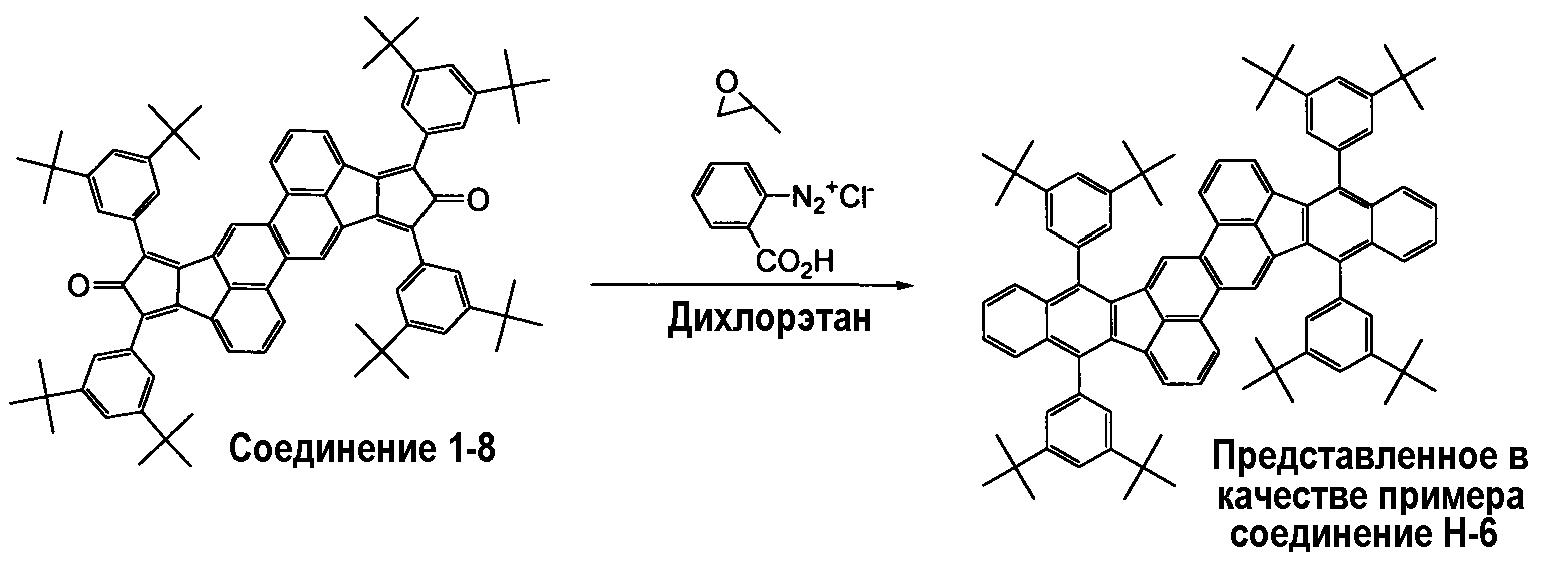
Реагенты и растворители, приведенные ниже, загружали в реакционную колбу и перемешивали при 70°С в течение 5 часов.
Соединение 1-8: 55 мг (0,0485 ммоль)
Бензолдиазоний-2-карбоксилат гидрохлорид: 500 мг (0,27 ммоль)
Пропиленоксид: 0,5 мл
Дихлорэтан: 5 мл
После завершения реакции оставляли реакционную смесь для охлаждения до комнатной температуры, и полученные в результате кристаллы отделяли фильтрованием. Кристаллы тщательно промывали диэтиловым эфиром-гексаном, и затем очищали колоночной хроматографией на силикагеле (элюирующий растворитель: гексан/хлороформ=3/1), получая 33 мг представленного в качестве примера соединения Н-6 (выход: 55%).
Физические свойства полученного соединения измеряли и численно выражали.
(Молекулярная масса)
Было подтверждено, что соединение имеет М+ 1229,79 посредством MALDI-TOF-MS (время пролетного масс-спектрометра с ионизацией лазерной десорбцией с использованием матрицы), и таким образом оно идентифицировано как представленное в качестве примера соединение Н-6.
(ЯМР)
Структура этого соединения была подтверждена снятым ЯМР-спектром.
1Н-ЯМР (CDCl3, 400 МГц) σ (м.д.): 7,87-7,86 (м, 4Н), 7,78-7,77 (м, 2Н), 7,73 (д, 2Н, J=8,0 Гц), 7,66 (т, 2Н, J=2,0 Гц), 7,48-7,41 (м, 14Н), 7,35 (т, 2Н, J=7,6 Гц), 6,65 (д, 2Н, J=7,2 Гц), 1,42 (с, 36Н), 1,39 (с, 36Н).
(Характеристики светоизлучения)
В растворе измеряли спектр излучения представленного в качестве примера соединения Н-6. До того, как проводили регистрацию спектра излучения, был предварительно снят спектр поглощения представленного в качестве примера соединения Н-6 в растворе толуола (1×10-5 моль/л), с использованием спектрофотометра “U-3010” (произведенного Hitachi High-Technologies Corporation). После регистрации абсорбционного спектра снимали спектр излучения (спектр флуоресценции) представленного в качестве примера соединения Н-6 в растворе толуола (1×10-5 моль/л), с использованием флуоресцентного спектрофотометра “F-4500” (произведенного Hitachi High-Technologies Corporation). В этом случае длину волны возбуждающего света устанавливали 351 нм исходя из результатов регистрации абсорбционного спектра. Как результат регистрации был получен спектр флуоресценции, показанный на фиг.6. Было найдено из спектра флуоресценции, показанного на фиг.6, что максимумы с длинами волн для представленного в качестве примера соединения Н-6 имеют первый пик и второй пик при 469 нм и 502 нм, соответственно, и соединение Н-6 проявляет хорошее синее излучение.
Пример 2
Синтез представленного в качестве примера соединения Н-1
(2-1) Синтез синтетического промежуточного соединения 1-10

Реагенты и растворители, приведенные ниже, загружали в реакционную колбу и перемешивали при 80°С в течение 0,5 часа в токе газообразного азота.
Соединение 1-6: 0,76 г (2,26 ммоль)
Соединение 1-9: 0,8 г (3,80 ммоль)
Этанол: 18 мл
Толуол: 2 мл
6н Гидроксид калия: 800 мл
После завершения реакции оставляли реакционную смесь для охлаждения до комнатной температуры, и полученные в результате кристаллы отделяли фильтрованием. Кристаллы промывали метанолом и IPE, и сушили в высоком вакууме, получая 330 мг соединения 1-10 (выход: 21%).
(2-2) Синтез представленного в качестве примера соединения Н-1

Реагенты и растворители, приведенные ниже, загружали в реакционную колбу и перемешивали при 70°С в течение 2 часов.
Соединение 1-10: 76 мг (0,111 ммоль)
Бензолдиазоний-2-карбоксилат гидрохлорид: 82 мг (0,444 ммоль)
Пропиленоксид: 0,2 мл
Дихлорэтан: 4 мл
После завершения реакции оставляли реакционную смесь для охлаждения до комнатной температуры, и полученные в результате кристаллы отделяли фильтрованием. Кристаллы тщательно промывали диэтиловым эфиром и затем очищали колоночной хроматографией на силикагеле (элюирующий растворитель: гексан/хлороформ=3/1), получая 45 мг представленного в качестве примера соединения Н-1 (выход: 51%).
Физические свойства полученного соединения измеряли и численно выражали.
(Молекулярная масса)
Было подтверждено, что соединение имеет М+ 780,04 посредством MALDI-TOF-MS (время пролетного масс-спектрометра с ионизацией лазерной десорбцией с использованием матрицы), и таким образом оно идентифицировано как представленное в качестве примера соединение Н-1.
(ЯМР)
Структура этого соединения была подтверждена снятым ЯМР-спектром.
1Н-ЯМР (CDCl3, 400 МГц) σ (м.д.): 7,81 (т, 6Н, J=2,8 Гц), 7,73-7,65 (м, 18Н), 7,60-7,58 (м, 4Н), 7,43-7,38 (м, 6Н), 7,54 (д, 2Н, J=6,8 Гц), 1,42 (с, 36Н), 1,40 (с, 36Н).
В дальнейшем, каждое из представленных в качестве примера соединений Н-3, Н-5, Н-7 и I-1 может быть синтезировано такими же синтетическими способами, как в примере 1. А именно, синтез осуществляли при тех же условиях, как и в примере 1, за исключением того, что производное дибромхризена и производное ацетона, представленные в нижеприведенной таблице 1, применялись вместо соединения 1-1 и соединения 1-7, соответственно, в примере 1.

Кроме того, каждое из представленных соединений B-1, C-3, D-1, E-1, F-1, G-2, H-2, I-3 и J-2 могут быть синтезированы посредством способа, представленного на схеме синтеза 1. А именно, в качестве производного дибромхризена и производного бороновой кислоты по схеме синтеза 1 применяются соединения, показанные в нижеприведенной таблице 2, соответственно каждому из производных.

Пример 6
Изготовление органического светоизлучающего устройства
В этом примере было изготовлено органическое светоизлучающее устройство, показанное на фиг.3. Во-первых, оксид индия-олова (ITO) (анод 2) был сформирован в виде пленки толщиной 100 нм на стеклянной подложке (подложка 1), и таким образом была изготовлена стеклянная подложка с ITO электродом. Во-вторых, слой, включающий органическое соединение, и катод подвергали напылению в вакууме, используя электрический нагрев, для постоянного формирования пленки на этой стеклянной подложке с ITO электродом. А именно, во-первых, соединение 2, приведенное ниже, применяли в качестве переносящего недостаток электрона слоя 5 для формирования пленки толщиной 20 нм. Затем, соединение 3, приведенное ниже, служащее в качестве хозяина, и представленное в качестве примера соединение Н-1, служащее в качестве гостя, были совместно напылены в качестве светоизлучающего слоя 3, таким образом, что содержание представленного в качестве примера соединения Н-1 составляло 1% мас. из расчета на соединение 3. В этом случае светоизлучающий слой 3 был сформирован в виде пленки толщиной 30 нм. Последовательно, соединение 4, приведенное ниже, применяли в качестве электронпереносящего слоя, формируя пленку толщиной 30 нм. Затем KF применяли для формирования пленки толщиной 1 нм, и в довершении всего алюминий применяли для формирования пленки толщиной 100 нм. Здесь KF и алюминий функционируют как катод 4.

Следует заметить, что давление в вакуумной камере устанавливали 10-5 Па в процессе формирования пленки. Кроме того, при изготовлении устройства каждый из электродов, противолежащий другому электроду, формировали таким образом, чтобы у него была площадь 3 мм2. Как описано выше, было получено органическое светоизлучающее устройство.
Физические свойства полученного органического светоизлучающего устройства измеряли и численно выражали. А именно, вольт-амперные характеристики и яркость свечения устройства измеряли микроамперметром “4140B” произведенным компанией Hewlett-Packard Development Company, L.P и измерителем яркости “BM 7”, произведенным Topcon Corporation, соответственно. В результате органическое светоизлучающее устройство, показывающее яркость свечения 300 кд/м2 при используемой разности потенциалов 4,0 В и синее излучение наблюдали. Далее подтвердили, что устройство эксплуатировалось при плотности тока 30 мА/см2 в атмосфере азота и показывало хорошую долговечность после приведения в рабочее состояние применением разности потенциалов в течение 100 часов.
Тогда как настоящее изобретение описано со ссылкой на иллюстративные примеры осуществления изобретения, следует понимать, что изобретение не ограничивается раскрытыми иллюстративными примерами осуществления изобретения. Объем нижеследующей формулы изобретения соответствует полной интерпретации настолько, чтобы вместить все подобные модификации и эквивалентные структуры и принципы действия.
Настоящая заявка испрашивает преимущество японских патентных заявок №№ 2007-096343, поданной 2 апреля 2007 г. и 2008-038298, поданной 20 февраля 2008 г., которые, таким образом, включены в виде ссылки в этот документ во всей своей полноте.
Реферат
Изобретение относится к конденсированному циклическому ароматическому соединению, представленному нижеследующей общей формулой [2]: ! ! где каждый, R1, R2, R3, R5-R8, R10-R13, R15-R18, R20 представляют собой атом водорода, R4, R9, R14, R19 представляют собой фенил, необязательно замещенный 2 заместителями, выбранными из третбутила. Также изобретение относится к применению обозначенного соединения в качестве органического светоизлучающего слоя в органическом светоизлучающем устройстве. Настоящее изобретение относится к веществу, которое может использоваться для создания светоизлучающего устройства, имеющего высокую эффективность излучения света и хорошую долговечность. 2 н.п. ф-лы, 2 табл., 6 ил.
Формула

где каждый R1, R2, R3, R5-R8, R10-R13, R15-R18, R20 представляют собой атом водорода, R4, R9, R14, R19 представляют собой фенил, необязательно замещенный 2 заместителями, выбранными из третбутила.
Документы, цитированные в отчёте о поиске
Флуоресцентные изделия, имеющие несколько слоев пленки

Комментарии