Средство для колориметрического определения аналита - RU2015513C1
Код документа: RU2015513C1
Чертежи

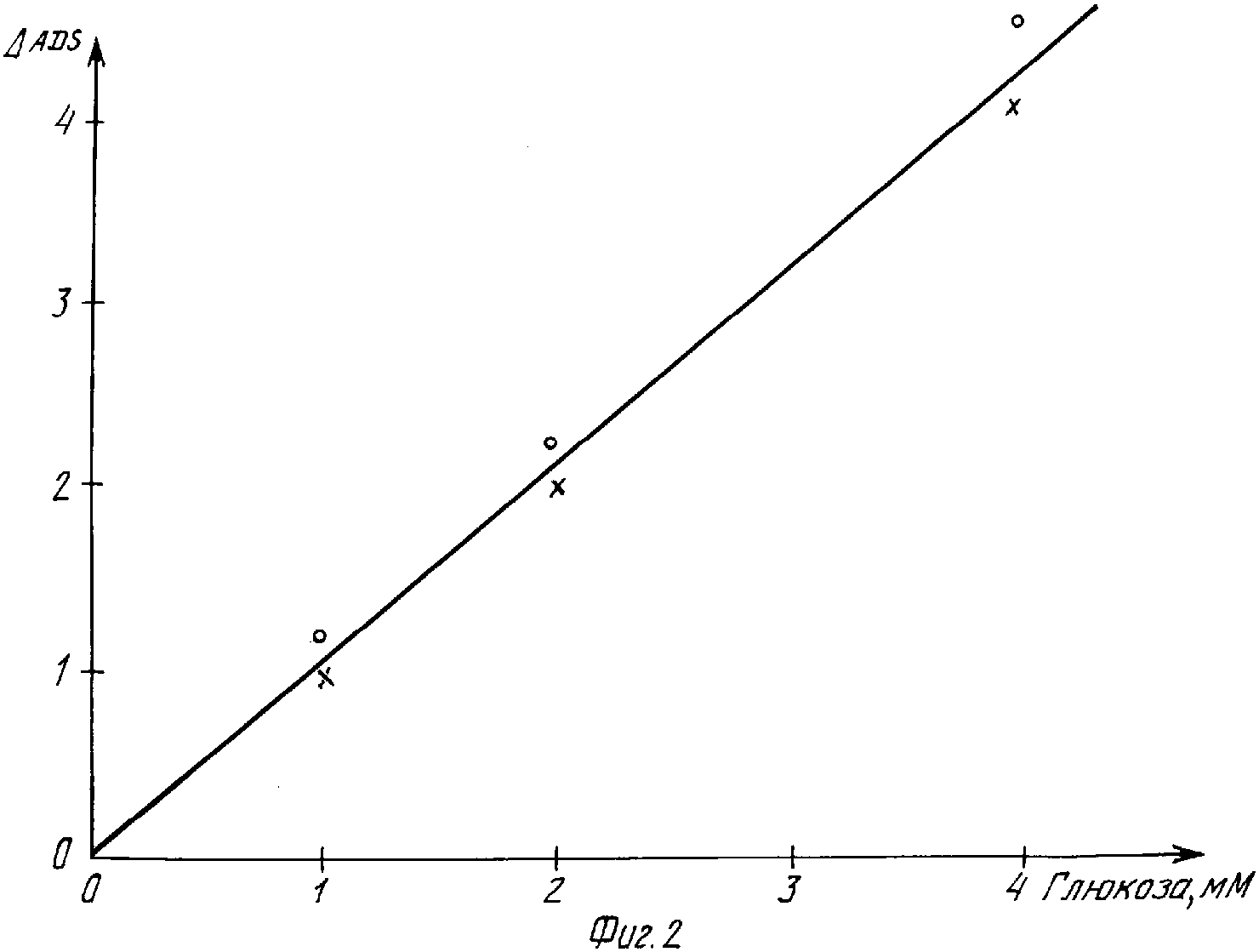
Описание
Изобретение относится к способам колориметрического определения веществ (аналита) с помощью их ферментативного окисления в присутствии акцептора электронов и последующей оценки содержания восстановленного акцептора электронов по изменению окраски.
Цель изобретения - повышение точности способа.
Способ осуществляется следующим образом.
В растворе или на твердом носителе проводят реакцию аналита и цветообразующего акцептора электронов в присутствии фермента класса оксидоредуктаз, а
определение аналита проводят колориметрически. При этом в качестве фермента используют флавиноксидазу или НАД (Ф)-независимую дегидрогеназу, а в качестве цветообразующего акцептора электронов
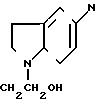
- непосредственно реагирующее с аналитом и ферментом вещество: n-бензохинондиоксим, бензофураны общей формулы I
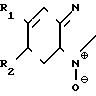
(I) где R1=R2=H;
R1=H; R2=COCH3;
R1= R2= CH3 или 2, 4-диметоксинитробензол, N-(2-гидроксиэтил)-5 нитрозоиндолин, NN-диметил-4-нитрозо-1-нафтиламин или производные n-нитробензола общей формулы II

(II) где R - гидроксил, остаток диметиламина, диэтиламина или диэтаноламина.
Способ в соответствии с изобретением реализуется таким образом, что исследуемая проба контактирует с соответствующей оксидоредуктазой и с одним или несколькими указанными краскообразующими электронными акцепторами. Если проба содержит аналит, который окисляется оксиредуктазой, то восстанавливается краскообразующий электронный акцептор. Если восстановленный электронный акцептор имеет другую окраску, чем первоначальный электронный акцептор в окисленной форме, или если электронный акцептор в результате процесса ферментативного окисления перешел из бесцветного состояния в окрашенное состояние, то интенсивность образованной окраски может соотноситься непосредственно визуально, возможно с помощью эталонных окрасок или фотометрически с концентрацией аналита в пробе.
Если окраска восстановленного электронного акцептора в основном такая же, как и окраска первоначально использованного электронного акцептора, или если происходит осветление окраски или полное обесцвечивание, то за реакцией ферментативного окисления должна следовать последующая реакция, которая приводит к цвету, по интенсивности которого визуально или фотометрически также можно определить концентрацию аналита в пробе.
Способ может быть реализован в так называемой влажной пробе, например в кювете, или в виде так называемой сухой пробы на соответствующем носителе реактивов, причем необходимые тест-реактивы располагаются на твердом носителе, в частности на впитывающем или способном набухать материале. Такие тест-носители известны (европейский патент N 0016387, выложенная заявка ФРГ N 3247608, европейский патент N 0262445 или европейский патент N 0256806).
Средства колориметрического определения аналита для реализации способа в соответствии с изобретением, как они охарактеризованы в формуле изобретения, также являются предметом изобретения. Такое средство наряду с необходимой для ферментативного окисления определяемого аналита оксиредуктазой содержит, по меньшей мере, один краскообразующий электронный акцептор, который непосредственно принимает высвобождающиеся при окислении электроны из системы аналит/фермент. В качестве окисляющих ферментов и краскообразующих электронных акцепторов применяются указанные для способа в соответствии с изобретением вещества.
Для сохранения пригодного для реализации способа водородного показателя, который, в частности, ориентируется на используемые ферменты, средство в соответствии с изобретением содержит буферную систему. Кроме того, оно может содержать другие обычно пригодные для таких средств использованные добавочные вещества, например, смачивающие вещества, стабилизаторы и т.д. Если окисление электронного акцептора не приводит к измеряемому изменению цвета, то средство в соответствии с изобретением для колориметрического определения аналита включает естественно также необходимые для последующей реакции реактивы.
Средство в соответствии с изобретением может существовать в форме раствора или может быть нанесено на впитывающий или способный набухать носитель. В форме раствора средство содержит преимущественно все необходимые для способа в соответствии с изобретением реактивы. В качестве растворителей во внимание принимаются вода, растворимые в воде органические растворители, например метанол, этанол, ацетон или диметилформамид или смеси из воды и таких органических растворителей. Из соображений сохраняемости может быть предпочтительным распределение для теста реактивов по двум или большему количеству растворов, которые смешиваются лишь при непосредственном исследовании. Последнее, в частности, может быть оправдано тогда, когда после окисления аналита восстановленный электронный акцептор в ходе последующей реакции, например окислительной реакции сочетания, преобразуется дальше. Типичными концентрациями использованных в средстве в соответствии с изобретением электронных акцепторов являются: 0,01-100 ммол/л, предпочтительно 0,1 - 25 ммол/л. Реактивы для последующих реакций используются, по меньшей мере, в стехиометрическом отношении к электронным акцепторам, предпочтительно в избытке, в частности в 2-10-кратном избытке.
Средство в соответствии с изобретением может существовать также в форме тест-полосы. Такие тест-полосы известны во многих вариантах выполнения. Для всех общим является то, что необходимые для реализации способа определения реактивы имеются на твердых несущих слоях. В качестве несущих слоев во внимание, в частности, принимаются впитывающие и/или способные набухать материалы, которые смачиваются жидкостью исследуемой пробы. Примерами являются желатина, целлюлоза или прочесы из синтетического волокна. Или на этих несущих материалах имеются реактивы в твердой форме.
При подаче жидкости пробы на тест-полосу или при погружении тест-полосы в жидкость пробы в полосе образуется жидкая среда, внутри которой протекает реакция обнаружения. Вызванное реакцией краскообразование может оцениваться визуально или фотометрически, например методом отражательной фотометрии.
Специальный предмет изобретения касается использования субстанции из группы соединений с азотом на ступени окисления между +1 и -1 в качестве непосредственного электронного акцептора системы аналит/оксидоредуктаза. В этой связи под системой аналит/оксиредуктаза понимается необходимая для реакции ферментативного окисления комбинация из аналита и окисляющего фермента, а также при необходимости совместно с естественно необходимыми для окисления коферментами, например флавин или пирролохинолинхинон, взаимодействующими с ферментом, или/и с кофакторами, например соли металлов. Было обнаружено, что субстанции из группы нитросоединений, N-оксиды, гидроксиламины и оксимы, предпочтительно нитросоединения, N-оксиды и оксимы, в общем и целом могут использоваться в качестве краскообразующих электронных акцепторов при окислении аналита с помощью оксиредуктазы.
Изобретение имеет преимущество, заключающееся в том, что нет надобности в катализаторах восстановления, например диафораза или N-метилфеназинметосульфат, для восстановления краскообразующего электронного акцептора. Его восстановление теперь может осуществляться непосредственно с помощью системы аналит/фермент. Таким образом, можно избежать возможных мешающих побочных реакций.
В частности, в случае использования оксидаз для ферментативного окисления аналитов благодаря использованию соединений в соответствии с изобретением предотвращается образование перекиси водорода как предварительной ступени колориметрического способа определения. Это устраняет или уменьшает мешающее воздействие окисляюще действующих соединений.
Наконец, использованные соединения в соответствии с изобретением предлагают настоящую альтернативу там, где лимитировано или нежелательно поступление кислорода воздуха. Кислород в качестве электронного акцептора при ферментативном окислении может быть замещен этими соединениями. Совершенно особые преимущества это дает при использовании средств в соответствии с изобретением в форме тест-полос. В то время как эти тест-полосы до сих пор особенно при высоких концентрациях аналита должны строиться таким образом, чтобы при ферментативных окислениях с помощью оксидазы имелся доступ кислорода воздуха к нанесенной на тест-полосу смеси реактивов, теперь создаются тест-полосы, которые работают особенно быстро и надежно. В то время как до сих пор при использовании пленочных тест-полос проба после подачи на тест-полосу часто по истечении определенного времени вновь должна смываться, чтобы кислород вообще мог диффундировать в тест-полосу, теперь в этой мере при смачивании электронных акцепторов в соответствии с изобретением нет надобности. Благодаря тому, что удается избежать зависящей от времени диффузии кислорода в тест-полосу, получаются при кинетических измерениях, зависимых от концентрации аналита скорости реакции и при измерениях конечных точек в конечной точке независимо от концентрации аналита скорости реакции, которые допускают более быстрые, более надежные и более простые способы определения, чем это было возможно до сих пор.
Примеры показывают некоторые из возможных вариантов способа колориметрического определения аналита с помощью ментативного окисления.
П р и м е р 1. Восстановление N-оксидов с помощью оксидаз или независимых от НАД (Ф) дигедрогеназ и их субстратов.
А) 40 г поливинилпропионата
(например, пропиофана 70D, БАСФ АГ, Людвигсхафен, ФРГ),
45 г альгината натрия (например, альгифон фон келко, Дивжен оф Мерк унд. Ко., Кларк, Нью Джерси, США),
2,5 г гидролизата белка
(например, кретеин С, Крода ГмбХ, Неттетал, ФРГ),
10 мл 0,1 М трис-буфера, водородный показатель 7,5,
750 иммунизирующих единиц глюкозооксидазы (ЕС 1.1.3.4) и 1 мл 0,1 М раствора
резацурина в воде были размещены до получения гомогенной массы, эта масса была нанесена на матовую с одной стороны поликарбонатную пленку (например, покалон Лонда, Райнфельден, ФРГ) толщиной 140 мкм
(просвет ракеля 200 мкм) и высушена в течение 30 мин при температуре 50оС.
При подаче содержащего глюкозу раствора (40 мг/дл) на такую пленку реактивный слой в течение 1 мин изменил окраску с голубого цвета на красный. Присутствие 20 мг/дл мочевой кислоты и 20 мг/дл глютатиона не привело к нарушению цветной реакции. При подаче растворов, которые не содержали глюкозу, реактивный слой сохранил ту окраску, которую он имел до подачи пробы. Он остался голубым.
Вместо опыта, проведенного с глюкозой и глюкозооксидазой, был проведен опыт с
использованием
пирувата и пируватоксидазы (ЕС 1.2.3.3),
лактата и лактатоксидазы (ЕС 1.1.3.2),
глицерин-3-фосфата и глицерин-3-фосфатоксидазы (ЕС 1.1.3.21), в котором был
достигнут такой же цветной результат.
Б) Если при изготовлении указанной пленки вместо резецирина использовали следующие бензфуроксаны
а) R1=R2:H
b) R15H; R2: т СО-СН3 (производство по N.P. Ayyangov Synthesis 1987, 616)
c) R1: H; R2, CHO (производство по М.L.Ed- wards, T.Het. Chemistry 13, 653 (1976)
d) R1=R2:CH3 (производство по T.A.Usta et al., T.Het. Chemistry 18, 655 (1981) в концентрации 250 мг на одно приготовление пленки, тогда окраска в присутствии глюкозы в исследованной пробе изменялась соответственно с бесцветной на оранжевую. С увеличением концентрации глюкозы возрастала интенсивность цвета.
Присутствие 20 мг/дл мочевой кислоты не привело к нарушению цветной реакции.
Пары
субстрат/фермент:
пируват/пируватоксидаза (ЕС 1.2.3.3),
лактат/лактатоксидаза (ЕС 1.1.3.2)
глицерин-3-фосфат/глицерин-3-фосфатоксидаза (ЕС 1.1.3.21) удалось обнаружить также
с помощью вышеупомянутых бензфуроксанов.
П р и м е р 2. Восстановление нитросоединений с помощью глюкозооксидазы и глюкозы
А) 2000 мкл 0,1 М буфера лимонная кислота/NaOH,
водородный показатель 6,0
200 мкл 0,1 М раствора n-нитрозо-N,N-диметиланилина в этаноле
100 мкл глюкозооксидазы (ЕС 1.1.3.4) (2500 иммунизирующих единиц/мл) или глюкозодегидрогеназы
(ЕС 1.1.99.10)
200 мкл пробы с известным содержанием глюкозы в воде
а) 5 ммоль
b) 10 ммоль
с) 15 ммоль
d) 20 ммоль
е) 50 ммоль были смешаны и
инкубированы в течение 2 мин при температуре 25оС. Затем было добавлено
250 мкл 0,1 М раствора N-метилантраниловой кислоты в этаноле,
125 мкл 0,2 М раствора
гексацианоферрата калия (II) в воде и
125 мкл 0,2 М раствора гексацианоферрата калия (III) в воде.
По истечении 1 мин было произведено 25-кратное разбавление и была измерена абсорбция реакционной смеси, которая в присутствии глюкозы окрашивается в зеленый цвет, при 710 нм относительно величины потускнения (вышеупомянутая реакционная смесь без глюкозы). Полученные результаты дали прямую. Удельный коэффициент погасания ε710=24000 М-1 СМ-1 может быть использован для определения неизвестных концентраций глюкозы в растворах.
Б) Если в предыдущем опыте n-нитрозодиметиланилин заменяли
а) n-нитрозофенилом,
b) n-нитрозо-N,N-диэтиланилином,
с) n-нитрозо-N,
N-диэтаноламилином (производство no D'Amico et al., J. Amer, Chem, Soc, 81, 5957 (1959), то в присутствии глюкозы в результате сочетания с N-метилантрониловой кислотой наблюдалось изменение цвета
а) коричневого на голубой,
b) желтого на зеленый,
с) желтого на зеленый,
В) Если в вышеупомянутом опыте в пункте А) N-метилантраниловую кислоту заменяли
а)
N-метил-N-метиленанилином фосфоновой кислоты,
с) анилин-2-сульфокислотой, то в присутствии глюкозы в результате сочетания с n-нитрозо-N,N-диметиланилином наблюдался цвет с
а) λмакс=735 нм
b) λмакс=590 нм
с) λмакс=640 нм.
В случае использования n-нитрозо-N,N-диметиланилина и N-метил-N-метиленанилина фосфоновой кислоты была найдена воспроизведенная на фиг.1 зависимость изменения поглощения света при 735 нм от концентрации глюкозы. С этой целью было измерено погасание после разбавления в цитратном буфере (1+24), водородный показатель 6 и нанесено относительно концентрации глюкозы в тестовом составе.
П р и м е р 3. Обнаружение глюкозы путем образования металлического серебра.
Исходная смесь из цитратного буфера, n-нитрозо-N,N-диметиланилина, глюкозооксидазы и пробы инкубировалась как и в примере 2А, в течение 2 мин при температуре 25оС и затем было добавлено 250 мкл 100 мМ раствора нитрата серебра в воде, а также 250 мкл раствора золя золота в воде. (Получение золя золота осуществлялось в соответствии со следующим предписанием: к 100 мл кипящей дистиллированной воды последовательно добавляется 0,4 мг HA4C4, растворенного в 0,4 мл воды; 0,2 мл 0,1 М раствора NaSCN в воде и 0,5 мл 0,1 М раствора К2СО3 в воде. По истечении 10 мин смесь охлаждают).
С помощью полученных без промежуточного разбавления результатов при 700, 850 и 1300 нм были получены воспроизведенные на фиг.2 кривые. Они могут служить в качестве эталонных кривых для определения неизвестного содержания глюкозы в растворах.
П р и м е р 4. Обнаружение глюкозы путем образования молибдена голубого.
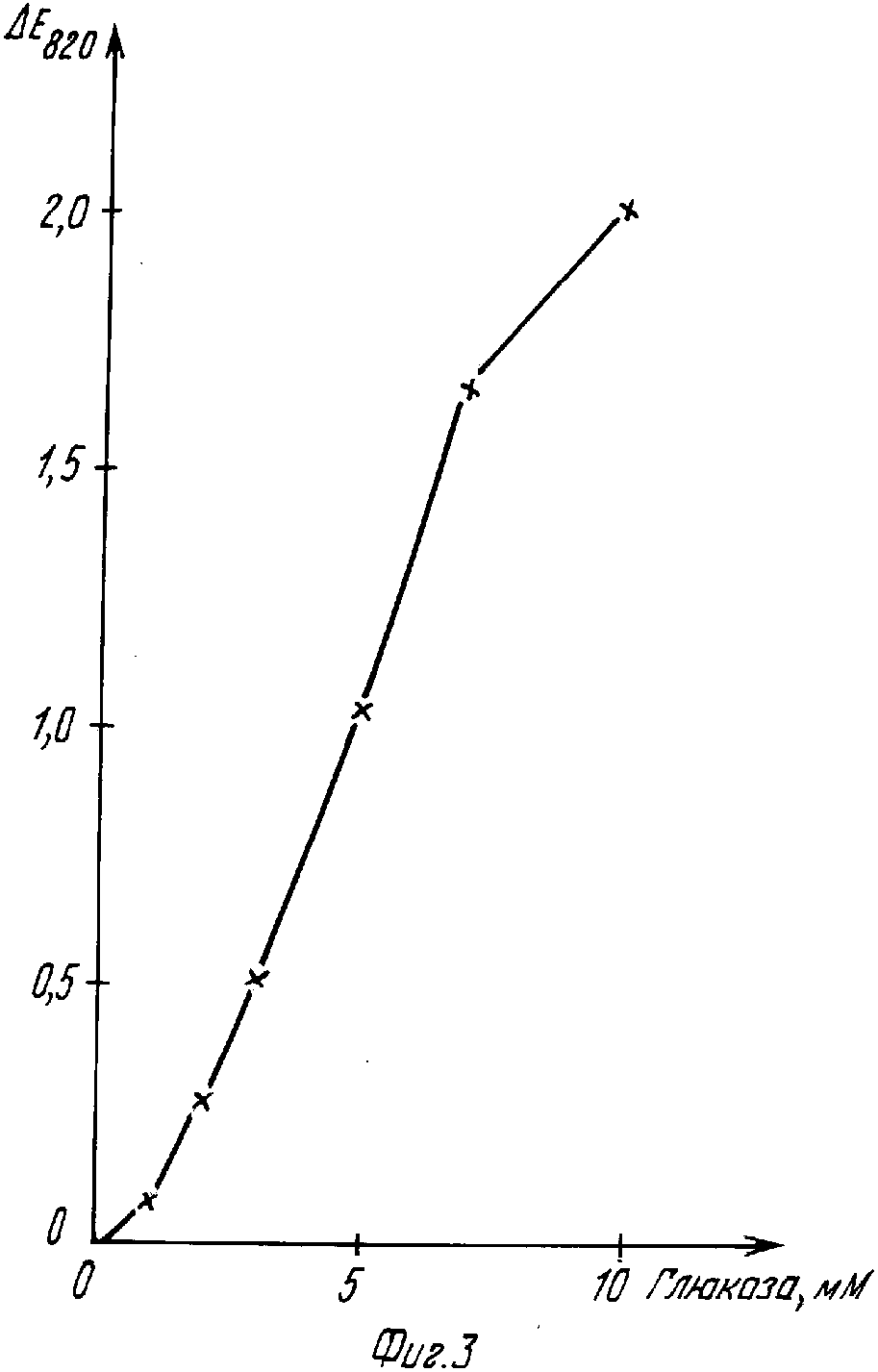
К раствору из 200 мг 2,18-фосфорно-молибденовой кислоты (получение, например, возможно по g.Brauer "Handbuch der praparativen Anerganishen Chemie", Enkc-Verlag, Stuttgarts. 1278 (1954) или A.Rosenheim, A.Traube, Z.Anerg, Chemie 5, 99 (1910) в 920-Х мкл 0,1 М буфера лимонная кислота/NaOH, 40 мкл 0,1 М раствора n-нитрозо-N,N-диметиланилина, водородный показатель 5,5 было добавлено 40 мкл глюкозооксидазы (6250 иммунизирующих единиц/мл воды). Спустя 1 мин после добавления Х мкл (Х=0, 1, 2, 3, 5, 7, 10) содержащей глюкозу пробы с известным содержанием глюкозы (1Мэ раствор был разбавлен до 50 мл и было измерено изменение абсорбции (Е) при 820 нм. В качестве результата была получена воспроизведенная на фиг.3 кривая. Она может служить в качестве кривой для определения неизвестного содержания глюкозы в растворах, причем С представляет собой концентрацию в пробе до проведенного с целью измерения разбавления.
П р и м е р 5. Кинетическое определение глюкозы с помощью независящей от НАД (Ф) глюкозодегидрогеназы.
Были приготовлены следующие растворы:
Тестовый буфер: 0,1 М трис/соляная кислота,
водородный показатель 7,5, содержащий 1% сывороточного альбумина крови крупного рогатого скота.
Электронный акцептор: 0,1 М раствор n-нитрозо-N,N-диметиланилина в этаноле.
Индикатор: 2,18-фосфорно-молибденовая кислота, 100 мг/мл воды.
Фермент: глюкозодегидрогеназа (ЕС 1.1.99.17), 50 иммунизирующих единиц/мл тестового буфера.
Раствор глюкозы: a) 36 мг глюкозы/дл человеческой плазмы
b) 72 мг глюкозы/дл человеческой плазмы
с) 144 мг глюкозы/дл человеческой плазмы
d) 360 мг глюкозы/дл человеческой
плазмы
е) 720 мг глюкозы/дл человеческой плазмы
f) 1440 мг глюкозы/дл человеческой плазмы
g) 3600 мг глюкозы/дл человеческой плазмы
В односантиметровую кюветту было
помещено 1740 мкл буфера, 250 мкл электронного акцептора, 250 мкл индикатора и 10 мкл глюкозодегидрогеназы, смесь была нагрета до 25оС, затем было добавлено 250 мкл раствора глюкозы. С
добавлением раствора глюкозы, которое считалось точкой отсчета, регистрировалось изменением абсорбции в минуту (Δ Е/мин) при 820 нм. Были получены следующие величины (см. табл.1).
П р и м е р 6. Тестовая полоса для обнаружения глюкозы путем образования молибдена голубого.
1 г алтганата натрия (например, альгифон фон келко, Дивижен оф Марк унд Ко.,
Кларк, Нью Джерси, США) 45 г поливинилпропината (напри-
мер, пропиофана 70D, фирмы
БАСФ АГ, Людвигсхарен, ФРГ) 0,75 г нонисульфата натрия 10,15 г дигидрогенфосфата калия 85,5 г
дистиллированной воды 4 г аэрозоля СОК 84 (фирмы
ДЕГУССА, Ханау, ФРГ) перемешиваются до получения гомогенной массы и с помощью 10% раствора едкого натра смесь доводится до водородного
показателя 5,5.
Затем было добавлено 65 г глюкозооксидазы (250 иммунизирующих единиц/мг), 260 мг n-нитрозо-N,N-диметиланилина, 1,3 г 2,18-фосформолибденовой кислоты. Масса была нанесена ракелем с толщиной слоя 320 мкм на полистирольную пленку толщиной 1 мм и высушена в течение 1 ч при температуре 60оС. При подаче капли содержащего глюкозу раствора в течение 1 мин появляется явная окраска в зеленый цвет. Интенсивность окраски усиливается с увеличением концентрации глюкозы и может быть оценена визуально с помощью шкалы сравнения или отражательно фотометрическим способом.
Вместо электронного акцептора n-нитрозо-N,N-диметиланилина можно было бы использовать также n-бензохинондиоксим или n-нитрозо-N,N-диэтаноланилин. При хранении в темноте при комнатной температуре окраска стабильна в течение нескольких недель.
Если в упомянутом примере n-нитрозо-N,N-диметиланилин заменяют пероксидазой (100 мг; 200 иммунизирующих единиц/мг)
и фосформолибденовую кислоту заменяют 3,3',5,5'-тетраметилбензидином (300 мг), то получают зависящий от кислорода глюкозотест в том виде, в котором он в принципе известен из уровня техники. Однако
тогда в противоположность упомянутому примеру раствор пробы после подачи на тестовую полосу должен смываться, чтобы кислород мог диффундироваться и чтобы вообще появлялась окраска. Дополнительно к
этому недостатку окончательная окраска с более высокой концентрацией глюкозы всегда достигается медленнее и полученная краска менее стабильна при хранении. Таким образом, преимуществами замены
кислорода электронными акцепторами в соответствии с изобретением являются:
не требуется смывание пробы после подачи на тестовую полосу,
более быстрая реакция,
при
кинетическом измерении зависящая от концентрации аналита скорость реакции,
при измерении по конечной точке независящая от концентрации аналита скорость реакции в конечной точке,
более стабильный краситель.
П р и м е р 7. Обнаружение глюкозы с помощью независимой от НАД (Ф) глюкозодегидрогеназы и резацурина.
К 2050 мкл тестового буфера (0,2 моль цитрата, 1 мас. % альбумина, водородный показатель 7,0) и 100 мкл раствора электронного акцептора (10 ммоль резацурина в воде) в кюветту было добавлено 250 мкл раствора пробы (концентрация глюкозы Сглюкозы= от 0 до 0,5 ммоль) и 100 мкл раствора фермента (глюкозодегидрогеназы (ЕС 1.1.99.17) 200 иммунизирующих единиц/мл в тестовом буфере). По истечении 2 мин относительно остающейся постоянной величина потускнения с помощью 100 мкл тестового буфера вместо раствора фермента была измерена абсорбция при 530 нм. Были получены следующие результаты (см. табл. 2).
До концентраций пробы 0,5 ммоль тест является линейным. В этой области концентрация в кюветте может быть вычислена из коэффициента погасания ε530= 4350 М-1 СМ-1. При более высоких концентрациях пробы может использоваться промежуточное разбавление или меньший объем пробы. Более низкие концентрации пробы могут более чувствительно определяться с помощью флуоресценции продукта резоруфина.
Аналогичным образом тест может проводиться с бензфуроксаном и указанными в примере 1 Б производными бензфуроксана, а также с нитросоединениями в соответствии с примером 2.
Таким же образом с помощью независящей от НАД (Ф) алкогольдегидрогеназы (ЕС 1.1.99.8) может обнаруживаться этанол.
П р и м е р 8. Определение лактата с помощью лактатоксидазы и нитросоединений в качестве электронного акцептора.
В кюветте были смешаны 2240 мкл тестового буфера (0,2 М лимонная кислота/едкий натр, водородный показатель 6,35), 5 млк электронного акцептора (0,1 М раствор N-N-димитил-п-нитрозоанилина в этаноле) и 250 мкл пробы с известными концентрациями лактата и смесь была нагрета до температуры 25оС. Тест начался с добавления 5 млк раствора фермента (лактатоксидазы (педиококус сп) 200 иммунизирующих единиц/мл тестового раствора) и было зарегистрировано изменение погасания Δ Е/мин при 390 нм. Были получены следующие результаты (см. табл.3).
При этом Слактат является концентрацией лактата, которая находится в кюветте при проведении измерения.
Тест можно было бы ускорить или замедлять путем изменений концентрации электронного акцептора, концентрации фермента, наблюдаемой длины волны и температуры. В качестве электронных акцепторов можно было бы также использовать N, N-диэтил-п-нитрозонилин, N,N-бис- (2-гидроксиэтил)-n-нитрозоанилин, бензфуроксан и резацурин.
П р и м е р 9. Определение глюкозы образованием металлического серебра.
Аналогично примеру 3 инкубировали исходную смесь из цитрабуфера, глюкозы-оксидазы, пробы и вместо n-нитрозо-N,N-диметиланилина с
а) 2,
4-диметоксинитрозобензолом

б) N-(2-гидроксиэтил)-5-нитрозоиндолином


в) N,N-диметил-4-нитрозо-1-нафтиламином

По полученным без промежуточного разбавления результатам при 700, 850 и 1300 нм были получены кривые, представленные на фиг.2.
Реферат
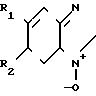
Использование: медицина, клинические исследования биологической жидкости. Цель - повышение точности определения за счет устранения зависимости от наличия кислорода или никотинамидных коферментов. Сущность изобретения: средство содержит фермент класса оксидоредуктаз (флавиноксидазу или НАД (Ф) - независимую дегидрогеназу) и цветообразующий акценптор электронов, выбранный из группы: n-бензохинондиоксим, бензфураноксаны общей формулы
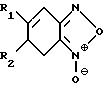

Формула
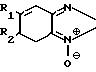
R1 = R2 = H;
R1 = H, R2 = COCH3,
R1 = R2 = CH3,
или 2,4-диметокси-нитрозобензол, N-(2-гидроксиэтил)-5-нитрозоиндолин, N, N-диметил-4-нитрозо-1-нафтиламин, или производные n-нитрозобензола общей формулы
R


где R - гидроксил, остаток диметиламина, диэтиламина или диэтаноламина.

Комментарии