Способы и композиции для модуляции и обнаружения активности wisp - RU2412201C2
Код документа: RU2412201C2
Чертежи

















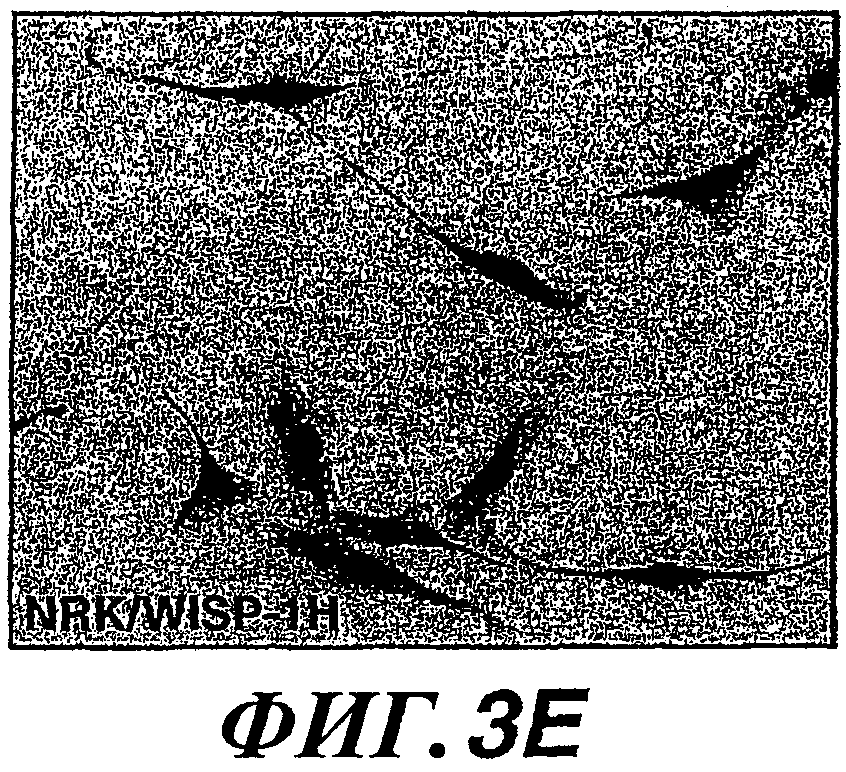













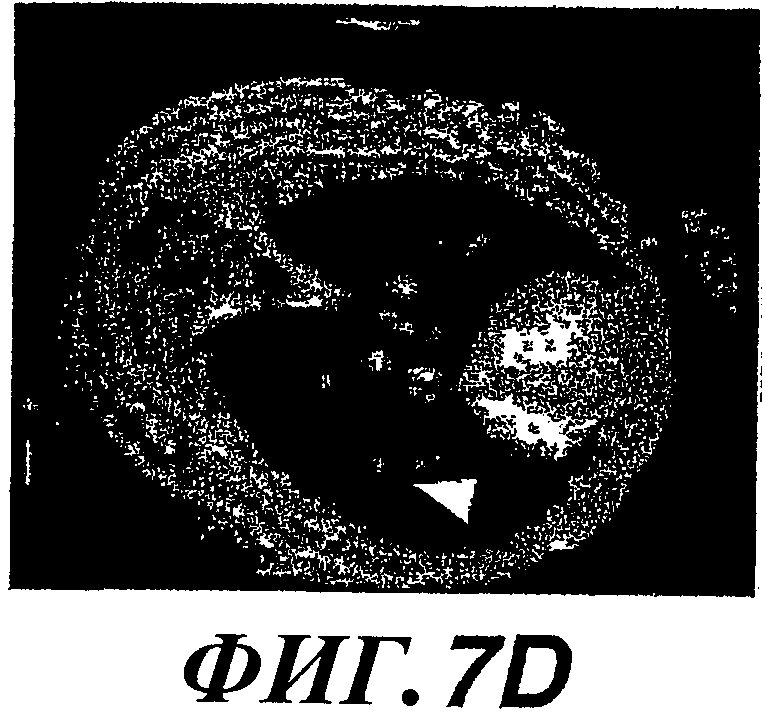






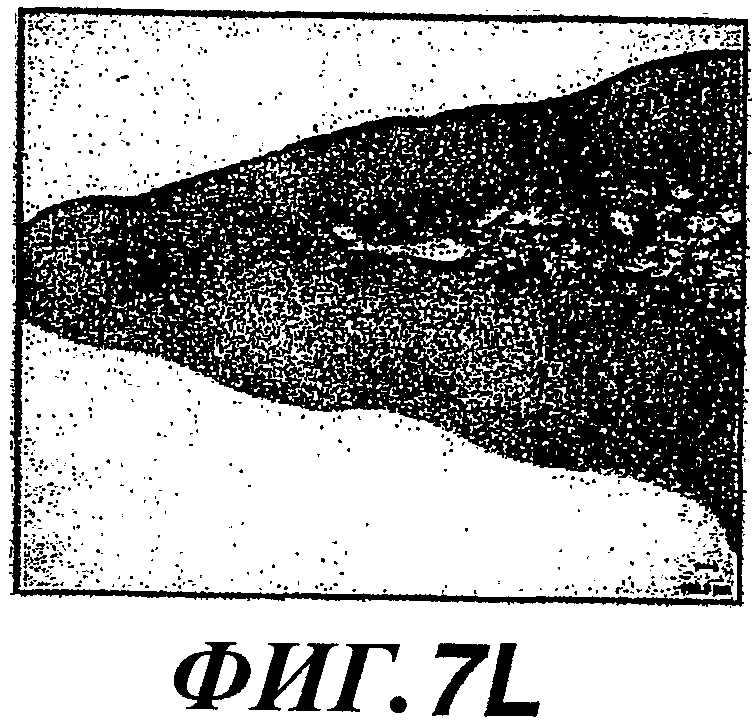






















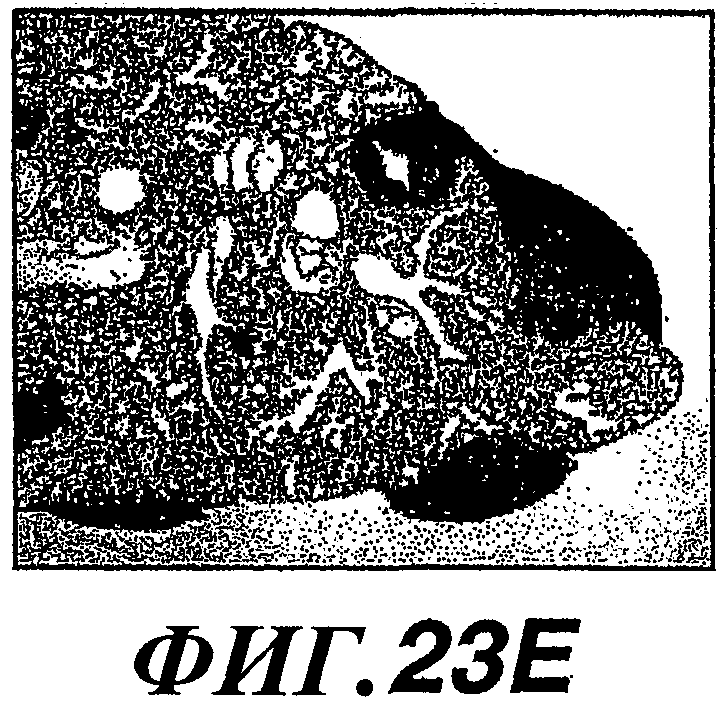









Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам и композициям для модуляции активности полипептидов WISP, в частности полипептидов WISP-1. Настоящее изобретение относится также к способам и композициям для диагностики и/или лечения in vitro, in situ и/или in vivo клеток или патологических состояний у млекопитающих, обусловленных полипептидами WISP.
Уровень техники
Фактор роста соединительной ткани (CTGF) является фактором роста, индуцируемым в фибробластах многими факторами, включая TGF-β, и имеет важное значение для способности TGF-β вызывать свободный рост клеток (AIG), что является отличительным признаком трансформированных клеток. CТGF оказывает также митогенное и хемотаксическое действие на клетки, поэтому считается, что факторы роста, относящиеся к данному семейству, играют определенную роль в нормальном развитии, росте и восстановлении ткани человека. Были выделены, клонированы, секвенированы и исследованы пять белков, относящихся к CТGF, включая Cyr61, Nov, WISP-1, WISP-2 и WISP-3, при этом была установлена их принадлежность к семейству генов CCN (Oemar and Luescher, Arterioscler. Тhromb. Vasc. Biol., 17:1483-1489 (1997); Brigstock, Endocrine Rev., 20:189-206 (1999)). Установлено, что ген, кодирующий Cyr61, стимулирует развитие кровеносных сосудов, рост опухоли и васкуляризацию (Babic et al., Proc. Natl. Acad. Sci. USA, 95:6355-6360 (1998)). Ген Nov экспрессируется в почке в основном на эмбриональной стадии, и изменение экспрессии гена Nov по отношению к нормальной почке было обнаружено в аденосаркомах почек у птиц и опухолях Вильмаса у человека (Martinerie et al., Oncogene, 9:2729-2732 (1994)). Wt1 уменьшает экспрессию гена Nov у человека, что может иметь важное значение для нормального и опухолевого нефрогенеза (Martinerie et al., Oncogene, 12: 1479-1492 (1996)).
Разные члены семейства CCN взаимодействуют с разными растворимыми или ассоциированными с матриксом макромолекулами в определенных сульфатированных гликоконъюгатах (Bork, FEBS Letters, 327:125-130). Указанное взаимодействие было использовано для очистки Cyr61 и CTGF методом аффинной хроматографии на гепарин-агарозе (Frazier et al., J. Invest. Dermatol., 107:404-411 (1996); Kireeva et al., Mol. Cell. Biol., 16:1326-1334 (1996)). Секретированный белок Cyr61 ассоциирован как с внеклеточным матриксом, так и с поверхностью клетки благодаря его сродству к сульфату гепарина (Yang et al., Cell. Growth Diff., 2:351-357 (1991)). Недавно было установлено, что WISP-1 взаимодействует с декорином и бигликаном, двумя секретируемыми протеогликанами сульфата дерматана (Desnoyers et al., J. Biol. Chem., 276:47599-47607 (2001)).
Белок ELM1 мышей недавно был идентифицирован в слабо метастазирующих клетках (Hashimoto et al., J. Exp. Med., 187:289-296 (1998)). Ген elm1, мышиный ортолог описанного ниже WISP-1, является еще одним членом семейства генов CNN. Указанный ген подавляет in vivo рост опухоли и метастазирование клеток меланомы К-1735 у мышей. В недавно опубликованной статье, посвященной rCop-1, крысиному ортологу описанного ниже WISP-2, представлены данные об отсутствии экспрессии данного гена после трансформации клетки (Zhang et al., Mol. Cell. Biol., 18:6131-6141 (1998)).
Wnt кодированы большим семейством генов, члены которого обнаружены у круглых червей, насекомых, хрящевых рыб и позвоночных (Holland et al., Dev. Suppl., 125-133 (1994)). Считается, что Wnt участвуют в разных процессах развития и физиологии, так как разнообразные виды имеют много консервативных генов Wnt (McMahon, Trends Genet., 8:236-242 (1992); Nusse and Varmus, Cell, 69:1073-1087 (1992)). Гены Wnt кодируют секретируемые гликопротеины, которые, как считается, действуют в качестве паракринных или аутокринных сигналов, активных в первичных клетках нескольких типов (McMahon, см. выше (1992); Nusse and Varmus, см. выше (1992)). Семейство факторов роста Wnt включает более десяти генов, идентифицированных у мышей (Wnt-1, -2, -3A, -3B, -4, -5A, -5B, -6, -7A, -7B, -8A, -8B, -10B, -11, -12 и -13) (см., например, Gavin et al., Genes Dev., 4:2319-2332 (1990); Lee et al., Proc. Natl. Acad. Sci. USA, 92:2268-2272 (1995); Christiansen et al., Mech. Dev., 51:341-350 (1995)), и, по крайней мере, девять генов, идентифицированных у человека (Wnt-1, -2, -3, -5A, -7A, -7B, -8B, -10B и -11) методом клонирования кДНК (см., например, Vant Veer et al., Mol. Cell. Biol., 4:2532-2534 (1984)).
Протоонкоген Wnt-1 (int-1) был первоначально идентифицирован в опухолях молочной железы, индуцированных вирусом опухоли молочной железы мышей (MMTV) путем введения последовательности вирусной ДНК (Nusse and Varmus, Cell, 31:99-109 (1982)). У взрослых мышей экспрессия мРНК Wnt-1 обнаружена только в яичках на более поздних стадиях развития сперматозоидов. Белок Wnt-1 имеет молекулярную массу, равную примерно 42 кДа, и содержит аминоконцевую гидрофобную область, которая может функционировать в качестве сигнальной последовательности для секреции (Nusse and Varmus, см. выше, 1992). Экспрессия Wnt-2 обнаружена в тканях плода и взрослых мышей, и его распространение не перекрывает паттерн экспрессии Wnt-1. Wnt-3 ассоциирован с онкогенезом молочной железы у мышей. Экспрессия Wnt-3 у эмбрионов мышей обнаружена в нервных трубках и зачатках конечностей. Транскрипты Wnt-5А обнаружены в развивающихся передних и задних конечностях в период с 9,5 до 14,5 дня, при этом наибольшие уровни экспрессии сконцентрированы в апикальной эктодерме дистальной части конечностей (Nusse and Varmus, см. выше (1992)). В научной литературе недавно был описан фактор роста Wnt, получивший название Wnt-х, (WO95/17416), экспрессия которого была обнаружена в костных тканях и клетках, выделенных из кости. Кроме того, были представлены данные о роли Wnt-x в сохранении зрелых остеобластов и использовании фактора роста Wnt-x в качестве терапевтического средства или при создании других терапевтических средств для лечения костных заболеваний.
Wnt могут играть определенную роль в локальной передаче сигналов в клетки (Peifer and Polakis, Science, 287:1606-1609 (2000)). Биохимические исследования показали, что большая часть секретируемого белка Wnt может быть обнаружена связанной с поверхностью клеток или внеклеточным матриксом, а не в свободно диффундированной форме в среде (Papkoff and Schryver, Mol. Cell. Biol., 10: 2723-2730 (1990)); Bradley and Brown, EMBO J., 9:1569-1575 (1990).
Исследования мутаций в генах Wnt позволили выявить роль Wnt в регулировании роста и образовании ткани. У дрозофилы ген бескрылости (wg) кодирует Wnt-родственный ген (Rijsewik et al., Cell, 50:649-657 (1987)), и мутации гена wg изменяют структуру эмбриональной эктодермы, развитие нервных клеток и рост имагинального диска (Morata and Lawerence, Dev. Biol., 56:227-240 (1977); Bаker, Dev. Biol., 125:96-108 (1988); Kligensmith and Nusse, Dev. Biol., 166:396-414 (1994)). У Caenorhabditis elegans lin-44 кодирует гомолог Wnt, который необходим для асимметричного деления клеток (Herman and Horvitz, Development, 120:1035-1047 (1994)). Мутации с выключением генов у мышей показали, что Wnt имеют важное значение для развития головного мозга (McMahon and Bradley, Cell, 62:1073-1085 (1990); Thomas and Cappechi, Nature, 346:847-850 (1990)), роста зачатков почек у эмбриона (Stark et al., Nаture, 372:679-683 (1994)), зачатка хвоста (Takada et al., Genеs Dev., 8:174-189 (1994)) и зачатков конечностей (Parr and McMahon, Nature, 374:350-353 (1995)). Сверхэкспрессия Wnt-1 в молочной железе может вызвать гиперплазию молочной железы (McMahon, см. выше (1992); Nusse and Varmus, см. выше (1992)), ускоренное развитие альвеол (Bradbury et al., Dev. Biol., 170:553-563 (1995)) и аденокарциномы молочной железы (Li et al., Oncogene, 19:1002-1009 (2000)).
Wnt-5A и Wnt-5B экспрессированы в задней и боковой мезодерме, а также во внезародышевой мезодерме на 7-8 день развития эмбриона мыши (Gavin et al., см. выше (1990)). Вышеуказанные эмбриональные домены способствуют образованию области AGM и тканей желточного мешка, из которых образуются многие предшественники гемопоэтических клеток и HSC (Dzierzak and Medvinsky, Trends Genet., 11: 359-366 (1995)); Zon et al., in Gluckman and Coulombel, ed., Collogue, INSERM, 235: 17-22 (1995), presented at the Joint International Workshop on Foetal and Neonatal Hematopoiesis and Mechanism of Bone Marrow Failure, Paris France, April 3-6, 1995; Kanatsu and Nishikawa, Development, 122: 823-830 (1996)). Wnt-5A, Wnt-10B и другие Wnt были обнаружены в зачатках конечностей, что свидетельствует о возможной роли указанных генов в развитии и паттерне микроокружения на ранней стадии образования костей, как показано для Wnt-7B (Gavin et al., см. выше (1990); Christiansen et al., Mech. Devel., 51:341-350 (1995); Parr and McMahon, см. выше (1995)).
Для ознакомления с генами Wnt см. публикацию Cаdigan and Nusse, Genes & Dev., 11:3286-3305 (1997).
В публикации Pennica et al., Proc. Natl. Acad. Sci., 95:14717-14722 (1998), описано клонирование и исследование двух генов, WISP-1 и WISP-2, содержание которых повышено в линии эпителиальных клеток молочной железы C57MG у мышей, трансформированных Wnt-1, и третьего родственного гена, WISP-3. (См. также WO 99/21998, опубликованную 6 мая 1999 г.; WO 99/21999, опубликованную 6 мая 1999 г.). В публикации Pennica et al. отмечено, что указанные гены WISP могут находиться внизу (даунстрим) от пути передачи сигналов Wnt-1, и что аберрантные уровни экспрессии WISP в случае рака ободочной кишки могут играть определенную роль в онкогенезе ободочной кишки. WISP-1 недавно был идентифицирован в качестве гена, регулируемого β-катенином, и исследование его онкогенной активности показало, что WISP-1 может способствовать онкогенезу, опосредованному β-катенином (Xu et al., Gene & Develop., 14:585-595 (2000)). Сверхэкспрессия WISP-1 в нормальных клетках почки крысы (NRK-49F) вызывает морфологическую трансформацию, ускоренный рост клеток и повышенную плотность насыщения. Кроме того, указанные клетки легко образуют опухоли при инъецировании “голым” мышам, из чего следует, что WISP-1 может играть определенную роль в онкогенезе (Xu et al., см. выше, 2000). WISP-1 сверхэкспрессирован также в трансформированных линиях раковых клеток молочной железы человека и примерно в 47% первичных раковых клеток молочной железы человека, характеризующихся некоторыми прогрессирующими признаками (Xie et al., Cancer Res., 61:8917-8923 (2001); Saxena et al., Mol. Cell Biochem., 228:99-104 (2001); Michaelson et al., Oncogene, 20:5093-5099 (2001)). В научной литературе были также представлены данные о сверхэкспрессии определенного варианта WISP-1 примерно в 86% клеток фиброзного рака желудка у человека (Tanaka et al., Oncogene, 20:5525-5532 (2001)).
В публикации Hurvitz et al., Nature Genetics, 23:94-97 (1999), описано исследование WISP-3, при выполнении которого было установлено, что девять разных мутаций WISP-3 у неродственных субъектов ассоциированы с аутосомным рецессивным заболеванием скелета, прогрессирующей псевдоревматоидной дисплазией (PPD). Экспрессия WISP-3 была выявлена методом RT-PCR Хурвицем и др. в синовиоцитах человека, хондроцитах суставного хряща и мезенхимных клетках-предшественниках, выделенных из костного мозга.
В заявке на патент РСТ WO 98/21236, опубликованной 22 мая 1998 г., описан ген-3 фактора роста соединительной ткани человека (CTGF-3), кодирующий член надсемейства факторов роста с молекулярной массой 26 кДа. В публикации WO 98/21236 указано, что аминокислотная последовательность CTGF-3 была получена из клона кДНК остеобластов человека, и что CTGF-3 был экспрессирован во многих тканях, таких как яичник, яички, сердце, легкое, скелетные мышцы, мозговое вещество надпочечника, корковое вещество надпочечника, тимус, предстательная железа, тонкий кишечник и ободочная кишка.
В научной литературе отмечено, что гиалуроновая кислота (определяемая также как НА, гиалуронат или гиалуронан) является важным компонентом внеклеточного матрикса (см., например, публикации Hardingham et al., FASEB J., 6:861-870 (1992); Lаurent et al., FASEB J., 6:2397-2404 (1992)). Гиалуроновая кислота является компонентом кожи и мезенхимных тканей, где она облегчает миграцию клеток в процессе заживления ран, воспаления и эмбрионального морфогенеза (Knudson et al., FASEB J., 7:1233-1241 (1993); Knudson et al., CIBA Found. Symp., 143:150-169 (1989)). Кроме того, известно, что гиалуроновая кислота играет определенную роль в некоторых типах метастазов (Naor et al., CD44: Structure, Function and Association with the Malignant Process, Advances in Cancer Research, Academic Press (1997), pages 241-319). Наибольшие концентрации гиалуроновой кислоты обнаружены в коже и скелетно-мышечной системе, где она составляет более 50% общего содержания в организме (Banerji et al., J. Cell Biol., 144:789-801 (1999)).
Разные исследователи занимались изучением рецепторов, связывающих гиалуроновую кислоту. Одним из идентифицированных рецепторов гиалуроновой кислоты является белок CD44. (См., например, публикации Culty et al., J. Cell Biology, 111:2765-2774 (1990); Aruffo et al., Cell, 61:1303-1313 (1990); Naor et al., CD44: Structure, Function, and Association with the Malignant Process, Advances in Cancer Research, Academic Press (1997), pages 241-319), Ropponen et al., Cancer Res., 58:342-347 (1998); Masaki et al., Cancer, 92:2539-2546 (2001)). CD44 представляет собой семейство гликопротеинов на поверхности клетки, образуемых из одного гена в результате альтернативного сплайсинга и дифференциального гликозилирования (Wielenga et al., Am. J. Pathology, 154:515-523 (1999)). Считается, что CD44 действует в качестве рецептора клеточной адгезии, связывающего внеклеточные молекулы, в частности гиалуронат, с клеткой и цитоскелетом (Wielenga et al., см. выше). CD44 экспрессирован на эпителиальных, мезенхимных и лимфоидных клетках (Lesley et al., Adv. Immunol., 54:271-335 (1994)). В публикации Wielenga et al. отмечено, что, на основании определенных экспериментов, позволяющих проанализировать экспрессию CD44 в слизистой оболочке тонкого кишечника мышей и человека с генетическими дефектами АРС или Tcf-4, был сделан вывод о возможности регулирования экспрессии CD44 при помощи пути передачи сигналов WNT (Wielenga et al., см. выше).
Другие рецепторы гиалуроновой кислоты (НА), исследованные до настоящего времени, включают RHAMM (определяемый также как рецептор подвижности, опосредуемой гиалуроновой кислотой), внутриклеточный белок с молекулярной массой 58 кДа, временно экспрессируемый на поверхности трансформированных лимфоцитов (Hardwick et al., J. Cell Biol., 117:1343-1350 (1992); Turley et al., Exp. Cell Res., 207:277-282 (1993)). Установлено, что экспрессия RHAMM в фибробластах стимулирует метастазы и играет важную роль в трансформации H-Ras (Hall et al., см. ниже).
Другой рецептор, связывающий гиалуроновую кислоту, описан в публикации Banerji et al. (см. выше). В публикации Banerji et al. рассмотрен рецептор, присутствующий в стенках лимфатических сосудов и именуемый “LYVE-1”, который является встроенным в мембрану полипептидом типа I, состоящим из 322 остатков и обладающим 41% сходством с рецептором CD44. В отличие от рецептора CD44 гиалуроновой кислоты белок LYVE-1 отсутствует в кровеносных сосудах. Кроме того, в качестве рецепторов НА были описаны также лайилин (Bono et al., Mol. Biol. Cell, 12:891-900 (2001)) и HARE (Zhou et al., J. Biol. Chem., 275:37733-37741 (2000)).
Сущность изобретения
Автор настоящей заявки весьма неожиданно обнаружил, что WISP-1 может индуцировать экспрессию мРНК HAS2 (гиалуронан-синтазы 2), CD44 и RHAMM, синтез белка CD44 и секрецию гиалуроновой кислоты (НА). Индукция или секреция таких молекул может стимулировать или усиливать рост, подвижность и/или способность к метастазированию раковых клеток. Таким образом, настоящее изобретение относится, например, к антагонистам WISP-1 и способам применения таких антагонистов. Антагонисты, рассмотренные в настоящем описании изобретения, могут быть использованы, среди прочего, для диагностики или лечения in vitro, in situ или in vivo раковых клеток или других патологических состояний у млекопитающих, обусловленных индукцией или секрецией HAS2, HA, CD44 или RHAMM.
Некоторые варианты осуществления изобретения относятся к выделенным антагонистам WISP-1. Такие антагонисты могут включать антитела, в частности антитела против WISP-1. В предпочтительных вариантах осуществления изобретения указанные антагонисты могут блокировать или нейтрализовать индукцию или секрецию HAS2, HA, CD44 или RHAMM, вызываемую WISP-1. Такие антитела-антагонисты могут быть, например, моноклональными антителами, химерными антителами, гуманизированными антителами или человеческими антителами. Антагонисты WISP-1, пригодные для использования в настоящем изобретении, включают иммуноадгезины WISP-1, варианты WISP-1, их ковалентно модифицированные формы или слитые белки. В качестве примера можно отметить, что такие антагонисты могут включать пегилированный WISP-1 или WISP-1, слитый с гетерологичными последовательностями, такими как эпитопные метки или лейциновые зипперы. Способы по настоящему изобретению относятся к использованию молекулы антагониста одного типа или комбинации антагонистов двух или более типов.
Способы по настоящему изобретению включают способы лечения патологических состояний или заболеваний у млекопитающих, обусловленных или являющихся следствием индукции или секреции HAS2, HA, CD44 или RHAMM, вызываемой WISP-1. При осуществлении способов лечения антагонисты WISP-1 могут быть введены млекопитающему, страдающему таким патологическим состоянием или заболеванием. Например, настоящее изобретение относится к способу воздействия на клетки млекопитающего, в частности раковые клетки, одного или нескольких антагонистов WISP-1 в количестве, достаточном для уменьшения, нейтрализации или блокирования индукции или секреции HAS2, HA, CD44 или RHAMM, вызываемой WISP-1. Клетка может находиться в культуре клеток или в организме млекопитающего, например млекопитающего, страдающего раком.
Настоящее изобретение относится также к композициям, содержащим один или несколько антагонистов WISP-1. Композиции по настоящему изобретению необязательно содержат фармацевтически приемлемые носители или разбавители. Указанные композиции предпочтительно содержат один или несколько антагонистов WISP-1 в количестве, которое является терапевтически эффективным для лечения патологического состояния или заболевания.
Настоящее изобретение относится также к изделиям и наборам, включающим один или несколько антагонистов WISP-1.
Настоящее изобретение относится также к способам выполнения скрининговых анализов для идентификации молекул-кандидатов, таких как низкомолекулярные соединения, полипептиды или антитела, действующих в качестве антагонистов, блокирующих или нейтрализующих индукцию или секрецию HAS2, HA, CD44 или RHAMM, вызываемую WISP-1.
Более конкретные варианты осуществления изобретения относятся к выделенным антагонистам WISP-1, которые ингибируют или нейтрализуют индукцию или секрецию HAS2, HA, CD44 или RHAMM, вызываемую нативным полипептидом WISP-1, по крайней мере, в клетке млекопитающего одного типа, причем указанный антагонист выбирают из группы, включающей антитело против WISP-1, иммуноадгезин WISP-1, вариант WISP-1 и их слитые белки. Антагонист может включать антитело против WISP-1, связывающее нативный полипептид WISP-1 человека, включающий аминокислоты 23-367, показанные на фиг.9А-9С, либо один или несколько доменов WISP-1, содержащих аминокислоты, кодируемые последовательностями SEQ ID NO:3, 4, 5, 6, 7, 8, 9, 10 или 11 по настоящему изобретению. Антитело против WISP-1 может быть химерным, гуманизированным или человеческим антителом.
Настоящее изобретение относится также к композициям, содержащим антагонисты, представленные в настоящем описании изобретения, и носитель, причем носитель необязательно является фармацевтически приемлемым носителем.
Настоящее изобретение относится также к способам ингибирования или нейтрализации индукции или секреции HAS2, HA, CD44 или RHAMM, вызываемой WISP-1, в клетках млекопитающего, которые включают воздействие на указанные клетки млекопитающего эффективным количеством антагониста WISP-1, выбираемого из группы, состоящей из:
а) иммуноадгезина WISP-1;
b) полипептида WISP-1, связанного с небелковым полимером, выбираемым из группы, состоящей из полиэтиленгликоля, полипропиленгликоля и полиоксиалкилена;
с) антитела против WISP-1;
d) варианта WISP-1.
Иммуноадгезины WISP-1, используемые в способах по настоящему изобретению, могут включать последовательность WISP-1, слитую с Fc-областью иммуноглобулина. Антитела против WISP-1, используемые в способах по настоящему изобретению, могут связываться с нативным WISP-1 человека, содержащим аминокислоты 23-367, показанные на фиг.9А-9С, либо с одним или несколькими доменами WISP-1, описанными в приведенных ниже примерах. При осуществлении способов по настоящему изобретению клетки млекопитающего могут содержать раковые клетки, причем указанные клетки необязательно содержат раковые клетки ободочной кишки или прямой и ободочной кишки, раковые клетки молочной железы, раковые клетки легкого или раковые клетки головного мозга (такие как глиома или глиобластома).
Другие варианты осуществления изобретения относятся к способам лечения рака у млекопитающего, которые включают введение указанному млекопитающему эффективного количества антагониста WISP-1. При осуществлении указанных способов антагонист может необязательно ингибировать или нейтрализовать индукцию или секрецию HAS2, HA, CD44 или RHAMM, вызываемую нативным полипептидом WISP-1 человека, по крайней мере, в клетках млекопитающего одного типа, при этом указанный антагонист выбирают из группы, состоящей из антитела против WISP-1, иммуноадгезина WISP-1 и варианта WISP-1. Антагонист может необязательно ингибировать рост или метастизирование раковых клеток. Рак у млекопитающего может включать раковые клетки ободочной кишки или прямой и ободочной кишки, раковые клетки молочной железы, раковые клетки легкого или раковые клетки головного мозга (такие как глиома или глиобластома). Антагонисты, используемые при осуществлении способов по настоящему изобретению, необязательно ингибируют или уменьшает рост или метастазирование раковых клеток. При осуществлении указанных способов млекопитающее может быть также подвергнуто воздействию химиотерапии, лучевой терапии, пролекарства, цитотоксического агента, ингибитора роста или цитокина.
Более конкретные варианты осуществления изобретения относятся к антителам, которые специфически связываются с одним или несколькими доменами полипептида WISP-1 (описанными в приведенных ниже примерах), включающего аминокислоты, кодируемые последовательностями SEQ ID NO:3, 4, 5, 6, 7, 8, 9, 10 или 11 по настоящему изобретению. Антитело необязательно является моноклональным антителом. Моноклональное антитело необязательно включает антитело 3D11, 11C2, 9C10, 5D4 или 9С11, секретируемое гибридомой, депонированной в Американской коллекции типовых культур (АТСС) соответственно под номером доступа РТА-4624, РТА-4628, РТА-4626, РТА-4625 или РТА-4627.
Настоящее изобретение относится также к антителам, которые связываются с тем же эпитопом, что и моноклональное антитело 3D11, 11C2, 9C10, 5D4 или 9С11, продуцируемое линией клеток гибридомы, депонированной в АТСС соответственно под номером доступа РТА-4624, РТА-4628, РТА-4626, РТА-4625 или РТА-4627.
Другие конкретные варианты осуществления изобретения относятся к линии клеток гибридомы, продуцирующей моноклональное антитело 3D11, 11C2, 9C10, 5D4 или 9С11, депонированной в АТСС соответственно под номером доступа РТА-4624, РТА-4628, РТА-4626, РТА-4625 или РТА-4627, и к моноклональному антителу 3D11, 11C2, 9C10, 5D4 или 9С11, секретируемому гибридомой, депонированной в АТСС соответственно под номером доступа РТА-4624, РТА-4628, РТА-4626, РТА-4625 или РТА-4627.
Настоящее изобретение относится также к выделенным моноклональным антителам против WISP-1, содержащим антитела, которые связываются с полипептидом WISP-1 и конкурентно ингибируют связывание моноклонального антитела, продуцируемого гибридомой, депонированной в АТСС под номером доступа РТА-4624, РТА-4628, РТА-4626, РТА-4625 или РТА-4627, с указанным полипептидом WISP-1.
Настоящее изобретение относится также к химерным или гуманизированным антителам против WISP-1, которые специфически связываются с полипептидом WISP-1 и включают (а) последовательность, выделенную из антитела 3D11, 11C2, 9C10, 5D4 или 9С11, секретируемого гибридомой, депонированной в АТСС соответственно под номером доступа РТА-4624, РТА-4628, РТА-4626, РТА-4625 или РТА-4627. Такие антитела могут необязательно включать тяжелую цепь, легкую цепь или вариабельные области, выделенные из антитела 3D11, 11C2, 9C10, 5D4 или 9С11.
Антитела против WISP-1 могут быть связаны с одним или несколькими небелковыми полимерами, выбираемыми из группы, состоящей из полиэтиленгликоля, полипропиленгликоля и полиоксиалкилена, а также с цитотоксическим агентом или ферментом, радиоактиваным изотопом, флуоресцентным соединением или хемилюминесцентным соединением.
Краткое описание чертежей
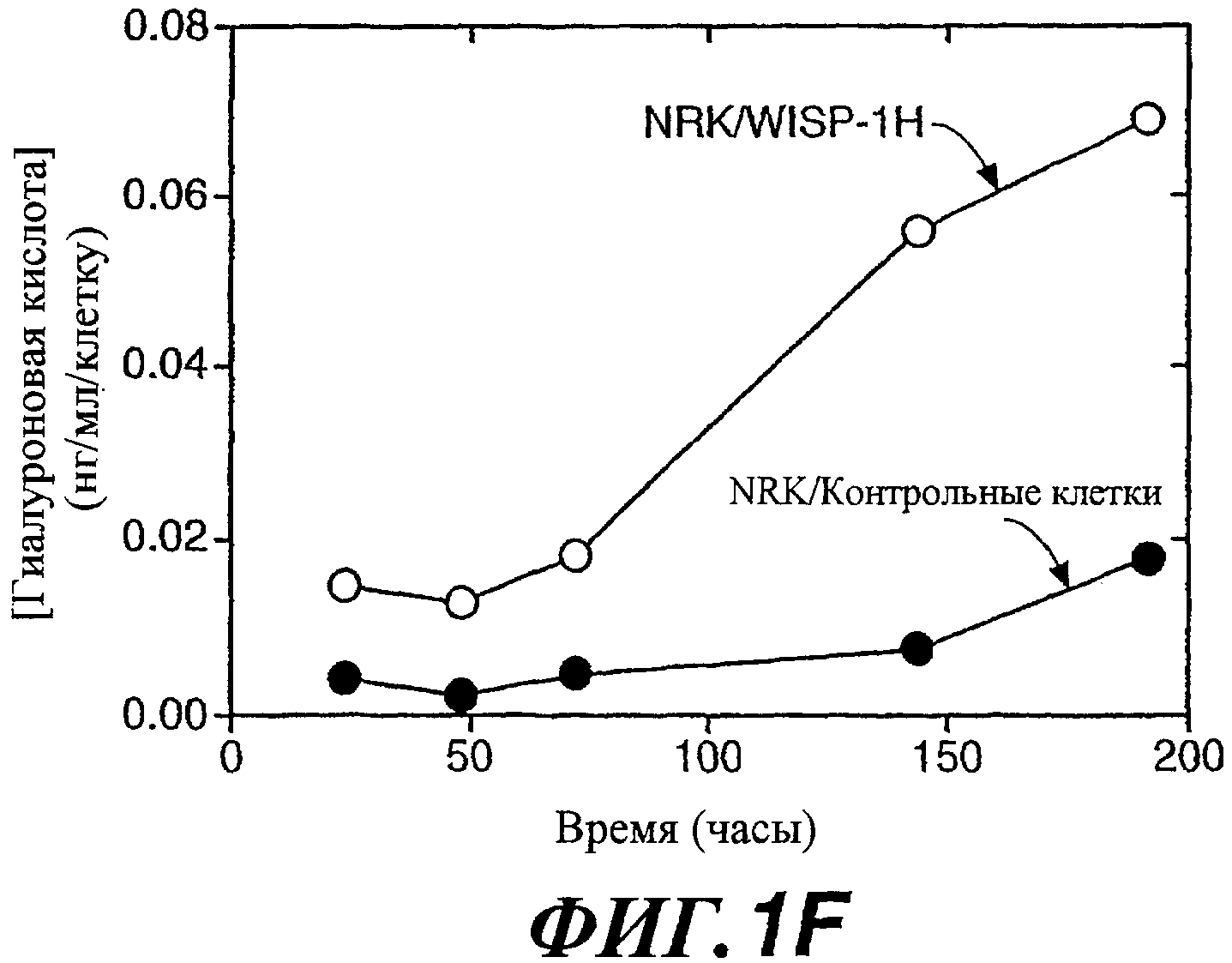
На фиг.1А-1F показана стимуляция WISP-1 продуцирования гиалуронана. Анализ методом исключения частиц показывает наличие пленки из гиалуронана на поверхности NRK/WISP-1H (A) и NRK/WISP-1L (B), которая отсутствует на NRK/контрольных клетках (С). NRK/WISP-1H (D) и NRK/контрольные клетки (Е) окрашивали bHABP с целью обнаружения гиалуронана. На фиг.(F) показано время накопления гиалуроновой кислоты (НА) в средах с NRK/WISP-1H и NRK/контрольными клетками.
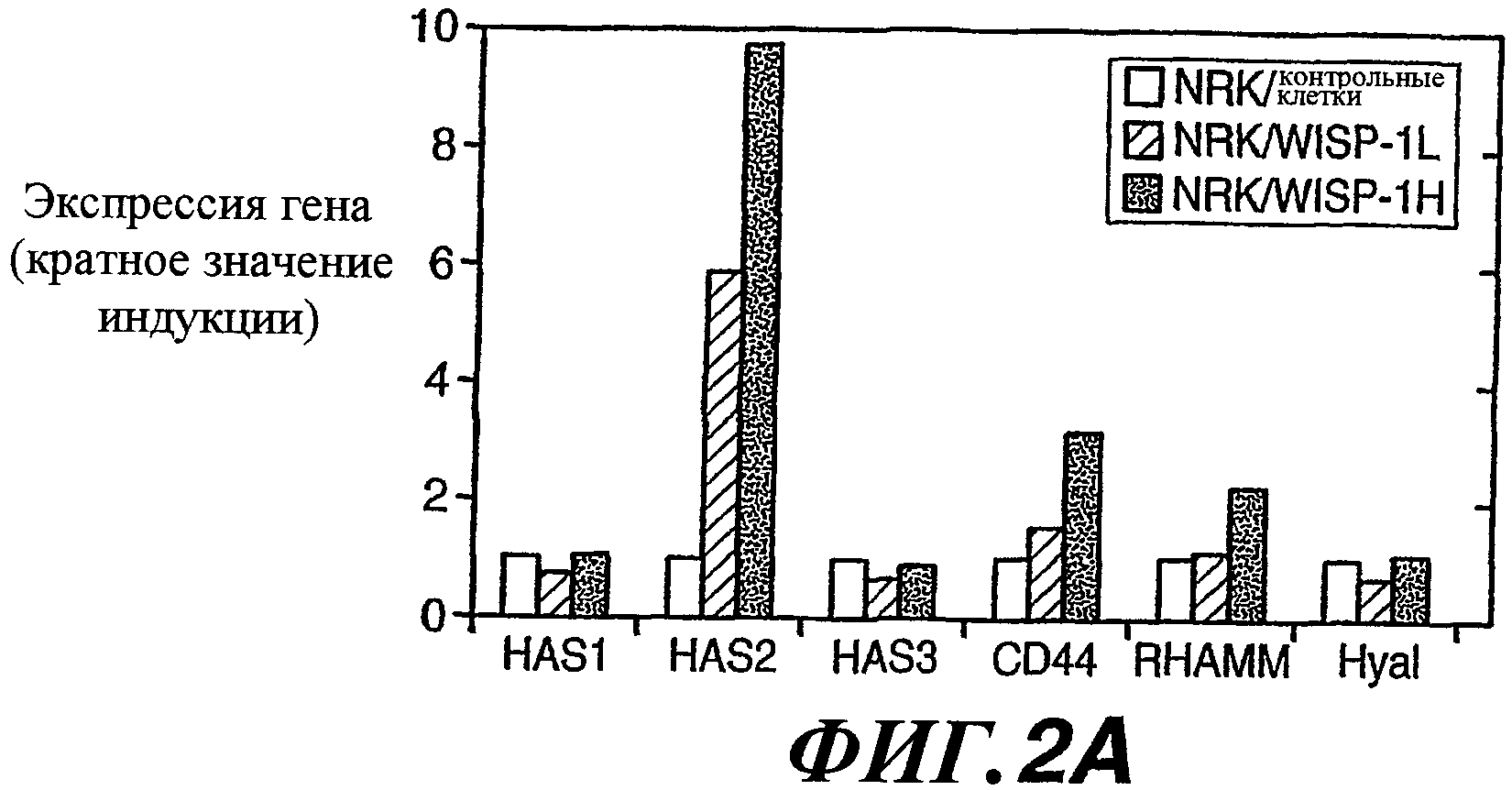
На фиг.2А-2С показано увеличение экспрессии мРНК HAS2, CD44 и RHAMM и экспрессии белка CD44, вызываемое WISP-1. На фиг.(А) показан анализ методом RT-PCR в реальном времени экспрессии мРНК HAS1, HAS2, HAS3, CD44, RHAMM и гиалуронидазы (Hyal) в NRK/WISP-1H, NRK/WISP-1L и NRK/контрольных клетках. Результаты представлены в виде кратного увеличения индукции по сравнению с экспрессией в NRK/контрольных клетках. На фиг.(В) показан анализ методом проточной цитометрии экспрессии CD44 в NRK/WISP-1H и NRK/контрольных клетках. Заштрихованный участок представляет интенсивность флуоресценции только вторичного антитела. На фиг.(С) показан анализ методом вестерн-блоттинга белка CD44 в NRK/WISP-1H и NRK/контрольных клетках. В качестве нагрузочного эталона было использовано окрашивание актина.
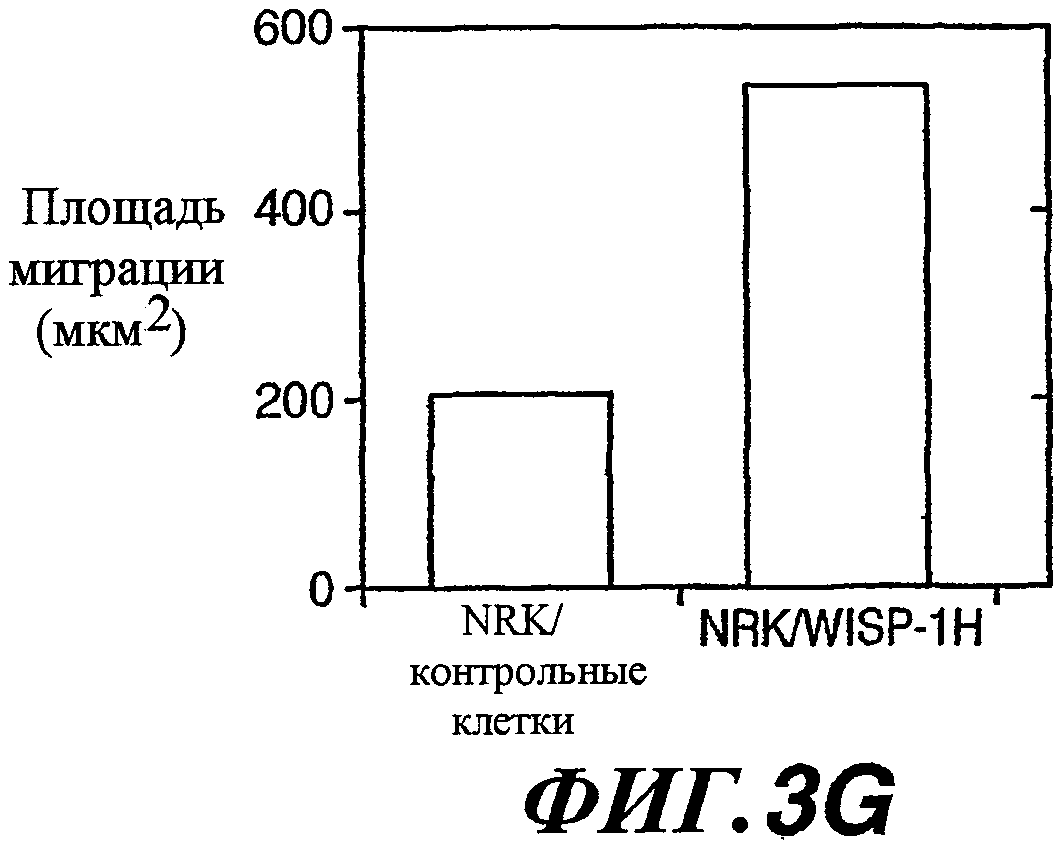
На фиг.3А-3G показано увеличение подвижности и изменение морфологии клеток вследствие экспрессии WISP-1. NRK/контрольные клетки (А) образовывали четко выраженные колонии при культивировании с низкой плотностью, в то время как клетки NRK/WISP-1L (B) и NRK/WISP-1H (С) рассеивались. Клетки NRK/WISP-1H (E) характеризовались дифференцированной веретенообразной морфологией с расслоением по сравнению с NRK/контрольными клетками (D). На фиг.(F) показана произвольная миграция NRK/WISP-1H и NRK/контрольных клеток, измеренная в течение 15 часов при помощи микроскопии с замедленной съемкой при увеличенных интервалах времени между кадрами. Результаты показывают типичное среднее расстояние миграции клеток в одном поле. На фиг.(G) показана подвижность NRK/WISP-1H и NRK/контрольных клеток, определенная при помощи клеточного анализа заживления раны и измеренная через 15 часов при помощи микроскопии с замедленной съемкой при увеличенных интервалах времени между кадрами. Приведенные данные представляют собой результаты типичного эксперимента.
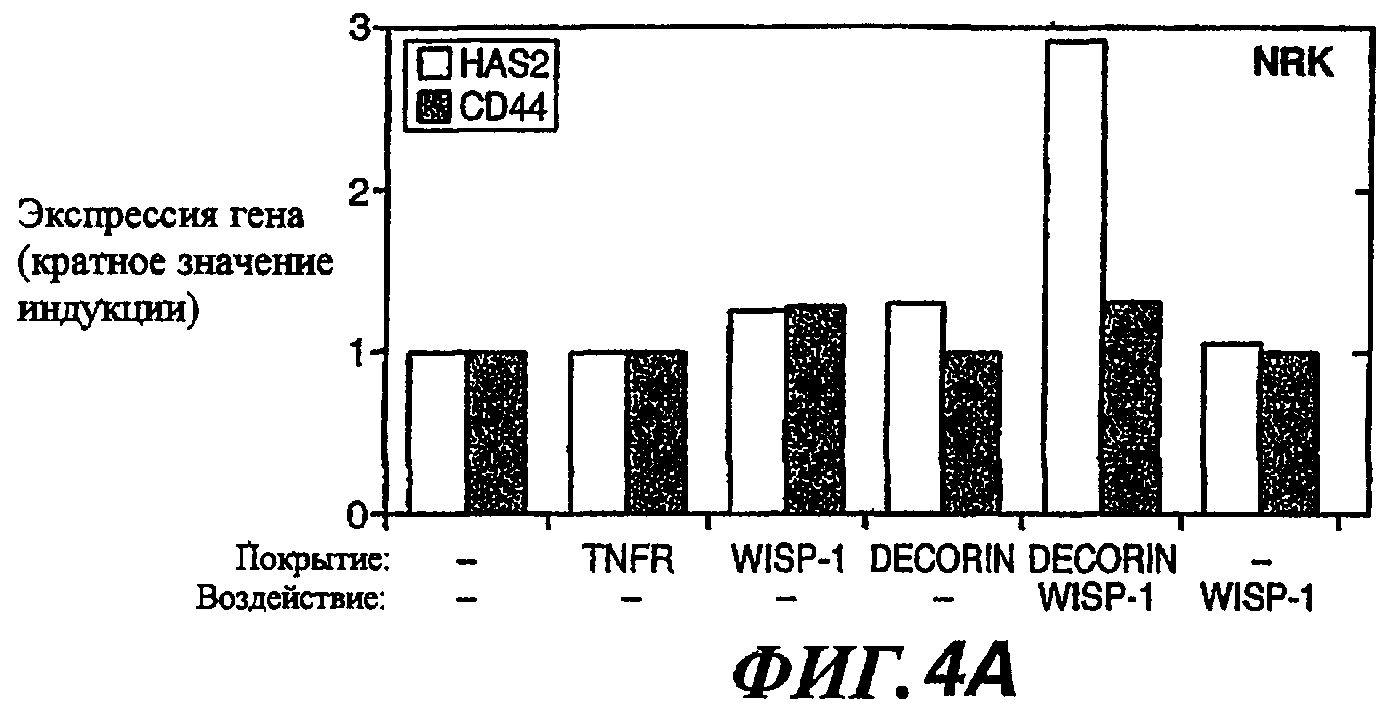
На фиг.4А-4С показана экспрессия мРНК HAS2 и гаптотаксическая миграция клеток NRK, вызываемые добавлением WISP-1. На фиг.(А) представлены результаты анализа методом RT-PCR в реальном времени экспрессии HAS2 и CD44 в клетках NRK, посеянных на поверхность с покрытием. В некоторых случаях субстраты с покрытием подвергали дальнейшей инкубации с WISP-1 (обработка). Результаты выражены в виде кратного значения индукции по сравнению с экспрессией в клетках NRK, культивируемых на непокрытой, не подвергнутой обработке поверхности. Покрывали нижнюю сторону фильтров модифицированной камеры Бойдена и в верхнюю камеру вводили клетки NRK (B) или клетки SW480 (C). В некоторых случаях клетки вводили непосредственно в нижнюю камеру. Подвижность клеток определяли путем подсчета клеток, переместившихся на нижнюю сторону перегородки.
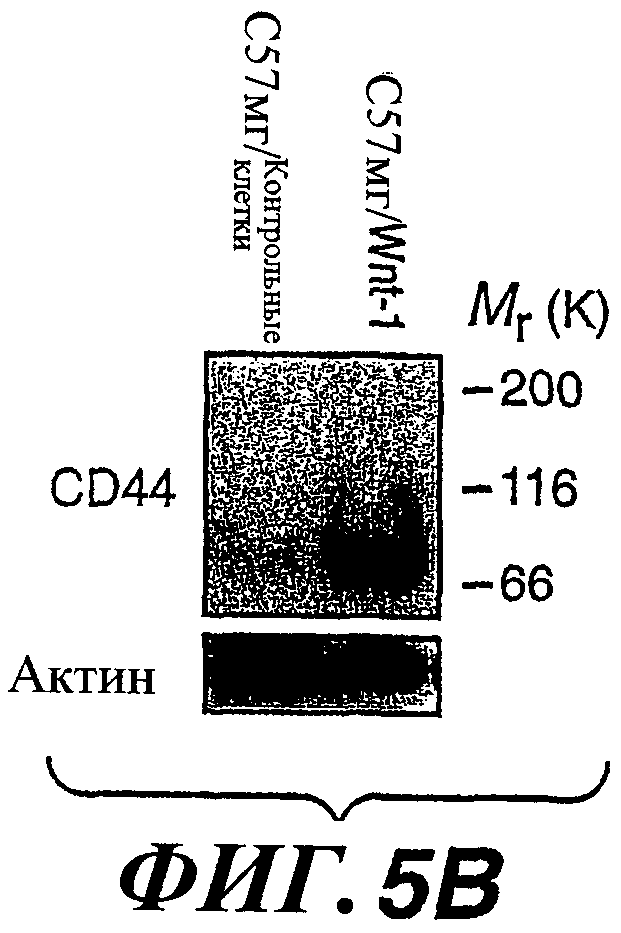
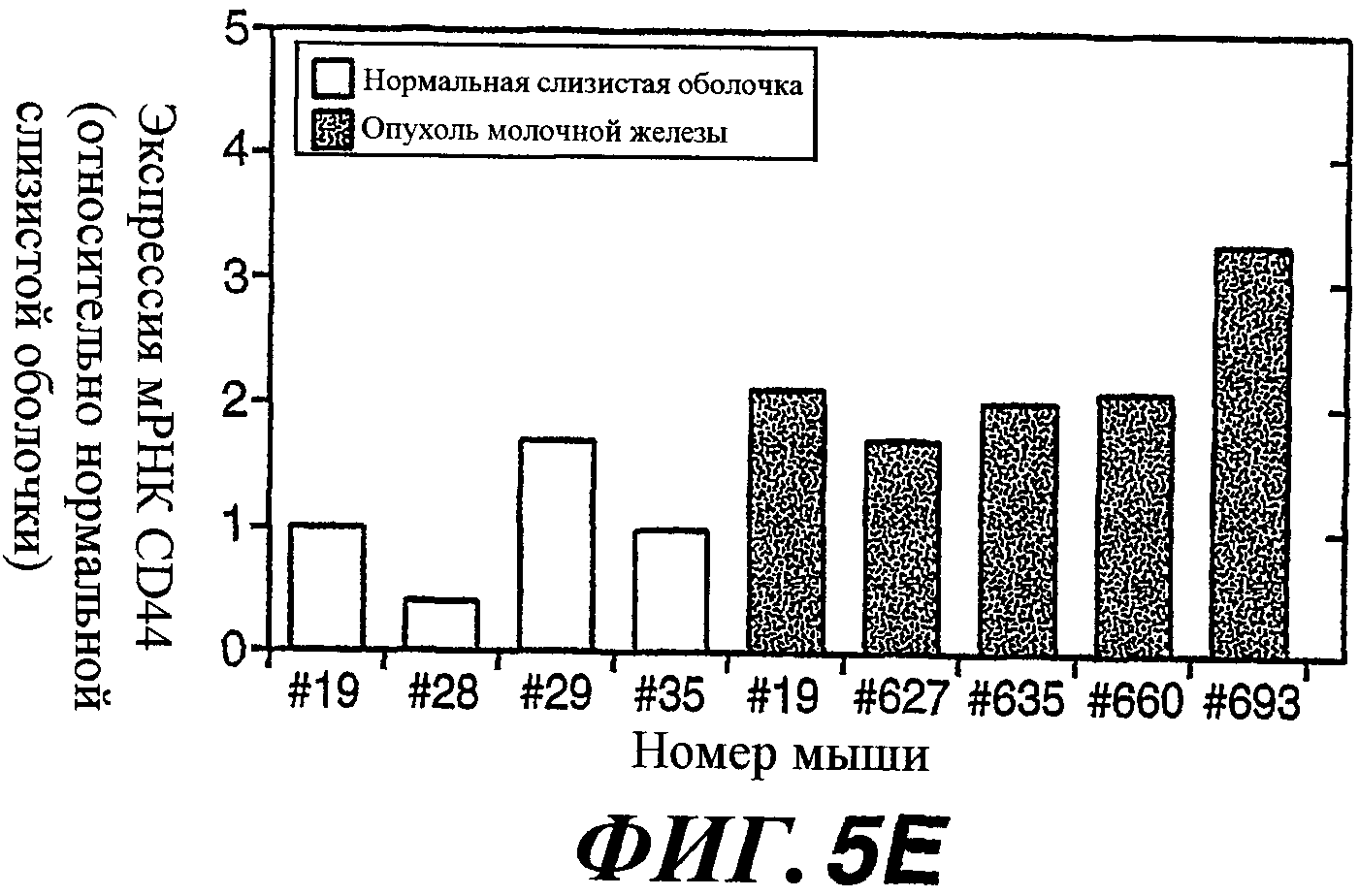
На фиг.5А-5Е показана сверхэкспрессия WISP-1, HAS2 и CD44 и повышенная подвижность клеток C57MG/Wnt-1 и MMTV-Wnt-1 в опухолях молочной железы у трансгенных мышей. На фиг.(А) показан анализ методом RT-PCR в реальном времени экспрессии WISP-1, HAS2 и CD44 в клетках C57MG/Wnt-1 и C57MG/контрольных клетках. Результаты выражены в виде кратного значения индукции по сравнению с экспрессией в C57MG/контрольных клетках. На фиг.(В) показан анализ методом вестерн-блоттинга содержания CD44 в С57MG/Wnt-1 и C57MG/контрольных клетках. В качестве нагрузочного эталона использовали окрашивание актина. На фиг.(С) показано образование C57MG/контрольными клетками четко выраженных колоний при культивировании с низкой плотностью, в то время как клетки C57MG/Wnt-1 рассеивались. Полуколичественный анализ методом RT-PCR был выполнен для определения HAS2 (D) и CD44 (E) в опухолях молочной железы у трансгенных мышей MMTV-Wnt-1. Результаты выражены в виде относительного кратного значения индукции по сравнению с экспрессией в нормальной ткани молочной железы.
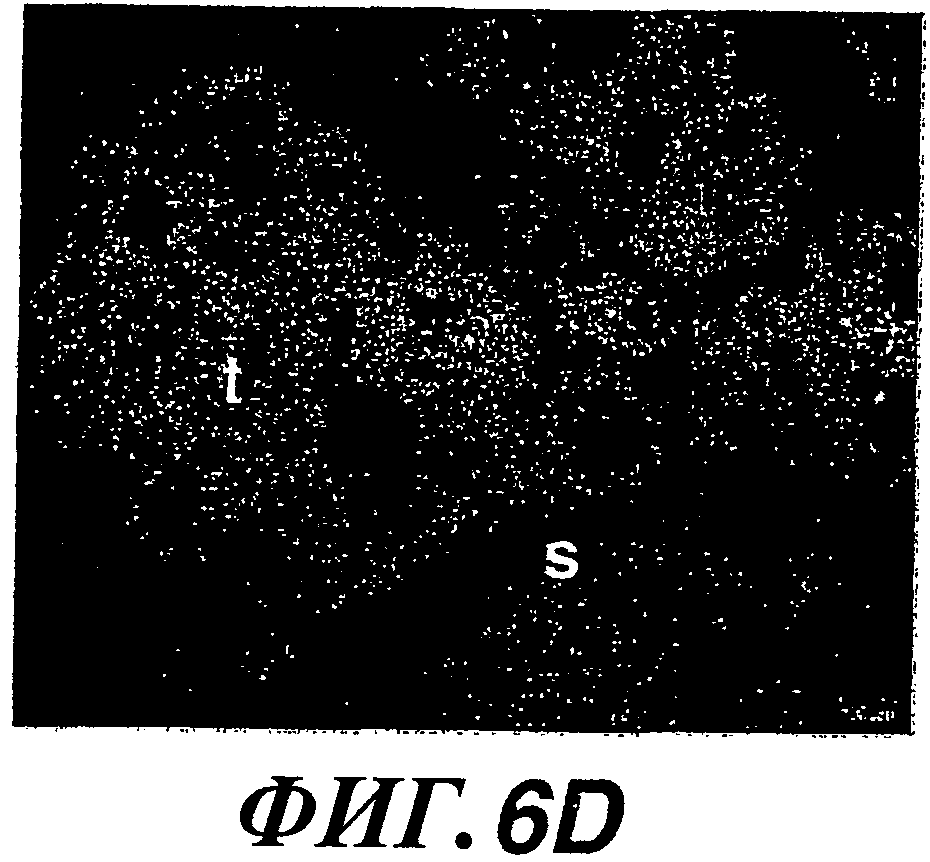
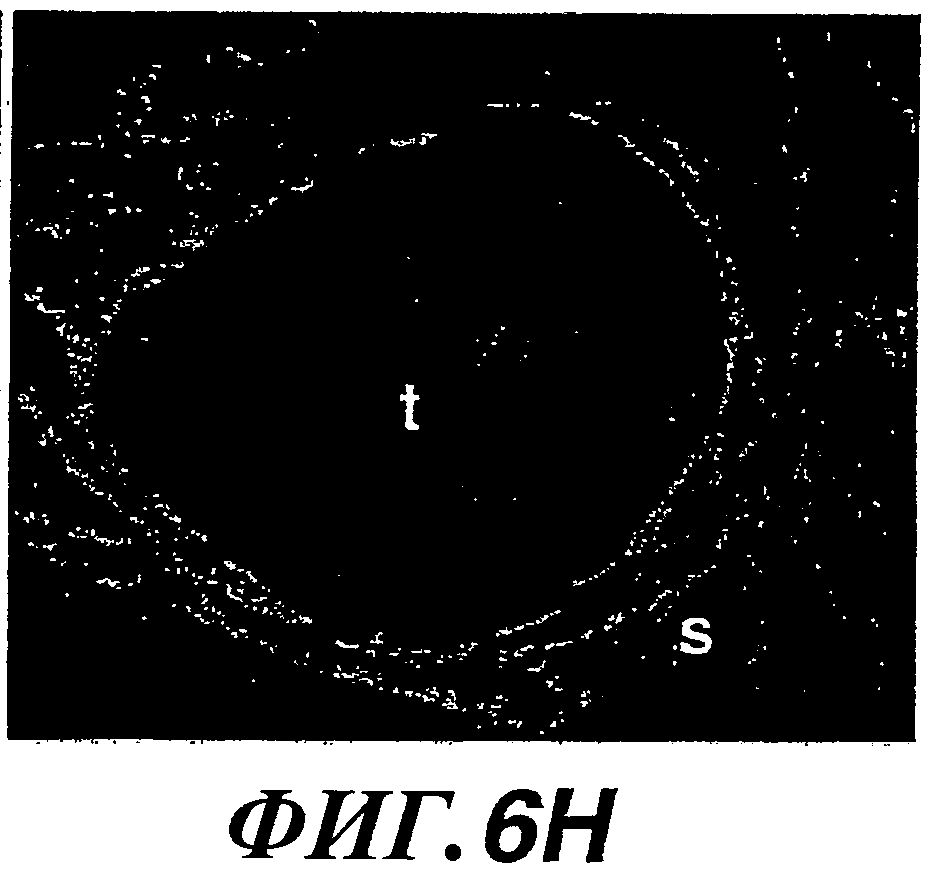
На фиг.6А-6Н показана экспрессия WISP-1, HAS2 и CD44 и накопление гиалуроновой кислоты в опухолях молочной железы у трансгенных мышей MMTV-Wnt-1. Гибридизация in situ WISP-1 (A, B), НAS2 (C, D) и CD44 (E, F), иммуногистохимический анализ CD44 (G) и флуоресцентное окрашивание bHABP гиалуронана (Н) в опухолях молочной железы у трансгенных мышей MMTV-Wnt-1 (t, опухоль; s, строма.)
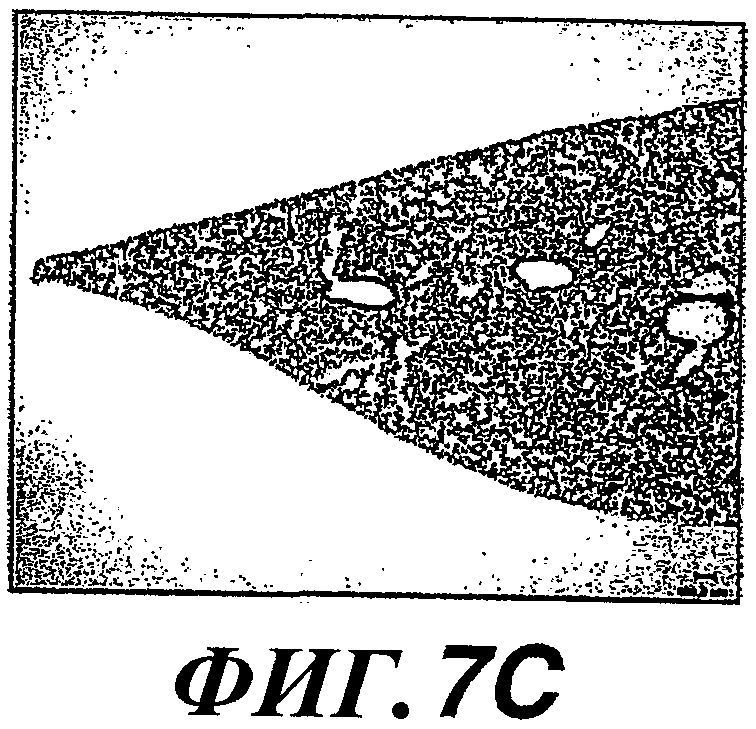
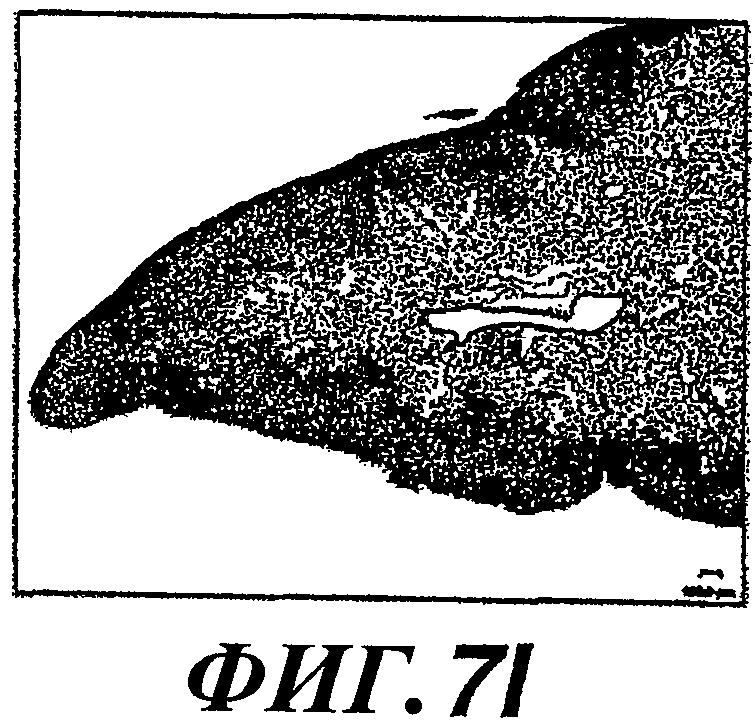
На фиг.7А-7L показано образование колоний метастатических клеток в легком и рост опухоли, стимулируемые экспрессией WISP-1. Действие WISP-1 анализировали путем инъецирования NRK/контрольных клеток, клеток NRK/WISP-IL или NRK/WISP-1H в хвостовую вену “голым” мышам. Через разные промежутки времени после инъекции легкие визуализировали при помощи ЯМР-томографии (A, D, G, J), иссекали и регистрировали макроскопическую картину (В, Е, Н, К) и гистологические признаки (C, F, I, L). Тяжесть поражения легкого опухолями классифицировали как нормальное (А, В, С), степень I (D, E, F), степень II (G, H, I) или степень III (J, K, L).
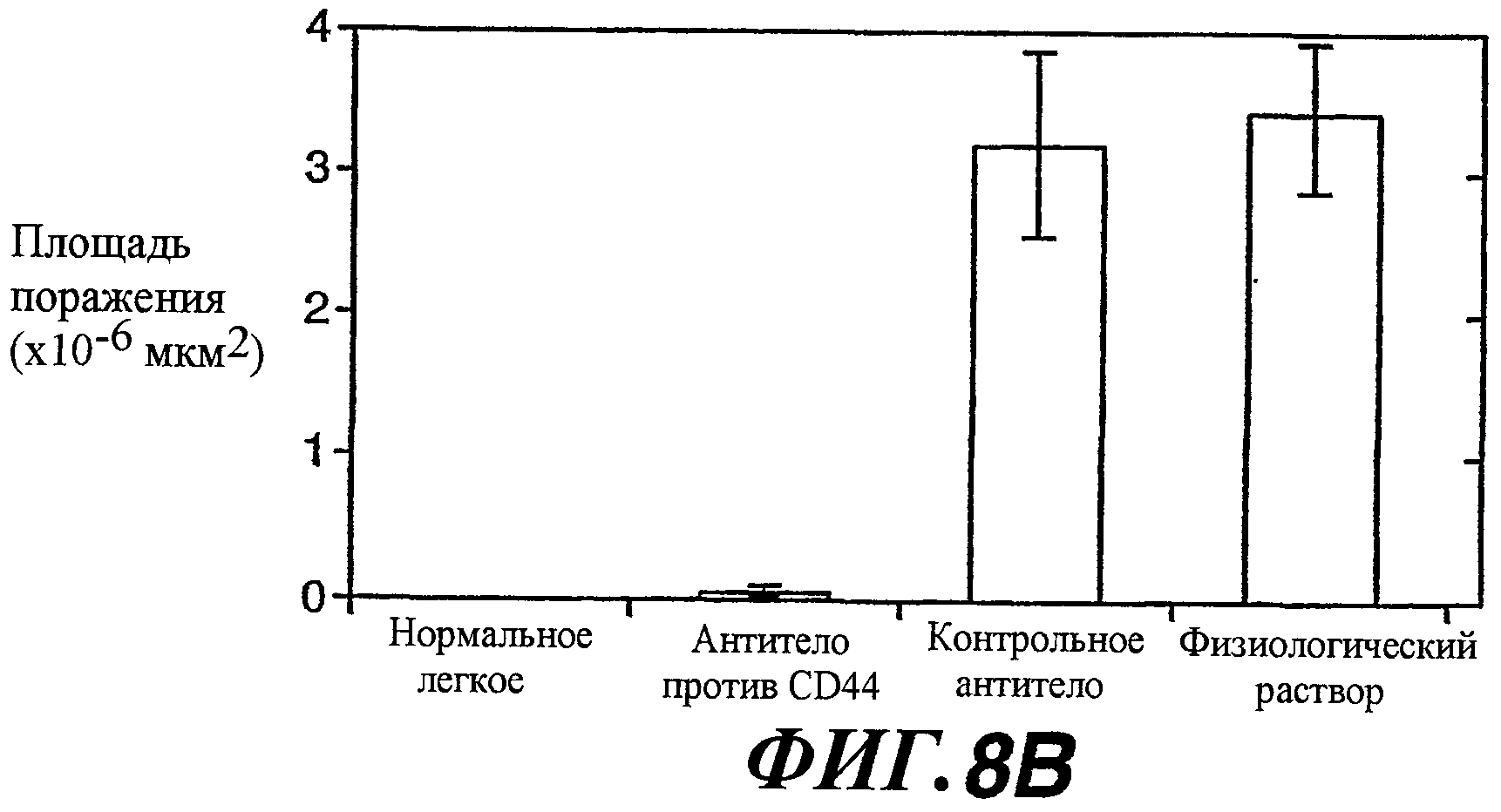
На фиг.8А-В показано предотвращение антителом против CD44 метастазирования клеток NRK/WISP-1H. Клетки NRK/WISP-1H (2,5×105 клеток) инъецировали в хвостовую вену “голым” мышам. Мышам дважды в неделю вводили 10 мг/кг антитела против CD44, изотипически сходное контрольное антитело или только буфер (PBS). Легкие иссекали через четыре недели для выполнения макроскопического морфологического анализа. Для сравнения показано изображение нормального легкого.
На фиг.9А-9С показана нуклеотидная (SEQ ID NO:2) и предполагаемая аминокислотная последовательность (SEQ ID NO:1) нативного полипептида WISP-1 человека.
На фиг.10 показано влияние экспрессии WISP-1 на способность к метастазированию клеток NRK.
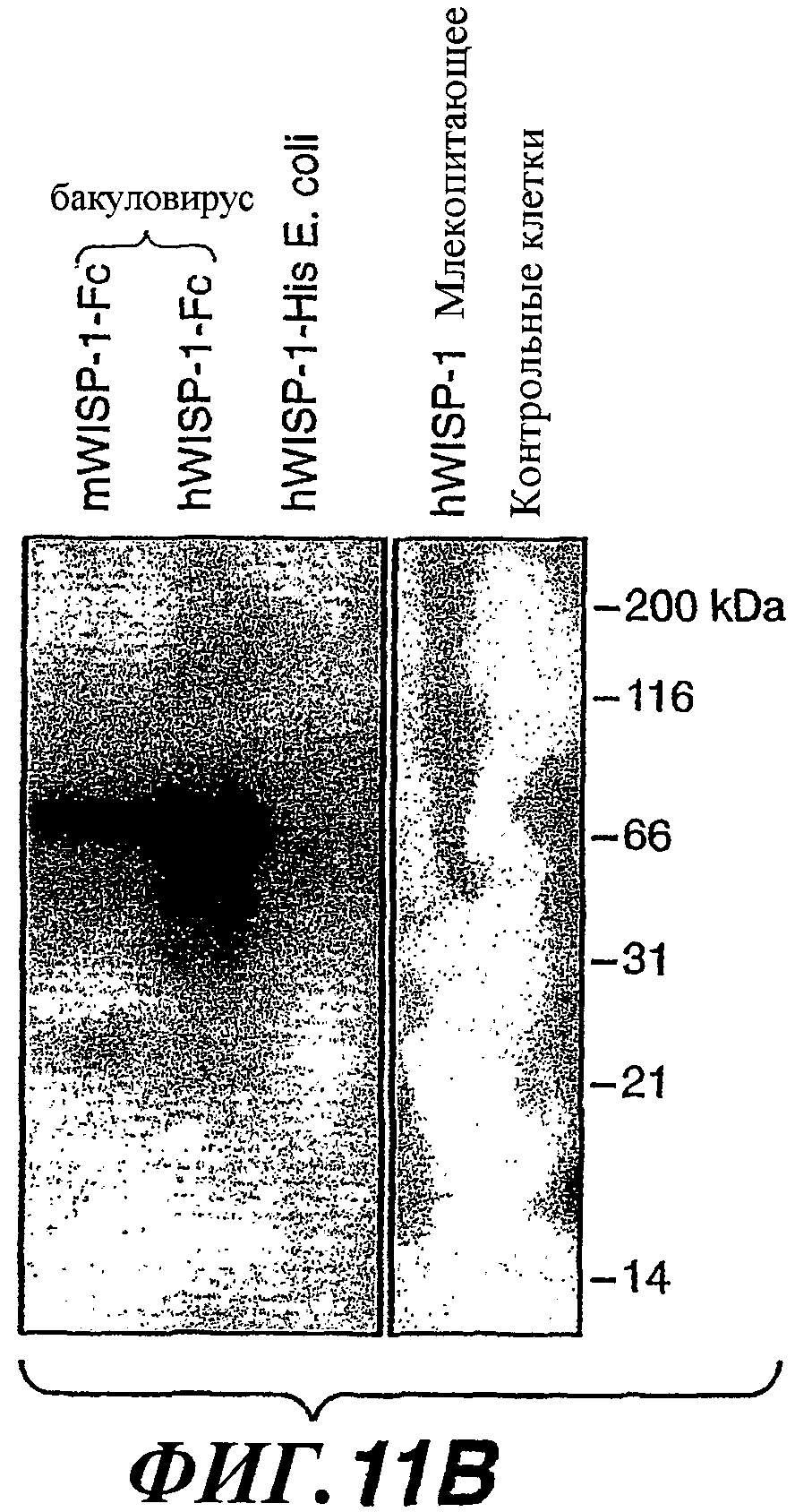
На фиг.11А-В показаны свойства связывания антител против WISP-1 с разными конструкциями и препаратами на основе WISP-1.
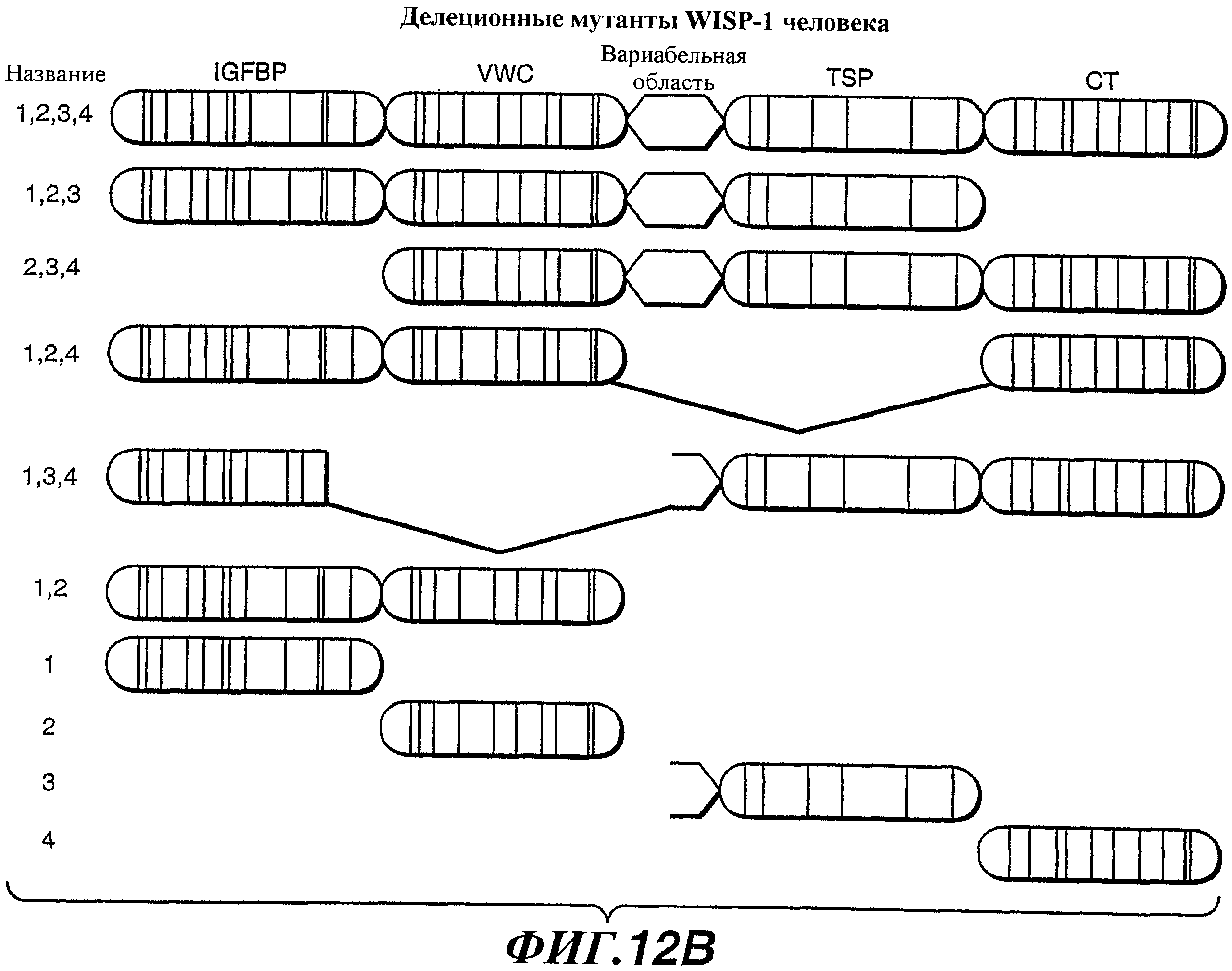
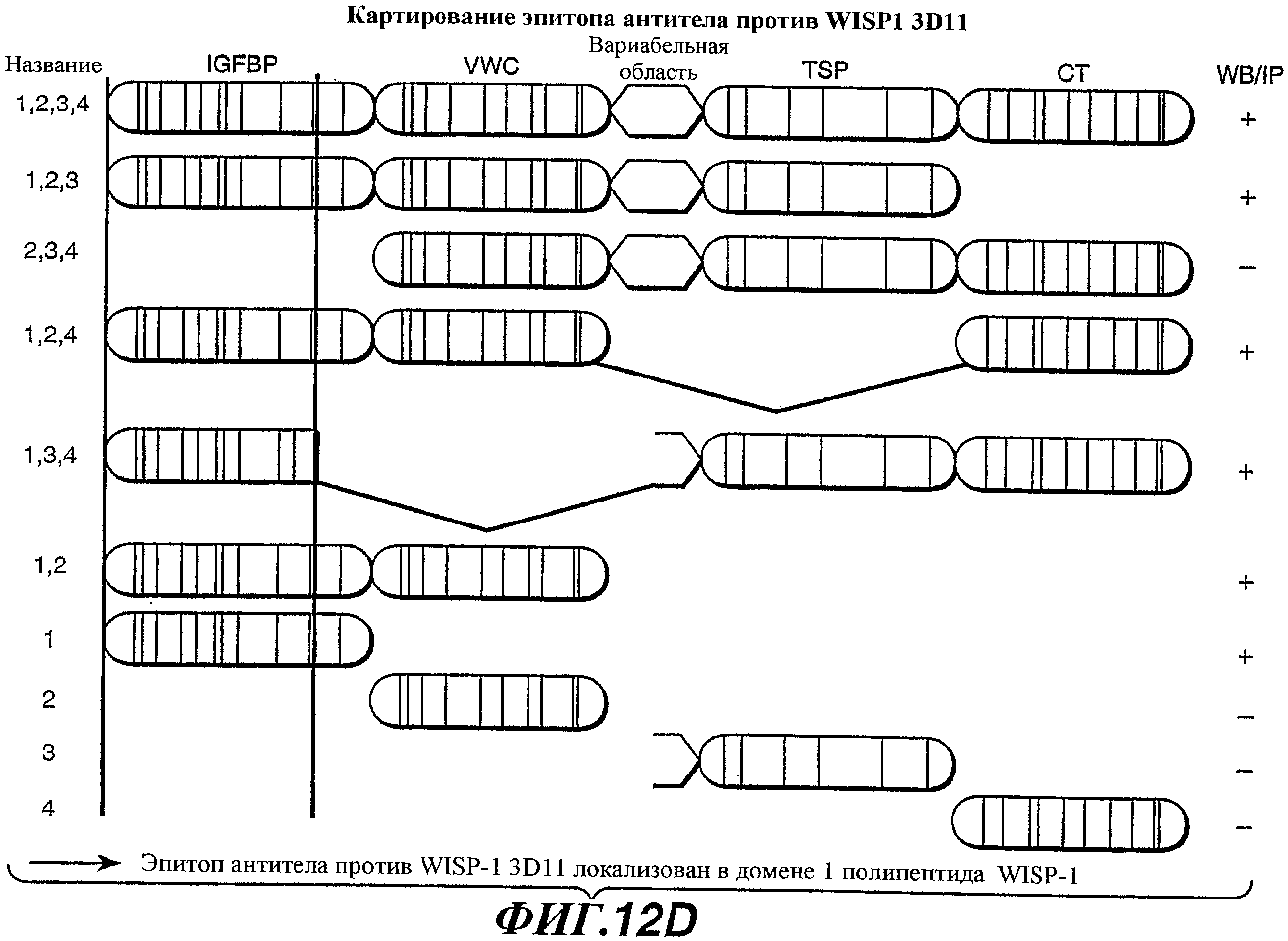
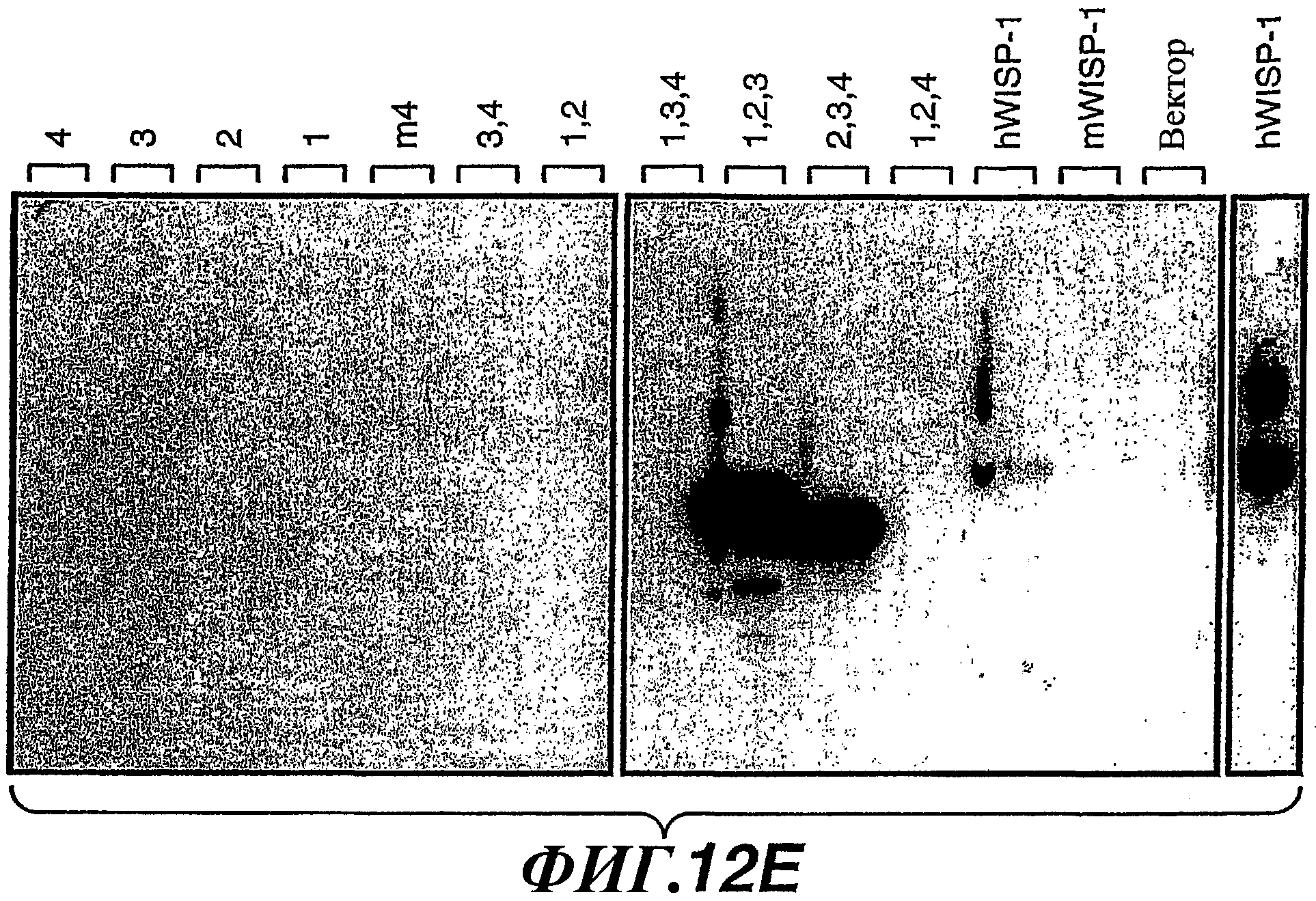
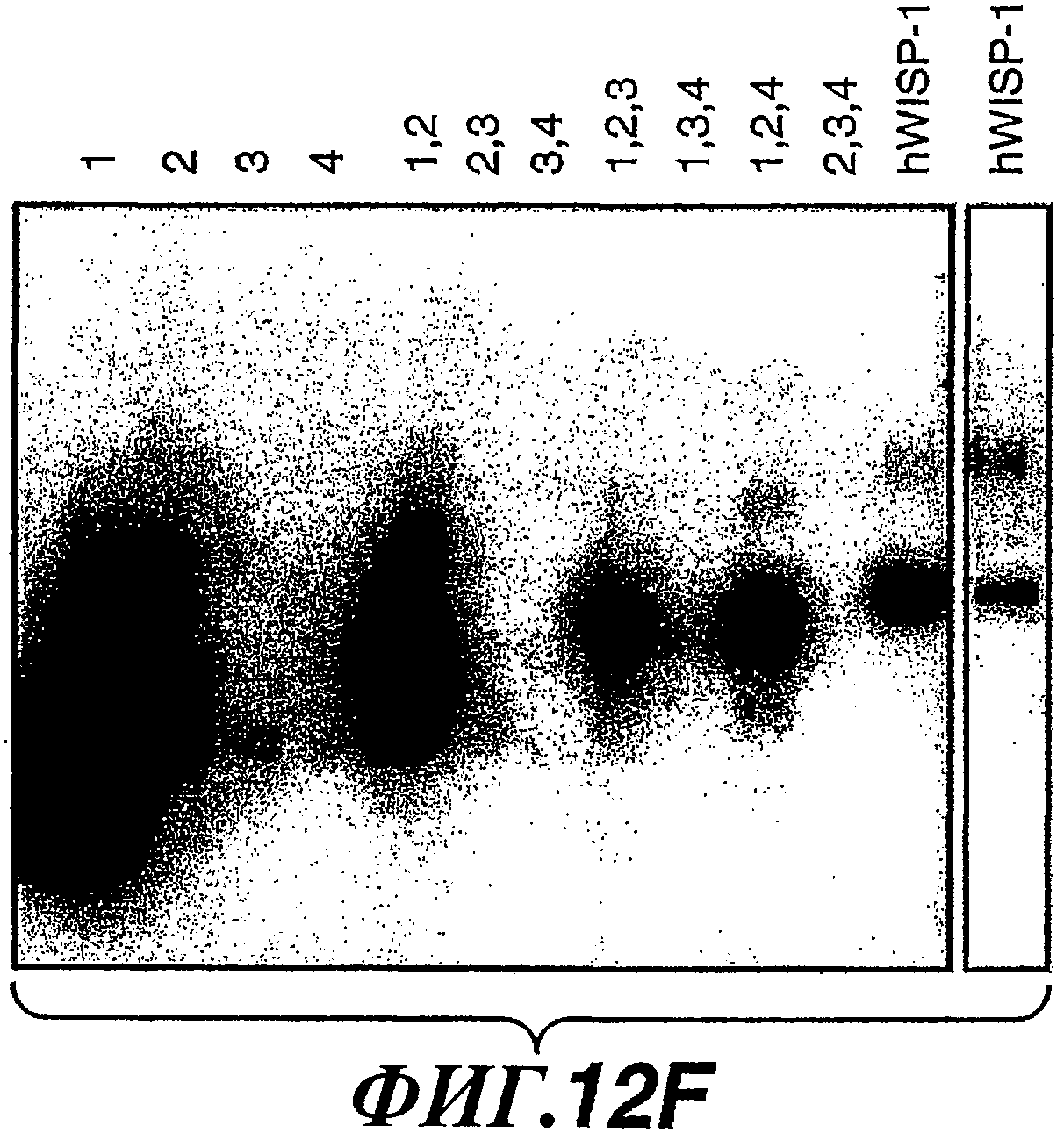
На фиг.12А-G изображены схемы разных доменов полипептида WISP-1 и показаны результаты анализов, выполненных для идентификации эпитопов, узнаваемых антителами против WISP-1 соответственно 11С2, 5D4, 9C11 и 3D11. На фиг.12С показана аминокислотная последовательность, представленная в SEQ ID NO:20.
На фиг.13 показаны результаты анализа, выполненного для идентификации эпитопа, узнаваемого антителом против WISP-1 9С10.
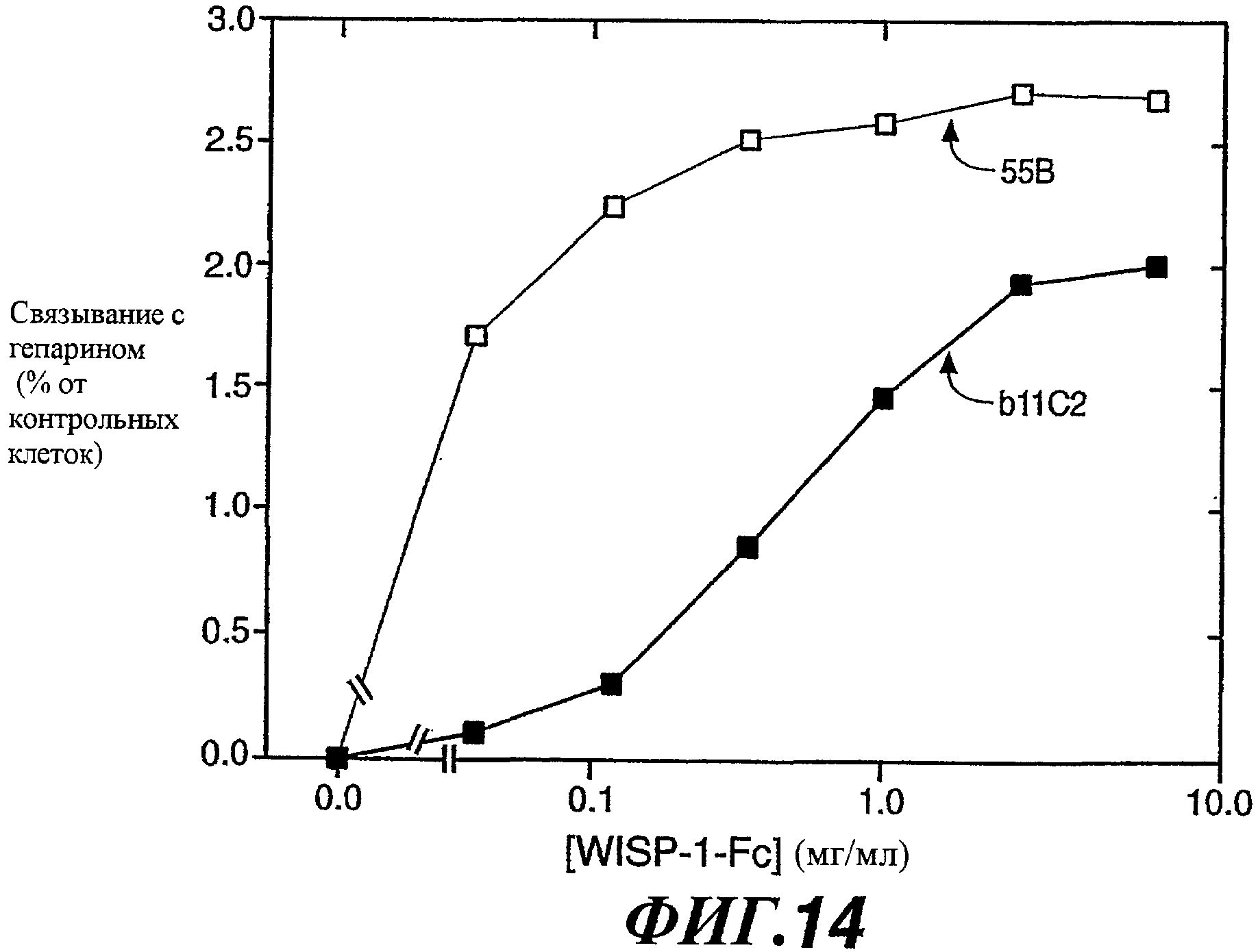
На фиг.14 показаны результаты анализа ELISA, свидетельствующие об обнаружении WISP-1 антителами против WISP-1.
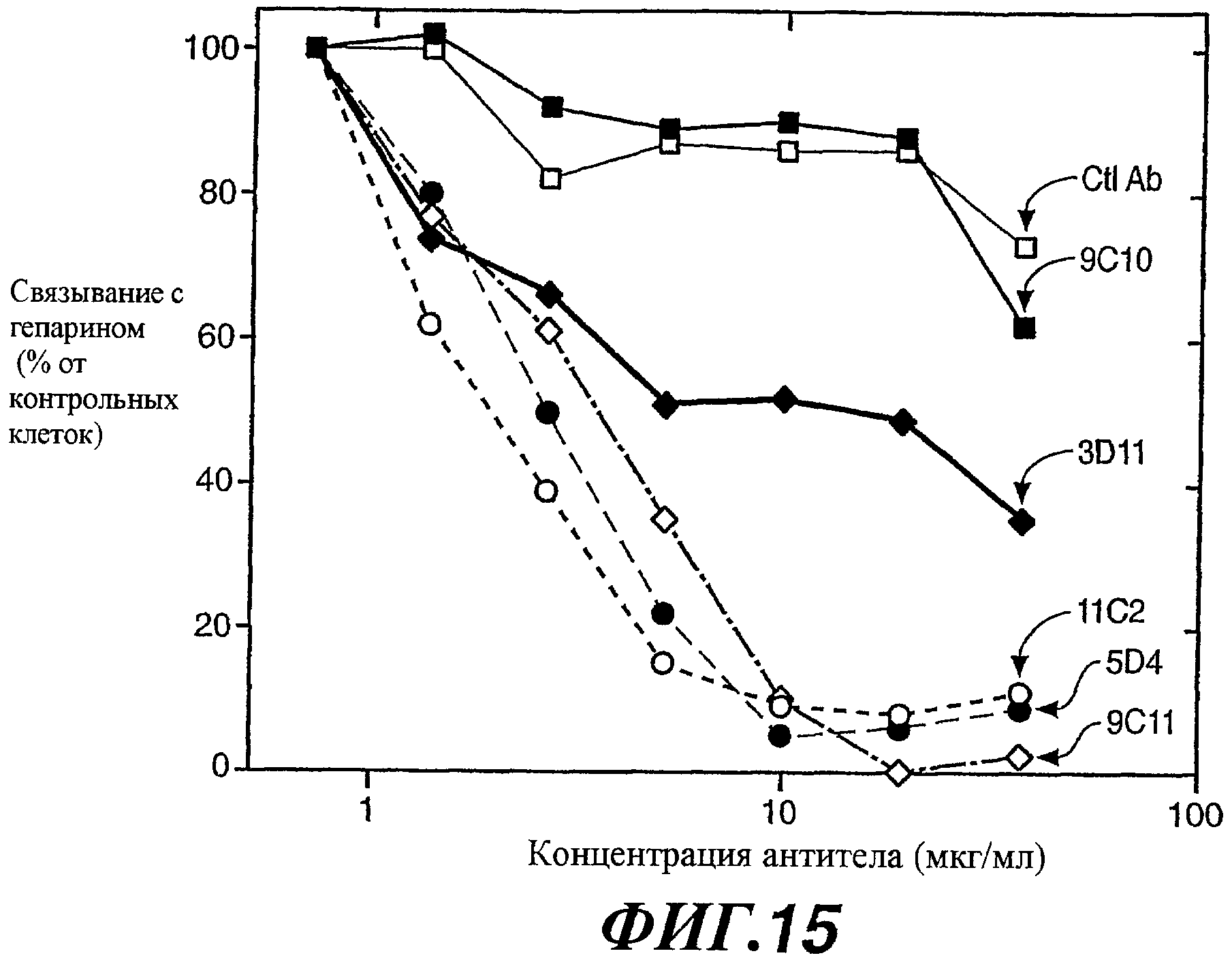
На фиг.15 показаны результаты анализа связывания ELISA, свидетельствующие о том, что антитела против WISP-1, узнающие вариабельную область WISP-1, могут ингибировать связывание WISP-1 с гепарином.
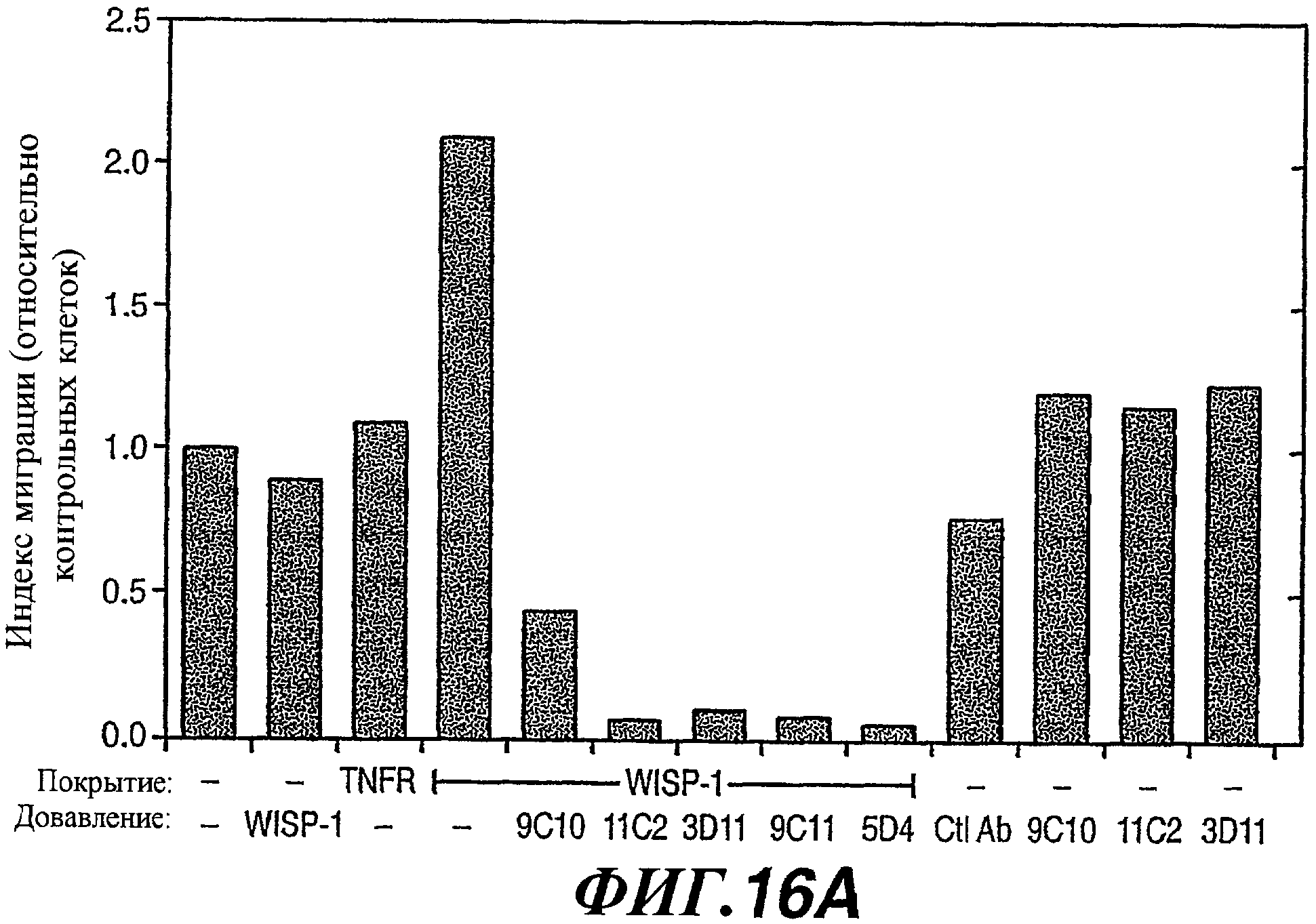
На фиг.16А-В показаны результаты анализа обнаружения ингибирования гаптотаксиса клеток NRK антителами против WISP-1 (16А) и приведена таблица, в которой суммированы свойства и характеристики антител против WISP-1 (16В).
На фиг.17А-Е показаны результаты исследования in vivo действия антител против WISP-1. Тяжесть поражений у животных, которых подвергали воздействию антитела против WISP-1, через 3 недели была значительно ослаблена по сравнению с контрольными животными (фиг.17A, B). У мышей, которым вводили антитела против WISP-1 (n=5), сократилось число узелков и средняя площадь метастатических очагов по сравнению с животными, которым вводили контрольное антитело (фиг.17C, D). Общая площадь поражений в легких сократилась на 82-97% по сравнению с животными, которым вводили изотипически сходное контрольное антитело (фиг.17E).
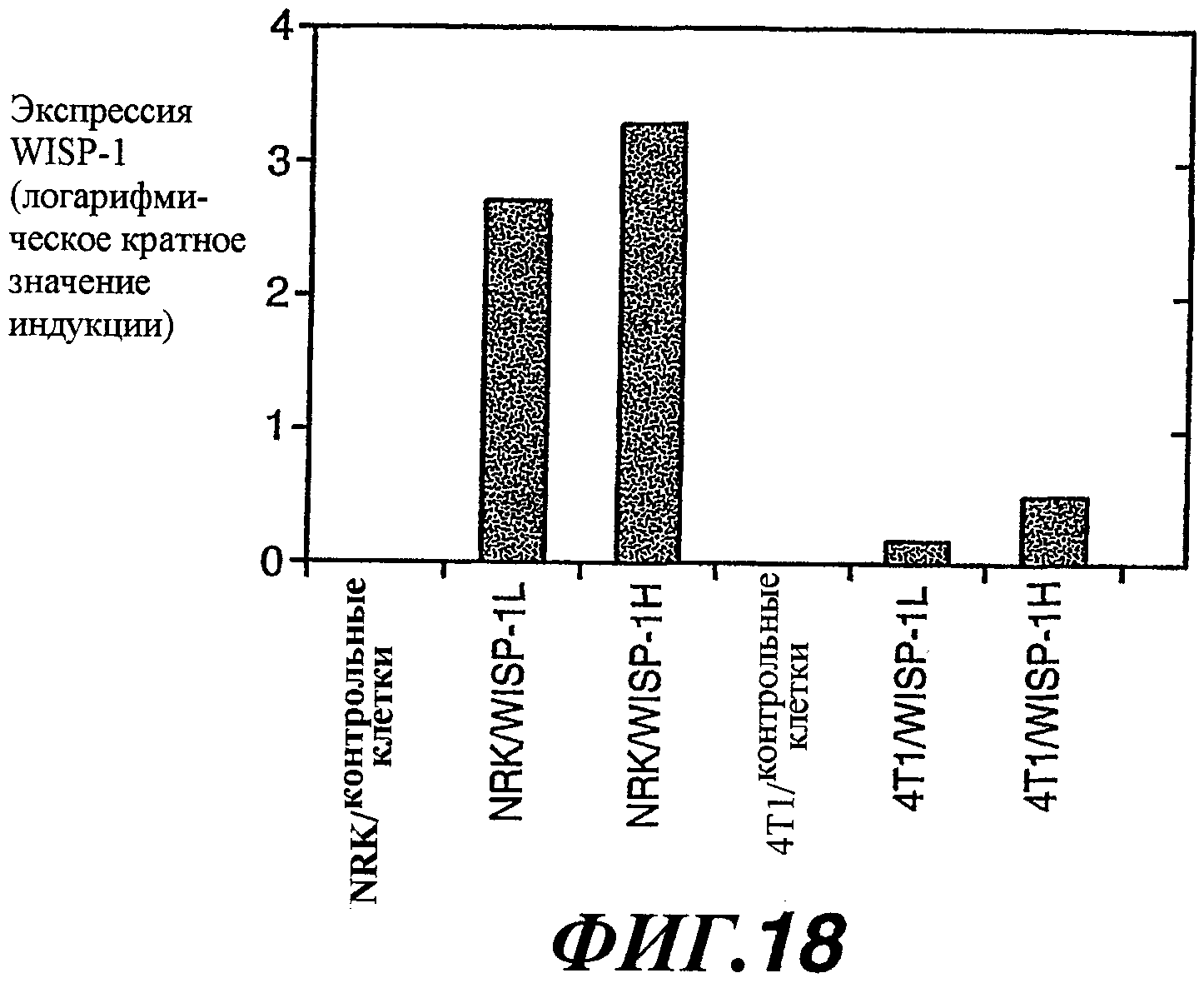
На фиг.18 изображена столбчатая диаграмма, показывающая экспрессию WISP-1 в линиях 4Т1/контрольных клеток, 4Т1/WISP-1L, 4T1/WISP-1H, NRK/контрольных клеток, NRK/WISP-1L и WISP-1H, измеренную полуколичественным методом RT-PCR (Taqman).
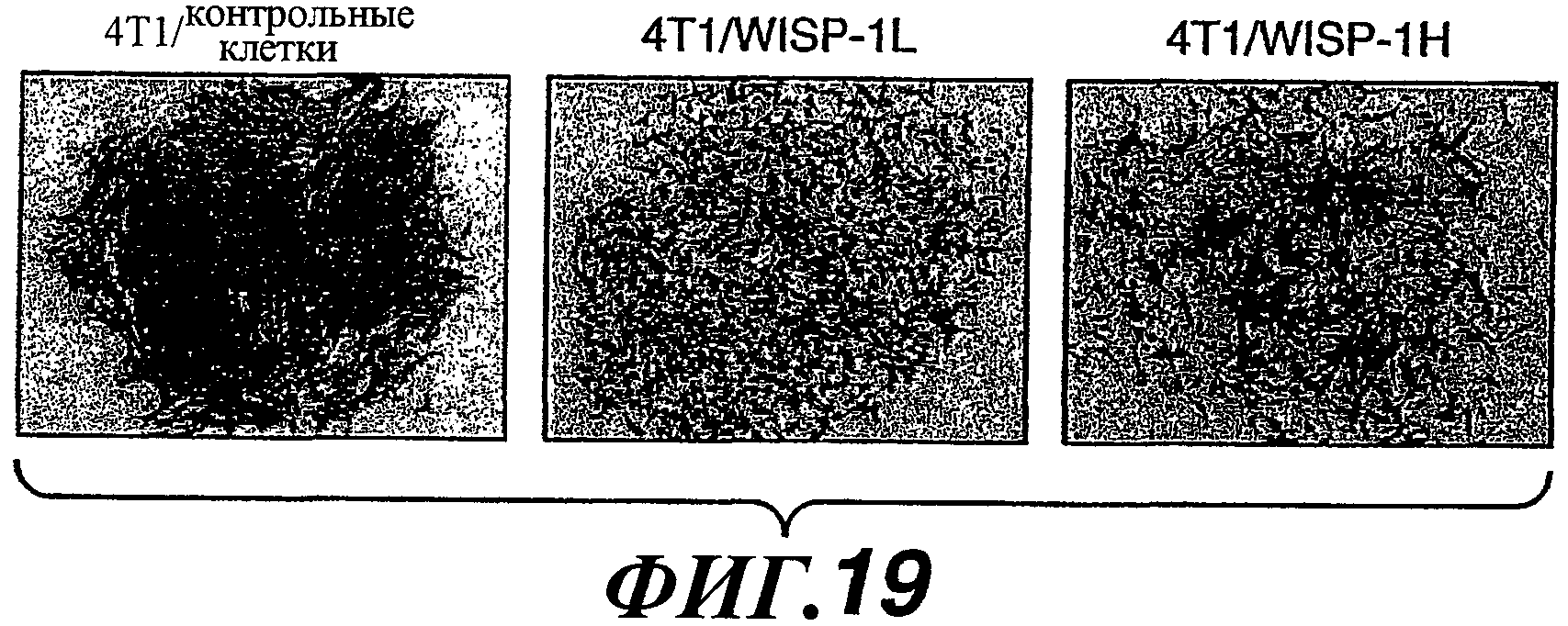
На фиг.19 показаны результаты анализа колониеобразования in vitro линий 4Т1/контрольных клеток, 4Т1/WISP-1L и 4T1/WISP-1H.
На фиг.20 показаны результаты анализа измерения индекса инвазии in vitro с использованием модифицированной системы камер Бойдена с матригелем и линий 4Т1/контрольных клеток, 4Т1/WISP-1L и 4Т1/WISP-1H.
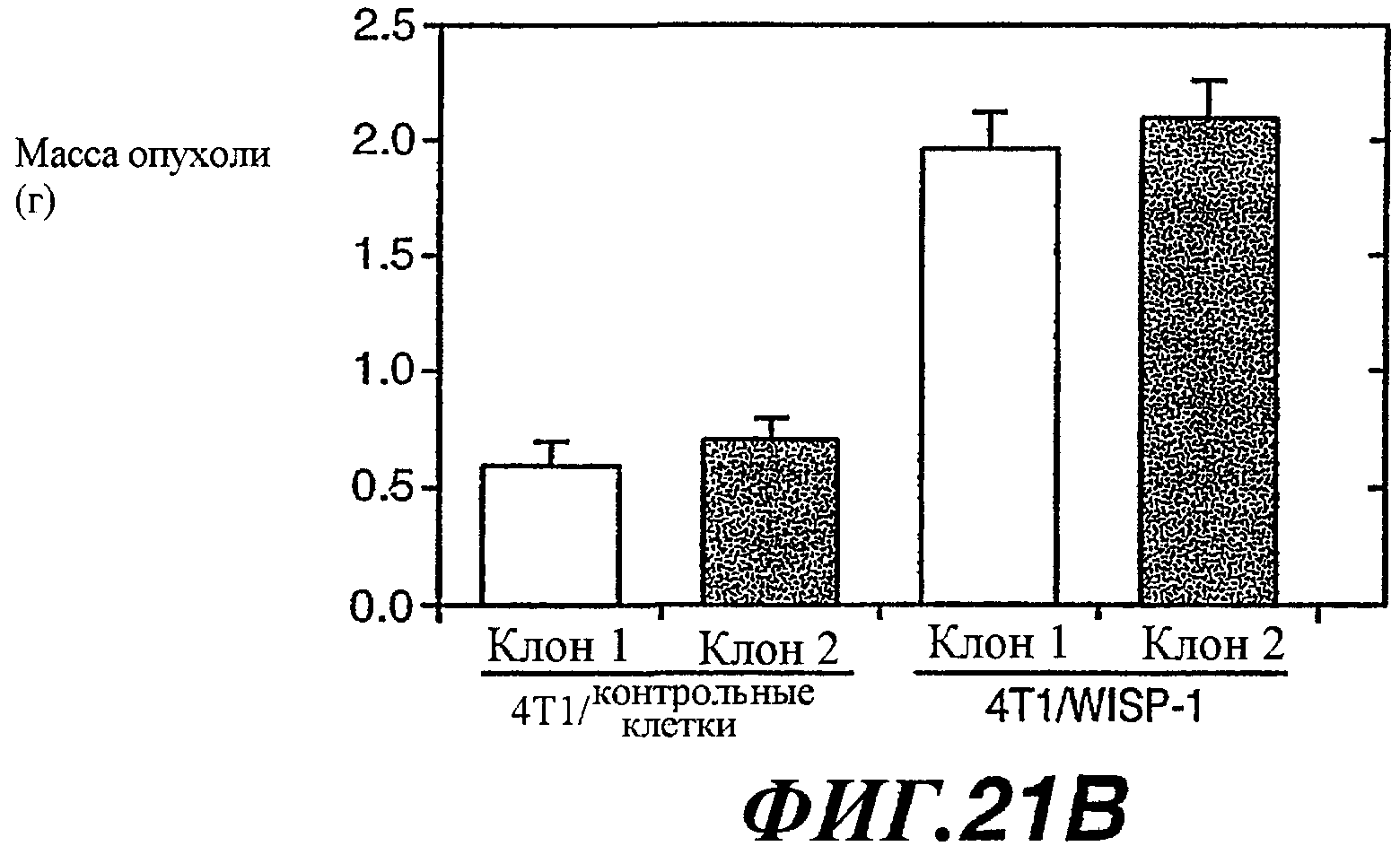
На фиг.21А-В показано воздействие экспрессии WISP-1 на онкогенез эпителиальных клеток молочной железы. Воздействие WISP-1 анализировали путем инъецирования мышам Balb/C 4Т1/контрольных клеток 1, 4Т1/контрольных клеток 2, 4Т1/WISP-1L или 4Т1/WISP-1H. Указаны объем опухоли (21А) и масса опухоли (21В).
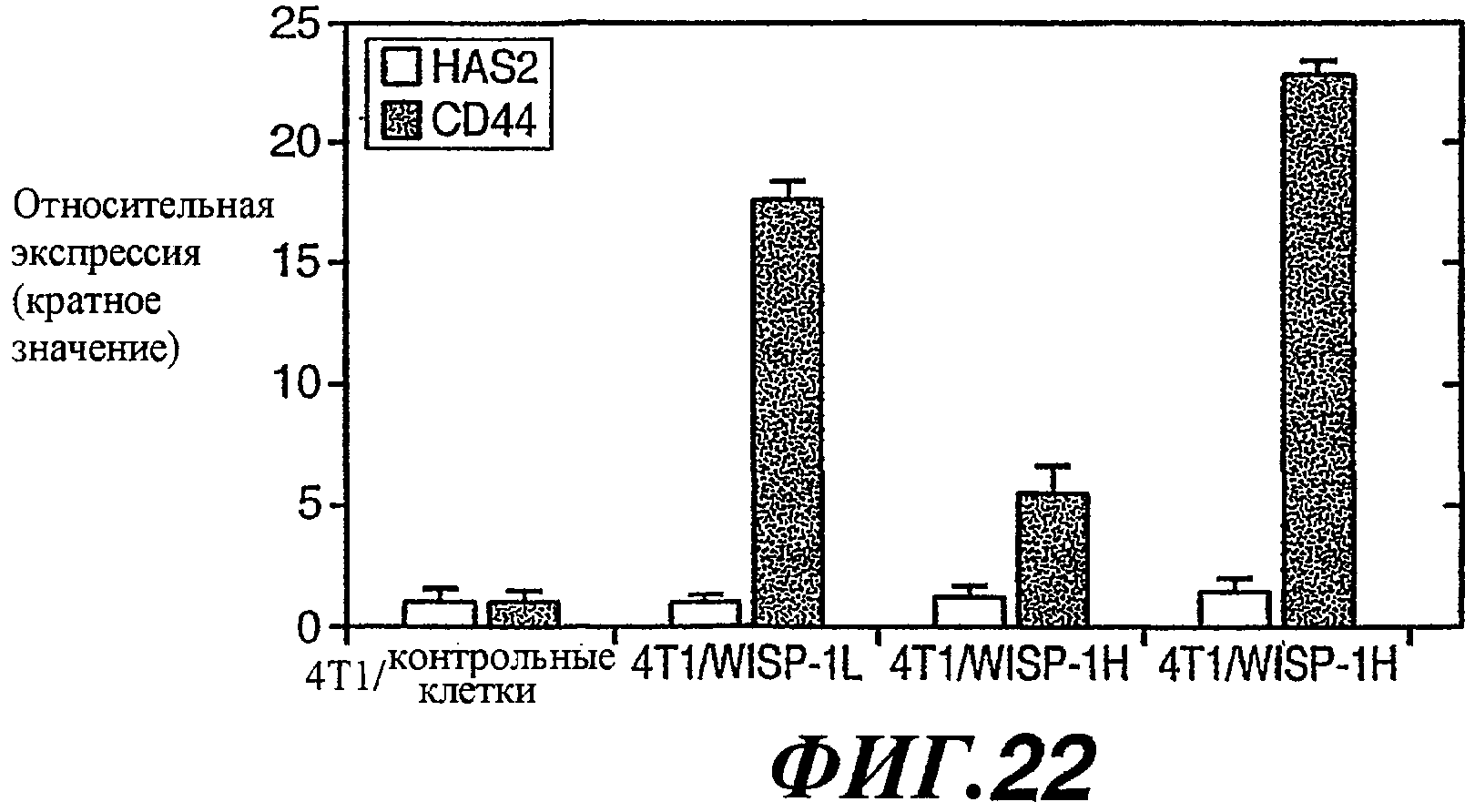
На фиг.22 изображена столбчатая диаграмма, показывающая относительную экспрессию HAS2 и CD44 в опухолях, образованных инокулированными 4Т1/контрольными клетками, клетками 4T1/WISP-1L и 4Т1/WISP-1H.
На фиг.23А-F показано воздействие WISP-1 на метастазирование эпителиальных клеток молочной железы, определенное in vivo путем инокуляции клеток 4Т1 в жировые тела молочной железы мышей и исследования степени распространения метастазов при помощи микрокомпьютерной томографии и гистологии. Через 31 день у мышей, которым инокулировали клетки 4T1/WISP-1L или 4T1/WISP-1H, наблюдалось обширное метастазирование легкого (фиг.23B и 23D) по сравнению с мышами, которым инъецировали 4Т1/контрольные клетки (фиг.23A и 23C). В результате выполнения иммуногистохимического анализа было также установлено, что в метастатических очагах легкого, вызванных 4Т1/WISP-1, был экспрессирован CD44 в высокой концентрации (фиг.23E). В указанных опухолях CD44 был локализован в плазматической мембране клеток 4Т1/WISP-1 (фиг.23F).
На фиг.24А показана экспрессия WISP-1 в NRK/контрольных клетках, NRK/WISP-1_1234, NRK/WISP-1_134, NRK/WISP-1_234, NRK/WISP-1_123 и NRK/WISP-1_124, измеренная полуколичественным методом RT-PCR (Taqman); результаты выражены в виде значения, кратного экспрессии WISP-1 в клетках NRK/WISP-1_1234. На фиг.24В показано воздействие указанных конструкций на онкогенез in vivo; результаты выражены в виде воздействия на объем опухоли.
На фиг.25 представлен гистологический анализ иссеченных опухолей, изображенных на фиг.24, который показал, что опухолевые клетки из опухолей NRK/WISP-1_234 были фенотипически подобны опухолевым клеткам из опухолей NHR/WISP-1_1234. В указанных опухолях клетки представляли собой дифференцированные и веретенообразные фибробласты. Опухолевые клетки из опухолей NRK/WISP-1_134 отличались фенотипически, были менее дифференцированными, часто многоядерными и характеризовались высокой скоростью митоза, о чем свидетельствует присутствие многочисленных митотических фигур (стрелки).
На фиг.26 представлен гистологический анализ иссеченных опухолей в ксенотрансплантате NRK/WISP-1_134, показанном на фиг.24, из которого следует, что опухолевые клетки проникли в несколько кровеносных сосудов, расположенных рядом с опухолью.
На фиг.27 показаны результаты анализа экспрессии в виде кратного значения инвазии по сравнению с контрольными клетками, при выполнении которого клетки НЕК 293, трансфицированные пустым вектором, культивировали в модифицированной системе камер Бойдена. Клетки 4Т1 характеризовались 4-кратным увеличением инвазии, когда клетки НЕК 293, экспрессирующие конструкции WISP-1_1234, WISP-1_134 или WISP-123, высевали в нижнюю камеру.
На фиг.28А-28В показано воздействие растворимого полипептида WISP-1-домен-1 на стимулированную WISP-1 инвазию клеток 4Т1 при определении с использованием модифицированной системы камер Бойдена, покрытых матригелем. Результаты выражены в виде относительного кратного значения инвазии по сравнению с 4Т1/контрольными клетками. WISP-1-домен-1-His и WISP-1-домен-1-Fc оказывали антагонистическое действие на стимулированную WISP-1 инвазицию клеток 4Т1 в зависимости от дозы.
На фиг.29 показан анализ гибридизации in situ тканей из модели ксенотрансплантата НРАС аденокарциномы поджелудочной железы человека, выполненный для оценки экспрессии WISP-1.
На фиг.30 изображен график, показывающий воздействие конструкций WISP-1 на объем опухоли в модели с использованием “голых” мышей.
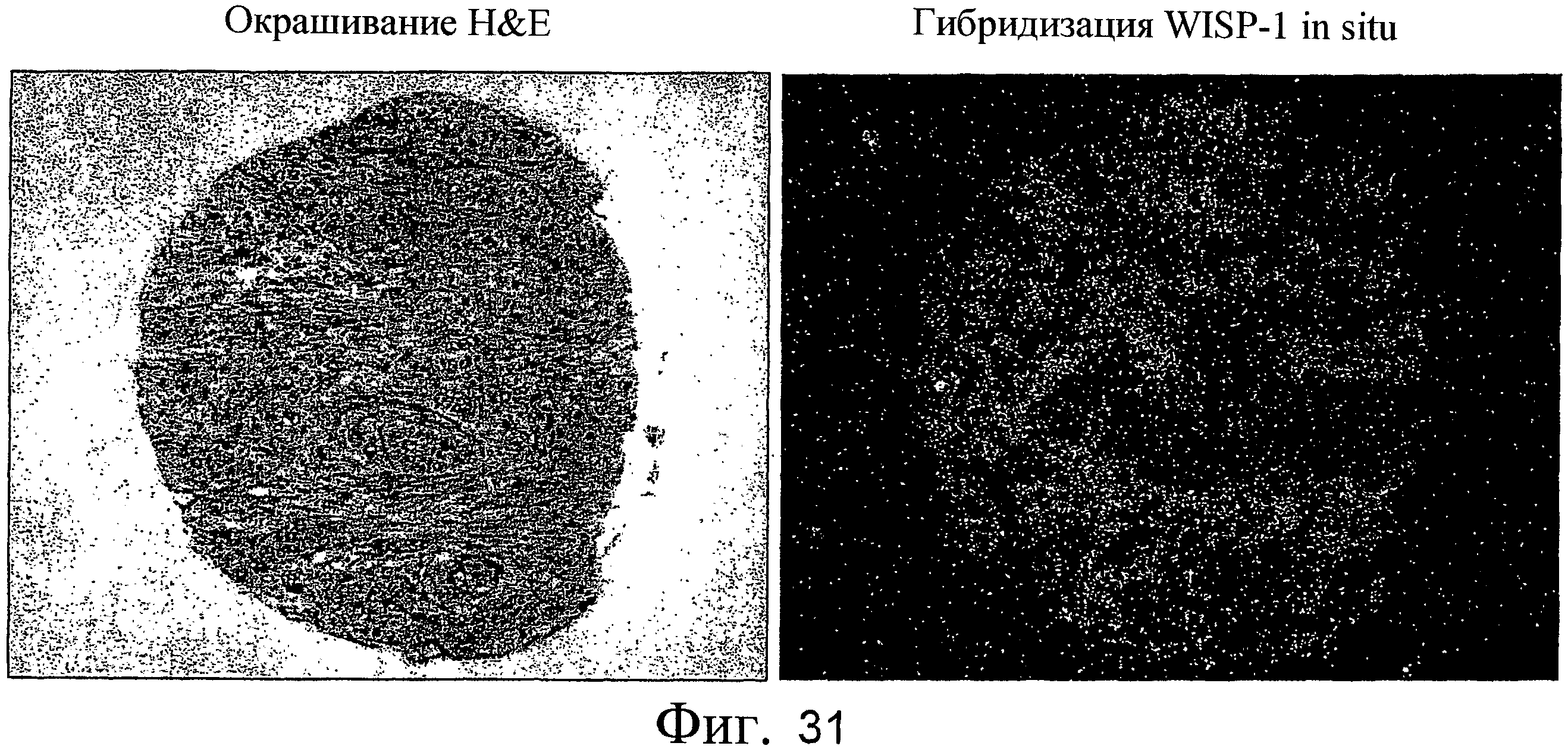
На фиг.31 показаны анализы гибридизации in situ, выполненные для оценки экспрессии WISP-1 в первичной аденокарциноме поджелудочной железы человека.
На фиг.32 показано иммуногистохимическое окрашивание для оценки экспрессии WISP-1 в первичной аденокарциноме ободочной кишки.
Подробное описание изобретения
I. Определения терминов
Термин “полипептид WISP” означает семейство белков WISP человека и мыши с нативной последовательностью и их вариантов, расcмотренных в настоящем описании изобретения, гены которых индуцированы, по крайней мере, Wnt-1. В определение данного термина входит WISP-1 и его варианты. Такие белки WISP-1 описаны ниже, а также в заявке РСТ WO 99/21998, опубликованной 6 мая 1999 г., патенте США № 6387657 В1, выданном 14 мая 2002 г., и публикации Pennica et al., Proc. Natl. Acad. Sci., 95:14717-14722 (1998).
Термины “полипептид WISP-1”, “гомолог WISP-1” и их грамматические варианты в значении, использованном в настоящем описании изобретения, означают белок WISP-1 с нативной последовательностью и его варианты (которые определены ниже). Полипептид WISP-1 может быть выделен из разных источников, например из тканей человека разных типов или других источников, или получен методами рекомбинантных ДНК, методами синтеза, любыми комбинациями указанных методов и подобными методами.
Термин “полипептид WISP-1 с нативной последовательностью” означает полипептид, имеющий такую же аминокислотную последовательность, что и полипептид WISP-1, существующий в природе. Такие полипептиды WISP-1 с нативной последовательностью могут быть выделены из природного источника или получены методами рекомбинантных ДНК или методами синтеза. Термин “полипептид WISP-1 с нативной последовательностью”, в частности, означает существующие в природе процессированные или секретированные формы полипептида WISP-1 по настоящему изобретению, существующие в природе вариантые формы (например, альтернативно сплайсированные формы или сплайсируемые варианты) и существующие в природе аллельные варианты полипептида WISP-1. В одном варианте осуществления изобретения полипептид WISP-1 с нативной последовательностью является зрелым или непроцессированным полипептидом WISP-1 человека с нативной последовательностью, включающей соответственно аминокислоты 23-367, показанные на фиг.9, или аминокислоты 1-367, показанные на фиг.9, при наличии или отсутствии N-концевого метионина.
В другом варианте осуществления изобретения полипептид WISP-1 с нативной последовательностью является полипептидом полной длины или зрелым полипептидом WISP-1 человека с нативной последовательностью, включающей аминокислоты 23-367 или 1-367, показанные на фиг.9, где остаток валина в положении 184 или остаток аланина в положении 202 заменены соответственно остатком изолейцина или серина, при наличии или отсутствии N-концевого метионина. В другом варианте осуществления изобретения полипептид WISP-1 с нативной последовательностью является полипептидом полной длины или зрелым полипептидом WISP-1 человека с нативной последовательностью, включающей аминокислоты 23-367 или 1-367, показанные на фиг.9, где остаток валина в положении 184 и остаток аланина в положении 202 заменены соответственно остатком изолейцина или серина, при наличии или отсутствии N-концевого метионина.
В другом варианте осуществления изобретения полипептид WISP-1 с нативной последовательностью является полипептидом, кодируемым нуклеотидной последовательностью, содержащей один сплайсированный вариант WISP-1 человека или другие варианты с нативной последовательностью, включающие SEQ ID NO:23, 24, 25, 26, 27, 28 или 29, представленные в WO 99/21998, при наличии или отсутствии N-концевого метионина.
Термин “вариант WISP-1” означает описанный ниже активный полипептид WISP-1, аминокислотная последовательность которого, по крайней мере, примерно на 80%, предпочтительно, по крайней мере, примерно на 85%, 86%, 87%, 88%, 89%, более предпочтительно, по крайней мере, примерно на 90%, 91%, 92%, 93%, 94%, наиболее предпочтительно, по крайней мере, примерно на 95%, 96%, 97%, 98% или 99% идентична зрелому WISP-1 человека, имеющему выведенную аминокислотную последовательность, показанную на фиг.9, или его растворимому фрагменту. Такие варианты включают, например, полипептиды WISP-1, в которых один или несколько аминокислотных остатков добавлены или удалены из N- или С-конца полноразмерных или зрелых последовательностей, показанных на фиг.9, или полипептиды WISP-1, в которых один или несколько аминокислотных остатков вставлены или удалены из внутренней последовательности или доменов полипептида, включая варианты из других видов, за исключением полипептида WISP-1 с нативной последовательностью. Такой вариант предпочтительно действует в качестве описанного ниже антагониста.
Термин “внеклеточный домен”, “ECD” или “секретируемый” белок означает форму полипептида, в которой по существу отсутствуют любые трансмембранные и цитоплазматические домены. “Секретируемая” форма белка или полипептида может включать или не включать сигнальную последовательность.
“Строгие условия” представляют собой такие условия, в которых (1) промывку выполняют при низкой ионной силе и высокой температуре, например, используя 0,015 М хлорида натрия/0,0015 М цитрата натрия/0,1% додецилсульфата натрия при 50°С; (2) в процессе гибридизации используют денатурирующий агент, такой как формамид, например 50% (об/об) формамида с 0,1% бычьего сывороточного альбумина/0,1% фиколла/0,1% поливинилпирролидона/50 нМ натрий-фосфатного буфера при рН 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°С; (3) используют 50% формамида, 5-кратный объем SSC (0,75 М NaCl, 0,075 М цитрата натрия), 50 мМ фосфата натрия (рН 6,8), 0,1% пирофосфата натрия, 5-кратный раствор Денхардта, обработанной ультразвуком ДНК спермы лосося (50 мкг/мл), 0,1% SDS и 10% сульфата декстрана при 42°С и выполняют промывки при 42°С в 0,2-кратном объеме SSC и 0,1% SDS; или (4) используют буфер с 10% сульфата декстрана, 2-кратный объем SSC (хлорид натрия/цитрат натрия) и 50% формамида при 55°С и выполняют последующие промывки в строгих условиях, включающих использование 0,1-кратного объема SSC, содержащего EDTA, при 55°С.
“Умеренно строгие условия” описаны в публикации Sambrook et al., Molecular Cloning: A Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989) и включают использование промывочного раствора и менее строгих условий гибридизации (например, температура, ионная сила и процентное содержание SDS) по сравнению с описанными выше. Примером умеренно строгих условий являются условия, в которых выполняют инкубацию в течение ночи при 37°С в растворе, содержащем: 20% формамида, 5-кратный объем SSC (150 мМ NaCl, 15 мМ тринатрийцитрата), 50 мМ фосфата натрия (рН 7,6), 5-кратный раствор Денхардта, 10% сульфата декстрана и 20 мг/мл денатурированной, гидродинамически фрагментированной ДНК спермы лосося, с последующей промывкой фильтров в 1-кратном объеме SSC при температуре около 37-50°С. Специалисту в данной области должно быть известно, как отрегулировать температуру, ионную силу и т.д. для соответствия таким факторам, как длина зонда и тому подобные.
Термин “выделенный”, используемый для описания разных полипептидов по настоящему изобретению, означает полипептид, который был идентифицирован и отделен и/или выделен из компонента естественного окружения. Загрязняющими компонентами естественного окружения являются вещества, которые обычно препятствуют диагностическому или терапевтическому использованию данного полипептида и могут включают ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления изобретения полипептид должен быть очищен (1) до степени, достаточной для получения, по крайней мере, 15 остатков N-концевой или внутренней аминокислотной последовательности, при помощи центрифужного секвенатора или (2) до гомогенного состояния методом SDS-PAGE в невосстановительных или восстановительных условиях при окрашивании кумассии голубым или предпочтительно серебром. Выделенный полипептид включает полипептид in situ в рекомбинантных клетках, так как должен отсутствовать, по крайней мере, один компонент естественного окружения WISP. Однако, как правило, выделенный полипептид получают в результате выполнения, по крайней мере, одной стадии очистки.
Термин “регуляторные последовательности” означает последовательности ДНК, необходимые для экспрессии функционально связанной кодирующей последовательности в определенном организме-хозяине. Регуляторные последовательности, пригодные для прокариотических клеток, включают, например, промотор, необязательно операторную последовательность и сайт связывания рибосомы. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является “функционально связанной”, когда она функционально взаимосвязана с другой последовательностью нуклеиновой кислоты. Например, ДНК предпоследовательности или секреторной лидерной последовательности функционально связана с ДНК полипептида, если она экспрессирована в виде пребелка, участвующего в секреции указанного полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию данной последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если его расположение облегчает трансляцию. Термин “функционально связанный” обычно означает, что связанные последовательности ДНК являются смежными и в случае секреторной лидерной последовательности являются смежными, и находятся в фазе считывания. Однако энхансеры не должны быть смежными. Связывание осуществляется путем лигирования на приемлемых сайтах рестрикции. При отсутствии таких сайтов используют синтетические олигонуклеотидные адапторы или линкеры в соответствии с общепринятой практикой.
“Липосома” является малой везикулой, состоящей из разных типов липидов, фосфолипидов и/или поверхностно-активного вещества, который пригоден для доставки лекарственного средства (такого как инсулин и варианты инсулина, рассмотренные в настоящем описании изобретения) в организм млекопитающего. Компоненты липосомы обычно образуют двухслойную структуру, аналогичную расположению липидов в биологических мембранах.
Термины “аминокислота” и “аминокислоты” означают все природные L-альфа-аминокислоты. В определение данного термина входят норлейцин, орнитин и гомоцистеин. Аминокислоты имеют однобуквенные или трехбуквенные обозначения:
В списке последовательностей и на чертежах могут быть использованы некоторые другие однобуквенные или трехбуквенные обозначения для идентификации двух или более аминокислот или нуклеотидов в данном положении последовательности.
Термин “процентная (%) идентичность аминокислотных последовательностей” применительно к полипептидным последовательностям, идентифицированным в настоящем описании изобретения, означает процентное значение аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в полипептидной последовательности по настоящему изобретению после выполнения сравнительного анализа последовательностей и введения при необходимости разрывов для достижения максимальной процентной идентичности последовательностей без учета любых консервативных замен в виде части идентичности последовательностей. Сравнительный анализ для определения процентной идентичности аминокислотных последовательностей может быть выполнен разными способами, известными в данной области, например, при помощи общедоступных компьютерных программ, таких как BLAST, BLAST-2, ALIGN, ALIGN-2 или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие парамеры для выполнения сравнения, включая любые алгоритмы, необходимые для достижения максимального соответствия по всей длине сравниваемых последовательностей. Однако в соответствии с целями настоящего изобретения значения процентной идентичности аминокислотных последовательностей получены при помощи компьютерной программы сравнения последовательностей ALIGN-2, полный исходный код которой приведен в нижеследующей таблице. Компьютерная программа сравнения последовательностей ALIGN-2 была создана в компании Genentech, Inc., и исходный код, приведенный в нижеследующей таблице, был направлен вместе документацией пользователя в Ведомство по охране авторского права США, округ Вашингтон, 20559, и зарегистрирован под регистрационным номером TXU510087. Программа ALIGN-2 может быть приобретена в компании Genentech, Inc., South San Francisco, California, или компилирована из исходного кода, приведенного в нижеследующей таблице. Программа ALIGN-2 должна быть компилирована для использования в операционной системе UNIX, предпочтительно в цифровой системе UNIX V4.OD. Все параметры сравнения последовательностей заданы программой ALIGN-2 и не подлежат изменению.
Термин “меченый эпитоп” в используемом здесь значении означает химерный полипептид, который представляет собой полипептид, слитый с “маркерным полипептидом”. Маркерный полипептид имеет достаточное число остатков для образования эпитопа, против которого может быть создано антитело. Маркерный полипептид предпочтительно является достаточно специфичным, чтобы антитело по существу не взаимодействовало с другими эпитопами. Приемлемые маркерные полипептиды обычно содержат, по крайней мере, шесть аминокислотных остатков, как правило, от около 8 до 50 аминокислотных остатков (предпочтительно от около 10 до 20 аминокислотных остатков).
В используемом здесь значении термин “иммуноадгезин” означает антителоподобные молекулы, которые сочетают специфичность связывания гетерологичного белка (“адгезин”) с эффекторными функциями константных областей иммуноглобулина. В структурном отношении иммуноадгезины характеризуются слиянием аминокислотной последовательности с требуемой специфичностью связывания, отличной от антигенузнающего и связывающего сайта антитела (то есть является “гетерологичным”), и последовательности константной области иммуноглобулина. Часть адгезина молекулы иммуноадгезина обычно является смежной аминокислотной последовательностью, содержащей, по крайней мере, сайт связывания рецептора или лиганда. Последовательность константной области иммуноглобулина в иммуноадгезине может быть получена из любого иммуноглобулина, такого как подтипы IgG-1, IgG-2, IgG-3 или IgG-4, IgA (включая IgA-1 и IgA-2), IgE, IgD или IgM.
Термин “антагонист” использован в самом широком смысле и означает любую молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует одну или несколько биологических активностей полипептида WISP-1 in vitro, in situ или in vivo. Примеры таких биологических активностей полипептидов WISP-1 включают индукцию или секрецию HAS2, HA, CD44 или RHAMM, по крайней мере, в клетке млекопитающего одного типа. Антагонист может действовать прямо или косвенно. Например, антагонист может частично или полностью блокировать, ингибировать или нейтрализовать одну или несколько биологических активностей полипептида WISP-1 in vitro, in situ или in vivo, например в результате прямого связывания с полипептидом WISP-1. Антагонист может также косвенно частично или полностью блокировать, ингибировать или нейтрализовать одну или несколько биологических активностей полипептида WISP-1 in vitro, in situ или in vivo, например в результате блокирования или ингибирования другой эффекторной молекулы.
Термин “антагонист WISP-1” означает любую молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует биологическую активность WISP-1, и включает, не ограничиваясь ими, антитела, иммуноадгезины, иммуноадгезины WISP-1, слитые белки WISP-1, ковалентно модифицированные формы WISP-1, варианты WISP-1 и их слитые белки, антитела против WISP-1 и высшие олигомерные формы WISP-1 (димеры, агрегаты), гомо- или гетерополимерные формы WISP-1. Способность молекулы антагониста WISP-1 частично или полностью блокировать, ингибировать или нейтрализовать биологическую активность WISP-1 можно определить с помощью анализов, позволяющих оценить воздействие молекулы антагониста на разные клетки, представленных в примерах, или в модели метастазирования рака легкого in vivo у мышей. Разные анализы могут быть выполнены в известных форматах in vitro или in vivo. Антагонисты WISP-1, используемые в способах по настоящему изобретению, предпочтительно способны блокировать или нейтрализовать, по крайней мере, один тип активности WISP-1, которая может быть необязательно определена при выполнении анализов, рассмотренных в настоящем описании изобретения.
Термин “антитело” использован в самом широком смысле и специфически означает, например, отдельные моноклональные антитела, композиции антител с полиэпитопной специфичностью, одноцепочечные антитела и фрагменты антител. Термин “антитело” в используемом здесь значении означает интактные молекулы иммуноглобулина или антитела, поликлональные антитела, мультиспецифические антитела (то есть биспецифические антитела, образованные, по крайней мере, из двух интактных антител) и фрагменты иммуноглобулина (такие как Fab, F(ab')2 или Fv), если они обладают любыми желаемыми антагонистическими свойствами, рассмотренными в настоящем описании изобретения.
Антитела обычно являются белками или полипептидами, обладающими специфичностью связывания со специфическим антигеном. Нативные антитела обычно являются гетеротетрамерными гликопротеинами, состоящими из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь обычно связана с тяжелой цепью одной ковалентной дисульфидной связью, при этом число дисульфидных связей изменяется у тяжелых цепей разных изотипов иммуноглобулина. Каждая тяжелая и легкая цепи имеют также равномерно расположенные внутрицепные дисульфидные мостики. Каждая тяжелая цепь имеет у одного конца вариабельную область (VH), за которой следует несколько константных областей. Каждая легкая цепь имеет вариабельную область у одного конца (VL) и константную область у другого конца; константная область легкой цепи совмещена с первой константной областью тяжелой цепи, и вариабельная область легкой цепи совмещена с вариабельной областью тяжелой цепи. Считается, что определенные аминокислотные остатки образуют поверхность раздела между вариабельными областями легкой и тяжелой цепи (Chоthia et al., J. Mol. Biol., 186:651-663 (1985); Novotny and Haber, Proc. Natl. Acad. Sci. USA, 82:4592-4596 (1985)). Легкие цепи антител из любого вида позвоночных могут быть отнесены к одному из двух четко выраженных типов, именуемых каппа и лямбда, на основании аминокислотных последовательностей константных областей. В зависимости от аминокислотной последовательности константной области тяжелых цепей иммуноглобулины могут быть отнесены к разным классам. Существуют пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из указанных классов могут быть далее разделены на подклассы (изотипы), например IgG-1, IgG-2, IgG-3 и IgG-4; IgA-1 и IgA-2. Константные области тяжелой цепи, соответствующие разным классам иммуноглобулинов, именуются, соответственно, альфа, дельта, эпсилон, гамма и мю.
Термин “фрагменты антитела” означает часть интактного антитела, обычно антигенсвязывающую или вариабельную область интактного антитела. Примеры фрагментов антитела включают Fab, Fab', F(ab')2 и Fv-фрагменты, диантитела, одноцепочечные антитела и мультиспецифические антитела, образуемые из фрагментов антител.
Термин “вариабельный” использован в настоящем описании изобретения для обозначения определенных частей вариабельных областей, имеющих разные последовательности и используемых для специфического связывания каждого конкретного антитела с определенным антигеном. Однако вариабельность обычно распределена неравномерно в вариабельных областях антител. Вариабельность обычно сконцентрирована в трех сегментах, именуемых определяющими комплементарность областями (CDR) или гипервариабельными участками, которые расположены в вариабельных областях легкой и тяжелой цепей. Более консервативные части вариабельных областей именуются остовными областями (FR). Вариабельные области нативных тяжелых и легких цепей включают четыре остовные области, имеющие в основном β-складчатую конфигурацию и соединенные тремя гипервариабельными участками, которые образуют петли, соединяющие и в некоторых случаях образующие часть β-складчатой структуры. Гипервариабельные участки в каждой цепи удерживаются в непосредственной близости друг от друга остовными областями и вместе с гипервариабельными участками из другой цепи образуют антигенсвязывающий сайт антител (см. публикацию Kabat, E.A. et al., Sequences of Proteins of Immunological Interest, National Institutes of Health, Bethesda, MD (1987)). Константные области непосредственно не участвуют в связывании антитела с антигеном, но выполняют разные эффекторные функции, например определяют участие антитела в антителозависимой клеточной токсичности.
Термин “моноклональное антитело” в используемом здесь значении означает антитело, полученное из популяции по существу гомогенных антител, то есть отдельные антитела, образующие популяцию, являются идентичными за исключением возможных природных мутаций, которые могут присутствовать в незначительном количестве. Моноклональные антитела обладают высокой специфичностью, будучи направленными против одного антигенного сайта. Кроме того, в отличие от препаратов на основе обычных (поликлональных) антител, которые обычно включают разные антитела против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты в антигене.
Моноклональные антитела по настоящему изобретению включают химерные, гибридные и рекомбинантные антитела, продуцируемые в результате сплайсинга и замены вариабельной области (включая гипервариабельный участок) представляющего интерес антитела константной областью (например, “гуманизированные” антитела), легкой цепи тяжелой цепью, цепи из одного вида цепью из другого вида или слияния с гетерологичными белками независимо от вида, класса или подкласса иммуноглобулина, а также фрагменты антитела (например, Fab, F(ab')2 и Fv), если они обладают требуемой биологической активностью или свойствами. См., например, патент США № 4816567 и публикацию Mage et al., in Monoclonal Antibody Production Techniques and Applications, pp.79-97 (Marcel Dekker, Inc., New York, 1987).
Таким образом, определение “моноклональный” служит для обозначения характера антитела, получаемого по существу из гомогенной популяции антител, и не ограничивает получение антитела каким-либо конкретным методом. Например, моноклональные антитела, предназначенные для использования в соответствии с настоящим изобретением, могут быть получены методом гибридом, впервые описанным в публикации Kohler and Milstein, Nature, 256:495 (1975), или методами рекомбинантных ДНК, описанными в патенте США № 4816567. “Моноклональные антитела” могут быть также выделены из библиотек фагов, создаваемых методами, описанными, например, в публикации McCafferty et al., Nature, 348:552-554 (1990).
“Гуманизированные” формы антител, отличных от человеческих (например, мыши), представляют собой специфические химерные иммуноглобулины, цепи иммуноглобулина или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), которые содержат минимальную последовательность, выделенную из иммуноглобулина, отличного от человеческого. Гуманизированные антитела в основном являются иммуноглобулинами человека (антитело-реципиент), в которых остатки из гипервариабельного участка (CDR) реципиента заменены остатками из гипервариабельного участка вида, отличного от человека (антитело-донор), такого как мышь, крыса или кролик, обладающего требуемой специфичностью, сродством и антигенсвязывающей способностью. В некоторых случаях остатки остовной Fv-области (FR) иммуноглобулина человека заменены соответствующими остатками, отличными от человеческих. Кроме того, гуманизированное антитело может содержать остатки, которые отсутствуют как в антителе-реципиенте, так и в импортируемых последовательностях гипервариабельного участка или остовной области. Указанные модификации выполняют для дальнейшего улучшения и оптимизации действия антитела. Гуманизированное антитело обычно содержит все вариабельные области за исключением одной и, как правило, две вариабельные области, в которых все или по существу все гипервариабельные участки соответствуют гипервариабельным участкам иммуноглобулина, отличного от человеческого, и все или по существу все остовные области являются областями консенсусной последовательности иммуноглобулина человека. Кроме того, гуманизированное антитело оптимально содержит, по крайней мере, часть константной области или домена (Fc) иммуноглобулина, обычно иммуноглобулина человека.
“Человеческое антитело” является антителом, которое содержит аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, продуцированного человеком и/или созданного любыми методами получения человеческих антител, известными в данной области или рассмотренными в настоящем описании изобретения. В указанное определение человеческого антитела входят антитела, содержащие, по крайней мере, один полипептид тяжелой цепи человека или, по крайней мере, один полипептид легкой цепи человека, например антитело, содержащее полипептид легкой цепи мыши и полипептид тяжелой цепи человека. Человеческие антитела могут быть получены разными методами, известными в данной области. В одном варианте осуществления изобретения человеческое антитело выбирают из библиотеки фагов, экспрессирующей человеческие антитела (Vaughan et al., Nature Biotechnology, 14:309-314 (1996); Sheets et al., PNAS, (USA) 95:6157-6162 (1998); Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991)). Человеческие антитела могут быть также созданы путем введения локусов иммуноглобулина человека трансгенным животным, например мышам, у которых частично или полностью инактивированы гены эндогенного иммуноглобулина. После стимуляции происходит продуцирование человеческих антител, которые во всех отношениях близко напоминают антитела, образуемые в организме человека, включая реаранжировку генов, сборку и спектр антител. Данный подход описан, например, в патентах США №№ 5545807, 5545806, 5569825, 5625126, 5633425, 5661016 и следующих научных публикациях: Marks et al., Bio/Technology, 10:779-783 (1992); Lonberg et al., Nature, 368:856-859 (1994); Morrison, Nature, 368:812-13 (1994); Fishwild et al., Nature Biotechnology, 14:845-51 (1996); Neuberger, Nature Biotechnology, 14:826 (1996); Lonberg and Huszar, Intern. Rev. Immunol., 13:65-93 (1995). Альтернативно, человеческое антитело может быть получено путем иммортализации В-лимфоцитов человека, продуцирующих антитело против антигена-мишени (такие В-лимфоциты могут быть получены у субъекта или могут быть иммунизированы in vitro). См., например, публикации Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985), Boerner et al., J. Immunol., 147 (1):86-95 (1991) и патент США № 5750373.
Термин “Fc-область” использован для определения С-концевой области тяжелой цепи иммуноглобулина, которая может быть получена в результате расщепления папаином интактного антитела. Fc-область может быть Fc-областью с нативной последовательностью или вариантной Fc-областью. Несмотря на то, что границы Fc-области тяжелой цепи иммуноглобулина могут изменяться, Fc-область тяжелой цепи IgG человека обычно определяется участком от аминокислотного остатка примерно в положении Cуs226 или Pro230 до карбоксильного конца Fc-области (в настоящем описании изобретения использована система нумерации, приведенная в публикации Kabat et al., см. выше). Fc-область иммуноглобулина обычно включает две константные области, СН2-домен и СН3-домен, и необязательно СН4-домен.
Термин “цепь Fc-области” в используемом здесь значении означает одну из двух полипептидных цепей Fc-области.
“СН2-домен” Fc-области IgG человека (определяемый также как “Сγ2”-домен) обычно расположен от аминокислотного остатка примерно в положении 231 до аминокислотного остатка примерно в положении 340. СН2-домен является уникальным в том отношении, что он не спарен с другим доменом. Вместо этого две N-связанные разветвленные углеводные цепи расположены между двумя СН2-доменами молекулы интактного нативного IgG. Предполагается, что углевод может служить заменой спариванию доменов и помогает стабилизировать СН2-домен (Burton, Molec. Immunol. 22:161-206 (1985)). СН2-домен по настоящему изобретению может представлять собой СН2-домен с нативной последовательностью или вариантный СН2-домен.
“СН3-домен” включает участок остатков от С-конца до СН2-домена в Fc-области (то есть от аминокислотного остатка примерно в положении 341 до аминокислотного остатка примерно в положении 447 IgG). СН3-область по настоящему изобретению может представлять собой СН3-домен с нативной последовательностью или вариантный СН3-домен (например, СН3-домен с введенным “выступом” в одной цепи и соответствующей введенной “полостью” в другой цепи; см. патент США № 5821333). Такие вариантые СН3-домены могут быть использованы для создания мультиспецифических (например, биспецифических) антител, рассмотренных в настоящем описании изобретения.
“Шарнирная область” обычно определяется как участок, расположенный примерно от остатка Glu216 или Cys226 примерно до остатка Pro230 IgG1 человека (Burton, Molec. Immunol. 22:161-206 (1985)). Шарнирные области других изотипов IgG можно совместить с последовательностью IgG1, помещая в те же положения первый и последний остатки цистеина, образующие S-S связи между тяжелыми цепями. Шарнирная область по настоящему изобретению может представлять собой шарнирную область с нативной последовательностью или вариантную шарнирную область. Две полипептидные цепи вариантной шарнирной области обычно сохраняют, по крайней мере, один остаток цистеина в полипептидной цепи, поэтому две полипептидные цепи вариантной шарнирной области могут образовывать дисульфидную связь между двумя цепями. Предпочтительной шарнирной областью является шарнирная область человека с нативной последовательностью, например шарнирная область IgG1 человека с нативной последовательностью.
“Функциональная Fc-область” выполняет, по крайней мере, одну “эффекторную функцию” Fc-области с нативной последовательностью. Типичные “эффекторные функции” включают связывание C1q; комплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антителозависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; уменьшение числа рецепторов на поверхности клетки (например, В-клеточный рецептор; BCR) и т.д. Такие эффекторные функции обычно требуют объединения Fc-области с доменом связывания (например, вариабельная область антитела) и могут быть определены при помощи разных анализов, существующих в данной области для оценки таких эффекторных функций антитела.
“Fc-область с нативной последовательностью” включает аминокислотную последовательность, идентичную аминокислотной последовательности Fc-области, встречающейся в природе. “Вариантная Fc-область” включает аминокислотную последовательность, отличающуюся от нативной последовательности Fc-области заменой, по крайней мере, одной аминокислоты. Вариантная Fc-область предпочтительно включает замену, по крайней мере, одной аминокислоты по сравнению с Fc-областью с нативной последовательностью или Fc-областью исходного полипептида, например замену от одной до десяти аминокислот и предпочтительно от одной до пяти аминокислот в Fc-области с нативной последовательностью или Fc-области исходного полипептида. Последовательность вариантной Fc-области по настоящему изобретению предпочтительно, по крайней мере, на 80% идентична Fc-области с нативной последовательностью и/или Fc-области исходного полипептида и более предпочтительно идентична, по крайней мере, на 90%, наиболее предпочтительно идентична, по крайней мере, на 95%.
Термины “антителозависимая клеточно-опосредованная цитотоксичность” и “ADCC” означают клеточно-опосредованное взаимодействие, в процессе которого неспецифические цитотоксические клетки, экспрессирующие Fc-рецепторы (FcR) (например, естественные клетки-киллеры (NK), нейтрофилы и макрофаги), узнают связанное антитело на клетке-мишени и вызывают лизис указанной клетки-мишени. Первичные клетки, опосредующие ADCC, клетки-киллеры, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках суммирована в таблице 3 на странице 464 публикации Ravetch and Kinet, Annu. Rev. Immunol., 9:457-92 (1991). Для оценки активности ADCC представляющей интерес молекулы может быть выполнен анализ ADCC in vitro, аналогичный описанному в патенте США № 5500362 или 5821337. Приемлемые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK). Альтернативно или дополнительно активность ADCC представляющей интерес молекулы можно оценить in vivo, например, в животной модели, такой как модель, описанная в публикации Clynes et al., PNAS (USA), 95:652-656 (1998).
“Эффекторные клетки человека” являются лейкоцитами, экспрессирующими один или несколько FcR и выполняющими эффекторные функции. Указанные клетки предпочтительно экспрессируют, по крайней мере, FcγRIII и выполняют эффекторную функцию ADCC. Примеры лейкоцитов человека, опосредующих ADCC, включают мононуклеарные клетки периферической крови (РВМС), естественные клетки-киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы, причем предпочтительными клетками являются РВМС и NK-клетки. Эффекторные клетки могут быть выделены из природного источника, например из крови или РВМС, методом, описанным в настоящем описании изобретения.
Термины “Fc-рецептор” и “FcR” использованы для описания рецептора, связывающегося с Fc-областью антитела. Предпочтительным Fc-рецептором является FcR человека с нативной последовательностью. Кроме того, предпочтительным FcR является рецептор, связывающий антитело IgG (гамма-рецептор), который включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, в том числе аллельные варианты и альтернативно сплайсированные формы указанных рецепторов. Рецепторы FcγRII включают FcγRIIА (“активирующий рецептор”) и FcγRIIВ (“ингибирующий рецептор”), которые имеют одинаковые аминокислотные последовательности, которые отличаются главным образом цитоплазматическими доменами. Активирующий рецептор FcγRIIА содержит активирующий фрагмент на основе тирозина иммунорецептора (ITAM) в цитоплазматическом домене. Ингибирующий рецептор FcγRIIВ содержит ингибирующий фрагмент на основе тирозина иммунорецептора (ITIM) в цитоплазматическом домене (см. публикацию Daeron, Annu. Rev. Immunol., 15:203-234 (1997)). Fc-рецепторы рассмотрены в публикациях Ravetch and Kinet, Annu. Rev. Immunol., 9:457-92 (1991); Capel et al., Immunomethods, 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med., 126:330-41 (1995). Другие Fc-рецепторы, в том числе рецепторы, которые могут быть идентифицированы в будущем, также входят в определение термина “FcR”, приведенного в настоящем описании изобретения. В определение данного термина входит также неонатальный рецептор, FcRn, ответственный за перенос материнских IgG в плод (Guyer et al., J. Immunol., 117:587 (1976); and Kim et al., J. Immunol., 24:249 (1994)).
Термины “комплементзависимая цитотоксичность” и “CDC” означают лизис мишени в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплементов (C1q) с молекулой (например, антителом), образующей комплекс с родственным антигеном. Для определения активации комплемента может быть выполнен анализ CDC, например описанный в публикации Gazzano-Santoro et al., J. Immunol. Methods, 202:163 (1996).
Антитело с “созревшей аффинностью” является антителом с одним или несколькими изменениями в одном или нескольких гипервариабельных участках (CDR), которые повышают сродство антитела к антигену по сравнению с исходным антителом, не содержащим указанных изменений. Предпочтительные антитела с созревшей аффинностью обладают наномолярным или даже пикомолярным сродством к антигену-мишени. Антитела с созревшей аффинностью получают методами, известными в данной области. В публикации Marks et al., Bio/Technology, 10:779-783 (1992) описано созревание аффинности в результате перестановки VH- и VL-доменов. Неспецифический мутагенез остатков CDR и/или остовной области описан в следующих публикациях: Barbas et al., Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al., Gene, 169:147-155 (1995); Yelton et al., J. Immunol., 155:1994-2004 (1995); Jackson et al., J. Immunol., 154 (7):3310-9 (1995); and Hawkins et al., J. Mol. Biol., 226:889-896 (1992).
Термин “иммуноспецифический”, использованный в выражении “иммуноспецифическое связывание антител”, означает, например, антигенспецифическое связывание, происходящее между антигенсвязывающим сайтом антитела и специфическим антигеном, узнаваемым данным антителом.
Термины “рак”, “раковый”, “метастаз” и “злокачественный” служат для описания физиологического состояния у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примеры рака включают, не ограничиваясь ими, аденокарциному, лимфому, бластому, меланому, саркому и лейкоз. Более конкретные примеры таких раков включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, рак желудочно-кишечного тракта, ходжкинскую и неходжкинскую лимфому, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, такой как печеночная карцинома и гепатома, рак мочевого пузыря, рак молочной железы, рак ободочной кишки, рак прямой и ободочной кишки, эндометриальную карциному, миелому (такую как множественная миелома), карциному слюнных желез, рак почки, такой как почечно-клеточный рак и опухоль Вильмса, базально-клеточный рак, меланому, рак предстательной железы, рак женских наружных половых органов, рак щитовидной железы, рак яичка, рак пищевода и разные типы рака головы и шеи. Предпочтительные типы рака, подлежащие лечению по настоящему изобретению, включают рак молочной железы, рак желудка, рак легкого, рак ободочной кишки или рак прямой и ободочной кишки, глиому и глиобластому.
Термин “пролекарство” в использованном здесь значении означает предшественник или производную форму фармацевтически активного вещества, которая является менее цитотоксической для раковых клеток по сравнению с исходным лекарственным средством и может быть ферментативно активирована или превращена в более активную исходную форму. См., например, публикации Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery", Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). Пролекарства по настоящему изобретению включают, не ограничиваясь ими, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, пролекарства, модифицированные D-аминокислотой, гликозилированные пролекарства, бета-лактамсодержащие пролекарства, необязательно замещенные феноксиацетамидсодержащие пролекарства или необязательно замещенные фенилацетамидсодержащие пролекарства, 5-фторцитозин и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активное цитотоксическое свободное лекарственное средство. Примеры цитотоксических лекарственных средств, из которых могут быть получены пролекарства, пригодные для использования в настоящем изобретении, включают, не ограничиваясь ими, описанные ниже химиотерапевтические средства.
Термин “цитотоксическое средство” в использованном здесь значении означает вещество, которое ингибирует или предотвращает функцию клеток и/или вызывает разрушение клеток. В определение данного термина входят радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu), химиотерапевтические средства и токсины, такие как низкомолекулярные токсины или ферментативно активируемые токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или варианты.
“Химиотерапевтическое средство” является химическим соединением, пригодным для лечения таких заболеваний, как рак. Примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXAN™); алкилсульфонаты, такие как бисульфан, импросульфан и пиросульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включающие алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (в частности, буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; СС-1065 (включая синтетические аналоги адозелезина, карзелезина и бизелезина); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин (включая синтетические аналоги, KW-2189 и CBI-TMI); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембикин, фенестерин, преднимустин, трофосфамид, урацилиприт; нитрозмочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности, калихеамицин γ1I и калихеамицин θ1I, см., например, публикацию Agnew, Chem. Intl. Ed. Еngl. 33:183-186 (1994); динемицин, включая динемицин А; эсперамицин; а также неокарзиностатиновый хромофор и родственные хромофоры, являющиеся хромпротеинэнедииновыми антибиотиками), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (в том числе морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; средства для лечения надпочечников, такие как аминоглутетимид, митотан, трилостан; восполнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамидгликозид; аминолевулиновая кислота; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демекольцин; диазиквон; элфорнитин; ацетат эллиптиния; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; майтанзиноиды, такие как майтанзин и анзамитоцины; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофилловая кислота; 2-этил-гидразид; прокарбазин; PSK®; разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2''-трихлор-триэтиламин; трихотецены (в частности, токсин Т-2, верракурин А, роридин А и ангидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (“Ara-C”); циклофосфамид; тиотепа; таксоиды, например паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Princeton, NJ) и доксетаксел (TAXOTERE®, Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноевая кислота; капецитабин и фармацевтически приемлемые соли, кислоты и производные вышеуказанных веществ. В определение данного термина входят также антигормональные средства, регулирующие или ингибирующие воздействие гормонов на опухоли, такие как антиэстрогены, включающие, например, тамоксифен, ралоксифен, 4(5)-имидазолы, ингибирующие ароматазу, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (Fareston); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; фармацевтически приемлемые соли, кислоты и производные вышеуказанных веществ.
Термин “ингибитор роста” в используемом здесь значении означает соединение или композицию, ингибирующую рост клетки in vitro или in vivo. Таким образом, ингибитор роста является веществом, которое существенно уменьшает процентное содержание клеток, сверхэкспрессирующих такие гены в S-фазе. Примеры ингибиторов роста включают средства, блокирующие продолжение клеточного цикла (на стадии, отличной от S-фазы), в частности средства, индуцирующие задержку G1 и М-фазы. Классические блокаторы М-фазы включают препараты на основе барвинка (винкристин и винболастин), таксол и ингибиторы топо II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средства, вызывающие задержку G1, распространяют свое действие также на S-фазу, например ДНК-алкилирующие средства, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ара-С. С дополнительной информацией можно ознакомиться в публикации The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, entitled “Cell cycle regulation, oncogens, and antineoplastic drugs” by Murakami et al. (WB Saunders: Philadelphia, 1995), особенно стр.13.
Термин “цитокин” является общим термином для обозначения белков, высвобождаемых одной популяцией клеток, которые воздействуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. К цитокинам относятся гормоны роста, такие как гормон роста человека, N-метионильный гормон роста человека и гормон роста крупного рогатого скота; паращитовидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреостимулирующий гормон (TSH) и лютеинизирующий гормон (LH); фактор роста печени; фактор роста фибробластов; пролактин; плацентарный лактоген; α- и β-фактор некроза опухолей; лиганд апо-2 (определяемый также как TRAIL); ингибитор муллериана; гонадотропинассоциированный пептид мыши; ингибин; активин; эндотелиальный фактор роста сосудов; интегрин; тромбопоэтин (ТРО); факторы роста нервов; тромбоцитарный фактор роста; трансформирующие факторы роста (TGF), такие как TGF-α и TGD-β; инсулиноподобный фактор роста I и II; эритропоэтин (ЕРО); остеоиндуктивный фактор; интерфероны, такие как α-, β- и γ-инртерферон; колониестимулирующие факторы (CSF), такие как CSF макрофагов (М-CSF); CSF гранулоцитов и макрофагов (GM-CSF) и CSF гранулоцитов (G-CSF); интерлейкины (IL), такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12; и другие полипептидные факторы, включающие LIF и кит-лиганд (KL). В используемом здесь значении термин “цитокин” означает белки, полученные из природных источников или из культуры рекомбинантных клеток, и биологически активные эквиваленты цитокинов с нативной последовательностью.
“Лечение” означает вмешательство с целью предотвращения развития или изменения патологии заболевания. Таким образом, термин “лечение” означает как терапевтическое лечение, так и профилактические или превентивные меры, которые позволяют предотвратить возникновение или замедлить (ослабить) развитие патологического состояния или заболевания у субъекта. Субъектами, нуждающимися в лечении, являются субъекты, уже страдающие заболеванием, а также субъекты, у которых необходимо предотвратить возникновение заболевания. В процессе лечения заболевания терапевтическое средство может непосредственно уменьшать или увеличивать степень реакции патологического компонента заболевания или делать заболевание более восприимчивым к лечению другими терапевтическими средствами, например антибиотиками, противогрибковыми средствами, противовоспалительными средствами, химиотерапевтическими средствами и т.д.
Термин “эффективное количество” означает минимальную концентрацию антагониста WISP-1, которая вызывает, индуцирует или приводит к детектируемому улучшению или ослаблению патологического состояния. При лечении рака эффективное количество является таким количеством, которое вызывает, индуцирует или приводит к уменьшению числа раковых клеток или объема опухоли. Кроме того, “терапевтически эффективное количество” представляет собой минимальную концентрацию (количество) антагониста WISP-1, вводимого млекопитающему, которая должна эффективно ослаблять, по крайней мере, один патологический симптом.
“Хроническое” введение означает введение одного или нескольких факторов в непрерывном режиме, в отличие от кратковременного режима, для сохранения первоначального терапевтического действия (активности) в течение продолжительного периода времени. “Периодическое введение” предполагает циклическое введение в отличие от последовательного введения, выполняемого без перерыва.
“Млекопитающее”, соответствующее целям лечения, является любым животным, классифицируемым как млекопитающее, включая человека, домашних и сельскохозяйственных животных, животных в зоопарке, спортивных или комнатных животных, таких как собаки, лошади, кошки, крупный рогатый скот, свиньи, хомячки и т.д. Млекопитающим предпочтительно является человек.
Введение “в комбинации с” одним или несколькими другими терапевтическими средствами означает одновременное и последовательное введение, выполняемое в любом порядке.
“Носители” в используемом здесь значении включают фармацевтически приемлемые носители, наполнители или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего, подвергаемого лечению, в используемых дозах и концентрациях. Физиологически приемлемым носителем часто является водный буферный раствор. Примеры физиологически приемлемых носителей включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включающие аскорбиновую кислоту; низкомолекулярный (менее примерно 10 остатков) полипептид; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как ТWEEN®, полиэтиленгликоль (PEG), PLURONICS® и гиалуроновая кислота (НА).
II. Композиции по настоящему изобретению и способы их применения
Как описано в приведенных ниже примерах, автор настоящего изобретения к собственному удивлению обнаружил, что эктопическая экспрессия WISP-1 в фибробластах запускает продуцирование гиалуроновой кислоты, в частности повышенное продуцирование гиалуроновой кислоты вызывало ее накопление на поверхности клетки и в культуральной среде. Считается, что гиалуроновая кислота на поверхности клетки может усиливать свободный рост и онкогенность клеток (Kosaki et al., Cancer Res., 59:1141-1145 (1999)) и может уменьшать контактное ингибирование пролиферации клеток, стимулируя таким образом миграцию клеток (Ichikawa et al., J. Invest. Dermatol., 113:935-939 (1999); Itano et al., Proc. Natl. Acad. Sci., 99:3609-3614 (2002)). Образование пленки гиалуронана также определяет способность клеток к метастазированию (Zhang et al., Cancer Res., 55:428-433 (1995); Toole et al., J. Biol. Chem., 277:4593-4596 (2002)). В результате выполнения анализа экспрессии синтаз гиалуроновой кислоты (HAS1, HAS2 и HAS3) было установлено, что WISP-1 стимулирует индукцию HAS2 при неизменных уровнях мРНК HAS1 и HAS3. HAS2 является основной мишенью, вызывающей повышенный синтез НА факторами роста и цитокинами (Pienimaki et al., J. Biol. Chem., 276:20428-20435 (2001)). Эктопическая экспрессия HAS2 увеличивает секрецию НА и вызывает образование пленки гиалуронана (Kosaki et al., см. выше). Кроме того, считается, что HAS2 имеет важное значение для опосредуемой гиалуронаном трансформации эпителия в мезенхиму в процессе морфогенеза сердца (Camenisch et al., J. Clin. Invest., 106:349-360 (2000)). Так как превращение эпителия в мезенхиму также имеет важное значение для инвазии и метастазирования опухоли, считается, что HAS2 играет важную роль в развитии эпителиальной опухоли (Boyer et al., Biochem. Pharmacol., 60:1091-1099 (2000); Hay, Acta Anat., 154:8-20 (1995); Arias, Cell, 105:425-431 (2001)). Полученные результаты показывают, что секреция НФ, индуцируемая WISP-1, может иметь важное значение для инвазии и метастазирования опухоли.
WISP-1 также индуцирует экспрессию двух рецепторов НА, CD44 и RHAMM. Индуцируя экспрессию рецептора НА и увеличивая продуцирование НА, WISP-1 может активировать аутокринную и/или паракринную петлю. Взаимодействия гиалуронана с CD44 и RHAMM стимулирует движение и пролиферацию клеток in vitro, рост и метастазирование опухоли in vivo (Turley et al., J. Biol. Chem., 277:4589-4592 (2002); Sy et al., Curr. Тop. Microbiol. Immunol., 213:129-153 (1996); Hall et al., J. Neurooncol., 26:221-229 (1995)).
Воздействие WISP-1 на миграцию клеток исследовали при выполнении клеточного анализа заживления ран и при помощи микроскопии с замедленной съемкой при увеличенных интервалах времени между кадрами, при этом полученные данные показали, что экспрессия WISP-1 стимулирует подвижность клеток. Кроме того, выделенные клетки характеризовались повышенной миграцией, из чего следует, что WISP-1 может воздействовать через аутокринный механизм. Очищенный рекомбинантный WISP-1 стимулировал экспрессию HAS2 и CD44 при нанесении на поверхность. Подобная индукция еще больше возрастала, когда WISP-1 связывали, осуществляя его взаимодействие с декорином. Аналогичным образом WISP-1 стимулировал подвижность клеток при связывании с поверхностью, из чего следует, что WISP-1 может также действовать через паракринный механизм при связывании с субстратом. В приведенных ниже примерах показано, что подвижность клеток, индуцированная WISP-1, была опосредована CD44, так как указанная миграция прекращалась под воздействием антитела против CD44. Подвижность клеток, индуцированная WISP-1, была также ингибирована антителами против WISP-1. Кроме того, гаптотаксическая активность WISP-1 не была ограничена одним типом клеток, так как данный полипептид индуцировал миграцию, как нормальных фибробластов, так и клеток аденокарциномы ободочной кишки.
Поскольку считается, что WISP-1 является расположенным в нижней области эффектором Wnt-1, линию клеток С57MG/Wnt-1 анализировали в отношении фенотипов, обнаруженных в клетках NRK/WISP-1. В соответствии с ролью WISP-1 внизу от Wnt-1 клетки С57MG/Wnt-1 сверхэкспрессировали HAS2 и CD44 и характеризовали более высоким содержанием белка CD44 по сравнению с линией материнских клеток. Кроме того, клетки C57/Wnt-1 спонтанно рассеивались в культуре и демонстрировали дедифференцированную веретенообразную морфологию подобно клеткам NRK/WISP-1H.
Кроме того, был выполнен анализ экспрессии в группе опухолей молочной железы MMTV-Wnt-1, при этом была обнаружена повышенная экспрессия CD44 и HAS2 во всех опухолях молочной железы у трансгенных мышей MMTV-Wnt-1. В указанных опухолях экспрессия WISP-1 была локализована в стромальных фибробластах, в то время как CD44 и HAS2 были экспрессированы эпителиальными опухолевыми клетками. Несмотря на отсутствие экспрессии HAS2, околоопухолевая строма содержала высокие уровни НА, в то время как паренхима опухоли была лишь слабо окрашена в отношении НА. Хотя общепризнанным фактом является то, что фибробласты участвуют в продуцировании НА, происхождение стромальной НА определенно не известно. Так как экспрессия HAS2 была обнаружена только в паренхиме, экспериментальные результаты, приведенные в настоящем описании изобретения, позволяют предположить, что опухолевые клетки имеют непосредственное отношение к синтезу и отложению НА в строме. Накопление гиалуронана в околоопухолевой строме часто встречается в некольких типах опухолей и ранее отмечалось в научной литературе для аденокарцином яичника, молочной железы, предстательной железы и ободочной кишки (Ropponen et al., Cancer Res., 58:342-347 (1998); Lipponen et al., Eur. J. Cancer. 37:849-856 (2001); Auvinen et al., Am. J. Pathol., 156:529-536 (2000); Anttila et al., Cancer Res., 60:150-155 (2000)). Кроме того, высокий уровень НА в строме был ассоциирован с плохой дифференцировкой, метастатическим поведением и неблагоприятным прогнозом.
Так как НА и CD44 ассоциированы с инвазией опухоли, способность к метастазированию клеток, экспрессирующих WISP-1, оценивали in vivo. После инокуляции животных в хвост клетки NRK/WISP-1 быстро создавали колонии в легких инъецированных мышей и образовывали инвазивные опухоли. Клетки NRK/WISP-1 характеризовались значительной способностью к метастазированию в отличие от клеток NRK. Гистологическое исследование показало, что клетки NRK/WISP-1 заполняли сосудистую сеть и проникали в дыхательные пути. Число колоний в легких было пропорционально числу инъецированных клеток, времени, прошедшему после инъекции, и экспрессии WISP-1. Кроме того, было установлено, что способность к метастазированию пропорциональна уровням экспрессии CD44 и HAS2, и введение мышам, инокулированным клетками NRK/WISP-1H, антитела против CD44 или антитела против WISP-1 значительно уменьшало число и размер опухолей в легких. Таким образом, вполне вероятно, что уровни WISP-1 стимулировали образование колоний в легких через механизм гиалуронана-CD44. Данный вывод соответствует ранее приведенным данным, указывающим на значение CD44 и его взаимодействия с гиалуроновой кислотой для роста и метастазирования опухоли и сохранения метастатических клеток в сосудистой сети легких (Sy et al., см. выше; Kogerman et al., Proc. Natl. Acad. Sci., 94:13233-13238 (1997)).
Несмотря на то что активация пути передачи сигналов Wnt антигенпредставляющими клетками (АРС) или мутации β-катенина обычно могут быть ассоциированы с раком прямой и ободочной кишки, некоторые данные позволяют предположить, что данный механизм действует также в других типах рака, включая аденокарциному молочной железы (Polakis, Genes Dev., 14:1837-1851 (2000); Brown, Breast Cancer Res., 3:351-355 (2001)). Сокращение АРС и повышенные уровни β-катенина были обнаружены в линиях клеток рака молочной железы человека (Schlosshauer et al., Carcinogenesis, 21:1453-1456 (2000)). Соматические мутации гена АРС были обнаружены в первичном раке молочной железы (Furuuchi et al., Am. J. Pathol., 156:1997-2005 (2000)). Кроме того, мутации, активирующие β-катенин, стимулируют аденокарциномы молочной железы у мышей (Michaelson et al., Oncogene, 20:5525-5532 (2001)). Повышенные уровни Wnt-1 и β-катенина были обнаружены в инвазивных карциномах протоков молочной железы и легли в основу плохого прогноза болезни (Lin et al., Proc. Natl. Acad. Sci., 97:4262-4266 (2000)). Поэтому вполне возможно, что экспрессия WISP-1, обнаруженная в некоторых аденокарциномах молочной железы, была вызвана активацией пути передачи сигналов Wnt. При выполнении анализа Taqman была также обнаружена сверхэкспрессия WISP-1 в таких видах рака, как опухоль молочной железы и нейроглия.
На основании полученных данных считается, что антагонисты WISP-1 должны быть особенно пригодны для лечения и диагностики разных патологических нарушений, таких как рак. Таким образом, настоящее изобретение относится к способам модуляции, блокировки или нейтрализации активности WISP-1 в клетках млекопитающих, которые включают воздействие на клетки требуемого количества антагониста WISP-1. Количество используемого антагониста WISP-1 должно эффективно уменьшать или ингибировать рост, метастазирование или подвижность раковых клеток. Подобный результат может быть достигнут in vivo или ex vivo в соответствии, например, со способами, описанными ниже и рассмотренными в примерах. Типичные состояния или нарушения, подлежащие лечению такими антагонистами WISP-1, включают заболевания у млекопитающих, клинически определяемые как рак.
Настоящее изобретение относится также к диагностическим методам. Например, антагонисты могут быть использованы для обнаружения инвазивных или метастатических раков. Молекула антагониста может быть использована, например, при выполнении анализов по обнаружению или количественному определению метастатических раковых клеток в образце. Образец, такой как клетки, полученные у млекопитающего, можно инкубировать в присутствии меченого антагониста и детектировать меченый антагонист, связанный в образце.
Антагонисты, которые могут быть использованы в способах по настоящему изобретению, включают, не ограничиваясь ими, иммуноадгезины WISP-1, слитые белки, содержащие WISP-1, ковалентно модифицированные формы WISP-1, варианты WISP-1, их слитые белки и антитела против WISP-1. В настоящем описании изобретения рассмотрены разные методы, которые могут быть использованы для получения антагонистов. Например, описаны методы получения полипептидов WISP-1. Кроме того, описаны другие модификации полипептидов и антител к WISP-1.
Помимо непроцессированного полипептида WISP-1 с нативной последовательностью могут быть получены варианты полипептидов WISP-1. Варианты WISP-1 могут быть получены путем замены соответствующих нуклеотидов в кодирующей ДНК и/или синтеза требуемого полипептида. Специалистам в данной области должно быть понятно, что замены аминокислот могут изменить посттрансляционные процессы полипептида WISP-1, например изменить число или положение сайтов гликозилирования или характеристики связывания с мембраной.
Изменения в полипептиды WISP-1, рассмотренные в настоящем описании изобретения, могут быть внесены любыми методами выполнения консервативных и неконсервативных мутаций, описанных, например, в патенте США № 5364934. Изменения могут включать замену, делецию или инсерцию одного или нескольких кодонов, кодирующих данный полипептид, что вызывает изменение аминокислотной последовательности по сравнению с полипептидом с нативной последовательностью. Изменение необязательно включает замену, по крайней мере, одной аминокислоты любой другой аминокислотой в одном или нескольких доменах полипептида WISP-1. Аминокислотные остатки, которые можно вставить, заменить или удалить без вреда для требуемой активности, можно определить, сравнивая последовательность полипептида WISP-1 с последовательностью известных гомологичных белковых молекул и сводя к минимуму число замен в аминокислотной последовательности, производимых в областях высокой гомологии. Замены аминокислот могут представлять собой замену одной аминокислоты другой аминокислотой, обладающей аналогичными структурными и/или химическими свойствами, например замену лейцина серином, то есть консервативные замены аминокислот. Инсерции или делеции могут необязательно включать примерно 1-5 аминокислот. Допустимое изменение можно определить путем систематического выполнения инсерций, делеций или замен аминокислот в последовательности и испытания полученных вариантов в отношении активности, характерной для непроцессированной или зрелой нативной последовательности.
Настоящее изобретение относится к фрагментам полипептида WISP-1. Такие фрагменты могут быть процессированы у N-конца или С-конца, либо в них могут отсутствовать внутренние остатки, например, по сравнению с непроцессированным нативным белком. В некоторых фрагментах отсутствуют аминокислотные остатки, которые не имеют важного значения для требуемой биологической активности полипептида WISP-1.
Фрагменты полипептида WISP-1 могут быть получены любыми известными методами. Требуемые пептидные фрагменты могут быть синтезированы химическим путем. Альтернативный метод включает создание фрагментов полипептида путем ферментативного расщепления, например в результате обработки белка ферментом, который, как известно, расщепляет белки на сайтах, определяемых определенными аминокислотными остатками, или расщепления ДНК приемлемыми рестрикционными ферментами и выделение требуемого фрагмента. Другим приемлемым методом является выделение и амплификация фрагмента ДНК, кодирующего требуемый фрагмент полипептида, при помощи полимеразной реакции синтеза цепи (PCR). Олигонуклеотиды, которые определяют требуемые концы фрагмента ДНК, служат в качестве 5'- и 3'-концевых затравок при выполнении PCR.
Определенные варианты осуществления изобретения относятся к представляющим интерес консервативным заменам, показанным в приведенной ниже таблице под заголовком “Предпочтительные замены”. Если такие замены вызывают изменение биологической активности, выполняют более значимые замены, указанные в приведенной ниже таблице под заголовком “Иллюстративные замены” или описанные ниже со ссылкой на классы аминокислот, после чего продукты исследуют.
Значительные модификации функции или иммунологической идентичности полипептида WISP-1 осуществляют путем выбора замен, существенно отличающихся по своему действию в отношении сохранения (а) структуры полипептидного остова в месте замены, например, в виде складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы на сайте-мишени или (с) величины боковой цепи. Природные остатки подразделяются на группы на основании общих свойств боковой цепи:
(1) гидрофобные: норлейцин, met, ala, val, leu, ile;
(2) нейтральные гидрофильные: cys, ser, thr;
(3) кислотные: asp, glu;
(4) основные: asn, gln, his, lys, arg;
(5) остатки, влияющие на ориентацию цепи: gly, pro; и
(6) ароматические: trp, tyr, phe.
Неконсервативные замены предполагают замену остатка, относящегося к одному из указанных классов, остатком другого класса. Такие замененные остатки могут быть также введены в сайты консервативных замен или более предпочтительно в остальные (неконсервативные) сайты.
Изменения могут быть произведены методами, известными в данной области, такими как сайтнаправленный мутагенез с использованием олигонуклеотидов, сканирование аланином и мутагенез методом PCR. Сайтнаправленный мутагенез (Carter et al., Nucl. Acids Res., 13:4331 (1986); Zoller et al., Nucl. Acids Res., 10:6487 (1987)), кластерный мутагенез (Wells et al., Gene, 34:315 (1985)), мутагенез методом рестрикционного отбора (Wells et al., Philos. Trans. R. So. London SerA, 317:415 (1986)) или другие известные методы могут быть выполнены с использованием клонированной ДНК для получения ДНК варианта полипептида WISP-1.
Анализ методом сканирующих аминокислот также может быть использован для идентификации одной или нескольких аминокислот в смежной последовательности. Предпочтительными сканирующими аминокислотами являются относительно низкомолекулярные нейтральные аминокислоты. Такие аминокислоты включают аланин, глицин, серин и цистеин. Аланин обычно является предпочтительной сканирующей аминокислотой в данной группе, так как он удаляет боковую цепь в бета-положении углерода и в меньшей степени изменяет конформацию основной цепи варианта (Cunningham and Wells, Science, 244:1081-1085 (1989)). Предпочтение обычно отдается аланину также потому, что он является наиболее распространенной аминокислотой. Кроме того, аланин часто встречается как в скрытых, так и в открытых положениях (Creighton, The Proteins, (W.H. Freeman & Co., N.Y.); Chothia, J. Mol. Biol., 150:1 (1976)). Если замена аланина не позволяет получить соответствующий вариант, может быть использована изотерическая аминокислота.
Любой остаток цистеина, не участвующий в сохранении правильной конформации полипептида WISP-1, также может быть заменен, обычно серином, для улучшения устойчивости молекулы к окислению и предотвращения аберрантного перекрестного связывания. И наоборот, цистеиновые связи могут быть введены в полипептид WISP-1 для улучшения его устойчивости.
Приведенное ниже описание относится главным образом к получению полипептидов WISP-1 путем культивирования клеток, трансформированных или трансфицированных вектором, содержащим нуклеиновую кислоту, кодирующую полипептид WISP-1. Вполне понятно, что для получения полипептидов WISP-1 могут быть использованы альтернативные методы, хорошо известные в данной области. Например, соответствующую аминокислотную последовательность или ее части можно получить путем прямого пептидного синтеза с использованием твердофазных методов (см., например, публикации Stewart et al., Solid-Phase Peptide Synthesis, W.H. Freeman Co., San Francisco, CA (1969); Merrifield, J. Am. Chem. Soc., 85:2149-2154 (1963)). Белок может быть синтезирован in vitro ручными или автоматическими методами. Автоматический синтез может быть осуществлен, например, в синтезаторе пептидов компании Applied Biosystems (Foster City, CA) в соответствии с инструкциями изготовителя. Разные части полипептида WISP-1 могут быть химически синтезированы отдельно и объединены при помощи химических или ферментативных методов с образованием требуемого полипептида WISP-1. Описанные методы пригодны также для получения вариантов WISP-1, модифицированных форм WISP-1 и антител против WISP-1.
1. Выделение ДНК, кодирующей полипептид WISP-1
ДНК, кодирующую полипептид WISP-1, можно получить из библиотеки кДНК, созданной из ткани, которая, как считается, содержит мРНК полипептида WISP-1 и экспрессирует ее на детектируемом уровне. ДНК полипептида WISP-1 человека может быть получена из библиотеки кДНК, созданной из ткани человека. Ген, кодирующий полипептид WISP-1, может быть также получен из геномной библиотеки или известными методами синтеза (например, методом автоматического синтеза нуклеиновой кислоты).
Скрининг библиотек может быть выполнен с помощью зондов (таких как олигонуклеотиды, содержащие, по крайней мере, около 20-80 оснований), предназначенных для идентификации представляющего интерес гена или белка, кодированного данным геном. Скрининг библиотеки кДНК или геномной библиотеки можен быть выполнен стандартными методами, такими как описанные в публикации Sambrook et al., Molecular Cloning: A Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989). Альтернативным способом выделения гена, кодирующего полипептид WISP-1, является полимеразная реакция синтеза цепи (PCR) (Sambrook et al., см. выше; Dieffenbach et al., PCR Primer: A Laboratory Manual (Cold Spring Harbor Laboratory Press (1995)).
В данной области хорошо известны методы скрининга библиотеки кДНК. Олигонуклеотидные последовательности, выбранные в качестве зондов, должны иметь достаточную длину и четко выраженную конфигурацию, чтобы свести к минимуму ложные положительные результаты. Олигонуклеотид предпочтительно метят, чтобы его можно было обнаружить после гибридизации с ДНК в библиотеке, подвергаемой скринингу. Методы мечения хорошо известны в данной области и включают использование радиоактивных меток, таких как32Р-меченый ATP, биотинилирование или мечение ферментом. Условия гибридизации, в том числе условия средней и высокой строгости, описаны в публикации Sambrook et al., см. выше.
Последовательности, идентифицированные такими методами скрининга библиотек, можно сравнить и сопоставить с другими известными последовательностями, внесенными в общедоступные базы данных, такие как GenBank, или другие частные базы данных. Идентичность последовательностей (на аминокислотном или нуклеотидном уровне) в определенных областях молекулы или во всей непроцессированной последовательности можно определить методами, известными в данной области и рассмотренными в настоящем описании изобретения.
Нуклеиновую кислоту, содержащую кодирующую белок последовательность, можно получить путем скрининга выбранных библиотек кДНК или геномных библиотек с использованием выведенной аминокислотной последовательности, впервые рассмотренной в настоящем описании изобретения, и при необходимости с помощью известных методов удлинения затравок, описанных в публикации Sambrook et al., см. выше, для обнаружения предшественников и процессинга промежуточных соединений мРНК, которые не могут быть обратно транскрибированы в кДНК.
2. Отбор и трансформация клеток-хозяев
Клетки-хозяева трансфицируют или трансформируют экспрессирующими или клонирующими векторами, рассмотренными в настоящем описании изобретения и предназначенными для продуцирования полипептида WISP-1, и культивируют в стандартной питательной среде, модифицированной соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих требуемые последовательности. Условия культивирования, такие как среда, температура, рН и тому подобные, могут быть выбраны квалифицированным специалистом без излишнего экспериментирования. Основные принципы, методики и практические методы максимального увеличения продуктивности культур клеток описаны в публикациях Mammalian Cell Biotechnology: a Practical Approach, M. Butler, ed. (IRL Press, 1991) и Sambrook et al., см выше.
Специалистам в данной области известны методы трансфекции эукариотических клеток и трансформации прокариотических клеток, например методы с использованием CaCl2, CaPO4, липосом и электропорации. В зависимости от используемой клетки-хозяина трансформацию выполняют стандартными методами, пригодными для таких клеток. Прокариотические клетки обычно обрабатывают кальцием с использованием хлорида кальция методом, описанным в публикации Sambrook et al., см. выше. Некоторые растительные клетки трансформируют путем инфицирования Agrobacterium tumefaciens методом, описанным в публикации Shaw et al., Gene, 23:315 (1983) и заявке WO 89/05859, опубликованной 29 июня 1989 г. Для клеток млекопитающих без таких клеточных оболочек можно использовать метод осаждения фосфатом кальция, описанный в публикации Graham and van der Eb, Virology, 52:456-457 (1978). Основные принципы трансфекции системы клеток-хозяев млекопитающих описаны в патенте США № 4399216. Дрожжи обычно трансформируют методом, описанным в публикациях Van Solingen et al., J. Bact., 130:946 (1977) и Hsiao et al., Proc. Natl. Acad. Sci. (USA), 76:3829 (1979). Однако могут быть также использованы другие методы введения ДНК в клетки, такие как микроинъекция в ядро, электропорация, слияние бактериального протопласта с интактными клетками или поликатионами, такими как полибрен, полиорнитин. Для ознакомления с разными методами трансформации клеток млекопитающих см. публикации Keown et al., Methods in Enzymology, 185:527-537 (1990) и Mansour et al., Nature, 336:348-352 (1988).
Клетки-хозяева, пригодные для клонирования или экспрессии ДНК в векторах по настоящему изобретению, включают прокариотические, дрожжевые или высшие эукариотические клетки. Приемлемые прокариоты включают, не ограничиваясь ими, эубактерии, такие как грамотрицательные или грамположительные организмы, например Enterobacteriaceae, такие как Е. coli. Общедоступными являются разные штаммы E. coli, такие как штамм ММ294 E. coli K12 (АТСС 31446); E. сoli X1776 (АТСС 31537); штамм W3110 E. coli (АТСС 27325) и К5 772 (АТСС 53635). Другие приемлемые прокариотические клетки-хозяева включают Enterobacteriaceae, такие как Escherichia, например E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например Salmonella typhimurium, Serratia, например Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, В. licheniformis 41P, описанные в патенте DD 266710, опубликованном 12 апреля 1989 г.), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Приведенные примеры являются иллюстративными и не ограничивают объем изобретения. Штамм W3110 является особенно предпочтительным хозяином или первичным хозяином, так как он представляет собой обычно используемый штамм-хозяин для ферментации рекомбинантного продукта ДНК. Указанные клетки-хозяева предпочтительно секретируют минимальные количества протеолитических ферментов. Например, штамм W3110 может быть модифицирован для выполнения генетических мутаций в генах, кодирующих эндогенные белки хозяина, и примеры таких хозяев включают штамм 1А2 W3110 E. coli, который имеет полный генотип tonA; штамм 9Е4 W3110 E. coli, который имеет полный генотип tonA ptr3; штамм 27С7 W3110 E. coli (АТСС 55244), который имеет полный генотип tonA ptr3 phoA E15 (argF-lac)169 degP ompT kanr; штамм 37D6 W3110 E. coli, который имеет полный генотип tonA ptr3 phoA E15 (argF-lac)169 degP ompT rbs7 ilvG kanr; штамм 40В4 W3110 E. coli, который является штаммом 37D6 с мутацией в виде делеции degP, не сообщающей устойчивость к канамицину; и штамм E. coli, содержащий мутантную периплазматическую протеазу и описанный в патенте США № 4946783, выданном 7 августа 1990 г. Альтернативно, могут быть использованы методы клонирования in vitro, например PCR или другие полимеразные реакции синтеза нуклеиновой кислоты.
Помимо прокариотов приемлемыми хозяевами для клонирования или экспрессии векторов, кодирующих полипептид WISP-1, являются эукариотические микробы, такие как нитевидные грибы или дрожжи. Saccharomyces cerevisiae является обычно используемым низшим эукариотическим микроорганизмом-хозяином. Другие хозяева включают Schizosaccharomyces pombe (Beach and Nurse, Nature, 290:140 [1981]; европейский патент № 139383, опубликованный 2 мая 1985 г.); хозяева Kluyveromyces (патент США № 4943529; Fleer et al., Bio/Technology, 9:968-975 (1991)), такие как, например, K. lactis (MW98-8C, CBS683, CBS4574; Louvencourt et al., J. Bacteriol., 154(2):737-742 [1983]), K. fragilis (ATCC 12424), K. bulgaricus (AТCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906; Van den Berg et al., Bio/Technology, 8:135 (1990)), K. thermotolerans и K. marxianus; yarrowia (европейский патент № 402226); Pichia pastoris (европейский патент № 183070; Sreekrishna et al., J. Basic Mictobiol., 28:265-278 [1988]); Сandida; Trichoderma reesia (европейский патент № 244234); Neurospora crassa (Case et al., Proc. Natl. Acad. Sci. USA, 76: 5259-5263 [1979]); Schwanniomyces, такие как Schwanniomyces occidentalis (европейский патент № 394538, опубликованный 31 октября 1990 г.); и нитевидные грибы, такие как, например, Neurospora, Penicillium, Tolypocladium (заявка WO 91/00357, опубликованная 10 января 1991 г.), и хозяева Aspergillus, такие как A. nidulans (Ballance et al., Biochem. Biophys. Res. Commun., 112: 284-289 [1983]; Tilburn et al., Gene, 26:205-221 [1983]; Yelton et al., Proc. Natl. Acad. Sci. USA, 81:1470-1474 [1984]) и A. niger (Kelly and Hynes, EMBO J., 4:475-479 [1985]). В настоящем изобретении могут быть использованы метилотрофные дрожжи, которые включают, не ограничиваясь ими, дрожжи, способные расти на метаноле, выбираемые из родов, включающих Hansenula, Candida, Kloeckera, Pichia, Saccharomyces, Torulopsis и Rhodotorula. Перечень специфических видов, являющихся типичными для данного класса дрожжей, представлен в публикации C. Anthony, The Biochemistry of Methylotrophs, 269 (1982).
Клетки-хозяева, пригодные для экспрессии гликозилированного полипептида WISP-1, выделяют из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки насекомых, таких как Drosophila S2 и Spodoptera Sf9, а также растительные клетки, такие как культуры клеток хлопка, кукурузы, картофеля, сои, петунии, томатов и табака. Были идентифицированы многочисленные бакуловирусные штаммы, варианты и соответствующие приемлемые клетки-хозяева насекомых, полученные из таких хозяев как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Общедоступны для трансфекции разные вирусные штаммы, например вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, которые могут быть использованы в качестве вирусов по настоящему изобретению, в частности для трансфекции клеток Spodoptera frugiperda.
Однако наибольший интерес представляют клетки позвоночных, и размножение клеток позвоночных в культуре (культуре ткани) стало обычной процедурой. Примерами приемлемых линий клеток-хозяев млекопитающих являются линия клеток почки CV1 обезьяны, трансформированная SV40 (COS-7, ATCC CRL 1651); линия клеток почки эмбриона человека (клетки 293 или клетки 293, субклонированные для выращивания в суспензионной культуре, Graham et al., J. Gen. Virol., 36:59 (1977)); клетки почки детеныша хомячка (ВНК, АТСС CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мыши (ТМ4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1, ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени буйволовой крысы (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (ММТ 060562, АТСС CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci., 383: 44-68 (1982)); клетки MRC 5; клетки FS4 и линия клеток гепатомы человека (Hep G2).
Клетки-хозяева трансформируют вышеуказанными экспрессирующими или клонирующими векторами для продуцирования полипептида WISP-1 и культивируют в стандартной питательной среде, модифицированной соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих требуемые последовательности.
3. Выбор и использование реплицируемого вектора
Нуклеиновая кислота (например, кДНК или геномная ДНК), кодирующая полипептид WISP-1, может быть введена в реплицируемый вектор для клонирования (амплификации дНК) или экспрессии. Общедоступными являются разные векторы. Вектор может быть, например, в форме плазмиды, космиды, вирусной частицы или фага. Соответствующая последовательность нуклеиновой кислоты может быть введена в вектор разными способами. ДНК обычно вводят в соответствующий сайт рестрикционной эндонуклеазы методами, известными в данной области. Компоненты вектора обычно включают, не ограничиваясь ими, одну или несколько сигнальных последовательностей, ориджин репликации, один или несколько генов-маркеров, энхансер, промотор и терминирующую транскрипцию последовательность. Приемлемые векторы, содержащие один или несколько указанных компонентов, создают стандартными методами лигирования, известными квалифицированным специалистам в данной области.
WISP-1 может быть продуцирован рекомбинантными методами не только в том виде, как есть, но и в виде полипептида, слитого с гетерологичным полипептидом, который может быть сигнальной последовательностью, или другим полипептидом, имеющим специфический сайт расщепления у N-конца зрелого белка или полипептида. Сигнальная последовательность может быть компонентом вектора или частью ДНК, кодирующей полипептид WISP-1, введенной в вектор. Сигнальная последовательность может быть прокариотической сигнальной последовательностью, выбираемой, например, из группы, включающей щелочную фосфатазу, пенициллиназу, lpp или лидерные последовательности теплостойкого энтеротоксина II. Для секреции в дрожжах сигнальная последовательность может быть, например, лидерной последовательностью дрожжевой инвертазы, лидерной последовательностью альфа-фактора (включая лидерные последовательности α-фактора Saccharomyces и Kluyveromуces, последняя из которых описана в патенте США № 5010182), лидерной последовательностью кислотной фосфатазы, лидерной последовательностью глюкоамилазы C. albicans (европейский патент № 362179, опубликованный 4 апреля 1990 г.) или сигнальной последовательностью, описанной в заявке WO 90/13646, опубликованной 15 ноября 1990 г. Для экспрессии в клетках млекопитающих сигнальные последовательности млекопитающих могут быть использованы для прямой секреции белка, в частности сигнальные последовательности из секретированных полипептидов того же или родственного вида, а также секреторные лидерные последовательности вируса.
Экспрессирующие и клонирующие векторы содержат последовательность нуклеиновой кислоты, которая позволяет вектору реаплицировать в одной или нескольких выбранных клетках-хозяевах. Такие последовательности хорошо известны для разных бактерий, дрожжей и вирусов. Ориджин репликации плазмиды pBR322 пригоден для большинства грамотрицательных бактерий, 2µ ориджин репликации плазмиды пригоден для дрожжей, и разные ориджины репликации вирусов (SV40, полиома, аденовирус, VSV или BPV) пригодны для клонирующих векторов в клетках млекопитающих.
Экспрессирующие и клонирующие векторы обычно содержат селектирующий ген, именуемый также селектируемым маркером. Типичные селектирующие гены кодируют белки, которые (а) сообщают устойчивость к антибиотикам или другим токсинам, таким как ампициллин, неомицин, метотрексат или тетрациклин, (b) восполняют недостаток ауксотрофа, или (с) вводят необходимые питательные вещества, отсутствующие в комплексной среде, например, ген, кодирующий D-аланинрацемазу для Bacilli.
Примером приемлемых селектируемых маркеров для клеток млекопитающих являются маркеры, позволяющие идентифицировать клетки, способные поглощать нуклеиновую кислоту, кодирующую полипептид WISP-1, такие как DHFR или тимидинкиназа. Приемлемой клеткой-хозяином при использовании DHFR дикого типа является линия клеток СНО с отсутствием активности DHFR, полученная и размноженная способом, описанным в публикации Urlaub et al., Proc. Natl. Acad. Sci. USA, 77:4216 (1980). Селектирующим геном, пригодным для использования в дрожжах, является ген trp1, присутствующий в дрожжевой плазмиде YRp7 (Stinchcomb et al., Nature, 282:39 (1979); Kingsman et al., Gene, 7:141 (1979); Tschemper et al., Gene, 10: 157 (1980)). Ген trp1 является селектирующим маркером для мутантного штамма дрожжей, неспособного расти на триптофане, например АТСС № 44076 или РЕР4-1 (Jones, Genetics, 85:12 (1977)).
Экспрессирующие и клонирующие векторы обычно содержат промотор, функционально связанный с последовательностью нуклеиновой кислоты, кодирующей полипептид WISP-1, который направляет синтез мРНК. В данной области хорошо известны промоторы, узнаваемые разными потенциальными клетками-хозяевами. Промоторы, пригодные для использования в прокариотических хозяевах, включают системы β-лактамазных и лактозных промоторов (Chang et al., Nature, 275: 615 (1978); Goeddel et al., Nature, 281:544 (1979)), щелочную фосфатазу, систему триптофановых промоторов (trp) (Goeddel, Nucleic Acids Res., 8:4057 (1980); европейский патент № 36776) и гибридные промоторы, такие как промотор tac (deBoer et al., Proc. Natl. Acad. Sci. USA, 80:21-25 (1983)). Промоторы, пригодные для использования в бактериальных системах, содержат также последовательность Шайна-Дальгарно (S.D.), функционально связанную с ДНК, кодирующей полипептид WISP.
Примеры промоторных последовательностей, пригодных для использования в дрожжевых хозяевах, включают промоторы для 3-фосфоглицераткиназы (Hitzeman et al., J. Biol. Chem., 255:2073 (1980)) или других гликолитических ферментов (Hess et al., J. Adv. Enzyme Reg., 7:149 (1968); Holland, Biochemistry, 17:4900 (1978)), таких как энолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа.
Другие промоторы для дрожжей, которые являются индуцибельными промоторами и обладают дополнительным преимуществом регулирования транскрипции в условиях выращивания, представляют собой промоторные области для алкогольдегидрогеназы 2, изоцитохрома С, кислой фосфатазы, расщепляющих ферментов, ассоциированных с азотистым обменом, металлотионеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, определяющих утилизацию мальтозы и галактозы. Векторы и промоторы, пригодные для экспрессии в дрожжах, описаны в европейском патенте № 73657.
Транскрипция полипептида WISP из векторов в клетках-хозяевах млекопитающих регулируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус птичьей оспы (патент Великобритании № 2211504, опубликованный 5 июля 1989 г.), аденовирус (такой как аденовирус 2), бычий вирус папилломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита В и вакуолизирующий обезьяний вирус (SV40), из гетерологичных промоторов млекопитающих, таких как актиновый промотор или иммуноглобулиновый промотор, и из хитшоковых промоторов, при условии, что такие промоторы совместимы с системами клеток-хозяев.
Транскрипция ДНК, кодирующей полипептид WISP-1, высшими эукариотами может быть увеличена путем введения в вектор энхансерной последовательности. Энхансеры являются цис-действующими элементами ДНК обычно длиной около 10-300 п.о., которые воздействуют на промотор с целью увеличения его транскрипции. В настоящее время известны многие энхансерные последовательности, выделяемые из генов млекопитающих (глобин, эластаза, альбумин, фетопротеин и инсулин). Однако обычно используют энхансер из вируса эукариотической клетки. Примеры таких энхансеров включают энхансер SV40 в поздней области ориджина репликации (100-270 п.о.), энхансер раннего промотора цитомегаловируса, энхансер полиомы в поздней области ориджина репликации и энхансеры аденовируса. Энхансер может быть сплайсирован в вектор в положении 5'- или 3'-конца относительно кодирующей последовательности полипептида WISP-1, но предпочтительно его располагают на сайте 5'-конца от промотора.
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (дрожжевые, грибные, растительные, животные клетки, клетки насекомых и человека или ядросодержащие клетки из других многоклеточных организмов), содержат также последовательности, необходимые для терминации транскрипции и стабилизации мРНК. Такие последовательности обычно получают из 5'-конца и иногда из 3'-конца нетранслированных областей эукариотических или вирусных ДНК или кДНК. Указанные области содержат нуклеотидные сегменты, транскрибированные в виде полиаденилированных фрагментов в нетранслированной части мРНК, кодирующей полипептид WISP-1.
Другие методы, векторы и клетки-хозяева, пригодные для синтеза полипептида WISP в культуре рекомбинантных клеток позвоночных, описаны в публикациях Gething et al., Nature, 293:620-625 (1981); Mantei et al., Nature, 281:40-46 (1979); и европейских патентах №№ 117060 и 117058.
4. Культивирование клеток-хозяев
Клетки-хозяева, используемые для продуцирования полипептида WISP по настоящему изобретению, можно культивировать в разных средах. Для культивирования клеток-хозяев пригодны коммерчески доступные среды, такие как среда F10 Хэма (Sigma), минимальная поддерживающая среда ((МЕМ), (Sigma)), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла ((DMEM), Sigma). Кроме того, в качестве культуральной среды для клеток-хозяев могут быть использованы любые среды, описанные в публикациях Ham et al., Mеth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США №№ 4767704, 4657866, 4927762, 4560655 или 5122469; WO 90/03430; WO 87/00195 или заменяющем патенте США № 30985. Любые из указанных сред при необходимости могут быть дополнены гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид и фосфат натрия, кальция, магния), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCIN™), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне), глюкозой или эквивалентными источниками энергии. В указанные среды могут быть также введены в соответствующих концентрациях любые другие необходимые добавки, известные специалистам в данной области. Условия культивирования, такие как температура, рН и тому подобные, соответствуют ранее используемым для экспрессии отобранных клеток-хозяев и должны быть очевидны специалистам в данной области.
5. Обнаружение амплификации/экспрессии гена
Амплификацию и/или экспрессию гена можно измерить в образце стандартными методами, такими как саузерн-блоттинг, нозерн-блоттинг, предназначенными для количественного определения транскрипции мРНК (Thomas, Proc. Natl. Acad. Sci. USA, 77:5201-5205 (1980)), дот-блоттинг (анализ ДНК) или гибридизация in situ, с использованием соответствующим образом меченого зонда на основе последовательностей, рассмотренных в настоящем описании изобретения. Альтернативно, можно использовать антитела, которые могут узнавать специфические дуплексы, включая дуплексы ДНК, дуплексы РНК и гибридные дуплексы ДНК-РНК или дуплексы ДНК-белок. Антитела в свою очередь могут быть помечены, и анализ может быть выполнен в условиях связывания дуплекса с поверхностью, поэтому при образовании дуплекса на поверхности можно обнаружить присутствие антитела, связанного с данным дуплексом.
Экспрессию гена можно альтернативно измерить иммунологическими методами, такими как иммуногистохимическое окрашивание клеток или срезов ткани и анализ культуры клеток или жидкостей организма, с целью количественного определения экспрессии генного продукта. Антитела, пригодные для иммуногистохимического окрашивания и/или анализа образцов жидкостей организма, могут быть моноклональными или поликлональными и могут быть получены в организме любого млекопитающего. Можно получить антитела против полипептида WISP с нативной последовательностью, против синтетического пептида на основе последовательностей ДНК по настоящему изобретению или против экзогенной последовательности, слитой с ДНК полипептида WISP и кодирующей специфический эпитоп антитела.
6. Очистка полипептида WISP
Полипептид WISP может быть выделен в разных формах из культуральной среды или лизатов клеток-хозяев. Мембраносвязанный полипептид WISP может быть выделен из мембраны с использованием приемлемого раствора детергента (например, тритон-Х 100) или путем ферментативного расщепления. Клетки, используемые для экспрессии полипептида WISP-1, могут быть разрушены разными физическими или химическими методами, такими как циклическое замораживание-оттаивание, обработка ультразвуком, механическое разрушение или использование агентов для лизиса клеток.
Может быть желательно очистить полипептид WISP-1 от белков или полипептидов рекомбинантных клеток. Следующие методы являются примерами приемлемых методов очистки: фракционирование на ионообменной колонке; осаждение этанолом; ВЭЖХ с обращенной фазой; хроматография на силикагеле или катионообменной смоле, такой как DEAE; хроматофокусирование; SDS-PAGE; осаждение сульфатом аммония; гель-фильтрация с использованием, например, сефадекса G-75; очистка на колонках с белком А-сефарозой для удаления загрязняющих примесей, таких как IgG; и очистка на колонках с образованием хелатов с металлами для связывания форм полипептида WISP-1 с меченым эпитопом. Могут быть использованы разные методы очистки белка, которые известны в данной области и описаны, например, в публикациях Deutscher, Methods in Enzymology, 182 (1990); Scopes, Protein Purification: Principles and Practice, Sрringer-Verlag, New York (1982). Выбираемые стадии очистки зависят, например, от характера процесса продуцирования и продуцируемого полипептида WISP-1.
В качестве антагонистов при осуществлении способов по настоящему изобретению могут быть использованы растворимые формы WISP-1. Такие растворимые формы WISP-1 могут включать описанные ниже модификации (такие как слияние с иммуноглобулином, мечение эпитопа или лейциновый зиппер). В способах по настоящему изобретению могут быть также использованы молекулы иммуноадгезинов. Иммуноадгезины WISP-1 могут включать разные формы WISP-1, такие как непроцессированный полипептид, а также растворимые формы WISP-1 или его фрагмента. В определенных вариантах осуществления изобретения молекула может представлять собой слияние полипептида WISP-1 с иммуноглобулином или конкретной областью иммуноглобулина. В двухвалентной форме иммуноадгезина такое слияние может быть произведено с Fc-областью молекулы IgG. Слияния с Ig предпочтительно включают введение растворимой формы полипептида (удаление или инактивация трансмембранного домена) вместо, по крайней мере, одной вариабельной области в молекуле Ig. В особенно предпочтительном варианте осуществления изобретения слияние с иммуноглобулином включает шарнирную, СН2- и СН3-области или шарнирную, СН1-, СН2- и СН3-области молекулы IgG1. Для ознакомления со способами слияния с иммуноглобулином см. также патент США № 5428130, выданный 27 июня 1995 г., и публикацию Chamow et al., TIBTECH, 14:52-60 (1996).
В самой простой конструкции иммуноадгезина один или несколько доменов связывания адгезина (например, WISP-1) объединены с Fc-областью тяжелой цепи иммуноглобулина. При получении иммуноадгезинов по настоящему изобретению нуклеиновая кислота, кодирующая домен связывания адгезина, должна быть слита у С-конца с нуклеиновой кислотой, кодирующей N-конец последовательности константной области иммуноглобулина, однако слияния у N-конца также возможны.
В случае таких слияний кодированный химерный полипептид обычно сохраняет, по крайней мере, функционально активную шарнирную область, СН2- и СН3-домены константной области тяжелой цепи иммуноглобулина. Слияния также производят с С-концом Fc-части константной области или непосредственно у N-конца с СН1-доменом тяжелой цепи или соответствующей областью легкой цепи. Точный сайт, на котором может быть произведено слияние, не имеет конкретного значения; определенные сайты хорошо известны и могут быть выбраны с точки зрения оптимизации характеристик биологической активности, секреции или связывания иммуноадгезина.
В предпочтительном варианте осуществления изобретения последовательность адгезина сливают с N-концом Fc-области иммуноглобулина G1 (IgG1). С последовательностью адгезина можно слить всю константную область тяжелой цепи. Однако более предпочтительно для слияния используют последовательность, начинающуюся в шарнирной области непосредственно вверху от сайта расщепления папаином, который химически определяет Fc-область IgG (то есть остаток 216, считая первый остаток константной области тяжелой цепи остатком 114), или аналогичные сайты других иммуноглобулинов. В особенно предпочтительном варианте осуществления изобретения аминокислотную последовательность адгезина сливают с (а) шарнирной областью и СН2- и СН3-доменами или (b) СН1, шарнирной областью, СН2- и СН3-доменами тяжелой цепи IgG.
В случае биспецифических иммуноадгезинов указанные иммуноадгезины собирают в виде мультимеров, в частности гетеродимеров или гетеротетрамеров. Собранные иммуноглобулины должны иметь известную структуру звеньев. Форма, в которой существуют IgG, IgD и IgE, представляет собой основную четырехцепную структурную единицу. Четырехцепная единица повторяется в иммуноглобулинах с более высокой молекулярной массой; IgM обычно существует в виде пентамера четырех основных единиц, удерживаемых вместе дисульфидными связями. Глобулин IgA и иногда глобулин IgG могут также существовать в сыворотке в мультимерной форме. В случае мультимера все четыре единицы могут быть одинаковыми или разными.
Ниже схематически представлены разные типичные собранные иммуноадгезины, входящие в объем настоящего изобретения:
(а) АСL-АСL;
(b) АСH-(АСH, АСL-АСH, АСL-VHCH или VLCL-ACH);
(c) АСL-ACH-(АСL-АСH, АСL-VHCH, VLCL-ACH или VLCL-VHCH);
(d) ACL-VHCH-(ACH, АСL-VHCH или VLCL-ACH);
(e) VLCL-ACH-(ACL-VHCH или VLCL-ACH); и
(f) (A-Y)n-(VLCL-VHCH)2,
где все элементы А означают одинаковые или разные аминокислотные последовательности адгезина;
VL означает вариабельную область легкой цепи иммуноглобулина;
VН означает вариабельную область тяжелой цепи иммуноглобулина;
СL означает константную область легкой цепи иммуноглобулина;
СН означает константную область тяжелой цепи иммуноглобулина;
n означает целое число больше 1;
Y означает остаток ковалентного перекрестносшивающего агента.
Для краткости изложения в вышеуказанных структурах указаны только основные признаки; в них не указаны соединительные домены (J) или другие домены иммуноглобулинов и не показаны дисульфидные связи. Однако, в случае необходимости таких доменов для активности связывания, они должны быть созданы на обычных участках, занимаемых ими в молекулах иммуноглобулина.
Альтернативно, последовательности адгезина могут быть введены между последовательностями тяжелой и легкой цепей иммуноглобулина, в результате чего получают иммуноглобулин, содержащий химерную тяжелую цепь. В данном варианте осуществления изобретения последовательности адгезина сливают с 3'-концом тяжелой цепи иммуноглобулина в каждом плече иммуноглобулина между шарнирной областью и СН2-доменом или между СН2- и СН3-доменами. Аналогичные конструкции были представлены в публикации Hoogenboom et al., Mol. Immunol., 28:1027-1037 (1991).
Хотя присутствие легкой цепи иммуноглобулина является необязательным в иммуноадгезинах по настоящему изобретению, легкая цепь иммуноглобулина может присутствовать, будучи ковалентно связанной с полипептидом, полученным в результате слияния адгезина и тяжелой цепи иммуноглобулина, или непосредственно слитой с адгезином. В первом случае ДНК, кодирующая легкую цепь иммуноглобулина, обычно коэкспрессирована с ДНК, кодирующей белок, полученный в результате слияния адгезина с тяжелой цепью иммуноглобулина. В процессе секреции гибридная тяжелая цепь и легкая цепь должны быть ковалентно связаны с образованием структуры, подобной иммуноглобулину, которая содержит две пары тяжелой и легкой цепей иммуноглобулина, связанных дисульфидными связями. Методы, пригодные для получения таких структур, описаны, например, в патенте США № 4816567, выданном 28 марта 1989 г. Иммуноадгезины обычно создают путем слияния последовательности кДНК, кодирующей часть адгезина в рамке считывания, с последовательностью кДНК иммуноглобулина. Однако можно также произвести слияние с геномными фрагментами иммуноглобулина (см., например, публикации Aruffo et al., Cell, 61:1303-1313 (1990); и Stamenkovic et al., Cell. 66:1133-1144 (1991)). Последний тип слияния требует для экспрессии присутствия регуляторных последовательностей Ig. кДНК, кодирующие константные области тяжелой цепи IgG, могут быть выделены на основании опубликованных последовательностей из библиотек кДНК, полученных из лимфоцитов селезенки или периферической крови методами гибридизации или полимеразной реакции синтеза цепи (PCR). кДНК, кодирующие “адгезин” и иммуноглобулиновые части иммуноадгезина, вводят вместе с плазмидным вектором, который направляет эффективную экспрессию в выбранных клетках-хозяевах.
В другом варианте осуществления изобретения WISP-1 или антагонист WISP-1 может быть ковалентно модифицирован путем связывания полипептида рецептора с одним из многочисленных небелковых полимеров, таких как полиэтиленгликоль (PEG), полипропиленгликоль или полиоксиалкилены, способом, описанным в патентах США №№ 4640835, 4496689, 4301144, 4670417, 4791192 или 4179337, или с другими подобными молекулами, такими как полиглутамат. Такие пегилированные формы могут быть получены методами, известными в данной области.
В объем настоящего изобретения входят также лейциновые зипперы указанных молекул. Термин “лейциновый зиппер” используется в данной области для обозначения последовательности с высоким содержанием лейцина, которая усиливает, стимулирует или выполняет димеризацию или тримеризацию слитого с ней партнера (например, последовательность или молекула, с которой слит или связан лейциновый зиппер). В данной области описаны полипептиды разных лейциновых зипперов. См., например, публикацию Landschulz et al., Science, 240:1759 (1988); патент США № 5716805; WO 94/10308; публикации Hoppe et al., FEBS Letters, 344:1991 (1994); Maniatis et al., Nature, 341:24 (1989). Специалистам в данной области должно быть понятно, что последовательность лейцинового зиппера может быть слита у 5'- или 3'-конца молекулы WISP-1 или антагониста WISP-1.
Полипептиды WISP-1 по настоящему изобретению могут быть также модифицированы с образованием химерных молекул в результате слияния указанного полипептида с другим гетерологичным полипептидом или аминокислотной последовательностью. Такой гетерологичный полипептид или аминокислотная последовательность предпочтительно вызывают олигомеризацию химерной молекулы. В одном варианте осуществления изобретения такая химерная молекула включает слияние полипептида WISP-1 с меченым полипептидом, образующим эпитоп, с которым может избирательно связываться антитело против данной метки. Эпитопную метку обычно располагают у амино- или карбоксильного конца полипептида. Присутствие форм полипептида с меченым эпитопом можно обнаружить, используя антитело против меченого полипептида. Кроме того, наличие эпитопной метки позволяет легко очистить меченый полипептид методом аффинной очистки с использованием антитела против метки или матрицы аффинности другого типа, которая связывается с эпитопной меткой. В данной области хорошо известны разные меченые полипептиды и соответствующие антитела к ним. Примеры включают полигистидиновые (поли-his) или полигистидин-глициновые (поли-his-gly) метки; меченый полипептид glu Ha и антитело 12СА5 к нему (Field et al., Mol. Cell. Biol., 8:2159-2165 (1988)); метку с-myc и антитела 8F9, 3C7, 6Е10, G4, B7 и 9Е10 к ней (Evan et al., Molecular and Cellular Biology, 5:3610-3616 (1985)); и гликопротеин D (gD) вируса простого герпеса и антитело у указанной метке (Paborsky et al., Protein Engineering, 3(6):547-553 (1990)). Другие меченые полипептиды включают Flag-пептид (Hopp et al., Biotechnology, 6:1204-1210 (1988)); пептид эпитопа КТ3 (Martin et al., Science, 255:192-194 (1992)); пептид тубулинового эпитопа (Skinner et al., J. Biol. Chem., 266:15163-15166 (1991)); и пептидную метку белка гена 10 Т7 (Lutz-Freyermuth et al., Proc. Natl. Acad. Sci. USA, 87:6393-6397 (1990)).
Предполагается, что антитела против WISP-1 также могут быть использованы при осуществлении способов по настоящему изобретению. Примеры таких молекул включают нейтрализующие или блокирующие антитела, которые могут уменьшать рост, метастазирование или подвижность раковых клеток. Антитела против WISP-1 могут быть моноклональными антителами.
Моноклональные антитела могут быть получены методами гибридом, аналогичными описанным в публикации Kohler and Milstein, Nature, 256:495 (1975). В соответствии с методом гибридом мышь, хомячок или другое приемлемое животное-хозяин обычно иммунизируют иммунизирующим агентом для индукции лимфоцитов, продуцирующих или способных продуцировать антитела, которые специфически связываются с иммунизирующим агентом. Альтернативно, лимфоциты могут быть иммунизированы in vitro.
Иммунизирующим агентом обычно является полипептид WISP-1 или его слитый белок, в частности слитый белок WISР-1-IgG.
Лимфоциты периферической крови (“PBL”) обычно используют в тех случаях, когда могут быть желательны клетки человека, и клетки селезенки или лимфатического узла обычно используют в тех случаях, когда могут быть желательны клетки млекопитающего, отличного от человека. Лимфоциты затем сливают с иммортализованными клетками, используя приемлемый агент, вызывающий слияние клеток, такой как полиэтиленгликоль, для образования клеток гибридомы [Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, (1986) pp. 59-103]. Иммортализованные клетки обычно являются трансформированными клетками млекопитающих, в частности миеломными клетками грызуна, быка и человека. Обычно используют линии миеломных клеток крыс или мышей. Клетки гибридомы можно культивировать в приемлемой культуральной среде, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживание неслитых иммортализованных клеток. Например, если в материнских клетках отсутствует фермент гипоксантингуанин-фосфорибозилтрасфераза (HGPRT или HPRT), культуральная среда для гибридом обычно содержит гипоксантин, аминоптерин и тимидин (“среда НАТ”), которые предотвращают рост клеток с отсутствием HGРRT.
Предпочтительные линии иммортализованных клеток включают клетки, которые эффективно сливаются, поддерживают устойчиво высокую экспрессию антитела выбранными антителопродуцирующими клетками и являются восприимчивыми к среде, такой как среда НАТ. Более предпочтительными линиями иммортализованных клеток являются линии миеломных клеток мыши, которые могут быть приобретены, например, в Центре Salk Institute Cell Distribution Center, San Diego, California, и Американской коллекции типовых культур, Manassas, Virginia. В научной литературе описаны линии миеломных клеток человека и гетеромиеломных клеток мыши-человека, которые предназначены для продуцирования моноклональных антител человека (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Tehniques and Applications, Marcel Dekker, Inc., New York, (1987) pp. 51-63).
Культуральная среда, в которой культивируют клетки гибридомы, может быть подвергнута анализу на наличие моноклональных антител против WISP-1. Специфичность связывания моноклональных антител, продуцированных клетками гибридомы, определяют методом иммунопреципитации или при помощи анализа связывания in vitro, такого как радиоиммуноанализ (RIA) или твердофазный иммуноферментный анализ (ELISA). Такие методы и анализы известны в данной области. Сродство связывания моноклонального антитела можно определить, например, при помощи анализа Скатчарда, описанного в публикации Munson and Pollard, Anal. Biochem., 107:220 (1980).
После идентификации требуемых клеток гибридомы клоны могут быть субклонированы методами серийных разведений и выращены стандартными методами (Goding, см. выше). Культуральные среды, пригодные для указанной цели, включают, например, модифицированную по способу Дульбекко среду Игла или среду RPMI-1640. Альтернативно, клетки гибридомы могут быть выращены in vivo в виде асцита в организме млекопитающего.
Моноклональные антитела, секретированные субклонами, могут быть выделены или очищены от культурной среды или асцитической жидкости стандартными методами очистки иммуноглобулина, такими как, например, белок А-сефароза, хроматография на гидроксилапатите, гель-электрофорез, диализ или аффинная хроматография.
Моноклональные антитела могут быть также получены методами рекомбинантных ДНК, описанными в патенте США № 4816567. ДНК, кодирующую моноклональные антитела, можно легко выделить и секвенировать стандартными методами (например, при помощи олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелую и легкую цепи моноклональных антител). Клетки гибридомы служат в качестве предпочтительного источника такой ДНК. Выделенная ДНК может быть введена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки COS обезьян, клетки яичника китайского хомячка (СНО) или миеломные клетки, которые по-другому не продуцируют белок иммуноглобулина, для синтеза моноклональных антител в рекомбинантных клетках-хозяевах. ДНК также может быть модифицирована, например, путем введения кодирующей последовательности для константных областей тяжелой и легкой цепей человека вместо гомологичных последовательностей мыши (Morrison et al., Proc. Nat. Acad. Sci. 81, 6851 (1984)) или путем ковалентного связывания кодирующей последовательности иммуноглобулина со всей или частью кодирующей последовательности для полипептида, отличного от иммуноглобулина.
Такие полипептиды, отличные от иммуноглобулина, обычно вводят вместо константных областей антитела по настоящему изобретению или вместо вариабельных областей одного антигенсвязывающего сайта антитела по настоящему изобретению для создания химерного двухвалентного антитела, содержащего один антигенсвязывающий сайт со специфичностью к WISP-1 и другой антигенсвязывающий сайт со специфичностью к другому антигену.
Химерные или гибридные антитела могут быть также получены in vitro методами, известными в области химии синтетических белков, с использованием перекрестносшивающих агентов. Например, иммунотоксины могут быть получены при помощи реакции обмена дисульфидных связей или образования простой тиоэфирной связи. Примеры реагентов, пригодных для указанной цели, включают иминотиолат и метил-4-меркаптобутиримидат.
Могут быть также получены одноцепочечные Fv-фрагменты, описанные в публикации Iliades et al., FEBS Letters, 409:437-441 (1997). Связывание таких одноцепочечных фрагментов с использованием разных линкеров описано в публикации Kortt et al., Protein Engineering, 10:423-433 (1997). В данной области хорошо известны разные методы рекомбинантного продуцирования и манипуляции антителами. Иллюстративные примеры таких методов, обычно используемых специалистами в данной области, более подробно описаны ниже.
(i) Гуманизированные антитела
Гуманизированное антитело обычно содержит один или несколько аминокислотных остатков, введенных в него из источника, отличного от человека. Указанные аминокислотные остатки, отличные от человеческих, часто определяют как “импортные” остатки, которые обычно получают из “импортной” вариабельной области. Антитела могут быть гуманизированы методом, разработанным Винтером с соавторами, (Jones et al., Nature, 321:522-525 (1986); Rieсhmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988)), путем замены гипервариабельных участков (CDR) или последовательностей CDR человеческого антитела соответствующими последовательностями грызунов.
Таким образом, такие “гуманизированные” антитела являются химерными антителами, в которых часть интактной вариабельной области человека заменяют соответствующей последовательностью из вида, отличного от человека. Гуманизированные антитела обычно являются человеческими антителами, в которых некоторые остатки CDR и, возможно, некоторые остатки остовной области заменены остатками из аналогичных сайтов антител грызунов.
Важно, чтобы антитела были гуманизированы с сохранением высокого сродства к антигену и других благоприятных биологических свойств. В соответствии с предпочтительным способом гуманизированные антитела получают, анализируя исходные последовательности и разные предполагаемые гуманизированные продукты при помощи трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулина являются общедоступными и хорошо известны специалистам в данной области. Существуют компьютерные программы, которые иллюстрируют и воспроизводят вероятные трехмерные структуры выбранных последовательностей иммуноглобулина-кандидата. Изучение полученных изображений позволяет проанализировать вероятную роль остатков в функционировании последовательности иммуноглобулина-кандидата, то есть проанализировать остатки, влияющие на способность иммуноглобулина-кандидата связываться со своим антигеном. Подобным образом остатки остовной области могут быть выбраны и объединены из консенсусной и импортной последовательности с достижением требуемых характеристик антитела, таких как более высокое сродство к антигену-мишени. Как правило, остатки CDR непосредственно и в наибольшей степени влияют на связывание антигена.
(ii) Человеческие антитела
Человеческие моноклональные антитела могут быть получены методом гибридом. Линии миеломных клеток человека и гетеромиеломных клеток мыши-человека, используемые для продуцирования человеческих моноклональных антител, описаны, например, в публикациях Kozbor, J. Immunol. 133, 3001 (1984) и Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987).
В настоящее время могут быть получены трансгенные животные (например, мыши), способные в результате иммунизации продуцировать спектр человеческих антител без продуцирования эндогенного иммуноглобулина. Например, как отмечено в научной литературе, гомозиготная делеция гена соединительной области (JH) тяжелой цепи антитела у химерных и гаметических мутантных мышей вызывает полное ингибирование продуцирования эндогенного антитела. Введение в организм таких гаметических мутантных мышей генов гаметического иммуноглобулина человека вызывает продуцирование человеческих антител при антигенной стимуляции. См., например, публикации Jakobovits et al., Proc. Natl. Acad. Sci. USA 90, 2551-255 (1993); Jakobovits et al., Nature, 362, 255-258 (1993).
В публикации Mendez et al. (Nature Genetics 15: 146-156 (1997)) описан усовершенствованный метод и созданная линия трансгенных мышей, получивших название “Xenomouse II”, которые при антигенной стимуляции образуют человеческие антитела с высокой степенью сродства. Подобный результат был достигнут путем гаметического введения локусов тяжелой и легкой цепей человека с большим числом остатков мышам с делецией в эндогенном JН-сегменте в соответствии с приведенным выше описанием. Мышь Xenomouse II содержит 1020 т.п.о. локуса тяжелой цепи человека, включающего примерно 66 генов VН-области, полностью DН- и JН-области и три разные константные области (µ, δ и χ), а также 800 т.п.о. локуса κ-цепи человека, включающего 32 гена Vк-области, Jк-сегменты и гены Ск-области. Антитела, продуцированные указанными мышами, близко соответствуют человеческим антителам во всех отношениях, включая реаранжировку, сборку и набор генов. Человеческие антитела предпочтительно экспрессируются вместо эндогенных антител вследствие делеции эндогенного JН-сегмента, что предотвращает реаранжировку генов в данном локусе мыши.
Альтернативно, для продуцирования человеческих антител и их фрагментов in vitro из набора генов вариабельной (V) области иммуноглобулина, полученных у неиммунизированных доноров, можно использовать метод отображения на фаге (McCafferty et al., Nature 348, 552-553 [1990]). В соответствии с указанным методом гены V-области антитела клонируют в рамке считывания в главный или минорный ген белка оболочки нитевидного бактериофага, такого как М13 или fd, и отображают в виде функциональных фрагментов антитела на поверхности фаговой частицы. Так как нитевидная частица содержит копию одноцепочечной ДНК генома фага, отбор на основе функциональных свойств антитела также позволяет выбрать ген, кодирующий антитело, обладающее требуемыми свойствами. Таким образом, фаг имитирует некоторые свойства В-клетки. Отображение на фаге может быть выполнено в разных форматах; для ознакомления с указанными форматами см., например, публикацию Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3, 564-571 (1993). Для отображения на фаге можно использовать несколько источников сегментов V-гена. В публикации Clackson et al., Nature 352, 624-628 (1991) описано выделение целого ряда антител против оксазолона из небольшой произвольной комбинаторной библиотеки V-генов, полученных из селезенок иммунизированных мышей. Можно создать набор V-генов неиммунизированных доноров-людей и выделить антитела к целому ряду антигенов (включая аутоантигены) методами, описанными в публикациях Marks et al., J. Mol. Biol. 222, 581-597 (1991) или Griffith et al., EMBO J., 12, 725-734 (1993). При возникновении естественной иммунной реакции гены антител накапливают значительное число мутаций (соматическая гипермутация). Некоторые введенные изменения сообщают более высокое сродство, и В-клетки, отображающие поверхностный иммуноглобулин с высокой степенью сродства, предпочтительно реплицируются и дифференцируются во время последующей антигенной стимулиции. Данный естественный процесс можно имитировать методом, известным как “перестановка цепи” (Marks et al., Bio/Technol. 10, 779-783 [1992]). При помощи данного метода сродство “первичных” человеческих антител, полученных отображением на фаге, можно улучшить путем последующей замены генов V-области тяжелой и легкой цепей набором природных вариантов (наборов) генов V-области, полученных у неиммунизированных доноров. Указанный метод позволяет продуцировать антитела и фрагменты антител со сродством в нМ диапазоне. Стратегия получения очень широкого спектра антител на фаге (известного также как “источник всех библиотек”) описана в публикации Waterhouse et al., Nucl. Acids Res. 21, 2265-2266 (1993). Перестановка генов может быть также использована для создания человеческих антител из антител грызунов, когда человеческое антитело характеризуется такой же специфичностью и сродством к исходному антителу грызуна. В соответствии с указанным методом, который определяется также как “импринтинг эпитопов”, ген V-области тяжелой или легкой цепей антител грызуна, полученный методом отображения на фаге, заменяют набором генов V-области человека, создавая таким образом грызун-человеческие химеры. Отбор в отношении антигена позволяет выделить человеческую переменную, способную восстанавливать функциональный антигенсвязывающий сайт, то есть эпитоп определяет (запечатлевает) выбор партнера. При повторении данного процесса с целью замены оставшейся V-области грызуна получают человеческое антитело (см. заявку на патент РСТ WO 93/06213, опубликованную 1 апреля 1993 г.). В отличие от традиционной гуманизации антител грызунов путем присоединения CDR указанный метод позволяет получить полностью человеческие антитела, в которых отсутствуют остатки остовной области или CDR грызуна.
Как будет описано ниже, антитела по настоящему изобретению могут необязательно включать мономерные, димерные и многовалентные формы антител. Специалисты в данной области могут создавать такие димерные или многовалентные формы методами, известными в данной области. Методы получения моновалентных антител также хорошо известны в данной области. Например, один метод предполагает рекомбинантную экспрессию легкой цели и модифицированной тяжелой цепи иммуноглобулина. Тяжелую цепь обычно усекают в любой точке Fc-области для предотвращения перекрестного сшивания тяжелой цепи. Альтернативно, соответствующие остатки цистеина заменяют другим аминокислотным остатком или удаляют для предотвращения перекрестного сшивания.
(iii) Биспецифические антитела
Биспецифические антитела являются моноклональными, предпочтительно человеческими или гуманизированными антителами, которые обладают специфичностью связывания в отношении, по крайней мере, двух разных антигенов. В данном случае одна из специфичностей связывания относится к WISP-1. Например, в объем настоящего изобретения входят биспецифические антитела, специфически связывающиеся с WISP-1 или вариантами WISP-1 и другим членом семейства CNN (например, WISP-2, WISP-3, CTGF, Cyr61 или Nov) или другими молекулами, такими как CD44.
В данной области известны методы получения биспецифических антител. Рекомбинантное продуцирование биспецифических антител традиционно основано на коэкспрессии двух пар тяжелых-легких цепей иммуноглобулина, где две тяжелые цепи обладают разной специфичностью (Millstein and Cuello, Nature 305, 537-539 (1983)). Вследствие произвольной реаранжировки тяжелой и легкой цепей иммуноглобулина указанные гибридомы (квадромы) продуцируют потенциальную смесь из 10 разных молекул антител, из которых только одна молекула имеет правильную биспецифическую структуру. Очистка правильной молекулы, которую обычно производят при помощи аффинной хроматографии, представляет собой достаточно сложный процесс, при этом выход продукта является низким. Аналогичные способы описаны в публикации заявки РСТ № WO 93/08829 (опубликована 13 мая 1993 г.) и публикации Traunecker et al., EMBO 10, 3655-3659 (1991).
В соответствии с другим и более предпочтительным подходом вариабельные области антитела с требуемыми специфичностями связывания (антигенсвязывающие сайты антитела) сливают с последовательностями константной области иммуноглобулина. Слияние предпочтительно производят с константной областью тяжелой цепи иммуноглобулина, включающей, по крайней мере, часть шарнирной области, СН2- и СН3-области. Желательно, чтобы, по крайней мере, в одном из слияний присутствовала первая константная область (СН1) тяжелой цепи, содержащая сайт, необходимый для связывания с легкой цепью. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и при желании легкую цепь иммуноглобулина, вводят в отдельные экспрессирующие векторы и котрансфицируют в приемлемый организм-хозяин. Подобный подход обеспечивает большую гибкость в регулировании взаимных пропорций трех полипептидных фрагментов, когда разные соотношения трех полипептидных цепей, использованных в конструкции, обеспечивают оптимальный выход. Однако можно ввести кодирующие последовательности для двух или всех трех полипептидных цепей в одном экспрессирующем векторе, когда экспрессия, по крайней мере, двух полипептидных цепей в равных отношениях обеспечивает высокие выходы, или когда указанные отношения не имеют конкретного значения. В предпочтительном варианте осуществления данного способа биспецифические антитела состоят из тяжелой цепи гибридного иммуноглобулина с первой специфичностью связывания в одном плече и парой тяжелых-легких цепей гибридного иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Установлено, что такая асимметричная структура облегчает отделение требуемого биспецифического соединения от нежелательных комбинаций цепей иммуноглобулина, так как присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы облегчает отделение. Подобный подход описан в заявке РСТ № WO 94/04690, опубликованной 3 марта 1994 г.
Для более подробного ознакомления с созданием биспецифических антител см., например, публикацию Suresh et al., Methods in Enzynology 121, 210 (1986).
(iv) Гетероконъюгатные антитела
В объем настоящего изобретения входят также гетероконъюгатные антитела. Гетероконъюгатные антитела состоят из двух ковалентно связанных антител. Такие антитела, например, были предложены для направленного воздействия клеток иммунной системы на нежелательные клетки (патент США № 4676980) и для лечения ВИЧ-инфекции (публикация заявки РСТ №№ WO 91/00360 и WO 92/200373; европейский патент № 03089). Гетероконъюгатные антитела могут быть получены при помощи любых известных методов перекрестного сшивания. В данной области хорошо известны приемлемые перекрестносшивающие агенты, которые описаны в патенте США № 4676980, наряду с целым рядом методов перекрестного сшивания.
(v) Фрагменты антител
В некоторых вариантах осуществления изобретения антитело против WISP-1 (в том числе антитела мыши, человеческие и гуманизированные антитела и варианты антител) является фрагментом антитела. Для получения фрагментов антитела разработаны разные методы. Указанные фрагменты традиционно получали путем протеолитического расщепления интактных антител (см., например, публикации Morimoto et al., J. Biochem. Biophys. Methods 24:107-117 (1992) и Brennan et al., Science 229:81 (1985). Однако в настоящее время указанные фрагменты могут быть продуцированы рекомбинантными клетками хозяина. Например, Fab'-SH фрагменты могут быть выделены непосредственно из E. coli и химически связаны с образованием F(аb')2-фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). В другом варианте осуществления изобретения F(аb')2 получают, используя лейциновый зиппер GCN4 для стимуляции сборки F(ab')2-молекулы. В соответствии с другим подходом Fv-, Fab- или F(ab')2-фрагменты могут быть выделены непосредственно из культуры рекомбинатных клеток-хозяев. Специалисту в данной области должны быть известны разные методы продуцирования фрагментов антитела. Например, расщепление может быть произведено папаином. Примеры расщепления папаином описаны в заявке WO 94/29348, опубликованной 22 декабря 1994 г., и патенте США № 4342566. В результате расщепления антител папаинов обычно образуются два идентичных антигенсвязывающих фрагмента, именуемых Fab-фрагментами, каждый из которых имеет один антигенсвязывающий сайт, и остаточный Fc-фрагмент. В результате обработки пепсином образуется F(ab')2-фрагмент, который имеет два антигенсвязывающих сайта и способен вызывать перекрестное сшивание антигена.
Fab-фрагменты, полученные в результате расщепления антитела, содержат также константные области легкой цепи и первую константную область (СН1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков у карбоксильного конца СН1-области тяжелой цепи, включая один или несколько остатков цистеина из шарнирной области антитела. В настоящем описании изобретения аббревиатурой Fab'-SH обозначен Fab'-фрагмент, в котором один или несколько остатков цистеина константных областей содержат свободную тиоловую группу. F(ab')2-фрагменты антитела первоначально были получены в виде пар Fab'-фрагментов с остатками цистеина шарнирной области между ними. Кроме того, известны другие химические связи фрагментов антитела.
Антитела гликозилированы в консервативных положениях своих константных областей (Jefferis and Lund, Chem. Immunol. 65:111-128 [1997]; Wright and Morrison, TibTECH 15:26-32 [1997]). Олигосахаридные боковые цепи иммуноглобулинов влияют на функцию белка (Boyd et al., Mol. Immunol. 32:1311-1318 [1996]; Wittwe and Howard, Biochem. 29:4175-4180 [1990]) и внутримолекулярное взаимодействие между частями гликопротеина, которые могут определять конформацию и существующую трехмерную поверхность гликопротеина (Hefferis and Lund, см. выше; Wyss and Wagner, Current Opin. Biotech. 7:409-416 [1996]). Олигосахариды могут также осуществлять направленную доставку данного гликопротеина в определенные молекулы на основании специфических структур узнавания. Например, установлено, что в агалактозилированном IgG олигосахаридная часть “выпадает” из пространства между СН2-областью, и концевые остатки N-ацетил-глюкозамина приобретают способность связывать маннозасвязывающий белок (Malhotra et al., Nature Med. 1:237-243 [1995]). Удаление гликопептидазой олигосахаридов из CAMPATH-1H (рекомбинантное гуманизированное моноклональное антитело IgG1 мыши, которое узнает антиген CDw52 лимфоцитов человека), продуцированного в клетках яичника китайского хомячка (СНО), привело к полному отсутствию комплементопосредованного лизиса (CMCL) (Boyd et al., Mol. Immunol. 32:1311-1318 [1996]), в то время как избирательное удаление остатков сиаловой кислоты при помощи нейраминидазы не вызывало отсутствия СMCL. Кроме того, в научной литературе сообщалось, что гликозилирование антител влияет на антителозависимую клеточную цитотоксичность (ADCC). В частности, клетки СНО с тетрациклин-регулируемой экспрессией β(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII), катализируемое гликозилтрансферазой образование двурассекающей GlcNAc, характеризуются лучшей активностью ADCC (Umana et al., Mature Biotech. 17:176-180 [1999]).
Гликозилированные варианты антител включают варианты, в которых изменен паттерн гликозилирования антитела. Под изменением подразумевается удаление одной или нескольких углеводных частей, обнаруженных в антителе, введение одной или нескольких углеводных частей в антитело, изменение состава гликозилирования (паттерна гликозилирования), степень гликозилирования и т.д. Гликозилированные варианты, например, могут быть получены путем удаления, изменения и/или добавления одного или нескольких сайтов гликозилирования в последовательность нуклеиновой кислоты, кодирующей антитело.
Гликозилирование антител обычно является N-связанным или О-связанным. N-связанное гликозилирование предполагает присоединение углеводной части к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где Х означает любую аминокислоту за исключением пролина, представляют собой узнающие последовательности, служащие для ферментативного присоединения углеводной части к боковой цепи аспарагина. Таким образом, наличие любой из указанных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. О-связанное гликозилирование предполагает присоединение одного из сахаров, а именно N-ацетилгалактозамина, галактозы или ксилозы, к гидроксиаминокислоте, наиболее часто к серину или треонину, хотя для указанной цели может быть также использован 5-гидроксипролин или 5-гидроксилизин.
Сайты гликозилирования обычно добавляют в антитело путем изменения аминокислотной последовательности с введением в нее одной или нескольких вышеуказанных трипептидных последовательностей (для сайтов N-связанного гликозилирования). Изменение может быть также произведено путем добавления одного или нескольких остатков серина или треонина в последовательность исходного антитела (для сайтов О-связанного гликозилирования).
Гликозилирование (включая паттерн гликозилирования) антител может быть также изменено без изменения нуклеотидной последовательности. Гликозилирование в значительной степени зависит от клетки-хозяина, используемой для экспрессии антитела. Так как клетка, используемая для экспрессии рекомбинантных гликопротеинов, например антител, в качестве потенциальных лекарственных средств, редко бывает естественной клеткой, можно ожидать значительных изменений паттерна гликозилирования антител (см., например, публикацию Hse et al., J. Biol. Chem. 272:9062-9070 [1997]). Помимо выбора клеток-хозяев необходимо учитывать другие факторы, влияющие на гликозилирование в процессе рекомбинантного продуцирования антител, которые включают условия выращивания, состав среды, плотность культуры, насыщение кислородом, рН, схемы очистки и тому подобные. Были предложены разные способы изменения паттерна гликозилирования, достигаемого в определенном организме-хозяине, включая введение или сверхэкспрессию определенных ферментов, участвующих в продуцировании олигосахаридов (патенты США №№ 5047335, 5510261 и 5278299). Гликозилирование или определенные типы гликозилирования можно устранить в гликопротеине ферментативным путем, например с помощью эндогликозидазы Н (эндо Н). Кроме того, можно генетически создать рекомбинантную клетку-хозяина, например сделать ее неспособной процессировать определенные типы полисахаридов. Указанные и подобные методы хорошо известны в данной области.
Структуру гликозилирования антител можно легко проанализировать стандартными методами анализа углеводов, включая лектиновую хроматографию, ЯМР, масс-спектрометрию, ВЭЖХ, GPC, композиционный анализ моносахарида, последовательное ферментативное расщепление и HPAEC-PAD, где использована анионообменная хроматография с высоким значением рН для разделения олигосахаридов на основе заряда. Методы выделения олигосахаридов для аналитических целей также известны и включают без каких-либо ограничений ферментативную обработку (обычно выполняемую с использованием пептид-N-гликозидазы F/эндо-β-галактозидазы), удаление в сильнощелочных условиях с целью выделения главным образом О-связанных структур и химические методы с использованием безводного гидразина для выделения N- и О-связанных олигосахаридов.
В объем настоящего изобретения входят также триантитела. Такие антитела описаны, например, в публикациях Iliades et al., см. выше, и Kortt et al., см. выше.
Антитела по настоящему изобретению могут быть модифицированы путем конъюгирования антитела с цитотоксическим агентом (таким как молекула токсина) или активирующим пролекарство ферментом, который превращает пролекарство (например, пептидильное химиотерапевтическое средство, см. WO 81/01145) в активное противораковое средство. См., например, WO 88/07378 и патент США № 4975278. Указанный метод определяется также как “антителозависимая ферментопосредованная пролекарственная терапия” (ADEPT).
Ферментный компонент иммуноконъюгата, пригодный для ADEPT, включает любой фермент, способный превращать пролекарство в более активную цитотоксическую форму. Ферменты, используемые в способе по настоящему изобретению, включают, не ограничиваясь ими, щелочную фосфатазу, способную превращать фосфат-содержащие пролекарства в свободные лекарственные средства; арилсульфатазу, способную превращать сульфат-содержащие пролекарства в свободные лекарственные средства; цитозиндеаминазу, способную превращать нетоксичный 5-фторцитозин в противораковое средство, 5-фторурацил; протеазы, такие как протеаза Serratia, термолизин, субтилизин, карбоксипептидазы и катепсины (такие как катепсины В и L), способные превращать пептид-содержащие пролекарства в свободные лекарственные средства; каспазы, такие как каспаза-3; D-аланил-карбоксипептидазы, способные превращать пролекарства, содержащие D-аминокислотные заместители; ферменты, расщепляющие углеводы, такие как бета-галактозидаза и нейраминидаза, способные превращать гликозилированные пролекарства в свободые лекарственные средства; бета-лактамазу, способную превращать лекарственные средства, являющиеся производными бета-лактамов, в свободные лекарственные средства; и пенициллинамидазы, такие как пенициллин-V-амидаза или пенициллин-G-амидаза, способные превращать лекарственные средства, являющиеся производными феноксиацетильных или фенилацетильных групп в положении атомов азота амина, в свободные лекарственные средства. Альтернативно, для превращения пролекарств по настоящему изобретению в свободные активные лекарственные средства могут быть использованы антитела с ферментативной активностью, известные также в данной области как “абзимы” (см., например, публикацию Massey, Nature 328:457-458 (1987)). Для доставки абзима в популяцию опухолевых клеток могут быть использованы конъюгаты антитело-абзим, полученные в соответствии с настоящим описанием изобретения.
Ферменты могут быть ковалентно связаны с антителами методами, хорошо известными в данной области, такими как использование гетеробифункциональных перекрестносшивающих реагентов. Альтернативно, методами рекомбинантных ДНК, хорошо известными в данной области, могут быть созданы слитые белки, содержащие, по крайней мере, одну антигенсвязывающую область антитела по настоящему изобретению, связанную, по крайней мере, с одной функционально активной частью фермента по настоящему изобретению (см., например, публикацию Neuberger et al., Nature, 312:604-608 (1984).
Настоящее изобретение относится также к модификациям антитела. Например, антитело может быть связано с одним из многочисленных небелковых полимеров, таких как полиэтиленгликоль, полипропиленгликоль, полиоксиалкилены, сополимеры полиэтиленгликоля и полипропиленгликоля, или другими молекулами, такими как полиглутамат. Антитело может быть также заключено в микрокапсулы, полученные, например, методами коацервации или межфазной полимеризации (например, соответственно гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметилметакрилатные микрокапсулы), в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в публикации Remington's Pharmaceutical Sciences, 16th edition, Osol, A., Ed. (1980). Для увеличения времени полужизни антитела в кровяном русле в антитело (особенно фрагмент антитела) можно ввести спасающий рецепторсвязывающий эпитоп способом, описанным, например, в патенте США № 5739277. В используемом здесь значении термин “спасающий рецепторсвязывающий эпитоп” означает эпитоп Fc-области молекулы IgG (например, IgG-1, IgG-2, IgG-3 или IgG-4), ответственный за увеличение времени полужизни молекулы IgG в кровяном русле in vivo.
Препараты
Антагонисты WISP-1 по настоящему изобретению могут необязательно находиться в носителе. Приемлемые носители и их составы описаны в публикации Remington's Pharmaceutical Sciences, 16th ed., 1980, Mack Publishing Co., edited by Osol et al. Чтобы сделать препарат изотоническим, в носителе используют соответствующее количество фармацевтически приемлемой соли. Примеры носителя включают физиологический раствор, раствор Рингера и раствор декстрозы. Показатель рН носителя предпочтительно равен примерно 5-8, более предпочтительно примерно 7,4-7,8. Специалистам в данной области должно быть очевидно, что определенные носители могут быть более предпочтительными в зависимости, например, от способа введения и концентрации вводимого активного агента. Носитель может быть в форме лиофилизованного препарата или водного раствора.
Приемлемые носители, наполнители или стабилизаторы предпочтительно должны быть нетоксичными для клеток и/или реципиентов в используемых дозах и концентрациях и могут включать буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, такие как аскорбиновая кислота и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония, хлорид гексаметония, хлорид бензалкония, хлорид бензетония; феноловый, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол, резорцин, циклогексанол, 3-пентанол и м-крезол); низкомолекулярные (менее примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, в том числе глюкоза, манноза или декстрины; хелатообразующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
Препарат может также содержать несколько активных соединений, необходимых для лечения определенного заболевания, предпочтительно соединений, обладающих комплементарной активностью и не оказывающих вредного воздействия друг на друга.
Антагонисты по настоящему изобретению могут быть также заключены в микрокапсулы, полученные, например, методами коацервации или межфазной полимеризации, такие как, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметилметакрилатные микрокапсулы, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в публикации Remington's Pharmaceutical Sciences, 16th edition, Osol, A., Ed. (1980).
Препараты, предназначенные для введения in vivo, должны быть стерильными. Стерилизацию осуществляют фильтрованием через стерильные фильтрующие мембраны.
Могут быть получены препараты с пролонгированным действием. Приемлемые примеры препаратов с пролонгированным действием включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие активный агент, которые представляют собой формованные изделия, например пленки или микрокапсулы. Примеры матриц с пролонгированным действием включают сложные полиэфиры, гидрогели (например, поли-2-гидроксиэтилметакрилат или поливиниловый спирт), полилактиды (патент США № 3773919), сополимеры L-глутамовой кислоты и γ-этил-L-глутамата, не поддающийся разрушению этиленвинилацетат, поддающиеся разрушению сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляную кислоту. Несмотря на то что полимеры, такие как этиленвинилацетат и сополимер молочной кислоты и гликолевой кислоты, способны высвобождать молекулы в течение более 100 дней, определенные гидрогели высвобождают белки в течение более коротких периодов времени.
Способы лечения
Молекулы по настоящему изобретению пригодны для лечения разных патологических состояний, таких как рак. Указанные состояния можно лечить путем введения одного или нескольких антагонистов, рассмотренных в настоящем описании изобретения.
Разные патологические состояния по настоящему изобретению могут быть диагностированы у млекопитающих квалифицированным врачом. В данной области существуют диагностические методы, которые позволяют, например, диагностировать или обнаружить у млекопитающего рак или иммунное заболевание. Например, рак может быть идентифицирован методами, которые включают, не ограничиваясь ими, пальпацию, анализ крови, рентгенологическую диагностику, ЯМР и тому подобные.
Антагонисты можно вводить известными способами, такими как внутривенное введение в виде инъекции ударной дозы вещества или непрерывного вливания в течение определенного периода времени, внутримышечное, внутрибрюшинное, цереброспинальное, подкожное, внутрисуставное, интратекальное, пероральное, местное введение или ингаляция. Введение можно необязательно производить путем вливания при помощи мининасоса, используя разные коммерчески доступные устройства. Антагонисты можно также вводить, используя методы генотерапии, описанные в данной области.
Эффективные дозы и схемы введения антагонистов могут быть определены эмпирически специалистом в данной области. Могут быть использованы однократные или многократные дозы. В настоящее время считается, что эффективная доза или количество антагониста, используемого отдельно, может находиться в пределах от около 1 мкг/кг до около 100 мг/кг массы тела или более в сутки. Расчет доз для разных видов млекопитающих может быть произведен методом, известным в данной области, например описанным в публикации Mordenti et al., Pharmaceut. Res., 8:1351 (1991).
При введении антагониста in vivo нормальные дозы могут находиться в пределах от около 10 нг/кг до 100 мг/кг массы тела млекопитающего или более в сутки, предпочтительно от около 1 мкг/кг в сутки до 10 мг/кг в сутки в зависимости от способа введения. В научной литературе содержатся руководства по определению доз и способов доставки; см., например, патенты США №№ 4657760, 5206344 или 5225212. Предполагается, что разные заболевания можно эффективно лечить разными препаратами, и что направленная доставка препарата в один орган или ткань может отличаться от способа доставки в другой орган или ткань. Специалистам в данной области должно быть понятно, что доза вводимого антагониста будет различной в зависимости, например, от млекопитающего, которому вводят данный агонист или антагонист, способа введения и других лекарственных средств или терапевтических методов, применяемых для лечения указанного млекопитающего.
В зависимости от типа клеток и/или тяжести заболевания начальная доза может составлять от 1 мкг/кг до 15 мг/кг (например, 0,1-20 мг/кг) антитела-антагониста в виде одного или нескольких отдельных введений или непрерывного вливания. Типичная суточная доза может составлять от около 1 мкг/кг до 100 мг/кг или больше в зависимости от вышеуказанных факторов. Лечение продолжают с учетом состояния субъекта до достижения требуемого подавления симптомов заболевания, для чего повторяют введение препарата в течение нескольких дней или более продолжительного периода времени. Однако могут быть использованы другие схемы приема лекарственного средства.
При осуществлении способов по настоящему изобретению может быть использован один тип антагониста. Например, может быть введена молекула иммуноадгезина WISP-1. Альтернативно, квалифицированный врач может использовать комбинацию антагонистов, например, комбинацию иммуноадгезина WISP-1 и антитела против WISP-1. Считается, что при осуществлении способов по настоящему изобретению может быть также проведено дополнительное лечение. Такие дополнительные виды лечения могут включать, не ограничиваясь ими, лучевую терапию, цитокины, ингибиторы роста, химиотерапевтические средства, цитотоксические средства, ингибиторы тирозинкиназы, ингибиторы расфарнезилтрансферазы, ингибиторы развития кровеносных сосудов и ингибиторы циклинзависимой киназы, которые известны в данной области и более подробно рассмотрены выше в разделе I. Кроме того, может быть проведено лечение с использованием терапевтических антител, направленно воздействующих на опухолевые антигены, таких как Rituxan™ или Herceptin™, а также антител, препятствующих развитию кровеносных сосудов, таких как антитела против VEGF.
Препараты и схемы применения химиотерапевтических средств могут быть подобраны в соответствии с инструкциями изготовителей или в результате эмпирического определения квалифицированным врачом. Препараты и схемы применения таких химиотерапевтических средств описаны также в публикации Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992). Химиотерапевтическое средство можно вводить до или после введения антагониста или одновременно с указанным антагонистом. Введение антагониста может быть, например, объединено с введением антиэстрогена, такого как тамоксифен, или антипрогестерона, такого как онапристон (см. европейский патент № 616812) в дозах, известных для таких молекул.
Может быть желательно ввести также антитела против других антигенов, например, антитела, связывающиеся с CD20, CD11a, CD18, CD40, CD44, ErbB2, EGFR, ErbB3, ErbB4, эндотелиальным фактором роста сосудов (VEGF) или другими членами семейства TNFR (такими как DR4, DR5, OPG, TNFR1, TNFR2). Альтернативно или дополнительно, субъекту могут быть введены два или большее число антител, связывающих один и тот же или два или более разных антигенов, рассмотренных в настоящем описании изобретения. Благоприятное действие иногда оказывает введение субъекту одного или нескольких цитокинов. В одном варианте осуществления изобретения антагонисты по настоящему изобретению вводят вместе с ингибитором роста. Например, сначала может быть введен ингибитор роста и затем антагонист по настоящему изобретению.
Антагонист и одно или несколько других лекарственных средств можно вводить одновременно или последовательно. После введения антагониста может быть произведен анализ in vitro подвергнутых воздействию клеток. При лечении in vivo состояние подвергнутого лечению млекопитающего можно контролировать разными способами, хорошо известными квалифицированному врачу.
Изделия
Другой вариант осуществления изобретения относится к изделию, содержащему вещества, используемые для лечения вышеуказанных заболеваний. Изделие включает контейнер и этикетку. Приемлемыми контейнерами являются, например, флаконы, пузырьки, шприцы и пробирки. Контейнеры могут быть изготовлены из разных материалов, таких как стекло или пластик. В контейнере с отверстием для стерильного доступа (например, указанный контейнер может представлять собой мешок для внутривенного раствора или пузырек с пробкой, проницаемой для иглы для подкожных инъекций) находится композиция, позволяющая эффективно лечить заболевание. Активные агенты в композиции могут включать один или несколько антагонистов. На этикетке, напечатанной на контейнере или прикрепленной к нему, должно быть указано, что данная композиция предназначена для лечения соответствующего заболевания. В комплект указанного изделия может далее входить второй контейнер, содержащий фармацевтически приемлемый буфер, такой как физиологический раствор с фосфатным буфером, раствор Рингера и раствор декстрозы. Указанное изделие может далее содержать другие вещества, желательные с коммерческой точки зрения или с точки зрения пользователя, которые включают другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши с инструкциями по применению.
Нижеследующие примеры приведены только для иллюстрации и никоим образом не ограничивают объем настоящего изобретения.
Все патенты и научные публикации, приведенные в настоящем описании изобретения, включены полностью в качестве ссылки.
Примеры
Коммерчески доступные реагенты, указанные в примерах, были использованы в соответствии с инструкциями изготовителя за исключением особо оговоренных случаев. Клетки, указанные в нижеследующих примерах и в описании изобретения под номерами доступа АТСС, предоставлены Американской коллекцией типовых культур, Манассас, шт. Виргиния. За исключением особо оговоренных случаев в настоящем изобретении использованы стандартные методы рекомбинантных ДНК, описанные выше и в следующих публикациях: Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press N.Y., 1989; Ausubel et al., Current Protocols in Molecular Biology, Green Publishing Associates and Wiley Interscience, N.Y., 1989; Innis et al., PCR. Protocols: A Guide to Methods and Applications, Academic Press, Inc., N.Y., 1990; Harlow et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, 1988; Gait, M.J., Oligonucleotide Synthesis, IRL Press, Oxford, 1984; R.I. Freshney, Animal Cell Culture, 1987; Coligan et al., Current Protocols in Immunology, 1991.
Ниже приведено описание анализов и веществ, указанных в нижеследующих примерах.
Белки и антитела. Непроцессированный слитый белок WISP-1-Fc человека был экспрессирован и очищен ранее описанным методом (Desnoyers et al., J. Biol. Chem., 276:47599-47607 (2991)). Очищенное антитело мыши против CD44 крысы (клон ОХ49) было предоставлено компанией BD Bioscience (Bedford MA). Изотипически сходное контрольное антитело IgG2a мыши было предоставлено компанией Pharmingen. Антитело мыши против CD44 крысы, конъюгированное с FITC, было предоставлено компанией Serotec (Raleigh, NC), изотипически сходное контрольное антитело IgG1 мыши, конъюгированное с FITC, было предоставлено компанией DAKO (Denmark). Антитело крысы против CD44 мыши (клон КМ114) было предоставлено компанией Pharmingen. Антитело к актину (клон С4) было предоставлено компанией ICN biomedicals (Aurora, OH). Моноклональные антитела мыши против WISP-1 человека были созданы и отобраны с использованием WISP-1-Fc в качестве иммуногена, и используемые для указанной цели методы и реагенты описаны в примерах патента США № 6387657, выданного 14 мая 2002 г. Пять таких моноклональных антител депонированы заявителями в АТСС, как указано ниже.
Клетки и образцы ткани. Линии клеток NRK-49F и SW480 (АТСС, Манассас, шт. Виргиния) помещали в модифицированную по способу Дульбекко среду Игла с высокой концентрацией глюкозы (HGDMEM), содержащую 10% фетальной телячьей сыворотки (FBS). Материнские клетки С57MG и клетки C57MG, экспрессирующие Wnt-1 (C57MG/Wnt-1), клетки NRK-49F, экспрессирующие hWISP-1 (NRK/WISP-1H) на высоком уровне, клетки NRK-49F, экспрессирующие hWISP-1 (NRK/WISP-1L) на более низком уровне, и клетки NRK-49F, содержащие пустой вектор (NRK/контрольные клетки), которые были предоставлены компанией Arnold Levine (Princeton University, Princeton, NJ), помещали в среду, содержащую 2,5 мкг/мл-1 пуромицина (Xu et al., Genes Dev., 14:585-595 (2000)). Трансгенных мышей по гену Wnt-1, предоставленных компанией Harold Varmus (National Cancer Institute, National Institute of Health, Bethesda, MD), спаривали с мышами с отсутствием гена р53, предоставленными компанией Jackson Laboratories (Bar Harbor, MA), с целью создания трансгенных мышей по гену Wnt-1 с выключенным геном р53. У указанных мышей брали для анализа образцы опухоли молочной железы и эпителия протока молочной железы.
Анализ методом исключения частиц. Скорость оседания эритроцитов определяли ранее описанным методом при внесении незначительных изменений (Knudson et al., J. Cell Sci., 99:227-235 (1991)). Клетки NRK/WISР-1 (нормальные фибробласты почки крысы, трансфицированные WISP-1; см. публикацию Xu et al., Genes Dev., 14:585-595 (2000)) и NRK/контрольные клетки (нормальные фибробласты почки крысы; предоставленные компанией Arnold Levine, Princeton University, Princeton, NJ) (1×105 клеток/лунку) высевали на 6-луночные планшеты Falcon (Becton Dickinson, Franklin Lanes, NJ) и выдерживали в модифицированной по способу Дульбекко среде Игла с высокой концентрацией глюкозы, содержащей 10% фетальной телячьей сыворотки (FBS) (Life Technologies, Gaithersburg, MD), в течение ночи при 37°С, 5% СО2. На следующий день среду удаляли, добавляли 108 RBC овцы (Inter-Cell Technologies, Hopewell, NJ) в 750 мкл PBS/0,1% BSA (Boehringer Mannheim, Indianapolis, IN) и оставляли для оседания в течение 15 минут. Клетки исследовали под инвертированным микроскопом Nilon Diaphot 300 и получали цифровые изображения при помощи цифровой фотокамеры DKC-5000 SONY (Япония).
Окрашивание гиалуронана в культивируемых клетках. Окрашивание гиалуронана выполняли ранее описанным методом при внесении незначительных изменений (Pienimaki et al., J. Biol. Chem., 276:20428-20435 (2001)). Клетки NRK/WISP-1 и NRK/контрольные клетки (8-10×103) культивировали на 8-луночных пластиковых планшетах и выдерживали (как было описано выше) в течение ночи при 37°С, 5% СО2. На следующий день клетки промывали физиологическим раствором с фосфатным буфером (PBS) и фиксировали 4% параформальдегидом в PBS в течение 20 минут при комнатной температуре. Клетки промывали PBS и сайты неспецифического связывания насыщали в течение 30 минут дистиллированной водой, содержащей 1% бычьего сывороточного альбумина (BSA) и 0,1% тритона Х-100 (Calbiоchem, LaJolla, CA). Добавляли биотинилированный НА-связывающий белок (НА-ВР) (Seikagaku America, Falmouth, MA) (5 мкг/мл в PBS/3% BSA) и инкубировали в течение ночи при комнатной температуре. На следующий день клетки промывали PBS и инкубировали в течение 30 минут со стрептавидином, конъюгированным с FITC, (1:1000) (DAKO, Carpinteria, CA) в TBS и 1% BSA. Клетки промывали в PBS, заключали в среду Vectashield (Burlingame, CA), содержащую 1 мкг/мл Hоechst 33342 (Molecular Probes, Eugene, OR) и визуализировали под флуоресцентным микроскопом Eclipse 800 Nikon. Снимки были получены с помощью видиокамеры CCD Photometrics 300, действующей при -40°С и присоединенной к компьютеру Apple G3. Тот же метод использовали для окрашивания замороженных срезов опухолей молочной железы, полученных у трансгенных мышей по гену Wnt-1.
Полимеразная реакция синтеза цепи с обратной транскрипцией (RT-PCR) в реальном времени. Относительный уровень экспрессии РНК определяли при помощи RT-PCR в реальном времени ранее описанным методом (Winer et al., Anal. Biochem., 270:41-49 (1999)). Общую РНК экстрагировали из клеток при помощи три-реагента в соответствии с инструкциями изготовителя (Molecular Research Center). Были созданы специфические затравки и флуорогенные зонды, которые использовали для амплификации и количественного определения уровня экспрессии генов. Специфические сигналы генов были нормализованы относительно обязательного гена глицеральдегид-3-фосфат-дегидрогеназы. Для каждого эксперимента усредняли три совокупности полученных данных. Все реагенты для RT-PCR TaqMan были приобретены в компании Applied Biosystems (Foster City, CA). Для исследования влияния рекомбинантного полипептида WISP-1 на экспрессию генов чашки Петри (35 мм) покрывали в течение ночи при 4°С 75 мкг/мл hWISP-1-Fс в PBS. На следующий день клетки (3×105 клеток/чашку) культивировали на поверхности с покрытием и через 18 часов выполняли анализ экспрессии. В некоторых случаях поверхность с покрытием промывали и обрабатывали в течение 2 часов при комнатной температуре, прежде чем произвести посев клеток.
Анализ методом сортировки клеток с возбуждением флуоресценции. Клетки обрабатывали трипсином, промывали РBS и инкубировали в РBS с 1% BSA/20% глюкозы, содержащем 1 мкг/мл антитела против CD44, конъюгированного с FITС, (Serotec, Raleigh, NC) или изотипически сходного контрольного антитела (DAKO, Denmark) в течение 30 минут при комнатной температуре. Клетки промывали тем же буфером и анализировали в устройстве XL-MCL EPICS (Coulter, Miami, FL).
Вестерн-блоттинг. Клетки NRK/C и NRK/W1H культивировали до слияния на 10 см2 планшетах. Клетки промывали РBS и экстрагировали 300 мкл 1% тритона-Х100 в TBS в течение 5 минут. Белки осаждали, добавляя к экстракту 10 объемов ацетона. Образцы восстанавливали, денатурировали и вводили в полиакриламидный гель с додецилсульфатом натрия в градиенте 4-20%. Гель переносили на мембраны из PVDF, зондировали антителом против CD44 крысы (ОХ49) или антителом против CD44 мыши (КМ114) в концентрации, равной 1 мкг/мл, и производили определение, используя HRP-конъюгированное вторичное антитело против IgG мыши и детектирующие реагенты ECL Amersham. Определение актина в образцах использовали в качестве нагрузочного эталона.
Анализ рассеяния. Клетки культивировали на 24-луночных планшетах при низкой концентрации (~1000 клеток/лунку) и оставляли для образования колоний на 3 дня. Клетки окрашивали красителем из набора Diff-Quik (Dade Behring, Newark, DE) и исследовали колонии под микроскопом.
Клеточный анализ заживления ран. Миграцию клеток исследовали при помощи ранее описанного клеточного анализа заживления ран при внесении незначительных изменений (Pienimaki et al., J. Biol. Chem., 276:20428-20435 (2001)). Клетки культивировали до слияния. В слое клеток проводили одну линию (~1 мм), используя микропипетку, оснащенную съемным желтым наконечником. Миграцию клеток на очищенном участке контролировали под микроскопом с замедленной съемкой при увеличенных интервалах времени между кадрами в течение 15 часов. Участок, вновь заполненный клетками по истечении указанного периода, измеряли при помощи программного обеспечения обработки изображений NIH, калиброванного микрометром на столике микроскопа.
Микроскопия с замедленной съемкой при увеличенных интервалах времени между кадрами. Клетки культивировали в HGDMEM/10% FBS и произвольную миграцию клеток исследовали в течение 15 часов под микроскопом с замедленной съемкой при увеличенных интервалах времени между кадрами. Расстояние, пройденное клетками, измеряли при помощи программного обеспечения обработки изображений NIH, калиброванного микрометром на столике микроскопа.
Анализ миграции. Гаптотаксис измеряли при помощи модифицированной системы камер Бойдена ранее описанным методом (Bourguignon et al., J. Biol. Chem., 275:1829-1838 (2000)). Нижнюю сторону мембранных фильтров РЕТ с размером пор 8 мкм в форме 24-луночного планшета (Falcon) покрывали в течение ночи при 4°С 50 мкл белка (50 мг/мл) в PBS. Покрытые перегородки промывали в бессывороточной среде и в верхнюю камеру добавляли 0,5×105 клеток NRK в 0,5 мл среды HGDMEM/10% PBS. Нижнюю камеру заполняли 0,75 мл такой же среды, и планшеты инкубировали в течение ночи при 37°С. На следующий день верхнюю камеру протирали ватным тампоном, клетки, мигрировавшие на нижнюю сторону перегородки, окрашивали красителем из набора Diff-Quik (Dade Behring Inc.) и подсчитывали под микроскопом. Для каждого эксперимента усредняли три совокупности полученных данных. В некоторых случаях покрытые перегородки промывали и обрабатывали в течение 2 часов при комнатной температуре.
Гибридизация in situ. Были созданы затравки для PCR, позволяющие амплифицировать фрагмент длиной 740 п.о. WISP-1 мыши в интервале нуклеотидов 440-1180 NM_018865 (верхняя область - 5' GGCTGCCATCTGTGACCCA (SEQ ID NO:12) и нижняя область - 5' CATAGGACCT GCCGGGAGAA A (SEQ ID NO:13)), фрагмент длиной 706 п.о. WISP-1 мыши в интервале нуклеотидов 204-910 NM_018865 (верхняя область - 5' GCCGTGGCAGTCCTGAGGG (SEQ ID NO:14) и нижняя область - 5' CAGCACCGGG CATTGACGTT A (SEQ ID NO:15)), фрагмент длиной 464 п.о. CD44 мыши в интервале нуклеотидов 144-608 М27129 (верхняя область - 5' TGGAGAAAAATGGCCGCTAC A (SEQ ID NO:16) и нижняя область - 5' TGGGGTGCTC TTCTCGATGG (SEQ ID NO:17)) или фрагмент длиной 630 п.о. HAS2 мыши в интервале нуклеотидов 927-1557 NM_008216 (верхняя область - 5' GGACAAATCGGCCACGTACA T (SEQ ID NO:18) и нижняя область - 5' CTTGCTCCAT CGGGTCTGC (SEQ ID NO:19)). Затравки включали удлиняющие сегменты, кодирующие 27-нуклеотидные сайты инициации РНК-полимеразы Т7 или Т3, которые позволяют выполнять транскрипцию in vitro соответственно смысловых или антисмысловых зондов из амплифицированных продуктов (Lu et al., Cell Vision, 1:169-176 (1994)). Все ткани фиксировали в 4% формалине и заливали парафином. Срезы толщиной 3-5 микрон удаляли из парафина, извлекали белки в 4 мг/мл протеиназы К в течение 30 минут при 37°С и подвергали дальнейшей обработке для гибридизации in situ ранее описанным методом (Holcomb et al., EMBO J., Aug. 2000 1; 19(15):4046-55). Смысловые и антисмысловые зонды, меченные33Р-UTP, гибридизировали со срезами при 55°С в течение ночи. Негибридизированный зонд удаляли в результате инкубации в 20 мг/мл РНКазы А в течение 30 минут при 37°С, срезы промывали в строгих условиях при 55°С в 0,1×SSC в течение 2 часов и дегидратировали в градиенте этанолов. Препараты погружали в эмульсию для отслеживания ядер NBT2, выдерживали в запечатанных пластиковых коробках для препаратов с дессикантом в течение 4 недель при 4°С, проявляли и подвергали контрастному окрашиванию гематоксилином и эозином.
Пример 1
Устойчивые линии фибробластов, экспрессирующих WISP-1 на высоком (NRK/WISР-1H) или низком (NRK/WISP-1L) уровнях, и линию контрольных клеток, содержащих пустой вектор, (NRK/контрольные клетки) использовали для определения влияния WISP-1 на продуцирование гиалуроновой кислоты (НА). Как показали результаты анализа методом исключения частиц, вокруг клеток NRK/WISР-1H образовалась большая пленка из гиалуронана, способная сделать невозможным оседание эритроцитов (фиг.1A). Вокруг клеток NRК/WISP-1L образовался матрикс меньшего размера (фиг.1B), при этом вокруг NRK/контрольных клеток (фиг.1C) или клеток NRK/WISP-1H, обработанных гиалуронидазой, матрикс отсутствовал (данные не показаны).
Накопление гиалуроновой кислоты по поверхности клеток определяли также методом флуоресцентного окрашивания с использованием биотинилированного НА-связывающего белка (bHABP). Окрашивание позволило обнаружить накопление гиалуроновой кислоты на поверхности клеток NRК/WISP-1H (фиг.1D), при этом окрашивание не было обнаружено на контрольных клетках NRK (фиг.1E).
Воздействие WISP-1 на секрецию гиалуроновой кислоты определяли, сравнивая накопление НА в культуральной среде, содержащей клетки NRK/WISP-1H или NRK/контрольные клетки, с течением времени. Через 24 часа концентрация НА в среде с NRK/WISP-1H была в 3,5 раза больше, чем в среде с NRK/контрольными клетками, и постепенно увеличилась в 8 раз через 144 часа (фиг.1F). Полученные результаты показывают, что экспрессия WISP-1 в клетках NRK стимулирует накопление гиалуроновой кислоты (НА) на поверхности клеток и в культуральной среде.
Пример 2
Для идентификации фермента, отвечающего за запуск полипептидом WISP-1 продуцирования гиалуроновой кислоты (НА), анализировали экспрессию известных синтаз НА (HAS1, HAS2 и HAS3) в клетках NRK/WISP-1H, NRK/WISP-1L и NRK/контрольных клетках. Экспрессия HAS2 увеличилась в 10 раз в клетках, продуцирующих WISP-1, в то время как уровни мРНК HAS1 и HAS3 были идентичны контрольным клеткам (фиг.2A). Уровни мРНК CD44 и RHAMM также увеличились в линиях клеток NRK/WISP-1, при этом экспрессия гиалуронидазы осталась без изменения (фиг.2A). Кроме того, уровни мРНК HAS2, CD44 и RHAMM были пропорциональны экспрессии WISP-1. Как показали результаты анализа FACS (фиг.2B) и вестерн-блоттинга (фиг.2C), увеличение экспрессии мРНК CD44 в клетках NRK/WISP-1H вызвало 4-кратное повышение уровня белка CD44.
Пример 3
Как было показано, гиалуроновая кислота стимулирует миграцию клеток, взаимодействуя с двумя рецепторами на поверхности клетки, CD44 и RHAMM (Hall et al., см. выше; Bourguignon et al., см. выше). Так как WISP-1 увеличивал как продуцирование гиалуроновой кислоты, так и экспрессию CD44 и RHAMM, определяли подвижность клеток, экспрессирующих WISP-1. При культивировании с низкой плотностью NRK/контрольные клетки пролиферировали и образовывали хорошо выраженные колонии (фиг.3A). Пролиферирующие клетки NRK/WISP-1L образовывали менее выраженные группы, так как некоторые клетки отделялись от растущих колоний (фиг.3B). Клетки NRK/WISP-1H не образовывали колонии и произвольно рассеивались (фиг.3C). В отличие от контрольных клеток (фиг.3D) клетки, экспрессирующие WISP-1, имели сверхудлиненную морфологию с выраженной пластинчатостью, характерную для большой подвижности (фиг.3E). В результате выполнения микроскопии с замедленной съемкой при увеличенных интервалах времени между кадрами было обнаружено 4-кратное увеличение расстояния миграции клеток NRK/WISP-1H по сравнению с контрольными клетками (фиг.3F). При выполнении клеточного анализа заживления ран также было обнаружено 2,5-кратное увеличение площади миграции клеток NRK/WISP-1H (фиг.3G). Полученные результаты показывают, что экспрессия WISP-1 может стимулировать миграцию клеток.
Пример 4
Чтобы определить, может ли эктопическое добавление WISP-1 стимулировать экспрессию HAS2 и миграцию клеток, выполняли анализ с использованием очищенного рекомбинантного WISP-1-IgG (Desnoyers et al., см. выше). Добавление WISP-1 в культуральную среду не стимулировало экспрессию HAS2 (данные не показаны). При культивировании клеток NRK на поверхности, покрытой WISP-1-IgG, экспрессия HAS2 увеличивалась по сравнению с клетками, культивируемыми на пластиковой поверхности без покрытия или на поверхности, покрытой неродственным химерным белком IgG (TNFR-IgG) (фиг.4A). Хотя декорин, используемый отдельно, стимулировал экспрессию HAS2, подобная индукция увеличилась в три раза после инкубации на поверхности с покрытием с WISP-1. Был также исследован эффект эктопического добавления WISP-1 на миграцию клеток NRK. При выполнении анализа переноса WISP-1-IgG вызывал гаптотаксическую миграцию клеток NRK при покрытии нижней поверхности фильтра (фиг.4B). Покрытие неродственным химерным белком IgG (TNFR-IgG) или добавление WISP-1-IgG в нижнюю камеру не стимулировало миграцию. Антитело против CD44 или WISP-1 (фиг.4B) ингибировало гаптотаксическую миграцию, индуцированную WISP-1. Кроме того, гаптотаксическая активность WISP-1 не ограничивалась фибробластами, так как WISP-1 также стимулировал миграцию клеток SW480, представляющих собой линию клеток аденокарциномы ободочной кишки (фиг.4C). Полученные результаты показывают, что эктопическое добавление WISP-1 увеличивает экспрессию HAS2 и стимулирует миграцию клеток через CD44-опосредованный механизм. Считается, хотя данное явление до конца не изучено, что представление WISP-1 может иметь важное значение для миграции, поскольку может потребоваться его связывание с субстратом для проявления такой активности.
Пример 5
Так как считается, что WISP-1 является расположенным в нижней области эффектором Wnt-1, анализировали экспрессию WISP-1, HAS2 и CD44 в линии эпителиальных клеток молочной железы, устойчиво трансфицированных Wnt-1 (C57MG/Wnt-1). При сравнении с линией контрольных клеток (C57MG) в клетках C57MG/Wnt-1 наблюдалось соответственно 2,7-, 5,8- и 3-кратное увеличение экспрессии мРНК WISP-1, HAS2 и CD44 (фиг.5A). Как показали результаты вестерн-блоттинга, клетки С57/Wnt-1 характеризовались также 6-кратным увеличением содержания белка CD44 (фиг.5B). Кроме того, в отличие от линии контрольных клеток, клетки, экспрессирующие Wnt-1, не образовывали четко выраженных колоний и рассеивались при введении в культуру с низкой плотностью (фиг.5C). Полученные результаты показывают, что экспрессия HAS2 и CD44 и подвижность клеток увеличиваются в линиях клеток, в которых Wnt-1 индуцирует экспрессию WISP-1.
Пример 6
Экспрессия Wnt-1 в эпителии молочной железы стимулирует развитие опухоли у трансгенных мышей (Li et al., Oncogene, 19:1002-1009 (2000); Tsukamoto et al., Cell, 55:619-625 (1988)). Так как WISP-1 предположительно является расположенным в нижней области эффектором Wnt-1, измеряли экспрессию мРНК HАS2 и CD44 в спонтанно возникающих опухолях молочной железы у трансгенных мышей MMTV-Wnt-1. При сравнении с эпителием протоков молочной железы экспрессия мРНК HAS2 была увеличена в 2,5-5,5 раза во всех подвергнутых анализу опухолях молочной железы (n=5, фиг.5D). Аналогичным образом экспрессия мРНК CD44 была в 2,2-4,2 раза выше во всех опухолях (n=5; фиг.5E). Полученные результаты показывают, что HAS2 и CD44 сверхэкспрессированы в экспрессирующих WISP-1 опухолях молочной железы у трансгенных мышей MMTV-Wnt-1.
Пример 7
Гибридизация in situ показала повышенную экспрессию WISP-1 в околоопухолевой строме опухолей молочной железы у трансгенных мышей MMTV-Wnt-1 (фиг. 6A, B). В отличие от этого экспрессия HAS2 (фиг. 6C-D) и CD44 (фиг.6E-F) была обнаружена только в эпителиальных опухолевых клетках. Локализация CD44 в паренхиме опухоли была подтверждена иммуногистохимическим анализом (фиг.6G). Окрашивание связующего белка выявило накопление гиалуронана в опухолевой строме (фиг.6H). Наибольшая интенсивность окрашивания была обнаружена в непосредственной близости от дольки опухоли, в то время как более слабое окрашивание было локализовано в нормальном эпителии протока молочной железы. Полученные результаты совместимы с предположением о том, что WISP-1 может регулировать взаимодействие между опухолью и стромальными клетками при участии гиалуроновой кислоты и CD44.
Пример 8
Метастазирование и способность к росту трансформированных линий клеток определяли ранее описанным методом (Welch et al., Cancer Res., 60:1552-1556 (2000)). Использовали самок швейцарских мышей nu/nu в возрасте девяти недель. Клетки обрабатывали трипсином и дважды промывали PBS. Каждой мыши инъецировали в боковую хвостовую вену 100 мкл суспензии, содержащей 5×104 или 2,5×105 клеток. Через 2, 3 и 4 недели после инъекции мышей исследовали методом ЯМР-томографии (MRI) для выявления поражений легких и производили аутопсию. Легкие погружали в фиксатор Боуина, полученные срезы окрашивали H&E и использовали для определения образования колоний в опухоли легкого.
Исследовали продольные срезы левого легкого и по одному поперечному срезу краниальных, медиальных, каудальных и вспомогательных долей правого легкого. В гистологическом отношении пораженные легкие имели веретенообразные опухолевые клетки, которые проникали в интерстициальную ткань легких. Однако, поскольку величина изменений была различной, была создана нижеследующая система градации.
I = Минимальное поражение интерстициальной ткани легкого - поражено 10-20% легкого. Скопления и кластеры веретенообразных опухолевых клеток разрушают интерстициальную ткань легкого в нескольких очагах. Очаги поражения обычно расположены на поверхности плевры, проникая в интерстициальную ткань. Сосуды или основные дыхательные пути не поражены.
II = Среднее поражение интерстициальной ткани легкого - поражено 20-50% легкого. Скопления и кластеры веретенообразных опухолевых клеток разрушают интерстициальную ткань легкого в нескольких очагах. Некоторые сосуды или основные дыхательные пути заполнены веретенообразными клетками. Веретенообразные клетки часто образуют широкую полосу или большую массу рядом с плеврой и проникают в интерстициальную ткань. Верхний мезотелий является распухшим (реактивным).
III = Сильное поражение интерстициальной ткани легкого - поражено 50-100% легкого. Скопления и кластеры веретенообразных опухолевых клеток разрушают интерстициальную ткань легкого в нескольких очагах. Кровеносные сосуды и основные дыхательные пути заполнены веретенообразными клетками. Веретенообразные клетки образуют широкую полосу или большую массу рядом с плеврой и проникают в интерстициальную ткань. Веретенообразные клетки часто погружены в светлое базофильное или амфофильное бесклеточное вещество. Верхний мезотелий является распухшим (реактивным). Остается минимальный непораженный участок для газообмена.
Результаты образования колоний в легких “голых” мышей, инокулированных клетками NRK/WISP-1H, NRK/WISP-1L и NRK/контрольными клетками, суммированы на фиг.7 и 10. У мышей, инокулированных NRK/WISP-1H или NRK/WISP-1L, клетки образовывали массы в легких в зависимости от времени и дозы. Наиболее сильные поражения наблюдались у мышей, которым инъецировали 2,5×105 NRK/WISP-1H и подвергали аутопсии через 4 недели после инъекции. Через 2 и 3 недели после инъекции у мышей имело место менее сильное, но прогрессирующее развитие опухоли (степень I-II; см. приведенную выше систему градации). У мышей, которым инъецировали 2,5×105 NRK/WISP-1L, наблюдалось минимальное образование опухоли в легком через 4 недели после инъекции. Через 4 недели после инъекции мыши, которым инокулировали 0,5×105 клеток NRK/WISP-1L, оставались здоровыми или характеризовались минимальной инфильтрацией опухолевых клеток (стадия I), в то время как у мышей, которым инъецировали 0,5×105 клеток NRK/WISP-1H, наблюдалась повышенная инфильтрации опухолевых клеток (стадия I-II). Гистологическое исследование показало, что легкие животных, которым инокулировали NRK/контрольные клетки, оставались здоровыми (фиг.7A-C). У животных, которым инъецировали NRK/WISP-1, опухолевые веретенообразные клетки первоначально образовывали небольшие кластеры, расположенные внутри или рядом с плевральной поверхностью легких (стадия I; фиг.7D-F), которые часто были погружены в светлое базофильное или амфофильное бесклеточное вещество. У животных, пораженных в большей степени, опухолевые клетки образовывали широкую слитую полосу рядом с плеврой (стадия II; фиг.7G-I). У животных, пораженных в наибольшей степени, кровеносные сосуды и основные дыхательные пути были заполнены веретенообразными клетками (стадия III; фиг.7J-L). ЯМР-томография показала наличие повышенной плотности (гиперсигнал) в правом и левом легких вдоль плевры у животных с гистологическим поражением на стадиях II и III. Тяжесть поражения, выявленная при выполнении ЯМР-томографии, была сопоставима с гистологической оценкой (фиг.7A, D, G, J). Полученные результаты показывают, что экспрессия WISP-1 стимулирует рост клеточных метастазов.
Пример 9
Клетки NRK/WISP-1H (2,5×105 клеток) инокулировали в хвостовую вену “голым” мышам. Начиная со дня инокуляции клеток мышам внутрибрюшинно дважды в неделю инъецировали 10 мг/кг антитела против CD44, изотипически сходного контрольного антитела или только буфера (PBS). Легкие фиксировали и иссекали через четыре недели для выполнения макроскопического анатомического анализа.
Через 4 недели тяжесть поражений, обнаруженных у животных, которым вводили антитело против CD44 (n=5), изменялась от нормального состояния до поражения стадии I, в то время как у всех животных (n=10), которым вводили контрольное антитело или физиологический раствор, возникли поражения стадии III (фиг.8A). Средняя площадь метастатических очагов в легких животных, которым вводили антитело против CD44, сократилась на 99% (Р<0,00003) по сравнению с животными, которым вводили контрольное антитело (фиг.8B).
Пример 10
Исследовали специфичности связывания определенных антител против WISP-1. Непроцессированный полипептид WISP-1 мыши (номер доступа в банке генов GenBank NM_018865) и непроцессированный полипептид WISP-1 человека (номер доступа в банке генов GenBank AF100779; фиг.9) клонировали в экспрессирующем векторе, кодирующем Fc-область IgG-1 человека внизу от последовательности WISP-1. Полученный рекомбинантный слитый белок (WISP-1-Fc) синтезировали в бакуловирусной экспрессирующей системе с использованием клеток насекомых Sf9 и очищали до гомогенного состояния от бессывороточной кондиционированной среды методом аффинной хроматографии на колонке с белком А-сефарозой 4 и высокой скоростью потока (Amersham Pharmacia Biotech). Непроцессированный полипептид WISP-1 человека также экспрессировали с аминоконцевой гексагистидиновой меткой (WISP-1-His) в штамме E. coli. Клеточный лизат подвергали хроматографии на колонке с агарозой Ni2+-NTA (Qiagen). WISP-1-His элюировали в градиенте имидазола от 0 до 500 мМ. Фракции, содержащие элюированный WISP-1-His, собирали и подвергали диализу. WISP-1 человека был получен из экспрессирующей системы млекопитающих путем лизинга клеток NRK, устойчиво трансфицированных WISP-1 человека (Arnold Levine; Princeton University, Princeton, NJ), буфером для SDS-PАGE. Лизат контрольных клеток был получен с использованием клеток NRK, устойчиво трансфицированных пустым вектором.
WISP-1 (50 нг) из разных экспрессирующих систем подвергали электрофорезу на полиакриламидном геле с SDS, переносили с помощью электрошока на поливинилдифторидные (PVDF) мембраны и зондировали разными моноклональными антителами против WISP-1.
Антитела против WISP-1 3D11.D7 (определяемые также как “3D11”), 11С2.С10 (определяемые также как “11C2”), 9С11.С7 (определяемые также как “9C11”) и 5D4.F6 (определяемые также как “5D4”) специфически связывались с WISP-1, полученным из бакуловирусной и бактериальной экспрессирующих систем, а также из экспрессирующей системы млекопитающего (фиг.11A). Указанные антитела не связывались с WISP-1 мыши, полученным из бакуловируса, и не узнавали белок из контрольного лизата. Антитела против WISP-1 6F8, 3A7, 10H12, 3A11, 6E3, 3H10, 5G1 и 10В1 узнавали WISP-1 человека и мыши только при создании в бакуловирусной экспрессирующей системе (фиг.11B). Указанные антитела не узнавали WISP-1 человека при продуцировании в бактериальной экспрессирующей системе или экспрессирующей системе млекопитающего. Антитело из клона 9С10 не связывалось ни с одним белком по результатам вестерн-блоттинга.
Полученные результаты позволяют предположить, что антитела против WISP-1 3D11, 11C2, 9C11 и 5D4 специфически узнают WISP-1 человека и могут быть использованы для обнаружения WISP-1 методом вестерн-блоттинга.
Пример 11
Выполняли анализ для идентификации эпитопов, узнаваемых антителами против WISP-1 11C2, 9C11, 5D4 и 3D11.
Непроцессированный полипептид WISP-1 человека (номер доступа в банке генов GenBank AF100779) клонировали в экспрессирующем векторе pIRESpuro2 (Clontech Laboratories, Palo Alto, CA), кодирующем 6 остатков гистидина внизу от последовательности WISP-1. Кроме того, были созданы делеционные мутанты путем удаления одного, двух или трех доменов WISP-1 человека. Полученные конструкции также клонировали в экспрессирующем векторе pIRESpuro2. Номенклатура, использованная для идентификации разных конструкций WISP-1, относится к их доменам. (см. фиг.12В). Домен 1 являетcя доменом белка, связывающим инсулиноподобный фактор роста (IFGBP), домен 2 является доменом фактора С фон Виллебранда (VWFc), домен 3 является тромбоспондином (TSP), домен 4 является С-концевым (СТ) доменом. Вариабельная область расположена между доменами 2 и 3. Указанные области и домены WISP-1 показаны на фиг.12А.
Ниже приведены последовательности, кодирующие указанные домены WISP-1. Последовательности конструкций WISP-1:
Домен 1:

Домен 2:
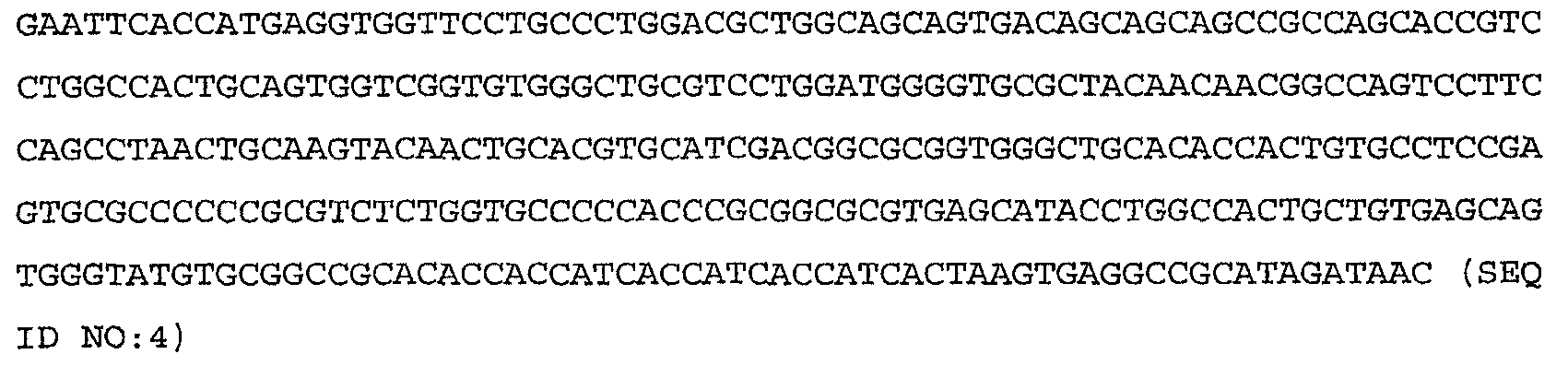
Домен 3:
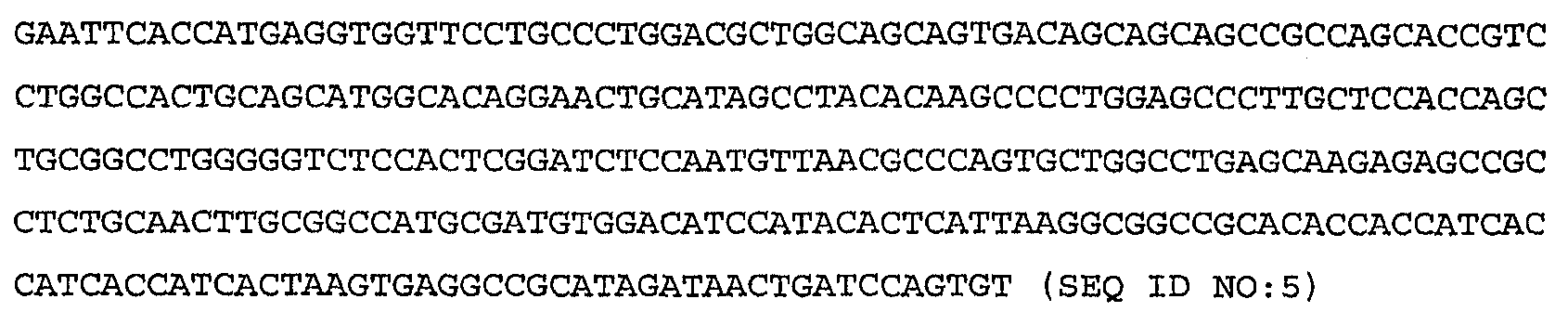
Домен 4:

Домен 1, 2:
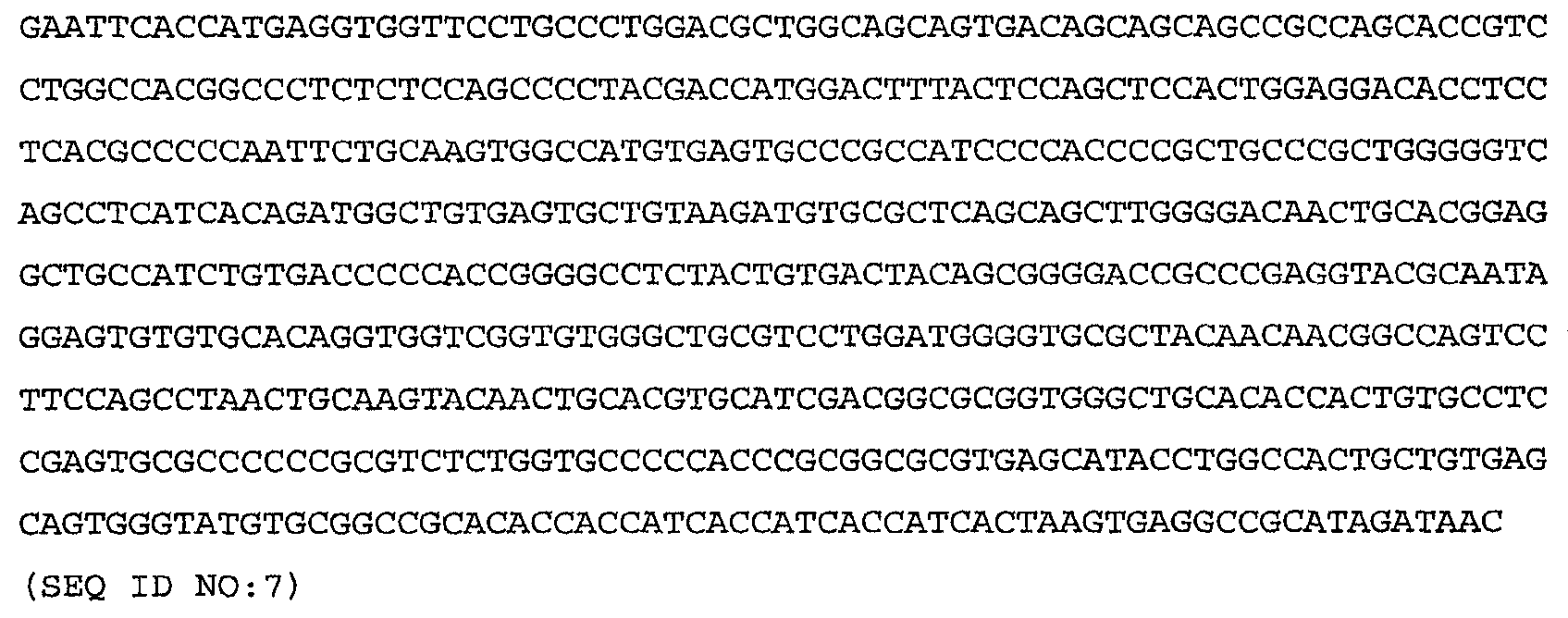
Домен 1, 2, 3:


Домен 1, 2, 4:
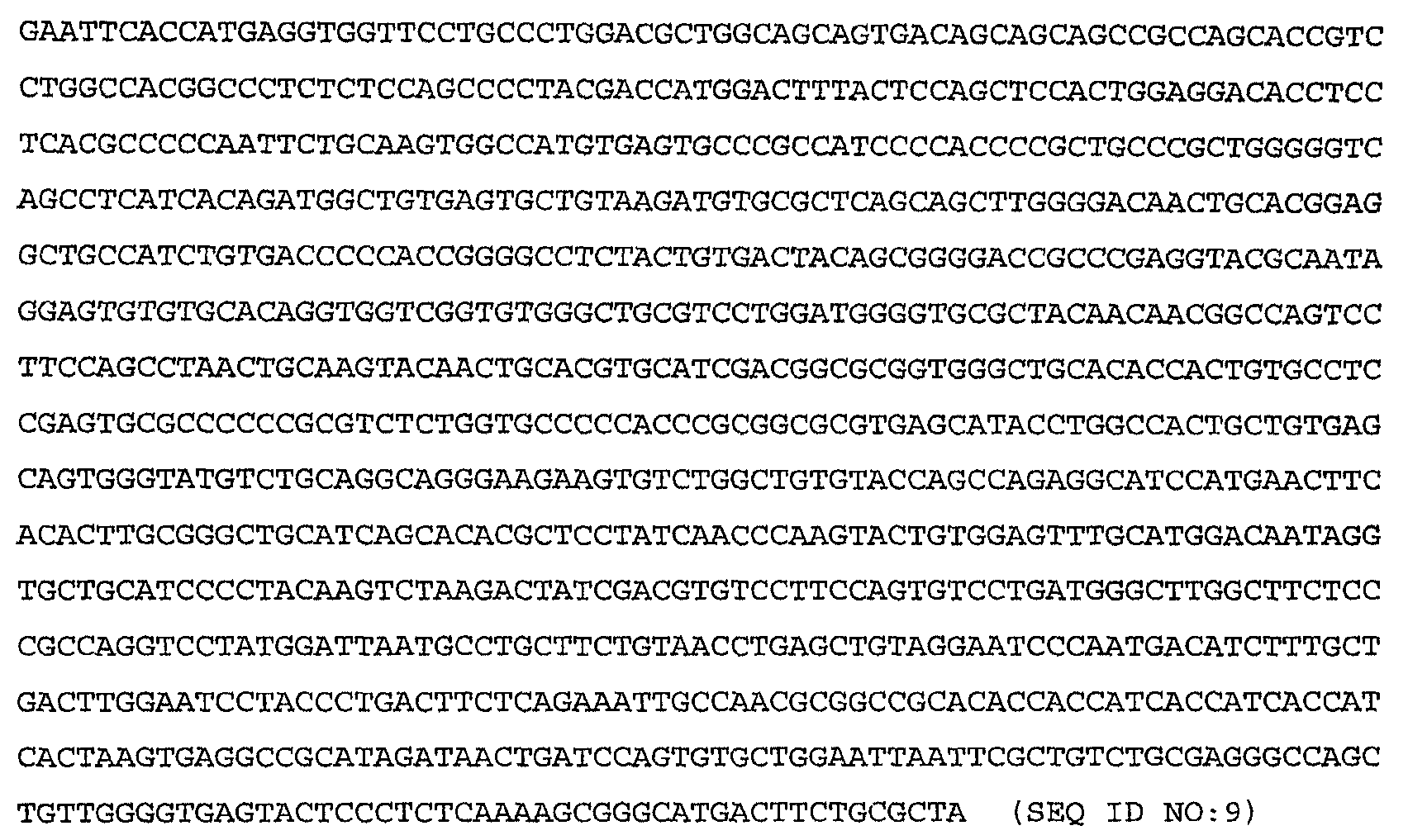
Домен 1, 3, 4:

Домен 2, 3, 4:


Клетки (НЕК 293Т) трансфицировали разными конструкциями и культуральную среду собирали через 48 часов. Один миллилитр культуральной среды инкубировали с 20 мкл кобальт-агарозы в течение 1 часа, центрифугировали и промывали. Абсорбированные белки элюировали, нагревая осадок после центрифугирования при 100°С в течение 5 минут в 20 мкл буфера для SDS-PAGE. Образцы подвергали электрофорезу, переносили с помощью электрошока на PVDF и зондировали разными антителами против WISP-1.
Антитела 11С2, 9С11 и 5D4 узнавали только конструкции WISP-1, содержащие 19 первых аминокислот вариабельной области, расположенной между доменами 2 и 3 (фиг.12С, 12Е, 12G). Антитело против WISP-1 3D11 узнавало только конструкции WISР-1, содержащие домен 1 (аминокислоты 24-177; фиг.12D, 12F).
Полученные результаты показывают, что антитела 11С2, 9С11 и 5D4 специфически узнают вариабельную область WISP-1, в то время как антитело 3D11 специфически узнает домен 1 WISP-1.
Пример 12
Выполняли анализ для идентификации эпитопа, узнаваемого антителом против WISP-1 9С10.F5 (определяемым также как “9C10”).
Культуральную среду клеток НЕК 293Т, трансфицированных разными делеционными конструкциями WISP-1 (описанными выше в примере 11), инкубировали с 1 мкг антитела против WISP-1 9C10 и 20 мкл белка А-агарозы в течение 1 часа при комнатной температуре. Иммунный комплекс осаждали центрифугированием и элюировали, нагревая осадок после центрифугирования при 100°С в течение 5 минут в 20 мкл буфера для SDS-PAGE. Образцы подвергали электрофорезу, переносили с помощью электрошока на PVDF и зондировали антителом против WISP-1 11С2.
Антитело 9С10 вызывало иммунопреципитацию только конструкций, содержащих домен 1 WISP-1 (фиг.13). Полученные результаты показывают, что антитело 9С10 специфически узнает домен 1 WISP-1 и может быть использовано для иммунопреципитации.
Пример 13
Планшеты Maxisorb покрывали в течение ночи при 4°С антителом против WISP-1 9С10 (100 мкл 2 мкг/мл в карбонатном буфере, рН 9,6). Планшеты блокировали 200 мкл PBS/3% BSA в течение 1 часа. Строили стандартную кривую серийных разведений WISP-1-Fc (100 мкл в PBS/3% BSA) и инкубировали планшеты в течение 1 часа. После инкубации планшеты промывали 100 мкл PBS/0,05% твина и в течение 1 часа инкубировали антитела против WISP-1 (100 мкл 2 мкг/мл) в PBS/3% BSA (биотинилированное антитело 11С2 или 55В). При использовании биотинилированного антитела 11С2 планшеты продолжали инкубировать с 2 мкг/мл HRP-конъюгированного стрептавидина. При использовании антитела 55В планшеты промывали и инкубировали с HRP-конъюгированным антителом осла против IgG кролика в течение 1 часа. В конце инкубации лунки 6 раз промывали 200 мкл физиологического раствора с фосфатным буфером (PBS), содержащего 0,05% твина-20, и визуализировали сигнал, используя 100 мкл хромогенного субстрата ТМВ на основе пероксидазы из хрена (Kirkegaard & Perry Laboratories). Взаимодействие прекращали, добавляя 100 мкл 1М раствора фосфорной кислоты, и измеряли оптическую плотность (OD) при 450 нм. Неспецифическое связывание определяли в параллельных инкубациях без покрытия лунок титрационного микропланшета. При отсутствии WISP-1-Fc или антитела против WISP-1 сигнал не возникал.
Используя антитело 9С10 для улавливания и антитела 11С2 и 55В для обнаружения выполняли анализ ELISA, позволяющий обнаружить концентрацию WISP-1, равную всего 0,4 мкг/мл (фиг.14). Анализ ELISA может быть использован для обнаружения белка WISP-1 в таких биологических жидкостях как сыворотка.
Пример 14
Планшеты Maxisorb покрывали в течение ночи при 4°С 50 мл/лунку 10 мкг/мл гепарина (Sigma). Сайты неспецифического связывания блокировали 200 мкл PBS/3% BSA в течение 1 часа. Затем планшеты инкубировали в течение 1 часа с 50 мкл 6 мкг/мл hWISP-1-Fc в PBS/3% BSA в присутствии серийных разведений антител против WISP-1. Планшеты промывали PBS/0,05% твина и продолжали инкубировать в течение 1 часа с 50 мкл 2 мкг/мл HRP-конъюгированного антитела против IgG-Fc человека в PBS/3% BSA. Планшеты промывали и добавляли 100 мкл субстрата на основе HRP (ТМВ). Окрашивание прекращали, добавляя 100 мкл 1М раствора фосфорной кислоты, и измеряли оптическую плотность при 450 нм.
Антитела против WISP-1 11С2, 5D4 и 9С11 ингибировали связывание WISP-1 с гепарином при значении IC50, соответственно равном 1,9, 2,5 и 3,7 мкг/мл (фиг.15). Антитело 3D11 умеренно уменьшало связывание WISP-1 с гепарином при максимальном ингибировании, равном 62% при наибольшей испытанной концентрации (40 мкг/мл). Антитело 9С10 не ослабляло связывание WISP-1 с гепарином, при этом кривая ингибирования была аналогична кривой неродственного контрольного антитела.
Полученные результаты показывают, что антитела, узнающие вариабельную область, могут ингибировать связывание WISP-1 с гепарином. Так как два антитела против WISP-1, узнающие домен 1, оказывают небольшое влияние или вообще не влияют на связывание WISP-1 с гепарином, в настоящее время считается менее вероятным участие домена 1 в указанном взаимодействии.
Пример 15
Гаптотаксис измеряли, используя модифицированную систему камер Бойдена. Нижнюю сторону мембранных фильтров РЕТ с размером пор 8 мкм в форме 24-луночного планшета (Becton Dickinson, Franklin Lakes, New Jersey) покрывали в течение ночи при 4°С 50 мкл белка (50 мкг/мл) в PBS. В верхнюю камеру помещали нормальные клетки почки крысы (NRK; 5×104/0,5 мл HGDMEM/10% FBS), нижнюю камеру заполняли такой же средой и планшеты инкубировали при 37°С. На следующий день верхнюю камеру протирали ватным тампоном, клетки, мигрировавшие на нижнюю сторону перегородки, окрашивали и подсчитывали под микроскопом. Для каждого эксперимента усредняли три совокупности полученных данных. В некоторых случаях покрытые перегородки промывали и обрабатывали в течение 2 часов при комнатной температуре.
При выполнении анализа переноса WISP-1-Fc, нанесенный на нижнюю поверхность фильтров, индуцировал гаптотаксическую миграцию клеток NRK (фиг.16А). Покрытие неродственным химерным белком IgG (TNFR-Fc) или добавление WISP-1-Fc в нижнюю камеру не стимулировало миграцию. В присутствии WISP-1-Fc пять разных антител против WISP-1 (9C10, 11C2, 3D11, 9C11, 5D4) значительно ингибировали миграцию клеток. При отсутствии WISP-1-Fc указанные антитела не влияли на миграцию клеток. Полученные результаты показывают, что антитела против WISP-1 могут модулировать миграцию клеток в присутствии WISP-1. Благодаря своей способности блокировать миграцию клеток антитела против WISP-1 могут иметь важное терапевтическое значение для предотвращения развития рака.
Характеристики и свойства антител 3D11, 9C10, 11C2, 5D4 и 9С11, рассмотренных в примерах, суммированы на фиг.16В.
Пример 16
Самкам швейцарских мышей nu/nu в возрасте девяти недель инъецировали в боковую хвостовую вену 100 мкл суспензии, содержащей 2,5×105 клеток. Начиная со дня инокуляции мышам два раза в неделю внутрибрюшинно инъецировали (10 мг/кг) антитела против WISP-1 (9C11, 11C2, 5D4, 9C10, 3D11) или изотипически сходное контрольное антитело. Через 3 недели легкие перфузировали 4% нейтральным забуференным формалином, иссекали и изготавливали срезы, окрашенные H&E. Исследовали продольные срезы левого легкого и по одному поперечному срезу краниальных, медиальных, каудальных и вспомогательных долей правого легкого. Для каждого препарата подсчитывали число метастатических очагов и с помощью программного обеспечения SPOT RT (Diagnostic Instruments Incorporated, Burlingame, California) измеряли среднюю площадь метастатических очагов. Площадь (мкм2) определяли, по крайней мере, для пяти отдельных метастатических очагов в четырех срезах легкого.
Через 3 недели поражения, обнаруженные у животных, которым вводили антитело против WISP-1, стали значительно меньше по сравнению с контрольными животными (фиг.17A, B). Число узлов и средняя площадь метастатических очагов у мышей, которым вводили антитела против WISP-1 (n=5), сократились по сравнению с животными, которым вводили контрольное антитело (фиг.17C, D). Кроме того, при введении антитела против WISP-1 общая площадь поражений легкого уменьшилась на 82-97% по сравнению с животным, которому вводили изотипически сходное контрольное антитело (фиг.17E). Полученные результаты показывают, что антитела против WISP-1 эффективно уменьшают in vivo опухолевую массу, относящуюся к метастазам. Несмотря на то что механизм действия антител против WISP-1 до конца не изучен, считается, что эффективность указанных антител может быть опосредована способностью уменьшать рост и/или ингибировать подвижность, инвазию и диссеминацию раковых клеток в ткани.
Пример 17
Непроцессированный полипептид WISP-1 мыши (номер доступа в банке генов GenBamk NM_018865) клонировали в экспрессирующем векторе pRK млекопитающего. Полученную конструкцию (pRK-WISP-1; 18 мкг) котрансфицировали с 2 мкг плазмиды pSVi-пуромицина в линию клеток аденокарциномы молочной железы мыши 4Т1 (предоставленную д-ром Фредом Миллером, Barbara Ann Karmanos Cancer Institute, Detroit, MI), используя фуген-6 (Roche) в соответствии с инструкциями изготовителя. Через 2 дня клетки отбирали в 2 мкг/мл пуромицина. Через 2 недели клоны выделяли и определяли экспрессию WISP-1 иммунофлуоресцентным методом. Аналогичным образом создавали линии контрольных клеток, используя пустой вектор. Полученные линии 4Т1/контрольных клеток и клеток 4Т1/WISP-1 культивировали в среде Искова, содержащей 10% FBS и 3 мкг/мл пуромицина.
Экспрессию WISP-1 в линиях 4Т1/контрольных клеток, 4Т1/WISP-1L, 4T1/WISP-1H, NRK/контрольных клеток, NRK/WISP-1L и NRK/WISP-1H измеряли полуколичественным методом RT-PCR (Taqman), используя затравки и зонды, не различающие ген WISP-1 человека и мыши.
WISP-1 не был экспрессирован в линиях 4Т1/контрольных клеток. Экспрессия WISP-1 в линии клеток 4Т1/WISP-1H была в 2 раза выше, чем в клетках 4Т1/WISP-1L, но в 700 раз меньше, чем в клетках NRK/WISP-1H (фиг.18).
Пример 18
Для определение воздействия WISP-1 на рассеяние клеток 4Т1 100000 4Т1/контрольных клеток, 4Т1/WISP-1L или 4T1/WISP-1H высевали на 6-луночных планшет в среду Искова, содержащую 10% фетальной телячьей сыворотки. При культивировании клеток с низкой плотностью 4Т1/контрольные клетки пролиферировали и образовывали хорошо выраженные колонии (фиг.19). Пролиферирующие клетки 4Т1/WISP-1L образовывали менее выраженные группы, так как некоторые клетки отделялись от растущих колоний (фиг.19). Колонии клеток 4Т1/WISP-1H отсутствовали, и клетки рассеивались произвольных образом (фиг.19). Полученные результаты позволяют предположить, что экспрессия WISP-1 стимулирует миграцию клеток.
Пример 19
Воздействие WISP-1 на инвазию клеток 4Т1 также определяли, используя модифицированную систему камер Бойдена, покрытых матригелем, с мембранными фильтрами РЕТ с размером пор 8 мкм в форме 24-луночного планшета (Falcon). 4Т1/контрольные клетки, клетки 4Т1/WISP-1L или 4Т1/WISP-1H (100000 клеток) вводили в верхнюю камеру в 0,5 мл среды Искова. Нижнюю камеру заполняли 0,75 мл такой же среды, содержащей 5% фетальной телячьей сыворотки, и инкубировали планшеты в течение ночи при 37°С. На следующий день верхнюю камеру протирали ватным тампоном и клетки, мигрировавшие на нижнюю сторону перегородки, окрашивали красителем из набора Diff-Quick (Dade Behring Inc.) и подсчитывали под микроскопом. Для каждого эксперимента усредняли три совокупности полученных данных. Клетки 4Т1/WISP-1H и 4Т1/WISP-1L характеризовались соответственно 12- и 6-кратным увеличением инвазии по сравнению с 4Т1/контрольными клетками (фиг.20). Полученные результаты позволяют предположить, что WISP-1 стимулирует онкогенную инвазию в эпителиальные клетки молочной железы и может играть определенную роль в образовании метастазов.
Пример 20
Воздействие WISP-1 на онкогенез эпителиальных клеток молочной железы исследовали, инъецируя 1,5×105 клеток (4Т1/контрольные клетки 1, 4Т1/контрольные клетки 2, 4Т1/WISP-1L или 4Т1/WISP-1H) в жировое тело четвертой молочной железы самок мышей BALB/c в возрасте 6-8 недель (6 мышей/группу). Объем опухолей измеряли три раза в неделю. Через тридцать один день после инъекции мышей умерщвляли, опухоли иссекали и взвешивали.
Инокуляция клеток 4T1/WISP-1L (фиг.21A; пустые квадраты) и 4Т1/WISP-1H (фиг.21A; закрашенные квадраты) вызывала более быстрый рост опухолей по сравнению с 4Т1/контрольными клетками 1 и 4Т1/контрольными клетками 2 (фиг.21A; пустые и закрашенные кружки). Через 31 день опухоли, образовавшиеся в результате инокуляции 4Т1/WISP-1L и 4Т1/WISP-1Н, были в 4 раза больше (фиг.21A) и в 3 раза тяжелее (фиг.21B) опухолей, образованных 4Т1/контрольными клетками. Полученные результаты позволяют предположить, что WISP-1 может увеличивать пролиферацию эпителиальных опухолевых клеток молочной железы.
Пример 21
Измеряли экспрессию HAS2 и CD44 в опухолях, образованных инокулированными 4Т1/контрольными клетками, клетками 4Т1/WISP-1L и 4Т1/WISP-1H. По сравнению с опухолью, образованной 4Т1/контрольными клетками, экспрессия CD44 была в 5-23 раза больше в опухолях, образованных клетками 4Т1/WISP-1 (фиг.22). С другой стороны, экспрессия HAS2 была одинаковой во всех анализированных опухолях. Полученные результаты позволяют предположить, что WISP-1 увеличивает экспрессию CD44 у мышей, инокулированных клетками 4Т1. Сверхэкспрессия CD44 в указанных опухолях может стимулировать образование метастазов.
Пример 22
Воздействие WISP-1 на метастазирование эпителиальных клеток молочной железы определяли путем инокуляции клеток 4Т1 в жировые тела молочных желез мышей (см. пример 20) и исследования степени развития метастазов при помощи микрокомпьютерной томографии и гистологии. Через 31 день у мышей, инокулированных клетками 4Т1/WISP-1L или 4Т1/WISP-1H, образовались обширные метастазы в легкие (фиг.23B и 23D) по сравнению с мышами, которым инъецировали 4Т1/контрольные клетки (фиг.23A и 23C). Не наблюдалось существенного различия между метастазированием клеток 4Т1/WISP-1L и 4Т1/WISP-1H. У мышей, инокулированных 4Т1/контрольными клетками, было в среднем 2,11 очага в легких при средней массе 0,68 грамма, в то время как у мышей, инокулированных клетками 4Т1/WISP-1, было в среднем 20,25 очага в легких при средней массе 12,46 граммов. Кроме того, средняя гистологическая оценка легкого у мышей, которым инъецировали клетки 4Т1/WISP-1, была равна 0,92 по сравнению с 0,11 у мышей, которым инъецировали NRK/контрольные клетки.
Иммуногистохимическим методом было установлено, что в метастатических очагах легких, вызванных клетками 4Т1/WISP-1, был экспрессирован CD44 на высоком уровне (фиг.23E). В указанных опухолях CD44 был локализован на плазматической мембране клеток 4Т1/WISP-1 (фиг.23F). Полученные результаты показывают, что WISP-1 стимулирует метастазирование клеток 4Т1, увеличивая число метастатических очагов в легких (в 10 раз) и их размер (в 18 раз). Кроме того, повышенная экспрессия CD44 сохранялась после метастазирования клеток 4Т1/WISP-1 в легкие.
Клинические исследования мышей, инокулированных 4Т1/контрольными клетками 1 или клетками 4Т1/WISP-1 показали, что экспрессия WISP-1 стимулировала образование метастазов на дополнительных вторичных участках. У мышей, которым инокулировали клетки 4Т1/WISP-1H, образовалась бесцветная белая масса на почке, в то время как у других мышей не были обнаружены опухоли почек.
Пример 23
Вышеописанные непроцессированные и делеционные мутантные конструкции WISP-1 человека трансфицировали в нормальные клетки почки крыс (NRK-49F). Через 48 часов в культуральную среду добавляли 2 мкг/мл пуромицина. Через 2 недели анализировали пулы экспрессирующих клеток, и полученные линии клеток культивировали в модифицированной по способу Дульбекко среде Игла с высоким содержанием глюкозы (HGDMEM), содержащей 10% фетальной телячьей сыворотки (PBS) и 2 мкг/мл пуромицина.
Экспрессию WISP-1 в линиях NRK/контрольных клеток, клеток NRK/WISP-1_1234, NRK/WISP-1_134, NRK/WISP-1_234, NRK/WISP-1_123 и NRK/WISP-1_124 измеряли полуколичественным методом RT-PCR (Taqman). Результаты выражены в виде значений, кратных относительной экспрессии WISP-1 в клетках NRK/WISP-1_1234 (фиг.24А). Экспрессия WISP-1 в клетках NRK/WISP-1_134 и NRK/WISP-1_234 была в 0,035 и 0,09 раза больше, чем в клетках NRK/WISP-1_1234. Экспрессия в клетках NRK/WISP-1_123 была в 16,1 раза больше и в клетках NRK/WISP-1_124 была в 7,6 раза больше, чем в клетках NRK/WISP-1_1234.
Участие определенных доменов в онкогенезе, стимулированном WISP-1, определяли у самок “голых” мышей в возрасте 6-8 недель, которым подкожно инъецировали 5×106 клеток (NRK/контрольные клетки, клетки NRK/WISP-1_1234, NRK/WISP-1_123, NRK/WISP-1_124, NRK/WISP-1_134 и NRK/WISP-1_234). Объем опухолей измеряли каждую неделю. Через 35 дней мышей умерщвляли, опухоли иссекали и подвергали гистологическому анализу.
Инокуляция клеток NRK/WISP-1_1234 (фиг.24В; закрашенные треугольники), NRK/WISP-1_134 (фиг.24В; закрашенные кружки) и NRK/WISP-1_234 (фиг.24В; закрашенные квадраты) вызывала образование опухолей. Однако инокуляция клеток NRK/WISP-1_123 (фиг.24В; пустые квадраты), NRK/WISP-1_124 (фиг.24В; пустые кружки) и NRK/контрольных клеток (фиг.24В; пустые треугольники) не вызывала образования опухолей. Через 35 дней опухоли NRK/WISP-1_234 были сравнимы по размеру с опухолями NRK/WISP-1_1234. Однако опухоли NRK/WISP-1_134, были в 2,5 раза больше опухолей NRK/WISP-1_1234. Полученные результаты позволяют предположить, что домены 1 и 2 не нужны для стимулированного WISP-1 онкогенеза клеток NRK, а домены 3 и 4 необходимы для стимулированного WISP-1 онкогенеза клеток NRK. Считается, что антагонисты WISP-1 по настоящему изобретению могут предпочтительно связываться и/или блокировать домены 3 и/или 4 WISP-1.
Кроме того, полученные результаты позволяют предположить, что делеция домена 2 WISP-1 может усиливать его онкогенную способность.
Гистологический анализ иссеченных опухолей (фиг.25) показал, что опухолевые клетки из опухолей NRK/WISP-1_234 были фенотипически подобны опухолевым клеткам из опухолей NRK/WISP-1_1234. Клетки в указанных опухолях представляли собой дифференцированные и веретенообразные фибробласты. Однако опухолевые клетки из опухолей NRK/WISP-1_134 отличались в фенотипическом отношении и были менее дифференцированными, часто многоядерными и характеризовались высокой скоростью митоза, о чем свидетельствует присутствие многочисленных митотических фигур (стрелки). Кроме того, опухолевые клетки проникли в несколько кровеносных сосудов, расположенных рядом с опухолями NRK/WISP-1_134 (фиг.26). Полученные результаты показывают, что экспрессия WISP-1_134 может сообщать онкогенность клеткам NRK, стимулируя их рост и способность к инвазии in vivo. Экспрессия указанной конструкции вызывает фенотипическую трансформацию, характерную для агрессивных опухолевых клеток.
Пример 24
Участие определенных доменов WISP-1 в стимулированной инвазии клеток 4Т1 определяли с помощью модифицированной системы камер Бойдена, покрытых матригелем, с мембранными фильтрами РЕТ с размером пор 8 мкм в форме 24-луночного планшета (BD Bioscience). Клетки НЕК 293 (20×106), устойчиво экспрессирующие вышеуказанные конструкции WISP-1 (WISP-1_1234, WISP-1_134, WISP-1_123, WISP-1_12, WISP-1_23, WISP-1_3, WISP-1_1 и WISP-1_4), высевали в нижнюю камеру в 0,75 мл смеси сред с соотношением 50:50 (смесь среды DME и среды F-12 Хэма (1:1)), содержащей 5% фетальной телячьей сыворотки, и культивировали планшеты в течение ночи при 37°С. На следующий день в верхнюю камеру вводили клетки 4Т1 (100000 клеток) в 0,5 мл бессывороточной смеси сред (50:50) и культивировали планшеты в течение ночи при 37°С. На следующий день верхнюю камеру протирали ватным тампоном, и клетки, мигрировавшие на нижнюю сторону перегородки, окрашивали красителем из набора Diff-Quick (Dade Behring Inc.) и подсчитывали под микроскопом. Для каждого эксперимента усредняли три совокупности полученных данных и выражали результаты в виде кратного значения инвазии по сравнению с контрольным экспериментом, в котором клетки НЕК 293, трансфицированные пустым вектором, культивировали в нижней камере. Клетки 4Т1 характеризовались 4-кратным увеличением инвазии, когда клетки НЕК 293, экспрессирующие конструкции WISP-1_1234, WISP-1_134 или WISP-1_23, высевали в нижнюю камеру (фиг.27). Клетки НЕК 293, экспрессирующие конструкцию WISP-1_12, увеличивали инвазию клеток 4Т1 только в 2,5 раза. Увеличение инвазии клеток 4Т1 было предельным, когда клетки НЕК 293, экспрессирующие WISP-1_23, WISP-1_3, WISP-1_1 или WISP-1_4, культивировали в нижней камере. Полученные результаты позволяют предположить, что домен 1 необходим для стимулированной WISP-1 инвазии клеток 4Т1. Кроме того, полученные данные показывают, что одного домена 1 полипептида WISP-1, по-видимому, является недостаточным для стимуляции инвазии клеток 4Т1.
Пример 25
Выполняли анализ для определения антагонистической активности домена 1 полипептида WISP-1 на стимулированную WISP-1 инвазию клеток 4Т1. Домен 1 полипептида WISP-1 клонировали в экспрессирующем векторе, непосредственно вверху от последовательности Fc-области IgG1 человека. Полученный рекомбинантный слитый белок (WISP-1-домен 1-Fc) синтезировали в экспрессирующей системе млекопитающего, используя клетки яичника китайского хомячка (СНО), и очищали до гомогенного состояния от кондиционированной среды при помощи аффинной хроматографии на колонке с белком А-сефарозой 4 и высокой скоростью потока (Amersham Pharmacia Biotech). Домен 1 полипептида WISP-1 также экспрессировали с аминоконцевой гекса-гистидиновой меткой (WISP-1-домен-1-His) в экспрессирующей системе СНО и очищали до гомогенного состояния от супернатанта культуры при помощи аффинной хроматографии на колонке с Ni2+-NTA-агарозой (Qiagen). Фракции, содержащие элюированный белок WISP-1-домен-1-His, собирали и подвергали диализу.
Антагонистическое действие очищенного растворимого полипептида WISP-1-домен-1 на стимулированную WISP-1 инвазию клеток 4Т1 определяли с помощью модифицированной системы камер Бойдена, покрытых матригелем, с мембранными фильтрами РЕТ с размером пор 8 мкм в форме 24-луночного планшета (BD Bioscience). 4Т1/контрольные клетки или клетки 4Т1/WISP-1 (100000 клеток) вводили в верхнюю камеру в 0,5 мл среды Искова. Нижнюю камеру заполняли 0,75 мл такой же среды, содержащей 5% фетальной телячьей сыворотки. В верхнюю и нижнюю камеры добавляли WISP-1-домен-1-Fc или WISP-1-домен-1-His в разных концентрациях и инкубировали планшеты в течение ночи при 37°С. На следующий день верхнюю камеру протирали ватным тампоном, и клетки, мигрировавшие на нижнюю сторону перегородки, окрашивали красителем из набора Diff-Quik (Dade Behring Inc.) и подсчитывали под микроскопом. Для каждого эксперимента усредняли три совокупности полученных данных. Результаты выражали в виде относительного кратного значения инвазии по сравнению с 4Т1/контрольными клетками. WISP-1-домен-1-His и WISP-1-домен-1-Fc проявляли антагонистическую активность в отношении стимулированной WISP-1 инвазии 4Т1 в зависимости от дозы (фиг.28). WISP-1-домен-1-His и WISP-1-домен-1-Fc имели значение IC50, равное 0,01 мкг/мл. Полученные результаты позволяют предположить, что очищенный полипептид WISP-1-домен-1 оказывает антагонистическое действие на стимулированную WISP-1 инвазию клеток.
Пример 26
Выполняли исследование на животных для определения экспрессии WISP-1 в модели ксенотрансплантата НРАС аденокарциномы поджелудочной железы человека. Самкам “голых” мышей в возрасте 6-8 недель подкожно инъецировали 5×106 клеток аденокарциномы поджелудочной железы человека (линия клеток НРАС, № по каталогу CRL-2119; AТCC, Manassas, VA, UDA). Через 21 день мышей умерщвляли, опухоли иссекали и анализировали экспрессию WISP-1 путем гибридизации in situ с использованием зонда, специфичного к WISP-1 человека, и зонда, специфичного к WISP-1 мыши (фиг.29). Полученные результаты свидетельствуют о сильной экспрессии WISP-1 мыши на участках, соответствующих опухолевой строме. С другой стороны, в иссеченных опухолях не была обнаружена экспрессия WISP-1 человека. Кроме того, в результате иммуногистохимического окрашивания опухолевой стромы в опухолях было обнаружено высокое содержание α-актина гладких мышц и низкое содержание виментина. Полученные результаты показывают, что инокуляция клеток НРАС “голым” мышам индуцирует рекрутинг миофибробластической стромы мыши, в которой экспрессирован WISP-1.
Пример 27
Выполняли исследование на животных для определения эффективности WISP-1-домен-1 in vivo для замедления роста опухоли. Конструкции WISP-1_1, WISP-1_12 человека, клонированные в экспрессирующем векторе (pIRES puro2; Clontech Laboratories, Palo Alto, CA), трансфицировали в линию клеток аденокарциномы поджелудочной железы человека НРАС. Через 48 часов в культуральную среду добавляли 2 мкг/мл пуромицина. Через 2 недели анализировали пулы экспрессирующих клеток и полученные линии клеток культивировали в смеси сред (50:5О) (смесь DME и среды F-12 Хэма (1:1)), содержащей 10% фетальной телячьей сыворотки (FBS) и 2 мкг/мл пуромицина.
Эффективность воздействия WISP-1-домен-1 in vivo на замедление роста опухоли определяли, инъецируя подкожно 5×106 клеток (клетки НРАС/WISP-1_12, HPAC/WISP-1_1) самкам “голых” мышей в возрасте 6-8 недель (10 мышей/группе). Объем опухолей измеряли два раза в неделю до 25-го дня. Полученные результаты показывают, что экспрессия WISP-1_1 или WISP-1_12 в клетках НРАС замедляет рост опухоли in vivo. Объем опухолей клеток НРАС/WISP-1_12 и НРАС/WISP-1_1 был соответственно на 12% и 54% меньше по сравнению с опухолями контрольных клеток НРАС (фиг.30). Полученные результаты показывают, что WISP-1-домен-1 и WISP-1-домен-12, экспрессированные клетками НРАС, замедляют рост опухоли, вероятно, в результате антагонистического воздействия на стимуляцию опухоли полипептидом WISP-1 мыши.
Пример 28
Исследовали гибридизацию in situ для определения экспрессии WISP-1 в первичных аденокарциномах поджелудочной железы человека. При использовании микроматрицы опухоли (ТМА) было установлено, что 68% (125/184) образцов дали положительные результаты в отношении экспрессии WISP-1. Кроме того, в указанных образцах экспрессия WISP-1 была ограничена стромальным компартментом (фиг.31). Полученные результаты свидетельствуют о высокой частоте экспрессии WISP-1 в стромальном компартменте первичных опухолей поджелудочной железы человека.
Пример 29
Выполняли иммуногистохимическое окрашивание для определения экспрессии WISP-1 в первичных аденокарциномах ободочной кишки. Панель из 15 образцов первичных аденокарцином человека окрашивали в отношении WISP-1, используя поликлональное антитело козы, специфичное к WISP-1 (R&D systems; № по каталогу AF1627). Полипептид WISP-1 был обнаружен в 100% (15/15) подвергнутых анализу образцов. Во всех случаях WISP-1 был локализован в стромальном компартменте, окружающем опухоли (фиг.32). Полученные результаты показывают, что WISP-1 локализован преимущественно в стромальном компартменте аденокарцином ободочной кишки человека.
Конструкции WISP-1:
Домен 2, 3:

Домен 1-IgG:

Депонирование материалов
Нижеследующие материалы были депонированы в Американскую коллекцию типовых культур по адресу: 10801 University Blvd., Manassas, VA 20110-2209, USA (AТCC):
Вышеуказанные материалы были депонированы на условиях и в соответствии с регламентом Будапештского соглашения о международном признании депонирования микроорганизмов в целях патентования (Будапештское соглашение). Данное соглашение гарантирует хранение депонированной жизнеспособной культуры в течение 30 лет со дня даты депонирования. Депозит должен быть предоставлен Американской коллекцией типовых культур (АТСС) на условиях Будапештского соглашения и согласно договора между компанией Genentech, Inc. и АТСС, который гарантирует постоянную и неограниченную доступность потомства депонированной культуры для общественности после выдачи соответствующего патента США или публикации заявки на патент США, или заявки, поданной в зарубежное патентное ведомство с целью получения иностранного патента, в зависимости от того, какая из указанных заявок будет первой, а также для любого лица, определенного комиссаром по патентам и товарным знакам США в соответствии с разделом 35 Кодекса законов США, §122, и правилами, установленными комиссаром на основе вышеуказанного раздела (включая раздел 37 Свода федеральных законов, §1.14, со ссылкой на раздел 886 официального бюллетеня патентного ведомства США, §638).
Правопреемник настоящей заявки согласен с тем, что, в случае гибели, утраты или уничтожения культуры депонированных материалов при культивировании в приемлемых условиях, материалы будут своевременно заменены при уведомлении о произошедшем другой стороной. Доступность депонированных материалов не должна быть истолкована как лицензия на осуществление изобретения в нарушение прав, предоставляемых любым государственным органом в соответствии с патентным правом, действующим в данной стране.
Приведенное выше письменное описание изобретения считается достаточным для осуществления изобретения специалистом в данной области. Настоящее изобретение не должно быть ограничено приведенными примерами. Специалистам в данной области должны быть очевидны разные модификации настоящего изобретения, помимо рассмотренных в описании изобретения, которые входят в объем прилагаемой формулы изобретения.
Реферат
Изобретение относится к биотехнологии и представляет собой способ ингибирования или нейтрализации индукции или секреции HAS2, НА, CD44 или RHAMM нативным полипептидом домена 1 WISP-1 человека в клетках млекопитающего, по крайней мере, одного типа. Также посредством указанного полипептида реализуются способ лечения различных видов рака млекопитающего и способ ингибирования подвижности раковых клеток. Изобретение также относится к применению полипептида домена 1 WISP-1 в производстве лекарственных средств для ингибирования или нейтрализации индукции или секреции HAS2, НА, CD44 или RHAMM, для ингибирования подвижности раковых клеток, а также для лечения рака. Изобретение может эффективно использоваться при профилактике и лечении различных видов рака. 6 н. и 19 з.п. ф-лы, 1 табл., 32 ил.
Формула
a) полипептида домена 1 WISP-1, по существу, состоящего из аминокислот 24-117 SEQ ID NO: 1; и
b) полипептида домена 1 WISP-1, по существу, состоящего из полипептида, имеющего, по меньшей мере, 95% идентичность с аминокислотами 24-117 SEQ ID NO: 1, который ингибирует или нейтрализует индукцию иди секрецию полипептидом WISP-1 HAS2, НА, CD44 или RHAMM.
a) полипептида домена 1 WISP-1, по существу, состоящего из аминокислот 24-117 SEQ ID NO: 1; и
b) полипептида домена 1 WISP-1, по существу, состоящего из полипептида, имеющего, по меньшей мере, 95% идентичность с аминокислотами 24-117 SEQ ID NO: 1, который ингибирует или нейтрализует индукцию или секрецию полипептидом WISP-1 HAS2, НА, CD44 или RHAMM,
где указанный рак представляет собой рак поджелудочной железы, рак ободочной кишки или ободочной и прямой кишки, рак молочной железы, рак легкого или рак головного мозга.
a) полипептида домена 1 WISP-1, по существу, состоящего из аминокислот 24-117 SEQ ID NO: 1; и
b) полипептида домена 1 WISP-1, по существу, состоящего из полипептида, имеющего, по меньшей мере, 95% идентичность с аминокислотами 24-117 SEQ ID NO: 1, который ингибирует подвижность раковых клеток,
где указанная раковая клетка является раковой клеткой поджелудочной железы, раковой клеткой ободочной кишки или ободочной и прямой кишки, раковой клеткой молочной железы, раковой клеткой легкого или раковой клеткой головного мозга.
а) полипептида домена 1 WISP-1, по существу, состоящего из аминокислот 24-117 SEQ ID NO: 1; и
b) полипептида домена 1 WISP-1, по существу, состоящего из полипептида, имеющего, по меньшей мере, 95% идентичность с аминокислотами 24-117 SEQ ID NO: 1, который ингибирует или нейтрализует индукцию или секрецию полипептидом WISP-1 HAS2, НА, CD44 или RHAMM.
a) полипептида домена 1 WISP-1, по существу, состоящего из аминокислот 24-117 SEQ ID NO: 1; и
b) полипептида домена 1 WISP-1, по существу, состоящего из полипептида, имеющего, по меньшей мере, 95% идентичность с аминокислотами 24-117 SEQ ID NO: 1, который ингибирует подвижность раковых клеток,
где указанная раковая клетка является раковой клеткой поджелудочной железы, раковой клеткой ободочной кишки или ободочной и прямой кишки, раковой клеткой молочной железы, раковой клеткой легкого или раковой клеткой головного мозга.
а) полипептида домена 1 WISP-1, по существу, состоящего из аминокислот 24-117 SEQ ID NO: 1; и
b) полипептида домена 1 WISP-1, по существу, состоящего из полипептида, имеющего, по меньшей мере, 95% идентичность с аминокислотами 24-117 SEQ ID NO: 1, который ингибирует или нейтрализует индукцию или секрецию полипептидом WISP-1 HAS2, HA, CD44 или RHAMM,
где указанный рак представляет собой рак поджелудочной железы, рак ободочной кишки или ободочной и прямой кишки, рак молочной железы, рак легкого или рак головного мозга.

Комментарии