Иммуногенные композиции, способы получения таких композиций и плазмида, включенная в такие композиции - RU2442825C2
Код документа: RU2442825C2
Чертежи








Описание
Все процитированные здесь документы включены полностью с помощью ссылки.
Область техники
Изобретение относится к области экспрессии белка, в особенности к области экспрессии поверхностного антигена вируса гепатита В (HBsAg) для применения в получении вакцин.
Уровень техники
Вакцины против гепатита В доступны уже в течение многих лет (например, смотри главу 16 ссылки 1), и их активным ингредиентом является поверхностный антиген (HBsAg) вируса гепатита В (HBV). В исходных HBV вакцинах применяли HBsAg, который очищали из человеческой крови, тогда как вакцины на основе рекомбинантно экспрессирующегося HBsAg стали широко доступны в 1990 годы. С тех пор HBsAg также вводят в качестве компонента в мультивалентные вакцины, т.е. вакцины, содержащие смесь иммуногенов из более чем одного патогена, так что введение вакцины может одновременно иммунизировать пациента против более чем одного патогена. Эти мультивалентные вакцины обычно включают HBsAg плюс, по меньшей мере, 'DTP' (дифтерия, столбняк, коклюш) антигены.
Исходная одновалентная рекомбинантная вакцина против HBV ENGERIX B™ включает адъювант на основе гидроксида алюминия. Совсем недавно стали доступны одновалентные вакцины против HBV на основе более современных адъювантов, например, 'AS04' адъювант [2] применяют в продукте FENDRIX™ фирмы GSK, RC-529 адъювант в продукте SUPERVAX™ фирмы Berna Biotech, или CpG олигонуклеотидные адъюванты, такие как CPG7909 [3] фирмы Coley Pharmaceuticals.
Для рекомбинантной экспрессии HBsAg описано большое разнообразие систем. Хозяева, используемые для экспрессии, включают бактерии, дрожжи (включая виды Saccharomyces, Hanensula и Pichia), культуру клеток млекопитающих (включая клетки CHO, клетки COS, клетки Bu3), клетки насекомых (используя бакуловирусные векторы) и растительные клетки (например, 'съедобные вакцины').
Целью изобретения является представить дополнительные и улучшенные системы для рекомбинантной экспрессии HBsAg, особенно для получения HBsAg, который применяют в комбинированных вакцинах (тех, которые содержат DTP-антигены) или в новых одновалентных HBV вакцинах.
Описание изобретения
Ранние сообщения о рекомбинантной экспрессии HBsAg фокусировались на E.coli [4-6], мышиных клетках [7], клетках человека [8], клетках обезьяны [9] и на дрожжах [10-12]. Однако совсем недавно привлекла к себе повышенное внимание экспрессия в рекомбинантных растениях [13-24], а также экспрессия в дрожжах Pichia pastoris [25, 26] и в Hanensula polymorpha [27, 28].
Несмотря на развитие этих современных экспрессирующих систем, HBsAg согласно изобретению экспрессируется в хозяине Saccharomyces cerevisiae. При экспрессии HBsAg на основе дрожжей доступны разнообразные варианты выбора, включая выбор вида и штамма дрожжей, условий культивирования, промотора, применяемого для контроля экспрессии, последовательностей терминации гена, применяемых кодонов и т.д. Согласно изобретению HBsAg экспрессируется в хозяине Saccharomyces cerevisiae, несущем плазмиду, имеющую последовательность, кодирующую HBsAg, где плазмида включает: (1) расположенный выше промотор из гена глицеральдегид-3-фосфат дегидрогеназы для контроля экспрессии последовательности, кодирующей HBsAg; и (2) расположенный ниже последовательности, кодирующей HbsAg, терминатор транскрипции ARG3. Плазмиды могут также включать: (3) маркер селекции LEU2; (4) последовательность плазмиды 2μ; и (5) последовательность начала репликации функциональную в Escherichia coli.
HBsAg может экспрессироваться в этом хозяине Saccharomyces cerevisiae и может быть очищен для применения в производстве вакцин и, в особенности, в производстве комбинированных вакцин и в новых одновалентных HBV вакцинах. Этот экспрессирующийся в дрожжах материал является подходящим для применения в комплексных вакцинах, несмотря на сообщения в ссылке 29 о том, что экспрессирующийся в S.cerevisiae HBsAg может иметь иммуноподавляющий потенциал.
Мультивалентные вакцины
Таким образом, в изобретении представлен способ получения мультивалентной иммуногенной композиции, включающий стадии: (а) получение HBV компонента путем очистки HBsAg после экспрессии в хозяине по изобретению S.cerevisiae; (b) получение, по меньшей мере, одного отличного от HBV компонента; и (с) смешивание HBV и отличного от HBV компонентов для получения мультивалентной композиции.
В изобретении также представлена мультивалентная иммуногенная композиция, включающая (а) HBV компонент, включающий HBsAg, экспрессирующийся в хозяине по изобретению S.cerevisiae; и (b) по меньшей мере, один отличный от HBV компонент. Композиция также обычно включает один или несколько адъювантов.
Эти мультивалентные композиции в особенности пригодны для одновременной защиты детей от инфекции HBV и отличных от HBV патогенов. Типичным пациентом является ребенок первого года жизни, который получит первую дозу композиции в возрасте 6-9 недель. Две или три следующие дозы обычно будут вводить с интервалами примерно 6-8 недель. Композицию можно также применять для завершения графика первичной иммунизации другой вакциной. Композицию можно также применять для ревакцинации, например, детей в возрасте 1-16 лет.
Одновалентные вакцины
В изобретении также представлен способ получения одновалентной иммуногенной композиции, включающий стадии: (а) получение HBV компонента путем очистки HBsAg после экспрессии в хозяине по изобретению S.cerevisiae; (b) объединение HBsAg с адъювантом для получения иммуногенной композиции. Адъювантом предпочтительно является адъювант, отличный от гидроксида алюминия, и более предпочтительно адъювант, состоящий не только из соли алюминия.
В изобретении также представлена одновалентная иммуногенная композиция, включающая (а) HBV компонент, включающий HBsAg, экспрессирующийся в хозяине по изобретению S.cerevisiae; и (b) адъювант.
Эти одновалентные композиции в особенности пригодны для защиты от и/или для лечения инфекций вируса гепатита В у пациентов, для которых существующие адъювантные вакцины (такие как продукт ENGERIX B™) оказались неэффективными. Подгруппы пациентов, которым композиции особенно подходят, включают: пациентов с иммунной недостаточностью; пациентов, находящихся на гемодиализе; пациентов перед диализом; пациентов с почечной недостаточностью; пациентов с почечным нарушением; пациентов с ранним почечным нарушением, которым не требуется гемодиализ; пациентов, ожидающих трансплантации печени, например, прибывающих в списках ожидания; пациентов с конечной стадией почечного нарушения; пациентов, перенесших трансплантацию органа (особенно трансплантацию печени), например, за 6 месяцев до первой дозы вакцины по изобретению; пациентов, кто получает (или получил, например, за 6 месяцев до первой дозы вакцины по изобретению) лечение иммуноглобулином гепатита В (HBIg); пациентов с гаплотипом HLA DQ2 [30]; пациентов с гаплотипом HLA DR3 [30]; пациентов с гаплотипом HLA DR7 [30]; пациентов с HLA аллелем DQB1*0202 [31]; пациентов, инфицированных ВИЧ; хронических носителей ВИЧ; пациентов, которые недавно перенесли переливание крови; пациентов, получающих иммуноподавляющие лекарственные средства; пациентов, страдающих AIDS; пациентов с асцитом; пациентов с циррозом; пациентов с энцефалопатией; пациентов, получающих лечение интерфероном, и в особенности ifn-α; пациентов, курящих сигареты; пациентов, курящих сигары; пациентов с индексом массы тела ≥30 кг/м2; и пациентов, которые получили HBsAg вакцину, но у которых не произошла сероконверсия (например, они имеют титр анти-HBsAg в сыворотке <10 мIU/мл после стандартного первичного графика дозирования, такого как 3 дозы ENGERIX B™).
Эти пациенты могут иметь почечный клиренс креатинина менее чем 30 мл/мин (пределы скорости выведения для здоровых мужчин составляют ~100-140 мл/мин и 90-130 мл/мин для женщин). Пациентам предпочтительно, по меньшей мере, 15 лет, например, между 15 и 40 годами, между 40 и 60 годами или даже более 60 лет. Пациентов в возрасте свыше 55 лет можно было успешно лечить, не взирая на любые лежащие в основе заболевания.
Поверхностный антиген гепатита В
Вирион HBV состоит из внутреннего ядра, окруженного белками внешней оболочки или капсидом. Основным компонентом капсида является белок, обозначенный как 'HBsAg'. Все существующие вакцины против гепатита В содержат HBsAg, когда этот антиген вводят в нормальные вакцины, он стимулирует продукцию анти-HBsAg антител, которые защищают против HBV инфекции.
Для производства вакцины HBsAg можно получать двумя путями. Первый способ включает очистку антигена в форме частиц из плазмы хронических носителей гепатита В, поскольку большие количества HBsAg синтезируются в печени и высвобождаются в кровоток во время HBV инфекции. Второй путь включает экспрессию белка методами рекомбинантной ДНК. Для применения по настоящему изобретению HBsAg рекомбинантно экспрессируется в дрожжах Saccharomyces cerevisiae.
В отличие от нативного HBsAg (т.е. очищенного из плазмы продукта) HBsAg, применяемый по изобретению, не гликозилирован. Эта форма HBsAg является предпочтительной, так как она высокоиммуногенна и может быть получена без риска заражения продуктами крови.
Экспрессирующийся в дрожжах HBsAg представлен преимущественно в форме по существу сферических частиц (средний диаметр около 20 нм), включающих липидный матрикс, включающий фосфолипиды. В отличие от полученных из плазмы частиц HBsAg экспрессирующиеся в дрожжах частицы могут включать фосфатидилинозитол. Кроме того, липидный матрикс может включать не ионные поверхностно активные вещества, такие как полисорбат 20, который может быть введен в матрикс во время очистки антигена от экспрессирующего хозяина - дрожжей. Применение полисорбата 20 во время разрушения рекомбинантных дрожжевых клеток на начальной стадии очистки HBsAg является одним из путей, когда полисорбат 20 может быть введен в HBsAg частицы. Полисорбат 20 обычно присутствует в весовом соотношении, по меньшей мере, 5 мкг на 100 мкг HBsAg.
Все известные субтипы HBV содержат общий детерминант 'а'. Объединенные с другими детерминантами и субдетерминантами были идентифицированы девять субтипов: aywl, ayw2, ayw3, ayw4, ayr, adw2, adw4, adrq- и adrq+. Кроме этих субтипов были обнаружены другие варианты, такие как HBV-мутанты, которые были обнаружены у иммунизированных индивидуумов ("ускользнувшие мутанты"). В то время как в некоторых исследованиях обнаружили, что у людей с ослабленным иммунитетом (например, пациентов, находящихся на гемодиалезе) большая часть сывороток инфицирована субтипами adw4 или ayw3 (например, смотри ссылку 32, где 75% сывороток было инфицировано adw4, возрастая до 88% у части пациентов, находящихся на гемодиализе; и ссылку 33, где 58% части образцов пациентов, находящихся на гемодиализе было инфицировано ayw3), наиболее предпочтительным субтипом HBV для применения по изобретению является субтип adw2. Этот субтип был обнаружен у единственного пациента, находящегося на гемодиализе, описанного в ссылке 32, и только в малом количестве при вспышке HBV инфекции в эпидемическом очаге среди пациентов, находящихся на гемодиализе в Калифорнии и Небраска в 1994 году [34] и позже в Бразилии [35, 36], но он является высокоиммуногенным и эффективным у более чем 98% пациентов, находящихся на гемодиализе.
Предпочтительный HBsAg имеет следующую 226-членную аминокислотную последовательность (SEQ ID NO: 3):

В изобретении может применяться SEQ ID NO: 3 или последовательность, отличающаяся от SEQ ID NO: 3 и имеющая до 10 (т.е. 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10) единичных аминокислотных замен.
Последовательность, кодирующая HbsAg, может представлять собой следующую 678-членную нуклеотидую последовательность (SEQ ID NO: 4):

За последним кодоном последовательности, кодирующей HBsAg, предпочтительно следует стоп-кодон ТАА (охра). Кроме 'S' последовательности поверхностный антиген может включать всю или часть пре-S-последовательности, такую как вся или часть пре-S1 и/или пре-S2-последовательности. Предпочтительно, однако, применять только S-последовательность, как показано выше.
Промотор GAPDH
Согласно изобретению HBsAg экспрессируется в хозяине Saccharomyces cerevisiae, несущем плазмиду, имеющую расположенный выше промотор из гена глицеральдегид-3-фосфат-дегидрогеназы (GAPDH) и, в особенности, из дрожжевого GAPDH [37-40]. Промотор связан с последовательностью, кодирующей HBsAg, так чтобы регулировать ее транскрипцию.
Глицеральдегид-3-фосфат-дегидрогеназа представляет собой гликолитический фермент, и было обнаружено, что его промотор особенно подходит для контроля экспрессии HBsAg в S.Cerevisiae [41]. Промотор GAPDH, описанный в ссылке 41, имеет следующую 1061-членную последовательность (SEQ ID NO: 5):

Этот промотор может быть использован согласно изобретению, но предпочтительно использовать промотор, включающий следующую 1060-членную последовательность (SEQ ID NO: 1):

Эта последовательность отличается от SEQ ID NO: 5 в следующих положениях: (1) нуклеотидная замена А/С в положении 42; (2) нуклеотидная замена Т/А в положении 194; (3) нуклеотидная мутация С/А в положении 301; (4) нуклеотидная вставка А в положении 471; (5) замена остатка С/Т в положении 569; (6) замена остатка С/Т в положении 597; (7) нуклеотидная вставка Т в положении 604 (пента-Т вместо тетра-Т); и (8) замена 3'-GCTT последовательности на одно А:
В изобретении может применяться промоторная последовательность SEQ ID NO: 1 или последовательность, отличная от SEQ ID NO: 1 и имеющая до 20 точечных мутаций (то есть 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20), где каждая точечная мутация представляет собой делецию, замену или вставку одного нуклеотида.
1060-членная последовательность предпочтительно располагается непосредственно перед старт-кодоном ATG, кодирующим N-конец HBsAg (SEQ ID NO: 2), например:

Терминатор ARG3
Согласно изобретению HBsAg экспрессируется в хозяине Saccharomyces cerevisiae, несущем плазмиду, имеющую расположенный ниже терминатор транскрипции из ARG3. Терминатор связан с последовательностью, кодирующей HBsAg, так чтобы регулировать ее транскрипцию.
В дрожжах ген ARG3 кодирует фермент орнитинкарбамоилтрансферазу [42], и его последовательность терминации транскрипции применялась в нескольких дрожжевых рекомбинантных системах экспрессии [43-45]. Она пригодна для контроля экспрессии HBsAg в дрожжах, особенно в комбинации с промотором GAPDH.
Последовательность располагается непосредственно за стоп-кодоном ARG3, как описано в GenBank GI:171076, представляет собой следующую 450-членную последовательность (SEQ ID NO: 6):

При увеличении на 250 нуклеотидов, дополнительно введенных в кодирующую последовательность, ген ARG3 включает следующую 700-членную последовательность (SEQ ID NO: 6):
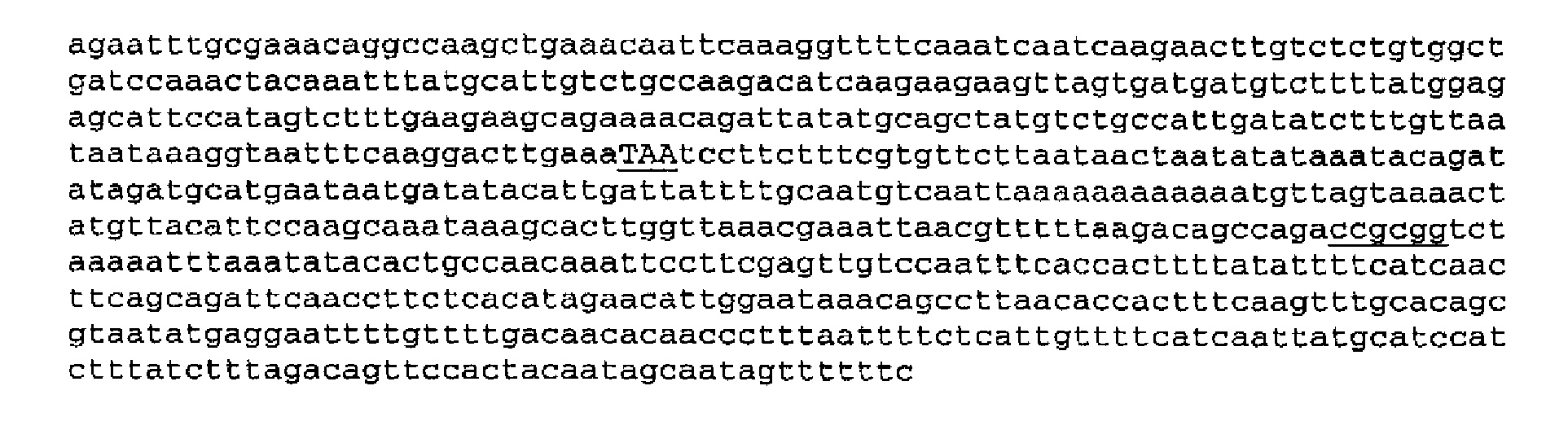
Терминация транскрипции в SEQ ID NO: 7 происходит в области подчеркнутого сайта SacII.
Предпочтительный терминатор для применения по изобретению включает часть обеих последовательностей - кодирующей и расположенной ниже из области ARG3, и особенно включает следующую 689-членную нуклеотидную последовательность (SEQ ID NO: 8), которая имеет тот же 3'-конец, что и SEQ ID NO: 7:

Эта применяемая последовательность включает EcoRI сайт вблизи 5'-конца (подчеркнут), что облегчает вставку терминатора в желаемое положение.
Также может присутствовать дополнительная расположенная ниже последовательность терминатора из ARG3. Может быть включено до 1500 нуклеотидов из ARG3 (т.е. до 800 дополнительных нуклеотидов ниже SEQ ID NO: 7), например до 1200 нуклеотидов или примерно 1150 нуклеотидов.
В изобретении может применяться последовательность терминатора SEQ ID NO: 8 или последовательность, отличная от SEQ ID NO: 8 и имеющая до 30 точечных мутаций (т.е. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40), каждая точечная мутация представляет собой делецию, замену или вставку одного нуклеотида.
689-членная последовательность предпочтительно расположена непосредственно за стоп-кодоном С-конца HBsAg (SEQ ID NO: 9), например:
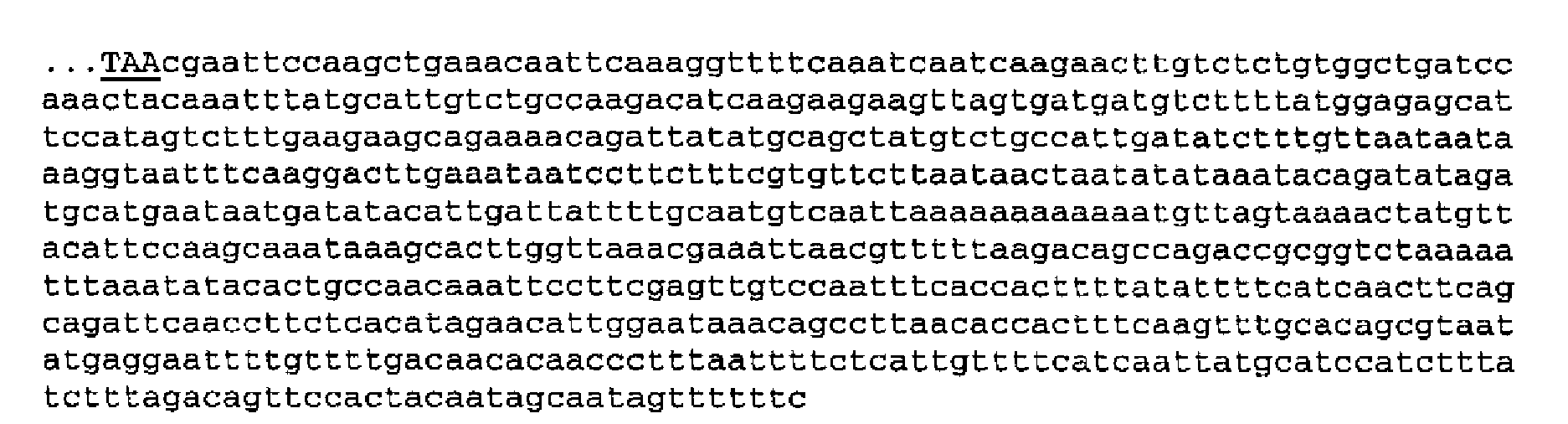
Плазмида
Ген, кодирующий HBsAg, промотор GAPDH и терминатор ARG3, функционально связаны как часть одной и той же плазмиды. Плазмиды по изобретению также обычно включают 1, 2 или предпочтительно 3 следующих элемента: маркер селекции LEU2; последовательность плазмиды 2µ; и последовательность начала репликации функциональную в E.coli. Эти три компонента были ранее описаны в плазмидах, применяемых для экспрессии HBsAg [45].
Маркер селекции LEU2 часто применяется в генетике дрожжей. LEU2 кодирует 3-изопропилмалат-дегидрогеназу, которая является третьим ферментом в пути биосинтеза лейцина. Маркер LEU2 плазмиды дает возможность синтезировать лейцин из метаболических предшественников и применяется в ауксотрофных по лейцину клетках-хозяевах, например в LEU2-нуль мутантах. Таким образом, маркер LEU2 дает возможность ауксотрофам по лейцину, которые не могут нормально расти без добавления лейцина, расти в отсутствии лейцина.
Последовательность плазмиды 2µ также является известной в генетике дрожжей [46] и применяется для увеличения числа копий плазмиды. Любая подходящая последовательность 2µ плазмиды может применяться в плазмидах по изобретению. Плазмида включает дрожжевую последовательность начала репликации, и обычно она содержится в последовательности 2µ.
Путем включения последовательности начала репликации, функциональной в E.coli, плазмиды могут действовать как шатл-векторы между дрожжами и E.coli, таким образом давая возможность манипуляций с плазмидой в соответствующих системах E.coli.
Таким образом, в изобретении представлена плазмида, содержащая следующие элементы: (1) последовательность, кодирующую HBsAg; (2) расположенный выше промотор из гена глицеральдегид-3-фосфатдегидрогеназы для контроля экспрессии последовательности, кодирующей HBsAg; и (3) расположенный ниже последовательности, кодирующей HbsAg, терминатор транскрипции ARG3. Плазмида может также включать следующие элементы: (4) маркер селекции LEU2; (5) последовательность плазмиды 2µ; и (6) последовательность начала репликации функциональная в E.coli. последовательность, кодирующая HBsAg, предпочтительно кодирует HBsAg с аминокислотной последовательностью SEQ ID NO: 3 или последовательностью, отличной от SEQ ID NO: 3, имеющей до 10 единичных аминокислотных замен (т.е. 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10). Последовательность промотора GAPDH предпочтительно включает SEQ ID NO: 1 или последовательность, отличную от SEQ ID NO: 1, имеющую до 20 точечных мутаций (т.е. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20). Последовательность терминатора ARG3 предпочтительно включает SEQ ID NO: 8 или последовательность, отличную от SEQ ID NO: 8, имеющую до 20 точечных мутаций (т.е. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20). Плазмида может сохраняться в хозяине S.cerevisiae и может применяться для экспрессии HBsAg.
Плазмиды с последовательностью, имеющей от 14500 до 15000 п.о., являются предпочтительными, например от 14600 до 14700 п.о.
Хозяин S.cerevisiae
Saccharomyces cerevisiae является широко применяемым дрожжевым хозяином для рекомбинантной экспрессии. По изобретению может применяться любой подходящий S.cerevisiae хозяин. Однако предпочтительно применять хозяин, ауксотрофный по лейцину, так чтобы применять плазмиду с маркером селекции LEU2. Клетка-хозяин может быть leu2-3 Ieu2-112 мутантной.
Дополнительными характеристиками предпочтительных дрожжевых хозяев являются штаммы his3 и/или canl-11. Наиболее предпочтительным дрожжевым хозяином является штамм leu2-3 Ieu2-112 his3 canl-11, такой как штамм DC5.
В изобретении представлен дрожжевой штамм, несущий плазмиду по изобретению. В изобретении также представлено применение этого дрожжевого штамма в производстве композиции по изобретению.
Экспрессия и очистка HBsAg
Методики культивирования дрожжевых культур для рекомбинантной экспрессии белка хорошо известны из уровня техники. Дрожжи могут культивироваться в синтетической среде, например, содержащей очищенные аминокислоты (обычно без лейцина, где применяется маркер LEU2), витамины, соли и т.д. HBsAg может быть затем очищен с помощью способа, включающего стадии, такие как преципитация, ион-обменная хроматография и ультрафильтрация. Другие стадии, которые могут применяться во время очистки, включают гель-проникающую хроматографию и ультрацентрифугирование с хлоридом цезия.
Особенно предпочтительной стадией для повсеместного включения в способ очистки является стадия разрушения клетки в присутствии не ионного детергента, такого как Triton-X100 или эфиры жирных кислот полиоксиэтиленсорбитан, такого как моноолеат полиоксиэтиленсорбитан (также известный как полисорбат 80) или более предпочтительно монолаурат полиоксиэтиленсорбитан (также известный как полисорбат 20). Разрушенные клетки можно затем центрифугировать, чтобы получить супернатант, в котором присутствует HBsAg. Белок можно затем очистить из супернатанта, например, с использованием способа, описанного в ссылке 47.
После очистки HBsAg может быть подвергнут диализу (например, с цистеином), который может быть применен для удаления любых ртутных консервантов, таких как тимерозал, который может применяться при получении HBsAg [48].
HBsAg, экспрессированный и очищенный согласно изобретению, может быть объединен с отличными от HBV антигенами для получения мультивалентных вакцин или может быть объединен с новыми адъювантами для получения улучшенных одновалентных вакцин.
Одновалетные иммуногенные композиции
HBsAg, экспрессированный и очищенный согласно изобретению, может быть объединен с новыми адъювантами для получения улучшенных одновалентных вакцин. Три определенных интересующих адъюванта для применения в одновалентных вакцинах представляют собой: CpG-олигонуклеотиды; производные аминоалкилглюкозаминидфосфата; и смесь 3d-MPL с солями алюминия.
CpG-олигонуклеотидные адъюванты представляют собой иммуностимуляторные олигонуклеотиды, которые включают нуклеотидные последовательности, содержащие CpG-мотив (динуклеотидная последовательность, содержащая неметилированный цитозин и следующий за ним гуанозин). Было показано, что бактериальная двухцепочечная РНК или олигонуклеотиды, содержащие палиндромные или поли(dG) последовательности, также являются иммуностимуляторными. CpG могут включать нуклеотидные модификации/аналоги, такие как фосфоротиоатные, и могут быть двухцепочечными или одноцепочечными. Необязательно гуанозин может быть заменен на аналог, такой как 2'-дезокси-7-деазагуанозин. В ссылках 49-51 приведены примеры возможных аналогов для замен. Адъювантный эффект CpG-олигонуклеотидов дополнительно обсуждается в ссылках 52-57.
CpG-последовательность может быть направлена на TLR9, такой как мотив GTCGTT (SEQ ID NO: 11) или TTCGTT (SEQ ID NO: 12) [58]. Для индуцирования Th1-иммунного ответа CpG-последовательность может быть специфической, такой как CpG-А ODN, или для индуцирования В-клеточного ответа может быть более специфической, такой как CpG-В ODN. CpG-А ODN и CpG-В ODN обсуждаются в ссылках 59-61. Предпочтительно CpG представляет собой CpG-А ODN.
Предпочтительно CpG-олигонуклеотид сконструирован так, что 5'-конец доступен для распознавания рецептором. Необязательно две CpG-олигонуклеотидные последовательности могут быть присоединены с их 3'-концами для образования «иммуномеров». Смотри, например, ссылки 58 и 62-64.
Аминоалкилглюкозаминидфосфатные производные (AGP) включают RC-529 [65-68], который представляет собой аминоалкилглюкозаминид 4-фосфат, продаваемый Корпорацией Corixa.
AS04 представляет собой смесь адъюванта на основе соли алюминия и 3D-MPL адъюванта [69]. При использовании AS04 HBsAg предпочтительно адсорбируется на соли алюминия, например, как описано в ссылке 70. Предпочтительно соль алюминия является фосфатом, и, по меньшей мере, 50% (по весу) общего количества HBsAg адсорбируется на фосфате алюминия, например ≥60%, ≥70%, ≥80%, ≥90%, ≥95%, ≥98% или более. Процент адсорбированного материала можно легко измерить путем разделения адсорбированного материала от неадсорбированного, например, путем центрифугирования, при котором адсорбированный на алюминии антиген легко образует осадок, тогда как неадсорбированный антиген останется в супернатанте. Количество HBsAg в супернатанте (например, измеренное с помощью анти-HBsAg ELISA) может быть вычтено из общего количества HBsAg в композиции, и затем может быть рассчитан процент адсорбированного материала. Предпочтительно, что HBsAg адсорбируется полностью, т.е. в супернатанте ничего не детектируется.
3D-MPL адъювант также может быть адсорбирован на фосфат алюминия. Предпочтительно, по меньшей мере, 50% (по весу) общего количества 3D-MPL адсорбируется, например ≥60%, ≥70%, ≥80%, ≥90%, ≥95%, ≥98% или более. Процент адсорбированного материала может быть измерен тем же способом, что и для HBsAg. В композиции, имеющей общую концентрацию 3D-MPL 50 мкг/мл, концентрация не адсорбированного 3D-MPL должна быть менее чем 25 мкг/мл, например, ≤20 мкг/мл, ≤15 мкг/мл, ≤10 мкг/мл, ≤5 мкг/мл, ≤2 мкг/мл, ≤1 мкг/мл и т.д.
Адъюванты на основе фосфата алюминия описаны ниже более подробно.
3-О-деацилированный монофосфориллипид А (3D-MPL) также обозначается как 3 де-О-ацилированный монофосфориллипид А или как 3-О-дезацил-4'-монофосфориллипид А. Название обозначает, что положение 3 восстановленного конца глюкозамина в монофосфориллипиде А является деацилированным. Он был получен из лишенного гептозы мутанта Salmonella minnesota и является химически подобным липиду А, но лишенным кислото-лабильной фосфорильной группы и основно-лабильной ацильной группы. Он активирует клетки линий моноцитов/макрофагов и стимулирует высвобождение некоторых цитокинов, включающих IL-I, IL-12, TNF-α и GM-CSF. Получение 3D-MPL впервые было описано в ссылке 71, и продукт производился и продавался Корпорацией Corixa под торговой маркой MPL™. Дополнительные подробности можно найти в ссылках 72-75. 3D-MPL может быть включен в комбинацию с триэтаноламином, триэтиламмонием или ионом триэтиламина.
3D-MPL может принимать форму смеси родственных молекул, отличающихся их ацилированием (например, имеющим 3, 4, 5 или 6 ацильных цепей, которые могут быть различными по длине). Два моносахарида 2-дезокси-2-амино-глюкозы являются N-ацилированными по их углеродному положению 2 (т.е. по положению 2 и 2'), а также имеет место О-ацилирование по положению 3'. Группа, присоединенная к атому углерода 2, имеет формулу -NH-CO-CH2-CR1R1'.
Группа, присоединенная к атому углерода 2', имеет формулу -NH-CO-CH2-CR2R2'. Группа, присоединенная к атому углерода 3', имеет формулу -NH-CO-CH2-CR3R3'. Характерная структура показана ниже:
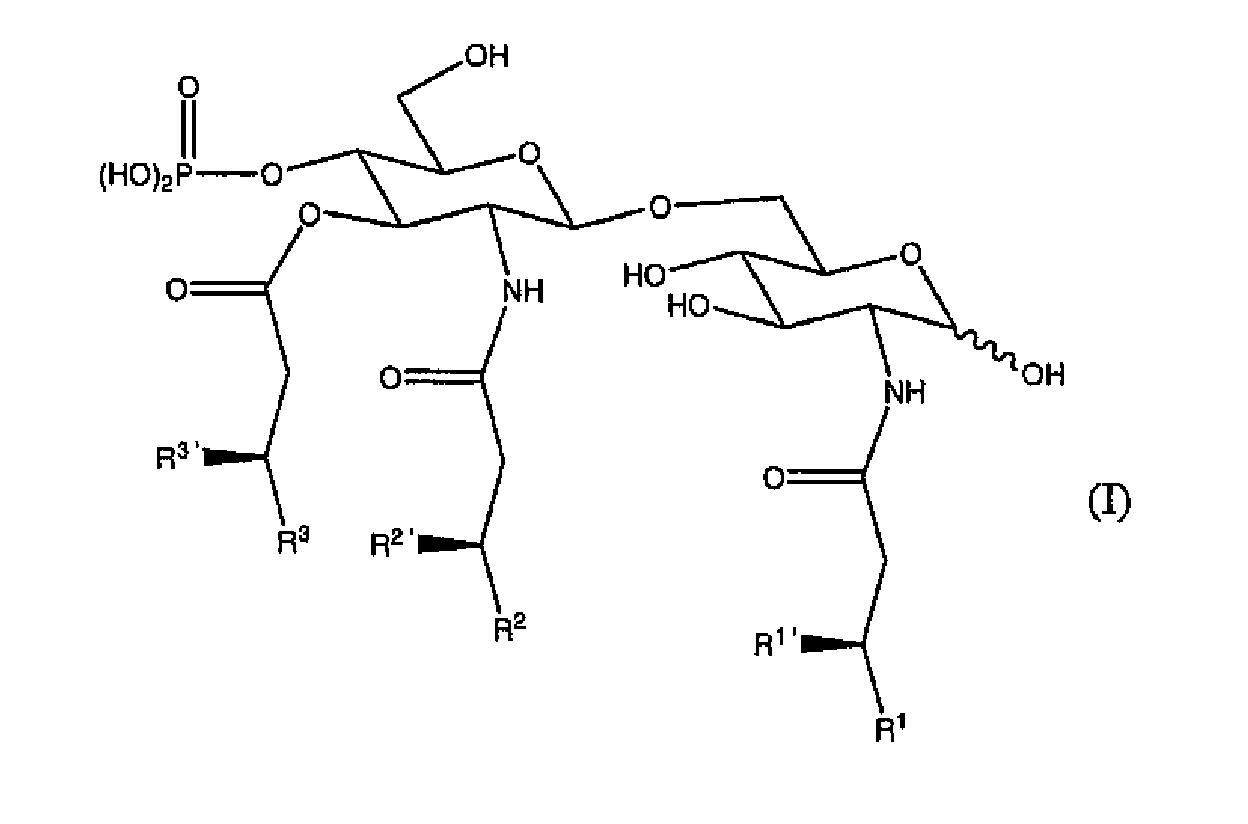
Группы R1, R2 и R3каждая независимо являются -(CH2)n-CH3. Значение n предпочтительно находится между 8 и 16, более предпочтительно между 9 и 12 и наиболее предпочтительно 10.
Группы R1', R2' и R3'каждая независимо может являться: (а) -H; (b) -OH; или (c) -O-CO-R4, где R4 является или -H, или (CH2)m-CH3, где значение m предпочтительно находится между 8 и 16 и более предпочтительно 10, 12 или 14. В положении 2 m предпочтительно 14. В положении 2' m предпочтительно 10. В положении 3' m предпочтительно 12. Группы R1', R2' и R3', таким образом, предпочтительно являются -О-ацильными группами из додекановой кислоты, тетрадекановой кислоты или гексадекановой кислоты.
Когда все R1', R2' и R3' представляют собой -Н, то 3D-MPL имеет только 3 ацильные цепи (одна на каждое из положений 2, 2' и 3). Когда только два из R1', R2' и R3' представляют собой -Н, то 3D-MPL может иметь 4 ацильные цепи. Когда только один из R1', R2' и R3' представляет собой -Н, то 3D-MPL может иметь 5 ацильных цепей. Когда ни один из R1', R2' и R3' не является -Н, то 3D-MPL может иметь 6 ацильных цепей. Применяемый согласно изобретению 3D-MPL адъювант может представлять собой смесь этих форм, имеющих от 3 до 6 ацильных цепей, но предпочтительно включать в смесь 3D-MPL с 6 ацильными цепями, и в особенности обеспечивать, чтобы форма с 6 ацильными цепями составляла, по меньшей мере, 10% по весу от общего количества 3D-MPL, например ≥20%, ≥30%, ≥40%, ≥50% или более. Было обнаружено, что 3D-MPL с 6 ацильными цепями является наиболее активной формой адъюванта.
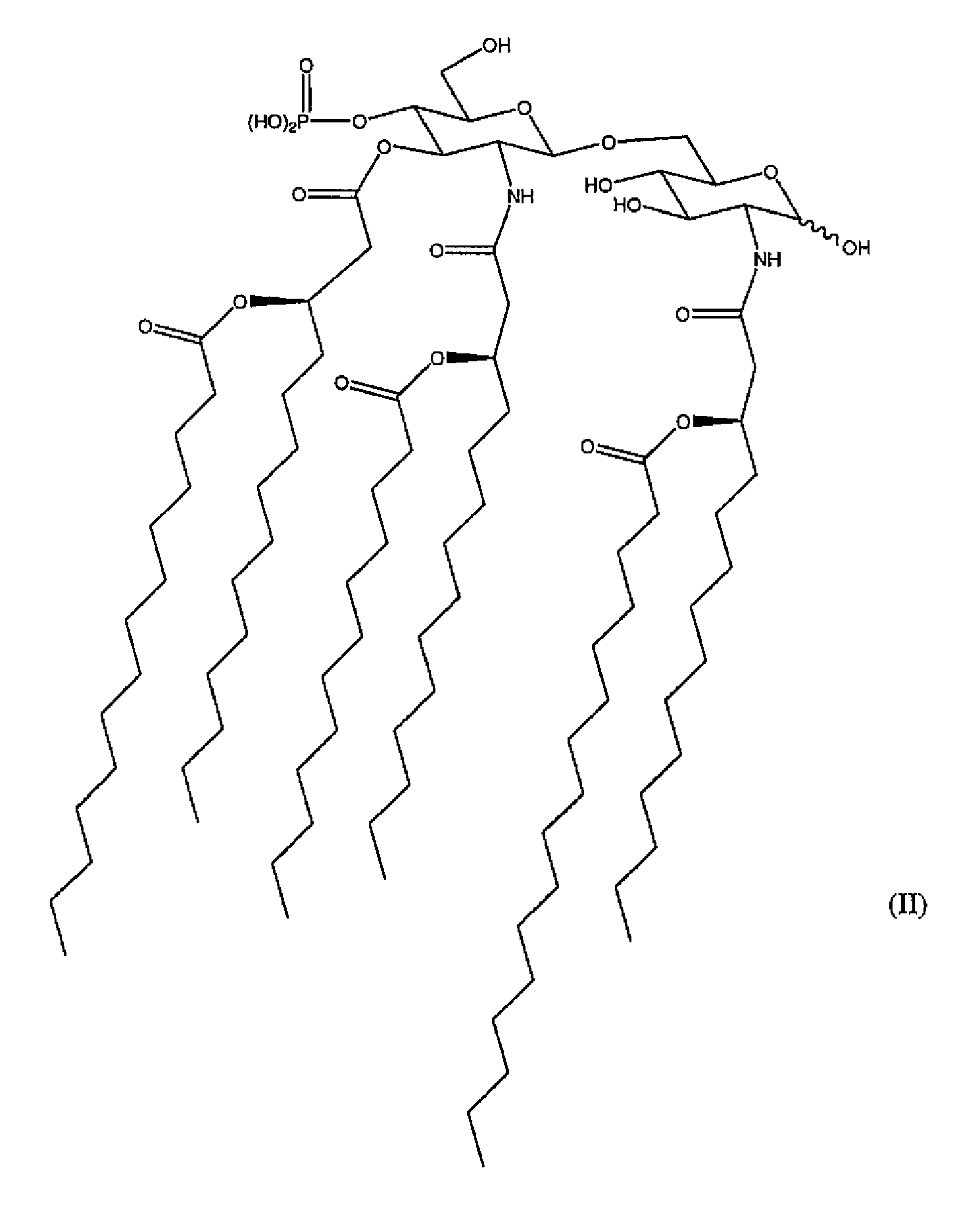
Наиболее предпочтительная форма 3D-MPL для включения в композиции по изобретению имеет формулу (II), показанную ниже.
В водных условиях 3D-MPL может образовывать мицелярные агрегаты или частицы различного размера, например диаметром <150 нм или >500 нм. Каждая из них или обе эти частицы могут применяться по изобретению, и лучшие частицы могут быть выбраны с помощью типового теста. Было опубликовано, что меньшие частицы (например, достаточно маленькие, чтобы получить чистую водную суспензию 3D-MPL) являются лучшими [76] и предпочтительны для применения согласно изобретению. Предпочтительные частицы имеют средний диаметр менее чем 220 нм, более предпочтительно менее чем 200 нм, менее чем 150 нм и менее чем 120 нм. Они могут иметь даже средний диаметр менее чем 100 нм. Однако в большинстве случаев средний диаметр не бывает ниже чем 50 нм.
После того как 3D-MPL адсорбируется на фосфат алюминия, не представляется возможным непосредственно измерить размер частицы, но размер частицы можно измерить перед тем, как произойдет адсорбция.
Диаметр частицы можно оценить с помощью типовой методики динамического светорассеяния, с помощью которой обнаруживают средний диаметр частицы. Когда указанная частица имеет средний диаметра х нм, то в основном будет распределение частиц около этой величины, но, по меньшей мере, 50% количества частиц (например, ≥60%, ≥70%, ≥80%, ≥90% и более) будет иметь диаметр в пределе х±20%.
Мультивалентные иммуногенные композиции
HBsAg, экспрессированный и очищенный согласно изобретению, может быть объединен с одним или несколькими отличными от HBV антигентами для получения мультивалентных вакцин. Отличные от HBV антигены могут включать бактериальные и/или вирусные антигены. Типичные отличные от HBV компоненты для применения согласно изобретению включают, но не ограничены ими:
дифтерийный анатоксин ('D')
столбнячный анатоксин ('Т')
коклюшный антиген ('Р'), который может быть или клеточным ('wP') или бесклеточным ('аР')
антиген вируса гепатита А (HAV)
конъюгированный капсульный сахарид Haemophilus influenzae типа b ('Hib')
инактивированный полиовирус (IPV)
конъюгированный капсульный сахарид Neisseria meningitidis серогруппы С ('MenC')
конъюгированный капсульный сахарид Neisseria meningitidis серогруппы A ('MenA')
конъюгированный капсульный сахарид Neisseria meningitidis серогруппы W135 ('MenW135')
конъюгированный капсульный сахарид Neisseria meningitidis серогруппы Y ('MenY')
конъюгированный капсульный сахарид Streptococcus pneumoniae
антиген вируса кори
антиген вируса свинки
антиген вируса краснухи
антиген вируса ветряной оспы
антиген вируса гриппа
Может применяться более чем один из этих отличных от HBV антигенов. Следующие комбинации антигенов наиболее предпочтительны:
Двухвалентные вакцины: HBV-HAV; HBV-Hib.
Трехвалентные вакцины: HBV-D-T.
Четырехвалентные вакцины: HBV-D-T-P.
Пятивалентные вакцины: HBV-D-T-P-Hib; HBV-D-T-P-IPV.
Шестивалентные вакцины: HBV-D-T-P-Hib-IPV.
Семивалентные вакцины: HBV-D-T-P-Hib-MenA-MenC; HBV-D-T-P-Hib-IPV-MenC.
Дифтерийный анатоксин ('D') описан более подробно в главе 13 ссылки 1. Предпочтительными дифтерийными анатоксинами являются те, которые получены с помощью обработки формальдегидом. Дифтерийный анатоксин может быть получен с помощью выращивания C.diphtheriae в ростовой среде (например, среде Fenton или среде Linggoud & Fenton), в которую может быть добавлен бычий экстракт с последующей обработкой формальдегидом, ультрафильтрацией и преципитацией. Анатоксинный материал может затем быть обработан с помощью способа, включающего стерильную фильтрацию и/или диализ. Количества дифтерийного анатоксина могут быть выражены в международных единицах (IU). Например, NIBSC утверждает 'Третий Международный Стандарт Дифтерийного Адсорбированного Анатоксина 1999' [77,78], где содержится 160 IU на ампулу. В качестве альтернативы IU системы Lf единица («единицы флокуляции» или «доза флокуляции осадков») определяется как количество анатоксина, которое при смешивании с Международной Единицей анатоксина приводит к получению оптимальной флоккулирующей смеси [79]. Например, NIBSC утверждает 'Дифтерийный Анатоксин, План' [80], где содержится 300LF на ампулу, а также утверждает 'Первый Международный Совет по Реагентам для Дифтерийных Анатоксинов для Флокуляционных Тестов' [81], где содержится 900LF на ампулу.
Столбнячный анатоксин ('Т') описан более подробно в главе 27 ссылки 1. Предпочтительными столбнячными анатоксинами являются те, которые получены с помощью обработки формальдегидом. Столбнячный анатоксин может быть получен с помощью выращивания C.diphtheriae в ростовой среде (например, среде Latham, выделенной из бычъего казеина) с последующей обработкой формальдегидом, ультрафильтрацией и преципитацией. Материал может затем быть обработан с помощью способа, включающего стерильную фильтрацию и/или диализ. Количества столбнячного анатоксина могут быть выражены в международных единицах (IU). Например, NIBSC утверждает 'Третий Международный Стандарт Столбнячного Адсорбированного Анатоксина 2000' [82, 83], где содержится 469 IU на ампулу. В качестве альтернативы IU системы Lf единица («единицы флокуляции» или «доза флокуляции осадков») определяется как количество анатоксина, которое при смешивании с Международной Единицей анатоксина приводит к получению оптимальной флоккулирующей смеси [79]. Например, NIBSC утверждает 'Первый Международный Совет по Реагентам для Столбнячных Анатоксинов для Флокуляционных Тестов' [84], где содержится 1000LF на ампулу.
Коклюшный антиген ('Р') может быть или клеточным ('wP'), или бесклеточным ('аР'). Клеточные коклюшные антигены обычно принимают форму инактивированных B.pertussis клеток. Получение клеточных коклюшных антигенов хорошо задокументировано (например, смотри главу 21 ссылки 1), например, они могут быть получены путем тепловой инактивации культуры B.pertussis в фазе I. Количества wP антигенов могут быть выражены в международных единицах (IU). Например, NIBSC утверждает 'Третий Международный Стандарт Коклюшной Вакцины' [85], где содержится 46 IU на ампулу. Каждая ампула содержит вымороженный-высушенный осадок 2 мл аликвот водного раствора, который содержал 10 литров бактериальной суспензии (эквивалентно 180 единицам мутности по определению U.S. Стандарта Мутности), разведенной в восьми литрах M/15 буфера Соренсена pH 7,0. В качестве альтернативы IU системе также используется единица 'OU' («единицы мутности») (например, 4 OU может быть примерно 1 IU). Бесклеточные коклюшные антигены, в настоящий момент используемые в вакцинах, включают коклюшный анатоксин (РТ), филаментный гемагглютинин (FHA), пертактин (также известный как '69 кДа белок внешней мембраны') и фимбрии (например, аглютиногены 2 и 3). В изобретении предпочтительно применяются два из и предпочтительно все три из PT, FHA и пертактина (т.е. без применения фимбрий). Эти три антигена предпочтительно получают путем выделения из B.pertussis культуры, выращенной в модифицированной жидкой среде Stainer-Scholte. PT и FHA могут быть выделены из ферментационного бульона (например, путем адсорбции на гидроксиапатитный гель), тогда как пертактин может быть экстрагирован из клеток с помощью тепловой обработки и флоккуляции (например, с применением хлорида бария). Антигены могут быть очищены с помощью последовательных стадий хроматографии и/или преципитации. PT и FHA могут быть очищены с помощью гидрофобной хроматографии, аффинной хроматографии и эксклюзионной хроматографии. FHA и пертектин могут быть обработаны формальдегидом перед применением согласно изобретению. РТ предпочтительно детоксифицируется путем обработки формальдегидом и/или глутаральдегидом. В качестве альтернативы этой процедуре химической детоксификации РТ может быть представлен как мутантный РТ, в котором ферментативная активность уменьшена путем мутагенеза [86], но детоксификация путем химической обработки является предпочтительной. Количества бесклеточных коклюшных антигенов обычно выражены в микрограммах.
Вакцины против вируса гепатита А (HAV) описаны в главе 15 ссылки 1. В основе предпочтительного HAV компонента лежит инактивированный вирус, и инактивации можно достичь путем обработки формалином. Вирус может расти на человеческих легочных эмбриональных диплоидных фибробластах, таких как MRC-5 клетки. Предпочтительным HAV штаммом является HM175, хотя CR326F также может использоваться. Клетки могут выращивать при условиях, дающих возможность вирусного роста. Клетки лизируются, и полученная в результате суспензия может быть очищена с помощью ультрафильтрации и гель-проникающей хроматографии.
Конъюгаты капсульного сахарида H.influenzae типа b ('Hib') описаны более подробно в главе 14 ссылки 1. Капсульный сахарид Hib конъюгируется с белком-носителем, чтобы усилить его иммуногенность, особенно у детей. Могут быть использованы разнообразные белки-носители, включая дифтерийный анатоксин CRM 197, комплекс белков внешней мембраны из серогруппы В менингококка, H.influenzae белок D или столбнячный анатоксин. Столбнячный анатоксин является предпочтительным носителем, как используется в продукте, обычно обозначаемом как 'PRP-T'. PRP-T может быть получен путем активации капсульного сахарида Hib с использованием цианоген бромида, конденсирующего активированный сахарид с линкером адипиновой кислоты (таким как (1-этил-3-(3-диметиламинопропил)карбодиимид), обычно гидрохлоридная соль), и затем с проведением реакции линкер-сахарида с белком-носителем в виде столбнячного анатоксина. Часть сахарида в Hib конъюгате может включать полноразмерный полирибозилрибитолфосфат (PRP), полученный из Hib бактерий, и/или она может включать фрагменты полноразмерного PRP. Могут использоваться конъюгаты с соотношением сахарид:белок (вес/вес) между 1:5 (т.е. избыток белка) и 5:1 (т.е. избыток сахарида), например, соотношения между 1:2 и 5:1 и соотношения между 1:1,25 и 1:2,5. В предпочтительных конъюгатах весовое соотношение сахарида к белку-носителю находится между 1:1,25 и 1:3,5. В вакцинах, где столбнячный анатоксин присутствует как в качестве антигена, так и в качестве белка-носителя, весовое соотношение сахарида к белку-носителю в конъюгате может быть между 1:0.3 и 1:2 [87]. Введение Hib конъюгата предпочтительно приводит в результате к концентрации анти-PRP антител ≥0,15 мкг/мл и более предпочтительно ≥1 мкг/мл, и эти величины являются принятыми стандартами пороговой чувствительности.
Вакцина инактивированного полиовируса (IPV) более подробно описана в главе 24 ссылки 1. Полиовирусы могут быть выращены в клеточной культуре, и предпочтительной используемой культурой является клеточная линия Vero, выделенная из почки обезьяны. Клетки Vero можно легко культивировать на микроносителях. После того как вырастут, вирионы могут быть очищены с использованием таких методик, как ультрафильтрация, диафильтрация и хроматография. Перед введением пациентам полиовирусы должны быть инактивированы, и этого можно достичь путем обработки формальдегидом. Полиомиелиты могут быть вызваны одним из трех типов полиовирусов. Три типа и им подобные вызывают идентичные симптомы, но антигенно они очень сильно различаются, и инфекция одним типом не защищает от инфекции другими. Таким образом, предпочтительно применять три полиовирусных антигена по изобретению: полиовирус Типа 1 (например, Mahoney штамм), полиовирус Типа 2 (например, MEF-I штамм) и полиовирус Типа 3 (например, Saukett штамм). Вирусы предпочтительно выращивают, очищают и инактивируют индивидуально, и затем объединяют с получением суммарной трехвалентной смеси для применения по изобретению. Количества IPV обычно выражены в 'DU' единицах («D-антиген единица» [88]).
Конъюгированные менингококковые антигены включают капсульные сахаридные антигены из N.Meningitidis, конъюгированные с белками-носителями. Конъюгированные вакцины против серогруппы С были улучшены для применения у человека и включают MENJUGATE™ [89], MENINGITEC™ и NEISVAC-C™. Известны смеси конъюгатов из серогрупп А+С [90,91], и были опубликованы смеси конъюгатов из серогрупп A+C+W135+Y [92-95] и были улучшены в 2005 до MENACTRA™ продукта. Менингококковый сахарид(ы), применяемый по изобретению, может быть из одной или нескольких серогрупп A, C, W135 и Y, например A+C, A+W135, A+Y, C+W135, C+Y, W135+Y, A+C+W135, A+C+Y, C+W135+Y, A+C+W135+Y. Предпочтительно применять, по меньшей мере, сахарид серогруппы С, и предпочтительно применять сахариды из обеих серогрупп А и С. В продуктах MENJUGATE™ и MENINGITEC™ применяется белок-носитель CRM197, и этот носитель также может применяться согласно изобретению. В продукте NEISV AC-C™ применяется столбнячный анатоксин как белок-носитель, и этот носитель также может применяться согласно изобретению, как и дифтерийный анатоксин. В особенности, предпочтительным белком-носителем для менингококковых конъюгатов является белок D из H.influenzae, которого нет ни в одной из существующих конъюгированных вакцин. Сахаридная часть конъюгата может включать полноразмерные сахариды, полученные из менингококков, и/или могут включать фрагменты полноразмерных сахаридов. Сахариды серогруппы С могут быть получены из OAc+ или OAc- штаммов. Для сахаридов серогруппы А предпочтительно, чтобы по меньшей мере 50% остатков маннозамина было O-ацетилировано по положению С-3 (например, по меньшей мере, 60%, 70%, 80%, 90%, 95% или более). Могут применяться менингококковые конъюгаты с соотношением сахарид:белок (вес/вес) между 1:10 (т.е. избыток белка) и 10:1 (т.е. избыток сахарида), например соотношения между 1:5 и 5:1, между 1:2,5 и 2,5:1 или между 1:1,25 и 1,25:1. Введение конъюгата предпочтительно приводит в результате к увеличению титра бактерицидного теста сыворотки (SBA) для релевантной серогруппы, по меньшей мере, в 4 раза, и предпочтительно, по меньшей мере, в 8 раз. SBA титры можно измерить, используя комплемент крольчат или человеческий комплемент [96].
Конъюгированные пневмококковые антигены включают капсульные сахаридные антигены из S.pneumoniae, конъюгированные с белками-носителями [например, ссылки 97-99]. Предпочтительно включать сахариды из более чем одного серотипа S.pneumoniae: широко применяются смеси полисахаридов из 23 различных серотипов, применяются в качестве конъюгированных вакцин с полисахаридами из 5-11 различных серотипов [100]. Например, PrevNar™ [101] содержит антигены из семи серотипов (4, 6B, 9V, 14, 18C, 19F, и 23F), где каждый сахарид индивидуально конъюгирован с CRM1Q7 путем восстановительного аминирования с 2 мкг каждого сахарида на дозу 0,5 мл (4 мкг серотипа 6B) и с конъюгатами, адсорбированными на адъюванте на основе фосфата алюминия. Композиции по изобретению предпочтительно включают, по меньшей мере, серотипы 6B, 14, 19F и 23F. Дополнительные серотипы предпочтительно выбраны из 1, 3, 4, 5, 7F, 9V и 18C.
Антигены для защиты от вирусов кори, свинки и краснухи обычно представляют собой живые вирусы, какие присутствуют в известных одновалентных и трехвалентных ('MMR') вакцинах. Вакцины против вируса кори более подробно описаны в главе 19 ссылки 1. Вакцины против вируса свинки более подробно описаны в главе 20 ссылки 1. Вакцины против вируса краснухи более подробно описаны в главе 26 ссылки 1. Типичные штаммы вируса кори включают: Moraten; Connaught; Schwarz; Edmonston- Zagreb; CAM-70; AIK-C; TD97; Leningrad-16; Shanghai-191 и т.д. Штаммы Schwarz и Moraten являются наиболее типичными для применения в США и Европе. Типичные штаммы вируса свинки включают: Jeryl Lynn; RIT 4385; Urabe; Hoshino; Rubini; Leningrad-3; Leningrad-Zagreb; Miyahara; Torii; NK M-46; S-12 и т.д. Штаммы Jeryl Lynn, RIT 4385, Urabe и Leningrad-Zagreb являются наиболее распространенными штаммами. Типичные штаммы вируса краснухи включают: RA27/3; Matsuba; TCRB 19; Takahashi; Matsuura; TP-336 и т.д. Штамм RA27/3 является наиболее типичными для применения на западе.
VZV антигены для защиты от вируса ветряной оспы обычно представляют собой живые вирусы, в основе которых лежит вирусный штамм Oka. VZV вакцины более подробно описаны в главе 28 ссылки 1.
Антигены вируса гриппа более подробно описаны в главах 17 и 18 ссылки 1. В общих чертах, в основе вакцины против вируса гриппа могут быть живые или инактивированные вирусы, и в основе инактивированных вирусов может быть целый вирус, 'частицы' вируса или очищенные поверхностные антигены (включая гемагглютинин и нейраминидазу). Вирусы, применяемые для получения вакцин, могут быть выращены или на яичных или на клеточных культурах. Штаммы вакцин вируса гриппа меняются от сезона к сезону. В настоящий интерпандемический период вакцины обычно включают два штамма вируса гриппа А (HlNl и H3N2) и один штамм вируса гриппа В, и полученные трехвалентные вакцины являются типичными. В изобретении могут также применяться вирусы из пандемических штаммов (т.е. штаммов, к которым получатель вакцины и основная человеческая популяция иммунологически не устойчива), таких как Н2, Н5, Н7 и Н9 субтипов штаммов (в особенности вируса гриппа А), и вакцины против вируса гриппа для пандемических штаммов могут быть одновалентными, или в основании вакцины может быть нормальная трехвалентная вакцина с добавкой пандемического штамма. Вирус гриппа может быть реассортантным штаммом и может быть получен с помощью методик обратной генетики. Вирус может быть ослабленным. Вирус может быть термочувствительным. Вирус может быть холодостойким.
При создании мультивалентных комбинаций антигены могут быть последовательно индивидуально объединены, или они могут быть предварительно смешаны и добавлены вместе. Например, 4-валентная DTP-HBsAg вакцина может быть получена с помощью способа, включающего последовательное добавление HBsAg, D, T и P антигенов в пробирку, или с помощью предварительного смешивания D, T и P антигенов и затем объединения HBsAg и DTP смеси.
Антигенные компоненты могут быть объединены в любом удобном порядке.
Когда дифтерийные и столбнячные анатоксины включают в композицию по изобретению, то их предпочтительно предварительно смешивают, перед тем как объединить с HBsAg. Таким образом, способ по изобретению включает объединение первого компонента, включающего HBsAg, со вторым компонентом, включающим оба антигена D и T. Таким образом, предпочтительно применять предварительно смешанный компонент D-T. Этот двухвалентный компонент можно применять в способе по изобретению, например, он может быть объединен с HBsAg для получения трехвалентного компонента D-T-HBV. В качестве альтернативы, предварительно смешанный D-T компонент может быть объединен с дополнительными отличными от HBV антигенами (например, с бесклеточными коклюшными антигенами), и этот компонент может быть затем объединен с HBsAg и т.д.
Подобным образом, когда антигены - дифтерийный анатоксин, столбнячный анатоксин и клеточные коклюшные антигены - включают в композицию, то их предпочтительно предварительно смешивают, таким образом, способ по изобретению включает объединение первого компонента, включающего HBsAg, со вторым компонентом, включающим антигены D, T и Pw. Таким образом, предпочтительно применять предварительно смешанный компонент D-T-Pw и затем применять этот компонент в способе по изобретению.
Когда адъювант включают в композиции по изобретению, то он также может быть добавлен на различных стадиях. Обычно антигены объединяют с адъювантами перед применением в способе по изобретению (например, двухвалентную D-T смесь адсорбируют на адъювант(ы) на основе соли алюминия перед применением в способе по изобретению), но также возможно добавлять адъювант после того, как антигены будут смешаны, или возможно добавлять антигены к адъюванту (например, начать с адъюванта в водном растворе, затем добавить антигены или индивидуально, или предварительно смешанные). Как описано ниже, HBsAg компонент предпочтительно адсорбируют на адъювант на основе фосфата алюминия перед объединением с антигенными компонентами, отличными от HBV.
Гибридные белки HBsAg
Также как изобретение применяется для экспрессии HBsAg, изобретение может применяться для экспрессии гибридных антигенов, которые включают последовательность HBsAg и последовательность, отличную от HBsAg внутри одного полипептида. Отличная от HBsAg последовательность может быть вставлена в последовательность HBsAg или может быть сшита с N-концом или С-концом последовательности HBsAg.
Известно, что сшивают последовательность HBsAg с гетерологичными антигенами для того, чтобы использовать способность HBsAg собираться в частицы. Например, в ссылке 102 опубликовано создание гибрида HIV-I gpl20 с HBsAg с получением белка, спонтанно собирающегося в частицы, которые напоминают нативные HBsAg частицы по размеру и плотности и согласуются по липидной композиции примерно на 25% и по содержанию gp120 примерно на 100% на частицу. gp120 имеет возможность собираться в свою нативную конформацию в гибриде и сохраняет биологическую активность. Подобным образом, HIV gp41 эпитопы были улучшены путем создания внутренних гибридов с HBsAg, и гибридный белок способен к самосборке в дрожжах в липопротеиновые частицы размером 22 нм [103].
Этот способ также применяется для малярийных вакцин. В ссылке 104 опубликовано, что эпитопы до 61 аминокислоты из малярийного антигена gp120 вставляли в HBsAg последовательность и что экспрессирующиеся гибридные частицы могли вызывать анти-gp120 иммунный ответ у животных. В ссылке 105 опубликована последовательность имеющего 16 повторов 4-членной последовательности циркумспорозоитного белка, который экспрессировался в виде гибридного с HBsAg белка. В ссылке 106 опубликовано продуцирование в дрожжах вирусо-подобных частиц, состоящих из гибрида Pfsl6 и HBsAg. В ссылке 107 описан гибридный антиген, в котором циркумспорозоитный белок сшивают с HBsAg. В ссылке 108 описано образование гибрида С-концевой области мерозоитного поверхностного белка 1 организма P.vivax, который образует иммуногенные частицы размером 20-45 нм. Таким образом, хорошо известно из уровня техники применение HBsAg для существующих малярийных антигенов в форме самособирающихся частиц.
Способ в особенности удобен для последовательностей HBsAg с антигенами из HIV, Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae или Plasmodium ovale. Подходящие HIV антигены для получения гибридов HBsAg включают гликопротеин оболочки gp120 или антигенные фрагменты на его основе [102]. Подходящие антигены P.falciparum для получения гибридов HBsAg могут быть получены на основе субъединицы циркумспорозоитного поверхностного антигена («CSP»), например, они могут включать от 3 до 20 повторов их NANP мотива (SEQ ID NO: 14), и/или они могут включать C-концевую область CSP (но обычно не включающую последние 12 аминокислот из C-концевой области). Например, в изобретении может применяться антиген, известный как "RTS", который содержит большую часть C-концевой области CSP из NF54 или 7G8 изолята P.falciparum (аминокислоты 210-398, которые включают 19 NANP повторы и аминокислоты 367-390 из области T клеточного эпитопа), образующий гибрид с N-концевой областью HBsAg, которую представляют четыре аминокислоты области preS2 из HBsAg. При экспрессии в дрожжах RTS образует частицы, которые включают липиды (в основном фосфолипиды) в дополнение к белкам. Таким образом, последовательность RTS может содержать, также как представленная здесь SEQ ID NO: 15: (i) N-концевой остаток метионина; (ii) Met-Ala-Pro; (iii) 189 аминокислот, соответствующих или аминокислотам 210-398 CS белка из P.falciparum 7G8 или аминокислотам 207-395 CS белка из P.falciparum NF54; (iv) Arg или GIy; (v) Pro-Val-Thr-Asn из белка Pre-S2 вируса гепатита В; и (vi) HBsAg. Из 7G8 изолята полноразмерный RTS имеет последовательность, полученную также как SEQ ID NO: 1 в ссылке 109 (смотри также Фигуру 5 ссылки 110):

Этот гибридный антиген может экспрессироваться в дрожжах с применением последовательности, кодирующей SEQ ID NO:15. Предпочтительно в дрожжах ко-экспрессировать гибридный белок с нормальным HBsAg. Этот способ ранее применялся для RTS, и продукт ко-экспрессии обозначен как "RTS,S". Используется соотношение RTS:S примерно 1:4. Таким образом, аспектом применения по настоящему изобретению является ко-экспрессия (i) HBsAg и (ii) RTS. Один или оба из этих антигенов могут экспрессироваться с применением вышеописанных здесь плазмид. Ко-экспрессирующиеся белки образуют антигенные частицы, которые могут применяться в виде активного ингредиента в малярийных вакцинах.
Адъюванты для применения в мультивалентных вакцинах
Современные адъюванты, включающие CpG, AGPs и AS04, описаны выше. Так как они могут применяться в мультавалентных композициях по изобретению, то предпочтительно их применение вместо солей алюминия. Они включают адъюванты, известные как гидроксид алюминия и фосфат алюминия. Эти названия являются общепринятыми, но применяются только для удобства, поскольку не являются точным описанием реального химического соединения, которое присутствует [например, смотри главу 9 ссылки 111]. В изобретении может применяться любой из адъювантов "гидроксид" или "фосфат", которые в основном применяются в качестве адъювантов. Адъюванты, известные как "гидроксид алюминия", обычно представляют собой соли гидроксида алюминия, которые обычно, по меньшей мере, частично являются кристаллическими. Оксигидроксид алюминия, который можно представить формулой AlO(OH), можно отличить от других соединений алюминия, таких как гидроксид алюминия Al(OH)3, с помощью инфракрасной спектроскопии (IR), особенно благодаря присутствию в диапазоне поглощения при
1070 см-1 и наличию сильного пика при 3090-3100 см-1 [глава 9 ссылки 111].
Адъюванты, известные как "фосфат алюминия", обычно представляют собой гидроксифосфаты, часто также содержащие малое количество сульфата (т.е. гидроксифосфат сульфат алюминия). Они могут быть получены путем преципитации, и реакционные условия и концентрации в способе преципитации влияют на степень замещения фосфата на гидроксил в соли. Гидроксифосфаты в основном имеют молярное соотношение PO4/Al между 0,3 и 1,2. Гидроксифосфаты можно отличить от строго AlPO4 по присутствию гидроксильной группы. Например, в IR диапазоне спектра при 3164 см-1 (например, при нагревании до 200°С) выявляется присутствие структурных гидроксилов [гл.9 ссылки 111].
Молярное соотношение PO4/Al+3 адъюванта на основе фосфата алюминия будет в основном между 0,3 и 1,2, предпочтительно между 0,8 и 1,2 и более предпочтительно 0,95±0,1. Фосфат алюминия в основном является аморфным, в особенности это характерно для солей гидроксифосфата. Типичный адъювант представляет собой аморфный гидроксифосфат алюминия с молярным соотношением PO4/Al между 0,84 и 0,92, включая случай при концентрации 0,6 мг Al+3/мл. Фосфат алюминия в основном представляет собой частицы. Типичные диаметры частиц находятся в пределах 0,5-20 мкм (например, примерно 5-10 мкм) после адсорбции любого антигена.
PZC фосфата алюминия является обратно пропорциональным степени замещения фосфата на гидроксил, и эта степень замещения может варьироваться в зависимости от реакционных условий, от концентраций реагирующих веществ, используемых для получения соли путем осаждения. PZC также меняется при изменении концентрации свободных ионов фосфата в растворе (больше фосфата = больше кислого PZC) или при добавлении буфера, такого как гистидиновый буфер (делает PZC более основным). Фосфаты алюминия, применяемые согласно изобретению, в основном будут иметь PZC между 4,0 и 7,0, более предпочтительно между 5,0 и 6,5, например примерно 5,7.
Раствор фосфата алюминия, применяемый для получения композиции по изобретению, может содержать буфер (например, фосфатный или гистидиновый или буфер Tris), но это не всегда необходимо. Раствор фосфата алюминия предпочтительно является стерильным и свободным от пирогенов. Раствор фосфата алюминия может включать свободные ионы водного фосфата, например, присутствующие в концентрации между 1,0 и 20 мМ, предпочтительно между 5 и 15 мМ и более предпочтительно примерно 10 мМ. Раствор фосфата алюминия может также включать хлорид натрия. Концентрация хлорида натрия предпочтительно находится в пределах от 0,1 до 100 мг/мл (например, 0,5-50 мг/мл, 1-20 мг/мл, 2-10 мг/мл) и более предпочтительно примерно 3±1 мг/мл. Присутствие NaCl облегчает правильное измерение pH перед адсорбцией антигенов.
Соли алюминия могут применяться для адсорбции любого из HBV и отличного от HBV антигенов. HBsAg предпочтительно адсорбируется на адъювант на основе фосфата алюминия [70]. Дифтерийный анатоксин предпочтительно адсорбируется на адъювант на основе гидроксида алюминия. Столбнячный анатоксин предпочтительно адсорбируется на адъювант на основе гидроксида алюминия, но это не является необходимым (например, может применяться адсорбция столбнячного анатоксина при 0-10% адсорбции). Бесклеточные коклюшные антигены и, в особенности, 69 кДа антиген предпочтительно адсорбируются на адъювант на основе гидроксида алюминия. Конъюгированные Hib антигены могут быть адсорбированы на фосфат алюминия [112, 113] или могут быть не адсорбированными. Такой способ Hib адсорбции в особенности применяется в вакцинах, включающих D-T-Pw-Hib-HBsAg антигены. Другие конъюгированные антигены (например, менингококки, пневмококки) могут быть подобным образом адсорбированы на соль алюминия (например, фосфат) или могут быть не адсорбированными [114]. IPV антигены обычно не адсорбируются на любой адъювант перед применением в способе по изобретению, но они могут быть адсорбированы на алюминиевый адъювант(ы), состоящие из других компонентов.
Для адсорбции HBsAg адъювант на основе фосфата алюминия предпочтительно применяется в форме водного раствора, к которому добавлен HBsAg (NB: является стандартным обозначать водный фосфат алюминия как "раствор", хотя строго с физико-химической точки зрения соль является нерастворимой и образует суспензию). Предпочтительно разводить фосфат алюминия до требуемой концентрации и обеспечивать гомогенность раствора перед добавлением HBsAg. Концентрация Al+3 перед добавлением HBsAg в основном находится между 0 и 10 мг/мл. Предпочтительная концентрация Al+3 находится между 2 и 6 мг/мл.
Два предпочтительных компонента для применения в способе по изобретению представляют собой: (1) двухвалентный D-T компонент, включающий адъювант на основе гидроксида алюминия; и (2) трехвалентный D-T-Pw компонент, включающий оба адъюванта гидроксид алюминия и фосфат алюминия.
Фармацевтические композиции
Кроме компонентов адъюванта и антигена композиции могут включать дополнительные компоненты. Эти компоненты могут иметь различные источники. Например, они могут присутствовать в одном из компонентов антигена или адъюванта, который применяется при производстве, или могут быть добавлены отдельно от антигенных компонентов.
Предпочтительные композиции по изобретению включают один или несколько фармацевтических носителей и/или наполнителей.
Для контроля тоничности предпочтительно включать физиологическую соль, такую как натриевая соль. Предпочтительным является хлорид натрия (NaCl), который может присутствовать в концентрациях, которые находятся между 1 и 20 мг/мл. Композиции в основном имеют осмоляльность, которая находится между 200 мОсм/кг, предпочтительно между 240-360 мОсм/кг, и более предпочтительно будут находиться в пределах 290-300 мОсм/кг. Ранее было опубликовано, что осмоляльность не влияет на боль, вызванную при вакцинации [115], но, тем не менее, предпочтительно поддерживать осмоляльность в этих пределах.
Композиции по изобретению могут включать один или несколько буферов. Обычные буферы включают: фосфатный буфер; Tris буфер; боратный буфер; сукцинатный буфер; гистидиновый буфер; или цитратный буфер. Буферы обычно включены в концентрации в пределах 5-2OмМ.
pH композиции по изобретению в основном будет находиться между 5,0 и 7,5 и более обычно между 5,0 и 6,0 для оптимальной стабильности или между 6,0 и 7,0. Таким образом, способ по изобретению может включать стадию приведения pH нерасфасованной вакцины перед способом упаковки. Композиции по изобретению предпочтительно являются стерильными.
Композиции по изобретению предпочтительно являются не пирогенными, например, содержащими <1 EU (эндотоксиновой единицы, стандартное измерение) на дозу и предпочтительно <0,1 EU на дозу.
Композиции по изобретению предпочтительно свободны от глютена.
pH любых вакцинных веществ, упакованных в водных растворах, предпочтительно находится между 5 и 8, например между 5,5 и 6,5.
Благодаря адсорбционной природе HBsAg конечный вакцинный продукт может представлять собой непрозрачную суспензию. Это отсутствие прозрачности обозначает, что микробную контаминацию нельзя легко заметить, и, таким образом, вакцина предпочтительно содержит антимикробный агент. Это особенно важно, когда упакованная вакцина предназначена для многократного применения. Предпочтительные антимикробные агенты для включения в состав представляют собой 2-феноксиэтанол и тимерозал. Однако предпочтительно не применять ртутные консерванты (например, тимерозал) в способе по изобретению. Однако присутствие следовых количеств может быть неизбежным, если HBsAg обрабатывали таким консервантом перед применением для получения композиции по изобретению. Однако для безопасности предпочтительно, чтобы конечная композиция содержала менее чем примерно 25 нг/мл ртути. Более предпочтительно, чтобы конечный вакцинный продукт содержал тимерозал ниже уровня детекции. Этого в основном можно достичь путем удаления ртутного консерванта из способа получения антигенов перед их добавлением в способ по изобретению или избегать применения тимерозала в способе получения компонентов, применяемых для получения композиции.
Когда применяется двухвалентная D-T смесь в способе по изобретению, то она должна быть свободна от тимерозала. В некоторых воплощениях D-T смесь может включать 2-феноксиэтанол, но в других она свободна и от тимерозала, и от 2-феноксиэтанола. Когда применяется трехвалентная D-T-Pw смесь в способе по изобретению, то она может быть свободна от 2-феноксиэтанола, но может включать тимерозал.
В процессе производства разведение компонентов для получения конечных желаемых концентраций обычно будет осуществляться в WFI (воде для инъекций).
Концентрация фосфата алюминия в композиции по изобретению выражается как содержание Al3+, предпочтительно менее чем 5 мг/мл, например ≤4 мг/мл, ≤3 мг/мл, ≤2 мг/мл, ≤1 мг/мл и т.д.
Концентрация любого 3D-MPL в композиции по изобретению предпочтительно менее чем 200 мкг/мл, например ≤150 мкг/мл, ≤125 мкг/мл, ≤110 мкг/мл, ≤100 мкг/мл и т.д.
Концентрация HBsAg в композиции по изобретению предпочтительно менее чем 60 мкг/мл, например ≤55 мкг/мл, ≤50 мкг/мл, ≤45 мкг/мл, ≤40 мкг/мл и т.д. Концентрация примерно 20 мкг/мл является обычной. Концентрация дифтерийного анатоксина в композиции по изобретению обычно составляет, по меньшей мере, 50 IU/мл. Концентрация столбнячного анатоксина в композиции по изобретению обычно составляет, по меньшей мере, 100 IU/мл.
Соотношение дифтерийного и столбнячного анатоксинов в композиции по изобретению обычно находится между 2:1 и 3:1 (измеренное в Lf единицах), предпочтительно между 2,4:1 и 2,6:1 и более предпочтительно 2,5:1. Когда применяется коклюшный антиген, то он обычно присутствует в концентрации, по меньшей мере, 8 IU/мл; когда применяются бесклеточные антигены, то они обычно присутствуют в количестве, которое находится между 25-75 мкг для PT, примерно 25-75 мкг для FHA и примерно 10-20 мкг пертактина на дозу.
Количество Hib конъюгата, измеренное как для сахарида, в композиции по изобретению обычно находится между 10 и 30 мкг/мл.
Количество HAV антигена, измеренное в EU (Elisa Единицы), обычно составляет, по меньшей мере, 600 EU/мл.
Количество IPV антигена зависит от штамма серотипа. Для вируса типа 1 композиция обычно содержит примерно 80 DU/мл. Для вируса типа 2 композиция обычно содержит примерно 16 DU/мл. Для вируса типа 3 композиция обычно содержит примерно 65 DU/мл. Количество менингококкового конъюгата, измеренное как для сахарида, в композиции по изобретению обычно находится между 5 и 25 мкг/мл для каждой серогруппы.
Количество пневмококкового конъюгата, измеренное как для сахарида, в композиции по изобретению обычно находится между 2 и 20 мкг/мл для каждой серогруппы.
Композиции по изобретению предпочтительно вводят пациентам в дозах по 0,5 мл. Когда ссылаются на дозы по 0,5 мл, то следует понимать, что туда включено нормальное отклонение, например, 0,5 мл + 0,05 мл.
В изобретении может быть представлено нерасфасованное вещество, подходящее для упаковки в индивидуальные дозы, которые могут затем предлагаться для введения пациентам. Вышеуказанные концентрации обычно являются концентрациями в конечных упакованных дозах, и, таким образом, концентрации в нерасфасованной вакцине могут быть выше (например, их следует уменьшить до конечных концентраций путем разведения). Композиции по изобретению в основном представлены в форме водного раствора.
Упаковка композиций по изобретению
После объединения HBsAg и адъювантов способ по изобретению может включать стадию извлечения и упаковки 0,5 мл образца смеси в емкость. В случае мультидозовых вакцин необходимые многочисленные количества доз будут извлечены и упакованы вместе в одну емкость. Способы по изобретению могут включать дополнительную стадию упаковки вакцины в емкости для применения. Подходящие емкости включают ампулы и одноразовые шприцы (предпочтительно стерильные).
Когда композицию по изобретению упаковывают в ампулы, то они предпочтительно сделаны из стекла или пластикового материала. Ампулу предпочтительно стерилизуют, перед тем как добавляют в нее композицию. Чтобы избежать проблем с пациентами, чувствительными к латексу, ампулы предпочтительно закупоривают свободными от латекса пробками. Ампула может включать одну дозу вакцины или может включать более чем одну дозу ('мультидозовая' ампула), например 10 доз. При применении мультидозовой ампулы каждая доза должна быть извлечена стерильной иглой и шприцом при строго асептических условиях, стараясь избегать контаминации содержимого ампулы. Предпочтительные ампулы сделаны из бесцветного стекла.
Ампула может иметь разъем (например, Luer lock), адаптированный так, что предварительно наполненный шприц может быть вставлен в разъем, и содержимое шприца может быть внесено в ампулу (например, чтобы восстановить там лиофилизованное вещество), и содержимое ампулы может быть удалено обратно в шприц. После удаления шприца из ампулы можно затем присоединить иглу и композицию можно ввести пациенту. Разъем предпочтительно находится внутри кончика или крышки, так что перед тем как разъем будет доступен, следует удалить кончик или крышку.
Когда композиция упакована в шприц, у шприца обычно нет присоединенной к нему иглы, хотя шприц может быть снабжен отдельной иглой для сборки и применения. Безопасные иглы являются предпочтительными. Являются обычными иглы 1-дюймовая 23-членная, 1-дюймовая 25-членная и 5/8-дюймовая 25-членная. Шприцы могут быть снабжены съемными маркировками, на которых для облегчения ведения учета может быть напечатан номер лота и дата окончания срока годности содержимого. Поршень в шприце предпочтительно имеет ограничитель, чтобы предотвратить случайное удаление поршня во время аспирации. Шприцы могут иметь латексный каучуковый разъем и/или поршень. Одноразовые шприцы содержат одну дозу вакцины. Шприц в основном будет иметь наконечник, который необходимо удалить, перед тем как присоединить иглу, наконечник предпочтительно сделан из бутилкаучука. Если шприц и игла упакованы отдельно, то игла предпочтительно снабжена бутилкаучуковым колпачком. Серый бутилкаучук является предпочтительным. Предпочтительными шприцами являются те, что продаются под торговой маркой "Tip-Lok"™.
Когда применяется стеклянная емкость (например, шприц или ампула), то более предпочтительно применять емкость, сделанную из боросиликатного стекла, чем известково-натриевого стекла. После того как композиция упакована в емкость, емкость может быть затем помещена в коробку для продажи, например в картонную коробку, и коробка будет затем маркирована данными по вакцине, например ее торговым названием, списком антигенов в вакцине (например, 'гепатит B рекомбинантный', и т.д.), описанием емкости (например, 'Одноразовые Предварительно Наполненные Tip-Lok Шприцы' или '10×0,5 мл Однодозовые Ампулы'), ее дозой (например, 'каждая содержит одну дозу по 0,5 ml'), предостережениями (например, 'Только для Применения у Взрослых' или 'Только для Педиатрического Применения'), датой окончания срока годности, показаниями (например, 'активная иммунизация против инфекции вируса гепатита В (HBV), вызванной всеми известными субтипами, для пациентов с почечной недостаточностью (включая перед диализом и находящихся на гемодиализе) пациентов в возрасте от 15 лет и старше' и т.д.), номером патента и т.д. Каждая коробка может содержать более чем одну упакованную вакцин, например пять или десять упакованных вакцин (особенно для ампул). Если вакцина содержится в шприце, то на упаковке может быть показан рисунок шприца.
Вакцина может быть упакована вместе с аннотацией (например, в одной и той же коробке), включающей подробное описание вакцины, например инструкции по введению, подробное описание антигенов в вакцине и т.д. Инструкции могут также содержать предостережения, например держать раствор адреналина в зоне легкого доступа на случай анафилактической реакции, следующей за вакцинацией и т.д. Упакованная вакцина предпочтительно хранится при температуре, которая находится между 2°C и 8°C. Ее не следует замораживать.
Вакцины могут быть представлены в полностью жидкой форме (т.е. где все антигенные компоненты представлены в водном растворе или суспензии) в процессе производства, или они могут быть получены в форме, где некоторые компоненты представлены в жидкой форме, а другие в лиофилизованной форме. Таким образом, конечная вакцина может быть получена непосредственно во время применения путем смешивания вместе двух компонентов: (a) первого компонента, включающего антигены в водном растворе; и (b) второго компонента, включающего лиофилизованные антигены. Два компонента предпочтительно представлены в отдельных емкостях (например, ампулах и/или шприцах), и в изобретении представлен набор, включающий компоненты (a) и (b). Этот формат применяется в особенности для вакцин, которые включают конъюгированный компонент, в особенности Hib и/или менингококковые конъюгаты, поскольку они могут быть более стабильными в лиофилизованной форме. Таким образом, конъюгаты могут быть лиофилизованы перед их применением по изобретению. Дополнительные компоненты также могут быть добавлены перед вымораживанием, например, такие как стабилизаторы. Предпочтительными стабилизаторами для включения в состав являются лактоза, сахароза и маннит, также как смеси на их основе, например смеси лактоза/сахароза, смеси сахароза/маннит и т.д. Конечная вакцина может, таким образом, содержать лактозу и/или сахарозу. Применение смеси сахароза/маннит может ускорить процесс сушки.
Таким образом, в изобретении представлен способ для получения комбинированной вакцины с двумя емкостями, включающий следующие стадии:
- получение комбинированной вакцины в форме водного раствора, как описано выше, но где один или несколько из указанных антигенов не включает конъюгированный капсульный сахаридный антиген;
- получение указанной комбинированной вакцины в первой емкости (например, шприце);
- получение конъюгированного капсульного сахаридного антигена в лиофилизованной форме;
- упаковка указанного лиофилизованного антигена во вторую емкость (например, ампулу); и
- упаковка первой емкости и второй емкости вместе в набор.
Набор может быть затем передан медикам.
D, T, P и HBsAg компоненты представлены предпочтительно в жидкой форме.
Способы лечения и введения вакцины
Композиции по изобретению подходят для введения людям, и в изобретении представлен способ индуцирования иммунного ответа у пациента, включающий стадию введения композиции по изобретению пациенту.
В изобретении также представлена композиция по изобретению для применения при лечении.
В изобретении также представлено применение (i) HBsAg экспрессирующегося согласно изобретению и (ii) одного или нескольких отличных от HBV антигенов для производства лекарственного средства для введения пациенту.
В изобретении также представлено применение (i) HBsAg, экспрессирующегося согласно изобретению, и (ii) адъюванта, отличного от гидроксида алюминия, для производства лекарственного средства для введения пациенту. Лекарственное средство предпочтительно является одновалентной вакциной. Предпочтительные группы пациентов, для которых предназначена вакцина, указаны выше.
Иммуногенными композициями по изобретению предпочтительно являются вакцины, предназначенные для применения в целях предупреждения и/или лечения инфекции вируса гепатита В. Пациенты, получившие композиции по изобретению, предпочтительно имеют сывороточный анти-HBsAg GM титр ≥500 мIU/мл, измеренный через 6 недель после первой иммунизации. Более предпочтительно, когда титр составляет ≥500 мIU/мл, при измерении через 12 месяцев. Для того чтобы получить полный эффект, типичный график иммунизации для ребенка может включать введение более чем одной дозы. Например, дозы могут быть распределены: 0 и 6 месяцев (время 0 соответствует первой дозе); 0, 1, 2 и 6 месяцев; в день 0, день 21 и затем третья доза между 6 и 12 месяцами; или в 0, 1, 2, 6 и 12 месяцев.
Композиции по изобретению могут быть введены путем внутримышечной инъекции, например, в руку или в ногу. Вакцины, полученные по изобретению, могут быть введены пациентам в то же время, что и отдельная пневмококковая конъюгированная вакцина, такая как Prevnar™.
В процессе хранения может наблюдаться выпадение осадка компонентов, в случае если композиции по изобретению включают адъювант с основой на алюминии. Таким образом, композицию следует перемешать с помощью встряхивания перед введением пациенту. Перемешанная с помощью встряхивания композиция будет представлять собой мутную белую суспензию.
Предпочтительные вакцины
Специфические мультивалентные иммуногенные композиции по изобретению включают:
- Двухвалентную композицию, включающую HBsAg и HAV. Вакцина представлена в форме водного раствора. Она включает оба адъюванта на основе гидроксида алюминия и на основе фосфата алюминия. HBsAg адсорбируется на фосфат алюминия. HAV адсорбируется на гидроксид алюминия. Количества на мл: примерно 720 ELISA единиц HAV; примерно 20 мкг HBsAg. Доза: примерно 1 мл. Может быть представлена в предварительно наполненном шприце.
- Пятивалентная композиция, включающая HBsAg, D, T, Pa и IPV. Вакцина представлена в форме водного раствора. Она включает оба адъюванта на основе гидроксида алюминия и на основе фосфата алюминия. HBsAg адсорбируется на фосфат алюминия. D, T и Pa адсорбируются на гидроксид алюминия. Количества на мл: примерно 50 Lf дифтерийного анатоксина; примерно 20 Lf столбнячного анатоксина; примерно 50 мкг PT; примерно 50 мкг FHA; примерно 16 мкг пертактина; примерно 20 мкг HBsAg; примерно 80 DU полиовируса типа 1; примерно 16 DU полиовируса типа 2; примерно 64 DU полиовируса типа 3. Доза: примерно 0,5 мл. Может быть представлена в предварительно наполненном шприце.
- Пятивалентная композиция, включающая HBsAg, D, T, Pa и IPV. Вакцина представлена в форме водного раствора. Она включает оба адъюванта на основе гидроксида алюминия и на основе фосфата алюминия. HBsAg адсорбируется на фосфат алюминия. D, T и Pa адсорбируются на гидроксид алюминия. Количества на мл: по меньшей мере, 60 IU дифтерийного анатоксина; по меньшей мере, 80 IU столбнячного анатоксина; примерно 50 мкг PT; примерно 50 мкг FHA; примерно 16 мкг пертактина; примерно 20 мкг HBsAg; примерно 80 DU полиовируса типа 1; примерно 16 DU полиовируса типа 2; примерно 64 DU полиовируса типа 3. Доза: примерно 0,5 мл. Может быть представлена в предварительно наполненном шприце.
- Четырехвалентная композиция, включающая HBsAg, D, T и Pw. Компоненты представлены в форме водного раствора. Она включает оба адъюванта на основе гидроксида алюминия и на основе фосфата алюминия. HBsAg адсорбируется на фосфат алюминия. D и T адсорбируются на гидроксид алюминия. Композиция включает тимерозал, но предпочтительно не содержит 2-пеноксиэтанол. Количества на мл: по меньшей мере 60 IU дифтерийного анатоксина; по меньшей мере 120 IU столбнячного анатоксина; по меньшей мере 8 IU Pw; примерно 20 мкг HBsAg. Доза: примерно 0,5 мл.
- Пятивалентная композиция, включающая HBsAg, D, T, Pw и Hib-T конъюгат. Компоненты HBsAg, D, T и Pw представлены в форме водного раствора; Hib-T лиофилизован. Она включает оба адъюванта на основе гидроксида алюминия и на основе фосфата алюминия. HBsAg адсорбируется на фосфат алюминия. D и T адсорбируются на гидроксид алюминия. HBsAg и Hib-T адсорбируются на фосфат алюминия. Лиофилизованный Hib-T включает лактозу. Компонент в водном растворе может включать тимерозал. Количества на мл: по меньшей мере 60 IU дифтерийного анатоксина; по меньшей мере 120 IU столбнячного анатоксина (плюс между 5-25 мкг столбнячного анатоксина в качестве носителя в Hib-T); по меньшей мере 8 IU Pw; примерно 20 мкг HBsAg; примерно 5 мкг Hib-T, измеренного как для сахарида. Доза: примерно 0,5 мл.
Эти композиции могут применяться отдельно или как компоненты дополнительных вакцин. Например, в изобретении представлена шестивалентная композиция, включающая пятивалентную композицию HBsAg-D-T-Pa-IPV, описанную выше, плюс лиофилизованный Hib-T конъюгат. Лиофилизованный Hib-T предпочтительно не адсорбируется на соли алюминия. В изобретении также представлена пятивалентная композиция, включающая четырехвалентную композицию HBsAg-D-T-Pw, описанную выше, плюс лиофилизованный Hib-T конъюгат. В изобретении также представлена семивалентная композиция, включающая четырехвалентную композицию HBsAg-D-T-Pw, описанную выше, плюс лиофилизованная смесь Hib-T конъюгата, MenA конъюгата и MenC конъюгата. Конечные вакцины могут быть получены путем восстановления лиофилизованных веществ с находящимися в водном растворе HBsAg-содержащими веществами во время применения, и лиофилизованные компоненты в водном растворе предпочтительно упакованы вместе в наборе, как описано выше.
Специфическая одновалентная иммуногенная композиция по изобретению представляет собой:
- HBsAg в комбинации с адъювантом на основе фосфата алюминия и с 3D-MPL адъювантом, где HBsAg и 3D-MPL оба адсорбируются на фосфат алюминия. Количества на дозу: примерно 20 мкг HBsAg, примерно 50 мкг 3D-MPL, примерно 0,5 mg Al3+.
Специфические способы по изобретению включают следующие стадии: - Очистить HBsAg после экспрессии согласно изобретению; адсорбировать HBsAg на адъювант на основе фосфата алюминия; получить свободную от тимерозала двухвалентную смесь D-T с адъювантом на основе гидроксида алюминия; получить PT, FHA и пертактин для Pa компонента; получить IPV антигены, как объединенные типы 1, 2 и 3, предпочтительно без адъюванта на основе соли алюминия; объединить D-T, Pa, IPV и HBsAg, в любом порядке с получением конечной пятивалентной комбинации; необязательно упаковывать в шприц.
- Очистить HBsAg после экспрессии согласно изобретению; адсорбировать HBsAg на адъювант на основе фосфата алюминия; получить свободную от 2-феноксиэтанола, тимерозал-содержащую трехвалентную смесь D-T-Pw с адъювантами на основе гидроксида алюминия и на основе фосфата алюминия; объединить D-T-Pw и HBsAg с получением конечной четырехвалентной комбинации; необязательно упаковывать в шприц; необязательно упаковывать в комбинации с лиофилизованным конъюгированным компонентом(ами), например Hib-T, MenA, MenC.
- Очистить HBsAg после экспрессии согласно изобретению; адсорбировать HBsAg на адъювант на основе фосфата алюминия; получить свободную от 2-феноксиэтанола, тимерозал-содержащую трехвалентную смесь D-T-Pw с адъювантами на основе гидроксида алюминия и на основе фосфата алюминия; получить лиофилизованный Hib-T конъюгат; объединить D-T-Pw и HBsAg с получением четырехвалентного компонента в водном растворе; упаковать четырехвалентный компонент в водном растворе в стеклянную ампулу; упаковать лиофилизованный Hib-T в стеклянную ампулу; объединить две ампулы, чтобы они были представлены в одном наборе для восстановления с получением пятивалентной комбинированной вакцины. Стеклянные ампулы могут быть из стекла типа I и иметь бутилкаучукоые ограничители.
- Очистить HBsAg после экспрессии согласно изобретению; адсорбировать HBsAg на адъювант на основе фосфата алюминия; получить свободную от 2-феноксиэтанола тимерозал-содержащую трехвалентную смесь D-T-Pw с адъювантами на основе гидроксида алюминия и на основе фосфата алюминия; получить IPV антигены, как объединенные типы 1, 2 и 3, предпочтительно без адъюванта на основе соли алюминия; объединить D-T-Pw, IPV и HBsAg, в любом порядке с получением конечной пятивалентной комбинации; необязательно упаковывать в шприц; необязательно упаковывать в комбинации с лиофилизованным конъюгированным компонентом(ами), например Hib-T, MenA, MenC.
Дополнительные компоненты, например хлорид натрия, адъюванты, консерванты и т.д., могут быть добавлены на любой стадии. Эти способы могут применяться, например, чтобы получить вакцины, описанные выше.
Различные стадии способа могут быть осуществлены, по существу, в одно время или могут быть осуществлены отдельно. Они могут быть осуществлены в одном месте или в различных местах, даже в различных странах, например, экспрессия HBsAg и лиофилизация Hib-T конъюгата могут быть проведены в различных местах.
Белки-носители для конъюгатов
Конъюгированные сахаридные антигены включают белок-носитель, к которому сахарид ковалентно присоединяется или напрямую, или через линкер. Основную информацию по методикам конъюгирования можно обнаружить в ссылке 116.
Известны различные белки для применения в качестве носителей, и предпочтительными белками-носителями являются бактериальные токсины или анатоксины, такие как дифтерийный анатоксин или столбнячный анатоксин. Другие подходящие белки-носители включают, но не ограничены ими, CRM197 мутант дифтерийного анатоксина [117-119], белок внешней мембраны N. meningitidis [120], синтетические пептиды [121, 122], белки теплового шока [123, 124], коклюшные белки [125, 126], цитокины [127], лимфокины [127], гормоны [127], фркторы роста [127], искусственные белки, включающие множественные человеческие CD4+ T-клеточные эпитопы из различных выделенных из патогенов антигенов [128], такие как N19 [129], белок D из H.influenzae [130,131], пневмококковый поверхностный белок PspA [132], пневмолизин [133], содержащие железо белки [134], токсин A или B из C.difficile [135], S.agalactiae белки [136] и т.д.
Присоединение сахарида к носителю предпочтительно осуществляется через -NH2 группу, например, в боковой цепи остатка лизина в белке-носителе или остатка аргинина. Присоединение к -SH группам (например, в боковой цепи цистеина) также возможно.
Конъюгаты с сахаридом: соотношения белка (вес/вес) между 1:5 (т.е. избыток белка) и 5:1 (т.е. избыток сахарида) являются предпочтительными.
Композиции могут включать малое количество свободного носителя. Не связанный ни с каким носителем включают в состав как отдельный антиген, не конъюгированного носителя предпочтительно не больше чем 5% от общего количества белка-носителя в композиции в целом, и более предпочтительно, что он присутствует в количестве менее чем 2% по весу.
Возможно включать более чем один тип белка-носителя в композицию, например, чтобы уменьшить риск подавления носителя.
Белок-носитель, применяемый для N.meningitidis конъюгатов, может быть белком D из H.influenzae. Этот белок подробно описан в ссылках 137 и 138, и его применение в качестве белка-носителя в конъюгатах описано в ссылке 139. Термин "белок D" включает фрагменты нативного полноразмерного белка, как описано в ссылке 139, и также гибридные белки, включающие или полноразмерный белок D или эти фрагменты (например, гибрид фрагмента белка вируса гриппа NSl и фрагмента белка D). Фрагменты сохраняют способность превращать T-независимые сахаридные антигены в T-зависимый антиген при их конъюгировании. Типичные фрагменты будут включать, по меньшей мере, N-концевую часть 1/3 белка D. Белок может легко экспрессироваться в E.coli [138], и этот рекомбинантный материал является предпочтительным для применения по изобретению [139].
Общие понятия
Термин "содержащий" охватывает понятия "включающий" также как "состоящий", например, композиция "содержащая" X может состоять исключительно из X или может включать что-то дополнительное, например X+Y. Слово "по существу" не исключает "полностью", например, композиция, которая "по существу свободна" от Y, может быть полностью свободна от Y. Где это необходимо, слово "по существу" может быть изъято из определения изобретения.
Термин "примерно" по отношению к численной величине x обозначает, например, x+10%.
Если специфически не определено, то способ, включающий стадию смешивания двух или более компонентов, не требует никакого специфического порядка смешивания. Таким образом, компоненты могут быть смешаны в любом порядке. Там где присутствуют три компонента, то два компонента могут быть объединены друг с другом, и затем комбинация может быть объединена с третьим компонентом и т.д.
Где антиген описывается как "адсорбированный" с адъювантом, то предпочтительно, что адсорбируется, по меньшей мере, 50% (по весу) антигена, например 50%, 60%, 70%, 80%, 90%, 95%, 98% или более. Предпочтительно, чтобы дифтерийный анатоксин или столбнячный анатоксин адсорбировались оба полностью, т.е. чтобы в супернатанте ничего не детектировалось. Также предпочтительна полная адсорбция HBsAg.
Было бы удобно, если бы ионизируемые группы могли существовать в нейтральной форме, показанной здесь в формуле, или могли существовать в заряженной форме, например, в зависимости от pH. Таким образом, фосфатная группа может быть показана как -P-O-(OH)2, эта формула является характерной только для нейтральной фосфатной группы, и другие заряженные формы также охвачены в изобретении. Подобным образом, кольца сахаров могут существовать в открытой или закрытой форме, в то время как закрытые формы показаны здесь в структурной формуле, открытые формы также охвачены в изобретении.
Когда в культуре клеток применяются животные материалы (и в особенности бычьи), то они должны быть получены из источников, свободных от трансмиссивных губчатых энцефалопатий (TSEs), и в особенности свободны от бычьих губчатых энцефалопатий (BSE).
Подробное описание списка последовательностей
Способы для осуществления изобретения
Получение плазмид
Плазмида сконструирована с включением различных элементов в следующем порядке: дрожжевой GAPDH промотор; последовательность, кодирующая HbsAg; область, включающая дрожжевой терминатор транскрипции ARG3; ДНК из E.coli вектора pBR327; дрожжевая ДНК с LEU2 маркером; ДНК из E.coli вектора pBR327; дрожжевая последовательность плазмиды 2µ; ДНК из E.coli вектора pBR327. Последовательности pBR327 включают последовательность начала репликации, функциональную в E.coli. Размер плазмиды составляет в целом между 14600 и 14700 п.о.
Последовательность GAPDH промотора включает следующий 1060-мер (SEQ ID NO: 1):


Последовательность, кодирующая HBsAg, является соответственно (SEQ ID NO: 4) вместе со следующим за ней охра стоп-кодоном:

Эта последовательность кодирует полипептид со следующей аминокислотной последовательностью SEQ ID NO: 3:

Последовательность ARG3 включает следующую 689-членную последовательность (SEQ ED NO: 8) вместе с дополнительной последовательностью из области, расположенной ниже или из ARG3:
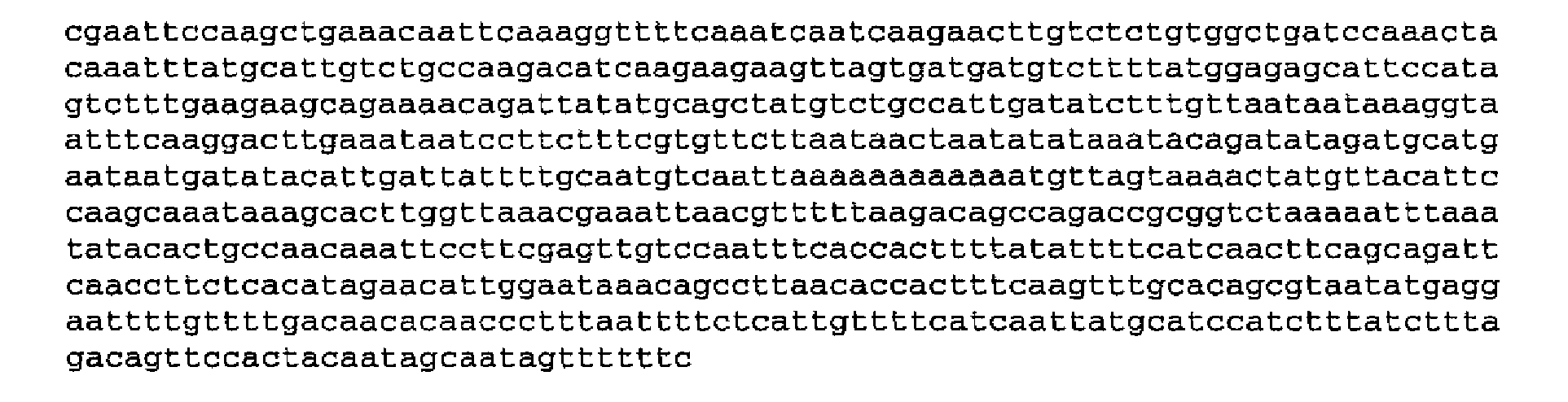
Таким образом, плазмида включает следующий 2430-член в экспрессирующей кассете (SEQ ED NO: 13):


Анализ последовательности элементов плазмиды
Последовательность GAPDH промотора (SEQ ID NO: 1) отличалась от последовательности GAPDH промотора, описанной в ссылке 41 (SEQ ID NO: 5), в нескольких положениях:


SEQ ID NO: 1 сравнили с "Всеми GenBank+EMBL+DDBJ+PDB последовательностями (но не с EST, STS, GSS, образцами окружающей среды или фазой 0, 1 или 2 HTGS последовательностей)" 7-ого Апреля 2005, без фильтрации. Верхняя строчка этого исследования сравнений с SEQ ID NO: 1 соответственно:
>gi│l췍췍췍췍췍췍│emb│Z72978.1│SCYGR193C S.cerevisiae хромосома VII открытая рамка ORF YGR193c
Длина = 2262
Счет = 2085 бит (1052), Ожидание = 0,0
Идентичности = 1058/1060 (99%)
Цепь = Плюс/Минус


Таким образом, SEQ ID NO: 1 отличается двумя нуклеотидами по сравнению с обратной комплементарной последовательностью ближайшей совпадающей последовательности.
Последовательность, кодирующую HBsAg (SEQ ID NO: 4), проанализировали на предмет сравнения с последовательностями GenBank тем же путем. SEQ ID NO: 4 отличается от ближайшей совпадающей последовательности (AY576426.1) из базы данных только нуклеотидом 350 (A/G). Это отличие приводит в результате к изменению кодона Ser/Asn.
Кодируемая последовательность (SEQ ID NO: 3) была проанализирована с помощью BLASTP 4-го Апреля 2005 с применением базы данных "не-избыточных GenBank CDS трансляций+PDB+SwissProt+PIR+PRF, за исключением образцов окружающей среды" без фильтрации. SEQ ID NO: 3 отличается от ближайших совпадающих последовательностей из базы данных аминокислотой в положении 117, имеющей остаток Asn, а не Ser. Верхнюю строчку занимала последовательность CAA84792.1 (SEQ ID NO: 10)
>gi│527444│emb│CAA84792.l│ поверхностный белок S [вирус Гепатита B] gi│7429123│pir││jQ1575 главный поверхностный антиген - вирус гепатита B
Длина = 400
Счет = 494 биты (1271), Ожидание = e-139
Идентичности = 225/226 (99%), Положительные = 226/226 (100%)


BLASTN анализ расположенной ниже последовательности из ARG3 (SEQ ID NO: 8) обнаружил 100% совпадение с последовательностью базы данных M28301.1, но только последовательность размером свыше 683-мера перекрывает SEQ ID NO: 8, начиная с нуклеотида 7. CLUSTALW сравнение этих двух последовательностей, включающих 7 нуклеотидов на 5' конце SEQ ID NO: 8, приведено ниже:


Экспрессия и адсорбция HBsAg
Плазмида применяется, чтобы трансформировать дрожжевой штамм S.cerevisiae (DC5) leu2-3 Ieu2-112 his3 canl-11. Дрожжи выращивают в синтетической среде, содержащей очищенные аминокислоты (но без лейцина), витамины и подходящие соли. Экспрессированный HBsAg очищают с помощью способа, включающего получение клеток, преципитацию, ультрафильтрацию, гель-проникающую хроматографию, ионо-обменную хроматографию, ультрацентрифугирование и обессоливание.
Очищенный антиген является не гликозилированным и может быть виден в форме по существу сферических частиц (со средним диаметром ~20 нм).
Суспензию фосфата алюминия в изотонической соли смешивают с очищенным концентратом HBsAg. После доведения pH до значений между 5,2 и 6,0 смесь оставляют при комнатной температуре в течение дня с помешиванием. Адсорбция антигена на адъювант происходит после этого времени.
Одновалентная вакцина
Для получения одновалентной вакцины 3D-MPL добавляют к адсорбированному HBsAg и с использованием воды для инъекции и стерильной соли проводят разведение, чтобы получить конечную концентрацию HBsAg 20 мкг/мл. Эту нерасфасованную вакцину затем упаковывают в индивидуальные дозы, или в ампулы, или в одноразовые шприцы.
Мультивалентная вакцина
Для получения комбинированной вакцины смесь DTPw антигенов получают из Chiron Behring в Марбурге, Германии. Эту смесь смешивают с адсорбированным HBsAg с получением продукта четырехвалентной вакцины. Четырехвалентный продукт можно применять сам по себе или можно применять, чтобы восстановить или (a) лиофилизованный Hib-T конъюгат, который адсорбируется на адъювант на основе фосфата алюминия, или (b) трехвалентную смесь из лиофилизованных конъюгатов Hib, MenA и MenC.
Следует понимать, что изобретение было описано только с помощью примера, и могут быть произведены модификации не выходя за рамки и не отступая от сути изобретения.
ССЫЛКИ
(содержания которых введены сюда с помощью ссылки)



Реферат
Изобретение относится к области биотехнологии и касается иммуногенных композиций, содержащих плазмиду для экспрессии поверхностного антигена вируса гепатита В (HBsAg). Охарактеризованная плазмида включает: (1) последовательность, кодирующую HBsAg, имеющий аминокислотную последовательность SEQ ID NO: 3; (2) расположенный выше промотор из гена глицеральдегид-3-фосфат дегидрогеназы для контроля экспрессии последовательности, кодирующей HBsAg, где промотор содержит нуклеотидную последовательность SEQ ID NO: 1; и (3) терминатор транскрипции ARG3, расположенный ниже последовательности, кодирующей HBsAg, где терминатор включает SEQ ID NO:8. HBsAg может быть очищен и применен в производстве вакцин, в частности в производстве одновалентных и комбинированных вакцин. 9 н. и 31 з.п. ф-лы.
Формула
(a) HBV компонент, включающий HBsAg, экспрессированный в хозяине S.cerevisiae, несущем плазмиду, имеющую последовательность, кодирующую HBsAg, где плазмида включает: (1) расположенный выше промотор из гена глицеральдегид-3-фосфат дегидрогеназы для контроля экспрессии последовательности, кодирующей HBsAg; и (2) терминатор транскрипции ARG3, расположенный ниже последовательности, кодирующей HBsAg;
(b) по меньшей мере, один отличный от HBV компонент, выбранный из дифтерийного анатоксина, столбнячного анатоксина, клеточного коклюшного антигена, бесклеточного коклюшного антигена, антигена вируса гепатита А, конъюгированного капсульного сахарида Haemophilus influenzae типа b, инактивированного полиовируса, конъюгированного капсульного сахарида Neisseria meningitides серогруппы С, конъюгированного капсульного сахарида Neisseria meningitides серогруппы А, конъюгированного капсульного сахарида Neisseria meningitides серогруппы W135 или конъюгированного капсульного сахарида Neisseria meningitides серогруппы Y; и
(c) один или несколько адъювантов.
(a) получение HBV компонента путем очистки HBsAg после экспрессии в хозяине S.cerevisiae, несущем плазмиду, имеющую последовательность, кодирующую HBsAg, где плазмида включает: (1) расположенный выше промотор из гена глицеральдегид-3-фосфат дегидрогеназы для контроля экспрессии последовательности, кодирующей HBsAg; и (2) терминатор транскрипции ARG3, расположенный ниже последовательности, кодирующей HBsAg;
(b) получение, по меньшей мере, одного отличного от HBV компонента; выбранного из дифтерийного анатоксина, столбнячного анатоксина, клеточного коклюшного антигена, бесклеточного коклюшного антигена, антигена вируса гепатита А, конъюгированного капсульного сахарида Haemophilus influenzae типа b, инактивированного полиовируса, конъюгированного капсульного сахарида Neisseria meningitides серогруппы С, конъюгированного капсульного сахарида Neisseria meningitides серогруппы А, конъюгированного капсульного сахарида Neisseria meningitides серогруппы W135 или конъюгированного капсульного сахарида Neisseria meningitides серогруппы Y; и
(c) смешивание HBV и отличного от HBV компонентов с получением мультивалентной композиции.
(а) HBV компонент, включающий HBsAg, экспрессированный в хозяине S.cerevisiae, несущем плазмиду, имеющую последовательность, кодирующую HBsAg, где плазмида включает: (1) расположенный выше промотор из гена глицеральдегид-3-фосфат дегидрогеназы для контроля экспрессии последовательности, кодирующей HBsAg; и (2) терминатор транскрипции ARG3, расположенный ниже последовательности, кодирующей HBsAg; и
(b) адъювант, включающий смесь адъюванта на основе фосфата алюминия и адъюванта 3D-MPL.
(a) получение HBV компонента путем очистки HBsAg после экспрессии в хозяине S.cerevisiae, несущем плазмиду, имеющую последовательность, кодирующую HBsAg, где плазмида включает: (1) расположенный выше промотор из гена глицеральдегид-3-фосфат дегидрогеназы для контроля экспрессии последовательности, кодирующей HBsAg; и (2) терминатор транскрипции ARG3, расположенный ниже последовательности, кодирующей HBsAg; и
(b) объединение HBsAg с адъювантом, включающим смесь адъюванта на основе фосфата алюминия и адъюванта 3D-MPL.
(1) последовательность, кодирующую HBsAg, имеющий аминокислотную последовательность SEQ ID NO: 3;
(2) расположенный выше промотор из гена глицеральдегид-3-фосфат дегидрогеназы для контроля экспрессии последовательности, кодирующей HBsAg, где промотор содержит нуклеотидную последовательность SEQ ID NO: 1; и
(3) терминатор транскрипции ARG3, расположенный ниже последовательности, кодирующей HBsAg, где терминатор включает SEQ ID NO: 8.

Комментарии