Анти-ifnar1 антитела с пониженным сродством с лигандом fc - RU2556125C2
Код документа: RU2556125C2
Чертежи




































































Описание
По настоящей заявке испрашивается приоритет в соответствии с разделом 35 Свода законов США, §119(е), на основе следующих предварительных заявок на патенты США: US 61/006962, поданной 8 февраля 2008 г., 61/034618, поданной 7 марта 2007 г., и 61/049970, поданной 2 мая 2008 г., сущность которых включена в настоящее описание в виде ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к выделенным антителам и композициям, специфичным в отношении рецептора 1 интерферона альфа (interferon alpha receptor 1 - IFNAR1), с пониженным сродством в отношении лигандов Fc. Настоящее изобретение также относится к нуклеиновым кислотам, кодирующим такие антитела, комплементарным нуклеиновым кислотам, векторам, клеткам-хозяевам и способам их получения и применения, включая терапевтические композиции, составы, способы введения и устройства.
Уровень техники
Интерфероны
Интерфероны (IFN) I типа (IFNα, IFNβ, IFNω, IFNτ) представляют семейство структурно близких цитокинов, обладающих противовирусным, противоопухолевым и иммуномодулирующим действием (Hardy и др. Blood 97, 2001, С.473; Cutrone и Langer J. Biol. Chem. 276, 2001, с.17140). Локус IFNα человека включает два подсемейства. Первое подсемейство состоит из 14 неаллельных генов и 4 псевдогенов, обладающих по меньшей мере 80% гомологии. Второе подсемейство, αII или омега (ω), включает 5 псевдогенов и 1 функциональный ген, проявляющий 70% гомологию с генами IFNα (Weissmann и Weber Prog. Nucl. Кислота Res. Mol. Biol., 33, 1986, cc.251-300). Подтипы IFNα обладают разными специфическими действиями, но одинаковым биологическим спектром (Streuli. Proc. Natl. Acad. Sci. USA 78, 1981, с.2848) и одним и тем же клеточным рецептором (Agnet M. и др. в кн.: «Interferon 5», 1983, под ред. I. Gresser, изд-во Academic Press, Лондон, cc.1-22). Подтипы интерферона альфа обозначают следующим образом: IFNα 1, 2а, 2b, 4, 4b, 5, 6, 7, 8, 10, 14, 16, 17 и 21.
Интерферон β (IFNβ) кодирует один ген, который примерно на 50% гомологичен генам IFNα.
Интерферон γ, который вырабатывается активированными лимфоцитами, не проявляет какой-либо гомологии с альфа/бета интерферонами и не взаимодействует с их рецептором.
Рецепторы интерферона
Все интерфероны I типа человека связываются с рецептором на поверхности клеток (рецептор IFN альфа, IFNAR), состоящим из двух трансмембранных белков, IFNAR1 и IFNAR2 (Uze и др. Cell 60, 1990, с.225; Novick и др. Cell 77, 1994, с.391). Белок IFNAR1 важен для высокого связывающего сродства и дифференциальной специфичности комплекса IFNAR (Cutrone и др. J. Bio Chem 276(20), 2001, cc.17140-17148). Хотя функциональных отличий для каждого подтипа IFN I типа не было выявлено, предполагают, что каждый подтип может проявлять разные взаимодействия с компонентами рецептора IFNAR, приводя к возможному различию результатов по передаче сигналов (Cook и др. J. Biol. Chem. 271, 1996, с.13448). В частности исследования, в которых используют мутантные формы белков IFNAR1 и IFNAR2, подтверждают, что сигналы альфа и бета интерферонов по-разному передаются через рецептор за счет дифференциального взаимодействия с соответствующими цепями (Lewerenz и др. J. Mol. Biol. 282, 1998, с.585).
Функции интерферонов
Ранние функциональные исследования интерферонов I типа были сосредоточены на врожденной защите от вирусных инфекций (Haller и др. J. Ехр. Med. 154, 1981, с.199; Lindenmann и др. Methods Enzymol. 78, 1981, с.181). Однако в последующих исследованиях рассматривали интерфероны I типа в качестве мощных иммунорегулирующих цитокинов при формировании адаптивного иммунного ответа. Особенно показано, что интерфероны I типа облегчают дифференциацию не подвергнутых какому-либо воздействию Т-клеток по метаболическому пути Th1 (Brinkmann и др. J. Ехр. Med. 178, 1993, с.1655) для повышения выработки антител (Finkelman и др. J. Ехр. Med. 174, 1991, с.1179) и поддержки функционального действия и выживания Т-клеток памяти (Santini и др. J. Ехр. Med. 191, 2000, с.1777; Tough и др. Science 272, 1996, с.1947).
Некоторые группы исследователей в предшествующих исследованиях высказали предположение, что IFNα может повысить созревание или активацию дендровидных клеток (ДК) (Santini и др. (2000) J. Ехр. Med. 191:1777; Luft и др. J. Immunol. 161, 1998, с.1947; Luft и др. Int. Immunol. 14, 2002, с.367; Radvanyi и др. Scand. J. Immunol. 50, 1999, с.499). Кроме того, повышенная экспрессия интерферонов I типа описана при многочисленных аутоиммунных заболеваниях (Foulis и др. Lancet 2, 1987, с.1423; Hooks и др. Arthritis Rheum. 25, 1982, с.396; Hertzog и др. Clin. Immunol. Immunopathol. 48, 1988, с.192; Hopkins и Meager Clin. Ехр. Immunol. 73, 1988, с.88; Arvin и Miller Arthritis Rheum. 27, 1984, с.582). Большинство связанных с этим исследованных примеров представляет инсулин-зависимый сахарный диабет (ИЗСД) (Foulis (1987)) и системная красная волчанка (СКВ) (Hooks (1982)), которые ассоциированы с повышенными уровнями IFNα, и ревматоидный артрит (PA) (Hertzog (1988), Hopkins и Meager (1988), Arvin и Miller (1984)), в котором IFNβ может играть более существенную роль.
Кроме того, сообщают, что введение интерферона α обостряет основное заболевание у пациентов с псориазом и рассеянным склерозом, а также индукцию СКВ-подобного синдрома у пациентов, у которых ранее не было аутоиммунного заболевания. Также было установлено, что интерферон α индуцирует гломерулонефрит у нормальных мышей и для ускорения начала спонтанного аутоиммунного заболевания у мышей NZB/W. Кроме того, установлено, что терапия IFNα в некоторых случаях приводит к нежелательным побочным эффектам, в том числе к лихорадке и неврологическим нарушениям. Следовательно, имеются патологические ситуации, при которых подавление действия IFN I типа может быть полезно для пациента, и существует потребность в агентах, эффективных для подавления действия IFN I типа.
Эффекторные функции антител
Область Fc антитела взаимодействует с рядом лигандов (называемых также «лигандами Fc», к которым относятся, но которыми перечень не ограничивается, агенты, специфически связывающиеся с областью Fc антител, например, рецепторы Fc и C1q), включая рецепторы Fc и C1q, обеспечивая должное функционирование важных признаков, называемых эффекторными функциями. Рецепторы Fc опосредуют взаимодействие между антителами и клеточными выростами иммунной системы (Raghavan и др., Annu Rev Cell Dev Biol 12, 1996, cc.181-220; Ravetch и др., Annu Rev Immunol 19, 2001, cc.275-290). У людей к этому семейству белков относятся: FcγRI (CD64), в том числе изоформы FcγRIA, FcγRIB и FcγRIC; FcγRII (CD32), в том числе изоформы FcγRIIA, FcγRIIB и FcγRIIC; и FcγRIII (CD16), в том числе изоформы FcγRIIIA и FcγRIIB (Jefferis и др., Immunol Lett 82, 2002, cc.57-65). Эти рецепторы обычно имеют внеклеточный домен, который опосредует связывание с Fc, областью мембранного связывания и внутриклеточным доменом, которые могут опосредовать некоторые действия по передаче сигнала в клетке. Эти рецепторы экспрессируются в различных клетках иммунной системы, включая моноциты, макрофаги, нейтрофилы, дендровидные клетки, эозинофилы, тучные клетки, тромбоциты, В-клетки, крупные гранулярные лимфоциты, клетки Лангерганса, природные клетки-киллеры (NK) и Т-клетки. Формирование комплекса Fc/FcγR рекрутирует такие эффекторные клетки к сайтам связанного антигена, обычно приводя к передаче сигналов внутри клеток и последующим важным иммунным ответам, например, к высвобождению медиаторов воспаления, активации В-клеток, эндоцитозу, фагоцитозу и цитотоксической атаке. Способность опосредовать цитотоксические и фагоцитарные эффекторные функции является важным механизмом, с помощью которого антитела расстраивают клетки-мишени. Опосредованную клетками реакцию, в которой неспецифические цитотоксические клетки, экспрессирующие FcγR, распознают связанное антитело на клетках-мишенях и затем вызывают лизис клеток-мишеней, называют антитело-зависимой клеточно-опосредованной цитотоксичностью (антитело dependent cellular cytotoxicity - ADCC) (Raghavan и др., Annu Rev Cell Dev Biol 12, 1996, cc.181-220; Ghetie и др., Annu Rev Immunol 18, 2000, cc.739-766; Ravetch и др., Annu Rev Immunol 19, 2001, cc.275-290). Опосредованную клетками реакцию, в которой неспецифические цитотоксические клетки, экспрессирующие FcγR, распознают связанное антитело на клетке-мишени и затем вызывают фагоцитоз клеток-мишеней, называют антитело-зависимым клеточно-опосредованным фагоцитозом (антитело dependent cell-mediated phagocytosis - ADCP). Кроме того, перекрывающийся сайт в области Fc на молекуле также контролирует активацию клеточно-независимой цитотоксической функции, опосредованной комплементом, которая также называется комплемент-зависимой цитотоксичностью (complement dependent cytotoxicity - CDC).
Разные типы FcγR человека
Рецепторы FcγR человека подразделяют на три разных класса: FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16). Рецептор FcγRI является рецептором высокой степени сродства (Ka: 10-8-10-9 М-1)и связывает и иммунные комплексы, и мономерные молекулы IgG, хотя Fc рецепторы FcγRII и FcγRIII ингибируют пониженное сродство (<10-7 М-1 и 2-3×10-7, соответственно) (Gessner J.E. и др., Annn Hematology 76, 1998, cc.231-248). Передача сигналов через FcγR происходит или через иммунорецепторный основанный на тирозине активирующий мотив (immunoreceptor tyrosine-based activation motif - ITAM), или через иммунорецепторный основанный на тирозине ингибирующий мотив (immunoreceptor tyrosine-based inhibitory motif - ITIM) для всех трансмембранных рецепторов (Presta, Adv Drug Deli Rev 58, 2006, cc.640-656).
Внеклеточный гликопротеин FcγRI массой 72 кДа преимущественно экспрессируется на миелоидных клетках, например, моноцитах, клетках-предшественников макрофагов CD4+ и может вызвать ответы в виде ADCC, эндоцитоза и фагоцитоза (Siberil и др. J Immunol Lett 106, 2006, cc.111-118).
Рецепторы группы FcγRII массой 40 кДа (А, В и С изоформы) проявляют внеклеточные домены, но не содержат домены активной трансдукции сигналов. Эти рецепторы распространяют сигналы через фосфорилирование цитоплазматического хвостового домена (Amigorena S. и др., Science. 256, 1992, cc.1808-1812). Рецептор FcγRIIA в основном экспрессируется на моноцитах, макрофагах, нейтрофилах и тромбоцитах, несмотря на то, что рецептор FcγRIIC был идентифицирован только на клетках NK. Было установлено, что эти два рецептора инициируют ADCC, эндоцитоз, фагоцитоз и высвобождение медиатора воспаления (Cassel и др., Mol Immunol 30, 1993, cc.451-460). Напротив, рецепторы FcγRIIB (типов В1 и В2) экспрессируются на В-клетках, тучных клетках, базофилах, моноцитах, макрофагах и дендровидных клетках, а также установлено, что они снижают иммунный ответ, запускаемый изоформами А и С.
Рецептор FcγRIIIA массой 50 кДа, экспрессируемый на клетках NK, моноцитах, макрофагах и подгруппой Т-лимфоцитов, где он активирует ADCC, фагоцитоз, эндоцитоз и высвобождение цитокина (Gessner и др.). Изоформой FcγRIIIB является гликозилфосфатидилинозит (glycosyl-phosphatidylinositol - GPI) заякоренный периферический мембранный белок, участвующий в дегрануляции и выработке промежуточных соединений реакционноспособного кислорода (Salmon J.E. и др,. J Clin Inves 95, 1995, cc.2877-2785).
Молекулы IgG также проявляют различную по изотипам специфичность в отношении рецепторов FcγR. Молекулы IgG3 сильно связываются со всеми изоформами FcγR. Изоформы IgG1, наиболее превалирующие изоформы в крови, связываются со всеми рецепторами FcγR, хотя и с меньшим сродством в отношении изоформ FcγRIIA/B. IgG4 является промежуточным связующим для FcγRI и слабым связующим для FcγRIIB. В конечном счете IgG2 связывается слабо только с одной аллельной формой FcγRIIA (FcγRIIA-H131) (Siberil и др., J Immunol Lett 106, 2006, cc.111-118).
Комплемент
Воспалительный каскад комплемента является частью врожденного иммунного ответа и является ключевым в отношении способности индивидуума сдерживать инфекцию. Другим важным лигандом Fc является белок комплемента C1q. Fc, связываясь с C1q, опосредует процесс, называемый комплемент-зависимой цитотоксичностью (complement dependent cytotoxicity - CDC) (по этой теме см. обзор Ward и др., Ther Immunol 2, 1995, cc.77-94). Clq способен связывать шесть антител, хотя связывание с двумя IgG достаточно для активирования каскада комплемента. C1q формирует комплекс с сериновыми протеазами C1r и C1s для формирования комплекса С1 метаболического пути комплемента.
Области и аминокислотные остатки IgG, участвующие в связывании FcγR
Проводилось тщательное исследование картирования сайтов связывания IgG человека с разными рецепторами FcγR. Эти исследования, основанные на генетически измененных молекулах IgG, выявили короткие непрерывные участки аминокислотных остатков (234-238) N-концевой части домена СН2, в качестве непосредственно вовлеченных в связывание со всеми рецепторами FcγR. Кроме того, остатки 268, 297, 327 и 329 могут воздействовать на связывание с подгруппой FcγR. Кроме того, множественные остатки, локализованные на доменах СН2 и CH3, также влияют на связывание с FcγR (Canfield S.M. и др., J Exp Med 173, 1991, cc.1483-1491; Chappel M.S. и др. Proc Nat Acad Sci USA 888, 1991, cc.9036-9040; Gergely J. и др., FASEB J 4, 1990, cc.3275-3283).
Токсичность, связанная с терапевтическими антителами
Во многих случаях связывание и стимуляция эффекторных функций, опосредованных областью Fc иммуноглобулинов, весьма полезны, однако в некоторых случаях может быть более полезным снизить или элиминировать эффекторную функцию. Это особенно справедливо для тех антител, которые разработаны для доставки лекарственного средства (например, токсинов и изотопов) к клеткам-мишеням, когда Fc/FcγR-опосредованные эффекторные функции приводят здоровые иммунные клетки в соприкосновение со смертельным грузом, что приводит к истощению нормальной лимфоидной ткани вместе с клетками-мишенями (Hutchins и др., PNAS USA 92, 1995, cc.11980-11984; White и др., Annu Rev Med 52, 2001, cc.125-145). В этих случаях применение антител, которые слабо рекрутируют комплемент или эффекторные клетки, может обладать огромным преимуществом (см., например, Wu и др., Cell Immunol 200, 2000, cc.16-26; Shields и др., J. Biol Chem 276, 2001, cc.6591-6604; US 6194551; US 5885573 и РСТ публикацию WO 04/029207).
В других случаях, например, если целью является блокирование взаимодействия широко экспрессируемого рецептора с его близким лигандом, может быть полезно понизить или элиминировать все эффекторные функции антитела для снижения нежелательной токсичности. Кроме того, если терапевтическое антитело проявляет беспорядочное связывание в ряде тканей человека, может быть целесообразно ограничить нацеливание эффекторной функции на разнообразный набор тканей для ограничения токсичности. Хотя некоторые известные подклассы имуноглобулинов человека, которые утратили специфические эффекторные функции, неизвестны природные иммуноглобулины, утратившие эффекторные функции. Другим подходом может быть конструирование или внесение мутации применительно к принципиально важным остатков в области Fc, ответственной за эффекторную функцию. См., например, публикации РСТ WO2006076594, WO199958572, US20060134709, WO2006047350, WO2006053301 и US 5624821, каждая из которых включена в настоящее изобретение в виде ссылки на ее сущность.
Применение моноклональных антител для лечения многих заболеваний хорошо изучено. С неисчислимыми эффекторными функциями, которые антитело может индуцировать, одним из необходимых условий для терапевтических антител является то, что они нацеливаются конкретно на требуемую мишень. Например, но этот пример не является ограничительным, специфичность ткани-мишени анализируется путем определения иммуногистохимии (ИГХ) исследуемой ткани. Важно, что лекарственное средство связывается только с тканями, которые содержат исследуемую мишень. Расстройство такого действия может привести к повышенной токсичности терапевтического антитела из-за несоответствующей активации эффекторной функции, вызываемой по сайту, не являющемуся мишенью. Если эффекторная функция может быть понижена или удалена, опасности широко распространенного связывания терапевтического средства можно избежать. Учитывая вышесказанное, имеется нерешенная проблема по разработке антител с пониженным или удаленным сродством в отношении по меньшей мере одного лиганда Fc, ответственного за действие эффекторной функции. Такие антитела могут быть особенно полезны для применения в лечении хронического воспаления и аутоиммунных состояний.
В настоящем изобретении цитирование и обсуждение ссылок нельзя истолковывать в качестве допущения, что таков предшествующий уровень для настоящего изобретения.
Краткое описание фигур
С целью иллюстрации настоящего изобретения в виде фигур представлены определенные варианты осуществления настоящего изобретения. Однако настоящее изобретение не ограничивается точным описанием манипуляций и инструментария тех вариантов настоящего изобретения, которые отображены на фигурах.
Фиг.1А. Выравнивание последовательности нуклеиновой кислоты (SEQ ID No:7) и выравнивание последовательности аминокислот (SEQ ID No:8) 3F11 VH с областями CDR, отмеченными подчеркиванием сверху.
Фиг.1Б. Выравнивание последовательности нуклеиновой кислоты (SEQ ID No:9) и аминокислотной последовательности (SEQ ID No:10) 3F11 VK с областями CDR, отмеченными подчеркиванием сверху.
Фиг.2А. Выравнивание последовательности нуклеиновой кислоты (SEQ ID No:17) и выравнивание последовательности аминокислот (SEQ ID No:18) 4G5 VH с областями CDR, отмеченными подчеркиванием сверху.
Фиг.2Б. Выравнивание последовательности нуклеиновой кислоты (SEQ ID No:19) и выравнивание последовательности аминокислот (SEQ ID No:20) 4G5 VK с областями CDR, отмеченными подчеркиванием сверху.
Фиг.3А. Выравнивание последовательности нуклеиновой кислоты (SEQ ID No:27) и выравнивание последовательности аминокислот (SEQ ID No:28) 11E2 VH с областями CDR, отмеченными подчеркиванием сверху.
Фиг.3Б. Выравнивание последовательности нуклеиновой кислоты (SEQ ID No:29) и выравнивание последовательности аминокислот (SEQ ID No:30) 11E2 VK с областями CDR, отмеченными подчеркиванием сверху.
Фиг.4А. Выравнивание последовательности нуклеиновой кислоты (SEQ ID No:37) и выравнивание последовательности аминокислот (SEQ ID No:38) 9D4 VH с областями CDR, отмеченными подчеркиванием сверху.
Фиг.4В. Выравнивание последовательности нуклеиновой кислоты (SEQ ID No:39) и выравнивание последовательности аминокислот (SEQ ID No:40) 9D4 VK с областями CDR, отмеченными подчеркиванием сверху.
Фиг.5. Выравнивание аминокислотной последовательности константных областей тяжелой цепи для 9D4. Стрелки показывают аминокислотные замещения (немодифицированные на модифицированные) для повышения стабильности и пониженного сродства в отношении по меньшей мере одного лиганда Fc.
Фиг.6А. Профиль иммуногистохимического окрашивания ткани гловного мозга, обработанной различными анти-IFNAR1 антителами. Антитело 9D4 демонстрирует профиль пониженного окрашивания при инкубировании с тканью головного мозга человека по сравнению с антителами 4G5 и MDX-1333.
Фиг.6Б. Профиль иммуногистохимического окрашивания моноцитов человека, обработанных различными анти-IFNAR1 антителами. В качестве положительного контроля различные анти-IFNAR1 антитела исследуют на реактивность в отношении моноцитов человека.
Фиг.7. Анти-IFNAR1 антитело 9D4 ингибирует передачу сигнала IFNα по данным исследования активирования STAT, основанного на клетках. Обработка антителом 9D4 ингибирует STAT1/3/4 фосфорилирование тирозина в ответ на стимулирование интерфероном альфа, что было установлено методом вестерн-блоттинга с коммерчески доступными антителами STAT.
Фиг.8. Анти-IFNAR1 антитела блокируют передачу сигнала различных концентраций интерферонов I типа, производных от клеток ПДК. Представлены величины IC50 для антитела 9D4, блокирующего передачу сигнала IFN, в люциферазном репортерном анализе, использующем супернатанты IFN I типа, очищенные от трех независимых доноров. Содержатся относительные количества IFNα, IFNβ и IFNω в каждом очищенном супернатанте интерферона I типа.
Фиг.9 А, Б, В. Анти-IFNAR1 антитела 9D4, 9D4-DM (двойной мутант) и 9D4-TM (тройной мутант) проявляют схожие связывающие свойства. Показанные данные представляют немодифицированное антитело 9D4 наряду с 2 модифицированными антителами, 9D4-DM и 9D4-TM. Модифицированные антитела проявляют сходные показатели связывания IFNAR1 с немодифицированным антителом.
Фиг.10А. Анти-IFNAR1 антитело 9D4 связывает растворимый рецептор интерферона альфа (soluble interferon alpha receptor - sIFNαR1). Представлены данные равновесного связывания, которые показывают доза-зависимое связывание 9D4 с растворимым рецептором интерферона альфа.
Фиг.10Б. Определение величины Kd антитела 9D4 на мононуклеарных клетках периферической крови (МКПК) человека. Показано определение константы диссоциации антитела 9D4, измеренное по связыванию с МКПК человека.
Фиг.11. Анти-IFNAR1 антитела ингибируют индуцированную IFNα передачу сигнала в люциферазном репортерном анализе. Анти-IFNAR1 антитела, включая немодифицированные и модифицированные антитела, проявляют сходные величины IC50 для блокирования передачи сигнала через лейкоцитарный IFN в системе люциферазного репортерного анализа.
Фиг.12А. Определение изоэлектрической точки 9D4 антитела (немодифицированного) и модифицированного 9D4 антитела. Показан IEF гель, документирующий относительные величины pI для антител 9D4 WT (немодифицированного), 9D4-DM и 9D4-TM.
Фиг.12Б. Определение температуры плавления антитела 9D4 (немодифицированного) и модифицированного антитела 9D4. На фигуре представлены кривые плавления, представляющие относительные температуры плавления (melting temperatures - Tm) для антител 9D4, 9D4-DM и 9D4-TM.
Фиг.13. Профилактическое лечение с помощью анти-IFNAR антител блокирует Adv-IFNα индуцированную протеинурию. Мышей, обработанных контрольным вектором, Adv-IFNα, Adv-IFNα + предварительная обработка изотипическим контролем и Adv-IFNα + предварительная обработка анти-IFNAR, исследуют на протеинурию на протяжении 9 недель. Мыши, предварительно обработанные анти-IFNAR антителом, не проявляют протеинурии после введения IFNα.
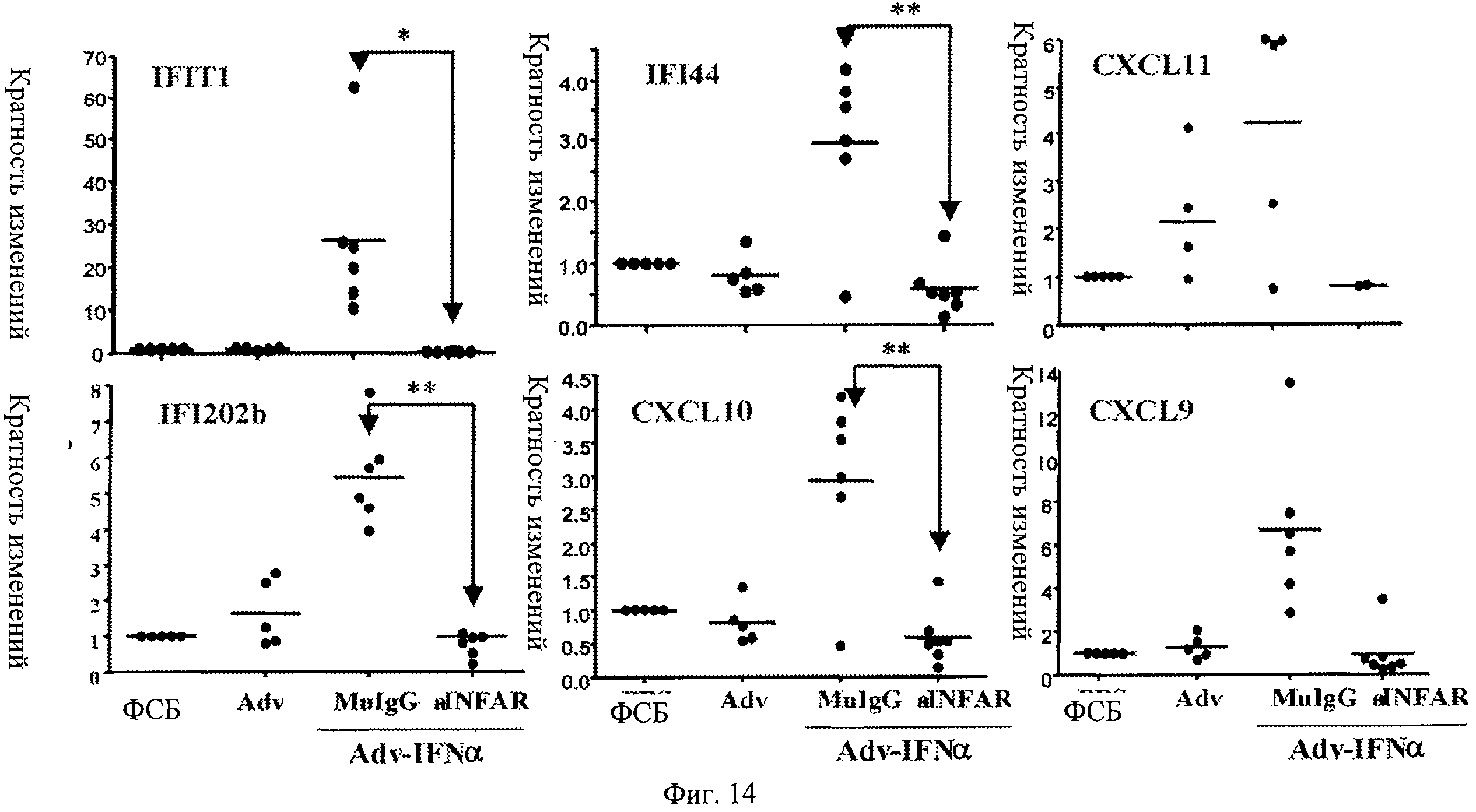
Фиг.14. Профилактическое лечение анти-IFNAR антителами блокирует повышенную регуляцию генов, ответственных за IFNα (IFIT1, IFI44, CXCL11, IFI202b, CXCL19, CXCL9), в крови. Мыши, предварительно обработанные анти-IFNAR антителами, не проявляют повышенной регуляции отобранных генов, отвечающих за IFNα, при заражении аденовирусом, кодирующим IFN альфа, по сравнению с мышами, предварительно обработанными контрольным вирусом, ФСБ или контролями изотипических IgG. Представлена относительная экспрессия шести генов, о которых известно, что они отвечают на IFNα в образцах крови, взятых от мышей через 3 недели после индукции IFNα инфицированием Adv-IFNα.
Фиг.15 А, Б. Профилактическое лечение анти-IFNAR антителами блокирует индуцированную IFNα выработку аутоантитела. Мыши, предварительно обработанные анти-IFNAR антителами, не проявляют повышенной выработки аутоантитела при инфицировании аденовирусом, кодирующим IFNα, по сравнению мышами, предварительно обработанными контрольным вирусом, ФСБ или изотипическими контролями IgG. Представлены концентрации анти-днДНК и анти-SSA/Ro в образцах крови, взятых от мышей через 6 мин после индукции IFNα инфицированием Adv-IFNα.
Фиг.16 А, Б. Профилактическое лечение анти-IFNAR антителами блокирует повышенную регуляцию цитокинов в почках. Мыши, предварительно обработанные анти-IFNAR антителами, не проявляют повышенной регуляции цитокинов в почках при заражении аденовирусом, кодирующим IFNα5, по сравнению с мышами, предварительно обработанными контрольным вирусом, ФСБ или контрольными изотипическими IgG. Представлено измерение уровней IP-10 и IL-18 в образцах почек, полученных от мышей через 6 недель после индукции IFNα инфекцией Adv-IFNα5.
Фиг.17. Профилактическое лечение с помощью анти-IFNAR антител блокирует индуцированную IFN выработку аутоантитела. Представлены титры антител к антиядерным антигенам (ANA) из сыворотки мыши. Мыши, обработанные анти-IFNAR антителами, проявляют пониженные титры ANA в сыворотке после введения IFN по сравнению с мышами, ранее обработанными контрольным вирусом, ФСБ или изотипным контролем.
Фиг.18. Опосредованное антителом подавление развития дендровидных клеток, опосредуемого плазмой СКВ. Представлены результаты 5 отдельных экспериментов, в которых IFN, полученный от пациентов с СКВ, инкубируют в присутствии анти-IFNAR1 антитела 9D4 и затем добавляют к моноцитам человека. Наличие анти-IFNAR1 антитела 9D4 ингибирует способность IFN, полученного от пациентов с СКВ, индуцировать маркеры CD38 и CD123 дендровидных клеток в дифференцирующихся моноцитах.
Фиг.19. Анти-IFNAR1 антитела подавляют экспрессию CD38, CD123 и CD86 в моноцитах, после стимуляции лейкоцитарным интерфероном. По данным измерения процента подавления экспрессии при контрольном стимулировании, анти-IFNAR1 антитела 9D4, 9D4-DM и 9D4-TM проявляют сходные профили экспрессии CD38, CD123 и CD86 в дифференцирующихся моноцитах.
Фиг.20. Модифицированные анти-IFNAR1 антитела проявляют пониженное связывание с Fc рецептором FcγRI по сравнению с немодифицированными анти-IFNAR1 антителами. Анти-IFNAR1 антитела 9D4 (немодифицированное), 9D4-DM (модифицированное) и 9D4-TM (модифицированное) анализируют по способности связываться с планшетом, с которым связан рецептор FcγRI, в эксперименте ELISA. В качестве положительного контроля для связывания Fc рецептора используют неродственное немодифицированное антитело (контрольное антитело).
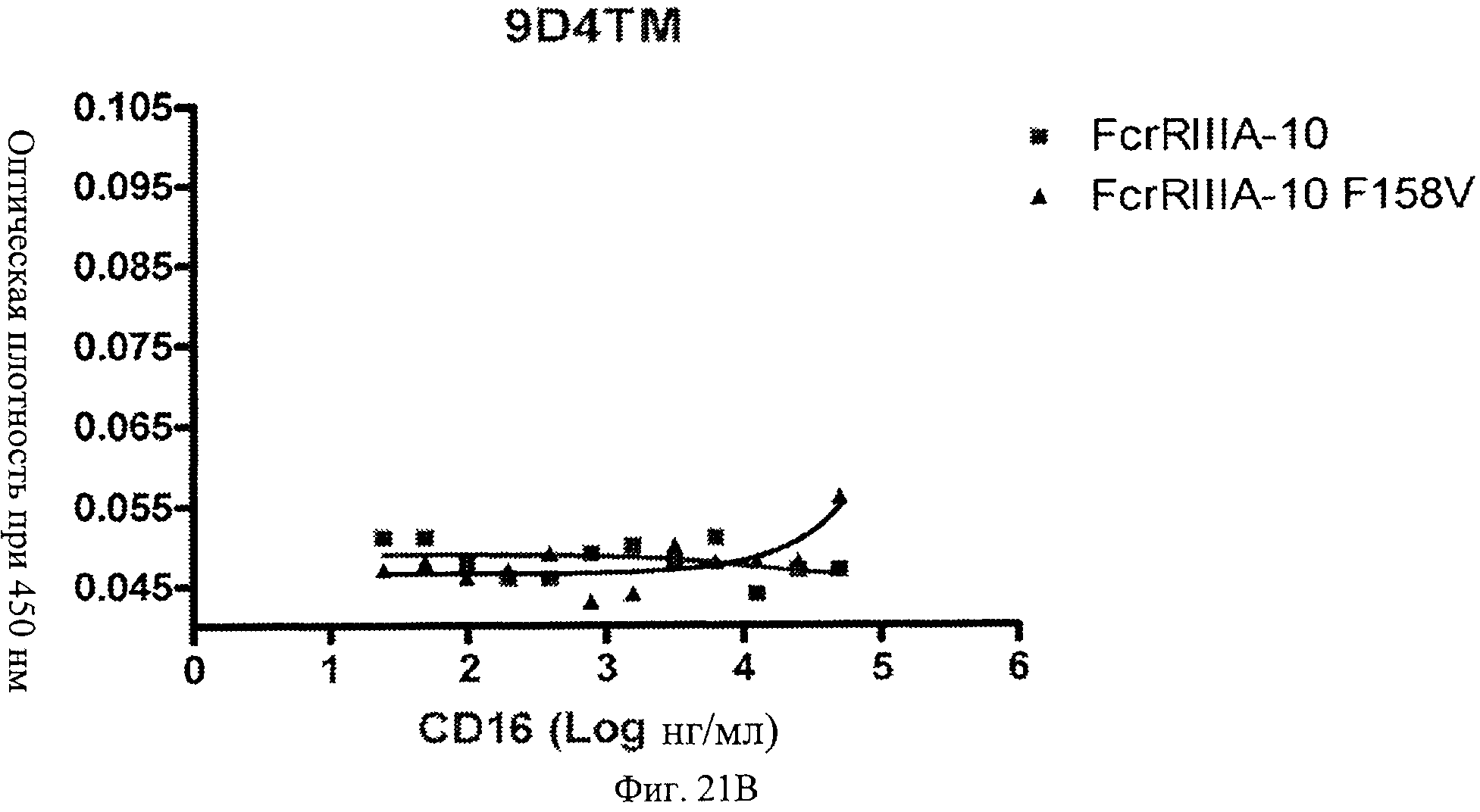
Фиг.21 А, Б, В. Модифицированные анти-IFNAR1 антитела проявляют пониженное связывание с Fc рецептором FcγRIIIA по сравнению с немодифицированными анти-IFNAR1 антителами. Связанные с планшетом немодифицированное анти-IFNAR1 антитело 9D4(A) и модифицированное анти-IFNAR1 антитела 9D4-DM(В) и 9D4-TM(С) анализируют по способности связывать свободный рецептор FcγRIIIA в экспериментальном формате ELISA.
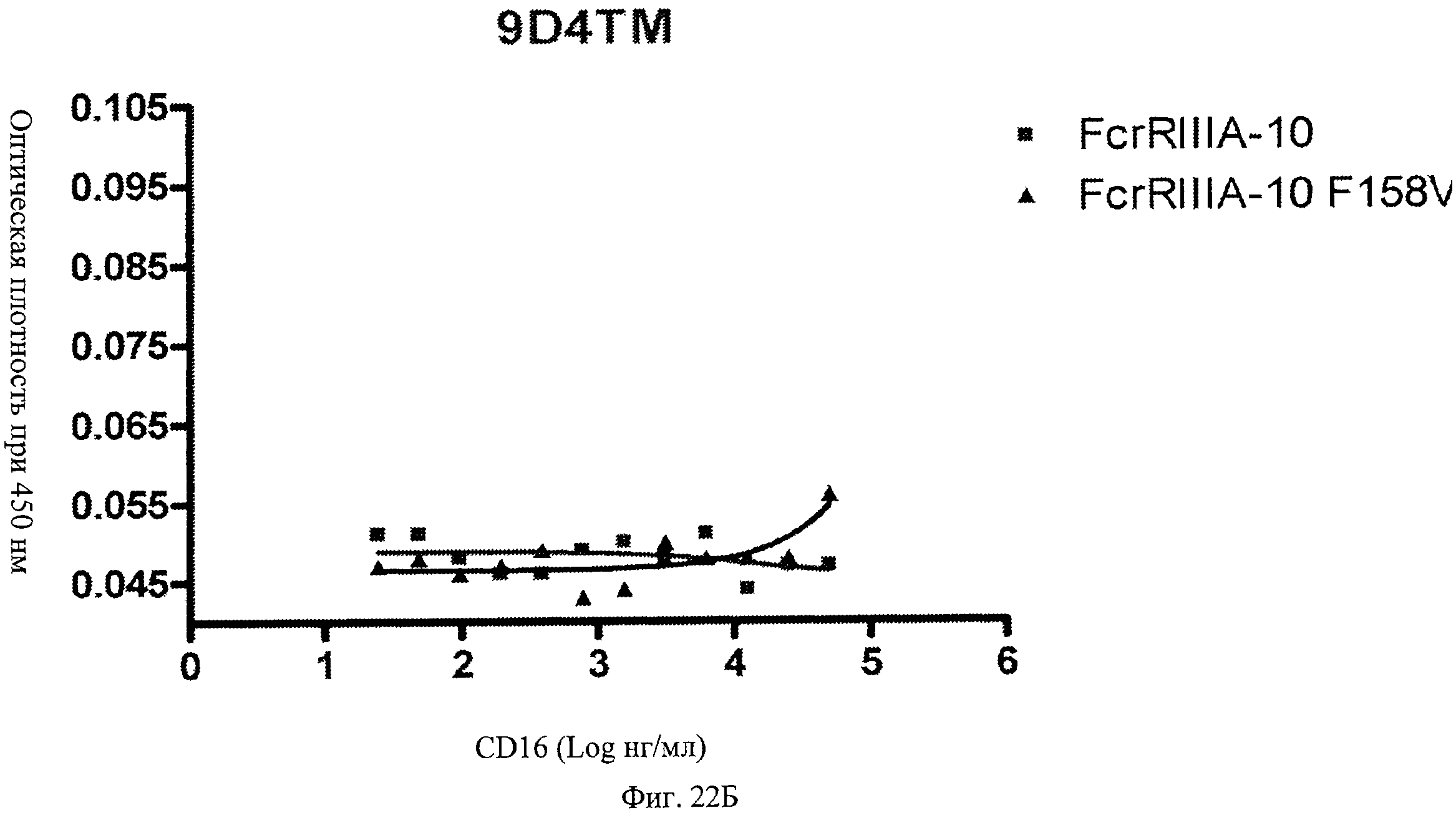
Фиг.22 А, Б, В. Модифицированные анти-IFNAR1 антитела проявляют пониженное связывание с Fc рецептором FcγRIIIA. Свободное немодифицированное анти-IFNAR1 антитело 9D4(A) и модифицированные анти-IFNAR1 антитела 9D4-DM(B) и 9D4-TM(C) анализируют по способности связывать связанный с планшетом рецептор FcγRIIIA в экспериментальном формате ELISA.
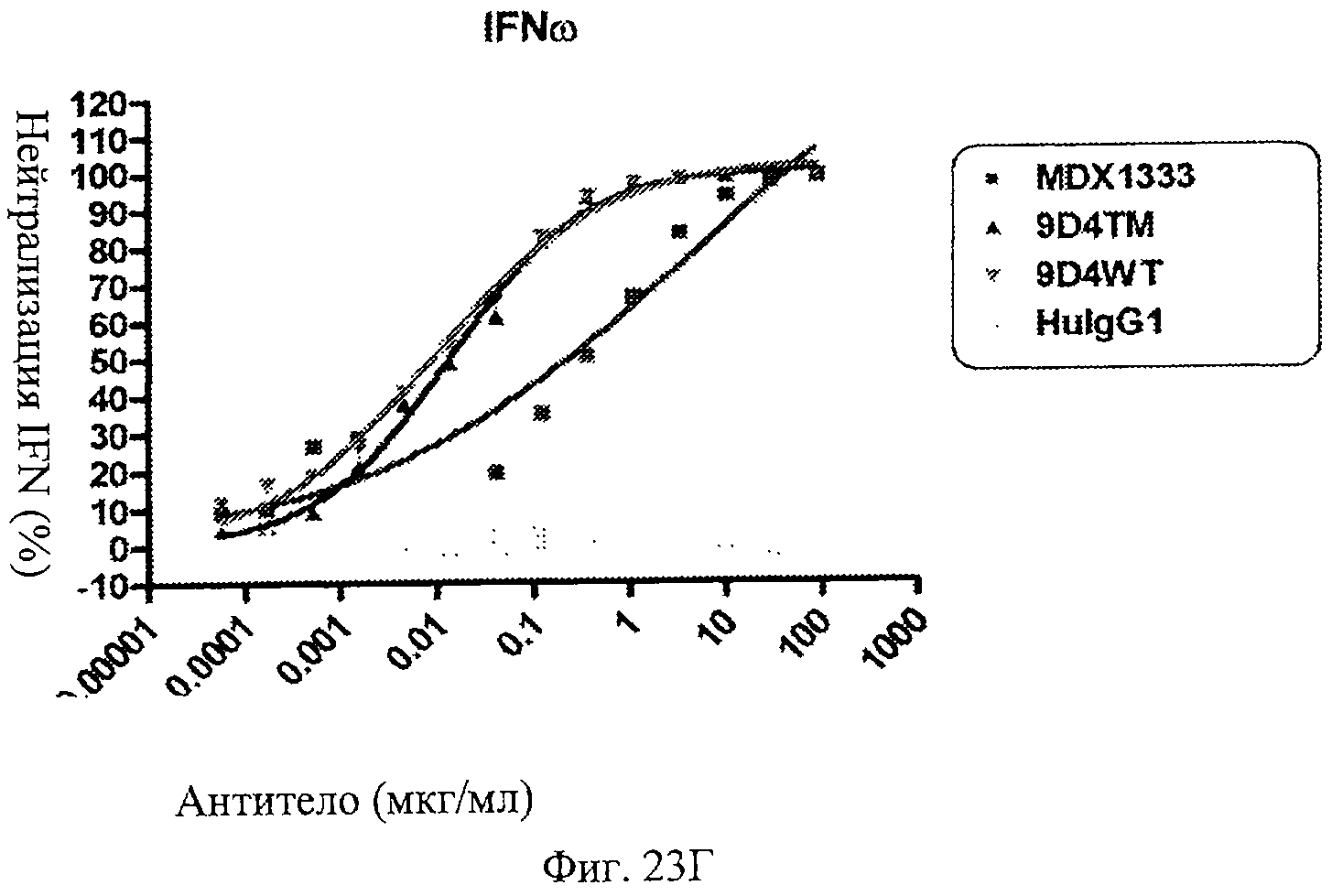
Фиг.23 А-Д. Нейтрализация подтипов IFN в сыворотке пациентов с СКВ. По данным измерений в репортерном анализе анти-IFNAR1 антитела MDX-1333, 9D4-WT и 9D4-TM подавляют опосредованную IFN передачу сигнала α10 (А), лейкоцитарного интерферона (Б), α2b (В), ω (Г) и β (Д).
Фиг.24. Анти-IFNAR1 антитела нейтрализует интерферон I типа от пациентов с СКВ. С помощью репортерного анализа показано, что анти-IFNAR1 антитело, 9D4, подавляет опосредованную интерфероном I типа передачу сигнала по сравнению с контрольным, неродственным антителом.
Фиг.25 А-Г. Анти-IFNAR антитела подавляют индуцированную IFNα популяцию ПДК среди МКПК. Анти-IFNAR антитела блокируют повышение клеток ПДК, установленное по экспрессии эпитопа на поверхности клеток, индуцированной эктопической аденовирусной экспрессией, вызванной экспрессией интерферона альфа в селезенке (А), лимфоузлах (Б), периферической крови (В) и костном мозге (Г).
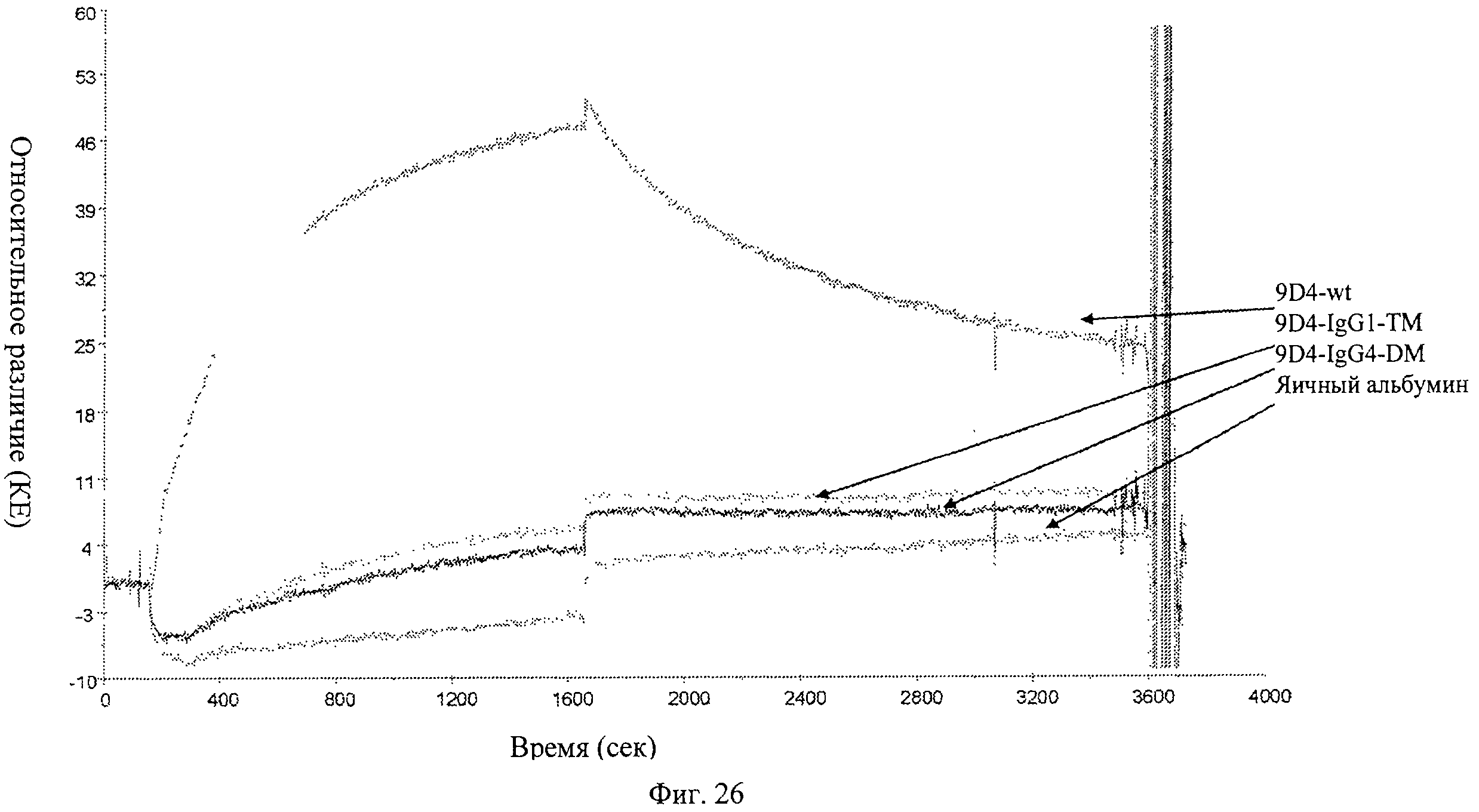
Фиг.26. Анализ связывания анти-IFNAR1 антител 9D4-WT, 9D4-DM и 9D4-TM с Fc рецептором FcγRI определяют методом BIACore. Вкратце, анти-IFNAR1 антитела иммобилизуют и добавляют свободный FcγRI для измерения аффинности. Из рисунка следует, что модифицированные антитела 9D4-DM и 9D4-TM проявляют пониженное сродство со свободным FcγRI по сравнению с немодифицированным антителом 9D4-WT.
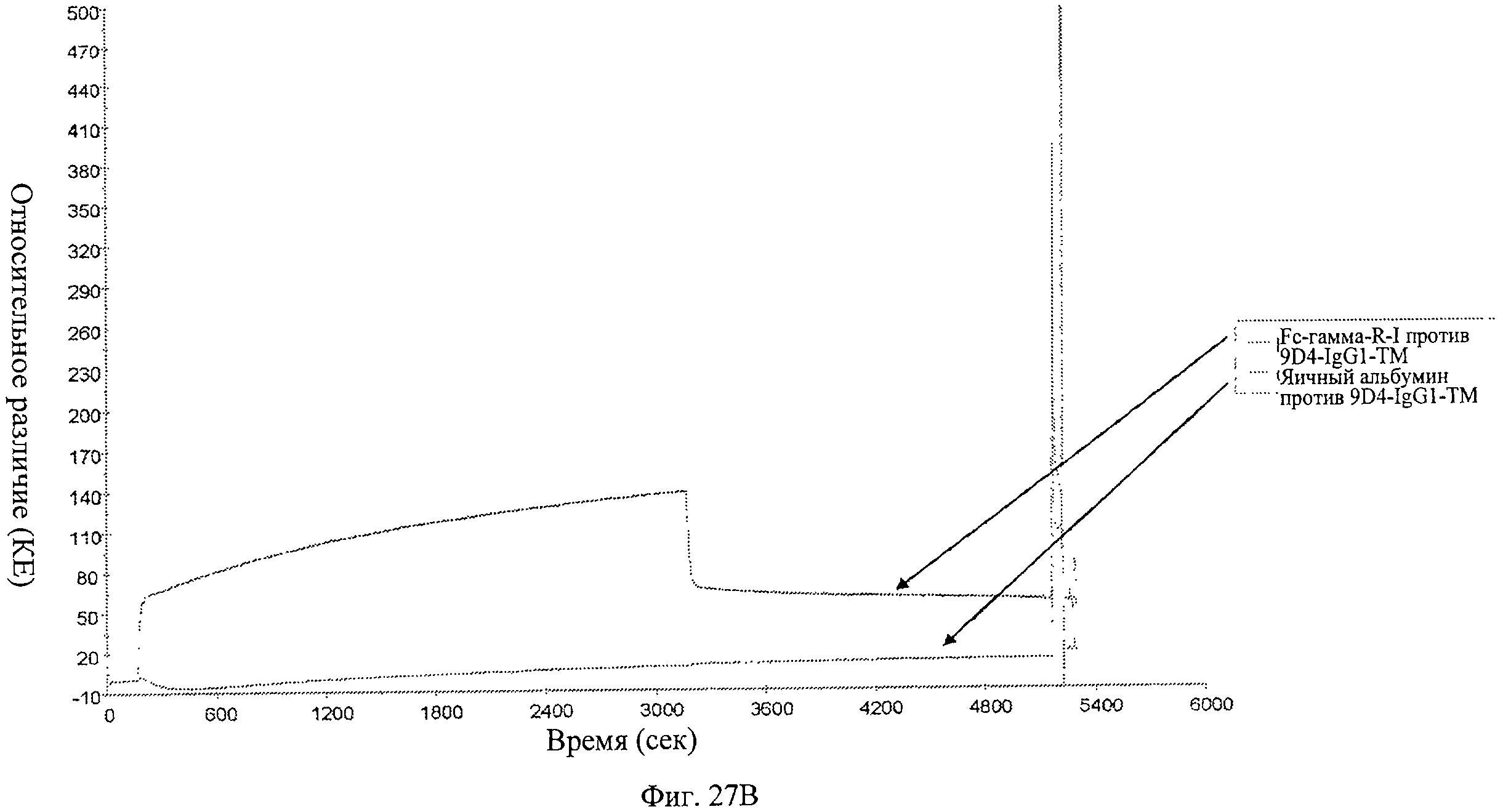
Фиг.27 А-В. Анализ связывания анти-IFNAR1 антител 9D4-WT, 9D4-DM и 9D4-TM с Fc рецептором FcγRI определяют методом BIACore. Вкратце, свободные анти-IFNAR1 антитела пропускают через иммобилизованный FcγRI для измерения аффинности. Из фигуры следует, что модифицированные антитела 9D4-DM (Б) и 9D4-TM (В) проявляют пониженное сродство со связанным FcγRI по сравнению с немодифицированным антителом 9D4-WT (А).
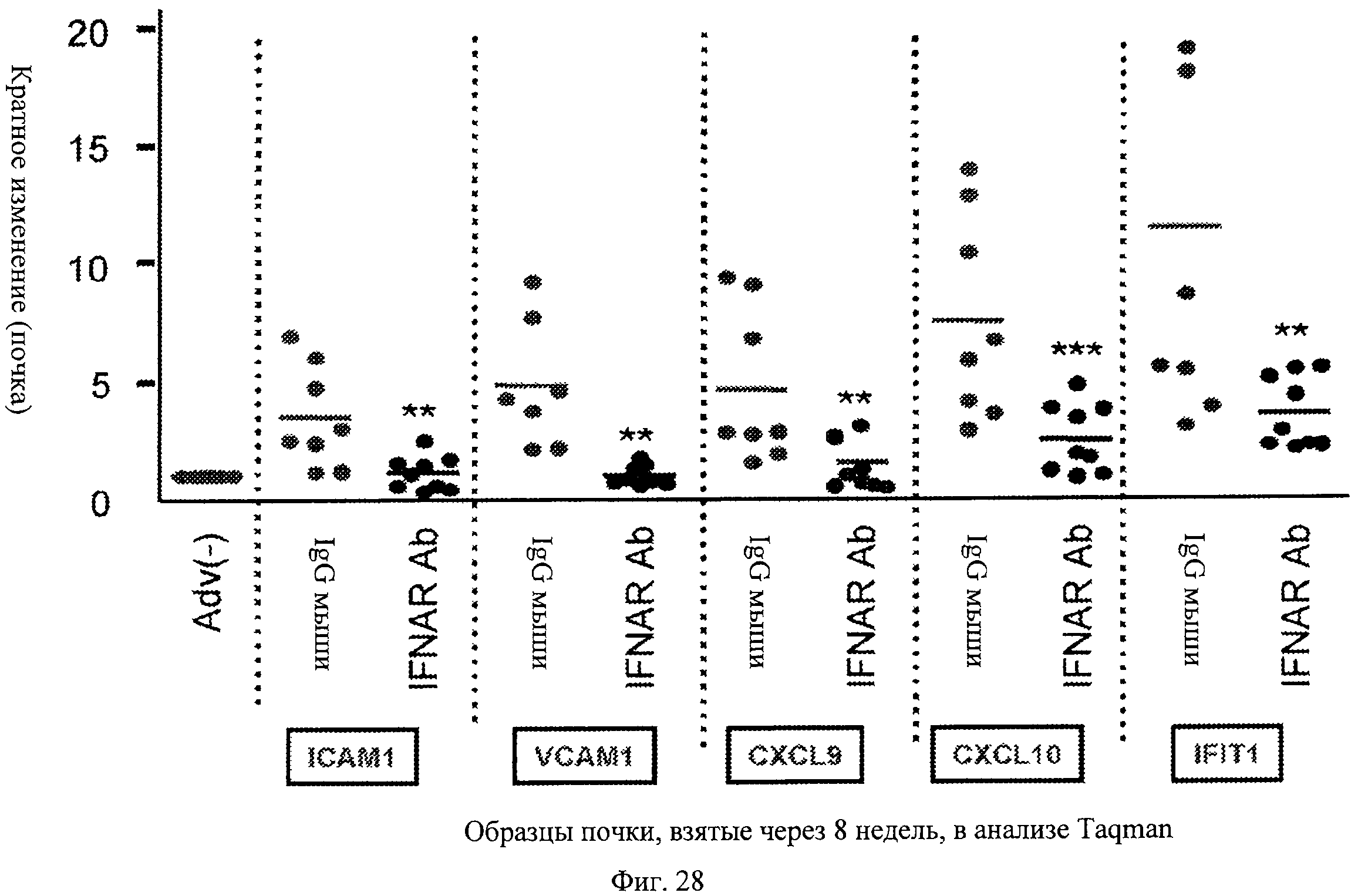
Фиг.28. Анти-IFNAR антитела ингибируют IFNα-чувствительную генную индукцию в почках. Вкратце, в мышах - модели повышенного проявления волчанки, лечение анти-IFNAR антителами блокирует индукцию в почках шести генов (ICAM1, VCAM1, CXCL9, CXCL10 и IFIT1), опосредованную эктопически экспрессируемым IFNα, по сравнению с контрольными мышами по данным измерения методом Taqman.
Фиг.29. Анти-IFNAR антитела ингибируют выработку анти-днДНК антител в мышах - модели повышенного проявления волчанки. Вкратце, мыши, эктопически экспрессирующие IFNα и обработанные анти-IFNAR антителами, не аккумулируют анти-днДНК антитела до того же уровня, что и у мышей, сходным образом инфицированных и обработанных контрольным антителом IgG.
Фиг.30. Анти-IFNAR антитела способны понизить протеинурию при терапевтическом лечении мышей - модели повышенного проявления волчанки. (А) Вкратце, мыши с симптомами волчанки, сформировавшимися под воздействием экспрессируемого IFNα, например с протеинурией. В терапевтическом исследовании анти-IFNAR антитела вводят мышам при достижении порога оценки, соответствующего протеинурии. Анти-IFNAR антитела, ФСБ или контрольный IgG вводят дважды в неделю на протяжении курса, длительностью 5 недель. У животных в группе лечения анти-IFNAR антителом проявляется пониженная тяжесть протеинурии во время эксперимента по сравнению с животными в группах применения ФСБ или контрольного IgG.
Фиг.31. Анти-IFNAR антитела способны повышать выживаемость при терапевтическом лечении мышей - модели повышенного проявления волчанки. (А) Вкратце, мыши, имеющие эктопически экспрессируемый IFNα, имеют пониженную степень выживаемости, примерно составляющую 8 недель, после развития симптомов, напоминающих симптомы волчанки, например, протеинурию. В терапевтическом исследовании анти-IFNAR антитела вводят мышам после достижения порога протеинурии. Анти-IFNAR антитела, ФСБ или контрольный IgG вводят дважды в неделю на протяжении 5 недельного курса. Через 5 недель лечение антителом прекращают и смертность прослеживают для всех трех групп лечения. В группе лечения анти-IFNAR антитело намного ниже показатель смертности по сравнению с группой, в которой использовали только ФСБ, или группами контрольных IgG, в каждой из которых установлена 100% смертность к 9 неделе.
Фиг.32. Представление содержимого асимметричной единицы кристаллов области Fc-TM, которая включает мутации L234F/L235E/P331S. Мутация Р331 обозначена красным цветом. Один ион цинка хелатирован двумя пространственно сближенными остатками гистидина. Углеводные остатки, присоединенные в положении 297, моделируют исходя из их электронной плотности.
Фиг.33. Кинетические изображения показывают интернализацию антитела 9D4-TM. Клетки ТНР-1 окрашивают 1 мкМ CFSE в инкубаторе при 37°С в атмосфере СО2 в течение 10 мин с последующей обработкой 1 мкг/мл Alexa647-9D4-TM на льду в течение 1 ч. После удаления несвязанного реактива клетки инкубируют при 37°С в течение назначенного времени (0, 15, 30 и 60 мин) и получают изображения взятых клеток.
Фиг.34. Анти-IFNAR1 антитело 9D4-TM не проявляет действия CDC при оценке методом in vitro. На фигуре показаны результаты анализа CDC для определения способности антитела 9D4-TM вызывать действие CDC. Из фигуры следует, что 9D4-TM антитело не проявляет какого-либо CDC действия по сравнению с положительным контрольным антителом. Действие CDC также не выявляется для неродственного контрольного антитела, R347. Вкратце, клетки, экспрессирующие антиген IFNAR1, инкубируют или с положительным контрольным антителом, 9D4-TM, или с R347. После серий промывок добавляют свеже приготовленную сыворотку человека. Комплемент-зависимую цитотоксичность (CDC) измеряют, используя анализ высвобождения лактатдегидрогеназы (ЛДГ).
Терминология
Понятия «интерферон альфа», «IFNα», «IFNa», «IFNA» и «IFN альфа» в настоящем изобретении используют взаимозаменяемо, и они означают белки IFN альфа, кодируемые функциональным геном локуса гена интерферона альфа с 75% или выше идентичностью последовательности с последовательностью IFN альфа 1 (идентификационный номер NP_076918 в GenBank, у кодируемого белка идентификационный номер NM_024013 в GenBank). Примерами подтипов IFN альфа являются IFN альфа 1, альфа 2а, альфа 2b, альфа 4, альфа 4b альфа 5, альфа 6, альфа 7, альфа 8, альфа 10, альфа 13, альфа 14, альфа 16, альфа 17 и альфа 21. Понятия «интерферон альфа», «IFNα» и «IFN альфа» означают рекомбинантные формы различных подтипов IFN альфа, а также природные продукты, которые включают белки IFN альфа, например лейкоцитарный IFN и лимфобластоидный IFN.
Понятия «рецептор-1 интерферона альфа», «IFNAR1», «IFNAR-1» и «антиген IFNAR-1» используют взаимозаменяемо; к ним относятся варианты, изоформы, гомологи IFNAR-1 человека от других видов и аналоги, имеющие по меньшей мере один общий эпитоп с IFNAR-1. Таким образом, антитела человека по настоящему изобретению могут в некоторых вариантах осуществления настоящего изобретения перекрестно реагировать с IFNAR-1 других видов (т.е. происходящих не от человека) или с другими белками, которые структурно близки с IFNAR-1 человека (например, гомологами IFNAR-1 человека). В других вариантах осуществления настоящего изобретения антитела могут быть полностью специфичными для IFNAR-1 человека и не проявлять видовую или другого типа перекрестную реакционную способность. Полная последовательность кДНК IFNAR-1 человека имеет идентификационный номер NM_000629 в Genbank.
В контексте настоящего изобретения понятие «консервативные модификации последовательности» включает аминокислотные модификации, которые не влияют или не изменяют показателей связывания антитела, содержащего аминокислотную последовательность. К таким консервативным модификациям относятся аминокислотные замещения, вставки и делеции. Модификации могут быть внедрены в антитело по настоящему изобретению стандартными методами, известными в данной области, например, сайт-направленным мутагенезом и ПЦР-опосредованным мутагенезом. Консервативными являются аминокислотные замещения, у которых аминокислотный остаток замещен аминокислотным остатком со схожей боковой цепью. Например, одна или несколько аминокислот со сходной полярностью действуют в качестве функциональных эквивалентов и приводят к непроявляемому изменению в аминокислотной последовательности пептида. Замещения, которые нейтральны по заряду и которые замещают остаток на меньший остаток, могут также рассматриваться в качестве «консервативных замещений», даже если остатки находятся в разных группах (например, замещение фенилаланина на меньший изолейцин). Семейства аминокислотных остатков, имеющих схожие боковые цепи, известны и определены в данной области. Несколько неограничивающих примеров семейств аминокислот показано в табл.1.
Подробное описание настоящего изобретения
В отличие от предшествующих разработок в настоящем изобретении было установлено, что анти-IFNAR1 антитела с пониженной или усеченной эффекторной функцией желательны для лечения хронических аутоиммунных и/или воспалительных заболеваний. Ранее были разработаны антитела, направленные против IFNAR1, при этом имели ввиду, что эффекторная функция может играть роль в опосредовании лечения или по меньшей мере в смягчении состояния при хроническом аутоиммунном и/или воспалительном заболевании (см., например, публикации US 20060029601 или РСТ WO 06002177). Согласно этой концепции многие предшествующие разработки были направлены на идентификацию анти-IFNAR1 антител с сильной эффекторной функцией и на дальнейшее повышение эффекторной функции путем повышения сродства антитела с рецепторами Fc (например, FcRn, FcγRIIIa, FcγRIIb) и/или белком комплемента C1q. Сложилось мнение, что такие полученные в результате анти-IFNAR1 антитела с повышенной эффекторной функцией полезны при лечении указанных болезненных состояний.
В отличие от такого сложившегося ранее мнения настоящее изобретение описывает анти-IFNAR1 антитела с пониженной или усеченной эффекторной функцией (например, цитотоксичностью ADCC и/или CDC). Через исследования тканевой перекрестной реакционной способности неожиданно было установлено, что анти-IFNAR1 антитела с сильной или повышенной эффекторной функцией проявляют предрасположенность к нежелательной токсичности из-за преобладания окрашивания анти-IFNAR1 на тканях, не являющихся мишенями. Такая токсичность может возникнуть из неспецифической активации ADCC и/или CDC по несоответствующим сайтам. Для снижения или элиминации такой нежелательной токсичности была установлена необходимость снижения эффекторной функции полипептидов, включающих область Fc.
Таким образом, один из объектов настоящего изобретения охватывает модифицированные антитела или другие полипептиды, включающие область Fc антитела, содержащую вставку, замещение или делецию по меньшей мере одного аминокислотного остатка области Fc, что приводит к пониженному или усеченному сродству в отношении по меньшей мере одного лиганда Fc (обозначаемые в настоящем изобретении «модифицированными антителами по настоящему изобретению», «модифицированными антителами» или «антителами по настоящему изобретению»). Область Fc взаимодействует с рядом лигандов, включая, но ими не ограничиваясь, рецепторы Fc (например, FcRn, FcγRIIIa, FcγRIIb), белок комплемента C1q и другие молекулы, например, белки А и G. Такие взаимодействия существенны для различных эффекторных функций и последующих событий по передаче сигнала, включая, но ими не ограничиваясь, антителозависимую клеточно опосредованную цитотоксичность (ADCC) и комплементзависимую цитотоксичность (CDC). Таким образом, в некоторых вариантах осуществления настоящего изобретения модифицированные антитела по настоящему изобретению имеют пониженное или усеченное сродство в отношении лиганда Fc, связанное с облегчением эффекторной функции по сравнению с антителом, имеющим ту же аминокислотную последовательность, что и антитело по настоящему изобретению, но не включающее дополнения, замещения или делеции по меньшей мере одного аминокислотного остатка с областью Fc (также называемого в настоящем изобретении «немодифицированным антителом»). В некоторых вариантах осуществления настоящего изобретения антитела по настоящему изобретению включают по меньшей мере один или несколько из следующих признаков: пониженную или усеченную эффекторную (ADCC и/или CDC) функцию, пониженное или усеченное связывание с рецепторами Fc, или пониженную или усеченную токсичность. Более конкретно варианты осуществления по настоящему изобретению предусматривают анти-IFNAR1 антитела с пониженным сродством к рецепторам Fc (например, FcRn, FcγRIIIa, FcγRIIb) и/или белку комплемента C1q.
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению включают область Fc, включающую по меньшей мере одно добавление, замещение или делецию аминокислотного остатка, выбранного из положений 234, 235 и 331, причем система нумерации константной области дана по индексу EU, разработанному Kabat и др. (Публикация Национального института здоровья США 91-3242, 1991, Национальная служба технической информации, Спрингфилд, Вирджиния). В некоторых вариантах осуществления настоящего изобретения антитела по настоящему изобретению включают область Fc, содержащую по меньшей мере одно аминокислотное замещение, выбранное из группы состоящей из: L234F, L235E и P331S, причем первая буква и номер означают немодифицированную аминокислоту и ее положение, а вторая буква представляет замещенную аминокислоту по указанному положению.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению дополнительно включают область Fc, содержащую по меньшей мере одно добавление, замещение или делецию аминокислотного остатка, которое коррелирует с повышенной стабильностью антитела. В одном из вариантов осуществления настоящего изобретения добавление, замещение или деления аминокислотного остатка находится в положении 228 области Fc, причем система нумерации константной области дана по индексу EU, разработанному Kabat и др. В определенных вариантах осуществления, антитела по настоящему изобретению включают область Fc, содержащую аминокислотное замещение по положению 228, причем замещение осуществлено на остаток серина. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению подтипа IgG4 включают аминокислотное замещение серина по положению 228 области Fc. В других вариантах осуществления настоящего изобретения антитела по настоящему изобретению уже включают остаток серина по положению 228 области Fc; в таких вариантах осуществления модификации не требуются. В других вариантах осуществления антитела по настоящему изобретению не нуждаются в модификации остатка 228 области Fc или уже содержат серин в указанном положении.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению могут быть какими-либо антителами какого-либо подкласса (например, но ими перечень не ограничивается, IgG, IgM и IgE). В некоторых вариантах осуществления настоящего изобретения антитела по настоящему изобретению являются представителями класса антител IgG. В некоторых вариантах осуществления антитела по настоящему изобретению относятся к подклассу IgG1. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению относятся к подклассу IgG1 и включают следующие аминокислотные замещения: 234F, 235Е и 331S области Fc. В других вариантах осуществления антитела по настоящему изобретению относятся к подклассу IgG4. В определенных вариантах осуществления антитела по настоящему изобретению относятся к подклассу IgG4 и включают следующие аминокислотные замещения: S228P и L235E области Fc.
В некоторых вариантах осуществления настоящего изобретения модифицированные антитела по настоящему изобретению могут вырабатываться путем комбинирования вариабельного домена или его фрагмента с доменом Fc, включающим одно или несколько аминокислотных замещений, описанных в настоящем изобретении. В других вариантах осуществления настоящего изобретения модифицированные антитела по настоящему изобретению могут вырабатываться путем модификации антитела, содержащего домен Fc, за счет внедрения одного или нескольких замещающих остатков аминокислот в домен Fc.
Пониженное связывание с лигандами Fc
Для специалиста в данной области очевидно, что антитела по настоящему изобретению могут иметь измененные (относительно немодифицированного антитела) FcγR и/или C1q связывающие свойства (к примерам связывающих свойств относятся, но ими не ограничиваются, связывающая специфичность, равновесная константа диссоциации (KD), степени диссоциации и ассоциации (Koff и Kon соответственно), связывающее сродство и/или авидитет) и что определенные изменения более или менее желательны. В данной области известно, что равновесную константу диссоциации (KD) выражают в виде koff/kon. Специалист в данной области может определить тот кинетический параметр, который наиболее важен для применения данного антитела. Например, модификация, которая снижает связывание с одним или несколькими положительными регуляторами (например, FcγRIIIA) и/или повышает связывание с ингибирующим Fc рецептором (например, FcγRIIB), может быть применима для снижения действия ADCC. Таким образом, степень связывающего сродства (например, констант равновесной диссоциации (KD)) может показать, если действие ADCC антитела по настоящему изобретению повышено или понижено. Кроме того, модификация, которая снижает связывание с C1q, может быть применима для снижения или элиминации действия CDC.
Сродство и связывающие свойства области Fc с ее лигандом могут быть определены с помощью различных методов исследования in vitro (биохимических или иммунологических), известных в данной области для определения взаимодействий Fc-FcγR, т.е., специфического связывания области Fc с рецептором FcγR, включая, но ими не ограничиваясь, методы равновесия (например, фермент-связанный иммуносорбентный анализ (ELISA) или радиоиммуноанализ (RIA)), или кинетические методы (например, BIACORE®) и другие методы, например, косвенные методы исследования связывания, методы конкурентного ингибирования, переноса энергии флуоресцентного резонанса (fluorescence resonance energy transfer - FRET), гель-электрофорез и хроматографию (например, гель-фильтрацию). В этих и других методах можно использовать метку одного или нескольких исследуемых компонентов и/или применять различные методы обнаружения, включая, но ими не ограничиваясь, хромогенные, флуоресцентные, люминесцентные или изотопные метки. Подробное испытание связывающего сродства и кинетики см. в кн.: «Fundamental Immunology», 1999, под ред. Paul W.E., 4е изд., изд-во Lippincott-Raven, Филадельфия.
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению проявляют пониженное связывающее сродство в отношении одного или нескольких рецепторов Fc, включая, но им не ограничиваясь, рецептор FcγRI (CD64), включая изоформы FcγRIA, FcγRIB и FcγRIC; FcγRII (CD32 включая изоформы FcγRIIA, FcγRIIB и FcγRIIC); и FcγRIII (CD16, включая изоформы FcγRIIIA и FcγRIIB) по сравнению с немодифицированным антителом. В некоторых вариантах осуществления настоящего изобретения антитела по настоящему изобретению не включают сопутствующего повышения связывания рецептора FcγRIIB по сравнению с немодифицированным (например, содержащим область Fc дикого типа) антителом.
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению проявляют пониженное сродство с FcγRI по сравнению с немодифицированным антителом. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецептором FcγRI, которое по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз меньше, чем у немодифицированного антитела.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецептором FcγRI, которое по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 40%, по меньшей мере на 30%, по меньшей мере на 20%, по меньшей мере на 10%, или по меньшей мере на 5% меньше, чем у немодифицированного антитела.
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению проявляют пониженное сродство с рецептором FcγRIIIA по сравнению с немодифицированным антителом. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецептором FcγRIIIA, которое по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз меньше, чем у немодифицированного антитела.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецептором FcγRIIIA, которое по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 40%, по меньшей мере на 30%, по меньшей мере на 20%, по меньшей мере на 10%, или по меньшей мере на 5% меньше, чем у немодифицированного антитела.
В данной области известно, что аллельный вариант F158V рецептора FcγRIIIA обладает измененными характеристиками связывания с антителами. В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению связываются с пониженным сродством с рецептором FcγRIIIA (F158V) по сравнению с немодифицированным антителом. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецептором FcγRIIIA (F158V), которое по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз меньше, чем у немодифицированного антитела. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецептором FcγRIIIA (F158V), которое по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 40%, по меньшей мере на 30%, по меньшей мере на 20%, по меньшей мере на 10%, или по меньшей мере на 5% меньше, чем у немодифицированного антитела.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют повышенное сродство с рецептором FcγRIIB по сравнению с немодифицированным антителом. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецептором FcγRIIB, которое неизменно или повышено по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз по сравнению с немодифицированным антителом. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецептором FcγRIIB, которое повышено по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, или по меньшей мере на 95% относительно сродства немодифицированного антитела.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецепторами FcγRI, FcγRIIIA или FcγRIIIA (F158V), которое составляет примерно от 100 нМ до примерно 100 мкМ, или примерно от 100 нМ до примерно 10 мкМ, или примерно от 100 нМ до примерно 1 мкМ, или примерно от 1 нМ до примерно 100 мкМ, или примерно от 10 нМ до примерно 100 мкМ, или примерно от 1 мкМ до примерно 100 мкМ, или примерно от 10 мкМ до примерно 100 мкМ. В некоторых вариантах осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецепторами FcγRI, FcγRIIIA или FcγRIIIA (F158V), которые больше 1 мкМ, больше 5 мкМ, больше 10 мкМ, больше 25 мкМ, больше 50 мкМ или больше 100 мкМ.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецептором FcγRIIB, которое составляет примерно от 100 нМ до примерно 100 мкМ, или примерно от 100 нМ до примерно 10 мкМ, или примерно от 100 нМ до примерно 1 мкМ, или примерно от 1 нМ до примерно 100 мкМ, или примерно от 10 нМ до примерно 100 мкМ, или примерно от 1 мкМ до примерно 100 мкМ, или примерно от 10 мкМ до примерно 100 мкМ. В некоторых вариантах осуществления настоящего изобретения, антитела по настоящему изобретению проявляют сродство с рецепторами FcγRI, FcγRIIIA или FcγRIIIA (F158V), которое составляет менее 100 мкМ, менее 50 мкМ, менее 10 мкМ, менее 5 мкМ, менее 2,5 мкМ, менее 1 мкМ, или менее 100 нМ, или менее 10 нМ.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецептором FcγRIIB, которое составляет примерно от 100 нМ до примерно 100 мкМ, или примерно от 100 нМ до примерно 10 мкМ, или примерно от 100 нМ до примерно 1 мкМ, или примерно от 1 нМ до примерно 100 мкМ, или примерно от 10 нМ до примерно 100 мкМ, или примерно от 1 мкМ до примерно 100 мкМ, или примерно от 10 мкМ до примерно 100 мкМ. В некоторых вариантах осуществления настоящего изобретения, антитела по настоящему изобретению проявляют сродство с рецепторами FcγRI, FcγRIIIA или FcγRIIIA (F158V), которое составляет менее 100 мкМ, менее 50 мкМ, менее 10 мкМ, менее 5 мкМ, менее 2,5 мкМ, менее 1 мкМ, или менее 100 нМ, или менее 10 нМ.
Пониженное действие ADCC
В данной области известно, что антитела способны направлять атаку и разрушение целевого антигена по множеству процессов, в совокупности известных под названием «эффекторных функций антитела». Один из процессов, называемый «антитело-зависимая клеточноопосредованная цитотоксичность» или «ADCC», относится к форме цитотоксичности, при которой секретированный Ig связывается с рецепторами Fc (FcR), имеющимися на некоторых клетках цитотоксичности (например, природных клетках-киллерах (NK), нейтрофилах и макрофагах), давая возможность этим эффекторным клеткам цитотоксичности специфически связываться с несущими антиген клетками-мишенями и затем уничтожать клетки-мишени цитотоксинами. Специфичные с высоким сродством IgG антитела, направленные на поверхность клеток-мишеней, «вооружают» клетки цитотоксичности и необходимы для такого уничтожения. Лизис клеток-мишеней внеклеточный, требует прямого контакта между клетками и не включает комплемента. Другим процессом, на который распространяется понятие эффекторной функции, является комплемент-зависимая цитотоксичность (обозначаемая в настоящем изобретении «CDC»), которая относится к биохимическому событию разрушения клеток-мишеней, опосредованного системой комплемента. Система комплемента является сложной системой белков, обнаруживаемых в плазме нормальной крови, которые комбинируются с антителами для разрушения патогенных бактерий и других чужеродных клеток.
Может быть исследована способность какого-либо определенного антитела опосредовать лизис клеток-мишеней за счет ADCC. Для оценки действия ADCC исследуемое антитело добавляют к клеткам-мишеням в комбинации с иммунными эффекторными клетками, которые могут быть активированы комплексами антигена с антителом, что приводит к цитолизу клеток-мишеней. Цитолиз обычно обнаруживают по высвобождению метки (например, радиоактивных веществ, флуоресцентных красителей или природных внутриклеточных белков) из лизированных клеток. К полезным эффекторным клеткам относятся, например, мононуклеарные клетки периферической крови (МКПК) и клетки природные киллеры (Natural Killer - NK). Конкретные примеры исследований ADCC in vitro описаны Wisecarver и др., 79, 1985, cc.277-282; Bruggemann и др., J Exp Med 166, 1987, cc.1351-1361; Wilkinson и др., J Immunol Methods 258, 2001, cc.183-191; Patel и др., J Immunol Methods 184, 1995, cc.29-38. В другом варианте, или кроме того, действие ADCC исследуемого антитела может быть оценено in vivo, например, в модели животного, например, согласно описанию dynes и др., PNAS USA 95, 1998, cc.652-656.
Предполагают, что антитела по настоящему изобретению описаны с помощью функциональных исследований in vitro для определения одной или нескольких эффекторных клеточных функций, опосредованных FcγR. В некоторых вариантах осуществления настоящего изобретения антитела по настоящему изобретению имеют сходные связывающие свойства и эффекторные клеточные функции в моделях in vivo (например, описанные в настоящем изобретении), такие же, что и установленные в исследованиях in in vitro. Однако настоящее изобретение не исключает антител по настоящему изобретению, которые не проявляют нужного фенотипа в исследованиях, основывающихся на in vitro, но реально проявляют желательный фенотип in vivo.
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению проявляют пониженное действие ADCC по сравнению с немодифицированным антителом. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют действие ADCC, которое по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз или по меньшей мере в 10 раз или по меньшей мере в 50 раз или по меньшей мере в 100 раз меньше действия немодифицированного антитела, В еще одном другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют действие ADCC, которое понижено по меньшей мере на 10%, или по меньшей мере на 20%, или по меньшей мере на 30%, или по меньшей мере на 40%, или по меньшей мере на 50%, или по меньшей мере на 60%, или по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 100%, или по меньшей мере на 200%, или по меньшей мере на 300%, или по меньшей мере на 400%, или по меньшей мере на 500% относительно немодифицированного антитела. В некоторых вариантах осуществления настоящего изобретения антитела по настоящему изобретению не проявляют выявляемого действия ADCC. В некоторых конкретных вариантах осуществления снижение и/или усечение действия ADCC может быть связано с пониженным сродством антител по настоящему изобретению, которое они проявляют в отношении лигандов и/или рецепторов Fc.
Пониженное действие CDC
Метаболический путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой, например, антитела, объединенного с родственным антигеном. Для оценки активации комплемента может быть выполнено исследование CDC, например, описанное Gazzano-Santoro и др., J. Immunol. Methods, 202, 1996, с.163.
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению проявляют пониженное сродство с C1q относительно немодифицированного антитела В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с рецептором C1q, которое по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз меньше, чем сродство немодифицированного антитела.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с C1q, которое по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 40%, по меньшей мере на 30%, по меньшей мере на 20%, по меньшей мере на 10%, или по меньшей мере на 5% меньше сродства немодифицированного антитела.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют сродство с C1q, которое составляет примерно от 100 нМ до примерно 100 мкМ, или примерно от 100 нМ до примерно 10 мкМ, или примерно от 100 нМ до примерно 1 мкМ, или примерно от 1 нМ до примерно 100 мкМ, или примерно от 10 нМ до примерно 100 мкМ, или примерно от 1 мкМ до примерно 100 мкМ, или примерно от 10 мкМ до примерно 100 мкМ. В некоторых вариантах осуществления настоящего изобретения, антитела по настоящему изобретению проявляют сродство с C1q, которое больше чем 1 мкМ, больше чем 5 мкМ, больше чем 10 мкМ, больше чем 25 мкМ, больше чем 50 мкМ, или больше чем 100 мкМ.
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению проявляют пониженное действие CDC по сравнению с немодифицированным антителом. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют действие CDC, которое по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз или по меньшей мере в 10 раз, или по меньшей мере в 50 раз, или по меньшей мере в 100 раз меньше, чем действие немодифицированного антитела. В еще одном другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют действие CDC, которое уменьшено по меньшей мере на 10%, или по меньшей мере на 20%, или по меньшей мере на 30%, или по меньшей мере на 40%, или по меньшей мере на 50%, или по меньшей мере на 60%, или по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 100%, или по меньшей мере на 200%, или по меньшей мере на 300%, или по меньшей мере на 400%, или по меньшей мере на 500% относительно действия немодифицированного антитела. В некоторых вариантах осуществления настоящего изобретения антитела по настоящему изобретению не проявляют выявляемого действия CDC. В некоторых вариантах осуществления настоящего изобретения понижение и/или усечение действия CDC может быть приписано пониженному сродству, которое антитела по настоящему изобретению проявляют в отношении лигандов Fc и/или рецепторов.
Пониженная токсичность, связанная с антителом
В данной области известно, что биологическая терапия может обладать побочной токсичностью, связанной со сложной природой направляемой иммунной системой распознавания и атаки на нежелательные клетки и/или мишени. Если распознавания и/или нацеливания для атаки нет, но требуется лечение, последствием может быть побочная токсичность. Например, окрашивание антителом тканей, не являющихся мишенями, может быть показателем потенциальной токсичности.
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению проявляют пониженное окрашивание не целевых тканей по сравнению с немодифицированным антителом. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют пониженное окрашивание не целевых тканей, которое по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз меньше, чем окрашивание немодифицированным антителом. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют пониженное окрашивание не целевых тканей, которое понижено по меньшей мере на 10%, или по меньшей мере на 20%, или по меньшей мере на 30%, или по меньшей мере на 40%, или по меньшей мере на 50%, или по меньшей мере на 60%, или по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 100%, или по меньшей мере на 200%, или по меньшей мере на 300%, или по меньшей мере на 400%, или по меньшей мере на 500% относительно немодифицированного антитела.
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению проявляют пониженную связанную с антителом токсичность по сравнению с немодифицированным антителом. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют токсичность, которая по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз меньше, чем токсичность немодифицированного антитела. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению проявляют токсичность, которая понижена по меньшей мере на 10%, или по меньшей мере на 20%, или по меньшей мере на 30%, или по меньшей мере на 40%, или по меньшей мере на 50%, или по меньшей мере на 60%, или по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 100%, или по меньшей мере на 200%, или по меньшей мере на 300%, или по меньшей мере на 400%, или по меньшей мере на 500% по сравнению с токсичностью немодифицированного антитела.
Интернализация антител
Антитела по настоящему изобретению могут связываться с антигенами на поверхности клеток, которые могут интернализировать, также принося антитела в клетку. Попадая внутрь клетки, антитела могут быть высвобождены в цитоплазму, нацелены на определенный компартмент или возвращены на поверхность клетки. В некоторых вариантах осуществления настоящего изобретения антитела по настоящему изобретению связывают антигены на поверхности клеток, которые интернализируют. В других вариантах осуществления настоящего изобретения антитела по настоящему изобретению могут быть направлены на специфические органеллы или компартменты клетки. В других вариантах осуществления настоящего изобретения антитела по настоящему изобретению могут быть возвращены на поверхность клетки или на периферию после интернализации. В одном из вариантов осуществления настоящего изобретения антитело по настоящему изобретению специфично в отношении IFNAR1.
Интернализацию антител можно измерить принятыми в данной области методами, например, представленными в примере 34. В некоторых вариантах осуществления настоящего изобретения степень интернализации представлена в качестве процента от общего количества антитела, связанного с клетками. В других вариантах осуществления настоящего изобретения степень интернализации антитела представлена путем сравнения с неспецифическим контрольным антителом. В других вариантах осуществления настоящего изобретения степень интернализации антитела представляют путем сравнения антитела, которое связывает антиген на поверхности клетки, с антителом, которое не интернализовано. В некоторых других вариантах осуществления настоящего изобретения степень интернализации антитела коррелирует с разрушением антитела. В других вариантах осуществления настоящего изобретения степень интернализации антитела представлена в виде соотношения окрашивания цитоплазмы к окрашиванию поверхности клеток.
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению в случае связывания интернализируют в клетки, причем интернализация составляет по меньшей мере примерно на 10%, по меньшей мере примерно на 20%, по меньшей мере примерно на 30%, по меньшей мере примерно на 40%, по меньшей мере примерно на 50%, по меньшей мере примерно на 60%, по меньшей мере примерно на 70%, по меньшей мере примерно на 80%, или по меньшей мере примерно на 90%, по меньшей мере примерно на 100%, по меньшей мере примерно на 110%, по меньшей мере примерно на 130%, по меньшей мере примерно на 140%, по меньшей мере примерно на 150%, по меньшей мере примерно на 160%, или по меньшей мере примерно на 170% больше по сравнению с неспецифическим контрольным антителом.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению в случае связывания интернализируют в клетки, причем интернализация составляет на 1-10%, 10-20%, 20-30%, 30-40%, 40-50%, 50-60%, 60-70%, 70-80%, 80-90%, 90-100%, 100-110%, 110-120%, 120-130%, 130-140%, 140-150%, 150-160%, 160-170% больше, чем у неспецифического контрольного антитела.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению в случае связывания интернализируют в клетки, причем интернализация на 1-10%, 10-20%, 20-30%, 30-40%, 40-50%, 50-60%, 60-70%, 70-80%, 80-90%, 90-100%, 100-110%, 110-120%, 120-130%, 130-140%, 140-150%, 150-160%, 160-170% больше, чем у контрольных антител, по данным определения интернализации методом с применением вторичного антитела.
Трехмерная структура области Fc человека
Настоящее изобретение также предусматривает кристаллические формы области Fc IgG человека, причем область Fc человека, обозначаемая Fc-TM, включает аминокислотные замещения L234F, L235E и P331S, причем система нумерации дана по индексу EU, разработанному Kabat, и проявляет пониженную или усеченную эффекторную функцию (ADCC и/или CDC), пониженное или усеченное связывание с рецепторами Fc, и/или пониженную или усеченную токсичность. В некоторых вариантах осуществления настоящего изобретения кристаллы отличаются ромбической пространственной группой С2221 с элементарной ячейкой а=50,18, b=147,30 и с=75,47. В некоторых вариантах осуществления настоящего изобретения кристаллы имеют дифракционное качество для определения трехмерной структуры дифракции рентгеновских лучей кристаллического полипептида (полипептидов) высокого разрешения, предпочтительно для разрешения примерно более 3 Å, обычно в диапазоне примерно от 2 Å до примерно 3 Å.
Настоящее изобретение также предусматривает высокого разрешения трехмерные структуры и атомные структурные координаты кристаллов Fc-TM. Специфические методы, используемые для получения кристаллов и структурных координат, приводят ниже в примерах.
Координаты атомной структуры кристаллического Fc-TM, полученные от формы С2221 кристалла с разрешением 2.3 Å, перечислены в табл.6. Все остатки по положениям с 236 до 445 могут быть установлены по электронной плотности и электронная плотность не наблюдается для остатков шарнирной области перед положением 236, включая мутации L234F и L235E, Плотность электронов в положении 331 соответствует серину.
Общая трехмерная структура Fc-TM весьма схожа с ранее опубликованными структурами нелигандных областей Fc (Deisenhofer, Biochemistry, 20, 1981, cc.2361-2370; Krapp и др., J. Mol. Biol. 325, 2003, cc.979-989; Matsumiya и др., J. Mol. Biol. 368, 2007, cc.767-779; Oganesyan и др., Molecular Immunology, December 11, 2007, в печати). При индивидуальной оценке Fc-TM CH2 и CH3 домены демонстрируют высокую степень структурной консервативности и жесткости при сравнении с другими нелигандными немутантными структурами Fc человека.
Может быть применена информация о структуре в различных вычислительных или компьютерных методах для скрининга, конструирования или идентификации анти-IFNAR антител с измененными биологическими свойствами. Например, кристаллы и структурные координаты, полученные от них, могут применяться для скрининга, конструирования или идентификации аминокислотных добавлений, замещений или делеций в области Fc, которые приводят к пониженному или разрушительному связыванию с рецепторами Fc, пониженной или разрушительной эффекторной (ADCC и/или CDC) функции, или пониженной или разрушительной токсичности.
Если антитело было сконструировано и отобрано указанными выше способами, его эффекторная функция, связывание с рецепторами Fc, или токсичность могут быть тестированы и оптимизированы каким-либо методом, известным в данной области. Примеры методов описаны в разделах 5.1-5.4 выше.
Настоящее изобретение также относится к анти-IFNAR1 антителам, которые сконструированы или выбраны с помощью информации о структуре Fc-TM и которые проявляют требуемое биологическое действие. В некоторых вариантах осуществления настоящего изобретения такие антитела включают область Fc с мутациями L234F, L235E и P331S. В некоторых вариантах осуществления настоящего изобретения такие антитела включают область Fc с одним или несколькими дополнениями, замещениями или делениями аминокислотного остатка (остатков), не являющихся аминокислотными остатками 234, 235 и 331.
Анти-IFNAR1 антитела
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению специфичны (т.е. специфически связывают) в отношении IFNAR1. Такие антитела также могут быть обозначены «анти- IFNAR1 антителами по настоящему изобретению». В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению специфичны в отношении IFNAR1 человека. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению могут перекрестно реагировать с IFNAR1 других видов (но не человека) или с другими белками, которые структурно связаны с IFNAR1 человека (например, гомологами IFNAR1 человека). В других вариантах осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению могут быть специфичны только в отношении IFNAR1 человека и не проявляют видовой или других типов перекрестной реакционоспособности.
В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют пониженное связывающее сродство с лигандами Fc и имеют по меньшей мере одно из следующих свойств: пониженную или разрушительную эффекторную функцию (ADCC и/или CDC), пониженное или разрушительное связывание с лигандами Fc, или пониженную или разрушительную токсичность по сравнению с немодифицированным антителом.
В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают дополнение, замещение или делецию по меньшей мере одного аминокислотного остатка из группы, состоящей из: L234F, L235E и P331S. В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают аминокислотные замещения: L234F, L235E и P331S в области Fc. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антителом по настоящему изобретению является антитело изотипа IgG.
В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению относятся к подклассу IgG4. В еще одном из вариантов осуществления настоящего изобретения анти-IFNAR1 IgG4 антитела по настоящему изобретению включают аминокислотное замещение L235E в области Fc. В другом варианте осуществления настоящего изобретения анти-IFNAR1 IgG4 антитела по настоящему изобретению также включают аминокислотное замещение, которое коррелирует с повышенной стабильностью. В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 IgG4 антитела по настоящему изобретению также включают аминокислотное замещение S228P в области Fc.
В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют пониженное или разрушительное связывающее сродство с рецепторами Fc (например, с FcγRI (CD64), но этим рецептором перечень не ограничивается, включая изоформы FcγRIA, FcγRIB и Fc-yRIC; FcγRII (CD32), включая изоформы FcγRIIA, FcγRIIB, и FcγRIIC; и FcγRIII (CD16), включая изоформы FcγRIIIA и FcγRIIB) по сравнению с немодифицированным антителом. В некоторых вариантах осуществления настоящего изобретения анти-IFNAR 1 антитела по настоящему изобретению проявляют пониженное сродство с FcγRI по сравнению с немодифицированным антителом. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют пониженное сродство с рецептором FcγRIIIA относительно немодифицированного антитела. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению связываются с пониженным сродством с аллелем F158V FcγRIIIA относительно немодифицированного антитела.
В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют пониженное или разрушительное связывающее сродство с C1q по сравнению с немодифицированным антителом. В одном из вариантов осуществления настоящего изобретения анти-IFNAR 1 антитела по настоящему изобретению проявляют пониженное сродство с FcγRI относительно немодифицированного антитела.
В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют пониженную или разрушительную эффекторную функцию. В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют пониженное или разрушенное действие ADCC и/или CDC. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют пониженную или разрушительную токсичность.
Последовательности анти-IFNAR1 антител
В одном из вариантов осуществления настоящего изобретения аминокислотные последовательности вариабельных областей тяжелых цепей и/или вариабельных областей легких цепей анти-IFNAR1 антител по настоящему изобретению предусмотрены в настоящем изобретении и представлены на фиг.1А, 2А, 3А, 4А и фиг.1Б, 2Б, 3Б, 4Б, соответственно. В еще одном из вариантов осуществления настоящего изобретения полинуклеотидная последовательность, кодирующая вариабельные области тяжелой цепи и вариабельные области легкой цепи анти-IFNAR1 антитела по настоящему изобретению, предусмотрены в настоящем изобретении и представлены на фиг.1А, 2А, 3А, 4А и фиг.1Б, 2Б, 3Б, 4Б, соответственно.
В другом варианте осуществления настоящего изобретения с выбранными последовательностями анти-IFNAR1 антитела по настоящему изобретению можно ознакомиться в патенте US 5919453, патентных заявках US 10/831459, 10/182058, 11/157494 и 11/521102, сущность которых включена в настоящее изобретение в виде ссылок. В другом варианте осуществления настоящего изобретения последовательности анти-IFNAR1 антител по настоящему изобретению не включают последовательности, приведенные в патенте US 5919453, патентных заявках US 10/831459, 10/182058, 11/157494 и 11/521102.
В других вариантах осуществления настоящего изобретения антитела по настоящему изобретению описаны в патентных заявках US 60/842925, 60/866917, 60/911397, 60/915309, 11/852106 и РСТ US2007/07791, сущность которых включена в настоящее изобретение в виде ссылок.
В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению также включают антитела, которые содержат аминокислотную последовательность вариабельной тяжелой цепи и/или вариабельной легкой цепи, которая по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, или по меньшей мере на 99% идентична аминокислотной последовательности вариабельной тяжелой цепи и/или легкой цепи антител 3F11, 11Е2, 4G5 и 9D4 (см., последовательности на фиг.1-4).
Следует учитывать, что номера остатков областей, определяющих комплементарность (CDR), упоминаемые в настоящем описании, даны по классификации Kabat и др. (Публикация Национального института здоровья США 91-3242, 1991, Национальная служба технической информации, Спрингфилд, Ванкувер). Конкретно остатки 24-34 (CDR1), 50-56 (CDR2) и 89-97 (CDR3) в вариабельном домене легкой цепи и 31-35 (CDR1), 50-65 (CDR2) и 95-102 (CDR3) в вариабельном домене тяжелой цепи. Отмечено, что области CDR существенно варьируют от антитела к антителу (и по определению не проявляют гомологии с консенсусными последовательностями по Kabat). Максимальное выравнивание остатков каркасного участка часто нуждается в инсерции «спейсерных» остатков в системе нумерации, используют для области Fv. Следует учитывать, что упоминаемые в настоящем изобретении области CDR представлены выше в нумерации по Kabat и др. Кроме того, идентичность определенных отдельных остатков по какому-либо данному номеру сайта по Kabat могут варьировать от цепи антитела к цепи антитела из-за межвидовых или аллельных дивергенции.
В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают по меньшей мере одну область VH CDR, имеющую аминокислотную последовательность какой-либо из последовательностей CDR, перечисленных в табл.2. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают по меньшей мере одну область VL CDR, имеющую аминокислотную последовательность какой-либо из последовательностей VL CDR, перечисленных в табл.2. В других вариантах осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают одну или несколько областей VH CDR и одну или несколько областей VL CDR, перечисленных в табл.2. В еще одних других вариантах осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают какую-либо комбинацию областей VH CDR и VL CDR, перечисленных в табл.2. В еще одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению могут включать по меньшей мере 1, или по меньшей мере 2, или по меньшей мере 3, или по меньшей мере 4, или по меньшей мере 5, или по меньшей мере 6 CDR, выбранных из табл.2. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению могут включать домен VH и/или домен VL, каждый из которых включает 1, 2 или 3 CDR. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению могут включать область VH, дополнительно содержащую 1, 2, или 3 области CDR (CDRH#) тяжелой цепи, перечисленные в табл.2. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению могут включать область VL, дополнительно содержащую 1, 2, или 3 области CDR легкой цепи (CDRL#), перечисленные в табл.2.
В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают области CDR антитела 3F11 (см., например, табл.2). В еще одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают области CDR антитела 4G5 (см., например табл.2). В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают области CDR антитела 11Е2 (см., например табл.2). В еще одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают области CDR антитела 9D4 (см., например, табл.2).
В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают аминокислотную последовательность вариабельной тяжелой цепи и/или вариабельной легкой цепи, которые включают по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 10, по меньшей мере 15, или по меньшей мере 20 аминокислотных замещений, добавлений или делений по сравнению с вариабельной тяжелой цепью и/или вариабельной легкой цепью, представленными на фиг.1, 2, 3 или 4. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают одну или несколько CDR с по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5 или по меньшей мере 10 аминокислотными замещениями, делениями или добавлениями в одной или нескольких областях CDR, перечисленных в табл.2.
В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают антитела, кодируемые полинуклеотидной последовательностью, которая гибридизируется с нуклеотидной последовательностью, представленной на фиг.1, 2, 3 или 4, в жестких условиях. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают одну или несколько областей CDR, кодируемых нуклеотидной последовательностью, которая гибридизируется в жестких условиях с нуклеотидной последовательностью одной или нескольких областей CDR, перечисленных на фиг.1, 2, 3 или 4. Условия жесткой гибридизации включают, но ими не ограничиваются, гибридизацию со связанной с фильтром ДНК в 6х натрий хлориде/натрий цитрате (SSC) примерно при 45°C с последующим одним или несколькими промываниями в 0,2×SSC/0,1% SDS примерно при 50-65°С, в условиях высокой жесткости, например, гибридизацию со связанной с фильтром ДНК в 6×SSC примерно при 45°C с последующим одним или несколькими промываниями в 0,1×SSC/0,2% SDS примерно при 60°С, или в каких-либо других условиях жесткой гибридизации, известных специалистам в данной области (см., например, кн.: «Current Protocols in Molecular Biology», 1989, под ред. Ausubel P.M. и др., т.1, изд. Green Publishing Associates, Inc. и John Wiley и Sons, Inc., Нью-Йорк, cc.6.3.1-6.3.6, 2.10.3). В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению включают, но ими не ограничиваются, антитела, кодируемые полинуклеотидной последовательностью, которая по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, или по меньшей мере на 99% идентична полинуклеотидной последовательности, кодирующей антитела 3F11, 11Е2, 4G5 или 9D4 (см., фиг.1-4).
Связывающее сродство анти-IFNAR1 антител
В некоторых вариантах осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют высокое связывающее сродство с IFNAR1. В некоторых вариантах осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют степень ассоциации (kon), составляющую по меньшей мере 105 М-1 сек-1, по меньшей мере 5×105 М- сек-1, по меньшей мере 106 М-1 сек-1, по меньшей мере 5×106 М-1 сек-1, по меньшей мере 107 М-1 сек-1, по меньшей мере 5×107 М-1 сек-1, или по меньшей мере 108 М-1 сек-1. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют величину kon, составляющую по меньшей мере 2×105 М-1 сек-1, по меньшей мере 5×105 М-1 сек-1, по меньшей мере 106 М-1 сек-1, по меньшей мере 5×106 М-1 сек-1, по меньшей мере 107 М-1 сек-1, по меньшей мере 5×107 М-1 сек-1, или по меньшей мере 108 М-1 сек-1.
В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют степень диссоциации (koff) менее чем 10-1 сек-1, менее чем 5×10-1 сек-1, менее чем 10-2 сек-1, менее чем 5×10-2 сек-1, менее чем 10-3 сек-1, менее чем 5×10-3 сек-1, менее чем 10-4 сек-1, менее чем 5×10-4 сек-1, менее чем 10-5 сек-1, менее чем 5×10-5 сек-1, менее чем 10-6 сек-1, менее чем 5×10-6 сек-1, менее чем 10-7 сек-1, менее чем 5×10-7 сек-1, менее чем 10-8 сек-1, менее чем 5×10-8 сек-1, менее чем 10-9 сек-1, менее чем 5×10-9 сек-1 или менее чем 10-10-1 сек-1. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют koff менее чем 5×10-4 сек-1, менее чем 10-5 сек-1, менее чем 5×10-5 сек-1, менее чем 10-6 сек-1, менее чем 5×10-6 сек-1, менее чем 10-7 сек-1, менее чем 5×10-7 сек-1, менее чем 10-8 сек-1, менее чем 5×10-8 сек-1, менее чем 10-9 сек-1, менее чем 5×10-9 сек-1 или менее чем 10-10 сек-1.
В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют константу сродства или Ka (kon/koff), составляющую по меньшей мере 102 М-1, по меньшей мере 5×102 М-1, по меньшей мере 103 М-1, по меньшей мере 5×103 М-1, по меньшей мере 104 М-1, по меньшей мере 5×104 М-1, по меньшей мере 105 М-1, по меньшей мере 5×105 М-1, по меньшей мере 106 М-1, по меньшей мере 5×106 М-1, по меньшей мере 107 М-1, по меньшей мере 5×107 М-1, по меньшей мере 108 М-1, по меньшей мере 5×108 М-1, по меньшей мере 109 М-1, по меньшей мере 5×109 М-1, по меньшей мере 1010 М-1, по меньшей мере 5×101 М-1, по меньшей мере 1011 М-1, по меньшей мере 5×1011 М-1, по меньшей мере 1012 М-1, по меньшей мере 5×1012 М, по меньшей мере 1013 М-1, по меньшей мере 5×1013 М-1, по меньшей мере 1014 М-1, по меньшей мере 5×1014 М-1, по меньшей мере 1015 М-1, или по меньшей мере 5×1015 М-1.
В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют константу диссоциации или KD (koff/kon), составляющую менее 10-2 М, менее 5×10-2 М, менее 10-3 М, менее 5×10-3 M, менее 10-4 М, менее 5×10-4 M, менее 10-5 М, менее 5×10-5 M, менее 10-6 М, менее 5×10-6 M, менее 10-7 М, менее 5×10-7 M, менее 10-8 М, менее 5×10-8 M, менее 10-9 М, менее 5×10-9 M, менее 10-10 M, менее 5×10-10 M, менее 10-11 М, менее 5×10-11 М, менее 10-12 М, менее 5×10-12 М, менее 10-13 М, менее 5×10-13 M, менее 10-14 М, менее 5×10-14 М, менее 10-15 M или менее 5×10-15 M.
Специфичность подтипов интерферона альфа
В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют способность блокировать связывание с IFNAR1 и/или нейтрализовать биологическое действие одного или нескольких интерферонов (IFN) типа I, включая, но ими не ограничиваясь, IFNα, IFNβ и IFNω. Связывание подтипов IFNα может быть определено обычными методами исследования конкуренции, например, описанными в кн.: «Antibodies: A Laboratory Manual», CSHL. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют способность блокировать связывание с IFNAR1 и/или нейтрализовать биологическое действие интерферонов, включая, но ими не ограничиваясь, IFNα, IFNβ и IFNω. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют способность блокировать связывание с IFNAR1 и/или нейтрализовать биологическое действие одного или нескольких подтипов IFNα, включая, но ими не ограничиваясь, подтипы IFNα 1, 2а, 2b, 4, 4b, 5, 6, 7, 8, 10, 14, 16, 17 и 21. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют способность блокировать связывание с IFNAR1 и/или нейтрализовать биологическое действие подтипов IFNα. В этом контексте анти-IFNAR1 антитела по настоящему изобретению проявляют способность блокировать связывание и/или нейтрализовать биологическое действие подтипов IFNα: IFNα 1, 2а, 2b, 4, 4b, 5, 6, 7, 8, 10, 14, 16, 17 и 21. В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению не проявляют способности блокировать связывание IFNAR1 и/или нейтрализовать биологическое действие одного или нескольких подтипов IFNα, включая, но ими не ограничиваясь, подтипы IFNα 1, 2а, 2b, 4, 4b, 5, 6, 7, 8, 10, 14, 16, 17 и 21. В некоторых вариантах осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют способность блокировать связывание IFNAR1 и/или нейтрализовать биологическое действие всех подтипов IFNα, за исключением IFNα21.
В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют способность блокировать связывание IFNAR1 и/или нейтрализовать биологическое действие по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, или по меньшей мере 13 из следующих подтипов IFNα: 1, 2а, 2b, 4, 4b, 5, 6, 7, 8, 10, 14, 16, 17 и 21. В других вариантах осуществления анти-IFNAR1 антитела по настоящему изобретению не проявляют способности блокировать связывание IFNAR1 и/или нейтрализовать биологическое действие по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12 или по меньшей мере 13 из следующих подтипов IFNα: 1, 2а, 2b, 4, 4b, 5, 6, 7, 8, 10, 14, 16, 17 и 21.
В других вариантах осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют способность блокировать связывание с IFNAR1 и/или нейтрализовать биологическое действие неприродных интерферонов, подобных интерферонам I типа. Такие неприродные интерфероны I типа, или гибридные интерфероны, подобные интерферонам I типа, представляют молекулу, которая была изменена по сравнению с их природными структурами методами рекомбинации или синтеза. Гибридные интерфероны, описанные в US 7232563, представляют молекулярное замещение различных сегментов структуры природного интерферона для создания молекулы, обладающей повышенной силой и/или пониженной токсичностью.
В других вариантах осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют способность блокировать связывание с IFNAR1 и/или нейтрализовать биологическое действие мутантных интерферонов I типа. Мутантные интерфероны I типа описаны в US 6299870 и 6300474, сущность которых включена в настоящее изобретение в виде ссылок.
В других вариантах осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют способность блокировать связывание с IFNAR1 и/или нейтрализовать биологическое действие интерферонов, подобных интерферонам I типа, происходящих от других видов животных. Такие интерфероны, подобные интерферонам I типа, выделены из кур, кошек, мышей, крыс, кроликов, коз, лошадей или из животных других видов. В некоторых вариантах осуществления настоящего изобретения интерфероны I типа человека выделены из клеток, полученных от кур, кошек, мышей, крыс, кроликов, коз, лошадей или животных других видов. В других вариантах осуществления настоящего изобретения интерфероны I типа человека вызывают разные варианты гликозилирования, если они производны от кур, кошек, мышей, крыс, кроликов, коз, лошадей или животных других видов. С дополнительным обсуждением интерферонов от других видов животных можно ознакомиться в публикации Всемирной организации по защите интеллектуальной собственности WO06099451A3, включенной в настоящее изобретение в виде ссылки.
Для задач, решаемых в настоящем изобретении, способность анти-IFNAR1 антитела по настоящему изобретению нейтрализовать действие IFNα может быть подвергнута мониторингу, например, методом исследования активации рецептора киназы (Kinase Receptor Activation - KIRA), описанном в WO 95/14930, путем измерения способности антитела-кандидата снижать фосфорилирование тирозина (возникающее из-за связывания лиганда) комплекса IFNAR1/R2 рецептор.
В другом варианте или необязательно, для задачи, решаемой в настоящем изобретении, способность анти-IFNAR1 антитела по настоящему изобретению нейтрализовывать конкуренцию клеточного ответа через IFNα может быть протестирована путем мониторинга нейтрализации антивирусного действия IFNα согласно описанию Kawade, J. Interferon Res. 1, 1980, 61, с.70, или Kawade, Watanabe, J. Interferon Res. 4, 1984, cc.571 584, или Yousefi и др., Am. J. Clin. Pathol. 83, 1985, cc.735-740, или путем тестирования способности анти-IFNAR1 антитела по настоящему изобретению нейтрализовывать способность of IFNα активировать связывание сигнальной молекулы, интерферон-стимулированного фактора 3 (interferon-stimulated factor 3 - ISGF3), с олигонуклеотидом, производным от интерферон-стимулированного элемента ответа (interferon-stimulated response element - ISRE), в анализе сдвига электрофоретической подвижности по описанию Kurabayashi и др., Mol. Cell Biol., 15, 1995, с.6386.
В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют способность ингибировать по меньшей мере одну IFNα-опосредованную функцию рецептора IFNAR1. В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению ингибируют действие рецептора IFNAR1 в ответ на IFNα или его подтипы по меньшей мере примерно на 60%, по меньшей мере примерно на 70%, по меньшей мере примерно на 75%, по меньшей мере примерно на 80%, по меньшей мере примерно на 85%, по меньшей мере примерно на 90%, по меньшей мере примерно на 95%, или по меньшей мере примерно на 99%. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению ингибируют действие рецептора IFNAR1 в ответ на IFNα или его подтипы по данным измерения методом K.IRA, описанным выше, по меньшей мере примерно на 60%, по меньшей мере примерно на 70%, по меньшей мере примерно на 75%, по меньшей мере примерно на 80%, по меньшей мере примерно на 85%, по меньшей мере примерно на 90%, по меньшей мере примерно на 95%, или по меньшей мере примерно на 99%. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению ингибируют действие рецептора IFNAR1 в ответ на IFNα или его подтипы по данным измерения связывания сигнальной молекулы, интерферон-стимулированного фактора 3 (ISGF3), с олигонуклеотидом, производным от интерферон-стимулированного элемента ответа (ISRE), в анализе сдвига электрофоретической подвижности по описанию Kurabayashi и др., Mol. Cell Biol., 15, 1995, с.6386, по меньшей мере примерно на 60%, по меньшей мере примерно на 70%, по меньшей мере примерно на 75%, по меньшей мере примерно на 80%, по меньшей мере примерно на 85%, по меньшей мере примерно на 90%, по меньшей мере примерно на 95%, или по меньшей мере примерно на 99%. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению ингибируют действие рецептора IFNAR1 в ответ на IFNα или его подтипы по данным измерения известным в данной области методом, по меньшей мере примерно на 60%, по меньшей мере примерно на 70%, по меньшей мере примерно на 75%, по меньшей мере примерно на 80%, по меньшей мере примерно на 85%, по меньшей мере примерно на 90%, по меньшей мере примерно на 95%, или по меньшей мере примерно на 99%.
В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют способность нейтрализовать противовирусные свойства IFNα или его подтипов. В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению нейтрализуют по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95%, или по меньшей мере примерно 99% противовирусного действия IFNα или его подтипов, что было установлено в противовирусных исследованиях Kawade (1980) или Yousefi (1985). В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению не нейтрализуют противовирусные свойства IFNα или его подтипов.
Для решения задачи, выдвигаемой в настоящем изобретении, способность анти-IFNAR1 антитела по настоящему изобретению блокировать связывание IFNα или его подтипов с IFNAR1 может быть измерено рутинным исследованием конкуренции, например, описанным в кн.: «Antibodies: A Laboratory Manual», 1988, изд. Cold Spring Harbor Laboratory, под ред. Harlow и David Lane. В одном из вариантов осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению проявляют способность блокировать или ингибировать связывание следующих подтипов IFNα: 1, 2, 4, 5, 8, 10 и 21 с IFNAR1. В другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению способны блокировать или ингибировать связывание: по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, или по меньшей мере 7 из следующих подтипов IFNα: 1, 2, 4, 5, 8, 10 и 21 с IFNAR1.
Антитела по настоящему изобретению могут влиять на IFNAR для регуляции IFN-1-отвечающих генов. IFN-1-отвечающие гены были установлены в следующих патентных заявках: US60/873008, 60/907762, 60/924 584, 60/960187, 60/966 176 и PCT/US2007/02494, сущность каждой из которых включена в настоящее описание в виде ссылки.
Антитела
Антитела по настоящему изобретению могут включать моноклональное антитела, полиспецифичные антитела, человека антитела, гуманизированные антитела, камелидизированные антитела, химерные антитела, одноцепочечные Fvs (single-chain - scFv), дисульфид-связанные (disulfide-linked Fvs - sdFv), анти-идиотипические (анти-Id) антитела и эпитоп-связывающие фрагменты какого-либо из указанных выше соединений. В частности к антителам относятся молекулы иммуноглобулина и иммунологически активные фрагменты молекул иммуноглобулина, т.е. молекулы, которые содержат сайт связывания антигена, причем указанные фрагменты могут гибридизироваться или не гибридизироваться с доменом другого иммуноглобулина, включая, но ими не ограничиваясь, область Fc или ее фрагмент. Выше было отмечено, что понятия «антитело» и «антитела» особенно включают модифицированные антитела, описанные в настоящем изобретении. Молекулы иммуноглобулина могут быть какого-либо типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса. Антитела по настоящему изобретению могут относиться к какому-либо изотипу. В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению относятся к IgG1, IgG2, IgG3 или IgG4 изотипу. Антитела по настоящему изобретению могут быть антителами полной длины, включающими вариабельную и константную области, или их антиген-связывающими фрагментами, например, одноцепочечным антителом.
Понятие «антигенсвязывающий фрагмент» антитела (или просто «фрагмент антитела») в контексте настоящего изобретения относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном (например, IFNAR1). Было показано, что антигенсвязывающая функция антитела может осуществляться фрагментами антитела полной длины. К примерам связывающих фрагментов, обозначаемых термином «антигенсвязывающий фрагмент» антитела, относятся: (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1 (ii) фрагмент F(ab')2, двухвалентный фрагмент, состоящий из двух фрагментов Fab, связанных дисульфидным мостиком в шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела; (v) фрагмент dAb (Ward и др., Nature 341, 1989, cc.544-546, состоящий из домена VH; и (vi) выделенная область, определяющая комплементариность (CDR). Кроме того, хотя два домена фрагмента Fv, VL и VH, кодируются двумя разными генами, они могут быть соединены, используя методы рекомбинации, синтетическим линкером, который позволяет им быть единой белковой цепью, в которой области VL и VH соединены для формирования моновалентной молекулы (называемой одноцепочечной цепью Fv (scFv); см., например, Bird и др. Science 242, 1988, cc.423-426; и Huston и др. Proc. Natl. Acad. Sci. USA 85, 1988, cc.5879-5883). Такие одноцепочечные антитела также относятся к понятию «антигенсвязывающего фрагмента» антитела. Такие фрагменты антитела получают, используя традиционные методики, известные специалистам в данной области, и фрагменты подвергают скринингу тем же образом, что и интактные антитела.
В других вариантах осуществления настоящего изобретения предусмотрены гибридные белки (называемые «гибридными белками по настоящему изобретению»), включая модифицированную область Fc с пониженным или измененным сродством с лигандом Fc, ответственным за облегчение эффекторной функции по сравнению с областью Fc, имеющей ту же аминокислотную последовательность, что и гибридный белок по настоящему изобретению, но имеющую дополнение, замещение или делецию по меньшей мере одного аминокислотного остатка в области Fc.
В других вариантах осуществления настоящего изобретения гибридные белки по настоящему изобретению могут включать пептид, полипептид, каркас белка, scFv, dsFv, двухвалентные антитела, тандемные антитела (Tandab) или миметик антитела, гибридизированный с модифицированной областью Fc. В некоторых вариантах осуществления настоящего изобретения гибридные белки по настоящему изобретению включают линкерную область, соединяющую пептид, полипептид, каркас белка (scaffold), scFv, dsFv, двухвалентные антитела, Tandab или миметик антитела с модифицированной областью Fc. Применение природных а также искусственных пептидных линкеров для соединения полипептидов в новые связанные гибридные полипептиды известно из литературы (Hallewell и др. J. ВЫ. Chem. 264, 1989, cc.5260-5268; Alfthan и др. Protein Eng. 8, 1995, cc.725-731; Robinson & Sauer Biochemistry 35, 1996, cc.109-116; Khandekar и др. J. Biol. Chem. 272, 1997, cc.32190-32197; Fares и др. Endocrinology 139, 1998, cc.2459-2464; Smallshaw и др. Protein Eng. 12, 1999, cc.623-630; US 5856456).
В одном из вариантов осуществления настоящего изобретения гибридные белки по настоящему изобретению включают область Fc, включающую по меньшей мере одно дополнение, замещение или делецию аминокислотного остатка, выбранного из группы, состоящей из: 234, 235 и 331, причем система нумерации константной области дана по индексу EU, разработанному Kabat и др. (Публикация Национального института здоровья США 91-3242, 1991, Национальная служба технической информации, Спрингфилд, Вирджиния). В одном из вариантов осуществления настоящего изобретения гибридные белки по настоящему изобретению включают область Fc, включающую по меньшей мере один аминокислотный остаток, выбранный из группы, состоящей из: L234F, L235E и P331S.
В другом варианте осуществления настоящего изобретения, гибридные белки по настоящему изобретению также включают область Fc, включающую по меньшей мере одно дополнение, замещение или делецию аминокислотного остатка, который коррелирует с повышенной стабильностью гибридного белка. В одном из вариантов осуществления настоящего изобретения дополнение, замещение или делеция аминокислотного остатка содержится в положении 228 области Fc, причем система нумерации константной области соответствует индексу EU, разработанному Kabat и Kabat и др. (см. выше). В некоторых вариантах осуществления настоящего изобретения гибридные белки по настоящему изобретению включают область Fc, содержащую аминокислотное замещение по положению 228, причем замещение является остатком серина.
В некоторых вариантах осуществления настоящего изобретения антитела или гибридные белки по настоящему изобретению включают одну или несколько сконструированных гликоформ, т.е. углеводных композиций, которые ковалентно присоединены к молекуле, включающей область Fc. Сконструированные гликоформы могут применяться с разными целями, включая но ими не ограничиваясь, понижение эффекторной функции. Сконструированные гликоформы могут быть получены каким-либо методом, известным специалистам в данной области, например, используя сконструированные или вариантные экспрессирующие штаммы, совместной экспрессией с одним или несколькими ферментами, например, DI N-ацетилглюкозаминилтрансферазой III (GnTIll), экспрессией молекулы, включающей область Fc, в разных организмах и линиях клеток из разных организмов, или модификацией углевода (углеводов) после экспрессии молекулы, включающей область Fc. Способы получения конструируемых гликоформ известны в данной области и включают, но ими не ограничиваются, методы, описанные в работах Umana и др, Nat. Biotechnol 17, 1999, cc.176-180; Davies и др., Biotechnol Bioeng 74, 2001, cc.288-294; Shields и др, J Biol Chem 277, 2002, cc.26733-26740; Shinkawa и др., J Biol Chem 278, 2003, cc.3466-3473) US 6602684; US 10/277370; US 10/113929; PCT WO 00/61739А1; РСТ WO 01/292246А1; РСТ WO 02/311140A1; РСТ WO 02/30954A1; Potillegent™ технология (фирма Biowa, Inc. Princeton, Нью-Джерси); GlycoMAb™ технология конструирования гликозилирования (фирма GLYCART biotechnology AG, Цюрих, Швейцария); сущность каждой из этих работ включена в настоящее изобретение в виде ссылки. См., например, публикации WO 00061739; ЕА01229125; US 20030115614; Okazaki и др., JMB, 336, 2004, cc.1239-49, каждая из которых включена в настоящее изобретение в виде ссылки.
Конъюгаты антител
Настоящее изобретение охватывает применение антител или их фрагментов, конъюгированных или гибридизированных с одной или несколькими частями молекул, включая но ими не ограничиваясь, пептиды, олипептиды, белки, гибридные белки, молекулы нуклеиновых кислот, низкомолекулярные соединения, агенты-миметики, синтетические лекарственные средства, неорганические молекулы и органические молекулы.
Настоящее изобретение охватывает применение антител или их фрагментов, рекомбинантно гибридизированных или химически конъюгированных (включая и ковалентные, и нековалентные конъюгаты) с гетерологичным белком или полипептидом (или их фрагментом с полипептидом, включающим по меньшей мере 10, по меньшей мере 20, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 60, по меньшей мере 70, по меньшей мере 80, по меньшей мере 90 или по меньшей мере 100 аминокислот) для получения гибридных белков. Гибриды необязательно должны быть прямыми, они могут иметь соединение через линкерные последовательности. Например, антитела могут применяться для нацеливания гетерологичных полипептидов на определенные типы клеток, или in vitro, или in vivo, используя или конъюгируя антитела с антителами, специфичными в отношении определенных рецепторов на поверхности клеток. Антитела, которые гибридизируют или конъюгируют с гетерологичными полипептидами, также могут применяться в иммуноисследованиях in vitro и методах очистки, используя методы, известные в данной области. См., например, WO 93/21232; ЕР 439095; Naramura и др., Immunol. Lett. 39, 1994, cc.91-99; US 5474981; Gillies и др., PNAS 89, 1992, cc.1428-1432; и Fell и др., J. Immunol. 146, 1991, cc.2446-2452, сущность которых включена в настоящее изобретение в виде ссылок.
Дополнительные гибридные белки могут быть получены методами генной перетасовки, перетасовки мотивов, перетасовки экзонов и/или перетасовки кодонов (все эти методы называются «перетасовкой ДНК»). Перетасовка ДНК может быть применена для изменения действия антитела по настоящему изобретению или их фрагментов (например, антител или их фрагментов с повышенным сродством и пониженной степенью диссоциации). См. основные публикации: US 5605793; 5811238; 5830721; 5834252; 5837458; Patten и др., Curr. Opinion Biotechnol. 8, 1997, cc.724-733; Harayama, Trends Biotechnol. 16(2), 1998, cc.76-82; Hansson и др., J. Mol. Biol. 287, 1999, cc.265-276; Lorenzo и Blasco, Biotechniques 24(2), 1998, cc.308-313 (сущность каждого из этих патентов и публикаций включены в настоящее изобретение в виде ссылки). Антитела или их фрагменты, или кодируемые антитела или их фрагменты, могут быть модифицированы путем случайного мутагенеза методом ПЦР случайных ошибок, случайной нуклеотидной инсерцией или другими методами перед рекомбинацией. Одна или несколько частей полинуклеотида, кодирующих антитело или фрагмент антитела, части которого специфически связываются с IFNAR1, могут быть рекомбинированы с одним или несколькими компонентами, мотивами, секциями, частями, доменами, фрагментами и т.д. одной или нескольких гетерологичных молекул.
Кроме того, антитела или их фрагменты могут гибридизироваться с маркерными последовательностями, например, пептидом, для облегчения очистки. В других вариантах осуществления настоящего изобретения маркерной аминокислотной последовательностью является пептид гексагистидин, например, метка, поставляемая в векторе pQE (QIAGEN, Inc., 9259 Eton Avenue, Chatsworth, Калифорния, 91311), наряду с другими, многие из которых коммерчески доступны. По описанию Gentz и др., Proc. Natl, Acad. Sci. USA 86, 1989, cc.821-824, например, гексагистидин предусмотрен для удобства очистки гибридного белка. К другим пептидным меткам, применимым для очистки, относятся, но ими не ограничиваются, метка гемагглютинина «ГА (hemagglutinin - НА)», которая соответствует эпитопу, производному от белка гемагглютинина вируса гриппа (Wilson и др., Cell 37, 1984, с.767), и метка «Flag».
В других вариантах осуществления настоящего изобретения антитела по настоящему изобретению, или фрагменты, или их производные конъюгируют с диагностическим или выявляемым агентом. Такие антитела могут быть полезны для мониторинга или прогноза развития или прогрессирования воспалительного расстройства в качестве части метода клинического тестирования, например, определения эффективности определенной терапии. Такие диагностика и выявление могут достигаться путем соединения антитела с выявляемыми веществами, включая, но ими не ограничиваясь, различные ферменты, например, но ими не ограничиваясь, пероксидазу хрена, щелочную фосфатазу, бета-галактозидазу или ацетилхолинэстеразу; простетические группы, например, но ими не ограничиваясь, стрептавидин/биотин и авидин/биотин; флуоресцентные материалы, например, но ими не ограничиваясь, умбеллиферон, флуоресцеин, флуоресцеин изотиоционат, родамин, дихлортриазиниламинфлуоресцеин, дансил хлорид или фикоэритрин; люминесцентные материалы, например, но им не ограничиваясь, люминол; биолюминесцентные материалы, например но ими не ограничиваясь, люцифераза, люциферин и экворин; радиоактивные материалы, например но ими перечень не ограничивается, иод (131I,125I,123I,121I), углерод (14C), сера (35S), ритий (3Н), индий (115In,113In,112In,111In), технеций (99Tc), таллий (201Ti), галлий (68Ga,67Ga), палладий (103Pd), молибден (99Мо), ксенон (133Хе), фтор (18F),153Sm,177Lu,159Gd,149Pm,140La,175Yb,166Ho,90Y,47Sc,186Re,188Re,142Pr,105Rh,97Ru,68Ge,57Co,62Zn,85Sr,32P,153Gd,169Yb,51Cr,54Mn,75Se,113Sn и117Tin; металлы с эмиссией позитронов, используя различную позитрон-эмиссионную томографию, нерадиоактивные ионы парамагнитных металлов и молекулы, которые отмечены радиометкой или конъюгированы с определенными радиоизотопами.
Известны методы конъюгации терапевтических частей молекулы с антителами, см., например, кн.: Arnon и др. «Monoclonal Antibodies and Cancer Therapy», 1985, под ред. Reisfeld и др., изд. Alan R. Liss, Inc., cc.243-256; кн.: «Controlled Drug Delivery», 1987, под ред. Robinson и др., 2-е изд., изд. Marcel Dekker, Inc., cc.623-653; кн.: «Monoclonal Antibodies 84: Biological and Clinical Applications», 1985, под ред. Pinchera и др., cc.475-506; «Monoclonal Antibodies For Cancer Detection и Therapy», 1985, под ред. Baldwin и др., изд. Academic Press, cc.303-316; Thorpe и др., Immunol. Rev. 62, 1982, cc.119-158.
В другом варианте антитело может быть конъюгировано со вторым антителом для формирования гетероконъюгата антител согласно описанию в патенте US 4676980, сущность которого включена в настоящее изобретение в виде ссылки. Терапевтическая часть молекулы или лекарственное средство, конъюгировапнные с антителом или его фрагментом, которое специфически связывается с IFNAR1, могут быть выбраны для достижения требуемого профилактического или терапевтического эффекта (эффектов) в отношении определенного расстройства у субъекта. Врач или другой медицинский работник должны учитывать нижеследующее при принятии решения о том, какая терапевтическая часть молекулы или лекарственное средство должны конъюгировать с антителом или его фрагментом, которые специфически связываются с IFNAR1: природу болезни, тяжесть болезни и состояние субъекта.
Способы получения антител
Антитела или их фрагменты могут быть получены каким-либо методом, известным в данной области, для синтеза антител, в частности, химическим синтезом или методами рекомбинантной экспрессии.
Моноклональные антитела могут быть получены, используя широкий круг методик, известных в данной области, включая применение гибридом, рекомбинантов и фагового дисплея или их комбинации. Например, моноклональные антитела могут быть получены, используя методы с применением гибридом, включая известные в данной области методы и рекомендации, описанные, например, в кн.: Harlow и др., «Antibodies: A Laboratory Manual», 1988, изд-во Cold Spring Harbor Laboratory Press, 2-е изд.; в кн.: Hammerling и др. «Моноклональное Antibodies and T-Cell Hybridomas», 1981, изд-во Elsevier, Нью-Йорк, cc.563-681 (сущность указанных работ включена в настоящее изобретение в виде ссылок). Понятие «моноклональное антитело», используемое в настоящем изобретении, не ограничивается антителами, получаемыми с применением гибридом. Понятие «моноклональное антитело» относится к антителу, получаемому от одного клона, включая какой-либо эукариотический, прокариотический или фаговый клон, но не к способу, с помощью которого его получают.
Методы получения и скрининга специфических антител, используя метод гибридом, являются обычными, хорошо известными в данной области. Вкратце, мыши могут быть иммунизированы IFNAR1, и если иммунный ответ обнаружен, например, антитела, специфичные в отношении IFNAR1, обнаружены в сыворотке, получают селезенку мыши и выделяют из нее спленоциты. Затем спленоциты гибридизируют известными методами с какими-либо соответствующими клетками миеломы, например, клетками из клеточной линии SP20, которую можно получить из коллекции АТСС. Гибридомы отбирают и клонируют серийными разведениями. Затем клоны гибридом исследуют методами, известными в данной области для клеток, которые секретируют антитела, способные связывать полипептид по настоящему изобретению. Асцитная жидкость, которая обычно содержит высокие уровни антител, может быть получена иммунизацией мышей положительными гибридомными клонами.
Таким образом, моноклональное антитела могут быть получены путем культивирования гибридомных клеток, секретирующих антитело по настоящему изобретению, причем гибридомы получают слиянием спленоцитов, выделенных из мыши, иммунизированной IFNAR1, с клетками миеломы и затем скрининга гибридом, получаемых в результате гибридизации гибридомных клонов, которые сектерируют антитело, способное связывать IFNAR1.
Фрагменты антител, которые распознают специфические эпитопы IFNAR1, могут быть получены каким-либо из методов, известных специалистам в данной области. Например, фрагменты Fab и F(ab')2 по настоящему изобретению могут быть получены протеолитическим расщеплением молекул иммуноглобулина, используя ферменты, например, папаин (для получения фрагментов Fab) или пепсин (для получения фрагментов F(ab')2). Фрагменты F(ab')2 содержат вариабельную область, константную область легкой цепи и домен СН1 тяжелой цепи. Кроме того, антитела по настоящему изобретению также могут быть получены, используя различные методы фагового дисплея, известные в данной области.
В методах фагового дисплея домены функционального антитела выставляют на поверхности фаговых частиц, которые несут полинуклеотидные последовательности, кодирующие их. В частности последовательности ДНК, кодирующие домены VH и VL, амплифицируют из библиотек кДНК животных (например, библиотек лимфоидных тканей кДНК человека или грызуна). ДНК, кодирующая домены VH и VL, рекомбинируют вместе с линкером scFv методом ПЦР и клонируют в фагмидный вектор (например, pCANTAB 6 или pComb 3 HSS). Вектор электропортируют в Е.coli, а Е.coli инфицируют хелперным фагом. Фаги, используемые в этих методах, обычно являются нитчатыми фагами, включая fd и М13, а домены VH и VL обычно рекомбинантно гибридизированы или с фаговым геном III, или с фаговым геном VIII. Фаг, экспрессирующий антигенсвязывающий домен, который связывается с исследуемым эпитопом IFNAR1, может быть выбран или идентифицирован по антигену, например, используя меченый антиген или антиген, связанный или захваченный твердой поверхностью или гранулой. К примерам методов фагового дисплея, которые могут применяться для получения антитела по настоящему изобретению, относятся методы, описанные в работах Brinkman и др., J. Immunol. Methods 182, 1995, сс.41-50; Ames и др., J. Immunol. Methods 184, 1995, сс.177-186; Kettleborough и др., Eur. J. Immunol. 24, 1994, сс.952-958; Persic и др., Gene 187, 1997, сс.9-18; Burton и др., Advances in Immunology 57, 1994, сс.191-280; PCT/GB91/01134; WO 90/02809, WO 91/10737, WO 92/01047, WO 92/18619, WO 93/11236, WO 95/15982, WO 95/20401, и W097/13844; US 5698426, 5223409, 5403484, 5580717, 5427908, 5750753, 5821047, 5571698, 5427908, 5516637, 5780225, 5658727, 5733743 и 5969108; сущность каждой из перечисленных работ включена в настоящее изобретение в виде ссылки.
Согласно описанным выше ссылкам, после отбора фага антитело, кодирующее области фага, может быть выделено и использовано для получения целых антител, включая антитела человека, или какие-либо другие желательные антигенсвязывающие фрагменты, и экспрессировано в каком-либо желательном хозяине, включая клетки млекопитающих, клетки насекомых, клетки растений, дрожжи и бактерии, например, согласно описанному ниже. Методики рекомбинантно получаемых фрагментов Fab, Fab' и F(ab')2 могут также применяться, используя методы, известные в данной области, например, описанные в международной публикации WO 92/22324; Mullinax и др., BioTechniques 12(6), 1992, cc.864-869; Sawai и др., AJRI 34, 1995, cc.26-34; и Better и др., Science 240, 1988, cc.1041-1043 (указанные работы включены в настоящее описание в виде ссылки на их сущность).
Для получения целых антител могут применяться праймеры ПЦР, включая нуклеотидные последовательности VH или VL, сайт рестрикции и фланкирующую последовательность для защиты сайта рестрикции, для амплификации последовательностей VH или VL в клонах scFv. Используя методы клонирования, известные специалистам в данной области, амплифицированные ПЦР домены VH могут быть клонированы в векторы, экспрессирующие константную область VH, например, константную область гамма 4 человека, и ПЦР амплифицированные домены VL могут быть клонированы в векторы, экспрессирующие константную область VL, например, константные области каппа и лямбда человека. В некоторых вариантах осуществления настоящего изобретения векторы экспрессии доменов VH или VL включают промотор EF-1 альфа, сигнал секреции, сайт клонирования для вариабельного домена, константного домена и селективного маркера, например, неомицина. Домены VH и VL также могут быть клонированы в вектор, экспрессирующий необходимые константные области. Векторы конверсии тяжелой цепи и векторы конверсии легкой цепи затем совместно трансфецируют в линии клеток для выработки стабильных или временных линий клеток, которые экспрессируют антитела полной длины, например, IgG, используя методы, известные специалистам в данной области.
Для некоторых применений, включая применение in vivo антител для человека и методы выявления in vitro, может быть полезно использовать антитела человека или химерные антитела. Антитела, являющиеся полностью антителами человека, особенно желательны для терапевтического лечения людей. Антитела человека могут быть получены разными методами, известными в данной области, включая методы фагового дисплея, описанные выше, с использованием библиотек антител, производных от последовательностей иммуноглобулина человека. См. также US 4444887 и 4716111, международные публикации WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741, каждая из которых включена в настоящее изобретение в виде ссылки на ее сущность.
Химерное антитело является молекулой, в которой разные части антитела производны от разных молекул иммуноглобулина. Методы получения химерных антител известны в данной области. См., например, Morrison, Science 229, 1985, с.1202; Oi и др., BioTechniques 4, 1986, с.214; Gillies и др., J. Immunol. Methods 125, 1989, cc.191-202; US 5807715, 4816567, 4816397 и 6311415, каждая из которых включена в настоящее изобретение в виде ссылки на ее сущность.
Гуманизированным антителом является антитело или его фрагмент, которое способно связываться с предварительно определенным антигеном и которое включает каркасный участок, имеющий в основном аминокислотную последовательность иммуноглобулина человека и область CDR, аминокислотная последовательность которой по существу не является последовательностью иммуноглобулина человека. Гуманизированное антитело включает в основном все из по меньшей мере одного и обычно двух вариабельных доменов (Fab, Fab', F(ab')2, Fabc, Fv), в которых все или почти все области CDR соответствуют тем доменам иммуноглобулина, не являющегося иммуноглобулином человека (т.е. антитела доноры), и все или почти все каркасные участки от консенсусной последовательности иммуноглобулина человека. В некоторых случаях гуманизированное антитело также включает по меньшей мере часть константной области иммуноглобулина (Fc), обычно иммуноглобулина человека. Обычно антитело может содержать и легкую цепь, и по меньшей мере вариабельный домен тяжелой цепи. Антитело также может включать СН1, шарнирную область, СН2, СН3 и СН4 области тяжелой цепи. Гуманизированное антитело может быть выбрано из какого-либо класса иммуноглобулинов, включая IgM, IgG, IgD, IgA и IgE, и какой-либо изотип, включая IgG1, IgG2, IgG3 и IgG4. Обычно константный домен является комплемент-фиксирующим константным доменом, если требуется, чтобы гуманизированное антитело проявляло: цитотоксическое действие и классом обычно является IgG1. Если цитотоксическое действие нежелательно, константный домен может относиться к классу IgG2. Гуманизированное антитело может включать последовательности более чем от одного класса или изотипа, и отбор определенных константных доменов для оптимизации требуемых эффекторных функций может быть осуществлен специалистами в данной области. Каркасный участок и CDR гуманизированного антитела не должны точно соответствовать исходным последовательностям, например, в CDR донора или консенсусному каркасному участку, могут быть произведены мутации путем замены, инсерции или делеции по меньшей мере одного остатка таким образом, что остаток CDR или каркасного участка по этому сайту не соответствует ни консенсусному, ни импортному антителу. Такие мутации, однако, могут быть небольшими. Обычно, по меньшей мере 75% остатков гуманизированного антитела может соответствовать остаткам исходной каркасной области (FR) и последовательностей CDR, более часто 90%, и возможно больше 95%. Гуманизированное антитело может быть выработано, используя разные методы, известные в данной области, включая, но ими не ограничиваясь, CDR-пересадку (ЕР 239400, WO 91/09967, US 5225539, 5530101 и 5585089), облицовку или обновление (ЕР 592106 и ЕР 519596; Padlan, Molecular Immunology 28(4/5), 1991, cc.489-498; Studnicka и др., Protein Engineering 7(6), 1994, cc.805-814; Roguska и др., PNAS 91, 1994, cc.969-973), перетасовку цепи (US 5565332) и методы, описанные, например, в US 6407213, 5766886, WO 9317105, Tan и др., J. Immunol. 169, 2002, cc.1119-1125 (2002), Caldas и др., Protein Eng. 13(5), 2000, cc.353-360, Morea и др., Methods 20(3), 2000, cc.267-279, Васа и др., J. Biol. Chem. 272(16), 1997, cc.10678-10684, Roguska и др., Protein Eng. 9(10), 1996, cc.895-904, Couto и др., Cancer Res. 55(23), 1995, cc.5973s-5977s, Couto и др., Cancer Res. 55(8): 1995, cc.1717-1722, Sandhu J. S., Gene 150(2), 1994, cc.409-410, Pedersen и др., J. Mol. Biol. 235(3), 1994, cc.959-973. Часто каркасные остатки в каркасных участках могут быть замещены соответствующим остатком из CDR антитела донора для изменения или улучшения связывания антигена. Такие замещения в каркасных участках идентифицируют методами, известными в данной области, например, моделированием взаимодействий остатков CDR и каркасного участка для идентификации остатков каркасного участка, важных для связывания антигена, и сравнение последовательности для идентификации необычных остатков каркасного участка по определенным положениям. (См., например, US 5585089; и Riechmann и др., Nature 332, 1988, с.323, сущность которых включена в настоящее изобретение в виде ссылок).
Полинуклеотиды, кодирующие антитело
Настоящее изобретение также охватывает полинуклеотиды, которые гибридизируются в условиях высокой жесткости, средней или низкой жесткости, например, согласно указанному выше, с подинуклеотидами, которые кодируют антитело по настоящему изобретению.
Полинуклеотиды могут быть получены, и нуклеотидная последовательность полинуклеотидов может быть определена каким-либо методом, известным в данной области. Поскольку известны аминокислотные последовательности антитела, нуклеотидные последовательности, кодирующие эти антитела, могут быть определены методами, известными в данной области, т.е. кодоны нуклеотидов, о которых известно, какие аминокислоты они кодируют, собирают таким образом, чтобы получить нуклеиновую кислоту, которая кодирует антитело или его фрагмент по настоящему изобретению. Такой полинуклеотид, кодирующий антитело, может быть собран из химически синтезированных олигонуклеотидов (например, описанных Kutmejer и др., BioTechniques 17, 1994, с.242), методом, который вкратце включает синтез перекрывающихся олигонуклеотидов, содержащих части последовательности, кодирующей антитело, отжиг и лигирование таких олигонуклеотидов и затем амплификацию лигированных олигонуклеотидов методом ПЦР.
В другом варианте полинуклеотид, кодирующий антитело, может быть выработан из нуклеиновой кислоты из соответствующего источника. Если клон, содержащий нуклеиновую кислоту, который кодирует определенное антитело, недоступен, но последовательность молекулы антитела известна, нуклеиновая кислота, кодирующая иммуноглобулин, может быть синтезирована химически или получена из соответствующего источника (например, библиотеки кДНК антител, или выработанной из нее библиотеки кДНК, или из нуклеиновой кислоты, обычно поли А+РНК, выделенной из какой-либо ткани или клетки, экспрессирующих антитело, например, гибридомных клеток, отобранных для экспрессии антитела по настоящему изобретению) путем ПЦР амплификации, используя синтетические праймеры, гибридизируемые с 3' и 5' концов последовательности или клонированием, используя олигонуклеотидный зонд, специфичный в отношении определенной генной последовательности для идентификации, например, клона кДНК из библиотеки кДНК, которое кодирует антитело. Амплифицированные нуклеиновые кислоты, выработанные методом ПЦР, могут быть клонированы в реплицируемых векторах клонирования, используя какой-либо метод, известный в данной области.
Если нуклеотидная последовательность антитела определена, нуклеотидная последовательность антитела может быть изменена методами, известными в данной области для манипуляции с нуклеотидными последовательностями, например, методами рекомбинации ДНК, сайт-направленного мутагенеза, ПЦР и др. (см., например, методами, описанными в кн.: Sambrook и др. «Molecular Cloning, A Laboratory Manual», 1990, 2-е изд., изд-во Cold Spring Harbor Laboratory, Cold Spring Harbor, Нью-Йорк, и в кн.; «Current Protocols in Molecular Biology», 1998, под ред. Ausubel и др., изд-во John Wiley & Sons, Нью-Йорк, сущность которых включена в настоящее изобретение в виде ссылок) для выработка антител с разной аминокислотной последовательностью, например, для создания аминокислотных замещений, делеций и/или инсерций.
В одном из вариантов осуществления настоящего изобретения одна или несколько областей CDR внедрены в каркасные области, используя обычные методы рекомбинации ДНК. Каркасные области могут быть природными или консенсусными каркасными участками и при определенных обстоятельствах каркасными участками человека (см., например, перечень каркасных участков человека в работе Chothia и др., J. Mol. Biol. 278, 1998, 457-479). Необязательно полинуклеотид, полученный комбинацией каркасных областей и CDR, кодирует антитело, которое специфически связывается с IFNAR1. Необязательно может быть получено одно или несколько аминокислотных замещений в каркасных участках и в некоторых случаях аминокислотные замещения улучшают связывание антитела с его антигеном. Кроме того, такие методы могут применяться для получения аминокислотных замещений или делеций одного или нескольких остатков цистеина в вариабельной области, участвующих во внутрицепочечной дисульфидной связи для получения молекул антитела, утративших одну или несколько внутрицепочечных дисульфидных связей. Другие изменения полинуклеотидов по настоящему изобретению относятся к области охвата настоящего изобретения и известны специалистам в данной области.
В некоторых вариантах осуществления настоящего изобретения антитела по настоящему изобретению кодируются полинуклеотидными последовательностями, представленными на фиг.1-4. В других вариантах осуществления настоящего изобретения полинуклеотиды по настоящему изобретению кодируют антитела, включающие константные области легкой цепи и тяжелой цепи, соответствующие SEQ ID Nos: 41 и 42, соответственно. В других вариантах осуществления настоящего изобретения полинуклеотиды по настоящему изобретению кодируют антитела, включающие константные области тяжелой цепи, соответствующие SEQ ID No:42 с учетом аллельной вариации, причем вариация составляет по меньшей мере один или несколько остатков, выбранных из группы, состоящей из положений 214, 221, 356 и 358, определенных по системе нумерации индекса EU.
Рекомбинантная экспрессии антитела
Рекомбинантная экспрессии антитела по настоящему изобретению, производного, аналога или его фрагмента (например, тяжелой или легкой цепи антитела по настоящему изобретению, или его части, или одноцепочечного антитела по настоящему изобретению), требует конструирования вектора экспрессии, содержащего полинуклеотид, который кодирует антитело. Если получают полинуклеотид, кодирующий молекулу антитела, или тяжелую или легкую цепь антитела, или его часть (но необязательно содержащего вариабельный домен тяжелой или легкой цепи), по настоящему изобретению, вектор для получения молекулы антитела может быть получен методом рекомбинации ДНК, используя методики, известные в данной области. Таким образом, методы получения белка путем экспрессии полинуклеотида, содержащего антитело, кодируемое нуклеотидной последовательностью и описанное в настоящем изобретении. Методы, известные специалистам в данной области, могут применяться для конструирования векторов экспрессии, содержащих кодирующие антитело последовательности и соответствующие сигналы контроля транскрипции и трансляции. Эти методы включают, например, методы рекомбинации ДНК in vitro, методы синтеза и генетической рекомбинации in vivo. Настоящее изобретение, таким образом, предусматривает реплицируемые векторы, включающие нуклеотидную последовательность, кодирующую молекулу антитела по настоящему изобретению, тяжелую или легкую цепь антитела, вариабельный домен тяжелой или легкой цепи антитела или его части, или CDR тяжелой или легкой цепи, функционально связанные с промотором. Такие векторы могут включать нуклеотидную последовательность, кодирующую константную область молекулы антитела (см., например, WO 86/05807; WO 89/01036; US 5122464) и вариабельный домен антитела может быть клонирован в такой вектор для экспрессии целой тяжелой цепи, целой легкой цепи, или и целой тяжелой цепи, и целой легкой цепи.
Вектор экспрессии переносят в клетку-хозяина обычными методами и трансфецированные клетки затем культивируют обычными методами для получения антитела по настоящему изобретению. Таким образом, настоящее изобретение включает клетки-хозяева, содержащие полинуклеотид, кодирующий антитело по настоящему изобретению или его фрагменты, или его тяжелую или легкую цепь, или его часть, или одноцепочечное антитело по настоящему изобретению, функционально связанное с гетерологичным промотором. В других вариантах осуществления настоящего изобретения для экспрессии двухцепочечного антитела векторы, кодирующие и тяжелую, и легкую цепи, могут совместно экспрессироваться в клетках-хозяевах для экспрессии целой молекулы иммуноглобулина, что подробно описано ниже.
Различные системы вектора экспрессии могут использоваться для экспрессии молекул антитела по настоящему изобретению (см., например, US 5807715). Такие системы экспрессии хозяина представляют векторы, с помощью которых исследуемые кодирующие последовательности могут быть получены и существенно очищены, а также представляют клетки, которые могут при трансформации или трансфекции соответствующими кодирующими последовательностями экспрессировать молекулу антитела по настоящему изобретению in situ. К ним относятся, но ими не ограничиваются, микроорганизмы, например, бактерии (например, Е.coli и В.subtilis), трансформированные векторами экспрессии ДНК рекомбинантного бактериофага, плазмидной ДНК или космидной ДНК, содержащими последовательности, кодирующие антитело; дрожжи (например, Saccharomyces и Pichia), трансформированные рекомбинантными дрожжевыми векторами экспрессии, содержащими последовательности, кодирующие антитело; системы клеток насекомых, инфицированные векторами экспрессии рекомбинантных вирусов (например, бакуловирусов), которые содержат последовательности, кодирующие антитело; системы клеток растений, инфицированные векторами экспрессии рекомбинантных вирусов (например, вирусом мозаики цветной капусты (cauliflower mosaic virus - CaMV), вирусом табачной мозаики (tobacco mosaic virus - TMV)) или трансформированными рекомбинантными плазмидными векторами экспрессии (например, плазмидой Ti), содержащими последовательности, кодирующие антитело; или системы клеток млекопитающих (например, клетки COS, СНО, BHK, 293, NS0 и 3Т3), несущие конструкции рекомбинантной экспрессии, содержащие промоторы, производные от генома клеток млекопитающих (например, промотор металлотионеина) или от вирусов млекопитающих (например, аденовирусный поздний промотор; промотор вируса коровьей оспы 7.5K). В некоторых вариантах осуществления настоящего изобретения бактериальные клетки, например Escherichia coli, и в других вариантах осуществления настоящего изобретения, эукариотические клетки, особенно для экспрессии целой молекулы рекомбинантного антитела, используют для экспрессии молекулы рекомбинантного антитела. Например, клетки млекопитающих, например, клетки яичника китайского хомячка (Chinese hamster ovary cells - СНО), в сцеплении с вектором, например, главный элемент промежуточного раннего генного промотора цитомегаловируса человека, являются эффективной системой экспрессии антител (Foecking и др., Gene 45, 1986, с.101; и Cockett и др., Bio/Technology 8, 1990, с.2). В некоторых вариантах осуществления настоящего изобретения экспрессия нуклеотидных последовательностей, кодирующих антитела или их фрагменты, которые специфически связываются с IFNAR1, регулируется конститутивным промотором, индуцибельным промотором или специфическим тканевым промотором.
В бактериальных системах преимущественно может быть выбран ряд векторов экспрессии, в зависимости от применения определенной молекулы антитела, предназначенной для экспрессии. Например, при получении большого количества такого белка, для выработки фармацевтических композиций молекулы антитела могут быть желательны векторы, направляющие экспрессию высоких уровней продуктов гибридных белков, которые легко очищаются. К таким векторам относятся, но ими не ограничиваются, вектор экспрессии Е.coli pUR278 (Ruther и др., ЕМВО 12, 1983, с.1791), в котором кодирующая антитело последовательность может быть лигирована в вектор в рамку с lac Z кодирующей областью таким образом, что вырабатывается гибридный белок; векторы pIN (Inouye & Inouye, Nucleic Acids Res. 13? 1985, cc.3101-3109; Van Heeke & Schuster, J. Biol. Chem. 24, 1989, cc.5503-5509); и др. Векторы pGEX также могут применяться для экспрессии чужеродных полипептидов в качестве гибридных белков с глютатион-5-трансферазой (glutathione 5-transferase - GST). В целом такие гибридные белки растворимы и могут быть легко очищены из лизировавшихся клеток путем адсорбции и связывания с матричными глутатионовыми агарозными гранулами с последующей элюцией в присутствии свободного глутатиона. Векторы pGEX конструируют для включения сайтов расщепления тромбина или протеазы фактора Ха таким образом, что продукт может быть высвобожден от части молекулы GST.
В клетках-хозяевах млекопитающих может применяться ряд систем экспрессии на основе вирусов. В тех случаях, когда аденовирус применяют в качестве вектора экспрессии, исследуемую кодирующую антитело последовательность можно лигировать с контрольным комплексом транскрипции/трансляции аденовируса, например, поздним промотором и трехраздельной лидерной последовательностью. Такой химерный ген затем может быть инсертирован в геном аденовируса путем рекомбинации in vitro или in vivo. Инсерция в незначительную область вирусного генома (например, область Е1 или Е3) может привести к получению рекомбинантного вируса, который жизнеспособен и может экспрессировать молекулу антитела в инфицированных хозяевах (например, см. Logan и Shenk, Proc. Natl. Acad. Sci. USA 81, 1984, cc.355-359). Специфические сигналы инициации могут также потребоваться для эффективной трансляции кодирующих последовательностей инсертированного антитела. К таким сигналам относятся кодон инициации ATG и смежные последовательности. Кроме того, инициирующий кодон должен быть в фазе с рамкой считывания требуемой кодируемой последовательности, чтобы убедиться в трансляции целого инсерта. Такие экзогенные сигналы контроля трансляции и кодоны инициации могут быть разного происхождения, и природного, и синтетического. Эффективность экспрессии может быть повышена за счет включения соответствующих элементов повышения транскрипции, терминаторов транскрипции и др. (см., например, Bittner и др., Methods in Enzymol. 153, 1987, cc.516-544).
Кроме того, может быть выбран штамм клеток-хозяев, который модулирует экспрессию инсертированных последовательностей или модифицирует и процессирует генный продукт определенным требуемым образом. Такие модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут быть важными для функции белка. Разные клетки-хозяева обладают свойствами и специфическими механизмами для пост-трансляционного процессинга и модификации белков и генных продуктов. Соответствующие клеточные линии или системы хозяина могут быть выбраны, чтобы обеспечить надлежащую модификацию и процессинг чужеродного экспрессированного белка. Для этого могут применяться эукариотические клетки-хозяева, которые обладают клеточным механизмом для должного процессинга первичного транскрипта, гликозилирования и фосфорилирования генного продукта. К таким клеткам-хозяевам относятся, но ими не ограничиваются, клетки СНО, VERY, ВНК, HeLa, COS, MDCK, 293, 3Т3, W138, ВТ483, Hs578T, HTB2, BT2O и T47D, NS0 (линия клеток миеломы грызуна, которая эндогенно не вырабатывает каких-либо цепей иммуноглобулина), CRL7O3O и HsS78Bst.
Для длительной на высоком уровне выработки рекомбинантных белков предпочтительна стабильная экспрессия. Например, могут быть сконструированы линии клеток, которые стабильно экспрессируют молекулу антитела. Применению векторов экспрессии, которые содержат вирусные начала репликации, предпочтительнее, если клетки-хозяева могут быть трансформированы ДНК, контролируемой соответствующими элементами контроля экспрессии (например, промотором, энхансером, последовательностями, терминаторами транскрипции, сайтами полиаденилирования и др.) и селективным маркером. После интродукции чужеродной ДНК сконструированные клетки могут осуществлять рост в течение 1-2 суток в обогащенных средах, и затем их переносят на селективные среды. Селективный маркер в рекомбинантной плазмиде обусловливает устойчивость к отбору и допускает у клеток стабильную интеграцию плазмиды в хромосомы и рост для формирования центра, который в свою очередь может быть клонирован и размножен в клеточных линиях. Этот метод может преимущественно применяться для конструирования линий клеток, экспрессирующих молекулу антитела. Такие сконструированные клеточные линии могут быть особенно полезны для скрининга и оценки композиций, которые прямо или косвенно взаимодействуют с молекулой антитела.
Может применяться ряд систем отбора, включая, но ими не ограничиваясь, гены тимидинкиназы вируса герпес симплекс (Wigler и др., Cell 11, 1977, с.223), гипоксантингуанинфосфорибозилтрансферазы (Szybalska & Szybalski, Proc. Natl. Acad. Sci. USA 48, 1992, с.202) и аденинфосфорибозилтрансферазы (Lowy и др., Cell 22, 1980, cc.8-17), в tk-, hgprt- или aprt- клетках, соответственно. Также может применяться устойчивость к антиметаболитам в качестве основы для отбора следующих генов: гена dhfr, который обусловливает устойчивость к метотрексату (Wigler и др., Natl. Acad. Sci. USA 77, 1980, с.357; O'Hare и др., Proc. Natl. Acad. Sci. USA 78, 1981, с.1527); гена gpt, который обусловливает устойчивость к микофеноловой кислоте (Mulligan & Berg, Proc. Natl. Acad. Sci. USA 78, 1981, с.2072); гена neo, который обусловливает устойчивость к аминогликозиду G-418 (Wu и Wu, Biotherapy 3, 1991, cc.87-95; Tolstoshev, Ann. Rev. Pharmacol. Toxicol. 32, 1993, cc.573-596; Mulligan, Science 260, 1993, cc.926-932; Morgan и Anderson, Ann. Rev. Biochem. 62, 1993, cc.191-217; May, TIB TECH 11(5), 1993, cc.155-215); и гена hygro, который обусловливает устойчивость к гигромицину (Santerre и др., Gene 30, 1984, с.147). Методы, хорошо известные в области рекомбинантной ДНК, могут быть должным образом применены для отбора требуемого рекомбинантного клона; они описаны, например, в кн.: «Current Protocols in Molecular Biology», 1993, под ред. Ausubel и др., изд. John Wiley & Sons, Нью-Йорк; в кн.: Kriegler «Gene Transfer and Expression, A Laboratory Manual», 1990, изд. Stockton Press, Нью-Йорк; в кн.: «Current Protocols in Human Genetics», 1994, под ред. Dracopoli и др., изд. John Wiley & Sons, Нью-Йорк, главы 12 и 13; Colberre-Garapin и др., J. Mol. Biol. 150, 1981, с.1; указанные работы включены в настоящее изобретение в виде ссылок на их сущность.
Уровни экспрессии молекулы антитела могут быть повышены амплификацией вектора (см. обзор в кн.: Bebbington и Hentschel «The use of vectors based on gene amplification for the expression of cloned genes in mammalian cells in DNA cloning», 1987, изд. Academic Press, Нью-Йорк, т.3). Если маркер в системе вектора, экспрессирующего антитело, поддается амплификации, повышение уровня содержащегося ингибитора в культуре клеток-хозяев может повысить число копий гена-маркера. Поскольку амплифицированная область ассоциирована с геном антитела, выработка антитела также может повыситься (Crouse и др., Mol. Cell. Biol. 3, 1983, с.257).
Клетка-хозяин может быть совместно трансфецирована двумя векторами экспрессии по настоящему изобретению: первый вектор кодирует полипептид, производный от тяжелой цепи, и второй вектор кодирует полипептид, производный от легкой цепи. Два вектора могут содержать идентичные селективные маркеры, которые показывают равную экспрессию полипептидов тяжелой и легкой цепи. В другом варианте может применяться один вектор, который кодирует и способен экспрессировать полипептиды и тяжелой, и легкой цепей. В таких случаях легкую цепь следует поместить перед тяжелой цепью чтобы избежать избытка токсичной свободной тяжелой цепи (Proudfoot, Nature 322, 1986, с.52; Kohler, Proc. Natl. Acad. Sci. USA 77, 1980, 2, с.197). Кодирующие последовательности тяжелой и легкой цепей могут включать кДНК или геномную ДНК.
Если молекулы антитела по настоящему изобретению получают методом рекомбинантной экспрессии, их могут очистить каким-либо методом, известным в данной области для очистки молекул иммуноглобулина, например, хроматографией (например, ионообменной, аффинной, особенно аффинной в отношении специфического антигена после белка А, и эксклюзионной колоночной хроматографией), центрифугированием, дифференциальной растворимостью или каким-либо другим стандартным методом, предназначенным для очистки белков. Кроме того, антитела по настоящему изобретению или их фрагменты могут быть гибридизированы с гетерологичными полипептидными последовательностями, описанными в настоящем изобретении, или другими, известными в данной области, которые способны облегчить очистку.
Масштабирование получения антител
Большие количества антител по настоящему изобретению могут быть получены с помощью масштабируемого процесса (называемого в настоящем изобретении «масштабируемым процессом по настоящему изобретению»), В некоторых вариантах осуществления настоящего изобретения антитела могут быть получены с помощью масштабируемого процесса по настоящему изобретению в исследовательской лаборатории, который может быть масштабирован для получения антитела по настоящему изобретению в аналитических биореакторах (например, но ими не ограничиваясь, в биореакторах объемом 5 л, 10 л, 15 л, 30 л или 50 л). В других вариантах осуществления настоящего изобретения антитела могут быть получены с помощью масштабируемого процесса по настоящему изобретению в исследовательской лаборатории, в ходе которого может быть повышена выработка до уровня выработки антитела по настоящему изобретению в биореакторах промышленного масштаба (например, но ими не ограничиваясь, 75 л, 100 л, 150 л, 300 л или 500 л). В некоторых вариантах осуществления настоящего изобретения масштабируемый процесс по настоящему изобретению приводит к небольшой или неизмененной эффективности выработки по сравнению процессом выработки, осуществляемом в исследовательской лаборатории. В других вариантах осуществления настоящего изобретения масштабируемый способ по настоящему изобретению позволяет получать антитела с эффективностью выработки на уровне примерно 10 мг/л, примерно 20 мг/л, примерно 30 мг/л, примерно 50 мг/л, примерно 75 мг/л, примерно 100 мг/л, примерно 125 мг/л, примерно 150 мг/л, примерно 175 мг/л, примерно 200 мг/л, примерно 250 мг/л, примерно 300 мг/л или выше. В других вариантах осуществления настоящего изобретения гибридные белки могут быть получены путем масштабирования способов настоящего изобретения.
В других вариантах осуществления настоящего изобретения масштабируемый способ по настоящему изобретению позволяет получать антитела с эффективностью выработки на уровне по меньшей мере примерно 10 мг/л, по меньшей мере примерно 20 мг/л, по меньшей мере примерно 30 мг/л, по меньшей мере примерно 50 мг/л, по меньшей мере примерно 75 мг/л, по меньшей мере примерно 100 мг/л, по меньшей мере примерно 125 мг/л, по меньшей мере примерно 150 мг/л, по меньшей мере примерно 175 мг/л, по меньшей мере примерно 200 мг/л, по меньшей мере примерно 250 мг/л, по меньшей мере примерно 300 мг/л или более.
В других вариантах осуществления настоящего изобретения масштабируемый способ по настоящему изобретению позволяет получать антитела с эффективностью выработки на уровне по меньшей мере примерно от 10 мг/л до примерно 300 мг/л, примерно от 10 мг/л до примерно 250 мг/л, примерно от 10 мг/л до примерно 200 мг/л, примерно от 10 мг/л до примерно 175 мг/л, примерно от 10 мг/л до примерно 150 мг/л, примерно от 10 мг/л до примерно 100 мг/л, примерно от 20 мг/л до примерно 300 мг/л, примерно от 20 мг/л до примерно 250 мг/л, примерно от 20 мг/л до примерно 200 мг/л, от 20 мг/л до примерно 175 мг/л, примерно от 20 мг/л до примерно 150 мг/л, примерно от 20 мг/л до примерно 125 мг/л, примерно от 20 мг/л до примерно 100 мг/л, примерно от 30 мг/л до примерно 300 мг/л, примерно от 30 мг/л до примерно 250 мг/л, примерно от 30 мг/л до примерно 200 мг/л, примерно от 30 мг/л до примерно 175 мг/л, примерно от 30 мг/л до примерно 150 мг/л, примерно от 30 мг/л до примерно 125 мг/л, примерно от 30 мг/л до примерно 100 мг/л, примерно от 0 мг/л до примерно 300 мг/л, примерно от 50 мг/л до примерно 250 мг/л, примерно от 50 мг/л до примерно 200 мг/л, от 50 мг/л до примерно 175 мг/л, примерно от 50 мг/л до примерно 150 мг/л, примерно от 50 мг/л до примерно 125 мг/л, или примерно от 50 мг/л до примерно 100 мг/л.
Другие способы конструирования антител
В другом варианте осуществления настоящего изобретения шарнирную область Fc антитела по настоящему изобретению мутируют для снижения биологического периода полураспада антитела. Точнее, одна или несколько аминокислотных мутаций интродуцированы в СН2-СН3 доменную интерфейсную область Fc-шарнирного фрагмента таким образом, что антитело обладает пониженным связыванием стафилококкового белка A (Staphylococcyl protein A - SpA) по сравнению со связыванием нативного Fc-шарнирного домена SpA. Такой подход более подробно описан в US 6165745.
В другом варианте осуществления настоящего изобретения антитело модифицировано для повышения биологического полупериода существования. Возможны различные подходы. Например, может быть внедрена одна или несколько из следующих мутаций: T252L, T254S, T256F согласно описанию в US 6277375. В другом варианте осуществления настоящего изобретения может быть внедрена одна или несколько из следующих мутаций: M252Y, S254T, Т256Е, описанных в US 7083784. В другом варианте для повышения биологического полупериода существования антитело может быть модифицировано в области СН1 или CL для содержания реутилизируемого рецептор-связывающего эпитопа, взятого из двух петель домена СН2 области Fc в IgG согласно описанию в US 5869046 и 6121022.
В других вариантах осуществления настоящего изобретения область Fc модифицирована замещением по меньшей мере одного аминокислотного остатка на другой аминокислотный остаток для понижения эффекторной функции (функций) антитела. Например, одна или несколько аминокислот, выбранных из аминокислотных остатков 234, 235, 236, 237, 297, 318, 320 и 322, могут быть замещены другими аминокислотными остатками таким образом, что антитело приобретает пониженное сродство с эффекторным лигандом, но сохраняет антигенсвязывающую способность исходного антитела. Эффекторный лиганд, в отношении которого сродство понижено, может быть, например, рецептором Fc или компонентом С1 комплемента. Такой подход дополнительно подробно описан в US 5624821 и 5648260.
В другом примере один или несколько аминокислотных остатков, выбранных из аминокислотных остатков 329, 331 и 322, могут быть замещены другими аминокислотными остатками таким образом, что антитело приобретает пониженное связывание C1q и/или пониженную или упраздненную комплемент-зависимую цитотоксичность (CDC). Такой подход более подробно описан в US 6194551.
В другом примере один или несколько аминокислотных остатков по положениям аминокислот 231 и 239 модифицированы, чтобы таким образом понизить способность антитела фиксировать комплемент. Такой подход дополнительно описан в публикации РСТ WO 94/29351.
В еще одном другом варианте осуществления настоящего изобретения область Fc антитела по настоящему изобретению дополнительно модифицирована для снижения способности антитела опосредовать антитело-зависимую клеточную цитотоксичность (ADCC) и/или для снижения сродства антитела с рецептором Fey путем модификации одной или нескольких аминокислот по следующим положениям: 238, 239, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327, 329, 330, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434, 435, 437, 438 или 439. Такой подход дополнительно описан в публикации РСТ WO 00/42072.
Другая модификация антитела в контексте настоящего изобретения достигается пэгелированием. Антитело может быть пэгелировано, например, для повышения биологического полупериода существования антитела (например, в сыворотке). Пэгелирование антитела или его фрагмента обычно достигается реакцией с полиэтиленгликолем (ПЭГ), например, с реакционноспособным сложным эфиром или производным альдегида ПЭГ, в условиях, при которых одна или несколько групп ПЭГ становятся присоединенными к антителу или фрагменту антитела. В некоторых случаях пэгелирование проводят через реакцию ацелирования или реакцию алкилирования с молекулой реактивного ПЭГ (или аналогичного водорастворимого полимера). В контексте настоящего изобретения понятие «полиэтиленгликоль» охватывает какие-либо формы ПЭГ, которые используют для получения производных других белков, например, моно(С1-С10)алкокси- или арилоксиполиэтиленгликоля или полиэтиленгликольмалеимида. В некоторых вариантах осуществления настоящего изобретения антитело, предназначенное для пэгелирования, является агликозилированным антителом. Методы пэгелирования белков известны в данной области и могут применяться в отношении антител по настоящему изобретению. См., например, ЕР 0154316 и ЕР 0401384.
Таким образом, в другом объекте настоящего изобретения структурные свойства анти-IFNAR1 антител, например, 3F11, 4G5, 11Е2 и 9D4, но ими перечень не ограничивается, используют для создания структурно близкого анти-IFNAR1 антитела, которое сохраняет по меньшей мере одно функциональное свойство антитела по настоящему изобретению, например связывание с IFNAR1. Например, одна или несколько областей CDR антител 3F11, 4G5, 11Е2 или 9D4, или их мутаций могут быть рекомбинантно комбинированы с известными каркасными областями и/или другими областями CDR для создания дополнительного рекомбинантно сконструированного анти-IFNAR1 антитела по настоящему изобретению, описанного выше. К другим типам модификаций относятся модификации, описанные в предшествующем разделе. Исходным материалом для метода инженерии является одна или несколько последовательностей VH и/или VL, описанных в настоящем изобретении, или одна или несколько их областей CDR. Для создания сконструированного антитела необязательно действительно получать (т.е. экспрессировать в виде белка) антитело, имеющее одну или несколько последовательностей VH и/или VL, предусмотренных в настоящем изобретении, или одну или несколько их областей CDR. Предпочтительнее информацию, содержащуюся в последовательности (последовательностях), используют в качестве исходного материала для создания последовательности (последовательностей) «второго поколения», производной от исходной последовательности (последовательностей), и затем последовательность (последовательности) «второго поколения» готовят и экспрессируют в качестве белка.
Композиции
В другом варианте осуществления настоящего изобретения предусматривают композиции, содержащие одно моноклональное антитело или комбинацию моноклональных антител, или гибридные белки, включающие его область Fc, согласно описанию настоящего изобретения, переработанные вместе с носителем. Такие композиции могут включать одно антитело или комбинацию (например, двух или нескольких разных) антител, гибридные белки, иммуноконъюгаты или биспецифические молекулы по настоящему изобретению. В некоторых вариантах осуществления настоящего изобретения такие композиции физиологически переносимы и в связи с этим применимы для введения субъекту (также называемые «фармацевтическими композициями по настоящему изобретению»). Например, фармацевтические композиции по настоящему изобретению могут включать комбинацию антител (или иммуноконъюгатов, или биспецифических антител), которые связываются с разными эпитопами на антигене-мишени, или которые обладают комплементарным действием.
В другом варианте осуществления настоящего изобретения композиции по настоящему изобретению могут включать одну или несколько фармацевтически приемлемых солей. К примерам таких солей относятся кислые аддитивные соли и основные аддитивные соли. К кислым аддитивным солям относятся соли нетоксичных неорганических кислот, например, соляной, азотистой, фосфорной, серной, бромисто-водородной, йодисто-водородной, фосфористой и др., соли нетоксичных органических кислот, например, алифатических моно- и дикарбоновых кислот, фенил-замещенных алканоевых кислот, гидроксиалканоевых кислот, ароматических кислот, алифатических и ароматических сульфоновых кислот и др. К основным аддитивным солям относятся соли щелочных и щелочноземельных металлов, например, натрия, калия, магния, кальция и др., а также нетоксических органических аминов, например, N,N'-дибензилэтилендиамина, N-метилглюкамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, прокаина и др.
В другом варианте осуществления настоящего изобретения композиции по настоящему изобретению также могут включать фармацевтически приемлемый антиоксидант. К примерам фармацевтически приемлемых антиоксидантов относятся: (1) водорастворимые антиоксиданты, например, аскорбиновая кислота, цистеин гидрохлорид, натрий бисульфат, натрий метабисульфит, натрий сульфит и др.; (2) маслорастворимые антиоксиданты, например, аскорбилпальмитат, бутилированный гидроксианизол (butylated hydroxyanisole - ВНА), бутилированный гидрокситолуол (butylated hydroxytoluene - ВНТ), лецитин, пропилгаллат, альфа-токоферол и др.; и (3) агенты хелатирования металлов, например, лимонная кислота, этилендиаминтетрауксусная кислота (ethylenediamine tetraacetic кислота - EDTA), сорбит, винная кислота, фосфорная кислота и др.
К примерам соответствующих водных и неводных носителей, которых можно использовать в описываемых композициях по настоящему изобретению, относятся вода, этанол, полиолы (например, глицерин, пропиленгликоль, полиэтиленгликоль и др.) и соответствующие их смеси, растительные масла, например, оливковое масло, и инъекционные органические эфиры, например, этилолеат. Требуемая текучесть может поддерживаться, например, применением покровных материалов, например, лецитина, за счет поддержания требуемого размера частиц в случае дисперсий и применением поверхностно активных агентов.
В другом варианте осуществления настоящего изобретения композиции по настоящему изобретению также могут включать адъюванты, например, консерванты, увлажняющие агенты, эмульгирующие агенты и диспергирующие агенты. Предупредить попадание микроорганизмов можно или стерилизацией, или включением различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, феноласкорбиновой кислоты и др. Также может быть желательно включение изотонических агентов, например, Сахаров, натрия хлорида и др., в композиции. Кроме того, пролонгированное всасывание инъекционной фармацевтической формы может быть осуществлено, например, включением агентов, которые откладывают поглощение, например, алюминия моностеарета и желатина.
К фармацевтически приемлемым агентам относятся стерильные водные растворы или дисперсии и стерильные порошки для быстрого приготовления стерильных инъекционных растворов или дисперсий. Применение таких сред и агентов для фармацевтически действующих веществ известно в данной области. Исключение составляют какие-либо обычные среды или агенты, несовместимые с действующим соединением, применение которых рассматривают в фармацевтических композициях по настоящему изобретению. Дополнительные действующие соединения могут также быть включены в композиции. Терапевтические композиции обычно должны быть стерильными и стабильными в условиях получения и хранения. Композиция может быть переработана в виде раствора, микроэмульсии, липосом или иной структуры, применимой для высокой концентрации лекарственного средства. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и др.) и их соответствующие смеси. Необходимая текучесть может поддерживаться, например, применением покровного материала, например, лецитина, за счет поддержания требуемого размера частиц в случае дисперсий и применением поверхностно активных агентов. Во многих случаях может быть полезно включение изотонических агентов, например, Сахаров, многоатомных спиртов, например, маннита, сорбита или натрия хлорида в композиции. Кроме того, пролонгированное всасывание инъекционной композиции может быть осуществлено, например, включением в композицию агента, который откладывает поглощение, например, моностеаретов и желатина.
Стерильные инъекционные растворы могут быть приготовлены путем включения действующего соединения в требуемом количестве в соответствующий растворитель отдельно или в комбинации ингредиентов, пронумерованных выше, по мере надобности, с последующей стерилизацией микрофильтрацией. Обычно дисперсии получают путем включения действующего соединения в стерильный растворитель, который содержит основную дисперсионную среду и необходимые другие ингредиенты из числа указанных выше. В случае стерильных порошков для получения стерильных инъекционных растворов предпочтительными методами получения являются вакуумное высушивание и лиофилизация, в результате которых получают порошок действующего ингредиента плюс какой-либо дополнительных требуемый ингредиент из его ранее стерилизованного фильтрацией раствора.
В одном из вариантов осуществления настоящего изобретения композиции (например, жидкие составы) по настоящему изобретению являются составами, не содержащими пирогенов, которые практически не содержат эндотоксинов и/или близких пирогенных веществ. К эндотоксинам относятся токсины, которые присутствуют внутри микроорганизмов и высвобождаются при разрушении или гибели микроорганизмов. Пирогенные вещества также включают индуцирующие лихорадку термостабильные вещества (гликопротеины) из внешней мембраны бактерий и других микроорганизмов. Оба эти вещества могут вызвать лихорадку, гипотонию и шок при введении людям. Из-за потенциально вредных воздействий полезно удалить даже малые количества эндотоксинов из вводимых внутривенно фармацевтических лекарственных растворов. Управление по контролю за пищевыми продуктами и медикаментами США (The Food & Drug Administration - FDA) установило верхний предел в 5 единиц эндотоксина (endotoxin units - EU) на дозу на кг массы тела на протяжении одного часа внутривенного применения лекарства (The United States Pharmacopeial Convention, Pharmacopeial Forum 26 (1), 2000, с.223). При введении терапевтических белков в количествах нескольких сотен или тысяч мг, например, в случае моноклонального антитела, полезно удалить даже следы эндотоксина. В одном из вариантов осуществления настоящего изобретения уровни эндотоксина и пирогенна в композиции составляет менее 10 EU/мг, или менее 5 EU/мг, или менее 1 EU/мг, или менее 0,1 EU/мг, или менее 0,01 EU/мг, или менее 0,001 EU/мг. В другом варианте осуществления настоящего изобретения уровни эндотоксина и пирогенна в композиции составляет менее примерно 10 EU/мг, или менее примерно 5 EU/мг, или менее примерно 1 EU/мг, или менее примерно 0,1 EU/мг, или менее примерно 0,01 EU/мг, или менее примерно 0,001 EU/мг.
Количество действующего ингредиента, которое может быть скомбинировано с материалом носителя для получения одной дозированной формы, может варьировать в зависимости от субъекта, подвергаемого лечению, и от способа введения. Количество действующего ингредиента, которое может комбинироваться с материалом носителя для получения одной дозированной формы, обычно может составлять количество композиции, которое вызывает терапевтический эффект. Обычно из 100% такое количество может варьировать примерно от 0,01% до примерно 99% действующего ингредиента, также примерно от 0,1% до примерно 70%, также примерно от 1% до примерно 30% действующего ингредиента в комбинации с фармацевтически приемлемом носителем.
Режимы дозирования устанавливают для обеспечения оптимального желаемого ответа (например, терапевтического ответа). Например, может быть введен единственный болюс, несколько отдельных доз на протяжении времени или доза может быть пропорционально уменьшена или увеличена в зависимости от предписаний в связи с конкретной терапевтической ситуацией. Особенно предпочтительно перерабатывать парентеральные композиции в дозированной форме для простоты введения и единообразия дозирования. Дозированная форма в контексте настоящего изобретения относится к физически дискретным единицам, пригодным в виде единичных доз для лечения субъектов; каждая лекарственная форма содержит заранее определенное количество действующего соединения, рассчитанное для получения требуемого терапевтического эффекта вместе с требуемым фармацевтическим носителем. Технические требования к дозированным лекарственным формам по настоящему изобретению диктуются и непосредственно зависят от (а) определенных свойств действующего соединения и определенного терапевтического эффекта, который стремятся достичь, и (б) обязательных ограничений в данной области приготовления действующего соединения для лечения чувствительности индивидуумов.
Для введения антитела дозы варьируют в диапазоне примерно 0,0001-100 мг/кг, чаще от 0,01 до 5 мг/кг массы тела хозяина. Например, дозировки могут составлять 0,3 мг/кг массы тела, 1 мг/кг массы тела, 3 мг/кг массы тела, 5 мг/кг массы тела или 10 мг/кг массы тела или 1-10 мг/кг. Типичный режим лечения закрепляет введение один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, раз в месяц, один раз каждые 3 месяца или один раз каждые 3-6 месяцев. Режимы дозирования анти-IFNAR1 антитела по настоящему изобретению включают 1 мг/кг массы тела или 3 мг/кг массы тела, введенные внутривенно, с применяемым антителом, используя одну из следующих схем дозирования: (i) шесть доз каждые четыре недели, затем каждые три месяца; (ii) каждые три недели; (iii) 3 мг/кг массы тела однократно, затем 1 мг/кг массы тела каждые три недели.
В другом варианте антитело гибридного белка может быть введено в качестве состава устойчивого высвобождения, и в этом случае требуется менее частое введение. Дозирование и частота введения существенно зависят от периода полураспада антитела в организме пациента. Обычно антитела человека показывают наибольший период полураспада, за ними следуют гуманизированные антитела, химерные антитела и антитела, не являющиеся антителами человека. Доза и частота введения могут варьировать в зависимости от того, является лечение профилактическим или терапевтическим. При профилактическом использовании относительно низкую дозу вводят с относительно редкими интервалами на протяжении длительного периода. Некоторые пациенты получают лечение на протяжении всей оставшейся жизни. При терапевтических применениях иногда требуются относительно высокие дозы при относительно коротких интервалах до тех пор, пока у пациента проявляется частичное или полное улучшение симптомов заболевания. Впоследствии пациента переводят на профилактический режим.
Реальные уровни действующих ингредиентов в фармацевтических композициях настоящего изобретения могут варьировать таким образом, чтобы получить количество действующего ингредиента, эффективного для достижения желаемого терапевтического ответа для конкретного пациента, композиции и способа введения без токсичности для пациента. Уровень выбранной дозы может зависеть от различных фармакокинетических факторов, включая действие определенной композиции, применяемой по настоящему изобретению, или сложного эфира, соли или ее амида, способа введения, времени введения, степени экскреции определенного применяемого соединения, длительности лечения, других лекарственных средств, соединений и/или материалов, используемых в комбинации с определенными применяемыми композициями, возраста, пола, массы тела, состояния, общего состояния здоровья и предшествующей историей болезни пациента, подвергаемого лечению, и от других факторов, учитываемых в медицине.
Терапевтически эффективная доза анти-IFNAR1 антитела по настоящему изобретению приводит к снижению тяжести симптомов болезни, повышению частоты и длительности периодов болезни без проявления симптомов или предупреждения ухудшения или нетрудоспособности из-за тяжести проявления болезни. В случае, например, системной красной волчанки (СКВ) терапевтически эффективная доза может предупредить дальнейшее ухудшение физических симптомов, связанных с СКВ, например, боли, утомляемости или слабости. Терапевтически эффективная доза также может предупредить или отсрочить СКВ, что может быть желательно при наличии ранних или предварительных симптомов болезни. Также терапевтически эффективная доза отсрочивает хроническое прогрессирование, связанное с СКВ. Лабораторные тесты, используемые в диагностике СКВ, включают химические, гематологические, серологические и радиологические тесты. Таким образом, может быть применено какое-либо клиническое или биохимическое исследование, которое позволяет проводить мониторинг каких-либо вышеупомянутых показателей, чтобы определить, представляет ли определенное лечение терапевтически эффективную дозу для лечения СКВ. Специалист в данной области может определить такие количества, основанные на определенных факторах, например, размере субъекта, тяжести симптомов у субъекта, определенной композиции или выбранного способа введения.
Композиция по настоящему изобретению может быть введена одним или несколькими способами введения, используя один или несколько различных методов, известных в данной области. Специалистам известно, что путь и/или способ введения может варьировать в зависимости от желаемых результатов. Выбранные способы введения антител по настоящему изобретению включают внутривенное, внутримышечное, чрезкожное, внутрибрюшинное, подкожное, наряду с другими парентеральными способами введения или другими парентеральными способами введения, например, инъекцией или смешанными способами. Парентеральное введение может представлять способы введения, отличные от энтерального и местного введения, обычно инъекцией, и включает, но ими не ограничивается, способы введения: внутривенный, внутримышечный, внутриартериальный, подоболочечный, внутрикапсульный, внутриглазной, внутрисердечный, внутрикожный, внутрибрюшинный, внутритрахейный, подкожный, под кутикулу, внутрисуставный, подкапсульный, субарахноидальный, интраспинальный, эпидуральный и внутригрудинный, а также инфузию.
В другом варианте осуществления настоящего изобретения антитело по настоящему изобретению может быть введено другим, отличным от парентерального, путем, например, местно, эпидермально или через слизистую, например, интраназально, орально, вагинально, ректально, сублигвально или местно.
Действующие соединения могут быть переработаны с носителями, которые защитят соединение от быстрого высвобождения, например, состав контролируемого высвобождения, включая импланты, чрезкожные пластыри и системы микроинкапсулированной доставки. Могут применяться биоразрушаемые биосовместимые полимеры, например, этиленвинилацетат, полиангидриды, полигликолиевая кислота, коллаген, полиортоэфиры и полимасляная кислота. Многие методы получения таких составов запатентованы или в целом известны специалистам в данной области. См., например, кн.: «Sustained and Controlled Release Drug Delivery Systems», 1978, под ред. J.R. Robinson, изд. Marcel Dekker, Inc., Нью-Йорк.
Терапевтические композиции могут вводиться с помощью медицинских устройств, известных в данной области. Например, в другом варианте осуществления настоящего изобретения терапевтическая композиция по настоящему изобретению может вводиться с помощью устройства для подкожных инъекций без иглы, например, с помощью устройств, описанных в US 5399163,5383851, 5312335, 5064413, 4941880, 4790824 или 4596556. Примеры известных имплантов и модулей, применимых в настоящем изобретении, описаны в патентах: US 4487603, в котором описаны имплантируемые микроинфузионные насосы для распределения лекарственного средства на контролируемом уровне; US 4486194, в котором описано терапевтическое устройство для введения лекарственных средств через кожу; US 4447233, в котором описан насос для инфузии лекарственного средства для доставки лекарственного средства с определенной скоростью инфузии; US 4447224, в котором описан имплантируемый прибор для инфузии с переменной скоростью подачи для непрерывного введения лекарственного средства; US 4439196, в котором описаны осмотические системы доставки лекарственных средств с многокамерными компартментами; и US 4475196, в котором описаны осмотические системы доставки лекарственных средств. Эти патенты включены в настоящее изобретение в виде ссылок. Многие другие такие импланты, системы доставки и модули известны специалистам в данной области.
В некоторых вариантах осуществления настоящего изобретения антитела по настоящему изобретению могут быть переработаны для обеспечения надлежащего распределения in vivo. Например, гемоэнцефалический барьер (ГЭБ) включает много в высокой степени гидрофильных соединений. Чтобы убедиться, что терапевтические соединения по настоящему изобретению пересекают ГЭБ (если это необходимо), они должны быть переработаны, например, в липосомы. О способах получения липосом см., например, US 4522811, 5374548 и 5399331. Липосомы могут включать одну или несколько частей молекул, которые селективно переносят в определенные клетки или органы, таким образом повышая целевую доставку лекарственных средств (см., например, V.V. Ranade J. Clin. Pharmacol. 29, 1989, с.685). Примерами целевых частей молекул являются фолат или биотин (см., например, US 5416016); маннозиды (Umezawa и др., Biochem. Biophys. Res. Commun. 153, 1988, с.1038); антитела (P.O. Bloeman и др. FEBS Lett. 357, 1995, с.140; М. Owais и др. Antimicrob. Agents Chemother. 39, 1995, с.180); поверхностно-активный рецептор белка A (Briscoe и др. Am. J. Physiol. 1233, 1995, с.134; p120 (Schreier и др. J. Biol. Chem. 269, 1994, с.9090); см. также K. Keinanen; M.L. Laukkanen FEBS Lett. 346, 1994, с.123; J.J. Killion; I.J. Fidler Immunomethods 4, 1994, с.273.
Применение в диагностике
В других вариантах осуществления настоящего изобретения антитела по настоящему изобретению применимы в качестве диагностических и терапевтических средств in vitro и in vivo. Например, эти молекулы могут вводиться в клетки в культуре, например, in vitro или ex vivo, или в организме субъекта, например, in vivo, для лечения, предупреждения или диагностики различных заболеваний.
В одном из вариантов осуществления настоящего изобретения антитела по настоящему изобретению могут применяться для выявления уровней IFNAR1 или уровней клеток, которые экспрессируют IFNAR1. Этого можно достичь, например, контактом образца (например, образца in vitro) и контрольного образца с анти-IFNAR1 антителом в условиях, которые позволяют формировать комплекс между антителом и IFNAR1. Какие-либо комплексы, сформированные между антителом и IFNAR1, выявляют и сравнивают в образце и в контроле. Например, стандартные методы обнаружения, известные в данной области, например, ELISA и жидкостная цитометрия, могут осуществляться, используя композиции по настоящему изобретению.
Таким образом, в одном объекте настоящего изобретения также предусмотрены способы выявления наличия IFNAR1 (например, антиген IFNAR1 человека) в образцы, или измерения количества IFNAR1, включающие контактирование образца и контрольного образца с антителами по настоящему изобретению или их антигенсвязывающих частей, которые специфически связываются с IFNAR1 в условиях, которые допускают формирование комплекса между антителом или его частью и IFNAR1. Затем выявляют формирование комплекса, причем различие в формировании комплекса между исследуемым образцом и контрольным образцом является показателем наличия в исследуемом образце IFNAR1.
Терапевтические применения
IFNAR1 представляет часть клеточного рецептора для интерферонов I типа, причем известно, что интерфероны I типа являются иммунорегуляторными цитокинами, участвующими в дифференциации Т-клеток, выработке антител и в действии или выживании Т-клеток памяти. Кроме того, повышенная экспрессия интерферонов I типа описана при многочисленных аутоиммунных заболеваниях, при ВИЧ-инфекции, при отторжении трансплантата и при заболевании трансплантат-против-хозяина (ТПХ). Таким образом, анти-IFNAR1 антитела по настоящему изобретению или их фрагменты, которые ингибируют функциональное действие интерферонов I типа, могут применяться при различных клинических показаниях, в том числе при аберрантном или нежелательном действии интерферонов I типа. Настоящее изобретение охватывает способы предупреждения, лечения, поддержания, облегчения или подавления опосредованных интерфероном I типа заболеваний или расстройств, в которых предусмотрено введение антител или их антигенсвязывающих частей по настоящему изобретению.
К определенным примерам аутоиммунных состояний, при которых антитела по настоящему изобретению могут быть применены, относятся, но ими не ограничиваются, следующие состояния: системная красная волчанка (СКВ), инсулинзависимый сахарный диабет (ИЗСД), воспалительная болезнь кишечника (ВБК) (включая болезнь Крона, язвенный колит и глютеновая болезнь), рассеянный склероз (PC), псориаз, аутоиммунный тиреоидит, ревматоидный артрит (РА) и гломерулонефрит. Кроме того, композиции антител по настоящему изобретению могут применяться для ингибирования или предупреждения отторжения трансплантата или для лечение болезни трансплантат-против-хозяина (ТПХ) или для лечения инфекции ВИЧ/СПИД.
Высокие уровни IFNα выявлены в сыворотке пациентов с системной красной волчанкой (СКВ) (см., например, Kim и др. Clin. Exp. Immunol. 70, 1987, cc.562-569). Кроме того, показано, что введение IFNα, например при лечении рака или вирусных инфекций, индуцирует СКВ (Garcia-Porrua и др. Clin. Exp. Rheumatol. 16, 1998, cc.107-108). Таким образом, в другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению могут применяться для лечения СКВ введением антитела субъекту, нуждающемуся в таком лечении.
Другие методы лечения СКВ описаны в патентных заявках US 60/907767, 60/966174 и PCT/US2007/02494, сущность каждой из которых включена в настоящее изобретение в виде ссылки.
IFNα также участвует в патологии диабета первого типа. Например, установлено наличие иммунореактивного IFNα в бета-клетках поджелудочной железы у пациентов I типа (Foulis и др. Lancet 2, 1987, cc.1423-1427). Также было показано, что пролонгированное применение IFNα в противовирусной терапии индуцирует диабет I типа (Waguri и др. Diabetes Res. Clin. Pract. 23, 1994, cc.33-36). Таким образом, в другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела или их фрагменты по настоящему изобретению могут применяться для лечения диабета I типа введением антитела субъекту, нуждающемуся в таком лечении. Антитело может применяться отдельно или в комбинации с другими антидиабетическими агентами, например, с инсулином.
Установлено, что антитела к IFNAR1 эффективны в модели животного с воспалительной болезнью кишечника (см. патентную заявку US 60/465155). Так анти-IFNAR1 антитела или их фрагменты по настоящему изобретению могут применяться в лечении воспалительной болезни кишечника (ВБК), включая язвенный колит и болезнь Крона, введением антитела субъекту, нуждающемуся в таком лечении.
Обработку IFNα также исследовали на предмет индукции аутоиммунного тиреоидита (Monzani и др. Clin. Exp. Med. 3, 2004, cc.199-210; Prummel и Laurberg Thyroid 13, 2003, cc.547-551). Таким образом, в другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению могут применяться в лечении аутоиммунного заболевания щитовидки, включая аутоиммунный первичный гипотиреоидизм, болезнь Грейвса, тиреоидит Хашимото и деструктивный тиреоидизм с гипотиреоидизмом введением антитела по настоящему изобретению субъекту, нуждающемуся в таком лечении. Антитела по настоящему изобретению могут применяться отдельно или в комбинации с другими агентами или способами лечения, например, с анти-тиреотоксическими лекарственными средствами, радиоактивным иодом и промежуточной тиреоидэктомией.
Высокие уровни IFNα также наблюдают в кровяном русле пациентов с инфекцией ВИЧ, и его наличие является прогностическим маркером прогрессирования СПИД (DeStefano и др. J. Infec. Disease 146, 1982, с.451; Vadhan-Raj и др. Cancer Res. 46, 1986, с.417). Таким образом, в другом варианте осуществления настоящего изобретения анти-IFNAR1 антитела по настоящему изобретению могут применяться для лечения инфекции ВИЧ или СПИД путем введения антитела по настоящему изобретению субъекту, нуждающемуся в этом лечении. В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению могут применяться отдельно или в комбинации с другими анти-ВИЧ агентами, например, нуклеозидными ингибиторами обратной транскриптазы, ненуклеозидными ингибиторами обратной транскриптазы, ингибиторами протеазы и гибридными ингибиторами.
Установлено, что антитела к IFNAR1 эффективны в подавлении отторжения аллотрансплантата и пролонгировании выживания аллотрансплантата (см., например, Tovey и др. J. Leukoc. Biol. 59, 1996, cc.512-517; Benizri и др. J. Interferon Cytokine Res. 18, 1998, cc.273-284). Таким образом, анти-IFNAR1 антитела по настоящему изобретению также могут применяться реципиентами трансплантата для ингибирования отторжения аллотрансплантата и/или пролонгирования выживания аллотрансплантата. Настоящее изобретение предусматривает способ ингибирования отторжения трансплантата путем введения анти-IFNAR1 антитела по настоящему изобретению реципиенту трансплантата, нуждающемуся в таком лечении. Примерами тканевых трансплантатов, которые могут быть обработаны, являются, но ими не ограничиваются, печень, легкие, почки, сердце, тонкий кишечник и островковые клетки поджелудочной железы, а также лечение болезни трансплантат-против-хозяина (ТПХ). Антитела по настоящему изобретению могут применяться отдельно или в комбинации с другими агентами для подавления отторжения трансплантата, например, с иммуносупрессирующими агентами (например, циклоспорином, азатиоприном, метилпреднизалоном, преднизалоном, преднизоном, микофенолятом мофетила, сирилимусом, рапамицином, такролимусом), противоинфекционными агентами (например, ацикловиром, клотримазолом, ганцикловиром, нистатином, триметопримсульфаметоксазолом), диуретиками (например, буметанидом, фуросемидом, метолазоном) и лекарственными средствами для лечения язв (например, циметидином, фарнотидином, лансопразолом, омепразолом, ранитидином, сукралфатом).
В некоторых вариантах осуществления настоящего изобретения предусмотрены способы введения и применения композиций и антител по настоящему изобретению для лечения и предупреждения широкого спектра воспалительных состояний, включая и хронические, и острые состояния, например, но ими не ограничиваясь, аппендицит, язвы пептические, язвы желудка и двенадцатиперстной кишки, перитониты, панкреатиты, язвенный, псевдомембранный, острый и ишемический колиты, дивертикулит, эпиглоттис, алахазию, холангит, холецистит, гепатит, болезнь Крона, энтерит, болезнь Уиппла, астму, аллергию, анафилактический шок, болезнь иммунного комплекса, ишемию органов, реперфузионное повреждение, некроз органов, сенную лихорадку, сепсис, септицемию, эндотоксический шок, кахексию, гиперпирексию, эозинофильную гранулему, грануломатоз, саркоидоз, септический аборт, эпидидимит, вагинит, простатит, уретрит, бронхит, эмфизему, ринит, муковисцидоз, пневмонит, легочный ультрамикроскопический кремниевый вулканический кониоз, альвеолит, бронхиолит, фарингит, плеврит, синусит, грипп, респираторную синцитиальную вирусную инфекцию, герпесную инфекцию, ВИЧ инфекцию, инфекцию вируса гепатита В, инфекцию вируса гепатита С, диссеминированную бактериемию, лихорадку Денге, кандидоз, малярию, филяриоз, амебиоз, альвеококкоз, ожоги, дерматит, дерматомиозит, солнечный ожог, крапивницу, бородавки, волдыри, васкулит, ангиит, эндокардит, артериит, атеросклероз, тромбофлебит, перикардит, миокардит, миокардиальную ишемию, узелковый периартериит, ревматическую атаку, болезнь Альцгеймера, глютенчувствительную целиакию, застойную сердечную недостаточность, рестеноз, хроническое обструктивное заболевание легких (chronic obstructive pulmonary болезнь - COPD), синдром расстройства дыхания у взрослых, менингит, энцефалит, рассеянный склероз, ишемический инсульт, церебральную эмболию, синдром Гийена-Барре, неврит, невралгию, повреждение спинного мозга, паралич, увеит, артриты, артральгию, остеомиелит, фасцит, болезнь Педжета, подагру, периодонтальную болезнь, ревматоидный артрит, синовит, астенический бульбарный паралич, тиреоидит, системную красную волчанку, синдром Гудпасчура, синдром Бехчета, отторжение аллотрансплантата, болезнь трансплантат-против-хозяина, диабет I типа, анкилозирующий спондилоартрит, болезнь Берже, синдром Рейтера и болезнь Ходжкина.
В другом варианте осуществления настоящего изобретения способы введения и композиции антител по настоящему изобретению могут быть полезны для предупреждения, лечения, облегчения симптомов, ассоциированных с условиями состояний или заболеваний, включающих: болезнь Грейвса, тиреоидит Хашимото, болезнь Крона, псориаз, псориатический артрит, симпатическую офтальмию, аутоиммунный оофорит, аутоиммунный орхит, аутоиммунный лимфопролиферативный синдром, антифосфолипидный синдром, синдром Шегрена, склеродерму, болезнь Аддисона, синдром полиэндокринной недостаточности, синдром Гийена-Барре, иммунную тромботическую пурпуру, пернициозную анемию, злокачественную миастению, первичный билиарный цирроз печени, смешанную болезнь соединительной ткани, витилиго, аутоиммунный увеит, аутоиммунную гемолитическую анемию, аутоиммунную тромбоцитопению, глютеновую болезнь, герпетиформный дерматит, аутоиммунный гепатит, пемфигус, пемфигус вульгарный, пемфигус листовидный, буллезный пемфигоид, аутоиммунный миокардит, аутоиммунный васкулит, круговую алопецию, аутоиммунный атеросклероз, Бехчета болезнь, аутоиммунную миелопатию, аутоиммунную гемофилия, аутоиммунный интерстициальный цистит, аутоиммунный диабет несахарный, аутоиммунный эндометриоз, рецидивирующий полихондрит, анкилозирующий спондилоартрит, аутоиммунную крапивницу, дерматомиозит, синдром Миллера-Фишера, болезнь Берже, синдром Гудпасчера и герпес беременных.
В другом варианте осуществления настоящего изобретения способы введения и композиции антител по настоящему изобретению могут быть полезны для предупреждения, лечения, облегчения симптомов, ассоциированных с синдромом Шегрена. Синдромом Шегрена является аутоиммунным расстройством, в котором иммунные клетки поражают и разрушают эндокринные железы, вырабатывающие слезную жидкость и слюну. Синдром назван в честь шведского офтальмолога Генрика Шегрена (1899-1986), впервые его описавшего. Синдромом Шегрена также ассоциирован с ревматическими расстройствами, например, ревматоидным артритом, и в 90% случаев пациенты положительны по ревматоидному фактору. Характерными симптомами этого расстройства являются сухость во рту и сухость глаз. Кроме того, синдром Шегрена может привести к сухости кожи, носа и влагалища, и может затронуть другие органы тела, включая почки, кровеносные сосуды, легкие, печень, поджелудочную железу и мозг. Девять из десяти пациентов с синдромом Шегрена представляют женщины, и средний возраст при начале заболевания приближается к пятидесяти годам, хотя синдромом Шегрена встречается во всех возрастных группах и у мужчин, и у женщин. Это заболевание установлено у 4 миллионов человек только в США, выводя его на второе место среди наиболее распространенных аутоиммунных ревматических заболеваний.
Миозит представляет общее состояние, отличающееся воспалением скелетных мышц или произвольно сокращающихся мышц. Воспаление мышц может быть вызвано аллергической реакцией, воздействием токсического вещества или лекарственного средства, другим заболеванием, например, раком или ревматоидными состояниями, или вирусом или другим инфекционным агентом. Хронические воспалительные миопатии являются идиопатиями, что означает, что причина их возникновения неизвестна. Установлено, что они являются аутоиммунными расстройствами, при которых лейкоциты (которые в норме побеждают болезнь) атакуют кровеносные сосуды, нормальные мышечные волокна и соединительную ткань в органах, костях и суставах.
Полимиозит поражает скелетные мышцы (участвующие в движении) по обеим сторонам тела. Это заболевание редко наблюдают в возрасте до 18 лет; в большинстве случаев возраст пациентов колеблется от 31 до 60 лет. Помимо перечисленных выше симптомов прогрессирует мышечная слабость, которая приводит к затруднению глотания, речи, подъема из сидячего положения, подъема по лестнице, поднятия предметов, поднятия рук выше головы. У пациентов с полимиозитом также проявляется артрит, одышка и сердечная аритмия.
Дерматомиозит отличается кожной сыпью, которая предшествует или сопровождает прогрессирующую мышечную слабость. Сыпь располагается пятнами с изменением цвета на сине-красный или красный и для нее характерно развитие на веках и мышцах, занятых в сгибании и разгибании суставов, включая суставы пальцев, локтей, пяток и пальцев ног. Красная сыпь также может быть на лице, шее, плечах, верхней части грудной клетки, спины и других мест и они могут быть опухшими в областях поражения. Красная сыпь иногда возникает без очевидного участия мышц. У взрослых с дерматомиозитом могут проявиться потеря массы тела и слабое проявление лихорадки, воспаленные легкие и чувствительность к свету. Дерматомиозит взрослых в отличие от полимиозита может сопровождать опухоли груди, легких, женских половых опухолей или кишечника. У детей и взрослых с дерматомиозитом может произойти отложение кальция, которое проявляется в виде твердых выростов под кожей или в мышцах (кальциноз). В большинстве случаев кальциноз бывает через 1-3 года после начала заболевания, но может возникнуть много лет спустя. Такие отложения чаще наблюдают при дерматомиозите у детей, чем при дерматомиозите, который развивается у взрослых. Дерматомиозит может быть связан с коллаген-васкулярными или аутоиммунными заболеваниями.
Миозит с тельцами включений (МТВ) отличается прогрессирующей мышечной слабостью и истощением. МТВ сходен с полимиозитом, но имеет специфические отличия. Начало мышечной слабости обычно нарастает постепенно (на протяжении месяцев или лет) и поражает и проксимальные, и дистальные мышцы. Мышечная слабость может поразить только одну сторону тела. Мелкие отверстия, называемые вакуолями, наблюдают в клетках пораженных мышечных волокон. Падения и спотыкания обычно являются первыми заметными симптомами МТВ. У некоторых пациентов расстройство начинается слабостью в запястьях и пальцах, которая вызывает затруднение, если нужно что-то зашнуровать, застегнуть или заколоть. Может быть слабость мышц запястьев и пальцев, а также атрофия (истончение или потеря массы мышц) мышц предплечья и четырехглавых мышц ног. Затруднение при глотании испытывают пациенты с МТВ примерно в половине случаев заболевания. Симптомы этого заболевания обычно начинаются в возрасте после 50 лет, хотя оно может возникнуть раньше. В отличие от полимиозита и деоматомиозита МТВ возникает чаще у мужчин, чем у женщин.
Ювенильный миозит иногда имеет сходство с дерматомиозитом и полимиозитом взрослых. Обычно он поражает детей в возрасте 2-15 лет с симптомами, к которым относятся слабость и воспаление проксимальных мышц, отек (нарушенный отток жидкости в тканях тела, вызывающий набухание), боль в мышцах, усталость, кожная сыпь, лихорадка и контрактуры (хроническое сокращение мышц или сухожилий вокруг суставов, вызванное воспалением сухожилий вокруг мышц, которые не дают суставам свободно двигаться). Дети с ювенильным миозитом также могут иметь затрудненное заглатывание и дыхание, а также может быть поражено сердце. Примерно у 20-30% детей с ювенильным дерматитом развивается кальциоз. В крови детей с ювенильным дерматитом уровень мышечного фермента креатинкиназы может не превышать нормы, но уровни других мышечных ферментов норму превышают. Таким образом, в других вариантах осуществления настоящего изобретения антитела по настоящему изобретению могут применяться для предупреждения, лечения или облегчения миозита, воспалительного миозита, идиопатического миозита, полимиозита, дерматомиозита, миозита с тельцами включения (МТВ), ювенильного миозита или симптомов, связанных с этими состояниями.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению могут быть полезны для предупреждения, лечения или облегчения симптомов, связанных с васкулитом.
Антитела по настоящему изобретению могут быть полезны для лечения склеродермы. Методы лечения склеродермы описаны в патентных заявках US 60/996175, опубликованной 5 ноября 2007 г., и патентной заявке РСТ PCT/US2008/82481, сущность которых включена в настоящее изобретение в виде ссылок.
В другом варианте осуществления настоящего изобретения антитела по настоящему изобретению могут быть полезны для предупреждения, лечения или облегчения симптомов, связанных с саркоидозом. Саркоидоз (также называемый болезнью Бенье-Бека) представляет расстройство иммунной системы, отличающееся ненекротизирующими гранулемами (мелкими узелками воспалений). Практически может быть поражен какой-либо орган; однако гранулема наиболее часто проявляется в легких или лимфоузлах. Симптомы могут иногда проявляться внезапно, но обычно появляется постепенно. При рентгене легких саркоидоз может иметь вид туберкулеза или лимфомы.
В рамках охвата настоящего изобретения также предусмотрены наборы, включающие композиции (например, анти-IFNAR1 антител) по настоящему изобретению и инструкции по применению. Набор может также включать по меньшей мере один дополнительный реагент или одно или несколько дополнительных антител по настоящему изобретению (например, антитело, обладающее комплементарным действием, которое связывается с эпитопом на антигене-мишени, отличающегося от первого антитела). Наборы обычно включают этикетку, указывающую соответствующее применение содержимого набора. На этикетке приведена какая-либо письменная или в электронной форме представленная информация от поставщика, вложенная в набор, или прикрепленная к нему снаружи, или иным образом прилагаемая к набору.
Комбинации
Композиции по настоящему изобретению также могут вводиться при комбинированной терапии, например, комбинированной с другими агентами. Например, комбинированная терапия может включать анти-IFNAR1 антитело по настоящему изобретению в комбинации по меньшей мере с одним другим иммуносупрессантом.
В некоторых способах два или несколько моноклональных антител с разной связывающей специфичностью вводят одновременно, при этом дозировка каждого введенного антитела попадает в указанные диапазоны. Антитело обычно вводят при разных причинам. Интервалы между отдельными дозировками могут составлять, например, недели, месяцы, каждые три месяца и год. Интервалы могут также быть нерегулярными согласно показаниям измерения в крови уровней антитела к антигену-мишени у пациента. В некоторых способах дозу регулируют таким образом, чтобы достичь концентрации антитела в плазме примерно 1-1000 мкг /мл и в некоторых способах примерно 25-300 мкг/мл.
Если антитела к IFNAR1 вводят вместе с другим агентом, они могут вводиться в любом порядке или одновременно. Например, анти-IFNAR1 антитело по настоящему изобретению может применяться в комбинации с одним или несколькими из следующих агентов: лекарственных средств, содержащих мезаламин (включая сульфасалазин и другие агенты, содержащие 5-аминосалициловую кислоту (5-АСК), например, олсалазин и балсалазид), нестероидных противовоспалительных средств (НПВС), анальгетиков, кортикостероидов (например, прединизона, гидрокортизона), TNF-ингибиторов (включая адалимумаб (продукт HUMIRA®), этанерсепт (продукт ENBREL®) и инфликсимаб (продукт REMICADE®)), иммуносупрессантов (например 6-меркаптопурин, азатиоприн и циклоспорин А) и антибиотических анти-IFNα антител, антителам против рецептора IFNγ и растворимого IFNγ рецептора. Кроме того, анти-IFNAR1 антитело по настоящему изобретению может применяться в комбинации с антагонистом лиганда Flt3 (см., например, патентную заявку US 2002/0160974).
В других вариантах осуществления настоящего изобретения композиции по настоящему изобретению могут также включать агенты, применяемые для лечения СКВ. К таким агентам относятся анальгетики, кортикостероиды (например, прединизон, гидрокортизон), иммунодепрессанты (например, циклофосфамид, азатиоприн и метотрексат), противомалярийные средства (например, гидроксихлорохин) и биологические лекарственные средства, которые ингибируют выработку днДНК антител (например, LJP 394).
Эквиваленты
Специалисты в данной области могут установить или выяснить, используя только обычные эксперименты, много эквивалентов вариантов осуществления настоящего изобретения, приведенных в описании.
Все публикации, патенты и патентные заявки, указанные в настоящем описании, включены в него в виде ссылки на их сущность в той же степени, как если бы каждая отдельная публикация, патент или патентная заявка были бы конкретно и отдельно показаны к включению в настоящее изобретение в виде ссылки.
Кроме того, предварительные заявки на патенты US 61/006962, 61/034618 и 61/049970 включены в настоящее изобретение в виде ссылок на их сущность.
Конкретные варианты осуществления настоящего изобретения
1. Модифицированное моноклональное антитело класса IgG, специфичное в отношении IFNAR1, причем указанное антитело включает в область Fc по меньшей мере одно аминокислотное замещение, выбранное из группы, состоящей из L234F, L235E и P331S, нумерация которых дана по индексу EU, разработанному по Kabat, причем указанное антитело проявляет пониженное сродство по меньшей мере с одним лигандом Fc по сравнению с немодифицированным антителом.
2. Антитело по варианту осуществления настоящего изобретения 1, причем указанное антитело относится к подклассу IgG1 или IgG4.
3. Антитело по варианту осуществления настоящего изобретения 2, причем указанное антитело является молекулой класса IgG1.
4. Антитело по варианту осуществления настоящего изобретения 3, причем указанное антитело включает аминокислотное замещение P331S.
5. Антитело по варианту осуществления настоящего изобретения 3, причем указанное антитело включает аминокислотные замещения: L234F и L235E.
6. Антитело по варианту осуществления настоящего изобретения 3, причем указанное антитело включает аминокислотные замещения: L234F, L235E и P331S.
7. Антитело по варианту осуществления настоящего изобретения 3, причем указанное антитело является молекулой класса IgG4.
8. Антитело по варианту осуществления настоящего изобретения 7, причем указанное антитело включает аминокислотное замещение L235E в области Fc.
9. Антитело по варианту осуществления настоящего изобретения 7, причем указанное антитело дополнительно включает аминокислотное замещение S228P в области Fc.
10. Антитело по одному из вариантов осуществления настоящего изобретения 1-9, причем указанное антитело включает по меньшей мере одну область, определяющую комплементарность (CDR), выбранную из табл.2.
11. Антитело по одному из вариантов осуществления настоящего изобретения 1-10, причем указанное антитело включает:
а. вариабельную область CDR1 тяжелой цепи человека, включающую Seq ID NO:31;
б. вариабельную область CDR2 тяжелой цепи человека, включающую Seq ID NO:32;
в. вариабельную область CDR3 тяжелой цепи человека, включающую Seq ID NO:33;
г. вариабельную область CDR1 легкой цепи человека, включающую Seq ID NO:34;
д. вариабельную область CDR2 легкой цепи человека, включающую Seq ID NO:35; и
е. вариабельную область CDR3 легкой цепи человека, включающую Seq ID NO:36.
12. Антитело по одному из вариантов осуществления настоящего изобретения 1-10, причем указанное антитело включает:
а. вариабельную область CDR1 тяжелой цепи человека, включающую Seq ID NO:1;
б. вариабельную область CDR2 тяжелой цепи человека, включающую Seq ID NO:2;
в. вариабельную область CDR3 тяжелой цепи человека, включающую Seq ID NO:3;
г. вариабельную область CDR1 легкой цепи человека, включающую Seq ID NO:4;
д. вариабельную область CDR2 легкой цепи человека, включающую Seq ID NO:5; и
е. вариабельную область CDR3 легкой цепи человека, включающую Seq ID NO:6.
13. Антитело по одному из вариантов осуществления настоящего изобретения 1-10, причем указанное антитело включает:
а. вариабельную область CDR1 тяжелой цепи человека, включающую Seq ID NO:11;
б. вариабельную область CDR2 тяжелой цепи человека, включающую Seq ID NO:12;
в. вариабельную область CDR3 тяжелой цепи человека, включающую Seq ID NO:13;
г. вариабельную область CDR1 легкой цепи человека, включающую Seq ID NO:14;
д. вариабельную область CDR2 легкой цепи человека, включающую Seq ID NO:15; and
е. вариабельную область CDR3 легкой цепи человека, включающую Seq ID NO:16.
14. Антитело по одному из вариантов осуществления настоящего изобретения 1-10, причем указанное антитело включает:
а. вариабельную область CDR1 тяжелой цепи человека, включающую Seq ID NO:21;
б. вариабельную область CDR2 тяжелой цепи человека, включающую Seq ID NO:22;
в. вариабельную область CDR3 тяжелой цепи человека, включающую Seq ID NO:23;
г. вариабельную область CDR1 легкой цепи человека, включающую Seq ID NO:24;
д. вариабельную область CDR2 легкой цепи человека, включающую Seq ID NO:25; and
e. вариабельную область CDR3 легкой цепи человека, включающую Seq ID NO:26.
15. Антитело по одному из вариантов осуществления настоящего изобретения 1-10, причем указанное антитело включает:
а. вариабельную область тяжелой цепи человека, включающую аминокислотную последовательность Seq ID No:38; и
б. вариабельную область легкой цепи человека, включающую аминокислотную последовательность Seq ID No:40.
16. Антитело по одному из вариантов осуществления настоящего изобретения 1-10, причем указанное антитело включает:
а. вариабельную область тяжелой цепи человека, включающую аминокислотную последовательность Seq ID No:8; и
б. вариабельную область легкой цепи человека, включающую аминокислотную последовательность Seq ID No:10.
17. Антитело по одному из вариантов осуществления настоящего изобретения 1-10, причем указанное антитело включает:
а. вариабельную область тяжелой цепи человека, включающую аминокислотную последовательность Seq ID No:18; и
б. вариабельную область легкой цепи человека, включающую аминокислотную последовательность Seq ID No:20.
18. Антитело по одному из вариантов осуществления настоящего изобретения 1-10, причем указанное антитело включает:
а. вариабельную область тяжелой цепи человека, включающую аминокислотную последовательность Seq ID No:28; и
б. вариабельную область легкой цепи человека, включающую аминокислотную последовательность Seq ID No:30.
19. Антитело по одному из вариантов осуществления настоящего изобретения 1-18, причем указанное антитело включает последовательность константной области легкой цепи Seq ID No:41.
20. Антитело по одному из вариантов осуществления настоящего изобретения 1-18, причем указанное антитело включает константную область тяжелой цепи человека с последовательностью Seq ID No:42.
21. Антитело по одному из вариантов осуществления настоящего изобретения 1-18, причем указанное антитело включает константную область легкой цепи, имеющую аминокислотную последовательность Seq ID No:41 и константную область тяжелой цепи, имеющую аминокислотную последовательность Seq ID No:42.
22. Антитело по одному из вариантов осуществления настоящего изобретения 19-21, причем указанное антитело включает аминокислотную последовательность тяжелой цепи, включая аллельную вариацию, причем указанная аллельная вариация представляет по меньшей мере одно или несколько положений, выбранных из группы, состоящей из 214, 221, 356 и 358 по системе нумерации по индексу EU.
23. Антитело по одному из предшествующих вариантов осуществления, причем указанное антитело выбрано из группы, состоящей из: антитела человека, гуманизированного антитела, химерного антитела, внутриклеточного антитела и синтетического антитела.
24. Выделенная нуклеиновая кислота, включающая полинуклеотидную последовательность, кодирующую антитело по одному из предшествующих вариантов осуществления настоящего изобретения.
25. Нуклеиновая кислота по варианту осуществления настоящего изобретения 24, причем указанная нуклеиновая кислота является репликативным вектором.
26. Нуклеиновая кислота по варианту осуществления настоящего изобретения 25, причем указанная полинуклеотидная последовательность функционально связана с промотором.
27. Клетка-хозяин, включающая или трансформированная вектором по варианту осуществления настоящего изобретения 25 или 26.
28. Трансгенная мышь, включающая трансгены тяжелой и легкой цепей иммуноглобулина человека, причем указанная мышь экспрессирует антитело по одному из вариантов осуществления настоящего изобретения 1-23.
29. Гибридома, полученная от мыши по варианту осуществления настоящего изобретения 28, причем гибридома вырабатывает указанное антитело.
30. Фармацевтическая композиция, включающая антитело по одному из вариантов осуществления настоящего изобретения 1-23 и фармацевтически приемлемый эксципиент.
31. Способ лечения состояния или заболевания, связанного с иммунным расстройством, включающий введение субъекту, нуждающемуся в этом, эффективного количества композиции по варианту осуществления настоящего изобретения 30.
32. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание является заболеванием, которое опосредовано интерфероном I типа.
33. Способ по варианту осуществления настоящего изобретения 32, причем указанный интерферон I типа является интерфероном альфа.
34. Способ по варианту осуществления настоящего изобретения 33, причем указанное заболевание, опосредованное интерфероном I типа, связано с рецептором интерферона типа I.
35. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является ВИЧ инфекцией заболевания СПИД.
36. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является системной красной волчанкой.
37. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является синдром Шегрена.
38. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является миозитом.
39. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является воспалительным миозитом.
40. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является полиомиозитом.
41. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является дерматомиозитом.
42. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является миозит с включенными тельцами.
43. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является ювенильным миозитом.
44. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является идиопатическим воспалительным миозитом.
45. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является васкулитом.
46. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является саркоидозом.
47. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство выбрано из группы, включающей: воспалительную болезнь кишечника, рассеянный склероз, аутоиммунный тиреоидоз, инсулинзависимый сахарный диабет, гломерулонефрит и заболевание трансплантат-против-хозяина.
48. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является псориазом или состоянием, возникающим вследствие псориаза.
49. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является отторжением трансплантата или заболеванием трансплантат-против-хозяина.
50. Способ по варианту осуществления настоящего изобретения 31, причем указанное заболевание или расстройство является выбрано из группы, включающей: болезнь Грейвса, тиреоидит Хашимото, болезнь Крона, псориаз, псориатический артрит, симпатический офтальмит, аутоиммунный оофорит, аутоиммунный орхит, аутоиммунный лимфопролиферативный синдром, антифосфолипидный синдром, синдром Шегрена, склеродерму, болезнь Аддисона, синдром полиэндокринной недостаточности, синдром Гийена-Барре, иммунную тромбоцитопеническую пурпуру, пернициозную анемию, злокачественную миастению, первичный билиарный цирроз печени, смешанную болезнь соединительной ткани, витилиго, аутоиммунный увеит, аутоиммунную гемолитическую анемию, аутоиммунную тромбоцитопению, глютеновую болезнь, герпетиформный дерматит, аутоиммунный гепатит, пемфигус, пемфигус вульгарный, пемфигус листовидный, буллезный пемфигоид, аутоиммунный миокардит, аутоиммунный васкулит, гнездную алопецию, аутоиммунный атеросклероз, болезнь Бехчета, аутоиммунную миелопатию, аутоиммунную гемофилию, аутоиммунный интерстициальный цистит, аутоиммунный несахарный диабет, аутоиммунный эндометриоз, рецидивирующий полихондрит, анкилозирующий спондилоартрит, анкилозирующий спондилоартрит, аутоиммунную крапивницу, дерматомиозит, синдром Миллера-Фишера, IgA нефропатию, синдром Гудпасчера и герпес беременных.
51. Способ по одному из вариантов осуществления настоящего изобретения 31-50, дополнительно включающий введение по меньшей мере одного агента, выбранного из группы, состоящей из: фототерапии, кортикостероидов, преднизона, НПВС, плазмафереза, иммуносупрессантов, метотрексата, ретиноевой кислоты, тиогуанина, микофенолята мофетила, эфиров фумаровой кислоты, циклофосфамида, азатиоприна, циклоспорина и иммуноглобулинов.
52. Способ по одному из вариантов осуществления настоящего изобретения 31-51, дополнительно включающий введение по меньшей мере одного агента, выбранного из группы, состоящей из: алефацепта (продукта AMEVIVE™), этанерсепта (продукта ENBREL®), адалимумаба (продукта HUMIRA®), инфликсимаба (продукта REMICADE®), белимумаба (продукта LYMPHOSTATB™), ритуксимаба (продукта RITUXAN®) и эфализумаба (продукта RAPTIVA®).
53. Кристалл, включающий область Fc IgG человека, в котором область Fc IgG человека включает по меньшей мере одно аминокислотное замещение, выбранное из группы, состоящей из L234F, L235E и P331S, нумерация которых дана по индексу EU, разработанному по Kabat, и в которой указанный фрагмент проявляет пониженное сродство в отношении по меньшей мере одного лиганда Fc по сравнению с немодифицированной областью Fc.
54. Кристалл по варианту осуществления настоящего изобретения 53, в котором область Fc IgG человека включает аминокислотные замещения L234F, L235E и P331S.
55. Кристалл по варианту осуществления настоящего изобретения 53, отличающийся дифракционным качеством.
56. Кристалл по варианту осуществления настоящего изобретения 53, который является нативным кристаллом.
57. Кристалл по варианту осуществления настоящего изобретения 53, отличающийся ромбической элементарной ячейкой а=50,18±0,2 Å, b=147,30±0,2 Å и c=75,47±0,2 Å.
58. Кристалл по варианту осуществления настоящего изобретения 53, который имеет пространственную группу C2221.
59. Модифицированное моноклональное антитело, причем указанное антитело включает в указанной области Fc аминокислотные замещения L234F, L235E и P331S, нумерация которых дана по индексу EU, разработанному по Rabat, и указанное антитело проявляет пониженное сродство в отношении по меньшей мере одного лиганда Fc по сравнению с немодифицированным антителом.
60. Гибридный белок, включающий модифицированную область Fc, причем указанная область Fc включает аминокислотные замещения L234F, L235E и P331S, нумерация которых дана по индексу EU, разработанному по Kabat, и указанная область Fc проявляет пониженное сродство в отношении по меньшей мере одного лиганда Fc по сравнению с областью Fc.
61. Способ получения антитела по одному из вариантов осуществления настоящего изобретения 1-23 или 59.
62. Антитело по одному из вариантов осуществления настоящего изобретения 1-23 или 59, причем указанное антитело является интернализирующим антителом.
63. Гибридный белок по варианту осуществления 60, причем указанный гибридный белок является интернализирующим гибридным белком.
64. Гибридный белок по варианту осуществления 63, причем указанный гибридный белок специфически связывается с IFNAR1.
65. Антитело по одному из вариантов осуществления настоящего изобретения 1-23, 59 или 62, причем указанное антитело проявляет пониженную или усеченную антителозависимую цитотоксичность (ADCC) по сравнению с указанным немодифицированным антителом.
66. Антитело по одному из вариантов осуществления настоящего изобретения 1-23, 59 или 62, причем указанное антитело проявляет пониженную или усеченную комплементзависимую цитотоксичность (CDC) по сравнению с указанным немодифицированным антителом.
67. Антитело по одному из вариантов осуществления настоящего изобретения 1-23, 59 или 62, причем указанное антитело проявляет пониженную или усеченную цитотоксичность ADCC и CDC по сравнению с указанным немодифицированным антителом.
Последовательности
Константная область легкой цепи (SEQ ID No:41)

Константная область тяжелой цепи (SEQ ID No:42)

Примеры
Настоящее изобретение описано ниже со ссылкой на примеры. Эти примеры предусмотрены только для иллюстрации, и настоящее изобретение никоим образом ими не ограничивается, и указанные примеры приводятся, чтобы охватить какую-либо или все вариации, которые являются результатом приводимых в настоящем изобретении способов.
Пример 1. ИГХ профиль множества анти-IFNAR1 антител
Цель. Для оценки ИГХ профиля анти-IFNAR1 антител по набору разных тканей.
Методы. Иммуногистохимические методики для изучения свойств связывания антитела известны в данной области и, например, могут быть осуществлены путем выделения требуемых клеток или тканей и приготовления их для микроскопирования путем стандартной фиксации и методов закрепления на поверхности.
Макрофаги мышей. Суспензию клеток осаждают центрифугированием для формирования осадка. Осадок замораживают в среде для заморозки ОСТ для формирования блока. Срезы нарезают слоями толщиной 5 мкм, на 10 мин замачивают в ацетоне и оставляют высыхать с влагопоглотителем в течение ночи. Перед применением срезы погружают в 10% формалин в нейтральном буфере на 10 сек и промывают 3 раза в буфере (1× TBS с 0,01% Tween20).
Моноциты человека. Суспензию клеток смачивают/наносят каплей непосредственно на предметные стекла. Предметные стекла оставляют высушиваться в течение ночи и затем вымачивают в ацетоне в течение 10 мин и оставляют высыхать на воздухе. Перед применением стекла полностью погружают в 10% нейтральный буферный формалин в течение 10 сек и промывают 3× в буфере (1× TBS с 0,01% Tween20).
Ткани мозга и сердца человека. Образцы ткани доноров замораживают в среде для заморозки ОСТ для формирования блока. Нарезают срезы толщиной 5 мкм, вымачивают в ацетоне в течение 10 мин и оставляют высушиваться с поглотителем в течение ночи. Перед применением срезы погружают в 10% нейтральный буферный формалин в течение 10 сек и промывают 3 раза в буфере (1× TBS с 0,01% Tween 20).
Нанесение метки на антитело. Антитела конъюгируют с биотином по следующему протоколу. Примерно 500 мкг антитела смешивают с биотином, который берут в 20-кратном избытке, и инкубируют в течение 2 ч в темноте при 4°С. Через 2 ч инкубирования смесь антитела/биотина вносят в предварительно уравновешенную колонку PD10 с 1X ФСБ. Впоследствии конъюгированные с биотином антитела концентрируют до требуемой концентрации, используя пробирку для концентрирования YM-30 Centricon.
Окрашивание срезов. После промывки в буфере срезы обрабатывают, чтобы подавить эндогенные пероксидазы, путем обработки раствором глюкозооксидазы (1 ЕД/мл, Sigma G0543), B-D(+) глюкозы (10 мМ, Sigma G5250), азида натрия (1 мМ, Sigma 8032) в течение 1 ч при комнатной температуре. Затем срезы ополаскивают буфером для промывки (1× TBS с 0,01% Tween 20), Срезы помещают в раствор для блокирования белка (1× ФСБ рН 7,2, 0,5% казеин (N-Z амин, Sigma C0626), 1% БСА (Sigma A7906), 1,5% нормальной сыворотки козы (Jackson Labs #005-000-001) в течение 30 мин при комнатной температуре. Биотинилированное антитело (см. выше) наносят на срезы путем разведения в блокирующем растворе белка. Инкубирование срезов с биотинилированным антителом проводят при комнатной температуре в течение 2 ч. Срезы ополаскивают 3 раза промывочным буфером (1× TBS, 0,01% Tween 20). Выявление антител осуществляют, используя набор Vectastain Kit (фирма Vector Laboratories). Срезы промывают и еще раз окрашивают, используя гематоксилин. Срезы обезвоживают и накрывают покровными стеклами перед просмотром.
Результаты. На фиг.6А представлены результаты ИГХ анализа образцов ткани головного мозга человека, окрашенных различными анти-IFNAR1 и контрольными антителами. Антитела MDX-1333 (75 мкг/мл) и 4G5 (50 мкг/мл) проявляют сильное окрашивание ткани головного мозга, которое выражено в виде коричневого/темного окрашивания, наблюдаемого по всей площади образцов. Антитело 9D4 (50 мкг/мл), а также MDX-1333 и 4G5, не окрашивают образец ткани головного мозга человека, что показано в виде пониженного коричневого/темного окрашивания по всему образцу. Контрольный изотип IgG1 включают, чтобы показать специфичность связывания конкретного антитела.
На фиг.6Б представлены результаты ИГХ анализа моноцитов, окрашенных различными анти-IFNAR1 и контрольными антителами. Все антитела MDX-1333 (50 и 20 мкг/мл), 4G5 (50 мкг/мл) и 9D4 (50 и 20 мкг/мл) проявляют выраженное окрашивание моноцитов человека, которое проявляется в виде коричневого/темного окрашивания образцов. Изотипическое контрольное антитело R3-47 (50 мкг/мл) не проявляет выраженного окрашивания моноцитов человека. Кроме того, MDX-1333 (50 мкг/мл) не окрашивает очищенные макрофаги мыши.
Выводы. При ИГХ исследовании анти-IFNAR1 антитело 9D4 проявляет пониженный уровень окрашивания по сравнению другими анти-IFNAR1 антителами, например, MDX-1333 и 4G5.
Пример 2. Получение антитела 9D4 ТМ
Модифицированное анти-IFNAR1 антитело, обозначаемое «9D4-TM», получают по приводимой ниже процедуре.
Рецептор человека γ1 Fc клонируют и конструируют из лимфоцитов периферической крови (ЛПК) человека первичным выделением общей РНК, транскрибируя кДНК и ПЦР-амплификацией константных областей с ген-специфическими праймерами содержащими сайты рестрикции Ара I и EcoRI, для клонирования в вектор млекопитающих РЕЕ6. Тройной мутант (ТМ) включает три изменения аминокислот в IgG человека для снижения эффекторной функции ADCC (L234F, L235E и P331S). ТМ конструируют, используя IgG1 человека (KOL) в качестве матрицы и сайт-направленный мутагенез (QuickChange XL, фирма Stratagene) для кодирования изменения трех остатков в области Fc. Последовательность мутагенных праймеров для кодирования изменений L234F/1235E/P331S следующая:
MD1056=5' cgtgcccagcacctgaaTtcGAggggggaccgtcagtcttc 3'L234F, L235E прямой (SEQ ID NO:43)
MD1057=5' gaagactgacggtccccccTCgaAttcaggtgctgggcacg 3' L234F, L235E обратный (SEQ ID NO:44)
MD1058=5' ccaacaaagccctcccagccTccatcgagaaaaccatctcc 3' P331S прямой (SEQ ID NO:45)
MD1059=5' ggagatggttttctcgatggAggctgggagggctttgttgg 3' P331S обратный (SEQ ID NO:46)
У клонов, кодирующих антитело 9D4-TM, секвенируют последовательность для подтверждения тройной мутации и определяют на генетическом анализаторе ABI3100.
Пример 3. Получение антитела 9D4 DM
Модифицированное анти-IFNAR1 антитело, обозначаемое «9D4-DM», получают по приводимой ниже процедуре.
Область γ4 Fc человека клонируют и конструируют из ЛПК человека путем первичного выделения общей РНК, транскрипции кДНК и ПЦР-амплификации константных областей с ген-специфическими праймерами, содержащими сайты рестрикции Ара I и EcoRI для клонирования в векторе млекопитающих РЕЕ6.
Двойной мутант (ДМ) включает две мутации в области Fc IgG4 человека, S228P и L235E. Мутагенные праймеры для кодирования DM включают:
MD1060=5' ggtcccccatgcccaCcatgcccagcacctg 3' шарнир S228P прямой (SEQ ID NO:47)
MD1061=5' caggtgctgggcatgGtgggcatgggggacc 3' шарнир S228P обратный (SEQ ID NO:48)
MD1062=5' ccagcacctgagttcGAggggggaccatcagtc 3' IgG4 L234F, L235E прямой (SEQ ID NO:49)
MD1063=5' gactgatggtccccccTCgaactcaggtgctgg 3' IgG4 L234F, L235E обратный (SEQ ID NO:50).
Клоны, кодирующие антитело 9D4-DM, секвенируют для подтверждения изменений в кодировании и определяют на генетическом анализаторе ABI3100.
Пример 4. Анти-IFNAR1 антитела ингибируют IFN-опосредованное STAT фосфорилирование.
Цель. Установить способность анти-IFNAR1 антитела 9D4-TM ингибировать IFN-опосредованное STAT фосфорилирование в мононуклеарных клетках периферической крови (МКПК).
Методы. МКПК от здоровых людей-доноров очищают, используя среду LSM (фирма МР Biomedical, Solon, Огайо). МКПК подсчитывают и высевают в количестве 106 клеток в лунку для определенного состояния. Антитела добавляют в количестве 10 мкг/мл в соответствующую лунку и инкубируют при 37°С, в атмосфере 5% СО2 в течение 10 мин. После предварительного инкубирования с антителами, рекомбинантный IFNα2a человека (фирма PBL Biomedical, Piscataway, Нью-Джерси) или IFN, производный плазмацитных дендровидных клеток (ПДК) (см. ниже получение супернатантов IFN I типа из ПДК), вносят в соответствующие лунки в концентрации 100 или 500 МЕ/мл в течение 20 мин. Клетки осаждают центрифугированием при 1200 об./мин в течение 5 мин и промывают стерильным 1× ФСБ. После дополнительного осаждения центрифугированием удаляют ФСБ и лизируют клетки, используя реагент для экстракции белков млекопитающих (фирма Pierce, Rockford, Иллинойс) с добавлением 300 мкл 1× коктейлей 1 и 2 ингибиторов фосфатазы (фирма Sigma, Сэнт-Луис, Миссури) и 1× ингибитор протеазы (фирма Roche Biomedical, Nutley, Нью-Джерси). Лизаты инкубируют в течение 10 мин на круговой качалке для осуществления полного лизиса, переносят в пробирки для микроцентрифугирования и осаждают центрифугированием при 14000 об/мин для удаления остатков клеток. Образец буфера NuPAGE (фирма Invitrogen, Карлсбад, Калифорния) и dTT (фирма Sigma, Сэнт-Луис, Миссури) добавляют к лизатам до конечной концентрации 1× и все образцы денатурируют блокировкой теплом при 100°С в течение примерно 10 мин. 15 мкл каждого образца добавляют к NuPage 10% Bis-tris полиакриламидному гелю (фирма Invitrogen, Карлсбад, Калифорния) в NuPAGE MES SDS подвижном буфере, обогащенном антиоксидантным буфером 1× NuPAGE. Образцы проводят при 180 V в течение 30 мин для разделения белков на полосы. Белки затем переносят на нитроцеллюлозную мембрану и пятна блокируют в буфере 1× ФСБ (фирма Gibco BRL, Карлсбад, Калифорния), содержащем 5% БСА (фирма Sigma, Сэнт-Луис, Миссури) в течение ночи при 4°С. Блокирующую среду потом удаляют и 0,2 мкг/мл анти-STAT1, анти-STAT1 pY701 или 1:1000 разведение β-активного антитела (фирма Cell Signaling Technology, Данверс, Массачусетс) добавляют к соответствующим пятнам и инкубируют в течение ночи при 4°С. Пятна промывают трижды в 1× TBS с 0,05% Tween20 (фирма Sigma, Сэнт-Луис, Миссури). Анти-раббическое вторичное антитело, конъюгированное с пероксидазой хрена и разведенное 1:25000, добавляют к пятнам и инкубируют в течение 1 ч при комнатной температуре. Пятна промывают согласно описанному выше и 3 мл 1:1 смеси реагента Pico Supersignal West (фирма Pierce, Rockfor, Иллинойс) добавляют к каждому пятну на 1 мин. Пятна просушивают, избыток реагента удаляют и полосы визуализируют, используя процессор Kodak X-omat 1000А.
Результаты. На фиг.7. представлены результаты исследования по активированию STAT, в котором клетки простимулированы лейкоцитарным IFN в присутствии или в отсутствие анти-IFNAR1 антител. В отсутствии антител лейкоцитарный интерферон стимулирует фосфорилирование изоформ 1, 3 и 5 STAT. Инкубирование клеток с антителом 9D4-TM ингибирует фосфорилирование, опосредованное лечением лейкоцитарным интерфероном. Клетки, обработанные изотипическим контрольным антителом R3-47, не проявляют ингибирования фосфорилирования STAT в ответ на стимулирование лейкоцитарным интерфероном.
Заключение. Результаты на фиг.7 показывают, что антитело 9D4-TM способно ингибировать ответы на IFNα, например, индукцию фосфорилирования STAT в мононуклеарных клетках периферической крови.
Пример 5. Анти-IFNAR1 антитела ингибируют передачу сигнала IFN I типа.
Цель. Используя очищенный IFN I типа из клеток ПДК, применяют репортерный анализ для определения способности анти-IFNAR1 антитела блокировать передачу сигнала IFN I типа.
Методы. Плазмацитные дендровидные клетки (ПДК) выделяют из цельной крови здоровых доноров, используя среду для отделения лимфоцитов (фирма МР Biomedical, Solon, Огайо), с последующим положительным отбором, используя набор CD304 (BDCA-4/Neuropilin-l) MicroBead Kit (фирма Milteny Biotec, Auburn Калифорния). Очищенные ПДК затем культивируют при плотности 1×106 клеток/мл в среде RPMI 1640, обогащенной 10% ФСТ (фирма Gibco BRL) и 6 мкг/мл CpGA (фирма InVivogen, San Diego, Калифорния). Супернатанты собирают и осветляют через 20 ч в культуре и IFN I типа оценивают количественно, используя стабильно трансфецированную линию репортерных клеток HEK293-ISRE против стандартной кривой лейкоцитарного IFN человека (фирма PBL Biomedical, Piscataway Нью-Джерси).
ПДК от трех здоровых людей-доноров используют для получения производного от супернатантов ПДК человека интерферона I типа, описанного выше. Клетки HEK293 (АТСС, Manassas, Вирджиния) стабильно трансфецируют репортерной плазмидой pHTS-ISRE (фирма Biomyx Technology, Сан-Диего, Калифорния) и поддерживают в среди DMEM, обогащенной 10% ФСТ, 1× NEAA и 700 мкг/мл G418 (фирма Invitrogen, Карлсбад, Калифорния). Клетки засевают в количестве 80000 клетки в лунку в белые/прозрачные 96-луночные планшеты Optilix (VWR, West Chester, Пенсильвания). Соответствующие концентрации антитела (611 - 0,00004 нМ) вносят в каждую лунку и затем вносят соответствующие концентрации супернатантов с интерфероном I типа, полученные от ПДК человека. Клетки, IFN и антитела инкубируют в течение ночи при 37°С в атмосфере 5% СО2 и амплификацию белка люциферазы оценивают лизированием клеток реагентом для лизиса клеток (Cell Culture Lysis reagent) и визуализацией, используя систему Luciferase Assay System (фирма Promega, Мэдисон, Висконсин). Сигнал измеряют в имп./сек и получают величины IC50.
Результаты. Супернатанты IFN I типа собирают из клеток ПДК, отобранных от трех конкретных доноров. В люциферазном репортерном исследовании инкубирование анти-IFNAR1 антител подавляет способность к передаче сигнала различными концентрациями супернатанта IFN I типа (фиг.8).
Заключение. Эти результаты показывают, что анти-IFNAR1 антитела способны ингибировать опосредованную IFN I типа передачу сигнала по результатам измерения активности в репортерном исследовании.
Пример 6. Модифицированные анти-IFNAR1 антитела проявляют способность к связыванию, сходную со способностью исходного немодифицированного антитела.
Цель. Для исследования связывания IFNAR1 модифицированными антителами по сравнению с исходными немодифицированными вариантами. На фиг.9 представлены кривые связывающего сродства для антител 9D4, 9D4DM и 9D4TM. Константы связывания (Kd) для 9D4, 9D4DM и 9D4TM анти-IFNAR1 антител определяют по кривым связывания.
Методы. 200000 HEK 293F клеток высевают в круглодонный 96-луночный планшет, используя 50 мкл среды RPMI 1640, обогащенной 10% ФСТ. Меченое европием антитело 9D4-TM получают по контракту с PerkinElmer Life и Analytical Sciences. Для измерения неспецифического сигнала европия добавляют 25 мкл 100-кратного избытка немеченого серийно разведенного анти-IFNAR1 антитела в соответствующие лунки 96-луночного планшета за 5-10 мин до внесения меченого антитела 9D4-TM. Затем добавляют 25 мкл конъюгированного с европием серийно разведенного антитела в соответствующие лунки, и клетки и антитела аккуратно перемешивают при комнатной температуре в течение 1-2 ч. После инкубирования для связывания 150 мкл клеточной среды добавляют во все лунки и планшеты центрифугируют при 1200 об./мин в течение 5 мин при комнатной температуре. Быстро сливают надосадок и 250 мкл клеточной среды добавляют во все лунки. Осаждение центрифугированием и промывание повторяют в общей сложности 3 раза. Клетки затем ресуспендируют в 100 мкл клеточной среды. 50 мкл ресуспендированных клеток переносят в 200 мкл усиливающего раствора DELPHIA (фирма PerkinElmer) в желтые планшеты для микротитрований DELPHIA и эмиссию европия измеряют на ридере Victor2 Multilabel (фирма PerkinElmer). Сигналы измеряют в имп./сек и величины Кд и Втах получают, используя программное обеспечение GraphPad Prism 4.
Результаты. Представленные на фиг.9 данные показывают, что модифицированные антитела 9D4-TM и 9D4-DM проявляют сходное связывающее сродство с IFNAR1 (9D4=0,06±0,02 нМ, 9D4-DM=0,06±0,02 нМ, 9D4-TM=0,03±0,01 нМ) по сравнению с исходным немодифицированным антителом.
Заключение. Представленные данные показывают, что модифицированные антитела обладают сходными связывающими свойствами с IFNAR1 с исходным немодифицированным антителом.
Пример 7. Данные исследования равновесного связывания для антитела 9D4-TM против sIFNαRI
Цель. Определить данные по равновесному связыванию для антитела 9D4-TM, используя растворимый рецептор IFNAR1 (sIFNAR1).
Методы. Лигандом sIFNAR1 покрывают гранулы UltraLink® Biosupport (фирма PIERCE, Rockford, Иллинойс) в концентрации 5 мкг/мл и 50 мкг/мл в буфере для нанесения покрытия (50 мМ буфер углекислого натрия, рН9) в течение 1-2 суток при 4°С. Гранулы с покрытием затем отделяют (мягким вращением с переменной интенсивностью) от непрореагировавшего раствора лиганда и аккуратно покачивают в блокирующем буфере (1 мл 1М Tris, pH 8, содержащем БСА в концентрации 10 мг/мл) в течение примерно 15 мин при комнатной температуре (КТ). Затем суспензию гранул опять осаждают центрифугированием для удаления блокирующего раствора и стадию блокирования повторяют в течение примерно 2 ч при комнатной температуре, используя свежую аликвоту блокирующего буфера. После стадии блокирования гранулы с покрытием хранят при 4°С до использования. Перед применением гранулы с покрытием из sINFARl переносят во флакон для гранул, ресуспендируют в 27 мл инструментарного подвижного буфера (ФСБ, рН7,4 - 0,02% NaN3), затем присоединяют к прибору KinExA 3000.
Все константы равновесного связывания (KD) получают на основании измерений, сделанных на приборе KinExA 3000 (фирма Sapidyne Instruments, Boise, Айдахо). Вкратце, 9D4-TM IgG получают в концентрации 1 пМ, 10 пМ и 50 пМ и распределяют по трем сериям пробирок. Этот диапазон концентраций IgG разрабатывают для осуществления измерений и по рецептор-, и по KD-контролируемым условиям. Двукратные серийные разведения лиганда sINFAR1 затем титруют с указанными растворами IgG в концентрациях, варьирующих от 19,5 фМ до 1 нМ. По данным поставщика теоретическая кривая моделирует доступность на основании программного обеспечения (фирма Sapidyne Instruments, Boise, Айдахо), и эти равновесные смеси инкубируют примерно в течение 2-6 суток при комнатной температуре. По завершении этого периода проводят эксперименты по тестированию сигнала для определения рабочих условий. Выявление свободного антитела становится возможным, используя видоспецифичный Су5-меченый реагент вторичного антитела (Су5 AffiniPure F(ab')2 фрагмент козьего анти-IgG человека, часть №109-176-097, фирма Jackson Immuno Research Laboratories), используемый в концентрации 0,1, 1,0 или 2,0 мкг/мл ФСБ, рН7,4 - 0,02% NaN3, содержащий БСА в концентрации 1 мг/мл. Полученные экспериментальные данные затем совместно подбирают, используя показатель, полученный по построенной на основании программного обеспечения n-кривой, для получения указанной константы связывания (KD).
Результаты. На фиг.10А показаны кривые связывания для трех концентраций 9D4-TM (1 пМ, 10 пМ и 50 пМ) с sIFNαRI. Данные по меньшей мере от трех независимых экспериментах подбирают по полученной с помощью программного обеспечения кривой для получения относительной величины KD для антитела 9D4-TM. Величину KD антитела 9D4-TM в данном анализе связывания определяют равной 1,1 пМ с 95% доверительным интервалом от 0,603 пМ до 1,8 пМ. Процент ошибки при определении KD 1,1 пМ составляет 1,96%. Также было установлено, что величины Kon и Koff для антитела 9D4-TM составляют 7×106±1,3×106 сек-1 и 7,7×10-6±1,57×10-6 1/мсек соответственно (данные не представлены).
Заключение. Модифицированное анти-IFNAR1 антитело 9D4-TM проявляет очень низкую величину KD примерно составляющую 1,1 пМ для sIFNAR1 по определению методом KinExa.
Пример 8. Определение сродства антитела 9D4-TM на МКПК человека
Цель. Определение связывающего сродства с МКПК человека.
Методы. Мононуклеарные клетки периферической крови от здоровых людей-доноров очищают, используя среду LSM (фирма МР Biomedical, Solon, Огайо). Клетки подсчитывают и по 200000 клеток высевают в круглодонный 96-луночный планшет, используя 50 мкл среды RPMI 1640, обогащенной 10% ФСТ. Меченое европием антитело 9D4-TM получают по контракту с фирмами PerkinElmer Life и Analytical Sciences. Для измерения неспецифического сигнала европия добавляют 25 мкл 100-кратного немеченого избытка серийно разведенного 9D4-TM в соответствующие лунки 96-луночного планшета в течение 5-10 мин перед добавлением меченого 9D4-TM. 25 мкл конъюгированного с европием серийно разведенного 9D4-TM затем добавляют в определенные лунки и клетки с антителами аккуратно перемешивают при комнатной температуре в течение 1-2 ч. После инкубирования для связывания 150 мкл клеточной среды вносят в лунки и планшеты осаждают центрифугированием при 1200 об./мин в течение 5 мин при комнатной температуре. Надосадок быстро сливают и 250 мкл клеточной среды вносят во все лунки. Осаждение центрифугированием и промывание повторяют в общей сложности до трех раз. Затем клетки ресуспендируют в 100 мкл клеточной среды. 50 мкл ресуспендированных клеток переносят в 200 мкл DELPHIA усиливающего раствора (фирма PerkinElmer) в желтые планшеты для микротитрований DELPHIA, и эмиссию европия измеряют на ридере Victor2 Multilabel (фирма PerkinElmer). Сигналы измеряют в имп./сек и величины Kd и В max получают, используя программное обеспечение GraphPad Prism 4.
Результаты. Используя измерения сродства, приведенные на фиг.10Б, определяют, что Kd связывания 9D4-TM с МКПК человека составляет 0,29 нМ ± 0,11 нМ при установленном числе сайтов связывания 1448±447. Используя близкий подход установлено, что константа связывающего сродства для IFNAR макаки крабоеда составляет 0,65±0,42 нМ при установленном числе сайтов связывания 648±204 (данные не представлены).
Заключение. Результаты, представленные на фиг.10Б, показывают, что антитело 9D4-TM специфически связывается с высоким сродством с МКПК человека.
Пример 9. Модифицированные анти-IFNAR1 антитела проявляют сходное действие с исходным немодифицированным антителом.
Цель. Показать, что модифицированные анти-IFNAR2 антитела (т.е. анти-IFNAR1 антитела с пониженным сродством с лигандом Fc) проявляют сходное действие с исходными немодифицированными антителами.
Методы. Система люциферазного репортерного исследования, используемая в этом примере, описана выше (см. пример 3). Антителами к IFNAR1, используемыми в этом примере, являются 9D4, 9D4-DM, 9D4-TM, MDX-1333. В качестве контроля используют антитело R3-47.
Результаты. Используя люциферазную репортерную систему получают величины IC50 для различных анти-IFNAR1 антител, описанных выше (см. фиг.11А). Анти-IFNAR1 антитело 9D4 (0,01 нМ) и модифицированные антитела, например 9D4-DM (0,01 пМ) и 9D4-TM (0,02 нМ), каждое вызывают сходную величину IC50 в репортерном исследовании, показывая, что они проявляют схожую активность. Другое анти-IFNAR1 антитело, MDX1333 (0,04 нМ), также проявляет схожую активность с немодифицированным 9D4 антителом. Изотипический контроль не ингибирует опосредованную IFN I типа передачу сигнала в таком люциферазном репортерном исследовании.
Заключение. Модифицированные анти-IFNAR1 антитела проявляют схожее действие с немодифицированными версиями, что следует из величин IC50, которые получены в системе люциферазного репортерного исследования, сконструированной для подсчета случаев IFN передачи сигнала.
Пример 10. 9D4-TM ингибирует действие многочисленных изоформ интерферона альфа I типа
Цель. Показать, что 9D4-TM ингибирует передачу сигнала, свойственную специфическим и многочисленным изоформам интерферона альфа.
Методы. Систем люциферазного репортерного исследования, используемая в настоящем примере, была описана выше (см. пример 5).
Результаты. Величины IC50 для опосредованного антителом 9D4-TM ингибирования действия интерферона I типа представлены в табл.4.
Показано, что 9D4-TM проявляет величины IC50 в субнаномолярном диапазоне для многочисленных изоформ интерферона альфа, лейкоцитарного интерферона и интерферона омега.
Заключение. Модифицированное анти-IFNAR1 антитело 9D4-TM проявляет способность ингибировать передачу сигнала, обусловленную множеством специфических подтипов интерферона альфа, а также лейкоцитарным интерфероном альфа, в репортерном исследовании.
Пример 11. Определение изоэлектрической точки антител 9D4, 9D4DM и 9D4TM
Цель. Оценить биофизические свойства исходного немодифицированного антитела 9D4 и сравнить с модифицированными антителами 9D4-DM и 9D4-TM.
Методы. Анализ нативного изоэлектрического фокусирования в полиакриламидном гельэлектрофорезе (IEF-PAGE) проводят следующим образом. В готовые амфолиновые гели (фирма Amersham Biosciences, pI диапазон 3,5-9,5) вносят 8 мкг белка. Образцы белка диализируют в 10 мМ гистидине рН 6 перед загрузкой на гель. Широкий диапазон стандартов маркеров pI (фирма Amersham, pI диапазон 3-10, 8 мкл) используют для определения относительной величины pI для Mab. Электрофорез проводят при 1500 V, 50 мА в течение 105 мин. Гель фиксируют в течение 45 мин, используя фиксирующий раствор Sigma (5×), разведенный очищенной водой до 1×. Окрашивают в течение ночи при комнатной температуре, используя краситель простой синий (фирма Invitrogen). Удаление красителя проводят в растворе, содержащем 25% этанола, 8% уксусной кислоты и 67% чистой воды. Изоэлектрические точки определяют, используя денситометр Bio-Rad GS-800 вместе с программным обеспечением Quantity One Imaging Software.
Результаты. На фиг.12А представлено определение изоэлектрических точек (isoelectric point - pI) для антител 9D4WT, 9D4DM и 9D4TM. Образцы антител, исследованные по описанным выше методам, проявляя следующие отличительные особенности. Антитело 9D4 WT проявляет выраженные полосы белка, соответствующие 8,2, 8,35 и 8,51. Антитело 9D4 DM проявляет одну выраженную полосу белка, соответствующую 7,13. Антитело 9D4 ТМ проявляет выраженные полосы белка, соответствующие 8,09 и 8,18.
Заключение. Согласно представленному в примере, модифицированные антитела 9D4-DM и 9D4-TM проявляют очень схожие биофизические свойства (pI) с исходным немодифицированным антителом 9D4.
Пример 12. Термостабильность 9D4, 9D4-DM и 9D4-TM
Цель. Оценить биофизические характеристики исходного немодифицированного антитела 9D4 по сравнению с модифицированными антителами 9D4-DM и 9D4-TM.
Методы. Дифференциальную сканирующую калориметрию осуществляют следующим образом: температуру плавления (Tm) измеряют с помощью VP-DSC (фирма MicroCal, LLC), используя скорость сканирования 1,0°С/мин и диапазон температуры 20-110°С. Период фильтрации 8 сек используют наряду с предварительным сканированием в течение 15 мин. Образцы получают диализом в 10 мМ гистидине-HCl, рН 6, используя кассеты для диализа Pierce (3,5 кДа). Концентрации Mab составляют 0,14 мг/мл, 0,79 мг/мл и 0,64 мг/мл по определению при A280. Температуры плавления определяют, следуя рекомендациям производителя и используя программное обеспечение Origin, поставляемое вместе с системой. Вкратце, разнородные базовые линии движутся с буфером и в образце, и в контрольных клетках, для установления теплового равновесия. После вычитания исходных данных из термограммы образца, данные нормализуют по концентрации.
Результаты. Антитела 9D4, 9D4-DM, 9D4-TM подвергают дифференциальной сканирующей калориметрии, подробно описанной выше (см. результаты на фиг.12Б). Каждое из исследованных антител проявляет сходную температуру плавления в настоящем исследовании. Конкретно антитела проявляют следующие температуры плавления: 9D4 WT=70,41°С, 9D4-DM=70,41°С, и 9D4-TM=70,88°С.
Заключение. Согласно представленному в примере, модифицированные антитела 9D4-DM и 9D4-TM проявляют очень схожие биофизические свойства (Tm) с исходным немодифицированным антителом 9D4.
Пример 13. Суррогаты анти-IFNAR антител защищают мышей от индуцированной IFNα протеинурии
Цель. Показать, что анти-IFNAR антитела защищают мышей от индуцированной протеинурии на модели СКВ.
Методы. Самок мышей NZB/W F1 получают от фирмы Jackson Labs и содержат в условиях, исключающих попадание патогенов. Рекомбинантный аденовирусный вектор, содержащий кДНК IFNα подтипа 5 мыши под контролем промотора/энхансера CMV (Adv-mIFNα5), используют для индукции начала заболевания волчанки у этих мышей. Мышам (8 мышей на группу) в возрасте 8-11 недель вводят одну внутривенную инъекцию 0,3×1010 вирусных частиц Adv-mIFNα5. Контрольным животным вводят то же количество контрольных вирусных частиц Adv. В некоторых экспериментах мышам вводят инъекцией последовательно дозы Adv-mIFNα5, ранжированные от 0,01×1010 до 1,0х10110 вирусных частиц на мышь. Для определения эффективности анти-IFNAR1 мышам вводят в последующие 5 суток внутрибрюшинно антитело в количестве 10 мг/кг, начиная от времени поставки вируса Adv. При протеинурии мочу тестируют, используя измерительный стержень (Chemstrip 2 GP; фирма Roche Diagnostics). Протеинурию оценивают в 1 балл для уровней 30 мг/дл, 2 для 100 мг/дл и 3 для уровней ≥ 500 мг/дл. Считают, что у мышей протеинурия, если двум последовательным образцам мочи присваивают оценку «2» или выше.
Результаты. Результаты по инфицированным аденовирусом мышам, обработанным анти-IFNAR1 антителами, представлены на фиг.13. У мышей, инфицированных Adv-mIFNα5, начало проявления протеинурии начинается примерно после 3 недель. Инфицированные мыши, обработанные контрольным IgG антителом мыши, не защищены от начала развития протеинурии на протяжении курса эксперимента, что показано по началу проявления протеинурии, которая начинается примерно после 4 недель. У мышей, которым вводили анти-IFNAR антитела, нет признаков протеинурии на протяжении 8 недель исследования. У мышей, которым вводили контрольный аденовирус, нет признаков протеинурии на всем протяжении эксперимента.
Заключение. Рассматриваемые вместе эти данные в указанном примере показывают, что наличие анти-IFNAR антител является защитой от индуцированной adv-IFN протеинурии в модели мыши in vivo.
Пример 14. Анти-IFNAR антитела блокируют генную регуляцию, индуцируемую IFN I типа
Цель. Показать, что анти-IFNAR1 антитела ингибируют или снижают регуляцию гена интерферона I типа в модели СКВ на мышах.
Методы. От мышей, используемых в экспериментах в примере 13, также берут образцы для анализа в настоящем примере. РНК выделяют из тканей, используя лизирующий буфер RLT (фирма Qiagen). Для твердых тканей (почек, селезенки, кожи) каждый раз используют для процессинга РНК не более 50 мг ткани. Образцы помещают в лизирующий буфер и лизирующий матрикс А (фирма Qbiogene) и обрабатывают в течение 30 сек при 4,5 м/сек, используя гомогенизатор Fastprep24 (фирма Thermo Electron Corporation, Уолтем, Массачусетс). Для получения МКПК образцы цельной крови центрифугируют и осадок лизируют в буфере RLT. После лизиса образцы быстро замораживают при -80°С до дальнейшего применения. Для выделения РНК оттаянные лизаты тканей сначала обрабатывают, используя спиновые колонки Qiashredder, затем равные объемы 70% этанола добавляют к тканевым лизатам и РНК очищают, используя мини-наборы для спиновых колонок Rneasy mini spin column, no рекомендациям производителя.
кДНК получают из 3 мкг РНК, используя обратную транскриптазу Superscript III и праймер олиго-d(T), по протоколу производителя (фирма Invitrogen, Corp. Карлсбад, Калифорния). Образцы кДНК разводят в воде, не содержащей нуклеазы, и хранят при -80°С.
Уровни экспрессии отобранных генов измеряют с помощью метода ПЦР реального времени TaqMan®, используя систему ABI 7900HT Fast Real-time PCR system (фирма Applied Biosystems, Фостер-сити, Калифорния). Ген домашнего хозяйства β-актина используют для эндогенного контроля. Конечный объем реакционных смесей составляет 20 мкл и включает 1 мкл кДНК, 2 мкл 20х праймеров и зондов (фирма TaqMan® Gene Expression Assays, Applied Biosystems) и 18 мкл разведенной смеси продукта TaqMan® Fast Universal PCR Master Mix. Условия амплификации следующие: 20 сек при 95°С, 50 циклов по 1 сек при 95°С и 20 сек при 60°С. Величины СТ варьируют 0 до 50, причем последняя величина означает отсутствие формирования продукта. Количественную оценку экспрессии гена проводят, используя сравнительный метод СТ (Sequence Detector User Bulletin 2; фирма Applied Biosystems), и выражают в виде кратности отличия от гена «домашнего хозяйства».
Результаты. Интерферон I типа, врожденно экспрессируемый в мышах (см. пример 13), приводит к индукции ряда генов. На фиг.14 показаны кратные изменения шести генов, ответственных за интерферон I типа, в разных популяциях мышей, используемых в этом эксперименте. Особенно гены IFIT1, IFI44, IFI202b, CXCL9, CXCL10 и CXCL11 все индуцированы в мышах, врожденно экспрессирующих IFNα и обработанных неспецифическим IgG мыши. Мыши, врожденно экспрессирующие IFNα и обработанные анти-IFNAR антителами, не проявляют какой-либо индукции шести генов, ответственных за интерферон I типа. В качестве контроля для демонстрации специфичности кодируемого аденовирусом IFNα мышей обрабатывали ФСБ или контрольным аденовирусом, и они не проявляют какой-либо индукции этих 6 генов. Эти результаты показывают, что введение анти-IFNAR антител может блокировать индукцию гена, ответственного за IFN альфа in vivo в модели мыши.
Заключение. Анти-IFNAR антитела могут блокировать регуляцию генов, ответственных за интерферон I типа, в мышах - моделях СКВ.
Пример 15. Анти-IFNAR антитела блокируют выработку анти-днДНК и анти-SSA/Ro (анти-ядерный антиген) антител, индуцируемых интерфероном I типа
Цель. Показать способность анти-IFNAR антител блокировать выработку анти-ядерных антител, например анти-днДНК и анти-SSa/Ro, индуцированных интерфероном I типа в мышах - моделях СКВ.
Методы. Подготовка и обработка мышей показаны в примере 13. Уровни сывороточных анти-днДНК аутоантител оценивают методом ELISA. Вкратце, планшеты ELISA, предварительно обработанные поли(Д-лизином) (100 мкг/мл), покрывают активированной ДНК из тимуса теленка (5 мкг/мл в карбонатном-бикарбонатном буфере) (фирма SIGMA). После инкубирования в течение ночи при 4°С планшеты блокируют ФСБ/10% ФСТ. Сыворотку (в разведении 1/200) инкубируют в течение 30 мин при комнатной температуре. Связанный IgG обнаруживают с помощью конъюгированного с пероксидазой козьего антимышиного IgG (1/4000) (KPL), добавленного в планшеты, в течение 30 мин. Связывание определяют добавлением субстрата ТМВ (KPL) и стоп-раствора (KPL), и оптическую плотность считывают при 450 нм. Мышиный анти-днДНК IgG стандарт в сыворотке исследуют в серийном разведении (от 625 нг/мл) (фирма Alfa Diagnostic) в каждом планшете для стандартизации. Уровни сывороточных анти-SSA/Ro аутоантител измеряют методом ELISA (фирма Alfa Diagnostic), следуя инструкциям производителя.
Результаты. Интерферон I типа врожденно экспрессируется в мышах (см. пример 13), что приводит к накоплению анти-днДНК и анти-SSA/Ro антител. На фиг.15 представлены относительные количества анти-днДНК (А) и анти-SSA/Ro (Б) антител в разных популяциях мышей (контрольный аденовирус, Adv-IFNα+ФСБ, Adv-IFNα+MuIgG и Adv-IFNα+анти-IFNAR) по измерению методом ELISA. Мыши, инфицированные контрольным аденовирусом, показывают незначительное накопление анти-днДНК или анти-SSA/Ro антител в этом эксперименте. Мыши, инфицированные аденовирусом, кодирующим IFNα, и обработанные ФСБ, накапливают анти-днДНК и анти-SSA/Ro антитела. Adv-IFNα инфицированные мыши, обработанные анти-IFNAR антителами, получают меньше анти-днДНК и анти-SSA/Ro антител, чем Adv-IFNa-инфицированные мыши, обработанные неспецифическим IgG. Эти результаты показывают, что лечение анти-IFNAR антителами ингибирует накопление анти-днДНК и анти-SSA/Ro антител в ответ на врожденно экспрессированный IFN I типа.
Пример 16. Анти-IFNAR антитела блокируют выработку IP-10 и IL-18, индуцированную интерфероном I типа
Цель. Показать способность анти-IFNAR антител блокировать накопление цитокинов, индуцированных IFNα, в мышах - моделях СКВ.
Методы. От мышей, используемых в экспериментах в примере 13, также берут образцы для анализа в настоящем примере. Уровни цитокинов в сыворотке измеряют методом ELISA (фирма R&D systems), следуя инструкциям производителя.
Результаты. Интерферон I типа, врожденно экспрессируемый в мышах (см. пример 13), приводит к накоплению цитокинов IP-10 и IL-18. На фиг.16 представлены относительные количества IP-10 (А) и IL-18 (Б) в разных популяциях мышей (ФСБ, контрольный аденовирус, Adv-IFNα+MuIgG и Adv-IFNα+Анти-IFNAR), измеренные методом ELISA. Интерферон I типа, врожденно экспрессируемый в мышах (см. пример 12), приводит к накоплению цитокинов, IP-10 и IL-18. Мыши, инфицированные контрольным аденовирусом, проявляют небольшое накопление цитокинов IP-10 (А) или IL-18 (Б) в этом эксперименте. Мыши, инфицированные Adv-IFNα и обработанные анти-IFNAR антителами, аккумулирует меньше цитокинов IP-10 и IL-18, чем мыши, инфицированные Adv-IFNα и обработанные неспецифическим IgG. Эти результаты показывают, что лечение анти-IFNAR антителами ингибирует накопление цитокинов IP-10 и IL-18 в ответ на врожденно экспрессируемый IFN I типа.
Заключение. Анти-IFNAR антитела способны блокировать накопление цикокинов, индуцированных IFNα, в мышах - моделях СКВ.
Пример 17. Анти-IFNAR антитела блокируют выработку ANA (антиядерных антител), индуцируемую интерфероном I типа
Цель. Показать способность анти-IFNAR антител блокировать накопление индуцированных IFNα анти-ядерных антител в мышах - моделях СКВ.
Методы. От мышей, используемых в экспериментах в примере 13, также берут образцы для анализа в настоящем примере. Уровни антиядерного антитела (ANA) измеряют с помощью тест-набора ANA (фирма Antibody Incorporated) с Нер-2 стабилизированным субстратом и митотических фигур, следуя инструкциям производителя. Сыворотку разводят серийно и инкубируют с клетками Нер-2 на срезах и связанное антиядерное антитело обнаруживают с помощью меченого Hi-FITC козьего анти-мышиного IgG (H+L) (фирма Antibody Incorporated). Титр ANA выражают в виде фактора разведения сыворотки, при котором ANA больше не выявляется.
Результаты. Врожденно экспрессированный в мышах интерферон I типа (см. пример 13) приводит к накоплению анти-ANA антитела. На фиг.17 показан титр в сыворотке анти-ANA антител в разных популяциях мышей (без вируса, контрольный аденовирус, Adv-IFNα+ФСБ, Adv-IFNα+MuIgG и Adv-IFNα+Анти-IFNAR) по данным измерений методом серийных разведении окрашивания на клетках НЕР2. У мышей, инфицированных контрольным аденовирусом, показано небольшое накопление анти-ANA антител в этом эксперименте. Мыши, инфицированные аденовирусом, кодирующим IFNα, и обработанные ФСБ, накапливают анти-ANA антитела. У мышей, инфицированных Adv-IFNα и обработанных анти-IFNAR антителами, проявляется меньше анти-ANA антител, чем у мышей, инфицированных Adv-IFNα и обработанных неспецифическим IgG. Эти результаты показывают, что лечение анти-IFNAR антителами ингибирует накопление анти-ANA антител в ответ на врожденно экспрессированный IFN I типа.
Заключение. Анти-IFNAR антитела способны блокировать накопление анти-ядерных антител, индуцированных IFNα в мышах - моделях СКВ.
Пример 18. Подавление антителом опосредованного плазмой больных СКВ развития дендровидных клеток
Цель. Плазма больных СКВ индуцирует развитие дендровидных клеток из нормальных моноцитов человека. В этом примере исследуют очищенное моноклональное антитело 9D4-TM на способность подавлять развитие дендровидных клеток, которую оценивают по способности антител ингибировать индукцию маркеров CD38 и CD123 на поверхности клеток под действием плазмы больных СКВ.
Методы. Методы были ранее описаны в патентной заявке US 20006/0029601, сущность которой включена в настоящее изобретение в виде ссылки. По существу эксперименты проводят следующим образом. 25 мл реактива buffy coat разводят в 4 раза фосфатно солевым буфером (ФСБ). Образец отделяют в конических пробирках 4×50 мл, и 15 мл среды для отделения лимфоцитов (фирма ICN Biomedicals) наслаивают нижним слоем. Через 30 мин центрифугирования в режиме 500 g слой клеток buffy, содержащий мононуклеарные клетки периферической крови (МКПК), извлекают и промывают ФСБ. Клетки ресуспендируют в культуральной среде, содержащей 1% инактивированной нагреванием сыворотки человека, до концентрации 4×106 клеток/мл. Моноциты выделяют инкубированием МКПК (2,0×107 клеток/5 мл/колбы 25 см2) в течение 1,5 ч при 37°С в культуральной среде и затем дважды отмывают неприкрепленные клетки. Для индукции созревания моноцитов клетки инкубируют со средой, содержащей 25% плазмы человека от здоровых добровольцев или от пациентов с СКВ. Исследования по блокированию антитела проводят путем добавления 30 мкг/мл анти-IFNAR1 антитела или изотипического контроля, IgG1, к культуре. Клетки инкубируют в течение 4 суток, промывают ФСБ и обрабатывают реактивом Versene в соотношении 1:5000 в течение 10 мин при 37°С. При необходимости клетки отделяют аккуратным мягким соскабливанием перед промывкой и анализом. Каждую культуру ресуспендируют в окрашивающей среде (солевой сбалансированный раствор Hanks's Balanced Salt Solution с 0,2% натрия бикарбоната, 0,01% азида натрия, 0,1 мМ EDTA, 20 мМ HEPES и 2% фетальной сыворотки теленка) и равномерно распределяют в шесть лунок 96-луночного планшета с V-образным дном. Клетки осаждают центрифугированием с переменным режимом приэх34\ 2100 об./мин на роторе Sorvall RTH-750 и ресуспендируют в 25 мкл окрашивающей среды. Один микрограмм специфического конъюгированного с фикоэритрином антитела вносят в каждую лунку и инкубируют на льду в течение 45 мин. Клетки трижды промывают, ресуспендируют в 200 мкл 2% параформальдегида в ФСБ и анализируют методом жидкостной цитометрии на проточном цитофлуориметре Becton Dickinson FACScalibur. Сортировочные окна обозначают на передней стороне против боковой стороны точечного графика для удаления контаминантных клеток из анализа.
Результаты. В этом эксперименте дифференциацию моноцитов человека в дендровидные клетки в ответ на IFN, полученный из плазмы пациентов с СКВ, блокированных обработкой антителом 9D4-TM, измеряют по экспрессии на поверхности клеток двух маркеров дендровидных клеток, CD38 и CD123. На фиг.18. разные образцы сыворотки пациентов с СКВ не могут повысить экспрессию на поверхности клеток CD38 и CD123 при наличии 9D4-TM. Величины IC50 антитела 9D4-TM варьируют от 0,02 нМ до 0,06 нМ и для CD38, и для CD123.
Заключение. Анти-IFNAR1 антитело 9D4-TM может блокировать способность IFNα, полученного от пациентов с СКВ, индуцировать созревание ПДК, измеренное по экспрессии маркеров на поверхности клеток.
Пример 19. Анти-IFNAR антитела сдерживают экспрессию CD38, CD123 и CD86 в моноцитах, простимулированных лейкоцитарным IFN.
Цель. В этом примере антитела 9D4, 9D4-DM и 9D4 ТМ исследуют по подавлению развития дендровидных клеток, которое оценивают по способности антител ингибировать индукцию маркеров CD38 и CD123 на поверхности клеток лейкоцитарным IFN.
Методы. Моноциты выделяют из цельной крови здоровых доноров, используя среду для отделения лимфоцитов (фирма МР Biomedical, Solon, Огайо), с последующим положительным отбором, используя набор для выделения моноцитов Monocyte Isolation kit II (фирма Milteny Biotec, Auburn, Калифорния). Затем очищенные моноциты культивируют при густоте 1×106 клеток/мл в среде RPMI 1640 с добавлением 10% ФСТ (фирма Gibco BRL). Серийные разведения антител получают до конечных концентраций 3 мкг/мл - 20 пг/мл в среде и вносят в соответствующие лунки с клетками. После предварительного инкубирования примерно в течение 5 мин добавляют 100 МЕ/мл лейкоцитарного IFN человека (фирма PBL Biomedical, Piscataway, Нью-Джерси) в определенные лунки и культуры инкубируют при 37°С, в атмосфере 5% СО2 в течение 48 ч, после чего оценивают экспрессию CD38 и CD123 на поверхности клеток. Вкратце, клетки осаждают центрифугированием при 1200 об./мин в течение 5 мин и культуральную среду удаляют из монослоев путем отсасывания с последующим однократным промыванием стерильным ФСБ. ФСБ удаляют и 1 мл стерильного буфера для диссоциации клеток (фирма Gibco BRL, Карлсбад, Калифорния) или 0,05% трипсина (фирма Invitrogen, Карлсбад, Калифорния) добавляют в лунки для удаления клеток из монослоев. Через 5 мин и краткого перемешивания добавляют равные объемы среды RPMI 1640 с добавлением 10% ФСТ в каждую лунку с последующими двумя сериями центрифугирования и промывки стерильным ФСБ. 50 мкл 1× ФСБ, обогащенного 5% БСА (фирма Sigma, St. Louis, Монтана) и 10 мкг/мл цельного IgG человека (фирма Jackson ImmunoResearch Laboratories, West Grove, Пенсильвания) добавляют в каждую лунку для блокирования связывания неспецифического Fc антитела и инкубируют в течение 10 мин при комнатной температуре. Добавляют в соответствующие лунки по 50 мкл 1× ФСБ, обогащенного 5% БСА и РЕ-анти CD123 человека и FITC-анти CD38 человека антител (фирма Becton Dickinson, Franklin Lakes, Нью-Джерси)и инкубируют в течение 30 мин на льду. Клетки однократно промывают в 1× ФСБ, обогащенным 5% БСА, и измеряют экспрессию белка на поверхности клеток на приборе BD LSRII (фирма Becton Dickinson, Franklin Lakes, Нью-Джерси).
Результаты. На фиг.19 показаны кривые подавления экспрессии CD38 (А), CD123 (Б) и CD86 (В) под воздействием МКПК, простимулированных лейкоцитарным IFN, которые инкубируют с анти-IFNAR антителами 9D4, 9D4DM и 9D4TM. Для каждой молекулы CD анти-IFNAR антитела вызывают схожие кривые подавления, которые используют для получения величин IC50. Для экспрессии CD38 на МКПК, стимулируемых лейкоцитарным IFN (А), анти-IFNAR антитела вызывают следующие величины IC50: 9D4=4,3 нг/мл, 9D4DM=40 нг/мл, 9D4TM=25 нг/мл. Для экспрессии CD123 на МКПК, стимулируемых лейкоцитарным IFN (Б), анти-IFNAR антитела вызывают следующие величины IC50: 9D4=7 нг/мл, 9D4DM=21 нг/мл, 9D4TM=10 нг/мл. Для экспрессии CD86 на МКПК, стимулируемых лейкоцитарным IFN (В), анти-IFNAR антитела вызывают следующие величины IC50: 9D4=20 нг/мл, 9D4DM=20 нг/мл, 9D4TM=26 нг/мл.
Заключение. Результаты в этом примере показывают, что антитела по настоящему изобретению 9D4-DM и 9D4-TM проявляют сходные кривые подавления индуцированных IFN маркеров на поверхности клеток ПДК по сравнению с исходным 9D4 антителом.
Пример 20. Модифицированные анти-IFNAR1 антитела проявляют пониженное связывание с Fc рецептором FcγRI.
Цель. Показать пониженное связывание специфического Fc рецептора с модифицированными анти-IFNAR1 антителами.
Методы. Действие по связыванию модифицированных антител 9D4-DM и 9D4-TM с FcγRI (CD64) человека оценивают методом ELISA. FcγRI в ФСБ (рН 7,4) наносят в лунки в количестве 25 мкг/лунку в планшет для микротитрований (номер в каталоге Costar 3690) при концентрации 20 мкг/мл в течение ночи при 4°С. После промывки и блокирования 4% молоком в течение 1 ч при комнатной температуре биотинилированные 9D4, 9D4TM, 9D4DM и контрольное антитела добавляют в ранее блокированный планшет и инкубируют при 37°С в течение 1 ч, начиная с концентрации 500 мг/мл и с последующими двукратными серийными разведениями. Планшет промывают ФСБ (рН 7,4); содержащим 0,05% of Tween 20, и добавляют в каждую лунку 25 мкл HRP конъюгированного авидина. После инкубирования в течение часа при 37°С планшеты промывают еще раз и добавляют по 50 мкл/лунку субстрата - SureBlue TMB пероксидазы (номер в каталоге KPL 52-00-03). Реакцию останавливают с помощью 50 мкл 0,2 М H2SO4 через 5-10 мин. Сигнал ELISA считывают при 450 нм.
Результаты. В анализе связывания, основанном на методе ELISA (фиг.20), модифицированные анти-IFNAR1 антитела 9D4DM и 9D4TM проявляют пониженное связывающее сродство с FcγRI по сравнению с немодифицированным 9D4WT антителом, а также с контрольным антителом.
Заключение. Эти результаты показывают, что модифицированные анти-IFNAR1 антитела 9D4-DM и 9D4-TM вызывают пониженное сродство с Fc рецептором FcγRI по сравнению с немодифицированным 9D4 антителом. Пониженное сродство с рецептором FcγRI может привести к пониженной индукции ADCC.
Пример 21. Fc рецептор FcγRIIIA проявляет пониженное связывание с модифицированными анти-IFNAR1 антителами.
Цель. Показать пониженное связывание специфического Fc рецептора с модифицированными анти-IFNAR1 антителами 9D4-DM и 9D4-TM по сравнению с немодифицированным анти-IFNAR1 антителом 9D4.
Методы. Пятьдесят мг/мл антител 9D4, 9D4TM и 9D4DM, разведенных в ФСБ, наносят на планшет для микротитрований Immunlon IV на ночь при 4°С. После промывки и блокирования 4% молоком в течение 1 ч при комнатной температуре FcγRIIIA варианты 158F (низкое сродство) и 158V (высокое сродство) с мишенью Flag добавляют в лунки блокированного планшета, начиная с 50 мг/мл, затем двукратными серийными разведениями. Планшеты промывают через 1 ч и инкубируют с биотином, конъюгированным с анти-Flag антителом (фирма Sigma) в концентрации 2 мг/мл. После промывки 25 мкл HRP конъюгированного авидина добавляют в каждую лунку. Несвязанные материалы удаляют промыванием в течение 1 ч после инкубирования. Сигнал связывания обнаруживают с субстратом ТМВ.
Результаты. Результаты исследования связывания на основе метода ELISA между анти-IFNAR1 антителами (9D4WT, 9D4DM и 9D4TM) и Fc рецепторами FcγRIIIA высокого и низкого сродства показаны на фиг.21(А, Б, В). На фиг.21(А) 9D4WT антитела, нанесенные на планшет ELISA, эффективно связывают рецептор FcγRIIIA высокого сродства в концентрациях, больше чем 3 нг/мл, хотя ограничено связывание рецептора FcγRIIIA низкого сродства во всех исследуемых концентрациях. На фиг.21(Б) модифицированные 9D4DM антитела, нанесенные на планшет ELISA, эффективно не связывают рецепторы FcγRIIIA с высоким или низким сродством в какой-либо исследуемой концентрации. Подобным образом на фиг.21(В) модифицированные 9D4TM антитела, нанесенные на планшет ELISA, эффективно не связывают рецепторы FcγRIIIA с высоким или низким сродством в какой-либо исследуемой концентрации.
Заключение. Эти результаты означают, что модифицированные анти-IFNAR1 антитела 9D4-DM и 9D4-TM имеют пониженное сродство с рецептором FcγRIIIA по сравнению с немодифицированным анти-IFNAR1 антителом 9D4. Кроме того, пониженное сродство со специфическим рецептором Fc может привести к снижению эффекторной функции ADCC.
Пример 22. Модифицированные антитела 9D4DM и 9D4TM проявляют пониженное связывание с Fc рецептором FcγRIIIA.
Цель. Показать пониженное связывание специфического Fc рецептора с модифицированными антителами 9D4DM и 9D4TM.
Методы. Пятьдесят мг/мл вариантов FcγRIIIA (FcγRIIIA-10 158F и FcγRIIIA-10 158V) в ФСБ нанесли на планшет для микротитрований Immunlon IV в течение ночи при 4°С. После промывки и блокирования 4% молоком в течение 1 ч при комнатной температуре биотинилированные антитела 9D4, 9D4TM и 9D4DM добавляют в лунки блокированного планшета в концентрации 100 мг/мл. Планшет промывают 1 ч и инкубируют с HRP конъюгированным авидином. Несвязанные материалы удаляют промыванием в течение 1 ч после инкубирования. Сигнал о связывании определяют по субстрату ТМВ.
Результаты. Результаты анализа связывания, основанного на методе ELISA, между Fc рецепторами FcγRIIIA высокого и низкого сродства и анти-IFNAR1 антителами (9D4WT, 9D4DM и 9D4TM) показаны на фиг.22(А, Б, В). На фиг.22(А) немодифицированное анти-IFNAR1 антитело 9D4 в концентрациях больше 3 нг/мл эффективно связывается с рецептором FcγRIIIA высокого сродства, иммобилизованном на планшете ELISA, причем антитело показывает ограниченное связывание с иммобилизованным рецептором FcγRIIIA низкого сродства со всеми исследуемыми концентрациями. На фиг.22(Б) модифицированное анти-IFNAR1 антитело 9D4DM эффективно не связывает иммобилизованные рецепторы FcγRIIIA с высоким или низким сродством в каких-либо исследованных концентрациях по сравнению с немодифицированным 9D4WT анти-IFNAR1 антителом. Сходным образом на фиг.22(В) модифицированное анти-IFNAR1 антитело 9D4TM эффективно не связывает иммобилизованные FcγRIIIA рецепторы высокого или низкого сродства в какой-либо исследуемой концентрации по сравнению с немодифицированным 9D4WT анти-IFNAR1 антителом.
Заключение. Этот пример показывает, что модифицированные антитела 9D4DM и 9D4TM проявляют пониженное сродство с рецептором Fc, FcγRIIIA по сравнению с родительским немодифицированным антителом 9D4. Такое пониженное сродство может привести к снижению опосредованной FcγRIIIA эффекторной функции ADCC по сравнению с родительским антителом.
Пример 23. Нейтрализация подтипов IFNα анти-IFNAR1 антителами.
Цель. Показать способность анти-IFNAR1 антител MDX-1333, 9D4WT и 9D4TM нейтрализовывать специфические подтипы IFNα в репортерном исследовании.
Методы. Репортерные исследования по нейтрализации IFNα хорошо документированы в данной области. В этом примере нейтрализацию IFNα измеряют репортерным исследованием, основанным на H1L3. Далее приводится пример исследования нейтрализации IFNα, используя клетки HiL3 в качестве репортера. Клетки гепатомы человека линии HiL3 трансфецируют плазмидой, содержащей стимулируемый IFNα элемент ответа - люциферазу (ISRE-Luc), и ген устойчивости к неомицину. Эти клетки были любезно предоставлены доктором Michael Tovey (фирма CNRS, Париж, Франция). Клетки Hil3 в количестве 30000 клеток/лунку культивируют в белых отражающих 96-луночных планшетах (фирма DYNEX Microlite) в течение ночи в среде Игла в модификации Дульбекко, содержащей 10% фетальной сыворотки теленка и 1 мг/мл G418 (+пенициллин/стрептомицин/L-глутамин). После инкубирования добавляют различные формы интерферона и планшеты инкубируют в течение 18 ч. Реакцию заканчивают добавлением 10 мл литического буфера в колбу с субстратом для люциферазы (набор Luc Lite Plus kit, фирма Perkin-Elmer); 100 мкл раствора этого субстрата добавляют в каждую лунку и считывают на счетчике Top Count в течение 10 мин (10 мин ожидания в темноте и считывание лунки за 1 сек). Для каждой концентрации IFN определяют число импульсов в секунду (имп./сек) и концентрацию IFN или имп./сек в каждом образце подсчитывают по кривой титрования IFN, используя программное обеспечение Prism software (Сан-Диего, Калифорния) с параметрами линейной регрессии.
Результаты. Нейтрализация способности анти-IFNAR1 антител в отношении IFN разных видов в HiL3 репортерном анализе показаны на фиг.23(А-Д). Анти-IFNAR1 антитела MDX-1333, 9D4WT и 9D4TM ингибируют множество подтипов интерферона I типа со сходной интенсивностью. Анти-IFNAR1 антитела MDX-1333, 9D4WT и 9D4TM нейтрализуют IFNα10 (А) с величинами IC50 0,09880 мкг/мл, 0,008345 мкг/мл и 0,004287 мкг/мл, соответственно. Анти-IFNAR1 антитела MDX-1333, 9D4WT и 9D4TM нейтрализуют лейкоцитарный IFN человека (Б) с величинами IC50 1,121 мкг/мл, 0,02104 мкг/мл и 0,02120 мкг/мл, соответственно. Анти-IFNAR1 антитела MDX-1333, 9D4WT и 9D4TM нейтрализуют IFNα 2b (В) с величинами IC50 0,0006462 Анти-IFNAR1, 0,002789 Анти-IFNAR1 и 0,0008279 мкг/мл, соответственно. Анти-IFNAR1 антитела MDX-1333, 9D4WT и 9D4TM нейтрализуют IFNω (Г) с величинами IC50 5,323 мкг/мл, 0,01015 мкг/мл и 0,01423 мкг/мл, соответственно. Анти-IFNAR1 антитела MDX-1333, 9D4WT и 9D4TM нейтрализуют IFNβ (Д) с величинами IC50 18,97 мкг/мл, 0,7403 мкг/мл и 0,2611 мкг/мл соответственно.
Заключение. Эти результаты показывают, что анти-IFNAR1 антитела MDX-1333, 9D4WT (немодифицированное) и 9D4TM (модифицированное) проявляют сходную специфичность и емкость нейтрализации для множества интерферонов I типа.
Пример 24. Анти-IFNAR1 антитела нейтрализуют IFN I типа в плазме пациентов с СКВ
Цель. Показать способность анти-IFNAR1 антител нейтрализовать IFN I типа в плазме, выделенной от пациентов с СКВ, с помощью измерений репортерным методом.
Методы. Стабильно трансфецированные клетки PIL-5 ISRE поддерживают в среде RPMI 1640+1× пеницидлин-стрептомицин-глутамин + 10% ФСТ и засевают 100000 клеток на лунку в белые/прозрачные 96-луночные планшеты Optilix (VWR, West Chester, Пенсильвания). Титруемые антитела добавляют в соответствующие лунки до конечной концентрации, варьирующей от 90 мкг/мл до 60 пг/мл. Образцы сыворотки пациентов с СКВ, положительные по интерферону I типа, добавляют в каждую лунку до конечной концентрации сыворотки 50% на лунку. Клетки, IFN и антитела инкубируют в течение ночи при 37°С, в атмосфере 5% СО2. После инкубирования в течение ночи клетки быстро осаждают при 1200 об/мин в течение 5 мин и амплификацию люциферазного белка оценивают путем лизиса клеток реагентом для лизиса клеток Cell Culture Lysis и визуализируют, используя систему исследования люциферазы Luciferase Assay System (фирма Promega, Мэдисон, Висконсин). Сигнал измеряют в имп./сек и кривые IC50 получают, используя для анализа программное обеспечение GraphPad Prism 4.
Результаты. Антитело 9D4-TM нейтрализует интерфероны I типа в плазме пациентов с СКВ. Результаты исследования нейтрализации интерферонов I типа в плазме пациентов с СКВ показаны на фиг.24. Нейтрализация интерферона I типа, содержащегося в образце плазмы пациента с СКВ, специфически осуществляется антителом 9D4-TM по сравнению с изотипическим контролем при повышенных концентрациях антитела. В особенности 9D4-TM проявляет величину IC50=0,04 нМ для нейтрализации интерферонов I типа в этом образце плазмы, взятом у пациента с СКВ.
Заключение. Этот результат означает, что модифицированное анти-IFNAR1 антитело 9D4-TM способно эффективно нейтрализовать интерферон I типа у пациентов с СКВ.
Пример 25. Анти-IFNAR антитела подавляют индуцированную IFNα популяцию ПДК среди МКПК
Цель. Показать способность анти-IFNAR1 антител подавлять накопление клеток ПДК в периферической крови мыши - модели СКВ.
Методы. От мышей, используемых в экспериментах в примере 13, также берут образцы для анализа в настоящем примере. МКПК выделяют из селезенки, лимфатических узлов, костного мозга и периферической крови, используя стандартные методы выделения и окрашенные маркеры В220 и Ly6C на поверхности клеток. Выделенные МКПК анализируют методом FACS и дважды положительные клетки (В220 и Ly6C) оценивают в качестве клеток ПДК и родственные популяции представлены на фиг.25.
Результаты. На фиг.25 показано, что эктопическая экспрессия IFNα запускает рост клеток ПДК среди МКПК, выделенных из селезенки (А), лимфоузлов (Б), периферической крови (В) и костного мозга (Г) в присутствии ФСБ или мышиного неспецифического IgG. Мыши, обработанные анти-IFNAR антителами, не накапливают клеток ПДК в ответ на IFN-альфа. Мыши, обработанные контрольным аденовирусом, не накапливают клеток ПДК в популяции МКПК.
Заключение. Эти результаты показывают, что анти-IFNAR антитела специфически блокируют индуцированную IFNa повышенную регуляцию клеток ПДК.
Пример 26. Модифицированные анти-IFNAR1 антитела проявляют пониженное связывающее сродство с рецепторами Fc.
Цель. Оценка относительного связывающего сродства модифицированных анти-IFNAR1 антител 9D4-DM и 9D4-TM по сравнению с исходным немодифицированным антителом 9D4 с различными рецепторами Fc.
Методы. Все эксперименты проводят на приборе BIAcore 3000 (фирма BIAcore, Inc., Уппсала, Швеция). В типичном эксперименте 1 мкМ растворы иммуноглобулинов 9D4 IgG используют для иммобилизации примерно от ~7000 КЕ до ~11000 КЕ на поверхности сенсорных чипов СМ5, используя стандартный протокол соединения аминокислот (фирма BIAcore, Inc.). Отдельно на каждом чипе также получают чистую поверхность, используя тот же протокол, но без белка. На протяжении всего эксперимента такие чистые поверхности используют в качестве клеточного контроля и они служат для коррекции неспецифического связывания и некоторых артефактов «домашнего хозяйства». Для экспериментов по связыванию тестов получают FcγRI в концентрации 20 нМ в буфере HBS-EP (фирма BIAcore, Inc.), состоящим из: 10 мМ буфер HEPES, рН7,4, 150 мМ NaCl, 3 мМ EDTA и 0,005% Р20. Между инъекциями FcγRI вырабатывают на поверхности IgG путем инъекции 5 ммолей HCl, длящейся 1 мин. Перекрывание сенсограмм получают, используя программное обеспечение BIAevaluation 4.1 (фирма BIAcore, Inc., Уппсала, Швеция).
Результаты. Анти-IFNAR1 антитело 9D4 и модифицированные анти-IFNAR1 антитела 9D4-TM и 9D4-DM исследуют на связывающее сродство с иммобилизованным белком FcγRI в формате исследования BIAcore. На фиг.26 показано, что анти-IFNAR1 антитело 9D4 проявляет высокое сродство с иммобилизованным FcγRI. Связывание анти-IFNAR1 антитела 9D4 с FcγRI является специфичным, поскольку аналогичное исследование с яичным альбумином проявляет очень небольшое сродство с иммобилизованным рецептором. Модифицированные анти-IFNAR1 антитела 9D4-TM и 9D4-DM проявляют пониженное сродство иммобилизованного рецептора FcγRI по сравнению с немодифицированным 9D4 анти-IFNAR1 антителом.
Заключение. Полученное пониженное сродство в отношении FcγRI, проявляемое модифицированными анти-IFNAR1 антителами 9D4-TM и 9D4-DM, означает, что эти антитела могут иметь пониженную способность к активированию ADCC in vivo.
Пример 27. Рецепторы Fc проявляют пониженное связывающее сродство с модифицированными анти-IFNAR1 антителами.
Цель. Оценить относительное связывающее сродство различных рецепторов Fc с модифицированными анти-IFNAR1 антителами 9D4-DM и 9D4-TM и исходным немодифицированным анти-IFNAR1 антителом 9D4.
Методы. Измерения поверхностного плазменного резонанса.
Все эксперименты проводят на приборе BIAcore 3000 (фирма BIAcore, Inc., Уппсала, Швеция). В обычном эксперименте 1 мкМ раствор FcγRI используют для иммобилизации примерно от ~7000 КЕ до ~11000 КЕ белка на поверхностях сенсорного чипа СМ5, используя стандартный протокол соединения аминокислот (BIAcore, Inc.). Отдельно на каждом чипе также получают чистую поверхность, используя тот же протокол, но без белка. На протяжении всего эксперимента такие чистые поверхности используют в качестве клеточного контроля и они служат для коррекции неспецифического связывания и некоторых артефактов «домашнего хозяйства». Для экспериментов по связыванию тестов получают антитела в концентрации 333 нМ в буфере HBS-ЕР (фирмы BIAcore, Inc., состоящий из: 10 мМ буфера HEPES, рН 7,4, 150 мМ NaCl, 3 мМ EDTA и 0,005% Р20. Между инъекциями антитела FcγRI вырабатывают на поверхности IgG путем инъекции 3 М MgCl2, длящейся 1 мин. Перекрывание сенсограмм получают, используя программное обеспечение BIAevaluation 4.1 (фирма BIAcore, Inc., Уппсала, Швеция).
Результаты. Анти-IFNAR1 антитела 9D4, 9D4-TM и 9D4-DM иммобилизуют и инкубируют с растворимым FcγRI. Связывающее сродство растворимого FcγRI рецептора с каждым из анти-IFNAR1 антител измеряют методом BIAcore, и получаемые кривые представлены на фиг.27 А, Б и В. Рецептор FcγRI связывает иммобилизованное анти-IFNAR1 антитело 9D4 с высоким сродством, показанным на фиг.27А. Такое взаимодействие высоко специфично, поскольку яичный альбумин не показывает какого-либо связывания с иммобилизованным анти-IFNAR1 антителом 9D4. Модифицированные антитела 9D4-TM и 9D4-DM в отличие от немодифицированного антитела 9D4 не связывают FcγRI так же сильно. На фиг.27Б модифицированное анти-IFNAR1 антитело 9D4-DM иммобилизируют и инкубируют или с растворимым FcγRI или с яичным альбумином. Рецептор FcγRI проявляет низкое связывающее сродство с иммобилизованным антителом 9D4-DM. Такое связывающее сродство сходно с неспецифическим взаимодействием, наблюдаемым в случае растворимого яичного альбумина. На фиг.27В модифицированное анти-IFNAR1 антитело 9D4-TM иммобилизируют и инкубируют или с растворимым FcγRI, или с яичным альбумином. Рецептор FcγRI проявляет низкое связывающее сродство с иммобилизованным антителом 9D4-TM. Такое связывающее сродство сходно с неспецифическим взаимодействием, наблюдаемым в случае растворимого яичного альбумина.
Заключение. Пониженное сродство, проявляемое Fc рецептором FcγRI в отношении иммобилизованных модифицированных анти-IFNAR1 антител 9D4-DM и 9D4-TM относительно немодифицированного анти-IFNAR1 антитела 9D4 означает, что модифицированные антитела могут проявлять пониженную способность вызывать ответ ADCC.
Пример 28. Анти-IFNAR антитела блокируют зависящую от IFNα индукцию генов
Цель. Показать способность анти-IFNAR антител блокировать зависящую от IFNα индукцию генов в мышах - модели СКВ.
Методы. От мышей из экспериментальных процедур, описанных в примере 13, также получают образцы для анализа в этом примере. Через 8 недель в эксперименте мышей умерщвляют и удаляют ткань почки. Не более 50 мг ткани используют для экстракции РНК, используя лизирующий буфер RLT (фирма Qiagen). Образцы помещают в лизирующий буфер и лизирующий матрикс А (фирма Qbiogene) и обрабатывают в течение 30 сек при 4,5 м/сек, используя гомогенизатор Fastprep24 (фирма Thermo Electron Corporation, Уолтем, Массачусетс). Для выделения РНК оттаянные тканевые лизаты сначала процессируют, используя спиновые колонки Qiashredder, затем равные объемы 70% этанола добавляют к тканевым лизатам и РНК очищают, используя наборы мини-наборы для спиновых колонок Rneasy, следуя инструкциям производителя. Из 3 мкг РНК получают кДНК, используя обратную транскриптазу Superscript III и праймер олиго-d(Т) согласно протоколу производителя (фирма Invitrogen, Corp. Карлсбад, Калифорния). Образцы кДНК разводят в воде, не содержащей рестриктазы, и хранят при -80°С.
Уровни экспрессии выбранных генов измеряют методом ПЦР реального времени TaqMan®, используя систему ABI 7900HT Fast Real-time PCR (фирма Applied Biosystems, Foster City, Калифорния). Ген β-актина, относящийся к генам «домашнего хозяйства», используют для эндогенного контроля. Конечный объем реакционной смеси равен 20 мкл и состоит из 1 мкл кДНК, 2 мкл 20× праймеров и зондов (метод генной экспрессии TaqMan®, фирма Applied Biosystems) и 18 мкл разведенной смеси TaqMan® Fast Universal PCR Master Mix. Условия амплификации: 20 сек при 95°С, 50 циклов по 1 сек при 95°С и 20 сек при 60°С. Величины СТ варьируют от 0 до 50, причем последнее число означает отсутствие формирования продукта. Количественную оценку генной экспрессии проводят, используя сравнительный метод СТ (Sequence Detector User Bulletin 2; фирма Applied Biosystems), и выражают в виде кратности величины отличия относительно гена «домашнего хозяйства».
Результаты. На фиг.28 показаны результаты сравнительного анализа экспрессии в почках 6 генов, индуцированных интерфероном альфа, через 8 недель в мышах - модели с усиленным проявлением волчанки. Мышей, врожденно экспрессирующих интерферон альфа, обрабатывают мышиным IgG или анти-IFNAR антителами. Через 8 недель у мышей, обработанных контрольным IgG, показана на высоком уровне индукция генов, ответственных за IFNα, а именно ICAM1, VCAM1, CXCL9, CXCL10 и IFIT1. В мышах, обработанных анти-IFNAR антителами, не показана индукция генов, ответственных за IFNα, через 8 недель.
Заключение. В мышах - модели с усиленным проявлением волчанки, лечение анти-IFNAR антителами блокирует индукцию в почках шести генов (ICAM1, VCAM1, CXCL9, CXCL10 и IFIT1), опосредованную врожденно экспрессируемым IFN-альфа по сравнению с контрольными мышами по данным измерения методом Taqman. Эти результаты показывают, что анти-IFNAR антитела способны блокировать опосредованную IFNα передачу сигнала в мышах - модели СКВ.
Пример 29. Анти-IFNAR антитела ингибируют накопление аутоантитела в сыворотке
Цель. Показать способность анти-IFNAR антитела ингибировать накопление аутоантител в сыворотке мышей - модели СКВ.
Методы. От мышей из экспериментальных процедур, описанных в примере 13, также получают образцы для анализа в этом примере. Образцы цельной крови берут с интервалом 1 неделя со 2 по 7 неделю используемого режима. Уровни сывороточного анти-днДНК аутоантитела определяют методом ELISA. Вкратце, планшеты ELISA предварительно обрабатывают поли(L-лизином) (100 мкг/мл), покрывают активированной ДНК тимуса теленка (5 мкг/мл в карбонатном-бикарбонатном буфере) (фирма SIGMA). После инкубирования в течение ночи при 4°С планшеты блокируют с помощью ФСБ/10% ФСТ. Сыворотку (разведение 1/200) инкубируют в течение 30 мин при комнатной температуре. Связанный IgG обнаруживают с помощью конъюгированного с пероксидазой козьего анти-мышиного IgG (1/4000) (KPL), добавленного в планшеты, в течение 30 мин. Связывание измеряют добавлением субстрата ТМВ (KPL) и стоп-раствора (KPL), и оптическую плотность считывают при 450 нм. Стандарт мышиного анти-днДНК IgG в сыворотке серийно разводят в каждом планшете (от 625 нг/мл) (фирма Alfa Diagnostic) для стандартизации.
Результаты. На фиг.29 показаны результаты, полученные методом ELISA, по уровням анти-днДНК в сыворотке мыши на протяжении курса у мышей - модели с усиленным проявлением волчанки. Мышей, врожденно экспрессирующих IFNα, обрабатывают анти-IFNAR антителами или контрольными антителами IgG мыши на протяжении режима 7 недель. Мыши, не обработанные анти-IFNAR антителами, не накапливают анти-днДНК антител в той же степени или в той же протяженности по сравнению с мышами, обработанными контрольными IgG антителами. У мышей, инфицированных контрольным аденовирусом, не развиваются анти-днДНК антитела на протяжении курса.
Заключение. Эти результаты показывают, что анти-IFNAR антитела снижают накопление анти-днДНК антител в ответ на повышенные уровни IFN альфа.
Пример 30. Анти-IFNAR антитела снижают протеинурию в мышах-модели с усиленным проявлением волчанки.
Цель. Показать способность анти-IFNAR антител снижать сформированную протеинурию (установленную терапевтически) на модели мышей с СКВ.
Методы. От мышей из экспериментальных процедур, описанных в примере 13, также получают образцы для анализа в этом примере. Однако, при терапевтическом подходе, у мышей допускают развитие протеинурии в виде симптома волчанки до применения антител. Конкретно допускают развитие протеинурии у мышей с оценкой 2,0-2,5, описанной ранее. Когда пороговый уровень протеинурии пройден, проводят режим обработки дозами ФСБ, контрольного IgG или анти-IFNAR антител дважды в неделю в течение 5 дополнительных недель. Дважды в неделю берут анализы мочи для анализа и получения оценки протеинурии.
Результаты. На фиг.30А представлены результаты терапевтического исследования анти-IFNAR антител, снижающих оценку протеинурии у мышей, представляющих модель с повышенным проявлением волчанки. Вкратце, допускали развитие у мышей протеинурии и животным в разных группах вводили или ФСБ, или контрольный IgG, или анти-IFNAR антитела в качестве лечения. Из данных на фигуре следует, что оценка протеинурии снижается только в группе, получающей анти-IFNAR антитела. У мышей, получающих в качестве лечения ФСБ или контрольный IgG, продолжает со временем повышаться оценка степени проявления протеинурии. (Б) Анализ площади под кривой по результатам, полученным через пять недель, показал, что группа, в которой мышей лечили анти-IFNAR антителом, отличается от обеих групп, в которых мышей обрабатывали только ФСБ или контрольным IgG, и в которых результаты были схожи.
Заключение. Эти результаты показывают, что анти-IFNAR антитела могут применяться в терапевтическом лечении СКВ.
Пример 31. Анти-IFNAR антитела снижают смертность в мышах - модели с усиленным проявлением волчанки.
Цель. Показать способность анти-IFNAR антител понизить смертность мышей с установленной терапевтически моделью СКВ.
Методы. От мышей из экспериментальных процедур, описанных в примере 13, также получают образцы для анализа в этом примере. При терапевтическом подходе допускают развитие у мышей протеинурии в качестве симптома волчанки до начала применения антител. Конкретно допускают развитие протеинурии у мышей с оценкой 2,0-2,5, описанной ранее. Когда пороговый уровень протеинурии пройден, проводят режим лечения дозами ФСБ, контрольного IgG или анти-IFNAR антител дважды в неделю в течение 5 дополнительных недель. Общую смертность прослеживают в течение дополнительных 4 недель.
Результаты. На фиг.31 приведены показатели смертности, полученные из терапевтического исследования анти-IFNAR антител на модели с усиленным проявлением волчанки. Вкратце, после формирования протеинурии в группе мышам вводят или ФСБ, или контрольный IgG, или анти-IFNAR антитела в качестве лечения. У мышей, обработанных анти-IFNAR антителами, не отмечают гибели к 5 неделям, хотя у мышей, обработанных ФСБ или контрольным IgG, степень смертности достигает 87,5% и 62,5% соответственно. Кроме того, на протяжении 9 недель исследования у животных, обработанных анти-IFNAR антителами, проявляется высокая степень выживания по сравнению с животными, обработанными ФСБ или контрольным IgG.
Заключение. Результаты в этом примере показывают, что анти-IFNAR антитела могут понизить смертность, ассоциированную с волчанкой.
Пример 32. Отсутствие опосредованного антителом 9D4-TM действия ADCC.
Цель. Чтобы подтвердить, что антитело 9D4-TM не может индуцировать действие ADCC из-за присущего ему слабого связывающего сродства с рецепторами FcγRI и FcγRIIIA, проводят серии экспериментов.
Методы. Клетки-мишени 293F метят меткой для клеток DiO (фирма Invitrogen, эксперименты I и II) и комбинируют с немечеными эффекторами МКПК (в течение 4 ч при 37°С) при отсутствии или наличии 10 мкг/мл антитела 9D4-TM, изотипического IgG1 человека в виде отрицательного контроля R3-47, 9D4-WT или анти-EphA2 антитела, используемого в качестве положительного контроля. Лизис клеток-мишеней оценивают по измерению DiO+/PI+ (пропидия иодита) двойного положительного окрашивания. Соотношение эффектор-мишень составляет 50-1, процент лизиса подсчитывают по формуле: [(процент двойного положительного окрашивания в присутствии антитела - процент двойного положительного окрашивания только в среде) / (процент двойного положительного окрашивания в лизирующем буфере - процент двойного положительного окрашивания только в среде)]. Сто процентов лизиса достигают добавлением лизирующего буфера (фирма Promega).
В другом варианте клетки-мишени 293F инкубируют с клетками линии трансгенных клеток NK, стабильно экспрессирующих FcγRIIIA (эксперимент III) в течение 4 ч при 37°С, в отсутствии или в присутствии 10 мкг/мл антитела 9D4-TM, изотипического IgG1 человека в виде отрицательного контроля R3-47, 9D4-WT или анти-EphA2 антитела, используемого в качестве положительного контроля. Соотношение эффектор-мишень составляет 4-1, процент лизиса подсчитывают по формуле: 100× (экспериментальная величина - эффекторная спонтанная величина - целевая спонтанная величина) /(целевой максимум - целевая спонтанная величина).
В экспериментах I и II (соотношение МКПК-293Н составляет 50-1) процент лизиса рассчитывают по формуле; [(процент двойного положительного окрашивания в присутствии антитела - процент двойного положительного окрашивания только в среде) / (процент двойного положительного окрашивания в присутствии лизирующего буфера - процент двойного положительного окрашивания только в среде)]. В эксперименте III (соотношение линии трансгенных клеток NK, экспрессирующих FcγIIIA, к 293Н составляет 4-1) процент лизиса рассчитывают по формуле: 100× (экспериментальная величина - эффекторная спонтанная величина - целевая спонтанная величина) /(целевой максимум - целевая спонтанная величина).
Результаты. Модифицированное антитело 9D4-TM или немодифицированное антитело 9D4-WT не проявляют регистрируемого действия ADCC в отношении клеток 293F, превышающего действие в случае антитела R3-47 (табл.4). Напротив, положительное контрольное антитело, анти-EphA2 антитело, вызывает двукратное повышение цитотоксичности относительно фонового уровня. Эти результаты подтверждают, что антитело 9D4-TM не может опосредовать ADCC в отношении мишеней, экспрессирующих IFNAR1.
Заключение. Эти результаты показывают, что модифицированное анти-IFNAR1 антитело 9D4-TM не стимулирует выявляемого действия ADCC, направленного на клетки-мишени, экспрессирующие IFNAR1.
Пример 33. Трехмерные структуры области Fc человека, включающей мутации L234F/L235E/P331S.
Цель. Определить трехмерные структуры области Fc IgG1 человека, включающие мутации L234F/L235E/P331S (Fc-TM).
Методы
Очистка Fc-TM. Фрагмент Fc/TM человека получают в результате ферментативного расщепления антитела 9D4-TM. Расщепление проводят, используя иммобилизованный фицин, по инструкциям производителя (фирма Pierce). Очистку сначала проводят на колонках HiTrap с белком А по инструкциям производителя (фирма GE Healthcare, Piscataway, Нью-Джерси). После диализа в 50 мМ NaOAc/pH 5,2 раствор белка наносят на колонку HiTrap SP HP (фирма GE Healthcare) и собирают в исключенном объеме. Исключенный объем загружают на колонку HiTrap Q (фирма GE Healthcare) и элюируют в градиенте NaCl для получения гомогенного препарата Fc/TM, оцениваемого по методу SDS-PAGE в редуцирующих и нередуцирующих условиях. Fc-TM SDS-PAGE профиль показывает наличие только одной полосы около 25 кДа или 50 кДа в редуцирующих и нередуцирующих условиях, соответственно. Это наблюдение четко показывает наличие по меньшей мере одной дисульфидной связи внутри цепи по положению С226 и/или С229. Следовательно, мутантные «расположенные ниже» остатки F234 и Е235 содержатся в полипептидной цепи, представляющей кристалл.
Кристаллизация белка Fc-TM. Очищенный белок Fc-TM концентрируют примерно до 5 мг/мл, используя концентратор Centricon (фирма Millipore, Billerica MA, отсечение 30 КДа). Условия кристаллизации идентифицируют, используя коммерческий скрининг от фирм Hampton Research (фирма Hampton Research, Aliso Viejo, Калифорния), Emerald BioSystems (фирма Emerald BioSystems, Inc., Bainbridge Island, Вашингтон) и Molecular Dimensions (фирма Molecular Dimensions Inc., Apopka, Флорида). Каждый скрининг дает несколько потенциально пригодных условий кристаллизации. При оптимизации получают кристаллы дифракционного качества из 0,2 М ацетата цинка, 0,1 М имидазола малата, рН 8,0, 5% ПЭГ 3350, 5% глицерина при концентрации белка 2,0 мг/мл. В этих условиях хорошо сформированные кристаллы с тремя измерениями, варьирующими от 0,1 до 0,2 мм, выращивают за 2-3 суток.
Сбор данных. Данные по дифракции получают от одного кристалла в Центре Перспективных исследований в биотехнологии (Center for Advanced Research in Biotechnology - фирма CARB, Университет Мэрилендского биотехнологического Института, Роквилл, Мэриленд), используя ротационный анодный генератор Rigaku MicroMax™ 007 с сигнальной пластиной R-AXIS IV++ (фирма Rigaku/MSC, The Woodlands, TX). Перед охлаждением кристалл хранят в течение нескольких минут в его растворе для роста с добавлением 20% глицерина. Затем кристалл охлаждают до 105°К с криогенным охладителем X- stream 2000 (Rigaku/MSC). Дифракция до 2,3 Å достигается после одного круга отжига согласно описанию Oganesyan и др., 2007. Данные по дифракции, включающие 234 изображения, собирают, используя диапазон колебания 0,5°, кристалл/детектор расстояния 200 мм и время экспозиции 600 сек. Данные объединяют и масштабируют, используя программное обеспечение HKL 2000 (Otwinowski & Minor, 1997).
Определение структуры. Молекулярное замещение, уточнение структуры и подсчет электронной плотности проводят, используя программное обеспечение ССР4 (фирма Collaborative Computational Project). C-лицевой центрированный ромбический кристалл содержит 58% растворителя и VM 2,9, допуская один полипептид Fc в асимметричной единице клетки. Кристаллическую структуру Fc/TM определяют молекулярным замещением и уточнением при разрешении 2,3Å. Структуру Fc человека, соответствующую PDB ID No 2DTQ (Matsumiya и др., J. Mol. Biol. 368, 2007, cc.767-779), используют в качестве модели в связи с ее высоким разрешением и нелигандным состоянием. В частности, домены CH2 и CH3 были оценены раздельно для минимизации какого-либо смещения в терминах относительной конформации доменов. Данные до 3,0 Å используют для цели молекулярного замещения, применяя фазер (МсСоу и др., Acta Cryst. D61, 2005, cc.458-464). После очищения растворов конечный LL-прирост и Z-оценка составляют 1192 и 31, соответственно. Взвешенная электронная плотность, рассчитанная с помощью FWT/PHWT при 3,0 Å, показывает хорошее сличение с моделью за исключением некоторых петель в CH2 и CH3 доменах. Сильное положительное отличие электронной плотности, рассчитанное с помощью DELFWT/PHDELWT, наблюдают в ожидаемом месте N-связанных углеводных остатков, присоединенных к N297. Какая-либо плотность отсутствует у какого-либо шарнирного остатка, предшествующего остатку в положении 236, результат предположительно относится к высокой эластичности этой области. Установлено, что только две ранее описанные нелигандные структуры Fc человека могут выявить положения 234 и 235 (2DTQ/2DTS; Matsumiya и др., J. Mol. Biol. 368, 2007, cc.767-779). Также не могут быть визуализированы остатки в положениях 446 и 447. Остаток в положении 331 был впервые сконструирован в виде аланина.
Несколько чередующихся циклов уточнения с использованием программы «Refmac 5» (Murshudov и др., Acta Cryst. D53, 1997, cc.240-255) и конструирования структуры вручную с использованием графической компьютерной программы «О» (Jones и др., (1991) Acta Cryst. A47, 110-119) сходятся с величиной Rфактор, составляющей 21,6, и величиной свободного Rфактор, составляющего 27,5, для данных при разрешении 2,3 А. После первого цикла уточнения по данным электронной плотности идентифицировано положение сахаридных остатков и замена на остаток серина в положении 331. На остальных стадиях уточнения модель анализировали с использованием программы TLS Motion Determination (TLSMD), поступающей от соответствующего сервера (Painter и др., J. Appl. Cryst. 39, 2006, cc.109-111; Painter и др., Acta Cryst. D62, 2006, cc.439-450). Следующие циклы уточнения проводили с использованием программы метода уточнения жестких моделей на пяти определенных группах остатков (остатки 236-324, 325-341, 342-358, 359-403 и 404-445). Ионы цинка, присутствующие в буферном растворе для кристаллизации, идентифицировали по электронной плотности и определяли их положение в модели, если позволяли координационные сфера и расстояние. В частности устанавливают координаты одного иона цинка по Н310 и Н435. Другой координируют по Н285 и Н268 в симметрично соотнесенном полипептиде. Два других иона цинка расположены в координатах Е-318 и Е345. Во всех случаях молекулы воды дополняют ожидаемую координационную сферу ионов цинка. Углеводную часть молекулы моделируют по электронной плотности, и итоговая модель содержит девять остатков сахара, по существу описанных нами в контексте другой Fc структуры человека (Oganesyan и др., Molecular Immunology, December 11, 2007, в печати). Итоговая модель содержит 75 молекул растворителя. Данные кристаллографии и статистику очистки приводят в табл.6.
Результаты. Fc-TM кристаллизуется в пространственной группе C2221 с одним полипептидом в асимметричной области (фиг, 32). Получают дифрактограммы кристалла с разрешением 2,3 Å и с относительно высокою средней мозаичностью 1,26°. Такая высокая мозаичность объясняется свойствами холодных, и неохлажденных кристаллов. Все остатки в положениях 236-445 могут быть отслежены по электронной плотности, причем не наблюдают электронной плотности для остатков шарнирной области перед положением 236, таким образом компенсируя невидимость мутаций L234F и L235E. Электронная плотность в положении 331 соответствует серину.
Атомные координаты и экспериментальные структурные факторы Fc-TM были депонированы в банке данных белков Protein Data Bank под номером в каталоге 3C2S.
Общая трехмерная структура Fc-TM очень близка ранее описанным структурам нелигандных областей Fc человека (Deisenhofer, Biochemistry, 20, 1981, cc.2361-2370; Krapp и др., J. Mol. Biol. 325, 2003, cc.979-989; Matsumiya и др., J. Mol. Biol. 368, 2007, cc.767-779; Oganesyan и др., Molecular Immunology, December 11, 2007, в печати). Точнее структуры Fc человека соответствуют PDB ID номерам 1H3W (Krapp и др., J. Mol. Biol. 325, 2003, cc.979-989) и 2QL1 (Oganesyan и др., Molecular Immunology, December 11, 2007, в печати), которые наиболее близки к Fc-TM в отношении параметров элементарной ячейки, содержания асимметричной области, пространственной группы и упаковки. При индивидуальной оценке домены Fc-TM CH2 и CH3 характеризуются высокой консервативностью и жесткостью структуры при сравнении с другими нелигандными немутантными структурами Fc человека. Например, среднеквадратичные координационные смещения атомов Со, составляют 0,6 и 0,4 Å для доменов CH2 и CH3, соответственно, при наложении Fc-TM с цепью А PDB ID номер 2DTQ (Matsumiya и др., J. Mol. Biol. 368, 2007, cc.767-779).
Табл.7, представленная ниже, предусматривает координаты атомных структур антитела Fc-TM. В табл.7 представлены нижеследующие аббревиатуры.
Обозначение «тип атома» относится к элементу, координаты которого предусмотрены. Первая буква в колонке означает элемент.
Обозначение «А.А.» означает аминокислоту.
Обозначения «X, Y и Z» означают декартовы координаты элемента.
«В» означает температурный фактор, который соответствует движению атома вокруг его атомного центра.
«ОСС» относится к занятости и представляет процент времени, в течение которого атом определенного типа занимает в конкретных координатах. Величины ОСС варьируют от 0 до 1, причем 1 соответствует 100%.















































Заключение. Установлено, что трехмерная структура Fc/TM весьма схожа со структурой других нелигандных немутированных областей Fc человека. Выраженные широко варьирующие функциональные эффекты набора ТМ замещений не были вызваны крупными структурными перестройками в структуре Fc, а предпочтительнее за счет локализованных утрат нескольких взаимодействий по сайтам мутаций.
Пример 34. Интернализация анти-IFNAR1 антител
Цель. Исследование способности анти-IFNAR1 антител к интернализации в клетках.
Методы. Клетки ТНР-1 культивируют в среде RPMI-1640, содержащей 0,05 мМ 2-меркаптоэтанола и 10% фетальной сыворотки теленка при 37°С в инкубаторе с 5% СО2. Клетки ТНР-1 засевают в количестве 2×105 клеток/мл в свежую культуральную среду за сутки до эксперимента. В день проведения эксперимента клетки промывают, подсчитывают и заново суспендируют в ФСБ в количестве 3×106 клеток/мл. Клетки окрашивают 1 мкМ CFSE при 37°С в инкубаторе с СО2 в течение 10 мин. После двух дополнительных промываний в ФСБ клетки помещают на лед и инкубируют с блокатором FcR, используя 20 мкл на 106 клеток на льду в течение 5 мин, и затем окрашивают 1 мкг/мл Alexa647-9D4-TM или Alexa 647-R347 (неспецифическое контрольное антитело) на льду в течение 1 ч. После удаления несвязанного mAb путем 3 промываний ФСБ клетки ресуспендируют в ФСБ, содержащем 2% БСА и азид натрия. Начинают интернализацию путем переноса клеток в камеру с контролем среды: с температурой 37°С, 5% СО2 и 70% влажностью, и кинетику интернализации Alexa647-9D4-TM записывают на протяжении времени наблюдения флуоресценции клеток.
Флуоресценцию клеток анализируют, используя алгоритм. В этом алгоритме применяют цитозольный краситель CFSE для идентификации связи клетки и мембранной области. С помощью алгоритма подсчитывают ассоциированную с антителом 9D4-TM флуоресценцию внутри клеток, а также на мембране. Степень флуоресценции, накопленной внутри клеток, подсчитывают с помощью модели подбора данных, используя программное обеспечение SAAMII.
Результаты. Alexa647-9D4-TM связывается с клетками ТНР-1. Не наблюдают связывания Alexa647-R347, изотипического контроля 9D4-TM, на тех же клетках. Этот результат показывает специфическое связывание с клетками ТНР-1 9D4-TM (фиг.33). При 4°С связывание 9D4-TM преимущественно локализовано на поверхности клеток (0 мин - фиг.33). Если клетки инкубируют при 37°С сигнал флуоресценции для окрашивания 9D4-TM существенно понижен с поверхности клеток и накапливается в цитозольном компартменте в виде прерывистых крапинок. Кинетические изображения, записанные на протяжении 60 мин, показывают постепенную миграцию флуоресценцию с поверхности клеток к прерывистым крапинкам, локализованным в цитозольном компартменте (через 15, 30 и 50 мин, фиг.33). Результаты четко показывают интернализацию антитела 9D4-TM на клетках ТНР-1.
Пример 35. Отсутствие действия CDC, опосредованного антителом 9D4-TM
Цель. Проводят серии экспериментов, чтобы определить, способно ли антитело 9D4-TM индуцировать действие CDC.
Методы. Свеже взятую кровь (примерно 100 мл) от здоровых людей-доноров собирают и осаждают центрифугированием в течение 10 мин при 3000 g для отделения сыворотки от клеток. Фракцию сыворотки разделяют на две пробирки. Содержимое первой пробирки разводят средой RPMI 1640 без фенола до конечной концентрации 10% сыворотки (не инактивированной нагревом (НИН)). Вторую пробирку помещают на водяную баню 56°С и выдерживают в течение 30 мин для тепловой инактивации компонентов комплемента. Затем содержимое второй пробирки разводят средой RPMI 1640 без фенола до конечной концентрации 10% сыворотки человека, инактивированной нагревом (ИН).
Клетки Daudi В используют в качестве клеток-мишеней, поскольку они экспрессируют CD20 (мишень для антитела положительного контроля) и IFNAR1. Клетки-мишени промывают и ресуспендируют в среде RPMI без фенола с 10% не инактивированной нагревом сыворотки или в среде RPMI без фенола с 10% инактивированной нагревом сыворотки до конечной концентрации 0,4×106 клеток/мл. Растворы антитела получают в виде 3× серий разведении с концентрациями, варьирующими от 50 мкг/мл до 1,3×10-6 мкг/мл. Повторяемые растворы препаратов антител производят в каждой среде - и с инактивированной теплом сывороткой человека, и с неинактивированной теплом сывороткой человека. Исследование CDC производят добавлением 50 мкл сред НИН или ИН в соответствующие круглодонные лунки 96-луночного планшета. В соответствующие лунки добавляют по 50 мкл серийных растворов антител. Затем в лунки вносят по 50 мкл препаратов клеток-мишеней, в том числе в дополнительные лунки только с клетками-мишенями в качестве контроля. Планшеты инкубируют при 37°С в течение 4 ч в атмосфере 5% СО2. Через 3,5 ч инкубирования добавляют по 20 мкл литического буфера в соответствующие контрольные лунки, предназначенные для определения сигнала максимального лизиса. Анализ высвобождения лактатдегидрогеназы (ЛДГ) Quantitate™ проводят, используя протоколы, описанные в исследовании нерадиоактивной цитотоксичности фирмы Promega №01780. Поглощение измеряют при 490 нМ, и Kd величины получают, используя программное обеспечение для анализа GraphPad Prism 4.
Результаты. На фиг.34 представлены результаты по CDC, полученные согласно описанному выше. Модифицированное анти-IFNAR1 антитело 9D4-TM не проявляет выявляемого действия CDC на клетки-мишени Daudi В, превышающего такое же действие антитела R347. Напротив, положительное контрольное антитело, которое связывает антиген CD20, экспрессируемый на клетках Daudi В, вызывает доза-зависимое повышение цитотоксичности, превышающее уровень фона. Эти результаты подтверждают, что антитело 9D4-TM не может опосредовать CDC в клетках-мишенях, экспрессирующих IFNAR1.
Пример 36. Модифицированное анти-IFNAR1 антитело 9D4-TM не проявляет какой-либо побочной токсичности
Цель. Чтобы подтвердить, что антитело 9D4-TM не вызывает какой-либо побочной токсичности, исследуют токсичность, вызванную одной дозой у макак крабоедов.
Методы. В настоящем исследовании в 4 группах, включающих по 10 животных каждая (5/пол/группу), животные получают по одной дозе 0, 5, 30 или 100 мг/кг антитела 9D4-TM в первые сутки. После дозирования по 2 животных/пол/группу умерщвляют и вскрывают на 3 сутки, а всех оставшихся животных подвергают мониторингу до 70 суток и затем удаляют из исследования без вскрытия. Токсичность оценивают по смертности, клиническим признакам (включая менструации), иммунофенотипированию, массе тела, состоянию здоровья (по частоте сокращений сердца, частоте дыхания и температуре тела), клинической патологии, массе органов и данным микроскопии.
Результаты. В условиях, указанных выше, нет связанных с антителом 9D4-TM нежелательных изменений в показателях смертности, клинических признаках (включая менструации), массе тела, состоянии здоровья (сокращениях сердца, частоте дыхания и температуре тела), клинической патологии, массе органов и данных микроскопии. Эти результаты означают, что модифицированное анти-IFNAR1 антитело 9D4-TM не вызывает какой-либо побочной токсичности.
Поскольку конкретные варианты осуществления настоящего изобретения приведены для пояснения описания, специалистам в данной области очевидно, что многочисленные вариации деталей могут быть произведены без отклонения от рамок охвата настоящего изобретения, обозначенных в прилагаемой формуле изобретения.
Все публикации, патенты и патентные заявки, упоминаемые в описании настоящего изобретения, включены в него в виде ссылок в зависимости от того, насколько конкретно каждую отдельную публикацию, патент и патентную заявку целесообразно включить в настоящее изобретение в виде ссылки.
Реферат
Предложенное изобретение относится к иммунологии. Предложено моноклональное анти-IFNAR1 антитело с мутациями L234F, L235E и P331S в области Fc человеческого IgG1, обладающее пониженным сродством в отношении Fcgamma RI, Fcgamma RIIIА и c1q рецепторов по сравнению с немодифицированным антителом. Описана выделенная нуклеиновая кислота, обеспечивающая экспрессию указанного антитела, содержащая кодирующую антитело нуклеотидную последовательность, и фармацевтическая композиция на основе указанного антитела. Использование изобретения обеспечивает антитело с пониженным сродством к рецепторам Fcgamma RI, Fcgamma RIIIА и c1q, что обеспечивает снижение нежелательных эффекторных функций при лечении хронического воспаления и аутоиммунных состояний. 3 н. и 6 з.п. ф-лы, 34 ил., 7 табл., 36 пр.
Формула
а. вариабельную область CDR1 легкой цепи человека, включающую Seq ID NO: 1;
б. вариабельную область CDR2 легкой цепи человека, включающую Seq ID NO: 2;
в. вариабельную область CDR3 легкой цепи человека, включающую Seq ID NO: 3;
г. вариабельную область CDR1 тяжелой цепи человека, включающую Seq ID NO: 4;
д. вариабельную область CDR2 тяжелой цепи человека, включающую Seq ID NO: 5; и
е. вариабельную область CDR3 тяжелой цепи человека, включающую Seq ID NO: 6.
а. вариабельную область CDR1 легкой цепи человека, включающую Seq ID NO: 21;
б. вариабельную область CDR2 легкой цепи человека, включающую Seq ID NO: 22;
в. вариабельную область CDR3 легкой цепи человека, включающую Seq ID NO: 23;
г. вариабельную область CDR1 тяжелой цепи человека, включающую Seq ID NO: 24;
д. вариабельную область CDR2 тяжелой цепи человека, включающую Seq ID NO: 25; и
е. вариабельную область CDR3 тяжелой цепи человека, включающую Seq ID NO: 26.
а. вариабельную область тяжелой цепи человека, содержащую аминокислотную последовательность Seq ID No: 38; и
б. вариабельную область легкой цепи человека, содержащую аминокислотную последовательность Seq ID No: 40.
а. вариабельную область тяжелой цепи человека, содержащую аминокислотную последовательность Seq ID No: 18; и
б. вариабельную область легкой цепи человека, содержащую аминокислотную последовательность Seq ID No: 20.
а. вариабельную область тяжелой цепи человека, содержащую аминокислотную последовательность Seq ID No: 28; и
б. вариабельную область легкой цепи человека, содержащую аминокислотную последовательность Seq ID No: 30.

Комментарии