Способ получения животного со стойкими сенсомоторными и поведенческими нарушениями (варианты) и применение трансгенного по эпидермальному фактору роста животного в качестве модели животного со стойкими сенсомоторными и поведенческими нарушениями (варианты - RU2234216C2
Код документа: RU2234216C2
Чертежи






Описание
Область техники
Данное изобретение относится к области биологии и медицины и, в частности, к шизофреническому модельному животному с сенсомоторными и поведенческими (бихевиористическими) нарушениями и способу его получения.
Уровень техники
Шизофрения является очень серьезным хроническим заболеванием, которое появляется у 0,7-1,0% индивидов популяции. Например, в Японии сотни тысяч пациентов госпитализируют на длительный срок вследствие этого заболевания. Основной симптом данного заболевания сопровождается различными психологическими нарушениями, в том числе позитивными симптомами, такими как бред, галлюцинации и слуховые галлюцинации, в дополнение к негативным симптомам, таким как уход от общества (аутизм) и депрессия. В настоящее время причина появления этого заболевания и биологическая патология этого заболевания не выяснены.
Шизофрения появляется в период от подросткового возраста до зрелого возраста с характерными симптомами в восприятии, деятельности головного мозга, эмоции и поведении. Во многих случаях это заболевание прогрессирует хронически, и пациенты страдают от разнообразных трудностей в отношении адаптации к обществу. В отношении шизофрении, существуют классификации позитивных симптомов (галлюцинации, бреда, пониженной деятельности головного мозга, напряженности, странного поведения и т.д.) и негативных симптомов (уплощение в движении, снижение в волевых актах и уход от общества и т.д.). В социальном плане, вследствие специфической патологии данного заболевания, желательно разработать последовательную и всеобъемлющую систему лечения данного заболевания, включающую обнаружение появления, лечение и возвращение к социальной жизни на ранней стадии и предупреждение рецидива.
В качестве эффективного терапевтического лекарственного средства для улучшения позитивного симптома шизофрении известны только антагонисты нейротрансмиттеров (нейромедиаторов), такие как антагонист допамина или антагонист серотонина. Во многих случаях обязательным является длительный период введения такого лекарственного средства. Конкретными примерами лекарственных средств, обычно прописываемых пациентам, являются производные фенотиазина, производные тиоксантена, производные бутирофенона и бензамида.
Кроме исследования механизма действия этих лекарственных средств, известно, что стимулирующие лекарственные средства, такие как амфетамин, индуцируют позитивные явления шизофрении у людей. Таким образом, была предложена "допаминовая гипотеза", заключающаяся в том, что функциональное нарушение допамина участвует в возникновении шизофрении. Кроме того, на основании этих фактов, животное, которому продолжительно вводили амфетамин, было принято в качестве модельного животного шизофрении. Подобным образом, лекарственное средство, которое индуцирует галлюцинацию у людей, может вводиться животному для получения модельного животного для изучения шизофрении. Животное, которому вводят фенциклидин, является одним из подобных примеров. В этом случае фенциклидин является ингибитором рецептора глутамина, и было выяснено, что рецептор глутамина участвует в физиологической функции головного мозга, такой как память и приобретение знаний.
Что касается большинства общепринятых шизофренических модельных животных, упомянутых выше, они часто проявляют временное нарушение функции головного мозга, зависящее от введения лекарственных средств. Однако они не могут воспроизводить хроническую патологию шизофрении, наблюдаемую у людей. Кроме того, хотя антагонисты допамина могут улучшать позитивный симптом, лишь немногие терапевтические лекарственные средства являются эффективными для лечения негативных симптомов. Считается, что такая ситуация обусловлена отсутствием подходящей модели шизофренического животного.
До сих пор различные гипотезы предлагались в отношении механизма появления шизофрении. Одной из таких гипотез является гипотеза нарушения развития головного мозга, представленная Winderger et al. [1]. Однако биологические факторы, вызывающие нарушения в развитии центральной нервной системы, и механизмы, участвующие в появлении таких нарушений, до сих пор не были выяснены. Данное изобретение впервые обеспечивает модельное животное, которое научно олицетворяет такую гипотезу.
Сущность изобретения
Таким образом, целью данного изобретения является обеспечение модельного животного с продолжительными сенсомоторными и поведенческими нарушениями, чрезвычайно сходными с шизофренией, для применения в исследовании механизма шизофрении и в создании терапевтических лекарственных средств.
Для решения указанных выше задач авторы данного изобретения обратили внимание на вышеупомянутую гипотезу нарушения развития головного мозга. То есть, авторы данного изобретения получили модельное животное со стойкими сенсомоторными и поведенческими нарушениями, чрезвычайно сходными с шизофренией, введением специфических белковых факторов, которые ингибируют развитие функции головного мозга, или экспрессией генов, кодирующих эти белковые факторы.
Данное изобретение подробно объясняется в следующем ниже описании, однако предпочтительные варианты и примеры не должны рассматриваться как ограничение объема данного изобретения.
Перечень фигур
Фиг.1 - приведена диаграмма, показывающая торможение предварительными импульсами в контрольной группе и EGF-группе (группе, получавшей эпидермальный фактор роста).
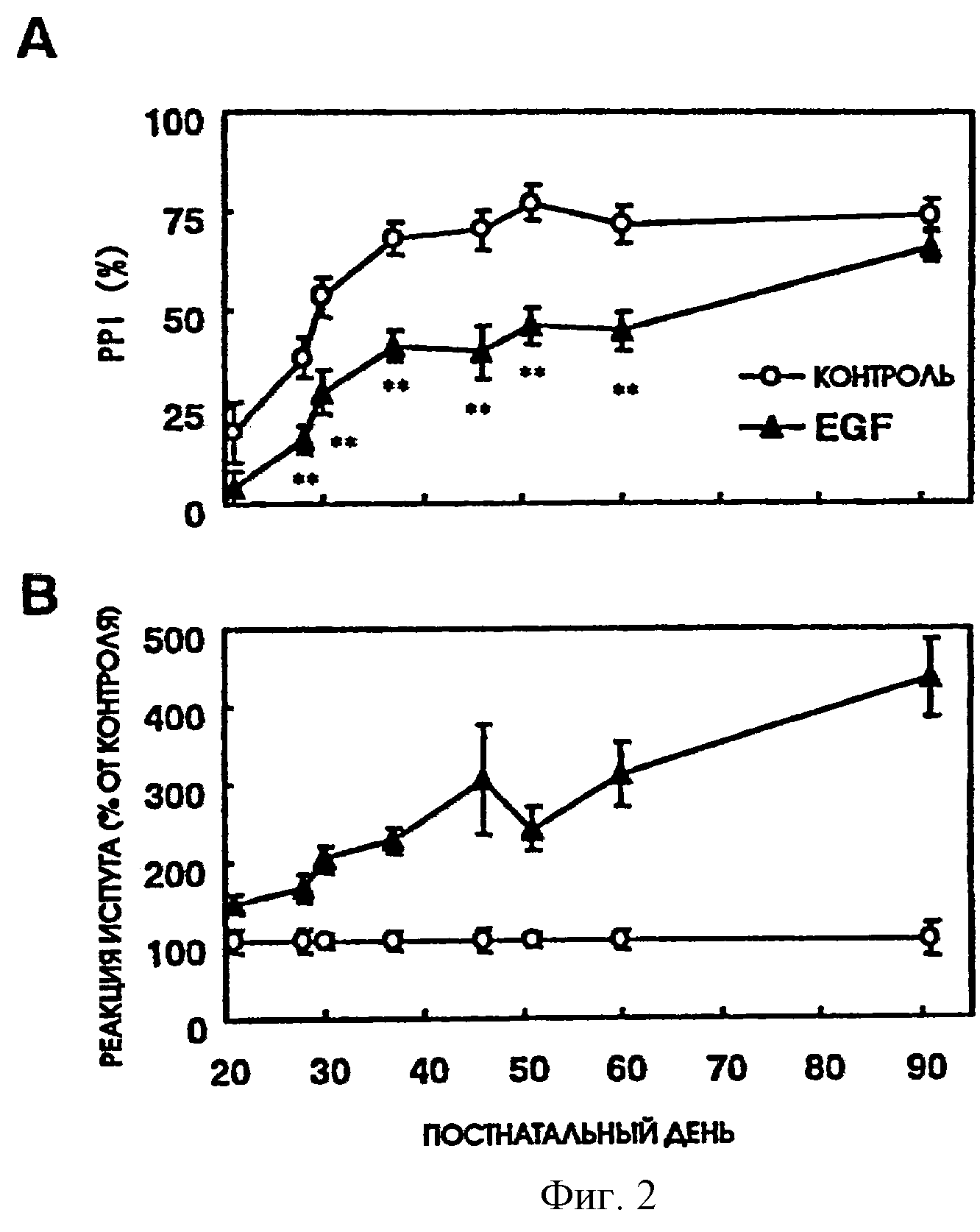
Фиг.2 - приведен график, показывающий изменение торможения предварительными импульсами в зависимости от постнатального дня.
Фиг.3 - приведена диаграмма, показывающая влияние инъекций клозапина на торможение предварительными импульсами, измеренное в контрольной группе и EGF-группе.
Фиг.4 - приведена диаграмма, показывающая влияние инъекций клозапина и инъекций галоперидола на торможение предварительными импульсами и реакцию испуга в контрольной группе и EGF-группе.
Фиг.5 - приведена диаграмма, показывающая нарушения моторной активности при введении EGF у крыс на 52-й и 24-й постнатальный день.
Фиг.6 - приведена диаграмма, показывающая нарушения моторной активности при введении EGF и уменьшение таких нарушений при введении клозапина и галоперидола у крыс на 52-й и 24-й постнатальный день.
Фиг.7 - приведена диаграмма, показывающая нарушения в социальных взаимодействиях при введении EGF на примере фырканья (сопения).
Фиг.8 - приведена диаграмма, показывающая влияние введения EGF на способность крыс к обучению на примере реакции активного избегания.
Данное изобретение относится к шизофреническому модельному животному с сенсомоторными и поведенческими нарушениями, полученному путем введения ювенильному животному в стадии его роста специфических белковых факторов, которые ингибируют развитие функции головного мозга, и способу получения такого животного. Животное данного изобретения может быть получено не только введением вышеупомянутого белкового фактора, но также экспрессией генов, кодирующих эти белковые факторы. Эпидермальный фактор роста (EGF), фактор альфа опухолевого роста (TGF-α), гепаринсвязывающий эпидермальный фактор роста и амфирегулин являются предпочтительными в качестве приемлемых белковых факторов. Конкретные примеры сенсомоторных и поведенческих нарушений, вызываемых эпидермальным фактором роста (EGF), показаны в следующих примерах. Три белковых фактора - фактор альфа опухолевого роста (TGF-α), гепаринсвязывающий эпидермальный фактор роста и амфирегулин имеют общую сходную стерическую структуру. Кроме того, известно, что все они связываются с рецепторной молекулой эпидермального фактора роста, т.е. обладают сходной биологической активностью [5]. Возможность индукции торможения развития функции головного мозга с помощью вышеуказанных белковых факторов до сих пор не была обнаружена. Между тем известно, что эти белковые факторы активируют ряд путей STAT (трансдукторов сигналов и активаторов транскрипции) в системе трансдукции (передачи) сигналов клетки. Таким образом, в соответствии с данным изобретением, предполагается, что путь STAT участвует в развитии у модельного животного сенсомоторных и поведенческих нарушений. В соответствии с данным изобретением, белковые факторы не ограничиваются только вышеуказанными белковыми факторами, и также могут быть использованы другие белковые факторы, имеющие какую-либо нейрохимически эквивалентную функцию.
Эти белковые факторы должны вводиться или экспрессироваться на неонатальной стадии развития этих животных, и эта стадия должна быть стадией эмбриона или плода при беременности или стадией, как можно более ранней (постнатальной) после рождения. В данном описании выражение “ювенильное животное в стадии его развития” означает животное, у которого нервная система как раз и находится на стадии развития, следовательно, еще не развита полностью. У ювенильного животного с еще не завершенным развитием нервной системы белковые факторы оказывают значительное влияние на торможение функции головного мозга. Например, у мышей развитие головного мозга по существу завершается на 20-30-й постнатальный день. Таким образом, мыши до этого возраста будут соответствовать указанному термину. В данном изобретении введение или экспрессия белкового фактора должны быть завершены до этого срока.
В качестве видов животных, которые могут быть использованы в качестве модельного животного, в соответствии с данным изобретением, можно использовать любых млекопитающих, за исключением человека. В качестве предпочтительных видов животных могут быть упомянуты обезьяна (шимпанзе), собака, кошка, кролик, морская свинка, крыса и мышь. Особенно предпочтительными видами животных являются крыса, мышь и обезьяна (шимпанзе), так как к настоящему времени для них накоплены многочисленные данные.
Согласно изобретению, белковые факторы можно вводить или экспрессировать с помощью двух типов способов. Один из них основан на инъекции этих белковых факторов (внутрибрюшинная или подкожная). Поскольку белковый фактор легко разрушается в пищеварительном тракте, для его введения нежелательно использовать пероральное введение. Доза белкового фактора изменяется в зависимости от типа белкового фактора, типа животного или способа введения. Однако обычно вводимая дневная доза находится в диапазоне 0,01 - 100 мг/кг, предпочтительно 0,1 - 10 мг/кг. При введении белкового фактора в организме животного наблюдается его метаболизм и разрушение. Поскольку концентрация белкового фактора в организме быстро уменьшается, его следует вводить (инъецировать) несколько раз в течение нескольких дней. Согласно изобретению, можно использовать белковые факторы как выделенные из бактериальных продуцентов, так и из клеток животных.
Другой способ основан на избыточной экспрессии белковых факторов с использованием генов, кодирующих эти белковые факторы. Гены, кодирующие эпидермальный фактор роста (EGF), фактор альфа опухолевого роста (TGF-α), гепаринсвязывающий эпидермальный фактор роста и амфирегулин, уже были известны, таким образом, обеспечить избыточную экспрессию белкового фактора можно с использованием различных способов, обычно применяемых в данной области. Например, ген, кодирующий вышеуказанный белковый фактор, может быть инъецирован в необходимую область - мишень животного, например в желудочки головного мозга, что обеспечивает избыточную экспрессию данного белка. В результате может быть получено модельное животное, в соответствии с данным изобретением, с сенсомоторными и поведенческими нарушениями. Для достижения локальной экспрессии этих генов можно использовать рекомбинантные вирусные векторы, для введения в клетки которых можно использовать метод кальций-фосфатной копреципитации, в котором ДНК вводят в клетки совместно с мелкими кристаллами фосфата кальция, метод электропорации, в котором на клеточной мембране открываются мелкие поры при приложении временного высокого напряжения, ДЭАЭ-декстрановый метод, липофектиновый метод, в котором ДНК заключают в искусственную липидную мембрану для слияния с клеточной мембраной, и т.п. Кроме того, известен способ "пистолет", в котором ДНК, связанную с частицами золота, выстреливают в ткань с помощью специального пистолета. В этих способах в клетку вводят ген. Оказалось, что результаты, наблюдаемые при введении гена, аналогичны результатам, наблюдаемым при введении белкового фактора.
Кроме того, модельное животное данного изобретения может быть получено при манипуляции эмбриональными половыми клетками или оплодотворенной яйцеклеткой животного, посредством которого генетический признак данного изобретения может быть трансформирован и вышеупомянутый белковый фактор может быть избыточно экспрессирован. В качестве способов, обычно используемых для достижения такой цели, могут быть упомянуты способ микроинъекции и способ эмбриональных стволовых клеток (ES-клеток). В способе микроинъекции ДНК инъецируют непосредственно в оплодотворенную яйцеклетку под микроскопом с помощью тонкой стеклянной трубочки. В ES-способе целевую ДНК вводят в ES-клетку и затем эту ЕS-клетку возвращают в эмбриональные клетки зародышевой линии. В результате получают трансгенное животное, причем эта линия может сохраняться и обеспечивать модельное животное для шизофрении.
Модельное животное, согласно данному изобретению, можно использовать для разработки терапевтического лекарственного средства или диагностического средства психоза, свидетельствующего о шизофренической патологии. Кроме того, это модельное животное можно также использовать для изучения механизма психоза, обнаруживающего патологический признак шизофрении или признак, сходный с шизофренией. Как уже упоминалось выше, арсенал терапевтических лекарственных средств для лечения шизофрении в настоящее время является недостаточным. В частности, лекарственное средство, эффективное для улучшения негативного симптома, еще не было создано вследствие отсутствия хорошего модельного животного. Таким образом, модельное животное данного изобретения окажется весьма полезным для решения этой проблемы. Кроме того, модельное животное данного изобретения, полученное на основе гипотезы нарушения развития нервной системы, окажется чрезвычайно полезным для изучения биохимических механизмов шизофрении. В данном описании способ применения животного, полученного в соответствии с данным изобретением, в качестве шизофренического модельного животного с сенсомоторными и поведенческими нарушениями, означает способ применения этого животного для разработки терапевтического лекарственного средства или диагностического средства психоза, свидетельствующего о патологическом признаке шизофрении, или психоза, сходного с шизофренией, или для изучения биохимических механизмов шизофрении. Однако применение данного изобретения не ограничивается решением вышеуказанных задач, и другие возможные применения, реализуемые посредством применения животного с сенсомоторными и поведенческими нарушениями, в соответствии с данным изобретением, должны быть также включены в объем данного изобретения.
У модельных животных шизофрении, получаемых по способу данного изобретения, наблюдаются стойкие сенсомоторные и поведенческие нарушения, подобные нарушениям, наблюдаемым у шизофренических пациентов. Это, по-видимому, согласуется с тем, что шизофрения часто проявляется в подростковом возрасте или после подросткового возраста. Далее описываются способы, используемые для оценки сенсомоторных и поведенческих нарушений модельного животного, в соответствии с данным изобретением. В данном описании выражение “стойкие сенсомоторные и поведенческие нарушения” означает, что эти нарушения не являются временными (преходящими), а сохраняются долгосрочно, по меньшей мере, в течение десяти дней.
В качестве способа, используемого для оценки сенсомоторных и поведенческих нарушений, могут быть упомянуты бихевиористические измерения, такие как торможение предварительными импульсами реакции испуга, латентное торможение, социальное взаимодействие, моторная активность животного. Торможение предварительными импульсами реакции испуга является тестом для оценки способности восприятия - моторной активности с использованием реакции испуга в качестве показателя, и реакция испуга может оцениваться одинаковым образом у человека и у животных. В этом тесте оценка дефицита внимания и нарушения в обработке информации в головном мозге может быть достигнута научным и объективным образом. Эти два признака считаются основными факторами, участвующими в шизофренической патологии. Когда слабый звуковой (акустический) сигнал (предварительный импульс), который не вызывает реакции испуга, подается животному в течение 10-150 мс перед тем, как подвергнуть его воздействию сильного звука в 120 дБ (децибел), реакция испуга, вызываемая сильным звуком, уменьшается. Этот тест проводят с измерением такой реакции. Такое уменьшение посредством торможения предварительными импульсами называют “торможением предварительными импульсами”. Было известно, что значимое уменьшение торможения предварительными импульсами наблюдается у шизофренических пациентов и у шизофренических модельных животных [2].
В латентном торможении оценивали торможение обучения, называемого “тренировкой”, которое выполняли перед тестом на обучение. Принцип этого теста сходен с принципом вышеописанного торможения предварительными импульсами [3]. Например, в исследовании формирования условных рефлексов по типу исследований Павлова, если испытуемое животное ранее было приучено к стимулу (раздражителю) в виде звонка (условно-рефлекторный стимул: CS) без кормления (безусловно-рефлекторный стимул: US), то обучение “звонок (CS) означает кормление (US)” тормозится. Обычно у шизофренического пациента или его модельного животного способность обращать внимание в общем и обучаться “тренировкой” уменьшаются. Таким образом, торможение обучения, вызванное предварительным обеспечением CS и латентным торможением, едва ли встречается у шизофренических пациентов и у их модельных животных [3].
Тест социального взаимодействия основан на том, что такие пациенты не любят вступать в контакт с другими индивидуумами и держатся в стороне от общества. Обычно, когда животное встречает незнакомого индивидуума, наблюдается поведение фырканья (сопения). В целом сообщалось уменьшение этого поведения у шизофренических пациентов и у шизофренических модельных животных.
Сведения, подтверждающие возможность осуществления изобретения
Пример 1
1. Стойкое нарушение торможения предварительными импульсами при введении эпидермального фактора роста
Крыс SD (Nippon SLC) 2-го постнатального дня использовали в качестве испытуемых (тест)-животных. Рекомбинантный эпидермальный фактор роста человека (EGF; Higeta Shoyu) и цитохром-С (Sigma) растворяли в физиологическом растворе до концентрации 70 мкл/мл. Начиная с 2-го постнатального дня каждый второй день крысам вводили подкожно в область задней части шеи по 25 мкл раствора на 1 г веса тела (в каждом случае 1,75 мг/кг). Эту операцию повторяли пять раз до 10-го постнатального дня. Начиная с 21-го постнатального дня в камере для тестирования реакции испуга определяли реакцию испуга и торможение предварительными импульсами измеряли (Sab Diego Instrument). To есть, акустический (звуковой сигнал) использовали в качестве сенсорной стимуляции для индуцирования реакции испуга. В качестве предварительного импульса использовали акустические импульсные сигналы с интенсивностью, превышающей на 5-15 дБ шум окружающей среды (фоновый шум). Через 100 миллисекунд подавали импульсные сигналы с интенсивностью 120 дБ. Ответную реакцию, полученную при комбинации предварительного импульса и 120 дБ, делили на ответную реакцию, полученную только при 120 дБ (%), для получения соотношения между "стимулом" и "реакцией". Соотношение между "стимулом" и "реакцией" вычитали из 100, и оно было названо предварительным импульсным торможением (PPI). Формула, используемого для расчета торможения предварительными импульсами (PPI), приведена ниже.
РРI(%)=Ответ (120 дБ)-Ответ (предварит, импульса+120 дБ)=×100
Ответ (120 дБ)
Торможение предварительными импульсами (PPI) определяли на 30 (Р30), 33 (Р33) и 37 (Р37) постнатальные дни (фиг.1). На фиг.1А показаны результаты торможения предварительными импульсами на 30-й (Р30, фиг.1А), 33-й (Р33, фиг.1В) и 37-й (Р37, фиг.1С) постнатальные дни. Для Р30 у группы, получавшей EGF (EGF V), было обнаружено значительное уменьшение (*р<0,05) в торможении предварительными импульсами, по сравнению с группой, получавшей цитохром-С (Cont V) при интенсивности предварительных импульсов 80 дБ и 85 дБ. Для Р33 у группы, получавшей EGF (EGF V), также было обнаружено значимое уменьшение (*р<0,05) в торможении предварительными импульсами при интенсивности предварительных импульсов 80 дБ и 85 дБ. Для Р37 у группы, получавшей EGF (EGF V), также было обнаружено значимое уменьшение (*р<0,05) в торможении предварительными импульсами при всех интенсивностях предварительных импульсов 74 дБ, 80 дБ и 85 дБ.
Результаты торможения предварительными импульсами (фиг.2А) и реакции испуга (фиг.2В) для различных постнатальных дней показаны на фиг.2. На фиг.2 открытые кружки показывают результаты, полученные для контрольной группы, получавшей цитохром-С (n=10), а черные треугольники показывают результаты, полученные для группы, получавшей эпидермальный фактор роста группу (n=10), соответственно. На фиг.2А приведены результаты измерений, выполненных при интенсивности предварительных импульсов 75 дБ на 21, 28, 30, 37, 46, 51, 60 и 90 постнатальные дни. Эти результаты показаны в виде среднего ± SEM, где звездочками отмечено значимое различие (*р<0,05, **<0,01) между двумя группами. На фиг.2В приведены результаты реакции испуга, показывающие различие между крысами, не получавшими (контроль) и получавшими (опыт) EGF, в ответ на акустические (звуковые) раздражители 120 дБ (% от контроля). Результаты, приведенные на фиг.2, показывают, что значительное различие наблюдалось после 28-го постнатального дня.
2. Снижение нарушений торможения предварительными импульсами при введении клозапина
Для оценки адекватности (пригодности) модели по изобретению определяли влияние 8-хлор-11-(4-метил-1-пиперазинил)-5Н-дибензо[b,е][1,4]диазепина (клозапина: Sigma-Aldrich Fine Chemical Co. Ltd.), который является общепризнанным терапевтическим средством для лечения шизофрении у людей на данное модельное животное. Для этого группе, получавшей рекомбинантный EGF человека, и контрольной группе, получавшей цитохром-С, каждый день вводили клозапин внутрибрюшинно. Клозапин вводили с 21-го постнатального дня, с которого примерно и начинают обнаруживать хронические нарушения торможения предварительными импульсами. Торможение предварительными импульсами (PPI) измеряли на 30-й (Р30), 33-й (Р33) и 37-й (Р37) постнатальные дни (фиг.3). Результаты для 30-го (Р30) постнатального дня показаны на фиг.3А, для 33-го (Р33) - на фиг.3В и для 37-го (Р37) - на фиг.3С, соответственно. На 30-й постнатальный день, который является 9-ым днем лечения клопазином, значительные нарушения в торможении предварительными импульсами сохраняются в получавшей EGF-группе (EGF CZP) по сравнению с получавшей цитохром-С группой (фиг.3А). Однако уже на 33-й (Р33) и 37-й (Р37) постнатальные дни значительное различие в торможении предварительными импульсами у получавшей EGF-группы (EGF CZP) не наблюдалось, по сравнению с получавшей цитохром-С контрольной группой (Cont CZP) (фиг.3В, фиг.3С).
Авторы также определяли влияние 4-(4-[п-хлорфенил]-4-гидроксипиперидино)-4’-фторбутирофенона (галоперидола: Sigma-Aldrich Fine Chemical Co. Ltd.). Галоперидол вводили внутрибрюшинно в дозе 0,3 мг/кг. Тестирование проводили на четырех группах (фиг.4): (1) контрольная группа - крысы, не получавшие EGF, + введение физраствора, (2) крысы, получавшие EGF, + введение физраствора (EGF/VEH, n=10), (3) крысы, получавшие EGF, + введение клозапина (EGF/CLP, n=10) и (4) крысы, получавшие EGF, + введение галоперидола (EGF/HPD, n=6). Введение физраствора, клозапина и галоперидола продолжали в течение одной недели. Спустя двадцать три часа после последнего введения, выполняли тест на крысах соответствующей группы. Фиг.4А показывает данные торможения предварительными импульсами при интенсивности предварительных импульсов 75 дБ; метки в виде звездочек указывают на значимое различие, по сравнению с контрольной группой CON/VEH (*р<0,05, **<0,01). Как следует из результатов, приведенных на фиг.4А, при введении клозапина наблюдалось значительное улучшение в торможении предварительными импульсами. В случае галоперидола таких результатов обнаружено не было. На фиг.4В показаны результаты теста по реакции испуга (% в сравнении с группой CON/VEH) для каждой группы, в сравнении с акустическими стимулами 120 дБ. У групп, получавших EGF, наблюдалась реакция испуга, причем значительно более сильная, чем у группы CON/VEH, однако антипсихотические лекарственные средства, описанные выше, не были эффективными для реакции испуга при 120 дБ.
3. Спонтанные нарушения в моторной активности, вызываемые введением EGF
Локомоторные активности животных изучали на 24-й и 52-й постнатальные дни. На 24-й постнатальный день тест проводили с использованием автоматического прибора для мониторинга активности Activity Monitor (Neuro Science). На 53-й постнатальный день тест проводили с использованием ящика, имеющего размер 51×51×80 см, с линиями, нанесенными через каждые 17 см. Тест заключался в определении числа пересечений линий (горизонтальная активность) и числа подскоков (вертикальная активность) в течение 10 минут.
Средние величины (±SЕМ) горизонтальной активности (пересечение линий) и вертикальной активности (подскоков) на 24-й (Р24) и 52-й (Р52) постнатальные дни показаны на фиг. 5. На фиг.5А приведены результаты, полученные на 24-й постнатальный день (n=15, 8 самцов и 7 самок), а на фиг.5В приведены результаты, полученные на 52-й постнатальный день (n=10, 5 самцов и 5 самок). На фиг.5 левая вертикальная ось показывает число горизонтальной активности, тогда как правая вертикальная ось показывает число вертикальной активности. Левые столбцы указывают число пересечений линий, а правые столбцы указывают число подскоков, соответственно. Кроме того, белые столбцы показывают контрольную группу (CON), a черные столбцы показывают получавшую EGF-группу, соответственно.
На 24-й постнатальный день для группы, получавшей EGF, не было обнаружено значительного различия ни в числе горизонтальной активности, ни в числе вертикальной активности по сравнению с получавшей цитохром-С группой (CON) (фиг.5А). Однако после дальнейшего роста на 52-й постнатальный день, т.е. после приобретения фертильности наблюдалось значительное различие в числе вертикальной активности EGF-группы по сравнению с получавшей цитохром-С группой (фиг.5). Полученные данные соответствуют известному наблюдению, что шизофрения часто проявляется после наступления подросткового возраста.
Действие антипсихотического лекарственного средства на моторную активность исследовали также у крыс на 52-й постнатальный день. Результаты, полученные в исследованиях на четырех группах, показаны на фиг.6, где: (1) контрольная группа крыс, не получавших EGF, + введение физраствора (CON/VEH) в качестве носителя, (2) крысы, получавшие EGF, + введение физраствора (EGF/VEH, n=10), (3) крысы, получавшие EGF, + введение клозапина (EGF/CLP, n=10) и (4) крысы, получавшие EGF, + введение галоперидола (EGF/HAL, n=6). В каждой группе использовали одинаковое число самцов и самок. Физраствор, галоперидол и клозапин вводили в течение трех недель, и каждую группу исследовали через 48 часов после последнего введения. Отметки (*) и (#) указывают на значительное различие, по сравнению с группой CON/VEH и EGF/VEH, соответственно (* р<0,05, # р<0,01). Как следует из результатов, приведенных на фиг.6, вертикальная активность крыс EGF-группы значительно уменьшалась при продолжительном введении галоперидола и клозапина. Между тем, введение этих лекарственных средств не оказало влияния на горизонтальную активность.
4. Нарушение социальной интеракции (социальных взаимодействий) при введении эпидермального фактора роста
Нарушения социальных взаимодействий у крыс, получавших EGF, исследовали по способу File et al. На 52-й постнатальный день при встрече двух крыс наблюдали поведение "фырканья" (сопения), и время поведения "фырканья" использовали в качестве показателя тревожности. В условиях, применяемых в экспериментах для оценки социального взаимодействия, как для крыс контрольной группы, так и для крыс группы, получавшей EGF, наблюдалось поведение избегания. Поведение фырканья наблюдали при высоком уровне света и в незнакомым условиях в открытом пространстве. Обе группы животных записывали на видеоленту и регистрировали поведение фырканья животных в ответ на фырканье партнера (фиг.7).
На фиг.7 показаны средние величины продолжительности (±SEM) поведения фырканья. Исследование выполняли на четырех группах: (1) контрольной группе крыс, не получавших EGF, + введение физраствора (CON/VEH), (2) крыс, получавших EGF + введение физраствора (EGF/VEH, n=10), (3) крыс, получавших EGF, + введение клозапина (EGF/CLOZ, n=10) и (4) крыс, получавших EGF, + введение галоперидола (EGF/HAL, n=6). Физраствор, клозапин или галоперидол вводили в течение трех недель, и тест выполняли через 48 часов после последнего введения. Пометка ** показывает значительное различие в сравнении с группой CON/VEH (** р<0,01). По сравнению с контрольными крысами, поведение фырканья при встрече незнакомого партнера заметно понижалось (EGF/VEH). Кроме того, пониженное поведение фырканья в группе, получавшей EGF, снималось инъекцией клозапина (EGF/CLOZ). Между тем, галоперидол не был эффективным в устранении поведения фырканья (EGF/HAL).
5. Исследование способности обучения с использованием реакции активного избегания
Способность к обучению определяли по реакции активного избегания. Тест активного избегания выполняли в устройстве с челночной коробкой с использованием крыс на 51-60 постнатальные дни (10 испытаний/день). В качестве условно-рефлекторного стимула (CS) использовали акустический сигнал с интенсивностью 80 дБ и комнатный свет в течение 5 секунд. После условно-рефлекторного стимула (CS) тест-животные должны были переместиться в другую сторону устройства с челночной коробкой (реакция избегания), для того чтобы перевернуть ее и избежать безусловно-рефлекторного стимула (US), описанного ниже. В качестве US использовали электрический шок путем подачи постоянного тока 0,6 мА в течение 10 секунд. Параллельно тест-животных испытывали на способность избегать электрического шока посредством научения.
На фиг.8 показаны результаты (±SEM) реакции избегания в процентах. На фиг.8 символы открытых кружков указывают обработанную цитохромом-С контрольную группу (CON: n=10) и символы черных треугольников указывают обработанную EGF-группу (EGF: n=10), соответственно. Было обнаружено, что способность обеих групп избегать электрического шока значимо улучшалась во время тренировки, и в этом не было различий между обеими группами. Между этими двумя группами не наблюдалось различий в латентном периоде реакции и в числе перемещений между двумя сторонами челночной коробки. Таким образом, способность к обучению крыс, получавших EGF, по-видимому, является нормальной во взрослой фазе, что исключает возможность того, что все функции их головного мозга были нарушены.
Согласно данному изобретению, была получена шизофреническая модель животного с сенсомоторными и поведенческими нарушениями путем введения специфического белкового фактора, тормозящего развитие функции головного мозга. Животное данного изобретения можно использовать для разработки и оценки лекарственных средств для лечения шизофрении и диагностических средств для диагностики шизофрении.
Литература
1. Weinberger DR. Arch Gen Psychiatry 44: 660-669 (1987).
2. Braff DL, Geyer MA. Arch Gen Psychiatry 47: 181-188 (1990).
3. Brauch I, Hemsley DR, Gray JA, J. Nerv. Ment. Dis. 176: 598-606 (1991).
4. Sams-Dodd F. Rev Neurosci. 10(1): 59-90 (1999).
5. Morrison R; "Neurotropic Factors" Loughlin SE and Fallon JH eds. Academic Press, Chapter 11; 339-357 (1993).
Реферат
Изобретение относится к области генной инженерии и медицины. Предложен способ получения животного со стойкими сенсомоторными и поведенческими нарушениями и применение такого животного. Способ предусматривает введение ювенильному животному белкового фактора или гена, кодирующего белковый фактор, где белковый фактор представляет собой эпидермальный фактор роста, фактор опухолевого роста альфа, гепаринсвязывающий фактор роста или амфирегулин. Либо предложенный способ предусматривает введение гена, кодирующего белковый фактор, в раннюю эмбриональную зародышевую линию или оплодотворенную яйцеклетку животного, для его трансформации. Предложенные способы позволяют получать животных со стойкими сенсомоторными и поведенческими нарушениями. Животные, полученные такими способами, могут быть использованы в медицине как шизофреническое модельное животное с сенсомоторными и поведенческими (бихевиористическими) нарушениями. 5 н.п. ф-лы, 8 ил.


Комментарии