Мыши, экспрессирующие ограниченный репертуар легких цепей иммуноглобулина - RU2689664C2
Код документа: RU2689664C2
Чертежи



















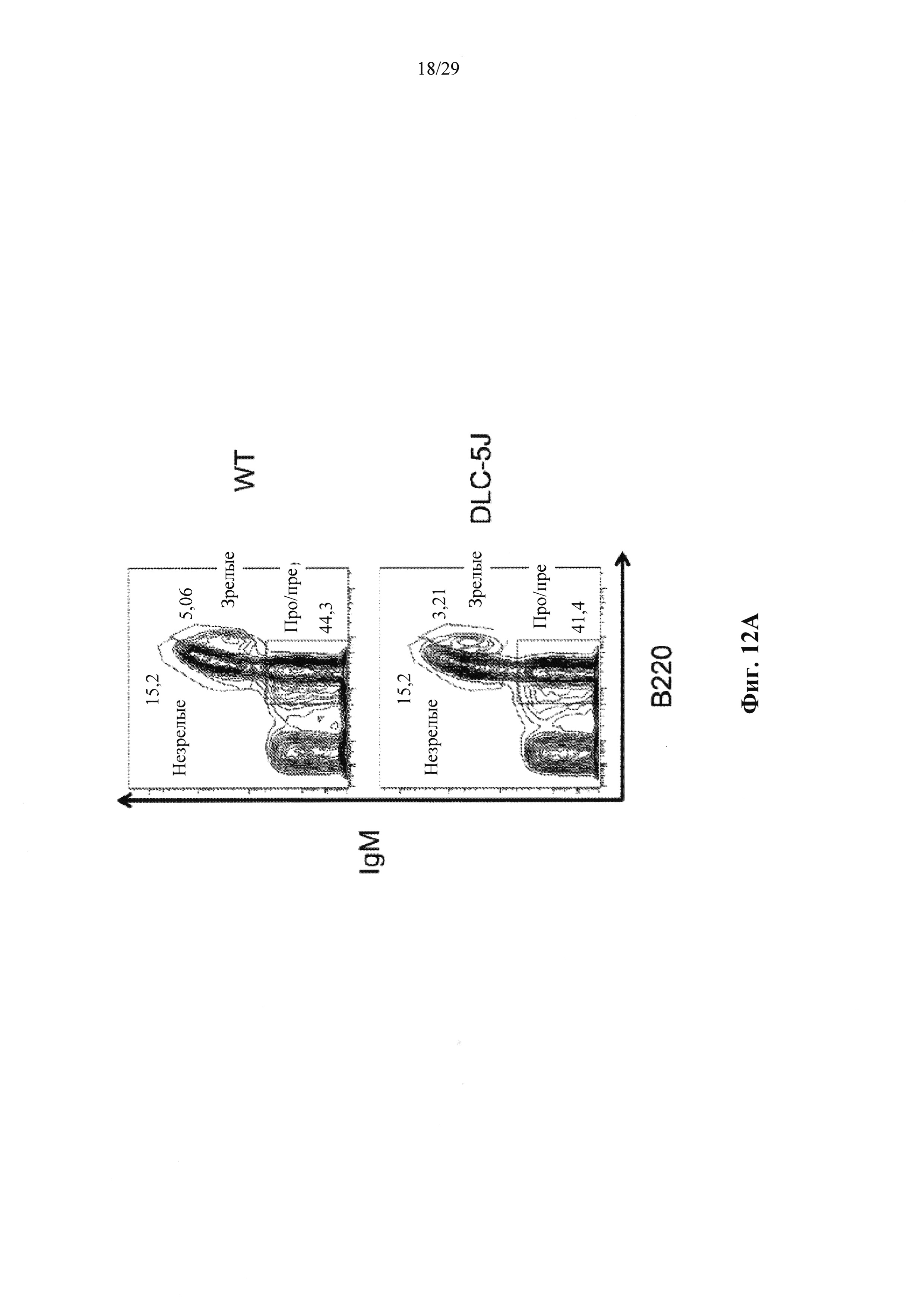
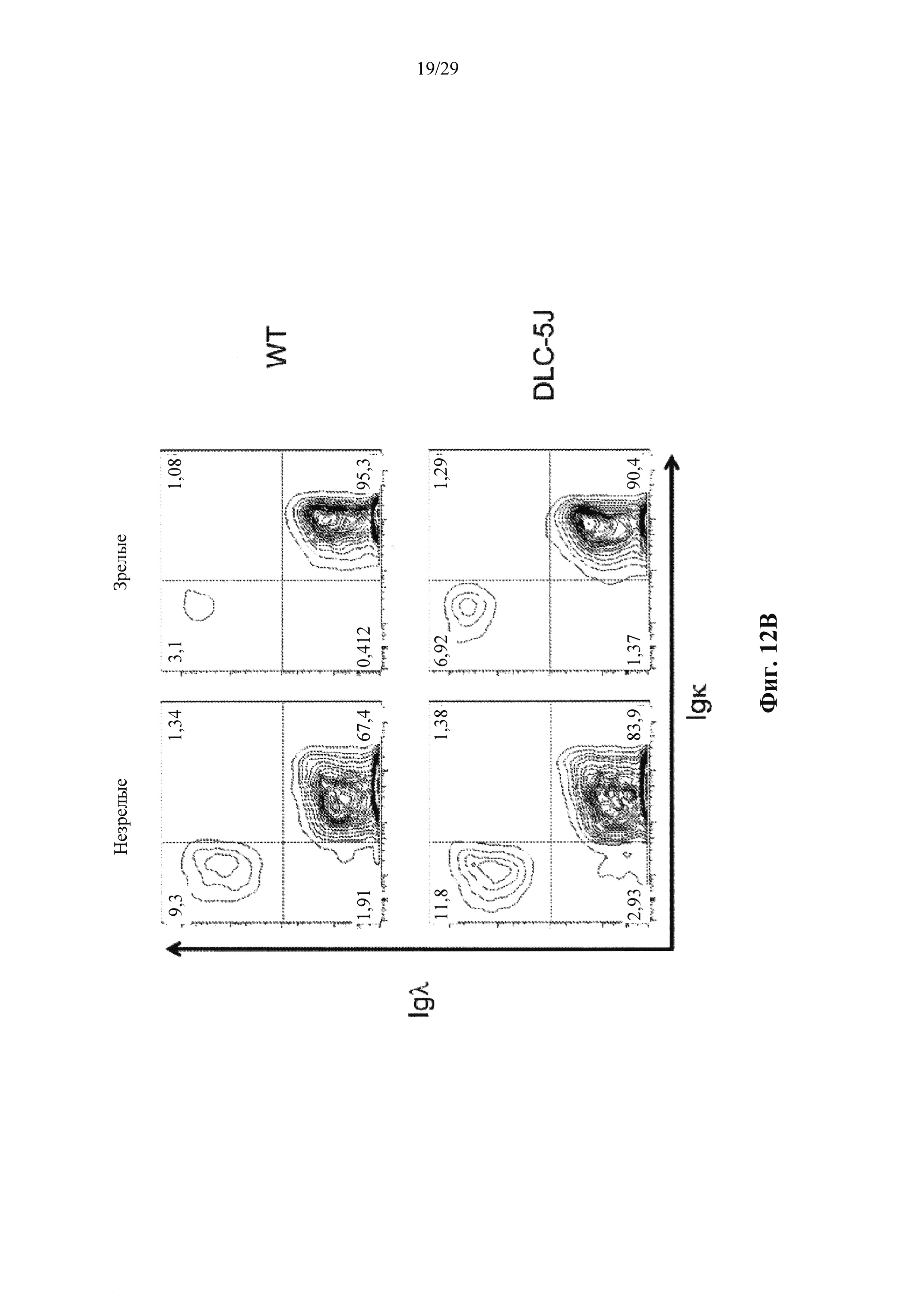

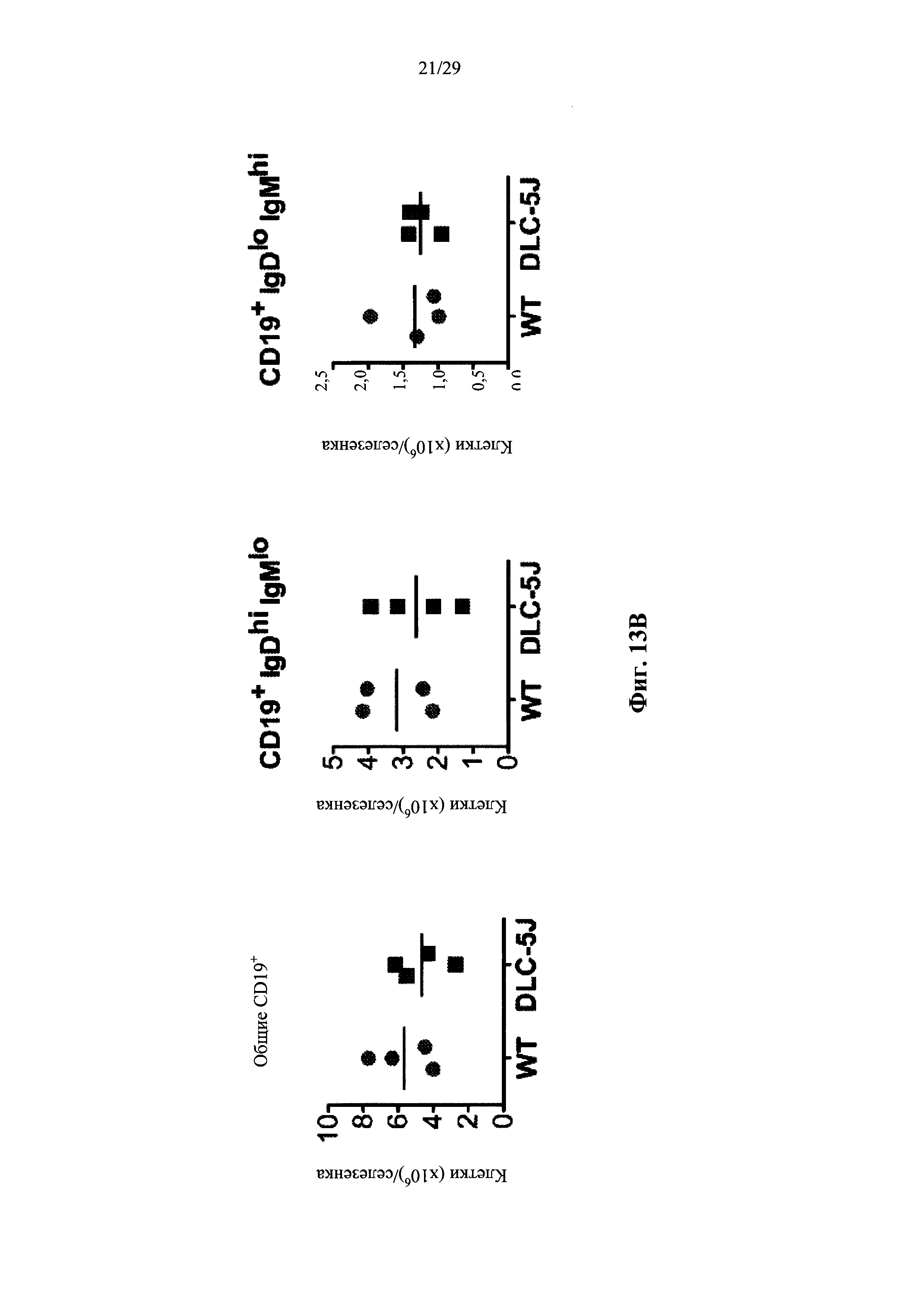
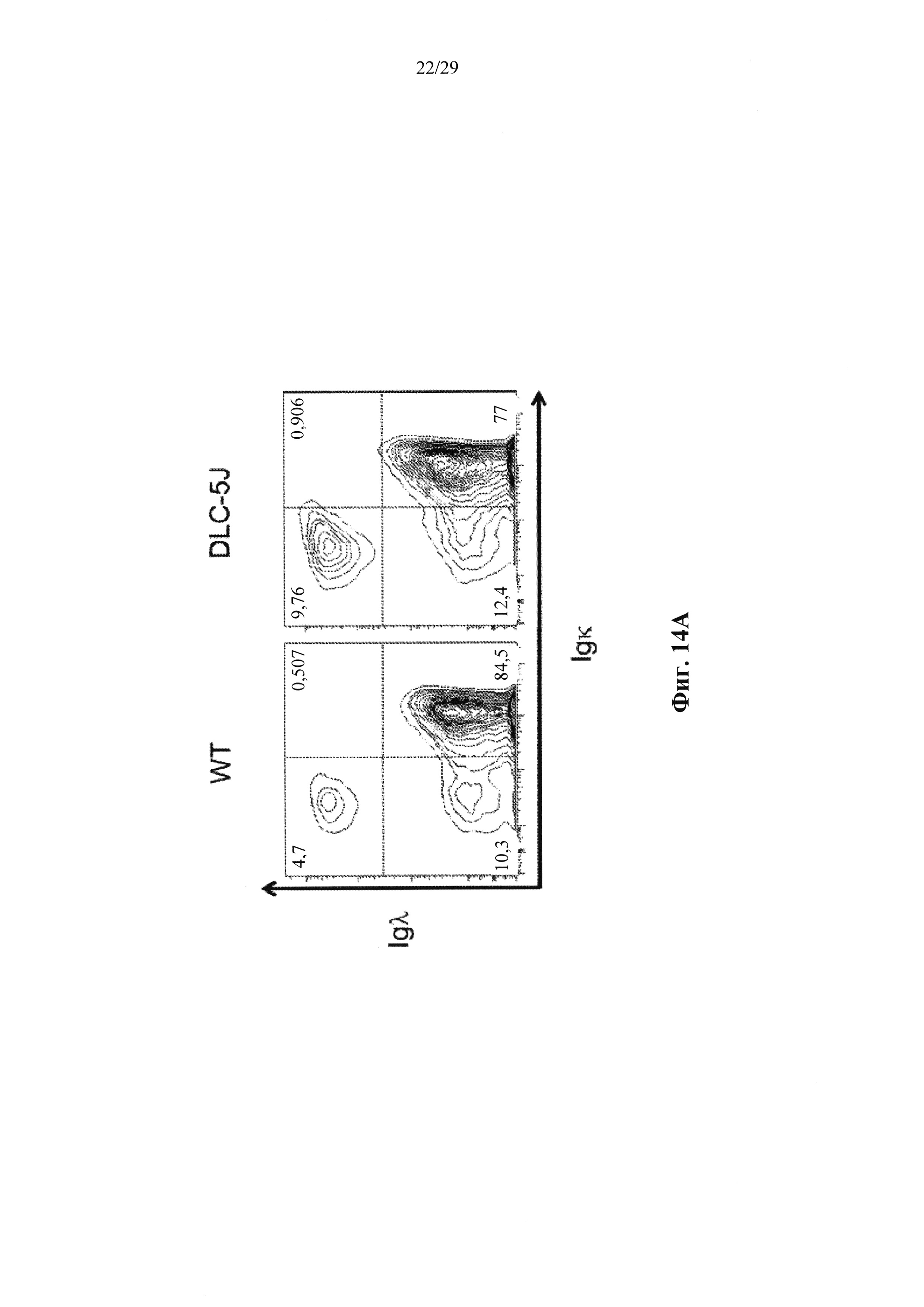
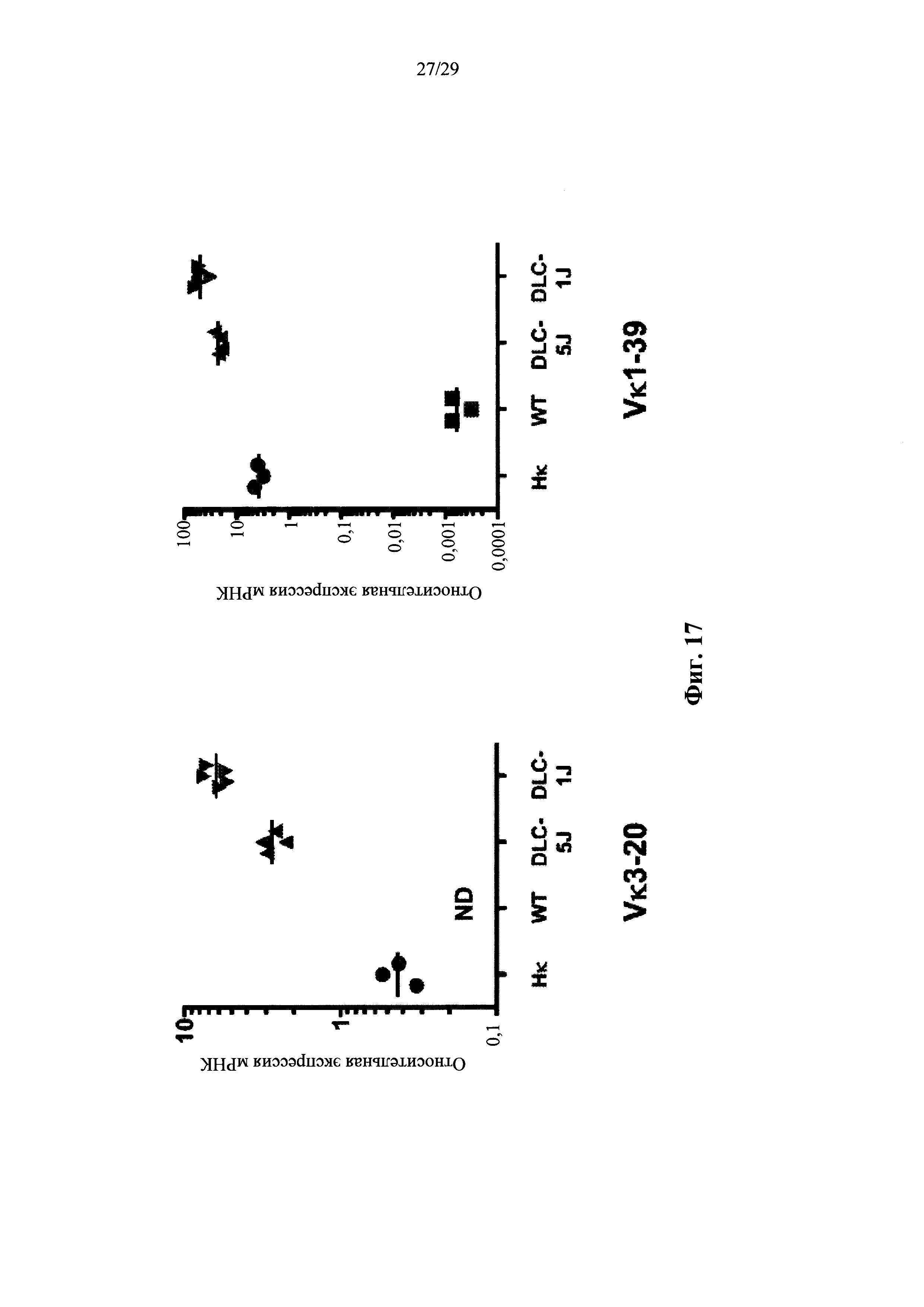
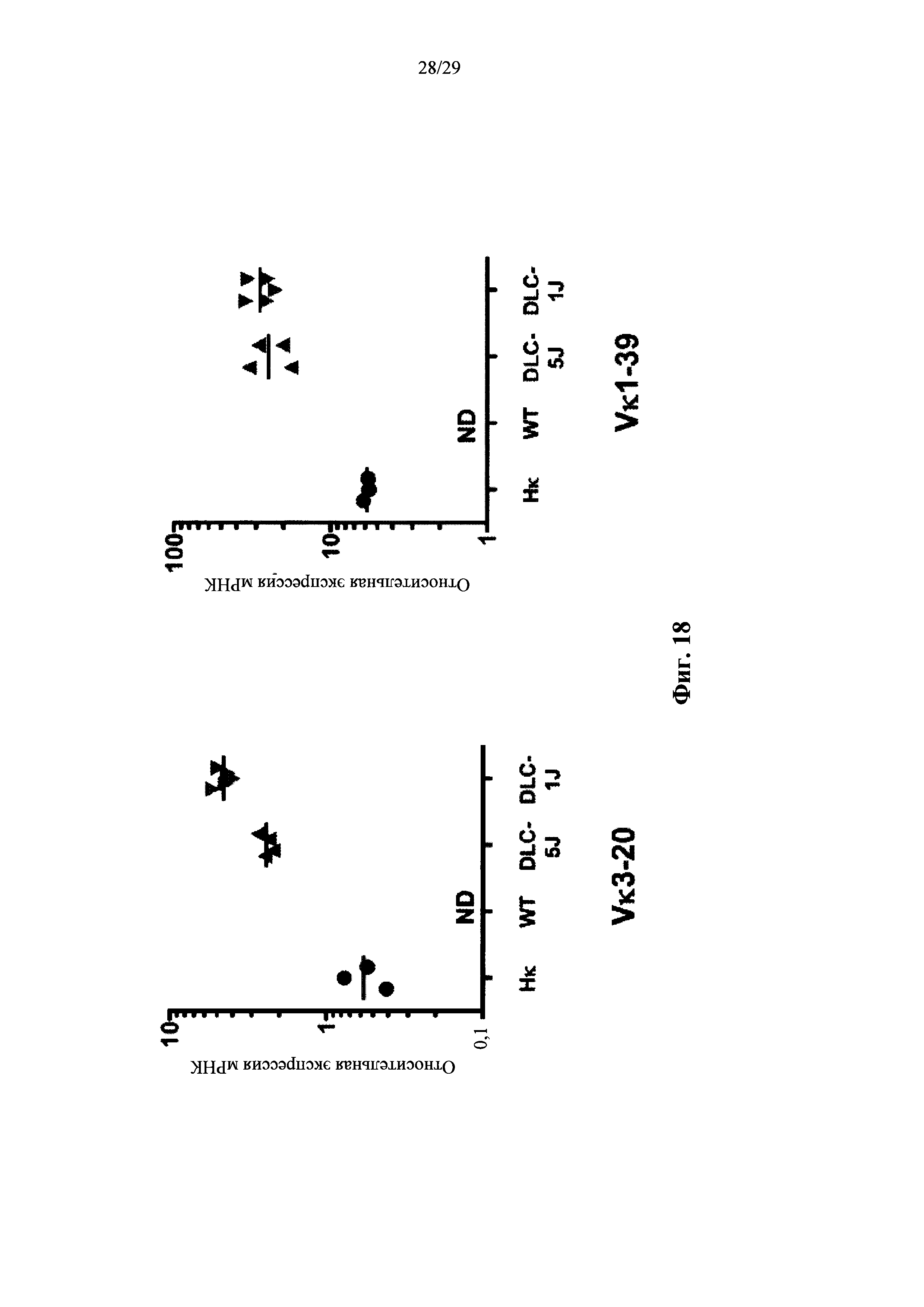
Описание
Ссылка на родственные заявки
По настоящей заявке испрашивается приоритет в соответствии с § 119(e) 35 U.S.С. предварительной заявки на патент США с серийным номером 13/798455, поданной 13 марта 2013 г., которая полностью включена в настоящий документ посредством ссылки.
Перечень последовательностей
Настоящая заявка ссылается на перечень последовательностей, представленный в электронной форме в виде файла ascii.txt, названном "2010794-0550 ST25", 13 марта 2014 г. Файл.txt был создан 11 марта 2014 г. и его размер составляет 33 кб.
Область техники
Предусмотрена генетически модифицированная мышь, которая экспрессирует антитела, содержащие общую легкую цепь с человеческой вариабельной областью/мышиной константной областью, связанную с разнообразными тяжелыми цепями с человеческой вариабельной областью/мышиной константной областью. Предусмотрен способ получения человеческого биспецифического антитела из человеческих генных последовательностей вариабельной области В-клеток мыши.
Уровень техники
Антитела, как правило, содержат компонент гомодимерной тяжелой цепи, причем каждый мономер тяжелой цепи связан с идентичной легкой цепью. Антитела, содержащие компонент гетеродимерной тяжелой цепи (например, биспецифические антитела) желательны в качестве терапевтических антител. Но получение биспецифических антител, содержащих подходящий компонент легкой цепи, который может удовлетворительно связываться с каждой из тяжелых цепей биспецифического антитела, оказалось проблематичным.
Согласно одному подходу легкая цепь может быть выбрана с помощью статистики обозревающего использования для всех вариабельных доменов легкой цепи, идентификации наиболее часто используемой легкой цепи в человеческих антителах и образования пары такой легкой цепи in vitro с двумя тяжелыми цепями с отличающейся спецификой.
Согласно другому подходу легкая цепь может быть выбрана путем наблюдения последовательностей легкой цепи в библиотеке фагового дисплея (например, библиотеке фагового дисплея, содержащей человеческие последовательности вариабельной области легкой цепи, например, библиотеке scFv человека) и выбора наиболее широко используемой вариабельной области легкой цепи из библиотеки. Легкая цепь затем может быть исследована на двух различных представляющих интерес тяжелых цепях.
Согласно другому подходу легкая цепь может быть выбрана путем анализа библиотеки фагового дисплея вариабельных последовательностей легкой цепи с использованием вариабельных последовательностей тяжелой цепи обеих представляющих интерес тяжелых цепей. Легкая цепь, которая связывается с двумя вариабельными последовательностями тяжелой цепи, может быть выбрана в качестве легкой цепи для тяжелых цепей.
Согласно другому подходу кандидатная легкая цепь может быть выровнена с родственными тяжелым цепям легкими цепями, и могут быть сделаны модификации в легкой цепи для более тесного соответствия характеристикам последовательности, общих для родственных легких цепей обеих тяжелых цепей. Если шансы иммуногенности должны быть сведены к минимуму, модификации предпочтительно приводят к последовательностям, которые присутствуют в известных последовательностях легких цепей человека, таким образом, что протеолитический процессинг вряд ли будет производить Т-клеточный эпитоп на основе известных в настоящей области техники параметров и способов оценки вероятности иммуногенности (т.е. in silico, а также анализы мокрым путем).
Каждый из описанных выше подходов основан на способах in vitro, которые вносят ряд априорных ограничений, например, идентичность последовательности, способность связываться со специфическими заранее выбранными тяжелыми цепями и т.д. Существует необходимость в настоящей области техники в композициях и способах, которые не основаны на условиях манипулирования in vitro, но которые вместо этого используют биологически более оптимальные подходы к созданию человеческих связывающих эпитопы белков, которые включают в себя общую легкую цепь.
Краткое раскрытие настоящего изобретения
Предусмотрены генетически модифицированные мыши, которые экспрессируют вариабельные домены тяжелой и легкой цепи иммуноглобулина человека, причем мыши содержат ограниченный вариабельный репертуар легких цепей. Предусмотрена биологическая система для создания человеческого вариабельного домена легкой цепи, который связывается и экспрессируется с разнообразным репертуаром вариабельных доменов тяжелой цепи человека с созревшей аффинностью. Предусмотрены способы получения связывающих белков, содержащих вариабельные домены иммуноглобулина, предусматривающие иммунизацию мышей, которые содержат ограниченный репертуар легких цепей иммуноглобулина представляющим интерес антигеном, и использование генной последовательности вариабельной области иммуноглобулина мыши в связывающем белке, который специфически связывается с представляющим интерес антигеном. Способы предусматривают способы получения вариабельных доменов тяжелых цепей иммуноглобулина человека, пригодных для использования при получении мультиспецифических антигенсвязывающих белков.
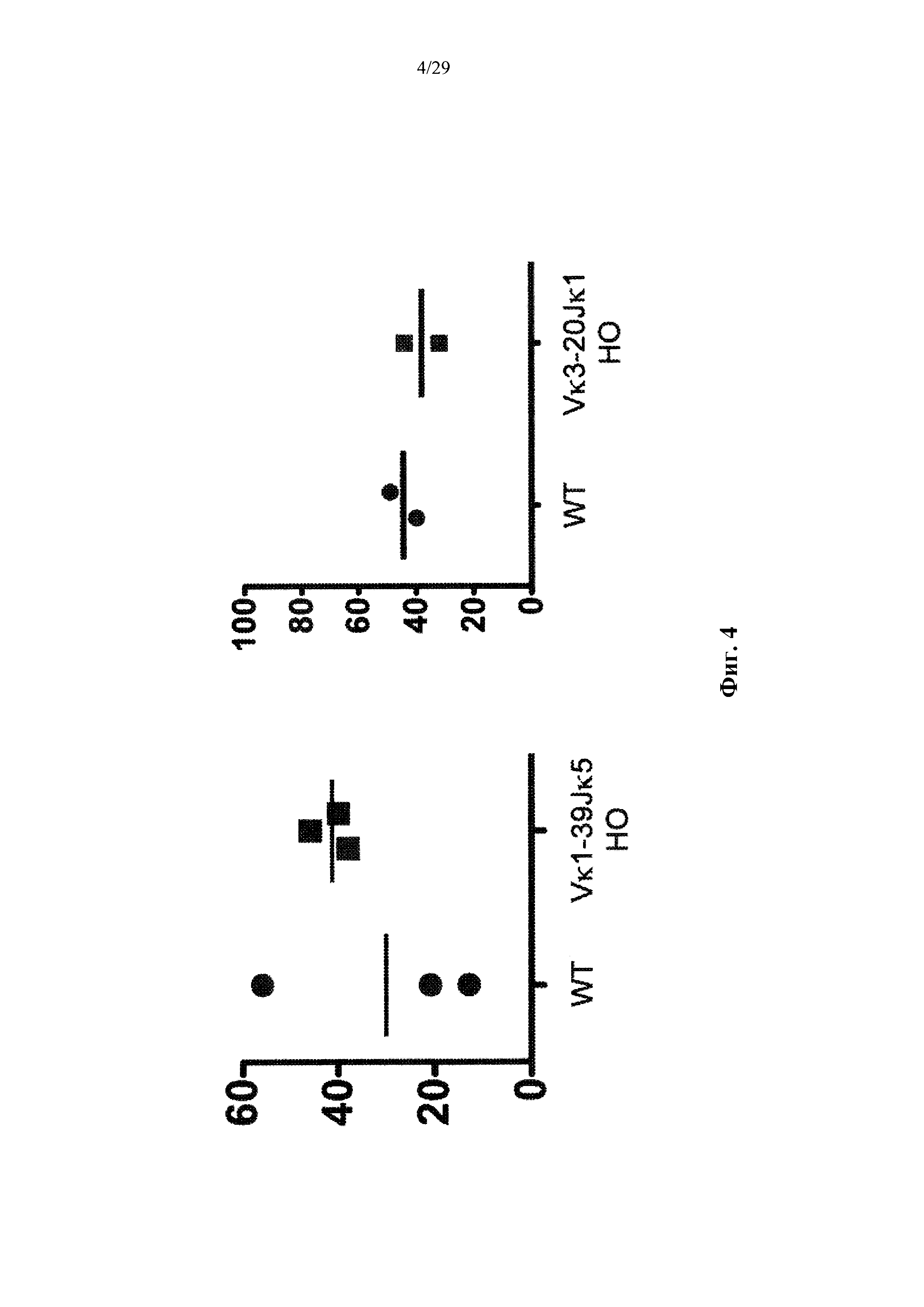
Предусмотрены генетически модифицированные мыши, которые выбирают подходящие вариабельные домены тяжелой цепи иммуноглобулина человека с созревшей аффинностью, происходящие из репертуара нереаранжированных генных сегментов вариабельной области тяжелой цепи человека, причем вариабельные домены тяжелой цепи человека с созревшей аффинностью связываются и экспрессируются с единственным вариабельным доменом легкой цепи человека, происходящим от одного генного сегмента вариабельной области легкой цепи человека. Также предусмотрены генетически модифицированные мыши, которые представляют собой выбор двух генных сегментов вариабельной области легкой цепи человека. Согласно различным аспектам один или два генных сегментов включают в себя Vκ1-39 человека и/или Vκ3-20 человека.
Предусмотрены генетически модифицированные мыши, которые экспрессируют ограниченный репертуар вариабельных доменов легкой цепи человека или единственный вариабельный домен легкой цепи человека из ограниченного репертуара генных сегментов вариабельной области легкой цепи человека. Согласно некоторым вариантам осуществления предусмотренных мышей подвергают генной инженерии, чтобы они включали в себя единственный нереаранжированный генный сегмент вариабельной области легкой цепи человека (или два генных сегмента вариабельной области легкой цепи человека), который реаранжируется, чтобы образовать реаранжированный ген вариабельной области легкой цепи человека (или два реаранжированных гена вариабельной области легкой цепи), который экспрессирует единственную легкую цепь (или который экспрессирует любую из двух или обе легкие цепи). Реаранжированные вариабельные домены легкой цепи человека способны к образованию пары с множеством тяжелых цепей человека с созревшей аффинностью, выбранных мышами, причем вариабельные области тяжелых цепей специфически связываются с различными эпитопами.
Предусмотрены генетически модифицированные мыши, которые экспрессируют ограниченный репертуар вариабельных доменов легкой цепи человека или единственный вариабельный домен легкой цепи человека из ограниченного репертуара последовательностей вариабельной области легкой цепи человека. Согласно некоторым вариантам осуществления предусмотренных мышей подвергают генной инженерии, чтобы они включали в себя единственную последовательность V/J легкой цепи человека (или две последовательности V/J), которая экспрессирует вариабельную область единственной легкой цепи (или которая экспрессирует любую из двух или обе вариабельные области). Легкая цепь, содержащая вариабельную последовательность способна к образованию пары с множеством тяжелых цепей человека с созревшей аффинностью, клонально выбранных мышами, причем вариабельные области тяжелой цепи специфически связываются с различными эпитопами.
Согласно одному аспекту предусмотрена генетически модифицированная мышь, которая содержит единственный генный сегмент вариабельной области (VL) легкой цепи иммуноглобулина человека, который способен к реаранжировке с генным сегментом J человека (выбранным из одного или множества сегментов JL) и кодированию человеческого домена VL легкой цепи иммуноглобулина. Согласно другому аспекту предусмотрена генетически модифицированная мышь, которая содержит не более двух человеческих генных сегментов VL, каждый из которых способен к реаранжировке с человеческим генным сегментом J (выбранным из одного или множества сегментов JL) и кодированию человеческого домена VL легкой цепи иммуноглобулина. Согласно некоторым вариантам осуществления два генных сегмента VL человека соседствуют в геноме мыши. Согласно некоторым вариантам осуществления два генных сегмента VL человека находятся в различных локусах (например, гетерозигота, содержащая первый сегмент VL человека в первой аллели легкой цепи и второй сегмент VL человека во второй аллели легкой цепи, причем первый и второй сегменты VL человека не идентичны) в геноме мыши. Согласно некоторым вариантам осуществления два генных сегмента VL человека представляют собой генный сегмент Vκ1-39 человека и генный сегмент Vκ3-20 человека. Согласно одному варианту осуществления генный сегмент JL человека выбирают из группы, состоящей из JκI, Jκ2, Jκ3, Jκ4, Jκ5 и попарной их комбинации. Согласно различным вариантам осуществления предусмотренная подвергнутая генной инженерии мышь не способна экспрессировать легкую цепь иммуноглобулина, которая содержит эндогенный генный сегмент VL. Например, согласно некоторым вариантам осуществления предусмотренная подвергнутая генной инженерии мышь содержит генетическую модификацию, которая инактивирует и/или удаляет часть или весь эндогенный генный сегмент VL.
Согласно одному варианту осуществления единственный генный сегмент VL человека функционально связан с генным сегментом JL человека, выбранным из Jκ1, Jκ2, Jκ3, Jκ4 и Jκ5, причем единственный генный сегмент VL человека способен к реаранжировке для образования последовательности, кодирующей ген вариабельной области легкой цепи с любым одним или несколькими генными сегментами JL человека.
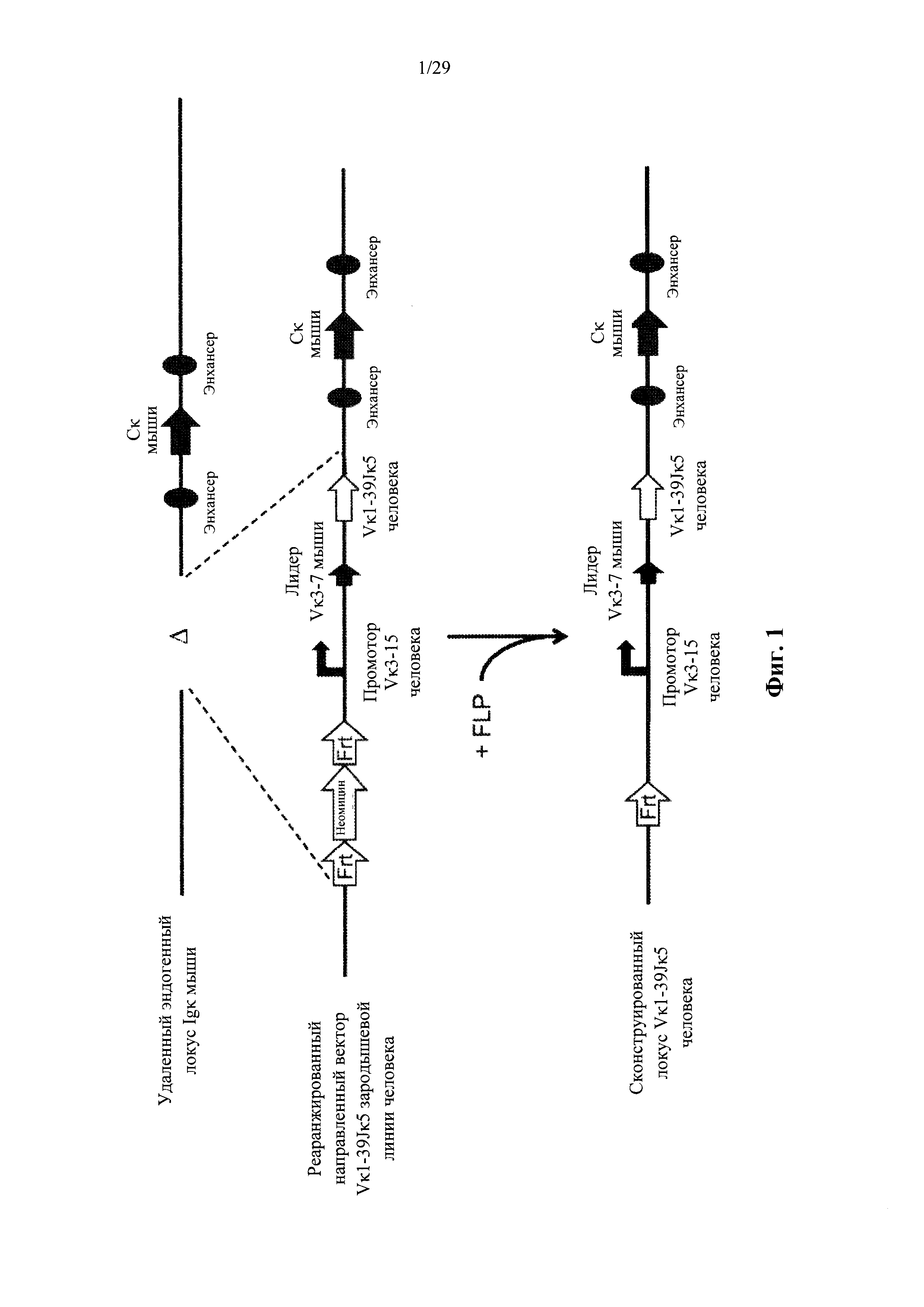
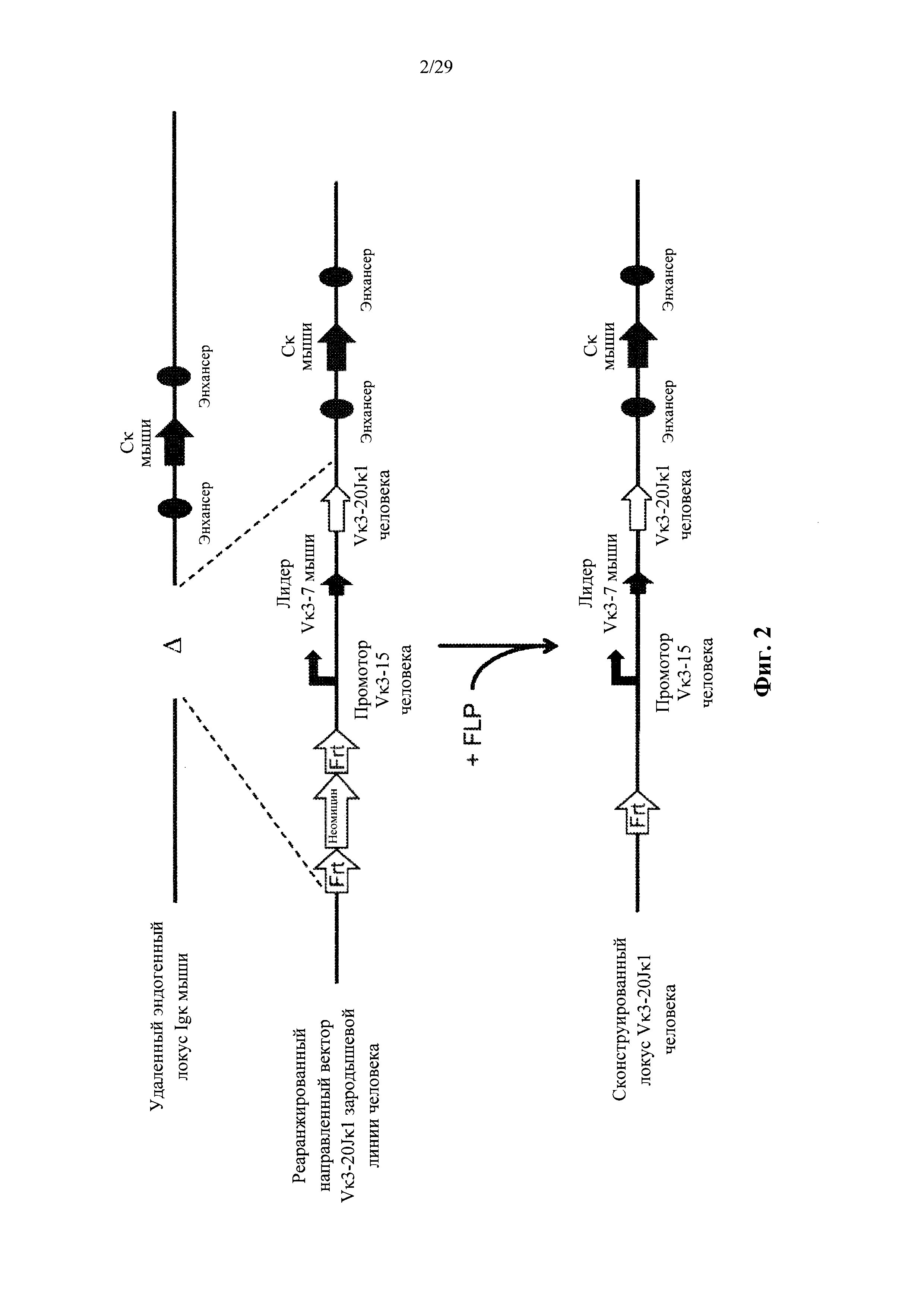
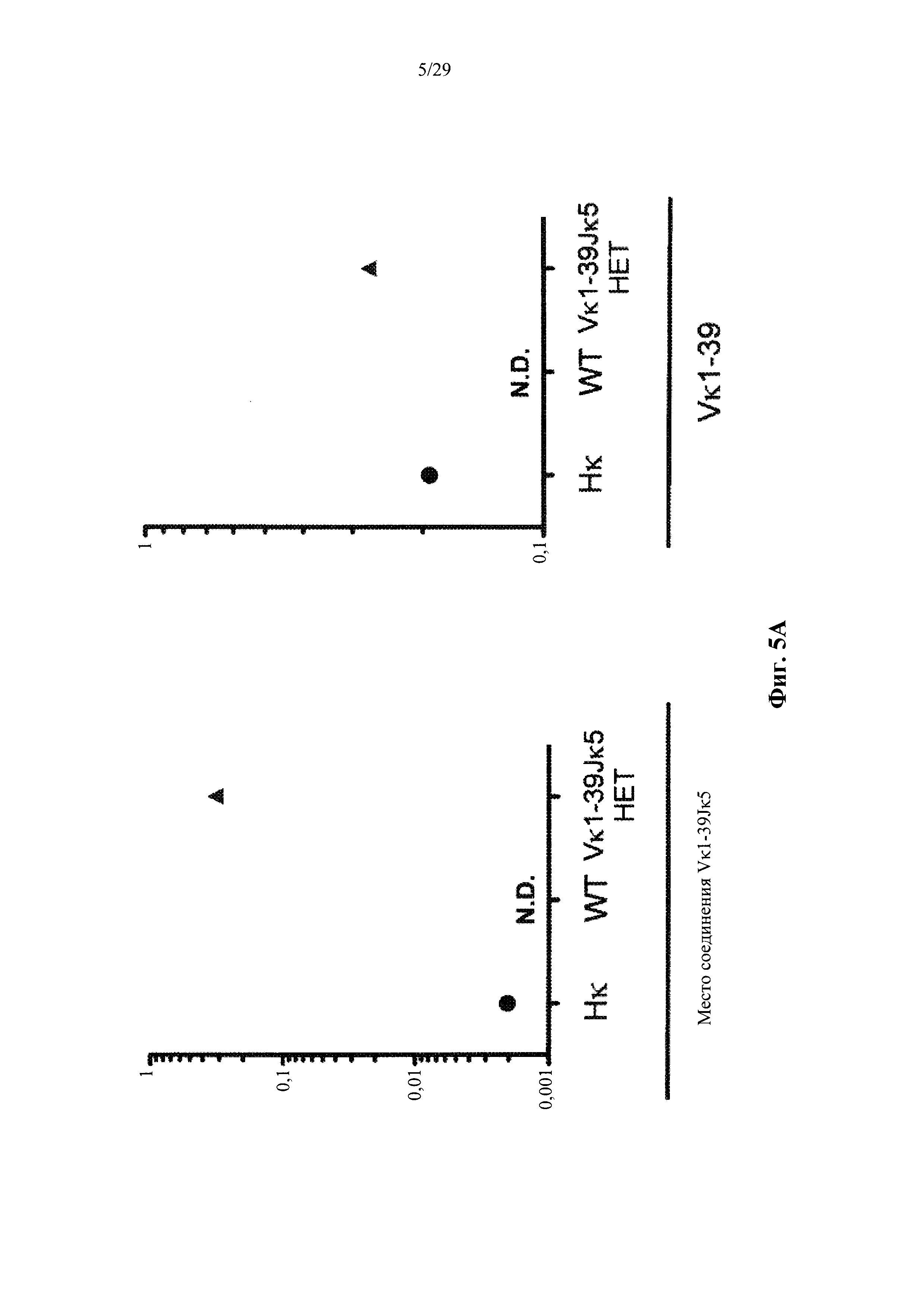
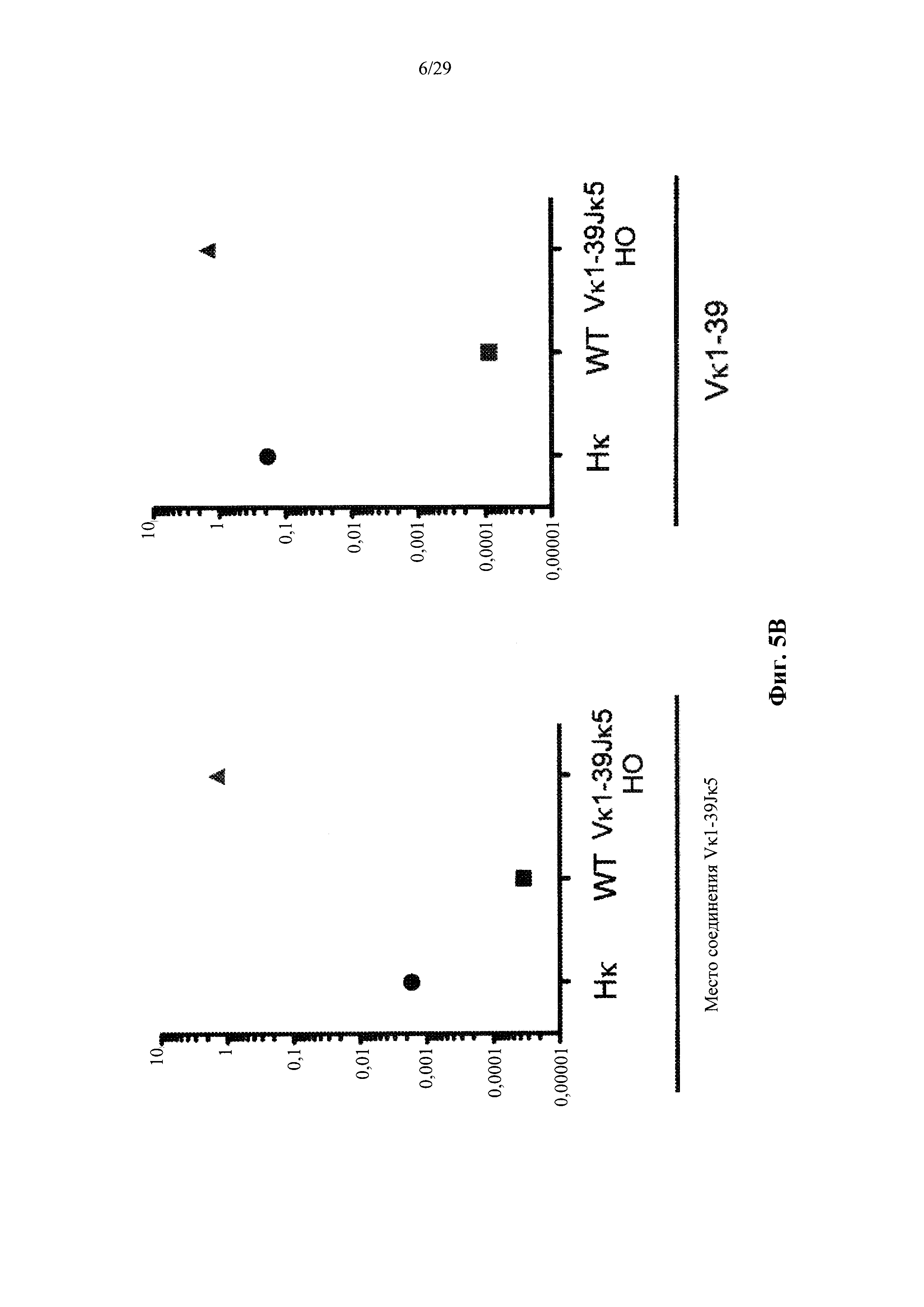
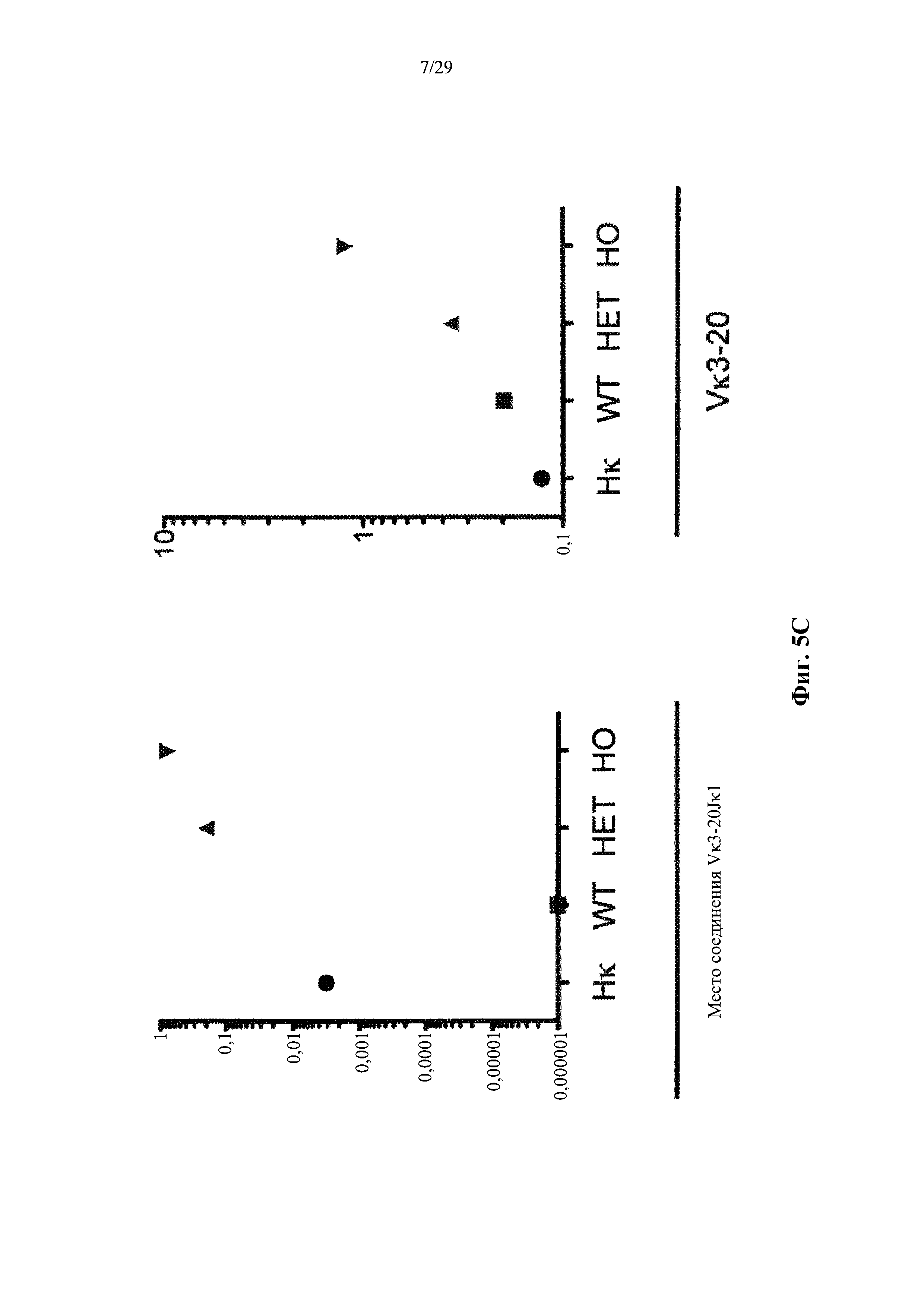
Согласно одному варианту осуществления предусмотренная подвергнутая генной инженерии мышь содержит локус легкой цепи иммуноглобулина, который не содержит эндогенный генный сегмент VL мыши, который способен к реаранжировке для образования гена легкой цепи иммуноглобулина, причем локус VL содержит единственный генный сегмент VL человека, который способен к реаранжировке для кодирования гена области VL легкой цепи. Согласно конкретным вариантам осуществления генный сегмент VL человека представляет собой генный сегмент Vκ1-39Jκ5 человека или генный сегмент Vκ3-20Jκ1 человека. Согласно некоторым вариантам осуществления предусмотренная генетически модифицированная мышь содержит локус VL, который не содержит эндогенный генный сегмент VL мыши, который способен к реаранжировке для образования гена легкой цепи иммуноглобулина, причем локус VL содержит не более двух генных сегментов VL человека, которые способны к реаранжировке для кодирования области VL гена легкой цепи. Согласно некоторым определенным вариантам осуществления не более чем два генных сегмента VL человека представляют собой выбранные из группы, состоящей из генного сегмента Vκ1-39 человека, генного сегмента Vκ3-20 и их комбинации. Согласно некоторым определенным вариантам осуществления не более чем два генных сегмента VL человека представляют собой генный сегмент Vκ1-39Jκ5 человека и генный сегмент Vκ3-20Jκ1 человека.
Согласно одному аспекту предусмотрена генетически модифицированная мышь, которая содержит единственную реаранжированную (V/J) вариабельную область (VL) легкой цепи иммуноглобулина человека (т.е. область VL/JL), которая кодирует человеческий домен VL легкой цепи иммуноглобулина. Согласно другому аспекту мышь содержит не более чем две реаранжированные области VL человека, которые способны к кодированию человеческого домена VL легкой цепи иммуноглобулина.
Согласно одному варианту осуществления область VL представляет собой реаранжированную последовательность Vκ1-39/J человека или реаранжированную последовательность Vκ3-20/J человека. Согласно одному варианту осуществления человеческий сегмент JL реаранжированной последовательности VL/JL выбирают из Jκ1, Jκ2, Jκ3, Jκ4 и Jκ5. Согласно конкретному варианту осуществления область VL представляет собой последовательность Vκ1-39Jκ5 человека или последовательность Vκ3-20Jκ1 человека. Согласно конкретному варианту осуществления мышь содержит как последовательность Vκ1-39Jκ5 человека, так и последовательность Vκ3-20Jκ1 человека.
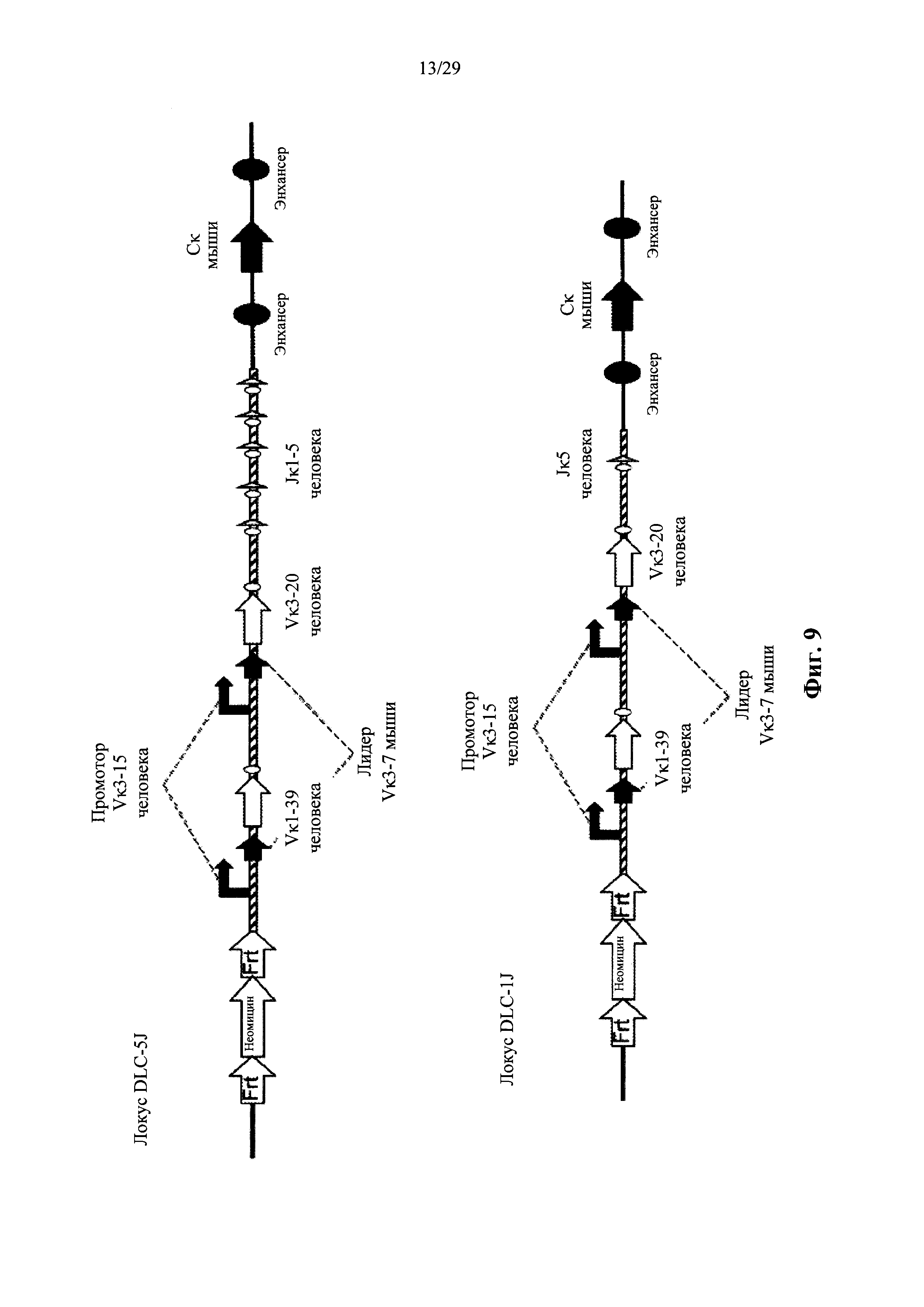
Согласно одному варианту осуществления генный сегмент VL человека функционально связан с лидерной последовательностью человека или мыши. Согласно одному варианту осуществления лидерная последовательность представляет собой мышиную лидерную последовательность. Согласно конкретному варианту осуществления мышиная лидерная последовательность представляет собой мышиную лидерную последовательность Vκ3-7. Согласно конкретному варианту осуществления лидерная последовательность функционально связана с нереаранжированным генным сегментом VL человека. Согласно конкретному варианту осуществления лидерная последовательность функционально связана с реаранжированной последовательностью VL/JL человека.
Согласно одному варианту осуществления генный сегмент VL функционально связан с промоторной последовательностью иммуноглобулина. Согласно одному варианту осуществления промоторная последовательность представляет собой человеческую промоторную последовательность. Согласно конкретному варианту осуществления промотор иммуноглобулина человека представляет собой промотор Vκ3-15 человека. Согласно конкретному варианту осуществления промотор функционально связан с нереаранжированным генным сегментом VL человека. Согласно конкретному варианту осуществления промотор функционально связан с реаранжированной последовательностью VL/JL человека.
Согласно одному варианту осуществления локус легкой цепи содержит лидерную последовательность, фланкированную с 5' (по отношению к направлению транскрипции генного сегмента VL) промотором иммуноглобулина человека и фланкированную с 3' генным сегментом VL человека, который реаранжирует с человеческим сегментом J и кодирует домен VL обратной химерной легкой цепи, содержащей эндогенную константную область легкой цепи (CL) мыши. Согласно конкретному варианту осуществления генный сегмент VL находится в локусе Vκ мыши и CL мыши представляет собой Сκ мыши.
Согласно одному варианту осуществления локус легкой цепи содержит лидерную последовательность, фланкированную с 5' (по отношению к направлению транскрипции генного сегмента VL) промотором иммуноглобулина человека и фланкированную с 3' реаранжированной областью VL человека (последовательность VL/JL), и кодирует домен VL обратной химерной легкой цепи, содержащей эндогенную константную область легкой цепи (CL) мыши. Согласно конкретному варианту осуществления реаранжированная последовательность VL/JL человека находится на локусе каппа (κ) мыши и CL мыши представляет собой Сκ мыши.
Согласно одному варианту осуществления локус VL модифицированной мыши представляет собой локус к легкой цепи и локус к легкой цепи содержит интронный энхансер к мыши, 3' энхансер к мыши или как интронный энхансер, так и 3' энхансер.
Согласно одному варианту осуществления мышь содержит нефункциональный локус легкой цепи лямбда (λ) иммуноглобулина. Согласно конкретному варианту осуществления локус легкой цепи λ содержит делецию одной или нескольких последовательностей локуса, причем одна или несколько делеций приводит локус легкой цепи λ к неспособности к реаранжировке для образования гена легкой цепи. Согласно другому варианту осуществления все или по существу все из генных сегментов VL в локусе легкой цепи λ удаляются.
Согласно одному варианту осуществления мышь создает легкую цепь, которая содержит соматически мутированный домен VL, полученный из генного сегмента VL человека. Согласно одному варианту осуществления легкая цепь содержит соматически мутированный домен VL, полученный из генного сегмента VL человека, и область Сκ мыши. Согласно одному варианту осуществления мышь не экспрессирует легкую цепь λ.
Согласно одному варианту осуществления генетически модифицированная мышь способна к соматическому гипермутированию последовательности области VL человека. Согласно конкретному варианту осуществления мышь содержит клетку, которая содержит реаранжированный ген легкой цепи иммуноглобулина, полученный из человеческого генного сегмента VL, который способен к реаранжированию и кодированию домена VL, и реаранжированный ген легкой цепи иммуноглобулина содержит соматически мутированный домен VL.
Согласно одному варианту осуществления мышь содержит клетку, которая экспрессирует легкую цепь, содержащую соматически мутированный домен VL человека, связанный с Сκ мыши, причем легкая цепь связывается с тяжелой цепью, содержащей соматически мутированный домен VH, полученный из генного сегмента VH человека, и причем тяжелая цепь содержит константную область тяжелой цепи (CH) мыши. Согласно конкретному варианту осуществления тяжелая цепь содержит CH1 мыши, шарнир мыши, CH2 мыши и CH3 мыши. Согласно конкретному варианту осуществления тяжелая цепь содержит CH1 человека, шарнир, CH2 мыши и CH3 мыши.
Согласно одному варианту осуществления мышь содержит замещение эндогенных генных сегментов VH мыши одним или несколькими генными сегментами VH человека, причем генные сегменты VH человека функционально связаны с геном области CH мыши, таким образом, что мышь реаранжирует генные сегменты VH человека и экспрессирует обратную химерную тяжелую цепь иммуноглобулина, которая содержит домен VH человека и CH мыши. Согласно одному варианту осуществления 90-100% нереаранжированных генных сегментов VH мыши замещаются по меньшей мере одним нереаранжированным генным сегментом VH человека. Согласно конкретному варианту осуществления все или по существу все из эндогенных генных сегментов VH мыши замещаются по меньшей мере одним нереаранжированным генным сегментом VH человека. Согласно одному варианту осуществления замещение представляет собой замещение по меньшей мере на 19, по меньшей мере на 39 или по меньшей мере на 80 или 81 нереаранжированных генных сегментов VH человека. Согласно одному варианту осуществления замещение представляет собой замещение на 12 функциональных нереаранжированных генных сегментов VH человека, по меньшей мере на 25 функциональных нереаранжированных генных сегментов VH человека или по меньшей мере на 43 функциональных нереаранжированных генных сегмента VH человека. Согласно одному варианту осуществления мышь содержит замещение всех сегментов DH и JH мыши по меньшей мере одним нереаранжированным сегментом DH человека и по меньшей мере одним нереаранжированным сегментом JH человека. Согласно одному варианту осуществления по меньшей мере один переаранжированный сегмент DH человека выбирают из 1-1, D1-7, 1-26, 2-8, 2-15, 3-3, 3-10, 3-16, 3-22, 5-5, 5-12, 6-6, 6-13, 7-27 и их комбинации. Согласно одному варианту осуществления по меньшей мере один нереаранжированный сегмент JH человека выбирают из 1, 2, 3, 4, 5, 6 и их комбинации. Согласно конкретному варианту осуществления один или несколько генных сегментов VH человека выбирают из генных сегментов VH человека 1-2,1-8, 1-24, 1-69, 2-5, 3-7, 3-9, 3-11, 3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 3-53,4-31,4-39,4-59, 5-51, 6-1 и их комбинации.
Согласно одному варианту осуществления мышь содержит В-клетку, которая экспрессирует связывающий белок, который специфически связывается с представляющим интерес антигеном, причем связывающий белок содержит легкую цепь, полученную из реаранжировки Vκ1-39/Jκ5 человека или реаранжировки Vκ3-20/JκI, и причем клетка содержит реаранжированный ген тяжелой цепи иммуноглобулина, полученный из реаранжировки генных сегментов VH человека, выбранных из генных сегментов 1-69, 2-5, 3-13, 3-23, 3-30, 3-33, 3-53, 4-39, 4-59 и 5-51. Согласно одному варианту осуществления один или несколько генных сегментов VH человека реаранжируют с генным сегментом JH тяжелой цепи человека, выбранным из 1, 2, 3, 4, 5 и 6. Согласно одному варианту осуществления один или несколько генных сегментов VH и JH человека реаранжируют с генным сегментом DH человека, выбранным из 1-1, 1-7, 1-26, 2-8, 2-15, 3-3, 3-10, 3-16, 3-22, 5-5, 5-12, 6-6, 6-13 и 7-27. Согласно конкретному варианту осуществления ген легкой цепи содержит 1, 2, 3, 4 или 5 или более соматических гипермутаций.
Согласно одному варианту осуществления мышь содержит В-клетку, которая содержит реаранжированную генную последовательность вариабельной области тяжелой цепи иммуноглобулина, содержащую область VH/DH/JH, выбранную из 2-5/6-6/1, 2-5/3-22/1, 3-13/6-6/5, 3-23/2-8/4, 3-23/3-3/4, 3-23/3-10/4, 3-23/6-6/4, 3-23/7-27/4, 3-30/1-1/4, 3-30/1-7/4, 3-30/3-3/3, 3-30/3-3/4, 3-30/3-22/5, 3-30/5-5/2, 3-30/5-12/4, 3-30/6-6/1, 3-30/6-6/3, 3-30/6-6/4, 3-30/6-6/5, 3-30/6-13/4, 3-30/7-27/4, 3-30/7-27/5, 3-30/7-27/6, 3-33/1-7/4, 3-33/2-15/4, 4-39/1-26/3, 4-59/3-16/3, 4-59/3-16/4, 4-59/3-22/3, 5-51/3-16/6, 5-51/5-5/3, 5-51/6-13/5, 3-53/1-1/4, 1-69/6-6/5 и 1-69/6-13/4. Согласно конкретному варианту осуществления В-клетка экспрессирует связывающий белок, содержащий вариабельную область тяжелой цепи иммуноглобулина человека, слитую с константной областью тяжелой цепи мыши, и вариабельную область легкой цепи иммуноглобулина человека, слитую с константной областью легкой цепи мыши.
Согласно одному варианту осуществления реаранжированная область VL человека представляет собой последовательность Vκ1-39Jκ5 человека, и мышь экспрессирует обратную химерную легкую цепь, содержащую (I) домен VL, полученный из последовательности VL/JL человека, и (II) CL мыши; причем легкая цепь связана с обратной химерной тяжелой цепью, содержащей (I) CH мыши и (II) соматически мутированный домен VH человека, полученный из генного сегмента VH человека, выбранного из генных сегментов VH человека 1-2, 1-8, 1-24, 1-69, 2-5, 3-7, 3-9, 3-11, 3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 3-53, 4-31, 4-39, 4-59, 5-51 и 6-1 и их комбинации. Согласно одному варианту осуществления мышь экспрессирует легкую цепь, которая соматически мутировала. Согласно одному варианту осуществления CL представляет собой Сκ мыши. Согласно конкретному варианту осуществления генный сегмент VH человека выбирают из генных сегментов 2-5, 3-13, 3-23, 3-30, 4-59, 5-51 и 1-69. Согласно конкретному варианту осуществления соматически мутированный домен VH человека содержит последовательность, полученную из сегмента DH, выбранного из 1-1, 1-7, 2-8, 3-3, 3-10, 3-16, 3-22, 5-5, 5-12, 6-6, 6-13 и 7-27. Согласно конкретному варианту осуществления соматически мутированный домен VH человека содержит последовательность, полученную из сегмента JH, выбранного из 1, 2, 3, 4, 5 и 6. Согласно конкретному варианту осуществления соматически мутированный домен VH человека кодируется реаранжированной последовательностью VH/DH/JH человека, выбранной из 2-5/6-6/1, 2-5/3-22/1, 3-13/6-6/5, 3-23/2-8/4, 3-23/3-3/4, 3-23/3-10/4, 3-23/6-6/4, 3-23/7-27/4, 3-30/1-1/4, 3-30/1-7/4, 3-30/3-3/4, 3-30/3-22/5, 3-30/5-5/2, 3-30/5-12/4, 3-30/6-6/1, 3-30/6-6/3, 3-30/6-6/4, 3-30/6-6/5, 3-30/6-13/4, 3-30/7-27/4, 3-30/7-27/5, 3-30/7-27/6, 4-59/3-16/3, 4-59/3-16/4, 4-59/3-22/3, 5-51/5-5/3, 1-69/6-6/5 и 1-69/6-13/4.
Согласно одному варианту осуществления реаранжированная область VL человека представляет собой последовательность Vκ3-20Jκ1 человека, и мышь экспрессирует обратную химерную легкую цепь, содержащую (I) домен VL, полученный из последовательности VL/JL человека, и (II) CL мыши; причем легкая цепь связана с обратной химерной тяжелой цепью, содержащей (I) CH мыши и (II) соматически мутированный домен VH человека, полученный из генного сегмента VH человека, выбранного из генных сегментов VH человека 1-2, 1-8, 1-24, 1-69, 2-5, 3-7, 3-9, 3-11, 3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 3-53, 4-31, 4-39, 4-59, 5-51 и 6-1 и их комбинации. Согласно одному варианту осуществления мышь экспрессирует легкую цепь, которая соматически мутировала. Согласно одному варианту осуществления CL представляет собой Сκ мыши. Согласно конкретному варианту осуществления генный сегмент VH человека выбирают из генных сегментов 3-30, 3-33, 3-53, 4-39 и 5-51. Согласно конкретному варианту осуществления соматически мутированный домен VH человека содержит последовательность, полученную из сегмента DH, выбранного из 1-1, 1-7, 1-26, 2-15, 3-3, 3-16 и 6-13. Согласно конкретному варианту осуществления соматически мутированный домен VH человека содержит последовательность, полученную из сегмента JH, выбранного из 3, 4, 5 и 6. Согласно конкретному варианту осуществления соматически мутированный домен VH человека кодируется реаранжированной последовательностью VH/DH/JH человека, выбранной из 3-30/1-1/4, 3-30/3-3/3, 3-33/1-7/4, 3-33/2-15/4, 4-39/1-26/3, 5-51/3-16/6, 5-51/6-13/5 и 3-53/1-1/4.
Согласно одному варианту осуществления мышь содержит как реаранжированную последовательность Vκ1-39Jκ5 человека, так и реаранжированную последовательность Vκ3-20Jκ1 человека, и мышь экспрессирует обратную химерную легкую цепь, содержащую (I) домен VL, полученный из последовательности Vκ1-39Jκ5 человека или последовательности Vκ3-20Jκ1 человека, и (II) CL мыши; причем легкая цепь связана с обратной химерной тяжелой цепью, содержащей (I) CH мыши и (II) соматически мутированный домен VH человека, полученный из генного сегмента VH человека, выбранного из генных сегментов VH человека 1-2,1-8, 1-24, 1-69, 2-5, 3-7, 3-9, 3-11, 3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 3-53, 4-31, 4-39, 4-59, 5-51 и 6-1 и их комбинации. Согласно одному варианту осуществления мышь экспрессирует легкую цепь, которая соматически мутирована. Согласно одному варианту осуществления CL представляет собой Сκ мыши.
Согласно одному варианту осуществления 90-100% эндогенных нереаранжированных генных сегментов VH мыши замещаются по меньшей мере одним нереаранжированным генным сегментом VH человека. Согласно конкретному варианту осуществления все или по существу все из эндогенных нереаранжированных генных сегментов VH мыши замещаются по меньшей мере одним нереаранжированным генным сегментом VH человека. Согласно одному варианту осуществления замещение представляет собой замещение по меньшей мере на 18, по меньшей мере на 39 или по меньшей мере на 80 или 81 нереаранжированный генный сегмент VH человека. Согласно одному варианту осуществления замещение представляет собой замещение на 12 функциональных нереаранжированных генных сегментов VH человека, по меньшей мере на 25 функциональных переаранжированных генных сегментов VH человека или по меньшей мере на 43 функциональных переаранжированных генных сегмента VH человека.
Согласно одному варианту осуществления генетически модифицированная мышь представляют собой линию C57BL, согласно конкретному варианту осуществления выбранную из C57BL/A, C57BL/An, C57BL/GrFa, C57BL/KaLwN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6NJ, C57BL/10, C57BL/10ScSn, C57BL/10Cr и C57BL/01a. Согласно конкретному варианту осуществления генетически модифицированная мышь представляет собой смесь вышеупомянутой линии 129 и вышеупомянутой линии C57BL/6. Согласно другому конкретному варианту осуществления мышь представляет собой смесь вышеупомянутых линий 129 или смесь вышеупомянутых линий BL/6. Согласно конкретному варианту осуществления линия 129 смеси представляет собой линию 129S6 (129/SvEvTac).
Согласно одному варианту осуществления мышь экспрессирует обратное химерное антитело, содержащее легкую цепь, которая содержит Сκ мыши и соматически мутированный домен VL человека, полученный из реаранжированной последовательности Vκ1-39Jκ5 человека или реаранжированной последовательности Vκ3-20Jκ1 человека, и тяжелую цепь, которая содержит CH мыши и соматически мутированный домен VH человека, полученный из генного сегмента VH человека, выбранного из генных сегментов VH человека 11-2, 1-8, 1-24, 1-69, 2-5, 3-7, 3-9, 3-11, 3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 3-53, 4-31, 4-39, 4-59, 5-51 и 6-1, причем мышь не экспрессирует полностью мышиное антитело и не экспрессирует полностью человеческое антитело. Согласно одному варианту осуществления мышь содержит локус легкой цепи κ, который содержит замещение эндогенных генных сегментов легкой цепи к мыши реаранжированной последовательностью Vκ1-39Jκ5 человека или реаранжированной последовательностью Vκ3-20Jκ1 человека, и содержит замещение всех или практически всех эндогенных генных сегментов VH мыши полным или по существу полным репертуаром генных сегментов VH человека.
Согласно одному аспекту предусмотрена популяция антигенспецифических антител, полученных от описанной в настоящем документе мыши, причем антитела содержат ген легкой цепи, полученный из реаранжировки Vκ1-39/Jκ5 человека или реаранжировки Vκ3-20/Jκ1 человека, и причем антитела содержат реаранжированный ген тяжелой цепи иммуноглобулина, полученный из реаранжировки генного сегмента VH человека, выбранного из генного сегмента VH человека 1-2, 1-3, 1-8, 1-18, 1-24, 1-46, 1-58, 1-69, 2-5, 2-26, 2-70, 3-7, 3-9, 3-11, 3-13, 3-15, 3-16, 3-20, 3-21, 3-23, 3-30, 3-33, 3-43, 3-48, 3-53, 3-64, 3-72, 3-73, 4-31, 4-34, 4-39, 4-59, 5-51 и 6-1. Согласно одному варианту осуществления один или несколько генных сегментов VH человека реаранжируют с генным сегментом JH тяжелой цепи человека, выбранным из 1, 2, 3, 4, 5 и 6. Согласно конкретному варианту осуществления легкая цепь содержит 1, 2, 3, 4 или 5 или более соматических гипермутаций.
Согласно одному варианту осуществления легкая цепь содержит 1, 2, 3 или 4 соматических гипермутаций. Согласно одному варианту осуществления ген легкой цепи содержит 1 или 2 мутации. Согласно различным вариантам осуществления ген легкой цепи способен подвергаться множественным мутациям вдоль его последовательности.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ1-39/Jκ5 человека, и легкая цепь содержит по меньшей мере одну или не более чем четыре соматические гипермутации. Согласно одному варианту осуществления легкая цепь содержит по меньшей мере две соматические гипермутации. Согласно одному варианту осуществления легкая цепь содержит по меньшей мере три соматические гипермутации. Согласно одному варианту осуществления легкая цепь содержит по меньшей мере четыре соматические гипермутации. Согласно конкретному варианту осуществления по меньшей мере одна такая соматическая гипермутация присутствует в одной или нескольких каркасных областях (FW) легкой цепи. Согласно конкретному варианту осуществления по меньшей мере одна такая соматическая гипермутация присутствует в одной или нескольких определяющих комплементарность областях (CDR) легкой цепи. Согласно конкретному варианту осуществления по меньшей мере одна такая соматическая гипермутация присутствует в одной или нескольких FW и/или одной или нескольких CDR легкой цепи. Согласно различным вариантам осуществления каркасные области выбирают из каркаса 1 (FW1), каркаса 2 (FW2), каркаса 3 (FW3) и/или их комбинации. Согласно различным вариантам осуществления CDR выбирают из CDR1, CDR2, CDR3 и/или их комбинации.
Согласно одному варианту осуществления тяжелая цепь содержит по меньшей мере одну мутацию в одной или нескольких FW или одной или нескольких CDR. Согласно одному варианту осуществления тяжелая цепь содержит по меньшей мере одну мутацию в одной или нескольких FW и одной или нескольких CDR. Согласно одному варианту осуществления тяжелая цепь содержит по меньшей мере две мутации в одной или нескольких FW и одной или нескольких CDR. Согласно одному варианту осуществления тяжелая цепь содержит по меньшей мере три мутации в одной или нескольких FW и одной или нескольких CDR. Согласно одному варианту осуществления тяжелая цепь содержит по меньшей мере четыре мутации в одной или нескольких FW и одной или нескольких CDR. Согласно одному варианту осуществления тяжелая цепь содержит по меньшей мере пять или более пяти мутаций в одной или нескольких FW и одной или нескольких CDR. Согласно конкретному варианту осуществления тяжелая цепь содержит по меньшей мере пять или более пяти мутаций в двух FW; согласно конкретному варианту осуществления тяжелая цепь содержит по меньшей мере пять или более пяти мутаций в одной FW и одной CDR.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ1-39/Jκ5 человека, и приблизительно 9% полученных из Vκ1-39/Jκ5 легких цепей содержат по меньшей мере одну мутацию, присутствующую в FW1; согласно одному варианту осуществления по меньшей мере 9% легких цепей содержат одну мутацию, присутствующую в FW1. Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ1-39/Jκ5 человека и приблизительно 25% полученных из Vκ1-39/Jκ5 легких цепей содержат по меньшей мере одну или не более чем две мутации, присутствующие в CDR1; согласно одному варианту осуществления по меньшей мере 9% легких цепей содержат одну мутацию, присутствующую в CDR1; согласно одному варианту осуществления по меньшей мере 5% легких цепей содержат две мутации, присутствующие в CDR1.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ1-39/Jκ5 человека, и приблизительно 20% полученных из Vκ1-39/Jκ5 легких цепей содержат по меньшей мере одну или не более чем три мутации, присутствующие в FW2; согласно одному варианту осуществления по меньшей мере 17% легких цепей содержат одну мутацию, присутствующую в FW2; согласно одному варианту осуществления по меньшей мере 1% легких цепей содержат две мутации, присутствующие в FW2; согласно одному варианту осуществления по меньшей мере 1% легких цепей содержат три мутации, присутствующие в FW2.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ1-39/Jκ5 человека, и приблизительно 10% полученных из Vκ1-39/Jκ5 легких цепей содержат по меньшей мере одну или не более чем две мутации, присутствующие в CDR2; согласно одному варианту осуществления по меньшей мере 10% легких цепей содержат одну мутацию, присутствующую в CDR2; согласно одному варианту осуществления по меньшей мере 1% легких цепей содержат две мутации, присутствующие в CDR2.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ1-39/Jκ5 человека, и приблизительно 29% полученных из Vκ1-39/Jκ5 легких цепей содержат по меньшей мере одну или не более четырех мутаций, присутствующих в FW3; согласно одному варианту осуществления по меньшей мере 21% легких цепей содержит одну мутацию, присутствующую в FW3; согласно одному варианту осуществления по меньшей мере 5% легких цепей содержат две мутации, присутствующие в FW3; согласно одному варианту осуществления по меньшей мере 2% легких цепей содержат три мутации, присутствующие в FW3; согласно одному варианту осуществления по меньшей мере 2% легких цепей содержат четыре мутации, присутствующие в FW3.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ1-39/Jκ5 человека, и приблизительно 37% полученных из Vκ1-39/Jκ5 легких цепей содержат по меньшей мере одну или не более чем четыре мутации, присутствующие в CDR3; согласно одному варианту осуществления по меньшей мере 27% легких цепей содержат одну мутацию, присутствующую в CDR3; согласно одному варианту осуществления по меньшей мере 8% легких цепей содержат две мутации, присутствующие в CDR3; согласно одному варианту осуществления по меньшей мере 1% легких цепей содержит три мутации, присутствующие в CDR3; согласно одному варианту осуществления по меньшей мере 1% легких цепей содержит четыре мутации, присутствующие в CDR3.
Согласно одному варианту осуществления предусмотрена популяция антигенспецифических антител, полученных от описанной в настоящем документе мыши, причем антитела содержат легкую цепь, полученную из реаранжировки Vκ1-39/Jκ5 человека, и приблизительно 9% полученных из Vκ1-39/Jκ5 легких цепей содержат одну или несколько мутаций, присутствующих в FW1, приблизительно 25% полученных из Vκ1-39/Jκ5 легких цепей содержат одну или несколько мутаций, присутствующих в CDR1, приблизительно 20% полученных из Vκ1-39/Jκ5 легких цепей содержат одну или несколько мутаций, присутствующих в FW2, приблизительно 10% полученных из Vκ1-39/Jκ5 легких цепей содержат одну или несколько мутаций, присутствующих в CDR2, приблизительно 29% полученных из Vκ1-39/Jκ5 легких цепей содержат одну или несколько мутаций, присутствующих в FW3, и приблизительно 37% полученных из Vκ1-39/Jκ5 легких цепей содержат одну или несколько мутаций, присутствующих в CDR3.
Согласно одному варианту осуществления легкая цепь происходит от реаранжировки Vκ1-39/Jκ5 человека, и приблизительно 35% тяжелых цепей содержат по меньшей мере одну мутацию, присутствующую в FW1; согласно одному варианту осуществления по меньшей мере 25% тяжелых цепей содержат одну мутацию, присутствующую в FW1; согласно одному варианту осуществления по меньшей мере 9% тяжелых цепей содержат две мутации, присутствующие в FW1; Согласно одному варианту осуществления по меньшей мере 1% тяжелых цепей содержит три мутации, присутствующие в FW1; согласно одному варианту осуществления по меньшей мере 1% тяжелых цепей содержит более пяти мутаций, присутствующих в FW1.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ1-39/Jκ5 человека, и приблизительно 92% тяжелых цепей содержат по меньшей мере одну или не более четырех мутаций, присутствующих в CDR1; согласно одному варианту осуществления по меньшей мере 92% тяжелых цепей содержат по меньшей мере одну, по меньшей мере две, по меньшей мере три или по меньшей мере четыре мутации, присутствующие в CDR1; согласно одному варианту осуществления по меньшей мере 26% тяжелых цепей содержат одну мутацию, присутствующую в CDR1; согласно одному варианту осуществления по меньшей мере 44% тяжелых цепей содержат две мутации, присутствующие в CDR1; согласно одному варианту осуществления по меньшей мере 19% тяжелых цепей содержат три мутации, присутствующие в CDR1; согласно одному варианту осуществления по меньшей мере 3% тяжелых цепей содержат четыре мутации, присутствующие в CDR1.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ1-39/Jκ5 человека, и приблизительно 66% тяжелых цепей содержат по меньшей мере одну или не более трех мутаций, присутствующих в FW2; согласно одному варианту осуществления по меньшей мере 66% тяжелых цепей содержат по меньшей мере одну, по меньшей мере две или по меньшей мере три мутации, присутствующие в FW2; согласно одному варианту осуществления по меньшей мере 35% тяжелых цепей содержат одну мутацию, присутствующую в FW2; согласно одному варианту осуществления по меньшей мере 23% тяжелых цепей содержат две мутации, присутствующих в FW2; согласно одному варианту осуществления по меньшей мере 8% тяжелых цепей содержат три мутации, присутствующие в FW2.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ1-39/Jκ5 человека, и приблизительно 70% тяжелых цепей содержат по меньшей мере одну или не более четырех мутаций, присутствующих в CDR2; согласно одному варианту осуществления по меньшей мере 70% тяжелых цепей содержат по меньшей мере две, по меньшей мере три или по меньшей мере четыре мутации, присутствующие в CDR2; согласно одному варианту осуществления по меньшей мере 34% содержат одну мутацию, присутствующую в CDR2; согласно одному варианту осуществления по меньшей мере 20% тяжелых цепей содержат две мутации, присутствующие в CDR2; согласно одному варианту осуществления по меньшей мере 12% тяжелых цепей содержат три мутации, присутствующие в CDR2; согласно одному варианту осуществления по меньшей мере 5% тяжелых цепей содержат четыре мутации, присутствующие в CDR2.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ1-39/Jκ5 человека, и приблизительно 91% тяжелых цепей содержат по меньшей мере одну или до пяти или более мутаций, присутствующих в FW3; согласно одному варианту осуществления по меньшей мере 91% тяжелых цепей содержит по меньшей мере две, по меньшей мере три, по меньшей мере четыре или по меньшей мере пять или более мутаций, присутствующих в FW3; согласно одному варианту осуществления по меньшей мере 19% тяжелых цепей содержат одну мутацию, присутствующую в FW3; согласно одному варианту осуществления по меньшей мере 33% тяжелых цепей содержат две мутации, присутствующие в FW3; согласно одному варианту осуществления по меньшей мере 22% тяжелых цепей содержат три мутации, присутствующие в FW3; согласно одному варианту осуществления по меньшей мере 11% тяжелых цепей содержат четыре мутации, присутствующие в FW3; согласно одному варианту осуществления по меньшей мере 7% тяжелых цепей содержат пять или более мутаций, присутствующих в FW3.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ1-39/Jκ5 человека, и приблизительно 63% тяжелых цепей содержат по меньшей мере одну или не более чем две мутации, присутствующие в CDR3; согласно одному варианту осуществления по меньшей мере 63% тяжелых цепей содержат по меньшей мере одну мутацию, присутствующую в CDR3; согласно одному варианту осуществления по меньшей мере 54% тяжелых цепей содержат одну мутацию, присутствующую в CDR3'; согласно одному варианту осуществления по меньшей мере 9% тяжелых цепей содержат две мутации, присутствующие в CDR3.
Согласно одному варианту осуществления предусмотрена популяция антигенспецифических антител, полученных от описанной в настоящем документе мыши, причем антитела содержат легкую цепь, полученную из реаранжировки Vκ1-39/Jκ5 человека и приблизительно 35% полученных из Vκ1-39/Jκ5 тяжелых цепей содержат одну или несколько мутаций, присутствующих в FW1, приблизительно 92% тяжелых цепей содержат одну или несколько мутаций, присутствующих в CDR1, приблизительно 66% тяжелых цепей содержат одну или несколько мутаций, присутствующих в FW2, приблизительно 70% тяжелых цепей содержат одну или несколько мутаций, присутствующих в CDR2, приблизительно 91% тяжелых цепей содержат одну или несколько мутаций, присутствующих в FW3, и приблизительно 63% тяжелых цепей содержат одну или несколько мутаций, присутствующих в CDR3.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и ген легкой цепи содержит по меньшей мере одну или не более чем две соматические гипермутации; согласно одному варианту осуществления ген легкой цепи содержит по меньшей мере две, по меньшей мере три, по меньшей мере четыре или более соматических гипермутаций. Согласно конкретному варианту осуществления мутации присутствуют в одной или нескольких каркасных областях легкой цепи. Согласно конкретному варианту осуществления мутации присутствуют в одной или нескольких областях CDR легкой цепи. Согласно конкретному варианту осуществления мутации присутствуют в одной или нескольких каркасных областях и/или одной или нескольких областях CDR легкой цепи. Согласно различным вариантам осуществления каркасные области выбирают из каркаса 1 (FW1), каркаса 2 (FW2), каркаса 3 (FW3) и/или их комбинации.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и приблизительно 10% полученных из Vκ3-20/Jκ1 легких цепей содержат по меньшей мере одну мутацию, присутствующую в FW1; согласно одному варианту осуществления по меньшей мере 10% легких цепей содержат одну мутацию в FW1.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и приблизительно 53% полученных из Vκ3-20/Jκ1 легких цепей содержат по меньшей мере одну или не более чем две мутации, присутствующие в CDR1; согласно одному варианту осуществления по меньшей мере 27% легких цепей содержат одну или несколько мутаций в CDR1; согласно одному варианту осуществления приблизительно 54% легких цепей содержат одну или две мутации, присутствующие в CDR1.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и приблизительно 6% полученных из Vκ3-20/Jκ1 легких цепей содержат по меньшей мере одну или не более чем две мутации, присутствующие в FW2; согласно одному варианту осуществления по меньшей мере 6% легких цепей содержат по меньшей мере одну мутацию, присутствующую в FW2; согласно одному варианту осуществления по меньшей мере 3% легких цепей содержат одну мутацию, присутствующую в FW2; согласно одному варианту осуществления по меньшей мере 3% легких цепей содержат две мутации, присутствующие в FW2.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и по меньшей мере приблизительно 3% полученных из Vκ3-20/Jκ1 легких цепей содержат по меньшей мере одну мутацию, присутствующую в CDR2; согласно одному варианту осуществления по меньшей мере 3% легких цепей содержат одну мутацию в CDR2.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и приблизительно 17% или более полученных из Vκ3-20/Jκ1 легких цепей содержат по меньшей мере одну или не более чем две мутации, присутствующие в FW3; согласно одному варианту осуществления по меньшей мере 20% легких цепей содержат одну мутацию, присутствующую в FW3; согласно одному варианту осуществления по меньшей мере 17% легких цепей содержат две мутации, присутствующие в FW3.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и по меньшей мере 43% полученных из Vκ3-20/Jκ1 легких цепей содержат по меньшей мере одну мутацию, присутствующую в CDR3; согласно одному варианту осуществления по меньшей мере 43% легких цепей содержат одну мутацию в CDR3.
Согласно одному варианту осуществления предусмотрена популяция антигенспецифических антител, полученных от описанной в настоящем документе мыши, причем антитела содержат легкую цепь, полученную из реаранжировки Vκ3-20/Jκ1 человека, и приблизительно 10% полученных из Vκ3-20/Jκ1 легких цепей содержат одну или несколько мутаций, присутствующих в FW1, по меньшей мере приблизительно 53% полученных из Vκ3-20/Jκ1 легких цепей содержат одну или несколько мутаций, присутствующих в CDR1, приблизительно 6% полученных из Vκ3-20/Jκ1 легких цепей содержат одну или несколько мутаций, присутствующих в FW2, приблизительно 3% полученных из Vκ3-20/Jκ1 легких цепей содержат одну или несколько мутаций, присутствующих в CDR2, приблизительно 37% полученных из Vκ3-20/Jκ1 легких цепей содержат одну или несколько мутаций, присутствующих в FW3, и приблизительно 43% полученных из Vκ3-20/Jκ1 легких цепей содержат одну или несколько мутаций, присутствующих в CDR3.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и приблизительно 43% тяжелых цепей содержат по меньшей мере одну или не более чем две мутации, присутствующие в FW1; согласно одному варианту осуществления по меньшей мере 41% тяжелых цепей содержат по меньшей мере одну мутацию, присутствующую в FW1; согласно одному варианту осуществления приблизительно 41% тяжелых цепей содержат одну мутацию, присутствующую в FW1; согласно одному варианту осуществления приблизительно 2% тяжелых цепей содержат две мутации, присутствующие в FW1.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и приблизительно 92% тяжелых цепей содержат по меньшей мере одну или не более чем четыре мутации, присутствующие в CDR1; согласно одному варианту осуществления по меньшей мере 43% тяжелых цепей содержат по меньшей мере одну мутацию, присутствующую в CDR1; согласно одному варианту осуществления по меньшей мере 25% тяжелых цепей содержат по меньшей мере две мутации, присутствующие в CDR1; согласно одному варианту осуществления по меньшей мере 15% тяжелых цепей содержат по меньшей мере 3 мутации, присутствующие в CDR1; согласно одному варианту осуществления по меньшей мере 10% тяжелых цепей содержат 4 или более мутаций, присутствующих в CDR1.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и приблизительно 46% тяжелых цепей содержат по меньшей мере одну или не более чем три мутации, присутствующие в FW2; согласно одному варианту осуществления по меньшей мере 34% тяжелых цепей содержат по меньшей мере одну мутацию, присутствующую в FW2; согласно одному варианту осуществления по меньшей мере 10% тяжелых цепей содержат две или несколько мутаций, присутствующих в FW2; согласно одному варианту осуществления по меньшей мере 2% тяжелых цепей содержат три или несколько мутаций, присутствующих в FW2.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и приблизительно 84% тяжелых цепей содержат по меньшей мере одну или до пяти или более чем пять мутаций, присутствующих в CDR2; согласно одному варианту осуществления по меньшей мере 39% тяжелых цепей содержат одну или несколько мутаций, присутствующих в CDR2; согласно одному варианту осуществления по меньшей мере 18% тяжелых цепей содержат две или несколько мутаций, присутствующих в CDR2; согласно одному варианту осуществления по меньшей мере 21% тяжелых цепей содержат три или несколько мутаций, присутствующих в CDR2; согласно одному варианту осуществления по меньшей мере 3% тяжелых цепей содержат четыре или более мутаций, присутствующих в CDR2; согласно одному варианту осуществления по меньшей мере 2% тяжелых цепей содержат пять или более мутаций, присутствующих в CDR2.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и приблизительно 92% тяжелых цепей содержат по меньшей мере одну или до пяти или более чем пять мутаций, присутствующих в FW3; согласно одному варианту осуществления по меньшей мере 21% легких цепей содержат по меньшей мере одну мутацию, присутствующую в FW3; согласно одному варианту осуществления по меньшей мере 20% тяжелых цепей содержат по меньшей мере две мутации, присутствующие в FW3; согласно одному варианту осуществления по меньшей мере 13% тяжелых цепей содержат по меньшей мере три мутации, присутствующие в FW3; согласно одному варианту осуществления по меньшей мере 20% тяжелых цепей содержат по меньшей мере четыре мутации в FW3; согласно одному варианту осуществления по меньшей мере 18% тяжелых цепей содержат по меньшей мере 5 мутаций в FW3.
Согласно одному варианту осуществления легкую цепь получают из реаранжировки Vκ3-20/Jκ1 человека, и приблизительно 7% тяжелых цепей содержат по меньшей мере одну мутацию, присутствующую в CDR3; согласно одному варианту осуществления приблизительно 7% тяжелых цепей содержат одну мутацию в CDR3.
Согласно одному варианту осуществления предусмотрена популяция антигенспецифических антител, полученных от описанной в настоящем документе мыши, причем антитела содержат легкую цепь, полученную из реаранжировки Vκ3 20/Jκ1 человека, и приблизительно 43% тяжелых цепей содержат одну или несколько мутаций, присутствующих в FW1, приблизительно 92% тяжелых цепей содержат одну или несколько мутаций, присутствующих в CDR1, приблизительно 46% тяжелых цепей содержат одну или несколько мутаций, присутствующих в FW2, приблизительно 84% тяжелых цепей содержат одну или несколько мутаций, присутствующих в CDR2, приблизительно 92% тяжелых цепей содержат одну или несколько мутаций, присутствующих в FW3, и приблизительно 7% тяжелых цепей содержат одну или несколько мутаций, присутствующих в CDR3.
Согласно одному аспекту предусмотрена мышь, которая экспрессирует легкую цепь иммуноглобулина из реаранжированной последовательности легкой цепи иммуноглобулина, причем реаранжированная последовательность легкой цепи иммуноглобулина присутствует в зародышевой линии мыши, причем легкая цепь иммуноглобулина содержит вариабельную последовательность человека. Согласно одному варианту осуществления зародышевая линия мыши содержит реаранжированную последовательность легкой цепи иммуноглобулина, который происходит от того же сегмента V и того же сегмента J, как и все несуррогатные последовательности легкой цепи, присутствующие в каждой В-клетке мыши, которая содержит реаранжированную последовательность легкой цепи.
Согласно одному варианту осуществления зародышевая линия мыши не содержит функциональный нереаранжированный генный сегмент V легкой цепи иммуноглобулина. Согласно одному варианту осуществления зародышевая линия мыши не содержит функциональный нереаранжированный генный сегмент J легкой цепи иммуноглобулина.
Согласно одному варианту осуществления зародышевая линия мыши содержит не более одной, не более двух или не более трех реаранжированных последовательностей легкой цепи (J/V).
Согласно одному варианту осуществления реаранжированная последовательность V/J содержит последовательность легкой цепи κ. Согласно конкретному варианту осуществления последовательность легкой цепи к представляет собой последовательность легкой цепи κ человека. Согласно конкретному варианту осуществления последовательность легкой цепи κ выбирают из последовательности Vκ1-39/J человека, последовательности Vκ3-20/J человека и их комбинации. Согласно конкретному варианту осуществления последовательность легкой цепи κ представляет собой последовательности Vκ1-39/Jκ5 человека. Согласно конкретному варианту осуществления последовательность легкой цепи κ представляет собой последовательность Vκ3-20/Jκ1 человека.
Согласно одному варианту осуществления мышь дополнительно содержит в своей зародышевой линии последовательность, выбранную из 5' интронного энхансера к мыши по отношению к реаранжированной последовательности легкой цепи иммуноглобулина, 3' энхансера к мыши и их комбинации.
Согласно одному варианту осуществления мышь содержит нереаранжированный генный сегмент VH человека, нереаранжированный генный сегмент DH и нереаранжированный генный сегмент JH человека, причем указанные генные сегменты VH, DH и JH способны к реаранжировке для образования вариабельной генной последовательности тяжелой цепи иммуноглобулина, функционально связанной с константной генной последовательностью тяжелой цепи. Согласно одному варианту осуществления мышь содержит множество генных сегментов VH, DH и JH человека. Согласно конкретному варианту осуществления генные сегменты VH, DH и JH человека замещают эндогенные генные сегменты VH, DH и JH мыши в эндогенном локусе тяжелой цепи иммуноглобулина мыши. Согласно конкретному варианту осуществления мышь содержит замещение всех или практически всех функциональных генных сегментов VH, DH и JH мыши всеми или по существу всеми функциональными генными сегментами VH, DH и JH человека.
Согласно одному варианту осуществления мышь экспрессирует легкую цепь иммуноглобулина, которая содержит константную последовательность мыши. Согласно одному варианту осуществления мышь экспрессирует легкую цепь иммуноглобулина, которая содержит константную последовательность человека.
Согласно одному варианту осуществления мышь экспрессирует тяжелую цепь иммуноглобулина, которая содержит мышиную последовательность, выбранную из последовательности CH1, шарнирной последовательности, последовательности CH2, последовательности CH3 и их комбинации.
Согласно одному варианту осуществления мышь экспрессирует тяжелую цепь иммуноглобулина, которая содержит человеческую последовательность, выбранную из последовательности CH1, шарнирной последовательности, последовательности CH2, последовательности CH3 и их комбинации.
Согласно одному варианту осуществления реаранжированная последовательность легкой цепи иммуноглобулина в зародышевой линии мыши находится в эндогенном локусе легкой цепи иммуноглобулина мыши. Согласно конкретному варианту осуществления реаранжированная последовательность легкой цепи иммуноглобулина в зародышевой линии мыши замещает все или по существу все мышиные последовательности V и J легкой цепи в эндогенном локусе легкой цепи иммуноглобулина мыши.
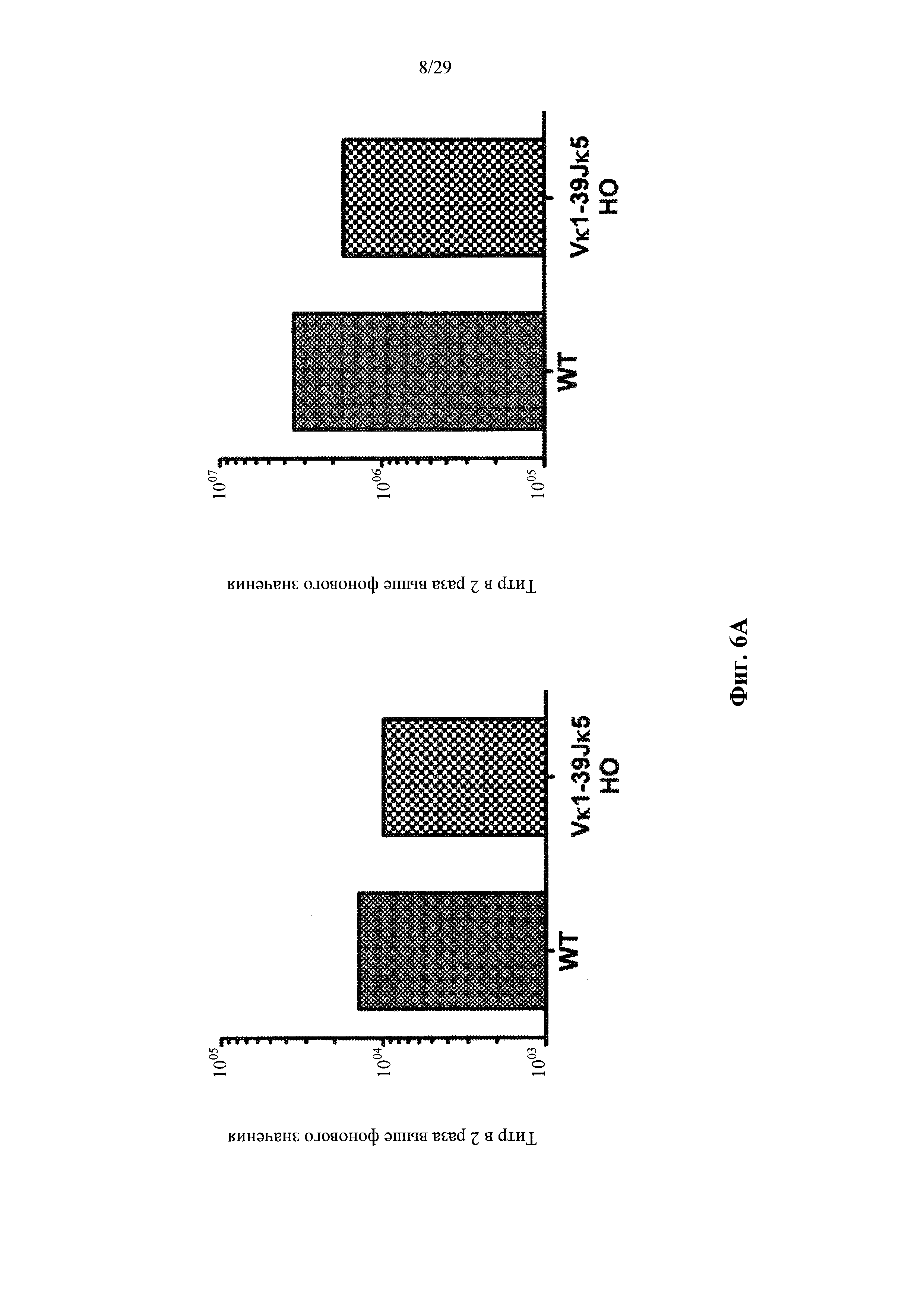
Согласно одному аспекту предусмотрена мышь, которая содержит В-клеточную популяцию, характеризующуюся каждой В-клеткой, которая содержит несуррогатную последовательность легкой цепи, содержащую реаранжированный ген легкой цепи, который производится из единственного генного сегмента V человека и единственного генного сегмента J человека, причем только вариабельная последовательность легкой цепи в зародышевой линии мыши представляет собой реаранжированную последовательность, произведенную от единственного сегмента V человека и единственного сегмента J человека, и причем каждая В-клетка, которая содержит реаранжированный ген легкой цепи дополнительно содержит ген, кодирующий родственный вариабельный домен тяжелой цепи человека, и причем реаранжированный ген легкой цепи содержит по меньшей мере одну, по меньшей мере две, по меньшей мере три или по меньшей мере четыре соматические гипермутации.
Согласно некоторым вариантам осуществления предусмотрена мышь, чья популяция зрелых В-клеток характеризуется тем, что каждая зрелая В-клетка содержит несуррогатную последовательность легкой цепи на своей поверхности, эта последовательность содержит реаранжированный ген легкой цепи, который создается посредством реаранжировки одного из двух генных сегментов VL человека и одного из не более чем пяти генных сегментов JL человека, причем только вариабельная последовательность легкой цепи (последовательность VLJL) в зародышевой линии мыши представляет собой реаранжированную последовательность, которая создается путем реаранжировки одного из двух генных сегментов VL человека и одного из не более чем пяти генных сегментов JL человека, и причем каждая В-клетка, которая содержит реаранжированный ген легкой цепи, дополнительно содержит ген, кодирующий родственный вариабельный домен тяжелой цепи человека, и причем реаранжированный ген легкой цепи содержит по меньшей мере одну, по меньшей мере две, по меньшей мере три, по меньшей мере четыре или пять или более соматических гипермутаций. Согласно некоторым вариантам осуществления реаранжированный ген легкой цепи содержит одну, две, три, четыре или пять соматических гипермутаций. Согласно некоторым вариантам осуществления описанные в настоящем документе мыши были иммунизированы представляющим интерес антигеном, и, согласно некоторым вариантам осуществления, популяция зрелых В-клеток обогащается В-клетками, которые связываются с представляющим интерес антигеном.
Согласно некоторым вариантам осуществления предусмотрена мышь, чья популяция зрелых В-клеток характеризуется тем, что каждая зрелая В-клетка содержит несуррогатную последовательность легкой цепи на своей поверхности, эта последовательность содержит реаранжированный ген легкой цепи, который создается посредством реаранжировки одного из двух генных сегментов VL человека и одного из двух или более (например, 2, 3, 4 или 5) генных сегментов JL человека, причем генные сегменты VL состоят по существу из двух генных сегментов VL, которые не идентичны, и локус VL содержит два или более (например, 2, 3, 4 или 5) генных сегмента JL человека, и причем каждая В-клетка, которая содержит реаранжированный ген легкой цепи, дополнительно содержит ген, кодирующий родственный вариабельный домен тяжелой цепи человека, и причем реаранжированный ген легкой цепи содержит по меньшей мере одну, по меньшей мере две, по меньшей мере три, по меньшей мере четыре или пять или более соматических гипермутаций. Согласно некоторым вариантам осуществления реаранжированный ген легкой цепи содержит одну, две, три, четыре или пять соматических гипермутаций. Согласно некоторым вариантам осуществления описанные в настоящем документе мыши были иммунизированы представляющим интерес антигеном, и, согласно некоторым вариантам осуществления, популяция зрелых В-клеток обогащается В-клетками, которые связываются с представляющим интерес антигеном.
Согласно одному аспекту предусмотрена плюрипотентная, индуцированная плюрипотентная или тотипотентная клетка, полученная из описанной в настоящем документе мыши. Согласно конкретному варианту осуществления клетка представляет собой мышиную эмбриональную стволовую (ЭС) клетку.
Согласно одному аспекту предусмотрена ткань, полученная из описанной в настоящем документе мыши. Согласно одному варианту осуществления ткань происходит из селезенки, лимфатического узла или костного мозга описанной в настоящем документе мыши.
Согласно одному аспекту предусмотрено ядро, полученное из описанной в настоящем документе мыши. Согласно одному варианту осуществления ядро получают из диплоидной клетки, которая не представляет собой В-клетку.
Согласно одному аспекту предусмотрена клетка мыши, которая выделена из описанной в настоящем документе мыши. Согласно одному варианту осуществления клетка представляет собой ЭС клетку. Согласно одному варианту осуществления клетка представляет собой лимфоцит. Согласно одному варианту осуществления лимфоцит представляет собой В-клетку. Согласно одному варианту осуществления В-клетка экспрессирует химерную тяжелую цепь, содержащую вариабельный домен, полученный из генного сегмента человека; и легкую цепь, полученную из реаранжированной последовательности Vκ1-39/J человека, реаранжированной последовательности Vκ3-20/J человека или их комбинации; причем вариабельный домен тяжелой цепи сливают с константной областью мыши и вариабельный домен легкой цепи сливают с константной областью мыши или человека.
Согласно одному аспекту предусмотрена гибридома, причем гибридому получают с В-клеткой описанной в настоящем документе мыши. Согласно конкретному варианту осуществления В-клетка происходит из описанной в настоящем документе мыши, которую иммунизировали иммуногеном, содержащим представляющий интерес эпитоп, и В-клетка экспрессирует связывающий белок, который связывается с представляющим интерес эпитопом, связывающий белок содержит соматически мутированный домен VH человека и CH мыши и содержит домен VL человека, полученный из реаранжированного Vκ1-39Jκ5 человека или реаранжированного Vκ3-20Jκ1 человека и CL мыши.
Согласно одному аспекту предусмотрен эмбрион мыши, причем эмбрион содержит донорскую ЭС клетку, которая происходит от описанной в настоящем документе мыши.
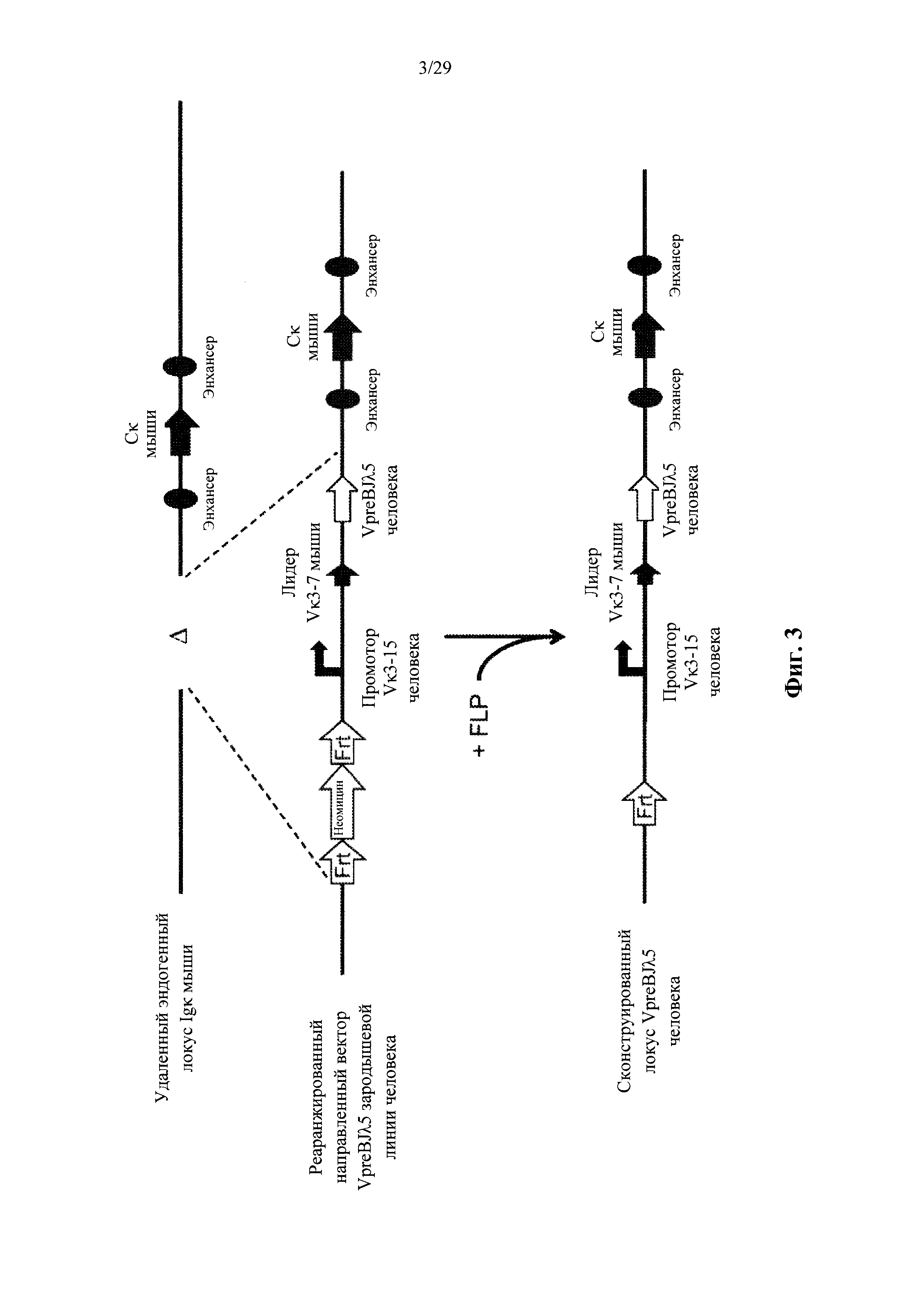
Согласно одному аспекту предусмотрен направленный вектор, содержащий от 5' к 3' в направлении транскрипции по отношению к последовательности 5' и 3' плечей гомологии вектора мыши, 5' плечо гомологии мыши, человеческий или мышиный иммуноглобулиновый промотор, лидерную последовательность человека или мыши и область VL человека, выбранную из реаранжированной человеческой Vκ1-39Jκ5 или реаранжированной человеческой Vκ3-20Jκ1, и 3' плечо гомологии мыши. Согласно одному варианту осуществления 5' и 3' плечи гомологии направляют вектор к последовательности 5' по отношению к энхансерной последовательности, которая присутствует на 5' и проксимальна по отношению к гену мыши Сκ. Согласно одному варианту осуществления промотор представляет собой промотор генного сегмента вариабельной области иммуноглобулина человека. Согласно конкретному варианту осуществления промотор представляет собой промотор Vκ3-15 человека. Согласно одному варианту осуществления лидерная последовательность представляет собой мышиную лидерную последовательность. Согласно конкретному варианту осуществления мышиная лидерная последовательность представляет собой лидерную последовательность Vκ3-7 мыши.
Согласно одному аспекту предусмотрен описанный выше направленный вектор, но вместо 5' плеча гомологии мыши человеческий или мышиный промотор фланкирован со стороны 5' сайтом узнавания сайт-специфической рекомбиназы (SRRS), а вместо 3' плеча гомологии мыши область VL человека фланкирована со стороны 3' SRRS.
Согласно одному аспекту предусмотрено обратное химерное антитело, созданное описанной в настоящем документе мышью, причем обратное химерное антитело содержит легкую цепь, содержащую человеческую VL и мышиную CL, и тяжелую цепь, содержащую человеческую VH и мышиную СН.
Согласно одному аспекту предусмотрен способ получения антитела, предусматривающий экспрессию в одной клетке (а) первой генной последовательности VH из описанной в настоящем документе иммунизированной мыши, слитой с генной последовательностью CH человека; (b) генной последовательности VL из описанной в настоящем документе иммунизированной мыши, слитой с генной последовательностью CL человека; и (с) поддержание клетки в условиях, достаточных для экспрессии полностью человеческого антитела, и выделение антитела. Согласно одному варианту осуществления клетка содержит вторую генную последовательность VH из второй описанной в настоящем документе иммунизированной мыши, слитую с генной последовательностью CH человека, первая генная последовательность VH кодирует домен VH, который распознает первый эпитоп, и вторая генная последовательность VH кодирует домен VH, который распознает второй эпитоп, причем первый эпитоп и второй эпитоп не идентичны.
Согласно одному аспекту предусмотрен способ производства связывающего эпитоп белка, предусматривающий подвергание описанной в настоящем документе мыши воздействию иммуногена, который содержит представляющий интерес эпитоп, поддержание мыши в условиях, достаточных для того, чтобы мышь производила молекулу иммуноглобулина, которая специфически связывается с представляющим интерес эпитопом, и выделение молекулы иммуноглобулина, которая специфически связывается с представляющим интерес эпитопом; причем связывающий эпитоп белок содержит тяжелую цепь, которая содержит соматически мутированную VH человека и СН мыши, связанную с легкой цепью, содержащей CL мыши и VL человека, полученные из реаранжированного Vκ1-39Jκ5 человека или реаранжированного Vκ3-20Jκ1 человека.
Согласно одному аспекту предусмотрена клетка, которая экспрессирует связывающий эпитоп белок, причем клетка содержит: (а) нуклеотидную последовательность человека, кодирующую домен VL человека, который происходит от реаранжированного человеческого Vκ1-39Jκ5 или реаранжированного человеческого Vκ3-20Jκ1, причем нуклеотидную последовательность человека сливают (непосредственно или через линкер) с последовательностью кДНК константного домена легкой цепи иммуноглобулина человека (например, последовательностью ДНК константного домена κ человека); и (b) первую нуклеотидную последовательность VH человека, кодирующую домен VH человека, полученный из первой нуклеотидной последовательности VH человека, причем первую нуклеотидную последовательность VH человека сливают (непосредственно или через линкер) с последовательностью кДНК константного домена тяжелой цепи иммуноглобулина человека; причем связывающий эпитоп белок распознает первый эпитоп. Согласно одному варианту осуществления связывающий эпитоп белок связывается с первым эпитопом с константой диссоциации, составляющей менее чем 10-6 М, менее чем 10-8 М, менее чем 10-9 М, менее чем 10-10 М, менее чем 10-11 M или менее чем 10-12 М.
Согласно одному варианту осуществления клетка содержит вторую нуклеотидную последовательность человека, кодирующую второй домен VH человека, причем вторую последовательность человека сливают (непосредственно или через линкер) с последовательностью кДНК константного домена тяжелой цепи иммуноглобулина человека, и причем второй домена VH человека не специфически распознает первый эпитоп (например, отображает константу диссоциации, например, 10-6 Μ, 10-5 Μ, 10-4 M или выше), причем связывающий эпитоп белок распознает первый эпитоп и второй эпитоп, и причем первая и вторая тяжелые цепи иммуноглобулина каждая связывается с идентичной легкой цепью из (а).
Согласно одному варианту осуществления второй домен VH связывается со вторым эпитопом с константой диссоциации, ниже чем 10-6 М, ниже чем 10-7 М, ниже чем 10-8 М, ниже чем 10-9 М, ниже чем 10-10 М, ниже чем 10-11 M или ниже чем 10-12 М.
Согласно одному варианту осуществления связывающий эпитоп белок содержит первую тяжелую цепь иммуноглобулина и вторую тяжелую цепь иммуноглобулина, каждая из которых связана с идентичной легкой цепью, полученной из реаранжированной области VL человека, выбранной из человеческого Vκ1-39Jκ5 или человеческого Vκ3-20Jκ1, причем первая тяжелая цепь иммуноглобулина связывается с первым эпитопом с константой диссоциации в диапазоне от наномолей до пикомолей, вторая тяжелая цепь иммуноглобулина связывается со вторым эпитопом с константой диссоциации в диапазоне от наномолей до пикомолей, первый эпитоп и второй эпитоп не идентичны, первая тяжелая цепь иммуноглобулина не связывается со вторым эпитопом или связывается со вторым эпитопом с константой диссоциации слабее, чем в микромолярном диапазоне (например, в миллимолярном диапазоне), вторая тяжелая цепь иммуноглобулина не связывается с первым эпитопом или связывается с первым эпитопом с константой диссоциации слабее, чем в микромолярном диапазоне (например, в миллимолярном диапазоне), и один или несколько из VL, VH первой тяжелой цепи иммуноглобулина и VH второй тяжелой цепи иммуноглобулина соматически мутированы.
Согласно одному варианту осуществления первая тяжелая цепь иммуноглобулина содержит связывающий белок А остаток, а вторая тяжелая цепь иммуноглобулина не содержит связывающий белок А остаток.
Согласно одному варианту осуществления клетку выбирают из СНО, COS, 293, HeLa, а также ретинальной клетки, экспрессирующей вирусную последовательность нуклеиновой кислоты (например, клетка PERC.6™).
Согласно одному аспекту предусмотрено обратное химерное антитело, содержащее человеческий VH и мышиный константный домен тяжелой цепи, человеческий VL и мышиный константный домен легкой цепи, причем антитело получают способом, который предусматривает иммунизацию описанной в настоящем документе мыши иммуногеном, содержащим эпитоп, и антитело специфически связывается с эпитопом иммуногена, которым иммунизировали мышь. Согласно одному варианту осуществления домен VL соматически мутирован. Согласно одному варианту осуществления домен VH соматически мутирован. Согласно одному варианту осуществления как домен VL, так и домен VH соматически мутированы. Согласно одному варианту осуществления VL связан с доменом Сκ мыши.
Согласно одному аспекту предусмотрена мышь, содержащая генные сегменты VH человека, замещающие все или практически все мышиные генные сегменты VH в эндогенном локусе тяжелой цепи мыши; не более одной или двух реаранжированных последовательностей VL/JL легкой цепи человека, выбранных из реаранжированной Vκ1-39/J и реаранжированной Vκ3-20/J или их комбинации, замещая все мышиные генные сегменты легкой цепи; причем вариабельные генные сегменты тяжелой цепи человека связаны с константным геном мыши и реаранжированные последовательности легкой цепи человека связаны с константным геном человека или мыши.
Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая генные сегменты VH иммуноглобулина человека, заменяющие все или по существу все генные сегменты VH иммуноглобулина мыши в эндогенном локусе тяжелой цепи иммуноглобулина мыши; не более чем два нереаранжированных генных сегмента VL иммуноглобулина человека и два или более (например, 2, 3, 4 или 5) нереаранжированных генных сегментов JL иммуноглобулина человека, или пять генных сегментов JL иммуноглобулина человека, заменяющие все генные сегменты легкой цепи иммуноглобулина мыши; причем генные сегменты VH иммуноглобулина человека связаны с константным геном иммуноглобулина мыши и нереаранжированные генные сегменты VL и JL иммуноглобулина человека связаны с человеческим или отличным от человеческого константным геном иммуноглобулина. Согласно некоторым вариантам осуществления отличный от человеческого константный ген представляет собой константный ген иммуноглобулина мыши. Согласно некоторым вариантам осуществления отличный от человеческого константный ген представляет собой константный ген иммуноглобулина крысы.
Согласно одному аспекту предусмотрена мышиная ЭС клетка, содержащая замещение всех или практически всех вариабельных генных сегментов тяжелой цепи мыши вариабельными генными сегментами тяжелой цепи человека, и не более чем одну или две реаранжированные последовательности VL/JL легкой цепи человека, причем вариабельные генные сегменты тяжелой цепи человека связаны с константным геном тяжелой цепи иммуноглобулина мыши, и реаранжированные последовательности VL/JL легкой цепи человека связаны с константным геном тяжелой цепи иммуноглобулина мыши или человека. Согласно конкретному варианту осуществления константный ген легкой цепи представляет собой константный ген мыши.
Согласно некоторым вариантам осуществления предусмотрена ЭС клетка мыши, содержащая замещение всех или по существу всех генных сегментов VH иммуноглобулина мыши генными сегментами VH иммуноглобулина человека и не более чем два переаранжированных генных сегмента VL иммуноглобулина человека и два или более (например, 2, 3, 4 или 5) нереаранжированных генных сегмента JL иммуноглобулина человека, причем генные сегменты VH иммуноглобулина человека связаны с константным геном тяжелой цепи иммуноглобулина мыши и нереаранжированные генные сегменты VL и JL иммуноглобулина человека связаны с отличным от человеческого или человеческим константным геном легкой цепи иммуноглобулина. Согласно некоторым определенным вариантам осуществления отличный от человеческого константный ген легкой цепи иммуноглобулина представляет собой мышиный константный ген иммуноглобулина. Согласно некоторым определенным вариантам осуществления мышь содержит пять нереаранжированных генных сегментов JL иммуноглобулина.
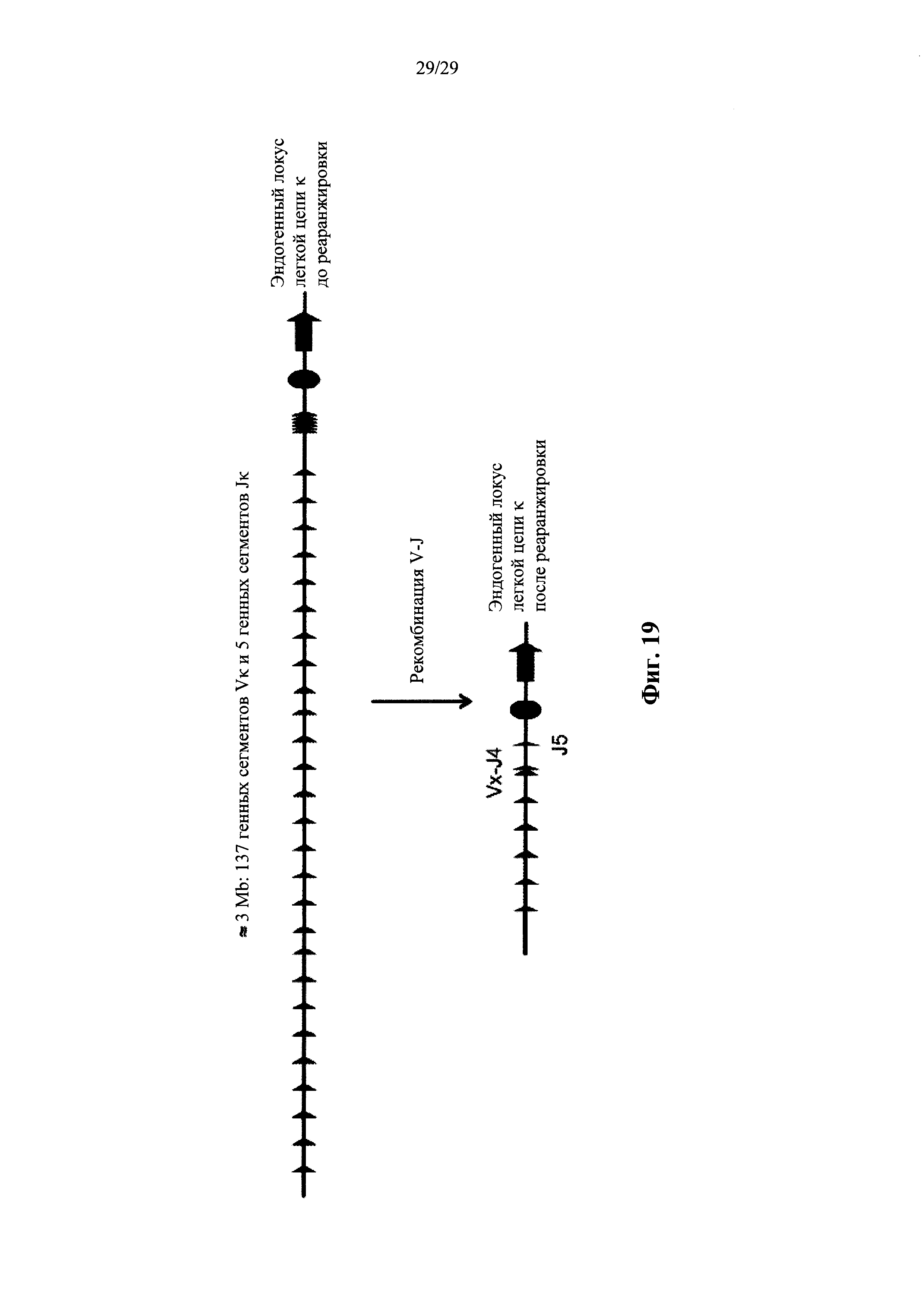
Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19, в которой по меньшей мере один, а согласно некоторым вариантам осуществления все генные сегменты VL мыши замещаются одним генным сегментом VL человека или не более чем двумя генными сегментами VL человека. Согласно некоторым вариантам осуществления человеческие генные сегменты VL мыши способны к реаранжировке с одним из двух или более генных сегментов JL человека для кодирования иммуноглобулинового домена VL антитела. Согласно некоторым вариантам осуществления человеческий генный сегмент(ы) VL локуса легкой цепи описанной в настоящем документе мыши функционально связан(ы) с двумя или более (например, двумя, тремя, четырьмя или пятью) генными сегментами JL человека.
Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она не содержит нуклеотидную последовательность до реаранжировки, которая кодирует эндогенный генный сегмент VL. Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она не содержит нуклеотидную последовательность до реаранжировки, которая кодирует эндогенный генный сегмент JL. Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она не содержит нуклеотидную последовательность до реаранжировки, которая кодирует эндогенные генные сегменты VLи JL.
Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она не содержит нуклеотидную последовательность после реаранжировки, которая кодирует эндогенный генный сегмент VL. Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она не содержит нуклеотидную последовательность после реаранжировки, которая кодирует эндогенный генный сегмент JL. Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она не содержит нуклеотидную последовательность после реаранжировки, которая кодирует эндогенные генные сегменты VL и JL.
Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она содержит не более двух генных сегментов VL человека и два или более (например, два, три, четыре или пять) генных сегментов JL человека до реаранжировки. Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она содержит не более двух генных сегментов VL человека и пять генных сегментов JL человека до реаранжировки.
Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она содержит не более двух генных сегментов VL человека и пять или менее (например, 5, 4, 3, 2 или 1) генных сегментов JL человека после реаранжировки. Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она содержит не более двух генных сегментов VL человека и один, два, три, четыре или пять генных сегментов JL человека после реаранжировки.
Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она содержит один генный сегмент VL человека и пять или менее (например, 5, 4, 3, 2 или 1) генных сегментов JL человека после реаранжировки. Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она содержит один генный сегмент VL человека и один, два, три, четыре или пять генных сегментов JL человека после реаранжировки.
Согласно различным вариантам осуществления генные сегменты VL и JL человека представляют собой генные сегменты Vκ и Jκ человека. Согласно различным вариантам осуществления сегменты Vκ человека выбирают из генного сегмента Vκ1-39 человека и генного сегмента Vκ3-20 человека. Согласно некоторым вариантам осуществления сегменты Vκ человека представляют собой Vκ1-39 человека и Vκ3-20 человека. Согласно некоторым вариантам осуществления сегменты Jκ человека выбирают из генных сегментов Jκ1, Jκ2, Jκ3, Jκ4, Jκ5 и их комбинации. Согласно некоторым вариантам осуществления генные сегменты Jκ человека представляют собой Jκ1, Jκ2, Jκ3, Jκ4 и Jκ5 человека.
Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого отличается от эталонной структуры на фиг. 19 тем, что она предусматривает структуру, которая представляет собой по существу такую же, как и структура на фиг. 1, фиг. 2, фиг. 3 или фиг. 9 до реаранжировки. Согласно некоторым вариантам осуществления предусмотрена мышь, содержащая локус легкой цепи, структура которого идентична структуре на фиг. 1, фиг. 2, фиг. 3 или фиг. 9 до реаранжировки.
Согласно одному аспекту предусмотрен антигенсвязывающий белок, произведенный описанной в настоящем документе мышью. Согласно конкретному варианту осуществления антигенсвязывающий белок содержит вариабельную область тяжелой цепи иммуноглобулина человека, слитую с константной областью мыши, и вариабельную область легкой цепи иммуноглобулина человека, полученную из генного сегмента Vκ1-39 или генного сегмента Vκ3-20, причем константная область легкой цепи представляет собой константную область мыши.
Согласно одному аспекту предусмотрен полностью человеческий антигенсвязывающий белок, произведенный из генной последовательности вариабельной области иммуноглобулина описанной в настоящем документе мыши, причем антигенсвязывающий белок содержит полностью человеческую тяжелую цепь, содержащую вариабельную область человека, полученную из последовательности описанной в настоящем документе мыши, и полностью человеческую легкую цепь, содержащую Vκ1-39 или Vκ3-20. Согласно одному варианту осуществления вариабельная область легкой цепи содержит от одной до пяти соматических мутаций. Согласно одному варианту осуществления вариабельная область легкой цепи представляет собой родственную вариабельную область легкой цепи, которая образует пару в В-клетке мыши с вариабельной областью тяжелой цепи.
Согласно одному варианту осуществления полностью человеческий антигенсвязывающий белок содержит первую тяжелую цепь и вторую тяжелую цепь, причем первая тяжелая цепь и вторая тяжелая цепь содержат неидентичные вариабельные области, независимо полученные из описанной в настоящем документе мыши, и причем каждая из первой и второй тяжелой цепи экспрессирует из клетки-хозяина, связанной с легкой цепью человека, полученной из генного сегмента Vκ1-39 или генного сегмента Vκ3-20. Согласно одному варианту осуществления первая тяжелая цепь содержит первую вариабельную область тяжелой цепи, которая специфически связывается с первым эпитопом первого антигена, и вторая тяжелая цепь содержит вторую вариабельную область тяжелой цепи, которая специфически связывается со вторым эпитопом второго антигена. Согласно конкретному варианту осуществления первый антиген и второй антиген отличаются. Согласно конкретному варианту осуществления первый антиген и второй антиген одинаковы, и первый эпитоп и второй эпитоп не идентичны; согласно конкретному варианту осуществления связывание первого эпитопа первой молекулой связывающего белка не блокирует связывание второго эпитопа второй молекулой связывающего белка.
Согласно одному аспекту полностью человеческий связывающий белок, полученный из человеческой иммуноглобулиновой последовательности описанной в настоящем документе мыши, содержит первую тяжелую цепь иммуноглобулина и вторую тяжелую цепь иммуноглобулина, причем первая тяжелая цепь иммуноглобулина содержит первую вариабельную область, которая не идентична вариабельной области второй тяжелой цепи иммуноглобулина, и причем первая тяжелая цепь иммуноглобулина содержит детерминанту связывания белка А дикого типа, а вторая тяжелая цепь не содержит детерминанту связывания белка А дикого типа. Согласно одному варианту осуществления первая тяжелая цепь иммуноглобулина связывается с белком А в условиях выделения, а вторая тяжелая цепь иммуноглобулина не связывается с белком А или связывается с белком А по меньшей мере в 10 раз, в сто раз или в тысячу раз слабее, чем первая тяжелая цепь иммуноглобулина связывается с белком А в условиях выделения. Согласно конкретному варианту осуществления первая и вторая тяжелые цепи представляют собой изотипы IgG1, причем вторая тяжелая цепь содержит модификацию, выбранную из 95R (EU 435R), 96F (EU 436F) и их комбинации, и причем у первой тяжелой цепи отсутствует такая модификация.
Согласно одному аспекту предусмотрен способ производства биспецифического антигенсвязывающего белка, предусматривающий подвергание первой описанной в настоящем документе мыши воздействию первого представляющего интерес антигена, который содержит первый эпитоп, подвергание второй описанной в настоящем документе мыши воздействию второго представляющего интерес антигена, который содержит второй эпитоп, позволяя первой и второй мыши поддерживать иммунные ответы к представляющим интерес антигенам, идентификацию в первой мыши первой вариабельной области тяжелой цепи человека, которая связывается с первым эпитопом первого представляющего интерес антигена, идентификацию во второй мыши второй вариабельной области тяжелой цепи человека, которая связывается со вторым эпитопом второго представляющего интерес антигена, производство первого гена полностью человеческой тяжелой цепи, который кодирует первую тяжелую цепь, которая связывается с первым эпитопом первого представляющего интерес антигена, производство второго гена полностью человеческой тяжелой цепи, который кодирует вторую тяжелую цепь, которая связывает со вторым эпитопом второго представляющего интерес антигена, экспрессию первой тяжелой цепи и второй тяжелой цепи в клетке, которая экспрессирует единственную полностью человеческую легкую цепь, полученную из генного сегмента Vκ1-39 человека или Vκ3-20 человека, чтобы образовать биспецифический антигенсвязывающий белок, и выделение биспецифического антигенсвязывающего белка.
Согласно одному варианту осуществления первый антиген и второй антиген не идентичны.
Согласно одному варианту осуществления первый антиген и второй антиген идентичны, и первый эпитоп и второй эпитоп не идентичны. Согласно одному варианту осуществления связывание первой вариабельной области тяжелой цепи с первым эпитопом не блокирует связывание второй вариабельной области тяжелой цепи со вторым эпитопом.
Согласно одному варианту осуществления легкая цепь человека, когда в паре с первой тяжелой цепью, специфически связывается с первым эпитопом первого антигена и, когда в паре со второй тяжелой цепью, специфически связывается со вторым эпитопом второго антигена.
Согласно одному варианту осуществления первый антиген выбирают из растворимого антигена и клеточного поверхностного антигена (например, опухолевого антигена), а второй антиген содержит рецептор клеточной поверхности. Согласно конкретному варианту осуществления рецептор клеточной поверхности представляет собой иммуноглобулиновый рецептор. Согласно конкретному варианту осуществления иммуноглобулиновый рецептор представляет собой Fc рецептор. Согласно одному варианту осуществления первый антиген и второй антиген представляют собой такие же рецепторы клеточной поверхности, и связывание первой тяжелой цепи с первым эпитопом не блокирует связывание второй тяжелой цепи со вторым эпитопом.
Согласно одному варианту осуществления вариабельный домен легкой цепи содержит от 2 до 5 соматических мутаций. Согласно одному варианту осуществления вариабельный домен легкой цепи представляет собой соматически мутированную родственную легкую цепь, экспрессируемую в В-клетке первой или второй иммунизированной мыши или первым, или вторым вариабельным доменом тяжелой цепи. Согласно одному варианту осуществления легкая цепь клетки содержит последовательность зародышевой линии.
Согласно одному варианту осуществления первая полностью человеческая тяжелая цепь содержит аминокислотную модификацию, которая снижает ее аффинность к белку А, а вторая полностью человеческая тяжелая цепь не содержит модификацию, которая снижает ее аффинность к белку А.
Согласно одному аспекту предусмотрен способ получения биспецифического антитела, которое специфически связывается с первым и вторым антигеном, причем способ предусматривает (а) идентификацию первой последовательности нуклеиновой кислоты, которая кодирует первый вариабельный домен тяжелой цепи (VH) человека, который специфичен для первого антигена; (b) идентификацию второй последовательности нуклеиновой кислоты, которая кодирует второй вариабельный домен тяжелой цепи (VH) человека, который специфичен для второго антигена; (с) предоставление третьей последовательности нуклеиновой кислоты, которая кодирует вариабельную область легкой цепи (VL) человека, которая, когда в паре с областью VH (а) специфически связывается с первым антигеном, и когда в паре с областью VH (b) специфически связывается со вторым антигеном; (d) культивирование клетки-хозяина, содержащей первую, вторую и третью последовательности нуклеиновых кислот, чтобы обеспечить экспрессию первой и второй областей VH человека и области VL человека с образованием биспецифического антитела; и (d) выделение указанного биспецифического антитела. Согласно различным аспектам первый и второй антигены отличаются друг от друга. Согласно различным аспектам первую и вторую последовательности нуклеиновых кислот выделяют из иммунизированной мыши, которая экспрессирует область VL иммуноглобулина человека из реаранжированной последовательности легкой цепи иммуноглобулина, причем реаранжированная последовательность иммуноглобулина находится в зародышевой линии мыши.
Согласно одному варианту осуществления область VL человека получают из реаранжированной последовательности легкой цепи человека, содержащей генный сегмент Vκ1-39 человека или генный сегмент Vκ3-20 человека. Согласно конкретному варианту осуществления реаранжированная последовательность легкой цепи человека представляет собой последовательность зародышевой линии (т.е. не содержит соматическую гипермутацию в последовательности генного сегмента V).
Согласно одному варианту осуществления третью последовательность нуклеиновой кислоты выделяют из мыши, которая экспрессирует область VL иммуноглобулина человека из реаранжированной последовательности легкой цепи иммуноглобулина в зародышевой линии мыши. Согласно одному варианту осуществления реаранжированная последовательности легкой цепи иммуноглобулина содержит генный сегмент Vκ1-39 человека или Vκ3-20 человека. Согласно конкретному варианту осуществления реаранжированная последовательность легкой цепи иммуноглобулина содержит генный сегмент Vκ1-39 человека. Согласно одному варианту осуществления область VL иммуноглобулина человека экспрессируется из модифицированного эндогенного локуса легкой цепи иммуноглобулина.
Согласно одному варианту осуществления первый и второй антигены присутствуют на одной молекуле. Согласно одному варианту осуществления первый и второй антигены присутствуют на разных молекулах. Согласно различным вариантам осуществления первая или вторая последовательность нуклеиновой кислоты содержит модификацию, которая уменьшает аффинность кодированной тяжелой цепи к белку А.
Согласно одному варианту осуществления первая или вторая последовательности нуклеиновой кислоты содержат реаранжированную последовательность вариабельной области тяжелой цепи человека, содержащую генный сегмент тяжелой цепи человека, выбранный из VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VHI-46, VH1-58, VH1-69, VH2-5, VH2-26, VH2-70, VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-20, VH3-21, VH3-23, VH3-30, VH3-33, VH3-43, VH3-48, VH3-53, VH3-64, VH3-72, VH3-73, VH4-31, VH4-34, VH4-39, VH4-59, VH5-51 и VH6-1. Согласно конкретному варианту осуществления генный сегмент тяжелой цепи представляет собой VH2-5, VH3-23 или VH3-30.
Согласно одному аспекту предусмотрен способ получения биспецифического антитела, которое специфически связывается с первым и вторым антигеном, причем способ предусматривает (а) идентификацию первой последовательности нуклеиновой кислоты, которая кодирует первый вариабельный домен тяжелой цепи (VH) человека, который специфичен для первого антигена; (b) идентификацию второй последовательности нуклеиновой кислоты, которая кодирует второй вариабельный домен тяжелой цепи (VH) человека, который специфичен для второго антигена; (с) предоставление третьей последовательности нуклеиновой кислоты, которая кодирует вариабельную область легкой цепи (VL) человека, которая, когда в паре с областью VH (а) специфически связывается с первым антигеном, и когда в паре с областью VH (b) специфически связывается со вторым антигеном; (d) культивирование клетки-хозяина, содержащей первую, вторую и третью последовательности нуклеиновых кислот, чтобы обеспечить экспрессию первой и второй областей VH человека и области VL человека с образованием биспецифического антитела; и (d) выделение указанного биспецифического антитела. Согласно различным аспектам первый и второй антигены отличаются друг от друга. Согласно различным аспектам первую и вторую последовательности нуклеиновых кислот выделяют из иммунизированной мыши, которая экспрессирует область VL иммуноглобулина человека из реаранжированной последовательности иммуноглобулина, который происходит от генного сегмента Vκ1-39 человека или Vκ3-20 человека, причем реаранжированный генный сегмент Vκ1-39 или Vκ3-30 человека находится в зародышевой линии мыши.
Согласно одному варианту осуществления третья последовательность нуклеиновой кислоты представляет собой последовательность зародышевой линии (т.е. не содержит соматическую гипермутацию в последовательности генного сегмента V). Согласно одному варианту осуществления третью последовательность нуклеиновой кислоты выделяют из мыши, которая экспрессирует область VL иммуноглобулина человека, полученную из генного сегмента Vκ3-20 человека или Vκ1-39 человека из реаранжированной последовательности легкой цепи иммуноглобулина в зародышевой линии мыши. Согласно конкретному варианту осуществления третья последовательность нуклеиновой кислоты содержит от двух до пяти соматических гипермутаций в определяющей комплементарность области (CDR) и/или каркасной области (FWR). Согласно одному варианту осуществления область VLиммуноглобулина человека экспрессируется из модифицированного эндогенного локуса легкой цепи иммуноглобулина.
Согласно одному варианту осуществления первый и второй антигены присутствуют на одной молекуле. Согласно одному варианту осуществления первый и второй антигены присутствуют на разных молекулах. Согласно одному варианту осуществления первая или вторая последовательность нуклеиновой кислоты содержит модификацию, которая уменьшает аффинность кодированной тяжелой цепи к белку А.
Согласно одному варианту осуществления первая или вторая последовательности нуклеиновой кислоты содержат реаранжированную последовательность вариабельной области тяжелой цепи человека, содержащую генный сегмент тяжелой цепи человека, выбранный из VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VH1-46, VH1-58, VH1-69, VH2-5, VH2-26, VH2-70, VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-20, VH3-21, VH3-23, VH3-30, VH3-33, VH3-43, VH3-48, VH3-53, VH3-64, VH3-72, VH3-73, VH4-31, VH4-34, VH4-39, VH4-59, VH5-51 и VH6-1. Согласно конкретному варианту осуществления генный сегмент тяжелой цепи представляет собой VH2-5, VH3-23 или VH3-30.
Согласно одному аспекту предусмотрен способ создания биспецифического антитела, предусматривающий подвергание описанной в настоящем документе мыши воздействию представляющим интерес антигеном, позволяя мыши поддерживать иммунный ответ на представляющий интерес антиген, идентификацию первой вариабельной области тяжелой цепи человека, которая связывается с первым эпитопом представляющего интерес антигена, идентификацию второй вариабельной области тяжелой цепи человека, которая связывается со вторым эпитопом представляющего интерес антигена, создание первого гена полностью человеческой тяжелой цепи, который кодирует первую тяжелую цепь, которая связывается с первым эпитопом представляющего интерес антигена, создание второго гена полностью человеческой тяжелой цепи, который кодирует вторую тяжелую цепь, которая связывается со вторым эпитопом представляющего интерес антигена, экспрессирующего первую тяжелую цепь и вторую тяжелую цепь в клетке, которая экспрессирует единственную полностью человеческую легкую цепь, полученную из генного сегмента Vκ1-39 человека или Vκ3-20 человека для образования биспецифического антитела, и выделение биспецифического антигенсвязывающего белка.
Согласно одному варианту осуществления первый эпитоп и второй эпитоп не идентичны. Согласно одному варианту осуществления связывание первой вариабельной области тяжелой цепи с первым эпитопом не блокирует связывание второй вариабельной области тяжелой цепи со вторым эпитопом. Согласно одному варианту осуществления первая и вторая тяжелые цепи способны связываться с первым и вторым эпитопом одновременно.
Согласно одному варианту осуществления биспецифическое антитело связывается с первым и вторым эпитопами одновременно. Согласно одному варианту осуществления биспецифическое антитело связывается с первым эпитопом и вторым эпитопом независимо.
Согласно одному варианту осуществления связывающий ответ биспецифического антитела на антиген приблизительно в 2 раза выше, чем связывающий ответ первой вариабельной области тяжелой цепи на антиген. Согласно одному варианту осуществления связывающий ответ биспецифического антитела на антиген приблизительно в 2 раза выше, чем связывающий ответ второй вариабельной области тяжелой цепи на антиген. Согласно одному варианту осуществления связывающий ответ биспецифического антитела на антиген приблизительно такой же, как или приблизительно равен связывающему ответу первого вариабельной области тяжелой цепи и/или второй вариабельной области тяжелой цепи на антиген.
Согласно одному варианту осуществления антиген выбирают из растворимого антигена, клеточного поверхностного антигена (например, опухолевого антигена) и рецептора клеточной поверхности. Согласно конкретному варианту осуществления рецептор клеточной поверхности представляет собой рецептор иммуноглобулина. Согласно конкретному варианту осуществления рецептор иммуноглобулина представляет собой Fc рецептор.
Согласно одному варианту осуществления вариабельный домен легкой цепи содержит от 2 до 5 соматических мутаций. Согласно одному варианту осуществления вариабельный домен легкой цепи представляет собой соматически мутированную родственную легкую цепь, экспрессируемую в В-клетке иммунизированной мыши, или с первым, или вторым вариабельным доменом тяжелой цепи.
Согласно одному варианту осуществления первая полностью человеческая тяжелая цепь содержит аминокислотную модификацию, которая снижает ее аффинность к белку А, а вторая полностью человеческая тяжелая цепь не содержит модификацию, которая снижает ее аффинность к белку А.
Согласно различным вариантам осуществления способы получения биспецифических антител усиливаются использованием общей легкой цепи для образования пары с каждой вариабельной областью тяжелой цепи биспецифических антител. Согласно различным вариантам осуществления использование описанной в настоящем документе общей легкой цепи уменьшает количество несоответствующих видов иммуноглобулинов, не характеризующихся биспецифичностью, по сравнению с использованием оригинальных родственных легких цепей. Согласно различным вариантам осуществления вариабельные области тяжелой цепи биспецифических антител идентифицируют из моноспецифических антител, содержащих общую легкую цепь. Согласно различным вариантам осуществления вариабельные области тяжелой цепи биспецифических антител содержат вариабельные генные сегменты тяжелой цепи человека, которые реаранжируют in vivo в В-клетках мыши, которые были ранее сконструированы для экспрессии ограниченного репертуара легких цепей человека или единственной легкой цепи человека, родственной тяжелым цепям человека и, в ответ на воздействие представляющим интерес антигеном, производят репертуар химерных антител, содержащих множество вариабельных областей тяжелой цепи человека, которые родственны с одной или одной из двух возможных вариабельных областей легкой цепи человека, причем химерные антитела специфичны к представляющему интерес антигену.
Согласно различным аспектам предусмотрен способ получения биспецифического антитела, содержащего 1) первый полипептид и второй полипептид, причем первый и второй полипептиды каждый включает в себя домен мультимеризации (например, домен Fc иммуноглобулина), позволяя первому и второму полипептидам образовывать димер, и домены мультимеризации обеспечивают стабильное взаимодействие между первым и вторым полипептидами, и причем один из доменов мультимеризации несет аминокислотную модификацию, которая уменьшает его аффинность к белку А, а другой домен мультимеризация не несет модификацию, 2) связывающий домен в каждом из первого и второго полипептида, каждый связывающий домен, содержащий вариабельную тяжелую цепь и вариабельную легкую цепь, причем вариабельная легкая цепь первого полипептида и вариабельная легкая цепь второго полипептида содержат общую аминокислотную последовательность, которая характеризуется идентичностью аминокислотной последовательности с оригинальной легкой цепью каждого из полипептидов, составляющей по меньшей мере 80%, по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95% и наиболее предпочтительно 100% идентичность последовательности. Согласно различным вариантам осуществления вариабельную легкую цепь получают из генного сегмента Vκ1-39 человека или Vκ3-20 человека. Согласно различным вариантам осуществления вариабельная легкая цепь представляет собой реаранжированную последовательность легкой цепи человека. Согласно различным вариантам осуществления вариабельную легкую цепь выделяют из описанной в настоящем документе мыши.
Согласно различным вариантам осуществления способ предусматривает следующие стадии: (I) культивирования клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую первый полипептид, второй полипептид и общую легкую цепь, причем нуклеиновая кислота экспрессируется; и (II) выделения биспецифического антитела из культуры клетки-хозяина; согласно одному варианту осуществления нуклеиновая кислота, кодирующая первый полипептид, или нуклеиновая кислота, кодирующая второй полипептид, несет аминокислотную модификацию, которая уменьшает ее аффинность к белку А. Согласно одному варианту осуществления нуклеиновая кислота, кодирующая первый полипептид, второй полипептид и общую легкую цепь, присутствует в одном векторе или в отдельных векторах. Согласно одному варианту осуществления клетка-хозяин используется для создания биспецифического антитела в соответствии с предыдущим пунктом.
Согласно одному аспекту предусмотрен способ получения биспецифического антитела, предусматривающий (а) выбор первой нуклеиновой кислоты, кодирующей первую вариабельную область тяжелой цепи человека, выделенную из описанной в настоящем документе мыши; (b) выбор второй нуклеиновой кислоты, кодирующей вторую вариабельную область тяжелой цепи человека, выделенную из той же или отдельной описанной в настоящем документе мыши; (с) предоставление третьей нуклеиновой кислоты, кодирующей вариабельную область легкой цепи человека, выделенной из описанной в настоящем документе мыши или полученной из описанной в настоящем документе реаранжированной вариабельной области легкой цепи человека; (с) введение в клетку-хозяина первой, второй и третьей нуклеиновых кислот и культивирование клетки-хозяина таким образом, чтобы происходила экспрессия первой, второй и третьей нуклеиновой кислоты; и (d) выделение биспецифического антитела, образованного из культуры клеток.
Согласно одному варианту осуществления первая и вторая вариабельные области тяжелой цепи человека соматически мутированы. Согласно конкретному варианту осуществления первая и вторая вариабельные области тяжелой цепи человека независимо получены из реаранжированного генного сегмента VH человека, выбранного из генных сегментов VH человека 1-2, 1-3, 1-8, 1-18, 1-24, 1-46, 1-58, 1-69, 2-5, 2-26, 2-70, 3-7, 3-9, 3-11, 3-13, 3-15, 3-16, 3-20, 3-21, 3-23, 3-30, 3-33, 3-43, 3-48, 3-53, 3-64, 3-72, 3-73, 4-31, 4-34, 4-39, 4-59, 5-51 и 6-1. Согласно одному варианту осуществления первая и вторая вариабельные области тяжелой цепи человека независимо получены из реаранжированного генного сегмента VH человека, выбранного из 2-5, 3-30 и 3-23. Согласно одному варианту осуществления первую вариабельную область тяжелой цепи человека получают из генного сегмента VH2-5 человека и вариабельную область тяжелой цепи человека получают из генного сегмента VH3-30 человека. Согласно одному варианту осуществления первую вариабельную область тяжелой цепи человека получают из генного сегмента VH3-30 человека и вторую вариабельную область тяжелой цепи человека получают из генного сегмента VH3-23 человека. Согласно одному варианту осуществления первую вариабельную область тяжелой цепи человека получают из генного сегмента VH3-23 человека и вторую вариабельную область тяжелой цепи человека получают из генного сегмента VH3-30 человека.
Согласно одному варианту осуществления первую или вторую нуклеиновую кислоту модифицируют перед стадией (с), причем первую или вторую нуклеиновую кислоту модифицируют таким образом, что она характеризуется уменьшенным сродством к белку А.
Согласно одному варианту осуществления третью нуклеиновую кислоту выделяют из описанной в настоящем документе мыши. Согласно одному варианту осуществления третья нуклеиновая кислота содержит от 2 до 5 соматических мутаций. Согласно одному варианту осуществления третья нуклеиновая кислота кодирует вариабельную область легкой цепи человека, полученную из генного сегмента Vκ1-39 человека. Согласно одному варианту осуществления третья нуклеиновой кислоты кодирует вариабельную область легкой цепи человека, полученную из генного сегмента Vκ3-20 человека.
Согласно одному варианту осуществления третью нуклеиновую кислоту получают из реаранжированной вариабельной области легкой цепи человека. Согласно одному варианту осуществления реаранжированная вариабельная область легкой цепи человека содержит последовательность, полученную из генного сегмента Vκ1-39 человека или генного сегмента Vκ3-20 человека. Согласно одному варианту осуществления реаранжированная вариабельная область легкой цепи человека представляет собой последовательность Vκ1-39 зародышевой линии человека (т.е. не содержит соматическую гипермутацию в последовательности генного сегмента V). Согласно одному варианту осуществления реаранжированная вариабельная область легкой цепи человека представляет собой последовательность Vκ3-20 зародышевой линии человека.
Согласно различным вариантам осуществления предусмотрен способ получения биспецифических антител, который предусматривает первую тяжелую цепь человека, содержащую вариабельный домен, полученный из модифицированной мыши, которая не содержит реаранжированную последовательность легкой цепи человека в его зародышевой линии, причем первая тяжелая цепь человека образует пару с родственной легкой цепью человека, которая содержит реаранжированную вариабельную область легкой цепи человека, полученную из генного сегмента Vκ1-39 человека или Vκ3-20 человека. Согласно различным вариантам осуществления вторую тяжелую цепь человека с отличной специфичностью от первой тяжелой цепи человека идентифицируют из иммунизированной описанной в настоящем документе мыши. Нуклеиновые кислоты, кодирующие две тяжелые цепи и общую легкую цепь, вводят в клетку-хозяина, как описано в предыдущих пунктах, так что происходит экспрессия всех трех цепей, и биспецифическое антитело выделяют из клеточной культуры.
Согласно одному варианту осуществления мышь иммунизируют тем же антигеном, используемым для производства первого вариабельного домена тяжелой цепи человека. Согласно одному варианту осуществления мышь иммунизируют другим антигеном, используемым для производства первого вариабельного домена тяжелой цепи человека.
Согласно одному аспекту предусмотрен способ выбора тяжелых цепей человека, которые могут образовывать пару с единственной легкой цепью человека для получения биспецифического антитела, включая в себя нуклеиновые кислоты, которые кодируют биспецифическое антитело и клетку-хозяина, содержащую нуклеиновые кислоты.
Согласно одному аспекту предусмотрен способ увеличения количества желаемого биспецифического антитела в культуре клеток среди нежелательных продуктов, таких как моноспецифические антитела, причем одна из тяжелых цепей биспецифического антитела модифицирована, чтобы уменьшить его аффинность к белку А.
Согласно одному аспекту предусмотрена выделенная клетка-хозяин, причем клетка-хозяин содержит (а) первую последовательность нуклеиновой кислоты, кодирующую первую вариабельную область тяжелой цепи человека, которая связывается с первым антигеном, причем первую последовательность нуклеиновой кислоты выделяют из мыши, иммунизированной первым антигеном, который экспрессирует область VL иммуноглобулина человека из реаранжированной последовательности легкой цепи иммуноглобулина в зародышевой линии мыши; (b) вторую последовательность нуклеиновой кислоты, кодирующую вторую вариабельную область тяжелой цепи человека, которая связывается со вторым антигеном, причем вторую последовательность нуклеиновой кислоты выделяют из мыши, иммунизированной вторым антигеном, который экспрессирует область VL иммуноглобулина человека из реаранжированной последовательности легкой цепи иммуноглобулина в зародышевой линии мыши; (с) третью последовательность нуклеиновой кислоты, кодирующую вариабельную область легкой цепи человека, которая, когда в паре с вариабельной областью тяжелой цепи (а), специфически связывается с первым антигеном, и когда в паре с вариабельной областью тяжелой цепи (b), специфически связывается со вторым антигеном.
Согласно различным аспектам первый и второй антигены отличаются друг от друга. Согласно различным аспектам экспрессия первой, второй и третьей последовательности нуклеиновых кислот приводит к образованию биспецифического антитела, которое специфически связывается с первым и вторым антигенами.
Согласно одному варианту осуществления область VL человека получают из реаранжированной последовательности легкой цепи человека, содержащей генный сегмент Vκ1-39 человека или генный сегмент Vκ3-20 человека. Согласно конкретному варианту осуществления реаранжированная последовательность легкой цепи человека представляет собой последовательность зародышевой линии (т.е. не содержит соматическую гипермутацию в вариабельном домене). Согласно одному варианту осуществления третью последовательность нуклеиновой кислоты выделяют из мыши, которая экспрессирует область VL иммуноглобулина человека из реаранжированной последовательности легкой цепи иммуноглобулина, причем реаранжированная последовательность легкой цепи человека присутствует в зародышевой линии мыши. Согласно одному варианту осуществления реаранжированная последовательность легкой цепи иммуноглобулина содержит генный сегмент Vκ1-39 человека или генный сегмент Vκ3-20 человека. Согласно конкретному варианту осуществления генный сегмент Vκ1-39 человека или генный сегмент Vκ3-20 человека содержит по меньшей мере одну соматическую гипермутацию в определяющей комплементарность области (CDR) или каркасной области (FWR). Согласно конкретному варианту осуществления первую, вторую и третью последовательности нуклеиновых кислот выделяют из мыши, которая экспрессирует область VL иммуноглобулина человека, полученную из генного сегмента Vκ3-20 человека или Vκ1-39 человека из реаранжированной последовательности легкой цепи иммуноглобулина, причем реаранжированная последовательности легкой цепи иммуноглобулина присутствует в зародышевой линии мыши.
Согласно различным вариантам осуществления мышь не содержит эндогенный генный сегмент вариабельной области легкой цепи, который способен к реаранжировке для образования легкой цепи иммуноглобулина.
Согласно одному варианту осуществления область VL иммуноглобулина человека экспрессируется из модифицированного эндогенного локуса легкой цепи иммуноглобулина. Согласно одному варианту осуществления первый и второй антигены присутствуют на одной молекуле. Согласно одному варианту осуществления первый и второй антигены присутствуют на разных молекулах. Согласно одному варианту осуществления первая или вторая последовательность нуклеиновой кислоты содержит модификацию, которая уменьшает аффинность кодированной тяжелой цепи к белку А.
Согласно одному варианту осуществления первая или вторая последовательности нуклеиновой кислоты содержат реаранжированную последовательность вариабельной области тяжелой цепи человека, содержащую генный сегмент тяжелой цепи человека, выбранный из VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VHI-46, VH1-58, VH1-69, VH2-5, VH2-26, VH2-70, VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-20, VH3-21, VH3-23, VH3-30, VH3-33, VH3-43, VH3-48, VH3-53, VH3-64, VH3-72, VH3-73, VH4-31, VH4-34, VH4-39, VH4-59, VH5-51 и VH6-1. Согласно конкретному варианту осуществления генный сегмент тяжелой цепи представляет собой VH2-5, VH3-23 или VH3-30.
Согласно одному аспекту предусмотрено антитело или биспецифическое антитело, содержащее человеческий вариабельный домен тяжелой цепи, созданный в соответствии с настоящим изобретением. Согласно другому аспекту предусмотрено использование описанной в настоящем документе мыши для получения полностью человеческого антитела или полностью человеческого биспецифического антитела.
Согласно одному аспекту описанная в настоящем документе генетически модифицированная мышь, эмбрион или клетка содержит локус легкой цепи κ, который сохраняет эндогенные регуляторные или контрольные элементы, например, интронный энхансер к мыши, 3' энхансер к мыши или как интронный энхансер, так и 3' энхансер, причем регуляторные или контрольные элементы облегчают соматическую мутацию и созревание аффинности экспрессируемой последовательности локуса легкой цепи к.
Согласно одному аспекту предусмотрена мышь, которая содержит В-клеточную популяцию, характеризующуюся наличием легких цепей иммуноглобулинов, полученных из не более чем одного или не более чем двух реаранжированных или нереаранжированных генных сегментов V и J легкой цепи иммуноглобулина, причем мышь обладает соотношением легких цепей κ:λ приблизительно таким же, как мышь, которая содержит комплемент дикого типа генных сегментов V и J легкой цепи иммуноглобулина.
Согласно одному варианту осуществления легкие цепи иммуноглобулина получают не более чем из одного или не более чем из двух реаранжированных генных сегментов V и J легкой цепи иммуноглобулина. Согласно конкретному варианту осуществления легкие цепи получают не более чем из одного реаранжированного генного сегмента V и J легкой цепи иммуноглобулина. Согласно одному варианту осуществления легкие цепи иммуноглобулина создаются из одного из двух нереаранжированных генных сегментов VL иммуноглобулина и одного из 1, 2, 3, 4 или 5 генных сегментов JL иммуноглобулина. Согласно одному варианту осуществления легкие цепи иммуноглобулина создаются из одного из двух нереаранжированных генных сегментов VL иммуноглобулина и одного генного сегмента JL иммуноглобулина.
Согласно одному аспекту предусмотрена описанная в настоящем документе мышь, которая экспрессирует легкую цепь иммуноглобулина, полученную из не более чем одной или не более чем двух последовательностей Vκ/Jκ человека, причем мышь содержит замещение всех или практически всех эндогенных генных сегментов вариабельной области тяжелой цепи мыши одним или несколькими генными сегментами вариабельной области тяжелой цепи человека, и мышь проявляет соотношение (a) CD19+ В-клеток, которые экспрессируют иммуноглобулин, содержащий легкую цепь λ, к (b) CD19+ В-клеткам, которые экспрессируют иммуноглобулин, содержащий легкую цепь κ, составляющее от приблизительно 1 до приблизительно 20.
Согласно одному варианту осуществления мышь экспрессирует единственную легкую цепь κ, полученную из последовательности Vκ1-39Jκ5 человека, и отношение CD19+ В-клеток, которые экспрессируют иммуноглобулин, содержащий легкую цепь λ, к CD19+ В-клеткам, которые экспрессируют иммуноглобулин, содержащий легкую цепь κ, составляет от приблизительно 1 до приблизительно 20; согласно одному варианту осуществления соотношение составляет приблизительно от 1 до по меньшей мере приблизительно 66; согласно конкретному варианту осуществления отношение составляет от 1 до 66.
Согласно одному варианту осуществления мышь экспрессирует единственную легкую цепь κ, полученную из последовательности Vκ3-20Jκ5 человека, и отношение CD19+ В-клеток, которые экспрессируют иммуноглобулин, содержащий легкую цепь λ, к CD19+ В-клеткам, которые экспрессируют иммуноглобулин, содержащий легкую цепь κ, составляет от приблизительно 1 до приблизительно 20; согласно одному варианту осуществления отношение составляет приблизительно от 1 до приблизительно 21. Согласно конкретному варианту осуществления отношение составляет от 1 до 20 или от 1 до 21.
Согласно некоторым вариантам осуществления в настоящем изобретении предусмотрена мышь, которая экспрессирует легкую цепь иммуноглобулина, последовательность которой идентична той, которая достигается путем реаранжировки одного из двух генных сегментов Vκ человека с 1, 2, 3, 4 или 5 генными сегментами Jκ человека.
Согласно некоторым вариантам осуществления предусмотрена мышь, которая экспрессирует легкую цепь иммуноглобулина, полученную от реаранжировки одного из двух генных сегментов Vκ человека и одного из 1, 2, 3, 4 или 5 генных сегментов Jκ человека, причем мышь содержит замещение всех или по существу всех эндогенных генных сегментов VH иммуноглобулина одним или несколькими генными сегментами VH, одним или несколькими генными сегментами DH и одним или несколькими генными сегментами JH иммуноглобулина человека, а мышь обладает отношением (а) В-клеток в костном мозге, которые экспрессируют иммуноглобулин, содержащий легкую цепь λ, к (b) В-клеткам в костном мозге, которые экспрессируют иммуноглобулин, содержащий легкую цепь κ, составляющим от приблизительно 1 до приблизительно 15. Согласно некоторым вариантам осуществления реаранжировка включает в себя генный сегмент Vκ1-39 человека. Согласно некоторым вариантам осуществления реаранжировка включает в себя генный сегмент Vκ3-20 человека. Согласно некоторым вариантам осуществления замещение эндогенных генных сегментов VH иммуноглобулина происходит в эндогенном локусе VH иммуноглобулина. Согласно некоторым вариантам осуществления два генных сегмента Vκ человека находятся в эндогенном локусе Vκ иммуноглобулина, и согласно некоторым вариантам осуществления два генных сегмента Vκ человека замещают все или по существу все генные сегменты Vκ иммуноглобулина мыши. Согласно некоторым вариантам осуществления два генных сегмента Vκ человека находятся в эндогенном локусе Vκ иммуноглобулина, и согласно некоторым вариантам осуществления два генных сегмента Vκ человека замещают все или по существу все генные сегменты Vκ и Jκ иммуноглобулина мыши. Согласно различным вариантам осуществления два генных сегмента Vκ человека функционально связаны с двумя или более (например, 2, 3,4, 5) генными сегментами Jκ человека.
Согласно некоторым вариантах осуществления мышь согласно настоящему изобретению экспрессирует легкую цепь, созданную посредством реаранжировки генного сегмента Vκ1-39 человека или генного сегмента Vκ3-20 человека и одного из двух или более (например, 2, 3, 4 или 5) генных сегментов Jκ человека, и отношение незрелых В-клеток в костном мозге, которые экспрессируют иммуноглобулин, содержащий легкую цепь λ, к незрелым В-клеткам, которые экспрессируют иммуноглобулин, содержащий легкую цепь κ, составляет от приблизительно 1 до приблизительно 13.
Согласно некоторым вариантах осуществления мышь согласно настоящему изобретению экспрессирует легкую цепь, созданную посредством реаранжировки генного сегмента Vκ1-39 человека или генного сегмента Vκ3-20 человека и одного из двух или более (например, 2, 3, 4 или 5) генных сегментов Jκ человека, и отношение зрелых В-клеток в костном мозге, которые экспрессируют иммуноглобулин, содержащий легкую цепь λ, к незрелым В-клеткам, которые экспрессируют иммуноглобулин, содержащий легкую цепь κ, составляет от приблизительно 1 до приблизительно 7.
Согласно некоторым вариантах осуществления мышь согласно настоящему изобретению экспрессирует легкую цепь, созданную посредством реаранжировки генного сегмента Vκ1-39 человека или генного сегмента Vκ3-20 человека и одного из двух или более (например, 2, 3, 4 или 5) генных сегментов Jκ человека, и характеризуется наличием популяции про-В-клеток в костном мозге в диапазоне от приблизительно 2,5×104 до приблизительно 1,5×105 клеток, включая в себя, например, приблизительно 2,5×104, 3,0×104, 3,5×104, 4,0×104, 4,5×104, 5,0×104, 5,5×104, 6,0×104, 6,5×104, 7,0×104, 7,5×104, 8,0×104, 8,5×104, 9,0×104, 9,5×104, 1,0×105 или 1,5×105 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию про-В-клеток в костном мозге, составляющую приблизительно 2,88×104 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию про-В-клеток в костном мозге, составляющую приблизительно 6,42×104 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию про-В-клеток в костном мозге, составляющую приблизительно 9,16×104 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию про-В-клеток в костном мозге, составляющую приблизительно 1,19×105 клеток. Иллюстративные про-В-клетки в костном мозге описанных в настоящем документе генетически модифицированных мышей характеризуются экспрессией CD19, CD43, c-kit и/или их комбинации (например, CD19+, CD43+, c-kit+).
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению экспрессирует легкую цепь, созданную посредством реаранжировки генного сегмента Vκ1-39 человека или генного сегмента Vκ3-20 человека и одного из двух или более (например, 2, 3, 4 или 5) генных сегментов Jκ человека, и характеризуется наличием популяции пре-В-клеток в костном мозге в диапазоне от приблизительно 1×106 до приблизительно 2×106 клеток, включая в себя, например, приблизительно 1,0×106, 1,1×106, 1,2×106, 1,3×106, 1,4×106, 1,5×106, 1,6×106, 1,7×106, 1,8×106, 1,9×106 или 2,0×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию пре-В-клеток в костном мозге, составляющую приблизительно 1,25×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию пре-В-клеток в костном мозге, составляющую приблизительно 1,46×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию пре-В-клеток в костном мозге, составляющую приблизительно 1,64×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию пре-В-клеток в костном мозге, составляющую приблизительно 2,03×106 клеток. Иллюстративные пре-В-клетки в костном мозге описанных в настоящем документе генетически модифицированных мышей характеризуются экспрессией CD19, CD43, c-kit и/или их комбинации (например, CD19+, CD43-, c-kit-).
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению экспрессирует легкую цепь, созданную посредством реаранжировки генного сегмента Vκ1-39 человека или генного сегмента Vκ3-20 человека и одного из двух или более (например, 2, 3, 4 или 5) генных сегментов Jκ человека, и характеризуется наличием популяции незрелых В-клеток в костном мозге в диапазоне от приблизительно 5×105 до приблизительно 7×105 клеток, включая в себя, например, приблизительно 5,0×105, 5,1×105, 5,2×105, 5,3×105, 5,4×105, 5,5×105, 5,6×105, 5,7×105, 5,8×105, 5,9×105, 6,0×105, 6,1×105, 6,2×105, 6,3×105, 6,4×105, 6,5×105, 6,6×105, 6,7×105, 6,8×105, 6,9×105 или 7,0×105 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию незрелых В-клеток в костном мозге, составляющую приблизительно 5,33×105 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию незрелых В-клеток в костном мозге, составляющую приблизительно 5,80×105 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию незрелых В-клеток в костном мозге, составляющую приблизительно 5,92×105 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию незрелых В-клеток в костном мозге, составляющую приблизительно 6,67×105 клеток. Иллюстративные незрелые В-клетки в костном мозге описанных в настоящем документе генетически модифицированных мышей характеризуются экспрессией IgM, В220 и/или их комбинации (например, IgM+, B220int).
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению экспрессирует легкую цепь, созданную посредством реаранжировки генного сегмента Vκ1-39 человека или генного сегмента Vκ3-20 человека и одного из двух или более (например, 2, 3, 4 или 5) генных сегментов Jκ человека, и характеризуется наличием популяции зрелых В-клеток в костном мозге в диапазоне от приблизительно 3×104 до приблизительно 1,5×105 клеток, включая в себя, например, приблизительно 3,0×104, 3,5×104, 4,0×104, 4,5×104, 5,0×104, 5,5×104, 6,0×104, 6,5×104, 7,0×104, 7,5×104, 8,0×104, 8,5×104, 9,0×104, 9,5×104, 1,0×105 или 1,5×105 клетки; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию зрелых В-клеток в костном мозге, составляющую приблизительно 3,11×104 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию зрелых В-клеток в костном мозге, составляющую приблизительно 1,09×105 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию зрелых В-клеток в костном мозге, составляющую приблизительно 1,16×105 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию зрелых В-клеток в костном мозге, составляющую приблизительно 1,44×105 клеток. Иллюстративные зрелые В-клетки в костном мозге описанных в настоящем документе генетически модифицированных мышей характеризуются экспрессией IgM, В220 и/или их комбинации (например, IgM+, B220hi).
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению экспрессирует легкую цепь, созданную посредством реарранжировки генного сегмента Vκ1-39 человека или генного сегмента Vκ3-20 человека и одного из двух или более (например, 2, 3, 4 или 5) генных сегментов Jκ человека, и характеризуется наличием популяции общих В-клеток в костном мозге в диапазоне от приблизительно 1×106 до приблизительно 3×106 клеток, включая в себя, например, приблизительно 1,0×106, 1,1×106, 1,2×106, 1,3×106, 1,4×106, 1,5×106, 1,6×106, 1,7×106, 1,8×106, 1,9×106, 2,0×106, 2,1×106, 2,2×106, 2,3×106, 2,4×106, 2,5×106, 2,6×106, 2,7×106, 2,8×106, 2,9×106 или 2,0×106 клетки; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию общих В-клеток в костном мозге, составляющую приблизительно 1,59×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию общих В-клеток в костном мозге, составляющую приблизительно 1,75×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию общих В-клеток в костном мозге, составляющую приблизительно 2,13×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию общих В-клеток в костном мозге, составляющую приблизительно 2,55×106 клеток. Иллюстративные общие В-клетки в костном мозге описанных в настоящем документе генетически модифицированных мышей характеризуются экспрессией CD19, CD20 и/или их комбинации (например, CD19+).
Согласно одному аспекту предусмотрена генетически модифицированная мышь, которая экспрессирует единственную реаранжированную легкую цепь κ, причем мышь содержит функциональный локус легкой цепи λ и причем мышь экспрессирует популяцию В-клеток, которая содержит Igκ+ клетки, которые экспрессируют легкую цепь κ, полученную из той же единственной реаранжированной легкой цепи к. Согласно одному варианту осуществления процент Igκ+Igλ+ В-клеток у мыши приблизительно такой же, как и у мыши дикого типа. Согласно конкретному варианту осуществления процент Igκ+Igλ+ В-клеток у мыши составляет от приблизительно 2 до приблизительно 6 процентов. Согласно конкретному варианту осуществления процент Igκ+Igλ+ В-клеток у мыши, у которой единственную реаранжированную легкую цепь к получают из последовательности Vκ1-39Jκ5, составляет от приблизительно 2 до приблизительно 3; согласно конкретному варианту осуществления процент составляет приблизительно 2,6. Согласно конкретному варианту осуществления процент Igκ+Igλ+ В-клеток у мыши, у которой единственную реаранжированную легкую цепь к получают из последовательности Vκ3-20Jκ1, составляет от приблизительно 4 до приблизительно 8; согласно конкретному варианту осуществления процент составляет приблизительно 6.
Согласно некоторым вариантам осуществления предусмотрена генетически модифицированная мышь, которая экспрессирует легкую цепь иммуноглобулина, содержащую реаранжированную последовательность Vκ/Jκ иммуноглобулина человека, причем мышь содержит функциональный локус легкой цепи λ иммуноглобулина и причем мышь содержит популяцию В-клеток селезенки, которая характеризуется соотношением Ιgλ+ В-клеток к Igλ+ В-клеток, которое составляет от приблизительно 1 до приблизительно 8; согласно некоторым вариантам осуществления от приблизительно 1 до приблизительно 5. Согласно некоторым вариантам осуществления реаранжированная последовательность Vκ/Jκ иммуноглобулина человека образуется посредством реаранжировки одного из двух генных сегментов Vκ иммуноглобулина человека и одного из 1, 2, 3, 4 или 5 генных сегментов Jκ иммуноглобулина человека. Согласно некоторым вариантам осуществления реаранжированная последовательность Vκ/Jκ иммуноглобулина человека образуется посредством реаранжировки генного сегмента Vκ1-39 иммуноглобулина человека и генного сегмента Jκ иммуноглобулина человека, выбранного из Jκ1, Jκ2, Jκ3, Jκ4, Jκ5 и их комбинации. Согласно некоторым вариантам осуществления реаранжированная последовательность Vκ/Jκ иммуноглобулина человека образуется посредством реаранжировки генного сегмента Vκ3-20 иммуноглобулина человека и генного сегмента Jκ иммуноглобулина человека, выбранного из Jκ1, Jκ2, Jκ3, Jκ4, Jκ5 и их комбинации.
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+ В-клеток селезенки в диапазоне приблизительно от 2×106 до 7×106 клеток, включая в себя, например, приблизительно 2,0×106, 2,5×106, 3,0×106, 3,5×106, 4,0×106, 4,5×106, 5,0×106, 5,5×106, 6,0×106, 6,5×106 или 7,0×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+ В-клеток селезенки, составляющую приблизительно 2,74×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+ В-клеток селезенки, составляющую приблизительно 4,30×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+ В-клеток селезенки, составляющую приблизительно 5,53×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+ В-клеток селезенки, составляющую приблизительно 6,18×106 клеток.
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+, IgDhi, IgMlo В-клеток селезенки в диапазоне от приблизительно 1×106 до 4×106 клеток, включая в себя, например, приблизительно 1,0×106, 1,5×106, 2,0×106, 2,5×106, 3,0×106, 3,5×106, 4,0×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+, IgDhi, IgMlo В-клеток селезенки, составляющую приблизительно 1,30×106; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+, IgDhi, IgMlo В-клеток селезенки, составляющую приблизительно 2,13×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+, IgDhi, IgMlo В-клеток селезенки, составляющую приблизительно 3,15×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+, IgDhi, IgMlo В-клеток селезенки, составляющую приблизительно 3,93×106 клеток.
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+, IgDlo, IgMhi В-клеток селезенки в диапазоне от приблизительно 9×105 до 2×106 клеток, включая в себя, например, приблизительно 9,0×105, 9,25×105, 9,5×105, 9,75×105, 1,0×106, 1,25×106, 1,50×106, 1,75×106, 2,0×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+, IgDlo, IgMhi В-клеток селезенки, составляющую приблизительно 9,52×105; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+, IgDlo, IgMhi В-клеток селезенки, составляющую приблизительно 1,23×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+, IgDlo, IgMhi В-клеток селезенки, составляющую приблизительно 1,40×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию CD19+, IgDlo, IgMhi В-клеток селезенки, составляющую приблизительно 1.42×106 клеток.
Согласно некоторых вариантах осуществления предусмотрена генетически модифицированная мышь, причем мышь содержит локус легкой цепи κ иммуноглобулина, который содержит два переаранжированных генных сегмента Vκ иммуноглобулина человека и два или более (например, 2, 3, 4 или 5) нереаранжированных генных сегмента Jκ человека, и причем мышь содержит популяцию периферических В-клеток селезенки, содержащую переходные (например, Τ1, Т2 и Т3) популяции В-клеток, которые приблизительно такие же, как и у мыши, которая содержит комплемент дикого типа генных сегментов V и J легкой цепи к иммуноглобулина. Иллюстративные переходные популяции В-клеток (например, Т1, Т2 и Т3) в селезенке описанной в настоящем документе генетически модифицированной мыши характеризуются экспрессией IgM, CD23, CD93, В220 и/или их комбинации.
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т1 В-клеток в селезенке (например, CD93+, В220+, IgMhi, CD23-) в диапазоне от приблизительно 2×106 до приблизительно 7×106 клеток, включая в себя, например, приблизительно 2,0×106, 2,5×106, 3,0×106, 3,5×106, 4,0×106, 4,5×106, 5,0×106, 5,5×106, 6,0×106, 6,5×106 или 7,0×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т1 В-клеток в селезенке, составляющую приблизительно 2,16×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т1 В-клеток в селезенке, составляющую приблизительно 3,63×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т1 В-клеток в селезенке, составляющую приблизительно 3,91×106; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т1 В-клеток в селезенке, составляющую приблизительно 6,83×106 клеток.
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т2 В-клеток в селезенке (например, CD93+, В220+, IgMhi, CD23+) в диапазоне от приблизительно 1×106 до 7×106 клеток, включая в себя, например, приблизительно 1,0×106, 1,5×106, 2,0×106, 2,5×106, 3,0×106, 3,5×106, 4,0×106, 4,5×106, 5,0×106, 5,5×106, 6,0×106, 6,5×106 или 7,0×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т2 В-клеток в селезенке, составляющую приблизительно 1,30×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т2 В-клеток в селезенке, составляющую приблизительно 2,46×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т2 В-клеток в селезенке, составляющую приблизительно 3,24×106; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т2 В-клеток в селезенке, составляющую приблизительно 6,52×106 клеток.
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т3 В-клеток в селезенке (например, CD93+, В220+, IgMlo, CD23+) в диапазоне от приблизительно 1×106 до 4×106 клеток, включая в себя, например, приблизительно 1,0×106, 1,5×106, 2,0×106, 2,5×106, 3,0×106, 3,5×106 или 4,0×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т3 В-клеток в селезенке, составляющую приблизительно 1,08×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т3 В-клеток в селезенке, составляющую приблизительно 1,35×106 клеток; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т3 В-клеток в селезенке, составляющую приблизительно 3,37×106; согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию Т3 В-клеток в селезенке, составляющую приблизительно 3,63×106 клеток.
Согласно некоторым вариантам осуществления предусмотрена генетически модифицированная мышь, причем мышь содержит локус легкой цепи κ иммуноглобулина, который содержит два нереаранжированных генных сегмента Vκ иммуноглобулина человека и 1, 2, 3, 4 или 5 нереаранжированных генных сегмента Jκ иммуноглобулина человека, и причем мышь содержит периферическую популяцию В-клеток селезенки, содержащую популяции В-клеток маргинальной зоны и предшественников маргинальной зоны, которые приблизительно такие же, как у мыши, которая содержит комплемент дикого типа генных сегментов Vκ и Jκ иммуноглобулина. Иллюстративные популяции В-клеток маргинальной зоны в селезенке описанной в настоящем документе генетически модифицированной мыши характеризуются экспрессией IgM, CD21/35, CD23, CD93, В220 и/или их комбинации.
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит популяцию В-клеток маргинальной зоны в селезенке (например, CD93-, В220+, IgMhi, CD21/35hi, CD23-) в диапазоне от приблизительно 1×106 до приблизительно 3×106 клеток, включительно, например, приблизительно 1,0×106, 1,5×106, 2,0×106, 2,5×106 или 3,0×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию В-клеток маргинальной зоны в селезенке, составляющую приблизительно 1,47×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию В-клеток маргинальной зоны в селезенке, составляющую приблизительно 1,49×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию В-клеток маргинальной зоны в селезенке, составляющую приблизительно 2,26×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат популяцию В-клеток маргинальной зоны в селезенке, составляющую приблизительно 2,33×106 клеток.
Согласно некоторым вариантам осуществления предусмотрена генетически модифицированная мышь, причем мышь содержит локус легкой цепи κ иммуноглобулина, который содержит два нереаранжированных генных сегмента Vκ иммуноглобулина человека и 1, 2, 3, 4 или 5 нереаранжированных генных сегментов Jκ иммуноглобулина человека, и причем мышь содержит периферическую популяцию В-клеток селезенки, содержащую фолликулярную (например, FO-I и FO-II) популяцию(и) В-клеток, которые приблизительно такие же, как у мыши, которая содержит комплемент дикого типа генных сегментов Vκ и Jκ иммуноглобулина. Иллюстративные фолликулярные популяции В-клеток (например, FO-I и FO-II) в селезенке описанной в настоящем документе генетически модифицированной мыши характеризуются экспрессией IgM, IgD, CD21/35, CD93, В220 и/или их комбинации.
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит фолликулярную популяцию типа 1 В-клеток в селезенке (например, CD93-, В220+, CD21/35int, IgMlo, IgDhi) в диапазоне от приблизительно 3×106до приблизительно 1,5×107 клеток включительно, например, приблизительно 3,0×106, 3,5×106, 4,0×106, 4,5×106, 5,0×106, 5,5×106, 6,0×106, 6,5×106, 7,0×106, 7,5×106, 8,0×106, 8,5×106, 9,0×106, 9,5×106, 1,0×107 или 1,5×107 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат фолликулярную популяцию типа 1 В-клеток в селезенке, составляющую приблизительно 3,57×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат фолликулярную популяцию типа 1 В-клеток в селезенке, составляющую приблизительно 6,31×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат фолликулярную популяцию типа 1 В-клеток в селезенке, составляющую приблизительно 9,42×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат фолликулярную популяцию типа 1 В-клеток в селезенке, составляющую приблизительно 1,14×107 клеток.
Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению содержит фолликулярную популяцию типа 2 В-клеток в селезенке (например, CD93-, В220+, CD21/35int, IgMint, IgDhi) в диапазоне от приблизительно 1×106 до приблизительно 2×106 клеток включительно, например, 1,0×106, 1,25×106, 1,5×106, 1,75×106 или 2,0×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат фолликулярную популяцию типа 2 В-клеток в селезенке, составляющую приблизительно 1,14×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат фолликулярную популяцию типа 2 В-клеток в селезенке, составляющую приблизительно 1,45×106 клеток; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат фолликулярную популяцию типа 2 В-клеток в селезенке, составляющую приблизительно 1,80×106; согласно некоторым вариантам осуществления мыши согласно настоящему изобретению содержат фолликулярную популяцию типа 2 В-клеток в селезенке, составляющую приблизительно 2,06×106 клеток.
Согласно одному аспекту предусмотрена генетически модифицированная мышь, причем мышь экспрессирует единственную реаранжированную легкую цепь κ, полученную из генного сегмента Vκ и Jκ человека, причем мышь экспрессирует популяцию В-клеток, которая содержит единственную легкую цепь κ, полученную из последовательности единственной реаранжированной легкой цепи κ, причем генетически модифицированная мышь не приводила к устойчивости к соматическим гипермутациям. Согласно одному варианту осуществления по меньшей мере 90% легких цепей κ, экспрессированных на В-клетке мыши, проявляют по меньшей мере от одной до пяти соматических гипермутаций.
Согласно одному аспекту предусмотрена генетически модифицированная мышь, которую модифицируют, чтобы экспрессировать единственную легкую цепь κ, полученную из не более чем одной или не более чем двух последовательностей реаранжированной легкой цепи κ, причем мышь демонстрирует использование легкой цепи κ, которое приблизительно в два раза или более, по меньшей мере приблизительно в три раза или более или по меньшей мере приблизительно в четыре раза или более выше, чем использование легкой цепи κ, проявляемое мышью дикого типа, или выше, чем использование легкой цепи κ, проявляемое мышью той же линии, которая содержит репертуар генных сегментов легкой цепи к дикого типа. Согласно конкретному варианту осуществления мышь экспрессирует единственную легкую цепь к из не более чем одной реаранжированной последовательности легкой цепи к. Согласно более конкретному варианту осуществления реаранжированную последовательность легкой цепи к выбирают из последовательности Vκ1-39Jκ5 и Vκ3-20Jκ1. Согласно одному варианту осуществления реаранжированная последовательность легкой цепи к представляет собой последовательность Vκ1-39Jκ5. Согласно одному варианту осуществления реаранжированная последовательность легкой цепи к представляет собой последовательность Vκ3-20Jκ1.
Согласно одному аспекту предусмотрена генетически модифицированная мышь, которая экспрессирует единственную легкую цепь κ, полученную из не более чем одной или не более чем двух реаранжированных последовательности легкой цепи κ, причем мышь проявляет использование легкой цепи κ, которое приблизительно в 100 раз или более, по меньшей мере приблизительно в 200 раз или более, по меньшей мере приблизительно в 300 раз или более, по меньшей мере приблизительно в 400 раз или более, по меньшей мере приблизительно в 500 раз или более, по меньшей мере приблизительно в 600 раз или более, по меньшей мере приблизительно в 700 раз или более, по меньшей мере приблизительно в 800 раз или более, по меньшей мере приблизительно в 900 раз или более, по меньшей мере приблизительно в 1000 раз или более превышает использование такой же легкой цепи κ, проявляемое мышью, несущей полный или по существу полный локус легкой цепи κ человека. Согласно конкретному варианту осуществления мышь, несущая полный или по существу полный локус легкой цепи κ человека не содержит функциональную нереаранжированную последовательность легкой цепи κ мыши. Согласно конкретному варианту осуществления мышь экспрессирует единственную легкую цепь κ не более чем из одной реаранжированной последовательности легкой цепи κ. Согласно одному варианту осуществления мышь содержит одну копию реаранжированной последовательности легкой цепи κ (например, гетерозиготу). Согласно одному варианту осуществления мышь содержит две копии реаранжированной последовательности легкой цепи κ (например, гомозиготу). Согласно более конкретному варианту осуществления реаранжированную последовательность легкой цепи κ выбирают из последовательности Vκ1-39Jκ5 и Vκ3-20Jκ1. Согласно одному варианту осуществления реаранжированная последовательность легкой цепи κ представляет собой последовательность Vκ1-39Jκ5. Согласно одному варианту осуществления реаранжированная последовательность легкой цепи κ представляет собой последовательность Vκ3-20Jκ1.
Согласно одному аспекту предусмотрена генетически модифицированная мышь, которая экспрессирует единственную легкую цепь, полученную не более чем из одной или не более чем из двух реаранжированных последовательностей легкой цепи, причем легкая цепь в генетически модифицированной мыши демонстрирует уровень экспрессии, который по меньшей мере от 10 раз до приблизительно 1000 раз, от 100 раз до приблизительно 1000 раз, от 200 раз до приблизительно 1000 раз, от 300 раз до приблизительно 1000 раз, от 400 раз до приблизительно 1000 раз, от 500 раз до приблизительно 1000 раз, от 600 раз до приблизительно 1000 раз, от 700 раз до приблизительно 1000 раз, от 800 раз до приблизительно 1000 раз или от 900 раз до приблизительно 1000 раз выше, чем экспрессия той же реаранжированной легкой цепи, проявляемой мышью, несущей полный или по существу полный локус легкой цепи. Согласно одному варианту осуществления легкая цепь содержит последовательность человека. Согласно конкретному варианту осуществления последовательность человека представляет собой последовательность κ. Согласно одному варианту осуществления последовательность человека представляет собой последовательность λ. Согласно одному варианту осуществления легкая цепь представляет собой полностью человеческую легкую цепь.
Согласно одному варианту осуществления уровень экспрессии характеризуется количественным определением мРНК транскрибированной последовательности легкой цепи и сравнением ее с транскрибируемой последовательностью легкой цепи мыши, несущей полный или практически полный локус легкой цепи.
Согласно одному аспекту предусмотрена генетически модифицированная мышь, которая экспрессирует единственную легкую цепь κ, полученную из не более чем одной или не более чем двух реаранжированных последовательностей легкой цепи κ, причем мышь при иммунизации антигеном проявляет сывороточный титр, который сравним с мышью дикого типа, иммунизированной тем же антигеном. Согласно конкретному варианту осуществления мышь экспрессирует единственную легкую цепь κ не более чем из одной реаранжированной последовательности легкой цепи κ. Согласно одному варианту осуществления сывороточный титр характеризуется как общий иммуноглобулин. Согласно конкретному варианту осуществления сывороточный титр характеризуется как специфический титр IgM. Согласно конкретному варианту осуществления сывороточный титр характеризуется как специфический титр IgG. Согласно более конкретному варианту осуществления реаранжированную последовательность легкой цепи к выбирают из последовательности Vκ1-39Jκ5 и Vκ3-20Jκ1. Согласно одному варианту осуществления реаранжированная последовательность легкой цепи κ представляет собой последовательность Vκ1-39Jκ5. Согласно одному варианту осуществления реаранжированная последовательность легкой цепи κ представляет собой последовательность Vκ3-20Jκ1.
Согласно одному аспекту предусмотрена генетически модифицированная мышь, которая экспрессирует популяцию антигенспецифических антител, причем все легкие цепи иммуноглобулина популяции антигенспецифических антител содержат вариабельную область легкой цепи (VL) человека, полученную из того же единственного генного сегмента VL человека, и тяжелые цепи иммуноглобулина содержат вариабельную область тяжелой цепи (VH) человека, полученную от одного из множества генных сегментов VH человека.
Согласно различным вариантам осуществления генные сегменты VH человека выбирают из VH1-2, VH1-3, VH1-8, VH1-18, VH1-24, VH1-46, VH1-58, VH1-69, VH2-5, VH2-26, VH2-70, VH3-7, VH3-9, VH3-11, VH3-13, VH3-15, VH3-20, VH3-21, VH3-23, VH3-30, VH3-33, VH3-43, VH3-48, VH3-53, VH3-64, VH3-72, VH3-73, VH4-31, VH4-34, VH4-39, VH4-59, VH5-51 и VH6-1.
Согласно различным вариантам осуществления такой же единственный генный сегмент VL человека выбирают из генного сегмента Vκ1-39 человека и генного сегмента Vκ3-20 человека. Согласно различным вариантам осуществления все легкие цепи иммуноглобулинов содержат генный сегмент легкой цепи J (JL) человека, выбираемый из генного сегмента Jκ и Jλ. Согласно конкретному варианту осуществления генный сегмент JL человека выбирают из генного сегмента Jκ1 и Jκ5 человека. Согласно различным вариантам осуществления мышь не содержит последовательность, выбранную из генного сегмента VL иммуноглобулина мыши, генного сегмента JL иммуноглобулина мыши и их комбинации. Согласно различным вариантам осуществления область VL человека функционально связана с константной областью легкой цепи (CL) иммуноглобулина человека, мыши или крысы. Согласно конкретному варианту осуществления область VL человека функционально связана с областью Сκ мыши. Согласно конкретному варианту осуществления область VL человека функционально связана с областью Сκ крысы.
Согласно различным вариантам осуществления область VL человека экспрессируется из эндогенного локуса легкой цепи иммуноглобулина. Согласно различным вариантам осуществления область VH человека функционально связана с константной областью тяжелой цепи (CH) иммуноглобулина человека, мыши или крысы. Согласно различным вариантам осуществления область (CH) содержит последовательность человека, выбранную из CH1, шарнирной области, CH2, CH3, CH4 и/или их комбинации. Согласно различным вариантам осуществления область VH человека экспрессируется из эндогенного локуса тяжелой цепи иммуноглобулина.
Согласно одному аспекту предусмотрена генетически модифицированная мышь, которая экспрессирует множество тяжелых цепей иммуноглобулина, связанных с единственной легкой цепью. Согласно одному варианту осуществления тяжелая цепь содержит последовательность человека. Согласно различным вариантам осуществления последовательность человека выбирают из вариабельной последовательности, CH1, шарнира, CH2, CH3 и их комбинации. Согласно одному варианту осуществления единственная легкая цепь содержит последовательность человека. Согласно различным вариантам осуществления последовательность человека выбирают из вариабельной последовательности, константной последовательности и их комбинации. Согласно одному варианту осуществления мышь содержит непригодный эндогенный локус иммуноглобулина и экспрессирует тяжелую цепь и/или легкую цепь из трансгена или внехромосомального эписома. Согласно одному варианту осуществления мышь содержит замещение в эндогенном локусе мыши некоторых или всех эндогенных генных сегментов тяжелой цепи мыши (т.е. V, D, J) и/или некоторых или всех эндогенных константных последовательностей тяжелой цепи мыши (например, CH1, шарнир, CH2, CH3, или их сочетание), и/или некоторых или всех эндогенных последовательностей легкой цепи мыши (например, V, J, константной или их комбинации) одной или несколькими последовательностями иммуноглобулина человека.
Согласно одному аспекту предусмотрена мышь, подходящая для создания антител, которые содержат ту же легкую цепь, причем все или по существу все антитела, произведенные в мыши, экспрессируются с той же легкой цепью. Согласно одному варианту осуществления легкая цепь экспрессируется из эндогенного локуса легкой цепи.
Согласно одному аспекту предусмотрен способ создания легкой цепи для антитела человека, предусматривающий получение от описанной в настоящем документе мыши последовательности легкой цепи и последовательности тяжелой цепи, и использование последовательности легкой цепи и последовательности тяжелой цепи в создании антитела человека. Согласно одному варианту осуществления антитело человека представляет собой биспецифическое антитело.
Согласно одному аспекту предусмотрен способ идентификации вариабельного домена тяжелой цепи человека, который способен к связыванию представляющего интерес антигена с описанной в настоящем документе сконструированной легкой цепью, причем способ предусматривает предоставление вариабельного домена тяжелой цепи, полученного из первого антитела, которое способно связываться с антигеном, восстановление вариабельного домена тяжелой цепи с последовательностью легкой цепи зародышевой линии и трансфекцию клетки таким образом, что каждая экспрессируется с образованием второго антитела, подвергание второго антитела воздействию антигена и измерение связывания второго антитела с антигеном.
Согласно одному варианту осуществления легкая цепь первого антитела содержит последовательность Vκ1-39 человека. Согласно одному варианту осуществления легкая цепь первого антитела содержит последовательность Vκ3-20 человека. Согласно одному варианту осуществления последовательность легкой цепи зародышевой линии содержит последовательность Vκ1-39 или Vκ3-20 человека. Согласно различным вариантам осуществления связывание второго антитела с антигеном определяется путем сравнения связывание первого антитела с антигеном.
Любой из описанных в настоящем документе вариантов осуществления и аспектов может быть использован в сочетании друг с другом, если не указано иное или не очевидно из контекста. Другие варианты осуществления будут очевидны специалистам в настоящей области техники при рассмотрении нижеследующего описания.
Краткое описание графических материалов
На фиг. 1 показана стратегия направленного воздействия для замещения эндогенных генных сегментов вариабельной области легкой цепи иммуноглобулина мыши областью гена Vκ1-39Jκ5 человека.
На фиг. 2 показана стратегия направленного воздействия для замещения эндогенных генных сегментов вариабельной области легкой цепи иммуноглобулина мыши областью гена Vκ3-20Jκ1 человека.
На фиг. 3 показана стратегия направленного воздействия для замещения эндогенных генных сегментов вариабельной области легкой цепи иммуноглобулина мыши областью гена VpreB/Jλ5 человека.
На фиг. 4 показан процент CD19+ В-клеток (ось у) из периферической крови для мышей дикого типа (WT), мышей, гомозиготных по сконструированной реаранжированной области легкой цепи Vκ1-39Jκ5 человека (Vκ1-39Jκ5 НО), и мышей, гомозиготных по сконструированной реаранжированной области легкой цепи Vκ3-20Jκ1 человека (Vκ3-20Jκ1 НО).
На фиг. 5А показана относительная экспрессия мРНК (ось у) полученной из Vκ1-39 легкой цепи в анализе количественной ПЦР с использованием зондов, специфических для сращивания сконструированной реаранжированной области легкой цепи Vκ1-39Jκ5 человека (зонд сращивания Vκ1-39Jκ5) и генного сегмента Vκ1-39 человека (зонд Vκ1-39) в мыши, гомозиготной по замещению эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека (Нκ), в мыши дикого типа (WT) и мыши, гетерозиготной по сконструированной реаранжированной области легкой цепи Vκ1-39Jκ5 человека (Vκ1-39Jκ5 НО). Сигналы нормируют к экспрессии Сκ мыши. N.D.: не обнаружено.
На фиг. 5В показана относительная экспрессия мРНК (ось у) полученной из Vκ1-39 легкой цепи в количественной ПЦР с использованием зондов, специфических для сращивания сконструированной реаранжированной области легкой цепи Vκ1-39Jκ5 человека (зонд сращивания Vκ1-39Jκ5) и генного сегмента Vκ1-39 человека (зонд Vκ1-39) в мыши, гомозиготной по замещению эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека (Нκ), в мыши дикого типа (WT) и мыши, гомозиготной по сконструированной реаранжированной области легкой цепи Vκ1-39Jκ5 человека (Vκ1-39Jκ5 НО). Сигналы нормируют к экспрессии Сκ мыши.
На фиг. 5С показана относительная экспрессия мРНК (ось у) полученной из Vκ3-20 легкой цепи в анализе количественной ПЦР с использованием зондов, специфических для сращивания сконструированной реаранжированной области легкой цепи Vκ3-20Jκ1 человека (зонд сращивания Vκ3-20Jκ1) и генного сегмента Vκ3-20 человека (зонд Vκ3-20) в мыши, гомозиготной по замещению эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека (Нκ), в мыши дикого типа (WT) и мыши, гетерозиготной (НЕТ) и гомозиготной (НО) по сконструированной реаранжированной области легкой цепи Vκ3-20Jκ1 человека. Сигналы нормируют к экспрессии Сκ мыши.
На фиг. 6А показан титр IgM (слева) и IgG (справа) у мышей дикого типа (WT, N=2) и мышей, гомозиготных по сконструированной реаранжированной области легкой цепи Vκ1-39Jκ5 человека (Vκ1-39Jκ5 НО; N=2), иммунизированных β-галактозидазой.
На фиг. 6В показан титр общего иммуноглобулина (IgM, IgG, IgA) у мышей дикого типа (WT, N=5) и мышей, гомозиготных по сконструированной реаранжированной области легкой цепи Vκ3-20Jκ1 человека (Vκ3-20Jκ1 НО; N=5), иммунизированных β-галактозидазой.
На фиг. 7А показана схема моноспецифических антител (исходное-1 и исходное-2) и биспецифического антитела (биспецифическое), полученного из вариабельных областей тяжелой цепи от каждого исходного моноспецифического антитела. Показана общая вариабельная область легкой цепи (затемненная) в биспецифическом антителе.
На фиг. 7В показана схема характеристик связывания двух исходных моноклональных антител (исходное-1 и исходное-2) для представляющего интерес антигена, а также характеристик связывания биспецифического антитела, полученного из образования пары вариабельных областей тяжелой цепи от каждого моноспецифического исходного антитело с общей легкой цепью. Показана способность биспецифического антитела связываться с двумя различными эпитопами представляющего интерес антигена либо отдельно (внизу слева), либо одновременно (внизу справа).
На фиг. 8 показана гистограмма связывания биспецифических антител в количестве 300 нМ (затемненные столбики) и моноспецифических антител (полосатые и серые столбики) с захваченной мономерной поверхностью антигена Ε в единицах ΒΙ ACORE™ (RU). Указаны моноклональное исходное-1 антитело (P1 Ab), моноклональное исходное-2 (Р2 Ab) и биспецифические антитела (BsAb).
На фиг. 9 показаны два генетически модифицированных эндогенных локуса легкой цепи иммуноглобулина (например, легкой цепи κ). Локус наверху (DLC-5J) содержит сконструированный фрагмент ДНК человека (линия с полосами), содержащий два генных сегмента Vκ человека и пять генных сегментов Jκ человека. Локус внизу (DLC-1J) содержит сконструированный фрагмент ДНК человека (линия с полосами), содержащий два генных сегмента Vκ человека и один генный сегмент Jκ человека. Каждый локус способен к реаранжировке для образования области Vκ человека, функционально связанной с эндогенной константной областью легкой цепи (например, Сκ). Показаны иммуноглобулиновые промотеры (стрелка над локусом), лидерные экзоны (закрашенные стрелки) и два генных сегмента Vκ человека (незакрашенные стрелки), все фланкированные выше против хода транскрипции (5') с помощью неомициновой кассеты, содержащей сайты рекомбинации FRT. Сигнальные последовательности рекомбинации, сконструированные с каждым из генных сегментов человека (Vκ и Jκ), обозначены открытыми овалами, расположенными рядом с каждым сегментом гена.
На фиг. 10А, в верхней части панели, показаны репрезентативные контурные графики костного мозга, окрашенного на В- и Т-клетки (CD19+ и CD3+, соответственно) от мыши дикого типа (WT) и мыши, гомозиготной по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J). В нижней части панели показаны репрезентативные контурные графики костного мозга, гейтированного по CD19+ и окрашенного на ckit+ и CD43+, от мыши дикого типа (WT) и мыши, гомозиготной по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J). Про- и пре-В-клетки отмечены на контурных графиках нижней части панели.
На фиг. 10В показано количество про- (CD19+CD43+ckit+) и пре- (CD19+CD43-ckit-) В-клеток в костном мозге, полученном из бедренных костей мышей дикого типа (WT) и мышей, гомозиготных по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J).
На фиг. 11А показаны репрезентативные контурные графики костного мозга, гейтированного по синглетам, окрашенным на иммуноглобулин M (IgM) и В220 от мыши дикого типа (WT) и мыши, гомозиготной по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J). Незрелые, зрелые и про/пре-В-клетки отмечены на каждом контурном графике.
На фиг. 11В показано общее число В-клеток (CD19+), незрелых В-клеток (B220intIgM+) и зрелых В-клеток (B220hiIgM+) в костном мозге, выделенном из бедренных костей мышей дикого типа (WT) и мышей, гомозиготных по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J).
На фиг. 12А показаны репрезентативные контурные графики костного мозга, гейтированного по синглетам, окрашенным на иммуноглобулин M (IgM) и В220 от мыши дикого типа (WT) и мыши, гомозиготной по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J). Незрелые, зрелые и про/пре-В-клетки отмечены на каждом контурном графике.
На фиг. 12В показаны репрезентативные контурные графики костного мозга, гейтированного по незрелым (B220intIgM+) и зрелым (B220hiIgM+) В-клеткам, окрашенным на экспрессию Igλ и Igκ, выделенным из бедренных костей мыши дикого типа (WT) и мыши, гомозиготной по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J).
На фиг. 13А в верхней части панели показаны репрезентативные контурные графики спленоцитов, гейтированных по синглетам и окрашенных на В- и Т-клетки (CD19+ и CD3+, соответственно) от мыши дикого типа (WT) и мыши, гомозиготной по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J). На нижней части панели показаны репрезентативные контурные графики спленоцитов, гейтированных по CD19+ и окрашенных на иммуноглобулин D (IgD) и иммуноглобулин M (IgM) от мыши дикого типа (WT) и мыши, гомозиготной по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J). Зрелые (54 для WT, 56,9 для DLC-5J) и переходные (23,6 для WT, 25,6 для DLC-5J) В-клетки отмечены на каждом из контурных графиков.
На фиг. 13В показано общее количество CD19+ В-клеток, переходных В-клеток (CD19+IgMhiIgDlo) и зрелых В-клеток (CD19IgMloIgDhi) в собранных селезенках от мышей дикого типа (WT) и мышей, гомозиготных по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J).
На фиг. 14А показаны репрезентативные контурные графики Igλ+ и Igκ+ спленоцитов, гейтированных по CD19+ от мыши дикого типа (WT) и мыши, гомозиготной по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J).
На фиг. 14В показано общее количество В-клеток (CD19+), Igκ+ В-клеток (CD19+Igκ+) и Igλ+ В-клеток (CD19+Igλ+) в собранных селезенках мышей дикого типа (WT) и мышей, гомозиготных по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J).
На фиг. 15А показано развитие периферических В-клеток у мышей, гомозиготных по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека. На первом (крайнем слева) контурном графике показаны CD93+ и В220+ спленоциты, гейтированные по CD19+, указывая на незрелые (39,6) и зрелые (57,8) В-клетки. На втором (верхнем среднем) контурном графике показана экспрессия IgM+ и CD23+ в незрелых В-клетках, указывая на популяции Т1 (33,7; IgD-IgM+CD21loCD23-), Т2 (21,2; IgDhiIgMhiCD21midCD23+) и Т3 (29,1) В-клеток. На третьем (нижнем среднем) контурном графике показана экспрессия CD21+(CD35+) и IgM+ зрелых В-клеток, указывая на небольшую популяцию (14,8), которая приводит к образованию В-клеток маргинальной зоны, и вторую популяцию (70,5), которая приводит к образованию фолликулярных (FO) В-клеток. На четвертом (верхнем справа) контурном графике показана экспрессия В220+ и CD23+ в зрелых В-клетках, указывая на В-клеточные популяции маргинальной зоны (90,5; MZ) и предшественников маргинальной зоны (7,3; IgMhiIgDhiCD21hiCD23+). На пятом (нижнем справа) контурном графике показана экспрессия IgD+ и IgM+ в зрелых В-клетках, указывая на В-клеточные популяции FO-I (79,0; IgDhiIgMloCD21midCD23+) и FO-II (15,1; IgDhiIgMhiCD21midCD23+). Показан процент клеток в каждой гейтированной области.
На фиг. 15В показано развитие периферических В-клеток у мышей дикого типа. На первом (крайнем слева) контурном графике показаны CD93+ и В220+ спленоциты, гейтированные по CD19+, указывая на незрелые (31,1) и зрелые (64,4) В-клетки. На втором (верхнем среднем) контурном графике показана экспрессия IgM+ и CD23+ в незрелых В-клетках, указывая на популяции Т1 (28,5; IgD-IgM+CD21loCD23-), Т2 (28,7; IgDhiIgMhiCD21midCD23+) и Т3 (30,7) В-клеток. На третьем (нижнем среднем) контурном графике показана экспрессия CD21+ (CD35+) и IgM+ зрелых В-клеток, указывая на небольшую популяцию (7,69), которая приводит к образованию В-клеток маргинальной зоны, и вторую популяцию (78,5), которая приводит к образованию фолликулярных (FO) В-клеток. На четвертом (верхнем справа) контурном графике показана экспрессия В220+ и CD23+ в зрелых В-клетках, указывая на В-клеточные популяции маргинальной зоны (79,9; MZ) и предшественников маргинальной зоны (19,4; IgMhiIgDhiCD21midCD23+). На пятом (нижнем справа) контурном графике показана экспрессия IgD+ и IgM+ в зрелых В-клетках, указывая на В-клеточные популяции FO-I (83,6; IgDhiIgMloCD21midCD23+) и FO-II (13,1; IgDhiIgMhiCD21midCD23+). Показан процент клеток в каждой гейтированной области.
На фиг. 16 показано общее количество переходных, маргинальной зоны и фолликулярных В-клеточных популяций в собранных селезенках мышей дикого типа (WT) и мышей, гомозиготных по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека.
На фиг. 17 показана относительная экспрессия мРНК в костном мозге (ось у) полученных из Vκ3-20 и полученных из Vκ1-39 легких цепей в анализе количественной ПЦР с использованием зондов, специфических для генных сегментов Vκ3-20 или Vκ1-39 у мышей, гомозиготных по замещению эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека (Нκ), у мышей дикого типа (WT), мышей, гомозиготных по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J), и мышей, гомозиготных по двум генным сегментам Vκ человека и одному генному сегменту Jκ человека (DLC-1J). Сигналы нормированы к экспрессии Сκ мыши. ND: не обнаружено.
На фиг. 18 показана относительная экспрессия мРНК в целых селезенках (ось у) полученных из Vκ3-20 и полученных из Vκ1-39 легких цепей в анализе количественной ПЦР с использованием зондов, специфических для генных сегментов Vκ3-20 или Vκ1-39 у мышей, гомозиготных по замещению эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека (Нκ), у мышей дикого типа (WT), мышей, гомозиготных по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (DLC-5J), и мышей, гомозиготных по двум генным сегментам Vκ человека и одному генному сегменту Jκ человека (DLC-1J). Сигналы нормированы к экспрессии Сκ мыши. ND: не обнаружено.
На фиг. 19 показана общая иллюстрация рекомбинации генного сегмента V и J аллеля легкой цепи κ иммуноглобулина в мыши и структура локуса легкой цепи до реаранжировки (вверху) и после реаранжировки (внизу). Такая реаранжировка, как показана, представляет собой только одну из нескольких возможных событий реаранжировки.
Подробное описание настоящего изобретения
Настоящее изобретение не ограничивается конкретными способами и описанными экспериментальными условиями, поскольку такие способы и условия могут варьироваться. Кроме того, следует понимать, что используемая в настоящем документе терминология предназначена только для цели описания конкретных вариантов осуществления и не предусмотрена для ограничения, поскольку объем настоящего изобретения определяется формулой изобретения.
Если не указано иное, все используемые в настоящем документе термины и фразы включают в себя те значения, которыми термины и фразы характеризуются в настоящей области техники, если иное прямо не указано или явно не следует из контекста, в котором используется термин или фраза. Хотя любые способы и материалы, подобные или эквивалентные описанным в настоящем документе, могут быть использованы на практике или при тестировании настоящего изобретения, в настоящем документе описаны конкретные способы и материалы. Все упомянутые публикации полностью включены в настоящий документ посредством ссылки.
Используемый в настоящем документе термин "антитело" включает в себя молекулы иммуноглобулина, содержащие четыре полипептидных цепи, две тяжелые (Н) цепи и две легкие (L) цепи, связанные дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область (VH) тяжелой цепи и константную область (CH) тяжелой цепи. Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (VL) и константную область легкой цепи (CL). Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), чередующиеся с областями, которые представляют собой более консервативные, называемые каркасными областями (FR). Каждая VH и VL содержит три CDR и четыре FR, расположенные от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (CDR тяжелой цепи могут сокращаться до HCDR1, HCDR2 и HCDR3; CDR легкой цепи могут сокращаться до LCDR1, LCDR2 и LCDR3). Термин «антитело с высокой аффинностью» относится к антителу, которое характеризуется KD по отношению к его эпитопу-мишени, составляющей приблизительно 10-9 M или ниже (например, приблизительно 1×10-9 Μ, 1×10-10 M, 1×10-11 Μ или приблизительно 1×10-12 M). Согласно одному варианту осуществления KD измеряют с помощью поверхностного плазмонного резонанса, например, BIACORE™; согласно другому варианту осуществления КD измеряют с помощью ELISA.
Фраза "биспецифическое антитело" относится к антителу, способному к селективному связыванию двух или более эпитопов. Биспецифические антитела включают в себя фрагменты двух различных моноклональных антител (фиг. 7А) и, как правило, содержат две неидентичные тяжелые цепи, полученные из двух различных моноклональных антител, причем каждая тяжелая цепь специфически связывается с различным эпитопом - или на двух различных молекулах (например, различные эпитопы на двух различных иммуногенах, смотрите фиг. 7В, внизу слева), или на одной молекуле (например, различные эпитопы на одном иммуногене; смотрите фиг. 7В, внизу слева), или на той же молекуле (например, различные эпитопы на одном и том же иммуногене; смотрите фиг. 7В, внизу справа). Если биспецифическое антитело способно к селективному связыванию двух различных эпитопов (первого эпитопа и второго эпитопа), то аффинность первой тяжелой цепи к первому эпитопу будет, как правило, по меньшей мере на один-два или три, или четыре, или более порядков величин ниже, чем аффинность первой тяжелой цепи ко второму эпитопу, и наоборот. Эпитопы, специфически связанные с биспецифическим антителом, могут присутствовать на одинаковой или отличающейся мишени (например, на одинаковом или отличающемся белке, смотрите фиг. 7В). Иллюстративные биспецифические антитела включают в себя антитела с первой тяжелой цепью, специфической к опухолевому антигену, и второй тяжелой цепью, специфического к цитотоксическому маркеру, например, Fc-рецептору (например, FcγRI, FcγRII, FcγRIII и т.п.) или Т-клеточному маркеру (например, CD3, CD28 и т.п.). Кроме того, вторая вариабельная область тяжелой цепи может быть замещена вариабельной областью тяжелой цепи, характеризующейся отличной желаемой специфичностью. Например, биспецифические антитела с первой тяжелой цепью, специфической к опухолевому антигену, и второй тяжелой цепью, специфической к токсину, могут быть спарены для того, чтобы доставить токсин (например, сапорин, алкалоид барвинка и т.п.) к опухолевой клетке. Другие иллюстративные биспецифические антитела включают в себя антитела с первой тяжелой цепью, специфической к активирующему рецептору (например, В-клеточному рецептору, FcγRI, FcγRIIA, FcγRIIIA, FcγRI, Т-клеточному рецептору и т.п.), и второй тяжелой цепью, специфической к ингибирующему рецептору (например, FcγRIIB, CD5, CD22, CD72, CD300a и т.п.). Такие биспецифические антитела могут быть сконструированы для терапевтических состояний, связанных с клеточной активацией (например, аллергия и астма). Биспецифические антитела могут быть получены, например, путем комбинации тяжелых цепей, которые распознают различные эпитопы одного и того же или отличного иммуногена (фиг. 7В). Например, последовательности нуклеиновых кислот, кодирующие вариабельные последовательности тяжелой цепи, которые распознают различные эпитопы одного и того же или отличного иммуногена, могут быть слиты с последовательностями нуклеиновых кислот, кодирующими одинаковые или различные константные области тяжелой цепи, и такие последовательности могут быть экспрессированы в клетке, которая экспрессирует легкую цепь иммуноглобулина. Типичное биспецифическое антитело содержит две тяжелые цепи, каждая из которых содержит три CDR тяжелой цепи, с последующими (с N-конца до С-конца) доменом CH1, шарниром, доменом CH2 и доменом CH3, и легкую цепь иммуноглобулина, которая либо не обеспечивает специфичности связывания с эпитопом, но которая может соединяться с каждой тяжелой цепью, либо может соединяться с каждой тяжелой цепью и которая может связываться с одним или несколькими эпитопами, связанными связывающими эпитоп областями тяжелой цепи, или которая может соединяться с каждой тяжелой цепью и обеспечивает связывание или одной или обеих тяжелых цепей с одним или обоими эпитопами.
Термин "клетка" включает в себя любую клетку, которая подходит для экспрессии рекомбинантной последовательности нуклеиновой кислоты. Клетки включают в себя клетки прокариот и эукариот (одноклеточных или многоклеточных), бактериальные клетки (например, штаммы Е. coli, Bacillus spp., Streptomyces spp.и т.д.), клетки микобактерий, клетки грибов, дрожжевые клетки (например, S. cerevisiae, S. pombe, P. pastoris, P. methanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, инфицированные бакуловирусом клетки насекомых, Trichoplusia ni и т.д.), клетки отличных от человека животных, клетки человека или такие слияния клеток, как, например, гибридомы или квадромы. Согласно некоторым вариантам осуществления клетка представляет собой клетку человека, мартышки, человекообразной обезьяны, хомяка, крысы или мыши. Согласно некоторым вариантам осуществления клетка представляет собой эукариотическую и ее выбирают из следующих клеток: СНО (например, СНО K1, DXB-11 СНО, Veggie-CHO), COS (например, COS-7), ретинальной клетки, Vero, CV1, почечной клетки (например, НЕК293, 293 EBNA, MSR 293, MDCK, НаК, ВНК), HeLa, HepG2, WI38, MRC 5, Colo205, НВ 8065, HL-60, (например, ВНК21), Jurkat, Daudi, А431 (эпидермальная), CV-1, U937, ЗТЗ, клетки L, клетки С127, SP2/0, NS-0, ММТ 060562, клетки Сертоли, клетки BRL 3А, клетки HT1080, клетки миеломы, опухолевой клетки и клеточной линии, происходящей из вышеупомянутой клетки. Согласно некоторым вариантам осуществления клетка содержит один или несколько вирусных генов, например, ретинальная клетка, которая экспрессирует вирусный ген (например, клетка PER.C6™).
Фраза "определяющая комплементарность область" или термин "CDR" предусматривает аминокислотную последовательность, кодируемую последовательностью нуклеиновой кислоты генов иммуноглобулина организма, которая в норме (т.е. у животного дикого типа) находится между двумя каркасными областями в вариабельной области легкой или тяжелой цепи молекулы иммуноглобулина (например, антитела или Т-клеточного рецептора). CDR может кодироваться, например, зародышевой последовательностью или реаранжированной или нереаранжированной последовательностью, и, например, нативной или зрелой В-клеткой или Т-клеткой. CDR может быть соматически мутирована (например, отличаться от последовательности, кодируемой в зародышевой линии животного), гуманизирована и/или модифицирована с помощью аминокислотных замен, вставок или делеций. В некоторых обстоятельствах (например, для CDR3) CDR могут кодироваться двумя или более последовательностями (например, зародышевыми последовательностями), которые не представляют собой смежные (например, в нереаранжированной последовательности нуклеиновой кислоты), но представляют собой смежные в последовательности нуклеиновой кислоты В-клетки, например, в результате сплайсинга или соединения последовательностей (например, рекомбинации V-D-J для образования CDR3 тяжелой цепи).
Термин "консервативный" при использовании для описания консервативной аминокислотной замены предусматривает замену аминокислотного остатка другим аминокислотным остатком, содержащим R-группу боковой цепи со сходными химическими свойствами (например, заряд или гидрофобность). Как правило, консервативная аминокислотная замена не будет существенно изменять представляющие интерес функциональные свойства белка, например, способность вариабельной области специфически связываться с эпитопом-мишенью с необходимой аффинностью. Примеры групп аминокислот, которые содержат боковые цепи со сходными химическими свойствами включают в себя такие алифатические боковые цепи, как глицин, аланин, валин, лейцин и изолейцин; такие алифатическо-гидроксильные боковые цепи, как серии и треонин; такие содержащие амид боковые цепи, как аспарагин и глутамин; такие ароматические боковые цепи, как фенилаланин, тирозин и триптофан; такие основные боковые цепи, как лизин, аргинин и гистидин; такие кислотные боковые цепи, как аспарагиновая кислота и глутаминовая кислота; и такие серосодержащие боковые цепи, как цистеин и метионин. Группы консервативных замен аминокислот включают в себя, например, валин/лейцин/изолейцин, фенилаланин/тирозин, лизин/аргинин, аланин/валин, глутамат/аспартат и аспарагин/глутамин. Согласно некоторым вариантам осуществления консервативная аминокислотная замена может представлять собой замену любого нативного остатка в белке аланином, как используется, например, в сканирующем аланином мутагенезе. Согласно некоторым вариантам осуществления производится консервативная замена, которая характеризуется положительным значением в матрице логарифмического правдоподобия РАМ250, раскрытой в Gonnet et al. (1992) Exhaustive Matching of the Entire Protein Sequence Database, Science 256:1443-45, включенной в настоящий документ посредством ссылки. Согласно некоторым вариантам осуществления замена представляет собой умеренно консервативную замену, причем замена характеризуется неотрицательным значением в матрице логарифмического правдоподобия РАМ250.
Согласно некоторым вариантам осуществления положения остатков в легкой цепи или тяжелой цепи иммуноглобулина отличаются на одну или несколько консервативных аминокислотных замен. Согласно некоторым вариантам осуществления положения остатков в легкой цепи иммуноглобулина или ее функциональном фрагменте (например, фрагменте, который обеспечивает экспрессию и секрецию, например, из В-клетки) не идентичны легкой цепи, чья аминокислотная последовательность представлена в настоящем документе, но отличается на одну или несколько консервативных аминокислотных замен.
Фраза "связывающий эпитоп белок" предусматривает белок, характеризующийся по меньшей мере одной CDR и который способен к селективному распознаванию эпитопа, например, способен к связыванию эпитопа с KD, составляющей приблизительно один микромоль или ниже (например, KD, составляющей приблизительно 1×10-6 Μ, 1×10-7 M, 1×10-9 Μ, 1×10-9 Μ, 1×10-10 Μ, 1×10-11 Μ или приблизительно 1×10-12 Μ). Для терапевтических связывающих эпитоп белков (например, терапевтических антител) зачастую необходима KD, которая находится в наномолярном или пикомолярном диапазоне.
Фраза "функциональный фрагмент" предусматривает фрагменты связывающих эпитоп белков, которые могут экспрессироваться, секретироваться и специфически связываться с эпитопом с КD в микромолярном, наномолярном или пикомолярном диапазоне. Специфическое распознавание предусматривает наличие КD, которая находится по меньшей мере в микромолярном диапазоне, наномолярном диапазоне или пикомолярном диапазоне.
Термин "зародышевый" включает в себя ссылку на последовательность нуклеиновой кислоты иммуноглобулина в несоматически мутированной клетке, например, несоматически мутированной В-клетке или пре-В-клетке или гематопоэтической клетке.
Фраза "тяжелая цепь" или "тяжелая цепь иммуноглобулина" предусматривает последовательность константной области тяжелой цепи иммуноглобулина из любого организма. Вариабельные домены тяжелой цепи включают в себя три CDR и четыре FR области тяжелой цепи, если не указано иное. Фрагменты тяжелых цепей включают в себя CDR, CDR и FR и их комбинации. Типичная тяжелая цепь содержит после вариабельного домена (в направлении от N-конца к С-концу) домен CH1, шарнир, домен CH2 и домен CH3. Функциональный фрагмент тяжелой цепи включает в себя фрагмент, который способен к специфическому распознаванию эпитопа (например, распознаванию эпитопа с KD в микромолярном, наномолярном или пикомолярном диапазоне), который способен к экспрессии и секреции из клетки и который содержит по меньшей мере одну CDR.
Термин "идентичность" при использовании в отношении последовательности предусматривает идентичность, которая определяется с помощью ряда различных известных в настоящей области техники алгоритмов, которые могут использоваться для измерения идентичности нуклеотидных и/или аминокислотных последовательностей. Согласно некоторым вариантам осуществления описанные в настоящем документе идентичности определяют с использованием выравнивания CLustalW версии 1.83 (медленного), использующего штраф за открытие пропуска в последовательности, составляющий 10,0, штраф за удлинения пропуска, составляющий 0,1, и с использованием матрицы подобия Gonnet (MAC VECTOR™ 10.0.2, Mac Vector Inc., 2008). Длина последовательностей, сравниваемых относительно идентичности последовательностей, будет зависеть от конкретных последовательностей, но в случае константного домена легкой цепи длина должна содержать последовательность достаточной длины для укладки в константный домен легкой цепи, который способен к самосборке для образования канонического константного домена легкой цепи, например, способного к образованию двух складчатых бета-слоев, содержащих бета-тяжи и способного взаимодействовать по меньшей мере с одним доменом CH1 человека или мыши. В случае домена CH1 длина последовательности должна содержать последовательность достаточной длины для укладки в домен CH1, который способен к образованию двух складчатых бета-слоев, содержащих бета-тяжи и способен взаимодействовать по меньшей мере с одним константным доменом легкой цепи мыши или человека.
Фраза "молекула иммуноглобулина" включает в себя две тяжелые цепи иммуноглобулина и две легкие цепи иммуноглобулина. Тяжелые цепи могут быть идентичными или различными и легкие цепи могут быть идентичными или различными.
Фраза "легкая цепь" предусматривает последовательность легкой цепи иммуноглобулина из любого организма и если не указано иное, предусматривает легкие цепи κ и λ человека и VпpeB, а также суррогатные легкие цепи. Вариабельные домены легкой цепи (VL), как правило, включают в себя три CDR и четыре каркасные (FR) области легкой цепи, если не указано иное. Как правило, полноразмерная легкая цепь включает в себя от амино-конца к карбокси-концу домен VL, который включает в себя FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, и константный домен легкой цепи. Легкие цепи включают в себя такие, например, которые не связываются селективно или с. первым, или со вторым эпитопом, селективно связанными со связывающим эпитоп белком, в котором они появляются. Легкие цепи также включают в себя те, которые связываются и распознают или содействуют тяжелой цепи в связывании и распознавании одного или нескольких эпитопов, селективно связанных со связывающим эпитоп белком, в котором они появляются. Общие легкие цепи представляют собой цепи, полученные из реаранжированной последовательности Vκ1-39Jκ5 человека или реаранжированной последовательности Vκ3-20Jκ1 человека, и включают в себя соматически мутированные версии (например, с созревшей аффинностью).
Фраза "микромолярный диапазон" предназначена для обозначения 1-999 мкмоль; фраза "наномолярный диапазон" предназначена для обозначения 1-999 нмоль; фраза "пикомолярный диапазон" предназначена для обозначения 1-999 пмоль.
Фраза "соматически мутированный" предусматривает ссылку на последовательность нуклеиновой кислоты из В-клетки, которая подверглась переключению класса, причем последовательность нуклеиновой кислоты вариабельной области иммуноглобулина (например, вариабельного домена тяжелой цепи или включающей в себя последовательность CDR или FR тяжелой цепи) в подвергшейся переключению класса В-клетке не идентична последовательности нуклеиновой кислоты в В-клетке перед переключением класса, так что, например, существует различие в последовательности нуклеиновой кислоты CDR или каркасной области между В-клеткой, которая не подверглась переключению класса, и В-клеткой, которая подверглась переключению класса. "Соматически мутированный" предусматривает ссылку на последовательности нуклеиновых кислот из В-клеток с созревшей аффинностью, которые не идентичны соответствующим последовательностям вариабельной области иммуноглобулина в В-клетках с несозревшей аффинностью (т.е. последовательности в геноме гаметоцитов). Фраза "соматически мутированный" также предусматривает ссылку на последовательность нуклеиновой кислоты вариабельной области иммуноглобулина из В-клетки после воздействия на В-клетку представляющего интерес эпитопа, причем последовательность нуклеиновой кислоты отличается от соответствующей последовательности нуклеиновой кислоты перед воздействием на В-клетку представляющим интерес эпитопом. Фраза "соматически мутированный" относится к последовательностям из антител, которые были образованы у животного, например, мыши, содержащей последовательности нуклеиновых кислот вариабельной области иммуноглобулина человека, в ответ на сенсибилизацию иммуногеном, и которые представляют собой результат процессов отбора, наследственно функционирующих у такого животного.
Термин "нереаранжированный" в отношении последовательности нуклеиновой кислоты включает в себя последовательности нуклеиновых кислот, которые существуют в зародышевой линии клетки животного.
Фраза "вариабельный домен" предусматривает аминокислотную последовательность легкой или тяжелой цепи иммуноглобулина (модифицированной при необходимости), которая содержит следующие аминокислотные области, последовательно от N-конца к С-концу (если не указано иное): FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Универсальная легкая цепь
Предыдущие попытки получить применимые мультиспецифические связывающие эпитоп белки, например, биспецифические антитела, были затруднены различными проблемами, которые зачастую характеризовались общей парадигмой: in vitro селекция или манипуляция с последовательностями для рационального конструирования или для конструирования методом проб и ошибок подходящего формата для образования пары гетеродимерного биспецифического иммуноглобулина человека. К сожалению, большинство, если не все из подходов in vitro конструирования обеспечивают преимущественно узкоспециализированные решения проблем, которые подходят, если вообще подходят, для отдельных молекул. С другой стороны, способы in vivo для использования сложных организмов для отбора соответствующих пар, которые способны привести к получению терапевтических средств для людей, не были реализованы.
В настоящей области техники известны мыши, содержащие локусы иммуноглобулинов человека, вариабельные и константные области, случайным образом вставленные в геном мыши. Исходные линии таких мышей содержали ограниченное количество генных сегментов иммуноглобулина человека. В частности, несколько линий, содержащих генные сегменты легкой цепи иммуноглобулина человека, содержали один, три или четыре генных сегмента VL иммуноглобулина человека и пять генных сегментов JL иммуноглобулина человека (Taylor et al. 1992, Nucleic Acids Research 20(23): 6287-6295; Fishwild et al. 1996, Nature Biotechnology 14: 845-851; Lonberg et al. 1994, Nature 368: 856-859; Green et al. 1994, Nature Genetics 7:13-21; Green and Jakobovits 1998, J. Exp.Med. 188(3): 483-495; Green 1999, J. Immunol. Methods 231: 11-23). Эти мыши, которые содержали только несколько генных сегментов VL иммуноглобулина человека в виде части полностью человеческих трансгенов, случайным образом вставленных в геном мыши, демонстрировали аномальные количества В-клеток, нарушенное развитие В-клеток и другие иммунодефициты. Экспрессия генов VL иммуноглобулина человека, что обнаружено с помощью поверхностной экспрессии Сκ человека на В-клетках, была ниже, чем эндогенной легкой цепи κ, по сравнению с диким типом. Неожиданно, в настоящем изобретении предусмотрены мыши, чьи количества В-клеток и развитие представляло собой почти дикого типа, по сравнению с мышами, подвергнутыми генной инженерии в эндогенных локусах легкой цепи к иммуноглобулина, чтобы содержать один или два генных сегмента Vκ иммуноглобулина человека (например, примеры 2 и 14, таблицы 3, 25 и 26 и фиг. 4, 10А-18). Кроме того, согласно некоторым вариантам осуществления предусмотренные в настоящем изобретении мыши способны производить несколько высокоаффинных обратных химерных антител, содержащих домены VH и VL человека, в ответ на антиген, причем домены VL содержат по одному из двух возможных генных сегментов VL человека и один из пяти возможных генных сегментов JL человека (например, смотрите примеры 5-10, 12 и 14). Таким образом, в отличие от предварительных линий мышей, сконструированных с минилокусами легкой цепи иммуноглобулина человека (т.е. ограниченным числом генных сегментов иммуноглобулинов человека), предусмотренные в настоящее время сконструированные мыши, которые содержат ограниченное количество генных сегментов VL иммуноглобулина человека (один или два) и, согласно некоторым вариантам осуществления, два или более (например, 2, 3, 4 или 5) генных сегментов JL иммуноглобулина человека, на удивление проявляют нормальные количества В-клеток нормальную экспрессию легкой цепи иммуноглобулина и нормальное развитие В-клеток. Кроме того, такие предусмотренные мыши также не показывают сниженную или нарушенную способность поддерживать надежные иммунные ответы на множественные антигены как результат ограниченного репертуара легких цепей иммуноглобулина. Соответственно, предусмотрены мыши, которые содержат гуманизированный локус VL, содержащий не более двух нереаранжированных генных сегментов VL иммуноглобулина человека и два или более (например, 2, 3, 4 или 5) генных сегментов JL иммуноглобулина человека - или не более двух реаранжированных сегментов VLJL человека - и, которые проявляют популяции В-клеток дикого типа в количестве и проявляют развитие В-клеток дикого типа.
Как правило, нативные мышиные последовательности зачастую не представляют собой хороший источник терапевтических последовательностей человека. По меньшей мере по этой причине создание вариабельных областей тяжелой цепи иммуноглобулина мыши, которые образуют пары с общей легкой цепью человека, находит ограниченную практическую применимость. Больше попыток конструирования in vitro будет затрачено в процессе проб и ошибок в попытке гуманизировать вариабельные последовательности тяжелой цепи мыши, при этом надеясь сохранить специфичность и аффинность эпитопа при поддержании способности соединяться с общей легкой цепью человека, с неопределенным результатом. В конце такого процесса конечный продукт может сохранять некоторую специфичность и аффинность и связываться с общей легкой цепью, но в конечном счете, иммуногенность у человека, вероятно, будет сохранять значительную степень риска.
Следовательно, подходящая мышь для получения терапевтических средств для людей будет включать в себя подходящий большой репертуар генных сегментов вариабельной области тяжелой цепи человека вместо эндогенных генных сегментов вариабельной области тяжелой цепи мыши. Генные сегменты вариабельной области тяжелой цепи человека должны быть способны реаранжировать и рекомбинировать с эндогенным константным доменом тяжелой цепи мыши для образования обратной химерной тяжелой цепи (т.е. тяжелой цепи, содержащей вариабельный домен человека и константную область мыши). Тяжелая цепь должна быть способна к переключению класса и соматической гипермутации так, чтобы подходящий большой репертуар вариабельных доменов тяжелой цепи был доступен для мыши для выбора одного, который может связываться с ограниченным репертуаром вариабельных областей легкой цепи человека.
Мышь, которая выбирает общую легкую цепь для множества тяжелых цепей, характеризуется практической применимостью. Согласно различным вариантам осуществления антитела, которые экспрессируются у мыши, которая может экспрессировать только общую легкую цепь, будут содержать тяжелые цепи, которые могут связываться и экспрессироваться с идентичной или по существу идентичной легкой цепью. Это особенно применимо в получении биспецифических антител. Например, такая мышь может быть иммунизирована первым иммуногеном для образования В-клетки, которая экспрессирует антитело, которое специфически связывается с первым эпитопом. Мышь (или аналогичная генетически мышь) может быть иммунизирована вторым иммуногеном для образования В-клетки, которая экспрессирует антитело, которое специфически связывается со вторым эпитопом. Вариабельные области тяжелых цепей могут быть клонированы из В-клеток и экспрессированы с одинаковой константной областью тяжелой цепи и одинаковой вариабельной областью легкой цепи (например, общей легкой цепи) в клетке для образования биспецифического антитела, причем вариабельный компонент тяжелой цепи биспецифического антитела был выбран мышью для связывания и экспрессии с вариабельным компонентном легкой цепи (или общей легкой цепи).
Авторы настоящего изобретения сконструировали мышь для образования легких цепей иммуноглобулина, которые будут подходящим образом создавать пары с достаточно разнообразным семейством тяжелых цепей, включающим в себя тяжелые цепи, чьи вариабельные области отклоняются от зародышевых последовательностей, например, вариабельные области с созревшей аффинностью или соматически мутированные вариабельные области. Согласно различным вариантам осуществления мышь разработана для образования пары вариабельных доменов легкой цепи человека с вариабельными доменами тяжелой цепи человека, которые содержат соматические мутации, таким образом, обеспечивая путь к получению связывающих белков с высокой аффинностью, подходящих для применения в качестве терапевтических средств для людей.
Генетически сконструированная мышь посредством длительного и сложного процесса селекции антитела в пределах организма, образует биологически приемлемые выборы в образовании пар разнообразного набора вариабельных доменов тяжелой цепи человека с ограниченным числом вариантов легкой цепи человека. Для достижения этого мышь конструируют так, чтобы она представляла ограниченное число вариантов вариабельных доменов легкой цепи человека в сочетании с широким разнообразием вариантов вариабельных доменов тяжелой цепи человека. При сенсибилизации иммуногеном мышь максимально увеличивает число решений в ее репертуаре для развития антитела к иммуногену, ограниченное преимущественно или исключительно числом или вариантами легких цепей в ее репертуаре. Согласно различным вариантам осуществления это включает в себя предоставление мыши возможности достичь подходящих и совместимых соматических мутаций вариабельного домена легкой цепи, которые будут при этом совместимыми с относительно широким разнообразием вариабельных доменов тяжелой цепи человека, включая в себя, в частности, соматически мутированные вариабельные домены тяжелой цепи человека.
Для достижения ограниченного репертуара вариантов легкой цепи мышь конструируют для приведения в нефункциональное или по существу нефункциональное состояние ее способности образовывать или реаранжировать нативный вариабельный домен легкой цепи мыши. Этого можно достичь, например, путем удаления генных сегментов вариабельной области легкой цепи мыши. Эндогенный локус мыши может быть затем модифицирован с помощью экзогенного подходящего предпочтительного генного сегмента вариабельной области легкой цепи человека, функционально связанного с эндогенным константным доменом легкой цепи мыши, таким способом, чтобы экзогенные генные сегменты вариабельной области человека могли комбинироваться с эндогенным геном константной области легкой цепи мыши и образовывать реаранжированный ген обратной химерной легкой цепи (вариабельная область человека, константная область мыши). Согласно различным вариантам осуществления вариабельная область легкой цепи способна быть соматически мутированной. Согласно различным вариантам осуществления для максимизации способности вариабельной области легкой цепи к достижению соматических мутаций сохраняют подходящий(е) энхансер(ы) у мыши. Например, в модификации локуса легкой цепи κ мыши для замещения эндогенных генных сегментов легкой цепи к мыши генными сегментами легкой цепи κ человека интронный энхансер к мыши и 3' энхансер к мыши представляют собой функционально сохраненные или неразрушенные.
Предусмотрена генетически сконструированная мышь, которая экспрессирует ограниченный репертуар обратных химерных (вариабельная область человека, константная область мыши) легких цепей, связанных с разнообразием обратных химерных (вариабельная область человека, константная область мыши) тяжелых цепей. Согласно различным вариантам осуществления эндогенные генные сегменты легкой цепи к мыши подвергают делеции и замещают одной (или двумя) реаранжированной областью легкой цепи человека, функционально связанной с эндогенным геном Сκ мыши. Согласно вариантам осуществления для максимизации соматической гипермутации реаранжированной области легкой цепи человека сохраняют интронный энхансер κ мыши и 3' энхансер к мыши. Согласно различным вариантам осуществления мышь также содержит нефункциональный локус легкой цепи λ или его делецию, или делецию, которая делает локус неспособным образовывать легкую цепь λ.
Предусмотрена генетически сконструированная мышь, которая согласно различным вариантам осуществления содержит локус вариабельной области легкой цепи, не содержащий эндогенные генные сегменты VL и JL легкой цепи мыши и содержащий реаранжированную вариабельную область легкой цепи человека, согласно одному варианту осуществления реаранжированную последовательность VL/JL человека, функционально связанную с константной областью мыши, причем локус способен подвергаться соматической гипермутации и причем локус экспрессирует легкую цепь, содержащую последовательность VL/JL человека, связанную с константной областью мыши. Таким образом, согласно различным вариантам осуществления локус содержит 3' энхансер к мыши, который связан с нормальным уровнем соматической гипермутации или уровнем дикого типа.
Генетически сконструированная мышь согласно различным вариантам осуществления при иммунизации представляющим интерес антигеном образует В-клетки, которые проявляют разнообразие реаранжировок вариабельных областей тяжелой цепи иммуноглобулина человека, которые экспрессируют и функционируют с одной или двумя реаранжированными легкими цепями, включая в себя варианты осуществления, при которых одна или две легкие цепи содержат вариабельные области легкой цепи человека, которые содержат, например, от 1 до 5 соматических мутаций. Согласно различным вариантам осуществления экспрессированные таким образом легкие цепи человека способны к ассоциации и экспрессии с любой вариабельной областью тяжелой цепи иммуноглобулина человека, экспрессированной у мыши.
В дополнение к генетически сконструированным мышам, содержащим ограниченный репертуар легких цепей иммуноглобулина (например, единственный генный сегмент VL человека или не более двух генных сегментов VL человека и один генный сегмент JL человека или, возможно, два или более генных сегмента JL человека), как описано в настоящем документе, также в настоящем документе предусмотрены и другие генетически модифицированные отличные от человека животные, которые содержат единственный генный сегмент VL человека или не более двух генных сегментов VL человека. Согласно некоторым вариантам осуществления такие отличные от человека животные содержат единственную реаранжированную область VL человека, состоящую из реаранжированной последовательности VLJL человека. Согласно некоторым вариантам осуществления такие отличные от человека животные содержат не более двух генных сегментов VL человека и два или более (например, 2, 3, 4 или 5) генных сегментов JL человека. Согласно различным вариантам осуществления генные сегменты человека функционально связаны с отличной от человеческой константной областью легкой цепи, например, константной областью легкой цепи мыши, крысы.
Такие отличные от человека животные могут быть выбраны из группы, состоящей из мыши, крысы, кролика, свиньи, коровы (например, коровы, быка, буйвола), оленя, овцы, козы, курицы, кошки, собаки, хорька, примата (например, мартышки, макака-резуса). Для отличных от человека животных, у которых подходящие генетически модифицируемые ЭС клетки не представляют собой легко доступные, используются другие способы для получения отличного от человека животного, содержащего описанные в настоящем документе генетические модификации. Такие способы включают в себя, например, модификацию не-ЭС клеточного генома (например, фибробласта или индуцированной плюрипотентной клетки) и применение ядерного переноса для передачи модифицированного генома в подходящую клетку, например, яйцеклетку, и постепенное выращивание модифицированной клетки (например, модифицированного ооцита) в отличном от человека животном в подходящих условиях для образования эмбриона.
Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению представляет собой млекопитающее. Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению представляет собой небольшое млекопитающее, например, из надсемейства Dipodoidea или Muroidea. Согласно некоторым вариантам осуществления генетически модифицированное животные согласно настоящему изобретению представляет собой грызуна. Согласно некоторым вариантам осуществления грызуна согласно настоящему изобретению выбирают из мыши, крысы и хомячка. Согласно некоторым вариантам осуществления грызуна согласно настоящему изобретению выбирают из надсемейства мышиных. Согласно некоторым вариантам осуществления генетически модифицированное животное согласно настоящему изобретению представляет собой животное из семейства, выбранного из Calomyscidae (например, мышевидные хомячки), Cricetidae (например, хомячок, крысы и мыши Нового Света, полевки), Muridae (истинные мыши и крысы, песчанки, колючие мыши, хохлатые крысы), Nesomyidae (рипидомисы, скальные крысы, белохвостые крысы, Малагасийские крысы и мыши), Platacanthomyidae (например, колючие соневидные хомяки) и Spalacidae (например, кроты, бамбуковые крысы и цокоры). Согласно некоторым вариантам осуществления генетически модифицированное животное согласно настоящему изобретению выбирают из истинной мыши или крысы (семейство Muridae), песчанки, колючей мыши и косматого хомяка. Согласно некоторым вариантам осуществления генетически модифицированное животное согласно настоящему изобретению представляет собой представителя семейства Muridae. Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению представляет собой грызуна. Согласно некоторым определенных вариантах осуществления грызуна согласно настоящему изобретению выбирают из мыши и крысы. Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению представляет собой мышь.
Согласно некоторым вариантам осуществления отличное от человека животное согласно настоящему изобретению представляет собой грызуна, который представляет собой мышь линии C57BL, выбранной из C57BL/A, C57BL/An, C57BL/GrFa, C57BL/KaLwN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6N, C57BL/6NJ, C57BL/10, C57BL/10ScSn, C57BL/10Cr и C57BL/01a. Согласно другому варианту осуществления мышь согласно настоящему изобретению представляет собой мышь линии 129, выбранной из группы, состоящей из 129Р1, 129Р2, 129РЗ, 129X1, 129S1 (например, 129S1/SV, 129Sl/SvIm), 129S2, 129S4, 129S5, 129S6, 129S9/SvEVH (129/SvEvTac), 129S7, 129S8, 129Т1, 129Т2 (смотрите, например, Festing et al., 1999, Mammalian Genome 10:836; Auerbach et al., 2000, Biotechniques 29(5): 1024-1028, 1030, 1032). Согласно некоторым определенным вариантам осуществления генетически модифицированная мышь согласно настоящему изобретению представляет собой сочетание вышеуказанной линии 129 и вышеуказанной линии C57BL/6. Согласно некоторым определенным вариантам осуществления генетически модифицированная мышь согласно настоящему изобретению представляет собой сочетание вышеуказанных линий 129 или сочетание вышеуказанных линий BL/6. Согласно некоторым определенным вариантам осуществления описанная в настоящем документе линия 129 сочетания представляет собой линию 129S6 (129/SvEvTac). Согласно другому варианту осуществления мышь согласно настоящему изобретению представляет собой линию BALB, например, линию BALB/C. Согласно некоторым вариантам осуществления мышь согласно настоящему изобретению представляет собой сочетание линии BALB и другой вышеуказанной линии.
Согласно одному варианту осуществления отличное от человека животное согласно настоящему изобретению представляет собой крысу. Согласно некоторым определенным вариантам осуществления крысу согласно настоящему изобретению выбирают из крысы линии Wistar, линии LEA, линии Sprague Dawley, линии Fischer, F344, F6 и Dark Agouti. Согласно некоторым определенным вариантам осуществления линия описанной в настоящем документе крысы представляет собой сочетание двух или более линий, выбранных из группы, состоящей из Wistar, LEA, Sprague Dawley, Fischer, F344, F6 и Dark Agouti.
Связывающие эпитоп белки, которые связываются более чем с одним эпитопом
Описанные в настоящем документе композиции и способы могут использоваться для образования связывающих белков, которые связываются более чем с одним эпитопом с высокой аффинностью, например, биспецифических антител. Преимущества настоящего изобретения включают в себя способность выбирать подходящим образом высокую степень связывания тяжелых цепей иммуноглобулина (например, с созревшей аффинностью), каждая из которых будет ассоциироваться с одной легкой цепью.
Сообщалось о некоторых техниках для получения фрагментов биспецифических антител из культуры рекомбинантных клеток. Однако синтез и экспрессия биспецифических связывающих белков были проблематичными, частично вследствие ограничений, связанных с идентификацией подходящей легкой цепи, которая может связываться и экспрессировать с двумя различными тяжелыми цепями, и частично вследствие проблем с выделением. Согласно различным вариантам осуществления описанные в настоящем документе способы и композиции предусматривают преимущество полноразмерных биспецифических антител, которые не требуют специальной модификации(й) для поддержания традиционной структуры иммуноглобулина путем повышения стабильности/взаимодействия компонентов (фиг. 7А). Согласно различным вариантам осуществления такая модификация(и) характеризовалась доказанной громоздкостью и служила препятствием на пути развития технологии биспецифических антител и их потенциального использования в лечении заболеваний человека. Таким образом, согласно различным вариантам осуществления посредством обеспечения естественной структуры иммуноглобулина (т.е. полноразмерной), характеризующейся дополнительным свойством нескольких специфичностей, полноразмерные биспецифические антитела поддерживают их критические эффекторные функции, которых лишены предыдущие биспецифические фрагменты, и дополнительно обеспечивают терапевтические средства, которые демонстрируют важный фармакокинетический параметр более длительного периода полураспада.
Описанные в настоящем документе способы и композиции позволяют генетически модифицированной мыши выбирать, посредством в остальном нормальных процессов, подходящую легкую цепь, которая может связываться и экспрессироваться более чем одной с тяжелой цепью, включая в себя тяжелые цепи, которые представляют собой соматически мутированные (например, с созревшей аффинностью). Последовательности VL и VH человека из подходящих В-клеток описанных в настоящем документе иммунизированных мышей, которые экспрессируют антитела с созревшей аффинностью, содержащие обратные химерные тяжелые цепи (т.е. вариабельная область человека и константная область мыши), могут быть идентифицированы и клонированы в рамку считывания в вектор экспрессии с подходящей генной последовательностью константной области человека (например, IgG1 человека). Могут быть получены два таких конструкта, причем каждый конструкт кодирует вариабельный домен тяжелой цепи человека, который связывается с отличным эпитопом. Одна из VL человека (например, Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека) в зародышевой последовательности или из В-клетки, причем последовательность была соматически мутирована, может быть слита внутри рамки считывания с подходящим геном константной области человека (например, геном к константной области человека). Эти три полностью человеческих тяжелых и легких конструкта могут быть помещены в подходящую клетку для экспрессии. Клетка будет экспрессировать два основных вида: гомодимерную тяжелую цепь с идентичной легкой цепью и гетеродимерную тяжелую цепь с идентичной легкой цепью. Для обеспечения легкого разделения этих основных видов одну из тяжелых цепей модифицируют для исключения связывающей белок А детерминанты, получая в результате отличающуюся аффинность гомодимерного связывающего белка от гетеродимерного связывающего белка. Адресованные этому вопросу композиции и способы описаны в USSN 12/832838, поданной 25 июня 2010, названной "Readily Isolated Bispecific Antibodies with Native Immunoglobulin Format", опубликованной в виде US 2010/0331527A1, включенной в настоящий документ посредством ссылки.
Согласно одному аспекту предусмотрен описанный в настоящем документе связывающий эпитоп белок, причем последовательности VL и VH человека происходят из описанных в настоящем документе мышей, которые были иммунизированы антигеном, содержащим представляющий интерес эпитоп.
Согласно одному варианту осуществления предусмотрен связывающий эпитоп белок, который содержит первый и второй полипептид, причем первый полипептид содержит, от N-конца к С-концу, связывающую первый эпитоп область, которая селективно связывается с первым эпитопом, за которой следует константная область, которая содержит первую область CH3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации; и второй полипептид содержит, от N-конца к С-концу, связывающую второй эпитоп область, которая селективно связывается со вторым эпитопом, за которой следует константная область, которая содержит вторую область CH3 человека IgG, выбранного из IgG1, IgG2, IgG4 и их комбинации, причем вторая область CH3 содержит модификацию, которая снижает или устраняет связывание второго домена CH3 с белком А.
Согласно одному варианту осуществления вторая область CH3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU). Согласно другому варианту осуществления вторая область CH3 дополнительно содержит модификацию Y96F (IMGT; Y436F по EU).
Согласно одному варианту осуществления вторая область CH3 происходит из модифицированного IgG1 человека и дополнительно содержит модификацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L358M, N384S, K392N, V397M и V422I по EU).
Согласно одному варианту осуществления вторая область CH3 происходит из модифицированного IgG2 человека и дополнительно содержит модификацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT; N384S, K392N и V422I по EU).
Согласно одному варианту осуществления вторая область CH3 происходит из модифицированного IgG4 человека и дополнительно содержит модификацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I по EU).
Один способ получения связывающего эпитоп белка, который связывается более чем с одним эпитопом, представляет собой иммунизацию первой мыши согласно настоящему изобретению антигеном, который содержит первый представляющий интерес эпитоп, причем мышь содержит эндогенный локус вариабельной области легкой цепи иммуноглобулина, который не содержит эндогенную VL мыши, которая способна к реаранжировке и образованию легкой цепи, причем в эндогенном локусе вариабельной области легкой цепи иммуноглобулина мыши находится единственная реаранжированная область VL человека, функционально связанная с эндогенным геном константной области легкой цепи мыши, и реаранжированная область VL человека выбрана из Vκ1-39Jκ5 человека и Vκ3-20Jκ1 человека, и эндогенные генные сегменты VH мыши были замещены полностью или частично генными сегментами VH человека, так чтобы тяжелые цепи иммуноглобулина, образованные мышью, представляли собой исключительно или по существу тяжелые цепи, которые содержат вариабельные домены человека и константные домены мыши. Будучи иммунизированной, такая мышь будет образовывать обратное химерное антитело, содержащее только один из двух вариабельных доменов легкой цепи человека (например, один из Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека). Как только идентифицируют В-клетку, которая кодирует VH, который связывается с представляющим интерес эпитопом, нуклеотидная последовательность VH (и необязательно VL) может быть извлечена (например, с помощью ПЦР) и клонирована в конструкт экспрессии внутри рамки считывания с подходящим константным доменом иммуноглобулина человека. Этот процесс может быть повторен для идентификации второго домена VH, который связывается со вторым эпитопом, и вторая генная последовательность VH может быть извлечена и клонирована в вектор экспрессии внутри рамки считывания со вторым подходящим константным доменом иммуноглобулина. Первый и второй константные домены иммуноглобулина могут принадлежать одному и тому же или различному изотипу, и один из константных доменов иммуноглобулина (но не другой) может быть модифицирован, как описано в настоящем документе или в заявке на патент США №2010/0331527 А1, и связывающий эпитоп белок может быть экспрессирован в подходящей клетке и выделен на основании его дифференциальной аффинности к белку А, по сравнению с гомодимерным связывающим эпитоп белком, например, как описано в заявке на патент США №2010/0331527 А1.
Согласно одному варианту осуществления предусмотрен способ получения биспецифического связывающего эпитоп белка, предусматривающий идентификацию первой нуклеотидной последовательности VH (VH1) с созревшей аффинностью (например, содержащей одну или несколько соматических гипермутаций) человека из описанной в настоящем документе мыши, идентификацию второй нуклеотидной последовательности VH (VH2) с созревшей аффинностью (например, содержащей одну или несколько соматических гипермутаций) человека из описанной в настоящем документе мыши, клонирование VHI внутри рамки считывания с тяжелой цепью человека, не содержащей модификацию детерминанты белка А, как описано в заявке на патент США № US 2010/0331527А1 для образования тяжелой цепи 1 (НС1), клонирование VH2 внутри рамки считывания с тяжелой цепью человека, содержащей детерминанту белка А, как описано в заявке на патент США №2010/0331527А1, для образования тяжелой цепи 2 (НС2), введение вектора экспрессии, содержащего НС1, и аналогичного или другого вектора экспрессии, содержащего НС2, в клетку, причем клетка также экспрессирует легкую цепь иммуноглобулина человека, которая содержит Vκ1-39 человекаЛк5 человека или Vκ3-20 человека/Jк1 человека, слитую с константным доменом легкой цепи человека, позволяя клетке экспрессировать биспецифический связывающий эпитоп белок, содержащий домен VH, кодируемый VH1, и домен VH, кодируемый VH2, и выделение биспецифического связывающего эпитоп белка на основании его дифференциальной способности связывать белок А, по сравнению с моноспецифическим гомодимерным связывающим эпитоп белком. Согласно конкретному варианту осуществления НС1 представляет собой IgG1 и НС2 представляет собой IgG1, который содержит модификацию H95R (IMGT; H435R по EU) и дополнительно содержит модификацию Y96F (IMGT; Y436F по EU). Согласно одному варианту осуществления домен VH, кодируемый VH1, домен VH, кодируемый VH2, или оба представляют собой соматически мутированные.
Гены VH человека, которые экспрессируются с общей VL человека
Разнообразные вариабельные области человека из антител с созревшей аффинностью, возникших к четырем различным антигенам, экспрессировали либо с их родственной легкой цепью, либо по меньшей мере с одной из легких цепей человека, выбранной из Vκ1-39Jκ5 человека, Vκ3-20Jκ1 человека или VpreB/Jλ5 человека (смотрите пример 1). Для антител к каждому из антигенов соматически мутированные тяжелые цепи высокой аффинности из различных семейств генов успешно образовывали пары с реаранжированными зародышевыми областями Vκ1-39Jκ5 и Vκ3-20Jκ1 человека и секретировались из клеток, экспрессирующих тяжелые и легкие цепи. Для Vκ1-39Jκ5 и Vκ3-20Jκ1 домены VH, происходящие из следующих семейств генов VH человека, благоприятно экспрессировались: 1-2, 1-8, 1-24, 2-5, 3-7, 3-9, 3-11, 3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 4-31, 4-39, 4-59, 5-51 и 6-1. Таким образом, мышь, которую конструировали для экспрессии ограниченного репертуара доменов VL человека из одной или обеих Vκ1-39Jκ5 и Vκ3-20Jκ1, будет образовывать разнообразную популяцию соматически мутированных доменов VH человека из локуса VH, модифицированного для замещения генных сегментов VH мыши генными сегментами VH человека.
Мыши, генетически сконструированные для экспрессии обратных химерных (вариабельная область человека, константная область мыши) тяжелых цепей иммуноглобулина, связанных с единственной реаранжированной легкой цепью (например, Vκ1-39/J или Vκ3-20/J), будучи иммунизированными представляющим интерес антигеном, образовывали В-клетки, которые содержали разнообразие реаранжировок VH человека и экспрессировали разнообразие высокоаффинных антигенспецифических антител с разнообразными свойствами относительно их способности блокировать связывание антигена с его лигандом и относительно их способности связывать варианты антигена (смотрите примеры 5-10).
Таким образом, описанные в настоящем документе мыши и способы применимы в получении и селекции вариабельных доменов тяжелой цепи иммуноглобулина человека, включающих в себя соматически мутированные вариабельные домены тяжелой цепи человека, которые представляют собой результат разнообразия реаранжировок, которые проявляют широкий спектр аффинностей (включая в себя проявление Ко, составляющей приблизительно наномоли или менее), широкий спектр специфичностей (включая в себя связывание с различными эпитопами одного антигена) и которые связываются и экспрессируются с одинаковой или по существу одинаковой вариабельной областью легкой цепи иммуноглобулина человека.
Полностью человеческие биспецифические антитела, содержащие общую легкую цепь
В качестве первой стадии в различных вариантах осуществления первую и вторую последовательности нуклеиновой кислоты, каждая из которых кодирует вариабельные домены тяжелой цепи человека (и любые дополнительные последовательности нуклеиновых кислот, образующих биспецифического антитела), выбирают из исходных моноклональных антител с желаемыми характеристиками, такими как, например, способность связываться с различными эпитопами (смотрите фиг. 7А и 7В), характеризующихся различными аффинностями и т.п. Как правило, последовательности нуклеиновых кислот, кодирующие вариабельные домены тяжелой цепи человека, выделяют из описанных в настоящем документе иммунизированных мышей, чтобы обеспечить сливание с константными областями тяжелой цепи человека, чтобы быть пригодными для введения человеку. Дополнительные модификации последовательности(ей) могут быть получены путем введения мутаций, которые добавляют дополнительную функциональность биспецифическому антителу, которая включает в себя, например, увеличение времени полужизни в сыворотке (например, смотрите U.S. 7217797) и/или увеличение антителозависимой клеточноопосредованной цитотоксичности (например, смотрите U.S. 6737056). Введение мутаций в константные области антител известны в настоящей области техники. Кроме того, часть биспецифического антитела может быть произведена рекомбинантно в культуре клеток, а другая часть(и) молекулы может быть произведена указанными выше способами.
Были описаны некоторые способы производства антител. Например, согласно различным вариантам осуществления химерные антитела получают у описанных в настоящем документе мышей. Антитела могут быть выделены непосредственно из В-клеток иммунизированной мыши (например, смотрите U.S. 2007/0280945Al) и/или В клетки иммунизированной мыши могут быть использованы для получения гибридом (Kohler and Milstein, 1975, Nature 256:495-497). ДНК, кодирующую антитела (тяжелые и/или легкие цепи человека) из описанных в настоящем документе мышей, легко выделяют и секвенируют с использованием обычных техник. Гибридома и/или В-клетки, полученные из описанных в настоящем документе мышей, служат в качестве предпочтительного источника такой ДНК. После выделения ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, которые иным образом не производят белок иммуноглобулина, чтобы получить синтез моноклональных антител в рекомбинантных клетках-хозяевах. ДНК также может быть модифицирована, например, путем замены кодирующей последовательности для константных доменов тяжелой и легкой цепи человека вместо мышиных последовательностей.
Согласно различным вариантам осуществления после выделения ДНК и отбора первой и второй последовательностей нуклеиновых кислот, которые кодируют первый и второй вариабельные домены тяжелой цепи человека с требуемой специфичностью/аффинностью и третью последовательность нуклеиновой кислоты, которая кодирует домен легкой цепи человека (реаранжированная последовательность зародышевой линии или последовательность легкой цепи, выделенная из описанной в настоящем документе мыши), три кодирующие молекулы последовательности нуклеиновой кислоты экспрессируют с образованием биспецифического антитела с использованием рекомбинантных способов, которые широко доступны в настоящей области техники. Часто, система экспрессии выбора будет включать в себя экспрессирующий вектор клеток млекопитающего и хозяина таким образом, что биспецифическое антитело соответствующим образом гликозилируют (например, в случае биспецифических антител, содержащих домены антител, которые гликозилированы). Тем не менее, молекулы могут быть также получены в прокариотических системах экспрессии. Как правило, клетка-хозяин будет трансформирована с ДНК, кодирующей первый вариабельный домен тяжелой цепи человека, второй вариабельный домен тяжелой цепи человека, домен легкой цепи человека на единственном векторе или независимых векторах. Тем не менее возможно экспрессировать первый вариабельный домен тяжелой цепи человека, второй вариабельный домен тяжелой цепи человека и домен легкой цепи человека (компоненты биспецифических антител) в независимых системах экспрессии и образовать пару экспрессированных полипептидов in vitro. Согласно различным вариантам осуществления домен легкой цепи человека содержит последовательность зародышевой линии. Согласно различным вариантам осуществления домен легкой цепи человека содержит не более чем одну, не более чем две, не более чем три, не более чем четыре или не более чем пять соматических гипермутаций с вариабельной последовательностью легкой цепи домена легкой цепи.
Согласно различным вариантам осуществления нуклеиновую кислоту(ы) (например, кДНК или геномную ДНК), кодирующую две тяжелые цепи и единственную легкую цепь человека, встраивают в реплицируемый вектор для дальнейшего клонирования (амплификации ДНК) и/или для экспрессии. Многие векторы доступны, и, как правило, включают в себя без ограничения один или несколько из следующих компонентов: сигнальную последовательность, точку начала репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции. Каждый компонент может быть выбран отдельно или на основании выбора клетки-хозяина или других критериев, определенных экспериментально. Несколько примеров каждого компонента известны в настоящей области техники.
Векторы экспрессии и клонирования, как правило, содержат промотор, который распознается организмом-хозяином и функционально связан с последовательностями нуклеиновых кислот, которые кодируют каждый или все компоненты биспецифического антитела. Большое количество промоторов, распознаваемых различными потенциальными клетками-хозяевами, хорошо известно. Эти промоторы функционально связаны с кодирующей биспецифические антитела ДНК, путем удаления промотора из источника ДНК с помощью расщепления ферментами рестрикции и вставки выделенной промоторной последовательности в вектор.
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (дрожжей, грибов, насекомых, растений, животных, человека или ядросодержащих клеток из других многоклеточных организмов) могут также содержать последовательности, необходимые для терминации транскрипции и стабилизации мРНК. Такие последовательности обычно доступны из 5'- и иногда 3' нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые как полиаденилированные фрагменты в нетранслируемой части мРНК, кодирующей компоненты биспецифических антител. Подходящие экспрессирующие векторы для различных вариантов осуществления включают в себя те, которые обеспечивают временную экспрессию в клетках млекопитающих ДНК, кодирующей биспецифическое антитело. В общем, временная экспрессия включает в себя использование вектора экспрессии, который способен эффективно реплицироваться в клетке-хозяине, таким образом, что клетка-хозяин накапливает много копий вектора экспрессии, и, в свою очередь, синтезирует высокое содержание требуемого полипептида, кодируемого вектором экспрессии. Переходные системы экспрессии, содержащие подходящий экспрессирующий вектор и клетку-хозяина, обеспечивают удобную положительную идентификацию полипептидов, кодируемых клонированными ДНК, а также для быстрого скрининга биспецифических антител, обладающих желаемыми специфичностями/аффинностями связывания или желаемыми характеристиками гель миграции, по сравнению с исходными антителами, обладающими гомодимерами первого или второго вариабельных доменов тяжелой цепи человека.
Согласно различным вариантам осуществления, как только ДНК, кодирующую компоненты биспецифического антитела, собирают в желаемый описанный выше вектор(ы), они вводятся в подходящую клетку-хозяина для экспрессии и восстановления. Трансфекция клеток-хозяев может быть осуществлена с использованием стандартных техник, известных в настоящей области техники, соответствующих выбранной клетке-хозяину (например, электропорация, ядерная микроинъекция, слияние бактериальных протопластов с интактными клетками или поликатионы, например, полибрен, полиорнитин и т.д.).
Клетку-хозяина выбирают, согласно различным вариантам осуществления, такую, которая наилучшим образом подходит к экспрессирующему содержащему компоненты вектору и позволяет наиболее эффективно и благоприятно производить виды биспецифических антител. Иллюстративные клетки-хозяева для экспрессии включают в себя клетки прокариот и эукариот (одноклеточных или многоклеточных), бактериальные клетки (например, штаммы Е. coli, Bacillus spp., Streptomyces spp. и т.д.), клетки микобактерий, клетки грибов, дрожжевые клетки (например, S. cerevisiae, S. pombe, P. pastoris, P. methanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, инфицированные бакуловирусом клетки насекомых, Trichoplusia ni и т.д.), клетки отличных от человека животных, клетки человека или такие слияния клеток, как, например, гибридомы или квадромы. Согласно некоторым вариантам осуществления клетка представляет собой клетку человека, мартышки, человекообразной обезьяны, хомяка, крысы или мыши. Согласно некоторым вариантам осуществления клетка представляет собой эукариотическую клетку, выбранную из СНО (например, СНО K1, DXB-11 СНО, Veggie-CHO), COS (например, COS-7), ретинальной клетки, Vero, CV1, почечной клетки (например, НЕК293, 293 EBNA, MSR 293, MDCK, НаК, ВНК), HeLa, HepG2, WI38, MRC 5, Colo205, НВ 8065, HL-60, (например, ВНК21), Jurkat, Daudi, А431 (эпидермальная), CV-1, U937, ЗТЗ, клетки L, клетки С127, SP2/0, NS-0, ММТ 060562, клетки Сертоли, клетки BRL 3А, клетки HT1080, клетки миеломы, опухолевой клетки и клеточной линии, происходящей из вышеупомянутой клетки. Согласно некоторым вариантам осуществления клетка содержит один или несколько вирусных генов, например, ретинальная клетка, которая экспрессирует вирусный ген (например, клетка PER.C6™).
Клетки-хозяева млекопитающих, используемые для получения биспецифического антитела, можно культивировать в различных средах. Коммерчески доступные среды, такие как Хама F10 (Sigma), минимальная эссенциальная среда ((MEM), Sigma) RPMI-1640 (Sigma) и модифицированная Дульбекко среда Игла ((DMEM), Sigma) подходят для культивирования клеток-хозяев. Среды могут быть дополнены при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальция, магния и фосфат), буферами (такими как HEPES), нуклеозидами (такими как аденозин и тимидин), антибиотиками (такими как GENTAMYCIN™), микроэлементами (определенными как неорганические соединения, как правило, присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие добавки также могут быть включены в соответствующих концентрациях, как известно специалистам в настоящей области техники. Условия культивирования, такие как температура, рН и т.п., согласно различным вариантам осуществления, представляют собой те, которые ранее использовали с клеткой-хозяином, выбранной для экспрессии, и будут очевидны специалистам в настоящей области техники.
Биспецифическое антитело представляет собой, согласно различным вариантам осуществления, выделенное из культуральной среды в виде секретируемого полипептида, хотя оно также может быть выделено из лизата клеток-хозяев, когда производится непосредственно без секреторного сигнала. Если биспецифическое антитело представляет собой мембраносвязанное, оно может быть высвобождено из мембраны с использованием раствора подходящего детергента (например, Triton Χ-100). Предпочтительно, описанные в настоящем документе биспецифические антитела включают в себя использование первого домена CH3 иммуноглобулина и второго домена CH3 иммуноглобулина, причем первый и второй домены CH3 иммуноглобулина отличаются друг от друга по меньшей мере одной аминокислотой и причем по меньшей мере одно различие аминокислоты уменьшает связывание биспецифического антитела с белком А, по сравнению с биспецифическим антителом без различия аминокислоты (смотрите U.S. 2010/0331527 А1; включенной в настоящий документ посредством ссылки). Согласно одному варианту осуществления первый домен CH3 иммуноглобулина связывается с белком А, а второй домен CH3 иммуноглобулина содержит мутацию, которая уменьшает или отменяет связывание белка А, такую как модификация H95R (по нумерации экзонов IMGT; H435R по нумерации EU). Второй CH3 может дополнительно содержать модификацию Y96F (по IMGT; Y436F EU). Дополнительные модификации, которые могут быть обнаружены во втором CH3, включают в себя: D16E, L18M, N44S, K52N, V57M и V82I (по IMGT; D356E, L358M, N384S, K392N, V397M и V422I ЕС) в случае антител IgG1; N44S, K52N и V82I (IMGT; N384S, K392N и V422I ЕС) в случае антител IgG2 и Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (по IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I ЕС) в случае антител IgG4. Вариации на формате описанного выше биспецифического антитела находятся в пределах объема настоящего изобретения.
Из-за двойственной природы биспецифических антител (т.е. могут быть специфическими к различным эпитопам одного полипептида или могут содержать антигенсвязывающие домены, специфические к более чем одному полипептиду-мишени (смотрите фиг. 7 В; смотрите также, например, Tutt et al., 1991, J. Immunol. 147:60-69; Kufer et al., 2004, Trends Biotechnol. 22:238-244), они предлагают множество полезных преимуществ для терапевтического применения. Например, биспецифические антитела могут быть использованы для перенаправленной цитотоксичности (например, чтобы уничтожать опухолевые клетки), в качестве адъюванта вакцины, для доставки тромболитических средств к сгусткам, для преобразования активируемых ферментами пролекарств в сайте-мишени (например, опухоли), для лечения инфекционных заболеваний, направленного воздействия иммунных комплексов на рецепторы клеточной поверхности или для доставки иммунотоксинов к опухолевым клеткам.
Описанные в настоящем документе биспецифические антитела также могут быть использованы в нескольких терапевтических и нетерапевтических и/или диагностических способах анализа, таких как иммуноферментные анализы, двухсайтовые иммуноанализы, иммунодиагностики in vitro или in vivo различных заболеваний (например, злокачественной опухоли), анализы конкурентного связывания, прямые и косвенные сэндвич анализы и анализы иммунопреципитации. Другие применения биспецифических антител будут очевидны специалистам в настоящей области техники.
Следующие примеры предусмотрены для того, чтобы описать специалистам в настоящей области техники получение и применение способов и композиций согласно настоящему изобретению и не предусмотрены для ограничения объема того, что авторы настоящего изобретения рассматривают как их изобретение. Были предприняты попытки соблюдения точности относительно используемых чисел (например, количеств, температуры и т.д.), но необходимо учитывать некоторые экспериментальные погрешности и отклонения. Если не указано иное, части представляют собой части по весу, молекулярный вес представляет собой средний молекулярный вес, температура указана в градусах Цельсия и давление равно или близко атмосферному.
ПРИМЕРЫ
Следующие примеры предусмотрены для того, чтобы описать специалистам в настоящей области техники получение и применение способов и композиций согласно настоящему изобретению и не предусмотрены для ограничения объема того, что авторы настоящего изобретения рассматривают как их изобретение. Были предприняты попытки соблюдения точности относительно используемых чисел (например, количеств, температуры и т.д.), но необходимо учитывать некоторые экспериментальные погрешности и отклонения. Если не указано иное, температура указана в градусах Цельсия, давление равно или близко атмосферному, части представляют собой части по весу и молекулярный вес представляет собой средний молекулярный вес.
Пример 1
Идентификация областей VH человека, которые связываются с выбранными областями VL человека
Конструировали систему экспрессии in vitro для определения того, может ли единственная реаранжированная легкая цепь зародышевой линии человека совместно экспрессироваться с тяжелыми цепями человека из антигенспецифических антител человека.
Способы получения антител человека у генетически модифицированных мышей известны (смотрите, например, патент США №6596541, Regeneran Pharmaceuticals, VELOCIMMUNE®). Технология VELOCIMMUNE® предусматривает создание генетически модифицированной мыши, характеризующейся геномом, содержащим вариабельные области тяжелой и легкой цепи человека, функционально связанные с эндогенными локусами константной области мыши так, чтобы мышь производила антитело, содержащее вариабельную область человека и константную область мыши в ответ на стимуляцию антигеном. ДНК, кодирующая вариабельные области тяжелых и легких цепей антител, производимых мышью VELOCIMMUNE®, представляют собой полностью человеческие. Вначале, выделяют химерные антитела с высокой аффинностью, характеризующиеся вариабельной областью человека и константной областью мыши. Как описано ниже, определяют характеристики антител и отбирают по необходимым характеристикам, включающим в себя аффинность, селективность, эпитоп и т.д. Константные области мыши замещают необходимой константной областью человека для получения полностью человеческого антитела, содержащего изотип не-IgM, например, дикого типа или модифицированного IgG1, IgG2, IgG3 или IgG4. Наряду с тем, что выбранная константная область может варьировать в соответствии с конкретным применением, характеристики высокоаффинного связывания с антигеном и специфичностью к мишени находятся в вариабельной области.
Мышь VELOCIMMUNE® иммунизировали с помощью фактора роста, который стимулирует ангиогенез (антиген С), и антигенспецифические человеческие антитела выделяли и секвенировали в отношении частоты использования генов V с использованием стандартных техник, принятых в настоящей области техники. Выбранные антитела клонировали в отношении константных областей тяжелой и легкой цепи человека и 69 тяжелых цепей выбирали для образования пары с одной из трех легких цепей человека: (1) родственной легкой цепью κ, связанной с константной областью κ человека, (2) реаранжированной Vκ1-39Jκ5 зародышевой линии человека, связанной с константной областью к человека, или (3) реаранжированной Vκ3-20Jκ1 зародышевой линии человека, связанной с константной областью к человека. Каждую пару тяжелой цепи с легкой цепью котрансфицировали в клетки СНО-К1 с использованием стандартных техник. Присутствие антитела в супернатанте обнаруживали с помощью античеловеческого IgG в анализе ELISA. Титр антител (нг/мл) определяли для каждой пары тяжелой цепи с легкой цепью и титры с различными реаранжированными зародышевыми легкими цепями сравнивали с титрами, полученными с молекулой исходного антитела (т.е. тяжелая цепь, спаренная с родственной легкой цепью), и рассчитывали процент нативного титра (таблица 1). VH: вариабельный ген тяжелой цепи. ND: не обнаружена экспрессия при текущих экспериментальных условиях.
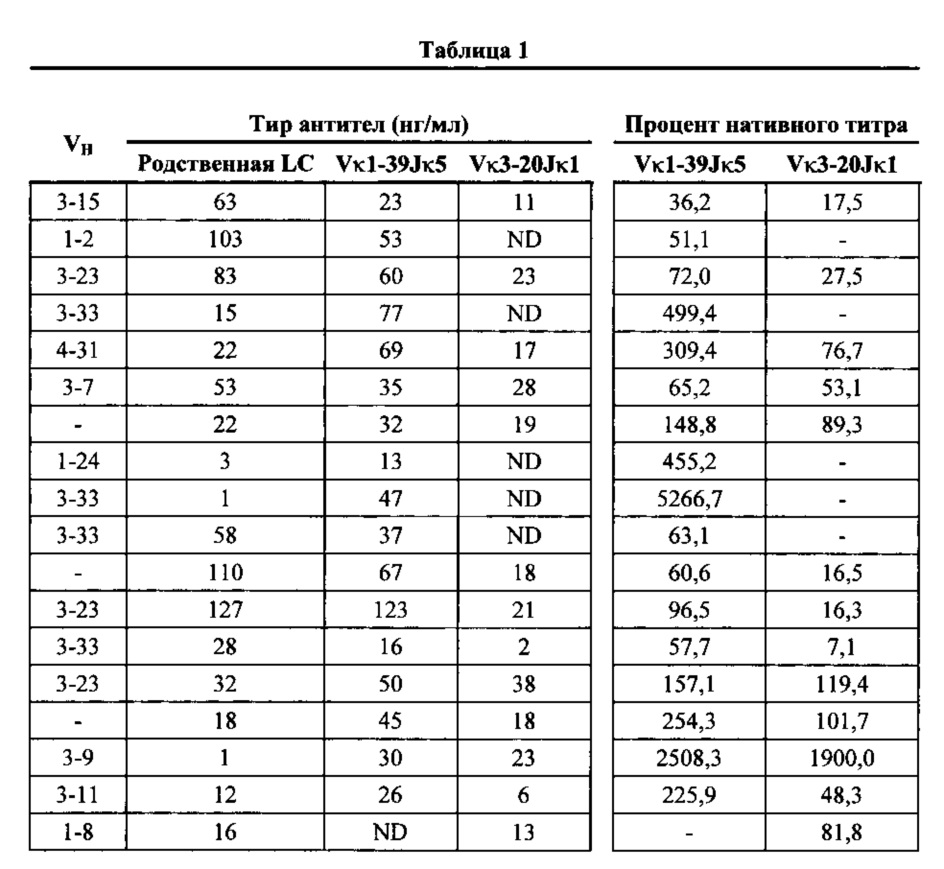
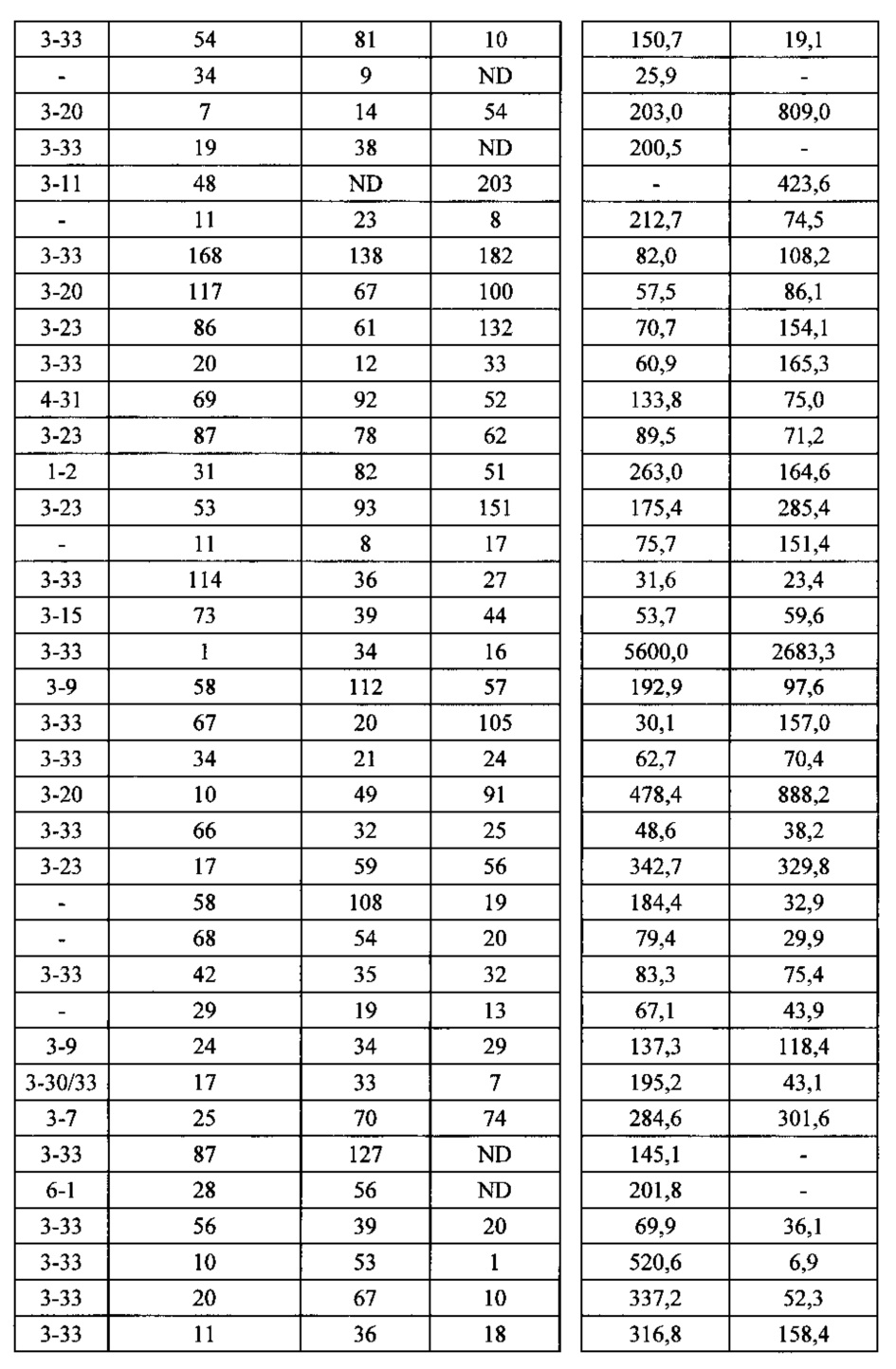
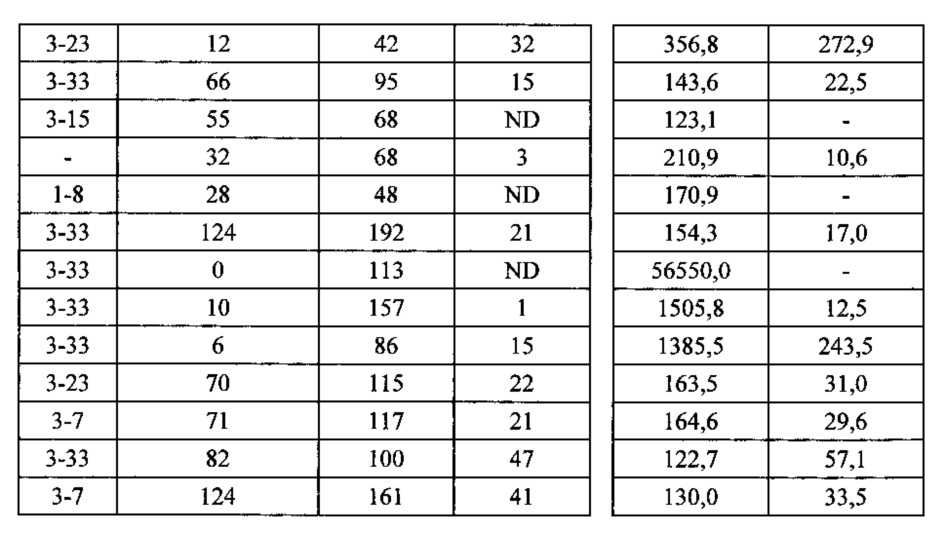
Согласно сходному эксперименту мышей VELOCIMMUNE® иммунизировали с помощью нескольких различных антигенов и выбранные тяжелые цепи антиген-специфических антител человека исследовали в отношении их способности образовывать пару с различными реаранжированными легкими цепями зародышевой линии человека (как описано выше). Используемые в настоящем эксперименте антигены включали в себя фермент, вовлеченный в гомеостаз холестерола (антиген А), гормон сыворотки, вовлеченный в регуляцию гомеостаза глюкозы (антиген В), фактор роста, который стимулирует ангиогенез (антиген С) и рецептор клеточной поверхности (антиген D). Антиген-специфические антитела выделяли из мышей каждой группы иммунизации и вариабельные области тяжелой цепи и легкой цепи клонировали и секвенировали. Из последовательности тяжелых и легких цепей определяли частоту использования генов V и выбранные тяжелые цепи спаривали или с их родственной легкой цепью, или с реаранжированной областью Vκ1-39Jκ5 зародышевой линии человека. Каждую пару тяжелой цепи с легкой цепью котрансфицировали в клетки СНО-К1 и присутствие антитела в супернатанте обнаруживали с помощью античеловеческого IgG в анализе ELISA. Титр антител (мкг/мл) определяли для каждого спаривания тяжелой цепи с легкой цепью и титры с различными реаранжированными легкими цепями зародышевой линии человека сравнивали с титрами, полученными с молекулой исходного антитела (т.е. тяжелой цепью, образовавшей пару с родственной легкой цепью) и рассчитывали процент нативного титра (таблица 2). VH: вариабельный ген тяжелой цепи. Vκ: вариабельный ген легкой цепи κ. ND: не обнаружена экспрессия при текущих экспериментальных условиях.
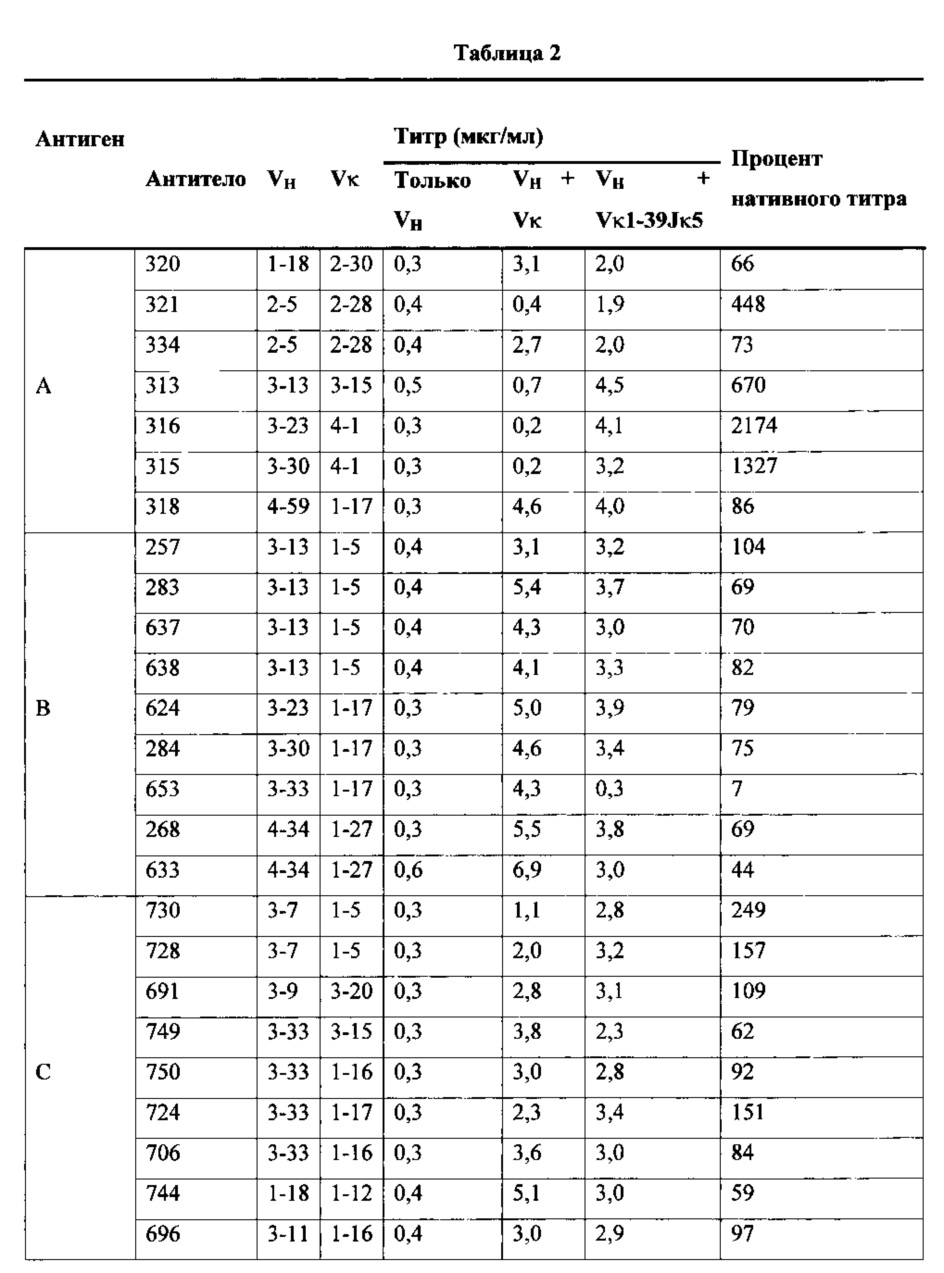
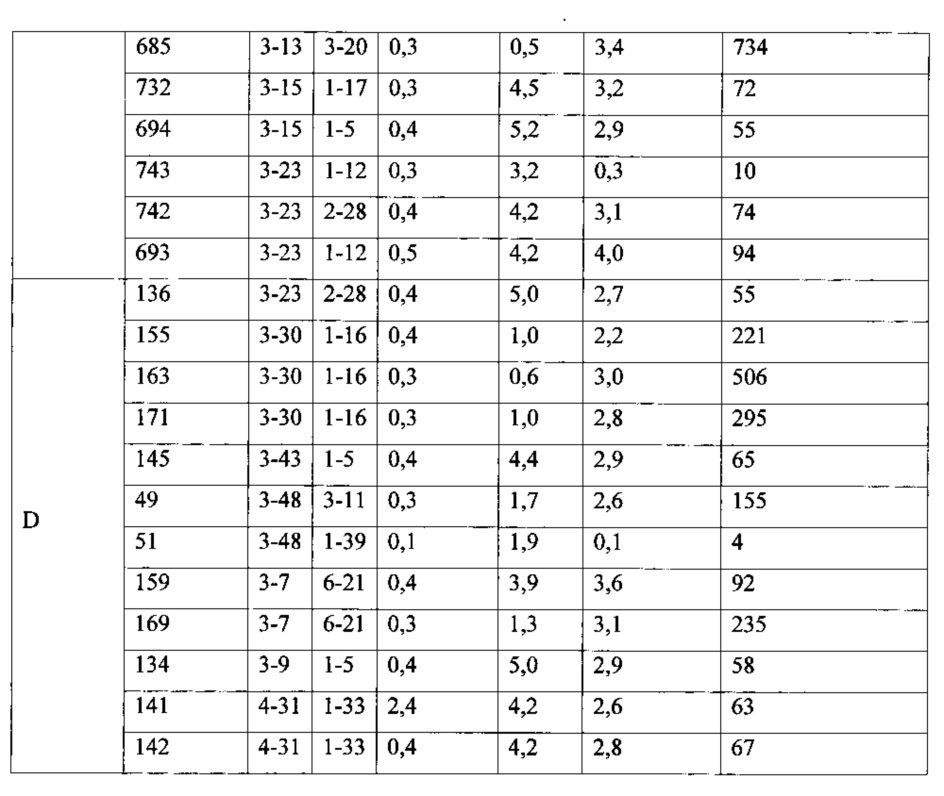
Полученные из этих экспериментов результаты показывают, что соматически мутированные, высокоаффинные тяжелые цепи из различных семейств генов способны образовывать пары с реаранжированными областями Vκ1-39Jκ5 и Vκ3-20Jκ1 зародышевой линии человека и секретироваться из клетки в виде нормальной молекулы антитела. Как показано в таблице 1, титр антител увеличивался приблизительно для 61% (42 из 69) тяжелых цепей при образовании пары с реаранжированной легкой цепью Vκ1-39Jκ5 человека и приблизительно для 29% (20 из 69) тяжелых цепей при образовании пары с реаранжированной легкой цепью Vκ3-20JκI человека, по сравнению с родственной легкой цепью исходного антитела. Приблизительно для 20% (14 из 69) тяжелых цепей обе реаранжированные легкие цепи зародышевой линии человека обеспечивали увеличение экспрессии, по сравнению с родственной легкой цепью исходного антитела. Как показано в таблице 2, реаранжированная область Vκ1-39Jκ5 зародышевой линии человека обеспечивала увеличение экспрессии нескольких тяжелых цепей, специфических для диапазона различных классов антигенов, по сравнению с родственной легкой цепью для исходных антител. Титр антител увеличивался более чем в два раза приблизительно для 35% (15/43) тяжелых цепей, по сравнению с родственной легкой цепью для исходных антител. Для двух тяжелых цепей (315 и 316) увеличение было больше чем десятикратным, по сравнению с исходным антителом. Во всех тяжелых цепях, которые показали увеличение экспрессии относительно родственной легкой цепи исходного антитела, тяжелые цепи третьего семейства (VH3) были представлены в избытке, по сравнению с другими генными семействами вариабельной области тяжелой цепи. Это демонстрирует благоприятное взаимодействие тяжелых цепей VH3 человека в образовании пар с реаранжированными легкими цепями Vκ1-39Jκ5 и Vκ3-20Jκ1 зародышевой линии человека.
Пример 2
Получение реаранжированного локуса легкой цепи зародышевой линии человека
Различные направленные векторы реаранжированной легкой цепи зародышевой линии человека получали с использованием технологии VELOOGENE® (смотрите, например, патент США №6586251 и Valenzuela et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotech. 21(6):652-659) для модификации мышиных геномных клонов на основе бактериальной искусственной хромосомы (ВАС) 302g12 и 254m04 (Invitrogen). С использованием этих двух ВАС-клонов геномные конструкты конструировали так, чтобы они содержали единственную реаранжированную область легкой цепи зародышевой линии человека и вставляли в эндогенный локус легкой цепи κ, который предварительно модифицировали для удаления эндогенных вариабельных и соединяющих генных сегментов κ.
Конструкция направленных векторов реаранжированной легкой цепи зародышевой линии человека.
Три различные реаранжированные области легкой цепи зародышевой линии человека получали с использованием стандартных молекулярно-биологических техник, принятых в настоящей области техники. Вариабельные генные сегменты человека, используемые для конструкции этих трех областей, включали в себя реаранжированную последовательность Vκ1-39Jκ5 человека, реаранжированную последовательность Vκ3-20Jκ1 человека и реаранжированную последовательность VpreBJλ5 человека.
Сегмент ДНК, содержащий экзон 1 (кодирующий лидерный пептид) и интрон 1 гена Vκ3-7 мыши, получали с помощью синтеза ДНК de novo (Integrated DNA Technologies). Включали часть 5' нетранслируемой области около встречающегося в природе сайта рестрикционного фермента BlpI. Экзоны генов Vκ1-39 и Vκ3-20 человека амплифицировали с помощью ПЦР из геномных ВАС-библиотек человека. Прямые праймеры содержали 5'-удлинение, содержащее акцепторный сайт сплайсинга интрона 1 гена Vκ3-7 мыши. Обратный праймер, используемый для ПЦР последовательности Vκ1-39 человека, содержал удлинение, кодирующее Jκ5 человека, тогда как обратный праймер, используемый для ПЦР последовательности Vκ3-20 человека, содержал удлинение, кодирующее JκI человека. Последовательность VpreBJλ5 человека получали с помощью синтеза ДНК de novo (Integrated DNA Technologies). Часть интрона Jκ-Cκ человека, содержащую донорный сайт сплайсинга, амплифицировали с помощью ПЦР из плазмиды pBS-296-HA18-PISceI. Прямой праймер ПЦР содержал удлинение, кодирующее часть либо последовательности Jκ5, JκI человека, либо Jλ5 человека. Обратный праймер содержал сайт PI-SceI, который ранее сконструировали в интрон.
Vκ3-7 экзон1/интрон 1 мыши, экзоны вариабельной легкой цепи человека и фрагменты Jκ-Cκ интрона человека сшивали вместе с помощью ПЦР перекрывающегося удлинения, расщепляли с помощью BlpI и PI-SceI и лигировали в плазмиду pBS-296-HA18-PISceI, которая содержала промотор из вариабельного генного сегмента Vκ3-15 человека. Фланкированную lox кассету гигромицина в плазмиде pBS-296-HA18-PISceI замещали фланкированной FRT кассетой гигромицина, фланкированной сайтами NotI и AscI. Фрагмент NotI/PI-SceI этой плазмиды лигировали в модифицированную ВАС 254 т04 мыши, которая содержала часть интрона Jκ-Cκ мыши, экзон Сκ мыши и приблизительно 75 т.п.н. геномной последовательности ниже по ходу транскрипции от локуса к мыши, которые обеспечивали 3' плечо гомологии для гомологичной рекомбинации в ЭС клетках мыши. Фрагмент NotI/AscI этой ВАС затем лигировали в модифицированную ВАС 302g12 мыши, которая содержала фланкированную FRT кассету неомицина и приблизительно 23 т.п.н. геномной последовательности выше против хода транскрипции от эндогенного локуса κ для гомологичной рекомбинации в ЭС клетках мыши.
Направленный вектор реаранжированной Vκ1-39Jκ5 зародышевой линии человека (фиг. 1). Сайты рестрикционных ферментов вводили на 5' и 3' концах сконструированной вставки легкой цепи для клонирования в направленный вектор: сайт AscI на 5' конце и сайт PI-SceI на 3' конце. В пределах 5' сайта AscI и 3' сайта PI-SceI направленный конструкт в направлении 5'-3' содержал 5' плечо гомологии, содержащее последовательность 5' по отношению к эндогенному локусу легкой цепи к мыши, полученному из клона ВАС 302g12 мыши, фланкированный FRT ген устойчивости к неомицину, геномную последовательность, содержащую промотор Vκ3-15 человека, лидерную последовательность вариабельного генного сегмента Vκ3-7 мыши, последовательность интрона вариабельного генного сегмента Vκ3-7 мыши, открытую рамку считывания реаранжированной зародышевой области Vκ1-39Jκ5 человека, геномную последовательность, содержащую часть интрона Jκ-Cκ человека и 3' плечо гомологии, содержащее последовательность 3' эндогенного генного сегмента Jκ5 мыши, полученного из клона ВАС 254 т04 мыши (фиг. 1, средняя часть). Гены и/или последовательности выше против хода транскрипции от эндогенного локуса легкой цепи к мыши и ниже по ходу транскрипции от наиболее 3' генного сегмента Jκ (например, эндогенный 3' энхансер) не были модифицированы направленным конструктом (смотрите фиг. 1). Последовательность сконструированного локуса Vκ1-39Jκ5 человека показана в SEQ ID NO: 1.
Направленную вставку реаранжированной области Vκ1-39Jκ5 зародышевой линии человека в ДНК ВАС подтверждали с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров, расположенных на последовательностях в пределах реаранжированной зародышевой области легкой цепи человека. Кратко, последовательность интрона 3' по отношению к лидерной последовательности Vκ3-7 мыши подтверждали с помощью праймеров ULC-m1F (AGGTGAGGGT ACAGATAAGT GTTATGAG; SEQ ID NO: 2) и ULC-m1R (TGACAAATGC CCTAATTATA GTGATCA; SEQ ID NO: 3). Открытую рамку считывания реаранжированной области Vκ1-39Jκ5 зародышевой линии человека подтверждали с помощью праймеров 1633-h2F (GGGCAAGTCA GAGCATTAGC A; SEQ ID NO: 4) и 1633-h2R (TGCAAACTGG ATGCAGCATA G; SEQ ID NO: 5). Кассету неомицина подтверждали с помощью праймеров neoF (ggtggagagg ctattcggc; SEQ ID NO: 6) и neoR (gaacacggcg gcatcag; SEQ ID NO: 7). Направленную ДНК ВАС затем использовали для электропорации ЭС клеток мыши для создания модифицированных ЭС клеток для получения химерных мышей, которые экспрессируют реаранжированную область Vκ1-39Jκ5 зародышевой линии человека.
Положительные ЭС клеточные клоны подтверждали с помощью Taqman™ скрининга и кариотипирования с использованием зондов, специфических для сконструированной области легкой цепи Vκ1-39Jκ5, вставленной в эндогенный локус. Кратко, зонд neoP (TGGGCACAAC AGACAATCGG CTG; SEQ ID NO: 8), который связывается в пределах маркерного гена неомицина, зонд ULC-m1P (CCATTATGAT GCTCCATGCC TCTCTGTTC; SEQ ID NO: 9), который связывается в пределах интронной последовательности 3' по отношению к лидерной последовательности Vκ3-7 мыши, и зонд 1633h2P (ATCAGCAGAA ACCAGGGAAA GCCCCT; SEQ ID NO: 10), который связывается в пределах открытой рамки считывания реаранжированной Vκ1-39Jκ5 зародышевой линии человека. Положительные ЭС клеточные клоны затем использовали для имплантации самкам мышей для получения помета детенышей, экспрессирующих область легкой цепи Vκ1-39Jκ5 зародышевой линии.
Альтернативно, ЭС клетки, несущие реаранжированную область легкой цепи Vκ1-39Jκ5 зародышевой линии человека, трансфицировали с конструктом, который экспрессирует FLP для удаления фланкированной FRT кассеты неомицина, введенной с помощью направленного конструкта. Необязательно, кассету неомицина удаляют путем скрещивания с мышами, которые экспрессируют рекомбиназу FLP (например, патент США №6774279). Необязательно, кассету неомицина сохраняют у мышей.
Направленный вектор реаранжированной Vκ3-20Jκ1 зародышевой линии человека (фиг. 2). Аналогичным образом, сконструированный локус легкой цепи, экспрессирующий реаранжированную область Vκ3-20Jκ1 зародышевой линии человека, получали с использованием направленного конструкта, содержащего, в направлении от 5' к 3', 5' плечо гомологии, содержащее последовательность 5' по отношению к эндогенному локусу легкой цепи к мыши, полученному из клона ВАС 302g12 мыши, фланкированный FRT устойчивый к неомицину ген, геномную последовательность, включающую в себя промотор Vκ3-15 человека, лидерную последовательность вариабельного генного сегмента Vκ3-7 мыши, последовательность интрона вариабельного генного сегмента Vκ3-7 мыши, открытую рамку считывания реаранжированной области Vκ3-20Jκ1 зародышевой линии человека, геномную последовательность, содержащую часть интрона Jκ-Cκ человека, и 3' плечо гомологии, содержащее последовательность 3' эндогенного генного сегмента Jκ5 мыши, полученного из клона ВАС 254 т04 мыши (фиг. 2, средняя часть). Последовательность сконструированного локуса Vκ3-20Jκ1 человека показана в SEQ ID NO: 11.
Направленную вставку реаранжированной области Vκ3-20Jκ1 зародышевой линии человека в ДНК ВАС подтверждали с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров, расположенных на последовательностях в пределах реаранжированной области легкой цепи Vκ3-20Jκ1 зародышевой линии человека. Вкратце, последовательность интрона 3' по отношению к лидерной последовательности Vκ3-7 мыши подтверждали с помощью праймеров ULC-m1F (SEQ ID NO: 2) и ULC-m1R (SEQ ID NO: 3). Открытую рамку считывания реаранжированной области Vκ3-20Jκ1 зародышевой линии человека подтверждали с помощью праймеров 1635-h2F (TCCAGGCACC CTGTCTTTG; SEQ ID NO: 12) и 1635-h2R (AAGTAGCTGC TGCTAACACT CTGACT; SEQ ID NO: 13). Кассету неомицина подтверждали с помощью праймеров neoF (SEQ ID NO: 6) и neoR (SEQ ID NO: 7). Направленную ДНК ВАС затем использовали для электропорации ЭС клеток мыши для создания модифицированных ЭС клеток для получения химерных мышей, которые экспрессируют реаранжированную легкую цепь Vκ3-20Jκ1 зародышевой линии человека.
Положительные ЭС клеточные клоны подтверждают с помощью Taqman™ скрининга и кариотипирования с использованием зондов, специфических для сконструированной области легкой цепи Vκ3-20Jκ1, вставленной в эндогенный локус легкой цепи к. Кратко, зонд neoP (SEQ ID NO: 8), который связывается в пределах маркерного гена неомицина, зонд ULC-mlP (SEQ ID NO: 9), который связывается в пределах лидерной последовательности Vκ3-7 мыши, и зонд 1635h2P (AAAGAGCCAC CCTCTCCTGC AGGG; SEQ ID NO: 14), который связывается в пределах открытой рамки считывания Vκ3-20Jκ1 человека. Положительные ЭС клеточные клоны затем используют для имплантации самкам мышей для получения помета детенышей, экспрессирующих зародышевую область легкой цепи.
Альтернативно, ЭС клетки, несущие реаранжированную область легкой цепи Vκ3-20Jκ1 зародышевой линии человека, могут быть трансфицированы с конструктом, который экспрессирует FLP для удаления фланкированной FRT кассеты неомицина, введенной с помощью направленного конструкта. Необязательно, кассету неомицина удаляют путем скрещивания с мышами, которые экспрессируют рекомбиназу FLP (например, патент США №6774279). Необязательно, кассету неомицина сохраняют у мышей.
Направленный вектор реаранжированной VpreBJλ5 зародышевой линии человека (фиг. 3). Аналогичным образом, сконструированный локус легкой цепи, экспрессирующий реаранжированную область VpreBJλ5 зародышевой линии человека, получали с использованием направленного конструкта, включающего в себя, в направлении от 5' к 3', 5' плечо гомологии, содержащее последовательность 5' по отношению к эндогенному локусу легкой цепи к мыши, полученному из клона ВАС 302g 12 мыши, фланкированный FRT устойчивый к неомицину ген, геномную последовательность, включающую в себя промотор Vκ3-15 человека, лидерную последовательность вариабельного генного сегмента Vκ3-7 мыши, последовательность интрона вариабельного генного сегмента Vκ3-7 мыши, открытую рамку считывания реаранжированной области VpreBJλ5 зародышевой линии человека, геномную последовательность, содержащую часть интрона Jκ-Cκ человека, и 3' плечо гомологии, содержащее последовательность 3' эндогенного генного сегмента Jκ5 мыши, полученного из клона ВАС 254m04 мыши (фиг. 3, средняя часть). Последовательность сконструированного локуса VpreBJλ5 человека показана в SEQ ID NO: 15.
Направленную вставку реаранжированной области VpreBJλ5 зародышевой линии человека в ДНК ВАС подтверждали с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров, расположенных на последовательностях в пределах реаранжированной области легкой цепи VpreBJλ5 зародышевой линии человека. Вкратце, последовательность интрона 3' по отношению к лидерной последовательности Vκ3-7 мыши подтверждали с помощью праймеров ULC-m1F (SEQ ID NO: 2) и ULC-m1R (SEQ ID NO: 3). Открытую рамку считывания реаранжированной области VpreBJλ5 зародышевой линии человека подтверждали с помощью праймеров 1616-h1F (TGTCCTCGGC CCTTGGA; SEQ ID NO: 16) и 1616-h1R (CCGATGTCAT GGTCGTTCCT; SEQ ID NO: 17). Кассету неомицина подтверждали с помощью праймеров neoF (SEQ ID NO: 6) и neoR (SEQ ID NO: 7). Направленную ДНК ВАС затем использовали для электропорации ЭС клеток мыши для создания модифицированных ЭС клеток для получения химерных мышей, которые экспрессируют реаранжированную легкую цепь VpreBJλ5 зародышевой линии человека.
Положительные ЭС клеточные клоны подтверждают с помощью Taqman™ скрининга и кариотипирования с использованием зондов, специфических для сконструированной области легкой цепи VpreBJλ5, вставленной в эндогенный локус легкой цепи κ. Вкратце, зонд neoP (SEQ ID NO: 8), который связывается в пределах маркерного гена неомицина, зонд ULC-m1P (SEQ ID NO: 9), который связывается в пределах лидерной последовательности Vκ3-7 мыши, и зонд 1616h1P (ACAATCCGCC TCACCTGCAC ССТ; SEQ ID NO: 18), который связывается в пределах открытой рамки считывания VpreBJλ5 человека. Положительные ЭС клеточные клоны затем используют для имплантации самкам мышей для получения помета детенышей, экспрессирующих зародышевую область легкой цепи.
Альтернативно, ЭС клетки, несущие реаранжированную область легкой цепи VpreBJλ5 зародышевой линии человека, могут быть трансфицированы с конструктом, который экспрессирует FLP для удаления фланкированной FRT кассеты неомицина, введенной с помощью направленного конструкта. Необязательно, кассету неомицина удаляют путем скрещивания с мышами, которые экспрессируют рекомбиназу FLP (например, патент США №6774279). Необязательно, кассету неомицина сохраняют у мышей.
Пример 3
Получение мышей, экспрессирующих единственную реаранжированную легкую цепь человека
Описанные выше направленные ЭС клетки использовали в качестве донорных ЭС клеток и вводили в эмбрион мыши на стадии 8 клеток с помощью способа VELOCIMOUSE® (смотрите, например, патент США №7294754 и Poueymirou et al. (2007) F0 generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses, Nature Biotech. 25(1):91-99). VELOCIMICE®, несущих независимо сконструированную зародышевую область легкой цепи Vκ1-39Jκ5 человека, область легкой цепи Vκ3-20Jκ1 или область легкой цепи VpreBJλ5, идентифицировали путем генотипирования с использованием модификации анализа аллелей (Valenzuela et al., ранее), который обнаруживает присутствие уникальной реаранжированной области легкой цепи зародышевой линии человека.
Детенышей генотипируют, и детеныша, гетерозиготного или гомозиготного в отношении уникальной реаранжированной области легкой цепи зародышевой линии человека выбирают путем получения характеристик экспрессии реаранжированной области легкой цепи зародышевой линии человека.
Проточная цитометрия. Экспрессию реаранжированной области легкой цепи человека в репертуаре нормальных антител мышей с общей легкой цепью подтверждали с помощью анализа экспрессии κ и λ иммуноглобулина в спленоцитах и периферической крови мышей с общей легкой цепью. Суспензии клеток от собранных селезенок и периферической крови мышей дикого типа (n=5), мышей, гетерозиготных в отношении общей легкой цепи Vκ1-39Jκ5 (n=3), гомозиготных в отношении общей легкой цепи Vκ1-39Jκ5 (n=3), гетерозиготных в отношении общей легкой цепи Vκ3-20Jκ1 (n=2) и гомозиготных в отношении общей легкой цепи Vκ3-20Jκ1 (n=2), получали с использованием стандартных способов и окрашивали с помощью CD19+, IgI+ и Igκ+ с использованием флуоресцентно меченых антител (BD Pharmigen).
Вкратце, 1×106 клеток инкубировали с антимышиным CD16/CD32 (клон 2.4G2, BD Pharmigen) на льду в течение 10 минут с последующим мечением следующим коктейлем антител в течение 30 минут на льду: конъюгированный с АРС антимышиный CD19 (клон 1D3, BD Pharmigen), конъюгированный с PerCP-Су5.5 антимышиный CD3 (клон 17А2, BioLegend), конъюгированный с FITC антимышиный Igκ (клон 187.1, BD Pharmigen), конъюгированный с РЕ антимышиный Igλ, (клон RML-42, BioLegend). После окрашивания клетки отмывали и фиксировали в 2% формальдегиде. Сбор данных проводили на проточном цитометре LSRII и анализировали с помощью FlowJo™. Гейтирование: общие В-клетки (CD19+CD3-), Igκ+ В-клетки (Igκ+Igλ-CD19+CD3-), Igλ+ В-клетки (Igκ-Igλ+CD19+CD3-). Данные, собранные от образцов крови и спленоцитов, показали сходные результаты. В таблице 3 представлено процентное отношение положительных CD19+ В-клеток из периферической крови одной репрезентативной мыши из каждой группы, которые представляют собой Igλ+, Igκ+ или Igλ+Igκ+. Процентное отношение CD19+ В-клеток в периферической крови от мышей дикого типа (WT) и мышей, гомозиготных в отношении общей легкой цепи или Vκ1-39Jκ5, или Vκ3-20Jκ1, показаны на фиг. 4.
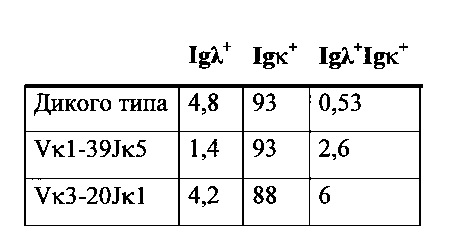
Экспрессия общей легкой цепи. Экспрессию каждой общей легкой цепи (Vκ1-39Jκ5 и Vκ3-20Jκ1) анализировали у гетерозиготных и гомозиготных мышей с использованием анализа количественной ПЦР (например, Taqman™).
Вкратце, очищали CD19+ В-клетки из селезенок мышей дикого типа, мышей, гомозиготных в отношении замещения локусов вариабельной области тяжелой цепи и легкой к цепи мыши соответствующими локусами вариабельной области тяжелой цепи и к легкой цепи (Нκ) человека, а также мышей, гомозиготных и гетерозиготных в отношении каждой реаранжированной области легкой цепи человека (Vκ1-39Jκ5 или Vκ3-20Jκ1) с использованием мышиных CD19 Microbeads (Miltenyi Biotec) в соответствии с инструкциями производителя. Общую РНК очищали от CD19+ В-клеток с использованием мининабора RNeasy (Qiagen) в соответствии с инструкциями производителя и геномную РНК удаляли с использованием обработки не содержащей РНКазу ДНКазой на колонке (Qiagen). 200 нг мРНК обратно транскрибировали в кДНК с использованием набора First Stand cDNA Synthesis (Invitrogen) и полученную кДНК амплифицировали с использованием универсального мастер-микса для ПЦР Taqman (Applied Biosystems). Все реакции проводили с использованием системы обнаружения последовательности ABI 7900 (Applied Biosystems) с использованием праймеров и Taqman™ MGB зондов, охватывающих (1) участок соединения Vκ-Jκ для обеих общих легких цепей, (2) только ген Vκ (т.е. Vκ1-39 и Vκ3-20) и (3) область Сκ мыши. В таблице 4 представлены последовательности праймеров и зондов, используемых для настоящего анализа. Относительную экспрессию нормировали к экспрессии области Сκ мыши. Результаты показаны на фиг. 5А, 5В и 5С.

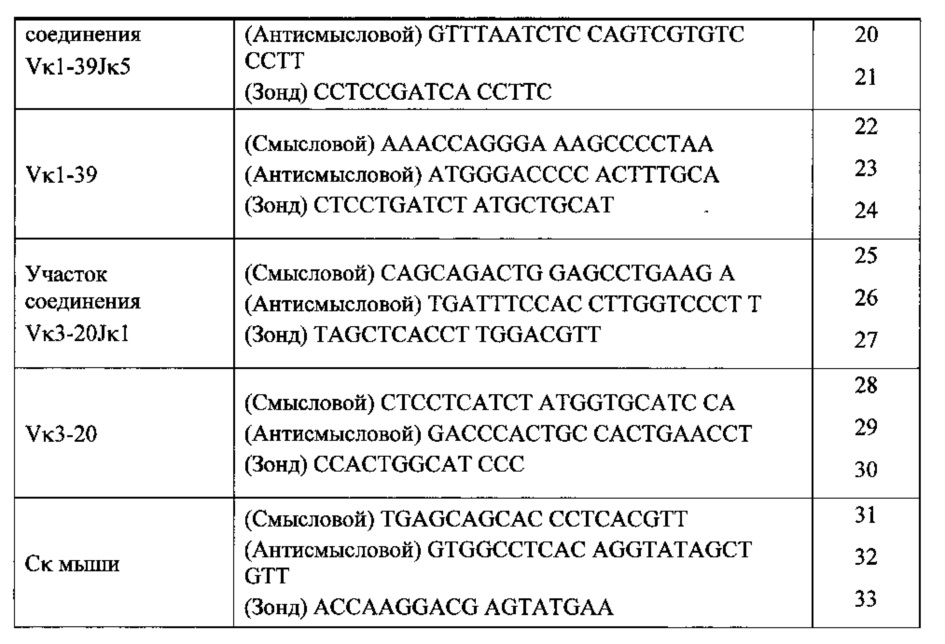
Антигенспецифические антитела с общей легкой цепью. Мышей с общей легкой цепью, несущих общую легкую цепь или Vκ1-39Jκ5, или Vκ3-20Jκ1 на эндогенном локусе легкой цепи к мыши, иммунизировали с помощью β-галактозидазы и измеряли титр антител.
Вкратце, β-галактозидазу (Sigma) эмульгировали в адъюванте titermax (Sigma), согласно инструкциям производителя. Мышей дикого типа (n=7), гомозиготных в отношении общей легкой цепи Vκ1-39Jκ5 (n=2) и гомозиготных в отношении общей легкой цепи Vκ3-20Jκ1 (n=5) иммунизировали с помощью подкожной инъекции β-галактозидазы/Titermax в количестве 100 мкг. Мышей повторно иммунизировали с помощью подкожной инъекции β-галактозидазы/Titermax в количестве 50 мкг два раза, с интервалом в 3 недели. После второй повторной иммунизации кровь собирали из находящихся под анестезией мышей с использованием ретроорбитального кровотечения в пробирки для отделения сыворотки (BD Biosciences) согласно инструкциям производителя. Для измерения антител IgM или IgG к β-галактозидазе планшеты для ELISA (Nunc) покрывали 1 мкг/мл β-галактозидазы в течение ночи при 4°С. Избыток антигенов смывали перед блокированием с помощью PBS с 1% BSA в течение одного часа при комнатной температуре. Серийные разведения сыворотки добавляли к планшетам и инкубировали в течение одного часа при комнатной температуре перед отмыванием. Планшеты затем инкубировали с конъюгированным с HRP анти-IgM (Southern Biotech) или анти-IgG (Southern Biotech) в течение одного часа при комнатной температуре. После следующего отмывания планшеты проявляли с помощью субстрата ТМВ (BD Biosciences). Реакции останавливали с помощью 1 н. серной кислоты и считывали OD450 с использованием сканирующего спектрофотометра для считывания планшетов Victor Х5 (Perkin Elmer). Данные анализировали с помощью GraphPad Prism и сигнал рассчитывали как разведение сыворотки, которое в два раза выше фонового значения. Результаты показаны на фиг. 6А и 6В.
Как показано в настоящем примере, отношение κ/λ В-клеток как в компартменте селезенки, так и в периферических компартментах мышей с общей легкой цепью Vκ1-39Jκ5 и Vκ3-20Jκ1 показало паттерн приблизительно дикого типа (таблица 3 и фиг. 4). Мыши с общей легкой цепью VpreBJλ5, тем не менее, показали меньшее количество периферических В-клеток, из которых приблизительно 1-2% экспрессируют сконструированную область легкой цепи человека (данные не показаны). Уровни экспрессии реаранжированных областей легкой цепи человека Vκ1-39Jκ5 и Vκ3-20Jκ1 из эндогенного локуса легкой цепи к повышались, по сравнению с эндогенным локусом легкой цепи κ, содержащим полное замещение генных сегментов Vκ и Jκ мыши генными сегментами Vκ и Jκ человека (фиг. 5А, 5В и 5С). Уровни экспрессии VpreBJλ5 реаранжированной области легкой цепи человека демонстрировали сходную высокую экспрессию из эндогенного локуса легкой цепи κ, как у гетерозиготных, так и гомозиготных мышей (данные не показаны). Это демонстрирует, что в прямой конкуренции с мышиными λ, κ или обоими эндогенными локусами легкой цепи, единственная реаранжированная последовательность VL/JL человека может давать в результате более высокие уровни, чем уровень экспрессии дикого типа из эндогенного локуса легкой цепи κ, и приводить к нормальному количеству В-клеток селезенки и крови. Более того, присутствие сконструированного локуса легкой цепи κ, характеризующегося или последовательностью Vκ1-39Jκ5 человека, или Vκ3-20Jκ1 человека, будет хорошо переноситься мышами и, вероятно, функционировать способом дикого типа путем репрезентации значительной части репертуара легких цепей в гуморальном компоненте иммунного ответа (фиг. 6А и 6В).
Пример 4
Скрещивание мышей, экспрессирующих единственную реаранжированную легкую цепь зародышевой линии человека
В настоящем примере описаны некоторые другие линии генетически модифицированных мышей, которые могут скрещиваться с какой-либо из описанных в настоящем документе мышей с общей легкой цепью для создания множественных линий генетически модифицированных мышей, характеризующихся множественными генетически модифицированными локусами иммуноглобулина.
Нокаут эндогенной Igλ (КО). Для оптимизации частоты использования сконструированного локуса легкой цепи, мышей, несущих одну из реаранжированных областей легкой цепи зародышевой линии человека, скрещивают с другой мышью, содержащей делецию в эндогенном локусе легкой цепи λ. Таким образом, полученное потомство будет экспрессировать в качестве своей единственной легкой цепи реаранжированную область легкой цепи зародышевой линии человека, как описано в примере 2. Скрещивание проводят с помощью стандартных техник, принятых в настоящей области техники и, альтернативно, с помощью коммерческого производителя (например, Jackson Laboratory). Линии мышей, несущие сконструированный локус легкой цепи и делецию эндогенного локуса легкой цепи λ, подвергают скринингу в отношении присутствия уникальной области легкой цепи и отсутствия эндогенных легких цепей λ мыши.
Гуманизированный эндогенный локус тяжелой цепи. Мышей, несущих сконструированный зародышевый локус легкой цепи человека, скрещивают с мышами, которые содержат замещение эндогенного вариабельного генного локуса тяжелой цепи мыши вариабельным генным локусом тяжелой цепи человека (смотрите патент США №6596541; мышь VELOCIMMUNE®, Regeneran Pharmaceuticals, Inc.). Мышь VELOCIMMUNE® содержит геном, содержащий вариабельные области тяжелой цепи человека, функционально связанные с эндогенными локусами константной области мыши так, чтобы мышь производила антитела, содержащие вариабельную область тяжелой цепи человека и константную область тяжелой цепи мыши в ответ на антигенную стимуляцию. ДНК, кодирующая вариабельные области тяжелых цепей антител, выделяют и функционально связывают с ДНК, кодирующей константные области тяжелой цепи человека. ДНК затем экспрессируют в клетке, способной к экспрессии полностью человеческой тяжелой цепи антитела.
Получают мышей, несущих замещение эндогенного локуса VH мыши локусом VH человека, и единственную реаранжированную зародышевую область VL человека на эндогенном локусе легкой цепи κ. Обратные химерные антитела, содержащие соматически мутированные тяжелые цепи (VH человека и CH мыши) с единственной легкой цепью человека (VL человека и CL мыши) получают при иммунизации с помощью представляющего интерес антигена. Определяют нуклеотидные последовательности VH и VL В-клеток, экспрессирующих антитела и полностью человеческие антитела получают путем слияния нуклеотидных последовательностей VH и VL с нуклеотидными последовательностями CH и CL человека в подходящей системе экспрессии.
Пример 5
Получение антител из мышей, экспрессирующих тяжелые цепи человека и реаранжированную область легкой цепи зародышевой линии человека
После скрещивания мышей, которые содержат сконструированную область легкой цепи человека с различными необходимыми линиями, содержащими модификации и делеции других эндогенных локусов Ig (как описано в примере 4), выбранных мышей могут иммунизировать с помощью представляющего интерес антигена.
Как правило, мышь VELOCIMMUNE®, содержащую одну из единственных реаранжированных зародышевых областей легкой цепи человека, подвергают сенсибилизации с помощью антигена, и лимфатические клетки (такие как В-клетки) выделяют из сыворотки животных. Лимфатические клетки подвергают слиянию с миеломной клеточной линией для получения иммортализированных гибридомных клеточных линий, и такие гибридомные клеточные линии подвергают скринингу и селекции для идентификации гибридомных клеточных линий, которые производят антитела, содержащие вариабельные области тяжелой цепи человека и реаранжированные зародышевые легкие цепи человека, которые представляют собой специфические по отношению к используемому для иммунизация антигену. ДНК, кодирующую вариабельные области тяжелых цепей и легкой цепи, выделяют и связывают с необходимыми изотопическими константными областями тяжелой цепи и легкой цепи. Вследствие присутствия эндогенных последовательностей мыши и каких-либо дополнительных цис-действующих элементов, присутствующих в эндогенном локусе, единственная легкая цепь каждого антитела может быть соматически мутировала. Это вносит дополнительное разнообразие в антигенспецифический репертуар, содержащий единственную легкую цепь и разнообразные последовательности тяжелой цепи. Полученные клонированные последовательности антитела впоследствии экспрессируют в такой клетке, как СНО клетка. Альтернативно, ДНК, кодирующие антигенспецифические химерные антитела или вариабельные домены легких и тяжелых цепей, определяют непосредственно из антигенспецифических лимфоцитов.
Вначале выделяют высокоаффинные химерные антитела, содержащие вариабельную область человека и константную область мыши. Как описано выше, определяют характеристики антител и проводят отбор антител в отношении необходимых характеристик, включающих в себя аффинность, селективность, эпитоп и т.д. Константные области мыши замещают необходимой константной областью человека для получения полностью человеческого антитела, содержащего соматически мутированную тяжелую цепь человека и единственную легкую цепь, происходящую из реаранжированной области легкой цепи зародышевой линии человека согласно настоящему изобретению. Подходящие константные области человека включают в себя, например, IgG1 или IgG4 дикого типа или модифицированные IgG1 или IgG4.
Отдельные когорты мышей VELOCIMMUNE®, содержащие замещение эндогенного локуса тяжелой цепи мыши генными сегментами VH, DH и JH человека и замещение эндогенного локуса легкой цепи к мыши либо сконструированной областью легкой цепи Vκ1-39Jκ5 зародышевой линии человека, либо сконструированной областью легкой цепи Vκ3-20Jκ1 зародышевой линии человека (описанными выше), иммунизировали с помощью белка рецептора клеточной поверхности человека (антиген Е). Антиген Ε вводят непосредственно в подушечку стопы задней лапы мышей с помощью шести последовательных инъекций каждые 3-4 дня. 2-3 мкг антигена Ε смешивают с 10 мкг CpG олигонуклеотида (№ по кат. tlrl-modn - ODN1826 олигонуклеотид; InVivogen, Сан-Диего, Калифорния) и с 25 мкг Adju-Phos (гелевый адъювант фосфата алюминия, № по кат. Н-71639-250; Brenntag Biosector, Фредерикссунд, Дания) перед инъекцией. В общем шесть инъекций вводят перед последней повторной иммунизацией антигеном, который вводят за 3-5 дней до умерщвления. Образцы крови после 4-ой и 6-ой инъекции собирают и иммунный ответ антител подвергают мониторингу с помощью стандартного антигенспецифического иммуноанализа.
Когда достигается необходимый иммунный ответ, спленоциты собирают и подвергают слиянию с миеломными клетками мыши для сохранения их жизнеспособности и образования гибридомных клеточных линий. Гибридомные клеточные линии подвергают скринингу и селекции для идентификации клеточных линий, которые производят специфические к антигену Ε антитела с общей легкой цепью. С использованием этой техники получают некоторые специфические к антигену Ε антитела с общей легкой цепью (т.е. антитела, обладающие вариабельными доменами тяжелой цепи человека, одинаковым вариабельным доменом легкой цепи человека и константными доменами мыши).
Альтернативно, антитела с общей легкой цепью к антигену Ε выделяют непосредственно из антигенположительных В-клеток без слияния с миеломными клетками, как описано в заявке на патент США №2007/0280945Al, специально полностью включенной в настоящий документ посредством ссылки. С использованием настоящего способа получали некоторые полностью человеческие антитела с общей легкой цепью к антигену Ε (т.е. антитела, обладающие вариабельными доменами тяжелой цепи человека или сконструированной областью легкой цепи Vκ1-39Jκ5 человека, или сконструированной областью легкой цепи Vκ3-20Jκ1 человека и константными доменами человека).
Биологические свойства иллюстративных антител к антигену Ε с общей легкой цепью, полученных согласно способам настоящего примера, подробно описаны в разделах, представленных ниже.
Пример 6
Частота использования генных сегментов тяжелой цепи в антигенспецифических антителах с общей легкой цепью
Для анализа структуры произведенных человеческих антител к антигену Ε с общей легкой цепью нуклеиновые кислоты, кодирующие вариабельные области тяжелой цепи антитела, клонировали и секвенировали. Из последовательностей нуклеиновых кислот и предсказанных аминокислотных последовательностей антител частоту использования генов идентифицировали для вариабельной области тяжелой цепи (HCVR) выбранных антител с общей легкой цепью, полученных из иммунизированных мышей VELOCIMMUNE®, содержащих либо сконструированную область легкой цепи Vκ1-39Jκ5 человека, либо сконструированную область легкой цепи Vκ3-20Jκ1 человека. Результаты показаны в таблицах 5 и 6, в которых показано, что мыши согласно настоящему изобретению образуют антиген-специфические антитела с общей легкой цепью из разнообразных генных сегментов тяжелой цепи человека, вследствие разнообразия реаранжировок, при использовании мыши, которая экспрессирует легкую цепь только из легкой цепи, происходящей из Vκ1-39 человека или Vκ3-20 человека. Генные сегменты VH человека из 2, 3, 4 и 5 семейств реаранжировали с разнообразными сегментами человека DH и сегментами человека JH для получения антиген-специфических антител.
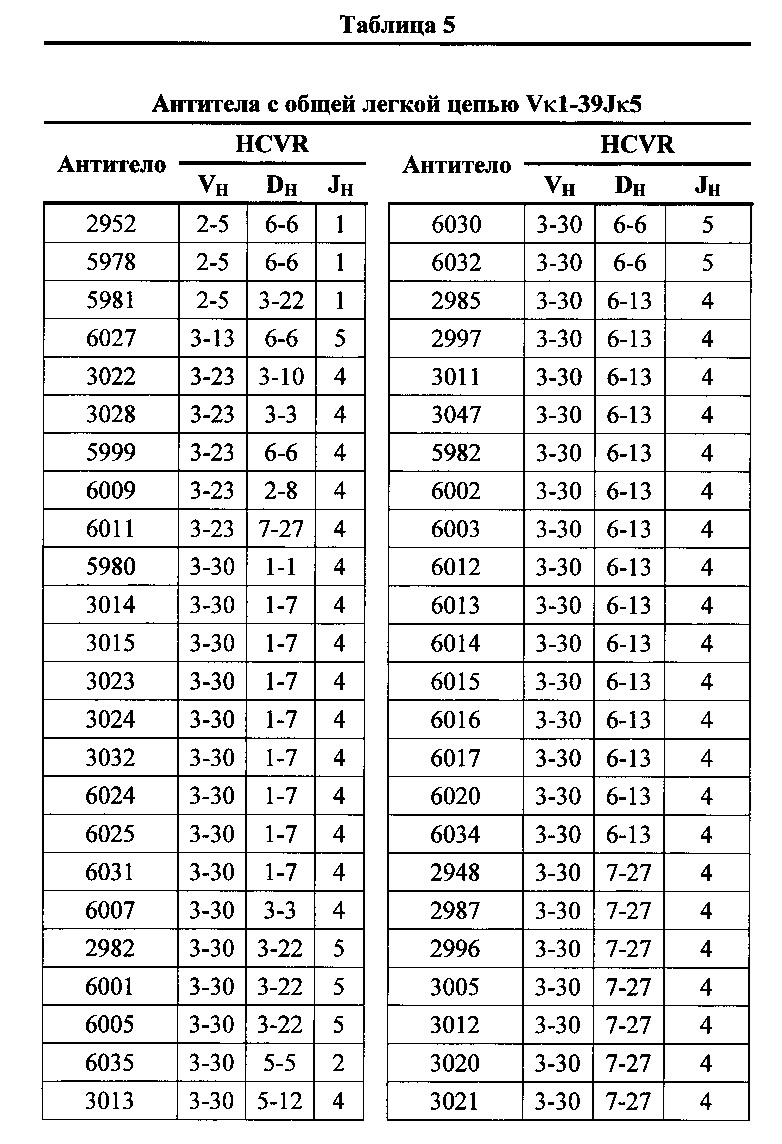
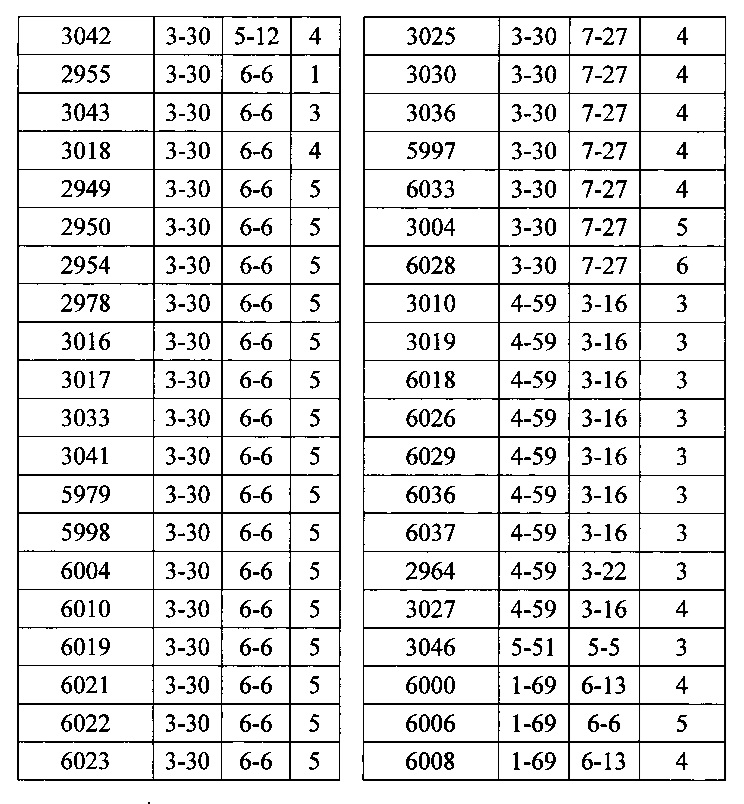
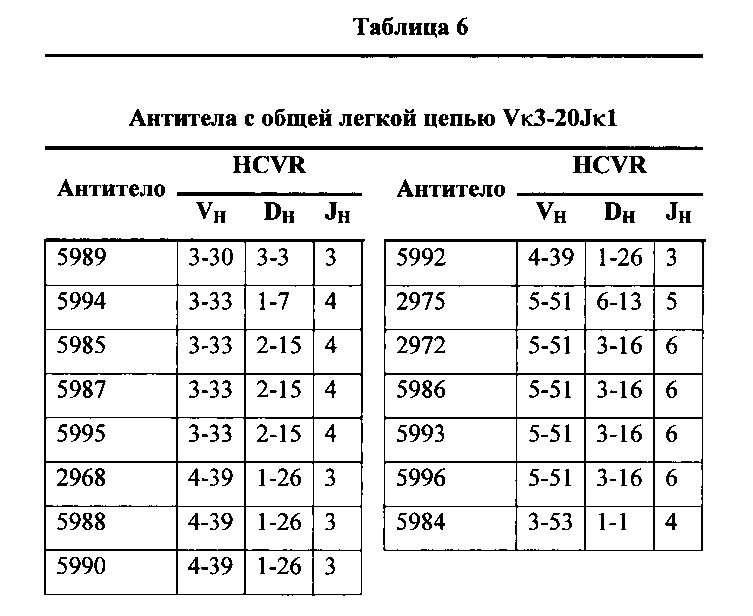
Пример 7
Определение блокирующей способности антиген-специфических антител с общей легкой цепью с помощью анализа LUMINEX™
Девяносто восемь антител с общей легкой цепью человека, возникших против антигена Е, анализировали в отношении их способности блокировать связывание естественного лиганда антигена Ε (лиганда Υ) с антигеном Ε в исследовании на основе изучения гранул.
Внеклеточный домен (ECD) антигена Ε конъюгировали с двумя метками туе эпитопа и 6Х гистидиновой меткой (антиген E-mmH) и связывали через аминогруппу с карбоксилированными микрогранулами в концентрации 20 мкг/мл в буфере MES. Смесь инкубировали в течение двух часов при комнатной температуре с последующей дезактивацией гранул с помощью 1 M Tris рН 8,0 с последующей отмывкой в PBS с 0,05% (объем/объем) Tween-20. Гранулы затем блокировали с помощью PBS (Irvine Scientific, Санта-Ана, Калифорния), содержащего 2% (вес/объем) BSA (Sigma-Aldrich Corp., Сент-Луис, Миссури). В 96-луночном планшете для фильтрации супернатанты, содержащие специфические к антигену Ε антитела с общей легкой цепью, разбавляли 1:15 в буфере. Получали отрицательный контроль, содержащий имитацию супернатанта с компонентами сред, аналогичными супернатанту антител. Меченные антигеном Ε гранулы добавляли к супернатантам и инкубировали в течение ночи при 4°С. Белок биотинилированного лиганда Y добавляли до конечной концентрации, составляющей 0,06 нМ, и инкубировали в течение двух часов при комнатной температуре. Обнаружение биотинилированного лиганда Y, связанного с меченными комплексом антиген E-myc-myc-6His гранулами, определяли с помощью конъюгированного со стрептавидином R-фикоэритрином (Moss Inc, Пасадена, Мериленд) с последующим измерением на основанном на проточной цитометрии анализаторе LUMINEX™. Фоновую среднюю интенсивность флуоресценции (MFI) образца без лиганда Y вычитали из всех образцов. Процент блокирования рассчитывали путем деления вычтенного из фонового значения MFI каждого образца на скорректированное значение отрицательного контроля, умножая на 100 и вычитая полученное значение из 100.
Согласно аналогичному эксперименту такие же 98 антител с общей легкой цепью человека, возникших против антигена Е, анализировали в отношении их способности блокировать связывание антигена Ε с меченными лигандом Y гранулами.
Вкратце, лиганд Y связывали через аминогруппу с карбоксилированными микрогранулами в концентрации 20 мкг/мл с разведением в буфере MES. Смесь инкубировали в течение двух часов при комнатной температуре с последующей дезактивацией гранул с помощью 1М Tris рН 8, затем отмывая в PBS с 0,05% (объем/объем) Tween-20. Гранулы затем блокировали с помощью PBS (Irvine Scientific, Санта-Ана, Калифорния), содержащего 2% (вес/объем) BSA (Sigma-Aldrich Corp., Сент-Луис, Миссури). В 96-луночном планшете для фильтрации супернатанты, содержащие специфические для антигена Е антитела с общей легкой цепью, разбавляли 1:15 в буфере. Получали отрицательный контроль, содержащий имитацию супернатанта с компонентами сред, аналогичными супернатанту антител. Биотинилированный антиген E-mmH добавляли до конечной концентрации, составляющей 0,42 нМ, и инкубировали в течение ночи при 4°С. Меченные лигандом Y гранулы затем добавляли к смеси антитела с антигеном Е и инкубировали в течение двух часов при комнатной температуре. Обнаружение биотинилированного антигена E-mmH, связанного с меченными лигандом Y гранулами, определяли с помощью R-фикоэритрина, конъюгированного со стрептавидином (Moss Inc, Пасадена, Мериленд) с последующим измерением на основанном на проточной цитометрии анализаторе LUMINEX™. Фоновую среднюю интенсивность флуоресценции (MFI) образца без антигена Е вычитали из всех образцов. Процент блокирования рассчитывали путем деления вычтенного из фонового значения MFI каждого образца на скорректированное значение отрицательного контроля, умножая на 100 и вычитая полученное значение из 100.
На таблицах 7 и 8 показан процент блокирования для всех 98 антител к антигену Е с общей легкой цепью, исследованных в обоих анализах LUMINEX™. ND: не определено при текущих экспериментальных условиях.


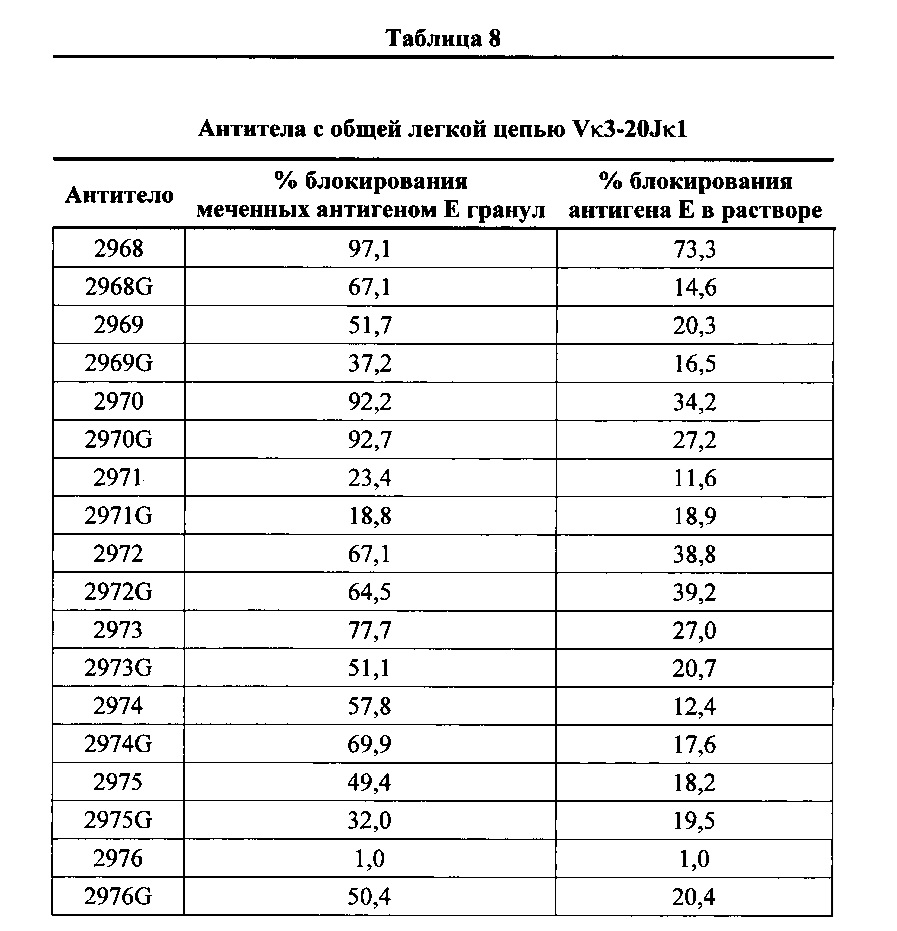
В первом описанном выше эксперименте LUMINEX™ 80 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ1-39Jκ5, исследовали в отношении их способности блокировать связывание лиганда Y с меченными антигеном Е гранулами. Из этих 80 антител с общей легкой цепью 68 продемонстрировали блокирование >50%, наряду с тем, что 12 продемонстрировали блокирование <50% (6 при 25-50% блокировании и 6 при блокировании <25%). Для 18 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ3-20Jκ1, 12 продемонстрировали блокирование >50%, наряду с тем, что 6 продемонстрировали блокирование <50% (3 при 25-50% блокировании и 3 при блокировании <25%) связывания лиганда Y с меченными антигеном Е гранулами.
Во втором описанном выше эксперименте LUMINEX™ те же 80 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ1-39Jκ5, исследовали в отношении их способности блокировать связывание антигена Ε с меченными лигандом Y гранулами. Из этих 80 антител с общей легкой цепью 36 продемонстрировали блокирование >50%, наряду с тем, что 44 продемонстрировали блокирование <50% (27 при 25-50% блокировании и 17 при блокировании <25%). Для 18 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ3-20Jκ1, 1 продемонстрировало блокирование >50%, наряду с тем, что 17 продемонстрировали блокирование <50% (5 при 25-50% блокировании и 12 при блокировании <25%) связывания антигена Ε с меченными лигандом Y гранулами.
Данные таблиц 7 и 8 показывают, что описанные в таблицах 5 и 6 реаранжировки создают специфические для антигена Ε антитела с общей легкой цепью, которые блокировали связывание лиганда Y с его родственным рецептором антигеном Ε с переменными степенями эффективности, что находится в соответствии с антителами к антигену Ε с общей легкой цепью из таблиц 5 и 6, содержащих антитела со специфичностью к перекрывающимся и неперекрывающимся эпитопам по отношению к антигену Е.
Пример 8
Определение способности к блокированию антиген-специфических антител с общей легкой цепью с помощью ELISA
Человеческие антитела с общей легкой цепью, возникшие к антигену Е, исследовали в отношении их способности блокировать связывание антигена Ε с покрытой лигандом Y поверхностью в анализе ELISA.
Лигандом Y покрывали 96-луночные планшеты в концентрации 2 мкг/мл с разведением в PBS и инкубировали в течение ночи с последующей четырехкратной отмывкой в PBS с 0,05% Tween-20. Планшет затем блокировали с помощью PBS (Irvine Scientific, Санта-Ана, Калифорния), содержащего 0,5% (вес/объем) BSA (Sigma-Aldrich Corp., Сент-Луис, Миссури) в течение одного часа при комнатной температуре. В отдельном планшете супернатанты, содержащие антитела с общей легкой цепью к антигену Ε разбавляли 1:10 в буфере. Имитацию супернатанта с такими же компонентами антител использовали в качестве отрицательного контроля. Антиген Е-mmH (описанный выше) добавляли до конечной концентрации 0,150 нМ и инкубировали в течение одного часа при комнатной температуре. Смесь антитело/антиген E-mmH затем добавляли к содержащему лиганд Y планшету и инкубировали в течение одного часа при комнатной температуре. Обнаружение антигена E-mmH, связанного с лигандом Y, определяли с помощью пероксидазы хрена (HRP), конъюгированной с антителом к пента-His (Qiagen, Валенсия, Калифорния) и проявляли с помощью стандартной колориметрической реакции с использованием субстрата тетраметилбензидина (ТМВ) (BD Biosciences, Сан-Хосе, Калифорния), нейтрализованного серной кислотой. Поглощение считывали при OD450 в течение 0,1 сек. Фоновое поглощение образца без антигена Е вычитали из всех образцов. Процент блокирования рассчитывали путем деления вычтенного из фонового значения MFI каждого образца на скорректированное значение отрицательного контроля, умножая на 100 и вычитая полученное значение из 100.
На таблицах 9 и 10 показан процент блокирования для всех 98 антител к антигену Е с общей легкой цепью, исследованных в анализе ELISA. ND: не определено при текущих экспериментальных условиях.
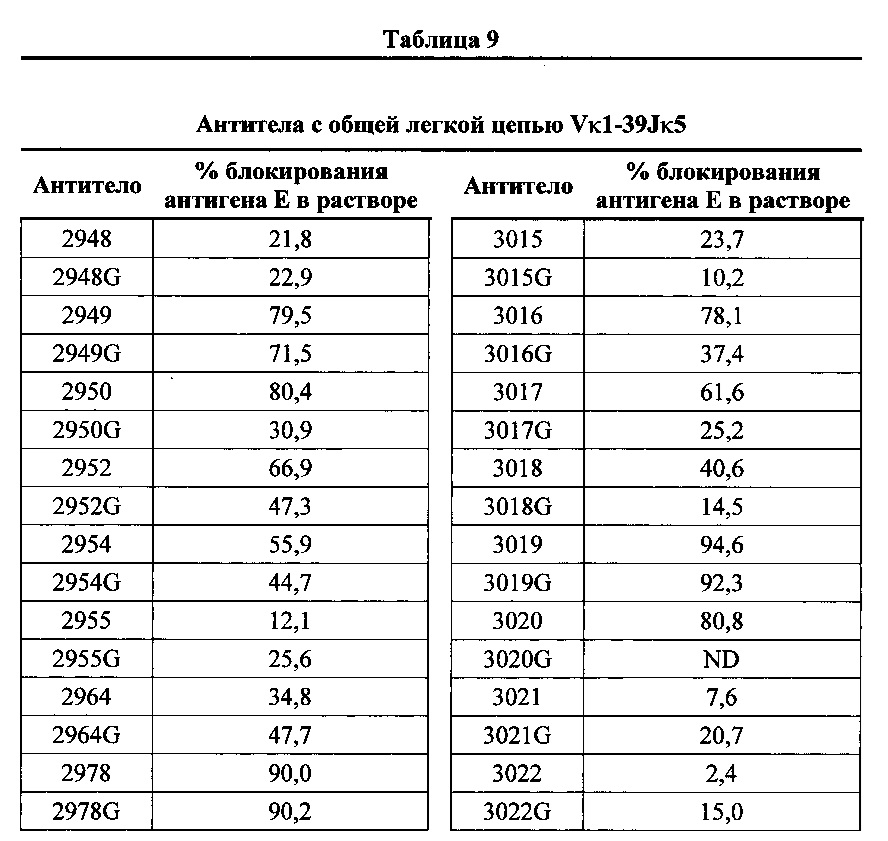
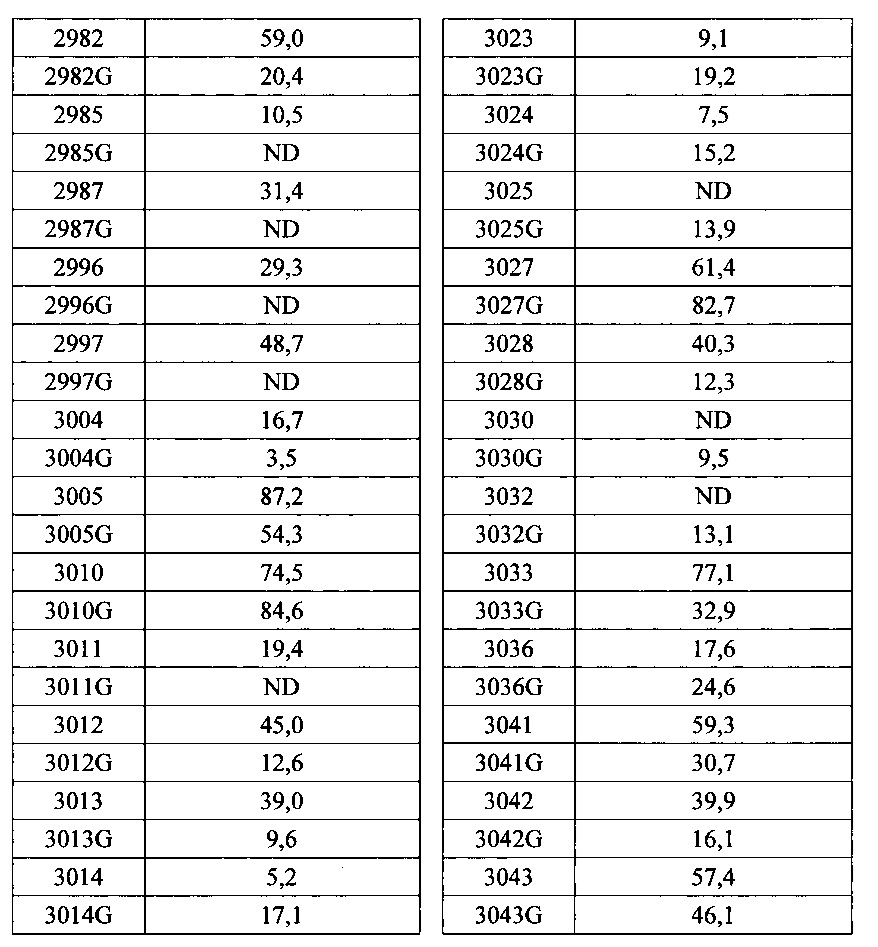
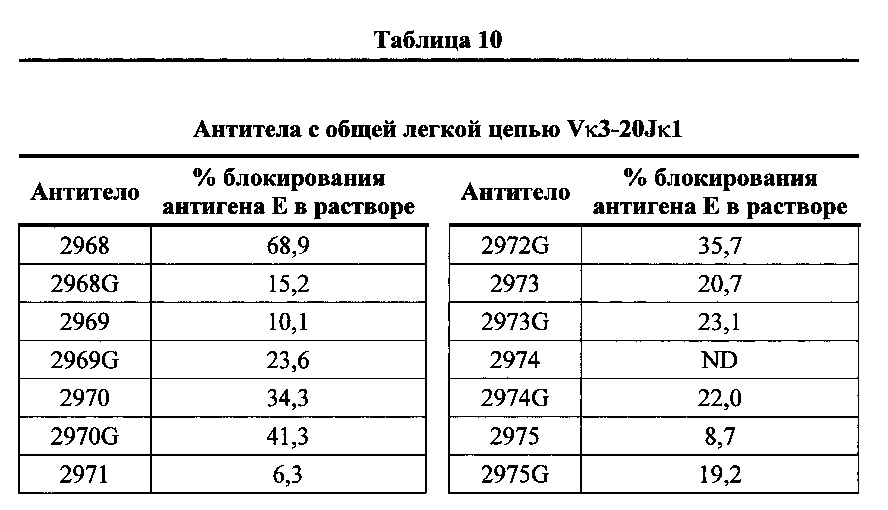
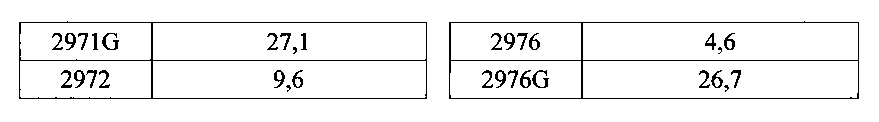
Как описано в настоящем примере, из 80 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ1-39Jκ5, исследованных в отношении их способности блокировать связывание антигена Е с покрытой лигандом Y поверхностью, 22 продемонстрировали блокирование >50%, наряду с тем, что 58 продемонстрировали блокирование <50% (20 при 25-50% блокировании и 38 при блокировании <25%). Для 18 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ3-20Jκ1, одно продемонстрировало блокирование >50%, наряду с тем, что 17 продемонстрировали блокирование <50% (5 при 25-50% блокировании и 12 при блокировании <25%) связывания антигена Е с покрытой лигандом Y поверхностью.
Эти результаты также согласуются с пулом антител с общей легкой цепью, специфических для антигена Е, содержащим антитела со специфичностью к перекрывающимся и неперекрывающимся эпитопам по отношению к антигену Е.
Пример 9
Определение аффинности с помощью BIACORE™ для антиген-специфических антител с общей легкой цепью
Равновесные константы диссоциации (KD) для выбранных супернатантов антител определяли с помощью SPR (поверхностного плазмонного резонанса) с использованием прибора BIAcore™ Т100 (GE Healthcare). Все данные получали с использованием HBS-EP (10 мМ Hepes, 150 мМ NaCl, 0,3 мМ EDTA, 0,05% поверхностно-активного вещества Р20, рН 7,4) в качестве как подвижного буфера, так и буфера для образца, при 25°С. Антитела захватывали из сырых образцов супернатанта на поверхности сенсорного чипа СМ5, предварительно дериватизированной с помощью высокой плотности антител к Fc человека с использованием стандартного химического взаимодействия соединения через аминогруппу. В ходе стадии захвата супернатанты впрыскивали по всей поверхности антител к Fc человека со скоростью потока, составляющей 3 мкл/мин в течение в общем 3 минут. За стадией захвата следовало введение или подвижного буфера, или аналита в концентрации 100 нМ в течение 2 минут при скорости потока, составляющей 35 мкл/мин. Диссоциацию антигена от захваченного антитела отслеживали в течение 6 минут. Захваченное антитело удаляли кратковременным введением 10 мМ глицина, рН 1,5. Все сенсограммы дважды соотносили с эталонными значениями путем вычитания сенсограмм от введений буфера из сенсограмм аналита, тем самым удаляя артефакты, вызванные диссоциацией антитела от поверхности захвата. Данные связывания для каждого антитела согласовывали с моделью связывания 1:1 с переносом масс с использованием программного обеспечения для оценки BIAcore Т100 v2.1. Результаты показаны в таблицах 11 и 12.
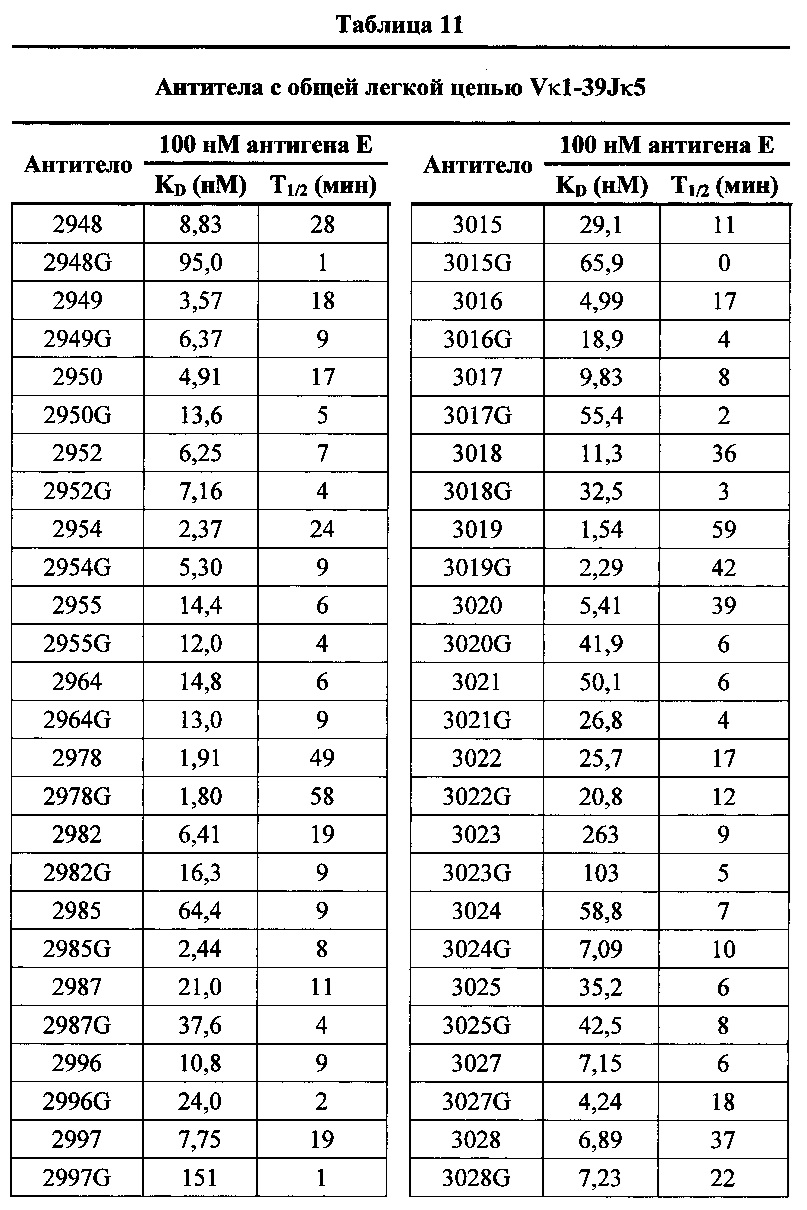
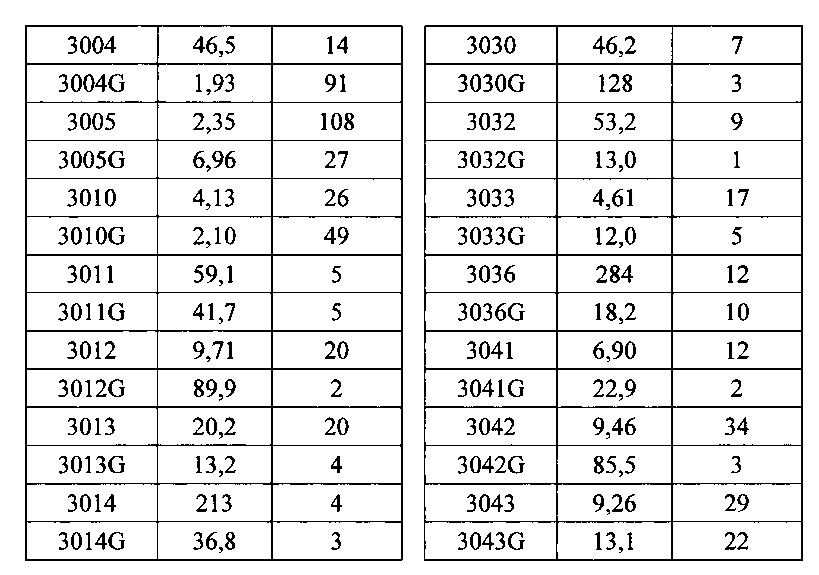
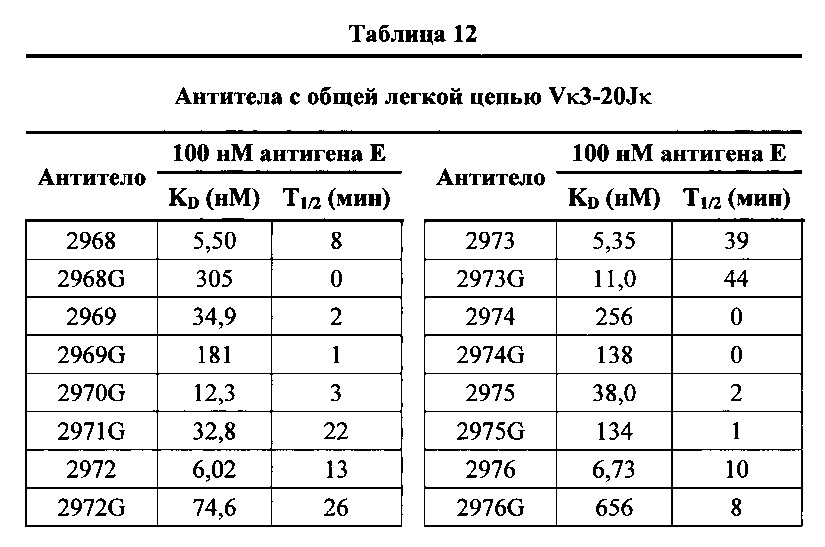
Аффинности связывания антител с общей легкой цепью, содержащих показанные в таблицах 5 и 6 реаранжировки, варьируют, причем почти все проявляют KD в наномолярном диапазоне. Данные аффинности согласуются с антителами с общей легкой цепью, полученными в результате комбинаторной ассоциации описанных в таблицах 5 и 6 реаранжированных вариабельных доменов, представляющих собой высокоаффинные, клонально-селективные и соматически мутированные. Объединяя с предварительно показанными данными, описанные в таблицах 5 и 6 антитела с общей легкой цепью содержат набор разнообразных, высокоаффинных антител, которые проявляют специфичность в отношении одного или нескольких эпитопов на антигене Е.
Пример 10
Определение специфичностей связывания антиген-специфических антител с общей легкой цепью с помощью анализа LUMINEX™
Выбранные антитела с общей легкой цепью к антигену Ε исследовали в отношении их способности связываться с ECD (внеклеточный домен) антигена Ε и вариантами ECD антигена Е, включающими в себя ортолог яванского макака (Mf антиген Е), который отличается от белка человека приблизительно на 10% его аминокислотных остатков; делеционный мутант антигена Е, у которого отсутствуют последние 10 аминокислот с С-конца ECD (антиген Е-ΔСТ); и два мутанта, содержащих аланиновую замену на предполагаемых положениях взаимодействия с лигандом Y (антиген Е-Ala1 и антиген Е-А1а2). Белки антигена Ε получали в СНО клетках, и каждый содержал С-концевую метку myc-myc-His.
Для исследований связывания белок ECD антигена Ε или вариантный белок (описанный выше) из 1 мл культуральной среды захватывали путем инкубации в течение 2 часов при комнатной температуре с 1×106 микросферическими (Luminex™) гранулами, ковалентно покрытыми моноклональным антителом к myc (MAb 9Е10, гибридомная клеточная линия CRL-1729™; АТСС, Манассас, Виргиния). Гранулы затем отмывали с помощью PBS перед применением. Супернатанты, содержащие антитела с общей легкой цепью к антигену Е, разбавляли 1:4 в буфере и добавляли к 96-луночным планшетам для фильтрования. Имитацию супернатанта без антител использовали в качестве отрицательного контроля. Гранулы, содержащие захваченные белки антигена Е, затем добавляли к образцам антител (3000 гранул на лунку) и инкубировали в течение ночи при 4°С. На следующий день гранулы образца отмывали и связанное антитело с общей легкой цепью обнаруживали с помощью конъюгированного с R-фикоэритрином антитела к IgG человека. Интенсивность флуоресценции гранул (приблизительно 100 гранул, подсчитанных для связывания каждого образца антитела с каждым белком антигена Е) измеряли с помощью анализатора на основе проточной цитометрии Luminex™ и регистрировали среднюю интенсивность флуоресценции (MFI) по меньшей мере для 100 подсчитанных гранул на одно взаимодействие гранулы с антителом. Результаты показаны в таблицах 13 и 14.
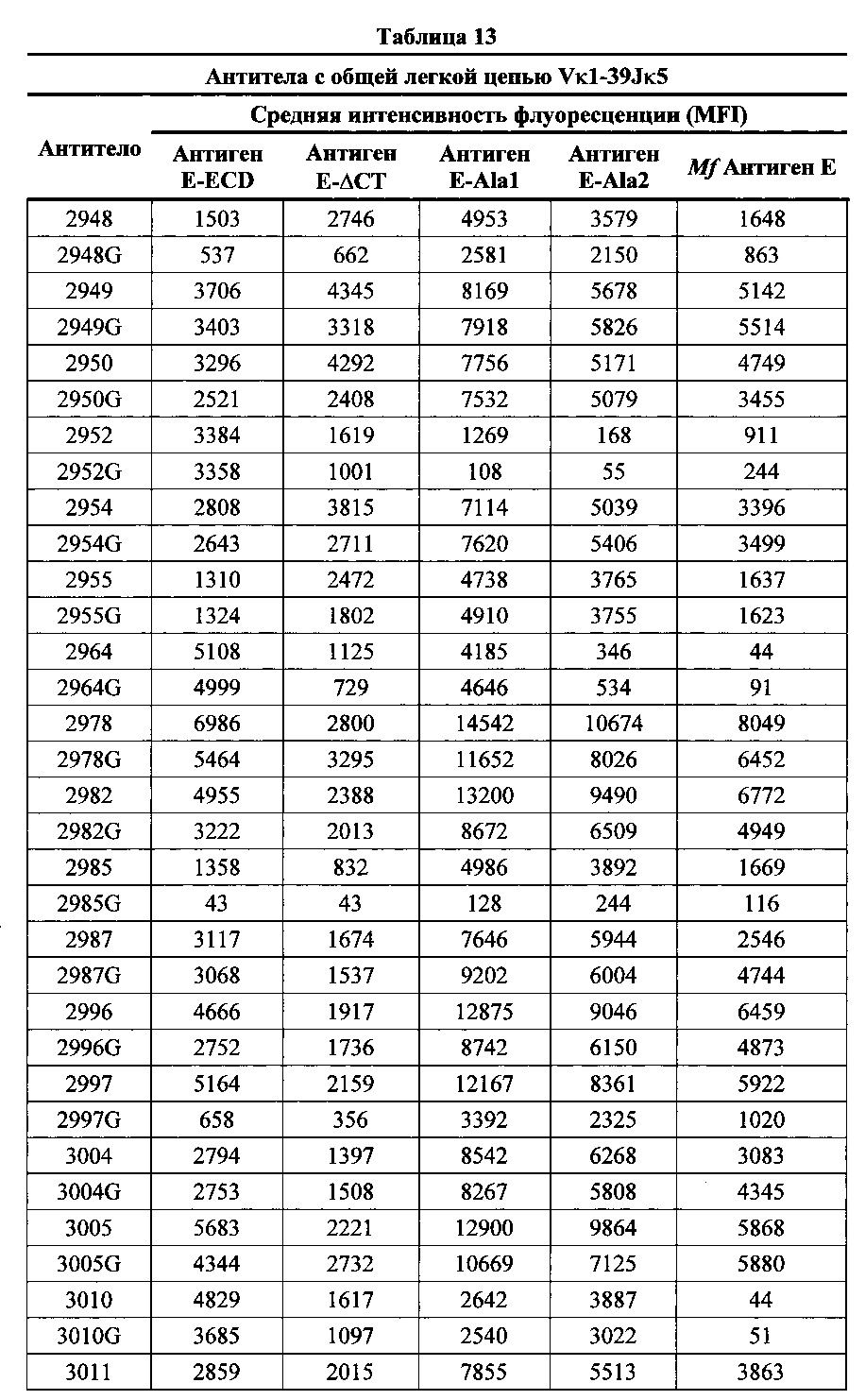
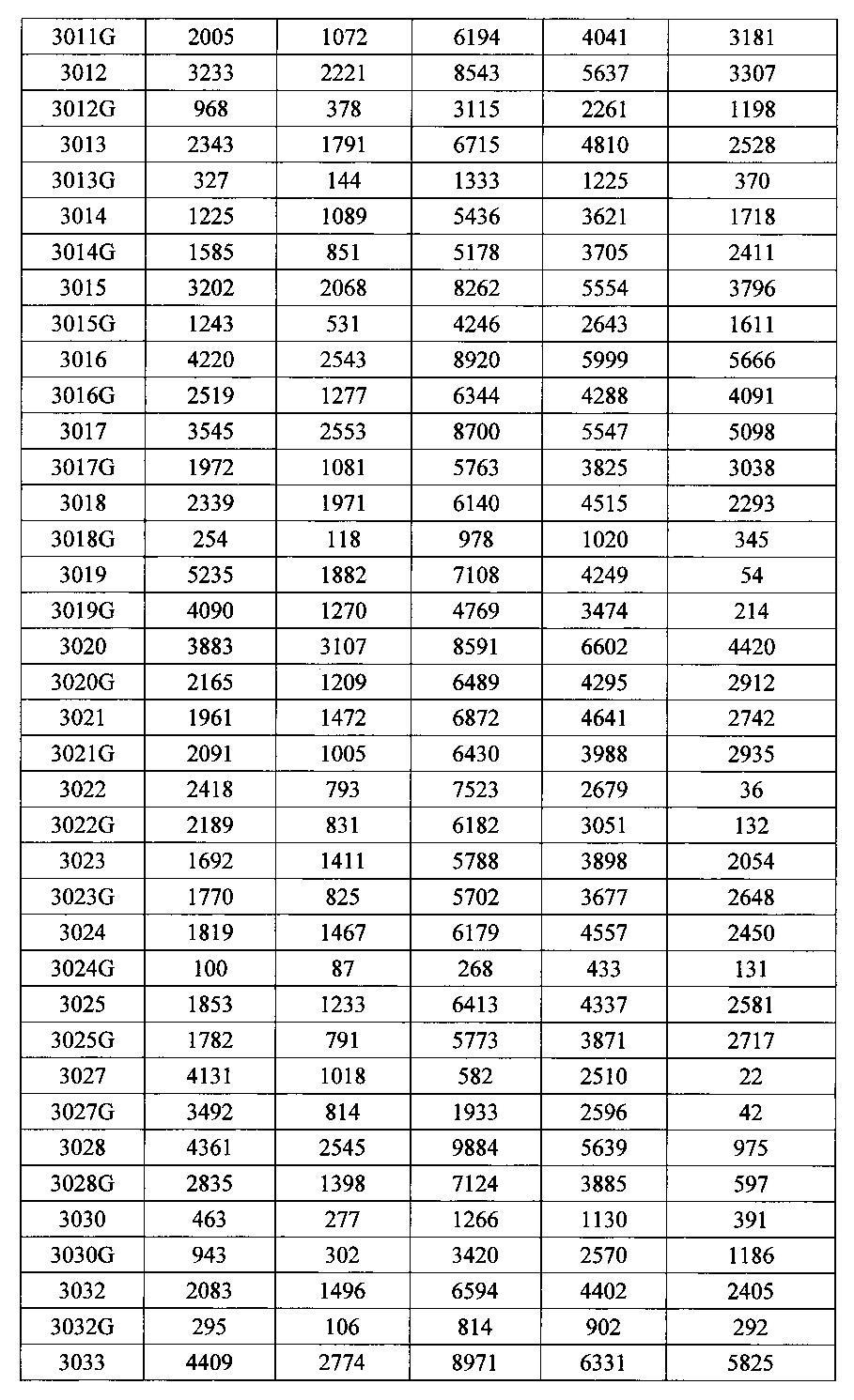
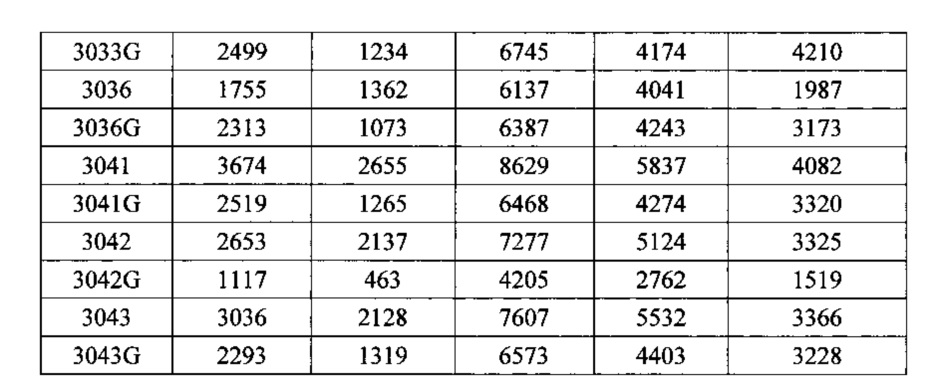
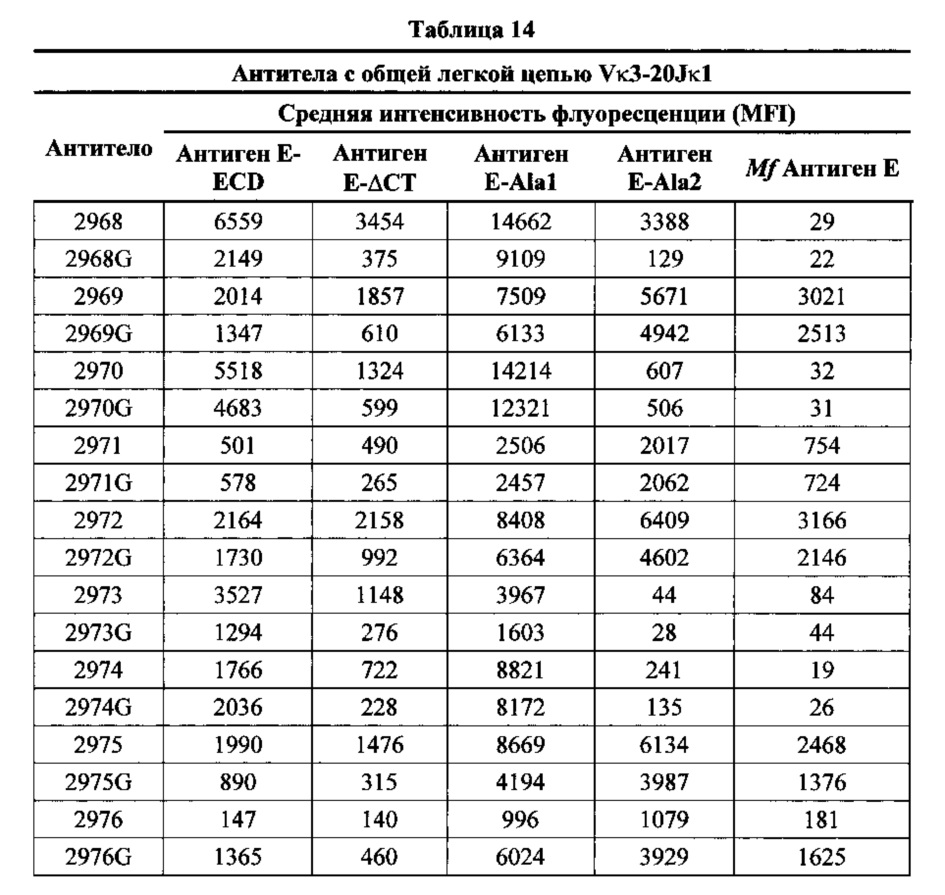
Супернатанты антител с общей легкой цепью к антигену Е проявляли высокоспецифическое связывание с гранулами, связанными с ECD антигена Е. Для этих гранул имитация супернатанта отрицательного контроля давала в результате пренебрежимо малый сигнал (<10 MFI), по сравнению с образцом гранул с ECD антигена, тогда как супернатанты, содержащие антитела с общей легкой цепью к антигену Ε проявляли сильный сигнал связывания (средняя MFI, составляющая 2627, для 98 супернатанов антител; MFI>500 для 91 из 98 образцов антител).
В качестве измерения способности выбранных антител с общей легкой цепью к антигену Ε идентифицировать различные эпитопы на ECD антигена Е, определяли относительное связывание антител с вариантами. Все четыре варианта антигена Ε захватывали на гранулы к myc LUMINEX™, как описано выше для исследований связывания нативного ECD антигена Е, и определяли отношения относительного связывания (MFIвариант/MFIECDантигена Е). Для 98 исследованных супернатантов антител с общей легкой цепью, показанных в таблицах 12 и 13, средние отношения (MFIвариант/MFIECDантигенаE) отличались для каждого варианта, вероятно, отражая различные захваченные количества белков на гранулах (средние отношения, составляющие 0,61, 2,9, 2,0 и 1,0 для антигена Е-ΔСТ, антигена Е-Alal, антигена Е-Аlа2 и Mf антигена Е, соответственно). Для каждого варианта белка связывание для подгруппы из 98 исследованных антител с общей легкой цепью показало значительно сниженное связывание, указывая на чувствительность к мутации, которая характеризовала изучаемый вариант. Например, 19 из образцов антител с общей легкой цепью связывались с Mf антигеном Ε с отношением MFIвариант/MFIECDантигенаE, составляющим <8%. Поскольку многие из этой группы содержали антитела с высокой или относительно высокой аффинностью (5 с KD<5 нМ, 15 с KD<50 нМ), возможно, что более низкий сигнал для этой группы представляет собой результат чувствительности к различиям в последовательности (эпитопе) между нативным ECD антигена Ε и изучаемым вариантом, а не результатом более низких аффинностей.
Эти данные показывают, что описанные в таблицах 5 и 6 антитела с общей легкой цепью представляют собой разнообразную группу специфических для антигена Ε антител с общей легкой цепью, которые специфически распознают более чем один эпитоп на антигене Е.
Пример 11
Перетасовка легких цепей в антителах с общими легкими цепями
Тяжелые цепи отдельных антиген-специфических антител с общей легкой цепью исследовали на связывание с антигеном Ε после восстановления тяжелых цепей со сконструированной легкой цепью или Vκ1-39Jκ5 зародышевой линии, или Vκ3-20Jκ1 зародышевой линии (как описано в примере 1).
Вкратце, 247 тяжелых цепей специфических к антигену Е антител с общей легкой цепью (Vκ1-39Jκ5 и Vκ3-20Jκ1) трансфицировали со сконструированной легкой цепью или Vκ1-39Jκ5 зародышевой линии, или Vκ3-20Jκ1 зародышевой линии и повторно подвергали скринингу на связывания с антигеном Е с помощью анализа LUMINEX™ (как описано в примере 7 и примере 10). Связывание с антигеном Е подтверждали с помощью BIACORE™ (как описано в примере 9). Результаты показаны в таблице 15.
Как показано в настоящем примере, двадцать восемь специфических к антигену Е антител с общей легкой цепью были способны к связыванию с антигеном Е после восстановления с формой зародышевой линии легкой цепи.

Пример 12
Частота использования генов тяжелой цепи и частота соматических гипермутаций в антителах с общей легкой цепью
Последовательности тяжелой и легкой цепи (>6000) антител, возникших у мышей VELCOIMMUNE® (например, патент США №6596541 и патент США №7105348), составляли с последовательностями тяжелой и легкой цепи (>600) антител с общей легкой цепью, полученных с помощью схемы мультиантигенной иммунизации с использованием мышей со сконструированными легкими цепями (описано выше), чтобы сравнить частоту использования генного сегмента тяжелой цепи и частоту соматических гипермутаций цепей антител.
Частота использование генов тяжелой цепи. Последовательности тяжелой и легкой цепи, полученные из мышей VELOCIMMUNE®, содержащих замещение эндогенного локуса тяжелой цепи мыши генными сегментами VH, DH и JH человека и замещение эндогенного локуса легкой цепи к мыши либо сконструированной областью легкой цепи Vκ1-39Jκ5 зародышевой линии человека, либо сконструированной областью легкой цепи Vκ3-20Jκ1 человека (как описано в примере 2), иммунизированные человеческим рецептором клеточной поверхности (антиген Е), гетеродимером двух человеческих гликопротеинов клеточной поверхности (антиген F), человеческим цитокиновым рецептором (антиген G) и человеческим антигеном дифференцировки опухолей (антиген Н), анализировали на частоту использования генных сегментов тяжелой цепи и записывали генные сегменты VH и JH. Результаты показаны в таблицах 16-18. Проценты в таблицах 16-18 представляют собой округленные значения и в некоторых случаях могут быть не равны 100%, когда суммируются.
В таблице 16 представлен процент частоты использования семейства тяжелых цепей для антитела от мышей VELCOIMMUNE® (VI), антител от мышей VELCOIMMUNE®, характеризующихся наличием родственной легкой цепи Vκ1-39 (VI - Vκ1-39), антител от мышей со сконструированной легкой цепью Vκ1-39 (Vκ1-39), антител от мышей VELCOIMMUNE®, характеризующихся наличием родственной легкой цепи Vκ3-20 (VI - Vκ3-20), и антител от мышей со сконструированной легкой цепью Vκ3-20 (Vκ3-20). В таблице 17 представлен процент частоты использования генов VH и JH для антител от мышей VELCOIMMUNE® (VI), антител от мышей VELCOIMMUNE®, характеризующихся наличием родственной легкой цепи Vκ1-39 (VI - Vκ1-39), антител от мышей со сконструированной легкой цепью Vκ1-39 (Vκ1-39), антител от мышей VELCOIMMUNE®, характеризующихся наличием родственной легкой цепи Vκ3-20 (VI - Vκ3-20), и антител от мышей со сконструированной легкой цепью Vκ3-20 (Vκ3-20). В таблице 18 представлен процент частоты использования гена VH для антител от мышей со сконструированной легкой цепью Vκ1-39 (мыши Vκ1-39) из каждой группы иммунизации (антигены Е, F, G и Н) и процент частоты использования гена VH для антител от мышей со сконструированной легкой цепью Vκ3-20 (мыши Vκ3-20) из выбранных групп иммунизации (антигены Ε и G).
Как показано в настоящем примере, частота использования гена тяжелой цепи для антигенов, исследованных в мышах со сконструированной легкой цепью Vκ1-39Jκ5, характеризовалась преобладанием подгруппы III семейства VH (VH3-7, VH3-9, VH3-11, VH3-13, VH3-20, VH3-23, VH3-30, VH3-33 и VH3-48). Примечательно, что частота использования других подгрупп семейства VH характеризовалось частотой использования VH1-18, VH1-69, VH2-5, VH4-59 и VH6-1. Для антигенов, исследованных в мышах со сконструированной легкой цепью Vκ3-20Jκ1, частота использования гена тяжелой цепи характеризовалась преобладанием подгруппы III семейства VH, IV семейства VH и V семейства VH (VH3-11, VH3-30, VH3-33, VH4-39, VH4-59 и VH5-51). Примечательно, что частота использования других подгрупп семейства VH характеризовалось частотой использования VH1-18, VH1-69, VH2-70 и VH6-1.
Частота соматических гипермутаций. Тяжелые и легкие цепи из антител, индуцированных у мышей VELCOIMMUNE® и мышей со сконструированной легкой цепи (описано выше), выравнивали по отношению к последовательностям зародышевой линии в соответствии с частотой использования генов тяжелой и легкой цепи, продемонстрированной для каждой тяжелой и/или легкой цепи. Рассчитывали аминокислотные изменения для каждой каркасной области (FW) и определяющей комплементарность области (CDR) как для тяжелой, так и легкой цепи каждой последовательности. Результаты приведены в таблицах 19-22. Проценты в таблицах 21-24 представляют собой округленные значения и в некоторых случаях могут быть не равны 100% при суммировании.
В таблице 19 представлено количество аминокислотных (АА) изменений, наблюдаемых в каждой области FW и CDR тяжелых цепей антител от мышей VELCOIMMUNE®, тяжелых цепей антител от мышей со сконструированной легкой цепью Vκ1-39 (мыши Vκ1-39) и тяжелых цепей антител от мышей со сконструированной легкой цепью Vκ3-20 (мыши Vκ3-20). В таблице 20 представлено количество аминокислотных (АА) изменений, наблюдаемых в каждой области FW и CDR легких цепей антител от мышей VELCOIMMUNE®, легких цепей антител от мышей со сконструированной Vκ1-39 (мыши Vκ1-39) и легких цепей антител от мышей со сконструированной Vκ3-20 (мыши Vκ3-20). В таблице 21 представлено количество аминокислотных (АА) изменений, наблюдаемых в каждой области FW и CDR тяжелых цепей антител от мышей со сконструированной легкой цепью Vκ1-39 (мыши Vκ1-39) для отдельных групп иммунизации (антигены Е, F и Н). В таблице 22 представлено количество аминокислотных (АА) изменений, наблюдаемых в каждой области FW и CDR тяжелых цепей антител от мышей со сконструированной легкой цепью Vκ3-20 (мыши Vκ3-20) для отдельных групп иммунизации (антигены Е и G).

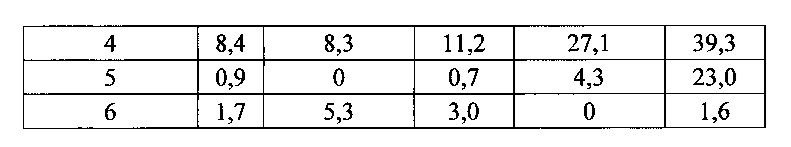
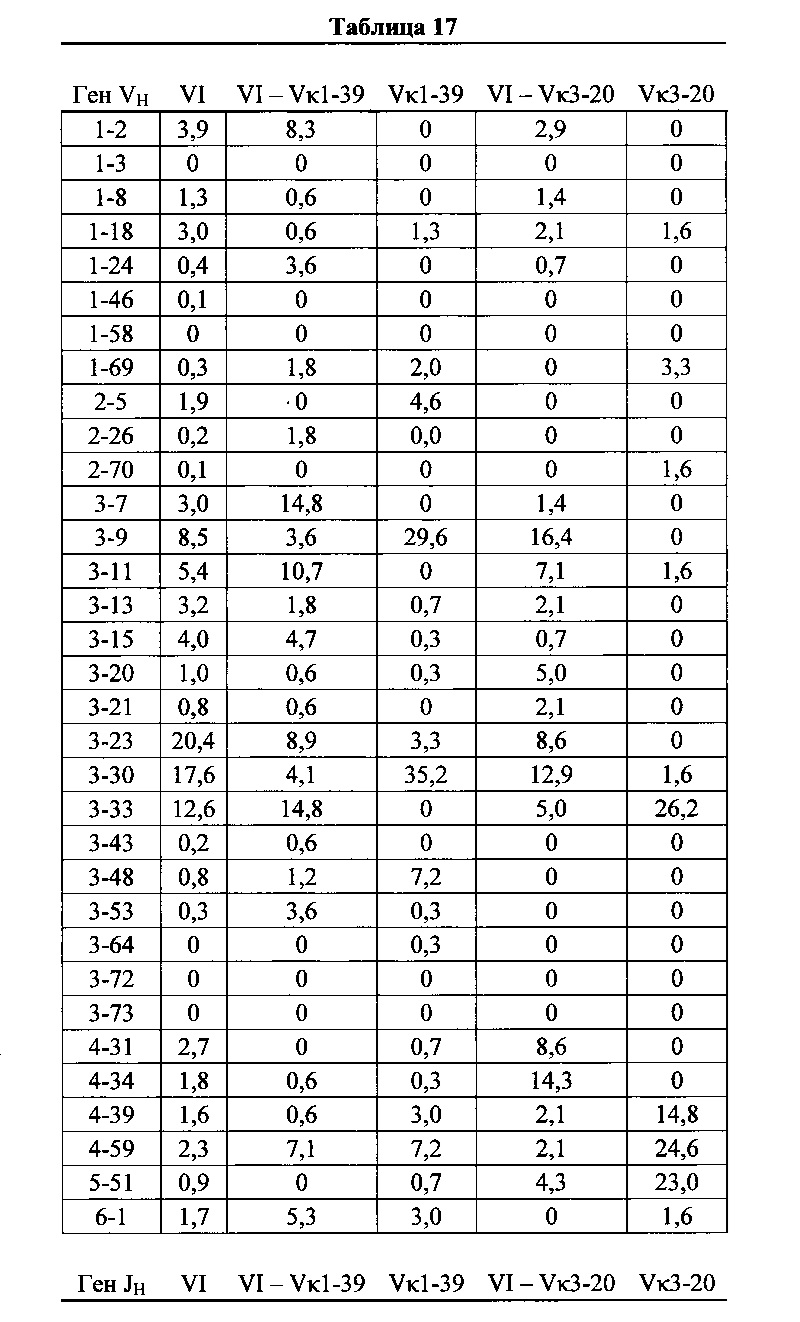
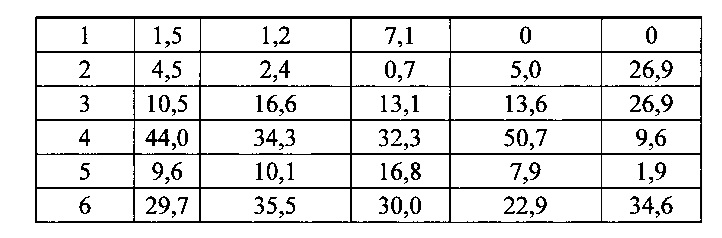
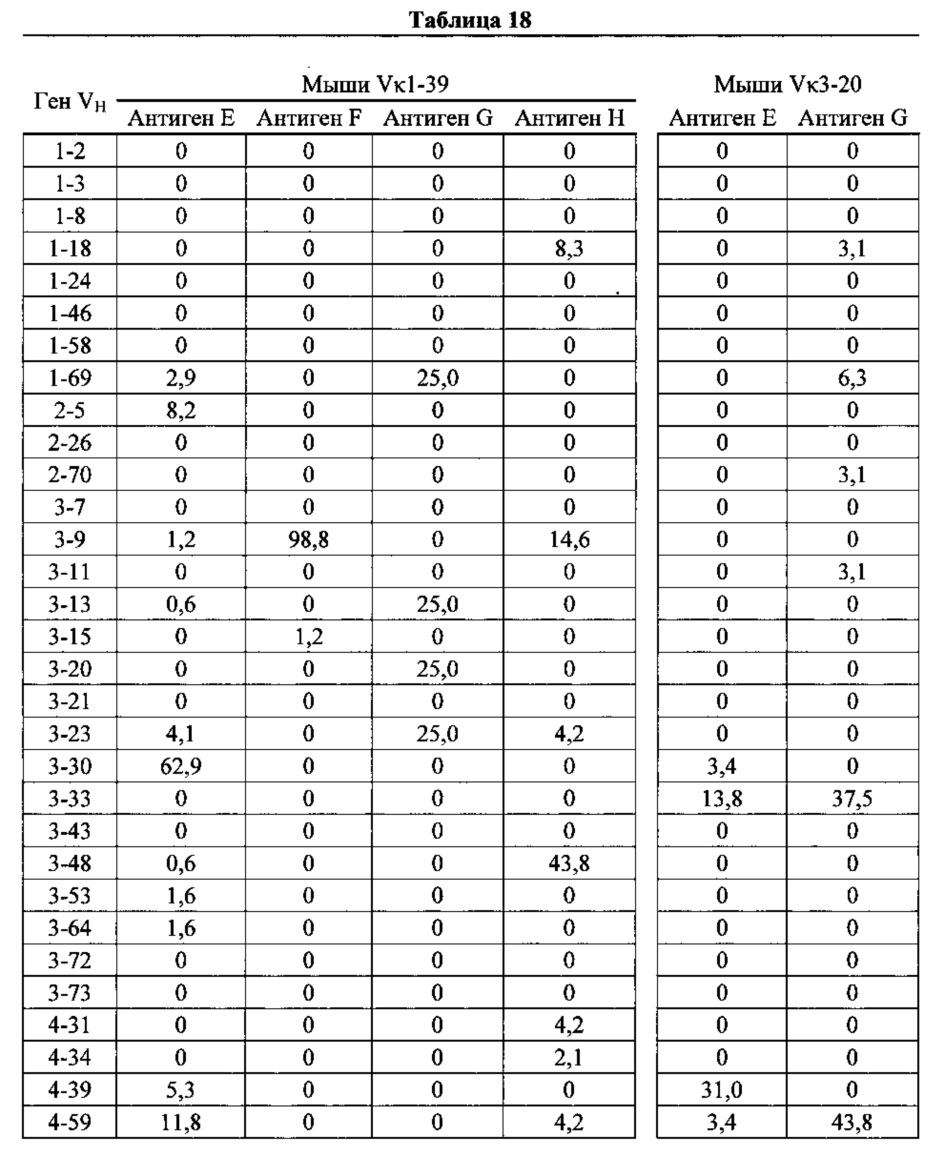

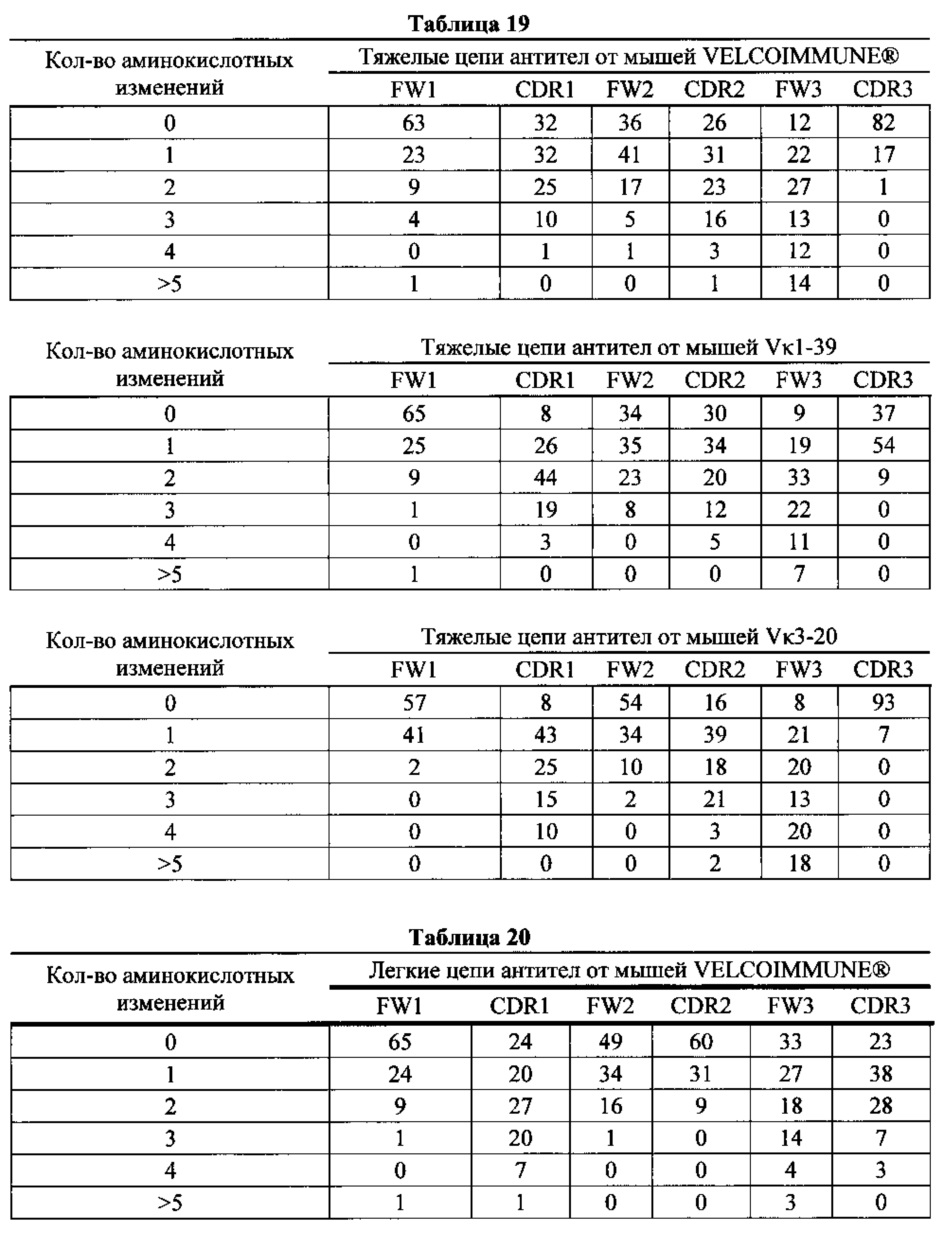
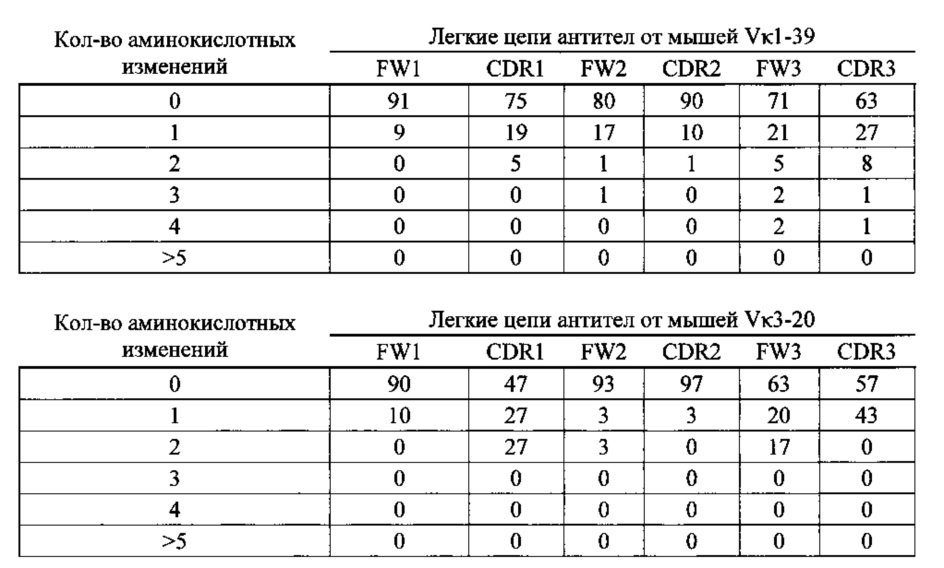
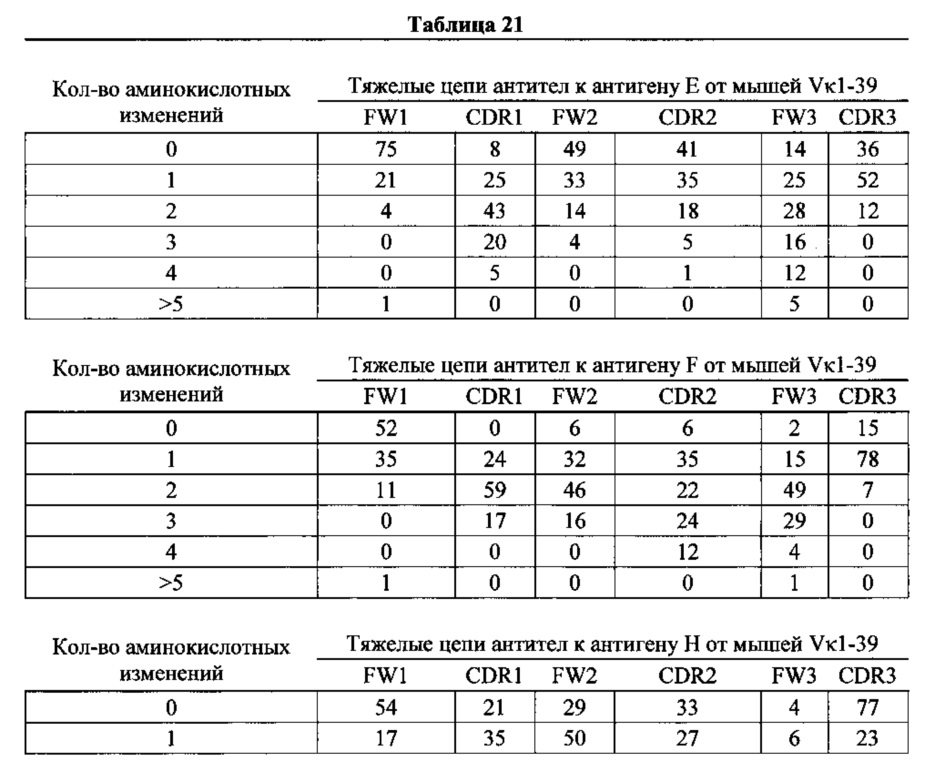
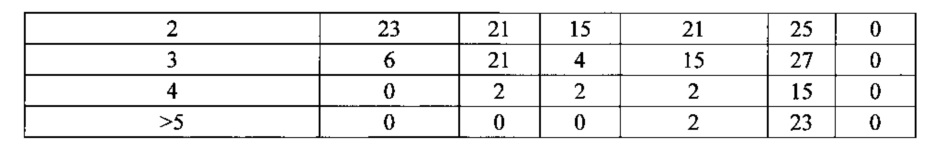
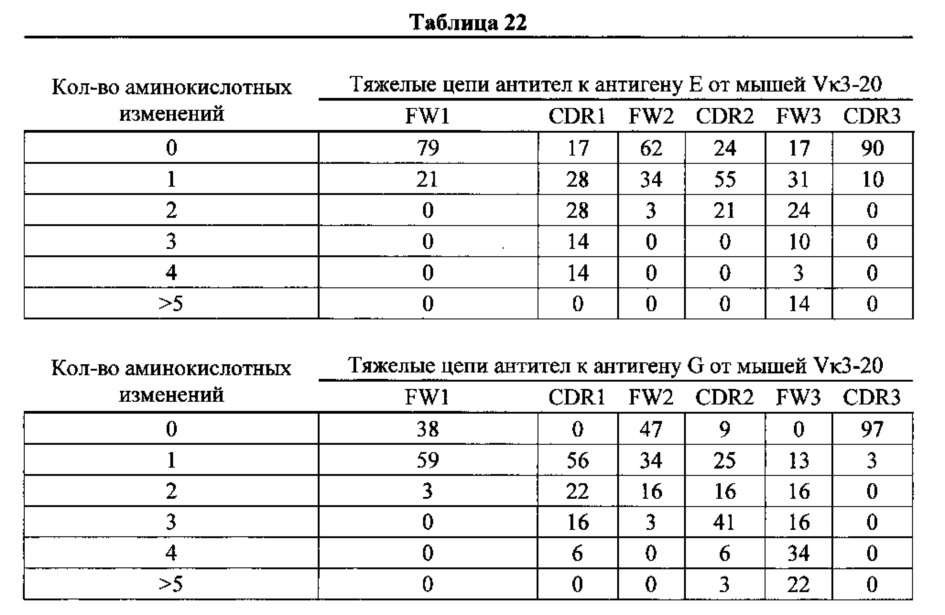
Пример 13.
Аффинность связывания биспецифических антител, содержащих универсальные легкие цепи
Полностью человеческие биспецифические антитела конструировали из клонированных вариабельных областей тяжелой цепи человека выбранных моноспецифических антител к антигену Е с общей легкой цепью (как описано в примере 5) с использованием стандартных техник рекомбинантной ДНК, известных в настоящей области техники. В таблице 23 представлено образование пар тяжелых цепей человека (НС-1 и НС-2) из выбранных исходных моноспецифических антител, каждая пара используется с реаранжированной легкой цепью Vκ1-39/Jκ1 зародышевой линии человека для конструирования каждого биспецифического антитела.
Связывание биспецифических или исходных моноспецифических антител к антигену Е к внеклеточному домену (ECD) антигена Е определяли с использованием поверхностного плазмонного резонансного биосенсорного анализа в реальном времени на инструменте BIACORE™ 2000 (GE Healthcare). Поверхность сенсора СМ5 BIACORE™, дериватизированную специфическим к с-Мус моноклональным антителом (клон # 9Е10) с использованием химии EDC-NHS, использовали для захвата С-концевого помеченного myc-myc-гексагистидином ECD антигена Ε (антиген Е-mmh). Приблизительно 190 единиц отклика антигена-mmh захватывали на поверхности сенсора BIACORE™, а затем вводили концентрации 300 нМ и 50 нМ различных биспецифических или исходных моноспецифических антител к антигену Ε при скорости потока 50 мкл/мин. Эксперимент проводили при 25°С в рабочем буфере HBST (0,01 M HEPES, рН 7,4, 0,15 M NaCl, 3 мМ ЭДТА, 0,05% об/об поверхностно-активного вещества Р20). Количество антитела, связывающегося с поверхностью антигена-mmh при концентрации 300 нМ, записывали три секунды до конца введения антител и построения графиков.
В таблице 24 и на фиг. 8 представлены отклики связывания (единицы BIACORE™; RU), наблюдаемые для каждого биспецифического антитела (BsAb) и моноспецифического родительского антитела (РАЬ-1, РАЬ-2). Поскольку каждое антитело вводили при насыщающих условиях на идентичные поверхности антигена-mmh, отклик связывания отражает стехиометрии связывания для каждого связывания антитела с поверхностью захвата антигена.
Как показано в настоящем примере, наблюдаемый отклик связывания для каждого биспецифического антитела был приблизительно в 2 раза больше, чем отклик связывания для каждого исходного моноспецифического антитела (таблица 24 и фиг. 8), что свидетельствует о функциональной конструкции биспецифических антител с использованием тяжелых цепей антигенспецифических моноклональных антител и общей легкой цепи, где каждое плечо Fab в молекуле биспецифического антитела связывается одновременно с различными эпитопами на внеклеточном домене рецептора клеточной поверхности (антиген Е, смотрите фиг. 7В, внизу слева).
Пример 14. Получение и анализ мышей, экспрессирующих две легкие цепи человека
Используя описанные выше в примере 2 способы, конструировали два дополнительных сконструированных локуса легкой цепи, содержащих два генных сегмента Vκ человека (например, генный сегмент Vκ1-39 человека и генный сегмент Vκ3-20 человека) (фиг. 9). Один сконструированный локус легкой цепи содержал два генных сегмента Vκ человека и пять генных сегментов Jκ человека в нереаранжированной конфигурации (DLC-5J). Второй сконструированный локус легкой цепи содержал два генных сегмента Vκ человека и один генный сегмент Jκ человека в нереаранжированной конфигурации (DLC-1J). Для каждого из двух дополнительных сконструированных локусов легкой цепи, генные сегменты человека фланкировали с 3' сигнальными последовательностями рекомбинации, чтобы обеспечить реаранжировку in vivo генных сегментов человека в В-клетках.
Модифицированные клоны ВАС-ДНК, отдельно содержащие каждый из сконструированных локусов легкой цепи, функционально связанные с последовательностями мыши (т.е. выше против хода и ниже по ходу транскрипции последовательностей эндогенного локуса легкой цепи к иммуноглобулина), подтверждали с помощью ПЦР с использованием праймеров, расположенных в последовательностях внутри каждого сконструированного локуса легкой цепи, содержащего два генных сегмента Vκ человека, а затем с помощью электропорации в ЭС клетки для создания мышей, которые экспрессируют любой из двух генных сегментов Vκ человека (как описано выше). Положительные ЭС клеточные клоны, которые содержат любой из описанных выше сконструированных локусов легкой цепи, подтверждали с помощью скрининга TAQMAN™ и кариотипирования с использованием зондов, специфических для сконструированных локусов легкой цепи (как описано выше). Подтвержденные ЭС клеточные клоны затем использовали для имплантации самкам мышей, чтобы привести к получению помета детенышей, экспрессирующих вариабельный домен легкой цепи человека, слитый с доменом Сκ мыши, упоминаемые в настоящем документе как мыши с двойной легкой цепью (DLC).
Альтернативно, ЭС клетки, несущие сконструированный локус легкой цепи, могут быть трансфицированы с конструктом, который экспрессирует FLP, чтобы удалить фланкированную FRT неомициновую кассету, введенную с помощью направленного конструкта. Необязательно, неомициновую кассету удаляют путем селекции мышей, которые экспрессируют FLP рекомбиназу (например, патент США №6774279). Необязательно, неомициновую кассету сохраняют у мышей.
Проточная цитометрия. Популяции В-клеток и развитие В-клеток у DLC мышей подтверждали с помощью анализа проточной цитометрией препаратов спленоцитов и костного мозга. Клеточные суспензии от мышей, гомозиготных по двум генным сегментам Vκ человека и пяти генным сегментам Jκ человека (n=4), мышей, гомозиготных по двум генным сегментам Vκ человека и одному генному сегменту Jκ человека (n=4), и мышей дикого типа (n=4) получали с использованием стандартных способов (описанных выше) и окрашивали флуоресцентно меченными антителами (как это описано в примере 3).
Вкратце, 1×106 клеток инкубировали с антителом к мышиному CD16/CD32 (клон 2.4G2, BD Pharmigen) на льду в течение 10 минут, после чего производили мечение со следующим коктейлем антител в течение 30 минут на льду: конъюгированным с АРС-Н7 антителом к мышиному CD 19 (клон 1D3, BD Pharmigen), конъюгированным с Pacific Blue антителом к мышиному CD3 (клон 17А2, BioLegend), конъюгированным с FITC антителом к мышиному Igκ (клон 187,1, BD Pharmigen) или антителом к мышиному CD43 (клон 1В11, BioLegend), конъюгированным с РЕ антителом к мышиному Igλ (клон RML-42, BioLegend) или антителом к мышиному c-kit (клон 2 В8, BioLegend), конъюгированным с РегСР-Су5.5 антителом к мышиному IgD (BioLegend), конъюгированным с РЕ-Су7 антителом к мышиному IgM (клон II/41, eBioscience), конъюгированным с APC антителом к мышиному В220 (клон RA3-6B2, eBioscience). После окрашивания клетки промывали и фиксировали в 2% формальдегиде. Сбор данных выполняли на проточном цитометре LSRII и анализировали с помощью FlowJo (Tree Star, Inc.). Гейтирование: общие В-клетки (CD19+CD3-), Igκ+ В-клетки (Igκ+Igλ- CD19+CD3-), В-клетки (Igκ-Igλ+CD19+CD3-). Результаты для компартмента костного мозга показаны на фиг. 10А - фиг. 12В. Результаты по компартменту селезенки показаны на фиг. 13А - фиг. 16.
Как показано в этом примере, мыши DLC-5J демонстрируют нормальные популяции В-клеток в пределах компартментов селезенки и костного мозга (фиг. 10А-16). Мыши DLC-5J продемонстрировали популяции незрелых, зрелых и пре/про-В-клеток в компартменте костного мозга, которые по существу такие же, как наблюдались у однопометников дикого типа. В самом деле, локус DLC-5J был способен конкурировать с эндогенным локусом легкой цепи λ с образованием соотношения κ:λ, которое по существу такое же, как наблюдали у мышей дикого типа (фиг. 14В). Кроме того, мыши DLC-5J демонстрируют нормальное развитие периферических В-клеток, поскольку прогрессирование В-клеток через различные стадии в компартменте селезенки (например, незрелые, зрелые, Τ1, Т2 Т3, предшественники маргинальной зоны, маргинальной зоны, фолликулярные-1, фолликулярные-II и т.д.) происходит таким образом, который по существу такой же, как наблюдался у мышей дикого типа (фиг 15А-16). Напротив, мыши DLC-1J продемонстрировала низкое общее количество В-клеток и повышенную частоту использования легкой цепи λ, по сравнению со сконструированной легкой цепью λ (данные не показаны).
Экспрессия двойной легкой цепи. Экспрессию обоих генных сегментов Vκ человека анализировали в гомозиготных мышах с использованием анализа количественной ПЦР в соответствии с примером 3. Вкратце, CD19+ В-клетки очищали из костного мозга и целых селезенок мышей дикого типа, мышей, гомозиготных по замещению вариабельных локусов тяжелой цепи и легкой цепи к мыши соответствующими вариабельными локусами тяжелой цепи и легкой цепи к человека (Нκ), а также мышей, гомозиготных по сконструированным локусам легкой цепи κ, содержащим два генных сегмента Vκ человека и либо пять генных сегментов Jκ человека (DLC-5J), либо один генный сегмент Jκ человека (DLC-1J). Относительную экспрессию нормировали к экспрессии области Сκ мыши (n=3-5 мышей на группу). Результаты показаны на фиг. 17 и фиг. 18.
Экспрессию легких цепей, содержащих реаранжированный генный сегмент Vκ3-20 человека или генный сегмент Vκ1-39 человека обнаруживали, как в костном мозге, так и в селезенке мышей DLC-5J и DLC-1J (фиг. 17 и фиг. 18). В компартменте костного мозга экспрессия как полученных из Vκ3-20 человека, так и полученных из Vκ1-39 человека легких цепей в обеих линиях DLC мышей была значительно выше, по сравнению с мышами, содержащими замещение генного сегмента Vκ и Jκ мыши соответствующими генными сегментами Vκ и Jκ человека (Нκ; фиг. 17). Наблюдаемая экспрессия полученной из Vκ3-20 легкой цепи человека превышала от приблизительно шести раз (DLC-5J) до пятнадцати раз (DLC-1J) таковую у мышей Нκ. DLC-1J мыши показали экспрессию полученных из Vκ3-20 легких цепей человека приблизительно в два раза более высокую, чем мыши DLC-5J, в компартменте костного мозга. Наблюдаемая экспрессия полученной из Vκ1-39 легкой цепи человека превышала от приблизительно шести раз (DLC-5J) до тринадцати раз (DLC-1J) таковую у мышей Нκ. DLC-1J мыши показали экспрессию полученных из Vκ1-39 легких цепей человека приблизительно в два раза более высокую, чем мыши DLC-5J, в компартменте костного мозга.
В компартменте селезенки экспрессия как полученных из Vκ3-20, так и полученных из Vκ1-39 легких цепей человека в обеих линиях DLC мышей была значительно выше, по сравнению с мышами Нκ (фиг. 18). Наблюдаемая экспрессия полученных из Vκ3-20 легких цепей человека приблизительно от четырех раз (DLC-5J) до восьми раз (DLC-1J) превышала таковую у мышей Нκ. DLC-1J мыши показали экспрессию полученных из Vκ3-20 легких цепей человека приблизительно в два раза более высокую, чем мыши DLC-5J, в компартменте селезенки. Наблюдаемая экспрессия полученных из Vκ1-39 легких цепей человека приблизительно от четырех раз (DLC-5J) до пяти раз (DLC-1J) превышала таковую у мышей Нκ. DLC-1J мыши показали аналогичную экспрессию полученных из Vκ1-39 легких цепей человека, по сравнению с DLC-5J мышами, в компартменте селезенки.
Частота использования VL/JL человека у DLC-5J мышей. Мышей, гомозиготных по двум нереаранжированным генным сегментам Vκ человека и пяти нереаранжированным генным сегментам Jκ человека (DLC-5J), анализировали на частоту использования генного сегмента Vκ/Jκ человека в В-клетках селезенки с помощью полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР).
Вкратце, селезенки от гомозиготных DLC-5J мышей (n=3) и мышей дикого типа (n=2) собирали и сливали в 10 мл RPMI 1640 (Sigma), содержащем 10% инактивированную нагреванием фетальную бычью сыворотку с использованием матовых стекол, чтобы создать отдельные клеточные суспензии. Спленоциты осаждали на центрифуге (1200 оборотов в минуту в течение пяти минут) и эритроциты крови лизировали в 5 мл лизирующего буфера АСК (Gibco) в течение трех минут. Спленоциты разбавляли PBS (Irvine Scientific), фильтровали через клеточный фильтр 0,7 мкм и снова центрифугировали для осаждения клеток, после чего проводили ресуспендирование в 1 мл PBS.
РНК выделяли из осажденных спленоцитов с использованием мининабора ДНК/РНК AllPrep (Qiagen) в соответствии с требованиями производителя. ОТ-ПЦР проводили на РНК спленоцитов с использованием 5' системы RACE (быстрая амплификация концов кДНК) с праймерами, специфическими к гену Сκ мыши в соответствии с инструкциями производителя (Invitrogen). Праймеры, специфические для гена Сκ мыши представляли собой 3' mIgκC RACE1 (AAGAAGCACA CGACTGAGGC AC; SEQ ID NO: 34) и mIgKC3'-1 (CTCACTGGAT GGTGGGAAGA TGGA; SEQ ID NO: 35). ПЦР-продукты очищали на геле и клонировали в вектор pCR®2.1-TOPO® (TOPO® ТА Cloning® Kit, Invitrogen) и секвенировали с прямым M13 (GTAAAACGAC GGCCAG; SEQ ID NO: 36) и обратным М13 (CAGGAAACAG CTATGAC; SEQ ID NO: 37) праймерами, расположенными в векторе в местах, фланкирующих сайт клонирования. Секвенировали десять клонов из каждого образца селезенки. Последовательности сравнивали с мышиными и человеческими наборами иммуноглобулинов из набора эталонных IMGT/V-QUEST для определения частоты использования Vκ/Jκ. В таблице 25 представлены комбинации Vκ/Jκ для выбранных клонов, наблюдаемых в клонах ОТ-ПЦР из каждого образца спленоцитов. В таблице 26 представлена аминокислотная последовательность соединений человеческого Vκ/человеческого Jκ и человеческого Jκ/мышиного Сκ выбранных клонов ОТ-ПЦР из DLC-5J гомозиготных мышей. Строчные буквы указывают на мутации в аминокислотной последовательности вариабельной области или нешаблонных добавлениях, представляющих собой результат N и/или Ρ добавлений при рекомбинации.
Как показано в этом примере, мыши, гомозиготные по двум нереаранжированным генным сегментам Vκ человека и пяти нереаранжированным генным сегментам Jκ человека (DLC-5J), функционально связанными с мышиным геном Сκ, способны продуктивно рекомбинировать оба генных сегмента Vκ человека с несколькими генными сегментами Jκ человека, чтобы производить ограниченный репертуар легких цепей иммуноглобулина. Среди реаранжировок в DLC-5J гомозиготной мыши, представленной в таблице 25, уникальные реаранжировки Vκ/Jκ человека наблюдались для Vκ1-39/Jκ2 (1), Vκ1-39/Jκ3 (1), Vκ3-20/Jκ1 (7), Vκ3-20/Jκ2 (4) и Vκ3-20/Jκ3 (1). Кроме того, такие уникальные реаранжировки демонстрировали соединительное разнообразие благодаря наличию уникальных аминокислот в области CDR3 легкой цепи (таблица 26) в результате или мутации и/или рекомбинации генных сегментов Vκ и Jκ человека в процессе развития. Все реаранжировки показали функциональное прочитывание в Сκ мыши (таблица 26).
Взятые вместе, эти данные показывают, что мыши, сконструированные, чтобы представлять выбор не более двух генных сегментов VL человека, оба из которых способны к реаранжировке (например, с одним или несколькими и, согласно некоторым вариантам осуществления, до пяти генных сегментов JL человека) и кодированию домена VL человека легкой цепи иммуноглобулина, характеризуются количествами и развитием В-клеток, которые почти такие же, как у мышей дикого типа во всех аспектах. Такие мыши производят сбор антител, содержащих легкие цепи иммуноглобулинов, которые содержат один из двух возможных генных сегментов VL человека, присутствующих в наборе. Этот набор антител производится мышью в ответ на сенсибилизацию антигеном и связан с разнообразием обратных химерных (человеческих вариабельных/мышиных константных) тяжелых цепей.


Реферат
Изобретение относится к области биохимии, в частности к генетически модифицированной мыши для получения антитела, содержащей в своем геноме зародышевой линии два неаранжированных генных сегмента Vκ иммуноглобулина человека и пять неаранжированных генных сегментов Jκ иммуноглобулина человека, функционально связанных с последовательностью константной области легкой цепи иммуноглобулина мыши, а также один или несколько неаранжированных генных сегментов Vиммуноглобулина человека, один или несколько неаранжированных генных сегментов Dиммуноглобулина человека и один или несколько неаранжированных генных сегментов Jиммуноглобулина человека, функционально связанных с последовательностью константной области тяжелой цепи иммуноглобулина мыши, а также к ее применению для получения антитела и для идентификации последовательности нуклеиновой кислоты, кодирующей вариабельный домен тяжелой цепи иммуноглобулина человека. Также раскрыты выделенная В-клетка из вышеуказанной генетически модифицированной мыши, а также гибридома, полученная из указанной В-клетки. Изобретение позволяет эффективно получать антитело. 6 н. и 9 з.п. ф-лы, 19 ил., 26 табл., 14 пр.

Комментарии