Способ снижения концентрации co2 в жидкости и устройство для его осуществления - RU2449828C2
Код документа: RU2449828C2
Чертежи

Описание
Область техники, к которой относится изобретение
Данное изобретение направлено на снижение концентрации СО2. Изобретение предлагает применение жидкостей и устройств для уменьшения концентрации СО2 в жидкостях.
Предшествующий уровень техники
Климатические изменения оказывают существенное влияние на геосферу планеты. Одним из главных эффектов изменений климата является выделение в атмосферу различных парниковых газов, усиливающих глобальное потепление. Большинство выделяемых парниковых газов возникает в результате деятельности человека, главным образом в качестве побочных продуктов сжигания ископаемого топлива (например, угля, нефти, бензина, природного газа) с выделением в качестве основного газа CO2. Снижение выделения СО2 является необходимым до тех пор, пока не будут доступными альтернативные источники энергии или пока не будут доступными другие экономные, чистые и выгодные технологии.
По-видимому, ископаемое топливо является преобладающим источником энергии для данного столетия, поскольку нет альтернативного источника энергии, позволяющего существенно заменить энергию ископаемого топлива без других ограничений. Более того, глобальное потребление энергии значительно возрастает, сопровождая повышение глобальных норм жизни, во многих частях мира. Разработка эффективного способа снижения или стабилизации атмосферной концентрации СО2 является критической для предотвращения или по крайней мере смягчения массивных глобальных изменений климата, поскольку улучшение эффективности производства и утилизации энергии и разработка возобновляемых источников энергии не могут полностью решить проблемы, вызванные текущим (и будущим) выделением парниковых газов.
Повышение атмосферного CO2 влияет на гидросферу планеты. В воде CO2 находится в химическом равновесии с бикарбонатом (НСО3-) и углекислотой (Н2СО3) (уравнение 1). Изменение концентрации одного из компонентов в этом равновесии существенно изменяет рН.
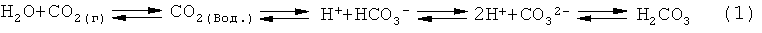
рН и концентрация СО2 также влияют на химические процессы в воде и образование минералов. Например, когда преобладают щелочные условия, факторы равновесия благоприятствуют осаждению бикарбонатов и групп углекислоты в качестве карбонатных минералов. С другой стороны, кислые условия способствуют выделению СО2 и диссоциации карбонатов.
Ясно, что снижение выделения CO2 является необходимым для предотвращения потенциально вредных изменений биосферы. Изоляция СО2 является известным способом снижения выделения СО2 в атмосферу. Например, месторождение нефти и газа Слейпнер, расположенное в Северном море, применяется для хранения сжатого СО2, который прокачивается насосом в 200-метровый слой песчаника, примерно на 1000 метров ниже морского дна. Примерно 1 миллион метрических тонн CO2 (эквивалентно примерно 3% общего CO2, ежегодно выделяемого Норвегией), ежегодно изолируется на Слейпнере.
Долговременная эффективность такой изоляции остается предметом интенсивного исследования и обсуждений. В частности, неоднозначность времени хранения (из-за утечки), сейсмической нестабильности, изменений в слоистых структурах из-за давления и/или химических реакций, инициируемых и/или катализируемых хранящимся CO2, и потенциальной миграции поверхностного CO2 вызывает серьезные сомнения в долговременной целостности такой системы.
Минеральная изоляция включает реакцию СО2 до формирования геологически стабильных карбонатов, т.е. минеральную карбонизацию. Предложено несколько способов достижения карбонизации, основанных большей частью на кислотно-основных реакциях между CO2 и различными видами силикатов. В схеме подземного введения, проводимого при 105°С и давлении 90 атм, СО2 используется для тестирования адекватности улавливания минералами CO2. Данная схема введения неудачна из-за медленной кинетики реакции. Считается, однако, что введение CO2 в водоносный материал и взаимодействие в геологических масштабах времени могут дать желаемый результат.
Улавливание и хранение CO2 является сложной задачей, и остается много проблем. Карбонизация минералов является многообещающим способом, поскольку имеется ряд преимуществ снижения концентрации CO2 путем карбонизации минералов. Одним из преимуществ является долговременная стабильность образующихся карбонатов, которые безопасны для окружающей среды и являются стабильными материалами в геологических масштабах времени. Другим преимуществом является обширная доступность сырьевых материалов для изоляции CO2. Другим преимуществом карбонизации минералов является их возможность быть экономически жизнеспособными, поскольку общий процесс является экзотермическим. В дополнение, ее возможность к производству побочных продуктов с дополнительными ценными свойствами при процессе карбонизации может далее компенсировать ее затраты. Другим преимуществом процесса минеральной карбонизации также является большая доступность мест, в которых может осуществляться изоляция.
Таким образом, в настоящее время имеется потребность в реальных средствах изоляции CO2 для значительного снижения концентрации СО2 в атмосфере и в воде в пригодных практически временных масштабах.
Краткое изложение сущности изобретения
В одном воплощении изобретение обеспечивает способ снижения концентрации CO2 в жидкости, включающий введение потока первого газа, не включающего CO2 или включающего его следовые количества, и введение второго газа, включающего СО2 в концентрации выше той, что находится в равновесии воздух-вода, в жидкость, включающую:
соль, и
жидкость;
где в указанной жидкости образуется твердый карбонат, а концентрация указанного СО2 в указанной жидкости снижается.
В одном воплощении данное изобретение обеспечивает жидкость, включающую первый газ под давлением, не включающий СО2 или включающий его следовые количества, и второй газ, включающий СО2 в концентрации по крайней мере выше той, что находится в равновесии воздух-вода, и соль.
В одном воплощении данное изобретение обеспечивает способ снижения концентрации СО2 в жидкости, включающий этапы:
i) введения потока СО2 в жидкость, включающую соль, с образованием углекислоты в растворе; и
ii) смешивания указанного раствора углекислоты в (i) с основанием, где рН указанной смеси в (ii) находится между 9-12; и
образуется твердый карбонат, а концентрация СО2 в указанном образце жидкости снижается.
В одном воплощении изобретение обеспечивает устройство для снижения концентрации СО2 в жидкости, включающее:
- первый конвейер для введения первого газа, не включающего СО2 или включающего его следовые количества;
- второй конвейер для введения второго газа, включающего СО2 в концентрации по крайней мере выше той, что находится в равновесии воздух-вода, и
- реакционную камеру;
где при добавлении раствора, включающего соль, в указанную реакционную камеру, введении указанного первого газа в указанную реакционную камеру через указанный первый конвейер и введении указанного второго газа в указанную реакционную камеру через указанный второй конвейер происходит образование твердого карбоната в указанной реакционной камере и выделение непрореагировавшего газа, включающего CO2 в сниженной концентрации.
В другом воплощении изобретение обеспечивает способ снижения концентрации CO2 в жидкости, где указанный способ включает внесение указанной жидкости в устройство данного изобретения,
В одном воплощении изобретение обеспечивает устройство для снижения концентрации CO2 в образце жидкости, включающее:
- первый конвейер для введения основания;
- второй конвейер для введения образца жидкости, включающего CO2;
- реакционную камеру; и
где при добавлении раствора, включающего соль, в указанную реакционную камеру, введении указанного основания в указанную реакционную камеру через указанный первый конвейер и введении указанного образца жидкости в указанную реакционную камеру через указанный второй конвейер происходит образование твердого карбоната в указанной реакционной камере и выделение непрореагировавшего газа.
В другом воплощении данное изобретение обеспечивает способ снижения концентрации CO2 в образце жидкости, где указанный способ включает введение образца жидкости в устройство данного изобретения для снижения концентрации СО2 в жидкости.
Краткое описание чертежей
Изобретение можно лучше понять со ссылкой на следующее подробное описание с сопроводительными чертежами, на которых:
Фиг.1 схематически изображает элементы устройства для выполнения одного воплощения способа данного изобретения. Конвейер (1-10) подает воду из внешнего источника в реакционную камеру, которая в данном воплощении является резервуаром (1-20). Давление или насос подают воду так, что она выходит из камеры (1-30) и может рециркулировать. Вводится концентрированный CO2 - проводящий газ (1-40). Воздух, или воздух, содержащий одну или более добавок для дальнейшего повышения/контроля рН, или основание в газовой фазе или щелочном растворе (1-90) поступают в камеру и осаждают твердый карбонат (1-20А). Устройство может включать выводы для высвобождения воздуха или СО2 (1-100), который может повторно поступать в камеру через порты ввода (1-40) и (1-90) соответственно. Трубопроводы и другие сходные типы оборудования могут применяться для проведения газов до желаемых мест расположения. Дополнительные порты могут обеспечивать введение (или дополнительное введение) минеральных гранул (или коллоида), суспендированных в воде, и/или любого другого твердого матриксного материала (который действует как материал для образования ядра для облегчения осаждения карбоната) (1-50) и (1-70); и/или источников солей, таких как соли кальция или магния (1-60) и (1-80).
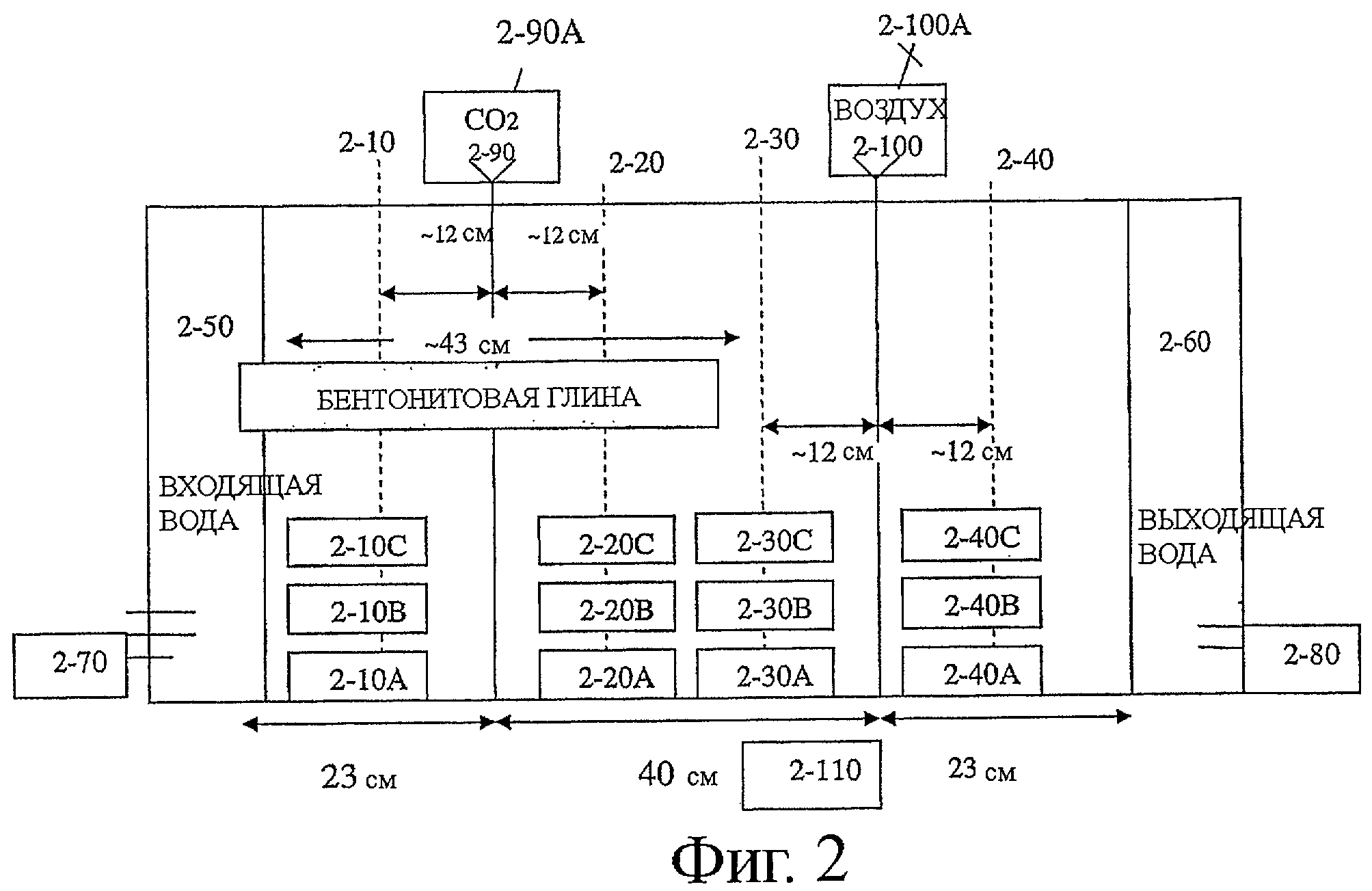
Фиг.2 является схематическим изображением экспериментальной проточной ячейки. Ячейка разделена на три секции: резервуар (2-110), источник притока (2-50) и выводной проток (2-60), расположенные на любом конце. Перистальтические насосы (2-70 и 2-80), работающие постоянно, расположены так, чтобы вода циркулировала. Конвейер для введения воздуха (2-100) и для СО2 (2-90) расположены внутри ячейки. Ячейка упакована песком и дополнительно частично закрыта покрывающим элементом из глины. Конвейеры соединены с клапаном, контролирующим поток и давление воздуха (2-100А) и CO2 (2-90А). Четыре устройства для отбора проб, расположенные в ячейке (2-10, 2-20, 2-30, 2-40) для обеспечения отбора проб в различных участках, на различных высотах, обозначенных как А, В или С.
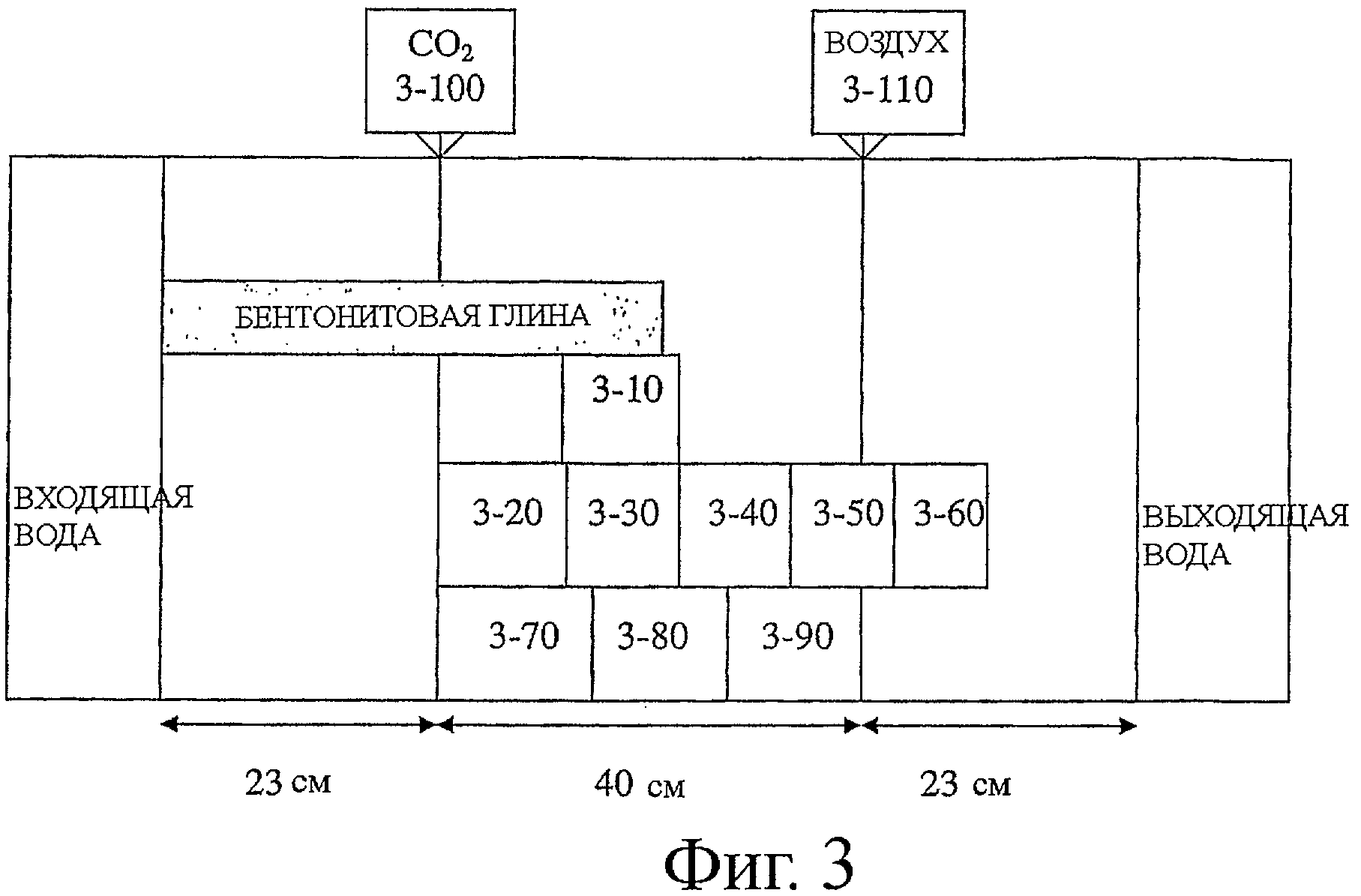
Фиг.3 является схематическим изображением проточной ячейки из фиг.2, с участками отбора пробы, отмеченными в зависимости от их близости к конвейерам (3-100;3-110).
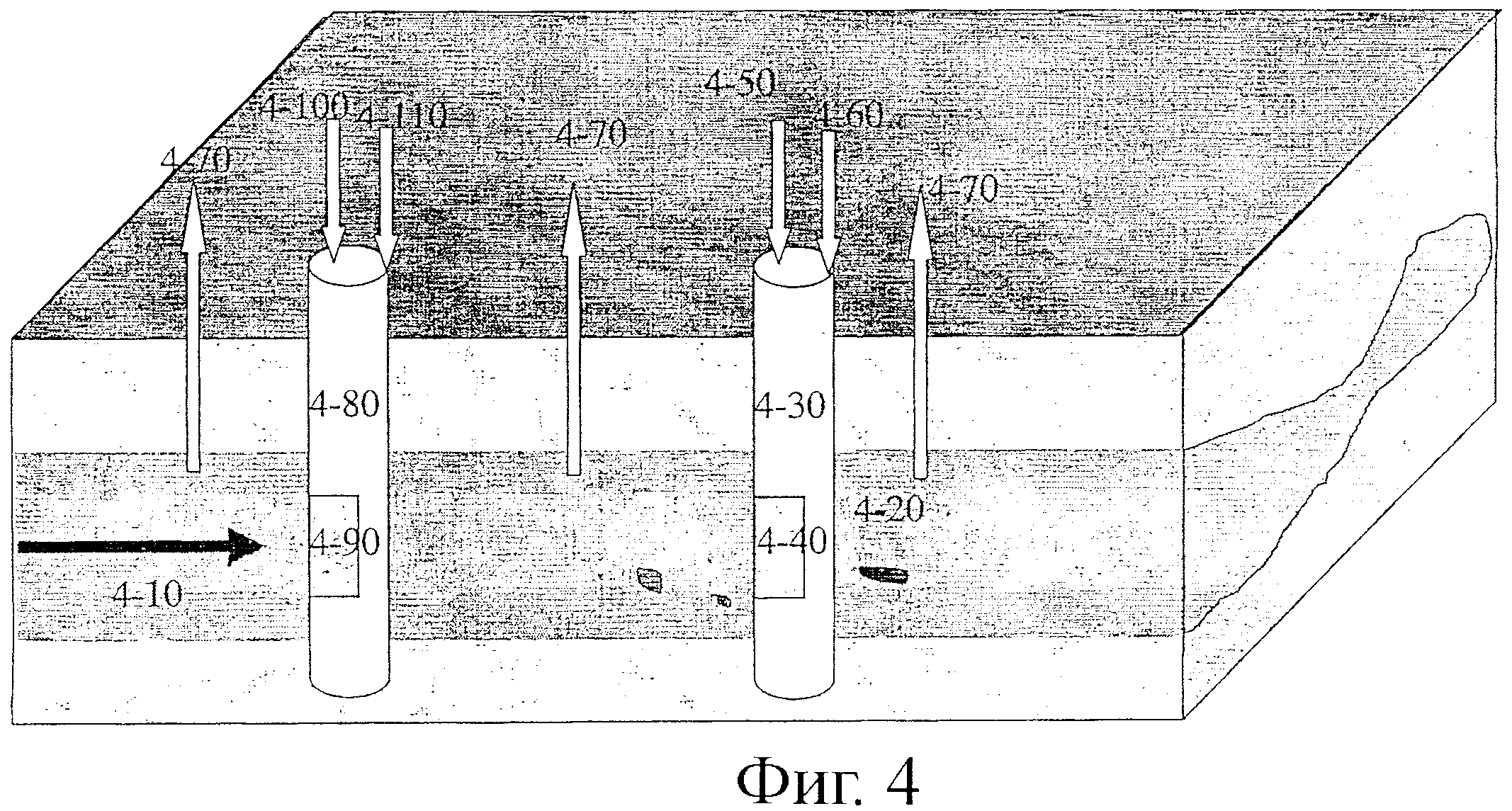
Фиг.4 является схематической иллюстрацией подземной системы с двойными скважинами. Двуокись углерода (обогащенная, концентрированная форма газа, чистый CO2 или CO2, смешанный с другими газами) и воздух (или другой газ или смесь газов) подаются через вводы (4-100) и (4-50), соответственно, через вводные скважины (4-80) и (4-30), соответственно, и дополнительно просеиваются, (4-90) и (4-40), соответственно, для обеспечения свободного прохождения CO2 и воздуха, например, к водоносному слою (4-10). Водоносный слой, посредством насосов или вводных скважин, или за счет естественного градиента, может обеспечивать поток грунтовой воды. Другие вводы (4-110) и (4-60) введены в каждую скважину (4-80 и 4-30, соответственно) для дополнительного добавления солей (таких как соли кальция или магния) и/или минеральных гранул (или коллоида), суспендированных в воде, и/или другого твердого матриксного материала. Избыток CO2 и/или воздуха высвобождается через дополнительные выводы (4-70) и может возвращаться назад во вводы (4-100) и (4-50), соответственно. Кода CO2 и воздух вводятся в водоносный слой, образуется твердый карбонат (4-20).
Нужно понять, что для простоты и ясности иллюстрации элементы, показанные на фигурах, не обязательно изображены в масштабе. Например, размеры некоторых элементов могут быть преувеличены относительно других элементов для ясности. Далее, там, где это необходимо, номера ссылок могут повторяться на фигурах для указания соответствующих или аналогичных элементов.
Подробное изложение сущности данного изобретения
В последующем подробном описании далее установлены многочисленные конкретные детали для того, чтобы обеспечить доскональное понимание изобретения. Однако, специалистам в данной области техники понятно, что данное изобретение может осуществляться на практике без этих конкретных деталей. В других случаях хорошо известные способы, процедуры и компоненты не описываются подробно, чтобы не затруднять понимание данного изобретения.
Данное изобретение обеспечивает, в некоторых воплощениях, способы, жидкости и устройства для снижения атмосферной концентрации CO2. В некоторых воплощениях такие жидкости, способы и устройства пригодны для обработки воздуха в любой окружающей среде. В другом воплощении такие жидкости, способы и устройства пригодны для обработки воздуха в виде побочного продукта производственного процесса перед высвобождением в окружающую среду. Как таковые, способы, жидкости и устройства для применения в соответствии с данным изобретением благоприятны для окружающей среды. В некоторых воплощениях атмосферный СО2 является воздухом из любого участка, загрязненного высоким уровнем CO2. В некоторых воплощениях поток CO2 совместно с дополнительным потоком воздуха вводят в резервуар, включающий водный раствор ионов металла, где указанные ионы металла осаждают CO2, образуя твердый карбонат, таким образом снижая атмосферную концентрацию СО2 путем образования осадка, твердого карбоната, и предотвращая утечку СО2 в атмосферу. В некоторых воплощениях поток СО2 вводят в водный раствор, включающий ионы металла и основания, добавленные в указанный водный раствор, где указанные ионы металла осаждают CO2, образуя твердый карбонат, таким образом снижая атмосферную концентрацию СО2 путем образования твердого карбоната, и предотвращая утечку CO2 в атмосферу.
В некоторых воплощениях данное изобретение обеспечивает способы, жидкости и устройства для снижения концентрации СО2 в жидкости. В некоторых воплощениях жидкость является водным раствором. В некоторых воплощениях данное изобретение обеспечивает способы, жидкости и устройства для снижения концентрации CO2 в водном растворе. В некоторых воплощениях поток СО2 вместе с потоком воздуха вводят в водный раствор, включающий ионы металла, образуя высокую концентрацию CO2 в водном растворе, где СО2 образует осадок вместе с ионами металла, таким образом снижая концентрацию СО2 в водном растворе. В некоторых воплощениях поток СО2 вводят в водный раствор, включающий ионы металла и основания, добавленные в указанный водный раствор, где указанные ионы металла осаждают СО2, образуя твердый карбонат, таким образом снижая атмосферную концентрацию СО2 путем образования осадка, твердого карбоната, и предотвращая утечку СО2 в атмосферу.
В некоторых воплощениях водный раствор происходит из природного источника. В другом воплощении данное изобретение предполагает применение природных источников для снижения концентрации СО2. В другом воплощении природными источниками являются океаны, озера, реки, моря, резервуары, грунтовая вода или солоноватая вода, богатая ионами Са.
В другом воплощении водный раствор является сточными водами опреснительной установки.
В одном воплощении такие способы, жидкости и устройства могут найти применение в обработке воздуха, содержащего высокий уровень СО2. В другом воплощении СО2 может быть получен при сжигании отходов, пластика, углеводородов, древесины, ископаемого топлива, угля, лигнита, лигроина, масла, бензина, дизельного топлива, керосина, нефти, сжиженного нефтяного газа (LPG), природного газа, баллонного газа, метана, бутана, пропана, газолиновых добавок, этанола, метанола, биодизеля, моноалкил эфира и/или их комбинаций.
В другом воплощении такие способы, жидкости и устройства могут найти применение в обработке СО2, вырабатываемого в виде побочного продукта в процессах человеческой деятельности. В другом воплощении такие способы, жидкости и устройства могут найти применение в снижении парникового эффекта. В другом воплощении такие способы, жидкости и устройства могут найти применение в снижении глобального потепления. В другом воплощении такие способы, жидкости и устройства могут найти применение в снижении гидравлической проводимости, например, для предотвращения проникновения соленой воды или других загрязнителей.
В одном воплощении данное изобретение обеспечивает способ снижения концентрации любого газового или жидкого загрязнителя путем связывания или хранения газовых или жидких загрязнителей в слое почвы, с образованием менее токсичного продукта. В одном воплощении такой слой включает ионный и/или пористый материал.
В одном воплощении газы, обрабатываемые с помощью способов, жидкостей и устройств данного изобретения, могут включать парниковый газ, такой как включающий СО, СО2, NOx, SOx, и/или метан (где х является целым числом 1-2). В другом воплощении концентрация атмосферного SO2 или SO2, растворенного в воде, может быть снижена путем образования твердых сульфатов, например, сульфата кальция или сульфата магния.
В одном воплощении данное изобретение обеспечивает способ снижения концентрации СО2 в жидкости, включающий введение потока первого газа, не включающего или включающего следовые количества СО2, в жидкость, включающую:
второй газ, включающий СО2 в концентрации по крайней мере выше той, что находится в равновесии воздух-вода;
соль; и
жидкость;
где образуется твердый карбонат в указанной жидкости, а концентрация СО2 в указанной жидкости снижается.
В некоторых воплощениях способы и устройства применяют жидкости, включающие первый газ, где указанным первым газом является воздух, азот, аргон, кислород, СО, NOx, SOx, метан или их любые комбинации. В другом воплощении следовые количества СО2 в указанном первом газе находятся в диапазоне 0-0,04% о/о СО2. В другом воплощении первый газ получают на химическом заводе. В другом воплощении первый газ получают из коммерческого источника. В другом воплощении первый газ получают из атмосферы.
В некоторых воплощениях способы и устройства применяют жидкости, включающие второй газ, включающий CO2 в концентрации по крайней мере выше той, что находится в равновесии воздух-вода, где концентрация атмосферного СО2, влияющая на равновесие воздух-вода, в настоящее время составляет около 350 ч./млн (0,035% о/о). В другом воплощении концентрация CO2, находящегося в равновесии воздух-вода, находится в диапазоне 200-1000 ч./млн, в зависимости от условий окружающей среды, таких как рН, минерализация, температура и давление.
В одном воплощении способы и устройства применяют жидкости, включающие второй газ, включающий СО2 в концентрации по крайней мере 0,1% о/о. В другом воплощении второй газ включает CO2 в концентрации по крайней мере 0,5% о/о. В другом воплощении второй газ включает СО2 в концентрации по крайней мере 1% о/о. В другом воплощении второй газ включает СО2 в концентрации по крайней мере 10% о/о. В другом воплощении второй газ включает СО2 в концентрации по крайней мере 20% о/о. В другом воплощении второй газ включает CO2 в концентрации по крайней мере 30% о/о. В другом воплощении второй газ включает СО2 в концентрации по крайней мере 50% о/о. В другом воплощении второй газ является чистым CO2.
В одном воплощении термин «чистый» относится ко второму газу как смеси СО2, газа и/или жидкости с CO2 в диапазоне 90-100% о/о, имеющему концентрацию CO2 в диапазоне 90-100% о/о. В другом воплощении диапазон концентрации СО2 составляет примерно 95-100% о/о. В другом воплощении диапазон концентрации СО2 составляет примерно 99-100% о/о. В другом воплощении диапазон концентрации СО2 составляет примерно 70-100% о/о. В другом воплощении термин «чистый» относится к СО2, свободному от других газов. В одном воплощении второй газ, применяемый в способах, устройствах и жидкостях, находится в водном растворе.
В другом воплощении водный раствор является сверхнасыщенным раствором СО2.
В одном воплощении первый газ и второй газ, применяющиеся в способах, устройствах и жидкостях данного изобретения, вводятся в жидкость. В соответствии с данным аспектом, и в одном воплощении, первый газ вводят при скорости потока, эффективной для снижения концентрации СО2 в жидкости. В другом воплощении первый газ имеет скорость потока в диапазоне отношения второго газа к первому газу примерно от 20:1 до 1:500. Еще в одном варианте первый газ вводят при скорости потока в диапазоне отношения второго газа к первому газу примерно от 2:1 до 1:200. В другом воплощении первый газ вводят при скорости потока в диапазоне отношения второго газа к первому газу примерно от 10:1 до 1:10000.
В другом воплощении способы, жидкость и устройства применяют второй газ, где указанный второй газ наносят или вводят в жидкость или раствор при объемной скорости потока, эффективной для повышения концентрации CO2 в жидкости или растворе. В другом воплощении объемная скорость потока зависит от размера обрабатываемой зоны.
В одном воплощении способы, жидкость и устройства применяют первый газ, где первый газ наносится, вводится или вносится в жидкость или в раствор перед солюбилизацией, внесением или введением второго газа. В другом воплощении способы устройства и жидкость включают или применяют первый газ, который может наноситься, вводиться или вноситься в жидкость или раствор после солюбилизации, внесения или введения второго газа. В другом воплощении способы, устройства и жидкость включают или применяют первый газ, который может наноситься, вводиться или вноситься в жидкость или раствор одновременно с солюбилизацией, внесением или введением второго газа.
В одном воплощении способы, жидкость и устройства применяют первый газ, который удаляет или снижает CO2 в водном растворе и одновременно повышает рН раствора. В другом воплощении рН в указанном водном растворе находится между 9-12 на участке 1-100 м от введения первого газа. В другом воплощении рН в указанном водном растворе находится между 9-12 на участке 0,1-100 м от введения первого газа. В другом воплощении рН в указанном водном растворе находится между 9-12 на участке 50-100 м от введения первого газа. В другом воплощении рН в указанном водном растворе находится между 9-12 на участке 1-10 м от введения первого газа. В другом воплощении рН в указанном водном растворе находится между 9-12 на участке 0,1-1 м от введения первого газа. В другом воплощении рН в указанном водном растворе находится между 9-12, где участок эффективности зависит от скорости потока первого газа. В другом воплощении этот процесс облегчает осаждение твердого карбоната, в то время как CO2 из указанного второго газа связывается в виде карбоната. В одном воплощении осадок твердого карбоната остается в жидкости. В другом воплощении твердый карбонатный осадок дополнительно выделяют. В другом воплощении выделение осадка осуществляют посредством фильтрации и/или центрифугирования, или их комбинации. В другом воплощении осадок извлекают, в другом воплощении повторно перерабатывают, а в другом воплощении регенерируют или повторно используют.
В другом воплощении способы, жидкость и устройства применяют второй газ, где указанный второй газ является последствием процесса человеческой деятельности, последствием природного процесса, или газом, создаваемым в виде побочного продукта в процессе человеческой деятельности. В другом воплощении способы, жидкость и устройства применяют второй газ, где указанный второй газ высвобождается в атмосферу и подается в жидкость через трубопроводы. В другом воплощении способы, жидкость и устройства применяют второй газ, где указанный второй газ передается через выхлопную систему завода, где CO2 выбрасывается в жидкость через трубопроводы, таким образом предотвращая высвобождение CO2 в атмосферу.
В некоторых воплощениях способы и устройства применяют жидкости, включающие второй газ, включающий СО2 в концентрации по крайней мере выше той, что находится в равновесии воздух-вода, где указанный второй газ создается в виде побочного продукта процесса человеческой деятельности и выбрасывается в атмосферный воздух, таким образом формируя воздух, загрязненный СО2.
В одном воплощении способы, жидкость и устройства применяют СО2. В другом воплощении CO2 получают из второго газа, включающего СО2 в концентрации по крайней мере выше той, что находится в равновесии воздух-вода, для образования твердого карбоната. В другом воплощении СО2 получают из первого газа, включающего следовые количества CO2, для образования твердого карбоната. В другом воплощении СО2 получают из воды для образования твердого карбоната.
В одном воплощении способы, жидкость и устройства применяют жидкость или водный раствор, где нанесение или введение первого газа до или после второго газа приводит к повышению рН. В другом воплощении рН является щелочным рН при введении первого газа. В другом воплощении щелочной рН, образуемый при введении первого газа, находится в диапазоне 7-9. В другом воплощении щелочной рН, образуемый при введении первого газа, находится в диапазоне 7-8. В другом воплощении щелочной рН, образуемый при введении первого газа, находится в диапазоне 7-10. В одном воплощении способы, устройства и жидкость включают или применяют жидкость и/или водный раствор при щелочном рН.
В одном воплощении при воздействии второго газа на первый газ в присутствии солевого раствора образуется твердый карбонат.
В одном воплощении данное изобретение обеспечивает способ снижения концентрации СО2 в жидкости, включающий этапы:
i) внесения потока CO2 в жидкость, включающую соль, до образования углекислоты в растворе; и
ii) смешивания раствора указанной углекислоты (i) с основанием,
где рН указанной смеси (ii) находится между 9-12; и
образуется твердый карбонат, а концентрация CO2 в указанном растворе снижается.
В одном воплощении раствор углекислоты из этапа (i) добавляют к основанию до повышения рН указанного раствора и образования твердого карбоната. В другом воплощении раствор углекислоты включает углекислоту, бикарбонат, соль и СО2. В другом воплощении основание добавляют к раствору углекислоты.
В некоторых воплощениях CO2, применяемый в способах, устройствах и жидкостях, вводят в жидкость, включающую соль, при скорости потока, эффективной для увеличения концентрации СО2 в указанной жидкости. В другом воплощении CO2 применяют в смеси газов, включающей СО2. В другом воплощении смесью газов является воздух, обогащенный CO2. В другом воплощении скорость потока зависит от размера обрабатываемой зоны. В другом воплощении более высокая скорость потока снижает выход образующегося твердого карбоната в соответствии с Примером 35. В другом воплощении CO2 вводят при нормальном атмосферном давлении. В другом воплощении применяют 12% CO2/воздух, таким образом парциальное давление CO2 составляет 0,12 атмосфер. В другом воплощении применяют 12% CO2/воздух, в соответствии с Примерами 31-37. В другом воплощении термин «нормальное давление» относится к атмосферному давлению. В другом воплощении воздух, обогащенный CO2, выделяется при нормальном/атмосферном давлении. В другом воплощении применяют 100% CO2 при атмосферном давлении.
В некоторых воплощениях способы, устройства и жидкости данного изобретения применяют жидкость, включающую соль, в которую вносят и/или вводят CO2. В одном воплощении концентрация указанного СО2 в указанной жидкости эффективна для образования твердого карбоната. В другом воплощении указанная жидкость насыщена CO2.
В некоторых воплощениях способы, устройства и жидкости данного изобретения применяют углекислоту. В одном воплощении указанная углекислота образуется в водном растворе, включающем соль металла, при внесении и/или введении СО2 в указанный водный раствор. В другом воплощении указанная углекислота образуется в указанном водном растворе при рН в диапазоне 3-6. В другом воплощении указанная углекислота образуется при рН в диапазоне 3,5-5,5. В другом воплощении указанная углекислота образуется при рН в диапазоне 4-5.
В некоторых воплощениях СО2, применяемый в способах, устройствах и жидкостях, вносят или вводят в жидкость. В другом воплощении СО2 является смесью CO2 и газа и/или жидкости. В другом воплощении смесь включает СО2 и воздух. В другом воплощении смесью является атмосферный воздух. В другом варианте смесь включает, по меньшей мере, 0,1% о/о CO2. Еще в одном варианте смесь включает, по меньшей мере, 0,5% о/о CO2. В другом воплощении смесь включает по крайней мере 10% о/о СО2. В другом воплощении смесь включает по крайней мере 1% о/о CO2. В другом воплощении смесь включает по крайней мере 20% о/о CO2. В другом воплощении смесь включает по крайней мере 30% о/о СО2. В другом воплощении смесь включает по крайней мере 50% о/о CO2. В другом воплощении СО2 является чистым газом.
В некоторых воплощениях способы, устройства и жидкости данного изобретения применяют основание. В одном воплощении основание включает NH3 (газ), NH3 (жидк.), NaOH, известковую воду, Са(ОН)2, угольную золу или их любую комбинацию. В другом воплощении известковая вода является свежеприготовленной из хлорида кальция и гидроксида натрия. В другом воплощении известковая вода является свежеприготовленной из хлорида кальция и гидроксида натрия в соответствии с примерами 4-8 и 16. В другом воплощении применяют коммерческую известковую воду. В другом воплощении применяют коммерческий твердый Са(ОН)2. В другом воплощении применяют водный раствор NaOH. В другом воплощении применяют гранулы NaOH. В одном воплощении NH3 (газ) или NH3 (жидк.) являются источником аммиака, обусловленном синтезом при деятельности человека. В другом воплощении NH3 (газ) или NH3 (жидк.) происходят из домашних или природных источников гуано птиц, из птицефабрик или минеральных месторождений. В другом воплощении NH3 (газ) или NH3(жидк.) происходят из бычьей, свиной, овечьей, лошадиной мочи и/или фекалий. В другом воплощении NH3 (газ) или NH3 (жидк.) происходят из сточных вод рыбохозяйств или морских млекопитающих. В другом воплощении NH3 (газ) или NH3 (жидк.) происходят из мочи. В одном воплощении навоз животных используют в качестве источника указанного основания. В другом воплощении навоз животных происходит от свиней и цыплят.
В одном воплощении раствор углекислоты добавляют к основанию, что приводит к повышению рН до 8,5-12,5. В другом воплощении рН повышается до значений между 9-12. В другом воплощении рН повышается до значений между 9-11. В другом воплощении рН повышается до значений между 10-11.
В другом воплощении раствор углекислоты добавляют к основанию в атмосфере инертного газа. В другом воплощении раствор углекислоты добавляют в атмосфере аргона.
В одном воплощении CO2, углекислоту и раствор бикарбоната добавляют к основанию, где отношение между указанной углекислотой/CO2/бикарбонатом и основанием находится в диапазоне молярного отношения от 1:100 до 1:1. В одном воплощении отношение указанной углекислоты/СО2/бикарбоната и основания находится в диапазоне молярного отношения 1:100 и 1:80. В одном воплощении отношение указанной угольной кислоты/CO2/бикарбоната и основания находится в диапазоне молярного отношения от 1:80 до 1:60. В одном воплощении отношение указанной угольной кислоты/CO2/бикарбоната и основания находится в диапазоне молярного отношения от 1:60 до 1:40. В одном воплощении отношение указанной угольной кислоты/CO2/бикарбоната и основания находится в диапазоне молярного отношения от 1:40 до 1:20. В одном воплощении отношение указанной угольной кислоты/СО2/бикарбоната и основания находится в диапазоне молярного отношения от 1:20 до 1:10.
В другом воплощении твердый карбонат образуется при добавлении раствора углекислоты к основанию. В другом воплощении осаждение твердого карбоната по крайней мере при рН 9 повышает выход. В другом воплощении осаждение твердого карбоната при рН в диапазоне 9-12 повышает выход. В другом воплощении осаждение твердого карбоната по крайней мере при рН 10 повышает выход. В другом воплощении повышение рН выше значения 12,5 снижает выход твердых карбонатов и повышает выход твердых гидроксидов.
В другом воплощении соль металла и/или основание дополнительно добавляют после образования твердого карбоната, таким образом повышая выход твердого карбоната.
В некоторых воплощениях способы, применение устройств и жидкостей данного изобретения обеспечивает твердый карбонат. В одном воплощении осадок твердого карбоната далее выделяют. В другом воплощении выделение осадка осуществляют посредством фильтрации и/или центрифугирования, или их комбинации. В другом воплощении осадок извлекают, а в другом воплощении повторно перерабатывают, или в другом воплощении регенерируют или повторно используют. В другом воплощении фильтрат извлекают, а в другом воплощении повторно перерабатывают, или в другом воплощении регенерируют или повторно используют. В другом воплощении фильтрат повторно перерабатывают и добавляют к основанию, и/или ион металла добавляют к фильтрату для обеспечения дополнительного осаждения твердого карбоната. В другом воплощении фильтрат повторно перерабатывают и добавляют к основанию, и/или ион металла, CO2, или любую их комбинацию добавляют к фильтрату для обеспечения дополнительного осаждения твердого карбоната.
В другом воплощении способы, жидкость и устройства данного изобретения применяют газ СО2, где указанный газ СО2 высвобождается в процессе человеческой деятельности, вследствие природного процесса, или этот газ вырабатывается в качестве побочного продукта в процессе человеческой деятельности. В другом воплощении способы, жидкость и устройства применяют газ CO2, где указанный газ CO2 высвобождается в атмосферу, и подается в жидкость по трубопроводам. В другом воплощении способы, жидкость и устройства применяют газ СО2, где указанный газ СО2 подается из вытяжной системы завода, где СО2 выбрасывается в жидкость по трубопроводам.
В одном воплощении термин «жидкость» относится к любому материалу или веществу, текучему или перемещающемуся. В одном воплощении термин «жидкость» относится к любому материалу или веществу, находящемуся в полутвердой форме, или в другом воплощении в жидкой форме, или в другом воплощении в виде ила, или в другом воплощении в виде пара, или в другом воплощении в виде газа, или в другом воплощении в виде в любой другой форме или состоянии, которые текут, или в другом воплощении, движутся.
Жидкости данного изобретения для применения в способах и/или устройствах данного изобретения включают, среди прочего, водные растворы. В другом воплощении жидкости данного изобретения для применения в способах и/или устройствах данного изобретения включают, среди прочего, физиологический раствор. В другом воплощении жидкости данного изобретения для применения в способах и/или устройствах данного изобретения включают, среди прочего, источник грунтовой воды. В другом воплощении жидкости данного изобретения для применения в способах и/или устройствах данного изобретения включают, среди прочего, природный источник воды. В другом воплощении жидкости данного изобретения для применения в способах и/или устройствах данного изобретения включают, среди прочего, сброс от опреснительной установки.
В одном воплощении термин «природный источник воды» может включать море, стоки от опреснительных установок, солоноватую воду, богатую ионами Са, озеро, океан, реку, или грунтовую воду.
В другом воплощении жидкости данного изобретения для применения в способах и/или устройствах данного изобретения включают, среди прочего, газ. В одном воплощении жидкости данного изобретения для применения в способах и/или устройствах данного изобретения включают, среди прочего, водный раствор с введенным газом. В другом воплощении жидкости данного изобретения для применения в способах и/или устройствах данного изобретения включают, среди прочего, газ, растворенный в водном растворе. В другом растворе жидкости данного изобретения для применения в способах и/или устройствах данного изобретения включают, среди прочего, жидкость. В другом воплощении жидкости данного изобретения для применения в способах и/или устройствах данного изобретения включают, среди прочего, водоносный слой.
В одном воплощении термин «снижение» относится к уменьшению. В другом воплощении термин «снижение» относится к падению, сокращению или аннулированию. В одном воплощении данного изобретения «снижение концентрации CO2» относится к изоляции СО2 в виде твердых карбонатов. В другом воплощении термин «снижение концентрации СО2» относится к замедлению подъема атмосферной концентрации СО2.
В некоторых воплощениях снижение концентрации СО2 в жидкости посредством способов, жидкостей и устройств данного изобретения применяет, среди прочего, образование твердых карбонатов, снижая таким образом CO2.
В одном воплощении термин «атмосферный воздух» относится к газу. В другом воплощении термин «атмосферный воздух» относится к воздуху. В другом воплощении термин «атмосферный воздух» воздух относится к части атмосферы. В другом воплощении термин «атмосферный воздух» относится к определенному окружению, например, внешней среде завода, производящего СО2 в качестве побочного продукта, или в пределах радиуса 10 км от завода, производящего CO2 в качестве побочного продукта, или центру деревни или промышленной области, и т.д.
В одном воплощении атмосферный воздух содержит высокий уровень CO2 вследствие процессов человеческой деятельности. В соответствии с данным аспектом, и в одном воплощении процесс включает, среди прочего, высвобождение CO2, например, при сжигании отходов, пластика, полимеров, углеводородов, углеродистых материалов, древесного топлива, ископаемого топлива, угля, лигнита, лигроина, масла, бензина, дизельного топлива, керосина, нефти, сжиженного нефтяного газа (LPG), природного газа, баллонного газа, метана, бутана, пропана, газолиновых добавок, этанола, метанола, биодизеля, моноалкил эфира и/или их комбинаций.
В другом воплощении воздух, содержащий высокий уровень CO2, переработанный и очищенный по крайней мере частично посредством способов, жидкостей и устройств данного изобретения, происходит от природного биологического процесса. В одном воплощении процессом является, например, разрушение органических материалов или продуктов сельского хозяйства (например, домашнего скота, сжигания на полях сельскохозяйственных остатков), производящее СО2 прямым или непрямым образом (например, высвобождением метана), с высвобождением загрязняющих веществ в объем окружающего воздуха. Например, метан вырабатывается в процессе пищеварения домашним скотом. В другом воплощении выделение метана сельскохозяйственными животными происходит от массивных «отстойников», используемых для хранения необработанных животных отходов с ферм. В другом воплощении CO2 и углеводороды, включающие метан, окисляются в атмосфере до CO2. Имеются различные источники метана, включая те, что производятся или высвобождаются бактериями, в лесах, сельскохозяйственными животными, или в процессах, проводимых в нефтяной и газовой промышленности. В другом воплощении повышенный уровень СО2 возникает в результате вырубания лесов. Ферментация сахаров и крахмалов (катализируемая дрожжами) производит этанол и газообразный CO2. В другом воплощении крупномасштабные промышленные процессы вырабатывают CO2. В другом воплощении крупномасштабные промышленные процессы включают контролируемое окисление этилена с получением окиси этилена и двуокиси углерода; нейтрализацию кислот, присутствующих в сточных водах промышленных процессов, проводимых с применением карбоната кальция (общеизвестного как известняк). CO2 возникает в результате кислотно-основной реакции. Большие количества побочного продукта двуокиси углерода производятся заводами, которые предназначены для производства водорода или аммиака. Эти заводы работают с потоком, преобразуя природный газ, сжиженный нефтяной газ (LPG) или лигроин в смесь синтезируемого газа (т.е. водорода, окиси углерода и двуокиси углерода, а окись углерода затем каталитически удаляют путем формирования дополнительной двуокиси углерода посредством реакции перемещения вода-газ. В дополнение промышленные процессы, применяющие углеводороды, такие как ацетилен, известны как источник CO2. Другие промышленные источники включают: (i) обработку фосфатных пород, способных высвобождать двуокись углерода; (ii) процессы сжигания, применяемые в генераторах для производства энергии путем реакции углеводородов с кислородом.
Нужно понять, что любой процесс, дающий жидкость, загрязненную СО2 любыми средствами, может применяться для способов, жидкостей и устройств данного изобретения.
В одном воплощении способов, жидкости и устройств данного изобретения применяется соль, где указанная соль является солью металла. В другом воплощении соль может включать, среди прочего, ионы кальция, ионы натрия, ионы калия, ионы магния, ионы бария, ионы марганца, ионы железа, ионы стронция, ионы цинка, ионы алюминия, ионы аммония, катионы, или любой другой катион, образующий твердый карбонат, или их любые комбинации. В другом воплощении указанная соль является ионом Са2+. В другом воплощении соль для применения в данном изобретении может включать, среди прочего, хлорид кальция, гидроксид кальция, соль Красного моря, CaSO4, оксид кальция, гидроксид магния, солоноватую воду, опреснительные стоки или их любые комбинации. В другом воплощении соль является минералом. В другом воплощении минерал является кальцитом, арагонитом, ватеритом, гипсом, магнезитом, оливином, серпентином или любой их комбинацией. В другом воплощении соль является неорганической солью. В другом воплощении соль является органической солью.
В другом воплощении концентрация указанного иона металла в указанной жидкости данного изобретения находится в диапазоне между 0.05М и 5М, где осаждение усиливается при повышении концентрации соли/иона металла. В другом воплощении концентрация указанного иона металла в указанной жидкости находится в диапазоне между 0,1М и 3М. В другом воплощении концентрация указанного иона металла в указанной жидкости находится в диапазоне между 0,1М и 1М. В другом воплощении концентрация указанного иона металла в указанной жидкости находится в диапазоне между 0,1М и 2М. В другом воплощении насыщенный раствор солей металлов снижает выход твердого карбоната.
В одном воплощении концентрация соли данного изобретения в жидкости данного изобретения меньше 0,01% в/в. В другом воплощении концентрация соли в жидкости составляет примерно между 0,01-20% в/в. В другом воплощении концентрация соли в жидкости составляет примерно между 0,01-0,1% в/в. В другом воплощении концентрация соли в жидкости составляет примерно между 0,1-1% в/в. В другом воплощении концентрация соли в жидкости составляет примерно между 0,01-1% в/в. В другом воплощении концентрация соли в жидкости составляет примерно между 1-3% в/в. В другом воплощении концентрация соли в жидкости составляет примерно между 3-10% в/в. В другом воплощении концентрация соли в жидкости составляет примерно между 10-20% в/в.
В одном воплощении выбор соли зависит от константы растворимости (Ksp) твердого карбоната, образующегося при реакции указанной соли с двуокисью углерода. В другом воплощении предпочтительной солью является соль, образующаяся с двуокисью углерода, твердый карбонат с низкой константой растворимости (Ksp) в водном растворе. Например, предпочтительной солью является соль кальция (хлорид кальция, гидроксид кальция, сульфат кальция), образующая вместе с двуокисью углерода карбонат кальция в виде осадка в водном растворе, имеющий низкую константу растворимости.
В одном воплощении способы данного изобретения включают образование слоя осадка твердого карбоната, где малые частицы твердого карбоната и/или твердый карбонат могут формировать пористое наполнение. В другом воплощении слой осадка твердого карбоната, малые частицы и/или пористое наполнение являются изолирующим слоем, под который можно дополнительно вводить СО2, в одном воплощении, и/или СО2 можно дополнительно восстанавливать под указанным слоем осадка твердого карбоната, малых частиц и/или пористого наполнения.
В другом воплощении термин «сверхнасыщенный» относится к водному раствору, включающему СО2 в концентрации, превышающей его растворимость. В другом воплощении растворимость CO2 в воде при комнатной температуре составляет около 33 мМ. Равновесие концентрации СО2 в воде является функцией температуры, давления, рН и солености. В одном воплощении растворимость СО2 в растворе зависит от давления СО2 в равновесии с раствором, причем растворимость возрастает с повышением давления. В другом воплощении растворимость CO2 в растворе зависит от температуры, причем растворимость снижается при повышении температуры. В другом воплощении растворимость СО2 снижается при повышении солености. В другом воплощении растворимость СО2 зависит от рН, причем растворимость СО2 возрастает при повышении рН.
В одном воплощении термин «примерно» относится к отклонению между 0,0001-5% от указанного числа или ряда чисел. В одном воплощении термин «примерно» относится к отклонению между 1-10% от указанного числа или ряда чисел. В одном воплощении термин «примерно» относится отклонению вплоть до 25% от указанного числа или ряда чисел.
В одном воплощении термины «а» и «an», используемые здесь, относятся по крайней мере к одному или множеству указанных элементов, которые могут присутствовать в любом желаемом порядке величин, для выполнения конкретного применения, как понятно специалистам в данной области техники. В одном воплощении термин «газ» относится к двум или более видам газа, которые отличаются по составу. В некоторых воплощениях жидкости, наборы и способы данного изобретения могут включать и/или применять множество видов газов для снижения концентрации CO2.
В одном воплощении выбор давления наносимых, вносимых или вводимых газов в данном изобретении зависит от размера резервуара над землей, в одном воплощении, или от того, наносится ли газ в подземную систему, такую как водоносный пласт, в другом воплощении.
Удаление СО2 является признанным в данной области техники термином, означающим, в некоторых воплощениях, удаление СО2, уменьшение или снижение содержания CO2 в жидкости или атмосфере. В некоторых воплощениях удаленный CO2 может быть повторно использован в системе с обратной связью, передающей CO2 в жидкость и/или реакционную камеру данного изобретения.
В некоторых воплощениях способы, жидкость и устройство могут включать повышение давления или скорости потока жидкостей, вводимых для повышения скорости осаждения твердого карбоната. В некоторых воплощениях способы, жидкость и устройство могут включать изменение жидкости для повышения скорости осаждения твердого карбоната. В некоторых воплощениях способы, жидкость и устройство могут включать изменение размера реакционной камеры для повышения скорости осаждения твердого карбоната. В некоторых воплощениях способы, жидкость и устройство могут включать изменение рН для увеличения скорости осаждения твердого карбоната. В некоторых воплощениях способы, жидкость и устройство могут включать изменение времени введения газа и/или жидкостей для повышения скорости осаждения твердого карбоната. В некоторых воплощениях способы, жидкости и устройства могут включать изменение относительной скорости потока вводимых газов и/или жидкостей для повышения скорости осаждения твердого карбоната. В одном воплощении вводимыми газами и/или жидкостями являются газ, включающий СО2, воздух, основание в газовой фазе, основный раствор, или любой газ данного изобретения,
В некоторых воплощениях количество осажденного твердого карбоната может быть функцией потока вводимых газов в данном изобретении. В другом воплощении количество осажденного твердого карбоната является функцией потока второго газа, газа CO2 или основания. В другом воплощении количество осажденного твердого карбоната является функцией отношения между потоком первого газа и потоком второго газа. В другом воплощении количество осажденного твердого карбоната является функцией концентрации соли. В другом воплощении количество осажденного твердого карбоната является функцией отношения между концентрациями соли и кристаллизующим материалом. В другом воплощении количество осажденного твердого карбоната является функцией температуры. В другом воплощении количество осажденного твердого карбоната является функцией рН. В другом воплощении количество осажденного твердого карбоната является функцией времени. В другом воплощении количество осажденного твердого карбоната является функцией концентрации других компонентов в жидкости.
Нужно понять, что изоляция СО2, образование твердого карбоната и любое последующее концентрирование, выделение, восстановление и повторное применение в любом последующем приложении считается частью данного изобретения. Такое восстановление и повторное применение легко понятно любому специалисту в данной области техники и может включать, например, применение фильтрации, центрифугирования или помещение полупроницаемого барьера на выходе потока воды, так что вода проводится, а твердый карбонат задерживается, и таким образом может быть концентрирован или изолирован.
В одном воплощении превращение СО2 в указанный карбонат можно анализировать изотопными измерениями, где имеются два стабильных изотопа углерода с атомным массами 12 и 13, и радиоактивный изотоп с атомной массой 14. Относительное количество любых двух изотопов одного и того же элемента варьирует по причине природных различий изотопного состава биогеохимических соединений. Благодаря изотопному фракционированию исследователи - биогеохимики могут проводить измерение отношений изотопов в соединениях, найденных в различных образцах земли, океана и атмосферных систем для изучения широкого разнообразия процессов. В другом воплощении СО2 можно анализировать с помощью газохроматографических масс-спектральных (ГХМС), масс-спектральных (МС) и/или спектрофотометрических методов, таких как инфракрасные методы (ИК).
В соответствии с данным аспектом и в некоторых воплощениях, превращение СО2 обнаруживается и применяется для установления снижения концентрации СО2. В другом воплощении детекция применяется для установления концентрации CO2 в растворе перед введением первого газа. В другом воплощении детекция применяется для установления количества СО2 в твердом карбонате.
В некоторых воплощениях выход образующегося твердого карбоната подсчитывают на основании количества СО2, введенного в жидкость данного изобретения. В другом воплощении выход образующегося твердого карбоната подсчитывают на основании количества ионов металла в жидкости. В другом воплощении выход образующегося твердого карбоната, основанный на количестве ионов металла в жидкости, подсчитывают в соответствии с Примером 30 и 33. В другом воплощении выход образующегося твердого карбоната, основанный на количестве введенного CO2, подсчитывают в соответствии с Примером 32.
В одном воплощении данное изобретение обеспечивает способ снижения концентрации CO2 в жидкости, включающий нанесение потока первого газа, не включающего или включающего следовые количества СО2, и нанесение потока второго газа, включающего CO2 в концентрации, по крайней мере превышающей ту, что находится в равновесии воздух-вода в жидкости, включающей:
соль; и
жидкость;
где твердый карбонат формируется в указанной жидкости, а концентрация указанного CO2 в указанной жидкости снижается. В соответствии с данным аспектом и в одном воплощении, указанная жидкость является водоносным слоем и дополнительно включает камни, несущие поры, не заполненные или заполненные солевым раствором. В другом воплощении CO2 хранится в указанных порах и/или образует твердый карбонат с солями солевого раствора в указанных порах.
В одном воплощении данное изобретение обеспечивает способ снижения концентрации CO2 в образце жидкости, включающий этапы:
i) нанесения потока CO2 на жидкость, включающую соль, с образованием углекислоты в растворе; и
ii) смешивания указанного раствора углекислоты в (i) с основанием,
в то время как рН указанной смеси в (ii) находится между 9-12; и
образуется твердый карбонат, а концентрация CO2 в указанном образце жидкости снижается. В соответствии с данным аспектом и в одном воплощении, указанная жидкость является водоносным слоем и дополнительно включает камни, несущие поры, не заполненные или заполненные солевым раствором. В другом воплощении СО2 хранится в указанных порах и/или образует твердый карбонат с солями солевого раствора в указанных порах.
В соответствии с данным аспектом и в одном воплощении способ приводит к выработке твердого карбоната, бикарбоната, углекислоты или любой их комбинации в виде конечных продуктов. В одном воплощении твердый карбонат или бикарбонат может включать ионы кальция, натрия, калия, магния, бария, марганца, железа, стронция, цинка, аммония или алюминия, или любой другой катион, образующий твердый карбонат, или любую их комбинацию.
В соответствии с данным аспектом и водном воплощении способ снижения концентрации CO2 в жидкости приводит к выработке твердого карбоната в виде осадка, или в другом воплощении к выработке карбоната в виде суспензии, или в другом воплощении к выработке растворимого карбоната, или в другом воплощении к выработке углекислоты, или в другом воплощении к выработке бикарбоната, или любой их комбинации. В соответствии с данным аспектом и в одном воплощении, жидкость является водоносным слоем, а CO2 дополнительно хранится в пористых камнях водоносного слоя.
В некоторых воплощениях способы, жидкость и устройства проводятся при условиях внешней среды. В одном воплощении термин «условия внешней среды» относятся к природным условиям. В другом воплощении такие условия относятся к температуре, например, когда желаемые жидкости находятся наиболее типично при комнатной температуре, то условия внешней среды, представленные для применения способов, жидкости и устройств данного изобретения, проводятся при комнатной температуре. В другом воплощении термин «условия внешней среды» относится к условиям, в которых находится в природе, например, существует в морях, резервуарах океанов, озерах, реках, почве, земле, облаках, льдах, пустыне, дне океана и т.д. В некоторых воплощениях условия внешней среды являются примерно теми, что находятся по отношению к жидкости, в которую хотят внести или ввести первый газ и/или второй газ, например, жидкостям, находящимся, например, в морской воде, источниках питьевой воды, для применения способов, жидкости и устройств по данному изобретению, при сходных условиях, включая концентрацию соли, температуру, давление и т.д., как в морской воде. В соответствии с данным аспектом и в одном воплощении, способы, жидкость и устройство данного изобретения осуществляются при условиях внешней среды, приближенных к тем, что находятся в море, в резервуаре, океане, озере или реке с точки зрения температуры, давления, концентрации соли и рН.
В одном воплощении способы, жидкость и устройства осуществляются при комнатной температуре. В другом воплощении способы, жидкость и устройства осуществляются при температуре, зависящей от той, что находится во внешней среде, в которой осуществляется способ.
В одном воплощении способы, жидкость и устройства применяют материал, служащий местом кристаллизации для образования карбоната в жидкости. В одном воплощении материал является минералом или коллоидными гранулами. В другом воплощении кристаллизующий материал суспендирован в воде и/или встроен в материал твердого матрикса.
Пример 2 представляет некоторые воплощения способов данного изобретения для снижения концентрации CO2 в жидкости и изоляции CO2 в виде осадка карбоната. В одном воплощении карбонат кальция образуется в участках введения воздуха, таким образом обосновывая применение системы Примера 2 для изоляции СО2 посредством осаждения карбоната.
Пример 3 представляет некоторые воплощения способов данного изобретения, включая измерение и анализ твердого карбоната посредством изотопного анализа.
В одном воплощении данное изобретение обеспечивает устройство для снижения концентрации CO2 в жидкости, включающее:
- первый конвейер для введения первого газа, не включающего или включающего следовые количества CO2;
- второй конвейер для введения второго газа, включающего CO2 в концентрации, по крайней мере превышающей ту, что находится в равновесии воздух-вода; и
- реакционную камеру;
при этом при добавлении раствора, включающего соль, в указанную реакционную камеру, введении указанного первого газа в указанную реакционную камеру через указанный первый конвейер и введении указанного второго газа в указанную реакционную камеру через указанный второй конвейер происходит образование твердого карбоната в указанной реакционной камере и увеличение непрореагировавшего газа, включающего сниженную концентрацию CO2.
В одном воплощении данное изобретение обеспечивает устройство для снижения концентрации CO2 в образце жидкости, включающий:
- первый конвейер для введения основания;
- второй конвейер для введения образца жидкости, включающей СО2;
- реакционную камеру; и
при добавлении раствора, включающего соль, в указанную реакционную камеру, введении указанного основания в указанную реакционную камеру через указанный первый конвейер и введении указанного образца жидкости в указанную реакционную камеру через указанный второй конвейер происходит образование твердого карбоната в указанной реакционной камере и увеличение непрореагировавшего газа.
Нужно понять, что любое воплощение, описанное здесь, например, по отношению к жидкости, первому газу, второму газу, газу СО2, основанию, карбонату, кристаллизующему материалу и т.д., применяется к любому аспекту данного изобретения, включая способы, устройства или жидкости и их соответствующие воплощения.
В одном воплощении устройства изобретения включают множество вводов для введения соли, воды, первого газа и/или второго газа. В другом воплощении устройство данного изобретения дополнительно включает выводы для воды, первого газа и/или второго газа. В некоторых воплощениях устройство включает серию каналов для передачи соответствующей соли, воды, первого газа и/или второго газа в реакционную камеру. В некоторых воплощениях устройство включает серию каналов для передачи соответствующей воды, первого газа и/или второго газа для выпуска из устройства. В другом воплощении устройство дополнительно включает конвейер для высвобождения газа из реакционной камеры. В некоторых воплощениях такие каналы сконструированы так, чтобы обеспечить контакт между вводимыми материалами. В некоторых воплощениях устройство включает насосы для облегчения передачи и/или контакта материалов в реакционной камере. В некоторых воплощениях выводы расположены, например, в трубопроводах, для передачи газа к вводам другого цикла изоляции CO2.
В одном воплощении устройство изобретения включает множество вводов для введения соли, воды, газа СО2 и/или основания. В другом воплощении устройство изобретения дополнительно включает выводы для воды, газа CO2, или любого другого непрореагировавшего газа. В некоторых воплощениях устройство включает серию каналов для передачи соответствующей соли, воды, газа СО2 и/или основания в реакционную камеру. В некоторых воплощениях устройство включает серию каналов для передачи соответствующей соли, воды, газа CO2 и/или основания для выпуска из устройства. В другом воплощении устройство дополнительно включает конвейер для высвобождения газа из реакционной камеры. В некоторых воплощениях такие каналы сконструированы так, чтобы обеспечить контакт между вводимыми материалами. В некоторых воплощениях устройство включает насосы для облегчения проведения и/или контакта материалов в реакционной камере. В некоторых воплощениях выводы расположены, например, в трубопроводах, для передачи газа к вводам другого цикла изоляции CO2.
В некоторых воплощениях устройство данного изобретения дополнительно включает источник воды. В одном воплощении вода происходит из водопроводной воды, подземной воды, морской воды, опресняющих установок, солоноватой воды, богатой Са, океанской воды, реки и/или озера.
В одном воплощении устройство данного изобретения дополнительно включает конвейер от источника воды в реакционную камеру. В другом воплощении устройство дополнительно включает конвейер от реакционной камеры к указанному источнику воды. В другом воплощении устройство дополнительно включает насос для циркуляции воды в устройстве. В другом воплощении устройство дополнительно включает насос для циркуляции воды от реакционной камеры к источнику воды, и наоборот. В другом воплощении реакционная камера включает источник воды. В другом воплощении устройство дополнительно включает насос для циркуляции воды в реакционной камере.
В одном воплощении устройство дополнительно включает источник соли. В другом воплощении устройство дополнительно включает конвейер от указанного источника соли к указанному источнику воды.
В одном воплощении первый конвейер, второй конвейер или их комбинация проводит первый газ, второй газ или их комбинацию к подземному источнику воды.
В одном воплощении первый конвейер, второй конвейер или их комбинация проводит основание, газ CO2 или их комбинацию к подземному источнику воды.
В одном воплощении устройства данного изобретения включают проточную систему, так что водный раствор, включающий соль, может протекать через устройство, который может, в одном воплощении, обеспечивать проведение реакции в течение длительного периода времени; таким образом процесс является более эффективным с точки зрения процента изолируемого СО2, в некоторых воплощениях, или количества осадка. В некоторых воплощениях эти временные рамки составляют недели и месяцы. В других воплощениях - месяцы и годы. В другом воплощении устройство данного изобретения включает проточную систему, так что водный раствор, включающий соль и СО2, может протекать через устройство, которое может, в одном воплощении, обеспечивать реакцию с основанием, и таким образом, твердый карбонат образуется в пределах минут. В другом воплощении временные рамки составляют секунды. В другом воплощении временные рамки составляют часы. В другом воплощении основание является NaOH, известковой водой или аммиаком.
В другом воплощении устройства данного изобретения могут включать мешалку. В некоторых воплощениях мешалка расположена в реакционной камере. В одном воплощении устройство может дополнительно включать ультразвуковую систему. В одном воплощении устройство включает средства для создания магнитного поля в устройстве, которое в некоторых воплощениях расположено для создания таких полей во многих направлениях, которые в некоторых воплощениях могут передвигать или перемешивать магнитные частицы в реакционной камере. Специалистам в данной области техники понятно, что устройства данного изобретения, в некоторых воплощениях, сконструированы модулярно для приспособления разнообразия смешивающих механизмов или орудий, считающихся частью данного изобретения.
В одном воплощении первый газ передается в реакционную камеру перед вводом второго газа. В одном воплощении первый аз передается в реакционную камеру перед солюбилизацией второго газа. В другом воплощении первый газ вводится в реакционную камеру.
В одном воплощении первый газ передается в реакционную камеру после подачи второго газа. В одном воплощении первый газ передается в реакционную камеру после солюбилизации второго газа в жидкости. В одном воплощении второй газ вводится в жидкость в реакционной камере.
В одном воплощении первый газ подается в реакционную камеру одновременно со вторым газом.
В одном воплощении газ СО2 подается в реакционную камеру перед подачей основания. В одном воплощении основание подается в реакционную камеру перед солюбилизацией газа СО2 в жидкости.
В некоторых воплощениях устройства данного изобретения включают порты или клапаны, через которые может создаваться давление, или в другом воплощении, могут подаваться жидкости под конкретным давлением. В одном воплощении жидкость вводят в устройство под приложенным давлением 1 атм. В одном воплощении жидкость вводят в устройство под приложенным давлением 1-10 атм. В одном воплощении жидкость вводят в устройство под приложенным давлением 10-20 атм. В одном воплощении жидкость вводят в устройство под давлением 20-30 атм. В одном воплощении жидкость вводят в устройство под давлением 30-40 атм. В одном воплощении жидкость вводят в устройство под давлением 40-50 атм. В одном воплощении жидкость вводят в устройство под давлением 50-100 атм.
В другом воплощении жидкость, включающую соль, вводят в реакционную камеру. В другом воплощении жидкость вначале вводят в реакционную камеру, а затем соль вводят в реакционную камеру. В другом воплощении жидкость, включающую соль и кристаллизующий материал, вводят в реакционную камеру. В другом воплощении в реакционную камеру вначале вводят жидкость, включающую соль, а затем в реакционную камеру вводят кристаллизующий материал. В другом воплощении в реакционную камеру вначале вводят жидкость, включающую соль, а затем в реакционную камеру вводят кристаллизующий материал. В другом воплощении в реакционную камеру вначале вводят жидкость, включающую кристаллизующий материал, а затем в реакционную камеру добавляют соль. В другом воплощении вначале в реакционную камеру вводят жидкость, а затем соль и кристаллизующий материал последовательно или одновременно вводят в реакционную камеру.
В одном воплощении такая транспортировка осуществляется посредством множества отдельных камер или каналов внутри устройства, передающего отдельные материалы в камеру. В другом воплощении камеры/каналы сконструированы так, чтобы обеспечить перемешивание компонентов в течение желаемого времени и при конкретных желаемых условиях.
В одном воплощении устройства данного изобретения могут дополнительно включать элементы контроля окружающей среды, которые в свою очередь контролируют температуру, давление, рН или их любую комбинацию. В другом воплощении устройство дополнительно включает по крайней мере один контроллер окружающей среды. В другом воплощении устройство дополнительно включает насосы для введения жидкостей в реакционную камеру под контролируемым давлением. В одном воплощении устройство данного изобретения может включать источник магнитного поля и миксер для обеспечения магнитно-контролируемого флюидизирования материала, вносимого в устройство. В другом воплощении устройство может включать механическую мешалку, монитор, контроллер введения, нагреватель, источник света, источник ультрафиолета или ультразвука, или любую их комбинацию.
В одном воплощении реакционная камера включает материал, изготовленный человеком. В другом воплощении реакционная камера образована природными элементами, создающими контур или отсек, считающиеся реакционной камерой. В другом воплощении реакционная камера является резервуаром. В другом воплощении реакционная камера является водоносным слоем.
В одном воплощении трубопроводы, конвейеры, трубы, клапаны и порты включают материал, изготовленный человеком. В другом воплощении материал, изготовленный человеком, включает нержавеющую сталь, сплавы металлов, волокно, резину, поливинилхлорид (ПВХ), пластик, медь, тефлон, стекло, бетон, алюминий, кевлар, или любые их комбинации.
В другом воплощении реакционная камера является водоносным слоем, в которую первый газ и второй газ вводят через две отдельных вводных ячейки, с последующим образованием твердого карбоната и дополнительным выведением избытка газа через вывод, как изображено на Фигуре 4.
В одном воплощении устройство данного изобретения включает конвейер, который служит как проводник атмосферного воздуха в реакционную камеру. В другом воплощении атмосферный воздух включает газ с СО2 загрязнителями, который высвобождается в воздух вследствие процессов человеческой деятельности, или вследствие природных процессов, или газ образуется в виде побочного продукта в процессе человеческой деятельности и высвобождается в атмосферу.
В другом воплощении устройство данного изобретения включает конвейер, который служит как проводник для газа к реакционной камере. В другом воплощении газ включает CO2 загрязнители вследствие процессов человеческой деятельности, или созданные в качестве побочного продукта процесса человеческой деятельности, и передаваемые из вытяжной системы завода, или выбросов химического завода в закрытую систему устройства данного изобретения.
В одном воплощении устройство дополнительно включает трубопроводы, трубы или конвейер от источника CO2, например, вытяжной системы завода, дымохода, химического завода, электростанции, или любой их комбинации, к портам устройства. В другом воплощении трубопроводы, трубы или конвейеры дополнительно включают заслонки, клапаны, регуляторы давления, насосы или любые их комбинации.
В соответствии с данным аспектом и в одном воплощении, устройство данного изобретения включает конвейер для газа, включающего СО; от вывода химического завода к реакционной камере, таким образом предотвращая загрязнение атмосферного воздуха СО2. В другом воплощении конвейер проводит газ в закрытой системе, включающей насосы, трубопроводы, каналы, трубы, скважины, туннели или штольни. В другом воплощении конвейер может дополнительно включать средства контроля давления, контролирующие давление газа, вводимого в реакционную камеру.
В другом воплощении устройство данного изобретения включает трубопроводы, применяемые в качестве выводов избытка первого газа и/или второго газа из реакционной камеры к конвейеру для другого цикла введения газа в реакционную камеру. В другом воплощении конвейер является таким же или отличается от конвейера, применяемого для введения первого газа или второго газа в жидкость.
В одном воплощении устройство данного изобретения дополнительно включает трубопроводы, каналы, конвейеры, трубы, насосы, скважины, клапаны или любую их комбинацию, для доставки газа в реакционную камеру, или доставки из реакционной камеры в окружающую среду, или рециркуляции потока в газовой системе. В другом воплощении трубопроводы, каналы, конвейеры, трубы, насосы, скважины, клапаны или любая их комбинация может влиять на давление, время, скорость потока газа.
В другом воплощении конвейер, доставляющий второй газ или газ CO2 к реакционной камере, дополнительно включает фильтр, расположенный между вводом и выводом конвейера. В другом воплощении фильтр может фильтровать малые частицы, такие как, например, пыль, соль, песок, или любую их комбинацию, и предотвращать их введение в реакционную камеру.
В некоторых воплощениях устройства данного изобретения расположены в тесной близости большим предприятиям, выделяющим CO2, таким как электростанции и заводы по производству бетона. В одном воплощении указанные предприятия вырабатывают большое количество выбросов CO2, и устройства данного изобретения обладают соответствующей емкостью для растворения CO2 в воде и осаждения карбоната.
В одном воплощении устройства данного изобретения являются внешними (надземными), где система с парой вводов для воздуха и введения СО2, имеет раздельные вводы, как изображено на Фигуре 1. В другом воплощении устройства данного изобретения являются внешними (надземными), где система с парой вводов для введения CO2 и основного раствора имеет раздельные вводы, как изображено на Фигуре 1. В другом воплощении резервуар включает морскую воду, опреснительные стоки или пресную воду с дополнительно добавленным источником кальция. В другом воплощении устройство построено вдоль побережья или рядом с озером или рекой. В другом воплощении вода из резервуара может течь в соседний резервуар, где поддерживаются основные условия (рН 9-12). Смешивание двух растворов из двух резервуаров ведет к осаждению карбоната кальция.
В одном воплощении устройства данного изобретения являются встроенными (подземными), где система двойных скважин с введением воздуха и CO2 имеет раздельные вводы, как изображено на Фигуре 4. В другом воплощении устройства данного изобретения являются встроенными (подземными), где система с двойными скважинами с введением СО2 и основного раствора имеет раздельные вводы, как изображено на Фигуре 4. В другом воплощении резервуар включает морскую воду, опреснительные стоки или пресную воду с дополнительно добавленным источником кальция. В другом воплощении устройство построено в открытом море или вдоль побережья, или рядом с озером или рекой, где CO2 или воздух, содержащий CO2, возможно, прямо из газового тракта, образует пузыри для растворения CO2. В другом воплощении вода из резервуара может течь в соседний резервуар, где поддерживаются основные условия (рН 9-12). Смешивание двух растворов из двух резервуаров ведет к осаждению карбоната кальция.
В одном воплощении данное изобретение обеспечивает способ снижения концентрации CO2 в жидкости, где указанный способ включает нанесение указанной жидкости в устройство для снижения концентрации СО2, в жидкости, где устройство включает:
- первый конвейер для введения первого газа, не включающего или включающего следовые количества CO2;
- второй конвейер для введения второго газа, включающего CO2 в концентрации, по крайней мере превышающей ту, что находится в равновесии воздух-вода; и
- реакционную камеру;
при этом при добавлении раствора, включающего соль, в указанную реакционную камеру, введении указанного первого газа в указанную реакционную камеру через указанный первый конвейер и введении указанного второго газа в указанную реакционную камеру через указанный второй конвейер происходит образование твердого карбоната в указанной реакционной камере и подъем непрореагировавшего газа, включающего сниженную концентрацию СО2.
В одном воплощении данное изобретение обеспечивает способ снижения концентрации CO2 в жидкости, где указанный способ включает нанесение указанной жидкости в устройство для снижения концентрации CO2 в образце жидкости, где устройство включает:
- первый конвейер для введения основания;
- второй конвейер для введения образца жидкости, включающего CO2;
- реакционную камеру; и
при этом при добавлении раствора, включающего соль, в указанную реакционную камеру, введении указанного основания в указанную реакционную камеру через указанный первый конвейер и введении указанного образца жидкости в указанную реакционную камеру через указанный второй конвейер происходит образование твердого карбоната в указанной реакционной камере и подъем непрореагировавшего газа.
Некоторые воплощения способов снижения концентрации CO2 и устройства и жидкости для достижения этого, и жидкости, охватываемые данным изобретением, приведены здесь в Примере 1, где достигается образование 111 г карбоната кальция спустя две недели после введения воздуха и CO2.
Некоторые воплощения способов снижения концентрации CO2 и устройства и жидкости для достижения этого, и жидкости, охватываемые данным изобретением, приведены здесь в Примере 33, где достигается образование осадка карбоната кальция в виде 72,5% от общего Са2+ в растворе, и достигается осаждение карбоната в виде 68,6% от общего введенного CO2. В одном воплощении достигнутый выход составил 97,8% от общего Са2+ в растворе в соответствии с Примером 30.
В одном воплощении данное изобретение обеспечивает жидкость, включающую первый газ под давлением, не включающий или включающий следовые количества CO2, второй газ, включающий CO2 в концентрации, по крайней мере превышающей ту, что находится в равновесии воздух-вода, и соль.
В одном воплощении данное изобретение обеспечивает жидкость, включающую основание, CO2 в концентрации, по крайней мере превышающей ту, что находится в равновесии воздух-вода, и соль.
Нужно понять, что жидкость данного изобретения и любые воплощения, описанные здесь по отношению к жидкости, применяются к любому аспекту данного изобретения, включая способы, устройства и их представленные воплощения.
Одно воплощение представленного применения способов, жидкости и устройств данного изобретения изображено на фигуре 1. В одном воплощении такое приспособление может быть желательно для снижения концентрации CO2 с применением способа и/или устройства над землей, где притекающий водный раствор (дополнительно содержащий некоторое количество растворенного СО2) (1-10), дополнительно содержащий растворенный кальций, магний, и/или другие катионы, подается через резервуар (1-20), содержащий (дополнительно) минеральные материалы, подающиеся в резервуар через отверстия и действующие как участки кристаллизации для усиления осаждения карбоната. Поток проводит воду из резервуара, и поэтому вода (1-30) может повторно возвращаться в резервуар (1-20). Газ, включающий СО2 в чистом виде или в высокой концентрации, или смешанный с другими газами, вводится (1-40) в жидкость. Образуется воздух, или воздух, содержащий одну или более добавку для дополнительного повышения/контроля рН, или основание в газовой фазе или основном растворе (1-90) и твердый карбонат (1-20А).
В другом воплощении устройство включает вывод для высвобождения избытка газа или CO2 (1-100), а высвобождаемый газ может быть возвращен обратно в камеру через отверстия ввода (1-40) или (1-90). В некоторых воплощениях такое приспособление может дополнительно включать дополнительные отверстия, обеспечивающие введение (или дополнительное введение) минеральных гранул (или коллоида), суспендированных в воде и/или любом другом твердом матриксном материале (который действует как кристаллизующий материал для усиления осаждения карбоната) (1-50) и (1-70). В некоторых воплощениях источник соли, такой как соль кальция или магния, вводят через отверстия (1-60) и (1-80). В другом воплощении такое приспособление может обеспечивать накопление карбоната внутри резервуара на протяжении времени. В другом воплощении такое приспособление может обеспечивать выделение образующегося твердого карбоната и его повторное применение.
Одно воплощение представленного применения способов, жидкостей и/или устройства данного изобретения изображено на фигуре 4. В одном воплощении такое приспособление может быть желательно для снижения концентрации СО2 с применением способа и/или устройства под землей, где CO2 (обогащенный, в форме концентрированного газа, чистый CO2 или CO2, смешанный с другими газами) и воздух (или другой газ или смесь газов) подаются через вводы (4-100) и (4-50), соответственно, через вводные скважины (4-80) и (4-30), соответственно, и дополнительно через секцию скважины (4-90) и (4-40), соответственно, и просеивается, чтобы обеспечить поступление воздуха из скважин в водоносный слой (4-10). Водоносный слой включает воду, поступившую естественным образом, посредством насосов или за счет вводных скважин, обеспечивающих поток почвенной воды. В другом воплощении другие вводы (4-110) и (4-60) вводятся в каждую скважину (4-80) и (4-30), соответственно, для дополнительного добавления солей (такой как соли кальция или магния) и/или минеральных гранул (или коллоида), суспендированных в воде и/или любом другом твердом матриксном материале. В одном воплощении избыток CO2 и/или воздуха высвобождается через дополнительные выводы (4-70) и может быть возвращен обратно к вводам (4-100) и (4-50), соответственно. В другом воплощении, как только CO2 и воздух вводят в водоносный слой, образуется твердый карбонат (4-20).
В другом воплощении такое приспособление может быть желательно для изоляции CO2 в виде твердого карбоната, где твердый карбонат остается в водоносном слое.
Следующие примеры представлены для более полной иллюстрации предпочтительных воплощений изобретения. Однако они не должны никоим образом истолковываться как ограничивающие широкую область изобретения.
Примеры
Материалы и методы
Была сконструирована проточная ячейка, сформированная, как изображено на Фигуре 2. Проточная ячейка включает акриловые листы толщиной 20 мм. Внутренние размеры проточной ячейки составляют 86,5 см в длину × 10 см в ширину × 48 см в высоту. Ячейка была сконструирована для обеспечения потока в длину. Ячейка была разделена на три секции: главная проточная ячейка, содержащая песок, и резервуары притока и оттока воды на каждом конце. Оба резервуара притока и оттока воды составили 3,5 см в длину, отделяясь от отсека главной ячейки сетчатой подложкой и мелкоячеистым ситом с гидравлической проводимостью больше, чем у песка. Различные постоянные головки на концах резервуара защищались с применением регулируемых флаконов для сброса. Выброс из отводящего резервуара определяли путем измерения объема оттекающей воды в течение определенного интервала. Перистальтические насосы постоянно работали на каждом конце резервуара для обеспечения полного смешивания. В ячейку были помещены трубка для введения воздуха 0,5 см (внутренний диаметр) и трубка для введения CO2 0,5 см (внутренний диаметр). Трубки были разделены расстоянием 40 см, а позднее окружены песком, когда ячейка была упакована. Трубки были соединены с клапаном, подающим воздух при объемной скорости потока 500 л/час, и СО2 при объемной скорости потока 1,5 л/час, соответственно. Поток воздуха и CO2 регулировали с помощью измерителей потока и давления.
Материалы
В устройство вносили следующее: Accusand, имеющий размер фракции 30/40, с диаметром гранул 0,532 мм и пористостью 0,35; бентонитовую глину (Fisher Sci. Co.); водный раствор 4,12 мМ Cl-, 1,17 мМ NO3-, 3,89 мМ Са2+, 1,2 мМ Mg2+, 0,06 мМ К+, 0,01 мМ F-, 0,89 мМ SO42+, 2,46 мМ Ка+, 3,69 мМ НСО3-, 0,76 мМ СО22- (водопроводная вода); CO2 был предоставлен Gordon Gas (Израиль).
Выделение CO2
Устройство заполняли Accusand 30/40 до общей высоты, частично покрывали бентонитовой глиной (как представлено на Фигуре 2), которую применяли для увеличения времени пребывания и распределения CO2 за счет стимуляции пути конкретного потока. Размеры глины в данном воплощении составили 43 см в длину × 4 см в ширину × 28-32 см в высоту. Проточную ячейку заполняли водопроводной водой при рН 7,5. Ионный состав водопроводной воды, подаваемой в водную камеру, поддерживали постоянным с помощью большого подающего резервуара с водопроводной водой. Поток воды оставляли для стабилизации в течение ночи вместе с потоком воздуха, затем добавляли CaCl2 (328 г/120 л), и начинали введение СО2. Воздух и CO2 вводили в течение двух недель и проводили измерение рН спустя 7 часов, одну неделю и две недели.
Показательные образцы воды анализировали, определяя рН как функцию образования карбоната кальция. Образцы, имеющие кислый рН (5-6,5) были связаны с высокой концентрацией растворенного CO2, в то время как образцы, имеющие щелочной рН (7,5-8), были связаны с продукцией карбоната кальция.
Анализ образцов осажденного карбоната проводили путем изотопного анализа. CO2 имеет специфические изотопные черты. CO2, присутствующий в постоянной воде, происходит из неорганического источника с δ13C≈-1‰ - -2‰ (хотя значение может находиться в диапазоне+2‰ - -4‰), в то время как CO2, содержащийся во введенном воздухе, имеет δ13C≈-7‰ - -8‰. Изотопные черты для введенного CO2 из органического источника представляют δ13С≈-25‰ - -35‰.
Пример 1
Устройство проточной ячейки, стимулирующее СО2-зависимые изменения рН
Анализировали образцы с различной высоты и участков проточной ячейки (как представлено на Фигуре 2) и измеряли их рН. Измерения рН служили индикатором содержания CO2. Низкий рН соответствовал высокой концентрации CO2. Увеличение развития осаждения карбоната наблюдалось в течение короткого времени (минуты и часы в проточной ячейке), о чем свидетельствовало повышение рН (Таблица 1).
В Таблице 1 показана тенденция к изменению рН в образцах, где образцы взяты из участков введения CO2 представлены более кислым рН, а образцы в участках введения воздуха представлены более щелочным рН.
Малые изменения скорости потока могут также оказывать влияние на сдвиг рН со временем.
Пример 2
Устройство проточной ячейки, стимулирующее изоляцию СО2
Анализировали пять представительных образцов (песок и осажденный карбонат) и измеряли карбонат кальция в процентах от веса образца песка путем растворения осажденного карбоната в кислом растворе и анализа содержания высвобождаемых газов, где 1 г осажденного карбоната кальция эквивалентен 0,44 г CO2. Анализируемые образцы находились в участке между двумя вводными скважинами. Расположение образцов представлено на Фигуре 3.
В образце 3-20 было получено ~0,2-~0,3% в/в карбоната кальция от образца песка; в образце 3-30 было получено ~0,2% в/в карбоната кальция от образца песка; в образце 3-40 было получено ~0,4% в/в карбоната кальция от образца песка; в образце 3-50 было получено ~1,2-~1,3% в/в карбоната кальция от образца песка; в образце 3-60 было получено ~0,4% в/в карбоната кальция от образца песка.
Таким образом, образцы, близкие к введению воздуха (например, образец 3-50), давали более высокую концентрацию карбоната кальция, демонстрируя образование карбоната кальция, подтверждая применение данной системы для изоляции СО2 посредством осаждения карбоната, где формировалось 111 г карбоната кальция спустя 2 недели введения воздуха и СО2.
Пример 3
Образование осадка карбоната из введенного CO2
Значения изотопной характеристики CO2 отличаются в зависимости от окружающей среды, в которой образуется газ. Был проведен изотопный анализ образцов в участках, изображенных на фиг.3:
Образец 3-20: -19,4‰
Образец 3-30: -17,6‰
Образец 3-40: -10,5‰
Образец 3-50: -5,5‰
Образец 3-60: -9,6‰
Образец 3-10: -18,2‰
Образец 3-70: -21,1‰
Образец 3-80: -21,6‰
Образец 3-90: -4,8‰
На основании результатов изотопного анализа ясно, что образование карбоната происходит в результате введения CO2, так как на изотопные характеристики CO2 влияли как СО2, содержащийся во вводимом воздухе, так и CO2, введенный из органического источника.
Пример 4
Осадок карбоната из хлорида кальция (10 г/л) и известковой воды, собранный центрифугированием
Раствор хлорида кальция (500 мл, 10 г/л) продували CO2 при нормальном давлении в течение 30 минут. рН составил 4,0. К этому времени раствор добавляли к насыщенному раствору гидроксида кальция (рН=12,2), который предварительно готовили при реакции растворов гидроксида натрия (0,1 М) и хлорида кальция (0,09 М). Осадок формировался немедленно. Раствор сливали декантацией и собирали продукт центрифугированием. Слитый раствор имел рН 7,8, снизившийся до 6,4 из-за отделения CO2 из воздуха в раствор. Осадок высушивали вакуумом при комнатной температуре, выделив 0,71 грамм.
В заключение, известковую воду можно применять для осаждения карбоната кальция.
Пример 5
Осадок карбоната из хлорида кальция (10 г/л) и известковой воды из газоочистителя СО2, собранный фильтрацией
Раствор хлорида кальция (500 мл, 10 г/л) продували СО2 при нормальном давлении в течение 30 минут. рН составил 3,8. К этому времени раствор добавляли к насыщенному раствору гидроксида кальция (рН=12,1), который предварительно готовили при реакции растворов гидроксида натрия (0,1 М) и хлорида кальция (0,09 М) и который применяли в качестве очистителя воздуха. Осадок формировался немедленно. Раствор фильтровали и выделили 1,11 грамм. Фильтрат имел рН 8,7.
В заключение, известковую воду из газоочистителя можно применять так же эффективно, как свежеприготовленную известковую воду.
Пример 6
Осадок карбоната из хлорида кальция (10 г/л), известковой воды и NaOH, собранный фильтрацией
Раствор хлорида кальция (500 мл, 10 г/л) продували СО2 при нормальном давлении в течение 30 минут. рН составил 3,8. К этому времени раствор добавляли к насыщенному раствору гидроксида кальция (рН=12,2), который предварительно готовили при реакции растворов гидроксида натрия (0,1 М) и хлорида кальция (0,09 М). Осадок формировался немедленно. Раствор сливали декантацией, и продукт собирали фильтрацией через 0,2 микронную фильтрующую мембрану (выделили 0,24 грамма). Фильтрат имел рН 7,8. Добавили твердый NaOH, увеличив рН раствора до 11, что привело к дополнительному осаждению. Фильтрацией было выделено дополнительно 1,24 грамма. Общий собранный продукт составил 1,48 грамм.
В заключение: добавление NaOH к фильтрату повышает выход осадка карбоната.
Пример 7
Осадок карбоната из хлорида кальция (10 г/л), известковой воды и NaOH, фильтрованный под аргоном
Раствор хлорида кальция (500 мл, 10 г/л) продували СО2 при нормальном давлении в течение 30 минут. рН составил 3,7. К этому времени раствор добавляли к насыщенному раствору гидроксида кальция (рН=12,2), который предварительно готовили при реакции растворов NaOH (0,1 М) и CaCl2 (0,09 М). Осадок формировался немедленно. Раствор сливали декантацией, и продукт собирали фильтрацией через 0,2 микронную фильтрующую мембрану (выделили 1,08 грамма). Фильтрат, имевший рН 7, сделали щелочным, рН 10,7, путем добавления твердого NaOH. Дополнительные 1,30 грамм СаСО2 были выделены путем фильтрации под слоем аргона. рН раствора составил 11,0 и оставался стабильным. Общий собранный продукт составил 2,38 грамм.
В заключение: рН снижается при воздействии CO2 из воздуха. Слой аргона предотвращает снижение рН при фильтрации и повышает количество выделенного СаСО3. Как указано здесь, добавления слоя аргона значительно улучшает выход; 2,38 г против 1,48 г (61%).
Пример 8
Осадок карбоната из хлорида кальция (10 г/л), известковой воды и NaOH под аргоном при 20°С
Готовили раствор хлорида кальция (500 мл, 10 г/л), имеющий рН 5,7 при 20°С. CO2 продували через смесь в течение 45 минут, и рН снижался до 5,3. К этому раствору добавляли свежеприготовленную известковую воду (насыщенный гидроксид кальция, 0,2 М NaOH и 0,09 М CaCl2, 500 мл, рН 12,4). Образовавшийся осадок отделяли фильтрацией (было выделено 1,16 г). рН фильтрата составил 7,4, и был увеличен до 10,4 гидроксидом натрия. Вторую часть осадка получали фильтрацией (было собрано дополнительно 0,51 г). рН фильтрата составил 10,3. Общее количество выделенного твердого вещества составило 1,67 г.
В заключение: выход осадка карбоната выше при 20°С, чем при более низкой температуре (1°С), и выше при более высоких концентрациях используемого хлорида кальция (10 г/л), чем при низких концентрациях (1 г/л).
Пример 9
Осадок карбоната из хлорида кальция (20 г/л), известковой воды (из гранул) и NaOH под слоем аргона при 20°С
Готовили раствор хлорида кальция (500 мл, 20 г/л), имеющий рН 8,5 при 20°С. Двуокись углерода продували через смесь в течение 35 минут, и рН снижался до 3,8. К раствору, насыщенному двуокисью углерода, добавляли раствор известковой воды, приготовленный из твердого гидроксида кальция (500 мл). Образовавшийся осадок отделяли фильтрацией под слоем аргона (было выделено 1,19 г). рН фильтрата составил 7,0, и был увеличен до 10,4 добавлением гидроксида натрия. Вторую часть осадка получали фильтрацией (было собрано дополнительно 0,33 г). рН фильтрата составил 10,3. Общее количество выделенного твердого вещества составило 1,52 г.
В заключение: хлорид кальция 20 г/л при комнатной температуре дает примерно тот же самый выход осадка карбоната, что и при использовании хлорида кальция 10 г/л при комнатной температуре. Раствор гидроксида кальция, приготовленный их гранул или свежеприготовленный, также обеспечивает примерно одинаковый выход осадка карбоната (1,52 г и 1,67 г, соответственно).
Пример 10
Осадок карбоната из хлорида кальция (10 г/л), известковой воды (из гранул) и NaOH под аргоном при 20°С
Готовили раствор хлорида кальция (500 мл, 10 г/л), имеющий рН 5,8 при 20°С. Двуокись углерода продували через смесь в течение 100 минут, и рН снижался до 3,9. Этот раствор добавляли к известковой воде, приготовленной из твердого гидроксида кальция. Образовавшийся осадок отделяли фильтрацией (было выделено 1,00 г). рН фильтрата составил 6,8. рН был увеличен до 11,1 добавлением гидроксида натрия, для получения большего количества гидроксида кальция. Вторую часть осадка получали фильтрацией (было собрано дополнительно 0,44 г). рН фильтрата составил 11,1. Общее количество выделенного твердого вещества составило 1,44 г.
В заключение: 10 г/л хлорида кальция при комнатной температуре дает примерно тот же самый выход осадка карбоната, что и при использовании 20 г/л хлорида кальция при комнатной температуре (1,44 г и 1,52 г, соответственно), с применением гранул Са(ОН)2.
Пример 11
Осадок карбоната из хлорида кальция (10 г/л), известковой воды (из гранул) и NaOH, добавленного перед фильтрацией под аргоном при 20°С
Готовили раствор хлорида кальция (500 мл, 10 г/л), имеющий рН 6,8 при 20°С. Двуокись углерода продували через смесь в течение 100 минут, и рН снижался до 4,2. Добавляли 2 мл 20% NaOH (6 M) с последующим добавлением 500 мл раствора известковой воды (рН 12), приготовленного из твердого гидроксида кальция. Образовавшийся осадок отделяли фильтрацией (было выделено 1,05 г). рН фильтрата составил 6,7. рН повышали до 11,1 добавлением гидроксида натрия, для получения большего количества карбоната кальция. Вторую часть осадка получали фильтрацией (было собрано дополнительно 0,91 г). рН фильтрата составил 11,1. Общее количество выделенного твердого вещества составило 1,96 г.
В заключение: добавление дополнительного основания перед фильтрацией повышает выход СаСО3.
Пример 12
Осадок карбоната из соли Красного моря (RSS) и хлорида кальция (10 г/л), с применением известковой воды в качестве основания, под аргоном
Соль Красного моря (RSS) добавляли к раствору хлорида кальция, чтобы определить, действительно ли большое количество NaCl в морской воде предотвращает осаждение СаСО3, поскольку в соответствии с процессом Solvay: 2NaCl+СаСО3→Na2CO3+CaCl2.
Соль Красного моря включает следующие ионы на основании 30 г RSS в 1 л воды.
Na+: 10692 ч./млн
Са2+: 380 ч./млн
Mg2+: 1200 ч./млн
Cl-: 16,811 ч./млн
S2-: 785,5 ч./млн
Щелочность составляет 2,3 мэкв/л [НСО3-]+[СО32-]
Соль Красного моря (15 г) добавляли к раствору CaCl2 (500 мл, 10 г/л), получая раствор с рН 7,8. Твердые соли не растворялись полностью. СО2 продували через смесь в течение 10 минут, и рН снизился до 4,6. Большая часть солей растворилась, и не отмечалось дальнейшего растворения спустя дополнительный час. Раствор сливали декантацией. К нему добавляли известковую воду (насыщенный Са(ОН)2, 500 мл, рН 12,3), и образовавшийся осадок отделяли фильтрацией через фильтрующую мембрану 0,2 микрон под слоем аргона. Фильтрат имел рН 8,7. Твердое вещество высушили в печи, было выделено 1,26 г. рН фильтрата не увеличился, поскольку не было получено второй порции СаСО3.
В заключение: соль Красного моря не нарушает осаждение карбоната.
Пример 13
Осадок карбоната из соли Красного моря (RSS) и хлорида кальция (1 г/л), под аргоном при 20°С
Готовили раствор (500 мл) соли Красного моря (30 г/л) и хлорида кальция (1 г/л), имеющий рН 8,1. Двуокись углерода продували через смесь в течение 30 минут, и рН снижался до 4,7. К этому раствору добавляли свежеприготовленный раствор известковой воды (насыщенный гидроксид кальция, 0,2 М NaOH плюс 0,09 М CaCl2, 500 мл, рН 12,4). Формировался осадок. Смесь хранили под слоем аргона и фильтровали через 0,2 микронную фильтрующую мембрану. Фильтрацию также проводили под слоем аргона. Фильтрат имел рН 9,5. Твердое вещество высушили в печи, получив 0,92 г СаСО3.
В заключение: снижение содержания ионов кальция снижает выход карбоната кальция.
Пример 14
Осадок карбоната из воды с угольной золой и хлорида кальция (10 г/л), с применением известковой воды и NaOH в качестве основания, под аргоном при 20°С
Невысушенную, непросеянную южноафриканскую почвенную золу (500 г) суспендировали в 500 мл деионизованной воды, помещая кашицу во вращающийся шейкер на 15 часов. Водную фазу удаляли фильтрацией, и остаток золы промывали водой. Полученный фильтрат имел рН 12,7. Хлорид кальция, 500 мл (10 г CaCl2/ 10 мл Н2О) помещали в 2000 мл градуированный цилиндр. Раствор продували двуокисью углерода, и рН снижался до рН 3,83. Продувание продолжалось 1 час. Воду из угольной золы (590 мл) добавляли к раствору хлорида кальция, насыщенному СО2, и рН комбинированного раствора составил 5,5. В данной точке не формировалось осадка. Затем добавляли 500 мл раствора известковой воды (насыщенного Са(ОН)2), с образованием осадка и повышением рН до 8,5. Далее увеличивали щелочность добавлением 20 мл 50% NaOH (pH 12,7). Осадок фильтровали и высушивали, получив 2,39 г.
В заключение: угольная зола сама по себе недостаточно повышает рН для осаждения карбоната кальция, однако увеличение количества основания (Са(ОН)2 и NaOH) повышает количество полученного продукта.
Пример 15
Осадок карбоната из воды с угольной золой и хлорида кальция (10 г/л), с применением известковой воды и NaOH под аргоном при 20°С
Раствор хлорида кальция, 500 мл (10 г CaCl2/ 10 мл Н2О) помещали в 2000 мл градуированный цилиндр. Исходный рН составил 4,7. Раствор продували двуокисью углерода, и рН снижался до рН 3,9. Продувание продолжалось 40 минут. Затем добавляли 500 мл известковой воды, насыщенной Са(ОН)2, рН 12,2, с образованием осадка и повышением рН до 8,6. К этой смеси добавляли воду с угольной золы (650 мл, рН 12,9), приготовленную как в Примере 14, и рН объединенного раствора повышался до рН 9. Далее увеличивали щелочность добавлением 11 мл 50% NaOH (рН 12,2). Осадок фильтровали и высушивали, получив 2,46 г.
В заключение: прядок добавления воды с угольной золы не влияет на количество выделенного продукта (2,46 г против 2,39 г в Примере 14).
Пример 16
Осадок карбоната из соли Красного моря (30 г/л) и хлорида кальция (1 г/л), под аргоном при 1°С
Готовили раствор (500 мл) соли Красного моря (30 г/л) и хлорида кальция (1 г/л), имеющий рН 8,1. Раствор охлаждали на ледяной/водяной бане до 1°С. Двуокись углерода продували при нормальном давлении через смесь в течение 30 минут, и рН снижался до 4,7. Раствор хранили на ледяной бане при 1°С. К этому раствору добавляли свежеприготовленный раствор известковой воды (насыщенный гидроксид кальция, 0,2 М NaOH плюс 0,09 М CaCl2, 500 мл, рН 12,4). Формировался осадок. Смесь хранили под слоем аргона и фильтровали через 0,2 микронную фильтрующую мембрану. Фильтрацию также проводили под слоем аргона. Фильтрат имел рН 7,8. Твердое вещество высушили в печи, получив 0,09 г СаСО3.
В заключение: низкая температура снижает выход карбоната кальция (0,09 г против 0,92 г в Примере 13).
Пример 17
Осадок карбоната из хлорида кальция (10 г/л), с применением известковой воды и NaOH в качестве основания, под аргоном при 1°С
Готовили раствор хлорида кальция (500 мл, 10 г/л Н2О; 9,09%, d=1,005 г/мл), имеющий рН 5,7 при 20°С. Раствор охлаждали до 5°С, и рН повышался до 5,9. Двуокисью углерода продували раствор, содержащийся в 1,0 л градуированном цилиндре. рН снижался до 4,1 за 30 минут, температура составила 1°С. Раствор известковой воды (500 мл) добавляли к раствору хлорида кальция/двуокиси углерода. Формировался осадок, а рН повышался до 8,7. Поскольку рН начал снижаться, добавили раствор гидроксида натрия (20 мл, d 1,2 г/мл). Смесь фильтровали. Фильтрат имел рН 12,7. Осадок с фильтра высушивали в печи, и выделили 4,06 г.
В заключение: снижение температуры уменьшает выход полученного СаСО3, однако, при подведении рН с NaOH выход осадка карбоната увеличивается.
Пример 18
Осадок карбоната из хлорида кальция (20 г/л), с применением известковой воды и NaOH в качестве основания, под аргоном при 1°С
Раствор хлорида кальция (500 мл, 20 г/л) помещали в 1 л градуированный цилиндр на ледяную/водяную баню. Исходный рН составил 7,8. Спустя 1 час продувания двуокисью углерода через раствор, рН составил 3,8, а температура была ниже 1°С. Добавляли раствор известковой воды (500 мл), и формировался осадок. Затем добавляли раствор 50% NaOH (6 мл, d - 1,50 г/мл), и фильтровали раствор. Фильтрат имел рН ~13. Твердое вещество выделяли и высушивали в печи, было выделено 5,28 г.
В заключение: повышение концентрации ионов кальция повышает выход осадка карбоната.
Пример 19
Осадок карбоната из хлорида кальция (20 г/л), с применением известковой воды и NaOH (50%) в качестве основания, под аргоном в полупоточной системе
Готовили раствор хлорида кальция (40 г в 2,0 л Н2О), имеющий исходный рН 7,5. Раствор помещали в колбу Эрленмейера, оснащенную запорным краном на дне. Продували СО2 в течение одного часа, получая насыщенный раствор, имеющий рН 3,8. Этот раствор CaCl2, насыщенный СО2, добавляли потоком под действием силы тяжести в реакционную колбу, содержащую 500 мл известковой воды с рН 12,9. Скорость потока составила 2,7 мл/мин в течение 15 минут и была повышена до 15 мл/мин. рН в реакционной колбе, содержащей известковую воду и осажденный карбонат кальция, контролировали рН-электродом. рН доводили до значения между 10 и 11 добавлением по каплям 50% в/в NaOH. В целом в ходе реакции было добавлено 6,0 мл NaOH. Смесь фильтровали под слоем аргона через фильтровальную бумагу Whatman 50. Фильтрат имел рН 10,8. Твердый СаСО3 был выделен и высушен в печи, было получено 6,40 г.
В заключение: полупоточная система с применением потока раствора, насыщенного двуокисью углерода, под силой тяжести была эффективной. Количество выделенного карбоната кальция (6,40 г/2 л) сопоставимо с количеством в Примере 9 (1,52 г/0,5 л).
Пример 20
Осадок карбоната из хлорида кальция (20 г/л), с применением известковой воды в качестве основания, под аргоном в полупроточной системе
Готовили раствор хлорида кальция (40 г в 2,0 л Н2О). Применяли то же устройство, что в Примере 19. Двуокисью углерода продували раствор (исходный рН 8,2) в течение 2 часов, вызывая снижение рН до 3,8. Этот раствор CaCl2, насыщенный CO2, добавляли потоком под действием силы тяжести в реакционную колбу, содержащую 500 мл известковой воды с рН 12,9. Скорость потока составила 8,8 мл/мин в течение 34 минут, к этому времени рН составил 10,4. Известковую воду прокачивали перистальтическим насосом в реакционную колбу со скоростью 9 мл/мин. Скорость добавления известковой воды регулировали так, чтобы поддерживать рН между 10 и 11. Смесь известковой воды и осажденного карбоната кальция фильтровали под слоем аргона. Фильтрат имел рН 10,5 и общую массу 5299 г. 19,9 г образца было высушено, и содержало 0,16 г (0,835%) твердого вещества, что соответствовало 44,2 граммам растворенного твердого вещества (хлорида кальция и гидроксида кальция). В целом было выделено 6,31 г СаСО3 (после высушивания в печи).
В заключение: известковую воду легче применять, чем NaOH, и она дает сходное количество карбоната кальция.
Пример 21
Осадок карбоната из водопроводной воды с применением известковой воды в качестве основания, под аргоном с помощью полупроточной системы
Стандартную городскую водопроводную воду Реховота (Израиль) (2,0 л), имеющую рН 7,2, помещали в колбу и продували CO2. рН снижался до 5,1 спустя 1 час. Этот раствор добавляли к 500 мл известковой воды (рН 12,5). В реакционном растворе контролировали рН постоянно, с помощью рН электрода, погруженного в реакционную смесь. Известковую воду добавляли к реакционной смеси для поддержания рН выше 10. Когда добавили всю водопроводную воду, насыщенную СО2, смесь фильтровали. Объем фильтрата составил 4910 мл с рН 11,1; было выделено 5,68 г СаСО3.
В заключение: известковая вода была главным источником кальция для СаСО3.
Пример 22
Осадок карбоната из повторно обработанного конечного фильтрата из Примера 21 с применением известковой воды в качестве основания, с помощью полупроточной системы
Фильтрат из Примера 21 (2,0 л, рН 10,9) насыщали CO2. рН снизился до 5,0. Этот раствор добавляли обычным потоком под действием силы тяжести к 500 мл известковой воды (рН 12,3). Добавляли дополнительную известковую воду для поддержания рН выше 10, так что было использовано только 1150 мл от исходных 2,0 л. Всего было использовано 5,1 л известковой воды. Окончательный рН составил 11,2; было выделено 4,02 г СаСО3.
В заключение: с применением повторно использованной фильтратной воды было изолировано больше СО2, однако потребовалось большее количество известковой воды.
Пример 23
Осадок карбоната из соли Красного моря (30 г/л) с применением NaOH в качестве основания, с помощью полупроточной системы
В 5,0 л колбу вносили 60,0 г соли Красного моря и 2, л дистиллированной воды. Раствор, имеющий рН 8,7, насыщали CO2, снижая рН до 4,5. В реакционный сосуд вносили NaOH (500 мл, 0,01М, рН 12,1) и в него приливали под действием силы тяжести раствор соли Красного моря / СО2, снижая рН до 9. Дополнительно 0,25 М NaOH прокачивали насосом в реакционную смесь, но осаждения не происходило, пока не добавили по крайней мере 500 мл раствора соли Красного моря. Поддерживали рН на уровне примерно 11,5. Осажденное твердое вещество медленно фильтровали. Его выделяли фильтрацией под вакуумом и высушивали в печи, получая 5,98 г продукта. Рентгеновская дифракция продукта показала, что он является частично кристаллическим и частично аморфным. Он не был кальцитом, арагонитом, ватеритом или кальцитом моногидратом.
В заключение: NaOH был использован вместо известковой воды в качестве основания. Источником кальция служила только RSS, образуя карбонат кальция.
Пример 24
Осадок карбоната из гипса с применением NaOH в качестве основания, с помощью полупроточной системы
В 5,0 л колбу добавляли 2,0 л дистиллированной воды, содержащей CaSO4·2H2O (2,0 г/л). рН составил 7,7. СО2 продували через раствор, снижая рН до 3,8. В реакционную колбу вносили 500 мл 2,0 г/л CaSO4·2H2O и повышали рН до 10,1 с помощью NaOH (0,350 мл, 0,25 М). Раствор, насыщенный СО2, подавали под действием силы тяжести в реакционную колбу, и поддерживали рН между 10 и 10,5 с помощью NaOH (0,25 М). Осаждение происходило после добавления 500 мл раствора, насыщенного CO2. Окончательный рН составил 10,3. Выход продукта был очень низким, когда реакционную смесь профильтровали. Таким образом, рН фильтрата довели до 11,7 с NaOH, что привело к большему образованию осадка. Твердое вещество выделяли вакуумной фильтрацией и высушиванием в печи, получив 1,49 грамм продукта, который исследовали рентгеновской дифракцией, получив кристаллические формы ватерита и кальцита.
В заключение: гипс можно применять для осаждения СО2 в форме карбонатов кальция.
Пример 25
Осадок карбоната из гипса (2,0 г/л) и воды с солью Красного моря, с применением NaOH в качестве основания, с помощью полупроточной системы
Готовили раствор соли Красного моря (RSS) (60 г, 2,0 л Н2О) с CaSO4·2H2O (2,0 г/л). Раствор насыщали CO2. рН снизился с 8,6 до 4,6 спустя 2 часа продувания CO2. В колбе, содержащей 500 мл воды с CaSO4·2H2O (2,0 г/л) и RSS (30 г/л), подводил рН до 10,4 с помощью NaOH (0,1 М). Раствор, насыщенный CO2, подавали под действием силы тяжести, и поддерживали рН около конечного значения 10,4. Продукт выделяли вакуумной фильтрацией и высушивали в печи (было выделено 3,43 г).
В заключение: более высокий выход карбоната может быть получен путем объединения соли Красного моря и гипса (3,43 г против 1,49 г в Примере 24).
Пример 26
Осадок карбоната из повторно использованного фильтрата из Примера 25 и воды с солью Красного моря, с применением NaOH в качестве основания, с помощью полупроточной системы
В фильтрат из Примера 25 (2,8 л) добавляли 5,46 г CaSO4·2H2O. В колбу помещали 800 мл и доводили рН до 10,3 с 0,2 М NaOH. Другие 2,0 л раствора насыщали CO2 (рН 5,9). Затем его добавляли к щелочному раствору потоком под действием силы тяжести. Поддерживали рН между 10,0 и 10,6 с помощью 0,2 М NaOH. Твердый материал собирали фильтрацией и высушивали в печи, получив 5,64 г.
В заключение: карбонат можно получить в реакции с повторно использованной водой, несмотря на высокую концентрацию других ионов.
Пример 27
Осадок карбоната из повторно использованного фильтрата из Примера 26 и воды с солью Красного моря, с применением NaOH в качестве основания, с помощью полупроточной системы
Фильтрат из Примера 26 (3,6 л) был повторно переработан третий раз, чтобы установить, оказывают ли влияние какие-либо накопленные соли на CO2 и осаждение карбоната. 1,6 л помещали в колбу, содержащую CaSO4·2H2O (3,2 г). Раствор фильтровали для удаления нерастворенного материала, и полученный раствор содержал 1,3 г CaSO4·2H2O. В другую колбу добавляли 2,0 л повторно используемого фильтрата и CaSO4·2H2O (4,0 г). Раствор насыщали CO2. рН данного раствора снизился с 10,3 до 6,0, и его подавали под действием силы тяжести в щелочной раствор. Поддерживали рН на уровне 10,5 с помощью NaOH (0,2 М). Продукт выделяли фильтрацией и высушивали в печи, получив 2,65 г.
В заключение: карбонат можно получить из повторно использованной воды с более высокой концентрацией ионов. Однако выход карбоната является низким.
Пример 28
Осадок карбоната из гипса (2,0 г/л) и воды с солью Красного моря, с применением NaOH в качестве основания
Готовили раствор соли Красного моря (RSS) (75 г, 2,0 л Н2О) с CaSO4·2H2O (2,0 г/л). Два литра раствора CO2 (окончательный рН 4,6). В других 500 мл раствора CaSO4·2H2O доводили рН до 10,3 с помощью NaOH (1 М) и поддерживали этот рН по мере добавления раствора, насыщенного CO2. Осаждался СаСО3, идентифицированный как кальцит с помощью рентгеновской дифракции. Было выделено 2,73 г.
Фильтрат (2,6 л) повторно использовали для повторения эксперимента. CaSO4·2H2O (4,2 г) добавляли к 2,1 л повторно используемого фильтрата (рН 9,8) и насыщали CO2 (окончательный рН 5,8). Этот раствор переносили с помощью силы тяжести в колбу, содержащую 500 мл фильтрата, содержащего 0,2 г CaSO4·2H2O, который вначале доводили до рН 10. рН поддерживали между 10,0 и 10,6 с помощью 1 М NaOH. Твердый материал собирали фильтрацией и высушивали в печи, получив 5,68 г.
Фильтрат от второго этапа перерабатывали вновь. Колбу, содержащую 2,1 л фильтрата и CaSO4·2H2O (7,9 г, рН 9,9), насыщали CO2 (рН 6,0). В другую колбу добавляли 0,5 л фильтрата и 0,15 г CaSO4·2H2O (рН 9,9). Раствор, насыщенный CO2, подавали с помощью силы тяжести в щелочной раствор и поддерживали рН между 10,3 и 10,4. Твердый материал, идентифицированный с помощью рентгеновской дифракции как кальция карбонат моногидрат, собирали фильтрацией и высушивали в печи, получив 6,10 г.
В заключение: карбонат в форме кальцита и кальция карбоната моногидрата можно получить в реакции с применением повторно переработанной воды, несмотря на высокую концентрацию других ионов.
Пример 29
Осадок карбоната из гипса и воды с солью Красного моря с применением гидроксида аммония в качестве основания, с перемешиванием воздухом на этапе 1
Этап 1. Исходный раствор: Раствор А: в 5,0 л колбу добавляли 60,0 г соли Красного моря, 8,00 г CaSO4·2H2O и 2,0 л деионизованной воды. Раствор продували СО2, снижая рН с 8,5 до 4,7. Продувание воздуха через этот раствор вызывало повышение рН до 8,1. Это Раствор А.
Раствор В. В другую колбу добавляли 500 мл раствора, содержащего 15 г соли Красного моря и 1,0 г CaSO4·2H2O, рН 8,7. Это Раствор В. Раствор А подавали под действием силы тяжести к раствору В при перемешивании. NH4OH (25%, 13,4 М, d 0,91, примерно 5 мл) также добавляли к Раствору В для поддержания рН между 10 и 11. Осажденное твердое вещество выделяли вакуумной фильтрацией и высушивали в печи (1,04 г). Продукт имел такой же спектр рентгеновской дифракции, как в Примере 23. Он имел несовершенную кристаллическую форму. Он показал слабые линии рентгеновской дифракции для арагонита и кальцита и имел выраженную абсорбцию, соответствующую рентгеновской абсорбции бруцита, Mg(OH)2.
Этап 2. Первое повторное применение фильтрата: Раствор А': В 5,0 л колбу вносили 3,2 г CaSO4·2H2O и 2,0 л фильтрата с этапа 1. CO2 продували через раствор, снижая рН от 10,4 до 6,0. Это Раствор А'. Раствор В': в другую колбу добавляли 500 мл фильтрата из этапа 1 и 0,2 г CaSO4·2H2O. рН составил 10,3. Раствор А' подавали под действием силы тяжести в Раствор В' при постоянном перемешивании. NH4OH (25%, 13,4 М, d 0,91, 65 мл) добавляли в реакционную смесь для поддержания рН между 10,2 и 10,4. Осажденное твердое вещество собирали фильтрацией и высушивали в печи (6,23 г). Фильтрат имел рН 10,3. Рентгеновская дифракция позволила идентифицировать продукт как смесь кальцита и арагонита.
Этап 3. Второе повторное применение фильтрата: Раствор А": В 5,0 л колбу вносили 2,0 л фильтрата с этапа 2. Исходный рН составил 10,4. Смесь перемешивали в течение ночи, но отмечалось очень незначительное растворение твердого вещества. Двуокись углерода продували через смесь, и рН снизился с 10,4 до 7,1. Это раствор А". Раствор В". В другую колбу вносили 500 мл фильтрата с этапа 2. рН составил 10,4. Раствор А" добавляли под действием силы тяжести в Раствор В" при постоянном перемешивании. NH4OH (25%, d 0,91, 13,4 M, 265 мл) добавляли в реакционную смесь для поддержания рН между 10,2 и 10,4. При этих условиях ничего не осаждалось. В смесь добавили 120 г твердой соли Красного моря. Нерастворимое твердое вещество выделяли фильтрацией, ресуспендировали в 1,0 л деионизованной воды и собирали фильтрацией. Осадок с фильтра ресуспендировали и собирали второй раз перед высушиванием в печи. Было выделено 11,65 г нерастворимого твердого вещества.
В заключение: а) Продукт, выделенный из насыщенной гипсом искусственной морской воды, является таким же, как выделенный из искусственной морской воды без гипса, когда удаляют избыток двуокиси углерода. b) Гидроксид аммония позволяет уловить больше двуокиси углерода.
Пример 30
Осадок карбоната из гипса и воды с солью Красного моря с применением гидроксида аммония в качестве основания.
Этап 1. Исходный раствор: Раствор А: в 5,0 л колбу добавляли 60,0 г соли Красного моря, 8,00 г CaSO4·2H2O и 2,0 л деионизованной воды. Раствор продували СО2, снижая рН с 8,6 до 4,7. Это Раствор А. Раствор В. В другую колбу добавляли 500 мл раствора, содержащего 15 г соли Красного моря и 1,0 г CaSO4·2H2O, доводили рН до 10,5 с помощью NH4OH (13,4 M). Это Раствор В. Раствор А подавали прямо в Раствор В под действием силы тяжести. Наконечник подающей трубки находился ниже поверхности Раствора В. В реакционной смеси поддерживали рН 10,3, но он иногда варьировал между 10,2 и 10,4. 25% NH4OH (13,4 M) прокачивали насосом в раствор для поддержания рН. Не отмечалось заметного осаждения, пока в реакционную смесь не добавляли примерно 500 мл Раствора А. рН был очень устойчивым в значении 10,3. Применяли 40 мл NH4OH, выделив в целом 2,82 г. Продукт был идентифицирован с помощью рентгеновской дифракции как кальцит, было сделано предположение, что имеется также небольшое количество совместно кристаллизованного моногидрокальцита.
Этап 2. Первое повторное применение фильтрата: Раствор А': В колбу помещали весь фильтрат с этапа 1 (2540 мл) и дополнительно 2,5 г CaSO4·2H2O и СО2 продували через раствор, снижая рН от 10,3 до 6,60. Это Раствор А'. Раствор В'. В 500 мл маточного раствора CaSO4·2H2O (2,0 г/л) добавляли 15 г соли Красного моря. Увеличивали рН до 10,4 с помощью NH4OH. Раствор А' подавали под действием силы тяжести в Раствор В', как описано выше. За исключением некоторых начальных отклонений рН между 10,1 и 10,5, рН поддерживали очень близко к 10,3 с применением дополнительных 370 мл 25% NH4OH. Осажденное твердое вещество собирали фильтрацией и ресуспендировали в деионизованной воде, фильтровали вновь и промывали 200 мл Н2О перед высушиванием в печи. Было выделено 7,16 г. Продукт был идентифицирован с помощью рентгеновской дифракции как кальцит моногидрат.
Этап 3. Второе повторное применение фильтрата. Было предположено, что избыток гидроксида аммония вместе с двуокисью углерода приводил к образованию карбоната или бикарбоната аммония, и что ограничивающим фактором для осаждения было количество ионов кальция. Аликвоту 100 мл фильтрата (общий объем 3370 мл) смешивали с 400 мл раствора CaSO4·2H2O (2,0 г/л). Формировался осадок. Его фильтровали и высушивали. Было выделено 0,274 г. Дополнительное добавление раствора CaSO4·2H2O не вызывало дальнейшего осаждения в данной аликвоте фильтрата. На основании этого измерения было подсчитано, что всего из фильтрата можно осадить 9,23 г хлорида кальция. Выделенный продукт был идентифицирован с помощью рентгеновской дифракции как кальцит.
В заключение: применение CaSO4·2H2O и NH4OH позволяет улавливать больше СО2, чем в других использованных системах. Только на этапах 1 и 2 выход на основании количества кальция, представленного в виде гипса и соль Красного моря, составил 98%.
Подсчет выхода осадка карбоната может быть проведен, например, в соответствии со следующими этапами:
Этап 1: 8,0 г CaSO4·2H2O (23,3% Са)=1,86 г ионов Са2+
RSS в 2 л Н2О, 380 ч./млн Са=0,76 г ионов Са2+
Таким образом, 2,62 г Са2+ в растворе А из этапа 1
1,0 г CaSO4·2H2O (23,3% Са)=0,233 г ионов Са2+
0,5 л RSS H2O, 380 ч./млн Са=0,190 г ионов Са2+
Общее количество грамм ионов Са на этапе 1 составляет (2,62+0,423)=3,04 г Са2+.
Общее число моль Са2+, доступное на этапе 1, составляет 3,04 г/40 г/моль=0,0760 моль Са2+.
Один моль СаСО3 может формировать один моль Са2+; молекулярный вес СаСО3составляет 100 г/моль, таким образом 0,0760 моль Са2+ составляет 7,60 г СаСО3 Соответственно 7,60 г СаСО3 может быть образовано на этапе 1.
Таким образом, выход на этапе 1 составляет (2,82 г выделено / 7,60×100)=37,1%.
Этап 2: Фильтрат с этапа 1 повторно использовали. Он имел (7,60-2,82)=4,78 г СаСО3 не было получено. Учитывая молекулярную массу 100 г/моль для СаСО3, в фильтрате находится 0,0478 моль Са2+, и учитывая атомный вес Са (40 г/моль), в фильтрате доступно: (0,0478)(40)=1,91 г Са2+.
2,5 г CaSO4·2H2O (23,3% Са) было добавлено в Раствор А', таким образом, было добавлено дополнительно 0,583 г ионов Са.
Раствор В' на этапе 2 включает 1,0 г CaSO4·2H2O (23,3% Са), таким образом, доступно 0,233 г Са2+, и 0,5 л RSS в воде (т.е. 380 ч./млн Са2+, 0,190 г).
Общее количество Са2+, доступного на этапе 2, составляет: (1,91+0,583+0,233+0,190)=2,92 г Са2+.
Таким образом, 2,92/40=0,0730 моль Са2+ доступно в форме в основном 7,30 г СаСО3 на этапе 2.
Поскольку на этапе 2 было выделено 7,16 г, то выход составляет: (7,16 г СаСО3 получено / 7,30 г возможного)×100=98,1% выход.
Общий выход в Примере 30 подсчитывали из добавленных соединений кальция:
Этап 1:
9,0 г CaSO4·2H2O (23,3% Са)=2,10 г ионов Са2+
2,5 л RSS H2O (380 ч./млн)=0,95 г ионов Са2+
Этап 2
3,5 г CaSO4·2H2O (23,3% Са)=0,82 г ионов Са2+
05 л RSS H2O (380 ч./млн)=0,19 г ионов Са2+
Всего на этапе 1 и этапе 2=4,06 г ионов Са2+ доступно в реакции, что составляет 0,102 моль Са2+ (м.м.=40 г/моль), доступного для получения 10,2 г СаСО3 (м.м.=100 г/моль).
Поскольку 2,82+7,16=9,98 г карбоната было выделено, на обоих этапах, общий выход составляет (2,82+7,17)/10,2×100=97,8%.
Пример 31
Осадок карбоната из гипса и воды с солью Красного моря с применением гидроксида аммония в качестве основания, и 12% CO2
Этап 1. Исходный раствор: Раствор соли Красного моря (30 г/л, 2 л) и CaSO4·2H2O (2 г/л) продували в течение 150 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 52 мл/мин. Этот раствор (рН 6,9) подавали под действием силы тяжести (4 л/час, 67 мл/мин) в 500 мл раствора (рН 10,3), содержащего 30 г/л соли Красного моря и 2 г/л CaSO4·2H2O. Во время эксперимента рН поддерживали на уровне 10,3 концентрированным NH4OH. Осажденное твердое вещество (смесь кальцита и арагонита) собирали фильтрацией и высушивали в печи: было выделено 1,00 г. На основании количества добавленного кальция из морской воды и гипса, выход СаСО3 составил 19%. На основании количества CO2, доставленного из газового баллона, выход СаСО3 составил 26%.
Этап 2. Первое повторное применение фильтрата. Фильтрат с этапа 1 (2,5 л, рН 10,3) продували в течение 145 минут 12% CO2/воздух, средняя скорость потока которого составила 47,0 мл/мин. Этот раствор (рН 9,8) подавали под действием силы тяжести в 500 мл раствора (рН 10,3) соли Красного моря (30 г/л) и CaSO4·2H2O (2 г/л). Во время эксперимента рН поддерживали на уровне 10,3 концентрированным NH4OH. Осажденное твердое вещество в виде смеси кальцита и арагонита собирали фильтрацией и высушивали в печи: было выделено 2,29 г.На основании количества кальция, добавленного в раствор, и количества, оставшегося в фильтрате на этапе 1, выход СаСО3 составил 43%. На основании количества CO2, доставленного из газового баллона, выход СаСО3 составил 67%.
Этап 3. Второе повторное применение фильтрата: фильтрат с этапа 2 (3,0 л, рН 10,3) уравновешивали CaSO4·2H2O (3,0 г) в течение 17,3 часов, во время которых его продували 12% CO2/воздух, средняя скорость потока которого составила 45,6 мл/мин. Большая часть CaSO4·2H2O не растворилась. Этот раствор (рН 9,1) подавали под действием силы тяжести в 500 мл раствора (рН 10,3), содержащего соль Красного моря (30 г/л) и CaSO4·2H2O (2 г/л). Во время эксперимента рН поддерживали на уровне 10,3 концентрированным NH4OH. Осажденное твердое вещество собирали фильтрацией и высушивали в печи: было выделено 1,25 г. 500 мл порцию фильтрата (всего 3,5 л, рН 10,3) добавляли к 1,0 л раствора CaCl2 (10 г/л), и дополнительно выделили 0,874 г. Более 99% твердого вещества составил кальцит. Таким образом, на основании целых 3,5 л из фильтрата можно выделить дополнительно 6,12 г СаСО3, а общее расчетное количество СаСО3, которое можно выделить на этом последнем этапе эксперимента, составляет 7,37 г. Это рассчитано на 31% CO2, использованного на этапе 3.
В заключение:
Общий выход на этапах 1 и 2, на основании доставленного CO2, составляет 45%. Общий выход, включая этап 3, составляет 34%.
Выход может быть увеличен, если на этапе 1 СО2 продувают через щелочной раствор.
На этапе 2, если концентрацию Са2+ или общее количество увеличить, выход может быть выше. Это можно осуществить смешиванием фильтрата и равного объема «гипсовой воды».
На этапе 3 можно получить больший выход, если известна оптимальная длительность продувания.
Расчет выхода осадка карбоната может быть проведен, например, в соответствии со следующими этапами:
Добавлений кальция в форме гипса и морской соли.
Этап 1
RSS 2 л × 0,380=0,760 г кальция с верха RSS
Гипс 2 л × 2,0 г/л × 0,233=0,932 г Са с верха гипса
RSS 0,5 л × 0,380=0,190 г кальция со дна RSS
Гипс 0,5 л × 2,0 г/л × 0,233=0,233 г Са со дна гипса
Общее количество кальция, добавленного на этапе 1=2,115 г кальция
Общее количество моль кальция на этапе 1: 2,115 г/40,08 г/моль=0,05277 моль кальция.
Этап 2
RSS 0,5 л × 0,380=0,190 г кальция со дна RSS
Гипс 0,5 л × 2,0 г/л × 0,233=0,233 г Са со дна гипса
Общее количество кальция, добавленного на этапе 2=0,423 г кальция
Общее количество моль кальция на этапе 2: 0,423 г/40,08 г/моль=0,01055 моль кальция.
Этап 3
Гипс 3,0 г × 0,233=0,699 г Са с верха гипса
RSS 0,5 л × 0,380=0,190 г кальция со дна RSS
Гипс 0,5 л × 2,0 г/л × 0,233=0,233 г Са со дна гипса
Общее количество кальция, добавленного на этапе 3=1,122 г
Общее количество моль кальция на этапе 3: 1,122/40,08 г/моль=0,02799
Общее количество моль кальция, добавленного на этапах 1, 2 и 3: 0,09131 моль добавленного кальция
Выход СаСО3 на основе добавленного Са2+:
((1,00 г+2,29 г+1,25 г)/100)/0,0913×100=49,7%
Добавленный CO2 (добавленный в виде коммерческой смеси 12% в воздухе)
Этап 1
(52 мл/мин)(150 мин)(0,12)(273 К/292 К)(1 моль/22,4 л) (1 л/1000 мл)=0,03907 моль CO2
Этап 2
(47,0 мл/мин)(145 мин)(0,12)(273 К/292 К)(1 моль/22,4 л) (1 л/1000 мл)=0,03413 моль CO2
Этап 3
(45,6 мл/мин)(60 мин/час)(17,3 часа)(0,12)(273 К/292 К)(1 моль/22,4 л) (1 л/1000 мл)=0,2371 моль CO2
Общее число моль CO2: 0,03917+0,03413+0,2371=0,3104 моль CO2 в целом.
Выход на основе СО2 только из этапов 1 и 2: 45%.
Пример 32
Осадок карбоната из гипса и воды с солью Красного моря с применением гидроксида аммония в качестве основания и 12% СО2, продуваемого в щелочном растворе
Этап 1. Раствор, содержащий соль Красного моря (30 г/л, 2 л) и CaSO4·2H2O (2 г/л), доводили до рН 10,5 концентрированным (25%) NH4OH. В этом растворе при данном рН ничего не осаждалось в течение 30 минут, после чего наблюдалось легкое помутнение из-за поглощения окружающего СО2. Раствор продували в течение 92 минут потоком газа 12% СО2/воздух, средняя скорость потока составила 66,5 мл/мин. Осаждение карбоната началось немедленно, и в течение этого времени рН поддерживали между 10,2 и 10,4 концентрированным NH4OH. Осажденное твердое вещество (1,62 г) выделяли фильтрацией и высушивали в печи.
Этап 2. Прозрачный фильтрат (рН 10,3) с этапа 1 продували в течение 150 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 68,8 мл/мин. В отличие от этапа 1, осаждение карбоната началось спустя первые несколько минут. рН поддерживали между 10,2 и 10,4 концентрированным NH4OH. Осажденное твердое вещество (1,60 г) выделяли фильтрацией и высушивали в печи.
Этап 3. Прозрачный фильтрат (рН 10,3) с этапа 2 продували в течение 60 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 70,3 мл/мин. В отличие от предыдущей части данного эксперимента, не наблюдалось осаждения в течение 45 минут. рН был повышен до 10,7 концентрированным (25%) NH4OH, и произошло осаждение. Твердое вещество собирали фильтрацией. Осадок на фильтре растрескивался, чего не наблюдалось в материале, образовавшемся при более низком рН. Такое поведение было отмечено в эксперименте 22. Осадок с фильтра ресуспендировали в Н2О (100 мл) и вновь фильтровали для удаления избытка NH4OH. Отмытый осадок с фильтра высушивали в печи, получив 1,89 г твердого вещества. Он имел несовершенную кристаллическую форму и некоторые черты рентгеновской дифракции, характерные для бруцита, Mg(OH)2.
В заключение:
На основании количества СО2, пропущенного через раствор, общий выход для карбоната составил 39% на основе расчетов, описанных здесь ниже.
Материал, собранный на этапах 1 и 2, отличается от материала, собранного на этапе 3. Если материалом первых двух этапов является СаСО3, то выход составляет 39% на основе СО2 и обусловлен удалением кальция.
Подсчет выхода осадка карбоната можно провести, например, в соответствии со следующими этапами:
Добавленный кальций в форме гипса и морской соли, только однократно.
RSS 2 л×0,380=0,760 г кальция из RSS
Гипс 2 л×2,0 г/л×0,233=0,932 г Са из гипса
Общее количество кальция, добавленного на этапе 1=1,692 кальция
Общее количество моль кальция на этапе 1: 1,692 г/40,08 г/моль=0,04222 моль кальция
(1,62+1,60)=3,22 г СаСО3 было собрано на этапах 1 и 2.
Это составляет 0,0322 моль СаСО3.
Выход СаСО3 на основании добавленного Са2+: ((1,60г+1,62 г)/100)/0,0422×100=76,3%.
Добавленный CO2 в виде коммерческого газа 12% CO2/88% воздуха
Этап 1:
66,5 мл/мин×92 мин×0,12(273 К/292 К)(1 моль/22,4 л)(1 л/1000 мл)=0,03064 моль CO2
Этап 2:
68,8 мл/мин×150 мин×0,12(273 К/292 К)(1 моль/22,4 л)(1 л/1000 мл)=0,05169 моль CO2
Общее число моль CO2: (0,03064+0,051б9)=0,08233 моль CO2
Выход на основе CO2=(0,032 моль карбоната/0,08233 моль CO2)×100=39,1%.
Пример 33
Осадок карбоната из гипса с применением гидроксида аммония в качестве основания и 12% CO2, продуваемого в щелочном растворе
Этап 1. Раствор CaSO4·2H2O (2 г/л, 2 л, 0,023 моль, 0,0115 М Са2+), доводили до рН 10,3 концентрированным (25%) NH4OH. Раствор продували в течение 80 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 58,9 мл/мин. Раствор начал становится мутным спустя 15 минут. Во время эксперимента рН поддерживали между 10,2 и 10,4 концентрированным NH4OH. Осажденное твердое вещество (0,8 г) выделяли фильтрацией и высушивали в печи.
Этап 2. Прозрачный фильтрат (рН 10,3) с этапа 1 продували вновь в течение 90 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 57,1 мл/мин. рН поддерживали между 10,2 и 10,4 концентрированным NH4OH. Осажденное твердое вещество (1,13 г) выделяли фильтрацией и высушивали в печи. рН фильтрата поднимали до 11,0, хотя не отмечалось существенного осадка. Спустя 15 часов фильтрат фильтровали через 20 микронный фильтр, получая еще 0,17 г карбоната кальция.
Этап 3. 2,0 л раствора, содержащего 2 г/л CaSO4·2H2O (0,023 моль, 0,0115 М Са2+), добавляли к фильтрату. Раствор стал мутным спустя 5 минут, и его фильтровали спустя 45 минут, получая дополнительно 1,28 г СаСО3. Фильтрат имел рН 10,7.
Заключение:
Всего было выделено 3,38 г СаСО3.
По крайней мере 69% CO2, введенного в систему, было изолировано с применением растворов гипса и аммиака. Это число можно увеличить путем более раннего выключения подачи CO2.
Более 90% Са2+, исходно добавленного в виде водного CaSO4, осаждалось в виде СаСО3.
Более высокие концентрации Са2+ можно получить с применением гипса, растворенного в морской воде, и в результате выделить больше СаСО3, как в Эксперименте 31 было примерно в два раза больше растворенного кальция, дававшего в два раза больше СаСО3.
Подсчитать выход осадка карбоната можно, например, в соответствии со следующими этапами:
Исходный раствор:
(2,00 л раствор)(2,00 г/л)=4,00 г CaSO4·2H2O, м.м. 172 г/моль
4,00 г/172 г/моль=0,0233 моль CaSO4·2H2O, таким образом 0,0233 моль Са2+.
На этапе 3 было добавлено дополнительно 0,0233 моль Са2+. Общее количество моль добавленного Са2+ составляет 0,0466.
Количество двуокиси углерода, введенной в систему.
Этап 1
а. Средняя скорость потока газа составила 58,9 мл/мин:
(58,9 мл/мин)(80 мин)=4710 мл 12% CO2 из баллона
(4710 мл)(0,12)=565 мл CO2 при 19°С.
b. Коррекция на идеальную температуру 273 К (приводящую к наименьшему объему)
(273 К/292 К)(565 мл)=529 мл
с. Число моль CO2
1,0 моль идеального газа/22,4 л=х моль CO2/0,529 л
х=0,0236 моль CO2
d. Процент CO2, уловленного на этапе 1
0,796 СаСО3/100 г/моль=0,00796 моль СаСО3
0,0078/0,0236=33,7%
Этап 2
а. Средняя скорость потока газа составила 57,1 мл/мин:
(57,1 мл/мин)(90 мин)=5140 мл 12% СО2 из баллона
(5149 мл)(0,12)=617 мл СО2 при 19°С.
b. Коррекция на идеальную температуру 273 К (приводящую к наименьшему объему)
(273 К/292 К)(617 мл)=577 мл
с. Число моль CO2
1,0 моль идеального газа/22,4 л=х моль CO2/0,577 л
х=0,0257 моль CO2
d. Процент CO2, уловленного на этапе 1
1,130 СаСО3/100 г/моль=0,0113 моль СаСО3
0,0113/0,0257=44,0%
Общий выход: Дополнительно 0,171 г собрано в течение ночи при рН=11.
Таким образом, общий выход от этапов 1 и 2:
(0,796+1,130+0,171)=2,10 г СаСО3
2,10 г/100 г/моль=0,0210 моль СаСО3
0,0210 моль/(0,0493)=42,6%
На этапе 3 было выделено дополнительно 1,282 г СаСО3.
Общее число моль СаСО3 сейчас составляет 0,0210+0,0128=0,0338
Выход на основе гипса составляет 0,0338/0,0466=0,725=72,5%
Таким образом, выход на основе СО2 составляет: 0,0338/0,0493=0,686=68,6%.
Пример 34
Осадок карбоната из гипса и воды с солью Красного моря с применением гидроксида аммония в качестве основания и продувания 12% CO2 в щелочной раствор и дополнительного гипса после осаждения
Этап 1. Раствор, содержащий соль Красного моря (30 г/л, 2 л) и CaSO4·2H2O (2,00 г/л), доводили до рН 10,5 концентрированным (25%) NH4OH. Из раствора ничего не осаждалось. Раствор продували в течение 60 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 54,2 мл/мин. рН поддерживали между 10,2 и 10,4 концентрированным NH4OH. Осажденное твердое вещество (1,07 г) выделяли фильтрацией и высушивали в печи. По результатам рентгеновской дифракции оно представляло более 99% арагонита.
Этап 2. Прозрачный фильтрат (рН 10,3) с этапа 1 продували в течение 90 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 63,7 мл/мин. Осаждение карбоната не происходило немедленно, и начиналось только спустя первые несколько минут. рН поддерживали между 10,2 и 10,4 концентрированным NH4OH. Осажденное твердое вещество (1,50 г) выделяли фильтрацией и высушивали в печи. По результатам рентгеновской дифракции оно представляло более 99% арагонита.
Этап 3. Прозрачный фильтрат (рН 10,3) с этапа 2 продували в течение 90 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 65,1 мл/мин. рН поддерживали между 10,2 и 10,4 концентрированным NH4OH. В целом было использовано 50 мл 25% NH4OH. Осажденное твердое вещество (0,54 г) выделяли фильтрацией и высушивали в печи. По результатам рентгеновской дифракции оно представляло более 99% арагонита.
Этап 4. 4,00 г CaSO4·2H2O добавляли к фильтрату с этапа 3. Его энергично перемешивали на вращающемся шейкере в течение 20 часов, а затем фильтровали и высушивали в печи. Твердое вещество (1,77 г) по результатам рентгеновской дифракции оказалось смесью арагонита и кальцита.
В заключение: было осаждено 3,11 г карбоната кальция. Процент кальция, удаленного за три этапа, составил 73%. На этапе 1 было получен выход СаСО3 66% на основании использованного CO2.
Подсчет выхода осадка карбоната может быть проведен, например, в соответствии со следующими этапами:
Количество кальция в растворе:
Из гипса:
(2,00 л раствор)(2,00 T/n)=4,00 г CaSO4·2H2O, м.м. 172 г/моль
4,00 г/172 г/моль=0,0233 моль CaSO4·2H2O, таким образом 0,0233 моль Са2+.
Из морской воды:
(2,00 л)(380 мг Са2+/л)(1 г/103 мг)(1 моль Са2+/40 г)=0,0190 моль Са2+
Общий Са2+ в растворе: 0,0423 моль Са2+
Моль CO2, использованного на:
Этапе 1:
(54,2 мл/мин)(60 мин)(0,12)(273 К/292 К)(1 моль/22,4 л)(1 л/1000 мл)=0,0163 моль CO2
Этапе 2:
(63,7 мл/мин)(90 мин)(0,12)(273 К/292 К)(1 моль газа на STP/22,4 л)(1 л/1000 мл)=0,0287 моль CO2
Этапе 3:
(65,1 мл/мин)(90 мин)(0,12)(273 К/292 К)(1 моль газа на STP/22,4 л)(1 л/1000 мл)=0,0294 моль CO2
Выход на основе Са2+:
(1,073 г+1,498 г+0,535 г)/100 г СаСО3/моль)/0,0423 моль CO2 × 100=73,4%
Выход на основе СО2:
Этап 1: 1,073 г=0,01073 моль СаСО3=0,01073 моль СаСО3 уловлено 0,01073/0,0163×100=65,8%
Этап 2: 1,498 г=0,01498 моль СаСО3=0,01498 моль СаСО3 уловлено 0,01498/0,0287×100=52,2%
Этап 3: 0,535 г=0,00535 моль СаСО3=0,00535 моль СаСО3 уловлено 0,00535/0,0294×100=18,2%
Общий выход на основе СО2:
(0,03106 моль СаСО3)/(0,0744 моль CO2 использованного)=41,7%
Пример 35
Осадок карбоната из гипса и воды с солью Красного моря с применением гидроксида аммония в качестве основания и продувания 12% СО2 в щелочной раствор с 30-минутными интервалами.
Этап 1. Раствор, содержащий соль Красного моря (30,00 г/л, 2,0 л) и CaSO4·2H2O (2,00 г/л), доводили до рН 10,3 концентрированным (25%) NH4OH. Раствор продували в течение 30 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 73,8 мл/мин. рН поддерживали между 10,2 и 10,4 7 мл концентрированного NH4OH. Осажденное твердое вещество (0,414 г) выделяли фильтрацией и высушивали в печи. По результатам рентгеновской дифракции оно представляло собой смесь 53% арагонита и 47% кальцита.
Этап 2. Прозрачный фильтрат (рН 10,3) с этапа 1 продували в течение 30 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 76,5 мл/мин. Осаждение карбоната начиналось спустя примерно 9 минут. рН поддерживали между 10,2 и 10,4 6 мл концентрированного NH4OH. Осажденное твердое вещество (0,535 г) выделяли фильтрацией и высушивали в печи. По результатам рентгеновской дифракции оно было представлено практически чистым арагонитом.
Этап 3. Прозрачный фильтрат (рН 10,3) с этапа 2 продували в течение 30 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 77,9 мл/мин. рН поддерживали между 10,2 и 10,4 7 мл концентрированного NH4OH. Осажденное твердое вещество (0,436 г) выделяли фильтрацией и высушивали в печи. По результатам рентгеновской дифракции оно было представлено практически чистым арагонитом.
Этап 4. Прозрачный фильтрат (рН 10,3) с этапа 3 продували в течение 30 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 79,5 мл/мин. рН поддерживали между 10,2 и 10,4 6 мл концентрированного NH4OH. Осажденное твердое вещество (0,313 г) выделяли фильтрацией и высушивали в печи. По результатам рентгеновской дифракции оно было представлено арагонитом с некоторым количеством кальцита.
Этап 5. Дополнительный материал (0,409 г) был снят со стенок реакционной колбы после выполнения последовательности реакции. По результатам рентгеновской дифракции оно было представлено смесью 70% арагонита и 30% кальцита.
В заключение:
На этапе 1 получен СаСО3 с 37,3% выходом. Молярное отношение использованных NH3/CO2 составило 8,4.
На этапе 2 получен СаСО3 с 46,5% выходом. Молярное отношение использованных NH3/СО2 составило 7,0.
На этапе 3 получен СаСО3 с 37,0% выходом. Молярное отношение использованных NH3/СО2 составило 7,9.
На этапе 4 получен СаСО3 с 26,2% выходом. Молярное отношение использованных NH3/CO2 составило 6,7.
Общий выход СаСО3 на основе CO2 составил 45,5%.
Общее молярное отношение использованных NH3/CO2 составило 7,4.
Было осаждено 49,8% Са2+.
Большая скорость потока приводила к меньшему выходу.
Пример 36
Осадок карбоната из гипса с применением гидроксида аммония в качестве основания и продувания 12% СО2 в щелочной раствор с 30-минутными интервалами
Этап 1. Раствор CaSO4·2H2O (2,0 л, 2,0 г/л), доводили до рН 10,3 0,5 мл концентрированного (25%) NH4OH. Раствор продували в течение 30 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 80,1 мл/мин. Осаждение карбоната началось только спустя 20 минут. рН поддерживали между 10,2 и 10,4 8 мл концентрированного NH4OH. Осажденное твердое вещество (0,319 г) выделяли фильтрацией и высушивали в печи. По результатам рентгеновской дифракции оно представляло собой смесь 48% арагонита и 52% кальцита.
Этап 2. Прозрачный фильтрат (рН 10,3) с этапа 1 продували в течение 30 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 80,4 мл/мин. рН поддерживали между 10,2 и 10,4 11 мл концентрированного NH4OH. Осажденное твердое вещество (0,502 г) выделяли фильтрацией и высушивали в печи. По результатам рентгеновской дифракции оно представляло собой смесь 86% арагонита и 14% кальцита.
Этап 3. Прозрачный фильтрат (рН 10,3) с этапа 2 продували в течение 30 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 80,8 мл/мин. рН поддерживали между 10,2 и 10,4 12 мл концентрированного NH4OH. Осажденное твердое вещество (0,526 г) выделяли фильтрацией и высушивали в печи. По результатам рентгеновской дифракции оно было представлено практически чистым арагонитом.
Этап 4. Прозрачный фильтрат (рН 10,3) с этапа 3 продували в течение 30 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 81,1 мл/мин. рН поддерживали между 10,2 и 10,4 16 мл концентрированного NH4OH. Осажденное твердое вещество (0,521 г) выделяли фильтрацией и высушивали в печи. По результатам рентгеновской дифракции оно было представлено практически чистым арагонитом.
Этап 5. Дополнительный материал (0,091 г) был снят со стенок реакционной колбы после выполнения последовательности реакции. По результатам рентгеновской дифракции оно было представлено смесью арагонита и кальцита.
В заключение:
На этапе 1 получен СаСО3 с 26,5% выходом. Молярное отношение использованных NH3/CO2 составило 8,9.
На этапе 2 получен СаСО3 с 41,5% выходом. Молярное отношение использованных NH3/CO2 составило 12,2.
На этапе 3 получен СаСО3 с 43,3% выходом. Молярное отношение использованных NH3/CO2 составило 13,2.
На этапе 4 получен СаСО3 с 42,7% выходом. Молярное отношение использованных NH3/CO2 составило 17,5.
Общий выход СаСО3 на основе CO2 составил 40,4%.
Общее молярное отношение использованных NH3/CO2 составило 13,1.
Было осаждено 84,1% Са2+.
Пресная вода, содержащая растворенный гипс, удаляла меньше CO2 из потока газа, чем морская вода, содержащая сопоставимое количество растворенного гипса.
Пресная вода, содержащая растворенный гипс, требовала больше NH4OH для поддержания рН 10,3, чем морская вода, содержащая сопоставимое количество растворенного гипса.
Пример 37
Осадок карбоната из гипса с применением гидроксида аммония в качестве основания и продувания 12% СО2 в щелочной раствор (рН 9,3)
Этап 1. Раствор CaSO4·2H2O (2,0 л, 2,0 г/л), доводили до рН 9,3 концентрированным (25%) NH4OH. Раствор продували в течение 60 минут потоком газа 12% CO2/воздух, средняя скорость потока составила 79,5 мл/мин. Осаждение карбоната началось только спустя 20 минут. рН поддерживали между 9,2 и 9,4 2,9 мл концентрированного NH4OH. Осажденное твердое вещество (0,864 г) выделяли фильтрацией и высушивали в печи. По результатам рентгеновской дифракции оно представляло собой смесь арагонита, кальцита и ватерита.
В заключение:
Количество СО2, собранного в эксперименте (0,864 г), было погрешностью эксперимента, сходной с карбонатом, полученным на этапах 1 и 2 (0,821 г) Примера 36.
Выход СаСО3 на основе CO2 составил 36%. (Средний выход на этапах 1 и 2 в Примере 36 составил 34%).
Отношение NH3/CO2=2,9. (Отношение для этапов 1 и 2 выше составило 10,6).
CO2 можно успешно улавливать при рН 9,3.
Пример 38.
Осадок карбоната из воды с солью Красного моря с применением гидроксида аммония в качестве основания и продувания 12% СО2 в щелочной раствор.
Раствор соли Красного моря (4,5 л, 135,0 г RSS, 30,0 г/л, 380 ч./млн Са2+, рН 8,8) доводили до рН 9,6 концентрированным (25%, d=0,91) NH4OH. CO2 продували через раствор со средней скоростью 85,3 мл/мин в течение 120 минут. рН поддерживали на уровне 9,3 в течение 50 минут, но за это время не наблюдалось осаждения СаСО3. В это время было добавлено дополнительно 135,0 г твердой соли Красного моря. После растворения всей этой соли отмечалось минимальное осаждение только спустя 110 минут. рН увеличили до 10,3 с помощью NH4OH, и реакционная смесь стала мутной. Ее профильтровали через 0,2 микронный фильтр после продувания CO2 в течение 120 минут. Выделенное твердое вещество было высушено в печи (0,739 г) и по результатам рентгеновской дифракции оказалось арагонитом.
В заключение:
Выход СаСО3 на основе CO2 составил 14%. Это составляет примерно 1/3 от результатов предыдущих экспериментов, и может быть вызвано новыми условиями эксперимента.
Выход СаСО3 составил 8,6% на основе общего Са2+, присутствующего в растворе.
Отношение NH3/CO2 составило 5,5.
Концентрация Са2+ является недостаточной для осаждения СаСО3 в условиях, успешно применяемых с гипсом в Примере 37. По этой причине растворимость продукта карбоната кальция не была увеличена при используемых условиях, а именно, концентрация кальция в морской воде является низкой без добавления кальция, таким образом концентрация карбоната тоже является низкой.
Повышение концентрации всех солей в морской воде (включая Са2+ путем добавления твердой соли Красного моря (как в этом случае) или путем удаления воды (при обессоливании с помощью обратного осмоса) может вызвать осаждение СаСО3 и сопутствующим улавливанием СО2.
Пример 39.
Осадок карбоната из воды с солью Красного моря с применением гидроксида аммония в качестве основания и продувания 12% CO2 в щелочной раствор.
Раствор соли Красного моря (4,50 л, 135,0 г RSS, 30,0 г/л, 380 ч./млн Са2+, рН 8,8) доводили до рН 10,0 концентрированным (25%, d=0,91) NH4OH. СО2 продували через раствор со средней скоростью 83,6 мл/мин в течение 180 минут. рН поддерживали на уровне 10,0 в течение 180 минут с помощью концентрированного гидроксида аммония. Осаждение СаСО3 началось спустя 60 минут и продолжалось на протяжении эксперимента. Твердое вещество выделяли фильтрацией через фильтровальную бумагу Whatman 1 и высушивали в печи (2,236 г). По результатам рентгеновской дифракции вещество было арагонитом.
В заключение:
Выход СаСО3 на основе использованного количества СО2 составил 30%.
Выход СаСО3 на основе доступного Са2+ составил 52%.
Отношение NH3/СО2 составило 3,2.
Концентрация Са2+ в морской воде является достаточной для осаждения СаСО3, если можно повысить концентрацию СО32-.
Длительное продувание CO2 в присутствии водного NH3 повышает уровень СО32-, пригодного для образования СаСО3.
Реферат
Группа изобретений относится к способу и устройству снижения концентрации СО2 в потоке. Способ включает введение потока первого газа, не включающего СО2 или включающего его следовые количества, первым конвейером и введение второго газа, включающего СО2 в концентрации по меньшей мере выше той, что находится в равновесии воздух-вода, в поток жидкости вторым конвейером. При добавлении раствора, включающего соль, в реакционную камеру, введении в реакционную камеру первого и второго газа происходит образование твердого карбоната в реакционной камере и выделение непрореагировавшего газа, включающего СО2 в сниженной концентрации. Способ осуществляют при комнатной температуре. Первый газ является воздухом. Второй газ является атмосферным воздухом, загрязненным вследствие процесса деятельности человека или вследствие природного процесса. Способ по второму варианту заключается во внесении потока СО2 в жидкость, включающую соль, с образованием углекислоты в растворе и смешивании раствора углекислоты с основанием при рН смеси, равном 9-12. При добавлении раствора, включающего соль, в реакционную камеру, введении основания в реакционную камеру через первый конвейер и введении образца жидкости в реакционную камеру через второй конвейер происходит образование твердого карбоната в реакционной камере и выделение непрореагировавшего газа. Технический результат: снижение концентрации атмосферного СО2 путем образования твердого карбоната. 6 н. и 56 з.п. ф-лы, 39 прим., 4 ил., 1 табл.
Формула
- первый конвейер для введения первого газа, не включающего СО2 или включающего его следовые количества,
- второй конвейер для введения второго газа, включающего СО2 в концентрации по крайней мере выше той, что находится в равновесии воздух-вода, и
- реакционную камеру,
в котором при добавлении раствора, включающего соль, в реакционную камеру, введении первого газа в реакционную камеру через первый конвейер, и введении второго газа в реакционную камеру через второй конвейер происходит образование твердого карбоната в реакционной камере и выделение непрореагировавшего газа, включающего СО2 в сниженной концентрации.
i) внесения потока СО2 в жидкость, включающую соль, с образованием углекислоты в растворе; и
ii) смешивания раствора углекислоты в (i) с основанием,
в то время как рН смеси в (ii) находится между 9-12 с образованием твердого карбоната, а концентрация СО2 в образце жидкости снижается.
- первый конвейер для введения основания,
- второй конвейер для введения образца жидкости, включающего СО2,
- реакционную камеру, и
в котором при добавлении раствора, включающего соль, в реакционную камеру, введении основания в реакционную камеру через первый конвейер, и введении образца жидкости в реакционную камеру через второй конвейер, происходит образование твердого карбоната в реакционной камере и выделение непрореагировавшего газа.
Документы, цитированные в отчёте о поиске
Способ и реактор для непрерывной реакции газа с жидкостью

Комментарии