Рекомбинантный вектор, обеспечивающий синтез физиологически активного вещества (варианты), содержащий промоторный сайт гена β -казеина корейских местных козлов, способ получения физиологически активного вещества (варианты) - RU2191826C2
Код документа: RU2191826C2
Чертежи












Описание
Изобретение касается тканеспецифической системы экспрессии, использующей промоторный сайт гена β-казеина из молочной железы корейских местных козлов, благодаря которой могут продуцироваться физиологически активные вещества. Более детально, данное изобретение касается получения новых рекомбинантных векторов, экспрессирующихся в млекопитающих, в которых соединены регуляторный район гена β-казеина, ген физиологически активного вещества и район гена, регулирующий терминацию. Данное изобретение также касается метода получения физиологически активных веществ в клеточных линиях, полученных из ткани молочной железы, а также в животных с использованием новых рекомбинантных векторов.
Предпосылки изобретения
Физиологически активные вещества продуцируются и секретируются в
следовых количествах в человеческом организме и играют существенную роль в обмене веществ и других биохимических реакциях. В настоящее время к физиологически активным веществам относят инсулин,
интерлейкины, ростовые факторы, регулирующие гемопоэз, такие как фактор из стволовых клеток, фактор, стимулирующий образование колоний гранулоцитов, эритропоэтин и т.д. Эти вещества слишком
многочисленны для того, чтобы подробно описывать их основные функции в человеческом организме. Причина, по которой такие физиологически активные вещества, несмотря на их важность, до сих пор не
выпускаются в промышленном масштабе, связана с тем, что их трудно выделить и очистить из-за их незначительных количеств в человеческом организме. Хотя физиологически активные вещества получают,
используя систему экспрессии прокариот, физиологически активные вещества, полученные, например, из E.coli, часто не выполняют своих обычных функций в организме человека и, кроме того, все еще
существует проблема их безопасности, которая должна быть решена до того, как они будут использоваться для лечения.
На основании данных, полученных из академических публикаций, известно, что даже если используется промоторный сайт гена, который специфически экспрессируется в ткани молочной железы, уровень экспрессии различен в зависимости от вида животных, из которых получен промотор, а также от генов, которые экспрессируются под этим промотором (Clark et al. (1987) Trends Biotech. 5, 20-24; Simons et al., (1987) Nature 328, 530-532; Lee at al., (1988) Nucl. Acids Res. 16, 1027-1041; Vilotte et al., (1988) Eur. J. Biochem. 186, 43-48; Gorden et al., (1987) Bio/Technology 8, 443-446; Shani et al., (1992) Transgenic Res. 1, 195-208; Wright et al., (1991) Bio/Technology 9, 830-834; Ebert et al., (1991) Bio/Technology 9, 835-838; Mega et al., (1994) Transgenic Res. 3, 36-42; Wei et al., (1995) Transgenic Res. 4, 232-240; Gutierrez et al., (1996) Transgenic Res. 5, 271-279).
Для производства физиологически активных веществ обычно применялись системы экспрессии, которые используют преимущества E.coli (Корейское Пат. Издание No. 94-5585) и клеток животных. Эти методы могли бы иногда успешно применяться в промышленном производстве, но до сих пор существует немало проблем, требующих решения. Например, в случае системы экспрессии, использующей клетки E.coli, возможно массовое производство при небольшой стоимости. Однако, поскольку E. coli является прокариотом, то в ней не осуществляется пост-трансляционная модификация, которая характерна для эукариот. Так, например, такое физиологически активное для человека вещество, как эритропоэтин (ЕРО), не проявляет своей активности, если продуцируется в E.coli. Для решения этой проблемы были проведены и до сих пор проводятся активные исследования, направленные на развитие систем экспрессии, которые имеют преимущества животных клеток. Продукты, которые образуются в результате применения этих систем, активны в организме человека, так как они претерпевают пост-трансляционные изменения. Тем не менее, не решенной остается проблема высокой стоимости культивирования клеток животных.
Почти для всех физиологически активных веществ, которые получают в промышленном масштабе, используют вышеперечисленные методики, но остаются нерешенными проблемы, такие, как сохранение активности, стоимость, выделение и очистка.
Раскрытие изобретения
Система экспрессии, специфичная для молочной железы, базирующаяся на представленных изобретениях, названных
pGbc, pGbc_L и pGbc_S, которые хранятся в Корейской Коллекции Типовых Культур Корейского научно-исследовательского института биологических наук и биотехнологии с 13 мая 1997 года (депозитные номера
КСТС 8790Р, 8791P и 8792Р соответственно), дает возможность получать желаемые белки путем экспрессии в животных клетках, происходящих из ткани молочной железы, или из молока, секретируемого
трансгенными животными с этими системами экспрессии, и таким образом решает вышеперечисленные проблемы, такие как сохранение активности, стоимость производства, выделение и очистка желаемых белков.
Использование регулирующего экспрессию участка гена β-казеина, специфически экспрессирующегося в тканях молочной железы, для производства физиологически активных для человека веществ имеет ряд технических преимуществ. Во-первых, поскольку белки-мишени, получаемые в результате применения описываемого в данном изобретении метода рекомбинации, претерпевают те же посттрансляционные изменения, что и соответствующие им природные белки, то полученные таким образом белки-мишени сохраняют свою активность в организме человека. Во-вторых, благодаря специфичности системы экспрессии для ткани молочной железы данное изобретение, использующее эти системы экспрессии для клеток, происходящих из ткани молочной железы, или трансгенных животных, позволяет получать физиологически активные вещества значительно дешевле, чем системы экспрессии, использующие другие клетки животных. Белки, образующиеся в клетках, происходящих из ткани молочной железы, или в молоке, секретируемом трансгенными животными, не многочисленны, так что белок-мишень можно легко выделить и очистить. Кроме того, использование трансгенных животных не требует значительных капиталовложений при увеличении масштаба производства белков-мишеней, а также предотвращает их загрязнение при производстве. Третье преимущество заключается в безопасности образующихся физиологически активных веществ. Поскольку среди веществ, секретируемых молочной железой, нет токсинов, то система экспрессии, описываемая в данном изобретении, является более безопасной, чем прочие традиционные системы.
Для получения физиологически активных веществ были развиты методы, использующие Е. сoli или клетки животных, и не так давно стали использовать преимущества трансгенных животных. Методы экспрессии, использующие в качестве хозяина клетки Е.соli или клетки животных, в настоящее время ограничены для промышленного применения вследствие вышеупомянутых недостатков, таких как сохранение активности физиологически активных веществ, стоимость их производства, выделение и очистка. Для того, чтобы решить эти проблемы, быстро развивается технология получения трансгенных животных и родственные технологии, которые в настоящее время успешно используются в биологических исследованиях.
Данное изобретение использует для производства белков клеточную линию, происходящую из ткани молочной железы, и трансгенных животных. В связи с этим в данном изобретении используются молекулярно-биологические методы и другие передовые технологии. Например, методы получения рекомбинантной ДНК необходимы для конструирования векторов, которые способны специфически экспрессироваться в ткани молочной железы, а метод микроинъекции необходим для получения трансгенных животных, содержащих эти векторы.
Хотя специалистам, работающим в этой области, хорошо известно, что использование промоторных сайтов генов, специфически экспрессирующихся в ткани молочной железы, при конструировании вектора, способного специфически экспрессировать белки в ткани молочной железы, и экспрессирующего вектора в данном изобретении берет свое начало из коммерческого вектора pRC/RSV (Invitrogen Inc. ), система экспрессии, описываемая в данном изобретении, совершенно отлична от других традиционных методов по следующим аспектам. Во-первых, использующийся в данном изобретении промотор гена β-казеина получен из корейских местных козлов. Вторая характерная особенность заключается в том, что промоторный сайт гена β-казеина козла соединяется с первым экзоном структурного гена через первый экзон гена β-казеина. В большинстве же случаев между промоторным сайтом и первым экзоном структурного гена вставляется интрон. В-третьих, в данном изобретении в векторах, экспрессирующихся в млекопитающих, ген бычьего гормона роста следует за структурным геном для того, чтобы выполнялась предпочтительная терминация транскрипции. Независимо от того, присутствует ли поли(А)-сигнальная последовательность в структурном гене или нет, терминатор гена бычьего гормона роста соединяется со структурным геном.
Краткое описание
чертежей
Вышеназванные и другие объекты и аспекты данного изобретения станут более понятными благодаря ссылкам на чертежи и описаниям, сопровождающим эти чертежи.
Фиг.1 схематически показывает часть общей структуры новых векторов pGbc_ S и pGbc_ L, предназначенных для трансфекции в животные клетки, и нового вектора для трансгенных животных.
Фиг. 2 показывает нуклеотидную последовательность промотора гена β-казеина корейских козлов.
Фиг. 3 показывает диаграмму, схематически иллюстрирующую конструкцию рекомбинантного вектора pGbc_S, согласно данному изобретению.
Фиг. 4 показывает диаграмму, схематически иллюстрирующую конструкцию рекомбинантного вектора pGbc_L, согласно данному изобретению.
Фиг. 5 показывает диаграмму, схематически иллюстрирующую рекомбинацию между вектором pGbc_S и геном hGCSF, согласно данному изобретению.
Фиг. 6 показывает диаграмму, схематически иллюстрирующую рекомбинацию между вектором pGbc_S и геном hGMCSF, согласно данному изобретению.
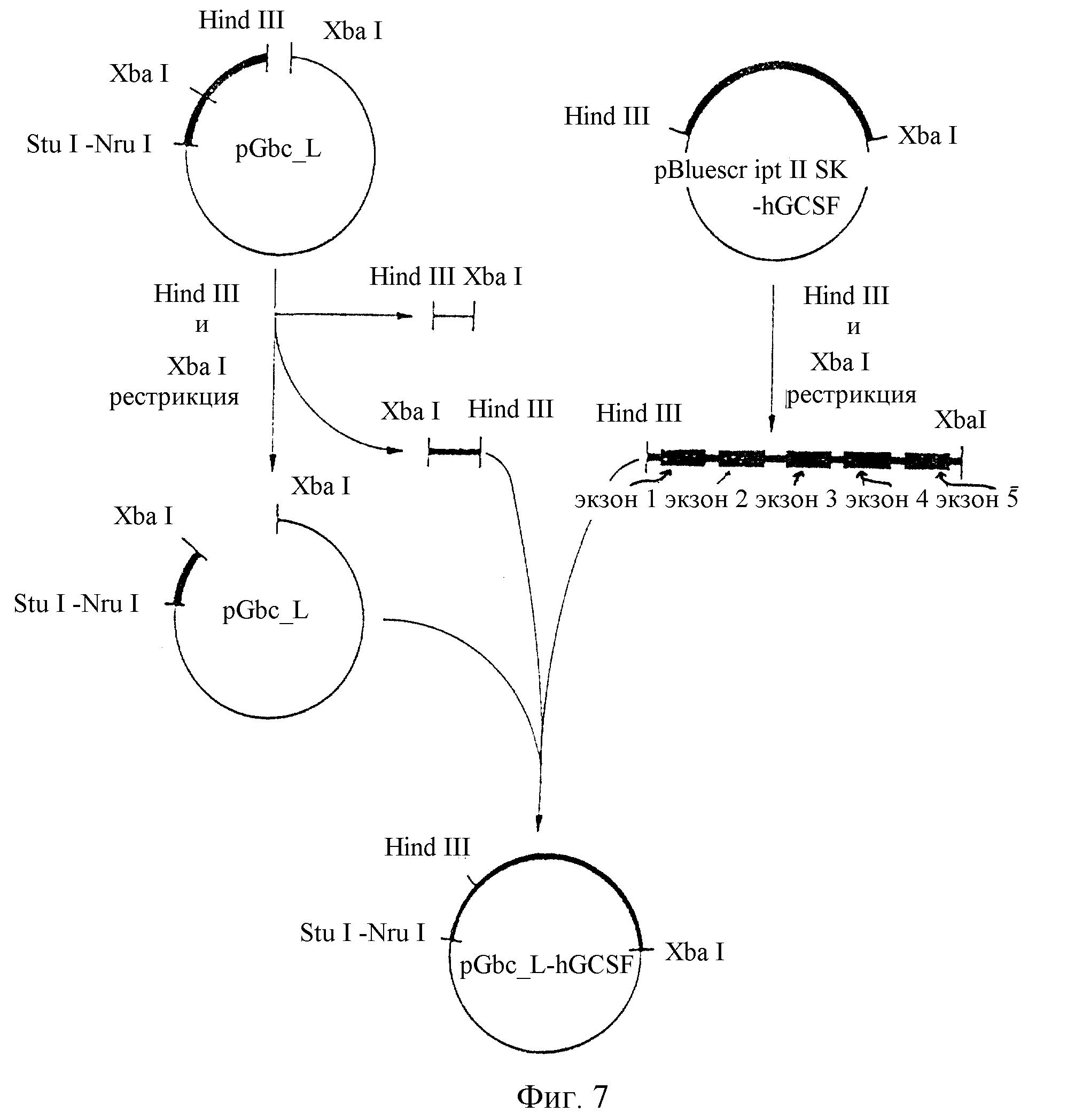
Фиг. 7 показывает диаграмму, схематически иллюстрирующую рекомбинацию между вектором pGbc_L и геном hGCSF, согласно данному изобретению.
Фиг. 8 показывает диаграмму, схематически иллюстрирующую рекомбинацию между вектором pGbc_L и геном hGMCSF, согласно данному изобретению.
Фиг. 9 показывает диаграмму, схематически иллюстрирующую рекомбинацию между вектором pGbc и геном hGCSF или геном hGMCSF, согласно данному изобретению.
Фиг. 10 показывает результаты анализа, осуществленного с помощью метода Вестерн-блоттинга, для белков hGM-CSF, получаемых из клеток линии НС11, происходящей из ткани молочной железы мыши, которые трансфицированы рекомбинантным вектором pGbc_ L или pGbc_ S, содержащим ген hGM-CSF, согласно данному изобретению.
Фиг. 11 показывает график, построенный по результатам твердофазного иммуноферментного анализа (ELISA) для белков hGM-CSF, получаемых из клеток линии НС11, происходящей из ткани молочной железы мыши, которые трансфицированы вектором pGbc_ L или pGbc_S, содержащим ген hGM-CSF, согласно данному изобретению.
Фиг. 12 показывает график, построенный по результатам ELISA для белков hG-CSF, получаемых из клеток линии НС11, происходящей их ткани молочной железы мыши, которые трансфицированы рекомбинантным вектором pGbc_L или pGbc_S, несущим ген hG-CSF, согласно данному изобретению.
Фиг. 13 представляет фотографию продуктов ПЦР, полученных с использованием в качестве матрицы геномной ДНК трансгенных мышей.
Фиг. 14 показывает результаты Вестерн-блоттинга для белков hG-CSF, секретирующихся в молоке трансгенных мышей, согласно данному изобретению.
Фиг. 15 показывает график, построенный по результатам ELISA, для белков hG-CSF, секретирующихся в молоке трансгенных мышей, согласно данному изобретению.
Фиг. 16 показывает график, построенный по результатам ELISA, для белков hG-MCSF, секретирующихся в молоке трансгенных мышей, согласно данному изобретению.
Наилучшие способы выполнения данного изобретения
[1] Конструирование экспрессирующих векторов
1) Амплификация промотора, экзонов 1 и 2 гена β
-казеина корейских местных козлов
Две пары праймеров предназначаются для амплификации с помощью полимеразной цепной реакции (ПЦР) части гена β-казеина, который, как сообщалось,
специфически экспрессируется в корейских местных козлах. Одна пара праймеров предназначена для амплификации участка гена β-казеина козла, включающего промоторный сайт и экзон 1, другая пара
праймеров предназначена для амплификации участка гена β-казеина козла, включающего интрон 1 и экзон 2. Продукт ПЦР для промотора и экзона 1 гена β-казеина козла разрезается
эндонуклеазами Sac I и Hind III, в то время как продукт ПЦР для интрона 1 и экзона 2 гена β-казеина козла разрезается эндонуклеазами Hind III и Sal I. Два разнонаправленных праймера для
амплификации промотора и экзона 1 гена β-казеина козла называются GBC-F1 и GBC-R1 и имеют следующую нуклеотидную последовательность: GBC-F1, 5'-GCT GAG CTC TTT AGT АТА TTG ТТА AGG А-3'; и
GBC-R1, 5'-TGT CAA GCT ТАТ СТТ ААА САС ССТ ТА-3'. Два разнонаправленных праймера для амплификации интрона 1 и экзона 2 гена β-казеина козла называются GBC-F2 и GBC-R2 и имеют следующую
нуклеотидную последовательность: GBC-F2, 5'-GCA TAA GCT ТТА САС TAT TTT CAG CAG-3'; и GBC-R2, 5'-АТА GTC GAC ССА GAG TTG TGG ТС-3'. После того, как два рестрицированных продукта ПЦР вместе встраивают
в вектор pBluescript II SK, поставляемый фирмой Stratagene, у получившейся плазмиды анализируют двухцепочечную ДНК с тем, чтобы определить нуклеотидную последовательность лигированных фрагментов
гена.
2) Конструирование векторов pGbc_S и pGbc_L
Участок ДНК в районе гена, клонированного в векторе Bluescript II SK (Stratagene), находящийся в пределах от 501 нуклеотида
до первого нуклеотида в 3'-5' направлении от стартового кодона для трансляции экзона 1, амплифицируют с помощью ПЦР. Этот продукт ПЦР разрезают с помощью рестрикционных ферментов Nru I и Hind III.
Вектор pRC/RSV, экспрессирующийся в млекопитающих, обрабатывают отдельно теми же ферментами для того, чтобы удалить участок LTR. В эту открытую плазмиду встраивают путем лигирования рестрицированный
продукт ПЦР и в результате получают вектор pGbc_S.
Рестрицированный продукт ПЦР затем обрабатывают рестриктазой Dra I и проводят выделение и очистку фрагмента гена, чьи противоположные концы разрезаны рестриктазами Hind III и Dra I. Вектор Bluescript II SK, включающий в себя промотор, экзон 1, интрон 1 и экзон 2 гена β-казеина козла, подвергают двойной рестрикции с помощью рестриктаз Stu I и Dra I, после чего выделяют и очищают фрагмент гена без экзона 1. Эти два фрагмента гена лигируют вместе в вектор pRc/RSV, который предварительно разрезают рестриктазами Nru I и Hind III, и получают вектор pGbc_L.
Правильно ли сконструированы векторы pGbc_S и pGbc_L или нет, подтверждается с помощью анализа нуклеотидной последовательности.
3)
Конструирование вектора pGbc и рекомбинация с генами физиологически активных веществ (фактор, стимулирующий рост колоний гранулоцитов (hGCSF) и фактор, стимулирующий рост гранулоцитарно-макрофагальных
колоний (hGMCSF))
Продукт ПЦР фрагмента гена А, включающий промоторный сайт и экзон 1, подвергают двойной рестрикции рестриктазами Sac I и Dra I для того, чтобы получить фрагмент гена,
содержащий промоторный сайт и участок экзона 1, удлиненный на один нуклеотид в 5' сторону от стартового кодона для трансляции. Продукт ПЦР размером 500 п.н., получение которого описано выше в пункте
2), отдельно обрабатывается рестриктазами Dra I и Hind III. Эти два фрагмента гена путем лигирования встраивают вместе в вектор pBluescript II SK(Stratagene), разрезанный рестриктазами Sac I и Hind
III, который затем открывают, разрезая рестриктазами Hind III и EcoR I. В эту открытую плазмиду лигируют процессированный фрагмент гена, который включает структурный ген, соединенный с терминаторным
участком гена бычьего гормона роста, и который разрезается рестриктазами Hind III и EcoR I. Общая структура векторов типа pGbc схематически показана на фиг.1.
[2] Рекомбинация между
векторами, специфически экспрессирующимися в тканях молочной железы, и генами hGCSF и hGMCSF
1) Используя хорошо известные методы исследования генов и ПЦР (Sambrook et al. (1989) Molecular
Cloning: A Laboratory Manual, Cold Spring Harbor Press, New York), ген hGCSF и ген hGMCSF клонируют в коммерчески доступном плазмидном векторе pUC19.
2) Рекомбинация между геном hGCSF
и векторами pGbc_S и pGbc_L, специфически экспрессирующимися в тканях молочной железы
Вектор pUC19, в котором клонирован ген hGCSF, разрезают рестриктазами BamH I и Хbа I. Выделяют и очищают
Фрагмент 1, который включает участок, простирающийся от экзона 2 до конца поли(А)-сигнальной последовательности. Открытый таким образом вектор разрезают рестриктазой Pst I, в результате чего получают
Фрагмент 2, который включает участок, простирающийся от первого с 5'-конца нуклеотида стартового кодона для трансляции до первого с 5'-конца нуклеотида экзона 2. Фрагменты 1 и 2 встраивают путем
лигирования в вектор pBluescript II SK, который открывают с помощью рестриктаз Pst I и Хbа I, в результате получают рекомбинантную плазмиду pBluescript II SK-hGCSF. Эту плазмиду подвергают двойной
рестрикции эндонуклеазами Hind III и Хbа I для того, чтобы получить модифицированный ген hGCSF, который затем лигируют в вектор pGbc_S, который разрезают по тем же сайтам эндонуклеазими Hind III и Xba
I. В результате получают новую плазмиду pGbc_S-hGCSF.
Подобным же образом конструируют новую плазмиду pGbc_L-hGCSF путем лигирования фрагмента, полученного после эндонуклеазной рестрикции промотора гена β-казеина козла, и модифицированного фрагмента гена hGCSF, полученного после двойной рестрикции вектора pBluescript II SK-hGCSF рестриктазами Hind III и Xba I, в вектор pGbc_L, который открывают теми же эндонуклеазами.
3) Рекомбинация между геном hGMCSF и векторами pGbc_S и pGbc_L, специфически экспрессирующимися в тканях молочной железы
Ген hGMCSF, клонированный в векторе pUC19, выделяют путем рестрикции рестриктазами ВаmН I и EcoR I и затем вставляют путем лигирования в вектор Bluescript II SK (Stratagene), который разрезают
теми же эндонуклеазами. В результате получают рекомбинантную плазмиду pBluescript II SK-hGMCSF. Модифицированный ген получают обратно путем рестрикции рекомбинантной плазмиды рестриктазами Hind III и
Xba I и затем встраивают его в вектор pGbc_S, который разрезается по тем же сайтам эндонуклеазами Hind III и Xba I. В результате получают новую плазмиду pGbc_S-hGMCSF.
Подобным же образом конструируют новую плазмиду pGbc_L-hGMCSF, лигируя фрагмент, полученный при эндонуклеазной рестрикции промотора гена β-казеина козла, и модифицированный фрагмент гена hGMCSF, полученный в результате двойной рестрикции вектора Bluescript II SK-hGMCSF рестриктазами Hind III и Xba I, в вектор pGbc_L, который открывают теми же эндонуклеазами.
Успешное конструирование экспрессирующих векторов подтверждается анализом их нуклеотидной последовательности.
[3] Трансфекция pGbc_S-hGCSF/hGMCSF и pGbc_L-hGCSF/hGMCSF в клетки линии НС11, происходящей из
ткани молочной железы мыши, и индукция экспрессии гормонами, вызывающими лактацию
1) Культура клеток линии НС11
Клетки НС11 культивируют в среде RPMI 1640 (Gibco BRL) с добавлением
10% эмбриональной телячьей сыворотки, 10 нг/мл эпидермального ростового фактора, 5 мкг/мл инсулина и 50 мкг/мл гентамицина (Sigma).
2) Трансфекция pGbc_S-hGCSF, pGbc_S-hGMCSF,
pGbc_L-hGCSF и pGbc_L-hGMCSF в клетки HC11
Четыре новые плазмиды, сконструированные в данном изобретении, очищают с помощью системы QIAGEN-tip 100, поставляемой компанией QIAGEN, в
соответствии с методикой, рекомендуемой компанией. Введение очищенных плазмид в клетки НС11 выполняют с помощью электропоратора, выпускаемого фирмой Invitrogen, в соответствии с рекомендациями
фирмы-изготовителя.
3) Отбор клеток по их устойчивости к антибиотикам
Клетки НС11 переносят в колбы Т25 и культивируют в течение 24-48 часов в СO2-инкубаторе (5%
СO2) при 37oС, после чего среду для культивирования меняют на свежую среду RPMI 1640 (Gibco BRL) с добавлением 10% эмбриональной телячьей сыворотки, 10 нг/мл эпидермального
ростового фактора, 5 мкг/мл инсулина, и антибиотиков: гентамицина (Sigma) до конечной концентрации 50 мкг/мл и генетицина (Sigma) - 200 мкг/мл, для отбора трансфицированных клеток.
4)
Индукция экспрессии гормонами, вызывающими лактацию
После отбора трансфектантов селективную среду меняют на среду, индуцирующую экспрессию, состоящую из RPMI 1640 (Gibco BRL) с добавлением 5
мкг/мл инсулина, 200 мкг/мл генетицина (Sigma), 50 мкг/мл гентамицина, 5 мкг/мл козьего пролактина и 1мкМ дексаметазона. Клетки культивируют в СО2-инкубаторе (5%СО2) при 37oС в течение 4 дней без смены среды.
5) Анализ уровня экспрессии
Физиологически активные для человека вещества, вырабатывающиеся в результате индукции экспрессии
соответствующих генов, секретируются в среду. Для качественного анализа секретируемых продуктов используется метод Вестерн-блоттинга, тогда как для количественного анализа используется метод
фермент-зависимого иммуносорбционного анализа (ELISA). Для анализа экспрессии фактора, стимулирующего рост колоний гранулоцитов в качестве первичных антител для Вестерн-блоттинга применяют мышиные
моноклональные IgG или поликлональные антитела против G-CSF человека, а для анализа экспрессии фактора, стимулирующего рост гранулоцитарно-макрофагальных колоний, используют мышиные моноклональные IgG
против GM-CSF человека. В качестве вторых антител для Вестерн-блоттинга используются антимышиные IgG, конъюгированные с пероксидазой хрена. Для ELISA на 96-луночные платы сначала наносят
поликлональные IgG антитела козла против G-CSF человека или поликлональные IgG антитела козла против GM-CSF человека, которые затем обрабатываются продуктом экспрессии в качестве соответствующего
антигена или имеющимся в распоряжении коммерческим фактором, использующимся в качестве стандарта. Эти антигены связываются с теми же моноклональными антителами против G-CSF человека или против GM-CSF
человека, которые используются в Вестерн-блоттинге. Конечные комплексы антител обрабатываются антимышиными IgG, конъюгированными с щелочной фосфатазой с целью индукции цветной реакции (Ed. Harlow and
Davis Lane (1989) Antibodies A Laboratory Manual, Cold Spring harbor Laboratory Press, New York).
[4] Экспрессия в трансгенных мышах
1) Очистка векторов для трансфекции
Для очистки трансфицирующих векторов из E.coli используются системы QIAGEN tip 100 (Qiagen) и Elutip (Schleicher & Schuel). Сначала трансфицирующие векторы очищаются с помощью QIAGEN tip
100. Очищенные векторы разрезаются рестрикционными ферментами с последующей экстракцией с использованием набора Geneclean II. Экстрагированные векторы далее очищаются в соответствии с рекомендациями
фирмы Schleicher& Schuel и затем диализуются в растворе, состоящем из 10 мМ трис-HCI, рН 7,2 и 10 мМ ЭДТА, чтобы получить вектор в концентрации 40 нг/ мл, который позже используется для
микроинъекции.
2) Микроинъекция
В мужской пронуклеус оплодотворенной яйцеклетки мыши линии СВА окончательно очищенный экспрессирующий вектор вводится путем микроинъекции.
Оплодотворенная яйцеклетка имплантируется в матку "приемной" матери путем хирургической операции.
3) Выделение геномной ДНК и анализ генной индукции
У потомков от "приемной"
матери отрезают хвосты. Из них выделяется геномная ДНК и очищается в соответствии с известным методом (Vilotte,J.-L. Et al. , (1989) Eur.J.Biochem. 186, 43-48). Корректно или нет вводится в мышь
желаемый ген, определяется соответствующими методами, включая блоттинг по Саузерну и ПЦР.
4) Экстракция молока и анализ уровня экспрессии
Потомство мышей, в которых гены
встроены корректно, спаривают с нетрансгенными, нормальными мышами для получения следующего поколения. Спустя 10 дней после родов, трансгенные родившие мыши изолируются от их потомства на 3 часа.
Последующая перитонеальная индукция окситоцина приводит к выделению молока у родивших мышей. Уровень экспрессии генов анализируется так же, как и на клеточном уровне, с использованием
Вестерн-блоттинга и ELISA соответственно для качественного и количественного анализов.
Дальнейшее описание системы экспрессии в соответствии с данным изобретением будет дано со ссылкой на чертежи.
На фиг. 1 представлена генная структура рекомбинантных векторов pGbc S, pGbc L и pGbc. Первые два вектора сконструированы для экспрессии в животных клетках, тогда как последний - для экспрессии в трансгенных мышах. Как показано на фиг. 1, этот ген содержит регуляторный район гена β-казеина козла, структурный район гена CSF и терминаторный район гена бычьего гормона роста.
Регуляторный район гена β-казеина состоит из неполного экзона 1 этого гена, который охватывает один единственный нуклеотид из стартового кодона для трансляции со стороны 5'-конца, и 5'-фланкирующего района, включающего промоторный сайт гена β-казеина козла.
Стартовый кодон "ATG" в структурном районе гена CSF, как особо подчеркивают, сам происходит из физиологически активной экспрессирующейся субстанции. Ген hG-CSF состоит из 4 экзонов, тогда как ген hGM-CSF - из 5 экзонов, которые обозначены "экзон 4 или 5". "ТЕР" означает терминаторный кодон в гене CSF.
На этой фигуре протяженность районов не соответствует их действительной длине.
Фиг. 2 представляет нуклеотидную последовательность промотора гена β-казеина из корейского козла, который используется в данном изобретении. Эта нуклеотидная последовательность идентична последовательности промотора и экзона 1 гена β -казеина Capra hircus, определенной Робертсом с соавт. (Roberts, B. T. , Ditullio, P., Vitale, J., Hehir, K., and Gordon, K. Gene, 1992, 121: 255-262).
На фиг.3 схематически показан процесс получения рекомбинантного вектора pGbc S. Длина каждого района не соответствует их действительной длине. То, что две линии соединяются в одну линию со стрелкой, означает лигирование, тогда как MCS обозначает полилинкерный сайт, ПЦР-продукт - это продукт, полученный с помощью полимеразной цепной реакции, и RSV LTR представляет длинный тандемный повтор из вируса саркомы Рауса. Более толстые линии в ПЦР-продукте и pGbc S обозначают экзон 1 гена β-казеина козла. Рестриктазы располагаются над сайтами узнавания.
На фиг.4 схематически показан процесс получения рекомбинантного вектора pGbc L. Длина каждого района не соответствует их действительной длине. Одна линия со стрелкой, в которой три линии соединяются вместе, означает лигирование; MCS обозначает полилинкерный сайт, ПЦР-продукт - это продукт, полученный в результате полимеразной цепной реакции, и RSV LTR - это длинный тандемный повтор из вируса саркомы Рауса. Более толстые линии в ПЦР-продукте, промоторе и экзоне 1 из гена β-казеина козла и в pGbc L обозначают экзон 1 гена β-казеина козла.
На фиг.5 схематически показан процесс рекомбинации между плазмидой pGbc_ S и геном hGCSF.
На этой фигуре длины плазмид и ДНК фрагментов приводятся для наглядности и не отражают фактической их длины. Рестриктазы расположены над сайтами узнавания. Лигирование выражается соединением двух или более линий в одну линию со стрелкой. Экзоны выражаются более толстыми линиями, чем линии, обозначающие интронные участки генов. При изображении плазмид pBluescript II SK-hGCSF, pGbc_S и pGbc S-hGCSF экзоны и интроны не выделяются.
На фиг.6 схематически показан процесс рекомбинации между плазмидой pGbc_ S и геном hGMCSF.
Длины плазмид и ДНК фрагментов приводятся для наглядности и не отражают их действительной длины. Рестриктазы расположены над сайтами узнавания. Лигирование выражается соединением двух или более линий в одну линию со стрелкой. Экзоны обозначаются более толстыми линиями, чем линии, обозначающие интроны. При изображении плазмид pBluescript II SK-hGMCSF, pGbc_S и pGbc S-hGMCSF экзоны и интроны не выделяются.
На фиг. 7 схематически представлен процесс рекомбинации между плазмидой pGbc_L и геном hGCSF.
На этой фигуре длина каждой плазмиды и фрагментов ДНК не отражает их действительной длины. Рестриктазы располагаются над сайтами узнавания. Множество линий, объединяющихся в одну линию со стрелкой, обозначают лигирование. При изображении фрагмента ДНК, полученного путем рестрикции вектора pBluescript II SK-hGCSF рестриктазами Hind III и Xba I, более толстые линии обозначают экзоны. На других чертежах экзоны и интроны не выделяются.
На фиг. 8 схематически представлен процесс рекомбинации между плазмидой pGbc_L и геном hGMCSF.
На этой фигуре длина каждой плазмиды и фрагментов ДНК не отражает их действительной длины. Рестриктазы располагаются над сайтами узнавания. Множество линий, объединяющихся в одну линию со стрелкой, обозначают лигирование. При изображении фрагмента ДНК, полученного путем рестрикции вектора pBluescript II SK-hGMCSF рестриктазами Hind III и Xba I, более толстые линии обозначают экзоны. На других чертежах экзоны и интроны не выделяются.
Фиг. 9 показывает рекомбинацию между векторов pGbc и генами hGCSF и hGMCSF.
На этой фигуре длина каждой плазмиды и фрагментов ДНК не отражает их действительной длины. Рестрикционные ферменты располагаются над сайтами узнавания. Множество линий, объединяющихся в одну линию со стрелкой, обозначает лигирование. На чертежах, изображающих промотор и экзон 1 гена β-казеина козла и продукт ПЦР, более толстые линии обозначают экзоны.
На фиг. 10 представлен количественный анализ экспрессии гена hGM-CSF в клетках линии НС11 с помощью Вестерн-блоттинга. Белки для Вестерн-блоттинга были получены при индукции экспрессии в клетках линии НС 11, полученной из ткани молочной железы мыши, которые (клетки) были трансфицированы каждым из экспрессирующих векторов млекопитающих pGbc_ S и pGbc_L, содержащих ген hGM-CSF.
На фиг. 11 представлен количественный анализ экспрессии гена hGM-CSF в клетках линии НС11 с помощью ELISA. Белки для ELISA получали путем индукции экспрессии в клетках линии НС11, трансфицированных экспрессирующими векторами млекопитающих pGbc_S и pGbc_L, в которых клонирован ген hGM-CSF.
На фиг. 12 представлен количественный анализ экспрессии гена hG-CSF в клетках линии НС11 с помощью ELISA. Белки для ELISA получают из клеток НС11, трансфицированных экспрессирующими векторами млекопитающих pGbc_S и pGbc_L, в которых клонирован ген hG-CSF, путем индукции экспрессии этого гена в клетках.
Фиг. 13 представляет электрофорез продуктов ПЦР генов hGCSF в агарозном геле. На фигуре Дорожка (+) обозначает продукт ПЦР гена hGCSF, для получения которого в качестве матрицы используют плазмиду pGbc-hGCSF. На Дорожке TG-2 представлен продукт ПЦР, для получения которого в качестве матрицы используется геномная ДНК трансгенных мышей, которые рождаются от "приемной" мыши, в матку которой имплантируется оплодотворенная яйцеклетка, трансфицированная плазмидой pGbc-hGbc-hGCSF. Дорожка TG-2.1 обозначает трансгенных потомков от TG-2. На Дорожке (-) представлен пробег продукта ПЦР, для получения которого в качестве матрицы используется геномная ДНК нетрансгенных, то есть нормальных мышей.
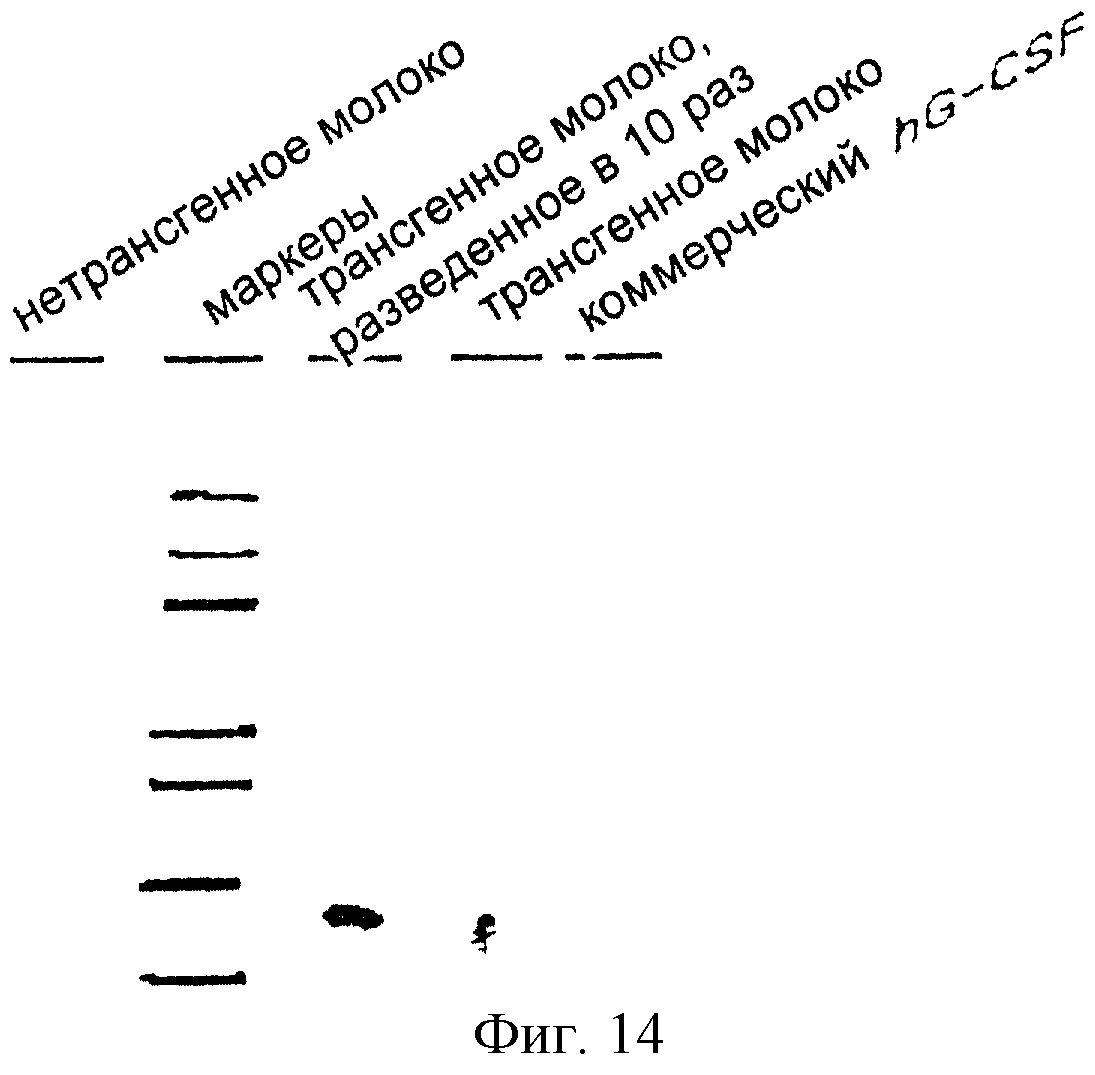
На фиг.14 представлен качественный анализ экспрессии гена hG-CSF в молоке трансгенных мышей с помощью метода Вестерн-блоттинга. Белки для Вестерн-блоттинга получают из молока, секретируемого трансгенными мышами, в которых вводятся экспрессионные векторы млекопитающих pGbc_S и pGbc_L, каждый из которых содержит ген hG-CSF.
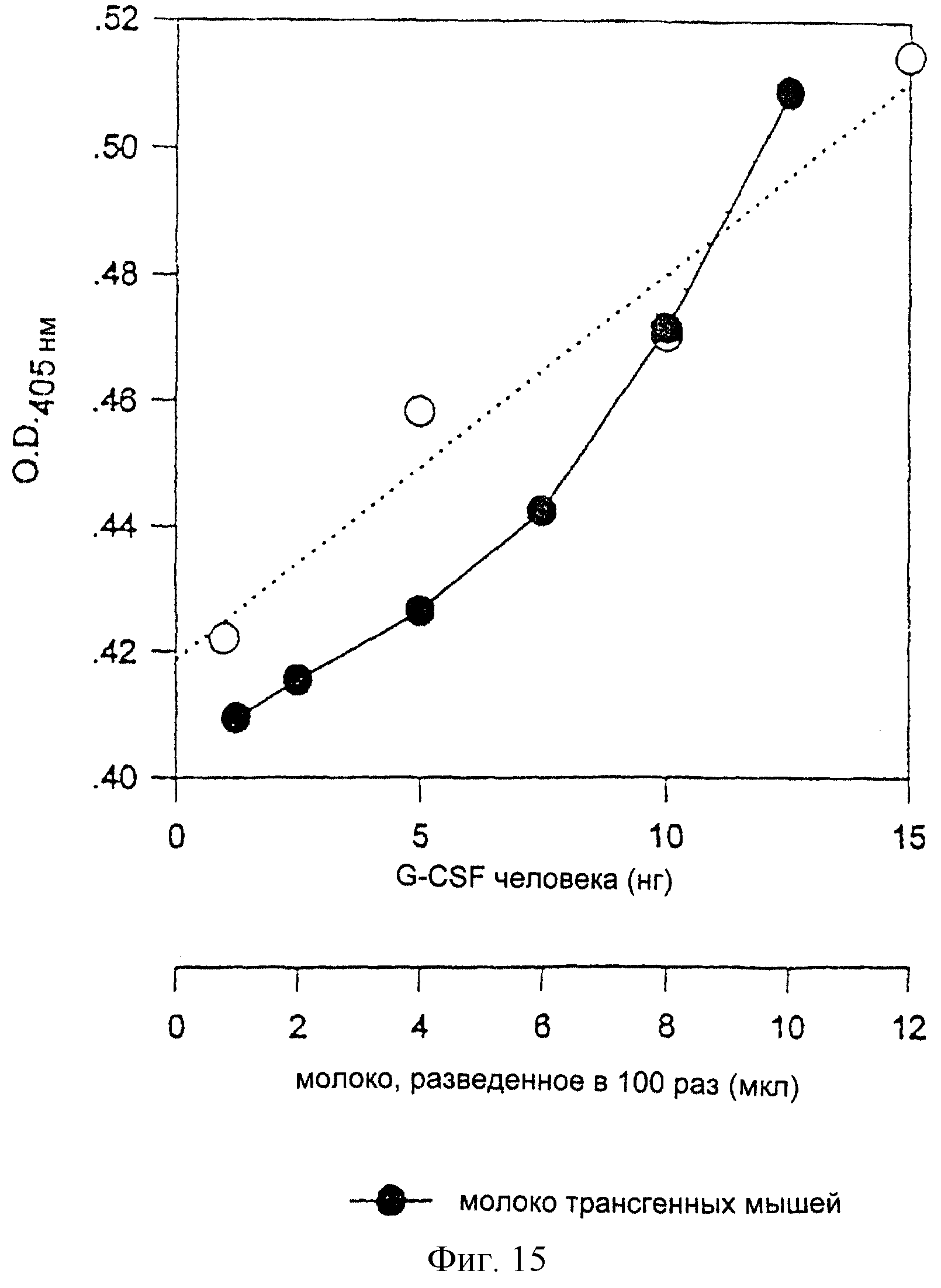
На фиг. 15 представлен количественный анализ экспрессии гена hG-CSF в молоке, секретируемом трансгенными мышами, с помощью ELISA. Белки для ELISA получают из молока трансгенных мышей, в которых вводятся экспрессирующие векторы млекопитающих pGbc_S-hGCSF и pGbc_L-hGCSF.
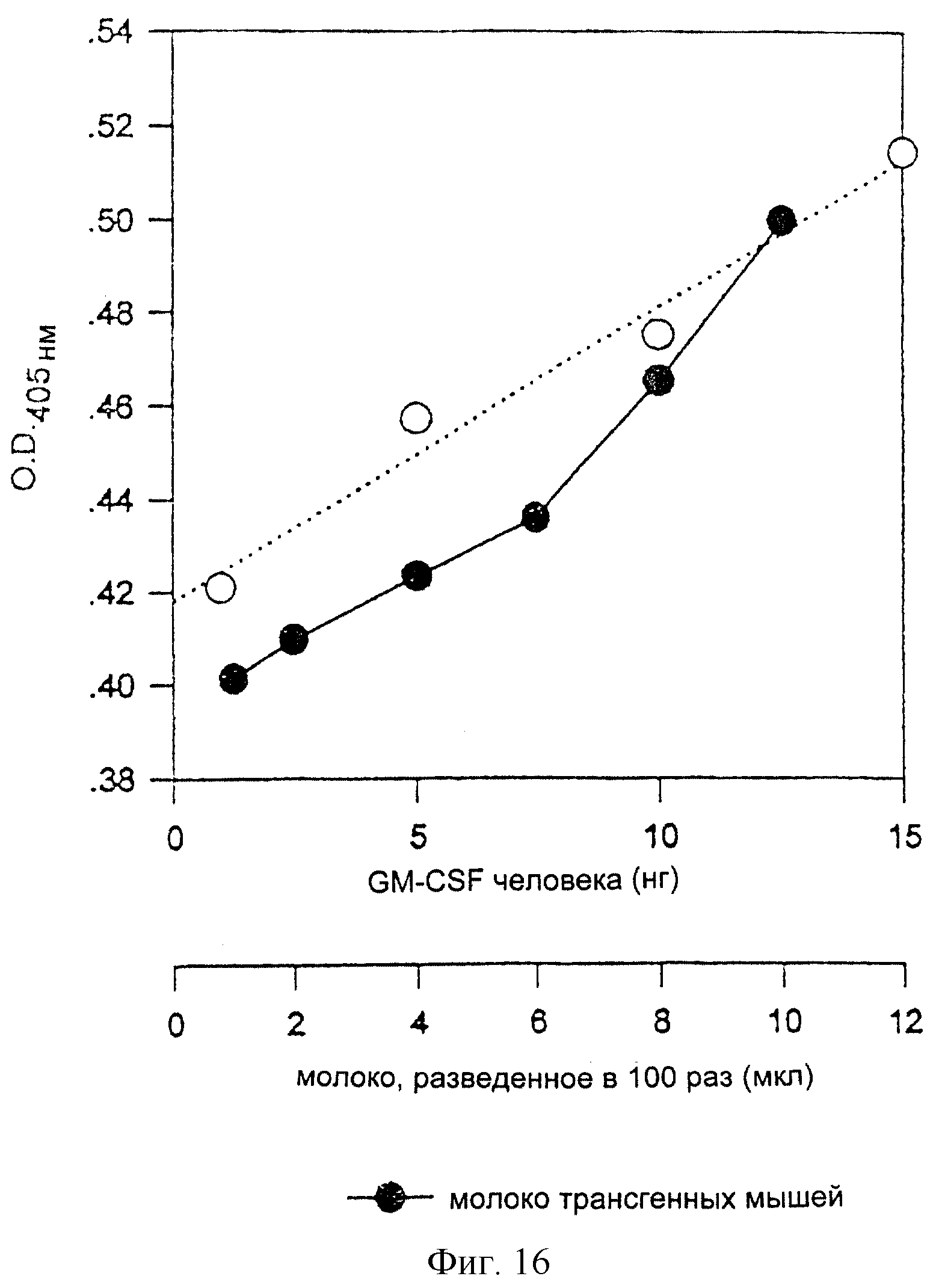
На фиг. 16 представлен количественный анализ экспрессии гена hG-CSF в молоке, секретируемом трансгенными мышами, в которых вводятся экспрессирующие векторы млекопитающих pGbc_S-hGMCSF и pGbc_L-hGMCSF.
Лучшее понимание данного изобретения может быть получено при рассмотрении следующих примеров, которые наглядно иллюстрируют, но не ограничивают данное изобретение.
ПРИМЕР I: Получение экспрессирующих векторов для клеток линии НС11 с использованием промоторного сайта гена β-казеина козла и терминаторного сайта гена бычьего гормона роста.
1) Получение вектора pGbc_S
Из вектора pBluescript II SK (Stratagene), в котором был клонирован
фрагмент ДНК, включающий промоторный сайт, экзон 1, интрон 1 и экзон 2 гена β-казеина козла, был получен участок ДНК, который охватывает расстояние от 501 нуклеотида до первого нуклеотида со
стороны 5'-конца от стартового кодона экзона 1, с помощью ПЦР с использованием праймеров CAS-F1 и CAS-F2, которые имели соответственно нуклеотидные последовательности 5'- TGA TCG CGA GTC САС CAG GCT
СТА CTG ТС-3' и 5'-GAG AAG СТТ ААТ GGA ТАА TGA TCT GA-3'. ПЦР состояла из 35 термических циклов, в которых нагревание выполнялось в следующем порядке: 94oС, 3 мин; 55oС, 1 мин и
72oС, 1 мин для первого цикла; 94oС, 1 мин; 55oС, 1 мин и 72oС, 1 мин для циклов 2-34, и 94oС, 1 мин; 55oС, 1 мин и 72oС, 5
мин для последнего цикла.
В экспрессирующий вектор млекопитающих pRc/RSV, который разрезался эндонуклеазами Nru I и Hind III с тем, чтобы открыть его и удалить в нем последовательность LTR, встраивали с помощью лигирования ПЦР-продукт, также полученный в результате двойной рестрикции теми же эндонуклеазами. В результате была получена новая плазмида pGbc_S, как вкратце показано на фиг.3.
2) Конструирование вектора pGbc_L
Описанный выше в 1) процессированный продукт ПЦР обрабатывали рестриктазой Dra I. Полученный таким образом фрагмент ДНК с концами,
разрезанными рестриктазами Dra I и Hind III, выделяли электроэлюцией. Отдельно, из вектора pBluescript II SK (Stratagene), в котором был клонирован фрагмент ДНК, включающий промоторный сайт, экзон 1,
интрон 1 и экзон 2 гена β-казеина козла, получали фрагмент ДНК с концами, разрезанными рестриктазами Stu I / Dra I, который включал промоторный сайт и неполный экзон 1, расширенный на один
нуклеотид в 3'-5' - направлении от стартового кодона, с помощью ферментативного переваривания и разделения в агарозном геле. Два фрагмента ДНК встраивались одновременно в вектор pRC/RSV, который
открывался двойной рестрикцией рестриктазами Nru I и Hind III, для получения новой плазмиды pGbc_L. Получение вкратце показано на фиг.4.
3) Идентификация конструкций pGbc_S и pGbc_L
Успешное конструирование плазмид pGbc_S и pGbc_L подтверждалось анализом нуклеотидной последовательности. Анализ нуклеотидной последовательности проводился с использованием набора Sequenase Ver
2.0, поставляемого фирмой Amersham (США), в соответствии с рекомендациями производителя. Для секвенирования были сконструированы два праймера, имеющие соответственно нуклеотидные последовательности
5'-AGG CAA GGC TTG АСС GAC-3' и 5'- GGA GGG GCA AAC AAC AGA TG-3'.
ПРИМЕР II: Рекомбинация между геном hGCSF и экспрессирующим вектором млекопитающих для клеток НС11
Ген hGCSF
встраивался в каждый из векторов pGbc_S и pGbc_L в соответствии с рекомбинационной стратегией, изображенной на фиг.5 и 7. При рекомбинации экзон 1 гена β-казеина непосредственно соединялся с
экзоном 1 гена hG-CSF, несмотря на то, что стартовый кодон для трансляции экзона 1 гена hG-CSF сохранялся.
Более детально, сначала вектор pUC 19, в котором был клонирован ген hG-CSF, разрезался рестрикционными ферментами ВаmН I и Хbа I и подвергался электрофорезу в агарозном геле с тем, чтобы отделить друг от друга два получившихся фрагмента ДНК. Эти два фрагмента ДНК, состоящие из Фрагмента 1 и другого фрагмента, очищались с помощью набора Geneclean II, поставляемого фирмой BIO101. Предполагали, что Фрагмент 1 состоит из экзона 2 с поли(А)-сигнальной последовательностью. Другой фрагмент, включающий в себя вектор и экзон 1, разрезался рестриктазой Pst I и затем уже меньшие фрагменты отделялись друг от друга в агарозном геле. Очистка с использованием набора Geneclean II, поставляемого фирмой BIO101, позволяла получить Фрагмент 2, который заключал в себе один нуклеотид с 5'-конца от стартового кодона для трансляции вплоть до первого нуклеотида с 5'-конца экзона 2. Фрагмент 1 и Фрагмент 2 вместе встраивали в плазмиду pBluescript II SK путем лигирования, с тем, чтобы получить новую рекомбинантную плазмиду pBluescript II SK-hGCSF. Эта плазмида дважды разрезалась рестриктазами Hind III и Хbа I, чтобы получить модифицированный фрагмент гена hG-CSF, который затем встраивался в вектор pGbc_ S, предварительно открытый рестрикцией ферментами Hind III и Хbа I. В результате была получена новая рекомбинантная плазмида pGbc S_hGCSF.
Отдельно, вектор pGbc_L открывался путем рестрикции ферментами Hind III и Хbа I. После обработки щелочной фосфатазой и электрофореза в агарозном геле открытый вектор pGbc очищали, используя набор Geneclean II. Фрагмент ДНК, полученный с помощью эндонуклеазной рестрикции промотора гена β-казеина козла, и модифицированный фрагмент гена hGCSF, полученный путем двойной рестрикции плазмиды pBluescript II SK-hGCSF рестриктазами Hind III и Хbа I лигируются вместе в открытый вектор для того, чтобы получить новую рекомбинантную плазмиду pGbc_L-hGCSF.
Успешное конструирование новых рекомбинантных плазмид pGbc_S-hGCSF и pGbc_L-hGCSF подтверждалось анализом нуклеотидной последовательности. Анализ нуклеотидной последовательности проводился с использованием набора Sequenase Ver 2.0, поставляемого фирмой Amersham (США) в соответствии с рекомендациями производителя. Для секвенирования были сконструированы три праймера VI, V2 и Р1, имеющих соответственно нуклеотидную последовательность 5'-AGG CAA GGC TTG ACC GAC-3', 5'-GGA GGG GCA AAC AAC AGA TG-3' и 5'-САС TAT TGG ТТТ ТАТ ТТС-3'.
ПРИМЕР III: Рекомбинация между геном hGMCSF и экспрессирующими векторами млекопитающих pGbc_S и pGbc_L для клеток НС11
Рекомбинация проводилась в соответствии
со стратегией, изображенной на фиг.6 и 8.
Сначала ген hGMCSF, который был клонирован в векторе pUC19, вырезали с помощью рестриктаз ВаmН I и EcoR I и очищали с помощью набора Geneclean II (BIO101) из агарозного геля, в котором рестрицированные фрагменты ДНК подвергались электрофорезу. Затем, ген hGMCSF встраивался путем лигирования в вектор Bluescript II SK (Stratagene), который разрезался теми же эндонуклеазами и обрабатывался бычьей щелочной фосфатазой, в результате получали рекомбинантную плазмиду pBluescript II SK-hGMCSF. Модифицированный ген получали обратно из рекомбинантной плазмиды с помощью рестрикции рестриктазами Hind III и Xba I, электрофореза в агарозном геле и очистки с помощью набора Geneclean II (BIO101) и затем лигировали в вектор pGbc_S, который предварительно обрабатывали теми же эндонуклеазами и бычьей щелочной фосфатазой, в результате получали новую плазмиду pGbc_S-hGMCSF.
Подобным же образом конструировали новую плазмиду pGbc_L-hGMCSF, лигируя фрагмент ДНК, полученный путем эндонуклеазной рестрикции промотора β-казеина козла, и модифицированный фрагмент гена hGMCSF, полученный путем двойной рестрикции плазмиды pBluescript II SK-hGMCSF рестриктазами Hind III и Xba I, в открытый вектор pGbc_ L, который был получен в результате обработки рестриктазами Hind III и Xba I и дальнейшей обработки бычьей щелочной фосфатазой и очистки из агарозного геля, в котором проводили электрофорез.
Успешное конструирование экспрессирующих векторов подтверждается анализом нуклеотидной последовательности с использованием праймеров V1, V2 и Р1.
ПРИМЕР IV: Конструирование вектора для трансфекции
Экспрессирующие векторы млекопитающих для трансфекции с той же структурой гена, что и
на фиг.1, были сконструированы в соответствии со стратегией рекомбинации, показанной на фиг.9. Они могли быть получены встраиванием промоторного сайта гена β-казеина козла, гена физиологически
активного вещества и терминаторного участка гена бычьего гормона роста в вектор Bluescript II SK (Stratagene).
Более детально, фрагмент ДНК из гена β-казеина козла или его фрагмента, включающий промоторный сайт и участок экзона 1, удлиненный на 1 нуклеотид в 3'-5'-направлении от стартового кодона для трансляции, получали путем рестрикции рестриктазами Sac I и Hind III. После очистки, включающей этапы экстракции в растворе фенол: хлороформ = 1:1, преципитации 95% этанолом и растворения в дистиллированной воде, фрагмент ДНК далее разрезали рестриктазой Dra I. Электрофорез в агарозном геле и очистка с использованием набора Geneclean II (BIO101) давали Фрагмент 1, который заключал в себе участок экзона 1.
Отдельно, участок ДНК, который охватывал расстояние от 501 нуклеотида до первого нуклеотида со стороны 5'-конца от стартового кодона для трансляции экзона 1 гена β-казеина, получали с помощью ПЦР с использованием праймеров CAS-F1 и CAS-R1, затем разрезали рестриктазами Dra I и Hind III. Фрагмент 2, который состоял из экзона 1, получали электроэлюцией.
Фрагменты 1 и 2 встраивали путем лигирования в вектор Bluescript II SK (Stratagene), который предварительно уже был обработан рестриктазами Sac I и Hind III, а затем бычьей щелочной фосфатазой. Полученная таким образом рекомбинантная плазмида открывалась путем двойной рестрикции рестриктазами Hind III и EcoR I. В этот открытый клонированный сайт встраивали фрагмент ДНК, в котором ген физиологически активного вещества соединялся с терминаторным участком гена бычьего гормона роста.
Успешность вышеописанной процедуры рекомбинации подтверждалась анализом нуклеотидной последовательности с использованием праймера Р1.
ПРИМЕР V: Экспрессия гена hGMCSF в клетках линии НС11, происходящей из ткани молочной железы мыши
Плазмиды pGbc_S и pGbc_L, полученные соответственно в результате рекомбинации между
плазмидой pGbc_S и геном hGMCSF и между плазмидой pGbc_L и геном hGMCSF, как описано в Примере III, перед введением в клетки НС11 очищали с помощью системы QIAGEN-tip 100 (Qiagen).
Клетки E.coli после того, как в них вводилась любая из плазмид, помещали в 150 мл среды LB, содержащей 100 мкг/мл ампициллина, и инкубировали при 37oС в течение 10 часов при перемешивании. Клетки осаждали путем центрифугирования и плазмиды выделяли из клеток в соответствии с рекомендациями фирмы Qiagen.
Трансфекцию очищенных плазмид в клетки НС11 осуществляли с помощью электропоратора, поставляемого фирмой Invitrogen. Клетки НС11 выращивали во флаконах Т25 для культур тканей в CO2-инкубаторе (5% СО2) при 37oС до тех пор, пока они не покрывали 80% площади дна флаконов. Затем их открепляли раствором трипсина (Gibco BRL) и суспендировали в буфере PBS. Эту клеточную суспензию центрифугировали при 1500 об/мин и полученные клетки промывали еще раз охлажденным буфером PBS. Небольшой объем клеточной суспензии брали для подсчета количества клеток, а оставшиеся клетки осаждали центрифугированием при 1500 об/мин. Полученный осадок клеток разводили буфером PBS до конечной концентрации 3•106-1•107 клеток/500 мкл.
20 мкг очищенной плазмиды и 500 мкл клеточной суспензии вносили в 0,4 см кювету, которую затем помещали на лед на 10 мин. После установки одного из значений 71, 250, 500 и 1000 мкF, электропоратор контролировали по напряжению и сопротивлению. Электропоратор заряжали в течение 3 мин для того, чтобы воздействовать зарядом на кювету, помещенную в камеру электропоратора. Затем кювету помещали на лед на 10 мин, после чего в суспензию клеток добавляли 1 мл ростовой среды и переносили во флакон Т25 с 4 мл ростовой среды. После культивирования в течение 24-48 часов в СO2-инкубаторе при 37oС клетки помещали в свежую среду RPMI 1640 (Gibco BRL) с 10% эмбриональной телячьей сыворотки, 10 мкг/мл эпидермального ростового фактора, 5 мкг/мл инсулина, 50 мкг/мл гентамицина и 200 мкг/мл генетицина (Sigma) для селекции трансфицированных клеток. Селективную среду меняли на свежую на второй или третий день. После 7 дней культивирования в селективной среде выживали только клетки, в которых были встроены плазмиды. Эти трансфицированные клетки продолжали наращивать до определенной плотности.
После селекции селективную среду меняли на индуктивную среду, состоящую из среды RPMI 1640 (Gibco BRL) с добавлением 5 мкг/мл инсулина, 200 мкг/мл генетицина (Sigma), 50 мкг/мл гентамицина, 5 мкг/мл козьего пролактина и 1 мкМ дексаметазона. Клетки культивировали в СO2-инкубаторе (5% CO2) при 37oС в течение 4 дней без смены среды.
Белок hGMCSF, продуцирующийся в результате индукции экспрессии гена, секретировался в среду. Для качественного анализа секретируемых продуктов использовался метод Вестерн-блоттинга, тогда как для количественного анализа - твердофазный иммуноферментный анализ (ELISA). В качестве первичных антител для анализа экспрессии фактора, стимулирующего образование гранулоцитарно-макрофагальных колоний, для Вестерн-блоттинга использовались мышиные IgG против GM-CSF человека. В качестве вторых антител для Вестерн-блоттинга использовались анти-мышиные IgG, конъюгированные с пероксидазой хрена. При проведении ELISA на 96-луночную плату сначала наносили козьи поликлональные IgG антитела против GM-CSF человека, которые затем обрабатывали продуктом экспрессии в качестве соответствующего антигена либо коммерческим фактором, использующимся в качестве стандарта. Последние связывались с теми же моноклональными антителами к GM-CSF человека, которые использовались для Вестерн-блоттинга. Конечный комплекс антител обрабатывали анти-мышиными моноклональными IgG антителами, конъюгированными с щелочной фосфатазой для индукции цветной реакции (Ed Harlow and Davis Lane (1989) Antibodies A Laboratory Manual, Cold Spring harbor Laboratory Press, New York).
Результаты, полученные из анализов с помощью Вестерн-блоттинга и ELISA, представлены на фиг. 10 и 11 и показывают, что оба новых рекомбинантных вектора pGbc_S и pGbc_L индуцируют экспрессию белка в количестве 40 нг/мл.
ПРИМЕР VI: Экспрессия гена hGCSF в
клетках НС11
Плазмиды pGbc_S-hGCSF и pGbc_L-hGCSF, полученные соответственно в результате рекомбинации между плазмидой pGbc_S и геном hGCSF и между плазмидой pGbc_L и геном hGCSF, перед тем,
как вводить их в клетки НС11, очищали с помощью системы QIAGEN-tip 100 (Qiagen) таким же образом, как описано в Примере V. Введение осуществляли с помощью метода кальций-фосфатного соосаждения или
метода электропорации. После трансфекции и культивирования в селективной среде, имеющей тот же состав, что в Примере V, оставались только генетицин-устойчивые колонии. Эти колонии переносили во
флаконы Т75 и наращивали до достижения определенной плотности. Клетки помещали в свежую индуктивную среду, содержащую гормоны лактации пролактин и дексаметазон, и культивировали в течение 4 дней,
после чего среда отделялась от клеток с помощью центрифугирования. Супернатант использовали для Вестерн-блоттинга и ELISA. Полученные результаты, представленные на фиг.12, показывают, что оба новых
рекомбинантных вектора pGbc_S и pGbc_L индуцируют экспрессию белка в количестве 40 нг/мл.
ПРИМЕР VII: Экспрессия гена hGCSF в трансгенных мышах
Новый рекомбинантный вектор
pGbc-hGCSF, полученный в результате рекомбинации между вектором pGbc и геном hGMCSF, очищали с помощью QIAGEN tip 100 и разрезали рестриктазами BssH I и Крn I, после чего выделяли из агарозного геля с
помощью набора Geneclean II (BIO101). Для микроинъекций выделенные векторы далее очищали в соответствии с рекомендациями фирмы Schleicher& Schuell и диализовали в растворе, состоящем из 10 мМ
Tris-HCl (pH 7,2) и 10 мМ ЭДТА, чтобы получить раствор ДНК с концентрацией 40 нг/мл.
В мужской пронуклеус оплодотворенной яйцеклетки мыши линии СВА вводили путем микроинъекции окончательно очищенный экспрессирующий вектор. Эту оплодотворенную яйцеклетку имплантировали в матку "приемной" матери. Из хвостов потомков этой "приемной" матери выделяли геномную ДНК. Трансгенных мышей определяли с помощью ПЦР, как показано на фиг.13, и подтверждали с помощью блоттинга по Саузерну.
Потомство мышей, которые, как было определено, имеют гены, встроенные в их геномную ДНК, спаривали с нетрансгенными, нормальными мышами для получения следующего поколения потомков. Спустя 10 дней после родов, трансгенные родившие мыши отделялись от их потомства на 3 часа. После перитонеальной инъекции окситоцина вместе с анестетиком у родивших мышей выделялось молоко.
Уровень экспрессии генов был проанализирован тем же способом, что и в случае с клетками, с использованием методов Вестерн-блоттинга и ELISA соответственно для качественного и количественного анализов. В этих анализах применяли те же антитела, которые использовали в Примере V. Результаты представлены на фиг.14 и 15. Из результатов Вестерн-блоттинга становится очевидным, что белок от трансгенных мышей идентичен коммерческому белку hGCSF (Gibco BRL) и экспрессируется в ткани молочной железы трансгенных мышей, как показано на фиг. 14. Результаты ELISA показывают, что белок hGCSF экспрессируется в количестве 150 нг/мл, как показано на фиг.15.
ПРИМЕР VIII:
Экспрессия гена hGMCSF в трансгенных мышах
Новый рекомбинантный вектор pGbc-hGMCSF, полученный в результате рекомбинации между вектором pGbc и геном hGMCSF, очищали с помощью системы QIAGEN
tip 100 и разрезали рестриктазами BssH I и Крn I, с последующей экстракцией из агарозного геля с помощью набора Geneclean II (BIO101). Для микроинъекций экстрагированные векторы далее очищали в
соответствии с методикой, рекомендуемой фирмой Schleicher& Schuell, и затем диализовали в растворе, состоящем из 10 мМ Tris-HCl (pH 7.2) и 10 мМ ЭДТА, для того, чтобы получить раствор ДНК с
концентрацией 40 нг/мл.
Окончательно очищенный экспрессирующий вектор вводили путем микроинъекции в мужской пронуклеус оплодотворенной яйцеклетки мыши линии СВА. Далее эту оплодотворенную яйцеклетку имплантировали в матку "приемной" матери. Из хвостов потомков этой "приемной" матери выделяли геномную ДНК.
Трансгенных мышей определяли с помощью ПЦР с последующим подтверждением с помощью блоттинга по Саузерну.
У трансгенных мышей брали молоко и анализировали его с помощью методов Вестерн-блоттинга и ELISA. Результаты Вестерн-блоттинга, где в качестве положительного контроля использовался коммерческий фактор hGMCSF (BIO101), показывают, что белок от трансгенных мышей является белком hGMCSF и что он экспрессируется в ткани молочной железы этих мышей. Результаты ELISA показывают, что белок hGMCSF от трансгенных мышей экспрессируется в количестве 130 нг/мкл, как показано на фиг.16.
Промышленное
применение
Как описано выше, системы экспрессии, специфичные для ткани молочной железы и использующие промоторный сайт гена β-казеина корейских местных козлов, согласно данному
изобретению дают возможность получать физиологически активные вещества in vivo, то есть в клетках, происходящих из ткани молочной железы, а также в трансгенных животных. Поскольку получаемые таким
образом белки подвергаются пост-трансляционным модификациям, то они могут сохранять свою нормальную активность в организме человека. Кроме того, системы экспрессии согласно данному изобретению дают
возможность легко получать белки в большом количестве. Когда белки продуцируются на клеточном уровне, то в качестве индуктора экспрессии используется гормон, вызывающий лактацию. В случае трансгенных
животных белки можно легко получить из секретируемого ими молока. Таким образом, производство белков может быть доведено до промышленного уровня. Кроме того, системы экспрессии, специфичные для ткани
молочной железы, согласно данному изобретению имеют значительные преимущества при выделении и очистке желаемого белка, такие как легкость проведения процедур и безопасность получаемых белков.
Далее перечислены основные технические преимущества, которые даст система экспрессии, специфичная для ткани молочной железы, согласно данному изобретению.
Во-первых, поскольку белки-мишени, которые продуцируются в системах экспрессии, специфичных для ткани молочной железы, использующих промоторный сайт гена β-казеина корейских местных козлов, претерпевают те же пост-трансляционные модификации, что и соответствующие им нативные белки, то эти белки-мишени могут сохранять свою активность в организме человека. Преодолевая ограничения общепринятых систем экспрессии, использующих в качестве хозяйских клетки E.coli, системы экспрессии из данного изобретения в равной степени могут применяться для получения любых видов физиологически активных веществ.
Во-вторых, промотор гена β-казеина козла, используемый в данном изобретении, дает возможность сопровождающему его структурному гену экспрессироваться в больших количествах при соответствующей индукции, что приводит к значительному снижению стоимости получения соответствующих белков. Хорошо известно, что экспрессия гена β-казеина козла в значительной степени может быть индуцирована гормонами из ткани молочной железы, то есть гормонами, вызывающими лактацию. Клетки, происходящие из ткани молочной железы, в которые вводили экспрессионные системы, использующие промотор гена β-казеина козла, могут продуцировать желаемые белки в количестве 40 нг/мл при обработке следовым количеством индуктора, гормона, вызывающего лактацию, тогда как трансгенные животные с этими системами экспрессии могут продуцировать желаемые белки в количестве 130-150 нг/мкл под действием их собственных гормонов. Как нам известно, более значительные количества этих продуктов можно получать, если изменить длину промоторного сайта гена β-казеина козла и условия экспрессии. Следовательно, данное изобретение предлагает новый метод гиперпродукции белков.
В-третьих, увеличение гипер-продукции белков-мишеней может быть легко достигнуто благодаря системам экспрессии, специфичным для ткани молочной железы, без существенных затрат. Поскольку белки-мишени секретируются в молоко, то увеличение количества получаемых белков может быть достигнуто путем простого увеличения количества трансгенных животных. Это может сохранить низкую себестоимость продукции белков при переходе от лабораторного уровня на уровень промышленного производства. То есть стоимость производства физиологически активных веществ может быть значительно снижена благодаря использованию заявленных в данном изобретении систем эекспрессии, специфичных для ткани молочной железы.
В-четвертых, данное изобретение базируется на простоте и безвредности белков, секретируемых молочной железой. Существует всего несколько белков, которые экспрессируются в ткани молочной железы, поэтому каждый белок может быть выделен с помощью обычных методов. Кроме того, в молоке отсутствуют вредные белки.
Данное изобретение было описано в иллюстративной форме и это должно служить лучшему пониманию используемой терминологии и является более предпочтительным, чем ограниченное описание. Методики, описанные в данном изобретении, могут иметь много модификаций и вариаций. Например, другие физиологически активные вещества могут быть экспрессированы благодаря системам экспрессии, описанным в данном изобретении, при незначительной помощи хорошо известных методов рекомбинации ДНК. Поэтому данное изобретение не ограничивается только экспрессией hG-CSF или hGM-CSF, которая детально описана здесь. Очевидно, что в пределах заявленной формулы изобретения данное изобретение может применяться иначе, чем конкретно описано.
Реферат
Изобретение относится к биотехнологии и может быть использовано для получения физиологически активных веществ. Рекомбинантный вектор pGbc (КСТС 8790Р), содержащий промоторный сайт и часть экзона 1 гена β-казеина корейских местных козлов, конструируют на основе pBluescript II SК. Рекомбинантный вектор pGbc_L (КСТС 8791Р) и pGbc_S (КСТС 8792Р), содержащие промоторный сайт и часть экзона 1 гена β-казеина корейских местных козлов, конструируют на основе pRc/RSV. В сконструированный вектор клонируют структурный ген, кодирующий физиологически активное вещество. Физиологически активное вещество получают путем культивирования клеток млекопитающих, трансфицированных вектором, сконструированным на основе pGbc_L или pGbc_S, и путем создания трансгенного животного с помощью вектора, полученного на основе pGbc. Изобретение позволяет получать физиологически активные вещества в системе экспрессии млекопитающих. 5 с. и 4 з.п. ф-лы, 16 ил.

Комментарии