Электролитический способ получения аммиака - RU2686465C2
Код документа: RU2686465C2
Чертежи









Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области химической технологии, и более конкретно оно относится к получению аммиака электролитическими способами и к новым катализаторам для этих способов.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Аммиак - это одно из химических веществ, которые в наибольших количествах производятся по всему миру. Промышленный синтез аммиака, в настоящее время общеизвестный под названием способа Хабера-Боша, является первой гетерогенной каталитической системой и ключевым элементом мирового промышленного производства азотных удобрений. В настоящее время аммиак также привлекает внимание как возможный энергоноситель и потенциальное транспортное топливо с высокой удельной энергоемкостью, но не выделяющее CO2. Централизованный и энергоемкий способ Хабера-Боша требует высокого давления (от 150 атм до 350 атм) и высокой температуры (от 350°С до 550°С) для прямой диссоциации и соединения молекул азота и газообразного водорода над катализатором на основе рутения или железа с образованием аммиака в ходе следующей реакции:

Недостатками этого промышленного способа являются высокая температура и высокое давление, которые необходимы по кинетическим и термодинамическим причинам. Другим и более серьезным недостатком является то, что газообразный водород получают из природного газа. Этот многостадийный способ занимает большую часть химического завода и является наиболее дорогостоящим и невыгодным для окружающей среды. Это основная причина, по которой необходим экологически устойчивый способ, так как запасы природного газа когда-нибудь будут исчерпаны. Поэтому большое значение могла бы иметь маломасштабная система для децентрализованного производства аммиака, в которой использовалось бы меньше энергии и природных ресурсов. Кроме того, для оптимизации эффективности синтеза аммиака очень желательными были бы новые катализаторы, способные гидрогенизировать молекулярный азот с разумной скоростью, но при менее жестких условиях.
Тройная связь в молекулярном азоте N2 является очень прочной, и вследствие этого азот является крайне неактивным, и его часто используют в качестве инертного газа. Эта связь разрушается в жестких условиях в способе Хабера-Боша, однако она разрушается и в условиях окружающей среды в ходе естественного процесса разложения микроорганизмами с участием фермента нитрогеназы. Активным центром нитрогеназы является кластер MoFe7S9N, который катализирует образование аммиака из сольватированных протонов, электронов и атмосферного азота в электрохимической реакции

Благодаря своей природе, биологическое связывание азота привлекало большое внимание в качестве подхода, альтернативного способу Хабера-Боша, для синтеза аммиака в условиях окружающей среды. Было затрачено много сил на проведение исследований, в которых пытались разработать сходные электрохимические способы. Хотя эти исследования обеспечили понимание процесса образования аммиака, его кинетика все еще остается слишком медленной для практического применения, и в большинстве случаев преимущественно образуется газообразный водород, причем эта реакция идет гораздо легче, чем протонирование азота. Оказалось, что восстановление молекулярного азота протонами и электронами с избирательным образованием аммиака при комнатной температуре и атмосферном давлении является гораздо более трудной задачей, чем ожидалось.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Автор настоящего изобретения неожиданно обнаружил, что некоторые катализаторы на основе нитридов металлов можно использовать в электрохимических способах получения аммиака. Это привело к созданию настоящего изобретения, которое дает возможность получения аммиака при комнатной температуре окружающей среды и атмосферном давлении.
В первом аспекте настоящее изобретение предусматривает способ получения аммиака, который включает подачу газообразного азота в электролитическую ячейку, где он вступает в контакт с поверхностью катодного электрода, причем эта поверхность содержит каталитическую поверхность, содержащую нитридный катализатор, электролитическая ячейка содержит донор протонов, и через электролитическую ячейку протекает электрический ток, за счет чего азот реагирует с протонами с образованием аммиака. Следующий аспект настоящего изобретения предусматривает систему для получения аммиака, включающую электрохимическую ячейку с поверхностью катодного электрода, содержащей каталитическую поверхность, которая загружена катализатором, содержащим один или более нитридов, выбранных из группы, состоящей из нитрида скандия, нитрида титана, нитрида ванадия, нитрида хрома, нитрида марганца, нитрида меди, нитрида иттрия, нитрида циркония, нитрида ниобия, нитрида молибдена, нитрида серебра, нитрида гафния, нитрида тантала, нитрида золота, нитрида железа, нитрида кобальта, нитрида никеля, нитрида рутения, нитрида родия, нитрида палладия, нитрида осмия и нитрида иридия.
Настоящее изобретение также относится к способам и системам, которые включают способы и системы для получения аммиака по настоящему изобретению. Соответственно, в другом аспекте настоящего изобретения предусмотрен способ удаления NOx и/или SOx газа из потока газа, который включает стадии (а) получения аммиака in situ способом по настоящему изобретению и (b) проведения реакции полученного таким образом аммиака с потоком газа, причем аммиак реагирует с NOx и/или SOx в потоке газа. Поток газа предпочтительно может быть выхлопным газом двигателя, например - выхлопным газом из автомобильного двигателя, например - дизельного двигателя.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Специалист в данной области техники поймет, что графические материалы, описанные ниже, предназначены исключительно для иллюстративных целей. Графические материалы никоим образом не ограничивают объем настоящего изобретения.
Фиг. 1: а) механизм Марса - Ван Кревелена образования аммиака на (100) гранях RS-структурированных нитридов металлов. Первый атом Н непосредственно и прочно связывается с поверхностным атом N, второй атом Н прочно связывается с тем же атомом N, точно так же связывается третий атом Н с образованием аммиака. b) Механизм реакции для некоторых (100) граней RS-структурированных нитридов металлов, таких как TiN, TaN, HfN и ScN, где на поверхности образуется однослойное Н-покрытие, которое в конечном итоге приводит к образованию Н2 вместо получения NH3.
Фиг. 2: Энергия активации вакансии N-атома в верхнем слое для ее перемещения во второй слой в зависимости от энергии реакции.
Фиг. 3: Схема свободной энергии (100) граней RS структуры VN. Скорость-определяющей стадией является присоединение первого Н к атому N в поверхностном слое с высотой потенциального барьера, равной 0,51 эВ. Нижний график отображает свободную энергию всех промежуточных продуктов, рассчитанную при нулевом потенциале. Верхняя кривая отображает свободную энергию всех промежуточных продуктов с учетом эффекта начального потенциала.
Фиг. 4: Начальные потенциалы для наиболее перспективных кандидатов для восстановления атмосферного азота до аммиака. Начальный потенциал или каталитическую активность (-ΔG) определяют как свободную энергию реакции скорость-определяющей стадии для любой из элементарных стадий общей реакции. Перспективные нитриды для образования аммиака помечены. Чем ближе значение -ΔG к нулю, тем более активен нитрид в отношении образования аммиака.
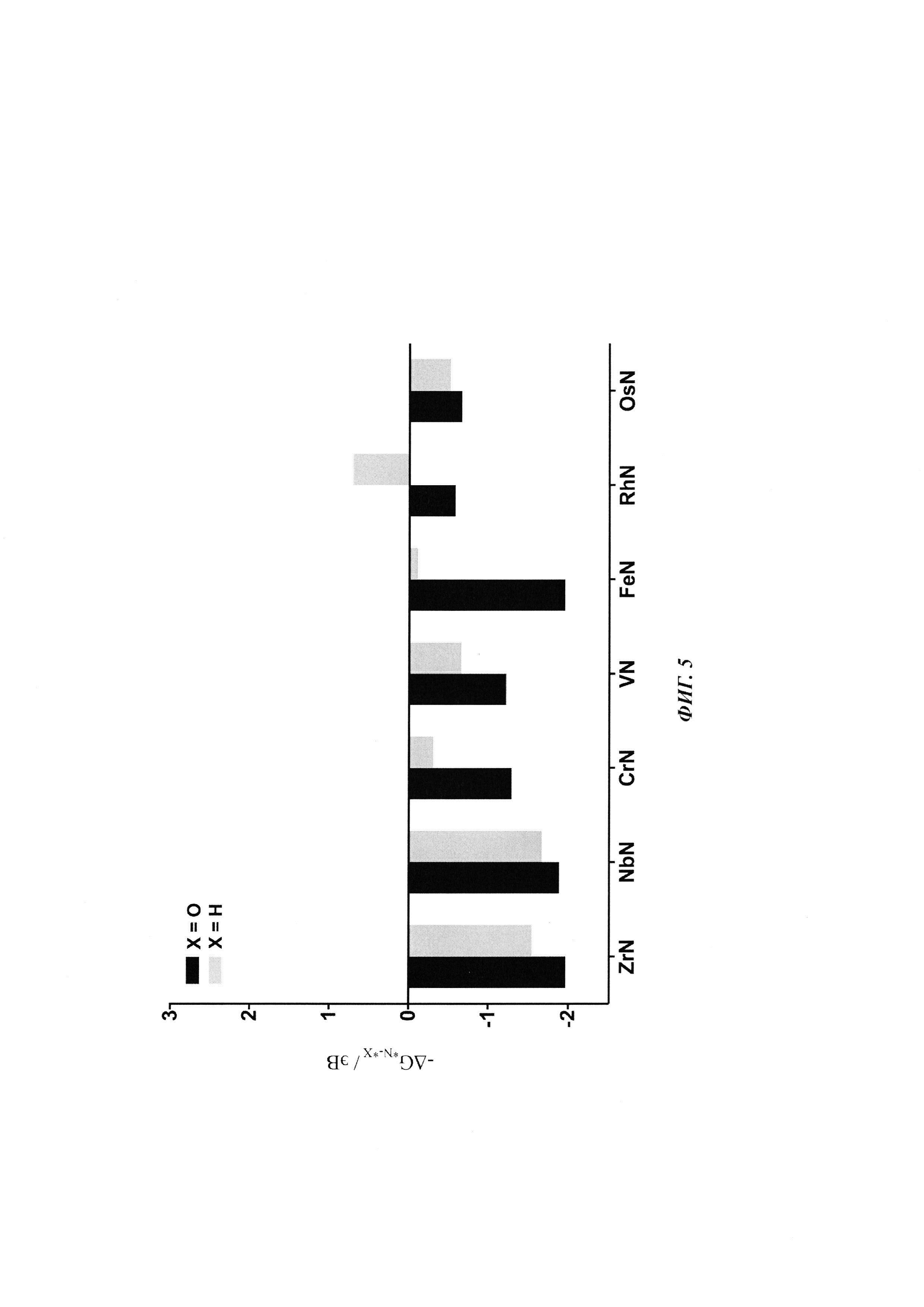
Фиг. 5: Разность свободной энергии адсорбции кислорода (в пересчете на H2O) и водорода (в пересчете на Н2) по сравнению с азотом (в пересчете на N2) к N-вакансии при начальных потенциалах, необходимых для восстановления N2 до NH3, для каждого из нитридов. Во всех случаях, кроме RhN, вакансия будет заполнена азотом, а не отравлена водородом или кислородом.
Фиг. 6: Изменение свободной энергии (ΔGRDS, в эВ) на скорость-определяющей стадии образования NH3 на катализаторах на основе нитридов переходных металлов. Рассмотрен имеющий ограничения механизм, в котором присоединение Н ограничено одним участком поверхности, и 6(Н+ + е-) используется для образования 2NH3. Горизонтальная пунктирная линия показывает линию отсечки при скрининге подходящего катализатора; все нитриды с ΔGRDS ≤ 1,5 эВ могут быть каталитически активными в отношении образования аммиака и обсуждаются в дальнейшем в данном исследовании. Надписи над каждым столбиком указывают молекулы, образующиеся на скорость-определяющей стадии.
Фиг. 7. График свободной энергии для образования NH3 по неограниченному механизму Марса - Ван Кревелена на (100) грани RS-структурированного ZrN (а) и (110) грани ZB-структурированного OsN (b). Для ZrN скорость-определяющей стадией является стадия второго протонирования с ΔG = 0,76 эВ. После заполнения N-вакансии один протон, который уже был адсорбирован на металлическом Zr (BZrH), мигрирует к N-адатому (адсорбированному атому азота) с образованием NH (ENH). Нижняя линия на (а) показывает свободную энергию всех стабильных промежуточных продуктов, рассчитанную при нулевом потенциале. Верхняя линия показывает свободную энергию всех стабильных промежуточных продуктов при начальном потенциале. Для OsN скорость-определяющей стадией (RDS; от англ.: rate-determining step) является заполнение N-вакансии с ΔG = 0,65 эВ. Поскольку RDS не включает переноса протона-электрона, не возникает смещения потенциала, и рельеф свободной энергии OsN изображен только при нулевом потенциале.
Фиг. 8. Изменение свободной энергии (ΔGRDS, в эВ) на скорость-определяющей стадии образования NH3 на катализаторах на основе нитридов переходных металлов. Рассмотрен неограниченный механизм, в котором на каждой стадии присоединения Н исследованы все возможные центры адсорбции, включая другие атомы N, атомы металла и центры образования мостиковых связей, и для образования 2NH3 необходимо по меньшей мере 6(Н+ + е-). Надписи над каждым столбиком указывают молекулы, образующиеся на скорость-определяющей стадии, смысл которых разъяснен на Фиг. 5. Надписи в каждом столбике показывают число протонов и электронов, необходимых для образования 2NH3.
Фиг. 9. Сравнение диаграмм свободной энергии для образования NH3 по механизму Марса - Ван Кревелена на различных гранях RS и ZB кристаллических структур VN при нулевом потенциале. Двунаправленные стрелки показывают потенциал-определяющую стадию на каждой грани. За исключением (100) граней RS-структуры VN, для которых энергетически выгодным является одновакантный подход, в случае других граней более доминантным является заполнение димерной вакансии.
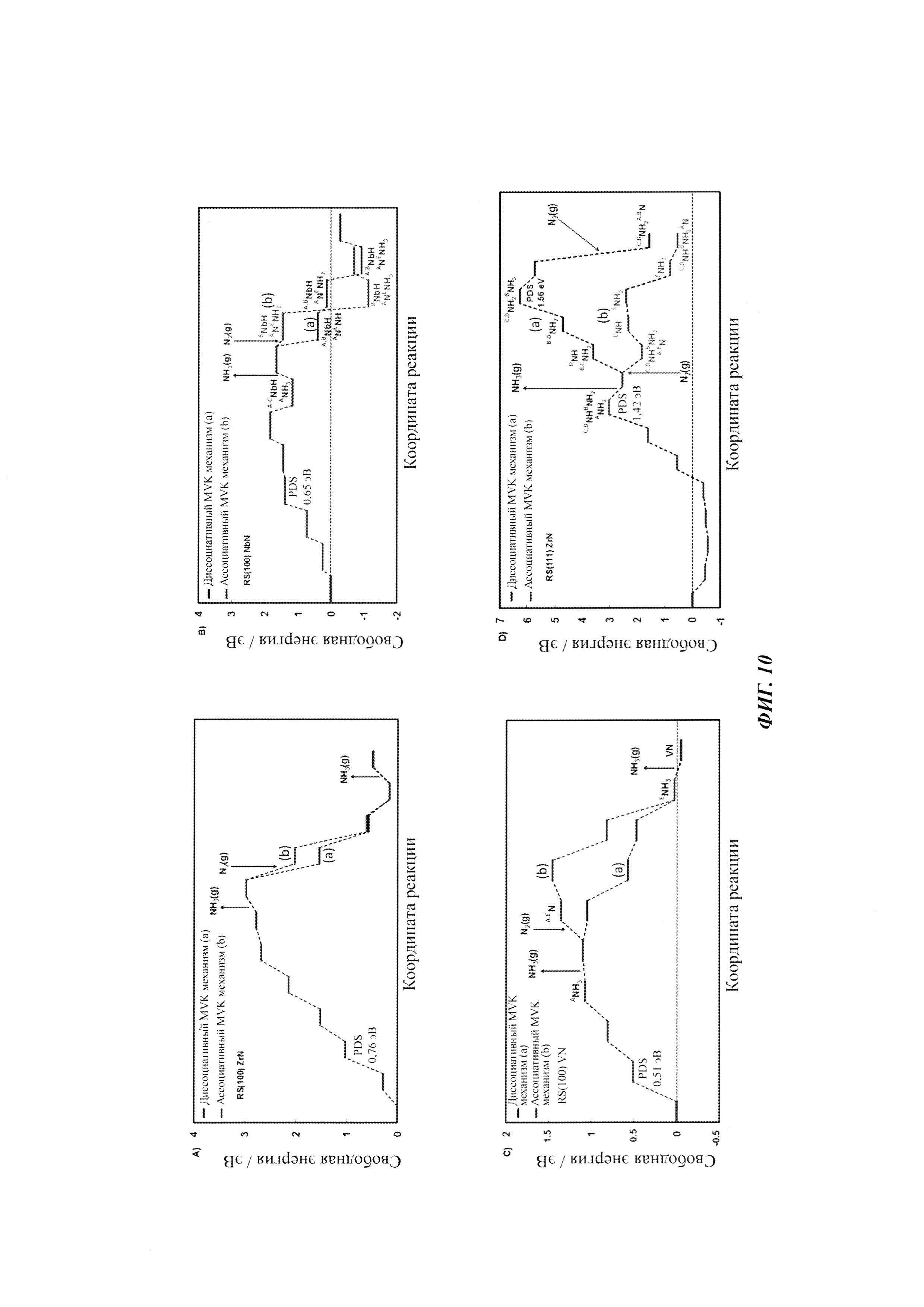
Фиг. 10. Диаграммы свободной энергии (100) граней RS-структуры ZrN (А), NbN (В), VN (С) и (111) ZrN (D) при нулевом потенциале, когда вакансия заполняется N2(g), либо ассоциативно, либо диссоциативно (одномерная или димерная вакансия). В случае NbN (В) эти два пути участвуют в образовании двух различных промежуточных продуктов. Поэтому молекулы, образующиеся на каждой и различных стадий, показаны по-разному. В случае RS(111) ZrN (D) ассоциативный MVK должен быть предпочтительным по сравнению с димерной вакансией, поскольку он требует немного менее отрицательного перенапряжения (0,14 В) для протекания реакции образования аммиака.
Фиг. 11. Разность энергий (ΔЕ = E2-E1) вакансии, заполненной азотом (Е2), и нитрида с N-вакансией на поверхности и N2 в вакууме (Е1) и соответствующий активационный барьер расщепления N2 (Еа). Нитриды, для которых диссоциативная одиночная вакансия более выгодна, показаны как «sv», а нитриды, для которых более доминантной является димерная вакансия, обозначены как «dv». Барьер диссоциации выше 0,70 эВ считается высоким барьером, который трудно преодолеть в условиях окружающей среды.
Фиг. 12. Сравнение изменения свободной энергии потенциал-определяющей стадии (PDS; от англ.: potential-determining step) образования NH3 на четырех различных гранях нитридов-кандидатов ZrN, VN, NbN и CrN. Рассмотрен механизм Марса - Ван Кревелена (MVK; от англ.: Mars-Van Krevelen), в котором на каждой стадии присоединения Н исследованы все возможные центры адсорбции, включая другие атомы N, атомы металла и центры образования мостиковых связей, и для образования 2NH3 необходимо по меньшей мере 6(Н+ + е-). Для каждой поверхности определен наиболее выгодный механизм реакции, либо ассоциативный (A-MVK), либо диссоциативный (D-MVK). Надписи над каждым столбиком указывают молекулы, образующиеся в PDS, смысл которых разъяснен выше под Фиг. 9. Надписи в каждом столбике указывают число протонов и электронов, необходимых для полного каталитического цикла образования 2NH3. (100) грани ZB-структуры ZrN и NbN не включены из-за их структурной нестабильности. *Т в случае ZB(110) ZrN обозначает мостиковое положение адсорбированного Н. *br в случае ZB(100) CrN обозначает мостиковое положение адсорбированного Н между 2Cr.
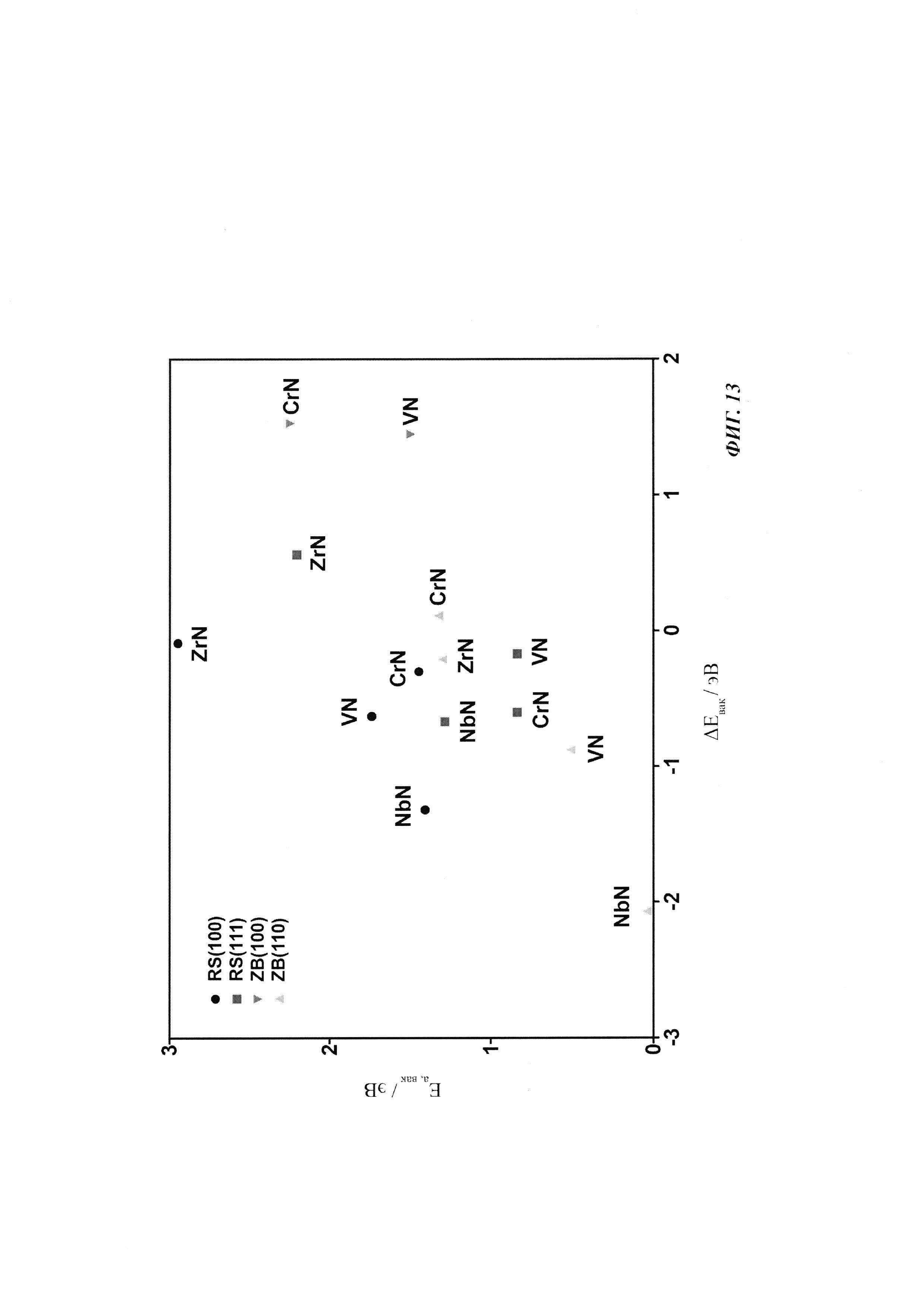
Фиг. 13. Разности энергий (ΔEvac) N-вакансии в поверхностном слое и первом подповерхностном слое нитрида и соответствующий активационный барьер миграции N-вакансии. Обнаружено, что (100) грани ZB-структуры ZrN и NbN являются нестабильными, и поэтому они не показаны на рисунке и исключены из дальнейшего исследования. Обнаружено, что ZB(110) ZrN и NbN нестабильны в отношении образования *N и *NH на поверхности.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее будут описаны примеры вариантов осуществления настоящего изобретения. Также приведены примеры некоторых вариантов осуществления настоящего изобретения со ссылками на графические материалы. Эти примеры приведены для обеспечения лучшего понимания настоящего изобретения без ограничения его объема.
В приведенном ниже описании описано несколько стадий. Специалист в данной области техники поймет, что, если иное не требуется согласно контексту, то последовательность стадий не является критичной для результирующей конфигурации и ее эффекта. Кроме того, специалисту в данной области техники будет очевидно, что, независимо от последовательности стадий, между некоторыми или всеми описанными стадиями может иметься или отсутствовать временная задержка.
Следует понимать, что изобретение применимо к системам и способам получения аммиака. Кроме того, система и способ по настоящему изобретению проиллюстрированы в приведенных ниже вариантах осуществления настоящего изобретения. Следует понимать, что изобретение может быть модифицировано и/или использовано в системах или в комбинации с системами, которые требуют использования и/или образования аммиака.
Настоящее изобретение основано на неожиданном открытии, состоящем в том, что на поверхности некоторых катализаторов на основе галоидных соединений металлов можно получать аммиак при температуре и давлении окружающей среды. Из-за важности аммиака, особенно для производства удобрений, и энергоемких и невыгодных для окружающей среды условий, которые обычно используют в процессе его производства, изобретение найдет важные применения в различных отраслях промышленности.
Соответственно, изобретение обеспечивает способы и системы для получения аммиака при температуре и давлении окружающей среды. В способе и системе по настоящему изобретению электролитическая ячейка может быть любой из спектра стандартных коммерчески доступных и подходящих конструкций электролитических ячеек, в которые может быть включен катод специального назначения по настоящему изобретению. Соответственно, в варианте осуществления настоящего изобретения ячейка и система могут включать одну или более катодных ячеек и одну или более анодных ячеек.
В контексте настоящего изобретения электролитическая ячейка является электрохимической ячейкой, в которой осуществляется окислительно-восстановительная реакция при подаче в ячейку электрической энергии.
Донором протонов может быть любое подходящее вещество, которое способно отдавать протоны в электролитическую ячейку. Донором протонов может быть, например, кислота, например - любая подходящая органическая или неорганическая кислота.
Электролитическая ячейка может содержать три части или три компонента - катодный электрод, анодный электрод и электролит. Различные части или компоненты могут находиться в раздельных резервуарах, или они могут находиться в одном резервуаре. Электролитом может быть водный раствор, в котором растворены ионы. Электролит также может быть расплавленной солью, например - хлоридом натрия.
В целом, катализатор на поверхности электрода в идеале должен иметь следующие характеристики: он должен быть (а) химически стабильным, он не должен (b) окисляться или иным образом расходоваться во время электролитического процесса, он должен (с) ускорять образование аммиака, и (d) использование катализатора должно приводить к образованию минимального количества газообразного водорода. Как будет описано далее, катализаторы на основе нитридов по настоящему изобретению соответствуют этим характеристикам.
Преимуществом настоящего изобретения является то, что способ можно удобно осуществлять с использованием водных электролитов, предпочтительно - водных растворов с растворенными электролитами (солями). Соответственно, в предпочтительных вариантах осуществления способа и системы электролитическая ячейка содержит один или более водных растворов электролитов в одном или более отсеках ячейки. Водные растворы электролитов могут содержать любые из различных характерных неорганических или органических солей, например, но не ограничиваясь этим, растворимые хлоридные, нитратные, хлоратные, бромидные соли и т.п., например - хлорид натрия, хлорид калия, хлорид кальция, хлорид аммония и другие. Водный раствор электролита может также дополнительно или альтернативно содержать одну или более органических или неорганических кислот. Неорганические кислоты могут включать минеральные кислоты, которые включают, но не ограничиваются этим, соляную кислоту, азотную кислоту, фосфорную кислоту, серную кислоту, борную кислоту, фтористоводородную кислоту, бромистоводородную кислоту и перхлорную кислоту.
Как очевидно из изложенного, важным признаком настоящего изобретения являются состав и структура катодного электрода. В некоторых вариантах осуществления настоящего изобретения нитридный катализатор на поверхности катодного электрода выбран из одного или более из следующего: нитрида скандия, нитрида титана, нитрида ванадия, нитрида хрома, нитрида марганца, нитрида меди, нитрида иттрия, нитрида циркония, нитрида ниобия, нитрида молибдена, нитрида серебра, нитрида гафния, нитрида тантала, нитрида золота, нитрида железа, нитрида кобальта, нитрида никеля, нитрида рутения, нитрида родия, нитрида палладия, нитрида осмия и нитрида иридия. Предпочтительно катализатор содержит один или более из нитрида ванадия, нитрида хрома и нитрида циркония.
В зависимости от состава катализатора может быть предпочтительной подходящая структура поверхности кристалла. У нитридов металлов существуют различные кристаллические структуры, и различные структуры можно получить при различных условиях роста. Специалист в данной области техники сможет выбрать подходящие структуры поверхности кристаллов. Например, одними из простейших и довольно распространенных структур являются структуры каменной соли (RS; от англ.: rocksalt) и цинковой обманки (ZB; от англ.: zinkblende).
Соответственно, в некоторых вариантах осуществления настоящего изобретения поверхность катализатора по настоящему изобретению имеет кристаллическую структуру, выбранную из структуры каменной соли (RS) и цинковой обманки (ZB). Также возможны другие кристаллические структуры, например - структура хлорида цезия, или другие структуры, известные в данной области техники (см., например, International Tables for Crystallography; http://lt.iucr.org).
Несколько различных поверхностных граней могут существовать в данной кристаллической структуре (поликристаллические поверхности). Например, могут быть выбраны (100) и (111) грани структуры каменной соли и (100) и (110) грани структур цинковой обманки. В некоторых вариантах осуществления настоящего изобретения нитриды VN, ZnN, MnN и CrN могут иметь структуру каменной соли со (100) и (110) гранями. Показано, что такие нитриды являются наиболее распространенными в экспериментальных условиях и образуются в различных экспериментальных условиях. (Прим. перев.: В контексте настоящего описания (100), (110), (111) - кристаллографические индексы Миллера, характеризующие расположение атомных плоскостей в кристалле).
Соответственно, в некоторых вариантах осуществления настоящего изобретения поверхность катализатора включает поверхность, выбранную из поверхностей типа каменной соли (RS) и типа цинковой обманки (ZB). Поверхности могут иметь любую подходящую грань, включая, но не ограничиваясь этим, (100) грань, (111) грань и (110) грань. В некоторых вариантах осуществления настоящего изобретения поверхностная грань может быть выбрана из RS (100) грани, RS (110) грани, ZB (100) грани и ZB (110) грани. Неограничивающие примеры вещества с подходящими поверхностями RS (100) грани включают нитрид титана, нитрид тантала, нитрид циркония, нитрид гафния, нитрид скандия, нитрид хрома, нитрид ниобия и нитрид ванадия. Применимые неограничивающие примеры веществ с поверхностью ZB (110) грани включают нитрид кобальта, нитрид железа, нитрид никеля, нитрид осмия, нитрид иридия, нитрид рутения, нитрид палладия, нитрид осмия и нитрид родия.
В некоторых предпочтительных вариантах осуществления настоящего изобретения катализатор может быть выбран из RS (100) VN, ZB (110) CrN, ZB (110) NbN, RS(100) NbN, RS (111) CrN, RS (100) CrN, RS (100) ZrN, RS(111)VN, ZB(100) VN, ZB (110) ZrN, ZB (110) VN, AB (100) CrN и RS (111) ZrN.
Как будет понятно специалисту в данной области техники, катализатор по настоящему изобретению может содержать один нитрид металла. Катализатор также может содержать смесь двух или более нитридов металлов. Такие смешанные нитриды могут содержать одну структуру, например - структуру каменной соли или структуру цинковой обманки. Смешанные нитриды также могут содержать смесь нитридов, которые являются различными кристаллическими структурами. Смешанные нитриды могут также содержать одну грань или смесь граней. Такие катализаторы на основе смешанных нитридов можно вырастить или получить раздельно, а затем объединить в смешанные катализаторы, содержащие различные нитриды с различными кристаллическими структурами.
Как описано более детально в данной работе, протекание тока через электролитическую ячейку приводит к химической реакции, в которой азот реагирует с протонами с образованием аммиака. Протекание тока обеспечивают посредством подачи напряжения на ячейку. Изобретение делает возможным электролитическое получение аммиака при низком электродном потенциале, что обеспечивает преимущества в отношении эффективности использования энергии и требований к оборудованию.
Безотносительно к какой-либо конкретной теории, считается, что нитридные катализаторы способны сдвигать узкое место синтеза аммиака от расщепления N2 к последующему образованию соединений азота и водорода (*NH, *NH2 или *NH3), за счет чего можно ожидать более простого, но имеющего более высокую скорость образования аммиака.
В некоторых полезных вариантах осуществления настоящего изобретения аммиак может образовываться при электродном потенциале менее примерно -1,0 В, менее примерно -0,8 В, и предпочтительно - менее примерно -0,5 В или менее примерно -0,4 В. В некоторых вариантах осуществления настоящего изобретения аммиак может образовываться при электродном потенциале в диапазоне от примерно -0,2 В до примерно -1,0 В, например - в диапазоне от примерно -0,3 В до примерно -0,8 В, в диапазоне от примерно -0,4 В до примерно -0,8 В или в диапазоне от примерно -0,4 В до примерно -0,6 В. Верхняя граница диапазона может быть равна примерно -0,6 В, примерно -0,7 В, примерно -0,8 В или примерно -1,0 В. Нижняя граница диапазона может быть равна примерно -0,2 В, примерно -0,3 В, примерно -0,4 В или примерно -0,6 В. В предпочтительном варианте осуществления настоящего изобретения аммиак может образовываться при электродном потенциале, лежащем в диапазоне от примерно -0,40 В до примерно -0,60 В.
Преимуществом настоящего изобретения является более эффективное образование NH3 по сравнению с образованием Н2, которое было проблемой в исследованиях и опытах на предшествующем уровне техники. В варианте осуществления настоящего изобретения образуется менее примерно 20% молей Н2 по сравнению с количеством молей образовавшегося NH3, предпочтительно образуется менее 10% молей Н2 по сравнению с количеством молей образовавшегося NH3, более предпочтительно образуется менее 5% молей Н2 по сравнению с количеством молей образовавшегося NH3, и еще более предпочтительно образуется менее 2,5% или менее 1%.
Система по настоящему изобретению может быть сконструирована так, чтобы она включала один или более вышеуказанных признаков способа. Преимуществом настоящего изобретения является то, что система может быть сделана маленькой, надежной в эксплуатации и дешевой, например - для локального использования для производства удобрений вблизи целевого места их применения.
Аммиак можно использовать как таковой в качестве удобрения посредством инжекции в почву в виде газа, но это требует инвестиций фермеров в резервуары-накопители, выдерживающие высокое давление, и в оборудование для инжекции. Аммиак также можно использовать для получения мочевины, в характерном случае - в реакции с диоксидом углерода. Можно провести реакцию аммиака с получением азотной кислоты, которая в свою очередь легко вступает в реакцию с образованием нитрата аммония. Соответственно, системы и способы по настоящему изобретению легко можно объединить с имеющимися решениями для проведения реакции полученного аммиака с получением других желаемых продуктов, таких как вышеуказанные, но без ограничения ими.
NOx и SOx - это родовые понятия для моноазотистых и моносернистых оксидов, таких как NO, NO2, SO, SO2 и SO3. Эти газы образуются во время горения, в частности - при высоких температурах. В областях с интенсивным движением автотранспортных средств количество этих загрязнителей может быть значительным.
Соответственно, полезный аспект настоящего изобретения относится к системе для удаления NOx и/или SOx из потока газа за счет реакции потока газа с аммиаком, который образуется in situ в потоке или в системе, которая может находиться в жидкостном соединении с потоком газа. В этом контексте in situ следует понимать так, что аммиак образуется внутри системы, например - внутри потока газа или в отсеке, находящемся внутри системы, который жидкостно соединен с потоком газа. Аммиак, который образуется при контакте с потоком газа, будет реагировать с NOx и/или SOx в потоке газа таким образом, что эти токсичные молекулы будут преобразованы в другие виды молекул, такие как N2, H2O и (NH4)2SO4. В некоторых вариантах осуществления настоящего изобретения система может быть предназначена для применения в выхлопной трубе автомобильного двигателя или в других двигателях, где аммиак может быть получен in situ способом по настоящему изобретению, и который затем используют для снижения содержания SOx и/или NOX в выхлопных газах из двигателя. В такой системе можно удобно использовать электрический ток, генерируемый двигателем автомобиля в процессе преобразования энергии. Таким образом, за счет использования электрического тока из двигателя автомобиля аммиак может быть получен in situ, и полученный таким образом аммиак может быть направлен для реакции с SOx и/или NOx, содержащимися в выхлопных газах автомобиля. Аммиак может быть получен в автомобиле и затем подан в выхлопную трубу автомобиля. Также он может быть получен in situ в системе для удаления выхлопных газов автомобиля. Таким образом, NOx и/или SOx удаляются из выхлопных газов автомобиля, за счет чего снижается содержание загрязняющих веществ в выхлопном газе.
Неограничивающие варианты осуществления настоящего изобретения включают:
1. Способ получения аммиака, включающий:
подачу газообразного азота в электролитическую ячейку, где он вступает в контакт с поверхностью катодного электрода, причем эта поверхность содержит каталитическую поверхность, содержащую нитридный катализатор, электролитическая ячейка содержит донор протонов, и
пропускание электрического тока через электролитическую ячейку, за счет чего азот реагирует с протонами с образованием аммиака.
2. Способ по варианту осуществления 1, отличающийся тем, что нитридный катализатор содержит один или более нитридов, выбранных из группы, состоящей из нитрида скандия, нитрида титана, нитрида ванадия, нитрида хрома, нитрида марганца, нитрида меди, нитрида иттрия, нитрида циркония, нитрида ниобия, нитрида молибдена, нитрида серебра, нитрида гафния, нитрида тантала, нитрида железа, нитрида кобальта, нитрида никеля, нитрида рутения, нитрида родия, нитрида палладия, нитрида осмия и нитрида иридия.
3. Способ по варианту 1 или варианту 2, отличающийся тем, что каталитическая поверхность содержит поверхность, выбранную из поверхностей типа каменной соли (RS) и типа цинковой обманки (ZB).
4. Способ по варианту 3, отличающийся тем, что каталитическая поверхность содержит поверхность, выбранную из RS (100) грани, RS (111) грани, ZB (100) грани и ZB (110) грани.
5. Способ по любому из вариантов с 2 по 4, отличающийся тем, что каталитическая поверхность содержит поверхность RS (100) грани, выбранной из группы, состоящей из нитрида титана, нитрида тантала, нитрида циркония, нитрида гафния, нитрида скандия, нитрида иттрия, нитрида марганца, нитрида ниобия, нитрида серебра, нитрида меди, нитрида хрома и нитрида ванадия.
6. Способ по любому из вариантов с 2 по 4, отличающийся тем, что каталитическая поверхность содержит поверхность ZB (110) грани, выбранной из группы, состоящей из нитрида кобальта, нитрида железа, нитрида никеля, нитрида осмия, нитрида иридия, нитрида рутения, нитрида палладия и нитрида родия.
7. Способ по любому из предыдущих вариантов, отличающийся тем, что катализатор включает один или более из нитрида циркония, нитрида ванадия, нитрида хрома, нитрида ниобия, нитрида железа и нитрида осмия.
8. Способ по любому из предыдущих вариантов, отличающийся тем, что аммиак образуется при электродном потенциале менее примерно -0,8 В, и предпочтительно - менее примерно -0,5 В.
9. Способ по любому из предыдущих вариантов, отличающийся тем, что аммиак образуется при электродном потенциале, лежащем в диапазоне от примерно -0,4 В до примерно -0,60 В.
10. Способ по любому из предыдущих вариантов, отличающийся тем, что образуется менее 20% молей Н2 по сравнению с количеством молей образовавшегося NH3, и предпочтительно образуется менее 10% молей Н2, и более предпочтительно образуется менее 5% молей Н2.
11. Способ по любому из предыдущих вариантов, отличающийся тем, что электролитическая ячейка содержит один или более водных растворов электролитов.
12. Система для получения аммиака, включающая электрохимическую ячейку с поверхностью катодного электрода, имеющей каталитическую поверхность, причем эта поверхность заполнена катализатором, содержащим один или более нитридов, выбранных из группы, состоящей из нитрида скандия, нитрида титана, нитрида ванадия, нитрида хрома, нитрида марганца, нитрида меди, нитрида иттрия, нитрида циркония, нитрида ниобия, нитрида молибдена, нитрида серебра, нитрида гафния, нитрида тантала, нитрида железа, нитрида кобальта, нитрида никеля, нитрида рутения, нитрида родия, нитрида палладия, нитрида осмия и нитрида иридия.
13. Система по варианту 12, отличающаяся тем, что каталитическая поверхность содержит поверхность, выбранную из поверхностей типа каменной соли (RS) и типа цинковой обманки (ZB).
14. Система по варианту 13, отличающаяся тем, что каталитическая поверхность содержит поверхность, выбранную из RS (100) грани, RS (111) грани, ZB (100) грани и ZB (110) грани.
15. Система по варианту 13 или 14, отличающаяся тем, что каталитическая поверхность содержит поверхность RS (100) грани, выбранной из группы, состоящей из нитрида титана, нитрида тантала, нитрида циркония, нитрида гафния, нитрида скандия, нитрида иттрия, нитрида марганца, нитрида ниобия, нитрида серебра, нитрида меди, нитрида хрома и нитрида ванадия.
16. Система по варианту 13 или 14, отличающаяся тем, что каталитическая поверхность содержит поверхность ZB (110) грани, выбранной из группы, состоящей из нитрида кобальта, нитрида железа, нитрида никеля, нитрида осмия, нитрида иридия, нитрида рутения, нитрида палладия и нитрида родия.
17. Система по любому из вариантов с 13 по 16, отличающаяся тем, что катализатор включает один или более из нитрида циркония, нитрида ванадия, нитрида ниобия, нитрида железа, нитрида осмия и нитрида хрома.
18. Система по любому из вариантов с 12 по 17, отличающаяся тем, что электролитическая ячейка содержит один или более водных растворов электролитов.
19. Способ удаления NOx и/или SOx газа из выхлопного газа двигателя, который включает стадии (а) получения аммиака in situ способом по любому из пунктов с 1 по 11 и (b) проведения реакции полученного таким образом аммиака с выхлопным газом двигателя, в которой аммиак реагирует с NOx и/или SOx в выхлопном газе двигателя.
20. Способ по варианту 19, отличающийся тем, что он включает проведение реакции аммиака, полученного in situ, с NOx в выхлопном газе двигателя.
21. Способ по любому из вариантов с 1 по 11, отличающийся тем, что катализатор содержит нитрид ванадия или нитрид хрома.
22. Способ по варианту 21, отличающийся тем, что катализатор содержит поверхность, выбранную из RS (100) грани, RS (111) грани, ZB (100) грани и ZB (110) грани.
23. Способ по варианту 21 или варианту 22, отличающийся тем, что катализатор выбран из группы, состоящей из нитрида ванадия, имеющего RS (100) грань, нитрида хрома, имеющего RS (111) грань, нитрида ванадия, имеющего ZB (100) грань и нитрида хрома, имеющего ZB (110) грань.
При использовании в контексте настоящего изобретения, в том числе - в формуле изобретения, формы единственного числа терминов следует понимать как включающие форму множественного числа, и наоборот, если из контекста не следует иное. Соответственно, необходимо отметить, что при использовании в контексте настоящего изобретения формы единственного числа с артиклями «а», «an» и «the» включают формы множественного числа, если в контексте явным образом не указано иное.
Во всем тексте описания и в формуле изобретения термины «содержит», «включает», «имеет» и их варианты следует понимать как означающие «включает, но не ограничивается этим», и они не исключают другие компоненты.
Настоящее изобретение также охватывает точные термины, признаки, значения, диапазоны и т.п. в случае, если эти термины, признаки, значения, диапазоны и т.п. используются совместно с такими терминами, как «примерно», «около», «в целом», «по существу», «практически», «по меньшей мере» и т.п. (то есть термин «примерно -0,3» также включает «точно -0,3», а термин «по существу постоянный» также включает «строго постоянный»).
Термин «по меньшей мере один» следует понимать как «один или более», и поэтому он охватывает оба варианта осуществления, которые включают один или множество компонентов. Кроме того, зависимые пункты формулы изобретения, которые ссылаются на независимые пункты формулы изобретения, которые описывают признаки как «по меньшей мере один» имеют то же значение, как в случае, если на признак ссылаются как на «один» или «по меньшей мере один».
Следует понимать, что можно осуществить изменения вышеуказанных вариантов осуществления настоящего изобретения, которые также входят в объем настоящего изобретения. Признаки, раскрытые в описании, если не указано иное, можно заменить альтернативными признаками, выполняющими ту же, эквивалентную или сходную задачу. Соответственно, если не указано иное, любой раскрытый признак представляет собой пример родовой серии эквивалентных или сходных признаков.
Использование оборотов речи, относящихся к примерам, таких как «например», «такой как» и т.п., предназначено для лучшей иллюстрации настоящего изобретения и не указывают на ограничение объема изобретения, если это не заявлено в явной форме. Все стадии, описанные в данной публикации, могут выполняться в любой последовательности или одновременно, если в контексте в явной форме не указано иное.
Все признаки и/или стадии, раскрытые в данной публикации, могут быть объединены в любую комбинацию, за исключением комбинаций, в которых по меньшей мере некоторые признаки и/или стадии взаимно исключают друг друга. В частности, предпочтительные признаки настоящего изобретения применимы ко всем аспектам настоящего изобретения и могут быть использованы в любой комбинации.
Далее настоящее изобретение будет проиллюстрировано следующими неограничивающими примерами его осуществления, которые дополнительно раскрывают конкретные преимущества и варианты осуществления настоящего изобретения.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1
Расчеты методом теории функционала плотности профиля свободной энергии для вероятных катализаторов
Расчеты методом теории функционала плотности (DFT; от англ.: density functional theory) использовали для расчета профиля свободной энергии восстановления поверхностного азота, чтобы найти перспективных кандидатов среди широкого спектра нитридных катализаторов, которые целесообразно было бы испытать экспериментально. Анализировали стабильность поверхности и вакансий, детальную каталитическую активность, отравление дефектов и начальный потенциал, необходимый для образования аммиака.
Расчеты методом DFT53, 54 выполнили с использованием модифицированного обменно-корреляционного функционала Пердью-Бурке-Эрнзерхофа (RPBE; от англ.: revised Perduw-Burke-Ernzerhof)55. Базисный набор плоских волн56,57 с энергией отсечки, равной 350 эВ, использовали с представлением электронов внутренних оболочек как проекционных присоединенных волн (PAW; от англ.: projector augmented wave), как реализовано в программном пакете VASP56,57,59,60. Пути минимальной энергии (МЕР; от англ.: minimum energy path) и энергию активации, необходимую для переходов, рассчитали с использованием метода упругой ленты (NEB; от англ.: nudged elastic band)61,62. Предварительное исследование показало, что некоторые 3d мононитриды являются или антиферромагнетиками (RS VN, CrN, MnN, FeN и ZB MnN), или ферромагнетиками (ZB VN, CrN) при равновесных постоянных их кристаллических решеток, и по этой причине с ними работали как со спин-поляризованными69. Все остальные расчеты были ограничены по спину синглетным состоянием. Самосогласованную электронную плотность определили посредством итеративной диагонализации гамильтониана Кона-Шэма с заполнением состояний Кона-Шэма, размытых согласно распределению Ферми-Дирака с параметром размытости kaT, равным 0,1 эВ. Для всех поверхностей использовали метод Монкхорста-Пака выбора k-точек с сеткой размерностью 4×4×1, и использовали максимальную симметрию для снижения числа k-точек в расчетах.
RS и ZB структуры, которые являются мононитридными структурами, использовали в исследовании для моделирования нитридов переходных металлов. Обе структуры моделировали в объемной форме с использованием сходных DFT расчетов. Рассматривали (100) и (111) грани RS структуры и (100) и (110) грани ZB структуры. Каждая нитридная пластина состояла из 40 атомов, находящихся в пяти слоях, причем каждый слой состоял из четырех атомов металла и четырех атомов азота. Граничные условия были периодическими в х и у направлениях, и соседние пластины были разделены слоем вакуума толщиной 12 А в z направлении. Во всех структурах два нижних слоя пластины были зафиксированы, а для верхних слоев и адсорбированных частиц допускалась релаксация. Во время структурных оптимизаций энергию конвергировали к 0,01 эВ. Постоянные решетки для всех структур рассчитывали на уровне RPBE55.
Полная реакция электрохимического процесса имеет вид:
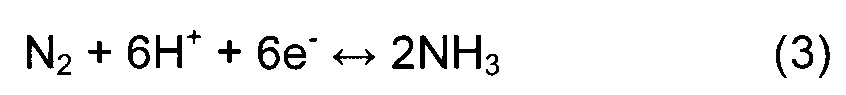
В настоящем исследовании рассмотрены гетерогенные поверхностные реакции типа Марса -Ван Кревелена52, в которых поверхностный атом N восстанавливается до аммиака, а образовавшаяся N-вакансия затем заполняется за счет молекулы N2, инжектированной в систему. Гидрогенизирование поверхности выполняли по механизму Хейровски64, в котором поверхностный атом азота последовательно гидрогенизируется за счет прямого присоединения протонов из раствора и электронов с поверхности электрода.
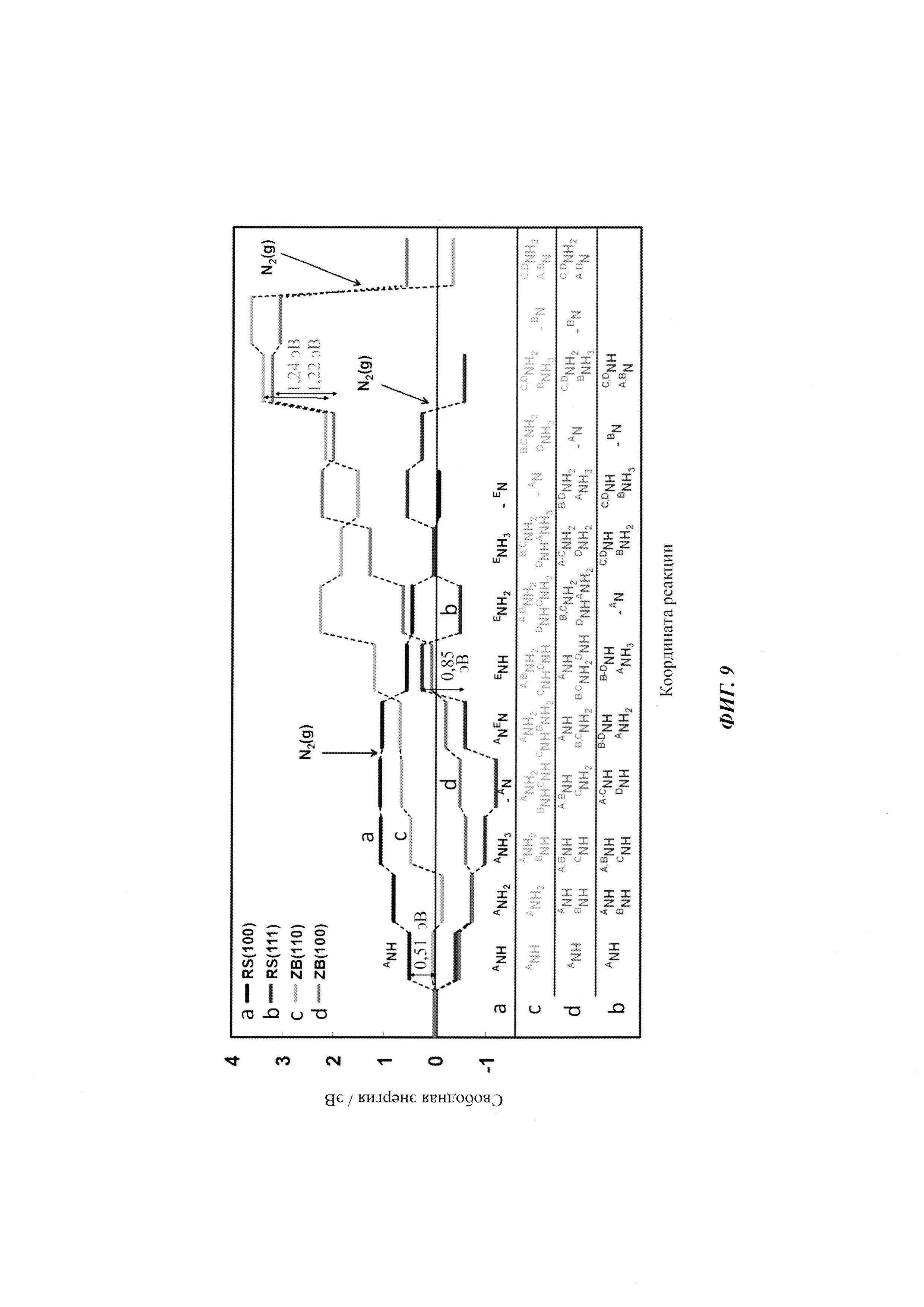
Для перспективных кандидатов доминантный механизм, наблюдавшийся в этом исследовании, состоял в том, что первый протон непосредственно и прочно связывается с поверхностным атомом Т. После этого второй протон присоединяется к тому же поверхностному атому N, и так же присоединяется третий с образованием аммиака. Механизм реакции показан изображением типа «шарики и стержни» на Фиг. 1(a) и в уравнениях (4)-(10):

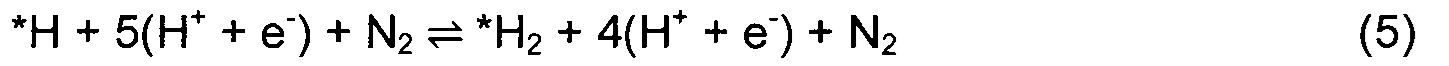
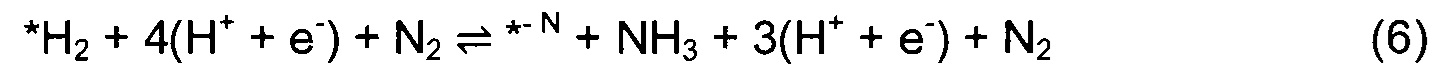
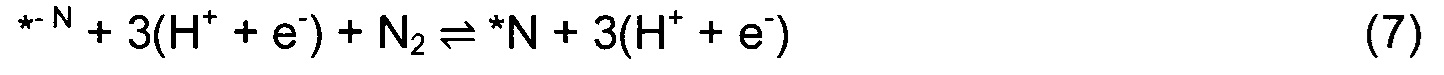

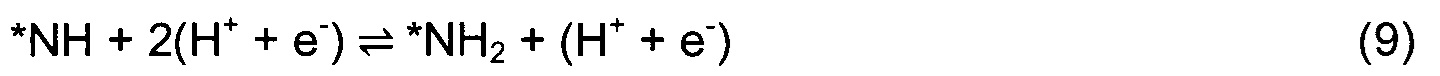

Звездочка (*) изображает участок поверхности, который может быть атомом N или атомом металла. Азотный дефект в поверхностном слое обозначен как *-N. DTF расчеты использовали для определения минимальной энергетической конфигурации каждой стадии реакции и энергий адсорбции всех промежуточных стадий согласно реакциям (4)-(10). Наиболее выгодное положение Н-адатома в каждом случае определяли посредством релаксации нитрида с адатомом в различных положениях и нахождения адатома с наименьшей полной энергией. Немного другой механизм реакции рассмотрен в случае (110) граней ZB структуры. Из-за очень высокого барьера для заполнения образовавшейся вакансии после образования первой молекулы аммиака вместо этого образуются две молекулы NH3 и образуются две вакансии. Затем димерные вакансии заполняются молекулой N2 из газовой фазы. Механизм приведен в уравнениях (11)-(17).


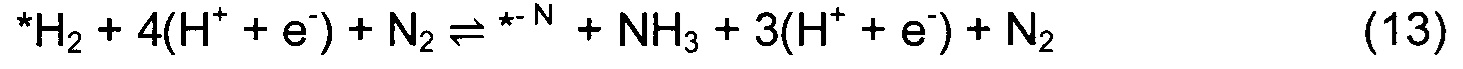
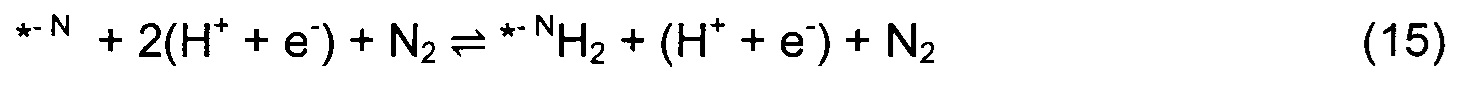



Абсолютно другой механизм реакции обнаружили для некоторых (100) граней RS структур, таких как TiN, TaN, HfN и ScN, где непрерывное протонирование поверхности приводит к образованию однослойного покрытия, способствующего выделению водорода, а не образованию аммиака (см. Фиг. 1(b)).
Для того чтобы найти наиболее перспективных кандидатов среди широкого спектра нитридов переходных металлов, автор изобретения определил пять важных критериев, которым должен соответствовать нитрид, от которого можно ожидать электрохимического получения аммиака в условиях окружающей среды. Этими критериями были: стабильность граней, стабильность вакансий в верхнем слое, каталитическая активность, возможность заполнения N-вакансии азотом, а не ее отравление водородом или кислородом из воды, и стабильность нитридов при начальном потенциале, соответственно.
Стабильность граней
В качестве первого критерия была рассмотрена стабильность нитридов в четырех гранях, указанных выше. Рассчитали полную энергию пластин и выполнили оптимизацию геометрии чистых поверхностей. Стабильность совместно с энергией образования различных граней сравнили с целью выявления наиболее стабильных структур. Этот первый критерий исключает ряд нитридов, которые не могут быть хорошими катализаторами для получения аммиака из-за нестабильности пластины и большого смещения поверхностных атомов во время минимизации энергии. Из начальных 104 нитридов остался 21 нитрид, у которых были стабильными либо (100) грани RS структуры, либо (110) грани ZB структуры. Этими нитридами были ScN, TiN, VN, CrN, MnN, CuN, YN, ZrN, NbN, MoN, AgN, HfN и TaN, имеющие первую кристаллическую структуру, и FeN, CoN, NiN, RuN, RhN, PdN, OsN и IrN, имеющие вторую кристаллическую структуру.
На основании предварительной работы была признана стабильность вакансии в верхнем слое определяющим фактором для поиска хорошего катализатора - фактором, которому должны соответствовать перспективные кандидаты, предположительно способные генерировать аммиак. По существу, если в верхнем слое нитрида создается N-вакансия, то важным вопросом является, будет ли она заполняться молекулой N2, или дефект будет мигрировать в объем кристалла. Первой стадией миграции является смещение из первого слоя во второй. Если эта стадия имеет меньшую энергию, то вероятно, что нитрид в конечном итоге будет восстановлен до чистого металла, а весь азот в нитриде будет преобразован в аммиак. В этом случае создание первой N-вакансии и разница ее энергии при перемещении во второй слой может быть хорошей мерой стабильности дефекта на поверхности по сравнению с объемом. Соответственно, определяют минимальную энергетическую конфигурацию поверхности каждого нитрида с N-вакансией и без N-вакансии в поверхностном слое и во втором слое. В представленном исследовании рассчитали разность энергий ΔЕ для этих двух конфигураций. Она показывает, сможет ли нитрид восстановиться до чистого металла вследствие восстановления всех атомов N до аммиака. Также рассчитали энергетический барьер для перемещения атома N из второго слоя для заполнения вакансии в поверхностном слое, то есть для перемещения N-вакансии из первого слоя во второй, с использованием способа упругой ленты (NEB) (см. Фиг. 2). Если энергетический барьер (энергия активации) достаточно высок, он может препятствовать миграции поверхностной вакансии в кристалл, даже если это энергетически предпочтительно.
Второй критерий исключил еще несколько нитридов из списка потенциальных кандидатов, для которых необходимо провести каталитические исследования. В следующем разделе (100) грани RS структуры TiN, TaN, ZrN, HfN, ScN, YN, CrN, NbN, MnN и VN совместно с (110) гранями ZB структуры FeN, OsN и RhN, которые по двум предыдущим критериям, были определены как структурно стабильные и имеющие стабильную N-вакансию в верхнем слое, были подвергнуты электрокаталитическому анализу.
Каталитическая активность стабильных нитридов
Для исследования каталитической активности прошедших отбор нитридов, выбранных на предыдущих стадиях, рассчитали свободную энергию всех промежуточных продуктов, образующихся при восстановлении N2 до NH3. Механизмом реакции был механизм Марса - Ван Кревелена, обобщенный на Фиг. 1 и в уравнениях (4)-(10) и (11)-(17). Атомы водорода по одному добавляли к наиболее стабильной конфигурации поверхности и использовали DFT расчеты для определения конфигураций с минимальной энергией и энергий связи. Конфигурации с минимальной энергией адсорбированных частиц показаны на Фиг. 1. Затем свободную энергию использовали в качестве меры электрокаталитической активности. Определили наиболее положительное значение свободной энергии реакции между любыми двумя стабильными соседними промежуточными продуктами для каждого нитрида, и эта стадия была индикатором скорость-определяющей стадии реакции. -ΔG (отрицательное значение свободной энергии скорость-определяющей стадии) было мерой скорости, показывающей начальный потенциал реакции. DFT расчеты показали, что наиболее экзергонической стадией, или потенциал-определяющей стадией, при восстановлении азота до аммиака на RS (100) поверхности VN было присоединение первого водорода к N-адатому в направлении образования первой молекулы аммиака, свободная энергия которого на 0,51 эВ выше (см. энергетическую диаграмму, Фиг. 3). Поэтому для ускорения реакции был создан начальный потенциал, равный -0,51 В, для снижения барьера и снижения свободной энергии всех остальных промежуточных реакций. Влияние приложенного электрического потенциала в конечном итоге было учтено согласно уравнению (18), как объяснено в ссылках 30 и 49. Диаграмма свободной энергии проиллюстрирована на Фиг. 3, где учтены скорость-определяющая стадия (RDS) и эффект приложенного смещающего потенциала.
С учетом трех указанных выше критериев для оптимального катализатора образования аммиака на Фиг. 4 показана электрокаталитическая активность, выраженная через соответствующие начальные потенциалы. Эти нитриды отличаются структурной стабильностью и стабильностью N-вакансий и высокой способностью катализировать восстановление азота до аммиака. До этого момента было обнаружено 7 кандидатов для электрохимического получения аммиака (Фиг. 4). Но это еще не конец истории, поскольку существуют еще два фактора, которые могут влиять на образование аммиака в эксперименте.
Адсорбция к N-вакансии
Несмотря на структурную стабильность, стабильность вакансии и каталитическую активность, наиболее перспективным нитридом, способным обеспечивать образование аммиака, должен быть нитрид, в котором N-вакансия более прочно заполняется азотом, чем водородом или кислородом. В противном случае катализатор будет отравлен, и цикл образования аммиака прервется. Поэтому энергия адсорбции этих частиц была рассчитана с использованием DTF, чтобы определить, достаточно ли прочно атмосферный азот связывается с N-вакансией, или кислород или водород отравят нитриды. Фиг. 5 демонстрирует разницу свободных энергий адсорбции кислорода (в пересчете на H2O) и водорода (в пересчете на Н2) относительно азота (в пересчете на N2) к N-вакансии при начальных потенциалах, необходимых для восстановления N2 до NH3, для каждого нитрида. Во всех случаях, кроме RhN, вакансия заполняется азотом лучше, чем отравляется водородом или кислородом.
Стабильность перспективных нитридов при начальном потенциале
Для того чтобы экспериментально определить наиболее подходящий катализатор для успешного получения аммиака, кроме четырех вышеуказанных критериев перспективные кандидаты также должны быть стабильными при напряжении, необходимом для инициации реакции. Если данный нитрид разлагается на чистый металл и аммиак во время электрохимической реакции, его не считают катализатором, приемлемым для получения аммиака. Соответственно, последним, но не менее важным критерием, учитываемым в данном исследовании, является проверка стабильности перспективных кандидатов при напряжениях, необходимых для снижения барьера, ускорения реакции и инициации активности. Для кандидатов с ZB структурой, кроме FeN, не рассматривали внешнее напряжение, поскольку скорость-определяющая стадия, соответствующая заполнению вакансии, не включает перенос электронов и протонов. Поэтому были исследованы только (100) грани RS структуры CrN, VN, NbN и ZrN и (110) грани ZB структуры FeN, где RDS включает протонирование поверхности, и для снижения барьера прикладывают начальный потенциал.
Стабильность конкретного нитрида в зависимости от приложенного напряжения определяют следующим образом. Разложение нитрида металла на соответствующий металл и аммиак можно представить как

где MexNy - это рассматриваемый нитрид металла, a Me - соответствующий металл. Общее изменение свободной энергии в реакции задано выражением
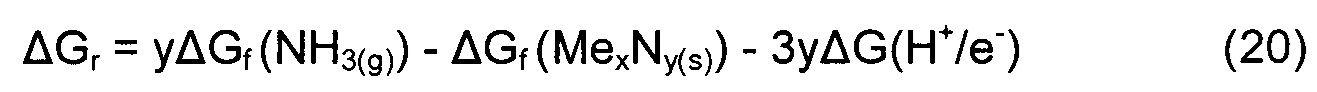
где член, относящийся к чистому металлу, исключен, поскольку он находится в стандартном состоянии и поэтому равен нулю. Член 3yΔG(H+/e-) определяет вклад в свободную энергию протонов и электронов. Чтобы найти приложенный потенциал, при котором нитрид восстанавливается до металла, ΔG должно быть равно нулю, или

Поэтому необходимый потенциал можно выразить как

Рассчитанные перенапряжения для некоторых нитридов приведены в Таблице 2. Свободная энергия образования NH3(g) принята равной -0,17 эВ65,66. Все значения ΔGf (MexNy(s) определены при 300 К66-68. Чтобы данный нитрид можно было использовать для электрохимического получения аммиака, стабильность должна быть равна или больше потенциала, необходимого для образования аммиака. В соответствии с потенциалом разложения, представленным в Таблице 2, только RS-структура ZrN не начинает разлагаться при указанных напряжениях - факт, который повышает мотивацию к экспериментальному исследованию этого перспективного кандидата. Однако, поскольку потенциал разложения и начальный потенциал для VN близки, также существует возможность того, что VN может быть способным восстанавливать N2 до NH3. Наконец, этот анализ не был распространен на NbN или FeN, так что возможно, что они также могут быть перспективными кандидатами.

Таблица 2 демонстрирует расчетные значения потенциалов, необходимых для преобразования нитрида металла в соответствующий металл, согласно уравнению 19. Значения ΔGf (MexNy(s)) взяты из ссылок67,68. Также включены расчетные начальные потенциалы, необходимые для образования аммиака.
Для того чтобы нитрид переходного металла был подходящим кандидатом для электрохимического восстановления N2 до аммиака в условиях окружающей среды, в данном исследовании в качестве пяти основных факторов были исследованы структурная стабильность, электрохимическая активность, стабильность в отношении подвижности дефектов, предпочтительное заполнение N-вакансии азотом и стабильность нитрида при начальном потенциале. Поэтому конечный результат состоит в том, что наиболее перспективными нитридными пластинами являются (100) грани RS структуры ZrN, поскольку они требуют низкого перенапряжения (-0,76 В относительно NHE) для восстановления N2, и N-вакансия в верхнем слое является термодинамически стабильной.
Согласно каталитическим оценкам автора и с экспериментальной точки зрения, к CrN необходимо приложить потенциал, равный -0,53 В, для поддержания восстановления азота до аммиака, однако если потенциал снижается ниже -0,24 В, нитрид становится нестабильным и может разложиться. Однако кинетика может исключить это явление, поскольку миграция N-вакансии с поверхности в объем встречается с активационным барьером порядка 1,5 эВ (см. Фиг. 2). VN должен быть еще более стабильным в этом отношении, поскольку необходимо -0,51 В для протекания реакции, тогда как приложенный потенциал может опуститься ниже -0,46 В, прежде чем нитрид разложится. Кроме того, более высокий барьер, равный 1,8 эВ, необходим для миграции его вакансии в объем. ZrN может быть наиболее стабильным нитридом в отношении разложения, поскольку он не только имеет предельный уровень надежности, равный 0,3 В, так как его разложение начинается при потенциале ниже -1,03 В, но он также имеет очень высокий барьер, равный примерно 3 эВ, для миграции вакансии в объем.
Выводы
Теоретический анализ возможности электрохимического получения аммиака в условиях окружающей среды на электродах, содержащих нитриды переходных металлов, позволяет выявить подходящих кандидатов, которые способны восстанавливать поверхностный азот до аммиака при низком потенциале, лежащем в диапазоне от примерно -0,51 В до примерно -0,76 В относительно стандартного водородного электрода (NHE; от англ.: normal hydrogen electrode), по механизму Марса - Ван Кревелена. Предложенный начальный потенциал для электрохимического получения аммиака на (100) гранях RS структуры CrN, VN и ZrN равен -0,53 В, -0,51 В и -0,76 В относительно NHE, соответственно. При использовании (110) граней ZB структуры FeN в качестве катодного электрода для получения аммиака необходимо -0,75 В. Что касается последней структуры, то RhN и OsN также могут восстанавливать поверхностный азот до аммиака. Однако при этом потребуются более высокая температура для ускорения реакции и более высокие значения давления для заполнения N-вакансии, чтобы электрохимически получить аммиак. В отличие от предыдущих исследований, в которых конкурирующей реакцией50 была реакция выделения водорода (HER; от англ.: hydrogen evolution reaction), или сообщалось, что потенциал, стимулирующий образование аммиака, был относительно высоким, наиболее перспективные кандидаты, представленные в данной работе, требуют более низкого потенциала для начала реакции. Кроме того, они могут препятствовать HER и все еще оставаться очень хорошими катализаторами для получения NH3. Поэтому образование водорода больше не будет мешать восстановлению N2 до NH3. Поэтому можно ожидать значительно большего количества аммиака, чем газообразного водорода. Кроме того, у большинства перспективных кандидатов из данного исследования при граничном потенциале N-вакансия является стабильной в отношении протонирования и окисления водой, и она должна легко заполняться атмосферным азотом, инжектированным в систему при атмосферном давлении. Вдобавок представленные катализаторы не разлагаются до соответствующих металлов при предложенных начальных потенциалах. Это, безусловно, свидетельствует в пользу идеи о том, что нитриды, раскрытые в настоящем изобретении, являются перспективными кандидатами для экспериментального испытания на получение аммиака.
Ссылки
1. Schlogl, R. Catalytic synthesis of ammonia - "a never-ending story"? Angew. Chem. Int. Ed. Engl. 42, 2004-2008 (2003).
2. Klerke, A., Christensen, С.H., Norskov, J.K. & Vegge, T. Ammonia for hydrogen storage: challenges and opportunities. J. Mater. Chem. 18, 2304 (2008).
3. Smil, V. Global population and the nitrogen cycle. Sci. Am. 277, 76-81 (1997).
4. Jennings, J.R. Catalytic ammonia synthesis: fundamentals and practice. (Springer, 1991).
5. Benefits, S. How a century of ammonia synthesis changed the world. 1, (2008).
6. Aika, K. & Tamara, K. in Ammonia 103-148 (Springer, 1995).
7. Ertl, G. Primary steps in catalytic synthesis of ammonia. J. Vac. Sci. Technol. A Vacuum, Surfaces, Film. 1, 1247 (1983).
8. Ertl, G. Reactions at surfaces: From atoms to complexity (Nobel lecture). Angew. Chemie Int. Ed. 47, 3524-3535 (2008).
9. Spencer, N.D., Schoonmaker, R.C. & Somorjai, G.A. Iron single crystals as ammonia synthesis catalysts: effect of surface structure on catalyst activity. J. Catal. 74, 129-135(1982).
10. Stoltze, P. & Norskov, J. Bridging the "Pressure Gap" between ultrahigh-vacuum surface physics and high-pressure catalysis. Phys. Rev. Lett. (1985).
11. Honkala, K. et al. Ammonia synthesis from first-principles calculations. Science 307, 555-558 (2005).
12. Dahl, S. et al. Role of steps in N2 activation on Ru(0001). Phys. Rev. Lett. 83, 1814-1817(1999).
13. Dahl, S., Tornqvist, E. & Chorkendorff, I. Dissociative adsorption of N2 on ru (0001): A surface reaction totally dominated by steps. J. Catal. 390, 381-390 (2000).
14. Jacobsen, C, Dahl, S. & Hansen, P. Structure sensitivity of supported ruthenium catalysts for ammonia synthesis. Mo/. Catal. A 163, 19-26 (2000).
15. Kastner, J. & Blochl, P. E. Ammonia production at the FeMo cofactor of nitrogenase: results from density functional theory. J. Am. Chem. Soc. 129, 2998-3006 (2007).
16. Howard, J.B. & Rees, D.C. Overview of biological nitrogen fixation. 103, 17088-17093 (2006).
17. Burgess, В.K. & Lowe, D.J. Mechanism of Molybdenum nitrogenase. Chem. Rev. 96, 2983-3012(1996).
18. Marnellos, G. Ammonia synthesis at atmospheric pressure. Science (80-.). 282, 98-100(1998).
19. Marnellos, G., Karagiannakis, G., Zisekas, S. & Stoukides, M. Electrocatalytic synthesis of ammonia at atmospheric pressure. Stud. Surf. Sci. Catal. 130, 413-418(2000).
20. Kordali, V., Kyriacou, G. & Lambrou, C. Electrochemical synthesis of ammonia at atmospheric pressure and low temperature in a solid polymer electrolyte cell. Chem. Commun. 1673-1674(2000). doi:10.1039/b004885m
21. Murakami, Т., Nishikiori, Т., Nohira, Т. & Ito, Y. Electrolytic synthesis of ammonia in molten salts under atmospheric pressure. J. Am. Chem. Soc. 125, 334-335 (2003).
22. Pappenfus, Т.M., Lee, K., Thoma, L.M. & Dukart, C.R. Wind to ammonia: Electrochemical processes in room temperature ionic liquids. ECS Trans. 16, 89-93 (2009).
23. Amar, I. a., Lan, R., Petit, С.T. G., Arrighi, V. & Tao, S. Electrochemical synthesis of ammonia based on a carbonate-oxide composite electrolyte. Solid State Ionics 182, 133-138 (2011).
24. Marnellos, G. Synthesis of ammonia at atmospheric pressure with the use of solid state proton conductors. J. Catal. 193, 80-87 (2000).
25. Denvir, A. & Murphy, O. Electrochemical synthesis of ammonia. WO Pat. 2, (2003).
26. Ouzounidou, M., Skodra, A., Kokkofitis, C. & Stoukides, M. Catalytic and electrocatalytic synthesis of NH3 in a H+ conducting cell by using an industrial Fe catalyst. Solid State Ionics 178, 153-159 (2007).
27. Song, Z., Cai, Т., Hanson, J.C, Rodriguez, J.A. & Hrbek, J. Structure and reactivity of Ru nanoparticles supported on modified graphite surfaces: A study of the model catalysts for ammonia synthesis. J. Am. Chem. Soc. 126, 8576-8584 (2004).
28. Studt, F. & Tuczek, F. Energetics and Mechanism of a Room-Temperature Catalytic Process for Ammonia Synthesis (Schrock Cycle): Comparison with Biological Nitrogen Fixation. Angew. Chemie Int. Ed. 44, 5639-5642 (2005).
29. Logadottir, A. The Bronsted-Evans-Polanyi relation and the volcano plot for ammonia synthesis over transition metal catalysts. J. Catal. 197,229-231 (2001).
30. Norskov, J.K. et al. Origin of the overpotential for oxygen reduction at a fuel-cell cathode. J. Phys. Chem. В 108, 17886-17892 (2004).
31. Rod, Т.H., Logadottir, A. & Norskov, J.K. Ammonia synthesis at low temperatures. J. Chem. Phys. 112, 5343 (2000).
32. Hellman, A. et al. Predicting catalysis: understanding ammonia synthesis from first-principles calculations. J. Phys. Chem. 6110, 17719-17735 (2006).
33. Lin, В. & Wei, К. Carbon-supported Ru catalyst with lithium promoter for ammonia synthesis. Catal. Commun. 41, 110-114 (2013).
34. Pickett, C. & Talarmin, J. Electrosynthesis of ammonia. Nature 317, 652-653 (1985).
35. Chatt, J., Pearman, A. & Richards, R. The reduction of mono-coordinated molecular nitrogen to ammonia in a protic environment. Nature 253, 39-40 (1975).
36. Lowe, D. & Thorneley, R. The mechanism of Klebsiella pneumoniae nitrogenase action. The determination of rate constants required for the simulation of the kinetics of N2 reduction and H2 evolution. Biochem. J 224, 895-901 (1984).
37. Toth, L. Transition metal carbides and nitrides. (Academic press, 1971).
38. Ojha, P., Aynyas, M. & Sanyal, S. P. Pressure-induced structural phase transformation and elastic properties of transition metal mononitrides. J. Phys. Chem. Solids 68,148-152 (2007).
39. Brik, M.G. & Ma, C.-G. First-principles studies of the electronic and elastic properties of metal nitrides XN (X=Sc, Ti, V, Cr, Zr, Nb). Comput. Mater. Sci. 51, 380-388 (2012).
40. Allen, A.D. & Senoff, С.V. Nitrogenopentammineruthenium(II) complexes. Chem. Commun. 2, 621 (1965).
41. Vol'pin, M.E. & Shur, V. B. Nitrogen fixation by transition metal complexes. Nature 1236 (1966).
42. Gambarotta, S. & Scott, J. Multimetallic cooperative activation of N2. Angew. Chem. Int. Ed. Engl. 43, 5298-308 (2004).
43. Hidai, M. & Mizobe, Y. Research inspired by the chemistry of nitrogenase Novel metal complexes and their reactivity toward dinitrogen, nitriles, and alkynes. Can. J. Chem. 83, 358-374 (2005).
44. Studt, F. & Tuczek, F. Theoretical, spectroscopic, and mechanistic studies on transition-metal dinitrogen complexes: implications to reactivity and relevance to the nitrogenase problem. J. Comput. Chem. 27, 1278-1291 (2006).
45. Himmel, H.-J. & Reiher, M. Intrinsic dinitrogen activation at bare metal atoms. Angew. Chem. Int. Ed. Engl. 45,6264-6288 (2006).
46. Ballmann, J., Munha, R.F. & Fryzuk, M.D. The hydride route to the preparation of dinitrogen complexes. Chem. Commun. (Camb). 46, 1013-1025 (2010).
47. Hinrichsen, S., Broda, H., Gradert, C, Soncksen, L. & Tuczek, F. Recent developments in synthetic nitrogen fixation. Annu. Reports Sect. "A " (Inorganic Chem. 108,17(2012).
48. Nishibayashi, Y. Molybdenum-catalyzed reduction of molecular dinitrogen under mild reaction conditions. Dalton Trans. 41, 7447-7453 (2012).
49. Skulason, E. et al. A theoretical evaluation of possible transition metal electro-catalysts for N2 reduction. Phys. Chem. Chem. Phys. 14, 1235-1245 (2012).
50. Howalt, J.G., Bligaard, Т., Rossmeisl, J. & Vegge, T. DFT based study of transition metal nano-clusters for electrochemical NH3 production. Phys. Chem. Chem. Phys. 15, 7785-7795 (2013).
51. Howalt, J.G. & Vegge, T. Electrochemical ammonia production on molybdenum nitride nanoclusters. Phys. Chem. Chem. Phys. 1-25 (2013).
52. Mars, P. & VanKrevelen, D. W. special supplement to Chem. Eng. Sci. 3, 41 (1954).
53. Hohenberg, P. & Kohn, W. Inhomogeneous Electron Gas. Phys. Rev. 155, (1964).
54. Kohn, W. & Sham, L. Self-Consistent Equation Including Exchange and Correlation Effect. Phys. Rev. 385, (1965).
55. Hammer, В., Hansen, L. & Norskov, J. Improved adsorption energetics within density-functional theory using revised Perdew-Burke-Ernzerhof functionals. Phys. Rev. В 59,7413-7421 (1999).
56. Kresse, G. & Furthmuller, J. Efficiency of ab-initio total energy calculations for metals and semiconductors using a plane-wave basis set. Comput. Mater. Sci. 6, 15-50 (1996).
57. Kresse, G. & Furthmuller, J. Efficient iterative schemes for ab initio total-energy calculations using a plane-wave basis set. Phys. Rev. B. Condens. Matter 54, 11169-11186 (1996).
58. Blochl, P. Projector augmented-wave method. Phys. Rev. В 50, 17953-17979 (1994).
59. Kresse, G. & Hafner, J. Ab. initio molecular dynamics for liquid metals. Phys. Rev. В 47, 558-561 (1993).
60. Kresse, G. & Hafner, J. Ab initio molecular-dynamics simulation of the liquid-metal-amorphous-semiconductor transition in germanium. Phys. Rev. В 49, (1994).
61. Henkelman, G., Uberuaga, B.P. & Jonsson, H. A climbing image nudged elastic band method for finding saddle points and minimum energy paths. J. Chem. Phys. 113, 9901 (2000).
62. Henkelman, G. & Jonsson, H. Improved tangent estimate in the nudged elastic band method for finding minimum energy paths and saddle points. J. Chem. Phys. 113, 9978 (2000).
63. Monkhorst, H. & Pack, J. Special Points for Brillouin-zone integrations. Phys. Rev. 613, 5188-5192 (1976).
64. Heyrovsky, J. A theory of overpotential. Reel, des Trav. Chim. des Pays-Bas 179, 44-47 (1927).
65. Darrell D. Ebbing, S. D. G. General Chemistry, Enhanced Edition. 746 (Charles Hartford, 2010).
66. Lide, D.R. CRC Handbook of Chemistry and Physic. (1997).
67. Rao, Y.K. Stoichiometry and Thermodynamics of Metallurgical Processes. (Chambridge University Press, 1985).
68. Reed, Т.B. Free energy of formation of binary compounds: an atlas of charts for high-temperature chemical calculations. (MIT Press Cambridge, Mass., 1971).
69. Hlynsson, V.F., Skulason, E. & Garden, A.L. A systematic, first-principles study of the structural preference and magnetic properties of mononitrides of the d-block metals. J. Alloys Compd. 603, 172-179 (2014).
Пример 2
Дальнейшие DFT расчеты выполнили согласно методологии, описанной выше в Примере 1. Определили изменение свободной энергии RDS нескольких нитридов, как показано на Фиг. 6. Большинство нитридов обнаружили относительно высокую активность в отношении образования аммиака, за исключением ScN, YN и HfN, у которых ΔGRDS > 1,5 эВ. Все нитриды с ΔGRDS ≤ 1,5 эВ были признаны потенциально активными и были сохранены для более детального механистического исследования.
Интересным моментом, который следует отметить, является то, что отсутствует явная тенденция в природе RDS; для некоторых нитридов скорость-определяющим является присоединение первого протона, тогда как для других скорость-определяющим является присоединение третьего, четвертого или пятого протона, а для некоторых RDS является выделение молекулы аммиака. Это отличается от случая электрохимического получения аммиака на чистых металлах, где преимущественно существуют лишь две различных RDS для всего спектра поверхностей чистых переходных металлов. Это приводит к вулканической форме графика активности, построенного в зависимости от стандартного дескриптора. В нашем случае мы не наблюдали линейной связи со стандартным дескриптором, и поскольку тенденции в RDS нет, анализ вулканического графика затруднен, и необходимо в явной форме рассчитать все элементарные стадии для всех нитридов.
Для тех нитридов, которые проявили приемлемую каталитическую активность, когда адсорбция Н была ограничена одним атомом N, рассмотрен неограниченный механизм. При таком подходе на каждой стадии присоединения Н исследуют все возможные центры адсорбции, включая другие атомы N, атомы металла и места образования мостиков. DFT используют для определения наиболее стабильного центра адсорбции на каждой стадии. Диаграммы свободной энергии для образования NH3 в соответствии с этим неограниченным механизмом показаны на Фиг. 7 для (100) грани RS структуры ZrN (а) и (110) грани ZB структуры OsN (b), а остальные содержатся в дополнительном депозитарии.
В случае VN, CrN и RuN обнаружено, что механизм идентичен ограниченному механизму, в котором каждый следующий атом Н присоединяется к тому же атому N с образованием одной молекулы NH3, затем второй молекулы, причем для образования 2NH3 необходимо всего 6(Н+ + е-). В случае ZrN (Фиг. 7а) наличие возможности присоединения Н к любому поверхностному центру приводит вначале к протонированию поверхностного атома Zr, а затем - атома N. Протонирование N является RDS при образовании аммиака, аналогично ограниченному механизму. Однако присутствие атома Н на соседнем атоме Zr снижает свободную энергию образования *NH на 0,23 эВ. Сходный случай обнаружен для NbN, где два соседних атома Nb протонируются перед RDS, которой является протонирование первого поверхностного N. Свободная энергия RDS снижается на 0,29 эВ из-за Н-экрана на ниобии. В случае OsN и MnN неограниченный механизм приводит к другой RDS и другому пути реакции, чем в случае ограниченного механизма. В случае MnN до выделения первой молекулы аммиака образуются 3(*NH2) и 1(*NH), и для образования 2NH3 необходимо 9(Н+ + е-). В этом случае атомы металла не протонируются. В противоположность этому, в случае OsN (Фиг. 7b) Н-атомы закрывают все атомы металла на поверхности и поверхностные атомы N, и для образования 2NH3 необходимо 13(Н+ + е-). В случае OsN присоединение N2(g) для заполнения N-вакансии является эндотермическим, что соответствует увеличению свободной энергии, которое невозможно преодолеть за счет внешнего приложенного напряжения, поскольку в этой стадии присутствует перенос протонов и электронов.
Интересной тенденцией, которую наблюдали при сравнении ограниченного и неограниченного механизмов, является то, что для RS нитридов необходимо относительно небольшое Н-покрытие для получения 2NH3. Кроме того, дополнительные атомы Н обычно присоединяются к соседним атомам металла, а не к другим атомам N, что снижает ΔGRDS примерно на 0,05-0,3 эВ, по сравнению с ограниченным механизмом. В противоположность этому, в случае ZB нитридов необходимо более высокое Н-покрытие для образования 2NH3. Результатом этого является то, что ΔGRDS увеличивается примерно на 0,12 эВ по сравнению с ограниченным механизмом. Для случаев, в которых требуется больше минимальных 6(Н+ + е-) для получения 2NH3, по-видимому, будет наблюдаться более низкая фарадеевская эффективность. В случае TiN и TaN неограниченный механизм обеспечивает полное покрытие поверхности атомами Н без образования NH3. Поэтому каталитическая активность этих нитридов при этом рассматривается как активность потенциальных катализаторов выделения водорода, но эти результаты не входят в объем настоящего исследования.
После исключения нитридов, которые либо не обеспечивают образования аммиака (TiN и TaN), либо имеют начальный потенциал более 1,5 В (ScN, YN и HfN), восемь катализаторов на основе нитридов металлов признаны потенциально активными в отношении образования аммиака и показаны на Фиг. 8. Шесть RS нитридов и RuN с ZB структурой обеспечивают электрохимическое получение аммиака в условиях окружающей среды, тогда как OsN с ZB структурой предпочтительно требует более высокого давления для заполнения N-вакансии и завершения каталитического цикла образования аммиака.
Пример 3
Пригодность катализатора на основе VN для получения аммиака испытали в электролитической ячейке. Эксперимент провели с использованием атмосферного воздуха (78% N2) и воды в качестве реагентов, причем водный раствор в качестве электролита содержал 0,05 М H2SO4. Измерения провели при комнатной температуре и атмосферном давлении. Приложенный потенциал регулировали с помощью потенциостата. Рабочий электрод состоял из VN - одного из перспективных кандидатов по результатам DFT расчетов, тогда как противоэлектрод состоял из Pt, а электродом сравнения был Ag-AgCl электрод. Приведенные значения напряжения пересчитаны в соответствии со шкалой обратимого водородного электрода (RHE; от англ.: reversible hydrogen electrode). Результаты приведены в Таблице 3. Как можно видеть, катализатор на основе VN обеспечил образование аммиака при температуре и давлении окружающей среды с очень высоким выходом и при низком приложенном напряжении, равном -0,3 В относительно RHE. Использование распространенных реагентов и условия, использованные в данном случае, позволят легко перевести этот процесс на коммерческую основу в форме маломасштабного и децентрализованного устройства, и перспективными являются высокие выходы и низкий приложенный потенциал. Повышение скорости от 10-12 моль/см2⋅с до 10-9 моль/см2⋅с, то есть на три порядка, будет способствовать использованию этой системы в практических целях. Этого можно добиться за счет дальнейшего усовершенствования катализатора и усиления переноса электронов к поверхности.

Пример 4
DFT расчеты
Представленные в данной работе результаты рассчитаны методом DFT с использованием обменно-корреляционного функционала RPBE42. Сердцевины ионов и их взаимодействие с валентными электронами были описаны посредством PAW обработки электронов внутренних оболочек, как реализовано в программном пакете Vienna Ab initio Simulation Package (VASP)44,47. Волновые функции валентных электронов были расширены до базисного набора плоских волн с энергией отсечки, равной 350 эВ. Электронная плотность валентных состояний была получена посредством самосогласованной итеративной диагонализации гамильтониана Кона-Шэма с заполнением состояний Кона-Шэма, размытых согласно распределению Ферми-Дирака с параметром размытости kaT, равным 0,1 эВ. Энергии активации рассчитали как наивысшую точку в пути минимальной энергии (МЕР), определенную с использованием метода подталкивания упругой ленты с забирающимся образом (CI-NEB; от англ.: climbing image nudged elastic band)61,62. Зону Бриллюэна систем строили с использованием сетки Монкхорста-Пака размерностью 4×4×1.
В настоящем исследовании проанализировали RS и ZB структуры мононитридов Zr, Nb, Cr и V, поскольку ранее было обнаружено, что они являются очень перспективными для электрохимического получения аммиака (см. Пример 1). Для каждой кристаллической структуры были выбраны две грани с низким индексом - (100) и (111) грани RS структуры и (100) и (110) грани ZB структуры. Для моделирования поверхностей всех нитридов были выбраны 40 атомов, расположенных в пяти слоях, причем каждый слой состоял из четырех атомов металла и четырех атомов азота. Два нижних слоя были фиксированными, тогда как для адсорбированных частиц совместно с тремя верхними слоями нитридов допускалась полная релаксация. Граничные условия были периодическими в х и у направлениях, и соседние пластины были разделены слоем вакуума толщиной 12 А в z направлении. Структурную оптимизацию считали конвергированной, если силы, действующие в любом направлении на все подвижные атомы, были меньше 0,01 эВ/А. Спиновые магнитные моменты VN и CrN были взяты из той же публикации, из которой были взяты RPBE постоянные решеток50.
Электрохимические реакции и моделирование
Механизм Марса - Ван Кревелена (MVK)
В первую очередь был рассмотрен гетерогенный механизм MVK-типа, согласно которому молекула NH3 образуется из поверхностного атома N, и N-вакансия создается перед регенерацией катализатора газообразным N2. Катодная реакция электрохимического процесса имеет вид:
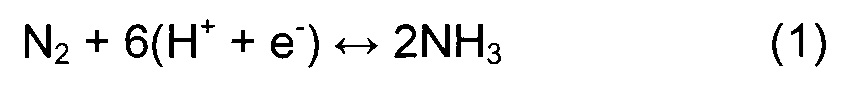
За источник протонов была принята анодная реакция51:
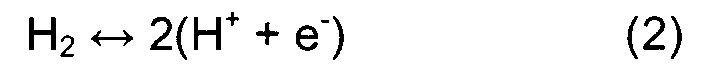
Гидрогенизацию поверхности осуществляют посредством последовательного присоединения к поверхности атомов Н, представляющих собой протон из раствора и электрон с поверхности электрода. В данном исследовании рассматривают три возможных механизма MVK - диссоциативный одновакансионный, димерно-вакансионный и ассоциативный одновакансионный подход. Для всех нитридов вначале исследовали механизм реакции на основании диссоциативного одновакансионного подхода согласно уравнениям (3)-(11).
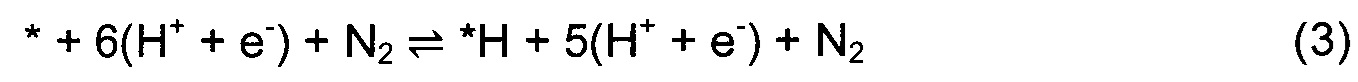

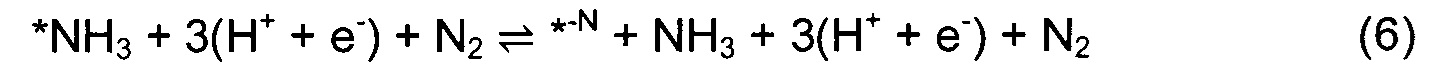


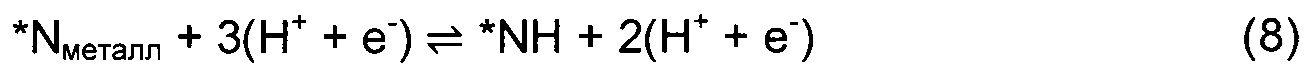



Звездочка * изображает центр на поверхности. N-вакансия в поверхностном слое обозначена как *-N. *Nвак и *Nметалл показывают N-адатом, заполняющий N-вакансию и адсорбирующийся к соседнему атому металла, соответственно. Если обнаруживается, что присоединение N2 для заполнения вакансии является эндотермической стадией, то рассматривают второй подход, в котором после образования первого NH3 протонирование продолжается с образованием второй молекулы, и остается димерная вакансия. Присоединение N2 для заполнения димерной вакансии должно быть экзотермической стадией. Механизм димерно-вакансионного подхода отражен в уравнениях (12)-(20).
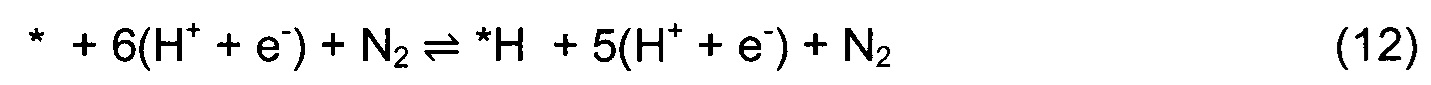








Димерная вакансия в поверхностном слое обозначена как *-2N. В случае медленного и трудного осуществления каталитического цикла в условиях окружающей среды из-за высокого кинетического барьера расщепления N2 на одиночной или димерной вакансии, исследовали возможность ассоциативного одновакансионного механизма MVK. Механизм ассоциативного одновакансионного подхода указан в уравнениях (21)-(29).


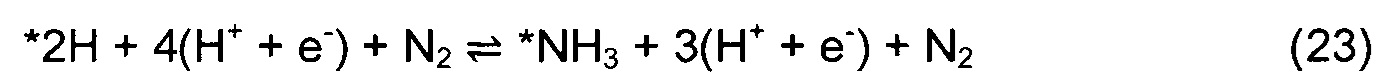


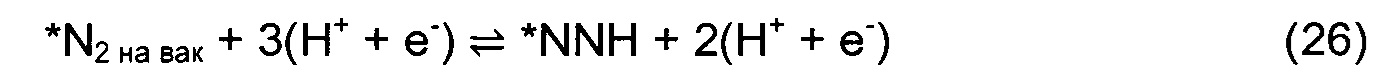
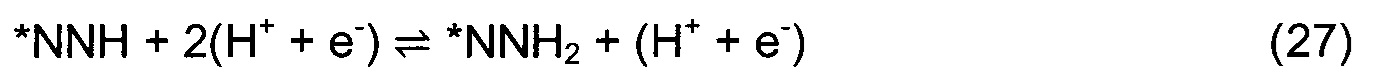


Звездочка * изображает центр на поверхности. *N2на вак изображает N2, ассоциативно связанный с N-вакансией, a *NNH обозначает протонирование наружного N от N2, заполняющего N-вакансию. DFT расчеты использовали для расчета минимальной энергетической конфигурации каждой частицы на поверхности и для расчета энергий адсорбции всех промежуточных продуктов согласно реакциям (3)-(29). Проанализированы различные центры на поверхности, и идентифицирован оптимальный центр связывания. Принято, что активационными барьерами между стабильными минимумами во время электрохимических реакций можно пренебречь. Свободную энергию каждой элементарной стадии и изменение свободной энергии при нулевом потенциале определили при рН = 0 согласно уравнению:

где ΔЕ - это энергия реакции, рассчитанная с использованием DFT. Коррекция нуля энергии (ΔEZPE) и разность энтропий (ΔS) рассчитаны для адсорбированных частиц с использованием вибрационных частот, полученных посредством анализа в нормальном режиме. Значения для газовой фазы взяты из стандартных молекулярных таблиц52. С использованием расчетного стандартного водородного электрода51 химический потенциал для (Н+ + е-) привязывают к потенциалу 1/2Н2(g), а разность свободных энергий для реакции *А + (Н+ + е-) → *АН в стандартных условиях рассчитывают как изменения свободной энергии для реакции *А + 1/2Н2 → *АН. Для всех стадий электрохимической реакции включен эффект приложенного перенапряжения U посредством сдвига свободной энергии для реакций, включающих n электронов, на -neU:51

Включение в явной форме водного слоя53 в данной работе не анализировали из-за необходимости трудных компьютерных расчетов. Показано, что присутствие воды может способствовать большей стабилизации некоторых частиц по сравнению с другими за счет водородных связей. Например, ожидается, что *NH будет слегка стабилизироваться за счет водородных связей, тогда как воздействие водного слоя на *N будет пренебрежимо малым. Стабилизирующий эффект водородных связей на адсорбаты оценили в предыдущей публикации31. Была обнаружена относительно малая поправка на N-H связи, равная примерно 0,08 эВ на Н-связь. Из этого был сделан вывод, что начальные потенциалы, рассчитанные в настоящем исследовании, по-видимому изменяются на сходную величину, то есть менее чем на 0,1 эВ. Поэтому в настоящем исследовании такую коррекцию не производили.
Результаты и обсуждения
В наших предыдущих попытках выявления наиболее стабильных граней и анализа механизма MVK были обнаружены 4 перспективных кандидата для высокопроизводительного электрохимического восстановления N2 до NH3 в условиях окружающей среды (Пример 1). Анализы некоторых граней этих кандидатов были отброшены из-за их низкой стабильности. Однако возможны некоторые структуры/грани, которые обладают исключительно хорошей активностью, но не являются наиболее стабильными гранями. Поэтому активность этих граней нитридных катализаторов в отношении фиксации молекулярного азота заслуживает детального анализа. В последующих подразделах MVK механизм (как одновакансионный, так и димерно-вакансионный подход) изучили в приложении к новым граням, и их активность в отношении восстановления азота сравнили с (100) гранями RS структуры. Затем обратились к другим возможным механизмам и путям электрохимического образования аммиака на этих гранях, включая (100) грани RS структуры, таким как ассоциативные, диссоциативные и смешанные ассоциативно-диссоциативные механизмы.
Каталитическая активность
DFT расчеты использовали для исследования активности различных граней нитридных кандидатов в отношении восстановления азота до аммиака посредством оценки наиболее стабильного центра адсорбции на каждой стадии присоединения Н, в котором оценивали все возможные центры адсорбции, включая другие атомы N, атомы металла и центры образования мостиков. Свободную энергию всех промежуточных продуктов рассчитали по уравнению (30) в пересчете на N2 и Н2 в газовой фазе. Вначале осуществимость MVK механизма исследовали с использованием диссоциативного одновакансионного подхода в соответствии с уравнениями (3)-(11). Если этот подход оказывался блокирующим или замедляющим каталитический цикл в условиях окружающей среды из-за эндотермической стадии заполнения N-вакансии или десорбции N2 с нее, исследовали возможность диссоциативного димерно-вакансионного MVK механизма [согласно уравнениям (12)-(20); показан на Фиг. 9 для RS (111) и ZB (100/110) VN] или ассоциативного одновакансионного MVK механизма [согласно уравнениям (21)-(29); показан на Фиг. 10 для RS (111) ZrN]. Соответственно, для каждой поверхности рассмотрели три подхода и выбрали наиболее выгодный для продолжения работы. На Фиг. 9 диаграммы свободной энергии для двух кристаллических структур и четырех различных граней VN построены при нулевом потенциале в соответствии с MVK механизмом. Одновакансионный подход был более выгодным для RS(100) VN, тогда как димерно-вакансионный подход является более доминантным для других его граней. Кроме различного количества протон-электронных пар, необходимых для каталитического цикла образования 2NH3, другим различием, обнаруженным при сравнении одно- и димерно-вакансионного подхода, является термохимическая диссоциация N≡N связи, которая всегда является экзотермической стадией, сопровождающейся очень большим высвобождением свободной энергии (конечная стадия на RS(111) и ZB(100/110) поверхностях). Это показывает, что расщепление N2 не является PDS для образования аммиака на этих нитридах. Большое изменение свободной энергии, являющееся наиболее экзергонической стадией, можно объяснить большой диссоциативной энергией адсорбции азота на этих поверхностях. Это связано с высокой стабильностью N-адатомов в этом центре и может способствовать расщеплению N2 и заполнению димерной вакансии, с термохимической точки зрения. Однако оценки кинетики этого процесса остаются важными для обеспечения вероятности такой диссоциации и устойчивости каталитического цикла, и они будут рассмотрены в следующем разделе.
PDS и меру каталитической активности в отношении образования NH3 для каждого нитрида определяют как элементарную стадию реакции с наибольшим возрастанием свободной энергии (Фиг. 9, двунаправленные стрелки). Если эту элементарную стадию можно устранить за счет приложенного перенапряжения, то это перенапряжение называют начальным потенциалом, который является напряжением, необходимым для сдвига рельефа свободной энергии таким образом, чтобы снизилась свободная энергия всех стадий реакции. Все перенапряжения, указанные далее в этой публикации, определены относительно стандартного водородного электрода (SHE). Согласно Фиг. 9 для (100) граней RS структуры VN потенциал-определяющей стадией (PDS) является стадия первого протонирования (ANH) с ΔGPDS = +0,51 эВ. Соответственно, при приложении внешнего перенапряжения, равного -0,51 В, можно устранить это увеличение свободной энергии, и свободная энергия всех электрохимических стадий при этом снизится. Для RS(111) VN PDS является образование первой молекулы аммиака (ANH3), и оно является эндотермическим при +0,85 эВ. Для преодоления этого термохимического барьера потребуется перенапряжение, равное -0,85 В, которое будет способствовать протеканию реакции. В случае ZB(100) и (110) PDS является образование второй молекулы аммиака (BNH3), которая еще выше по свободной энергии, равной +1,22 эВ и +1,24 эВ, соответственно, что требует более низких перенапряжений для обеспечения реакции. Также видно, что аммиак по-разному адсорбируется на этих различных гранях VN. Энергия адсорбции первой и второй молекул аммиака рассчитана и равна +0,27 эВ и -0,44 эВ в случае RS(100), +0,85 эВ и +0,54 эВ в случае RS(111), -0,39 эВ и +1,24 эВ в случае ZB(110), +0,96 эВ и +1,22 эВ для ZB(100) поверхностей VN. Поэтому образование и адсорбция NH3 более вероятны на RS(100). С другой стороны, десорбция NH3 всегда является экзотермической на (100/111) RS и (100) ZB. Однако на ZB(110) десорбция второй молекулы NH3 является эндергонической при +0,24 эВ. Тем не менее, в реальности адсорбированный NH3, по-видимому, будет протонироваться дальше до NH4+ и выделяться в раствор, избегая таким образом этого небольшого повышения свободной энергии.
Возможность заполнения N-вакансии и продолжительность каталитического цикла
Для получения непрерывного каталитического цикла N-вакансия, остающаяся после выделения молекулы (или молекул) аммиака, должна заполниться N2(g), инжектированным в систему. Два варианта MVK механизма (одно- и димерно-вакансионный) требуют немного разных принципов заполнения вакансии. В случае димерно-вакансионного механизма MVK ожидается, что молекулярный азот просто диссоциирует в две вакансии, тогда как в случае одновакансионного MVK механизма существуют две возможности, исследованные в данной работе. Первая возможность состоит в диссоциативном заполнении одиночной вакансии. Для того чтобы это происходило, важным фактором является диссоциация молекулярного азота на вакансии, при которой один N-адатом заполняет одиночную вакансию, а второй связывается с соседним атомом металла, после чего протонируется с образованием второй молекулы аммиака и завершает каталитический цикл. Вторая возможность состоит в ассоциативном заполнении одиночной вакансии, при котором N2(g) связывается с одиночной вакансией, после чего наружный атом N протонируется с образованием второй молекулы аммиака и завершает каталитический цикл. Для ассоциативного заполнения вакансии профиль энергии построили исключительно с учетом энергий стабильных промежуточных продуктов. Однако для диссоциативного заполнения одиночной или димерной вакансии учитывали кинетический барьер расщепления N2, поскольку известно, что диссоциация N≡N создает высокие барьеры на многих поверхностях31,33.
Согласно результатам термохимических (Фиг. 2 и Фиг. 12) и кинетических исследований (Фиг. 3), выполненных на всех этих поверхностях, обнаружено, что все RS(100) нитриды, все ZB(110) поверхности, кроме VN, RS(111) и ZB(100) CrN восстанавливают азот до аммиака по диссоциативному MVK механизму, тогда как для RS(111) ZrN, NbN, VN и ZB(100/110) VN более выгодным является ассоциативный MVK механизм. В целом, при сравнении этих различных возможных механизмов обнаружили четыре различных поведения, что отмечено ниже и показано на Фиг. 10 для четырех поверхностей. Другие поверхности в большей или меньшей мере повторяют эту картину, i) Оба механизма работоспособны в условиях окружающей среды со сходными PDS, с образованием сходных частиц на каждой соответствующей стадии и со сходным числом протон-электронных пар (Фиг. 10А). ii) Оба механизма работоспособны в условиях окружающей среды со сходными PDS, но с образованием других частиц и с другим числом протон-электронных пар (Фиг. 10В). iii) Один механизм является более выгодным, чем другой, из-за большего изменения свободной энергии, объясняемого стадией, связанной с заполнением вакансии (Фиг. 10С), iv) Один из механизмов является более медленным из-за немного более высокого барьера для расщепления N2 и менее выгодным из-за более высокой PDS при сходном числе протон-электронных пар, но с образованием на каждой соответствующей стадии других частиц (Фиг. 10D).
DFT расчеты показывают, что свободная энергия при заполнении одиночной вакансии на RS(100) ZrN (Фиг. 2А) на -0,95 эВ ниже при ассоциативном пути, но на -1,44 эВ ниже при диссоциативном. Поэтому, с термодинамической точки зрения, для этой поверхности более выгодным является образование аммиака по диссоциативному одновакансионному принципу. Затем была изучена осуществимость диссоциации N2 с кинетической точки зрения. МЕР для диссоциации N2 на N-вакансии рассчитали с использованием CI-NEB способа, и результаты представлены на Фиг. 11. Обнаружено, что соответствующий барьер для расщепления N2 на ZrN очень низок (0,11 эВ) и поэтому не ограничивает реакцию в условиях окружающей среды. Для RS(100) NbN (Фиг. 10D) он равен -0,20 эВ и является экзотермическим при заполнении N-вакансии по ассоциативному пути, где два соседних атома Н мигрируют для связывания с наружным N-адатомом на вакансии (EN) и образуютENH2. Тем не менее, свободная энергия на -1,26 эВ ниже при диссоциативном заполнении N-вакансии, где один из соседних атомов Н мигрирует кEN и образуетENH. Поэтому для реакции более выгодно идти по диссоциативному пути с образованиемENH, а неENH2. Энергия активации, рассчитанная для расщепления N2 на NbN и заполнения одиночной вакансии, равна 0,35 эВ, что не должно быть проблематичным в условиях окружающей среды. В случае VN (Фиг. 10С) свободная энергия стадии заполнения одиночной вакансии, которая на -0,05 эВ ниже при диссоциативном заполнении, становится на +0,26 эВ выше при ассоциативном заполнении. Следующая стадия (протонирование N-адатома) также изменяется от экзергонической при -0,49 эВ до эндергонической при +0,10 эВ. Хотя эти термодинамические барьеры являются очень низкими и могут быть преодолены в условиях окружающей среды, диссоциативный путь должен быть более выгодным, поскольку активационный барьер для расщепления N2 для заполнения N-вакансии на этой поверхности также рассчитан и является низким (0,30 эВ). Как показано в нашей предыдущей работе, димерно-вакансионный MVK механизм более выгоден для RS(100) CrN. Кинетический анализ заполнения его вакансии выполнен в данном исследовании, и соответствующий барьер для расщепления N2 равен 0,17 эВ, если реакция протекает по диссоциативному димерно-вакансионному механизму. Кроме того, PDS будет равна 0,85 эВ для ассоциативного заполнения N-вакансии. Этого невозможно добиться за счет приложенного перенапряжения, поскольку на этой стадии нет переноса протон-электронной пары. Соответственно, диссоциативный MVK механизм на этой поверхности CrN должен осуществляться гораздо быстрее, чем ассоциативный MVK механизм.
Согласно результатам термохимических (Фиг. 10) и кинетических (Фиг. 11) исследований RS(100) кандидатов, должно быть быстрым и легким заполнение N-вакансии и поддержание устойчивого каталитического цикла по диссоциативному одновакансионному MVK механизму (в случае ZrN, NbN и VN) и димерно-вакансионному MVK механизму (в случае CrN). Мы полагаем, что быстрое расщепление N2 и легкое заполнение N-вакансии может быть объяснено: (i) существованием на этих поверхностях N-вакансионного центра, который активирует крайне инертный N2 и (ii) что наиболее важно, высокой аффинностью этих нитридов (более конкретно - центральных атомов переходных металлов) к азоту, являющейся движущей силой диссоциативной адсорбции N2. Однако для сдвига восстановления в сторону образования аммиака необходимы отрицательные потенциалы, лежащие в диапазоне по меньшей мере от 0,51 В до 0,76 В.
Что касается RS(111) поверхностей, то ассоциативный MVK механизм должен быть более доминантным для образования аммиака на ZrN, NbN и VN. PDS для ZrN равен 1,42 эВ при ассоциативном MVK механизме, но 1,56 эВ при диссоциативном. Кроме того, стадия после выделения первой молекулы аммиака на ZrN является эндергонической при +1,05 эВ при протонировании поверхностного N по диссоциативному пути плюс небольшой кинетический барьер, равный 0,18 эВ, для диссоциации N2 на димерной вакансии (Фиг. 11). Тем не менее, она является экзергонической при -0,70 эВ, если реакция идет по ассоциативному пути и N2 адсорбируется на вакансии (Фиг. 10D). Поэтому первый путь должен быть более выгодным в условиях окружающей среды. Сходным образом, на поверхности NbN ассоциативный механизм может способствовать образованию аммиака, поскольку он на -0,23 эВ более экзотермичен при адсорбции N2 на поверхности (A,EN), чем непрерывное протонирование поверхностного N и образование второго NH3 по диссоциативному пути. Имеется также барьер, равный 0,45 эВ, для расщепления N2 на димерной вакансии, если реакция протекает диссоциативно. В случае CrN ассоциативный MVK механизм должен быть медленным в условиях окружающей среды, поскольку стадия, связанная с заполнением вакансии, становится PDS (ΔGPDS = 0,77 эВ), что невозможно отрегулировать за счет внешнего перенапряжения. В то же время в случае диссоциативного пути протонирование поверхностного N становится PDS и стадией, регулируемой за счет внешнего перенапряжения (ΔGPDS = 0,71 эВ), Тем не менее, барьер для расщепления N2 равен 0,52 эВ, что может еще больше замедлить реакцию по диссоциативному пути. В случае VN, с одной стороны, реакция является на +0,24 эВ более эндотермичной, если она идет по ассоциативному MVK механизму и вакансия заполняется N2 (A,EN), чем при диссоциативном MVK механизме и продолжении протонирования поверхностного N (BNH2). С другой стороны, если реакция идет по диссоциативному MVK механизму, имеется большой барьер, равный примерно 1,15 эВ, для расщепления N2 и заполнения димерной вакансии. Соответственно, несмотря на PDS, которая выше на 0,24 эВ, по-видимому, реакция гораздо легче и быстрее пойдет по ассоциативному пути, что позволить избегнуть такого высокого барьера для расщепления.
Что касается семейства ZB(100), то обнаружено, что ассоциативный MVK механизм неактивен на CrN из-за нестабильности N2-адмолекулы в вакансии, и диссоциативный MVK механизм должен быть более выгодным путем для образования аммиака. В случае VN более низкая PDS была обнаружена при ассоциативном механизме при образовании первой молекулы аммиака (0,97 эВ,ANH3). При диссоциативном пути PDS равна 1,22 эВ при образовании второй молекулы аммиака (BNH3). Кроме того, обнаружен высокий барьер для расщепления N2 на вакансии, равный 1,57 эВ. Соответственно, ассоциативный путь должен быть доминантным механизмом для этого нитрида. На ZB(100) ZrN и NbN оба механизма одинаково работоспособны, особенно в случае NbN, поскольку имеется лишь крохотный барьер, равный 0,04 эВ, для расщепления N2 на вакансии, легко преодолимый в условиях окружающей среды. Тем не менее, на ZrN диссоциативная реакция может идти немного медленнее из-за барьера для расщепления, равного 0,46 эВ. На CrN PDS реакции равна 0,76 эВ (ANENH), если реакция протекает по ассоциативному MVK механизму, но снижается до 0,54 эВ (ACrHA,BNH), если она протекает по диссоциативному MVK механизму. На VN образование аммиака быстрее идет по ассоциативному MVK механизму с PDS, равной 1,06 эВ. В случае диссоциативного механизма PDS равна 1,24 эВ плюс небольшой барьер, равный 0,21 эВ, для расщепления азота.
Изменение свободной энергии для PDS на каждой грани нитридов-кандидатов, показанное на Фиг. 12, основано на наиболее выгодном механизме реакции, разъясненном выше. Большинство граней обнаруживают относительно высокую активность в отношении образования аммиака. Что касается PDS реакции, то у этих нитридов не обнаружено явной тенденции. В случае RS(100) граней ZrN, NbN и VN PDS является стадия первого протонирования поверхностного N. Тогда как для некоторых граней PDS является образование молекулы аммиака (например, RS(111) ZrN и VN, а также ZB(100) VN). Результат этих каталитических исследований показывает, что диссоциация молекулярного азота не является PDS н на одной из указанных поверхностей. Соответственно, был сделан вывод, что нитридные катализаторы способны сдвигать критический участок синтеза аммиака от расщепления N2 к последующему образованию азот-водородных частиц (*NH, *NH2 или *NH3), в связи с чем можно ожидать более легкого получения аммиака с более высокой скоростью.
Другим новым результатом настоящего исследования согласно Фиг. 12 является то, что, кроме перспективных (100) граней VN, использовавшихся ранее, (110) грани ZB структуры CrN и NbN также представляются очень активными в отношении образования аммиака по сравнению с другими RS и ZB аналогами. С учетом того, что наилучшим катализатором является катализатор с ΔGPDS < 1,0 эВ, активность этих нитридов снижается в следующем порядке: RS(100) VN, ZB(110) CrN и NbN с 0,51-0,59 эВ > RS(100) NbN с 0,65 эВ > RS(111) CrN, RS(100) CrN и ZrN с 0,71-0,76 эВ > RS(111) VN с 0,85 эВ > ZB(100) VN с 0,97 эВ > ZB(110) ZrN и VN с 1,02-1,06 эВ > ZB(100) CrN с 1,11 эВ > RS(111) ZrN с 1,42 эВ. Если эти 4 категории сравнить друг с другом на основании ориентации текстуры граней, то наиболее активную ориентацию в случае RS(100), RS(111), ZB(100) и ZB(110) имеют VN, CrN, VN и CrN, соответственно. Поэтому, с точки зрения активности, катализаторы на основе VN и CrN являются наиболее перспективными кандидатами для электрохимического получения аммиака, поскольку их активность выше на большем количестве граней, чем у других нитридов, исследованных в данной работе. С учетом более высокой фарадеевской эффективности, обеспечиваемой за счет меньшего числа электрон-протонных пар, которые нужно перенести для образования 2NH3, лучшими также должны быть RS(100) VN и CrN, поскольку они обеспечивают каталитический цикл на минимуме, равном 6(Н+ + е-).
Другим интересным наблюдением является то, что наиболее выгодным центром адсорбции Н для (111) грани является поверхностный N без тенденции к связыванию Н с соседним атомом (или атомами) металла даже при высоком покрытии. Хотя на других гранях обычно наблюдается адсорбция Н на соседнем атоме (или атомах) металла, при низком покрытии она является минимальной энергетической конфигурацией. Это означает, что на (111) гранях все добавленные протоны прочно связываются с поверхностными N, и невозможно получить первую молекулу аммиака без первоначального заполнения всех поверхностных N и образования 4NH (A-BNH) плюс один или два NH2 (A,BNH2). Тогда как на других гранях нитридов всегда вместе с поверхностным N протонируются один или два соседних атома металла, что приводит к образованию большего покрытия и требует явно более 6(Н+ + е-) для завершения каталитического цикла с образованием 2NH3. Это различное поведение может быть обусловлено компактной кристаллографией RS(111) и поверхностными атомами N, выступающими из поверхности. Это может снизить стерическое несоответствие и сделать поверхностные атомы N более доступными для протонов по сравнению с соседними атомами металла. Другое наблюдаемое различие состоит в том, что почти всегда в тех случаях, когда соседний атом (или атомы) металла протонируется совместно с поверхностным азотом, это немного снижает свободную энергию PDS. Как показано в предыдущей работе (Пример 1), из-за популяции протонов на соседнем атоме (или атомах) металла и эффекта покрытия, проявляющегося в смещении от ограниченного к неограниченному механизму, ΔGPDS снижалось в пределах до 0,3 эВ. Это может частично объяснить сделанное ранее наблюдение относительно более высокого ΔGPDS на (111) гранях, где такое покрытие отсутствует. Единственным исключением, однако, является VN, поскольку протонирование металла не является минимальной энергетической конфигурацией ни на одной из его граней, и протоны прочно адсорбируют только поверхностные атомы N.
Стабильность вакансии на поверхности
В MVK механизме поверхностный атом азота восстанавливается с образованием NH3, вследствие чего остается N-вакансия. Затем, как показано ранее, молекула газообразного N2 заполняет образовавшуюся N-вакансию, но только в том случае, если она стабильна на поверхности. В противном случае, азот, прореагировавший на поверхности, замещается дополнительными атомами азота из катализатора, а не из газообразного N2 (миграция N-вакансии в объем). Этот процесс в принципе может продолжаться до тех пор, пока все атомы азота нитрида металла не прореагируют и не образуют NH3, после чего останется лишь чистый металл. Стабильность N-вакансии на поверхности катализатора оценивали, сравнивая разность энергии нитридной пластины с N-вакансией в поверхностном слое (Evac,1) и энергии пластины с N-вакансией в первом подповерхностном слое (Evac,2). Нашли минимальную энергетическую конфигурацию каждой из этих пластин и разность энергий (ΔEvac = Evac,2 - Evac,1) использовали в качестве оценки термодинамической стабильности вакансии на поверхности нитрида. Также рассчитали активационные барьеры для миграции вакансии (Еа,vac), и результаты, полученные для ΔEvac и Еа,vac, представлены на Фиг. 13. Кроме RS(111) ZrN, Zb(110) CrN и ZB(100) CrN и VN, термодинамически выгодной для вакансии является ее миграция в объем, поскольку ΔEvac меньше нуля или близка к нулю. Однако очевидно, что многие из исследованных нитридов имеют высокий активационный барьер для миграции вакансии, и поэтому ожидается, что они продемонстрируют стабильную N-вакансию на поверхности. Следует уделить внимание ZB(110) NbN в отношении возможной миграции вакансии в объем, так как в данном случае нет ни термодинамического, ни кинетического барьера для предотвращения этого. Поэтому, несмотря на очень высокую активность этого нитрида в отношении NRR, может быть невозможно заполнить его N-вакансию N2(g), поскольку вакансия мигрирует в объем. С учетом термодинамики реакции и более высокого барьера для миграции в случае ZB(110) VN, стабильность вакансии на поверхности может быть в некоторой степени сохранена, поскольку кинетический барьер, равный 0,51 эВ, может замедлять ее миграцию в условиях окружающей среды. Необходимы дополнительные предосторожности, если поликристаллические пленки нитридов используют в электрохимической установке. Поскольку при миграции вакансии в объем на специфической грани вероятно, что начнется утечка и на других гранях, даже со стабильными вакансиями на поверхности. Это приведет к восстановлению всего содержания N в нитриде без заполнения вакансии, к прекращению каталитического цикла и к преобразованию нитридного катализатора в чистый металл.
Ссылки
31. Skulason, Е. et al. A theoretical evaluation of possible transition metal electro-catalysts for N2 reduction. Phys. Chem. Chem. Phys. 14, 1235-1245 (2012).
33. Howalt, J.G. & Vegge, T. Electrochemical ammonia production on molybdenum nitride nanoclusters. Phys. Chem. Chem. Phys. 15, 20957-20965 (2013).
42. Hammer, B. Hansen, L. & Norskov, J. Improved adsorption energetics within density-functional theory using revised Perdew-Burke-Ernzerhof functionals. Phys. Rev. В 59, 7413-7421 (1999).
43. Blochl, P. Projector augmented-wave method. Phys. Rev. В 50, 17953-17979 (1994).
44. Kresse, G. & Hafner, J. Ab. initio molecular dynamics for liquid metals. Phys. Rev. В 47, 558-561 (1993).
45. Kresse, G. & Hafner, J. Ab initio molecular-dynamics simulation of the liquid-metal-amorphous-semiconductor transition in germanium. Phys. Rev. В 49, 14251-14269 (1994).
46. Kresse, G. & Furthmuller, J. Efficiency of ab-initio total energy calculations for metals and semiconductors using a plane-wave basis set. Comput. Mater. Sci. 6, 15-50 (1996).
47. Kresse, G. & Furthmuller, J. Efficient iterative schemes for ab initio total-energy calculations using a plane-wave basis set. Phys. Rev. B. Condens. Matter 54, 11169-11186 (1996).
48. Henkelman, G., Uberuaga, B.P. & Jonsson, H. A climbing image nudged elastic band method for finding saddle points and minimum energy paths. J. Chem. Phys. 113, 9901-9904 (2000).
49. Henkelman, G. & Jonsson, H. Improved tangent estimate in the nudged elastic band method for finding minimum energy paths and saddle points. J. Chem. Phys. 113, 9978-9985 (2000).
50. Hlynsson, V.F., Skulason, E. & Garden, A.L. A systematic, first-principles study of the structural preference and magnetic properties of mononitrides of the d-block metals. J. Alloys Compd. 603, 172-179 (2014).
51. Norskov, J.K. et al. Origin of the overpotential for oxygen reduction at a fuel-cell cathode. J. Phys. Chem. В 108, 17886-17892 (2004).
52. Atkins, P.W. Physical Chemistry. C9-C14 (1994).
Реферат
Изобретение относится к способу получения аммиака, включающему: подачу газообразного азота в электролитическую ячейку, где он вступает в контакт с поверхностью катодного электрода, причем эта поверхность содержит каталитическую поверхность, содержащую нитридный катализатор, содержащий один или более нитридов, выбранных из группы, состоящей из нитрида ванадия, нитрида циркония, нитрида хрома, нитрида ниобия и нитрида рутения, и электролитическая ячейка содержит донор протонов, и пропускание электрического тока через электролитическую ячейку, за счет чего азот реагирует с протонами с образованием аммиака. Также изобретение относится к системе получения аммиака и способу удаления NOи/или SОгаза из потока газа. Использование предлагаемого изобретения позволяет получать аммиак при комнатной температуре окружающей среды и атмосферном давлении. 3 н. и 11 з.п. ф-лы, 13 ил., 2 табл., 4 пр.

Комментарии