Оптимизированные гены и экспрессионные кассеты мини-дистрофина и их применение - RU2753194C2
Код документа: RU2753194C2
Чертежи


























































Описание
ЗАЯВЛЕНИЕ О ФИНАНСИРУЕМЫХ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА ИССЛЕДОВАНИЯХ ИЛИ РАЗРАБОТКАХ
Данное изобретение было осуществлено при финансовой поддержке правительства в рамках грантов с номерами AR050595, AR056394 и AR056953, присужденных Национальными институтами здоровья. Правительство имеет определенные права на данное изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к полинуклеотидам, кодирующим белки мини-дистрофина, содержащим их вирусным векторам и способам их использования для доставки мини-дистрофина в клетку или организм индивида.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Мышечная дистрофия Дюшенна (DMD) представляет собой тяжелое связанное с X-хромосомой прогрессирующее нервно-мышечное заболевание, от которого страдает примерно один из 3600-9200 живорожденных лиц мужского пола. Заболевание вызывают мутации со сдвигом рамки в гене дистрофина, приводящие к отсутствию экспрессии белка дистрофина. Из-за отсутствия белка дистрофина скелетные мышцы и, в итоге, мышцы сердца и дыхательных путей (например, межреберные мышцы и диафрагма) дегенерируют, что приводит к преждевременной смерти. Прогрессирующая слабость и мышечная атрофия возникает в детстве, начиная с нижних конечностей и таза, а затем распространяется на верхние конечности. Другие симптомы включают утрату некоторых рефлексов, ковыляющую походку, частые падения, трудности при вставании из сидящего или лежачего положения, трудности при подъеме по лестнице, изменения общей осанки, нарушения дыхания и кардиомиопатию. Многие дети неспособны быстро бегать или прыгать. Атрофированные мышцы, особенно икроножные мышцы (и, реже, мышцы ягодиц, плеч и рук), могут быть увеличены за счет накопления жира и соединительной ткани, вследствие чего они выглядят более развитыми и здоровыми, чем они в действительности не являются (так называемая псевдогипертрофия). Обычными являются истончение костей и сколиоз. В итоге теряется способность к независимому передвижению и возникает необходимость в кресле-коляске, в большинстве случаев в возрасте 12-15 лет. По мере прогрессирования заболевания мышцы в диафрагме, задействованные в дыхании и при кашле, становятся слабее. Больные люди испытывают трудности с дыханием, страдают от респираторных инфекций и проблем с глотанием. Почти у всех пациентов с DMD развивается кардиомиопатия. Пневмония с осложнениями со стороны сердца является наиболее распространенной причиной смерти, которая часто наступает до третьего десятилетия жизни.
Мышечная дистрофия Беккера (BMD) имеет менее тяжелые симптомы, чем DMD, но также приводит к преждевременной смерти. В сравнении с DMD, BMD характеризуется более поздним развитием слабости скелетных мышц. В то время как пациенты с DMD начинают передвигаться в кресле-коляске до исполнения им 13 лет, пациенты с BMD теряют способность самостоятельно передвигаться и нуждаются в кресле-коляске в возрасте старше 16 лет. У пациентов с BMD сохраняется сила мышц-сгибателей шеи, в отличие от пациентов с DMD. Несмотря на меньшую вовлеченность скелетных мышц, сердечная недостаточность вследствие связанной с DMD дилатационной кардиомиопатии (DCM) является частой причиной осложнений и наиболее распространенной причиной смерти при BMD, которая наступает, в среднем, в возрасте 40 с небольшим лет.
Дистрофин представляет собой цитоплазматический белок, кодируемый геном dmd, его функция заключается в связывании актиновых филаментов цитоскелета с мембранными белками. Обычно белок дистрофин, находящийся преимущественно в скелетных и сердечных мышцах, с небольшими количествами, экспрессируемыми в мозге, действует как амортизатор при сокращении мышечных волокон путем связывания актина сократительного аппарата со слоем соединительной ткани, окружающим каждое мышечное волокно. В мышцах дистрофин находится на цитоплазматической поверхности мембраны сарколеммы.
Впервые обнаруженный в 1987 г., ген dmd представляет собой самый большой известный ген человека размером примерно 2,5 м.п.н. Ген расположен на X-хромосоме в положении Xp21 и содержит 79 экзонов. Наиболее распространенными мутациями, которые вызывают DMD или BMD, являются мутации больших делеций одного или более экзонов (60-70%), однако мутации дупликации (5-10%) и однонуклеотидные варианты (включая небольшие делеции или вставки, одиночные замены нуклеотидов и изменения сайтов сплайсинга, составляющие примерно 25%-35% патогенных вариантов у мужчин с DMD и примерно 10%-20% у мужчин с BMD) также могут являться причиной образования патогенных вариантов дистрофина.
При DMD мутации часто приводят к сдвигу рамки считывания, следствием чего является преждевременное появление стоп-кодона и образование укороченного, нефункционального или нестабильного белка. Точечные нонсенс-мутации также могут приводить к преждевременному появлению стоп-кодонов, с тем же результатом. При том, что мутации, вызывающие DMD, могут затрагивать любой экзон, экзоны 2-20 и 45-55 обычно являются «горячими точками» для мутаций больших делеций и дупликаций. Делеции в рамке считывания приводят к менее тяжелой форме мышечной дистрофии Беккера (BMD), при которой у пациентов экспрессируется укороченный, частично функциональный дистрофин.
Полноразмерный дистрофин представляет собой крупный (427 кДа) белок, содержащий ряд субдоменов, участвующих в выполняемой им функции. Эти субдомены включают, в порядке расположения от амино-конца к карбокси-концу, N-концевой актин-связывающий домен, центральный, так называемый «стержневой» домен, цистеин-богатый домен и, наконец, карбокси-концевой домен, или область. Стержневой домен состоит из 4 пролин-богатых шарнирных доменов (обозначаемых H) и 24 спектриновых повторов (обозначаемых R) в следующем порядке: первый шарнирный домен (H1), 3 спектриновых повтора (R1, R2, R3), второй шарнирный домен (H2), еще 16 спектриновых повторов (R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R17, R18, R19), третий шарнирный домен (H3), еще 5 спектриновых повторов (R20, R21, R22, R23, R24) и, наконец, четвертый шарнирный домен (H4). Субдомены возле карбокси-конца белка вовлечены в связывание с дистрофин-ассоциированным гликопротеиновым комплексом (DGC), крупным белковым комплексом, являющимся важным звеном между цитоскелетом и внеклеточным матриксом.
Никакое лечение не способно окончательно останавливать или обращать вспять прогрессирование DMD. Современным стандартом медицинской помощи является лечение кортикостероидами, однако оно всего лишь замедляет прогрессирование болезни на год или два. Недавно несколько новых лекарственных средств для терапии DMD были одобрены регуляторными органами. В их число входит аталурен, вызывающий сквозное прохождение рибосомы через преждевременные стоп-кодоны, и этеплирсен, вызывающий пропуск экзона 51, результатом чего является образование содержащего внутреннюю делецию частично функционального дистрофина. Однако не ожидается, что механизм действия этих лекарственных средств поможет лечению пациентов с DMD, и необходимы дополнительные доказательства их клинической эффективности при DMD.
С достигнутыми за последние 10-15 лет успехами в опосредованной аденоассоциированным вирусом (AAV) генной терапии, потенциально способной лечить различные редкие заболевания, возродился интерес и надежда на то, что AAV может быть использован для лечения DMD и менее тяжелых дистрофинoпатий (то есть, других мышечных заболеваний, связанных с мутациями в гене dmd). В связи с ограничением размера полезной нагрузки AAV векторов, усилия были сосредоточены на создании микро- или мини-дистрофинов, меньших по размеру вариантов дистрофина, в которых элиминированы несущественные субдомены, но сохранены по меньшей мере некоторые функции полноразмерного белка. Опосредованная AAV генная терапия мини-дистрофином показала многообещающие результаты у мышей mdx, животной модели DMD, с обширной экспрессией в мышцах и доказательством улучшения мышечной функции (смотри, например, Wang et al., J. Orthop. Res. 27:421 (2009)). Однако, когда аналогичные эксперименты с использованием вектора для микро-дистрофина были проведены на собаках GRMD, модели DMD, потребовались сильные иммунодепрессанты для достижения значительной трансдукции мышечных клеток (Yuasa et al., Gene Ther. 14:1249 (2007)). Аналогично, когда пациенты-люди с DMD получали AAV векторы, сконструированные для экспрессии мини-дистрофина, минимальный белок был обнаружен только у двух из шести пациентов, в то время как T-клеточный ответ против белка мини-дистрофина был стимулирован у трех пациентов (Bowles, et al., Mol Ther. 20(2):443-455 (2012)).
Таким образом, в данной области существует потребность в AAV векторах, кодирующих мини-дистрофины, которые могут быть экспрессированы на высоком уровне в трансдуцированных клетках индивидов, страдающих DMD, и при этом иммунные ответы на белок мини-дистрофин будут сведены к минимуму.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем документе раскрыты и приведены в качестве примеров белки мини-дистрофина, кодон-оптимизированные гены для экспрессии таких белков мини-дистрофина, AAV векторы для трансдукции клеток такими генами, а также способы предотвращения и лечения с использованием таких AAV векторов, в частности, предотвращения и лечения дистрофинoпатий у индивидов, которые нуждаются в этом. В некоторых из этих вариантов осуществления AAV векторы по изобретению способны контролировать продукцию значительных уровней мини-дистрофина в трансдуцированных клетках, в то же время не вызывая, или вызывая лишь ослабленный, иммунный ответ против белка мини-дистрофина.
Некоторые неограничивающие варианты осуществления (E) по изобретению приведены ниже. Эти и связанные варианты осуществления описаны более подробно в разделе «Подробное описание изобретения», включая примеры и чертежи.
E1. Белок мини-дистрофин, содержащий, состоящий в основном из, или состоящий из N-конца, актин-связывающего домена (ABD), шарнира H1, стержней R1 и R2, шарнира H3, стержней R22, R23 и R24, шарнира H4, цистеин-богатого (CR) домена и части карбокси-концевого (CT) домена мышечного белка дистрофина человека дикого типа (SEQ ID NO:25), при этом CT домен не содержит последние три аминокислотных остатка на карбокси-конце белка дистрофина дикого типа.
E2. Белок мини-дистрофин по п. E1, в котором N-конец и актин-связывающий домен (ABD) в совокупности содержат, состоят в основном из, или состоят из аминокислотных остатков 1-240 в SEQ ID NO:25; шарнир H1 содержит, состоит в основном из, или состоит из аминокислотных остатков 253-327 в SEQ ID NO:25; стержень R1 содержит, состоит в основном из, или состоит из аминокислотных остатков 337-447 в SEQ ID NO:25; стержень R2 содержит, состоит в основном из, или состоит из аминокислотных остатков 448-556 в SEQ ID NO:25; шарнир H3 содержит, состоит в основном из, или состоит из аминокислотных остатков 2424-2470 в SEQ ID NO:25; стержень R22 содержит, состоит в основном из, или состоит из аминокислотных остатков 2687-2802 в SEQ ID NO:25; стержень R23 содержит, состоит в основном из, или состоит из аминокислотных остатков 2803-2931 в SEQ ID NO:25; стержень R24 содержит, состоит в основном из, или состоит из аминокислотных остатков 2932-3040 в SEQ ID NO:25; шарнир H4 содержит, состоит в основном из, или состоит из аминокислотных остатков 3041-3112 в SEQ ID NO:25; CR домен содержит, состоит в основном из, или состоит из аминокислотных остатков 3113-3299 в SEQ ID NO:25; и часть CT домена содержит, состоит в основном из, или состоит из аминокислотных остатков 3300-3408 в SEQ ID NO:25.
E3. Белок мини-дистрофин по любому из пп. E1 и E2, который содержит, состоит в основном из, или состоит из аминокислотной последовательности SEQ ID NO:7.
E4. Белок мини-дистрофин, содержащий, состоящий в основном из, или состоящий из N-конца, актин-связывающего домена (ABD), шарнира H1, стержней R1, R2, R22, R23 и R24, шарнира H4, цистеин-богатого (CR) домена и части карбокси-концевого (CT) домена мышечного белка дистрофина человека дикого типа (SEQ ID NO:25), при этом CT домен не содержит последние три аминокислотных остатка на карбокси-конце белка дистрофина дикого типа.
E5. Белок мини-дистрофин по п. E4, в котором N-конец и актин-связывающий домен (ABD) в совокупности содержат, состоят в основном из, или состоят из аминокислотных остатков 1-240 в SEQ ID NO:25; шарнир H1 содержит, состоит в основном из, или состоит из аминокислотных остатков 253-327 в SEQ ID NO:25; стержень R1 содержит, состоит в основном из, или состоит из аминокислотных остатков 337-447 в SEQ ID NO:25; стержень R2 содержит, состоит в основном из, или состоит из аминокислотных остатков 448-556 в SEQ ID NO:25; стержень R22 содержит, состоит в основном из, или состоит из аминокислотных остатков 2687-2802 в SEQ ID NO:25; стержень R23 содержит, состоит в основном из, или состоит из аминокислотных остатков 2803-2931 в SEQ ID NO:25; стержень R24 содержит, состоит в основном из, или состоит из аминокислотных остатков 2932-3040 в SEQ ID NO:25; шарнир H4 содержит, состоит в основном из, или состоит из аминокислотных остатков 3041-3112 в SEQ ID NO:25; CR домен содержит, состоит в основном из, или состоит из аминокислотных остатков 3113-3299 в SEQ ID NO:25; и часть CT домена содержит, состоит в основном из, или состоит из аминокислотных остатков 3300-3408 в SEQ ID NO:25.
E6. Белок мини-дистрофин по любому из пп. E4 и E5, который содержит, состоит в основном из, или состоит из аминокислотной последовательности SEQ ID NO:8.
E7. Полинуклеотид, кодирующий белок мини-дистрофин по пунктам E1-E3.
E8. Полинуклеотид, кодирующий белок мини-дистрофин по пунктам E4-E6.
E9. Полинуклеотид по любому из пп. E7 и E8, нуклеотидная последовательность которого собрана из кодирующей последовательности природного гена дикого типа, кодирующего полноразмерный человеческий мышечный дистрофин, примером которого является эталонная последовательность NM_004006.2 в NCBI.
E10. Полинуклеотид по п. E9, нуклеотидная последовательность которого приведена в SEQ ID NO:26.
E11. Полинуклеотид по любому из пп. E7-E10, нуклеотидная последовательность которого является кодон-оптимизированной.
E12. Полинуклеотид по п. E11, в котором кодон-оптимизация приводит к уменьшению или увеличению содержания GC в сравнении с последовательность дикого типа.
E13. Полинуклеотид по п. E11, в котором кодон-оптимизация приводит к уменьшению или увеличению числа динуклеотидов CpG в сравнении с последовательность дикого типа.
E14. Полинуклеотид по п. E11, в котором кодон-оптимизация приводит к удалению одного или более криптических сайтов сплайсинга.
E15. Полинуклеотид по п. E11, в котором кодон-оптимизация приводит к удалению одного или более участков посадки рибосомы, отличных от участка в начале кодирующей последовательности для белка мини-дистрофина.
E16. Полинуклеотид по п. E11, в котором кодон-оптимизация приводит к замене одного или более редких кодонов на кодоны, которые встречаются с большей частотой в типе и/или виде клетки, в которой будет экспрессирован ген мини-дистрофина.
E17. Полинуклеотид по п. E12, в котором кодон-оптимизация приводит к увеличению содержания GC в сравнении с последовательностью дикого типа и увеличению уровня экспрессии гена на по меньшей мере 50%, 100%, 150%, 200%, 250%, 300%, 350%, 400%, 450%, 500%, 550%, 600%, 650%, 700%, 750%, 800%, 900%, 1000% или более.
E18. Полинуклеотид по п. E12, в котором кодон-оптимизация приводит к увеличению содержания GC в сравнении с последовательностью дикого типа на по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100% или более.
E19. Полинуклеотид по п. E12, в котором содержание GC составляет примерно или по меньшей мере 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70% или более.
E20. Полинуклеотид по п. E13, в котором кодон-оптимизация приводит к уменьшению или увеличению числа динуклеотидов CpG в сравнении с последовательностью дикого типа на примерно или по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60% или более.
E21. Полинуклеотид по п. E20, в котором число динуклеотидов CpG, в случае его уменьшения, уменьшено на количество, достаточное для полной или частичной супрессии сайленсинга экспрессии гена из-за метилирования CpG-мотивов.
E22. Полинуклеотид по п. E11, в котором кодон-оптимизация приводит к увеличению индекса адаптации кодонов (CAI) гена мини-дистрофина относительно высоко экспрессируемых генов человека до величины, которая составляет по меньшей мере 0,70, 0,71, 0,72, 0,73, 0,74, 0,75, 0,76, 0,77, 0,78, 0,79, 0,80, 0,81, 0,82, 0,83, 0,84, 0,85, 0,86, 0,87, 0,88, 0,89, 0,90, 0,91, 0,92, 0,93, 0,94, 0,95, 0,96, 0,97, 0,98 или 0,99.
E23. Полинуклеотид по любому из пп. E11-E22, нуклеотидная последовательность которого кодон-оптимизирована для человека.
E24. Полинуклеотид по любому из пп. E11-E22, нуклеотидная последовательность которого кодон-оптимизирована для собаки.
E25. Полинуклеотид по п. E23, последовательность которого, кодон-оптимизированная для человека, представляет собой SEQ ID NO:1, или нуклеотидную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,5% идентичную ей.
E26. Полинуклеотид по п. E23, последовательность которого, кодон-оптимизированная для человека, представляет собой SEQ ID NO:2, или нуклеотидную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,5% идентичную ей.
E27. Полинуклеотид по п. E24, последовательность которого, кодон-оптимизированная для собаки, представляет собой SEQ ID NO:3, или нуклеотидную последовательность, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,5% идентичную ей.
E28. Вектор, содержащий полинуклеотид по любому из пп. E7-E27.
E29. Вектор по п. E28, в котором полинуклеотид функционально связан с областью генетического контроля.
E30. Вектор по п. E29, в котором область генетического контроля представляет собой промотор.
E31. Вектор по п. E30, в котором промотор является специфическим для мышц в том, что он более активен в мышечных клетках в сравнении с клетками других типов, например клетками печени.
E32. Вектор по любому из пп. E30-E31, в котором область генетического контроля также включает энхансер.
E33. Вектор по любому из пп. E30-E32, в котором промотор и энхансер, при наличии, происходят из гена мышечной креатинкиназы (CK).
E34. Вектор по п. E33, в котором ген CK является геном мыши или человека.
E35. Вектор по п. E33, в котором область генетического контроля представляет собой энхансер и промотор CK7 мыши.
E36. Вектор по любому из пп. E29-E36, в котором область генетического контроля содержит нуклеотидную последовательность, выбранную из группы SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:16.
E37. Вектор по любому из пп. E28-E36, в котором полинуклеотид функционально связан с областью терминатора транскрипции.
E38. Вектор по п. E37, в котором область терминатора транскрипции содержит нуклеотидную последовательность SEQ ID NO:6 или SEQ ID NO:17.
E39. Вектор по любому из пп. E28-E38, представляющий собой геном AAV вирусного вектора и содержащий фланкирующие AAV инвертированные концевые повторы (ITR).
E40. Вектор по п. E39, в котором оба ITR представляют собой AAV2 ITR.
E41. Вектор по любому из пп. E39 и E40, нуклеотидная последовательность которого представляет собой нуклеотидную последовательность, выбранную из группы SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:18.
E42. Рекомбинантная AAV (rAAV) частица, содержащая AAV капсид и вектор по любому из пп. E39-E41.
E43. rAAV частица по п. E42, в которой AAV капсид представляет собой AAV9 капсид.
E44. rAAV частица, содержащая AAV капсид, имеющий тропизм к поперечно-полосатым мышцам, и векторный геном для экспрессии человеческого белка мини-дистрофина.
E45. rAAV частица по п. E44, в которой AAV капсид относится к серотипу AAV9.
E46. rAAV частица по любому из пп. E44 и E45, в которой векторный геном содержит кодон-оптимизированную для человека нуклеотидную последовательность, кодирующую человеческий белок мини-дистрофин.
E47. rAAV частица по любому из пп. E44-E46, при этом человеческий белок мини-дистрофин содержит следующие субдомены или их части из полноразмерного мышечного белка дистрофина человека, расположенные в порядке от N-конца к C-концу: N-концевой домен, актин-связывающий домен (ABD), шарнир H1, стержень R1, стержень R2, шарнир H3, стержень R22, стержень R23, стержень R24, шарнир H4, цистеин-богатый (CR) домен и часть карбокси-концевого (CT) домена, при этом часть CT домена не содержит последние 3 аминокислоты из дистрофина.
E48. rAAV частица по любому из пп. E44-E47, при этом человеческий белок мини-дистрофин содержит аминокислотную последовательность SEQ ID NO:7.
E49. rAAV частица по любому из пп. E44-E46, при этом человеческий белок мини-дистрофин содержит следующие субдомены или их части из полноразмерного мышечного белка дистрофина человека, расположенные в порядке от N-конца к C-концу: N-концевой домен, актин-связывающий домен (ABD), шарнир H1, стержень R1, стержень R2, стержень R22, стержень R23, стержень R24, шарнир H4, цистеин-богатый (CR) домен и часть карбокси-концевого (CT) домена, при этом часть CT домена не содержит последние 3 аминокислоты из дистрофина.
E50. rAAV частица по любому из пп. E44-E46 и E49, при этом человеческий белок мини-дистрофин содержит аминокислотную последовательность SEQ ID NO:8.
E51. rAAV частица по любому из пп. E44-E47, в которой кодон-оптимизированная для человека нуклеотидная последовательность, кодирующая человеческий белок мини-дистрофин, содержит нуклеотидную последовательность SEQ ID NO:1.
E52. rAAV частица по любому из пп. E44-E46, E49 и E50, в которой кодон-оптимизированная для человека нуклеотидная последовательность, кодирующая человеческий белок мини-дистрофин, содержит нуклеотидную последовательность SEQ ID NO:3.
E53. rAAV частица по любому из пп. E44-E52, в которой векторный геном дополнительно содержит AAV инвертированные концевые повторы (ITR), фланкирующие кодон-оптимизированную нуклеотидную последовательность.
E54. rAAV частица по п. E53, в которой AAV ITR представляют собой AAV2 ITR.
E55. rAAV частица по любому из пп. E44-E54, в которой векторный геном дополнительно содержит специфический для мышц транскрипционный регуляторный элемент, функционально связанный с кодон-оптимизированной для человека нуклеотидной последовательностью.
E56. rAAV частица по п. E55, в которой специфический для мышц транскрипционный регуляторный элемент расположен между 5′ AAV2 ITR и кодон-оптимизированной для человека нуклеотидной последовательностью.
E57. rAAV частица по любому из пп. E55 и E56, в которой специфический для мышц транскрипционный регуляторный элемент получен из гена креатинкиназы (CK) человека или мыши.
E58. rAAV частица по любому из пп. E55-E57, в которой специфический для мышц транскрипционный регуляторный элемент содержит энхансер и промотор.
E59. rAAV частица по любому из пп. E55-E58, в которой специфический для мышц транскрипционный регуляторный элемент представляет собой энхансер и промотор CK7 мыши.
E60. rAAV частица по любому из пп. E55-E59, в которой специфический для мышц транскрипционный регуляторный элемент содержит нуклеотидную последовательность SEQ ID NO:16.
E61. rAAV частица по любому из пп. E44-E60, в которой векторный геном дополнительно содержит последовательность терминации транскрипции, расположенную между кодон-оптимизированной нуклеотидной последовательностью и 3′ AAV2 ITR.
E62. rAAV частица по п. E61, в которой последовательность терминации транскрипции содержит сигнал полиаденилирования.
E63. rAAV частица по любому из пп. E44-E62, в которой векторный геном содержит в направлении от 5′ к 3′-концу: первый AAV2 ITR, специфический для мышц транскрипционный регуляторный элемент, функционально связанный с кодон-оптимизированной для человека нуклеотидной последовательностью, кодирующей человеческий белок мини-дистрофин, последовательность терминации транскрипции и второй AAV2 ITR.
E64. rAAV частица по п. E63, в которой специфический для мышц транскрипционный регуляторный элемент содержит нуклеотидную последовательность SEQ ID NO:16.
E65. rAAV частица по вариантам осуществления E63 или E64, в которой кодон-оптимизированная для человека нуклеотидная последовательность содержит нуклеотидную последовательность SEQ ID NO:1.
E66. rAAV частица по вариантам осуществления E63-E65, в которой последовательность терминации транскрипции содержит нуклеотидную последовательность SEQ ID NO:17.
E67. rAAV частица по любому из пп. E44-E48, E51 и E53-E66, в которой векторный геном содержит нуклеотидную последовательность SEQ ID NO:18 или ее обратный комплемент.
E68. rAAV частица по любому из пп. E44-E48, E51 и E53-E66, в которой векторный геном состоит в основном из нуклеотидной последовательности SEQ ID NO:18 или ее обратного комплемента.
E69. rAAV частица по любому из пп. E44-E48, E51 и E53-E66, в которой векторный геном состоит из нуклеотидной последовательности SEQ ID NO:18 или ее обратного комплемента.
E70. Рекомбинантная AAV частица, содержащая AAV9 капсид и векторный геном, содержащий нуклеотидную последовательность SEQ ID NO:18 или ее обратный комплемент.
E71. Рекомбинантная AAV частица, содержащая AAV9 капсид и векторный геном, состоящий в основном из нуклеотидной последовательности SEQ ID NO:18 или ее обратного комплемента.
E72. Рекомбинантная AAV частица, содержащая AAV9 капсид и векторный геном, состоящий из нуклеотидной последовательности SEQ ID NO:18 или ее обратного комплемента.
E73. Фармацевтическая композиция, содержащая rAAV частицу по любому из пп. E42-E72 и фармацевтически приемлемый носитель.
E74. Способ лечения дистрофинoпатии, включающий введение индивиду, который нуждается в лечении дистрофинoпатии, терапевтически эффективного количества композиции по п. E73.
E75. Применение рекомбинантной AAV (rAAV) частицы по любому из пп. E42-E72 или применение композиции по п. E73 в изготовлении лекарственного средства для лечения индивида, страдающего дистрофинoпатией.
E76. rAAV частица по любому из пп. E42-E72 или композиция по п. E73 для применения в лечении индивида, страдающего дистрофинoпатией.
E77. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E76, при этом дистрофинoпатия представляет собой мышечную дистрофию Дюшенна (DMD), мышечную дистрофию Беккера (BMD) или DMD-ассоциированную дилатационную кардиомиопатию.
E78. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E77, при этом индивид является мужчиной или женщиной.
E79. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E78, при этом индивид является ходячим, когда впервые получает лечение или введение композиции.
E80. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, при этом индивид находится в возрасте примерно или по меньшей мере 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 лет, когда впервые получает лечение или введение композиции.
E81. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для восстановления дистрофин-ассоциированного белкового комплекса на сарколемме мышечных клеток, в сравнении с не получавшими лечение контролями.
E82. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для улучшения состояния дистрофической гистопатологии в сердце, в сравнении с не получавшими лечение контролями.
E83. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для ингибирования фиброза в мышцах конечностей и диафрагме, в сравнении с не получавшими лечение контролями.
E84. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для снижения балльного показателя мышечных лезий, в сравнении с не получавшими лечение контролями.
E85. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для уменьшения мышечного утомления, в сравнении с не получавшими лечение контролями.
E86. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для увеличения максимальной абсолютной или относительной силы захвата передних конечностей у крыс Dmdmdx, в сравнении с не получавшими лечение контролями.
E87. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для увеличения поддающегося обнаружению уровня мРНК или белка мини-дистрофина в скелетных мышцах, сердечной мышце или диафрагме.
E88. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для уменьшения средних уровней MMP-9 в крови у индивидов до значений примерно в 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 раза превышающих значения у здоровых контролей.
E89. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для уменьшения средних уровней ALT, AST или LDH в крови у индивидов до значений примерно в 7, 6, 5, 4, 3 или 2 раза превышающих значения у здоровых контролей.
E90. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для уменьшения средних уровней общей CK в крови у индивидов до значений примерно в 50, 48, 46, 44, 42, 40, 38, 36, 34, 32, 30, 28, 26, 24, 22, 20, 18, 16, 14, 12, 10, 9, 8, 7, 6, 5, 4, 3 или 2 раза превышающих значения у здоровых контролей.
E91. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для увеличения средней дистанции 6-минутной ходьбы (6MWD) у индивидов на по меньшей мере 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 метров, в сравнении со средним показателем 6MWD у не получавших лечение контролей, через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33 или 36 месяцев после введения вектора.
E92. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для уменьшения среднего времени, необходимого для выполнения теста подъема на 4 ступени, на по меньшей мере 0,2, 0,4, 0,6, 0,8, 1,0, 1,2, 1,4, 1,6, 1,8, 2,0, 2,2, 2,4, 2,6, 2,8, 3,0, 3,2, 3,4, 3,6, 3,8 или 4,0 секунды, в сравнении со средним временем у не получавших лечение контролей, через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33 или 36 месяцев после введения вектора.
E93. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для уменьшения среднего количества индивидов, потерявших способность к самостоятельному передвижению, на по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60% или 65%, в сравнении со средним количеством не получавших лечение контролей, которые потеряли способность к самостоятельному передвижению, через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33 или 36 месяцев после введения вектора.
E94. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для уменьшения среднего количества жировой фракции в нижних конечностях у индивидов на по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70% или 75% в сравнении с средним количеством жировой фракции в нижних конечностях у не получавших лечение контролей, через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, или 36 месяцев после введения вектора.
E95. Способ, применение, rAAV частица или композиция для применения по любому из пп. E88-E94, при этом контроли по возрасту и полу соответствуют индивидам.
E96. Способ, применение, rAAV частица или композиция для применения по любому из пп. E91-E94, при этом индивиды и не получавшие лечение контроли стратифицированы по возрасту, предыдущему лечению кортикостероидами и/или исходным показателям выполнения 6MWT.
E97. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E79, которые являются эффективными для индукции в по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% или 90% скелетных мышечных волокон у индивида экспрессии белка мини-дистрофина, через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33 или 36 месяцев после введения вектора.
E98. Способ, применение, rAAV частица или композиция для применения по п. E97, при этом скелетные мышечные волокна находятся в полученном при биопсии образце из двуглавой, дельтовидной или четырехглавой мышцы индивида.
E99. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E98, которые вызывают клеточный иммунный ответ против белка мини-дистрофина или мышечное воспаление у не более, чем примерно 0%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или 20% индивидов, через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 или 36 месяцев после введения вектора.
E100. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E99, которые являются эффективными без необходимости в сопутствующей иммуносупрессии у получающих лечение индивидов.
E101. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E76, при этом индивид представляет собой крысу Dmdmdx, и способ, применение, rAAV частица или композиция для применения эффективно приводят к уменьшению сывороточных уровней AST, ALT, LDH или общей креатинкиназы через 3 месяца или 6 месяцев после инъекции, в сравнении с подобранными по возрасту контролями, которым вводили растворитель.
E102. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E76, при этом индивид представляет собой крысу Dmdmdx, и способ, применение, rAAV частица или композиция для применения эффективно приводят к уменьшению фиброза в двуглавых мышцах бедра, диафрагме или сердечной мышце через 3 месяца или 6 месяцев после инъекции, в сравнении с подобранными по возрасту контролями, которым вводили растворитель.
E103. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E76, при этом индивид представляет собой крысу Dmdmdx, и способ, применение, rAAV частица или композиция для применения эффективно приводят к увеличению силы захвата передних конечностей через 3 месяца или 6 месяцев после инъекции, в сравнении с подобранными по возрасту контролями, которым вводили растворитель.
E104. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E76, при этом индивид представляет собой крысу Dmdmdx, и способ, применение, rAAV частица или композиция для применения эффективно приводят к уменьшению мышечного утомления при измерении в 5 проводимых с короткими интервалами испытаниях, в которых измеряют силу захвата передних конечностей, через 3 месяца или 6 месяцев после инъекции, в сравнении с подобранными по возрасту контролями, которым вводили растворитель.
E105. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E76, при этом индивид представляет собой крысу Dmdmdx, и способ, применение, rAAV частица или композиция для применения эффективно приводят к увеличению фракции выброса левого желудочка при измерении методом эхокардиографии через 6 месяцев после инъекции, в сравнении с подобранными по возрасту контролями, которым вводили растворитель.
E106. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E76, при этом индивид представляет собой крысу Dmdmdx, и способ, применение, rAAV частица или композиция для применения эффективно приводят к увеличению соотношения скоростей раннего и позднего заполнения левого желудочка (то есть, соотношения E/A) при измерении методом эхокардиографии через 3 месяца или 6 месяцев после инъекции, в сравнении с подобранными по возрасту контролями, которым вводили растворитель.
E107. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E76, при этом индивид представляет собой крысу Dmdmdx, и способ, применение, rAAV частица или композиция для применения эффективно приводят к уменьшению времени изоволюметрического расслабления (ВИВР) или времени в миллисекундах между скоростью в пике Е и ее возвращением к исходному уровню, при этом время замедления пика Е (ВЗ) измеряют методом эхокардиографии через 3 месяца или 6 месяцев после инъекции, в сравнении с подобранными по возрасту контролями, которым вводили растворитель.
E108. Способ, применение, rAAV частица или композиция для применения по п. E74-E76, при этом индивид представляет собой крысу Dmdmdx, и способ, применение, rAAV частица или композиция для применения являются эффективными для трансдукции двуглавой мышцы бедра, диафрагмы, сердечной мышцы или других поперечно-полосатых мышц и экспрессии белка мини-дистрофина, закодированного геном opti-Dys3978, без индукции клеточного иммунного ответа против белка мини-дистрофина, через 3 месяца или 6 месяцев после инъекции.
E109. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E76, при этом индивид представляет собой крысу Dmdmdx, и способ, применение, rAAV частица или композиция для применения являются эффективными для частичного или полного обращения вспять увеличения конечно-диастолического диаметра левого желудочка, через 6 месяцев после инъекции, в сравнении с подобранными по возрасту контролями, которым вводили растворитель.
E110. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E100, при этом индивид также получает, или композиция также содержит, по меньшей мере второе средство, эффективное для лечения дистрофинoпатии, примеры которого включают антисмысловой олигонуклеотид, вызывающий пропуск экзона гена DMD, антитело против миостатина, средство, стимулирующее сквозное прохождение рибосомы через нонсенс-мутации, средство, подавляющее преждевременное образование стоп-кодонов, анаболический стероид или кортикостероид (такой как, без ограничения, преднизон, дефлазакорт или преднизолон).
E111. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E110, при этом композицию вводят системно, например, внутривенной инъекцией, или локально, например, непосредственно в мышцу.
E112. Способ, применение, rAAV частица или композиция для применения по любому из пп. E74-E111, при этом дозу rAAV частиц, используемых в способе, применении, rAAV частицах или композиции для применения, выбирают из группы доз, состоящей из: 1×1012 вг/кг, 2×1012 вг/кг, 3×1012 вг/кг, 4×1012 вг/кг, 5×1012 вг/кг, 6×1012 вг/кг, 7×1012 вг/кг, 8×1012 вг/кг, 9×1012 вг/кг, 1×1013 вг/кг, 2×1013 вг/кг, 3×1013 вг/кг, 4×1013 вг/кг, 5×1013 вг/кг, 6×1013 вг/кг, 7×1013 вг/кг, 8×1013 вг/кг, 9×1013 вг/кг, 1×1014 вг/кг, 1,5×1014 вг/кг, 2×1014 вг/кг, 2,5×1014 вг/кг, 3×1014 вг/кг, 3,5×1014 вг/кг, 4×1014 вг/кг, 5×1014 вг/кг, 6×1014 вг/кг, 7×1014 вг/кг, 8×1014 вг/кг и 9×1014 вг/кг, где размерность вг/кг означает количество векторных геномов на килограмм массы тела индивида.
E113. Композиция по п. E73, дополнительно содержащая пустые капсиды того же серотипа AAV, что и rAAV частица, при этом соотношение концентраций пустых капсидов и rAAV частиц составляет примерно или по меньшей мере 0,5:1, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1 или более.
E114. Способ экспрессии белка мини-дистрофина в клетке, включающий создание контакта клетки с rAAV частицей по любому из пп. E42-E72.
E115. Способ по п. E114, при этом клетка представляет собой мышечную клетку.
E116. Способ по п. E115, при этом мышечная клетка является клеткой скелетной мышцы, диафрагмы или сердца.
E117. Способ получения rAAV частицы по любому из пп. E42-E72, включающий введение в клетку-продуцент вектора по любому из пп. E39-E41, гена rep AAV, гена cap AAV и генов для хелперных функций, инкубацию клеток и очистку rAAV частиц, продуцированных клетками.
E118. Способ по п. E117, при этом клетки-продуценты являются адгерентными.
E119. Способ по п. E117, при этом клетки-продуценты являются неадгерентными.
E120. Способ по любому из пп. E117-E119, при этом вектор содержится в одной плазмиде, гены rep и cap AAV содержатся во второй плазмиде, и гены хелперной функции содержатся в третьей плазмиде, причем все три плазмиды вводят в упаковывающие клетки.
E121. Способ по любому из пп. E117-E120, при этом этап введения выполняют методом трансфекции.
E122. Способ по любому из пп. E117-E121, при этом клетки-продуценты представляют собой клетки HEK293.
E123. Способ по любому из пп. E117-E122, при этом клетки-продуценты выращивают в бессывороточной среде.
E124. Способ по любому из пп. E117-E123, при этом ген cap AAV кодирует белки VP1, VP2 и VP3 AAV9.
E125. Способ по любому из пп. E117-E124, при этом rAAV частицы очищают методом ультрацентрифугирования в градиенте плотности или хроматографии на колонке.
E126. rAAV частица, полученная способом по любому из пп. E117-E125.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1 представлена конструкция сильно укороченных генов мини-дистрофина. Мышечный дистрофин дикого типа имеет четыре основных домена: N-концевой домен (N); центральный стержневой домен, который содержит 24 стержневых повтора (R) и четыре шарнира (H); цистеин-богатый (CR) домен и карбокси-концевой (CT) домен. Гены мини-дистрофина конструировали путем удаления большой части центральных стержней и шарниров, а также большей части CT домена. Гены мини-дистрофина были кодон-оптимизированы, полностью синтезированы, а затем клонированы между промотором CMV или специфическим для мышц синтетическим гибридным промотором на 5'-конце гена и небольшой последовательностью поли(A) на 3'-конце гена. Этот генный сегмент, содержащий промотор, кодон-оптимизированный ген мини-дистрофина и сигнал полиA, затем был клонирован в плазмиду, содержащую левый и правый AAV инвертированные концевые повторы (ITR), так что генный сегмент был фланкирован ITR.
На Фиг. 2 показано, что кодон-оптимизация эффективно увеличивает экспрессию гена мини-дистрофина. На верхних панелях показано иммунофлуоресцентное (ИФ) окрашивание белка мини-дистрофина в (A) нетрансфицированных клетках 293 или после трансфекции исходной неоптимизированной (B) или оптимизированной (C) векторными плазмидами мини-дистрофина Dys3978. На нижних панелях представлены вестерн-блоты мини-дистрофина в трансфицированных клетках 293. Для левого блота использовали одинаковые количества клеточных лизатов, и видна очень сильная экспрессия в случае оптимизированной кДНК. Для правого блота использовали 100X разведение клеточного лизата от клеток 293, трансфицированных оптимизированной кДНК мини-дистрофина, при этом неоптимизированный образец не разводили. Примечательно, что сигнал от оптимизированного образца все-еще более сильный после 100X разведения.
На Фиг. 3 показано ИФ окрашивание человеческого мини-дистрофина, экспрессированного в организме мышей с двойным нокаутом дистрофина/утрофина (dKO), которым вводили AAV9 вектор. Были получены тонкие срезы образцов мышц и сердца от контрольных мышей C57BL/10 (C57) дикого типа, не получавших лечение мышей dKO и получавших AAV9-CMV-Hopti-Dys3978 мышей dKO (T-dKO) и окрашены антителом, которое узнает как мышиный дистрофин дикого типа, так и человеческий белок мини-дистрофин. Во всех изученных образцах была достигнута высокоэффективная экспрессия.
На Фиг. 4 показана нормализация массы тела мышей dKO в результате лечения AAV9-CMV-Hopti-Dys3978. Данные получены для контрольных мышей B10 (C57BL/10) дикого типа, не получавших лечение мышей mdx, не получавших лечение мышей dKO и получавших лечение вектором мышей dKO в возрасте 4 месяца.
На Фиг. 5 показано улучшение силы захвата и передвижения на «беговой дорожке» у мышей dKO в результате лечения AAV9-CMV-Hopti-Dys3978. Данные получены для контрольных мышей B10 (C57BL/10) дикого типа, не получавших лечение мышей mdx, не получавших лечение мышей dKO и получавших лечение вектором мышей dKO (T-dKO) в возрасте 3 месяцев.
На Фиг. 6A-6B показано уменьшение дистрофической патологии у мышей dKO в результате лечения AAV9-CMV-Hopti-Dys3978. (Фиг. 6A) Криосрезы (8-мкм) передних большеберцовых мышц от контрольных мышей C57BL/10 дикого типа, не получавших лечение мышей dKO и получавших лечение вектором мышей dKO (T-dKO) окрашивали гематоксилином и эозином (H&E) для гистопатологического анализа (увеличение 10X). (Фиг. 6B) Количественный анализ мышечной массы, массы сердца, процентного содержания центрально локализованных ядер и активности сывороточной креатинкиназы.
На Фиг. 7 приведены кривые выживаемости мышей dKO, получавших лечение кодон-оптимизированным для человека вектором мини-дистрофина Dys3978 (AAV9-CMV-Hopti-Dys3978) в сравнении с не получавшими лечение мышами dKO и мышами дикого типа. Более 50% получавших лечение мышей dKO выживали более 80 недель (продолжительность эксперимента).
На Фиг. 8 показано улучшение сердечных функций у мышей dKO в результате лечения AAV9-CMV-Hopti-Dys3978. Гемодинамический анализ проводили для контрольных мышей C57BL/10 дикого типа, не получавших лечение мышей mdx и получавших лечение AAV9 вектором мышей dKO. Не получавшие лечение мыши dKO были слишком слабы, чтобы выдержать процедуру. Данные собирали от трех групп мышей с воздействием или без воздействия добутамина.
На Фиг. 9A-9B показано улучшение результатов электрокардиографии (ЭКГ) у мышей dKO в результате лечения AAV9-CMV-Hopti-Dys3978. (Фиг. 9A) PR-интервал на ЭКГ был улучшен у мышей dKO, получавших лечение вектором. (Фиг. 9B) Количественные результаты анализа. При проведении эксперимента тщательно контролировали частоту сердечных сокращений у животных в трех группах, чтобы на результаты ЭКГ не влияли вариации частоты сердечных сокращений. *p<0,05.
На Фиг. 10 приведено сравнение не специфического для ткани промотора CMV и специфического для мышц промотора hCK в управлении кодон-оптимизированным для человека вектором мини-дистрофина Dys3978 у мышей mdx после инъекции в хвостовую вену векторов AAV9-Hopti-Dys3978, содержащих промотор CMV или hCK. Используя ИФ окрашивание, наблюдали устойчивую экспрессию человеческого мини-дистрофина Dys3978 в мышцах конечностей, а также в сердечной мышце. Очевидно, что промотор hCK был более эффективным, чем промотор CMV.
На Фиг. 11 показаны полученные методом магнитно-резонансной томографии (МРТ) изображения задней конечности собаки GRMD «Jelly» после изолированной перфузии вены конечности вектором AAV9-CMV-Hopti-Dys3978. Вектор вводили инфузией под давлением в правую заднюю ногу, на которую в области паха был наложен жесткий жгут. Бледные сигналы указывали на удержание раствора вектора в перфузированной конечности.
На Фиг. 12 показано ИФ окрашивание экспрессируемого человеческого мини-дистрофина Dys3978 через 2 месяца после инъекции вектора собаке GRMD «Jelly». Были изучены полученные при биопсии образцы 5 разных групп мышц как в правой, так и в левой, задних ногах. В не получавшей инъекцию левой ноге также можно было обнаружить dys3978, это свидетельствовало о том, что AAV9 вектор распространился из зоны инъекции в контралатеральную ногу.
На Фиг. 13 показано ИФ окрашивание экспрессируемого человеческого мини-дистрофина Dys3978 через 7 месяцев после инъекции вектора у собаки GRMD «Jelly». Были изучены полученные при биопсии образцы 4 разных групп мышц как в правой, так и в левой, задних ногах. В не получавшей инъекцию левой ноге также можно было обнаружить Dys3978, это свидетельствовало о том, что AAV9 вектор переместился из зоны инъекции в контралатеральную ногу. На тех же образцах был проведен вестерн-блот анализ на Dys3978.
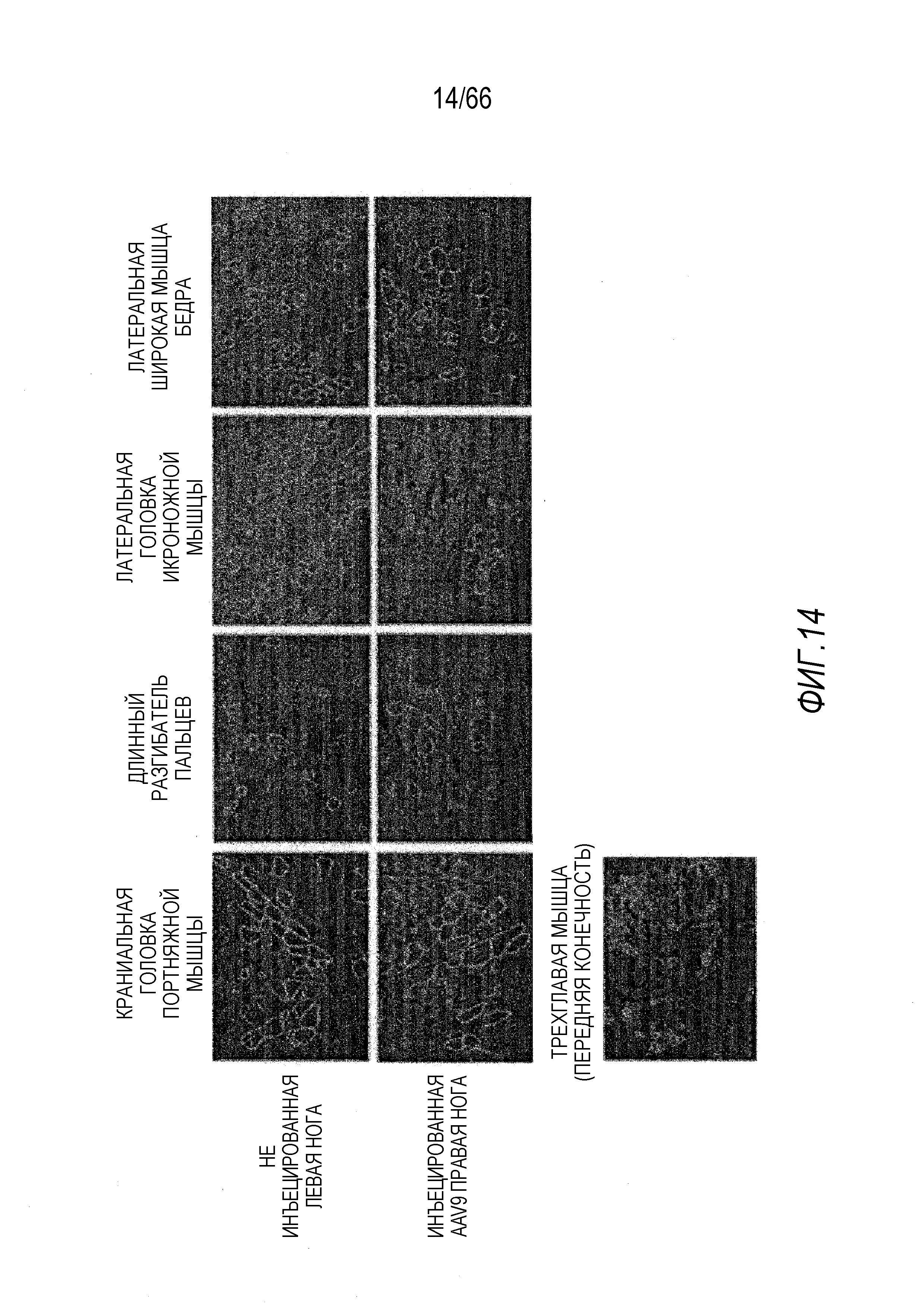
На Фиг. 14 показано ИФ окрашивание экспрессируемого человеческого мини-дистрофина Dys3978 через 12 месяцев после инъекции вектора у собаки GRMD «Jelly». Были изучены полученные при биопсии образцы 4 разных групп мышц как в правой, так и в левой, задних ногах и 1 образец из передней конечности. В не получавшей инъекцию левой ноге также можно было обнаружить Dys3978, это свидетельствовало о том, что AAV9 вектор переместился из зоны инъекции в контралатеральную ногу.
На Фиг. 15 показано ИФ окрашивание экспрессируемого человеческого мини-дистрофина Dys3978 через 2 года после инъекции вектора у собаки GRMD «Jelly». Были изучены полученные при биопсии образцы 2 разных групп мышц как в правой, так и в левой, задних ногах. Примечательно, что в не получавшей инъекцию левой ноге, судя по всему, находилось больше Dys3978, чем в получавшей инъекцию ноге.
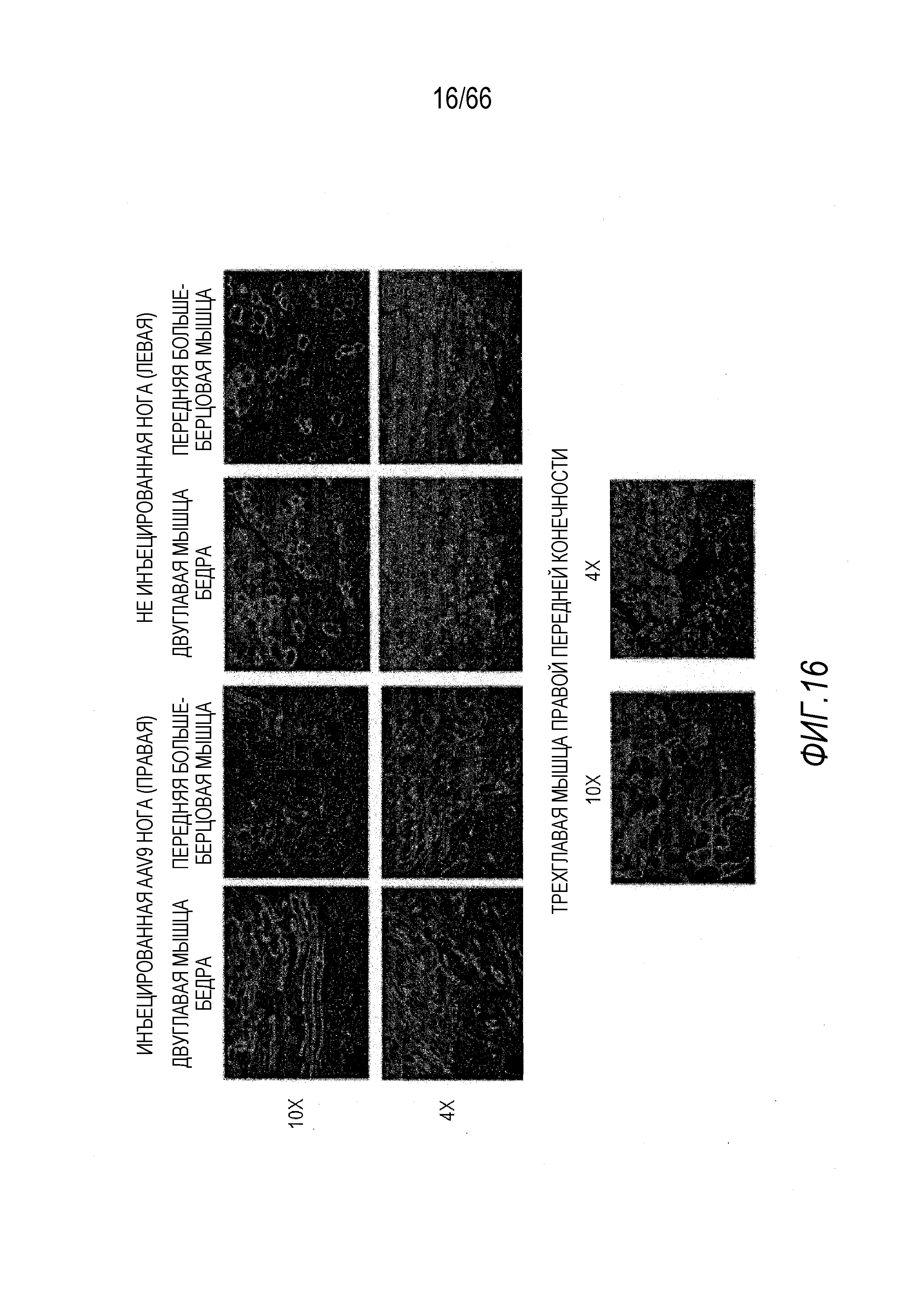
На Фиг. 16 показано ИФ окрашивание человеческого мини-дистрофина Dys3978. Были изучены полученные при биопсии образцы двух дополнительных (в сравнении с Фиг. 15) групп мышц как в правой, так и в левой, задних ногах и один образец из передней конечности собаки GRMD «Jelly». Образцы также собирали через 2 года после инъекции вектора.
На Фиг. 17 показано ИФ окрашивание человеческого мини-дистрофина Dys3978 через 4 года после инъекции вектора в образце из не получавшей инъекции левой задней ноги собаки GRMD «Jelly».
На Фиг. 18 показано ИФ окрашивание человеческого мини-дистрофина Dys3978 через период времени более 8 лет после инъекции вектора в образце от собаки GRMD «Jelly». Были изучены полученные при вскрытии образцы 5 разных групп мышц и сердца.
На Фиг. 19 показано ИФ окрашивание человеческого мини-дистрофина Dys3978 и эндогенного ревертантного дистрофина через период времени более 8 лет после инъекции вектора в образце от собаки GRMD «Jelly». Полученные при вскрытии образцы трех разных групп мышц окрашивали антителом, узнающим как человеческий, так и собачий, дистрофин (верхняя панель), или антителом, узнающим только собачий ревертантный дистрофин (нижняя панель). Мышечные волокна, положительные по ревертантному дистрофину, указаны стрелками. Ревертантные волокна представляют собой редкие мышечные волокна, окрашивающиеся положительно на белок дистрофин, которые встречаются у пациентов-людей с DMD, а также у мышей mdx и собак GRMD. Точный механизм возникновения ревертантных волокон неясен, но он может включать пропуск экзона в редких мышечных клетках, которые продуцируют укороченный дистрофин с эпитопами, узнаваемыми антителами-зондами. Смотри, например, Lu, QL, et al., J Cell Biol 148:985-96 (2000).
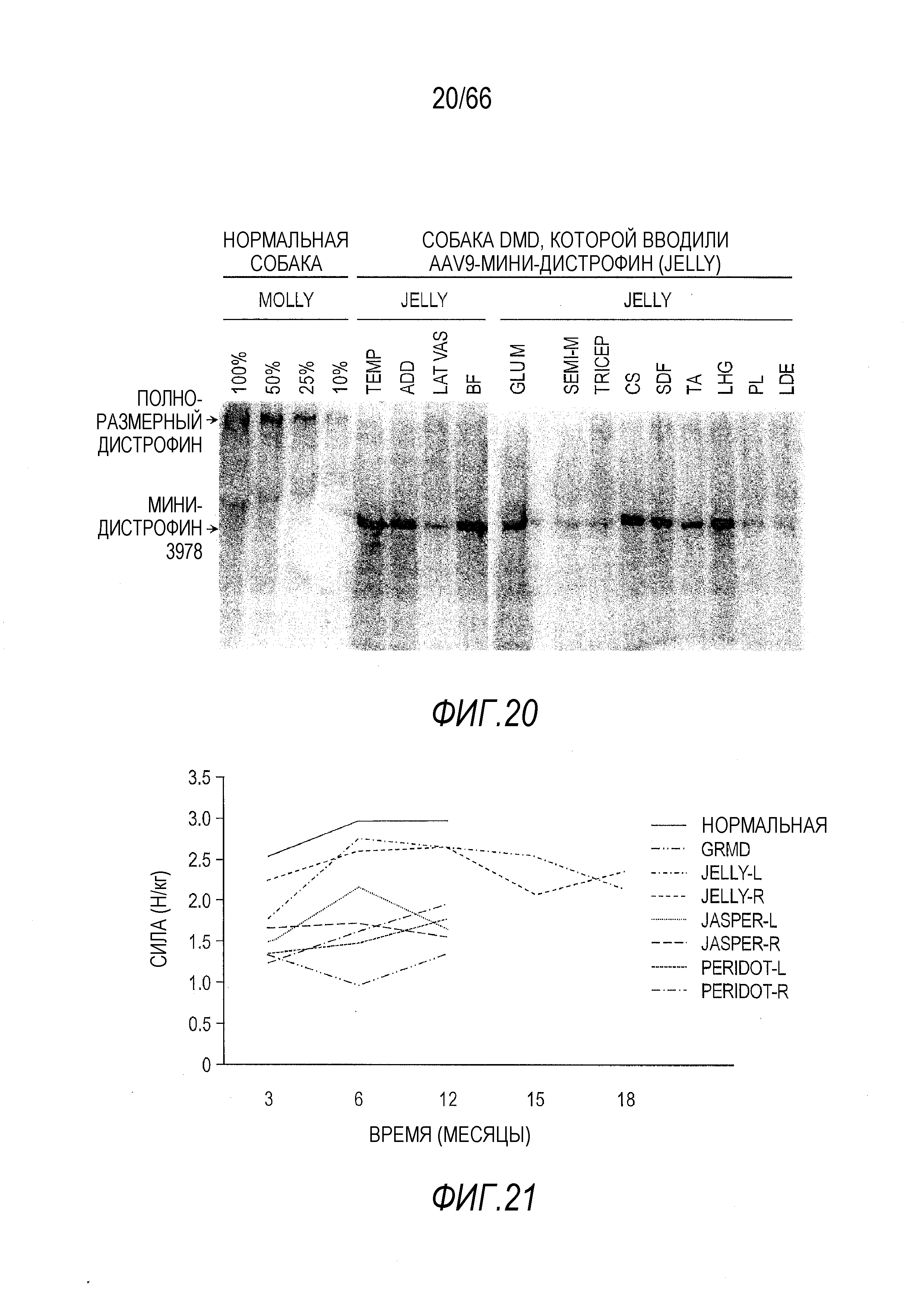
На Фиг. 20 показаны результаты вестерн-блот анализа человеческого мини-дистрофина Dys3978, присутствующего в образцах мышц собаки GRMD «Jelly», полученных при вскрытии через период времени более 8 лет после инъекции AAV9 вектора. На вестерн-блоте видно, что человеческий мини-дистрофин Dys3978 присутствует во всех изученных скелетных мышцах. Мышцы подобранной по возрасту и полу нормальной собаки по имени «Molly» использовали в качестве положительного контроля с серийными 2-кратными разведениями для количественного определения белка дистрофина. Молекулярная масса полноразмерного дистрофина дикого типа составляет примерно 400 кДа, в то время как у белка мини-дистрофина Dys3978 она составляет примерно 150 кДа.
На Фиг. 21 показано увеличение силы мышечного сокращения у собаки GRMD «Jelly» после инъекции вектора AAV9-CMV-Hopti-Dys3978 и экспрессии гена во всем теле. Верхняя кривая представляет мышечную силу нормальной собаки, а нижняя кривая представляет мышечную силу не получавшей лечение собаки GRMD. Две кривые, продолженные на большее количество временных точек, представляют мышечную силу собаки «Jelly». Еще две собаки GRMD, получавшие лечение вектором AAV9-CMV-собачий-мини-дистрофин Dys3849 (Wang, et al., PNAS 97(25):13714-9 (2000)), также были протестированы на мышечную силу и продемонстрировали улучшение данного параметра («Jasper» и «Peridot»).
На Фиг. 22 показаны результаты ИФ окрашивания экспрессируемого человеческого мини-дистрофина в образцах, полученных при биопсии мышц, через 4 месяца после инъекции вектора AAV9-hCK-Copti-Dys3978 собаке GRMD «Dunkin». Вектор был доставлен внутривенной инъекцией для обеспечения экспрессии гена во всем теле. Были изучены полученные при биопсии образцы 4 разных групп мышц в задних конечностях. Примечательно, что почти однородное присутствие мини-дистрофина Dys3978 было обнаружено во всех группах мышц.
На Фиг. 23 показаны результаты ИФ окрашивания экспрессируемого человеческого мини-дистрофина через 14 месяцев после инъекции вектора AAV9-hCK-Copti-Dys3978 в образцах от собаки GRMD «Dunkin». Полученные при вскрытии образцы были собраны и изучены. Примечательно, что широкое распространение и высокие уровни экспрессии мини-дистрофина Dys3978 были обнаружены в сердце и во всех группах мышц. Увеличение 4X.
На Фиг. 24 показаны результаты ИФ окрашивания мышцы диафрагмы, с высокими уровнями человеческого мини-дистрофина, обнаруженными через 14 месяцев после инъекции вектора AAV9-hCK-Copti-Dys3978 у собаки GRMD «Dunkin».
На Фиг. 25 показаны результаты ИФ окрашивания длинной малоберцовой мышцы, с высокими уровнями человеческого мини-дистрофина, обнаруженными через 14 месяцев после инъекции вектора AAV9-hCK-Copti-Dys3978 у собаки GRMD «Dunkin».
На Фиг. 26 показаны результаты ИФ окрашивания полуперепончатой мышцы, с высокими уровнями человеческого мини-дистрофина, обнаруженными через 14 месяцев после инъекции вектора AAV9-hCK-Copti-Dys3978 у собаки GRMD «Dunkin».
На Фиг. 27 показаны результаты ИФ окрашивания мышцы левого желудочка (ЛЖ) сердца, с высокими уровнями человеческого мини-дистрофина, обнаруженными через 14 месяцев после инъекции вектора AAV9-hCK-Copti-Dys3978 у собаки GRMD «Dunkin».
На Фиг. 28 показано обнаружение методом вестерн-блоттинга человеческого мини-дистрофина Dys3978 в образцах мышц собаки GRMD «Dunkin» через 4 месяца и 14 месяцев после инъекции вектора. Мышцы от подобранной по возрасту нормальной собаки использовали в качестве положительного контроля с серийными 2-кратными разведениями для количественного определения белка дистрофина. Молекулярная масса полноразмерного дистрофина дикого типа составляет примерно 400 кДа, в то время как у белка мини-дистрофина Dys3978 она составляет примерно 150 кДа. Примечательно, что мини-дистрофин Dys3978 не был обнаружен в печени.
На Фиг. 29 показано обнаружение методом вестерн-блоттинга экспрессированного человеческого мини-дистрофина Dys3978 в образце из сердца (ЛЖ) собаки GRMD «Dunkin» через 14 месяцев после инъекции вектора. Образец из сердца подобранной по возрасту нормальной собаки использовали в качестве положительного контроля с серийными 2-кратными разведениями для количественного определения белка дистрофина.
На Фиг. 30 показано восстановление дистрофин-ассоциированного белкового комплекса, о чем свидетельствует ИФ окрашивание человеческого мини-дистрофина Dys 3978, а также гамма-саркогликана (r-SG) в различных группах мышц.
На Фиг. 31 показан анализ копий ДНК вектора AAV9-CMV-Copti-Dys3978 в различных мышцах и тканях. Проводили количественную ПЦР (кПЦР) для определения числа копий геномной ДНК AAV вектора, которые были нормированы на диплоидные клетки.
На Фиг. 32 показано улучшение состояния дистрофической гистопатологии в сердце у собаки GRMD «Dunkin», получавшей вектор AAV9-CMV-Copti-Dys3978, в сравнении с подобранной по возрасту и не получавшей лечение собакой GRMD. Окрашивание HE.
На Фиг. 33 показано улучшение состояния дистрофической гистопатологии в мышце диафрагмы у собаки GRMD «Dunkin», получавшей вектор AAV9-CMV-Copti-Dys3978. В сравнении с подобранной по возрасту и не получавшей лечение собакой GRMD. Окрашивание HE.
На Фиг. 34 показано улучшение состояния дистрофической гистопатологии в мышцах конечностей у собаки GRMD «Dunkin», получавшей вектор AAV9-CMV-Copti-Dys3978, в сравнении с подобранной по возрасту и не получавшей лечение собакой GRMD. Окрашивание HE.
На Фиг. 35 показано ингибирование фиброза в мышцах конечностей и диафрагмы у собаки GRMD «Dunkin» в сравнении с подобранной по возрасту не получавшей лечение собакой GRMD. Трихромовая окраска по Массону с анилиновым синим.
На Фиг. 36A приведены микрофотографии, показывающие иммунологическое окрашивание антителом против дистрофина DYSB двуглавой мышцы бедра, полученной от крысы ДТ, которой вводили контроль - PBS (левая панель), крысы Dmdmdx, которой вводили контроль (центральная панель), и крысы Dmdmdx, которой вводили вектор AAV9.hCK.Hopti-Dys3978.spA (правая панель). Темный контур вокруг волокон показывает подсарколеммную локализацию дистрофина у крысы ДТ и мини-дистрофина у получавшей лечение вектором крысы Dmdmdx.
На Фиг. 36B приведены микрофотографии, показывающие окрашивание гематоксилином и эозином (HES) двуглавой мышцы бедра, полученной от крысы ДТ, которой вводили контроль (левая панель), крысы Dmdmdx, которой вводили контроль (центральная панель), и крысы Dmdmdx, которой вводили вектор AAV9.hCK.Hopti-Dys3978.spA (правая панель). Можно видеть кластер некротических волокон (*) и умеренный фиброз в эндомизии (черная стрелка).
На Фиг. 36C приведены микрофотографии, показывающие иммунологическое окрашивание антителом против дистрофина DYSB сердечной мышцы, полученной от крысы ДТ, которой вводили контроль (левая панель), крысы Dmdmdx, которой вводили контроль (центральная панель), и крысы Dmdmdx, которой вводили вектор AAV9.hCK.Hopti-Dys3978.spA (правая панель). Темный контур вокруг волокон показывает подсарколеммную локализацию дистрофина у крысы ДТ и мини-дистрофина у получавшей лечение вектором крысы Dmdmdx.
На Фиг. 36D приведены микрофотографии, показывающие окрашивание HES сердечной мышцы, полученной от крысы ДТ, которой вводили контроль (левая панель), крысы Dmdmdx, которой вводили контроль (центральная панель), и крысы Dmdmdx, которой вводили вектор AAV9.hCK.Hopti-Dys3978.spA (правая панель). Фиброзный очаг (незаштрихованная стрелка) показан на центральной панели, и очаг инфильтрации мононуклеарных клеток показан на правой панели.
На Фиг. 37 показана средняя масса тела в граммах у крыс ДТ, которым вводили растворитель (буфер), и крыс Dmdmdx, которым вводили растворитель и возрастающие дозы вектора AAV9.hCK.Hopti-Dys3978.spA, за период времени до 25 недель после введения доз. «ДТ» означает крыс дикого типа; «DMD» означает крыс Dmdmdx; «n» означает размер выборки; «Д» означает число дней после введения доз; «Н» означает число недель после введения доз; «E» означает десятикратный указанный коэффициент, возведенный в степень указанного показателя степени (таким образом, «1E13» соответствует 1×1013, «3E13» соответствует 3×1013, «1E14» соответствует 1×1014 и «3E14» соответствует 3×1014); «вг/кг» означает число векторных геномов на килограмм массы тела и «без ЧСА» относится к группе лечения, в которой вектор был введен в PBS без человеческого сывороточного альбумина. На правой стороне графика, через 25 недель, порядок данных средней массы тела сверху вниз является таким же, что и порядок сверху вниз в группах лечения, перечисленных в подписи к фигуре (за исключением лечения крыс Dmdmdx 1×1014 вг/кг вектора, введенного в растворителе без ЧСА, поскольку сбор этих данных был закончен через 13 недель после начала исследования). Те же сокращения использованы на других фигурах в настоящем документе.
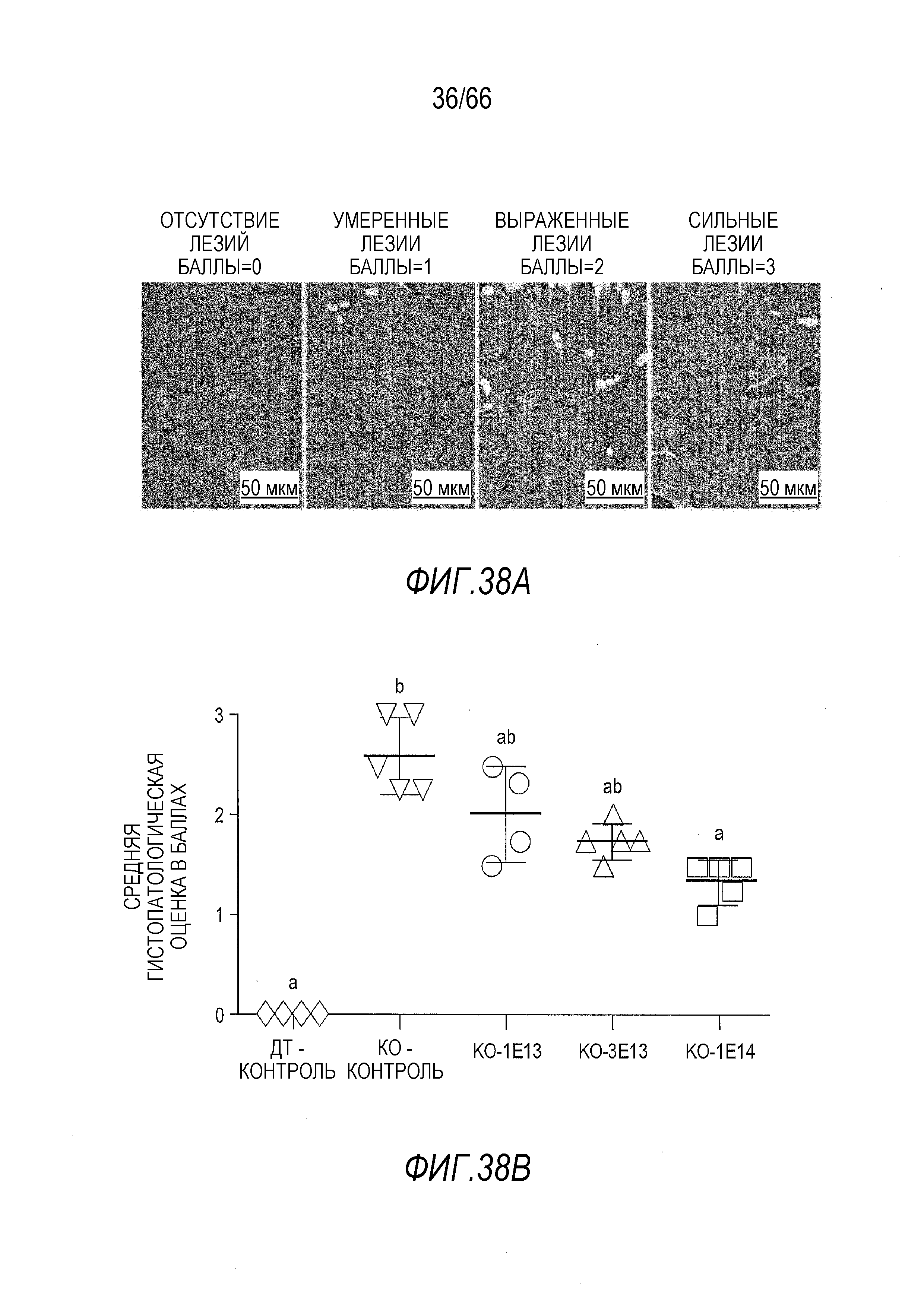
На Фиг. 38A приведены иллюстративные микрофотографии скелетных мышц от крыс Dmdmdx, окрашенных для гистологического исследования, иллюстрирующие полуколичественную систему оценки в баллах, используемую для оценки степени тяжести мышечных лезий, вызываемых отсутствием дистрофина. В скелетной мышце, такой, как показанная, балльная оценка 0 означает отсутствие лезий; 1 означает наличие некоторой регенеративной активности, на что указывают волокна с центрально расположенными ядрами и небольшие очаги регенерации; 2 означает наличие дегенеративных волокон, отдельных или в небольших кластерах; и 3 означает реструктурирование ткани и замену волокон фиброзной или жировой тканью. Для балльной оценки сердца использовали другие критерии, описанные в тексте.
На Фиг. 38B показаны общие баллы DMD лезий у крыс (то есть, среднее значение элементов общего результата для двуглавой мышцы бедра, грудной мышцы, диафрагмы и сердечной мышцы) через 3 месяца после инъекции, индивидуальные значения, а также среднее значение для всех крыс в каждой группе введения, и проведено сравнение для демонстрации зависимого от дозы вектора уменьшения балльного показателя лезий. «ДТ контроль» относится к крысам ДТ, получавшим растворитель, «KO контроль» относится к крысам Dmdmdx, получавшим растворитель, «KO 1E13», «3E13» и «1E14» относятся к крысам Dmdmdx, получавшим указанные дозы вектора AAV9.hCK.Hopti-Dys3978.spA, выраженные в виде вг/кг. Буквы над планками указывают на то, что служащие основой результата данные статистически не отличаются от значений других планок, над которыми имеются те же буквы. И наоборот, значения планок, над которыми стоят разные буквы, статистически отличаются друг от друга. Статистическую обработку данных проводили с использованием критериев Крускала-Уоллиса и Данна.
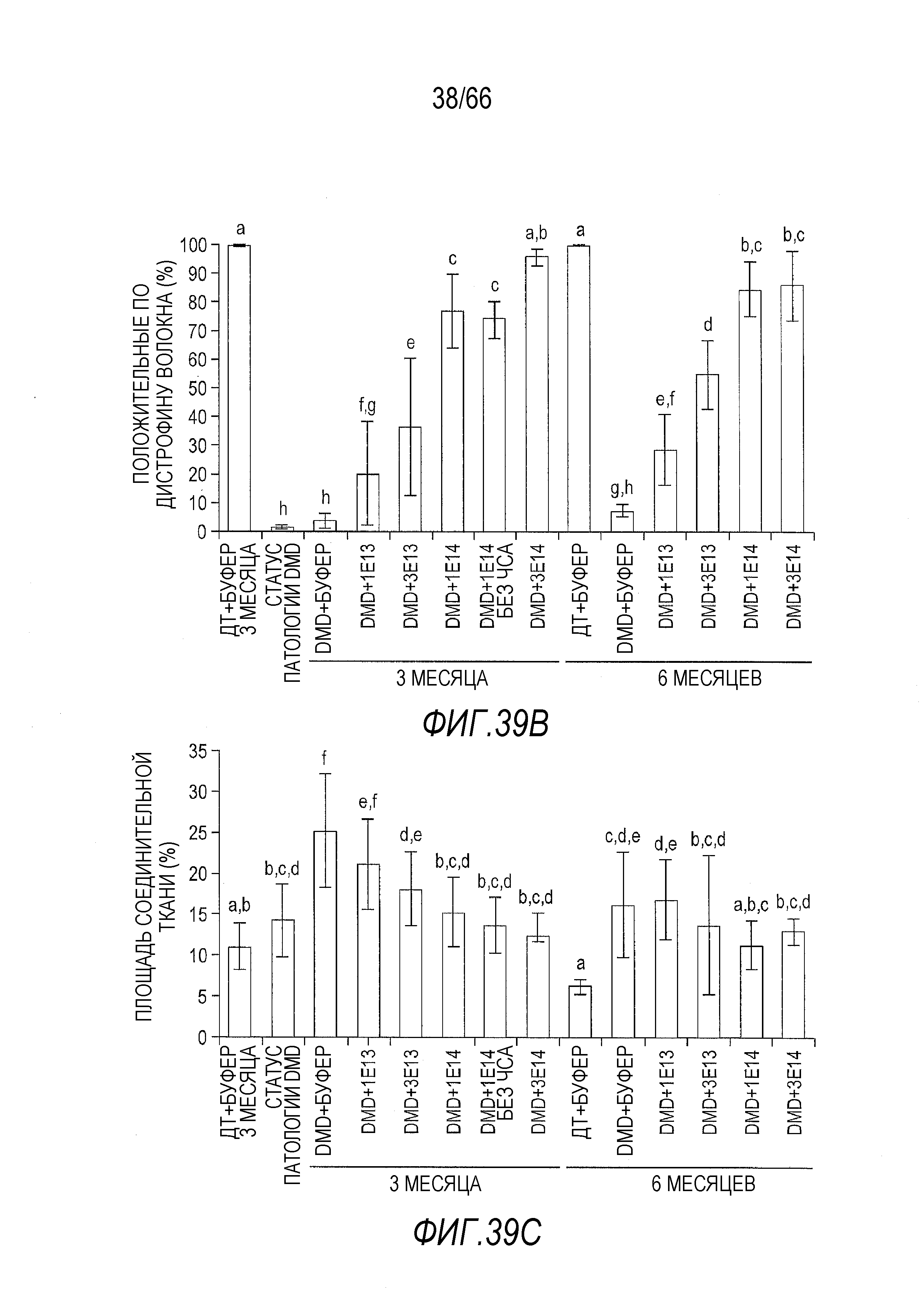
На Фиг. 39A представлены репрезентативные срезы образцов двуглавой мышцы бедра от крыс Dmdmdx, получавших возрастающие дозы вектора AAV9.hCK.Hopti-Dys3978.spA, и отрицательных контролей. Образцы были двояко мечены антителом, которое специфически связывается с полноразмерным крысиным дистрофином и человеческим мини-дистрофином, и конъюгатом агглютинина зародышей пшеницы, который окрашивает соединительную ткань. На верхней панели представлены микрофотографии от животных, умерщвленных через 3 месяца после инъекции. На нижней панели представлены микрофотографии от животных, умерщвленных через 6 месяцев после инъекции.
На Фиг. 39B показана процентная доля волокон, положительно окрашенных на присутствие белка дистрофина, в случайно выбранных срезах из образцов двуглавой мышцы бедра от крыс Dmdmdx, получавших возрастающие дозы вектора AAV9.hCK.Hopti-Dys3978.spA, и отрицательных контролей. Включены данные, полученные через 3 и 6 месяцев после инъекции. Буквы над планками указывают на то, что служащие основой результата данные статистически не отличаются от значений других планок, над которыми имеются те же буквы. И наоборот, значения планок, над которыми стоят разные буквы, статистически отличаются друг от друга. Статистическую обработку данных проводили с использованием анализа ANOVA и апостериорного двустороннего критерия Фишера.
На Фиг. 39C показана площадь, в процентах, положительно окрашенная на присутствие соединительной ткани, в случайно выбранных срезах из образцов двуглавой мышцы бедра от крыс Dmdmdx, получавших возрастающие дозы вектора AAV9.hCK.Hopti-Dys3978.spA, и отрицательных контролей. Включены данные, полученные через 3 и 6 месяцев после инъекции. Буквы над планками указывают на то, что служащие основой результата данные статистически не отличаются от значений других планок, над которыми имеются те же буквы. И наоборот, значения планок, над которыми стоят разные буквы, статистически отличаются друг от друга. Статистическую обработку данных проводили с использованием анализа ANOVA и апостериорного двустороннего критерия Фишера.
На Фиг. 40A показаны репрезентативные срезы из образцов мышц диафрагмы от крыс Dmdmdx, получавших возрастающие дозы вектора AAV9.hCK.Hopti-Dys3978.spA, и отрицательных контролей, умерщвленных через 3 месяца после инъекции. Образцы были двояко мечены антителом, которое специфически связывается с полноразмерным крысиным дистрофином и человеческим мини-дистрофином, и конъюгатом агглютинина зародышей пшеницы, который окрашивает соединительную ткань.
На Фиг. 40B показана процентная доля волокон, положительно окрашенных на присутствие белка дистрофина, в случайно выбранных срезах из образцов мышц диафрагмы от крыс Dmdmdx, получавших возрастающие дозы вектора AAV9.hCK.Hopti-Dys3978.spA, и отрицательных контролей. Включены данные, полученные через 3 и 6 месяцев после инъекции. Буквы над планками указывают на то, что служащие основой результата данные статистически не отличаются от значений других планок, над которыми имеются те же буквы. И наоборот, значения планок, над которыми стоят разные буквы, статистически отличаются друг от друга. Статистическую обработку данных проводили с использованием анализа ANOVA и апостериорного двустороннего критерия Фишера.
На Фиг. 40C показана площадь, в процентах, положительно окрашенная на присутствие соединительной ткани, в случайно выбранных срезах из образцов мышц диафрагмы от крыс Dmdmdx, получавших возрастающие дозы вектора AAV9.hCK.Hopti-Dys3978.spA, и отрицательных контролей. Включены данные, полученные через 3 и 6 месяцев после инъекции. Буквы над планками указывают на то, что служащие основой результата данные статистически не отличаются от значений других планок, над которыми имеются те же буквы. И наоборот, значения планок, над которыми стоят разные буквы, статистически отличаются друг от друга. Статистическую обработку данных проводили с использованием анализа ANOVA и апостериорного двустороннего критерия Фишера.
На Фиг. 41A показаны репрезентативные поперечные срезы сердца на одной трети расстояния от верхушки, полученные от крыс Dmdmdx, получавших возрастающие дозы вектора AAV9.hCK.Hopti-Dys3978.spA (верхняя панель), и отрицательных контролей (нижняя панель), умерщвленных через 3 месяца и 6 месяцев после инъекции. Гистологические срезы окрашивали пикросириусом красным для визуализации соединительной ткани. На средней панели представлены репрезентативные срезы сердечной мышцы от крыс Dmdmdx, получавших вектор и растворитель, двояко меченые антителом, которое специфически связывается с полноразмерным крысиным дистрофином и человеческим мини-дистрофином, и конъюгатом агглютинина зародышей пшеницы, который окрашивает соединительную ткань.
На Фиг. 41B показана процентная доля волокон, положительно окрашенных на присутствие белка дистрофина, в случайно выбранных срезах из образцов сердечной мышцы от крыс Dmdmdx, получавших возрастающие дозы вектора AAV9.hCK.Hopti-Dys3978.spA, и отрицательных контролей. Включены данные, полученные через 3 и 6 месяцев после инъекции. Буквы над планками указывают на то, что служащие основой результата данные статистически не отличаются от значений других планок, над которыми имеются те же буквы. И наоборот, значения планок, над которыми стоят разные буквы, статистически отличаются друг от друга. Статистическую обработку данных проводили с использованием анализа ANOVA и апостериорного двустороннего критерия Фишера.
На Фиг. 41C показана площадь, в процентах, положительно окрашенная на присутствие соединительной ткани, в случайно выбранных срезах из образцов сердечной мышцы от крыс Dmdmdx, получавших возрастающие дозы вектора AAV9.hCK.Hopti-Dys3978.spA, и отрицательных контролей. Включены данные, полученные через 3 и 6 месяцев после инъекции. Буквы над планками указывают на то, что служащие основой результата данные статистически не отличаются от значений других планок, над которыми имеются те же буквы. И наоборот, значения планок, над которыми стоят разные буквы, статистически отличаются друг от друга. Статистическую обработку данных проводили с использованием анализа ANOVA и апостериорного двустороннего критерия Фишера.
На Фиг. 42A представлены данные по мышечному утомлению для крыс Dmdmdx, получавших возрастающие дозы вектора AAV9.hCK.Hopti-Dys3978.spA, в сравнении с крысами Dmdmdx и ДТ, получавшими растворитель, измеренные в пяти повторных тестах, проведенных с короткими интервалами, в которых измеряли силу захвата конечностей. Тесты проводили через 3 месяца после инъекции с крысами, инъецированными в возрасте 7-9 недель или в возрасте примерно 4,5 месяца. График показывает уменьшение измеренной силы захвата передних конечностей от испытания 1 до испытания 5 (выраженной в виде процентной доли от силы в испытании 1). Результаты представлены в виде среднего значения ± SEM. Проводили статистическое сравнение данных для крыс Dmdmdx, получавших вектор, с данными для крыс ДТ, получавших растворитель (*p<0,05; ***p<0,001), а также для крыс Dmdmdx, получавших растворитель (¤¤p<0,01; ¤¤¤p<0,001), обе группы в качестве отрицательного контроля.
На Фиг. 42B представлены данные по мышечному утомлению для крыс Dmdmdx, получавших возрастающие дозы вектора AAV9.hCK.Hopti-Dys3978.spA, в сравнении с крысами Dmdmdx и ДТ, получавшими растворитель, измеренные в пяти повторных тестах, проведенных с короткими интервалами, в которых измеряли силу захвата конечностей. Тесты проводили через 6 месяцев после инъекции с крысами, инъецированными в возрасте 7-9 недель или в возрасте примерно 7,5 месяцев. График показывает уменьшение измеренной силы захвата передних конечностей от испытания 1 до испытания 5 (выраженной в виде процентной доли от силы в испытании 1). Результаты представлены в виде среднего значения ± SEM.
На Фиг. 43 представлены данные по конечно-диастолическому диаметру левого желудочка (ЛЖ), измеренному во время диастолы на основании изображений по длинной оси, полученных методом эхокардиографии в М-режиме, через 6 месяцев после инъекции у крыс ДТ и Dmdmdx, которым вводили растворитель или вектор AAV9.hCK.Hopti-Dys3978.spA. Показанная описательная статистика представляет собой среднее ± SEM.
На Фиг. 44 представлены данные по фракциям выброса, измеренным во время диастолы по изображениям длинной оси, полученным методом эхокардиографии в М-режиме, через 6 месяцев после инъекции у крыс ДТ и Dmdmdx, которым вводили растворитель или вектор AAV9.hCK.Hopti-Dys3978.spA. Показанная описательная статистика представляет собой среднее ± SEM, и символ «$» указывает на статистически значимую разницу между данными, над которыми он находится, и данными для крыс Dmdmdx, получавших растворитель (буфер) (p<0,05).
На Фиг. 45A показаны соотношения E/A, измеренные с использованием импульсного допплера с апикальной четырехкамерной позицией, через 3 месяца после инъекции у крыс ДТ и Dmdmdx, которым вводили растворитель или вектор AAV9.hCK.Hopti-Dys3978.spA. Показанная описательная статистика представляет собой среднее ± SEM, и символ «*» указывает на статистически значимую разницу между данными, над которыми он находится, и данными для крыс ДТ, получавших растворитель (буфер) (p<0,05).
На Фиг. 45B показаны соотношения E/A, измеренные с использованием импульсного допплера с апикальной четырехкамерной позицией, через 6 месяцев после инъекции у крыс ДТ и Dmdmdx, которым вводили растворитель или вектор AAV9.hCK.Hopti-Dys3978.spA. Показанная описательная статистика представляет собой среднее ± SEM, и символ «**» указывает на статистически значимую разницу между данными, над которыми он находится, и данными для крыс ДТ, получавших растворитель (буфер) (p<0,01).
На Фиг. 46A показано время изоволюметрического расслабления, измеренное с использованием импульсного допплера с апикальной четырехкамерной позицией, через 3 месяца после инъекции у крыс ДТ и Dmdmdx, которым вводили растворитель или вектор AAV9.hCK.Hopti-Dys3978.spA. Показанная описательная статистика представляет собой среднее ± SEM.
На Фиг. 46B показано время изоволюметрического расслабления, измеренное с использованием импульсного допплера с апикальной четырехкамерной позицией, через 6 месяцев после инъекции у крыс ДТ и Dmdmdx, которым вводили растворитель или вектор AAV9.hCK.Hopti-Dys3978.spA. Показанная описательная статистика представляет собой среднее ± SEM, и символ «$» указывает на статистически значимую разницу между данными, над которыми он находится, и данными для крыс Dmdmdx, получавших растворитель (буфер) (p<0,05).
На Фиг. 47 показано время замедления кровотока, измеренное с использованием импульсного допплера с апикальной четырехкамерной позицией, через 6 месяцев после инъекции у крыс ДТ и Dmdmdx, которым вводили растворитель или вектор AAV9.hCK.Hopti-Dys3978.spA. Показанная описательная статистика представляет собой среднее ± SEM, и символ «*» указывает на статистически значимую разницу между данными, над которыми он находится, и данными для крыс ДТ, получавших растворитель (буфер) (p<0,05).
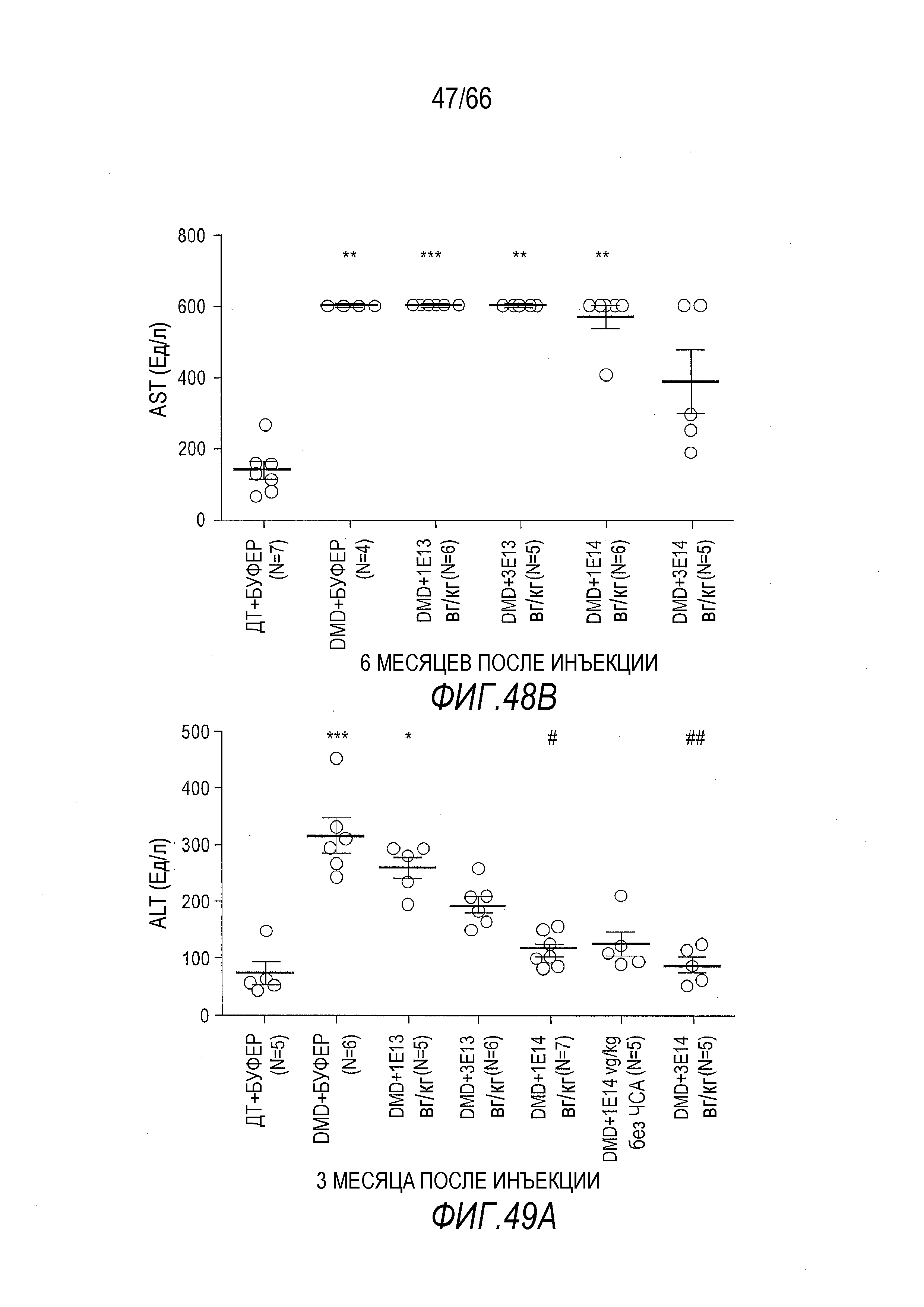
На Фиг. 48A показан эффект возрастающих доз вектора AAV9.hCK.Hopti-Dys3978.spA на уровни в крови AST у крыс Dmdmdx через 3 месяца после инъекции. Результаты представлены в виде среднего значения ± SEM. Статистический анализ выполняли с использованием непараметрического критерия Крускала-Уоллиса и апостериорного критерия множественного сравнения Данна. Проводили статистическое сравнение крыс Dmdmdx, получавших вектор, с крысами ДТ, получавшими буфер (растворитель) в качестве отрицательного контроля (**p<0,01, *p<0,05).
На Фиг. 48B показан эффект разных доз вектора AAV9.hCK.Hopti-Dys3978.spA на уровни в крови AST у крыс Dmdmdx через 6 месяцев после инъекции. Результаты представлены в виде среднего значения ± SEM. Статистический анализ выполняли с использованием непараметрического критерия Крускала-Уоллиса и апостериорного критерия множественного сравнения Данна. Проводили статистическое сравнение крыс Dmdmdx, получавших вектор, с крысами ДТ, получавшими буфер (растворитель), в качестве отрицательного контроля (***p<0,001, **p<0,01).
На Фиг. 49A показан эффект разных доз вектора AAV9.hCK.Hopti-Dys3978.spA на уровни в крови ALT у крыс Dmdmdx через 3 месяца после инъекции. Результаты представлены в виде среднего значения ± SEM. Статистический анализ выполняли с использованием непараметрического критерия Крускала-Уоллиса и апостериорного критерия множественного сравнения Данна. Проводили статистическое сравнение крыс Dmdmdx, получавших вектор, с крысами ДТ, получавшими буфер (растворитель) (***p<0,001, *p<0,05), или крысами Dmdmdx, получавшими буфер (##p<0,01, #p<0,05), в качестве отрицательных контролей.
На Фиг. 49B показан эффект разных доз вектора AAV9.hCK.Hopti-Dys3978.spA на уровни в крови ALT у крыс Dmdmdx через 6 месяцев после инъекции. Результаты представлены в виде среднего значения ± SEM. Статистический анализ выполняли с использованием непараметрического критерия Крускала-Уоллиса и апостериорного критерия множественного сравнения Данна. Проводили статистическое сравнение крыс Dmdmdx, получавших вектор, с крысами ДТ, получавшими буфер (растворитель), в качестве отрицательного контроля (**p<0,01).
На Фиг. 50A показан эффект разных доз вектора AAV9.hCK.Hopti-Dys3978.spA на уровни в крови LDH у крыс Dmdmdx через 3 месяца после инъекции. Результаты представлены в виде среднего значения ± SEM. Статистический анализ выполняли с использованием непараметрического критерия Крускала-Уоллиса и апостериорного критерия множественного сравнения Данна. Проводили статистическое сравнение крыс Dmdmdx, получавших вектор, с крысами ДТ, получавшими буфер (растворитель) (***p<0,001, **p<0,01), или крысами Dmdmdx, получавшими буфер (#p<0,05), в качестве отрицательных контролей.
На Фиг. 50B показан эффект разных доз вектора AAV9.hCK.Hopti-Dys3978.spA на уровни в крови LDH у крыс Dmdmdx через 6 месяцев после инъекции. Результаты представлены в виде среднего значения ± SEM. Статистический анализ выполняли с использованием непараметрического критерия Крускала-Уоллиса и апостериорного критерия множественного сравнения Данна. Проводили статистическое сравнение крыс Dmdmdx, получавших вектор, с крысами ДТ, получавшими буфер (растворитель), в качестве отрицательного контроля (**p<0,01).
На Фиг. 51A показан эффект разных доз вектора AAV9.hCK.Hopti-Dys3978.spA на уровни в крови общей креатинкиназы (CK) у крыс Dmdmdx через 3 месяца после инъекции. Результаты представлены в виде среднего значения ± SEM. Статистический анализ выполняли с использованием непараметрического критерия Крускала-Уоллиса и апостериорного критерия множественного сравнения Данна. Проводили статистическое сравнение крыс Dmdmdx, получавших вектор, с крысами ДТ, получавшими буфер (растворитель) (**p<0,01), или сравнение крыс Dmdmdx, получавших дозу 3×1014 вг/кг вектора, с крысами Dmdmdx, получавшими буфер или дозу 1×1013 вг/кг вектора (##p<0,01).
На Фиг. 51B показан эффект разных доз вектора AAV9.hCK.Hopti-Dys3978.spA на уровни в крови общей креатинкиназы (CK) у крыс Dmdmdx через 6 месяцев после инъекции. Результаты представлены в виде среднего значения ± SEM. Статистический анализ выполняли с использованием непараметрического критерия Крускала-Уоллиса и апостериорного критерия множественного сравнения Данна. Проводили статистическое сравнение крыс Dmdmdx, получавших вектор, с крысами ДТ, получавшими буфер (растворитель) (**p<0,01), в качестве отрицательного контроля (***p<0,001, **p<0,01, *p<0,05), или сравнение крыс Dmdmdx, получавших дозу 3×1014 вг/кг вектора, с крысами Dmdmdx, получавшими дозу 1×1013 вг/кг вектора ($p<0,05).
На Фиг. 52A показано постепенное изменение уровней общей креатинкиназы (CK) со дня инъекции (Д0) растворителя или вектора до момента эвтаназии через 3 месяца после инъекции. Незаштрихованные столбики показывают данные в день Д0, а заштрихованные столбики показывают данные через 3 месяца. Результаты представлены в виде среднего значения ± SEM.
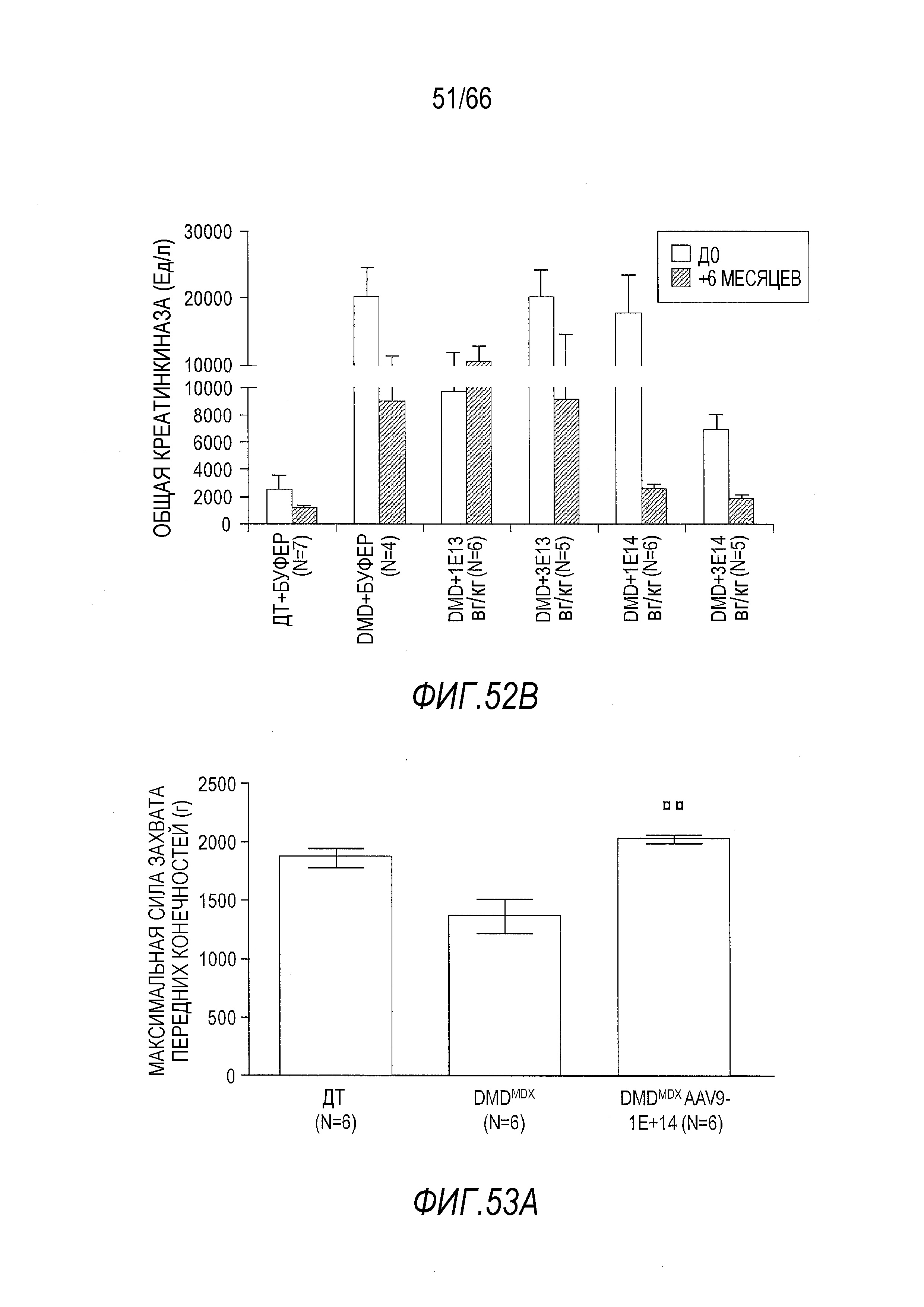
На Фиг. 52B показано постепенное изменение уровней общей креатинкиназы (CK) со дня инъекции (Д0) растворителя или вектора до момента эвтаназии через 6 месяцев после инъекции. Незаштрихованные столбики показывают данные в день Д0, а заштрихованные столбики показывают данные через 6 месяцев. Результаты представлены в виде среднего значения ± SEM.
На Фиг. 53A показана средняя абсолютная максимальная сила захвата передних конечностей у более старых крыс Dmdmdx, получавших дозу 1×1014 вг/кг вектора AAV9.hCK.Hopti-Dys3978.spA, в сравнении с крысами Dmdmdx и ДТ, получавшими растворитель. Тесты проводили через 3 месяца после инъекции с крысами, инъецированными в возрасте 4 месяца или в возрасте примерно 7 месяцев. Результаты представлены в виде среднего значения ± SEM. Проводили статистическое сравнение крыс Dmdmdx, получавших вектор, с крысами Dmdmdx, получавшими растворитель (*p<0,01).
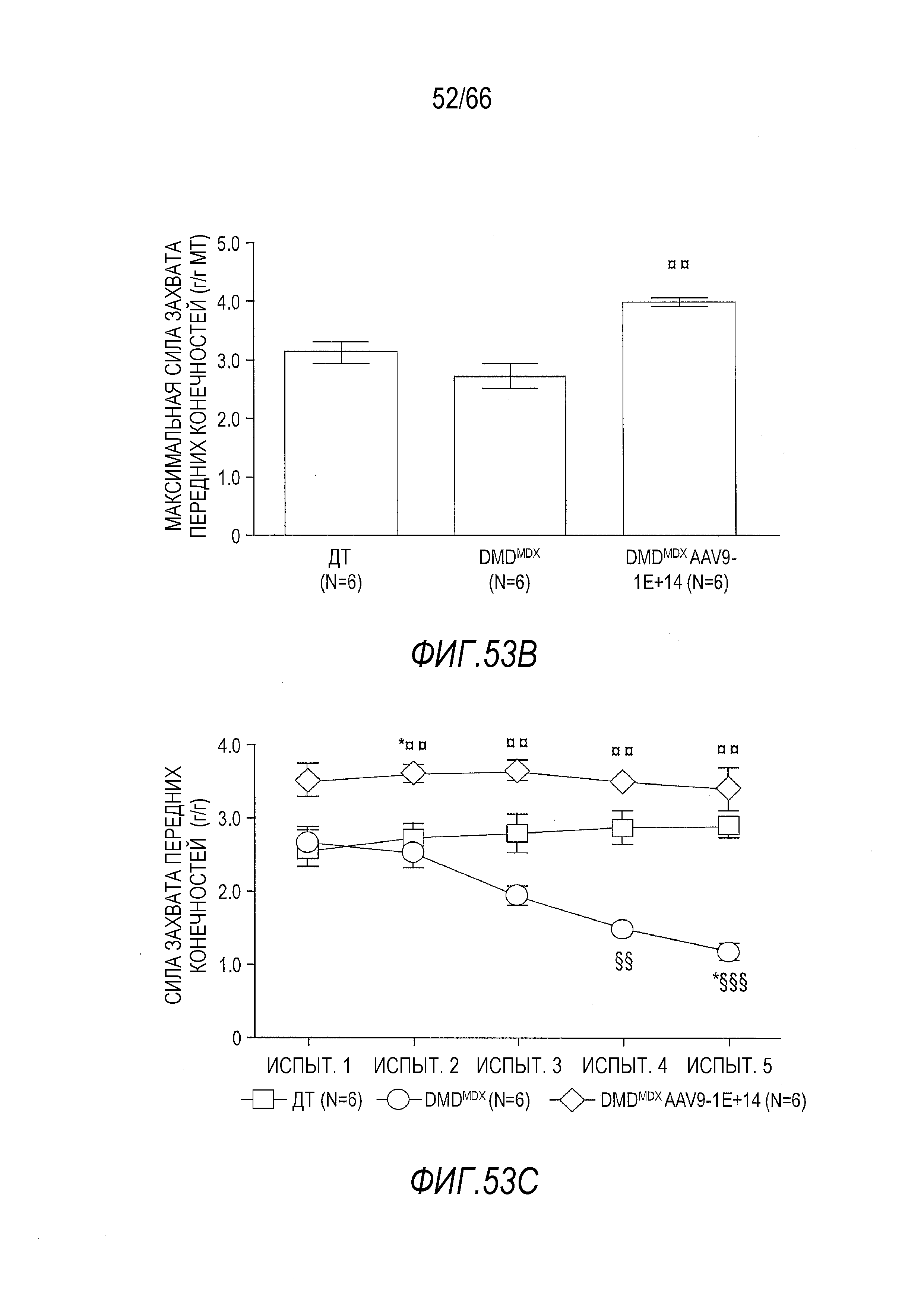
На Фиг. 53B показана средняя максимальная сила захвата передних конечностей относительно массы тела у более старых крыс Dmdmdx, получавших дозу 1×1014 вг/кг вектора AAV9.hCK.Hopti-Dys3978.spA, в сравнении с крысами Dmdmdx и ДТ, получавшими растворитель. Тесты проводили через 3 месяца после инъекции с крысами, инъецированными в возрасте 4 месяца или в возрасте примерно 7 месяцев. Результаты представлены в виде среднего значения ± SEM. Проводили статистическое сравнение крыс Dmdmdx, получавших вектор, с крысами Dmdmdx, получавшими растворитель (*p<0,01).
На Фиг. 53C показано постепенное изменение силы захвата передних конечностей в качестве показателя мышечного утомления у более старых крыс Dmdmdx, получавших дозу 1×1014 вг/кг вектора AAV9.hCK.Hopti-Dys3978.spA, в сравнении с крысами Dmdmdx и ДТ, получавшими растворитель. Тесты проводили путем измерения средней максимальной силы захвата 5 раз с короткими интервалами между испытаниями. Тесты проводили через 3 месяца после инъекции с крысами, инъецированными в возрасте 4 месяца или в возрасте примерно 7 месяцев. Результаты представлены относительно массы тела и в виде среднего значения ± SEM. Проводили статистическое сравнение крыс Dmdmdx, получавших вектор, с крысами ДТ, получавшими растворитель (*p<0,05), и крысами Dmdmdx, получавшими растворитель (¤¤p<0,01), и проводили сравнение более поздних испытаний с испытанием 1 у получавших растворитель крыс Dmdmdx ( p<0,01, p<0,001).
На Фиг. 54A показана средняя абсолютная максимальная сила захвата передних конечностей у более старых крыс Dmdmdx, получавших дозу 1×1014 вг/кг вектора AAV9.hCK.Hopti-Dys3978.spA, в сравнении с крысами Dmdmdx и ДТ, получавшими растворитель. Тесты проводили через 3 месяца после инъекции с крысами, инъецированными в возрасте 6 месяцев или в возрасте примерно 9 месяцев. Результаты представлены в виде среднего значения ± SEM. Проводили статистическое сравнение крыс Dmdmdx, получавших растворитель, с крысами ДТ, получавшими растворитель (**p<0,01).
На Фиг. 54B показана средняя максимальная сила захвата передних конечностей относительно массы тела у более старых крыс Dmdmdx, получавших дозу 1×1014 вг/кг вектора AAV9.hCK.Hopti-Dys3978.spA, в сравнении с крысами Dmdmdx и ДТ, получавшими растворитель. Тесты проводили через 3 месяца после инъекции с крысами, инъецированными в возрасте 6 месяцев или в возрасте примерно 9 месяцев. Результаты представлены в виде среднего значения ± SEM. Проводили статистическое сравнение крыс Dmdmdx, получавших растворитель, с крысами ДТ, получавшими растворитель (*p<0,05), или крыс Dmdmdx, получавших вектор, с крысами Dmdmdx, получавшими растворитель (¤p<0,05).
На Фиг. 54C показано постепенное изменение силы захвата передних конечностей в качестве показателя мышечного утомления у более старых крыс Dmdmdx, получавших дозу 1×1014 вг/кг вектора AAV9.hCK.Hopti-Dys3978.spA, в сравнении с крысами Dmdmdx и ДТ, получавшими растворитель. Тесты проводили путем измерения средней максимальной силы захвата 5 раз с короткими интервалами между испытаниями. Тесты проводили через 3 месяца после инъекции с крысами, инъецированными в возрасте 6 месяцев или в возрасте примерно 9 месяцев. Результаты представлены относительно массы тела и в виде среднего значения ± SEM. Проводили статистическое сравнение крыс Dmdmdx, получавших вектор, с крысами Dmdmdx, получавшими растворитель (¤p<0,05), крыс Dmdmdx, получавших растворитель, с крысами ДТ, получавшими растворитель (**p<0,01, ***p<0,001), и сравнение испытания 5 с испытанием 1 у получавших растворитель крыс Dmdmdx ( p<0,01).
На Фиг. 55A-55C показано выравнивание аминокислотных последовательностей белка мини-дистрофина Δ3990 (SEQ ID NO:27) и белка мини-дистрофина Dys3978 (SEQ ID NO:7).
На Фиг. 56A-56I показано выравнивание нуклеотидной последовательности, кодирующей мини-дистрофин Δ3990 (SEQ ID NO:28), которая получена из нуклеотидной последовательности дикого типа, кодирующей человеческий белок дистрофин, и кодон-оптимизированной для человека нуклеотидной последовательности, кодирующей мини-дистрофин Dys3978 (называемый Hopti-Dys3978; SEQ ID NO:1).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет описано со ссылкой на сопроводительные чертежи, которые представляют предпочтительные варианты осуществления изобретения. Однако данное изобретение может быть воплощено в разных формах и не должно быть ограничено вариантами осуществления, приведенными в настоящем документе. Скорее, данные варианты осуществления приведены для полноты и завершенности описания, и полностью представляют объем изобретения специалистам в данной области.
Если не указано иначе, все технические и научные термины, используемые в настоящем документе, имеют то значение, которое им обычно придают специалисты в области, к которой относится изобретение. Терминология, используемая в описании изобретения, предназначена лишь для описания конкретных вариантов осуществления и не должна ограничивать изобретение. Все публикации, патентные заявки, патенты и другие литературные источники, упомянутые в настоящем документе, включены посредством ссылки в полном объеме.
В настоящем документе нуклеотидные последовательности представлены только одной цепью, в направлении от 5' к 3'-концу, слева направо, если специально не указано иначе. Нуклеотиды и аминокислоты в настоящем документе представлены в соответствии с рекомендациями Комиссии IUPAC-IUB по биохимической номенклатуре, или (для аминокислот) в виде однобуквенного кода, или в виде трехбуквенного кода, и тот, и другой, соответствуют 37 CFR 1.822 и общепринятому употреблению. Смотри, например, PatentIn User Manual, 99-102 (Nov. 1990) (Бюро по патентам и торговым маркам США).
Если не указано иначе, стандартные методы, известные специалистам в данной области, могут быть использованы для создания конструктов рекомбинантного парвовируса и AAV (rAAV), упаковки векторов, экспрессирующих последовательности Rep и/или Cap парвовируса, и временной или стабильной трансфекции упаковывающих клеток. Такие методы известны специалистам в данной области. Смотри, например, SAMBROOK et al., MOLECULAR CLONING: A LABORATORY MANUAL 2nd Ed. (Cold Spring Harbor, NY, 1989); AUSUBEL et al., CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (Green Publishing Associates, Inc. и John Wiley & Sons, Inc., New York).
Кроме того, по настоящему изобретению также предусмотрено, что в некоторых вариантах осуществления изобретения любой признак или сочетание признаков, изложенных в настоящем документе, может быть исключено или опущено.
Для дополнительной иллюстрации, если, например, в спецификации указано, что конкретная аминокислота может быть выбрана из A, G, I, L и/или V, это выражение также должно означать, что данная аминокислота может быть выбрана из любого набора этих аминокислот, например, A, G, I или L; A, G, I или V; A или G; только L, и так далее, как если бы такие подгруппы сочетаний были специально указаны в настоящем документе. Более того, такое выражение также указывает на то, что одна или более из указанных аминокислот может быть исключена. Например, в конкретных вариантах осуществления аминокислота не является A, G или I; не является A; не является G или V, и так далее, как если бы каждое такое указание на исключение было бы специально приведено в настоящем документе.
Определения
Следующие термины использованы в описании настоящего изобретения и в прилагаемой формуле изобретения.
Форма единственного числа существительных должна также включать и соответствующую форму множественного числа, если из контекста явно не следует иное.
Кроме того, используемый в настоящем документе термин «примерно» применительно к измеряемой величине, такой как длина полинуклеотидной или полипептидной последовательности, доза, время, температура и тому подобное, должен включать вариации в размере 20%, 10%, 5%, 1%, 0,5% или даже 0,1% от указанного количества.
Кроме того, используемый в настоящем документе термин «и/или» означает и охватывает любые, и все, возможные сочетания одного или более из перечисленных наименований, а также отсутствие сочетаний при интерпретации альтернативы («или»).
Используемый в настоящем документе термин «аденоассоциированный вирус» (AAV) включает, но не ограничивается ими, AAV типа 1 (AAV1), AAV типа 2 (AAV2), AAV типа 3 (AAV3, включая типы 3A и 3B), AAV типа 4 (AAV4), AAV типа 5 (AAV5), AAV типа 6 (AAV6), AAV типа 7 (AAV7), AAV типа 8 (AAV8), AAV типа 9 (AAV9), AAV типа 10 (AAV10), AAV типа 11 (AAV11), AAV типа 12 (AAV12), AAV типа 13 (AAV13), птичий AAV ATCC VR-865, птичий AAV штамма DA-1, Bb1, Bb2, Ch5, Cy2, Cy3, Cy4, Cy5, Cy6, Hu1, Hu10, Hu11, Hu13, Hu15, Hu16, Hu17, Hu18, Hu19, Hu2, Hu20, Hu21, Hu22, Hu23, Hu24, Hu25, Hu26, Hu27, Hu28, Hu29, Hu3, Hu31, Hu32, Hu34, Hu35, Hu37, Hu39, Hu4, Hu40, Hu41, Hu42, Hu43, Hu44, Hu45, Hu46, Hu47, Hu48, Hu49, Hu51, Hu52, Hu53, Hu54, Hu55, Hu56, Hu57, Hu58, Hu6, Hu60, Hu61, Hu63, Hu64, Hu66, Hu67, Hu7, Hu9, HuLG15, HuS17, HuT17, HuT32, HuT40, HuT41, HuT70, HuT71, HuT88, Pi1, Pi2, Pi3, Rh1, Rh10, Rh13, Rh2, Rh25, Rh32, Rh33, Rh34, Rh35, Rh36, Rh37, Rh38, Rh40, Rh43, Rh48, Rh49, Rh50, Rh51, Rh52, Rh53, Rh54, Rh55, Rh57, Rh58, Rh61, Rh62, Rh64, Rh74, Rh8, змеиный AAV, птичий AAV, бычий AAV, собачий AAV, лошадиный AAV, овечий AAV, козий AAV, креветочный AAV, AAV1.1, AAV2.5, AAV6.1, AAV6.3.1, AAV9.45, RHM4-1 (SEQ ID NO:5 из WO 2015/013313), AAV2-TT, AAV2-TT-S312N, AAV3B-S312N, AAV-LK03, а также любые другие AAV, известные в настоящее время или открытые в будущем. Смотри, например, Fields et al., VIROLOGY, volume 2, chapter 69 (4th ed., Lippincott-Raven Publishers). Капсиды могут быть получены из ряда серотипов AAV, раскрытых в патенте США № 7906111; Gao et al., 2004, J. Virol. 78:6381; Moris et al., 2004, Virol. 33:375; WO 2013/063379; WO 2014/194132; и включают варианты AAV истинного типа (AAV-TT), раскрытые в WO 2015/121501, а также RHM4-1, от RHM15-1 до RHM15-6 и их варианты, раскрытые в WO 2015/013313; специалистам в данной области известно, что есть вероятность существования других вариантов, пока не идентифицированных, которые выполняют такую же, или аналогичную, функцию, или могут содержать компоненты из двух или более AAV капсидов. Полный набор белков cap AAV включает VP1, VP2 и VP3. Открытая рамка считывания, содержащая нуклеотидные последовательности, кодирующие белки AAV капсида, может содержать не полный набор белков cap AAV, или может быть предоставлен полный набор белков cap AAV.
А также любые другие AAV, известные в настоящее время или открытые в будущем. Смотри, например, FIELDS et al., VIROLOGY, volume 2, chapter 69 (4th ed., Lippincott-Raven Publishers). Были идентифицированы несколько относительно новых серотипов и клад AAV (Смотри, например, Gao et al., (2004) J. Virol. 78:6381; Moris et al., (2004) Virol. 33-:375).
AAV представляет собой небольшой безоболочечный вирус с икосаэдрическим капсидом диаметром примерно 20-30 нм. AAV не способны реплицироваться без помощи так называемых хелперных белков из других вирусов (например, аденовируса, вируса простого герпеса, вируса осповакцины и человеческого папилломавируса), и вследствие этого были выделены в особый род, депендовирусы (поскольку они зависят от других вирусов для репликации), в семействе парвовирусов. Хотя было открыто множество разных серотипов AAV, и у многих людей продуцируются антитела против одного или более серотипов AAV (что предполагает широкую распространенность AAV инфекции), не известны какие-либо заболевания, вызываемые AAV, это свидетельствует о том, что AAV не является патогенным для человека.
Хотя было открыто множество серотипов AAV, одним из наиболее полно охарактеризованных является AAV2, и в следующем далее описании биологии AAV основное внимание уделяется некоторым фактам, установленным для AAV2. Считается, что жизненный цикл AAV других серотипов является аналогичным, хотя детали могут отличаться. Конкретные детали того, каким образом AAV2 или AAV другого серотипа инфицирует клетки и реплицируется в них, приведены исключительно с целью облегчить понимание раскрытого в настоящем документе изобретения и никоим образом не должны ограничивать его объем. Даже если позже будет обнаружено, что какая-либо информация является неправильной или неполной, это не должно быть истолковано как умаление полезности или возможностей изобретения, раскрытого и заявленного в настоящем документе. Дополнительную информацию о жизненном цикле AAV можно найти в M. Goncalves, Virol J 2:43 (2005), MD Weitzman and RM Linden, Adeno-Associated Virus Biology, Ch. 1, pp. 1-23, Adeno-Associated Virus Methods and Protocols, Ed. RO Snyder and P Moullier, Humana Press (2011), GE Berry and A Asokan, Curr Opin Virol 21:54-60 (2016), и в ссылках, приведенных в этих документах.
Геном AAV2 дикого типа представляет собой линейную ДНК длиной примерно 4,7 килобаз. Хотя он является в основном одноцепочечным, 5' и 3'-концы генома состоят из так называемых инвертированных концевых повторов (ITR), каждый из которых имеет длину 145 пар нуклеотидов и содержит палиндромные последовательности, которые самоотжигаются по классическому принципу спаривания оснований Уотсона-Крика, образуя T-образные шпилечные структуры. Одна из этих структур содержит свободную 3'-гидроксильную группу, которая, при наличии клеточных ДНК-полимераз, делает возможной инициацию репликации вирусной ДНК по самопримирующему механизму замещения цепи. Смотри, например, M. Goncalves, Adeno-associated virus: from defective virus to effective vector, Virology J 2:43 (2005). Вследствие механизма, за счет которого одноцепочечные вирусные геномы реплицируются, а затем упаковываются в капсиды в инфицированных клетках, плюс (смысловая или кодирующая) и минус (антисмысловая или некодирующая) цепи упаковываются с одинаковой эффективностью в отдельные частицы.
В дополнение к фланкирующим ITR, геном AAV2 дикого типа содержит два гена, rep и cap, которые кодируют, соответственно, четыре репликационных белка (Rep 78, Rep 68, Rep 52 и Rep 40) и три капсидных белка (VP1, VP2 и VP3) за счет эффективного использования альтернативных промоторов и сплайсинга. Крупные репликационные белки, Rep 78 и 68, являются мультифункциональными и участвуют в транскрипции AAV, репликации вирусной ДНК и сайт-специфической интеграции вирусного генома в человеческую хромосому 19. Меньшие по размеру белки Rep вовлечены в упаковку вирусного генома в вирусные капсиды в ядрах инфицированных клеток. Три капсидных белка продуцируются за счет сочетания альтернативного сплайсинга и использования альтернативных сайтов начала трансляции, так что все три белка имеют общую последовательность около их карбокси-конца, но VP2 включает дополнительную амино-концевую последовательность, отсутствующую у VP3, и VP1 включает дополнительную амино-концевую последовательность, отсутствующую у VP2 и VP3. По оценкам, капсиды содержат в общей сложности 60 капсидных белков в примерной стехиометрии VP1:VP2:VP3, соответствующей 1:1:10, хотя эти соотношения, судя по всему, могут варьироваться.
Несмотря на относительно небольшой размер и, следовательно, способность нести гетерологичные гены, AAV был признан ведущим вирусным вектором для генной терапии. Преимущества использования AAV в сравнении с другими вирусами, предложенными в качестве векторов для генной терапии, включают способность AAV поддерживать долгосрочную экспрессию гена в трансдуцированных клетках, трансдуцировать как делящиеся, так и неделящиеся, клетки, трансдуцировать клетки самых разных типов в зависимости от серотипа, неспособность реплицироваться в отсутствие вируса-помощника и очевидное отсутствие патогенности, связанной с инфекциями дикого типа.
Из-за их небольшого размера капсиды AAV могут физически заключать в себе одноцепочечный ДНК-геном, составляющий не более примерно 4,7-5,0 килобаз в длину. Без модификации генома будет недостаточно пространства для включения гетерологичного гена, такого как кодирующая последовательность для терапевтического белка, и генных регуляторных элементов, таких как промотор и, необязательно, энхансер. Для создания дополнительного пространства гены rep и cap можно удалять и заменять их нужными гетерологичными последовательностями, при условии сохранения фланкирующих ITR. Функции генов rep и cap могут быть обеспечены в транс-положении на другом фрагменте ДНК. Напротив, ITR являются единственными вирусными элементами AAV, которые должны сохраняться в цис-положении с гетерологичной последовательностью. Комбинирование ITR с гетерологичным геном и перенесение генов rep и cap на другую плазмиду, лишенную ITR, также предотвращает продуцирование инфекционного AAV дикого типа в то же время, когда будет продуцироваться AAV вектор для генной терапии. Удаление rep и cap также означает, что AAV векторы для генной терапии не смогут реплицироваться в клетках, которые они трансдуцируют.
В некоторых вариантах осуществления геном AAV векторов представляет собой линейную одноцепочечную ДНК, фланкированную AAV ITR. Прежде, чем он сможет поддерживать транскрипцию и трансляцию гетерологичного гена, одноцепочечный ДНК-геном должен быть переведен в двухцепочечную форму клеточными ДНК-полимеразами, которые используют свободную 3′-OH группу одной из самопримируемых ITR для инициации синтеза второй цепи. В альтернативных вариантах осуществления полноразмерные одноцепочечные геномы противоположной полярности могут отжигаться, с образованием полноразмерного двухцепочечного генома, и это может происходить, когда множество AAV векторов, несущих геномы противоположной полярности, одновременно трансдуцируют одну и ту же клетку. После образования двухцепочечных векторных геномов, за счет любого механизма, клеточный аппарат транскрипции генов может использовать двухцепочечную ДНК для экспрессии гетерологичного гена.
В других вариантах осуществления векторный геном может быть сконструирован самокомплементарным (scAAV), имеющим ITR дикого типа на каждом конце и мутантный ITR в середине. Смотри, например, McCarty, DM, et al., Adeno-associated virus terminal repeat (TR) mutant generates self-complementary vectors to overcome the rate-limiting step to transduction in vivo. Gene Ther. 10:2112-18 (2003). Было высказано предположение, что после проникновения в клетку самокомплементарные геномы AAV могут самоотжигаться, начиная с ITR в середине, с образованием двухцепочечного генома, без необходимости в de novo репликации ДНК. Было показано, что данный подход приводит к более эффективной трансдукции и более быстрой экспрессии гетерологичного гена, однако при этом размер гетерологичного гена, который может быть использован, уменьшается примерно вполовину.
Были разработаны разные стратегии продуцирования AAV векторов для генной терапии, однако одним из наиболее распространенных является метод тройной трансфекции, в котором три разные плазмиды трансфицируют в клетки-продуценты. Смотри, например, публикацию N. Clement and J. Grieger, Mol Ther Methds Clin Dev, 3:16002 (2016), Grieger, JC, et al., Mol Ther 24(2):287-97 (2016) и приведенные в ней ссылки. В данном методе создают плазмиду, содержащую последовательность векторного генома, включающую, например, гетерологичный промотор и, необязательно, энхансер, а также гетерологичный ген для экспрессии нужных РНК или белка, фланкированную правым и левым ITR. Векторную плазмиду котрансфицируют в клетки-продуценты, такие как клетки HEK293, со второй плазмидой, содержащей гены rep и cap, и третьей плазмидой, содержащей хелперные гены аденовируса (или другого вируса), необходимые для репликации и упаковки векторного генома в AAV капсиды. В альтернативных вариантах осуществления метода все из генов rep, cap и аденовирусных хелперных генов находятся на одной и той же плазмиде, и две плазмиды котрансфицируют в клетки-продуценты. Примеры аденовирусных хелперных генов включают гены E1a, E1b, E2a, E4orf6 и VA РНК. Для многих серотипов AAV могут быть использованы AAV2 ITR вместо природных ITR без существенного нарушения способности векторного генома к репликации и упаковке в не-AAV2 капсиды. Для данного подхода, известного как псевдотипирование, всего лишь необходимо использование плазмиды rep/cap, которая содержит гены rep и cap из другого серотипа. Таким образом, например, в генно-терапевтическом AAV векторе можно использовать AAV9 капсид и векторный геном, содержащий AAV2 ITR, фланкирующие гетерологичный ген (он может быть обозначен «AAV2/9»), такой как ген мини-дистрофина. После продуцирования клеткой AAV частиц они могут быть собраны и очищены с использованием стандартных методов, известных в данной области, таких как ультрацентрифугирование в градиенте CsCl, или с использованием хроматографических колонок разных типов.
Парвовирусные частицы и геномы по настоящему изобретению могут быть получены из, но без ограничения, AAV. Геномные последовательности AAV разных серотипов и автономных парвовирусов, а также последовательности природных ITR, белков Rep и капсидных субъединиц известны в данной области. Такие последовательности можно найти в литературе или в общедоступных базах данных, таких как GenBank. Смотри, например, GenBank регистрационные номера NC_002077, NC_001401, NC_001729, NC_001863, NC_001829, NC_001862, NC_000883, NC_001701, NC_001510, NC_006152, NC_006261, AF063497, U89790, AF043303, AF028705, AF028704, J02275, J01901, J02275, X01457, AF288061, AH009962, AY028226, AY028223, AY631966, AX753250, EU285562, NC_001358, NC_001540, AF513851, AF513852 и AY530579; описание которых включено в настоящий документ посредством ссылки в качестве информации о нуклеотидных и аминокислотных последовательностях парвовирусов и AAV. Смотри также, например, Bantel-Schaal et al., (1999) J. Virol. 73: 939; Chiorini et al., (1997) J. Virol. 71:6823; Chiorini et al., (1999) J. Virol. 73:1309; Gao et al., (2002) Proc. Nat. Acad. Sci. USA 99:11854; Moris et al., (2004) Virol. 33-:375-383; Mori et al., (2004) Virol. 330:375; Muramatsu et al., (1996) Virol. 221:208; Ruffing et al., (1994) J. Gen. Virol. 75:3385; Rutledge et al., (1998) J. Virol. 72:309; Schmidt et al., (2008) J. Virol. 82:8911; Shade et al., (1986) J. Virol. 58:921; Srivastava et al., (1983) J. Virol. 45:555; Xiao et al., (1999) J. Virol. 73:3994; международные патентные публикации WO 00/28061, WO 99/61601, WO 98/11244 и патент США № 6156303; содержание которых включено в настоящий документ посредством ссылки в качестве информации о нуклеотидных и аминокислотных последовательностях парвовирусов и AAV. Последовательности ITR из AAV1, AAV2 и AAV3 приведены в публикации Xiao, X., (1996), «Characterization of Adeno-associated virus (AAV) DNA replication and integration», Ph.D. Dissertation, University of Pittsburgh, Pittsburgh, PA (включенной в настоящий документ в полном объеме).
Используемый в настоящем документе термин «трансдукция» клетки AAV означает AAV-опосредованный перенос генетического материала в клетку. Смотри, например, FIELDS et al., VIROLOGY, volume 2, chapter 69 (3d ed., Lippincott-Raven Publishers).
Термины «5′-сегмент» и «3′-сегмент» являются относительными терминами для определения пространственных взаимоотношений между двумя или более элементами. Таким образом, например, «3′-сегмент» полинуклеотида означает сегмент полинуклеотида, расположенный по ходу транскрипции после другого сегмента. Термин «3′-сегмент» не должен означать, что сегмент обязательно находится на 3′-конце полинуклеотида, или даже, что он обязательно находится в 3′-половине полинуклеотида, хотя это не исключено. Аналогично, «5′-сегмент» полинуклеотида означает сегмент полинуклеотида, расположенный по ходу транскрипции перед другим сегментом. Термин «5′-сегмент» не должен означать, что сегмент обязательно находится на 5′-конце полинуклеотида, или даже, что он обязательно находится в 5′-половине полинуклеотида, хотя это не исключено.
Используемый в настоящем документе термин «полипептид» охватывает как пептиды, так и белки, если нет иных указаний.
«Полинуклеотид» представляет собой линейную последовательность нуклеотидов, в которой 3′-положение каждой мономерной единицы связано с 5′-положением соседней мономерной единицы через фосфатную группу. Полинуклеотиды могут представлять собой РНК (содержащую только нуклеотиды РНК), ДНК (содержащую только нуклеотиды ДНК), гибриды РНК и ДНК (содержащие нуклеотиды РНК и ДНК), а также другие гибриды, содержащие природные и/или неприродные нуклеотиды. Линейный порядок нуклеотидов в полинуклеотиде называют «нуклеотидной последовательностью», «последовательностью нуклеиновой кислоты», «последовательностью оснований» или, иногда, просто «последовательностью» полинуклеотида. Как правило, порядок оснований указан, начиная с 5′-конца полинуклеотида и заканчивая 3′-концом полинуклеотида. Как известно в данной области, полинуклеотиды могут принимать вторичную структуру, например, за счет областей самокомплементарности. Полинуклеотиды также могут гибридизоваться с полностью или частично комплементарными полинуклеотидами по классическому механизму спаривания оснований Уотсона-Крика, или по другим механизмам, известным специалистам в данной области.
Используемый в настоящем документе термин «ген» означает фрагмент полинуклеотида, как правило, но не обязательно, ДНК, который кодирует полипептид или белок. В некоторых вариантах осуществления гены могут перемежаться с интронами. В некоторых вариантах осуществления полинуклеотид может кодировать более чем один полипептид или белок вследствие механизмов, известных как альтернативный сплайсинг, использование альтернативных инициирующих кодонов, или других биологических механизмов, известных специалистам в данной области. Термин «открытая рамка считывания», сокращенно «ORF», означает часть полинуклеотида, кодирующую полипептид или белок.
Используемый в настоящем документе термин «кодон-оптимизированная» означает кодирующую ген последовательность, которая была оптимизирована для повышения экспрессии путем замены одного или более кодонов, обычно присутствующих в кодирующей последовательности (например, в последовательности дикого типа, включая, например, кодирующую последовательность дистрофина или мини-дистрофина), кодоном для той же аминокислоты (синонимичным). В этом случае белок, кодируемый геном, является идентичным, однако лежащая в основе нуклеотидная последовательность гена или соответствующей мРНК отличается. В некоторых вариантах осуществления при оптимизации заменяют один или более редких кодонов (то есть, кодонов для тРНК, которые встречаются относительно нечасто в клетках конкретных биологических видов) синонимичными кодонами, которые встречаются более часто, для повышения эффективности трансляции. Например, при кодон-оптимизации для человека один или более кодонов в кодирующей последовательности заменяют кодонами, которые встречаются более часто в клетках человека для той же аминокислоты. Кодон-оптимизация также может приводить к повышению экспрессии гена за счет других механизмов, способных повышать эффективность транскрипции и/или трансляции. Стратегии включают, без ограничения, увеличение общего содержания GC (то есть, процентной доли гуанинов и цитозинов во всей кодирующей последовательности), уменьшение содержания CpG (то есть, числа динуклеотидов CG или GC в кодирующей последовательности), удаление криптических донорских или акцепторных сайтов сплайсинга, и/или добавление или удаление участков посадки рибосомы, таких как последовательности Kozak. Предпочтительно, если кодон-оптимизированный ген обеспечивает повышенную экспрессию белка, например, белок, кодируемый им, экспрессируется на значительно более высоком уровне в клетке, в сравнении с уровнем экспрессии белка, обеспечиваемым геном дикого типа в такой же, в остальном, клетке.
Используемый в настоящем документе термин «идентичность последовательности» имеет стандартное в данной области значение. Как известно в данной области, целый ряд разных программ можно использовать для определения того, имеет ли полинуклеотид или полипептид идентичность или сходство последовательности с известной последовательностью. Идентичность или сходство последовательности можно определять с использованием стандартных методов, известных в данной области, включая, но без ограничения, алгоритм поиска локальной идентичности последовательностей Смита-Уотермана, Adv. Appl. Math. 2:482 (1981), алгоритм выравнивания областей гомологии Нидлмана-Вунша, J. Mol. Biol. 48:443 (1970), метод поиска подобия Пирсона-Липмана, Proc. Natl. Acad. Sci. USA 85:2444 (1988), с помощью компьютеризированной реализации этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программ Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI), программы поиска наилучшего соответствия последовательностей, описанной Devereux et al., Nucl. Acid Res. 12:387 (1984), предпочтительно с использованием параметров по умолчанию, или путем визуальной инспекции.
Примером полезного алгоритма является PILEUP. PILEUP производит множественное выравнивание последовательностей из группы родственных последовательностей с использованием прогрессивных, попарных выравниваний. Он также может выстраивать дерево, показывающее кластеризующие отношения, которые используют для выравнивания. В PILEUP использован упрощенный вариант метода прогрессивного выравнивания Фенга-Дулитла, J. Mol. Evol. 35:351 (1987); метод аналогичен тому, который описан в Higgins & Sharp, CABIOS 5:151 (1989).
Другим примером полезного алгоритма является алгоритм BLAST, описанный в Altschul et al., J. Mol. Biol. 215:403 (1990) и Karlin et al., Proc. Natl. Acad. Sci. USA 90:5873 (1993). Особенно полезной программой BLAST является программа WU-BLAST-2, созданная на основании публикации Altschul et al., Meth. Enzymol., 266:460 (1996); blast.wustl/edu/blast/README.html. В WU-BLAST-2 используются несколько параметров поиска, которые предпочтительно настроены на значения по умолчанию. Параметры представляют собой динамические величины и устанавливаются самой программой в зависимости от состава конкретной последовательности и состава конкретной базы данных, против которой проводят поиск интересующей последовательности; однако значения можно корректировать для повышения чувствительности.
Дополнительным полезным алгоритмом является Gapped BLAST, описанный в публикации Altschul et al., Nucleic Acids Res. 25:3389 (1997).
Процентное значение идентичности аминокислотных последовательностей определяют по числу совпадающих идентичных остатков, деленному на общее число остатков в «более длинной» последовательности в области выравнивания. «Более длинной» последовательностью является последовательность, имеющая большее число фактических остатков в области выравнивания (пробелы, внесенные WU-Blast-2 для максимизации оценки выравнивания, игнорируются).
Аналогично, процент идентичности нуклеотидных последовательностей определяют, как процентную долю нуклеотидных остатков в последовательности-кандидате, которые идентичны нуклеотидам в полинуклеотиде, конкретно раскрытом в настоящем документе.
Выравнивание может включать внесение разрывов в выравниваемые последовательности. Кроме того, понятно, что для последовательностей, содержащих либо больше, либо меньше, нуклеотидов, чем полинуклеотиды, конкретно раскрытые в настоящем документе, в одном варианте осуществления процент идентичности последовательностей будет определен на основании числа идентичных нуклеотидов относительно общего числа нуклеотидов. Так, например, в одном варианте осуществления идентичность последовательностей в случае последовательностей, более коротких, чем последовательность, конкретно раскрытая в настоящем документе, будет определена с использованием числа нуклеотидов в более короткой последовательности. В расчетах идентичности последовательностей относительные веса замен не присваивают различным проявлениям вариации последовательности, таким как вставки, делеции, замены и так далее.
В одном варианте осуществления только в случае идентичности присваивают положительное значение (+1), и всем формам вариации последовательности, включая разрывы, присваивают значение «0», что устраняет необходимость в шкале весов замен или параметрах, описанных ниже для расчетов сходства последовательностей. Процент идентичности последовательностей можно рассчитывать, например, путем деления числа совпадающих идентичных остатков на общее число остатков «более короткой» последовательности в области выравнивания и умножения полученной величины на 100. «Более длинная» последовательность представляет собой последовательность, имеющую большее число фактических остатков в области выравнивания.
Термины «существенная гомология» или «существенное сходство» применительно к нуклеиновой кислоте или ее фрагменту означают, что при оптимальном выравнивании, с соответствующими вставками или делециями нуклеотидов, с другой нуклеиновой кислотой (или ее комплементарной цепью), идентичность нуклеотидных последовательностей составляет по меньшей мере примерно 95-99% последовательности.
Используемый в настоящем документе термин «выделенный» полинуклеотид (например, «выделенная ДНК» или «выделенная РНК») означает полинуклеотид, отделенный или в значительной степени свободный от по меньшей мере некоторых из других компонентов природного организма или вируса, например, клеточных или вирусных структурных компонентов, либо других полипептидов или нуклеиновых кислот, обычно связанных с полинуклеотидом.
Аналогично, «выделенный» полипептид означает полипептид, отделенный или в значительной степени свободный от по меньшей мере некоторых из других компонентов природного организма или вируса, например, клеточных или вирусных структурных компонентов, либо других полипептидов или нуклеиновых кислот, обычно связанных с полипептидом.
«Терапевтический полипептид» представляет собой полипептид, который способен облегчать или уменьшать симптомы, возникающие вследствие отсутствия или дефекта белка в клетке или в организме индивида. Альтернативно, «терапевтический полипептид» представляет собой полипептид, который иным образом приносит пользу индивиду, например, обладает противораковыми эффектами или повышает выживаемость трансплантата.
Используемый в настоящем документе термин «модифицированная» применительно к полинуклеотидной или полипептидной последовательности, означает последовательность, которая отличается от последовательности дикого типа вследствие одной или более делеций, добавлений, замен или любого их сочетания.
Используемые в настоящем документе термины «выделенный» или «очищенный» (или их грамматические эквиваленты) вирусный вектор означают, что вирусный вектор по меньшей мере частично отделен от по меньшей мере некоторых из других компонентов в исходном материале.
Термины «лечить», «терапия» или «лечение» (и их грамматические вариации) означают, что степень тяжести состояния индивида уменьшается, по меньшей мере частично улучшается или стабилизируется и/или достигается некоторое облегчение, ослабление, уменьшение или стабилизация по меньшей мере одного клинического симптома, и/или имеет место задержка прогрессирования заболевания или нарушения.
Термины «предотвращать», «предотвращение» и «профилактика» (и их грамматические вариации) означают предотвращение и/или задержку начала развития заболевания, нарушения и/или клинического симптома(ов) у индивида и/или уменьшение степени тяжести в начале развития заболевания, нарушения и/или клинического симптома(ов) относительно того, что имело бы место без применения способов по изобретению. Предотвращение может быть полным, например, полное отсутствие заболевания, нарушения и/или клинического симптома(ов). Предотвращение также может быть частичным, то есть, развитие заболевания, нарушения и/или клинического симптома(ов) у индивида, и/или степень тяжести в начале их развития имеет место в меньшей степени, чем это имело бы место без применения настоящего изобретения.
Используемый в настоящем документе термин «эффективное для лечения» количество означает количество, которое является достаточным для обеспечения некоторого улучшения состояния или принесения пользы индивиду. Альтернативно, «эффективное для лечения» количество означает количество, которое обеспечит некоторое облегчение, ослабление, уменьшение или стабилизацию по меньшей мере одного симптома у индивида. Специалисты в данной области понимают, что терапевтические эффекты не обязательно должны быть полными или исцеляющими при условии, что индивид получает некоторую пользу.
Используемый в настоящем документе термин «эффективное для предотвращения» количество представляет собой количество, которое является достаточным для предотвращения и/или отсрочки начала заболевания, нарушения и/или клинических симптомов у индивида, и/или для ослабления и/или уменьшения начальной степени тяжести заболевания, нарушения и/или клинических симптомов у индивида относительно того, что имело бы место без применения способов по изобретению. Специалисты в данной области понимают, что предотвращение не обязательно должно быть полным при условии, что индивид получает некоторую пользу.
В настоящем документе термины «гетерологичная» или «экзогенная» нуклеотидная последовательность, или последовательность нуклеиновой кислоты, используются взаимозаменяемо и относятся к последовательности нуклеиновой кислоты, которая не присутствует естественным образом в вирусе или клетке. В некоторых вариантах осуществления гетерологичная нуклеиновая кислота содержит открытую рамку считывания, кодирующую интересующий полипептид или нетранслируемую РНК (например, для доставки в клетку или в организм индивида).
Используемые в настоящем документе термины «вектор на основе вируса», «вирусный вектор», «вектор для доставки гена» или иногда просто «вектор» относятся к вириону или вирусной частице, которые действуют в качестве средства для доставки нуклеиновой кислоты, и означают векторный геном, упакованный в вирион или вирусную частицу. Векторы могут быть инфекционными или неинфекционными. Неинфекционные векторы не могут самостоятельно реплицироваться без экзогенно добавленных факторов. Векторы могут представлять собой AAV частицы или вирионы, содержащие AAV капсид, в который упакован AAV векторный геном. Эти векторы в настоящем документе также могут быть названы «рекомбинантные AAV» (сокращенно «rAAV») векторы, частицы или вирионы.
Векторный геном представляет собой полинуклеотид, упаковываемый в векторную частицу или вирион для доставки в клетку (эта клетка может быть названа «клетка-мишень»). Как правило, векторный геном конструируют для содержания гетерологичной нуклеотидной последовательности, такой как ген, которая должна быть доставлена в клетку-мишень. Векторный геном также может содержать одну или более нуклеотидных последовательностей, действующих в качестве регуляторных элементов, которые контролируют экспрессию гетерологичного гена в клетке-мишени. Векторный геном также может содержать дикого типа или модифицированную вирусную нуклеотидную последовательность(и), необходимую для продуцирования и/или функционирования вектора, например, без ограничения, репликации векторного генома в хозяине и упаковки в векторные частицы. В некоторых вариантах осуществления векторный геном представляет собой «AAV векторный геном», который может быть упакован в AAV капсид. В некоторых вариантах осуществления AAV векторный геном включает один или два инвертированных концевых повтора (ITR) в цис-положении с гетерологичным геном для поддержки репликации и упаковки. Все другие последовательности, кодирующие структурные и не структурные белки, необходимые для продуцирования AAV вектора, могут быть предоставлены в транс-положении (например, с плазмиды, или со стабильно интегрированных последовательностей в клетке-хозяине). В конкретных вариантах осуществления AAV векторный геном содержит по меньшей мере один ITR (например, AAV ITR), необязательно, два ITR (например, два AAV ITR), которые, как правило, будут находиться на 5′ и 3′-концах векторного генома и фланкировать гетерологичную нуклеотидную последовательность, но не обязательно должны быть смежными с ней. ITR могут быть одинаковыми или отличаться друг от друга, и происходить из одного и того же, или из разных серотипов AAV.
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и означают клетки, в которые введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформанты», «трансформированные клетки» и «трансдуцированные клетки», которые включают первичную трансформированную клетку и полученное от нее потомство независимо от числа пересевов. Для целей продуцирования AAV векторов некоторые клетки-хозяева могут быть использованы в качестве «продуцентов» или «упаковывающих» клеток, которые содержат все гены, необходимые для сборки функциональных вирусных частиц, включающих капсид и векторный геном. Как понятно специалистам в данной области, разные клетки-хозяева могут служить в качестве клеток-продуцентов, например, клетки HEK293 или линия клеток Pro10, но можно использовать и другие. Гены, необходимые для сборки вириона, включают векторный геном, описанный в других разделах настоящего документа, гены rep и cap AAV, а также некоторые хелперные гены из других вирусов, включая, без ограничения, аденовирус. Как понятно специалистам в данной области, гены, необходимые для продуцирования AAV, могут быть введены в клетки-продуценты разными способами, включая, без ограничения, трансфекцию одной или более плазмид, однако некоторые из генов могут уже присутствовать в клетках-продуцентах, либо интегрированные в геном, либо находящиеся на эписоме.
Термин «инвертированный концевой повтор» или «ITR» охватывает любой палиндромный вирусный концевой повтор или синтетическую последовательность, которая образует шпилечную структуру и действует в качестве инвертированного концевого повтора (то есть, опосредует некоторые вирусные функции, такие как репликация, упаковка вируса, интеграция и/или высвобождение провируса и тому подобное). ITR может представлять собой AAV ITR или не-AAV ITR. Например, последовательность не-AAV ITR, такая как последовательности других парвовирусов (например, собачьего парвовируса, бычьего парвовируса, мышиного парвовируса, свиного парвовируса, человеческого парвовируса B-19) или шпилечная структура SV40, служащая точкой начала репликации SV40, может быть использована в качестве ITR, которая может быть дополнительно модифицирована путем укорочения, замены, делеции, вставки и/или добавления. Кроме того, ITR может быть частично или полностью синтетическим, например, «двойная-D последовательность», описанная в патенте США № 5478745, выданном Samulski et al. Смотри также FIELDS et al., VIROLOGY, volume 2, chapters 69 & 70 (4th ed., Lippincott-Raven Publishers).
«AAV инвертированный концевой повтор» или «AAV ITR» может быть из любого AAV, включая, но без ограничения, серотипы 1, 2, 3a, 3b, 4, 5, 6, 7, 8, 9, 10, 11 или 13, змеиный AAV, птичий AAV, бычий AAV, собачий AAV, лошадиный AAV, овечий AAV, козий AAV, креветочный AAV, а также любые другие AAV, известные в настоящее время или открытые в будущем. AAV ITR не обязательно должен иметь природную последовательность концевого повтора (например, природная последовательность AAV ITR может быть изменена за счет вставки, делеции, укорочения и/или миссенс-мутаций) при условии, что концевой повтор опосредует нужные функции, например, репликацию, упаковку вируса, персистенцию и/или высвобождение провируса, и тому подобное. Последовательности AAV2 ITR имеют длину 145 пар нуклеотидов и приведены в настоящем документе в SEQ ID NO:14 и SEQ ID NO:15.
«Цис-мотивы» включают консервативные последовательности, такие как те, которые находятся на концах, или близко к концам, геномной последовательности и узнаются для инициации репликации; криптические промоторы или последовательности на внутренних положениях, вероятно, используемые для инициации транскрипции, сплайсинга или терминации.
Термин «фланкированная» применительно к последовательности, фланкированной другими элементами, указывает на присутствие одного или более фланкирующих элементов перед и/или после, то есть, в 5' и/или 3'-положении, по отношению к последовательности. Термин «фланкированная» не должен означать, что последовательности обязательно являются смежными. Например, могут присутствовать промежуточные последовательности между нуклеиновой кислотой, кодирующей трансген, и фланкирующим элементом. Если последовательность (например, трансген) «фланкирована» двумя другими элементами (например, TR), это означает, что один элемент расположен в 5'-положении относительно последовательности и другой расположен в 3'-положении относительно последовательности; однако между ними могут быть промежуточные последовательности.
«Трансфекция» клетки означает, что генетический материал введен в клетку с целью генетической модификации клетки. Трансфекцию можно выполнять разными методами, известными в данной области, например, с использованием фосфата кальция, полиэтиленимина, электропорации и тому подобного.
Термины «перенос гена» или «доставка гена» относятся к способам или системам для надежного введения чужеродной ДНК в клетки-хозяева. Такие способы могут приводить к временной экспрессии не интегрированной перенесенной ДНК, внехромосомной репликации и экспрессии перенесенных репликонов (например, эписом) или интеграции перенесенного генетического материала в геномную ДНК клеток-хозяев.
Термин «трансген» используют для обозначения любой гетерологичной нуклеотидной последовательности, включенной в вектор, в том числе вирусный вектор, для доставки и экспрессии в клетке-мишени (в настоящем документе также называемой «клетка-хозяин») и связанной с последовательностями контроля экспрессии, такими как промоторы. Специалисты в данной области понимают, что последовательности контроля экспрессии будут выбраны на основании способности стимулировать экспрессию трансгена в клетке-мишени. Примером трансгена является нуклеиновая кислота, кодирующая терапевтический полипептид.
Вирусные векторы по изобретению также могут быть «направленными» вирусными векторами (например, имеющими направленный тропизм) и/или «гибридным» парвовирусом (то есть, в котором вирусные ITR и вирусный капсид получены из разных парвовирусов), описанным в международной публикации патента WO 00/28004 и Chao et al., (2000) Mol. Therapy 2:619.
Кроме того, вирусный капсид или геномные элементы могут содержать другие модификации, включая вставки, делеции и/или замены.
Используемый в настоящем документе термин «кодирующие последовательности Rep» парвовируса или AAV означает нуклеотидные последовательности, кодирующие парвовирусные или AAV не структурные белки, которые опосредуют вирусную репликацию и продуцирование новых вирусных частиц. Репликационные гены и белки парвовируса и AAV описаны, например, в Fields et al., Virology, volume 2, chapters 69 & 70 (4th ed., Lippincott-Raven Publishers).
«Кодирующие последовательности Rep» не обязательно должны кодировать все парвовирусные или AAV белки Rep. Например, в случае AAV, кодирующие последовательности Rep не обязательно должны кодировать все четыре белка Rep AAV (Rep78, Rep 68, Rep52 и Rep40), фактически, считается, что AAV5 экспрессирует только сплайсированные белки Rep68 и Rep40. В репрезентативных вариантах осуществления кодирующие последовательности Rep кодируют по меньшей мере те репликационные белки, которые необходимы для репликации вирусного или векторного генома и упаковки в новые вирионы. Кодирующие последовательности Rep, как правило, будут кодировать по меньшей мере один большой белок Rep (то есть, Rep78/68) и один малый белок Rep (то есть, Rep52/40). В конкретных вариантах осуществления кодирующие последовательности Rep кодируют белок Rep78 AAV и белки Rep52 и/или Rep40 AAV. В других вариантах осуществления кодирующие последовательности Rep кодируют белки Rep68 и Rep52 и/или Rep40. В других вариантах осуществления кодирующие последовательности Rep кодируют белки Rep68 и Rep52, белки Rep68 и Rep40, белки Rep78 и Rep52 или белки Rep78 и Rep40.
Используемый в настоящем документе термин «большой белок Rep» относится к Rep68 и/или Rep78. Большие белки Rep по заявленному изобретению могут быть либо дикого типа, либо синтетическими. Большой белок Rep дикого типа может происходить из парвовируса или AAV, включая, но без ограничения, серотипы 1, 2, 3a, 3b, 4, 5, 6, 7, 8, 9, 10, 11 или 13, либо любой другой AAV, известный в настоящее время или открытый в будущем. Синтетический большой белок Rep может быть изменен путем вставки, делеции, укорочения и/или миссенс-мутаций.
В природном AAV геноме разные белки Rep закодированы одним геном за счет использования двух разных промоторов и альтернативного сплайсинга. Однако для целей продуцирования AAV белки Rep могут экспрессироваться в клетках-продуцентах с одного гена, или с разных полинуклеотидов, по одной экспрессируемой последовательности для каждого белка Rep. Таким образом, например, кодирующий Rep ген может быть сконструирован с инактивацией промотора p5 или p19, так что только малые или только большие белки Rep экспрессируются с соответствующих модифицированных генов. Экспрессия большого и малого белков Rep с разных генов может иметь преимущества, когда один из вирусных промоторов является неактивным в клетке-хозяине, в этом случае вместо него может быть использован конститутивно активный промотор, или когда желательно экспрессировать белки Rep на разных уровнях под контролем отдельных элементов контроля транскрипции и/или трансляции. Например, в некоторых вариантах осуществления может быть полезно понижающе регулировать экспрессию большого белка Rep относительно малого белка Rep (например, Rep78/68), чтобы избежать токсичности для клеток-хозяев (смотри, например, Urabe et al., (2002) Human Gene Therapy 13:1935).
Описанные в настоящем документе «кодирующие последовательности cap» парвовируса или AAV кодируют структурные белки, которые образуют капсид функционального парвовируса или AAV (то есть, способного упаковывать ДНК и инфицировать клетку-мишень). Как правило, кодирующие последовательности cap будут кодировать все из капсидных субъединиц парвовируса или AAV, но могут быть закодированы не все капсидные субъединицы при условии, что продуцируется функциональный капсид. Как правило, но не обязательно, кодирующие последовательности cap будут присутствовать на одной молекуле нуклеиновой кислоты.
Структура капсида автономных парвовирусов и AAV описана более подробно в BERNARD N. FIELDS et al., VIROLOGY, volume 2, chapters 69 & 70 (4th ed., Lippincott-Raven Publishers).
«Микро-дистрофин» или «мини-дистрофин» представляет собой рекомбинантный белок, содержащий некоторые субдомены или части субдоменов, имеющиеся в полноразмерном мышечном дистрофине, или их изоформы, обладающие по меньшей мере некоторыми функциональными свойствами дистрофина при экспрессии в мышечной клетке. Микро-дистрофины и мини-дистрофины имеют меньший размер, чем полноразмерный мышечный дистрофин (Dp427m). В сравнении с полноразмерным мышечным дистрофином микро-дистрофины и мини-дистрофины могут содержать делеции на N-конце, C-конце, внутри последовательности, или любое их сочетание.
Используемый в настоящем документе термин «дистрофинoпатия» означает мышечное заболевание, вызываемое патогенными вариантами DMD, гена, кодирующего белок дистрофин. Дистрофинoпатии проявляются в виде спектра фенотипов в зависимости от природы лежащего в основе повреждения гена. «Умеренная» часть спектра включает, без ограничения, фенотипы бессимптомного повышения сывороточной концентрации креатинфосфокиназы (CK) и мышечные судороги с миоглобинурией. «Тяжелая» часть спектра включает, без ограничения, прогрессирующие мышечные заболевания мышечную дистрофию Дюшенна (DMD) и мышечную дистрофию Беккера (BMD), при которых в основном поражаются скелетные мышцы и в меньшей степени сердце, и DMD-ассоциированную дилатационную кардиомиопатию (DCM), при которой в основном поражается сердце.
Полинуклеотиды, экспрессионные кассеты и векторы мини-дистрофина
Настоящее изобретение относится к кодон-оптимизированным последовательностям гена мини-дистрофина и содержащим их экспрессионным кассетам. Такие гены и экспрессионные кассеты полезны, в числе других вариантов применения, в генной терапии для предотвращения или лечения дистрофинoпатий, таких как DMD, у индивидов, которые нуждаются в этом. Экспрессируемые белки мини-дистрофина в трансдуцированных мышечных клетках способны копировать и заменять по меньшей мере некоторые из функций, обычно свойственных полноразмерному дистрофину, например, поддержку механической сильной связи между внеклеточным матриксом и цитоскелетом.
Кодон-оптимизированные последовательности разработаны для соответствия ограниченным размерам парвовирусных векторов, например, AAV векторов, а также для обеспечения повышенной экспрессии мини-дистрофина в сравнении с неоптимизированными последовательностями. В некоторых вариантах осуществления оптимизированные последовательности мини-дистрофина обеспечивают повышенную экспрессию белка мини-дистрофина в мышечных клетках или в мышцах у животных, которая по меньшей мере примерно на 5% выше, чем экспрессия не кодон-оптимизированных последовательностей дистрофина, например, по меньшей мере примерно на 5, 10, 20, 30, 40, 50, 75, 100, 200, 300, 400 или 500% или более, при этом не кодон-оптимизированная последовательность имеет в основе мРНК, кодирующую человеческий полноразмерный мышечный дистрофин дикого типа, например, NCBI эталонную последовательность NM_004006.2, которая включена в настоящий документ посредством ссылки.
Таким образом, один аспект изобретения относится к полинуклеотиду, кодирующему белок мини-дистрофин, содержащему, состоящему в основном из, или состоящему из: (a) нуклеотидной последовательности SEQ ID NO:1 или последовательности, по меньшей мере примерно на 90% идентичной ей; (b) нуклеотидной последовательности SEQ ID NO:2 или последовательности, по меньшей мере примерно на 90% идентичной ей; или (c) нуклеотидной последовательности SEQ ID NO:3 или последовательности, по меньшей мере примерно на 90% идентичной ей. В некоторых вариантах осуществления полинуклеотид является по меньшей мере примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичным одной из нуклеотидных последовательностей SEQ ID NO: 1-3. В конкретных вариантах осуществления полинуклеотид имеет длину, которая соответствует вместимости вирусного вектора, например, парвовирусного вектора, например, AAV вектора. В некоторых вариантах осуществления полинуклеотид включает примерно 5000, 4900, 4800, 4700, 4600, 4500, 4400, 4300, 4200, 4100 или примерно 4000 нуклеотидов, или менее.
В некоторых вариантах осуществления белок мини-дистрофин, кодируемый полинуклеотидом, содержит, состоит в основном из, или состоит из N-конца, шарнира H1, стержней R1 и R2, шарнира H3, стержней R22, R23 и R24, шарнира H4, цистеин-богатого домена (CR домена) и в некоторых вариантах осуществления всего или части карбокси-концевого домена (CT домена) белка дистрофина дикого типа. В других вариантах осуществления белок мини-дистрофин, кодируемый полинуклеотидом, содержит, состоит в основном из, или состоит из N-конца, актин-связывающего домена (ABD), шарнира H1, стержней R1 и R2, стержней R22, R23 и R24, шарнира H4, CR домена и в некоторых вариантах осуществления всего или части CT домена белка дистрофина дикого типа. В следующих вариантах осуществления белок мини-дистрофин не содержит последние три аминокислоты на C-конце белка дистрофина дикого типа (SEQ ID NO:25). В конкретных вариантах осуществления полинуклеотид кодирует белок мини-дистрофин, содержащий, состоящий в основном из, или состоящий из аминокислотной последовательности SEQ ID NO:7 или SEQ ID NO:8, или последовательности, по меньшей мере примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной аминокислотной последовательности SEQ ID NO:7 или SEQ ID NO:8.
Нуклеотидная последовательность дистрофина хорошо известна в данной области и ее можно найти в базах данных последовательностей, например, GenBank. Например, последовательность мРНК человеческого дистрофина соответствует последовательности в GenBank с регистрационным № M18533 или NCBI эталонной последовательности NM_004006.2, которые включены в настоящий документ посредством ссылки в полном объеме.
В некоторых вариантах осуществления полинуклеотид является частью экспрессионной кассеты для продуцирования белка дистрофина. Экспрессионная кассета может дополнительно содержать экспрессионные элементы, полезные для повышения экспрессии дистрофина.
В некоторых вариантах осуществления полинуклеотид по изобретению функционально связан с промотором. Промотор может представлять собой конститутивный промотор, либо тканеспецифический или тканепредпочтительный промотор, например, специфический для мышц или предпочтительно функционирующий в мышцах промотор. В некоторых вариантах осуществления промотор представляет собой промотор креатинкиназы, например, промотор, содержащий, состоящий в основном из, или состоящий из нуклеотидной последовательности SEQ ID NO:4 или SEQ ID NO:5.
В некоторых вариантах осуществления полинуклеотид по изобретению функционально связан с элементом полиаденилирования. В некоторых вариантах осуществления элемент полиаденилирования содержит нуклеотидную последовательность SEQ ID NO:6.
В некоторых вариантах осуществления полинуклеотид является частью экспрессионной кассеты, содержащей, состоящей в основном из, или состоящей из полинуклеотида, функционально связанного с промотором и элементом полиаденилирования. В конкретных вариантах осуществления генная экспрессионная кассета содержит, состоит в основном из, или состоит из любой из нуклеотидных последовательностей SEQ ID NO: 9-12 или последовательности, по меньшей мере примерно на 90% идентичной ей, например, по меньшей мере примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичной.
Другой аспект изобретения относится к вектору, содержащему полинуклеотиды по изобретению. Подходящие векторы включают, но без ограничения, плазмиду, фаг, фагмид, вирусный вектор (например, AAV вектор, аденовирусный вектор, герпесвирусный вектор, альфавирусный или бакуловирусный вектор), бактериальную искусственную хромосому (BAC) или дрожжевую искусственную хромосому (YAC). Например, нуклеиновая кислота может содержать, состоять из, или состоять в основном из AAV вектора, содержащего 5' и/или 3'-концевой повтор (например, 5' и/или 3'-концевой повтор AAV). В некоторых вариантах осуществления вектор представляет собой вирусный вектор, например, парвовирусный вектор, например, AAV вектор, например, AAV9 вектор. Вирусный вектор может дополнительно содержать нуклеиновую кислоту, содержащую рекомбинантную вирусную матрицу, при этом нуклеиновая кислота инкапсидирована в парвовирусном капсиде. Изобретение также относится к рекомбинантной парвовирусной частице (например, рекомбинантной AAV частице), содержащей полинуклеотиды по изобретению. Вирусные векторы и вирусные частицы дополнительно описаны ниже.
В конкретных вариантах осуществления вирусный вектор проявляет модифицированный тканевой тропизм в сравнении с векторами, из которых получен модифицированный вектор. В одном варианте осуществления парвовирусный вектор проявляет системный тропизм для мышц скелета, сердца и/или диафрагмы. В других вариантах осуществления парвовирусный вектор имеет сниженный тропизм для печени, в сравнении с вирусным вектором, содержащим капсидный белок дикого типа. Тканевой тропизм может быть модифицирован путем изменения некоторых аминокислот вирусного капсида, например, тех, которые присутствуют в белках VP1, VP2 и/или VP3 AAV капсида, как известно специалистам в данной области.
В некоторых вариантах осуществления векторный геном является самокомплементарным или дуплексным, и AAV вирионы, содержащие такие векторные геномы, известны как scAAV векторы. scAAV векторы описаны в международной публикации патента WO 01/92551 (содержание которого включено в настоящий документ посредством ссылки в полном объеме). Использование scAAV для экспрессии мини-дистрофина может приводить к увеличению числа трансдуцированных клеток, числа копий на трансдуцированную клетку, или и тому и другому.
Дополнительный аспект изобретения относится к трансформированной клетке, содержащей полинуклеотид и/или вектор по изобретению. Клетка может представлять собой in vitro, ex vivo или in vivo клетку.
Следующий аспект изобретения относится к не являющемуся человеком трансгенному животному, содержащему полинуклеотид и/или вектор, и/или трансформированную клетку по изобретению. В некоторых вариантах осуществления трансгенное животное представляет собой лабораторное животное, например, животную модель заболевания, например, животную модель мышечной дистрофии.
Другой аспект изобретения относится к белку мини-дистрофину, кодируемому полинуклеотидами по изобретению. Белок мини-дистрофин содержит все из последовательностей, необходимых для функционального белка дистрофина. Домены дистрофина хорошо известны в данной области и последовательности можно найти в базах данных последовательностей, например, GenBank. Например, аминокислотная последовательность человеческого дистрофина соответствует NCBI эталонной последовательности: NP_003997.1 и последовательности в GenBank с регистрационным № AAA53189, которые включены в настоящий документ посредством ссылки в полном объеме.
В некоторых вариантах осуществления белок мини-дистрофин содержит, состоит в основном из, или состоит из N-конца, шарнира H1, стержней R1 и R2, шарнира H3, стержней R22, R23 и R24, шарнира H4, CR домена и в некоторых вариантах осуществления всего или части CT домена, при этом белок мини-дистрофин не содержит последние три аминокислоты на C-конце белка дистрофина дикого типа (SEQ ID NO:25). В некоторых из этих вариантов осуществления N-концевой актин-связывающий домен содержит, состоит в основном из, или состоит из аминокислотных остатков 1-240 в SEQ ID NO:25, аминокислотной последовательности полноразмерного человеческого белка дистрофина; H1 содержит, состоит в основном из, или состоит из аминокислотных остатков 253-327 в SEQ ID NO:25; R1 содержит, состоит в основном из, или состоит из аминокислотных остатков 337-447 в SEQ ID NO:25; R2 содержит, состоит в основном из, или состоит из аминокислотных остатков 448-556 в SEQ ID NO:25; H3 содержит, состоит в основном из, или состоит из аминокислотных остатков 2424-2470 в SEQ ID NO:25; R22 содержит, состоит в основном из, или состоит из аминокислотных остатков 2687-2802 в SEQ ID NO:25; R23 содержит, состоит в основном из, или состоит из аминокислотных остатков 2803-2931 в SEQ ID NO:25; R24 содержит, состоит в основном из, или состоит из аминокислотных остатков 2932-3040 в SEQ ID NO:25; H4 содержит, состоит в основном из, или состоит из аминокислотных остатков 3041-3112 в SEQ ID NO:25; CR домен содержит, состоит в основном из, или состоит из аминокислотных остатков 3113-3299 в SEQ ID NO:25; и CT домен содержит, состоит в основном из, или состоит из аминокислотных остатков 3300-3408 в SEQ ID NO:25. В конкретных вариантах осуществления белок мини-дистрофин содержит, состоит в основном из, или состоит из аминокислотной последовательности SEQ ID NO:7. Дополнительное описание данного и родственных конструктов включено в пример 1 в настоящем документе.
В некоторых вариантах осуществления белок мини-дистрофин содержит, состоит в основном из, или состоит из N-конца, шарнира H1, стержней R1 и R2, стержней R22, R23 и R24, шарнира H4, CR домена и в некоторых вариантах осуществления всего или части CT домена. В конкретных вариантах осуществления белок мини-дистрофин не содержит последние три аминокислоты на C-конце белка дистрофина дикого типа. В некоторых из этих вариантов осуществления N-концевой актин-связывающий домен содержит, состоит в основном из, или состоит из аминокислотных остатков 1-240 в SEQ ID NO:25, аминокислотной последовательности полноразмерного человеческого белка дистрофина; H1 содержит, состоит в основном из, или состоит из аминокислотных остатков 253-327 в SEQ ID NO:25; R1 содержит, состоит в основном из, или состоит из аминокислотных остатков 337-447 в SEQ ID NO:25; R2 содержит, состоит в основном из, или состоит из аминокислотных остатков 448-556 в SEQ ID NO:25; R22 содержит, состоит в основном из, или состоит из аминокислотных остатков 2687-2802 в SEQ ID NO:25; R23 содержит, состоит в основном из, или состоит из аминокислотных остатков 2803-2931 в SEQ ID NO:25; R24 содержит, состоит в основном из, или состоит из аминокислотных остатков 2932-3040 в SEQ ID NO:25; H4 содержит, состоит в основном из, или состоит из аминокислотных остатков 3041-3112 в SEQ ID NO:25; цистеин-богатый домен содержит, состоит в основном из, или состоит из аминокислотных остатков 3113-3299 в SEQ ID NO:25; и карбокси-концевой домен содержит, состоит в основном из, или состоит из аминокислотных остатков 3300-3408 в SEQ ID NO:25. В конкретных вариантах осуществления белок мини-дистрофин содержит, состоит в основном из, или состоит из аминокислотной последовательности SEQ ID NO:8.
Следующий аспект изобретения относится к способу получения белка мини-дистрофина в клетке, включающему создание контакта клетки с полинуклеотидом или вектором по изобретению и, как следствие, продуцирование мини-дистрофина в клетке. Клетка может представлять собой in vitro, ex vivo или in vivo клетку, например, линию клеток или первичную клетку. Способы продуцирования белка в клетке путем введения полинуклеотида, кодирующего белок, хорошо известны в данной области.
Другой аспект изобретения относится к способу продуцирования белка мини-дистрофина в организме индивида, включающему доставку в организм индивида полинуклеотида, вектора и/или трансформированной клетки по изобретению, и, как следствие, продуцирование мини-дистрофина в организме индивида.
Дополнительный аспект изобретения относится к способу лечения мышечной дистрофии у индивида, который нуждается в этом, включающему доставку в организм индивида терапевтически эффективного количества полинуклеотида, вектора и/или трансформированной клетки по изобретению и, как следствие, лечение мышечной дистрофии у индивида. Мышечная дистрофия может представлять собой любую форму мышечной дистрофии, например, мышечную дистрофию Дюшенна или мышечную дистрофию Беккера.
Рекомбинантные вирусные векторы
Вирусные векторы по настоящему изобретению могут быть использованы для доставки полинуклеотидов, кодирующих мини-дистрофин, в клетки in vitro, ex vivo и in vivo. В частности, вирусные векторы могут быть успешно использованы для доставки или переноса полинуклеотидов, кодирующих мини-дистрофин, в клетки животных, в том числе млекопитающих.
Вирусный вектор также может содержать гетерологичную нуклеиновую кислоту, которая имеет гомологию с, и рекомбинирует с, локусом на хромосоме хозяина. Данный подход может быть использован, например, для коррекции генетического дефекта в клетке-хозяине.
В качестве следующей альтернативы, полинуклеотиды, кодирующие мини-дистрофин, могут быть использованы для продуцирования белка мини-дистрофина в клетке in vitro, ex vivo или in vivo. Например, вирусные векторы можно вводить в культивируемые клетки и выделять из них экспрессированный белок мини-дистрофин.
Специалисты в данной области понимают, что полинуклеотид, кодирующий мини-дистрофин, может быть функционально связан с соответствующими последовательностями контроля. Например, полинуклеотид может быть функционально связан с элементами контроля экспрессии, такими как сигналы контроля транскрипции/трансляции, точки начала репликации, сигналы полиаденилирования, внутренние участки посадки рибосомы (IRES), промоторы и/или энхансеры и тому подобное.
Специалисты в данной области понимают, что можно использовать различные элементы промотора и, необязательно, энхансера в зависимости от желательного уровня и тканевой специфичности экспрессии. Промотор/энхансер может быть конститутивным или индуцируемым, в зависимости от нужной схемы экспрессии. Промотор/энхансер может быть естественным или чужеродным, и может представлять собой природную или синтетическую последовательность. «Чужеродная» означает, что область инициации транскрипции не встречается у хозяина дикого типа, в который введена область инициации транскрипции. Энхансер, в случае его использования, может быть выбран из того же гена и биологического вида, что и промотор, из ортологичного гена у другого биологического вида, чем тот, из которого взят промотор, из другого гена у того же биологического вида, из которого взят промотор, или из другого гена у другого биологического вида, чем тот, из которого взят промотор.
В конкретных вариантах осуществления элементы промотора/энхансера могут быть естественными для клетки-мишени или индивида, получающего лечение. В репрезентативных вариантах осуществления элемент промотора/энхансера может быть естественным для гетерологичной нуклеотидной последовательности. Элемент промотора/энхансера, как правило, выбирают так, чтобы он функционировал в интересующей клетке-мишени. Кроме того, в конкретных вариантах осуществления элемент промотора/энхансера представляет собой элемент промотора/энхансера млекопитающего. Элемент промотора/энхансера может быть конститутивным или индуцируемым.
Индуцируемые элементы контроля экспрессии, как правило, являются предпочтительными в тех вариантах осуществления, в которых желательно обеспечивать регуляцию экспрессии гетерологичной нуклеотидной последовательности(й). Индуцируемые элементы промотора/энхансера для доставки гена могут быть тканеспецифическими или тканепредпочтительными элементами промотора/энхансера, и включают специфически или предпочтительно функционирующие в мышцах (включая специфически или предпочтительно функционирующие в скелетных и/или гладких мышцах) элементы промотора/энхансера. Другие индуцируемые элементы промотора/энхансера включают индуцируемые гормоном и индуцируемые металлом элементы. Иллюстративные индуцируемые элементы промотора/энхансера включают, но без ограничения, элемент Tet on/off, RU486-индуцируемый промотор, экдизон-индуцируемый промотор, рапамицин-индуцируемый промотор и металлотионеиновый промотор.
В вариантах осуществления, в которых полинуклеотид, кодирующий мини-дистрофин, транскрибируется, а затем транслируется в клетках-мишенях, в него обычно включают специфические сигналы инициации для эффективной трансляции вставленных кодирующих белок последовательностей. Эти экзогенные последовательности контроля трансляции, которые могут включать инициирующий кодон ATG и примыкающие последовательности, могут иметь разное происхождение, как природное, так и синтетическое.
Вирусные векторы по настоящему изобретению обеспечивают средство доставки полинуклеотида, кодирующего мини-дистрофин, в широкий диапазон клеток, включая делящиеся и неделящиеся клетки. Вирусные векторы можно использовать для доставки полинуклеотида в клетку in vitro, например, для продуцирования мини-дистрофина in vitro или для ex vivo генной терапии. Кроме того, вирусные векторы могут быть использованы в способе доставки полинуклеотида в организм индивида, который нуждается в этом, например, для экспрессии мини-дистрофина. В этом случае, белок может продуцироваться in vivo в организме индивида. Индивид может нуждаться в мини-дистрофине, поскольку индивид испытывает дефицит функционального дистрофина. Кроме того, способ может быть применен на практике, если продуцирование мини-дистрофина у индивида может иметь некоторый полезный эффект.
Вирусные векторы также можно использовать для продуцирования мини-дистрофина в культивируемых клетках или в организме индивида (например, с использованием индивида в качестве биореактора для продуцирования белка или для наблюдения за эффектами белка в организме индивида, например, в связи с методами скрининга).
Как правило, вирусные векторы по настоящему изобретению можно использовать для доставки полинуклеотида, кодирующего мини-дистрофин, с целью лечения и/или предотвращения любого болезненного состояния, для лечения которого может принести пользу доставка мини-дистрофина. Иллюстративные болезненные состояния включают, но без ограничения, мышечные дистрофии, в том числе Дюшенна и Беккера.
Вирусные векторы по настоящему изобретению можно использовать в методах диагностики и скрининга, при этом полинуклеотид, кодирующий мини-дистрофин, временно или стабильно экспрессируется в системе культивирования клеток или, альтернативно, в трансгенной животной модели.
Вирусные векторы по настоящему изобретению также можно использовать для различных не терапевтических целей, включая, но без ограничения, использование в протоколах для оценки тагретирования гена, клиренса, транскрипции, трансляции и так далее, как понятно специалистам в данной области. Вирусные векторы также можно использовать для оценки безопасности (распространения, токсичности, иммуногенности и так далее). Такие данные, например, рассматриваются Управлением по контролю за качеством пищевых продуктов и лекарственных средств США как часть процесса получения одобрения регуляторных органов перед проведением оценки клинической эффективности.
В конкретных вариантах осуществления изобретения, относящихся к AAV векторам или частицам для лечения дистрофинoпатии, такой как DMD, по изобретению предложены AAV векторы или частицы, включающие AAV капсиды от серотипа AAV, имеющего тропизм для поперечно-полосатых мышц, включая, без ограничения, скелетные мышцы, диафрагму и сердечную мышцу. Неограничивающими примерами природных AAV капсидов, имеющих тропизм для поперечно-полосатых мышц, являются AAV1, AAV6, AAV7, AAV8 и AAV9. Однако другие варианты осуществления включают AAV капсиды, которые, как известно, не существуют в природе, а сконструированы с целью создания новых AAV капсидов, которые предпочтительно трансдуцируют поперечно-полосатые мышцы, в сравнении с другими тканями. Такие рекомбинантные капсиды известны в данной области, однако изобретение охватывает и новые специфические для мышц AAV капсиды, которые будут созданы в будущем. Неограничивающие примеры специфических для мышц рекомбинантных AAV капсидов приведены в Yu, CY, et al., Gene Ther 16(8):953-62 (2009), Asokan, A, et al., Nat Biotech 28(1):79-82 (2010 (описание AAV2i8), Bowles, DE, et al., Mol Therapy 20(2):443-455 (2012) (описание AAV 2.5) и Asokan, A, et al., Mol Ther 20(4):699-708 (2012). Аминокислотные последовательности капсидных белков, включая белки VP1, VP2 и VP3, для многих природных и неприродных серотипов AAV известны в данной области. В одном неограничивающем примере аминокислотная последовательность серотипа AAV9 приведена в аминокислотной последовательности SEQ ID NO:13.
AAV частицы по изобретению для лечения дистрофинoпатии, такой как DMD, содержат векторный геном для экспрессии белка мини-дистрофина с субдоменами дистрофина, выбранными для по меньшей мере частичного восстановления в трансдуцированных мышечных клетках функции, выполняемой отсутствующим полноразмерным белком дистрофином. В некоторых вариантах осуществления белок мини-дистрофин сконструирован из субдоменов полноразмерного человеческого белка дистрофина дикого типа. В некоторых вариантах осуществления белок мини-дистрофин включает следующие субдомены из человеческого белка дистрофина в следующем порядке от N-конца к C-концу: N-концевой актин-связывающий домен (ABD); шарнирный домен H1; домены R1 и R2 спектриновых повторов; шарнирный домен H3; домены R22, R23 и R24 спектриновых повторов; шарнирный домен H4; цистеин-богатый (CR) домен и карбокси-концевой (CT) домен. В некоторых из этих вариантов осуществления N-концевой актин-связывающий домен содержит, состоит в основном из, или состоит из аминокислотных остатков 1-240 в SEQ ID NO:25, аминокислотной последовательности полноразмерного человеческого белка дистрофина; H1 содержит, состоит в основном из, или состоит из аминокислотных остатков 253-327 в SEQ ID NO:25; R1 содержит, состоит в основном из, или состоит из аминокислотных остатков 337-447 в SEQ ID NO:25; R2 содержит, состоит в основном из, или состоит из аминокислотных остатков 448-556 в SEQ ID NO:25; H3 содержит, состоит в основном из, или состоит из аминокислотных остатков 2424-2470 в SEQ ID NO:25; R22 содержит, состоит в основном из, или состоит из аминокислотных остатков 2687-2802 в SEQ ID NO:25; R23 содержит, состоит в основном из, или состоит из аминокислотных остатков 2803-2931 в SEQ ID NO:25; R24 содержит, состоит в основном из, или состоит из аминокислотных остатков 2932-3040 в SEQ ID NO:25; H4 содержит, состоит в основном из, или состоит из аминокислотных остатков 3041-3112 в SEQ ID NO:25; CR домен содержит, состоит в основном из, или состоит из аминокислотных остатков 3113-3299 в SEQ ID NO:25; и CT домен содержит, состоит в основном из, или состоит из аминокислотных остатков 3300-3408 в SEQ ID NO:25. В некоторых вариантах осуществления белок мини-дистрофин имеет аминокислотную последовательность SEQ ID NO:7.
Векторный геном AAV частиц по изобретению для лечения дистрофинoпатии, такой как DMD, содержит ген для экспрессии мини-дистрофина. Как правило, в векторном геноме будут отсутствовать гены rep и cap, обычно присутствующие в AAV дикого типа, с целью создания пространства для гена, экспрессирующего мини-дистрофин. В некоторых вариантах осуществления ген кодирует белок мини-дистрофин со следующими субдоменами полноразмерного человеческого белка дистрофина: ABD-H1-R1-R2-H3-R22-R23-R24-H4-CRD-CTD. В некоторых вариантах осуществления CTD представляет собой лишь часть CTD, присутствующего в мышечном дистрофине дикого типа, и в некоторых вариантах осуществления не содержит последние три аминокислоты, присутствующие в мышечном дистрофине дикого типа (SEQ ID NO:25). В конкретных вариантах осуществления ген кодирует человеческий белок мини-дистрофин, имеющий аминокислотную последовательность SEQ ID NO:7.
В некоторых вариантах осуществления ген, кодирующий человеческий белок мини-дистрофин, является кодон-оптимизированным для биологического вида, к которому относится индивид, которому AAV частицы по изобретению будут введены для осуществления генной терапии. Без связи с конкретной теорией, считается, что кодон-оптимизация повышает эффективность, с которой трансдуцированные клетки способны транскрибировать ген в мРНК и/или транслировать мРНК в белок, что приводит к повышению количества продуцируемого белка мини-дистрофина в сравнении с экспрессией кодирующего мини-дистрофин гена, который не является кодон-оптимизированным. В некоторых неограничивающих вариантах осуществления кодон-оптимизация представляет собой кодон-оптимизацию для человека, но можно выполнять кодон-оптимизацию и для других биологических видов, включая собак.
В некоторых вариантах осуществления кодон-оптимизация заключается в замене одного или более кодонов, которые спариваются с относительно редкими тРНК, присутствующими в организме биологического вида, такого как человек, синонимичными кодонами, которые спариваются с более распространенными тРНК для той же самой аминокислоты. Данный подход может приводить к повышению эффективности трансляции. В других вариантах осуществления кодон-оптимизация заключается в элиминации некоторых действующих в цис-положении мотивов, которые могут влиять на эффективность транскрипции или трансляции. Неограничивающие примеры кодон-оптимизации включают добавление сильной последовательности Kozak в запланированном начале кодирующей последовательности или элиминацию внутренних участков посадки рибосомы после запланированного инициирующего кодона. Другие действующие в цис-положении мотивы, которые могут быть элиминированы в процессе кодон-оптимизации, включают внутренние TATA-боксы; chi-сайты; элементы последовательности ARE, INS и/или CRS; повторяющиеся последовательности и/или вторичные структуры РНК; криптические донорские и/или акцепторные сайты сплайсинга, точки ветвления и сайты SalI.
В конкретных вариантах осуществления кодон-оптимизация заключается в увеличении содержания GC (то есть, числа нуклеиновых оснований G и C, присутствующих в нуклеотидной последовательности, как правило, выражаемого в процентах) относительно последовательности дикого типа, из которой получен ген мини-дистрофина. В некоторых вариантах осуществления содержание GC составляет по меньшей мере на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100% больше, чем содержание GC в соответствующем гене дикого типа. В связанных вариантах осуществления содержание GC кодон-оптимизированного гена составляет примерно или по меньшей мере 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, или более.
В некоторых вариантах осуществления кодон-оптимизация заключается в увеличении индекса адаптации кодонов (CAI) гена, кодирующего белок мини-дистрофин. CAI представляет собой меру предпочтения в использовании синонимичных кодонов у конкретных биологических видов. Значение CAI (которое имеет диапазон от 0 до 1) у конкретного биологического вида положительно коррелирует с уровнями генной экспрессии. Смотри, например, Sharp, PM and W-H Lie, Nuc Acids Res 15(3):1281-95 (1987). В некоторых вариантах осуществления кодон-оптимизация приводит к увеличению CAI гена мини-дистрофина относительно экспрессируемых на высоком уровне генов человека до величины, которая составляет по меньшей мере 0,70, 0,71, 0,72, 0,73, 0,74, 0,75, 0,76, 0,77, 0,78, 0,79, 0,80, 0,81, 0,82, 0,83, 0,84, 0,85, 0,86, 0,87, 0,88, 0,89, 0,90, 0,91, 0,92, 0,93, 0,94, 0,95, 0,96, 0,97, 0,98 или 0,99.
В других вариантах осуществления кодон-оптимизация заключается в уменьшении числа динуклеотидов CpG в кодирующей последовательности мини-дистрофина. Без связи с конкретной теорией функционирования, считается, что метилирование на динуклеотидах CpG может приводить к сайленсингу транскрипции гена, вследствие чего уменьшение числа динуклеотидов в последовательности гена может приводить к уменьшению уровня метилирования, в результате чего будет повышена эффективность транскрипции. Таким образом, в некоторых вариантах осуществления кодон-оптимизированных генов мини-дистрофина число динуклеотидов CpG уменьшено примерно или по меньшей мере на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60% или более в сравнении с последовательностью дикого типа, из которой получен ген мини-дистрофина.
Неограничивающим примером кодон-оптимизированного для человека человеческого гена мини-дистрофина является последовательность ДНК SEQ ID NO:1. Данную последовательность ДНК, которая имеет длину 3978 нуклеиновых оснований (включая стоп-кодон), в настоящем документе называют Hopti-Dys3978, хотя конкретная терминология использована лишь для удобства и не должна быть ограничивающей. Белковая последовательность мини-дистрофина, закодированная SEQ ID NO:1, имеющая название Dys3978, приведена в SEQ ID NO:7. Примером кодон-оптимизированного для собаки человеческого гена мини-дистрофина является SEQ ID NO:3, которая также кодирует Dys3978. Как описано более подробно в настоящем документе, кодирующая последовательность для мини-дистрофина SEQ ID NO:7 была собрана из подпоследовательностей гена полноразмерного человеческого мышечного дистрофина дикого типа (с NCBI эталонной последовательностью NM_004006.2, которая включена в настоящий документ посредством ссылки), соответствующих некоторым субдоменам, присутствующим в белке дистрофине (SEQ ID NO:25). Полученная последовательность гена в настоящем документе приведена в SEQ ID NO:26, которая затем была кодон-оптимизирована для человека, результатом чего стала последовательность ДНК SEQ ID NO:1. Без ограничения, кодон-оптимизация привела к увеличению содержания GC, уменьшению использования редких кодонов (то есть, увеличению индекса адаптации кодонов (CAI)) и включению сильного сайта инициации трансляции (консенсусной последовательности Kozak или аналогичной), в сравнении с последовательностью гена до кодон-оптимизации.
Векторный геном AAV частиц по изобретению для лечения дистрофинoпатии, такой как DMD, также включает AAV инвертированные концевые повторы (ITR), фланкирующие кодон-оптимизированный ген, кодирующий белок мини-дистрофин. В некоторых вариантах осуществления ITR происходят из того же серотипа AAV, что и капсид (например, без ограничения, AAV9 ITR, используемые с AAV9 капсидом), но в других вариантах осуществления могут быть использованы AAV ITR из другого серотипа. Например, ITR из серотипа AAV2 можно использовать в векторном геноме в сочетании с AAV капсидом из другого, не AAV2, серотипа. Неограничивающие примеры включают использование AAV2 ITR с капсидом из серотипов AAV1, AAV6, AAV7, AAV8 или AAV9, или другого природного или неприродного серотипа AAV. В конкретном неограничивающем примере AAV2 ITR можно использовать в сочетании с капсидом из серотипа AAV9. Применительно к «плюс», или смысловой, цепи ДНК векторного генома последовательность слева, 5' или перед AAV2 ITR приведена в виде последовательности ДНК SEQ ID NO:14, а последовательность справа, 3' или после AAV2 ITR приведена в виде последовательности ДНК SEQ ID NO:15.
Векторный геном AAV векторов по изобретению для лечения дистрофинoпатии, такой как DMD, дополнительно включает транскрипционный регуляторный элемент, функционально связанный с геном, кодирующим белок мини-дистрофин, так что векторный геном, после превращения в его двухцепочечную форму, может экспрессировать ген мини-дистрофина в трансдуцированных клетках. Транскрипционные регуляторные элементы, как правило, включают промотор и, необязательно, один или более элементов энхансера, которые действуют, повышая степень инициации транскрипции с промотора.
Функциональная связь транскрипционного регуляторного элемента с кодирующей последовательностью мини-дистрофина означает, что транскрипционный регуляторный элемент может действовать, контролируя транскрипцию и экспрессию гена, но не обязательно должен находиться в какой-либо конкретной структурной или пространственной связи. Поскольку векторные геномы по изобретению, как правило, упакованы в AAV капсиды в виде одноцепочечных молекул ДНК, следует понимать, что функциональная связь может не быть функциональной до тех пор, пока векторный геном не перейдет в двухцепочечную форму. Как правило, промотор будет находиться в положении 5′ или перед последовательностью гена, кодирующей белок мини-дистрофин, однако другие транскрипционные регуляторные элементы, такие как энхансеры, могут находиться в положении 5′ или в другом месте, например, в положении 3′, от гена.
В некоторых вариантах осуществления транскрипционный регуляторный элемент может представлять собой сильный конститутивно активный промотор, такой как те, которые встречаются в некоторых вирусах, инфицирующих эукариотические клетки. Хорошо известным в данной области примером является промотор из цитомегаловируса (CMV), однако известны и другие, например, промотор из вируса саркомы Рауса (RSV). Сильные вирусные промоторы, такие как CMV или RSV, как правило, не являются тканеспецифическими, так что в случае их использования белок мини-дистрофин экспрессировался бы не только в мышечных клетках, но и в клетках любого другого типа, например, в печени, при трансдукции AAV частицами по изобретению. Таким образом, в других вариантах осуществления можно использовать специфический для мышц транскрипционный регуляторный элемент для уменьшения количества белка мини-дистрофина, экспрессируемого в не-мышечных клетках, таких как клетки печени, которые также могут быть трансдуцированы AAV частицами по изобретению.
Специфические для мышц транскрипционные регуляторные элементы могут быть получены из специфических для мышц генов любых биологических видов, включая виды млекопитающих, например, без ограничения, специфических для мышц генов человека или мыши. Специфические для мышц транскрипционные регуляторные элементы обычно будут включать, как минимум, промотор из специфического для мышц гена, а также один или более энхансеров из того же самого или другого специфического для мышц гена. Такие энхансеры могут происходить из многих частей природного гена, например, энхансеры, расположенные в 5′ или 3′-положении от гена, или даже находящиеся в интронах. Специфические для мышц транскрипционные регуляторные элементы могут быть удалены в полном составе из специфического для мышц гена и вставлены в плазмиду для продуцирования AAV векторных геномов по изобретению, или могут быть сконструированы для адаптации их активности и уменьшения их размера насколько это возможно.
Неограничивающие примеры специфических для мышц генов, из которых специфические для мышц транскрипционные регуляторные элементы могут быть получены, включают ген мышечной креатинкиназы, ген тяжелой цепи миозина или ген легкой цепи миозина, или ген актина альфа-1 из скелетной мышцы, хотя можно использовать и другие. Эти гены могут быть человеческими, мышиными или других биологических видов.
Специфические для мышц транскрипционные регуляторные элементы, которые были созданы для использования в генной терапии, описаны в данной области и могут быть использованы в AAV векторах по изобретению для лечения мышечной дистрофии. В неограничивающих примерах Hauser описывает специфические для мышц транскрипционные регуляторные элементы, известные как CK4, CK5 и CK6, полученные из мышиного гена креатинкиназы (MCK) (Hauser, MA, et al., Mol Therapy 2(1):16-25 (2000)), Salva описывает специфические для мышц транскрипционные регуляторные элементы, известные как CK1 и CK7, полученные из гена MCK, а также MHCK1 и MHCK7, которые, кроме того, включают энхансеры из мышиного гена α-MHC (Salva, MZ, et al., Mol Therapy 15(2):320-9 (2007)), и Wang описывает специфические для мышц транскрипционные регуляторные элементы, известные как enh358MCK, dMCK и tMCK (Wang, B, et al., Gene Therapy 15:1489-9 (2008)). Использование других специфических для мышц транскрипционных регуляторных элементов в AAV векторах по изобретению для лечения мышечной дистрофии также возможно.
Неограничивающие примеры специфических для мышц транскрипционных регуляторных элементов, которые могут быть использованы в AAV векторах по изобретению для лечения мышечной дистрофии, включают CK4, CK5, CK6, CK1, CK7, MHCK1, MHCK7, enh358MCK, dMCK и tMCK, каждый из которых известен в данной области, или те, которые описаны в настоящем документе, как имеющие последовательности ДНК SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:16. Также можно использовать другие специфические для мышц транскрипционные регуляторные элементы.
Векторный геном AAV векторов по изобретению для лечения дистрофинoпатии, такой как DMD, также включает последовательность терминации транскрипции, расположенную в 3'-положении от кодирующей последовательности для гена мини-дистрофина. Включение последовательности терминации транскрипции гарантирует, что мРНК транскрипт, кодирующий белок мини-дистрофин, будет надлежащим образом полиаденилирован трансдуцированной клеткой, а следовательно, гарантирует эффективную трансляцию матрицы в белок. Без связи с конкретной теорией функционирования, исследования последовательностей терминации транскрипции у млекопитающих позволили идентифицировать консенсусную последовательность в 3' UTR генов, которая служит для терминации транскрипции и в качестве сигнала полиаденилирования растущего транскрипта. В частности, эти последовательности, как правило, включают мотив AATAAA, за которым следуют 15-30 нуклеотидов, а затем CA. Смотри, например, N. Proudfoot, Genes Dev 25:1770-82 (2011). Другие мотивы, такие как верхний элемент (USE) и нижний элемент (DSE) могут участвовать в терминации транскрипции в некоторых генах. Многие последовательности терминации транскрипции известны в данной области и могут быть использованы в AAV векторах по изобретению. Неограничивающие примеры включают сигнал полиаденилирования из ранних или поздних генов вируса SV40 (ранний SV40 или поздний полиA) или сигнал полиаденилирования из гена бычьего гормона роста (bGH полиA). Последовательности терминации транскрипции из других генов любых биологических видов также можно использовать в AAV векторах по изобретению. Альтернативно, можно конструировать синтетические последовательности терминации транскрипции и использовать в качестве сигнала терминации транскрипции и полиаденилирования. Дополнительные неограничивающие примеры последовательностей терминации транскрипции, которые могут быть использованы в AAV векторах по изобретению, включают те, которые описаны в настоящем документе, как имеющие последовательности ДНК SEQ ID NO:6 и SEQ ID NO:17.
В некоторых неограничивающих вариантах осуществления изобретение относится к AAV вирусной частице, или вектору, для лечения дистрофинoпатии, такой как DMD, включающей AAV капсид и векторный геном, кодирующий белок мини-дистрофин. В некоторых вариантах осуществления белок мини-дистрофин содержит следующие субдомены из полноразмерного человеческого белка дистрофина: ABD-H1-R1-R2-H3-R22-R23-R24-H4-CRD-CTD. В некоторых вариантах осуществления CTD представляет собой лишь часть CTD, присутствующего в мышечном дистрофине дикого типа, и в некоторых вариантах осуществления не содержит последние три аминокислоты, присутствующие в мышечном дистрофине дикого типа (SEQ ID NO:25). В некоторых вариантах осуществления ген, кодирующий белок мини-дистрофин с SEQ ID NO:7, является кодон-оптимизированным для человека и имеет последовательность ДНК SEQ ID NO:1. В некоторых вариантах осуществления AAV капсид получен из серотипа AAV9.
Как отмечено в других разделах настоящего документа, одноцепочечные AAV векторные геномы упакованы в капсиды в виде «плюс»-цепи или «минус»-цепи примерно в равных пропорциях. Следовательно, варианты осуществления вектора, или частицы, включают AAV частицы, в которых векторный геном имеет «плюс» полярность цепи (то есть, имеет нуклеотидную последовательность смысловой или кодирующей цепи ДНК), а также AAV частицы, в которых векторный геном имеет «минус» полярность цепи (то есть, имеет нуклеотидную последовательность антисмысловой или матричной цепи ДНК). Для конкретной нуклеотидной последовательности «плюс»-цепи в ее обычном порядке от 5′ к 3′-концу, нуклеотидная последовательность «минус»-цепи в ее порядке от 5′ к 3′-концу может быть определена как обратный комплемент нуклеотидной последовательности «плюс»-цепи.
В некоторых вариантах осуществления вектора векторный геном, имеющий полярность «плюс», содержит специфический для мышц транскрипционный регуляторный элемент, полученный из гена креатинкиназы, имеющий последовательность ДНК SEQ ID NO:16 и расположенный в 5′-положении от, и функционально связанный с, SEQ ID NO:1, последовательностью ДНК кодон-оптимизированного для человека гена, кодирующего белок мини-дистрофин. Также возможны частицы, содержащие соответствующую «минус»-цепь, в которой последовательность нуклеиновых оснований от 5′-конца будет обратным комплементом последовательности вышеупомянутой «плюс»-цепи. В других вариантах осуществления векторный геном, имеющий полярность «плюс», содержит первый AAV2 ITR, за которым следует последовательность ДНК SEQ ID NO:16, расположенная в 5′-положении от, и функционально связанная с последовательностью ДНК SEQ ID NO:1, и последовательность терминации транскрипции, содержащая последовательность ДНК SEQ ID NO:17, расположенную в 3′-положении от гена мини-дистрофина, за которой следует второй AAV2 ITR. Также возможны частицы, содержащие соответствующую «минус»-цепь, в которой последовательность нуклеиновых оснований от 5′-конца будет обратным комплементом последовательности вышеупомянутой «плюс»-цепи.
В других конкретных вариантах осуществления вектора векторный геном, имеющий полярность «плюс», содержит в направлении от 5′ к 3′-концу первый AAV2 ITR, последовательность транскрипционного регуляторного элемента, имеющего последовательность ДНК SEQ ID NO:16, кодон-оптимизированную для человека последовательность гена для экспрессии мини-дистрофина, гена с последовательностью ДНК SEQ ID NO:1, в функциональной связи с транскрипционным регуляторным элементом, последовательность терминации транскрипции, имеющую последовательность ДНК SEQ ID NO:17, и второй AAV2 ITR. Также возможны частицы, содержащие соответствующую «минус»-цепь, в которой последовательность нуклеиновых оснований от 5′-конца будет обратным комплементом последовательности вышеупомянутой «плюс»-цепи.
В конкретном неограничивающем варианте осуществления AAV вектор для лечения дистрофинoпатии, такой как DMD, который может быть назван в настоящем документе AAV9.hCK.Hopti-Dys3978.spA, содержит капсид из серотипа AAV9 и векторный геном, который может быть назван в настоящем документе hCK.Hopti-Dys3978.spA, содержащий, состоящий в основном из, или состоящий из, если геном имеет полярность «плюс», последовательности ДНК SEQ ID NO:18 или, если геном имеет полярность «минус», обратного комплемента последовательности ДНК SEQ ID NO:18 (то есть, если последовательность векторного генома читать с 5′ к 3′-концу).
Способы получения вирусных векторов
Настоящее изобретение также относится к способам получения AAV векторов. В одном конкретном варианте осуществления настоящее изобретение относится к способу получения рекомбинантной парвовирусной частицы, включающему введение в клетку, пермиссивную для репликации и упаковки AAV, рекомбинантного AAV векторного генома, содержащего ген мини-дистрофина, связанные элементы генетического контроля и фланкирующие AAV ITR, а также имеющего функции репликации и упаковки AAV, такие как те, которые обеспечиваются генами rep и cap AAV, в условиях, подходящих для репликации и упаковки рекомбинантных AAV частиц, в результате чего rAAV частицы продуцируются клеткой. Условия, достаточные для репликации и упаковки rAAV частиц, включают, без ограничения, наличие хелперных функций, таких как те, которые предоставляет аденовирус и/или герпесвирус. Клетки, пермиссивные для репликации и упаковки AAV, известны в настоящем документе как упаковывающие клетки или клетки-продуценты, термины, охваченные более широким термином «клетки-хозяева». Векторный геном rAAV частицы, функции репликации и упаковки, а также, при необходимости, хелперные функции могут быть предоставлены вирусными или невирусными векторами, такими как плазмиды, и могут существовать в упаковывающих клетках стабильно или временно, либо интегрированными в клеточный геном, либо в эписоме.
Рекомбинантные AAV векторы по изобретению могут быть получены несколькими методами, известными квалифицированным специалистам (смотри,например, WO 2013/063379). Иллюстративный метод описан в публикации Grieger, et al. 2015, Molecular Therapy 24(2):287-297, содержание которой включено посредством ссылки. Вкратце, эффективную трансфекцию клеток HEK293 используют в качестве отправной точки, при этом адгерентные клетки линии HEK293 из сертифицированного клинического главного клеточного банка используют для наращивания в суспензионных условиях, без содержания животных компонентов, во встряхиваемых колбах и биореакторах WAVE, позволяющих быстро и в больших масштабах получать rAAV частицы. При использовании метода тройной трансфекции (например, WO 96/40240) в некоторых вариантах осуществления суспензия клеток линии HEK293 может производить более 1×105 содержащих векторный геном (вг) частиц на клетку, или более 1×1014 вг/л клеточной культуры при сборе через 48 часов после трансфекции. Тройная трансфекция означает, что упаковывающую клетку трансфицируют тремя плазмидами: одна плазмида кодирует гены rep и cap AAV, другая плазмида кодирует различные хелперные функции (например, аденовирусные или HSV белки, такие как E1a, E1b, E2a, E4, и VA РНК) и еще одна плазмида кодирует векторный геном, то есть, ген мини-дистрофина и его различные элементы контроля, фланкированные AAV ITR. Для достижения желательного выхода можно оптимизировать ряд переменных, таких как выбор совместимой бессывороточной суспензионной среды, которая поддерживает как рост, так и трансфекцию, выбор реагента трансфекции, условий трансфекции и плотности клеток. Векторы можно собирать из среды и/или путем лизиса клеток, а затем очищать с использованием классического метода ультрацентрифугирования в градиенте плотности или метода колоночной хроматографии, либо других методов.
Функции упаковки обеспечивают гены для репликации и упаковки вирусного вектора. Таким образом, например, функции упаковки могут включать, по мере необходимости, функции, необходимые для экспрессии вирусных генов, репликации вирусного вектора, высвобождения вирусного вектора из интегрированного состояния, экспрессии вирусных генов и упаковки вирусного вектора в вирусную частицу. Обеспечивающие функции упаковки гены могут быть привнесены совместно или раздельно в упаковывающую клетку с использованием генетического конструкта, такого как плазмида или ампликон, бакуловирус или хелперный конструкт HSV. Обеспечивающие функции упаковки гены могут существовать вне хромосомы в упаковывающей клетке, но также могут быть интегрированы в хромосомную ДНК клетки. Примеры включают гены, кодирующие белки Rep и Cap AAV. Гены rep и cap могут быть введены в упаковывающую клетку совместно в виде части одного и того же вирусного или невирусного вектора. Например, последовательности rep и cap могут быть предоставлены гибридным аденовирусным вектором (например, вставлены в области E1a или E3 делетированного аденовирусного вектора) или герпесвирусным вектором, таким как EBV вектор. Альтернативно, гены rep и cap AAV могут быть предоставлены раздельно. Гены rep и cap также могут быть стабильно интегрированы в геном упаковывающей клетки или находиться на эписоме. Как правило, гены rep и cap не будут фланкированы ITR, чтобы избежать упаковки этих последовательностей в rAAV векторные частицы.
Хелперные функции обеспечивают хелперные вирусные элементы, необходимые для осуществления активного инфицирования упаковывающей клетки, которая необходима для инициации упаковки вирусного вектора. Примеры включают обеспечиваемые аденовирусом, бакуловирусом и/или герпесвирусом функции, которые достаточны для осуществления упаковки вирусного вектора. Например, аденовирусные хелперные функции, как правило, будут обеспечивать аденовирусные компоненты E1a, E1b, E2a, E4 и VA РНК. Обеспечивающие функции упаковки гены могут быть предоставлены путем инфицирования упаковывающей клетки необходимым вирусом. Альтернативно, можно избежать использования инфекционного вируса, при этом обеспечивающие функции упаковки гены могут быть введены совместно или раздельно в упаковывающую клетку с использованием невирусного вектора, такого как плазмида или ампликон. Смотри, например, хелперные плазмиды pXR, описанные в Rabinowitz et al., 2002, J. Virol. 76:791, и плазмиды pDG, описанные в Grimm et al., 1998, Human Gene Therapy 9:2745-2760. Обеспечивающие функции упаковки гены могут существовать вне хромосомы в упаковывающей клетке, но также могут быть интегрированы в хромосомную ДНК клетки (например, E1 или E3 в клетках HEK293).
Можно использовать любой способ введения нуклеотидной последовательности, обеспечивающей хелперные функции, в клетку-хозяина для репликации и упаковки, включая, но без ограничения, электропорацию, осаждение фосфатом кальция, микроинъекцию, катионные или анионные липосомы, а также липосомы в сочетании с сигналом ядерной локализации. В вариантах осуществления, в которых хелперные функции предоставлены за счет трансфекции с использованием вирусного вектора или инфекции с использованием вируса-помощника, можно использовать стандартные методы вирусного инфицирования.
Любые подходящие пермиссивные или упаковывающие клетки, известные в данной области, можно использовать для получения упакованного вирусного вектора. Предпочтительными являются клетки млекопитающих или клетки насекомых. Примеры клеток, которые могут быть использованы для получения упаковывающих клеток при осуществлении на практике изобретения, включают, например, линии клеток человека, такие как клетки VERO, WI38, MRC5, A549, HEK293 (которые экспрессируют функциональный аденовирусный E1 под контролем конститутивного промотора), B-50 или любые другие клетки HeLa, линии клеток HepG2, Saos-2, HuH7 и HT1080. В одном аспекте упаковывающая клетка может расти в суспензионной культуре, в частности, в бессывороточной ростовой среде. В одном варианте осуществления упаковывающая клетка представляет собой клетку HEK293, которая растет в суспензии в бессывороточной среде. В другом варианте осуществления упаковывающая клетка представляет собой клетку HEK293, описанную в патенте США № 9441206 и депонированную под ATCC № PTA 13274. Многочисленные линии упаковывающих клеток для rAAV частиц известны в данной области, включая, но без ограничения, те, которые раскрыты в WO 2002/46359.
Линии клеток, используемые в качестве упаковывающих клеток, включают линии клеток насекомых, в частности, когда бакуловирусные векторы используют для введения генов, необходимых для продуцирования rAAV частиц, описанных в настоящем документе. По настоящему изобретению можно использовать любые клетки насекомых, которые допускают репликацию AAV и которые могут поддерживаться в культуре. Примеры включают клетки Spodoptera frugiperda, такие как линии клеток Sf9 или Sf21, линии клеток Drosophila spp. или линии клеток комара, например, линии клеток Aedes albopictus.
После получения и очистки AAV векторных частиц по изобретению их можно титровать для получения композиций, предназначенных для введения индивидам, таким как индивиды-люди, страдающие мышечной дистрофией. Титрование AAV вектора можно выполнять способами, известными в данной области. В конкретных вариантах осуществления AAV векторные частицы можно титровать методом количественной ПЦР (кПЦР) с использованием праймеров против последовательностей в векторном геноме, например, последовательностей AAV2 ITR, в случае их присутствия, или других последовательностей в векторном геноме. При параллельном проведении кПЦР стандартов с известной концентрацией в разных разведениях, например, плазмиды, содержащей последовательность векторного генома, можно строить стандартную кривую, позволяющую рассчитывать концентрацию AAV вектора в виде числа векторных геномов (вг) на единицу объема, например, в микролитрах или миллилитрах. Альтернативно, число AAV векторных частиц, содержащих геномы, можно определять методом дот-блота с использованием соответствующего зонда для векторного генома. Эти методы описаны более подробно в публикациях Gray, SJ, et al., Production of recombinant adeno-associated viral vectors and use in in vitro and in vivo administration, Curr Protoc Neurosci (2011) и Werling NJ, et al., Gene Ther Meth 26:82-92 (2015). После определения концентрации AAV векторных геномов в маточном растворе его можно разводить или диализовать против соответствующих буферов для использования в получении композиции для введения индивидам.
Способы лечения
Изобретение относится к способам лечения дистрофинoпатии путем введения индивиду, который нуждается в лечении дистрофинoпатии, терапевтически эффективной дозы или количества AAV вектора по изобретению, такого как, без ограничения, вектор, известный как AAV9.hCK.Hopti-Dys3978.spA. В некоторых вариантах осуществления дистрофинoпатия представляет собой мышечную дистрофию, включая, без ограничения, мышечную дистрофию Дюшенна (DMD), мышечную дистрофию Беккера (BMD), DMD-ассоциированную дилатационную кардиомиопатию (DCM) и симптоматические состояния носительства у женщин. Таким образом, в некоторых вариантах осуществления изобретение относится к способам лечения мышечной дистрофии путем введения индивиду, который нуждается в лечении мышечной дистрофии, терапевтически эффективной дозы или количества AAV вектора по изобретению, такого как, без ограничения, вектор, известный как AAV9.hCK.Hopti-Dys3978.spA. В связанных вариантах осуществления изобретение относится к способам лечения мышечной дистрофии Дюшенна (DMD), мышечной дистрофии Беккера (BMD), DMD-ассоциированной дилатационной кардиомиопатии (DCM) и симптоматических состояний носительства у женщин, у индивидов, которые нуждаются в таком лечении.
Также предложено применение AAV вектора или фармацевтической композиции по изобретению в производстве лекарственного средства для использования в способах лечения, раскрытых в настоящем документе. Кроме того, предложен AAV вектор или фармацевтическая композиция по изобретению для использования в способе лечения, раскрытом в настоящем документе.
Лечение индивидов, страдающих дистрофинoпатией, такой как DMD, не обязательно должно приводить к излечению, чтобы считаться эффективным, при этом излечение определяют либо как остановку прогрессирования заболевания, либо как частичное или полное восстановление мышечной функции у индивида. Скорее, терапевтически эффективная доза, или количество, AAV вектора по изобретению представляет собой дозу, которая приводит к уменьшению или ослаблению симптомов, замедлению прогрессирования или улучшению качества жизни индивида, страдающего дистрофинoпатией, такой как DMD. В некоторых неограничивающих вариантах осуществления лечение индивидов, страдающих дистрофинoпатией, может приводить к улучшению их подвижности, отсрочке потери ими способности к самостоятельному передвижению или другому виду движений, и в случаях тяжелой дистрофинoпатии, такой как DMD, увеличению срока жизни индивидов, страдающих заболеванием.
Способы лечения по изобретению можно использовать для лечения мужчин или женщин, страдающих дистрофинoпатией, такой как DMD. В случае женщин, лечение может быть предоставлено имеющим симптомы носителям, или редким индивидам-женщинам с полностью развившимся заболеванием. Способы по изобретению также можно использовать для лечения индивидов любого возраста, страдающих дистрофинoпатией, включая индивидов в возрасте менее 1 года, либо примерно или по меньшей мере 1 года, либо примерно или по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 лет или старше. Индивиды, получающие лечение, могут быть ходячими или неходячими.
Способы лечения по изобретению можно использовать для лечения индивидов, страдающих дистрофинoпатией, независимо от исходного генетического нарушения (например, делеций, дупликаций, вариаций сайтов сплайсинга или нонсенс-мутаций в гене дистрофина) при условии, что нарушение приводит к уменьшению или потере функции природного человеческого гена дистрофина.
В конкретных вариантах осуществления изобретения лечение индивида терапевтически эффективной дозой, или количеством, AAV вектора мини-дистрофина будет приводить к уменьшению в тканях концентраций одного или более биомаркеров, связанных с наличием или прогрессированием мышечной дистрофии.
В некоторых вариантах осуществления биомаркеры представляют собой определенные ферменты, высвобождающиеся из поврежденных клеток скелетных мышц или сердечной мышцы в кровь (включая сыворотку или плазму). Неограничивающие примеры включают креатинкиназу (CK), трансаминазы аланинаминотрансферазу (ALT) и аспартатаминотрансферазу (AST) и лактатдегидрогеназу (LDH), средние уровни всех из которых, как известно, повышены у индивидов, страдающих DMD.
В некоторых вариантах осуществления терапевтически эффективная доза, или количество, AAV вектора мини-дистрофина по изобретению эффективна для уменьшения повышенных уровней ALT в крови пациентов с DMD до уровня, примерно в 7, 6, 5, 4, 3 или 2 раза превышающего уровень, как правило, наблюдаемый у здоровых индивидов аналогичного возраста и пола. В других вариантах осуществления терапевтически эффективная доза, или количество, AAV вектора мини-дистрофина по изобретению эффективна для уменьшения повышенных уровней AST в крови пациентов с DMD до уровня, примерно в 7, 6, 5, 4, 3 или 2 раза превышающего уровень, как правило, наблюдаемый у здоровых индивидов аналогичного возраста и пола. В некоторых вариантах осуществления терапевтически эффективная доза, или количество, AAV вектора мини-дистрофина по изобретению эффективна для уменьшения повышенных уровней LDH в крови пациентов с DMD до уровня, примерно в 7, 6, 5, 4, 3 или 2 раза превышающего уровень, как правило, наблюдаемый у здоровых индивидов аналогичного возраста и пола. И в некоторых других вариантах осуществления терапевтически эффективная доза, или количество, AAV вектора мини-дистрофина по изобретению эффективна для уменьшения повышенных уровней общей CK в крови пациентов с DMD до уровня, примерно в 50, 48, 46, 44, 42, 40, 38, 36, 34, 32, 30, 28, 26, 24, 22, 20, 18, 16, 14, 12, 10, 9, 8, 7, 6, 5, 4, 3 или 2 раза превышающего уровень, как правило, наблюдаемый у здоровых индивидов аналогичного возраста и пола. Было установлено, что уровень матриксной металлопротеиназы-9 (MMP-9), фермента, связанного с деградацией или реструктурированием внеклеточного матрикса, повышен в крови пациентов с DMD. Смотри, например, Nadaraja, VD, et al., Neuromusc. Disorders 21:569-578 (2011). Таким образом, в некоторых вариантах осуществления терапевтически эффективная доза, или количество, AAV вектора мини-дистрофина по изобретению эффективна для уменьшения повышенных уровней MMP-9 в крови пациентов с DMD до уровня, примерно в 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 раза превышающего уровень, как правило, наблюдаемый у здоровых индивидов аналогичного возраста и пола.
В других вариантах осуществления терапевтически эффективная доза, или количество, AAV вектора мини-дистрофина по изобретению эффективна для изменения уровней ALT, AST, LDH, CK и MMP-9, как указано выше, отдельно или в сочетании с одним или более из этих или других биомаркеров. Таким образом, в иллюстративном неограничивающем варианте осуществления терапевтически эффективная доза, или количество, AAV вектора мини-дистрофина по изобретению эффективна для уменьшения уровня ALT и AST, ALT и LDH, AST и CK или AST и MMP-9, и так далее.
В некоторых способах лечения по изобретению эффективная доза, или количество, AAV вектора представляет собой дозу, которая приводит к улучшению средних показателей индивида при выполнении теста 6-минутной ходьбы (6MWT). Установлено, что 6MWT является воспроизводимым и надежным тестом для определения мышечной функции и подвижности индивидов-людей, страдающих мышечной дистрофией, в частности, DMD. Смотри, например, McDonald, CM, et al., Muscle Nerve 41(4):500-10 (2010); Henricson, E, et al., PLOS Currents Musc Dys, 8 July 2013; McDonald, CM, et al., Muscle Nerve 48:343-56 (2013). В данном тесте регистрируют дистанцию в метрах, которую индивид после отдыха может проходить без остановок и без посторонней помощи в течение 6-минутного периода времени. Данная дистанция также известна как дистанция 6-минутной ходьбы (6MWD). В некоторых вариациях теста отдельный индивид может быть тестирован более одного раза в течение нескольких дней, и полученные результаты усредняют. Вследствие его преимуществ, 6MWT был одобрен в качестве основного клинического результата в испытаниях лекарственных средств с участием ходячих пациентов с DMD. Смотри, например, Bushby, K, et al., Muscle Nerve 50:477-87 (2014); Mendell, JR, et al., Ann Neurol 79:257-71 (2016); Campbell, C, et al., Muscle Nerve 55(4):458-64 (2017). Как правило, в этих испытаниях у каждого индивида в группе лечения тестируют способность к самостоятельному передвижению с использованием 6MWT в течение нескольких месяцев или лет для определения того, эффективно ли лечение.
В некоторых вариантах осуществления способов лечения по изобретению терапевтическую эффективность определяют статистически, оценивая эффект лечения AAV вектором по изобретению путем сравнения средних показателей 6MWT получающих лечение индивидов, например, индивидов, страдающих DMD, со средними показателями 6MWT не получающих лечение контрольных индивидов, страдающих дистрофинаoпатией того же типа, например, DMD. Эти контрольные индивиды могут быть включены в те же исследования, используемые для оценки терапевтической эффективности AAV векторов по изобретению, или могут быть аналогичными индивидами из исследований естественного прогрессирования DMD или других дистрофинoпатий. Контроли могут быть подобраны по возрасту (или стратифицированы, например, и без ограничения, на тех, которые моложе или старше некоторого порогового возраста, например 6, 7, 8, 9 или 10 лет), подобраны по статусу предшествующего лечения кортикостероидами (то есть, да или нет, либо продолжительности предшествующего лечения), подобраны по исходным показателям при выполнении 6MWT до какого-либо лечения (за исключением, возможно, кортикостероидов) (или стратифицированы, например, и без ограничения, на индивидов, чьи исходные показатели ниже или выше некоторого порового значения, например, 200 м, 250 м, 300 м, 350 м, 400 м, 450 м или 500 м), или по некоторым другим показателям, определяемым как клинически значимые.
В некоторых вариантах осуществления способов лечения по изобретению терапевтически эффективная доза, или количество, AAV вектора по изобретению является эффективной для увеличения среднего показателя 6MWD у индивидов, страдающих дистрофинoпатией, такой как DMD, на примерно или по меньшей мере 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 метров или более, в сравнении с показателями аналогичных подобранных или стратифицированных контролей, через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33 или 36 месяцев после введения вектора. В некоторых из этих вариантов осуществления AAV вектор содержит AAV9 капсид и геном, содержащий кодон-оптимизированный для человека ген, кодирующий белок мини-дистрофин, например, без ограничения, представляет собой вектор, обозначенный AAV9.hCK.Hopti-Dys3978.spA.
В некоторых вариантах осуществления способов лечения по изобретению терапевтически эффективная доза, или количество, AAV вектора по изобретению является эффективной для увеличения среднего показателя 6MWD у индивидов, страдающих дистрофинoпатией, такой как DMD, на примерно или по меньшей мере 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 метров или более, в сравнении с аналогичными подобранными по статусу или стратифицированными контролями, через 30, 60, 90, 120, 150, 180, 210, 240, 270, 300, 330, 360, 390, 420, 450, 480, 510, 540, 570, 600, 630, 660, 690 или 720 дней после введения вектора. В некоторых из этих вариантов осуществления AAV вектор содержит AAV9 капсид и геном, содержащий кодон-оптимизированный для человека ген, кодирующий белок мини-дистрофин, например, без ограничения, представляет собой вектор, обозначенный AAV9.hCK.Hopti-Dys3978.spA.
В качестве альтернативы 6MWT, терапевтическую эффективность можно выражать как уменьшение времени, которое занимает у индивида подъем на 4 ступени стандартного размера, тест, известный как тест подъема на 4 ступени. Этот тест используют для оценки эффективности лечения кортикостероидами у пациентов с DMD. Griggs, RC, et al., Arch Neurol 48(4):383-8 (1991). Таким образом, в некоторых вариантах осуществления способов лечения по изобретению терапевтически эффективная доза, или количество, AAV вектора по изобретению является эффективной для уменьшения среднего времени, необходимого индивидам, страдающим дистрофинoпатией, такой как DMD, для выполнения теста подъема на 4 ступени, на примерно или по меньшей мере 0,2, 0,4, 0,6, 0,8, 1,0, 1,2, 1,4, 1,6, 1,8, 2,0, 2,2, 2,4, 2,6, 2,8, 3,0, 3,2, 3,4, 3,6, 3,8 или 4,0 секунды или более, в сравнении с аналогичными подобранными по статусу или стратифицированными контролями, через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33 или 36 месяцев после введения вектора. В некоторых из этих вариантов осуществления AAV вектор содержит AAV9 капсид и геном, содержащий кодон-оптимизированный для человека ген, кодирующий белок мини-дистрофин, например, без ограничения, представляет собой вектор, обозначенный AAV9.hCK.Hopti-Dys3978.spA.
В связанных вариантах осуществления способов лечения по изобретению терапевтически эффективная доза, или количество, AAV вектора по изобретению является эффективной для уменьшения среднего времени, которое занимает у индивидов, страдающих дистрофинoпатией, такой как DMD, выполнение теста подъема на 4 ступени, на примерно или по меньшей мере 0,2, 0,4, 0,6, 0,8, 1,0, 1,2, 1,4, 1,6, 1,8, 2,0, 2,2, 2,4, 2,6, 2,8, 3,0, 3,2, 3,4, 3,6, 3,8 или 4,0 секунды или более, в сравнении с аналогичными подобранными по статусу или стратифицированными контролями, через 30, 60, 90, 120, 150, 180, 210, 240, 270, 300, 330, 360, 390, 420, 450, 480, 510, 540, 570, 600, 630, 660, 690 или 720 дней после введения вектора. В некоторых из этих вариантов осуществления AAV вектор содержит AAV9 капсид и геном, содержащий кодон-оптимизированный для человека ген, кодирующий белок мини-дистрофин, например, без ограничения, представляет собой вектор, обозначенный AAV9.hCK.Hopti-Dys3978.spA.
Терапевтическую эффективность также можно выражать в виде уменьшения с течением времени процентной доли индивидов, теряющих способность к самостоятельному передвижению, через определенный период времени после лечения в сравнении с контролями. Потерю способности к самостоятельному передвижению определяют как начало возникновения постоянной зависимости от использования инвалидной коляски. Таким образом, в других вариантах осуществления способов лечения по изобретению терапевтически эффективная доза, или количество, AAV вектора по изобретению через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33 или 36 месяцев после введения индивидам, страдающим дистрофинoпатией, такой как DMD, приводит к сокращению среднего числа индивидов, потерявших способность к самостоятельному передвижению, на по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65% или более, в сравнении с аналогичными подобранными по статусу или стратифицированными контролями. В некоторых из этих вариантов осуществления AAV вектор содержит AAV9 капсид и геном, содержащий кодон-оптимизированный для человека ген, кодирующий белок мини-дистрофин, например, без ограничения, представляет собой вектор, обозначенный AAV9.hCK.Hopti-Dys3978.spA.
В некоторых вариантах осуществления способов лечения по изобретению терапевтически эффективная доза, или количество, AAV вектора по изобретению является эффективной для задержки начала развития одного или более симптомов у индивида, страдающего дистрофинoпатией, такой как DMD. Диагностирование до начала развития симптомов можно проводить путем пренатального, перинатального или постнатального генетического тестирования на мутации в гене DMD. В некоторых вариантах осуществления лечение AAV вектором по изобретению эффективно для задержки начала развития одного или более симптомов DMD на по меньшей мере или примерно 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 15, 16, 18, 20, 22, 24, 25, 26, 28, 30, 32, 34, 35, 36, 38, 40, 42, 44, 45, 46, 48, 50, 52, 54, 55, 56, 28, 60, 62, 64, 65, 66, 68, 70, 72, 74, 75, 76, 78 или 80 месяцев, или более, в сравнении с аналогичными подобранными по статусу или стратифицированными контролями. Как понимают специалисты в данной области, ранние симптомы DMD включают, без ограничения, задержку развития способности к ходьбе (в среднем до возраста примерно 18 месяцев, в сравнении со средним возрастом 12-15 месяцев у детей без DMD); трудности при прыжках, беге или преодолении ступеней; склонность к падениям; проксимальную мышечную слабость, о чем свидетельствует, например, выполнение приема Говерса при подъеме с пола; увеличенные икроножные мышцы вследствие псевдогипертрофии; ковыляющую походку вследствие того, что индивид ходит на носках или подушечках пальцев ног; склонность поддерживать равновесие, выпячивая живот и оттягивая назад плечи, а также когнитивные нарушения, такие как недостаточность языковых навыков восприятия и передачи информации, функций пространственного зрения, мелкой моторики, внимания и способности к запоминанию. В некоторых из этих вариантов осуществления AAV вектор содержит AAV9 капсид и геном, содержащий кодон-оптимизированный для человека ген, кодирующий белок мини-дистрофин, например, без ограничения, представляет собой вектор, обозначенный AAV9.hCK.Hopti-Dys3978.spA.
Терапевтическую эффективность также можно выражать в виде уменьшения с течением времени процентной доли получавших лечение вектором индивидов, у которых возрастает количество жировой ткани, заменяющей сухую мышечную массу, в сравнении с не получавшими лечение контролями. В некоторых вариантах осуществления это прогрессирующее отложение жировой ткани можно определять МРТ анализом мышц ног пациентов с DMD и выражать в виде фракции жировой ткани (ФЖТ), как описано более подробно в публикации Willcocks, RJ, et al., Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large Duchenne muscular dystrophy cohort, Ann Neurol 79:535-47 (2016). В связанных вариантах осуществления лечение индивидов с DMD AAV вектором по изобретению является эффективным для уменьшения среднего показателя ФЖТ в их нижних конечностях при определении методом МРТ на примерно или по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или более, через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33 или 36 месяцев после лечения в сравнении с подобранными по статусу контролями. В некоторых из этих вариантов осуществления AAV вектор содержит AAV9 капсид и геном, содержащий кодон-оптимизированный для человека ген, кодирующий белок мини-дистрофин, например, без ограничения, представляет собой вектор, обозначенный AAV9.hCK.Hopti-Dys3978.spA.
В некоторых вариантах осуществления терапевтически эффективная доза, или количество, AAV вектора по изобретению представляет собой дозу, которая приводит к тому, что по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или более волокон скелетных мышц экспрессируют белок мини-дистрофин, через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33 или 36 месяцев после лечения. Процентную долю мышечных волокон, положительных по экспрессии белка мини-дистрофина, можно определять путем иммунологического окрашивания срезов биопсийных образцов мышечной ткани от получавших лечение индивидов антителом против дистрофина, способным специфически связывать белок мини-дистрофин. Подходящие методы иммунологического мечения описаны в примерах и знакомы специалистам в данной области. Иллюстративные мышцы, из которых могут быть получены биопсийные образцы от получающих лечение индивидов, включают двуглавую, дельтовидную и четырехглавую мышцы, хотя также можно проводить биопсию и других мышц. В некоторых из этих вариантов осуществления AAV вектор содержит AAV9 капсид и геном, содержащий кодон-оптимизированный для человека ген, кодирующий белок мини-дистрофин, например, без ограничения, представляет собой вектор, обозначенный AAV9.hCK.Hopti-Dys3978.spA.
В некоторых вариантах осуществления доза, или количество, AAV вектора по изобретению для лечения дистрофинoпатии, например, мышечной дистрофии, такой как DMD, является терапевтически эффективной и в то же время либо не вызывает клеточный (T-клеточный) иммунный ответ, специфический для белка мини-дистрофина, у получающих лечение индивидов, либо вызывает ответ лишь у небольшой процентной доли таких индивидов. Наличие или степень T-клеточного ответа против белка мини-дистрофина можно определять с использованием анализа ELISPOT для обнаружения мононуклеарных клеток периферической крови (МКПК), выделенных из крови индивида, которые продуцируют гамма-интерферон (IFNγ) в ответ на воздействие библиотеки перекрывающихся пептидов, охватывающих аминокислотную последовательность белка мини-дистрофина. В конкретных вариантах осуществления порог для положительного ответа в виде IFNγ может быть установлен в виде значения, превышающего 50 пятнообразующих клеток на миллион протестированных МКПК. Также можно использовать другие анализы для обнаружения T-клеточного ответа против белка мини-дистрофина, включая, без ограничения, обнаружение T-клеточных инфильтратов в биопсийных образцах мышц или других тканей, экспрессирующих белок мини-дистрофин, которые получены от получающих лечение вектором индивидов. Индивиды могут быть людьми или животными, например, животными моделями DMD, такими как мыши mdx, крысы mdx или собаки GRMD. В других вариантах осуществления доза, или количество, AAV вектора по изобретению для лечения дистрофинoпатии, например, мышечной дистрофии, такой как DMD, является терапевтически эффективной и в то же время либо не вызывает воспалительный ответ против капсида, векторного генома (или его любого компонента) или белка мини-дистрофина, экспрессируемого трансдуцированными клетками, либо вызывает ответ лишь у небольшой процентной доли таких индивидов. Без связи с конкретной теорией функционирования, воспаление в ответ на AAV вектор может являться следствием врожденных иммунных реакций. Воспаление, при наличии, в мышцах индивидов, получающих лечение вектором, можно обнаруживать методом магнитно-резонансной томографии. Смотри, например, J Garcia, Skeletal Radiol 29:425-38 (2000) и Schulze, M, et al., Am J Radiol 192:1708-16 (2009). Индивиды могут быть людьми или животными, например, животными моделями DMD, такими как мыши mdx, крысы mdx или собаки GRMD. В некоторых из вариантов осуществления, описанных выше, наличие или отсутствие клеточного иммунного ответа или воспаления определяют через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 или 36 месяцев после лечения, или через другой период времени после лечения. В связанных вариантах осуществления низкая процентная доля индивидов, у которых имеет место клеточный иммунный ответ на белок мини-дистрофин, будет меньшей или равной примерно 0%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или 20% индивидов, которым вводили вектор. В некоторых из этих вариантов осуществления AAV вектор содержит AAV9 капсид и геном, содержащий кодон-оптимизированный для человека ген, кодирующий белок мини-дистрофин, например, без ограничения, представляет собой вектор, обозначенный AAV9.hCK.Hopti-Dys3978.spA.
В связанных вариантах осуществления доза, или количество, AAV вектора по изобретению для лечения дистрофинoпатии, например, мышечной дистрофии, такой как DMD, является терапевтически эффективной без необходимости в сопутствующей иммуносупрессии у получающих лечение индивидов. Таким образом, в конкретных вариантах осуществления лечение индивида, страдающего дистрофинoпатией, такой как DMD, является эффективным без необходимости введения индивиду до, в процессе или после лечения AAV вектором одного или более иммуносупрессивных лекарственных средств (кроме лечения стероидами, которое считается современным стандартом медицинской помощи). Иллюстративные иммуносупрессивные лекарственные средства включают, но не ограничиваются ими, ингибиторы кальциневрина, такие как такролимус и циклоспорин, антипролиферативные средства, такие как микофенолят, лефлуномид и азатиоприн, или ингибиторы mTOR, такие как сиролимус и эверолимус.
Как описано более подробно в примерах, эффективность AAV векторов по изобретению, включая, без ограничения, вектор, обозначенный AAV9.hCK.Hopti-Dys3978.spA, может быть протестирована на животных моделях мышечной дистрофии Дюшенна, и результаты могут быть использованы для прогнозирования эффективных доз таких векторов для пациентов-людей с DMD. Различные животные модели известны в данной области, включая мышиную модель mdx, модель мышечной дистрофии у собак породы золотистый ретривер и, в последнее время, крысиную модель Dmdmdx, которая описана более подробно в примерах.
На основании крысиной модели Dmdmdx эффективные дозы AAV векторов по изобретению, включая вектор, обозначенный AAV9.hCK.Hopti-Dys3978.spA, могут быть установлены с учетом различных биологических параметров и аспектов течения заболевания у крыс.
Таким образом, в некоторых вариантах осуществления изобретения лечение крыс Dmdmdx дозой AAV9.hCK.Hopti-Dys3978.spA, составляющей по меньшей мере 1×1014 вг/кг или 3×1014 вг/кг, является эффективным для снижения сывороточных уровней AST, ALT, LDH или общей креатинкиназы, через 3 месяца или 6 месяцев после инъекции в сравнении с контролями.
В других вариантах осуществления лечение крыс Dmdmdx дозой AAV9.hCK.Hopti-Dys3978.spA, составляющей по меньшей мере 1×1014 вг/кг или 3×1014 вг/кг, является эффективным для уменьшения фиброза в двуглавой мышце бедра, диафрагме или сердечной мышце, через 3 месяца или 6 месяцев после инъекции в сравнении с контролями. В других вариантах осуществления лечение крыс Dmdmdx дозой AAV9.hCK.Hopti-Dys3978.spA, составляющей по меньшей мере 1×1014 вг/кг или 3×1014 вг/кг, является эффективным для увеличения силы захвата передних конечностей, через 3 месяца или 6 месяцев после инъекции в сравнении с контролями.
В других вариантах осуществления лечение крыс Dmdmdx дозой AAV9.hCK.Hopti-Dys3978.spA, составляющей по меньшей мере 1×1014 вг/кг или 3×1014 вг/кг, является эффективным для уменьшения мышечного утомления при измерении в 5 проводимых с короткими интервалами испытаниях, в которых измеряют силу захвата передних конечностей, через 3 месяца или 6 месяцев после инъекции в сравнении с контролями.
В некоторых других вариантах осуществления лечение крыс Dmdmdx дозой AAV9.hCK.Hopti-Dys3978.spA, составляющей по меньшей мере 1×1014 вг/кг или 3×1014 вг/кг, является эффективным для увеличения фракции выброса левого желудочка при измерении методом эхокардиографии, через 6 месяцев после инъекции в сравнении с контролями.
В других вариантах осуществления лечение крыс Dmdmdx дозой AAV9.hCK.Hopti-Dys3978.spA, составляющей по меньшей мере 1×1014 вг/кг или 3×1014 вг/кг, является эффективным для увеличения соотношения скоростей раннего и позднего заполнения левого желудочка (то есть, соотношения E/A) при измерении методом эхокардиографии, через 3 месяца или 6 месяцев после инъекции в сравнении с контролями.
В некоторых вариантах осуществления лечение крыс Dmdmdx дозой AAV9.hCK.Hopti-Dys3978.spA, составляющей по меньшей мере 1×1014 вг/кг или 3×1014 вг/кг, является эффективным для уменьшения времени изоволюметрического расслабления (ВИВР) или времени в миллисекундах между скоростью в пике Е и ее возвращением к исходному уровню (то есть, времени замедления пика Е (ВЗ)) при измерении методом эхокардиографии, через 3 месяца или 6 месяцев после инъекции в сравнении с контролями.
В каждом из вышеперечисленных вариантов осуществления увеличение или уменьшение физиологических показателей у получавших лечение вектором животных в сравнении с контрольными животными может, в некоторых вариантах осуществления, быть протестировано на статистическую значимость. Выбор используемого статистического метода находится в пределах компетенции специалистов в данной области. Если p-значение принимают в качестве меры для оценки статистической значимости, такие рассчитанные p-значения можно сравнивать с заранее определенным уровнем значимости и, если p-значение меньше уровня значимости, эффект лечения можно считать статистически значимым. В некоторых вариантах осуществления уровень значимости может быть установлен на уровне 0,25, 0,20, 0,15, 0,10, 0,05, 0,04, 0,03, 0,02, 0,01, 0,005, или некотором другом уровне значимости. Так, если в иллюстративном неограничивающем варианте осуществления уровень значимости установлен на величину 0,05, тогда расчетное p-значение <0,05 будет интерпретировано, как представляющее статистически значимую разницу между получавшей лечение вектором и контрольной группами.
В каждом из вышеперечисленных вариантов осуществления контроли могут быть подобранными по возрасту животными того же пола и генетического фона, которым не вводят ничего, или вводят только растворитель, но не вектор. Однако также возможны и другие контроли.
В некоторых других вариантах осуществления лечение крыс Dmdmdx дозой AAV9.hCK.Hopti-Dys3978.spA, составляющей по меньшей мере 3×1014 вг/кг, является эффективным для трансдукции двуглавой мышцы бедра, диафрагмы, сердечной мышцы или других поперечно-полосатых мышц и экспрессии белка мини-дистрофина, закодированного геном opti-Dys3978, без вызывания клеточного иммунного ответа против белка мини-дистрофина, через 3 месяца или 6 месяцев после инъекции. Клеточный иммунный ответ против белка мини-дистрофина можно оценивать путем получения спленоцитов или лимфоцитов крови, таких как мононуклеарные клетки периферической крови (МКПК), от тестируемых животных, инкубации клеток с пептидами из библиотеки перекрывающихся пептидов, охватывающих аминокислотную последовательность белка мини-дистрофина (например, пептидами длиной 15 аминокислот, каждый с перекрыванием 10 аминокислот) в пулах (например, 5 пулов), и определения того, будут ли клетки продуцировать гамма-интерферон (IFNγ) в ответ на воздействие пептидов. Продуцирование IFNγ можно определять с использованием анализа ELISPOT, известного специалистам в данной области. Смотри, например, Smith, JG, et al., Clin Vaccine Immunol 8(5):871-9 (2001), Schmittel A, et al., J Immunol Methods 247:17-24 (2001) и Marino, AT, et al., Measuring immune responses to recombinant AAV gene transfer, Ch. 11, pp. 259-72, Adeno-Associated Virus Methods and Protocols, Ed. RO Snyder and P Moullier, Humana Press (2011). В конкретных вариантах осуществления порог для положительного IFNγ-ответа может быть установлен, как превышающий 50 пятнообразующих клеток на миллион протестированных клеток, или в других вариантах осуществления, как по меньшей мере 3-кратно превышающий число пятнообразующих клеток, обнаруженных при использовании отрицательного контроля (например, только среды без добавления пептидов), таким образом, значения ниже данных порогов будут считаться отрицательным ответом.
В некоторых вариантах осуществления способов лечения по настоящему изобретению AAV вектор для лечения дистрофинoпатии, такой как DMD, вводят индивиду, который нуждается в лечении дистрофинoпатии, такой как DMD, в сочетании с по меньшей мере вторым средством, которое, как известно или считается, является эффективным для лечения дистрофинoпатии, такой как DMD. Совместное введение AAV вектора означает введение индивиду до, одновременно или после введения второго средства. В некоторых вариантах осуществления AAV вектор вводят совместно с антисмысловым олигонуклеотидом, вызывающим пропуск экзона гена DMD, например, экзона 51 гена дистрофина, или некоторого другого экзона гена дистрофина. Средства, вызывающие пропуск экзона 51 гена дистрофина, включают дрисаперсен и этеплирсен, однако можно использовать и другие. В других вариантах осуществления AAV вектор вводят совместно со средством, ингибирующим функцию миостатина у индивида, таким как антитело против миостатина, примеры которого приведены в патентах США №№ 7888486, 8992913 и 8415459. В других вариантах осуществления, в которых дистрофинoпатия у индивида может быть вызвана нонсенс-мутацией в гене дистрофина, AAV вектор вводят совместно со средством, стимулирующим сквозное прохождение рибосомы через нонсенс-мутации, таким как аталурен, или со средством, подавляющим преждевременное образование стоп-кодонов, таким как аминогликозид, например, гентамицин. В других вариантах осуществления AAV вектор вводят совместно с анаболическим стероидом, таким как оксандролон. И в других вариантах осуществления AAV вектор вводят совместно с кортикостероидом, таким как, без ограничения, преднизон, дефлазакорт или преднизолон. В некоторых вариантах осуществления данных способов AAV вектор представляет собой AAV9 вектор, содержащий геном, который содержит кодон-оптимизированный для человека ген, кодирующий белок мини-дистрофин, например, без ограничения, представляет собой вектор, обозначенный AAV9.hCK.Hopti-Dys3978.spA.
Фармацевтические препараты и способы ведения
Вирусные векторы и капсиды по настоящему изобретению находят применение как в области ветеринарии, так и в области медицины. Подходящие для лечения индивиды включают как птиц, так и млекопитающих. Используемый в настоящем документе термин «птица» включает, без ограничения, кур, уток, гусей, перепелок, индеек, фазанов, попугаев, длиннохвостых попугаев и тому подобных. Используемый в настоящем документе термин «млекопитающее» включает, без ограничения, людей, не являющихся людьми приматов, крупный рогатый скот, овец, коз, лошадей, кошек, собак, зайцеобразных и так далее. Индивиды-люди включают новорожденных, младенцев, несовершеннолетних и взрослых. Необязательно, индивид «нуждается» в применении способов по настоящему изобретению, например, из-за того, что индивид имеет, или предположительно может иметь, заболевание, включая те, которые описаны в настоящем документе или при которых может приносить пользу доставка полинуклеотида, включая те, которые описаны в настоящем документе. В качестве дополнительной возможности, индивид может быть лабораторным животным и/или животной моделью заболевания.
В конкретных вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей вирусный вектор (такой как rAAV частица) и/или капсид по изобретению в фармацевтически приемлемом носителе и, необязательно, другие лекарственные средства, фармацевтические средства, стабилизаторы, буферы, носители, адъюванты, разбавители и так далее. Для инъекции носитель, как правило, будет жидким. Для других способов введения носитель может быть либо твердым, либо жидким. Для ингаляционного введения носитель будет вдыхаемым и, необязательно, может быть в форме твердых или жидких частиц.
Термин «фармацевтически приемлемый» относится к материалу, который не является токсичным или иным образом нежелательным, то есть, материал можно вводить индивиду, не вызывая какие-либо нежелательные биологические эффекты.
Один аспект настоящего изобретения относится к способу переноса полинуклеотида, кодирующего мини-дистрофин, в клетку in vitro. Вирусный вектор может быть введен в клетки при соответствующем показателе множественности инфекции в соответствии со стандартными методами трансдукции, подходящими для конкретных клеток-мишеней. Титры вводимого вирусного вектора могут варьироваться в зависимости от типа и числа клеток-мишеней, а также конкретного вирусного вектора, и могут быть определены специалистами в данной области без излишнего экспериментирования. В репрезентативных вариантах осуществления по меньшей мере примерно 103 инфекционных единиц, более предпочтительно, по меньшей мере примерно 105 инфекционных единиц вводят в клетку.
Клетка(и), в которую вводят вирусный вектор, может быть любого типа, включая, но без ограничения, мышечные клетки (например, клетки скелетных мышц, клетки сердечной мышцы, гладкомышечные клетки и/или клетки мышцы диафрагмы), стволовые клетки, зародышевые клетки и тому подобное. В репрезентативных вариантах осуществления клетка может быть любой клеткой-предшественником. В качестве дополнительной возможности, клетка может быть стволовой клеткой (например, мышечной стволовой клеткой). Кроме того, клетка может быть получена от любого биологического вида, как указано выше.
Вирусный вектор можно вводить в клетки in vitro с целью последующего введения модифицированной клетки индивиду. В конкретных вариантах осуществления клетки получают от индивида, в них вводят вирусный вектор, а затем клетки вновь вводят индивиду. Способы получения клеток от индивида для проведения манипуляций ex vivo, с последующим введением индивиду известны в данной области (смотри, например, патент США № 5399346). Альтернативно, рекомбинантный вирусный вектор можно вводить в клетки от индивида-донора, в культивируемые клетки или в клетки из любого другого подходящего источника, и клетки вводят индивиду, который нуждается в этом (то есть, индивиду-«реципиенту»).
Подходящими клетками для ex vivo доставки генов являются клетки, описанные выше. Дозы клеток для введения индивиду будут варьироваться в зависимости от возраста, состояния здоровья и биологического вида индивида, типа клетки, нуклеиновой кислоты, экспрессируемой клеткой, способа введения и тому подобного. Как правило, по меньшей мере от примерно 102 до примерно 108 клеток или по меньшей мере от примерно 103 до примерно 106 клеток на дозу будут введены в фармацевтически приемлемом носителе. В конкретных вариантах осуществления клетки, трансдуцированные вирусным вектором, вводят индивиду в эффективном для лечения или эффективном для предотвращения количестве в сочетании с фармацевтическим носителем.
Следующий аспект изобретения относится к способу введения вирусного вектора индивидам. Введение вирусных векторов и/или капсидов по настоящему изобретению индивиду-человеку или животному, которые нуждаются в этом, можно выполнять любыми способами, известными в данной области. Необязательно, вирусный вектор и/или капсид доставляют в эффективной для лечения или эффективной для предотвращения дозе в фармацевтически приемлемом носителе.
Дозы вирусного вектора и/или капсида, вводимые индивиду, зависят от способа введения, заболевания или состояния, подлежащего лечению и/или предотвращению, состояния здоровья отдельного индивида, конкретного вирусного вектора или капсида, а также доставляемой нуклеиновой кислоты и тому подобного, и могут быть определены обычным образом. Иллюстративные дозы для достижения терапевтических эффектов представляют собой титры по меньшей мере примерно 105, 106, 107, 108, 109, 1010, 1011, 1012, 1013, 1014, 1015 трансдуцирующих единиц, необязательно, примерно 108-1013 трансдуцирующих единиц.
В конкретных вариантах осуществления для достижения желательного уровня экспрессии гена можно выполнять более одного введения (например, два, три, четыре или более введений) на протяжении определенного периода времени с разными интервалами, например, ежедневно, еженедельно, ежемесячно, ежегодно и так далее.
В конкретных вариантах осуществления AAV вектор или частицу по изобретению можно вводить индивиду в композициях, содержащих пустые AAV капсиды того же или иного серотипа. Пустые капсиды представляют собой AAV капсиды, имеющие типичный набор и соотношение капсидных белков VP1, VP2 и VP3, но не содержащие векторный геном. Без связи с конкретной теорией функционирования, считается, что присутствие пустых капсидов может способствовать уменьшению иммунного ответа против капсида AAV вектора и, за счет этого, повышению эффективности трансдукции. Пустые капсиды могут присутствовать естественным образом в препарате AAV вектора, или быть добавлены в известных количествах для достижения известных соотношений пустых капсидов и AAV вектора (то есть, капсидов, содержащих векторные геномы). Получение, очистка и количественное определение пустых капсидов находится в пределах компетенции специалистов в данной области. Композиции, содержащие AAV векторы по изобретению и пустые капсиды, могут быть сформулированы с избытком пустых капсидов относительно AAV векторов, или с избытком содержащих геном AAV векторов относительно пустых капсидов. Таким образом, в некоторых вариантах осуществления композиции по изобретению содержат AAV векторы по изобретению и пустые капсиды того же или иного серотипа, при этом соотношение пустых капсидов и AAV векторов составляет примерно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9,0, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10 к 1, или какое-либо другое соотношение.
В других вариантах осуществления изобретения предложены иллюстративные эффективные дозы AAV векторных частиц для лечения дистрофинoпатии, например, мышечной дистрофии, такой как DMD, выраженные в виде количества векторных геномов (вг) на килограмм массы тела индивида (кг), сокращенно вг/кг. В некоторых вариантах осуществления эффективная доза AAV вектора по изобретению, содержащего AAV9 капсид и геном, содержащий кодон-оптимизированный для человека ген, кодирующий белок мини-дистрофин, например, без ограничения, вектора, обозначенного AAV9.hCK.Hopti-Dys3978.spA, составляет примерно 1×1012 вг/кг, 2×1012 вг/кг, 3×1012 вг/кг, 4×1012 вг/кг, 5×1012 вг/кг, 6×1012 вг/кг, 7×1012 вг/кг, 8×1012 вг/кг, 9×1012 вг/кг, 1×1013 вг/кг, 2×1013 вг/кг, 3×1013 вг/кг, 4×1013 вг/кг, 5×1013 вг/кг, 6×1013 вг/кг, 7×1013 вг/кг, 8×1013 вг/кг, 9×1013 вг/кг, 1×1014 вг/кг, 1,5×1014 вг/кг, 2×1014 вг/кг, 2,5×1014 вг/кг, 3×1014 вг/кг, 3,5×1014 вг/кг, 4×1014 вг/кг, 5×1014 вг/кг, 6×1014 вг/кг, 7×1014 вг/кг, 8×1014 вг/кг или 9×1014 вг/кг, или какую-либо другую дозу. В любом из этих вариантов осуществления AAV вектор можно вводить индивиду в фармацевтически приемлемой композиции отдельно или с пустыми капсидами того же серотипа капсида, при соотношении пустых капсидов и векторов, составляющем примерно 0,5:1, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, или при каком-либо другом соотношении.
Иллюстративные способы введения включают пероральный, ректальный, трансмукозальный, интраназальный, ингаляцию (например, вдыхание аэрозоля), трансбуккальный (например, подъязычный), вагинальный, интратекальный, внутриглазной, чрескожный, внутриэндотелиальный, in utero (или in ovo), парентеральный (например, внутривенный, подкожный, внутрикожный, интракраниальный, внутримышечный (включая введение в скелетную мышцу, диафрагму и/или сердечную мышцу), интраплевральный, интрацеребральный и внутрисуставной), топический (например, на поверхность кожи и слизистых оболочек, включая поверхности дыхательных путей, и чрескожное введение), в лимфатические узлы и тому подобное, а также прямую инъекцию в ткань или орган (например, в скелетную мышцу, сердечную мышцу или мышцу диафрагмы).
Введение можно выполнять в любой участок тела индивида, включая, без ограничения, участок, выбранный из группы, состоящей из скелетной мышцы, гладкой мышцы, сердца и диафрагмы.
Введение в скелетную мышцу в соответствии с настоящим изобретением включает, но не ограничивается ими, введение в скелетную мышцу конечностей (например, в плечо, предплечье, бедро и/или голень), спины, шеи, головы (например, язык), груди, живота, таза/промежности и/или пальцев. Подходящие скелетные мышцы включают, но не ограничиваются ими, мышцу, отводящую мизинец (на руке), мышцу, отводящую мизинец (на ноге), мышцу, отводящую большой палец стопы, отводящую мышцу у основания пятой плюсневой кости, отводящую мышцу большого пальца, длинную отводящую мышцу большого пальца кисти, короткую приводящую мышцу, приводящую мышцу большого пальца стопы, длинную приводящую мышцу, большую приводящую мышцу, длинную приводящую мышцу большого пальца кисти, локтевую мышцу, переднюю лестничную мышцу, суставную мышцу колена, двуглавую мышцу плеча, двуглавую мышцу бедра, плечевую мышцу, плечелучевую мышцу, щечную мышцу, клювовидно-плечевую мышцу, мышцу, сморщивающую бровь, дельтовидную мышцу, мышцу, опускающую угол рта, мышцу, опускающую нижнюю губу, двубрюшную мышцу, тыльные межкостные мышцы (на руке), тыльные межкостные мышцы (на ноге), короткий лучевой разгибатель запястья, длинный лучевой разгибатель запястья, локтевой разгибатель запястья, разгибатель мизинца, разгибатель пальцев, короткий разгибатель пальцев, длинный разгибатель пальцев, короткий разгибатель большого пальца стопы, длинный разгибатель большого пальца стопы, разгибатель указательного пальца, короткий разгибатель большого пальца, длинный разгибатель большого пальца, лучевой сгибатель запястья, локтевой сгибатель запястья, короткий сгибатель мизинца (на руке), короткий сгибатель мизинца (на ноге), короткий сгибатель пальцев, длинный сгибатель пальцев, глубокий сгибатель пальцев кисти, поверхностный сгибатель пальцев кисти, короткий сгибатель большого пальца стопы, длинный сгибатель большого пальца стопы, короткий сгибатель большого пальца кисти, длинный сгибатель большого пальца кисти, лобную мышцу, икроножную мышцу, подбородочно-подъязычную мышцу, большую ягодичную мышцу, среднюю ягодичную мышцу, малую ягодичную мышцу, тонкую мышцу, подвздошно-реберную мышцу, подвздошно-поясничную мышцу, грудную подвздошно-реберную мышцу, подвздошную мышцу, нижнюю близнецовую мышцу, нижнюю косую мышцу, нижнюю прямую мышцу, подостную мышцу, межостистые мышцы, межпоперечные мышцы, боковую крыловидную мышцу, латеральную прямую мышцу, широчайшую мышцу спины, мышцу, поднимающую угол рта, мышцу, поднимающую верхнюю губу, мышцу, поднимающую верхнюю губу и крыло носа, мышцу, поднимающую верхнее веко, мышцу, поднимающую лопатку, длинные мышцы-вращатели, длиннейшую мышцу головы, длиннейшую мышцу шеи, длиннейшую мышцу груди, длинную мышцу головы, длинную мышцу шеи, червеобразную мышцу (на руке), червеобразную мышцу (на ноге), жевательную мышцу, медиальную крыловидную мышцу, медиальную прямую мышцу, среднюю лестничную мышцу, многораздельную мышцу, челюстно-подъязычную мышцу, нижнюю косую мышцу головы, верхнюю косую мышцу головы, внешнюю запирательную мышцу, внутреннюю запирательную мышцу, затылочную мышцу, лопаточно-подъязычную мышцу, мышцу, противопоставляющую мизинец, мышцу, противопоставляющую большой палец, круговую мышцу глаза, круговую мышцу рта, ладонные межкостные мышцы, короткую ладонную мышцу, длинную ладонную мышцу, гребенчатую мышцу, большую грудную мышцу, малую грудную мышцу, короткую малоберцовую мышцу, длинную малоберцовую мышцу, третью малоберцовую мышцу, грушевидную мышцу, подошвенные межкостные мышцы, подошвенную мышцу, подкожную мышцу шеи, подколенную мышцу, заднюю лестничную мышцу, квадратный пронатор, круглый пронатор, поясничную мышцу, квадратную мышцу бедра, квадратную мышцу подошвы, переднюю прямую мышцу головы, боковую прямую мышцу головы, большую заднюю прямую мышцу головы, малую заднюю прямую мышцу головы, прямую мышцу бедра, большую ромбовидную мышцу, малую ромбовидную мышцу, мышцу смеха, краниальную головку портняжной мышцы, наименьшую лестничную мышцу, полуперепончатую мышцу, полуостистую мышцу головы, полуостистую мышцу шеи, полуостистую мышцу груди, полусухожильную мышцу, переднюю зубчатую мышцу, короткие мышцы-вращатели, камбаловидную мышцу, остистую мышцу головы, остистую мышцу шеи, остистую мышцу груди, ременную мышцу головы, ременную мышцу шеи, грудино-ключично-сосцевидную мышцу, грудино-подъязычную мышцу, грудинощитовидную мышцу, шило-подъязычную мышцу, подключичную мышцу, подлопаточную мышцу, верхнюю близнецовую мышцу, верхнюю косую мышцу, верхнюю прямую мышцу, мышцу, вращающую кисть наружу, надостную мышцу, височную мышцу, мышцу, напрягающую широкую фасцию, большую круглую мышцу, малую круглую мышцу, грудную мышцу, щитоподъязычную мышцу, переднюю большеберцовую мышцу, заднюю большеберцовую мышцу, трапециевидную мышцу, трехглавую мышцу плеча, промежуточную широкую мышцу бедра, латеральную широкую мышцу бедра, медиальную широкую мышцу бедра, большую скуловую мышцу и малую скуловую мышцу, а также любую другую подходящую скелетную мышцу, известную в данной области.
Вирусный вектор можно доставлять в скелетную мышцу внутривенным введением, внутриартериальным введением, внутрибрюшинным введением, перфузией конечностей (необязательно, изолированной перфузией вены ноги и/или руки; смотри, например,Arruda et al., (2005) Blood 105: 3458-3464) и/или прямой внутримышечной инъекцией. В конкретных вариантах осуществления вирусный вектор и/или капсид вводят в конечность (руку и/или ногу) индивида (например, индивида, страдающего мышечной дистрофией, такой как DMD) путем перфузии конечности, необязательно, изолированной перфузии вены конечности (например, путем внутривенного или внутрисуставного введения). В вариантах осуществления изобретения вирусные векторы и/или капсиды по изобретению можно эффективно вводить без использования «гидродинамического» приема. Доставку в ткани (например, в мышцу) векторов предшествующего уровня техники часто усиливали за счет гидродинамического приема (например, внутривенного/внутривенного введения в большом объеме), что приводит к увеличению давления в сосудистой сети и способствует пересечению вектором барьера эндотелиальных клеток. В конкретных вариантах осуществления вирусные векторы и/или капсиды по изобретению можно вводить без использования гидродинамического приема, такого как инфузии больших объемов и/или повышение внутрисосудистого давления (например, с повышением нормального систолического давления, например, повышением внутрисосудистого давления менее чем, или ровно на 5%, 10%, 15%, 20%, 25% относительно нормального систолического давления). Такие способы позволяют уменьшать или избегать побочных эффектов, связанных с использованием гидродинамического приема, таких как отек, повреждение нервов и/или синдром сдавливания.
Введение в сердечную мышцу включает введение в левое предсердие, правое предсердие, левый желудочек, правый желудочек и/или перегородку. Вирусный вектор и/или капсид можно доставлять в сердечную мышцу внутривенным введением, внутриартериальным введением, например, внутриаортальным введением, прямой инъекцией в сердце (например, в левое предсердие, правое предсердие, левый желудочек, правый желудочек) и/или перфузией коронарной артерии.
Введение в мышцу диафрагмы можно выполнять любым подходящим способом, включая внутривенное введение, внутриартериальное введение и/или внутрибрюшинное введение.
Введение в гладкую мышцу можно выполнять любым подходящим способом, включая внутривенное введение, внутриартериальное введение и/или внутрибрюшинное введение. В одном варианте осуществления введение можно выполнять в эндотелиальные клетки, находящиеся в, вблизи и/или на гладких мышцах.
Доставку в ткань-мишень также можно осуществлять путем доставки депо, содержащего вирусный вектор и/или капсид. В репрезентативных вариантах осуществления депо, содержащее вирусный вектор и/или капсид, имплантируют в скелетную, гладкую, сердечную мышечную ткань и/или мышечную ткань диафрагмы, или ткань может контактировать с пленкой или другой матрицей, содержащей вирусный вектор и/или капсид. Такие имплантируемые матрицы или субстраты описаны в патенте США № 7201898.
В конкретных вариантах осуществления вирусный вектор по настоящему изобретению вводят в скелетную мышцу, мышцу диафрагмы и/или сердечную мышцу (например, для лечения и/или предотвращения мышечной дистрофии).
В репрезентативных вариантах осуществления изобретение используют для лечения и/или предотвращения заболеваний скелетной, сердечной мышцы и/или мышцы диафрагмы.
В репрезентативном варианте осуществления изобретение относится к способу лечения и/или предотвращения мышечной дистрофии у индивида, который нуждается в этом, включающему: введение эффективного для лечения или предотвращения количества вирусного вектора по изобретению индивиду-млекопитающему, при этом вирусный вектор содержит гетерологичную нуклеиновую кислоту, кодирующую дистрофин, мини-дистрофин или микро-дистрофин. В конкретных вариантах осуществления вирусный вектор может быть введен в скелетную мышцу, мышцу диафрагмы и/или сердечную мышцу, как описано в другом разделе настоящего документа.
Инъекционные препараты можно готовить в общепринятых формах, либо в виде жидких растворов или суспензий, твердых форм, подходящих для приготовления раствора или суспензии в жидкости перед инъекцией, или в виде эмульсий. Альтернативно, можно вводить вирусный вектор и/или вирусные капсиды по изобретению локально, а не системно, например, в депо или в препарате с замедленным высвобождением. Кроме того, вирусный вектор и/или вирусный капсид можно доставлять прикрепленными к имплантируемой хирургическим путем матрице (например, как описано в публикации патента США № 2004-0013645).
После описания настоящего изобретения оно будет объяснено более подробно в следующих далее примерах, которые включены в настоящий документ исключительно с иллюстративными целями, и которые не должны ограничивать изобретение.
Пример 1
Синтез кодон-оптимизированных человеческих генов мини-дистрофина
Ранее авторы изобретения создали ряд миниатюрных вариантов человеческого гена дистрофина методом ПЦР-клонирования кДНК человеческого мышечного дистрофина, получая гены мини-дистрофина, имеющие большие делеции в центральном стержневом домене и почти полную делецию C-концевой области кодирующей последовательности дистрофина (Wang et al., Proc. Natl. Acad. Sci., USA 97:13714 (2000); патенты США №№ 7001761 и 7510867). Тестирование этих генов мини-дистрофина показало, что они являются высоко функциональными in vivo в мышиных моделях DMD mdx (Watchko et al., Human Gene Therapy 13:1451 (2002)). Один из этих белков мини-дистрофина, называемый Δ3990, был описан в патенте США № 7510867 в виде SEQ ID NO:6. Белковая последовательность Δ3990 и ДНК, кодирующая ее, приведены в настоящем документе в виде SEQ ID NO:27 и SEQ ID NO:28, соответственно.
Также была разработана кодон-оптимизированная модификация Δ3990 мини-дистрофина и протестирована на активность. Этот новый человеческий мини-дистрофин, называемый Dys3978, имеет длину 1325 аминокислот и включает следующие части или субдомены из полноразмерного человеческого мышечного дистрофина дикого типа (SEQ ID NO:25): N-конец и актин-связывающий домен (ABD), шарнир H1, стержни R1 и R2, шарнир H3, стержни R22, R23 и R24, шарнир H4, цистеин-богатый домен (CR домен) и часть карбокси-концевого домена (CT домена). Аминокислотная последовательность данного белка приведена в SEQ ID NO:7 и схематически проиллюстрирована на Фиг. 1. Для уменьшения потенциальной иммуногенности последние четыре аминокислоты на C-конце белка Δ3990 были делетированы. При создании Δ3990 данная последовательность была образована путем соединения части амино-конца карбокси-концевого домена дистрофина (заканчивающегося на P3409) с последними тремя аминокислотами дистрофина (3683-3685, или DTM). Известно, что эта последовательность из четырех аминокислот не обладает какой-либо известной функцией и может выступать в качестве нового эпитопа, поскольку эта последовательность не существует в дистрофине дикого типа. Кроме того, валин в аминокислотном положении 2 в Δ3990, не присутствующий в дистрофине дикого типа, но возникающий в результате создания консенсусной последовательности инициации Kozak рядом с инициирующим кодоном Δ3990, был заменен на лейцин, обычно присутствующий в дистрофине. Таким образом, существуют 5 аминокислотных отличий между Δ3990 и Dys3978. Выравнивание аминокислотных последовательностей Δ3990 и Dys3978 приведено на Фиг. 55A-55C.
Ген, кодирующий Dys3978, был сконструирован путем объединения подпоследовательностей из кодирующей последовательности дистрофина дикого типа, соответствующих белковым субдоменам, описанным выше. Полученный ген приведен в SEQ ID NO:26. Для увеличения экспрессии Dys3978 последовательность гена была кодон-оптимизирована с использованием человеческих алгоритмов кодонов. Полученный кодон-оптимизированный для человека ген, называемый Hopti-Dys3978, приведен в SEQ ID NO:1. Кодон-оптимизированный для собаки ген, кодирующий Dys3978, называемый Copti-Dys3978, также был получен, его последовательность приведена в SEQ ID NO:3. Выравнивание для сравнения последовательностей ДНК Hopti-Dys3978 и не кодон-оптимизированного гена, кодирующего Δ3990, приведено на Фиг. 56A-56I.
Среди прочих изменений, кодон-оптимизация гена, кодирующего Dys3978, привела к увеличению общего содержания GC от примерно 46% в не кодон-оптимизированном гене до примерно 61% в кодон-оптимизированном для человека гене (то есть, Hopti-Dys3978). Увеличение содержания GC может приводить к увеличению уровней мРНК в клетках млекопитающих. Смотри, например, Grzegorz, K, et al., PLoS Biol, 4(6):e180 (2006); и Newman, ZR, et al., PNAS, E1362-71 (2016). Кодон-оптимизация также привела к увеличению индекса адаптации кодонов (CAI) и добавлению консенсусного сайта узнавания Kozak для инициации транскрипции в начале кодирующей последовательности.
Для исследования того, способна ли кодон-оптимизация для человека повышать экспрессию гена, ген Hopti-Dys3978 клонировали в экспрессионную кассету AAV вектора, содержащую конститутивно активный промотор CMV и небольшую синтетическую последовательность сигнала полиаденилирования (полиA) (SEQ ID NO:6). После трансфекции в человеческие клетки HEK293 векторная плазмида, содержащая ген Hopti-Dys3978, продемонстрировала на удивление более высокий уровень экспрессии белка, чем не оптимизированный ген Dys3978, что качественно определяли методом иммунофлуоресцентного окрашивания и вестерн-блоттинга на белок дистрофин (Фиг. 2).
Ген, кодирующий человеческий мини-дистрофин, аналогичный по структуре Dys3978, за исключением отсутствия шарнира H3, также был получен и кодон-оптимизирован. Данный ген, называемый Hopti-Dys3837 (SEQ ID NO:2), кодирует человеческий белок мини-дистрофин длиной 1278 аминокислот, называемый Dys3837 (SEQ ID NO:8), схематическое изображение которого также приведено на Фиг. 1.
Для других экспериментов, описанных в настоящем документе, кодон-оптимизированные для человека и для собаки гены Dys3978 помещали под контроль одной из двух разных комбинаций синтетических специфических для мышц промотора и энхансера, полученных из гена мышечной креатинкиназы, приведенных ниже:
1) Синтетический гибридный специфический для мышц промотор (hCK) (SEQ ID NO:4); и
2) Синтетический гибридный специфический для мышц промотор плюс (hCKplus) (SEQ ID NO:5).
Для использования в экспериментах были сконструированы следующие векторы с применением стандартных методов молекулярного клонирования. Генные экспрессионные кассеты с указанным промотором, геном мини-дистрофина и последовательностью полиA клонировали в каркас AAV векторной плазмиды, содержащий AAV2 инвертированные концевые повторы (ITR), фланкирующие экспрессионную кассету.
1) AAV-CMV-Hopti-Dys3978
2) AAV-hCK-Hopti-Dys3978 (SEQ ID NO:9)
3) AAV-hCK-Hopti-Dys3837 (SEQ ID NO:10)
4) AAV-hCKplus-Hopti-Dys3837 (SEQ ID NO:11)
5) AAV-hCK-Copti-Dys3978 (SEQ ID NO:12)
Пример 2
CMV-Hopti-Dys3978 у мышей с двойным нокаутом дистрофина/утрофина
Утрата дистрофина у пациентов, страдающих мышечной дистрофией Дюшенна (DMD), приводит к тяжелой дегенерации скелетных мышц и кардиомиопатии. Мыши mdx, лишенные только дистрофина, имеют гораздо более умеренный фенотип, в то время как мыши с двойным нокаутом генов (dKO), лишенные как дистрофина, так и его гомолога утрофина, проявляют тяжелые клинические признаки мышечной дистрофии, наблюдаемые у пациентов с DMD. Ранее было показано, что внутрибрюшинная инъекция новорожденным гомозиготным мышам dKO дозы 3×1011 вг/мышь AAV1-CMV-Δ3990 (не кодон-оптимизированного) могла приводить к частичному восстановлению роста, функционирования, а также к увеличению продолжительности жизни на несколько месяцев (уровень выживаемости 50% через 22 недели) (смотри Фиг. 6B в Wang et al., J. Orthop. Res, 27:421 (2009)). В данном эксперименте терапевтические эффекты системной доставки кодон-оптимизированного для человека гена Hopti-Dys3978 оценивали с использованием AAV9 в качестве капсида. Результаты показали, что однократное системное введение (в/б) AAV9-CMV-Hopti-Dys3978 в дозе примерно 2×1013вг/кг новорожденным мышам dKO в возрасте 1 недели приводило к широко распространенной экспрессии гена мини-дистрофина в скелетных мышцах и во всей сердечной мышце (Фиг. 3). У получавших AAV9 мышей dKO наблюдали почти нормальную кривую роста и массу тела (Фиг. 4) и значительно улучшенную мышечную функцию, что оценивали на основании результатов измерения силы захвата и бега на беговой дорожке (Фиг. 5). У получавших лечение мышей dKO также наблюдали уменьшение дистрофической патологии (Фиг. 6A-6B) и сильное улучшение общего состояния здоровья. При сравнении с мышами dKO, получавшими AAV1 вектор, экспрессирующий не кодон-оптимизированный Δ3990, мыши dKO, получавшие лечение геном Hopti-Dys3978, имели сильно увеличенную продолжительность жизни (уровень выживаемости 50%: 22 недели против более, чем 80 недель) (Фиг. 7). Неожиданно была восстановлена фертильность как самцов, так и самок, мышей dKO (Таблица 1), это свидетельствовало об общем улучшении функций и также возможном улучшении функции гладких мышц.
ТАБЛИЦА 1
Мини-дистрофин восстанавливает фертильность мышей dKO
Не получавшие лечение мыши dKO были полностью бесплодными. Однако фертильность была восстановлена при помощи AAV-CMV-Hopti-Dys3978 как у самцов, так и у самок, получавших лечение мышей dKO (T-dKO).
Результаты, описанные выше, демонстрируют, что системная доставка кодон-оптимизированного гена Hopti-Dys3978 была более эффективной, чем доставка не кодон-оптимизированного гена Δ3990.
Важно, что также имело место значительное улучшение сердечных функций. Терапевтические эффекты на сердце оценивали в возрасте 4 месяцев в гемодинамическом анализе с использованием системы петли объем-давление Миллара. Не получавшие лечение мыши dKO едва выживали более 4 месяцев. Из-за очень небольшого размера тела, кифоза и тяжелой мышечной и сердечной дисфункции мыши dKO были слишком слабы, чтобы перенести процедуру гемодинамического анализа. Вследствие этого, получавших AAV9 мышей dKO сравнивали с не получавшими лечение, подобранными по возрасту мышами mdx, которые имеют более умеренный фенотип благодаря интактному гену утрофина, который, как известно, компенсирует отсутствие дистрофина в данной модели. Хотя результаты измерения методом эхокардиографии показали, что у мышей mdx не было выраженной сердечной недостаточности относительно исходного состояния в сравнении с мышами C57/B10 дикого типа, у них была обнаружена явная недостаточность при измерении гемодинамики в исходном состоянии (Фиг. 8, незаштрихованные столбики). Результаты эксперимента показали, что получавшие AAV9 мыши dKO имели исходную сердечную гемодинамику, аналогичную таковой у мышей mdx, включая конечно-систолическое давление, конечно-диастолический объем, максимальную скорость изоволюметрического сокращения (dp/dtмакс) и максимальную скорость изоволюметрического расслабления (dp/dtмин). Однако после воздействия добутамина у получавших лечение мышей dKO наблюдалась исходная сердечная гемодинамика, аналогичная таковой у мышей mdx, включая конечно-систолическое давление, конечно-диастолический объем, максимальную скорость изоволюметрического сокращения (dp/dtмакс и dp/dtмин), в то время, как состояние получавших AAV9 мышей dKO было намного лучше, чем у мышей mdx, по всем изученным параметрам (Фиг. 8, заштрихованные столбики). Кроме того, более 50% мышей mdx погибли в пределах 30-мин окна воздействия добутамина, что согласуется с опубликованными ранее данными авторов изобретения (Wu et al., Proc. Natl. Acad. Sci. USA 105:14814 (2008)). Поразительно, но вследствие экспрессии в сердце трансгена мини-дистрофина у получавших AAV9 мышей dKO индуцируемая добутамином сердечная недостаточность была в значительной степени предотвращена. Более 90% получавших AAV9 мышей dKO выжили после вызываемого добутамином стресса в 30-мин окне. И наконец, обычно наблюдаемое на электрокардиограммах (ЭКГ) укорочение PR-интервала также было существенно изменено в лучшую сторону (Фиг. 9A-9B). PR-интервал представляет собой время от начала P-волны до начала комплекса QRS. В совокупности данные результаты демонстрируют эффективность терапии геном AAV9-CMV-Hopti-Dys3978 для лечения кардиомиопатии в мышиной модели тяжелой DMD.
Пример 3
hCK-Hopti-Dys3978 у мышей mdx
Для изучения того, способен ли гибридный синтетический специфический для мышц промотор hCK эффективно управлять экспрессией гена Dys3978, проводили сравнение с тем же конструктом, управляемым сильным неспецифическим промотором CMV. Иммунофлуоресцентное окрашивание экспрессируемого мини-дистрофина у мышей mdx после инъекции в хвостовую вену соответствующих векторов показало, что два промотора, то есть, hCK и CMV, обеспечивают эквивалентные уровни экспрессии в мышце и сердце (Фиг. 10).
Пример 4
CMV-Hopti-Dys3978 в собачьей модели DMD на собаках породы золотистый ретривер, страдающих мышечной дистрофией (GRMD)
Взяв за основу результаты исследований на мышах mdx и мышах с двойным нокаутом дистрофина/утрофина (dKO), тот же вектор, AAV9-CMV-Hopti-Dys3978, тестировали на собаке породы золотистый ретривер, страдающей мышечной дистрофией (GRMD), модели DMD на крупном животном. В частности, вектор вводили 2,5-месячной собаке GRMD, «Jelly», которую затем наблюдали в течение более 8 лет после инъекции.
Экспериментальные процедуры: Собаке GRMD «Jelly» (2,5-месячная самка; 6,3 кг; сывороточная CK: 20262 единиц/л до начала лечения) вводили инъекцией вектор AAV9-CMV-Hopti-Dys3978 в дозе 1×1013 вг/кг в правую заднюю конечность. Под общей анестезией резиновый жгут накладывали на проксимальную часть задней конечности (область паха) с охватом большинства мышц в правой задней конечности. AAV9 вектор вводили инъекцией через большую подкожную вену с использованием насоса Гарварда, установленного на скорость инъекции 1 мл/сек. Объем вектора составлял 20 мл/кг массы тела (всего 130 мл). Жгут снимали через 10 минут, считая с начала инъекции. Мышцы в инъецированной конечности стали более твердыми, что ощущалось при пальпации. МРТ изображения задних конечностей были получены через примерно 1 час после инъекции и подтвердили наличие содержащей вектор жидкости в инъецированной конечности (Фиг. 11). Никакие иммуносупрессанты, например, стероиды, ни разу не использовали на протяжении более, чем 8 лет наблюдения. Процедуру биопсии мышц выполняли в 5 временных точках в течение вплоть до 4 лет после инъекции вектора. Завершающее вскрытие проводили в возрасте 8 лет, 4 месяцев, в это время «Jelly» все-еще была способна к самостоятельному передвижению, но намного менее активна, чем раньше.
Результаты: Иммунофлуоресцентное (ИФ) окрашивание показало долговременную экспрессию мини-дистрофина в большинстве изученных образцов мышц вплоть до завершающего вскрытия. Интересно, что изначально в инъецированной конечности (биопсия через 2 месяца после инъекции) имела место более низкая экспрессия, чем в не инъецированной конечности, это свидетельствовало о связанном с процедурой воспалении и частичной инактивации промотора CMV (Фиг. 12). Тем не менее, экспрессия человеческого мини-дистрофина имела место в течение 8 лет у «Jelly», несмотря на исходное воспаление в инъецированной конечности. Биопсии мышц и иммунофлуоресцентное окрашивание, а также вестерн-блоттинг человеческого мини-дистрофина в последующих временных точках (7 месяцев, 1 год, 2 года и 4 года после инъекции вектора) показали постоянную экспрессию гена (Фиг. 13-17). Хотя процентное содержание положительных по мини-дистрофину мышечных волокон варьировалось между разными мышцами, некоторые мышцы имели более 90% положительных мышечных волокон при вскрытии (Фиг. 18). Совместное окрашивание мини-дистрофина и ревертантных мышечных волокон (антитело против C-конца) показало совместное присутствие обоих белков (Фиг. 19). Мини-дистрофин также наблюдали примерно в 20% кардиомиоцитов (Фиг. 18). Общая экспрессия гена была в основном стабильной. Например, количества положительных мышечных волокон в краниальной головке портняжной мышцы оставались сопоставимыми на протяжении 6 временных точек, от 2 и 7 месяцев до 1, 4 и 8 лет (сравните Фиг. 12, 13, 14, 17 и 18). Результаты вестерн-блоттинга подтвердили результаты ИФ окрашивания (Фиг. 20).
Измерение силы сокращения мышц показало частичное улучшение при сравнении с не получавшими лечение собаками (Фиг. 21). «Jelly» оставалась ходячей на протяжении более 8 лет наблюдения после периода лечения и была подвергнута эвтаназии вследствие кардиомиопатии в последний год. При вскрытии и осмотре патологоанатомом ни в одной из тканей не были обнаружены опухоли. Секвенирование ДНК показало, что у «Jelly» отсутствовала изменяющая течение заболевания мутация Jagged 1, обнаруженная у двух собак GRMD с фенотипически умеренным заболеванием, как недавно сообщалось (Vieira et al., Cell 163:1204 (2015)).
Пример 5
hCK-Copti-Dys3978 у собаки GRMD
В данном исследовании вектор AAV9-hCK-Copti-Dys3978 (модифицированный промотор креатинкиназы, управляющий кодон-оптимизированным для собаки геном человеческого мини-дистрофина 3978) использовали для введения собаке GRMD по имени «Dunkin». Ген кодирует тот же человеческий белок мини-дистрофин Dys3978, который использовали в других исследованиях, но является кодон-оптимизированным для собаки. Последовательность ДНК на 94% идентична кодон-оптимизированному для человека гену. Результаты экспериментов по трансфекции человеческих клеток HEK293, в которых сравнивали CK-Copti-Dys3978 (кодон-оптимизированный для собаки) и CK-Hopti-Dys3978 (кодон-оптимизированный для человека) показали практически одинаковые уровни экспрессии. Многочисленные эксперименты, в которых сравнивали оба конструкта у мышей mdx, также показали практически одинаковые уровни экспрессии.
Экспериментальная процедура: Собаке GRMD «Dunkin» (самка, возраст 2,5 месяца, 6,5 кг) вводили внутривенной инъекцией вектор AAV9-hCK-Copti-Dys3978 в дозе 4×1013 вг/кг через большую подкожную вену. В процессе инъекции собаке не вводили седативные препараты. Заметные побочные реакции или изменения поведения отсутствовали. Биопсию мышц выполняли через 4 месяца после инъекции вектора и вскрытие проводили через 14 месяцев после инъекции.
Результаты: Была обнаружена почти равномерно распространенная экспрессия мини-дистрофина на очень высоком уровне при иммунофлуоресцентном окрашивании мини-дистрофина 3978 в образцах скелетной мышцы, начиная с биопсийных образцов через 4 месяца после инъекции (Фиг. 22) до момента вскрытия через 14 месяцев после инъекции (Фиг. 23-26, результаты вскрытия).
При ИФ окрашивании также наблюдали довольно высокие уровни мини-дистрофина в сердечной мышце (Фиг. 27). Экспрессия с промотора CK, судя по всему, была более сильной и более однородной, чем с промотора CMV.
Вестерн-блот анализ подтвердил результаты ИФ окрашивания. В скелетных мышцах уровни мини-дистрофина были в основном выше нормального уровня дистрофина дикого типа у нормальных контрольных собак (Фиг. 28). Уровень Dys3978 в сердце составлял примерно половину уровня дистрофина дикого типа (Фиг. 29).
Экспрессия Dys3978 с кодон-оптимизированного для собаки гена Copti-Dys3978 приводила к эффективному восстановлению дистрофин-ассоциированного белкового комплекса, включающего гамма-саркогликан (Фиг. 30).
Результаты количественной ПЦР для определения числа копий векторной ДНК показали устойчивую корреляцию с уровнями экспрессии белка мини-дистрофина (Фиг. 31).
Ни в одном из исследованных образцов не были обнаружены признаки врожденного или клеточного иммунных ответов. Это сильно отличается от результатов, полученных для AAV9-CMV-opH-dys3978, свидетельствуя о том, что специфический для мышц промотор hCK является не только сильным, но также и более безопасным, чем промотор CMV.
Дистрофическая патология была в значительной степени уменьшена, о чем свидетельствовало окрашивание H&E и гистологическое исследование сердца (Фиг. 32), диафрагмы (Фиг. 33) и мышц конечностей (Фиг. 34). Трихромовое окрашивание по Массону с анилиновым синим также показало значительное уменьшение фиброза в мышцах конечностей и диафрагме (Фиг. 35).
ПРИМЕР 6
Получение вектора AAV9.hCK.Hopti-Dys3978.spA для in vivo экспериментов
Вектор AAV9.hCK.Hopti-Dys3978.spA, используемый в экспериментах с крысами Dmdmdx, описанных далее в примерах 7, 8 и 9, содержит AAV9 капсид и экспрессионную кассету, сконструированную для экспрессии миниатюрного варианта человеческого белка дистрофина, содержащего N-концевую область, шарнир 1 (H1), стержень 1 (R1), стержень 2 (R2), шарнир 3 (H3), стержень 22 (R22), стержень 23 (R23), стержень 24 (R24), шарнир 4 (H4), цистеин-богатый (CR) домен и часть карбокси-концевого (CT) домена из полноразмерного человеческого белка дистрофина Dp427m (SEQ ID NO:25), это минимально необходимые домены для выполнения функции. Белковая последовательность белка мини-дистрофина приведена в виде аминокислотной последовательности SEQ ID NO:7, которая закодирована кодон-оптимизированной для человека последовательностью ДНК, приведенной в виде нуклеотидной последовательности SEQ ID NO:1. Геном вектора AAV9.hCK.Hopti-Dys3978.spA приведен в виде нуклеотидной последовательности SEQ ID NO:18, или ее обратного комплемента, когда одноцепочечный геном упакован в своей отрицательной полярности.
Векторный геном содержит 5′ и 3′-фланкирующие AAV2 инвертированные концевые повторы (ITR) (имеющие последовательность ДНК SEQ ID NO:14 или SEQ ID NO:15, соответственно), синтетические гибридные энхансер и промотор, полученные из гена креатинкиназы (CK), служащие в качестве специфического для мышц регуляторного элемента транскрипции (hCK; с последовательностью ДНК SEQ ID NO:16), имеющий длину 3978 пар нуклеотидов кодон-оптимизированный для человека ген, кодирующий человеческий белок мини-дистрофин, описанный выше (то есть, ген Hopti-Dys3978), и небольшую синтетическую последовательность терминации транскрипции, включающую сигнал полиаденилирования (полиA) (spA; с последовательностью ДНК SEQ ID NO:17).
Вектор был изготовлен с использованием метода тройной трансфекции и линии растущих в бессывороточной среде неадгерентных клеток, полученных из клеток HEK293. Используемые плазмиды включали хелперную плазмиду для экспрессии аденовирусных хелперных белков, необходимых для эффективной репликации и упаковки вектора, плазмиду для упаковки, экспрессирующую ген rep AAV2 и белки AAV9 капсида, и третью плазмиду, содержащую последовательность экспрессионной кассеты, описанной выше.
Клетки выращивали и размножали из образца, полученного из рабочего банка клеток, и после достижения достаточного объема и плотности клеток клетки трансфицировали с использованием реагента для трансфекции. После инкубации, необходимой для продуцирования вектора в трансфицированных клетках, клетки лизировали для высвобождения вектора, лизат осветляли, и вектор очищали с использованием этапа обработки нуклеазой для удаления примесных нуклеиновых кислот, с последующим этапом центрифугирования в градиенте плотности йодиксанола, анионообменной хроматографией, диализом против буфера препарата, стерилизацией фильтрованием и последующим хранением при 2-8°C.
ПРИМЕР 7
Эффекты одной дозы AAV9.hCK.Hopti-Dys3978.spA в крысиной модели DMD
В данном примере описано тестирование AAV9.hCK.Hopti-Dys3978.spA в недавно разработанной модели на крысах Dmdmdx, которая имеет определенные преимущества перед классическими моделями на мышах mdx и собаках GRMD. Larcher, T., et al., Characterization of dystrophin deficient rats: a new model for Duchenne muscular dystrophy. PLoS One. 2014; 9(10):e110371. В частности, в модели на крысах Dmdmdx как скелетно-мышечные, так и сердечные проявления заболевания присутствуют на ранней стадии и развиваются последовательно, аналогично тому, как прогрессирует заболевание у человека.
В данных исследованиях самцам крыс Dmdmdx в возрасте 5-6 недель системно вводили в/в инъекцией в хвостовую вену одну дозу (1×1014 векторных геномов на килограмм массы тела, или вг/кг) вектора Dys3978, суспендированного в PBS. В качестве контроля, крыс дикого типа («ДТ») с тем же генетическим фоном (Sprague Dawley) подвергали такой же процедуре. Все процедуры проводили в «слепом» режиме относительно генотипа крыс или групп введения препаратов во избежание предвзятости. Трем крысам Dmdmdx и 4 крысам ДТ вводили вектор, при этом 3 крысам Dmdmdx и 2 крысам ДТ вводили только PBS в качестве отрицательного контроля (контрольное воздействие). Через три месяца после инъекции животных подвергали эвтаназии и проводили вскрытие для гистологического анализа тканей и иммуноцитохимического исследования экспрессии белка дистрофина.
Для гистопатологического обследования образцы тканей фиксировали в 10% нейтральном забуференном формалине, заливали парафином и получали 5-мкм срезы для окрашивания гематоксилином, эозином и шафраном (HES). Для иммунологического окрашивания на дистрофин дополнительные образцы (печень, сердце, двуглавую мышцу бедра, грудную мышцу и мышцу диафрагмы) замораживали и получали 8-мкм срезы. Мышиное моноклональное антитело NCL-DYSB против дистрофина (Novocastra Laboratories, Newcastle on Tyne, UK) использовали для обнаружения как белка дистрофина, так и мини-дистрофина (1:50), поскольку данное антитело не различает между полноразмерным дистрофином дикого типа и рекомбинантным мини-дистрофином. Все процедуры вскрытия и гистологического исследования проводили в «слепом» режиме.
При гистологическом исследовании не были обнаружены лезии в скелетной или сердечной мышце получавших PBS и вектор крыс ДТ. У всех крыс Dmdmdx имели место лезии волокон скелетных мышц, демонстрирующие некроз отдельных волокон, кластеры регенеративных небольших волокон, рассеянные гигантские гиалиновые волокна, анизоцитоз, центральное расположение ядер в волокнах, фиброз эндомизия и спорадический адипоз, которые характерны для скелетных мышц при DMD. Частота встречаемости и интенсивность этих лезий была повсеместно снижена у крыс Dmdmdx, получавших вектор, в сравнении с теми, которые получали только PBS. В сердце одной из крыс Dmdmdx (крыса 49), получавшей PBS, имели место лезии многоочагового некроза, очаговая инфильтрация мононуклеарных клеток и умеренный очаговый экстенсивный фиброз, что характерно для сердечной мышцы при DMD. У всех крыс Dmdmdx, получавших вектор, сердечная мышца выглядела аналогично и была обнаружена умеренная очаговая инфильтрация мононуклеарных клеток, как и у крыс Dmdmdx, получавших PBS, но в отличие от них в сердцах у крыс Dmdmdx, получавших вектор, не были обнаружены фиброзные очаги.
При иммуноцитохимическом исследовании у крыс ДТ был виден подсарколеммный дистрофин в волокнах скелетных мышц, диафрагмы и сердечной мышцы, и локализация обнаруженного дистрофина не отличалась у крыс, получавших вектор, в сравнении с крысами, получавшими только PBS. Однако наличие мини-дистрофина у получавших вектор крыс ДТ невозможно было подтвердить в данном анализе, поскольку используемое антитело против дистрофина не различало между дистрофином дикого типа и белком мини-дистрофином. Напротив, у одной из крыс Dmdmdx (крыса 49) были обнаружены редкие волокна скелетной мышцы (примерно от 5% до 10%), в которых был обнаружен подсарколеммный дистрофин, что согласуется с ранее описанным присутствием рассеянных ревертантных волокон в данной модели с частотой примерно 5% (Larcher et al., PlosOne, 2014). Однако у данной крысы не был обнаружен дистрофин в волокнах мышц диафрагмы или сердца. У всех получавших вектор Dys3978 крыс Dmdmdx подсарколеммный дистрофин также был обнаружен примерно в 80-95% волокон скелетных мышц, примерно в 30-50% волокон мышц диафрагмы и примерно в 70-80% волокон сердечной мышцы, хотя систематический подсчет не был произведен. У этих крыс в очень редких волокнах скелетных мышц (1 или 2 на мышечный срез) было обнаружено некоторое количество цитоплазматического межфибриллярного дистрофина. Как у крыс ДТ, так и у крыс Dmdmdx, получавших вектор, не были обнаружены признаки инфильтрации воспалительных клеток или повышенного некроза, которые могли указывать на стимуляцию клеточного иммунного ответа вследствие векторной трансдукции или продуцирования мини-дистрофина.
Подводя итог, через 3 месяца после системного введения дозы 1×1014 вг/кг вектора AAV9.hCK.opti-Dys3978.spA никакого гистологического изменения мышечных тканей не было обнаружено у крыс ДТ, получавших вектор, в сравнении с крысами, получавшими PBS, это указывало на то, что экспрессия белка мини-дистрофина хорошо переносилась здоровыми животными. Кроме того, введение вектора крысам Dmdmdx приводило к значительному и генерализованному присутствию мини-дистрофина в волокнах всех изученных мышц (двуглавая мышца бедра, грудная мышца, диафрагма и сердце) с картиной подсарколеммной локализации, аналогичной таковой в мышцах крыс ДТ. Экспрессия мини-дистрофина Dys3978 с вектора была связана с уменьшением фиброза и некроза (Фиг. 36A-36D).
ПРИМЕР 8
Эффекты возрастающих доз AAV9.hCK.Hopti-Dys3978.spA у крыс Dmdmdx, определенные через 3 месяца и 6 месяцев после инъекции
В данном примере описаны результаты введения крысам Dmdmdx, животной модели мышечной дистрофии Дюшенна, возрастающих доз AAV9.hCK.Hopti-Dys3978.spA и измерения эффектов через 3 месяца и 6 месяцев после введения.
Крысам вводили дозы в возрасте 7-8 недель в/в инъекцией в дорсальную пенильную вену, что приводило к системной доставке тестируемых препаратов. Четыре разные дозы вектора тестировали на 10-12 крысах Dmdmdx: 1×1013 вг/кг (5 крыс во временной точке 3 месяца и 6 крыс во временной точке 6 месяцев), 3×1013 вг/кг (6 крыс во временной точке 3 месяца и 5 крыс во временной точке 6 месяцев), 1×1014 вг/кг (7 во временной точке 3 месяца и 6 крыс во временной точке 6 месяцев) и 3×1014 вг/кг (5 крыс во временной точке 3 месяца и 5 крыс во временной точке 6 месяцев). Кроме того, и крысы Dmdmdx, и крысы ДТ, получали только растворитель (1X PBS, 215 мМ NaCl, 1,25% человеческого сывороточного альбумина, 5% (масс/об) сорбита) в качестве отрицательного контроля (6 крыс Dmdmdx во временной точке 3 месяца, 4 крысы Dmdmdx во временной точке 6 месяцев, 5 крыс ДТ во временной точке 3 месяца и 7 крыс ДТ во временной точке 6 месяцев). Пять не подвергнутых воздействию (то есть, без вектора и без растворителя) крыс Dmdmdx также включали в качестве дополнительных отрицательных контролей. Через 3 месяца и 6 месяцев после инъекции крыс из каждой группы введения подвергали эвтаназии и проводили вскрытие, получая образцы тканей для дальнейшего анализа. Перед умерщвлением животных тестировали на сердечную функцию и силу захвата для оценки эффекта лечения вектором на прогрессирование заболевания DMD.
Следует отметить, что дозы вектора могут быть представлены в тексте и на фигурах в двух разных количественно эквивалентных формах. Так, «1×1013» эквивалентно «1E13», «3×1013» эквивалентно «3E13», «1×1014» эквивалентно «1E14» и «3×1014» эквивалентно «3E14».
Масса тела
После введения препаратов и перед проведением эвтаназии крыс в каждой группе введения взвешивали ежедневно в течение первой недели, и затем еженедельно до момента умерщвления. Средняя масса тела всех крыс в каждой группе введения приведена в Таблице 2 (от момента перед инъекцией до 9 недель после инъекции) и Таблице 3 (недели 10-25 после инъекции) и результаты представлены на Фиг. 37 в виде графика зависимости от времени. На графике планки погрешностей представляют стандартную ошибку средних значений (SEM), которые также приведены в таблице. Во всех временных точках средняя масса тела крыс ДТ превышала таковую у крыс Dmdmdx, включая тех, которые получали вектор. Вследствие различий в возрасте и естественной вариабельности массы тела у крыс Dmdmdx отсутствовала устойчивая корреляция между дозой и массой тела до 4 недель после инъекции, после этого масса тела у всех получавших вектор крыс Dmdmdx, за исключением группы самой высокой дозы, была выше, чем у не получавших вектор крыс Dmdmdx, но ниже, чем у крыс ДТ. Через 12 недель после инъекции эффект дозы во всех группах введения был очевиден, с массой тела, пропорциональной дозе вектора в случае всех протестированных доз до завершения исследования.
ТАБЛИЦА 2
ТАБЛИЦА 3
Количественное определение векторной трансдукции и экспрессии РНК и белка у крыс Dmdmdx, получавших лечение вектором AAV9.hCK.Hopti-Dys3978.spA
Материалы и методы
Стандартные методы молекулярной биологии были использованы для определения числа копий трансгена методом количественной ПЦР (кПЦР), относительных уровней экспрессии мРНК транскриптов мини-дистрофина методом кПЦР с обратной транскрипцией (ОТ-кПЦР) и качественного определения экспрессии белка мини-дистрофина методом вестерн-блот анализа.
Для кПЦР геномную ДНК (гДНК) очищали из тканей с использованием набора Gentra Puregene от компании Qiagen. Затем образцы анализировали с использованием системы ПЦР в реальном времени StepOne Plus™ (Applied Biosystems®, Thermo Fisher Scientific), используя 50 нг гДНК в двойном повторе. Все реакции проводили в дуплексе в конечном объеме 20 мкл реакционной смеси, содержащей матрицу ДНК, Premix Ex taq (Ozyme), 0,3 мкл референсного красителя ROX (Ozyme), 0,2 мкмоль/л каждого праймера и 0,1 мкмоль/л Taqman® зонда.
Число копий вектора определяли с использованием праймеров и зонда, разработанных для амплификации области трансгена мини-дистрофина:
Прямой: 5'-CCAACAAAGTGCCCTACTACATC-3' SEQ ID NO:19
Обратный: 5'-GGTTGTGCTGGTCCAGGGCGT-3' SEQ ID NO:20
Зонд: 5'-FAM-CCGAGCTGTATCAGAGCCTGGCC-TAMRA-3' SEQ ID NO:21
Число копий эндогенной гДНК определяли с использованием праймеров и зонда, разработанных для амплификации гена HPRT1 крысы:
Прямой: 5'-GCGAAAGTGGAAAAGCCAAGT -3' SEQ ID NO:22
Обратный: 5'-GCCACATCAACAGGACTCTTGTAG-3' SEQ ID NO:23
Зонд: 5'-JOE-CAAAGCCTAAAAGACAGCGGCAAGTTGAAT-TAMRA-3' SEQ ID NO:24
Для каждого образца значения порогового цикла (Ct) сравнивали со значениями, полученными для разных разведений линеаризованных стандартных плазмид (содержащих либо экспрессионную кассету мини-дистрофина, либо ген HPRT1 крысы). Отсутствие ингибирования кПЦР в присутствии гДНК проверяли, анализируя 50 нг гДНК, экстрагированной из образцов тканей контрольного животного, в которые добавляли стандартную плазмиду в разных разведениях. Использовали дуплексную кПЦР (амплификацию 2 последовательностей в одной и той же реакции), и результаты выражали в виде количества векторных геномов на диплоидный геном (вг/дг). Чувствительность теста составляла 0,003 вг/дг.
Для ОТ-кПЦР суммарную РНК экстрагировали из образцов ткани реагентом TRIzol® (Thermo Fisher Scientific), а затем обрабатывали свободной от РНКаз ДНКазой I из набора TURBO DNA-free™ (Thermo Fischer Scientific). Проводили обратную транскрипцию суммарной РНК (500 нг) с использованием случайных праймеров (Thermo Fischer Scientific) и обратной транскриптазы M-MLV (Thermo Fischer Scientific) в конечном объеме 25 мкл. Затем проводили анализ методом дуплексной кПЦР разведенной 1/15 кДНК с использованием тех же специфических для мини-дистрофина и HPRT1 крысы праймеров и зондов, что и в реакции кПЦР для количественного определения числа копий трансгена методом кПЦР. Отсутствие ингибирования кПЦР в присутствии кДНК проверяли, анализируя кДНК, полученную из образцов тканей контрольного животного, в которые добавляли стандартную плазмиду в разных разведениях. Для каждого образца РНК значения Ct сравнивали со значениями, полученными для разных разведений стандартных плазмид (содержащих либо экспрессионную кассету мини-дистрофина, либо ген HPRT1 крысы). Результаты выражали в относительных количествах (RQ):
RQ=2-ΔCt=2-(Ct мишени - Ct эндогенного контроля)
Для каждого образца РНК отсутствие примесей ДНК также подтверждали анализом «кДНК-подобных образцов», полученных без добавления обратной транскриптазы в реакционную смесь.
Для вестерн-блот анализа уровней экспрессии белка суммарные белки экстрагировали из образцов тканей с использованием RIPA-буфера, содержащего коктейль ингибиторов протеаз (Sigma-Aldrich). Белковые экстракты, 50 мкг для двуглавой мышцы бедра, сердца и диафрагмы, или 100 мкг для печени, наносили на NuPAGE® Novex 3-8% трис-ацетатный гель и анализировали с использованием набора NuPAGE® для блоттинга крупных белков (Thermo Fischer Scientific). DTT в конечной концентрации 200 мМ использовали для восстановления белков перед нанесением на гель. Затем мембраны блокировали 5% раствором обезжиренного молока, 1% NP40 (Sigma-Aldrich) в TBST (трис-буферный солевой раствор, 0,1% Tween 20) и гибридизовали с антителом против дистрофина, специфичным для экзонов 10 и 11 белка дистрофина (1:100, моноклональные антитело MANEX 1011C), и с вторичным HRP-конъюгированным антителом против IgG мыши (1:2000, Dako). Для контроля белковой нагрузки ту же мембрану также гибридизовали с антителом против альфа-тубулина крысы (1:10000, Sigma) и с вторичным HRP-конъюгированным антителом против IgG мыши (1:2000, Dako). Иммуноблоты визуализировали при помощи системы хемилюминесцентного анализа ECL (Thermo Fisher Scientific).
Число копий трансгена человеческого мини-дистрофина через 3 и 6 месяцев после инъекции
Результаты определения числа копий трансгена (в виде количества векторных геномов на диплоидный геном (вг/дг)) в цельной крови, селезенке, сердце, двуглавой мышце бедра, грудной мышце, диафрагме и печени у крыс Dmdmdx, получавших вектор и растворитель, а также у крыс ДТ, которым вводили только растворитель, приведены в таблицах, ниже. Данные для временной точки 3 месяца после инъекции приведены в Таблице 4, и для временной точки 6 месяцев после инъекции приведены в Таблице 5. Данные представляют собой средние значения результатов от отдельных тестируемых животных.
ТАБЛИЦА 4
3 месяца после инъекции
ТАБЛИЦА 5
6 месяцев после инъекции
Сигнал кПЦР отсутствовал у крыс Dmdmdx или ДТ, которым вводили только растворитель, это подтверждало, что данные животные не получали никакого вектора, и сигнал кПЦР отсутствовал в цельной крови через 3 и 6 месяцев после инъекции.
ДНК мини-дистрофина была обнаружена у крыс Dmdmdx, которым вводили инъекцией вектор, как через 3, так и через 6 месяцев после инъекции. Исследуемые ткани можно расположить в следующем порядке, отражающем содержание копий трансгена: печень > сердце > двуглавая мышца бедра ≈ диафрагма ≈ грудная мышца > селезенка. Из проанализированных тканей печень, несомненно, была наиболее эффективно трансдуцирована, с числом копий вектора, достигающим в среднем 80-110 вг/дг у крыс, которым вводили дозу 3×1014 вг/кг вектора. Число копий вектора в печени было в 7-45 раз выше, чем в сердце, и в 40-300 раз выше, чем в двуглавой мышце бедра, диафрагме или грудной мышце. В сердце число копий вектора в среднем составляло примерно 1,0 вг/дг у крыс, которым вводили дозу 1×1014 вг/кг вектора, и примерно 5,0 вг/дг у крыс, которым вводили дозу 3×1014 вг/кг вектора. В случае дозы 1×1014 вг/кг, числа копий трансгена в двуглавой мышце бедра и грудной мышце были сходными и никогда не превышали 0,5 вг/дг. При увеличении дозы вектора до 3×1014 вг/кг среднее число копий трансгена возрастало до примерно 1,2 вг/дг. Данные для диафрагмы отличались особой вариабельностью из-за некоторых необычно высоких результатов у 4 животных, получавших два наиболее высоких уровня доз вектора, у которых числа копий трансгена находились в диапазоне примерно 9-15 вг/дг. Без учета этих выпадающих значений эффективность трансдукции диафрагмы является относительно низкой во временных точках 3 и 6 месяцев, с числом копий трансгена, в среднем составляющим примерно 0,2-0,4 вг/дг при дозе 1×1014 вг/кг и примерно 1,05-1,3 вг/дг при дозе 3×1014 вг/кг.
Экспрессия мРНК человеческого мини-дистрофина через 3 и 6 месяцев после инъекции
Два-четыре животных из каждой группы введения случайным образом выбирали для анализа методом ОТ-кПЦР количественных уровней мРНК транскриптов человеческого мини-дистрофина в образцах из двуглавой мышцы бедра, диафрагмы, сердца, селезенки и печени, полученных при вскрытии животных. Результаты, полученные для тестируемых животных, умерщвленных через 3 месяца и 6 месяцев после инъекции, приведены в Таблице 6 и Таблице 7, соответственно. Данные выражены в виде относительного количества (RQ) мРНК мини-дистрофина в сравнении с мРНК гена HPRT1 крысы.
Никакие транскрипты не были обнаружены ни в одной из тканей животных в группах отрицательного контроля (крысы ДТ и крысы Dmdmdx, получавшие растворитель) или в селезенке животных, получавших вектор, независимо от дозы. Во всех других исследованных тканях были обнаружены транскрипты с вектора, уровни которых, как правило, возрастали зависимым от дозы образом, хотя и с некоторой вариабельностью данных. Ткани в зависимости от уровней транскриптов можно расположить в следующем порядке: двуглавая мышца бедра > сердце ≈ диафрагма > печень. Как описано выше, печень была наиболее трансдуцированным органом среди тех, от которых брали образцы, с варьирующим числом копий вектора, примерно в 60-130 раз превышающим таковое в двуглавой мышце бедра. Несмотря на это, уровень мРНК мини-дистрофина в печени был примерно в 5-15 раз ниже, чем в двуглавой мышце бедра, что являлось свидетельством высокой специфичности для мышц активности промотора, используемого в векторах.
ТАБЛИЦА 6
3 месяца после инъекции
ТАБЛИЦА 7
6 месяцев после инъекции
Экспрессия человеческого белка мини-дистрофина через 3 и 6 месяцев после инъекции
Для тех же животных, случайным образом выбранных для определения уровней мРНК человеческого мини-дистрофина, также проводили анализ для определения уровней белка мини-дистрофина методом вестерн-блоттинга. Белок мини-дистрофин не был обнаружен ни в одной из тканей от животных в группах отрицательного контроля (крысы ДТ и крысы Dmdmdx, получавшие растворитель). Во временных точках 3 и 6 месяцев белок мини-дистрофин был обнаружен в двуглавой мышце бедра, сердце и диафрагме крыс Dmdmdx, получавших дозу вектора. В случае наименьшей протестированной дозы (1×1013 вг/кг) белок мини-дистрофин был обнаружен с меньшей частотой в образцах тканей, в сравнении с крысами, получавшими вектор в более высоких дозах. Данные результаты качественного определения приведены в Таблице 8.
ТАБЛИЦА 8
Существует положительная корреляция между количеством белка, обнаруженного методом вестерн-блоттинга, и дозой вектора, а также количеством мРНК мини-дистрофина в тех же образцах тканей. Требовалось примерно 1,5 RQ мРНК мини-дистрофина, чтобы белок мог быть обнаружен. В соответствии с низкими уровнями транскрипта мини-дистрофина, измеренными в печени, белок мини-дистрофин не был обнаружен в этой ткани, даже в случае использования самой высокой дозы вектора.
Гистопатологическая оценка
Сразу после эвтаназии крыс ДТ и Dmdmdx были собраны образцы тканей для гистопатологического исследования и иммуноцитохимического анализа.
Материалы и методы
Образцы тканей от получавших растворитель крыс ДТ, получавших растворитель и вектор крыс Dmdmdx собирали во время общего вскрытия через 3 и 6 месяцев после инъекции. Образцы также получали от не подвергнутых воздействию крыс Dmdmdx, умерщвленных в возрасте 7-9 недель, которые были использованы для сравнения исходных показателей. Ткани немедленно фиксировали в формалине для гистопатологического исследования или быстро замораживали для иммуногистохимического исследования (иммунологического мечения) и хранили до обработки. Для гистопатологического исследования образцы тканей фиксировали в 10% нейтральном забуференном формалине, заливали парафином и получали срезы (5-мкм), с последующим окрашиванием гематоксилином, эозином и шафраном (HES). Дополнительный срез залитой парафином ткани сердца окрашивали для визуализации коллагена пикросириусом красным F3B (Sigma-Aldrich Chimie SARL, Lyon, FR). Для обнаружения дистрофина и соединительной ткани путем иммунологического мечения образцы замораживали и получали срезы (8-мкм). Мышиное моноклональные антитело, NCL-DYSB (1:50, Novocastra Laboratories, Newcastle on Tyne, UK), которое специфически связывается с крысиным дистрофином, а также с человеческим мини-дистрофином opti-Dys3978, использовали в исследованиях с иммунологическим мечением для визуализации белка дистрофина. Конъюгат Alexa Fluor 555 с агглютинином из проростков пшеницы (WGA) (1:500, Molecular Probes, Eugene, OR) использовали для визуализации соединительной ткани. Ядра окрашивали DRAQ5 (1:1000, BioStatus Ltd, Shepshed, UK). Вскрытие и гистологическое исследование проводили в «слепом» режиме.
Количественную оценку окрашенных пикросириусом областей в срезах сердца проводили с использованием программы Nikon Imaging Software (Nikon, Champigny sur Marne, France). Количественную оценку окрашенных DYSB волокон и окрашенных WGA областей проводили с использованием общедоступной программы обработки изображений ImageJ (v 2.0.0-rc-49/1.51a).
Результаты
Гистопатологический анализ лезий DMD в мышцах через 3 и 6 месяцев после инъекции
Образцы тканей, окрашенные для гистологического исследования, изучали под микроскопом, и лезии, характерные для фенотипа DMD, систематически регистрировали. Лезии в скелетных и сердечных мышцах полуколичественно оценивали в баллах, как показано на Фиг. 38A. Для скелетных мышц (двуглавая мышца бедра, грудная мышца и диафрагма) оценка 0 баллов соответствовала отсутствию существенных лезий; оценка 1 балл соответствовала наличию некоторой регенерационной активности, на что указывали волокна с центральным расположением ядер и очаги регенерации; оценка 2 балла соответствовала наличию дегенеративных волокон, отдельных или в небольших кластерах; и оценка 3 балла соответствовала реструктурированию ткани и замене волокон фиброзной или жировой тканью. Для сердца балльная оценка была основана на интенсивности фиброза (1 балл для низкой и 2 балла для высокой) и наличии дегенеративных волокон (3 балла). Общую балльную оценку лезий для каждой крысы рассчитывали, как среднее значение оценок в баллах для двуглавой мышцы бедра, грудной мышцы, диафрагмы и сердечной мышцы животного. Балльные оценки для отдельных животных в каждой группе введения также усредняли.
Общие балльные оценки лезий для отдельных крыс и средние групповые значения для групп введения через 3 месяца после инъекции приведены на Фиг. 38B, на которой обозначение «ДТ контроль» относится к крысам ДТ, получавшим растворитель, которые имели балльные показатели лезий 0. «KO контроль» относится к крысам Dmdmdx, получавшим растворитель, а обозначения «KO 1E13, 3E13 и 1E14» относятся к крысам Dmdmdx, получавшим указанные дозы (то есть, 1×1013, 3×1013 и 1×1014, соответственно) вектора, выраженные в вг/кг. Как можно видеть, большое количество мышечных лезий, характерных для дистрофического фенотипа у крыс Dmdmdx, уменьшалось вследствие введения вектора зависимым от дозы образом.
Статистический анализ балльных оценок лезий (путем множественных парных сравнений с использованием критерия Данна) позволил выявить следующие различия между группами введения. В образцах двуглавой мышцы бедра через 3 месяца после инъекции отсутствовали существенные различия в балльных оценках лезий между крысами ДТ, получавшими растворитель, и крысами Dmdmdx, получавшими вектор в двух наиболее высоких дозах (1×1014 и 3×1014 вг/кг), и через 6 месяцев после инъекции отсутствовали существенные различия между крысами ДТ, получавшими растворитель, и крысами Dmdmdx, получавшими вектор в любой из четырех протестированных доз. В образцах грудной мышцы и диафрагмы через 3 месяца после инъекции отсутствовали существенные различия в балльных оценках лезий между крысами ДТ, получавшими растворитель, и крысами Dmdmdx, получавшими вектор в трех наиболее высоких протестированных дозах (3×1013, 1 x1014 и 3×1014 вг/кг), и через 6 месяцев после инъекции отсутствовали существенные различия в балльных оценках лезий между крысами ДТ, получавшими растворитель, и крысами Dmdmdx, получавшими вектор во всех четырех дозах. И наконец, в сердечной мышце в обеих временных точках отсутствовали существенные различия в балльных оценках лезий между крысами ДТ, получавшими растворитель, и крысами Dmdmdx, получавшими вектор во всех четырех дозах.
Гистоморфометрия через 3 и 6 месяцев после инъекции
После мечения образцов тканей антителом DYSB, которое специфически связывается как с крысиным дистрофином, так и с человеческим мини-дистрофином, экспрессируемым с вектора, подсчитывали процентную долю положительно окрашенных мышечных волокон в трех случайно выбранных микроскопических полях на образцах из двуглавой мышцы бедра, диафрагмы и сердечной мышцы от каждой крысы. Кроме того, рассчитывали площадь в трех случайно выбранных микроскопических полях, окрашенную положительно конъюгатом WGA, для определения степени фиброза соединительной ткани в замороженных образцах ткани из двуглавой мышцы бедра и диафрагмы. В связанном анализе определяли количество соединительной ткани (коллагена) в поперечных срезах сердца путем количественного определения площади, положительно окрашенной пикросириусом красным в гистологических препаратах. Результаты этих исследований приведены на Фиг. 39A-39C, Фиг. 40A-40C и Фиг. 41A-41C.
На Фиг. 39A представлены репрезентативные микрофотографии окрашенных срезов тканей из образцов двуглавой мышцы бедра от крыс ДТ, получавших растворитель (ДТ+буфер), крыс Dmdmdx, получавших растворитель (DMD+буфер), и крыс Dmdmdx, получавших вектор в возрастающих дозах 1×1013, 3×1013, 1×1014 и 3×1014 вг/кг (DMD+1E13, 3E13, 1E14 и 3E14, соответственно). На верхней панели приведены фотографии образцов, собранных через 3 месяца после инъекции, и на нижней панели приведены фотографии образцов, собранных через 6 месяцев после инъекции. На Фиг. 39B приведен график, показывающий процентную долю положительно окрашенных на дистрофин волокон в образцах двуглавой мышцы бедра от крыс ДТ и крыс Dmdmdx, которые получали растворитель, а также крыс Dmdmdx, которые получали возрастающие дозы вектора, во временных точках 3 и 6 месяцев. Также включены результаты для не подвергнутых воздействию крыс Dmdmdx в возрасте 7-9 недель («статус патологии DMD»). На Фиг. 39C приведен график, показывающий площадь, в процентах, занимаемую соединительной тканью (в качестве меры развития фиброза) в образцах двуглавой мышцы бедра от крыс WT и Dmdmdx из тех же групп введения во временных точках 3 и 6 месяцев, а также от не подвергнутых воздействию крыс Dmdmdx в возрасте 7-9 недель. На графиках одна и та же буква над планками погрешностей указывает на отсутствие статистически значимой разницы между данными, в то время как разные буквы указывают на наличие значимой разницы (например, два столбика с находящейся над ними буквой «a» статистически не отличаются друг от друга).
На Фиг. 40A представлены репрезентативные микрофотографии окрашенных срезов тканей из образцов диафрагмы от крыс ДТ, получавших растворитель (ДТ+буфер), крыс Dmdmdx, получавших растворитель (DMD+буфер), и крыс Dmdmdx, получавших вектор в возрастающих дозах 1×1013, 3×1013, 1×1014 и 3×1014 вг/кг (DMD+1E13, 3E13, 1E14 и 3E14, соответственно), все образцы получены через 3 месяца после инъекции. На Фиг. 40B приведен график, показывающий процентную долю положительно окрашенных на дистрофин волокон в образцах диафрагмы от крыс ДТ и крыс Dmdmdx, которые получали растворитель, а также крыс Dmdmdx, которые получали возрастающие дозы вектора, во временных точках 3 и 6 месяцев. Также включены результаты для не подвергнутых воздействию крыс Dmdmdx в возрасте 7-9 недель («статус патологии DMD»). На Фиг. 40C приведен график, показывающий площадь, в процентах, занимаемую соединительной тканью (в качестве меры развития фиброза) в образцах диафрагмы от крыс WT и Dmdmdx из тех же групп введения во временных точках 3 и 6 месяцев, а также от не подвергнутых воздействию крыс Dmdmdx в возрасте 7-9 недель. На графиках одна и та же буква над планками погрешностей указывает на отсутствие статистически значимой разницы между данными, в то время как разные буквы указывают на наличие значимой разницы (например, два столбика с находящейся над ними буквой «a» статистически не отличаются друг от друга).
На Фиг. 41A представлены репрезентативные микрофотографии окрашенных срезов тканей из образцов сердечной мышцы от крыс ДТ, получавших растворитель (ДТ+буфер), крыс Dmdmdx, получавших растворитель (DMD+буфер), и крыс Dmdmdx, получавших вектор в возрастающих дозах 1×1013, 3×1013, 1×1014 и 3×1014 вг/кг (DMD+1E13, 3E13, 1E14 и 3E14, соответственно). На верхней и нижней панелях показаны поперечные срезы сердца на одной трети расстояния от верхушки, подготовленные для гистологического исследования и окрашенные пикросириусом красным, которые получены от животных, умерщвленных через 3 и 6 месяцев после инъекции, соответственно. Черные планки указывают длину 2 мм. На средней панели показано иммунологическое мечение антителом против дистрофина и конъюгатом WGA образцов сердечной мышцы, полученных во временной точке 3 месяца. На Фиг. 41B приведен график, показывающий процентную долю положительно окрашенных на дистрофин волокон в образцах сердечной мышцы от крыс ДТ и крыс Dmdmdx, которые получали растворитель, а также крыс Dmdmdx, которые получали возрастающие дозы вектора, во временных точках 3 и 6 месяцев. Также включены результаты для не подвергнутых воздействию крыс Dmdmdx в возрасте 7-9 недель («статус патологии DMD»). На Фиг. 41C приведен график, показывающий площадь, в процентах, занимаемую соединительной тканью (в качестве меры развития фиброза) в образцах сердечной мышцы от крыс WT и Dmdmdx из тех же групп введения во временных точках 3 и 6 месяцев, а также от не подвергнутых воздействию крыс Dmdmdx в возрасте 7-9 недель. На графиках одна и та же буква над планками погрешностей указывает на отсутствие статистически значимой разницы между данными, в то время как разные буквы указывают на наличие значимой разницы (например, два столбика с находящейся над ними буквой «a» статистически не отличаются друг от друга).
Статистический анализ (анализ ANOVA и апостериорный двусторонний критерий Фишера) данных показал, что как через 3, так и через 6 месяцев после инъекции, имели место значимые различия в мечении дистрофина в двуглавой мышце бедра и сердце между крысами Dmdmdx, получавшими растворитель, и крысами Dmdmdx, получавшими любую дозу вектора. В диафрагме различия через 3 месяца после инъекции были значимыми в случае двух наиболее высоких протестированных доз, в то время как через 6 месяцев после инъекции различия были значимыми в случае трех наиболее высоких протестированных доз. При сравнении крыс ДТ, получавших растворитель, и крыс Dmdmdx, получавших дозу 3×1014 вг/кг, не были обнаружены значимые различия в двуглавой мышце бедра через 3 месяца после инъекции или в сердечной мышце через 6 месяцев после инъекции.
В мышцах крыс ДТ, получавших растворитель, во всех мышечных волокнах было отмечено интенсивное однородное подсарколеммное окрашивание антителом DYSB. В мышцах крыс Dmdmdx, получавших растворитель, в небольшой процентной доле рассеянных ревертантных волокон было отмечено аналогичное окрашивание (через 3 и 6 месяцев после инъекции, соответственно: двуглавая мышца бедра, 3,7 ± 2,4% и 7,3 ± 2,3%; диафрагма, 0,7 ± 1,5% и 5,8 ± 1,3%; сердечная мышца, 0,0 ± 0,0% и 0,1 ± 0,1%). У крыс Dmdmdx, которым вводили вектор, процентная доля волокон, положительно окрашенных на дистрофин, была увеличена во всех изученных мышцах, с волокнами, имеющими подсарколеммное окрашивание от слабой до интенсивной степени. Чтобы результаты считались положительными, должны были быть окрашены две трети волокон. Во временных точках 3 и 6 месяцев процентная доля положительно окрашенных на дистрофин волокон была сходной в образцах двуглавой мышцы бедра и сердечной мышцы, и при этом более высокой, чем в диафрагме. У крыс Dmdmdx, получавших вектор, число и размер фиброзных очагов, определяемых, как площадь, занимаемая соединительной тканью, были уменьшены в скелетной мышце, и интенсивность фиброза была уменьшена в сердечной мышце.
У не подвергнутых воздействию крыс Dmdmdx, умерщвленных в возрасте 7-9 недель, явный фиброз отсутствовал в двуглавой мышце бедра и в сердечной мышце, но уже имело место значительное разрастание соединительной ткани в диафрагме. В сравнении с крысами ДТ, у получавших растворитель крыс Dmdmdx наблюдалось очаговое или генерализованное утолщение эндомизиального и перимизиального пространства в скелетной мышце, что является показателем фиброза. В сердце у этих крыс имели место рассеянные и экстенсивные фиброзные очаги в желудочковых и септальных субэпикардиальных областях. В тяжелых случаях был отмечен трансмуральный фиброз, который изменял форму сердца. В сравнении с крысами Dmdmdx, получавшими растворитель, имело место значительное уменьшение числа и размера фиброзных очагов через 3 месяца после инъекции в двуглавой мышце бедра у крыс Dmdmdx, получавших дозу 3×1013 вг/кг и более высокие дозы вектора, и через 6 месяцев после инъекции в диафрагме крыс Dmdmdx, получавших дозу 3×1014 вг/кг вектора. В сердце значимые различия в степени фиброза были обнаружены между крысами Dmdmdx, получавшими растворитель, и крысами Dmdmdx, получавшими любую дозу вектора, в обеих временных точках. Через 3 месяца после инъекции никакого значимого различия с точки зрения фиброза не было обнаружено между крысами ДТ, получавшими растворитель, и крысами Dmdmdx, получавшими вектор в дозе 3×1013 вг/кг и выше. Имела место отрицательная корреляция между наблюдаемой степенью фиброза и дозой вектора (p=0,019 для двуглавой мышцы бедра; p=0,004 для диафрагмы и p=0,003 для сердечной мышцы, во всех случаях использовали метод линейной регрессии).
У крыс Dmdmdx введение вектора индуцировало экспрессию мини-дистрофина во всех проанализированных мышцах (двуглавой мышце бедра, диафрагме и сердце), и процентная доля волокон, экспрессирующих мини-дистрофин, положительно коррелировала с дозой вектора (p<0,001, метод линейной регрессии). Число положительных по мини-дистрофину волокон у получавших вектор крыс Dmdmdx было выше в двуглавой мышце бедра и сердце, чем в диафрагме, что указывало на некоторую неоднородность биораспределения или эффективности экспрессии. Экспрессия мини-дистрофина была сходной с точки зрения его подсарколеммной локализации, независимо от дозы, и аномальная локализация не была обнаружена даже в случае самой высокой проанализированной дозы, 3×1014 вг/кг. В некоторых волокнах было обнаружено прерывистое окрашивание дистрофина вдоль сарколеммы, хотя частота этого наблюдаемого факта уменьшалась с увеличением дозы вектора.
Сравнение числа положительных по мини-дистрофину мышечных волокон через 3 и 6 месяцев после инъекции показало отсутствие значимых различий между группами введения в случае двуглавой мышцы бедра. В диафрагме имело место значительное увеличение в период от 3 до 6 месяцев после инъекции при дозе 1×1014 вг/кг, в то время как в сердечной мышце имело место значительное увеличение в период между этими двумя временными точками при дозах 1×1013, 3×1013 и 1×1014 вг/кг.
Частота встречаемости и степень некоторых классических связанных с DMD мышечных лезий варьировалась между группами введения. Например, меньшее число некротических или дегенеративных волокон было отмечено у получавших вектор крыс Dmdmdx, в сравнении с крысами, получавшими только растворитель, и новые регенерированные волокна были видны в образцах от всех крыс Dmdmdx, однако их число, как правило, уменьшалось с увеличением дозы вектора.
Измерения силы захвата и мышечного утомления
Силу захвата передних конечностей у крыс Dmdmdx, получавших растворитель или возрастающие дозы вектора, измеряли через 3 и 6 месяцев после инъекции. Крыс ДТ, которым инъекцией вводили растворитель, включали в качестве отрицательных контролей. Инъекции крысам выполняли, когда они находились в возрасте 7-9 недель, а силу захвата тестировали, когда они находились в возрасте примерно 4,5 и 7,5 месяцев. Измеряли как максимальную силу захвата, так и силу захвата после повторных испытаний, в качестве показателя мышечного утомления.
Материалы и методы
Измеритель силы захвата лапы (Bio-GT3, BIOSEB, France), соединенный с преобразователем силы, использовали для измерения пика силы, генерируемой, когда передние лапы крыс помещали на T-стержень и осторожно оттягивали животных назад, пока они не отпускали стержень. Проводили последовательно пять тестов с коротким промежутком времени (20-40 секунд) между тестами, и уменьшение силы между первым и последним измерением считали показателем утомления. Результаты выражали в граммах (г) и нормировали на массу тела (г/г МТ). Измерение силы захвата проводил экспериментатор, неосведомленный о генотипе животных и группе введения препарата. Данные представляли в виде среднего значения ± SEM и проводили статистическую оценку с использованием непараметрического критерия Крускала-Уоллиса для анализа различий между группами. В случае обнаружения значительных общих эффектов различия между группами оценивали с использованием апостериорного критерия Данна. Постепенное изменение силы захвата анализировали с использованием критерия Фридмана, а затем апостериорного критерия Данна. Все анализы данных проводили с использованием программы GraphPad Prism 5 (GraphPad Software Inc., La Jolla, CA). На фигурах значимые различия с уровнем достоверности 95%, 99% и 99,9% представлены одним, двумя и тремя символами, соответственно.
Результаты
Результаты тестов на силу захвата для крыс, умерщвленных через 3 месяца после инъекции, приведены в Таблице 9 и Таблице 10. Как видно из Таблицы 9, у получавших растворитель крыс Dmdmdx наблюдалось уменьшение абсолютной силы захвата (то есть, без учета различий массы тела) в сравнении с крысами ДТ, получавшими растворитель (уменьшение 24±2%). Напротив, у крыс Dmdmdx, получавших вектор, наблюдалось зависимое от дозы увеличение абсолютной силы захвата в сравнении с контрольными крысами Dmdmdx, получавшими растворитель. В случае двух самых низких доз, 1×1013 и 3×1013 вг/кг, сила захвата возрастала на 13±7% и 24±8%, соответственно, но результаты не достигали уровня статистической значимости, в то время как в случае двух самых высоких доз, 1×1014 и 3×1014 вг/кг, сила захвата возрастала на 40±9% и 55±6%, соответственно, эти различия были статистически значимыми (p<0,01 и p<0,001, соответственно). Также, как видно из Таблицы 9, когда сила захвата передних конечностей была скорректирована на различия массы тела, отсутствовала статистически значимая разница между силой захвата крыс ДТ и крыс Dmdmdx, когда все эти крысы получали растворитель. Однако имело место зависимое от дозы увеличение относительной силы захвата у получавших вектор крыс Dmdmdx в сравнении с крысами Dmdmdx, получавшими растворитель, эти результаты достигали уровня статистической значимости в случае двух наиболее высоких доз, 1×1014 и 3×1014 вг/кг (увеличение 27±8%, p<0,05, и увеличение 39±6%, p<0,001, соответственно).
Силу захвата передних конечностей также измеряли во время пяти проводимых с короткими интервалами повторных испытаний для определения степени, в которой введение вектора может влиять на мышечное утомление, которое, как известно, характерно для этой модели на крысах Dmdmdx. Как показано на Фиг. 42A, у получавших растворитель крыс Dmdmdx наблюдалось заметное уменьшение силы захвата передних конечностей между первым и пятым испытаниями (уменьшение 63±5%), в то время как крысы ДТ, получавшие растворитель, были такими же сильными после пятого испытания, как и после первого, эффект, наблюдаемый ранее в этой модели (Larcher, et al., 2014).
Напротив, зависимое от дозы улучшение было отмечено у получавших вектор крыс Dmdmdx в сравнении с такими же крысами, получавшими только растворитель. Как видно из Таблицы 10, в случае двух самых низких протестированных доз (1×1013 и 3×1013 вг/кг) наблюдалась отсрочка в очевидном уменьшении силы захвата, что свидетельствовало об уменьшении утомления, по меньшей мере, на ранних этапах испытаний. Однако при более низких дозах к пятому испытанию все еще отсутствовала статистически значимая разница между силой захвата у получавших вектор крыс Dmdmdx и крыс Dmdmdx, получавших только растворитель. Тем не менее, сильная тенденция к сокращению уменьшения силы захвата была очевидной даже при этих низких дозах. В случае двух наиболее высоких доз, 1×1014 и 3×1014 вг/кг, у крыс Dmdmdx не наблюдали статистически значимых различий в степени утомления в сравнении с крысами ДТ, получавшими растворитель. Иными словами, после пяти испытаний эти получавшие вектор крысы Dmdmdx были неотличимы от животных дикого типа. Фактически, во всех испытаниях средняя сила захвата у крыс Dmdmdx, получавших самую высокую дозу вектора, была выше, чем таковая у контролей ДТ, хотя разница не была статистически значимой.
Результаты тестов на силу захвата для крыс, умерщвленных через 6 месяцев после инъекции, приведены в Таблице 11 и Таблице 12. Как видно из Таблицы 11, у получавших растворитель крыс Dmdmdx наблюдалось уменьшение силы захвата (то есть, не скорректированной на различия в массе тела) в сравнении с получавшими растворитель крысами ДТ (уменьшение абсолютной силы захвата 38±3%). Это различие было статистически значимым при измерении абсолютных показателей, но не в случае относительных величин. Напротив, у крыс Dmdmdx, которые получали вектор, наблюдалось зависимое от дозы увеличение абсолютной силы захвата в сравнении с получавшими растворитель контрольными крысами Dmdmdx. В случае двух самых низких доз, 1×1013 и 3×1013 вг/кг, сила захвата возрастала на 20±5% и 21±6%, соответственно, но результаты не достигали уровня статистической значимости, в то время как в случае двух наиболее высоких доз, 1×1014 и 3×1014 вг/кг, сила захвата возрастала на 39±9% и 41±5%, соответственно, эти результаты достигали уровня статистической значимости (p<0,05 и p<0,01, соответственно).
Так же, как и у крыс Dmdmdx, умерщвленных через 3 месяца после инъекции, у получавших растворитель крыс Dmdmdx, умерщвленных через 6 месяцев после инъекции, наблюдалось существенное уменьшение силы захвата передних конечностей между первым и пятым испытанием (уменьшение 57±3%) (Фиг. 42B), хотя это различие не было статистически значимым в сравнении с легким уменьшением силы захвата в течение пяти испытаний, наблюдаемым у крыс ДТ, получающих растворитель, скорее всего, вследствие небольшого размера выборки в данных исследованиях.
Напротив, зависимое от дозы улучшение наблюдалось у получавших вектор крыс Dmdmdx в сравнении с такими же крысами, получавшими только растворитель. Как видно из Таблицы 12, хотя две самые низкие дозы (1×1013 и 3×1013 вг/кг) не влияли существенно на уменьшение силы захвата в течение нескольких испытаний, в случае двух наиболее высоких доз (1×1014 и 3×1014 вг/кг) крысы Dmdmdx статистически значимо не отличались по степени утомления от крыс ДТ, получавших растворитель. Кроме того, в случае самой высокой дозы сила захвата у получавших вектор крыс Dmdmdx была статистически достоверно выше, чем у крыс Dmdmdx, получавших растворитель, при каждом испытании. Иными словами, после пяти испытаний эти получавшие вектор крысы Dmdmdx были неотличимы от животных дикого типа. Фактически, во всех испытаниях средняя сила захвата у крыс Dmdmdx, получавших самую высокую дозу вектора, была выше, чем таковая у контролей ДТ, хотя разница не была статистически значимой.
Исходя из результатов данных исследований, очевидно, что как через 3, так и через 6 месяцев после инъекции, доза 1×1014 вг/кг вектора была достаточной для обращения вспять уменьшения силы захвата, наблюдаемого у крыс Dmdmdx, и мышечного утомления, вызываемого несколькими проведенными с короткими интервалами тестами на силу захвата. Более того, доза 3×1014 вг/кг вектора действительно приводила к увеличению силы захвата и устойчивости к утомлению у крыс Dmdmdx до уровня, который превышал уровень у крыс ДТ с таким же генетическим фоном.
ТАБЛИЦА 9
Сила захвата в возрасте 4,5 месяцев (3 месяца после инъекции)
Масса тела животных (г); максимальная абсолютная сила захвата передних конечностей (г) и относительная сила захвата передних конечностей (г/г массы тела)
Значения представляют собой среднее ± SEM
n: число протестированных животных
*: p<0,05 против ДТ
¤: p<0,05, ¤¤: p<0,01 против Dmdmdx, получавших растворитель
ТАБЛИЦА 10
Сила захвата при утомлении в возрасте 4,5 месяцев (3 месяца после инъекции)
Относительная сила захвата передних конечностей (г/г массы тела) и уменьшение силы захвата между 1-м до 5-м испытаниями, выраженное в виде уменьшения, в процентах, относительно 1-го испытания
Значения представляют собой среднее ± SEM
n: число протестированных животных
*: p<0,05, **: p<0,01, ***: p<0,001 против ДТ
¤: p<0,05, ¤¤: p<0,01, ¤¤¤: p<0,001 против Dmdmdx, получавших растворитель
: p<0,05, : p<0,001 против 1-го испытания
ТАБЛИЦА 11
Сила захвата в возрасте 7,5 месяцев (6 месяцев после инъекции)
Масса тела животных (г); максимальная абсолютная сила захвата передних конечностей (г) и относительная сила захвата передних конечностей (г/г массы тела)
Значения представляют собой среднее ± SEM
n: число протестированных животных
*: p<0,05 против ДТ
¤¤: p<0,01; ¤¤¤: p<0,001 против Dmdmdx, получавших растворитель
ТАБЛИЦА 12
Сила захвата при утомлении в возрасте 7,5 месяцев (6 месяцев после инъекции)
Относительная сила захвата передних конечностей (г/г массы тела) и уменьшение силы захвата между 1-м до 5-м испытаниями, выраженное в виде уменьшения, в процентах, относительно 1-го испытания
Значения представляют собой среднее ± SEM
n: число протестированных животных
*: p<0,05 против ДТ
¤: p<0,05, ¤¤: p<0,01, ¤¤¤: p<0,001 против Dmdmdx, получавших растворитель
: p<0,05, : p<0,01, : p<0,001 против 1-го испытания
Сердечная функция
Сердечную функцию у крыс Dmdmdx и контролей ДТ тестировали через 3 и 6 месяцев после инъекции (в возрасте примерно 5 и 8 месяцев, соответственно) для определения того, может ли введение вектора приводить к структурным или функциональным изменениям в сердце при мышечной дистрофии в модели заболевания на крысах DMD. Методом двухмерной эхокардиографии определяли диастолическую толщину свободной стенки, конечно-диастолический диаметр ЛЖ, фракцию выброса ЛЖ и соотношение E/A через 3 и 6 месяцев после инъекции.
Материалы и методы
Измерения методом эхокардиографии проводил экспериментатор, неосведомленный о генотипе животных и группе введения препарата. Измерения методом двухмерной (2D) эхокардиографии проводили на тестируемых животных, используя ультразвуковую установку Vivid 7 Dimension (GE Healthcare) с 14-МГц преобразователем. Для обнаружения возможной реструктуризации конечно-диастолический диаметр левого желудочка и конечно-диастолическую толщину свободной стенки измеряли во время диастолы на основании изображений по длинной и короткой осям, полученных методом эхокардиографии в М-режиме. Систолическую функцию оценивали по фракции выброса, и диастолическую функцию определяли, проводя измерения трансмитрального потока для определения скорости заполнения желудочка с использованием импульсного допплера в апикальной четырехкамерной позиции для определения соотношения E/A, времени изоволюметрического расслабления и времени замедления пика Е, показателей диастолической дисфункции, которые объяснены ниже.
Соотношение E/A представляет собой соотношение пиковых скоростей движения крови из левого предсердия в левый желудочек в течение двух этапов опорожнения предсердия и наполнения желудочка. Кровь перемещается из левого предсердия в левый желудочек в два этапа. На первом этапе кровь из левого предсердия пассивно перемещается в находящийся ниже желудочек, когда митральный клапан открывается из-за отрицательного давления, создаваемого расслабляющимся желудочком. Скорость, с которой кровь движется во время этого начального этапа, называют «E», то есть, скорость раннего заполнения желудочка. Позже левое предсердие сокращается, выбрасывая оставшуюся в предсердии кровь, и скорость, с которой кровь движется на этом этапе, называют «A», то есть, скорость заполнения желудочка, создаваемая предсердием. Соотношение E/A представляет собой соотношение скоростей раннего (E) и позднего (A) заполнения желудочка. В здоровом сердце соотношение E/A превышает 1. Однако при миопатии Дюшенна стенка левого желудочка становится жесткой, уменьшая расслабление желудочка и втягивание крови из предсердия, в результате чего снижается скорость раннего (E) заполнения желудочка и уменьшается соотношение E/A. Время изоволюметрического расслабления (ВИВР) представляет собой интервал от закрытия аортального клапана до начала заполнения желудочка вследствие открытия митрального клапана, или время до начала заполнения желудочка после начала расслабления. Превышающее нормальное значение ВИВР указывает на плохое расслабление желудочка, которое было описано как у пациентов-людей с DMD (RC Bahler et al., J Am Soc Echocardiogr 18(6), 666-73 (2005); LW Markham et al., J Am Soc Echocardiogr 19(7), 865-71 (2006)), и так и у собак в модели DMD (V Chetboul et al., Eur Heart J 25(21), 1934-39 (2004); V Chetboul et al., Am J Vet Res 65(10), 1335-41 (2004)), и предшествует развитию дилатационной кардиомиопатии, ассоциированной с DMD. И наконец, время замедления пика Е (ВЗ) соответствует времени, в миллисекундах, от скорости в Е до ее возвращения к исходной величине, его увеличение является показателем диастолической дисфункции.
Результаты
Как через 3, так и через 6 месяцев после инъекции, не были обнаружены существенные различия в диастолической толщине свободной стенки между крысами ДТ и Dmdmdx, получавшими растворитель, это свидетельствовало о том, что данный параметр не является информативным с точки зрения протекания заболевания в данной модели в любом возрасте. Однако через 6 месяцев, но не через 3 месяца, после инъекции наблюдалась тенденция к увеличению конечно-диастолического диаметра левого желудочка у крыс Dmdmdx, получавших растворитель, в сравнении с контролями ДТ, которое обращалось вспять, если крысы Dmdmdx получали вектор, хотя результаты не достигали уровня статистической значимости (Фиг. 43).
Для оценки систолической функции измеряли фракцию выброса левого желудочка (ЛЖ). Отличий у крыс Dmdmdx через 3 месяца после инъекции обнаружено не было, но через 6 месяцев после инъекции у крыс Dmdmdx, которым вводили только растворитель, наблюдалось уменьшение фракции выброса ЛЖ, которое предотвращалось при введении вектора, хотя разница была статистически значимой только в случае одной из самых низких доз, 3×1013 вг/кг (Фиг. 44).
Для оценки диастолической дисфункции использовали допплер-эхокардиографию для измерения ранней (E) и поздней диастолической (A) скоростей, соотношения E/A, времени изоволюметрического расслабления (ВИВР) и времени замедления (ВЗ). Через 3 месяца после инъекции имело место статистически значимое уменьшение соотношения E/A у крыс Dmdmdx, получавших растворитель, в сравнении с контролями ДТ, и тенденция, предполагающая возвращение к нормальному соотношению E/A, у крыс Dmdmdx, получавших наиболее высокую дозу вектора, 3×1014 вг/кг, хотя результаты не достигали уровня статистической значимости (Фиг. 45A). Через 6 месяцев после инъекции соотношение E/A у крыс Dmdmdx, получавших растворитель, также было значительно снижено в сравнении с контролями ДТ, и также, как и в более ранней временной точке, имела место тенденция, предполагающая некоторый лечебный эффект вектора, хотя данные были весьма вариабельными и не достигали уровня статистической значимости (Фиг. 45B).
Через 3 месяца после инъекции ВИВР было повышено у крыс Dmdmdx, получавших растворитель, в сравнении с контролями ДТ, и имела место небольшая тенденция, предполагающая зависимое от дозы уменьшение ВИВР у крыс Dmdmdx, получавших вектор, хотя все эти различия в данных не достигали уровня статистической значимости (Фиг. 46A). Через 6 месяцев после инъекции у крыс Dmdmdx, получавших растворитель, ВИВР было значительно выше в сравнении с контролями ДТ, при этом при введении вектора наблюдалась сильная тенденция, предполагающая возврат ВИВР к нормальным уровням, результаты были статистически значимыми в случае самой низкой дозы вектора, 1×1013 вг/кг (Фиг. 46B).
И наконец, ВЗ могло быть измерено только у более старых крыс из-за технических сложностей с протоколом анестезии. Однако при исследовании через 6 месяцев после инъекции ВЗ было значительно повышено у крыс Dmdmdx, получавших растворитель, в сравнении с контролями ДТ, и имела место сильная тенденция к восстановлению до нормальных уровней после введения вектора во всех протестированных дозах (Фиг. 47).
Несмотря на вариабельность данных, результаты этих исследований убедительно свидетельствуют о наличии диастолической дисфункции в сердце у 5- и 8-месячных крыс Dmdmdx, которая могла быть, по меньшей мере частично, обращена вспять за счет введения вектора AAV9.hCK.Hopti-Dys3978.spA.
Химический анализ крови
Перед началом лечения и в момент эвтаназии у крыс были собраны образцы крови и сохранены для завершающего анализа. Проводили тесты для определения сывороточных концентраций мочевины, креатинина, щелочной фосфатазы (ALK), аланинаминотрансферазы (ALT), аспартатаминотрансферазы (AST), лактатдегидрогеназы (LDH), креатинкиназы (CK), тропонина I и антител против белка мини-дистрофина и AAV9 капсида. ALT, AST, CK и LDH представляют собой ферменты, высвобождаемые в кровь из поврежденных мышечных клеток, и, как известно, их уровни повышены у пациентов-людей с DMD.
Через 3 месяца и 6 месяцев после инъекции уровни мочевины, креатинина, ALK, общих сывороточных белков, общего билирубина и тропонина I существенно не отличались у животных из разных экспериментальных групп. Напротив, уровни AST, ALT, LDH и общей CK были повышены у получавших растворитель крыс Dmdmdx в сравнении с крысами ДТ, и изменялись в разной степени при введении вектора.
Как через 3, так и через 6 месяцев после инъекции, уровни AST были повышены у крыс Dmdmdx, получавших растворитель, в сравнении с крысами ДТ, хотя из-за вариабельности данных, уровень значимости был достигнут только во временной точке 6 месяцев. Если крысы Dmdmdx получали вектор, наблюдалась тенденция к снижению уровней AST (хотя и с широкой вариабельностью между отдельными животными) в группах введения доз 1×1014 и 3×1014 вг/кг через 3 месяца после инъекции и в группе введения дозы 3×1014 вг/кг через 6 месяцев после инъекции. Опять-таки, из-за вариабельности данных эти различия не достигали уровня статистической значимости. Эти результаты представлены на Фиг. 48A и Фиг. 48B, где приведены данные для временных точек 3 месяца и 6 месяцев после инъекции, соответственно.
Уровни ALT, LDH и общей CK изменялись аналогично в зависимости от возраста и введения вектора. Через 3 месяца после инъекции уровни ALT, LDH и общей CK были значительно повышены у крыс Dmdmdx, получавших растворитель, в сравнении с крысами ДТ. Введение крысам Dmdmdx вектора мини-дистрофина приводило к возникновению тенденции, предполагающей зависимое от дозы уменьшение уровней ALT, LDH и общей CK в сравнении с получавшими растворитель крысами Dmdmdx, и в некоторых случаях результаты достигали уровня статистической значимости. Эти результаты представлены на Фиг. 49A, Фиг. 50A и Фиг. 51A, соответственно. Через 6 месяцев после инъекции имела место тенденция в результатах, предполагающая повышение уровней ALT и LDH у крыс Dmdmdx, получавших растворитель, в сравнении с крысами ДТ, эти уровни уменьшались в случае введения наиболее высокой протестированной дозы, но ни одно их этих различий не было статистически достоверным. Эти результаты представлены на Фиг. 49B и Фиг. 50B, соответственно. Напротив, аналогично картине, наблюдаемой через 3 месяца после инъекции, уровни общей CK были значительно повышены у крыс Dmdmdx, получавших растворитель, через 6 месяцев после инъекции в сравнении с крысами ДТ, и введение вектора приводило к возникновению тенденции к уменьшению уровней, данные достигали уровня статистической значимости в случае наиболее высокой протестированной дозы вектора (Фиг. 51B).
Уровни общей CK в группах введения также сравнивали в день инъекции и через 3 и 6 месяцев после нее. Как показано на Фиг. 52A и Фиг. 52B, уровни общей CK в крови были неизменно низкими у крыс ДТ, которым вводили растворитель, в то время как уровни CK снижались у всех крыс Dmdmdx, включая тех, которые получали только растворитель и самую низкую дозу вектора. Напротив, уменьшение уровней CK через 3 и 6 месяцев происходило в гораздо большей степени у крыс Dmdmdx, получавших три наиболее высокие дозы вектора. Эти результаты согласуются с естественным течением DMD у человека, когда уровни CK, хотя и повышенные относительно контролей, уменьшаются по мере прогрессирования заболевания вследствие замены мышечной ткани жировой и фиброзной тканью, но также и с зависимым от дозы терапевтическим эффектом в случае наиболее высокой протестированной дозы вектора.
Также были отмечены различия в изоферментах CK. Перед введением доз изоформа CK-MM превалировала у крыс Dmdmdx (в среднем >90%), в то время как уровни изоформ CK-MM и CK-BB были сопоставимыми с таковыми у крыс ДТ (в среднем 40-60%), и уровни CK-MB были выше у крыс ДТ, чем у крыс Dmdmdx (4-6% против ≈1%). Через 3 и 6 месяцев после инъекции у крыс Dmdmdx, получавших дозы вектора выше 1×1013 вг/кг, наблюдалось небольшое увеличение пропорционального содержания изоформы CK-BB и небольшое уменьшение пропорционального содержания изоформы CK-MM, с тенденцией зависимости эффекта от дозы. Никакого четкого изменения пропорционального содержания изоформы CK-MB не наблюдалось у получавших вектор крыс Dmdmdx.
Иммунологические исследования
Гуморальный и клеточный иммунный ответ у крыс Dmdmdx, получавших вектор AAV9.hCK.Hopti-Dys3978.spA, определяли перед началом лечения и через 3 и 6 месяцев после инъекции, и сравнивали с отрицательными и положительными контролями. Образцы сыворотки получали перед инъекцией растворителя или вектора и при проведении эвтаназии через 3 месяца после инъекции. Спленоциты для анализа T-клеточного ответа собирали при проведении эвтаназии через 3 и 6 месяцев после инъекции.
Гуморальный ответ на экспрессию белка мини-дистрофина оценивали качественно путем вестерн-блот анализа сыворотки, полученной от тестируемых животных и разведенной 1:500. Сыворотки всех крыс, как WT, так и Dmdmdx, были отрицательны по антителам против белка мини-дистрофина в случае введения растворителя или до введения вектора. Напротив, у большинства крыс Dmdmdx, получавших вектор даже в самой низкой дозе 1×1013 вг/кг, продуцировались IgG антитела, которые связывали мини-дистрофин на вестерн-блотах. У 80%-100% крыс Dmdmdx, умерщвленных через 3 месяца после инъекции, и у 60%-100% крыс Dmdmdx, умерщвленных через 6 месяцев после инъекции, продуцировались IgG, специфические для белка мини-дистрофина, в зависимости от дозы.
Наличие антител к AAV9 векторному капсиду тестировали методом ELISA. В сыворотке от крыс ДТ и Dmdmdx, получавших растворитель, не были обнаружены IgG, реагирующие с AAV9. Напротив, у всех крыс, получавших вектор, независимо от дозы или от того, была ли проведена эвтаназия через 3 или через 6 месяцев после инъекции, продуцировались анти-AAV9 IgG с титрами, превышающими 1:10240, наивысшее протестированное разведение. Нейтрализующие антитела против AAV9 также были протестированы в анализе ингибирования клеточной трансдукции с использованием рекомбинантного AAV9 вектора, экспрессирующего ген репортера LacZ, обнаруживаемого при помощи люминометра. Титр был определен, как самое низкое разведение, приводящее к >50% ингибированию трансдукции. Нейтрализующие антитела против AAV9 были обнаружены в сыворотке от всех крыс Dmdmdx, получавших вектор, независимо от дозы или от того, была ли проведена эвтаназия через 3 или через 6 месяцев после инъекции, но не у тех же животных до инъекции или у крыс ДТ и Dmdmdx, которые получали только растворитель. Титры имели диапазон от 1:5000 до ≥1:500000 без четкой зависимости от дозы.
Наличие клеточного иммунного ответа на вектор оценивали в анализе ELISpot для IFNγ, проводимого на спленоцитах, собранных от получавших растворитель крыс ДТ и Dmdmdx, а также крыс Dmdmdx, получавших вектор. T-клеточный ответ на человеческий белок мини-дистрофин, экспрессируемый векторным геномом, тестировали с использованием банка перекрывающихся пептидов, охватывающих всю последовательность белка opti-dys3978 (длина 15 аминокислот, перекрывание 10 аминокислот, всего 263 пептидов) и специфического для крыс набора IFNγ-ELISpotBASIC (Mabtech). Отрицательный контроль состоял из не стимулированных спленоцитов и положительный контроль состоял из клеток, стимулированных митогеном конканавалином A. Секрецию IFNγ количественно определяли как число пятнообразующих клеток (SFC) на 106 клеток, и положительным ответом считали наличие >50 SFC/106 клеток или количества клеток, по меньшей мере 3-кратно превышающего значение, полученное для отрицательных контролей. Никакой специфический T-клеточный ответ против какой-либо пептидной последовательности из белка мини-дистрофина не был обнаружен при анализе спленоцитов, полученных от любого из протестированных животных через 3 месяца или 6 месяцев после инъекции, в том числе от крыс Dmdmdx, получавших наиболее высокую дозу 3×1014 вг/кг чектора.
Также изучали T-клеточный ответ против AAV9 капсида в анализе ELISpot на IFNγ, проводя скрининг против пептидных последовательностей из AAV9 (15-мерные пептиды, перекрывающиеся по 10 аминокислотам, разделенные на 3 пула). Положительный ответ в виде продуцирования IFNγ имел место у 16%-60% получавших вектор крыс Dmdmdx, умерщвленных через 3 месяца после инъекции, и у 16%-66% получавших вектор крыс Dmdmdx, умерщвленных через 6 месяцев после инъекции, и он положительно коррелировал с дозой вектора. Напротив, у всех крыс ДТ и Dmdmdx, получавших растворитель, отсутствовал T-клеточный ответ против AAV9 капсида.
ПРИМЕР 9
Сила захвата у более старых крыс Dmdmdx, получавших AAV9.hCK.Hopti-Dys3978.spA
Исследования, описанные в примере 8, выше, были начаты с молодыми крысами в возрасте 7-9 недель. В данном примере описан анализ мышечной функции у более старых крыс Dmdmdx, которым впервые вводили вектор AAV9.hCK.Hopti-Dys3978.spA, когда они находились в возрасте 4 месяца и 6 месяцев, соответственно. Средняя продолжительность жизни крыс линии Sprague Dawley составляет 24-36 месяцев. Целью данных экспериментов являлось определение того, может ли быть эффективным введение вектора на более поздних этапах жизни крыс Dmdmdx. Положительные результаты свидетельствовали бы о том, что лечение вектором пациентов-людей с DMD в более позднем возрасте, например, детей более старшего возраста, подростков, или даже молодежи, также может приводить к улучшению их мышечной функции.
Эксперименты, описанные в данном примере, проводили с использованием аналогичных материалов и методов, что и эксперименты, описанные в примере 8. Более конкретно, крысам Dmdmdx в возрасте 4 и 6 месяцев (n=6 для каждой возрастной группы) отдельно вводили дозу 1×1014 вг/кг вектора AAV9.hCK.Hopti-Dys3978.spA. В качестве отрицательных контролей, крысам ДТ и крысам Dmdmdx (n=6 для каждой возрастной группы) в возрасте 4 месяца и 6 месяцев отдельно вводили только растворитель. Через 3 месяца после инъекции крыс тестировали на силу захвата конечностей, как описано ранее. Как и в случае более молодых крыс, тестировали максимальную силу захвата передних конечностей и силу захвата при нескольких повторных испытаниях, проводимых с короткими интервалами. В последнем тесте определяли мышечное утомление.
Как показано на Фиг. 53A, через 3 месяца после инъекции максимальная сила захвата передних конечностей у крыс Dmdmdx, получавших растворитель в возрасте 4 месяца, была в среднем немного ниже, чем у крыс ДТ, получавших растворитель в возрасте 4 месяца, хотя результаты не достигали уровня статистической значимости. Напротив, у крыс Dmdmdx, которым вводили инъекцией дозу 1×1014 вг/кг вектора в возрасте 4 месяца, средняя максимальная сила захвата передних конечностей была выше, чем у крыс Dmdmdx, получавших только растворитель в том же возрасте, при этом разница была статистически значимой. Сила захвата у получавших вектор крыс была даже больше, чем у крыс ДТ, хотя разница не была статистически значимой. Результаты были аналогичными, когда данные нормировали на массу тела, как показано на Фиг. 53B. На Фиг. 53A и Фиг. 53B символ «¤¤» указывает на статистически значимую разницу между получавшими вектор и получавшими растворитель крысами Dmdmdx (p<0,01).
Что касается мышечного утомления, как показано на Фиг. 53C, крысы Dmdmdx, получавшие растворитель в возрасте 4 месяца, демонстрировали утомление после 2-го теста на силу захвата, в то время как крысы ДТ не проявляли признаки утомления даже после 4 тестов. Напротив, крысы Dmdmdx, получавшие вектор в возрасте 4 месяца, проявляли минимальные, если вообще проявляли, признаки мышечного утомления между 1-м и 5-м тестами на силу захвата. Получавшие вектор крысы Dmdmdx также в целом выглядели более сильными в сравнении с крысами ДТ, получавшими растворитель. На Фиг. 53C символ «*» указывает на статистически значимую разницу между получавшими вектор крысами Dmdmdx и крысами ДТ, получавшими растворитель (p<0,05); «¤¤» указывает на статистически значимую разницу между получавшими вектор и получавшими растворитель крысами Dmdmdx (p<0,01); и символы ʺ ʺ и ʺ ʺ указывают на статистически значимую разницу между получавшими растворитель крысами Dmdmdx в 4-м и 5-м тестах на силу захвата, соответственно, в сравнении с 1-м тестом на силу захвата (с p<0,01 и p<0,001, соответственно).
Как показано на Фиг. 54A, через 3 месяца после инъекции максимальная сила захвата передних конечностей у крыс Dmdmdx, получавших растворитель в возрасте 6 месяцев, была значительно ниже, чем у крыс ДТ, получавших растворитель в возрасте 6 месяцев. Этот эффект сохранялся, даже когда результаты нормировали на массу тела, как показано на Фиг. 54B. Введение крысам Dmdmdx дозы 1×1014 вг/кг вектора в возрасте 6 месяцев приводило к увеличению средней максимальной силы захвата передних конечностей в сравнении с крысами Dmdmdx, получавшими только растворитель, разница была статистически значимой при нормировании результатов на массу тела (Фиг. 54B). На Фиг. 54A и Фиг. 54B символы «*» и «**» указывают на статистически значимую разницу между получавшими растворитель крысами Dmdmdx и крысами ДТ (с p<0,05 и p<0,01, соответственно); и «¤» указывает на статистически значимую разницу между получавшими вектор и получавшими растворитель крысами Dmdmdx (p<0,05).
Что касается мышечного утомления, как показано на Фиг. 54C, крысы Dmdmdx, получавшие растворитель в возрасте 6 месяцев, демонстрировали утомление после 2-го теста на силу захвата, в то время как крысы ДТ не проявляли признаки утомления даже после 4 тестов. В отличие от крыс, получавших инъекцию в возрасте 4 месяца, крысы Dmdmdx, получавшие вектор в возрасте 6 месяцев, демонстрировали некоторое уменьшение силы на протяжении нескольких тестов на силу захвата, хотя и не в такой степени, как это имело место в случае получавших растворитель контрольных крыс Dmdmdx. Кроме того, в отличие от результатов тестов, проводимых с крысами, получавшими инъекцию в возрасте 4 месяца, похоже, что сила у крыс ДТ была больше, чем сила у крыс Dmdmdx, получавших вектор в возрасте 6 месяцев, на протяжении эксперимента. На Фиг. 54C символы «**» и «***» указывают на статистически значимую разницу между получавшими вектор крысами Dmdmdx и крысами ДТ, получавшими растворитель (с p<0,01 и p<0,001, соответственно); «¤» указывает на статистически значимую разницу между получавшими вектор и получавшими растворитель крысами Dmdmdx (p<0,05); и « » указывает на статистически значимую разницу между получавшими растворитель крысами Dmdmdx в 5-м тесте на силу захвата в сравнении с 1-м тестом на силу захвата (p<0,01).
ТАБЛИЦА 13
ТАБЛИЦА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Все вышеизложенное представляет собой иллюстрацию настоящего изобретения и не должно быть истолковано, как ограничение его объема. Изобретение определяется прилагаемой формулой изобретения, которая должна включать эквиваленты пунктов формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ДЗЕ ЮНИВЕРСИТИ ОФ НОРТ КАРОЛИНА ЭТ ЧЕПЕЛ ХИЛЛ
БАМБУ ТЕРАПЬЮТИКС, ИНК.
<120> ОПТИМИЗИРОВАННЫЕ ГЕНЫ И ЭКСПРЕССИОННЫЕ КАССЕТЫ МИНИ-ДИСТРОФИНА,
И ИХ ПРИМЕНЕНИЕ
<130> 5470-784
<150> US 62/352,675
<151> 2016-06-21
<150> US 62/516,449
<151> 2017-06-07
<160> 28
<170> PatentIn version 3.5
<210> 1
<211> 3978
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ген Hopti-Dys3978
<400> 1
atgctttggt gggaggaagt ggaggactgc tacgagagag aggacgtgca gaagaaaacc 60
ttcaccaagt gggtgaacgc ccagttcagc aagttcggca agcagcacat cgagaacctg 120
ttcagcgacc tgcaggatgg caggagactg ctggacctgc tggagggcct gaccggccag 180
aagctgccca aggagaaggg cagcaccaga gtgcacgccc tgaacaacgt gaacaaggcc 240
ctgagagtgc tgcagaacaa caacgtggac ctggtgaaca tcggcagcac cgacatcgtg 300
gacggcaacc acaagctgac cctgggcctg atctggaaca tcatcctgca ctggcaggtg 360
aagaacgtga tgaagaacat catggccggc ctgcagcaga ccaacagcga gaagatcctg 420
ctgagctggg tgaggcagag caccagaaac tacccccagg tgaacgtgat caacttcacc 480
acctcctgga gcgacggcct ggccctgaac gccctgatcc acagccacag acccgacctg 540
ttcgactgga acagcgtggt gtgtcagcag agcgccaccc agagactgga gcacgccttc 600
aacatcgcca gataccagct gggcatcgag aagctgctgg accccgagga cgtggacacc 660
acctaccccg acaagaaaag catcctcatg tacattacca gcctgttcca ggtgctgccc 720
cagcaggtgt ccatcgaggc catccaggaa gtggaaatgc tgcccaggcc ccccaaagtg 780
accaaggagg agcacttcca gctgcaccac cagatgcact acagccagca gatcacagtg 840
agcctggccc agggctatga gagaaccagc agccccaagc ccagattcaa gagctacgcc 900
tacacccagg ccgcctacgt gaccacctcc gaccccacca gaagcccctt ccccagccag 960
cacctggagg cccccgagga caagagcttc ggcagcagcc tgatggagag cgaagtgaac 1020
ctggacagat accagaccgc cctggaggaa gtgctgtcct ggctgctgag cgccgaggac 1080
accctgcagg cccagggcga gatcagcaac gacgtggaag tggtgaagga ccagttccac 1140
acccacgagg gctacatgat ggatctgacc gcccaccagg gcagagtggg caatatcctg 1200
cagctgggca gcaagctgat cggcaccggc aagctgagcg aggacgagga gaccgaagtg 1260
caggagcaga tgaacctgct gaacagcaga tgggagtgcc tgagagtggc cagcatggag 1320
aagcagagca acctgcacag agtgctgatg gacctgcaga accagaagct gaaggagctg 1380
aacgactggc tgaccaagac cgaggagcgg accagaaaga tggaggagga gcccctgggc 1440
cccgacctgg aggacctgaa gagacaggtg cagcagcaca aagtgctgca ggaggacctg 1500
gagcaggagc aggtgcgcgt gaacagcctg acccacatgg tggtggtcgt ggacgagagc 1560
agcggcgacc acgccacagc cgccctggaa gagcagctga aagtgctggg cgacagatgg 1620
gccaatattt gtaggtggac cgaggacaga tgggtgctgc tgcaggacca gcccgacctg 1680
gcccctggcc tgaccaccat cggcgccagc cccacccaga ccgtgaccct ggtgacccag 1740
cccgtggtga caaaggagac cgccatcagc aagctggaga tgcccagctc cctgatgctg 1800
gaagtgccca cccaccgcct gctccagcag ttccccctgg acctggagaa gttcctggcc 1860
tggctgaccg aggccgaaac caccgccaat gtgctccagg acgccactag aaaggagagg 1920
ctgctggagg acagcaaggg cgtgaaagag ctgatgaagc agtggcagga tctgcagggc 1980
gaaatcgagg cccacaccga cgtgtaccac aacctggacg agaacagcca gaagattctg 2040
aggagcctgg agggcagcga cgacgccgtc ctgctccaga ggaggctgga caacatgaac 2100
ttcaagtgga gcgagctgcg gaagaagagc ctgaacatcc ggagccacct ggaagccagc 2160
agcgaccagt ggaagagact gcacctgagc ctgcaggagc tgctggtgtg gctgcagctg 2220
aaggacgacg agctgagcag acaggccccc atcggcggcg acttccccgc cgtgcagaag 2280
cagaacgacg tgcaccgggc cttcaagagg gagctgaaaa ccaaggaacc cgtgatcatg 2340
agcaccctgg agacagtgcg gatcttcctg accgagcagc ccctggaggg actggagaag 2400
ctgtaccagg agcccagaga gctgcccccc gaggagagag cccagaacgt gaccaggctg 2460
ctgagaaagc aggccgagga agtgaatacc gagtgggaga agctgaatct gcacagcgcc 2520
gactggcaga gaaagatcga cgagaccctg gagagactcc aggaactgca ggaagccacc 2580
gacgagctgg acctgaagct gagacaggcc gaagtgatca agggcagctg gcagcctgtg 2640
ggcgatctgc tgatcgactc cctgcaggat cacctggaga aagtgaaggc cctgcggggc 2700
gagatcgccc ccctgaagga gaatgtgagc cacgtgaacg acctggccag acagctgacc 2760
accctgggca tccagctgag cccctacaac ctgagcacac tggaggatct gaacacccgg 2820
tggaaactgc tgcaggtggc cgtggaggat agagtgaggc agctgcacga agcccacaga 2880
gacttcggcc ctgcctccca gcacttcctg agcaccagcg tgcagggccc ctgggagaga 2940
gccatctccc ccaacaaagt gccctactac atcaaccacg agacccagac cacctgctgg 3000
gaccacccta agatgaccga gctgtatcag agcctggccg acctgaacaa tgtgcggttc 3060
agcgcctaca gaaccgccat gaagctgcgg agactgcaga aggccctgtg cctggatctg 3120
ctgagcctga gcgccgcctg cgacgccctg gaccagcaca acctgaagca gaatgaccag 3180
cccatggaca tcctgcagat catcaactgc ctgaccacaa tctacgaccg gctggaacag 3240
gagcacaaca acctggtgaa tgtgcccctg tgcgtggaca tgtgcctgaa ttggctgctg 3300
aacgtgtacg acaccggcag gaccggcaga atccgcgtgc tgagcttcaa gaccggcatc 3360
atcagcctgt gcaaggccca cctggaggat aagtaccgct acctgttcaa gcaggtggcc 3420
agcagcaccg gcttctgcga tcagaggaga ctgggcctgc tgctgcacga tagcatccag 3480
atccctaggc agctgggcga agtggccagc tttggcggca gcaacatcga gccctctgtg 3540
aggagctgct tccagttcgc caacaacaag cccgagatcg aggccgccct gttcctggac 3600
tggatgaggc tggagcctca gagcatggtg tggctgcctg tgctgcacag agtggccgcc 3660
gccgagaccg ccaagcacca ggccaagtgc aatatctgca aggagtgccc catcatcggc 3720
ttccggtaca ggagcctgaa gcacttcaac tacgacatct gccagagctg ctttttcagc 3780
ggcagagtgg ccaagggcca caaaatgcac taccccatgg tggagtactg cacccccacc 3840
acctccggcg aggatgtgag agacttcgcc aaagtgctga agaataagtt ccggaccaag 3900
cggtactttg ccaagcaccc caggatgggc tacctgcccg tgcagaccgt gctggaaggc 3960
gacaacatgg agacctga 3978
<210> 2
<211> 3837
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ген Hopti-Dys3837
<400> 2
atgctttggt gggaggaagt ggaggactgc tacgagagag aggacgtgca gaagaaaacc 60
ttcaccaagt gggtgaacgc ccagttcagc aagttcggca agcagcacat cgagaacctg 120
ttcagcgacc tgcaggatgg caggagactg ctggacctgc tggagggcct gaccggccag 180
aagctgccca aggagaaggg cagcaccaga gtgcacgccc tgaacaacgt gaacaaggcc 240
ctgagagtgc tgcagaacaa caacgtggac ctggtgaaca tcggcagcac cgacatcgtg 300
gacggcaacc acaagctgac cctgggcctg atctggaaca tcatcctgca ctggcaggtg 360
aagaacgtga tgaagaacat catggccggc ctgcagcaga ccaacagcga gaagatcctg 420
ctgagctggg tgaggcagag caccagaaac tacccccagg tgaacgtgat caacttcacc 480
acctcctgga gcgacggcct ggccctgaac gccctgatcc acagccacag acccgacctg 540
ttcgactgga acagcgtggt gtgtcagcag agcgccaccc agagactgga gcacgccttc 600
aacatcgcca gataccagct gggcatcgag aagctgctgg accccgagga cgtggacacc 660
acctaccccg acaagaaaag catcctcatg tacattacca gcctgttcca ggtgctgccc 720
cagcaggtgt ccatcgaggc catccaggaa gtggaaatgc tgcccaggcc ccccaaagtg 780
accaaggagg agcacttcca gctgcaccac cagatgcact acagccagca gatcacagtg 840
agcctggccc agggctatga gagaaccagc agccccaagc ccagattcaa gagctacgcc 900
tacacccagg ccgcctacgt gaccacctcc gaccccacca gaagcccctt ccccagccag 960
cacctggagg cccccgagga caagagcttc ggcagcagcc tgatggagag cgaagtgaac 1020
ctggacagat accagaccgc cctggaggaa gtgctgtcct ggctgctgag cgccgaggac 1080
accctgcagg cccagggcga gatcagcaac gacgtggaag tggtgaagga ccagttccac 1140
acccacgagg gctacatgat ggatctgacc gcccaccagg gcagagtggg caatatcctg 1200
cagctgggca gcaagctgat cggcaccggc aagctgagcg aggacgagga gaccgaagtg 1260
caggagcaga tgaacctgct gaacagcaga tgggagtgcc tgagagtggc cagcatggag 1320
aagcagagca acctgcacag agtgctgatg gacctgcaga accagaagct gaaggagctg 1380
aacgactggc tgaccaagac cgaggagcgg accagaaaga tggaggagga gcccctgggc 1440
cccgacctgg aggacctgaa gagacaggtg cagcagcaca aagtgctgca ggaggacctg 1500
gagcaggagc aggtgcgcgt gaacagcctg acccacatgg tggtggtcgt ggacgagagc 1560
agcggcgacc acgccacagc cgccctggaa gagcagctga aagtgctggg cgacagatgg 1620
gccaatattt gtaggtggac cgaggacaga tgggtgctgc tgcaggacac ccaccgcctg 1680
ctccagcagt tccccctgga cctggagaag ttcctggcct ggctgaccga ggccgaaacc 1740
accgccaatg tgctccagga cgccactaga aaggagaggc tgctggagga cagcaagggc 1800
gtgaaagagc tgatgaagca gtggcaggat ctgcagggcg aaatcgaggc ccacaccgac 1860
gtgtaccaca acctggacga gaacagccag aagattctga ggagcctgga gggcagcgac 1920
gacgccgtcc tgctccagag gaggctggac aacatgaact tcaagtggag cgagctgcgg 1980
aagaagagcc tgaacatccg gagccacctg gaagccagca gcgaccagtg gaagagactg 2040
cacctgagcc tgcaggagct gctggtgtgg ctgcagctga aggacgacga gctgagcaga 2100
caggccccca tcggcggcga cttccccgcc gtgcagaagc agaacgacgt gcaccgggcc 2160
ttcaagaggg agctgaaaac caaggaaccc gtgatcatga gcaccctgga gacagtgcgg 2220
atcttcctga ccgagcagcc cctggaggga ctggagaagc tgtaccagga gcccagagag 2280
ctgccccccg aggagagagc ccagaacgtg accaggctgc tgagaaagca ggccgaggaa 2340
gtgaataccg agtgggagaa gctgaatctg cacagcgccg actggcagag aaagatcgac 2400
gagaccctgg agagactcca ggaactgcag gaagccaccg acgagctgga cctgaagctg 2460
agacaggccg aagtgatcaa gggcagctgg cagcctgtgg gcgatctgct gatcgactcc 2520
ctgcaggatc acctggagaa agtgaaggcc ctgcggggcg agatcgcccc cctgaaggag 2580
aatgtgagcc acgtgaacga cctggccaga cagctgacca ccctgggcat ccagctgagc 2640
ccctacaacc tgagcacact ggaggatctg aacacccggt ggaaactgct gcaggtggcc 2700
gtggaggata gagtgaggca gctgcacgaa gcccacagag acttcggccc tgcctcccag 2760
cacttcctga gcaccagcgt gcagggcccc tgggagagag ccatctcccc caacaaagtg 2820
ccctactaca tcaaccacga gacccagacc acctgctggg accaccctaa gatgaccgag 2880
ctgtatcaga gcctggccga cctgaacaat gtgcggttca gcgcctacag aaccgccatg 2940
aagctgcgga gactgcagaa ggccctgtgc ctggatctgc tgagcctgag cgccgcctgc 3000
gacgccctgg accagcacaa cctgaagcag aatgaccagc ccatggacat cctgcagatc 3060
atcaactgcc tgaccacaat ctacgaccgg ctggaacagg agcacaacaa cctggtgaat 3120
gtgcccctgt gcgtggacat gtgcctgaat tggctgctga acgtgtacga caccggcagg 3180
accggcagaa tccgcgtgct gagcttcaag accggcatca tcagcctgtg caaggcccac 3240
ctggaggata agtaccgcta cctgttcaag caggtggcca gcagcaccgg cttctgcgat 3300
cagaggagac tgggcctgct gctgcacgat agcatccaga tccctaggca gctgggcgaa 3360
gtggccagct ttggcggcag caacatcgag ccctctgtga ggagctgctt ccagttcgcc 3420
aacaacaagc ccgagatcga ggccgccctg ttcctggact ggatgaggct ggagcctcag 3480
agcatggtgt ggctgcctgt gctgcacaga gtggccgccg ccgagaccgc caagcaccag 3540
gccaagtgca atatctgcaa ggagtgcccc atcatcggct tccggtacag gagcctgaag 3600
cacttcaact acgacatctg ccagagctgc tttttcagcg gcagagtggc caagggccac 3660
aaaatgcact accccatggt ggagtactgc acccccacca cctccggcga ggatgtgaga 3720
gacttcgcca aagtgctgaa gaataagttc cggaccaagc ggtactttgc caagcacccc 3780
aggatgggct acctgcccgt gcagaccgtg ctggaaggcg acaacatgga gacctga 3837
<210> 3
<211> 3978
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ген Copti-Dys3978
<400> 3
atgctttggt gggaggaagt ggaggactgc tacgagcggg aggacgtgca gaagaaaacc 60
ttcaccaagt gggtgaacgc ccagttcagc aagttcggca agcagcacat cgagaacctg 120
ttcagcgacc tgcaggacgg caggcggctg ctggacctcc tggaaggcct gaccggccag 180
aagctgccca aagagaaggg cagcaccagg gtgcacgccc tgaacaacgt gaacaaggcc 240
ctgagggtgc tgcagaacaa caacgtggac ctggtgaaca tcggcagcac cgacatcgtg 300
gacggcaacc acaagctgac cctgggcctg atctggaaca tcatcctgca ctggcaggtc 360
aagaacgtga tgaagaacat catggccggc ctgcagcaga ccaacagcga gaagatcctg 420
ctgtcctggg tgcggcagag caccaggaac tacccccagg tcaacgtgat caacttcacc 480
acctcttgga gcgacggcct ggccctgaac gccctgatcc acagccacag gcccgacctg 540
ttcgactgga acagcgtggt gtgccagcag agcgccaccc agaggctgga acacgccttc 600
aacatcgcca gataccagct gggcatcgag aagctgctgg atcccgagga cgtggacacc 660
acctaccccg acaagaaaag catcctcatg tacatcacca gcctgttcca ggtgctgccc 720
cagcaggtgt ccatcgaggc catccaggaa gtggagatgc tgcccaggcc ccccaaggtc 780
accaaagagg aacacttcca gctgcaccac cagatgcact acagccagca gatcaccgtg 840
agcctggccc agggctacga gaggaccagc agccccaagc ccaggttcaa gagctacgcc 900
tacacccagg ccgcctacgt gaccacctcc gaccccacca ggtccccctt ccccagccag 960
catctcgaag cccccgagga caagagcttc ggcagcagcc tgatggaaag cgaggtgaac 1020
ctggacagat accagaccgc cctggaagaa gtgctgtctt ggctgctgtc cgccgaggac 1080
accctgcagg cccagggcga gatcagcaac gacgtggagg tcgtgaagga ccagttccac 1140
acccacgagg gctacatgat ggacctgacc gcccaccagg gcagagtggg caacatcctg 1200
cagctgggca gcaagctgat cggcaccggc aagctgtccg aggacgagga aaccgaggtg 1260
caggaacaga tgaacctgct gaacagcaga tgggagtgcc tgagggtggc cagcatggaa 1320
aagcagagca acctgcacag ggtgctgatg gatctgcaga accagaagct caaagagctg 1380
aacgactggc tgaccaagac cgaggaaagg acccggaaga tggaagagga acccctgggc 1440
cccgatctcg aagatctgaa gaggcaggtg cagcagcaca aggtgctgca ggaagatctc 1500
gaacaggaac aggtccgggt caacagcctg acccacatgg tcgtggtggt ggacgagagc 1560
agcggcgacc acgccaccgc tgccctggaa gagcagctga aggtgctggg cgacagatgg 1620
gccaacatct gccggtggac cgaggacaga tgggtcctcc tgcaggacca gcccgacctg 1680
gcccctggcc tgacaaccat cggcgccagc cccacccaga ccgtgaccct ggtgacccag 1740
cccgtggtga ccaaagagac cgccatcagc aagctggaaa tgcccagctc cctgatgctg 1800
gaagtgccca cccacaggct cctccagcag ttccccctgg acctggaaaa gttcctggcc 1860
tggctgaccg aggccgagac caccgccaac gtgctgcagg acgccaccag gaaagagagg 1920
ctgctggaag atagcaaggg cgtgaaagag ctgatgaagc agtggcagga cctgcagggg 1980
gagattgagg cccacaccga cgtgtaccac aacctggacg agaacagcca gaaaatcctg 2040
agaagcctgg aaggcagcga cgacgccgtg ctgctgcaga ggcggctgga caacatgaac 2100
ttcaagtgga gcgagctgag gaagaagagc ctgaacatca ggtcccatct ggaagccagc 2160
agcgaccagt ggaagaggct gcacctgagc ctgcaggaac tgctcgtctg gctgcagctg 2220
aaagacgacg agctgtccag gcaggccccc atcggcggcg acttccccgc cgtgcagaaa 2280
cagaacgacg tgcacagggc cttcaagcgg gagctgaaaa ccaaagagcc cgtgatcatg 2340
agcaccctgg aaaccgtgag gatcttcctg accgagcagc ccctggaagg actggaaaag 2400
ctgtaccagg aacccagaga gctgcccccc gaggaacggg cccagaacgt gaccaggctg 2460
ctgagaaagc aggccgagga agtgaacacc gagtgggaga agctgaacct gcactccgcc 2520
gactggcaga ggaagatcga cgagaccctg gaaaggctcc aggaactgca ggaagccacc 2580
gacgagctgg acctgaagct gagacaggcc gaggtgatca agggcagctg gcagcccgtg 2640
ggcgacctgc tgatcgactc cctgcaggat cacctggaaa aagtgaaggc cctgcggggc 2700
gagatcgccc ccctgaaaga gaacgtcagc cacgtcaacg acctggccag gcagctgacc 2760
accctgggca tccagctgtc cccctacaac ctgtccaccc tggaagatct gaacacaagg 2820
tggaagctgc tgcaggtggc cgtggaggac agagtgaggc agctgcacga ggcccacagg 2880
gacttcggcc ctgcctccca gcacttcctg agcaccagcg tgcagggccc ctgggagagg 2940
gccatctccc ccaacaaggt gccctactac atcaaccacg agacccagac cacctgctgg 3000
gaccacccta agatgaccga gctgtaccag tccctggccg acctgaacaa tgtgcggttc 3060
agcgcctacc ggaccgccat gaagctgagg cggctgcaga aagccctgtg cctggatctg 3120
ctgtccctga gcgccgcctg cgacgccctg gaccagcaca acctgaagca gaacgaccag 3180
cccatggata tcctgcagat catcaactgt ctgaccacca tctacgacag gctggaacag 3240
gaacacaaca acctggtcaa cgtgcccctg tgcgtggaca tgtgcctgaa ctggctgctg 3300
aacgtgtacg acaccggcag gaccggccgg atcagggtgc tgtccttcaa gaccggcatc 3360
atcagcctgt gcaaggccca cctggaagat aagtaccgct acctgttcaa gcaggtggcc 3420
agctctaccg gcttctgcga ccagcggagg ctgggcctgc tgctgcacga cagcatccag 3480
atcccccggc agctgggcga ggtggcctcc ttcggcggca gcaacatcga gcccagcgtg 3540
cggagctgct tccagttcgc caacaacaag cccgagatcg aggccgccct gttcctggac 3600
tggatgcggc tggaacccca gagcatggtc tggctgcccg tgctgcacag agtggctgcc 3660
gccgagaccg ccaagcacca ggccaagtgc aacatctgca aagagtgccc catcatcggc 3720
ttcaggtaca gaagcctgaa gcacttcaac tacgacatct gccagagctg tttcttcagc 3780
ggcagggtgg ccaagggcca caaaatgcac taccccatgg tggagtactg cacccccacc 3840
acctccggcg aggacgtgag ggacttcgcc aaggtgctga agaataagtt ccggaccaag 3900
cggtacttcg ccaaacaccc caggatgggc tacctgcccg tgcagaccgt gctggaaggc 3960
gacaacatgg aaacctga 3978
<210> 4
<211> 606
<212> ДНК
<213> Искусственная последовательность
<220>
<223> промотор hCK
<400> 4
gaattcggta ccccactacg ggtttaggct gcccatgtaa ggaggcaagg cctggggaca 60
cccgagatgc ctggttataa ttaacccaga catgtggctg cccccccccc ccccaacacc 120
tgctgcctct aaaaataacc ctgtccctgg tggatcccct gcatgcgaag atcttcgaac 180
aaggctgtgg gggactgagg gcaggctgta acaggcttgg gggccagggc ttatacgtgc 240
ctgggactcc caaagtatta ctgttccatg ttcccggcga agggccagct gtcccccgcc 300
agctagactc agcacttagt ttaggaacca gtgagcaagt cagcccttgg ggcagcccat 360
acaaggccat ggggctgggc aagctgcacg cctgggtccg gggtgggcac ggtgcccggg 420
caacgagctg aaagctcatc tgctctcagg ggcccctccc tggggacagc ccctcctggc 480
tagtcacacc ctgtaggctc ctctatataa cccaggggca caggggctgc cctcattcta 540
ccaccacctc cacagcacag acagacactc aggagccagc cagcgtcgag cggccgatcc 600
gccacc 606
<210> 5
<211> 759
<212> ДНК
<213> Искусственная последовательность
<220>
<223> промотор hCKplus
<400> 5
gaattcggta ccccactacg ggtctaggct gcccatgtaa ggaggcaagg cctggggaca 60
cccgagatgc ctggttataa ttaaccccaa cacctgctgc cccccccccc ccaacacctg 120
ctgcctctaa aaataaccct gtccctggtg gatcccctgc atgccccact acgggtttag 180
gctgcccatg taaggaggca aggcctgggg acacccgaga tgcctggtta taattaaccc 240
agacatgtgg ctgccccccc cccccccaac acctgctgcc tctaaaaata accctgtccc 300
tggtggatcc cctgcatgcg aagatcttcg aacaaggctg tgggggactg agggcaggct 360
gtaacaggct tgggggccag ggcttatacg tgcctgggac tcccaaagta ttactgttcc 420
atgttcccgg cgaagggcca gctgtccccc gccagctaga ctcagcactt agtttaggaa 480
ccagtgagca agtcagccct tggggcagcc catacaaggc catggggctg ggcaagctgc 540
acgcctgggt ccggggtggg cacggtgccc gggcaacgag ctgaaagctc atctgctctc 600
aggggcccct ccctggggac agcccctcct ggctagtcac accctgtagg ctcctctata 660
taacccaggg gcacaggggc tgccctcatt ctaccaccac ctccacagca cagacagaca 720
ctcaggagcc agccagcgtc gagcggccga tccgccacc 759
<210> 6
<211> 67
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность полиA
<400> 6
tgaggagctc gagaggccta ataaagagct cagatgcatc gatcagagtg tgttggtttt 60
ttgtgtg 67
<210> 7
<211> 1325
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> белок Dys3978
<400> 7
Met Leu Trp Trp Glu Glu Val Glu Asp Cys Tyr Glu Arg Glu Asp Val
1 5 10 15
Gln Lys Lys Thr Phe Thr Lys Trp Val Asn Ala Gln Phe Ser Lys Phe
20 25 30
Gly Lys Gln His Ile Glu Asn Leu Phe Ser Asp Leu Gln Asp Gly Arg
35 40 45
Arg Leu Leu Asp Leu Leu Glu Gly Leu Thr Gly Gln Lys Leu Pro Lys
50 55 60
Glu Lys Gly Ser Thr Arg Val His Ala Leu Asn Asn Val Asn Lys Ala
65 70 75 80
Leu Arg Val Leu Gln Asn Asn Asn Val Asp Leu Val Asn Ile Gly Ser
85 90 95
Thr Asp Ile Val Asp Gly Asn His Lys Leu Thr Leu Gly Leu Ile Trp
100 105 110
Asn Ile Ile Leu His Trp Gln Val Lys Asn Val Met Lys Asn Ile Met
115 120 125
Ala Gly Leu Gln Gln Thr Asn Ser Glu Lys Ile Leu Leu Ser Trp Val
130 135 140
Arg Gln Ser Thr Arg Asn Tyr Pro Gln Val Asn Val Ile Asn Phe Thr
145 150 155 160
Thr Ser Trp Ser Asp Gly Leu Ala Leu Asn Ala Leu Ile His Ser His
165 170 175
Arg Pro Asp Leu Phe Asp Trp Asn Ser Val Val Cys Gln Gln Ser Ala
180 185 190
Thr Gln Arg Leu Glu His Ala Phe Asn Ile Ala Arg Tyr Gln Leu Gly
195 200 205
Ile Glu Lys Leu Leu Asp Pro Glu Asp Val Asp Thr Thr Tyr Pro Asp
210 215 220
Lys Lys Ser Ile Leu Met Tyr Ile Thr Ser Leu Phe Gln Val Leu Pro
225 230 235 240
Gln Gln Val Ser Ile Glu Ala Ile Gln Glu Val Glu Met Leu Pro Arg
245 250 255
Pro Pro Lys Val Thr Lys Glu Glu His Phe Gln Leu His His Gln Met
260 265 270
His Tyr Ser Gln Gln Ile Thr Val Ser Leu Ala Gln Gly Tyr Glu Arg
275 280 285
Thr Ser Ser Pro Lys Pro Arg Phe Lys Ser Tyr Ala Tyr Thr Gln Ala
290 295 300
Ala Tyr Val Thr Thr Ser Asp Pro Thr Arg Ser Pro Phe Pro Ser Gln
305 310 315 320
His Leu Glu Ala Pro Glu Asp Lys Ser Phe Gly Ser Ser Leu Met Glu
325 330 335
Ser Glu Val Asn Leu Asp Arg Tyr Gln Thr Ala Leu Glu Glu Val Leu
340 345 350
Ser Trp Leu Leu Ser Ala Glu Asp Thr Leu Gln Ala Gln Gly Glu Ile
355 360 365
Ser Asn Asp Val Glu Val Val Lys Asp Gln Phe His Thr His Glu Gly
370 375 380
Tyr Met Met Asp Leu Thr Ala His Gln Gly Arg Val Gly Asn Ile Leu
385 390 395 400
Gln Leu Gly Ser Lys Leu Ile Gly Thr Gly Lys Leu Ser Glu Asp Glu
405 410 415
Glu Thr Glu Val Gln Glu Gln Met Asn Leu Leu Asn Ser Arg Trp Glu
420 425 430
Cys Leu Arg Val Ala Ser Met Glu Lys Gln Ser Asn Leu His Arg Val
435 440 445
Leu Met Asp Leu Gln Asn Gln Lys Leu Lys Glu Leu Asn Asp Trp Leu
450 455 460
Thr Lys Thr Glu Glu Arg Thr Arg Lys Met Glu Glu Glu Pro Leu Gly
465 470 475 480
Pro Asp Leu Glu Asp Leu Lys Arg Gln Val Gln Gln His Lys Val Leu
485 490 495
Gln Glu Asp Leu Glu Gln Glu Gln Val Arg Val Asn Ser Leu Thr His
500 505 510
Met Val Val Val Val Asp Glu Ser Ser Gly Asp His Ala Thr Ala Ala
515 520 525
Leu Glu Glu Gln Leu Lys Val Leu Gly Asp Arg Trp Ala Asn Ile Cys
530 535 540
Arg Trp Thr Glu Asp Arg Trp Val Leu Leu Gln Asp Gln Pro Asp Leu
545 550 555 560
Ala Pro Gly Leu Thr Thr Ile Gly Ala Ser Pro Thr Gln Thr Val Thr
565 570 575
Leu Val Thr Gln Pro Val Val Thr Lys Glu Thr Ala Ile Ser Lys Leu
580 585 590
Glu Met Pro Ser Ser Leu Met Leu Glu Val Pro Thr His Arg Leu Leu
595 600 605
Gln Gln Phe Pro Leu Asp Leu Glu Lys Phe Leu Ala Trp Leu Thr Glu
610 615 620
Ala Glu Thr Thr Ala Asn Val Leu Gln Asp Ala Thr Arg Lys Glu Arg
625 630 635 640
Leu Leu Glu Asp Ser Lys Gly Val Lys Glu Leu Met Lys Gln Trp Gln
645 650 655
Asp Leu Gln Gly Glu Ile Glu Ala His Thr Asp Val Tyr His Asn Leu
660 665 670
Asp Glu Asn Ser Gln Lys Ile Leu Arg Ser Leu Glu Gly Ser Asp Asp
675 680 685
Ala Val Leu Leu Gln Arg Arg Leu Asp Asn Met Asn Phe Lys Trp Ser
690 695 700
Glu Leu Arg Lys Lys Ser Leu Asn Ile Arg Ser His Leu Glu Ala Ser
705 710 715 720
Ser Asp Gln Trp Lys Arg Leu His Leu Ser Leu Gln Glu Leu Leu Val
725 730 735
Trp Leu Gln Leu Lys Asp Asp Glu Leu Ser Arg Gln Ala Pro Ile Gly
740 745 750
Gly Asp Phe Pro Ala Val Gln Lys Gln Asn Asp Val His Arg Ala Phe
755 760 765
Lys Arg Glu Leu Lys Thr Lys Glu Pro Val Ile Met Ser Thr Leu Glu
770 775 780
Thr Val Arg Ile Phe Leu Thr Glu Gln Pro Leu Glu Gly Leu Glu Lys
785 790 795 800
Leu Tyr Gln Glu Pro Arg Glu Leu Pro Pro Glu Glu Arg Ala Gln Asn
805 810 815
Val Thr Arg Leu Leu Arg Lys Gln Ala Glu Glu Val Asn Thr Glu Trp
820 825 830
Glu Lys Leu Asn Leu His Ser Ala Asp Trp Gln Arg Lys Ile Asp Glu
835 840 845
Thr Leu Glu Arg Leu Gln Glu Leu Gln Glu Ala Thr Asp Glu Leu Asp
850 855 860
Leu Lys Leu Arg Gln Ala Glu Val Ile Lys Gly Ser Trp Gln Pro Val
865 870 875 880
Gly Asp Leu Leu Ile Asp Ser Leu Gln Asp His Leu Glu Lys Val Lys
885 890 895
Ala Leu Arg Gly Glu Ile Ala Pro Leu Lys Glu Asn Val Ser His Val
900 905 910
Asn Asp Leu Ala Arg Gln Leu Thr Thr Leu Gly Ile Gln Leu Ser Pro
915 920 925
Tyr Asn Leu Ser Thr Leu Glu Asp Leu Asn Thr Arg Trp Lys Leu Leu
930 935 940
Gln Val Ala Val Glu Asp Arg Val Arg Gln Leu His Glu Ala His Arg
945 950 955 960
Asp Phe Gly Pro Ala Ser Gln His Phe Leu Ser Thr Ser Val Gln Gly
965 970 975
Pro Trp Glu Arg Ala Ile Ser Pro Asn Lys Val Pro Tyr Tyr Ile Asn
980 985 990
His Glu Thr Gln Thr Thr Cys Trp Asp His Pro Lys Met Thr Glu Leu
995 1000 1005
Tyr Gln Ser Leu Ala Asp Leu Asn Asn Val Arg Phe Ser Ala Tyr
1010 1015 1020
Arg Thr Ala Met Lys Leu Arg Arg Leu Gln Lys Ala Leu Cys Leu
1025 1030 1035
Asp Leu Leu Ser Leu Ser Ala Ala Cys Asp Ala Leu Asp Gln His
1040 1045 1050
Asn Leu Lys Gln Asn Asp Gln Pro Met Asp Ile Leu Gln Ile Ile
1055 1060 1065
Asn Cys Leu Thr Thr Ile Tyr Asp Arg Leu Glu Gln Glu His Asn
1070 1075 1080
Asn Leu Val Asn Val Pro Leu Cys Val Asp Met Cys Leu Asn Trp
1085 1090 1095
Leu Leu Asn Val Tyr Asp Thr Gly Arg Thr Gly Arg Ile Arg Val
1100 1105 1110
Leu Ser Phe Lys Thr Gly Ile Ile Ser Leu Cys Lys Ala His Leu
1115 1120 1125
Glu Asp Lys Tyr Arg Tyr Leu Phe Lys Gln Val Ala Ser Ser Thr
1130 1135 1140
Gly Phe Cys Asp Gln Arg Arg Leu Gly Leu Leu Leu His Asp Ser
1145 1150 1155
Ile Gln Ile Pro Arg Gln Leu Gly Glu Val Ala Ser Phe Gly Gly
1160 1165 1170
Ser Asn Ile Glu Pro Ser Val Arg Ser Cys Phe Gln Phe Ala Asn
1175 1180 1185
Asn Lys Pro Glu Ile Glu Ala Ala Leu Phe Leu Asp Trp Met Arg
1190 1195 1200
Leu Glu Pro Gln Ser Met Val Trp Leu Pro Val Leu His Arg Val
1205 1210 1215
Ala Ala Ala Glu Thr Ala Lys His Gln Ala Lys Cys Asn Ile Cys
1220 1225 1230
Lys Glu Cys Pro Ile Ile Gly Phe Arg Tyr Arg Ser Leu Lys His
1235 1240 1245
Phe Asn Tyr Asp Ile Cys Gln Ser Cys Phe Phe Ser Gly Arg Val
1250 1255 1260
Ala Lys Gly His Lys Met His Tyr Pro Met Val Glu Tyr Cys Thr
1265 1270 1275
Pro Thr Thr Ser Gly Glu Asp Val Arg Asp Phe Ala Lys Val Leu
1280 1285 1290
Lys Asn Lys Phe Arg Thr Lys Arg Tyr Phe Ala Lys His Pro Arg
1295 1300 1305
Met Gly Tyr Leu Pro Val Gln Thr Val Leu Glu Gly Asp Asn Met
1310 1315 1320
Glu Thr
1325
<210> 8
<211> 1278
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> белок Dys3837
<400> 8
Met Leu Trp Trp Glu Glu Val Glu Asp Cys Tyr Glu Arg Glu Asp Val
1 5 10 15
Gln Lys Lys Thr Phe Thr Lys Trp Val Asn Ala Gln Phe Ser Lys Phe
20 25 30
Gly Lys Gln His Ile Glu Asn Leu Phe Ser Asp Leu Gln Asp Gly Arg
35 40 45
Arg Leu Leu Asp Leu Leu Glu Gly Leu Thr Gly Gln Lys Leu Pro Lys
50 55 60
Glu Lys Gly Ser Thr Arg Val His Ala Leu Asn Asn Val Asn Lys Ala
65 70 75 80
Leu Arg Val Leu Gln Asn Asn Asn Val Asp Leu Val Asn Ile Gly Ser
85 90 95
Thr Asp Ile Val Asp Gly Asn His Lys Leu Thr Leu Gly Leu Ile Trp
100 105 110
Asn Ile Ile Leu His Trp Gln Val Lys Asn Val Met Lys Asn Ile Met
115 120 125
Ala Gly Leu Gln Gln Thr Asn Ser Glu Lys Ile Leu Leu Ser Trp Val
130 135 140
Arg Gln Ser Thr Arg Asn Tyr Pro Gln Val Asn Val Ile Asn Phe Thr
145 150 155 160
Thr Ser Trp Ser Asp Gly Leu Ala Leu Asn Ala Leu Ile His Ser His
165 170 175
Arg Pro Asp Leu Phe Asp Trp Asn Ser Val Val Cys Gln Gln Ser Ala
180 185 190
Thr Gln Arg Leu Glu His Ala Phe Asn Ile Ala Arg Tyr Gln Leu Gly
195 200 205
Ile Glu Lys Leu Leu Asp Pro Glu Asp Val Asp Thr Thr Tyr Pro Asp
210 215 220
Lys Lys Ser Ile Leu Met Tyr Ile Thr Ser Leu Phe Gln Val Leu Pro
225 230 235 240
Gln Gln Val Ser Ile Glu Ala Ile Gln Glu Val Glu Met Leu Pro Arg
245 250 255
Pro Pro Lys Val Thr Lys Glu Glu His Phe Gln Leu His His Gln Met
260 265 270
His Tyr Ser Gln Gln Ile Thr Val Ser Leu Ala Gln Gly Tyr Glu Arg
275 280 285
Thr Ser Ser Pro Lys Pro Arg Phe Lys Ser Tyr Ala Tyr Thr Gln Ala
290 295 300
Ala Tyr Val Thr Thr Ser Asp Pro Thr Arg Ser Pro Phe Pro Ser Gln
305 310 315 320
His Leu Glu Ala Pro Glu Asp Lys Ser Phe Gly Ser Ser Leu Met Glu
325 330 335
Ser Glu Val Asn Leu Asp Arg Tyr Gln Thr Ala Leu Glu Glu Val Leu
340 345 350
Ser Trp Leu Leu Ser Ala Glu Asp Thr Leu Gln Ala Gln Gly Glu Ile
355 360 365
Ser Asn Asp Val Glu Val Val Lys Asp Gln Phe His Thr His Glu Gly
370 375 380
Tyr Met Met Asp Leu Thr Ala His Gln Gly Arg Val Gly Asn Ile Leu
385 390 395 400
Gln Leu Gly Ser Lys Leu Ile Gly Thr Gly Lys Leu Ser Glu Asp Glu
405 410 415
Glu Thr Glu Val Gln Glu Gln Met Asn Leu Leu Asn Ser Arg Trp Glu
420 425 430
Cys Leu Arg Val Ala Ser Met Glu Lys Gln Ser Asn Leu His Arg Val
435 440 445
Leu Met Asp Leu Gln Asn Gln Lys Leu Lys Glu Leu Asn Asp Trp Leu
450 455 460
Thr Lys Thr Glu Glu Arg Thr Arg Lys Met Glu Glu Glu Pro Leu Gly
465 470 475 480
Pro Asp Leu Glu Asp Leu Lys Arg Gln Val Gln Gln His Lys Val Leu
485 490 495
Gln Glu Asp Leu Glu Gln Glu Gln Val Arg Val Asn Ser Leu Thr His
500 505 510
Met Val Val Val Val Asp Glu Ser Ser Gly Asp His Ala Thr Ala Ala
515 520 525
Leu Glu Glu Gln Leu Lys Val Leu Gly Asp Arg Trp Ala Asn Ile Cys
530 535 540
Arg Trp Thr Glu Asp Arg Trp Val Leu Leu Gln Asp Thr His Arg Leu
545 550 555 560
Leu Gln Gln Phe Pro Leu Asp Leu Glu Lys Phe Leu Ala Trp Leu Thr
565 570 575
Glu Ala Glu Thr Thr Ala Asn Val Leu Gln Asp Ala Thr Arg Lys Glu
580 585 590
Arg Leu Leu Glu Asp Ser Lys Gly Val Lys Glu Leu Met Lys Gln Trp
595 600 605
Gln Asp Leu Gln Gly Glu Ile Glu Ala His Thr Asp Val Tyr His Asn
610 615 620
Leu Asp Glu Asn Ser Gln Lys Ile Leu Arg Ser Leu Glu Gly Ser Asp
625 630 635 640
Asp Ala Val Leu Leu Gln Arg Arg Leu Asp Asn Met Asn Phe Lys Trp
645 650 655
Ser Glu Leu Arg Lys Lys Ser Leu Asn Ile Arg Ser His Leu Glu Ala
660 665 670
Ser Ser Asp Gln Trp Lys Arg Leu His Leu Ser Leu Gln Glu Leu Leu
675 680 685
Val Trp Leu Gln Leu Lys Asp Asp Glu Leu Ser Arg Gln Ala Pro Ile
690 695 700
Gly Gly Asp Phe Pro Ala Val Gln Lys Gln Asn Asp Val His Arg Ala
705 710 715 720
Phe Lys Arg Glu Leu Lys Thr Lys Glu Pro Val Ile Met Ser Thr Leu
725 730 735
Glu Thr Val Arg Ile Phe Leu Thr Glu Gln Pro Leu Glu Gly Leu Glu
740 745 750
Lys Leu Tyr Gln Glu Pro Arg Glu Leu Pro Pro Glu Glu Arg Ala Gln
755 760 765
Asn Val Thr Arg Leu Leu Arg Lys Gln Ala Glu Glu Val Asn Thr Glu
770 775 780
Trp Glu Lys Leu Asn Leu His Ser Ala Asp Trp Gln Arg Lys Ile Asp
785 790 795 800
Glu Thr Leu Glu Arg Leu Gln Glu Leu Gln Glu Ala Thr Asp Glu Leu
805 810 815
Asp Leu Lys Leu Arg Gln Ala Glu Val Ile Lys Gly Ser Trp Gln Pro
820 825 830
Val Gly Asp Leu Leu Ile Asp Ser Leu Gln Asp His Leu Glu Lys Val
835 840 845
Lys Ala Leu Arg Gly Glu Ile Ala Pro Leu Lys Glu Asn Val Ser His
850 855 860
Val Asn Asp Leu Ala Arg Gln Leu Thr Thr Leu Gly Ile Gln Leu Ser
865 870 875 880
Pro Tyr Asn Leu Ser Thr Leu Glu Asp Leu Asn Thr Arg Trp Lys Leu
885 890 895
Leu Gln Val Ala Val Glu Asp Arg Val Arg Gln Leu His Glu Ala His
900 905 910
Arg Asp Phe Gly Pro Ala Ser Gln His Phe Leu Ser Thr Ser Val Gln
915 920 925
Gly Pro Trp Glu Arg Ala Ile Ser Pro Asn Lys Val Pro Tyr Tyr Ile
930 935 940
Asn His Glu Thr Gln Thr Thr Cys Trp Asp His Pro Lys Met Thr Glu
945 950 955 960
Leu Tyr Gln Ser Leu Ala Asp Leu Asn Asn Val Arg Phe Ser Ala Tyr
965 970 975
Arg Thr Ala Met Lys Leu Arg Arg Leu Gln Lys Ala Leu Cys Leu Asp
980 985 990
Leu Leu Ser Leu Ser Ala Ala Cys Asp Ala Leu Asp Gln His Asn Leu
995 1000 1005
Lys Gln Asn Asp Gln Pro Met Asp Ile Leu Gln Ile Ile Asn Cys
1010 1015 1020
Leu Thr Thr Ile Tyr Asp Arg Leu Glu Gln Glu His Asn Asn Leu
1025 1030 1035
Val Asn Val Pro Leu Cys Val Asp Met Cys Leu Asn Trp Leu Leu
1040 1045 1050
Asn Val Tyr Asp Thr Gly Arg Thr Gly Arg Ile Arg Val Leu Ser
1055 1060 1065
Phe Lys Thr Gly Ile Ile Ser Leu Cys Lys Ala His Leu Glu Asp
1070 1075 1080
Lys Tyr Arg Tyr Leu Phe Lys Gln Val Ala Ser Ser Thr Gly Phe
1085 1090 1095
Cys Asp Gln Arg Arg Leu Gly Leu Leu Leu His Asp Ser Ile Gln
1100 1105 1110
Ile Pro Arg Gln Leu Gly Glu Val Ala Ser Phe Gly Gly Ser Asn
1115 1120 1125
Ile Glu Pro Ser Val Arg Ser Cys Phe Gln Phe Ala Asn Asn Lys
1130 1135 1140
Pro Glu Ile Glu Ala Ala Leu Phe Leu Asp Trp Met Arg Leu Glu
1145 1150 1155
Pro Gln Ser Met Val Trp Leu Pro Val Leu His Arg Val Ala Ala
1160 1165 1170
Ala Glu Thr Ala Lys His Gln Ala Lys Cys Asn Ile Cys Lys Glu
1175 1180 1185
Cys Pro Ile Ile Gly Phe Arg Tyr Arg Ser Leu Lys His Phe Asn
1190 1195 1200
Tyr Asp Ile Cys Gln Ser Cys Phe Phe Ser Gly Arg Val Ala Lys
1205 1210 1215
Gly His Lys Met His Tyr Pro Met Val Glu Tyr Cys Thr Pro Thr
1220 1225 1230
Thr Ser Gly Glu Asp Val Arg Asp Phe Ala Lys Val Leu Lys Asn
1235 1240 1245
Lys Phe Arg Thr Lys Arg Tyr Phe Ala Lys His Pro Arg Met Gly
1250 1255 1260
Tyr Leu Pro Val Gln Thr Val Leu Glu Gly Asp Asn Met Glu Thr
1265 1270 1275
<210> 9
<211> 4953
<212> ДНК
<213> Искусственная последовательность
<220>
<223> AAV векторный геном с геном Hopti-Dys3978
<400> 9
ttggccactc cctctctgcg cgctcgctcg ctcactgagg ccgggcgacc aaaggtcgcc 60
cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc gagcgcgcag agagggagtg 120
gccaactcca tcactagggg ttcctagatc tgaattcggt accccactac gggtttaggc 180
tgcccatgta aggaggcaag gcctggggac acccgagatg cctggttata attaacccag 240
acatgtggct gccccccccc cccccaacac ctgctgcctc taaaaataac cctgtccctg 300
gtggatcccc tgcatgcgaa gatcttcgaa caaggctgtg ggggactgag ggcaggctgt 360
aacaggcttg ggggccaggg cttatacgtg cctgggactc ccaaagtatt actgttccat 420
gttcccggcg aagggccagc tgtcccccgc cagctagact cagcacttag tttaggaacc 480
agtgagcaag tcagcccttg gggcagccca tacaaggcca tggggctggg caagctgcac 540
gcctgggtcc ggggtgggca cggtgcccgg gcaacgagct gaaagctcat ctgctctcag 600
gggcccctcc ctggggacag cccctcctgg ctagtcacac cctgtaggct cctctatata 660
acccaggggc acaggggctg ccctcattct accaccacct ccacagcaca gacagacact 720
caggagccag ccagcgtcga gcggccgatc cgccaccatg ctttggtggg aggaagtgga 780
ggactgctac gagagagagg acgtgcagaa gaaaaccttc accaagtggg tgaacgccca 840
gttcagcaag ttcggcaagc agcacatcga gaacctgttc agcgacctgc aggatggcag 900
gagactgctg gacctgctgg agggcctgac cggccagaag ctgcccaagg agaagggcag 960
caccagagtg cacgccctga acaacgtgaa caaggccctg agagtgctgc agaacaacaa 1020
cgtggacctg gtgaacatcg gcagcaccga catcgtggac ggcaaccaca agctgaccct 1080
gggcctgatc tggaacatca tcctgcactg gcaggtgaag aacgtgatga agaacatcat 1140
ggccggcctg cagcagacca acagcgagaa gatcctgctg agctgggtga ggcagagcac 1200
cagaaactac ccccaggtga acgtgatcaa cttcaccacc tcctggagcg acggcctggc 1260
cctgaacgcc ctgatccaca gccacagacc cgacctgttc gactggaaca gcgtggtgtg 1320
tcagcagagc gccacccaga gactggagca cgccttcaac atcgccagat accagctggg 1380
catcgagaag ctgctggacc ccgaggacgt ggacaccacc taccccgaca agaaaagcat 1440
cctcatgtac attaccagcc tgttccaggt gctgccccag caggtgtcca tcgaggccat 1500
ccaggaagtg gaaatgctgc ccaggccccc caaagtgacc aaggaggagc acttccagct 1560
gcaccaccag atgcactaca gccagcagat cacagtgagc ctggcccagg gctatgagag 1620
aaccagcagc cccaagccca gattcaagag ctacgcctac acccaggccg cctacgtgac 1680
cacctccgac cccaccagaa gccccttccc cagccagcac ctggaggccc ccgaggacaa 1740
gagcttcggc agcagcctga tggagagcga agtgaacctg gacagatacc agaccgccct 1800
ggaggaagtg ctgtcctggc tgctgagcgc cgaggacacc ctgcaggccc agggcgagat 1860
cagcaacgac gtggaagtgg tgaaggacca gttccacacc cacgagggct acatgatgga 1920
tctgaccgcc caccagggca gagtgggcaa tatcctgcag ctgggcagca agctgatcgg 1980
caccggcaag ctgagcgagg acgaggagac cgaagtgcag gagcagatga acctgctgaa 2040
cagcagatgg gagtgcctga gagtggccag catggagaag cagagcaacc tgcacagagt 2100
gctgatggac ctgcagaacc agaagctgaa ggagctgaac gactggctga ccaagaccga 2160
ggagcggacc agaaagatgg aggaggagcc cctgggcccc gacctggagg acctgaagag 2220
acaggtgcag cagcacaaag tgctgcagga ggacctggag caggagcagg tgcgcgtgaa 2280
cagcctgacc cacatggtgg tggtcgtgga cgagagcagc ggcgaccacg ccacagccgc 2340
cctggaagag cagctgaaag tgctgggcga cagatgggcc aatatttgta ggtggaccga 2400
ggacagatgg gtgctgctgc aggaccagcc cgacctggcc cctggcctga ccaccatcgg 2460
cgccagcccc acccagaccg tgaccctggt gacccagccc gtggtgacaa aggagaccgc 2520
catcagcaag ctggagatgc ccagctccct gatgctggaa gtgcccaccc accgcctgct 2580
ccagcagttc cccctggacc tggagaagtt cctggcctgg ctgaccgagg ccgaaaccac 2640
cgccaatgtg ctccaggacg ccactagaaa ggagaggctg ctggaggaca gcaagggcgt 2700
gaaagagctg atgaagcagt ggcaggatct gcagggcgaa atcgaggccc acaccgacgt 2760
gtaccacaac ctggacgaga acagccagaa gattctgagg agcctggagg gcagcgacga 2820
cgccgtcctg ctccagagga ggctggacaa catgaacttc aagtggagcg agctgcggaa 2880
gaagagcctg aacatccgga gccacctgga agccagcagc gaccagtgga agagactgca 2940
cctgagcctg caggagctgc tggtgtggct gcagctgaag gacgacgagc tgagcagaca 3000
ggcccccatc ggcggcgact tccccgccgt gcagaagcag aacgacgtgc accgggcctt 3060
caagagggag ctgaaaacca aggaacccgt gatcatgagc accctggaga cagtgcggat 3120
cttcctgacc gagcagcccc tggagggact ggagaagctg taccaggagc ccagagagct 3180
gccccccgag gagagagccc agaacgtgac caggctgctg agaaagcagg ccgaggaagt 3240
gaataccgag tgggagaagc tgaatctgca cagcgccgac tggcagagaa agatcgacga 3300
gaccctggag agactccagg aactgcagga agccaccgac gagctggacc tgaagctgag 3360
acaggccgaa gtgatcaagg gcagctggca gcctgtgggc gatctgctga tcgactccct 3420
gcaggatcac ctggagaaag tgaaggccct gcggggcgag atcgcccccc tgaaggagaa 3480
tgtgagccac gtgaacgacc tggccagaca gctgaccacc ctgggcatcc agctgagccc 3540
ctacaacctg agcacactgg aggatctgaa cacccggtgg aaactgctgc aggtggccgt 3600
ggaggataga gtgaggcagc tgcacgaagc ccacagagac ttcggccctg cctcccagca 3660
cttcctgagc accagcgtgc agggcccctg ggagagagcc atctccccca acaaagtgcc 3720
ctactacatc aaccacgaga cccagaccac ctgctgggac caccctaaga tgaccgagct 3780
gtatcagagc ctggccgacc tgaacaatgt gcggttcagc gcctacagaa ccgccatgaa 3840
gctgcggaga ctgcagaagg ccctgtgcct ggatctgctg agcctgagcg ccgcctgcga 3900
cgccctggac cagcacaacc tgaagcagaa tgaccagccc atggacatcc tgcagatcat 3960
caactgcctg accacaatct acgaccggct ggaacaggag cacaacaacc tggtgaatgt 4020
gcccctgtgc gtggacatgt gcctgaattg gctgctgaac gtgtacgaca ccggcaggac 4080
cggcagaatc cgcgtgctga gcttcaagac cggcatcatc agcctgtgca aggcccacct 4140
ggaggataag taccgctacc tgttcaagca ggtggccagc agcaccggct tctgcgatca 4200
gaggagactg ggcctgctgc tgcacgatag catccagatc cctaggcagc tgggcgaagt 4260
ggccagcttt ggcggcagca acatcgagcc ctctgtgagg agctgcttcc agttcgccaa 4320
caacaagccc gagatcgagg ccgccctgtt cctggactgg atgaggctgg agcctcagag 4380
catggtgtgg ctgcctgtgc tgcacagagt ggccgccgcc gagaccgcca agcaccaggc 4440
caagtgcaat atctgcaagg agtgccccat catcggcttc cggtacagga gcctgaagca 4500
cttcaactac gacatctgcc agagctgctt tttcagcggc agagtggcca agggccacaa 4560
aatgcactac cccatggtgg agtactgcac ccccaccacc tccggcgagg atgtgagaga 4620
cttcgccaaa gtgctgaaga ataagttccg gaccaagcgg tactttgcca agcaccccag 4680
gatgggctac ctgcccgtgc agaccgtgct ggaaggcgac aacatggaga cctgatgagg 4740
agctcgagag gcctaataaa gagctcagat gcatcgatca gagtgtgttg gttttttgtg 4800
tgagatctag gaacccctag tgatggagtt ggccactccc tctctgcgcg ctcgctcgct 4860
cactgaggcc gcccgggcaa agcccgggcg tcgggcgacc tttggtcgcc cggcctcagt 4920
gagcgagcga gcgcgcagag agggagtggc caa 4953
<210> 10
<211> 4812
<212> ДНК
<213> Искусственная последовательность
<220>
<223> AAV векторный геном с геном Hopti-Dys3837
<400> 10
ttggccactc cctctctgcg cgctcgctcg ctcactgagg ccgggcgacc aaaggtcgcc 60
cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc gagcgcgcag agagggagtg 120
gccaactcca tcactagggg ttcctagatc tgaattcggt accccactac gggtttaggc 180
tgcccatgta aggaggcaag gcctggggac acccgagatg cctggttata attaacccag 240
acatgtggct gccccccccc cccccaacac ctgctgcctc taaaaataac cctgtccctg 300
gtggatcccc tgcatgcgaa gatcttcgaa caaggctgtg ggggactgag ggcaggctgt 360
aacaggcttg ggggccaggg cttatacgtg cctgggactc ccaaagtatt actgttccat 420
gttcccggcg aagggccagc tgtcccccgc cagctagact cagcacttag tttaggaacc 480
agtgagcaag tcagcccttg gggcagccca tacaaggcca tggggctggg caagctgcac 540
gcctgggtcc ggggtgggca cggtgcccgg gcaacgagct gaaagctcat ctgctctcag 600
gggcccctcc ctggggacag cccctcctgg ctagtcacac cctgtaggct cctctatata 660
acccaggggc acaggggctg ccctcattct accaccacct ccacagcaca gacagacact 720
caggagccag ccagcgtcga gcggccgatc cgccaccatg ctttggtggg aggaagtgga 780
ggactgctac gagagagagg acgtgcagaa gaaaaccttc accaagtggg tgaacgccca 840
gttcagcaag ttcggcaagc agcacatcga gaacctgttc agcgacctgc aggatggcag 900
gagactgctg gacctgctgg agggcctgac cggccagaag ctgcccaagg agaagggcag 960
caccagagtg cacgccctga acaacgtgaa caaggccctg agagtgctgc agaacaacaa 1020
cgtggacctg gtgaacatcg gcagcaccga catcgtggac ggcaaccaca agctgaccct 1080
gggcctgatc tggaacatca tcctgcactg gcaggtgaag aacgtgatga agaacatcat 1140
ggccggcctg cagcagacca acagcgagaa gatcctgctg agctgggtga ggcagagcac 1200
cagaaactac ccccaggtga acgtgatcaa cttcaccacc tcctggagcg acggcctggc 1260
cctgaacgcc ctgatccaca gccacagacc cgacctgttc gactggaaca gcgtggtgtg 1320
tcagcagagc gccacccaga gactggagca cgccttcaac atcgccagat accagctggg 1380
catcgagaag ctgctggacc ccgaggacgt ggacaccacc taccccgaca agaaaagcat 1440
cctcatgtac attaccagcc tgttccaggt gctgccccag caggtgtcca tcgaggccat 1500
ccaggaagtg gaaatgctgc ccaggccccc caaagtgacc aaggaggagc acttccagct 1560
gcaccaccag atgcactaca gccagcagat cacagtgagc ctggcccagg gctatgagag 1620
aaccagcagc cccaagccca gattcaagag ctacgcctac acccaggccg cctacgtgac 1680
cacctccgac cccaccagaa gccccttccc cagccagcac ctggaggccc ccgaggacaa 1740
gagcttcggc agcagcctga tggagagcga agtgaacctg gacagatacc agaccgccct 1800
ggaggaagtg ctgtcctggc tgctgagcgc cgaggacacc ctgcaggccc agggcgagat 1860
cagcaacgac gtggaagtgg tgaaggacca gttccacacc cacgagggct acatgatgga 1920
tctgaccgcc caccagggca gagtgggcaa tatcctgcag ctgggcagca agctgatcgg 1980
caccggcaag ctgagcgagg acgaggagac cgaagtgcag gagcagatga acctgctgaa 2040
cagcagatgg gagtgcctga gagtggccag catggagaag cagagcaacc tgcacagagt 2100
gctgatggac ctgcagaacc agaagctgaa ggagctgaac gactggctga ccaagaccga 2160
ggagcggacc agaaagatgg aggaggagcc cctgggcccc gacctggagg acctgaagag 2220
acaggtgcag cagcacaaag tgctgcagga ggacctggag caggagcagg tgcgcgtgaa 2280
cagcctgacc cacatggtgg tggtcgtgga cgagagcagc ggcgaccacg ccacagccgc 2340
cctggaagag cagctgaaag tgctgggcga cagatgggcc aatatttgta ggtggaccga 2400
ggacagatgg gtgctgctgc aggacaccca ccgcctgctc cagcagttcc ccctggacct 2460
ggagaagttc ctggcctggc tgaccgaggc cgaaaccacc gccaatgtgc tccaggacgc 2520
cactagaaag gagaggctgc tggaggacag caagggcgtg aaagagctga tgaagcagtg 2580
gcaggatctg cagggcgaaa tcgaggccca caccgacgtg taccacaacc tggacgagaa 2640
cagccagaag attctgagga gcctggaggg cagcgacgac gccgtcctgc tccagaggag 2700
gctggacaac atgaacttca agtggagcga gctgcggaag aagagcctga acatccggag 2760
ccacctggaa gccagcagcg accagtggaa gagactgcac ctgagcctgc aggagctgct 2820
ggtgtggctg cagctgaagg acgacgagct gagcagacag gcccccatcg gcggcgactt 2880
ccccgccgtg cagaagcaga acgacgtgca ccgggccttc aagagggagc tgaaaaccaa 2940
ggaacccgtg atcatgagca ccctggagac agtgcggatc ttcctgaccg agcagcccct 3000
ggagggactg gagaagctgt accaggagcc cagagagctg ccccccgagg agagagccca 3060
gaacgtgacc aggctgctga gaaagcaggc cgaggaagtg aataccgagt gggagaagct 3120
gaatctgcac agcgccgact ggcagagaaa gatcgacgag accctggaga gactccagga 3180
actgcaggaa gccaccgacg agctggacct gaagctgaga caggccgaag tgatcaaggg 3240
cagctggcag cctgtgggcg atctgctgat cgactccctg caggatcacc tggagaaagt 3300
gaaggccctg cggggcgaga tcgcccccct gaaggagaat gtgagccacg tgaacgacct 3360
ggccagacag ctgaccaccc tgggcatcca gctgagcccc tacaacctga gcacactgga 3420
ggatctgaac acccggtgga aactgctgca ggtggccgtg gaggatagag tgaggcagct 3480
gcacgaagcc cacagagact tcggccctgc ctcccagcac ttcctgagca ccagcgtgca 3540
gggcccctgg gagagagcca tctcccccaa caaagtgccc tactacatca accacgagac 3600
ccagaccacc tgctgggacc accctaagat gaccgagctg tatcagagcc tggccgacct 3660
gaacaatgtg cggttcagcg cctacagaac cgccatgaag ctgcggagac tgcagaaggc 3720
cctgtgcctg gatctgctga gcctgagcgc cgcctgcgac gccctggacc agcacaacct 3780
gaagcagaat gaccagccca tggacatcct gcagatcatc aactgcctga ccacaatcta 3840
cgaccggctg gaacaggagc acaacaacct ggtgaatgtg cccctgtgcg tggacatgtg 3900
cctgaattgg ctgctgaacg tgtacgacac cggcaggacc ggcagaatcc gcgtgctgag 3960
cttcaagacc ggcatcatca gcctgtgcaa ggcccacctg gaggataagt accgctacct 4020
gttcaagcag gtggccagca gcaccggctt ctgcgatcag aggagactgg gcctgctgct 4080
gcacgatagc atccagatcc ctaggcagct gggcgaagtg gccagctttg gcggcagcaa 4140
catcgagccc tctgtgagga gctgcttcca gttcgccaac aacaagcccg agatcgaggc 4200
cgccctgttc ctggactgga tgaggctgga gcctcagagc atggtgtggc tgcctgtgct 4260
gcacagagtg gccgccgccg agaccgccaa gcaccaggcc aagtgcaata tctgcaagga 4320
gtgccccatc atcggcttcc ggtacaggag cctgaagcac ttcaactacg acatctgcca 4380
gagctgcttt ttcagcggca gagtggccaa gggccacaaa atgcactacc ccatggtgga 4440
gtactgcacc cccaccacct ccggcgagga tgtgagagac ttcgccaaag tgctgaagaa 4500
taagttccgg accaagcggt actttgccaa gcaccccagg atgggctacc tgcccgtgca 4560
gaccgtgctg gaaggcgaca acatggagac ctgatgagga gctcgagagg cctaataaag 4620
agctcagatg catcgatcag agtgtgttgg ttttttgtgt gagatctagg aacccctagt 4680
gatggagttg gccactccct ctctgcgcgc tcgctcgctc actgaggccg cccgggcaaa 4740
gcccgggcgt cgggcgacct ttggtcgccc ggcctcagtg agcgagcgag cgcgcagaga 4800
gggagtggcc aa 4812
<210> 11
<211> 4965
<212> ДНК
<213> Искусственная последовательность
<220>
<223> AAV векторный геном с геном Hopti-Dys3837
<400> 11
ttggccactc cctctctgcg cgctcgctcg ctcactgagg ccgggcgacc aaaggtcgcc 60
cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc gagcgcgcag agagggagtg 120
gccaactcca tcactagggg ttcctagatc tgaattcggt accccactac gggtctaggc 180
tgcccatgta aggaggcaag gcctggggac acccgagatg cctggttata attaacccca 240
acacctgctg cccccccccc cccaacacct gctgcctcta aaaataaccc tgtccctggt 300
ggatcccctg catgccccac tacgggttta ggctgcccat gtaaggaggc aaggcctggg 360
gacacccgag atgcctggtt ataattaacc cagacatgtg gctgcccccc ccccccccaa 420
cacctgctgc ctctaaaaat aaccctgtcc ctggtggatc ccctgcatgc gaagatcttc 480
gaacaaggct gtgggggact gagggcaggc tgtaacaggc ttgggggcca gggcttatac 540
gtgcctggga ctcccaaagt attactgttc catgttcccg gcgaagggcc agctgtcccc 600
cgccagctag actcagcact tagtttagga accagtgagc aagtcagccc ttggggcagc 660
ccatacaagg ccatggggct gggcaagctg cacgcctggg tccggggtgg gcacggtgcc 720
cgggcaacga gctgaaagct catctgctct caggggcccc tccctgggga cagcccctcc 780
tggctagtca caccctgtag gctcctctat ataacccagg ggcacagggg ctgccctcat 840
tctaccacca cctccacagc acagacagac actcaggagc cagccagcgt cgagcggccg 900
atccgccacc atgctttggt gggaggaagt ggaggactgc tacgagagag aggacgtgca 960
gaagaaaacc ttcaccaagt gggtgaacgc ccagttcagc aagttcggca agcagcacat 1020
cgagaacctg ttcagcgacc tgcaggatgg caggagactg ctggacctgc tggagggcct 1080
gaccggccag aagctgccca aggagaaggg cagcaccaga gtgcacgccc tgaacaacgt 1140
gaacaaggcc ctgagagtgc tgcagaacaa caacgtggac ctggtgaaca tcggcagcac 1200
cgacatcgtg gacggcaacc acaagctgac cctgggcctg atctggaaca tcatcctgca 1260
ctggcaggtg aagaacgtga tgaagaacat catggccggc ctgcagcaga ccaacagcga 1320
gaagatcctg ctgagctggg tgaggcagag caccagaaac tacccccagg tgaacgtgat 1380
caacttcacc acctcctgga gcgacggcct ggccctgaac gccctgatcc acagccacag 1440
acccgacctg ttcgactgga acagcgtggt gtgtcagcag agcgccaccc agagactgga 1500
gcacgccttc aacatcgcca gataccagct gggcatcgag aagctgctgg accccgagga 1560
cgtggacacc acctaccccg acaagaaaag catcctcatg tacattacca gcctgttcca 1620
ggtgctgccc cagcaggtgt ccatcgaggc catccaggaa gtggaaatgc tgcccaggcc 1680
ccccaaagtg accaaggagg agcacttcca gctgcaccac cagatgcact acagccagca 1740
gatcacagtg agcctggccc agggctatga gagaaccagc agccccaagc ccagattcaa 1800
gagctacgcc tacacccagg ccgcctacgt gaccacctcc gaccccacca gaagcccctt 1860
ccccagccag cacctggagg cccccgagga caagagcttc ggcagcagcc tgatggagag 1920
cgaagtgaac ctggacagat accagaccgc cctggaggaa gtgctgtcct ggctgctgag 1980
cgccgaggac accctgcagg cccagggcga gatcagcaac gacgtggaag tggtgaagga 2040
ccagttccac acccacgagg gctacatgat ggatctgacc gcccaccagg gcagagtggg 2100
caatatcctg cagctgggca gcaagctgat cggcaccggc aagctgagcg aggacgagga 2160
gaccgaagtg caggagcaga tgaacctgct gaacagcaga tgggagtgcc tgagagtggc 2220
cagcatggag aagcagagca acctgcacag agtgctgatg gacctgcaga accagaagct 2280
gaaggagctg aacgactggc tgaccaagac cgaggagcgg accagaaaga tggaggagga 2340
gcccctgggc cccgacctgg aggacctgaa gagacaggtg cagcagcaca aagtgctgca 2400
ggaggacctg gagcaggagc aggtgcgcgt gaacagcctg acccacatgg tggtggtcgt 2460
ggacgagagc agcggcgacc acgccacagc cgccctggaa gagcagctga aagtgctggg 2520
cgacagatgg gccaatattt gtaggtggac cgaggacaga tgggtgctgc tgcaggacac 2580
ccaccgcctg ctccagcagt tccccctgga cctggagaag ttcctggcct ggctgaccga 2640
ggccgaaacc accgccaatg tgctccagga cgccactaga aaggagaggc tgctggagga 2700
cagcaagggc gtgaaagagc tgatgaagca gtggcaggat ctgcagggcg aaatcgaggc 2760
ccacaccgac gtgtaccaca acctggacga gaacagccag aagattctga ggagcctgga 2820
gggcagcgac gacgccgtcc tgctccagag gaggctggac aacatgaact tcaagtggag 2880
cgagctgcgg aagaagagcc tgaacatccg gagccacctg gaagccagca gcgaccagtg 2940
gaagagactg cacctgagcc tgcaggagct gctggtgtgg ctgcagctga aggacgacga 3000
gctgagcaga caggccccca tcggcggcga cttccccgcc gtgcagaagc agaacgacgt 3060
gcaccgggcc ttcaagaggg agctgaaaac caaggaaccc gtgatcatga gcaccctgga 3120
gacagtgcgg atcttcctga ccgagcagcc cctggaggga ctggagaagc tgtaccagga 3180
gcccagagag ctgccccccg aggagagagc ccagaacgtg accaggctgc tgagaaagca 3240
ggccgaggaa gtgaataccg agtgggagaa gctgaatctg cacagcgccg actggcagag 3300
aaagatcgac gagaccctgg agagactcca ggaactgcag gaagccaccg acgagctgga 3360
cctgaagctg agacaggccg aagtgatcaa gggcagctgg cagcctgtgg gcgatctgct 3420
gatcgactcc ctgcaggatc acctggagaa agtgaaggcc ctgcggggcg agatcgcccc 3480
cctgaaggag aatgtgagcc acgtgaacga cctggccaga cagctgacca ccctgggcat 3540
ccagctgagc ccctacaacc tgagcacact ggaggatctg aacacccggt ggaaactgct 3600
gcaggtggcc gtggaggata gagtgaggca gctgcacgaa gcccacagag acttcggccc 3660
tgcctcccag cacttcctga gcaccagcgt gcagggcccc tgggagagag ccatctcccc 3720
caacaaagtg ccctactaca tcaaccacga gacccagacc acctgctggg accaccctaa 3780
gatgaccgag ctgtatcaga gcctggccga cctgaacaat gtgcggttca gcgcctacag 3840
aaccgccatg aagctgcgga gactgcagaa ggccctgtgc ctggatctgc tgagcctgag 3900
cgccgcctgc gacgccctgg accagcacaa cctgaagcag aatgaccagc ccatggacat 3960
cctgcagatc atcaactgcc tgaccacaat ctacgaccgg ctggaacagg agcacaacaa 4020
cctggtgaat gtgcccctgt gcgtggacat gtgcctgaat tggctgctga acgtgtacga 4080
caccggcagg accggcagaa tccgcgtgct gagcttcaag accggcatca tcagcctgtg 4140
caaggcccac ctggaggata agtaccgcta cctgttcaag caggtggcca gcagcaccgg 4200
cttctgcgat cagaggagac tgggcctgct gctgcacgat agcatccaga tccctaggca 4260
gctgggcgaa gtggccagct ttggcggcag caacatcgag ccctctgtga ggagctgctt 4320
ccagttcgcc aacaacaagc ccgagatcga ggccgccctg ttcctggact ggatgaggct 4380
ggagcctcag agcatggtgt ggctgcctgt gctgcacaga gtggccgccg ccgagaccgc 4440
caagcaccag gccaagtgca atatctgcaa ggagtgcccc atcatcggct tccggtacag 4500
gagcctgaag cacttcaact acgacatctg ccagagctgc tttttcagcg gcagagtggc 4560
caagggccac aaaatgcact accccatggt ggagtactgc acccccacca cctccggcga 4620
ggatgtgaga gacttcgcca aagtgctgaa gaataagttc cggaccaagc ggtactttgc 4680
caagcacccc aggatgggct acctgcccgt gcagaccgtg ctggaaggcg acaacatgga 4740
gacctgatga ggagctcgag aggcctaata aagagctcag atgcatcgat cagagtgtgt 4800
tggttttttg tgtgagatct aggaacccct agtgatggag ttggccactc cctctctgcg 4860
cgctcgctcg ctcactgagg ccgcccgggc aaagcccggg cgtcgggcga cctttggtcg 4920
cccggcctca gtgagcgagc gagcgcgcag agagggagtg gccaa 4965
<210> 12
<211> 4955
<212> ДНК
<213> Искусственная последовательность
<220>
<223> AAV векторный геном с геном Copti-Dys3978
<400> 12
ttggccactc cctctctgcg cgctcgctcg ctcactgagg ccgggcgacc aaaggtcgcc 60
cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc gagcgcgcag agagggagtg 120
gccaactcca tcactagggg ttcctcagat ctgaattcgg taccccacta cgggtttagg 180
ctgcccatgt aaggaggcaa ggcctgggga cacccgagat gcctggttat aattaaccca 240
gacatgtggc tgcccccccc ccccccaaca cctgctgcct ctaaaaataa ccctgtccct 300
ggtggatccc ctgcatgcga agatcttcga acaaggctgt gggggactga gggcaggctg 360
taacaggctt gggggccagg gcttatacgt gcctgggact cccaaagtat tactgttcca 420
tgttcccggc gaagggccag ctgtcccccg ccagctagac tcagcactta gtttaggaac 480
cagtgagcaa gtcagccctt ggggcagccc atacaaggcc atggggctgg gcaagctgca 540
cgcctgggtc cggggtgggc acggtgcccg ggcaacgagc tgaaagctca tctgctctca 600
ggggcccctc cctggggaca gcccctcctg gctagtcaca ccctgtaggc tcctctatat 660
aacccagggg cacaggggct gccctcattc taccaccacc tccacagcac agacagacac 720
tcaggagcca gccagcgtcg agcggccgcc accatgcttt ggtgggagga agtggaggac 780
tgctacgagc gggaggacgt gcagaagaaa accttcacca agtgggtgaa cgcccagttc 840
agcaagttcg gcaagcagca catcgagaac ctgttcagcg acctgcagga cggcaggcgg 900
ctgctggacc tcctggaagg cctgaccggc cagaagctgc ccaaagagaa gggcagcacc 960
agggtgcacg ccctgaacaa cgtgaacaag gccctgaggg tgctgcagaa caacaacgtg 1020
gacctggtga acatcggcag caccgacatc gtggacggca accacaagct gaccctgggc 1080
ctgatctgga acatcatcct gcactggcag gtcaagaacg tgatgaagaa catcatggcc 1140
ggcctgcagc agaccaacag cgagaagatc ctgctgtcct gggtgcggca gagcaccagg 1200
aactaccccc aggtcaacgt gatcaacttc accacctctt ggagcgacgg cctggccctg 1260
aacgccctga tccacagcca caggcccgac ctgttcgact ggaacagcgt ggtgtgccag 1320
cagagcgcca cccagaggct ggaacacgcc ttcaacatcg ccagatacca gctgggcatc 1380
gagaagctgc tggatcccga ggacgtggac accacctacc ccgacaagaa aagcatcctc 1440
atgtacatca ccagcctgtt ccaggtgctg ccccagcagg tgtccatcga ggccatccag 1500
gaagtggaga tgctgcccag gccccccaag gtcaccaaag aggaacactt ccagctgcac 1560
caccagatgc actacagcca gcagatcacc gtgagcctgg cccagggcta cgagaggacc 1620
agcagcccca agcccaggtt caagagctac gcctacaccc aggccgccta cgtgaccacc 1680
tccgacccca ccaggtcccc cttccccagc cagcatctcg aagcccccga ggacaagagc 1740
ttcggcagca gcctgatgga aagcgaggtg aacctggaca gataccagac cgccctggaa 1800
gaagtgctgt cttggctgct gtccgccgag gacaccctgc aggcccaggg cgagatcagc 1860
aacgacgtgg aggtcgtgaa ggaccagttc cacacccacg agggctacat gatggacctg 1920
accgcccacc agggcagagt gggcaacatc ctgcagctgg gcagcaagct gatcggcacc 1980
ggcaagctgt ccgaggacga ggaaaccgag gtgcaggaac agatgaacct gctgaacagc 2040
agatgggagt gcctgagggt ggccagcatg gaaaagcaga gcaacctgca cagggtgctg 2100
atggatctgc agaaccagaa gctcaaagag ctgaacgact ggctgaccaa gaccgaggaa 2160
aggacccgga agatggaaga ggaacccctg ggccccgatc tcgaagatct gaagaggcag 2220
gtgcagcagc acaaggtgct gcaggaagat ctcgaacagg aacaggtccg ggtcaacagc 2280
ctgacccaca tggtcgtggt ggtggacgag agcagcggcg accacgccac cgctgccctg 2340
gaagagcagc tgaaggtgct gggcgacaga tgggccaaca tctgccggtg gaccgaggac 2400
agatgggtcc tcctgcagga ccagcccgac ctggcccctg gcctgacaac catcggcgcc 2460
agccccaccc agaccgtgac cctggtgacc cagcccgtgg tgaccaaaga gaccgccatc 2520
agcaagctgg aaatgcccag ctccctgatg ctggaagtgc ccacccacag gctcctccag 2580
cagttccccc tggacctgga aaagttcctg gcctggctga ccgaggccga gaccaccgcc 2640
aacgtgctgc aggacgccac caggaaagag aggctgctgg aagatagcaa gggcgtgaaa 2700
gagctgatga agcagtggca ggacctgcag ggggagattg aggcccacac cgacgtgtac 2760
cacaacctgg acgagaacag ccagaaaatc ctgagaagcc tggaaggcag cgacgacgcc 2820
gtgctgctgc agaggcggct ggacaacatg aacttcaagt ggagcgagct gaggaagaag 2880
agcctgaaca tcaggtccca tctggaagcc agcagcgacc agtggaagag gctgcacctg 2940
agcctgcagg aactgctcgt ctggctgcag ctgaaagacg acgagctgtc caggcaggcc 3000
cccatcggcg gcgacttccc cgccgtgcag aaacagaacg acgtgcacag ggccttcaag 3060
cgggagctga aaaccaaaga gcccgtgatc atgagcaccc tggaaaccgt gaggatcttc 3120
ctgaccgagc agcccctgga aggactggaa aagctgtacc aggaacccag agagctgccc 3180
cccgaggaac gggcccagaa cgtgaccagg ctgctgagaa agcaggccga ggaagtgaac 3240
accgagtggg agaagctgaa cctgcactcc gccgactggc agaggaagat cgacgagacc 3300
ctggaaaggc tccaggaact gcaggaagcc accgacgagc tggacctgaa gctgagacag 3360
gccgaggtga tcaagggcag ctggcagccc gtgggcgacc tgctgatcga ctccctgcag 3420
gatcacctgg aaaaagtgaa ggccctgcgg ggcgagatcg cccccctgaa agagaacgtc 3480
agccacgtca acgacctggc caggcagctg accaccctgg gcatccagct gtccccctac 3540
aacctgtcca ccctggaaga tctgaacaca aggtggaagc tgctgcaggt ggccgtggag 3600
gacagagtga ggcagctgca cgaggcccac agggacttcg gccctgcctc ccagcacttc 3660
ctgagcacca gcgtgcaggg cccctgggag agggccatct cccccaacaa ggtgccctac 3720
tacatcaacc acgagaccca gaccacctgc tgggaccacc ctaagatgac cgagctgtac 3780
cagtccctgg ccgacctgaa caatgtgcgg ttcagcgcct accggaccgc catgaagctg 3840
aggcggctgc agaaagccct gtgcctggat ctgctgtccc tgagcgccgc ctgcgacgcc 3900
ctggaccagc acaacctgaa gcagaacgac cagcccatgg atatcctgca gatcatcaac 3960
tgtctgacca ccatctacga caggctggaa caggaacaca acaacctggt caacgtgccc 4020
ctgtgcgtgg acatgtgcct gaactggctg ctgaacgtgt acgacaccgg caggaccggc 4080
cggatcaggg tgctgtcctt caagaccggc atcatcagcc tgtgcaaggc ccacctggaa 4140
gataagtacc gctacctgtt caagcaggtg gccagctcta ccggcttctg cgaccagcgg 4200
aggctgggcc tgctgctgca cgacagcatc cagatccccc ggcagctggg cgaggtggcc 4260
tccttcggcg gcagcaacat cgagcccagc gtgcggagct gcttccagtt cgccaacaac 4320
aagcccgaga tcgaggccgc cctgttcctg gactggatgc ggctggaacc ccagagcatg 4380
gtctggctgc ccgtgctgca cagagtggct gccgccgaga ccgccaagca ccaggccaag 4440
tgcaacatct gcaaagagtg ccccatcatc ggcttcaggt acagaagcct gaagcacttc 4500
aactacgaca tctgccagag ctgtttcttc agcggcaggg tggccaaggg ccacaaaatg 4560
cactacccca tggtggagta ctgcaccccc accacctccg gcgaggacgt gagggacttc 4620
gccaaggtgc tgaagaataa gttccggacc aagcggtact tcgccaaaca ccccaggatg 4680
ggctacctgc ccgtgcagac cgtgctggaa ggcgacaaca tggaaacctg ataacacgcg 4740
tcgactcgag aggcctaata aagagctcag atgcatcgat cagagtgtgt tggttttttg 4800
tgtgagatct aggaacccct agtgatggag ttggccactc cctctctgcg cgctcgctcg 4860
ctcactgagg ccgcccgggc aaagcccggg cgtcgggcga cctttggtcg cccggcctca 4920
gtgagcgagc gagcgcgcag agagggagtg gccaa 4955
<210> 13
<211> 736
<212> БЕЛОК
<213> аденоассоциированный вирус 9
<400> 13
Met Ala Ala Asp Gly Tyr Leu Pro Asp Trp Leu Glu Asp Asn Leu Ser
1 5 10 15
Glu Gly Ile Arg Glu Trp Trp Ala Leu Lys Pro Gly Ala Pro Gln Pro
20 25 30
Lys Ala Asn Gln Gln His Gln Asp Asn Ala Arg Gly Leu Val Leu Pro
35 40 45
Gly Tyr Lys Tyr Leu Gly Pro Gly Asn Gly Leu Asp Lys Gly Glu Pro
50 55 60
Val Asn Ala Ala Asp Ala Ala Ala Leu Glu His Asp Lys Ala Tyr Asp
65 70 75 80
Gln Gln Leu Lys Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala
85 90 95
Asp Ala Glu Phe Gln Glu Arg Leu Lys Glu Asp Thr Ser Phe Gly Gly
100 105 110
Asn Leu Gly Arg Ala Val Phe Gln Ala Lys Lys Arg Leu Leu Glu Pro
115 120 125
Leu Gly Leu Val Glu Glu Ala Ala Lys Thr Ala Pro Gly Lys Lys Arg
130 135 140
Pro Val Glu Gln Ser Pro Gln Glu Pro Asp Ser Ser Ala Gly Ile Gly
145 150 155 160
Lys Ser Gly Ala Gln Pro Ala Lys Lys Arg Leu Asn Phe Gly Gln Thr
165 170 175
Gly Asp Thr Glu Ser Val Pro Asp Pro Gln Pro Ile Gly Glu Pro Pro
180 185 190
Ala Ala Pro Ser Gly Val Gly Ser Leu Thr Met Ala Ser Gly Gly Gly
195 200 205
Ala Pro Val Ala Asp Asn Asn Glu Gly Ala Asp Gly Val Gly Ser Ser
210 215 220
Ser Gly Asn Trp His Cys Asp Ser Gln Trp Leu Gly Asp Arg Val Ile
225 230 235 240
Thr Thr Ser Thr Arg Thr Trp Ala Leu Pro Thr Tyr Asn Asn His Leu
245 250 255
Tyr Lys Gln Ile Ser Asn Ser Thr Ser Gly Gly Ser Ser Asn Asp Asn
260 265 270
Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg
275 280 285
Phe His Cys His Phe Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn
290 295 300
Asn Trp Gly Phe Arg Pro Lys Arg Leu Asn Phe Lys Leu Phe Asn Ile
305 310 315 320
Gln Val Lys Glu Val Thr Asp Asn Asn Gly Val Lys Thr Ile Ala Asn
325 330 335
Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp Ser Asp Tyr Gln Leu
340 345 350
Pro Tyr Val Leu Gly Ser Ala His Glu Gly Cys Leu Pro Pro Phe Pro
355 360 365
Ala Asp Val Phe Met Ile Pro Gln Tyr Gly Tyr Leu Thr Leu Asn Asp
370 375 380
Gly Ser Gln Ala Val Gly Arg Ser Ser Phe Tyr Cys Leu Glu Tyr Phe
385 390 395 400
Pro Ser Gln Met Leu Arg Thr Gly Asn Asn Phe Gln Phe Ser Tyr Glu
405 410 415
Phe Glu Asn Val Pro Phe His Ser Ser Tyr Ala His Ser Gln Ser Leu
420 425 430
Asp Arg Leu Met Asn Pro Leu Ile Asp Gln Tyr Leu Tyr Tyr Leu Ser
435 440 445
Lys Thr Ile Asn Gly Ser Gly Gln Asn Gln Gln Thr Leu Lys Phe Ser
450 455 460
Val Ala Gly Pro Ser Asn Met Ala Val Gln Gly Arg Asn Tyr Ile Pro
465 470 475 480
Gly Pro Ser Tyr Arg Gln Gln Arg Val Ser Thr Thr Val Thr Gln Asn
485 490 495
Asn Asn Ser Glu Phe Ala Trp Pro Gly Ala Ser Ser Trp Ala Leu Asn
500 505 510
Gly Arg Asn Ser Leu Met Asn Pro Gly Pro Ala Met Ala Ser His Lys
515 520 525
Glu Gly Glu Asp Arg Phe Phe Pro Leu Ser Gly Ser Leu Ile Phe Gly
530 535 540
Lys Gln Gly Thr Gly Arg Asp Asn Val Asp Ala Asp Lys Val Met Ile
545 550 555 560
Thr Asn Glu Glu Glu Ile Lys Thr Thr Asn Pro Val Ala Thr Glu Ser
565 570 575
Tyr Gly Gln Val Ala Thr Asn His Gln Ser Ala Gln Ala Gln Ala Gln
580 585 590
Thr Gly Trp Val Gln Asn Gln Gly Ile Leu Pro Gly Met Val Trp Gln
595 600 605
Asp Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro His
610 615 620
Thr Asp Gly Asn Phe His Pro Ser Pro Leu Met Gly Gly Phe Gly Met
625 630 635 640
Lys His Pro Pro Pro Gln Ile Leu Ile Lys Asn Thr Pro Val Pro Ala
645 650 655
Asp Pro Pro Thr Ala Phe Asn Lys Asp Lys Leu Asn Ser Phe Ile Thr
660 665 670
Gln Tyr Ser Thr Gly Gln Val Ser Val Glu Ile Glu Trp Glu Leu Gln
675 680 685
Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Ser Asn
690 695 700
Tyr Tyr Lys Ser Asn Asn Val Glu Phe Ala Val Asn Thr Glu Gly Val
705 710 715 720
Tyr Ser Glu Pro Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Asn Leu
725 730 735
<210> 14
<211> 145
<212> ДНК
<213> аденоассоциированный вирус 2
<400> 14
ttggccactc cctctctgcg cgctcgctcg ctcactgagg ccgggcgacc aaaggtcgcc 60
cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc gagcgcgcag agagggagtg 120
gccaactcca tcactagggg ttcct 145
<210> 15
<211> 145
<212> ДНК
<213> аденоассоциированный вирус 2
<400> 15
aggaacccct agtgatggag ttggccactc cctctctgcg cgctcgctcg ctcactgagg 60
ccgcccgggc aaagcccggg cgtcgggcga cctttggtcg cccggcctca gtgagcgagc 120
gagcgcgcag agagggagtg gccaa 145
<210> 16
<211> 577
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетические энхансер и промотор
<400> 16
ccactacggg tctaggctgc ccatgtaagg aggcaaggcc tggggacacc cgagatgcct 60
ggttataatt aacccagaca tgtggctgcc cccccccccc ccaacacctg ctgcctctaa 120
aaataaccct gtccctggtg gatcccctgc atgcgaagat cttcgaacaa ggctgtgggg 180
gactgagggc aggctgtaac aggcttgggg gccagggctt atacgtgcct gggactccca 240
aagtattact gttccatgtt cccggcgaag ggccagctgt cccccgccag ctagactcag 300
cacttagttt aggaaccagt gagcaagtca gcccttgggg cagcccatac aaggccatgg 360
ggctgggcaa gctgcacgcc tgggtccggg gtgggcacgg tgcccgggca acgagctgaa 420
agctcatctg ctctcagggg cccctccctg gggacagccc ctcctggcta gtcacaccct 480
gtaggctcct ctatataacc caggggcaca ggggctgccc tcattctacc accacctcca 540
cagcacagac agacactcag gagccagcca gcgtcga 577
<210> 17
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетический терминатор транскрипции
<400> 17
aggcctaata aagagctcag atgcatcgat cagagtgtgt tggttttttg tgtg 54
<210> 18
<211> 4955
<212> ДНК
<213> Искусственная последовательность
<220>
<223> AAV векторный геном с геном Hopti-Dys3978
<400> 18
ttggccactc cctctctgcg cgctcgctcg ctcactgagg ccgggcgacc aaaggtcgcc 60
cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc gagcgcgcag agagggagtg 120
gccaactcca tcactagggg ttcctcagat ctgaattcgg taccccacta cgggtctagg 180
ctgcccatgt aaggaggcaa ggcctgggga cacccgagat gcctggttat aattaaccca 240
gacatgtggc tgcccccccc ccccccaaca cctgctgcct ctaaaaataa ccctgtccct 300
ggtggatccc ctgcatgcga agatcttcga acaaggctgt gggggactga gggcaggctg 360
taacaggctt gggggccagg gcttatacgt gcctgggact cccaaagtat tactgttcca 420
tgttcccggc gaagggccag ctgtcccccg ccagctagac tcagcactta gtttaggaac 480
cagtgagcaa gtcagccctt ggggcagccc atacaaggcc atggggctgg gcaagctgca 540
cgcctgggtc cggggtgggc acggtgcccg ggcaacgagc tgaaagctca tctgctctca 600
ggggcccctc cctggggaca gcccctcctg gctagtcaca ccctgtaggc tcctctatat 660
aacccagggg cacaggggct gccctcattc taccaccacc tccacagcac agacagacac 720
tcaggagcca gccagcgtcg agcggccgat ccgccaccat gctttggtgg gaggaagtgg 780
aggactgcta cgagagagag gacgtgcaga agaaaacctt caccaagtgg gtgaacgccc 840
agttcagcaa gttcggcaag cagcacatcg agaacctgtt cagcgacctg caggatggca 900
ggagactgct ggacctgctg gagggcctga ccggccagaa gctgcccaag gagaagggca 960
gcaccagagt gcacgccctg aacaacgtga acaaggccct gagagtgctg cagaacaaca 1020
acgtggacct ggtgaacatc ggcagcaccg acatcgtgga cggcaaccac aagctgaccc 1080
tgggcctgat ctggaacatc atcctgcact ggcaggtgaa gaacgtgatg aagaacatca 1140
tggccggcct gcagcagacc aacagcgaga agatcctgct gagctgggtg aggcagagca 1200
ccagaaacta cccccaggtg aacgtgatca acttcaccac ctcctggagc gacggcctgg 1260
ccctgaacgc cctgatccac agccacagac ccgacctgtt cgactggaac agcgtggtgt 1320
gtcagcagag cgccacccag agactggagc acgccttcaa catcgccaga taccagctgg 1380
gcatcgagaa gctgctggac cccgaggacg tggacaccac ctaccccgac aagaaaagca 1440
tcctcatgta cattaccagc ctgttccagg tgctgcccca gcaggtgtcc atcgaggcca 1500
tccaggaagt ggaaatgctg cccaggcccc ccaaagtgac caaggaggag cacttccagc 1560
tgcaccacca gatgcactac agccagcaga tcacagtgag cctggcccag ggctatgaga 1620
gaaccagcag ccccaagccc agattcaaga gctacgccta cacccaggcc gcctacgtga 1680
ccacctccga ccccaccaga agccccttcc ccagccagca cctggaggcc cccgaggaca 1740
agagcttcgg cagcagcctg atggagagcg aagtgaacct ggacagatac cagaccgccc 1800
tggaggaagt gctgtcctgg ctgctgagcg ccgaggacac cctgcaggcc cagggcgaga 1860
tcagcaacga cgtggaagtg gtgaaggacc agttccacac ccacgagggc tacatgatgg 1920
atctgaccgc ccaccagggc agagtgggca atatcctgca gctgggcagc aagctgatcg 1980
gcaccggcaa gctgagcgag gacgaggaga ccgaagtgca ggagcagatg aacctgctga 2040
acagcagatg ggagtgcctg agagtggcca gcatggagaa gcagagcaac ctgcacagag 2100
tgctgatgga cctgcagaac cagaagctga aggagctgaa cgactggctg accaagaccg 2160
aggagcggac cagaaagatg gaggaggagc ccctgggccc cgacctggag gacctgaaga 2220
gacaggtgca gcagcacaaa gtgctgcagg aggacctgga gcaggagcag gtgcgcgtga 2280
acagcctgac ccacatggtg gtggtcgtgg acgagagcag cggcgaccac gccacagccg 2340
ccctggaaga gcagctgaaa gtgctgggcg acagatgggc caatatttgt aggtggaccg 2400
aggacagatg ggtgctgctg caggaccagc ccgacctggc ccctggcctg accaccatcg 2460
gcgccagccc cacccagacc gtgaccctgg tgacccagcc cgtggtgaca aaggagaccg 2520
ccatcagcaa gctggagatg cccagctccc tgatgctgga agtgcccacc caccgcctgc 2580
tccagcagtt ccccctggac ctggagaagt tcctggcctg gctgaccgag gccgaaacca 2640
ccgccaatgt gctccaggac gccactagaa aggagaggct gctggaggac agcaagggcg 2700
tgaaagagct gatgaagcag tggcaggatc tgcagggcga aatcgaggcc cacaccgacg 2760
tgtaccacaa cctggacgag aacagccaga agattctgag gagcctggag ggcagcgacg 2820
acgccgtcct gctccagagg aggctggaca acatgaactt caagtggagc gagctgcgga 2880
agaagagcct gaacatccgg agccacctgg aagccagcag cgaccagtgg aagagactgc 2940
acctgagcct gcaggagctg ctggtgtggc tgcagctgaa ggacgacgag ctgagcagac 3000
aggcccccat cggcggcgac ttccccgccg tgcagaagca gaacgacgtg caccgggcct 3060
tcaagaggga gctgaaaacc aaggaacccg tgatcatgag caccctggag acagtgcgga 3120
tcttcctgac cgagcagccc ctggagggac tggagaagct gtaccaggag cccagagagc 3180
tgccccccga ggagagagcc cagaacgtga ccaggctgct gagaaagcag gccgaggaag 3240
tgaataccga gtgggagaag ctgaatctgc acagcgccga ctggcagaga aagatcgacg 3300
agaccctgga gagactccag gaactgcagg aagccaccga cgagctggac ctgaagctga 3360
gacaggccga agtgatcaag ggcagctggc agcctgtggg cgatctgctg atcgactccc 3420
tgcaggatca cctggagaaa gtgaaggccc tgcggggcga gatcgccccc ctgaaggaga 3480
atgtgagcca cgtgaacgac ctggccagac agctgaccac cctgggcatc cagctgagcc 3540
cctacaacct gagcacactg gaggatctga acacccggtg gaaactgctg caggtggccg 3600
tggaggatag agtgaggcag ctgcacgaag cccacagaga cttcggccct gcctcccagc 3660
acttcctgag caccagcgtg cagggcccct gggagagagc catctccccc aacaaagtgc 3720
cctactacat caaccacgag acccagacca cctgctggga ccaccctaag atgaccgagc 3780
tgtatcagag cctggccgac ctgaacaatg tgcggttcag cgcctacaga accgccatga 3840
agctgcggag actgcagaag gccctgtgcc tggatctgct gagcctgagc gccgcctgcg 3900
acgccctgga ccagcacaac ctgaagcaga atgaccagcc catggacatc ctgcagatca 3960
tcaactgcct gaccacaatc tacgaccggc tggaacagga gcacaacaac ctggtgaatg 4020
tgcccctgtg cgtggacatg tgcctgaatt ggctgctgaa cgtgtacgac accggcagga 4080
ccggcagaat ccgcgtgctg agcttcaaga ccggcatcat cagcctgtgc aaggcccacc 4140
tggaggataa gtaccgctac ctgttcaagc aggtggccag cagcaccggc ttctgcgatc 4200
agaggagact gggcctgctg ctgcacgata gcatccagat ccctaggcag ctgggcgaag 4260
tggccagctt tggcggcagc aacatcgagc cctctgtgag gagctgcttc cagttcgcca 4320
acaacaagcc cgagatcgag gccgccctgt tcctggactg gatgaggctg gagcctcaga 4380
gcatggtgtg gctgcctgtg ctgcacagag tggccgccgc cgagaccgcc aagcaccagg 4440
ccaagtgcaa tatctgcaag gagtgcccca tcatcggctt ccggtacagg agcctgaagc 4500
acttcaacta cgacatctgc cagagctgct ttttcagcgg cagagtggcc aagggccaca 4560
aaatgcacta ccccatggtg gagtactgca cccccaccac ctccggcgag gatgtgagag 4620
acttcgccaa agtgctgaag aataagttcc ggaccaagcg gtactttgcc aagcacccca 4680
ggatgggcta cctgcccgtg cagaccgtgc tggaaggcga caacatggag acctgatgag 4740
gagctcgaga ggcctaataa agagctcaga tgcatcgatc agagtgtgtt ggttttttgt 4800
gtgagatctg aggaacccct agtgatggag ttggccactc cctctctgcg cgctcgctcg 4860
ctcactgagg ccgcccgggc aaagcccggg cgtcgggcga cctttggtcg cccggcctca 4920
gtgagcgagc gagcgcgcag agagggagtg gccaa 4955
<210> 19
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 19
ccaacaaagt gccctactac atc 23
<210> 20
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 20
ggttgtgctg gtccagggcg t 21
<210> 21
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 21
ccgagctgta tcagagcctg gcc 23
<210> 22
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 22
gcgaaagtgg aaaagccaag t 21
<210> 23
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 23
gccacatcaa caggactctt gtag 24
<210> 24
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 24
caaagcctaa aagacagcgg caagttgaat 30
<210> 25
<211> 3685
<212> БЕЛОК
<213> Homo sapiens
<400> 25
Met Leu Trp Trp Glu Glu Val Glu Asp Cys Tyr Glu Arg Glu Asp Val
1 5 10 15
Gln Lys Lys Thr Phe Thr Lys Trp Val Asn Ala Gln Phe Ser Lys Phe
20 25 30
Gly Lys Gln His Ile Glu Asn Leu Phe Ser Asp Leu Gln Asp Gly Arg
35 40 45
Arg Leu Leu Asp Leu Leu Glu Gly Leu Thr Gly Gln Lys Leu Pro Lys
50 55 60
Glu Lys Gly Ser Thr Arg Val His Ala Leu Asn Asn Val Asn Lys Ala
65 70 75 80
Leu Arg Val Leu Gln Asn Asn Asn Val Asp Leu Val Asn Ile Gly Ser
85 90 95
Thr Asp Ile Val Asp Gly Asn His Lys Leu Thr Leu Gly Leu Ile Trp
100 105 110
Asn Ile Ile Leu His Trp Gln Val Lys Asn Val Met Lys Asn Ile Met
115 120 125
Ala Gly Leu Gln Gln Thr Asn Ser Glu Lys Ile Leu Leu Ser Trp Val
130 135 140
Arg Gln Ser Thr Arg Asn Tyr Pro Gln Val Asn Val Ile Asn Phe Thr
145 150 155 160
Thr Ser Trp Ser Asp Gly Leu Ala Leu Asn Ala Leu Ile His Ser His
165 170 175
Arg Pro Asp Leu Phe Asp Trp Asn Ser Val Val Cys Gln Gln Ser Ala
180 185 190
Thr Gln Arg Leu Glu His Ala Phe Asn Ile Ala Arg Tyr Gln Leu Gly
195 200 205
Ile Glu Lys Leu Leu Asp Pro Glu Asp Val Asp Thr Thr Tyr Pro Asp
210 215 220
Lys Lys Ser Ile Leu Met Tyr Ile Thr Ser Leu Phe Gln Val Leu Pro
225 230 235 240
Gln Gln Val Ser Ile Glu Ala Ile Gln Glu Val Glu Met Leu Pro Arg
245 250 255
Pro Pro Lys Val Thr Lys Glu Glu His Phe Gln Leu His His Gln Met
260 265 270
His Tyr Ser Gln Gln Ile Thr Val Ser Leu Ala Gln Gly Tyr Glu Arg
275 280 285
Thr Ser Ser Pro Lys Pro Arg Phe Lys Ser Tyr Ala Tyr Thr Gln Ala
290 295 300
Ala Tyr Val Thr Thr Ser Asp Pro Thr Arg Ser Pro Phe Pro Ser Gln
305 310 315 320
His Leu Glu Ala Pro Glu Asp Lys Ser Phe Gly Ser Ser Leu Met Glu
325 330 335
Ser Glu Val Asn Leu Asp Arg Tyr Gln Thr Ala Leu Glu Glu Val Leu
340 345 350
Ser Trp Leu Leu Ser Ala Glu Asp Thr Leu Gln Ala Gln Gly Glu Ile
355 360 365
Ser Asn Asp Val Glu Val Val Lys Asp Gln Phe His Thr His Glu Gly
370 375 380
Tyr Met Met Asp Leu Thr Ala His Gln Gly Arg Val Gly Asn Ile Leu
385 390 395 400
Gln Leu Gly Ser Lys Leu Ile Gly Thr Gly Lys Leu Ser Glu Asp Glu
405 410 415
Glu Thr Glu Val Gln Glu Gln Met Asn Leu Leu Asn Ser Arg Trp Glu
420 425 430
Cys Leu Arg Val Ala Ser Met Glu Lys Gln Ser Asn Leu His Arg Val
435 440 445
Leu Met Asp Leu Gln Asn Gln Lys Leu Lys Glu Leu Asn Asp Trp Leu
450 455 460
Thr Lys Thr Glu Glu Arg Thr Arg Lys Met Glu Glu Glu Pro Leu Gly
465 470 475 480
Pro Asp Leu Glu Asp Leu Lys Arg Gln Val Gln Gln His Lys Val Leu
485 490 495
Gln Glu Asp Leu Glu Gln Glu Gln Val Arg Val Asn Ser Leu Thr His
500 505 510
Met Val Val Val Val Asp Glu Ser Ser Gly Asp His Ala Thr Ala Ala
515 520 525
Leu Glu Glu Gln Leu Lys Val Leu Gly Asp Arg Trp Ala Asn Ile Cys
530 535 540
Arg Trp Thr Glu Asp Arg Trp Val Leu Leu Gln Asp Ile Leu Leu Lys
545 550 555 560
Trp Gln Arg Leu Thr Glu Glu Gln Cys Leu Phe Ser Ala Trp Leu Ser
565 570 575
Glu Lys Glu Asp Ala Val Asn Lys Ile His Thr Thr Gly Phe Lys Asp
580 585 590
Gln Asn Glu Met Leu Ser Ser Leu Gln Lys Leu Ala Val Leu Lys Ala
595 600 605
Asp Leu Glu Lys Lys Lys Gln Ser Met Gly Lys Leu Tyr Ser Leu Lys
610 615 620
Gln Asp Leu Leu Ser Thr Leu Lys Asn Lys Ser Val Thr Gln Lys Thr
625 630 635 640
Glu Ala Trp Leu Asp Asn Phe Ala Arg Cys Trp Asp Asn Leu Val Gln
645 650 655
Lys Leu Glu Lys Ser Thr Ala Gln Ile Ser Gln Ala Val Thr Thr Thr
660 665 670
Gln Pro Ser Leu Thr Gln Thr Thr Val Met Glu Thr Val Thr Thr Val
675 680 685
Thr Thr Arg Glu Gln Ile Leu Val Lys His Ala Gln Glu Glu Leu Pro
690 695 700
Pro Pro Pro Pro Gln Lys Lys Arg Gln Ile Thr Val Asp Ser Glu Ile
705 710 715 720
Arg Lys Arg Leu Asp Val Asp Ile Thr Glu Leu His Ser Trp Ile Thr
725 730 735
Arg Ser Glu Ala Val Leu Gln Ser Pro Glu Phe Ala Ile Phe Arg Lys
740 745 750
Glu Gly Asn Phe Ser Asp Leu Lys Glu Lys Val Asn Ala Ile Glu Arg
755 760 765
Glu Lys Ala Glu Lys Phe Arg Lys Leu Gln Asp Ala Ser Arg Ser Ala
770 775 780
Gln Ala Leu Val Glu Gln Met Val Asn Glu Gly Val Asn Ala Asp Ser
785 790 795 800
Ile Lys Gln Ala Ser Glu Gln Leu Asn Ser Arg Trp Ile Glu Phe Cys
805 810 815
Gln Leu Leu Ser Glu Arg Leu Asn Trp Leu Glu Tyr Gln Asn Asn Ile
820 825 830
Ile Ala Phe Tyr Asn Gln Leu Gln Gln Leu Glu Gln Met Thr Thr Thr
835 840 845
Ala Glu Asn Trp Leu Lys Ile Gln Pro Thr Thr Pro Ser Glu Pro Thr
850 855 860
Ala Ile Lys Ser Gln Leu Lys Ile Cys Lys Asp Glu Val Asn Arg Leu
865 870 875 880
Ser Gly Leu Gln Pro Gln Ile Glu Arg Leu Lys Ile Gln Ser Ile Ala
885 890 895
Leu Lys Glu Lys Gly Gln Gly Pro Met Phe Leu Asp Ala Asp Phe Val
900 905 910
Ala Phe Thr Asn His Phe Lys Gln Val Phe Ser Asp Val Gln Ala Arg
915 920 925
Glu Lys Glu Leu Gln Thr Ile Phe Asp Thr Leu Pro Pro Met Arg Tyr
930 935 940
Gln Glu Thr Met Ser Ala Ile Arg Thr Trp Val Gln Gln Ser Glu Thr
945 950 955 960
Lys Leu Ser Ile Pro Gln Leu Ser Val Thr Asp Tyr Glu Ile Met Glu
965 970 975
Gln Arg Leu Gly Glu Leu Gln Ala Leu Gln Ser Ser Leu Gln Glu Gln
980 985 990
Gln Ser Gly Leu Tyr Tyr Leu Ser Thr Thr Val Lys Glu Met Ser Lys
995 1000 1005
Lys Ala Pro Ser Glu Ile Ser Arg Lys Tyr Gln Ser Glu Phe Glu
1010 1015 1020
Glu Ile Glu Gly Arg Trp Lys Lys Leu Ser Ser Gln Leu Val Glu
1025 1030 1035
His Cys Gln Lys Leu Glu Glu Gln Met Asn Lys Leu Arg Lys Ile
1040 1045 1050
Gln Asn His Ile Gln Thr Leu Lys Lys Trp Met Ala Glu Val Asp
1055 1060 1065
Val Phe Leu Lys Glu Glu Trp Pro Ala Leu Gly Asp Ser Glu Ile
1070 1075 1080
Leu Lys Lys Gln Leu Lys Gln Cys Arg Leu Leu Val Ser Asp Ile
1085 1090 1095
Gln Thr Ile Gln Pro Ser Leu Asn Ser Val Asn Glu Gly Gly Gln
1100 1105 1110
Lys Ile Lys Asn Glu Ala Glu Pro Glu Phe Ala Ser Arg Leu Glu
1115 1120 1125
Thr Glu Leu Lys Glu Leu Asn Thr Gln Trp Asp His Met Cys Gln
1130 1135 1140
Gln Val Tyr Ala Arg Lys Glu Ala Leu Lys Gly Gly Leu Glu Lys
1145 1150 1155
Thr Val Ser Leu Gln Lys Asp Leu Ser Glu Met His Glu Trp Met
1160 1165 1170
Thr Gln Ala Glu Glu Glu Tyr Leu Glu Arg Asp Phe Glu Tyr Lys
1175 1180 1185
Thr Pro Asp Glu Leu Gln Lys Ala Val Glu Glu Met Lys Arg Ala
1190 1195 1200
Lys Glu Glu Ala Gln Gln Lys Glu Ala Lys Val Lys Leu Leu Thr
1205 1210 1215
Glu Ser Val Asn Ser Val Ile Ala Gln Ala Pro Pro Val Ala Gln
1220 1225 1230
Glu Ala Leu Lys Lys Glu Leu Glu Thr Leu Thr Thr Asn Tyr Gln
1235 1240 1245
Trp Leu Cys Thr Arg Leu Asn Gly Lys Cys Lys Thr Leu Glu Glu
1250 1255 1260
Val Trp Ala Cys Trp His Glu Leu Leu Ser Tyr Leu Glu Lys Ala
1265 1270 1275
Asn Lys Trp Leu Asn Glu Val Glu Phe Lys Leu Lys Thr Thr Glu
1280 1285 1290
Asn Ile Pro Gly Gly Ala Glu Glu Ile Ser Glu Val Leu Asp Ser
1295 1300 1305
Leu Glu Asn Leu Met Arg His Ser Glu Asp Asn Pro Asn Gln Ile
1310 1315 1320
Arg Ile Leu Ala Gln Thr Leu Thr Asp Gly Gly Val Met Asp Glu
1325 1330 1335
Leu Ile Asn Glu Glu Leu Glu Thr Phe Asn Ser Arg Trp Arg Glu
1340 1345 1350
Leu His Glu Glu Ala Val Arg Arg Gln Lys Leu Leu Glu Gln Ser
1355 1360 1365
Ile Gln Ser Ala Gln Glu Thr Glu Lys Ser Leu His Leu Ile Gln
1370 1375 1380
Glu Ser Leu Thr Phe Ile Asp Lys Gln Leu Ala Ala Tyr Ile Ala
1385 1390 1395
Asp Lys Val Asp Ala Ala Gln Met Pro Gln Glu Ala Gln Lys Ile
1400 1405 1410
Gln Ser Asp Leu Thr Ser His Glu Ile Ser Leu Glu Glu Met Lys
1415 1420 1425
Lys His Asn Gln Gly Lys Glu Ala Ala Gln Arg Val Leu Ser Gln
1430 1435 1440
Ile Asp Val Ala Gln Lys Lys Leu Gln Asp Val Ser Met Lys Phe
1445 1450 1455
Arg Leu Phe Gln Lys Pro Ala Asn Phe Glu Gln Arg Leu Gln Glu
1460 1465 1470
Ser Lys Met Ile Leu Asp Glu Val Lys Met His Leu Pro Ala Leu
1475 1480 1485
Glu Thr Lys Ser Val Glu Gln Glu Val Val Gln Ser Gln Leu Asn
1490 1495 1500
His Cys Val Asn Leu Tyr Lys Ser Leu Ser Glu Val Lys Ser Glu
1505 1510 1515
Val Glu Met Val Ile Lys Thr Gly Arg Gln Ile Val Gln Lys Lys
1520 1525 1530
Gln Thr Glu Asn Pro Lys Glu Leu Asp Glu Arg Val Thr Ala Leu
1535 1540 1545
Lys Leu His Tyr Asn Glu Leu Gly Ala Lys Val Thr Glu Arg Lys
1550 1555 1560
Gln Gln Leu Glu Lys Cys Leu Lys Leu Ser Arg Lys Met Arg Lys
1565 1570 1575
Glu Met Asn Val Leu Thr Glu Trp Leu Ala Ala Thr Asp Met Glu
1580 1585 1590
Leu Thr Lys Arg Ser Ala Val Glu Gly Met Pro Ser Asn Leu Asp
1595 1600 1605
Ser Glu Val Ala Trp Gly Lys Ala Thr Gln Lys Glu Ile Glu Lys
1610 1615 1620
Gln Lys Val His Leu Lys Ser Ile Thr Glu Val Gly Glu Ala Leu
1625 1630 1635
Lys Thr Val Leu Gly Lys Lys Glu Thr Leu Val Glu Asp Lys Leu
1640 1645 1650
Ser Leu Leu Asn Ser Asn Trp Ile Ala Val Thr Ser Arg Ala Glu
1655 1660 1665
Glu Trp Leu Asn Leu Leu Leu Glu Tyr Gln Lys His Met Glu Thr
1670 1675 1680
Phe Asp Gln Asn Val Asp His Ile Thr Lys Trp Ile Ile Gln Ala
1685 1690 1695
Asp Thr Leu Leu Asp Glu Ser Glu Lys Lys Lys Pro Gln Gln Lys
1700 1705 1710
Glu Asp Val Leu Lys Arg Leu Lys Ala Glu Leu Asn Asp Ile Arg
1715 1720 1725
Pro Lys Val Asp Ser Thr Arg Asp Gln Ala Ala Asn Leu Met Ala
1730 1735 1740
Asn Arg Gly Asp His Cys Arg Lys Leu Val Glu Pro Gln Ile Ser
1745 1750 1755
Glu Leu Asn His Arg Phe Ala Ala Ile Ser His Arg Ile Lys Thr
1760 1765 1770
Gly Lys Ala Ser Ile Pro Leu Lys Glu Leu Glu Gln Phe Asn Ser
1775 1780 1785
Asp Ile Gln Lys Leu Leu Glu Pro Leu Glu Ala Glu Ile Gln Gln
1790 1795 1800
Gly Val Asn Leu Lys Glu Glu Asp Phe Asn Lys Asp Met Asn Glu
1805 1810 1815
Asp Asn Glu Gly Thr Val Lys Glu Leu Leu Gln Arg Gly Asp Asn
1820 1825 1830
Leu Gln Gln Arg Ile Thr Asp Glu Arg Lys Arg Glu Glu Ile Lys
1835 1840 1845
Ile Lys Gln Gln Leu Leu Gln Thr Lys His Asn Ala Leu Lys Asp
1850 1855 1860
Leu Arg Ser Gln Arg Arg Lys Lys Ala Leu Glu Ile Ser His Gln
1865 1870 1875
Trp Tyr Gln Tyr Lys Arg Gln Ala Asp Asp Leu Leu Lys Cys Leu
1880 1885 1890
Asp Asp Ile Glu Lys Lys Leu Ala Ser Leu Pro Glu Pro Arg Asp
1895 1900 1905
Glu Arg Lys Ile Lys Glu Ile Asp Arg Glu Leu Gln Lys Lys Lys
1910 1915 1920
Glu Glu Leu Asn Ala Val Arg Arg Gln Ala Glu Gly Leu Ser Glu
1925 1930 1935
Asp Gly Ala Ala Met Ala Val Glu Pro Thr Gln Ile Gln Leu Ser
1940 1945 1950
Lys Arg Trp Arg Glu Ile Glu Ser Lys Phe Ala Gln Phe Arg Arg
1955 1960 1965
Leu Asn Phe Ala Gln Ile His Thr Val Arg Glu Glu Thr Met Met
1970 1975 1980
Val Met Thr Glu Asp Met Pro Leu Glu Ile Ser Tyr Val Pro Ser
1985 1990 1995
Thr Tyr Leu Thr Glu Ile Thr His Val Ser Gln Ala Leu Leu Glu
2000 2005 2010
Val Glu Gln Leu Leu Asn Ala Pro Asp Leu Cys Ala Lys Asp Phe
2015 2020 2025
Glu Asp Leu Phe Lys Gln Glu Glu Ser Leu Lys Asn Ile Lys Asp
2030 2035 2040
Ser Leu Gln Gln Ser Ser Gly Arg Ile Asp Ile Ile His Ser Lys
2045 2050 2055
Lys Thr Ala Ala Leu Gln Ser Ala Thr Pro Val Glu Arg Val Lys
2060 2065 2070
Leu Gln Glu Ala Leu Ser Gln Leu Asp Phe Gln Trp Glu Lys Val
2075 2080 2085
Asn Lys Met Tyr Lys Asp Arg Gln Gly Arg Phe Asp Arg Ser Val
2090 2095 2100
Glu Lys Trp Arg Arg Phe His Tyr Asp Ile Lys Ile Phe Asn Gln
2105 2110 2115
Trp Leu Thr Glu Ala Glu Gln Phe Leu Arg Lys Thr Gln Ile Pro
2120 2125 2130
Glu Asn Trp Glu His Ala Lys Tyr Lys Trp Tyr Leu Lys Glu Leu
2135 2140 2145
Gln Asp Gly Ile Gly Gln Arg Gln Thr Val Val Arg Thr Leu Asn
2150 2155 2160
Ala Thr Gly Glu Glu Ile Ile Gln Gln Ser Ser Lys Thr Asp Ala
2165 2170 2175
Ser Ile Leu Gln Glu Lys Leu Gly Ser Leu Asn Leu Arg Trp Gln
2180 2185 2190
Glu Val Cys Lys Gln Leu Ser Asp Arg Lys Lys Arg Leu Glu Glu
2195 2200 2205
Gln Lys Asn Ile Leu Ser Glu Phe Gln Arg Asp Leu Asn Glu Phe
2210 2215 2220
Val Leu Trp Leu Glu Glu Ala Asp Asn Ile Ala Ser Ile Pro Leu
2225 2230 2235
Glu Pro Gly Lys Glu Gln Gln Leu Lys Glu Lys Leu Glu Gln Val
2240 2245 2250
Lys Leu Leu Val Glu Glu Leu Pro Leu Arg Gln Gly Ile Leu Lys
2255 2260 2265
Gln Leu Asn Glu Thr Gly Gly Pro Val Leu Val Ser Ala Pro Ile
2270 2275 2280
Ser Pro Glu Glu Gln Asp Lys Leu Glu Asn Lys Leu Lys Gln Thr
2285 2290 2295
Asn Leu Gln Trp Ile Lys Val Ser Arg Ala Leu Pro Glu Lys Gln
2300 2305 2310
Gly Glu Ile Glu Ala Gln Ile Lys Asp Leu Gly Gln Leu Glu Lys
2315 2320 2325
Lys Leu Glu Asp Leu Glu Glu Gln Leu Asn His Leu Leu Leu Trp
2330 2335 2340
Leu Ser Pro Ile Arg Asn Gln Leu Glu Ile Tyr Asn Gln Pro Asn
2345 2350 2355
Gln Glu Gly Pro Phe Asp Val Gln Glu Thr Glu Ile Ala Val Gln
2360 2365 2370
Ala Lys Gln Pro Asp Val Glu Glu Ile Leu Ser Lys Gly Gln His
2375 2380 2385
Leu Tyr Lys Glu Lys Pro Ala Thr Gln Pro Val Lys Arg Lys Leu
2390 2395 2400
Glu Asp Leu Ser Ser Glu Trp Lys Ala Val Asn Arg Leu Leu Gln
2405 2410 2415
Glu Leu Arg Ala Lys Gln Pro Asp Leu Ala Pro Gly Leu Thr Thr
2420 2425 2430
Ile Gly Ala Ser Pro Thr Gln Thr Val Thr Leu Val Thr Gln Pro
2435 2440 2445
Val Val Thr Lys Glu Thr Ala Ile Ser Lys Leu Glu Met Pro Ser
2450 2455 2460
Ser Leu Met Leu Glu Val Pro Ala Leu Ala Asp Phe Asn Arg Ala
2465 2470 2475
Trp Thr Glu Leu Thr Asp Trp Leu Ser Leu Leu Asp Gln Val Ile
2480 2485 2490
Lys Ser Gln Arg Val Met Val Gly Asp Leu Glu Asp Ile Asn Glu
2495 2500 2505
Met Ile Ile Lys Gln Lys Ala Thr Met Gln Asp Leu Glu Gln Arg
2510 2515 2520
Arg Pro Gln Leu Glu Glu Leu Ile Thr Ala Ala Gln Asn Leu Lys
2525 2530 2535
Asn Lys Thr Ser Asn Gln Glu Ala Arg Thr Ile Ile Thr Asp Arg
2540 2545 2550
Ile Glu Arg Ile Gln Asn Gln Trp Asp Glu Val Gln Glu His Leu
2555 2560 2565
Gln Asn Arg Arg Gln Gln Leu Asn Glu Met Leu Lys Asp Ser Thr
2570 2575 2580
Gln Trp Leu Glu Ala Lys Glu Glu Ala Glu Gln Val Leu Gly Gln
2585 2590 2595
Ala Arg Ala Lys Leu Glu Ser Trp Lys Glu Gly Pro Tyr Thr Val
2600 2605 2610
Asp Ala Ile Gln Lys Lys Ile Thr Glu Thr Lys Gln Leu Ala Lys
2615 2620 2625
Asp Leu Arg Gln Trp Gln Thr Asn Val Asp Val Ala Asn Asp Leu
2630 2635 2640
Ala Leu Lys Leu Leu Arg Asp Tyr Ser Ala Asp Asp Thr Arg Lys
2645 2650 2655
Val His Met Ile Thr Glu Asn Ile Asn Ala Ser Trp Arg Ser Ile
2660 2665 2670
His Lys Arg Val Ser Glu Arg Glu Ala Ala Leu Glu Glu Thr His
2675 2680 2685
Arg Leu Leu Gln Gln Phe Pro Leu Asp Leu Glu Lys Phe Leu Ala
2690 2695 2700
Trp Leu Thr Glu Ala Glu Thr Thr Ala Asn Val Leu Gln Asp Ala
2705 2710 2715
Thr Arg Lys Glu Arg Leu Leu Glu Asp Ser Lys Gly Val Lys Glu
2720 2725 2730
Leu Met Lys Gln Trp Gln Asp Leu Gln Gly Glu Ile Glu Ala His
2735 2740 2745
Thr Asp Val Tyr His Asn Leu Asp Glu Asn Ser Gln Lys Ile Leu
2750 2755 2760
Arg Ser Leu Glu Gly Ser Asp Asp Ala Val Leu Leu Gln Arg Arg
2765 2770 2775
Leu Asp Asn Met Asn Phe Lys Trp Ser Glu Leu Arg Lys Lys Ser
2780 2785 2790
Leu Asn Ile Arg Ser His Leu Glu Ala Ser Ser Asp Gln Trp Lys
2795 2800 2805
Arg Leu His Leu Ser Leu Gln Glu Leu Leu Val Trp Leu Gln Leu
2810 2815 2820
Lys Asp Asp Glu Leu Ser Arg Gln Ala Pro Ile Gly Gly Asp Phe
2825 2830 2835
Pro Ala Val Gln Lys Gln Asn Asp Val His Arg Ala Phe Lys Arg
2840 2845 2850
Glu Leu Lys Thr Lys Glu Pro Val Ile Met Ser Thr Leu Glu Thr
2855 2860 2865
Val Arg Ile Phe Leu Thr Glu Gln Pro Leu Glu Gly Leu Glu Lys
2870 2875 2880
Leu Tyr Gln Glu Pro Arg Glu Leu Pro Pro Glu Glu Arg Ala Gln
2885 2890 2895
Asn Val Thr Arg Leu Leu Arg Lys Gln Ala Glu Glu Val Asn Thr
2900 2905 2910
Glu Trp Glu Lys Leu Asn Leu His Ser Ala Asp Trp Gln Arg Lys
2915 2920 2925
Ile Asp Glu Thr Leu Glu Arg Leu Gln Glu Leu Gln Glu Ala Thr
2930 2935 2940
Asp Glu Leu Asp Leu Lys Leu Arg Gln Ala Glu Val Ile Lys Gly
2945 2950 2955
Ser Trp Gln Pro Val Gly Asp Leu Leu Ile Asp Ser Leu Gln Asp
2960 2965 2970
His Leu Glu Lys Val Lys Ala Leu Arg Gly Glu Ile Ala Pro Leu
2975 2980 2985
Lys Glu Asn Val Ser His Val Asn Asp Leu Ala Arg Gln Leu Thr
2990 2995 3000
Thr Leu Gly Ile Gln Leu Ser Pro Tyr Asn Leu Ser Thr Leu Glu
3005 3010 3015
Asp Leu Asn Thr Arg Trp Lys Leu Leu Gln Val Ala Val Glu Asp
3020 3025 3030
Arg Val Arg Gln Leu His Glu Ala His Arg Asp Phe Gly Pro Ala
3035 3040 3045
Ser Gln His Phe Leu Ser Thr Ser Val Gln Gly Pro Trp Glu Arg
3050 3055 3060
Ala Ile Ser Pro Asn Lys Val Pro Tyr Tyr Ile Asn His Glu Thr
3065 3070 3075
Gln Thr Thr Cys Trp Asp His Pro Lys Met Thr Glu Leu Tyr Gln
3080 3085 3090
Ser Leu Ala Asp Leu Asn Asn Val Arg Phe Ser Ala Tyr Arg Thr
3095 3100 3105
Ala Met Lys Leu Arg Arg Leu Gln Lys Ala Leu Cys Leu Asp Leu
3110 3115 3120
Leu Ser Leu Ser Ala Ala Cys Asp Ala Leu Asp Gln His Asn Leu
3125 3130 3135
Lys Gln Asn Asp Gln Pro Met Asp Ile Leu Gln Ile Ile Asn Cys
3140 3145 3150
Leu Thr Thr Ile Tyr Asp Arg Leu Glu Gln Glu His Asn Asn Leu
3155 3160 3165
Val Asn Val Pro Leu Cys Val Asp Met Cys Leu Asn Trp Leu Leu
3170 3175 3180
Asn Val Tyr Asp Thr Gly Arg Thr Gly Arg Ile Arg Val Leu Ser
3185 3190 3195
Phe Lys Thr Gly Ile Ile Ser Leu Cys Lys Ala His Leu Glu Asp
3200 3205 3210
Lys Tyr Arg Tyr Leu Phe Lys Gln Val Ala Ser Ser Thr Gly Phe
3215 3220 3225
Cys Asp Gln Arg Arg Leu Gly Leu Leu Leu His Asp Ser Ile Gln
3230 3235 3240
Ile Pro Arg Gln Leu Gly Glu Val Ala Ser Phe Gly Gly Ser Asn
3245 3250 3255
Ile Glu Pro Ser Val Arg Ser Cys Phe Gln Phe Ala Asn Asn Lys
3260 3265 3270
Pro Glu Ile Glu Ala Ala Leu Phe Leu Asp Trp Met Arg Leu Glu
3275 3280 3285
Pro Gln Ser Met Val Trp Leu Pro Val Leu His Arg Val Ala Ala
3290 3295 3300
Ala Glu Thr Ala Lys His Gln Ala Lys Cys Asn Ile Cys Lys Glu
3305 3310 3315
Cys Pro Ile Ile Gly Phe Arg Tyr Arg Ser Leu Lys His Phe Asn
3320 3325 3330
Tyr Asp Ile Cys Gln Ser Cys Phe Phe Ser Gly Arg Val Ala Lys
3335 3340 3345
Gly His Lys Met His Tyr Pro Met Val Glu Tyr Cys Thr Pro Thr
3350 3355 3360
Thr Ser Gly Glu Asp Val Arg Asp Phe Ala Lys Val Leu Lys Asn
3365 3370 3375
Lys Phe Arg Thr Lys Arg Tyr Phe Ala Lys His Pro Arg Met Gly
3380 3385 3390
Tyr Leu Pro Val Gln Thr Val Leu Glu Gly Asp Asn Met Glu Thr
3395 3400 3405
Pro Val Thr Leu Ile Asn Phe Trp Pro Val Asp Ser Ala Pro Ala
3410 3415 3420
Ser Ser Pro Gln Leu Ser His Asp Asp Thr His Ser Arg Ile Glu
3425 3430 3435
His Tyr Ala Ser Arg Leu Ala Glu Met Glu Asn Ser Asn Gly Ser
3440 3445 3450
Tyr Leu Asn Asp Ser Ile Ser Pro Asn Glu Ser Ile Asp Asp Glu
3455 3460 3465
His Leu Leu Ile Gln His Tyr Cys Gln Ser Leu Asn Gln Asp Ser
3470 3475 3480
Pro Leu Ser Gln Pro Arg Ser Pro Ala Gln Ile Leu Ile Ser Leu
3485 3490 3495
Glu Ser Glu Glu Arg Gly Glu Leu Glu Arg Ile Leu Ala Asp Leu
3500 3505 3510
Glu Glu Glu Asn Arg Asn Leu Gln Ala Glu Tyr Asp Arg Leu Lys
3515 3520 3525
Gln Gln His Glu His Lys Gly Leu Ser Pro Leu Pro Ser Pro Pro
3530 3535 3540
Glu Met Met Pro Thr Ser Pro Gln Ser Pro Arg Asp Ala Glu Leu
3545 3550 3555
Ile Ala Glu Ala Lys Leu Leu Arg Gln His Lys Gly Arg Leu Glu
3560 3565 3570
Ala Arg Met Gln Ile Leu Glu Asp His Asn Lys Gln Leu Glu Ser
3575 3580 3585
Gln Leu His Arg Leu Arg Gln Leu Leu Glu Gln Pro Gln Ala Glu
3590 3595 3600
Ala Lys Val Asn Gly Thr Thr Val Ser Ser Pro Ser Thr Ser Leu
3605 3610 3615
Gln Arg Ser Asp Ser Ser Gln Pro Met Leu Leu Arg Val Val Gly
3620 3625 3630
Ser Gln Thr Ser Asp Ser Met Gly Glu Glu Asp Leu Leu Ser Pro
3635 3640 3645
Pro Gln Asp Thr Ser Thr Gly Leu Glu Glu Val Met Glu Gln Leu
3650 3655 3660
Asn Asn Ser Phe Pro Ser Ser Arg Gly Arg Asn Thr Pro Gly Lys
3665 3670 3675
Pro Met Arg Glu Asp Thr Met
3680 3685
<210> 26
<211> 3978
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Не кодон-оптимизированный ген Dys3978
<400> 26
atgctttggt gggaagaagt agaggactgt tatgaaagag aagatgttca aaagaaaaca 60
ttcacaaaat gggtaaatgc acaattttct aagtttggga agcagcatat tgagaacctc 120
ttcagtgacc tacaggatgg gaggcgcctc ctagacctcc tcgaaggcct gacagggcaa 180
aaactgccaa aagaaaaagg atccacaaga gttcatgccc tgaacaatgt caacaaggca 240
ctgcgggttt tgcagaacaa taatgttgat ttagtgaata ttggaagtac tgacatcgta 300
gatggaaatc ataaactgac tcttggtttg atttggaata taatcctcca ctggcaggtc 360
aaaaatgtaa tgaaaaatat catggctgga ttgcaacaaa ccaacagtga aaagattctc 420
ctgagctggg tccgacaatc aactcgtaat tatccacagg ttaatgtaat caacttcacc 480
accagctggt ctgatggcct ggctttgaat gctctcatcc atagtcatag gccagaccta 540
tttgactgga atagtgtggt ttgccagcag tcagccacac aacgactgga acatgcattc 600
aacatcgcca gatatcaatt aggcatagag aaactactcg atcctgaaga tgttgatacc 660
acctatccag ataagaagtc catcttaatg tacatcacat cactcttcca agttttgcct 720
caacaagtga gcattgaagc catccaggaa gtggaaatgt tgccaaggcc acctaaagtg 780
actaaagaag aacattttca gttacatcat caaatgcact attctcaaca gatcacggtc 840
agtctagcac agggatatga gagaacttct tcccctaagc ctcgattcaa gagctatgcc 900
tacacacagg ctgcttatgt caccacctct gaccctacac ggagcccatt tccttcacag 960
catttggaag ctcctgaaga caagtcattt ggcagttcat tgatggagag tgaagtaaac 1020
ctggaccgtt atcaaacagc tttagaagaa gtattatcgt ggcttctttc tgctgaggac 1080
acattgcaag cacaaggaga gatttctaat gatgtggaag tggtgaaaga ccagtttcat 1140
actcatgagg ggtacatgat ggatttgaca gcccatcagg gccgggttgg taatattcta 1200
caattgggaa gtaagctgat tggaacagga aaattatcag aagatgaaga aactgaagta 1260
caagagcaga tgaatctcct aaattcaaga tgggaatgcc tcagggtagc tagcatggaa 1320
aaacaaagca atttacatag agttttaatg gatctccaga atcagaaact gaaagagttg 1380
aatgactggc taacaaaaac agaagaaaga acaaggaaaa tggaggaaga gcctcttgga 1440
cctgatcttg aagacctaaa acgccaagta caacaacata aggtgcttca agaagatcta 1500
gaacaagaac aagtcagggt caattctctc actcacatgg tggtggtagt tgatgaatct 1560
agtggagatc acgcaactgc tgctttggaa gaacaactta aggtattggg agatcgatgg 1620
gcaaacatct gtagatggac agaagaccgc tgggttcttt tacaagacca gcctgaccta 1680
gctcctggac tgaccactat tggagcctct cctactcaga ctgttactct ggtgacacaa 1740
cctgtggtta ctaaggaaac tgccatctcc aaactagaaa tgccatcttc cttgatgttg 1800
gaggtaccta ctcatagatt actgcaacag ttccccctgg acctggaaaa gtttcttgcc 1860
tggcttacag aagctgaaac aactgccaat gtcctacagg atgctacccg taaggaaagg 1920
ctcctagaag actccaaggg agtaaaagag ctgatgaaac aatggcaaga cctccaaggt 1980
gaaattgaag ctcacacaga tgtttatcac aacctggatg aaaacagcca aaaaatcctg 2040
agatccctgg aaggttccga tgatgcagtc ctgttacaaa gacgtttgga taacatgaac 2100
ttcaagtgga gtgaacttcg gaaaaagtct ctcaacatta ggtcccattt ggaagccagt 2160
tctgaccagt ggaagcgtct gcacctttct ctgcaggaac ttctggtgtg gctacagctg 2220
aaagatgatg aattaagccg gcaggcacct attggaggcg actttccagc agttcagaag 2280
cagaacgatg tacatagggc cttcaagagg gaattgaaaa ctaaagaacc tgtaatcatg 2340
agtactcttg agactgtacg aatatttctg acagagcagc ctttggaagg actagagaaa 2400
ctctaccagg agcccagaga gctgcctcct gaggagagag cccagaatgt cactcggctt 2460
ctacgaaagc aggctgagga ggtcaatact gagtgggaaa aattgaacct gcactccgct 2520
gactggcaga gaaaaataga tgagaccctt gaaagactcc aggaacttca agaggccacg 2580
gatgagctgg acctcaagct gcgccaagct gaggtgatca agggatcctg gcagcccgtg 2640
ggcgatctcc tcattgactc tctccaagat cacctcgaga aagtcaaggc acttcgagga 2700
gaaattgcgc ctctgaaaga gaacgtgagc cacgtcaatg accttgctcg ccagcttacc 2760
actttgggca ttcagctctc accgtataac ctcagcactc tggaagacct gaacaccaga 2820
tggaagcttc tgcaggtggc cgtcgaggac cgagtcaggc agctgcatga agcccacagg 2880
gactttggtc cagcatctca gcactttctt tccacgtctg tccagggtcc ctgggagaga 2940
gccatctcgc caaacaaagt gccctactat atcaaccacg agactcaaac aacttgctgg 3000
gaccatccca aaatgacaga gctctaccag tctttagctg acctgaataa tgtcagattc 3060
tcagcttata ggactgccat gaaactccga agactgcaga aggccctttg cttggatctc 3120
ttgagcctgt cagctgcatg tgatgccttg gaccagcaca acctcaagca aaatgaccag 3180
cccatggata tcctgcagat tattaattgt ttgaccacta tttatgaccg cctggagcaa 3240
gagcacaaca atttggtcaa cgtccctctc tgcgtggata tgtgtctgaa ctggctgctg 3300
aatgtttatg atacgggacg aacagggagg atccgtgtcc tgtcttttaa aactggcatc 3360
atttccctgt gtaaagcaca tttggaagac aagtacagat accttttcaa gcaagtggca 3420
agttcaacag gattttgtga ccagcgcagg ctgggcctcc ttctgcatga ttctatccaa 3480
attccaagac agttgggtga agttgcatcc tttgggggca gtaacattga gccaagtgtc 3540
cggagctgct tccaatttgc taataataag ccagagatcg aagcggccct cttcctagac 3600
tggatgagac tggaacccca gtccatggtg tggctgcccg tcctgcacag agtggctgct 3660
gcagaaactg ccaagcatca ggccaaatgt aacatctgca aagagtgtcc aatcattgga 3720
ttcaggtaca ggagtctaaa gcactttaat tatgacatct gccaaagctg ctttttttct 3780
ggtcgagttg caaaaggcca taaaatgcac tatcccatgg tggaatattg cactccgact 3840
acatcaggag aagatgttcg agactttgcc aaggtactaa aaaacaaatt tcgaaccaaa 3900
aggtattttg cgaagcatcc ccgaatgggc tacctgccag tgcagactgt cttagagggg 3960
gacaacatgg aaacttag 3978
<210> 27
<211> 1329
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> белок дельта3990
<400> 27
Met Val Trp Trp Glu Glu Val Glu Asp Cys Tyr Glu Arg Glu Asp Val
1 5 10 15
Gln Lys Lys Thr Phe Thr Lys Trp Val Asn Ala Gln Phe Ser Lys Phe
20 25 30
Gly Lys Gln His Ile Glu Asn Leu Phe Ser Asp Leu Gln Asp Gly Arg
35 40 45
Arg Leu Leu Asp Leu Leu Glu Gly Leu Thr Gly Gln Lys Leu Pro Lys
50 55 60
Glu Lys Gly Ser Thr Arg Val His Ala Leu Asn Asn Val Asn Lys Ala
65 70 75 80
Leu Arg Val Leu Gln Asn Asn Asn Val Asp Leu Val Asn Ile Gly Ser
85 90 95
Thr Asp Ile Val Asp Gly Asn His Lys Leu Thr Leu Gly Leu Ile Trp
100 105 110
Asn Ile Ile Leu His Trp Gln Val Lys Asn Val Met Lys Asn Ile Met
115 120 125
Ala Gly Leu Gln Gln Thr Asn Ser Glu Lys Ile Leu Leu Ser Trp Val
130 135 140
Arg Gln Ser Thr Arg Asn Tyr Pro Gln Val Asn Val Ile Asn Phe Thr
145 150 155 160
Thr Ser Trp Ser Asp Gly Leu Ala Leu Asn Ala Leu Ile His Ser His
165 170 175
Arg Pro Asp Leu Phe Asp Trp Asn Ser Val Val Cys Gln Gln Ser Ala
180 185 190
Thr Gln Arg Leu Glu His Ala Phe Asn Ile Ala Arg Tyr Gln Leu Gly
195 200 205
Ile Glu Lys Leu Leu Asp Pro Glu Asp Val Asp Thr Thr Tyr Pro Asp
210 215 220
Lys Lys Ser Ile Leu Met Tyr Ile Thr Ser Leu Phe Gln Val Leu Pro
225 230 235 240
Gln Gln Val Ser Ile Glu Ala Ile Gln Glu Val Glu Met Leu Pro Arg
245 250 255
Pro Pro Lys Val Thr Lys Glu Glu His Phe Gln Leu His His Gln Met
260 265 270
His Tyr Ser Gln Gln Ile Thr Val Ser Leu Ala Gln Gly Tyr Glu Arg
275 280 285
Thr Ser Ser Pro Lys Pro Arg Phe Lys Ser Tyr Ala Tyr Thr Gln Ala
290 295 300
Ala Tyr Val Thr Thr Ser Asp Pro Thr Arg Ser Pro Phe Pro Ser Gln
305 310 315 320
His Leu Glu Ala Pro Glu Asp Lys Ser Phe Gly Ser Ser Leu Met Glu
325 330 335
Ser Glu Val Asn Leu Asp Arg Tyr Gln Thr Ala Leu Glu Glu Val Leu
340 345 350
Ser Trp Leu Leu Ser Ala Glu Asp Thr Leu Gln Ala Gln Gly Glu Ile
355 360 365
Ser Asn Asp Val Glu Val Val Lys Asp Gln Phe His Thr His Glu Gly
370 375 380
Tyr Met Met Asp Leu Thr Ala His Gln Gly Arg Val Gly Asn Ile Leu
385 390 395 400
Gln Leu Gly Ser Lys Leu Ile Gly Thr Gly Lys Leu Ser Glu Asp Glu
405 410 415
Glu Thr Glu Val Gln Glu Gln Met Asn Leu Leu Asn Ser Arg Trp Glu
420 425 430
Cys Leu Arg Val Ala Ser Met Glu Lys Gln Ser Asn Leu His Arg Val
435 440 445
Leu Met Asp Leu Gln Asn Gln Lys Leu Lys Glu Leu Asn Asp Trp Leu
450 455 460
Thr Lys Thr Glu Glu Arg Thr Arg Lys Met Glu Glu Glu Pro Leu Gly
465 470 475 480
Pro Asp Leu Glu Asp Leu Lys Arg Gln Val Gln Gln His Lys Val Leu
485 490 495
Gln Glu Asp Leu Glu Gln Glu Gln Val Arg Val Asn Ser Leu Thr His
500 505 510
Met Val Val Val Val Asp Glu Ser Ser Gly Asp His Ala Thr Ala Ala
515 520 525
Leu Glu Glu Gln Leu Lys Val Leu Gly Asp Arg Trp Ala Asn Ile Cys
530 535 540
Arg Trp Thr Glu Asp Arg Trp Val Leu Leu Gln Asp Gln Pro Asp Leu
545 550 555 560
Ala Pro Gly Leu Thr Thr Ile Gly Ala Ser Pro Thr Gln Thr Val Thr
565 570 575
Leu Val Thr Gln Pro Val Val Thr Lys Glu Thr Ala Ile Ser Lys Leu
580 585 590
Glu Met Pro Ser Ser Leu Met Leu Glu Val Pro Thr His Arg Leu Leu
595 600 605
Gln Gln Phe Pro Leu Asp Leu Glu Lys Phe Leu Ala Trp Leu Thr Glu
610 615 620
Ala Glu Thr Thr Ala Asn Val Leu Gln Asp Ala Thr Arg Lys Glu Arg
625 630 635 640
Leu Leu Glu Asp Ser Lys Gly Val Lys Glu Leu Met Lys Gln Trp Gln
645 650 655
Asp Leu Gln Gly Glu Ile Glu Ala His Thr Asp Val Tyr His Asn Leu
660 665 670
Asp Glu Asn Ser Gln Lys Ile Leu Arg Ser Leu Glu Gly Ser Asp Asp
675 680 685
Ala Val Leu Leu Gln Arg Arg Leu Asp Asn Met Asn Phe Lys Trp Ser
690 695 700
Glu Leu Arg Lys Lys Ser Leu Asn Ile Arg Ser His Leu Glu Ala Ser
705 710 715 720
Ser Asp Gln Trp Lys Arg Leu His Leu Ser Leu Gln Glu Leu Leu Val
725 730 735
Trp Leu Gln Leu Lys Asp Asp Glu Leu Ser Arg Gln Ala Pro Ile Gly
740 745 750
Gly Asp Phe Pro Ala Val Gln Lys Gln Asn Asp Val His Arg Ala Phe
755 760 765
Lys Arg Glu Leu Lys Thr Lys Glu Pro Val Ile Met Ser Thr Leu Glu
770 775 780
Thr Val Arg Ile Phe Leu Thr Glu Gln Pro Leu Glu Gly Leu Glu Lys
785 790 795 800
Leu Tyr Gln Glu Pro Arg Glu Leu Pro Pro Glu Glu Arg Ala Gln Asn
805 810 815
Val Thr Arg Leu Leu Arg Lys Gln Ala Glu Glu Val Asn Thr Glu Trp
820 825 830
Glu Lys Leu Asn Leu His Ser Ala Asp Trp Gln Arg Lys Ile Asp Glu
835 840 845
Thr Leu Glu Arg Leu Gln Glu Leu Gln Glu Ala Thr Asp Glu Leu Asp
850 855 860
Leu Lys Leu Arg Gln Ala Glu Val Ile Lys Gly Ser Trp Gln Pro Val
865 870 875 880
Gly Asp Leu Leu Ile Asp Ser Leu Gln Asp His Leu Glu Lys Val Lys
885 890 895
Ala Leu Arg Gly Glu Ile Ala Pro Leu Lys Glu Asn Val Ser His Val
900 905 910
Asn Asp Leu Ala Arg Gln Leu Thr Thr Leu Gly Ile Gln Leu Ser Pro
915 920 925
Tyr Asn Leu Ser Thr Leu Glu Asp Leu Asn Thr Arg Trp Lys Leu Leu
930 935 940
Gln Val Ala Val Glu Asp Arg Val Arg Gln Leu His Glu Ala His Arg
945 950 955 960
Asp Phe Gly Pro Ala Ser Gln His Phe Leu Ser Thr Ser Val Gln Gly
965 970 975
Pro Trp Glu Arg Ala Ile Ser Pro Asn Lys Val Pro Tyr Tyr Ile Asn
980 985 990
His Glu Thr Gln Thr Thr Cys Trp Asp His Pro Lys Met Thr Glu Leu
995 1000 1005
Tyr Gln Ser Leu Ala Asp Leu Asn Asn Val Arg Phe Ser Ala Tyr
1010 1015 1020
Arg Thr Ala Met Lys Leu Arg Arg Leu Gln Lys Ala Leu Cys Leu
1025 1030 1035
Asp Leu Leu Ser Leu Ser Ala Ala Cys Asp Ala Leu Asp Gln His
1040 1045 1050
Asn Leu Lys Gln Asn Asp Gln Pro Met Asp Ile Leu Gln Ile Ile
1055 1060 1065
Asn Cys Leu Thr Thr Ile Tyr Asp Arg Leu Glu Gln Glu His Asn
1070 1075 1080
Asn Leu Val Asn Val Pro Leu Cys Val Asp Met Cys Leu Asn Trp
1085 1090 1095
Leu Leu Asn Val Tyr Asp Thr Gly Arg Thr Gly Arg Ile Arg Val
1100 1105 1110
Leu Ser Phe Lys Thr Gly Ile Ile Ser Leu Cys Lys Ala His Leu
1115 1120 1125
Glu Asp Lys Tyr Arg Tyr Leu Phe Lys Gln Val Ala Ser Ser Thr
1130 1135 1140
Gly Phe Cys Asp Gln Arg Arg Leu Gly Leu Leu Leu His Asp Ser
1145 1150 1155
Ile Gln Ile Pro Arg Gln Leu Gly Glu Val Ala Ser Phe Gly Gly
1160 1165 1170
Ser Asn Ile Glu Pro Ser Val Arg Ser Cys Phe Gln Phe Ala Asn
1175 1180 1185
Asn Lys Pro Glu Ile Glu Ala Ala Leu Phe Leu Asp Trp Met Arg
1190 1195 1200
Leu Glu Pro Gln Ser Met Val Trp Leu Pro Val Leu His Arg Val
1205 1210 1215
Ala Ala Ala Glu Thr Ala Lys His Gln Ala Lys Cys Asn Ile Cys
1220 1225 1230
Lys Glu Cys Pro Ile Ile Gly Phe Arg Tyr Arg Ser Leu Lys His
1235 1240 1245
Phe Asn Tyr Asp Ile Cys Gln Ser Cys Phe Phe Ser Gly Arg Val
1250 1255 1260
Ala Lys Gly His Lys Met His Tyr Pro Met Val Glu Tyr Cys Thr
1265 1270 1275
Pro Thr Thr Ser Gly Glu Asp Val Arg Asp Phe Ala Lys Val Leu
1280 1285 1290
Lys Asn Lys Phe Arg Thr Lys Arg Tyr Phe Ala Lys His Pro Arg
1295 1300 1305
Met Gly Tyr Leu Pro Val Gln Thr Val Leu Glu Gly Asp Asn Met
1310 1315 1320
Glu Thr Pro Asp Thr Met
1325
<210> 28
<211> 3990
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ген дельта3990
<400> 28
atggtttggt gggaagaagt agaggactgt tatgaaagag aagatgttca aaagaaaaca 60
ttcacaaaat gggtaaatgc acaattttct aagtttggga agcagcatat tgagaacctc 120
ttcagtgacc tacaggatgg gaggcgcctc ctagacctcc tcgaaggcct gacagggcaa 180
aaactgccaa aagaaaaagg atccacaaga gttcatgccc tgaacaatgt caacaaggca 240
ctgcgggttt tgcagaacaa taatgttgat ttagtgaata ttggaagtac tgacatcgta 300
gatggaaatc ataaactgac tcttggtttg atttggaata taatcctcca ctggcaggtc 360
aaaaatgtaa tgaaaaatat catggctgga ttgcaacaaa ccaacagtga aaagattctc 420
ctgagctggg tccgacaatc aactcgtaat tatccacagg ttaatgtaat caacttcacc 480
accagctggt ctgatggcct ggctttgaat gctctcatcc atagtcatag gccagaccta 540
tttgactgga atagtgtggt ttgccagcag tcagccacac aacgactgga acatgcattc 600
aacatcgcca gatatcaatt aggcatagag aaactactcg atcctgaaga tgttgatacc 660
acctatccag ataagaagtc catcttaatg tacatcacat cactcttcca agttttgcct 720
caacaagtga gcattgaagc catccaggaa gtggaaatgt tgccaaggcc acctaaagtg 780
actaaagaag aacattttca gttacatcat caaatgcact attctcaaca gatcacggtc 840
agtctagcac agggatatga gagaacttct tcccctaagc ctcgattcaa gagctatgcc 900
tacacacagg ctgcttatgt caccacctct gaccctacac ggagcccatt tccttcacag 960
catttggaag ctcctgaaga caagtcattt ggcagttcat tgatggagag tgaagtaaac 1020
ctggaccgtt atcaaacagc tttagaagaa gtattatcgt ggcttctttc tgctgaggac 1080
acattgcaag cacaaggaga gatttctaat gatgtggaag tggtgaaaga ccagtttcat 1140
actcatgagg ggtacatgat ggatttgaca gcccatcagg gccgggttgg taatattcta 1200
caattgggaa gtaagctgat tggaacagga aaattatcag aagatgaaga aactgaagta 1260
caagagcaga tgaatctcct aaattcaaga tgggaatgcc tcagggtagc tagcatggaa 1320
aaacaaagca atttacatag agttttaatg gatctccaga atcagaaact gaaagagttg 1380
aatgactggc taacaaaaac agaagaaaga acaaggaaaa tggaggaaga gcctcttgga 1440
cctgatcttg aagacctaaa acgccaagta caacaacata aggtgcttca agaagatcta 1500
gaacaagaac aagtcagggt caattctctc actcacatgg tggtggtagt tgatgaatct 1560
agtggagatc acgcaactgc tgctttggaa gaacaactta aggtattggg agatcgatgg 1620
gcaaacatct gtagatggac agaagaccgc tgggttcttt tacaagacca gcctgaccta 1680
gctcctggac tgaccactat tggagcctct cctactcaga ctgttactct ggtgacacaa 1740
cctgtggtta ctaaggaaac tgccatctcc aaactagaaa tgccatcttc cttgatgttg 1800
gaggtaccta ctcatagatt actgcaacag ttccccctgg acctggaaaa gtttcttgcc 1860
tggcttacag aagctgaaac aactgccaat gtcctacagg atgctacccg taaggaaagg 1920
ctcctagaag actccaaggg agtaaaagag ctgatgaaac aatggcaaga cctccaaggt 1980
gaaattgaag ctcacacaga tgtttatcac aacctggatg aaaacagcca aaaaatcctg 2040
agatccctgg aaggttccga tgatgcagtc ctgttacaaa gacgtttgga taacatgaac 2100
ttcaagtgga gtgaacttcg gaaaaagtct ctcaacatta ggtcccattt ggaagccagt 2160
tctgaccagt ggaagcgtct gcacctttct ctgcaggaac ttctggtgtg gctacagctg 2220
aaagatgatg aattaagccg gcaggcacct attggaggcg actttccagc agttcagaag 2280
cagaacgatg tacatagggc cttcaagagg gaattgaaaa ctaaagaacc tgtaatcatg 2340
agtactcttg agactgtacg aatatttctg acagagcagc ctttggaagg actagagaaa 2400
ctctaccagg agcccagaga gctgcctcct gaggagagag cccagaatgt cactcggctt 2460
ctacgaaagc aggctgagga ggtcaatact gagtgggaaa aattgaacct gcactccgct 2520
gactggcaga gaaaaataga tgagaccctt gaaagactcc aggaacttca agaggccacg 2580
gatgagctgg acctcaagct gcgccaagct gaggtgatca agggatcctg gcagcccgtg 2640
ggcgatctcc tcattgactc tctccaagat cacctcgaga aagtcaaggc acttcgagga 2700
gaaattgcgc ctctgaaaga gaacgtgagc cacgtcaatg accttgctcg ccagcttacc 2760
actttgggca ttcagctctc accgtataac ctcagcactc tggaagacct gaacaccaga 2820
tggaagcttc tgcaggtggc cgtcgaggac cgagtcaggc agctgcatga agcccacagg 2880
gactttggtc cagcatctca gcactttctt tccacgtctg tccagggtcc ctgggagaga 2940
gccatctcgc caaacaaagt gccctactat atcaaccacg agactcaaac aacttgctgg 3000
gaccatccca aaatgacaga gctctaccag tctttagctg acctgaataa tgtcagattc 3060
tcagcttata ggactgccat gaaactccga agactgcaga aggccctttg cttggatctc 3120
ttgagcctgt cagctgcatg tgatgccttg gaccagcaca acctcaagca aaatgaccag 3180
cccatggata tcctgcagat tattaattgt ttgaccacta tttatgaccg cctggagcaa 3240
gagcacaaca atttggtcaa cgtccctctc tgcgtggata tgtgtctgaa ctggctgctg 3300
aatgtttatg atacgggacg aacagggagg atccgtgtcc tgtcttttaa aactggcatc 3360
atttccctgt gtaaagcaca tttggaagac aagtacagat accttttcaa gcaagtggca 3420
agttcaacag gattttgtga ccagcgcagg ctgggcctcc ttctgcatga ttctatccaa 3480
attccaagac agttgggtga agttgcatcc tttgggggca gtaacattga gccaagtgtc 3540
cggagctgct tccaatttgc taataataag ccagagatcg aagcggccct cttcctagac 3600
tggatgagac tggaacccca gtccatggtg tggctgcccg tcctgcacag agtggctgct 3660
gcagaaactg ccaagcatca ggccaaatgt aacatctgca aagagtgtcc aatcattgga 3720
ttcaggtaca ggagtctaaa gcactttaat tatgacatct gccaaagctg ctttttttct 3780
ggtcgagttg caaaaggcca taaaatgcac tatcccatgg tggaatattg cactccgact 3840
acatcaggag aagatgttcg agactttgcc aaggtactaa aaaacaaatt tcgaaccaaa 3900
aggtattttg cgaagcatcc ccgaatgggc tacctgccag tgcagactgt cttagagggg 3960
gacaacatgg aaactcccga cacaatgtag 3990
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к генетическим конструкциям для экспрессии мини-дистрофина человека, и может быть использовано в медицине для лечения мышечной дистрофии Дюшенна (DMD) или другого мышечного заболевания, связанного с мутациями в гене DMD. Предложены кассета экспрессии, рекомбинантный векторный геном аденоассоциированного вируса (AAV), частицы рекомбинантного AAV (rAAV) для экспрессии белка мини-дистрофина человека, содержащие нуклеотидную последовательность, кодирующую белок мини-дистрофин человека с SEQ ID NO:7, а также способы получения и использования. Изобретение позволяет повысить эффективность терапии мышечного заболевания, связанного с мутациями в гене DMD, а также увеличить мышечную массу и силу у индивида. 13 н. и 25 з.п. ф-лы, 56 ил., 13 табл., 9 пр.
Формула
Документы, цитированные в отчёте о поиске
Дефектный рекомбинантный аденовирусный вектор (варианты)

Комментарии