Варианты рекомбинантных aav и их применения - RU2738421C2
Код документа: RU2738421C2
Чертежи




















Описание
РОДСТВЕННЫЕ ЗАЯВКИ
По этой заявке испрашивается приоритет по 35 закону Свода законов США, 119 (е) временной патентной заявки USSN 62/066856, поданный 21 октября 2014 года, озаглавленной «Варианты рекомбинантных AAV и их применения», полное содержание которой включено в настоящем описании в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Раскрытие в некоторых аспектах относится к выделенным нуклеиновым кислотам, композициям и наборам, используемым для идентификации аденоассоциированных вирусов в клетках. В некоторых аспектах, изобретение относится к новым AAV и способам их применения, а также к соответствующим наборам.
Предпосылки к созданию изобретения
Аденоассоциированный вирус (AAV) представляет собой небольшой и хелпер-зависимый вирус. Он был обнаружен в 1960-х годах в качестве загрязнителя препаратов аденовирусов (вирус, вызывающий простуду). Его рост в клетках зависит от наличия аденовируса, и поэтому он был назван как аденоассоциированный вирус. AAV-векторы появились в качестве эффективной платформы для переноса генов in vivo. Тем не менее, потребность в новых AAV-векторах для доставки генов сохраняется.
Краткое изложение сущности изобретения
Раскрытие в некоторых аспектах относится к новым AAV для возможности применения в генной терапии. В некоторых вариантах осуществления AAV, описанные в настоящем описании, содержат вариации аминокислот в одном или нескольких белках капсида, которые придают новые или улучшенные свойства тропизма к ткани. В соответствии с некоторыми вариантами осуществления, в настоящем описании были идентифицированы и описаны варианты AAV3B, AAV4 и AAV5, которые обладают полезными свойствами тканевой направленности. Например, изобретение относится к вариантам AAV3B, которые могут быть использованы для трансдуцирующих клеток, таких как, гепатоциты человека (например, присутствующие в ткани печени) и другие. Изобретение относится к вариантам AAV4 и AAV5, которые могут быть использованы для нацеливания на клетки центральной нервной системы (ЦНС), кардиопульмональной ткани, глазной ткани и других тканей. В некоторых вариантах осуществления вариантные AAV, описанные в настоящем описании, нацеливают на ткань, отличную от ткани, на которую нацелены соответствующие им AAV дикого типа. В некоторых вариантах осуществления варианты AAV3B нацеливают на клетки центральной нервной системы (ЦНС) или сердца. В некоторых вариантах осуществления варианты AAV4 нацеливают на клетки печени или почек. В некоторых вариантах осуществления, варианты AAV5 нацеливают на клетки ЦНС, печени, селезенки или сердца.
Раскрытие в некоторых аспектах относится к выделенной нуклеиновой кислоте, содержащей последовательность, выбранную из группы, состоящей из: SEQ ID NO: 1-47, которая кодирует белок капсида ААV. В некоторых вариантах осуществления, изобретенипе относится к фрагменту выделенной нуклеиновой кислоты. В некоторых вариантах осуществления изобретения фрагмент выделенной нуклеиновой кислоты не кодирует пептид, который идентичен любой из последовательностей SEQ ID NO: 98-100.
Раскрытие в некоторых аспектах относится к выделенному капсидному белку ААV, содержащему аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 51-61. В некоторых вариантах осуществления изобретения выделенный капсидный белок ААV содержит последовательность, выбранную из группы, состоящей из: SEQ ID NO: 51-61, причем аминокислота последовательности, которая не совпадает с соответствующей аминокислотой последовательности, представленной в SEQ ID NO: 98, замещена консервативной заменой. В некоторых вариантах осуществления изобретения выделенный капсидный белок ААV содержит последовательность, выбранную из группы, состоящей из: SEQ ID NO: 62-67, причем аминокислота последовательности, которая не совпадает с соответствующей аминокислотой последовательности, представленной в SEQ ID NO: 99, замещена консервативной заменой. В некоторых вариантах осуществления изобретения выделенный капсидный белок ААV содержит последовательность, выбранную из группы, состоящей из: SEQ ID NO: 68-97, причем аминокислота последовательности, которая не совпадает с соответствующей аминокислотой последовательности, представленной в SEQ ID NO: 100, замещена консервативной заменой.
В некоторых аспектах настоящего раскрытия изобретение относится к композиции, которая содержит любой из вышеуказанных выделенных белков капсида ААV. В некоторых вариантах осуществления композиция дополнительно содержит фармацевтически приемлемый носитель. В некоторых вариантах осуществления изобретение относится к композиции одного или нескольких из выделенных белков капсида ААV по раскрытию и физиологически совместимого носителя.
В некоторых аспектах настоящего раскрытия изобретение относится к рекомбинантному AAV (rAAV), который содержит любой из вышеуказанных выделенных белков капсида ААV. В некоторых вариантах осуществления изобретение относится к композиции, содержащей rAAV, также содержит фармацевтически приемлемый носитель. Изобретение также относится к рекомбинантному ААV, причем рекомбинантный AAV включает один или несколько из выделенных белков капсида ААV по раскрытию.
В некоторых аспектах настоящего раскрытия изобретение относится к клетке-хозяину, которая содержит нуклеиновую кислоту, которая содержит кодирующую последовательность, выбранную из группы, состоящей из: SEQ ID NO: 1-47, которая функционально связана с промотором. В некоторых вариантах осуществления изобретение относится к композиции, содержащей клетку-хозяин и стерильную среду для культивирования клеток. В некоторых вариантах осуществления изобретение относится к композиции, содержащей клетку-хозяин и криоконсервант.
В соответствии с некоторыми аспектами настоящего изобретения, оно относится к способу доставки трансгена пациенту. В некоторых вариантах осуществления изобретения способ включает введение любого из вышеуказанных rAAV пациенту, причем rAAV содержит по меньшей мере один трансген, и причем rAAV инфицирует клетки ткани-мишени пациента. В некоторых вариантах осуществления пациент выбран из мыши, крысы, кролика, собаки, кошки, овцы, свиньи и примата, отличного от человека. В одном варианте осуществления пациентом является человек. В некоторых вариантах осуществления по меньшей мере один трансген представляет собой ген, кодирующий белок. В некоторых вариантах осуществления по меньшей мере один трансген кодирует малую интерферирующую нуклеиновую кислоту. В некоторых вариантах осуществления малая интерферирующая нуклеиновая кислота является микроРНК. В некоторых вариантах осуществления малая интерферирующая нуклеиновая кислота представляет собой микроРНК-губку или TuD-РНК, которая ингибирует активность по меньшей мере одной микроРНК у пациента. В некоторых вариантах осуществления микроРНК экспрессируется в клетке ткани-мишени. В некоторых вариантах осуществления тканью-мишенью является скелетная мышца, сердце, печень, поджелудочная железа, головной мозг или легкое.
В некоторых вариантах осуществления настоящего изобретения трансген экспрессирует транскрипт, который содержит по меньшей мере один сайт связывания микроРНК, причем микроРНК ингибирует активность трансгена в ткани, отличной от ткани-мишени, путем гибридизации с сайтом связывания. В некоторых вариантах осуществления rAAV вводят пациенту внутривенно, чрескожно, внутриглазно, интратекально, интрацеребрально, перорально, внутримышечно, подкожно, интраназально или путем ингаляции.
В соответствии с некоторыми аспектами настоящего изобретения, оно относится к способу создания соматической трансгенной животной модели. В некоторых вариантах осуществления изобретения способ включает введение любого из вышеуказанных rAAV животному, отличному от человека, причем rAAV содержит по меньшей мере один трансген, и причем rAAV инфицирует клетку ткани-мишени животного, отличного от человека. В некоторых вариантах осуществления по меньшей мере один трансген представляет собой ген, кодирующий белок. В некоторых вариантах осуществления по меньшей мере один трансген кодирует малую интерферирующую нуклеиновую кислоту. В некоторых вариантах осуществления по меньшей мере один трансген кодирует молекулу-репортер. В некоторых вариантах осуществления малая интерферирующая нуклеиновая кислота является микроРНК. В некоторых вариантах осуществления малая интерферирующая нуклеиновая кислота представляет собой микроРНК-губку или TUD РНК, которая ингибирует активность по меньшей мере одной микроРНК у животного. В некоторых вариантах осуществления микроРНК экспрессируется в клетке ткани-мишени. В некоторых вариантах осуществления, ткань-мишень является скелетной мышцей, сердцем, печенью, поджелудочной железой, головным мозгом или легким. В некоторых вариантах осуществления настоящего изобретения трансген экспрессирует транскрипт, который содержит по меньшей мере один сайт связывания микроРНК, причем микроРНК ингибирует активность трансгена в ткани, отличной от ткани-мишени, путем гибридизации с сайтом связывания.
В соответствии с некоторыми аспектами настоящего изобретения, оно относится к способам создания соматической трансгенной животной модели, которые включают введение любого из вышеуказанных rAAV животному, отличному от человека, причем rAAV содержит по меньшей мере один трансген, причем трансген экспрессирует транскрипт, который включает по меньшей мере один сайт связывания микроРНК, причем микроРНК ингибирует активность трансгена в ткани, отличной от ткани-мишени, путем гибридизации с сайтом связывания транскрипта. В некоторых вариантах осуществления трансген содержит тканеспецифический промотор или индуцируемый промотор. В некоторых вариантах осуществления, тканеспецифический промотор представляет собой промотор печень-специфического тироксин-связывающего глобулина (TBG), промотор инсулина, промотор глюкагона, промотор соматостатина, промотор панкреатического полипептида (PPY), промотор синапсина-1 (Syn), промотор креатинкиназа (MCK), промотор десмина млекопитающего (DES), промотор тяжелой цепи α-миозина(a-MHC) или промотор тропонина Т (cTnT) сердца. В некоторых вариантах осуществления rAAV вводят животному внутривенно, чрескожно, внутриглазно, интратекально, перорально, внутримышечно, подкожно, интраназально или путем ингаляции. В соответствии с некоторыми аспектами настоящего изобретения, оно относится к трансгенной соматической животной модели, которую получают с помощью любого из указанных выше способов.
В других аспектах настоящего раскрытия, изобретение относится к набору для получения rAAV. В некоторых вариантах осуществления набор содержит контейнер с выделенной нуклеиновой кислотой, имеющей любую из последовательностей SEQ ID NO: 1-47. В некоторых вариантах осуществления настоящего изобретения набор дополнительно содержит инструкции для получения rAAV. В некоторых вариантах осуществления настоящего изобретения набор дополнительно содержит по меньшей мере один контейнер с рекомбинантным AAV-вектором, причем рекомбинантный AAV-вектор содержит трансген.
В других аспектах настоящего раскрытия изобретение относится к набору, который содержит контейнер с рекомбинантным AAV, имеющим какие-либо из вышеуказанных выделенных белков капсида ААV. В некоторых вариантах осуществления, контейнер из набора является шприцем.
В других аспектах настоящее изобретение относится к применению векторов на основе AAV в качестве транспортного средства для доставки генов, терапевтических, профилактических и научно-исследовательских целей, а также для развития соматических трансгенных животных моделей. В некоторых аспектах изобретение относится к серотипам AAV, которые продемонстрировали отличный тропизм к ткани/ типу клеток и могут достичь стабильного соматического переноса генов в тканях животных на уровнях, сходных с уровнями для аденовирусных векторов (например, до 100% трансдукции тканей in vivo в зависимости от ткани-мишени и дозы вектора) при отсутствии связанной с вектором токсикологии. В других аспектах изобретение относится к серотипам AAV, имеющим возможност нацеливания на ткань печени, сердца, скелетной мышцы, мозга и поджелудочной железы. Эти ткани связаны с широким спектром заболеваний человека, включая множество метаболических, сердечно-сосудистых и диабетических заболеваний. В некоторых вариантах осуществления rAAV содержит по меньшей мере один трансген. Трансген может быть трансгеном, который вызывает патологическое состояние. В некоторых вариантах осуществления трансген кодирует белок, который оказывает воздействие на патологическое состояние.
В другом аспекте новые AAV по раскрытию могут быть использованы в способе доставки трансгена пациенту. Способ осуществляют путем введения rAAV по раскрытию пациенту, причем rAAV содержит по меньшей мере один трансген. В некоторых вариантах осуществления rAAV нацелен на заранее определенную ткань пациента.
В другом аспекте, AAV по раскрытию могут быть использованы в способе создания соматической трансгенной животной модели. Способ осуществляют путем введения rAAV по раскрытию животному, причем rAAV содержит по меньшей мере один трансген, причем трансген вызывает патологическое состояние, и причем rAAV нацелен на заранее определенную ткань животного.
В одном варианте осуществления rAAV имеет капсид AAV, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 51-97.
Трансген может экспрессировать ряд генов, в том числе гены, связанные со злокачественными новообразованиями, проапоптотические гены и гены, связанные с апоптозом. В некоторых вариантах осуществления трансген экспрессирует малую интерферирующую нуклеиновую кислоту, способную ингибировать экспрессию гена, связанного с злокачественными новообразованиями. В других вариантах осуществления трансген экспрессирует малую интерферирующую нуклеиновую кислоту, способную ингибировать экспрессию гена, связанного с апоптозом. Малая интерферирующая нуклеиновая кислота в других вариантах осуществления по изобретению представляет собой микроРНК или shRNA. В соответствии с другим вариантам осуществления, трансген экспрессирует токсин, причем необязательно токсин представляет собой DTA. В других вариантах осуществления трансген экспрессирует ген-репортер, который необязательно является ферментом-репортером, например, бета-галактозидазой или флуоресцентным белком, таким как GFP.
Трансген может экспрессировать микроРНК. В других вариантах осуществления трансген экспрессирует микроРНК-губку, причем микроРНК-губка ингибирует активность одной или нескольких микроРНК у животного. МикроРНК может являться эндогенной микроРНК, или она может экспрессироваться в клетке сердца, печени, скелетной мышцы, головного мозга или ткани поджелудочной железы, в некоторых вариантах осуществления.
В одном варианте осуществления тканью-мишенью AAV является гонада, диафрагма, сердце, желудок, печень, селезенка, поджелудочная железа или почка. rAAV может трансдуцировать много различных типов ткани, таких как мышечные волокна, плоскоклеточные эпителиальные клетки, клетки проксимальных или дистальных извитых канальцев почек, гландулоциты слизистой, эндотелиальные клетки кровеносных сосудов или клетки гладких мышц.
В некоторых вариантах осуществления rAAV вводят в дозе 1010, 1011, 1012, 1013, 1014 или 1015 геномных копий на пациент. В некоторых вариантах осуществления rAAV вводят в дозе 1010, 1011, 1012, 1013 или 1014геномных копий на кг. rAAV можно вводить любым путем. Например, он может быть введен внутривенно (например, путем инъекции в воротную вену), в некоторых вариантах осуществления.
В некоторых вариантах осуществления трансген включает тканеспецифический промотор, такой как промотор печень-специфического тироксин-связывающего глобулина (TBG), промотор инсулина, промотор глюкагона, промотор соматостатина, промотор панкреатического полипептида (PPY), промотор синапсина-1 (Syn), промотор креатинкиназы (MCK), промотор десмина млекопитающих (DES), промотор тяжелой цепи α-миозина (a-MHC) или промотор тропонина Т (cTnT) сердца.
Соматическое трансгенное животное-модель может представлять собой млекопитающее, такое как мышь, крыса, кролик, собака, кошка, овца, свинья, отличный от человека примат.
В некоторых вариантах осуществления предполагаемое терапевтическое средство может быть введено в соматическое трансгенное животное-модель, чтобы определить влияние предполагаемого терапевтического агента на патологическое состояние у животного.
В другом аспекте раскрытие представляет собой соматическое трансгенное животное, полученное с помощью способов, описанных в настоящей заявке.
Набор для получения rAAV, при помощи которого создают соматическое трансгенное животное, имеющее патологическое состояние в предварительно определенной ткани, предоставляется в соответствии с другим аспектом изобретения. Набор включает по меньшей мере один контейнер с рекомбинантным AAV-вектором, по меньшей мере один контейнер с компонентом rAAV-упаковки и инструкции для конструирования и упаковки рекомбинантного AAV.
Компонент для упаковки rAAV может включать клетку-хозяин, экспрессирующую по меньшей мере один rep-ген и/ или по меньшей мере один cap-ген. В некоторых вариантах осуществления клетка-хозяин представляет собой клетку 293. В других вариантах осуществления клетка-хозяин экспрессирует по меньшей мере один генный продукт хелперного вируса, который влияет на продуцирование rAAV, содержащего рекомбинантный AAV-вектор. По меньшей мере один cap-ген, может кодировать белок капсида серотипа AAV, который нацелен на предварительно определенную ткань.
В других вариантах осуществления компонент упаковки rAAV необязательно включает хелперный вирус, причем хелперный вирус представляет собой аденовирус или вирус герпеса.
rAAV-вектор и его компоненты могут включать любой из элементов, описанных в настоящем описании. Например, в некоторых вариантах осуществления настоящего изобретения rAAV-вектор содержит трансген, например, любой из описанных в настоящем описании трансгенов. В некоторых вариантах осуществления трансген экспрессирует ингибитор микроРНК (например, микроРНК-губку или TUD РНК), причем ингибитор микроРНК ингибирует активность одной или нескольких микроРНК у соматического трансгенного животного.
Каждое из ограничений изобретения может включать различные варианты осуществления настоящего изобретения. Поэтому предполагается, что каждое из ограничений раскрытия с участием какого-либо одного элемента или комбинации элементов может быть включено в каждый из аспектов настоящего изобретения. Настоящее изобретение не ограничено в его применении деталями конструкции и расположением компонентов, изложенных в последующем описании или проиллюстрированных в чертежах. Изобретение допускает другие варианты осуществления и может быть осуществлено или осуществляется различными способами.
ПОДПИСИ К ЧЕРТЕЖАМ
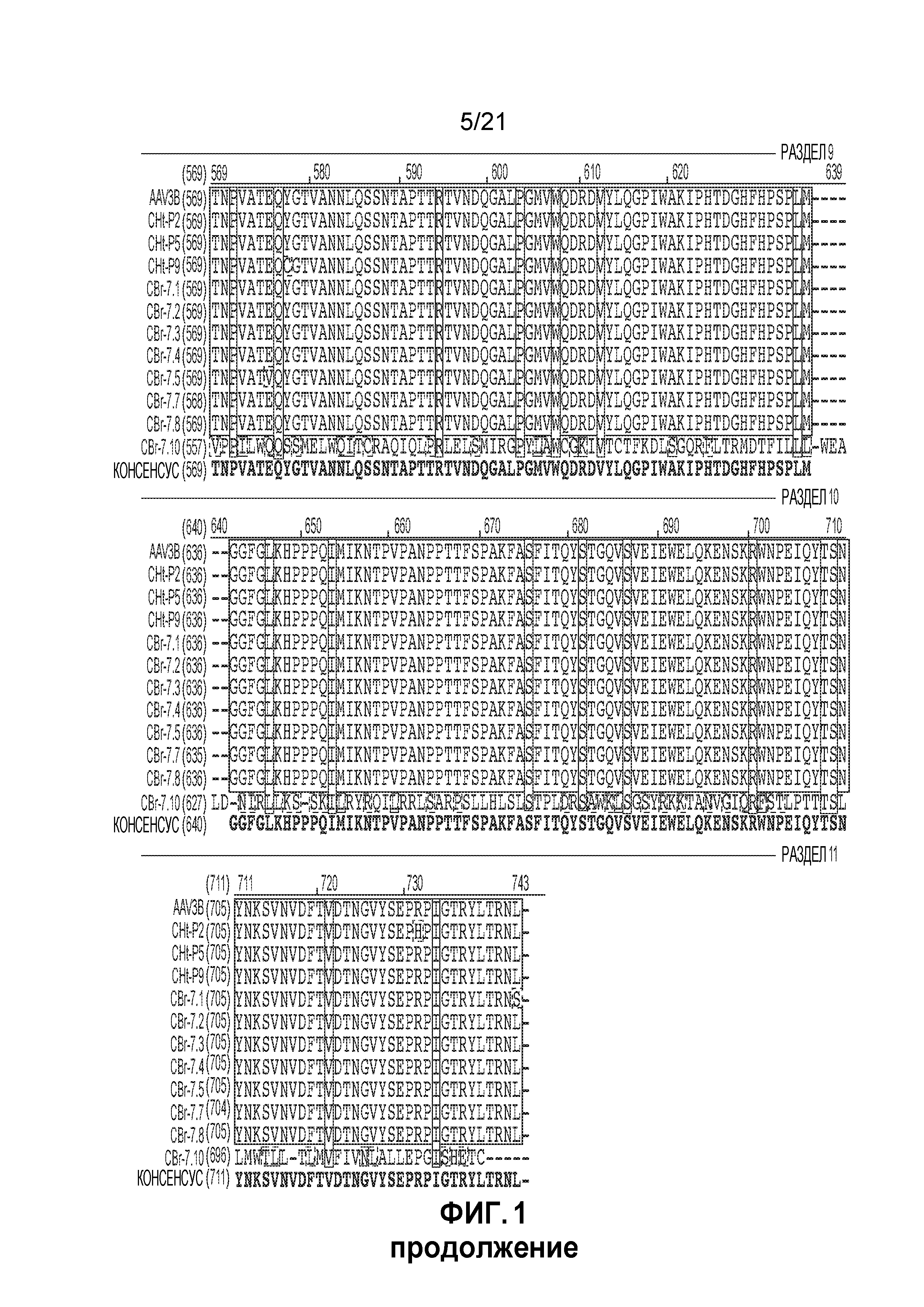
ФИГ. 1 иллюстрирует выравнивание вариантных капсидных последовательностей ААV 3B;
ФИГ. 2 иллюстрирует выравнивание вариантных капсидных последовательностей ААV 4;
ФИГ. 3 иллюстрирует выравнивание вариантных капсидных последовательностей ААV 5; и
ФИГ. 4 иллюстрирует результаты анализов трансдукции рекомбинантных AAV.
ПОДРОБНОЕ ОПИСАНИЕ
Адено-ассоциированный вирус (AAV) представляет собой небольшой ( ~26 нм), дефектный по репликации, необолочечный вирус, который, как правило, зависит от присутствия второго вируса, такого как аденовирус или вирус герпеса, для своего роста в клетках. Известно, что AAV вызывает заболевания и индуцирует очень мягкий иммунный ответ. AAV может инфицировать как делящиеся, так и не делящиеся клетки и может встраивать свой геном в геном клетки-хозяина. Эти особенности делают AAV очень привлекательным кандидатом для создания вирусных векторов для генной терапии. Прототипические AAV-векторы на основе серотипа 2 обеспечивали решающий эксперимент доказательства правильности концепции нетоксичного и стабильного переноса генов в моделях на мышах и крупных животных, однако демонстрировали низкую эффективность переноса генов для многих основных тканей-мишеней. Раскрытие в некоторых аспектах стремится преодолеть этот недостаток, предоставляя новый AAV, имеющий четко выраженные возможности тканевого нацеливания для генной терапии и научных исследований.
В некоторых аспектах настоящего раскрытия изобретение относится к новым белкам AAV-капсида при условии, которые имеют четко выраженные возможности тканевого нацеливания. В некоторых вариантах осуществления изобретения белки ААV-капсида выделяют из ткани, на которую нацелен ААV, включающий белок капсида. В некоторых аспектах предоставлены способы доставки трансгена в ткани-мишени у пациента. Способы доставки трансгена могут быть использованы для генной терапии (например, для лечения заболевания) или научно-исследовательских приложений (например, для создания соматического трансгенного животного-модели).
Способы обнаружения AAV
Большая часть биологии AAV зависит от его капсида. Поэтому способы обнаружения новых AAV были в значительной степени сосредоточены на выделении ДНК-последовательностей для AAV-капсидов. Главной особенностью скрытого жизненного цикла адено-ассоциированного вируса (AAV) является сохраняемость в виде интегрированных и/ или эписомных геномов в клетке-хозяине. Способы, используемые для выделения нового AAV, включают молекулярное восстановление на основе ПЦР латентных ДНК-геномов ААV, инфекционно вирусное восстановление латентного провирусного генома из тканевых ДНК in vitro при наличии хелперной функции аденовируса и восстановление кольцевого провирусного генома из тканевых ДНК путем ролинг-циклически-линейной амплификации, опосредованной изотермической полимеразой фага Phi-29. Все эти способы выделения используют латентность провирусных ДНК-геномов AAV и сфокусированы на восстановлении персистентной вирусной геномной ДНК.
Эндогенные латентные AAV-геномы транскрипционно активны в клетках млекопитающих (например, клетках тканей приматов, отличных от человека, таких как печень, селезенка и лимфатические узлы). Без желания связи с теорией, выдвинута гипотеза, что для поддержания AAV-персистенции в организме-хозяине может потребоваться низкий уровень транскрипции генов AAV, и полученные cap РНК могут служить более подходящими и обильными субстратами для получения функциональных последовательностей cap для развития вектора. Транскрипты как rep, так и cap генов детектируются с переменными содержанием при помощи способов детектирования РНК (например, ОT-ПЦР). Присутствие транскриптов гена cap и возможность получения кДНК РНК cap при помощи обратной транскрипции (ОТ) in vitro значительно увеличивает содержание матриц для восстановления на основе ПЦР новых cap последовательностей из тканей и повышения чувствительности нового AAV-раскрытия.
Новые cap последовательности также могут быть идентифицированы путем трансфекции клеток с тотальными клеточными ДНК, выделенными из тканей, которые несут провирусный AAV-геном при очень низком содержании. Клетки могут быть дополнительно трансфицированы генами, которые предоставляют функции хелперного вируса (например, аденовируса), чтобы вызвать и/ или стимулировать транскрипцию гена AAV в трансфицированных клетках. Новые cap последовательности по изобретению могут быть идентифицированы путем выделения cap мРНК из трансфицированных клеток, получения кДНК из мРНК (например, с помощью ОТ-ПЦР) и секвенирования кДНК.
Выделенные белки капсида и кодирующие их нуклеиновые кислоты
AAV, выделенные из млекопитающих, в частности, из отличных от человека приматов, можно использовать для создания векторов для переноса генов для клинического развития и применений в генной терапии человека. Изобретение предоставляет в некоторых аспектах новые AAV, которые были обнаружены в различных тканях приматов, отличных от человека с использованием способов, описанных в настоящей заявке. Нуклеиновые кислоты, кодирующие белки капсида этих новых AAV, были обнаружены как в вирусной геномной ДНК, так и в мРНК, выделенной из тканей приматов, отличных от человека. Нуклеиновые кислоты и белковые последовательности, а также другая информация о AAV приведены в таблицах 1 и 2, и в перечне последовательностей.
Выделенные нуклеиновые кислоты, которые кодируют белки AAV-капсида по раскрытию, включают любую нуклеиновую кислоту, имеющую последовательность, представленную любой из SEQ ID NO: от 1 до 47, а также любой нуклеиновой кислотой, имеющей последовательность с существенной гомологией к этому. В некоторых вариантах осуществления изобретение относится к выделенной нуклеиновой кислоте, которая имеет существенную гомологию с нуклеиновой кислотой, имеющей последовательность, представленную в любой из SEQ ID NO: от 1 до 47, но которая не кодирует белок, имеющий аминокислотную последовательность, как указано в любой из SEQ ID NO: от 98 до 100.
Кроме того, выделенные белки ААV-капсида по раскрытию включают в себя любой белок, имеющий аминокислотную последовательность, как указано в любой из SEQ ID NO: от 51 до 98, а также любого белка, имеющего существенную гомологию с ней. В некоторых вариантах осуществления изобретение предоставляет выделенный белок капсида, который имеет существенную гомологию с белком, имеющим последовательность, как указано в любой из SEQ ID NO: 98 до 100, но который не имеет аминокислотную последовательность, как указано в любой из SEQ ID NO: 98 до 100.
«Гомология» относится к проценту идентичности между двумя полинуклеотидными или двумя полипептидными фрагментами. Термин «существенная гомология», когда речь идет о нуклеиновой кислоте или ее фрагменте, указывает на то, что при оптимальном выравнивании с соответствующими нуклеотидными вставками или делециями с другой нуклеиновой кислотой (или ее комплементарной цепью), идентичность нуклеотидной последовательности составляет примерно от 90 до 100% выровненных последовательностей. Когда речь идет о полипептиде или его фрагменте, термин «существенная гомология» указывает на то, что при оптимальном выравнивании с соответствующими пробелами, вставками или делециями с другим полипептидом идентичность нуклеотидной последовательности составляет от примерно 90 до 100% выровненных последовательностей. Термин «высоко консервативный» означает, по меньшей мере, 80% идентичности, предпочтительно, по меньшей мере, 90% идентичности, и более предпочтительно, более чем 97% идентичности. В некоторых случаях высоко консервативный может относиться к 100% идентичности. Идентичность легко определяется специалистом в данной области техники, например, при помощи использования алгоритмов и компьютерных программ, известных специалистам в данной области техники.
Как описано в настоящем описании, выравнивание между последовательностями нуклеиновых кислот или полипептидов выполняется с использованием любой из множества публично или коммерчески доступных программ выравнивания нескольких последовательностей, таких как «CLUSTAL W», доступных через Web-серверы в Интернете. В качестве альтернативы можно также использовать утилиты Vector NTI. Есть также целый ряд алгоритмов, известных в данной области техники, которые могут быть использованы для определения идентичности нуклеотидных последовательностей, в том числе тех, которые содержатся в программах, описанных выше. В качестве другого примера, полинуклеотидные последовательности можно сравнивать с помощью BLASTN, которая предоставляет выравнивания и процент идентичности последовательности областей наилучшего совпадения между последовательностями запроса и поиска. Подобные программы доступны для сравнения аминокислотных последовательностей, например, программа "Clustal X", BLASTP. Как правило, любая из этих программ используются при настройках по умолчанию, хотя специалист в данной области может изменить эти настройки, как это необходимо. Кроме того, специалист в данной области может использовать другой алгоритм или компьютерную программу, которая предоставляет, по меньшей мере, уровень идентичности или выравнивания, как это предоставлено ссылочными алгоритмами и программами. Выравнивания могут быть использованы для идентификации соответствующих аминокислот между двумя белками или пептидами. «Соответствующая аминокислота» представляет собой аминокислотную последовательность белка или пептида, которая была выровнена с аминокислотой последовательности другого белка или пептида. Соответствующие аминокислоты могут быть идентичными или не идентичными. Соответствующая аминокислота, которая не является идентичной аминокислотой, может упоминаться как вариантная аминокислота. Таблицы соответствующих аминокислот среди различных AAV-вариантов представлены в таблицах 4-6.
В качестве альтернативы для нуклеиновых кислот, гомологию можно определить путем гибридизации полинуклеотидов в условиях, при которых образуются стабильные дуплексы между гомологичными участками, с последующим расщеплением нуклеазой(ами), специфической к однонитевой, и определением размера расщепленных фрагментов. ДНК-последовательности, которые в существенной степени являются гомологичными, могут быть идентифицированы в эксперименте Southern-гибридизации, например, при жестких условиях, как определено для данной конкретной системы. Определение соответствующих условий гибридизации находится в компетенции специалистов в данной области техники.
Последовательность «нуклеиновой кислоты» относится к последовательности ДНК или РНК. В некоторых вариантах осуществления термин нуклеиновая кислота захватывает последовательности, которые включают в себя любые из известных аналогов оснований ДНК и РНК, таких как, в качестве неограничивающих примеров, 4-ацетилцитозин, 8-гидрокси-N6-метил аденозин, азиридинилцитозин, псевдоизоцитозин, 5- (карбоксигидроксил-метил) урацил, 5-фторурацил, 5-бромурацил, 5- карбоксиметиламинометил-2-тиоурацил, 5-карбоксиметиламинометилурацил, дигидроурацил, инозин, N6-изопентениладенин, 1-метиладенин, 1-метилпсевдоурацил, 1-метилгуанин, 1-метилинозин, 2,2-диметилгуанин, 2-метиладенин, 2-метилгуанин, 3-метилцитозин, 5-метилцитозин, N6-метиладенин, 7-метилгуанин, 5- метиламинометилурацил, 5-метоксиаминометил-2-тиоурацил, бета-D-маннозилквеозин, 5'- метоксикарбонилметилурацил, 5- метоксиурацил, 2-метилтио-N6-изопентениладенин, метиловый эфир урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусную кислоту, оксибутоксозин, псевдоурацил, квеозин, 2-тиоцитозин, 5-метил-2-тиоурацил, 2-тиоурацил, 4-тиоурацил, 5-метилурацил, метиловый эфир -урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусную кислоту, псевдоурацил, квеозин, 2-тиоцитозин и 2,6-диаминопурин.
В некоторых вариантах осуществления, белки и нуклеиновые кислоты по раскрытию выделены. Как использовано в настоящем описании, термин «выделенный» означает искусственно полученный или произведенный. Используемый в настоящем описании по отношению к нуклеиновым кислотам термин «выделенный» обычно означает: (I) амплифицированный in vitro, например, полимеразной цепной реакции (ПЦР); (II) рекомбинантно продуцирован путем клонирования; (III) очищенный, например, путем расщепления и разделения в геле; или (IV) синтезированный с помощью, например, химического синтеза. Выделенная нуклеиновая кислота представляет собой такую, которой легко манипулировать с помощью способов рекомбинантной ДНК, хорошо известных в данной области техники. Таким образом, нуклеотидная последовательность, содержащаяся в векторе, в котором известны 5' и 3'-сайты рестрикции или для которого были раскрыты последовательности праймеров для полимеразной цепной реакции (ПЦР), считается выделенной, а последовательность нуклеиновых кислот, существующая в ее нативном состоянии в ее естественном хозяине, выделенной не считается. Выделенная нуклеиновая кислота может быть в существенной степени очищенной, но не обязательно. Например, нуклеиновая кислота, которая выделена в составе вектора для клонирования или экспрессии, не является чистой в том, что она может составлять только небольшой процент материала в клетке, в которой она находится. Впрочем, такая нуклеиновая кислота является выделенной, как этот термин используется в настоящем описании, поскольку ей легко манипулировать с помощью стандартных способов, известных специалистам в данной области техники. Используемый в настоящем описании в отношении белков или пептидов, термин «выделенный» в целом относится к белку или пептиду, который был искусственно получен или продуцирован (например, путем химического синтеза, с помощью технологии рекомбинантной ДНК и т.д.).
Следует иметь в виду, что можно сделать консервативные аминокислотные замены, чтобы предоставить функционально эквивалентные варианты или гомологи белков капсида. В некоторых аспектах раскрытие охватывает изменения последовательности, которые приводят к консервативным аминокислотным заменам. Как использовано в настоящем описании, консервативная аминокислотная замена относится к аминокислотной замене, которая не изменяет относительные характеристики заряда или размеров белка, в котором производится аминокислотная замена. Варианты могут быть получены в соответствии со способами изменения последовательности полипептида, известными любому специалисту в данной области техники, такими как можно найти в ссылках, которые компилируют такие способы, например, Molecular Cloning: A Laboratory Manual, J. Sambrook, et al., eds., Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989, or Current Protocols in Molecular Biology, F.M. Ausubel, et al., eds., John Wiley & Sons, Inc., New York. Консервативные аминокислотные замены включают замены, сделанные из аминокислот в пределах следующих групп: (а) М, I, L, V; (b) F, Y, W; (c) К, Р, Н; (d) A, G; (стандартное восточное время; (e) Q, N; и (f) Е, D. Таким образом, можно сделать консервативные аминокислотные замены в аминокислотной последовательности белков и полипептидов, описанных в настоящем описании.
Пример выделенной нуклеиновой кислоты, которая кодирует белок капсида ААV, представляет собой нуклеиновую кислоту, имеющую последовательность, выбранную из группы, состоящей из: SEQ ID NO: от 1 до 47. Фрагмент выделенной нуклеиновой кислоты, кодирующей последовательность капсида AAV, может быть полезен для конструирования нуклеиновой кислоты, кодирующей желаемую последовательность капсида. Фрагменты могут быть любой подходящей длины. В некоторых вариантах осуществления, фрагмент (часть) выделенной нуклеиновой кислоты, кодирующей последовательность капсида AAV может быть полезен для построения нуклеиновой кислоты, кодирующей желаемую последовательность капсида. Фрагменты могут быть любой соответствующей длины (например, по меньшей мере, 6, по меньшей мере, 9, по меньшей мере, 18, по меньшей мере, 36, по меньшей мере, 72, по меньшей мере, 144, по меньшей мере, 288, по меньшей мере, 576, по меньшей мере, 1152 или более нуклеотидов в длину). Например, фрагмент последовательности нуклеиновых кислот, кодирующей полипептид первого белка AAV-капсида, может быть использован для конструирования или может быть включен в последовательность нуклеиновых кислот, кодирующую вторую последовательность AAV-капсида, чтобы изменить свойства AAV капсида. В некоторых вариантах осуществления, белки ААV капсида, которые содержат фрагменты последовательности капсида из нескольких серотип AAV, называются химерными AAV капсидами. Фрагмент может представлять собой фрагмент, который не кодирует пептид, который идентичен любой из последовательностей SEQ ID NO: от 98 до 100. Например, фрагмент последовательности нуклеиновых кислот, кодирующий вариантную аминокислоту (по сравнению с известным AAV серотипом) может быть использован для конструирования, или может быть включен в последовательность нуклеиновых кислот, кодирующую последовательность AAV капсида, чтобы изменить свойства AAV капсида. В некоторых вариантах осуществления последовательность нуклеиновых кислот, кодирующая вариант AAV, может содержать от примерно 1 до примерно 100 аминокислотных вариантов по сравнению с известным AAV серотипом (например, AAV серотипа 3B, AAV4 или AAV5). В некоторых вариантах осуществления последовательность нуклеиновых кислот, кодирующая вариант AAV, может содержать приблизительно от 5 до приблизительно 50 вариантов аминокислот по сравнению с известным AAV серотипом (например, AAV серотипа 3B, AAV4 или AAV5). В некоторых вариантах осуществления последовательность нуклеиновых кислот, кодирующая вариант AAV, может содержать приблизительно от 10 до приблизительно 30 аминокислотных вариантов по сравнению с известным AAV серотипом (например, AAV серотипа 3B, AAV4 или AAV5).
В некоторых вариантах осуществления последовательность нуклеиновых кислот, кодирующая вариант AAV, может содержать 1 или 2, или 3, или 4, 5, или 6, или 7, или 8, или 9, или 10, или 11, или 12, или 13, или 14, или 15, или 16, или 17, или 18, или 19 или 20 аминокислотных вариантов по сравнению с известным AAV серотипом (например, AAV серотипа 3B, AAV4 или AAV5). Например, нуклеотидная последовательность, кодирующая AAV вариант (например, SEQ ID NO: 92 может содержать три аминокислотных варианта по сравнению с известным AAV серотипом (например, AAV5). Можно сконструировать рекомбинантную cap последовательность, имеющую одну или более из 3 аминокислотных вариантов, путем включения фрагментов последовательности нуклеиновых кислот, содержащей участок, кодирующий вариантную аминокислоту в последовательности нуклеиновых кислот, кодирующей известный AAV серотип. Фрагменты могут быть включены любым подходящим способом, в том числе с использованием сайт-направленного мутагенеза. Таким образом, могут быть созданы новые AAV варианты, обладающие новыми свойствами.
Рекомбинантные AAV
В некоторых аспектах настоящее изобретение предоставляет выделенные AAV. Используемый в настоящем описании по отношению к AAV термин «выделенный» относится к AAV, который был искусственно получен или продуцирован. Выделенные AAV могут быть получены с использованием рекомбинантных способов. Такие AAV упоминаются в настоящем описании как «рекомбинантные AAV». Рекомбинантные AAV (rAAV) предпочтительно обладают возможностями тканеспецифического нацеливания, такими, что трансген rAAV будет специфически доставлен к одной или нескольким заранее определенным тканям(ни). AAV-капсид является важным элементом в определении этих возможностей тканевоспецифического нацеливания. Таким образом, может быть выбран rAAV, имеющий капсид, подходящий для ткани-мишени. В некоторых вариантах осуществления rAAV содержит белок капсида, имеющий аминокислотную последовательность, как указано в любой из SEQ ID NO: 51-97, или белок, имеющий существенную гомологию с ней.
Способы получения рекомбинантных AAV, имеющих нужный белок капсида, хорошо известны в данной области техники. (Смотри, например, US 2003/0138772), содержание которых включено в данное описание в качестве ссылки во всей их полноте). Обычно способы включают в себя культивирование клетки-хозяина, которая содержит последовательность нуклеиновых кислот, кодирующую белок капсида AAV (например, нуклеиновой кислоты, имеющей последовательность, как указано в любой из SEQ ID NO: от 1 до 47), или ее фрагмент; функциональный ген rep; рекомбинантный AAV-вектор, состоящий из AAV инвертированных концевых повторов (ITR) и трансгена; и достаточные хелперные функции, чтобы обеспечить упаковку рекомбинантного AAV вектора в белки ААV капсида. В некоторых вариантах осуществления, белки капсида представляют собой структурные белки, кодируемые геном cap AAV. В некоторых вариантах осуществления изобретения, AAV включают три белки капсида, белки вириона от 1 до 3 (названные VP1, VP2 и VP3), каждый из которых может экспрессироваться с одного гена cap. Соответственно, в некоторых вариантах осуществления, белки VP1, VP2 и VP3 имеют общую последовательность ядра. В некоторых вариантах осуществления настоящего изобретения молекулярные массы VP1, VP2 и VP3 составляют, соответственно примерно 87 кДа, примерно 72 кДа и примерно 62 кДа. В некоторых вариантах осуществления, после трансляции белки капсида образуют сферическую 60-мерную белковую оболочку вокруг вирусного генома. В некоторых вариантах осуществления изобретения, белок оболочки в основном состоит из белка капсида VP3. В некоторых вариантах осуществления функции белков капсида состоят в защите вирусного генома, доставке генома и взаимодействии с хозяином. В некоторых аспектах, белки капсида доставляют вирусный геном к хозяину тканеспецифическим образом. В некоторых вариантах осуществления, белки капсида VP1 и/ или VP2 могут вносить вклад в тканевый тропизм упакованного AAV. В некоторых вариантах осуществления, тканевый тропизм упакованного AAV определяется белком капсида VP3. В некоторых вариантах осуществления, тканевый тропизм AAV усиливается или изменяется в результате мутаций, происходящих в белках капсида.
В некоторых аспектах, настоящее раскрытие описывает варианты серотипов AAV дикого типа. В некоторых вариантах осуществления, варианты изменили тропизм ткани. В некоторых вариантах осуществления варианты ААV, описанные в настоящем описании, включают вариации аминокислот (например, замены, делеции, вставки) в пределах cap гена. Как обсуждалось выше, все три белки капсида транскрибируются с одного гена cap. Соответственно, в некоторых вариантах осуществления аминокислотные вариации в гене cap присутствует во всех трех белках капсида, кодируемых указанным геном cap. В качестве альтернативы, в некоторых вариантах осуществления аминокислотная вариация может не присутствовать во всех трех белках капсида. В некоторых вариантах осуществления аминокислотная вариация происходит только в капсидном белке VP1. В некоторых вариантах осуществления аминокислотная вариация происходит только в капсидном белке VP2. В некоторых вариантах осуществления аминокислотная вариация происходит только в пределах капсидного белка VP3. В некоторых вариантах осуществления вариант ААV содержит более чем одну вариацию в гене cap. В некоторых вариантах осуществления более одной вариации происходит в пределах одного и того же капсидного белка (например, в пределах VP3). В некоторых вариантах осуществления более одной вариации происходит в пределах различных белков капсида (например, по меньшей мере, одна вариация в VP2 и, по меньшей мере, одна вариация в VP3).
В некоторых вариантах осуществления варианты AAV, описанные в настоящем описании, представляют собой варианты AAV3B, AAV4 или AAV5. AAV3B, как известно, эффективно трансдукцирует гепатоциты человека (например, ткани печени). Известно также, что AAV3B эффективно трансдукцирует злокачественные гепатоциты человека. Соответственно, в некоторых вариантах осуществления варианты AAV3B, описанные в настоящем описании, могут быть полезны для доставки генной терапии к злокачественным и нормальным гепатоцитам человека. Известно, что AAV4 и AAV5 нацелены на ткань центральной нервной системы (ЦНС), сердечно-легочную ткань и глаза. Соответственно, в некоторых вариантах осуществления варианты AAV4 и AAV5, описанные в настоящем описании, могут быть полезны для доставки генной терапии в ЦНС, сердечно-легочную ткань или глаза.
Следует иметь в виду, что варианты AAV3B, AAV4 и AAV5, описанные в настоящем описании, могут включать один или несколько вариантов в пределах гена cap по сравнению с соответствующим AAV дикого типа. Таким образом, в некоторых вариантах осуществления варианты AAV3B, AAV4 и AAV5, описанные в настоящем описании, могут иметь тканевый тропизм, полезный для доставки генной терапии к тканям дополнительных типов, которые не являются мишенью AAV3B, AAV4 или AAV5 дикого типа. В некоторых вариантах осуществления варианты AAV3B, описанные в настоящем описании (например, CBR-7,4, CBR-7,5, CBR-7,8) могут быть полезны для доставки генной терапии в центральную нервную систему (ЦНС). В некоторых вариантах осуществления, варианты AAV4, описанные в настоящем описании, могут быть полезны для нацеливания на клетки почки или клетки печени. В некоторых вариантах осуществления, варианты AAV5, описанные в настоящем описании, могут быть полезны для нацеливания генной терапии на печень, селезенку, сердце или головной мозг. Неограничивающие примеры вариантов AAV и их тканей-мишеней можно найти в таблице 1.
В некоторых аспектах варианты AAV, описанные в настоящем описании, могут быть полезны для лечения расстройств, связанных с ЦНС. Как используется в настоящем описании, «расстройства, связанные с ЦНС» представляет собой заболевания или состояния центральной нервной системы. Расстройство, связанное с ЦНС, может влиять на спинной мозг (например, миелопатия), головной мозг (например, энцефалопатия) или ткань, окружающую головной мозг и спинной мозг. Расстройство, связанное с ЦНС может иметь генетическое происхождение, либо наследственное, либо приобретенное через соматическую мутацию. Расстройство, связанное с ЦНС может быть психологическим состоянием или расстройством, например, синдром дефицита концентрации внимания с гиперактивностью, расстройства аутистического спектра, аффективное расстройство, шизофрения, депрессия, синдром Ретта и т.д. Расстройство, связанное с ЦНС может представлять собой аутоиммунным расстройством. Расстройство, связанное с ЦНС, также может представлять собой злокачественная опухоль ЦНС, например, злокачественную опухоль мозга. Расстройство, связанное с ЦНС, которое является злокачественной опухолью, может представлять собой первичную злокачественную опухоль ЦНС, например, астроцитому, глиобластому и т.д., или может представлять собой злокачественную опухоль, которая метастазировала в ткань ЦНС, например, злокачественная опухоль легких, давшая метастазы в головном мозге. Другие неограничивающие примеры расстройств, связанных с ЦНС включают болезнь Паркинсона, лизосомную болезнь накопления, ишемию, невропатическую боль, боковой амиотрофический склероз (ALS), рассеянный склероз (MS) и болезнь Канавана (CD).
В некоторых вариантах осуществления варианты AAV, описанные в настоящем описании, могут быть полезны для доставки генной терапии в клетки сердца (например, ткань сердца). Соответственно, в некоторых вариантах осуществления, варианты AAV, описанные в настоящем описании, могут быть полезны для лечения сердечно-сосудистых заболеваний. Используемый в настоящем описании термин «сердечно-сосудистые расстройства» представляет собой заболевание или состояние сердечно-сосудистой системы. Сердечно-сосудистое заболевание может влиять на сердце, кровеносную систему, артерии, вены, кровеносные сосуды и/ или капилляры. Сердечно-сосудистое расстройство может иметь генетическое происхождение, либо являться наследственным или приобретенным в результате соматической мутации. Неограничивающие примеры сердечно-сосудистых заболеваний включают ревматические болезни сердца, порок клапана сердца, гипертоническую болезнь сердца, аневризму, атеросклероз, гипертонию (например, высокое кровяное давление), заболевание периферических артерий (PAD), ишемическую болезнь сердца, стенокардию, коронарную болезнь сердца, болезнь коронарной артерии, инфаркт миокард, церебральные сосудистые заболевания, транзиторные ишемические атаки, воспалительное заболевание сердца, кардиомиопатия, экссудативная болезнь, врожденный порок сердца, сердечная недостаточность, инсульт и миокардит вследствие болезни Шагаса.
В некоторых вариантах осуществления варианты AAV, описанные в настоящем описании, могут быть нацелены на легкие и/ или ткани легочной системы. Соответственно, в некоторых вариантах осуществления, варианты AAV, описанные в настоящем описании, могут быть полезны для лечения легочных заболеваний. Как используется в настоящем описании, «легочное заболевание» представляет собой заболевание или состояние легочной системы. Легочное заболевание может влиять на легкие или мышцы, участвующие в дыхании. Легочное заболевание может иметь генетическое происхождение, либо являться наследственным или приобретенным вследствие соматической мутации. Легочное заболевание может представлять собой злокачественную опухоль легкого, в том числе, но не ограничиваясь этим, немелкоклеточный рак легкого, мелкоклеточный рак легкого и карциноидная опухоль легкого. Другие неограничивающие примеры легочных заболеваний включают острый бронхит, острый респираторный дистресс-синдром (ОРДС), асбестоз, астму, бронхоэктаз, бронхиолит, облитерирующий бронхиолит с организующейся пневмонией (BOOP), бронхолегочную дисплазию, биссиноз, хронический бронхит, кокцидиоидомикоз (Cocci), хроническое обструктивное легочное заболевание (ХОБЛ), криптогенная организующаяся пневмония (КС), муковисцидоз, эмфизема, хантавирусный легочный синдром, гистоплазмоз, метапневмовирус человек, аллергический пневмонит, грипп, lymphangiomatosis, лимфангиоматоз, ближневосточный респираторный синдром, микобактерия, отличная от туберкулезной, коклюш, пневмокониоз (черная болезнь легких), пневмония, синдром картагенера, первичная легочная гипертензия, легочная артериальная гипертензия, легочный фиброз, легочное сосудистое заболевание, респираторные синцитиальный Вирус (RSV), саркоидоз, тяжелый острый респираторный синдром (SARS), силикоз, апноэ во сне, синдром внезапной детской смерти (СВДС) и туберкулез.
В некоторых вариантах осуществления варианты AAV, описанные в настоящем описании, могут быть нацелены на ткань печени. Соответственно, в некоторых вариантах осуществления варианты AAV, описанные в настоящем описании, могут быть полезны для лечения заболеваний печени. Используемый в описании термин «заболевание печени» представляет собой заболевание или состояние печени. Заболевание печени может иметь генетическое происхождение, либо являться наследственным или приобретенным вследствие соматической мутации. Заболевание печени может представлять собой злокачественное новообразование печени, включая, но не ограничиваясь этим, гепатоцеллюлярную карциному (HCC), фиброламеллярную карциному, холангиокарциному, ангиосаркому и гепатобластому. Другие не ограничивающие примеры легочных заболеваний включают синдром Алажиля, недостаточность альфа-1 анти-трипсина, аутоиммунный гепатит, билиарную атрезию, цирроз печени, кистозное заболевание печени, жировую болезнь печени, галактоземию, камни в желчном пузыре, синдром Жильбера, гемохроматоз, болезнь печени во время беременности, неонатальный гепатит, первичный билиарный цирроз печени, первичный склерозирующий холангит, порфирии, синдром Рейе, саркоидоз, токсический гепатит, гликогеноз I типа, тирозинемию, вирусный гепатит А, В, С, болезнь Вильсона и шистосомоз.
В некоторых вариантах осуществления варианты AAV, описанные в настоящем описании, могут быть нацелены на ткань почек. Соответственно, в некоторых вариантах осуществления, варианты AAV, описанные в настоящем описании, могут быть полезны для лечения заболеваний почек. Используемый в настоящем описании термин «заболевание почек» представляет собой заболевание или состояние печени. Заболевание печени может иметь генетическое происхождение, либо является наследственным или приобретенным вследствие соматической мутации. Заболевание печени может представлять собой злокачественное новообразование почки, включая, но не ограничиваясь этим, почечно-клеточный рак, светлоклеточный рак, папиллярный рак типа 1, папиллярный рак типа 2, хромофобный рак, онкоцитарная карцинома, рак собирающих протоков, переходно-клеточный рак почечной лоханки и опухоль Вильмса. Другие неограничивающие примеры заболевания почек включают синдром Абдергальдена-Кауфмана-Лигнаса (нефропатический цистиноз), острую почечную недостаточность/ острое повреждение почек, острую лобарную нефронию, острую фосфатную нефропатию, острый тубулярный некроз, недостаточность аденинфосфорибозилтрансферазы, аденовирусный нефрит, синдром Альпорта, амилоидоз, ангиомиолипому, анальгетическую нефропатию, антитела к ангиотензину и фокальный сегментный гломерулосклероз, антифосфолипидный синдром, гломерулонефрит, связанный с анти- TNF-α терапией, мутации APOL1, синдром кажущегося избытка мнеракортикоидов, нефропатию, вызванную аристолохоновой кислотой, балканскую эндемическую нефропатию, синдром Бартера, битурию, β-талассемийное заболевание почек, нефропатию, связанную с кистой общего желчного протока, BK-полиому, Clq-нефропатию, кардиоренальный синдром, CFHR5-нефропатию, холестериновую эмболию, синдром Churg-Strauss, хилурию, разрушающуюся гломерулопатию, разрушающуюся гломерулопатию, связанную с CMV, врожденный нефротический синдром, коноренальный синдром (синдром Mainzer-Saldino или болезнь Saldino-Mainzer), контрастную нефропатию, интоксикацию сульфатом меди, корковый некроз, криоглобулинемию, кристалл-индуцированное острое повреждение почек, поликистоз почек, приобретенную цистинурию, болезнь плотного осадка (MPGN Типа 2), болезнь Дента (Х-хромосомный рецессивный нефролитиаз), синдром неадекватного диализа, диабетическую болезнь почек, несахарный диабет, EAST-синдром, эктопический мочеточник, водянка, болезнь Эрдгейма-Честера, болезнь Фабри, семейную гипокальциурическую гиперкальциемию, синдром Фанкони, синдром Фрейзера, фибронектиновую гломерулопатию, фибриллярный гломерулонефрит и иммунотактоидную гломерулопатию, синдром Фрэлея, очаговый сегментный гломерулосклероз, очаговый склероз, очаговый гломерулосклероз, синдром Галлоуя-Моуота, синдром Гительмана, гломерулярные заболевания, клубочковой трубчатый рефлюкс, глюкозурию, синдром Гудпасчера, гемолитический уремический синдром (ГУС), атипичный гемолитический уремический синдром (Ahus), гемофагоцитарный синдром, геморрагический цистит, гемосидероз, связанный с пароксизмальной ночной гемоглобинурией и гемолитической анемией, печеночную облитерирующую болезнь, синусоидальный окклюзионный синдром, гепатит C-ассоциированная почечная болезнь, гепаторенальный синдром, ВИЧ-ассоциированную нефропатию (HIVAN), подковообразную почку (почечное слияние), язву Ханнера, гиперальдостеронизм, гиперкальциемию, гиперкалиемию, гипермагнезиемию, гипернатремию, гипероксалурию, гиперфосфатемию, гипокальциемию, гипокалиемию, гипокалиемия-индуцированную дисфункцию почек, гипомагниемию, гипонатриемию, гипофосфатемию, IgA-нефропатию, IgG4, нефропатию, интерстициальный цистит, болевой синдром мочевого пузыря, интерстициальный нефрит, синдром Ивемарка, камни в почках, нефролитиаз, лептоспирозное заболевание почек, болезнь осаждения легкой цепи, болезнь осаждения моноклональных иммуноглобулинов, синдром Лиддла, синдром Лайтвуда-Олбрайта, липопротеиновая гломерулопатия, литиевая нефротоксичность, мутации LMX1B, вызывающие наследственный FSGS, гематурию с болью в пояснице, волчанку, системную красную волчанку, волчаночная почечная болезнь, волчаночный нефрит, гломерулонефрит, связанный с болезнью Лайма, малярийную нефропатию, злокачественную гипертонию, малакоплакию, меатальный стеноз уретры, медуллярную кистозную болезнь почек, спонгиозную почку, мегауретер, меламиновую токсичность и почечный мембранопролиферативный гломерулонефрит, мембранозную нефропатию, мезоамериканскую нефропатию, метаболический ацидоз, метаболический алкалоз, микроскопический поливаскулит, синдром Milk-Alkalai, болезнь минимальных изменений, поликистозную дисплазию почки, множественную миелому, миелопролиферативные новообразования и гломерулопатию, синдром ногтей-надколенников, нефрокальциноз, нефрогенный системный фиброз, нефроптоз (блуждающая почка, почечная птоза), нефротический синдром, нейрогенный мочевой пузырь, узловой гломерулосклероз, негонококковый синдром щелкунчика, орофациодигитальный синдром, ортостатическую гипотензию, ортостатическую протеинурию, осмотический диурез, плоскую почку, папиллярный некроз, папиллоренальный синдром (почечно-колобомальный синдром, выделенную гипоплазию), перитонеально-почечный синдром, задней уретральный клапан, постинфекционный гломерулонефрит, постстрептококковый гломерулонефрит, узелковый полиартрит, поликистоз почек, поздний уретральный клапан, преэклампсию, пролиферативный гломерулонефрит с депозитами моноклональных IgG (болезнь Насра), протеинурию (белок в моче), псевдогиперальдостеронизм, псевдогипопаратироидизм, легочно-почечный синдром, пиелонефрит (инфекция почки), пионефроз, радиационные нефропатии, синдром переедания, рефлюкс-нефропатию, быстро прогрессирующий гломерулонефрит, почечный абсцесс, периренальный абсцесс, почечную агенезию, аневризму почечной артерии, стеноз почечной артерии, почечно-клеточный рак, почечную кисту, почечную гипоурикемию с индуцированной физической нагрузкой острой почечной недостаточностью, почечный инфаркт, почечную остеодистрофию, ацидоз почечных канальцев, сбрасываемый осмостат, ретрокавальный мочеточник, забрюшинный фиброз, рабдомиолиз, рабдомиолиз, связанный с бариатрической хирургией, ревматоидное артрит-ассоциированное заболевание почек, саркоидозное заболевание почек, соль-теряющую, почечную и церебральную иммуно-костную дисплазию Шимке, склеродермие-почечный кризис, синдром извилистой фибулы-поликистоза почек, синдром Экснера, серповидно-клеточную нефропатию, воздействие диоксида кремния и хроническое заболевание почек, заболевание почек после гемопоэтических клеточной трансплантации, заболевание почек, связанное с трансплантацией стволовых клеток, болезнь тонких базальных мембран, доброкачественную наследственную гематурию, тригонит, туберозный склероз, трубчатый дисгенез, синдром лизиса опухоли, уремию, уремическую оптическую нейропатию, уретероцеле, разрастания слизистой оболочки уретры, стриктуру уретры, недержание мочи, инфекцию мочевыводящих путей, закупорку мочевых путей, мочепузырно-кишечный свищ, пузырно-мочеточниковый рефлюкс, болезнь Гиппеля-Линдау, варфарин-связанная нефропатия, гранулематоз Вегенера, гранулематоз с поливаскулитом и синдром Вундерлича.
В некоторых вариантах осуществления варианты AAV, описанные в настоящем описании, могут быть полезны для доставки генной терапии в глазную ткань. Соответственно, в некоторых вариантах осуществления варианты AAV, описанные в настоящем описании, могут быть полезны для лечения глазных заболеваний. Как используется в настоящем описании, «глазное заболевание» представляет собой заболевание или состояние глаз. Сердечно-сосудистое заболевание может влиять на глаз, склеру, роговицу, переднюю камеру, заднюю камеру, радужную оболочку глаза, зрачок, хрусталик, стекловидное тело, сетчатку или зрительный нерв. Глазное заболевание может иметь генетическое происхождение, либо является наследственным или приобретенным вследствие соматической мутации. Неограничивающие примеры глазных заболеваний и расстройств включают, в качестве неограничивающих примеров: возрастную макулярную дегенерацию, ретинопатию, диабетическую ретинопатию, отек макулы, глаукому, пигментный ретинит и злокачественную опухоль глаза.
Компоненты, культивируемые в клетке-хозяине для упаковки вектора rAAV в AAV-капсид, могут предоставляться клетке-хозяину в trans. В качестве альтернативы, любой один или более из требуемых компонентов (например, рекомбинантного AAV-вектор, rep-последовательности, cap-последовательности и/ или хелперные функции) может обеспечиваться стабильной клеткой-хозяином, которая была сконструирована, чтобы содержать один или более необходимых компонентов с использованием способов, известных специалистам в данной области техники. Наиболее предпочтительно, такая стабильная клетка-хозяин должна содержать требуемый компонент (ы) под контролем индуцируемого промотора. При этом, требуемый компонент (ы) может находиться под контролем конститутивного промотора. Примеры подходящих индуцируемых и конститутивных промоторов представлены в настоящем описании, при обсуждении регуляторных элементов, пригодных для использования с трансгеном. В еще одном альтернативном варианте, выбранная стабильная клетка-хозяин может содержать выбранный компонент (ы) под контролем конститутивного промотора и другой выбранный компонент (ы) под контролем одного или нескольких индуцируемых промоторов. Например, можно создать стабильную клетку-хозяин, которая является производной от 293 клеток (которые содержат E1 хелперные функции под контролем конститутивного промотора), но которые содержат белки rep и/ или cap под контролем индуцируемых промоторов. Тем не менее, другие стабильные клетки-хозяева могут быть получены специалистом в данной области техники.
Рекомбинантный AAV-вектор, rep-последовательности, cap-последовательности и/ или хелперные функции, необходимая для получения rAAV по раскрытию, могут быть доставлены в упаковочную клетку-хозяин с использованием любого соответствующего генетического элемента (вектора). В некоторых вариантах осуществления одна нуклеиновая кислота, кодирующая все три белка капсида (например, VP1, VP2 и VP3), доставляется в упаковывающую клетку-хозяин в одном векторе. В некоторых вариантах осуществления, нуклеиновые кислоты, кодирующие белки капсида, доставляются в упаковывающую клетку-хозяин в двух векторах; первый вектор, содержащий первую нуклеиновую кислоту, кодирующую два белка капсида (например, VP1 и VP2), и второй вектор, содержащий вторую нуклеиновую кислоту, кодирующую единственный капсидный белок (например, VP3). В некоторых вариантах осуществления три вектора, каждый из которых содержит нуклеиновую кислоту, кодирующую отдельный белок капсида, доставляются в упаковывающую клетку-хозяина. Выбранный генетический элемент можно доставлять любым подходящим способом, в том числе теми, которые описаны в настоящем описании. Способы, используемые для построения любого варианта осуществления по настоящему раскрытию, известны специалистам в области манипуляции с нуклеиновыми кислотами и включают в генную инженерию, рекомбинантную инженерию и синтетические способы. См., например, Sambrook et al, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, N.Y. Аналогично, способы образования rAAV-вирионов хорошо известны, и выбор подходящего способа не является ограничением настоящего изобретения. См., например, K. Fisher et al, J. Virol., 70:520-532 (1993) и патент США No. 5,478,745.
В некоторых вариантах осуществления изобретения рекомбинантные AAV можно получать с использованием способа тройной трансфекции (подробно описанного в патенте США No. 6,001,650). Как правило, рекомбинантные AAV получают путем трансфекцией клетки-хозяина с помощью рекомбинантного AAV-вектора (содержащего трансген) для упаковки в AAV-частицы, вектора с функцией ААV-хелпера и вектора с вспомогательной функцией. ААV-вектор с функцией хелпера кодирует последовательности «хелперной функции ААV» (например, rep и cap), которые функционируют в trans для продуктивной репликации и капсидирования AAV. Предпочтительно, чтобы AAV-вектор c хелперной функцией поддерживал эффективное продуцирование AAV-вектора без создания каких-либо детектируемых AAV-вирионов дикого типа (например, AAV-вирионы, содержащие функциональные гены rep и cap). Неограничивающие примеры векторов, пригодных для использования с настоящим изобретением, включают pHLP19, описанный в патенте США No. 6001650, и вектор pRep6cap6, описанный в патенте США No. 6, 156303, каждый из которых включен в настоящем описании в качестве ссылки во всей полноте. Вектор с вспомогательной функцией кодирует нуклеотидные последовательности для получения отличных от AAV вирусные и/ или клеточных функций, на основании которых зависит ААV-репликация (например, «хелперные функции»). Хелперные функции включают такие функции, которые необходимы для репликации AAV, в том числе, без ограничения, те группы, которые участвуют в активации транскрипции ААV-генов, стадие-специфическом ААV мРНК-сплайсинге, репликации ДНК AAV, синтезе cap-экспрессионных продуктов и сборке капсида ААV. Вспомогательные функции на основе вируса можно получить любым из известных вирусов-помощников, таких как аденовирус, вирус герпеса (кроме вируса простого герпеса 1-го типа) и вирус осповакцины.
В некоторых аспектах изобретение предоставляет трансфицированные клетки-хозяева. Термин «трансфекция» используется для обозначения поглощения клеткой чужеродной ДНК, и клетка становится «трансфицированной», когда экзогенная ДНК была введена внутрь клеточной мембраны. Ряд способов трансфекции, как правило, известны в данной области техники. См., например, Graham et al. (1973) Virology, 52:456, Sambrook et al. (1989) Molecular Cloning, a laboratory manual, Cold Spring Harbor Laboratories, New York, Davis et al. (1986) Basic Methods in Molecular Biology, Elsevier, and Chu et al. (1981) Gene 13:197. Такие способы могут быть использованы для введения одной или более экзогенных нуклеиновых кислот, таких как нуклеотидный интеграционный вектор и другие молекулы нуклеиновых кислот, в подходящие клетки-хозяева.
«Клетка-хозяин» относится к любой клетке, которая содержит или способна содержать представляющее интерес вещество. Часто клетка-хозяин представляет собой клетку млекопитающего. Клетка-хозяин может быть использована в качестве реципиента конструкции хелперного AAV, AAV минигенной плазмиды, вектора вспомогательной функции или другой передающейся ДНК, связанной с продуцированием рекомбинантных AAV. Термин включает потомство исходной клетки, которая была трансфицирована. Таким образом, термин «клетка-хозяин», используемый в настоящем описании, может относиться к клетке, которая была трансфицирована экзогенной ДНК-последовательностью. Следует понимать, что потомство одной родительской клетки может не обязательно быть полностью идентично по морфологии или геномной или общей ДНК комплементацией исходному родителю, вследствие природной, случайной или преднамеренной мутации.
Используемый в настоящем описании термин «клеточная линия» относится к популяции клеток, способных к непрерывному или продолжительному росту и делению in vitro. Часто, клеточные линии являются клоновыми популяциями, полученными из одной клетки-предшественника. Кроме того, в данной области техники известно, что спонтанные или индуцированные изменения могут происходить в кариотипе во время хранения или передач таких клоновых популяций. Таким образом, клетка, полученная из упомянутой клеточной линии, может не быть точно идентичной наследственным клеткам или культурам, и упомянутая клеточная линия включает такие варианты.
Используемые в настоящем описании термины «рекомбинантная клетка» относится к клетке, в которую был введен экзогенный сегмент ДНК, такой как ДНК-сегмент, который приводит к транскрипции биологически активного полипептида или продуцированию биологически активной нуклеиновой кислоты, такой как РНК.
Клетки также могут быть трансфицированы вектором (например, хелперным вектором), который обеспечивает хелперную функцию для AAV. Вектор, обеспечивающий хелперные функции, может обеспечить аденовирусные функции, в том числе, например, E1a, E1b, E2a, E4ORF6. Последовательности аденовирусного гена, предоставляющего эти функции, могут быть получены из любого известного аденовирусного серотипа, такого как серотип 2, 3, 4, 7, 12 и 40, а также дополнительно включающего какой-либо из идентифицированных в настоящее время человеческих типов, известных в данной области техники. Таким образом, в некоторых вариантах осуществления способы включают трансфекцию клетки вектором, экспрессирующим один или несколько генов, необходимых для репликации AAV, транскрипции гена AAV и/ или упаковки AAV.
Используемый в настоящем описании термин «вектор» включает любой генетический элемент, такой как плазмида, фаг, транспозон, космида, хромосома, искусственная хромосома, вирус, вирион и т.п., который способен к репликации, если связан с соответствующими элементами управления и который может передавать последовательности генов между клетками. Таким образом, этот термин включает клонирующие и экспрессионные носители, а также вирусные векторы. В некоторых вариантах осуществления изобретения, подходящими рассматриваются те векторы, в которых транскрибируемый сегмент нуклеиновой кислоты находится под транскрипционным контролем промотора. «Промотор» относится к последовательности ДНК, узнаваемой синтетическим аппаратом клетки или введенным синтетическим аппаратом, необходимой для инициирования специфической транскрипции гена. Выражения «функционально расположенный», «под контролем» или «под транскрипционным контролем» означает, что промотор находится в правильном положении и ориентации по отношению к нуклеиновой кислоте, чтобы контролировать инициацию РНК-полимеразы и экспрессию гена. Термин «экспрессионный вектор или конструкция» означает любой тип генетической конструкции, содержащей нуклеиновую кислоту, в которой часть или вся кодирующая последовательность нуклеиновой кислоты способна к транскрипции. В некоторых вариантах осуществления, экспрессия включает транскрипцию нуклеиновой кислоты, например, для образования биологически активного полипептидного продукта или ингибирующей РНК (например, shRNA, микроРНК, ингибитор микроРНК) с транскрибируемого гена.
В некоторых случаях, выделенный капсидный ген может быть использован для конструирования и упаковки рекомбинантных AAV, с использованием способов, хорошо известных в данной области, чтобы определить функциональные характеристики, связанные с капсидным белком, кодируемым геном. Например, выделенные гены капсида могут быть использованы для конструирования и упаковки рекомбинантного AAV (rAAV), содержащего ген-репортер (например, β-галактозидазы, GFP, люциферазы и т.д. ). rAAV затем может быть доставлен в организм животного (например, мыши), и возможности тканевого нацеливания нового выделенного гена капсида можно определить путем анализа экспрессии гена-репортера в различных тканях (например, сердце, печени, почке) у животного. Другие способы для характеристики новых выделенных генов капсида раскрыты в настоящем описании, а прочие хорошо известны в данной области техники.
Вышеуказанные способы упаковки рекомбинантных векторов в желаемые AAV-капсиды для получения rAAV по раскрытию не предназначены для ограничения, и другие подходящие способы будут очевидны для специалиста в данной области.
Рекомбинантные AAV-векторы
«Рекомбинантные AAV (rAAV) векторы» по раскрытию, как правило, состоят, как минимум, из трансгена и его регуляторных последовательностей, и 5' и 3' AAV инвертированных концевых повторов (ITR). Именно этот рекомбинантный AAV вектор упаковывается в белок капсида и доставляется к выбранной клетке-мишени. В некоторых вариантах осуществления трансген представляет собой последовательность нуклеиновых кислот, гетерологичную по отношению к последовательностям вектора, которые кодируют представляющий интерес полипептид, белок, функциональную молекулу РНК (например, микроРНК, ингибиторную микроРНК) или другой генный продукт. Кодирующая последовательность нуклеиновых кислот функционально связана с регуляторными компонентами способом, который обеспечивает трансгену транскрипцию, трансляцию и/ или экспрессию в клетке ткани-мишени.
AAV-последовательности вектора обычно содержат цис-действующие 5' и 3' инвертированные концевые повторяющиеся последовательности (см., например, B. J. Carter, in "Handbook of Parvoviruses", ed., P. Tijsser, CRC Press, pp. 155 168 (1990)). Последовательности ITR составляют примерно 145 пар оснований в длину. Предпочтительно, чтобы фактически полные последовательности, кодирующие ITR, использовались в молекуле, хотя допустима некоторая степень незначительной модификации этих последовательностей. Возможность изменять эти ITR-последовательности находится в пределах компетенции специалистов в данной области. (Смотри, например, тексты, такие как Sambrook et al, "Molecular Cloning. A Laboratory Manual", 2d ed., Cold Spring Harbor Laboratory, New York (1989); и K. Fisher et al., J Virol., 70:520 532 (1996)). Пример такой молекулы, используемой в настоящем изобретении, представляет собой «цис-действующая» плазмида, содержащая трансген, в котором выбранная последовательность трансгена и связанные с ним регуляторные элементы фланкированы 5'- и 3'-последовательностями ITR AAV. Последовательности ITR AAV могут быть получены из любого известного AAV, в том числе, определенных в настоящее время типов AAV млекопитающих.
В некоторых вариантах осуществления rAAV по настоящему изобретению представляют собой псевдотипические rAAV. Псевдотипирование представляет собой процесс получения вирусов или вирусных векторов в сочетании с белками чужеродных вирусных оболочек. Результатом является псевдотипическая вирусная частица. С помощью этого способа, белки чужеродных вирусных оболочек могут быть использованы для изменения тропизма хозяев или увеличения/ уменьшения устойчивости вирусных частиц. В некоторых аспектах псевдотипический rAAV содержит нуклеиновые кислоты из двух или более различных AAV, причем нуклеиновая кислота из одного AAV кодирует белок капсида, а нуклеиновая кислота, по меньшей мере, другого AAV кодирует другие вирусные белки и/ или вирусный геном. В некоторых вариантах осуществления псевдотипический rAAV относится к AAV, содержащему инвертированные концевые повторы (ITR) AAV одного серотипа и капсидный белок AAV другого серотипа. Например, псевдотипический AAV вектор, содержащий ITR серотипа X, инкапсидированный с белками Y, будет обозначен как AAVX/ Y (например, AAV2/ 1 имеет ITR от AAV2 и капсид от AAV1). В некоторых вариантах осуществления, псевдотипические rAAV могут быть полезны для комбинирования тканеспецифических возможностей нацеливания белка капсида AAV одного серотипа с вирусной ДНК AAV другого серотипа, обеспечивая тем самым целенаправленную доставку трансгена в ткань-мишень.
В дополнение к основным элементам, указанным выше для рекомбинантного AAV-вектора, вектор также включает в себя необходимые традиционные элементы контроля, которые функционально связаны с трансгеном способом, который обеспечивает его транскрипцию, трансляцию и/или экспрессию в клетке, трансфицированной плазмидным вектором или инфицированных вирусом, полученным при помощи раскрытия. Используемый в настоящем описании термин «функционально связанные» последовательности включают как последовательности, контролирующие экспрессию, которые являются смежными с представляющим интерес геном, так и последовательности, контролирующие экспрессию, которые действуют в транс-положении или на расстоянии, чтобы контролировать представляющий интерес ген.
Последовательности, контролирующие экспрессию, включают соответствующие последовательности инициации транскрипции, терминацию, промотора и энхансера; сигналы эффективного РНК-процессинга, такие как сигналы РНК-сплайсинга и полиаденилирования (полиА); последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые повышают эффективность трансляции (например, последовательность консенсуса Козака); последовательности, которые увеличивают стабильность белка; и при желании, последовательности, которые усиливают секрецию кодируемого продукта. Большое количество последовательностей, контролирующих экспрессию, в том числе промоторов, которые являются нативными, конститутивным, индуцибельными и/ или тканеспецифическими, известно в данной области техники и может быть использовано.
Как использовано в настоящем описании, последовательность нуклеиновых кислот (например, кодирующая последовательность) и регуляторные последовательности называются «функционально» связанными, когда они ковалентно связаны способом, чтобы поместить экспрессию или транскрипцию последовательности нуклеиновых кислот под действием или контроль регуляторных последовательностей. Если желательно, что последовательности нуклеиновых кислот были транслированы в функциональный белой, две последовательности ДНК, как говорит, являются функционально связаннными, если индукция промотора в 5'-регуляторных последовательностях приводит к транскрипции кодирующей последовательности, и если природа связи между этими двумя последовательностями ДНК (1) не приводит к введению мутации сдвига рамки считывания, (2) не мешает способности области промотора направлять транскрипцию кодирующих последовательностей или (3) не мешает способности соответствующего РНК-транскрипта транслироваться в белок. Таким образом, область промотора будет функционально связана с последовательностью нуклеиновой кислоты, если область промотора способна осуществлять транскрипцию этой последовательности ДНК таким образом, что в результате транскрипт может быть трпнслирован в желаемый белок или полипептид. Аналогичным образом, две или более кодирующих областей являются функционально связанными, если они связаны таким образом, что их транскрипция с общего промотора приводит к экспрессии двух или более белков, транслируемых в рамке. В некоторых вариантах осуществления, функционально связанные кодирующие последовательности приводят к образованию слитого белка. В некоторых вариантах осуществления, функционально связанные кодирующие последовательности приводят к образованию функциональной РНК (например, shRNA, микроРНК, микроРНК ингибитор).
Для нуклеиновых кислот, кодирующих белки, последовательность полиаденилирования, как правило, встраивается вслед за трансгенными последовательностями и перед 3' ITR-последовательностью AAV. Конструкция rAAV, применимая в настоящем изобретении, может также содержать интрон, желательно, расположенный между последовательностью промотора/ энхансера и трансгеном. Одной из возможных интронных последовательностей является производная от SV-40, которая упоминается как интронная последовательность SV-40. Еще одним элементом вектора, который может быть использован, является участок внутренней посадки рибосомы (IRES). Последовательность IRES используются для получения более одного полипептида с одного транскрипта гена. Последовательность IRES можно было бы использовать для получения белка, который содержит более одной полипептидной цепи. Выбор этих и других общих элементов вектора являются традиционными, и многие такие последовательности доступны [См., например, Sambrook и др., а также приведенные там ссылки на, например, страницы 3,18 3,26 и 16,17 16,27 и Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, 1989]. В некоторых вариантах осуществления последовательность вируса 2A ящура входит в полипротеин; это небольшой пептид (примерно 18 аминокислот в длину), который, как было показано, опосредуют расщепление полипротеинов (Ryan, M D et al., EMBO, 1994; 4: 928-933; Mattion, N M et al., J Virology, November 1996; p. 8124-8127; Furler, S et al., Gene Therapy, 2001; 8: 864-873; and Halpin, C et al., The Plant Journal, 1999; 4: 453-459). Активность отщепления последовательности 2А ранее была продемонстрирована в искусственных системах, включая плазмиды и векторы в генной терапии (AAV и ретровирусы) (Ryan, M D et al., EMBO, 1994; 4: 928-933; Mattion, N M et al., J Virology, November 1996; p. 8124-8127; Furler, S et al., Gene Therapy, 2001; 8: 864-873; and Halpin, C et al., The Plant Journal, 1999; 4: 453-459; de Felipe, P et al., Gene Therapy, 1999; 6: 198-208; de Felipe, P et al., Human Gene Therapy, 2000; 11: 1921-1931.; and Klump, H et al., Gene Therapy, 2001; 8: 811-817).
Точная природа регуляторных последовательностей, необходимых для экспрессии гена в клетках-хозяевах, может различаться между видами, тканями или типами клеток, однако в в общем случае они должны включать, по мере необходимости, 5'-нетранскрибируемые и 5'-нетранслируемые последовательности, участвующие в инициации транскрипции и трансляции, соответственно, такие как ТАТА-бокс, кеппирующая последовательность, СААТ-последовательность, энхансерные элементы и тому подобное. В частности, такие 5' нетранскрибируемые регуляторные последовательности включают промоторную область, которая включает в себя промоторную последовательность для транскрипционного контроль функционально связанного гена. Регуляторные последовательности могут также включать энхансерные последовательности или расположенные выше по течению активаторные последовательности, по желанию. Векторы по изобретению могут необязательно включать 5'-лидерные или сигнальные последовательности. Выбор и проектирование соответствующего вектора находится в пределах компетенции и усмотрения любого из специалистов в данной области техники.
Примеры конститутивных промоторов включают, без ограничения, ретровирусный LTR-промотор вируса саркомы Рауса (RSV) (необязательно с RSV-энхансером), промотор цитомегаловируса (CMV) (необязательно с CMV-энхансером) [См., например, Boshart et al, Cell, 41:521-530 (1985)], промотор SV40, промотор дигидрофолатредуктазы, промотор β-актина, промотор фосфоглицеролкиназы (PGK) и промотор EF1α [Invitrogen].
Индуцируемые промоторы обеспечивают регуляцию экспрессии генов и могут регулироваться с помощью экзогенных соединений, факторов окружающей среды, таких как температура, или наличием определенного физиологического состояния, например, острой фазы, определенного состояния дифференцировки клетки или в реплицирующихся клетках только. Индуцируемые промоторы и индуцибельные системы доступны из различных коммерческих источников, в том числе, без ограничения, Invitrogen, Clontech и ARIAD. Многие другие системы были описаны и могут быть легко выбраны специалистом в данной области. Примеры индуцируемых промоторов, регулируемых экзогенно промоторов включают цинк-индуцируемый промотор металлотионеина (МТ) овцы, дексаметазон (Dex)-индуцируемый промотор вируса опухоли молочной железы мыши (MMTV), систему промотора Т7-полимеразы (WO 98/10088); промотор экдизонома насекомых (No et al, Proc. Natl. Acad. Sci. USA, 93:3346-3351 (1996)), тетрациклин-репрессируемую систему (Gossen et al, Proc. Natl. Acad. Sci. USA, 89:5547-5551 (1992)), тетрациклин-индуцируемую систему (Gossen et al, Science, 268:1766-1769 (1995), смотри также Harvey et al, Curr. Opin. Chem. Biol., 2:512-518 (1998)), RU486-индуцируемую систему (Wang et al, Nat. Biotech., 15:239-243 (1997) и Wang et al, Gene Ther., 4:432-441 (1997)) и рапамицин-индуцируемую систему (Magari et al, J. Clin. Invest., 100:2865-2872 (1997)). Опять же, индуцируемых промоторов других типов, которые могут быть полезны в данном контексте, представляют собой промоторы, которые регулируются при помощи определенного физиологического состояния, например, температурой, острой фазой, конкретной стадией дифференцировки клетки или в реплицирующихся клетках только.
В другом варианте осуществления будет использоваться природный промотор для трансгена. Нативный промотор может быть предпочтительным, когда желательно, чтобы экспрессия трансгена имитировала нативную экспрессию. Нативный промотор может быть использован, когда экспрессия трансгена должна регулироваться по времени или уровню развития, или тканеспецифическим образом, или в ответ на конкретные транскрипционные стимулы. В дополнительном варианте осуществления, другие нативные элементы, контролирующие экспрессию, такие как энхансерные элементы, сайты полиаденилирования или консенсусные последовательности Козака также могут быть использованы, чтобы имитировать нативную экспрессию.
В некоторых вариантах осуществления настоящего изобретения регуляторные последовательности придают возможности тканеспецифической экспрессии генов. В некоторых случаях, тканеспецифические регуляторные последовательности связываются с тканеспецифическими факторами транскрипции, которые индуцируют транскрипцию тканеспецифическим образом. Такие тканеспецифические регуляторные последовательности (например, промоторы, энхансеры и т.д.) хорошо известны в данной области техники. Типичные тканеспецифические регуляторные последовательности включают, в качестве неограничивающих примеров, следующие тканеспецифические промоторы: промотор печень-специфического тироксин-связывающего глобулин (TBG), промотор инсулина, промотор глюкагона, промотор соматостатина, промотор панкреатического полипептида (PPY), промотор синапсина-1 (Syn), промотор креатинкиназы (MCK), промотор десмина млекопитающих (DES), промотор тяжелой цепи α-миозина (a-MHC), или промотор тропонина Т (cTnT) сердца. Другие типичные промоторы включают промотор бета-актина, основной промотор вируса гепатита B, (Chen et al., J. Bone Miner. Res., 11:654-64 (1996)); промотор альфа-фетопротеина (АФП), Arbuthnot et al., Hum. Gene Ther., 7:1503-14 (1996)); промотор остеокальцина костей (Stein et al., Mol. Biol. Rep., 24:185-96 (1997)); промотор сиалопротеина костей (Chen et al., J. Bone Miner. Res., 11:654-64 (1996)), CD2-промотор (Hansal et al., J. Immunol., 161:1063-8 (1998); промотор тяжелой цепи иммуноглобулина; промотор α-цепи Т-клеточного рецептора; нейрональный, например. промотор нейрон-специфической энолазы (NSE) (Andersen et al., Cell. Mol. Neurobiol., 13:503-15 (1993)), промотор гена легкой цепи нейрофиламентов (Piccioli et al., Proc. Natl. Acad. Sci. USA, 88:5611-5 (1991)), а также промотор нейрон-специфического гена vgf (Piccioli et al., Neuron, 15:373-84 (1995)), среди других, которые будут очевидны специалистам в данной области.
В некоторых вариантах осуществления, один или несколько сайтов связывания одной или нескольких микроРНК включены в трансген rAAV-вектора, чтобы ингибировать экспрессию трансгена в одной или нескольких тканях пациента, несущего трансген. Специалисту в данной области будет понятно, что можно выбрать сайты связывания, чтобы контролировать экспрессию трансгена тканеспецифическим образом. Например, сайты связывания для печень-специфической микроR-122 могут быть включены в трансген, чтобы ингибировать экспрессию этого трансгена в печени. Сайты-мишени в мРНК могут находиться в 5' UTR, 3'-UTR или в кодирующей области. Как правило, участок-мишень находится в 3' UTR мРНК. Кроме того, трансген может быть спроектирован таким образом, чтобы множественные микроРНК регулировали мРНК путем распознавания одинаковых или нескольких сайтов. Наличие множественных сайтов связывания микроРНК может приводить к совместным действиям нескольких RISC и обеспечивать высокую эффективность ингибирования экспрессии. Последовательность сайта-мишени может содержать в общей сложности 5-100, 10-60 или более нуклеотидов. Последовательность сайта-мишени может содержать, по меньшей мере, 5 нуклеотидов последовательности сайта связывания гена-мишени.
Рекомбинантный AAV-вектор: Трансген-кодирующие последовательности
Композиция трансгенной последовательности rAAV-вектора будет зависеть от применения, для которого определен результирующий вектор. Например, один тип последовательности трансгена включает последовательность репортера, который при экспрессии продуцирует регистрируемый сигнал. В другом примере трансген кодирует терапевтический белок или терапевтическую функциональную РНК. В другом примере трансген кодирует белок или функциональную РНК, которая предназначена для использования в исследовательских целях, например, для создания соматической трансгенной животной модели, несущий трансген, например, для изучения функции трансгенного продукта. В другом примере трансген кодирует белок или функциональную РНК, которая предназначена для использования для создания животной модели заболевания. Соответствующие трансгенные кодирующие последовательности будут очевидны для специалиста в данной области.
Репортерные последовательности, которые могут быть предоставлены в трансгене, включают, без ограничения, последовательности ДНК, кодирующие β-лактамазу, β-галактозидазу (LacZ), щелочную фосфатазу, тимидинкиназу, зеленый флуоресцентный белок (GFP), хлорамфеникол ацетилтрансферазы (CAT), люциферазу и другие белки, хорошо известные в данной области техники. Репортерные последовательности в случае, когда связаны с регуляторными элементами, которые управляют их экспрессией, обеспечивают сигналы, детектируемые с помощью обычных средств, в том числе при помощи ферментативного, радиографического, колориметрического, флуоресцентного или других спектрографических анализов, анализов флуоресцентно-активируемого клеточного сортинга и иммунологических анализов, в том числе твердофазного иммуноферментного анализа (ELISA), радиоиммуноанализа (RIA) и иммуногистохимии. Например в случае, когда маркерная последовательность представляет собой ген LacZ, наличие вектора, несущего сигнал, детектируют с помощью анализов на β-галактозидазную активность. В случае, когда трансгеном является зеленый флуоресцентный белок или люцифераза, вектор, несущий сигнал, можно определять визуально по образованию цвета или света в люминометре. Такие репортеры могут, например, быть полезными при проверке возможностей тканевоспецифического нацеливания и регуляторной активности тканеспецифического промотора rAAV.
В некоторых аспектах изобретение предоставляет rAAV-векторы для применения в способах профилактики или лечения одного или более генетических недостатков или дисфункций у млекопитающих, таких как, например, полипептидная недостаточность или полипептидная избыточность у млекопитающего, и в частности, для лечения или уменьшения тяжести или степен недостаточности в организме человека, проявляющего одно или более из расстройств, связанных с недостаточностью таких полипептидов в клетках и тканях. Способ включает в себя введение rAAV-вектора, который кодирует один или более терапевтических пептидов, полипептидов, миРНК, микроРНК, антисмысловых нуклеотидов и т.п., в фармацевтически приемлемом носителе пациенту в количестве и в течение периода времени, достаточного для лечения недостаточности или расстройства у пациента, страдающего от такого расстройства.
Таким образом, раскрытие охватывает доставку rAAV-векторов, кодирующих один или несколько пептидов, полипептидов или белков, которые являются полезными для лечения или профилактики болезненных состояний у пациента-млекопитающего. Типичные терапевтические белки включают один или несколько полипептидов, выбранных из группы, состоящей из факторов роста, интерлейкинов, интерферонов, противоапоптозных факторов, цитокинов, антидиабетических факторов, противоапоптозных средств, факторов свертывания, противоопухолевых факторов. Другие неограничивающие примеры терапевтических белков включают BDNF, CNTF, CSF, EGF, FGF, G-SCF, GM-CSF, гонадотропин, IFN, IFG-1, M-CSF, NGF, PDGF, PEDF, TGF, VEGF, TGF-B2, TNF, пролактин, соматотропин, XIAP1, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-10 (187А), вирусный IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17 и IL-18.
rAAV-векторы может содержать ген, передаваемый пациенту для лечения заболевания, связанного со снижением экспрессии, отсутствием экспрессии или дисфункцией гена. Типичные гены и связанные с ними болезненные состояния включают, в качестве неограничивающих примеров: глюкоза-6-фосфатазу, связанную с недостаточностью накопления гликогена типа 1А; фосфоенолпируваткарбоксикиназу, связанную с недостаточностью PEPCK; галактоза-1-фосфатуридилтрансферазу, связанную с галактоземией; фенилаланингидроксилазу, связанную с фенилкетонурией; разветвленноцепочечную альфа-кетокислотную дегидрогеназу, связанную с болезнью мочи с запахом кленового сиропа; фумарилацетоацетатгидролазу, связанную с тирозинемией 1-го типа; метилмалонил-КоА мутазу, связанныую с метилмалоновой ацидемией; ацил-СоА-дегидрогеназу со средней длиной цепи, связанную с недостаточностью ацетил-СоА со средней длиной цепи; орнитинтранскарбаминазу, связанную с недостаточностью орнитинтранскарбаминазы; аргининсукцинидсинтетазу, связанную с цитруллинемией; белок рецептора липопротеинов низкой плотности, связанный с семейной гиперхолестеринемия; UDP-глюкоуронозилтрансферазу, связанную с болезнью Криглера-Наджара; аденозиндезаминазу, связанную с тяжелой болезнью комбинированного иммунодефицита; гипоксантингуанинфосфорибозил трансферазу, связанную с подагрой и синдромом Леша-Ньян; биотинидазу, связанную с недостаточностью биотинидазы; бета-глюкоцереброзидазу, связанную с болезнью Гоше; бета-глюкуронидазу, связанную с синдромом Sly; мембранный белок пероксисом 70 кДа, связанный с синдромом Зеллвегера; порфобилиногендеаминазу, связанную с острой интермиттирующей порфирией; альфа-1 антитрипсин для лечения недостаточности альфа-1 антитрипсина (эмфиземы); эритропоэтин для лечения анемии вследствие талассемии или почечной недостаточности; фактор роста эндотелия сосудов, ангиопоэтин-1 и фактор роста фибробластов для лечения ишемических заболеваний; тромбомодулин и ингибитор пути тканевого фактора для лечения окклюзии кровеносных сосудов, которая наблюдается, например, при атеросклерозе, тромбозе или эмболии; ароматическую декарбоксилазу аминокислот (AADC) и тирозингидроксилазу (ТН) для лечения болезни Паркинсона; бета-адренергические рецепторы, антисмысловую к или мутантную форму фосфоламбана, аденозинтрифосфатазу-2 сарко(эндо)плазматического ретикулума (SERCA2) и аденилатциклазу сердца для лечения застойной сердечной недостаточности; ген-супрессор опухоли, такой как р53 для лечения различных видов рака; цитокин, такой как один из различных интерлейкинов для лечения воспалительных и иммунных расстройств и злокачественных новообразований; дистрофина или минидистрофин и атрофин или минитрофин для лечения мышечных дистрофий; и инсулин для лечения сахарного диабета.
В некоторых вариантах осуществления изобретение относится к AAV, содержащему нуклеиновую кислоту, кодирующую белок или функциональную РНК, полезную для лечения состояния, заболевания или расстройства, связанного с центральной нервной системой (ЦНС). Ниже приведен неограничивающий перечень генов, ассоциированных с поражением ЦНС: DRD2, GRIA1, GRIA2,GRIN1, SLC1A1, SYP, SYT1, CHRNA7, 3Rtau/4rTUS, APP, BAX, BCL-2, GRIK1, GFAP, IL-1, AGER, связанные с болезнью Альцгеймера; UCH-L1, SKP1, EGLN1, Nurr-1, BDNF, TrkB, gstm1, S106β, связанные с болезнью Паркинсона; IT15, PRNP, JPH3, TBP, ATXN1, ATXN2, ATXN3, Atrophin 1, FTL, TITF-1, связанные с болезнью Хантингтона; FXN, связанный с атаксией Фрейдриха; ООРА, связанный с болезнью Канавана; DMD, связанный с мышечной дистрофией; и SMN1, UBE1, DYNC1H1, связанные со спинальной мышечной атрофией. В некоторых вариантах осуществления изобретение относится к рекомбинантным AAV, содержащим нуклеиновые кислоты, которые экспрессируют один или несколько из вышеуказанных генов или их фрагментов. В некоторых вариантах осуществления изобретение относится к рекомбинантным AAV, содержащим нуклеиновые кислоты, которые экспрессируют одну или несколько функциональных РНК, которые ингибируют экспрессию одного или нескольких из вышеуказанных генов.
В некоторых вариантах осуществления изобретение относится к нуклеиновой кислоте, кодирующей белок или функциональную РНК, полезную для лечения состояния, заболевания или расстройства, связанного с сердечно-сосудистой системой. Ниже приведен неограничивающий перечень генов, ассоциированных с сердечно-сосудистыми заболеваниями: VEGF, FGF, SDF-1, коннексин 40, коннексин 43, SCN4a, HIF1a, SERCA2a, ADCY1 и ADCY6. В некоторых вариантах осуществления изобретение относится к рекомбинантным AAV, содержащим нуклеиновые кислоты, которые экспрессируют один или несколько из вышеуказанных генов или их фрагментов. В некоторых вариантах осуществления изобретение относится к рекомбинантным AAV, содержащим нуклеиновые кислоты, которые экспрессируют один или несколько функциональных РНК, которые ингибируют экспрессию одного или нескольких из вышеуказанных генов.
В некоторых вариантах осуществления изобретение относится к AAV, содержащему нуклеиновую кислоту, кодирующую белок или функциональную РНК, полезную для лечения состояния, заболевания или расстройства, связанного с легочной системой. Ниже приведен неограничивающий перечень генов, ассоциированных с болезнью легких: TNFa, TGFpi, SFTPA1, SFTPA2, SFTPB, SFTPC, HPS1, HPS3, HPS4, ADTB3A, ILIA, IL1B, LTA, IL6, CXCR1 и CXCR2. В некоторых вариантах осуществления изобретение относится к рекомбинантным AAV, содержащим нуклеиновые кислоты, которые экспрессируют один или несколько из вышеуказанных генов или их фрагментов. В некоторых вариантах осуществления изобретение относится к рекомбинантным AAV, содержащим нуклеиновые кислоты, которые экспрессируют одну или несколько функциональных РНК, которые ингибируют экспрессию одного или нескольких из вышеуказанных генов.
В некоторых вариантах осуществления изобретение относится к AAV, содержащему нуклеиновую кислоту, кодирующую белок или функциональную РНК, полезную для лечения состояния, заболевания или расстройства, связанного с печенью. Ниже приведен неограничивающий перечень генов, ассоциированных с заболеванием печени: A1-AT, HFE, ATP7B, фумарилацетоацетатгидролаза (FAH), глюкозо-6-фосфатаза, Ncan, GCKR, LYPLAL1 и PNPLA3. В некоторых вариантах осуществления изобретение относится к рекомбинантным AAV, содержащим нуклеиновые кислоты, которые экспрессируют один или несколько из вышеуказанных генов или их фрагментов. В некоторых вариантах осуществления изобретение относится к рекомбинантные AAV, содержащие нуклеиновые кислоты, которые экспрессируют один или несколько функциональных РНК, которые ингибируют экспрессию одного или нескольких из вышеуказанных генов.
В некоторых вариантах осуществления изобретение относится к AAV, содержащему нуклеиновую кислоту, кодирующую белок или функциональную РНК, полезную для лечения состояния, заболевания или расстройства, связанного с почками. Ниже приведен неограничивающий перечень генов, ассоциированных с заболеванием почек: PKD1, PKD2, PKHD1, NPHS1, NPHS2, PLCE1, CD2AP, LAMB2, TRPC6, WT1, LMX1B, SMARCAL1, COQ2, PDSS2, SCARB3, FN1, COL4A5, COL4A6, COL4A3, COL4A4, FOX1C, RET, UPK3A, ВМР-4, SIX2, CDC5L, USF2, ROB02, Slit2, Eya1, MYOG, SIXL, SIX5, FRAS1, FREM2, GATA3, KALI, Pax2, TCF2 и SALL1. В некоторых вариантах осуществления изобретение относится к рекомбинантным AAV, содержащим нуклеиновые кислоты, которые экспрессируют один или несколько из вышеуказанных генов или их фрагментов. В некоторых вариантах осуществления изобретение относится к рекомбинантным AAV, содержащим нуклеиновые кислоты, которые экспрессируют один или несколько функциональных РНК, которые ингибируют экспрессию одного или нескольких из вышеуказанных генов.
В некоторых вариантах осуществления изобретение относится к AAV, содержащему нуклеиновую кислоту, кодирующую белок или функциональную РНК, полезную для лечения состояния, заболевания или расстройства, связанного с глазом. Ниже приведен неограничивающий перечень генов, ассоциированных с глазной болезнью: CFH, С3, МТ-ND2, ARMS2, TIMP3, CAMK4, FMN1, RHO, USH2A, RPGR, RP2, TMCO, SIX1, SIX6, LRP12, ZFPM2, TBK1, GALC, миоцелин, CYP1B1, CAV1, CAV2, оптинейрин и CDKN2B. В некоторых вариантах осуществления изобретение относится к рекомбинантным AAV, содержащим нуклеиновые кислоты, которые экспрессируют один или несколько из вышеуказанных генов или их фрагментов. В некоторых вариантах осуществления изобретение относится к рекомбинантным AAV, содержащим нуклеиновые кислоты, которые экспрессируют один или несколько функциональных РНК, которые ингибируют экспрессию одного или нескольких из вышеуказанных генов.
rAAV по раскрытию можно применять для восстановления экспрессии генов, у которых снижена экспрессия, которые подавлены или иным образом дисфункциональны у пациента (например, супрессор опухоли, который был подавлен у пациента, имеющего злокачественное новообразование). rAAV по раскрытию можно также применять для нокдаун экспрессии генов, которые аберрантно экспрессируются у пациента (например, онкоген, который экспрессируется у пациента, имеющего злокачественное новообразование). В некоторых варианты осуществления rAAV-вектор, содержащий нуклеиновую кислоту, кодирующую генный продукт, связанный с злокачественным новообразованием (например, опухолевые супрессоры) можно применять для лечения злокачественного новообразования, путем введения rAAV, несущего rAAV-вектор, пациенту, имеющему злокачественное новообразование. В некоторых вариантах осуществления rAAV-вектор, содержащий нуклеиновую кислоту, кодирующую малую интерферирующую нуклеиновую кислоту (например, shRNA, микроРНК), которая ингибирует экспрессию генного продукта, связанного со злокачественным новообразованием (например, онкогены) можно применять для лечения злокачественного новообразования путем введения rAAV, несущие rAAV-вектор пациенту, имеющему злокачественное новообразование. В некоторых вариантах осуществления rAAV-вектор, содержащий нуклеиновую кислоту, кодирующую генный продукт, связанный с злокачественным новообразованием (или функциональную РНК, которая ингибирует экспрессию гена, связанного с злокачественным новообразованием) можно применять для исследовательских целей, например, чтобы изучать злокачественное новообразование или определить терапевтические средства, которые лечат злокачественное новообразование. Ниже приведен неограничивающий перечень иллюстративных известных генов, которые связаны с развитием злокачественного новообразования (например, онкогенов и опухолевых супрессоров): AARS, ABCB1, ABCC4, ABI2, ABL1, ABL2, ACK1, ACP2, ACY1, ADSL, AK1, AKR1C2, AKT1, ALB, ANPEP, ANXA5, ANXA7, AP2M1, APC, ARHGAP5, ARHGEF5, ARID4A, ASNS, ATF4, ATM, ATP5B, ATP5O, AXL, BARD1, BAX, BCL2, BHLHB2, BLMH, BRAF, BRCA1, BRCA2, BTK, CANX, CAP1, CAPN1, CAPNS1, CAV1, CBFB, CBLB, CCL2, CCND1, CCND2, CCND3, CCNE1, CCT5, CCYR61, CD24, CD44, CD59, CDC20, CDC25, CDC25A, CDC25B, CDC2L5, CDK10, CDK4, CDK5, CDK9, CDKL1, CDKN1A, CDKN1B, CDKN1C, CDKN2A, CDKN2B, CDKN2D, CEBPG, CENPC1, CGRRF1, CHAF1A, CIB1, CKMT1, CLK1, CLK2, CLK3, CLNS1A, CLTC, COL1A1, COL6A3, COX6C, COX7A2, CRAT, CRHR1, CSF1R, CSK, CSNK1G2, CTNNA1, CTNNB1, CTPS, CTSC, CTSD, CUL1, CYR61, DCC, DCN, DDX10, DEK, DHCR7, DHRS2, DHX8, DLG3, DVL1, DVL3, E2F1, E2F3, E2F5, EGFR, EGR1, EIF5, EPHA2, ERBB2, ERBB3, ERBB4, ERCC3, ETV1, ETV3, ETV6, F2R, FASTK, FBN1, FBN2, FES, FGFR1, FGR, FKBP8, FN1, FOS, FOSL1, FOSL2, FOXG1A, FOXO1A, FRAP1, FRZB, FTL, FZD2, FZD5, FZD9, G22P1, GAS6, GCN5L2, GDF15, GNA13, GNAS, GNB2, GNB2L1, GPR39, GRB2, GSK3A, GSPT1, GTF2I, HDAC1, HDGF, HMMR, HPRT1, HRB, HSPA4, HSPA5, HSPA8, HSPB1, HSPH1, HYAL1, HYOU1, ICAM1, ID1, ID2, IDUA, IER3, IFITM1, IGF1R, IGF2R, IGFBP3, IGFBP4, IGFBP5, IL1B, ILK, ING1, IRF3, ITGA3, ITGA6, ITGB4, JAK1, JARID1A, JUN, JUNB, JUND, K-ALPHA-1, KIT, KITLG, KLK10, KPNA2, KRAS2, KRT18, KRT2A, KRT9, LAMB1, LAMP2, LCK, LCN2, LEP, LITAF, LRPAP1, LTF, LYN, LZTR1, MADH1, MAP2K2, MAP3K8, MAPK12, MAPK13, MAPKAPK3, MAPRE1, MARS, MAS1, MCC, MCM2, MCM4, MDM2, MDM4, MET, MGST1, MICB, MLLT3, MME, MMP1, MMP14, MMP17, MMP2, MNDA, MSH2, MSH6, MT3, MYB, MYBL1, MYBL2, MYC, MYCL1, MYCN, MYD88, MYL9, MYLK, NEO1, NF1, NF2, NFKB1, NFKB2, NFSF7, NID, NINJ1, NMBR, NME1, NME2, NME3, NOTCH1, NOTCH2, NOTCH4, NPM1, NQO1, NR1D1, NR2F1, NR2F6, NRAS, NRG1, NSEP1, OSM, PA2G4, PABPC1, PCNA, PCTK1, PCTK2, PCTK3, PDGFA, PDGFB, PDGFRA, PDPK1, PEA15, PFDN4, PFDN5, PGAM1, PHB, PIK3CA, PIK3CB, PIK3CG, PIM1, PKM2, PKMYT1, PLK2, PPARD, PPARG, PPIH, PPP1CA, PPP2R5A, PRDX2, PRDX4, PRKAR1A, PRKCBP1, PRNP, PRSS15, PSMA1, PTCH, PTEN, PTGS1, PTMA, PTN, PTPRN, RAB5A, RAC1, RAD50, RAF1, RALBP1, RAP1A, RARA, RARB, RASGRF1, RB1, RBBP4, RBL2, REA, REL, RELA, RELB, RET, RFC2, RGS19, RHOA, RHOB, RHOC, RHOD, RIPK1, RPN2, RPS6KB1, RRM1, SARS, SELENBP1, SEMA3C, SEMA4D, SEPP1, SERPINH1, SFN, SFPQ, SFRS7, SHB, SHH, SIAH2, SIVA, SIVA TP53, SKI, SKIL, SLC16A1, SLC1A4, SLC20A1, SMO, SMPD1, SNAI2, SND1, SNRPB2, SOCS1, SOCS3, SOD1, SORT1, SPINT2, SPRY2, SRC, SRPX, STAT1, STAT2, STAT3, STAT5B, STC1, TAF1, TBL3, TBRG4, TCF1, TCF7L2, TFAP2C, TFDP1, TFDP2, TGFA, TGFB1, TGFBI, TGFBR2, TGFBR3, THBS1, TIE, TIMP1, TIMP3, TJP1, TK1, TLE1, TNF, TNFRSF10A, TNFRSF10B, TNFRSF1A, TNFRSF1B, TNFRSF6, TNFSF7, TNK1, TOB1, TP53, TP53BP2, TP53I3, TP73, TPBG, TPT1, TRADD, TRAM1, TRRAP, TSG101, TUFM, TXNRD1, TYRO3, UBC, UBE2L6, UCHL1, USP7, VDAC1, VEGF, VHL, VIL2, WEE1, WNT1, WNT2, WNT2B, WNT3, WNT5A, WT1, XRCC1, YES1, YWHAB, YWHAZ, ZAP70 и ZNF9.
В некоторых вариантах осуществления, настоящее изобретение относится к rAAV-вектору, содержащему нуклеиновую кислоту, кодирующую генный продукт, связанный с расстройством ЦНС. Ниже приведен неограничивающий перечень генов, ассоциированных с расстройствами, связанными с ЦНС: DRD2, GRIA1, GRIA2,GRIN1, SLC1A1, SYP, SYT1, CHRNA7, 3Rtau/4rTUS, APP, BAX, BCL-2, GRIK1, GFAP, IL-1, AGER, связанные с болезнью Альцгеймера; UCH-L1, SKP1, EGLN1, Nurr-1, BDNF, TrkB,gstm1, S106β, связанные с болезнью Паркинсона; IT15, PRNP, JPH3, TBP, ATXN1, ATXN2, ATXN3, Atrophin 1, FTL, TITF-1, связанные с болезнью Хантингтона; FXN, связанный с атаксией Фридриха; ООРА, связанный с болезнью Канавана; DMD, связанный с мышечной дистрофией; и SMN1, UBE1 и DYNC1H1, связанные со спинальной мышечной атрофией.
rAAV-вектор может содержать в качестве трансгена, нуклеиновую кислоту, кодирующую белок или функциональную РНК, которая модулирует апоптоз. Ниже приведен неограничивающий перечень генов, связанных с апоптозом, и нуклеиновых кислот, кодирующих продукты этих генов и их гомологов, и кодирующие малые интерферирующие нуклеиновые кислоты (например, shRNA, микроРНК), которые ингибируют экспрессию этих генов и их гомологов, являются полезными в качестве трансгенов в некоторых вариантах осуществления настоящего раскрытия: RPS27A, ABL1, AKT1, APAF1, BAD, BAG1, BAG3, BAG4, BAK1, BAX, BCL10, BCL2, BCL2A1, BCL2L1, BCL2L10, BCL2L11, BCL2L12, BCL2L13, BCL2L2, BCLAF1, BFAR, BID, BIK, NAIP, BIRC2, BIRC3, XIAP, BIRC5, BIRC6, BIRC7, BIRC8, BNIP1, BNIP2, BNIP3, BNIP3L, BOK, BRAF, CARD10, CARD11, NLRC4, CARD14, NOD2, NOD1, CARD6, CARD8, CARD9, CASP1, CASP10, CASP14, CASP2, CASP3, CASP4, CASP5, CASP6, CASP7, CASP8, CASP9, CFLAR, CIDEA, CIDEB, CRADD, DAPK1, DAPK2, DFFA, DFFB, FADD, GADD45A, GDNF, HRK, IGF1R, LTA, LTBR, MCL1, NOL3, PYCARD, RIPK1, RIPK2, TNF, TNFRSF10A, TNFRSF10B, TNFRSF10C, TNFRSF10D, TNFRSF11B, TNFRSF12A, TNFRSF14, TNFRSF19, TNFRSF1A, TNFRSF1B, TNFRSF21, TNFRSF25, CD40, FAS, TNFRSF6B, CD27, TNFRSF9, TNFSF10, TNFSF14, TNFSF18, CD40LG, FASLG, CD70, TNFSF8, TNFSF9, TP53, TP53BP2, TP73, TP63, TRADD, TRAF1, TRAF2, TRAF3, TRAF4, TRAF5 DRD2, GRIA1, GRIA2,GRIN1, SLC1A1, SYP, SYT1, CHRNA7, 3Rtau/4rTUS, APP, BAX, BCL-2, GRIK1, GFAP, IL-1, AGER, UCH-L1, SKP1, EGLN1, Nurr-1, BDNF, TrkB, gstml, S106β, IT15, PRNP, JPH3, TBP, ATXN1, ATXN2, ATXN3, атрофин 1, FTL, TITF-1, FXN, ASPA, DMD и SMN1, UBE1, DYNC1H1.
Специалисту в данной области будет также понятно, что в случае трансгенов, кодирующих белки или полипептиды, мутации, которые приводят к консервативным аминокислотным заменам, могут быть сделаны в трансгене, чтобы предоставить функционально эквивалентные варианты или гомологи белка или полипептида. В некоторых аспектах раскрытие охватывает изменения последовательности, которые приводят к консервативной аминокислотной замене трансгена. В некоторых вариантах трансген содержит ген, имеющий доминантно негативную мутацию. Например, трансген может экспрессировать мутантный белок, который взаимодействует с теми же самыми элементами, что и белок дикого типа, и тем самым блокирует некоторые аспекты функции белка дикого типа.
Полезные трансгенные продукты также включают микроРНК. микроРНК и другие малые интерферирующие нуклеиновые кислоты регулируют экспрессию генов с помощью расщепления/ деградации РНК транскрипта-мишени или репрессии трансляции матричной РНК-мишени (мРНК). микроРНК природно экспрессируются, как правило, в качестве 19-25 нетранслируемых РНК-продуктов. микроРНК проявляют свою активность через последовательность-специфические взаимодействия с 3'-нетранслируемыми областями (UTR) мРНК-мишеней. Эти эндогенно экспрессированные микроРНК образуют шпилькообразные предшественники, которые впоследствии процессируются в микроРНК-дуплекс, и далее в «зрелые» одноцепочечные молекулы микроРНК. Эта зрелая микроРНК направляет белковый комплекс, miRISC, который идентифицирует сайт-мишень, например, в 3'-UTR областях мРНК-мишеней на основе их комплементарности зрелой микроРНК.
Следует неограничивающий список генов микроРНК и их гомологов, полезных в качестве трансгенов или в качестве мишеней для малых интерферирующих нуклеиновых кислот, кодируемых трансгенами (например, микроРНК-губки, антисмысловые олигонуклеотиды, TUD РНК) в некоторых вариантах осуществления способов: hsa-let-7a, hsa-let-7a*, hsa-let-7b, hsa-let-7b*, hsa-let-7c, hsa-let-7c*, hsa-let-7d, hsa-let-7d*, hsa-let-7e, hsa-let-7e*, hsa-let-7f, hsa-let-7f-1*, hsa-let-7f-2*, hsa-let-7g, hsa-let-7g*, hsa-let-7i, hsa-let-7i*, hsa-miR-1, hsa-miR-100, hsa-miR-100*, hsa-miR-101, hsa-miR-101*, hsa-miR-103, hsa-miR-105, hsa-miR-105*, hsa-miR-106a, hsa-miR-106a*, hsa-miR-106b, hsa-miR-106b*, hsa-miR-107, hsa-miR-10a, hsa-miR-10a*, hsa-miR-10b, hsa-miR-10b*, hsa-miR-1178, hsa-miR-1179, hsa-miR-1180, hsa-miR-1181, hsa-miR-1182, hsa-miR-1183, hsa-miR-1184, hsa-miR-1185, hsa-miR-1197, hsa-miR-1200, hsa-miR-1201, hsa-miR-1202, hsa-miR-1203, hsa-miR-1204, hsa-miR-1205, hsa-miR-1206, hsa-miR-1207-3p, hsa-miR-1207-5p, hsa-miR-1208, hsa-miR-122, hsa-miR-122*, hsa-miR-1224-3p, hsa-miR-1224-5p, hsa-miR-1225-3p, hsa-miR-1225-5p, hsa-miR-1226, hsa-miR-1226*, hsa-miR-1227, hsa-miR-1228, hsa-miR-1228*, hsa-miR-1229, hsa-miR-1231, hsa-miR-1233, hsa-miR-1234, hsa-miR-1236, hsa-miR-1237, hsa-miR-1238, hsa-miR-124, hsa-miR-124*, hsa-miR-1243, hsa-miR-1244, hsa-miR-1245, hsa-miR-1246, hsa-miR-1247, hsa-miR-1248, hsa-miR-1249, hsa-miR-1250, hsa-miR-1251, hsa-miR-1252, hsa-miR-1253, hsa-miR-1254, hsa-miR-1255a, hsa-miR-1255b, hsa-miR-1256, hsa-miR-1257, hsa-miR-1258, hsa-miR-1259, hsa-miR-125a-3p, hsa-miR-125a-5p, hsa-miR-125b, hsa-miR-125b-1*, hsa-miR-125b-2*, hsa-miR-126, hsa-miR-126*, hsa-miR-1260, hsa-miR-1261, hsa-miR-1262, hsa-miR-1263, hsa-miR-1264, hsa-miR-1265, hsa-miR-1266, hsa-miR-1267, hsa-miR-1268, hsa-miR-1269, hsa-miR-1270, hsa-miR-1271, hsa-miR-1272, hsa-miR-1273, hsa-miR-127-3p, hsa-miR-1274a, hsa-miR-1274b, hsa-miR-1275, hsa-miR-127-5p, hsa-miR-1276, hsa-miR-1277, hsa-miR-1278, hsa-miR-1279, hsa-miR-128, hsa-miR-1280, hsa-miR-1281, hsa-miR-1282, hsa-miR-1283, hsa-miR-1284, hsa-miR-1285, hsa-miR-1286, hsa-miR-1287, hsa-miR-1288, hsa-miR-1289, hsa-miR-129*, hsa-miR-1290, hsa-miR-1291, hsa-miR-1292, hsa-miR-1293, hsa-miR-129-3p, hsa-miR-1294, hsa-miR-1295, hsa-miR-129-5p, hsa-miR-1296, hsa-miR-1297, hsa-miR-1298, hsa-miR-1299, hsa-miR-1300, hsa-miR-1301, hsa-miR-1302, hsa-miR-1303, hsa-miR-1304, hsa-miR-1305, hsa-miR-1306, hsa-miR-1307, hsa-miR-1308, hsa-miR-130a, hsa-miR-130a*, hsa-miR-130b, hsa-miR-130b*, hsa-miR-132, hsa-miR-132*, hsa-miR-1321, hsa-miR-1322, hsa-miR-1323, hsa-miR-1324, hsa-miR-133a, hsa-miR-133b, hsa-miR-134, hsa-miR-135a, hsa-miR-135a*, hsa-miR-135b, hsa-miR-135b*, hsa-miR-136, hsa-miR-136*, hsa-miR-137, hsa-miR-138, hsa-miR-138-1*, hsa-miR-138-2*, hsa-miR-139-3p, hsa-miR-139-5p, hsa-miR-140-3p, hsa-miR-140-5p, hsa-miR-141, hsa-miR-141*, hsa-miR-142-3p, hsa-miR-142-5p, hsa-miR-143, hsa-miR-143*, hsa-miR-144, hsa-miR-144*, hsa-miR-145, hsa-miR-145*, hsa-miR-146a, hsa-miR-146a*, hsa-miR-146b-3p, hsa-miR-146b-5p, hsa-miR-147, hsa-miR-147b, hsa-miR-148a, hsa-miR-148a*, hsa-miR-148b, hsa-miR-148b*, hsa-miR-149, hsa-miR-149*, hsa-miR-150, hsa-miR-150*, hsa-miR-151-3p, hsa-miR-151-5p, hsa-miR-152, hsa-miR-153, hsa-miR-154, hsa-miR-154*, hsa-miR-155, hsa-miR-155*, hsa-miR-15a, hsa-miR-15a*, hsa-miR-15b, hsa-miR-15b*, hsa-miR-16, hsa-miR-16-1*, hsa-miR-16-2*, hsa-miR-17, hsa-miR-17*, hsa-miR-181a, hsa-miR-181a*, hsa-miR-181a-2*, hsa-miR-181b, hsa-miR-181c, hsa-miR-181c*, hsa-miR-181d, hsa-miR-182, hsa-miR-182*, hsa-miR-1825, hsa-miR-1826, hsa-miR-1827, hsa-miR-183, hsa-miR-183*, hsa-miR-184, hsa-miR-185, hsa-miR-185*, hsa-miR-186, hsa-miR-186*, hsa-miR-187, hsa-miR-187*, hsa-miR-188-3p, hsa-miR-188-5p, hsa-miR-18a, hsa-miR-18a*, hsa-miR-18b, hsa-miR-18b*, hsa-miR-190, hsa-miR-190b, hsa-miR-191, hsa-miR-191*, hsa-miR-192, hsa-miR-192*, hsa-miR-193a-3p, hsa-miR-193a-5p, hsa-miR-193b, hsa-miR-193b*, hsa-miR-194, hsa-miR-194*, hsa-miR-195, hsa-miR-195*, hsa-miR-196a, hsa-miR-196a*, hsa-miR-196b, hsa-miR-197, hsa-miR-198, hsa-miR-199a-3p, hsa-miR-199a-5p, hsa-miR-199b-5p, hsa-miR-19a, hsa-miR-19a*, hsa-miR-19b, hsa-miR-19b-1*, hsa-miR-19b-2*, hsa-miR-200a, hsa-miR-200a*, hsa-miR-200b, hsa-miR-200b*, hsa-miR-200c, hsa-miR-200c*, hsa-miR-202, hsa-miR-202*, hsa-miR-203, hsa-miR-204, hsa-miR-205, hsa-miR-206, hsa-miR-208a, hsa-miR-208b, hsa-miR-20a, hsa-miR-20a*, hsa-miR-20b, hsa-miR-20b*, hsa-miR-21, hsa-miR-21*, hsa-miR-210, hsa-miR-211, hsa-miR-212, hsa-miR-214, hsa-miR-214*, hsa-miR-215, hsa-miR-216a, hsa-miR-216b, hsa-miR-217, hsa-miR-218, hsa-miR-218-1*, hsa-miR-218-2*, hsa-miR-219-1-3p, hsa-miR-219-2-3p, hsa-miR-219-5p, hsa-miR-22, hsa-miR-22*, hsa-miR-220a, hsa-miR-220b, hsa-miR-220c, hsa-miR-221, hsa-miR-221*, hsa-miR-222, hsa-miR-222*, hsa-miR-223, hsa-miR-223*, hsa-miR-224, hsa-miR-23a, hsa-miR-23a*, hsa-miR-23b, hsa-miR-23b*, hsa-miR-24, hsa-miR-24-1*, hsa-miR-24-2*, hsa-miR-25, hsa-miR-25*, hsa-miR-26a, hsa-miR-26a-1*, hsa-miR-26a-2*, hsa-miR-26b, hsa-miR-26b*, hsa-miR-27a, hsa-miR-27a*, hsa-miR-27b, hsa-miR-27b*, hsa-miR-28-3p, hsa-miR-28-5p, hsa-miR-296-3p, hsa-miR-296-5p, hsa-miR-297, hsa-miR-298, hsa-miR-299-3p, hsa-miR-299-5p, hsa-miR-29a, hsa-miR-29a*, hsa-miR-29b, hsa-miR-29b-1*, hsa-miR-29b-2*, hsa-miR-29c, hsa-miR-29c*, hsa-miR-300, hsa-miR-301a, hsa-miR-301b, hsa-miR-302a, hsa-miR-302a*, hsa-miR-302b, hsa-miR-302b*, hsa-miR-302c, hsa-miR-302c*, hsa-miR-302d, hsa-miR-302d*, hsa-miR-302e, hsa-miR-302f, hsa-miR-30a, hsa-miR-30a*, hsa-miR-30b, hsa-miR-30b*, hsa-miR-30c, hsa-miR-30c-1*, hsa-miR-30c-2*, hsa-miR-30d, hsa-miR-30d*, hsa-miR-30e, hsa-miR-30e*, hsa-miR-31, hsa-miR-31*, hsa-miR-32, hsa-miR-32*, hsa-miR-320a, hsa-miR-320b, hsa-miR-320c, hsa-miR-320d, hsa-miR-323-3p, hsa-miR-323-5p, hsa-miR-324-3p, hsa-miR-324-5p, hsa-miR-325, hsa-miR-326, hsa-miR-328, hsa-miR-329, hsa-miR-330-3p, hsa-miR-330-5p, hsa-miR-331-3p, hsa-miR-331-5p, hsa-miR-335, hsa-miR-335*, hsa-miR-337-3p, hsa-miR-337-5p, hsa-miR-338-3p, hsa-miR-338-5p, hsa-miR-339-3p, hsa-miR-339-5p, hsa-miR-33a, hsa-miR-33a*, hsa-miR-33b, hsa-miR-33b*, hsa-miR-340, hsa-miR-340*, hsa-miR-342-3p, hsa-miR-342-5p, hsa-miR-345, hsa-miR-346, hsa-miR-34a, hsa-miR-34a*, hsa-miR-34b, hsa-miR-34b*, hsa-miR-34c-3p, hsa-miR-34c-5p, hsa-miR-361-3p, hsa-miR-361-5p, hsa-miR-362-3p, hsa-miR-362-5p, hsa-miR-363, hsa-miR-363*, hsa-miR-365, hsa-miR-367, hsa-miR-367*, hsa-miR-369-3p, hsa-miR-369-5p, hsa-miR-370, hsa-miR-371-3p, hsa-miR-371-5p, hsa-miR-372, hsa-miR-373, hsa-miR-373*, hsa-miR-374a, hsa-miR-374a*, hsa-miR-374b, hsa-miR-374b*, hsa-miR-375, hsa-miR-376a, hsa-miR-376a*, hsa-miR-376b, hsa-miR-376c, hsa-miR-377, hsa-miR-377*, hsa-miR-378, hsa-miR-378*, hsa-miR-379, hsa-miR-379*, hsa-miR-380, hsa-miR-380*, hsa-miR-381, hsa-miR-382, hsa-miR-383, hsa-miR-384, hsa-miR-409-3p, hsa-miR-409-5p, hsa-miR-410, hsa-miR-411, hsa-miR-411*, hsa-miR-412, hsa-miR-421, hsa-miR-422a, hsa-miR-423-3p, hsa-miR-423-5p, hsa-miR-424, hsa-miR-424*, hsa-miR-425, hsa-miR-425*, hsa-miR-429, hsa-miR-431, hsa-miR-431*, hsa-miR-432, hsa-miR-432*, hsa-miR-433, hsa-miR-448, hsa-miR-449a, hsa-miR-449b, hsa-miR-450a, hsa-miR-450b-3p, hsa-miR-450b-5p, hsa-miR-451, hsa-miR-452, hsa-miR-452*, hsa-miR-453, hsa-miR-454, hsa-miR-454*, hsa-miR-455-3p, hsa-miR-455-5p, hsa-miR-483-3p, hsa-miR-483-5p, hsa-miR-484, hsa-miR-485-3p, hsa-miR-485-5p, hsa-miR-486-3p, hsa-miR-486-5p, hsa-miR-487a, hsa-miR-487b, hsa-miR-488, hsa-miR-488*, hsa-miR-489, hsa-miR-490-3p, hsa-miR-490-5p, hsa-miR-491-3p, hsa-miR-491-5p, hsa-miR-492, hsa-miR-493, hsa-miR-493*, hsa-miR-494, hsa-miR-495, hsa-miR-496, hsa-miR-497, hsa-miR-497*, hsa-miR-498, hsa-miR-499-3p, hsa-miR-499-5p, hsa-miR-500, hsa-miR-500*, hsa-miR-501-3p, hsa-miR-501-5p, hsa-miR-502-3p, hsa-miR-502-5p, hsa-miR-503, hsa-miR-504, hsa-miR-505, hsa-miR-505*, hsa-miR-506, hsa-miR-507, hsa-miR-508-3p, hsa-miR-508-5p, hsa-miR-509-3-5p, hsa-miR-509-3p, hsa-miR-509-5p, hsa-miR-510, hsa-miR-511, hsa-miR-512-3p, hsa-miR-512-5p, hsa-miR-513a-3p, hsa-miR-513a-5p, hsa-miR-513b, hsa-miR-513c, hsa-miR-514, hsa-miR-515-3p, hsa-miR-515-5p, hsa-miR-516a-3p, hsa-miR-516a-5p, hsa-miR-516b, hsa-miR-517*, hsa-miR-517a, hsa-miR-517b, hsa-miR-517c, hsa-miR-518a-3p, hsa-miR-518a-5p, hsa-miR-518b, hsa-miR-518c, hsa-miR-518c*, hsa-miR-518d-3p, hsa-miR-518d-5p, hsa-miR-518e, hsa-miR-518e*, hsa-miR-518f, hsa-miR-518f*, hsa-miR-519a, hsa-miR-519b-3p, hsa-miR-519c-3p, hsa-miR-519d, hsa-miR-519e, hsa-miR-519e*, hsa-miR-520a-3p, hsa-miR-520a-5p, hsa-miR-520b, hsa-miR-520c-3p, hsa-miR-520d-3p, hsa-miR-520d-5p, hsa-miR-520e, hsa-miR-520f, hsa-miR-520g, hsa-miR-520h, hsa-miR-521, hsa-miR-522, hsa-miR-523, hsa-miR-524-3p, hsa-miR-524-5p, hsa-miR-525-3p, hsa-miR-525-5p, hsa-miR-526b, hsa-miR-526b*, hsa-miR-532-3p, hsa-miR-532-5p, hsa-miR-539, hsa-miR-541, hsa-miR-541*, hsa-miR-542-3p, hsa-miR-542-5p, hsa-miR-543, hsa-miR-544, hsa-miR-545, hsa-miR-545*, hsa-miR-548a-3p, hsa-miR-548a-5p, hsa-miR-548b-3p, hsa-miR-548b-5p, hsa-miR-548c-3p, hsa-miR-548c-5p, hsa-miR-548d-3p, hsa-miR-548d-5p, hsa-miR-548e, hsa-miR-548f, hsa-miR-548g, hsa-miR-548h, hsa-miR-548i, hsa-miR-548j, hsa-miR-548k, hsa-miR-548l, hsa-miR-548m, hsa-miR-548n, hsa-miR-548o, hsa-miR-548p, hsa-miR-549, hsa-miR-550, hsa-miR-550*, hsa-miR-551a, hsa-miR-551b, hsa-miR-551b*, hsa-miR-552, hsa-miR-553, hsa-miR-554, hsa-miR-555, hsa-miR-556-3p, hsa-miR-556-5p, hsa-miR-557, hsa-miR-558, hsa-miR-559, hsa-miR-561, hsa-miR-562, hsa-miR-563, hsa-miR-564, hsa-miR-566, hsa-miR-567, hsa-miR-568, hsa-miR-569, hsa-miR-570, hsa-miR-571, hsa-miR-572, hsa-miR-573, hsa-miR-574-3p, hsa-miR-574-5p, hsa-miR-575, hsa-miR-576-3p, hsa-miR-576-5p, hsa-miR-577, hsa-miR-578, hsa-miR-579, hsa-miR-580, hsa-miR-581, hsa-miR-582-3p, hsa-miR-582-5p, hsa-miR-583, hsa-miR-584, hsa-miR-585, hsa-miR-586, hsa-miR-587, hsa-miR-588, hsa-miR-589, hsa-miR-589*, hsa-miR-590-3p, hsa-miR-590-5p, hsa-miR-591, hsa-miR-592, hsa-miR-593, hsa-miR-593*, hsa-miR-595, hsa-miR-596, hsa-miR-597, hsa-miR-598, hsa-miR-599, hsa-miR-600, hsa-miR-601, hsa-miR-602, hsa-miR-603, hsa-miR-604, hsa-miR-605, hsa-miR-606, hsa-miR-607, hsa-miR-608, hsa-miR-609, hsa-miR-610, hsa-miR-611, hsa-miR-612, hsa-miR-613, hsa-miR-614, hsa-miR-615-3p, hsa-miR-615-5p, hsa-miR-616, hsa-miR-616*, hsa-miR-617, hsa-miR-618, hsa-miR-619, hsa-miR-620, hsa-miR-621, hsa-miR-622, hsa-miR-623, hsa-miR-624, hsa-miR-624*, hsa-miR-625, hsa-miR-625*, hsa-miR-626, hsa-miR-627, hsa-miR-628-3p, hsa-miR-628-5p, hsa-miR-629, hsa-miR-629*, hsa-miR-630, hsa-miR-631, hsa-miR-632, hsa-miR-633, hsa-miR-634, hsa-miR-635, hsa-miR-636, hsa-miR-637, hsa-miR-638, hsa-miR-639, hsa-miR-640, hsa-miR-641, hsa-miR-642, hsa-miR-643, hsa-miR-644, hsa-miR-645, hsa-miR-646, hsa-miR-647, hsa-miR-648, hsa-miR-649, hsa-miR-650, hsa-miR-651, hsa-miR-652, hsa-miR-653, hsa-miR-654-3p, hsa-miR-654-5p, hsa-miR-655, hsa-miR-656, hsa-miR-657, hsa-miR-658, hsa-miR-659, hsa-miR-660, hsa-miR-661, hsa-miR-662, hsa-miR-663, hsa-miR-663b, hsa-miR-664, hsa-miR-664*, hsa-miR-665, hsa-miR-668, hsa-miR-671-3p, hsa-miR-671-5p, hsa-miR-675, hsa-miR-7, hsa-miR-708, hsa-miR-708*, hsa-miR-7-1*, hsa-miR-7-2*, hsa-miR-720, hsa-miR-744, hsa-miR-744*, hsa-miR-758, hsa-miR-760, hsa-miR-765, hsa-miR-766, hsa-miR-767-3p, hsa-miR-767-5p, hsa-miR-768-3p, hsa-miR-768-5p, hsa-miR-769-3p, hsa-miR-769-5p, hsa-miR-770-5p, hsa-miR-802, hsa-miR-873, hsa-miR-874, hsa-miR-875-3p, hsa-miR-875-5p, hsa-miR-876-3p, hsa-miR-876-5p, hsa-miR-877, hsa-miR-877*, hsa-miR-885-3p, hsa-miR-885-5p, hsa-miR-886-3p, hsa-miR-886-5p, hsa-miR-887, hsa-miR-888, hsa-miR-888*, hsa-miR-889, hsa-miR-890, hsa-miR-891a, hsa-miR-891b, hsa-miR-892a, hsa-miR-892b, hsa-miR-9, hsa-miR-9*, hsa-miR-920, hsa-miR-921, hsa-miR-922, hsa-miR-923, hsa-miR-924, hsa-miR-92a, hsa-miR-92a-1*, hsa-miR-92a-2*, hsa-miR-92b, hsa-miR-92b*, hsa-miR-93, hsa-miR-93*, hsa-miR-933, hsa-miR-934, hsa-miR-935, hsa-miR-936, hsa-miR-937, hsa-miR-938, hsa-miR-939, hsa-miR-940, hsa-miR-941, hsa-miR-942, hsa-miR-943, hsa-miR-944, hsa-miR-95, hsa-miR-96, hsa-miR-96*, hsa-miR-98, hsa-miR-99a, hsa-miR-99a*, hsa-miR-99b и hsa-miR-99b*.
МикроРНК ингибирует функцию мРНК, на которые она нацелена и, как следствие, ингибирует экспрессию полипептидов, кодируемых мРНК. Таким образом, блокирование (частично или полностью) активности микроРНК (например, сайленсинг микроРНК) может эффективно индуцировать или восстанавливать экспрессию полипептида, экспрессия которого ингибируется (дерепрессия полипептида). В одном варианте осуществления дерепрессия полипептидов, кодируемых мРНК - мишенями микроРНК осуществляется путем ингибирования активности микроРНК в клетках любым из множества способов. Например, блокирование активности микроРНК может быть достигнуто путем гибридизации с малой интерферирующей нуклеиновой кислотой (например, антисмысловой олигонуклеотид, микроРНК-губка, TUD РНК), которая комплементарна или в существенной степени комплементарна микроРНК, блокируя тем самым взаимодействие микроРНК с ее мРНК-мишенью. Как используется в настоящем описании, малая интерферирующая нуклеиновая кислота, которая в существенной степени комплементарна микроРНК, является та, которая способна к гибридизации с микроРНК, и блокированию активности микроРНК. В некоторых вариантах осуществления малая интерферирующая нуклеиновая кислота, которая в существенной степени комплементарна микроРНК, представляет собой малую интерферирующую нуклеиновую кислоту, которая комплементарна микроРНК по всем, кроме 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 оснований. В некоторых вариантах осуществления малая интерферирующая нуклеиновая кислота, которая в существенной степени комплементарна микроРНК, представляет собой малую интерферирующую нуклеиновую кислоту, которая комплементарна микроРНК по, по меньшей мере, одному основанию.
«Ингибитор микроРНК» представляет собой средство, которое блокирует функцию микроРНК, экспрессию и/ или процессинг. Например, эти молекулы включают, в качестве неограничивающих примеров, антисенсы, специфические к микроРНК, микроРНК-губки, жесткие ложные РНК (TUD РНК) и олигонуклеотиды микроРНК (двухцепочечные, шпильки, короткие олигонуклеотиды), которые ингибируют взаимодействие микроРНК с комплексом Drosha. Ингибиторы микроРНК могут экспрессироваться в клетках с трансгенов rAAV-вектора, как обсуждалось выше. МикроРНК-губки специфически ингибируют микроРНК через комплементарную гептамерную затравочную последовательность (Ebert, M.S. Nature Methods, Epub August, 12, 2007;). В некоторых вариантах осуществления целое семейство микроРНК может быть подавлено с использованием одной последовательности губки. TUD РНК достигают эффективной и долговременной супрессии, подавления специфических микроРНКа в клетках млекопитающих (смотрите, например, Takeshi Haraguchi, et al., Nucleic Acids Research, 2009, Vol. 37, No. 6 e43, содержание которого в связи с TuD РНК включено в настоящее описание в качестве ссылки). Другие способы сайленсинга функции микроРНК (дерепрессии мишеней микроРНК) в клетках будут очевидны любому специалисту в данной области техники.
В некоторых вариантах осуществления клонирующая способность рекомбинантного РНК-вектора может быть ограничена, и для желаемой кодирующей последовательности может потребоваться полная замена 4,8 т.п.н. генома вируса. Большие гены, таким образом, могут быть непригодны для использования в стандартном рекомбинантном AAV-векторе, в некоторых случаях. Специалисту будет понятно, что в данной области доступны варианты для преодоления ограниченных возможностей клонирования. К примеру, ITR AAV двух геномов можно отжечь с образованием конкатемеров от головы до хвоста, почти в два раза увеличивая емкость вектора. Размещение сайтов сплайсинга позволяет удалять ITR из транскрипта. Другие варианты для преодоления ограниченных возможностей клонирования будут очевидны специалистами в данной области техники.
Соматические трансгенные животные-модели, полученные передачей генов на основе rAAV
Настоящее изобретение также относится к получению соматических трансгенных животных-моделей заболеваний с использованием способов на основе рекомбинантного аденоассоциированного вируса (rAAV). Эти способы основаны, по меньшей мере, частично на наблюдении, что серотипы AAV и их варианты опосредуют эффективный и стабильный перенос генов тканеспецифическим образом у взрослых животных. Элементы rAAV (капсид, промотор, продукты трансгенов) комбинируют для получения соматических трансгенных животных моделей, которые экспрессируют стабильный трансген во времени и тканеспецифическим образом. Соматическое трансгенное животное, полученное с помощью способов по раскрытию, может служить в качестве полезных моделей болезни человека, патологического состояния и/ или для характеристики влияния гена, функция которого (например, тканеспецифичность, роль в болезни) неизвестна или не полностью понята. Например, животное (например, мышь) может быть инфицировано на определенной стадии развития (например, возраста) rAAV, содержащим капсид, обладающий возможностью тканеспецифичного нацеливания (например, печень, сердце, поджелудочная железа) и трансген, имеющий тканеспецифический промотор, запускающий экспрессию гена, вовлеченного в заболевание. При инфекции rAAV инфицирует различные клетки ткани-мишени и продуцирует продукт трансгена.
В некоторых вариантах осуществления последовательность кодирующей области трансгена модифицируется. Модификация может изменить функцию продукта, кодируемого трансгеном. Эффект модификации можно изучать in vivo путем генерации соматической модели трансгенного животного с использованием способов, описанных в настоящей заявке. В некоторых вариантах осуществления модификация последовательности кодирующей области представляет собой нонсенс мутацию, которая приводит к фрагменту (например, усеченному варианту). В других случаях, модификация представляет собой миссенс мутацию, которая приводит к аминокислотной замене. Другие модификации возможны и будут очевидны специалисту в данной области.
В некоторых вариантах осуществления трансген вызывает патологическое состояние. Трансген, который вызывает патологическое состояние, представляет собой ген, продукт которого играет роль в болезни или расстройстве (например, вызывает заболевание или расстройство, делает животное восприимчивым к болезни или расстройству) и/ или может вызвать заболевание или расстройство у животного. Затем животное можно наблюдать, чтобы оценить любое количество аспектов заболевания (например, прогрессирование, ответ на лечение и т.д.). Эти примеры не предназначены для ограничения, другие аспекты и примеры раскрыты в настоящем описании, и описаны более подробно ниже.
Раскрытие в некоторых аспектах предоставляет способы получения соматических трансгенных животных моделей путем целенаправленного уничтожения определенных типов клеток. Например, модель диабета 1 типа может быть получена путем целенаправленного разрушения панкреатических бета-островков. В других примерах, целенаправленное уничтожение определенных типов клеток может быть использовано для оценки роли специфических типов клеток на болезни человека. В связи с этим, трансгены, которые кодируют клеточные токсины (например, дифтерийный токсин (DTA)) или про-апоптотические гены (NTR, Box, и т.д.) могут быть полезны в качестве трансгенов для функциональной абляции конкретных типов клеток. Другие примеры трансгенов, чьи продукты убивают клетки, охватываются описанными в настоящем описании способами и будут очевидны для специалистов в данной области техники.
Раскрытие в некоторых аспектах относится к способам получения соматических трансгенных животных моделей для изучения долговременных эффектов сверхэкспрессии или нокдауна генов. Долговременная сверхэкспрессия или нокдаун (например, с помощью ингибитора shRNA, микроРНКа, микроРНК и т.д.) генов в конкретных тканях-мишенях может нарушать нормальный метаболический баланс и устанавливать патологическое состояние, в результате чего получается животная модель заболевания, такого как, например, злокачественное новообразование. Раскрытие в некоторых аспектах предоставляет способы получения соматических трансгенных животных моделей для изучения долговременнных эффектов сверхэкспрессии или нокдауна гена потенциальных онкогенов и других генов с целью изучения онкогенеза и функции генов в тканях-мишенях. Полезные продукты включают трансгенные белки, которые, как известно, связаны с раком, и малые интерферирующие нуклеиновые кислоты, ингибирующие экспрессию таких белков. Другие подходящие трансгены могут быть легко выбраны специалистом в данной области при условии, что они полезны для создания моделей на животных тканесецифического патологического состояния и/ или заболевания.
Способы введения рекомбинантных AAV
rAAV можно доставлять пациенту в композициях в соответствии с любыми подходящими способами, известными в данной области техники. rAAV, предпочтительно суспендированный в физиологически совместимом носителе (например, в композиции), может быть введен пациенту, например, животному-хозяину, такому как человек, мышь, крыса, кошка, собака, овца, кролик, лошадь, корова, коза, свинья, морская свинка, хомяк, курица, индейка или отличный от человека примат (например, макак). В некоторых вариантах осуществления животное-хозяин не включает человека.
Доставка rAAV млекопитающему может осущестляться, например, путем внутримышечной инъекции или путем введения в кровоток млекопитающего. Введение в кровоток можно проводить путем инъекции в вену, артерию или любой другой сосудистый канал. В некоторых вариантах осуществления настоящего изобретения rAAV вводят в кровоток посредством перфузии выделенной конечности, способ, хорошо известный в хирургическом искусстве, способ, фактически позволяющий специалисту изолировать конечность от системной циркуляции до введения rAAV-вирионов. Вариант способа перфузии изолированной конечности, описанный в патенте США No. 6177403, также может быть использован специалистом в данной области для введения вирионов в сосудистую сеть изолированной конечности, чтобы потенциально повысить трансдукции в мышечные клетки или ткани. Кроме того, в некоторых случаях может быть желательно доставить вирионы в ЦНС пациента. Под «ЦНС» подразумевают все клетки и ткани головного мозга и спинного мозга позвоночного. Таким образом, этот термин включает, в качестве неограничивающих примеров, нейрональные клетки, глиальные клетки, астроциты, цереброспинальную жидкость (CSF), интерстициальные пространства, кость, хрящ и тому подобное. Рекомбинантные AAV могут доставляться непосредственно в ЦНС или мозг путем инъекции, например, в желудочковую область, а также стриатум (например, хвостатое ядро или путамен стриатума), спинной мозг и нервно-мышечное соединение или мозжечковые дольки с помощью иглы, катетера или устройства, связанного с использованием нейрохирургических способов, известных в данной области техники, например, путем стереотаксической инъекции (См., например, Stein et al., J Virol 73:3424-3429, 1999; Davidson et al., PNAS 97:3428-3432, 2000; Davidson et al., Nat. Genet. 3:219-223, 1993; и Alisky and Davidson, Hum. Gene Ther. 11:2315-2329, 2000).
Композиции по изобретению могут содержать rAAV только, или в комбинации с одним или несколькими другими вирусами (например, второй кодирующий rAAV, имеющий один или более различных трансгенов). В некоторых вариантах осуществления композиция содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более различных rAAV, каждый из которых имеет один или более различных трансгенов.
Подходящие носители могут быть легко выбраны специалистом в данной области техники с учетом показаний, для которых rAAV направлен. Например, один подходящий носитель включает физиологический раствор, который может составлен с различными буферными растворами (например, забуференный фосфатом солевой раствор). Другие типичные носители включают физиологический раствор, стерильную лактозу, сахарозу, фосфат кальция, желатин, декстраны, агар, пектин, арахисовое масло, кунжутное масло и воду. Выбор носителя не является ограничением настоящего изобретения.
Необязательно, композиции по изобретению могут содержать, в дополнение к rAAV и носителю(ям), другие традиционные фармацевтические ингредиенты, такие как консерванты или химические стабилизаторы. Подходящие примеры включают консерванты хлорбутанол, сорбат калия, сорбиновую кислоту, диоксид серы, пропилгаллат, парабены, этилванилин, глицерин, фенол и парахлорфенол. Подходящие химические стабилизаторы включают желатин и альбумин.
rAAV вводят в количествах, достаточных для трансфекции клетки желаемой ткани и обеспечения достаточного уровня переноса и экспрессии генов без нежелательных побочных эффектов. Обычные и фармацевтически приемлемые способы введения включают, но не ограничиваются ими, прямую доставку в выбранный орган (например, доставка в печень инфузией в воротную вену), пероральный, ингаляцию (в том числе интраназальную и внутритрахеальную доставку), внутриглазной, внутривенный, внутримышечный, подкожный, внутрикожный, внутриопухолевый и другие парэнтеральные способы введения. Способы введения можно комбинировать, если это желательно.
Доза rAAV-вирионов, требуемых для достижения конкретного «терапевтического эффекта», например, единицы дозы в геномных копиях/ на килограмм массы тела (ГК/ кг), будет варьировать в зависимости от нескольких факторов, в том числе, в качестве неограничивающих примеров: способ введения rAAV-вирионов, уровень генной или РНК экспрессии, необходимый для достижения терапевтического эффекта, специфическое заболевание или расстройство, подвергаемое лечению, и стабильность генного или РНК продукта. Специалист в данной области техники может легко определить диапазон дозы rAAV-вирионов для лечения пациента, имеющего конкретное заболевание или расстройство, основываясь на вышеуказанных факторах, а также других факторах, которые хорошо известны в данной области техники.
Эффективное количество rAAV является количеством, достаточным для направленного инфицирования животного, для нацеливания на желаемую ткань. В некоторых вариантах осуществления эффективное количество rAAV является количеством, достаточным для получения стабильного соматического трансгенного животного-модели. Эффективное количество будет зависеть главным образом от таких факторов, как вид, возраст, масса, состояние здоровья пациента, а также от нацеливаемой ткани, и таким образом может меняться в зависимости от животного и ткани. Например, эффективное количество rAAV обычно находится в интервале от примерно 1 мл до примерно 100 мл раствора, содержащего от приблизительно 109до 1016 копий генома. В некоторых вариантах осуществления rAAV вводят в дозе 1010, 1011, 1012, 1013, 1014 или 1015геномных копий на пациента. В некоторых вариантах осуществления rAAV вводят в дозе 1010, 1011, 1012, 1013 или 1014геномных копий на кг. В некоторых случаях, доза от примерно 1011 до 1012rAAV геномных копий является подходящей. В некоторых вариантах осуществления, 1012 геномных копий rAAV является эффективным для нацеливания на ткани сердца, печени, и поджелудочной железы. В некоторых случаях, устойчивых трансгенных животных получают путем многократных доз rAAV.
В некоторых вариантах осуществления rAAV-композиции составляют для уменьшения агрегации AAV-частиц в композиции, в частности, когда rAAV присутствует в высоких концентрациях (например, ~1013 ГК/ мл или более). Способы уменьшения агрегации rAAV хорошо известны в данной области и включают, например, добавление поверхностно-активных веществ, регулирование рН, регулирование концентрации соли и т.д. (Смотри, например, Wright FR, et al., Molecular Therapy (2005) 12, 171-178, содержание которых включено в настоящее описание посредством ссылки.)
Рецептура растворов фармацевтически приемлемых наполнителей и носителей хорошо известна специалистам в данной области техники, поскольку является разработкой подходящего дозирования и режимов лечения для применения конкретных композиций, описанных в настоящем описании в различных режимах лечения.
Как правило, эти препараты могут содержать, по меньшей мере, примерно 0,1% активного соединения или более, хотя процентное содержание активного ингредиента (ов) могут, конечно, варьировать и обычно может быть в пределах от примерно 1 или 2% до примерно 70% или 80% или более от массы или объема общей композиции. Естественно, количество активного соединения в каждой терапевтически применяемой композиции может быть подготовлено таким образом, что подходящая доза будет получена в любой данной единичной дозе соединения. Такие факторы, как растворимость, биодоступность, биологический период полураспада, способ введения, срок хранения продукта, а также другие фармакологические соображения будут рассмотрены специалистами в данной области по подготовке таких фармацевтических препаратов, и, по существу, различные дозировки и схемы лечения могут быть желательными.
При определенных обстоятельствах желательно доставлять основанные на rAAV терапевтические конструкции в соответствующим образом сформулированных фармацевтических композициях, описанных в настоящем описании, либо подкожно, внутрь поджелудочной железы, интраназально, парентерально, внутривенно, внутримышечно, интратекально или перорально, внутрибрюшинно или путем ингаляции. В некоторых вариантах осуществления приемы введения, как описано в патентах США Nos. 5543158; 5641515 и 5399363 (каждый конкретно включен в настоящее описание в качестве ссылки во всей ее полноте), могут применяться для доставки rAAV. В некоторых вариантах осуществления, предпочтительным способом введения является инъекция в портальную вену.
Фармацевтические формы, подходящие для применения в виде инъекций, включают стерильные водные растворы или дисперсии и стерильные порошки для незапланированного приготовления стерильных инъекционных растворов или дисперсий. Дисперсии могут быть также приготовлены в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. При обычных условиях хранения и использования эти препараты содержат консервант для предотвращения роста микроорганизмов. Во многих случаях форма является стерильной и жидкой до такой степени, чтобы существовала возможность простого введения при помощи шприца. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибки. Носитель может быть растворителем или дисперсионной средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), их подходящие смеси и/ или растительные масла. Надлежащую текучесть можно поддерживать, например, путем использования покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем использования поверхностно-активных веществ. Предотвращение действия микроорганизмов может быть достигнуто с помощью различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, сорбиновой кислота, тимерозала и тому подобное. Во многих случаях будет предпочтительно включать изотонические средства, например, сахар или хлорид натрия. Пролонгированное всасывание инъекционных композиций может быть осуществлено за счет использования в композициях средств, задерживающих абсорбцию, например, моностеарата алюминия и желатина.
Для введения инъекционного водного раствора, например, раствор может быть соответствующим образом забуферен, при необходимости, и жидкий разбавитель сначала делают изотоническим с помощью достаточного количества физиологического раствора или глюкозы. Эти конкретные водные растворы особенно пригодны для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. В связи с этим, стерильная водная среда, которую можно использовать, должна быть известна специалистам в данной области техники. Например, одна доза может быть растворена в 1 мл изотонического раствора NaCl и либо добавлена к 1000 мл гиподермоклизисной жидкости, либо инъецирована в участок предполагаемой инфузии, (смотри, например, "Remington's Pharmaceutical Sciences" 15th Edition, pages 1035-1038 and 1570-1580). Некоторые вариации в дозировке обязательно будут иметь место в зависимости от состояния хозяина. Лицо, ответственное за введение, в любом случае, должно определить соответствующую дозу для конкретного организма-хозяина.
Стерильные растворы для инъекций получают путем включения активного rAAV в требуемом количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными в настоящем описании, с последующей стерилизацией фильтрованием в случае необходимости. Как правило, дисперсии получают включением различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и требуемые другие ингредиенты из тех, которые перечислены выше. В случае стерильных порошков для получения стерильных инъекционных растворов предпочтительными способами получения являются способы вакуумной сушки и сушки вымораживанием, которые дают порошок активного ингредиента плюс любой дополнительный желательный ингредиент из предварительно стерильно отфильтрованного раствора.
rAAV-композиции, раскрытые в настоящем описании, могут также быть подготовлены в нейтральной или солевой форме. Фармацевтически приемлемые соли включают кислотно-аддитивные соли (образованные со свободными аминогруппами белка) и соли, которые образованы с неорганическими кислотами, такими как, например, соляная кислота или фосфорная кислота, или органическими кислотами, такими как уксусная, щавелевая, винная, миндальный и тому подобное. Соли, образованные со свободными карбоксильными группами, также могут быть получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триметиламин, гистидин, прокаин и тому подобное. После приготовления растворы вводят способом, совместимым с лекарственной формой, и в таком количестве, которое является терапевтически эффективным. Препараты легко вводятся в различных лекарственных формах, таких как растворы для инъекций, капсулы с высвобождением лекарств и тому подобное.
Используемый в настоящем описании термин «носитель» включает любые и все растворители, дисперсионные среды, средства доставки, покрытия, разбавители, антибактериальные и противогрибковые средства, изотонические и задерживающие абсорбцию средства, буферы, растворы носителей, суспензии, коллоиды и тому подобное. Использование таких сред и средств для фармацевтически активных веществ хорошо известно в данной области техники. Дополнительные активные ингредиенты также могут быть включены в композицию. Фраза «фармацевтически приемлемый» относится к молекулярным частицам и композициям, которые не продуцируют аллергическую или подобную неблагоприятную реакцию при введении в организм хозяина.
Средства доставки, такие как липосомы, нанокапсулы, микрочастицы, микросферы, липидные частицы, везикулы и тому подобное, могут быть использованы для введения композиций по настоящему изобретению в подходящие клетки-хозяева. В частности, доставляющий трансгены rAAV-вектор можно подготовить для доставки либо инкапсулированными в липидную частицу, липосому, везикулу, наносферу или наночастицу или тому подобное.
Такие составы могут быть предпочтительными для введения фармацевтически приемлемых композиций, нуклеиновых кислот или rAAV-конструкций, раскрытых в настоящем описании. Создание и использование липосом, как правило, известны специалистам в данной области техники. В последнее время были разработаны липосомы с улучшенной стабильностью в сыворотке и увеличенным временем жизни в кровотоке (патент США No. 5741516). Кроме того, были описаны различные способы липосом и липосомо-подобных препаратов в качестве потенциальных носителей лекарств (патенты США Nos. 5567434, 5552157, 5565213, 5738868 и 5795587).
Липосомы успешно используются с несколькими типами клеток, которые обычно устойчивы к трансфекции при помощи других процедур. Кроме того, липосомы свободны от ограничений на длину ДНК, которые типичны для систем доставки на основе вирусов. Липосомы были эффективно использованы для введения генов, лекарственных средств, рентгенотерапевтических агентов, вирусов, факторы транскрипции и аллостерических эффекторов в различных культивируемых клеточных линиях и животных. Кроме того, были завершены некоторые успешные клинические испытания, исследующие эффективность липосом-опосредованной доставки лекарств.
Липосомы образуются из фосфолипидов, которые диспергированы в водной среде и спонтанно образуют многослойные концентрические двухслойные везикулы (также называемые многослойные везикулы (MLV). Как правило, MLV имеют диаметры от 25 нм до 4 мкм. Воздействие ультразвука на MLV приводит к образованию небольших однослойных пузырьков (SUV) с диаметром в диапазоне от 200 до 500 ангстрем, содержащих водный раствор в ядре.
В качестве альтернативы, могут быть использованы нанокапсульные препараты rAAV. Нанокапсулы обычно могут улавливать вещества в стабильно и воспроизводимо. Для того, чтобы избежать побочных эффектов из-за внутриклеточной полимерной перегрузки, такие ультрадисперсные частицы (размером примерно 0,1 мкм как) следует проектировать с использованием полимеров, способных разлагаться in vivo. Биоразлагаемые полиалкилцианакрилатные наночастицы, которые удовлетворяют этим требованиям, предлагаются для использования.
В дополнение к способам доставки, описанным выше, следующие способы также рассматриваются в качестве альтернативных способов доставки rAAV-композиций в организме-хозяине. Сонофорез (то есть, ультразвук) был использован и описан в патенте США No. 5656016 в качестве устройства для повышения скорости и эффективности проникновения лекарственного средства в и через систему кровообращения. Другие предусмотренные варианты доставки лекарственного средства предоставляют собой внутрикостные инъекции (патент США No 5779708), микрочиповые устройства (патент США No. 5797898), офтальмологические препараты (Bourlais et al., 1998), трансдермальные матрицы (патенты США Nos. 5770219 и 5783208), а также доставку, контролируемую обратной связью (патент США No. 5697899).
Наборы и родственные композиции
Описанные в настоящем описании средства в некоторых вариантах осуществления могут быть собраны в фармацевтические или диагностические или исследовательских наборы, чтобы облегчить их применение в терапевтических, диагностических и исследовательских приложениях. Набор может включать один или несколько контейнеров, хранящих компоненты по раскрытию и инструкции по применению. В частности, такие наборы могут включать в себя один или более средств, описанных в настоящем описании, вместе с инструкциями, описывающими предполагаемое применение и надлежащее использование этих агентов. В некоторых вариантах осуществления средства в наборе могут присутствовать в фармацевтической композиции и дозировке, подходящей для конкретного применения и способа введения средств. Наборы для исследовательских целей могут содержать компоненты в соответствующих концентрациях или количествах для выполнения различных экспериментов.
Набор может быть предназначен для облегчения использования исследователями описанных в настоящем описании способов и может иметь различные формы. Каждая из композиций комплекта, где это применимо, может быть представлены в жидкой форме (например, в растворе) или в твердой форме (например, сухой порошок). В некоторых случаях, некоторые из композиций могут быть составляемыми или иным образом процессируемыми (например, до активной формы), например, путем добавления подходящего растворителя или других видов (например, вода или среда для клеточной культуры), которые может быть или могут не быть предоставлены в наборе. Как использовано в настоящем описании, «инструкции» могут определять компонент инструкции и/ или содействия, и обычно включают в себя письменные инструкции или связанные с упаковкой по раскрытию. Инструкции также могут включать в себя любые устные или электронные инструкции, предоставляемые любым способом, таким образом, что пользователь будет четко понимать, что инструкции должны быть связаны с набором, например, аудиовизуально (например, видеомагнитофон, DVD и т.д.), через Интернет и/ или сетевую связь и т.д. Письменные инструкции могут быть в форме, предписанной правительственным агентством, регулирующим производство, применение или продажу фармацевтических или биологических продуктов, инструкции, в которых также может быть отражено подтверждение агентством по изготовлению, применению или продаже для введения животных.
Набор может содержать один или несколько из компонентов, описанных в настоящем описании, в одном или нескольких контейнерах. В качестве примера, в одном варианте осуществления набор может включать в себя инструкции для смешивания одного или нескольких компонентов набора и/ или выделения и смешивания образца и применение к пациенту. Набор может включать контейнер, содержащий средства, описанные в настоящем описании. Средства могут быть в виде жидкости, геля или твердого вещества (порошка). Средства могут быть получены в стерильных условиях, упакованы в шприц и помещены в холодильник. В качестве альтернативы они могут быть помещены во флакон или другой контейнер для хранения. Второй контейнер может содержать другие средства, подготовленные стерильно. В качестве альтернативы набор может включать в себя активные средства, предварительно смешанные и помещенные в шприц, флакон, пробирку или другой контейнер. Набор может иметь один или несколько или все компоненты, необходимые для введения средств животному, такие как шприц, устройства для топического нанесения или игла для внутривенного введения с тюбингом и мешком, в частности, в случае наборов для получения конкретных соматических животных-моделей.
Набор может иметь различные формы, такие как блистерный мешочек, мешочек в пластиковой упаковке, вакуумный герметичный мешочек, закрывающийся термопластный лоток, или аналогичный мешочек или лоточная форма, с вспомогательными приспособлениями, свободно упакованными в мешочке, одна или несколько пробирок, контейнеры, коробка или сумка. Набор может быть стерилизован после того, как добавляют вспомогательные приспособления, обеспечивая отдельным вспомогательным приспособлениям в контейнере возможность быть развернутыми по-другому. Наборы могут быть стерилизованы с использованием любых подходящих способов стерилизации, например, радиационной стерилизации, термической стерилизации или других способов стерилизации, известных в данной области техники. Набор может также включать другие компоненты, в зависимости от конкретного применения, например, контейнеры, клеточные среды, соли, буферы, реагенты, шприцы, иглы, ткань, например, марли, для нанесения или удаления дезинфицирующего средства, одноразовые перчатки, подложку для средств перед введением и т.д.
Инструкции, включенные в комплект, могут включать в себя способы детекции латентного AAV в клетке. Кроме того, наборы по изобретению могут включать инструкцию, отрицательный и/ или положительный контроль, контейнеры, разбавители и буферы для образца, пробирки для подготовки образцов и распечатанную или электронную таблицу последовательности эталонного AAV для сравнений последовательностей.
ПРИМЕРЫ
Пример 1: Выделение транскрипционно активной новой AAV-капсидной последовательности из тканей шимпанзе для разработки вектора
Для поиска новых AAV с предрасположенностью инфицирования приматов, было проанализировано множество тканей шимпанзе на наличие ААV-провирусных геномов и cap РНК, сначала при помощи количественной ПЦР и количественной ОТ-ПЦР с использованием набора из праймера и зонда для нацеливания на короткие участки консервативной cap последовательности. Шесть тканей (мозг, сердце, почки, печень, легкие и селезенка) от двух шимпанзе оценивали на cap последовательности AAV. Эти данные указывают на то, что все ткани несли AAV с различным содержанием, с самым высоким числом копий в печени. Впоследствии, были проведены ПЦР и ОТ-ПЦР клонирования, чтобы восстановить полноразмерные капсидные последовательности ДНК и РНК от обоих шимпанзе. кДНК-клоны (например, клоны VP1) анализировали с помощью секвенирования. В общей сложности 24 ДНК- и 23 РНК-клонов VP1 выделили с помощью ОТ-ПЦР и ПЦР и полностью секвенировали. Интересно, что 30 из этих 47 клонов были AAV5-подобными, из которых 14 клонов были продуктами ОТ-ПЦР.
Филогенетический анализ разделил капсидные клоны на три основных группы, тесно связанные с AAV3B, AAV4 и AAV5, которые пригодны для доставки генов в различные ткани (например, ткани-мишени ЦНС, почки, печени, селезенки и сердца). В таблице 1 приведены идентифицированные AAV-капсидные варианты. В таблице 2 представлены входящие номера NCBI AAV-серотипов дикого типа, связанных с выявленными вариантными последовательностями.
Вариантные cap кДНК-клоны с аминокислотными различиями от AAV3B, AAV4 или AAV5 и между собой были выбраны для дальнейшей характеристики с помощью анализа BLAST и множественного выравнивания последовательностей (таблица 3). Аминокислотные замены между вариантными белками капсида и AAV-серотипа дикого типа суммированы в таблицах 4-6.
Рекомбинантные AAV, содержащие капсиды примера (а именно, капсиды CBr-7.4, CBr-7.5 и CBr-7.8), были сконструированы и упакованы, чтобы содержать векторный геном, экспрессирующий люциферазу. Титры полученных rAAV составили 1.3 × 1010, 1.2 × 1010 и 1.2 × 1010 геномных копий/ мл для CBR-7,4, CBR-7,5 и CBR-7,8, соответственно. Клетки гепатомы Huh-7.5 были трансдуцированы рекомбинантными AAV, и экспрессию люциферазы проверяли, чтобы подтвердить трансдукцию и экспрессию (фиг. 4). AAV9 и AAV3B были исследованы в качестве контролей.
Таблица 1: ПОСЛЕДОВАТЕЛЬНОСТИ НОВЫХ AAV
Таблица 2: ВАРИАНТЫ ПОСЛЕДОВАТЕЛЬНОСТЕЙ AAV-КАПСИДА
Таблица 3: Аминокислотные замены среди вариантов AAV3B
Таблица 4: замены аминокислот среди вариантов AAV4
Таблица 5: Аминокислотные замены среди вариантов AAV5
Настоящее изобретение не ограничено в своем применении деталями конструкции и расположением компонентов, изложенных в настоящем описании или проиллюстрированных в чертежах. Изобретение допускает другие варианты осуществления и может применяться или осуществляться различными способами. Кроме того, фразеология и терминология, используемая в настоящем описании, имеет целью описание и не должна рассматриваться как ограничивающая. Использование «включающий», «содержащий» или «имеющий», «содержащий», «включающий» и их вариации в настоящем описании предназначено для охвата пунктов, перечисленных в дальнейшем, и их эквивалентов, а также дополнительных пунктов.
Таким образом, после описания нескольких аспектов, по меньшей мере, одного варианта осуществления настоящего изобретения должно быть понятно, что различные изменения, модификации и усовершенствования должны быть очевидными специалистам в данной области техники. Такие изменения, модификации и усовершенствования предназначены для того, чтобы быть частью данного описания, и предназначены для того, чтобы быть в пределах сущности и объема изобретения. Соответственно, приведенное выше описание и чертежи представлены только при помощи примера.
Реферат
Группа изобретений относится к биотехнологии и генной инженерии. Выделенный белок капсида AAV содержит последовательность, выбранную из группы, состоящей из: SEQ ID NO: от 51 до 61. Рекомбинантный вектор экспрессии содержит последовательность нуклеиновых кислот, кодирующую выделенный белок капсида ААV. Композиция для доставки трансгена пациенту содержит выделенный белок капсида ААV и фармацевтически приемлемый носитель. Рекомбинантный ААV (rAAV) содержит выделенный белок капсида ААV. Композиция для доставки трансгена пациенту содержит рекомбинантный rAAV и фармацевтически приемлемый носитель. Способ доставки трансгена пациенту включает введение rAAV пациенту, в котором rAAV содержит по меньшей мере один трансген и в котором rAAV инфицирует клетки ткани-мишени пациента. Способ создания соматической трансгенной животной модели включает введение рекомбинантного rAAV животному, отличному от человека, в котором rAAV содержит по меньшей мере один трансген и в котором rAAV инфицирует клетку ткани-мишени животного, отличного от человека. Набор для получения rAAV включает контейнер, содержащий рекомбинантный AAV, имеющий выделенный белок капсида ААV. Группа изобретений обеспечивает улучшенные свойства тропизма к ткани. 8 н. и 8 з.п. ф-лы, 4 ил., 5 табл., 1 пр.

Комментарии