Желудочно-кишечный пролиферативный фактор и его применения - RU2343158C2
Код документа: RU2343158C2
Чертежи



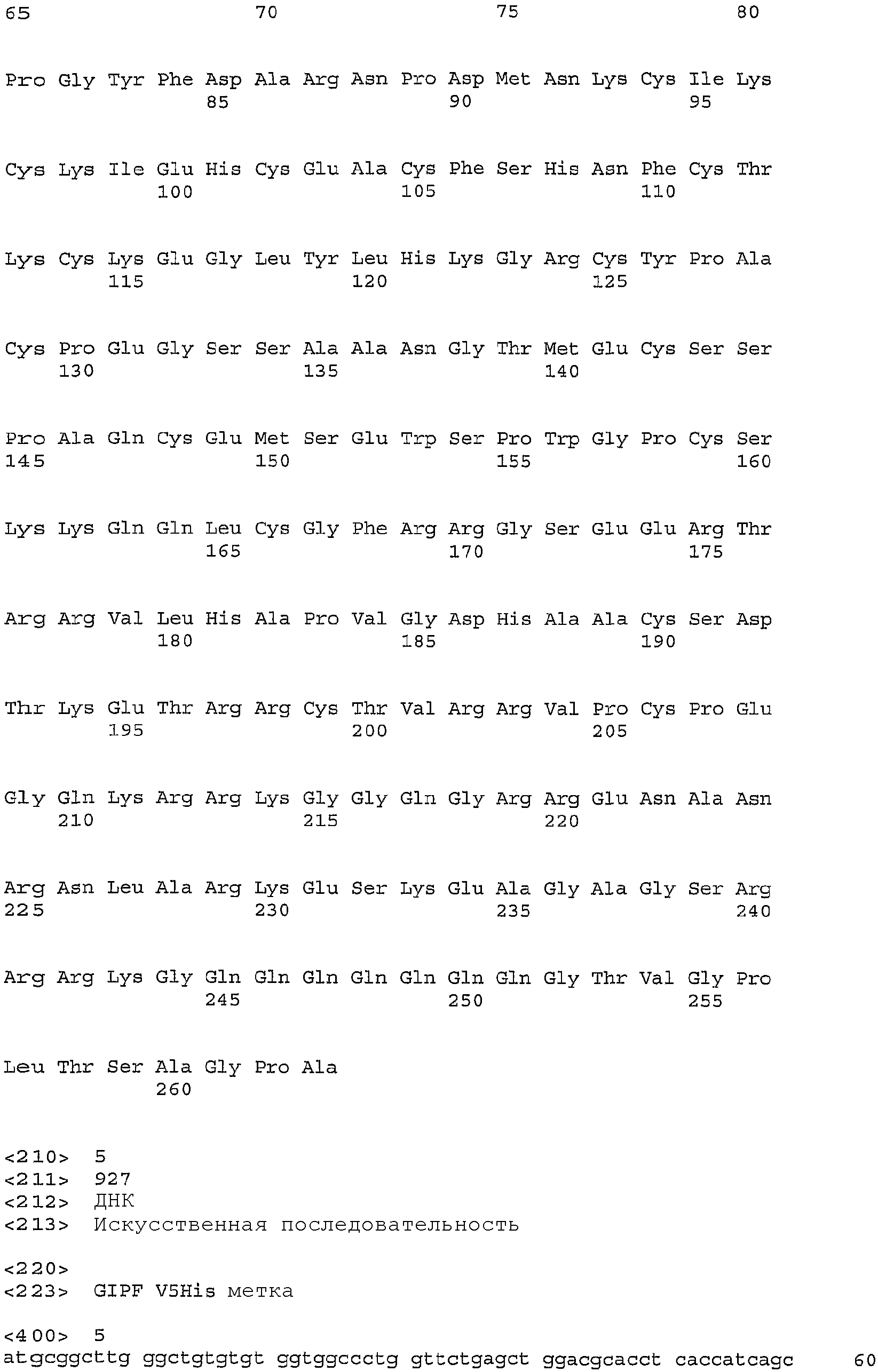






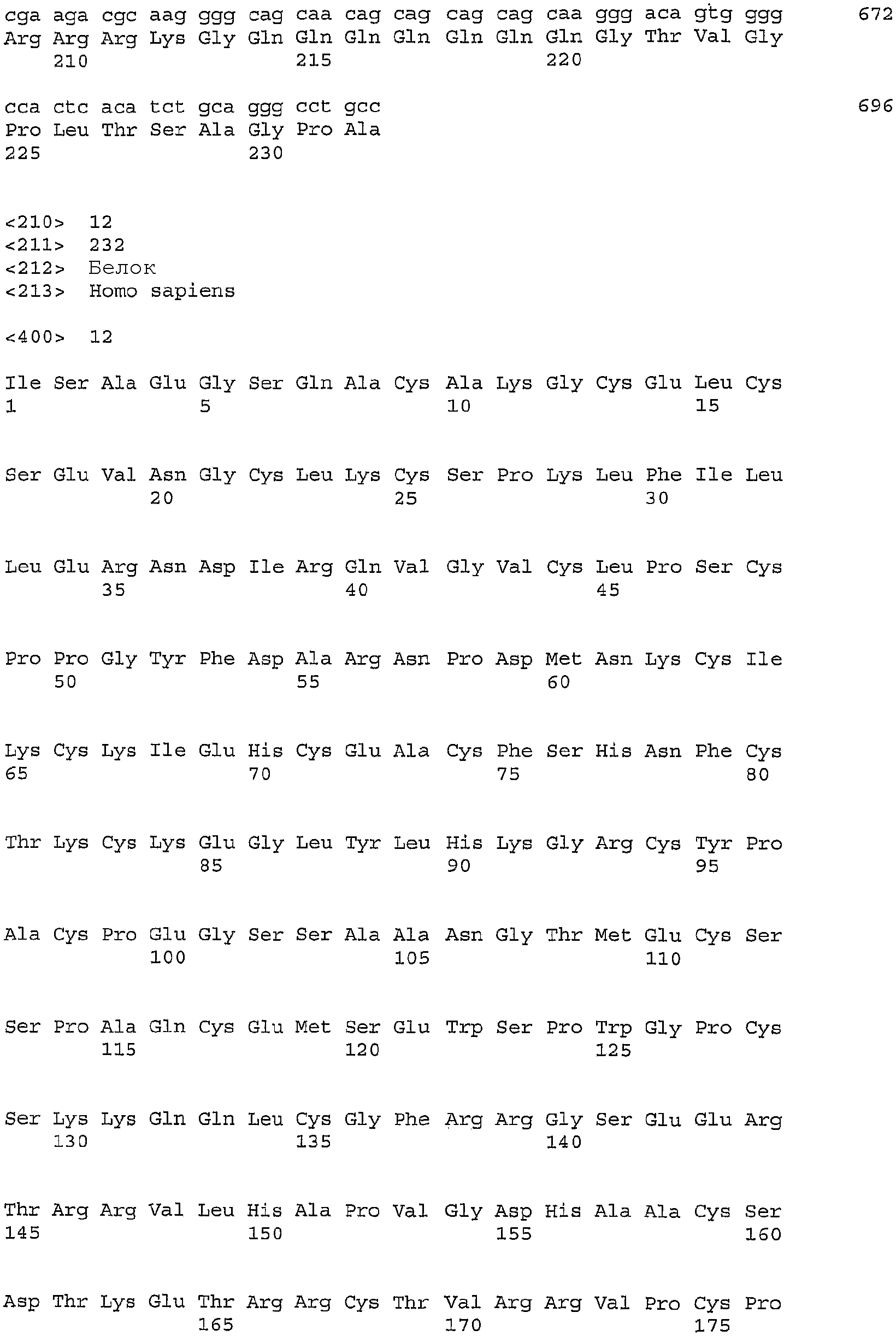








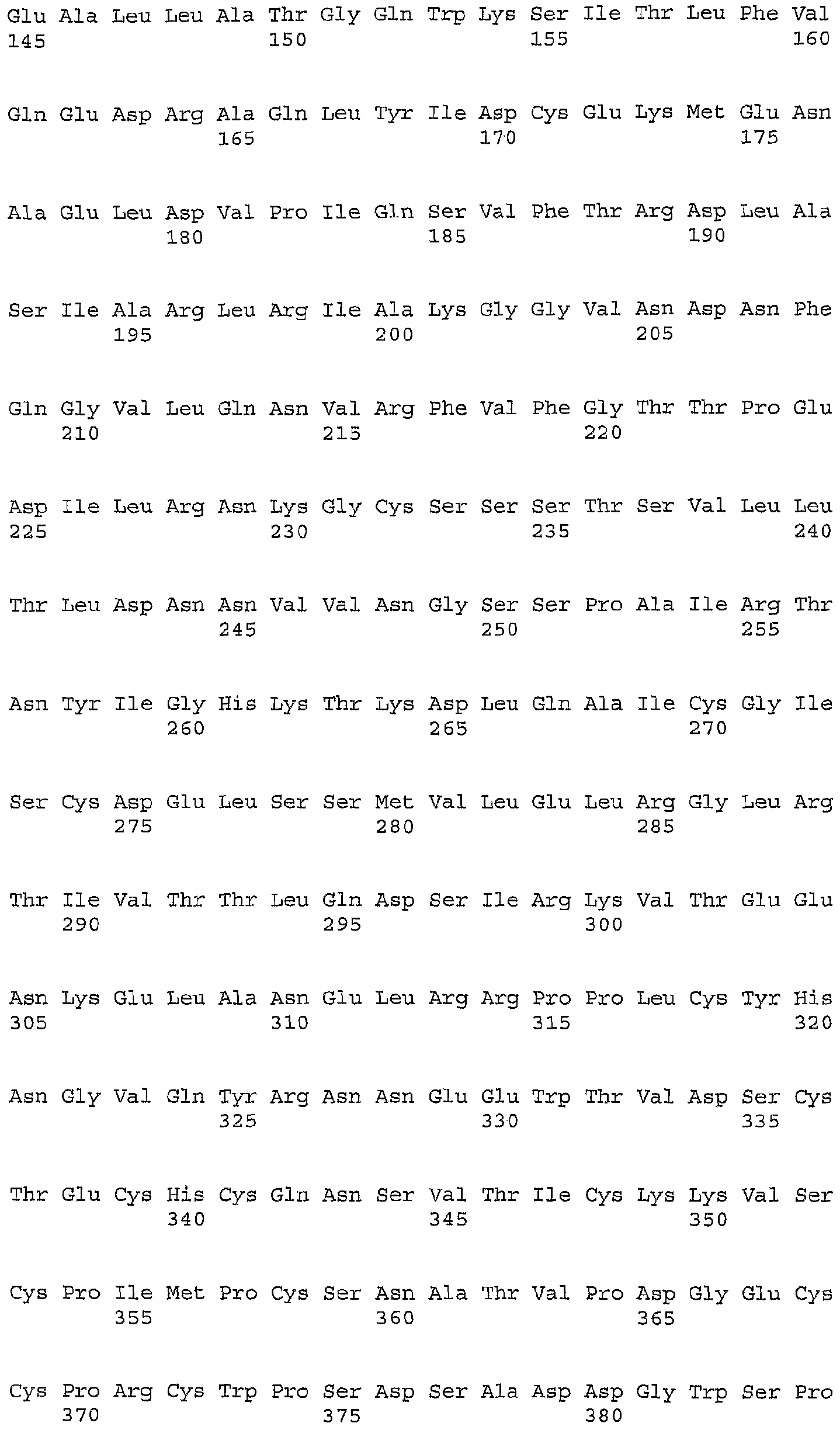












































































































































Описание
1. УРОВЕНЬ ТЕХНИКИ
1.1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение, в общем, относится к композициям, которые содержат полипептиды и полинуклеотиды фактора пролиферации желудочно-кишечного тракта и способам их применения.
1.2. СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Список последовательностей предоставлен.
1.3. УРОВЕНЬ ТЕХНИКИ
Терапия ионизирующим излучением и цитотоксическая химиотерапия вызывают повреждения слизистой оболочки ротовой полости и желудочно-кишечного тракта, которые остаются существенной проблемой для пациентов, подвергающихся лечению антинеопластическими лекарственными средствами. Мукозит представляет собой воспаление слизистых оболочек и является очень распространенной проблемой в данной популяции пациентов вследствие применения химиотерапии и лучевой терапии, используемых в лечебных или паллиативных целях. Повреждения слизистой оболочки в желудочно-кишечном тракте, наблюдаемые в случае лучевой и химиотерапии (по отношению к указанным областям), включают деструкцию клеток крипт, уменьшение длины ворсинок и изъязвление и некроз эпителия желудочно-кишечного тракта (Berthrong M, World J. Surg. 10: 155-170 (1986)), которые лежат в основе расстройств, включая мукозит желудочно-кишечного тракта и энтероколит. Для пациентов это может означать боль в животе, геморрагическую диарею, мальабсорбцию и в некоторых случаях бактериальную транслокацию (Guzman et al., J. Surg. Res. 46: 104-107(1989)). Кроме того, химиотерапия и ионизирующее излучение могут поражать другие слизистые оболочки, включая слизистые оболочки ротовой части глотки и губ и слизистую оболочку пищевода. Хорошо известно, что терапия комбинированными способами при совместном воздействии облучением и химиотерапией может вызывать сильно выраженные симптомы стоматита у пациентов с раком головы и шеи и эзофагита у пациентов с мелкоклеточным раком легкого.
Химиотерапия и лучевая терапия вызывают повреждение слизистой ротовой полости и желудочно-кишечного тракта вследствие прямой и опосредованной токсичности. Механизм прямого мукозита заключается в неспецифическом убивании быстро делящихся базальных эпителиальных клеток, что приводит к истончению эпителия, воспалению, сниженному восстановлению клеток и в конце концов изъязвлению. Указанные болезненные повреждения также являются причиной повышенного риска локальной и системной инфекции. Опосредованная токсичность по отношению к слизистой оболочке является подобным продуктом индуцированной химиотерапией миелосупрессии, которая создает возможность для бактериальных и вирусных инфекций в месте прямого повреждения слизистой оболочки. Тяжесть указанных эффектов может препятствовать повышению доз, замедлять лечение и предписывать снижение доз, таким образом ограничивая эффективность лечения злокачественных опухолей.
Профилактика и лечение в случае индуцированных химиотерапией и лучевой терапией повреждений (слизистой оболочки) желудочно-кишечного тракта (мукозита) обычно влечет за собой назначение субоптимальных доз химиотерапии или лучевой терапии, модификацию доз по нисходящей при последующих курсах лечения после токсического воздействия или применение специфичных антидотов, таких как лейковорин после умеренных доз или высоких доз метотрексата (Allegra CJ. Antifolates. In: Chabner and Collins, eds. Cancer Chemotherapy: Principles and Practice. Philadelphia, Pa. JP Lippincott Co; 1990:110-153).
Повреждение слизистой оболочки желудочно-кишечного тракта также связано с хроническими воспалительными расстройствами желудочно-кишечного тракта, которые вместе называют воспалительным заболеванием кишечника. Для лечения воспалительного заболевания кишечника доступна основанная на цитокинах терапия (Bouma and Strober Nature Rev 3: 521-533 (2003)). Однако часто показана резекция тонкого кишечника у пациентов с воспалительным заболеванием кишечника, таким как болезнь Крона. Хирургическое удаление тонкого кишечника также может быть необходимо после травматического повреждения, при остром сосудистом расстройстве и злокачественной опухоли. Хирургическое удаление, при котором оставляют менее 200 см жизнеспособного тонкого кишечника, создает для пациента риск развития синдрома короткой кишки (SBS). SBS является расстройством, которое клинически определяют по мальабсорбции, диарее, нарушению баланса жидкости и электролитов и истощению. Ведение пациентов с SBS часто требует долговременного, если не в течение всей жизни, применения парентерального питания (DiBaise et al., Am. J. Gastroenterol. 99: 1823-1832 (2004)).
Таким образом, существует необходимость найти средства, которые можно использовать профилактически или терапевтически, чтобы повысить переносимость лечения антинеопластическими средствами, чтобы усовершенствовать современные способы терапии для лечения воспалительного заболевания кишечника и восстановить процессы пищеварения и всасывания, которые нарушены после хирургической резекции кишечника.
2. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение отчасти основано на открытии того, что желудочно-кишечный пролиферативный фактор (GIPF) индуцирует пролиферацию эпителиальных клеток желудочно-кишечного тракта. Таким образом, композиции, содержащие GIPF, его фрагменты или аналоги, могут применяться для лечения состояний, при которых требуется эпителизация, например для лечения желудочно-кишечных расстройств, включая индуцированный химиотерапией и лучевой терапией мукозит, мукозит ротовой части глотки, губ и пищевода, воспалительное заболевание кишечника и другие состояния, включая раны, ожоги, глазные расстройства и любое расстройство, при котором требуется стимуляция пролиферации или регенерация эпителиальных клеток.
Соответственно, в одном варианте изобретение относится к композициям, содержащим терапевтически эффективное количество полипептида GIPF и фармацевтически приемлемый носитель.
Композиции согласно настоящему изобретению включают изолированные полинуклеотиды, кодирующие полипептиды GIPF, включая рекомбинантные молекулы ДНК и клонированные гены или их вырожденные варианты, особенно встречающиеся в природе варианты, такие как аллельные варианты. В частности, полинуклеотиды согласно настоящему изобретению основаны на полинуклеотиде GIPF, выделенном из библиотеки кДНК, полученной на основе мРНК кожи плода человека (SEQ ID NO: 2).
Композиции согласно настоящему изобретению также содержат векторы, такие как экспрессирующие векторы, содержащие полинуклеотиды согласно изобретению, клетки, генетически сконструированные так, чтобы они содержали такие полинуклеотиды, и клетки, генетически сконструированные для экспрессии таких полинуклеотидов.
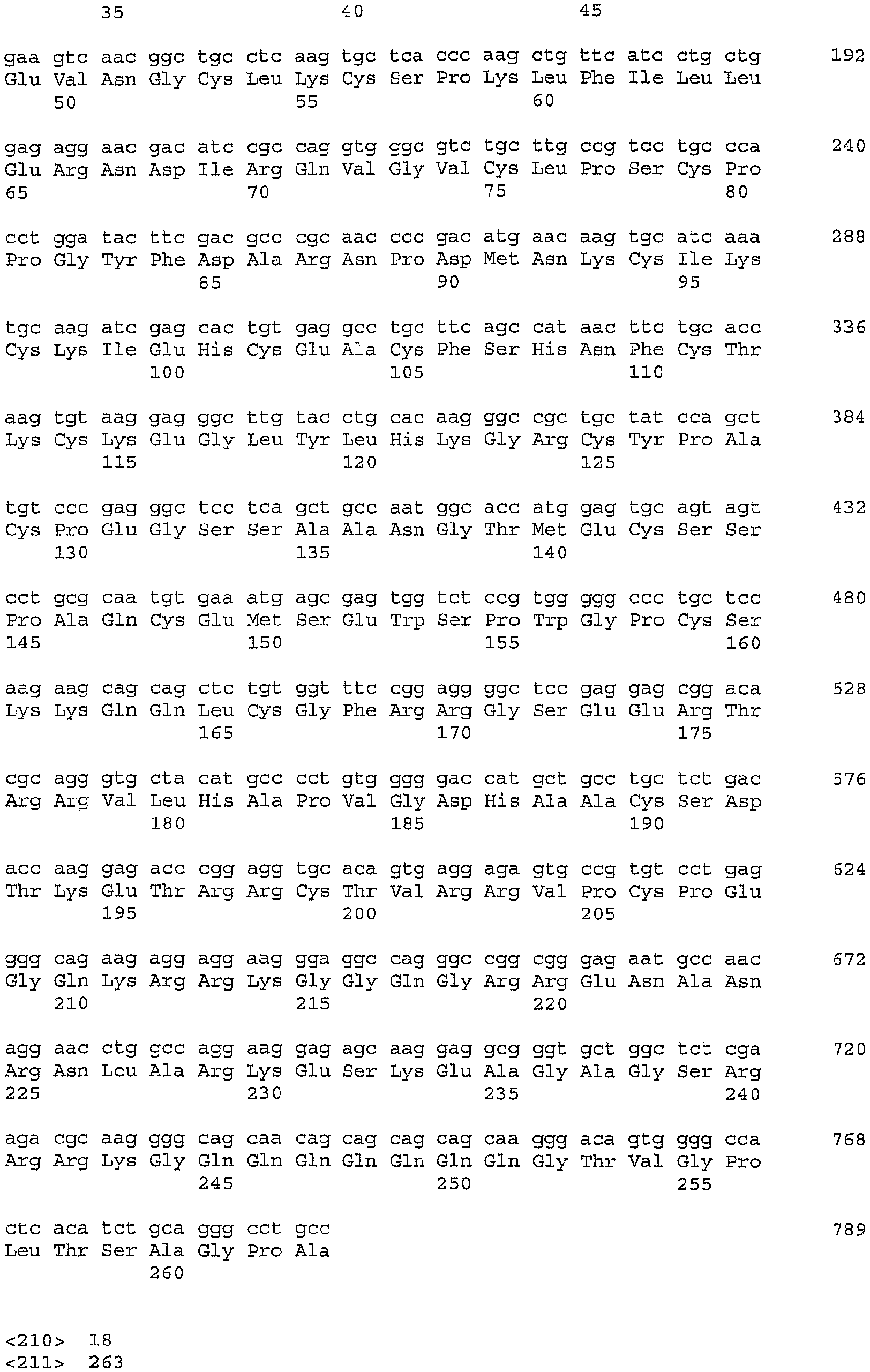
Композиции согласно изобретению содержат изолированные полинуклеотиды, которые включают без ограничения полинуклеотид GIPF, его фрагмент или вариант; полинуклеотид, содержащий кодирующую полноразмерный белок SEQ ID NO: 2 или 3 (например, SEQ ID NO: 4; GIPFwt); полинуклеотид, содержащий последовательность, кодирующую V5-His-меченый белок, SEQ ID NO: 5 (например, SEQ ID NO: 6; GIPFt); полинуклеотид, содержащий нуклеотидную последовательность кодирующей последовательности доминантного зрелого белка SEQ ID NO: 9 (например, SEQ ID NO: 10); полинуклеотид, содержащий нуклеотидную последовательность кодирующей последовательности зрелого белка SEQ ID NO: 11 (например, SEQ ID NO: 12); полинуклеотид, содержащий нуклеотидную последовательность домена тромбомпондина SEQ ID NO: 13 (например, SEQ ID NO: 14), полинуклеотид с последовательностью SEQ ID NO: 15, содержащий нуклеотидную последовательность, которая кодирует последовательность доминантного зрелого белка, в которой отсутствует сайт расщепления фурином (например, SEQ ID NO: 16); полинуклеотид с последовательностью SEQ ID NO: 17, содержащий нуклеотидную последовательность, которая кодирует полипептид GIPF, который содержит мутантный сайт расщепления фурином (SEQ ID NO: 18); и полинуклеотиды, которые кодируют полипептиды GIPF, которые содержат последовательности разной длины полноразмерного GIPF (SEQ ID NO: 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 и 177). Композиции полинуклеотидов согласно настоящему изобретению также содержат, но не ограничены указанным, полинуклеотид, который гибридизуется в жестких условиях гибридизации с (a) комплементом любой из нуклеотидных последовательностей, указанных в SEQ ID NO: 2, 3, 5, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177; (b) нуклеотидной последовательностью, кодирующей любую из последовательностей SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 или 178; полинуклеотид, который является вариантом (например, аллельным вариантом) любого полинуклеотида, указанного выше, имеющим по меньшей мере 70% (например, 75%, 80%, 85%, 90%, 92%, 94%, 96%, 98% или 99%) идентичности полинуклеотидной последовательности с полинуклеотидами; полинуклеотид, который кодирует видовой гомолог (например, ортолог) любого из полипептидов, указанных выше; или полинуклеотид, который кодирует полипептид, содержащий конкретный домен или укорочение полипептида с последовательностью SEQ ID NO: 4 или 6.
Данное изобретение, кроме того, относится к клонирующим или экспрессирующим векторам, содержащим по меньшей мере фрагмент полинуклеотидов, указанных выше, и клеткам-хозяевам или организмам, трансформированным указанными экспрессирующими векторами. Применимые векторы включают плазмиды, космиды, производные фага лямбда, фагмиды и тому подобное, которые хорошо известны в данной области. Соответственно, изобретение также относится к вектору, содержащему полинуклеотид согласно изобретению, и клетке-хозяину, содержащей полинуклеотид. В общем, вектор содержит начало репликации, функциональное по меньшей мере в одном организме, подходящие сайты рестрикции эндонуклеазами и селектируемый маркер для клетки-хозяина. Векторы согласно изобретению включают экспрессирующие векторы, векторы для репликации, векторы для создания зондов и векторы для секвенирования. Клеткой-хозяином согласно изобретению может быть прокариотическая или эукариотическая клетка и может быть одноклеточный организм или часть многоклеточного организма.
Фармацевтические композиции согласно настоящему изобретению содержат полипептиды, включающие без ограничения изолированный полипептид, выбранный из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 4, 6, 10, 12, 14, 16, 18, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 или 178. Полипептиды согласно изобретению также включают полипептиды с биологической активностью, которые кодируются (a) любым из полинуклеотидов, имеющим нуклеотидную последовательность, указанную в SEQ ID NO: 2, 3, 5, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 177 выше; или (b) полинуклеотидами, которые гибридизуются с комплементом полинуклеотидов по п.(a) в жестких условиях гибридизации. Также рассматриваются биологически или иммунологически активные аналоги любой из последовательностей белка, перечисленных в виде SEQ ID NO: 4, 6, 10, 12, 14, 16, 18, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 или 178, и по существу их эквиваленты, которые сохраняют биологическую активность. Полипептиды согласно изобретению могут быть полностью или частично синтезированы химическим способом, но предпочтительно получены способами рекомбинации с применением генетически сконструированных клеток (например, клеток-хозяев) согласно изобретению. Изобретение относится к полипептидам, которые по меньшей мере на 85%, 90%, 92%, 94%, 96%, 98% или 99% идентичны любой из последовательностей SEQ ID NO: 4, 6, 10, 12, 14, 16, 18, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 и 178. Изобретение также относится к полипептидам, которые отличаются по последовательности от любой из SEQ ID NO: 4, 6, 10, 12, 14, 16, 18, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 и 178 на 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 аминокислотным остатком. Изменения аминокислот могут быть консервативными или неконсервативными.
Изобретение также относится к способам получения полипептида GIPF, включающим в себя культивирование клеток-хозяев, содержащих экспрессирующий вектор, который содержит по меньшей мере фрагмент полинуклеотида GIPF, кодирующего полипептид GIPF согласно изобретению, в подходящей культуральной среде в условиях, обеспечивающих экспрессию требуемого полипептида, и очистку белка или пептид из культуры или из клеток-хозяев. Предпочтительные варианты включают варианты, в которых белок, полученный таким способом, является зрелой или доминантной зрелой формой белка.
Полипептиды согласно изобретению можно применять во множестве обычных процедур и способов, которые в настоящее время применяют по отношению к другим белкам. Например, полипептид согласно изобретению можно применять для создания антитела, которое специфично связывает полипептид. Такие антитела, особенно моноклональные антитела, применимы для выявления или количественной оценки полипептида в ткани.
В следующих вариантах настоящее изобретение относится к способу стимулирования пролиферации эпителиальных клеток. Способ заключается в контактировании эпителиальных клеток с композицией, которая содержит терапевтически эффективное количество полипептида GIPF, его фрагмента или аналога и фармацевтически приемлемый носитель. В частности, субъекту, нуждающемуся в стимулировании эпителиальных клеток (включая цитопротекцию, пролиферацию и/или дифференцировку), будет вводиться терапевтически эффективное или профилактически эффективное количество белка GIPF, его фрагментов или аналогов.
Во всех описанных способах эпителиальные клетки могут быть подвергнуты контакту с полипептидами GIPF in vitro или in vivo.
Также предлагается способ профилактики, лечения или облегчения патологического состояния, который включает в себя стадию введения субъекту млекопитающему терапевтически эффективного количества композиции, содержащей пептид согласно настоящему изобретению и фармацевтически приемлемый носитель.
В частности, полипептиды GIPF согласно изобретению можно применять для индукции пролиферации и/или дифференцировки клеток крипт желудочно-кишечного тракта, чтобы восстановить слой эпителия пищеварительного тракта. Таким образом, полипептиды и полинуклеотиды GIPF согласно изобретению можно использовать для лечения индуцированного химиотерапией или лучевой терапией мукозита и энтероколита и воспалительного заболевания кишечника. Их также можно использовать для лечения заболеваний и других состояний, включая раны, ожоги, глазные расстройства и любое расстройство, при котором требуется стимуляция пролиферации или регенерации эпителиальных клеток.
Полинуклеотиды и полипептиды согласно изобретению также можно использовать в качестве маркеров дифференцировки и развития эпителия желудочно-кишечного тракта.
Также предлагаются способы согласно изобретению для лечения расстройств, которые указаны в данном описании, которые заключаются во введении терапевтически эффективного количества композиции, содержащей полинуклеотид или полипептид согласно изобретению и фармацевтически приемлемый носитель, млекопитающему, у которого наблюдаются симптомы или тенденции, связанные с расстройствами, которые указаны в данном описании. Кроме того, изобретение относится к способам лечения заболеваний или расстройств, которые указаны в данном описании, включающим в себя стадию введения композиции, содержащей соединения и другие вещества, которые модулируют общую активность продуктов гена-мишени, и фармацевтически приемлемый носитель. Соединения и другие вещества могут влиять на осуществление такого модулирования либо на уровне экспрессии гена/белка-мишени, либо на уровне активности белка-мишени. В частности, предлагаются способы профилактики, лечения или облегчения патологического состояния, включая мукозит и воспалительное заболевание кишечника, раны, которые заключаются во введении млекопитающему, включая без ограничения человека, терапевтически эффективного количества композиции, содержащей полипептид согласно изобретению, или терапевтически эффективного количества композиции, содержащей связывающий партнер полипептидов GIPF согласно изобретению. Механизмы конкретного состояния или патологии будут определять, будут ли полезными полипептиды согласно изобретению или их связывающие партнеры для индивидуума, нуждающегося в лечении.
Изобретение, кроме того, относится к способам производства лекарственных средств, применимых в описанных выше способах.
Настоящее изобретение, кроме того, относится к способам выявления наличия полинуклеотидов или полипептидов согласно изобретению в образце (например, ткани или образце). Такие способы можно, например, использовать как часть прогностической и диагностической оценки расстройств, которые указаны в данном описании, и для идентификации субъектов, проявляющих предрасположенность к таким состояниям.
Изобретение относится к способу выявления полипептида согласно изобретению в образце, включающему в себя контактирование образца с соединением, которое связывается и образует комплекс с полипептидом в условиях и в течение периода времени, достаточного для образования комплекса, и регистрацию образования комплекса, так что если комплекс образуется, то выявляют полипептид.
Изобретение также относится к наборам, содержащим полинуклеотидные зонды и/или моноклональные антитела и необязательно стандарты количества для осуществления способов согласно изобретению. Кроме того, изобретение относится к способам оценки эффективности лекарственных средств и мониторинга улучшений у пациентов, вовлеченных в клинические испытания в отношении лечения расстройств, которые указаны выше.
Изобретение также относится к способам идентификации соединений, которые модулируют (т.е. увеличивают или уменьшают) экспрессию или активность полинуклеотидов и/или полипептидов согласно изобретению. Такие способы можно использовать, например, для идентификации соединений, которые усиливают терапевтическую активность полипептидов GIPF и ослабляют симптомы расстройств, которые указаны выше. Такие способы могут включать без ограничения анализы для идентификации соединений и других веществ, которые взаимодействуют (например, связываются) с полипептидами согласно изобретению.
Изобретение относится к способу идентификации соединения, которое связывается с полипептидом согласно настоящему изобретению, включающему в себя контактирование соединения с полипептидом в условиях и в течение времени, достаточного для образования комплекса полипептид/соединение, и регистрацию комплекса, так что если регистрируют комплекс полипептид/соединение, то идентифицируют соединение, которое связывается с полипептидом.
Также предлагается способ идентификации соединения, которое связывается с полипептидом, включающий в себя контактирование соединения с полипептидом в клетке в течение времени, достаточного для образования комплекса полипептид/соединение, при этом комплекс запускает экспрессию последовательности репортерного гена в клетке, и регистрацию комплекса посредством выявления экспрессии последовательности репортерного гена, так что если регистрируют комплекс полипептид/соединение, то идентифицируют соединение, которое связывается с полипептидом.
В другом варианте осуществления изобретения предлагается генная терапия посредством доставки полипептидов GIPF для лечения состояний или расстройств, указанных в данном описании.
В связанном варианте изобретение относится к применению вектора, содержащего ген, кодирующий полипептид GIPF, оперативно связанный с последовательностью регуляции экспрессии, которая обеспечивает экспрессию полипептида GIPF, в производстве лекарственного средства для лечения расстройств, которые указаны в данном описании. Более конкретно, изобретение относится к применению аденовирусного вектора согласно изобретению, например, такого как указанный ниже, в производстве лекарственного средства для лечения мукозита или воспалительного заболевания кишечника.
В дополнение к указанным выше способам и применениям изобретение относится к новому вирусному вектору, содержащему ген, кодирующий полипептид GIPF, оперативно связанный с последовательностью регуляции экспрессии. В предпочтительном варианте вирусным вектором является аденовирусный вектор. Вирусные векторы согласно изобретению могут обеспечивать ген, кодирующий любой полипептид GIPF, указанный выше.
Изобретение, кроме того, относится к фармацевтической композиции, содержащей любой из вирусных векторов согласно изобретению и фармацевтически приемлемый носитель.
В еще одном аспекте изобретение относится к трансгенной конструкции, содержащей нуклеиновую кислоту, кодирующую нативный белок GIPF человека, его аналог или фрагмент, под контролем последовательностей регуляции транскрипции, управляющих ее экспрессией в B-клетках. Трансгенная конструкция предпочтительно содержит специфичный для B-клеток промотор, такой как промотор каппа-цепи иммуноглобулина.
В другом аспекте изобретение относится к трансгенному млекопитающему, отличному от человека, которое продуцирует в своих B-клетках регистрируемые уровни нативного белка GIPF человека, его аналога или фрагмента, при этом указанное трансгенное млекопитающее имеет стабильно интегрированную в его геном последовательность нуклеиновой кислоты, кодирующую нативный белок GIPF человека, его аналог или фрагмент, обладающий биологической активностью нативного GIPF человека, оперативно связанную с последовательностями регуляции транскрипции, управляющими ее экспрессией в B-клетках. Последовательности регуляции транскрипции предпочтительно содержат специфичный для B-клеток промотор, такой как промотор каппа-цепи иммуноглобулина. Без ограничения трансгенным млекопитающим, отличным от человека, может быть, например, мышь, крыса, кролик, свинья, овца, коза или крупный рогатый скот.
В другом аспекте изобретение относится к способу скрининга выбранных для исследования лекарственных средств для лечения заболевания или расстройства, указанного в данном описании, включающему в себя (a) введение выбранного для исследования лекарственного средства трансгенной мыши, которая экспрессирует в своих B-клетках полипептид GIPF и у которой развивается растяжение кишечника, связанное с гиперпролиферацией эпителиальных клеток, и (b) оценку влияния выбранного для исследования лекарственного средства на гиперпролиферацию эпителиальных клеток. Выбранные для исследования лекарственные средства могут модулировать (т.е. увеличивать или уменьшать) экспрессию или активность полинуклеотидов и/или полипептидов согласно изобретению.
Изобретение также относится к способу лечения или облегчения патологического состояния, включая мукозит и воспалительное заболевание кишечника и раны, который включает в себя введение млекопитающему, включая, но не ограничивая указанным, человека, терапевтически эффективного количества полипептида GIPF вместе с цитокином.
В другом аспекте изобретение относится к фармацевтическим композициям, содержащим полипептид согласно изобретению, второе терапевтическое средство например цитокин, и фармацевтически приемлемый носитель.
Дополнительные аспекты и преимущества изобретения будут понятны специалистам в данной области при рассмотрении следующего описания, в котором подробно изложено практическое осуществление изобретения.
3. КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фигуре 1 изображена последовательность ДНК (SEQ ID NO: 2) (A) и соответствующая аминокислотная последовательность полноразмерного GIPF (SEQ ID NO: 4)(B). SEQ ID NO: 2 содержит 5-штрих- и 3-штрих-нетранслируемые области, связанные с открытой рамкой считывания.
На фигуре 2 изображена экспрессия мРНК GIPF в тканях человека (A) и мыши (B).
Фигура 3 является схематичным представлением полипептидов GIPF, входящих в композиции согласно изобретению. Числа, которые подчеркнуты, соответствуют номерам последовательностей SEQ ID NO полипептидов, а остальные числа являются номерами последовательностей SEQ ID NO кодирующих полинуклеотидных последовательностей.
На фигуре 4A показано выравнивание аминокислотных последовательностей с использованием BLASTP между белком GIPF, кодируемым последовательностью SEQ ID NO: 2 или 3 (например, SEQ ID NO: 4), и фактором роста стволовых клеток человека A1 SEQ ID NO: 23 (SEQ ID NO: 10 в PCT WO01/77169 A2), показано, что две последовательности обладают 63% сходством на протяжении от аминокислотного остатка 10 до 251 последовательности SEQ ID NO: 4 и от 11 до 257 аминокислотного остатка последовательности SEQ ID NO: 23, и 46% идентичностью на протяжении от 10 до 251 аминокислотного остатка последовательности SEQ ID NO: 4 и от 11 до 257 аминокислотного остатка последовательности SEQ ID NO: 23.
На фигуре 4B показано выравнивание аминокислотных последовательностей с использованием BLASTP между белком GIPF, кодируемым последовательностью SEQ ID NO: 2 или 3 (т.е., SEQ ID NO: 4), полипептидом GIPF и специфичной областью тромбоспондина 1 человека (аминокислотные остатки от 501 до 657 белка с номером доступа в SwissProt P07996; SEQ ID NO: 28). На фигуре показано, что две последовательности имеют 36% сходство и 26% идентичность на протяжении от 14 до 166 аминокислотного остатка последовательности SEQ ID NO: 4 и от 501 до 657 аминокислотного остатка последовательности SEQ ID NO: 28, где A=аланин, C=цистеин, D=аспарагиновая кислота, E=глутаминовая кислота, F=фенилаланин, G=глицин, H=гистидин, I=изолейцин, K=лизин, L=лейцин, M=метионин, N=аспарагин, P=пролин, Q=глутамин, R=аргинин, S=серин, T=треонин, V=валин, W=триптофан, Y=тирозин. Пробелы обозначены в виде тире.
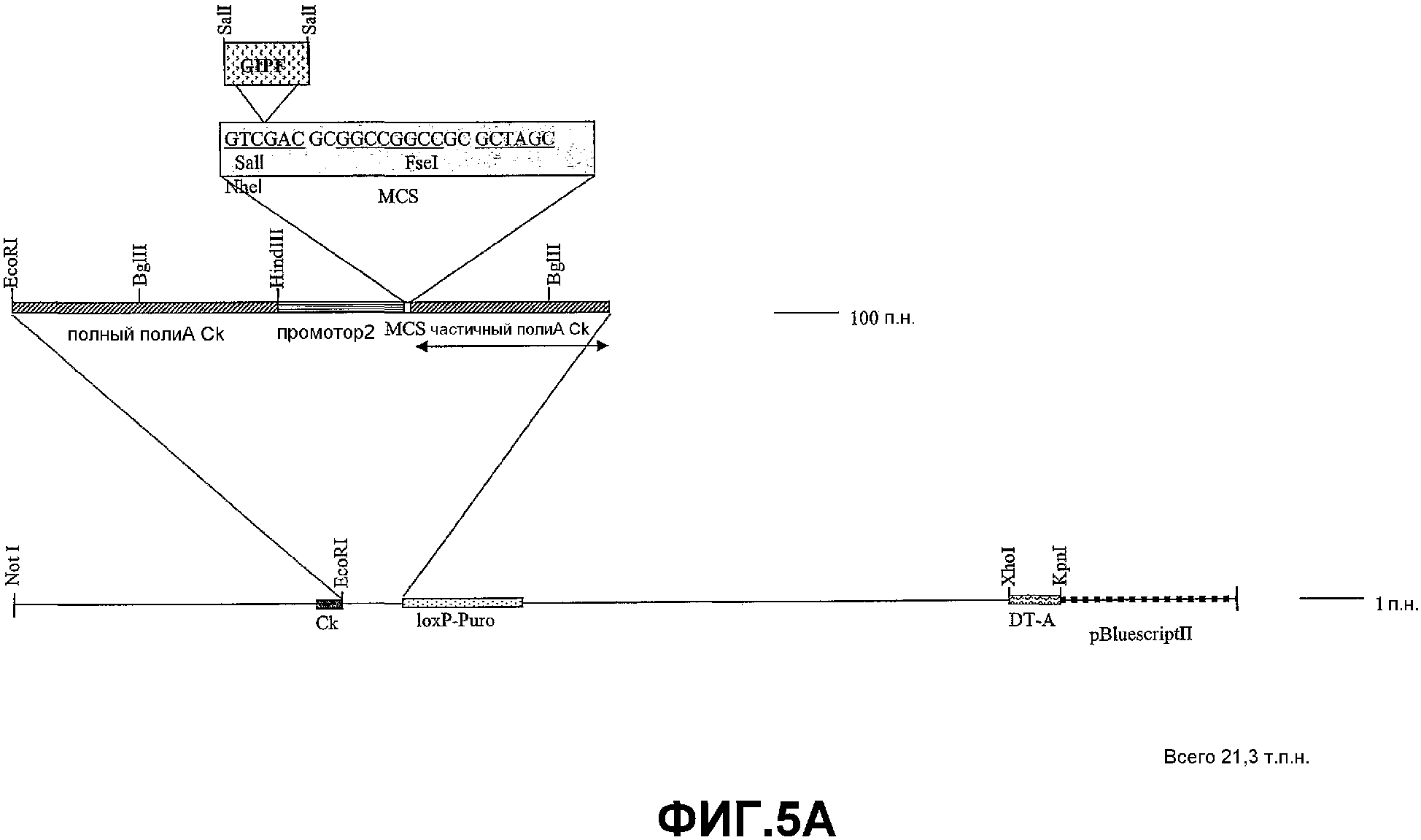
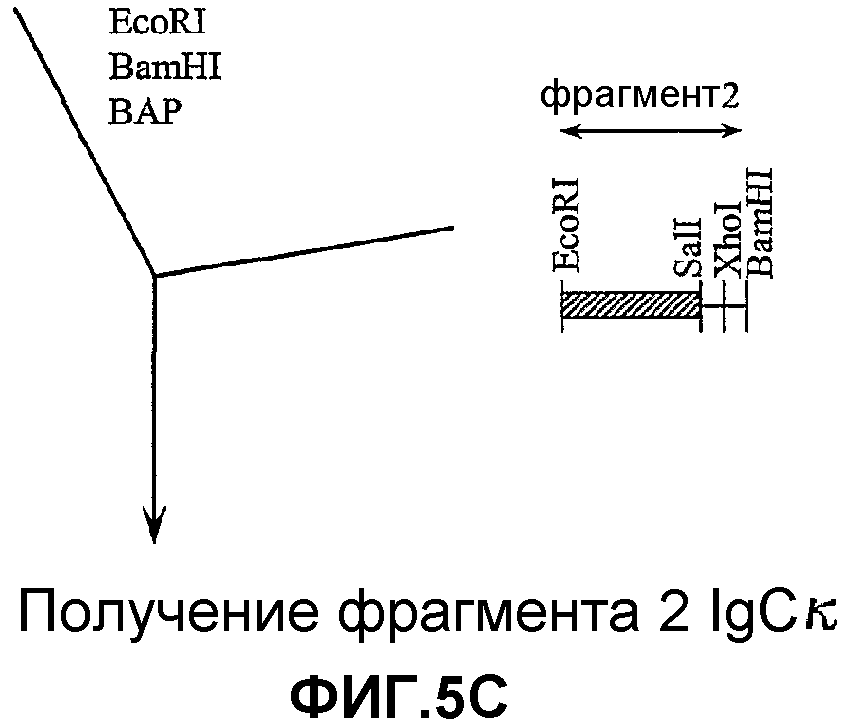
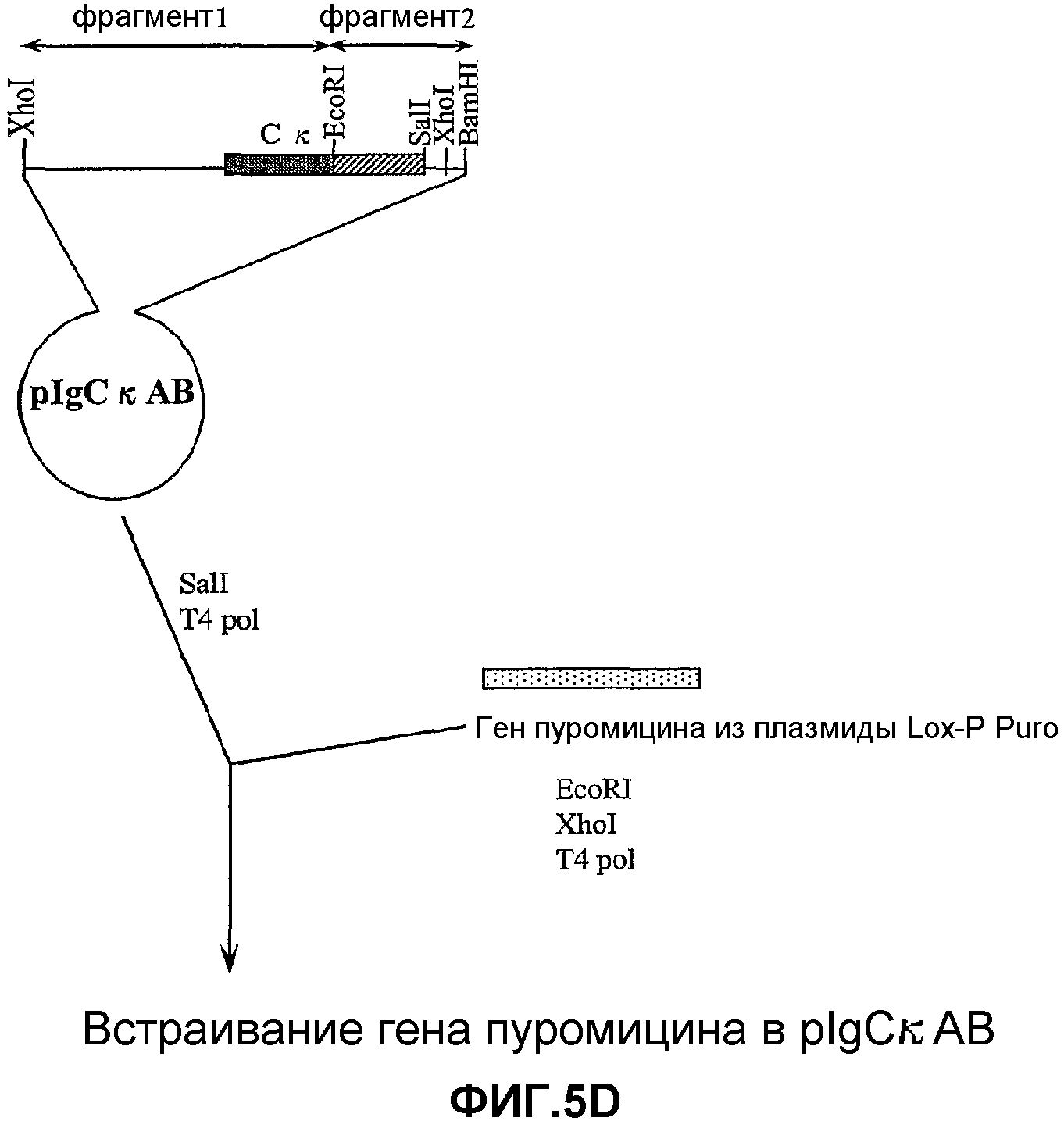
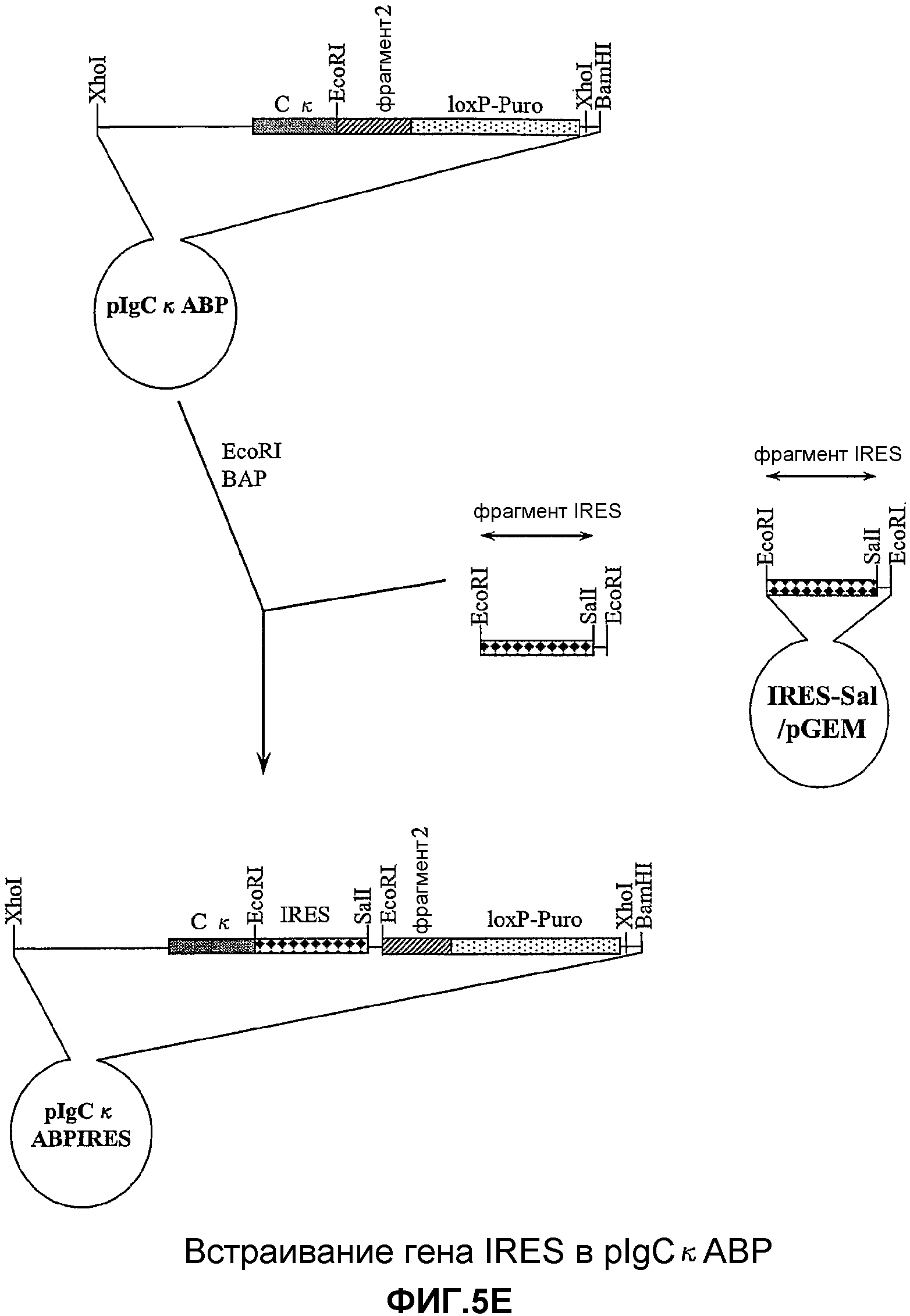
На фигурах 5A-5R изображены стадии способа, применяемого для создания вектора для целенаправленного встраивания (knock-in) GIPF (GIPF-KI) согласно изобретению. Также описан предпочтительный способ создания трансгенных мышей, которые экспрессируют GIPF в своих B-клетках.
На фигуре 6 изображено положение зонда, используемого в Саузерн-блот-анализе для отбора клонов ES, возникающих в результате гомологичной рекомбинации, а также размеры фрагментов расщепления EcoRI геномной ДНК мыши, которая была подвергнута гомологичной или негомологичной рекомбинации.
На фигуре 7 показана макроскопическая патология кишечного тракта у мышей GIPF-KI: контроль (A), GIPF-KI (B).
Фигура 8. Окрашивание гематоксилином и эозином поперченных срезов тонкого кишечника мышей GIPF-KI (A) и контрольных химерных мышей (B) соответственно.
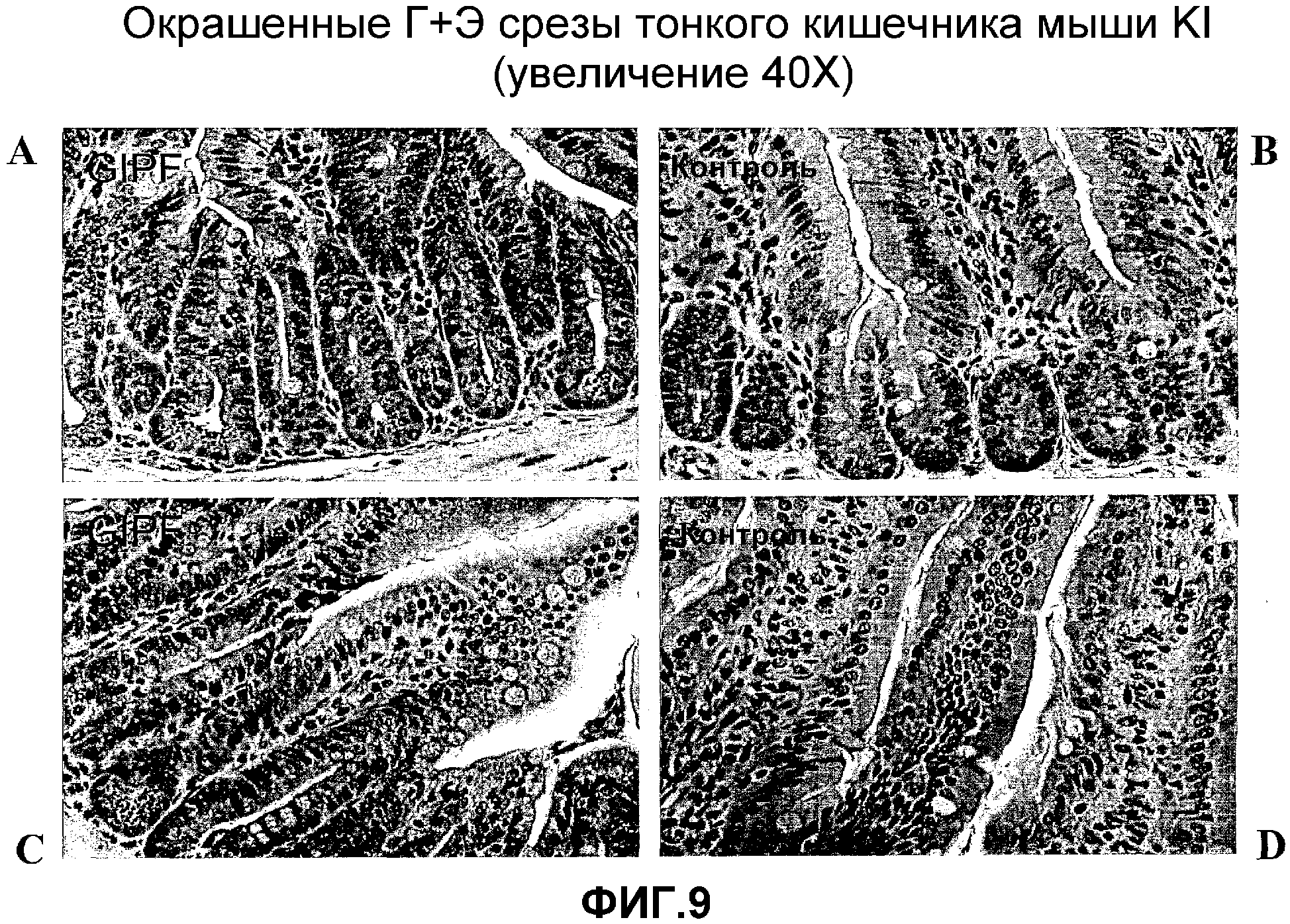
На фигуре 9 показано окрашивание гематоксилином и эозином срезов кишечника, показанных на фигуре 8, видимых при более высоком увеличении. Панели A и C соответствуют срезу GIPF-KI, видимому на панели A фигуры 8, а панели B и D соответствуют срезу кишечника, полученному от контрольной химерной мыши, видимому на панели B фигуры 8.
На фигуре 10 показано окрашивание Ki67 поперечных срезов тонкого кишечника от контрольной химерной мыши (A и C) и от мыши GIPF-KI (B и D).
Фигура 11. Поперечные срезы тонкого кишечника, полученные от контрольной мыши (A и C) и от мыши, обработанной 1×1010 вирусных частиц (B и D). Срезы получали через три дня после инъекции пустого аденовируса и GIPF-аденовируса соответственно.
Фигуре 12. Поперечные срезы тонкого кишечника, полученные от контрольной мыши (A и C) и от мыши, обработанной 1×1010 вирусных частиц (VP) (фигуры 12 B и D). Срезы получали через пять дней после инъекции пустого аденовируса или GIPF-аденовируса соответственно.
Фигура 13. Включение BrdU в пролиферирующие клетки крипт тонкого кишечника контрольных мышей (A и C) и мышей, обработанных 1×1010 вирусных частиц (VP) (B и D).
Фигура 14. Окрашивание Ki67 пролиферирующих клеток крипт тонкого кишечника контрольных (A и C) и обработанных GIPF-аденовирусом мышей (B и D).
Фигура 15. Окрашивание гематоксилином и эозином поперечных срезов, полученных из тонкого кишечника контрольных мышей (A и C) и мышей, которые были обработаны GIPF-аденовирусом в количестве 1×109 вирусных частиц (B и D).
Фигура 16. Окрашивание гематоксилином и эозином поперечных срезов, полученных из ободочной кишки контрольных (A и C) и обработанных GIPF-аденовирусом мышей (B и D).
Фигуры 17 (A и B). Необходимые условия растворимости нативного V5-His-меченого белка GIPF, очищенного из клеток CHO.
Фигуры 18 (A и B). Фармакокинетика V5-His-меченого белка GIPF в сыворотке мышей.
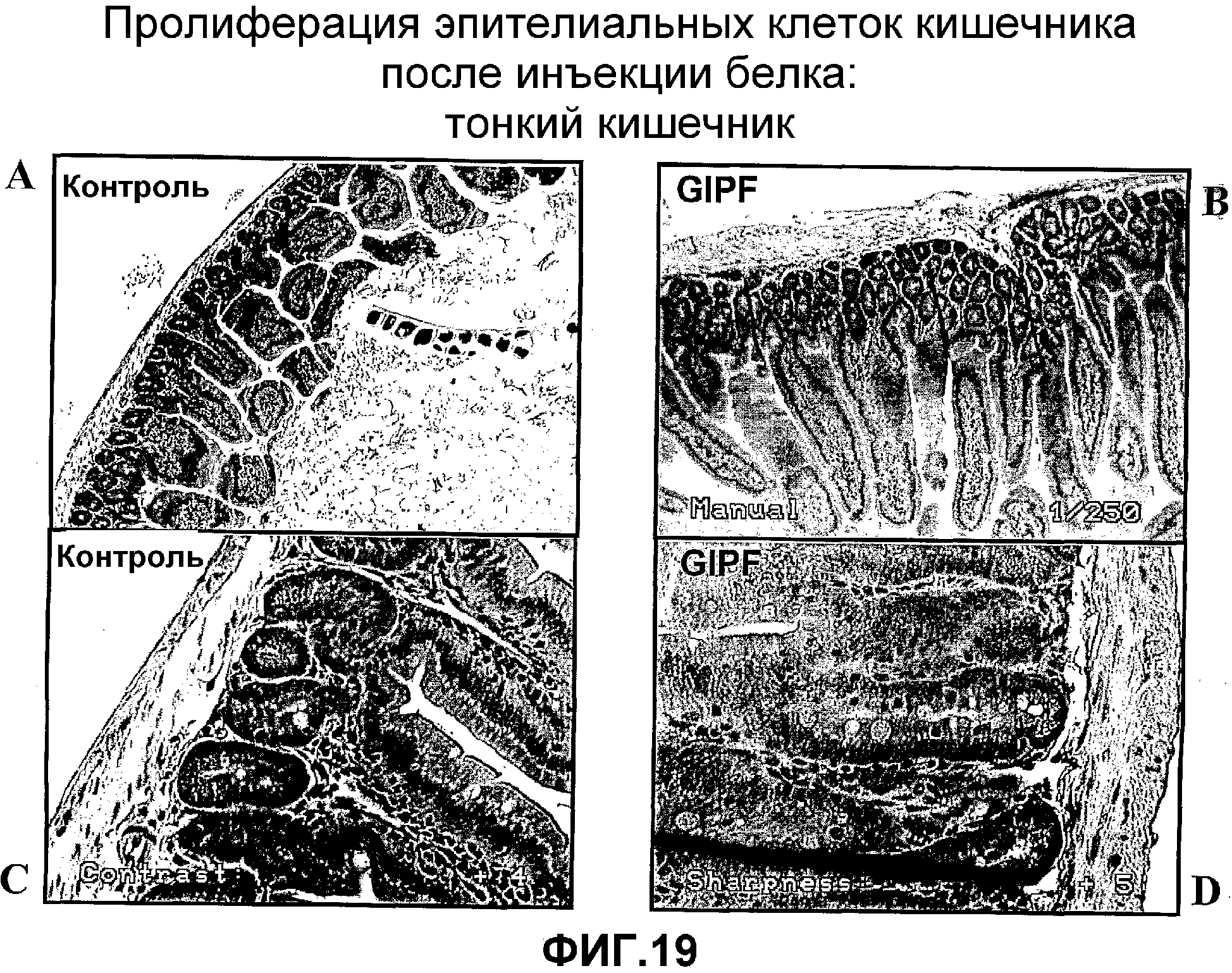
Фигура 19. Окрашивание гематоксилином и эозином поперечных срезов, полученных из тонкого кишечника контрольных мышей (A и C) и мышей, которые были обработаны очищенным белком GIPF (B и D).
Фигура 20. Включение BrdU в пролиферирующие клетки крипт тонкого кишечника контрольных мышей (A и C) и мышей, которые были обработаны очищенным белком GIPF (B и D).
Фигура 21. Окрашивание гематоксилином и эозином поперечных срезов, полученных из ободочной кишки контрольных мышей (A) и мышей, которые были обработаны очищенным белком GIPF (B).
Фигура 22. Включение BrdU в пролиферирующие клетки крипт ободочной кишки контрольных мышей (A и C) и мышей, которые были обработаны очищенным белком GIPF (B и D).
Фигура 23. Окрашивание гематоксилином и эозином поперечных срезов, полученных из тонкого кишечника необлученных мышей (A), облученных мышей, обработанных физиологическим раствором (B), KGF (C) или GIPFwt (D).
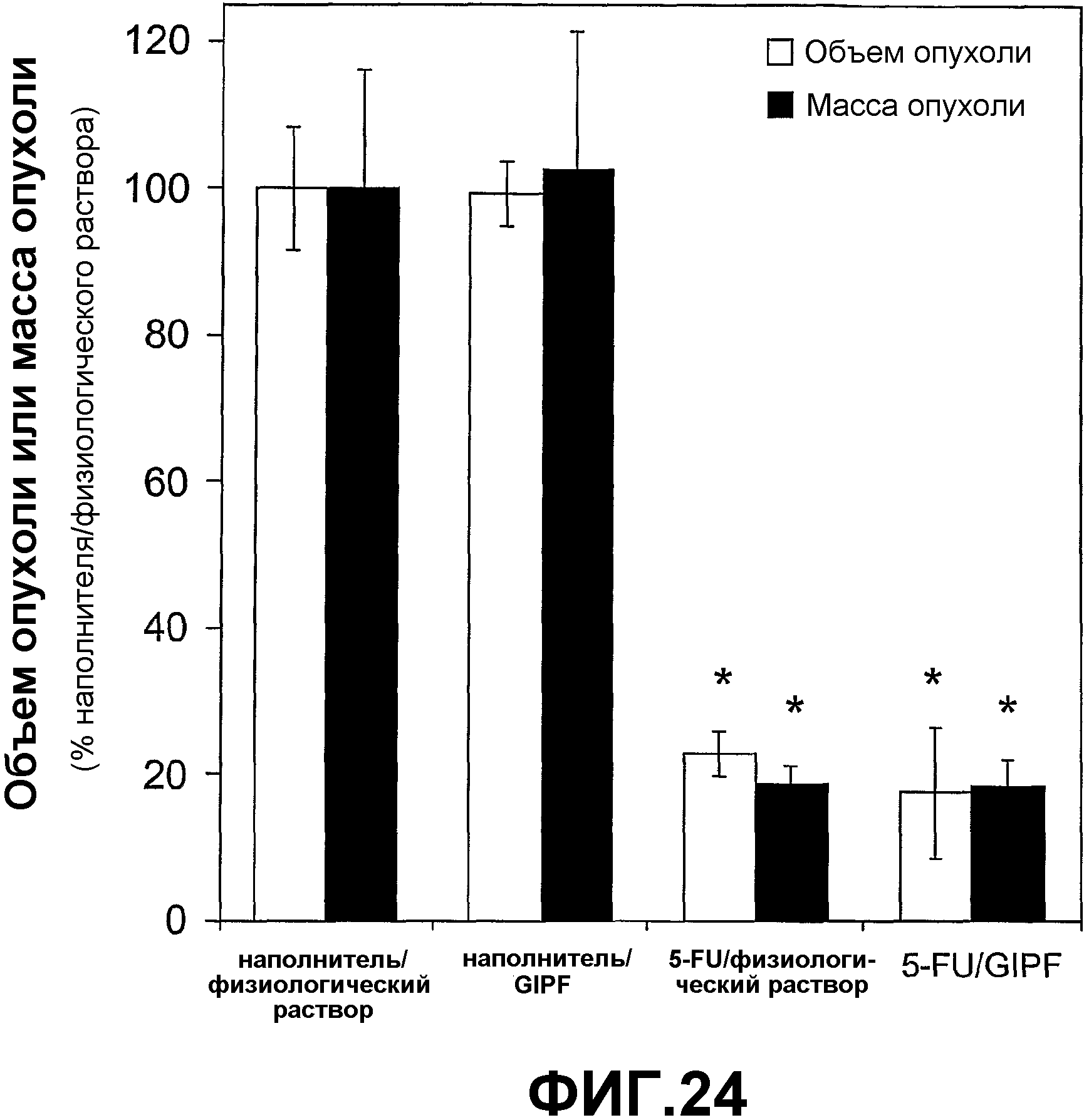
Фигура 24. Влияние 5-FU на размер опухолей у контрольных мышей и мышей, получающих GIPFwt.
Фигура 25. Влияние GIPF на макроскопическую патологию тонкого кишечника и ободочной кишки нормальных (E и F) и несущих опухоли мышей (A-D).
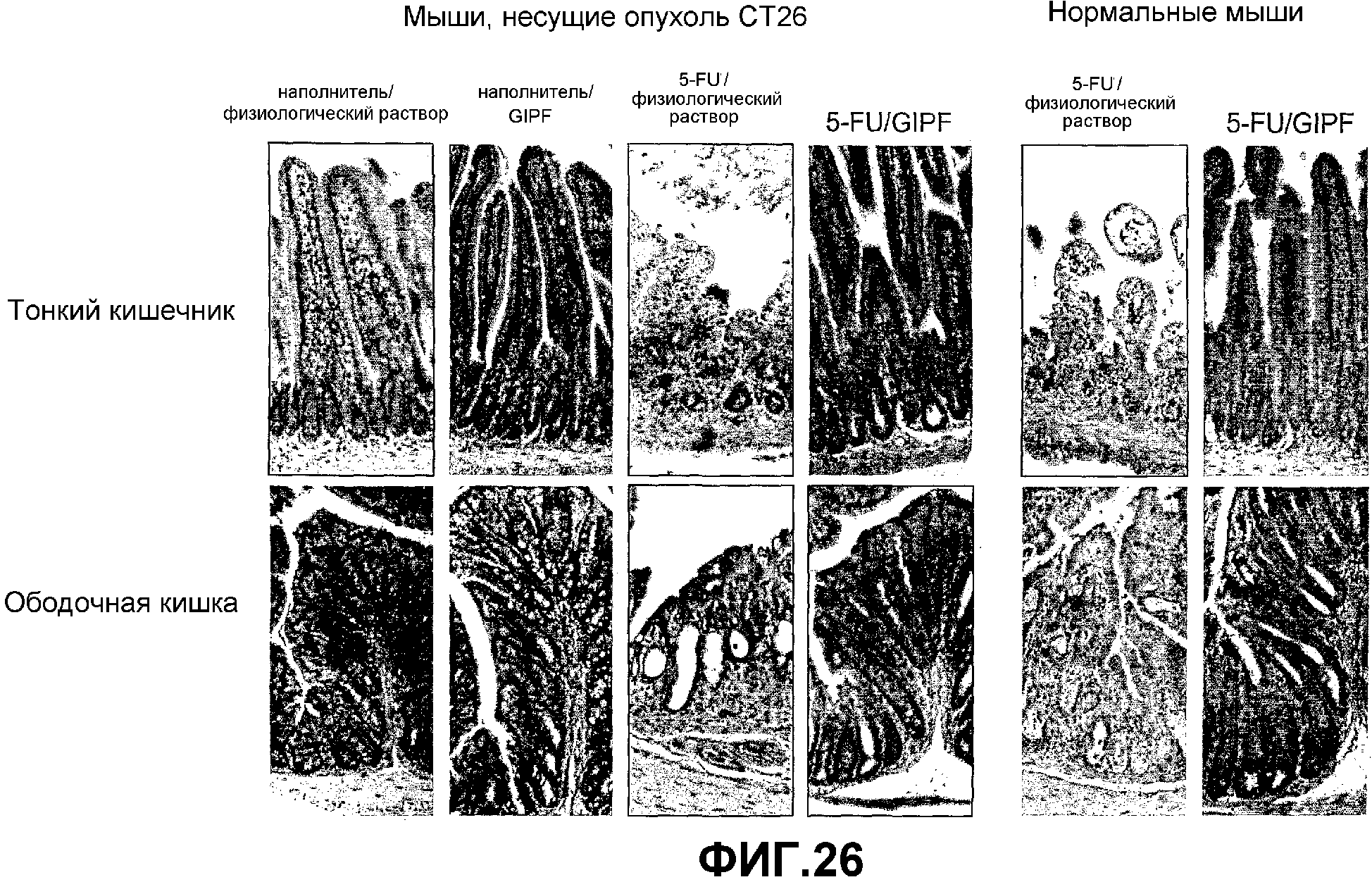
Фигура 26. Окрашивание гематоксилином и эозином поперечных срезов, полученных из тонкого кишечника и ободочной кишки нормальных и несущих опухоли мышей, которые получили 5-FU и/или GIPF.
Фигура 27. Микроморфометрические измерения высоты ворсинок и глубины крипт показывают влияние GIPF на эпителий кишечника мышей, которые получали 5-FU.
Фигура 28. Окрашивание Ki67 пролиферирующих эпителиальных клеток вентральной поверхности языка контрольных мышей (A и B) и мышей, обработанных KGF или GIPF (C-E) и подвергнутых общему облучению организма.
Фигура 29. Окрашивание Ki67 пролиферирующих эпителиальных клеток дорзальной поверхности языка контрольных мышей (A и B) и мышей, обработанных KGF или GIPF (C и D) и подвергнутых общему облучению организма.
Фигура 30. Пролиферативный индекс эпителия вентральной поверхности языка от мышей, обработанных KGF или GIPF и подвергнутых общему облучению организма.
Фигура 31. Окрашивание гематоксилином и эозином срезов, полученных из языка мышей, обработанных GIPF и подвергнутых общему облучению организма.
Фигура 32. Влияние GIPF на индекс активности воспалительного заболевания кишечника (IBDAI) мышей с DSS-индуцированным колитом.
Фигура 33. Влияние GIPF на количественный показатель массы тела животного у мышей с DSS-индуцированным колитом.
Фигура 34. Влияние GIPF на количественный показатель консистенции кала у мышей с DSS-индуцированным колитом.
Фигура 35. Влияние GIPF на количественный показатель ректального кровотечения у мышей с DSS-индуцированным колитом.
Фигура 36. Влияние GIPF на макроскопическую патологию тонкого кишечника и ободочной кишки контрольных и DSS-обработанных мышей.
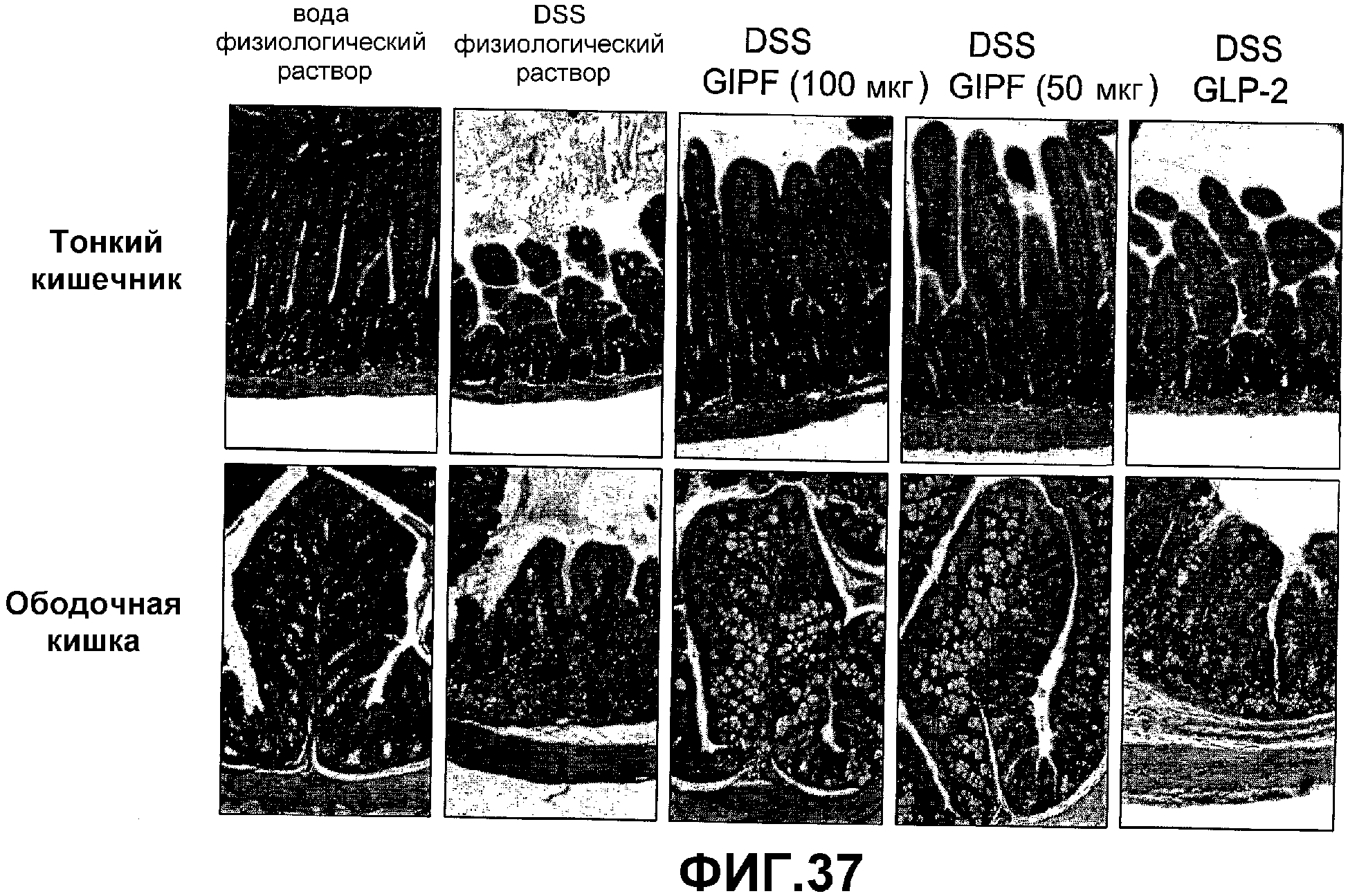
Фигура 37. Окрашивание гематоксилином и эозином поперечных срезов, полученных из тонкого кишечника и ободочной кишки мышей, которые получали DSS и/или GIPF.
Фигура 38. Микроморфометрические измерения высоты ворсинок и глубины крипт показывают влияние GIPF на эпителий кишечника мышей с DSS-индуцированным колитом.
Фигура 39. Включение BrdU в пролиферирующие клетки крипт тонкого кишечника и ободочной кишки мышей, которые получали DSS и/или GIPF.
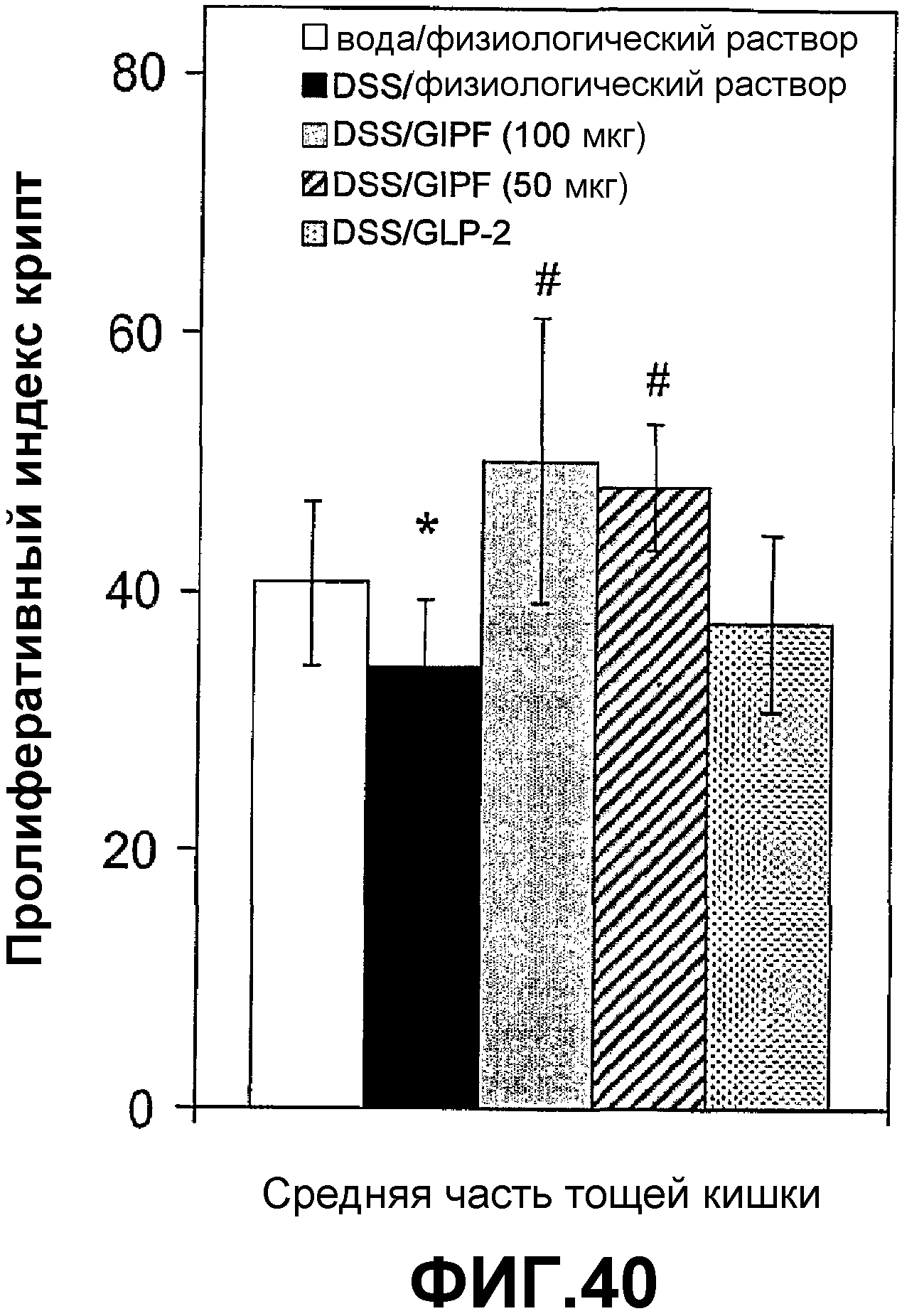
Фигура 40. Влияние GIPF на пролиферацию эпителия тонкого кишечника мышей с DSS-индуцированным колитом.
Фигура 41. Влияние GIPF на стабилизацию β-катенина в эндокринных клетках человека и эпителиальных клетках почки человека. GIPF индуцировал зависимую от дозы (A) и зависимую от времени (B) стабилизацию β-катенина в клетках HEK293. Стабилизирующее влияние GIPF не нарушалось при кипячении (C).
Фигура 42. Влияние GIPF на фосфорилирование GSK3.
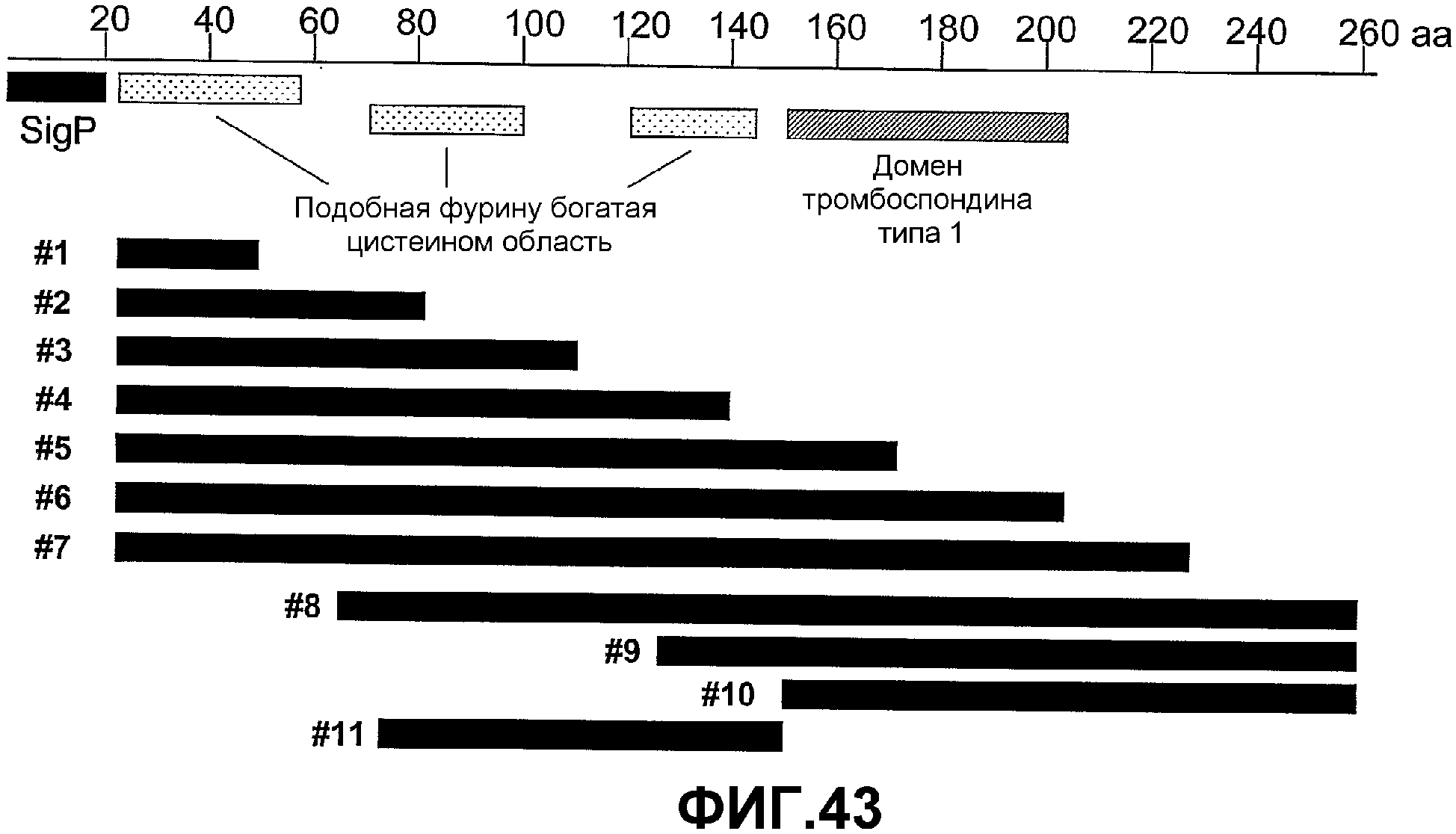
Фигура 43. Схематичное представление аналогов полипептида GIPF, сконструированных для определения способности различных областей GIPF стабилизировать β-катенин. Номера фрагментов 1-11 соответствуют последовательностям полипептида SEQ ID NO: 85, 87, 89, 91, 93, 95, 97, 99, 101, 103 и 105 соответственно.
Фигура 44. Стабилизация β-катенина аналогами GIPF, изображенными на фигуре 43.
Фигура 45. Сравнение активности GIPF человека и мыши в отношении макроскопической патологии кишечника мышей.
Фигура 46. Влияние GIPF на глубину кишечных крипт.
Фигура 47. Влияние GIPF на стабилизацию β-катенина в изолированных клетках крипт.
Фигура 48. Влияние GIPF на массу тела животных с TNBS-индуцированным колитом.
Фигура 49. Влияние GIPF на количественный показатель колита у животных с TNBS-индуцированным колитом.
Фигура 50. Влияние GIPF на хронический колит, индуцированный DSS.
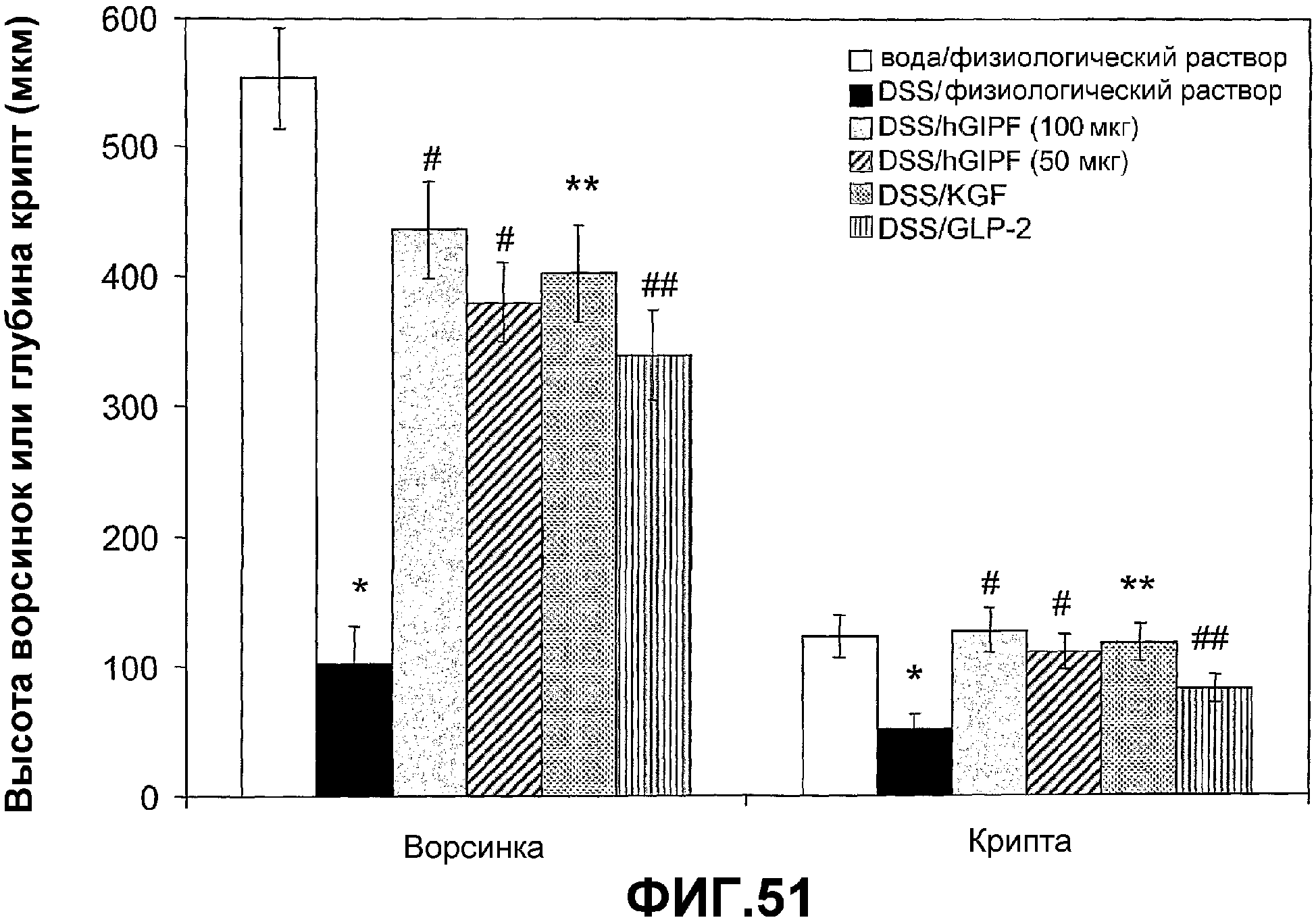
Фигура 51. Влияние GIPF на высоту ворсинок и глубину крипт у животных с DSS-индуцированным хроническим колитом.
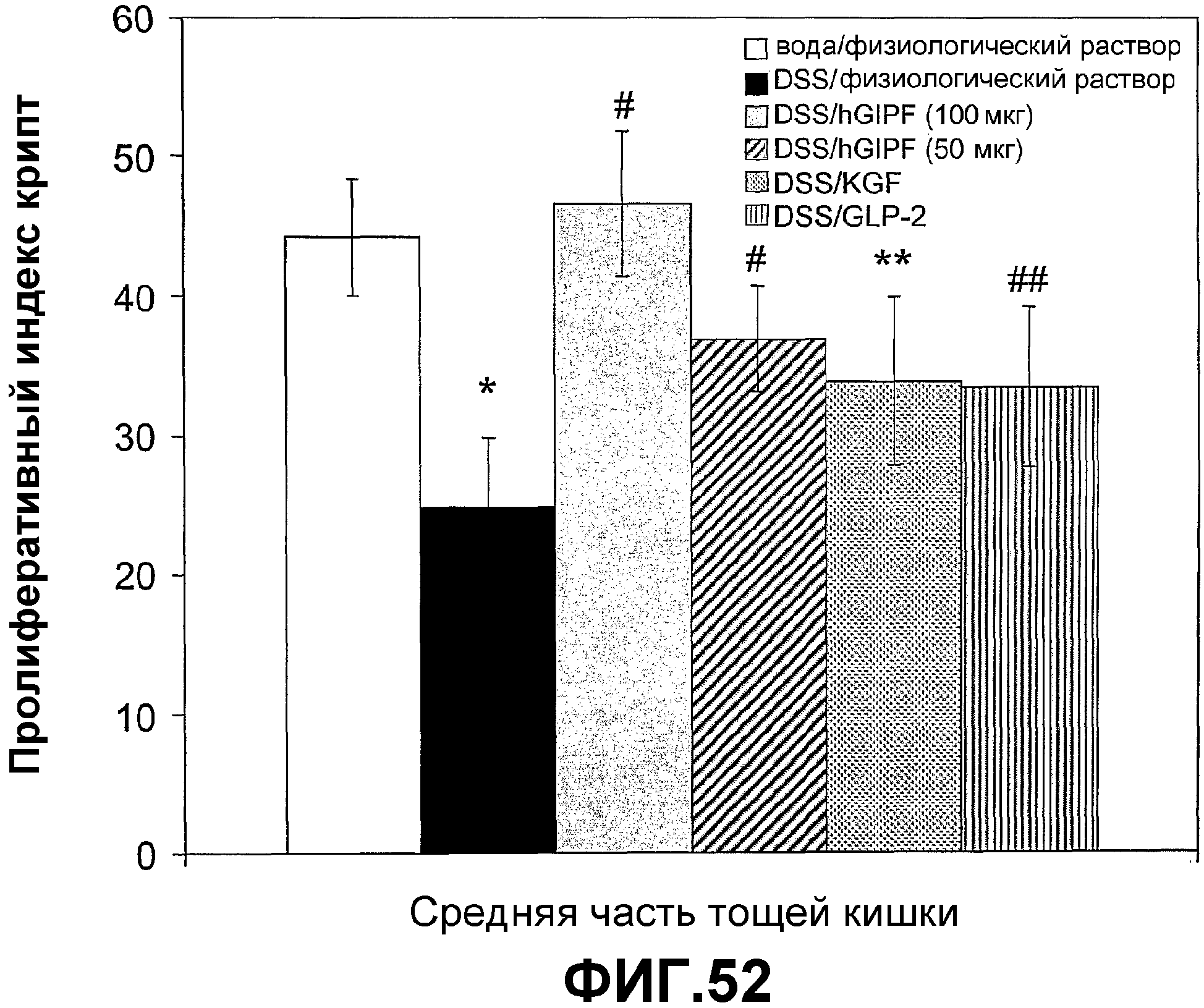
Фигура 52. Влияние GIPF на пролиферативный индекс крипт животных с DSS-индуцированным хроническим колитом.
Фигура 53. Влияние GIPF на жизнеспособность крипт после облучения.
Фигура 54 A-N. Представление в виде диаграммы конструирования трансгена для управляемой виллином экспрессии GIPF в эпителии трансгенных мышей.
Фигура 55. Эмбриональная экспрессия GIPF в эпителии кишечника и печени трансгенных мышей.
Фигура 56. Стабилизация β-катенина у трансгенных мышей, которые экспрессируют GIPF.
Фигура 57. Окрашивание гематоксилином и эозином срезов тонкого кишечника трансгенных мышей, которые экспрессируют GIPF.
Фигура 58 A-C. Представление в виде диаграммы конструирования трансгена для управляемой виллином экспрессии GIPF и Wnt3a у трансгенных мышей.
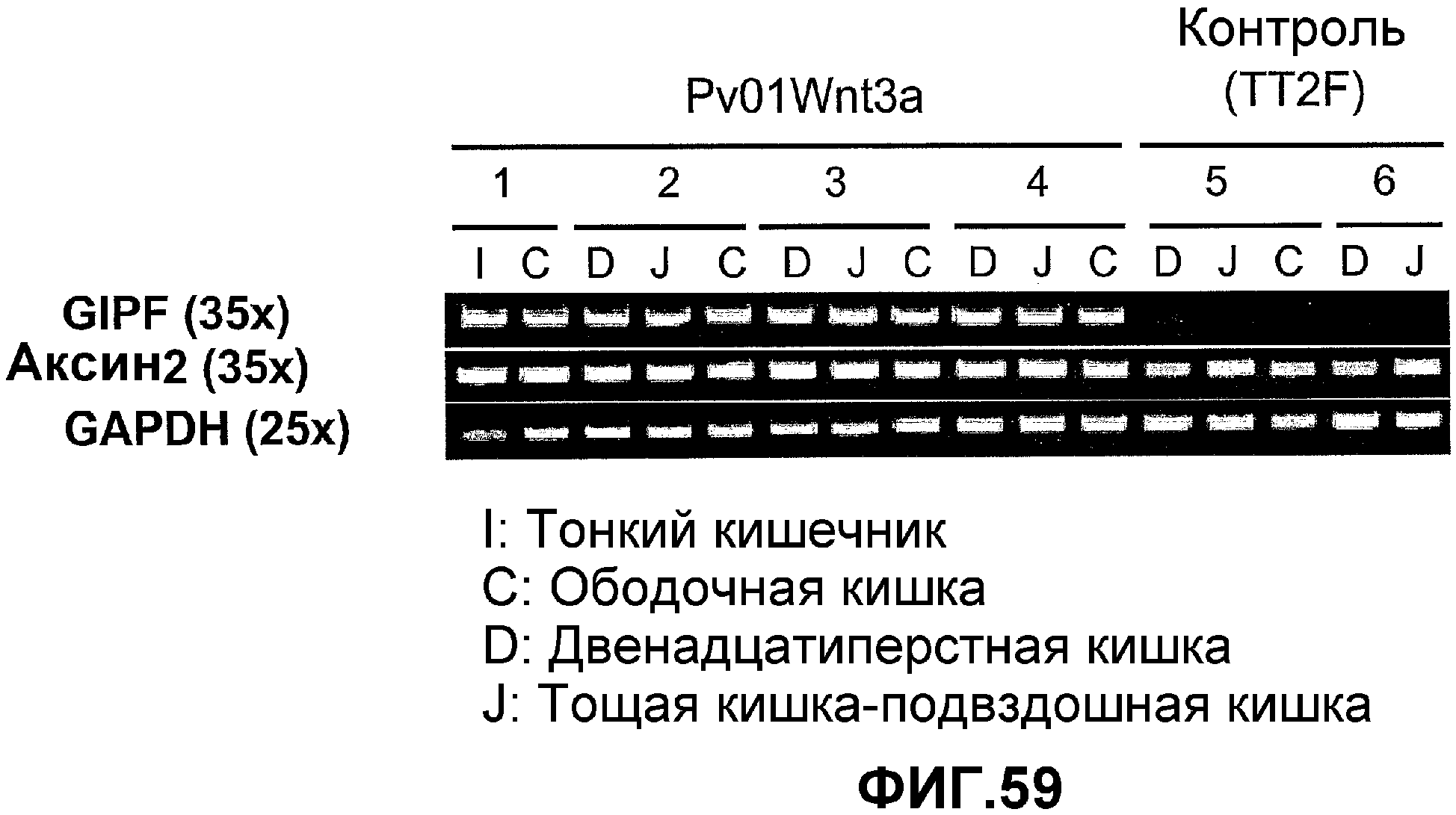
Фигура 59. Эмбриональная экспрессия GIPF и Wnt3a в тонком и толстом кишечнике трансгенных мышей.
Фигура 60. Стабилизация β-катенина у трансгенных мышей, которые экспрессируют GIPF и Wnt3a.
Фигура 61. Окрашивание гематоксилином и эозином срезов тонкого кишечника трансгенного эмбриона мыши, который экспрессирует GIPF и Wnt3a.
Фигура 62 A-K. Представление в виде диаграммы конструирования вектора RS-KO.
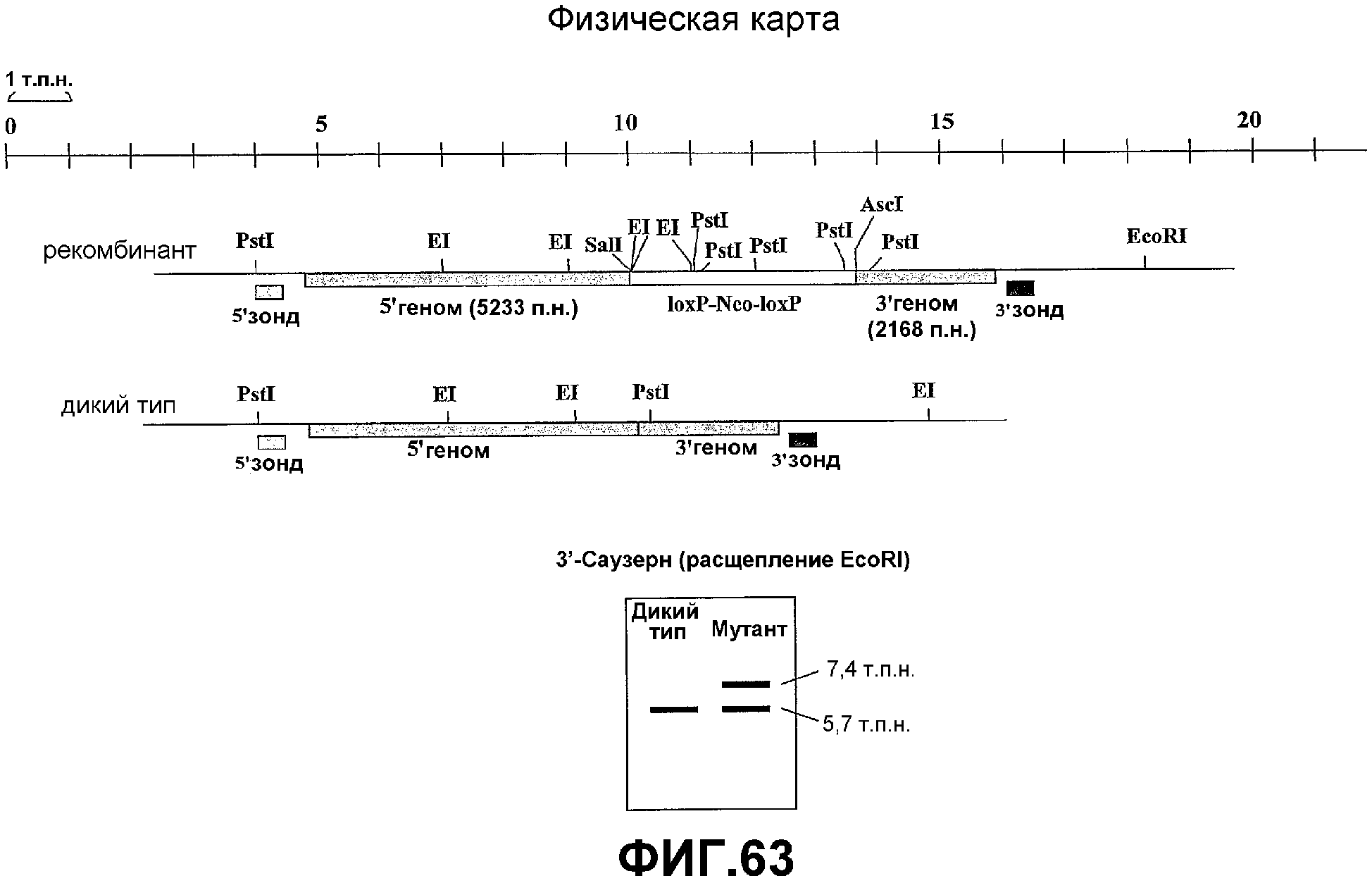
Фигура 63. Геномная карта клона дикого типа и рекомбинантного клона RS-KO.
Фигура 64A-K. Представление в виде диаграммы конструирования целенаправленно встраивающего вектора pCk m4 KI для экспрессии делеционного мутанта GIPF (SEQ ID NO: 91) у трансгенных мышей.
Фигура 65 A-C. Представление в виде диаграммы конструирования целенаправленно встраивающего вектора pPS m4KI для экспрессии делеционного мутанта GIPF (SEQ ID NO: 91) у трансгенных мышей.
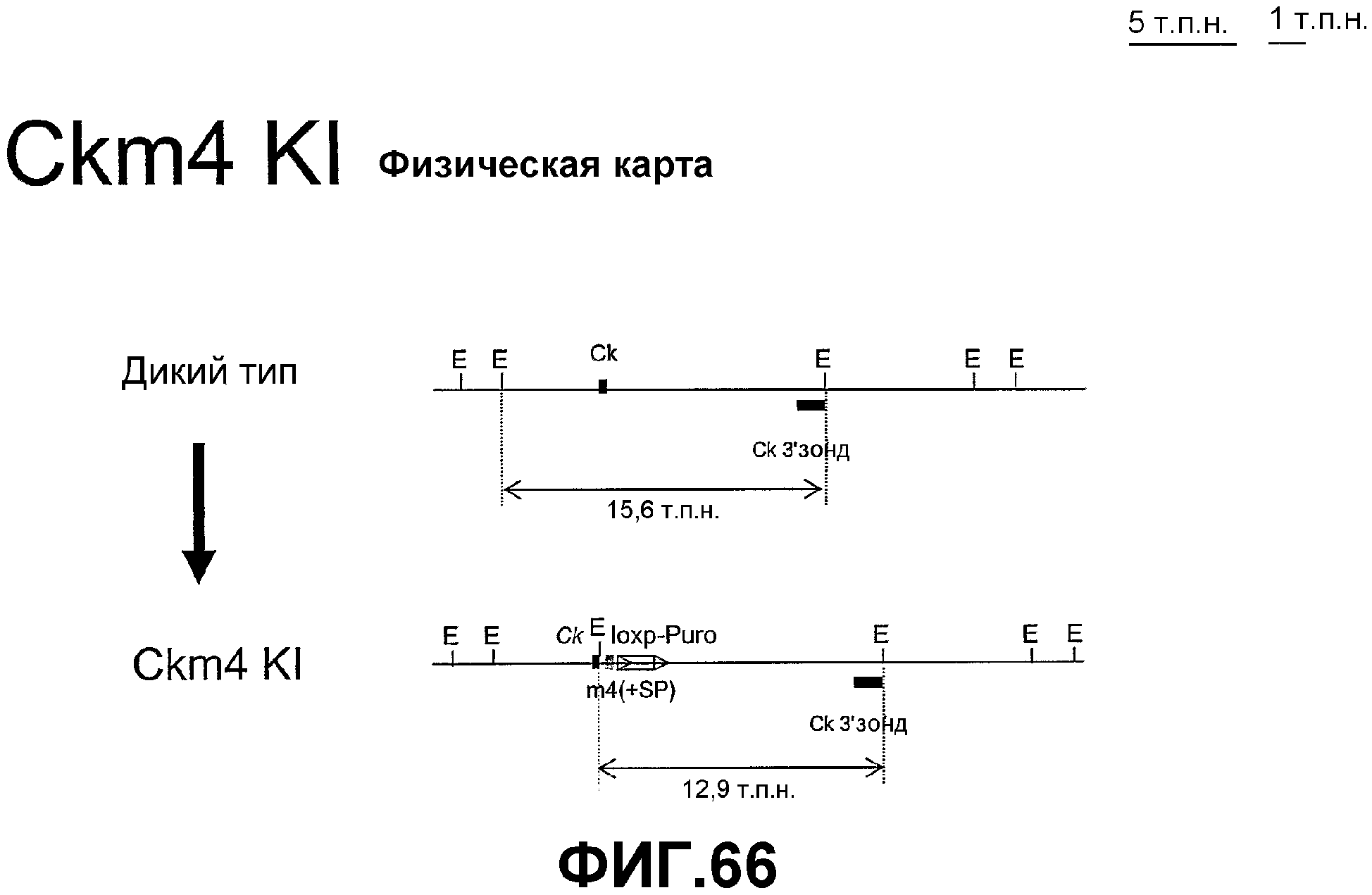
Фигура 66. Геномная карта клона дикого типа и рекомбинантного клона Ck m4 KI.
Фигура 67. Геномная карта клона дикого типа и рекомбинантного клона PS m4 KI.
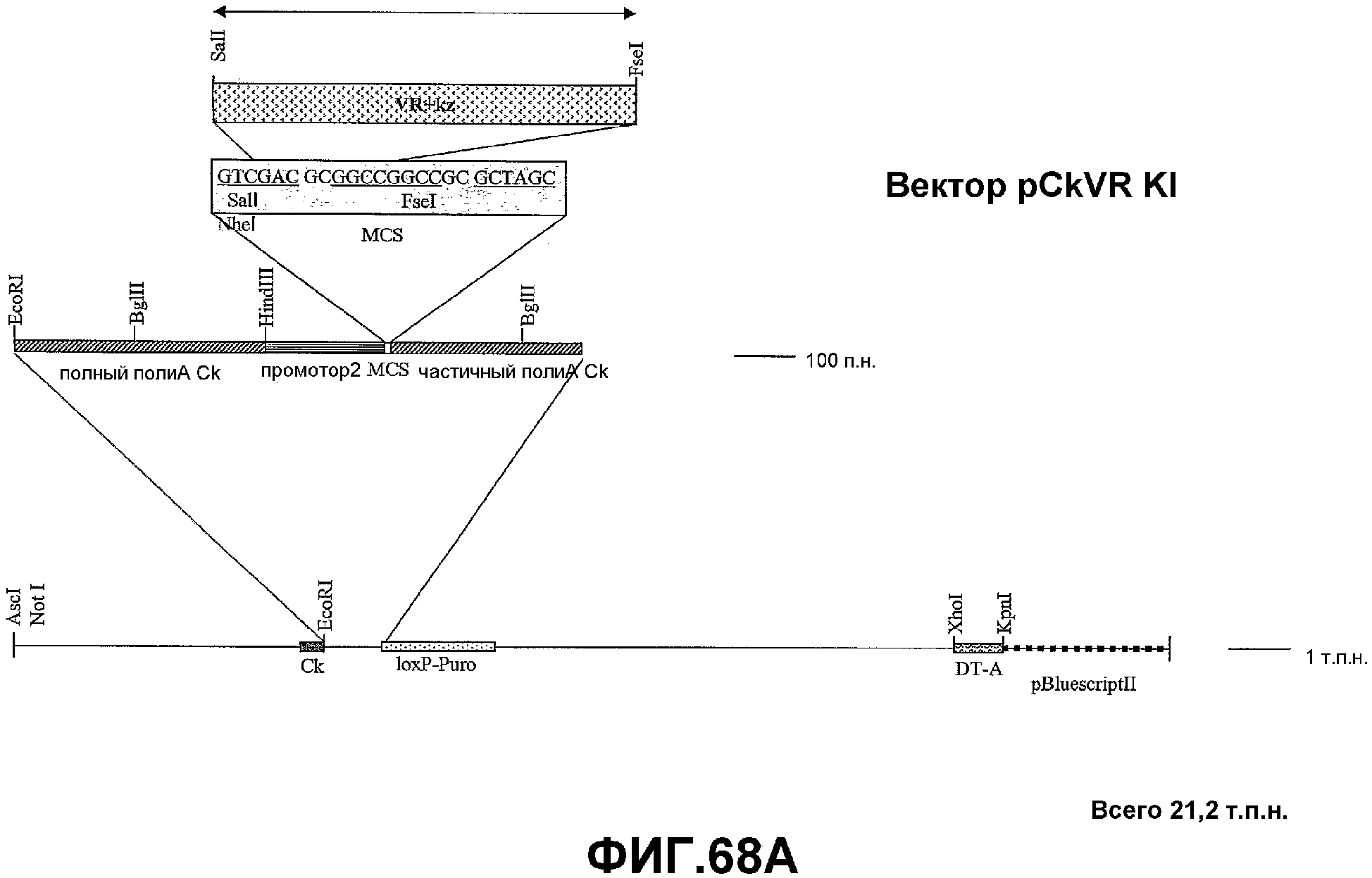
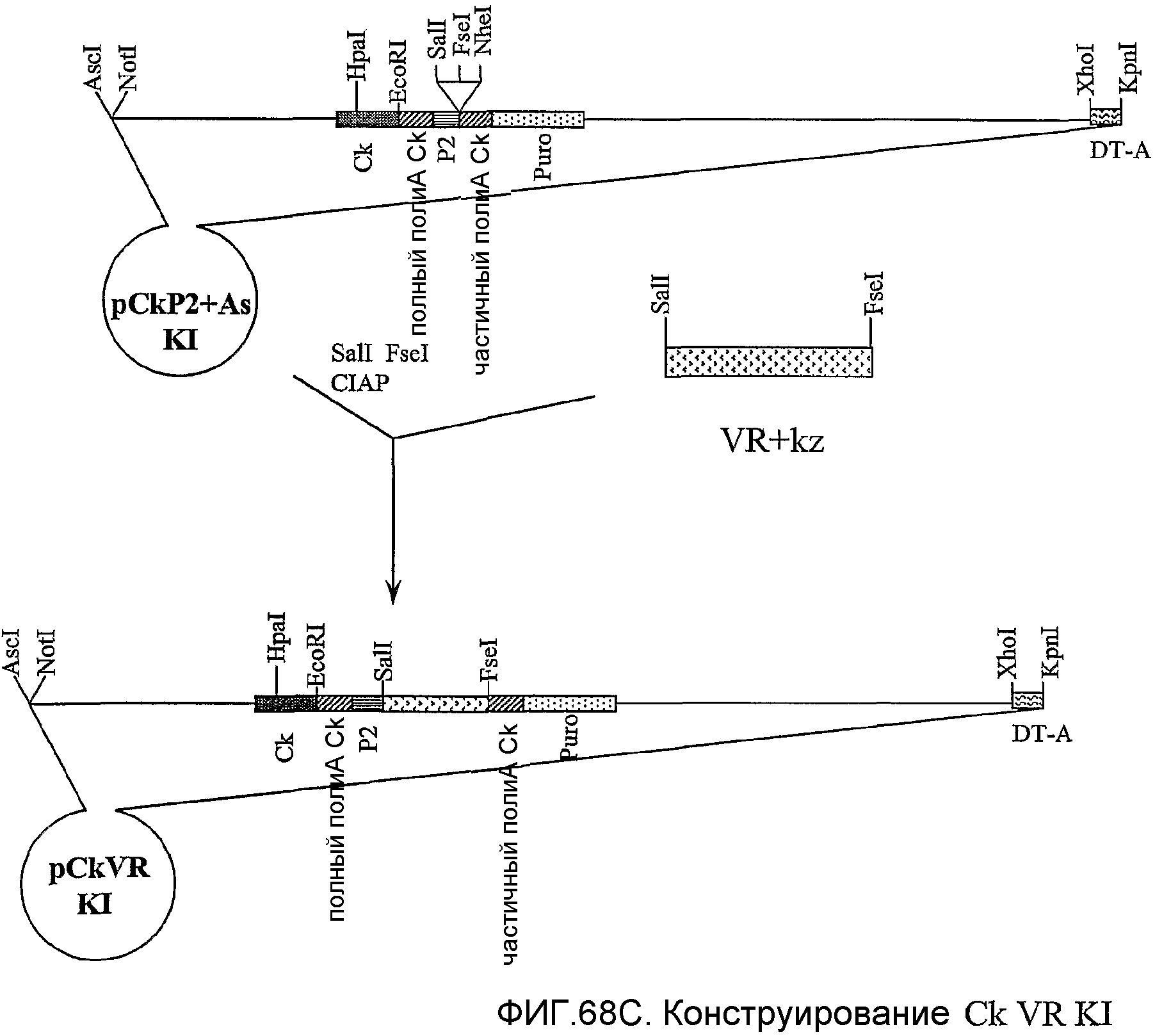
Фигура 68A-C. Представление в виде диаграммы конструирования целенаправленно встраивающего вектора pCk VRKI для экспрессии варианта GIPF (SEQ ID NO: 177; GenBank, номер доступа AK098225) у трансгенных мышей.
Фигура 69A-C. Представление в виде диаграммы конструирования целенаправленно встраивающего вектора pPS VR KI для экспрессии варианта GIPF (SEQ ID NO: 177; GenBank, номер доступа AK098225) у трансгенных мышей.
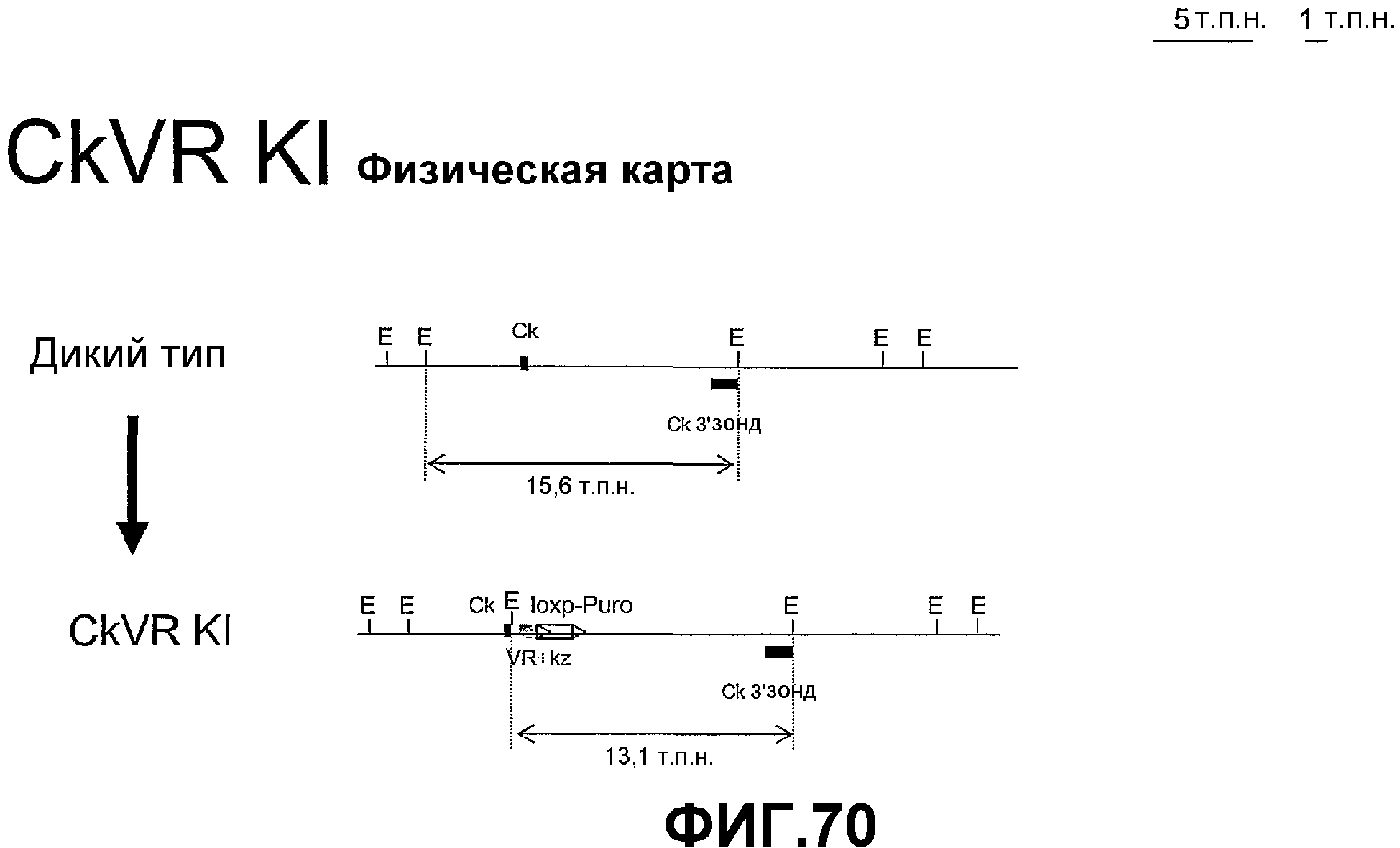
Фигура 70. Геномная карта клона дикого типа и рекомбинантного клона Ck VR KI.
Фигура 71. Геномная карта клона дикого типа и рекомбинантного клона PS VR KI.
Фигура 72. Сравнение тонкого и толстого кишечника контрольных и трансгенных мышей, экспрессирующих делеционный мутант GIPF SEQ ID NO: 91.
Фигура 73. Окрашивание гематоксилином и эозином поперечных срезов тонкого кишечника от трансгенных мышей, экспрессирующих делеционный мутант GIPF SEQ ID NO: 91 (малое увеличение).
Фигура 74. Окрашивание гематоксилином и эозином перекрестных срезов тонкого кишечника от трансгенных мышей, экспрессирующих делеционный мутант GIPF SEQ ID NO: 91 (большое увеличение).
Фигура 75. Стабилизация аксина-2 у трансгенных мышей, которые экспрессируют делеционный мутант GIPF SEQ ID NO: 91.
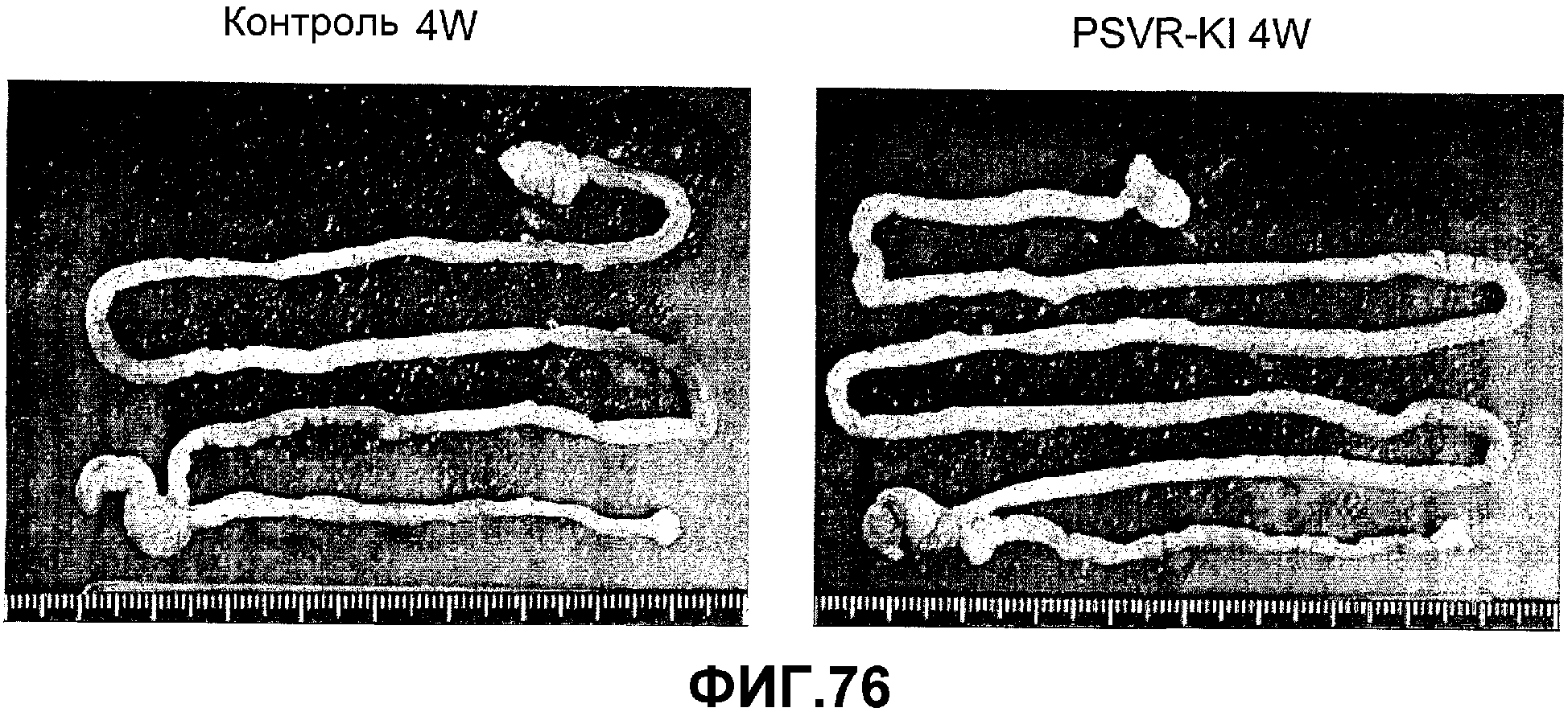
Фигура 76. Сравнение тонкого и толстого кишечника контрольных и трансгенных мышей (PSVR KI), экспрессирующих вариант GIPF (SEQ ID NO: 177; GenBank, номер доступа AK098225), с тонким и толстым кишечником контрольного животного.
Фигура 77. Окрашивание гематоксилином и эозином поперечных срезов тонкого кишечника от контрольной и трансгенной мыши (PSVR KI), экспрессирующей вариант GIPF (SEQ ID NO: 177; GenBank, номер доступа AK098225) (малое увеличение).
Фигура 78. Окрашивание гематоксилином и эозином поперечных срезов тонкого кишечника от контрольной и трансгенной мыши (PSVR KI), экспрессирующей вариант GIPF (SEQ ID NO: 177; GenBank, номер доступа AK098225) (большое увеличение).
Фигура 79. Стабилизация аксина-2 у контрольных и трансгенных мышей, которые экспрессируют вариант GIPF (SEQ ID NO: 177; GenBank, номер доступа AK098225).
Фигура 80. Окрашивание гематоксилином и эозином срезов толстого кишечника контрольного животного и животного, у которого индуцировали хронический IBD переносом T-клеток (пример 37).
4. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Полипептиды согласно изобретению изображены на фигуре 3 и подробно описаны ниже.
Полипептид GIPF с последовательностью SEQ ID NO: 4 является 263-аминокислотным белком с рассчитанной молекулярной массой примерно 29 кД в негликозилированной форме. SEQ ID NO: 2 является последовательностью кДНК, кодирующей полипептид GIPF. Начальный метионин начинается в положении 603 последовательности SEQ ID NO: 2, а предполагаемый стоп-кодон начинается в положении 1392 последовательности SEQ ID NO: 2. Поиски в базах данных белков с использованием алгоритма BLAST (Altschul S.F. et al., J. Mol. Evol. 36:290-300 (1993) and Altschul S.F. et al., J. Mol. Biol. 21:403-10 (1990), включенные в данное описание в виде ссылки) показывают, что последовательность SEQ ID NO: 4 является гомологичной последовательности SEQ ID NO: 23 фактора роста стволовых клеток A-1 (SEQ ID NO: 10 в PCT WO01/77169 A2) (фигуре 4A), и тромбоспондина 1 человека (SEQ ID NO: 28) (фигура 4B).
Рассчитанный сигнальный пептид примерно из двадцати остатков (SEQ ID NO: 8) простирается от остатка 1 до остатка 20 последовательности SEQ ID NO: 4. Внеклеточная часть применима сама по себе. Область сигнального пептида рассчитывали, используя программу Neural Network Signal P VI.I (Nielsen et al., Int. J. Neural Syst. 8: 581-599 (1997)), публикация включена в данное описание в виде ссылки) и/или используя программу Neural Network SignalP V1. 1 (Nielsen et al., (1997) Int. J. Neural Syst. 8, 581-599). Специалисту в данной области будет понятно, что фактический сайт расщепления может отличаться от сайта, рассчитанного компьютерной программой. SEQ ID NO: 10 представляет полипептид GIPF с последовательностью SEQ ID NO: 4, в которой отсутствует предполагаемый сигнальный пептид (SEQ ID NO: 8).
Два вида полипептидов, полученных из SEQ ID NO: 4, были клонированы и очищены из культуры клеток млекопитающих. SEQ ID NO: 10 является последовательностью формы полипептида, очищенной из культуральной среды клеток яичника китайского хомячка (CHO), которые трансфицированы векторной конструкцией, содержащей нуклеотидную последовательность SEQ ID NO: 3. Полипептид с последовательностью SEQ ID NO: 10 в данном описании упоминается как доминантная зрелая форма GIPF. SEQ ID NO: 9 является нуклеотидной последовательностью, которая кодирует полипептид с последовательностью SEQ ID NO: 10. N-концевую последовательность данной формы полипептида определяли посредством секвенирования на основе деградации по Эдману (Speicher, D.W.. Methods 6: 248-261 (1994); Tempst et al., Methods 6: 248-261 (1994)). SEQ ID NO: 12 является последовательностью зрелой формы полипептида, выделенной из культуральной среды клеток эмбриональной почки человека 293, которые трансфицированы векторной конструкцией, содержащей последовательность SEQ ID NO: 3. SEQ ID NO: 11 является соответствующей нуклеотидной последовательностью, которая кодирует полипептид SEQ ID NO: 12. Посредством секвенирования на основе деградации по Эдману было определено, что в полипептиде с последовательностью SEQ ID NO: 12 отсутствуют первые 31 аминокислотный остаток последовательности SEQ ID NO: 4. 31-Аминокислотный пептид содержит консенсусный сайт (SEQ ID NO: 20) для расщепления протеазой фурином (Zhou et al., J. Biol. Chem. 274: 20745-20748 (1999), публикация включена в данное описание в виде ссылки в полном объеме).
Используя компьютерную программу Pfam (Sonnhammer et al., Nucleic Acids Res., Vol. 26(1) pp. 320-322 (1998), публикация включена в данное описание в виде ссылки), полипептид GIPF (SEQ ID NO: 4) исследовали в отношении доменов, гомологичных известным пептидным доменам. Предполагается, что полипептид GIPF с последовательностью SEQ ID NO: 4 имеет домен тромбоспондина типа 1 (SEQ ID NO: 14, кодируемая нуклеотидной последовательностью SEQ ID NO 13). Оценка Pfam для домена тромбоспондина типа 1, находящегося в последовательности SEQ ID NO: 4, составляет 0,0034, и, как рассчитано, домен располагается от 151 до 206 аминокислотного остатка последовательности SEQ ID NO: 4. Домен тромбоспондина может быть применим сам по себе.
На основании использования пакета компьютерных программ MATRIX (Stanford University, Stanford, CA) (Wu et al., J. Comp. Biol., vol. 6, pp. 219-235 (1999), публикация включена в данное описание в виде ссылки) предполагается, что полипептид GIPF с последовательностью SEQ ID NO: 4 имеет домены, указанные в таблице ниже, где A=аланин, C=цистеин, D=аспарагиновая кислота, E=глутаминовая кислота, F=фенилаланин, G=глицин, H=гистидин, I=изолейцин, K=лизин, L=лейцин, M=метионин, N=аспарагин, P=пролин, Q=глутамин, R=аргинин, S=серин, T=треонин, V=валин, W=триптофан, Y=тирозин:
Чтобы регулировать продукцию либо доминантной зрелой, либо зрелой формы полипептида, которая преимущественно продуцировалась клетками CHO и/или 293 (SEQ ID NO: 10 и SEQ ID NO: 12 соответственно), были созданы синтетические конструкции. SEQ ID NO: 15 является нуклеотидной последовательностью, включенной в векторную систему, которая приводит к экспрессии полипептида (SEQ ID NO: 16), в котором рассчитанный сигнальный пептид (SEQ ID NO: 8) соседствует с преимущественной зрелой формой, продуцированной в клетках 293 (SEQ ID NO: 10). SEQ ID NO: 17 является последовательностью нуклеотидной конструкции, полученной сайт-специфичным мутагенезом (Weiner et al., Gene 126: 35-41 (1993)) так, чтобы она содержала мутацию в консенсусном сайте расщепления протеазой фурином (SEQ ID NO: 22). Указанная мутация заменяет первый остаток аргинина (R) в последовательности SEQ ID NO: 20 на глутамин (Q). Мутация с заменой аргинина на глутамин обеспечивает продукцию доминантной зрелой формы GIPF клетками 293 (SEQ ID NO: 10).
Тромбоспондины являются семейством белков внеклеточного матрикса, которые вовлечены в межклеточные взаимодействия и взаимодействия клеток с матриксом (Lawler et al., Curr. Opin. Cell Bio. 12: 634-640 (2000)). Известно более пяти разных тромбоспондинов с разным характером распределения в тканях. Некоторые ткани, подобные тканям сердца, хряща и головного мозга, экспрессируют большинство продуктов гена тромбоспондина. Тромбоспондин-1 является основным компонентов тромбоцитов крови. Тромбоспондин-1, по-видимому, функционирует на клеточной поверхности, объединяя мембранные белки и цитокины и другие растворимые факторы. Мембранные белки, которые связывают тромбоспондин-1, включают интегрины, интегрин-ассоциированный белок (CD47), CD36, протеогликаны. Трансформирующий фактор роста (TGF) и полученный из тромбоцитов фактор роста также связывают тромбоспондин-1.
Тромбоспондин-1 является крупным белком с множеством отдельных доменов. Он содержит глобулярный домен на обоих амино- и карбоксильном конце, область гомологии с проколлагеном и три типа мотивов повторяющихся последовательностей, называемых повторами тромбоспондина (TSP) типа 1, типа 2 и типа 3. Повторы TSP1 обнаружены во многих разных белках, включая компоненты комплемента (C6, C7, C8A и т.д.) белки внеклеточного матрикса, подобные ADAMTS, миндин, молекулу управления ростом аксонов, подобную F-спондину, сефмафоринам, а также SCO-спондину, и TRAP-белки Plasmodium.
Повтор тромбоспондина типа 1 (TSP1) может активировать TGFβ эпителиальных тканей, который вовлечен в регуляцию клеточного роста, дифференцировки, адгезии, миграции и гибели. TSP1, кроме того, вовлечен в связывание белков, связывание гепарина, прикрепление клеток, разрастание нейритов, ингибирование пролиферации, ингибирование ангиогенеза и активацию апоптоза. Домены TSP1 белка Plasmodium circumsporozoite (CS) и белков TRAP вовлечены в инвазию спорозоита в слюнные железы.
Последовательности TSP1 характеризуются консервативными цистинами, близко расположенными триптофанами и кластером основных остатков. В пространственной конфигурации последовательностей TSP1 видны два β-слоистых домена, которые, как показано, связывают гепарин (Kilpelainen et al. (200) J. Biol. Chem. 275, 13564-13570, публикация включена в данное описание в виде ссылки). Сходная пространственная укладка описана для связывающей гепарин связанной с ростом молекулы (HB-GAM). HB-GAM идентична митогенному и стимулирующему разрастание нейритов белку плейтрофину; специфичному для остеобластов фактору-1; связывающему гепарин нейротрофическому фактору и аффинному к гепарину регуляторному пептиду. Показано, что экспрессия HB-GAM связана с внеклеточным матриксом путей аксонов и синапсов, а также с базальными мембранами вне головного мозга и в хрящевой основе. Недавно показано, что N-синдекан является рецептором для HB-GAM в головном мозге, и подтверждено, что он играет роль в регуляции долговременного потенцирования гиппокампа, формы пластичности головного мозга, вовлеченной в память и обучение. Поэтому белки, содержащие TSP1, могут действовать в качестве активаторов роста и могут проявлять активности GIPF.
Кроме того, тромбоспондин, синтезируемый в костном мозге и депонируемый во внеклеточном матриксе, функционирует в качестве молекулы клеточной адгезии для первичных полипотентных клеток-предшественников, а также для гематопоэтических клеток-предшественников, коммитированных в направлении эритроидных, гранулоцитных и мегакариоцитных линий. Таким образом, тромбоспондины могут иметь важное значение для развития клеток крови (Long and Dixit (1990) Blood 75, 2311-2318, публикация включена в данное описание в виде ссылки).
Полипептиды и полинуклеотиды GIPF согласно изобретению можно использовать для индукции пролиферации или дифференцировки клеток крипт желудочно-кишечного тракта. Их также можно использовать для лечения состояний, при которых требуется эпителизация, например для лечения желудочно-кишечных расстройств, включая индуцированный химиотерапией и лучевой терапией мукозит, мукозит ротовой части глотки, губ и пищевода, воспалительное заболевание кишечника и другие состояния, включая раны, ожоги, глазные расстройства и любое расстройство, при котором требуется стимуляция пролиферации или регенерации эпителиальных клеток. Полинуклеотиды и полипептиды согласно изобретению, кроме того, можно использовать для создания новых тканей и органов, которые могут помогать пациентам, нуждающимся в трансплантированных тканях.
4.1. ОПРЕДЕЛЕНИЯ
В описании настоящего изобретение будут использованы следующие термины, и подразумевается, что они имеют определения, которые указаны ниже.
Необходимо отметить, что в используемом в данном описании и в прилагаемой формуле изобретения смысле формы единственного числа включают ссылки на множественное число, если контекст ясно не диктует иное.
Термин «GIPF» относится к «желудочно-кишечному фактору», который особенно активен на эпителиальных клетках.
Согласно настоящему изобретению термин «белок(ки) GIPF» или «полипептид(ды) GIPF» относится к полноразмерному белку в пределах от аминокислоты Met1 до аминокислоты Ala263 (SEQ ID NO: 4), его фрагментам и аналогам.
Все термины «полноразмерный GIPF», «длинная форма GIPF», «GIPF дикого типа» или «нативный GIPF» в используемом в данном описании смысле относятся к полипептиду, который содержит 263 аминокислотных остатка (SEQ ID NO: 4), который показан на фигуре 1B.
Термины «GIPFwt» или «hGIPF» относятся к полноразмерному полипептиду GIPF дикого типа человека (SEQ ID NO: 4); термин «GIPFt» относится к V5His6-меченому полипептиду GIPF человека (SEQ ID NO: 6) и «mGIPFt» относится к V5His6-меченому GIPF мыши (SEQ ID NO: 69). Вариант полипептида GIPF имеет изолейцин, а не валин в положении 50 последовательности SEQ ID NO: 4.
Термин «фрагмент» относится к полипептиду, полученному из нативного GIPF, который не содержит полной последовательности GIPF. Такой фрагмент может быть укороченным вариантом полноразмерной молекулы, например SEQ ID NO: 10 и 12, а также полипептидом с внутренней делецией, например SEQ ID NO: 16. Фрагмент GIPF может обладать биоактивностью GIPF, которую определяют по влиянию GIPF на пролиферацию эпителиальных клеток in vitro и/или in vivo, как описано в данной публикации.
Термин «аналог» относится к производным эталонной молекулы. Аналог может сохранять биологическую активность, которая описана выше. В общем, термин «аналог» относится к соединениям, имеющим нативную полипептидную последовательность и структуру с одной или несколькими добавлениями, заменами (обычно консервативными по природе) и/или делециями аминокислот по сравнению с нативной молекулой, при условии, что модификации не нарушают активность. Последовательность SEQ ID NO: 18 является примером аналога GIPF. Предпочтительно аналог обладает по меньшей мере такой же биологической активностью, как и исходная молекула, и даже может проявлять повышенную активность по сравнению с исходной молекулой. Способы получения полипептидных аналогов известны в данной области. Особенно предпочтительные аналоги содержат замены, которые являются консервативными по природе, т.е. такие замены, которые имеют место в семействе аминокислот, которые являются родственными по своим боковым цепям. В частности, аминокислоты обычно делят на четыре семейства: (1) кислые: аспартат и глутамат; (2) основные: лизин, аргинин, гистидин; (3) неполярные: аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные: глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, довольно предсказуемо, что отдельная замена лейцина изолейцином или валином, аспартата глутаматом, треонина серином или сходная консервативная замена аминокислоты структурно родственной аминокислотой будет сохранять биологическую активность GIPF.
Руководство по определению того, какие аминокислотные остатки могут быть заменены, добавлены или делетированы без отмены представляющих интерес активностей, можно найти, сравнивая последовательности конкретного полипептида с последовательностью гомологичных пептидов и минимизируя количество изменений аминокислотной последовательности, сделанных в областях высокой гомологии (консервативных областях), или заменяя аминокислоты консенсусной последовательностью.
Альтернативно рекомбинантные аналоги, кодирующие такие же или сходные полипептиды, могут быть синтезированы или отобраны с использованием «избыточности» генетического кода. Могут быть введены различные замены кодонов, такие как молчащие изменения, которые образуют различные сайты рестрикции, чтобы оптимизировать клонирование в плазмидном или вирусном векторе или экспрессию в конкретной прокариотической или эукариотической системе. Мутации в полинуклеотидной последовательности могут отражаться на полипептиде или доменах других пептидов, добавляемых к полипептиду, модифицируя свойства любой части полипептида, изменяя такие свойства, как аффинность связывания лиганда, аффинность между цепями или скорость разрушения/обмена.
Предпочтительно «замены» аминокислот являются результатом замены одной аминокислоты другой аминокислотой, имеющей сходные структурные и/или химические свойства, т.е. являются консервативными аминокислотными заменами. «Консервативные» аминокислотные замены могут быть осуществлены на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы используемых остатков. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; и отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. «Инсерции» или «делеции» предпочтительно имеют размер в пределах примерно от 1 до 20 аминокислот, более предпочтительно от 1 до 10 аминокислот. Возможное варьирование можно определить экспериментально посредством систематического получения инсерций, делеций или замен аминокислот в молекуле полипептида с использованием методики рекомбинантной ДНК и анализа полученных в результате рекомбинантных вариантов в отношении активности.
Альтернативно в том случае, когда требуется изменение функции, могут быть сконструированы инсерции, делеции или неконсервативные изменения, чтобы получить измененные полипептиды. Такие изменения, например, могут менять одну или несколько биологических функций или биохимических свойств полипептидов согласно изобретению. Например, такие изменения могут изменять такие свойства полипептидов, как аффинности связывания лигандов, аффинности между цепями или скорость разрушения/обмена. Кроме того, такие изменения могут быть выбраны так, чтобы создать полипептиды, которые лучше подходят для экспрессии, масштабирования и тому подобного в клетках-хозяевах, выбранных для экспрессии. Например, остатки цистеина могут быть делетированы или заменены другим аминокислотным остатком, чтобы удалить дисульфидные мостики.
Термин «производное» относится к полипептидам, химически модифицированным такими способами, как убиквитинирование, мечение (например, радионуклидами или различными ферментами), ковалентное связывание полимера, такое как пегилирование (дериватизация полиэтиленгликолем) и инсерция или замена с помощью химического синтеза такой аминокислотой, как орнитин, которая обычно не встречается в белках человека.
Термины «полипептид» и «белок» относятся к полимеру из аминокислотных остатков и не ограничены минимальной длиной продукта. Термины также включают, если не оговорено особо, модификации полипептида, которые не изменяют последовательность аминокислот, например гликозилированные, ацетилированные и фосфорилированные формы. Полипептид или белок в целях настоящего изобретения может быть получен синтетически или рекомбинантно, а также выделен из природных источников.
Под «очищенный» и «изолированный» по отношению к полипептиду или полинуклеотиду подразумевается, что указанная молекула присутствует по существу без других биологических макромолекул того же типа. Термин «очищенный» в используемом в данном описании смысле предпочтительно означает, что по меньшей мере 75% мас., более предпочтительно по меньшей мере 85% мас., еще более предпочтительно по меньшей мере 95% мас. и наиболее предпочтительно по меньшей мере 98% мас. биологических молекул данного типа присутствуют в образце. В одном варианте полинуклеотид или полипептид очищают так, что он составляет по меньшей мере 95% мас. от присутствующих идентичных биологических макромолекул, но могут присутствовать вода, буферы и другие малые молекулы, имеющие молекулярную массу менее 1000 дальтон.
«Изолированный полинуклеотид, который кодирует конкретный полипептид» относится к молекуле нуклеиновой кислоты, которая по существу не содержит других молекул нуклеиновой кислоты, которые не кодируют данный полипептид; однако молекула может включать в себя несколько дополнительных оснований или фрагментов, которые не оказывают вредного воздействия на основные характеристики композиции.
Термин «встречающийся в природе полипептид» относится к полипептидам, продуцируемым клетками, которые не были генетически сконструированы, и, в частности, охватывает различные полипептиды, возникающие в результате посттрансляционных модификаций полипептида, включая, без ограничения, ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидизацию и ацилирование.
Термин «часть, кодирующая транслируемый белок» означает последовательность, которая кодирует полноразмерный белок, который может содержать любую лидерную последовательность или последовательность процессинга.
Термин «последовательность, кодирующая доминантный зрелый белок» относится к последовательности, которая кодирует пептид или белок без какой-либо лидерной/сигнальной последовательности. «Часть доминантного зрелого белка» относится к части белка без лидерной/сигнальной последовательности. «Зрелая» форма относится к полипептиду GIPF, в котором отсутствует лидерная/сигнальная последовательность и сайт расщепления фурином. Пептид может иметь лидерную последовательность и/или сайт расщепления фурином, удаляемый во время процессинга в клетке, или белок может быть получен синтетически или с использованием полинуклеотида, кодирующего только последовательность, кодирующую зрелый белок. Предполагается, что часть зрелого или доминантного зрелого белка может содержать или может не содержать начальный остаток метионина. Начальный метионин часто удаляется во время процессинга пептида.
Термин «изолированный» в используемом в данном описании смысле относится к нуклеиновой кислоте или полипептиду, отделенному по меньшей мере от одного другого компонента (например, нуклеиновой кислоты или полипептида), присутствующего с данной нуклеиновой кислотой или полипептидом в природном источнике. В одном варианте нуклеиновая кислота или полипептид находятся в присутствии (если вообще имеется) только растворителя, буфера, иона или других компонентов, обычно присутствующих в растворе нуклеиновой кислоты или полипептида. Термины «изолированный» и «очищенный» не охватывают нуклеиновые кислоты или полипептиды, присутствующие в своем природном источнике.
Термин «рекомбинантный» при использовании в данном описании по отношению к полипептиду или белку, означает, что полипептид или белок получают из рекомбинантных систем экспрессии (например, микроорганизмов, насекомых или млекопитающих). «Микробные» относится к рекомбинантным полипептидам или белкам, полученным в системах экспрессии бактерий или грибов (например, дрожжей). По отношению к продукту термин «рекомбинантный микробный» определяет полипептид или белок, по существу не содержащий нативных эндогенных веществ и не сопровождаемый связанным нативным гликозилированием. Полипептиды или белки, экспрессируемые в большинстве бактериальных культур, например E. coli, не будут иметь модификаций в виде гликозилирования; полипептиды или белки, экспрессируемые в дрожжах, будут иметь характер гликозилирования, в общем, отличающийся от полипептидов или белков, экспрессируемых в клетках млекопитающих.
Под «рекомбинантным полипептидом» подразумевается полипептид, который был получен способом на основе рекомбинантной ДНК, который описан в данной публикации. В общем, ген, кодирующий требуемый полипептид, клонируют и затем экспрессируют в трансформированных организмах, как описано далее. Организм хозяина экспрессирует чужеродный ген, продуцируя полипептид в условиях экспрессии. Альтернативно промотор, регулирующий экспрессию эндогенного полипептида, может быть изменен, чтобы осуществлять экспрессию рекомбинантного полипептида.
Термин «активный» относится к таким формам полипептида, которые сохраняют биологическую и/или иммунологическую активности какого-либо встречающегося в природе полипептида. Согласно изобретению термины «биологически активный» или «биологическая активность» относятся к белку или пептиду, имеющему структурные, регуляторные или биохимические функции встречающейся в природе молекулы. Подобным образом «биологически активный» или «биологическая активность» относятся к способности природного, рекомбинантного или синтетического пептида GIPF или любого его пептида индуцировать специфичный биологический ответ у подходящих животных или в клетках и связываться со специфичными антителами.
Термин «секретируемый» включает белок, который транспортируется через мембрану, включая транспорт в результате сигнальных последовательностей в их аминокислотной последовательности, в случае его экспрессии в подходящей клетке-хозяине. «Секретируемые» белки включают без ограничения белки, секретируемые целиком (например, растворимые белки) или частично (например, рецепторы) из клетки, в которой они экспрессируются. «Секретируемые» белки также включают без ограничения белки, которые транспортируются через мембрану эндоплазматического ретикулума. Также подразумевается, что «секретируемые» белки включают белки, содержащие нетипичные сигнальные последовательности (например, интерлейкин-1 бета, смотри Krasney, P. A. and Young, P. R. (1992) Cytokine 4 (2): 134-143) и факторы, высвобождаемые из поврежденных клеток (например, антагонист рецептора интерлейкина-1, смотри Arend, W. P. et. al. (1998) Annu. Rev. Immunol. 16: 27-55).
Термин «полинуклеотид» или «молекула нуклеиновой кислоты» в используемом в данном описании смысле относится к полимерной форме нуклеотидов любой длины, либо рибонуклеотидов, либо дезоксирибонуклеотидов. Данный термин относится только к первичной структуре молекулы и, таким образом, включает двунитевую и однонитевую ДНК и РНК. Термин также включает известные типы модификаций, например метки, которые известны в данной области, метилирование, «кэпы», замену одного или нескольких встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации, такие, например, как модификации незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие подвешенные фрагменты, такие как, например, белки (включая, например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации интеркалирующими агентами (например, акридином, псораленом и т.д.), модификации, содержащие хелаты (например, металлов, радиоактивных металлов, бора, окислительных металлов и т.д.), модификации, содержащие алкилирующие агенты, модификации с использованием модифицированных связей (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида. В общем, участки нуклеиновых кислот, предлагаемых в данном изобретении, могут быть собраны из фрагментов генома и коротких олигонуклеотидных линкеров, или из серии олигонуклеотидов, или из отдельных нуклеотидов, с образованием синтетической нуклеиновой кислоты, которая способна экспрессироваться в рекомбинантной единице транскрипции, содержащей регуляторные элементы, полученные из оперона микроорганизма или вируса или из эукариотического гена.
Термины «олигонуклеотидный фрагмент» или «полинуклеотидный фрагмент», «часть», или «участок», или «зонд», или «праймер» используют взаимозаменяемо, и они относятся к последовательности нуклеотидных остатков, которые имеет длину, составляющую по меньшей мере примерно 5 нуклеотидов, более предпочтительно по меньшей мере примерно 7 нуклеотидов, более предпочтительно по меньшей мере примерно 9 нуклеотидов, более предпочтительно по меньшей мере примерно 11 нуклеотидов и наиболее предпочтительно по меньшей мере примерно 17 нуклеотидов. Фрагмент предпочтительно имеет длину меньше, чем примерно 500 нуклеотидов, предпочтительно меньше, чем примерно 200 нуклеотидов, более предпочтительно меньше, чем примерно 100 нуклеотидов, более предпочтительно меньше чем примерно 50 нуклеотидов, и наиболее предпочтительно меньше, чем 30 нуклеотидов. Предпочтительно зонд имеет длину примерно от 6 нуклеотидов до примерно 200 нуклеотидов, предпочтительно примерно от 15 до примерно 50 нуклеотидов, более предпочтительно примерно от 17 до 30 нуклеотидов и наиболее предпочтительно примерно от 20 до 25 нуклеотидов. Предпочтительно фрагменты можно использовать в полимеразной цепной реакции (ПЦР), различных способах гибридизации или способах, основанных на микроматрицах, чтобы идентифицировать или амплифицировать идентичные или родственные части молекул мРНК или ДНК. Фрагмент или участок может однозначно идентифицировать каждую полинуклеотидную последовательность согласно настоящему изобретению. Предпочтительно фрагмент содержит последовательность, в значительной степени сходную с частью последовательности SEQ ID NO: 1, 2, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177.
Зонды можно использовать, например, для определения того, присутствуют ли конкретные молекулы мРНК в клетке или ткани, или чтобы выделить сходные последовательности нуклеиновых кислот из хромосомной ДНК, как описано Walsh et al. (Walsh, P. S. et al., 1992, PCR Methods Appl. 1: 241-250). Их можно метить ник-трансляцией, реакцией заполнения фрагментом Кленова, ПЦР или другими способами, хорошо известными в данной области. Зонды согласно настоящему изобретению, их получение и/или мечение подробно описаны в Sambrook, J. et al., 1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, NY; или Ausubel, F.M. et al., 1989, Current Protocols in Molecular Biology, John Wiley & Sons, New York NY, обе публикации включены в данное описание в виде ссылки в полном объеме.
Последовательности нуклеиновой кислоты согласно настоящему изобретению также включают в себя записанную в виде последовательности информацию из любой из последовательностей нуклеиновых кислот SEQ ID NO: 1, 2, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177. Записанная в виде последовательности информация может представлять собой участок последовательности SEQ ID NO: 1, 2, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177, который однозначно идентифицирует или представляет записанную в виде последовательности информацию SEQ ID NO: 1, 2, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177. Один такой участок может представлять собой двадцатимерную последовательность нуклеиновой кислоты, поскольку вероятность того, что двадцатимер полностью совпадает с участком в геноме человека, составляет 1 к 300. В геноме человека имеется три миллиарда пар оснований в одном наборе хромосом. Поскольку существует 420 возможных двадцатимеров, то имеется в 300 раз больше двадцатимеров, чем пар оснований в наборе хромосом человека. На основании использования такого же анализа вероятность того, что семидесятимер полностью совпадает с участком в геноме человека, составляет примерно 1 к 5. В том случае, когда указанные фрагменты применяют в матрицах для исследований экспрессии, можно использовать пятнадцатимерные фрагменты. Вероятность того, что пятнадцатимер полностью совпадает с экспрессируемыми последовательностями, также составляет примерно один к пяти, поскольку экспрессируемые последовательности содержат примерно менее 5% последовательностей всего генома.
Подобным образом, при использовании записанной в виде последовательности информации для выявления одного несовпадения фрагмент может быть двадцатипятимером. Вероятность того, что двадцатипятимер может появляться в геноме человека с одним несовпадением, рассчитывают, умножая вероятность полного совпадения (1÷425) на повышенную вероятность несовпадения в каждом положении нуклеотидов (3×25). Вероятность того, что одиннадцатимер с одним несовпадением можно выявить на матрице для исследований экспрессии, составляет примерно один к пяти. Вероятность того, что двадцатимер с одним несовпадением может быть выявлен в геноме человека, составляет примерно один к пяти.
Термин «открытая рамка считывания» ORF означает серию нуклеотидных триплетов, кодирующих аминокислоты без каких-либо кодонов терминации, и означает последовательность, транслируемую в белок.
Термины «оперативно связанный» или «оперативно ассоциированный» относятся к функционально связанным последовательностям нуклеиновой кислоты. Например, промотор оперативно ассоциирован или оперативно связан с кодирующей последовательностью, если промотор регулирует транскрипцию кодирующей последовательности. Хотя оперативно связанные последовательности нуклеиновой кислоты могут быть непрерывными и находиться в одной и той же рамке считывания, некоторые генетические элементы, например гены-репрессоры, не являются непрерывно связанными с кодирующей последовательностью, но все же регулируют транскрипцию/трансляцию кодирующей последовательности.
Термины «рекомбинантная молекула ДНК» или «рекомбинантный полинуклеотид» используют в данном описании по отношению к полинуклеотиду геномного, кДНК, полусинтетического или синтетического происхождения, который в силу своего происхождения или обработки: (1) не связан со всем или частью полинуклеотида, с которым он связан в природе, (2) связан с другим полинуклеотидом, отличным от полинуклеотида, с которым он связан в природе, или (3) не встречается в природе. Таким образом, термин охватывает «синтетически полученные» молекулы нуклеиновых кислот.
Термины «комплементарный» или «комплементарность» относятся к природному связыванию полинуклеотидов в результате спаривания оснований. Например, последовательность 5'-AGT-3' связывается с комплементарной последовательностью 3'-TCA-5'. Комплементарность между двумя однонитевыми молекулами может быть «частичной», так что связывается только некоторая часть нуклеиновых кислот, или она может быть «полной» при условии, что существует абсолютная комплементарность между однонитевыми молекулами. Степень комплементарности между нитями нуклеиновых кислот оказывает существенное влияние на эффективность и жесткость гибридизации между нитями нуклеиновых кислот.
Термин «жесткие» используют по отношению к условиям, которые в данной области обычно понимают как жесткие. Условия жесткости включают условия высокой жесткости (например, гибридизацию со связанной на фильтре ДНК в 0,5 М NaHPO4, 7% додецилсульфате натрия (SDS), 1 мМ EDTA при 65°C и промывку в 0,1X SSC/0,1% SDS при 68°C) и условия умеренной жесткости (например, промывку в 0,2X SSC/0,1% SDS при 42°C). Другие примерные условия гибридизации указаны в данном описании в примерах.
В случаях гибридизации дезоксиолигонуклеотидов дополнительные примеры условий жесткости гибридизации включают промывку в 6X SSC/0,05% пирофосфате натрия при 37°C (для состоящих из 14 оснований олигонуклеотидов), 48°C (для состоящих из 17 оснований олигонуклеотидов), 55°C (для состоящих из 20 оснований олигонуклеотидов) и 60°C (для состоящих из 23 оснований олигонуклеотидов).
В используемом в данном описании смысле «по существу эквивалентная» может относиться к нуклеотидным и аминокислотным последовательностям, например мутантной последовательности, которая отличается от эталонной последовательности одной или несколькими заменами, делециями или добавлениями, суммарный эффект которых не приводит к неблагоприятному функциональному различию между эталонной и данной последовательностями. Обычно такая по существу эквивалентная последовательность отличается от одной из перечисленных в данном описании последовательностей не более чем примерно на 35% (т.е. количество замен, добавлений и/или делеций отдельных остатков в по существу эквивалентной последовательности по сравнению с соответствующей эталонной последовательностью, деленное на общее количество остатков в по существу эквивалентной последовательности, составляет примерно 0,35 или меньше). Говорят, что такая последовательность имеет 65% гомологии последовательности с указанной последовательностью. В одном варианте по существу эквивалентная, например, мутантная последовательность согласно изобретению отличается от указанной последовательности не более чем на 30% (70% идентичность последовательностей); в разновидности данного варианта не более чем на 25% (75% идентичность последовательностей); и в следующей разновидности данного варианта не более чем на 20% (80% идентичность последовательностей), и в следующей разновидности данного варианта не более чем на 10% (90% идентичность последовательностей), и в следующей разновидности данного варианта не более чем на 5% (95% идентичность последовательностей). По существу эквивалентные, например, мутантные аминокислотные последовательности согласно изобретению предпочтительно обладают по меньшей мере 80% идентичностью последовательностей с указанной аминокислотной последовательностью, более предпочтительно по меньшей мере 90% идентичностью последовательностей. По существу эквивалентная нуклеотидная последовательность согласно изобретению может иметь более низкий процент идентичности последовательностей, принимая во внимание, например, избыточность или вырожденность генетического кода. Предпочтительно нуклеотидная последовательность обладает по меньшей мере примерно 65% идентичностью, более предпочтительно по меньшей мере примерно 75% идентичностью и наиболее предпочтительно по меньшей мере примерно 95% идентичностью. В целях настоящего изобретения последовательности, обладающие по существу эквивалентной биологической активностью и по существу эквивалентными параметрами экспрессии, считаются по существу эквивалентными. В целях определения эквивалентности не следует принимать во внимание укорочение зрелой последовательности (например, вследствие мутации, которая создает ложный стоп-кодон). Идентичность последовательности можно определить, например, используя способ Jotun Hein (Hein J. (1990) Methods Enzymol. 183: 626-645). Идентичность последовательностей также можно определить другими способами, известными в данной области, например, варьируя условия гибридизации.
Термин «вектор» относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она была связана. Термин «экспрессирующий вектор» включает плазмиды, космиды или фаги, способные синтезировать белок GIPF, кодируемый соответствующим рекомбинантным геном, который несет вектор. Предпочтительными векторами являются векторы, способные к автономной репликации и экспрессии нуклеиновых кислот, с которыми они связаны.
Термин «трансформация» означает введение ДНК в подходящую клетку-хозяина, так чтобы ДНК могла реплицироваться, либо в виде внехромосомного элемента, либо посредством интеграции в хромосому.
Термин «трансфекция» относится к поглощению экспрессирующего вектора подходящей клеткой-хозяином, при этом в действительности любые кодирующие последовательности либо экспрессируются, либо не экспрессируются. Термин «инфекция» относится к внедрению нуклеиновых кислот в подходящую клетку-хозяина с использованием вируса или вирусного вектора.
Термин «транскрипционные регуляторные элементы» и «транскрипционные регуляторные последовательности» используют взаимозаменяемо по отношению к последовательностям ДНК, необходимым для экспрессии оперативно связанной кодирующей последовательности в конкретном организме. Регуляторные последовательности, которые являются подходящими для прокариот, включают, например, промотор, необязательно последовательность оператора и сайт связывания с рибосомой. Известно, что эукариотические клетки используют промоторы, энхансеры, сигналы сплайсинга и сигналы полиаденилирования. Подразумевается, что указанные термины охватывают все элементы, которые стимулируют или регулируют транскрипцию, включая промоторы, коровые элементы, необходимые для основного взаимодействия РНК-полимеразы и факторов транскрипции, расположенные выше элементы, энхансеры и элементы ответа (Lewin, «Genes V» (Oxford University Press, Oxford) pages 847-873).
Кодирующая последовательность находится «под контролем» регулирующих транскрипцию и регулирующих трансляцию последовательностей в клетке, когда РНК-полимераза транскрибирует кодирующую последовательность в мРНК, которая затем необязательно подвергается транс-РНК-сплайсингу и транслируется в белок, кодируемый кодирующей последовательностью.
Термин «тканеспецифичный промотор» означает нуклеотидную последовательность, которая служит в качестве промотора, т.е. регулирует экспрессию выбранной последовательности ДНК, оперативно связанной с промотором, и которая влияет на экспрессию выбранной последовательности ДНК в конкретных клетках, таких как B-клетки. В иллюстративном варианте генные конструкции, в которых используют специфичные для B-клеток промоторы, можно применять для того, чтобы предпочтительно управлять экспрессией белка GIPF или фрагмента белка GIPF в B-клетках.
Термин «фрагмент, модулирующий экспрессию», EMF, означает ряд нуклеотидов, которые модулируют экспрессию оперативно связанной ОРС или другого EMF.
В используемом в данном описании смысле говорят, что последовательность «модулирует экспрессию оперативно связанной последовательности» когда экспрессия последовательности изменяется при наличии EMF. EMF включают, но не ограничены указанным, промоторы и последовательности, модулирующие промоторы (индуцируемые элементы). Один класс EMF составляют фрагменты нуклеиновых кислот, которые индуцируют экспрессию оперативно связанной ОРС в ответ на специфичный регуляторный фактор или физиологическое событие.
Термин «рекомбинантный экспрессирующий носитель или вектор» относится к плазмиде, или фагу, или вирусу, или вектору для экспрессии полипептида с последовательности ДНК (РНК).
Экспрессирующий носитель может содержать единицу транскрипции, содержащую собранную конструкцию из (1) генетического элемента или элементов, играющих регуляторную роль в экспрессии гена, например промоторов или энхансеров, (2) структурной или кодирующей последовательности, которая транскрибируется в мРНК и транслируется в белок, и (3) подходящие последовательности для инициации и терминации транскрипции. Структурные единицы, предназначенные для применения в дрожжевых или эукариотических системах экспрессии, предпочтительно содержат лидерную последовательность, обеспечивающую секрецию из клетки транслированного белка клеткой-хозяином. Альтернативно, в том случае, когда рекомбинантный белок экспрессируется без лидерной или транспортной последовательности, он может содержать амино-концевой остаток метионина. Указанный остаток затем может быть отщеплен или может не отщепляться от экспрессированного рекомбинантного белка, образуя конечный продукт.
Термин «рекомбинантная экспрессирующая система» означает клетки-хозяева, которые имеют рекомбинантную транскрипционную единицу, стабильно интегрированную в хромосомную ДНК, или несут рекомбинантную транскрипционную единицу внехромосомно. Рекомбинантные экспрессирующие системы, которые определены в данном описании, будут экспрессировать гетерологичные полипептиды или белки при индукции регуляторных элементов, связанных с экспрессируемым участком ДНК или синтетическим геном. Указанный термин также означает клетки-хозяева, которые имеют стабильно интегрированный рекомбинантный генетический элемент или элементы, играющие регуляторную роль в экспрессии гена, например, промоторы или энхансеры. Рекомбинантные экспрессирующие системы, которые определены в данном описании, будут экспрессировать полипептиды или белки, эндогенные для клетки, при индукции регуляторных элементов, связанные с экспрессируемым эндогенным участком ДНК или геном. Клетки могут быть прокариотическими или эукариотическими.
Термин «трансген» относится к последовательности нуклеиновой кислоты, которая является частично или полностью гетерологичной, т.е. чужеродной, для трансгенного животного или клетки, в которую она внедрена, или является гомологичной эндогенному гену трансгенного животного или клетки, в которую она внедрена, но которая предназначена для встраивания или встроена в геном животного таким образом, чтобы изменить геном клетки, в которую она встроена, например, ее встраивают в положение, которое отличается от положения природного гена. Трансген может быть оперативно связан с одной или несколькими транскрипционными регуляторными последовательностями и любыми другими нуклеиновыми кислотами, такими как интроны, которые могут быть необходимы для оптимальной экспрессии выбранной нуклеиновой кислоты.
Соответственно, «трансгенная конструкция» относится к нуклеиновой кислоте, которая содержит трансген и необязательно такие другие последовательности нуклеиновой кислоты, как транскрипционные регуляторные последовательности, сайты полиаденилирования, начала репликации, маркерные гены и т.д., которые могут быть применимы при общей обработке трансгена для встраивания в геном организма хозяина.
Термин «трансгенный» используют в данном описании как прилагательное для описания свойства, например, животного или конструкции нести трансген. Например, в используемом в данном описании смысле «трансгенный организм» представляет собой любое животное, предпочтительно млекопитающее, отличное от человека, в котором одна или несколько клеток животного содержат гетерологичные нуклеиновые кислоты, введенные при вмешательстве человека, например, трансгенными способами, известными в данной области. Нуклеиновую кислоту вводят в клетку непосредственно или опосредованно в результате введения в предшественника клетки, посредством преднамеренной генетической манипуляции, такой как микроинъекция или инфекция рекомбинантным вирусом. Нуклеиновая кислота может быть интегрирована в хромосому, или она может представлять собой внехромосомно реплицирующуюся ДНК. В трансгенных животных, описанных в данной публикации, трансген заставляет клетку экспрессировать или сверхэкспрессировать белки GIPF.
Термин «полипотентная» относится к способности клетки дифференцироваться в ряд дифференцированных типов клеток, которые присутствуют во взрослом организме. Полипотентная клетка ограничена по своей способности к дифференцировке по сравнению с тотипотентной клеткой.
Термин «эмбриональные стволовые клетки (ES)» относится к клетке, которая может давать начало многим дифференцированным типам клеток в эмбрионе или взрослом организме, включая зародышевые клетки. Термин «стволовые клетки зародышевой линии (GSC)» относится к стволовым клеткам, полученным из примордиальных стволовых клеток, которые обеспечивают постоянный и непрерывный источник зародышевых клеток для образования гамет. Термин «примордиальные зародышевые клетки (PGC)» относится к небольшой популяции клеток, которые во время эмбриогенеза отделяются от других клеточных линий, в частности от желточного мешка, мезентерия или гонадных валиков, которые имеют возможность дифференцироваться в зародышевые клетки и другие клетки. PGC являются источником, из которого происходят клетки GSC и ES. Клетки PGC, GSC и ES способны к самовосстановлению. Таким образом, указанные клетки не только пополняют зародышевую линию и дают начало множеству окончательно дифференцированных клеток, которые составляют специализированные органы взрослого организма, но и способны восстанавливать самих себя. Термин «тотипотентная» относится к способности клетки дифференцироваться во все типы клеток взрослого организма. Термин «полипотентный» относится к способности клетки дифференцироваться в ряд дифференцированных типов клеток, которые присутствуют во взрослом организме. Полипотентная клетка ограничена по своей способности к дифференцировке по сравнению с тотипотентной клеткой.
Термины «линия-основатель» и «животное-основатель» относятся к таким животным, которые являются зрелым продуктом развития эмбрионов, в которые добавляли трансген, т.е. к таким животным, которые выращены из эмбрионов, в которые встраивали ДНК и которые были имплантированы в одного или несколько суррогатных хозяев.
Термины «потомство» и «потомство трансгенного животного» относятся к любому и всем потомкам каждого последующего поколения от исходных трансформированных млекопитающих.
Термин «млекопитающее, отличное от человека» относится ко всем представителям класса млекопитающих, за исключением человека. «Млекопитающее» относится к любому животному, классифицированному как млекопитающее, включая человека, домашних и сельскохозяйственных животных, и животных в зоопарках, используемых в спорте или комнатных животных, таких как мышь, крыса, кролик, свинья, овца, коза, крупный рогатый скот и высшие приматы.
Термины «лечить» или «лечение» относятся как к терапевтическим, так и профилактическим мерам, целью которых является предотвращение или уменьшение нежелательного физиологического изменения или состояния, такого как индуцированный химиотерапией или лучевой терапией мукозит. В целях данного изобретения благотворные или желаемые клинические результаты включают без ограничения ослабление симптомов, снижение степени заболевания, стабилизированное состояние при заболевании, либо регистрируемое, либо нерегистрируемой.
«Расстройство» является любым состоянием, при котором может быть полезным лечение молекулой, идентифицированной с использованием модели на трансгенном животном согласно изобретению. Расстройство включает хронические и острые расстройства или заболевания, включая патологические состояния предрасположенности млекопитающего к данному расстройству. Неограничивающие примеры расстройств, подвергаемых лечению согласно настоящему изобретению, включают мукозит, воспалительное заболевание кишечника и повреждения кожи. Предпочтительным расстройством, подвергаемым лечению согласно настоящему изобретению, является мукозит.
«Воспалительное заболевание кишечника (IBD)» в данном описании относится к идиопатическому или хроническому воспалительному заболеванию либо тонкого кишечника, либо толстой кишки, либо и того, и другого и включает болезнь Крона, язвенный колит, IBD, вызванное инфекционными агентами, и связанное с антибиотиками IBD.
«Мукозит» в данном описании относится к воспалению слизистых оболочек пищеварительного тракта, включая ротовую часть глотки и губы, пищевод и толстый и тонкий кишечник.
«Синдром короткой кишки» или «SBS» в данном описании относится к состоянию нарушению всасывания питательных веществ в результате анатомической или функциональной утраты значительной части длины тонкого кишечника.
Термины «эффективное количество» или «фармацевтически эффективное количество» относятся к нетоксичному, но достаточному количеству средства для обеспечения требуемого биологического результата. Таким результатом может быть уменьшение и/или ослабление признаков, симптомов или причин заболевания или любое другое требуемое изменение биологической системы. Например, эффективным количеством фрагмента GIPF для применения в способах согласно данному изобретению является количество, достаточное для того, чтобы способствовать стимуляции или пролиферации эпителиальных клеток, и предпочтительно количество, достаточное для того, чтобы вызвать усиленную регенерацию эпителия желудочно-кишечного тракта у субъекта, страдающего от индуцированного химиотерапией или лучевой терапией мукозита, воспалительного заболевания кишечника или других расстройств, при которых требуется пролиферация эпителиальных клеток. Такие количества описаны ниже. Подходящее «эффективное» количество в любом отдельном случае может быть определено специалистом в данной области с использованием обычного экспериментирования.
Под «фармацевтически приемлемым» или «фармакологически приемлемым» подразумевается вещество, которое не является биологически или по другим причинам нежелательным, т.е. вещество может быть введено индивидууму, не вызывая при этом каких-либо нежелательных биологических эффектов или не взаимодействуя опасным образом с какими-либо компонентами композиции, в состав которой оно входит.
Под «физиологическим pH» или «pH в физиологических пределах» подразумевается pH в диапазоне примерно от 7,0 до 8,0 включительно. Предпочтительное физиологическое значение pH находится в диапазоне примерно от 7,2 до 7,6 включительно.
В используемом в данном описании смысле термин «субъект» охватывает млекопитающих и животных, отличных от млекопитающих. Примеры млекопитающих включают, но не ограничены указанным, любого представителя класса млекопитающих: человека, приматов, отличных от человека, таких как шимпанзе, и другие виды человекообразных обезьян и обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы, свиньи; домашних животных, таких как кролики, собаки и кошки; лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки, и тому подобных. Примеры животных, отличных от млекопитающих, включают без ограничения птиц, рыб и тому подобное. Термин не означает конкретный возраст или пол.
4.2 КОМПОЗИЦИИ СОГЛАСНО ИЗОБРЕТЕНИЮ
4.2.1. КОМПОЗИЦИИ НУКЛЕИНОВОЙ КИСЛОТЫ
Изобретение основано на открытии того, что композиции, содержащие полипептид фактора роста эпителиальных клеток, GIPF, и полинуклеотиды, кодирующие полипептид GIPF, стимулируют рост и пролиферацию эпителиальных клеток кишечника, включая клетки крипт. Поэтому рассматривается применение указанных композиций для диагностики и лечения состояний, при которых требуется стимуляция пролиферации или регенерации эпителиальных клеток.
Изолированные полинуклеотиды согласно изобретению включают, но не ограничены указанным, полинуклеотид, содержащий любую из нуклеотидных последовательностей SEQ ID NO: 2, 3, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177 полинуклеотид, содержащий последовательность, кодирующую полноразмерный белок, SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177 (например, кодирующую последовательности SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 или 178); и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую последовательность зрелого и доминантного зрелого белка полипептида SEQ ID NO: 4. Полинуклеотиды согласно настоящему изобретению также включают, но не ограничены указанным, полинуклеотид, который гибридизуется в жестких условиях с (a) комплементом любой из нуклеотидных последовательностей SEQ ID NO: 2, 3, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177; (b) полинуклеотидом, кодирующим любой из полипептидов с последовательностью SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 или 178; (c) полинуклеотидом, который является аллельным вариантом любого из перечисленных выше полинуклеотидов; (d) полинуклеотидом, который кодирует видовой гомолог любого из перечисленных выше белков; или (e) полинуклеотидом, который кодирует полипептид, содержащий специфичный домен или укорочение полипептидов с последовательностями SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 или 178. Представляющие интерес домены включают внеклеточные, трансмембранные или цитоплазматические домены или их комбинации и каталитические и связывающие субстрат домены.
Полинуклеотиды согласно изобретению включают встречающуюся в природе или полностью или частично синтетическую ДНК, например кДНК и геномную ДНК, и РНК, например мРНК. Полинуклеотиды могут включать в себя всю кодирующую область кДНК или могут представлять собой часть кодирующей области кДНК.
Настоящее изобретение также относится к композициям, содержащим гены, соответствующие последовательностям кДНК, описанным в данной публикации. Соответствующие гены могут быть выделены согласно известным способам с использованием информации о последовательностях, приведенной в данном описании. Такие способы включают получение зондов или праймеров на основе приведенной информации о последовательностях для идентификации и/или амплификации генов в подходящих геномных библиотеках или других источниках геномного материала. Дополнительная 5'- и 3'-последовательность может быть получена с использованием способов, известных в данной области. Например, полноразмерную кДНК или геномную ДНК, которая соответствует любому полинуклеотиду с последовательностью SEQ ID NO: 2, можно получить скринингом подходящих библиотек кДНК или геномной ДНК в подходящих условиях гибридизации с использованием любого из полинуклеотидов с последовательностью SEQ ID NO: 2, 3, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177 или его части в качестве зонда. Альтернативно полинуклеотиды SEQ ID NO: 2, 3, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177 можно использовать в качестве основы для подходящего праймера(ов), который обеспечивает идентификацию и/или амплификацию генов в подходящих библиотеках геномной ДНК или кДНК.
Последовательности нуклеиновой кислоты согласно изобретению могут быть собраны из EST и последовательностей (включая последовательности кДНК и геномные последовательности), полученных из одной или нескольких опубликованных баз данных, таких как dbEST, gbpri и UniGene. Последовательности EST могут обеспечивать идентификацию записанной в виде последовательности информации, информации в виде типичного фрагмента или участка или информацию о новом участке для полноразмерного гена.
Полинуклеотиды согласно изобретению также относятся к полинуклеотидам, содержащим нуклеотидные последовательности, которые являются по существу эквивалентными указанным выше полинуклеотидам. Полинуклеотиды согласно изобретению могут иметь, например, по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88% или 89%, более обычно по меньшей мере примерно 90%, 91%, 92%, 93% или 94% и еще более обычно по меньшей мере примерно 95%, 96%, 97%, 98% или 99% идентичность последовательностей с указанным выше полинуклеотидом.
В объем последовательностей нуклеиновых кислот согласно изобретению включены фрагменты последовательности нуклеиновой кислоты, которые гибридизуются в жестких условиях с любой из нуклеотидных последовательностей SEQ ID NO: 1, 6, 8, 10, 12, 14, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177, или комплементарными им последовательностями, при этом фрагмент имеет длину больше, чем примерно 5 нуклеотидов, предпочтительно 7 нуклеотидов, более предпочтительно больше, чем 9 нуклеотидов, и наиболее предпочтительно больше, чем 17 нуклеотидов. Рассматриваются фрагменты из 15, 17 или 20 нуклеотидов или более, которые являются избирательными (т.е. специфично гибридизуются с любым из полинуклеотидов согласно изобретению). Зонды, способные специфично гибридизоваться с полинуклеотидом, могут отличать полинуклеотидные последовательности согласно изобретению от других полинуклеотидных последовательностей того же семейства генов или могут отличать гены человека от генов других видов и предпочтительно основаны на уникальных нуклеотидных последовательностях.
Последовательности, входящие в объем настоящего изобретения, не ограничены указанными конкретными последовательностями и также включают их аллельные и видовые варианты. Аллельные и видовые варианты могут быть обычным образом определены при сравнении последовательности, представленной в SEQ ID NO: 2, 3, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177, ее типичного фрагмента или нуклеотидной последовательности, идентичной по меньшей мере на 90%, предпочтительно идентичной на 95% последовательности SEQ ID NO: 2, 3, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177, с последовательностью из другого изолята того же самого вида. Кроме того, чтобы привести в соответствие с вариабельностью кодонов, изобретение включает молекулы нуклеиновой кислоты, кодирующие такие же аминокислотные последовательности, что и конкретные ОРС, указанные в данном описании. Другими словами, специально рассматривается замена в кодирующей области ОРС одного кодона на другой, который кодирует такую же аминокислоту.
Результат о ближайших соседях для нуклеиновых кислот согласно настоящему изобретению можно получить поиском в базе данных с использованием алгоритма или программы. Предпочтительно используют BLAST, что означает Basic Local Alignment Search Tool, для поиска локальных выравниваний последовательностей (Altshul, S.F. J Mol. Evol. 36 290-300 (1993) и Altschul S.F. et al. J. Mol. Biol. 21:403-410 (1990)).
Видовые гомологи (или ортологи) описанных полинуклеотидов и белков также предлагаются в настоящем изобретении. Видовые гомологи могут быть выделены и идентифицированы посредством получения подходящих зондов или праймеров на основе последовательностей, представленных в данном описании, и скрининга подходящего источника нуклеиновой кислоты требуемого вида.
Изобретение также охватывает аллельные варианты описанных полинуклеотидов или белков; то есть встречающиеся в природе альтернативные формы выделенного полинуклеотида, которые также кодируют белки, которые являются идентичными, гомологичными или родственными белкам, кодируемым полинуклеотидами.
Последовательности нуклеиновой кислоты согласно изобретению, кроме того, относятся к последовательностям, которые кодируют аналоги описанных аминокислот. Указанные аналоги аминокислотных последовательностей могут быть получены способами, известными в данной области, посредством введения подходящего нуклеотидного изменения в нативный полинуклеотид или его вариант. Имеется две переменных в конструировании вариантов аминокислотных последовательностей: положение мутации и природа мутации. Нуклеиновые кислоты, кодирующие аналоги аминокислотных последовательностей, предпочтительно конструируют введением мутации в полинуклеотид так, чтобы он кодировал аминокислотную последовательность, которая не встречается в природе. Указанные изменения нуклеиновой кислоты могут быть осуществлены в местах, которые различаются в нуклеиновых кислотах от разных видов (вариабельные положения), или в высоко консервативной области (константные области). Сайты в таких положениях обычно будут подвергаться модификациям последовательно, например сначала заменой с использованием консервативной альтернативы (например, гидрофобной аминокислоты на другую гидрофобную аминокислоту) и затем с использованием более отдаленной альтернативы (например, гидрофобной аминокислоты на заряженную аминокислоту), и затем могут быть осуществлены делеции или инсерции в сайте-мишени. Делеции аминокислотных последовательностей обычно имеют диапазон примерно от 1 до 30 остатков, предпочтительно примерно от 1 до 10 остатков, и, как правило, являются непрерывными. Инсерции аминокислот включают слияния на амино- и/или карбоксильном конце длиной в диапазоне от одного до ста или более остатков, а также инсерции внутри последовательности одного или множества аминокислотных остатков. Инсерции внутри последовательности, как правило, могут иметь диапазон примерно от 1 до 10 аминокислотных остатков, предпочтительно от 1 до 5 остатков. Примеры концевых инсерций включают гетерологичные сигнальные последовательности, необходимые для секреции или для направления к мишени внутри клетки в разных клетках-хозяевах, и такие последовательности, как последовательности полигистидина, применимые для очистки экспрессированного белка.
В предпочтительном способе полинуклеотиды, кодирующие новые аминокислотные последовательности, изменяют сайт-специфичным мутагенезом. В таком способе используют олигонуклеотидные последовательности, чтобы изменить полинуклеотид так, чтобы он кодировал требуемый аминокислотный вариант, а также достаточное количество расположенных рядом нуклеотидов по обеим сторонам измененной аминокислоты, чтобы образовать стабильный дуплекс с каждой стороны от сайта, подвергаемого изменению. В общем, способы сайт-специфичного мутагенеза хорошо известны специалистам в данной области, и пример данного способа приведен в публикациях, например в Edelman et al., DNA 2:183 (1983). Универсальный и эффективный способ получения сайт-специфичных изменений в полинуклеотидной последовательности опубликован в Zoller and Smith, Nucleic Acids Res. 10:6487-6500 (1982). Также можно использовать ПЦР, чтобы создать варианты аминокислотной последовательности на основе новых нуклеиновых кислот. В том случае, когда в качестве исходного материала используют небольшие количества ДНК-матрицы, праймер(ры), которые незначительно отличаются по последовательности от соответствующей области в ДНК-матрице, могут создавать требуемый аминокислотный вариант. ПЦР-амплификация в результате дает популяцию фрагментов ДНК-продукта, которые отличаются от полинуклеотидной матрицы, кодирующей полипептид в положении, обусловленном праймером. Фрагменты ДНК-продукта заменяют соответствующую область в плазмиде, и это приводит к полинуклеотиду, кодирующему требуемый аминокислотный вариант.
Следующим способом создания аминокислотных вариантов является способ кассетного мутагенеза, описанный в Wells et al., Gene 34: 315 (1985); и другие способы мутагенеза, хорошо известные в данной области, такие, например, как способы, описанные в Sambrook et al., выше, и Current Protocols in Molecular Biology, Ausubel et al. Вследствие свойственной вырожденности генетического кода при практическом осуществлении изобретения можно использовать другие последовательности ДНК, которые кодируют по существу такую же или функционально эквивалентную аминокислотную последовательность, для клонирования и экспрессии указанных новых нуклеиновых кислот. Такие последовательности ДНК включают последовательности, которые способны гибридизоваться с соответствующей новой последовательностью нуклеиновой кислоты в жестких условиях.
Полинуклеотиды, кодирующие предпочтительные укороченные полипептиды согласно изобретению, можно использовать для создания полинуклеотидов, кодирующих химерные или слитый белки, содержащие один или несколько доменов согласно изобретению и гетерологичные последовательности белка.
Полинуклеотиды согласно изобретению дополнительно включают комплемент любого из полинуклеотидов, указанных выше. Полинуклеотид может представлять собой ДНК (геномную, кДНК, амплифицированную или синтетическую) или РНК. Способы и алгоритмы получения таких полинуклеотидов хорошо известны специалистам в данной области и могут включать, например, способы определения условий гибридизации, при которых можно обычным образом выделять полинуклеотиды с требуемой идентичностью последовательностей.
Согласно изобретению полинуклеотидные последовательности, содержащие последовательности, кодирующие доминантный зрелый белок или зрелый белок, кодирующие любую из последовательностей SEQ ID NO: 6 или 8, или их функциональные эквиваленты, можно использовать для создания рекомбинантных молекул ДНК, которые управляют экспрессией данной нуклеиновой кислоты или ее функционального эквивалента в подходящих клетках-хозяевах. Также в изобретение включены вставки кДНК любого их клонов, идентифицированных в данном описании.
Полинуклеотид согласно изобретению может быть связан с любой из множества других нуклеотидных последовательностей хорошо разработанными способами на основе рекомбинантной ДНК (смотри Sambrook J. et al. (1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, NY). Применимые нуклеотидные последовательности для связывания с полинуклеотидами включают ряд векторов, например плазмиды, космиды, производные фага лямбда, фагмиды и тому подобное, которые хорошо известны в данной области. Соответственно, изобретение также относится к вектору, содержащему полинуклеотид согласно изобретению, и к клетке-хозяину, содержащей полинуклеотид. В общем, вектор содержит начало репликации, функциональное по меньшей мере в одном организме, подходящие сайты эндонуклеаз рестрикции и селектируемый маркер для клетки-хозяина. Векторы согласно изобретению включают экспрессирующие векторы, векторы для репликации, векторы для создания зондов и векторы для секвенирования. Клеткой-хозяином согласно изобретению может быть прокариотическая или эукариотическая клетка и может быть одноклеточный организм или часть многоклеточного организма.
Настоящее изобретение, кроме того, относится к рекомбинантным конструкциям, содержащим нуклеиновую кислоту, имеющую любую из нуклеотидных последовательностей SEQ ID NO: 2, 3, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177, или ее фрагмент, или любые другие полинуклеотиды GIPF. В одном варианте рекомбинантные конструкции согласно настоящему изобретению содержат вектор, такой как плазмидный или вирусный вектор, в который встроена нуклеиновая кислота, имеющая любую из нуклеотидных последовательностей SEQ ID NO: 2, 3, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177, или ее фрагмент. В случае вектора, содержащего одну из ОРС согласно настоящему изобретению, вектор может дополнительно содержать регуляторные последовательности, включая, например, промотор, оперативно связанный с ОРС. Большое количество подходящих векторов и промоторов известны специалистам в данной области и коммерчески доступны для создания рекомбинантных конструкций согласно настоящему изобретению. В качестве примера предлагаются следующие векторы. Бактериальные: pBs, phagescript, Psi174, pBluescript SK, pBs KS, pNH8a, pNH16a, pNH18a, pNH46a (Stratagene); pTrc99A, pKK223-3, pKK233-3, pDR540, pRIT5 (Pharmacia). Эукариотические: pWLneo, pSV2cat, pOG44, PXTI, pSG (Stratagene), pSVK3, pBPV, pMSG и pSVL (Pharmacia). В одном варианте нуклеиновая кислота с последовательностью SEQ ID NO: 3 встроена в вектор CκP2KI согласно изобретению, как описано в примерах.
Изолированный полинуклеотид согласно изобретению может быть оперативно связан с последовательностью регуляции экспрессии, такой как экспрессирующие векторы pMT2 или pED, описанные в Kaufman et al., Nucleic Acids Res. 19, 4485-4490 (1991), чтобы получить белок рекомбинантно. Многие подходящие последовательности регуляции экспрессии известны в данной области. Обычные способы экспрессии рекомбинантных белков также известны, и примеры таких способов описаны в R. Kaufman, Methods in Enzymology 185, 537-566 (1990). Как определено в данном описании, «оперативно связанный» означает, что изолированный полинуклеотид согласно изобретению и последовательность регуляции экспрессии являются подходящими для вектора или клетки таким образом, что белок экспрессируется клеткой-хозяином, которая была трансформирована (трансфицирована) связанными полинуклеотидом/последовательностью регуляции экспрессии.
Промоторные области могут быть выбраны из любого требуемого гена с использованием векторов CAT (хлорамфениколацетилтрансфераза) или других векторов с селектируемыми маркерами. Двумя подходящими векторами являются pKK232-8 и pCM7. Конкретно можно назвать бактериальные промоторы lack, lacZ, T3, T7, gpt, PR лямбда и trc. Эукариотические промоторы включают немедленный ранний промотор CMV, промоторы тимидинкиназы HSV, ранний и поздний SV40, LTR из ретровируса и промотор металлотионеина-1 мыши. Выбор подходящего вектора и промотора может быть легко осуществлен специалистом в данной области. В общем, рекомбинантные экспрессирующие векторы будут содержать начала репликации и селектируемые маркеры, обеспечивающие возможность трансформации клетки-хозяина, например ген резистентности к ампициллину E. coli и ген TRP1 S. cerevisiae, и промотор, полученный из высоко экспрессируемого гена, чтобы управлять транскрипцией расположенной ниже структурной последовательности. Такие промоторы могут быть получены из оперонов, кодирующих наряду с прочим гликолитические ферменты, такие как 3-фосфоглицераткиназа (PGK), a-фактор, кислая фосфатаза, или белки теплового шока. Гетерологичную структурную последовательность повергают сборке в подходящей фазе с последовательностями инициации и терминации трансляции и предпочтительно с лидерной последовательностью, способной направлять секрецию транслируемого белка в периплазматическое пространство или внеклеточную среду. Необязательно гетерологичная последовательность может кодировать слитый белок, содержащий амино-концевой пептид для идентификации, придающий требуемые свойства, например пептид для стабилизации или более простой очистки экспрессированного рекомбинантного продукта. Применимые экспрессирующие векторы для применения в бактериях конструируют встраиванием структурной последовательности ДНК, кодирующей требуемый белок, вместе с подходящими сигналами инициации и терминации трансляции в оперативной фазе считывания с функциональным промотором. Вектор будет содержать один или несколько фенотипических селектируемых маркеров и начало репликации, чтобы обеспечить поддержание вектора и при необходимости обеспечить амплификацию в хозяине. Подходящие прокариотические хозяева для трансформации включают E. coli, Bacillus subtilis, Salmonella typhimurium и различные виды родов Pseudomonas, Steptomyces и Staphylococcus, хотя также могут быть использованы виды других родов по выбору.
В качестве типичного, но не ограничивающего примера применимые экспрессирующие векторы для использования в бактериях могут содержать селектируемый маркер и бактериальное начало репликации, полученные из коммерчески доступных плазмид, содержащих генетические элементы хорошо известного клонирующего вектора pBR322 (ATCC 37017). Такие коммерческие векторы включают, например, pKK223-3 (Pharmacia Fine Chemicals, Uppsala, Sweden) и GEM1 (Promega Biotech, Madison, WI, USA). Указанные участки «остова» pBR322 комбинируют с подходящим промотором и структурной последовательностью, которую необходимо экспрессировать. После трансформации подходящего штамма-хозяина и выращивания штамма-хозяина до подходящей плотности клеток выбранный промотор индуцируют или дерепрессируют подходящим способом (например, сдвигом температуры или посредством химической индукции) и клетки культивируют в течение дополнительного периода времени. Клетки обычно собирают центрифугированием, разрушают физическими или химическими способами и полученный в результате грубый экстракт сохраняют для дальнейшей очистки.
Кроме использования экспрессирующих векторов при практическом осуществлении настоящего изобретения, настоящее изобретение дополнительно относится к новым экспрессирующим векторам, содержащим промоторные элементы, оперативно связанные с полинуклеотидными последовательностями, кодирующими представляющий интерес белок. Одним примером такого вектора является pcDNA/вектор, который описан в примере 8.
4.2.2. ХОЗЯЕВА
Настоящее изобретение, кроме того, относится к клеткам-хозяевам, генетически сконструированным с использованием векторов согласно данному изобретению, которые могут представлять собой, например, клонирующий вектор или экспрессирующий вектор, которые содержат полинуклеотиды согласно изобретению. Например, такие клетки-хозяева могут содержать нуклеиновые кислоты согласно изобретению, внедренные в клетку-хозяина с использованием известных способов трансформации, трансфекции или инфекции. Вектор может быть, например, в форме плазмиды, вирусной частицы, фага и т.д. Сконструированные клетки-хозяева можно культивировать в подходящих питательных средах, модифицированных так, чтобы они подходили для активации промоторов, селекции трансформантов или амплификации генов GIPF. Условия культивирования, такие как температура, pH и тому подобное, являются такими же, которые использовали ранее для клетки-хозяина, выбранной для экспрессии, и условия будут очевидны для специалиста в данной области. Настоящее изобретение, кроме того, относится к клеткам-хозяевам, генетически сконструированным для экспрессии полинуклеотидов согласно изобретению, в которых такие полинуклеотиды оперативно связаны с регуляторной последовательностью, гетерологичной по отношению к клетке-хозяину, которая управляет экспрессией полинуклеотидов в клетке.
Клеткой-хозяином может быть клетка-хозяин высшего эукариота, такая как клетка млекопитающего, клетка-хозяин низшего эукариота, такая как дрожжевая клетка, или клеткой-хозяином может быть прокариотическая клетка, такая как бактериальная клетка. Введение рекомбинантной конструкции в клетку-хозяина можно осуществить с помощью трансфекции с использованием фосфата кальция, трансфекции, опосредованной DEAE, декстраном или электропорации (Davis, L. et al., Basic Methods in Molecular Biology (1986)). Клетки-хозяева, содержащие один из полинуклеотидов согласно изобретению, могут быть использованы в обычных способах для получения генного продукта, кодируемого выделенным фрагментом (в случае ОРС), или могут быть использованы для получения гетерологичного белка под контролем EMF.
Можно использовать любую систему хозяин/вектор, чтобы экспрессировать один или несколько полипептидов GIPF. Системы включают, но не ограничены указанным, эукариотических хозяев, таких как клетки HeLa, клетки Cv-1, клетки COS и клетки Sf9, а также прокариотического хозяина, такого как E. coli и B. subtilis. Наиболее предпочтительными клетками являются клетки, которые в норме не экспрессируют конкретный полипептид или белок или которые экспрессируют полипептид или белок на низком уровне в природе. Зрелые белки могут быть экспрессированы в клетках млекопитающих, дрожжах, бактериях или других клетках под контролем подходящих промоторов. Также можно применять бесклеточные системы трансляции для получения таких белков с использованием РНК, полученных с применением конструкций ДНК согласно настоящему изобретению. Подходящие клонирующие и экспрессирующие векторы для применения в прокариотических и эукариотических хозяевах описаны в Sambrook, et al., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor, New York (1989), описание которой включенное в данную публикацию в виде ссылки.
Различную систему культур клеток млекопитающих можно использовать для экспрессии рекомбинантного белка. Примеры систем экспрессии млекопитающих включают линии COS-7 фибробластов почки обезьяны, описанные в Gluzman, Cell 23:175 (1981), и другие линии клеток, способных экспрессировать совместимый вектор, например линии клеток C127, 3T3, CHO, HeLa и BHK. Экспрессирующие векторы млекопитающих будут содержать начало репликации, подходящий промотор, а также любые необходимые сайты связывания рибосомы, сайт полиаденилирования, донорные и акцепторные сайты сплайсинга, последовательности терминации транскрипции и 5'-фланкирующие нетранскрибируемые последовательности. Последовательности ДНК, полученные из генома вируса SV40, например начало SV40, ранний промотор, энхансер, сайты сплайсинга и полиаденилирования, могут быть использован для обеспечения требуемыми нетранскрибируемыми генетическими элементами. Рекомбинантные полипептиды и белки, полученные в бактериальной культуре, обычно выделяют начальной экстракцией из осадков клеток с последующими одной или несколькими стадиями обессоливания, водной ионообменной или эксклюзионной хроматографии. При необходимости можно использовать стадии рефолдинга белка в завершающую конфигурацию зрелого белка. Наконец можно использовать высокоэффективную жидкостную хроматографию (ВЭЖХ) для конечных стадий очистки. Клетки микроорганизмов, используемые для экспрессии белков, можно разрушать любым удобным способом, включая циклы замораживания-оттаивания, обработку ультразвуком, механическое разрушение или применение средств для лизиса клеток.
Ряд типов клеток могут выступать в качестве подходящих клеток-хозяев для экспрессии белка. Клетки-хозяева млекопитающих включают, например, клетки обезьян COS, эпидермальные клетки человека A431, клетки Colo205 человека, клетки 3T3, клетки CV-1, другие трансформированные линии клеток приматов, нормальные диплоидные клетки, клеточные линии, полученные из культур in vitro первичной ткани, первичных эксплантатов, клетки HeLa, L-клетки мышей, BHK, HL-60, U937, клетки HaK или Jurkat. Предпочтительно белки GIPF эксрессируются в клетках яичника китайского хомячка (CHO) и клетках эмбриональной почки человека 293.
Альтернативно возможно получение белка у низших эукариот, таких как дрожжи, или в прокариотах, таких как бактерии. Потенциально подходящие штаммы дрожжей включают Saccharomyces cerevisiae, Schizosaccharomyces pombe, штаммы Kluyveromyces, Candida, Pichia pastoris или любой штамм дрожжей, способный экспрессировать гетерологичные белки. Потенциально подходящие бактериальные штаммы включают Escherichia coli, Bacillus subtilis, Salmonella typhimurium или любой бактериальный штамм, способный экспрессировать гетерологичные белки. Если белок получают в дрожжах или бактериях, то может быть необходимо модифицировать полученный в них белок, например, фосфорилированием или гликозилированием соответствующих сайтов, чтобы получить функциональный белок. Такие ковалентные связывания можно осуществить с использованием известных химических или ферментативных способов.
4.2.3. ХИМЕРНЫЕ И СЛИТЫЕ БЕЛКИ
Изобретение также относится к химерным и слитым белкам GIPF. В используемом в данном описании смысле «химерный белок» или «слитый белок» GIPF содержит полипептид GIPF, оперативно связанный с полипептидом, отличным от GIPF. «Полипептид GIPF» относится к полипептиду, имеющему аминокислотную последовательность, соответствующую белку GIPF, тогда как «полипептид, отличный от GIPF» относится к полипептиду, имеющему аминокислотную последовательность, соответствующую белку, который по существу не гомологичен белку GIPF, например белку, который отличается от белка GIPF и который получен из того же самого или другого организма. В слитом белке GIPF полипептид GIPF может соответствовать полному белку GIPF или его части. В одном варианте слитый белок GIPF содержит по меньшей мере одну биологически активную часть белка GIPF. В другом варианте слитый белок GIPF содержит по меньшей мере две биологически активных части белка GIPF. В еще одном варианте слитый белок GIPF содержит по меньшей мере три биологически активных части белка GIPF. По отношению к слитому белку подразумевается, что термин «оперативно связанный» указывает, что полипептид GIPF и полипептид, отличный от GIPF, слиты в рамке друг с другом. Полипептид, отличный от GIPF, может быть слит с N-концом или C-концом полипептида GIPF.
В одном варианте слитым белком является слитый белок GST-GIPF, в котором последовательности GIPF слиты с C-концом последовательностей GST (глутатион-S-трансферазы). Такие слитые белки могут облегчать очистку рекомбинантных полипептидов GIPF. В другом варианте слитым белком является белок GIPF, содержащий гетерологичную сигнальную последовательность на своем N-конце. В некоторых клетках-хозяевах (например, клетках-хозяевах млекопитающих), экспрессия и/или секреция GIPF может быть увеличена благодаря использованию гетерологичной сигнальной последовательности. Предпочтительно полипептид GIPF сливают с V5-His-меткой для простого выявления с помощью анти-V5-антитела и для быстрой очистки, как описано в примерах.
Химерный или слитый белок GIPF согласно изобретению может быть получен стандартными способами на основе рекомбинантной ДНК. Например, фрагменты ДНК, кодирующие разные полипептидные последовательности, лигируют вместе в рамке обычным способом, например, используя затупленные или ступенчатые концы для лигирования, расщепление ферментами рестрикции для получения подходящих концов, заполнение липких концов в соответствующих случаях, обработку щелочной фосфатазой, чтобы избежать нежелательного связывания, и ферментативное лигирование. В другом варианте можно синтезировать слитый ген обычными способами, включая применение автоматизированных синтезаторов ДНК. Альтернативно можно осуществлять ПЦР-амплификацию фрагментов гена с использованием якорных праймеров, которые дают начало комплементарным перекрываниям между двумя следующими друг за другом фрагментами гена, которые затем можно подвергнуть отжигу и повторно амплификации для создания химерной генной последовательности (смотри, например, Ausubel, et al. (eds.) CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, 1992). Кроме того, коммерчески доступны многие экспрессирующие векторы, которые уже кодируют фрагмент для слияния (например, полипептид GST). Кодирующая GIPF нуклеиновая кислота может быть клонирована в таком экспрессирующем векторе для того, чтобы связать фрагмент для слияния в рамке с белком GIPF.
4.2.4. КОМПОЗИЦИИ ПОЛИПЕПТИДОВ
Фармацевтические композиции согласно изобретению содержат изолированные полипептиды GIPF, которые включают, но не ограничены указанным, полипептид, содержащий аминокислотную последовательность, указанную в любой из последовательностей SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 или 178, или аминокислотную последовательность, кодируемую любой из нуклеотидных последовательностей SEQ ID NO: 2, 3, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177. Полипептиды согласно изобретению также включают полипептиды предпочтительно с биологической или иммунологической активностью, которые кодируются: (a) полинуклеотидом, имеющим любую из нуклеотидных последовательностей, указанных в SEQ ID NO: 2, 3, 5, 7, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102 или 104, или (b) полинуклеотидами, кодирующими любую из аминокислотных последовательностей, указанных в виде SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 или 178, или (c) полинуклеотидами, которые гибридизуются с комплементом полинуклеотидов либо (a), либо (b) в жестких условиях гибридизации. Изобретение также относится к биологически активным или иммунологически активным вариантам любой из аминокислотных последовательностей, указанных в виде SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 или 178; и к «по существу эквивалентным» им (например, имеющим по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88% или 89%, более обычно по меньшей мере примерно 90%, 91%, 92%, 93% или 94% и еще более обычно по меньшей мере примерно 95%, 96%, 97%, 98% или 99%, наиболее обычно по меньшей мере примерно 99% идентичность на уровне аминокислот), которые сохраняют биологическую активность. Полипептиды, кодируемые аллельными вариантами, могут иметь сходную, повышенную или пониженную активность по сравнению с полипептидами, содержащими последовательность SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 или 178.
Фрагменты белков согласно настоящему изобретению, которые способны проявлять биологическую активность, также входят в объем настоящего изобретения. Фрагменты белка могут быть в линейной форме, или они могут быть циклизованы с использованием известных способов, например, как описано в H. U. Saragovi, et al., Bio/Technology 10,773-778 (1992) и в R. S. McDowell, et al., J. Amer. Chem. Soc. 114, 9245-9253(1992), обе публикации включены в данное описание в виде ссылки. Такие фрагменты могут быть слиты с молекулами-носителями, такими как иммуноглобулины, для многих целей, включая повышение валентности связывающих сайтов белка.
Настоящее изобретение также относится как к полноразмерным, так и доминантным зрелым формам (например, без сигнальной последовательности или последовательности предшественника) или зрелым формам (например, в которых отсутствует сигнальная последовательность и сайт расщепления фурином) описанных белов. Кодирующую белок последовательность идентифицируют в списке последовательностей посредством трансляции описанных нуклеотидных последовательностей. Зрелая форма такого белка может быть получена в результате экспрессии полноразмерного полинуклеотида в подходящей клетке млекопитающего или другой клетке-хозяине. Последовательность зрелой формы белка также можно определить на основе аминокислотной последовательности полноразмерной формы.
Композиции белка согласно настоящему изобретению могут дополнительно содержать подходящий носитель, такой как гидрофильный, например, фармацевтически приемлемый, носитель.
Настоящее изобретение, кроме того, относится к изолированным полипептидам, кодируемым фрагментами нуклеиновой кислоты согласно настоящему изобретению или вырожденными вариантами фрагментов нуклеиновой кислоты согласно настоящему изобретению. Под «вырожденным вариантом» подразумеваются нуклеотидные фрагменты, которые отличаются от фрагмента нуклеиновой кислоты согласно настоящему изобретению (например, ОРС) по нуклеотидной последовательности, но вследствие вырожденности генетического кода кодируют идентичную полипептидную последовательность. Предпочтительными фрагментами нуклеиновой кислоты согласно настоящему изобретению являются ОРС, которые кодируют белки.
Множество методик, известных в данной области, можно использовать для получения любого из изолированных полипептидов или белков согласно настоящему изобретению. На самом простом уровне аминокислотная последовательность может быть синтезирована с использованием коммерчески доступных синтезаторов пептидов. Синтетически сконструированные последовательности белков в силу общих первичных, вторичных или третичных структурных и/или конформационных свойств с белками могут обладать общими с ними биологическими свойствами, включая активность белка. Такой способ особенно применим для получения небольших пептидов и фрагментов более крупных полипептидов. Фрагменты применимы, например, для создания антител против нативного полипептида. Таким образом, их можно использовать в качестве биологически активных или иммунологических заменителей природных, очищенных белков при скрининге терапевтических соединений и в иммунологических способах разработки антител.
Полипептиды и белки согласно настоящему изобретению альтернативно можно очищать из клеток, которые были изменены так, чтобы они экспрессировали полипептид или белок. В используемом в данном описании смысле говорят, что клетка изменена так, чтобы она экспрессировала требуемый полипептид или белок, когда посредством генетической обработки получают клетку для продуцирования полипептида или белка, который в норме клетка не продуцирует или который в норме клетка продуцирует на низком уровне. Специалист в данной области может легко адаптировать способы введения и экспрессии любых рекомбинантных или синтетических последовательностей в эукариотических или прокариотических клетках, чтобы создать клетку, которая продуцирует один из полипептидов или белков согласно настоящему изобретению.
Изобретение также относится к способам получения полипептида, включающим в себя выращивание культуры клеток-хозяев согласно изобретению в подходящей культуральной среде и очистку белка из клеток или культуры, в которой клетки выращивали. Например, способы согласно изобретению включают способ получения полипептида, при котором клетку-хозяина, содержащую подходящий экспрессирующий вектор, который содержит полинуклеотид согласно изобретению, культивируют в условиях, которые обеспечивают возможность экспрессии кодируемого полипептида. Полипептид может быть извлечен из культуры, обычно из культуральной среды или из лизата, приготовленного из клеток-хозяев, и далее очищен. Предпочтительные варианты включают варианты, в которых белок, полученный таким способом, является полноразмерной или зрелой формой белка.
В альтернативном способе полипептид или белок очищают из бактериальных клеток, которые трансформированы ДНК, кодирующей GIPF, чтобы получить полипептид или белок. Специалист в данной области может без труда следовать известным способам выделения полипептидов и белков, чтобы получить один из изолированных полипептидов или белков согласно настоящему изобретению. Способы включают, но не ограничены указанным, иммунохроматографию, ВЭЖХ, эксклюзионную хроматографию по размеру, ионообменную хроматографию и иммуноаффинную хроматографию. Смотри, например, Scopes, Protein Purification: Principles and Practice, Springer-Verlag (1994); Sambrook, et al., in Molecular Cloning: A Laboratory Manual; Ausubel et al., Current Protocols in Molecular Biology. Фрагменты полипептидов, которые сохраняют биологическую/иммунологическую активность, включают фрагменты, содержащие примерно более 100 аминокислот или примерно более 200 аминокислот, и фрагменты, которые кодируют специфичные домены белка.
Очищенные полипептиды можно использовать в анализах связывания in vitro, которые хорошо известны в данной области, чтобы идентифицировать молекулы, которые связываются с полипептидами. Указанные молекулы включают, но не ограничены указанным, например малые молекулы, молекулы из комбинаторных библиотек, антитела или другие белки. Молекулы, идентифицированные в анализе связывания, затем тестируют в отношении активности антагониста или агониста в культуре ткани in vivo или в животных моделях, которые хорошо известны в данной области. Коротко, молекулы титруют во множество культур клеток или вводят животным и затем тестируют в отношении либо гибели клеток/животных, либо пролонгированной жизнеспособности животных/клеток.
Белок согласно изобретению также может быть экспрессирован в виде продукта трансгенных животных, например в виде компонента молока трансгенных коров, коз, свиней или овец, которые характеризуются соматическими или половыми клетками, содержащими нуклеотидную последовательность, кодирующую белок.
Белки, предлагаемые в данном изобретении, также включают белки, характеризуемые аминокислотными последовательностями, сходными с аминокислотными последовательностями очищенных белков, но в которых имеется модификация, получаемая в природе или преднамеренно сконструированная. Например, модификации в последовательности пептида или ДНК могут быть получены специалистами в данной области с использованием известных способов. Представляющие интерес модификации в последовательностях белка могут включать изменение, замещение, замену, инсерцию или делецию выбранного аминокислотного остатка в кодирующей последовательности. Например, один или несколько остатков цистеина могут быть делетированы или заменены другой аминокислотой, чтобы изменить конформацию молекулы. Способы такого изменения, замещения, замены, инсерции или делеции хорошо известны специалистам в данной области (смотри, например, патент США No. 4518584). Предпочтительно такое изменение, замещение, замена, инсерция или делеция сохраняют требуемую активность белка. Области белка, которые важны для функционирования белка, могут быть определены различными способами, известными в данной области, включая способ сканирования аланином, который заключается в систематической замене одной аминокислоты или цепочек аминокислот аланином с последующим тестированием полученного в результате содержащего аланин варианта в отношении биологической активности. Данный тип анализа определяет важность заменяемой аминокислоты (аминокислот) для биологической активности. Области белка, которые важны для функционирования белка, можно определить с помощью программы eMATRIX.
Другие фрагменты и производные последовательностей белков, которые, как предполагается, могут сохранять активность белка в целом или частично и применимы для скрининга или в других иммунологических способах, также могут быть легко получены специалистами в данной области на основе полученного описания. Такие модификации входят в объем настоящего изобретения.
Белок также может быть получен посредством оперативного связывания изолированного полинуклеотида согласно изобретению с подходящими регуляторными последовательностями в одном или нескольких экспрессирующих векторах насекомых и с использованием систем экспрессии насекомых. Материалы и способы для систем экспрессии бакуловирус/клетка насекомого коммерчески доступны в форме набора, например, из Invitrogen, San Diego, Calif., U. S. A. (набор MaxBat), и такие способы хорошо известны в данной области, например описаны в работе Summers and Smith, Texas Agricultural Experiment Station Bulletin No. 1555 (1987), включенной в данное описание в виде ссылки. В используемом в данном описании смысле клетка насекомого, способная экспрессировать полинуклеотид согласно настоящему изобретению, является «трансформированной».
Белок согласно изобретению может быть получен культивированием трансформированных клеток-хозяев в условиях культивирования, подходящих для экспрессии рекомбинантного белка. Полученный в результате экспрессированный белок затем может быть очищен из такой культуры (т.е. из культуральной среды или экстрактов клеток) с использованием известных способов очистки, таких как гель-фильтрация и ионообменная хроматография. Очистка белка также может включать использование аффинной колонки, содержащей агенты, которые будут связываться с белком; одну или несколько стадий очистки на колонке с аффинными смолами, такими как конканавалин A-агароза, гепарин-toyopearlTM или сефароза 3GA Cibacrom blue; одну или несколько стадий, включающих в себя хроматографию на основе гидрофобного взаимодействия с использованием таких смол, как фениловый эфир, бутиловый эфир или пропиловый эфир; или иммуноаффинную хроматографию.
Альтернативно белок согласно изобретению также может быть экспрессирован в форме, которая будет облегчать очистку. Например, он может быть экспрессирован в виде слитого белка, такого как белки, слитые со связывающим мальтозу белком (MOB), глутатион-S-трансферазой (GST) или тиоредоксином (TRX) или His-меткой. Наборы для экспрессии и очистки таких слитых белков являются коммерчески доступными из New England BioLab (Beverly, Mass.), Pharmacia (Piscataway, N. J.) и Invitrogen соответственно. Белок также можно метить эпитопом и затем очищать, используя специфичное антитело, направленное к такому эпитопу. Один из таких эпитопов («FLAG®») коммерчески доступен из Kodak (New Haven, Conn.).
Наконец можно использовать одну или несколько стадий обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) с использованием гидрофобных сред для ОФ-ВЭЖХ, например силикагеля, имеющего боковые метильные или другие алифатические группы, для дополнительной очистки белка. Некоторые или все указанные выше стадии очистки в различных комбинациях также можно использовать для получения по существу гомогенного изолированного рекомбинантного белка. Очищенный таким образом белок по существу не содержит других белков млекопитающих и согласно настоящему изобретению его определяют как «изолированный белок».
Полипептиды согласно изобретению включают аналоги GIPF. К ним относятся фрагменты полипептида GIPF, а также полипептиды GIPF, в которых одна или несколько аминокислот делетированы, введены в виде инсерции или заменены. Также аналоги полипептида GIPF согласно изобретению охватывают слияния полипептидов GIPF или модификаций полипептидов GIPF, в которых полипептид или аналог GIPF слит с другим компонентом или компонентами, например направляющим к мишени компонентом или другим терапевтическим средством. Такие аналоги могут проявлять улучшенные свойства, такие как активность и/или стабильность. Примеры компонентов, которые могут быть слиты с полипептидом GIPF или аналогом, включают, например, направляющие к мишени компоненты, которые обеспечивают доставку полипептида в тонкий кишечник, например антитела к тонкому кишечнику или антитела к рецептору и лигандам, экспрессируемым на клетках желудочно-кишечного тракта. Другие компоненты, которые могут быть слиты с полипептидом GIPF, включают терапевтические средства, которые используют для лечения желудочно-кишечных расстройств и других состояний, указанных в данном описании, например цитокины или другие лекарственные средства.
4.2.5. ГЕННАЯ ТЕРАПИЯ
Изобретение относится к генной терапии для лечения заболеваний, указанных в данном описании. Доставку функционального гена, кодирующего полипептиды согласно изобретению, в соответствующие клетки осуществляют ex vivo, in situ или in vivo с применением векторов и, более конкретно, вирусных векторов (например, аденовируса, аденоассоциированного вируса или ретровируса) или ex vivo с применением способов физического переноса ДНК (например, липосом или химических обработок). Смотри, например, Anderson, Nature, supplement to vol. 392, no. 6679, pp. 25-20 (1998). Для дополнительного обзора методики генной терапии смотри Friedmann, Science, 244: 1275-1281 (1989); Verma, Scientific American: 68-84 (1990); и Miller, Nature, 357: 455-460 (1992).
Как обсуждалось выше, «вектор» представляет собой любое средство для переноса нуклеиновой кислоты согласно изобретению в клетку-хозяина. Предпочтительными векторами являются вирусные векторы, такие как ретровирусы, вирусы герпеса, аденовирусы и аденоассоциированные вирусы. Таким образом, ген или последовательность нуклеиновой кислоты, кодирующую белок GIPF или его полипептидный доменный фрагмент, вводят in vivo, ex vivo или in vitro с использованием вирусного вектора или посредством прямого внедрения ДНК. Экспрессия в тканях-мишенях может быть осуществлена направлением трансгенного вектора к конкретным клеткам-мишеням, например с использованием вирусного вектора или лиганда рецептора, или с использованием тканеспецифичного промотора, или и того, и другого.
Вирусные векторы, обычно используемые для направления к мишени in vivo или ex vivo и для терапевтических способов, являются основанными на ДНК векторами и ретровирусными векторами. Способы конструирования и применения вирусных векторов известны в данной области [смотри, например, Miller and Rosman, BioTechniques 7: 980-990 (1992)]. Предпочтительно вирусные векторы являются дефектными по репликации, то есть они неспособны автономно реплицироваться в клетке-мишени. В общем, в геноме дефектных по репликации вирусных векторов, которые применяют в объеме настоящего изобретения, отсутствует по меньшей мере одна область, которая необходима для репликации вируса в инфицированной клетке. Указанные области могут быть либо удалены (целиком или частично), либо сделаны нефункциональными любым способом, известным специалисту в данной области. Такие способы включают полное удаление, замену (другими последовательностями, в частности встроенной нуклеиновой кислотой), частичную делецию или добавление одного или нескольких оснований в важную (для репликации) область. Такие способы могут быть осуществлены in vitro (на изолированной ДНК) или in situ с использованием способов генетического манипулирования или обработкой мутагенными средствами. Предпочтительно в дефектном по репликации вирусе сохраняют последовательности его генома, которые необходимы для покрывания вирусных частиц оболочкой.
Векторы на основе ДНК-вирусов включают аттенуированный или дефектный ДНК-вирус, такой как без ограничения вирус простого герпеса (HSV), папилломавирус, вирус Эпштейн-Барр (EBV), аденовирус, аденоассоциированный вирус (AAV) и тому подобное. Дефектные вирусы, в которых полностью или почти полностью отсутствуют вирусные гены, являются предпочтительными. Дефектный вирус является неинфекционным после введения в клетку. Применение дефектных вирусных векторов позволяет вводить в клетки в конкретную ограниченную область, не беспокоясь, что вектор может инфицировать другие клетки. Таким образом, может быть осуществлено целенаправленное воздействие специфично на конкретную ткань. Примеры конкретных векторов включают, но не ограничены указанным, вектор на основе дефектного вируса герпеса 1 (HSV1) [Kaplitt et al., Molec. Cell. Neurosci. 2: 320-330 (1991)], вектор на основе дефектного вируса герпеса, в котором отсутствует ген гликобелка L [публикация патента RD 371005 A], или другие векторы на основе дефектного вируса герпеса [международная публикация патента No. WO 94/21807, опубликованная 29 сентября 1994; международная публикация патента No. WO 92/05263, опубликованная 2 апреля 1994]; аттенуированный аденовирусный вектор, такой как вектор, описанный Stratford-Perricaudet et al. [J. Clin. Invest. 90: 626-630 (1992); смотри также La Salle et al., Science 259: 988-990 (1993)]; и вектор на основе дефектного аденоассоциированного вируса [Samulski et al., J. Virol. 61:3096-3101 (1987); Samulski et al., J. Virol. 63:3822-3828 (1989); Lebkowski et al., Mol. Cell. Biol. 8:3988-3996 (1988)].
Предпочтительно для введения in vivo используют подходящую иммуносупрессирующую обработку вместе с вирусным вектором, например аденовирусным вектором, чтобы избежать иммунной дезактивации вирусного вектора и трансфицированной клетки. Например, иммуносупрессирующие цитокины, такие как интерлейкин-12 (IL-12), интерферон-γ (IFN-γ) или анти-CD4-антитело, могут быть введены для блокирования гуморального или клеточного иммунного ответов на вирусные векторы [смотри, например, Wilson, Nature Medicine (1995)]. Кроме того, полезно использовать вирусный вектор, который сконструирован так, чтобы он экспрессировал минимальное количество антигенов.
В предпочтительном варианте вектор является аденовирусным вектором. Как показано в примерах, продемонстрировано, что аденовирусный вектор сам по себе является особенно эффективным для доставки полипептида GIPF, что выявлено по неожиданно эффективному воздействию стимулирования пролиферации эпителиальных клеток кишечника, приводящего к заметному, диффузному утолщению слизистой оболочки в результате гиперплазии эпителия крипт и заметному увеличению глубины крипт и сложному ветвлению. Аденовирусы являются ДНК-вирусами эукариот, которые можно модифицировать для эффективной доставки нуклеиновой кислоты согласно изобретению в разные типы клеток. Существуют различные серотипы аденовируса. Из указанных серотипов в объеме настоящего изобретение предпочтение отдается применению аденовирусов человека типа 2 или типа 5 (Ad 2 или Ad 5) или аденовирусов животного происхождения (смотри W094/26914). Такие аденовирусы животного происхождения, которые можно использовать в объеме настоящего изобретения, включают аденовирусы собак, коров, мышей (пример: Mav1, Beard et al., Virology 75 (1990) 81), овец, свиней, птиц и обезьян (пример: SAV).
Предпочтительно дефектные по репликации аденовирусные векторы согласно изобретению содержат ITR, последовательность для капсидирования и представляющую интерес нуклеиновую кислоту. Еще более предпочтительно по меньшей мере область E1 аденовирусного вектора является нефункциональной. Другие области также могут быть модифицированы, в частности область E3 (WO95/02697), область E2 (WO94/28938), область E4 (WO94/28152, WO94/12649 и WO95/02697) или любой из поздних генов L1-L5.
В предпочтительном варианте аденовирусный вектор имеет делецию в области E1 и E3. Примеры E1-делетированных аденовирусов описаны в патенте EP 185573, содержание которого включено в данное описание в виде ссылки.
Дефектные по репликации рекомбинантные аденовирусы согласно изобретению могут быть получены любым способом, известным специалисту в данной области (Levrero et al., Gene 101 (1991) 195, EP 185 573; Graham, EMBO J. 3 (1984) 2917). В частности, их можно получить гомологичной рекомбинацией между аденовирусом и плазмидой, которая несет наряду с прочим представляющую интерес последовательность ДНК. Гомологичная рекомбинация осуществляется после котрансфекции указанного аденовируса и плазмиды в подходящую линию клеток. Линия клеток, которую используют, предпочтительно должна (i) быть трансформируемой указанными элементами и (ii) содержать последовательности, которые способны комплементировать часть генома дефектного по репликации аденовируса, предпочтительно в интегрированной форме, чтобы избежать риска рекомбинации. Примерами клеточных линий, которые могут быть использованы, являются линия клеток эмбриональной почки человека 293 (Graham et al., J. Gen. Virol. 36 (1977) 59), которая содержит левую часть генома аденовируса Ad5 (12%), интегрированную в ее геном, и линии клеток, которые способны комплементировать функции E1 и E4, которые описаны в заявках WO94/26914 и WO95/02697. Рекомбинантные аденовирусы извлекают и очищают, используя стандартные способы молекулярной биологии, которые хорошо известны специалисту в данной области.
Промоторы, которые можно использовать в настоящем изобретении, включают как конститутивные промоторы, так и регулируемые (индуцируемые) промоторы. Промотор может быть ответственным за экспрессию нуклеиновой кислоты в природе. Он также может быть из гетерологичного источника. В частности, он может представлять собой промоторные последовательности эукариотических или вирусных генов. Например, он может представлять собой промоторные последовательности, полученные из генома клетки, которую требуется инфицировать. Подобным образом, он может представлять собой промоторные последовательности, полученные из генома вируса, включая используемый аденовирус. В этом отношении можно указать, например, промоторы генов E1 A, MLP, CMV и RSV и тому подобные.
Кроме того, промотор можно модифицировать добавлением активирующих или регуляторных последовательностей или последовательностей, обеспечивающих тканеспецифичную или преобладающую экспрессию (промоторы енолазы и GFAP и тому подобные). Кроме того, когда нуклеиновая кислота не содержит последовательностей промотора, он может быть встроен, например, в вирусный геном ниже такой последовательности.
Некоторые промоторы, применимые при практическом осуществлении данного изобретения, являются повсеместными промоторами (например, HPRT, виментина, актина, тубулина), промоторами промежуточных филаментов (например, десмина, нейофиламентов, кератина, GFAP), промоторами терапевтических генов (например, типа MDR, CFTR, фактора VIII), тканеспецифичными промоторами (например, промотор актина в гладкомышечных клетках), промоторами, которые предпочтительно активируются в делящихся клетках, промоторами, которые отвечают на стимул (например, рецептора стероидного гормона, рецептора ретиноевой кислоты), регулируемыми тетрациклином модуляторами транскрипции, немедленным ранним промотором цитомегаловируса, LTR ретровирусов, промоторами металлотионеина, SV-40, E1a и MLP. Регулируемые тетрациклином модуляторы транскрипции и промоторы CMV описаны в WO 96/01313, патентах США No. 5168062 и 5385839, содержание которых включено в данное описание в виде ссылки.
Таким образом, промоторы, которые могут быть использованы для регуляции экспрессии генов, включают, но не ограничены указанным, промотор цитомегаловируса (CMV), область раннего промотора SV40 (Benoist and Chambon, 1981, Nature 290: 304-310), промотор, находящийся в 3'-длинном концевом повторе вируса саркомы Рауса (Yamamoto, et al., 1980, Cell 22: 787- 797), промотор тимидинкиназы герпеса (Wagner et al., 1981, Proc. Natl. Acad. Sci. USA. 78: 1441-1445), регуляторные последовательности гена металлотионеина (Brinster et al., 1982, Nature 296: 39-42); векторы для прокариотической экспрессии, такие как промотор b-лактамазы (Villa-Kamaroff, et al., 1978, Proc. Natl. Acad. Sci. U. S. A. 75: 3727-3731) или промотор tac (DeBoer, et al., 1983, Proc. Natl. Acad. Sci. U. S. A. 80: 21-25); смотри также "Useful proteins from recombinant bacteria" in Scientific American, 1980, 242:74-94; промоторные элементы из дрожжей или других грибов, такие как промотор Gal 4, промотор ADC (алкогольдегидрогеназы), промотор PGK (фосфоглицеринкиназы), промотор щелочной фосфатазы; и области регуляции транскрипции у животных, которые проявляют тканевую специфичность и были использованы у трансгенных животных: регуляторная область гена эластазы I, которая активна в ацинарных клетках поджелудочной железы (Swift et al., 1984, Cell 38:639-646; Ornitz et al., 1986, Cold Spring Harbor Symp. Quant. Biol. 50:399-409; MacDonald, 1987, Hepatology 7:425-515); регуляторную область гена инсулина, которая активна в бета-клетках поджелудочной железы (Hanahan, 1985, Nature 315: 115-122), регуляторную область гена иммуноглобулина, которая активна в лимфоидных клетках (Grosschedl et al., 1984, Cell 38:647-658; Adames et al., 1985, Nature 318:533-538; Alexander et al., 1987, Mol. Cell. Biol. 7:1436-1444), регуляторную область вируса опухоли молочной железы мышей, которая активна в клетках семенников, молочной железы, лимфоидных и тучных клетках (Leder et al., 1986, Cell 45: 485-495), регуляторную область гена альбумина, которая активна в печени (Pinkert et al., 1987, Genes and Devel. 1: 268-276), регуляторную область гена альфа-фетобелка, которая активна в печени (Krumlaufet al., 1985, Mol. Cell. Biol. 5:1639-1648; Hammer et al., 1987, Science 235:53-58), регуляторную область гена альфа 1-антитрипсина, которая активна в печени (Kelsey et al., 1987, Genes and Devel. 1: 161-171), регуляторную область гена бета-глобина, которая активна в миелоидных клетках (Mogram et al., 1985, Nature 315: 338-340; Kollias et al., 1986, Cell 46: 89-94), регуляторную область гена основного белка миелина, которая активна в олигодендроцитах головного мозга (Readhead et al., 1987, Cell 48: 703-712), регуляторную область гена легкой цепи миозина-2, которая активна в скелетной мышце (Sani, 1985, Nature 314: 283-286), и регуляторную область гена гонадотропного рилизинг-гормона, которая активна в гипоталамусе (Mason et al., 1986, Science 234: 1372-1378).
Введение любого из нуклеотидов согласно настоящему изобретению или гена, кодирующего полипептиды согласно настоящему изобретению, также можно осуществить с использованием внехромосомных субстратов (временная экспрессия) или искусственных хромосом (стабильная экспрессия). Клетки также можно культивировать ex vivo в присутствии белков согласно настоящему изобретению, чтобы вызвать пролиферацию или получить требуемый эффект на активность в таких клетках. Обработанные клетки затем можно ввести in vivo в терапевтических целях. Кроме применения вирусных векторов при практическом осуществлении настоящего изобретения, настоящее изобретение дополнительно относится к новому вектору, содержащему элементы оператора и промотора, оперативно связанные с полинуклеотидными последовательностями, кодирующими представляющий интерес белок. Новым аденовирусным вектором является вектор pAdenoVator-CMV5-Intron, который подробно описан в примерах.
4.2.6. ТРАНСГЕННЫЕ ЖИВОТНЫЕ
Полинуклеотиды согласно настоящему изобретению также дают возможность создания химерных животных, которые специфично экспрессируют полипептиды GIPF в B-клетках. Такие животные применимы в качестве моделей для исследования in vivo активностей полипептида, а также для исследования модуляторов полипептидов согласно изобретению. Предпочтительный вариант осуществления изобретения относится к модели трансгенных нокаутированных (KI), которая была создана для определения биологической функции GIPF быстрым способом. Модель трансгенного KI-животного описана в международной заявке на выдачу патента PCT/JP02/11236, опубликованной в виде WO2003/041495. Трансгенная модель связана с трансгеном GIPF, который кодирует специфичную для B-клеток экспрессию GIPF под контролем промотора легкой цепи каппа иммуноглобулина. Трансген вводят в ES-клетки TT2F, которые содержат интактные локусы тяжелой и легкой цепи иммуноглобулина, и ES-клетки, которые содержат трансген GIPF, имплантируют мышам, у которых отсутствуют оба аллеля тяжелой цепи антитела (IgH-KOΔH-/-) (Kitamura et al., Nature 350: 423-426 (1991), публикация включена в данное описание в виде ссылки в полном объеме). Таким образом, экспрессия легких цепей каппа иммуноглобулина может происходить только в функциональных B-клетках, которые получены из ES-клеток, которые экспрессируют цепи IG (WO 00/10383; EP1106061A1). Подобным образом экспрессия GIPF B-клетками происходит только у химерных мышей GIPF-KI. Таким образом, модель на трансгенном животном согласно изобретению обеспечивает возможность быстрого фенотипического анализа химерных животных, а не гетерозиготных или гомозиготных животных, содержащих трансгены, передаваемые через зародышевую линию. Кроме того, экспрессия трансгена ограничена B-клетками, которые секретируют белок GIPF в систему кровообращения животного, таким образом подвергая все ткани воздействию GIPF и обеспечивая возможность быстрой оценки биологического влияния GIPF или любого другого кодируемого полипептида. Имеется в виду, что трансгенную систему согласно настоящему изобретению можно использовать для экспрессии и оценки биологической функции любого полипептида. Другое преимущество трансгенной модели согласно изобретению связано с временной экспрессией трансгена. Активность промотора легкой цепи каппа начинается примерно на 14 день после беременности, и заметное повышение концентрации иммуноглобулина в циркуляции наблюдается после отнятия от груди, таким образом можно избежать каких-либо потенциально опасных воздействий, которые GIPF может оказывать на ранее развитие мыши. Иллюстративный вариант трансгенного животного согласно изобретению описан в примерах.
4.2.6.1. Общий способ получения трансгенных млекопитающих, отличных от человека
Все трансгенные животные согласно настоящему изобретению содержат во множестве своих клеток трансген согласно настоящему изобретению, и указанный трансген изменяет фенотип «клетки-хозяина» в отношении специфичной экспрессии GIPF B-клетками, которые секретируют полипептиды GIPF в систему кровообращения трансгенного животного. Различные аспекты методики получения трансгенных животных хорошо известны в данной области и подробно описаны в литературе, например в Hogan et al., Manipulating the Mouse Embryo (Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., [1986]). Хотя получение трансгенных животных проиллюстрировано в данном описании со ссылкой на трансгенных мышей, это сделано только в целях иллюстрации и не должно рассматриваться как ограничение объема изобретения. Данное конкретное описание может быть легко адаптировано специалистами в данной области для того, чтобы включить трансгенные последовательности GIPF в любого млекопитающего, отличного от человека, используя способы и материалы, описанные ниже. Животные, подходящие для трансгенных экспериментов, могут быть получены из стандартных коммерческих источников, таких как Taconic (Germantown, N. Y.).
A. Трансгенная конструкция
Конструирование трансгенов можно осуществить с использованием любого подходящего способа генетической инженерии, хорошо известного в данной области, включая без ограничения стандартные способы расщепления эндонуклеазами рестрикции, лигирования, трансформации, очистки плазмид, секвенирования ДНК и т.д., которые описаны в Sambrook et al., Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Laboratory, N.Y., (1989)).
Трансгены согласно настоящему изобретению обычно оперативно связаны с последовательностями регуляции транскрипции, такими как промоторы и/или энхансеры, чтобы регулировать экспрессию трансгена конкретным образом. В некоторых вариантах применимыми последовательностями регуляции транскрипции являются последовательности, которые в высокой степени регулируются в отношении активности, как во времени, так и пространственно. Таким образом, предпочтительными промоторами могут быть промоторы, которые активны только в конкретных тканях или типах клеток. Промоторы/энхансеры, которые можно использовать для регуляции экспрессии трансгена in vivo включают, но не ограничены указанным, промотор/энхансер цитомегаловируса человека (CMV) (Karasuyama et al., J. Exp. Med. 169: 13 [1989]), промотор β-актина человека (Gunning et al., Proc. Natl. Acad. Sci. USA 84: 4831-4835 [1987]), индуцируемый глюкокортикоидами промотор, присутствующий в длинном концевом повторе вируса опухоли молочной железы мышей (LTR MMTV) (Kiessig et al., Mol. Cell Biol. 4: 1354-1362 [1984]), последовательности длинного концевого повтора вируса лейкоза мышей Молони (LTR MuLV) (Weiss et al. [1985] RNA Tumor Viruses, Cold Spring Harbor Laboratory, Cold Spring Harbor, N. Y.), область раннего или позднего промотора SV40 (Benoist et al. Nature 290: 304-310 [1981]; Templeton et al. Mol. Cell Biol., 4: 817 [1984]; и Sprague et al., J. ViroL, 45: 773 [1983]), промотор, находящийся в 3'-длинном концевом повторе вируса саркомы Рауса (RSV) (Yamamoto et al., Cell 22: 787-797 [1980]), промотор/энхансер тимидинкиназы вируса простого герпеса (HSV) (Wagner et al. Proc. Natl. Acad. Sci. USA 82: 3567-71[1981]), промотор металлотионеина (MT) (Palmiter et al., Nature 300: 611-615 [1982]) и промотор LAT вируса простого герпеса (Wolfe et al. Nature Genetics 1: 379-384 [1992]). Предпочтительно промотором является промотор P2 легкой цепи каппа иммуноглобулина (REF).
В дополнение к трансгену и последовательностям регуляции транскрипции векторы, применимые для получения трансгенов согласно данному изобретению, обычно содержат один или несколько других элементов, применимых для оптимизации экспрессии трансгена в животном-хозяине. Таким образом, трансгенная конструкция может содержать элементы терминации транскрипции, например элементы для управления полиаденилированием мРНК-транскрипта, а также интронные последовательности. Например, трансген может быть фланкирован на своем 3'-конце последовательностями SV40 (SV40 intron/pA), которые добавляют сигналы терминации транскрипции и полиаденилирования к транскрипту трансгену. В других вариантах трансген может содержать интронные последовательности. Во многих случаях экспрессия трансгена повышается в присутствии одного или нескольких интронов в кодирующей последовательности.
В следующих вариантах трансгенная конструкция может содержать дополнительные элементы, которые облегчают ее обработку в клетках (например, в бактериальных клетках) перед встраиванием в намеченную реципиентную клетку. Например, вектор может содержать элементы начала репликации для амплификации в прокариотических клетках. Кроме того, трансгенная конструкция может содержать селектируемые маркеры для выделения клеток либо из животного-реципиента, либо клеток, созданных в качестве промежуточных для получения трансгенного животного (например, бактериальных клеток, используемых для амплификации конструкции, или ES-клеток, используемых для введения трансгена). Гены селектируемых маркеров могут кодировать белки, необходимые для выживания и/или роста трансфицированных клеток в условиях селективного культивирования. Типичные гены маркеров для селекции кодируют белки, которые, например: (i) придают резистентность к антибиотикам или другим токсинам, например к ампициллину, тетрациклину или канамицину в случае прокариотических клеток-хозяев, и к неомицину, гигромицину или метотрексату в случае клеток млекопитающих; или (ii) комплементриуют ауксотрофную недостаточность клеток.
B. Клетки, используемые для введения трансгена
В иллюстративном варианте «трансгенных млекопитающих, отличных от человека» согласно изобретению получают введением трансгена GIPF в зародышевую линию млекопитающего, отличного от человека. Эмбриональные клетки-мишени на разных стадиях развития можно использовать для введения трансгена GIPF. Используют различные способы в зависимости от стадии развития эмбриональной клетки-мишени. Конкретную линию(линии) любого животного, используемого в практике данного изобретения, выбирают в отношении хорошего общего состояния здоровья, хороших выходов эмбрионов, хорошей видимости пронуклеуса в эмбрионе и хорошей репродуктивной способности.
В одном варианте трансгенную конструкцию вводят в эмбрион на стадии одной клетки. В общем, самок животных подвергают суперовуляции в результате гормональной обработки, спаривают и извлекают оплодотворенные яйцеклетки. Например, в случае мышей самок шестинедельного возраста индуцируют к суперовуляции инъекцией 5 ед. (0,1 мл в/б) гонадотропина сыворотки жеребой кобылы (PMSG; Sigma) с последующей инъекцией через 48 часов 5 ед. (0,1 мл, в/б) хорионического гонадотропина человека (hCG; Sigma). В данном случае используют линию мышей FVB. Затем самок сразу же спаривают с самцами-производителями в течение ночи. Таких самок затем исследуют в отношении копуляционных пробок. Тех, которые были скрещены, подвергают эвтаназии в результате асфиксией при действии CO2 или смещением шеи, и эмбрионы извлекают из вырезанных яйцеводов и помещают в фосфатно-солевой буфер Дульбекко с 0,5% бычьего сывороточного альбумина (БСА; Sigma). Окружающие клетки яичника удаляют гиалуронидазой (1 мг/мл). Затем эмбрионы с пронуклеусом промывают и помещают в сбалансированный солевой раствор Игла, содержащий 0,5% БСА (EBSS), в инкубатор при 37,5°C с увлажненной атмосферой, содержащей 5% CO2, 95% воздуха вплоть до момента инъекции.
Обычно оплодотворенные эмбрионы инкубируют в подходящих средах вплоть по появления пронуклеуса. Примерно в это время вводят трансген в женский или мужской пронуклеус, как описано ниже. У некоторых видов, таких как мыши, мужской пронуклеус является предпочтительным. Например, экзогенный генетический материал добавляют в ранний мужской пронуклеус как можно быстрее после образования мужского пронуклеуса, то есть когда мужской и женский пронуклеусы хорошо отделены и оба расположены вблизи клеточной мембраны. Альтернативно, экзогенный генетический материал может быть добавлен в ядро сперматозоида после того, как он был индуцирован к деконденсации. Сперматозоид, содержащий экзогенный генетический материал, затем можно добавить к яйцеклетке, или деконденсированный сперматозоид может быть добавлен к яйцеклетке, а трансгенные конструкции добавляют сразу же после этого.
Кроме похожих биологических рассуждений, физические рассуждения также обусловливают количество (например, объем) экзогенного генетического материала, который может быть добавлен в ядро зиготы или к генетическому материалу, которое образует часть ядра зиготы. В общем, объем встраиваемого экзогенного генетического материала не будет превышать примерно 10 пиколитров. Физическое влияние добавления не должно быть столь большим, чтобы физически нарушить жизнеспособность зиготы. Биологический предел количества и разнообразия последовательностей ДНК будет варьировать в зависимости от конкретной зиготы и функций экзогенного генетического материала и будет легко понятен специалисту в данной области, так как генетический материал, включая экзогенный генетический материал, полученной в результате зиготы должен быть биологически способным инициировать и поддерживать дифференцировку и развитие зиготы в функциональный организм.
Количество копий трансгенных конструкций, которые добавляют к зиготе, зависит от общего количества добавляемого экзогенного генетического материала и будет представлять собой количество, которое дает возможность проходить генетической трансформации. Теоретически требуется только одна копия; однако, как правило, используют множество копий, например 1000-20000 копий, трансгенной конструкции, чтобы гарантировать, что одна копия будет функциональной.
C. Способы введения трансгена
Каждая трансгенная конструкция, которую необходимо встроить в клетку, сначала должна быть в линейной форме, так как частота рекомбинации выше в случае линейных молекул ДНК по сравнению с кольцевыми молекулами. Поэтому, если конструкция была встроена в вектор, то осуществляют линеаризацию посредством расщепления ДНК подходящей эндонуклеазой рестрикции, выбранной так, чтобы она разрезала только в пределах последовательности вектора, а не в последовательности трансгена.
Введение трансгена в эмбрион можно осуществить любым способом, известным в данной области, при условии, что он не разрушает клетку, ядерную оболочку или другие существующие клеточные или генетические структуры. Некоторые из широко используемых способов включают микроинъекцию, электропорацию или липофекцию. После введения трансгена эмбрион можно инкубировать in vitro в течение различных периодов времени, или повторно имплантировать в суррогатного хозяина, или осуществить и то и другое. Одним общеизвестным способом является инкубация эмбрионов in vitro в течение примерно 1-7 дней, в зависимости от вида, и затем их повторная имплантация в суррогатного хозяина.
Зигота является наилучшей мишенью для введения трансгенной конструкции способом микроинъекции. У мыши мужской пронуклеус достигает размера примерно 20 микрометров в диаметре, что позволяет осуществлять воспроизводимую инъекцию 1-2 пл раствора ДНК. Применение зигот в качестве мишени для переноса генов имеет большое преимущество в том, что в большинстве случаев инъецированная ДНК будет включаться в ген хозяина перед первым делением дробления (Brinster et al. Proc. Natl. Acad. Sci. USA 82: 4438-4442 (1985)). Как следствие все клетки трансгенного животного будут нести внедренный трансген. Это будет, в общем, также отражаться в виде эффективной передачи трансгена потомству от родоначальника, так как 50% половых клеток будут нести трансген.
Также можно использовать ретровирусную инфекцию, чтобы ввести трансген млекопитающему, отличному от человека. Развивающийся эмбрион, отличный от эмбриона человека, можно культивировать in vitro до стадии бластоцисты. В это время бластомеры могут быть мишенями для ретровирусной инфекции (Jaenich, R. Proc. Natl. Acad. Sci. USA 73: 1260-1264 (1976)). Эффективную инфекцию бластомеров осуществляют посредством ферментативной обработки, чтобы удалить zona pellucida (Manipulating the Mouse Embryo, Hogan eds., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, (1986)). Вирусной векторной системой, используемой для введения трансгена, обычно является дефектный по репликации ретровирус, несущий трансген (Jahner et al. Proc. Natl. Acad. Sci. USA 82: 6927-6931 (1985)). Van der Putten et al. Proc. Natl. Acad. Sci. USA 82: 6148-6152 (1985)). Трансфекцию легко и эффективно осуществляют культивированием бластомеров на монослое продуцирующих вирус клеток (Van der Putten, выше; Stewart et al. EMBO J. 6: 383-388 (1987)). Альтернативно инфекция может быть осуществлена на более поздней стадии. Вирус или продуцирующие вирус клетки также могут быть инъецированы в бластоцель (Jahner et al. Nature 298: 623-628(1982)). Большинство родоначальников будут мозаичными в отношении трансгена, так как внедрение происходит только в подгруппу клеток, которые образуют трансгенное животное. Кроме того, родоначальник может содержать различные ретровирусные инсерции трансгена в разных положениях в геноме, которые, как правило, будут сегрегировать в потомстве. Кроме того, также возможно введение трансгенов в зародышевую линию путем внутриматочной ретровирусной инфекции эмбриона в середине периода беременности (Jahner et al. (1982) выше).
Инсерцию трансгенной конструкции в ES-клетки можно осуществить с использованием множества способов, хорошо известных в данной области, включая, например, электропорацию, микроинъекцию и обработку фосфатом кальция. Предпочтительным способом инсерции является электропорация, при которой ES-клетки и трансгенную конструкцию ДНК подвергают воздействию электрического импульса с использованием устройства для электропорации и следуя руководству производителя по применению. После электропорации ES-клеткам обычно дают возможность восстановиться в подходящих условиях инкубации. Затем проводят скрининг клеток в отношении присутствия трансгена.
D. Имплантация эмбрионов
Подготавливают псевдобеременных, приемных или суррогатных матерей в целях имплантации эмбрионов, которые были модифицированы введением трансгена. Таких приемных матерей обычно получают при скрещивании с подвергнутыми вазэктомии самцами того же вида. Стадия псевдобеременности приемной матери важна для успешной имплантации и зависит от вида. Для мышей указанная стадия представляет собой примерно 2-3 дня псевдобеременности. Реципиентных самок скрещивают в одно и то же время с самками-донорами. Хотя следующее описание относится к мышам, оно может быть адаптировано для любого другого млекопитающего, отличного от человека, специалистами в данной области. Во время переноса эмбриона реципиентных самок анестезируют внутрибрюшинной инъекцией 0,015 мл 2,5% авертина на грамм массы тела. Яйцеводы обнажают одним дорсальным надрезом по средней линии. Затем надрез делают через стенку тела непосредственно над яйцеводом. Затем сумку яичника разрывают часовым пинцетом. Эмбрионы, которые необходимо перенести, помещают в DPBS (фосфатно-солевой буфер Дульбекко) и в кончик пипетки для переноса (примерно 10-12 эмбрионов). Кончик пипетки вводят в воронку и переносят эмбрионы. После переноса разрез закрывают двумя швами. Количество эмбрионов, имплантируемых в конкретного хозяина, будет варьировать в зависимости от вида, но обычно будет сравнимо с количеством потомства, которое обычно производит вид.
В том случае, когда использовали ES-клетку для введения трансгена, трансформированные ES-клетки внедряли в эмбрион, как описано ранее, и эмбрионы имплантировали в матку псевдобеременной приемной матери для прохождения беременности.
E. Скрининг в отношении присутствия или экспрессии трансгена
Трансгенное потомство суррогатного хозяина может быть подвергнуто скринингу в отношении присутствия и/или экспрессии трансгена любым подходящим способом. Потомство, которое рождается от приемной матери, может быть сначала подвергнуто скринингу в отношении мозаичной масти в том случае, если была использована методика селекции по масти (как описано выше). Альтернативно или дополнительно скрининг часто осуществляют с применением Саузерн-блота или ПЦР ДНК, полученной из ткани хвоста, используя зонд, который комплементарен по меньшей мере части трансгена. Вестерн-блот-анализ или иммуногистохимический анализ с использованием антитела против белка, кодируемого трансгеном, можно использовать в качестве альтернативного или дополнительного способа скрининга в отношении наличия продукта трансгена. Альтернативно ткани или клетки, которые предположительно экспрессируют трансген на более высоких уровнях, тестируют в отношении экспрессии РНК трансгена с использованием Нозерн-анализа или ОТ-ПЦР.
Альтернативные или дополнительные способы оценки присутствия трансгена включают без ограничения подходящие биохимические анализы, такие как ферментные и/или иммунологические анализы, гистологическое окрашивание в отношении конкретного маркера или ферментативных активностей, проточно-цитометрический анализ и тому подобное. Анализ крови также может быть применим для выявления присутствия продукта трансгена в крови, а также для оценки влияния трансгена на уровни различных типов кровяных клеток и других компонентов крови.
F. Разведение трансгенных животных
Потомство трансгенных животных может быть получено скрещиванием трансгенного животного с подходящим партнером или посредством оплодотворения in vitro с использованием яйцеклеток и/или сперматозоидов, полученных от трансгенного животного. В том случае, когда необходимо осуществить скрещивание с партнером, партнер может быть трансгенным или нетрансгенным; когда он является трансгенным, он может содержать такой же или другой трансген или тот и другой. Альтернативно партнер может представлять исходную линию. В том случае, когда используют оплодотворение in vitro, оплодотворенный эмбрион может быть имплантирован в суррогатного хозяина, или инкубирован in vitro, или можно осуществлять и то и другое. Используя любой способ можно оценить потомство в отношении присутствия трансгена, используя описанные выше способы или другие подходящие способы. Обычно скрещивание и обратное скрещивание осуществляют спариванием сибсов или исходной линии с потомством, в зависимости от цели каждой конкретной стадии процесса разведения.
Предпочтительный вариант осуществления изобретения относится к мышам, у которых отсутствуют оба аллеля тяжелой цепи антитела (IgH-KOΔH-/-) и которые имеют очень низкие уровни циркулирующих антител (Kitamura et al., Nature 350: 423-426 (1991)). В одном аспекте изобретение относится к трансгенному млекопитающему, отличному от человека, которое продуцирует в своих B-клетках белок GIPF или его фрагмент. Трансгенное млекопитающее имеет стабильно интегрированную в ее геном последовательность нуклеиновой кислоты, кодирующую GIPF или его фрагмент, обладающий биологической активностью нативного белка, оперативно связанную с последовательностями регуляции транскрипции, управляющими ее экспрессией в B-клетках. Последовательности регуляции транскрипции предпочтительно содержат специфичный для B-клеток промотор, такой как промотор цепи каппа иммуноглобулина. Без ограничения трансгенным млекопитающим, отличным от человека, может быть, например, мышь, крыса, кролик, свинья, коза или крупный рогатый скот.
4.2.7. РОСТОВАЯ АКТИВНОСТЬ КЛЕТОК КРИПТ И ТКАНЕЙ
Полипептид GIPF согласно изобретению проявляет активность фактора роста и вовлечен в пролиферацию и дифференцировку клеток кишечных крипт. GIPF также может проявлять активность фактора роста по отношению к другим эпителиальным клеткам желудочно-кишечного тракта. Введение полипептида согласно изобретению к клеткам крипт in vivo или ex vivo может поддерживать и увеличивать популяции клеток в тотипотентном состоянии, которые могут быть применимы для реконструирования поврежденных или пораженных заболеванием тканей, трансплантации, производства биофармацевтических препаратов и разработки биосенсоров. Возможность получать большие количества клеток человека имеет важные рабочие применения для получения белков человека, которые в настоящее время необходимо получать из источников, отличных от человека, или от доноров, имплантации клеток для лечения тканей, для пересадки таких клеток желудочно-кишечного тракта.
Предполагается, что множество различных экзогенных факторов роста и/или цитокинов можно вводить в комбинации с полипептидом согласно изобретению, чтобы достичь требуемого эффекта, включая любые факторы роста, перечисленные в данном описании, другие факторы для поддержания стволовых клеток и, в частности, включая фактор стволовых клеток (SCF), лейкоз-ингибирующий фактор (LIF), лиганд Flt-3 (Flt-3L), любой из интерлейкинов, рекомбинантный растворимый рецептор IL-6, слитый с IL-6, воспалительный белок макрофагов 1-альфа (MIP-1-альфа), G-CSF, GM-CSF, тромбопоэтин (TPO), фактор тромбоцитов 4 (PF-4), полученный из тромбоцитов фактор роста (PDGF), факторы роста нервов, основной фактор роста фибробластов (bFGF), фактор роста кератиноцитов-2 (KGF2) и глюкагон-подобный пептид 2 (GLP-2).
Эпителиальные клетки кишечника, включая клетки крипт, могут быть трансфицированы полинуклеотидом согласно изобретению, чтобы индуцировать аутокринную экспрессию полипептида согласно изобретению. Это позволит создать недифференцированные линии клеток, которые применимы в таком состоянии или которые затем могут быть дифференцированы в требуемые типы зрелых клеток. Указанные стабильные линии клеток также могут служить в качестве источника недифференцированной мРНК для создания библиотек кДНК и матриц для экспериментов с использованием полимеразной цепной реакции. Такие исследования могли бы обеспечить возможность для выделения и идентификации дифференциально экспрессируемых генов в популяциях клеток крипт, которые регулируют пролиферацию и/или поддержание крипт.
Размножение и поддержание популяций эпителиальных стволовых клеток будет полезным при лечении многих патологических состояний. Например, полипептиды согласно настоящему изобретению могут быть использованы для обработки клеток крипт в культуре, чтобы создать эпителиальные клетки желудочно-кишечного тракта, которые могут быть использованы для пополнения или замены клеток, поврежденных заболеванием, аутоиммунной болезнью, случайным повреждением или генетическими расстройствами, воспалением, вызванным ионизирующим излучением, химиотерапией, инфекцией и воспалением.
Также можно воздействовать на экспрессию полипептида согласно изобретению и на его влияние на клетки крипт, чтобы осуществить регулируемую дифференцировку клеток крипт в более дифференцированные типы клеток. Широко используемый способ получения чистых популяций специфичных дифференцированных типов клеток из популяций недифференцированных стволовых клеток заключается в применении специфичного для типа клеток промотора, управляющего селектируемым маркером.
Культуры in vitro эпителиальных клеток кишечника, включая клетки крипт, можно использовать для определения того, проявляет ли полипептид согласно изобретению активность фактора роста. Клетки крипт выделяют из дезагрегированных крипт ободочной кишки человека и слизистой оболочки ободочной кишки мыши, и клоногенную активность GIPF можно оценивать, используя способ, описанный в работе Whitehead et al., Gastroenterology 117: 858-865 (1999), которая включена в данное описание в виде ссылки в полном объеме. Активность фактора роста можно анализировать в присутствии полипептида согласно изобретению отдельно или в комбинации с другими факторами роста или цитокинами.
Композиции согласно настоящему изобретению также могут быть использованы для пролиферации эпителиальных клеток кишечника, включая клетки крипт, и для регенерации ткани ротовой полости и желудочно-кишечного тракта, т.е. для лечения повреждений, испытываемых эпителиальным слоем, которые заключаются в дегенерации, гибели или травме эпителиальных клеток крипт. Более конкретно, композиция может быть использована для лечения заболеваний желудочно-кишечного тракта, которые указаны в данном описании.
Композиции согласно изобретению также могут быть применимы для стимуляции лучшего или более быстрого закрытия незаживающих ран, включая без ограничения пролежневые язвы, язвы, связанные с недостаточностью сосудов, хирургические и травматические раны и тому подобные. Анализы активности в заживлении ран включают без ограничения анализы, описанные в Winter, Epidermal Wound Healing, pp. 71-112 (Maibach, H. I. and Rovee, D. T., eds.), Year Book Medical Publishers, Inc., Chicago, которые модифицированы Eaglstein and Mertz, J. Invest. Dermatol. 71: 382-84 (1978).
4.2.8. ИММУНОМОДУЛИРУЮЩАЯ АКТИВНОСТЬ
Полипептид согласно настоящему изобретению может проявлять активность, связанную с регуляцией компонентов иммунной системы, включая без ограничения продукцию и/или активность цитокинов и/или клеток иммунной системы. Полинуклеотид согласно изобретению может кодировать полипептид, проявляющий такие свойства. Регуляция цитокинов и/или клеток иммунной системы может заключаться в повышении и/или понижении уровней цитокинов или количества конкретных клеток иммунной системы.
Полипептиды согласно изобретению с такой иммуномодулирующей активностью могут быть использованы для лечения различных иммунных расстройств. Указанные расстройства включают, но не ограничены указанным, воспалительное заболевание кишечника (IBD), которое включает язвенный колит и/или болезнь Крона, и мукозит вследствие противоопухолевой терапии, заключающейся в лечении облучением и/или в химиотерапии. Причиной указанных иммунных расстройств может быть, например, идиопатическая (т.е. неизвестная причина), генетическая, инфекционные агенты (например, вирусы, бактерии, грибы) и/или повреждение, индуцированное противоопухолевой терапией (например, лучевой терапией и/или химиотерапией).
Модулирование иммунных ответов и/или компонентов иммунной системы можно осуществить рядом способов. Понижающая регуляция может быть в форме ингибирования или блокирования уже развивающегося иммунного ответа или может заключаться в предотвращении индукции иммунного ответа. Функции активированных T-клеток могут быть ингибированы в результате супрессии T-клеточных ответов, или в результате индукции специфичной толерантности T-клеток, или в результате и того, и другого. Иммуносупрессия T-клеточных ответов, как правило, является активным, неспецифичным в отношении антигена процессом, который требует постоянного воздействия на T-клетки супрессирующего агента. Толерантность, которая заключается в индукции неотвечаемости или анергии T-клеток, отличается от иммуносупрессии тем, что она обычно является антиген-специфичной и продолжается после прекращения экспонирования с вызывающим толерантность агентом. Оперативно толерантность может быть показана по отсутствию T-клеточного ответа при повторном воздействие конкретного антигена в отсутствие вызывающего толерантность агента.
Воспалительное заболевание кишечника почти всегда опосредовано одним из двух путей: чрезмерным ответом T-хелперных клеток 1 (Th1), связанным с высоким уровнями IL-12, IFN-гамма и/или TNF, или чрезмерным ответом T-хелперных клеток 2 (Th2), связанным с высокими уровнями IL-4, IL-5 и/или IL-13 (публикация Bouma et al., включенная в данное описание в виде ссылки в полном объеме). Поэтому механизм, посредством которого полипептиды согласно изобретению могут опосредовать иммуномодулирующую активность при лечении заболевания, может заключаться в понижающей регуляции ряда популяций клеток Th1 и/или Th2. Альтернативно другая активность может заключаться в снижении уровней цитокинов (например, IL-12, IFN-гамма, TNF, IL-4, IL-5 и/или IL-13), которые связаны и/или опосредуют воспалительный ответ.
Активность полипептида согласно настоящему изобретению можно наряду с другими способами измерить следующими способами.
Анализы пролиферации T-клеток или тимоцитов включают без ограничения анализы, описанные в: Current Protocols in Immunology, Ed by J. E. Coligan, A. M. Kruisbeek, D. H. Margulies, E. M. Shevach, W. Strober, Pub. Greene Publishing Associates and Wiley-Interscience. Chapter 3, In Vitro assays for Mouse Lymphocyte Function 3.1-3.19; Chapter 7, Immunologic studies in Humans); Takai et al., J. Immunol. 137:3494-3500, 1986; Bertagnolli et al., J. Immunol. 145:1706-1712, 1990; Bertagnolli et al., Cellular Immunology 133:327-341, 1991; Bertagnolli, et al., I. Immunol. 149:3778-3783, 1992; Bowman et al., I. Immunol. 152:1756-1761, 1994.
Анализы продукции цитокинов и/или пролиферации клеток селезенки, клеток лимфатических узлов или тимоцитов включают без ограничения анализы, описанные в: Polyclonal T cell stimulation, Kruisbeek, A. M. and Shevach, E. M. In Current Protocols in Immunology. J. E. e.a. Coligan eds. Vol 1 pp. 3.12.1-3.12.14, John Wiley and Sons, Toronto. 1994; and Measurement of mouse and human interferon-γ, Schreiber, R. D. In Current Protocols in Immunology. J. E. e.a. Coligan eds. Vol 1 pp. 6.8.1-6.8.8, John Wiley and Sons, Toronto. 1994.
Анализы ответов T-клеточных клонов на антигены (которые наряду с прочим будут идентифицировать белки, которые влияют на взаимодействие APC-T-клеток, а также управляют эффектами T-клеток, посредством измерения пролиферации и продукции цитокинов) включают без ограничения анализы, описанные в: Current Protocols in Immunology, Ed by J. E. Coligan, A. M. Kruisbeek, D. H. Margulies, E. M. Shevach, W Strober, Pub. Greene Publishing Associates and Wiley-Interscience (Chapter 3, In Vitro assays for Mouse Lymphocyte Function; Chapter 6, Cytokines and their cellular receptors; Chapter 7, Immunologic studies in Humans); Weinberger et al., Proc. Natl. Acad. Sci. USA 77:6091-6095, 1980; Weinberger et al., Eur. J. Immun. 11:405-411, 1981; Takai et al., J. Immunol. 137:3494-3500, 1986; Takai et al., J. Immunol. 140:508-512, 1988).
4.2.9. ХЕМОТАКСИЧЕСКАЯ/ХЕМОКИНЕТИЧЕСКАЯ АКТИВНОСТЬ
Полипептид согласно настоящему изобретению может быть вовлечен в хемотаксическую или хемокинетическую активность по отношению к клеткам млекопитающих, включая, например, моноциты, фибробласты, нейтрофилы, T-клетки, тучные клетки, эозинофилы, эпителиальные и/или эндотелиальные клетки. Полинуклеотид согласно изобретению может кодировать полипептид, проявляющий такие свойства. Хемотаксическую и хемокинетическую активацию рецепторов можно использовать для мобилизации или привлечения требуемой популяции клеток к требуемому месту действия. Хемотаксические или хемокинетические композиции (например, белков, антител, связывающих партнеров или модуляторов согласно изобретению) дают особые преимущества при лечении ран и другой травмы тканей, а также при лечении локализованных инфекций. Например, привлечение лимфоцитов, моноцитов или нейтрофилов к опухолям или местам инфекции может приводить к улучшенным иммунным ответам против опухоли или инфицирующего агента.
Белок или пептид обладает хемотаксической активностью по отношению к конкретной популяции клеток, если он стимулирует, прямо или опосредованно, направленную ориентацию или движение такой клеточной популяции. Предпочтительно белок или пептид обладает способностью непосредственно стимулировать направленное движение клеток. Обладает ли конкретный белок хемотаксической активностью в отношении популяции клеток, можно легко определить, используя такой белок или пептид в любом известном анализе хемотаксиса клеток.
Анализы хемотаксической активности (которые будут идентифицировать белки, которые индуцируют или предотвращают хемотаксис) заключаются в анализах, в которых измеряют способность белка индуцировать миграцию клеток через мембрану, а также способность белка индуцировать адгезию одной популяции клеток на другой популяции клеток. Подходящие анализы движения и адгезии включают без ограничения анализы, описанные в: Current Protocols in Immunology, Ed by J. E. Coligan, A. M. Kruisbeek, D. H. Marguiles, E. M. Shevach, W. Strober, Pub. Greene Publishing Associates and Wiley-Interscience. Chapter 6.12, Measurement of alpha and beta Chemokines 6.12.1-6.12.28; Taub et al. J. Clin. Invest. 95:1370-1376, 1995; Lind et al. APMIS 103:140-146, 1995; Muller et al Eur. J. Immunol. 25:1744-1748; Gruber et al. J. of Immunol. 152:5860-5867, 1994; Johnston et al. J. of Immunol. 153:1762-1768, 1994.
4.2.10. СКРИНИНГ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Трансгенные млекопитающие, отличные от человека, и их потомство согласно настоящему изобретению обеспечивают несколько важных применений, которые будут легко понятны специалисту в данной области. Трансгенные животные особенно применимы для скрининга соединений, которые модулируют (т.е. повышают или понижают) активность полипептидов GIPF. Скрининг применимого соединения заключается во введении выбранного для исследования соединения в определенном диапазоне доз трансгенному животному и в анализе в разных временных точках влияния соединения на активность белка GIPF. Соединение можно вводить до появления или при появлении вздутия живота. Введение может быть пероральным или с помощью подходящей инъекции, в зависимости от химической природы оцениваемого соединения. Клеточный ответ на соединение оценивают с течением времени, используя подходящие биохимические и/или гистологические анализы.
Источники тестируемых соединений, которые могут быть подвергнуты скринингу в отношении способности связываться или модулировать (т.е. повышать или понижать) активность полипептидов согласно изобретению, включают (1) неорганические и органические химические библиотеки, (2) библиотеки природных продуктов, и (3) комбинаторные библиотеки, состоящие из любых молекул случайных пептидов или миметиков пептидов, олигонуклеотидов или органических молекул.
Химические библиотеки можно легко синтезировать или приобрести из ряда коммерческих источников, и они могут включать в себя структурные аналоги известных соединений или соединений, которые идентифицируют как «лучшие» или «лидирующие» посредством скрининга природных продуктов.
Источниками библиотек природных продуктов являются микроорганизмы (включая бактерии и грибы), животные, растения или другие растительные или морские организмы, и библиотеки смесей для скрининга могут быть созданы: (1) ферментацией и экстракцией бульонов от почвенных, растительных или морских микроорганизмов (2) экстракцией самих организмов. Библиотеки природных продуктов включают поликетиды, нерибосомные пептиды и их варианты (не встречающиеся в природе). Для обзора смотри Science 282: 63-68 (1998).
Комбинаторные библиотеки состоят из большого количества пептидов, олигонуклеотидов или органических соединений и могут быть легко получены традиционными способами автоматизированного синтеза, ПЦР, клонирования или собственно синтетическими способами. Особый интерес представляют комбинаторные библиотеки пептидов и олигонуклеотидов. Другие представляющие интерес библиотеки включают набор, полученный многопараллельным синтезом пептидов, белков, пептидомиметиков, рекомбинаторные и полипептидные библиотеки. Для обзора комбинаторной химии и создаваемых на ее основе библиотек смотри Myers, Curr. Opin. Biotechnol. 8: 701- 707 (1997). Обзор и примеры библиотек пептидомиметиков смотри в Al-Obeidi et al., Mol. Biotechnol, 9(3):205-23 (1998); Hruby et al., Curr Opin Chem Biol, 1(1):114-19 (1997); Dorner et al., Bioorg Med Chem, 4(5):709-15 (1996) (алкилированные дипептиды).
4.3. ЗАБОЛЕВАНИЯ, ПОДДАЮЩИЕСЯ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ GIPF
В одном аспекте настоящее изобретение относится к фармацевтическим реагентам и способам, применимым для лечения заболеваний и состояний, при которых требуется эпителизация. Полипептиды GIPF применимы для повышения цитопротекции, пролиферации и/или дифференцировки эпителиальных клеток ротовой полости и желудочно-кишечного тракта. В частности, полипептиды GIPF применимы для лечения или профилактики заболеваний или состояний, которые включают без ограничения желудочно-кишечные заболевания, мукозит желудочно-кишечного тракта, мукозит ротовой части глотки, губ и пищевода (пероральный мукозит), воспалительное заболевание кишечника, синдром короткой кишки, язвы желудка и двенадцатиперстной кишки, эрозии желудочно-кишечного тракта, включая эрозивный гастрит, эзофагит, желудочно-пищеводный рефлюкс и другие состояния, включая раны, ожоги, глазные расстройства и любое расстройство, при котором требуется стимуляция пролиферации или регенерации эпителиальных клеток. Также рассматривается лечение заболеваний, которые приводят к неэффективной продукции слизи в ротовой полости и желудочно-кишечном тракте.
Мукозит, к которому относятся мукозит ротовой полости и желудочно-кишечный мукозит, является осложнением при некоторых способах терапии злокачественной опухоли, при которых слой, выстилающий пищеварительную систему, воспаляется. GIPF применим для профилактики и/или ослабления дегенерации слизистой оболочки пищеварительного тракта, которая вызвана химиотерапией и/или лучевой терапией, назначенной пациенту для лечения злокачественной опухоли или назначенной в качестве адъювантной терапии после удаления опухоли. Примеры химиотерапевтических средства включают без ограничения BCNU, бусульфан, карбоплатин, циклофосфамид, таннорубицин, доксорубицин, этопозид, 5-фторурацил, гемцитабин, ифофамид, иринотекан, мельфалан, метотрексат, навельбин, тотпотекан и таксол, и примеры схем лечения включают без ограничения BEAM (бусульфан, этопозид, цитозин арабинозид, метотрексат); циклофосфамид и общее облучение тела; циклофосфамид, общее облучение тела и этопозид; циклофосфамид и бусульфан; и 5-фторурацил с лейковорином или левамизолом. Лечение, обработка до лечения или обработка после лечения GIPF применима для получения цитопротекторного эффекта, или регенерации, или и того, и другого, например слизистой оболочки тонкого кишечника и ободочной кишки, что позволяет использовать повышенные дозы терапевтического воздействия при снижении его возможных побочных эффектов.
Воспалительное заболевание кишечника, которое можно лечить GIPF, включает общее воспалительное заболевание кишечника, которое характеризуется хроническими, рецидивирующими, воспалительными расстройствами неизвестного происхождения, болезнь Крона, дисплазию, связанную с воспалительным заболеванием кишечника, промежуточный колит, язвенный колит; неинфекционный колит, включая активный колит, связанный с антибиотиками колит, коллагеновый колит, воспаление в отключенной кишке, эозинофильный колит, болезнь «трансплантат против хозяина», гранулематозный колит, ишемический колит, геморрагический колит, малакоплакию, некротизирующий энтероколит, лучевой энтероколит, тифлит; инфекционный колит, включая аденовирусный и амебный колит, балантидиоз, ассоциированный с HSV/СПИДом колит и колит, вызванный трипаносомами, E. coli, Mycobacterium avium intracellulare, Sotavirus, Salmonella, Shigella, Campylobacter jejuni, Clostridium, Botulinum, и колит, связанный с шистосомозом, спирохетозом, сифилисом, трихурозом, туберкулезом, брюшными тифом, Vibrio cholera и Yersinia.
Синдром короткой кишки представляет собой группу проблем, поражающих людей, у которых была удалена половина или больше тонкого кишечника. Наиболее распространенной причиной удаления части тонкого кишечника является болезнь Крона. Кроме того, хирургическая резекция части кишечника может требоваться для удаления злокачественного роста. Диарея является основным симптомом синдрома короткой кишки. Другие симптомы включают спазмы, вздутие и изжогу. Многие люди с синдромом короткой кишки имеют плохое питание вследствие того, что их оставшийся тонкий кишечник неспособен всасывать достаточное количество воды, витаминов и других питательных вещества из пищи. Они также обезвоживаются, что может угрожать их жизни. Проблемы, связанные с обезвоживанием и недостаточным питанием, включают слабость, усталость, депрессию, потерю массы, бактериальные инфекции и чувствительность к пище. Синдром короткой кишки лечат посредством изменения питания, внутривенным кормлением, добавками витаминов и минеральных веществ и медикаментами для облегчения симптомов. Полипептиды GIPF могут быть применимы для усиления пролиферации неподверженной резекции ткани кишечника, таким образом увеличивая площадь всасывающей поверхности кишечника, и ослабления симптомов, связанных с синдромом короткой кишки.
Цитопротекторную и/или регенерирующую активность полипептидов GIPF можно тестировать в моделях in vivo индуцированного облучением мукозита (Withers and Elkind, Int. J. Radiat. 17: 261-267 (1970), публикация включена в данное описание в виде ссылки), в моделях in vivo индуцированного химиотерапией мукозита (Soris et al., Oral Surg Oral Med Oral Pathol 69:437-443 (1990); Moore, Cancer Chemother Pharmacol 15:11-15 (1985); Farell et al., Cell Prolif 35:78-85 (2002), все публикации включены в виде ссылки в полном объеме); в модели колита и изъязвления или воспаления тонкого кишечника с использованием декстрансульфата натрия (DSS) (Jeffers et al., Gastroenterology 123:1151-1162 (2002), Han et al., Am J Physiol Gastrointest Liver Physiol 279:G1011-G1022 (2000); и в хирургической модели синдрома короткой кишки (SBS) (Scott et al. Am J Physiol G911-G921 (1998); Helmrath et al., J Am Coll Surg 183:441-449 (1996)), публикации включены в данное описание в виде ссылки в полном объеме).
Осуществляют сравнение уровней экспрессии мРНК и белка GIPF между пораженными заболеванием клетками, тканью и соответствующими нормальными образцами, чтобы определить, отвечает ли субъект на терапию GIPF. В способах выявления и количественной оценки экспрессии мРНК полипептида GIPF или белка используют стандартные методики выявления и количественной оценки нуклеиновых кислот и белков, которые хорошо известны в данной области и описаны в Sambrook, et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, NY (1989) или Ausubel, et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, NY (1989), обе публикации включены в данное описание в виде ссылки в полном объеме. Стандартные способы выявления и количественной оценки мРНК GIPF включают гибридизацию in situ с использованием меченых рибозондов GIPF (Gemou-Engesaeth, et al., Pediatrics 109: E24-E32 (2002), публикация включена в данное описание в виде ссылки в полном объеме), Нозерн-блот и родственные способы с использованием полинуклеотидных зондов GIPF (Kunzli, et al., Cancer 94: 22 8(2002), публикация включена в данное описание в виде ссылки в полном объеме), ОТ-ПЦР-анализ с использованием GIPF-специфичных праймеров (Angchaiskisiri, et al., Blood 99: 130 (2002)) и другие способы выявления с помощью амплификации, такие как анализ гибридизации в растворе ДНК с разветвленной цепью (Jardi, et al., J. Viral Hepat. 8: 465-471 (2001), публикация включена в данное описание в виде ссылки в полном объеме), опосредованную транскрипцией амплификацию (Kimura, et al., J. Clin. Microbiol. 40: 439-445 (2002)), продукты на микроматрицы, такие как олигонуклеотиды, кДНК и моноклональные антитела, и ПЦР в реальном времени (Simpson, et al., Molec. Vision, 6: 178-183 (2000), публикация включена в данное описание в виде ссылки в полном объеме). Стандартные способы выявления и количественной оценки белка GIPF включают Вестерн-блот-анализ (Sambrook, et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, NY (1989), Ausubel, et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, NY (1989)), иммуноцитохимический анализ (Racila, et al., Proc. Natl. Acad. Sci. USA 95: 4589-4594 (1998) выше) и множество иммуноанализов, включая твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (РИА) и специфичный ферментный иммуноанализ (EIA) (Sambrook, et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, NY (1989), Ausubel, et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, NY (1989)).
Заболевания и состояния, которые можно лечить способами согласно настоящему изобретению, предпочтительно встречаются у млекопитающих. Млекопитающие включают, например, человека и других приматов, а также домашних питомцев или сопутствующих животных, таких как собаки и кошки, лабораторных животных, таких как крысы, мыши и кролики, и сельскохозяйственных животных, таких как лошади, свиньи, овца и крупный рогатый скот.
4.3.1. ТЕРАПЕВТИЧЕСКИЕ СПОСОБЫ
Композиции (содержащие полипептидные фрагменты, аналоги, варианты и антитела или другие связывающие партнеры или модуляторы, включая антисмысловые полинуклеотиды) согласно изобретению имеют многочисленные применения в ряде терапевтических способов. Примеры терапевтических применений включают, но не ограничены указанным, применения, приведенные в качестве примеров в данном описании.
Одним вариантом осуществления изобретения является введение эффективного количества полипептидов GIPF или другой композиции согласно изобретению индивидуумам, пораженным заболеванием или расстройством, которое можно лечить пептидами согласно изобретению. Хотя способ введения не является особенно важным, предпочтительно парентеральное введение. Примером способов введения является доставка подкожного или внутривенного болюса. Дозу полипептидов GIPF или другой композиции согласно изобретению обычно будет определять врач, назначающий лечение. Предполагается, что доза будет варьировать в соответствии с возрастом, массой, состоянием и ответом отдельного пациента. Обычно вводимое количество полипептида в расчете на дозу будет находиться в пределах примерно от 0,01 мкг/кг до 100 мг/кг массы тела, при этом предпочтительная доза составляет примерно от 0,1 мкг/кг до 10 мг/кг массы тела пациента. Для парентерального введения полипептиды GIPF согласно изобретению будут приготовлены в виде инъекционной формы в комбинации с фармацевтически приемлемым парентеральным наполнителем. Такие наполнители хорошо известны в данной области, и примеры включают воду, физиологический раствор, раствор Рингера, раствор декстрозы и растворы, состоящие из небольших количеств сывороточного альбумина человека. Наполнитель может содержать небольшие количества добавок, которые поддерживают изотоничность и стабильность полипептида или другого активного ингредиента. Приготовление таких растворов известно специалистам в данной области.
4.3.2. ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ
Белок или другую композицию согласно настоящему изобретению (полученную из любого источника, включая без ограничения рекомбинантные и нерекомбинантные источники и включая антитела и другие связывающие партнеры полипептидов согласно изобретению) можно вводить нуждающемуся в этом пациенту как таковую или в составе фармацевтической композиции, в которой ее смешивают с подходящими носителями или эксципиентом(ами) в дозах, подходящих для лечения или улучшения состояния в случае ряда расстройств. Такая композиция необязательно может содержать (кроме белка или другого активного ингредиента и носителя) разбавители, наполнители, соли, буферы, стабилизаторы, солюбилизаторы и другие вещества, хорошо известные в данной области. Термин «фармацевтически приемлемый» означает нетоксичное вещество, которое не мешает эффективности биологической активности активного ингредиента(ов). Характеристики носителя будут зависеть от пути введения. Фармацевтические композиции согласно изобретению также могут содержать цитокины, лимфокины или другие гематопоэтические факторы и различные факторы роста, такие как любой FGF, эпидермальный фактор роста (EGF), полученный из тромбоцитов фактор роста (PDGF), трансформирующие факторы роста (TGF-α и TGF-β), инсулиноподобный фактор роста (IGF), фактор роста кератиноцитов (KGF) и тому подобные, а также цитокины, описанные в данной публикации.
Фармацевтическая композиция дополнительно может содержать другие агенты, которые либо усиливают активность белка или другого активного ингредиента, либо дополняют его активность или применение при лечении. Такие дополнительные факторы и/или агенты могут быть включены в фармацевтическую композицию для получения синергетического эффекта с белком или другим активным ингредиентом согласно изобретению или для минимизации побочных эффектов. Наоборот, белок или другие активные ингредиенты согласно настоящему изобретению могут быть включены в препараты конкретного цитокина, лимфокина, другого гематопоэтического фактора, тромболитического или антитромботического фактора или противовоспалительного средства, чтобы минимизировать побочные эффекты фактора свертывания, цитокина, лимфокина, другого гематопоэтического фактора, тромболитического или антитромботического фактора или противовоспалительного средства (такого как IL-1Ra, IL-1 Hy1, IL-1 Hy2, анти-TNF, кортикостероиды, иммуносупрессоры). Белок согласно настоящему изобретению может быть активным в виде мультимеров (например, гетеродимеров или гомодимеров) или комплексов с таким же белком или другими белками. В результате фармацевтические композиции согласно изобретению могут содержать белок согласно изобретению в такой мультимерной или комплексной форме.
В качестве альтернативы включения в состав фармацевтической композиции согласно изобретению, содержащей первый белок, второй белок или терапевтическое средство, могут быть одновременно введены с первым белком (например, в одно и то же время или в другое время, при условии, что в месте лечения достигаются терапевтические концентрации комбинации средств). Способы приготовления и введения соединений согласно настоящей заявке можно найти в «Remington's Pharmaceutical Sciences», Mack Publishing Co., Easton, PA, последняя редакция. Терапевтически эффективная доза, кроме того, относится к такому количеству соединения, которое достаточно для того, чтобы вызвать ослабление симптомов, например для лечения, исцеления, профилактики или улучшения соответствующего патологического состояния или для увеличения степени лечения, исцеления, профилактики или улучшения таких состояний. В случае применения по отношению к отдельному активному ингредиенту, вводимому отдельно, терапевтически эффективная доза относится к такому ингредиенту отдельно. В случае применения по отношению к комбинации терапевтически эффективная доза относится к объединенным количествам активных ингредиентов, которые приводят к терапевтическому эффекту при введении в комбинации либо последовательно, либо одновременно.
При практическом осуществлении способа лечения или применения согласно настоящему изобретению терапевтически эффективное количество белка или другого активного ингредиента согласно настоящему изобретению вводят млекопитающему, имеющему состояние, которое необходимо лечить. Белок или другой активный ингредиент согласно настоящему изобретению может быть введен согласно способу, предлагаемому в изобретении, либо отдельно, либо в комбинации с другими способами терапии, такими как лечение с использованием цитокинов, лимфокинов или других гематопоэтических факторов. При совместном введении с одним или несколькими цитокинами, лимфокинами или другими гематопоэтическими факторами белок или другой активный ингредиент согласно настоящему изобретению может быть введен либо одновременно с цитокином(ами), лимфокином(ами), другим гематопоэтическим фактором(ами), тромболитическими или антитромботическими факторами, либо последовательно. При введении последовательно назначающий лечение врач будет принимать решение о подходящей последовательности введения белка или другого активного ингредиента согласно настоящему изобретению в комбинации с цитокином(ами), лимфокином(ами), другим гематопоэтическим фактором(ами), тромболитическими или антитромботическими факторами.
4.3.3. ПУТИ ВВЕДЕНИЯ
Подходящие пути введения могут, например, включать пероральное, ректальное, через слизистую оболочку или кишечное введение; парентеральную доставку, включая внутримышечные, подкожные, интрамедуллярные инъекции, а также интратекальные, прямые внутрижелудочковые, внутривенные, внутрибрюшинные, интраназальные или внутриглазные инъекции. Введение белка или другого активного ингредиента согласно настоящему изобретению, используемого в фармацевтической композиции или при практическом осуществлении способа согласно настоящему изобретению, можно осуществить множеством обычных путей, таких как пероральный прием внутрь, ингаляция, местное применение или кожная, подкожная, внутрибрюшинная (в/б), парентеральная или внутривенная инъекция. Предпочтительно внутривенное введение пациенту.
Альтернативно можно вводить соединение локально, а не системно, например посредством инъекции соединения непосредственно в ткань, часто в виде депо или препарата длительного высвобождения.
В другом варианте предлагается имплантация клеток, продуцирующих GIPF (клеточная терапия), субъекту, которому необходима пролиферация и/или стимуляция эпителиальных клеток. Клетки, которые в норме не экспрессируют GIPF или которые экспрессируют низкие уровни GIPF, могут быть модифицированы так, чтобы они продуцировали терапевтически уровни GIPF, посредством трансформации полинуклеотидом, который кодирует GIPF. Клетки могут относится к тому же виду, что и субъект, или могут быть получены от другого вида. Предпочтительно клетки получают от субъекта, которому необходима терапия GIPF. Клетки человека или клетки животного, отличного от человека, могут быть имплантированы субъекту с использованием биосовместимой, полупроницаемой полимерной оболочки, которая обеспечивает возможность высвобождения белка GIPF, или могут быть имплантированы непосредственно без инкапсуляции.
В другом варианте предлагается генная терапия in vivo. Нуклеотидную последовательность, кодирующую GIPF, вводят непосредственно субъекту для секреции белка, чтобы предотвратить или лечить заболевания, которые указаны в данном описании. Полинуклеотид, кодирующий GIPF, может быть инъецирован непосредственно в ткань, подвергаемую лечению, или он может быть доставлен в клетки пораженной ткани вирусным вектором, например аденовирусным вектором или ретровирусным вектором. Физический перенос подходящих векторов, содержащих кодирующую GIPF нуклеиновую кислоту, также можно осуществить способами, включая опосредованный липосомами перенос, прямую инъекцию голой ДНК, опосредованный рецепторами перенос или бомбардировку микрочастицами.
Полипептиды согласно изобретению вводят любым путем, который доставляет эффективную дозу к требуемому месту действия. Определение подходящего пути введения и эффективной дозы для конкретного показания к применению доступно специалисту в данной области. Предпочтительно для лечения ран терапевтическое соединение вводят непосредственно в место раны. Подходящие пределы доз для полипептидов согласно изобретению можно экстраполировать на основании указанных доз или исходя из сходных исследований в подходящих животных моделях. Затем при необходимости дозы могут быть скорректированы лечащим врачом, чтобы обеспечить максимальную терапевтическую пользу.
4.3.4. КОМПОЗИЦИИ/ПРЕПАРАТЫ
Таким образом, фармацевтические композиции для применения согласно настоящему изобретению могут быть приготовлены обычным способом с использованием одного или нескольких физиологически приемлемых носителей, содержащих эксципиенты и вспомогательные средства, которые облегчают обработку активного соединения для получения препаратов, которые можно использовать фармацевтически. Указанные фармацевтические композиции могут быть произведены способом, который по сути известен, например способами обычного смешивания, растворения, гранулирования, получения драже, растирания в порошок, эмульгирования, инкапсуляции, способами улавливания или лиофилизации. Соответствующее приготовление зависит от выбранного пути введения. В том случае, когда терапевтически эффективное количество белка или другого активного ингредиента согласно настоящему изобретению вводят перорально, белок или другой активный ингредиент согласно настоящему изобретению будет иметь форму таблетки, капсулы, порошка, раствора или эликсира. При введении в форме таблетки фармацевтическая композиция согласно изобретению может дополнительно содержать твердый носитель, такой как желатин или адъювант. Таблетка, капсула и порошок содержат примерно от 5 до 95% белка или другого активного ингредиента согласно настоящему изобретению и предпочтительно примерно от 25 до 90% белка или другого активного ингредиента согласно настоящему изобретению. При введении в жидкой форме можно добавлять жидкий носитель, такой как вода, керосин, масла животного или растительного происхождения, такие как арахисовое масло, минеральное масло, соевое масло или кунжутное масло, или синтетические масла. Жидкая форма фармацевтической композиции дополнительно может содержать физиологический раствор соли, декстрозы или раствор другого сахарида, или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль. При введении в жидкой форме фармацевтическая композиция содержит примерно от 0,5 до 90% мас. белка или другого активного ингредиента согласно настоящему изобретению и предпочтительно примерно от 1 до 50% белка или другого активного ингредиента согласно настоящему изобретению.
Когда терапевтически эффективное количество белка или другого активного ингредиента согласно настоящему изобретению вводят внутривенной, кожной или подкожной инъекцией, белок или другой активный ингредиент согласно настоящему изобретению будет иметь форму апирогенного, парентерально приемлемого водного раствора. Приготовление таких парентерально приемлемых растворов белка или другого активного ингредиента с учетом pH, изотоничности, стабильности и тому подобного, известно специалистам в данной области. Предпочтительная фармацевтическая композиция для внутривенной, кожной или подкожной инъекции должна содержать кроме белка или другого активного ингредиента согласно настоящему изобретению изотоничный наполнитель, такой как хлорид натрия для инъекций, раствор Рингера для инъекций, декстрозу для инъекций, декстрозу и хлорид натрия для инъекций, лактат Рингера для инъекций или другой наполнитель, который известен в данной области. Фармацевтическая композиция согласно настоящему изобретению также может содержать стабилизаторы, консерванты, буферы, антиоксиданты или другие добавки, известные специалистам в данной области. Для инъекции средства согласно изобретению могут быть приготовлены в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хенкса, раствор Рингера или физиологический солевой буфер. Для введения через слизистую оболочку в препарате используют проникающие вещества, подходящие для барьера, через который препарат должен проникнуть. Такие проникающие вещества, в общем, известны в данной области.
Для перорального введения соединения могут быть легко приготовлены комбинированием активного соединения с фармацевтически приемлемыми носителями, хорошо известными в данной области. Такие носители позволяют готовить соединения согласно изобретению в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и тому подобного для перорального приема внутрь пациентом, подвергаемым лечению. Фармацевтические препараты для перорального применения могут быть получены с использованием твердого эксципиента, необязательно измельчением полученной в результате смеси и обработкой смеси гранул после добавления при необходимости вспомогательных веществ, чтобы получить таблетки или сердцевины драже. Подходящими эксципиентами, в частности, являются такие наполнители, как сахара, включая лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, например кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий-карбоксиметилцеллюлоза и/или поливинилпирролидон (PVP). При необходимости могут быть добавлены дезинтегрирующие средства, такие как поперечно сшитый поливинилпирролидон, агар или альгиновая кислота и ее соли, такие как альгинат натрия. Сердцевины драже предлагаются с подходящими оболочками. Для этой цели можно использовать концентрированные растворы сахаров, которые необязательно могут содержать аравийскую камедь, тальк, поливинилпирролидон, гель карбопол, полиэтиленгликоль и/или диоксид титана, растворы глазури и подходящие органические растворители или смеси растворителей. Красители или пигменты могут быть добавлены к таблеткам или оболочкам драже для идентификации или для характеристики разных комбинаций доз активных соединений.
Фармацевтические препараты, которые можно использовать перорально, включают заполняемые капсулы, сделанные из желатина, а также мягкие герметичные капсулы, сделанные из желатина и пластификатора, такого как глицерин или сорбит. Заполняемые капсулы могут содержать активные ингредиенты в смеси с таким наполнителем, как лактоза, связывающими веществами, такими как крахмалы, и/или скользящими веществами, такими как тальк или стеарат магния, и необязательно стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Все препараты для перорального введения должны быть в дозах, подходящих для такого введения. Для буккального введения композиции могут иметь форму таблеток или лепешек, приготовленных обычным способом.
В случае введения путем ингаляции соединения для применения согласно настоящему изобретению легко доставляют в форме подачи аэрозольного спрея из упаковок под давлением или распылителя с применением подходящего газа-вытеснителя, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением стандартная доза может быть определена благодаря наличию клапана для доставки дозированного количества. Могут быть приготовлены капсулы и картриджи, например, из желатина для применения в ингаляторе или инсуффляторе, содержащие порошкообразную смесь соединения и подходящей порошкообразной основы, такой как лактоза или крахмал. Соединения могут быть приготовлены для парентерального введения путем инъекции, например болюсной инъекции или непрерывной инфузии. Препараты для инъекции могут предоставляться в дозированной лекарственной форме, например в ампулах или емкостях, содержащих много доз, с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных наполнителях, и могут содержать агенты для приготовления композиций, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты.
Фармацевтические препараты для парентерального введения включают водные растворы активных соединений в водорастворимой форме. Кроме того, могут быть приготовлены суспензии активных соединений в виде подходящих масляных суспензий для инъекции. Подходящие липофильные растворители или наполнители включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат, или триглицериды, или липосомы. Водные суспензии для инъекции могут содержать вещества, которые увеличивают вязкость суспензии, такие как натрий-карбоксиметилцеллюлоза, сорбит или декстран. Необязательно суспензия также может содержать подходящие стабилизаторы или агенты, которые увеличивают растворимость соединений, чтобы обеспечить возможность получения высоко концентрированных растворов. Альтернативно активный ингредиент может быть в форме порошка для приготовления состава с подходящим наполнителем, например стерильной апирогенной водой, перед применением.
Соединения также могут быть приготовлены в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащие обычные основы для суппозиториев, такие как масло какао или другие глицериды. Кроме описанных выше препаратов соединения также могут быть приготовлены в виде депонируемого препарата. Такие длительно действующие препараты можно вводить путем имплантации (например, подкожно или внутримышечно) или посредством внутримышечной инъекции. Таким образом, например, соединения могут быть приготовлены в виде композиции с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в подходящем масле) или ионообменными смолами или в виде плохо растворимых производных, например в виде плохо растворимой соли.
Фармацевтическим носителем для гидрофобных соединений согласно изобретению является система корастворителей, содержащая бензиловый спирт, неполярное поверхностно-активное вещество, водорастворимый органический полимер и водную фазу. Системой корастворителей может быть система корастворителей VPD. VPD представляет собой раствор 3% мас./об. бензилового спирта, 8% мас./об. неполярного поверхностно-активного вещества полисорбата 80 и 65% мас./об. полиэтиленгликоля 300, доведенного до объема абсолютным этанолом. Система корастворителей VPD (VPD:5W) состоит из VPD, разбавленного 1:1 5% раствором декстрозы в воде. Указанная система корастворителей хорошо растворяет гидрофобные соединения, и сама имеет низкую токсичность при системном введении. Конечно, соотношения в системе корастворителей могут в значительной степени варьировать, не нарушая ее характеристики растворимости и токсичности. Кроме того, индивидуальные компоненты системы корастворителей могут варьировать: например, могут быть использованы другие низко токсичные неполярные поверхностно-активные вещества вместо полисорбата 80; размер фракции полиэтиленгликоля может варьировать; полиэтиленгликоль может быть заменен другими биосовместимыми полимерами, например поливинилпирролидоном; и декстрозу можно заменять другими сахарами или полисахаридами. Альтернативно можно использовать другие системы доставки для гидрофобных фармацевтических соединений. Липосомы и эмульсии являются хорошо известными примерами наполнителей или носителей для доставки гидрофобных лекарственных средств. Также могут быть использованы некоторые органические растворители, такие как диметилсульфоксид, хотя обычно ценою более высокой токсичности. Кроме того, соединения могут быть доставлены с использованием системы длительного высвобождения, такой как полупроницаемые матрицы твердых гидрофобных полимеров, содержащих терапевтическое средство. Разработаны различные типы материалов для длительного высвобождения, и такие материалы хорошо известны специалистам в данной области. Капсулы для замедленного высвобождения могут в зависимости от их химической природы высвобождать соединения в течение от нескольких недель до более 100 дней. В зависимости от химической природы и биологической стабильности терапевтического реагента можно использовать дополнительные методики стабилизации белка или другого активного ингредиента.
Фармацевтические композиции также могут содержать подходящие твердые или находящиеся в гелевой фазе носители или эксципиенты. Примеры таких носителей или эксципиентов включают, но не ограничены указанным, карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли. Многие активные ингредиенты согласно изобретению могут предлагаться в виде солей с фармацевтически совместимыми противоионами. Такими фармацевтически приемлемыми аддитивными солями основания являются такие соли, которые сохраняют биологическую эффективность и свойства свободных кислот и которые получают в результате взаимодействия с неорганическими или органическими основаниями, такими как гидроксид натрия, гидроксид магния, аммиак, триалкиламин, диалкиламин, моноалкиламин, двухосновные аминокислоты, ацетат натрия, бензоат калия, триэтаноламин и тому подобные.
Фармацевтическая композиция согласно изобретению может быть в форме комплекса белка(ов) или другого активного ингредиента согласно настоящему изобретению с белковыми или пептидными антигенами. Белковый и/или пептидный антиген будет доставлять стимулирующий сигнал как к B-, так и к T-лимфоцитам. B-лимфоциты будут отвечать на антиген посредством иммуноглобулинового рецептора на их поверхности. T-лимфоциты буду отвечать на антиген посредством T-клеточного рецептора (TCR) после презентации антигена белками MHC. MHC и структурно родственные белки, включая белки, кодируемые генами MHC класса I и класса II, на клетках-хозяевах будут служить для презентации пептидного антигена(ов) T-лимфоцитам. Антигенные компоненты также могут быть доставлены в виде очищенных комплексов MHC-пептид отдельно или с костимулирующими молекулами, которые могут непосредственно давать сигнал T-клеткам. Альтернативно антитела, способные связывать поверхностный иммуноглобулин и другие молекулы на B-клетках, а также антитела, способные связывать TCR и другие молекулы на T-клетках, можно комбинировать с фармацевтической композицией согласно изобретению.
Фармацевтическая композиция согласно изобретению может иметь форму липосомы, в которой белок согласно настоящему изобретению комбинируют в дополнение к другим фармацевтически приемлемым носителям с амфипатическими агентами, такими как липиды, которые существуют в агрегированной форме в виде мицелл, нерастворимых монослоев, жидких кристаллов или ламеллярных слоев в водном растворе. Подходящие липиды для приготовления липосом включают без ограничения моноглицериды, диглицериды, сульфатиды, лизолецитины, фосфолипиды, сапонин, желчные кислоты и тому подобное. Приготовление таких липосомных препаратов известно специалистам в данной области, как описано, например, в патентах США No. 4235871, 4501728, 4837028 и 4737323, которые все включены в данное описание в виде ссылки.
Количество белка или другого активного ингредиента согласно настоящему изобретению в фармацевтической композиции согласно настоящему изобретению будет зависеть от природы и тяжести состояний, подвергаемого лечению, и от природы предыдущего лечения, которому пациент подвергался. Конечно, лечащий врач будет принимать решение о количестве белка или другого активного ингредиента согласно настоящему изобретению для лечения каждого конкретного пациента. Сначала лечащий врач будет вводить низкие дозы белка или другого активного ингредиента согласно настоящему изобретению и наблюдать ответ пациента. Более высокие дозы белка или другого активного ингредиента согласно настоящему изобретению можно вводить вплоть до получения оптимального терапевтического эффекта для пациента, и с этого момента дозу больше не увеличивают. Предполагается, что различные фармацевтические композиции, используемые при практическом осуществлении способа согласно настоящему изобретению, должны содержать примерно от 0,01 мкг до примерно 100 мг (предпочтительно примерно от 0,1 мкг до примерно 10 мг, более предпочтительно примерно от 0,1 мкг до примерно 1 мг) белка или другого активного ингредиента согласно настоящему изобретению на кг массы тела. В случае композиций согласно настоящему изобретению, которые применимы для регенерации кости, хряща, сухожилия или связки, терапевтический способ заключается во введении композиции местно, системно или локально в виде имплантата или устройства. При введении терапевтическая композиция для применения в данном изобретении имеет апирогенную, физиологически приемлемую форму. Кроме того, композиция при желании может быть инкапсулирована или инъецирована в вязкой форме для доставки в определенное место повреждения кости, хряща или ткани. Местное введение может быть подходящим для заживления ран и восстановления ткани. Терапевтически применимые средства, отличные от белка или другого активного ингредиента согласно изобретению, которые необязательно также могут быть включены в композицию, которая описана выше, могут быть альтернативно или дополнительно введены одновременно или последовательно с композицией в способах согласно изобретению. Предпочтительно для образования кости и/или хряща композиция может содержать матрицу, способную доставлять композицию, содержащую белок или содержащую другой активный ингредиент, в место повреждения кости и/или хряща, которая обеспечивает структуру для развития кости и хряща и может оптимально ресорбироваться в кости. Такие матрицы могут быть образованы из материалов, используемых в настоящее время для других применений имплантируемых медицинских средств.
Выбор материала матрицы основан на биосовместимости, биологической разрушаемости, механических свойствах, косметическом виде и свойствах поверхности контакта. Конкретное применение композиций будет определять подходящий состав. Возможными матрицами для композиций могут быть биоразрушаемые и химически определенные сульфат кальция, трикальцийфосфат, гидроксиапатит, полимолочная кислота, полигликолевая кислота и полиангидриды. Другие возможные материалы являются биоразрушаемыми и биологически строго определенными, такие как кость или коллаген кожи. Дополнительные матрицы состоят из чистых белков или компонентов внеклеточного матрикса. Другие возможные матрицы является биологически неразрушаемыми и химически определенными, такими как полученный спеканием гидроксиапатит, биостекло, алюминаты или другая керамика. Матрицы могут состоять из комбинаций любого из указанных выше типов материала, таких как полимолочная кислота и гидроксиапатит или коллаген и трикальцийфосфат. Биокерамика может быть изменена по составу, например алюмофосфат кальция, и подвергнута обработке для изменения размера пор, размера частиц, формы частиц и биологической разрушаемости. Предпочтительным в настоящее время является сополимер 50:50 (молярная масса) молочной кислоты и гликолевой кислоты в форме пористых частиц, имеющих диаметр в диапазоне от 150 до 800 микрон. В некоторых применениях будет полезным использование комплексообразующего агента, такого как карбоксиметилцеллюлоза или аутологичный кровяной сгусток, чтобы предотвратить диссоциацию композиций белка из матрицы.
Предпочтительным семейством комплексообразующих агентов являются целлюлозные материалы, такие как алкилцеллюлозы (включая гидроксиалкилцеллюлозы), включая метилцеллюлозу, этилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и карбоксиметилцеллюлозу, при этом наиболее предпочтительными являются катионные соли карбоксиметилцеллюлозы (CMC). Другие предпочтительные комплексообразующие агенты включают гиалуроновую кислоту, альгинат натрия, поли(этиленгликоль), полиоксиэтиленоксид, карбоксивиниловый полимер и поли(виниловый спирт). Количество комплексообразующего агента, применимого в данном изобретении, составляет 0,5-20 % мас., предпочтительно 1-10 % мас. от общей массы препарата, что составляет количество, необходимое для предотвращения десорбции белка из полимерной матрицы и обеспечения соответствующей обработки композиции, однако не настолько большое, чтобы препятствовать инфильтрации матрицы клетками-предшественниками, таким образом обеспечивая возможность того, чтобы белок способствовал остеогенной активности клеток-предшественников. В следующих композициях белки или другой активный ингредиент согласно изобретению можно комбинировать с другими средствами, полезными при лечении дефекта кости и/или хряща, раны или ткани, о которой идет речь. Указанные средства включают различные факторы роста, такие как эпидермальный фактор роста (EGF), полученный из тромбоцитов фактор роста (PDGF), трансформирующие факторы роста (TGF-α и TGF-β) и инсулиноподобный фактор роста (IGF).
Терапевтические композиции в настоящее время также полезны для ветеринарных применений. В частности, кроме людей домашние животные и чистокровные лошади являются желательными пациентами для такого лечения белками или другим активным ингредиентом согласно настоящему изобретению. Схему дозирования содержащей белок фармацевтической композиции, используемой для восстановления ткани, будет определять лечащий врач, учитывая различные факторы, которые модифицируют действие белков, например количество массы ткани, которую необходимо образовать, место повреждения, состояние поврежденной ткани, размер раны, тип поврежденной ткани (например, кость), возраст, пол и питание пациента, тяжесть какой-либо инфекции, время введения и другие клинические факторы. Доза может варьировать в зависимости от типа матрицы, используемой для реконструирования, и в зависимости от добавления других белков в фармацевтическую композицию. Например, добавление других известных факторов роста, таких как IGF I (инсулиноподобный фактор роста I), к конечной композиции также может влиять на дозу. Течение лечения можно контролировать периодической оценкой роста и/или восстановления ткани/кости, например, с помощью рентгеновских лучей, гистоморфометрическими определениями и мечением тетрациклином.
Полинуклеотиды согласно настоящему изобретению также можно использовать для генной терапии. Такие полинуклеотиды могут быть введены либо in vivo, либо ex vivo в клетки для экспрессии у млекопитающего. Полинуклеотиды согласно изобретению также могут быть введены другими известными способами введения нуклеиновой кислоты в клетку или организм (включая без ограничения введение в форме вирусных векторов или голой ДНК). Клетки также можно культивировать ex vivo в присутствии белков согласно настоящему изобретению, для того чтобы такие клетки пролиферировали или чтобы оказать требуемое влияние на такие клетки или их активность. Затем обработанные клетки можно ввести in vivo для терапевтических целей.
4.3.5. ЭФФЕКТИВНЫЕ ДОЗЫ
Фармацевтические композиции, подходящие для применения в настоящем изобретении, включают композиции, в которых активные ингредиенты содержатся в эффективном количестве, чтобы достичь требуемой цели. Более конкретно, терапевтически эффективное количество означает количество, эффективное для предотвращения развития или для ослабления существующих симптомов у субъекта, подвергаемого лечению. Специалисты в данной области могут определить эффективное количество, особенно в свете приведенного в данной публикации подробного описания. Для любого соединения, используемого в способе согласно изобретению, терапевтически эффективную дозу сначала можно определить на основе соответствующих анализов in vitro. Например, доза может быть приготовлена в животных моделях, чтобы достичь диапазона циркулирующей концентрации, который можно использовать для более точного определения доз, применимых для человека. Например, доза может быть приготовлена в животных моделях так, чтобы достичь диапазона циркулирующей концентрации, который включает IC50, определенную в культуре клеток (т.е. концентрацию тестируемого соединения, которая дает полумаксимальное ингибирование биологической активности белка). Такую информацию можно использовать для более точного определения доз, применимых для человека.
Терапевтически эффективная доза относится к такому количеству соединения, которое приводит к ослаблению симптомов или продлению жизнеспособности пациента. Токсичность и терапевтическую эффективность таких соединений можно определить стандартными фармацевтическими способами в культурах клеток или на экспериментальных животных, например для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной для 50% популяции). Отношение доз, вызывающих токсический и терапевтический эффекты, является терапевтическим индексом, и терапевтический индекс может быть выражен в виде соотношения между LD50 и ED50. Соединения, которые имеют высокие терапевтические индексы, являются предпочтительными. Данные, полученные на основании указанных анализов культур клеток и исследований на животных, можно использовать для приготовления диапазона доз для применения на человеке. Доза таких соединений предпочтительно находится в диапазоне циркулирующих концентраций, которые включают ED50 при небольшой токсичности или в отсутствие токсичности. Доза может варьировать в данном диапазоне в зависимости от используемой дозированной формы и используемого пути введения. Точный состав, путь введения и доза могут быть выбраны врачом с точки зрения состояний пациента. Смотри, например, Fingl et al., 1975, в «The Pharmacological Basis of Therapeutics», Ch. 1 p. 1. Дозовое количество и интервал можно корректировать индивидуально, чтобы получить уровни активного компонента в плазме, которые достаточны для поддержания требуемых эффектов, или получить минимальную эффективную концентрацию (MEC). MEC будет варьировать для каждого соединения, но может быть определена на основании данных in vitro. Дозы, необходимые для достижения MEC, будут зависеть от индивидуальных параметров и пути введения. Однако можно использовать анализ ВЭЖХ или биоанализы для определения концентраций в плазме.
Интервалы введения доз также можно определить, используя значение MEC. Соединения следует вводить, используя схему, которая поддерживает уровни в плазме выше MEC в течение 10-90% времени, предпочтительно 30-90% и наиболее предпочтительно 50-90%. В случаях локального введения или избирательного поглощения эффективная локальная концентрация лекарственного средства может быть не связана с концентрацией в плазме.
Примерная схема дозирования для полипептидов или других композиций согласно изобретению будет в диапазоне примерно от 0,01 мкг/кг до 100 мг/кг массы тела ежедневно, при этом предпочтительная доза составляет примерно от 0,1 мкг/кг до 25 мг/кг массы тела пациента ежедневно, варьируя у взрослых и детей. Дозирование может быть один раз в день или эквивалентные дозы могут быть доставлены с более длительными или более короткими интервалами.
Количество вводимой композиции, конечно, будет зависеть от субъекта, подвергаемого лечению, от возраста и массы субъекта, тяжести болезни, способа введения и усмотрения лечащего врача.
4.3.6. ДИАГНОСТИЧЕСКИЕ АНАЛИЗЫ И НАБОРЫ
Настоящее изобретение, кроме того, относится к способам идентификации наличия или экспрессии одной из ОРС согласно настоящему изобретению или ее гомолога в тестируемом образце с использованием зонда нуклеиновой кислоты или антитела согласно настоящему изобретению, необязательно конъюгированного или иным образом связанного с подходящей меткой.
В общем, способы выявления полинуклеотида согласно изобретению могут заключаться в контактировании образца с соединением, которое связывается и образует комплекс с полинуклеотидом, в течение периода времени, достаточного для образования комплекса, и выявлении комплекса, так что если выявляют комплекс, то выявляют полинуклеотид согласно изобретению в образце. Такие способы также могут заключаться в контактировании образца в жестких условиях гибридизации с праймерами нуклеиновой кислоты, которые отжигаются с полинуклеотидом согласно изобретению в таких условиях, и амплификации подвергнутых отжигу полинуклеотидов, так что если полинуклеотид амплифицируют, то в образце выявляют полинуклеотид согласно изобретению.
В общем, способы выявления полипептида согласно изобретению могут заключаться в контактировании образца с соединением, которое связывает и образует комплекс с полипептидом, в течение периода времени, достаточного для образования комплекса, и выявлении комплекса, так что если комплекс выявляют, то в образце выявляют полипептид согласно изобретению.
Подробно, такие способы заключаются в инкубации тестируемого образца с одним или несколькими антителами или одним или несколькими зондами нуклеиновой кислоты согласно настоящему изобретению и анализе связывания зондов нуклеиновой кислоты или антител с компонентами в тестируемом образце.
Условия инкубации зонда нуклеиновой кислоты или антитела с тестируемым образцом варьируют. Условия инкубации зависят от формы, используемой в анализе, используемых способов регистрации и типа и природы зонда нуклеиновой кислоты или антитела, используемых в анализе. Специалисту в данной области будет понятно, что любую из общедоступных форм гибридизации, амплификации или иммунологического анализа легко можно адаптировать для использования зондов нуклеиновой кислоты или антител согласно настоящему изобретению. Примеры таких анализов можно найти в Chard, T., An Introduction to Radioimmunoassay and Related Techniques, Elsevier Science Publishers, Amsterdam, The Netherlands (1986); Bullock, G.R. et al, Techniques in Immunocytochemistry, Academic Press, Orlando, FL Vol. 1 (1982), Vol. 2 (1983), Vol. 3 (1985); Tijssen, P., Practice and Theory of Immunoassays: Laboratory Techniques in Biochemistry and Molecular Biology, Elsevier Science Publishers, Amsterdam, The Netherlands (1985). Тестируемые образцы согласно настоящему изобретению включают клетки, белковые экстракты или экстракты мембран клеток или биологические жидкости, такие как слюна, кровь, сыворотка, плазма или моча. Тестируемый образец, используемый в описанном выше способе, будет варьировать в зависимости от формы анализа, природы способа регистрации и тканей, клеток или экстрактов, используемых в качестве образца для анализа. Способы получения экстрактов белков или экстрактов мембран клеток хорошо известны в данной области и легко могут быть адаптированы для получения образца, который совместим с используемой системой.
В другом варианте осуществления настоящего изобретения предлагаются наборы, которые содержат необходимые реагенты для осуществления анализов согласно настоящему изобретению. В частности, изобретение относится к набору с отделениями, компактно вмещающему одну или несколько емкостей, который содержит: (a) первую емкость, содержащую один из зондов или одно из антител согласно настоящему изобретению; и (b) одну или несколько других емкостей, содержащих один или несколько из следующих реагентов: реагенты для промывки, реагенты, способные выявлять присутствие связанного зонда или антитела.
Подробно, набор с отделениями включает любой набор, в котором реагенты находятся в отдельных емкостях. Такие емкости включают небольшие стеклянные сосуды, пластмассовые сосуды или полоски из пластика или бумаги. Такие емкости позволяют эффективно переносить реагенты из одного отделения в другое отделение, так что образцы и реагенты перекрестно не загрязняются, и агенты или растворы каждой емкости можно количественным образом добавлять из одного отделения в другое. Такие емкости будут включать емкость, в которую будут вносить тестируемый образец, емкость, которая содержит антитела, используемые в анализе, емкости, которые содержат реагенты для промывки (такие как фосфатно-солевой буфер, трис-буферы и т.д.), и емкости, которые содержат реагенты, используемые для регистрации связанного антитела или зонда. Типы реагентов для регистрации включают меченые зонды нуклеиновой кислоты, меченые вторые антитела или альтернативно, если первое антитело является меченым, ферментные или связывающие антитело реагенты, которые способны взаимодействовать с меченым антителом. Специалисту в данной области будет без труда понятно, что описанные зонды и антитела согласно настоящему изобретению можно легко включить в одну из разработанных форм наборов, которые хорошо известны в данной области.
4.3.7. СКРИНИНГОВЫЕ АНАЛИЗЫ
С использованием изолированных белков и полинуклеотидов согласно изобретению в настоящем изобретении, кроме того, предлагаются способы получения и идентификации модулирующих агентов, которые связываются с полипептидом, кодируемым ОРС, соответствующей нуклеотидной последовательности, указанной в SEQ ID NO: 2, 3, 5, 9, 11, 13, 15, 17, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 177, или ввязываются с конкретным доменом полипептида, кодируемым нуклеиновой кислотой. Подробно, указанный способ включает в себя стадии:
(a) контактирования агента с изолированным белком, кодируемым ОРС согласно настоящему изобретению, или нуклеиновой кислотой согласно изобретению; и
(b) определения того, связывается ли агент с указанным белком или указанной нуклеиновой кислотой.
Модулирующие агенты могут увеличивать или уменьшать пролиферативную активность GIPF на эпителиальных клетках.
В общем, такие способы идентификации соединений, которые связываются с полинуклеотидом согласно изобретению, могут заключаться в контактировании соединения с полинуклеотидом согласно изобретению в течение времени, достаточного для образования комплекса полинуклеотид/соединение, и выявлении комплекса, так что если комплекс полинуклеотид/соединение выявлен, то идентифицировано соединение, которое связывается с полинуклеотидом согласно изобретению.
Подобным образом, в общем, такие способы идентификации соединений, которые связываются с полипептидом согласно изобретению, могут заключаться в контактировании соединения с полипептидом согласно изобретению в течение времени, достаточного для образования комплекса полипептид/соединение, и выявлении комплекса, так что если комплекс полипептид/соединение выявлен, то идентифицировано соединение, которое связывается с полинуклеотидом согласно изобретению.
Способы идентификации соединений, которые связываются с полипептидом согласно изобретению, также могут заключаться в контактировании соединения с полипептидом согласно изобретению в клетке в течение времени, достаточного для образования комплекса полипептид/соединение, при этом комплекс запускает экспрессию последовательности гена-мишени в клетке, и выявлении комплекса посредством регистрации экспрессии последовательности репортерного гена, так что если комплекс полипептид/соединение выявлен, то идентифицировано соединение, которое связывается с полипептидом согласно изобретению.
Соединения, идентифицированные такими способами, могут включать соединения, которые модулируют активность полипептида согласно изобретению (то есть увеличивают или уменьшают его активность по сравнению с активностью, наблюдаемой в отсутствие соединения). Альтернативно соединения, идентифицированные такими способами, могут включать соединения, которые модулируют экспрессию полинуклеотида согласно изобретению (то есть увеличивают или уменьшают экспрессию по сравнению с уровнями экспрессии, наблюдаемыми в отсутствие соединения). Соединения, такие как соединения, идентифицированные способами согласно изобретению, можно тестировать с использованием стандартных анализов, хорошо известных специалистам в данной области, в отношении их способности модулировать активность/экспрессию.
Агентами, подвергаемыми скринингу в указанном выше анализе, могут быть без ограничения пептиды, углеводы, производные витаминов или другие фармацевтические средства. Агенты могут быть выбраны и подвергнуты скринингу случайным образом или выбраны рационально или сконструированы с использованием способов моделирования белка.
В случае случайного скрининга агенты, такие как пептиды, углеводы, фармацевтические средства и тому подобное, выбирают случайным образом и анализируют в отношении их способности связываться с белком, кодируемым ОРС согласно настоящему изобретению. Альтернативно агенты могут быть рационально отобраны или сконструированы. В используемом в данном описании смысле говорят, что агент «отобран или сконструирован рационально», когда агент выбирают на основе конфигурации конкретного белка. Например, специалист в данной области может легко адаптировать имеющиеся в настоящем способы создания пептидов, фармацевтических средств и тому подобного, способных связываться с конкретной последовательностью пептида, чтобы создать рационально сконструированные антипептидные пептиды, например, смотри в Hurby et al., Application of Synthetic Peptides: Antisense Peptides, "In Synthetic Peptides, A User's Guide, W.H. Freeman, NY (1992), pp. 289-307, и Kaspczak et al., Biochemistry 28:9230-8 (1989), или фармацевтические средства или тому подобное.
В дополнение к вышесказанному, один класс агентов согласно настоящему изобретению, который широко описан, можно использовать для регуляции экспрессии генов посредством связывания с одной из ОРС или EMF согласно настоящему изобретению. Как описано выше, такие агенты могут быть подвергнуты случайному скринингу или рационально сконструированы/отобраны. Целенаправленное воздействие на ОРС или EMF позволяет специалисту в данной области конструировать специфичные для последовательности или специфичные отношению к элементу агенты, модулирующие экспрессию либо одной ОРС, либо нескольких ОРС, которые основаны на одном и том же EMF для регуляции экспрессии. Одним классом ДНК-связывающих агентов являются агенты, которые содержат остатки оснований, которые гибридизуются или образуют трехспиральную структуру посредством связывания с ДНК или РНК. Такие агенты могут быть основаны на классическом фосфодиэфирном остове рибонуклеиновой кислоты или могут представлять собой множество сульфгидрильных или полимерных производных, которые обладают способностью связывать основания.
Агенты, подходящие для применения в указанных способах, обычно содержат от 20 до 40 оснований и сконструированы так, чтобы они были комплементарными области гена, вовлеченного в транскрипцию (тройная спираль - смотри Lee et al., Nucl. Acids Res. 6:3073 (1979); Cooney et al., Science 241:456 (1988); и Dervan et al., Science 251:1360 (1991)) или самой мРНК (антисмысловые - Okano, J. Neurochem. 56:560 (1991); Oligodeoxynucleotides as Antisense Inhibitors of Gene Expression, CRC Press, Boca Raton, FL (1988)). Образование тройной спирали оптимально приводит к остановке транскрипции РНК с ДНК, тогда как гибридизация антисмысловой РНК блокирует трансляцию молекулы мРНК в полипептид. Показано, что оба способа являются эффективными в модельных системах. Информация, содержащаяся в последовательностях согласно настоящему изобретению, необходима для конструирования антисмыслового олигонуклеотида или олигонуклеотида для образования тройной спирали и других ДНК-связывающих агентов.
Агенты, которые связываются с белком, кодируемым одной из ОРС согласно настоящему изобретению, могут быть использованы в качестве диагностического средства. Агенты, которые связываются с белком, кодируемым одной из ОРС согласно настоящему изобретению, могут быть приготовлены в виде композиций с использованием известных способов создания фармацевтических композиций.
5. ПРИМЕРЫ
ПРИМЕР 1
ВЫДЕЛЕНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO: 1 ИЗ БИБЛИОТЕКИ кДНК ЧЕЛОВЕКА
Новую нуклеиновую кислоту с последовательностью SEQ ID NO: 1 получали из библиотеки кДНК человека, полученной из кожи плода (Invitrogen), используя стандартную ПЦР, способы секвенирования посредством гибидизационного анализа характерных признаков последовательности и секвенирования по Сэнджеру. Вставки библиотеки амплифицировали в ПЦР, используя праймеры, специфичные для векторных последовательностей, фланкирующих вставки. Указанные образцы наносили пятнами на нейлоновые мембраны и исследовали, используя олигонуклеотидные зонды, чтобы показать характерные признаки последовательности. Клоны объединяли в группы со сходными или идентичными последовательностями и из каждой группы отбирали один типичный клон для секвенирования в геле. Затем рассчитывали 5'-последовательность амплифицированной вставки, используя обратный праймер для секвенирования M13 в типичном протоколе секвенирования по Сэнджеру. ПЦР-продукты очищали и подвергали секвенированию с использованием меченых флуоресцентным красителем терминаторов цикла секвенирования. Секвенирование в геле при одном проходе осуществляли, используя секвенатор 377 Applied Biosystems (ABI). Вставку последовательности SEQ ID NO: 1 описали в виде новой последовательности в международной публикации WO 03/(029405).
ПРИМЕР 2
СБОРКА ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO: 2
Нуклеиновую кислоту (SEQ ID NO: 2) согласно изобретению собирали из последовательностей, которые получали из библиотеки кДНК способами, описанными в примере 1 выше, и в некоторых случаях получали на основе одной или нескольких опубликованных баз данных. Конечную последовательность собирали, используя последовательности EST в качестве затравки. Затем использовали рекурсивный алгоритм, чтобы нарастить затравку в удлиненную структуру наращиванием дополнительных последовательностей из разных баз данных (например, базы данных Nuvelo, содержащей последовательности EST, dbEST, версия 124, gbpri 124 и UniGene, версия 124), которые имеют отношение к данной сборке. Алгоритм заканчивался, когда не было дополнительных последовательностей из указанных выше баз данных, которые могли бы удлинить сборку. Включение составляющих последовательностей в сборку было основано на совпадении в BLASTN с удлиняющейся сборкой при оценке в баллах в BLAST больше 300 и идентичностью в процентах выше 95%.
Используя PHRAP (Univ. of Washington) или CAP4 (Paracel), на основе сборки создавали полноразмерную последовательность кДНК гена и соответствующую ей последовательность белка. Любые сдвиги рамки и неправильные стоп-кодоны корректировали посредством редактирования вручную. Во время редактирования последовательность проверяли, используя FASTY и BLAST по отношению к Genbank (например, dbEST версия 124, gbpri 124, UniGene версия 124, Genpept вариант 124). Другими компьютерными программами, которые могли быть использованы в способе редактирования, являлись phredPhrap и Consed (University of Washington) и ed-ready, ed-ext и cg-zip-2 (Hyseq, Inc.). Полноразмерные нуклеотидная и аминокислотная последовательности показаны в списке последовательностей в виде SEQ ID NO: 2 и 4 соответственно.
Чтобы экспрессировать GIPF (SEQ ID NO: 4), полноразмерную ДНК GIPF амплифицировали в ПЦР из библиотеки кДНК Marathon-ready (Clontech). Первичный продукт ПЦР затем амплифицировали, используя гнездовые праймеры для ПЦР, которые создавали полипептид GIPF при экспрессии в подходящих линиях клеток, которые описаны ниже.
ПРИМЕР 3
ЭКСПРЕССИЯ GIPF В ТКАНЯХ МЫШИ И ЧЕЛОВЕКА
A. Распределение мРНК GIPF в тканях
На фигуре 2 показана относительная экспрессия мРНК GIPF, которую получали из тканей человека (A) и мыши (B).
Суммарную мРНК получали их тканей, показанных на фигуре 2, согласно протоколу, предоставленному производителем (Qiagen, Valencia, CA). РНК подвергали количественной ПЦР в режиме реального времени (TaqMan) (Simpson et al., Molec. Vision 6: 178-183 (2000)), чтобы определить относительную экспрессию GIPF в указанных тканях. Прямой и обратный праймеры, которые использовали в реакциях ПЦР в случае РНК человека представляли собой: 5' GACCATGCTGCCTGCTCTGACAC 3' (прямой; SEQ ID NO: 29) и 5' CACCCGCCTCCTTGCTCTCC 3' (обратный; SEQ ID NO: 30) соответственно; и прямой и обратный праймеры, которые использовали в реакциях ПЦР в случае РНК мыши, представляли собой: 5' GGGGGAGACCACACCACCTGCT 3' (SEQ ID NO: 31) и 5' TTGGACCTCGGCTCCTTGCTGTTC 3' (SEQ ID NO: 32) соответственно. Последовательности ДНК, кодирующие фактор элонгации 1, β-актин и АТФ-синтазу 6, использовали в качестве позитивных контролей и факторов нормализации во всех образцах. Все анализы осуществляли в трех повторах и полученные в результате значения усредняли.
На оси Y показано количество копий мРНК GIPF на клетку, при условии, что каждая клетка имеет 400000 мРНК-транскриптов со средней длиной 1,2 п.н. и что 2% суммарной РНК в клетке составляет мРНК. На фигуре 2 показано, что мРНК GIPF экспрессируется на высоких уровнях во всех тестированных тканях. Наиболее высокие уровни мРНК GIPF наблюдали в коже, легком, яичнике и головном мозге мышей и в тонком кишечнике, коже, яичнике, семеннике и головном мозге человека.
B. Распределение белка GIPF в тканях
Экспрессию GIPF в образцах тканей человека регистрировали, используя кроличьи поликлональные анти-GIPF-антитела (таблица 1). Кроличьи поликлональные антитела создавали иммунизацией кроликов пептидом, который, как рассчитано, является иммуногенным и имеет аминокислотную последовательность Glu Ser Lys Glu Ala Gly Ala Gly Ser Arg Arg Arg Lys Gly Gln (SEQ ID NO: 67). Анти-GIPF-антитело аффинно очищали из сыворотки кроликов, используя пептид GIPF, связанный с Affi-Gel 10 (Bio-Rad), и хранили в фосфатно-солевом буфере с 0,1% азида натрия. Образцы тканей надпочечной железы, мочевого пузыря, молочной железы, ободочной кишки, почки, печени, легкого, яичника, поджелудочной железы, плаценты, простаты, кожи, тонкого кишечника, селезенки, желудка, семенника, щитовидной железы, миндалевидной железы и матки готовили для иммуногистохимического анализа (IHC) (LifeSpan Biosciences, Inc., Seatlle, WA), фиксируя ткани в 10% формалине, заливая в парафин и делая срезы с использованием стандартных способов. Срезы исследовали, используя GIPF-специфичное антитело, и визуализировали с помощью конъюгированного с биотином второго антитела против Ig кролика, используя AEC в качестве субстрата.
Клеточная локализация GIPF в тканях человека показана в таблице 1. Наиболее интенсивное окрашивание наблюдали в цитоплазме подгруппы островковых клеток поджелудочной железы и в цитоплазме внутриэпителиальных нейроэндокринных клеток тонкого кишечника и желудка. Заметное окрашивание также присутствовало в коре надпочечников, фовеолярном эпителии желудка и эпителии почечных канальцев. Лимфоциты часто были позитивными и проявляли преимущественно ядерное окрашивание. В коже присутствовала очаговая позитивность в зернистом слое и в пилосебацейных комплексах. В нескольких типах клеток наблюдалось менее интенсивное окрашивание цитоплазмы и ядра, включая респираторный эпителий, пневмоциты типа II, эпителий простаты и эпителий молочной железы. Слабое очаговое окрашивание ядер присутствовало в гепатоцитах, эпителии ободочной кишки, трофобластах плаценты, эпителии молочной железы, яичнике и фолликулярном эпителии щитовидной железы. В клетках ганглиев наблюдали розовое окрашивание, тогда как другие типы клеток, включая железистый эпителий, гладкую мускулатуру, эндотелий, внутрисосудистые нейтрофилы, и фибробласты тестировали как негативные в отношении GIPF.
ПРИМЕР 4
ЖИВОТНЫЕ, ТРАНСГЕННЫЕ ПО GIPF
A. Конструирование вектора GIPF-KI
Конструирование вектора, целенаправленного встраивающего (knock-in) трансген GIPF (GIPF-KI) (фигура 5A), осуществляли согласно способу, описанному ниже и изображенному на фигурах 5B-5R.
ДНК, кодирующую константную область каппа иммуноглобулина мыши (IgCκ) и проксимальную область, получали амплификацией двух фрагментов следующим образом:
Фигура 5B. Получение фрагмента 1 IgCκ
Прямой (igkc1; SEQ ID NO: 34) и обратный (igkc2; SEQ ID NO: 35) праймеры для ПЦР синтезировали на основе последовательности константной области каппа иммуноглобулина мыши (IgCκ) и проксимальной области, которую получали из GenBank (gi: V00777; SEQ ID NO: 33), и использовали для амплификации ДНК, которая кодирует фрагмент 1 фрагмента 1 IgCκ. igkc1: ATCTCGAGGAACCACTTTCCTGAGGACACAGTGATAGG (SEQ ID NO: 34) получали добавлением последовательности узнавания Xho I в 5'-концевом сайте, и igkc2: ATGAATTCCTAACACTCATTCCTGTTGAAGCTCTTGAC (SEQ ID NO: 35) получали добавлением последовательности узнавания EcoR I в 5'-концевом сайте. ПЦР осуществляли, используя 25 нг клона pBluescript SK II(+), который содержит константную область и область соединения мыши (WO00/10383) и служил в качестве матрицы. Продукт ПЦР расщепляли ферментами рестрикции EcoRI и Xho I и лигировали в вектор pBluescript II KS(-) (Stratagene), который предварительно расщепляли ферментами рестрикции EcoR I и XhoI. Полученная в результате плазмида pIgCκA содержала нужную последовательность кДНК фрагмента 1 IgCκ мыши без замены в нуклеотидной последовательности в области между Xho I и EcoRI.
Фигура 5C. Получение фрагмента 2 IgCκ
Прямой (igkc3; SEQ ID NO: 36) и обратный (igkc4; SEQ ID NO: 37) праймеры для ПЦР синтезировали на основе последовательности области мыши, расположенной ниже константной области каппа иммуноглобулина (IgCκ), которую получали из GenBank (gi: V00777; SEQ ID NO: 33), и использовали для амплификации ДНК, которая кодирует фрагмент 2 IgCκ. Igkc3: ATGAATTCAGACAAAGGTCCTGAGACGCCACC (SEQ ID NO: 36) получали добавлением последовательности узнавания EcoR I в 5'-концевом сайте, и igkc4: ATGGATCCTCGAGTCGACTGGATTTCAGGGCAACTAAACATT (SEQ ID NO: 37) получали добавлением последовательности узнавания BamHI, Xho I и Sal I в 5'-концевом сайте. ПЦР осуществляли, используя 25 нг клона pBluescript SK II(+), который содержит константную область и область соединения и служил в качестве матрицы (WO 00/10383). Продукт ПЦР расщепляли ферментами рестрикции EcoR I и BamH I и лигировали в вектор IgCκA (смотри выше), предварительно расщепленный ферментами рестрикции EcoR I и BamH I. Полученная в результате плазмида pIgCκAB содержала намеченные фрагменты кДНК 1 и 2, полученные из константной области иммуноглобулина мыши, без замены в нуклеотидной последовательности в области между EcoR I и BamH I.
Фигура 5D. Встраивание гена пуромицина в pIgCκAB
Плазмиду Lox-P Puro (WO 00/10383) расщепляли ферментами рестрикции EcoR I и Xho I и обрабатывали ДНК-полимеразой T4. Полученный в результате фрагмент лигировали в вектор pIgCκAB (смотри выше), предварительно расщепленный ферментом рестрикции Sal I и обрабатывали ДНК-полимеразой T4. После подтверждения связывания областей между pIgCκ AB и фрагментом Lox-P Puro получали плазмиду pIgCκ ABP.
Фигура 5E. Встраивание кДНК IRES в pIgCκ ABP
Следующие прямой (iresfw; SEQ ID NO: 38) и обратный (iresrv; SEQ ID NO: 39) праймеры для ПЦР синтезировали на основе последовательности области IRES плазмиды pIREShyg (Clontech). iresfw: ATGAATTCGCCCCTCTCCCTCCCCCCCCCCTA (SEQ ID NO: 38) получали добавлением последовательности узнавания EcoRI в 5'-концевом сайте, и iresrv: ATGAATTCGTCGACTTGTGGCAAGCTTATCATCGTGTT (SEQ ID NO: 39) получали добавлением последовательностей узнавания EcoRI и Sal I в 5'-концевом сайте. ПЦР осуществляли, используя 150 нг плазмиды pIREShyg (Clontech) в качестве матрицы. Продукт ПЦР расщепляли ферментом рестрикции EcoR I и лигировали в вектор pGEM-T (Promega), который предварительно был расщеплен ферментом рестрикции EcoRI. Получали плазмиду IRES-Sal/pGEM, которая содержала намеченную последовательность кДНК без замен в нуклеотидной последовательности. Плазмиду IRES-Sal/pGEM расщепляли ферментом рестрикции EcoR I и лигировали в плазмиду pIgCκ ABP (смотри выше), которую предварительно расщепляли ферментом рестрикции EcoRI. После подтверждения последовательности связывающей области между pIgCκ ABP и IRES-Sal получали плазмиду pIgCκ ABP IRES.
Фигура 5F. Конструирование плазмиды PΔCκ Sal
Вектор IgCκ KO (WO00/10383) расщепляли ферментом рестрикции Sac II и затем частично расщепляли ферментом рестрикции EcoRI. Полосу длиной 14,6 т.п.н., в которой отсутствовала область LoxP-PGK Puro, выделяли и лигировали с SacII/EcoRI-совместимым линкером, созданным отжигом следующих двух олигонуклеотидов (Sal1plus и Sal1minus), чтобы заменить область LoxP-PGKPuro сайтом рестрикции Sal I. После подтверждения последовательности получали плазмиду pΔCκSal.
Sal1plus: 5' AGTCGACA 3' (SEQ ID NO: 40) и
Sal1minus: 5' AATTTGTCGACTGC 3' (SEQ ID NO: 41).
Фигура 5G. Конструирование плазмиды pKIκ
Плазмиду pIgCκABP IRES расщепляли ферментом рестрикции Xho I и полученный в результате фрагмент, состоящий из C-области, IRES и loxP-Puromycin, лигировали с вектором pΔCκSal (смотри выше), который предварительно расщепляли ферментом рестрикции Sal I. После подтверждения последовательности получали вектор pKIκ.
Фигура 5H. Получение фрагмента pIgCκΔ IRES
Плазмиду pIgCκ ABP IRES частично расщепляли ферментами рестрикции EcoR I и Bgl II и выделяли полученный в результате фрагмент pIgCκΔ IRES, в котором отсутствовала часть гена IRES.
Фигура 5I. Получение фрагмента промотора P2 мыши с помощью ПЦР
Следующие праймеры для ПЦР синтезировали на основе последовательности промотора каппа иммуноглобулина мыши, полученной из GenBank (gi: aj231225; SEQ ID NO: 42). P2F: CCCAAGCTTTGGTGATTATTCAGAGTAGTTTTAGATGAGTGCAT (SEQ ID NO: 43) получали добавлением последовательности узнавания Hind III в 5'-концевом сайте, и P2R: ACGCGTCGACTTTGTCTTTGAACTTTGGTCCCTAGCTAATTACTA (SEQ ID NO: 44) получали добавлением последовательности узнавания Sal I в 5'-концевом сайте. ПЦР осуществляли, используя 25 нг геномной ДНК мыши в качестве матрицы (геномная ДНК из ES-клеток TT2F). Продукт ПЦР расщепляли ферментами рестрикции Hind III и Sal I и лигировали в вектор pBluescript II KS- (Stratagene), который предварительно расщепляли ферментами рестрикции Hind III и Sal I. После подтверждения последовательности полученную в результате плазмиду расщепляли ферментами рестрикции Hind III и Sal I и выделяли Hind III-Sal I-фрагмент, содержащий фрагмент промотора P2 мыши.
Фигура 5J. Получение неполного фрагмента полиА Cκ с помощью ПЦР
Следующие праймеры для ПЦР синтезировали на основе последовательности поли-A-области каппа иммуноглобулина мыши, полученной из GenBank (gi: v00777) PPF: ACGCGTCGACGCGGCCGGCCGCGCTAGCAGACAAAGGTCCTGAGACGCCACCACCAGCTCCCC (SEQ ID NO: 45) получали добавлением последовательности узнавания Sal I, Fse I и Nhe I в 5'-концевом сайте, и PPR: GAAGATCTCAAGTGCAAAGACTCACTTTATTGAATATTTTCTG (SEQ ID NO: 46) получали добавлением последовательности узнавания Bgl II в 5'-концевом сайте. ПЦР осуществляли, используя 25 нг геномной ДНК мыши в качестве матрицы (геномная ДНК из ES-клеток TT2F). Продукт ПЦР расщепляли ферментами рестрикции Sal I и Bgl II и лигировали в вектор psp72 (Promega KK), который предварительно расщепляли ферментами рестрикции Sal I и Bgl II. После подтверждения последовательности очищенную плазмиду расщепляли ферментами рестрикции Sal I и Bgl II, чтобы создать «неполный фрагмент полиА Ck».
Фигура 5K. Получение полного фрагмента полиА Cκ с помощью ПЦР
Следующие праймеры для ПЦР синтезировали на основе последовательности полиА-области каппа иммуноглобулина мыши, полученной из GenBank (gi: v00777): TPF: GGAATTCAGACAAAGGTCCTGAGACGCCACCACCAGCTCCCC (SEQ ID NO: 47) получали добавлением последовательности узнавания EcoR I в 5'-концевом сайте и TPR: CCCAAGCTTGCCTCCTCAAACCTACCATGGCCCAGAGAAATAAG (SEQ ID NO: 48) получали добавлением последовательности узнавания Hind III в 5'-концевом сайте. ПЦР осуществляли, используя 25 нг геномной ДНК мыши в качестве матрицы (геномная ДНК из ES-клеток TT2F). Продукт ПЦР расщепляли ферментами рестрикции EcoR I и Hind III и лигировали в вектор pBluescript II KS- (Stratagene), который предварительно расщепляли ферментами рестрикции EcoRI и HindIII. После подтверждения последовательности плазмиду расщепляли ферментами рестрикции EcoR I и Hind III, чтобы создать «полный фрагмент полиА Ck».
Фигура 5L. Конструирование ДНК-фрагмента A, который состоит из полного фрагмента полиА Cκ, фрагмента промотора P2 и неполного фрагмента полиА Ck
«Полный фрагмент полиА Cκ», «фрагмент промотора P2» и «неполный фрагмент полиА Cκ», созданные, как описано выше, лигировали в описанном порядке в вектор pBluescript II KS- (Stratagene), которые предварительно расщепляли ферментами рестрикции EcoR I и Bgl II. После подтверждения последовательности очищенную плазмиду расщепляли ферментами рестрикции EcoR I и Bgl II, создавая «ДНК-фрагмент A».
Фигура 5M. Конструирование плазмиды pIgCκΔ IRES ProA
«ДНК-фрагмент A» лигировали во «фрагмент pIgCκΔ IRES», выделенный, как описано выше. После подтверждения последовательности получали плазмиду pIgCκΔ IRES ProA.
Фигура 5N. Конструирование плазмиды Cκ P2 H
Плазмиду pIgCκΔ IRES ProA расщепляли Xho I и выделенный таким образом основной фрагмент, который содержал геномную область, расположенную выше IgCκ мыши, IgCκ мыши, ДНК-фрагмент A и Lox-P Puro, лигировали с pΔCκ Sal, которую предварительно расщепляли ферментом рестрикции Sal I. После подтверждения последовательности получали плазмиду Cκ P2 H.
Фигура 5O. Конструирование плазмиды Cκ 5'-genomic
Следующие праймеры для ПЦР синтезировали на основе последовательности участка ДНК, содержащего гены J- и C-области каппа иммуноглобулина мыши, полученной из GenBank (gi: v00777). 5GF: ATAAGAATGCGGCCGCCTCAGAGCAAATGGGTTCTACAGGCCTAACAACCT (SEQ ID NO: 49) получали добавлением последовательности узнавания Not I в 5'-концевой сайт, и 5GR: CCGGAATTCCTAACACTCATTCCTGTTGAAGCTCTTGACAATGG, (SEQ ID NO: 50) получали добавлением последовательности узнавания в 5'-концевой сайт. ПЦР осуществляли, используя 25 нг геномной ДНК мыши (геномная ДНК из ES-клеток TT2F в качестве матрицы). Продукт ПЦР расщепляли ферментами рестрикции Not I и EcoR I и лигировали с вектором pBluescript II KS- (Stratagene), которые предварительно расщепляли ферментами рестрикции Not I и EcoRI. После подтверждения последовательности получали плазмиду Cκ 5'-genomic.
Фигура 5P. Конструирование плазмиды Cκ P2 KIΔ DT
Плазмиду Cκ P2 H расщепляли EcoRI и Xho I и получали фрагмент длиной 11 т.п.н. и лигировали в плазмиду Cκ 5'-genomic, которую предварительно расщепляли ферментами рестрикции EcoR I и Xho I. После подтверждения последовательности получали плазмиду Cκ P2 KIΔ DT.
Фигура 5Q. Конструирование вектора Cκ P2 KI
Фрагмент DT-A выделяли из плазмиды PKIκ, используя ферменты рестрикции Xho I и Kpn I, и лигировали в плазмиду Cκ P2 KIΔ DT, которую предварительно расщепляли ферментами рестрикции XhoI и Kpn I. После подтверждения последовательности получали вектор CkP2 KI.
Фигура 5R. Сборка вектора GIPF-KI
Фрагмент кДНК GIPF амплифицировали, используя следующие праймеры для ПЦР, которые синтезировали на основе последовательности кДНК GIPF человека (SEQ ID NO: 2). SA3F: ACGCGTCGACCCACATGCGGCTTGGGCTGTGTGT (SEQ ID NO: 51) получали добавлением последовательности узнавания Sal I и последовательности Козака в 5'-концевой сайт, и SA3R: ACGCGTCGACGTCGACCTAGGCAGGCCCTG (SEQ ID NO: 52) получали добавлением последовательности узнавания Sal I в 5'-концевой сайт. ПЦР осуществляли, используя пул кДНК Marathon-Ready (фетальная кожа и фетальное легкое, BD Biosciences CLONTECH) в качестве матрицы. Продукт ПЦР продукт расщепляли ферментом рестрикции Sal I и лигировали с вектором pBluescript II KS- (Stratagene), который предварительно расщепляли ферментом рестрикции Sal I. После подтверждения последовательности получали клон и подтверждали, что он содержит правильную последовательность кДНК GIPF без замены в нуклеотидной последовательности. Клон расщепляли ферментом рестрикции Sal I и фрагмент кДНК GIPF очищали и лигировали в вектор Cκ P2 KI, который предварительно расщепляли ферментом рестрикции Sal I. После подтверждения последовательности получали вектор GIPF-KI (фигура 5A).
B. Создание трансгенных мышей GIPF-KI
Общие способы получения эмбрионов мышей, культивирования, инъекции ES-клеток в эмбрионы, трансплантации в матки приемных матерей осуществляли согласно способу, описанному в Aizawa Shinichi, "Biomanual Series 8, Gene Targeting", published by Yodosha, 1995.
Вектор GIPF-KI линеаризовали, используя Not I, и переносили в полученные из F1 C57BL/6 X CBA ES-клетки TT2F мыши ((Uchida, 1995), Lifetech oriental) электропорацией согласно способу, описанному в Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", published by Yodosha, 1995. Подвергнутые электропорации ES-клетки суспендировали в 20 мл среды для ES [DMEM (GIBCO), 18% FCS (GIBCO), 0,1 мМ 2-меркаптоэтанол (GIBCO), 1000 ед./мл LIF (лейкоз-ингибирующий фактор, CHEMICON International, Inc.)] и инокулировали в две пластиковые чашки для культуры ткани диаметром 100 мм (Corning), в которые предварительно высевали питающие клетки (Invitrogen). Через день среду заменяли средой, содержащей 0,75 г/мл пуромицина (Sigma). Через семь-девять дней после этого собирали всего 119 образованных колоний. Каждую колонию выращивали до слитого состояния в 12-луночной чашке и затем четыре пятых культуры суспендировали в 0,2 мл среды для криоконсервации [ES-среда + 10% ДМСО (Sigma)] и хранили в замороженном виде при -80°C. Оставшуюся одну пятую часть инокулировали в 12-луночный покрытый желатином планшет и культивировали в течение 2 дней. Затем выделяли геномную ДНК, используя набор для выделения ДНК Puregene (Gentra System). Геномную ДНК, выделенную из резистентных к пуромицину клеток TT2F, расщепляли ферментом рестрикции EcoR I (Takara Shuzo) и затем подвергали электрофорезу в 0,8% агарозном геле. Разделенные фрагменты ДНК переносили на мембрану (GeneScreen, NENTM Life Science Products) и затем осуществляли гибридизацию, используя в качестве зонда фрагмент ДНК, полученный из 3'-области геномной ДНК IgJκ-Cκ (Xho I-EcoR I, 1,3 т.п.н. (SEQ ID NO: 67): WO 00/10383, пример No. 48). На картине полос не измененного клона ES видна одна полоса с М.м., соответствующей примерно 15 т.п.н., а в случае целенаправленно измененного клона ES видны две полосы с М.м., соответствующей примерно 15 т.п.н. и 13,4 т.п.н. (фигура 6). Два из 48 целенаправленно измененных клонов ES № 10, 12 отбирали после Саузерн-анализа (процент гомологичной рекомбинации составлял примерно 4,2%). Отобранные клоны ES также тестировали в анализе кариотипов согласно способу, описанному Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", published by Yodosha, 1995. Два клона ES № 10, 12, в которых наблюдали нормальный кариотип, использовали для имплантации в эмбрионы.
Клетки замороженных исходных культур целенаправленно измененных клонов клеток ES № 10, 12 размораживали, начинали культивировать и инъецировали в эмбрионы на стадии 8 клеток, полученные при скрещивании самца и самки мыши линии мышей, нокаутированных по тяжелой цепи иммуноглобулина (Tomizuka et. al. Proc. Natl. Acad. Sci. USA, 97: 722-727, 2000); норма инъекции составляла 10-12 клеток на эмбрион. После культивирования эмбрионов в течение ночи в среде для ES-клеток для развития в бластоцисты примерно десять эмбрионов с инъецированными клетками TT2F трансплантировали с каждой стороны матки приемной матери мыши ICR (CREA JAPAN, INC.), которую подвергали обработке для получения состояния псевдобеременности в течение 2,5 дней. В результате трансплантации из общего количества инъецированных эмбрионов, составляющего 120, родилось 24 потомка мышей. Химеризм потомства определяли по степени полученной благодаря клеткам TT2F масти агути (темно-коричневая) в полученной от эмбриона-хоязина (ICR) масти альбинос. Выяснено, что из 24 потомков 11 мышей (мышей knock-in) имели частичную масть агути, что свидетельствовало о вкладе ES-клеток. Геномную ДНК, выделенную из хвостов мышей knock-in, использовали для анализа ПЦР. Два следующих праймера для ПЦР синтезировали на основе последовательности вектора GIPF-KI: SACF: CTGACTAGACTCTATCTTGC (SEQ ID NO: 53) и SACR: CCACGGAGACCACTCGCTCATT (SEQ ID NO: 54). ПЦР осуществляли, используя 25 нг геномной ДНК из хвоста мыши в качестве матрицы. Полученный в результате реакционный раствор подвергали электрофорезу в 0,8% агарозном геле и выявили полосу 606 п.н.. Нормальные клоны клеток TT2F использовали для получения контрольных химерных мышей.
Мышей содержали в условиях цикла 12/12-часов темнота/освещение (свет включали в 8:00 утра) и они получали профильтрованную через 5 мкм-фильтру и корм CE-2 (CLEA JAPAN, INC.) по желанию. Самцов мышей содержали отдельно после отнятия от груди.
ПРИМЕР 5
ОЦЕНКА БИОЛОГИЧЕСКОЙ АКТИВНОСТИ GIPF С ИСПОЛЬЗОВАНИЕМ ТРАНСГЕННЫХ МЫШЕЙ GIPF-KI
Макроскопические патологические изменения и гистологические изменения тонкого кишечника и ободочной кишки трансгенных мышей, описанных выше, оценивали следующим образом.
Трансгенные по GIPF мыши KI демонстрировали рост тонкого кишечника за счет увеличения размера клеток, начиная с 4-недельного возраста, и значительное вздутие живота во время развития. На фигуре 7 показано, что трансгенные по GIPF KI-мыши 15-недельного возраста имеют заметное вздутие живота и увеличенную массу тонкого кишечника по сравнению с соответствующей контрольной KI-мышью. Гистопатологическую оценку с использованием окрашивания гематоксилином и эозином (Г+Э) (Issacson, P. G., and Wright, D. H., 1983) осуществляли на залитых в парафин срезах (толщиной 5 мкм) различных тканей, включая печень, селезенку, легкое, почки, сердце, тонкий кишечник и толстый кишечник. Г+Э-срезы тонкого кишечника показаны на фигуре 8 (при малом увеличении) и фигуре 9 (при большом увеличении). Гистопатологическое описание представлено IDEXX Laboratories, Inc. и описано ниже.
Единственное значимое различие между гистологической картиной тканей от контрольных мышей и мышей knock-in обнаружено в тонком кишечнике. Указанное изменение заключается в заметном диффузном утолщении слизистой оболочки в результате эпителиальной гиперплазии крипт с заметным увеличением длины крипт и сложности ветвления. Крипты были выстланы вздутыми цилиндрическими эпителиальными клетками с базофильной цитоплазмой и базально расположенными крупными овоидными гетерохроматическими ядрами с частыми митозами. Многочисленные апоптозные тельца были рассеяны по эпителию крипт, свидетельствуя о повышенной скорости оборота клеток. Эпителиальные клетки крипт в большинстве случаев также дифференцировались как в клетки Панета, так и в секретирующие слизь бокаловидные клетки на протяжении длины крипт. Ворсистый эпителий существенно не изменялся. Сходные изменения наблюдали в слизистой оболочке тонкого кишечника, связанной с Пейеровыми бляшками. Слизистая оболочка кишечника в норме вытягивается в наружную сторону и может образовывать небольшие впячивания в лимфоидную ткань Пейеровой бляшки. У мышей GIPF-KI гиперпластические изменения также наблюдали на поверхности и во впячиваниях, где изменения были связаны с умеренно острым воспалением и накоплениями некротических клеток в криптах, т.е. микроабсцессами крипт. Срез такой Пейеровой бляшки был сделан тангенциально, поэтому количество и характер лимфоидной ткани было трудно оценить. Однако имелись небольшие количества плазматических клеток, что свидетельствовало о трансформации B-лимфоцитов в клетки, продуцирующие антитела. Других видимых изменений в популяциях лимфоидных клеток или воспалительных клеток в кишечнике или других тканях не было.
Чтобы измерить пролиферацию эпителиальных клеток кишечника у мышей KI, осуществляли иммуногистохимический анализ с использованием моноклонального антитела крыс против мышиного антигена Ki67 (Dako Ltd., High Wycombe, UK) на залитых в парафин срезах тонкого кишечника контрольных мышей и мышей GIPF KI согласно инструкции производителя и описанному ранее способу (Scholzen, T. et al. 2000). Как показано на фигуре 10, у мышей GIPF KI наблюдали повышенное количество Ki67-позитивных эпителиальных клеток в тонком кишечнике, что свидетельствовало о повышенной пролиферации при экспрессии белка GIPF.
Трех мышей GIPF-KI исследовали в 12-месячном возрасте. Указанные мыши 12-месячного возраста проявляли типичное вздутие живота и повышенную массу кишечника, которые наблюдали у более молодых животных. Готовили Г+Э-срезы различных тканей, включая селезенку, печень, надпочечник, почку, тимус, сердце, легкое, тонкий кишечник, толстый кишечник, желудок и головной мозг.
Гистологический анализ срезов тонкого кишечника мышей GIPF-KI 12-месячного возраста показал, что GIPF индуцировал заметное увеличение длины крипт и в такой же степени, как увеличение, наблюдаемое у животных GIPF-KI 15-недельного возраста. Кроме того, гистологический анализ срезов других органов выявил, что на протяжении длительного периода, составляющего 12 месяцев, GIPF не проявлял какой-либо видимой онкогенной активности. Спонтанный онкогенез иногда наблюдается у некоторых мышей, независимо от того, были ли мыши нормальными или KI-трансгенными животными. У контрольных мышей 12-месячного возраста наблюдалась низкая частота аденомы печени.
ПРИМЕР 6
АДЕНОВИРУСНЫЙ GIPF-ВЕКТОР
кДНК GIPF (SEQ ID NO: 2) клонировали в pAdenoVatorCMV5-Intron, используя сайты NheI и XbaI в сайтах множественного клонирования (MCS), чтобы создать V5His6-меченый GIPF-рекомбинантный аденовирус. pAdenoVator-CMV5-Intron получали посредством модификации pAdenoVatorCMV5-IRES-GFP (Qbiogene, Carlsbad, CA, USA). pAdenoVator-CMV5-IRES-GFP расщепляли SpeI, чтобы удалить его MCS, IRES и GFP и лигировали с ПЦР-амплифицированным Intron-MCS-V5His-BGH polyA на основе вектора pcDNA/Intron с использованием праймеров: 5'-CACCCCTAGGTCAATATTGGCCATTAGC-3' (SEQ ID NO: 55) и 5'-CACCCCT-AGGTAGGCATCCCCAGCATGC-3' (SEQ ID NO: 56).
Трансформацию бактериальных клеток BJ5183 (Qbiogene, Carlsbad, CA, U. S. A), которые несут плазмиду AdEasy-1, которая кодирует геном аденовируса-5 (делетированный по E1/E3), линеаризованным вектором для переноса осуществляли электропорацией согласно инструкциям производителя. Создавали рекомбинантный аденовирус и амплифицировали в клетках QBI-293A (Qbiogene, Carlsbad, CA, U. S. A) и очищали зональным центрифугированием в CsCl, как описано ранее (Garnier, A., J. Cote et al. 1994). Экспрессию рекомбинантного белка клетками 293A, которые были инфицированы рекомбинантным аденовирусом, измеряли в Вестерн-анализе, используя анти-V5-антитело (Invitrogene Inc., Carlsbad, CA). Титр очищенных в CsCl рекомбинантных вирусов измеряли с использованием набора для быстрого определения титра Adeno-X (BD biosciences, Palo Alto, U. S. A.) согласно протоколам производителя. Коротко, исходную культуру вирусов тестировали посредством инфекции клеток 293A серийными разведениями исходной культуры рекомбинантного аденовируса с последующей фиксацией и окрашиванием трансдуцированных клеток мышиным антителом против гексона через 48 часов после инфекции. Сигнал регистрировали с использованием козьего антитела против антител мыши, конъюгированным с пероксидазой хрена, и выявляли с применением усиленного металлом тетрагидрохлорида 3,3'-диаминобензидина (DAB).
ПРИМЕР 7
ВВЕДЕНИЕ GIPF-АДЕНОВИРУСА В КАЧЕСТВЕ МОДЕЛИ ДЛЯ ОЦЕНКИ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ GIPF
GIPF-рекомбинантный аденовирус вводили нормальным мышам, чтобы определить влияние GIPF на эпителий кишечника и ободочной кишки и чтобы подтвердить, что фенотип, наблюдаемый у трансгенных по GIPF мышей, может быть создан у нетрансгенного животного. Перед инъекцией аденовируса мышей BALB/C 6-8-недельного возраста анестезировали с использованием изофлурана. 1×1010 вирусных частиц на мышь инъецировали через ретроорбитальную вену. Такой же титр контрольного вируса (пустого вируса) или отдельно PBS использовали в качестве контролей. Мышей забивали на 3 день или 5 день после инъекции вируса (n=3 во всех группах). За 4 часа до умерщвления внутрибрюшинно (в/б) инъецировали 1 мг бромдезоксиуридина (BrdU), чтобы определить пролиферацию in vivo эпителиальных клеток. Различные ткани, включая тонкий кишечник, ободочную кишку, селезенку, печень и костный мозг, собирали и фиксировали в формалине. Залитые в парафин срезы красили гематоксилином и эозином (Г+Э) для гистологической оценки. Срезы также обрабатывали для иммуногистохимического анализа BrdU согласно инструкции производителя (Oncogene Research product, Boston, U. S. A.). Как описано ранее (McKinley, J. N. et al. 2000). Также осуществляли иммуногистохимический анализ с использованием моноклонального антитела крысы против антигена Ki67 мыши (Dako Ltd., High Wycombe, UK), чтобы оценить пролиферацию эпителиальных клеток кишечника согласно инструкции производителя и способу, описанному ранее (Scholzen, T. et al. 2000).
Окрашивание Г+Э срезов тонкого кишечника мышей, которых умерщвляли через 3 для после инъекции аденовируса (фигура 11), показало, что тонкий кишечник мышей, которые получали GIPF-аденовирус, был значительно изменен и имел такие же гистологические характеристики, которые наблюдали у GIPF-трансгенных мышей (фигуры 8 и 9). Гистологические изменения, вызванные GIPF, включали заметное диффузное утолщение слизистой оболочки в результате эпителиальной гиперплазии крипт с заметным увеличением длины крипт и сложности ветвления. Крипты были выстланы вздутыми цилиндрическими эпителиальными клетками с базофильной цитоплазмой и базально расположенными крупными овоидными гетерохроматическими ядрами с частыми митозами. Эпителиальные клетки крипт в большинстве случаев также дифференцировались как в клетки Панета, так и в секретирующие слизь бокаловидные клетки на протяжении длины крипт. Влияние GIPF на пролиферацию эпителиальных клеток крипт дополнительно усиливалось на 5 день после инъекции вируса, как показано на фигуре 12. Чтобы оценить влияние GIPF на пролиферацию эпителиальных клеток кишечника осуществляли включение BrdU и иммуноокрашивание Ki67 на срезах тонкого кишечника контрольных мышей и мышей, которые получали GIPF-аденовирус. Как показано на фигурах 13 и 14, мыши, которые получали GIPF-аденовирус, имели маленькие кишечные крипты, которые имели значительно больше BrdU- и Ki67-позитивных клеток, соответственно. Биологическое влияние GIPF на пролиферацию эпителиальных клеток крипт также наблюдали при более низкой дозе вируса, составляющей 1×109 вирусных частиц на мышь (фигуре 15). В дополнение к эффекту, наблюдаемому в тонком кишечнике, GIPF также индуцировал гиперплазию эпителия крипт с заметным увеличением длины крипт и повышенным количеством и размером клеток бокаловидных клеток в ободочной кишке (фигура 16).
ПРИМЕР 8
ЭКСПРЕССИЯ ВЕКТОРОВ, КОДИРУЮЩИХ GIPF и АНАЛОГИ GIPF
кДНК, кодирующую GIPF (SEQ ID NO: 3), клонировали в векторе pcDNA/Intron, используя сайты KpnI и XbaI, чтобы создать GIFT дикого типа и V5His6-меченый на карбоксильном конце GIPF (SEQ ID NO: 5). Экспрессирующий вектор млекопитающих pcDNA/Intron получали посредством генетической модификации вектора pcDNA3.1TOPO (Invitrogene Inc., Carlsbad, CA) введением сконструированного химерного интрона, полученного из экспрессирующего вектора млекопитающих pCI (Promega, Madison, WI). pCI расщепляли BglII и KpnI и последовательность интрона клонировали в pcDNA3.1, который был расщеплен BglII и KpnI. ОРС GIPF из последовательности SEQ ID NO: 2 (SEQ ID NO: 3) сначала клонировали в pcDNA3.1/V5His-TOPO (Invitrogen) с помощью ПЦР, используя следующие прямой 5' CACCATGCGGCTTGGGCTGTCTC 3' (SEQ ID NO: 57) и обратный 5' GGCAGGCCCTGCAGATGTGAGTG 3' (SEQ ID NO:58) праймеры, и KpnI-XbaI-вставку из pcDNA 3.1/V5His-TOPO, которая содержит полную ОРС GIPF, лигировали в модифицированный вектор pcDNA/Intron, чтобы создать конструкцию pcDNA/Intron.
Аналоги полноразмерного белка GIPF создавали следующим образом. Мутацию рассчитанных консенсусных сайтов расщепления фурином (аминокислота 28 R/Q) GIPF в pcDNA/Intron получали сайт-направленным мутагенезом, используя праймеры 5'-GATCAAGGGGAAACAGCAGAGGCGGATCAG-3' (SEQ ID NO: 59) и 5'-CTGATCCGCCTCTGCTGTTTCCCCTTGATC-3' (SEQ ID NO: 60). Делеционный мутант GIPF (делетированные аминокислотные остатки 21-31) (SEQ ID NO: 16) создавали, используя способ сшивания. Делецию вводили ПЦР-амплификацией двух фрагментов с использованием набора праймеров 1: 5'-CACCGCTAGCCTCGAGAATTCACGCGTG-3' (SEQ ID NO: 61) и фосфо-5'-GCTGATGGTGAGGTGCGTC-3' (SEQ ID NO: 62), набора 2: фосфо-5'-ATCAGTGCCGAGGGGAGCCAG-3' (SEQ ID NO: 63) и 5'-GCCCTCTAGAGCGGCAGGCCCTGCAGATG-3' (SEQ ID NO: 64), с последующим лигированием двух фрагментов. кДНК GIPF, несущую делецию аминокислот 21-31, амплифицировали в ПЦР, используя прямой и обратный праймеры с последовательностями SEQ ID NO: 61 и 64 соответственно, расщепляли NheI и XbaI и субклонировали в векторе pcDNA/Intron, используя сайты NheI и XbaI в его сайтах множественного клонирования. Подтверждали последовательности обоих мутантов.
Домен тромбоспондина (TSP) (нуклеотиды от 451 до 618 ОРС GIPF (SEQ ID NO: 13) также клонировали в векторе pcDNA/Intron для экспрессии у млекопитающих. кДНК, кодирующую домен TSP, амплифицировали в ПЦР, используя NheI-прямой праймер: CCGGCTAGCCACCATGGCGCAATGTGAAATGA (SEQ ID NO: 65) и NotI-обратный праймер: CCATGCGGCCGCCCTCCTCACTGTGCACCT (SEQ ID NO: 66). Расщепленный ферментами рестрикции NheI и NotI продукт ПЦР лигировали в расщепленный NheI и NotI вектор pcDNA/Intron. Чтобы создать рекомбинантный аденовирус, домен TSP, полученный в результате описанной выше ПЦР-амплификации, клонировали в pAdenoVator- CMV5-Intron, используя ферменты рестрикции NheI и NotI. Подтверждали последовательность ПЦР-амплифицированного домена TSP.
Другие аналоги, в которых отсутствуют различные части фурин-подобной богатой цистеином области GIPF, описаны в примере 19.
Биологическую активность аналогов GIPF, описанных выше, оценивали in vivo и in vitro, используя способы, описанные в примерах ниже. Биологическую активность аналогов GIPF оценивали с использованием трансгенной по GIPF модели.
ПРИМЕР 9
ОЧИСТКА РЕКОМБИНАНТНОГО GIPF
A. Экспрессия и очистка GIPFt в эукариотических клетках:
V5-His-меченый GIPF (GIPFt) (SEQ ID NO: 5) экспрессировали в клетках HEK293 и CHO клетки и очищали следующим образом:
Стабильную культуру клеток HEK293, которые были трансфицированы конструкцией GIPF-pcDNA/Intron, содержащей ДНК, кодирующую VS-His-меченый полипептид GIPF (SEQ ID NO: 5), выращивали в бессывороточной среде 293 Free-style (GIBCO). Суспензионную культуру высевали при плотности клеток 1 миллион клеток/мл и собирали через 4-6 дней. Уровень V5-His-меченого GIPF, который был секретирован в культуральную среду, анализировали в ELISA.
Стабильную культуру клеток CHO, которые были трансформированы вектором pDEF 25, содержащим нуклеотидную последовательность, которая кодирует V5-His-меченый GIPF (SEQ ID NO: 5), выращивали в бессывороточной среде EX-CELL302 (JRH). Экспрессирующий вектор содержит последовательность ДНК, которая кодирует DHFR, который обеспечивает возможность позитивной селекции и амплификации в присутствии метотрексата (MTX). Уровень V5-His-меченого GIPF, который был секретирован в культуральную среду, анализировали в ELISA.
Среду, содержащую секретированный белок GIPF, собирали и замораживали при -80°C. Среды размораживали при 4°C и добавляли ингибиторы протеаз, EDTA и Pefabloc (Roche, Basel, Switzerland) в конечной концентрации 1 мМ каждого для предотвращения разрушения GIPF. Среды фильтровали через 0,22 мкм-фильтр PES (Corning) и концентрировали в 10 раз, используя систему TFF (Pall Filtron) с мембраной с пределом отсечения по молекулярной массе 10 кД. Буферы концентрированных сред заменяли 20 мМ фосфатом натрия, 0,5 М NaCl, pH 7. Добавление 0,5 М NaCl в фосфатный буфер является важным для сохранения полной растворимости V5-His-меченого GIPF при pH 7 во время очистки. После ультрафильтрации и диафильтрации добавляли смесь ингибиторов протеаз млекопитающих (Sigma) в конечном разведении 1:500 (об./об.).
Аффинную хелатирующую колонку HiTrap Ni2+ (Pharmacia) уравновешивали 20 мМ фосфатом натрия, pH 7, 0,5 М NaCl. Среду с замененным буфером фильтровали через 0,22 мкм-фильтр PES и наносили на Ni2+-хелатирующую аффинную колонку. Ni2+-колонку промывали 10 объемами колонки (CV) 20 мМ имидазола и белок элюировали градиентом имидазола от 20 мМ до 300 мМ в 35 CV. Фракции анализировали в SDS-ПААГ и Вестерн-блоте. Фракции, содержащие V5-His-меченый GIPF, анализировали и объединяли, получая раствор белка GIPF, который имел чистоту 75-80%.
Буфер, содержащий белок GIPF, выделенный с использованием Ni2+-колонки, заменяли на 20 мМ фосфат натрия, 0,3 М аргинин, pH 7, чтобы удалить NaCl. NaCl заменяли 0,3 М Arg в фосфатном буфере, чтобы поддерживать полную растворимость V5-His-меченого белка GIPF во время последующих стадий очистки. Белок GIPF, выделенный с использованием Ni2+-колонки, наносили на высокоэффективную катионообменную колонку с сефарозой SP (Pharmacia, Piscataway, NJ), которая была уравновешена 20 мМ фосфатом натрия, 0,3 М аргинином, pH 7. Колонку промывали 8 CV 0,1 М NaCl и элюировали градиентом от 0,1 М до 1 М NaCl в 30 CV. Фракции, содержащие V5-His-меченый GIPF, объединяли, получая раствор белка, который имел чистоту 90-95%.
Буфер объединенных фракций заменяли 20 мМ фосфатом натрия, pH 7,0, 15 М NaCl, белок концентрировали до 1 или 2 мг/мл и пропускали через стерильный 0,22 мкм-фильтр. Чистый препарат GIPF хранили при -80°C.
Выход белка, полученный в конце каждой стадии очистки, анализировали и количественно оценивали в ELISA, анализе белка по Бредфорду и ВЭЖХ. Извлечение белка GIPFt в процентах определяли на каждой стадии процесса очистки, и результаты показаны в таблице 2 ниже.
Анализ в SDS-ПААГ очищенного белка GIPF осуществляли в восстанавливающих и не восстанавливающих условиях, и показано, что V5-His-меченый белок GIPF, полученный как из клеток CHO, так и из клеток 293, существует в виде мономера. Белок GIPF гликозилирован и мигрирует в SDS-ПААГ в не восстанавливающих условиях с молекулярной массой (М.м.) примерно 42 кД. Существует небольшое различие по М.м. белка GIPF, очищенного из клеток CHO, и белка GIPF, очищенного из клеток HEK293. Это различие можно объяснить степенью, в которой GIPF гликозилируется в разных типах клеток. Анализ N-концевой последовательности показал, что клетки HEK293 продуцировали две формы полипептида: доминантную мутантную форму (SEQ ID NO: 10), которая соответствует белку GIPF с последовательностью SEQ ID NO: 4, в которой отсутствует сигнальная последовательность, и зрелую форму (SEQ ID NO: 12), которая соответствует белку GIPF с последовательностью SEQ ID NO: 4, в которой отсутствует как сигнальный пептид, так и последовательность расщепления фурином. Две формы хорошо разделялись на колонке SP и экспрессировались в соотношении зрелой формы к доминантной зрелой форме примерно 1:2.
Определяли влияние NaCl и аргинина (Arg) на растворимость белка GIPF при pH 7, и результаты показаны на фигуре 17 A. Определено, что в отсутствие 0,3 М Arg происходит 50% потеря белка во время очистки. На фигуре 17 B показана растворимость очищенного белка в PBS (20 мМ фосфат натрия, 0,15 М NaCl, pH 7). Белок GIPF сохранялся в растворе при концентрациях до 8 мг/мл при 4°C, pH 7 в течение 7 дней.
В заключение, очистку V5-His-меченого GIPF из культур клеток HEK293 или CHO осуществляли 1) концентрированием и диафильтрацией белка GIPF, присутствующего в культуральных средах, 2) осуществлением Ni2+-хелатирующей аффинной хроматографии, и 3) SP-катионообменной хроматографии. Способ очистки давал белок GIPF, очищенный >90%. Общее извлечение при данном способе очистки составляет примерно 50%. Добавление 0,5 М NaCl к буферу в ходе осуществления очистки диафильтрацией сред и на Ni-колонке имеет важное значение для поддержания GIPF в полностью растворимом состоянии при pH 7. Для связывания GIPF на колонке SP NaCl удаляли и добавляли 0,3 М Arg, чтобы сохранить высокую растворимость и повысить извлечение белка. Показано, что добавление 0,5 М NaCl и 0,3 Arg во время первой и второй стадий очистки увеличивает общее извлечение по меньшей мере с 25% до 50%.
Доминантную зрелую и зрелую формы V5His-меченого GIPF использовали для тестирования биологической активности GIPF in vivo в условиях, описанных в примере 10. Белок, очищенный способом согласно данному примеру, всегда индуцировал значительную пролиферацию эпителиальных клеток кишечных крипт, которая лежит в основе растяжения тонкого кишечника мышей, которым вводили очищенный белок GIPF.
B. Экспрессия и очистки GIPFwt в эукариотических клетках:
Немеченый белок GIPF дикого типа (GIPFwt; SEQ ID NO: 4) экспрессировали и очищали способом, сходным со способом, описанным для меченого белка GIPF. Стабильную культуру клеток HEK293, которые были трансфицированы вектором pcDNA/Intron, содержащим ДНК (SEQ ID NO: 3), кодирующую полноразмерный полипептид GIPF (GIPFwt) (SEQ ID NO: 4), адаптировали для роста в суспензии и выращивали в бессывороточной среде 293 Free-style (GIBCO) в присутствии 25 мкг/мл генетицина.
Рост культуры клеток во вращающемся сосуде: для получения в небольшом масштабе во вращающихся сосудах аликвоту замороженной исходной культуры клеток выращивали и размножали в среде 293 Free-style с добавлением 0,5% фетальной сыворотки теленка (FBS). Клетки высевали и размножали во вращающихся сосудах при плотности клеток 0,3-0,5 миллион/мл при каждом посеве. Когда накапливалось достаточное количество клеток для получения и плотность клеток достигала 1 миллион клеток/мл, среды заменяли бессывороточными средами 293 Free-style, чтобы удалить 0,5% FBS, и собирали через 6 дней. Начальная жизнеспособность клеток составляла 80-90% и снижалась до 30% во время сбора. Уровень GIFPwt, который был секретирован в культуральную среду, оценивали с помощью ELISA и Вестерн-блота. Выращивание GIPFwt во вращающихся сосудах давало 1,2-1,5 мг/л.
Выращивание культур клеток в биореакторах: способ выращивания с подпиткой использовали для крупномасштабного получения в биореакторах. Суспензионную культуру клеток HEK293, адаптированных к росту без сыворотки, высевали при плотности клеток 0,2-0,4 миллиона/мл при пересеве клеток. Клетки выращивали в бессывороточной среде 293 Free-style и размножали, начиная со встряхиваемых флаконов объемом 50-500 мл до 20-50 ферментеров с перемешиванием для посева в биореактор на 200 л и 500 л. Когда накапливалось достаточное количество клеток, клетки высевали в биореактор при плотности 0,2-0,4 миллиона клеток/мл. Когда плотность клеток достигала 1 миллиона клеток/мл, добавляли витамины и аминокислоты MEM (GIBCO), чтобы стимулировать и поддержать рост. Клетки собирали из биореактора через 6-7 дней, когда жизнеспособность клеток снижалась до 25-30%. Уровень GIPFwt, который был секретирован в культуральную среду, анализировали с помощью ELISA и Вестерн-блота. Вестерн-анализ секретированного GIPF показал, что разрушения белка не происходило. Вестерн-анализ осуществляли с использованием очищенного поликлонального анти-GIPF-антитела и выявление белка в ELISA осуществляли с использованием очищенного поликлонального анти-GIPF-антитела цыпленка и поликлонального анти-GIPF-антитела кролика в качестве антитела для регистрации. Поликлональные антитела кролика и цыпленка получали против целого белка. Выращивание GIPFwt в биореакторах давало 2,6-3 мг/л.
Ультрафильтрация-диафильтрация: среду, содержащую секретированный белок GIPFwt, собирали центрифугированием. Добавляли ингибиторы протеаз 1 мМ EDTA и 0,2 мМ Pefabloc (Roche, Basel, Switzerland), чтобы предотвратить разрушение GIPF. Среду фильтровали через 0,22 мкм-фильтр PES (Corning) и концентрировали в 10 раз, используя систему TFF (Pall Filtron) или систему полых волокон (Spectrum) с мембраной с пределом отсечения 10 кД. Буфер концентрированной среды заменяли 20 мМ фосфатом натрия, 0,3 М Arg, pH 7. Добавление 0,3 М Arg в фосфатный буфер имеет важное значение для поддержания GIPFwt в полностью растворимом состоянии при pH 7 во время очистки. После ультрафильтрации и диафильтрации добавляли смесь ингибиторов протеаз млекопитающих (Sigma) в разведении 1:500 (об./об.).
Q-анионообменная хроматография: анионообменную колонку HP с Q-сефарозой (Amersham) уравновешивали 20 мМ натрий-фосфатным (NaP) буфером с pH 7,0, содержащим 0,3 М Arg. Концентрированную в 10 раз среду с замененным буфером фильтровали через 0,22 мкм-фильтр PES и наносили на колонку с Q-сефарозой, чтобы связать примеси и нуклеиновые кислоты.
SP-катионообменная хроматография: поток, проходящий через Q-сефарозу, содержащий GIPFwt, собирали и наносили на катионообменную колонку HP с SP-сефарозой (Amersham), которая связывает белок GIPF. Колонку с SP-сефарозой промывали 15 объемами колонки (CV) 20 мМ NaP, 0,3 М Arg, 0,1 М NaCl, pH 7, и GIPF элюировали градиентом от 0,1 М до 0,7 М NaCl в 40 объемах колонки. Фракции анализировали с помощью SDS-ПААГ и Вестерн-блота. Фракции, содержащие GIPFwt, анализировали и объединяли. Буфер, объединенный фракций, заменяли 20 мМ фосфатом натрия, pH 7, 0,15 М NaCl. Определили, что чистота очищенного белка составляет 92-95% при анализе с использованием окрашивания Кумасси SDS-геля. Белок концентрировали до 1 мг/мл и пропускали через стерильный 0,22 мкм-фильтр и хранили при -80°C.
Выход, полученный в конце каждой стадии процесса очистки, количественно оценивали в ELISA, анализе по Бредфорду, и рассчитывали извлечение белка GIPF в процентах, как показано в таблице 3.
Уровень эндотоксина в конечном приготовленном растворе белка GIPF анализировали с использованием набора для анализа хромогенного LAL (лизат амебоцитов Limulus) (Charles River), и, как было определено, уровень составлял 0,24 ед. на мг GIPF.
C. Экспрессия и очистка GIPFt из дрожжей:
GIPFt экспрессировали и очищали из культуры дрожжей и биологическую активность сравнивали с биологической активностью GIPFt, который был очищен из культуры клеток HEK 293, описанной выше.
Нуклеотидную последовательность, кодирующую GIPFt (SEQ ID NO: 5) клонировали в экспрессирующем векторе Pichia pPICZαA, который содержит сигнальную последовательность секреции α-фактора дрожжей. Для экспрессии GIPFt использовали штамм дикого типа Pichia pastoris X-33. Протоколы применения векторов Pichia, экспрессии и очистки рекомбинантных белков доступны из Invitrogen Life Technologies (Carlsbad, CA, USA), а также описаны в "Pichia Protocols: Methods in Molecular Biology" (D.R. Higgins and J. Cregg eds., The Humana Press, Totowa, NJ (1998)).
Коротко, GIPFt очищали, используя SP-катионообменную хроматографию с последующей аффинной хроматографией на колонке IMAC Ni2+. Ni2+-колонку промывали 20 мМ имидазолом и GIPF элюировали в градиенте имидазола 20-300 мМ в 30 объемах колонки. SDS-ПААГ очищенного продукта выявил широкую и размытую полосу белка с М.м. примерно 50 кД, что свидетельствует о том, что GIPFt гликозилирован в разной степени. Биологическую активность анализировали in vitro и in vivo, как описано в примерах 17 и 20 соответственно.
Белок GIPFt, который экспрессировали в Pichia pastoris, индуцировал пролиферацию эпителия кишечника мышей и стабилизировал β-катенин, хотя и в меньшей степени, чем получали в случае белка GIPF, который очищали из клеток HEK293 (данные не показаны).
D. Очистка мышиного ортолога GIPF - mGIPFt:
Последовательность SEQ ID NO: 68, которая кодирует мышиный ортолог GIPF человека, клонировали в векторе pcDNA/Intron, чтобы экспрессировать V5-His-меченый белок mGIPFt. Меченый мышиный белок экспрессировали в клетках HEK 293 и очищали согласно способу, описанному выше для очистки белка GIPFt человека. Белок очищали до 80% чистоты и готовили в виде композиции в PBS. Биологическую активность mGIPFt анализировали in vivo и in vitro, и, как показано, белок обладает такими же свойствами в отношении пролиферации, что и GIPF человека (пример 20).
E. Характеристики очищенного рекомбинантного GIPF
SDS-ПААГ-анализ очищенных белков GIPF (GIFPt и GIPFwt) осуществляли в восстанавливающих и не восстанавливающих условиях, и показано, что V5-His-меченые белки GIPF, полученные из клеток 293, существуют в виде мономера. Белки GIPFt и GIPFwt гликозилированы и мигрируют в SDS-ПААГ в не восстанавливающих условиях с молекулярной массой (М.м.) примерно 42 кД и 38 кД соответственно. Масс-спектроскопия с лазерной десорбцией/ионизацией при содействии матрицы (MALDI) показала, что соответствующие молекулярные массы для GIPFt и GIPFwt составляют 37,8 кД и 32,9 кД, тогда как теоретическая молекулярная масса GIPFt и GIPFwt, в которых отсутствует сигнальный пептид, составляет 30,2 кД и 26,8 кД соответственно. Разница в молекулярных массах свидетельствовала о том, что это могло быть вызвано гликозилированием белка. Затем осуществляли полное дегликозилирование N-связанных и O-связанных олигосахаридов, используя N- и O-гликаназу (Prozyme, San Leandro, CA, USA) согласно инструкциям производителя. SDS-ПААГ-анализ дегликозилированного белка показал снижение кажущейся молекулярной массы на 4-5 кД. Дегликозилирование не влияло на биологическую активность GIPF при анализе in vitro и in vivo, которые описаны в примерах 17 и 20 соответственно (данные не показаны).
Стабильность белка. Чтобы тестировать активность GIPF после денатурации, GIPF кипятили в течение 5 минут и быстро охлаждали на льду. Сохраняемую GIPF полную активность определяли in vitro (смотри пример 17) и in vivo (смотри пример 21). Полученные данные показывают, что GIPF является стабильным белком.
Кэпирование остатков цистеина. Осуществляли восстановление и алкилирование остатков цистеина, чтобы лишить GIPF активности. Восстановление дисульфидных связей GIPF (1 мг/мл) получали посредством инкубации GIPF в 30 мМ DTT, pH 8, при 37°C в течение 1 часа. Затем свободные сульфгидрилы подвергали S-карбоксиметидированию с использованием 20 мМ йодацетамида при 37°C в темноте в течение 30 минут (Crestfield AM; Moore S; Stein W.H. J. Biol. Chem. 1963; 238, 622). Реакцию останавливали замораживанием и избыток DTT и йодацетамида удаляли диализом против PBS. Биологическую активность кэпированного GIPF анализировали, используя анализы in vitro и in vivo. Биологическая активность GIPF исчезала при кэпировании (смотри примеры 17 и 20).
Анализ N-концевой последовательности показал, что клетки HEK293 продуцировали две формы либо полипептида GIPFt, либо полипептида GIPFwt: доминантную зрелую форму (SEQ ID NO: 10), которая соответствует белку GIPF с последовательностью SEQ ID NO: 4, в которой отсутствует сигнальная последовательность, и зрелую форму (SEQ ID NO: 12), которая соответствует белку GIPF с последовательностью SEQ ID NO: 4, в которой отсутствует и сигнальный пептид, и последовательность расщепления фурином. Две формы хорошо разделялись на SP-колонке и экспрессировались в соотношении зрелой формы к доминантной зрелой форме примерно 1:2. Хотя обе доминантная зрелая и зрелая формы GIPFt индуцируют пролиферацию клеток кишечных крипт in vivo, использовали доминантную зрелую форму, чтобы тестировать терапевтическое действие GIPF в животных моделях заболевания, описанных в примерах 11, 12, 13, и 14. Клетки CHO экспрессируют только доминантную зрелую форму GIPF.
Мутагенез сайта расщепления фурином (Arg28-> Gln). Чтобы показать, что зрелая форма GIPF, полученная из клеток HEK 293, возникает в результате природного процессинга протеазой фурином, консервативную последовательность сайта расщепления фурином подвергали мутации, чтобы заменить Arg28QRR на Gln28-QRR. Мутантный белок (SEQ ID NO: 18) экспрессировали в клетках HEK293 и очищали согласно способу, используемому для очистки GIFPt (пример 9A). N-концевое секвенирование очищенного белка подтвердило, что в культуре экспрессировалась только доминантная зрелая форма. Полученные данные подтверждают, что зрелая форма образуется в результате протеолитического расщепления активностью клеточной протеазы фурина. Кроме того, общее извлечение очищенной доминантной зрелой формы увеличивалось с 50% до 68%.
В заключение, способы очистки давали белок GIPFt, чистота которого составляла > 90%, и GIPFwt, чистота которого составляла 92-95%. Общее извлечение доминантной зрелой формы GIPF с использованием любых способов очистки составляет примерно 50%. Однако выход может быть увеличен в результате экспрессии белка, который имеет мутантный сайт расщепления фурином. Добавление 0,5 М NaCl к буферу во время процесса очистки диафильтрацией среды и на Ni-колонке имеет важно значение для поддержания GIPF в полностью растворимом состоянии при pH 7. Для связывания GIPF на SP-колонке NaCl удаляли и добавляли 0,3 М Arg, чтобы поддерживать высокую растворимость и повысить выход белка.
Доминантную зрелую форму и зрелую форму GIPFt и GIPFwt использовали для тестирования биологической активности GIPF in vivo. Белки, очищенные способами согласно данному примеру, всегда индуцировали значительную пролиферацию эпителиальных клеток кишечных крипт, которая лежит в основе растяжения тонкого кишечника мышей, которым вводили очищенный белок GIPF.
На биологическую активность GIPF не влияло дегликозилирование или кипячение, но активность исчезала при кэпировании остатков цистеина йодацетамидом.
ПРИМЕР 10
БИОЛОГИЧЕСКОЕ ТЕСТИРОВАНИЕ IN VIVO РЕКОМБИНАНТНОГО БЕЛКА GIPF, ЭКСПРЕССИРОВАННОГО В КЛЕТКАХ HEK293 И CHO
Биологическое действие in vivo белка GIPFt, который получали из клеток HEK293 и CHO, оценивали у нормальных мышей следующим образом.
Фармакокинетику (PK) рекомбинантного V5His6-меченого белка GIPF (GIPFt) определяли у мышей. Мышам BALB/c 6-8-недельного возраста инъецировали в/в через хвостовую вену однократную дозу либо 40 мг/кг белка GIPFt, либо буфера для приготовления препарата в качестве контроля. Кровь отбирали через 0, 30 мин, 1 час, 3 часа, 6 часов и 24 часа после инъекции и уровень белка в сыворотке в каждой временной точке анализировали Вестерн-анализом, используя анти-V5-антитело (Invitrogene Inc., Carlsbad, CA) (фигура 18A). На фигуре 18A показано, что не выявлено существенного разрушения белка GIPF сыворотки. Время полужизни белка GIPF в сыворотке рассчитывали на основании полулогарифмического графика концентрации белка после инъекции с использованием Positope (Invitrogene Inc., Carlsbad, CA) в качестве стандартного V5-меченого белка и оценили, что время полужизни составляет 5,3 часа (фигура 18B).
Чтобы исследовать, может ли очищенный рекомбинантный белок GIPFt создавать фенотип, сходный с фенотипом, наблюдаемым у мышей с целенаправленно введенным геном GIPF (knock-in), и у мышей, которым инъецировали рекомбинантный аденовирус, мышам BALB/c 6-8-недельного возраста ежедневно инъецировали через хвостовую вену либо 4 мг/кг белка GIPFt, либо буфера для приготовления препарата в качестве контроля в течение 7 дней. Мышей забивали на 8 день через 24 часа после последней инъекции. За четыре часа до умерщвления в/б инъецировали 1 мг бромдезоксиуридина (BrdU), чтобы определить пролиферативную активность GIPF. Различные ткани, включая тонкий кишечник, ободочную кишку, селезенку, печень и костный мозг, собирали и фиксировали в формалине. Залитые парафином срезы красили гематоксилином и эозином для гистологической оценки. Срезы также обрабатывали для иммуногистохимического анализа BrdU согласно инструкции производителя (Oncogene Research product, Boston, U. S. A.) и как описано ранее (McKinley, J. N. et al. 2000). Во всех экспериментах анализировали по меньшей мере 3 животных на группу и эксперименты повторяли по меньшей мере два раза.
Окрашивание Г+Э срезов желудочно-кишечного тракта показало, что значительная пролиферация эпителиальных клеток кишечных крипт в тонком кишечнике и ободочной кишке наблюдалась у мышей, которые получали GIPF (фигуры 19 и 21 соответственно). Полученный результат соответствует результатам, полученным на трансгенных мышах с целенаправленно введенным геном GIPF (knock-in) и на мышах, которые получали GIPF-аденовирус (смотри примеры выше). Пролиферативное действие белка GIPF подтверждали, анализируя включение BrdU как в тонком кишечнике (фигура 20), так и в ободочной кишке (фигура 22).
ПРИМЕР 11
ПРОФИЛАКТИЧЕСКОЕ ДЕЙСТВИЕ GIPF НА ИНДУЦИРОВАННЫЙ ОБЛУЧЕНИЕМ МУКОЗИТ
Эффективность GIPF в качестве профилактического и терапевтического средства тестировали в животной модели индуцированного облучением мукозита.
Использовали сорок восемь взрослых самцов мышей BDF1 мышей 10-12-недельного возраста. После доставки от поставщика и до эксперимента животных содержали в течение двух недель в отдельно проветриваемых клетках в условиях цикла 12 часов освещение: темнота, чтобы стабилизировать циркадный ритм. Животным давали корм и воду по желанию.
Животных делили на 8 групп по 6 животных и обрабатывали следующим образом:
1. Инъецировали 2 мг/кг GIPF в/в за 72, 48 и 24 часа до облучения рентгеновским излучением 13 Гр (все тело).
2. Инъецировали 5 мг/кг GIPF в/в за 72, 48 и 24 часа до облучения рентгеновским излучением 13 Гр (все тело).
3. Инъецировали 125 мкг KGF в/в за 72, 48 и 24 часа до облучения рентгеновским излучением 13 Гр (все тело).
4. Инъецировали наполнитель физиологический раствор в/в за 72, 48 и 24 часа до облучения рентгеновским излучением 13 Гр (все тело).
5. Необработанные, необлученные контроли.
6. Инъецировали 2 мг/кг GIPF в/в через 24, 48 и 72 часа после облучения рентгеновским излучением 13 Гр (все тело).
7. Инъецировали 5 мг/кг GIPF в/в через 24, 48 и 72 часа после облучения рентгеновским излучением 13 Гр (все тело).
8. Инъецировали физиологический раствор в/в через 24, 48 и 72 часа после облучения рентгеновским излучением 13 Гр (все тело).
Все инъекции вводили в 15:00 часов. Повреждение кишечника индуцировали, используя однократную дозу 13 Гр рентгеновского излучения (подаваемого по 0,7 Гр/мин) в 15:00.
Через четыре дня после облучения животных забивали. Извлекали тонкий кишечник и фиксировали в фиксаторе Карнуа перед обработкой для гистологического анализа. Нарезали поперечные срезы толщиной 3 мкм и красили гематоксилином и эозином. Сразу после умерщвления также извлекали двенадцатиперстную кишку, среднюю часть ободочной кишки, печень, легкое, язык, селезенку, желудок и поджелудочную железу и фиксировали в формалине в течение ночи, затем хранили в 70% этаноле.
Для каждого животного анализировали десять окружностей кишечника (60 на группу) - окружность эквивалентна определенной длине кишечника и, следовательно, подходящей исходной единице длины. Оценивали количество жизнеспособных крипт на окружность и определяли среднее значения для группы (таблица 4). Оценивали только крипты, содержащие 10 или более сильно окрашенных Г+Э клеток (исключая клетки Панета), и только интактные окружности, не содержащие Пейеровых бляшек.
Также измеряли среднюю ширину крипт (измеряемую в самой широкой точке), чтобы скорректировать ошибки оценки вследствие разницы в размере крипт. Корректировку применяли таким образом:
Скорректированное количество крипт/окружность =
Все животные выдерживали обработку и не проявляли видимых неблагоприятных эффектов. На фигуре 23 A-D показаны срезы тонкого кишечника от животных необработанной группы 5 (A), группы, предварительно обработанной физиологическим раствором 4 (B), KGF-обработанной группы 3 (C) и GIPF-обработанной группы 2 (D). Очаги регенерации (жизнеспособные крипты с одной или несколькими клоногенными клетками) ясно видны на срезе ткани животных, обработанных физиологическим раствором (группа 4) (фигура 23B). Кроме указанных очагов мезенхима полностью оголена, и у данных животных могла бы развиться диарея, и они могли бы умереть вследствие мукозита, если бы им дали возможность жить более четырех дней после облучения. GIPF обеспечивал защиту структуры кишечника (фигура 23 D) сходным образом с защитой, обеспечиваемой KGF (фигура 23 C).
Сразу видно, что предварительная обработка GIPF значительно увеличивала количество крипт, которые оставались жизнеспособными при облучении 13 Гр. Предварительная обработка GIPF в дозе 2 мг/кг (группа 1) увеличивала жизнеспособность в 1,95 раз по сравнению с криптами из необработанной группы 4 (также называемым фактором защиты), а доза GIPF 5 мг/кг (группа 2) дополнительно увеличивала жизнеспособность крипт в 2,66 раза. Это очень значительное увеличение и почти сравнимое с эффектом, наблюдаемым при обработке известной оптимальной дозой KGF (группа 3), которая увеличивала жизнеспособность крипт в 3,16 раза.
Следовательно, показано, что GIPF защищает эпителий тонкого кишечника от повреждающего воздействия излучения и может быть использован в качестве эффективного профилактического средства для пациентов, которым показана лучевая терапия.
ПРИМЕР 12
МОДЕЛЬ ИНДУЦИРОВАННОГО ХИМИОТЕРАПИЕЙ МУКОЗИТА
Эффективность рекомбинантного GIPF человека (GIPFwt) при лечении индуцированного химиотерапией мукозита оценивали у здоровых и несущих опухоли мышей. Экспериментальный протокол был основан на протоколе, описанном Boushey et al. (Cancer Res 61: 687-693 (2001)).
Один миллион клеток карциномы ободочной кишки мышей CT26 (ATCC, Manassas, VA, USA) инъецировали п/к сингенным самкам мышей BALB/c и давали возможность развиваться опухолям в течение 5 дней. Здоровых и несущих опухоли животных делили на экспериментальные группы по 6 мышей в каждой и обрабатывали следующим образом:
1) мышам, несущим опухоли, инъецировали наполнитель (50% ДМСО) в/б с 1 дня по 5 день, физиологический раствор инъецировали в/в с 0 дня по 7 день (TVS);
2) мышам, несущим опухоли, инъецировали наполнитель (50% ДМСО) в/б с 1 дня по 5 день, 50 мкг GIPF в 100 мкл физиологического раствора инъецировали в/в ежедневно с 0 дня по 7 день (TVG);
3) мышам, несущим опухоли, инъецировали 50 мг/кг 5-FU в/б с 1 дня по 5 день, физиологический раствор инъецировали в/в с 0 дня по 7 день (TDS);
4) мышам, несущим опухоли, инъецировали 50 мг/кг 5-FU в/б с 1 дня по 5 день, 50 мкг GIPF в 100 мкл физиологического раствора инъецировали в/в с 0 дня по 7 день (TDG);
5) здоровым мышам инъецировали 50 мг/кг 5-FU в/б с 1 дня по 5 день, физиологический раствор инъецировали в/в с 0 дня по 7 день (NDS);
6) здоровым мышам инъецировали 50 мг/кг 5-FU в/б с 1 дня по 5 день, 50 мкг GIPF в 100 мкл физиологического раствора инъецировали в/в с 0 дня по 7 день (NDG).
В 0, 2, 4, 6 и 8 день регистрировали измерения массы тела животных, тяжесть диареи и размер опухолей. Оценка диареи в 0-3 балла отражала соответствующее ухудшение симптома от 0, что является нормальным, до 3, что является показателем тяжелого состояния. Изменение массы тела рассчитывали в виде процента массы тела от массы тела в необработанной группе. Длину, ширину и высоту опухоли измеряли кронциркулями и объем опухоли рассчитывали как (длина × ширина × высота)/2.
Всех животных подвергали эвтаназии на 8 день. Толстый и тонкий кишечник извлекали и взвешивали, измеряли их длину, регистрировали диаметр средней части тощей кишки. Участок (1 см) средней части тощей кишки вырезали примерно на расстоянии 14-15 см от привратника желудка и участок (1 см) поперечной ободочной кишки вырезали на расстоянии 4 см от соединения подвздошной и слепой кишки. Участки кишечника промывали и фиксировали с использованием 10% нейтрального забуференного формалина для гистологического анализа. Гистологическое исследование и морфометрию слизистой оболочки осуществляли на срезах ткани с использованием компьютерной программы ImagePro (Imagepro, Ltd., Ashford, Middlesex, UK).
Влияние GIPFwt на тяжесть диареи, массу тела и размер опухоли суммировали следующим образом:
GIPF значимо снижал тяжесть диареи, вызванной 5-FU у здоровых и несущих опухоли мышей в группах 6 и 4 соответственно по сравнению с оценкой в баллах для нормальных и несущих опухоли мышей в группах 5 и 3, которые не получали GIPF. Подобным образом GIPF снижал потерю массы тела, которую испытывали 5-FU-обработанные животные.
Опухоли у необработанных несущих опухоли мышей (группа 1) имели сходный размер с опухолями у GIPF-обработанных несущих опухоли мышей (группа 2). Таким образом, GIPF не влиял на рост опухоли. Как ожидалось, 5-FU уменьшал размер опухолей у мышей группы 3, а также он уменьшал размер опухолей у мышей группы 4. Таким образом, GIPF не мешал активности 5-FU в уменьшении размера опухолей (фигура 24).
Влияние GIPF на макроскопическую картину кишечника показано на фигуре 25, и соответствующее измерение диаметра, массы и длины кишечника приведено в таблице 5. Кишечник нормальных и несущих опухоли мышей, которые получали 5-FU, был атрофирован (фигура 25E), и наблюдались многочисленные повреждения, связанные с кровотечением, тогда как картина кишечников от мышей, которые получали GIPF очевидно была нормальной и сопровождалась типичным растяжением вследствие пролиферативного влияния GIPF на эпителий кишечника (фигура 25 B, C, D и F).
Гистологический анализ срезов тонкого кишечника и ободочной кишки для всех экспериментальных групп показал, что GIPF сохранял структуру кишечника мышей, которые получали 5-FU посредством предотвращения тяжелого повреждения отделов слизистой оболочки кишечника в области ворсинок и крипт, вызванного 5-FU (фигура 26), на фигуре 26 A показано влияние 5-FU на тонкий кишечник и на фигуре 26B показано влияние 5-FU на ободочную кишку. Микроморфометрические измерения высоты ворсинок и глубины крипт в средней части тощей кишки подтверждают, что влияние GIPF является значимым (фигура 27), GIPF защищает тонкий кишечник и ободочную кишку от вредного влияния 5-FU, и он не мешает терапевтическим эффектам 5-FU. Следовательно, GIPF может быть использован вместе с химиотерапевтическими средствами, чтобы уменьшить вредные побочные эффекты противоопухолевой терапии.
ПРИМЕР 13
ПРОФИЛАКТИЧЕСКОЕ ДЕЙСТВИЕ GIPF НА ИНДУЦИРОВАННЫЙ ХИМИОТЕРАПИЕЙ И ОБЛУЧЕНИЕМ МУКОЗИТ РОТОВОЙ ПОЛОСТИ
Влияние GIPF на пролиферацию дорсального (буккального) и вентрального эпителия языка исследовали у мышей, которых подвергали облучению рентгеновским излучением или вводили дозу 5-FU, как описано в примерах 11 и 12 соответственно.
Иммуногистохимический анализ с использованием моноклонального антитела крыс против антигена Ki67 мыши (Dako Ltd., High Wycombe, UK) осуществляли согласно инструкции производителя и способу, описанному ранее (Scholzen, T. et al. 2000), на залитых парафином срезах языка от необлученных и облученных мышей (группы 1, 2 и 3 в примере 11).
GIPF заметно увеличивал количество ядер, которые окрашивались в отношении Ki67, в вентральном и дорсальном эпителии языка облученных животных по сравнению с количеством у животных, которые не получали GIPF (фигуры 28 и 29). Пролиферативный индекс эпителия, который рассчитывают в виде процента клеток вентрального эпителия, которые окрашивались позитивно в отношении Ki67, подтвердил, что GIPF значимо снижал потерю клеточности, вызванную облучением в вентральном эпителии языка (фигуры 30). Гистологический анализ срезов языка животных, которых обрабатывали 5-FU (группы 2-6 в примере 12), показал, что GIPF сохраняет морфологию слоев дорсального и вентрального эпителия у нормальных и несущих опухоли животных, которых обрабатывали 5-FU (фигура 31).
Слой эпителия языка у всех животных, которых обрабатывали GIPF, был заметно менее поврежден 5-FU, чем слой эпителия языка у экспериментальных животных, которые не получали GIPF.
Следовательно, GIPF можно использовать в качестве терапевтического средства для лечения и/или профилактики индуцированного химиотерапией и лучевой терапией мукозита ротовой полости. Количественные животные модели мукозита ротовой полости (например, Wardly et al., Arch. Oral. Biol. 43: 567-577 (1998); Potten et al., Cell Prolif. 35: 32-47 (2002)) можно использовать для исследования дополнительных терапевтических свойств GIPF при введении в комбинации с другим цитотоксическим средством, чтобы дополнительно оценить возможную роль GIPF в снижении тяжести уменьшения количества клеток и в увеличении скорости регенерации эпителиальных слоев эпителия ротовой полости и кишечника.
ПРИМЕР 14
ТЕРАПЕВТИЧЕСКОЕ ДЕЙСТВИЕ GIPF НА ИНДУЦИРОВАННЫЙ ДЕКСТРАНСУЛЬФАТОМ НАТРИЯ КОЛИТ
Эффективность рекомбинантного GIPF человека (GIPFwt) при лечении колита тестировали в мышиной модели индуцированного декстрансульфатом натрия (DSS) колита и сравнивали с эффективностью GLP-2 (L'Heureux and Brubaker J Pharmacol Exp Ther 306:347-354 (2003); Kriegelstein et al, J Clin Invest 110:1773-1782 (2002); Siegmund et al., J Pharmacol Exp Ther 296:99-105 (2001)).
Самок мышей BALB/c шести-восьми-недельного возраста (Charles River Laboratories, Wilmington, MA, USA) содержали в вентилируемых клетках и акклиматизировали в течение одной недели к циклу 12 часов освещения: темнота. Двадцать четыре мыши, имеющих сходную массу тела (примерно 20 г; колебания <5%), содержали в 4 клетках и кормили по желанию и 4% раствором DSS (об./масс.) для питья в течение 7 дней.
На 7 день регистрировали массу тела каждого животного и определяли оценку в баллах потери массы тела, консистенцию испражнений и анальное кровотечение, как показано в таблице 6 ниже.
Оценку в баллах использовали для расчета индекса активности IBD (IBDAI), который использовали в качестве показателя тяжести колита, и рассчитывали в виде средней оценки, даваемой для сведенных в таблицу параметров. Оценку потери массы, консистенции испражнений и ректального кровотечения определяли ежедневно и IBDAI регистрировали ежедневно в течение эксперимента.
На 7 день 4% (об./масс.) раствор DSS для питья заменяли 1% (об./масс.) раствором DSS, чтобы сохранить активность заболевания без усиления эффекта DSS. Отбирали шестнадцать животных, получавших DSS, в отношении единообразной и сравнимой активности заболевания и делили на группы по 4 животных и обрабатывали следующим образом:
1. Вода, инъекции физиологического раствора в/в ежедневно (10 утра) в течение 7 дней.
2. DSS (1%) в течение 7 дней, инъекции физиологического раствора в/в ежедневно (10 утра) в течение 7 дней.
3. DSS (1%) в течение 7 дней, инъекции 100 мкг GIPF ежедневно в/в (10 утра) в течение 7 дней.
4. DSS (1%) в течение 7 дней, инъекции 50 мкг GIPF ежедневно в/в (10 утра) в течение 7 дней.
5. DSS (1%) в течение 7 дней, инъекции 10 мкг GLP-2 п/к дважды в день (10 утра и 6 вечера) в течение 7 дней.
Белок GIPF, используемый в указанных экспериментах, представлял собой рекомбинантный белок GIPF человека (SEQ ID NO: 4; GIPFwt), который экспрессировали и очищали согласно способу, описанному в примере 9. Аналог GLP-2, h[Gly2]GLP-2 был синтезирован и приобретен из Biosource International (Camarillo, CA, USA).
На 14 день корм из клеток убирали, чтобы обеспечить возможность для очистки кишечника и животных умерщвляли смещением шеи. Всем животным инъецировали 4 мг/0,1 мл BrdU за два часа до умерщвления. Извлекали толстый и тонкий кишечник и взвешивали, измеряли их длину и регистрировали диаметр средней части тощей кишки. Участок (1 см) средней части тощей кишки вырезали примерно на расстоянии 14-15 см от привратника желудка, и участок (1 см) поперечной ободочной кишки вырезали на расстоянии примерно 4 см от соединения подвздошной и слепой кишки. Участки кишечника промывали и фиксировали с использованием 10% нейтрального забуференного формалина для гистологического анализа. Гистологическое исследование и морфометрию слизистой оболочки осуществляли на срезах ткани с использованием компьютерной программы ImagePro (Imagepro, Ltd., Ashford, Middlesex, UK). IBDAI для мышей экспериментальных групп 2-5 показаны на фигуре 32, и соответствующие оценки потери массы, консистенции испражнений и ректального кровотечения показаны на фигурах 33, 34 и 35 соответственно. Полученные данные показывают, что GIPF оказывал терапевтическое воздействие, уменьшая тяжесть колита уже на 11 день. На 14 день GIPF-обработанные мыши групп 3 и 4 имели значимо более низкий IBDIA (1,75 и 1,83 соответственно), чем необработанные мыши группы 2 (3,75). GLP-2 оказывал умеренное влияние на тяжесть колита, и на 14 день он снижал IBDAI у DSS-обработанных мышей до 3,25.
Пример макроскопической патологии кишечника и ободочной кишки мышей групп 1, 2, 3 и 5 показан на фигуре 36. У животных, получающих DSS с физиологическим раствором, развивался тяжелый колит, который обычно был связан с атрофией, гиперемией и диареей, по сравнению с контрольной группой. В тонком и толстом кишечнике животных, которых обрабатывали GIPF, наблюдали некоторое растяжение, и кишечники были удивительно сходны с кишечниками в контрольной группе. Полученные данные показывают, что GIPF можно использовать в качестве эффективного терапевтического средства для лечения воспалительного заболевания кишечника. Хотя, GLP-2 оказывал некоторое терапевтическое воздействие, тонкий и толстый кишечник из данной группы выглядел в самой малой степени менее поврежденным, чем у животных в контрольной группе. Значимость изменения отражена в измерениях тонкого и толстого кишечника, показанных в таблице 7.
Окрашивание Г+Э залитых парафином срезов показало, что DSS вызывал массивную инфильтрацию воспалительными клетками и разрушение отделов ворсинок и крипт слизистой оболочки тонкого кишечника и ободочной кишки (фигура 37). В соответствии с наблюдениями макроскопической патологии, описанными выше, GIPF отменял эффекты, вызванные DSS, и восстанавливал структуру крипт и ворсинок кишечника. Крипты у обработанных GIPF животных были расширены по сравнению с криптами в контрольной группе. GLP-2 оказывал некоторый терапевтический эффект, хотя и на уровне, намного меньшем, чем GIPF (данные не показаны). Микроморфометрия ворсинок и крипт (фигура 38) подтвердила, что целебный эффект GIPF отражался в значимом восстановлении высоты ворсинок и глубины крипт, которые были подвергнуты тяжелому разрушению колитом. Восстановление структуры слизистой оболочки при действии GIPF получало заниженную оценку в результате значительной пролиферации клеток крипт (фигуры 39 и 40). Пролиферативный индекс крипт, который рассчитывали в виде процента клеток крипт, которые окрашивались позитивно в отношении BrdU, был значимо выше у DSS-обработанных мышей, которые получали GIPFwt, чем у DSS-обработанных мышей, которым инъецировали физиологический раствор (P<0,05) (фигура 40).
ПРИМЕР 15
ТЕРАПЕВТИЧЕСКОЕ ДЕЙСТВИЕ GIPF ПОСЛЕ МАССИВНОЙ РЕЗЕКЦИИ КИШЕЧНИКА
Влияние GIPF на повышение адаптивного ответа на массивную резекцию кишечника тестировали в животной модели синдрома короткой кишки (SBS) на крысах. Животная модель, используемая в исследовании влияния энтеротропных средств, описана (Scott et al. Am J Physiol G911-G921 (1998); Helmrath et al., J Am Coll Surg 183:441-449 (1996)), и протокол эксперимента включен в данное описание в виде ссылки.
Животных делят на группы: группу с резекцией, которые будут иметь хирургическую резекцию 75% средней тощей кишки и подвздошной кишки, контрольную группу с мнимой операцией по резекции, при которой кишечник рассекают и выполняют реанастомоз, и не подвергаемую операции контрольную группу. Животным вводят физиологический раствор или GIPF в дозе 2 мг/кг. 75% резекцию кишечника выбирают, чтобы максимизировать любой адаптивный ответ, и сохранение равных частей проксимальной тощей кишки и дистальной подвздошной кишки основано на последствиях для питания удаления специализированной способности терминального отдела подвздошной кишки всасывать витамин B12 и желчные кислоты и тормозящего влияния подвздошной кишки. У крыс сохранение 25% тонкого кишечника, включая часть дистальной подвздошной кишки достаточно, чтобы обеспечить животным с резекцией возможности достичь такой же скорости роста, как у контрольных животных.
Метаболический, морфологический, гистологический и функциональный ответ кишечника на резекцию и лечение GIPF оценивают в ходе эксперимента, а также в виде анализа конечных результатов на 10 день. Потребление корма и рост, макроскопическую и микроскопическую морфологию тонкого кишечника и функциональную оценку всасывающих свойств слизистой оболочки оценивали, как описано (Scott et al., выше).
GIPF значимо увеличивает потребление корма и снижает потерю массы тела, которая обычно сопровождает резекцию тонкого кишечника. GIPF также увеличивал длину оставшейся части кишечника, ее диаметр, влажную массу и влажную массу слизистой оболочки и увеличивал всасывающую способность оставшейся части тонкого кишечника. Окрашивание Г+Э макроскопических срезов тонкого кишечника показывает, что GIPF удлиняет как высоту ворсинок, так и глубину крипт и усиливает пролиферацию клеток крипт в кишечнике животных с резекциями тонкого кишечника. Таким образом, GIPF снижает эффекты резекции кишечника посредством усиления адаптации кишечника.
ПРИМЕР 16
ВЛИЯНИЕ GIPF НА ПРОЛИФЕРАЦИЮ ОПУХОЛЕВЫХ КЛЕТОК
GIPF индуцирует сильное пролиферативное действие на эпителиальные клетки кишечных крипт in vivo. Чтобы исследовать пролиферативное действие in vitro тестировали влияние рекомбинантного GIPFwt на пролиферацию различных линий опухолевых и нормальных клеток in vitro. Скорость клеточной пролиферации указанных ниже линий клеток (ATCC) измеряли, оценивая включение3H-тимидина:
Клетки высевали по 10000-50000 клеток на лунку в зависимости от линии клеток и обрабатывали возрастающими дозами GIPFwt (1,37-1000 нг/мл). Скорость пролиферации GIPF-обработанных клеток сравнивали со скоростью пролиферации необработанных клеток или клеток, которые выращивали в 10% полной среде (среда роста, 2,5% диализованной FBS и пенициллин/стрептомицин). Клетки инкубировали в течение 48 часов при 37°C и импульсно метили 0,5 мккюри3H-тимидина в течение последних 20-24 часов инкубации. Клетки собирали и определяли количество3H-тимидина, которое было включено, и результаты определяли в двух повторах образцов для экспериментов, проводимых в двух повторах.
GIPFwt не влиял на скорость пролиферации большинства опухолевых клеток, которые были тестированы. Увеличение скорости пролиферации было индуцировано только при более высоких дозах GIPF в клетках IEC28, T84, HCT116 и HT29. Степень пролиферации составляла менее 40% от скорости пролиферации в необработанных клетках.
Следовательно, полученные данные свидетельствуют, что GIPF не может усиливать скорость пролиферации опухолей, существующих in vivo, и GIPF можно использовать для лечения пациентов со злокачественной опухолью, которые страдают от мукозита, вызванного противоопухолевой терапией.
ПРИМЕР 17
ВЛИЯНИЕ GIPF НА ВНУТРИКЛЕТОЧНУЮ ПЕРЕДАЧУ СИГНАЛА
Путь передачи сигнала wnt/β-катенин играет центральную роль в развитии и гомеостазе. Известно, что в тонком кишечнике передача сигнала wnt играет важную роль в качестве регулятора пролиферации кишечных крипт посредством стабилизации β-катенина, который затем индуцирует трансактивацию генов-мишеней T-клеточного фактора (TCF) (Wetering et al., Cell 111:241-250 (2002); Batle et al., Cell, 111:251-263, (2002); Perreault et al., J Biol Chem 276:43328-43333 (2001); Booth et al., Nat Med 8:1360-1361 (2002)).
Чтобы оценить влияние GIPF на путь передачи сигнала wnt/β-катенин, измеряли стабилизацию β-катенина в различных линиях культивируемых клеток. Клетки высевали по 1 миллиону клеток/лунку в 6-луночную чашку с модифицированную Дульбекко среду Игла с добавлением 10% FBS. На следующий день клетки выращивали в бессывороточной среде и обрабатывали либо GIPF в концентрации 50 нг/мл, либо LiCl2 (позитивный контроль) в концентрации 10 мМ в условиях низкого содержания сыворотки (0,1% FBS). Цитоплазматические фракции готовили, как описано Haertel-Weismann et al. (J. Biol. Chem. 175: 32046-32051 (2000)). Белки разделяли в градиентном (4-20%) SDS-ПААГ и оценивали уровень β-катенина, используя кроличье антитело против β-катенина (Abcam), которое визуализировали с использованием конъюгированного с пероксидазой второго антитела (Cell Signaling).
Среди тестированных линий клеток GIPF индуцировал стабилизацию β-катенина в линии эндокринных L-клеток человека (NCI-H716, данные не показаны) и в клетках HEK 293 зависимым от дозы и связанным со временем способом (фигура 41 A и B соответственно). В соответствии с данными, описанными в примере 18, кипячение GIPF не влияло на его способность стабилизировать β-катенин, но влияние отменялось при обработке протеиназой K и при восстановлении DTT (фигура 41 C).
Чтобы далее исследовать путь передачи сигнала, посредством которого GIPF приводит к накоплению β-катенина, анализировали активность GSK3β в клетках HEK293 клетки. В каноническом wnt-пути передачи сигнала Wnt активирует β-катенин посредством ингибирования GSK3β, которая в противном случае может фосфорилировать β-катенин и делать его мишенью для разрушения протеосомой.
GIPF увеличивал фосфорилирование GSK3β в клетках HEK 293 зависимым от времени образом (фигура 42). Полученные данные показали, что GIPF может активировать β-катенин посредством канонического wnt-пути передачи сигнала, ингибируя фосфорилирование β-катенина ферментом GSK3. Однако GIPF не индуцировал стабилизацию β-катенина в других линиях клеток, включая линию эпителиальных клеток мышей C57MG, в которой Wnt3A, как было показано, оказывает сильное влияние на индукцию активации β-катенина. Кроме того, Dickkopf-1 (Dkkl), который является сильным ингибитором пути передачи сигнала Wnt (Kuhnert, PNAS 101: 266-271, 2004), не полностью ингибировал стабилизацию β-катенина посредством GIPF в клетках 293 (данные не показаны). Полученные данные свидетельствуют, что GIPF может стабилизировать β-катенин посредством пути, который отличается от известного канонического пути Wnt/β-катенин.
ПРИМЕР 18
ВЛИЯНИЕ GIPF НА ЭКСПРЕССИЮ ГЕНОВ-МИШЕНЕЙ β-КАТЕНИНА
Накопление β-катенина приводит к его транслокации в ядро, где он связывается с факторами транскрипции семейства TCF/LEF. Вследствие своей трансактивирующей способности комплекс β-катенин-фактор транскрипции связывается с ДНК и активирует гены-мишени wnt. Чтобы дополнительно исследовать GIPF-индуцированную передачу сигнала β-катенина, авторы определили активацию расположенных ниже генов-мишеней в клетках HEK293 и NCI-H716 с использованием количественной ПЦР.
1 X 106 клеток HEK-293 и 2 X 106 клеток NCI-H716 (ATCC) высевали в 6-луночные чашки и давали возможность прикрепиться в течение 6 часов в полной среде. Затем среду клеток заменяли на среду для анализа с 0,1% FBS инкубировали в течение ночи. В день анализа средства для обработки добавляли к клеткам в дополнительном объеме 1 мл среды для анализа. Клетки инкубировали в течение 8 часов при 37°C/5%CO2 либо с 20 мМ LiCl (Sigma), 100 нг/мл Wnt-3A (R & D Systems), 250 нг/мл GIPFt, либо 250 нг/мл кэпированного белка GIPF. Лунку с необработанными клетками, поддерживаемыми в среде для анализа, включали в качестве фона экспрессии гена. Суммарную РНК выделяли из обоих типов клеток, используя мининабор RNeasy и набор DNaseI (Qiagen), оценивали качество и концентрацию суммарной РНК. В случае каждого образца 4 мкг суммарной РНК праймировали при 70°C в течение 3 мин, используя 3 мкг случайных гексамеров и 2 мМ каждого dNTP. Реакционные смеси охлаждали на льду в течение 1 мин. Объем реакции доводили до 22 мкл 5X-буфером M-MLV (Promega), 25 мМ MgCl2, 0,1 М DTT и RNaseOut (Invitrogen). После добавления 400 единиц обратной транскриптазы M-MLV (Promega) реакционные смеси инкубировали 10 мин при 23°C, 50 мин при 42°C и 5 мин при 70°C, чтобы остановить реакцию. Затем кДНК разбавляли и обрабатывали 1 единицей РНКазы H (Invitrogen), чтобы расщепить оставшуюся РНК. Концентрацию кДНК измеряли при OD 260 нм. Для каждой количественной реакции ПЦР SYBR Green объемом 10 мкл использовали 2 мкл кДНК (440 нг), вместе с 1,25 мкМ каждого из праймеров, прямого и обратного, и 2X смесь SYBR Green mastermix (Eurogentec). Реакции осуществляли в трех повторах. Конструировали праймеры для количественной ПЦР для следующих генов-мишеней β-катенина человека: аксин-2 (SEQ ID NO: 70 и 71), CD44 (SEQ ID NO: 72 и 73), Epherin B2 (SEQ ID NO: 74 и 75), c-myc (SEQ ID NO: 76 и 77), проглюкагон (SEQ ID NO: 78 и 79) и Cox-2 (SEQ ID NO: 80 и 81). EF1 человека (SEQ ID NO: 82 и 83) использовали в качестве гена «домашнего хозяйства», чтобы стандартизировать уровни экспрессии.
GIPF увеличивал экспрессию аксина-2 в клетках HEK-293 и NCI-H716 и вызывал повышающую регуляцию CD44 и EphrinB2 до уровней, которые были выше уровней, возникающих в результате стимуляции Wnt3A или литием. GIPF не влиял на уровни экспрессии генов Cox-2, c-myc и проглюкагона (данные не показаны).
Полученные данные позволили проникнуть в механизмы, вовлеченные в индуцированную GIPF активацию генов-мишеней. Осуществляли дополнительные исследования для того, чтобы объяснить события ниже по ходу передачи сигнала GIPF.
ПРИМЕР 19
АНАЛИЗ АКТИВНОСТИ GIFP IN VITRO
Одиннадцать делеционных мутантов GIPF (SEQ ID NO: 84, 86, 88, 90, 92, 94, 96, 98, 100, 102 и 104) субклонировали в векторе pIntron/IgK и временно экспрессировали в клетках HEK293. Положение каждого кодируемого полипептидного фрагмента (SEQ ID NO: 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105 и 178) в полноразмерном полипептиде GIPF показано на фигуре 43. Экспрессирующий вектор млекопитающих pIntron/IgK получали генетическим модифицированием вектора pSectag (Invitrogene Inc., Carlsbad, CA) посредством введения сконструированного химерного интрона, полученного из экспрессирующего вектора млекопитающих pCI (Promega, Madison, WI). Вектор pcDNA/Intron расщепляли BglII и NheI и последовательность интрона клонировали в pSectag, который предварительно расщепляли BglII и NheI. Прямой и обратный праймеры, используемые для амплификации и субклонирования полинуклеотидных фрагментов, соответствуют SEQ ID NO: 106-119, которые указаны в списке последовательностей. Прямой праймер с последовательностью SEQ ID NO: 106 использовали с обратными праймерами для фрагментов 1-7 (праймеры SEQ ID NO: 107-113); прямой праймер с последовательностью SEQ ID NO: 114 использовали с обратными праймерами для фрагментов 8-10 (SEQ ID NO: 115-117).
Полипептидные фрагменты временно экспрессировали в клетках HEK 293 и анализировали активность фрагментов в стабилизации β-катенина, как описано в примере 17. Полипептидный фрагмент с последовательностью SEQ ID NO: 91 индуцировал наибольшую стабилизацию β-катенина по сравнению с активностью, проявляемой другими тестируемыми фрагментами. Полученные данные свидетельствуют, что фурин-подобный богатый цистеином домен GIPF может быть важным для опосредования пролиферативной активности GIPF. Однако активность полипептида SEQ ID NO: 91 была ниже, чем активность полноразмерного GIPF (фигура 44). Следовательно, другие части белка GIPF необходимы для обеспечения максимальной стабилизации β-катенина.
ПРИМЕР 20
БЫСТРЫЙ АНАЛИЗ IN VIVO АКТИВНОСТИ РЕКОМБИНАНТНОГО GIFP
Разработали быстрый анализ in vivo для тестирования биологической активности очищенного GIPF.
Активность GIPF человека и мыши (GIPFwt и mGIPFt) тестировали у мышей, которые группировали и обрабатывали следующим образом:
1. Физиологический раствор, инъекции в/в.
2. GIPFwt, инъекции 100 мкг в/в.
3. GIPFwt, инъекции 50 мкг в/в.
4. mGIPFt, инъекции 100 мкг в/в.
5. mGIPFt, инъекции 50 мкг в/в.
6. GIPFwt, прокипяченный, инъекции 100 мкг в/в.
7. GIPFwt, кэпированный, инъекции 100 мкг в/в.
8. GIPFwt, инъекции 100 мкг п/к.
В экспериментах использовали двадцать четыре самки мышей BALB/c. GIPF инъецировали ежедневно в течение трех дней. Животных умерщвляли на 4 день. Перед умерщвлением собирали 0,5 мл крови для гематологического анализа и за два часа до умерщвления всем животным инъецировали в/б 0,4 мл раствора BrdU 1 мг/мл. Тонкий кишечник и ободочную кишку вырезали, измеряли, как описано выше, и участки средней части тощей кишки и ободочной кишки обрабатывали для гистологического анализа, как описано в предыдущих примерах.
Результаты показаны на фигуре 45. Растяжение кишечника мышей, которые получали белок GIPF мыши, mGIPFt, было сопоставимо с растяжением, индуцированным GIPFwt человека. Кроме того, фенотип кишечника мышей, которые получали GIPFwt посредством подкожного введения, был сопоставим с фенотипом мышей, которые получали GIPFwt посредством в/в-пути. Как указано ранее, кипячение GIPFwt не влияло на его способность вызывать растяжение кишечника. Полученные данные согласуются с измерениями длины, массы и диаметра кишечника из всех групп животных (таблица 8).
Все гематологические результаты были в диапазоне нормы для животных, таким образом свидетельствуя, что GIFP не вызывал каких-либо непосредственных неблагоприятных эффектов. Влияние GIPFwt и mGIPFt на высоту ворсинок и глубину крипт показало, что GIPF значительно увеличивал глубину крипт у здоровых мышей после 3-дневной схемы. В отличие от влияния GIPF на увеличение высоты ворсинок у больных животных GIPF не влиял на высоту ворсинок у нормальных здоровых животных (фигура 46).
Полученные данные показывают, что пролиферативное действие рекомбинантного GIPF человека не является результатом эктопического действия. Кроме того, GIPF проявляет свою биологическую активность независимо от того, вводят ли его внутривенно или подкожно.
ПРИМЕР 21
АНАЛИЗЫ IN VITRO АКТИВНОСТИ GIPF В ИЗОЛИРОВАННЫХ КЛЕТКАХ КРИПТ
Влияние GIPF на передачу сигнала и пролиферацию эпителиальных клеток крипт анализировали в изолированных клетках крипт ободочной кишки мыши согласно способу Fujimoteo et al. (Fujimoto et al., Gastroenterology 117: 858-865 (2002)).
Ободочные кишки мышей вырезали и стерилизовали в 0,04% растворе гипохлорита натрия в течение 15 минут. После промывки в PBS ободочные кишки инкубировали в растворе DTT/EDTA (0,5 мМ DTT, 3 мМ EDTA в PBS) в течение 90 мин при комнатной температуре. После инкубации ткань промывали один раз в PBS и добавляли 10 мл PBS. Пробирку энергично встряхивали, чтобы высвободить крипты из подслизистой оболочки. PBS, содержащий крипты, переносили в центрифужную пробирку и стадию встряхивания повторяли вплоть до того, как выход крипт уменьшался. Крипты осторожно центрифугировали (400 об/мин в течение 5 мин) и промывали свежим PBS. Крипты ресуспендировали в 20 мл 0,3% панкреатина (Sigma) в PBS и инкубировали в течение 90 мин при комнатной температуре, встряхивая каждые 10 минут в течение первых 30 минут и каждые 30 минут после этого. В конце инкубации добавляли равный объем PBS и крипты центрифугировали при 1000 об/мин в течение 5 мин и промывали раствором EDTA/DTT еще 1-2 раза до удаления всей слизистой оболочки. Клетки крипт ресуспендировали в 1X-среде (RPMI 1640 с добавлением 5% FCS, глутамина, NaHCO3, инсулина, трансферрина, селена, пенициллина/стрептомицина). Агрегаты клеток разрушали с использованием шприца с иглами калибра 21G, затем 23G. Клетки считали и использовали для анализа стабилизации β-катенина; для определения пролиферативной активности по включению3H-тимидина и для тестирования способности GIPF влиять на клоногенность клеток крипт.
A. Влияние GIPF на активацию β-катенина in vivo исследовали в клетках крипт, которые были выделены от мышей Balb/c через 6 часов после того, как им инъецировали в/в 100 мкг GIPFwt, который описан выше.
Как показано на фигуре 47, GIPFwt индуцировал значительную стабилизацию β-катенина в цитозоле изолированных клеток крипт по сравнению со стабилизацией, наблюдаемой в клетках крипт от контрольных мышей. На фигуре 47A показан уровень нефосфорилированного активного β-катенина, а на фигуре 47B показан уровень суммарного β-катенина, присутствующего в цитозоле. Нефосфорилированный β-катенин выявляли с использованием антитела против β-катенина, которое приобретали из Upstate (Waltham, MA, USA), тогда как уровень суммарного β-катенина анализировали с использованием антитела из Abcam (Cambridge, MA, USA), которое узнает как фосфорилированный, так и нефосфорилированный белок. Полученный результат показывает, что индуцированная GIPF пролиферация эпителиальных клеток крипт у мышей может быть опосредована передачей сигнала β-катенина.
B. Влияние GIPFwt на пролиферацию изолированных клеток крипт анализировали in vitro по включению3H-тимидина. Результаты показали, что белок GIPFwt увеличивал пролиферацию изолированных клеток крипт зависимым от дозы образом.
Следовательно, GIPF индуцирует пролиферацию изолированных клеток крипт посредством стабилизации β-катенина, и изолированные клетки кишечника можно использовать для оценки путей передачи сигнала, которые лежат в основе пролиферативного действия GIPF.
C. Осуществляли анализ клоногенности, описанный Whitehead et al. (Whitehead et al. Gastroenterology, 117: 858-865 (1999)), чтобы исследовать способность GIPF регулировать пролиферацию и/или дифференцировку слизистой оболочки кишечника. Коротко, подложку, содержащую равную смесь 1% агара и 2X-среды RPMI плюс 10% FBS, добавляли в чашки диаметром 35 мм. Изолированные клетки крипт добавляли к среде для верхнего слоя (равные части 0,8% агарозы и 2X-среды RPMI плюс 10% FBS) в концентрации 50000 клеток на мл и аликвоты по 2 мл клеточной суспензии вносили в каждую лунку. Чашки инкубировали в присутствии GIPF в концентрации 50, 100 и 200 нг/мл в течение 3-4 недель при 37°C. После инкубации чашки исследовали и подсчитывали количество колоний. Колонии определяли как агрегаты из более чем 40 клеток.
GIPF стимулирует образование колоний. Анализ клоногенности используют для тестирования пролиферативной активности GIPF и аналогов GIPF in vitro.
ПРИМЕР 22
ВЛИЯНИЕ GIPF НА TNBS-ИНДУЦИРОВАННЫЙ КОЛИТ
Гаптен 2,4,6-тринитробензолсульфоновая кислота (TNBS) индуцирует хронический колит, который характеризуется тяжелым трансмуральным воспалением, связанным с диареей, выпадением прямой кишки и потерей массы. Указанные клинические и гистопатологические признаки указывают, что TNBS-индуцированный колит имитирует важные показатели болезни Крона человека (Neurath et al., J. Exp. Med. 182: 1281-1290 (1995)).
Терапевтическое действие GIPF тестировали у мышей с TNBS-индуцированным колитом. Воспаление кишечника индуцировали у самок мышей BALBc 6-8-недельного возраста (группа 2) однократным ректальным введением 1 мг TNBS, как описано (Neurath et al, выше). Группа контрольных животных (группа 1) получала ректальное введение только наполнителя (45% этанол). Терапевтическое действие hGIPF тестировали подкожным введением ежедневных доз 100 мкг (группа 3) или 50 мкг (группа 4) hGIPF (4 мг/кг или 2 мг/кг) животным, которые получали TNBS в течение 3 дней. Мышей умерщвляли через 7 дней и оценивали индукцию колита посредством TNBS. hGIPF значимо уменьшал потерю массы тела, индуцированную TNBS, у животных группы 2 (фигура 48). hGIPF также уменьшал тяжелую диарею, изъязвление, кровотечение и атрофию ободочной кишки, от которой страдали обработанные TNBS животные группы 2 (данные не показаны).
Гистологические изменения оценивали на окрашенных Г+Э залитых в парафин срезах ободочной кишки от контрольной группы и TNBS-группы. hGIPF снижал индуцированную TNBS трансмуральную инфильтрацию и разрушение структуры крипт слизистой оболочки в ободочной кишке мышей (фигуре 49). На графике на фигуре 49 представлено действие hGIPF, определяемое с использованием гистологической классификации колита ободочной кишки следующим образом:
Кроме того, hGIPF сокращал увеличение активности TNBS-индуцированной миелопероксидазы, которое является критерием инфильтрации нейтрофилов в ободочной кишке мышей. Обработка GIPF значимо уменьшала индуцированную TNBS диарею, воспаление и утолщение стенки ободочной кишки и потерю бокаловидных клеток по сравнению с животными, которых не обрабатывали GIPF. Следовательно, GIPF потенциально можно использовать в качестве терапевтического средства для лечения пациентов с болезнью Крона.
ПРИМЕР 23
ТЕРАПЕВТИЧЕСКОЕ ДЕЙСТВИЕ GIPF НА ХРОНИЧЕСКИЙ ИНДУЦИРОВАННЫЙ ДЕКСТРАНСУЛЬФАТОМ НАТРИЯ КОЛИТ У МЫШЕЙ
Эффективность рекомбинантного GIPF человека (GIPFwt) при лечении колита тестировали в мышиной модели хронического индуцированного декстрансульфатом натрия (DSS) колита (L'Heureux and Brubaker J Pharmacol Exp Ther 306:347-354 (2003); Kriegelstein et al., J Clin Invest 110:1773-1782 (2002); Siegmund et al., J Pharmacol Exp Ther 296:99-105 (2001)).
Самок мышей BALB/c шести-восьми-недельного возраста (Charles River Laboratories, Wilmington, MA, USA) содержали в вентилируемых клетках и акклиматизировали в течение одной недели к 12-часовому циклу освещенность:темнота. Мышам скармливали 4% DSS (об./мас.) в питьевой воде с 0 по 7 день, чтобы индуцировать колит. С 7 дня по 21 день мышам давали воду без DSS, чтобы индуцировать первую фазу ремиссии. С 21 дня по 28 день мышам снова давали 4% DSS, чтобы индуцировать первую фазу рецидива. С 28 дня по 35 день мышам снова давали воду без DSS, чтобы индуцировать 2-ю фазу ремиссии. На 35 день мышей случайным образом распределяли по разным экспериментальным группам и начинали терапию GIPF на 35 день и продолжали до 42 дня. За мышами наблюдали ежедневно с 35 дня по 42 день в отношении признаков активности заболевания. На 42 день эксперимент заканчивали, мышей умерщвляли и собирали ткань кишечника для анализа.
GIPF значимо уменьшал DSS-индуцированный колит у мышей зависимым от дозы образом, что отражалось в значимом снижении индекса активности воспалительного заболевания кишечника (IBDAI) (фигуре 50; *P<0,05 (ANOVA, группа DSS/физиологический раствор по сравнению с группой DSS/hGIPF); #P<0,05 (ANOVA, DSS/физиологический раствор по сравнению с DSS/KGF); **P<0,05 (ANOVA, DSS/физиологический раствор по сравнению с DSS/GLP-2)). Определение IBDAI приведено в примере 14. На окрашенных Г+Э срезах тонкого кишечника и ободочной кишки видно, что hGIPF предотвращал индуцированное DSS повреждение слизистой оболочки кишечника мышей и реверсировал индуцированное DSS укорочение длины ворсинок и глубины крипт (фигура 51). GIPF также подавлял супрессирующее действие DSS на пролиферацию клеток крипт в тонком кишечнике (фигуре 52; *P<0,05 (ANOVA, DSS/физиологический раствор по сравнению с группой вода/физиологический раствор); #P<0,05 (ANOVA, DSS/hGIPF по сравнению с DSS/физиологический раствор); **P<0,05 (ANOVA, DSS/KGF по сравнению с DSS/физиологический раствор); ##P<0,05 (ANOVA, DSS/GLP-2 по сравнению с DSS/физиологический раствор)). Пролиферативный индекс крипт определен в примере 14.
В заключение, терапевтическая обработка GIPF значимо уменьшает хронический индуцированный DSS колит у мышей, что свидетельствует о том, что GIPF потенциально можно использовать для лечения воспалительного заболевания кишечника человека.
ПРИМЕР 24
СНИЖЕНИЕ 5-FU-ИНДУЦИРОВАННОЙ ТОКСИЧНОСТИ С ПОМОЩЬЮ hGIPF
Эффективность hGIPF в снижении токсичности 5-FU в желудочно-кишечном тракте оценивали у нормальных мышей BDF-1.
Мышей делили на следующие группы:
1) инъекции наполнителя с лечением физиологическим раствором;
2) инъекция 5-FU с лечением физиологическим раствором;
3) инъекции 5-FU с лечением GIPF.
Самкам мышей BDF-1 в возрасте 11-13 недель ежедневно вводили подкожные инъекции либо физиологического раствора, либо 100 мкг на дозу hGIPF, начиная с -3 дня. С 0 дня по 4 день каждой мыши внутрибрюшинно инъецировали дозу 50 мг/кг 5FU в течение 4 следующих друг за другом дней. У мышей ежедневно контролировали массу тела, появление диареи и смертность.
Лечение GIPF значимо снижало 5-FU-индуцированную токсичность в желудочно-кишечном тракте, включая уменьшение максимальной потери массы тела, оценку диареи в баллах и смертность (таблица 9), таким образом свидетельствуя о том, что GIPF является эффективным в снижении индуцированной химиотерапией токсичности в желудочно-кишечном тракте у мышей.
ПРИМЕР 25
АКТИВНОСТЬ GIPF IN VIVO У ПРИМАТОВ, ОТЛИЧНЫХ ОТ ЧЕЛОВЕКА
Исследование активности многократных доз GIPF осуществляли у макак-крабоедов, чтобы определить активность GIPF у приматов, отличных от человека.
Девять неинтактных самок обезьян подвергали отбору в отношении состояния здоровья штатными ветеринарными врачами или ветеринарными лаборантами SNBL USA (Everett, Washington, USA) и подвергали отбору на основе гематологии и химического анализа сыворотки. Из девяти животных женского пола, подтверждаемых в отношении здоровья, отбирали 8 и распределяли в группы для исследования. Животных, которых предварительно содержали на карантине, акклиматизировали в помещении для исследования в здании SNBL USA минимум 14 дней до начала исследования.
Протокол: Восемь самок распределяли на четыре группы обработки, которые указаны в таблице ниже и вводили дозы посредством внутривенной болюсной инъекции белка GIPF один раз в день в течение трех дней. На четвертый день всем животным вводили одну внутривенную болюсную инъекцию бромдезоксиуридина (BrdU) (50 мг/кг) примерно за 4 часа до вскрытия. Выбранные ткани собирали при вскрытии.
Наблюдения и исследования: Клиническое обследование осуществляли во время акклиматизации и на протяжении исследования следующим образом. Исследование смертности и испражнений осуществляли один раз в день утром, и клиническое обследование в отношении общего состояния здоровья и внешнего вида осуществляли один раз в день во второй половине дня, начиная с начала периода акклиматизации до конца жизни. При необходимости проводили дополнительные клинические обследования и регистрировали. Ветеринарный врач или ветеринарный лаборант оценивали каждого животного в отношении того, свидетельствует ли клиническое обследование об ухудшающемся состоянии, и уведомляли руководителя исследования.
Сбор образцов крови: Кровь брали один раз во время акклиматизации и один раз в день вскрытия перед введением BrdU для гематологии и химического анализа сыворотки.
Исследование макроскопической патологии: При вскрытии исследовали наружные поверхности тела, все отверстия и черепную, грудную и брюшную полости и их содержимое. Определение массы органов и гистопатологическое исследование проводили макроскопически, собирали и консервировали в 10% нейтральном забуференном формалине для гистопатологического исследования. Исследованные ткани перечислены ниже.
Анализ пролиферации тканей с использованием IHC BrdU: Для анализа BrdU готовили залитые парафином срезы.
Результат: Макроскопическое патологическое исследование при вскрытии не выявило явных изменений в исследованных органах, что свидетельствует об отсутствии токсичности hGIPF при данной схеме лечения. Кроме того, гематология и химический анализ сыворотки на образцах крови, собранных до и после обработки hGIPF, показал отсутствие изменение в клеточных компонентах крови, а также в тестированных биохимических параметрах сыворотки.
Выявлено наличие связанного с дозой увеличения длины тонкого кишечника. Средняя длина кишечника (в см) для групп 1, 2, 3 и 4 составляла 120,65, 122,555, 133,350 и 142,875 соответственно. Кроме того, как суммировано в таблице ниже (таблица 10), микроскопическая оценка гистологии отдельных тканей показала гиперплазию крипт двенадцатиперстной кишки, тощей кишки и подвздошной кишки во всех обработанных GIPF группах. Гиперплазию крипт также наблюдали в слепой кишке, ободочной кишке и прямой кишке, которая зависела от дозы. Полученный результат свидетельствует, что hGIPF оказывает пролиферативное действие на эпителиальные клетки крипт кишечника обезьян, которое согласуется с пролиферативным действие, наблюдаемым у мышей и крыс.
Чтобы подтвердить пролиферативное действие hGIPF, осуществляли иммуногистохимический анализ, чтобы проанализировать включение BrdU в тонком и толстом кишечнике. hGIPF увеличивал индекс BrdU-позитивной пролиферации как в тонком кишечнике, так и в ободочной кишке.
Полученные данные показывают, что hGIPF увеличивает пролиферацию в эпителии крипт у приматов, отличных от человека.
Индивидуальные гистопатологические данные
Степень
_ нет аномальных изменений
± очень слабые
+ слабые
2+ умеренные
3+ заметные
ПРИМЕР 26
ИССЛЕДОВАНИЕ ВСАСЫВАНИЯ, РАСПРЕДЕЛЕНИЯ, МЕТАБОЛИЗМА, ВЫВЕДЕНИЯ (ADME) С ИСПОЛЬЗОВАНИЕМ РАДИОАКТИВНО МЕЧЕННОГО БЕЛКА125I-hGIPF
Цель исследования: Определение фармакокинетики в плазме и распределения в тканях [125I]-hGIPF у мышей.
Мечение белка: Белок hGIPF метили [125I] способом мечения IODO-GEN (Amersham). Исходная удельная активность при мечении составляла 35 мкКи/мкг (1020 Ки/ммоль). Меченый белок дополнительно очищали перед инъекцией мышам.
Животные: Самцов мышей CD-1® [Crl:CD-1® (ICR)BR] акклиматизировали в течение 7 дней перед инъекцией и содержали отдельно в чистых подвешенных клетках из проволочной сетки. Клетки поднимали выше настила для клеток или другого подходящего материала, заменяемого по меньшей мере три раза в неделю. Каждая мышь получала дозу 1,67 мг/кг hGIPF, которая содержала 3 мкКи белка125I-hGIPF. После получения радиоактивной дозы животных, которых планировали для сбора мочи и фекалий, содержали по отдельности в блоках для определения метаболизма.
Дизайн исследования:
Всех животных, полученных для данного исследования, обрабатывали йодидом натрия, чтобы блокировать поглощение щитовидной железой свободного йодида из меченого испытываемого образца. Пероральное (зондовое) введение 0,1 мл 1% раствора NaI осуществляли примерно за 48, 24 и 1 час до введения дозы с радиоактивно меченным белком. Каждое животное получало однократную дозу [125I]-hGIPF, которую вводили посредством внутривенной инъекции. Животных делили на две группы и анализировали, как указано в разделе «Дизайн исследования» выше. В указанное время для эвтаназии собирали образцы крови и разделяли клеточную фракцию и плазму для анализа. Собирали образцы ткани печени, почки, легкого, языка, селезенки, головного мозга, пищевода, желудка, тонкого кишечника, толстого кишечника и толстого кишечника, включая его содержимое, и определяли включение [125I]-hGIPF в тканях.
Анализ включения125I-hGIPF осуществляли с помощью гамма-счета в мультикристаллическом гамма-счетчике DPC GAMMA-C12 согласно стандартным способам эксплуатации WIL. Результаты гамма-счета корректировали относительно времени полужизни изотопа. Расчеты количества радиоактивности в различных материалах, полученных в исследовании, осуществляли с использованием программ системы обработки токсикологических данных WIL или электронных таблиц согласно WIL стандартным способам эксплуатации. В общем, использовали только описательную статистику (например, суммы, арифметические средние, стандартные отклонения, стандартные ошибки, коэффициент вариаций, проценты). В тех случаях, когда это возможно, рассчитывали стандартные фармакокинетические параметры (например, Cmax, tmax, AUC (площадь под кривой), T1/2 (время полужизни)), используя стандартные фармакокинетические уравнения.
Результаты: Данные, показывающие концентрацию и кинетику [125I]-hGIPF в плазме, эритроцитах, печени, почке, легком, сердце, головном мозге, селезенке, пищеводе, желудке, тонком кишечнике и толстом кишечнике мышей, приведены в таблицах 11-14.
Как предполагалось, наиболее раннее Tmax и наибольшее Cmax наблюдали в интенсивно перфузируемых тканях, т.е. печени, почках, селезенке и легких, и самое длительное время полужизни наблюдали в почках и печени (таблица 11).
В каждой из тканей желудочно-кишечного тракта, включая пищевод, желудок и тонкий кишечник, наблюдали растянутое Tmax (таблица 12). В таблице 13 A показано извлечение в процентах радиоактивно меченного GIPF из тканей различных органов и содержимого кишечника, мочи, фекалий и тушки животных через 24 часа после введения радиоактивно меченного hGIPF. Извлечение hGIPF из тканей отдельных органов указано в таблице 13B. Данные показывают, что распределение радиоактивно меченного hGIPF обычно является высоким для органов желудочно-кишечного тракта после введения посредством внутривенного пути, таким образом свидетельствуя, что hGIPF может иметь высокую аффинность по отношению к тканям желудочно-кишечного тракта.
ПРИМЕР 27
ИНДУЦИРОВАННЫЙ ОБЛУЧЕНИЕМ МУКОЗИТ: ОЦЕНКА ОПТИМАЛЬНОЙ СХЕМЫ ЛЕЧЕНИЯ
Целью данного исследования было определение терапевтического протокола, который мог бы обеспечить максимальное профилактическое действие GIPF против индуцированного облучением мукозита.
Взрослые самцы мышей BDF-1 во время использования имели возраст 10-12 недель. Животных содержали в течение 1 недели в условиях 12-часового цикла освещение/темнота и все время получали корм и воду по желанию. Животных случайным образом делили на 6 групп по 5 животных в каждой (всего 30 мышей) и обрабатывали следующим образом:
1. Необработанный, необлученный контроль.
2. 4 мг/кг hGIPF в/в за 3, 2, 1 день до облучения рентгеновским излучением в дозе 13 Гр (облучение всего тела).
3. 4 мг/кг hGIPF в/в за 4, 3, 2 дня до облучения рентгеновским излучением в дозе 13 Гр (облучение всего тела).
4. 4 мг/кг hGIPF в/в за 5, 4, 3 дня до облучения рентгеновским излучением в дозе 13 Гр (облучение всего тела).
5. 4 мг/кг hGIPF в/в за 6, 5, 4 дня до облучения рентгеновским излучением в дозе 13 Гр (облучение всего тела).
6. Физиологический раствор в/в за 72, 48, 24 часа до облучения рентгеновским излучением в дозе 13 Гр (облучение всего тела).
Животных подвергали облучению всего тела, используя однократную дозу 13 Гр рентгеновского излучения, подаваемого по 2,7 Гр/мин. Животных обследовали ежедневно после облучения.
Через 4 дня после облучения животных умерщвляли. За два часа до умерщвления животным инъецировали 4 мг BrdU в объеме 0,4 мл. После вскрытия измеряли длину и массу тонкого и толстого кишечника и участки размером ˜1 см ткани тонкого кишечника (средняя часть тощей кишки), ободочной кишки (поперечная ободочная кишка), языка, пищевода и желудка фиксировали в 10% формалине.
Поперечные срезы тонкого кишечника анализировали в отношении поглощения BrdU. Оценивали количество жизнеспособных крипт на срезе и определяли среднее значение для группы. Оценивали только крипты, содержащие 10 или более сильно окрашенных Г+Э клеток (исключая клетки Панета) и только интактные срезы, не содержащие Пейеровых бляшек.
Также измеряли среднюю ширину крипт (измеряемую в самой широкой точке), чтобы скорректировать ошибки оценки вследствие разницы в размере крипт. Корректировку применяли таким образом:
Скорректированное количество крипт/окружность =
Результаты: Влияние hGIPF на жизнеспособность крипт после воздействия облучения показано на фигуре 53. Данные показывают, что hGIPF значимо уменьшал индуцированный облучением мукозит кишечника, когда hGIPF вводили животным за 24 часа или 48 часов до общего облучения тела (таблица 15).
Полученные данные подтверждают, что hGIPF можно использовать в качестве профилактического средства, чтобы компенсировать вредное влияние индуцированного облучением мукозита кишечника, и что введение дозы за 24 часа до общего облучения тела обеспечивает наибольшую защиту кишечных крипт.
ПРИМЕР 28
АНАЛИЗ ЗАВИСИМОЙ ОТ ЛИНИИ КЛЕТОК ПРОЛИФЕРАЦИИ В ТОНКОМ КИШЕЧНИКЕ МЫШЕЙ
Исследовали влияние hGIPF на кишечные крипты, чтобы определить, осуществляется ли влияние hGIPF перед началом морфологических изменений посредством воздействия на любые из типов клеток - стволовые клетки и переходные пролиферирующие клетки крипты.
Животных случайным образом делили на следующие группы:
1. PBS (1 мышь на группу): 1, 3, 6, 12, 24 или 48 часов после инъекции.
2. hGIPF (2 мыши на группу, однократная инъекция 100 мкг): 1, 3, 6, 12, 24 или 48 час после инъекции.
Каждому животному инъецировали BrdU (4 мг/кг) за 2 часа до умерщвления. Анализ глубины крипт, пролиферативного индекса крипт и места пролиферации клеток осуществляли на срезах тонкого кишечника в средней части тощей кишки. Пролиферативный индекс крипт измеряли посредством иммуногистохимического анализа BrdU в указанных временных точках (3, 6, 12, 24 и 48 часов) после однократной инъекции hGIPF (100 мкг). Анализировали 40 крипт от 2 мышей в отношении включение BrdU, и результаты приведены в виде среднего ± SD (*P < 0,01, ANOVA).
Результаты: Как показано в таблице 16, hGIPF увеличивал пролиферацию клеток крипт тонкого кишечника уже через 3 часа, и пролиферация достигала пика через 24 часа после обработки hGIPF. Индуцированная hGIPF пролиферация крипт реверсировала в течение 48 часов. Кроме того, анализ положения BrdU-позитивных клеток (Potten et al., Int. J. Exp. Path. 78: 219-243 (1997)) показал значительное увеличение пролиферации клеток крипт в положении 3-5 (от дна крипт, где расположены стволовые клетки), а также в верхней части крипт.
Полученные данные свидетельствуют, что hGIPF может влиять как на стволовые клетки, так и на популяцию делящихся переходных клеток.
ПРИМЕР 29
ВЛИЯНИЕ hGIPF НА ДИФФЕРЕНЦИРОВКУ И МИГРАЦИЮ КЛЕТОК КРИПТ
Оценивали количество бокаловидных клеток и клеток Панета после обработки мышей hGIPF, чтобы определить, влияет ли hGIPF на популяцию и распределение указанных типов клеток в тонком кишечнике.
Осуществляли окрашивание альциановым синим, чтобы визуализировать бокаловидные клетки на срезах средней части тощей кишки обработанных PBS и hGIPF мышей (n=3). Животным ежедневно инъецировали hGIPF (100 мкг) или PBS в течение 3 или 7 дней. Чтобы визуализировать клетки Панета осуществляли иммуногистохимический (IHC) анализ на срезах средней тощей кишки тех же животных, используя антитело против лизоцима.
Результаты: Иммуногистохимический анализ и окрашивание альциановым синим тонкого кишечника не выявило значимых изменений в количестве клеток Панета и бокаловидных клеток в тонком кишечнике hGIPF-обработанных мышей. hGIPF не влиял на созревание и миграцию дифференцированных клетки вдоль оси крипт/ворсинок.
ПРИМЕР 30
ТРАНСГЕННЫЕ ХИМЕРНЫЕ МЫШИ, КОТОРЫЕ ЭКСПРЕССИРУЮТ hGIPF В ЭПИТЕЛИАЛЬНЫХ КЛЕТКАХ КИШЕЧНИКА
1. Получение длинного фрагмента промотора гена виллина мыши (фиг. 54A).
Виллин, связывающий актин белок, обнаруженный в апикальной щеточной кайме всасывающих тканей, является одним из первых структурных генов, транскрипционно активируемых в энтодерме эмбрионального кишечника. Во взрослом организме виллин широко экспрессируется в каждой клетке эпителия кишечника как по вертикальной оси (от крипты до верхушки ворсинки), так и по горизонтальной оси (от двенадцатиперстной кишки до ободочной кишки) кишечника. Madison et al. документально подтвердили, что область длиной 12,4 т.п.н. гена виллина мыши стимулирует высокий уровень экспрессии двух разных репортерных генов (LacZ и рекомбиназы Cre) во всем эпителии кишечника трансгенных мышей (J. Biol. Chem. 277, p33275-33283, 2002). Чтобы создать трансгенных химерных мышей, экспрессирующих GIPF человека в эпителиальных клетках кишечника, авторы конструировали экспрессирующий вектор, в котором кДНК GIPF связана с указанными последовательностями регуляции транскрипции, управляющими ее экспрессией в эпителиальных клетках кишечника.
Информацию о нуклеотидной последовательности расположенной выше области гена виллина мыши получали из опубликованной базы данных (ensembl). ДНК BAC мыши (RP23-278N11; номер доступа в GenBank: AC098570) расщепляли EcoRI и BamHI (Roche) и подвергали электрофорезу в 0,8% агарозном геле, чтобы выделить фрагмент размером примерно 11 т.п.н.. После расщепления pBluescript II SK (-) (STRATAGENE) EcoRI и BamHI (Roche) фрагмент вектора выделяли электрофорезом в 0,8% агарозном геле и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба его конца. Указанный выше фрагмент ДНК длиной примерно 11 т.п.н. лигировали с дефосфорилированным фрагментом вектора и смесь для лигирования переносили в сверхкомпетентные клетки XL10-Gold (STRATAGENE). Образцы ДНК, приготовленные из полученных в результате трансформантов, подвергали ПЦР-амплификации, используя набор праймеров, описанный ниже (SEQ ID NO: 120 и 121). Анализ последовательности амплифицированного фрагмента показал наличие включения фрагмента промотора гена виллина длиной примерно 11,2 т.п.н. (pPvil 11.2). pPvil 11.2 расщепляли ферментами рестрикции ClaI и BamHI и реакционную смесь подвергали электрофорезу в 0,8% агарозном геле, чтобы выделить фрагмент длиной примерно 11,2 т.п.н.

(2) Получение короткого фрагмента промотора гена виллина мыши (фиг. 54B)
На основе нуклеотидной последовательности области, расположенной выше гена виллина мыши, полученной из опубликованной базы данных (ensembl), синтезировали две синтетических ДНК (SEQ ID NO: 122 и 123).
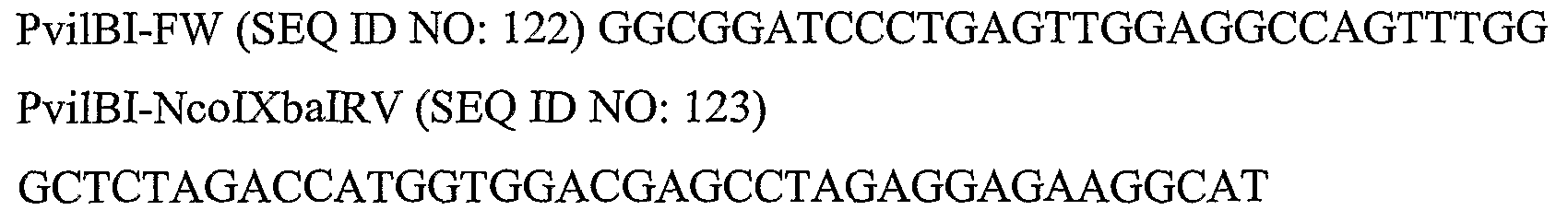
KOD-puls (TOYOBO) использовали для реакции ПЦР. Реакционная смесь для ПЦР содержала 10 пмоль каждого праймера и ДНК BAC мыши (RP23-278N11; номер доступа в GenBank: AC098570) в качестве матрицы. Указанную ПЦР-амплификацию осуществляли, используя начальную денатурирующую инкубацию при 94°C в течение двух минут. Затем осуществляли 30 циклов денатурации, отжига и амплификаци посредством инкубации при 94°C в течение 15 сек и 68°C в течение двух минут. Продукт ПЦР (около 1,9 т.п.н.) очищали электрофорезом в 0,8% агарозном геле и используя набор для экстракции из геля QIAquick (QIAGEN). После расщепления выделенного продукта ПЦР BamHI и XbaI расщепленный фрагмент очищали электрофорезом в 0,8% агарозном геле и используя набор для экстракции из геля QIAquick (QIAGEN). Очищенный фрагмент лигировали с pBluescript II SK (-) (STRATAGENE), который расщепляли XhoI и XbaI, и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба конца. Смесь для лигирования трансфицировали в DH5α и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента.
Клон, содержащий фрагмент с правильной нуклеотидной последовательностью, расщепляли NcoI. После обработки расщепленного фрагмента фрагментом Кленова (TAKARA BIO) для затупления обоих его концов его дополнительно расщепляли XbaI и очищали электрофорезом в 0,8% агарозном геле. Полученный в результате фрагмент обрабатывали щелочной фосфатазой E. coli C75, чтобы дефосфорилировать оба его конца.
(3) Получение фрагмента GIPF (фиг. 54C)
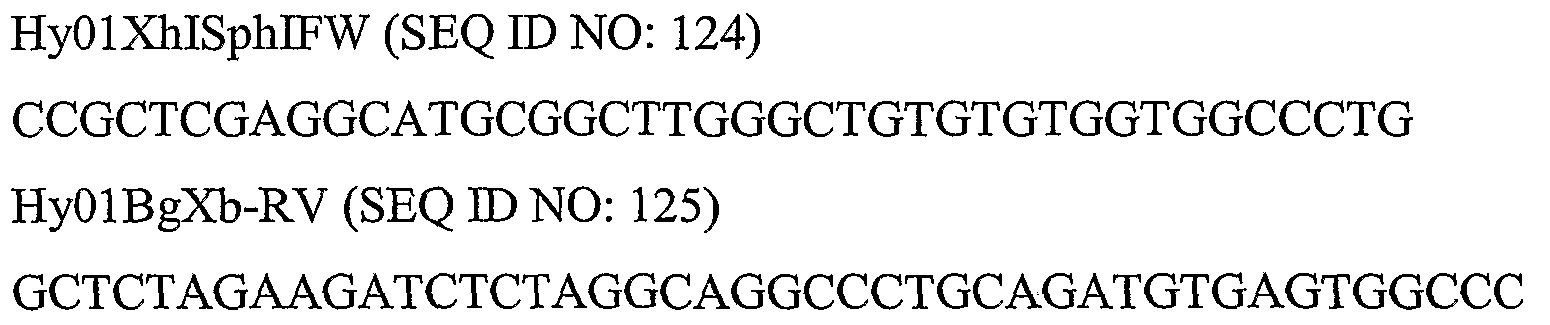
KOD-puls (TOYOBO) использовали для реакции ПЦР. Реакционная смесь для ПЦР содержала 10 пмоль каждого праймера (SEQ ID NO: 124 и 125)и кДНК GIPF в качестве матрицы. Указанную ПЦР-амплификацию осуществляли, используя начальную денатурирующую инкубацию при 94°C в течение трех минут. Затем осуществляли 30 циклов денатурации, отжига и амплификации посредством инкубации при 94°C в течение 15 сек и 68°C в течение двух минут. Продукт ПЦР (около 800 п.н.) очищали электрофорезом, используя 0,8% агар и набор для экстракции из геля QIAquick (QIAGEN). После расщепления выделенного продукта ПЦР XhoI и XbaI его лигировали с pBluescript II SK (-), который расщепляли XhoI и XbaI, и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба конца. Смесь для лигирования трансфицировали в DH5α и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Клон, содержащий фрагмент с правильной нуклеотидной последовательностью, расщепляли SphI. После обработки расщепленного фрагмента ферментом Blunding high (TOYOBO) для затупления обоих его концов, его дополнительно расщепляли XbaI и очищали электрофорезом в 0,8% агарозном геле.
(4) Конструирование pPvil 2-01 (фиг. 54D)
Фрагмент GIPF, полученный согласно п. (3), лигировали с pPvil2, полученным согласно п. (2), и смесь для лигирования трансфицировали в DH5α. Образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Отбирали клон, содержащий фрагмент с правильной нуклеотидной последовательностью (pPvil2-01).
(5) Получение pIRES-GFP (фиг. 54E)
После расщепления pIRES2-EGFP (BD Bioscience Clontech) EcoRI и NotI фрагмент, содержащий область IRES-GFP, очищали электрофорезом в 0,8% агарозном геле и используя набор для экстракции из геля QIA quick (QIAGEN). Очищенный фрагмент (IRES-GFP) лигировали в pcДНК3 (Invitrogen), который расщепляли XhoI и XbaI, и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба его конца. Смесь для лигирования трансфицировали в DH5α и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Отбирали клон, содержащий фрагмент с правильной нуклеотидной последовательностью (pIRES-GFP).
(6) Конструирование pUC119 IRES-GFP (фиг. 54F)
После расщепления pIRES-GFP BamHI и XbaI фрагмент, содержащий область IRES-GFP, очищали электрофорезом в 0,8% агарозном геле и используя набор для экстракции из геля QIAquick (QIAGEN). Очищенный фрагмент (IRES-GFP) лигировали в pUC119, который расщепляли BamHI и XbaI, и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба его конца. Смесь для лигирования трансфицировали в DH5α и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Отбирали клон, содержащий фрагмент с правильной нуклеотидной последовательностью (pUC119 IRES-GFP).
(7) Конструирование pUC119 IRES-GFP+As (фиг. 54G)
Фрагмент ДНК, полученный отжигом синтезированных олигонуклеотидов, описанных ниже (SEQ ID NO: 126 и 127), лигировали в pUC119 IRES-GFP, который расщепляли EcoRI и BamHI, и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба его конца. Смесь для лигирования трансфицировали в DH5α и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Отбирали клон, содержащий фрагмент с правильной нуклеотидной последовательностью (pUC 119 IRES-GFP+As).

(8) Конструирование pUC119 IRES-GFP+loxP (фиг. 54H)
Фрагмент ДНК, полученный отжигом синтезированных олигонуклеотидов, описанных ниже (SEQ ID NO: 128 и 129), лигировали в pUC119 IRES-GFP+As, который расщепляли NotI и XhoI, и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба его конца. Смесь для лигирования трансфицировали в DH5α, и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Отбирали клон, содержащий фрагмент с правильной нуклеотидной последовательностью (pUC 119 IRES-GFP+loxP).

(9) Получение фрагмента полиА бычьего гормона роста (BGH) (фиг. 54I)


KOD-puls- (TOYOBO) использовали для реакции ПЦР. Реакционная смесь для ПЦР содержала 10 пмоль каждого праймера (SEQ ID NO: 130 и 131) и фрагмент IRES-GFP, полученный согласно п. (6), в качестве матрицы. Указанную ПЦР-амплификацию осуществляли, используя начальную денатурирующую инкубацию при 94°C в течение трех минут. Затем осуществляли 30 циклов денатурации, отжига и амплификации посредством инкубации при 94°C в течение 15 сек и при 68°C в течение двух минут. Продукт ПЦР (длиной около 0,2 т.п.н.) очищали электрофорезом в 0,8% агарозном геле и используя набор для экстракции из геля QIAquick (QIAGEN). После расщепления выделенного продукта ПЦР BamHI и EcoRV его лигировали в pBluescript II SK (-), который расщепляли BamHI и EcoRV, и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба его конца. Смесь для лигирования трансфицировали в DH5α и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Клон, содержащий фрагмент с правильной нуклеотидной последовательностью, расщепляли PmeI и EcoRV, и фрагмент, содержащий область полиА бычьего гормона роста (BGH), очищали электрофорезом, используя 0,8% агар и набор для экстракции из геля QIAquick (QIAGEN).
(10) Получение фрагмента ДНК, содержащего последовательности IRES-GFP, полиА бычьего гормона роста и loxP (фиг. 54J)
pUC119 IRES-GFP+loxP расщепляли PmeI и очищали электрофорезом в 0,8% агарозном геле. Фрагмент полиА BGH, полученный согласно п. (9), лигировали с очищенным вектором pUC 119 IRES-GFP+loxP, который обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба его конца. Смесь для лигирования трансфицировали в DH5α и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Отбирали клон, содержащий фрагмент полиА BGH в таком же направлении, что и кодирующая последовательность GFP (pIRES-GFP+pA). pIRES-GFP+pA расщепляли BamHI и XbaI и фрагмент, содержащий последовательности IRES-GFP, полиА бычьего гормона роста и loxP очищали электрофорезом, используя 0,8% агар и набор для экстракции из геля QIAquick (QIAGEN).
(11) Конструирование pPvil 2-01GFP (фиг. 54K)
Фрагмент ДНК, содержащий последовательности IRES-GFP, полиА бычьего гормона роста и loxP [смотри (10)], лигировали в pPvil2GIPF, который расщепляли BglII и XbaI и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба его конца. Смесь для лигирования трансфицировали в DH5α и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Отбирали клон, содержащий фрагмент с правильной нуклеотидной последовательностью (pPvil 2-01 GFP).
(12) Конструирование pPv-total (фиг. 54L)
Длинный фрагмент примерно из 11,2 т.п.н. промотора гена виллина мыши [смотри (1)] лигировали в pPvil2-01GFP, который расщепляли BglII и ClaI, и обрабатывали щелочной фосфатазой E. coli C75, чтобы дефосфорилировать оба его конца. Смесь для лигирования трансфицировали в сверхкомпетентные клетки XL10-Gold (STRATAGENE) и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Отбирали клон, содержащий фрагмент с правильной нуклеотидной последовательностью (pPv-total).
(13) Конструирование pLoxP-STneoR (фиг. 54M)
pLoxP-STneo, описанный в WO 00/10383, расщепляли XhoI и обрабатывали ферментом Blunting high (TOYOBO) для затупления обоих его концов. Полученный в результате фрагмент ДНК, содержащий единицу loxP-Neor-loxP, очищали электрофорезом в 0,8% агарозном геле. Фрагмент ДНК, полученный отжигом синтезированных олигонуклеотидов, описанных ниже (SEQ ID NO: 132 и 133), лигировали в pBlueLAB (WO 00/10383), который расщепляли PacI и FseI, и очищали электрофорезом в 0,8% агарозном геле. Смесь для лигирования трансфицировали в DH5α и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Отбирали клон, содержащий фрагмент с правильной нуклеотидной последовательностью (pBlueLAB2). Описанный выше фрагмент ДНК, содержащий единицу loxP-Neor-loxP, лигировали в вектор pBlueLAB2, который расщепляли EcoRV, и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба его конца. Смесь для лигирования трансфицировали в DH5α и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Отбирали клон, содержащий фрагмент в направлении, противоположном направлению pLoxP-STneo (WO 00/10383) (pLoxP-STneoR).

(14) Конструирование pPv01GFP (фиг. 54N)
ДНК плазмиды pPv-total расщепляли ферментами рестрикции, ClaI и XhoI и фрагмент ДНК, содержащий единицу Pv-GIPF, очищали электрофорезом в 0,8% агарозном геле. Очищенный фрагмент ДНК лигировали в pLoxP-StneoR, который расщепляли ClaI и XhoI, и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба его конца. Смесь для лигирования трансфицировали в сверхкомпетентные клетки XL10-Gold (STRATAGENE) и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Отбирали клон, содержащий фрагмент с правильной нуклеотидной последовательностью (pPv01GFP).
(15) Получение ДНК плазмиды pPv01GFP для электропорации в ES-клетки мышей
Плазмидную ДНК pPv01GFP (60 мкг) расщепляли ClaI в реакционной смеси, содержащей 1 мМ спермидина (pH 7,0, Sigma), в течение 5 часов при 37°C. Затем реакционную смесь подвергали экстракции фенолом/хлороформом и осаждению этанолом (0,3 М NaHCO3) в течение 16 часов при -20°C. Линеаризованный фрагмент вектора растворяли в буфере HBS (0,5 мкг/мкл) и использовали для следующих экспериментов по электропорации.
(16) Получение трансгенных химерных мышей, экспрессирующих GIPF и GFP человека в эпителиальных клетках кишечника
Общие способы получения эмбрионов мышей, культивирования, инъекции ES-клеток в эмбрионы, трансплантации в матку приемной матери осуществляли согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Линеаризованный вектор pPv01GFP трансфицировали в полученные из линии F1 C57BL/6 X CBA ES-клетки мышей TT2F ((Uchida, 1995), Lifetech oriental) посредством электропорации согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Подвергнутые электропорации ES-клетки суспендировали в 20 мл среды ES и инокулировали в две пластиковые чашки для культуры ткани диаметром 100 мм (Corning), в которые предварительно высевали питающие клетки. Через день среду заменяли средой, содержащей 200 мкг/мл G418 (Invitrogen). Через семь-девять дней после этого собирали всего 24 колонии для каждого вектора. Каждую из колоний выращивали до слияния в монослой в 12-луночной чашке и затем четыре пятых части культуры суспендировали в 0,2 мл среды для криоконсервации (среда ES + 10% ДМСО (Sigma)) и хранили в замороженном виде при -80°C. Оставшуюся одну пятую часть инокулировали в 12-луночную, покрытую желатином чашку и культивировали в течение 2 дней. Затем выделяли геномную ДНК, используя набор для выделения ДНК Puregene (Gentra System). Геномную ДНК, выделенную из резистентных к G418 клеток TT2F, расщепляли ферментами рестрикции EcoRI и XhoI и затем подвергали электрофорезу в 0,8% агарозном геле. Используя расщепление EcoRI-XhoI, сохранение интактной экспрессирующей единицы, содержащей промотор виллина, последовательности кДНК GIPF человека, кДНК GFP и полиА BGH из pPv01GFP, в G418-резистентных клонах можно определить, регистрируя полосу размером примерно 16 т.п.н. Разделенные фрагменты ДНК переносили на мембрану (Gene Screen, NEN Life Science Products) и затем осуществляли гибридизацию, используя в качестве зонда фрагмент ДНК, полученный из области IRES pPV01 GFP [смотри (13)] посредством ПЦР с использованием набора праймеров, которые описаны ниже (SEQ ID NO: 134 и 135) (IRESprobeF1, R1). Авторы отбирали ES-клоны, в которых наблюдали одну полосу 16 т.п.н. при Саузерн-блоттинге. Отобранные клоны ES также тестировали с использованием анализа кариотипов согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Один клон ES, № 2, в котором наблюдали нормальный кариотип, использовали для инъекции в эмбрионы.

Клетки в замороженной исходной культуре клона трансфицированных ES-клеток №2 размораживали, начинали культивировать и инъецировали в эмбрионы на стадии 8 клеток, полученные скрещиванием самца и самки мыши линии мышей MCH(ICR) (CREA JAPAN, INC.); норма инъекции составляла 10-12 клеток на эмбрион. После культивирования эмбрионов в течение ночи в среде для ES-клеток для развития в бластоцисты примерно десять эмбрионов с инъецированными ES-клетками трансплантировали с каждой стороны матки приемной матери мыши ICR (CREA JAPAN, INC.), которую подвергали обработке для получения состояния псевдобеременности в течение 2,5 дней. Вклад тканей, полученных из ES-клона TT2F (агути), в полученные из эмбриона-хозяина (альбинос) ткани можно определить по пигментации глаз у эмбрионов и масти жизнеспособного потомства.
(17) Экспрессия мРНК GIPF-GFP человека у трансгенных химерных мышей
Образцы суммарной РНК получали из кишечного тракта полученных на основе pPv01GFP/TT2F-№2 химер на разных стадиях развития (E13,5, E16,5, E19,5, 3 день, 7 день) и подвергали полуколичественному ОТ-ПЦР-анализу, чтобы исследовать экспрессию мРНК GIPF-GFP. Первую нить кДНК синтезировали с помощью Superscript III (Invitrogen), используя случайные гексамеры и 500 нг суммарной РНК, экстрагированной из кишечного тракта полученных на основе pPv01GFP/TT2F-№2 химер и контрольных полученных на основе TT2F химер, используя Isogen (Nippon Gene) и RNasy Mini (QIAGEN). Полуколичественный ОТ-ПЦР-анализ осуществляли с использованием кДНК при специфичных температурах отжига для каждой пары праймеров. Продукты ПЦР подвергали электрофорезу в 2% агаровых гелях и красили бромидом этидия. Целостность РНК контролировали посредством амплификации кДНК GAPDH мыши. Нуклеотидные последовательности и температура отжига наборов праймеров для GIPF (Pv01RT F1, R1; SEQ ID NO: 136 и 137), аксина 2 (Axin2 F, R; SEQ ID NO: 138 и 139)) и mGAPDH (mGAPDH5,3; SEQ ID NO: 140 и 141) перечислены ниже.

Как показано на фиг. 55, транскрипты GIPF-GFP выявлялись на стадии E13,5 в кишечном тракте полученных на основе pPv01 GFP/TT2F-№2 химер и не выявлялись во всех исследованных образцах печени, что хорошо согласуется с предшествующим исследованием (Madison et al., J. Biol. Chem. 277, p33275-33283, 2002), в котором описано, что экспрессия трансгена, запускаемая промотором виллина длиной 13 т.п.н., сначала выявляется в задней кишке и средней кишке эмбриона на стадии 12,5 дней после зачатия, и что экспрессия в значительной степени специфична для эпителия кишечника. Также очевидно, что уровень экспрессии транскриптов GIPF-GFP постепенно повышается с возрастом в ходе развития. Eek-hoon et al. сообщили, что эндогенная экспрессия мРНК аксина 2 может быть индуцирована активацией пути передачи сигнала Wnt (Mol. Cell Biol. 22, 1172-1183, 2002). Также известно, что передача сигнала Wnt играет важную роль в развитии кишечного тракта. Поэтому авторы исследовали экспрессию аксина 2 в кишечном тракте полученных на основе pPv01 GFP/TT2F-№2 химер. Результат (фиг. 55) показывает, что повышенная экспрессия мРНК аксина 2 наблюдается на 3 и 7 день по сравнению с контрольными химерами, что свидетельствует о том, что экспрессия GIPF человека приводит к активации пути передачи сигнала Wnt в кишечном тракте новорожденного.
(18) Стабилизация β-катенина в кишечном тракте трансгенных химерных мышей
Чтобы оценить влияние GIPF на путь передачи сигнала Wnt/β-катенин, измеряли стабилизацию β-катенина в образцах тонкого кишечника и ободочной кишки, взятых от полученных на основе pPv01 GFP/TT2F-№2 химер на 10 день. Способ анализа стабилизации β-катенина описан в примере 17. Как показано на фиг. 56, экспрессия GIPF сильно индуцировала стабилизацию β-катенина как в образцах тонкого кишечника, так и в образцах ободочной кишки, взятых у полученных на основе pPv01 GFP/TT2F-№2 химер, по сравнению с контрольными химерами (дикого типа).
(19) Оценка фенотипических изменений в кишечном тракте трансгенных химерных мышей
У новорожденных полученных на основе pPv01 GFP/TT2F-№2 химерных детенышей наблюдали значимое вздутие живота на 3 день, и степень данного фенотипа постепенно усиливалась с возрастом. Визуальное обследование химер 3-дневного возраста при вскрытии показало заметное увеличение диаметра на всем протяжении тонкого кишечника, связанное с увеличением поверхностной васкуляризации. Целые эмбрионы, детенышей или желудочно-кишечные тракты фиксировали в растворе Буэна. Залитые парафином срезы красили гематоксилином и эозином (Г+Э) для гистологической оценки. Как показано на фиг. 57, гистопатологический анализ Г+Э-срезов от pPv01 GFP/TT2F-№2 (pPv01 №2) выявил увеличение количества крипт и ветвления, начиная с 19,5 дня эмбрионального развития (E 19,5) по 14 день (d14), по сравнению с контролем.
ПРИМЕР 31
ТРАНСГЕННЫЕ ХИМЕРНЫЕ МЫШИ, КОТОРЫЕ ЭКСПРЕССИРУЮТ GIPF И Wnt3a В ЭПИТЕЛИАЛЬНЫХ КЛЕТКАХ КИШЕЧНИКА
(1) Получение фрагмента Wnt3a (фиг. 58A)

KOD-puls- (TOYOBO) использовали для реакции ПЦР. Реакционная смесь для ПЦР содержала 10 пмоль каждого праймера (SEQ ID NO: 142 и 143) и кДНК Wnt3a человека в качестве матрицы. Указанную ПЦР-амплификацию осуществляли, используя начальную денатурирующую инкубацию при 94°C в течение трех минут. Затем осуществляли 30 циклов денатурации, отжига и амплификации посредством инкубации при 94°C в течение 15 сек и при 68°C в течение двух минут. Продукт ПЦР (длиной около 1,06 т.п.н.) очищали электрофорезом в 0,8% агарозном геле и используя набор для экстракции из геля QIAquick (QIAGEN). После расщепления выделенного продукта ПЦР BamHI и EcoRV его лигировали в pBluescriptIISK(-), который расщепляли BamHI и XbaI, и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба его конца. Смесь для лигирования трансфицировали в DH5α и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Клон, содержащий фрагмент с правильной нуклеотидной последовательностью, расщепляли NcoI и PmeI и фрагмент, содержащий кДНК Wnt3a, очищали электрофорезом, используя 0,8% агар и набор для экстракции из геля QIAquick (QIAGEN).
(2) Получение фрагмента IRES/Wnt3a+pA (фиг. 58B)
ДНК плазмиды pIRES/GFP+pA [смотри пример 30-(13)] расщепляли NcoI и PmeI и фрагмент вектора без кодирующей последовательности GFP очищали электрофорезом в 0,8% агарозном геле. Фрагмент, содержащий кДНК Wnt3a [смотри (1)], лигировали в очищенный векторный фрагмент, который обрабатывали щелочной фосфатазой E. coli C75, чтобы дефосфорилировать оба его конца. Смесь для лигирования трансфицировали в DH5α и образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Клон, содержащий фрагмент с правильной нуклеотидной последовательностью (pIRES/Wnt3a+pA), расщепляли AscI и XhoI, и фрагмент ДНК, содержащий единицу IRES/Wnt3a+pA, очищали электрофорезом в 0,8% агарозном геле и используя набор для экстракции из геля QIAquick (QIAGEN).
(3) Конструирование pPv01Wnt3a (фиг. 58C)
ДНК плазмиды pPv01GFP [смотри пример 30-(13)] расщепляли ферментами рестрикции AscI и XhoI и расщепленную реакционную смесь подвергали электрофорезу в 0,8% агарозном геле. Фрагмент вектора без области IRES/GFP+pA выделяли и обрабатывали щелочной фосфатазой кишечника теленка, чтобы дефосфорилировать оба его конца. Смесь для лигирования фрагмента IRES/Wnt3a+pA [смотри (2)] и указанного выше векторного фрагмента трансфицировали в сверхкомпетентные клетки XL10-Gold (STRATAGENE). Образцы ДНК, приготовленные из полученных в результате трансформантов, анализировали нуклеотидным секвенированием, чтобы подтвердить структуру встроенного фрагмента. Отбирали клон, содержащий фрагмент с правильной нуклеотидной последовательностью (pPv01Wnt3a).
(4) Подготовка ДНК плазмиды pPv01Wnt3a для плазмиде ДНК для электропорации в ES-клетки мыши
ДНК плазмиды pPv01Wnt3a (60 мкг) расщепляли ClaI в реакционной смеси, содержащей 1 мМ спермидина (pH 7,0, Sigma), в течение 5 часов при 37°C. Затем реакционную смесь подвергали экстракции фенолом/хлороформом и преципитации этанолом (0,3 М NaHCO3) в течение 16 часов при -20°C. Линеаризованный векторный фрагмент растворяли в буфере HBS (0,5 мкг/мкл) и использовали для последующих экспериментов по электропорации.
(5) Получение трансгенных химерных мышей, экспрессирующих GIPF и Wnt3a человека в эпителиальных клетках кишечника
Общие способы получения эмбрионов мышей, культивирования, инъекции ES-клеток в эмбрионы, трансплантации в матку приемной матери осуществляли согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Линеаризованный вектор pPv01Wnt3a трансфицировали в полученные из линии F1 C57BL/6 X CBA ES-клетки мышей TT2F ((Uchida, 1995), Lifetech oriental) посредством электропорации согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Подвергнутые электропорации ES-клетки суспендировали в 20 мл среды ES и инокулировали в две пластиковые чашки для культуры ткани диаметром 100 мм (Corning), в которые предварительно высевали питающие клетки. Через день среду заменяли средой, содержащей 200 мкг/мл G418 (Invitrogen). Через семь-девять дней после этого собирали всего 24 колонии для каждого вектора. Каждую из колоний выращивали до слияния в монослой в 12-луночной чашке и затем четыре пятых части культуры суспендировали в 0,2 мл среды для криоконсервации (среда ES + 10% ДМСО (Sigma)) и хранили в замороженном виде при -80°C. Оставшуюся одну пятую часть инокулировали в 12-луночную покрытую желатином чашку и культивировали в течение 2 дней. Затем выделяли геномную ДНК, используя набор для выделения ДНК Puregene (Gentra System). Геномную ДНК, выделенную из резистентных к G418 клеток TT2F, расщепляли ферментами рестрикции EcoRI и XhoI и затем подвергали электрофорезу в 0,8% агарозном геле. Используя расщепление EcoRI-XhoI, сохранение интактной экспрессирующей единицы, содержащей промотор виллина, последовательности кДНК GIPF человека, кДНК Wnt3a и полиА BGH из pPv01Wnt3a, в G418-резистентных клонах можно определить, регистрируя полосу размером примерно 16 т.п.н. Разделенные фрагменты ДНК переносили на мембрану (Gene Screen, NEN Life science Products) и затем осуществляли гибридизацию, используя в качестве зонда фрагмент ДНК, полученный из области IRES pPV01 GFP [смотри пример 30-(13)] посредством ПЦР с использованием набора праймеров, описанных в примере 30-(16) (IRESprobeF1, R1). Авторы отбирали клоны, в которых наблюдали одну полосу 16 т.п.н. при Саузерн-блоттинге. Отобранные клоны ES также тестировали с использованием анализа кариотипов согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Два клона ES, № 7 и №13, в которых наблюдали нормальный кариотип, использовали для инъекции в эмбрионы.
Клетки в замороженной исходной культуре клонов трансфицированных ES-клеток №7 и №13 размораживали, начинали культивировать и инъецировали в эмбрионы на стадии 8 клеток, полученные скрещиванием самца и самки мыши линии мышей MCH(ICR) (CREA JAPAN, INC.); норма инъекции составляла 10-12 клеток на эмбрион. После культивирования эмбрионов в течение ночи в среде для ES-клеток для развития в бластоцисты примерно десять эмбрионов с инъецированными ES-клетками трансплантировали с каждой стороны матки приемной матери мыши ICR (CREA JAPAN, INC.), которую подвергали обработке для получения состояния псевдобеременности в течение 2,5 дней. Вклад тканей, полученных из ES-клона TT2F (агути), в полученные из эмбриона-хозяина (альбинос) ткани можно определить по пигментации глаз у эмбрионов и масти жизнеспособного потомства.
(6) Экспрессия мРНК GIPF/Wnt3a человека у трансгенных химерных мышей
Образцы суммарной РНК получали из кишечного тракта полученных на основе pPv01 Wnt3a/TT2F-№7 и №13 новорожденных химер и подвергали полуколичественному ОТ-ПЦР-анализу, чтобы исследовать экспрессию мРНК GIPF-Wnt3a. Первую нить кДНК синтезировали с помощью Superscript III (Invitrogen), используя случайные гексамеры и 500 нг суммарной РНК, экстрагированной из кишечного тракта полученных на основе pPv01Wnt3a/TT2F-№7 и №13 химер и контрольных полученных на основе TT2F химер, используя Isogen (Nippon Gene) и RNasy Mini (QIAGEN). Полуколичественный ОТ-ПЦР-анализ осуществляли с использованием кДНК при специфичных температурах отжига для каждой пары праймеров. Продукты ПЦР подвергали электрофорезу в 2% агаровых гелях и красили бромидом этидия. Целостность РНК контролировали посредством амплификации кДНК GAPDH мыши. Нуклеотидные последовательности и температура отжига наборов праймеров для GIPF (Pv01RT F1, R1), аксина 2 (Axin2 F, R) и mGAPDH (mGAPDH5,3) перечислены ниже.

Как показано на фиг. 59, транскрипты GIPF-Wnt3a выявлялись в тканях кишечника полученных на основе pPv01Wnt3a/TT2F-№7 и №13 новорожденных химер (Pv01Wnt3a: 1-4). Результаты (фиг. 59) также показывают, что наблюдается повышенная экспрессия мРНК аксина 2 по сравнению с контрольными химерами (TT2F: 5 и 6).
(7) Стабилизация β-катенина в кишечном тракте трансгенных химерных мышей
Чтобы оценить влияние GIPF на путь передачи сигнала Wnt/β-катенин, измеряли стабилизацию β-катенина в образцах тонкого кишечника и ободочной кишки, взятых от полученных на основе pPv01Wnt3a/TT2F-№7 и №13 химер. Способ анализа стабилизации β-катенина описан в примере 17. Как показано на фиг. 60, коэкспрессия GIPF и Wnt3a индуцировала стабилизацию β-катенина в образцах двенадцатиперстной кишки и ободочной кишки, взятых у полученного на основе pPv01Wnt3a/TT2F-№7 эмбриона (E20,5: 1 и 2), по сравнению с контрольными химерами (дикого типа: 3 и 4).
(8) Оценка фенотипических изменений в кишечном тракте трансгенных химерных мышей
У новорожденных полученных на основе pPv01 Wnt3a/TT2F-№7 и №13 химерных детенышей наблюдали значимое вздутие живота. Визуальное обследование новорожденных химер при вскрытии показало заметное увеличение диаметра на всем протяжении тонкого кишечника, связанное с увеличением поверхностной васкуляризации. Целые эмбрионы, детенышей или желудочно-кишечные тракты фиксировали в растворе Буэна. Залитые парафином срезы красили гематоксилином и эозином (Г+Э) для гистологической оценки. Как показано на фиг. 61, гистопатологический анализ Г+Э-срезов от эмбрионов pPv01Wnt3a/TT2F-№13 на 20,5 день эмбрионального развития (E 20,5) выявил увеличение количества клеток с ворсинками, неравномерное ветвление и гиперплазию ворсинок. Степень указанных фенотипов проявлялась сильнее, чем фенотипов полученных на основе pPv01GFP/TT2F-№2 химер [Пример 30-(19)], что свидетельствует об усилении действия GIPF экспрессией Wnt3a.
ПРИМЕР 32
ES-КЛЕТКИ МЫШЕЙ RS-KO
A. Конструирование вектора RS-KO
Конструирование вектора RS-KO (фигура 62A) осуществлено согласно способу, описанному ниже, и изображено на фигурах 62B-1K.
Фигура 62B. Добавление новых сайтов рестрикции (NruI, SgrAI и AscI) в pBluescript II SK(-)(Stratagene).
Синтезировали олиго-ДНК-фрагменты (SEQ ID NO: 144 и 145) для добавления новых сайтов рестрикции в pBluescript II SK(-).

Полученные LinkA1 и LinkA2 лигировали в pBluescript II SK(-), которую предварительно расщепляли ферментами рестрикции SalI и XhoI. Полученная в результате плазмида pBlueLA содержала заново добавленные сайты рестрикции (NruI, SgrAI и AscI).
Фигура 62C. Добавление новых сайтов рестрикции (PacI, FseI и SalI к pBlueLA.
Синтезировали олиго-ДНК-фрагменты (SEQ ID NO: 146 и 147) для добавления новых сайтов рестрикции в pBlueLA.
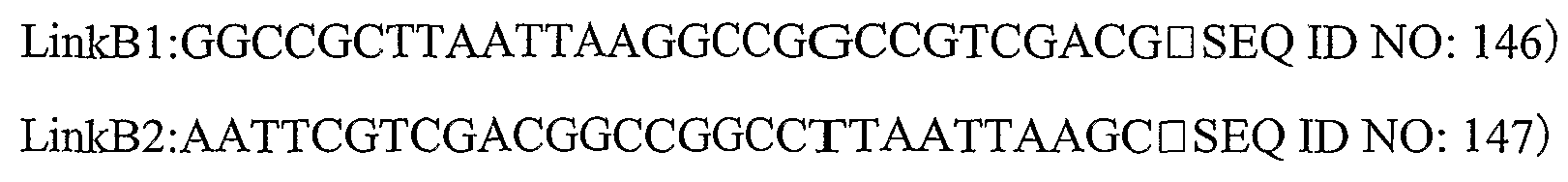
Полученные LinkB1 и LinkB2 лигировали в pBlueLA, которую предварительно расщепляли ферментами рестрикции NotI и EcoRI. Полученная в результате плазмида pBlueLAB содержала заново добавленные сайты рестрикции (PacI, FseI и SalI).
Фигура 62D. Получение фрагмента LoxP-Neo-B
Фрагмент LoxP-Neo-B получали обработкой ДНК-полимеразой T4 LoxP-Neo, который получали в результате расщепления XhoI плазмиды pLoxP-STneo (WO 00/10383).
Фигура 62E. Получение плазмиды pBlueLAB-LoxP-Neo
Фрагмент LoxP-Neo-B лигировали в pBlueLAB, которую предварительно расщепляли ферментом рестрикции EcoRV. Полученная в результате плазмида pBlueLAB-LoxP-Neo содержала фрагмент LoxP-Neo-B.
Фигура 62F. Получение фрагмента DT-A
pMC1DT-A□BCO BRL□ расщепляли XhoI и SalI и полученный в результате фрагмент DT-A отделяли и извлекали из агарозного геля после электрофореза.
Фигура 62G. Получение плазмиды pBlueLAB-LoxP-Neo-DT-A
Фрагмент DT-A фрагмент лигировали в pBlueLAB-LoxP-Neo, которую предварительно расщепляли ферментом рестрикции XhoI. Полученная в результате плазмида pBlueLAB-LoxP-Neo-DT-A содержала фрагмент DT-A.
Фигура 62H. Получение 3'-геномной области элемента RS
Прямой (RS3'FW2; SEQ ID NO: 148) и обратный (RS3'RV3; SEQ ID NO: 149) праймеры для ПЦР синтезировали на основе последовательности мыши, полученной из GenBank (номер доступа AC090291), и использовали для амплификации ДНК 3'-геномной области элемента RS. RS3'FW2: TTGGCGCGCCCTCCCTAGGACTGCAGTTGAGCTCAGATTTGA (SEQ ID NO: 148) получали добавлением последовательности узнавания AscI в 5'-концевой сайт, и RS3'RV3: CCGCTCGAGTCTTACTGTCTCAGCAACAATAATATAAACAGGGG (SEQ ID NO: 149) получали добавлением последовательности узнавания XhoI в 5'-концевой сайт. ПЦР осуществляли, используя BAC-клон RP23-435I4 (номер доступен в GenBank под номером доступа AC090291) в качестве матрицы. Продукт ПЦР расщепляли ферментами рестрикции AscI и XhoI и лигировали в pBlueLAB, которую предварительно расщепляли ферментами рестрикции AscI и XhoI. Полученная в результате плазмида содержала указанную последовательность ДНК 3'-геномной области элемента RS без замены в нуклеотидной последовательности в области между AscI и XhoI, и ее обрабатывали AscI и XhoI и затем получали 3'-геномную область элемента RS (примерно 2 т.п.н.).
Фигура 62I. Инсерция 3'-геномной области элемента RS в pBlueLAB-LoxP-Neo-DT-A
3'-геномную область элемента RS лигировали в pBlueLAB-LoxP-Neo-DT-A, которую предварительно расщепляли AscI и XhoI. После подтверждения области связывания между pBlueLAB-LoxP-Neo-DT-A и 3'-геномной областью элемента RS получали плазмиду pBlueLAB-LoxP-Neo-DT-A-3'RS.
Фигура 62J. Получение 5'-геномной области элемента RS мыши
Прямой (RS5'FW3; SEQ ID NO: 150) и обратный(RS5'RV3; SEQ ID NO: 151) праймеры для ПЦР синтезировали на основе последовательности мыши, полученной из GenBank (номер доступа AC090291), и использовали для амплификации ДНК 5'-геномной области элемента RS. RS5'FW3: ATAAGAATGCGGCCGCAAAGCTGGTGGGTTAAGACTATCTCGTGAAGTG (SEQ ID NO: 150) получали добавлением последовательности узнавания NotI в 5'-концевой сайт, и RS5'RV3: ACGCGTCGACTCACAGGTTGGTCCCTCTCTGTGTGTGGTTGCTGT (SEQ ID NO: 151) получали добавлением последовательности узнавания SalI в 5'-концевой сайт. ПЦР осуществляли, используя BAC-клон RP23-435I4 (номер доступа в GenBank AC090291) в качестве матрицы. Продукт ПЦР расщепляли ферментами рестрикции NotI и SalI и лигировали в pBlueLAB, которую предварительно расщепляли ферментами рестрикции NotI и SalI. Полученная в результате плазмида содержала указанную последовательность ДНК 5'-геномной области элемента RS без замены в нуклеотидной последовательности в области между NotI и SalI, и ее обрабатывали NotI и SalI и затем получали 5'-геномную область элемента RS (примерно 5 т.п.н.).
Фигура 62K. Инсерция 5'-геномной области элемента RS в pBlueLAB-LoxP-Neo-DT-A-3'RS
5'-геномную область элемента RS лигировали в pBlueLAB-LoxP-Neo-DT-A-3'RS, которую предварительно расщепляли NotI и SalI. После подтверждения области связывания между pBlueLAB-LoxP-Neo-DT-A-3'RS и 5'-геномной областью элемента RS конструировали вектор RS-KO.
B. Получение ES-клеток мыши RS-KO
Общие способы получения эмбрионов мышей и культивирования осуществляли согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Вектор RS-KO линеаризовали NotI и трансфицировали в полученные из F1 C57BL/6 X CBA ES-клетки мышей TT2F ((Uchida, 1995), Lifetech oriental) посредством электропорации согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Подвергнутые электропорации ES-клетки суспендировали в 20 мл среды ES [DMEM (GIBCO), 18% FBS (GIBCO), 0,1 мМ 2-меркаптоэтанол (GIBCO), 1000 ед./мл LIF (лейкоз-ингибирующий фактор, CHEMICON International, Inc.)] и инокулировали в две пластиковые чашки для культуры ткани диаметром 100 мм (Corning), в которые предварительно высевали питающие клетки. Через день среду заменяли средой, содержащей 0,75 г/мл пуромицина (Sigma). Через семь дней после этого собирали образовавшиеся резистентные к пуромицину колонии. Каждую из колоний выращивали до слияния в монослой в 24-луночной чашке и затем две трети культуры суспендировали в 0,2 мл среды для криоконсервации [FBS + 10% ДМСО (Sigma)] и хранили в замороженном виде при -80°C. Оставшуюся одну треть инокулировали в 12-луночную, покрытую желатином чашку и культивировали в течение 2 дней. Затем выделяли геномную ДНК, используя набор для выделения ДНК Puregene (Gentra System).
3'KO-зонд для Саузерн-анализа получали следующим образом. Праймеры RS3' Southern FW1 (SEQ ID NO: 152) и RS3' Southern RV2 (SEQ ID NO: 153) синтезировали на основе последовательности мыши, полученной из GenBank (номер доступа AC090291), и использовали для амплификации примерно 600-мерного ДНК-фрагмента 3'-геномной области элемента RS.
Геномную ДНК, выделенную из резистентных к пуромицину клеток TT2F, расщепляли ферментом рестрикции EcoR I (Takara Shuzo) и затем подвергали электрофорезу в 0,8% агарозном геле.
Разделенные фрагменты ДНК переносили на мембрану (GeneScreen, NENTM Life Science Products) и затем осуществляли гибридизацию с использованием в качестве зонда фрагмента ДНК, полученного из 3'-геномной области ДНК элемента RS (3'KO-зонд). На картине полос не измененного клона ES видна одна полоса с М.м., соответствующей примерно 5,7 т.п.н., а в случае целенаправленно измененного клона ES видны две полосы с М.м., соответствующей примерно 5,7 т.п.н. и 7,4 т.п.н. (фигура 63). Отобранные ES-клоны мыши RS-KO также тестировали с помощью анализа кариотипа согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. ES-клоны мыши RS-KO, в которых наблюдали нормальный кариотип, использовали для дальнейших экспериментов.
ПРИМЕР 33
ТРАНСГЕННЫЕ ЖИВОТНЫЕ С ДЕЛЕЦИОННОЙ МУТАЦИЕЙ GIPF
A. Конструирование вектора pCk m4 KI.
Конструирование вектора Ck, целенаправленно встраивающего делеционный мутантный GIPF 4 (pCk m4 KI) (фигура 64A), осуществляли согласно способу, описанному ниже и изображенному на фигурах 64B-64K.
Фигура 64B. Получение Ck P2 KI + AS KI
Синтезировали олиго-ДНК-фрагменты (SEQ ID NO: 154 и 155) для добавления новых сайтов рестрикции в Ck P2 KI.
Верхний линкер AscI: GGCCAGGCGCGCCTTGC (SEQ ID NO: 154)
Нижний линкер AscI: GGCCGCAAGGCGCGCCT (SEQ ID NO: 155)
Полученный верхний линкер AscI и нижний линкер AscI лигировали в Ck P2 KI, которую предварительно расщепляли ферментом рестрикции NotI. Полученная в результате плазмида Ck P2 KI + AS KI содержала заново добавленный сайт рестрикции (AscI).
Фигура 64C. Получение pBlueLAB+Nh
Синтезировали олиго-ДНК-фрагменты (SEQ ID NO: 156 и 157) для добавления новых сайтов рестрикции в pBlueLAB.
Полученные Pac-Nhe-Fse S и Pac-Nhe-Fse AS лигировали в pBlueLAB, которую предварительно расщепляли ферментами рестрикции PacI и FseI. Полученная в результате плазмида pBlueLAB+Nh содержала вновь добавленный сайт рестрикции (NheI).
Фигура 64D. Получение pBlueLAB+NhHp
Синтезировали олиго-ДНК-фрагменты (SEQ ID NO: 158 и 159) для добавления новых сайтов рестрикции в pBlueLAB+Nh.

Полученные S/HpaI/Hd-S и S/HpaI/Hd-AS лигировали в pBlueLAB+Nh, которую предварительно расщепляли ферментами рестрикции SalI и HindIII. Полученная в результате плазмида pBlueLAB+NhHp содержала вновь добавленный сайт рестрикции (HpaI).
Фигура 64E, Получение pCkpAP2
pCkP2+As KI расщепляли HpaI и NheI и полученный в результате фрагмент длиной 952 п.н. отделяли и извлекали из агарозного геля после электрофореза. Фрагмент длиной 952 п.н. лигировали в pBlueLAB+NhHp, которую предварительно расщепляли ферментами рестрикции HpaI и NheI. Полученная в результате плазмида pCkpAP2 содержала фрагмент длиной 952 п.н..
Фигура 64F. Получение pCkpAMCS
Синтезировали олиго-ДНК-фрагменты (SEQ ID NO: 160 и 161) для добавления новых сайтов рестрикции в pCkpAP2.

Полученные SPFNlinker-S и SPFNlinker-AS лигировали в CkpAMCS, которую предварительно расщепляли ферментами рестрикции HindIII и NheI. Полученная в результате плазмида CkpAMCS содержала вновь добавленный сайт рестрикции (PacI).
Фигура 64G. Получение pCkP2ΔP
pCkpAMCS расщепляли HpaI и NheI и полученный в результате фрагмент длиной примерно 700 п.н. отделяли и извлекали из агарозного геля после электрофореза. Фрагмент длиной 700 п.н. лигировали в pCkP2+AsKI, которую предварительно расщепляли ферментами рестрикции HpaI и NheI. Полученная в результате плазмида pCkP2ΔP содержала фрагмент длиной 700 п.н..
Фигура 64H. Получение pBS+PFN
Синтезировали олиго-ДНК-фрагменты (SEQ ID NO: 162 и 163) для добавления новых сайтов рестрикции в pBluescript II SK(-).

Полученные S/PFN/Hd-S и S/PFN/Hd-AS лигировали в pBluescript II SK(-), которую предварительно расщепляли ферментами рестрикции SalI и HindIII. Полученная в результате плазмида pBS+PFN содержала вновь добавленные сайты рестрикции (PacI, FseI и NheI).
Фигура 64I. Получение pPSs3.8
Прямой (PsecSP FW1; SEQ ID NO: 164) и обратный (PsecSP RV; SEQ ID NO: 165) праймеры для ПЦР синтезировали на основе последовательности мыши, полученной из GenBank (номер доступа K02159), и использовали для амплификации ДНК промотора и области, кодирующей лидерную последовательность Igκ. Область, кодирующая лидерную последовательность, содержала последовательность внутреннего интрона. PsecSP FW1: CCTTAATTAAAGTTATGTGTCCTAGAGGGCTGCAAACTCAAGATC (SEQ ID NO: 164) получали добавлением последовательности узнавания PacI в 5'-концевой сайт, и PsecSP RV: TTGGCCGGCCTTGGCGCCAGTGGAACCTGGAATGATAAACACAAAGATTATTG (SEQ ID NO: 165) получали добавлением последовательности узнавания FseI в 5'-концевой сайт. ПЦР осуществляли, используя геном мыши из ES-клеток TT2F ((Uchida, 1995), Lifetech oriental) в качестве матрицы. Продукт ПЦР расщепляли ферментами рестрикции PacI и FseI и лигировали в pBS+PFN, которую предварительно расщепляли ферментами рестрикции PacI и FseI. Полученная в результате плазмида pPSs3.8 содержала фрагмент ДНК фрагмент промотора и области, кодирующей лидерную последовательность Igκ.
Фигура 64J. Получение m4(+SP) и m4(-SP)
Прямой (Sal kozak GIPF F; SEQ ID NO: 166) и обратный (GIPF m4 RV Fse; SEQ ID NO: 167) праймеры для ПЦР синтезировали на основе последовательности делеционного мутанта № 4 (фигура 43; SEQ ID NO: 91) и использовали для амплификации ДНК лидерной последовательности GIPF и последовательности делеционного мутанта GIPF. Sal kozak GIPF F: AAG CGT CGA CCA CCA TGC GGC TTG GGC TGT GTG (SEQ ID NO: 166) получали добавлением последовательности узнавания SalI в 5'-концевой сайт, и GIPF m4 RV Fse: ATG GCC GGC CCT ACA TGG TGC CAT TGG CAG (SEQ ID NO: 167) получали добавлением последовательность узнавания FseI в 5'-концевой сайт. ПЦР осуществляли с использованием вектора GIPF KI в качестве матрицы. Продукт ПЦР расщепляли ферментами рестрикции SalI и FseI и затем получали фрагмент m4(+SP).
Прямой (Hy01(-SP) FW; SEQ ID NO: 168) и обратный (GIPF m4 RV Fse; SEQ ID NO: 169) праймеры для ПЦР синтезировали на основе последовательности делеционного мутанта №4 (фигура 43; SEQ ID NO: 91) и использовали для амплификации ДНК последовательности делеционного мутанта №4 GIPF. Hy01(-SP) FW: AGCCGGGGGATCAAGGGGAAAAGGCAGAGG (SEQ ID NO: 168) получали добавлением фосфорной кислоты в 5'-концевой сайт и GIPF m4 RV Fse: ATG GCC GGC CCT ACA TGG TGC CAT TGG CAG (SEQ ID NO: 169) получали добавлением последовательности узнавания FseI в 5'-концевой сайт. ПЦР осуществляли с использованием вектора GIPF KI в качестве матрицы. Продукт ПЦР продукт расщепляли ферментом рестрикции FseI и затем получали фрагмент m4(-SP).
Фигура 64K. Конструирование вектора pCk m4 KI
Фрагмент m4(+SP) лигировали в pCkP2+As KI, которую предварительно расщепляли ферментами рестрикции SalI и FseI. Полученный в результате вектор pCκ m4 KI содержал фрагмент m4(+SP), который использовали для создания мышей с делеционной мутацией GIPF.
B. Конструирование вектора pPSm4 KI.
Конструирование вектора PS, целенаправленного встраивающего делеционный мутант GIPF 4 (pPS m4 KI) (фигура 65A), осуществляли согласно способу, описанному ниже и изображенному на фигурах 65B-65C.
Фигура 65B. Получение pPSs3.8m4
Фрагмент m4(-SP) лигировали в pPSs3.8, которую предварительно расщепляли ферментами рестрикции SfoI и FseI. Полученный в результате pPSs3.8m4 содержал фрагмент m4(-SP).
Фигура 65C. Конструирование вектора pPSm4 KI
pPSs3.8m4 расщепляли PacI и FseI и полученный в результате фрагмент длиной примерно 1,2 т.п.н. отделяли и извлекали из агарозного геля после электрофореза. Фрагмент длиной 1,2 т.п.н. лигировали в CkP2ΔP, которую предварительно расщепляли ферментами рестрикции PacI и FseI. Полученный в результате вектор pPSm4 KI содержал фрагмент длиной 1,2 т.п.н., который использовали для создания мышей с делеционной мутацией GIPF.
C. Создание мышей с делеционным мутантным GIPF
Общие способы получения эмбрионов мышей, культивирования, инъекции ES-клеток в эмбрионы, трансплантации в матку приемных матерей осуществляли согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Вектор pCkm4 KI и вектор pPSm4 KI линеаризовали NotI и переносили в ES-клетки мыши RS-KO посредством электропорации согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Подвергнутые электропорации ES-клетки мыши RS-KO суспендировали в 20 мл среды ES [DMEM (GIBCO), 18% FBS (GIBCO), 0,1 мМ 2-меркаптоэтанол (GIBCO), 1000 ед./мл LIF (лейкоз-ингибирующий фактор, CHEMICON International, Inc.)] и инокулировали в две пластиковые чашки для культуры ткани диаметром 100 мм (Corning), в которые предварительно высевали питающие клетки. Через день среду заменяли средой, содержащей 0,75 г/мл пуромицина (Sigma). Через семь-девять дней после этого собирали 24 колонии, образованные ES-клетками мыши RS-KO с введенным посредством электропорации вектором pCkm4 KI, и 24 колонии, образованные ES-клетками мыши RS-KO с введенным посредством электропорации вектором pPSm4 KI, соответственно. Каждую из колоний выращивали до слияния в монослой в 12-луночной чашке и затем две трети культуры суспендировали в 0,2 мл среды для криоконсервации [FBS + 10% ДМСО (Sigma)] и хранили в замороженном виде при -80°C. Оставшуюся одну треть инокулировали в 12-луночную покрытую желатином чашку и культивировали в течение 2 дней. Затем выделяли геномную ДНК, используя набор для выделения ДНК Puregene (Gentra System). Геномную ДНК, выделенную из резистентных к пуромицину ES-клеток мыши RS-KO, расщепляли ферментом рестрикции EcoR I (Takara Shuzo) и затем подвергали электрофорезу в 0,8% агарозном геле. Разделенные фрагменты ДНК переносили на мембрану (GeneScreen, NENTM Life Science Products) и затем осуществляли гибридизацию с использованием в качестве зонда фрагмента ДНК, полученного из 3'-области геномной ДНК IgJκ-Cκ (Xho I-EcoR I, 1,3 т.п.н. (SEQ ID NO: 67): WO 00/10383, пример No. 48). На картине полос не измененного клона ES видна одна полоса, соответствующая М.м. примерно 15,6 т.п.н., а в случае клона ES мыши RS-KO с целенаправленно введенным pCkm4 KI видны две полосы, соответствующие М.м. примерно 15,6 т.п.н. и 12,9 т.п.н., и в случае клона ES мыши RS-KO с целенаправленно введенным pPSm4 KI видны две полосы с M.м. 15,6 т.п.н. и 12,5 т.п.н. соответственно (фигуры 66 и 67). Один из 10 клонов ES мыши RS-KO c целенаправленно введенным pCkm4 KI, клон №3, отбирали после Саузерн-анализа (степень гомологичной рекомбинации составляла примерно 41,7%) и один из 7 клонов ES мыши RS-KO c целенаправленно введенным pPSm4 KI, клон №7, отбирали после Саузерн-анализа (степень гомологичной рекомбинации составляла примерно 29,2%). Отобранные клоны ES также тестировали в анализе кариотипов согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Один клон №3 из ES-клонов мыши RS-KO c целенаправленно введенным pCkm4 KI и один клон №7 из ES-клонов мыши RS-KO c целенаправленно введенным pPSm4 KI, в которых наблюдали нормальный кариотип, использовали для имплантации в эмбрионы, соответственно.
Клетки замороженных исходных культур клона ES-клеток №3 мыши RS-KO c целенаправленно введенным pCkm4 KI и клона ES-клеток №7 мыши RS-KO c целенаправленно введенным pPSm4 KI размораживали, начинали культивировать и инъецировали в эмбрионы на стадии 8 клеток, полученные при скрещивании самца и самки мыши линии мышей, нокаутированных по тяжелой цепи иммуноглобулина (Tomizuka et. al. Proc. Natl. Acad. Sci. USA, 97: 722-727, 2000); норма инъекции составляла 10-12 клеток на эмбрион. После культивирования эмбрионов в течение ночи в среде для ES-клеток для развития в бластоцисты примерно десять эмбрионов с инъецированными ES-клетками трансплантировали с каждой стороны матки приемной матери мыши ICR (CREA JAPAN, INC.), которую подвергали обработке для получения состояния псевдобеременности в течение 2,5 дней. В результате трансплантации из каждых 80 инъецированных эмбрионов родилось 15 и 20 потомков мышей соответственно. Химеризм потомства определяли по степени полученной благодаря клеткам TT2F масти агути (темно-коричневая) в полученной от эмбриона-хоязина (ICR) масти альбинос. Выяснено, что из 15 потомков 9 мышей (мышей с целенаправленно введенным pCkm4) имели частичную масть агути, что свидетельствовало о вкладе ES-клеток мыши RS-KO, и из 20 потомков 16 мышей (мыши с целенаправленно введенным pPSm4) имели частичную масть агути, что свидетельствовало о вкладе ES-клеток мыши RS-KO. Мышей с делеционной мутацией GIPF получали таким же образом, как описано выше для других клонов ES-клеток мыши RS-KO с целенаправленно введенным pCkm4 KI и ES-клеток мыши RS-KO с целенаправленно введенным pPSm4.
Мышей содержали в условиях цикла 12/12-часов темнота/освещение (освещение включали в 8:00), и они получали профильтрованную через 5 мкм-фильтр воду и корм CE-2 (CLEA JAPAN, INC.) по желанию. Самцов мышей содержали отдельно после отлучения от груди.
ПРИМЕР 34
ТРАНСГЕННЫЕ ЖИВОТНЫЕ С ВАРИАНТОМ GIPF
A. Конструирование вектора pCk VR KI.
Конструирование вектора Ck, целенаправленно встраивающего вариант GIPF (pCk VR KI) (фигура 68A), осуществляли согласно способу, описанному ниже и изображенному на фигурах 68B-68C.
Фигура 6B. Получение варианта GIPF с последовательностью Козака kozak (VR+kz) и варианта GIPF (VR).
Прямой (VR Ck Fw; SEQ ID NO: 171) и обратный (VR KI Rv; SEQ ID NO: 171) праймеры для ПЦР синтезировали на основе последовательности из GenBank (номер доступа AK098225) и использовали для амплификации ДНК варианта GIPF с kozak в 5'-концевом сайте. VR Cκ Fw: ACG CGT CGA CCA CCA TGA TAT TCC GAG TCA GTG C (SEQ ID NO: 170) получали добавлением последовательности узнавания SalI в 5'-концевой сайт и VR KI Rv: GGC CGG CCC TAG GCA GGC CCT GCA GAT GTG AGT GG (SEQ ID NO: 171) получали добавлением последовательности узнавания FseI в 5'-концевой сайт. ПЦР осуществляли, используя вектор GIPF KI в качестве матрицы. Продукт ПЦР расщепляли ферментами рестрикции SalI и FseI и затем получали VR+kz.
Прямой (VR Fw; SEQ ID NO: 172) и обратный (VR KI Rv; SEQ ID NO: 173) праймеры для ПЦР синтезировали на основе последовательности из GenBank (номер доступа AK098225) и использовали для амплификации ДНК варианта GIPF. VR Fw: ATG ATA TTC CGA GTC AGT GCC GAG GGG AGC CAG (SEQ ID NO: 172) получали добавлением фосфорной кислоты в 5'-концевой сайт и VR KI Rv: GGC CGG CCC TAG GCA GGC CCT GCA GAT GTG AGT GG (SEQ ID NO: 173) получали добавлением последовательности узнавания FseI в 5'-концевой сайт. ПЦР осуществляли с использованием вектора GIPF KI в качестве матрицы. Продукт ПЦР расщепляли ферментом рестрикции FseI и затем получали VR.
Фигура 68C Конструирование вектора pCk VR KI
VR+kz лигировали в pCkP2+As KI, который предварительно расщепляли ферментами рестрикции SalI и FseI. Полученный в результате вектор pCk VR KI содержал VR+kz, который использовали для создания мышей с вариантом GIPF.
B. Конструирование вектора pPS VR KI.
Конструирование вектора PS, целенаправленно встраивающего вариант GIPF (pPS VR KI) (фигура 69A), осуществляли согласно способу, описанному ниже и изображенному на фигурах 69B-69C.
Фигура 69B. Получение pPSs3.8VR
VR лигировали в pPSs3.8, которые предварительно расщепляли ферментами рестрикции SfoI и FseI. Полученный в результате pPSs3.8VR содержал VR.
Фигура 69C. Конструирование вектора pPS VR KI
pPSs3.8VR расщепляли SalI и FseI и полученный в результате фрагмент длиной 1,5 т.п.н. отделяли и извлекали из агарозного геля после электрофореза. Фрагмент длиной 1,5 т.п.н. лигировали в CkP2ΔP, который предварительно расщепляли ферментами рестрикции SalI и FseI. Полученный в результате вектор pPS VR KI содержал фрагмент длиной 1,5 т.п.н., который использовали для создания мышей с вариантом GIPF.
C. Создание мышей с вариантом GIPF
Общие способы получения эмбрионов мышей, культивирования, инъекции ES-клеток в эмбрионы, трансплантации в матку приемных матерей осуществляли согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Вектор pCkVR KI и вектор pPSVR KI линеаризовали NotI и переносили в ES-клетки мыши RS-KO посредством электропорации согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Подвергнутые электропорации ES-клетки мыши RS-KO суспендировали в 20 мл среды ES [DMEM (GIBCO), 18% FBS (GIBCO), 0,1 мМ 2-меркаптоэтанол (GIBCO), 1000 ед./мл LIF (лейкоз-ингибирующий фактор, CHEMICON International, Inc.)] и инокулировали в две пластиковые чашки для культуры ткани диаметром 100 мм (Corning), в которые предварительно высевали питающие клетки. Через день среду заменяли средой, содержащей 0,75 г/мл пуромицина (Sigma). Через семь-девять дней после этого собирали 24 колонии, образованные ES-клетками мыши RS-KO с введенным посредством электропорации вектором pCkVR KI, и 24 колонии, образованные ES-клетками мыши RS-KO с введенным посредством электропорации вектором pPSVR KI, соответственно. Каждую из колоний выращивали до слияния в монослой в 12-луночной чашке и затем две трети культуры суспендировали в 0,2 мл среды для криоконсервации [FBS + 10% ДМСО (Sigma)] и хранили в замороженном виде при -80°C. Оставшуюся одну треть инокулировали в 12-луночную покрытую желатином чашку и культивировали в течение 2 дней. Затем выделяли геномную ДНК, используя набор для выделения ДНК Puregene (Gentra System). Геномную ДНК, выделенную из резистентных к пуромицину ES-клеток мыши RS-KO, расщепляли ферментом рестрикции EcoR I (Takara Shuzo) и затем подвергали электрофорезу в 0,8% агарозном геле. Разделенные фрагменты ДНК переносили на мембрану (GeneScreen, NENTM Life Science Products) и затем осуществляли гибридизацию с использованием в качестве зонда фрагмента ДНК, полученного из 3'-области геномной ДНК IgJκ-Cκ (Xho I-EcoR I, 1,3 т.п.н. (SEQ ID NO: 67): WO 00/10383, пример No. 48). На картине полос неизмененного клона ES видна одна полоса, соответствующая М.м. примерно 15,6 т.п.н.. В случае клона ES мыши RS-KO с целенаправленно введенным pCkVR KI видны две полосы, соответствующие М.м. примерно 15,6 т.п.н. и 13,1 т.п.н., и в случае клона ES мыши RS-KO с целенаправленно введенным pPSVR KI видны две полосы с M.м. 15,6 т.п.н. и 12,9 т.п.н., соответственно (фигуры 70 и 71). Один из 12 ES-клонов мыши RS-KO c целенаправленно введенным pCkVR KI, клон №3, отбирали после Саузерн-анализа (степень гомологичной рекомбинации составляла примерно 37,5%) и один из 8 ES-клонов мыши RS-KO c целенаправленно введенным pPSVR KI, клон №14, отбирали после Саузерн-анализа (степень гомологичной рекомбинации составляла примерно 25%). Отобранные ES-клоны также тестировали в анализе кариотипов согласно способу, описанному в работе Shinichi Aizawa, "Biomanual Series 8, Gene Targeting", опубликованной Yodosha, 1995. Один клон №3 из ES-клонов мыши RS-KO c целенаправленно введенным pCkVR KI и один клон №14 из ES-клонов мыши RS-KO c целенаправленно введенным pPSVR KI, в которых наблюдали нормальный кариотип, использовали для имплантации в эмбрионы, соответственно.
Клетки замороженных исходных культур клона ES-клеток №3 мыши RS-KO c целенаправленно введенным pCkVR KI и клона ES-клеток №14 мыши RS-KO c целенаправленно введенным pPSVR KI размораживали, начинали культивировать и инъецировали в эмбрионы на стадии 8 клеток, полученные при скрещивании самца и самки линии мышей, нокаутированных по тяжелой цепи иммуноглобулина (Tomizuka et. al. Proc. Natl. Acad. Sci. USA, 97: 722-727, 2000); норма инъекции составляла 10-12 клеток на эмбрион. После культивирования эмбрионов в течение ночи в среде для ES-клеток для развития в бластоцисты примерно десять эмбрионов с инъецированными ES-клетками трансплантировали с каждой стороны матки приемной матери мыши ICR (CREA JAPAN, INC.), которую подвергали обработке для получения состояния псевдобеременности в течение 2,5 дней. В результате трансплантации из каждых 220 инъецированных эмбрионов родилось 68 и 60 потомков мышей соответственно. Химеризм потомства определяли по степени полученной благодаря клеткам TT2F масти агути (темно-коричневая) в полученной от эмбриона-хозяина (ICR) масти альбинос. Выяснено, что из 68 потомков 47 мышей (мышей с целенаправленно введенным pCkVR) имели частичную масть агути, что свидетельствовало о вкладе ES-клеток мыши RS-KO, и из 60 потомков 38 мышей (мыши с целенаправленно введенным pPSVR) имели частичную масть агути, что свидетельствовало о вкладе ES-клеток мыши RS-KO. Мышей с вариантом GIPF получали таким же образом, как описано выше для других клонов ES-клеток мыши RS-KO с целенаправленно введенным pCkVR KI и ES-клеток мыши RS-KO с целенаправленно введенным pPSVR KI.
Мышей содержали в условиях цикла 12/12-часов темнота/освещение (освещение включали в 8:00), и они получали профильтрованную через 5 мкм-фильтр воду и корм CE-2 (CLEA JAPAN, INC.) по желанию. Самцов мышей содержали отдельно после отлучения от груди.
ПРИМЕР 35
ОЦЕНКА БИОЛОГИЧЕСКОЙ АКТИВНОСТИ ДЕЛЕЦИОННОГО МУТАНТА GIPF С ИСПОЛЬЗОВАНИЕМ ТРАНСГЕННЫХ МЫШЕЙ С ЦЕЛЕНАПРАВЛЕННО ВВЕДЕННЫМ (KI) ДЕЛЕЦИОННЫМ МУТАНТОМ GIPF
Макроскопические патологические изменения и гистологические изменения тонкого кишечника и ободочной кишки трансгенных мышей, описанных выше, оценивали следующим образом. Мышей с целенаправленно веденным (KI) делеционным мутантом GIPF (Ckm4-KI и PSm4-KI) собирали в 4-недельном возрасте. Макроскопическая картина желудочно-кишечного тракта мышей KI c делеционным мутантом GIPF мало отличалась от контроля (фигура 72). Для гистопатологической оценки желудочно-кишечный тракт извлекали и фиксировали в формалине. Залитые в парафин срезы красили гематоксилином и эозином (Г+Э) для гистологической оценки. Г+Э-срезы тонкого кишечника показаны на фигуре 73 (малое увеличение) и фигуре 74 (большое увеличение).
На Г+Э срезах тонкого кишечника KI-мышей с делеционным мутантом GIPF выявлено умеренное увеличение длины и количества крипт по сравнению с контролем. Имела место тенденция к большему увеличению длины и количества крипт в PSm4-KI, чем в Ckm4-KI.
Экспрессию гена делеционного мутанта GIPF №4 и индукцию экспрессии гена аксина-2, являющегося мишенью β-катенина, анализировали с использованием образцов тонкого кишечника и ободочной кишки, полученных от KI-мышей с делеционным мутантом GIPF. 50 мг образцов подвздошной кишки, ободочной кишки и печени отделяли и быстро замораживали, используя жидкий азот. Замороженные срезы гомогенизировали в 1 мл ISOGEN (NIPPON GENE) и экстрагировали суммарную РНК в рекомендуемых условиях. Чтобы удалить геномную ДНК раствор РНК обрабатывали ДНКазой (WAKO; дезоксирибонуклеаза качества RT) при 37°C в течение 15 мин. Затем суммарную РНК очищали с использованием RNasy Mini (QIAGEN) в рекомендуемых условиях. Для каждого образца синтезировали кДНК на основе 500 нг суммарной РНК, используя Super Script III (Invitrogen), в рекомендуемых условиях. Затем кДНК обрабатывали 1 единицей РНКазы H (Invitrogen) при 37°C в течение 20 мин, чтобы расщепить оставшуюся РНК. ПЦР осуществляли, используя синтезированную кДНК в качестве матрицы. Следующие два праймера использовали для выявления делеционного мутанта GIPF: PSm4RT F1: ATCAAGGGGAAAAGGCAGAG (SEQ ID NO: 174) и CkpolyA R2: CGCTTGTGGGGAAGCCTCCAAGACC (SEQ ID NO: 175). Для выявления аксина-2 использовали следующие два праймера: Axin2 F (MUS): CAGGAGCCTCACCCTTCG (SEQ ID NO: 138) и Axin2 R (MUS): ACGCCGAGGTGCTTGCCC (SEQ ID NO: 139). Праймеры GAPDH мыши: mGAPDH5: CACCATGGAGAAGGCCGGGGCCCAC (SEQ ID NO: 140) и mGAPDH3: ATCATACTTGGCAGGTTTCTCCAGG (SEQ ID NO: 141) использовали для выявления экспрессии генов «домашнего хозяйства». Реакционную смесь ПЦР получали добавлением стерилизованной дистиллированной воды к 2,5 мкл 10X буфера для ПЦР LA II (Takara Shuzo), 4 мкл смеси каждого 2,5 мМ dNTP (Takara Shuzo), 0,5 мкл каждого 10 мМ праймера, 2 мкл 10X-кДНК, разбавленной стерилизованной дистиллированной водой, и 0,5 мкл LA Taq (Takara Shuzo), чтобы получить 25 мкл. Для выявления делеционного мутанта GIPF и аксина-2 реакционную смесь для ПЦР инкубировали при 94°C в течение 2 мин, осуществляли 33 цикла реакции при 94°C в течение 30 секунд, при 60°C в течение 30 секунд и при 72°C в течение 30секунд. Для выявления GAPDH реакционную смесь для ПЦР инкубировали при 94°C в течение 2 мин, осуществляли 22 реакции при 94°C в течение 30 секунд, при 65°C в течение 30 секунд и при 72°C в течение 30 секунд.
Экспрессию гена делеционного мутанта GIPF выявляли в подвздошной кишке и ободочной кишке у PSm4-KI-мышей. Уровень экспрессии аксина-2 увеличивался у PSm4-KI-мышей по сравнению с контролем (фигура 75). Полученные данные свидетельствуют, что делеционная мутантная форма GIPF обладает активностью в индукции экспрессии генов, являющихся мишенью β-катенина, и ответственна за активацию ниже по ходу пути передачи сигнала β-катенина.
Таким образом, получено свидетельство того, что делеционный мутант GIPF №4 обладает активностью в стимуляции пути передачи сигнала β-катенина.
ПРИМЕР 36
ОЦЕНКА БИОЛОГИЧЕСКОЙ АКТИВНОСТИ ВАРИАНТА GIPF С ИСПОЛЬЗОВАНИЕМ ТРАНСГЕННЫХ МЫШЕЙ С ЦЕЛЕНАПРАВЛЕННО ВВЕДЕННЫМ (KI) ВАРИАНТОМ GIPF
Макроскопические патологические изменения и гистологические изменения тонкого кишечника и ободочной кишки трансгенных мышей, описанных выше, оценивали следующим образом. Мышей с целенаправленно веденным (KI) вариантом GIPF (CkVR-KI и PSVR-KI) собирали в 4-недельном возрасте. Макроскопическая картина собранных мышей PSVR-KI показала, что они имеют заметное растяжение кишечника и повышенную массу тонкого кишечника по сравнению с контрольной мышью (фигура 76). Для гистопатологической оценки желудочно-кишечный тракт извлекали и фиксировали в формалине. Залитые в парафин срезы красили гематоксилином и эозином (Г+Э) для гистологической оценки. Г+Э-срезы тонкого кишечника показаны на фигуре 77 (малое увеличение) и фигуре 78 (большое увеличение).
На Г+Э-срезах тонкого кишечника выявлено заметное различие между PSVR-KI и контролем. Как показано на фигуре 76, выявлена гиперплазия клеток крипт PSVR-KI с увеличенной длиной крипт и количеством клеток Панета по сравнению с контрольной мышью. С другой стороны, у CkVR-KI не наблюдали видимого растяжения кишечника или увеличения длины крипт (данные не показаны). Различие в наблюдаемых фенотипах между CkVR-KI и PSVR-KI предположительно обусловлены различием структуре KI-вектора.
Экспрессию гена делеционного мутанта GIPF №4 и индукцию экспрессии гена аксина-2, являющегося мишенью β-катенина, анализировали с использованием образцов тонкого кишечника и ободочной кишки, полученных от KI-мышей с делеционным мутантом GIPF. 50 мг образцов подвздошной кишки, ободочной кишки и печени отделяли и быстро замораживали, используя жидкий азот. Замороженные срезы гомогенизировали в 1 мл ISOGEN (NIPPON GENE) и экстрагировали суммарную РНК в рекомендуемых условиях. Чтобы удалить геномную ДНК, раствор РНК обрабатывали ДНКазой (WAKO; дезоксирибонуклеаза качества RT) при 37°C в течение 15 мин. Затем суммарную РНК очищали с использованием RNasy Mini (QIAGEN) в рекомендуемых условиях. Для каждого образца синтезировали кДНК на основе 500 нг суммарной РНК, используя Super Script III (Invitrogen), в рекомендуемых условиях. Затем кДНК обрабатывали 1 единицей РНКазы H (Invitrogen) при 37°C в течение 20 мин, чтобы расщепить оставшуюся РНК. ПЦР осуществляли, используя синтезированную кДНК в качестве матрицы. Следующие два праймера использовали для выявления варианта GIPF: PSFLJRT F1: ATAACTTCTGCACCAAGTGTAAGGA (SEQ ID NO: 176) и CkpolyA R2: CGCTTGTGGGGAAGCCTCCAAGACC (SEQ ID NO: 175). Для выявления аксина-2 использовали следующие два праймера: Axin2 F (MUS): CAGGAGCCTCACCCTTCG (SEQ ID NO: 138) и Axin2 R (MUS): ACGCCGAGGTGCTTGCCC (SEQ ID NO: 139). Праймеры GAPDH мыши: mGAPDH5: CACCATGGAGAAGGCCGGGGCCCAC (SEQ ID NO: 140) и mGAPDH3: ATCATACTTGGCAGGTTTCTCCAGG (SEQ ID NO: 141) использовали для выявления экспрессии генов «домашнего хозяйства». Реакционную смесь ПЦР получали добавлением стерилизованной дистиллированной воды к 2,5 мкл 10X буфера для ПЦР LA II (Takara Shuzo), 4 мкл смеси каждого 2,5 мМ dNTP (Takara Shuzo), 0,5 мкл каждого 10 мМ праймера, 2 мкл 10X-кДНК, разбавленной стерилизованной дистиллированной водой, и 0,5 мкл LA Taq (Takara Shuzo), чтобы получить 25 мкл. Для выявления варианта GIPF и аксина-2 реакционную смесь для ПЦР инкубировали при 94°C в течение 2 мин, осуществляли 33 цикла реакции при 94°C в течение 30 секунд, при 60°C в течение 30 секунд и при 72°C в течение 30 секунд. Для выявления GAPDH реакционную смесь для ПЦР инкубировали при 94°C в течение 2 мин, осуществляли 23 цикла реакции при 94°C в течение 30 секунд, при 65°C в течение 30 секунд и при 72°C в течение 30 секунд.
Экспрессию гена варианта GIPF выявляли в подвздошной кишке и ободочной кишке у PSVR-KI-мышей. Уровень экспрессии аксина-2 увеличивался у PSVR-KI-мышей по сравнению с контролем (фигура 79). Полученные данные свидетельствуют, что вариант GIPF обладает активностью в индукции экспрессии генов, являющихся мишенью β-катенина и ответственен за активацию ниже по ходу пути передачи сигнала β-катенина.
Таким образом, показано, что вариант GIPF обладает активностью в стимуляции пути передачи сигнала β-катенина.
ПРИМЕР 37
МОДЕЛЬ ПЕРЕНОСА T-КЛЕТОК CD4+CD45RBhigh
Об индукции хронического воспаления кишечника, сходного с воспалительным заболеванием кишечника, посредством переноса подгруппы T-лимфоцитов CD4+CD45RBhigh иммунодефицитным мышам SCID, сообщалось Aranda et al. (J. Immunol. 158: 3464-3473). Соответственно, терапевтическую эффективность GIPF по отношению к иммунологически индуцированному колиту тестировали в модели с переносом T-клеток CD4+CD45RBhigh следующим образом.
Использовали взрослых самок мышей C.B-17/Icr Crj-scid/scid (CHARLES RIVER JAPAN, INC.) 7-недельного возраста. После доставки от поставщика и до эксперимента животных содержали в течение двух недель в отдельно вентилируемых клетках в условия цикла 12 часов освещенность: темнота, чтобы стабилизировать циркадный ритм. Животным давали корм и воду по желанию.
В день переноса клеток (0 день) T-клетки CD4+CD45RBhigh собирали из селезенок 20 самок мышей BALB/c. Спленоциты суспендировали в 2% FBS, 2 мМ EDTA, PBS-буфере для сортировки и CD4-позитивные клетки отсортировывали с помощью FACS (Becton DiCκinson FACS Aria). Затем отсортированные CD4-позитивные клетки ресуспендировали в буфере для сортировки в концентрации 2×107 клеток/мл и пропускали фракцию CD4-позитивных и CD45RBhigh клеток. Собранные T-клетки CD4+CD45RBhigh центрифугировали и суспендировали в 6 мл PBS до 1,1×106 клеток/мл. 4,5×105 клеток/мышь T-клеток CD4+CD45RBhigh переносили 13 самкам мышей C.B-17/Icr Crj-scid/scid посредством в/б-инъекции.
После переноса T-клеток проводили мониторинг концентрации сывороточного амилоида A (SAA) в отношении прогрессирования воспаления. Также наблюдали за прогрессированием колита по уменьшению массы тела, консистенции испражнений и с помощью пробы на скрытую кровь. Концентрация SAA увеличивалась, начиная с 7 дня после переноса, и выявлено воспаление у мышей с перенесенными T-клетками. Через 12 дней после переноса T-клеток появлялись животные с жидким стулом и позитивные в тесте на скрытую кровь. Через 30 дней после переноса T-клеток наблюдали диарею и массивное кровотечение у мышей с перенесенными T-клетками. Через 40 дней наблюдали потерю массы тела у мышей с перенесенными T-клетками. Начиная с 61 дня после переноса T-клеток в/в инъецировали 100 мкг/дозу GIPF в течение 3 дней 4 мышам с перенесенными T-клетками. Также в/в инъецировали PBS в течение 3 дней 3 мышам с перенесенными T-клетками в качестве негативного контроля. На 70 день после переноса T-клеток указанных животных умерщвляли. Кишечник извлекали и фиксировали в формалине. Залитые в парафин срезы красили гематоксилином и эозином (Г+Э) для гистологической оценки.
Как показано на фигуре 80, окрашивание Г+Э срезов толстого кишечника мышей, которым инъецировали 100 мкг/дозу GIPF, показало отчетливые структуры желез с повышенным количеством митотических клеток и меньшим количеством продуктов распада некротических клеток по сравнению с мышами, которым инъецировали PBS. Гистопатологические изменения в слизистой оболочке толстого кишечника, вызванные переносом T-клеток, действительно уменьшались при инъекции GIPF. Следовательно, GIPF можно использовать для лечения пациентов, страдающих от мукозита, вызванного воспалительным заболеванием кишечника, включая болезнь Крона.
Реферат
Изобретение относится к биотехнологии. Раскрыто применение полипептида, представляющего собой пролиферативный фактор (GIPF), в качестве активного начала в производстве лекарственного средства для стимуляции пролиферации эпителиальных клеток у млекопитающего субъекта, предусматривающее введение указанному субъекту терапевтически эффективного количества указанного лекарственного средства или для лечения желудочно-кишечного расстройства или повреждения слизистой оболочки ротовой полости у млекопитающего субъекта. Изобретение позволяет расширить ассортимент лекарственных средств для стимуляции пролиферации эпителиальных клеток или для лечения желудочно-кишечного расстройства или повреждения слизистой оболочки ротовой полости у млекопитающего субъекта. 2 и 13 з.п. ф-лы, 80 ил., 16 табл.

Комментарии