Антитела к muc16 и их применение - RU2758113C2
Код документа: RU2758113C2
Чертежи

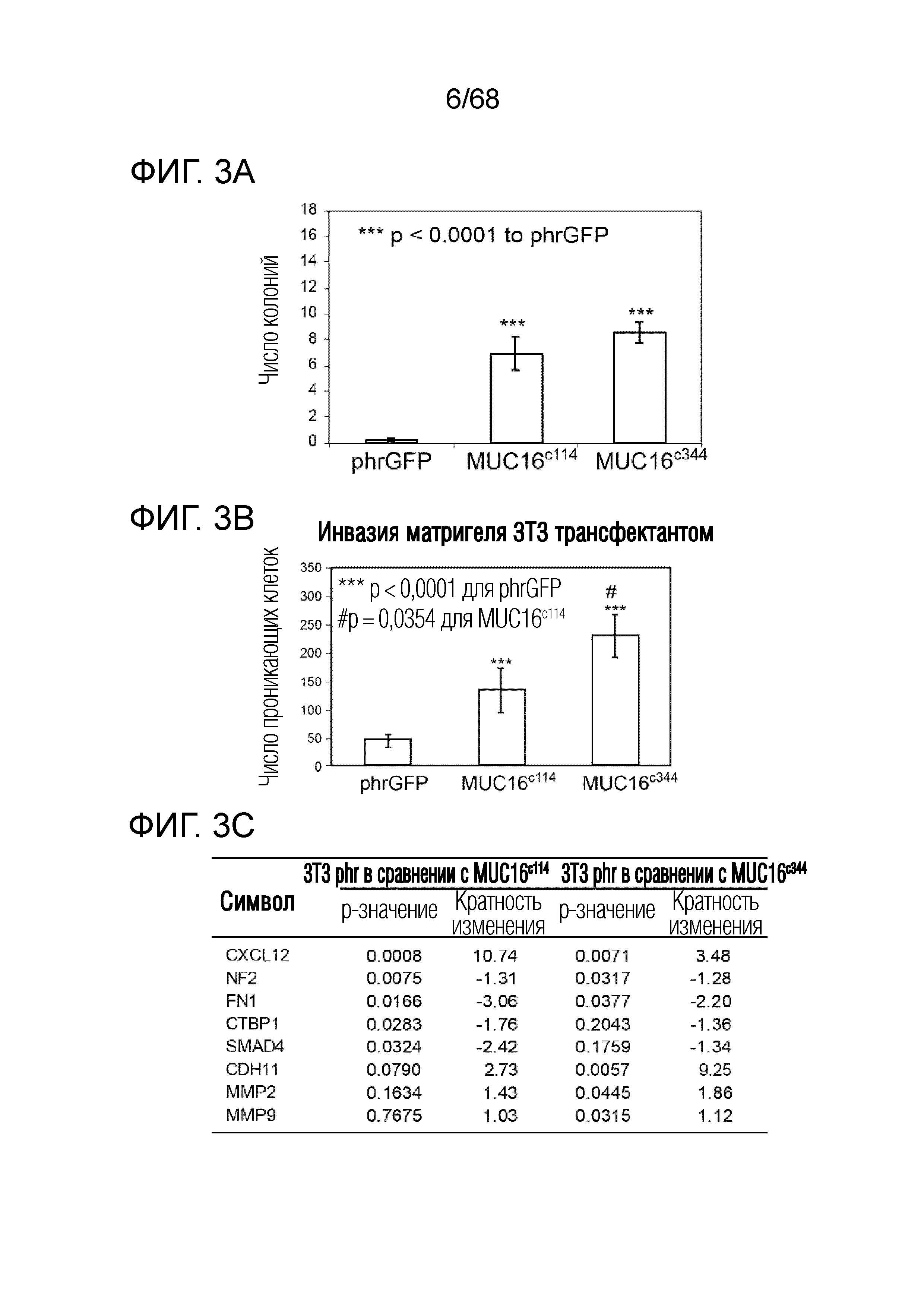
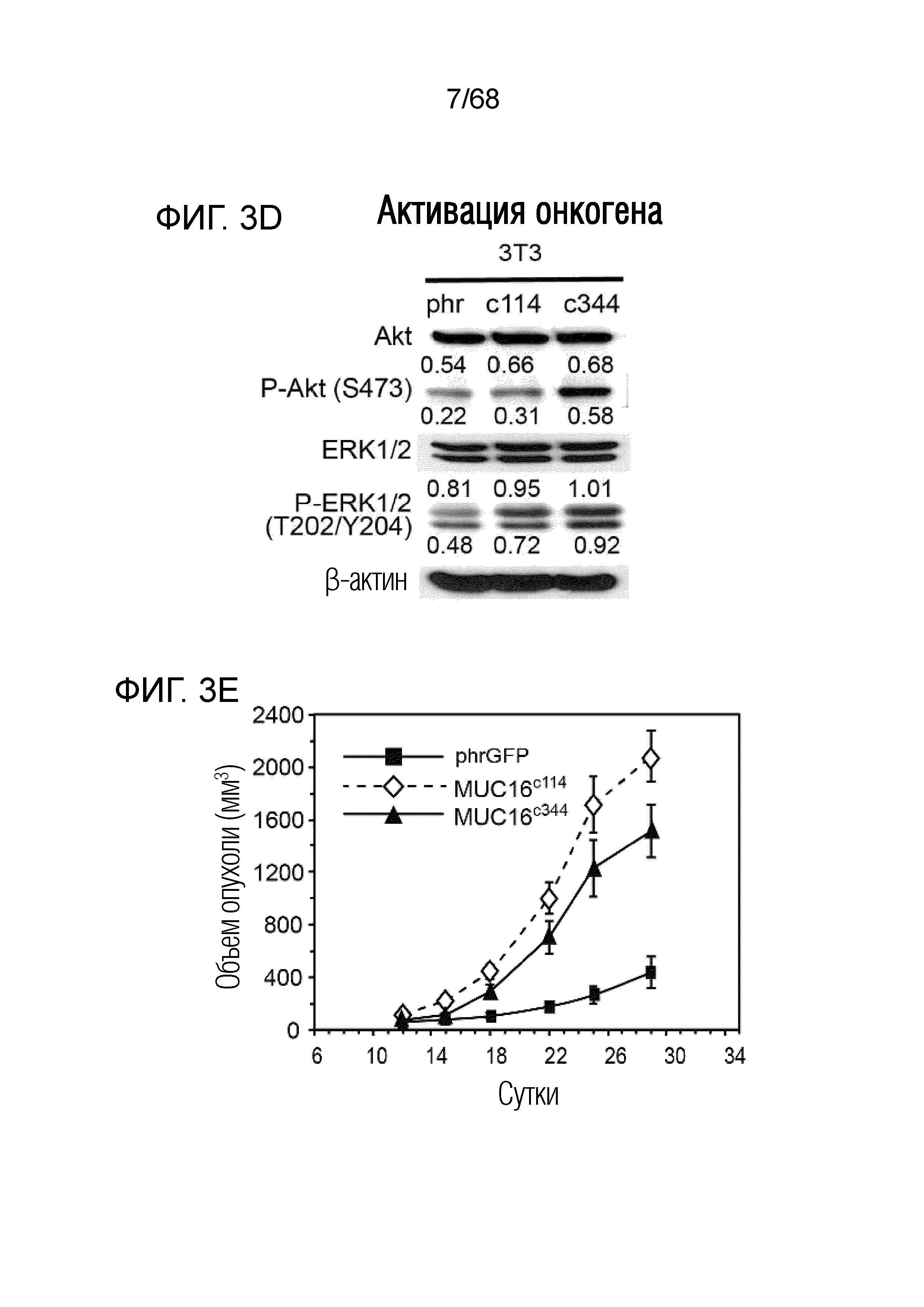
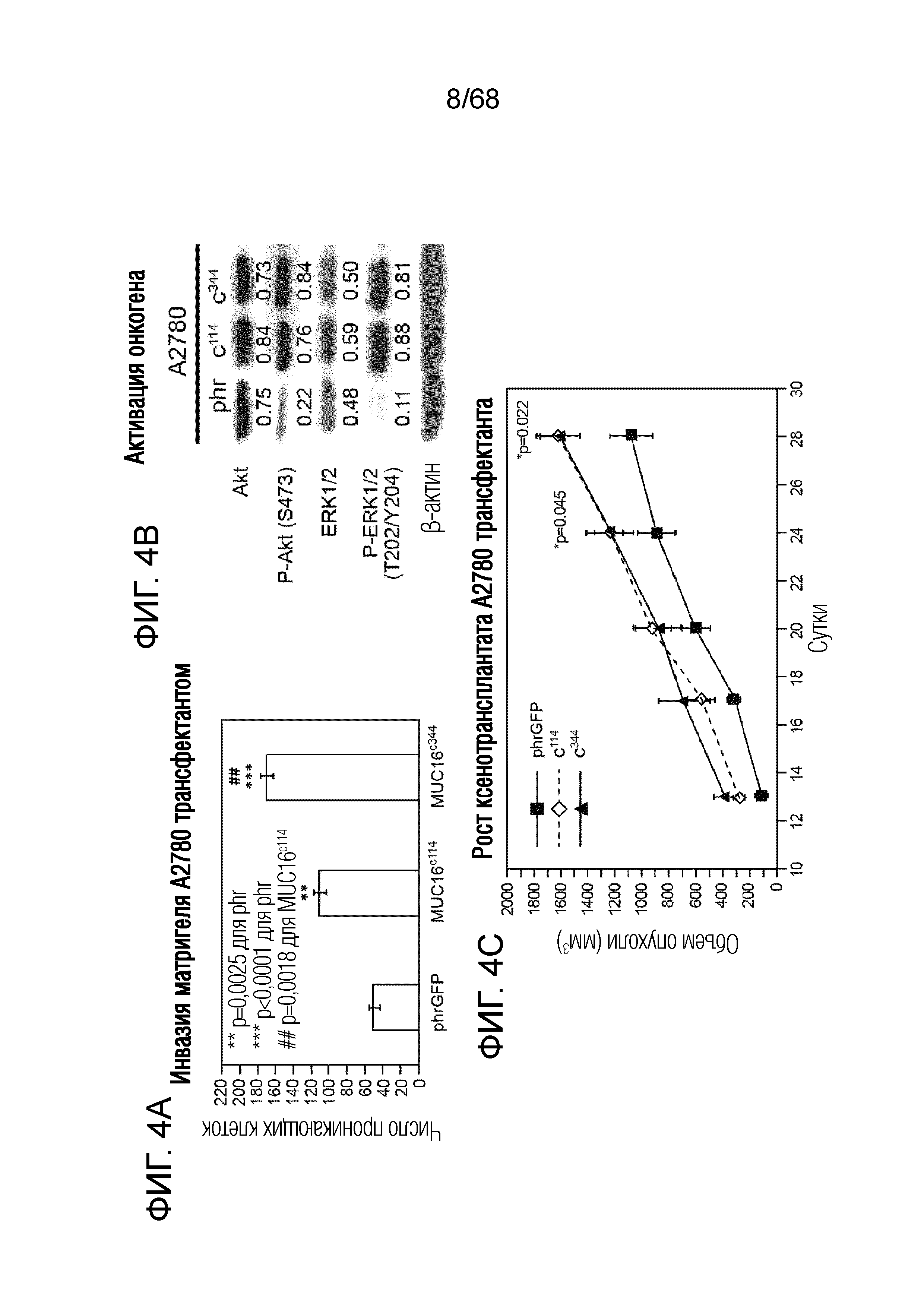
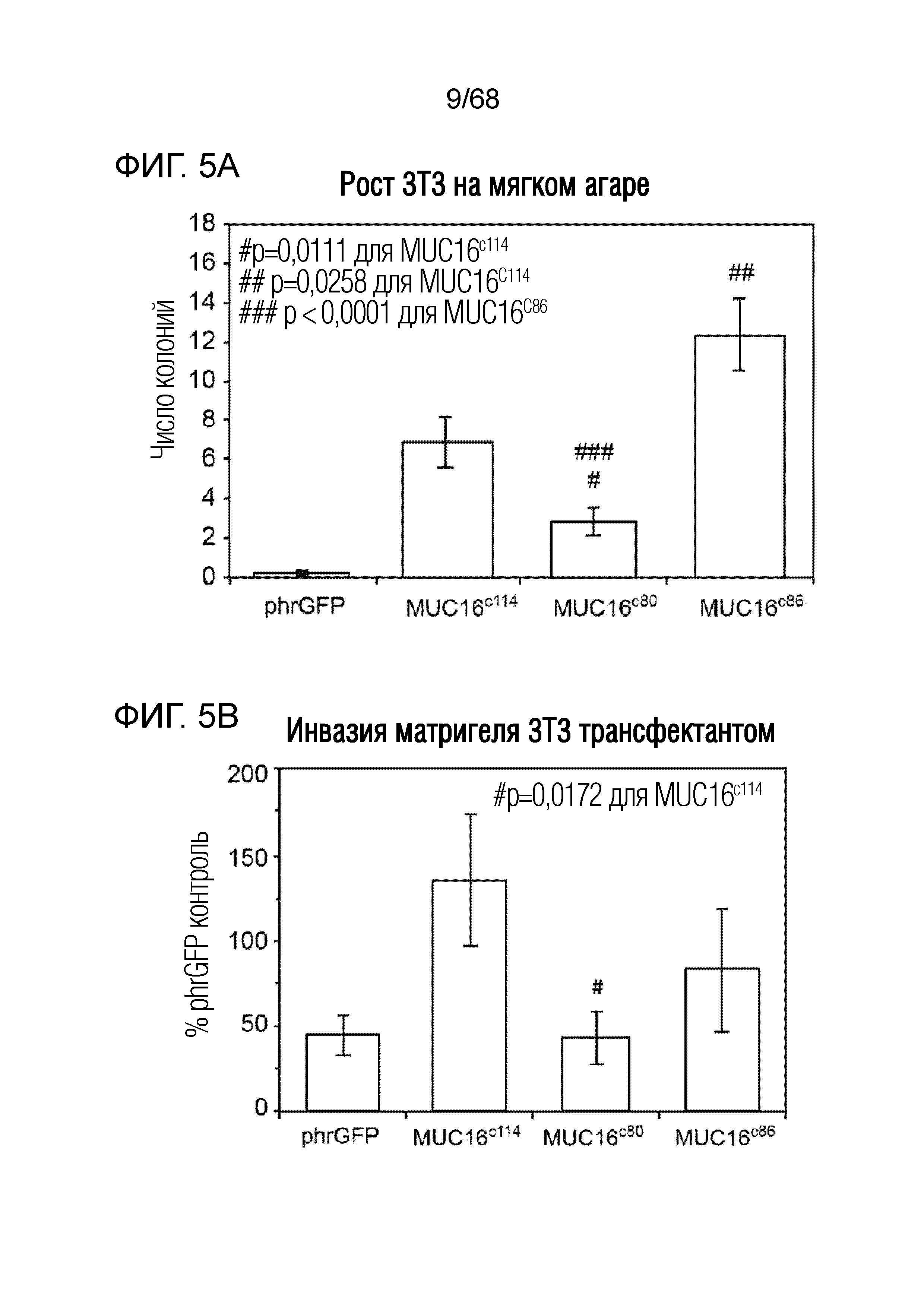















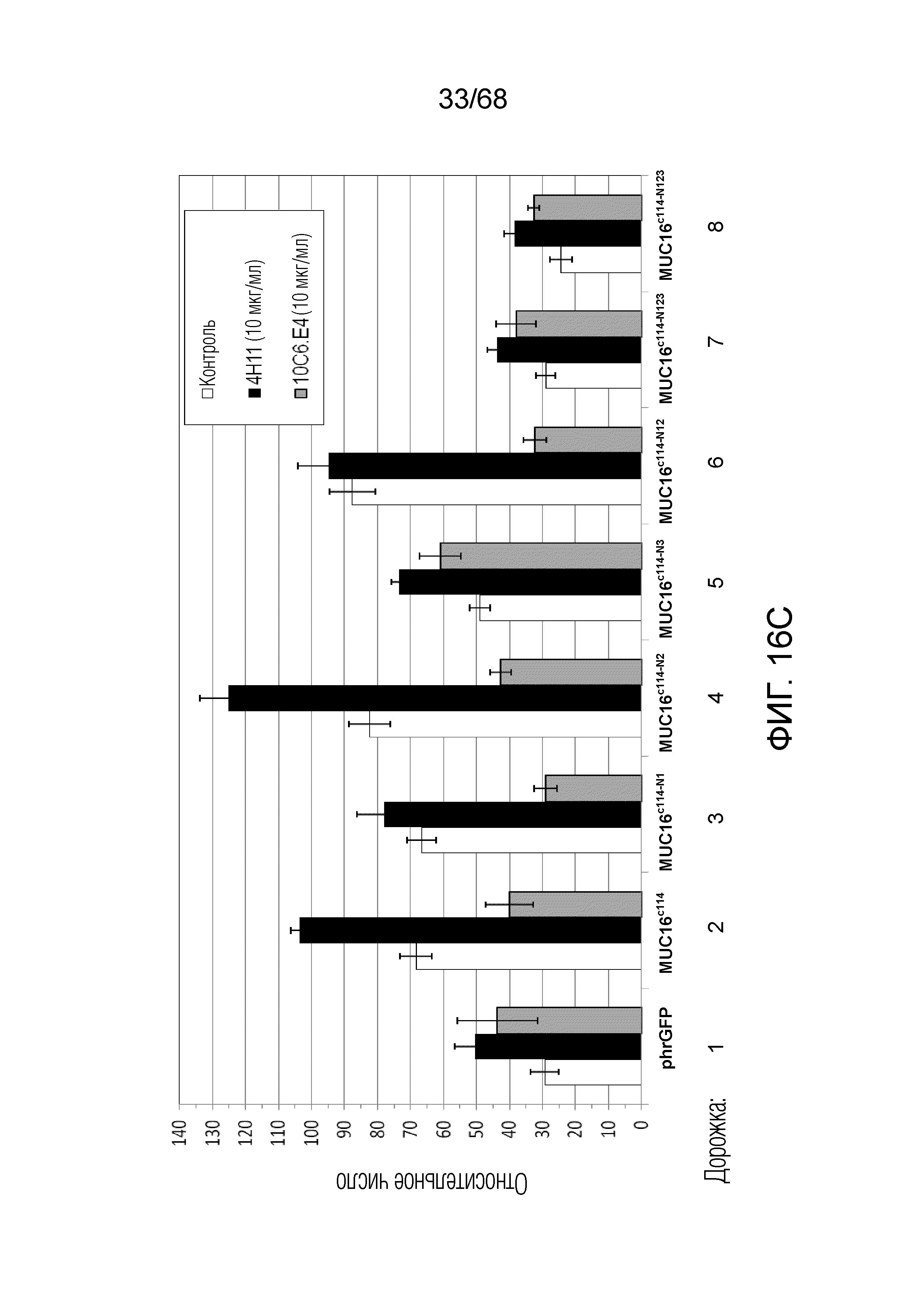


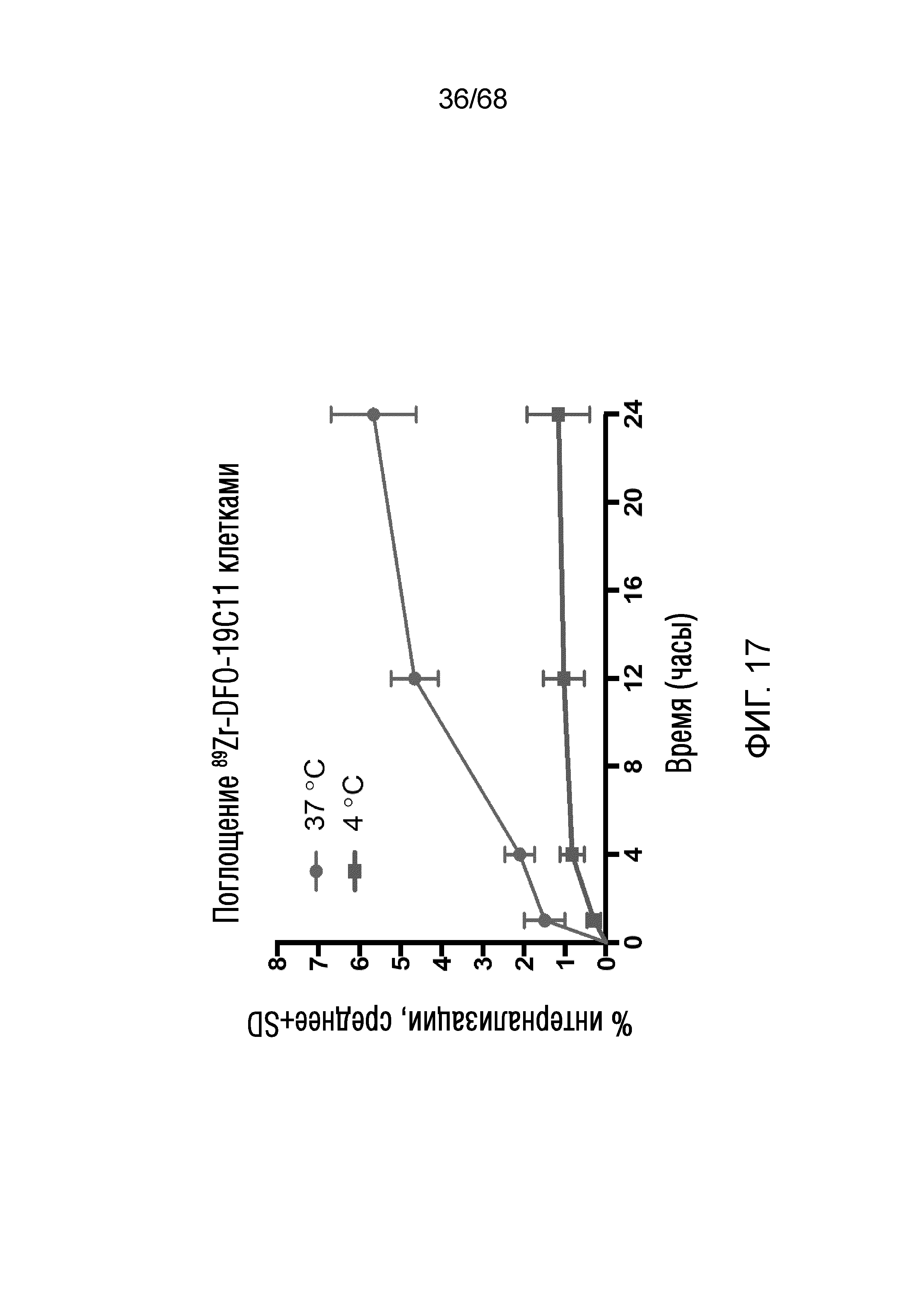
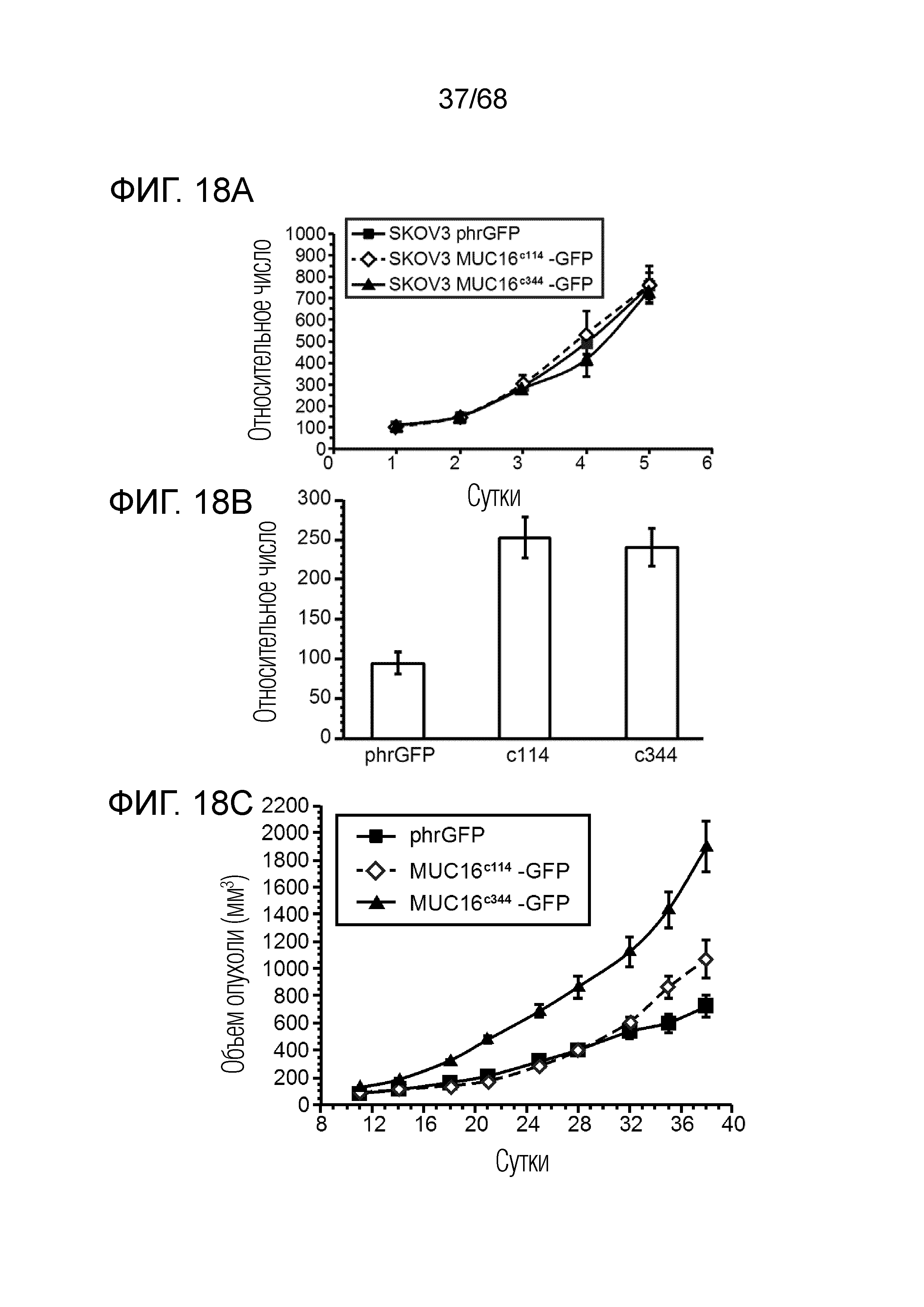
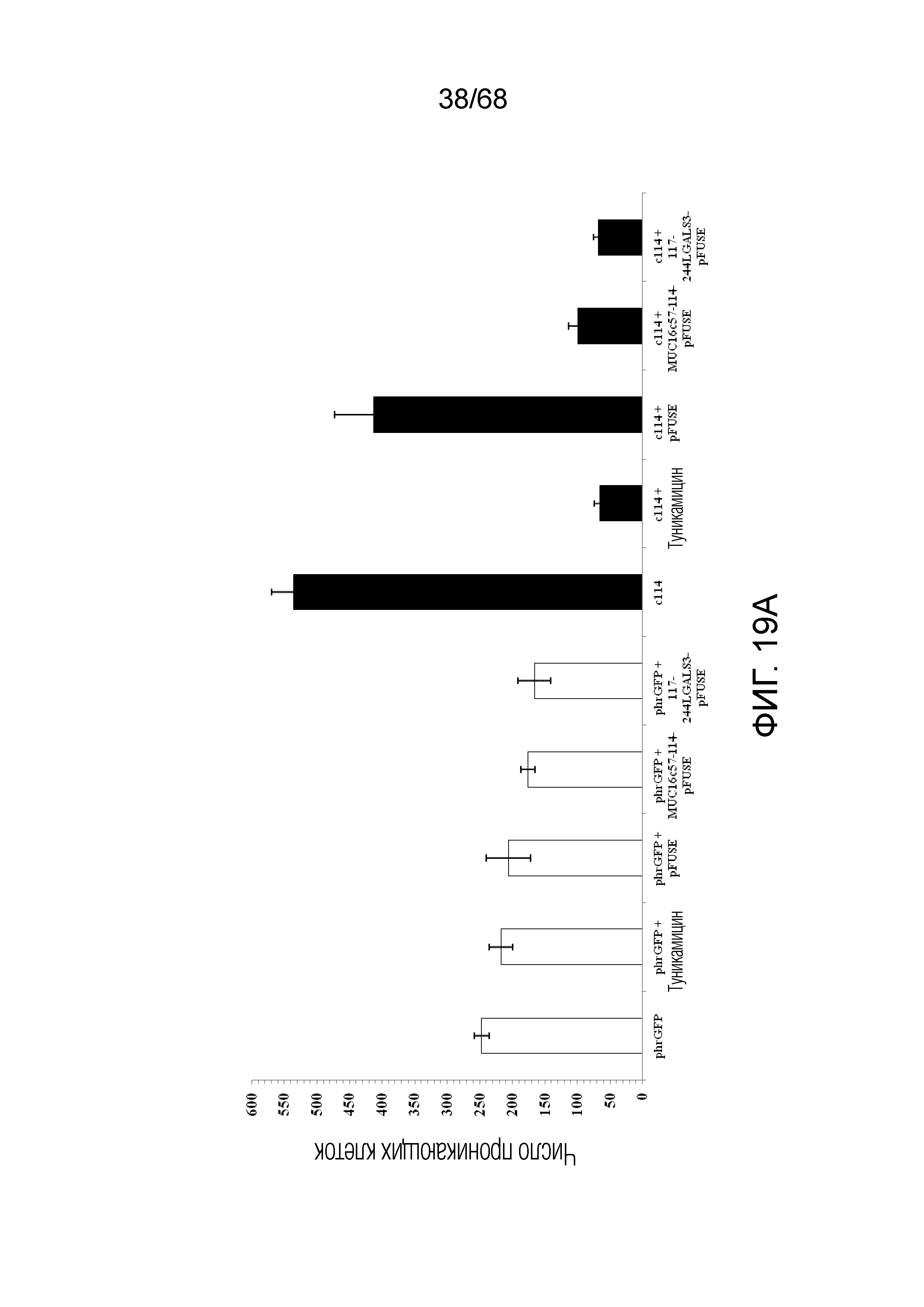


















Описание
[0001] По этой заявке испрашивается приоритет временной заявки на патент США № 62/134,402, поданной 17 марта 2015 года, которая в полном объеме включена в настоящее описание посредством ссылки.
[0002] Эта заявка включает по упоминанию список последовательностей, поданный с этой заявкой в виде текстового файла, озаглавленного «Sequence_Listing_13542-016-228.txt», который создан 14 марта 2016 года и имеет размер 388 Кбайт.
1. ОБЛАСТЬ
[0003] Настоящее изобретение относится к композициям, способам и применениям, в которых используют антитела, которые иммуноспецифически связываются с MUC16, связанным белком муцином, и модулируют экспрессию и/или активность MUC16 для контроляконтроля, лечения или предотвращения нарушений, таких как рак.
2. УРОВЕНЬ ТЕХНИКИ
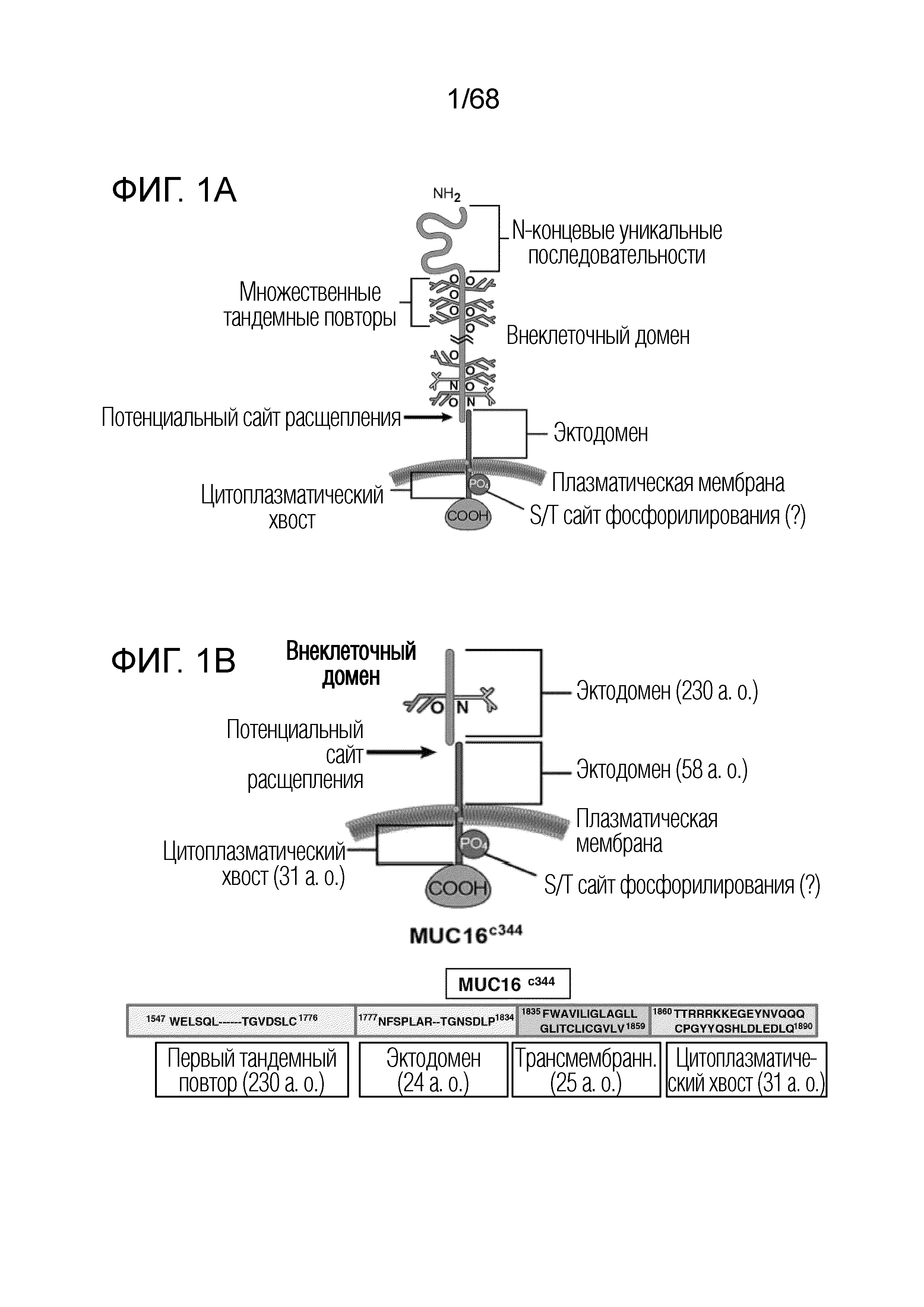
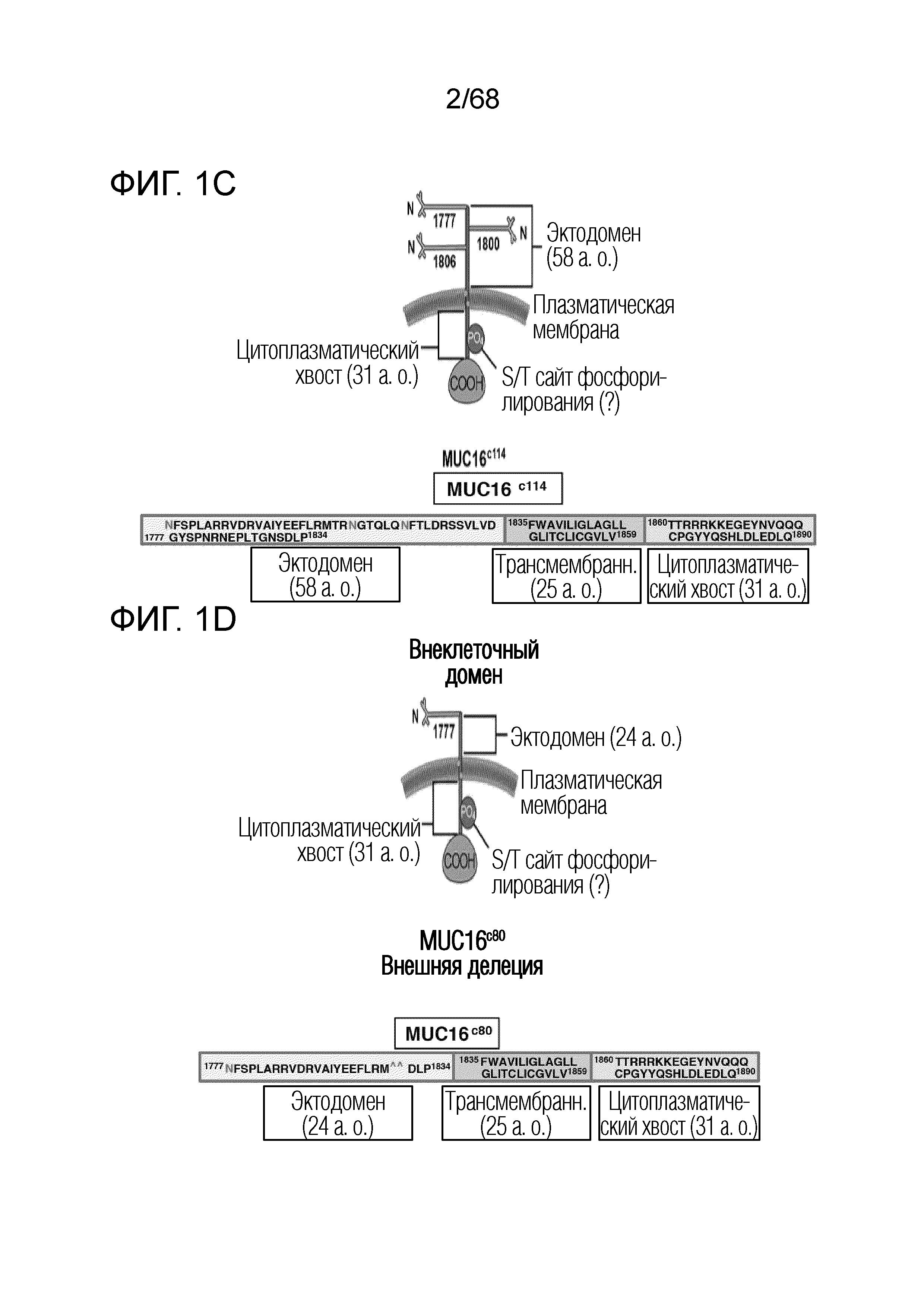
[0004] Муцины представляют собой важные биологические молекулы для клеточного гомеостаза и защиты эпителиальных поверхностей. Изменения экспрессии муцинов при раке яичников можно использовать для диагноза, прогноза и лечения (Singh AP, et al. Lancet Oncol 2008;9(11):1076-85). MUC16 представляет собой один такой муцин, который чрезмерно экспрессируется на большинстве карцином яичников и является установленным суррогатным сывороточным маркером (CA-125) для обнаружения и прогрессии рака яичников (Badgwell D, et al., Dis Markers 2007;23(5-6):397410; Bast RC, Jr, et al., Int J Gynecol Cancer 2005;15 Suppl 3:274-81; Fritsche HA, et al., Clin Chem 1998;44(7):1379-80; и Krivak TC, et al., Gynecol Oncol 2009;115(1):81-5). MUC16 представляет собой сильно гликозилированный муцин, состоящий из большого отщепляемого и высвобождаемого домена, называемого CA-125, состоящего из множества повторных последовательностей, и остающегося домена (MUC-CD), который содержит остаточный не повторяющийся внеклеточный фрагмент, трансмембранный домен и цитоплазматический хвост (O'Brien TJ, et al. Tumour Biol 2001;22(6):348-66). Поскольку иначе экспрессия антигена происходит только на низком уровне в матке, эндометрии, фаллопиевых трубах, яичниках и серозной оболочке брюшной и грудной полостей, MUC16 представляет собой потенциально привлекательную мишень для иммунологической терапии.
[0005] Однако тот факт, что происходит отщепление и секреция большей части внеклеточного домена MUC16, ограничивает полезность MUC16 в качестве целевого антигена на карциномах яичников. Фактически, до настоящего времени, большинство моноклональных антител к MUC16, о которых сообщалось, связываются с эпитопами, присутствующими на большой секретированной фракции CA-125 гликопротеина, причем ничего не известно о связывании с остающейся внеклеточной фракцией (MUC-CD) антигена (Bellone S, Am J Obstet Gynecol 2009;200(1):75 el-10, Berek JS. Expert Opin Biol Ther 2004;4(7):1159-65; O'Brien TJ, et al. Int J Biol Markers 1998;13(4):188-95). Таким образом, необходимо создание новых антител к не слущиваемой области MUC16 для диагностических и терапевтических подходов.
3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] Изобретение относится к антителам и их антигенсвязывающим фрагментам, а также полипептидам, содержащим такие антитела или антигенсвязывающие фрагменты, таким как слитые белки, конъюгаты, и/или химерные антигенные рецепторы, а также клеткам, экспрессирующим их. Среди антител и антигенсвязывающих фрагментов присутствуют те, которые специфически связываются с эпитопами белка MUC16. Такие антитела обозначают в настоящем описании как «антитела к гликозилированному MUC16». Такие эпитопы обычно представляют собой эпитопы во или по существу во внеклеточной части молекулы MUC16, в целом не слущиваемой форме MUC16; в некоторых вариантах осуществления эпитоп не находится в области тандемных повторов MUC16 и/или секретируемой форме MUC16 или антитело или фрагмент не связывается с ним. В некоторых вариантах осуществления эпитоп находится в или включает остатки в MUC16c114, и обычно содержит один или несколько гликозилированных остатков или участки гликозилирования в нем. В некоторых вариантах осуществления эпитоп включает один или несколько участков гликозилирования, таких как участки для N-гликозилирования. В некоторых аспектах эпитоп содержит остаток аспарагина, соответствующий Asn1806 или Asn1800 из последовательности MUC16, приведенной в SEQ ID № 150 (и/или его гликозилированной форме(ах)); в некоторых аспектах эпитоп содержит остаток аспарагина, соответствующий Asn1806 из SEQ ID № 150, но не содержит остаток аспарагина, соответствующий Asn1800 из SEQ ID № 150; в некоторых аспектах эпитоп содержит остаток аспарагина, соответствующий Asn1800 из SEQ ID № 150, но не содержит остаток аспарагина, соответствующий Asn1806 из SEQ ID № 150. В некоторых из каких-либо из таких вариантов осуществления такие один или несколько аспарагинов гликозилированы, например, N-гликозилированы. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент связывается с эпитопом внутри или тем, что содержит остатки внутри SEQ ID № 131; связывается с эпитопом внутри или тем, что содержит остатки внутри SEQ ID № 130, или их сочетанием; в некоторых вариантах осуществления антитело или фрагмент иммуноспецифически не связывается в областью MUC16, соответствующей SEQ ID № 168, или внутри остатков 2-19 из SEQ ID № 168.
[0007] В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты по изобретению включают одну или несколько определяющих комплементарность областей (CDR), соответствующих CDR тяжелой цепи и/или легкой цепи последовательности антитела, такой как последовательность антитела, направленного на участок гликозилирования MUC16, которая описана в настоящем описании, например, антитела с обозначением 18C6, антитела с обозначением 10C6 и/или антитела с обозначением 19C11. В некоторых вариантах осуществления антитело или фрагмент имеет CDR3 тяжелой цепи (HCDR3), имеющую последовательность, соответствующую HCDR3 одной из последовательностей тяжелой цепи, представленных в настоящем описании, например, последовательностей тяжелой цепи антитела с обозначением 18C6, антитела с обозначением 10C6, антитела с обозначением 19C11 и/или антитела с обозначением 7B12. В некоторых аспектах HCDR3 имеет последовательность, выбранную среди IGTAQATDALDY (SEQ ID № 105), GTAQATDALD (SEQ ID № 111); X18RIGTAQATDALDY (SEQ ID № 117), в которых X18 представляет собой T, A или S; SEQ ID № 5; SEQ ID № 25; SEQ ID № 45; SEQ ID № 65; и SEQ ID № 85; SEQ ID № 31, 51, 71 и 91; SEQ ID № 17; SEQ ID № 37; SEQ ID № 57; SEQ ID № 77; и SEQ ID № 97.
[0008] В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты по изобретению включают CDR1 тяжелой цепи (HCDR1), имеющую последовательность, соответствующую HCDR1 одной из последовательностей тяжелой цепи, представленных в настоящем описании, например, последовательностей тяжелой цепи антитела с обозначением 18C6, антитела с обозначением 10C6, антитела с обозначением 19C11 и/или антитела с обозначением 7B12. В некоторых аспектах, HCDR1 имеет последовательность, выбранную из TX1GMGVG (SEQ ID № 103), где X1 представляет собой L или V, последовательности GFSLX8TX9GM (SEQ ID № 109), в которой X8 представляет собой N или S и в которой X9 представляет собой L или V, GFSLX15TX16GMG (SEQ ID № 115), в которой X15 представляет собой N или S и X16 представляет собой V или L, и последовательности, приведенной в виде SEQ ID № 3; и последовательности, приведенной в виде SEQ ID № 9; и последовательности, приведенной в виде SEQ ID № 15; и последовательности, приведенной в любой из SEQ ID №№ 23, 43, 63, 83; и последовательности, приведенной в любой из SEQ ID №№ 29, 49, 69 и 89; и последовательности, приведенной в любой из SEQ ID №№ 35, 55, 75 и 95.
[0009] В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты по изобретению включают CDR2 тяжелой цепи (HCDR2), имеющую последовательность, соответствующую HCDR2 одной из последовательностей тяжелой цепи, представленных в настоящем описании, например, последовательностей тяжелой цепи антитела с обозначением 18C6, антитела с обозначением 10C6, антитела с обозначением 19C11 и/или антитела с обозначением 7B12. В некоторых аспектах HCDR2 имеет последовательность, выбранную среди HIWWDDX2DKYYX3PALKS (SEQ ID № 104), в которой X2 представляет собой E или отсутствует и X3 представляет собой Y или N; WDDX10 (SEQ ID № 110), в которой X10 представляет собой E или отсутствует; IWWDDX17DK (SEQ ID № 116), в которой X17 представляет собой E или отсутствует; последовательности, приведенной в виде SEQ ID № 4; последовательности, приведенной в виде SEQ ID № 10; и последовательности, приведенной в виде SEQ ID № 16; и последовательности, приведенной в любой из SEQ ID №№ 24, 44, 64, 84; и последовательности, приведенной в любой из SEQ ID №№ 30, 50, 70, 90; и последовательности, приведенной в любой из SEQ ID №№ 36, 56, 76, 96.
[0010] В некоторых вариантах осуществления, включая какие-либо из указанных выше вариантов осуществления, антитела или антигенсвязывающие фрагменты по изобретению включают, например, дополнительно включают, CDR3 легкой цепи (LCDR3), имеющую последовательность, соответствующую LCDR3 одной из последовательностей легкой цепи, представленных в настоящем описании, например, последовательностей легкой цепи антитела с обозначением 18C6, антитела с обозначением 10C6, антитела с обозначением 19C11 и/или антитела с обозначением 7B12. В некоторых аспектах LCDR3 имеет последовательность, выбранную среди MQX6LEX7PLT (SEQ ID № 108), в которой X6 представляет собой G или S и в которой X7 представляет собой H или Y; X13LEX14PL (SEQ ID № 114), в которой X13 представляет собой G или S и в которой X14 представляет собой H или Y; и MQSLEYPLT (SEQ ID № 120); последовательности, выбранной среди SEQ ID №№ 8, 28, 48, 68, и 88; последовательности, выбранной среди SEQ ID №№ 14, 34, 54, 74 и 94; и последовательности, выбранной среди SEQ ID №№ 20, 4, 60, 80 и 100.
[0011] В некоторых вариантах осуществления, включая какие-либо из указанных выше вариантов осуществления, антитела или антигенсвязывающие фрагменты по изобретению включают, например, дополнительно включают, CDR1 легкой цепи (LCDR1), имеющую последовательность, соответствующую LCDR1 одной из последовательностей легкой цепи, представленных в настоящем описании, например, последовательностей легкой цепи антитела с обозначением 18C6, антитела с обозначением 10C6, антитела с обозначением 19C11 и/или антитела с обозначением 7B12. В некоторых аспектах LCDR1 имеет последовательность, выбранную среди RSSKSLX4X5SNGNTYLY (SEQ ID № 106); SKSLX11X12SNGNTY (SEQ ID № 112), в которой X11 представляет собой L или R и в которой X12 представляет собой H или K; KSLX19X20SNGNTY (SEQ ID № 118), в которой X19 представляет собой V или L и в которой X20 представляет собой H или K; последовательности, выбранной среди SEQ ID №№ 6, 26, 46, 66 и 86; последовательности, выбранной среди SEQ ID №№ 12, 32, 52, 72 и 92; и последовательности, выбранной среди SEQ ID №№ 18, 38, 58, 78 и 98.
[0012] В некоторых вариантах осуществления, включая какие-либо из указанных выше вариантов осуществления, антитела или антигенсвязывающие фрагменты по изобретению включают, например, дополнительно включают, CDR2 легкой цепи (LCDR2), имеющую последовательность, соответствующую LCDR2 одной из последовательностей легкой цепи, представленных в настоящем описании, например, последовательностей легкой цепи антитела с обозначением 18C6, антитела с обозначением 10C6, антитела с обозначением 19C11 и/или антитела с обозначением 7B12. В некоторых аспектах LCDR2 имеет последовательность, выбранную среди YMSNLAS (SEQ ID № 107); YMS (SEQ ID № 113); и последовательности, приведенной в любой из SEQ ID №№ 7, 27, 47, 67, 87; 13, 33, 53, 73, 93, 19, 39, 59, 79, 99, 119.
[0013] Среди антител и антигенсвязывающих фрагментов по какому-либо из вариантов осуществления присутствуют те, которые имеют (a) определяющую комплементарность область (CDR)1 VH, содержащую аминокислотную последовательность TX1GMGVG (SEQ ID № 103), в которой X1 представляет собой L или V; (b) CDR2 VH, которая содержит аминокислотную последовательность HIWWDDX2DKYYX3PALKS (SEQ ID № 104), в которой X2 представляет собой E или отсутствует и X3 представляет собой Y или N; и (c) CDR3 VH, которая содержит аминокислотную последовательность IGTAQATDALDY (SEQ ID № 105).
[0014] Среди антител и антигенсвязывающих фрагментов по какому-либо из вариантов осуществления присутствуют те, которые имеют (a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX8TX9GM (SEQ ID № 109), в которой X8 представляет собой N или S и в которой X9 представляет собой L или V; (b) CDR2 VH, которая содержит аминокислотную последовательность WDDX10 (SEQ ID № 110), в которой X10 представляет собой E или отсутствует; и (c) CDR3 VH, которая содержит аминокислотную последовательность GTAQATDALD (SEQ ID № 111).
[0015] Среди антител и антигенсвязывающих фрагментов по какому-либо из вариантов осуществления присутствуют те, которые имеют (a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX15TX16GMG (SEQ ID № 115), в которой X15 представляет собой N или S и X16 представляет собой V или L; (b) CDR2 VH, которая содержит аминокислотную последовательность IWWDDX17DK (SEQ ID № 116), в которой X17 представляет собой E или отсутствует; и (c) CDR3 VH, которая содержит аминокислотную последовательность X18RIGTAQATDALDY (SEQ ID № 117), в которой X18 представляет собой T, A или S.
[0016] Среди антител и антигенсвязывающих фрагментов по какому-либо из вариантов осуществления присутствуют те, которые имеют CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 3, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 4, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 5; CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 9, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 10, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 11; CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 15, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 16, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 17; CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 23, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 24, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 25; CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 29, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 30, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 31; VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 35, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 36, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 37; CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 43, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 44, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 45; VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 49, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 50, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 51; CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 55, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 56, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 57; CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 63, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 64, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 65; CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 69, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 70, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 71; CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 75, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 76, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 77; CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 83, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 84, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 85; CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 89, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 90, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 91; VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 95, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 96, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 97.
[0017] Среди антител и антигенсвязывающих фрагментов по какому-либо из вариантов осуществления присутствуют те, которые имеют (a) CDR1 VL, которая содержит аминокислотную последовательность RSSKSLX4X5SNGNTYLY (SEQ ID № 106), в которой X4 представляет собой R или L и X5 представляет собой K или H; (b) CDR2 VL, которая содержит аминокислотную последовательность YMSNLAS (SEQ ID № 107); и (c) CDR3 VL, которая содержит аминокислотную последовательность MQX6LEX7PLT (SEQ ID № 108), в которой X6 представляет собой G или S и X7 представляет собой H или Y.
[0018] Среди антител и антигенсвязывающих фрагментов по какому-либо из вариантов осуществления присутствуют те, которые имеют (a) CDR1 VL, которая содержит аминокислотную последовательность SKSLX11X12SNGNTY (SEQ ID № 112), в которой X11 представляет собой L или R и X12 представляет собой H или K; (b) CDR2 VL, которая содержит аминокислотную последовательность YMS (SEQ ID № 113); и (c) CDR3 VL, которая содержит аминокислотную последовательность X13LEX14PL (SEQ ID № 114), в которой X13 представляет собой G или S и X14 представляет собой H или Y.
[0019] Среди антител и антигенсвязывающих фрагментов по какому-либо из вариантов осуществления присутствуют те, которые имеют CDR1 VL, которая содержит аминокислотную последовательность KSLX19X20SNGNTY (SEQ ID № 118), в которой X19 представляет собой V или L и X20 представляет собой H или K; (b) CDR2 VL, которая содержит аминокислотную последовательность YMS (SEQ ID № 119); и (c) CDR3 VL, которая содержит аминокислотную последовательность MQSLEYPLT (SEQ ID № 120).
[0020] Среди антител и антигенсвязывающих фрагментов по какому-либо из вариантов осуществления присутствуют те, которые имеют CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 26, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 27, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 28; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 32, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 33, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 34; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 38, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 39, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 40; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 46, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 47, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 48; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 52, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 53, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 54; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 58, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 59, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 60; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 86, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 87, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 88; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 92, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 93, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 94; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 98, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 99, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 100; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 6, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 7, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 8; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 12, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 13, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 14; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 18, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 19, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 20; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 66, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 67, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 68; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 72, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 73, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 74; или CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 78, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 79, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 80.
[0021] Среди антител и антигенсвязывающих фрагментов по какому-либо из вариантов осуществления присутствуют те, которые имеют (a) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность TX1GMGVG (SEQ ID № 103), в которой X1 представляет собой L или V; CDR2 VH, которая содержит аминокислотную последовательность HIWWDDX2DKYYX3PALKS (SEQ ID № 104), в которой X2 представляет собой E или отсутствует и X3 представляет собой Y или N; и CDR3 VH, которая содержит аминокислотную последовательность IGTAQATDALDY (SEQ ID № 105); и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность RSSKSLX4X5SNGNTYLY (SEQ ID № 106), в которой X4 представляет собой R или L и X5 представляет собой K или H; CDR2 VL, которая содержит аминокислотную последовательность YMSNLAS (SEQ ID № 107); и CDR3 VL, которая содержит аминокислотную последовательность MQX6LEX7PLT (SEQ ID № 108), в которой X6 представляет собой G или S и X7 представляет собой H или Y; или (b) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность GFSLX8TX9GM (SEQ ID № 109), в которой X8 представляет собой N или S и в которой X9 представляет собой L или V; CDR2 VH, которая содержит аминокислотную последовательность WDDX10 (SEQ ID № 110), в которой X10 представляет собой E или отсутствует; и CDR3 VH, которая содержит аминокислотную последовательность GTAQATDALD (SEQ ID № 111); и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность SKSLX11X12SNGNTY (SEQ ID № 112), в которой X11 представляет собой L или R и X12 представляет собой H или K; CDR2 VL, которая содержит аминокислотную последовательность YMS (SEQ ID № 113); и CDR3 VL, которая содержит аминокислотную последовательность X13LEX14PL (SEQ ID № 114), в которой X13 представляет собой G или S и X14 представляет собой H или Y; или (c) (i) CDR1 VH, которая содержит аминокислотную последовательность GFSLX15TX16GMG (SEQ ID № 115), в которой X15 представляет собой N или S и X16 представляет собой V или L; CDR2 VH, которая содержит аминокислотную последовательность IWWDDX17DK (SEQ ID № 116), в которой X17 представляет собой E или отсутствует; и CDR3 VH, которая содержит аминокислотную последовательность X18RIGTAQATDALDY (SEQ ID № 117), в которой X18 представляет собой T, A или S; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность KSLX19X20SNGNTY (SEQ ID № 118), в которой X19 представляет собой V или L и X20 представляет собой H или K; CDR2 VL, которая содержит аминокислотную последовательность YMS (SEQ ID № 119); и CDR3 VL, которая содержит аминокислотную последовательность MQSLEYPLT (SEQ ID № 120); или (d) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 23, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 24, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 25; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 26, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 27, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 28; или (e) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 29, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 30, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 31; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 32, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 33, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 34; или (f) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 35, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 36, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 37; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 38, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 39, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 40; или (g) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 43, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 44, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 45; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 46, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 47, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 48; или (h) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 49, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 50, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 51; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 52, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 53, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 54; или (i) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 55, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 56, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 57; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 58, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 59, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 60; или (j) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 83, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 84, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 85; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 86, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 87, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 88; или (k) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 89, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 90, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 91; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 92, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 93, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 94; или (l) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 95, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 96, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 97 и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 98, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 99, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 100; или (m) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 3, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 4, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 5; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 6, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 7, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 8; или (n) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 9, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 10, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 11; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 12, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 13, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 14; или (o) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 15, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 16, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 17; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 18, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 19, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 20; или (p) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 63, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 64, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 65; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 66, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 67, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 68; или (q) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 69, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 70, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 71; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 72, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 73, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 74; или (r) (i) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 75, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 76, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 77; и (ii) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 78, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 79, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 80.
[0022] Среди антител и антигенсвязывающих фрагментов по какому-либо из вариантов осуществления присутствуют те, которые имеют: (a) (i) VH, которая содержит аминокислотную последовательность QVX21LKESGPGX22LQPSQTLSLTCSFSGFSLX23TX24GMGVGWX25RQX26SGKGLEWLAH IWWDDX27DKYYX28PALKSRLTISX29X30X31SKNQVFLKIX32NVX33TADX34ATYYCX35RI GTAQATDALDYWGQGTSVTVSS (SEQ ID № 101), в которой X21 представляет собой T или N, X22 представляет собой I или K, X23 представляет собой N или S, X24 представляет собой V или L, X25 представляет собой S или I, X26 представляет собой P или S, X27 представляет собой E или отсутствует, X28 представляет собой N или Y, X29 представляет собой K или R, X30 представляет собой A или D, X31 представляет собой T или S, X32 представляет собой V или A, X33 представляет собой G или D, X34 представляет собой T, I или S и X35 представляет собой T, S или A; и (ii) VL, которая содержит аминокислотную последовательность DIVMTQAAPSX36X37VTPGESVSISCRSSKSLX38X39SNGNTYLYWFLQRPGQSPQRLIYYMSNLASGVPDRFSGRGSGTDFTLX40ISRVEAX41DVGVYYCMQX42LEX43PLTFGGGTKLEIK (SEQ ID № 102), в которой X36 представляет собой I или V, X37 представляет собой P или S, X38 представляет собой R или L, X39 представляет собой K или H, X40 представляет собой R или K, X41 представляет собой E или G, X42 представляет собой S или G и X43 представляет собой Y или H; или (b) (i) VH, которая содержит аминокислотную последовательность из SEQ ID № 1; и (ii) VL, которая содержит аминокислотную последовательность из SEQ ID № 2; или (c) (i) VH, которая содержит аминокислотную последовательность из SEQ ID № 21; и (ii) VL, которая содержит аминокислотную последовательность из SEQ ID № 22; или (d) (i) VH, которая содержит аминокислотную последовательность из SEQ ID № 41; и (ii) VL, которая содержит аминокислотную последовательность из SEQ ID № 42; или (e) (i) VH, которая содержит аминокислотную последовательность из SEQ ID № 61; и (ii) VL, которая содержит аминокислотную последовательность из SEQ ID № 62; или (f) (i) VH, которая содержит аминокислотную последовательность из SEQ ID № 81; и (ii) VL, которая содержит аминокислотную последовательность из SEQ ID № 82.
[0023] Также среди предоставленных антител или антигенсвязывающих фрагментов присутствуют те, которые имеют по меньшей мере 90, 95, 96, 97, 98, 99 или 100% идентичность с последовательностью(ями) VH и/или VL каких-либо таких антител и/или каких-либо антител, приведенных в таблицах 1 и 2. Также среди предоставленных антител и их фрагментов присутствуют те, которые конкурируют за связывание с MUC16 и/или его эпитопом с каким-либо из таких антител.
[0024] Изобретение также относится к слитым белкам, таким как химерные молекулы и/или конъюгаты, которые содержат какое-либо из антител, таких как химерные антигенные рецепторы (CAR), которые содержат такие антитела или фрагменты, и клетки, экспрессирующие такие молекулы. Изобретение также относится к гуманизированным версиям каких-либо таких антител.
[0025] В некоторых вариантах осуществления изобретение относится к антителу или его антигенсвязывающему фрагменту, где антитело (a) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (b) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (c) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16. В некоторых вариантах осуществления (i) клетка, которая рекомбинантно экспрессирует первую форму MUC16, представляет собой клетку SKOV3; (ii) клетка, которая рекомбинантно экспрессирует вторую форму MUC16, представляет собой клетку SKOV3; и (iii) клетки на стадии (c) представляют собой клетки SKOV3. В конкретном варианте осуществления антитело не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует третью форму MUC16, эта третья форма гликозилирована, и где аминокислотная последовательность третьей формы представляет собой SEQ ID № 139. В некоторых вариантах осуществления (i) клетка, которая рекомбинантно экспрессирует первую форму MUC16, представляет собой клетку SKOV3; (ii) клетка, которая рекомбинантно экспрессирует вторую форму MUC16, представляет собой клетку SKOV3; и (iii) клетки на стадии (c) представляют собой клетки SKOV3. В некоторых вариантах осуществления (i) клетка, которая рекомбинантно экспрессирует первую форму MUC16, представляет собой клетку SKOV3; (ii) клетка, которая рекомбинантно экспрессирует вторую форму MUC16, представляет собой клетку SKOV3; (iii) клетка, которая рекомбинантно экспрессирует третью форму MUC16, представляет собой клетку SKOV3; и (iv) клетки на стадии (c) представляют собой клетки SKOV3.
[0026] Также изобретение относится к антителу или его антигенсвязывающему фрагменту, где антитело (a) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (b) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует третью форму MUC16, эта третья форма гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (c) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16. В некоторых вариантах осуществления (i) клетка, которая рекомбинантно экспрессирует первую форму MUC16, представляет собой клетку SKOV3; (ii) клетка, которая рекомбинантно экспрессирует третью форму MUC16, представляет собой клетку SKOV3; и (iii) клетки на стадии (c) представляют собой клетки SKOV3.
[0027] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент иммуноспецифически связывается с эпитопом, который содержит N-гликозилированный аспарагин 1806 из SEQ ID № 150.
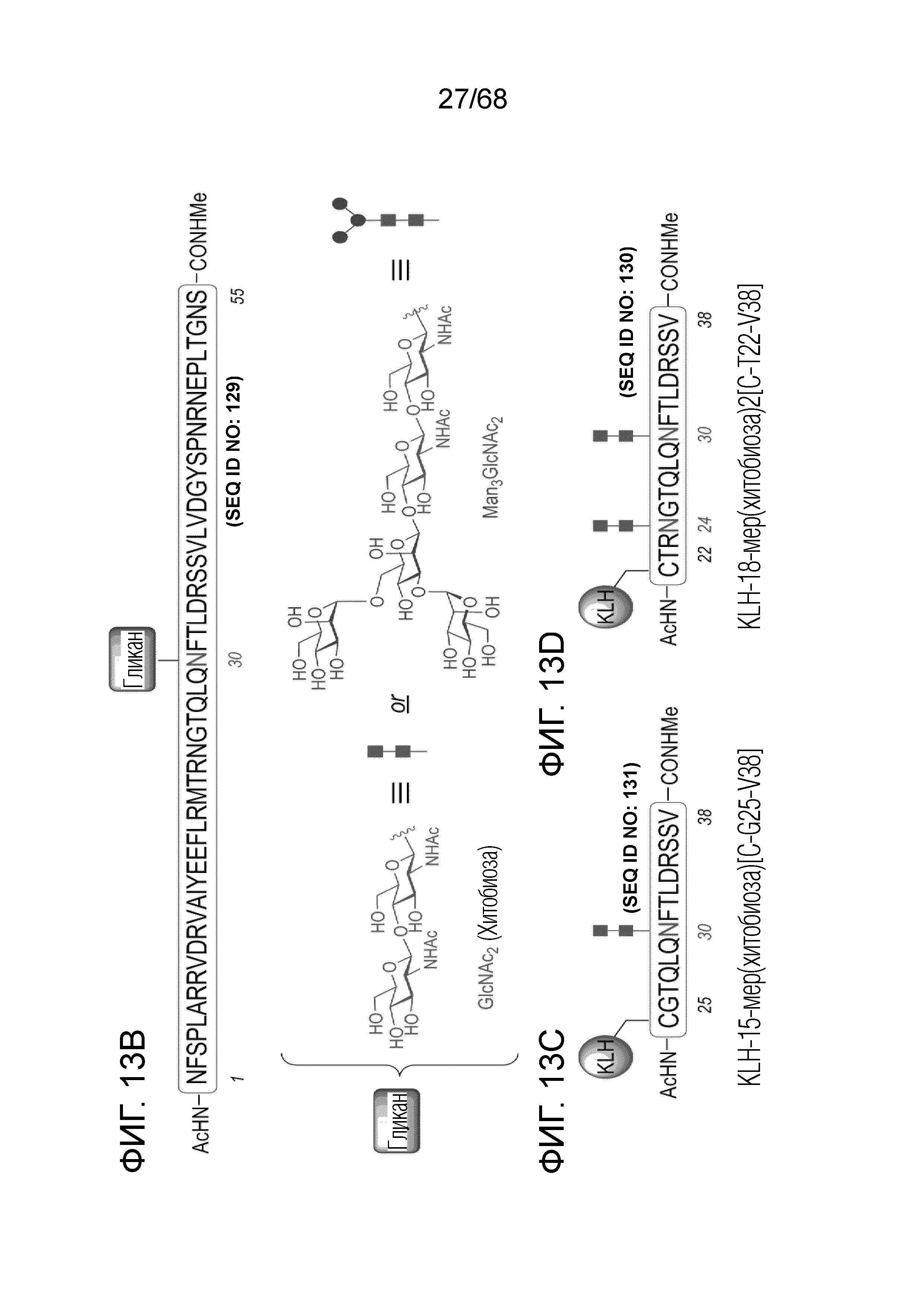
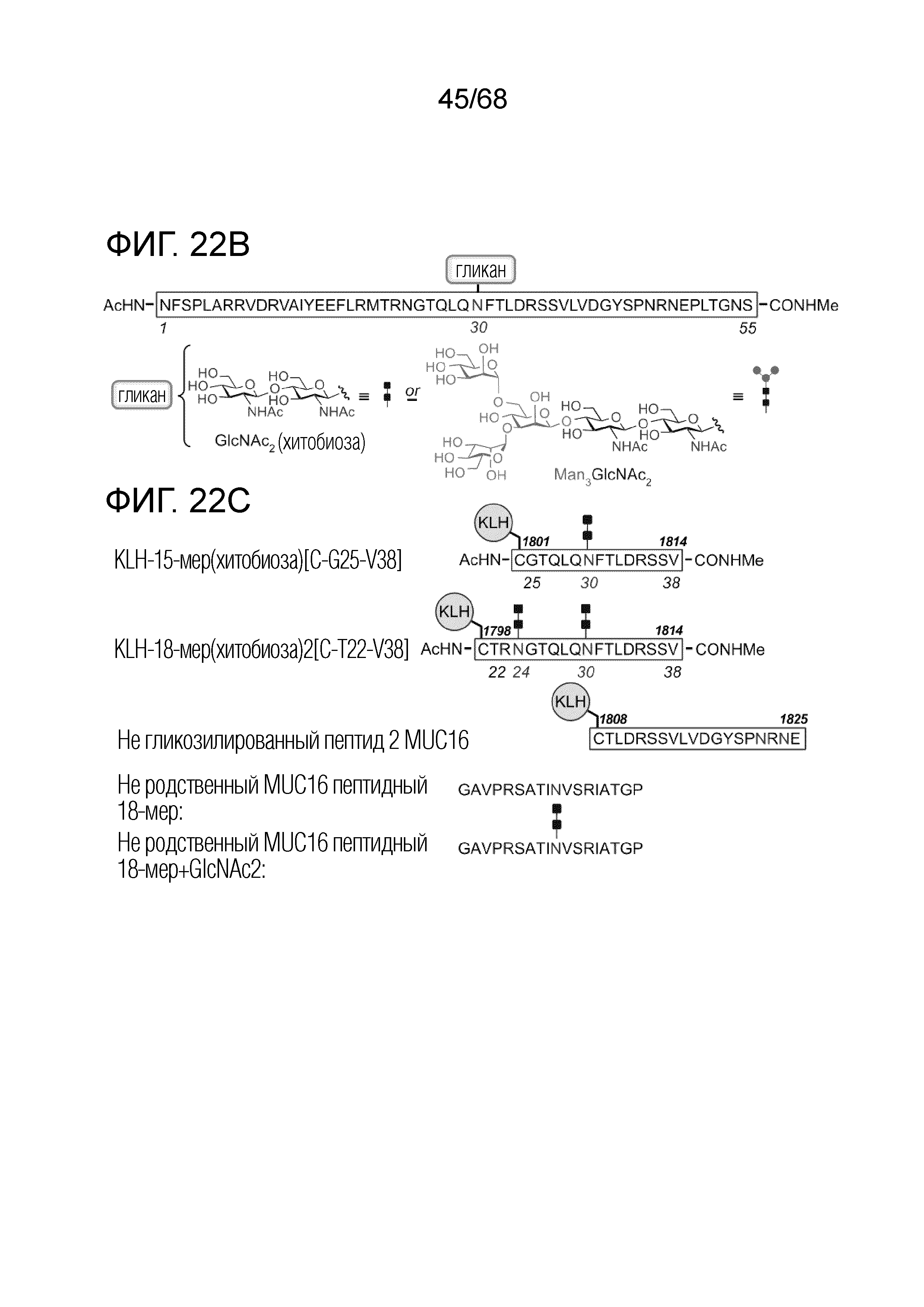
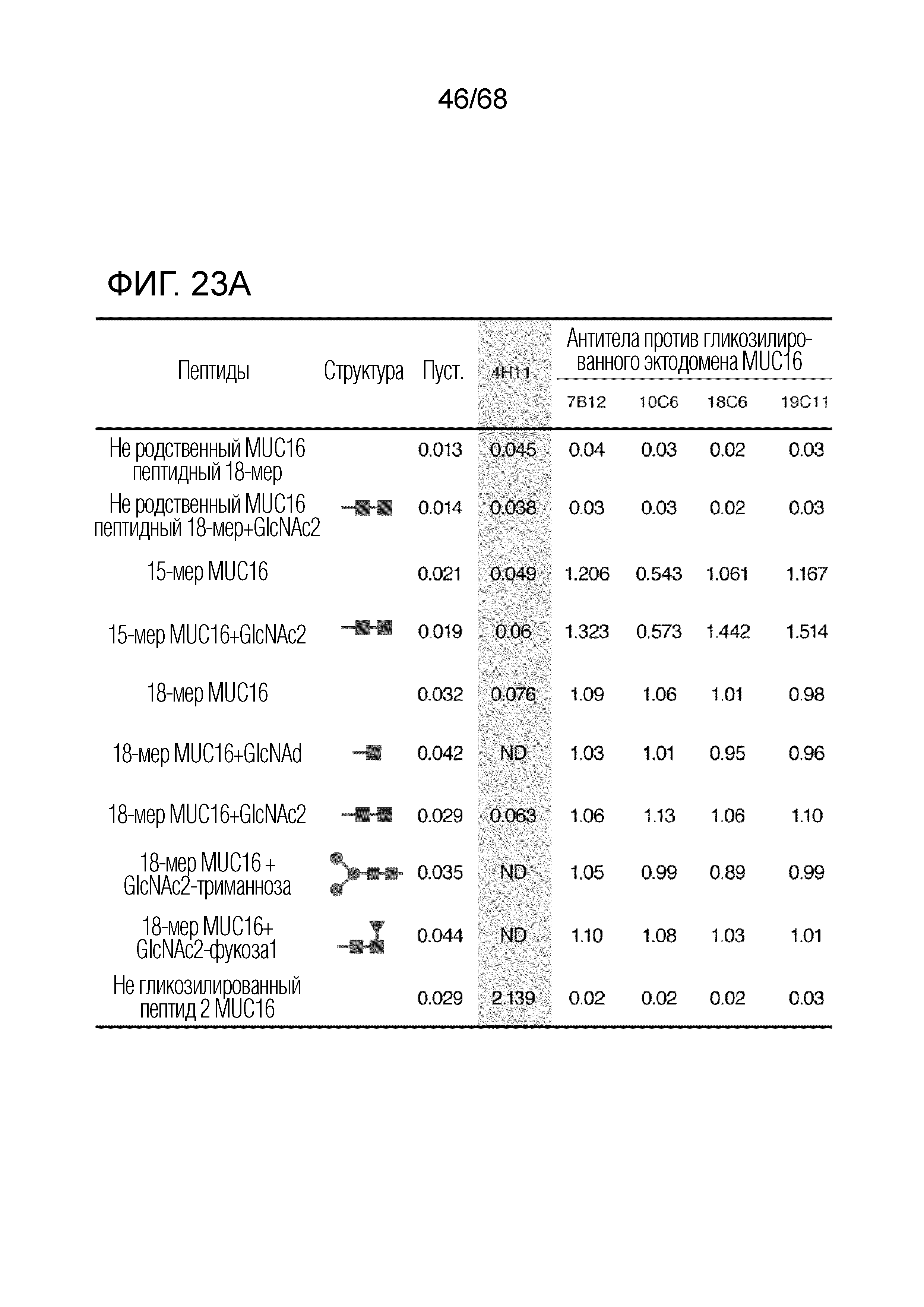
[0028] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент иммуноспецифически связывается с аминокислотной последовательностью CTRNGTQLQNFTLDRSSV (SEQ ID № 130), в которой аминокислотный остаток номер 4 (N4) и аминокислотный остаток номер 10 (N10) из CTRNGTQLQNFTLDRSSV (SEQ ID № 130) гликозилированы. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент иммуноспецифически связывается с аминокислотной последовательностью CGTQLQNFTLDRSSV (SEQ ID № 131), в которой аминокислотный остаток номер 7 (N7) из CGTQLQNFTLDRSSV (SEQ ID № 131) гликозилирован. В некоторых вариантах осуществления гликозилирование состоит из N-связанной хитобиозы.
[0029] В некоторых вариантах осуществления происходит интернализация антитела или его антигенсвязывающего фрагмента в клетку, которая экспрессирует первую форму MUC16, при контакте клетки с антителом или антигенсвязывающим фрагментом. В некоторых вариантах осуществления клетка представляет собой клетку SKOV3, которая рекомбинантно экспрессирует первую форму MUC16.
[0030] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибирует рост опухоли, которая экспрессирует гликозилированную форму MUC16.
[0031] В некоторых вариантах осуществления антитело представляет собой моноклональное антитело.
[0032] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи (VH), которая содержит (a) определяющую комплементарность область (CDR)1 VH, которая содержит аминокислотную последовательность TX1GMGVG (SEQ ID № 103), в которой X1 представляет собой L или V; (b) CDR2 VH, которая содержит аминокислотную последовательность HIWWDDX2DKYYX3PALKS (SEQ ID № 104), в которой X2 представляет собой E или отсутствует и X3 представляет собой Y или N; и (c) CDR3 VH, которая содержит аминокислотную последовательность IGTAQATDALDY (SEQ ID № 105).
[0033] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит (a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX8TX9GM (SEQ ID № 109), в которой X8 представляет собой N или S и в которой X9 представляет собой L или V; (b) CDR2 VH, которая содержит аминокислотную последовательность WDDX10 (SEQ ID № 110), в которой X10 представляет собой E или отсутствует; и (c) CDR3 VH, которая содержит аминокислотную последовательность GTAQATDALD (SEQ ID № 111).
[0034] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит (a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX15TX16GMG (SEQ ID № 115), в которой X15 представляет собой N или S и X16 представляет собой V или L; (b) CDR2 VH, которая содержит аминокислотную последовательность IWWDDX17DK (SEQ ID № 116), в которой X17 представляет собой E или отсутствует; и (c) CDR3 VH, которая содержит аминокислотную последовательность X18RIGTAQATDALDY (SEQ ID № 117), в которой X18 представляет собой T, A или S.
[0035] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 3, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 4, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 5.
[0036] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 9, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 10, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 11.
[0037] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 15, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 16, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 17.
[0038] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 23, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 24, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 25.
[0039] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 29, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 30, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 31.
[0040] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 35, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 36, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 37.
[0041] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 43, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 44, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 45.
[0042] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 49, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 50, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 51.
[0043] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 55, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 56, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 57.
[0044] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 63, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 64, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 65.
[0045] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 69, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 70, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 71.
[0046] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 75, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 76, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 77.
[0047] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 83, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 84, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 85.
[0048] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 89, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 90, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 91.
[0049] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 95, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 96, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 97.
[0050] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит аминокислотную последовательность QVX21LKESGPGX22LQPSQTLSLTCSFSGFSLX23TX24GMGVGWX25RQX26SGKGLEWLAH IWWDDX27DKYYX28PALKSRLTISX29X30X31SKNQVFLKIX32NVX33TADX34ATYYCX35RI GTAQATDALDYWGQGTSVTVSS (SEQ ID № 101), в которой X21 представляет собой T или N, X22 представляет собой I или K, X23 представляет собой N или S, X24 представляет собой V или L, X25 представляет собой S или I, X26 представляет собой P или S, X27 представляет собой E или отсутствует, X28 представляет собой N или Y, X29 представляет собой K или R, X30 представляет собой A или D, X31 представляет собой T или S, X32 представляет собой V или A, X33 представляет собой G или D, X34 представляет собой T, I или S и X35 представляет собой T, S или A.
[0051] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит аминокислотную последовательность из SEQ ID № 1.
[0052] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит аминокислотную последовательность из SEQ ID № 21.
[0053] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит аминокислотную последовательность из SEQ ID № 41.
[0054] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит аминокислотную последовательность из SEQ ID № 61.
[0055] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VH, которая содержит аминокислотную последовательность из SEQ ID № 81.
[0056] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит вариабельную область легкой цепи (VL), которая содержит (a) CDR1 VL, которая содержит аминокислотную последовательность RSSKSLX4X5SNGNTYLY (SEQ ID № 106), в которой X4 представляет собой R или L и X5 представляет собой K или H; (b) CDR2 VL, которая содержит аминокислотную последовательность YMSNLAS (SEQ ID № 107); и (c) CDR3 VL, которая содержит аминокислотную последовательность MQX6LEX7PLT (SEQ ID № 108), в которой X6 представляет собой G или S и X7 представляет собой H или Y.
[0057] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит
(a) CDR1 VL, которая содержит аминокислотную последовательность SKSLX11X12SNGNTY (SEQ ID № 112), в которой X11 представляет собой L или R и X12 представляет собой H или K; (b) CDR2 VL, которая содержит аминокислотную последовательность YMS (SEQ ID № 113); и (c) CDR3 VL, которая содержит аминокислотную последовательность X13LEX14PL (SEQ ID № 114), в которой X13 представляет собой G или S и X14 представляет собой H или Y.
[0058] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит (a) CDR1 VL, которая содержит аминокислотную последовательность KSLX19X20SNGNTY (SEQ ID № 118), в которой X19 представляет собой V или L и X20 представляет собой H или K; (b) CDR2 VL, которая содержит аминокислотную последовательность YMS (SEQ ID № 119); и (c) CDR3 VL, которая содержит аминокислотную последовательность MQSLEYPLT (SEQ ID № 120).
[0059] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит вариабельную область легкой цепи (VL), которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 26, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 27, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 28.
[0060] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 32, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 33, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 34.
[0061] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 38, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 39, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 40.
[0062] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 46, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 47, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 48.
[0063] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 52, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 53, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 54.
[0064] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 58, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 59, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 60.
[0065] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 86, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 87, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 88.
[0066] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 92, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 93, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 94.
[0067] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 98, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 99, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 100.
[0068] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 6, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 7, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 8.
[0069] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 12, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 13, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 14.
[0070] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 18, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 19, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 20.
[0071] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 66, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 67, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 68.
[0072] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 72, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 73, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 74.
[0073] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 78, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 79, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 80.
[0074] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит аминокислотную последовательность DIVMTQAAPSX36X37VTPGESVSISCRSSKSLX38X39SNGNTYLYWFLQRPGQSPQRLIYYMSNLASGVPDRFSGRGSGTDFTLX40ISRVEAX41DVGVYYCMQX42LEX43PLTFGGGTKLEIK (SEQ ID № 102), в которой X36 представляет собой I или V, X37 представляет собой P или S, X38 представляет собой R или L, X39 представляет собой K или H, X40 представляет собой R или K, X41 представляет собой E или G, X42 представляет собой S или G и X43 представляет собой Y или H.
[0075] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит аминокислотную последовательность из SEQ ID № 22.
[0076] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит аминокислотную последовательность из SEQ ID № 42.
[0077] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит аминокислотную последовательность из SEQ ID № 82.
[0078] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит аминокислотную последовательность из SEQ ID № 2.
[0079] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит VL, которая содержит аминокислотную последовательность из SEQ ID № 62.
[0080] В некоторых вариантах осуществления антитело содержит полученные у человека константные области тяжелой и легкой цепей. В некоторых вариантах осуществления константная область тяжелой цепи имеет изотип, выбранный из группы, состоящей из гамма1, гамма2, гамма3 и гамма4. В некоторых вариантах осуществления константная область легкой цепи имеет изотип, выбранный из группы, состоящей из каппа и лямбда.
[0081] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент гуманизированы. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляет собой гуманизированную форму антитела грызуна.
[0082] В некоторых вариантах осуществления антитело представляет собой иммуноглобулин, который содержит две идентичные тяжелые цепи и две идентичные легкие цепи. В некоторых вариантах осуществления иммуноглобулин представляет собой IgG.
[0083] Также в настоящем описании предоставлен конъюгат антитела, который содержит антитело или его антигенсвязывающий фрагмент, предоставленный в настоящем описании, конъюгированный со средством. В некоторых вариантах осуществления средство представляет собой визуализирующее средство или цитотоксическое средство.
[0084] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляет собой биспецифическое антитело. В некоторых вариантах осуществления биспецифическое антитело иммуноспецифически связывает CD3. В некоторых вариантах осуществления биспецифическое антитело содержит иммуноглобулин, который иммуноспецифически связывает MUC16, где легкую цепь иммуноглобулина конъюгируют через пептидный линкер с одноцепочечным вариабельным фрагментом (scFv), который иммуноспецифически связывает CD3. Также в настоящем описании предоставлен конъюгат биспецифического антитела, содержащий биспецифическое антитело, предоставленное в настоящем описании, конъюгированное со средством. В некоторых вариантах осуществления средство представляет собой визуализирующее средство или цитотоксическое средство.
[0085] В некоторых вариантах осуществления его антигенсвязывающий фрагмент представляет собой одноцепочечный вариабельный фрагмент (scFv). Также в настоящем описании предоставлен конъюгат scFv, который содержит scFv, предоставленный в настоящем описании, конъюгированный со средством. В некоторых вариантах осуществления средство представляет собой визуализирующее средство или цитотоксическое средство.
[0086] Также изобретение относится к слитым белкам, химерным молекулам и конъюгатам, которые содержат антитела и антигенсвязывающие фрагменты. Изобретение относится к химерным антигенным рецепторам (CAR), которые содержат одно или несколько из каких-либо из антител или их антигенсвязывающих фрагментов по изобретению, например, CAR, который содержит какой-либо из scFv, представленных в настоящем описании, или конъюгата scFv, представленного в настоящем описании; и/или CAR, которые содержат антигенсвязывающие домены, которые конкурируют с ними за связывание с MUC16.
[0087] Также изобретение относится к тяжелой цепи антитела или ее антигенсвязывающей части. Среди антител и их антигенсвязывающих фрагментов по изобретению присутствуют те, которые имеют тяжелые цепи и/или их антигенсвязывающие части, такие как их области VH; также изобретение относится к таким тяжелым цепям и их антигенсвязывающим частям. В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит (a) CDR1 VH, которая содержит аминокислотную последовательность TX1GMGVG (SEQ ID № 103), в которой X1 представляет собой L или V; (b) CDR2 VH, которая содержит аминокислотную последовательность HIWWDDX2DKYYX3PALKS (SEQ ID № 104), в которой X2 представляет собой E или отсутствует и X3 представляет собой Y или N; и (c) CDR3 VH, которая содержит аминокислотную последовательность IGTAQATDALDY (SEQ ID № 105); где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[0088] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит (a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX8TX9GM (SEQ ID № 109), в которой X8 представляет собой N или S и X9 представляет собой L или V; (b) CDR2 VH, которая содержит аминокислотную последовательность WDDX10 (SEQ ID № 110), в которой X10 представляет собой E или отсутствует; и (c) CDR3 VH, которая содержит аминокислотную последовательность GTAQATDALD (SEQ ID № 111); где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[0089] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит (a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX15TX16GMG (SEQ ID № 115), в которой X15 представляет собой N или S и X16 представляет собой V или L; (b) CDR2 VH, которая содержит аминокислотную последовательность IWWDDX17DK (SEQ ID № 116), в которой X17 представляет собой E или отсутствует; и (c) CDR3 VH, которая содержит аминокислотную последовательность X18RIGTAQATDALDY (SEQ ID № 117), в которой X18 представляет собой T, A или S; где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[0090] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 3, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 4, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 5, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[0091] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 9, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 10, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 11, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[0092] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающие части содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 15, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 16, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 17, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[0093] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 23, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 24, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 25, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[0094] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 29, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 30, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 31, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[0095] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 35, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 36, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 37, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[0096] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 43, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 44, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 45, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[0097] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 49, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 50, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 51, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[0098] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 55, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 56, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 57, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[0099] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 63, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 64, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 65, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00100] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 69, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 70, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 71, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00101] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 75, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 76, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 77, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00102] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 83, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 84, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 85, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00103] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 89, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 90, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 91, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00104] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 95, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 96, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 97, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00105] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит аминокислотную последовательность QVX21LKESGPGX22LQPSQTLSLTCSFSGFSLX23TX24GMGVGWX25RQX26SGKGLEWLAH IWWDDX27DKYYX28PALKSRLTISX29X30X31SKNQVFLKIX32NVX33TADX34ATYYCX35RI GTAQATDALDYWGQGTSVTVSS (SEQ ID № 101), в которой X21 представляет собой T или N, X22 представляет собой I или K, X23 представляет собой N или S, X24 представляет собой V или L, X25 представляет собой S или I, X26 представляет собой P или S, X27 представляет собой E или отсутствует, X28 представляет собой N или Y, X29 представляет собой K или R, X30 представляет собой A или D, X31 представляет собой T или S, X32 представляет собой V или A, X33 представляет собой G или D, X34 представляет собой T, I или S и X35 представляет собой T, S или A, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00106] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит аминокислотную последовательность из SEQ ID № 1, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00107] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит аминокислотную последовательность из SEQ ID № 21, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00108] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит аминокислотную последовательность из SEQ ID № 41, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00109] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит аминокислотную последовательность из SEQ ID № 61, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00110] В некоторых вариантах осуществления тяжелая цепь или ее антигенсвязывающая часть содержит VH, которая содержит аминокислотную последовательность из SEQ ID № 81, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащие тяжелую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00111] В некоторых вариантах осуществления тяжелая цепь антитела или ее антигенсвязывающая часть содержит полученную у человека константную область тяжелой цепи. В некоторых вариантах осуществления константная область тяжелой цепи имеет изотип, выбранный из группы, состоящей из гамма1, гамма2, гамма3 и гамма4. В некоторых вариантах осуществления тяжелая цепь антитела гуманизирована. В некоторых вариантах осуществления тяжелая цепь антитела представляет собой гуманизированную форму тяжелой цепи грызуна.
[00112] Также в настоящем описании предоставлен конъюгат тяжелой цепи антитела, который содержит тяжелую цепь антитела, предоставленную в настоящем описании, где указанную тяжелую цепь антитела конъюгируют со средством. В некоторых вариантах осуществления средство представляет собой визуализирующее средство или цитотоксическое средство.
[00113] Среди антител и их антигенсвязывающих фрагментов по изобретению присутствуют те, которые имеют легкие цепи и/или их части, такие как их области VL; также предоставлены такие легкие цепи и их антигенсвязывающие части. В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит (a) CDR1 VL, которая содержит аминокислотную последовательность RSSKSLX4X5SNGNTYLY (SEQ ID № 106), в которой X4 представляет собой R или L и X5 представляет собой K или H; (b) CDR2 VL, которая содержит аминокислотную последовательность YMSNLAS (SEQ ID № 107); и (c) CDR3 VL, которая содержит аминокислотную последовательность MQX6LEX7PLT (SEQ ID № 108), в которой X6 представляет собой G или S и X7 представляет собой H или Y, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00114] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит (a) CDR1 VL, которая содержит аминокислотную последовательность SKSLX11X12SNGNTY (SEQ ID № 112), в которой X11 представляет собой L или R и X12 представляет собой H или K; (b) CDR2 VL, которая содержит аминокислотную последовательность YMS (SEQ ID № 113); и (c) CDR3 VL, которая содержит аминокислотную последовательность X13LEX14PL (SEQ ID № 114), в которой X13 представляет собой G или S и X14 представляет собой H или Y, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00115] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит (a) CDR1 VL, которая содержит аминокислотную последовательность KSLX19X20SNGNTY (SEQ ID № 118), в которой X19 представляет собой V или L и X20 представляет собой H или K; (b) CDR2 VL, которая содержит аминокислотную последовательность YMS (SEQ ID № 119); и (c) CDR3 VL, которая содержит аминокислотную последовательность MQSLEYPLT (SEQ ID № 120), где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00116] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 6, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 7, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 8, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00117] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 12, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 13, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 14, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00118] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 18, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 19, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 20, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00119] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 26, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 27, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 28, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00120] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 32, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 33, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 34, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00121] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 38, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 39, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 40, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00122] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 46, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 47, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 48, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00123] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 52, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 53, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 54, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00124] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 58, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 59, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 60, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00125] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 66, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 67, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 68, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00126] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 72, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 73, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 74, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00127] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 78, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 79, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 80, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00128] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 86, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 87, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 88, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00129] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 92, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 93, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 94, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00130] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 98, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 99, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 100, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00131] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит аминокислотную последовательность DIVMTQAAPSX36X37VTPGESVSISCRSSKSLX38X39SNGNTYLYWFLQRPGQSPQRLIYYMSNLASGVPDRFSGRGSGTDFTLX40ISRVEAX41DVGVYYCMQX42LEX43PLTFGGGTKLEIK (SEQ ID № 102), в которой X36 представляет собой I или V, X37 представляет собой P или S, X38 представляет собой R или L, X39 представляет собой K или H, X40 представляет собой R или K, X41 представляет собой E или G, X42 представляет собой S или G и X43 представляет собой Y или H, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00132] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит аминокислотную последовательность из SEQ ID № 2, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00133] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит аминокислотную последовательность из SEQ ID № 22, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00134] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит аминокислотную последовательность из SEQ ID № 42, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00135] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит аминокислотную последовательность из SEQ ID № 62, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00136] В некоторых вариантах осуществления легкая цепь или ее антигенсвязывающая часть содержит VL, которая содержит аминокислотную последовательность из SEQ ID № 82, где, необязательно, антитело или его антигенсвязывающий фрагмент, содержащий легкую цепь антитела или ее антигенсвязывающую часть, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16.
[00137] В некоторых вариантах осуществления легкая цепь антитела или ее антигенсвязывающая часть содержит полученную у человека константную область легкой цепи. В некоторых вариантах осуществления константная область легкой цепи имеет изотип, выбранный из группы, состоящей из каппа и лямбда. В некоторых вариантах осуществления легкая цепь антитела гуманизирована. В некоторых вариантах осуществления легкая цепь антитела представляет собой гуманизированную форму антитела грызуна.
[00138] Также изобретение относится к конъюгату легкой цепи антитела, который содержит легкую цепь антитела, представленную в настоящем описании, конъюгированную со средством. В некоторых вариантах осуществления средство представляет собой визуализирующее средство или цитотоксическое средство.
[00139] Также изобретение относится к слитому белку, содержащему легкую цепь антитела, представленного в настоящем описании, конъюгированную через пептидный линкер с scFv. В некоторых вариантах осуществления scFv связывает CD3.
[00140] Также изобретение относится к клетке, такой как клетка иммунной системы, такая как T-клетка, которая рекомбинантно экспрессирует одну или несколько молекул, предоставленных в настоящем описании, таких как CAR, представленный в настоящем описании.
[00141] Также изобретение относится к полинуклеотиду, содержащему последовательности нуклеиновой кислоты, кодирующие scFv, представленный в настоящем описании. Также изобретение относится к полинуклеотиду, который содержит последовательности нуклеиновой кислоты, которые кодируют scFv, или его конъюгат, представленный в настоящем описании. Также изобретение относится к полинуклеотиду, который содержит последовательности нуклеиновой кислоты, которые кодируют CAR, представленный в настоящем описании. Также изобретение относится к полинуклеотиду, который содержит последовательности нуклеиновой кислоты, которые кодируют тяжелую цепь антитела, или ее антигенсвязывающую часть, представленную в настоящем описании. Также изобретение относится к полинуклеотиду, который содержит последовательности нуклеиновой кислоты, которые кодируют конъюгат тяжелой цепи антитела, представленный в настоящем описании. Также изобретение относится к полинуклеотиду, который содержит последовательности нуклеиновой кислоты, которые кодируют легкую цепь антитела, или ее антигенсвязывающую часть, представленную в настоящем описании. Также изобретение относится к полинуклеотиду, который содержит последовательности нуклеиновой кислоты, которые кодируют конъюгат легкой цепи антитела, представленный в настоящем описании. Также изобретение относится к полинуклеотиду, который содержит последовательности нуклеиновой кислоты, которые кодируют слитый белок, представленный в настоящем описании. Полинуклеотид, который содержит последовательности нуклеиновой кислоты, которые кодируют (a) тяжелую цепь антитела, или ее антигенсвязывающую часть, представленную в настоящем описании, или конъюгат тяжелой цепи антитела, представленный в настоящем описании; и (b) легкую цепь антитела, или ее антигенсвязывающую часть, представленную в настоящем описании, конъюгат легкой цепи антитела, представленный в настоящем описании, или слитый белок, представленный в настоящем описании.
[00142] Также изобретение относится к вектору, который содержит полинуклеотид, представленный в настоящем описании, функционально связанный с промотором. Также изобретение относится к вектору, который содержит (a) первый полинуклеотид, представленный в настоящем описании, функционально связанный с первым промотором; и (b) второй полинуклеотид, представленный в настоящем описании, функционально связанный со вторым промотором.
[00143] Также изобретение относится к клетке ex vivo, которая содержит полинуклеотид, представленный в настоящем описании, функционально связанный с промотором. Также изобретение относится к клетке ex vivo, которая содержит полинуклеотид, представленный в настоящем описании, функционально связанный с промотором. Также изобретение относится к клетке ex vivo, которая содержит вектор, представленный в настоящем описании. Также изобретение относится к клетке ex vivo, которая содержит один или несколько полинуклеотидов, которые кодируют антитело или его антигенсвязывающий фрагмент предоставленного в настоящем описании, функционально связанных с промотором.
[00144] Также изобретение относится к способу получения тяжелой цепи антитела, или ее антигенсвязывающей части, который включает культивирование клетки, представленной в настоящем описании, в таких условиях, что полинуклеотид экспрессируют с помощью клетки для того, чтобы получать тяжелую цепь антитела, или ее антигенсвязывающую часть, или конъюгат тяжелой цепи антитела, кодируемый полинуклеотидом.
[00145] Также изобретение относится к способу получения легкой цепи антитела, или ее антигенсвязывающей части, который включает культивирование клетки, представленной в настоящем описании, в таких условиях, что полинуклеотид экспрессируют с помощью клетки для того, чтобы получать легкую цепь антитела, или ее антигенсвязывающую часть, конъюгат легкой цепи антитела или слитый белок, кодируемый полинуклеотидом.
[00146] Также изобретение относится к способу получения антитела или его антигенсвязывающего фрагмента, который включает культивирование клетки ex vivo, представленной в настоящем описании, в таких условиях, что полинуклеотид, функционально связанный с первым промотором, и полинуклеотид, функционально связанный со вторым промотором, экспрессируют с помощью клетки для того, чтобы получать (i) тяжелую цепь антитела или конъюгат тяжелой цепи антитела, кодируемые полинуклеотидом; и (ii) легкую цепь антитела, конъюгат легкой цепи антитела или слитый белок, кодируемые полинуклеотидом.
[00147] Также изобретение относится к фармацевтической композиции, которая содержит: терапевтически эффективное количество антитела или его антигенсвязывающего фрагмента, представленного в настоящем описании, конъюгата антитела, представленного в настоящем описании, биспецифического антитела, представленного в настоящем описании, конъюгата биспецифического антитела, представленного в настоящем описании, scFv, конъюгата scFv, представленного в настоящем описании, CAR, представленного в настоящем описании, тяжелой цепи антитела, или ее антигенсвязывающей части, представленной в настоящем описании, конъюгата тяжелой цепи антитела, представленного в настоящем описании, легкой цепи антитела, или ее антигенсвязывающей части, представленной в настоящем описании, конъюгата легкой цепи антитела, представленного в настоящем описании, слитого белка, представленного в настоящем описании, или T-клетки, представленной в настоящем описании; и фармацевтически приемлемый носитель.
[00148] Также изобретение относится к способу лечения раке у пациента, который включает введение указанному пациенту фармацевтической композиции, представленной в настоящем описании. В некоторых вариантах осуществления рак представляет собой рак легкого, поджелудочной железы, молочной железы, матки, фаллопиевой трубы или первичной брюшины. В некоторых вариантах осуществления рак представляет собой рак яичника. В некоторых вариантах осуществления пациентом является пациент-человек. В конкретных вариантах осуществления, способ представляет собой способ комбинированного лечения, который дополнительно включает введение терапевтически эффективного количества дополнительного терапевтического средства пациенту.
[00149] В конкретном варианте осуществления способа комбинированного лечения фармацевтическая композиция содержит терапевтически эффективное количество первого антитела, которое представляет собой антитело или его антигенсвязывающий фрагмент, описанные в настоящем описании, где антитело или его антигенсвязывающий фрагмент распознает эпитоп в MUC16, который содержит N-гликозилированный Asn1806 из SEQ ID № 150, но не содержит N-гликозилированный Asn1800 из SEQ ID № 150, где дополнительное терапевтическое средство представляет собой второе антитело или его антигенсвязывающий фрагмент, где второе антитело или его антигенсвязывающий фрагмент распознает эпитоп в MUC16, который содержит N-гликозилированный Asn1806 из SEQ ID № 150 и также содержит N-гликозилированный Asn1800 из SEQ ID № 150. В конкретном варианте осуществления первое антитело или его антигенсвязывающий фрагмент идентифицируют по (i) его способности иммуноспецифически связывать клетку, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма MUC16 гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) отсутствию у него иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует третью форму MUC16, эта третья форма гликозилирована, где аминокислотная последовательность третьей формы представляет собой SEQ ID № 139; и (iii) его способности иммуноспецифически связывать клетку, которая рекомбинантно экспрессирует четвертую форму MUC16, эта четвертая форма гликозилирована, и где аминокислотная последовательность четвертой формы представляет собой SEQ ID № 152, и где клетка, которая рекомбинантно экспрессирует первую форму MUC16, клетка, которая рекомбинантно экспрессирует третью форму MUC16, и клетка, которая рекомбинантно экспрессирует четвертую форму MUC16, относятся к одному типу клеток, и где второе антитело или его антигенсвязывающий фрагмент идентифицируют по (i) его способности иммуноспецифически связываться с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; и (ii) отсутствию у него иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует пятую форму MUC16, эта пятая форма гликозилирована, и где аминокислотная последовательность пятой формы представляет собой SEQ ID № 172, где клетка, которая рекомбинантно экспрессирует первую форму MUC16, относится к тому же типу клеток, что клетка, которая рекомбинантно экспрессирует пятую форму MUC16.
[00150] В частном варианте осуществления способа комбинированного лечения, фармацевтическая композиция содержит терапевтически эффективное количество первого антитела или его антигенсвязывающего фрагмента, то есть антитела или его антигенсвязывающего фрагмента, описанного в настоящем описании, где антитело или его антигенсвязывающий фрагмент распознает эпитоп в MUC16, который содержит N-гликозилированный Asn1806 из SEQ ID № 150, но не содержит N-гликозилированный Asn1800 из SEQ ID № 150, где дополнительное терапевтическое средство представляет собой терапевтически эффективное количество второго антитела или его антигенсвязывающего фрагмента, где второе антитело или его антигенсвязывающий фрагмент распознает эпитоп в MUC16, который содержит N-гликозилированный Asn1800 из SEQ ID № 150, но не содержит N-гликозилированный Asn1806 из SEQ ID № 150. В конкретном варианте осуществления первое антитело или его антигенсвязывающий фрагмент идентифицируют по (i) его способности иммуноспецифически связывать клетку, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма MUC16 гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) отсутствию у него иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует третью форму MUC16, эта третья форма гликозилирована, и где аминокислотная последовательность третьей формы представляет собой SEQ ID № 139; и (iii) его способности иммуноспецифически связывать клетку, которая рекомбинантно экспрессирует четвертую форму MUC16, эта четвертая форма гликозилирована, и где аминокислотная последовательность четвертой формы представляет собой SEQ ID № 152, где клетка, которая рекомбинантно экспрессирует первую форму MUC16, клетка, которая рекомбинантно экспрессирует третью форму MUC16, и клетка, которая рекомбинантно экспрессирует четвертую форму MUC16, относятся к одному типу клеток, и где второе антитело или его антигенсвязывающий фрагмент идентифицируют по (i) его способности иммуноспецифически связываться с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) его способности иммуноспецифически связываться с клеткой, которая рекомбинантно экспрессирует третью форму MUC16, эта третья форма MUC16 гликозилирована, и где аминокислотная последовательность третьей формы представляет собой SEQ ID № 139; и (iii) отсутствию у него иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует четвертую форму MUC16, где аминокислотная последовательность четвертой формы представляет собой SEQ ID № 152; и, где клетка, которая рекомбинантно экспрессирует первую форму MUC16, клетка, которая рекомбинантно экспрессирует третью форму MUC16, и клетка, которая рекомбинантно экспрессирует четвертую форму MUC16, относятся к одному типу клеток.
[00151] Также изобретение относится к иммуногенному гликопептиду, который содержит один или несколько участков гликозилирования, где (i) иммуногенный гликопептид составляет от 10 до 60 аминокислотных остатков, от 10 до 30 аминокислотных остатков, от 15 до 25 аминокислотных остатков, от 15 до 20 аминокислотных остатков или от 15 до 18 аминокислотных остатков в длину, и (ii) по меньшей мере один из одного или нескольких участков гликозилирования связан с углеводом. В некоторых вариантах осуществления иммуногенный гликопептид содержит один, два или три участка гликозилирования. В некоторых вариантах осуществления иммуногенный гликопептид содержит участок гликозилирования, который связан с углеводом. В некоторых вариантах осуществления иммуногенный гликопептид содержит два участка гликозилирования, каждый из которых связан с углеводом. В некоторых вариантах осуществления углевод представляет собой N- или O-связанный углевод. В некоторых вариантах осуществления углевод представляет собой моносахарид, дисахарид, трисахарид, тетрасахарид или пентасахарид. В некоторых вариантах осуществления углевод представляет собой дисахарид. В некоторых вариантах осуществления дисахарид представляет собой хитобиозу.
[00152] В некоторых вариантах осуществления N-конец иммуногенного гликопептида ацетилирован. В некоторых вариантах осуществления C-конец гликопептида присутствует в форме производного N-метилкарбоксамида. В некоторых вариантах осуществления иммуногенный гликопептид конъюгируют с иммуногенным белком-переносчиком. В некоторых вариантах осуществления иммуногенным белком-переносчиком является гемоцианин морского блюдца.
[00153] В некоторых вариантах осуществления иммуногенный гликопептид составляет от 15 до 18 аминокислотных остатков в длину. В некоторых вариантах осуществления иммуногенный гликопептид содержит участок гликозилирования, который связан с хитобиозой. В некоторых вариантах осуществления иммуногенный гликопептид содержит два участка гликозилирования, каждый из которых связан с хитобиозой.
[00154] В некоторых вариантах осуществления иммуногенный гликопептид составляет 18 аминокислотных остатков в длину. В некоторых вариантах осуществления иммуногенные гликопептиды содержат два участка гликозилирования, каждый из которых связан с хитобиозой.
[00155] В некоторых вариантах осуществления иммуногенные гликопептиды составляют 15 аминокислотных остатков в длину. В некоторых вариантах осуществления иммуногенный гликопептид содержит участок гликозилирования, который связан с хитобиозой.
[00156] В некоторых вариантах осуществления иммуногенный гликопептид содержит по меньшей мере часть из 10 аминокислот из аминокислотной последовательности из SEQ ID № 150, где по меньшей мере один из одного или нескольких участков гликозилирования находится в указанной части аминокислотной последовательности.
[00157] В некоторых вариантах осуществления иммуногенный гликопептид содержит аминокислотную последовательность из SEQ ID № 129.
[00158] В некоторых вариантах осуществления иммуногенный гликопептид содержит участок гликозилирования в 30-м остатке (Asn) из SEQ ID № 129, который связан с хитобиозой.
[00159] В некоторых вариантах осуществления иммуногенный гликопептид содержит участок гликозилирования в 30-м остатке (Asn) из SEQ ID № 129, который связан с фрагментом Man3GlcNAc2.
[00160] В некоторых вариантах осуществления иммуногенный гликопептид содержит аминокислотную последовательность из SEQ ID № 130. В некоторых вариантах осуществления иммуногенные гликопептиды содержат два участка гликозилирования в 4-м остатке (Asn) и 10-м остатке (Asn) из SEQ ID № 130, каждый из которых связан с хитобиозой.
[00161] В некоторых вариантах осуществления иммуногенный гликопептид содержит аминокислотную последовательность из SEQ ID № 131. В некоторых вариантах осуществления иммуногенные гликопептиды содержат участок гликозилирования в 7-м остатке (Asn) из SEQ ID № 131, который связан с хитобиозой.
[00162] Также изобретение относится к способу получения антитела или его антигенсвязывающего фрагмента, которые специфически связывают гликоль-белок, который включает иммунизацию субъекта иммуногенным гликопептидом, который содержит один или несколько участков гликозилирования, где (i) иммуногенный гликопептид составляет от 10 до 60 аминокислотных остатков, от 10 до 30 аминокислотных остатков, от 15 до 25 аминокислотных остатков, от 15 до 20 аминокислотных остатков или от 15 до 18 аминокислотных остатков в длину, (ii) иммуногенный гликопептид содержит по меньшей мере часть из 10 аминокислот аминокислотной последовательности гликопротеина, (iii) по меньшей мере один из одного или нескольких участков гликозилирования связан с углеводом и (iv) по меньшей мере один из одного или нескольких участков гликозилирования находится в указанной части аминокислотной последовательности. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент не имеет специфического связывания с не гликозилированной формой гликопротеина. В некоторых вариантах осуществления субъектом является коза, овца, осел, курица, морская свинка, крыса, кролик или мышь. В некоторых вариантах осуществления субъектом является крыса, кролик или мышь. В некоторых вариантах осуществления субъектом является мышь. В некоторых вариантах осуществления иммуногенный гликопептид содержит один, два или три участка гликозилирования. Способ по любому из пп. 190-195, в котором иммуногенный гликопептид содержит участок гликозилирования, который связан с углеводом. В некоторых вариантах осуществления иммуногенный гликопептид содержит два участка гликозилирования, каждый из которых связан с углеводом. В некоторых вариантах осуществления углевод представляет собой N- или O-связанный углевод. В некоторых вариантах осуществления углевод представляет собой моносахарид, дисахарид, трисахарид, тетрасахарид или пентасахарид. В некоторых вариантах осуществления углевод представляет собой дисахарид. В некоторых вариантах осуществления дисахарид представляет собой хитобиозу. В некоторых вариантах осуществления N-конец иммуногенного гликопептида ацетилирован. В некоторых вариантах осуществления C-конец гликопептида находится в форме производного N-метилкарбоксамида. В некоторых вариантах осуществления иммуногенный гликопептид конъюгируют с иммуногенным белком-переносчиком. В некоторых вариантах осуществления иммуногенным белком-переносчиком является гемоцианин морского блюдца. В некоторых вариантах осуществления иммуногенный гликопептид составляет от 15 до 18 аминокислотных остатков в длину. В некоторых вариантах осуществления иммуногенный гликопептид содержит участок гликозилирования, который связан с хитобиозой. В некоторых вариантах осуществления иммуногенный гликопептид содержит два участка гликозилирования, каждый из которых связан с хитобиозой. В некоторых вариантах осуществления иммуногенный гликопептид составляет 18 аминокислотных остатков в длину. В некоторых вариантах осуществления иммуногенный гликопептид содержит два участка гликозилирования, каждый из которых связан с хитобиозой. В некоторых вариантах осуществления иммуногенный гликопептид составляет 15 аминокислотных остатков в длину. В некоторых вариантах осуществления иммуногенный гликопептид содержит участок гликозилирования, который связан с хитобиозой. В некоторых вариантах осуществления гликопротеин содержит аминокислотную последовательность из SEQ ID № 150. В некоторых вариантах осуществления иммуногенный гликопептид содержит аминокислотную последовательность из SEQ ID № 129. В некоторых вариантах осуществления иммуногенный гликопептид содержит участок гликозилирования в 30-м остатке (Asn) из SEQ ID № 129, который связан с хитобиозой. В некоторых вариантах осуществления иммуногенный гликопептид содержит участок гликозилирования в 30-м остатке (Asn) из SEQ ID № 129, который связан с фрагментом Man3GlcNAc2. В некоторых вариантах осуществления иммуногенный гликопептид содержит аминокислотную последовательность из SEQ ID № 130. В некоторых вариантах осуществления иммуногенный гликопептид содержит два участка гликозилирования в 4-м остатке (Asn) и 10-м остатке (Asn) из SEQ ID № 130, каждый из которых связан с хитобиозой. В некоторых вариантах осуществления иммуногенный гликопептид содержит аминокислотную последовательность из SEQ ID № 131. В некоторых вариантах осуществления иммуногенный гликопептид содержит участок гликозилирования в 7-м остатке (Asn) из SEQ ID № 131, который связан с хитобиозой.
[00163] Также изобретение относится к антителам и их антигенсвязывающим фрагментам, которые иммуноспецифически связываются с MUC16 и которые имеют последовательности VH, VL, CDR VH и/или CDR VL антитела, описанного в настоящем описании (например, 10C6, 7B12, 19C11, 16C5 или 18C6), а также их конъюгаты (например, с визуализирующими или цитотоксическими средствами).
4. КРАТКОЕ ОПИСАНИЕ ФИГУР
[00164] Фиг. 1A-1I. Конструкции MUC16. Фиг. 1A: схематическая иллюстрация MUC16. Фиг. 1B: Вверху: схематическая иллюстрация MUC16c344. Внизу: линейное представление усеченной конструкции MUC16c344. Аминокислотная последовательность N-конца первого тандемного повтора представляет собой то, что приведено в SEQ ID № 155. Аминокислотная последовательность C-конца первого тандемного повтора представляет собой то, что приведено в SEQ ID № 156. Аминокислотная последовательность N-конца эктодомена представляет собой то, что приведено в SEQ ID № 157. Аминокислотная последовательность C-конца эктодомена представляет собой то, что приведено в SEQ ID № 158. Фиг. 1C: Вверху: схематическая иллюстрация MUC16c114. Внизу: линейное представление MUC16c114. Аминокислотная последовательность эктодомена представляет собой то, что приведено в SEQ ID № 161. Аминокислотная последовательность трансмембранного домена представляет собой то, что приведено в SEQ ID № 159. Аминокислотная последовательность для цитоплазматического хвоста представляет собой то, что приведено в SEQ ID № 160. Фиг. 1D: Вверху: схематическая иллюстрация MUC16c80. Внизу: линейное представление MUC16c80. Аминокислотная последовательность эктодомена представляет собой то, что приведено в SEQ ID № 162. Аминокислотная последовательность трансмембранного домена представляет собой то, что приведено в SEQ ID № 159. Аминокислотная последовательность цитоплазматического хвоста представляет собой то, что приведено в SEQ ID № 159. Фиг. 1E: Вверху: схематическая иллюстрация MUC16c86. Внизу: линейное представление MUC16c86. Аминокислотная последовательность эктодомена представляет собой то, что приведено в SEQ ID № 163. Аминокислотная последовательность трансмембранного домена представляет собой то, что приведено в SEQ №: 164. Аминокислотная последовательность цитоплазматического домена представляет собой SEQ ID № 165. Фиг. 1F: линейное представление MUC16c114-N123. Аминокислотная последовательность 3(N→A)мутированного эктодомена 58 а. о. представляет собой то, что приведено в SEQ ID № 166. Аминокислотная последовательность трансмембранного домена представляет собой то, что приведено в SEQ ID № 159. Аминокислотная последовательность цитоплазматического домена представляет собой то, что приведено в SEQ ID № 160. На фиг. 1G, фиг. 1H и фиг. 1I приведен процент клеток, обнаруживаемых с помощью 4H11 через FACS анализ, где клеточные линии экспрессируют указанные конструкции MUC16.
[00165] Фиг. 2A-2C. Кривые роста in vitro для MUC16-трансфектантов. На фиг. 2A изображены кривы роста in vitro для MUC16c114 и MUC16c344 клеточных линий, по сравнению с контрольной клеточной линией (phrGFP), в клетках 3T3. На фиг. 2B изображены кривые роста in vitro для MUC16c114 и MUC16c344 клеточных линий, по сравнению с контрольной клеточной линией (phrGFP), в клетках A2780. На фиг. 2C изображены кривые роста in vitro для MUC16c114, MUC16c80 и MUC16c86 клеточных линий, по сравнению с контрольной клеточной линией (phrGFP), в клетках 3T3.
[00166] Фиг. 3A-3E. Эффект MUC16 в клетках 3T3. На фиг. 3A изображен рост на мягком агаре 3T3 трансфектантов в 60 мм чашках. После 14 суток колонии подсчитывали и наносили на график. Данные, представленные в таблице, представляют один из трех схожих экспериментов (*** p < 0,0001) по сравнению с ростом на мягком агаре клеток, экспрессирующих контрольный вектор phrGFP. На фиг. 3B представлен анализ инвазии матригеля для клеточных линий 3T3 после стабильных трансфекций с использованием или контрольного вектора phrGFP или MUC16c114 или MUC16c344 карбоксиконцевых конструкций. Каждый анализ осуществляли два или больше раз в трех повторениях и считали вручную. Обе MUC16c114 и MUC16c344 клеточные линии были значительно более инвазивными (*** p<0,0001) по сравнению с инвазией клеток, экспрессирующих контрольный вектор phrGFP, и результаты с использованием MUC16c344 клеточной линии значительно отличались от результатов с использованием MUC16c114 клеточной линии ((# p=0,0354). На фиг. 3C изображена экспрессия генов метастазов и инвазии, индуцированная экспрессией MUC16c114 и MUC16c344. Панель SuperArray из 80 транскриптов генов инвазии/метастазов исследовали на предмет клеточных линий, положительных по MUC16 конструкции и содержащих только вектор. Экспрессию выбранных транскриптов хемотаксиса, адгезии и инвазии измеряли в 3T3 MUC16c114 или 3T3 MUC16c344 клеточных линиях (каждое из трех тройных повторений исследовали в двух повторениях и сравнивали с контролями только с вектором phr посредством критерия хи-квадрат). p-значение для каждого транскрипта, скорректированное для повторных измерений, представлено в таблице. Включены все гены с изменениями при уровне p<0,05 или ниже. Фиг. 3D: трансфицированные клетки 3T3 исследовали на предмет активации путей передачи сигнала ERK/AKT по сравнению с контролями только с вектором. Фосфорилирование ERK1/2 (pT202/Y204) и AKT (S473) возрастало вслед за экспрессией конструкций MUC16c114 и MUC16c344, по сравнению с экспрессией вектора phr. Активацию обоих путей наблюдали в каждой из клеточных линий. Нормализованные по β-актину значения количественного денситометрического определения приведены на фиг. под каждым вестерн-блоттингом. На фиг. 3E показаны положительный по MUC16-конструкции опухолевый рост у бестимусных голых мышей. Два миллиона опухолевых клеток вводили в бок 15 nu/nu мышей, и наблюдали формирование опухоли у мышей. Опухоли измеряли штангенциркулем два раза в неделю. Различия в среднем объеме опухоли были значительно выше для мышей, несущих положительные по MUC16-конструкции опухоли (обе линии p<0,0001 по сравнению с клетками, экспрессирующими контрольный вектор phrGFP).
[00167] Фиг. 4A-4C. Онкогенные свойства фрагментов MUC16. На фиг. 4A представлен анализ инвазии матригеля для клеточных линий A2780, трансфицированных или контрольным вектором phrGFP или экспрессирующими карбоксиконец MUC16 векторами, MUC16c114 или MUC16c344. Каждый анализ осуществляли два или больше раз в трех повторениях и считали вручную. Результаты сравнивали с инвазией матригеля клетками, экспрессирующими контрольный вектор phrGFP или MUC16c114. MUC16c114 или MUC16c34 клеточные линии демонстрировали значимую инвазию матригеля относительно контрольного вектора phrGFP, и результаты с использованием MUC16c344 клеточной линии значительно отличались от результатов с использованием MUC16c114 клеточной линии (##p=0,0018). На фиг. 4B изображен эффект экспрессии MUC16, оказываемый на ERK/AKT передачу сигнала. Клетки A2780 исследовали на предмет активации путей передачи сигнала ERK/AKT. Фосфорилирование ERK1/2 (pT202/Y204) и AKT (S473) возрастало вслед за экспрессией каждой из конструкций экспрессии MUC16. Оба пути активировали в каждой из клеточных линий. Нормализованные по β-актину значения денситометрического количественного определения приведены под каждым вестерн-блоттингом на фиг. На фиг. 4C изображен положительный по MUC16-конструкции опухолевый рост у бестимусных голых мышей. Два миллиона опухолевых клеток вводили в бок 15 nu/nu мышей и наблюдали формирование опухоли у мышей. Опухоли измеряли штангенциркулем два раза в неделю. Различия в среднем объеме опухоли были значительно больше для мышей, несущих какую-либо из MUC16c114- или MUC16c344-положительных опухолей, в сутки 28, как показано на фиг.
[00168] Фиг. 5A-5D: эффекты усеченных вариантов MUC16c114. Фиг. 5A: рост на мягком агаре. 3T3 трансфектанты, экспрессирующие части внутреннего или внешнего домена MUC16c114, наслаивали на мягкий агар, как описано в разделе 6.1.2. Колонии подсчитывали и наносили на график. Приведенные данные представляют один из трех экспериментов. Скорости роста на мягком агаре для MUC16c80 и MUC16c86 значительно различались по сравнению со скоростью роста для MUC16c114 (# p =0,0111 и ## p=0,0258, соответственно), тогда как более высокий уровень значимости наблюдали для скорости роста для MUC1680-трансфектанта по сравнению со скоростью роста для MUC16c86-трансфектанта (### p<0,0001). На фиг. 5B представлен анализ инвазии матригеля для клеточных линий 3T3, трансфицированных или контрольным вектором phrGFP или MUC16 карбоксиконцевыми конструкциями. Каждый анализ осуществляли два или больше раз в трех повторениях и считали вручную. Инвазия MUC16c80 клетками-трансфектантами была значимой (# p=0,0172) по сравнению с инвазией MUC16c114 клеточной линии. На фиг. 5C изображен эффект экспрессии MUC16, оказываемый на ERK/AKT передачу сигнала. Трансфицированные клетки 3T3 исследовали на предмет активации путей передачи сигнала ERK/AKT. Фосфорилирование в ERK1/2 (pT202/Y204) и AKT (S473) возрастало вслед за MUC16c114; однако сигналы были ниже в клетках, трансфицированных MUC16c80 или MUC16c86 конструкциями. Нормализованные по β-актину значения денситометрического количественного определения приведены под каждым вестерн-блоттингом на фиг. На фиг. 5D изображен положительный по MUC16-конструкции опухолевый рост у бестимусных голых мышей. Два миллиона опухолевых клеток вводили в бок 20 nu/nu мышей и наблюдали формирование опухоли у мышей. Опухоли измеряли штангенциркулем два раза в неделю. Различия в среднем объеме опухоли были значительно больше для мышей, несущих MUC16+ опухоли. 3T3 MUC16c114 и 3T3 MUC16c86-трансфектанты значительно различались по сравнению с MUC16c80-трансфектантами (### p<0,0001).
[00169] Фиг. 6A-6B. Аминокислотная последовательность для MUC16c114 (аминокислотные остатки с 1777 до 1890 (SEQ ID № 133), фиг. 6A) и MUC16c344 (аминокислотные остатки с 1547 до 1890 (SEQ ID № 132), фиг. 6B). Участки N- и O-гликозилирования выделены и трансмембранный домен (аминокислотные остатки с 1835 до 1859) подчеркнут и помечен «трансмембранный домен». Аминокислотные остатки 1857-1884 представляют делецию из 28 аминокислот во внутреннем домене, присутствующую в MUC16c86 конструкции (см. фиг. 1). Аминокислотные остатки 1798-1831 представляют делецию из 34 аминокислот в эктодомене, присутствующую в MUC16c80 конструкции (см. фиг. 1).
[00170] Фиг. 7A-7H. Эффект N-гликозилирования, оказываемый на MUC16 трансформацию. На фиг. 7A представлен анализ инвазии матригеля для клеточных линий 3T3, трансфицированных контрольным вектором phrGFP или MUC16c114 или MUC16c114-N123 и MUC16c114 с обработкой туникамицином 0,1 мкг/мл. Результаты для MUC16c114 клеточной линии значительно отличались (### p<0,0001) от результатов для контрольной клеточной линии с вектором phrGFP. Результаты для MUC16c114-N123 клеточной линии значительно различались (** p=0,007) по сравнению с результатами для контрольной клеточной линии с вектором phrGFP. Обработка ингибитором N-гликозилирования туникамицином значительно ингибировала инвазию матригеля по сравнению с необработанными MUC16c114 (p=0,004). На фиг. 7B представлен анализ инвазии матригеля для 3T3 трансфицированных клеточных линий по сравнению с контрольным вектором phrGFP. Клетки 3T3, трансфицированные MUC16c114, обрабатывали только средами или обрабатывали с использованием 5 мкг/мл контрольного слитого белка pFUSE hIgG1-Fc2 или с использованием 5 мкг/мл слитого белка MUC16c57-c114-pFUSE hIgG1-Fc2 или с использованием 5 мкг/мл слитого белка117-244LGALS3-pFUSE hIgG1-Fc2, как подробно показано на фиг. 8. MUC16c114 клеточная линия была значительно более инвазивной, чем контрольные клетки 3T3 (*** p<0,0001), экспрессирующие контрольный вектор phrGFP, и на это не влияла экспозиция белком только из вектора pFUSE. В отличие от этого, MUC16c114 клеточная линия, которую обрабатывали слитным белком MUC16c57-c114-pFUSE hIgG1-Fc2 или слитным белком117-244LGALS3-pFUSE hIgG1-Fc2, демонстрировала значимое ингибирование инвазии матригеля по сравнению с MUC16c114 контрольными клетками. На фиг. 7C изображен эффект экспрессии MUC16, оказываемый на ERK/AKT передачу сигнала. Трансфицированные клетки 3T3 также исследовали на предмет активации путей передачи сигнала ERK/AKT. Фосфорилирование ERK1/2 (pT202/Y204) и AKT (S473) возрастало в 3T3, трансфицированных с использованием MUC16c114; однако эффект был уменьшен в клетках 3T3, трансфицированных MUC16c114-N123 вектором («MUC16c114-N123» и «MUC163(N→A)c114» используют в настоящем описании взаимозаменяемо). Несмотря на 3 мутации аспарагина в аланин, вестерн-блоттинг с использованием антитела против MUC16 (4H11 mAb) демонстрировал более высокий сигнал, чем клетки, трансфицированные контрольным вектором phrGFP или нативным MUC16c114, что указывает на то, что трансфицированные клетки 3T3 экспрессируют более высокие уровни белка MUC163(N→A)c114. Как используют в настоящем описании, «4H11» относится к моноклональному антителу против MUC16 с обозначением 4H11 в Rao et al. Appl. Immunohistochem Mol Morphol, 2010, 18(5):462-72 и в публикации международной патентной заявки № WO 2011/119979. На фиг. 7D изображен положительный по MUC16-конструкции опухолевый рост у бестимусных голых мышей. Два миллиона опухолевых клеток вводили в бок 20 nu/nu мышей и наблюдали формирование опухоли у мышей. Опухоли измеряли штангенциркулем два раза в неделю. Различия в среднем объеме опухоли были значительно больше для мышей, несущих MUC16c114 опухоли (p<0,0001). Результаты для 3T3-MUC16c114 трансфектанта имели высокую значимость по сравнению с результатами клеточной линии с контрольным вектором phrGFP (*** p<0,0001). Однако MUC16c114-N123 3T3 трансфектанты не демонстрируют какой-либо значимости относительно клеток 3T3 с контрольным вектором phrGFP, что указывает на то, что мутации N-гликозилирования значительно снижали опухолевый рост и инвазию. На фиг. 7E приведено линейное представление конструкции MUC16c57-114-pFUSE-human-IgG1-Fc2. Аминокислотная последовательность эктодомена представляет собой то, что приведено в SEQ ID № 161. На фиг. 7F изображены уровни белка конструкции MUC16c57-114-pFUSE-human-IgG1-Fc2, определяемые с помощью указанных антител. На фиг. 7G приведено линейное представление конструкции117-244LGALS3-pFUSE-human-IgG1-Fc2. Аминокислотная последовательность сахарсвязывающего домена, представляет собой то, что приведено в SEQ ID № 167. На фиг. 7H изображены уровни белка конструкции 17-244LGALS3-pFUSE-human-IgG1-Fc2, определяемые с помощью указанных антител.
[00171] Фиг. 8. Последовательность для аминокислотной последовательности эктодомена-MUC16c57->c114 (SEQ ID № 161; аминокислотные остатки 1777-1834 из MUC16), вставленной в вектор pFUSE-hIgG1-Fc2 для того, чтобы конструировать MUC16c57-c114pFUSE в качестве ложного рецептора, и аминокислотной последовательности117-244LGALS3 (SEQ ID № 167), вставленной в pFUSE-hIgG1-Fc2, что дает вектор117-244LGALS3pFUSE.
[00172] Фиг. 9A-9E. Трансгенные мыши MUC16c354. На фиг. 9A изображена стратегия для условной конструкции MUC16c354. Ранний энхансер CMV плюс промотор β-актина курицы (CAG) использовали для управления транскрипцией hrGFP между двумя loxP и последовательностью MUC16c354 ниже по направлению считывания. Фиг. 9B: саузерн-блоттинг показывает 12 кандидатов в MUC16c354 положительные основатели среди 99 животных после процедуры микроинъекции. Фиг. 9C: вестерн-блоттинг с антителом против MUC16, 4H11, использовали для того, чтобы идентифицировать основателей 9 (~50 копий) и 36 (~10 копий) для развития мышиной колонии MUC16c354; A5 представляет собой положительный контроль из стабильных трансфицированных SKOV3 с использованием MUC16c354. Фиг. 9D: гистологический анализ опухолей по двойным MUC16c354:p53+/-трансгенным мышам. Множественные саркомы и лимфомы идентифицировали у двойных MUC16c354:p53+/- трансгенных мышей. Срезы окрашивали гематоксилином и эозином (ГЭ). Опухоль включает гистоцитарную саркому в матке (I, масштабная полоска: 100 мкм), печени (II, масштабная полоска: 50 мкм), яичнике (III, масштабная полоска: 50 мкм) и костном мозге (IV, масштабная полоска: 50 мкм), а также лимфому в яичнике (V, масштабная полоска: 50 мкм), почке (VI, масштабная полоска: 50 мкм) и легком (VII, масштабная полоска: 50 мкм) с карциномой в легком (VIII, масштабная полоска: 50 мкм). Фиг. 9E: кривые выживаемости Каплана-Мейера, специфичные для рака трансгенных мышей: MUC16c354 мыши не демонстрировали самопроизвольное развитие опухоли в течение первых 18 месяцев, сходно с диким типом (WT). Однако когда MUC16c354 мышей скрещивали с p53+/- мышами, двойные трансгенные MUC16c354:p53+/- мыши демонстрировали значительно более плохую общую выживаемость из-за самопроизвольного развития опухоли по сравнению с p53+/- мышами (p<0,014) или MUC16c354 мышами.
[00173] Фиг. 10. Репрезентативная гистология тканей от самцов и самок MUC16c354 трансгенных мышей в возрасте 12 месяцев. Тканевые срезы окрашивали гематоксилином и эозином (ГЭ, масштабная полоска: 50 мкм). Гиперплазию эндометрия матки наблюдали при схожей заболеваемости и тяжести в обоих генотипах (здесь показано только у трансгенного животного). Яичник, легкое, ободочная кишка и печень трансгенных животных (Tg) были схожи с родительской линией (дикого типа, WT).
[00174] Фиг. 11A-11C. Влияние MUC16 на рак яичников человека. На фиг. 11A приведено число MUC16 транскриптов. На фиг. 11B: квинтиль пациентов с наивысшей экспрессией MUC16, в комбинации с 18 пациентами с идентифицированными мутациями MUC16, имеют значительно (p=0,02117) более плохую выживаемость по сравнению с пациентами с более низкой экспрессией MUC16 в анализе Каплана-Мейера. На фиг. 11C изображена связь генетических изменений MUC16 с мутационными событиями PI3K в раке яичников.
[00175] Фиг. 12A-12C. Требования к гликозилированию для MUC16 инвазии матригеля. На фиг. 12A представлен анализ инвазии матригеля для трансфицированных клеточных линий SKOV3. phrGFP относится к клеткам SKOV3, экспрессирующим контрольный вектор. MUC16c114 относится к клеткам SKOV3, экспрессирующим MUC16c114. N3 относится к клеткам SKOV3, экспрессирующим MUC16c114-N3. N1-2 относится к клеткам SKOV3, экспрессирующим MUC16c114-N12. N1-2-3 относится к клеткам SKOV3, экспрессирующим MUC16c114-N123. MUC16c114-shControl относится к клеткам SKOV-3, экспрессирующим MUC16c114 и контрольную shRNA (короткая шпилечная РНК). Популяция phrGFP shRNA MGAT #4 относится к клеткам SKOV3, экспрессирующим контрольный вектор и shRNA против MGAT5. Популяция phrGFP shRNA LGALS3 #15 относится к клеткам SKOV3, экспрессирующим контрольный вектор и shRNA против LGALS3. MUC16c114-shMGAT5 относится к клеткам SKOV3, экспрессирующим MUC16c114 и shRNA против MGAT5. MUC16c114-shLGALS3 относится к клеткам SKOV3, экспрессирующим MUC16c114 и shRNA против LGALS3. На фиг. 12B представлен анализ инвазии матригеля для клеток 3T3, экспрессирующих контрольный вектор, phrGFP, или указанных MUC16c114 конструкций. На фиг. 12C представлен опухолевый рост, как определяют по объему опухоли, у бестимусных голых мышей с имплантированными клетками SKOV3, экспрессирующими указанные конструкции.
[00176] Фиг. 13A-13D. Паттерны гликозилирования MUC16 и пептиды. На фиг. 13A изображено N-связанное профилирование клеток SKOV3, экспрессирующих MUC16c114-N12. Треугольники представляют фукозу. Квадраты представляют N-ацетилглюкозамин. Серые круги представляют маннозу. Белые круги представляют галактозу. Ромбы представляют N-ацетилнейрамовую кислоту. На фиг. 13B изображен иммуногенный 55-мер (SEQ ID № 129). На фиг. 13C изображен иммуногенный 15-мер (SEQ ID № 131). На фиг. 13D изображен иммуногенный 18-мер (SEQ ID № 130).
[00177] На фиг. 14 приведен подробный ELISA анализ относительной реактивности биологически реактивных супернатантов, содержащих антитела к гликозилированному MUC16, с гликозилированным и не гликозилированными антигенами как для 15-мера, так и 18-мера, используемых в качестве иммуногенов и скрининговых антигенных мишеней.
[00178] Фиг. 15A-15B. Антитела к гликозилированному MUC16 ингибируют инвазию матригеля. На фиг. 15A изображена инвазия матригеля клетками SKOV3, экспрессирующими контрольный вектор phrGFP или MUC16c114, в присутствии или отсутствии биологически реактивных супернатантов от создания антител к гликозилированному MUC16. Линия представляет собой эталонную линию для относительного числа 200. На фиг. 15B изображена инвазия матригеля клетками SKOV3, экспрессирующими контрольный вектор phrGFP или MUC16c114, в присутствии или отсутствии очищенных антител к гликозилированному MUC16. Линия представляет собой эталонную линию для относительного числа 90.
[00179] Фиг. 16A-16E. Антитела к гликозилированному MUC16 ингибируют инвазию матригеля. На фиг. 16A изображена инвазия матригеля клетками SKOV3, экспрессирующими контрольный вектор phrGFP или указанные конструкции MUC16c114 в присутствии (i) контрольного антитела; (ii) 4H11; или (iii) антитела к гликозилированному MUC16 клона 10C6.E4. На фиг. 16B изображена инвазия матригеля клетками SKOV3, стабильно экспрессирующими контрольный вектор phrGFP или указанные конструкции MUC16c344, после третей FACs сортировки с использованием 4H11, в присутствии (i) контрольного антитела; (ii) 4H11; или (iii) антитела к гликозилированному MUC16 клона 10C6.E4. На фиг. 16C изображена инвазия матригеля клетками 3T3, экспрессирующими контрольный вектор phrGFP или указанные конструкции MUC16c114, в присутствии (i) контрольного антитела; (ii) 4H11; или (iii) антитела к гликозилированному MUC16 клона 10C6.E4. На фиг. 16D изображен опухолевый рост, на который указывает объем опухоли, у бестимусных голых мышей с имплантированными клетками SKOV3, экспрессирующими MUC16c344, которых лечили плацебо (MUC16c344) или лечили антителом к гликозилированному MUC16 10C6.E4(MUC16c344+10C6.E4). Стрелки показывают сутки, в которые вводили 100 мкг антитела к гликозилированному MUC16. На фиг. 16E изображено окрашивание образцов опухоли яичника человека с использованием указанных антител.
[00180] На фиг. 17 изображен процент клеток, в которых происходит интернализация меченного антитела к гликозилированному MUC16 при указанной температуре и в указанные моменты времени.
[00181] На фиг. 18A изображены кривые роста in vitro для MUC16-трансфектантов. 1000 клеток SKOV3/лунка в 96-луночных плоскодонных планшетах культивировали с контрольным вектором phrGFP, вектором phrGFP, экспрессирующим MUC16c114 (SEQ ID № 133), или вектором phrGFP, экспрессирующим MUC16c344 (SEQ ID № 132), и инкубировали при 37°C в 5% CO2 в течение 5 суток. Каждые сутки планшет окрашивали аламаровым синим и инкубировали при 37°C в 5% CO2 в течение 4 часов. Планшеты считывали в считывателе планшетов CytoFluor Fluorescent. Между кривыми статистические различия не наблюдали. На фиг. 18B представлен анализ инвазии матригеля для клеток SKOV3 phrGFP, клеток SKOV3 MUC16c114-GFP или клеток SKOV3- MUC16c344-GFP. Каждый анализ осуществляли два или больше раз в трех повторениях и считали вручную. Результаты выражают как относительное число инвазивных клеток. c114 и c344 были статистически значимыми по сравнению с phrGFP. На фиг. 18C изображен опухолевый рост SKOV3 трансфектанта у самок бестимусных голых мышей. Два миллиона опухолевых клеток вводили в бок 10 nu/nu мышей и наблюдали формирование опухоли у мышей. Опухоли измеряли штангенциркулем два раза в неделю. Различия в среднем объеме опухоли были статистически значительно более высокими для мышей, несущих MUC16c344 опухоли (p<0,0001) и MUC16c114 опухоли (p=0,002) по сравнению с phrGFP опухолями. Сокращения для фиг. 18A-фиг.18C: «SKOV3 phrGFP» и «phrGFP» относятся к клеткам SKOV3, экспрессирующим контрольный вектор phrGFP; «SKOV3 MUC16c114-GFP» и «c114» относятся к клеткам SKOV3, экспрессирующим MUC16c114 (SEQ ID № 133); «SKOV3 MUC16c344-GFP» и «c344» относятся к клеткам SKOV3, экспрессирующим MUC16c344 (SEQ ID № 132).
[00182] На фиг. 19A-19F представлен эффект экспрессии MUC16, оказываемый на клетки рака яичника SKOV3. На фиг. 19A изображен анализ инвазии матригеля для клеток SKOV3, экспрессирующих контрольный вектор phrGFP («phrGFP») или вектор phrGFP, экспрессирующий MUC16c114 (SEQ ID № 133; «c114»), которые обрабатывали с использованием или без использования следующего: (1) туникамицин 5 мкг/мл; (2) контрольный белок pFUSE 5 мкг/мл; (3) слитый белок MUC16c57-114-pFUSE 5 мкг/мл; или (4) слитый белок117-244LGALS3-pFUSE 5 мкг/мл. Результаты выражают в виде числа инвазивных клеток через 48 часов после обработки. Клетки c114 были более инвазивными, чем клетки phrGFP (p<0,0001). На инвазивные свойства клеток c114 не влияла обработка с использованием белка только из вектора pFUSE. Обработка туникамицином (ингибитором N-гликозилирования) снижала инвазивные свойства клеток c114. Обработка слитным белком MUC16c57-114-pFUSE или117-244LGALS3-pFUSE снижала инвазивные свойства клеток c114 (p<0,0001). На фиг. 19B представлен анализ инвазии матригеля для клеток SKOV3, трансфицированных контрольным вектором phrGFP («phrGFP») или вектором phrGFP, экспрессирующим MUC16c114 (SEQ ID № 133) («c114»), в присутствии или отсутствии контрольной shRNA lamelli, MGAT5-специфичной shRNA или LGALS3-специфичной shRNA. Клетки c114, обработанные MGAT5-специфичной shRNA или LGALS3-специфичной shRNA, имели сниженную инвазию по сравнению с клетками phrGFP, обработанными с использованием shRNA. Контрольная shRNA не оказывала влияния на инвазию клеток c114. Каждый анализ осуществляли два или больше раз в трех повторениях и считали вручную. На фиг. 19C изображена зависимость от гликозилирования для SKOV3-MUC16c114 инвазии матригеля. Клетки SKOV3 трансфицировали контрольным вектором phrGFP или вектором phrGFP, экспрессирующим следующие мутанты MUC16: c114 (SEQ ID № 133), N1 mut c114 (SEQ ID № 151), N24 muc c114 (SEQ ID № 152), N30 mut c114 (SEQ ID № 139), N1-N24 mut c114 (SEQ ID № 153), N1-N24-N30 mut c114 (SEQ ID № 154). c114-экспрессирующие клетки демонстрировали повышенную инвазию по сравнению с контрольными клетками phrGFP. Повышенное инвазивное свойство c114-экспрессирующих клеток зависело от N-гликозилирования аспарагинов в положениях аминокислот 24 и 30 в MUC16c114 (SEQ ID № 133). Хотя важны оба участка N24 и N30, положение N30 выглядело для этого эффекта более важным, чем участок N24. Каждый анализ осуществляли два или больше раз в трех повторениях и считали вручную. Результаты выражают в виде % по сравнению с контрольным вектором phrGFP. На фиг. 19D изображена зависимость от гликозилирования для SKOV3-MUC16c344 инвазии матригеля. Клетки SKOV3 трансфицировали контрольным вектором phrGFP или вектором phrGFP, экспрессирующим следующие мутанты MUC16: c344 (SEQ ID № 132), N24 mut c344 (SEQ ID № 173), N30 mut c344 (SEQ ID № 174) или N24-N30 mut c344 (SEQ ID № 175). c344-экспрессирующие клетки демонстрировали повышенную инвазию по сравнению с контрольными клетками phrGFP. Повышенное инвазивное свойство c344-экспрессирующих клеток зависело от N-гликозилирования аспарагинов, соответствующих положениям аминокислот 24 и 30 в MUC16c114 (SEQ ID № 133). Каждый анализ осуществляли два или больше раз в трех повторениях и считали вручную. На фиг. 19E изображен эффект MUC16-экспрессии, оказываемый на выбранные пути передачи сигнала. Клетки SKOV3, трансфицированные MUC16c114 (SEQ ID № 133), обрабатывали с использованием или без использования контрольной shRNA («shLamelli») или shRNA против MGAT5 («shMGAT5») или LGALS3 («shLGALLS3») и сравнивали с клетками SKOV3, трансфицированными контрольным вектором phrGFP («phrGFP») или вектором phrGFP, экспрессирующим MUC16c114-N30mut (SEQ ID № 139) («N30 mut»), и клетки исследовали на предмет активации путей передачи сигнала pAKT, pERK1/2, pSRC и рецептора pEGF (pEGFR). Фосфорилирование AKT (S473) и ERK1/2 (pT202/Y204) возрастало в клетках MUC16c114. Каждое из нокдауна MGAT5 (shMGAT5), нокдауна галектина-3 (shLGALLS3) и мутации N30A снижало MUC16c114-индуцированную активацию онкогена в клеточных линиях SKOV3. На фиг. 19F изображен опухолевый рост SKOV3 трансфектанта у самок бестимусных голых мышей. Два миллиона опухолевых (описаны далее) клеток вводили в бок 10 nu/nu мышей для каждого условия и наблюдали формирование опухоли у мышей. Опухоли измеряли штангенциркулем два раза в неделю. Рост in vivo c114 опухолевых клеток был значительно более агрессивным (p<0,0001) по сравнению с опухолевыми клетками phrGFP. Опухолевые клетки N1-N24-N30-mut c114, c114-sh-MGAT5 и c114-sh-LGALS3 не демонстрировали усиления роста по сравнению с опухолевыми клетками phrGFP. Описание опухолевых клеток: «phrGFP» относится к клеткам SKOV3, трансфицированным контрольным вектором phrGFP; «c114» относится к клеткам SKOV3, трансфицированным вектором phrGFP, экспрессирующим MUC16c114 (SEQ ID № 133); «N1-N24-N30-mut c114» относится к клеткам SKOV3, трансфицированным вектором phrGFP, экспрессирующим MUC16c114-N1-N24-N30-mut (SEQ ID № 154); «c114-sh-MGAT5» относится к клеткам SKOV3, трансфицированным вектором phrGFP, экспрессирующим MUC16c114 (SEQ ID № 133), и обработанным shRNA против MGAT5; и «c114-sh-LGALS3» относится к клеткам SKOV3, трансфицированным вектором phrGFP, экспрессирующим MUC16c114 (SEQ ID № 133), и обработанным shRNA против LGALS3.
[00183] На фиг. 20A изображен эффект экспрессии MUC16, оказываемый на экспрессию EGFR на поверхности. SKOV3-phrGFP и SKOV3-MUC16c114 трансфектанты исследовали в присутствии или отсутствии обработки циклогексимидом (CHX) в течение 24 часов. Представлены геометрическое среднее флуоресценции экспрессии EGFR и MUC16 на базовом уровне и уровне после обработки CHX. EGFR в SKOV3-phrGFP образцах снижался до 58% от необработанных уровней после 24 часов обработки с использованием CHX. В этих клетках значимая экспрессия MUC16 не присутствовала. В отличие от этого, в клетках SKOV3-MUC16c114 имело место приблизительно 25% увеличение геометрической средней флуоресценции EGFR, которое снижалось до 83% от таковой у контроля после экспозиции CHX. Средняя флуоресценция MUC16c114 не значительно снижалась под действием CHX. На фиг. 20B изображена денситометрия соотношения EGFR/β-актин из вестерн-блоттинга общего клеточного EGFR и проиллюстрировано, что имеемо место устойчивое падение EGFR с течением времени в SKOV3-phrGFP клетках, обработанных с использованием CHX. В отличие от этого, общий уровень EGFR в клетках SKOV3-MUC16c114 сохранялся, что показывает стабилизацию EGFR по сравнению с MUC16(-) контрольной клеточной линией («phrGFP (-)»). На фиг. 20C представлен анализ инвазии матригеля для клеток SKOV3, трансфицированных контрольным вектором phrGFP («стабильный phrGFP»), SKOV3-MUC16c114 и SKOV3-MUC16c114(tet) тетрациклин-индуцибельных клеточных линий, выраженный в виде доли инвазии контрольных клеток. Тетрациклиновая индукция SKOV3-MUC16c114(tet) клеток вела к инвазивному фенотипу, схожему со стабильными SKOV3-MUC16c114 (SKOV3c114), тогда как не индуцированные клетки совпадали с контрольными клетками MUC16-phrGFP. Это MUC16-индуцированное увеличение инвазии матригеля полностью зависело от EGFR. Когда нокдаун шпилечной РНК EGFR (shEGFR) вводили в клетки SKOV3, тетрациклин индуцировал экспрессию MUC16 (4H11 положительный белок в вестерн-блоттинге), но не увеличивал инвазию матригеля. Каждый анализ осуществляли в трех повторениях и считали вручную. На фиг. 20D: стабильность EGFR в MUC16c114(+) и MUC16c114(-) клетках. Клеточные экстракты не индуцированных или тетрациклин-индуцированных клеточных линий SKOV3-MUC16c114(tet), обработанных с использованием CHX в течение 24 часов и исследованных на общий клеточный EGFR, выражают как денситометрические соотношения и нормализуют по β-актину. Наклон спада EGFR в тетрациклин-индуцированных клетках SKOV3-MUC16c114 воспроизводит эффект стабилизации EGFR от экспрессии MUC16c114 по сравнению с линией MUC16c114(-). Результат схож с эффектом стабильной трансфекции, показанным выше на фиг. 20B).
[00184] На фиг. 21 представлена денситометрия для анализа вестерн-блоттинга клеточных экстрактов не индуцированных или тетрациклин-индуцированных клеточных линий SKOV3c114 («Не индуцированные MUC16c114» и «Tet-индуцированные MUC16c114», соответственно), которые обрабатывали циклогексимидом в течение 24 часов. Вестерн-блоттинг исследовали на предмет pEGFR и нормализовали уровни белка по уровням β-актина. Наклоны тетрациклин-индуцированного SKOV3c114 pEGFR сигнала демонстрировали стабилизированный pEGFR по сравнению с не индуцированной клеточной линией SKOV3c114.
[00185] На фиг. 22A-22C представлена идентификация и химический синтез N-гликозилированных соединений эктодомена MUC16. Фиг. 22A: N-гликановое профилирование клеток SKOV3, трансфицированных phrGFP, экспрессирующим N1-N24 мутированный MUC16c114 (SEQ ID № SEQ ID № 153). Гликаны обнаруживали и определяли их характеристики с помощью полного ионного картирования в Complex Carbohydrate Research Center, University of Georgia. Треугольники: фукоза; квадраты: N-ацетилглюкозамин; круги, темные сплошные: манноза; круги, светлые сплошные: галактоза; ромбы: N-ацетилнейраминовая кислота. На фиг. 22B изображена схематическая структура антигенного 55-мера MUC16 с гликаном с одной хитобиозой (GlcNAc2) в положении N30. Этот N-гликопептидный антиген использовали для того, чтобы иммунизировать мышей для возникновения антител. Аминокислотная последовательность представляет собой то, что приведено в SEQ ID № 129. Квадраты представляют N-ацетилглюкозамин; круги представляют маннозу. На фиг. 22C изображена схематическая структура KLH-конъюгированного антигенного 15-мера MUC16, моногликозилированного хитобиозой в положении N30, и KLH-конъюгированного антигенного 18-мера MUC16, бис-гликозилированного двумя звеньями хитобиозы в положениях N24 и N30, соответственно. Эти конструкции N-гликопептид-KLH впоследствии использовали для того, чтобы иммунизировать мышей для образования моноклональных антител против GlcNAc2-пептидного эпитопа в эктодомене MUC16. Также включены последовательности не гликопептидов, не родственных MUC16, и не гликозилированного пептида 2 MUC16 для образования моноклонального антитела 4H11. Аминокислотная последовательность для KLH-15-мер(хитобиоза)[C-G25-V38] представляет собой то, что приведено в SEQ ID № 131. Аминокислотная последовательность для KLH-18-мер(хитобиоза)2[C-T22-V38] представляет собой то, что приведено в SEQ ID № 130. Аминокислотная последовательность для не гликозилированного пептида 2 MUC16 представляет собой то, что приведено в SEQ ID № 168. Аминокислотная последовательность для пептидного 18-мера, не родственного MUC16, и пептидного 18-мера, не родственного MUC16,+GlcNAc2 представляет собой то, что приведено в SEQ ID № 169. Квадраты представляют N-ацетилглюкозамин.
[00186] На фиг. 23A-23H изображено определение характеристик антитело к гликозилированному MUC16. На фиг. 23A представлена реактивность 4H11 и четырех ведущих моноклональных антител к GlcNAc2-MUC16-эктодомену (антител к гликозилированному MUC16) к различным MUC16 и GlcNAc2-гликозилированным пептидам согласно сэндвич-ELISA. Не наблюдали перекрестную реактивность эктодомена гликан-MUC16 с не гликозилированным пептидом 2 MUC16 (SEQ ID № 168) или любым из не родственных пептидов (SEQ ID № 169). Аналогичным образом, 4H11 по существу не имел аффинности к N-гликопептидным GlcNAc2-MUC16 15-меру (SEQ ID № 131) или (GlcNAc2)2-18-меру (SEQ ID № 130). Квадраты представляют N-ацетилглюкозамин; треугольники представляют фукозу; круги представляют маннозу. На фиг. 23B, фиг. 23C и фиг. 23D изображен эффект антител к гликозилированному MUC16, оказываемый на MUC16-усиленную инвазию матригеля. Результаты выражают в виде % по сравнению с контролем. Матригелевый анализ клеток SKOV3, трансфицированных phrGFP, экспрессирующим MUC16c114 (SEQ ID № 133) (фиг. 23B), клеток CAOV3 (фиг. 23C) и клеток OVCA-433 (фиг. 23D) с использованием или без использования (контроль) очищенного 4H11 или четырех антител к гликан-MUC16-эктодомену 18C6, 10C6, 19C22 или 7B12 по 5 мкг/мл. Каждое из четырех антител против гликан-MUC16-эктодомена (антител к гликозилированному MUC16) ингибировало инвазию трех различных MUC16(+) клеточных линий рака яичников (CAOV3 и OVCA-433), тогда как 4H11 оказывал меньший эффект на ингибирование инвазии клеток SKOV3-MUC16c114. На фиг. 23E изображено ингибирование стабилизации EGFR с помощью моноклонального антитела к гликозилированному MUC16 («MAB») 10C6. Денситометрия анализа вестерн-блоттинга клеточных экстрактов не индуцированных SKOV3-MUC16c114(tet), тетрациклин-индуцированных SKOV3-MUC16c114(tet) или обработанных моноклональным антителом к гликозилированному MUC16 10C6, тетрациклин-индуцированных SKOV3-MUC16c114(tet) клеточных линий, обработанных CHX и затем исследованных на общий EGFR в указанные часы (ч) после обработки циклогексамидом. Как видно на фиг. 20A, наклоны денситометрических кривых показывали, что присутствие MUC16c114 на клеточной поверхности стабилизировало EGFR. Антитело к гликозилированному MUC16 10C6 отменяло MUC16c114 стабилизацию общего белка EGFR, делая это подобно MUC16(-) не индуцированному контролю. На фиг. 23F изображены микропанели ткани яичника человека, окрашенные с использованием 4H11, OC125 (коммерческое) или моноклональных антител к гликозилированному MUC16 (10C6 и 19C11). Экспрессия MUC16 на серозном раке яичников согласовывалась и перекрывалась с OC125 и 4H11. На фиг. 23G и фиг. 23H изображен эффект антител к гликозилированному MUC16, оказываемый на опухолевый рост у самок бестимусных голых мышей. Два миллиона опухолевых клеток (клеток SKOV3, трансфицированных вектором phrGFP («phrGFP») или вектором phrGFP, экспрессирующим MUC16c344 (SEQ ID № 132; «c344»)) вводили в бок 20 nu/nu мышей. Десять мышей лечили внутривенно от суток 0 очищенным моноклональным антителом к гликозилированному MUC16 10C6 по 100 мкг/мышь два раза в неделю в течение 4 недель. Наблюдали формирование опухоли у всех мышей. Опухоли измеряли штангенциркулем два раза в неделю. На фиг. 23G представлен анализ инвазии матригеля теми же клетками, который выполняли в присутствии и отсутствии очищенного моноклонального антитела к гликозилированному MUC16 10C6 по 10 мкг/мл. На фиг. 23H показано, что различия в среднем объеме опухоли были значительно снижены (p=0,0004) у мышей, несущих MUC16c344 опухоли, которых лечили моноклональным антителом к гликозилированному MUC16 10C6, по сравнению с опухолями MUC16c344, которые не лечили, что указывает на защиту от эффекта MUC16, оказываемого на опухолевый рост.
[00187] На фиг. 24A-фиг.24D изображены галектин-опосредованные MUC16 белок-белковые взаимодействия. На фиг. 24A изображены иммуноблот (IB) и иммунопреципитация (IP) трех гликозилированных белков (EGFR DDK-His; MUC16c57-114-pFUSE и LGALS3Myc-DDK). Гликозилированный белок MUC16c57-114-pFUSE комбинировали с белком LGALS3 (0,13 мкг) и EGFR (0,13 мкг) и затем вращали при 4°C в течение 1 часа. Предварительно блокированные гранулы Protein A/G PLUS Agarose добавляли и вращали при 4°C в течение ночи. IP осадки тщательно промывали, кипятили в загрузочном буфере и разделяли с помощью электрофореза в 10% SDS-PAGE геле, затем переносили на нитроцеллюлозную мембрану. Мембрану исследовали с использованием антител против EGFR-v3, против 4H11-HRP или поликлональных антител против LGALS3. Как показано, связывание 4H11 демонстрировало, что MUC16c57-114-pFUSE присутствовал постоянно. LGALS3 был связан в дороже, положительной по MUC16c57-114-pFUSE, но EGFR обнаруживали только когда присутствовал как LGALS3, так и MUC16c57-114-pFUSE. Присутствие моноклонального антитела к гликозилированному MUC16 18C6 предотвращало формирование этих белковых комплексов LGALS3, EGFR и MUC16 (дорожки справа). На фиг. 24B изображена совместная локализация белков MUC16 и EGFR. Иммунофлуоресцентное окрашивание клеток OVCAR3 дикого типа или клеток SKOV3, трансфицированных phrGFP, экспрессирующим MUC16c344 (SEQ ID № 132; «SKOV3c344»), или phrGFP, экспрессирующим MUC16c114 (SEQ ID № 133; «SKOV3c114») с использованием EGFR-A647 и 4H11-PE для MUC16 или комбинации обоих реактивов EGFR-A647 и 4H11-PE для MUC16. Микроскопические изображения (масштаб 50 мкм) показывали совместную локализацию EGFR и MUC16c114 во всех трех клеточных линиях (см. стрелки). На фиг. 24C изображены иммуноблот (IB) и иммунопреципитация (IP) трех гликозилированных белков (интегрин β1Myc-DDK; MUC16c57-114-pFUSE и LGALS3Myc-DDK). В целом, использовали те же способы, что и на фиг. 24A. Анализ вестерн-блоттинга иммуноблота и все иммунопреципитированных образцов выполняли на 10% SDS-PAGE геле, осуществляли перенос на нитроцеллюлозную мембрану и исследовали с использованием антител или против 4C5-DDK для интегрина β1 или против 4H11-HRP или против 4C5-DDK для LGALS3. Как и в случае EGFR, все три белка необходимы для совместной преципитации белка интегрина β1. Антитело к гликозилированному MUC16 18C6 также блокировало комбинацию MUC16, LGALS3 и интегрина β1, как показано в трех правых дорожках. На фиг. 24D изображена совместная локализация MUC16 и белка интегрина β1. Иммунофлуоресцентное окрашивание клеток OVCAR3 дикого типа или клеток SKOV3, трансфицированных phrGFP, экспрессирующим MUC16c344 (SEQ ID № 132; «SKOV3c344»), или phrGFP, экспрессирующим MUC16c114 (SEQ ID № 133; «SKOV3c114»), с использованием интегрин β1-A647 или 4H11-PE для MUC16 или комбинации обоих реактивов интегрин β1-A647 или 4H11-PE для MUC16. Микроскопические изображения (масштаб 50 мкм) показывали совместную локализацию интегрина β1 и MUC16 в клетках OVCAR3, SKOV3c344 и SKOV3c114 (см. стрелки).
[00188] На фиг. 25A изображено иммунофлуоресцентное окрашивание клеток OVCAR3 дикого типа или клеток SKOV3, трансфицированных phrGFP, экспрессирующим MUC16c344 (SEQ ID № 132; «SKOV3c344»), или phrGFP, экспрессирующим MUC16c114 (SEQ ID № 133; «SKOV3c114»), или клеточных линий SKOV3c344 или SKOV3c114 с использованием EGFR-A647 или 4H11-PE для MUC16 или комбинации обоих реактивов. Микроскопические изображения (масштаб 100 мкм) четко показывали совместную локализацию EGFR и MUC16 (см. стрелки). Фиг. 25B: иммунофлуоресцентное окрашивание OVCAR3 дикого типа или SKOV3c344 или клеточных линий с использованием интегрин β1-A647 или 4H11-PE для MUC16 или комбинации обоих реактивов. Микроскопические изображения (масштаб 100 мкм) четко показывали совместную локализацию интегрина β1 и MUC16 (см. стрелки).
[00189] На фиг. 26A-26D изображена модель MUC16 стимулирования опухоли. На фиг. 26A приведена иллюстрация взаимоотношений EGFR-LGALS3-MUC16 и LGALS3-интегрин β1-MUC16. Сигнальная трансдукция SRC/ERK/AKT с помощью EGFR или SRC/FAK с помощью интегрина β1 зависела от MUC16 и взаимодействия сигнальных молекул с пентамерами LGALS3. На фиг. 26B изображена модель утраты гликозилирования: в shMGAT5-трансфицированных клеточных линиях N-гликозилирование в участках на MUC16, EGFR и интегрине β1 было снижено за счет утраты тетраантенных структур, что ведет к отсутствию связывания с LGALS3. На фиг. 26C изображена модель утраты галектина-3: в shLGALS3-трансфицированных клеточных линиях, хотя на MUC16 присутствовали участки N-гликозилирования, отсутствие связывания с LGALS3 вело к утрате ассоциации MUC16/EGFR или MUC16/интегрин β1 и снижению сигналов изнутри-наружу. На фиг. 26D изображена модель для потенциальных ингибиторов для взаимодействий MUC16/LGALS3. MUC16(+) клетки, на которые воздействовали антителом к гликозилированному MUC16 или «имитирующими» ложными рецепторами (против MUC16c57-114-pFUSE или117-244LGALS3-pFUSE), не могли связываться с LGALS3 гелями и впоследствии также с EGFR или интегрином β1.
[00190] На фиг. 27A изображен N-ацетилированный 55-членный пептидный амид с защитой боковой цепи (SEQ ID № 129). На фиг. 27B изображены кривые ESI-MS и UV из UPLC анализа на гликопептидный p55-мер[N1-S55]. Вычисленное для C486H760N84O111S8, 9812,25 (усредненные изотопы) [M+5H]5+ m/z 1963,45, найденное 1963,20; [M+6H]6+ m/z 1636,38, найденное 1636,24; [M+7H]7+ m/z 1402,75, найденное 1402,74. Колонка BEH C4, градиент: 80-99% ацетонитрил/вода в течение 6 минут при скорости потока 0,3 мл/мин.
[00191] На фиг. 28A изображен несущий хитобиозу гликопептидный 55-мер: «55-мер(хитобиоза)[N1-S55]» (GlcNAc2-55-мер) (SEQ ID № 129). На фиг. 28B изображены кривые ESI-MS и UV для UPLC анализа на гликопептидный «55-мер(хитобиоза) [N1-S55]» (GlcNAc2-55-мер). Вычисленное для C291H463N87O97S, 6764,38 (усредненные изотопы) [M+4H]4+ m/z 1692,10, найденное 1692,01; [M+5H]5+ m/z 1353,88, найденное 1353,86; [M+6H]6+ m/z 1128,40, найденное 1128,41; [M+7H]7+ m/z 967,34, найденное 967,45; [M+8H]8+ m/z 846,55, найденное 846,27. Колонка BEH C4, градиент: 20-40% ацетонитрил/вода в течение 6 минут при скорости потока 0,3 мл/мин.
[00192] На фиг. 29A изображен Man3GlcNAc2-несущий гликопептидный 55-мер: «55-мер(Man3GlcNAc2)[N1-S55]» (Man3GlcNAc2-55-мер) (SEQ ID № 129). На фиг. 29B изображены кривые ESI-MS и UV из аналитического ВЭЖХ анализа для гликопептида «55-мер(Man3GlcNAc2)[N1-S55]» (Man3GlcNAc2-55-мер). Вычисленное для C309H493N87O112S, 7250,80 (усредненные изотопы) [M+4H]4+ m/z 1813,70, найденное 1813,52; [M+5H]5+ m/z 1451,16, найденное 1451,02; [M+6H]6+ m/z 1209,47, найденное 1209,33; [M+7H]7+ m/z 1036,83, найденное 1036,74. Колонка Waters X-Bridge C18, градиент: 25-35% ацетонитрил/вода в течение 30 минут при скорости потока 0,2 мл/мин.
[00193] На фиг. 30A изображен пептидный 15-мер с защитой боковой цепи (p15-мер[C-G25-V38]) (SEQ ID № 131). На фиг. 30B изображен моногликозилированный хитобиозой гликопептидный 15-мер: 15-мер(хитобиоза)[C-G25-V38] (GlcNAc2-15-мер) (SEQ ID № 132). На фиг. 3°C изображены кривые ESI-MS и UV из аналитического ВЭЖХ анализа для гликопептида «15-мер(хитобиоза)[C-G25-V38]» (GlcNAc2-15-мер). Вычисленное для C87H142N24O35S, 2116,26 (усредненные изотопы) [2M+3H]3+ m/z 1411,84, найденное 1412,02; [M+2H]2+ m/z 1059,13, найденное 1059,15; [M+3H]3+ m/z 706,42, найденное 706,46. Колонка Varian Microsorb 300-5 C18, градиент: 15-30% ацетонитрил/вода в течение 30 минут при скорости потока 0,2 мл/мин.
[00194] На фиг. 31A изображен пептидный 18-мер с защитой боковой цепи (p18-мер[C-G22-V38]) (AF-I-165) (SEQ ID № 130). На фиг. 31B изображен бис-гликозилированный хитобиозой гликопептидный 18-мер: «18-мер(хитобиоза)2[C-T22-V38]» [(GlcNAc2)2-18-мер] (SEQ ID № 130). На фиг. 31C изображены кривые ESI-MS и UV из аналитического ВЭЖХ анализа для гликопептида «18-мер(хитобиоза)2[C-T22-V38]» [(GlcNAc2)2-18-мер]. Вычисленное для C117H193N33O50S, 2894,04 (усредненные изотопы) [2M+3H]3+ m/z 1930,36, найденное 1930,22; [M+2H]2+ m/z 1448,02, найденное 1447,65; [M+3H]3+ m/z 965,68, найденное 965,25. Колонка Varian Microsorb 300-5 C8, градиент: 15-30% ацетонитрил/вода в течение 30 минут при скорости потока 0,2 мл/мин.
[00195] На фиг. 32A изображен гликопептид «15-мер(хитобиоза)[C-G25-V38]», конъюгированный с KLH (SEQ ID № 131). На фиг. 32B изображен гликопептид «18-мер(хитобиоза)2[C-T22-V38]», конъюгированный с KLH (SEQ ID № 130).
5. ПОДРОБНОЕ ОПИСАНИЕ
[00196] Изобретение относится к антителам и их антигенсвязывающим фрагментам, и полипептидам, содержащим такие антитела или фрагменты, таким как слитые белки, конъюгаты и/или химерные антигенные рецепторы, а также клеткам, экспрессирующим их. Среди антител и фрагментов присутствуют те, которые специфично связываются с эпитопами белка MUC16. Такие антитела обозначают в настоящем описании как «антитела к гликозилированному MUC16». Такие эпитопы обычно представляют собой эпитопы внутри или по существу внутри внеклеточной части молекулы MUC16, в целом не слущиваемой формы MUC16; в некоторых вариантах осуществления эпитоп не находится внутри, или антитело или фрагмент не связывается с областью тандемных повторов MUC16 и/или секретируемой формой MUC16. В некоторых вариантах осуществления эпитоп находится внутри или содержит остатки внутри MUC16c114 и обычно содержит один или несколько гликозилированных остатков или участков гликозилирования в нем. В некоторых вариантах осуществления эпитоп содержит один или несколько участков гликозилирования, таких как участки для N-гликозилирования. В некоторых аспектах эпитоп содержит остаток аспарагина, соответствующий Asn1806 или Asn1800 последовательности MUC16, приведенной в SEQ ID № 150 (и/или его гликозилированной формы(форм)); в некоторых аспектах эпитоп содержит остаток аспарагина, соответствующий Asn1806 из SEQ ID № 150, но не содержит остаток аспарагина, соответствующий Asn1800 из SEQ ID № 150; в некоторых аспектах эпитоп содержит остаток аспарагина, соответствующий Asn1800 из SEQ ID № 150, но не содержит остаток аспарагина, соответствующий Asn1806 из SEQ ID № 150. В некоторых из каких-либо из таких вариантов осуществления такой один или несколько аспарагинов гликозилированы, например, N-гликозилированы. В некоторых вариантах осуществления антитело или фрагмент связывается с эпитопом внутри или тем, что содержит остатки внутри SEQ ID № 131; связывается с эпитопом внутри или тем, что содержит остатки внутри SEQ ID № 130, или их сочетанием; в некоторых вариантах осуществления антитело или фрагмент иммуноспецифически не связывается в области MUC16, соответствующей SEQ ID № 168, или внутри остатков 2-19 из SEQ ID № 168.
[00197] В одном из аспектов, изобретение относится к антителам (например, моноклональным антителам) и их антигенсвязывающим фрагментам, которые (i) иммуноспецифически связываются с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеют иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибируют инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16. В другом аспекте изобретение относится к антителам (например, моноклональным антителам), и их антигенсвязывающим фрагментам, которые (i) иммуноспецифически связываются с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеют иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует третью форму MUC16, эта третья форма гликозилирована, и где аминокислотная последовательность третьей формы представляет собой SEQ ID № 139; и (iii) ингибируют инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16. В предпочтительном варианте осуществления антитела к гликозилированному MUC16 и их антигенсвязывающие фрагменты, описанные в настоящем описании, иммуноспецифически связывают эпитоп, который содержит аминокислотный остаток 1806 (Asn1806) из SEQ ID № 150, где Asn1806 N-гликозилирован (в настоящем описании обозначают как «гликозилирование Asn1806»). Как показано в примерах в разделе 6 в настоящем описании, гликозилирование Asn1806 важно для MUC16-опосредованной инвазии и роста опухолевых клеток. Таким образом, антитела к гликозилированному MUC16 и их антигенсвязывающие фрагменты, описанные в настоящем описании, способны к связывающему блокированию такой инвазии и роста опухолевых клеток.
[00198] В одном из вариантов осуществления антителу к гликозилированному MUC16 или его антигенсвязывающему фрагменту необходим N-гликозилированный Asn1800 в дополнение к N-гликозилированном Asn1806 для связывания с MUC16 (т. е., оба N-гликозилированных участка представляют собой часть эпитопа, распознаваемого антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом). «Asn1800» относится к аминокислотному остатку 1800 из SEQ ID № 150. Такое антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент можно идентифицировать по (i) его способности иммуноспецифически связываться с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; и (ii) отсутствию у него иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует пятую форму MUC16, эта пятая форма гликозилирована, и где аминокислотная последовательность пятой формы представляет собой SEQ ID № 172, где клетка, которая рекомбинантно экспрессирует первую форму MUC16, относится к тому же типу клеток, что и клетка, которая рекомбинантно экспрессирует пятую форму MUC16.
[00199] В одном из вариантов осуществления антителу к гликозилированному MUC16 или его антигенсвязывающему фрагменту необходим N-гликозилированный Asn1806, но не необходим N-гликозилированный Asn1800, для связывания с MUC16 (т. е. N-гликозилированный Asn1806 представляет собой часть эпитопа, распознаваемого антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, но N-гликозилированный Asn1800 не представляет собой часть эпитопа, распознаваемого антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом). Такое антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент можно идентифицировать по (i) его способности иммуноспецифически связываться с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) отсутствию у него иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует третью форму MUC16, эта третья форма гликозилирована, и где аминокислотная последовательность третьей формы представляет собой SEQ ID № 139; и (iii) его способности иммуноспецифически связываться с клеткой, которая рекомбинантно экспрессирует четвертую форму MUC16, эта четвертая форма гликозилирована, и где аминокислотная последовательность четвертой формы представляет собой SEQ ID № 152; и (iii) где клетка, которая рекомбинантно экспрессирует первую форму MUC16, клетка, которая рекомбинантно экспрессирует третью форму MUC16, и клетка, которая рекомбинантно экспрессирует четвертую форму MUC16, относятся к одному типу клеток.
[00200] Белок, кодируемый аминокислотной последовательностью из SEQ ID № 133, также упоминают в настоящем описании как MUC16c114, и он состоит из C-концевых 114 аминокислотных остатков зрелого MUC16 (SEQ ID № 150 представляет собой последовательность зрелого MUC16). MUC16c114 способен к N-гликозилированию по аминокислотным остаткам аспарагина в положениях 1, 24 и 30 из SEQ ID № 133 (соответствующих положениям аминокислот Asn1777, Asn1800 и Asn1806 из SEQ ID № 150).
[00201] Белок, кодируемый аминокислотной последовательностью из SEQ ID № 139, также упоминают в настоящем описании как MUC16c114-N3. MUC16c114-N3 состоит из C-концевых 114 аминокислотных остатков зрелого MUC16 (SEQ ID № 150 представляет собой последовательность зрелого MUC16), за исключением того, что аспарагин в положении аминокислоты 30 (соответствующем положению аминокислоты 1806 из SEQ ID № 150) мутирован в аланин. Таким образом, MUC16c114-N3 не способен к N-гликозилированию в положении аминокислоты 30 из SEQ ID № 139 (соответствующем положению аминокислоты Asn1806 из SEQ ID № 150).
[00202] Белок, кодируемый аминокислотной последовательностью из SEQ ID № 152, также упоминают в настоящем описании как MUC16c114-N2. MUC16c114-N2 состоит из C-концевых 114 аминокислотных остатков зрелого MUC16 (SEQ ID № 150 представляет собой последовательность зрелого MUC16), за исключением того, что аспарагин в положении аминокислоты 24 (соответствующем положению аминокислоты Asn1800 из SEQ ID № 150) мутирован в аланин. Таким образом, MUC16c114-N2 не способен к N-гликозилированию в положении аминокислоты 24 из SEQ ID № 152 (соответствующем положению аминокислоты Asn1800 из SEQ ID № 150).
[00203] Белок, кодируемый аминокислотной последовательностью из SEQ ID № 172, также упоминают в настоящем описании как MUC16c114-N23. MUC16c114-N23 состоит из C-концевых 114 аминокислотных остатков зрелого MUC16 (SEQ ID № 150 представляет собой последовательность зрелого MUC16), за исключением того, что аспарагины в положениях аминокислот 24 и 30 (соответствующих положениям аминокислот Asn1800 и Asn1806 из SEQ ID № 150) мутированы в аланины. Таким образом, MUC16c114-N23 не способен к N-гликозилированию в положениях аминокислот 24 и 30 из SEQ ID № 157 (соответствующих положениям аминокислот Asn1800 и Asn1806 из SEQ ID № 150).
[00204] Также изобретение относится к тяжелым цепям и легким цепям, где антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, содержащее указанные тяжелые и легкие цепи, (i) иммуноспецифически связывается с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеет иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибирует инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16. Также изобретение относится к полинуклеотидам (например, выделенным полинуклеотидам), содержащим последовательности нуклеиновой кислоты (например, комплементарной ДНК (кДНК)), кодирующие такие антитела, и их антигенсвязывающие фрагменты, тяжелые цепи или легкие цепи. Кроме того, изобретение относится к векторам (например, экспрессирующим векторам) и клеткам (например, выделенным клеткам или клеткам ex vivo), содержащим полинуклеотиды (например, выделенные полинуклеотиды), содержащие последовательности нуклеиновой кислоты (например, комплементарной ДНК (кДНК)), кодирующие такие антитела, и их антигенсвязывающие фрагменты, тяжелые цепи или легкие цепи. Также изобретение относится к способам получения таких антител, их антигенсвязывающих фрагментов, тяжелых цепей, легких цепей, векторов и клеток. В других аспектах, изобретение относится к способам и применениям для активности MUC16 и/или управляемого MUC16 опухолевого роста или лечения или контроляконтроля определенных состояний или нарушений, описанных в настоящем описании, например, лечения или контроля рака. Также изобретение относится к связанным композициям (например, фармацевтическим композициям), наборам и диагностическим способам.
[00205] В рамках изобретения, термин «MUC16» или «полипептид MUC16» или «пептид MUC16» относится к связанному белку муцину MUC16, как описано в Yin BW and Lloyd KO, 2001, J Biol Chem. 276(29):27371-5. Под номером доступа GenBank™ NM_024690.2 (SEQ ID № 137) предоставлена образцовая последовательность нуклеиновой кислоты MUC16 человека. Под номером доступа GenBank™ NP_078966.2 (SEQ ID № 136) представлена образцовая аминокислотная последовательность MUC16 человека. Нативный MUC16 содержит внутриклеточный домен, трансмембранный домен, эктодомен проксимально к предполагаемому сайту расщепления и большую сильно гликозилированную область из 12-20 повторов, каждый 156 аминокислот в длину (фиг. 1A). «Незрелый» MUC16 относится к SEQ ID № 136, которая содержит сигнальную последовательность MUC16 (аминокислотные остатки 1-60 из SEQ ID № 136). «Зрелый MUC16» относится к нативному MUC16, как экспрессировано на клеточной поверхности, т.е. где сигнальная последовательность удалена посредством клеточного процессинга, например, SEQ ID № 150, где удалены первые 60 аминокислотных остатков из SEQ ID № 136 (т.е. SEQ ID № 136 представляет собой «незрелую» форму MUC16).
[00206] В отношении названий антител, (i) 18C6 и 18C6.D12 используют взаимозаменяемо, (ii) 10C6 и 10C6.E4 используют взаимозаменяемо, (iii) 19C11 и 19C11.H6 используют взаимозаменяемо, и (iv) 7B12 и 7B12.B3 используют взаимозаменяемо. Субклоны антител (т.е. 18C6.D12, 10C6.E4, 19C11.H6 и 7B12.B3) использовали в экспериментах, описанных в разделе 6.
5.1 АНТИТЕЛА
[00207] Антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты могут включать, например, моноклональные антитела, поликлональные антитела, рекомбинантно получаемые антитела, моноспецифические антитела, полиспецифические антитела (в том числе биспецифические антитела), антитела человека, гуманизированные антитела, химерные антитела, иммуноглобулины, синтетические антитела, тетрамерные антитела, содержащие молекулы двух тяжелых цепей и двух легких цепей, мономер легкой цепи антитела, мономер тяжелой цепи антитела, димер легкой цепи антитела, димер тяжелой цепи антитела, пару легкая цепь антитела-тяжелая цепь антитела, интраантитела, однодоменные антитела, моновалентные антитела, одноцепочечные антитела или одноцепочечные вариабельные фрагменты (scFv), камелизованные антитела, аффитела, и Fv с дисульфидной связью (dsFv) или их фрагменты. Такие антитела можно получать способами, известными в данной области.
[00208] Полиспецифическое антитело или его фрагмент относится к антителу или его фрагменту, которые могут связываться одновременно по меньшей мере с двумя мишенями, которые имеют различную структуру, например, два различных антигена, два различных эпитопа на одном и том же антигене или гаптен и антиген или эпитоп. Одна специфичность может быть, например, для антигена или эпитопа B-клетки, T-клетки, миелоидной, плазматической или тучной клетки, такой как, например, CD3. Другая специфичность может быть к другому антигену на клетках того же или другого типа, такому как, например, MUC16. Полиспецифические поливалентные антитела представляют собой конструкции, которые имеют больше чем один сайт связывания, и сайты связывания имеют различную специфичность, например, биспецифическое диатело, где один сайт связывания вступает в реакцию с одним антигеном, а другой с другим антигеном.
[00209] Биспецифическое антитело представляет собой антитело, которое может одновременно связываться с двумя мишенями, которые имеют различную структуру. Биспецифические антитела (bsAb) и фрагменты биспецифических антител (bsFab) имеют по меньшей мере одно плечо, которое иммуноспецифически связывается с первой мишенью, например, MUC16, и по меньшей мере одно другое плечо, которое иммуноспецифически связывается со второй мишенью, такой как, например, CD3. Различные биспецифические слитые белки можно получать с использованием молекулярного конструирования. В одной форме биспецифический слитый белок является двухвалентным и состоит, например, из (i) scFv с одним сайтом связывания для одного антигена и (ii) антитела или Fab фрагмента с одним сайтом связывания для второго антигена. В другой форме биспецифический слитый белок является четырехвалентным и состоит, например, из IgG с двумя сайтами связывания для одного антигена и двумя идентичными scFv для второго антигена. См., например, международную публикацию № WO 2011/1160119, которая включена по ссылке в настоящее описание в полном объеме.
[00210] Недавно разработанные способы получения биспецифических моноклональных антител включают использование сконструированных рекомбинантных моноклональных антител, которые имеют дополнительные остатки цистеина с тем, чтобы сшивать их более прочно, чем более обычные изотипы иммуноглобулинов. См., например, FitzGerald et al., Protein Eng. 10(10):1221-1225, 1997. Другой поход состоит в том, чтобы конструировать рекомбинантные слитые белки, соединяя два или больше различных одноцепочечнных сегментов антител или фрагментов антитела с требуемыми двойными специфичностями. См., например, Coloma et al., Nature Biotech. 15:159-163, 1997. Различные биспецифические слитые белки можно получать с использованием молекулярного конструирования.
[00211] Биспецифические слитые белки, соединяющие два или больше различных одноцепочечных антител или фрагментов антител, можно получать схожим образом. Рекомбинантные способы можно использовать для того, чтобы получать различные слитые белки. В некоторых аспектах, гибкий линкер соединяет scFv (например, scFv, направленный на CD3) с константной областью легкой цепи моноклонального антитела (например, антитела к гликозилированному MUC16, описанного в настоящем описании; см. раздел 5.1). Подходящие последовательности линкеров, необходимые для соединения тяжелой цепи Fc с scFv с сохранением рамки считывания, вводят в домены VL и Vκ через ПЦР реакции. Фрагмент ДНК, кодирующий scFv, после этого лигируют в каркасный вектор, содержащий ДНК последовательность, кодирующую домен CH1. Получаемую конструкцию вырезают и лигируют в вектор, который содержит ДНК последовательность, кодирующую область VH антитела (например, антитела к гликозилированному MUC16). Получаемый вектор можно использовать для того, чтобы трансфицировать подходящую клетку-хозяина, такую как клетка млекопитающего, для экспрессии биспецифического слитого белка.
[00212] Антитела к гликозилированному MUC16, описанные в настоящем описании (см. раздел 5.1), и их фрагменты в некоторых вариантах осуществления также можно использовать для того, чтобы получать функциональные биспецифические одноцепочечные антитела (bscAb), также называемые диателами, и их можно получать в клетках млекопитающих с использованием рекомбинантных способов. См., например, Mack et al., Proc. Natl. Acad. Sci., 92: 7021-7025, 1995, включенный в настоящее описание посредством ссылки. Например, bscAb можно получать посредством соединения двух одноцепочечных Fv фрагментов через линкер глицин-серин с использованием рекомбинантных способов. Домены VL и VH двух антител, представляющих интерес, выделяют с использованием стандартных способов ПЦР, известных в данной области. Биспецифические одноцепочечные антитела и биспецифические слитые белки включены в объем настоящего изобретения.
[00213] В некоторых вариантах осуществления антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, описанные в настоящем описании, относятся к scFv. scFv является термином, принятым в данной области. scFv содержит слитый белок вариабельных областей тяжелой (VH) и легкой (VL) цепей иммуноглобулина, где слитый белок сохраняет ту же антигенную специфичность, что и целый иммуноглобулин. VH сливают с VL через пептидный линкер. В некоторых вариантах осуществления пептидный линкер составляет между 5 и 25, 5 и 15, 10 и 20, 10 и 15 или 15 и 25 аминокислотными остатками в длину. В некоторых вариантах осуществления пептидный линкер scFv проявляет одну или несколько характеристик, подходящих для пептидного линкера, которые известны специалисту в данной области. В некоторых вариантах осуществления пептидный линкер scFv содержит аминокислоты, которые допускают растворимость пептидного линкера scFv, такие как, например, серин и треонин. В некоторых вариантах осуществления пептидный линкер scFv содержит аминокислоты, допускают гибкость пептидного линкера scFv, такие как, например, глицин. В некоторых вариантах осуществления пептидный линкер scFv соединяет N-конец VH с C-концом VL. В некоторых вариантах осуществления пептидный линкер scFv может соединять C-конец VH с N-концом VL.
[00214] В некоторых вариантах осуществления антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, описанные в настоящем описании, относятся к химерным антигенным рецепторам (CAR). CAR является термином, принятым в данной области. CAR может быть нацелен на антиген, ассоциированный с опухолью (например, MUC16). CAR, представленные в настоящем описании, обычно состоят из scFv, полученного из антитела к гликозилированному MUC16, трансмембранного домена, который в некоторых вариантах осуществления представляет собой трансмембранный домен, полученный из костимуляторной молекулы T-клетки (например, трансмембранный домен, полученный из CD28, CD8, CD38, OX-40 или 4-1BB), и первичный сигнальный домен, такой как цитоплазматический сигнальный домен дзета (ζ) цепи T-клеточного рецептора (TCR). В некоторых вариантах осуществления CAR дополнительно содержит одну или несколько дополнительных областей или доменов, таких как один или несколько спейсеров или линкеров, в том числе внеклеточный спейсер, такой как тот, который получен из антитела или другой молекулы клеточной поверхности, такой как спейсер, содержащий одно или несколько из CH2, CH3 и/или шарнирных областей антитела, или спейсер, полученный из молекулы CD28 или молекулы CD8, или другой спейсер. Также в настоящем описании предоставлены клетки, такие как T-клетки, сконструированные для того, чтобы экспрессировать такие CAR, например, те, которые рекомбинантно экспрессируют такой CAR. CAR-экспрессирующая T-клетка, при распознавании MUC16-экспрессирующей опухоли, предпочтительно индуцирует активацию, пролиферацию T-клетки и/или лизис клетки такой опухоли.
[00215] Антитела к гликозилированному MUC16 могут относиться к любому типу (например, IgG, IgE, IgM, IgD, IgA или IgY), любому классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 или IgA2) или любому подклассу (например, IgG2a или IgG2b) молекул иммуноглобулинов. В некоторых вариантах осуществления антитела, описанные в настоящем описании, представляют собой антитела IgG или их класс или подкласс. В некоторых вариантах осуществления антитела, описанные в настоящем описании, представляют собой антитела IgG1. В некоторых вариантах осуществления антитела, описанные в настоящем описании, представляют собой антитела IgG2. В некоторых вариантах осуществления антитела, описанные в настоящем описании, представляют собой антитела IgG2a. В некоторых вариантах осуществления антитела, описанные в настоящем описании, представляют собой антитела IgG2b. В некоторых вариантах осуществления антитела, описанные в настоящем описании, представляют собой смесь антител IgG2a и IgG2b. В конкретном варианте осуществления антитело представляет собой гуманизированную форму моноклонального антитела грызуна.
[00216] В частном варианте осуществления антиген, с которым связывается антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представляет собой форму MUC16, которая гликозилирована, например, в которой аминокислотная последовательность формы MUC16 представляет собой SEQ ID № 133. Белок, кодируемый аминокислотной последовательностью из SEQ ID № 133, также упоминают в настоящем описании как MUC16c114, и он состоит из C-концевых 114 аминокислотных остатков зрелого MUC16. MUC16c114 способен к N-гликозилированию аспарагина в положениях аминокислот 1, 24 и 30 из SEQ ID № 133 (соответствующих положениям аминокислот Asn1777, Asn1800 и Asn1806 из SEQ ID № 150). Зрелый MUC16 (SEQ ID № 150) относится к полноразмерному MUC16, в котором удалена сигнальная последовательность и в котором сигнальная последовательность состоит из первых 60 аминокислотных остатков из SEQ ID № 136 (т. е. SEQ ID № 136 представляет собой «незрелую» форму MUC16).
[00217] Антигенсвязывающие фрагменты антител к гликозилированному MUC16 могут представлять собой Fab фрагменты, F(ab')2 фрагменты или часть антитела к гликозилированному MUC16, которые содержат аминокислотные остатки, которые придают антителу к гликозилированному MUC16 его специфичность к антигену (например, определяющие комплементарность области (CDR)). Антитело к гликозилированному MUC16 можно получать от животных любых видов, таких как грызуны (например, мышь, крыса или хомяк) и человек.
[00218] В рамках изобретения, термины «вариабельная область» или «вариабельный домен» используют взаимозаменяемо, и они распространены в данной области. Вариабельная область обычно относится к части антитела, в целом, части легкой или тяжелой цепи, обычно приблизительно от 110 до 120 N-концевых аминокислот в зрелой тяжелой цепи и приблизительно от 90 до 100 N-концевых аминокислот в зрелой легкой цепи, которая отличается на протяжении последовательности среди антител и которая обеспечивает связывание и специфичность конкретного антитела к его конкретному антигену. Вариабельность в последовательности сосредоточена в тех областях, которые называют определяющими комплементарность областями (CDR), тогда как более высоко консервативные области в вариабельном домене называют каркасными областями (FR). CDR фланкированы с помощью FR. В целом, пространственная ориентация CDR и FR представляет собой следующее, в направлении от N-конца к C-концу: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. Не желая ограничиваться каким-либо конкретным механизмом или теорией, полагают, что CDR легкой и тяжелой цепей в первую очередь отвечают за взаимодействие и специфичность антитела в отношении антигена. В некоторых вариантах осуществления вариабельная область представляет собой вариабельную область грызуна (например, мыши или крысы). В некоторых вариантах осуществления вариабельная область представляет собой вариабельную область человека. В некоторых вариантах осуществления вариабельная область содержит CDR грызуна (например, мыши или крысы) и каркасные области (FR) человека. В конкретных вариантах осуществления вариабельная область представляет собой вариабельную область примата (например, не являющийся человеком примата). В некоторых вариантах осуществления вариабельная область содержит CDR грызуна или мыши и каркасные области (FR) примата (например, не являющегося человеком примата).
[00219] CDR определяют различными способами, известными в данной области, включая Kabat, Chothia и IMGT, а также образцовые определения. Определение Kabat основано на вариабельности последовательностей (Kabat, Elvin A. et al., Sequences of Proteins of Immunological Interest. Bethesda: National Institutes of Health, 1983). В отношении системы нумерации Kabat, (i) CDR1 VH обычно присутствует в положениях аминокислот от 31 до 35 тяжелой цепи, которые необязательно могут включать одну или две дополнительные аминокислоты после положения аминокислоты 35 (обозначаемые в схеме нумерации Kabat как 35A и 35B); (ii) CDR2 VH обычно присутствует в положениях аминокислот от 50 до 65 тяжелой цепи; и (iii) CDR2 VH обычно присутствует в положениях аминокислот от 95 до 102 тяжелой цепи (Kabat, Elvin A. et al., Sequences of Proteins of Immunological Interest. Bethesda: National Institutes of Health, 1983). В отношении системы нумерации Kabat, (i) CDR1 VL обычно присутствует в положениях аминокислот от 24 до 34 легкой цепи; (ii) CDR2 VL обычно присутствует в положениях аминокислот от 50 до 56 легкой цепи; и (iii) CDR3 VL обычно присутствует в положениях аминокислот от 89 до 97 легкой цепи (Kabat, Elvin A. et al., Sequences of Proteins of Immunological Interest. Bethesda: National Institutes of Health, 1983). Как хорошо известно специалистам в данной области, используя систему нумерации Kabat, фактическая линейная аминокислотная последовательность вариабельного домена антитела может содержать меньше или больше аминокислот из-за укорочения или удлинения FR и/или CDR и, по существу, номер аминокислоты по Kabat не обязательно является таким же, как ее линейный номер аминокислоты.
[00220] Определение Chothia основано на местоположении областей структурных петель (Chothia et al., (1987) J Mol Biol 196: 901-917; и патент США № 7709226). Термин «CDR по Chothia» и схожие термины общепризнаны в данной области и относятся к последовательностям CDR антител, как определяют в соответствии со способом Chothia and Lesk, 1987, J. Mol. Biol., 196:901-917, которые упоминают в настоящем описании как «CDR по Chothia» (также см., например, патент США № 7709226 и Martin, A., «Protein Sequence and Structure Analysis of Antibody Variable Domains» в Antibody Engineering, под редакцией Kontermann и Dübel, глава 31, стр. 422-439, Springer-Verlag, Berlin (2001)). В отношении системы нумерации Chothia, используя систему нумерации Kabat для нумерации аминокислотных остатков в области VH, (i) CDR1 VH обычно присутствует в положениях аминокислот от 26 до 32 тяжелой цепи; (ii) CDR2 VH обычно присутствует в положениях аминокислот от 53 до 55 тяжелой цепи; и (iii) CDR3 VH обычно присутствует в положениях аминокислот от 96 до 101 тяжелой цепи. В конкретном варианте осуществления в отношении системы нумерации Chothia, используя систему нумерации Kabat для нумерации аминокислотных остатков в области VH, (i) CDR1 VH обычно присутствует в положениях аминокислот от 26 до 32 или 34 тяжелой цепи; (ii) CDR2 VH обычно присутствует в положениях аминокислот от 52 до 56 (в одном из вариантов осуществления CDR2 находится в положениях 52A-56, где 52A следует за положением 52) тяжелой цепи; и (iii) CDR3 VH обычно присутствует в положениях аминокислот от 95 до 102 тяжелой цепи (в одном из вариантов осуществления аминокислоты в положениях с номерами 96-100 отсутствуют). В отношении системы нумерации Chothia, используя систему нумерации Kabat для нумерации аминокислотных остатков в области VL, (i) CDR1 VL обычно присутствует в положениях аминокислот от 26 до 33 легкой цепи; (ii) CDR2 VL обычно присутствует в положениях аминокислот от 50 до 52 легкой цепи; и (iii) CDR3 VL обычно присутствует в положениях аминокислот от 91 до 96 легкой цепи. В конкретном варианте осуществления в отношении системы нумерации Chothia, используя систему нумерации Kabat для нумерации аминокислотных остатков в области VL, (i) CDR1 VL обычно присутствует в положениях аминокислот от 24 до 34 легкой цепи; (ii) CDR2 VL обычно присутствует в положениях аминокислот от 50 до 56 легкой цепи; и (iii) CDR3 VL обычно присутствует в положениях аминокислот от 89 до 97 легкой цепи (в одном из вариантов осуществления аминокислоты в положениях с номерами 96-100 отсутствуют). Эти положения CDR по Chothia могут варьировать в зависимости от антитела, и их можно определять в соответствии со способами, известными в данной области.
[00221] Определение IMGT взято из IMGT («IMGT®, международной информационной системы ImMunoGeneTics®, веб-сайт imgt.org, основатель и директор: Marie-Paule Lefranc, Montpellier, France; см., например, Lefranc, M.-P., 1999, The Immunologist, 7:132-136 и Lefranc, M.-P. et al., 1999, Nucleic Acids Res., 27:209-212, оба они включены в настоящее описание посредством ссылки в полном объеме). В отношении системы нумерации IMGT, (i) CDR1 VH обычно присутствует в положениях аминокислот от 25 до 35 тяжелой цепи; (ii) CDR2 VH обычно присутствует в положениях аминокислот от 51 до 57 тяжелой цепи; и (iii) CDR2 VH обычно присутствует в положениях аминокислот от 93 до 102 тяжелой цепи. В отношении системы нумерации IMGT, (i) CDR1 VL обычно присутствует в положениях аминокислот от 27 до 32 легкой цепи; (ii) CDR2 VL обычно присутствует в положениях аминокислот от 50 до 52 легкой цепи; и (iii) CDR3 VL обычно присутствует в положениях аминокислот от 89 до 97 легкой цепи.
5.1.1 ПОСЛЕДОВАТЕЛЬНОСТИ И СТРУКТУРЫ
[00222] В некоторых вариантах осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающему фрагменту, которые содержат CDR VH какого-либо из антител к гликозилированному MUC16, представленных в настоящем описании, например, как изложено в таблицах 1, 3 и 5. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат CDR1 VH антитела к гликозилированному MUC16, как изложено в таблице 1, 3 или 5. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат CDR2 VH антитела к гликозилированному MUC16, как изложено в таблице 1, 3 или 5. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат CDR3 VH антитела к гликозилированному MUC16, как изложено в таблице 1, 3 или 5. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат одну, две или все три CDR VH антитела к гликозилированному MUC16, как изложено в таблице 1, 3 или 5 (например, CDR VL в ряду два таблицы 1, например, все CDR VH для антитела 10C6)
[00223] В некоторых вариантах осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающему фрагменту, которые содержат CDR VL какого-либо из антител к MUC16, представленных в настоящем описании, например, как изложено в таблицах 2, 4 и 6. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат CDR1 VH антитела к гликозилированному MUC16, как изложено в таблице 2, 4 или 6. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат CDR2 VH антитела к гликозилированному MUC16, как изложено в таблице 2, 4 или 6. В некоторых вариантах осуществления антитело к MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат CDR3 VH антитела к гликозилированному MUC16, как изложено в таблице 2, 4 или 6. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат одну, две или все три CDR VL антитела к гликозилированному MUC16 в таблице 2, 4 или 6 (например, CDR VL в ряду два таблицы 2, например, все CDR VH для антитела 10C6)
[00224] Таблица 1. Аминокислотные последовательности VH CDR (Kabat).
[00225] Таблица 2. Аминокислотные последовательности VL CDR (Kabat).
[00226] Таблица 3. Аминокислотные последовательности VH CDR (Chothia).
[00227] Таблица 4. Аминокислотные последовательности VL CDR (Chothia).
[00228] Таблица 5. Аминокислотные последовательности VH CDR (IMGT).
[00229] Таблица 6. Аминокислотные последовательности VL CDR (IMGT).
[00230] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит:
(a) CDR1 VH, которая содержит аминокислотную последовательность TX1GMGVG (SEQ ID № 103), в которой X1 представляет собой L или V;
(b) CDR2 VH, которая содержит аминокислотную последовательность HIWWDDX2DKYYX3PALKS (SEQ ID № 104), в которой X2 представляет собой E или отсутствует и X3 представляет собой Y или N; и
(c) CDR3 VH, которая содержит аминокислотную последовательность IGTAQATDALDY (SEQ ID № 105).
[00231] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит:
(a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX8TX9GM (SEQ ID № 109), в которой X8 представляет собой N или S и X9 представляет собой L или V;
(b) CDR2 VH, которая содержит аминокислотную последовательность WDDX10 (SEQ ID № 110), в которой X10 представляет собой E или отсутствует; и
(c) CDR3 VH, которая содержит аминокислотную последовательность GTAQATDALD (SEQ ID № 111).
[00232] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит:
(a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX15TX16GMG (SEQ ID № 115), в которой X15 представляет собой N или S и X16 представляет собой V или L;
(b) CDR2 VH, которая содержит аминокислотную последовательность IWWDDX17DK (SEQ ID № 116), в которой X17 представляет собой E или отсутствует; и
(c) CDR3 VH, которая содержит аминокислотную последовательность X18RIGTAQATDALDY (SEQ ID № 117), в которой X18 представляет собой T, A или S.
[00233] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 3, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 4, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 5. В конкретном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 9, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 10, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 11. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 15, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 16, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 17.
[00234] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 23, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 24, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 25. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 29, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 30, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 31. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 35, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 36, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 37.
[00235] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 43, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 44, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 45. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 49, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 50, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 51. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 55, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 56, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 57.
[00236] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 63, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 64, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 65. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 69, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 70, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 71. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 75, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 76, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 77.
[00237] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 83, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 84, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 85. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 89, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 90, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 91. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 95, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 96, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 97.
[00238] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит:
(a) CDR1 VL, которая содержит аминокислотную последовательность RSSKSLX4X5SNGNTYLY (SEQ ID № 106), в которой X4 представляет собой R или L и X5 представляет собой K или H;
(b) CDR2 VL, которая содержит аминокислотную последовательность YMSNLAS (SEQ ID № 107); и
(c) CDR3 VL, которая содержит аминокислотную последовательность MQX6LEX7PLT (SEQ ID № 108), в которой X6 представляет собой G или S и X7 представляет собой H или Y.
[00239] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит:
(a) CDR1 VL, которая содержит аминокислотную последовательность SKSLX11X12SNGNTY (SEQ ID № 112), в которой X11 представляет собой L или R и X12 представляет собой H или K;
(b) CDR2 VL, которая содержит аминокислотную последовательность YMS (SEQ ID № 113); и
(c) CDR3 VL, которая содержит аминокислотную последовательность X13LEX14PL (SEQ ID № 114), в которой X13 представляет собой G или S и X14 представляет собой H или Y.
[00240] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит:
(a) определяющую комплементарность область (CDR)1 VL, которая содержит аминокислотную последовательность KSLX19X20SNGNTY (SEQ ID № 118), в которой X19 представляет собой V или L и X20 представляет собой H или K;
(b) CDR2 VL, которая содержит аминокислотную последовательность YMS (SEQ ID № 119); и
(c) CDR3 VL, которая содержит аминокислотную последовательность MQSLEYPLT (SEQ ID № 120).
[00241] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 6, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 7, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 8. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 12, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 13, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 14. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 18, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 19, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 20.
[00242] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 26, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 27, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 28. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 32, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 33, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 34. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 38, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 39, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 40.
[00243] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 46, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 47, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 48. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 52, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 53, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 54. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 58, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 59, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 60.
[00244] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 66, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 67, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 68. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 72, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 73, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 74. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 78, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 79, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 80.
[00245] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 86, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 87, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 88. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 92, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 93, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 94. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 98, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 99, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 100.
[00246] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат:
(i) VH, которая содержит:
(a) CDR1 VH, которая содержит аминокислотную последовательность TX1GMGVG (SEQ ID № 103), в которой X1 представляет собой L или V;
(b) CDR2 VH, которая содержит аминокислотную последовательность HIWWDDX2DKYYX3PALKS (SEQ ID № 104), в которой X2 представляет собой E или отсутствует и в которой X3 представляет собой Y или N; и
(c) CDR3 VH, которая содержит аминокислотную последовательность IGTAQATDALDY (SEQ ID № 105); и
(ii) VL, которая содержит:
(a) CDR1 VL, которая содержит аминокислотную последовательность RSSKSLX4X5SNGNTYLY (SEQ ID № 106), в которой X4 представляет собой R или L и в которой X5 представляет собой K или H;
(b) CDR2 VL, которая содержит аминокислотную последовательность YMSNLAS (SEQ ID № 107); и
(c) CDR3 VL, которая содержит аминокислотную последовательность MQX6LEX7PLT (SEQ ID № 108), в которой X6 представляет собой G или S и в которой X7 представляет собой H или Y.
[00247] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат
(i) VH, которая содержит:
(a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX8TX9GM (SEQ ID № 109), в которой X8 представляет собой N или S и в которой X9 представляет собой L или V;
(b) CDR2 VH, которая содержит аминокислотную последовательность WDDX10 (SEQ ID № 110), в которой X10 представляет собой E или отсутствует; и
(c) CDR3 VH, которая содержит аминокислотную последовательность GTAQATDALD (SEQ ID № 111); и
(ii) VL, которая содержит:
(a) CDR1 VL, которая содержит аминокислотную последовательность SKSLX11X12SNGNTY (SEQ ID № 112), в которой X11 представляет собой L или R и в которой X12 представляет собой H или K;
(b) CDR2 VL, которая содержит аминокислотную последовательность YMS (SEQ ID № 113); и
(c) CDR3 VL, которая содержит аминокислотную последовательность X13LEX14PL (SEQ ID № 114), в которой X13 представляет собой G или S и в которой X14 представляет собой H или Y.
[00248] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат
(i) VH, которая содержит:
(a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX15TX16GMG (SEQ ID № 115), в которой X15 представляет собой N или S и в которой X16 представляет собой V или L;
(b) CDR2 VH, которая содержит аминокислотную последовательность IWWDDX17DK (SEQ ID № 116), в которой X17 представляет собой E или отсутствует; и
(c) CDR3 VH, которая содержит аминокислотную последовательность X18RIGTAQATDALDY (SEQ ID № 117), в которой X18 представляет собой T, A или S; и
(ii) VL, которая содержит:
(a) CDR1 VL, которая содержит аминокислотную последовательность KSLX19X20SNGNTY (SEQ ID № 118), в которой X19 представляет собой V или L и в которой X20 представляет собой H или K;
(b) CDR2 VL, которая содержит аминокислотную последовательность YMS (SEQ ID № 119); и
(c) CDR3 VL, которая содержит аминокислотную последовательность MQSLEYPLT (SEQ ID № 120).
[00249] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат:
(i) VH, которая содержит:
(a) CDR1 VH, которая содержит аминокислотную последовательность TX1GMGVG (SEQ ID № 103), в которой X1 представляет собой L или V;
(b) CDR2 VH, которая содержит аминокислотную последовательность HIWWDDX2DKYYX3PALKS (SEQ ID № 104), в которой X2 представляет собой E или отсутствует и в которой X3 представляет собой Y или N; и
(c) CDR3 VH, которая содержит аминокислотную последовательность IGTAQATDALDY (SEQ ID № 105); и
(ii) VL, которая содержит:
(a) CDR1 VL, которая содержит аминокислотную последовательность SEQ ID № 6;
(b) CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 7; и
(c) CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 8.
[00250] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат
(i) VH, которая содержит:
(a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX8TX9GM (SEQ ID № 109), в которой X8 представляет собой N или S и в которой X9 представляет собой L или V;
(b) CDR2 VH, которая содержит аминокислотную последовательность WDDX10 (SEQ ID № 110), в которой X10 представляет собой E или отсутствует; и
(c) CDR3 VH, которая содержит аминокислотную последовательность GTAQATDALD (SEQ ID № 111); и
(ii) VL, которая содержит:
(a) CDR1 VL, которая содержит аминокислотную последовательность SEQ ID № 12;
(b) CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 13; и
(c) CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 14.
[00251] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит:
(a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX15TX16GMG (SEQ ID № 115), в которой X15 представляет собой N или S и в которой X16 представляет собой V или L;
(b) CDR2 VH, которая содержит аминокислотную последовательность IWWDDX17DK (SEQ ID № 116), в которой X17 представляет собой E или отсутствует; и
(c) CDR3 VH, которая содержит аминокислотную последовательность X18RIGTAQATDALDY (SEQ ID № 117), в которой X18 представляет собой T, A или S; и
(ii) VL, которая содержит:
(a) CDR1 VL, которая содержит аминокислотную последовательность SEQ ID № 18;
(b) CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 19; и
(c) CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 20.
[00252] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат
(i) VH, которая содержит:
(a) CDR1 VH, которая содержит аминокислотную последовательность TX1GMGVG (SEQ ID № 103), в которой X1 представляет собой L или V;
(b) CDR2 VH, которая содержит аминокислотную последовательность HIWWDDX2DKYYX3PALKS (SEQ ID № 104), в которой X2 представляет собой E или отсутствует и в которой X3 представляет собой Y или N; и
(c) CDR3 VH, которая содержит аминокислотную последовательность IGTAQATDALDY (SEQ ID № 105); и
(ii) VL, которая содержит:
(a) CDR1 VL, которая содержит аминокислотную последовательность SEQ ID № 26;
(b) CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 27; и
(c) CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 28.
[00253] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат:
(i) VH, которая содержит:
(a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX8TX9GM (SEQ ID № 109), в которой X8 представляет собой N или S и в которой X9 представляет собой L или V;
(b) CDR2 VH, которая содержит аминокислотную последовательность WDDX10 (SEQ ID № 110), в которой X10 представляет собой E или отсутствует; и
(c) CDR3 VH, которая содержит аминокислотную последовательность GTAQATDALD (SEQ ID № 111); и
(ii) VL, которая содержит:
(a) CDR1 VL, которая содержит аминокислотную последовательность SEQ ID № 32;
(b) CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 33; и
(c) CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 34.
[00254] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат:
(i) VH, которая содержит:
(a) CDR1 VH, которая содержит аминокислотную последовательность GFSLX15TX16GMG (SEQ ID № 115), в которой X15 представляет собой N или S и в которой X16 представляет собой V или L;
(b) CDR2 VH, которая содержит аминокислотную последовательность IWWDDX17DK (SEQ ID № 116), в которой X17 представляет собой E или отсутствует; и
(c) CDR3 VH, которая содержит аминокислотную последовательность X18RIGTAQATDALDY (SEQ ID № 117), в которой X18 представляет собой T, A или S; и
(ii) VL, которая содержит:
(d) CDR1 VL, которая содержит аминокислотную последовательность SEQ ID № 38;
(e) CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 39; и
(f) CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 40.
[00255] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 3, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 4, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 5; и (b) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 6, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 7, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 8. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 9, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 10, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 11; и (b) CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 12, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 13, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 14. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 15, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 16, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 17; и (b) CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 18, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 19, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 20.
[00256] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 23, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 24, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 25; и (b) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 26, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 27, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 28. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 29, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 30, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 31; и (b) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 32, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 33, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 34. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 35, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 36, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 37; и (b) CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 38, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 39, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 40.
[00257] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 43, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 44, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 45; и (b) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 46, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 47, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 48. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 49, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 50, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 51; и (b) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 52, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 53, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 54. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 55, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 56, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 57; и (b) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 58, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 59, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 60.
[00258] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 63, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 64, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 65; и (b) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 66, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 67, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 68. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 69, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 70, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 71; и (b) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 72, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 73, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 74. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 75, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 76, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 77; и (b) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 78, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 79, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 80.
[00259] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 83, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 84, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 85; и (b) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 86, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 87, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 88. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 89, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 90, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 91; и (b) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 92, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 93, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 94. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит CDR1 VH, которая содержит аминокислотную последовательность из SEQ ID № 95, CDR2 VH, которая содержит аминокислотную последовательность из SEQ ID № 96, и CDR3 VH, которая содержит аминокислотную последовательность из SEQ ID № 97; и (b) VL, которая содержит CDR1 VL, которая содержит аминокислотную последовательность из SEQ ID № 98, CDR2 VL, которая содержит аминокислотную последовательность из SEQ ID № 99, и CDR3 VL, которая содержит аминокислотную последовательность из SEQ ID № 100.
[00260] Таблица 7. Аминокислотные последовательности домена VH
[00261] Таблица 8. Аминокислотные последовательности домена VL
[00262] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат область VH, которая содержит QVX21LKESGPGX22LQPSQTLSLTCSFSGFSLX23TX24GMGVGWX25RQX26SGKGLEWLAH IWWDDX27DKYYX28PALKSRLTISX29X30X31SKNQVFLKIX32NVX33TADX34ATYYCX35RI GTAQATDALDYWGQGTSVTVSS (SEQ ID № 101), в которой X21 представляет собой T или N, X22 представляет собой I или K, X23 представляет собой N или S, X24 представляет собой V или L, X25 представляет собой S или I, X26 представляет собой P или S, X27 представляет собой E или отсутствует, X28 представляет собой N или Y, X29 представляет собой K или R, X30 представляет собой A или D, X31 представляет собой T или S, X32 представляет собой V или A, X33 представляет собой G или D, X34 представляет собой T, I или S и X35 представляет собой T, S или A.
[00263] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат область VL, которая содержит DIVMTQAAPSX36X37VTPGESVSISCRSSKSLX38X39SNGNTYLYWFLQRPGQSPQRLIYYMSNLASGVPDRFSGRGSGTDFTLX40ISRVEAX41DVGVYYCMQX42LEX43PLTFGGGTKLEIK (SEQ ID № 102), в которой X36 представляет собой I или V, X37 представляет собой P или S, X38 представляет собой R или L, X39 представляет собой K или H, X40 представляет собой R или K, X41 представляет собой E или G, X42 представляет собой S или G и X43 представляет собой Y или H.
[00264] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат
(a) область VH, которая содержит QVX21LKESGPGX22LQPSQTLSLTCSFSGFSLX23TX24GMGVGWX25RQX26SGKGLEWLAH IWWDDX27DKYYX28PALKSRLTISX29X30X31SKNQVFLKIX32NVX33TADX34ATYYCX35RI GTAQATDALDYWGQGTSVTVSS (SEQ ID № 101), в которой X21 представляет собой T или N, X22 представляет собой I или K, X23 представляет собой N или S, X24 представляет собой V или L, X25 представляет собой S или I, X26 представляет собой P или S, X27 представляет собой E или отсутствует, X28 представляет собой N или Y, X29 представляет собой K или R, X30 представляет собой A или D, X31 представляет собой T или S, X32 представляет собой V или A, X33 представляет собой G или D, X34 представляет собой T, I или S и X35 представляет собой T, S или A; и
(b) область VL, которая содержит DIVMTQAAPSX36X37VTPGESVSISCRSSKSLX38X39SNGNTYLYWFLQRPGQSPQRLIYYMSNLASGVPDRFSGRGSGTDFTLX40ISRVEAX41DVGVYYCMQX42LEX43PLTFGGGTKLEIK (SEQ ID № 102), в которой X36 представляет собой I или V, X37 представляет собой P или S, X38 представляет собой R или L, X39 представляет собой K или H, X40 представляет собой R или K, X41 представляет собой E или G, X42 представляет собой S или G и X43 представляет собой Y или H.
[00265] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат
(a) область VH, которая содержит QVX21LKESGPGX22LQPSQTLSLTCSFSGFSLX23TX24GMGVGWX25RQX26SGKGLEWLAH IWWDDX27DKYYX28PALKSRLTISX29X30X31SKNQVFLKIX32NVX33TADX34ATYYCX35RI GTAQATDALDYWGQGTSVTVSS (SEQ ID № 101), в которой X21 представляет собой T или N, X22 представляет собой I или K, X23 представляет собой N или S, X24 представляет собой V или L, X25 представляет собой S или I, X26 представляет собой P или S, X27 представляет собой E или отсутствует, X28 представляет собой N или Y, X29 представляет собой K или R, X30 представляет собой A или D, X31 представляет собой T или S, X32 представляет собой V или A, X33 представляет собой G или D, X34 представляет собой T, I или S и X35 представляет собой T, S или A; и
(b) область VL, которая содержит аминокислотную последовательность из SEQ ID № 2.
[00266] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат
(a) область VH, которая содержит QVX21LKESGPGX22LQPSQTLSLTCSFSGFSLX23TX24GMGVGWX25RQX26SGKGLEWLAH IWWDDX27DKYYX28PALKSRLTISX29X30X31SKNQVFLKIX32NVX33TADX34ATYYCX35RI GTAQATDALDYWGQGTSVTVSS (SEQ ID № 101), в которой X21 представляет собой T или N, X22 представляет собой I или K, X23 представляет собой N или S, X24 представляет собой V или L, X25 представляет собой S или I, X26 представляет собой P или S, X27 представляет собой E или отсутствует, X28 представляет собой N или Y, X29 представляет собой K или R, X30 представляет собой A или D, X31 представляет собой T или S, X32 представляет собой V или A, X33 представляет собой G или D, X34 представляет собой T, I или S и X35 представляет собой T, S или A; и
(b) область VL, которая содержит аминокислотную последовательность из SEQ ID № 62.
[00267] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH, которая содержит аминокислотную последовательность как изложено в таблице 7. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат последовательность вариабельной области тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 1 (таблица 7) (например, VH антитела 10C6). В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат последовательность вариабельной области тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 21 (таблица 7) (например, VH антитела 7B12). В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат последовательность вариабельной области тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 41 (таблица 7) (например, VH антитела 19C11). В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат последовательность вариабельной области тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 61 (таблица 7) (например, VH антитела 16C5). В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат последовательность вариабельной области тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 81 (таблица 7) (например, VH антитела 18C6).
[00268] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VL, которая содержит аминокислотную последовательность как изложено в таблице 8. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат последовательность вариабельной области легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 2 (таблица 8) (например, VL антитела 10C6). В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат последовательность вариабельной области легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 22 (таблица 8) (например, VL антитела 7B12). В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат последовательность вариабельной области легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 42 (таблица 8) (например, VL антитела 19C11). В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат последовательность вариабельной области легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 62 (таблица 8) (например, VL антитела 16C5). В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат последовательность вариабельной области легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 82 (таблица 8) (например, VL антитела 18C6).
[00269] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) VH, которая содержит аминокислотную последовательность как изложено в таблице 7; и (b) VL, которая содержит аминокислотную последовательность как изложено в таблице 8. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) последовательность вариабельной области тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 1 (таблица 7) (например, VH антитела 10C6); и (b) последовательность вариабельной области легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 2 (таблица 8) (например, VL антитела 10C6). В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) последовательность вариабельной области тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 21 (таблица 7) (например, VH антитела 7B12); и (b) последовательность вариабельной области легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 22 (таблица 8) (например, VL антитела 7B12). В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) последовательность вариабельной области тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 41 (таблица 7) (например, VH антитела 19C11); и (b) последовательность вариабельной области легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 42 (таблица 8) (например, VL антитела 19C11). В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) последовательность вариабельной области тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 61 (таблица 7) (например, VH антитела 16C5); и (b) последовательность вариабельной области легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 62 (таблица 8) (например, VL антитела 16C5). В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат (a) последовательность вариабельной области тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 81 (таблица 7) (например, VH антитела 18C6); и (b) последовательность вариабельной области легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 82 (таблица 8) (например, VL антитела 18C6).
[00270] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат CDR VH (например, как изложено в таблице 1, 3 или 5) из VH, которая содержит аминокислотную последовательность как изложено в таблице 7, и CDR VL (например, как изложено в таблице 2, 4 или 6) из VL, которая содержит аминокислотную последовательность как изложено в таблице 8.
[00271] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, можно описывать только с помощью их домена VH, или только их домена VL, или только с помощью их трех CDR VH, или только с помощью их трех CDR VL. См., например, Rader C et al., (1998) PNAS 95: 8910-8915, включенный в настоящее описание посредством ссылки в полном объеме, где описана гуманизация антитела мыши против αvβ3 посредством идентификации комплементарной легкой цепи или тяжелой цепи, соответственно, в библиотеке легких цепей или тяжелых цепей человека, которая ведет к вариантам гуманизированного антитела, имеющим аффинности, которые равны или превышают аффинность исходного антитела. См. также Clackson T et al., (1991) Nature 352: 624-628, включенный в настоящее описание посредством ссылки в полном объеме, где описаны способы получения антител, которые связывают специфический антиген, с использованием специфического домена VH (или домена VL) и скрининга библиотеки на комплементарные вариабельные домены. См. также, Kim SJ & Hong HJ, (2007) J Microbiol 45: 572-577, включенный в настоящее описание посредством ссылки в полном объеме, где описаны способы получения антител, которые связывают специфический антиген, с использованием специфического домена VH и скрининга библиотеки (например, библиотеки VL человека) на комплементарные домены VL; выбранные домены VL, в свою очередь, можно использовать для того, чтобы направлять выбор дополнительных комплементарных доменов VH (например, человека).
[00272] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, могут представлять собой гуманизированное антитело, например, гуманизированную форму антитела грызуна. Гуманизированные антитела можно получать с использованием различных способов, известных в данной области, включая в качестве неограничивающих примеров пересадку CDR (европейский патент № EP 239,400; международная публикация № WO 91/09967; и патенты США №№ 5225539, 5530101 и 5585089), перестановку цепей (патент США № 5565332), вениринг или изменение поверхности (европейские патенты №№ EP 592,106 и EP 519,596; Padlan, 1991, Molecular Immunology 28(4/5):489-498; Studnicka et al., 1994, Protein Engineering 7(6):805-814; и Roguska et al., 1994, PNAS 91:969-973), и способы, раскрытые, например, в патенте США № 6407213, патенте США № 5766886, WO 9317105, Sandhu JS, Gene 150(2):409-10 (1994), Pedersen et al., J. Mol. Biol. 235(3):959-73 (1994), Couto et al., Cancer Res. 55(8):1717-22 (1995), Roguska et al., Protein Eng. 9(10):895 904 (1996), Baca et al., J. Biol. Chem. 272(16):10678-84 (1997), Couto et al., Cancer Res. 55 (23 Supp):5973s-5977s (1995), Caldas et al., Protein Eng. 13(5):353-60 (2000), Morea et al., Methods 20(3):267 79 (2000), и Tan et al., J. Immunol. 169:1119 25 (2002). Также см. публикацию патента США № US 2005/0042664 A1 (24 февраля 2005 года), каждое из которых в полном объеме включено в настоящее описание посредством ссылки.
[00273] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, могут представлять собой составное антитело человека. Составное антитело человека можно создавать посредством, например, конструирования последовательностей вариабельных областей из фрагментов нескольких последовательностей вариабельных областей антител человека, таким образом, чтобы избегать T-клеточных эпитопов, тем самым минимизируя иммуногенность получаемого антитела (см., например, Baker et al., 2010, Self Nonself., 1(4):314-322; Bryson et al., 2010, BioDrugs, 24(1):1-8; и Jones et al., 2009, Methods Mol Biol., 525:405-23). Такие антитела могут содержать человек последовательности константной области, например, константных областей легкой цепи и/или тяжелой цепи человека.
[00274] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, могут представлять собой деиммунизированное антитело. Деиммунизированное антитело представляет собой антитело, в котором удалены T-клеточные эпитопы. Описаны способы получения деиммунизированных антител. См., например, Jones et al., Methods Mol Biol. 2009;525:405-23, xiv, и De Groot et al., Cell. Immunol. 244:148-153(2006)).
[00275] В конкретных вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, представляют собой гуманизированный иммуноглобулин, который содержит 3 CDR VH и 3 CDR VL (т. е., CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL) каких-либо антител в таблице 1, таблице 2, и таблице 3, и таблице 4, таблице 5 и таблице 6, соответственно, полученные у человека каркасные области и полученные у человека константные области. Неограничивающие примеры каркасных областей человека описаны в данной области, например, см. Kabat et al. (1991) Sequences of Proteins of Immunological Interest, 5-е издание, U.S. Department of Health and Human Services, NIH Publication № 91-3242). В определенном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат каркасные области (например, каркасные области домена VL и/или домена VH), которые представляют собой каркасные области человека или получены из каркасных областей человека. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат каркасные области (например, каркасные области домена VL и/или домена VH), которые представляют собой каркасные области примата (например, примата, не являющегося человеком) или каркасные области, происходящие от примата (например, примата, не являющегося человеком). Например, CDR из антигенспецифичных антител, не принадлежащих человеку, обычно происходящих от грызуна (например, мыши или крысы), пересаживают на гомологи человека или примата, не являющегося человеком (например, человекообразных обезьян, например, Pan troglodytes, Pan paniscus или Gorilla gorilla, Pan troglodytes, мартышковых, например, из рода Macaca, или яванского макака Macaca cynomolgus). Каркасные последовательности приматов, не являющихся человеком, описаны в публикации патентной заявки США № US 2005/0208625.
[00276] В частном варианте осуществления положение CDR1 VH, CDR2 VH и/или CDR3 VH в области VH и/или положение CDR1 VL, CDR2 VL и/или CDR3 VL в области VL антитела к гликозилированному MUC16 или его антигенсвязывающему фрагменту, описанным в настоящем описании, могут варьировать на 1, 2, 3, 4, 5, 6 или больше положений аминокислот, при условии (i) сохранения иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) сохранения отсутствия иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) сохранения ингибирования инвазии матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16 (например, по существу сохранения, например, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95%). В другом варианте осуществления длина CDR1 VH, CDR2 VH и/или CDR3 VH в области VH и/или длина CDR1 VL, CDR2 VL и/или CDR3 VL в области VL антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, может варьировать (например, быть короче или длиннее) на 1, 2, 3, 4, 5, 6 или больше аминокислот, при условии (i) сохранения иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) сохранения отсутствия иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) сохранения ингибирования инвазии матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16 (например, по существу сохранения, например, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95%). В другом варианте осуществления аминоконец и/или карбоксиконец CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и/или CDR3 VL, описанных в настоящем описании, может быть продлен или укорочен на 1, 2, 3, 4, 5, 6 или больше аминокислот по сравнению с одним или несколькими CDR, описанными в настоящем описании, при условии (i) сохранения иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) сохранения отсутствия иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) сохранения ингибирования инвазии матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16 (например, по существу сохранения, например, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95%). В рамках изобретения, термины «иммуноспецифически связывает», «иммуноспецифически распознает», «специфически связывает» и «специфически распознает» представляют собой аналогичные термины в контексте антител и относятся к антителам и их антигенсвязывающим фрагментам, которые связываются с антигеном (например, эпитопом или иммунным комплексом) через участки связывания антигена, как понимает специалист в данной области, и не исключают перекрестной реактивности антитела или антигенсвязывающего фрагмента с другими антигенами. Любой известный в данной области способ можно использовать для того, чтобы устанавливать, (i) сохраняется ли иммуноспецифическое связывание с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) сохраняется ли отсутствие иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) сохраняется ли ингибирование инвазии матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16, например, анализы связывания ELISA или анализ FACs, как описано далее в разделе 6.
[00277] В конкретных аспектах изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые содержат тяжелую цепь антитела и/или легкую цепь, например, только тяжелую цепь, только легкую цепь или как тяжелую цепь, так и легкую цепь. В отношении тяжелой цепи, в частном варианте осуществления тяжелая цепь антитела к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанных в настоящем описании, может представлять собой альфа (α), дельта (δ), ипсилон (ε), гамма (γ) или мю (μ) тяжелую цепь. В другом конкретном варианте осуществления тяжелая цепь описанного антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента может содержать альфа (α), дельта (δ), ипсилон (ε), гамма (γ) или мю (μ) тяжелую цепь человека.
[00278] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, которые (i) иммуноспецифически связываются с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) не имеют иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139; и (iii) ингибируют инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют указанную первую форму MUC16, содержат тяжелую цепь, в которой аминокислотная последовательность вариабельной области тяжелой цепи содержит CDR1 VH, CDR2 VH и CDR3 VH, имеющие аминокислотные последовательности из SEQ ID № 103, SEQ ID № 104 и SEQ ID № 105, соответственно, SEQ ID № 109, SEQ ID № 110 и SEQ ID № 111, соответственно, или SEQ ID № 115, SEQ ID № 116 и SEQ ID № 117, соответственно, и в которой константная область тяжелой цепи представляет собой константную область альфа (α), дельта (δ), ипсилон (ε), гамма (γ) или мю (μ)тяжелой цепи человека. В рамках изобретения, термин «константная область» или «константный домен» являются взаимозаменяемыми и имеют в данной области обычное значение. Константная область представляет собой часть антитела, например, C-концевую часть легкой и/или тяжелой цепи, которая непосредственно не участвует в связывании антитела с антигеном, но которая может проявлять различные эффекторные функции, такие как взаимодействие с Fc-рецептором. Константная область молекулы иммуноглобулина в целом имеет более консервативную аминокислотную последовательность по сравнению с вариабельным доменом иммуноглобулина. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат тяжелую цепь, в которой аминокислотная последовательность вариабельной области тяжелой цепи содержит CDR1 VH, CDR2 VH и CDR3 VH антитела 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е., те, которые перечислены в таблице 1, таблице 3 или таблице 5) и в которой константная область тяжелой цепи представляет собой константную область альфа (α), дельта (δ), ипсилон (ε), гамма (γ) или мю (μ) тяжелой цепи человека.
[00279] В другом конкретном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат тяжелую цепь, в которой аминокислотная последовательность вариабельной области тяжелой цепи содержит аминокислотную последовательность из SEQ ID № 101, и в которой константная область тяжелой цепи представляет собой константную область альфа (α), дельта (δ), ипсилон (ε), гамма (γ) или мю (μ) тяжелой цепи человека. В другом конкретном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат тяжелую цепь, в которой аминокислотная последовательность вариабельной области тяжелой цепи содержит аминокислотную последовательность из SEQ ID № 1, SEQ ID № 21, SEQ ID № 41, SEQ ID № 61 или SEQ ID № 81 и в которой константная область тяжелой цепи представляет собой константную область альфа (α), дельта (δ), ипсилон (ε), гамма (γ) или мю (μ) тяжелой цепи человека.
[00280] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат тяжелую цепь, в которой аминокислотная последовательность вариабельной области тяжелой цепи содержит CDR1 VH, CDR2 VH и CDR3 VH, которые имеют аминокислотные последовательности из SEQ ID № 103, SEQ ID № 104 и SEQ ID № 105, соответственно, или SEQ ID № 109, SEQ ID № 110 или SEQ ID № 111, соответственно, или SEQ ID № 115, SEQ ID № 116 или SEQ ID № 117, соответственно, и в которой константная область тяжелой цепи представляет собой константную область тяжелой цепи человека. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат тяжелую цепь, в которой аминокислотная последовательность вариабельной области тяжелой цепи содержит CDR1 VH, CDR2 VH и CDR3 VH из любой одной из CDR VH антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 1, таблице 3 и таблице 5), и в которой константная область тяжелой цепи представляет собой константную область тяжелой цепи человека. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат тяжелую цепь, в которой аминокислотная последовательность вариабельной области тяжелой цепи содержит аминокислотную последовательность из SEQ ID № 101, и в которой константная область тяжелой цепи представляет собой константную область тяжелой цепи человека. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат тяжелую цепь, в которой аминокислотная последовательность вариабельной области тяжелой цепи содержит аминокислотную последовательность из любой одной из CDR VH антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 7), и в которой константная область тяжелой цепи представляет собой константную область тяжелой цепи человека. Неограничивающие примеры последовательностей константной области человека описаны в данной области, например, см. выше Kabat EA et al., (1991).
[00281] В отношении легкой цепи, в частном варианте осуществления легкая цепь антитела к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанных в настоящем описании, представляет собой каппа легкую цепь. В другом конкретном варианте осуществления, легкая цепь антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, представляет собой лямбда легкую цепь. В еще одном другом конкретном варианте осуществления, легкая цепь антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, представляет собой каппа легкую цепь человека или лямбда легкую цепь человека.
[00282] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат легкую цепь, в которой аминокислотная последовательность вариабельной области легкой цепи содержит CDR1 VL, CDR2 VL и CDR3 VL, которые имеют аминокислотные последовательности антитела SEQ ID № 106, SEQ ID № 107 и SEQ ID № 108, соответственно, или SEQ ID № 112, SEQ ID № 113 и SEQ ID № 114, соответственно, или SEQ ID № 118, SEQ ID № 119 и SEQ ID № 120, соответственно, и в которой константная область легкой цепи представляет собой константную область каппа или лямбда легкой цепи. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат легкую цепь, в которой аминокислотная последовательность вариабельной области легкой цепи содержит CDR1 VL, CDR2 VL и CDR3 VL антитела 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 2, таблице 4 или таблице 6) и в которой константная область легкой цепи представляет собой константную область каппа или лямбда легкой цепи.
[00283] В другом конкретном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат легкую цепь, в которой аминокислотная последовательность вариабельной области легкой цепи содержит аминокислотную последовательность из SEQ ID № 102, и в которой константная область легкой цепи представляет собой константную область каппа или лямбда легкой цепи. В другом конкретном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат легкую цепь, в которой аминокислотная последовательность вариабельной области легкой цепи содержит аминокислотную последовательность из SEQ ID № 2, SEQ ID № 22, SEQ ID № 42, SEQ ID № 62 или SEQ ID № 82, и в которой константная область легкой цепи представляет собой константную область каппа или лямбда легкой цепи.
[00284] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат легкую цепь, в которой аминокислотная последовательность вариабельной области легкой цепи содержит CDR1 VL, CDR2 VL и CDR3 VL, которые имеют аминокислотные последовательности из SEQ ID № 106, SEQ ID № 107 и SEQ ID № 108, соответственно, или SEQ ID № 112, SEQ ID № 113 и SEQ ID № 114, соответственно, или SEQ ID № 118, SEQ ID № 119 и SEQ ID № 120, соответственно, и в которой константная область легкой цепи содержит аминокислоту константной области легкой цепи человека. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат легкую цепь, в которой аминокислотная последовательность вариабельной области легкой цепи содержит CDR1 VL, CDR2 VL и CDR3 VL, которые имеют аминокислотные последовательности из любой одной из CDR VL антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 2, таблице 4 и таблице 6), и в которой константная область легкой цепи представляет собой константную область легкой цепи человека. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат легкую цепь, в которой аминокислотная последовательность вариабельной области легкой цепи содержит аминокислотную последовательность из SEQ ID № 102, и в которой константная область легкой цепи представляет собой константную область легкой цепи человека. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат легкую цепь, в которой аминокислотная последовательность вариабельной области легкой цепи содержит аминокислотную последовательность из любой одной из CDR VL антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 8), и в которой константная область легкой цепи представляет собой константную область легкой цепи человека. Неограничивающие примеры последовательностей константной области человека описаны в данной области, например, см. Kabat EA et al., (1991) выше.
[00285] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), как описано в настоящем описании, в которых константные области относятся к тому типу, который находят в молекуле иммуноглобулина IgG, IgE, IgM, IgD, IgA или IgY или молекуле иммуноглобулина IgG, IgE, IgM, IgD, IgA или IgY человека. В другом конкретном варианте осуществления, антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат VH и VL, которые содержат какие-либо аминокислотные последовательности, описанные в настоящем описании, и в которых константные области относятся к тому типу, который находят в молекуле иммуноглобулина IgG, IgE, IgM, IgD, IgA или IgY, каком-либо классе (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или каком-либо подклассе (например, IgG2a и IgG2b) молекул иммуноглобулинов. В частном варианте осуществления константные области относятся к тому типу, который находят в молекуле иммуноглобулина IgG, IgE, IgM, IgD, IgA или IgY человека, каком-либо классе (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или каком-либо подклассе (например, IgG2a и IgG2b) молекул иммуноглобулинов.
[00286] В другом конкретном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат тяжелую цепь и/или легкую цепь, где (i) тяжелая цепь содержит (a) вариабельную область, которая содержит CDR1 VH, CDR2 VH и CDR3 VH, которые имеют аминокислотные последовательности из SEQ ID № 103, SEQ ID № 104 и SEQ ID № 105, соответственно, SEQ ID № 109, SEQ ID № 110 и SEQ ID № 111, соответственно, или SEQ ID № 115, SEQ ID № 116 и SEQ ID № 117, соответственно, и (b) содержит константный домен тяжелой цепи, который представляет собой константный домен тяжелой цепи IgG человека; и/или (ii) легкая цепь содержит (a) вариабельную область, которая содержит CDR1 VL, CDR2 VL и CDR3 VL, которые имеют аминокислотные последовательности из SEQ ID № 106, SEQ ID № 107 и SEQ ID № 108, соответственно, или SEQ ID № 112, SEQ ID № 113 и SEQ ID № 114, соответственно, или SEQ ID № 118, SEQ ID № 119 и SEQ ID № 120, соответственно, и (b) константный домен легкой цепи, который представляет собой константный домен IgG человека. В другом конкретном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат тяжелую цепь и/или легкую цепь, где (i) тяжелая цепь содержит (a) вариабельную область, которая содержит CDR1 VH, CDR2 VH и CDR3 VH, которые имеют аминокислотные последовательности из любой одной из CDR VH антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 1, таблице 3 и таблице 5) и (b) содержит константный домен тяжелой цепи, который представляет собой константный домен тяжелой цепи IgG человека; и/или (ii) легкая цепь содержит (a) вариабельную область, которая содержит CDR1 VL, CDR2 VL и CDR3 VL, которые имеют аминокислотные последовательности из любой одной из CDR VL антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 2, таблице 4 и таблице 6), и (b) константный домен легкой цепи, который представляет собой константный домен IgG человека.
[00287] В другом конкретном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат тяжелую цепь и/или легкую цепь, где (i) тяжелая цепь содержит (a) вариабельную область, которая содержит аминокислотную последовательность из SEQ ID № 101, и (b) константный домен тяжелой цепи, который представляет собой константный домен IgG человека; и/или (ii) легкая цепь содержит (a) вариабельную область, которая содержит аминокислотную последовательность из SEQ ID № 102, и (b) константный домен легкой цепи, который представляет собой константный домен каппа легкой цепи человека. В другом конкретном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат тяжелую цепь и/или легкую цепь, где (i) тяжелая цепь содержит (a) вариабельную область, которая содержит аминокислотную последовательность VH из любого одного из антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 7), и (b) константный домен тяжелой цепи, который представляет собой константный домен IgG человека; и/или (ii) легкая цепь содержит (a) вариабельную область, которая содержит аминокислотную последовательность VL из любого одного из антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 8), и (b) константный домен легкой цепи, который представляет собой константный домен каппа легкой цепи человека.
[00288] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, или его антигенсвязывающий фрагмент содержат аминокислотные последовательности с процентом идентичности, описанным далее, относительно какой-либо одной из SEQ ID №№ 1-100. Математические алгоритмы можно использовать для того, чтобы определять процент идентичности между двумя последовательностями (например, аминокислотными последовательностями или последовательностями нуклеиновой кислоты). Предпочтительный неограничивающий пример математического алгоритма, используемого для сравнения двух последовательностей, представляет собой алгоритм Karlin and Altschul, 1990, Proc. Natl. Acad. Sci. U.S.A. 87:2264 2268, модифицированный как в Karlin and Altschul, 1993, Proc. Natl. Acad. Sci. U.S.A. 90:5873 5877. Такой алгоритм встроен в программы NBLAST и XBLAST из Altschul et al., 1990, J. Mol. Biol. 215:403. Нуклеотидный поиск BLAST можно осуществлять с использованием нуклеотидных параметров программы NBLAST, например, установленных на score=100, wordlength=12 для получения нуклеотидных последовательностей, гомологичных молекулам нуклеиновой кислоты, описанным в настоящем описании. Белковый поиск BLAST можно осуществлять с использованием параметров программы XBLAST, например, установленных на score 50, wordlength=3 для получения аминокислотных последовательностей, гомологичных белковой молекуле, описанной в настоящем описании. Gapped BLAST можно использовать, как описано в Altschul et al., 1997, Nucleic Acids Res. 25:3389 3402, для получения выравниваний с пропусками для целей сравнения. Альтернативно, итеративный поиск, который обнаруживает отдаленное родство между молекулами, можно осуществлять с помощью PSI BLAST (Id.). Параметры по умолчанию для соответствующих программ (например, XBLAST и NBLAST) можно использовать (см., например, National Center for Biotechnology Information (NCBI) во всемирной сети, ncbi.nlm.nih.gov) при использовании программ BLAST, Gapped BLAST и PSI Blast. Другой предпочтительны не ограничивающий пример математического алгоритма, используемого для сравнения последовательностей, представляет собой алгоритм Myers and Miller, 1988, CABIOS 4:11 17. Такой алгоритм встроен в программу ALIGN (версия 2.0), которая является частью пакета программного обеспечения для выравнивания последовательностей GCG. При использовании программы ALIGN для сравнения аминокислотных последовательностей можно использовать матрицу весов остатков PAM120, штраф за продление пропуска 12 и штраф за пропуск 4. Кроме того, процент идентичности между двумя последовательностями можно определять с использованием способов, схожих с теми, которые описаны выше, разрешая или не разрешая пропуски. Обычно только точные совпадения считают при вычислении процента идентичность.
[00289] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат VH, которая имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью из SEQ ID № 101. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат VH, которая имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью VH из любого одного из антител 10C6, 7B12, 19C11, 16C5 или 1B5 (т. е. тех, которые перечислены в таблице 7). В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат домен VH, который имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью из SEQ ID № 101, где антитело или антигенсвязывающий фрагмент содержат CDR (например, CDR VH и/или CDR VL), которые идентичны CDR (например, CDR VH и/или CDR VL), приведенным в таблице 1, таблице 2, таблице 3, таблице 4, таблице 5 или таблице 6. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат домен VH, который имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью VH из любого одного из антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 7), где антитело или антигенсвязывающий фрагмент содержат CDR (например, CDR VH и/или CDR VL), которые идентичны CDR (например, CDR VH и/или CDR VL), приведенным в таблице 1, таблице 2, таблице 3, таблице 4, таблице 5 или таблице 6.
[00290] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат VL, которая имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью из SEQ ID № 102. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат VL, которая имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью VL из любого одного из антител 10C6, 7B12, 19C11, 16C5 или 1B5 (т. е. тех, которые перечислены в таблице 8). В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат домен VL, который имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью из SEQ ID № 102, где антитело или антигенсвязывающий фрагмент содержат CDR (например, CDR VH и/или CDR VL), которые идентичны CDR (например, CDR VH и/или CDR VL), приведенным в таблице 1, таблице 2, таблице 3, таблице 4, таблице 5 или таблице 6. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат домен VL, который имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью VL из любого одного из антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 7), где антитело или антигенсвязывающий фрагмент содержат CDR (например, CDR VH и/или CDR VL), которые идентичны CDR (например, CDR VH и/или CDR VL), приведенным в таблице 1, таблице 2, таблице 3, таблице 4, таблице 5 или таблице 6.
[00291] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат: (i) домен VH, который имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью из SEQ ID № 101; и (ii) домен VL, который имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью из SEQ ID № 102. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат: (i) домен VH, который имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью VH из любого одного из антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 8); и (ii) домен VL, который имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью VL из любого одного из антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 7), соответственно. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат: (i) домен VH, который имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью из SEQ ID № 101; и (ii) домен VL, который имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью из SEQ ID № 102, где антитело или антигенсвязывающий фрагмент содержат CDR (например, CDR VH и/или CDR VL), которые идентичны CDR (например, CDR VH и/или CDR VL), приведенным в таблице 1, таблице 2, таблице 3, таблице 4, таблице 5 или таблице 6. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент содержат: (i) домен VH, который имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью VH из любого одного из антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 8); и (ii) домен VL, который имеет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% идентичность последовательностей с аминокислотной последовательностью VL из любого одного из антител 10C6, 7B12, 19C11, 16C5 или 18C6 (т. е. тех, которые перечислены в таблице 7), соответственно, где антитело или антигенсвязывающий фрагмент содержат CDR (например, CDR VH и/или CDR VL), которые идентичны CDR (например, CDR VH и/или CDR VL), приведенным в таблице 1, таблице 2, таблице 3, таблице 4, таблице 5 или таблице 6.
[00292] В другом аспекте изобретение относится к антителам, которые связывают тот же или перекрывающийся эпитоп антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанного в настоящем описании (например, 10C6, 7B12, 19C11, 16C5 и/или 16C5). В рамках изобретения, «эпитоп» является термином в данной области и может относиться к локализованной области антигена, с которой антитело может иммуноспецифически связываться. Эпитоп может представлять собой, например, прилегающие аминокислоты полипептида (линейный или непрерывный эпитоп) или эпитоп, например, может собираться вместе из двух или больше не непрерывных областей полипептида или полипептидов (конформационный, нелинейный или не непрерывный эпитоп). В некоторых вариантах осуществления эпитоп антитела можно определять посредством, например, ЯМР спектроскопии, рентгеновских дифракционных кристаллографических исследований, анализа ELISA, обмена водород/дейтерий в сочетании с масс-спектрометрией (например, MALDI масс-спектрометрией), матричного сканирующего анализа олигопептидов и/или картирования мутагенеза (например, картирования сайт-специфического мутагенеза). При рентгеновской кристаллографии кристаллизацию можно выполнять с использованием какого-либо из способов, известных в данной области (например, Giegé R et al., (1994) Acta Crystallogr D Biol Crystallogr 50(Pt 4): 339-350; McPherson A (1990) Eur J Biochem 189: 1-23; Chayen NE (1997) Structure 5: 1269-1274; McPherson A (1976) J Biol Chem 251: 6300-6303). Кристаллы антитело:антиген можно изучать с использованием хорошо известных способов рентгеновской дифракции и уточнение можно проводить с использованием компьютерного программного обеспечения, такого как X-PLOR (Yale University, 1992, распространитель Molecular Simulations, Inc.; см., например, Meth Enzymol (1985), тома 114 и 115, под редакцией Wyckoff HW et al.,; патентную заявку США № 2004/0014194), и BUSTER (Bricogne G (1993) Acta Crystallogr D Biol Crystallogr 49(Pt 1): 37-60; Bricogne G (1997) Meth Enzymol 276A: 361-423, ред. Carter CW; Roversi P et al., (2000) Acta Crystallogr D Biol Crystallogr 56(Pt 10): 1316-1323). Исследования по картированию мутагенеза можно выполнять с использованием какого-либо способа, известного специалисту в данной области. См., например, в Champe M et al., (1995) и Cunningham BC & Wells JA (1989) описание мутагенетических способов, включая способы сканирующего аланинового мутагенеза. Кроме того, антитела, которые распознают и связываются с одним и тем же или перекрывающимися эпитопами, можно идентифицировать с использованием повседневных способов, таких как иммунологический анализ, например, демонстрируя способность одного антитела блокировать связывание другого антитела с целевым антигеном, т. е., анализ конкурентного связывания. Анализы конкурентного связывания также можно использовать для того, чтобы определять, имеют ли два антитела схожую специфичность связывания с эпитопом. Конкурентное связывание можно определять в анализе, в котором тестируемый иммуноглобулин ингибирует иммуноспецифическое связывание эталонного антитела с общим антигеном. Известно множество типов анализов конкурентного связывания, например: твердофазный прямой или непрямой радиоиммунный анализ (RIA), твердофазный прямой или непрямой иммуноферментный анализ (EIA), конкурентный сэндвич-анализ (см. Stahli C et al., (1983) Methods Enzymol 9: 242-253); твердофазный прямой биотин-авидиновый EIA (см. Kirkland TN et al., (1986) J Immunol 137: 3614-9); твердофазный прямой меченый анализ, твердофазный прямой меченый сэндвич-анализ (см. Harlow E & Lane D, (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Press); тврдофазный прямой меченный RIA с использованием метки I-125 (см. Morel GA et al., (1988) Mol Immunol 25(1): 7-15); твердофазный прямой биотин-авидиновый EIA (Cheung RC et al., (1990) Virology 176: 546-52); и прямой меченный RIA. (Moldenhauer G et al., (1990) Scand J Immunol 32: 77-82). Обычно такой анализ включает использование очищенного антигена, связанного с твердой поверхностью, или клеток, несущих любой из этих не меченого тестового иммуноглобулина и меченного эталонного иммуноглобулина. Конкурентное ингибирование можно измерять посредством определения количества метки, связанной с твердой поверхностью, или клеток в присутствии тестового иммуноглобулина. Обычно тестовый иммуноглобулин присутствует в избытке. Обычно, когда конкурирующее антитело присутствует в избытке, оно будет ингибировать иммуноспецифическое связывание эталонного антитела с общим антигеном по меньшей мере на 50-55%, 55-60%, 60-65%, 65-70% 70-75% или больше. Анализ конкурентного связывания можно создавать в большом числе различных форматов с использованием или меченого антигена или меченого антитела. В обыкновенной версии этого анализа антиген иммобилизуют на 96-луночном планшете. Способность не меченых антител блокировать связывание меченых антител с антигеном после этого измеряют с использованием радиоактивных или ферментативных меток. Более подробно см., например, Wagener C et al., (1983) J Immunol 130: 2308-2315; Wagener C et al., (1984) J Immunol Methods 68: 269-274; Kuroki M et al., (1990) Cancer Res 50: 4872-4879; Kuroki M et al., (1992) Immunol Invest 21: 523-538; Kuroki M et al., (1992) Hybridoma 11: 391-407 и Antibodies: A Laboratory Manual, под ред. Ed Harlow E & Lane D, выше, стр. 386-389.
[00293] В определенных аспектах анализы конкурентного связывания можно использовать для того, чтобы определять, происходит ли конкурентное блокирование антитела, например, дозозависимым образом, с помощью другого антитела, например, антитело связывает по существу тот же эпитоп или перекрывающиеся эпитопы, как эталонное антитело, когда два антитела распознают идентичные или пространственно перекрывающиеся эпитопы, в анализах конкурентного связывания, таких как конкретные ELISA анализы, которые можно выполнять во множестве различных форматов, используя или меченый антиген или меченое антитело. В частном варианте осуществления антитело можно тестировать в анализах конкурентного связывания с использованием антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании (например, IgG антитело мыши, содержащее вариабельную область из 10C6, 7B12, 19C11, 16C5 или 16C5).
[00294] В другом аспекте изобретение относится к антителам, которые конкурируют (например, дозозависимым образом) за связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, описанными в настоящем описании (например, IgG антитело мыши, содержащее вариабельную область из 10C6, 7B12, 19C11, 16C5 или 16C5), как определяют с использованием анализов, известных специалисту в данной области или описанных в настоящем описании (например, ELISA). В другом аспекте изобретение относится к антителам, которые конкурентно ингибируют (например, дозозависимым образом) связывание антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании (например, IgG антитело мыши, содержащее вариабельную область из 10C6, 7B12, 19C11, 16C5 или 16C5), с MUC16, как определяют с использованием анализов, известных специалисту в данной области или описанных в настоящем описании (например, ELISA).
[00295] В некоторых вариантах осуществления изобретение относится к антителу, которое конкурирует с антителом, описанным в настоящем описании для связывания, в той же степени, что и антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, конкурируют сами с собой для связывания с MUC16. В некоторых вариантах осуществления в настоящем описании предоставлено первое антитело, которое конкурирует с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, описанными в настоящем описании, за связывание с MUC16, у которого конкурентность проявлена в виде сниженного связывания первого антитела с эпитопом больше чем на 80% (например, 85%, 90%, 95%, или 98% или от 80% до 85%, от 80% до 90%, от 85% до 90% или от 85% до 95%).
[00296] В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, содержащими VH, которая содержит CDR1 VH, CDR2 VH и/или CDR3 VH, которые содержат аминокислотные последовательности, как описано в таблице 1, таблице 3 или таблице 5. В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, содержащими CDR VH из 10C6 (см. таблицу 1, таблицу 3 и таблицу 5). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, содержащими CDR VH из 7B12 (см. таблицу 1, таблицу 3 и таблицу 5). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат CDR VH из 19C11 (см. таблицу 1, таблицу 3 и таблицу 5). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат CDR VH из 16C5 (см. таблицу 1, таблицу 3 и таблицу 5). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат CDR VH из 18C6 (см. таблицу 1, таблицу 3 и таблицу 5).
[00297] В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат VL, которая содержит CDR1 VL, CDR2 VL и/или CDR3 VL, которые содержат аминокислотные последовательности, как описано в таблице 2, таблице 4 или таблице 6. В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат CDR VL из 10C6 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат CDR VL из 7B12 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат CDR VL из 19C11 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат CDR VL из 16C5 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат CDR VL из 18C6 (см. таблицу 2, таблицу 4 и таблицу 6).
[00298] В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат (a) VH, которая содержит CDR1 VH, CDR2 VH и/или CDR3 VH, которые содержат аминокислотные последовательности, как описано в таблице 1, таблице 3 или таблице 5; и (b) VL, которая содержит CDR1 VL, CDR2 VL и/или CDR3 VL, которые содержат аминокислотные последовательности, как описано в таблице 2, таблице 4 или таблице 6. В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат (a) CDR VH из 10C6 (см. таблицу 1, таблицу 3 и таблицу 5); и (b) CDR VL из 10C6 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат (a) CDR VH из 7B12 (см. таблицу 1, таблицу 3 и таблицу 5); и (b) CDR VL из 7B12 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат (a) CDR VH из 19C11 (см. таблицу 1, таблицу 3 и таблицу 5); и (b) CDR VL из 19C11 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат (a) CDR VH из 16C5 (см. таблицу 1, таблицу 3 и таблицу 5); и (b) CDR VL из 16C5 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат (a) CDR VH из 18C6 (см. таблицу 1, таблицу 3 и таблицу 5); и (b) CDR VL из 18C6 (см. таблицу 2, таблицу 4 и таблицу 6).
[00299] В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат домен VH, который имеет аминокислотную последовательность, как описано в таблице 7. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат домен VH, который имеет аминокислотную последовательность из SEQ ID № 1. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат домен VH, который имеет аминокислотную последовательность из SEQ ID № 21. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат домен VH, который имеет аминокислотную последовательность из SEQ ID № 41. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат домен VH, который имеет аминокислотную последовательность из SEQ ID № 61. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат домен VH, который имеет аминокислотную последовательность из SEQ ID № 81.
[00300] В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат домен VL, который имеет аминокислотную последовательность, как описано в таблице 8. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат домен VL, который имеет аминокислотную последовательность из SEQ ID № 2. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат домен VL, который имеет аминокислотную последовательность из SEQ ID № 22. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат домен VL, который имеет аминокислотную последовательность из SEQ ID № 42. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат домен VL, который имеет аминокислотную последовательность из SEQ ID № 62. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат домен VL, который имеет аминокислотную последовательность из SEQ ID № 82.
[00301] В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат (a) домен VH, который имеет аминокислотную последовательность, как описано в таблице 7; и (b) домен VL, который имеет аминокислотную последовательность, как описано в таблице 8. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат (a) домен VH, который имеет аминокислотную последовательность из SEQ ID № 1; и (b) домен VL, который имеет аминокислотную последовательность из SEQ ID № 2. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат (a) домен VH, который имеет аминокислотную последовательность из SEQ ID № 21; и (b) домен VL, который имеет аминокислотную последовательность из SEQ ID № 22. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат (a) домен VH, который имеет аминокислотную последовательность из SEQ ID № 41; и (b) домен VL, который имеет аминокислотную последовательность из SEQ ID № 42. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат (a) домен VH, который имеет аминокислотную последовательность из SEQ ID № 61; и (b) домен VL, который имеет аминокислотную последовательность из SEQ ID № 62. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат (a) домен VH, который имеет аминокислотную последовательность из SEQ ID № 81; и (b) домен VL, который имеет аминокислотную последовательность из SEQ ID № 82.
[00302] В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит VH, которая содержит CDR1 VH, CDR2 VH и/или CDR3 VH, которые содержат аминокислотные последовательности, как описано в таблице 1, таблице 3 или таблице 5. В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит CDR VH из 10C6 (см. таблицу 1, таблицу 3 и таблицу 5). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит CDR VH из 7B12 (см. таблицу 1, таблицу 3 и таблицу 5). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые конкурируют (например, дозозависимым образом) за иммуноспецифическое связывание с MUC16 с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые содержат CDR VH из 19C11 (см. таблицу 1, таблицу 3 и таблицу 5). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит CDR VH из 16C5 (см. таблицу 1, таблицу 3 и таблицу 5). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит CDR VH из 18C6 (см. таблицу 1, таблицу 3 и таблицу 5).
[00303] В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент связываются с тем же или перекрывающимся эпитопом антитела, которое содержит VL, которая содержит CDR1 VL, CDR2 VL и/или CDR3 VL, которые содержат аминокислотные последовательности, как описано в таблице 2, таблице 4 или таблице 6. В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит CDR VL из 10C6 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит CDR VL из 7B12 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит CDR VL из 19C11 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит CDR VL из 16C5 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит CDR VL из 18C6 (см. таблицу 2, таблицу 4 и таблицу 6).
[00304] В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит (a) VH, которая содержит CDR1 VH, CDR2 VH и/или CDR3 VH, которые содержат аминокислотные последовательности, как описано в таблице 1, таблице 3 или таблице 5; и (b) VL, которая содержит CDR1 VL, CDR2 VL и/или CDR3 VL, которые содержат аминокислотные последовательности, как описано в таблице 2, таблице 4 или таблице 6. В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит (a) CDR VH из 10C6 (см. таблицу 1, таблицу 3 и таблицу 5); и (b) CDR VL из 10C6 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит (a) CDR VH из 7B12 (см. таблицу 1, таблицу 3 и таблицу 5); и (b) CDR VL из 7B12 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит (a) CDR VH из 19C11 (см. таблицу 1, таблицу 3 и таблицу 5); и (b) CDR VL из 19C11 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит (a) CDR VH из 16C5 (см. таблицу 1, таблицу 3 и таблицу 5); и (b) CDR VL из 16C5 (см. таблицу 2, таблицу 4 и таблицу 6). В частном варианте осуществления изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит (a) CDR VH из 18C6 (см. таблицу 1, таблицу 3 и таблицу 5); и (b) CDR VL из 18C6 (см. таблицу 2, таблицу 4 и таблицу 6).
[00305] В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит домен VH, который имеет аминокислотную последовательность, как описано в таблице 7. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит домен VH, который имеет аминокислотную последовательность из SEQ ID № 1. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит домен VH, который имеет аминокислотную последовательность из SEQ ID № 21. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит домен VH, который имеет аминокислотную последовательность из SEQ ID № 41. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит домен VH, который имеет аминокислотную последовательность из SEQ ID № 61. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит домен VH, который имеет аминокислотную последовательность из SEQ ID № 81.
[00306] В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит домен VL, который имеет аминокислотную последовательность, как описано в таблице 8. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит домен VL, который имеет аминокислотную последовательность из SEQ ID № 2. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит домен VL, который имеет аминокислотную последовательность из SEQ ID № 22. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит домен VL, который имеет аминокислотную последовательность из SEQ ID № 42. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит домен VL, который имеет аминокислотную последовательность из SEQ ID № 62. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит домен VL, который имеет аминокислотную последовательность из SEQ ID № 82.
[00307] В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит (a) домен VH, который имеет аминокислотную последовательность, как описано в таблице 7; и (b) домен VL, который имеет аминокислотную последовательность, как описано в таблице 8. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит (a) домен VH, который имеет аминокислотную последовательность из SEQ ID № 1; и (b) домен VL, который имеет аминокислотную последовательность из SEQ ID № 2. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит (a) домен VH, который имеет аминокислотную последовательность из SEQ ID № 21; и (b) домен VL, который имеет аминокислотную последовательность из SEQ ID № 22. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит (a) домен VH, который имеет аминокислотную последовательность из SEQ ID № 41; и (b) домен VL, который имеет аминокислотную последовательность из SEQ ID № 42. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит (a) домен VH, который имеет аминокислотную последовательность из SEQ ID № 61; и (b) домен VL, который имеет аминокислотную последовательность из SEQ ID № 62. В конкретных аспектах, изобретение относится к антителу к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с тем же или перекрывающимся эпитопом антитела, которое содержит (a) домен VH, который имеет аминокислотную последовательность из SEQ ID № 81; и (b) домен VL, который имеет аминокислотную последовательность из SEQ ID № 82.
[00308] Анализы, известные специалисту в данной области или описанные в настоящем описании (например, рентгеновскую кристаллографию, ELISA анализы и т. д.) можно использовать для того, чтобы определять, связываются ли два антитела с одним и тем же эпитопом. Аффинность можно измерять и/или выражать множеством путей, известных в данной области, включая в качестве неограничивающих примеров равновесную константу диссоциации (KD), и равновесную константу ассоциации (KA). KD можно определять способами, известными специалисту в данной области, такими как интерферометрия биослоя.
[00309] В некоторых вариантах осуществления эпитоп антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, используют в качестве иммуногена для того, чтобы получать антитела. См. способы получения антител, например, в разделе 5.3 и разделе 6.2.
5.1.2 ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ
[00310] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с kd меньше чем 0,5×10-3/с, 1×10-3/с, 1,5×10-3/с, 2×10-3/с, 2,5×10-3/с, 3×10-3/с, 4×10-3/с, 5×10-3/с, 6×10-3/с, 7×10-3/с, 8×10-3/с, 9×10-3/с, 1×10-4/с, 2×10-4/с, 3×10-4/с, 4×10-4/с, 5×10-4/с, 6×10-4/с, 7×10-4/с или 8×10-4/с. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с kd приблизительно 0,5×10-3/с, 1×10-3/с, 1,5×10-3/с, 2×10-3/с, 2,5×10-3/с, 3×10-3/с, 4×10-3/с, 5×10-3/с, 6×10-3/с, 7×10-3/с, 8×10-3/с, 9×10-3/с, 1×10-4/с, 2×10-4/с, 3×10-4/с, 4×10-4/с, 5×10-4/с, 6×10-4/с, 7×10-4/с, или 8×10-4/с. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с kd приблизительно от 0,5×10-3/с до 8×10-4/с. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с kd приблизительно 1×10-3/с. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с kd приблизительно 1,5×10-3/с. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с kd приблизительно 2×10-3/с. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с kd приблизительно 2×10-4/с. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с kd приблизительно 7×10-4/с.
[00311] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с ka по меньшей мере 2,5×104/с, 3×104/с, 3,5×104/с, 4×104/с, 4,5×104/с, 5×104/с, 5,5×104/с, 6×104/с, 6,5×104/с, 7×104/с, 7,5×104/с, 8×104/с, 9×104/с или 9×105/с. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с ka приблизительно 2,5×104/с, 3×104/с, 3,5×104/с, 4×104/с, 4,5×104/с, 5×104/с, 5,5×104/с, 6×104/с, 6,5×104/с, 7×104/с, 7,5×104/с, 8×104/с, 9×104/с или 9×105/с. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с ka приблизительно 4×104/с. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с ka приблизительно 6×104/с. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с ka приблизительно 7,5×104/с.
[00312] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с KD меньше чем 1000 нМ, 500 нМ, 100 нМ, 50 нМ, 25 нМ, 20 нМ, 15 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,5 нМ, 0,1 нМ или 0,05 нМ. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с KD приблизительно 1000 нМ, 500 нМ, 100 нМ, 50 нМ, 25 нМ, 20 нМ, 15 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,5 нМ, 0,1 нМ или 0,05 нМ. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с KD приблизительно от 500 нМ до 1000 нМ. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с KD приблизительно от 5 нМ до 75 нМ. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с KD приблизительно 7 нМ. В другом конкретном варианте осуществления, антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с KD приблизительно 10 пМ. В другом конкретном варианте осуществления, антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с KD приблизительно 15 пМ. В другом конкретном варианте осуществления, антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с KD приблизительно 20 пМ. В другом конкретном варианте осуществления, антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с KD приблизительно 25 пМ. В другом конкретном варианте осуществления, антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с MUC16 с KD приблизительно 65 пМ. В рамках изобретения, термин «приблизительно», когда используют для того, чтобы модифицировать числовое значение или числовой диапазон, указывает на то, что отклонения от 5% до 10% выше и от 5% до 10% ниже значения или диапазона остаются в пределах предполагаемого смысла указанного значения или диапазона.
[00313] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133. В некоторых вариантах осуществления клетка представляет собой клетку раке (например, клетку раке яичника, клетку раке легкого, клетку раке поджелудочной железы, клетку раке молочной железы, клетку раке фаллопиевой трубы, клетку раке матки (например, эндометрия) или клетку раке первичной брюшины). В некоторых вариантах осуществления клетка представляет собой клетку раке яичника. В некоторых вариантах осуществления клетка представляет собой клетку раке легкого. В некоторых вариантах осуществления клетка представляет собой клетку раке поджелудочной железы. В некоторых вариантах осуществления клетка представляет собой клетку раке молочной железы. В некоторых вариантах осуществления клетка представляет собой клетку раке матки (например, эндометрия). В некоторых вариантах осуществления клетка представляет собой клетку раке фаллопиевой трубы. В некоторых вариантах осуществления клетка представляет собой клетку раке первичной брюшины. В некоторых вариантах осуществления клетка представляет собой клетку SKOV3. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133, по меньшей мере в 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 250, 500 или 1000 раз сильнее, чем изотипическое контрольное антитело, которое связывается с клетками. Изотипическое контрольное антитело является термином, принятым в данной области. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133, приблизительно в 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 250, 500 или 1000 раз сильнее, чем изотипическое контрольное антитело связывается с клеткой. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133, между 10 и 50, 50 и 100, 100 и 250, 250 и 500 или 500 и 1000 раз сильнее, чем изотипическое контрольное антитело связывается с клеткой.
[00314] Белок, кодируемый аминокислотной последовательностью из SEQ ID № 133, также упоминают в настоящем описании как MUC16c114, и он состоит из C-концевых 114 аминокислотных остатков зрелого MUC16 (SEQ ID № 150 представляет собой последовательность зрелого MUC16). MUC16c114 способен к N-гликозилированию по аминокислоте аспарагин в положениях 1, 24 и 30 из SEQ ID № 133 (соответствующих положениям аминокислот Asn1777, Asn1800 и Asn1806 из SEQ ID № 150).
[00315] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, не имеют иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139. В некоторых вариантах осуществления клетки представляют собой клетки раке яичника. В некоторых вариантах осуществления клетки представляют собой клетки раке легкого. В некоторых вариантах осуществления клетки представляют собой клетки раке поджелудочной железы. В некоторых вариантах осуществления клетки представляют собой клетки раке молочной железы. В некоторых вариантах осуществления клетки представляют собой клетки раке матки (например, эндометрия). В некоторых вариантах осуществления клетки представляют собой клетки раке фаллопиевых труб. В некоторых вариантах осуществления клетки представляют собой клетки раке первичной брюшины. В некоторых вариантах осуществления клетки представляют собой клетки SKOV3. В некоторых вариантах осуществления вторую форму MUC16 сливают с поддающимся обнаружению белком, таким как, например, зеленый флуоресцентный белок или красный флуоресцентный белок. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139, самое большее в 1,1, 1,2, 1,3, 1,4, 1,5, 2, 3, 4 или 5 раз сильнее, чем изотипическое контрольное антитело связывается с клетками. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139, приблизительно в 1,1, 1,2, 1,3, 1,4, 1,5, 2, 3, 4 или 5 раз сильнее, чем изотипическое контрольное антитело связывается с клетками. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139, между 0 и 1,1, 1,1 и 1,5, 1,5 и 3, или 3 и 5 раз сильнее, чем изотипическое контрольное антитело связывается с клетками.
[00316] Белок, кодируемый аминокислотной последовательностью из SEQ ID № 139, также упоминают в настоящем описании как MUC16c114-N3. MUC16c114-N3 состоит из C-концевых 114 аминокислотных остатков зрелого MUC16 (SEQ ID № 150 представляет собой последовательность зрелого MUC16), за исключением того, что аспарагин в положении аминокислоты 30 (соответствующем положению аминокислоты 1806 из SEQ ID № 150) мутирован в аланин. Таким образом, MUC16c114-N3 не способен к N-гликозилированию в положении аминокислоты 30 из SEQ ID № 139 (соответствующем положению аминокислоты Asn1806 из SEQ ID № 150).
[00317] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139, по меньшей мере в 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 30 или 40 раз слабее, чем 4H11 связывается с клетками. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139, приблизительно в 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 30 или 40 раз слабее, чем 4H11 связывается с клетками. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с клеткой, которая рекомбинантно экспрессирует вторую форму MUC16, эта вторая форма не гликозилирована, и где аминокислотная последовательность второй формы представляет собой SEQ ID № 139, между 3 и 5, 5 и 10, 10 и 20, или 20 и 40 раз слабее, чем 4H11 связывается с клеткой.
[00318] Анализы для того, чтобы определять связывание антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанные в настоящем описании, с клеткой, например, такие как FACs, известны специалисту в данной области. См., например, способы, описанные в разделе 6.2.
[00319] В рамках изобретения, «4H11» относится к моноклональному антителу против MUC16 с обозначением 4H11 в Rao et al., Appl. Immunohistochem Mol Morphol, 2010, 18(5):462-72 и в публикации международной патентной заявки № WO 2011/119979.
[00320] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, связываются с пептидом, который содержит аминокислотную последовательность CTRNGTQLQNFTLDRSSV (SEQ ID № 130), в которой аминокислотный остаток номер 4 (N4) и аминокислотный остаток номер 10 (N10) из CTRNGTQLQNFTLDRSSV (SEQ ID № 130) гликозилированы. В некоторых вариантах осуществления пептид состоит из аминокислотной последовательности CTRNGTQLQNFTLDRSSV (SEQ ID № 130), в которой аминокислотный остаток номер 4 (N4) и аминокислотный остаток номер 10 (N10) из CTRNGTQLQNFTLDRSSV (SEQ ID № 130) гликозилированы. В некоторых вариантах осуществления гликозилирование состоит из N-связанной хитобиозы. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент связывается с пептидом, который содержит аминокислотную последовательность CGTQLQNFTLDRSSV (SEQ ID № 131), где аминокислотный остаток номер 7 (N7) из CGTQLQNFTLDRSSV (SEQ ID № 131) гликозилирован. В некоторых вариантах осуществления пептид состоит из аминокислотной последовательности CGTQLQNFTLDRSSV (SEQ ID № 131), где аминокислотный остаток номер 7 (N7) из CGTQLQNFTLDRSSV (SEQ ID № 131) гликозилирован. В некоторых вариантах осуществления гликозилирование состоит из N-связанной хитобиозы. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент связывается со смесью пептидов, где смесь пептидов содержит (a) первый пептид, который содержит аминокислотную последовательность CTRNGTQLQNFTLDRSSV (SEQ ID № 130), где аминокислотный остаток номер 4 (N4) и аминокислотный остаток номер 10 (N10) из CTRNGTQLQNFTLDRSSV (SEQ ID № 130) гликозилированы, и (b) второй пептид, который содержит аминокислотную последовательность CGTQLQNFTLDRSSV (SEQ ID № 131), где аминокислотный остаток номер 7 (N7) из CGTQLQNFTLDRSSV (SEQ ID № 131) гликозилирован. В некоторых вариантах осуществления первый пептид состоит из аминокислотной последовательности CTRNGTQLQNFTLDRSSV (SEQ ID № 130), где аминокислотный остаток номер 4 (N4) и аминокислотный остаток номер 10 (N10) из CTRNGTQLQNFTLDRSSV (SEQ ID № 130) гликозилированы. В некоторых вариантах осуществления второй пептид состоит из аминокислотной последовательности CGTQLQNFTLDRSSV (SEQ ID № 131), где аминокислотный остаток номер 7 (N7) из CGTQLQNFTLDRSSV (SEQ ID № 131) гликозилирован. В некоторых вариантах осуществления гликозилирование состоит из N-связанной хитобиозы.
[00321] Анализы для того, чтобы определять связывание антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, с клеткой, например, такие как ELISA, известны специалисту в данной области. См., например, способы, описанные в разделе 6.2. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с пептидом(ами) по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 30 раз сильнее, чем связывание моноклонального антитела против MUC16 4H11 с пептидом. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с пептидом(ами) приблизительно в 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 30 раз сильнее, чем связывание моноклонального антитела против MUC16 4H11 с пептидом.
[00322] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с пептидом(ами) с kd меньше чем 0,5×10-3/с, 1×10-3/с, 1,5×10-3/с, 2×10-3/с, 2,5×10-3/с, 3×10-3/с, 4×10-3/с, 5×10-3/с, 6×10-3/с, 7×10-3/с, 8×10-3/с, 9×10-3/с, 1×10-4/с, 2×10-4/с, 3×10-4/с, 4×10-4/с, 5×10-4/с, 6×10-4/с, 7×10-4/с или 8×10-4/с. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с пептидом(ами) с kd приблизительно 0,5×10-3/с, 1×10-3/с, 1,5×10-3/с, 2×10-3/с, 2,5×10-3/с, 3×10-3/с, 4×10-3/с, 5×10-3/с, 6×10-3/с, 7×10-3/с, 8×10-3/с, 9×10-3/с, 1×10-4/с, 2×10-4/с, 3×10-4/с, 4×10-4/с, 5×10-4/с, 6×10-4/с, 7×10-4/с или 8×10-4/с. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с пептидом(ами) с kd приблизительно от 0,5×10-3/с до 8×10-4/с.
[00323] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с пептидом(ами) с ka по меньшей мере 2,5×104/с, 3×104/с, 3,5×104/с, 4×104/с, 4,5×104/с, 5×104/с, 5,5×104/с, 6×104/с, 6,5×104/с, 7×104/с, 7,5×104/с, 8×104/с, 9×104/с или 9×105/с. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с пептидом(ами) с ka приблизительно 2,5×104/с, 3×104/с, 3,5×104/с, 4×104/с, 4,5×104/с, 5×104/с, 5,5×104/с, 6×104/с, 6,5×104/с, 7×104/с, 7,5×104/с, 8×104/с, 9×104/с или 9×105/с. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с пептидом(ами) с ka приблизительно от 2,5×104/с до 9×105/с.
[00324] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с пептидом(ами) с KD меньше чем 1000 нМ, 500 нМ, 100 нМ, 50 нМ, 25 нМ, 20 нМ, 15 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,5 нМ, 0,1 нМ или 0,05 нМ. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с пептидом(ами) with a KD приблизительно 1000 нМ, 500 нМ, 100 нМ, 50 нМ, 25 нМ, 20 нМ, 15 нМ, 10 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,5 нМ, 0,1 нМ или 0,05 нМ. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, связываются с пептидом(ами) с KD приблизительно от 500 нМ до 1000 нМ.
[00325] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или антигенсвязывающий фрагмент не имеют иммуноспецифического связывания с аминокислотной последовательностью CTRNGTQLQNFTLDRSSV (SEQ ID № 130), где аминокислотный остаток номер 4 (N4) и аминокислотный остаток номер 10 (N10) из CTRNGTQLQNFTLDRSSV (SEQ ID № 130) не гликозилированы. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент не имеют иммуноспецифического связывания с аминокислотной последовательностью CGTQLQNFTLDRSSV (SEQ ID № 131), где аминокислотный остаток номер 7 (N7) из CGTQLQNFTLDRSSV (SEQ ID № 131) гликозилирован. В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, не имеют иммуноспецифического связывания со смесью пептидов, где смесь пептидов содержит (a) первый пептид, который состоит из аминокислотной последовательности CTRNGTQLQNFTLDRSSV (SEQ ID № 130), где аминокислотный остаток номер 4 (N4) и аминокислотный остаток номер 10 (N10) из CTRNGTQLQNFTLDRSSV (SEQ ID № 130) гликозилированы, и (b) второй пептид, который состоит из аминокислотной последовательности CGTQLQNFTLDRSSV (SEQ ID № 131), где аминокислотный остаток номер 7 (N7) из CGTQLQNFTLDRSSV (SEQ ID № 131) гликозилирован.
[00326] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, ингибируют инвазию матригеля in vitro клетками, которые рекомбинантно экспрессируют определенную форму MUC16, которая гликозилирована, и где аминокислотная последовательность определенной формы MUC16 представляет собой SEQ ID № 133 (MUC16c114). В некоторых вариантах осуществления клетки, которые рекомбинантно экспрессируют гликозилированный MUC16c114, представляют собой клетки SKOV3. В некоторых вариантах осуществления гликозилированная форма MUC16c114 является N-гликозилированной. В некоторых вариантах осуществления гликозилированная форма MUC16c114 является N-гликозилированной по аминокислотному остатку Asn30 (соответствующему Asn1806 зрелого MUC16 (SEQ ID № 150)). В некоторых вариантах осуществления гликозилированная форма MUC16c114 является N-гликозилированной по аминокислотным остаткам Asn 24 и Asn30 (соответствующим Asn1800 и Asn1806, соответственно, зрелого MUC16 (SEQ ID № 150)). В некоторых вариантах осуществления гликозилированная форма MUC16c114 является N-гликозилированной по аминокислотным остаткам Asn1, Asn24 и Asn30 (соответствующим Asn1777, Asn1800 и Asn1806, соответственно, зрелого MUC16 (SEQ ID № 150)). В некоторых вариантах осуществления гликозилирование содержит N-связанную хитобиозу. В некоторых вариантах осуществления гликозилирование состоит из N-связанной хитобиозы. В некоторых вариантах осуществления инвазию матригеля ингибируют по меньшей мере в 1,25, 1,5, 1,75, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз по сравнению с инвазией матригеля in vitro клетками, где клетки обрабатывают контрольным антителом (например, антителом, которое не нацелено на MUC16) или с использованием 4H11. В некоторых вариантах осуществления инвазию матригеля ингибируют приблизительно в 1,25, 1,5, 1,75, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз по сравнению с инвазией матригеля in vitro клетками, где клетки обрабатывают контрольным антителом (например, антителом, которое не нацелено на MUC16) или с использованием 4H11.
[00327] Анализы для того, чтобы определять ингибирование инвазии матригеля, опосредованное антителом к гликозилированному MUC16 или антигенсвязывающим фрагментом, известны специалисту в данной области. См., например, способы, описанные в разделе 6.2. Например, BD BioCoat™ Matrigel™ Invasion Inserts or Chambers (№ по каталогу 354480 в 24-луночном планшете) и Control Inserts (№ по каталогу 354578 в 24-луночном планшете) можно приобретать в BD Biosciences, MA. Анализ инвазии матригеля можно осуществлять в соответствии с протоколом производителя. В кратком изложении, матригелевые камеры в 24-луночных планшетах (которые хранят при -20°C) и контрольные вставки (которые хранят при 4°C) оставляют, чтобы они доходили до комнатной температуры. Обе вставки регидратируют с использованием 0,5 мл бессывороточной среды во вставке, а также во внешней лунке 24-луночного планшета, в течение 2 ч при 37°C 5% CO2 во влажном инкубаторе. Культивируемые клетки SKOV3 трипсинизируют и промывают средой для культивирования. Миллион клеток отделяют в другую пробирку для центрифуги и промывают 3 раза бессывороточной средой. Эти клетки позднее корректируют, чтобы получить 5000 клеток в 0,5 мл бессывороточной среды. Среду в регидратированных вставках удаляют и вставки переносят в новый 24-луночный планшет, содержащий 0,75 мл среды для культивирования, содержащей 10% эмбриональной телячьей сыворотки (FBS), в лунке, которая служит в качестве хемоаттрактанта. Незамедлительно во вставку добавляют 0,5 мл клеток (5000 клеток) в бессывороточной среде. Надлежащее внимание уделяют проверки, чтобы воздушные пузырьки не застревали во вставке внешней лунке. 24-луночный планшет инкубируют при 37°C 5% CO2 во влажном инкубаторе в течение 48 ч. После инкубации не проникающие клетки удаляют с верхней поверхности мембраны «отскребанием», вставляя тампон с хлопком на конце в матригель или контрольную вставку и аккуратно прикладывая давление, при этом перемещая кончик тампона по поверхности мембраны. Отскребание повторяют с использованием второго тампона, увлажненного в среде. Затем вставки окрашивают в новом 24-луночном планшете, содержащем 0,5 мл 0,5% красителя кристаллического фиолетового в дистиллированной воде в течение 30 минут. После окрашивания вставки споласкивают в 3 стаканах дистиллированной воды для того, чтобы удалять избыточный краситель. Вставки сушат на воздухе в новом 24-луночном планшете. Проникшие клетки считают вручную под инвертированным микроскопом на увеличении 200×. Несколько полей мембран в трех повторениях подсчитывали и регистрировали на фиг.
[00328] В некоторых вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, способны ингибировать или снижать метастазирование, ингибировать опухолевый рост или индуцировать регресс опухоли в исследованиях в модели на мышах. Например, линии опухолевых клеток можно вводить бестимусным голым мышам, и бестимусным мышам можно вводить антитела к гликозилированному MUC16, описанные в настоящем описании, один или несколько раз, и можно осуществлять мониторинг прогрессирования опухоли из инъецированных опухолевых клеток в течение периода в недели и/или месяцы. В некоторых случаях, введение антител к гликозилированному MUC16 или их антигенсвязывающих фрагментов бестимусным голым мышам может происходить перед введением линий опухолевых клеток. В определенном варианте осуществления клетки SKOV3, экспрессирующие MUC16c114, используют для моделей ксенотрансплантата на мышах, описанных в настоящем описании. См., например, раздел 6.2 и раздел 6.3.
[00329] В конкретных вариантах осуществления антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, описанные в настоящем описании, ингибируют опухолевый рост или индуцируют регресс опухоли в модели на мышах по меньшей мере приблизительно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98%, 99% или 100%, как оценивают способами, описанными в настоящем описании или известными специалисту в данной области, по сравнению с мышами, которые получали имитацию лечения. В конкретных вариантах осуществления антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, описанные в настоящем описании, ингибируют опухолевый рост или индуцируют регресс опухоли в модели на мышах по меньшей мере приблизительно на 25% или 35%, необязательно приблизительно до 75%, как оценивают способами, описанными в настоящем описании или известными специалисту в данной области, по сравнению с мышами, которые получали имитацию лечения. В конкретных вариантах осуществления, антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, описанные в настоящем описании, ингибируют опухолевый рост или индуцируют регресс опухоли в модели на мышах посредством по меньшей мере приблизительно в 1 раз, 1,2 раза, 1,3 раза, 1,4 раза, 1,5 раза, 2 раза, 2,5 раза, 3 раза, 3,5 раза, 4 раза, 4,5 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 15 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз или 100 раз, как оценивают способами, описанными в настоящем описании или известными специалисту в данной области, по сравнению с мышами, которые получали имитацию лечения. Мышей, которые получали имитацию лечения, например, можно лечить фосфатно-солевым буфером или контролем (например, антителом против IgG).
[00330] Определение ингибирования роста опухоли или регресса опухоли можно оценивать, например, посредством мониторинга размера опухоли за период времени, например, посредством физического измерения пальпируемых опухолей или других визуальных способов обнаружения. Например, можно создавать линии опухолевых клеток для того, чтобы рекомбинантно экспрессировать визуализирующее средство, такое как зеленый флуоресцентный белок (GFP) или люцифераза, затем визуализацию GFP in vivo можно осуществлять посредством микроскопии, а визуализацию люциферазы in vivo можно осуществлять посредством вконтроля субстрата люциферазы мышам с ксенотрансплантатами и обнаружения люминесценции из-за того, что фермент люцифераза преобразует субстрат люциферазы. Степень или уровень обнаружения GFP или люциферазы коррелирует с размером опухоли у мышей с ксенотрансплантатами.
[00331] В некоторых вариантах осуществления антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, описанные в настоящем описании, могут повышать выживаемость животных в моделях ксенотрансплантата опухоли по сравнению с мышами, которые получали имитацию лечения. В конкретных вариантах осуществления, антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, описанные в настоящем описании, повышают выживаемость мышей в моделях ксенотрансплантата опухоли по меньшей мере приблизительно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99%, как оценивают способами, описанными в настоящем описании или известными специалисту в данной области, по сравнению с мышами, которые получали имитацию лечения. В конкретных вариантах осуществления, антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, описанные в настоящем описании, повышают выживаемость мышей в моделях ксенотрансплантата опухоли по меньшей мере приблизительно на 25% или 35%, необязательно приблизительно до 75%, как оценивают способами, описанными в настоящем описании или известными специалисту в данной области, по сравнению с мышами, которые получали имитацию лечения, в моделях ксенотрансплантата опухоли. В конкретных вариантах осуществления, антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, описанные в настоящем описании, повышают выживаемость мышей в моделях ксенотрансплантата опухоли по меньшей мере приблизительно в 1 раз, 1,2 раза, 1,3 раза, 1,4 раза, 1,5 раза, 2 раза, 2,5 раза, 3 раза, 3,5 раза, 4 раза, 4,5 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 15 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз или 100 раз, как оценивают способами, описанными в настоящем описании или известными специалисту в данной области, по сравнению с мышами, которые получали имитацию лечения, в моделях ксенотрансплантата опухоли. Выживаемость, например, можно определять посредством построения кривой выживаемости для числа выживших мышей в зависимости от времени (например, сутки или недели) после инъекции линии опухолевых клеток. Мышей, которые получали имитацию лечения, например, можно лечить фосфатно-солевым буфером или контролем (например, антителом против IgG).
[00332] В некоторых вариантах осуществления происходит интернализация антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, в клетку, которая экспрессирует определенную форму MUC16, которая гликозилирована, и где аминокислотная последовательность определенной формы MUC16 представляет собой SEQ ID № 133 (MUC16c114), при контакте клетки с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом. «Интернализированный» или «интернализация», по отношению к молекуле, которую интернализирует клетка, относится к прохождению молекулы, которая находится в контакте с внеклеточной поверхностью клеточной мембраны, через клеточную мембрану на внутриклеточную поверхность клеточной мембраны и/или в цитоплазму клетки. В некоторых вариантах осуществления клетки, которые рекомбинантно экспрессируют гликозилированный MUC16c114, представляют собой клетки SKOV3. В некоторых вариантах осуществления гликозилированная форма MUC16c114 является N-гликозилированной. В некоторых вариантах осуществления гликозилированная форма MUC16c114 является N-гликозилированной по аминокислотному остатку Asn30 (соответствующему Asn1806 зрелого MUC16 (SEQ ID № 150)). В некоторых вариантах осуществления гликозилированная форма MUC16c114 является N-гликозилированной по аминокислотным остаткам Asn 24 и Asn30 (соответствующим Asn1800 и Asn1806, соответственно, зрелого MUC16 (SEQ ID № 150)). В некоторых вариантах осуществления гликозилированная форма MUC16c114 является N-гликозилированной по аминокислотным остаткам Asn1, Asn24 и Asn30 (соответствующим Asn1777, Asn1800 и Asn1806, соответственно, зрелого MUC16 (SEQ ID № 150)). В некоторых вариантах осуществления гликозилирование содержит N-связанную хитобиозу. В некоторых вариантах осуществления гликозилирование состоит из N-связанной хитобиозы.
[00333] Анализы для того, чтобы определять интернализацию антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, в клетку, такие как, например, с использованием радиомеченных антител, известны специалисту в данной области. См., например, способы, описанные в разделе 6.2. Например, интернализацию меченного89Zr антитела можно исследовать на клетках SKOV3, экспрессирующих MUC16c114. В кратком изложении, приблизительно 1×105 клеток высевают в 12-луночный планшет и инкубируют в течение ночи при 37°C 5% CO2 в инкубаторе. Определенный объем радиоактивно меченного белка добавляют в каждую лунку и планшеты инкубируют при 37°C и 4°C в течение 1, 5, 12 и 24 часов. После каждого периода инкубации собирают среду и споласкивают клетки с использованием 1 мл фосфатно-солевого буфера (PBS). Активность, связанную с поверхностью, собирают посредством промывания клеток в 1 мл 100 мМ уксусной кислоты с использованием 100 мМ глицина (1:1, pH 3,5) при 4°C. Затем прилипшие клетки лизируют с использованием 1 мл 1 M NaOH. Каждый смыв собирают и подсчитывают активность. Соотношение активности в конечном смыве к общей активности всех смывов используют для того, чтобы определять % интернализованных. В некоторых вариантах осуществления анализ осуществляют при 37°C. В некоторых вариантах осуществления интернализация антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента происходит по меньшей мере в 1, 2, 3, 5, 6, 7, 8, 9 или 10 процентах клеток, инкубированных с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом. В некоторых вариантах осуществления интернализация антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента происходит приблизительно в 1, 2, 3, 5, 6, 7, 8, 9 или 10 процентах клеток, которые инкубировали с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом. В некоторых вариантах осуществления интернализация антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента происходит в пределах 1, 2, 3, 4, 8, 12, 16, 20 или 24 часов контакта клеток с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом.
5.2 КОНЪЮГАТЫ АНТИТЕЛА
[00334] В предпочтительных вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент (см. раздел 5.1), представленные в настоящем описании, не конъюгируют с какой-либо другой молекулой, такой как органический фрагмент, поддающаяся обнаружению метка или изотоп. В альтернативных вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент (см. раздел 5.1), представленные в настоящем описании, конъюгируют с одним или несколькими органическими фрагментами. В альтернативных вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, конъюгируют с одной или несколькими поддающимися обнаружению метками. В альтернативных вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, конъюгируют с одним или несколькими изотопами.
5.2.1 ПОДДАЮЩИЕСЯ ОБНАРУЖЕНИЮ МЕТКИ И ИЗОТОПЫ
[00335] В некоторых вариантах осуществления в настоящем описании предоставлены конъюгаты антител к гликозилированному MUC16 или их антигенсвязывающих фрагментов (см. раздел 5.1), где указанное антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент конъюгируют с одним или несколькими средствами, например, визуализирующим средством или цитотоксическим средством. Также в настоящем описании предоставлены конъюгаты биспецифических антител, в которых указанное биспецифическое антитело конъюгируют с одним или несколькими средствами, например, визуализирующим средством или цитотоксическим средством. Также в настоящем описании предоставлены конъюгаты тяжелых цепей антител, в котором указанную тяжелую цепь антитела конъюгируют с одним или несколькими средствами, например, визуализирующим средством или цитотоксическим средством. Также в настоящем описании предоставлены конъюгаты легких цепей антител, в которых указанную легкую цепь антитела конъюгируют с одним или несколькими средствами, например, визуализирующим средством или цитотоксическим средством. Также в настоящем описании предоставлены конъюгаты слитых белков, в которых указанный слитый белок конъюгируют со средством, например, визуализирующим средством или цитотоксическим средством. В некоторых вариантах осуществления средство конъюгируют ковалентно или не ковалентно.
[00336] В некоторых вариантах осуществления визуализирующее средство представляет собой поддающуюся обнаружению метку, такую как хромогенная, ферментативная, радиоизотопная, изотопная, флуоресцентная, токсическая, хемилюминесцентная метка, контрастное средство для ядерного магнитного резонанса или другая метка.
[00337] Неограничивающие примеры подходящих хромогенных меток включают диаминобензидин и 4-гидроксиазо-бензол-2-карбоновую кислоту.
[00338] Неограничивающие примеры подходящих ферментативных меток включают малатдегидрогеназу, стафилококковую нуклеазу, дельта-5-стероидизомеразу, дрожжевую дегидрогеназу спирта, альфа-глицеринфосфатдегидрогеназу, триозофосфатизомеразу, пероксидазу, щелочную фосфатазу, аспарагиназу, глюкозооксидазу, β-галактозидазу, рибонуклеазу, уреазу, каталазу, глюкозо-6-фосфат дегидрогеназу, глюкоамилазу и ацетилхолинэстеразу.
[00339] Неограничивающие примеры подходящих радиоизотопных меток включают3H,111In,125I,131I,32P,35S,14C,51Cr,57To,58Co,59Fe,75Se,152Eu,90Y,67Cu,217Ci,211At,212Pb,47Sc,223Ra,223Ra,89Zr,177Lu и109Pd. В некоторых вариантах осуществления111In является предпочтительным изотопом для визуализации in vivo, поскольку он позволяет избежать проблемы дегалогенирования125I- или131I-меченных антител к гликозилированному MUC16 или их антигенсвязывающих фрагментов в печени. Кроме того,111In имеет более благоприятную энергию гамма-излучения для визуализации (Perkins et al., Eur. J. Nucl. Med. 70:296-301 (1985); Carasquillo et al,, J. Nucl. Med. 25:281-287 (1987)). Например, показано, что происходит небольшой захват111In, сопряженного с моноклональными антителами с использованием 1-(п-изотиоцианатобензил)-ДПТК, в не опухолевых тканях, в частности, печени и, следовательно, происходит усиление специфичности определения местоположения опухоли (Esteban et al., J. Nucl. Med. 28:861-870 (1987)).
[00340] Неограничивающие примеры подходящих не радиоактивных изотопных меток включают157Gd,55Mn,162Dy,52Tr и56Fe.
[00341] Неограничивающие примеры подходящих флуоресцентных меток включают метку152Eu, флуоресцеиновую метку, изотиоцианатную метку, родаминовую метку, фикоэритриновую метку, фикоцианиновую метку, аллофикоцианиновую метку, метку зеленый флуоресцентный белок (GFP), метку о-фталевый альдегид и флуорескаминовую метку.
[00342] Неограничивающие примеры хемилюминесцентных меток включают люминоловую метку, изолюминоловую метку, метку сложный ароматический эфир акридиния, имидазоловую метку, метку соль акридиния, метку сложный эфир оксалата, люцифериновую метку, люциферазную метку и эквориновую метку.
[00343] Неограничивающие примеры контрастных средств для ядерного магнитного резонанса включают ядра тяжелых металлов, таких как Gd, Mn и железо.
[00344] Способы, известные специалисту в данной области для конъюгации описанных выше меток с указанными антителами к гликозилированному MUC16 или их антигенсвязывающими фрагментами, биспецифическими антителами, тяжелыми цепями антител, легкими цепями антител и слитными белками, описаны, например, в Kennedy et at., Clin. CMm. Acta 70:1-31 (1976), и Schurs et al., Clin. CMm. Acta 81:1-40 (1977). Способы связывания, отмеченные в последнем, представляют собой способ с глутаральдегидом, способ с перйодатом, способ с дималеимидом, способ со сложным эфиром м-малеимидобензил-N-гидроксисукцинимида, все эти способы включены посредством ссылки в настоящее описание.
[00345] Неограничивающие примеры цитотоксических средств включают цитостатические или цитоцидные средства, радиоактивные ионы металлов, например, альфа-излучатели, и токсины, например, экзотоксин Pseudomonas, абрин, токсин холеры, рицин A и дифтерийный токсин.
[00346] В некоторых вариантах осуществления средство представляет собой диагностическое средство. Диагностическое средство представляет собой средство, которое можно использовать при диагностировании или обнаружении заболевания посредством определения местоположения клеток, содержащих антиген. Пригодные диагностические средства включают, но не ограничиваясь этим, радиоизотопы, красители (например, с биотин-стрептавидиновым комплексом), контрастные средства, флуоресцентные соединения или молекулы и усиливающие средства (например, парамагнитные ионы) для магнитно-резонансной визуализации (MRI). Способ MRI и получение антител, конъюгированных с MRI усиливающим средством, описаны в патенте США № 6331175, который включен в полном объеме посредством ссылки. Предпочтительно, диагностические средства выбирают из группы, состоящей из радиоизотопов, усиливающих средств для использования в магнитно-резонансной визуализации и флуоресцентных соединений. Для того чтобы нагружать антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент радиоактивными металлами или парамагнитными ионами, можно быть необходимо проводить реакцию с реактивом, имеющим длинный хвост, к которому прикрепляют множество хелатирующих групп для связывания ионов. Такой хвост может представлять собой полимер, такой как полилизин, полисахарид или другая цепь, дериватизированная или допускающая дериватизацию, которая имеет боковые группы, с которыми можно связывать хелатирующие группы, такие как, например, этилендиаминтетрауксусная кислота (EDTA), диэтилентриаминпентауксусная кислота (DTPA), порфирины, полиамины, краун-эфиры, био-тиосемикарбазоны, полиоксимы и схожие группы, которые, как известно, можно использовать с этой целью. Хелаты связывают с антителами с использованием стандартных химических реакций. Хелат обычно связывают с антителом с помощью группы, которая допускает формирование связи с молекулой при минимальной потере иммунологической реактивности и минимальном агрегировании и/или внутреннем сшивании другие, более нестандартные, способы и реактивы для конъюгации хелатов с антителами раскрыты в патенте США № 4824659 на Hawthorne, озаглавленном «Antibody Conjugates», который выдан 25 апреля 1989 года, раскрытие которого включено в настоящее описание в полном объеме посредством ссылки. В частности, полезные комбинации металл-хелат включают 2-бензил-диэтилентриаминпентауксусную кислоту и ее монометиловый и циклогексиловый аналоги, используемые с диагностическими изотопами для радиологической визуализации. Те же хелаты, в комплексе с не радиоактивными металлами, такими как марганец, железо и гадолиний, можно использовать для MRI, когда используют наряду с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, предоставленными в настоящем описании. Макроциклические хелаты, такие как NOTA, DOTA и TETA, можно использовать с различными металлами и радиометаллами, наиболее конкретно с радионуклидами галлия, иттрия и меди, соответственно. Такие металл-хелатные комплексы можно делать очень стабильными посредством адаптации размера кольца к металлу, представляющему интерес. Другие хелаты кольцевого типа, такие как макроциклические простые полиэфиры, которые представляют интерес, для стабильного связывания нуклидов, таких как223Ra для RAIT, включены в настоящее описание.
[00347] В некоторых вариантах осуществления средство представляет собой органическое средство. Такие органические средства позволяют получать конъюгат с усовершенствованными фармакокинетическими свойствами (например, повышенным временем полужизни в сыворотке in vivo). Органический фрагмент может представлять собой гидрофильную полимерную группу, группу жирной кислоты или сложноэфирную группу жирной кислоты. В рамках изобретения, термин «жирная кислота» охватывает монокарбоновые кислоты и дикарбоновые кислоты. В рамках изобретения, «гидрофильная полимерная группа» относится к органическому полимеру, который более растворим в воде, чем в октане, например, полилизин. Гидрофильные полимеры, подходящие для модификации антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, предоставленных в настоящем описании, могут быть линейными или разветвленными и включают, например, полиалкангликоли (например, полиэтиленгликоль (PEG), монометоксиполиэтиленгликоль и полипропиленгликоль), углеводы (например, декстран, целлюлозу, олигосахариды и полисахариды), полимеры гидрофильных аминокислот (например, полилизин, полиаргинин и полиаспартат), полиалканоксиды (например, полиэтиленоксид и полипропиленоксид) и поливинилпирролидон. В некоторых вариантах осуществления гидрофильный полимер, который модифицирует антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, биспецифическое антитело, тяжелую цепь антитела, легкую цепь антитела или слитый белок, представленные в настоящем описании, имеет молекулярную массу приблизительно от 800 приблизительно до 150000 Да в виде отдельной молекулярной частицы. Например, можно использовать PEG5000 и PEG20000, в которых нижней индекс представляет собой усредненную молекулярную массу полимера в Да. Гидрофильную полимерную группу можно заменять на от одной приблизительно до шести алкильных групп, групп жирных кислот или сложных эфиров жирных кислот. Гидрофильные полимеры, которые замещают группами жирных кислот или сложных эфиров жирных кислот, можно получать с использованием подходящих способов. Например, полимер, содержащий аминогруппу, можно соединять с карбоксилатом жирной кислоты или сложного эфира жирной кислоты, и активированный карбоксилат (например, активированный N,N-карбонилдиимидазолом) на жирной кислоте или сложном эфире жирной кислоты можно соединять с гидроксильной группой на полимере.
[00348] Жирные кислоты и сложные эфиры жирных кислот, подходящие для модификации антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, биспецифического антитела, тяжелой цепи антитела, легкой цепи антитела или слитого белка, предоставленных в настоящем описании, могут быть насыщенными или могут содержать одно или несколько не насыщенных звеньев. Жирные кислоты, которые подходят для модификации антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, биспецифического антитела, тяжелой цепи антитела, легкой цепи антитела или слитого белка, предоставленных в настоящем описании, включают, например, н-додеканоат, н-тетрадеканоат, н-октадеканоат, н-эйкозаноат, н-докозаноат, н-триаконтаноат, н-тетраконтаноат, цис-дельта-9-октадеканоат, все цис-дельта-5,8,11,14-эйкозатетраеноат, октандикарбоновую кислоту, тетрадекандикарбоновую кислоту, октадекандикарбоновую кислоту, докозандикарбоновую кислоту и т.п. Подходящие сложные эфиры жирных кислот включают сложные моноэфиры дикарбоновых кислот, которые содержат линейную или разветвленную низшую алкильную группу. Низшая алкильная группа может содержать от одного приблизительно до двенадцати, предпочтительно от одного приблизительно до шести, атомов углерода.
[00349] Конъюгаты, представленные в настоящем описании, можно получать с использованием подходящих способов, например, посредством реакции с одним или несколькими модифицирующими средствами. В рамках изобретения, «активирующая группа» представляет собой химический фрагмент или функциональную группу, которая может, при подходящих условиях, вступать в реакцию со второй химической группой, тем самым формируя ковалентную связь между модифицирующим средством и второй химической группой. Например, аминореакционноспособные активирующие группы включают электрофильные группы, такие как, например, тозилат, мезилат, галоген (хлор, бром, фтор, йод), сложные N-гидроксисукцинимидиловые эфиры (NHS) и т.п. Активирующие группы, которые могут вступать в реакцию с тиолами, включают, например, малеимид, йодацетил, акрилолил, пиридилдисульфиды, тиол 5-тиол-2-нитробензойной кислоты (ТНБ-тиол) и т.п. Альдегидную функциональную группу можно соединять с амин- или гидразидсодержащими молекулами, и азидная группа может вступать в реакцию с группой трехвалентного фосфора для того, чтобы формировать фосфорамидатные или фосфоримидные связи. Подходящие способы контроля активирующих групп в молекулы известны в данной области (см., например, Hernanson, G. T., Bioconjugate Techniques, Academic Press: San Diego, Calif. (1996)). Активирующую группу можно связывать непосредственно с органической группой (например, гидрофильным полимером, жирной кислотой, сложным эфиром жирной кислоты), или через линкерный фрагмент, например, двухвалентную C1-C12 группу, в которой один или несколько атомов углерода можно заменять на гетероатом, такой как кислород, азот или сера. Подходящие линкерные фрагменты включают, например, тетраэтиленгликоль, (CH2)3 и NH. Модифицирующие средства, которые содержат линкерный фрагмент, можно получать, например, посредством реакции моно-Boc-алкилдиамина (например, моно-Boc-этилендиамина или моно-Boc-диаминогексана) с жирной кислотой в присутствии 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) для того, чтобы формировать амидную связь между свободным амином и карбоксилатом жирной кислоты. Защитную группу Boc можно удалять с продукта посредством обработки трифторуксусной кислотой (TFA) для того, чтобы обнажать первичный амин, который можно связывать с другим карбоксилатом, как описано, или он может вступать в реакцию с малеиновым ангидридом, а получаемый продукт циклизовать для того, чтобы получать активированное малеимидное производное жирной кислоты. (См., например, Thompson, et al., WO 92/16221, все положения которого включены в настоящее описание посредством ссылки.)
[00350] «Модифицирующее средство» может относиться к подходящей органической группе (например, гидрофильному полимеру, жирной кислоте и сложному эфиру жирной кислоты), которая содержит активирующую группу. Например, органические фрагменты можно связывать с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом не сайт-специфичным образом с использованием аминореакционноспособного модифицирующего средства, например, сложного эфира N-гидроксисукцинимида и полиэтиленгликоля. Модифицированное антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент также можно получать посредством восстановления дисульфидных связей (например, дисульфидных связей внутри цепей) антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, биспецифического антитела, тяжелой цепи антитела, легкой цепи антитела или слитого белка. Затем восстановленное антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, биспецифическое антитело, тяжелая цепь антитела, легкая цепь антитела или слитый белок может вступать в реакцию с тиолреакционноспособным модифицирующим средством для того, чтобы получать конъюгаты, представленные в настоящем описании. Конъюгаты, которые содержат органический фрагмент, который связан с конкретными участками антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, предоставленных в настоящем описании, можно получать с использованием подходящих способов, таких как обратный протеолиз (Fisch et al., Bioconjugate Chem., 3:147-153 (1992); Werlen et al., Bioconjugate Chem., 5:411-417 (1994); Kumaran et al., Protein Sci. 6(10):2233-2241 (1997); Itoh et al., Bioorg. Chem., 24(1): 59-68 (1996); Capellas et al., Biotechnol. Bioeng., 56(4):456-463 (1997)), и способов, описанных в Hermanson, G. T., Bioconjugate Techniques, Academic Press: San Diego, Calif. (1996).
5.3 ПОЛУЧЕНИЕ АНТИТЕЛ
5.3.1 ПОЛУЧЕНИЕ И СКРИНИНГ АНТИТЕЛ
[00351] В другом аспекте изобретение относится к способам получения антител к гликозилированному MUC16 или их антигенсвязывающих фрагментов (см. раздел 5.1 и раздел 5.2).
[00352] Антитела или их антигенсвязывающие фрагменты, описанные в настоящем описании, можно получать каким-либо известным в данной области способом для синтеза антител, например, посредством химического синтеза или способами рекомбинантной экспрессии. В способах, описанных в настоящем описании, используют, если не указано иное, общепринятые способы в молекулярной биологии, микробиологии, генетическом анализе, рекомбинантной ДНК, органической химии, биохимии, ПЦР, олигонуклеотидного синтеза и модификации, гибридизации нуклеиновых кислот и связанных областях в рамках компетенции в данной области техники. Эти способы описаны, например, в источниках, цитируемых в настоящем описании, и полностью объяснены литературе. См., например, Maniatis T et al., (1982) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; Sambrook J et al., (1989), Molecular Cloning: A Laboratory Manual, второе издание, Cold Spring Harbor Laboratory Press; Sambrook J et al., (2001) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Ausubel FM et al., Current Protocols in Molecular Biology, John Wiley & Sons (1987 и ежегодные обновления); Current Protocols in Immunology, John Wiley & Sons (1987 и ежегодные обновления) Gait (ред.) (1984) Oligonucleotide Synthesis: A Practical Approach, IRL Press; Eckstein (ред.) (1991) Oligonucleotides and Analogues: A Practical Approach, IRL Press; Birren B et al., (ред.) (1999) Genome Analysis: A Laboratory Manual, Cold Spring Harbor Laboratory Press.
[00353] В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, представляют собой антитело (например, рекомбинантное антитело), полученное, экспрессированное, созданное или выделенное с помощью какого-либо средства, которое включает создание, например, через синтез, генетическую инженерию последовательностей ДНК. В некоторых вариантах осуществления такое антитело содержит последовательности, которые кодируют последовательности ДНК, которые в природе не существуют в репертуаре зародышевой линии антител животного или млекопитающего (например, человека) in vivo. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, создают способом, который включает использование гликозилированной формы из SEQ ID № 129, SEQ ID № 130 и/или SEQ ID № 131. В частном варианте осуществления гликозилированная форма из SEQ ID № 129, SEQ ID № 130 и/или SEQ ID № 131 гликозилирована одной или несколькими хитобиозами. Подробное описание получения антител, описанных в настоящем описании, см., например, в разделе 6.2, разделе 6.3 и разделе 6.4.
[00354] В определенном аспекте, в настоящем описании предоставлен иммуногенный гликопептид, который содержит один или несколько участков гликозилирования, где (i) иммуногенный гликопептид составляет от 10 до 60 аминокислотных остатков, от 10 до 30 аминокислотных остатков, от 15 до 25 аминокислотных остатков, от 15 до 20 аминокислотных остатков или от 15 до 18 аминокислотных остатков в длину и (ii) по меньшей мере один из одного или нескольких участков гликозилирования связан с углеводом.
[00355] В некоторых вариантах осуществления иммуногенный гликопептид содержит один, два или три участка гликозилирования. В частном варианте осуществления иммуногенный гликопептид содержит один участок гликозилирования. В другом конкретном варианте осуществления иммуногенный гликопептид содержит два участка гликозилирования.
[00356] В конкретных вариантах осуществления иммуногенный гликопептид содержит один участок гликозилирования, который связан с углеводом. В конкретных вариантах осуществления иммуногенный гликопептид содержит два участка гликозилирования, каждый из которых связан с углеводом.
[00357] Углевод, связанный с одним или несколькими участками гликозилирования иммуногенного гликопептида, может представлять собой N-связанный углевод, O-связанный углевод или C-связанный углевод. N-связанный углевод прикрепляют к остатку аспарагина, и это представляет собой наиболее распространенную форму, встречающуюся в природе. Большинство N-связанных углеводов связаны с пептидом в форме GlcNAc-β-Asn. O-связанный углевод прикрепляют к гидроксильной боковой цепи аминокислоты (обычно, в серине или треонине). Большинство O-связанных углеводов связаны с пептидами в форме GlcNAc-β-Ser/Thr или GlcNAc-α-Ser/Thr. C-связанный углевод относится к маннозе, прикрепленной к остатку триптофана, и представляет собой наименее обыкновенную форму, встречающуюся в природе. В одном из вариантов осуществления углевод в иммуногенном гликопептиде представляет собой N- или O-связанный углевод. В частном варианте осуществления углевод в иммуногенном гликопептиде представляет собой N-связанный углевод.
[00358] Углевод, связанный с одним или несколькими участками гликозилирования иммуногенного гликопептида, может представлять собой моносахарид, дисахарид, олигосахарид (например, трисахарид, тетрасахарид или пентасахарид) или полисахарид. В некоторых вариантах осуществления углевод представляет собой моносахарид, дисахарид, трисахарид, тетрасахарид или пентасахарид. В частном варианте осуществления углевод представляет собой дисахарид. В частном варианте осуществления дисахарид представляет собой хитобиозу. В другом конкретном варианте осуществления, углевод представляет собой Man3GlcNAc2. В конкретных вариантах осуществления N-конец иммуногенного гликопептида ацетилирован. В конкретных вариантах осуществления C-конец иммуногенного гликопептида находится в форме производного N-метилкарбоксамида.
[00359] В некоторых вариантах осуществления иммуногенный гликопептид конъюгируют с иммуногенным белком-переносчиком. В большинстве случаев небольшие антигены (например, короткие пептиды или небольшие гаптены) не достаточно сложны для того, чтобы вызывать образование антител. Иммуногенные белки-переносчики, по причине их большого размера и сложной структуры, могут придавать иммуногенность конъюгированным небольшим антигенам, что ведет к образованию антител к эпитопам на небольших антигенах и иммуногенных белках-переносчиках. Следовательно, небольшие антигены всегда химически конъюгированы с иммуногенными белками-переносчиками для того, чтобы интенсифицировать иммунный ответ для успешного образования антител. Широко используемые иммуногенные белки-переносчики включают, но не ограничиваясь этим, гемоцианин морского блюдца (KLH), гемоцианин Concholepas concholepas (CCH), бычий сывороточный альбумин (BSA), и овальбумин (OVA). В частном варианте осуществления иммуногенный гликопептид конъюгируют с KLH. KLH представляет собой медьсодержащий полипептид, который относится к группе негемовых белков, называемых гемоцианинами, которые встречаются у членистоногих и моллюсков. KLH выделяют у фиссурелловых (Megathura crenulata). В силу его эволюционной удаленности от млекопитающих, высокой молекулярной массы, сложной структуры и большой поверхности, содержащей несколько сотен групп лизина, которые предоставляют первичные амины в качестве мишеней для конъюгации, KLH является чрезвычайно иммуногенным и эффективным белком-переносчиком у млекопитающих.
[00360] В некоторых вариантах осуществления иммуногенный гликопептид составляет от 10 до 60 аминокислотных остатков в длину. В некоторых вариантах осуществления иммуногенный гликопептид составляет от 10 до 30 аминокислотных остатков в длину. В некоторых вариантах осуществления иммуногенный гликопептид составляет от 15 до 25 аминокислотных остатков в длину. В некоторых вариантах осуществления иммуногенный гликопептид составляет от 15 до 20 аминокислотных остатков в длину. В конкретных вариантах осуществления, иммуногенный гликопептид составляет от 15 до 18 аминокислотных остатков в длину. В конкретном аспекте таких конкретных вариантов осуществления, в которых иммуногенный гликопептид составляет от 15 до 18 аминокислотных остатков в длину, иммуногенный гликопептид содержит участок гликозилирования, который связан с хитобиозой. В другом конкретном аспекте таких конкретных вариантов осуществления, в которых иммуногенный гликопептид составляет от 15 до 18 аминокислотных остатков в длину, иммуногенный гликопептид содержит два участка гликозилирования, каждый из которых связан с хитобиозой. В частном варианте осуществления иммуногенный гликопептид составляет 55 аминокислотных остатков в длину. В конкретном аспекте такого конкретного варианта осуществления, в котором иммуногенный гликопептид составляет 55 аминокислотных остатков в длину, иммуногенный гликопептид содержит участок гликозилирования, который связан с хитобиозой. В частном варианте осуществления иммуногенный гликопептид составляет 18 аминокислотных остатков в длину. В конкретном аспекте такого конкретного варианта осуществления, в котором иммуногенный гликопептид составляет 18 аминокислотных остатков в длину, иммуногенный гликопептид содержит два участка гликозилирования, каждый из которых связан с хитобиозой. В другом конкретном варианте осуществления иммуногенный гликопептид составляет 15 аминокислотных остатков в длину. В конкретном аспекте такого конкретного варианта осуществления, в котором иммуногенный гликопептид составляет 15 аминокислотных остатков в длину, иммуногенный гликопептид содержит участок гликозилирования, который связан с хитобиозой.
[00361] В некоторых вариантах осуществления иммуногенный гликопептид содержит по меньшей мере часть из 10 аминокислот аминокислотной последовательности из SEQ ID № 150, и по меньшей мере один из одного или нескольких участков гликозилирования иммуногенного гликопептида находится в указанной части аминокислотной последовательности. В определенных других вариантах осуществления иммуногенный гликопептид содержит часть по меньшей мере в 15, 20, 25 или 30 аминокислот из аминокислотной последовательности из SEQ ID № 150, и по меньшей мере один из одного или нескольких участков гликозилирования иммуногенного гликопептида находится в указанной части аминокислотной последовательности. В конкретных вариантах осуществления иммуногенный гликопептид составляет от 15 до 18 аминокислотных остатков в длину. В конкретных вариантах осуществления иммуногенный гликопептид составляет 55 аминокислотных остатков в длину. В конкретных вариантах осуществления иммуногенный гликопептид содержит аминокислотную последовательность из SEQ ID № 129. В частном варианте осуществления иммуногенный гликопептид составляет 55 аминокислотных остатков в длину и содержит аминокислотную последовательность из SEQ ID № 129. В частном варианте осуществления иммуногенный гликопептид, который содержит аминокислотную последовательность из SEQ ID № 129, содержит участок гликозилирования в 30-м остатке (Asn), который связан с хитобиозой. В другом конкретном варианте осуществления иммуногенный гликопептид, который содержит аминокислотную последовательность из SEQ ID № 129, содержит участок гликозилирования в 30-м остатке (Asn) из SEQ ID № 129, который связан с фрагментом Man3GlcNAc2. В конкретных вариантах осуществления иммуногенный гликопептид составляет 18 аминокислотных остатков в длину. В конкретных вариантах осуществления иммуногенный гликопептид содержит аминокислотную последовательность из SEQ ID № 130. В частном варианте осуществления иммуногенный гликопептид составляет 18 аминокислотных остатков в длину и содержит аминокислотную последовательность из SEQ ID № 130. В частном варианте осуществления иммуногенный гликопептид, который содержит аминокислотную последовательность из SEQ ID № 130, содержит два участка гликозилирования в 4-м остатке (Asn) и 10-м остатке (Asn), каждый из которых связан с хитобиозой. В конкретных вариантах осуществления иммуногенный гликопептид составляет 15 аминокислотных остатков в длину. В конкретных вариантах осуществления иммуногенный гликопептид содержит аминокислотную последовательность из SEQ ID № 131. В частном варианте осуществления иммуногенный гликопептид составляет 15 аминокислотных остатков в длину и содержит аминокислотную последовательность из SEQ ID № 131. В частном варианте осуществления иммуногенный гликопептид, который содержит аминокислотную последовательность из SEQ ID № 131, содержит участок гликозилирования в 7-м остатке (Asn), который связан с хитобиозой.
[00362] В другом аспекте изобретение относится к способу создания антитела или его антигенсвязывающего фрагмента, которые специфически связываются с гликопротеином, который включает иммунизацию субъекта иммуногенным гликопептидом, который содержит один или несколько участков гликозилирования, как описано выше. В некоторых вариантах осуществления иммуногенный гликопептид содержит по меньшей мере часть из 10 аминокислот аминокислотной последовательности гликопротеина, и по меньшей мере один из одного или нескольких участков гликозилирования иммуногенного гликопептида находится в указанной части аминокислотной последовательности. В других определенных вариантах осуществления иммуногенный гликопептид содержит часть по меньшей мере из 15, 20, 25 или 30 аминокислот аминокислотной последовательности гликопротеина, и по меньшей мере один из одного или нескольких участков гликозилирования иммуногенного гликопептида присутствует в указанной части аминокислотной последовательности. В частном варианте осуществления гликопротеин содержит аминокислотную последовательность из SEQ ID № 150. В частном варианте осуществления антитело или его антигенсвязывающий фрагмент не имеют специфического связывания с не гликозилированной формой гликопротеина. Субъект, иммунизируемый в соответствии со способами, описанными в настоящем описании, может представлять собой, но не ограничиваясь этим, козу, овцу, осла, курицу, морскую свинку, крысу, кролика или мышь. В некоторых вариантах осуществления субъект, иммунизируемый в соответствии со способами, описанными в настоящем описании, представляет собой крысу, кролика или мышь. В частном варианте осуществления субъект, иммунизируемый в соответствии со способами, описанными в настоящем описании, представляет собой мышь. Иммунизацию субъекта можно осуществлять каким-либо известным в данной области способом, например, посредством вконтроля иммуногенного гликопептида и адъюванта субъекту, как описано в примере 2 и примере 3 (см. раздел 6.2 и раздел 6.3).
[00363] В другом аспекте также изобретение относится к способу получения иммуногенного гликопептида, описанного в настоящем описании. В некоторых вариантах осуществления способ получения иммуногенного гликопептида включает связывание одного или нескольких участков гликозилирования иммуногенного гликопептида, описанных в настоящем описании, с углеводом (например, хитобиозой). В некоторых вариантах осуществления способ получения иммуногенного гликопептида также включает синтез фрагмента пептида. Фрагмент пептида иммуногенного гликопептида можно синтезировать каким-либо известным в данной области способом, например, посредством Fmoc твердофазного синтеза пептидов, как описано в примере 2 (см. раздел 6.2). В некоторых вариантах осуществления аминокислоту (например, аспарагин) в одном или нескольких участках гликозилирования защищают защитной группой во время синтеза иммуногенного гликопептида. В частном варианте осуществления только один остаток аспарагина фрагмента пептида связан с углеводом (например, хитобиозой), и защитная группа на аспарагине представляет собой аллиловую группу. В другом конкретном варианте осуществления каждый из больше чем одного (например, двух) остатков аспарагина фрагмента пептида связан с углеводом (например, хитобиозой), и защитная группа на остатках аспарагина представляет собой сложный эфир O-2-фенилизопропила (O-2-Phi Pr, OPp). Стадию связывания можно осуществлять каким-либо известным в данной области способом. В предпочтительном варианте осуществления молекулу углевода связывают с фрагментом пептида с использованием процедуры аспартилирования/снятия защитных групп в одной колбе, как описано в примере 2 (см. раздел 6.2.2.1).
[00364] Способы получения антител к гликозилированному MUC16 или их антигенсвязывающих фрагментов, описанных в настоящем описании, известны специалисту в данной области, например, посредством химического синтеза, посредством очистки из биологических источников или посредством способов рекомбинантной экспрессии, в том числе, например, из клетки млекопитающего или трансгенных препаратов. В способах, описанных в настоящем описании, если не указано иное, используют общепринятые способы в молекулярной биологии, микробиологии, генетическом анализе, рекомбинантной ДНК, органической химии, биохимии, ПЦР, олигонуклеотидном синтезе и модификации, гибридизации нуклеиновых кислот и связанных областях в рамках компетенции в данной области техники. Эти способы описаны, например, в источниках, цитируемых в настоящем описании, и полностью объяснены в литературе. См., например, Maniatis et al. (1982) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; Sambrook et al. (1989), Molecular Cloning: A Laboratory Manual, второе издание, Cold Spring Harbor Laboratory Press; Sambrook et al. (2001) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons (1987 и ежегодные обновления); Current Protocols in Immunology, John Wiley & Sons (1987 и ежегодные обновления) Gait (ред.) (1984) Oligonucleotide Synthesis: A Practical Approach, IRL Press; Eckstein (ред.) (1991) Oligonucleotides and Analogues: A Practical Approach, IRL Press; Birren et al. (ред.) (1999) Genome Analysis: A Laboratory Manual, Cold Spring Harbor Laboratory Press.
[00365] В данной области существуют различные способы получения антител к гликозилированному MUC16 или их антигенсвязывающих фрагментов, описанных в настоящем описании (см. раздел 5.1 и раздел 5.2). Например, антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент можно создавать посредством способов рекомбинантной ДНК, таких как те, которые описаны в патенте США № 4816567. Одна или несколько ДНК, кодирующих антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании, можно легко выделять и секвенировать с использованием стандартных процедур (например, с использованием олигонуклеотидных зондов, которые способны связываться специфично с генами, кодирующими тяжелые и легкие цепи мышиных антител или такие цепи у человека, гуманизированные, или из других источников). После выделения ДНК можно помещать в экспрессирующие векторы, которыми затем трансформируют клетки-хозяева, такие как клетки NS0, клетки COS обезьян, клетки яичника китайского хомяка (CHO), дрожжевые клетки, клетки водорослей, яйцеклетки или миеломные клетки, которые иначе не продуцируют белок иммуноглобулина, чтобы добиваться синтеза антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента в рекомбинантных клетках-хозяевах. ДНК также можно модифицировать, например, посредством подстановки кодирующей последовательности желаемого вида для константных доменов тяжелых и легких цепей человека вместо гомологичных последовательностей человека (патент США № 4816567; Morrison et al., выше) или посредством ковалентного соединения с кодирующей последовательностью иммуноглобулина всей или части кодирующей последовательности для не иммуноглобулинового полипептида. Такой не иммуноглобулиновый полипептид можно использовать вместо константных доменов антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, предоставленных в настоящем описании. В некоторых вариантах осуществления ДНК представляет собой то, что описано в разделе 5.3.2.
[00366] Антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, представленные в настоящем описании, также можно получать с использованием по меньшей мере одного полинуклеотида, кодирующего антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, чтобы предоставлять трансгенных животных или млекопитающих, таких как козы, коровы, лошади, овцы и т.п., которые продуцируют такие антитела в своем молоке. Таких животных можно предоставлять с применением известных способов. См., например, но не ограничиваясь этим, патенты США №№ 5827690; 5849992; 4873316; 5849992; 5994616, 5565362; 5304489 и т.п., каждый из которых полностью включен в настоящее описание посредством ссылки.
[00367] В некоторых вариантах осуществления антитела к гликозилированному MUC16 или их антигенсвязывающих фрагменты, представленные в настоящем описании, дополнительно можно получать с использованием по меньшей мере одного полинуклеотида, кодирующего антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, который предоставлен в настоящем описании, чтобы предоставлять трансгенные растения и культивируемые клетки растения (например, но не ограничиваясь этим, табака и маиса), которые продуцируют такие антитела, конкретные части или варианты в частях растений или в культивируемых клетках из них. В качестве неограничивающего примера, листья трансгенного табака, экспрессирующие рекомбинантные белки, успешно использовали для предоставления больших количеств рекомбинантных белков, например, с использованием индуцибельного промотора. См., например, Cramer et al., Curr. Top. Microbol. Immunol. 240:95-118 (1999) и цитируемые в нем ссылки. Также трансгенный маис использовали для того, чтобы экспрессировать белки млекопитающих на уровнях коммерческого получения, с биологическими активностями, эквивалентными тем, что получают в других рекомбинантных системах или выделяют из природных источников. См., например, Hood et al., Adv. Exp. Med. Biol. 464:127-147 (1999) и цитируемые в нем ссылки. Также из семян трансгенных растений получали в больших количествах антитела, в том числе фрагменты антител, такие как scFv, включая семена табака и клубни картофеля. См., например, Conrad et al., Plant Mol. Biol. 38:101-109 (1998) и цитируемые в нем ссылки. Таким образом, антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты также можно получать с использованием трансгенных растений, в соответствии с известными способами. См. также, например, Fischer et al., Biotechnol. Appl. Biochem. 30:99-108 (октябрь 1999 года), Ma et al., Trends Biotechnol. 13:522-7 (1995); Ma et al., Plant Physiol. 109:341-6 (1995); Whitelam et al., Biochem Soc. Trans. 22:940-944 (1994); и цитируемые в них ссылки. Каждый из вышеупомянутых источников полностью включен в настоящее описание посредством ссылки.
[00368] В некоторых вариантах осуществления антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, представленные в настоящем описании, можно получать с использованием по меньшей мере одного полинуклеотида, кодирующего антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленного в настоящем описании, чтобы предоставлять бактерии, которые продуцируют такие антитела к гликозилированному MUC16 или антигенсвязывающие фрагменты. В качестве неограничивающего примера, E. coli, экспрессирующие рекомбинантные белки, успешно использовали для предоставления больших количеств рекомбинантных белков. См., например, Verma et al., 1998, 216(1-2): 165-181 и цитируемые в нем ссылки.
[00369] Описаны способы получения полиспецифических (например, биспецифических антител), см., например, патенты США №№ 7951917; 7183076; 8227577; 5837242; 5989830; 5869620; 6132992 и 8586713.
[00370] В некоторых вариантах осуществления антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, представленные в настоящем описании, (см. раздел 5.1 и раздел 5.2) используют при создании биспецифических антител. Биспецифические антитела можно создавать посредством слияния двух гибридом для того, чтобы создавать гибридные молекулы иммуноглобулина с двумя сайтами связывания. Биспецифические антитела не только приковывают опухоли к T-клеткам; они сшивают CD3 на T-клетках и инициируют каскад активации. Таким образом, цитотоксичность, основанную на T-клеточных рецепторах, перенаправляют на желаемые опухолевые мишени, обходя ограничения MHC. Вооружение поликлонально активированных T-клеток (ATC) биспецифической связывающей молекулой против CD3 и против MUC16 объединяет направленную специфичность антитела к гликозилированному MUC16 с опосредованной перфорином/гранзимом цитотоксичностью T-клеток, которая не ограничена MHC. Биспецифические связывающие молекулы BsAb или BiTE могут вооружать размноженные ex vivo активированные T-клетки перед инфузией пациенту. Эта стратегия превращает каждую ATC в специфический CTL (Thakur and Lum, 2010, Curr Opin Mol Ther 12, 340-349; Grabert et al., 2006, Clin Cancer Res 12, 569-576).
[00371] Биспецифические связывающие молекулы могут состоять из антитела к гликозилированному MUC16, где антитело к гликозилированному MUC16 представляет собой иммуноглобулин, где каждая легкая цепь иммуноглобулина представляет собой слитый белок, где слитый белок представляет собой легкую цепь иммуноглобулина, связанную через пептидный линкер с scFv, нацеленный на CD3. Мутация N297A в домене CH2 ведет к aгликозилированию, которое ведет к отсутствию связывания с FcR или C1q.
[00372] A антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент можно использовать для того, чтобы создавать CAR. CAR наиболее часто состоят из антитела длины одноцепочечного вариабельного фрагмента (scFv), такого как тот, который происходит от моноклонального антитела, нацеленного на данный опухолеассоциированный антиген и/или его вариант, трансмембранного домена (например, трансмембранного домена, происходящего от молекулы поверхности T-клетки, такой как костимулирующая молекула, такая как CD8, CD28, OX-40 и 4-1BB), сигнальной части TCR комплекса, такой как внутриклеточный домен, и/или дополнительной части(и) дзета (ζ) цепи TCR, такой как ее цитоплазматический сигнальный домен. В частном варианте осуществления вариабельные области тяжелых и легких цепей моноклонального антитела к гликозилированному MUC16, описанных в настоящем описании, выделяют из гибридомной клеточной линии, которая создает моноклональное антитело к гликозилированному MUC16. Например, из гибридомной клеточной линии экстрагируют РНК и создают кДНК из РНК посредством ПЦР с обратной транскрипцией. Вариабельные области цепей VH и VL клонируют посредством стандартной ПЦР с использованием праймеров, специфичных к таким вариабельным областям. Получаемые фрагменты VH и VL субклонируют в челночный вектор, например, такой как клонирующий вектор TopoTA PCR 2.1 (Invitrogen), и секвенируют. Впоследствии фрагменты VH и VL лигируют к спейсерному домену (Gly4Ser)3, создавая scFv антитела к гликозилированному MUC16, и сливают с лидерным пептидом CD8 человека (CD8L) (CD8L-scFv антитела к гликозилированному MUC16) посредством перекрывающейся ПЦР (см., например, Maher J, et al. Nat Biotechnol 2002;20(1):70-5.; и Gong MC et al., Neoplasia 1999;1(2):123-7). Кодирующую область CD8L-scFv антитела к гликозилированному MUC16 сливают с шарнирным и трансмембранным доменами CD8 человека или альтернативно с трансмембранным и цитоплазматическим сигнальным доменами CD28, слитыми с CD3-ζ сигнальным доменом T-клеточного рецептора (см., например, Maher J, et al. Nat Biotechnol 2002;20(1):70-5.; Brentjens RJ, et al. Nat Med 2003;9(3):279-86; и Brentjens RJ, et al., Clin Cancer Res 2007;13(18 Pt 1):5426-35).
[00373] Также в настоящем описании предоставлена T-клетка, которая экспрессирует CAR, описанный в настоящем описании. Способы создания T-клетки, экспрессирующей CAR, известны в данной области. Например, конструкцию CAR можно субклонировать в модифицированный MMLV ретровирусный вектор SFG (см., например, Riviere I, et al., Proc Natl Acad Sci USA 1995;92(15):6733-7) или другие подходящие ретровирусные векторы. В некоторых вариантах осуществления ретровирусный вектор представляет собой лентивирусный вектор, например, вектор на основе HIV. VSV-G псевдотипированные ретровирусные супернатанты, происходящие от трансдуцировнных gpg29 фибробластов, можно использовать для того, чтобы конструировать стабильные клеточные линии PG13, продуцирующие вирус лейкоза гиббонов (GaLV) с псевдотипированной ретровирусной оболочкой (см., например, Gong MC, et al. Neoplasia 1999;1(2):123-7). Выделенные мононуклеарные клетки периферической крови (PBMC) здорового донора можно активировать с использованием фитогемагглютинина (PHA) по 2 мкг/мл (Sigma. St. Louis, MO) и трансдуцировать ретровирусом на покрытых ретронектином не тканевых культуральных планшетах (Quintas-Cardama A, et al., Hum Gene Ther 2007;18(12):1253-60) для того, чтобы создавать T-клетку, рекомбинантно экспрессирующую CAR. Перенос генов CAR в T-клетку можно оценивать с помощью FACS.
[00374] Однодоменные антитела, например, антитела, не содержащие легких цепей, можно получать способами, хорошо известными в данной области. См. Riechmann L & Muyldermans S (1999) J Immunol 231: 25-38; Nuttall SD et al., (2000) Curr Pharm Biotechnol 1(3): 253-263; Muyldermans S, (2001) J Biotechnol 74(4): 277-302; патент США № 6005079; и международные публикации №№ WO 94/04678, WO 94/25591 и WO 01/44301.
[00375] В конкретных вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, которые связываются с одним и тем же или перекрывающимся эпитопом, что и антитело к гликозилированному MUC16, описанное в настоящем описании, представляют собой антитело человека к гликозилированному MUC16 или его антигенсвязывающий фрагмент. В конкретных вариантах осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, которые конкурентно блокируют (например, дозозависимым образом) связывание с MUC16 какого-либо одного из антител, описанных в настоящем описании, представляют собой антитело человека к гликозилированному MUC16 или его антигенсвязывающий фрагмент. Антитела человека можно получать с использованием какого-либо способа, известного в данной области. Например, можно использовать трансгенных мышей, которые не способны экспрессировать функциональные эндогенные иммуноглобулины, но которые могут экспрессировать гены иммуноглобулинов человека. В частности, комплексы генов тяжелых и легких цепей иммуноглобулинов человека можно вводить случайно или посредством гомологичной рекомбинации в эмбриональные стволовые клетки мышей. Альтернативно, вариабельную область человека, константную область и область разнообразия можно вводить в эмбриональные стволовые клетки мыши в дополнение к генам тяжелых и легких цепей человека. Гены тяжелых и легких цепей иммуноглобулинов мыши можно делать не функциональным отдельно или одновременно со введением локусов иммуноглобулинов человека посредством гомологичной рекомбинации. В частности, гомозиготная делеция области JH предотвращает продуцирование эндогенных антител. Модифицированные эмбриональные стволовые клетки размножают и вводят микроинъекциями в бластоцисты для того, чтобы получать химерных мышей. Затем химерных мышей скрещивают для того, чтобы получать гомозиготного потомка, который экспрессирует антитела человека. Трансгенных мышей иммунизируют нормальным образом с использованием выбранного антигена, например, всего антигена или его части. Моноклональные антитела, направленные против антигена, можно получать от иммунизированных, трансгенных мышей с использованием стандартной гибридомной технологии. Трансгены иммуноглобулинов человека, которые несут трансгенные мыши, перестраиваются во время дифференцировки B-клеток и впоследствии проходят переключение класса и соматические мутации. Таким образом, используя такой способ, возможно получать терапевтически эффективные антитела IgG, IgA, IgM и IgE. Обзор этой технологии получения антитела человека см., например, в Lonberg N & Huszar D (1995) Int Rev Immunol 13:65-93. Подробное обсуждение этой технологии получения антител человека и моноклональных антител человека и протоколов для получения таких антител см., например, в международных публикациях №№ WO 98/24893, WO 96/34096 и WO 96/33735; и патентах США №№ 5413923, 5625126, 5633425, 5569825, 5661016, 5545806, 5814318 и 5939598. Примеры мышей, способных продуцировать антитела человека, включают Xenomouse™ (Abgenix, Inc.; патенты США №№ 6075181 и 6150184), HuAb-Mouse™ (Mederex, Inc./Gen Pharm; патенты США №№ 5545806 и 5569825), Trans Chromo Mouse™ (Kirin) и KM Mouse™ (Medarex/Kirin).
[00376] Антитела человека, которые иммуноспецифически связываются с MUC16, можно создавать различными способами, известными в данной области, включая описанные выше способы фагового дисплея, используя библиотеки антител, происходящие из последовательностей иммуноглобулинов человека. Также см. патенты США №№ 4444887, 4716111 и 5885793; и международные публикации №№ WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741.
[00377] В некоторых вариантах осуществления антитела человека можно получать с использованием гибридом мышь-человек. Например, лимфоциты периферической крови человека, трансформированные вирусом Эпштейна-Барр (EBV), можно сливать с миеломными клетками мыши для того, чтобы получать гибридомы мышь-человек, секретирующие моноклональные антитела человека, и можно осуществлять скрининг этих гибридом мышь-человек для того, чтобы определять те, которые секретируют моноклональные антитела человека, которые иммуноспецифически связываются с целевым антигеном. Такие способы известны и описаны в данной области, см., например, Shinmoto H et al., (2004) Cytotechnology 46: 19-23; Naganawa Y et al., (2005) Human Antibodies 14: 27-31.
[00378] В конкретных вариантах осуществления способы получения антител или их антигенсвязывающих фрагментов, которые иммуноспецифически связываются с MUC16, представляют собой то, что описано далее в разделе 6.2.
[00379] В конкретных вариантах осуществления способы скрининга и отбора антител или их антигенсвязывающих фрагментов, которые иммуноспецифически связываются с MUC16, представляют собой то, что описано далее в разделе 6.2.
[00380] Когда антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, получены, их можно очищать каким-либо известным в данной области способом очистки молекул иммуноглобулина, например, посредством хроматографии (например, ионообменной, аффинной, в частности, с помощью аффинности к специфическому антигену после белка A, и колоночной хроматографии на молекулярных ситах), центрифугирования, дифференциальной растворимости или каким-либо другим стандартным способом очистки белков. Кроме того, антитела, описанные в настоящем описании, можно сливать с гетерологичными полипептидными последовательностями, описанными в настоящем описании или иначе известными в данной области, чтобы содействовать очистке.
[00381] В конкретных вариантах осуществления, антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, выделяют или очищают. В целом, выделенное антитело представляет собой то, которое по существу не содержит других антител с другими антигенными специфичностями, нежели выделенное антитело. Например, в частном варианте осуществления препарат антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, по существу не содержит клеточного материала и/или химических предшественников. Фраза «по существу не содержит клеточный материал» включает препараты антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, где антитело отделено от клеточных компонентов клеток, из которых его выделяют или рекомбинантно получают. Таким образом, антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, который по существу не содержит клеточный материал, включает препараты антитела, которые содержат приблизительно меньше 30%, 20%, 10%, 5%, 2%, 1%, 0,5% или 0,1% (по сухому весу) гетерологичного белка (также обозначаемого в настоящем описании как «контаминирующий белок») и/или вариантов антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, например, форм антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента с отличной посттрансляционной модификацией или других отличных версий антитела к гликозилированному MUC16 или его антигенсвязывающему фрагменту (таких как фрагменты антител). Когда антитело получают рекомбинантно, оно также в целом по существу не содержит среды для культивирования, т.е. среда для культивирования составляет приблизительно меньше 20%, 10%, 2%, 1%, 0,5% или 0,1% объема препарата белка. Когда антитело получают химическим синтезом, в целом, оно по существу не содержит химических предшественников или других химических соединений, т.е. его отделяют от химических предшественников или других химических соединений, которые участвуют в синтезе белка. Соответственно, такие препараты антитела содержат приблизительно меньше 30%, 20%, 10% или 5% (по сухому весу) химических предшественников или соединений, отличных от антитела, представляющего интерес. В частном варианте осуществления антитела, описанные в настоящем описании, выделяют или очищают.
5.3.2 ПОЛИНУКЛЕОТИДЫ
[00382] В некоторых вариантах осуществления изобретение относится к полинуклеотидам, которые содержат нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент (см. раздел 5.1 и раздел 5.2). Также в настоящем описании предоставлены векторы, содержащие такие полинуклеотиды (см. раздел 5.3.3). Также изобретение относится к полинуклеотидам, которые кодируют антигены антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании (см. раздел 5.1 и раздел 5.2). Также изобретение относится к полинуклеотидам, которые гибридизуются при строгих условиях гибридизации или условиях гибридизации более низкой степени строгости с полинуклеотидами, которые кодируют антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании.
[00383] Фраза «очищенный» включает препараты полинуклеотида или молекул нуклеиновой кислоты, которые содержат приблизительно меньше 15%, 10%, 5%, 2%, 1%, 0,5% или 0,1% (в частности, приблизительно меньше 10%) другого материала, например, клеточного материала, среды для культивирования, других молекул нуклеиновой кислоты, химических предшественников и/или других химических соединений. В частном варианте осуществления молекулу(ы) нуклеиновой кислоты, которая кодирует антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, (см. раздел 5.1 и раздел 5.2) выделяют или очищают.
[00384] Молекулы нуклеиновой кислоты, представленные в настоящем описании, могут быть в форме РНК, такой как мРНК, гетерогенной ядерной РНК, тРНК или какой-либо другой форме, или в форме ДНК, включая в качестве неограничивающих примеров кДНК и геномную ДНК, полученную клонированием или полученную синтетически, или какие-либо их сочетания. ДНК может быть трехцепочечной, двухцепочечной или одноцепочечной или представлять собой какое-либо их сочетание. Любая часть по меньшей мере одной цепи ДНК или РНК может представлять собой кодирующую цепь, также известную как смысловая цепь, или она может представлять собой некодирующую цепь, также обозначаемую как антисмысловая цепь.
[00385] В некоторых вариантах осуществления в настоящем описании предоставлен полинуклеотид, который содержит нуклеотидные последовательности, кодирующие антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании (см. раздел 5.1 и раздел 5.2).
[00386] В конкретных аспектах также изобретение относится к полинуклеотидам, содержащие нуклеотидные последовательности, кодирующие антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты (см. раздел 5.1 и раздел 5.2), которые иммуноспецифически связываются с MUC16 и содержат аминокислотную последовательность, как описано в настоящем описании, а также антитела, которые конкурируют с таким антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом за связывание с MUC16 или которые связываются с тем же эпитопом, что и такие антитела.
[00387] Полинуклеотиды, представленные в настоящем описании, можно получать каким-либо известным в данной области способом. Например, если известна нуклеотидная последовательность, кодирующая антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент (см. раздел 5.1 и раздел 5.2), описанные в настоящем описании, полинуклеотид, кодирующий антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, можно собирать из химически синтезированных олигонуклеотидов (например, как описано в Kutmeier et al., BioMethods 17:242 (1994)), что, в кратком изложении, включает синтез перекрывающихся олигонуклеотидов, содержащих части последовательности, кодирующей антитело, ренатурацию и лигирование этих олигонуклеотидов, а затем амплификацию лигированных олигонуклеотидов посредством ПЦР.
[00388] Альтернативно, полинуклеотид, кодирующий антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент (см. раздел 5.1 и раздел 5.2), можно создавать из нуклеиновой кислоты из подходящего источника. Если клон, содержащий нуклеиновую кислоту, кодирующую конкретное антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, не доступен, но известна последовательность антитела к гликозилированному MUC16 или его антигенсвязывающий фрагмент, нуклеиновую кислоту, кодирующую антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, можно химически синтезировать или получать из подходящего источника (например, библиотеки кДНК антител или библиотеки кДНК, созданной из, или нуклеиновой кислоты, предпочтительно полиA+РНК, выделенной из, какой-либо ткани или клеток, экспрессирующих антитело, таких как гибридомные клетки, отобранные для того, чтобы экспрессировать антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, представленные в настоящем описании) посредством ПЦР амплификации с использованием синтетических праймеров, которые гибридизуются с 3'- и 5'-концами последовательности, или посредством клонирования с использованием олигонуклеотидного зонда, специфического для последовательности конкретного гена, чтобы идентифицировать, например, клон кДНК из библиотеки кДНК, который кодирует антитело. Затем амплифицированные нуклеиновые кислоты, создаваемые посредством ПЦР, можно клонировать в реплицируемые клонирующие векторы с использованием какого-либо способа, хорошо известного в данной области (см., например, раздел 5.3.3).
[00389] В таких вариантах осуществления полинуклеотидом, кодирующим такое антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, можно манипулировать с помощью способов, хорошо известных в данной области для манипуляций нуклеотидными последовательностями, например, способов рекомбинантной ДНК, сайт-специфического мутагенеза, ПЦР и т.д. (см., например, способы, описанные в Sambrook et al., 1990, Molecular Cloning, A Laboratory Manual, 2-е изд., Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. и Ausubel et al., ред., 1998, Current Protocols in Molecular Biology, John Wiley & Sons, N.Y., оба они включены посредством ссылки в настоящее описание в полном объеме), чтобы создавать антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, имеющие другую аминокислотную последовательность, например, чтобы создавать замены, делеции и/или инсерции аминокислот. Например, такие манипуляции можно осуществлять для того, чтобы делать кодируемую аминокислоту агликозилированной или уничтожать способность антитела связываться с C1q, Fc-рецептором или активировать систему комплемента.
[00390] Выделенные молекулы нуклеиновой кислоты, представленные в настоящем описании, могут включать молекулы нуклеиновой кислоты, содержащие открытую рамку считывания (ORF), необязательно с одним или несколькими интронами, например, но не ограничиваясь этим, по меньшей мере одну точно определенную часть по меньшей мере одной определяющей комплементарность области (CDR), в качестве CDR1, CDR2 и/или CDR3 по меньшей мере одной тяжелой цепи или легкой цепы; молекулы нуклеиновой кислоты, содержащие кодирующую последовательность для антитела к гликозилированному MUC16 или вариабельной области; и молекулы нуклеиновой кислоты, которые содержат нуклеотидную последовательность, по существу отличную от тех, которые описаны выше, но которые, из-за вырожденности генетического кода, все еще кодируют по меньшей мере одно антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, как описано в настоящем описании.
[00391] Также в настоящем описании предоставлены выделенные нуклеиновые кислоты, которые гибридизуются при селективных условиях гибридизации с полинуклеотидом, описанным в настоящем описании. Таким образом, полинуклеотиды по этому варианту осуществления можно использовать для выделения, обнаружения и/или количественного определения нуклеиновых кислот, содержащих такие полинуклеотиды. Например, полинуклеотиды, представленные в настоящем описании, можно использовать для того, чтобы идентифицировать, выделать или амплифицировать частичные или полноразмерные клоны в депонированной библиотеке. В некоторых вариантах осуществления полинуклеотиды представляют собой геномные или кДНК последовательности, выделенные из, или иначе комплементарные, кДНК из библиотеки нуклеиновых кислот человека или млекопитающего.
[00392] Нуклеиновые кислоты могут в целях удобства содержать последовательности в дополнение к полинуклеотиду, предоставленном в настоящем описании. Например, сайт множественного клонирования, содержащий один или несколько участков рестрикции эндонуклеаз, можно вставлять в нуклеиновую кислоту, чтобы содействовать выделению полинуклеотида. Кроме того, транслируемые последовательности можно вставлять для того, чтобы содействовать выделению транслированного полинуклеотида, представленного в настоящем описании. Например, последовательность гексагистидинового маркера предоставляет удобное средство для того, чтобы очищать полипептиды, представленные в настоящем описании. Нуклеиновая кислота, предоставленная в настоящем описании, за исключением кодирующей последовательности, необязательно представляет собой вектор, адаптер или линкер для клонирования и/или экспрессии полинуклеотида, представленного в настоящем описании.
[00393] Дополнительные последовательности также можно добавлять к таким последовательностям для клонирования и/или экспрессии, чтобы оптимизировать их функцию при клонировании и/или экспрессии, чтобы содействовать выделению полинуклеотида или усовершенствовать введение полинуклеотида в клетку. Использование клонирующих векторов, экспрессирующих векторов, адаптеров и линкеров хорошо известно в данной области (см., например, Ausubel, выше; или Sambrook, выше).
[00394] В частном варианте осуществления, используя повседневные способы рекомбинантной ДНК, одну или несколько из CDR антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, можно вставлять в известные каркасные области. Каркасные области могут быть встречающимся в природе или представлять собой консенсусные каркасные области и, предпочтительно, каркасные области человека (см., например, в Chothia et al., J. Mol. Biol. 278: 457-479 (1998) список каркасных областей человека). Предпочтительно, полинуклеотид, создаваемый посредством комбинации каркасных областей и CDR, кодирует антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, который иммуноспецифически связывает MUC16. Одну или несколько замен аминокислот можно создавать в каркасных областях и, предпочтительно, замены аминокислот улучшают связывание антитела с его антигеном. Дополнительно такие способы можно использовать, чтобы создавать замены или делеции аминокислот в одном или нескольких остатках цистеина вариабельной области, участвующих в межцепной дисульфидной связи для того, чтобы создавать молекулы антител, не имеющие одной или нескольких межцепных дисульфидных связей. Другие изменения в полинуклеотиде предусмотрены в настоящем описании и входят в компетенцию в данной области техники.
[00395] В некоторых вариантах осуществления выделенная или очищенная молекула нуклеиновой кислоты или ее фрагмент, при соединении с другой молекулой нуклеиновой кислоты, может кодировать слитый белок. Создание слитых белков входит в обычные навыки в данной области и может включать использование рестрикционного фермента или способов рекомбинантного клонирования (см., например, Gateway.TM. (Invitrogen)). Также см. патент США № 5314995.
[00396] В некоторых вариантах осуществления полинуклеотид в настоящем описании предоставлен в форме вектора (например, экспрессирующего вектора), как описано в разделе 5.3.3.
[00397] В определенных аспектах изобретение относится к полинуклеотидам, содержащие нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, или его антигенсвязывающий фрагмент (например, вариабельная область легкой цепи и/или вариабельная область тяжелой цепи), которые иммуноспецифически связываются с MUC16, и векторы, например, векторы, содержащие такие полинуклеотиды для их эффективной экспрессии в клетках-хозяевах (например, E. coli и клетки млекопитающих). В некоторых вариантах осуществления полинуклеотид выделяют или очищают.
[00398] В рамках изобретения, «выделенный» полинуклеотид или молекула нуклеиновой кислоты представляет собой то, что отделяют от других молекул нуклеиновой кислоты, которые присутствуют в природном источнике (например, у мыши или человека) молекулы нуклеиновой кислоты. Кроме того, «выделенная» молекула нуклеиновой кислоты, такая как молекула кДНК, может по существу не содержать другой клеточный материал или среду для культивирования, когда ее получают рекомбинантными способами, или по существу не содержать химические предшественники или другие химические соединения при химическом синтезе. Например, фраза «по существу не содержит» включает препараты полинуклеотида или молекулы нуклеиновой кислоты, которые содержат приблизительно меньше 15%, 10%, 5%, 2%, 1%, 0,5% или 0,1% другого материала, например, клеточного материала, среды для культивирования, других молекул нуклеиновой кислоты, химических предшественников и/или других химических соединений.
[00399] В конкретных аспектах изобретение относится к полинуклеотидам, которые содержат нуклеотидные последовательности, кодирующие антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты, и содержат аминокислотную последовательность, как описано в настоящем описании, а также антитела, которые конкурируют с такими антителами за связывание с MUC16 (например, дозозависимым образом) или которые связываются с тем же или перекрывающимся эпитопом, что и такие антитела.
[00400] В определенных аспектах изобретение относится к полинуклеотидам, содержащие последовательность нуклеиновой кислоты, кодирующей легкую цепь или тяжелую цепь антитела к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании. Полинуклеотиды могут содержать нуклеотидные последовательности, кодирующие тяжелую цепь, содержащую CDR VH, описанные в настоящем описании (см., например, таблицу 1, таблицу 3 и таблицу 5). Полинуклеотиды могут содержать нуклеотидные последовательности, кодирующие легкую цепь, содержащую CDR VL, описанные в настоящем описании (см., например, таблицу 2, таблицу 4 и таблицу 6).
[00401] В конкретных вариантах осуществления изобретение относится к полинуклеотидам, содержащие нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16, содержащее три CDR VH, например, содержащее CDR1 VH, CDR2 VH и CDR3 VH, как описано в таблице 1, таблице 3 или таблице 5. В конкретных вариантах осуществления полинуклеотид, описанный в настоящем описании, кодирует CDR1 VH, CDR2 VH и CDR3 VH из консенсусных CDR VH 10C6, 7B12, 19C11, 16C5 и 18C6 (т. е., SEQ ID № 103, SEQ ID № 104 и SEQ ID № 105, соответственно, или SEQ ID № 109, SEQ ID № 110 и SEQ ID № 111, соответственно, или SEQ ID № 115, SEQ ID № 116 и SEQ ID № 117). В конкретных вариантах осуществления полинуклеотид, описанный в настоящем описании, кодирует CDR1 VH, CDR2 VH и CDR3 VH из 10C6 (т. е., SEQ ID № 3, SEQ ID № 4 и SEQ ID № 5, соответственно, или SEQ ID № 9, SEQ ID № 10 и SEQ ID № 11, соответственно, или SEQ ID № 15, SEQ ID № 16 и SEQ ID № 17, соответственно). В конкретных вариантах осуществления, полинуклеотид, описанный в настоящем описании, кодирует CDR1 VH, CDR2 VH и CDR3 VH из 7B12 (т. е., SEQ ID № 23, SEQ ID № 24 и SEQ ID № 25, соответственно, или SEQ ID № 29, SEQ ID № 30 и SEQ ID № 31, соответственно, или SEQ ID № 35, SEQ ID № 36 и SEQ ID № 37, соответственно). В конкретных вариантах осуществления полинуклеотид, описанный в настоящем описании, кодирует CDR1 VH, CDR2 VH и CDR3 VH из 19C11 (т. е., SEQ ID № 43, SEQ ID № 44 и SEQ ID № 45, соответственно, или SEQ ID № 49, SEQ ID № 50 и SEQ ID № 51, соответственно, или SEQ ID № 55, SEQ ID № 56 и SEQ ID № 57, соответственно). В конкретных вариантах осуществления полинуклеотид, описанный в настоящем описании, кодирует CDR1 VH, CDR2 VH и CDR3 VH из 16C5 (т. е., SEQ ID № 63, SEQ ID № 64 и SEQ ID № 65, соответственно, или SEQ ID № 69, SEQ ID № 70 и SEQ ID № 71, соответственно, или SEQ ID № 75, SEQ ID № 76 и SEQ ID № 77, соответственно). В конкретных вариантах осуществления, полинуклеотид, описанный в настоящем описании, кодирует CDR1 VH, CDR2 VH и CDR3 VH из 18C6 (т. е., SEQ ID № 83, SEQ ID № 84 и SEQ ID № 85, соответственно, или SEQ ID № 89, SEQ ID № 90 и SEQ ID № 91, соответственно, или SEQ ID № 95, SEQ ID № 96 и SEQ ID № 97, соответственно).
[00402] В конкретных вариантах осуществления изобретение относится к полинуклеотидам, содержащие нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16, содержащее (a) три CDR VH, например, содержащее CDR1 VH, CDR2 VH и CDR3 VH, как описано в таблице 1, таблице 3 или таблице 5, и (b) три CDR цепи VL, например, содержащее CDR1 VL, CDR2 VL и CDR3 VL, как описано в таблице 2, таблице 4 или таблице 6. В конкретных вариантах осуществления полинуклеотид, описанный в настоящем описании, кодирует (a) CDR1 VH, CDR2 VH и CDR3 VH из консенсусных CDR VH 10C6, 7B12, 19C11, 16C5 и 18C6 (т. е., SEQ ID № 103, SEQ ID № 104 и SEQ ID № 105, соответственно, или SEQ ID № 109, SEQ ID № 110 и SEQ ID № 111, соответственно, или SEQ ID № 115, SEQ ID № 116 и SEQ ID № 117), и (b) CDR1 VL, CDR2 VL и CDR3 VL из консенсусных CDR VL 10C6, 7B12, 19C11, 16C5 и 18C6 (т. е., SEQ ID № 106, SEQ ID № 107 и SEQ ID № 108, соответственно, или SEQ ID № 112, SEQ ID № 113 и SEQ ID № 114, соответственно, или SEQ ID № 118, SEQ ID № 119 и SEQ ID № 120). В конкретных вариантах осуществления полинуклеотид, описанный в настоящем описании, кодирует (a) CDR1 VH, CDR2 VH и CDR3 VH из 10C6 (т. е., SEQ ID № 3, SEQ ID № 4 и SEQ ID № 5, соответственно, или SEQ ID № 9, SEQ ID № 10 и SEQ ID № 11, соответственно, или SEQ ID № 15, SEQ ID № 16 и SEQ ID № 17, соответственно), и (b) CDR1 VL, CDR2 VL и CDR3 VL из 10C6 (т. е., SEQ ID № 6, SEQ ID № 7 и SEQ ID № 8, соответственно, или SEQ ID № 12, SEQ ID № 13 и SEQ ID № 14, соответственно, или SEQ ID № 18, SEQ ID № 19 и SEQ ID № 20, соответственно). В конкретных вариантах осуществления полинуклеотид, описанный в настоящем описании, кодирует (a) CDR1 VH, CDR2 VH и CDR3 VH из 7B12 (т. е., SEQ ID № 23, SEQ ID № 24 и SEQ ID № 25, соответственно, или SEQ ID № 29, SEQ ID № 30 и SEQ ID № 31, соответственно, или SEQ ID № 35, SEQ ID № 36 и SEQ ID № 37, соответственно), и (b) CDR1 VL, CDR2 VL и CDR3 VL из 7B12 (т. е., SEQ ID № 26, SEQ ID № 27 и SEQ ID № 28, соответственно, или SEQ ID № 32, SEQ ID № 33 и SEQ ID № 34, соответственно, или SEQ ID № 38, SEQ ID № 39 и SEQ ID № 40, соответственно). В конкретных вариантах осуществления полинуклеотид, описанный в настоящем описании, кодирует (a) CDR1 VH, CDR2 VH и CDR3 VH из 19C11 (т. е., SEQ ID № 43, SEQ ID № 44 и SEQ ID № 45, соответственно, или SEQ ID № 49, SEQ ID № 50 и SEQ ID № 51, соответственно, или SEQ ID № 55, SEQ ID № 56 и SEQ ID № 57, соответственно), и (b) CDR1 VL, CDR2 VL и CDR3 VL из 19C11 (т. е., SEQ ID № 46, SEQ ID № 47 и SEQ ID № 48, соответственно, или SEQ ID № 52, SEQ ID № 53 и SEQ ID № 54, соответственно, или SEQ ID № 58, SEQ ID № 59 и SEQ ID № 60, соответственно). В конкретных вариантах осуществления полинуклеотид, описанный в настоящем описании, кодирует (a) CDR1 VH, CDR2 VH и CDR3 VH из 16C5 (т. е., SEQ ID № 63, SEQ ID № 64 и SEQ ID № 65, соответственно, или SEQ ID № 69, SEQ ID № 70 и SEQ ID № 71, соответственно, или SEQ ID № 75, SEQ ID № 76 и SEQ ID № 77, соответственно), и (b) CDR1 VL, CDR2 VL и CDR3 VL из 16C5 (т. е., SEQ ID № 66, SEQ ID № 67 и SEQ ID № 68, соответственно, или SEQ ID № 72, SEQ ID № 73 и SEQ ID № 74, соответственно, или SEQ ID № 78, SEQ ID № 79 и SEQ ID № 80, соответственно). В конкретных вариантах осуществления полинуклеотид, описанный в настоящем описании, кодирует (a) CDR1 VH, CDR2 VH и CDR3 VH из 18C6 (т. е., SEQ ID № 83, SEQ ID № 84 и SEQ ID № 85, соответственно, или SEQ ID № 89, SEQ ID № 90 и SEQ ID № 91, соответственно, или SEQ ID № 95, SEQ ID № 96 и SEQ ID № 97, соответственно), и (b) CDR1 VL, CDR2 VL и CDR3 VL из 18C6 (т. е., SEQ ID № 86, SEQ ID № 87 и SEQ ID № 88, соответственно, или SEQ ID № 92, SEQ ID № 93 и SEQ ID № 94, соответственно, или SEQ ID № 98, SEQ ID № 99 и SEQ ID № 100, соответственно).
[00403] В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16, описанное в настоящем описании, которое содержит вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность, описанную в настоящем описании (например, SEQ ID № 1, SEQ ID № 21, SEQ ID № 41, SEQ ID № 61, SEQ ID № 81 или SEQ ID № 101), где антитело иммуноспецифически связывается с MUC16.
[00404] В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16, описанное в настоящем описании, которое содержит вариабельную область легкой цепи, которая содержит аминокислотную последовательность, описанную в настоящем описании (например, SEQ ID № 2, SEQ ID № 22, SEQ ID № 42, SEQ ID № 62, SEQ ID № 82 или SEQ ID № 102), где антитело иммуноспецифически связывается с MUC16.
[00405] В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16, описанное в настоящем описании, которое содержит вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 101, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 102. В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16, описанное в настоящем описании, которое содержит вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 101, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 2. В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16, описанное в настоящем описании, которое содержит вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 101, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 42. В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16, описанное в настоящем описании, которое содержит вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 1, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 2. В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16, описанное в настоящем описании, которое содержит вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 21, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 22. В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16, описанное в настоящем описании, которое содержит вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 41, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 42. В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16, описанное в настоящем описании, которое содержит вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 61, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 62. В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16, описанное в настоящем описании, которое содержит вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность из SEQ ID № 81, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность из SEQ ID № 82.
[00406] В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, кодирует VH, которая содержит последовательность нуклеиновой кислоты из SEQ ID № 140, SEQ ID № 142, SEQ ID № 144, SEQ ID № 146 или SEQ ID № 148. В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, кодирует VL, которая содержит последовательность нуклеиновой кислоты из SEQ ID № 141, SEQ ID № 143, SEQ ID № 145, SEQ ID № 147 или SEQ ID № 149. В частном варианте осуществления полинуклеотид, описанный в настоящем описании, кодирует VH, которая содержит последовательность нуклеиновой кислоты из SEQ ID № 140, и VL, которая содержит последовательность нуклеиновой кислоты из SEQ ID № 141 (например, 10C6). В частном варианте осуществления полинуклеотид, описанный в настоящем описании, кодирует VH, которая содержит последовательность нуклеиновой кислоты из SEQ ID № 142, и VL, которая содержит последовательность нуклеиновой кислоты из SEQ ID № 143 (например, 7B12). В частном варианте осуществления полинуклеотид, описанный в настоящем описании, кодирует VH, которая содержит последовательность нуклеиновой кислоты из SEQ ID № 144, и VL, которая содержит последовательность нуклеиновой кислоты из SEQ ID № 145 (например, 19C11). В частном варианте осуществления полинуклеотид, описанный в настоящем описании, кодирует VH, которая содержит последовательность нуклеиновой кислоты из SEQ ID № 146, и VL, которая содержит последовательность нуклеиновой кислоты из SEQ ID № 147 (например, 16C5). В частном варианте осуществления полинуклеотид, описанный в настоящем описании, кодирует VH, которая содержит последовательность нуклеиновой кислоты из SEQ ID № 148, и VL, которая содержит последовательность нуклеиновой кислоты из SEQ ID № 149 (например, 18C6).
[00407] В конкретных аспектах, в настоящем описании предоставлен полинуклеотид, который содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, содержащие легкую цепь и тяжелую цепь, например, отдельную легкую цепь и тяжелую цепь. В отношении тяжелой цепи, в частном варианте осуществления полинуклеотид, представленный в настоящем описании, содержит нуклеотидную последовательность, кодирующую гамма (например, гамма1, гамма2, гамма3 или гамма4) тяжелую цепь. В частном варианте осуществления полинуклеотид, представленный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, где антитело содержит тяжелую цепь и где аминокислотная последовательность вариабельной области тяжелой цепи может содержать какую-либо аминокислотную последовательность из SEQ ID № 1, SEQ ID № 21, SEQ ID № 41, SEQ ID № 61, SEQ ID № 81 или SEQ ID № 101, и где константная область тяжелой цепи представляет собой константную область гамма тяжелой цепи человека.
[00408] В отношении легкой цепи, в частном варианте осуществления полинуклеотид, представленный в настоящем описании, содержит нуклеотидную последовательность, кодирующую каппа легкую цепь. В другом конкретном варианте осуществления полинуклеотид, представленный в настоящем описании, содержит нуклеотидную последовательность, кодирующую лямбда легкую цепь. В еще одном другом конкретном варианте осуществления, полинуклеотид, представленный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, которые содержат каппа легкую цепь человека или лямбда легкую цепь человека. В частном варианте осуществления полинуклеотид, представленный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, где антитело содержит легкую цепь и где аминокислотная последовательность вариабельной области легкой цепи может содержать какую-либо аминокислотную последовательность из SEQ ID № 2, SEQ ID № 22, SEQ ID № 42, SEQ ID № 62, SEQ ID № 82 или SEQ ID № 102, и где константная область легкой цепи представляет собой константную область каппа легкой цепи человека. В другом конкретном варианте осуществления полинуклеотид, представленный в настоящем описании, содержит нуклеотидную последовательность, кодирующую антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, содержат легкую цепь, где аминокислотная последовательность вариабельной области легкой цепи могут содержать какую-либо аминокислотную последовательность из SEQ ID № 2, SEQ ID № 22, SEQ ID № 42, SEQ ID № 62, SEQ ID № 82 или SEQ ID № 102, и где константная область легкой цепи представляет собой константную область лямбда легкой цепи человека.
[00409] Подробный пример создания антител к гликозилированному MUC16, описанных в настоящем описании, см. в разделе 6.2 и разделе 6.3.
5.3.3 КЛЕТКИ И ВЕКТОРЫ
[00410] В некоторых вариантах осуществления в настоящем описании предоставлены клетки (например, клетки ex vivo), экспрессирующие (например, рекомбинантно) одно или несколько антител к гликозилированному MUC16 или их антигенсвязывающих фрагментов (см. раздел 5.1 и раздел 5.2). Также в настоящем описании предоставлены векторы (например, экспрессирующие векторы), содержащие нуклеотидные последовательности (см., например, раздел 5.3.2), кодирующие антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, для рекомбинантной экспрессии в клетках-хозяевах, предпочтительно в клетках млекопитающих. Также в настоящем описании предоставлены клетки (например, клетки ex vivo), содержащие такие векторы или нуклеотидные последовательности, для рекомбинантной экспрессии антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных здесь. Также изобретение относится к способам получения антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, который включает экспрессию такого антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента из клетки (например, клетки ex vivo). В предпочтительном варианте осуществления клетка представляет собой клетку ex vivo.
[00411] Вектор (например, экспрессирующий вектор) представляет собой молекулу ДНК, содержащую ген, который экспрессируют в клетке (например, клетке ex vivo). Обычно, экспрессию гена помещают под управление определенных регуляторных элементов, в том числе конститутивных или индуцибельных промоторов, тканеспецифических регуляторных элементов и энхансеров. Такой ген называют «функционально связанным с» регуляторными элементами, например, промотором. Рекомбинантный организм-хозяин может представлять собой какую-либо прокариотическую или эукариотическую клетку, которая содержит или клонирующий вектор или экспрессирующий вектор. Этот термин также включает те прокариотические или эукариотические клетки, а также трансгенное животное, которые генетически сконструированы так, чтобы содержать клонированный ген(ы) в хромосоме или геноме клетки-хозяина или клеток-хозяев из клеток-хозяев (например, клеток ex vivo). В одном из вариантов осуществления промотор представляет собой CMV промотор.
[00412] В некоторых вариантах осуществления изобретение относится к вектору, который содержит один или несколько полинуклеотидов, как описано в разделе 5.3.2. В некоторых вариантах осуществления полинуклеотид, как описано в разделе 5.3.2, можно клонировать в подходящий вектор и можно использовать для того, чтобы трансформировать или трансфицировать любой подходящий организм-хозяин. Векторы и способы для того, чтобы конструировать такие векторы, известны специалисту в данной области и описаны в основных технических руководствах (см., в целом, «Recombinant DNA Part D», Methods in Enzymology, том 153, Wu and Grossman, ред., Academic Press (1987)). В некоторых вариантах осуществления вектор содержит регуляторные последовательности, такие как инициирующие и терминирующие транскрипцию и трансляцию кодоны, которые специфичны для организма-хозяина определенного типа (например, бактерии, гриба, растения, насекомого или млекопитающего), введению которому подлежит вектор, в зависимости от ситуации и учитывая то, представляет вектор собой ДНК или РНК. В некоторых вариантах осуществления вектор содержит регуляторные последовательности, которые специфичны для рода организма-хозяина. В некоторых вариантах осуществления вектор содержит регуляторные последовательности, которые специфичны для биологического вида организма-хозяина.
[00413] В некоторых вариантах осуществления вектор содержит один или несколько маркерных генов, которые делают возможным отбор трансформированных или трансфицированных организмов-хозяев. Неограничивающие примеры маркерных генов включают устойчивость к биоцидам, например, устойчивость к антибиотикам, тяжелым металлам и т. д., комплементацию у ауксотрофного организма-хозяина для того, чтобы обеспечивать прототрофность, и т. п. В предпочтительном варианте осуществления вектор содержит ампициллиновые и гигромициновые селективные маркеры.
[00414] В некоторых вариантах осуществления экспрессирующий вектор может содержать нативный или нормативный промотор, функционально связанный с полинуклеотидом, как описано в разделе 5.3.2. Выбор промоторов, например, сильных, слабых, индуцибельных, тканеспецифических и специфичных для развития, известен специалистам в данной области. Аналогичным образом, объединение молекулы нуклеиновой кислоты или ее фрагмента, как описано выше, с промотором также известно специалистам в данной области.
[00415] Неограничивающие примеры подходящих векторов включают те, которые разработаны для размножения и заселения или для экспрессии или для того и другого. Например, клонирующий вектор можно выбирать из группы, состоящей из серии pUC, серии pBluescript (Stratagene, LaJolla, Calif.), серии pET (Novagen, Madison, Wis.), серии pGEX (Pharmacia Biotech, Uppsala, Sweden) и серии pEX (Clontech, Palo Alto, Calif.). Бактериофаговые векторы, такие как lamda-GT10, lamda-GT11, lamda-ZapII (Stratagene), lamda-EMBL4 и lamda-NM1149, также можно использовать. Неограничивающие примеры растительных экспрессирующих векторов включают pBI110, pBI101.2, pBI101.3, pBI121 и pBIN19 (Clontech). Неограничивающие примеры животных экспрессирующих векторов включают pEUK-C1, pMAM и pMAMneo (Clontech). Систему клонирования TOPO (Invitrogen, Carlsbad, Calif.) также можно использовать в соответствии с рекомендациями производителя.
[00416] В некоторых вариантах осуществления вектор представляет собой вектор млекопитающего. В некоторых вариантах осуществления вектор млекопитающего содержит по меньшей мере один промоторный элемент, который опосредует инициацию транскрипции мРНК, кодирующую последовательность антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента и сигналы, необходимые для терминации транскрипции и полиаденилирования транскрипта. В некоторых вариантах осуществления вектор млекопитающего содержит дополнительные элементы, такие как, например, энхансеры, последовательности Козака и промежуточные последовательности, фланкированные донорными и акцепторными сайтами для сплайсинга РНК. В некоторых вариантах осуществления высокоэффективной транскрипции можно достичь с использованием, например, ранних и поздних промоторов из SV40, длинных концевых повторов (LTR) из ретровирусов, например, RSV, HTLVI, HIVI и раннего промотора цитомегаловируса (CMV). Однако также можно использовать клеточные элементы (например, промотор актина человека). Неограничивающие примеры экспрессирующих векторов млекопитающих включают векторы, такие как pIRESlneo, pRetro-Off, pRetro-On, PLXSN или pLNCX (Clonetech Labs, Palo Alto, Calif.), pcDNA3.1 (+/-), pcDNA/Zeo (+/-) или pcDNA3.1/Hygro (+/-) (Invitrogen), PSVL и PMSG (Pharmacia, Uppsala, Sweden), pRSVcat (ATCC 37152), pSV2dhfr (ATCC 37146) и pBC12MI (ATCC 67109). Неограничивающие примеры клеток-хозяев млекопитающих, которые можно использовать в комбинации с такими векторами млекопитающих, включают клетки Hela 293, H9 и Jurkat человека, клетки NIH3T3 и C127 мыши, клетки Cos 1, Cos 7 и CV 1, quail QC1-3, клетки L мыши и клетки яичника китайского хомяка (CHO).
[00417] В некоторых вариантах осуществления вектор представляет собой вирусный вектор, например, ретровирусные векторы, векторы на основе парвовирусов, например, векторы на основе аденоассоциированного вируса (AAV), AAV-аденовирусные химерные векторы и векторы на основе аденовирусов, и лентивирусные векторы, такие как векторы на основе Herpes simplex (HSV). В некоторых вариантах осуществления вирусным вектором манипулируют для того, чтобы делать репликацию вируса дефектной. В некоторых вариантах осуществления вирусным вектором манипулируют для того, чтобы устранять токсичность для организма-хозяина. Эти вирусные векторы можно получать с использованием стандартных способов рекомбинантной ДНК, которые описаны, например, в Sambrook et al., Molecular Cloning, a Laboratory Manual, 2-е издание, Cold Spring Harbor Press, Cold Spring Harbor, N.Y. (1989); и Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons, New York, N.Y. (1994)).
[00418] В некоторых вариантах осуществления вектор или полинуклеотид, описанный в настоящем описании, можно переносить в клетку (например, клетку ex vivo) общепринятыми способами, и получаемую клетку можно культивировать общепринятыми способами для того, чтобы получать антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании. Соответственно, в настоящем описании предоставлены клетки, содержащие полинуклеотид, кодирующий антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, его тяжелую или легкую цепь, или слитый полипептид с его легкой цепью, функционально связанные с промотором для экспрессии таких последовательностей в клетке-хозяине. В некоторых вариантах осуществления вектор, кодирующий тяжелую цепь, функционально связанную с промотором, и вектор, кодирующий легкую цепь, функционально связанную с промотором, можно совместно экспрессировать в клетке для экспрессии всего антитела к гликозилированному MUC16. В некоторых вариантах осуществления вектор, кодирующий тяжелую цепь, функционально связанную с промотором, и вектор, кодирующий слитый полипептид легкой цепи, функционально связанный с промотором, можно совместно экспрессировать в клетке для экспрессии всей биспецифической связывающей молекулы. В некоторых вариантах осуществления клетка содержит вектор, который содержит полинуклеотид, кодирующий полипептид как тяжелой цепи, так и легкой цепи антитела к гликозилированному MUC16, описанного в настоящем описании, который функционально связан с промотором. В некоторых вариантах осуществления клетка содержит вектор, который содержит полинуклеотид, кодирующий слитый полипептид как тяжелой цепи, так и легкой цепи биспецифической связывающей молекулы, описанной в настоящем описании, который функционально связан с промотором. В некоторых вариантах осуществления клетка содержит два различных вектора, первый вектор, который содержит полинуклеотид, кодирующий тяжелую цепь, который функционально связан с промотором, и второй вектор, который содержит полинуклеотид, кодирующий полипептид легкой цепи, который функционально связан с промотором. В некоторых вариантах осуществления клетка содержит два различных вектора, первый вектор, который содержит полинуклеотид, кодирующий тяжелую цепь, функционально связанный с промотором, и второй вектор, который содержит полинуклеотид, кодирующий слитый полипептид легкой цепи, функционально связанный с промотором. В некоторых вариантах осуществления первая клетка содержит первый вектор, который содержит полинуклеотид, кодирующий тяжелую цепь антитела к гликозилированному MUC16, описанного в настоящем описании, и вторая клетка содержит второй вектор, который содержит полинуклеотид, кодирующий полипептид легкой цепи антитела к гликозилированному MUC16, описанного в настоящем описании. В некоторых вариантах осуществления в настоящем описании предоставлена смесь клеток, содержащая такую первую клетку и такую вторую клетку. В некоторых вариантах осуществления первая клетка содержит первый вектор, который содержит полинуклеотид, кодирующий тяжелую цепь биспецифической связывающей молекулы, описанной в настоящем описании, и вторая клетка содержит второй вектор, который содержит полинуклеотид, кодирующий слитый полипептид легкой цепи биспецифической связывающей молекулы, описанной в настоящем описании. В некоторых вариантах осуществления в настоящем описании предоставлена смесь клеток, содержащая такую первую клетку и такую вторую клетку. В предпочтительном варианте осуществления клетка экспрессирует вектор или векторы так, что посредством клетки эффективно происходит как транскрипция, так и трансляция олигонуклеотида.
[00419] В варианте осуществления клетка экспрессирует вектор так, что посредством клетки эффективно как транскрипция, так и трансляция олигонуклеотида или его фрагмента.
[00420] В некоторых вариантах осуществления клетка присутствует в организме-хозяине, который может представлять собой животное, такое как млекопитающее. Примеры клеток включают, но не ограничиваясь этим, клетку человека, клеточную линию человека, E. coli (например, E. coli TB-1, TG-2, DH5a, XL-Blue MRF' (Stratagene), SA2821 и Y1090), B. subtilis, P. aerugenosa, S. cerevisiae, N. crassa, клетки насекомого (например, Sf9, Ea4) и другие, изложенные в настоящем описании далее. В предпочтительном варианте осуществления клетка представляет собой клетку CHO. В особенно предпочтительном варианте осуществления клетка представляет собой клетку CHO-S.
[00421] В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании, можно экспрессировать в стабильной клеточной линии, которая содержит полинуклеотид, встроенный в хромосому посредством контроля полинуклеотида в клетку. В некоторых вариантах осуществления полинуклеотид вводят в клетку, например, посредством электропорации. В некоторых вариантах осуществления полинуклеотид вводят в клетку, например, посредством трансфекции вектора, который содержит полинуклеотид, в клетку. В некоторых вариантах осуществления вектор совместно трансфицируют с селективным маркером, таким как DHFR, GPT, неомицин или гигромицин, для того, чтобы сделать возможным идентификацию и выделение трансфицированных клеток. В некоторых вариантах осуществления трансфицированный полинуклеотид также можно амплифицировать для того, чтобы экспрессировать большие количества кодируемого антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента. Например, маркер DHFR (дигидрофолатредуктаза) можно использовать для того, чтобы развивать клеточные линии, которые несут несколько сотен или даже несколько тысяч копий полинуклеотида, представляющего интерес. Другим примером селективного маркера является фермент глутаминсинтаза (GS) (Murphy, et al., Biochem. J. 227:277-279 (1991); Bebbington, et al., Bio/Technology 10:169-175 (1992)). Используя эти маркеры, клетки выращивают в селективной среде и отбирают клетки с наивысшей устойчивостью. Эти клеточные линии содержат амплифицированный ген(ы), встроенный в хромосому. Клетки яичника китайского хомячка (CHO) и NSO часто используют для получения антител.
[00422] В одном из вариантов осуществления вектор содержит (i) первую полинуклеотидную последовательность, кодирующую легкую цепь иммуноглобулина, который связывается с MUC16, которая функционально связана с первым промотором, и (ii) второй полинуклеотид, кодирующий тяжелую цепь иммуноглобулина, который связывается с MUC16, который функционально связан со вторым промотором. В некоторых вариантах осуществления вектор представляет собой вирусный вектор.
[00423] В одном из вариантов осуществления вектор содержит (i) первую полинуклеотидную последовательность, кодирующую слитый полипептид легкой цепи, который содержит легкую цепь иммуноглобулина, слитую с scFv, через пептидный линкер, где легкая цепь связывается с MUC16 и где scFv связывается с CD3, функционально связанную с первым промотором, и (ii) второй полинуклеотид, кодирующий тяжелую цепь иммуноглобулина, который связывается с MUC16, который функционально связан со вторым промотором. В некоторых вариантах осуществления вектор представляет собой вирусный вектор.
5.4 ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
[00424] В некоторых вариантах осуществления в настоящем описании предоставлены композиции (например, фармацевтические композиции) и наборы, содержащие фармацевтически эффективное количество одного или нескольких антител к гликозилированному MUC16 или их антигенсвязывающих фрагментов (см. раздел 5.1 и раздел 5.2). В некоторых вариантах осуществления фармацевтические композиции содержат клетки иммунной системы, например, T-клетки, рекомбинантно экспрессирующие антитело, его антигенсвязывающий фрагмент и/или CAR, описанные в настоящем описании. Композиции можно использовать при получении индивидуальных разовых стандартных дозированных форм. Композиции, представленные в настоящем описании, можно формулировать для парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, внутрикапсулярного, внутрихрящевого, внутриполостного, интрацилиального, интрацеребеллярного, интрацеребровентрикулярного, внутрь резервуара Оммайя, внутриглазного, интравитреального, внутриободочного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, внутриперикардиального, интраперитонеального, интраплеврального, внутрипростатного, внутрилегочного, внутриректального, внутрипочечного, интраретинального, интраспинального, интрасиновиального, внутригрудного, внутриматочного, интравезикального, болюсного, вагинального, ректального, буккального, сублингвального, интраназального, интратекального, внутрижелудочкового в головной мозг, внутрипаренхимального в головной мозг или трансдермального контроля. В предпочтительном варианте осуществления композицию формулируют для парентерального вконтроля. В особенно предпочтительном варианте осуществления композицию формулируют для внутривенного контроля. В предпочтительном варианте осуществления композицию формулируют для интраперитонеального контроля. В частном варианте осуществления композицию формулируют для интраперитонеального вконтроля, чтобы лечить перитонеальные метастазы. В предпочтительном варианте осуществления композицию формулируют для интратекального вконтроля. В частном варианте осуществления композицию формулируют для интратекального вконтроля, чтобы лечить метастазы головного мозга. См., например, Kramer et al., 2010, 97: 409-418. В предпочтительном варианте осуществления композицию формулируют для внутрижелудочкового контроля в головной мозг. В частном варианте осуществления композицию формулируют для внутрижелудочкового контроля, чтобы лечить метастазы головного мозга. См., например, Kramer et al., 2010, 97: 409-418. В предпочтительном варианте осуществления композицию формулируют для внутрипаренхимального контроля в головной мозг. В частном варианте осуществления композицию формулируют для внутрипаренхимального контроля, чтобы лечить опухоль головного мозга или метастазы опухоли головного мозга. См., например, Luther et al., 2014, Neuro Oncol, 16: 800-806, и Clinical Trial ID № NCT01502917.
[00425] В частном варианте осуществления композицию формулируют для интраперитонеального вконтроля для перитонеальных метастазов.
[00426] В некоторых вариантах осуществления в настоящем описании предоставлена композиция, которая содержит один или несколько полинуклеотидов, которые содержат нуклеотидные последовательности, кодирующие антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании. В некоторых вариантах осуществления в настоящем описании предоставлена композиция, которая содержит клетку, где клетка содержит один или несколько полинуклеотидов, которые содержат нуклеотидные последовательности, кодирующие антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании. В некоторых вариантах осуществления в настоящем описании предоставлена композиция, которая содержит вектор, этот вектор содержит один или несколько полинуклеотидов, которые содержат нуклеотидные последовательности, кодирующие антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании. В некоторых вариантах осуществления в настоящем описании предоставлена композиция, которая содержит клетку, эта клетка содержит вектор, где вектор содержит один или несколько полинуклеотидов, которые содержат нуклеотидные последовательности, кодирующие антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании.
[00427] В некоторых вариантах осуществления композиция, описанная в настоящем описании, представляет собой стабильный или консервированный состав. В некоторых вариантах осуществления стабильный состав содержит фосфатный буфер с физиологическим раствором или выбранной солью. В некоторых вариантах осуществления описанная композиция представляет собой консервированный состав множественного использования, подходящий для фармацевтического или ветеринарного использования. В некоторых вариантах осуществления композиция, описанная в настоящем описании, содержит консервант. Консерванты известны специалисту в данной области. Неограничивающие примеры консервантов включают фенол, м-крезол, п-крезол, о-крезол, хлоркрезол, бензиловый спирт, нитрит фенилртути, феноксиэтанол, формальдегид, хлорбутанол, хлорид магния (например, гексагидрат), алкилпарабен (метил, этил, пропил, бутил и т.п.), хлорид бензалкония, хлорид бензетония и дегидроацетат натрия и тимеросал, или их смеси в водном разбавителе. Любую подходящую концентрацию или смесь можно использовать, как известно в данной области, такую как 0,001-5% или какой-либо диапазон или значение между, такое как, но не ограничиваясь этим, 0,001, 0,003, 0,005, 0,009, 0,01, 0,02, 0,03, 0,05, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,3, 4,5, 4,6, 4,7, 4,8, 4,9 или какой-либо диапазон или значение между. Неограничивающие примеры включают отсутствие консерванта, 0,1-2% м-крезол (например, 0,2, 0,3, 0,4, 0,5, 0,9, 1,0%), 0,1-3% бензиловый спирт (например, 0,5, 0,9, 1,1, 1,5, 1,9, 2,0, 2,5%), 0,001-0,5% тимеросал (например, 0,005, 0,01), 0,001-2,0% фенол (например, 0,05, 0,25, 0,28, 0,5, 0,9, 1,0%), 0,0005-1,0% алкилпарабен(ы) (например, 0,00075, 0,0009, 0,001, 0,002, 0,005, 0,0075, 0,009, 0,01, 0,02, 0,05, 0,075, 0,09, 0,1, 0,2, 0,3, 0,5, 0,75, 0,9, 1,0%) и т.п.
[00428] Иногда может быть желательно доставлять композиции, представленные в настоящем описании, субъекту в течение длительных периодов времени, например, в течение периодов от одной недели до одного года или больше от одного вконтроля. Можно использовать различные медленно высвобождаемые, депо или имплантированные дозированные формы. Например, дозированная форма может содержать фармацевтически приемлемую нетоксичную соль соединений, которая имеет низкую степень растворимости в текучих веществах организма, например, (a) кислотно-аддитивную соль многоосновной кислоты, такой как фосфорная кислота, серная кислота, лимонная кислота, винная кислота, дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталин моно- или дисульфоновые кислоты, полигалактуроновая кислота и т. п.; (b) соль поливалентного катиона металла, такого как цинк, кальций, висмут, барий, магний, алюминий, медь, кобальт, никель, кадмий и т.п., или органического катиона, сформированного, например, из N,N'-дибензилэтилендиамина или этилендиамина; или (c) комбинации (a) и (b), например, соль таннат цинка. Дополнительно, композицию, предоставленную в настоящем описании, предпочтительно, относительно нерастворимую соль, такую как те, которые описаны выше, можно формулировать в геле, например, геле моностеарата алюминия, например, с сезамовым маслом, подходящим для инъекции. Особенно предпочтительные соли представляют собой соли цинка, соли танната цинка, соли памоата и т.п. Другой тип медленно высвобождаемого депо-состава для инъекции будет содержать соединение или соль, диспергированные для инкапсуляции в медленно распадающемся, нетоксичном, неантигенном полимере, таком как полимер полимолочной кислоты/полигликолевой кислоты, например, как описано в патенте США № 3773919. Соединения или, предпочтительно, относительно нерастворимые соли, такие как те, которые описаны выше, также можно формулировать в силастиковых пеллетах с холестериновой матрицей, в частности для использования у животных. Дополнительные медленно высвобождаемые, депо или имплантированные композиции, например, газовые или жидкие липосомы, известны в литературе (патент США № 5770222 и «Sustained and Controlled Release Drug Delivery Systems», ред. J. R. Robinson, Marcel Dekker, Inc., N.Y., 1978).
[00429] Диапазон композиции по меньшей мере одного антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, предоставленных в настоящем описании (см. раздел 5.1 и раздел 5.2), включает количества, получаемые при восстановлении, если во влажной/сухой системе, концентрации приблизительно от 1,0 мкг/мл приблизительно до 1000 мг/мл, несмотря на то, что более низкие и более высокие концентрации подходят и зависят от планируемого наполнителя для доставки, например, растворенные составы будут отличаться от трансдермального пластыря, пульмональных, чреcслизистых или осмотических или микронасосных способов.
[00430] В некоторых вариантах осуществления композиции, представленные в настоящем описании, содержат по меньшей мере одно из любого подходящего вспомогательного средства, такого как, но не ограничиваясь этим, разбавитель, связывающее средство, стабилизатор, буферы, соли, липофильные растворители, консервант, адъювант или тому подобное. В некоторых вариантах осуществления предпочтительны фармацевтически приемлемые вспомогательные средства. Неограничивающие примеры и способы получения таких стерильных растворов хорошо известны в данной области, например, но не ограничиваясь этим, Gennaro, Ed., Remington's Pharmaceutical Sciences, 18-е изд., Mack Publishing Co. (Easton, Pa.) 1990. Обычным образом можно выбирать фармацевтически приемлемые носители, которые подходят для способа вконтроля, растворимости и/или стабильности антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании.
[00431] В некоторых вариантах осуществления композиции, представленные в настоящем описании, содержат один или несколько фармацевтических эксципиентов и/или добавок. Неограничивающими примерами фармацевтических эксципиентов и добавок являются белки, пептиды, аминокислоты, липиды и углеводы (например, сахара, включая моносахариды, ди-, три-, тетра- и олигосахариды; производные сахаров, такие как альдиты, альдоновые кислоты, этерифицированные сахара и т.п.; и полисахариды или полимеры сахаров), которые могут присутствовать по отдельности или в комбинации, содержащей отдельно или в комбинации 1-99,99% по массе или объему. Неограничивающие примеры белковых эксципиентов включают сывороточный альбумин, такой как сывороточный альбумин человека (HSA), рекомбинантный альбумин человека (rHA), желатин, казеин и т. п. Неограничивающие примеры аминокислотных/антительных компонентов, которые также могут принимать участие в буферной емкости, включают аланин, глицин, аргинин, бетаин, гистидин, глутаминовую кислоту, аспарагиновую кислоту, цистеин, лизин, лейцин, изолейцин, валин, метионин, фенилаланин, аспартам и т.п. В некоторых вариантах осуществления аминокислотой является глицин. Неограничивающие примеры углеводных эксципиентов включают моносахариды, такие как фруктоза, мальтоза, галактоза, глюкоза, D-манноза, сорбоза и т.п.; дисахариды, такие как лактоза, сахароза, трегалоза, целлобиоза и т.п.; полисахариды, такие как раффиноза, мелицитоза, мальтодекстрины, декстраны, крахмалы и т.п.; и альдиты, такие как маннит, ксилит, мальтит, лактит, ксилит сорбит (глюцит), миоинозитол и т.п. В некоторых вариантах осуществления углеводным эксципиентом является маннит, трегалоза, или раффиноза.
[00432] В некоторых вариантах осуществления композиция, предоставленная в настоящем описании, содержит одно или несколько буферных или корректирующих pH средств; обычно, буфер представляет собой соль, полученную из органической кислоты или основания. Неограничивающие примеры буферов включают соли органических кислот, такие как соли лимонной кислоты, аскорбиновой кислоты, глюконовой кислоты, угольной кислоты, винной кислоты, янтарной кислоты, уксусной кислоты или фталевой кислоты; Tris, гидрохлорид трометамина или фосфатные буферы. В некоторых вариантах осуществления буфер представляет собой соли органической кислоты, такие как цитрат. Другие эксципиенты, например, изотонические средства, буферы, антиоксиданты, усилители консервантов, можно необязательно и предпочтительно добавлять в разбавитель. Изотоническое средство, такое как глицерин, широко используют в известных концентрациях. Физиологически переносимый буфер предпочтительно добавляют для обеспечения усовершенствованного управления pH. Композиции могут покрывать широкий диапазон pH, такой как приблизительно от pH 4 приблизительно до pH 10, и предпочтительные диапазоны приблизительно от pH 5 приблизительно до pH 9, и наиболее предпочтительный диапазон приблизительно 6,0 приблизительно до 8,0. Предпочтительно, композиции, представленные в настоящем описании, имеют pH между приблизительно 6,8 и приблизительно 7,8. Предпочтительные буферы включают фосфатные буферы, наиболее предпочтительно фосфат натрия, в частности фосфатно-солевой буфер (PBS).
[00433] В некоторых вариантах осуществления композиция, предоставленная в настоящем описании, содержит один или несколько полимерных эксципиентов/добавок, таких как, например, поливинилпирролидоны, фиколлы (полимерный сахар), декстраты (например, циклодекстрины, такие как 2-гидроксипропил-β-циклодекстрин), полиэтиленгликоли, ароматизаторы, противомикробные средства, подсластители, антиоксиданты, антистатические средства, поверхностно-активные средства (например, полисорбаты, такие как «TWEEN 20» и «TWEEN 80»), липиды (например, фосфолипиды, жирные кислоты), стероиды (например, холестерин) и/или хелатирующие средства (например, EDTA).
[00434] Другие добавки, такие как фармацевтически приемлемые солюбилизаторы, такие как Tween 20 (полиоксиэтилен (20) сорбитан монолаурат), Tween 40 (полиоксиэтилен (20) сорбитан монопальмитат), Tween 80 (полиоксиэтилен (20) сорбитан моноолеат), Pluronic F68 (блок-сополимеры полиоксиэтиленов и полиоксипропиленов) и PEG (полиэтиленгликоль), или неионные поверхностно-активные вещества, такие как полисорбат 20 или 80 или полоксамер 184 или 188, Pluronic.RTM. polyls, другие блок-сополимеры и хелаторы, такие как EDTA и EGTA, можно необязательно добавлять в композиции для того, чтобы снижать агрегирование. Эти добавки, в частности, можно использовать, если насос или пластмассовый контейнер используют для вконтроля композиции. Присутствие фармацевтически приемлемого поверхностно-активного средства смягчает предрасположенность белка к агрегации.
[00435] Дополнительные фармацевтические эксципиенты и/или добавки, пригодные для использования в композиции, представленной в настоящем описании, известны специалисту в данной области и упомянуты, например, в «Remington: The Science & Practice of Pharmacy», 19-е изд., Williams & Williams, (1995) и в «Physician's Desk Reference», 52-е изд., Medical Economics, Montvale, N.J. (1998), которые полностью включены в настоящее описание посредством ссылки. В определенных предпочтительных вариантах осуществления материалы носителей или эксципиентов представляют собой углеводы (например, сахариды и альдиты) и буферы (например, цитрат) или полимерные средства.
[00436] Предпочтительно, водный разбавитель необязательно дополнительно содержит фармацевтически приемлемый консервант. Предпочтительные консерванты включают те, которые выбраны из группы, состоящей из фенола, м-крезола, п-крезола, о-крезола, хлоркрезола, бензилового спирта, алкилпарабена (метил, этил, пропил, бутил и т. п.), хлорида бензалкония, хлорида бензетония, дегидроацетата натрия и тимеросала или их смесей. Концентрация консерванта, используемого в композиции, представляет собой концентрацию, достаточную для того, чтобы получать противомикробный эффект. Такие концентрации зависят от выбранного консерванта и уже определены специалистом в данной области.
[00437] Композиции, представленные в настоящем описании, можно получать с помощью процесса, который включает смешивание по меньшей мере одного антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании (см. раздел 5.1 и раздел 5.2), и консерванта, выбранного из группы, состоящей из фенола, м-крезола, п-крезола, о-крезола, хлоркрезола, бензилового спирта, алкилпарабена (метил, этил, пропил, бутил и т. п.), хлорида бензалкония, хлорида бензетония, дегидроацетата натрия и тимеросала или их смесей в водном разбавителе. Смешивание по меньшей мере одного антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, и консерванта в водном разбавителе осуществляют с использованием стандартных процедур растворения и смешивания. Для того чтобы получать подходящую композицию, например, отмеренное количество по меньшей мере одного антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, в буферном растворе объединяют с желаемым консервантом в буферном растворе в количествах, достаточных для предоставления антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, и консерванта в желаемых концентрациях. Композиции, представленные в настоящем описании, можно получать с помощью процесса, который включает смешивание по меньшей мере одного антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, и выбранного буфера, предпочтительно фосфатного буфера, содержащего физиологический раствор или выбранную соль. Смешивание по меньшей мере одного антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, и буфера в водном разбавителе осуществляют с использованием стандартных процедур растворения и смешивания. Для того чтобы получать подходящую композицию, например, отмеренное количество по меньшей мере одного антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, в воде или буфере объединяют с желаемым буферным средством в воде в количествах, достаточных для предоставления белка и буфера в желаемых концентрациях. Вариации этих процессов будут известны специалисту в данной области. Например, порядок добавления компонентов, используют ли дополнительные добавки, температура и pH, при которых получают композицию, все эти факторы можно оптимизировать для используемых концентрации и средств вконтроля.
5.4.1 ПАРЕНТЕРАЛЬНЫЕ СОСТАВЫ
[00438] В некоторых вариантах осуществления композицию, предоставленную в настоящем описании, формулируют для парентерального инъекционного вконтроля. В рамках изобретения, термин «парентеральный» включает внутривенный, внутрисосудистый, внутримышечный, внутрикожный, подкожный и внутриглазной. Для парентерального вконтроля композицию можно формулировать в виде раствора, суспензии, эмульсии или лиофилизированного порошка, совместно или отдельно предоставленных с фармацевтически приемлемым парентеральным наполнителем. Неограничивающие примеры таких наполнителей представляют собой воду, физиологический раствор, раствор Рингера, раствор декстрозы, глицерин, этанол и 1-10% сывороточный альбумин человека. Липосомы и неводные наполнители, такие как жирные масла, также можно использовать. Наполнитель или лиофилизированный порошок может содержать добавки, которые поддерживают изотоничность (например, хлорид натрия, маннит) и химическую стабильность (например, буферы и консерванты). Состав стерилизуют с помощью известных или подходящих способов.
[00439] Подходящие фармацевтические носители описаны в самом последнем издании Remington's Pharmaceutical Sciences, A. Osol, стандартом справочном тексте в этой области.
[00440] Составы для парентерального вконтроля могут содержать в качестве обыкновенных эксципиентов стерильную воду или физиологический раствор, полиалкиленгликоли, такие как полиэтиленгликоль, масла растительного происхождения, гидрогенизированные нафталины и т. п. Водные или масляные суспензии для инъекции можно получать с использованием подходящего эмульсификатора или увлажнителя и суспендирующего средства, в соответствии с известными способами. Средства для инъекции могут представлять собой нетоксичное, перорально не вводимое разбавляющее средство, такое как водный раствор или стерильный инъецируемый раствор или суспензия в растворителе. В качестве подходящего наполнителя или растворителя допустимы вода, раствор Рингера, изотонический физиологический раствор и т.д.; в качестве обычного растворителя или суспендирующего растворителя можно использовать стерильное нелетучее масло. Для этих целей можно использовать нелетучее масло и жирную кислоту какого-либо типа, включая природные или синтетические или полусинтетические жирные масла или жирные кислоты; природные или синтетические или полусинтетические моно- или ди- или триглицериды. Парентеральное введение известно в данной области и включает, но не ограничиваясь этим, стандартные средства инъекции, безыгольное устройство для инъекции давлением газа, как описано в патенте США № 5851198, и лазерное перфорационное устройство, как описано в патенте США № 5839446, которые полностью включены в настоящее описание посредством ссылки.
5.4.2 ЛЕГОЧНЫЕ СОСТАВЫ
[00441] В некоторых вариантах осуществления композицию, которая содержит антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании (см. раздел 5.1 и раздел 5.2), формулируют для легочного вконтроля. Для легочного вконтроля композицию доставляют при размере частицы, эффективном для достижения нижних дыхательных путей легких или синусов. Композиции для легочного вконтроля можно доставлять посредством какого-либо множества ингаляционных или назальных устройств, известных в данной области для вконтроля терапевтического средства посредством ингаляции. Эти устройства, способные осаждать аэрозольные составы в полости синуса или альвеолах пациента, включают ингаляторы отмеренных доз, небулайзеры, генераторы сухого порошка, распылители и т. п. Другие устройства, подходящие для того, чтобы направлять легочное или назальное введение антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, также известны в данной области. Во всех таких устройствах используют составы, подходящие для вконтроля, для дозирования антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, в аэрозоле. Такие аэрозоли могут состоять или из растворов (как водных, так и неводных) или из твердых частиц. В ингаляторах отмеренных доз, таких как ингалятор отмеренных доз Ventolin®, обычно используют газообразный пропеллент и необходимо приведение в действие во время вдоха (см., например, WO 94/16970, WO 98/35888). В ингаляторах сухого порошка, таких как Turbuhaler™ (Astra), Rotahaler® (Glaxo), Diskus® (Glaxo), устройствах, поставляемых на рынок Inhale Therapeutics, среди прочего, используют приведение смешанного порошка в движение дыханием (патент США № 4668218 Astra, EP 237507 Astra, WO 97/25086 Glaxo, WO 94/08552 Dura, Патент США № 5458135 Inhale, WO 94/06498 Fisons, полностью включены в настоящее описание посредством ссылки). Небулайзеры, такие как небулайзер Ultravent® (Mallinckrodt) и небулайзер Acorn II® (Marquest Medical Products) (патент США № 5404871 Aradigm, WO 97/22376), приведенные выше источники полностью включены в настоящее описание посредством ссылки, создают аэрозоли из растворов, тогда как ингаляторы отмеренных доз, ингаляторы сухого порошка и т.д. создают аэрозоли из мелких частиц. Такие примеры коммерчески доступных ингаляционных устройств представляют собой неограничивающие примеры, не предназначенные для ограничения объема.
[00442] В некоторых вариантах осуществления спрей, содержащий антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании (см. раздел 5.1 и раздел 5.2), можно получать, проталкивая суспензию или раствор по меньшей мере одного антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, через сопло под давлением. Размер и конфигурацию сопла, прикладываемое давление и скорость подачи жидкости можно выбирать для того, чтобы достигать желаемой выдачи и размера частиц. Электрораспыление можно получать, например, с помощью электрического поля совместно с капиллярной подачей или подачей через сопло. Благоприятно, частицы композиции, которая содержит по меньшей мере одно антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, доставляемые с помощью распылителя, имеют размер частицы приблизительно меньше 10 мкм, предпочтительно в диапазоне приблизительно от 1 мкм приблизительно до 5 мкм и наиболее предпочтительно приблизительно от 2 мкм приблизительно до 3 мкм.
[00443] Составы композиции, которая содержит по меньшей мере одно антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании (см. раздел 5.1 и раздел 5.2), пригодные для использования с распылителем, обычно содержат по меньшей мере одно антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, в водном растворе в концентрации приблизительно от 0,1 мг приблизительно до 100 мг на мл раствора или мг/г, или каком-либо диапазоне или значении между, например, но не ограничиваясь этим, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 45, 50, 60, 70, 80, 90 или 100 мг/мл или мг/г. Состав может содержать средства, такие как эксципиент, буфер, изотоническое средство, консервант, поверхностно-активное средство и, предпочтительно, цинк. Состав также может содержать эксципиент или средство для стабилизации композиции антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, такое как буфер, восстанавливающее средство, белок-наполнитель или углевод. Белки-наполнители, которые можно использовать при формулировании такой композиции, включают альбумин, протамин или тому подобное. Типичные углеводы, которые можно использовать при формулировании белков композиции антитела, включают сахарозу, маннит, лактозу, трегалозу, глюкозу или тому подобное. Композиция также может содержать поверхностно-активное средство, которое может снижать или предотвращать вызванное поверхностью агрегирование композиции, обусловленное атомизацей раствора при формировании аэрозоля. Можно использовать различные стандартные поверхностно-активные средства, такие как сложные эфиры полиоксиэтилена и жирных кислот и спирты, а также сложные эфиры полиоксиэтиленсорбита и жирных кислот. Количества в целом находятся в диапазоне между 0,001 и 14% по массе состава. Предпочтительные поверхностно-активные средства представляют собой полиоксиэтиленсорбитан моноолеат, полисорбат 80, полисорбат 20 или тому подобное.
[00444] В некоторых вариантах осуществления композицию вводят через небулайзер, такой как струйный небулайзер или ультразвуковой небулайзер. Обычно, в струйном небулайзере источник сжатого воздуха используют для того, чтобы создавать струю воздуха высокой скорости через отверстие. По мере расширения газа за пределами сопла возникает область низкого давления, которая увлекает раствор белка композиции антитела через капиллярную трубку, соединенную с резервуаром жидкости. Поток жидкости из капиллярной трубки рассекается на нестабильные нити и капли по мере выхода из трубки, создавая аэрозоль. Можно использовать спектр конфигураций, скоростей потока и типов перегородок, чтобы достигать желаемых характеристик эффективности данного струйного небулайзера. В ультразвуковом небулайзере высокочастотную электрическую энергию используют для того, чтобы создавать вибрационную механическую энергию, обычно с использованием пьезоэлектрического преобразователя. Эту энергию передают на состав белка композиции антитела или непосредственно или через соединяющее текучее вещество, создавая аэрозоль, содержащий белок композиции антитела. Благоприятно, частицы белка композиции антитела, доставляемые посредством небулайзера, имеют размер частицы приблизительно меньше 10 мкм, предпочтительно в диапазоне приблизительно от 1 мкм приблизительно до 5 мкм и наиболее предпочтительно приблизительно от 2 мкм приблизительно до 3 мкм.
[00445] В некоторых вариантах осуществления композицию вводят через ингалятор отмеренных доз (MDI), в котором пропеллент, по меньшей мере одно антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании (см. раздел 5.1 и раздел 5.2), и какие-либо эксципиенты или другие добавки содержатся в емкости в виде смеси, содержащей сжиженный сжатый газ. Приведением дозирующего клапана в действие высвобождают смесь фильеры в виде аэрозоля, предпочтительно содержащего частицы в диапазоне размеров приблизительно меньше 10 мкм, предпочтительно приблизительно от 1 мкм приблизительно до 5 мкм и наиболее предпочтительно приблизительно от 2 мкм приблизительно до 3 мкм. Желаемый размер частиц аэрозоля можно получать с использованием состава белка композиции антитела, получаемого различными способами, известными специалистам в данной области, включая размол на струйной мельнице, распылительную сушку, конденсацию в критической точке или тому подобное. Предпочтительные ингаляторы отмеренных доз включают те, что производят 3M или Glaxo и в которых используют пропеллент гидрофторуглерод.
[00446] Составы антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании (см. раздел 5.1 и раздел 5.2), для использования с устройством ингалятора отмеренных доз, в целом включают мелкодисперсный порошок, содержащий по меньшей мере одно антитело против IL-6, в виде суспензии в неводной среде, например, суспендированный в пропелленте с помощью поверхностно-активного средства. пропеллент может представлять собой какой-либо стандартный материал, используемый с этой целью, такой как хлорфторуглерод, гидрохлорфторуглерод, гидрофторуглерод, или углеводород, в том числе трихлорфторметан, дихлордифторметан, дихлортетрафторэтанол и 1,1,1,2-тетрафторэтан, HFA-134a (гидрофторалкан-134a), HFA-227 (гидрофторалкан-227) или тому подобное. Предпочтительно пропеллентом является гидрофторуглерод. Поверхностно-активное средство можно выбирать для того, чтобы стабилизировать по меньшей мере одно антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании, в виде суспензии в пропелленте, чтобы защищать активное средство от химического разрушения, и т.п. Подходящие поверхностно-активные средства включают сорбитантриолеат, лецитин сои, олеиновую кислоту или тому подобное. В некоторых случаях аэрозольные растворы предпочтительны при использовании таких растворителей, как этанол. В состав также можно включать дополнительные средства, известные в данной области для белковых составов.
5.4.3 ОРАЛЬНЫЕ СОСТАВЫ
[00447] В некоторых вариантах осуществления композицию, предоставленную в настоящем описании, формулируют для перорального вконтроля. В некоторых вариантах осуществления для перорального вконтроля композиции и способы вконтроля по меньшей мере одного антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, основаны на совместном введении адъювантов, например, таких как резорцины, и неионных поверхностно-активных средств, таких как простой полиоксиэтиленолеиловый эфир и простой н-гексадецилполиэтиленовый эфир, чтобы искусственно повышать проницаемость стенок кишечника, а также совместном введении ингибиторов ферментов, например, таких как ингибиторы панкреатического трипсина, диизопропилфторфосфат (DFF) и трасилол, для того, чтобы ингибировать ферментативное разрушение. Активное соединение, входящее в состав твердой дозированной формы для перорального вконтроля можно, смешивать по меньшей мере с одной добавкой, включая сахарозу, лактозу, целлюлозу, маннит, трегалозу, раффинозу, мальтит, декстран, крахмалы, агар, аргинаты, хитины, хитозаны, пектины, трагакантовую камедь, аравийскую камедь, желатин, коллаген, казеин, альбумин, синтетический или полусинтетический полимер и глицерид. Эти дозированные формы также могут содержать добавки другого типа(ов), такие как, например, неактивное разбавляющее средство, смазывающее средство, такое как стеарат магния, парабен, консервант, такой как сорбиновая кислота, аскорбиновая кислота, α-токоферол, антиоксидант, такой как цистеин, дезинтегрирующее средство, связывающее средство, загуститель, буферное средство, подсластитель, ароматизатор, отдушку и т.д.
[00448] В некоторых вариантах осуществления таблетки и пилюли для перорального вконтроля, кроме того, можно превращать в препараты с кишечным покрытием. В некоторых вариантах осуществления жидкие препараты для перорального вконтроля включают, например, препараты эмульсии, сиропа, крепкого настоя, суспензии и раствора, допустимые для медицинского использования. Эти препараты могут содержать неактивные разбавляющие средства, как правило, используемые в указанной области, например, воду. Липосомные препараты можно использовать для перорально вводимых препаратов, например, как описано для инсулина и гепарина (патент США № 4239754). Дополнительно, микросферы из искусственных полимеров смешанных аминокислот (протеиноидов) можно использовать при пероральном введении фармацевтических средств, например, как описано в патенте США № 4925673. Кроме того, при пероральном введении биологически активных средств используют соединения-носители, такие как те, которые описаны в патенте США № 5879681 и патенте США № 5871753,.
5.4.4 СОСТАВЫ ДЛЯ СЛИЗИСТЫХ
[00449] В некоторых вариантах осуществления композицию, предоставленную в настоящем описании, формулируют для абсорбции через поверхности слизистых. В некоторых вариантах осуществления для абсорбции через поверхности слизистых композиции и способы вконтроля по меньшей мере одного антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании (см. раздел 5.1 и раздел 5.2), включают эмульсию, содержащую множество субмикронных частиц, мукоадгезивную макромолекулу, биоактивный пептид и непрерывную водную фазу, которая способствует абсорбции через поверхности слизистых посредством достижения мукоадгезии частиц эмульсии (патент США № 5514670). Поверхности слизистых, подходящие для нанесения эмульсий, предоставленных в настоящем описании, могут включать, например, роговичный, конъюнктивальный, буккальный, сублингвальный, назальный, вагинальный, легочный, желудочный, кишечный и ректальный пути вконтроля. Составы для вагинального или ректального вконтроля, например, суппозитории, могут содержать в качестве эксципиентов, например, полиалкиленгликоли, вазелин, кокосовое масло и т.п. Составы для интраназального вконтроля могут быть твердыми и содержать в качестве эксципиентов, например, лактозу, или могут представлять собой водные или масляные растворы капель для носа. Для буккального вконтроля эксципиенты включают, например, сахара, стеарат кальция, стеарат магния, прежелатинизированный крахмал и т.п. (патент США № 5849695).
5.4.5 ТРАНСДЕРМАЛЬНЫЕ СОСТАВЫ
[00450] В некоторых вариантах осуществления композицию, предоставленную в настоящем описании, формулируют для трансдермального вконтроля. В некоторых вариантах осуществления для трансдермального вконтроля композиция содержит по меньшей мере одно антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании (см. раздел 5.1 и раздел 5.2), инкапсулированные в устройстве для доставки, например, таком как липосома или полимерные наночастицы, микрочастицы, микрокапсулы или микросферы (собирательно называемые микрочастицами, если не указано иное). Известно множество подходящих устройств для трансдермального вконтроля, включая микрочастицы, выполненные из синтетических полимеров, таких как полиоксикислоты, такие как полимолочная кислота, полигликолевая кислота и их сополимеры, сложные полиортоэфиры, полиангидриды и полифосфазены и природные полимеры, такие как коллаген, полиаминокислоты, альбумин и другие белки, альгинат и другие полисахариды, а также их сочетания (патент США № 5814599).
5.4.6 НАБОРЫ
[00451] Также в настоящем описании предоставлены наборы, содержащие одно или несколько антител, описанных в настоящем описании, или их антигенсвязывающих фрагментов или их конъюгатов. В частном варианте осуществления в настоящем описании предоставлен фармацевтический пакет или набор, содержащий один или несколько контейнеров, заполненных одним или несколькими ингредиентами фармацевтических композиций, описанных в настоящем описании, такими как одно или несколько антител или их антигенсвязывающих фрагментов, описанных в настоящем описании. В некоторых вариантах осуществления наборы содержат фармацевтическую композицию, описанную в настоящем описании, и профилактическое или терапевтическое средство.
[00452] Необязательно связанным с таким контейнером(ами) может быть уведомление в форме, предписанной государственным органом, регулирующим изготовление, использование или продажу фармацевтических или биологических продуктов, дозированная форма и/или инструкции для ее использования. В некоторых вариантах осуществления инструкции, включенные в набор, предоставляют руководство в отношении количеств доз и/или схем дозирования для вконтроля фармацевтической композиции(й).
[00453] Примеры фармацевтических упаковочных материалов включают, но не ограничиваясь этим, блистерные упаковки, бутылки, пакеты, саше, пробирки, ингаляторы, наносы, мешки, флаконы, контейнеры, шприцы и какой-либо упаковочный материал, подходящий для выбранной фармацевтической композиции и предполагаемого способа вконтроля и лечения.
[00454] Наборы, представленные в настоящем описании, дополнительно могут содержать устройства, которые используют для того, чтобы вводить активные ингредиенты. Примеры таких устройств включают, но не ограничиваясь этим, шприцы, безыгольные инъекторы, капельные мешки, пластыри и ингаляторы.
[00455] Наборы, представленные в настоящем описании, дополнительно могут содержать фармацевтически приемлемые наполнители, которые можно использовать для того, чтобы вводить ингредиенты. Например, если ингредиент предоставляют в твердой форме, которую нужно восстанавливать для парентерального вконтроля, набор может содержать закупоренный контейнер подходящего наполнителя, в котором ингредиент можно растворять для того, чтобы формировать стерильный раствор без частиц, который подходит для парентерального вконтроля, или можно восстанавливать в виде суспензии для перорального вконтроля. Примеры фармацевтически приемлемых наполнителей включают, но не ограничиваясь этим: водные наполнители, включая в качестве неограничивающих примеров воду для инъекций USP, хлорид натрия для инъекций, раствор Рингера для инъекций, декстрозу для инъекций, декстрозу и хлорид натрия для инъекций и лактированный раствор Рингера для инъекций; наполнители, смешиваемые с водой, включая в качестве неограничивающих примеров, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные наполнители, включая в качестве неограничивающих примеров кукурузное масло, хлопковое масло, арахисовое масло, сезамовое масло, этилолеат, изопропилмиристат и бензилбензоат.
5.5 ИСПОЛЬЗОВАНИЯ И СПОСОБЫ
5.5.1 ТЕРАПЕВТИЧЕСКИЕ ИСПОЛЬЗОВАНИЯ И СПОСОБЫ
[00456] В некоторых вариантах осуществления изобретение относится к способам лечения раке у субъекта, в частности, MUC16-положительной раке у субъекта, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента (см. раздел 5.1 и раздел 5.2). В частном варианте осуществления субъект представляет собой субъект, как описано в разделе 5.5.5. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент вводят в дозе, как описано в разделе 5.5.3. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент вводят в соответствии со способом, как описано в разделе 5.5. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент вводят в комбинации с одним или несколькими дополнительными фармацевтически активными средствами, как описано в разделе 5.5.4.
[00457] Для использования антитела к гликозилированному MUC16 или его фрагмента у субъекта конкретного биологического вида, используют антитело к гликозилированному MUC16 или его фрагмент, которые связываются с MUC16 этого конкретного биологического вида. Например, для лечения человека используют антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые связываются с MUC16 человека. В частном варианте осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент представляет собой иммуноглобулин.
[00458] Кроме того, для использования антитела к гликозилированному MUC16 или его фрагмента у субъекта конкретного биологического вида, антитело к гликозилированному MUC16, предпочтительно, константную область антитела к гликозилированному MUC16 или его антигенсвязывающий фрагмент получают у этого конкретного биологического вида. Например, для лечения человека антитело к гликозилированному MUC16 или его фрагмент может содержать антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которое представляет собой иммуноглобулин, где иммуноглобулин содержит константную область человека. В частном варианте осуществления субъектом является человек.
[00459] В частном варианте осуществления MUC16-положительная рак представляет собой рак яичников, рак легких, рак поджелудочной железы, рак молочной железы, рак фаллопиевой трубы, рак матки (например, эндометрия), рак первичной брюшины или рак какой-либо другой ткани, которая экспрессирует рецептор MUC16.
[00460] В конкретных вариантах осуществления лечение может быть направлено на достижение полезных или желаемых клинических результатов, включая, в качестве неограничивающих примеров, облегчение симптома, уменьшение степени заболевания, стабилизацию (т.е. отсутствие ухудшения) стадии заболевания, задержку или замедление прогрессирования заболевания, уменьшение интенсивности или облегчение стадии заболевания и ремиссию (частичную или полную), которые поддаются обнаружению или не поддаются обнаружению. В частном варианте осуществления «лечение» также может быть направлено на продление выживаемости по сравнению с ожидаемой выживаемостью, если не получать лечение. В конкретных вариантах осуществления введение антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании, или фармацевтической композиции, описанной в настоящем описании, субъекту со злокачественной опухолью (например, злокачественной опухолью яичников, злокачественной опухолью легких, злокачественной опухолью поджелудочной железы, злокачественной опухолью молочной железы, злокачественной опухолью фаллопиевой трубы, злокачественной опухолью матки (например, эндометрия) или злокачественной опухолью первичной брюшины или злокачественной опухолью какой-либо другой ткани, которая экспрессирует рецептор MUC16) достигает по меньшей мере одного, двух, трех, четырей или более из следующих эффектов: (i) снижение или уменьшение интенсивности тяжести одного или нескольких симптомов раке; (ii) уменьшение длительности одного или нескольких симптомов, связанных со злокачественной опухолью; (iii) предотвращение рецидива симптома, связанного со злокачественной опухолью; (iv) снижение госпитализации субъекта; (v) уменьшение длительности госпитализации; (vi) увеличение выживаемости субъекта; (vii) усиление или усовершенствование терапевтического эффекта другой терапии; (viii) ингибирование развития или начала одного или нескольких симптомов, связанных со злокачественной опухолью; (ix) уменьшение числа симптомов, связанных со злокачественной опухолью; (x) усовершенствование качества жизни, как оценивают способами, хорошо известными в данной области; (x) ингибирование рецидива опухоли; (xi) регрессия опухолей и/или одного или нескольких симптомов, связанных с ними; (xii) ингибирование прогрессирования опухолей и/или одного или нескольких симптомов, связанных с ними; (xiii) уменьшение роста опухоли; (xiv) уменьшение размера опухоли (например, объема или диаметра); (xv) уменьшение формирования вновь сформированной опухоли; (xvi) предотвращение, эрадикация, устранение или контроль первичных, регионарных и/или метастатических опухолей; (xvii) уменьшение числа или размера метастазов; (xviii) уменьшение смертности; (xix) увеличение безрецидивной выживаемости; (xx) размер опухоли сохраняется и не увеличивается или увеличивается меньше, чем увеличение опухоли после вконтроля стандартной терапии, как измеряют стандартными способами, доступными специалисту в данной области, такими как магнитно-резонансная визуализация (MRI), динамическая MRI с контрастированием (DCE-MRI), рентген и компьютерное томографическое (CT) сканирование или позитронно-эмиссионное томографическое (PET) сканирование; и/или (xxi) увеличение длительности ремиссии у пациентов. Лечение может быть направлено на достижение одного или нескольких из приведенных выше.
5.5.2 ДИАГНОСТИЧЕСКИЕ ИСПОЛЬЗОВАНИЯ
[00461] В некоторых вариантах осуществления антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты (см. раздел 5.1 и раздел 5.2), описанные в настоящем описании, можно использовать для диагностических целей, чтобы обнаруживать, диагностировать или осуществлять мониторинг состояния, описанного в настоящем описании (например, состояния, включающего MUC16-положительные клетки раке). В некоторых вариантах осуществления антитела к гликозилированному MUC16 или их антигенсвязывающие фрагменты для использования в диагностических целях метят, как описано в разделе 5.2.
[00462] В некоторых вариантах осуществления изобретение относится к способам обнаружения состояния, описанного в настоящем описании, которые включают (a) анализ экспрессии MUC16 или его фрагмента в клетках или образце ткани субъекта с использованием одного или нескольких антител к гликозилированному MUC16 или их антигенсвязывающих фрагментов, описанных в настоящем описании; и (b) сравнение уровня экспрессии MUC16 или его фрагмента с контрольным уровнем, например, уровнями в образцах нормальных тканей (например, от субъекта, не имеющего состояния, описанного в настоящем описании, или от того же пациента до начала состояния), в соответствии с чем увеличение или уменьшение анализируемого уровня экспрессии MUC16 или его фрагмента по сравнению с контрольным уровнем экспрессии MUC16 или его фрагмента отражает состояние, описанное в настоящем описании.
[00463] Антитела, описанные в настоящем описании, можно использовать для анализа уровней MUC16 или его фрагмента в биологическом образце с использованием классических иммуногистологических способов, как описано в настоящем описании или как известно специалистам в данной области (например, см. Jalkanen et al., 1985, J. Cell. Biol. 101:976-985; и Jalkanen et al., 1987, J. Cell. Biol. 105:3087-3096). Другие способы на основе антител, которые можно использовать для обнаружения экспрессии гена белка, включают иммунологические анализы, такие как твердофазный иммуноферментный анализ (ELISA) и радиоиммунологический анализ (RIA). Подходящие метки для анализа антител известны в данной области и включают ферментативные метки, такие как глюкозооксидаза; радиоизотопы, такие как йод (125I,121I), углерод (14C), сера (35S), тритий (3H), индий (121In) и технеций (99Tc); люминесцентные метки, такие как люминол; и флуоресцентные метки, такие как флуоресцеин и родамин, и биотин.
[00464] В некоторых вариантах осуществления мониторинг состояния, описанного в настоящем описании (например, MUC16-положительной раке), осуществляют посредством повторения способа диагностирования в течение определенного периода времени после начального диагноза.
[00465] Присутствие меченой молекулы можно обнаруживать у субъекта с использованием известных в данной области способов для сканирования in vivo. Специалисты в данной области смогут определять подходящий способ обнаружения конкретной метки. Способы и устройства, которые можно использовать в диагностических способах по изобретению, включают, но не ограничиваясь этим, компьютерную томографию (CT), сканирование всего организма, такое как позитронно-эмиссионная томография (PET), магнитно-резонансная визуализация (MRI) и сонография.
5.5.3 ДОЗЫ И СХЕМЫ
[00466] Антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент (см. раздел 5.1 и раздел 5.2) или композицию (см. раздел 5.4) или клетки, экспрессирующие антитела, или его антигенсвязывающие фрагменты, описанные в настоящем описании, можно доставлять субъекту с помощью различных путей. Они включают, но не ограничиваясь этим, парентеральный, интраназальный, интратрахеальный, пероральный, внутрикожный, топический, внутримышечный, интраперитонеальный, трансдермальный, внутривенный, внутриопухолевый, конъюнктивальный и подкожный пути. Легочное введение также можно использовать, например, с использованием ингалятора или небулайзера и состава с аэрозольным средством для применения в качестве спрея. В одном из вариантов осуществления антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент или композицию, описанную в настоящем описании, вводят парентерально субъекту (например, субъекту, как описано в разделе 5.5.5). В частном варианте осуществления указанное парентеральное введение является внутривенным, внутримышечным или подкожным.
[00467] Количество антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента или композиции, которое будет эффективно при лечении и/или предотвращении состояния, зависит от свойств заболевания, и его можно определять стандартными клиническими способами.
[00468] Точная доза, подлежащая использованию в композиции, также зависит от пути вконтроля и типа раке, и решение о ней следует принимать в соответствии с суждением практикующего врача и всех обстоятельств субъекта. Например, эффективные дозы также могут варьировать в зависимости от средства вконтроля, целевого места, физиологического состояния пациента (включая возраст, массу тела и состояние здоровья), является ли пациент человеком или животным, других вводимых лекарств, или является ли лечение профилактическим или терапевтическим. Дозы лечения оптимально титруют для того, чтобы оптимизировать безопасность и эффект.
[00469] В некоторых вариантах осуществления анализ in vitro используют для того, чтобы помогать идентифицировать оптимальные диапазоны доз. Эффективные дозы можно экстраполировать из кривых доза-эффект, полученных на тестовых системах in vitro или животных моделях.
[00470] Для антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента доза может находиться в диапазоне приблизительно от 0,0001 до 100 мг/кг и более обычно от 0,01 до 15 мг/кг массы тела пациента. Например, дозы могут составлять 1 мг/кг массы тела, 10 мг/кг массы тела или в диапазоне 1-10 мг/кг или другими словами 70 мг или 700 мг или в диапазоне 70-700 мг, соответственно, для пациента 70 кг. В целом, антитела человека имеют более длительное время полужизни внутри организма человека, чем антитела от других биологических видов из-за иммунного ответа на инородные полипептиды. Таким образом, часто возможны более низкие дозы антител человека и менее частое введение.
[00471] В некоторых вариантах осуществления, таких как при введении сконструированных клеток, экспрессирующих антитела или их антигенсвязывающие фрагменты, или CAR, субъект вводят субъекту в диапазоне приблизительно от одного миллиона приблизительно до 100 миллиард клеток, таком как, например, от 1 миллиона приблизительно до 50 миллиардов клеток (например, приблизительно 5 миллионов клеток, приблизительно 25 миллионов клеток, приблизительно 500 миллионов клеток, приблизительно 1 миллиард клеток, приблизительно 5 миллиардов клеток, приблизительно 20 миллиардов клеток, приблизительно 30 миллиардов клеток, приблизительно 40 миллиардов клеток или диапазон, определяемый какими-либо двумя из приведенных выше значений), таком как приблизительно от 10 миллионов приблизительно до 100 миллиардов клеток (например, приблизительно 20 миллионов клеток, приблизительно 30 миллионов клеток, приблизительно 40 миллионов клеток, приблизительно 60 миллионов клеток, приблизительно 70 миллионов клеток, приблизительно 80 миллионов клеток, приблизительно 90 миллионов клеток, приблизительно 10 миллиардов клеток, приблизительно 25 миллиардов клеток, приблизительно 50 миллиард клеток, приблизительно 75 миллиардов клеток, приблизительно 90 миллиардов клеток или диапазон, определяемый какими-либо двумя из приведенных выше значений), и в некоторых случаях приблизительно от 100 миллионов клеток приблизительно до 50 миллиардов клеток (например, приблизительно 120 миллионов клеток, приблизительно 250 миллионов клеток, приблизительно 350 миллионов клеток, приблизительно 450 миллионов клеток, приблизительно 650 миллионов клеток, приблизительно 800 миллионов клеток, приблизительно 900 миллионов клеток, приблизительно 3 миллиарда клеток, приблизительно 30 миллиардов клеток, приблизительно 45 миллиардов клеток) или какое-либо значение между этими диапазонами. В некоторых вариантах осуществления доза всех клеток и/или доза индивидуальных субпопуляций клеток находится в диапазоне между по или приблизительно 104 и по или приблизительно 109 клеток/кг (кг) массы тела, например, между 105 и 106 клеток/кг массы тела, например, по или приблизительно 1×105 клеток/кг, 1,5×105 клеток/кг, 2×105 клеток/кг или 1×106 клеток/кг, 2×106 клеток/кг, 5×106 клеток/кг или 10×106 клеток/кг массы тела. Например, в некоторых вариантах осуществления клетки вводят по, или в определенном диапазоне ошибки, между по или приблизительно 104 и по или приблизительно 109 T-клеток/кг (кг) массы тела, например, между 105 и 107 T-клеток/кг массы тела.
[00472] Антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент можно вводить во многих случаях. Интервалы между разовыми дозами может составлять 1 неделю, 2 недели, 3 недели, 4 недели, 1 месяц, 2 месяца, 3 месяца, 6 месяцев, 1 год или 2 года.
5.5.4 СПОСОБЫ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ
[00473] В частном варианте осуществления способы, представленные в настоящем описании для лечения раке (например, раке яичников, раке поджелудочной железы, раке легких, раке молочной железы, раке фаллопиевой трубы, раке матки (например, эндометрия) или раке первичной брюшины) у субъекта, включающие введение субъекту, нуждающемуся в этом, фармацевтической композиции, содержащей антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании (см. раздел 5.1 и раздел 5.2), дополнительно включают введение субъекту одного или нескольких дополнительных терапевтических средств. В частном варианте осуществления дополнительное терапевтическое средство предназначено для лечения раке у субъекта (например, раке яичников, раке поджелудочной железы, раке легких, раке молочной железы, раке фаллопиевой трубы, раке матки (например, эндометрия) и раке первичной брюшины). В частном варианте осуществления дополнительное терапевтическое средство предназначено для лечения каких-либо побочных эффектов лечения антителом к гликозилированному MUC16 или антигенсвязывающим фрагментом, описанными в настоящем описании (см. раздел 5.1 и раздел 5.2).
[00474] В одном из вариантов осуществления вводят первое антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые распознают эпитоп в MUC16, который содержит N-гликозилированный Asn1806, но не содержит N-гликозилированный Asn1800 (т.е. им нужен N-гликозилированный Asn1806, но не N-гликозилированный Asn1800, для связывания с MUC16) в комбинации со вторым антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, которые распознают эпитоп в MUC16, который содержит N-гликозилированный Asn1806 и также содержит N-гликозилированный Asn1800 (т.е. оба N-гликозилированных участка представляют собой часть эпитопа, распознаваемого антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом). Такое первое антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент можно идентифицировать по (i) его способности иммуноспецифически связывать клетку, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма MUC16 гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) отсутствию у него иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует третью форму MUC16, эта третья форма гликозилирована, и где аминокислотная последовательность третьей формы представляет собой SEQ ID № 139; и (iii) его способности иммуноспецифически связывать клетку, которая рекомбинантно экспрессирует четвертую форму MUC16, эта четвертая форма гликозилирована, и где аминокислотная последовательность четвертой формы представляет собой SEQ ID № 152, где клетка, которая рекомбинантно экспрессирует первую форму MUC16, клетка, которая рекомбинантно экспрессирует третью форму MUC16, и клетка, которая рекомбинантно экспрессирует четвертую форму MUC16, относятся к одному типу клеток. Такое второе антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент можно идентифицировать по (i) его способности иммуноспецифически связываться с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; и (ii) отсутствию у него иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует пятую форму MUC16, эта пятая форма гликозилирована, и где аминокислотная последовательность пятой формы представляет собой SEQ ID № 172, где клетка, которая рекомбинантно экспрессирует первую форму MUC16 относится к тому же типу клеток, что и клетка, которая рекомбинантно экспрессирует пятую форму MUC16. Белок, кодируемый аминокислотной последовательностью из SEQ ID № 172, также упоминают в настоящем описании как MUC16c114-N23. MUC16c114-N23 состоит из C-концевых 114 аминокислотных остатков зрелого MUC16 (SEQ ID № 150 представляет собой последовательность зрелого MUC16), за исключением того, что аспарагины в положениях аминокислот 24 и 30 (соответствующих положениям аминокислот Asn1800 и Asn1806 из SEQ ID № 150), мутированы в аланины. Таким образом, MUC16c114-N23 не способен к N-гликозилированию в положениях аминокислот 24 и 30 из SEQ ID № 172 (соответствующих положениям аминокислот Asn1800 и Asn1806 из SEQ ID № 150).
[00475] В одном из вариантов осуществления вводят первое антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, которые распознают эпитоп в MUC16, который содержит N-гликозилированный Asn1806, но не содержит N-гликозилированный Asn1800 (т.е. им нужен N-гликозилированный Asn1806, но не N-гликозилированный Asn1800, для связывания с MUC16) в комбинации со вторым антителом или его антигенсвязывающим фрагментом, которые распознают эпитоп в MUC16, который содержит N-гликозилированный Asn1800, но не содержит N-гликозилированный Asn1806 (т.е. им нужен N-гликозилированный Asn1800, но не N-гликозилированный Asn1806, для связывания с MUC16). Такое первое антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент можно идентифицировать по (i) его способности иммуноспецифически связывать клетку, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма MUC16 гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) отсутствию у него иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует третью форму MUC16, эта третья форма гликозилирована, и где аминокислотная последовательность третьей формы представляет собой SEQ ID № 139; и (iii) его способности иммуноспецифически связывать клетку, которая рекомбинантно экспрессирует четвертую форму MUC16, эта четвертая форма гликозилирована, и где аминокислотная последовательность четвертой формы представляет собой SEQ ID № 152, где клетка, которая рекомбинантно экспрессирует первую форму MUC16, клетка, которая рекомбинантно экспрессирует третью форму MUC16, и клетка, которая рекомбинантно экспрессирует четвертую форму MUC16, относятся к одному типу клеток. Такое второе антитело или его антигенсвязывающий фрагмент можно идентифицировать по (i) его способности иммуноспецифически связываться с клеткой, которая рекомбинантно экспрессирует первую форму MUC16, эта первая форма гликозилирована, и где аминокислотная последовательность первой формы представляет собой SEQ ID № 133; (ii) его способности иммуноспецифически связываться с клеткой, которая рекомбинантно экспрессирует третью форму MUC16, эта третья форма гликозилирована, и где аминокислотная последовательность третьей формы представляет собой SEQ ID № 139; и (iii) отсутствию у него иммуноспецифического связывания с клеткой, которая рекомбинантно экспрессирует четвертую форму MUC16, эта четвертая форма гликозилирована, где аминокислотная последовательность четвертой формы представляет собой SEQ ID № 152, где клетка, которая рекомбинантно экспрессирует первую форму MUC16, клетка, которая рекомбинантно экспрессирует третью форму MUC16, и клетка, которая рекомбинантно экспрессирует четвертую форму MUC16, относятся к одному типу клеток.
[00476] В конкретных вариантах осуществления дополнительным средством является средство, используемое для лечения раке яичников. В конкретных вариантах осуществления дополнительное средство представляет собой средство, используемое для лечения раке поджелудочной железы. В конкретных вариантах осуществления дополнительное средство представляет собой средство, используемое для лечения раке легких. В конкретных вариантах осуществления дополнительное средство представляет собой средство, используемое для лечения раке молочной железы. В конкретных вариантах осуществления дополнительное средство представляет собой средство, используемое для лечения раке фаллопиевой трубы. В конкретных вариантах осуществления дополнительное средство представляет собой средство, используемое для лечения раке матки (например, эндометрия). В конкретных вариантах осуществления дополнительное средство представляет собой средство, используемое для лечения раке первичной брюшины.
[00477] Антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании (см. раздел 5.1 и раздел 5.2), можно вводить с дополнительным терапевтическим средством параллельно или последовательно (до и/или после). Антитело или его антигенсвязывающий фрагмент и дополнительное терапевтическое средство можно вводить в той же или различных композициях, и с помощью того же или различных путей вконтроля. Первую терапию (которая представляет собой антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании (см. раздел 5.1 и раздел 5.2), или дополнительное терапевтическое средство) можно вводить прежде (например, за 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель до), параллельно с или после (например, через 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель после) вконтроля второй терапии (антитела к гликозилированному MUC16 или его антигенсвязывающего фрагмента, описанных в настоящем описании (см. раздел 5.1 и раздел 5.2), или дополнительного терапевтического средства) субъекту со злокачественной опухолью (например, злокачественной опухолью яичников, злокачественной опухолью поджелудочной железы, злокачественной опухолью легких, злокачественной опухолью молочной железы, злокачественной опухолью фаллопиевой трубы, злокачественной опухолью матки (например, эндометрия) и злокачественной опухолью первичной брюшины). В некоторых вариантах осуществления дополнительное терапевтическое средство, вводимое субъекту в комбинации с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, описанными в настоящем описании (см. раздел 5.1 и раздел 5.2), вводят в той же композиции (фармацевтической композиции). В других вариантах осуществления дополнительное терапевтическое средство, вводимое в комбинации с антителом к гликозилированному MUC16 или его антигенсвязывающим фрагментом, описанным в настоящем описании (см. раздел 5.1 и раздел 5.2), вводят субъекту в другой композиции, нежели антитело к гликозилированному MUC16 или его антигенсвязывающий фрагмент, описанные в настоящем описании (см. раздел 5.1 и раздел 5.2) (например, используют две или больше фармацевтических композиций).
5.5.5 ПОПУЛЯЦИЯ ПАЦИЕНТОВ
[00478] Субъект, которого лечат в соответствии со способами, предоставленными в настоящем описании, может представлять собой какое-либо млекопитающее, такое как грызун, кошка, собака, лошадь, корова, свинья, мартышка, примат или человек и т.д. В предпочтительном варианте осуществления субъектом является человек. В другом предпочтительном варианте осуществления субъектом является собака. В рамках изобретения, термины «субъект» и «пациент» используют взаимозаменяемо.
[00479] В некоторых вариантах осуществления у субъекта, которого лечат в соответствии со способами, предоставленными в настоящем описании, диагностирована MUC16-положительная рак, включая в качестве неограничивающих примеров рак яичника, легкого, поджелудочной железы, молочной железы, матки, фаллопиевой трубы или первичной брюшины или рак какой-либо другой ткани, которая экспрессирует MUC16.
[00480] Следующие примеры приведены в качестве иллюстрации и не ограничения.
6. ПРИМЕРЫ
6.1 ПРИМЕР 1: ЭКСПРЕССИЯ КАРБОКСИКОНЦЕВОЙ ЧАСТИ MUC16/CA125 ИНДУЦИРУЕТ ТРАНСФОРМАЦИЮ И ИНВАЗИЮ ОПУХОЛИ
6.1.1 ВВЕДЕНИЕ
[00481] Сывороточный антиген CA125, антигенный фрагмент MUC16, был главной опорой при оценке и ведении раке яичников с начала 1980-х годов, но его биология и вклад в манифестацию раке яичников плохо поняты (см. источники 1-3, как приведено в разделе 6.1.5, далее). Клонирование CA125, которого добились в 2001, сначала идентифицировало MUC16 как связанный муцин с небольшим внутриклеточным доменом, трансмембранным доменом, эктодоменом проксимально к предполагаемому сайту расщепления, и большой сильно гликозилированной областью из 12-20 тандемных повторов, каждый по 156 аминокислот в длину (фиг. 1A) (см. источники 4-6, как приведено в разделе 6.1.5, далее). Серьезные злокачественные опухоли яичника, фаллопиевой трубы и матки часто экспрессируют большие количества MUC16, а аберрантную экспрессию MUC16 можно найти в нескольких других злокачественных новообразованиях, в том числе злокачественных опухолях легкого, поджелудочной железы и молочной железы. Экспрессия других связанных муцинов является обыкновенным признаком эпителиальных органов, и они часто чрезмерно экспрессированы в злокачественном новообразовании. Два значимых примера представляют собой MUC1, который чрезмерно экспрессирован во многих злокачественных опухолях молочных желез и яичников, и MUC4, который характерно избыточен в злокачественных опухолях поджелудочной железы и желудочно-кишечного тракта (см. источник 7, как приведено в разделе 6.1.5, далее). Оба этих муцина идентифицированы как обладающие трансформирующими свойствами (см. источники 8 и 9, как приведено в разделе 6.1.5, далее). Механизмы трансформации различают и поняты не полностью. MUC1 имеет область гомологии с β-катенином, для которой показана транслокация в ядро и действие в качестве фактора транскрипции (см. источники 10 и 11, как приведено в разделе 6.1.5, далее). В отличие от этого, MUC4 имеет HER-связывающие домены в его трансмембранной области и действует, по меньшей мере отчасти, через киназы семейства HER (см. источники 12 и 13, как приведено в разделе 6.1.5, далее). MUC16 не содержит областей гомологии с любым из этих доменов и, похоже, развивался независимо (см. источник 12, как приведено в разделе 6.1.5, далее). По сравнению как с MUC1, так и с MUC4, экспрессия MUC16 более ограничена, и он экспрессирован обычно, почти исключительно, в мюллеровом тракте и глазном эпителии (см. источники 14-16, как приведено в разделе 6.1.5, далее). Области тандемных повторов молекулы MUC16, похоже, выполняет функцию ключевых взаимодействующих белков с мезотелином и другими белками стромы (см. источник 17, как приведено в разделе 6.1.5, далее). Эти взаимодействия, вероятно, отвечают за классические паттерны серозного распространения рака яичников. В клинических условиях высокие уровни циркулирующих элементов из MUC16, которые кодируют антиген CA125, связаны с нежелательным клиническим исходом, независимо от стадии, степени дифференцировки и других традиционных клинических факторов (см. источник 18, как приведено в разделе 6.1.5, далее). Другие идентифицировали C-конец MUC16 в качестве важного при инвазии и роста, но конкретные области проксимальной последовательности MUC16, отвечающие за трансформацию, не определены (см., например, Therialt et al. Gynecol Oncol 2011, 121(3):434-443 и Giannakouros et al. Int. J. Oncol. 2015, 41(1):91-98). Амплификацию геномных областей, кодирующих MUC16 в ДНК раке яичников, и сверхэкспрессию мРНК MUC16 наблюдали в проекте по раке яичников The Cancer Genome Atlas (TCGA) и связали с худшим исходом (см. источник 19, как приведено в разделе 6.1.5, далее). Утрата MUC16 у мышей не связана с отчетливым фенотипом, но эффект персистирующей или аберрантной экспрессии MUC16 не известен (см. источник 20, как приведено в разделе 6.1.5, далее). Данные в этом примере показывают, что экспрессия 114 C-концевых аминокислотных остатков MUC16 (MUC16c114, SEQ ID № 133) и, в частности, гликозилирование остатка Asn30 в MUC16c114 (соответствующего Asn1806 зрелого MUC16 (SEQ ID № 150)) связано с конкретными изменениями сигнальной трансдукции, экспрессии гена и агрессивным биологическим поведением.
6.1.2 МАТЕРИАЛЫ И СПОСОБЫ
6.1.2.1 Синтез ДНК конструкций карбоксиконца MUC16 (MUC16c114) и домена MUC16-CA125 (MUC16c344) и гликозилированного слитого белка
[00482] Создавали ДНК конструкции, кодирующие усеченные формы MUC16 (обозначаемые MUC16c344, MUC16c114, MUC16c80 и MUC16c86; фиг. 1B и фиг. 1C). Сайты множественного клонирования EcoRV и NotI вектора phrGFP II-C (phrGFP) (Stratagene, LaJolla, CA) использовали для встраивания ДНК MUC16c114, MUC16c80, MUC16c86 и MUC16c344, чтобы создавать GFP слитые конструкции получали с белком GFP, присутствующем на карбоксиконце усеченного слитого белка MUC16. ПЦР продукты для фрагментов MUC16 (MUC16c344, MUC16c114, MUC16c80 и MUC16c86) создавали с использованием ДНК pBK-CMV-MUC16-B53 в качестве матрицы (Yin BWT, et al., International Journal of Cancer, 2002, 98(5):737-740), и очищали продукты ПЦР в 1% агарозном геле, секвенировали и вставляли в сайты множественного клонирования EcoRV и NotI вектора phrGFP II-C (phrGFP). Вектор pFUSE-hIgG1-Fc2 приобретали в InvivoGen (San Diego, CA). Праймеры полимеразной цепной реакции (ПЦР) разрабатывали для эктодомена MUC16c57-114 (от положения 1777 до 1834 из SEQ ID № 150) или сахарсвязывающего домена из117-244LGALS3 ДНК последовательности синтезировали (Sigma-Genosys, The Woodlands, TX) с использованием сайта рестрикционного фермента EcoRV в качестве прямого праймера и сайта рестрикционного фермента NcoI в качестве обратного праймера. Продукты ПЦР для фрагмента MUC16c57-114 создавали с использованием pBK-CMV-MUC16-B53 ДНК в качестве матрицы и клона кДНК LGALS3 (MGC:2058 IMAGE:3050135 GenBank: AAH01120.1; DBSource accession BC001120.2), который получали из ATCC (Manassas, VA), использовали в качестве ДНК матрицы для того, чтобы синтезировать сахарсвязывающий домен продукта ПЦР LGALS3. Продукты ПЦР очищали в 1% агарозном геле, секвенировали и вставляли в вектор pFUSE-hIgG1-Fc2.
6.1.2.2 Праймеры и ПЦР
[00483] Прямой и обратный праймеры для MUC16-цитоплазматического домена (MUC16c114, карбоксиконец 114 а. о.) (5'-CCATGCGATATCGCCACCATGGTGAACTTCTCGCCACTGGCT-3' и 5'-TACGGCGGCCGCTTGCAGATCCTCCAGGTCTAGG-3', SEQ ID № 121 и SEQ ID № 122, соответственно). MUC16c344 (один тандемный повтор, который имеет только одну цистеиновую петлю, 344 а. о.) (5'-CCATGCGATATCGCCACCATGGTGACAGGCCCTGGGCTGGACAGA-3' и 5'-TACGGCGGCCGCTTGCAGATCCTCCAGGTCTAGG-3', SEQ ID № 123 и SEQ ID № 124, соответственно) с EcoRV и KOZAK в прямом праймере и NotI в обратном праймере. ДНК конструкцию MUC16c114-GFP использовали для того, чтобы создавать конструкции MUC16c80 и MUC16c86 с помощью праймеров QuikChange. Прямой и обратный праймеры для вектора pFUSE-hIgG1-Fc2 MUC16c57-114 (5'-CCATGCGATATCAAACTTCTCGCCACTGGCT-3' и 5'-AGATCTAACCATGGGAAGGTCAGAATTCCCAGT-3', SEQ ID № 125 и SEQ ID № 126, соответственно) и прямой и обратный праймеры для сахарсвязывающего домена117-244LGALS3 для вектора pFUSE-hIgG1-Fc2 (5'-CATGCGATATCACCTTATAACCTGCCTTTG-3' и 5'-AGATCTAACCATGGTATATGAAGCACTGGT-3', SEQ ID № 127 и SEQ ID № 128, соответственно) с EcoRV в прямом праймере и NcoI в обратном праймере. Все вышеприведенные праймеры синтезировали в Sigma Genosys, The Woodlands, TX.
[00484] Условий ПЦР достигали посредством следующих процессов: ДНК плавили при 95°C в течение 5 минут для того, чтобы достигать денатурации. Проводили тридцать повторных циклов нагрева при 97°C в течение 30 секунд, отжиг при 60°C в течение 1 минуты и удлинение при 72°C в течение 1 минуты. После этого следовало удлинение созданной цепи продукта ПЦР при 72°C в течение 5 минут и затем охлаждение при 4°C в течение ночи.
[00485] ДНК вектора phrGFP II-C, очищенную на геле ДНК MUC16c114, MUC16c80, MUC16c86, MUC16c344 и MUC16c678 индивидуально расщепляли в течение ночи при 37°C на водяной бане с использованием рестрикционных ферментов EcoRV и NotI (New England Biolabs, Beverly, MA). ДНК вектора pFUSE-hIgG1-Fc2, очищенную на геле ДНК MUC16c57-114 и117-244LGALS3 индивидуально расщепляли в течение ночи при 37°C на водяной бане с использованием рестрикционных ферментов EcoRV и NcoI (New England Biolabs, Beverly, MA). Расщепленную рестриктазами ДНК MUC16c114 и phrGFP; MUC16c344 и phrGFP; или MUC16c678 и phrGFP очищали на геле и лигировали в течение ночи с использованием T4 лигазы (Roche Diagnostics Corporation, Indianapolis, IN). Аналогичным образом, расщепленную рестриктазами ДНК MUC16c57-114 и pFUSE-hIgG1-Fc2;117-244LGALS3 и pFUSE-hIgG1-Fc2 очищали на геле и лигировали в течение ночи с использованием T4 лигазы (Roche Diagnostics Corporation, Indianapolis, IN). Лигированную ДНК трансформировали в суперкомпетентные клетки XL-1 Blue (Stratagene, La Jolla, CA), следуя протоколу производителя, и высевали их на чашки с агаром со средой LB, содержащей канамицин (50 мкг/мл, Sigma Chemical Co., St. Louis, MO) для векторов phrGFP или на чашки с агаром со средой LB, содержащей зеоцин 25 мкг/мл (Invitrogen, CA). Клоны отбирали на следующие сутки и Miniprep ДНК экстрагировали с использованием системы очистки Wizard Plus Miniprep DNA (Promega Corporation, Madison, WI). ДНК отобранных клонов секвенировали в центре коллективного использования по секвенированию ДНК MSKCC с использованием прямых и обратных праймеров MUC16 и phrGFP для того, чтобы подтверждать присутствие MUC16 и phrGFP в последовательностях в виде слитых конструкций или MUC16c57-114 и pFUSE-hIgG1-Fc2 или117-244LGALS3 и pFUSE-hIgG1-Fc2. Megaprep ДНК из таких клонов делали с использованием системы очистки Wizard Plus Megaprep DNA (Promega Corporation, Madison, WI), в которой также подтверждали присутствие MUC16 и phrGFP или MUC16c57-114 и pFUSE-hIgG1-Fc2 или117-244LGALS3 и pFUSE-hIgG1-Fc2 в ее последовательностях в виде слитых конструкций.
6.1.2.3 Сортировка флуоресцентно-активированных клеток (FACS)
[00486] Трансфицированные клетки трипсинизировали, промывали и считали с помощью гемоцитометра. Клетки распределяли в несколько пробирок Eppendorf по меньшей мере по 0,5-1×106/пробирка. Клетки промывали PBS, содержащим 1% FCS и 0,025% азида натрия (FACS буфер). Для поверхностного FACS окрашивания клетки инкубировали или без (для контроля вторым антителом) или с 1 мкг/пробирка биологически реактивных супернатантов MUC16-карбоксиконцевых МАт (4H11.2.5), Ат мыши против OC125 человека (M3519) (DakoCytomation, Dako North America Inc., Carpinteria, CA) в течение 30 минут на льду. Поверхности клеток в пробирках Eppendorf также окрашивали с использованием 1 мкг/пробирка неспецифических контрольных антител мыши совпадающего изотипа (13C4 для IgG1 и 4E11 для IgG2b МАт, полученных из моноклонального центра коллективного использования MSKCC)(данные не приведены) и инкубировали на льду в течение 30 минут. Все клетки промывали 3 раза в FACS буфере. Клетки инкубировали с 1 мкг/пробирка второго антитела козы против IgG1-PE или IgG2b-PE мыши в течение 30 минут на льду и затем промывали 3 раза в FACS буфере. Клетки анализировали с помощью FACS Calibur.
6.1.2.4 Клеточные культуры
[00487] Клетки NIH/3T3 (3T3) (фибробласты) получали через American Type Culture Collection (ATCC, Manassas, VA), и клетки A2780 представляют собой клеточную линию карциномы яичника человека (см. источник 28, как приведено в разделе 6.1.5, далее). Обе клеточные линии содержали в соответствии с опубликованными условиями. Стабильные MUC16-положительные клеточные линии создавали посредством трансфекции MUC16 экспрессирующих векторов (phrGFP-MUC16c344, phrGFP-MUC16c114, phrGFP-MUC16c80 и phrGFP-MUC16c86) и отбирали с использованием генетицина (G418, Invitrogen, Grand Island, NY) в соответствующей им среде для культивирования и выделяли на основании экспрессии зеленого флуоресцентного белка (GFP). MUC16c114 трансфектанты имеют на клеточной поверхности экспрессию белка MUC16 от предполагаемого сайта расщепления до карбоксиконца (аминокислоты с 1777 до 1890 из SEQ ID № 150) (см. источник 5, как приведено в разделе 6.1.5, далее). Клеточные линии с более длинными фрагментами MUC16 получали схожим образом, включая линии с экспрессией вектора MUC16c344-GFP, которые на клеточной поверхности имеют экспрессию белка MUC16 в виде фрагмента из 344 аминокислот, идущего до карбоксиконца MUC16 (аминокислоты с 1547 до 1890) (см. источник 5, как приведено в разделе 6.1.5, далее).
6.1.2.5 Трансфекция
[00488] Все конструкции вводили в клетки NIH/3T3 (3T3) и A2780 с использованием DOTAP (Roche Diagnostics, Indianapolis Corporation, IN), следуя протоколу производителя. Стабильные трансфектанты отбирали с использованием 400 мкг/мл G418 для клеток 3T3 и A2780 в соответствующих им средах для культивирования. Клетки сортировали два раза по экспрессии GFP в центр коллективного использования проточной цитометрии MSKCC (FCCF), и отобранные клетки выращивали в виде линий вплоть до 15 переносов. Обычный мониторинг посредством FACS анализа выполняли для того, чтобы подтверждать GFP-положительность этих линий. Белковые экстракты этих линий анализировали посредством вестерн-блоттинга с использованием моноклональных антител против hrGFP (Stratagene, La Jolla, CA) и против MUC16-карбоксиконца (см. источники 5 и 14, как приведено в разделе 6.1.5, далее).
6.1.2.6 Кривые роста
[00489] Одну тысячу стабильно трансфицированных клеток/лунка высевали в 200 мкл сред для культивирования/лунка в несколько 96-луночных плоскодонных планшетов и инкубировали при 37°C и 5% CO2 в течение 5 суток. Каждые сутки в трех повторениях культивируемые планшеты проявляли с использованием 25 мкл/лунка аламарового синего (ABD Serotec Co. UK) и инкубировали при 37°C и 5% CO2 в течение 4 часов. Планшеты считывали на флуоресцентном считывателе планшетов PerSeptive Biosystems CytoFluor Multiwell модель № 4000 с возбуждением на 530 нМ и испусканием на 620 нМ. Регистрировали кривые роста в течение 4 суток и, соответственно, строили график по средним значениям из планшетов в трех повторениях.
6.1.2.7 Анализ на мягком агаре
[00490] Стабильно трансфицированные клетки помещали в агарозную суспензию и высевали на тонкий слой агарозы и анализировали по их способности формировать безъякорные колонии. На чашку высевали от одного до пяти миллионов клеток в 10 мл суспензии среды-агарозы и инкубировали при 37°C и 5% CO2. Осуществляли мониторинг чашек на формирование колоний. Дополнительные среды для культивирования помещали сверху каждые 4-5 суток. После 11-14 суток культивирования колонии нумеровали и получали изображения колоний.
6.1.2.8 Трансфекция в эукариотических экспрессирующих векторах
[00491] Конструкции MUC16c57-114-pFUSE-hIgG1-Fc2 и117-244LGALS3-pFUSE-hIgG1-Fc2 отдельно трансфицировали в эмбриональные клетки почки человека (HEK) FreeStyle 293F (Invitrogen, CA), которые экспрессируют и секретируют слитые белки в бессывороточные среды. В три 10% SDS-PAGE геля вносили 5 мкг/дорожка супернатантов со слитными белками от временно трансфицированных клеток HEK 293F с контрольным пустым вектором pFUSE-hIgG1-Fc2, вектором MUC16c57-114-pFUSE-hIgG1-Fc2 и вектором LGALS3-pFUSE-hIgG1-Fc2. Один гель непосредственно окрашивали реактивом Gelcode, в соответствии с протоколом производителя. Белки из двух гелей переносили на две нитроцеллюлозные мембраны, которые блокировали фосфатно-солевым буфером с 5% обезжиренным молоком, который содержал 0,1% Tween-20 (PBST), в течение 1 часа при комнатной температуре на встряхивателе. Мембраны исследовали с использованием антитела против IgG1 человека-Fc-HRP (со специфичностью к γ1 цепи) (Southern Biotech Inc., CA) в разведении 1:5000 в PBST с 5% обезжиренным молоком; mAb 4H11-HRP в разведении 1:2000 (см. источник 14, как приведено в разделе 6.1.5, далее) в PBST с 5% обезжиренным молоком и mAb против GAL3 человека (Santa Cruz Biotechnology, CA) в разведении 1:200 в PBST с 5% обезжиренным молоком в течение ночи при 4°C на встряхивателе. GAL3-мембрану промывали три раза в PBST и метили вторым антителом против IgG мыши-HRP в разведении 1:3000 в PBST с 5% обезжиренным молоком в течение 1 часа при комнатной температуре на встряхивателе. Мембраны промывали три раза в PBST и затем их обрабатывали реактивом хемилюминесцентного субстрата ECL (Perkin Elmer, NY) в течение 5 минут, и излучаемые сигналы регистрировали на рентгеновских пленках.
6.1.2.9 Инвазия
[00492] Инвазию базальной мембраны определяли в камерах инвазии матригеля (BD Biosciences, Bedford, MA). Миграцию в матригеле измеряли в 48 часов в лунках в трех повторениях и сравнивали с контрольным вектором phrGFP и выражали в виде % phrGFP контрольной инвазии матригеля. Миграцию стабильных клеточных линий, обработанных 0,1 мкг/мл туникамицина (Sigma-Aldrich, St. Louis MO № по каталогу T7765) или слитным белком 5 мкг/мл MUC16c57-c114-pFUSE-hIgG1-Fc2 или 5 мкг/мл117-244LGALS3 pFUSE-hIgG1-Fc2, в матригеле после 48 часов измеряли и выражали в виде % phrGFP контрольной инвазии матригеля.
[00493] BD BioCoat™ Matrigel™ Invasion Inserts или Chambers (№ по каталогу 354480 в 24-луночном планшете) и Control Inserts (№ по каталогу 354578 в 24-луночном планшете) приобретали в BD Biosciences, MA. Анализ инвазии матригеля осуществляли в соответствии с протоколом производителя. В кратком изложении, матригелевые камеры в 24-луночных планшетах (хранили при -20°C) и контрольные вставки (хранили при 4°C) оставляли доходить до комнатной температуры. Обе вставки регидратировали в 0,5 мл бессывороточной среды во вставке, также как и во внешней лунке 24-луночного планшета, в течение 2 ч при 37°C 5% CO2 во влажном инкубаторе. Культивируемые клетки 3T3 или A2780 трипсинизировали и промывали средой для культивирования. Миллион клеток отделяли в другую пробирку для центрифуги и промывали 3 раза бессывороточной средой. Позже эти клетки корректировали, чтобы получить 10000 клеток в 0,5 мл бессывороточной среды. Среду в регидратированных вставках удаляли и вставку переносили в новый 24-луночный планшет, содержащий 0,75 мл среда для культивирования, содержащей 10% эмбриональной телячьей сыворотки (FBS), в лунке, которая служит в качестве хемоаттрактанта. Незамедлительно 0,5 мл клеток (10000 клеток) в бессывороточной среде добавляли во вставку. Надлежащее внимание уделяли, чтобы видеть, что воздушные пузырьки не застревали во вставке и внешней лунке. 24-луночный планшет инкубировали при 37°C 5% CO2 во влажном инкубаторе в течение 48 ч. После инкубации не проникающие клетки удаляли с верхней поверхности мембраны посредством «отскребания», вставляя тампон с хлопком на конце в матригель или контрольную вставку и аккуратно прикладывая давление, при этом перемещая кончик тампона по поверхности мембраны. Отскребание повторяли с использованием второго тампона, увлажненного в среде. Затем вставки окрашивали в новом 24-луночном планшете, содержащем 0,5 мл 0,5% красителя кристаллического фиолетового в дистиллированной воде в течение 30 минут. После окрашивания вставки споласкивали в 3 стаканах дистиллированной воды для того, чтобы удалять избыточный краситель. Вставки сушили на воздухе в новом 24-луночном планшете. Проникшие клетки считали вручную под инвертированным микроскопом при 200× увеличении. Несколько полей мембран в трех повторениях подсчитывали и регистрировали на фиг.
6.1.2.10 Полимеразная цепная реакция в реальном времени
[00494] Выделенную РНК получали, следуя протоколу RiboPure Kit (Ambion, Austin, TX). RT ПЦР для панели генов белков метастазов и внеклеточного матрикса осуществляли с использованием системы RT2 Profiler PCR Array (Super Array, Frederick, MD), как описано ранее (см. источник 29, как приведено в разделе 6.1.5, далее).
6.1.2.11 Опухолевый рост у бестимусных голых мышей
[00495] Трансфицированные клеточные линии и подходящие контрольные клеточные линии вводили в бок или перитонеальную полость бестимусных голых мышей и обычный уход за животными обеспечивали с помощью центра коллективного использования противоопухолевой оценки MSKCC. Для экспериментов по оценке опухолевого роста 2 миллиона клеток из каждой опухолевой линии имплантировали каждой из 5-15 бестимусных голых мышей. Измерения опухоли выполняли два раза в неделю и регистрировали опухолевый рост до максимального размера 1500 мм3 по руководствам MSKCC RARC.
6.1.2.12 Анализ вестерн-блоттинга
[00496] Стабильные клеточные линии культивировали в 10 см чашках в соответствующих им средах для культивирования и инкубировали при 37°C и 5% CO2 в течение 3 суток. Затем их промывали два раза в ледяном PBS и соскребали с использованием 1-2 мл ледяного PBS и центрифугировали. Осажденные клетки лизировали с использованием 0,2 мл модифицированного лизирующего буфера Ripa (20 мМ Tris-HCL, pH 7,4; 150 мМ NaCl; 1% NP-40; 1 мМ Na3VO4; 1 мМ PMSF; 1 мМ DTT; с коктейлями ингибиторов протеаз и фосфатаз (№ по каталогу 11836170001 в Roche Diagnostics, IN)) в течение 30 мин на льду и центрифугировали при 4°C в течение 10 мин. Концентрацию белка в супернатанте измеряли с использованием Bio-Rad Protein Assay (BioRaD Laboratories, Hercules, CA). Равные количества белка разделяли посредством электрофореза в SDS-полиакриламидном геле (SDS-PAGE) и переносили PVDF мембрану с использованием аппарата для переноса BioRad при 4°C. Мембраны блокировали с использованием 3% бычьего сывороточного альбумина (BSA) или 5% обезжиренного молока в PBS с 0,1% Tween-20 (PBST) при 4°C в течение ночи. Мембраны проявляли с использованием различных первичных антител (Cell Signaling, MA: Akt № по каталогу 9272; Phospho-Akt (Ser473)(193H12) № по каталогу 4058; p44/43 MAPK (Erk1/2) № по каталогу 9102; Phospho-p44/43 MAPK (Erk1/2)(Thr202/Tyr204) № по каталогу 9101); (Sigma-Aldrich, Inc., St. Louis, MO: β-Actin № по каталогу A5441); (Southern BioTech, Birmingham, AL: Anti-human-Fc-IgG1-HRP № по каталогу 9054-05 и Abgent, San Diego, CA: Polyclonal LGALS3 antibody № по каталогу AP11938b) при 4°C в течение ночи. Мембраны промывали три раза в PBST и проявляли с использованием HRP-конъюгированного антитела против мыши или против кролика (GE Healthcare, UK) (разведение 1:5000) в течение 1 часа при комнатной температуре. Затем мембраны промывали три раза в PBS-T и проявляли с использованием реактива Western Lightning Chemiluminescence (ECL, Perkin Elmer) в течение 1-5 минут при комнатной температуре, и сигналы проявляли на пленке HyBlot CL (Denville Scientific Inc. Metuchen, NJ).
6.1.2.13 Анализ экспрессии MUC16 в TCGA
[00497] Исчерпывающие геномные данные доступны для 316 образцов серозных рака яичников как часть проекта TCGA (tcga.cancer.gov). На генном уровне вызовы числа копий ДНК получали из CBS-сегментированных данных микрочипа Agilent 1M с использованием GISTIC. Экспрессию мРНК MUC16 измеряли с использованием трех различных платформ (Agilent 244K Whole Genome Expression Array, чипы Affymetrix HT-HG-U133A, and Affymetrix Exon 1.0), и значения экспрессии гена получали, как описано ранее (см. источник 30, как приведено в разделе 6.1.5, далее). Соматические мутации в MUC16 идентифицировали во всем экзоме, после чего следовало секвенирование следующего поколения (SOLiD или Illumina). Все данные TCGA загружали с cBio Cancer Genomics Portal (www.cbioportal.org). Затем значения экспрессии мРНК коррелировали с соответствующими категориями числа копий ДНК (гомозиготная делеция, гемизиготная делеция, диплоид, приобретение, амплификация на высоком уровне) и соматические мутации накладывали на все образцы и строили в виде коробчатой диаграммы с использованием статистической интергированной среды R (www.R-project.org), как описано ранее (см. источник 31, как приведено в разделе 6.1.5, далее). Клинические данные получали с портала данных TCGA (tcga-data.nci.nih.gov/tcga/).
6.1.2.14 MUC16c354 трансгенные мыши
[00498] Условную трансгенную конструкцию с карбоксиконцевыми 354 аминокислотами (MUC16c354) создавали, используя вектор phrGFP II-C (Stratagene, La Jolla, CA), и промотор CMV заменяли на промотор CAG из вектора pCAG-CreERT2 (Addgene, Cambridge, MA). Фрагмент MUC16c354 амплифицировали посредством ПЦР из конструкции B53, которую создавали Yin BW et al (см. источники 5 и 6, как приведено в разделе 6.1.5, далее). Условная конструкция MUC16c354 содержит следующие блоки: pCAG, 5' loxP, hrGFP, BGHpA, 3' loxP, MUC16c354, HA и SV40pA.
[00499] Используя приведенную выше условную трансгенную конструкцию MUC16c354, центр коллективного использования мышиной генетики MSKCC выполнял процедуру микроинъекции мышам B6CBAF1/J. Из 99 мышей идентифицировали двенадцать условных трансгенных MUC16c354 мышей посредством саузерн-блоттинга. Все 12 основателей скрещивали с мышами B6.FVB-Tg(EIIa-cre)C5379Lmgd/J (The Jackson Laboratory, Bar Harbor, MI) для того, чтобы удалять hrGFP, который располагался между двумя loxP. Рассекали MUC16c354 ПЦР положительных самок мышей для каждого основателя. Органы (головной мозг, ободочную кишку, сердце, почку, печень, легкое, яичник и селезенку) этих рассеченных мышей крошили и гомогенизировали. Образцы белков анализировали посредством вестерн-блоттинга для того, чтобы идентифицировать основателей с высокой экспрессией MUC16c354. Получаемых трансгенных мышей содержали на смешанном субстрате.
[00500] Двух основателей трансгенных MUC16c354 мышей скрещивали с p53 гетерозиготными мышами (B6.129S2- Trp53TM1Tyj/J) (The Jackson Laboratory, Bar Harbor, MI) для того, чтобы создавать двойных трансгенных MUC16c354:p53+/-. Получаемых трансгенных мышей содержали на смешанном субстрате. Генотипы всех мышей определяли посредством ПЦР с использованием экстрагированной ДНК пальца задней ноги или хвоста. Всех экспериментальных животных содержали в соответствии с руководствами, одобренными MSKCC Institutional Animal Care and Use Committee and Research Animal Resource Center, и NIH Guide for Care and Use of Laboratory Animals.
6.1.2.15 Гистологический анализ
[00501] Мышей в возрасте 12 месяцев умерщвляли и вскрывали. После макроскопического исследования, иссеченные образцы тканей фиксировали в течение 24 часов в 10% нейтральном буферном формалине, затем обрабатывали в спирте и ксилоле, заливали в парафин, делали срезы толщиной 5 мкм и окрашивали гематоксилином и эозином (ГЭ). Ткани исследовал ветеринарный патолог (SM), и неопластические и не неопластические повреждения диагностировали в соответствии с опубликованными руководствами по номенклатуре патологий грызунов.
6.1.2.16 Статистический анализ
[00502] Двусторонний парный критерий Стьюдента использовали для того, чтобы сравнивать группы для исследований роста in vitro, инвазии и потенциала роста на мягком агаре. Критерий хи-квадрат использовали для того, чтобы анализировать данные RT-ПЦР на значимость, в соответствии с предоставленным программным обеспечением (SuperArray). Сравнения объемов опухоли выполняли, используя оценку площади под кривой для всего объема опухоли с течением времени у каждого животного. Оценку объема опухоли выполняли на основании последних суток, в которые все животные были живы в обеих группах. Непараметрический критерий для рангов (критерий Вилкоксона на основе двойной выборки) использовали для того, чтобы тестировать различия в распределениях среди групп. В исследованиях выживаемости животных осуществляли анализ времени до наступления события, где событие определяли как время до превышения объема опухоли 1500 мм3 или образования язв. Животных с объемом опухоли меньше чем 1500 мм3 прослеживали вплоть до 60 суток и затем цензурировали. Способ Каплана-Мейера использовали для того, чтобы оценивать распределение выживаемости (см. источник 32, как приведено в разделе 6.1.5, далее).
6.1.3 РЕЗУЛЬТАТЫ
[00503] Полагают, что после очевидного отщепления и высвобождения области тандемных повторов белка MUC16, приблизительно 114 аминокислот карбоксиконца (c114) белка остаются на клеточной поверхности, и потенциальные функции этой части молекулы не известны. Анализировали роль этой самой проксимальной части белка MUC16 в злокачественной трансформации и поведении в клеточных линиях фибробластов 3T3 и раке яичников. Для того чтобы тестировать эффект элемента из остаточных c114 аминокислот, проксимального к сайту расщепления, конструировали два вектора: (1) вектор MUC16c114-GFP и (2) усеченный вектор MUC16c344-GFP (фиг. 1), и эти векторы и контрольный вектор phrGFP, независимо трансфицировали в клетки фибробластов 3T3. MUC16c114- и MUC16c344-экспрессирующие клеточные линии отбирали и содержали с использованием G418, и стабильную экспрессию MUC16c114 и MUC16c344 подтверждали посредством FACS анализа, используя моноклональные антитела, которые распознают уникальные аминокислотные последовательности карбоксиконца MUC16 (см. источник 14, как приведено в разделе 6.1.5, далее). Клеточные линии, которые экспрессируют 344 аминокислот из белка MUC16 (SEQ ID № 132) (линии MUC16c344-GFP), несут классический эпитоп CA125, который распознает антитело OC125 на клеточной поверхности при FACS анализе, и CA125 высвобождается в супернатант клеточной культуры. OC125 не распознает MUC16c114-GFP клетки. Однако все трансфицированные линии имели клеточные поверхности, положительные по внеклеточным последовательностям MUC16c114 (SEQ ID № 133), проксимальным к предполагаемому сайту расщепления, и их распознавало антитело 4H11, специфичное к эктодомену MUC16 (см. источник 14, как приведено в разделе 6.1.5, далее; фиг. 1).
6.1.3.1 Клетки 3T3
[00504] Чтобы исследовать трансформирующие свойства, которые придают остаточные элементы MUC16 после расщепления, анализировали характеристики клеточных линий 3T3 MUC16c114-GFP и 3T3 MUC16c344-GFP и эффекты этих двух минимальных элементов MUC16 сравнивали с векторными контролями. Экспрессия или самых проксимальных 114 аминокислот (MUC16c114) или проксимальных 344 аминокислот (MUC16c344) последовательности MUC16 не оказывала достоверного эффекта на скорости роста in vitro для какой-либо из трансфицированных клеточных линий по сравнению с таковой у родительской линии фиг. 2A. Однако экспрессия тех же элементов белка MUC16 по существу изменяла якорный рост 3T3 при клонировании на мягком агаре. Как минимальный c114 фрагмент, так и c344 фрагмент значительно увеличивали число колоний на мягком агаре по сравнению с контролями только с вектором (фиг. 3A). Проксимальные части экспрессии белка MUC16 также усиливали миграцию (p<0,0001) MUC16+ клеток 3T3 в классическом анализе инвазии матригеля по сравнению с клетками 3T3, трансфицированными контрольными векторами phrGFP (фиг. 3B). Когда клетки 3T3, экспрессирующие различные фрагменты белка MUC16, исследовали на экспрессию выбранных транскриптов генов метастазов и инвазии, имела место повышающая регуляция нескольких генов инвазии, включая хемокиновый лиганд 12 (CXCL12), кадгерин 11 (CDH11) и матриксные металлопротеиназы MMP2 и MMP9 (фиг. 3C). Другие транскрипты, включая фибронектин (FN1) и нейрофибромин (NF2), постоянно снижены. MUC16 может действовать через канонические пути передачи сигнала сходно с эффектами MUC1 и MUC4, поскольку MUC16 изменяет опухолевый рост in vivo и увеличивает инвазивные свойства клеток, несущих белок MUC16. Взаимодействующие пути ERK и AKT ранее идентифицированы в качестве важных сигнальных механизмов в раке яичников и регуляторов инвазии опухолевых клеток (см. источники 21 и 22, как приведено в разделе 6.1.5, далее). Как показано на фиг. 3D, имела место активация обоих путей, о чем свидетельствовало увеличение в pAKT(S473) и pERK (T202/Y204).
[00505] Наиболее однозначным признаком онкогенной трансформации является способность ускорять рост у иммунодефицитных мышей. Для того чтобы измерять эффекты MUC16, оказываемые на скорость роста опухоли, модель опухоли в боку использовали для того, чтобы облегчать регулярные измерения опухоли. Как показано на фиг. 3E, когда MUC16 экспрессирующие клеточные линии 3T3 (вектор phrGFP, MUC16c114-GFP и MUC16c344-GFP) имплантировали в бока бестимусных голых мышей, как MUC16c114-GFP, так и MUC16c344-GFP формировали более крупные опухоли по сравнению с контролями только с вектором через 4 недели. Отсутствовали статистические различия между клеточной линией, экспрессирующей белки MUC16c114-GFP и MUC16c344-GFP (фиг. 3E), что подсказывает, что онкогенные эффекты экспрессии MUC16 связаны с самыми проксимальными частями молекулы. Это увеличение скорости роста опухоли наблюдали на всем протяжении периода опухолевого роста, и оно находится в соответствии с клинической связью между высокими уровнями экспрессии MUC16 (в виде сывороточного CA125) и низкой выживаемостью (см. источник 18, как приведено в разделе 6.1.5, далее).
6.1.3.2 Клетки рака яичника человека A2780
[00506] Хотя экспрессия белка MUC16 в клетках 3T3 четко связана с признаками трансформации, некоторые полностью трансформированные клеточные линии раке яичников не имеют экспрессии MUC16 при культивировании. Для того чтобы исследовать вклад MUC16 в поведение клеток рака яичника человека, клетки A2780 (клеточная линия карциномы яичника человека, которая не экспрессирует MUC16) трансфицировали MUC16c114-GFP или MUC16c344-GFP. MUC16-экспрессирующие клетки отбирали с помощью G418 и подвергали FACS по экспрессии MUC16 и GFP. Поскольку эти клетки хорошо растут в мягком агаре в отсутствие экспрессии MUC16, анализировали эффект MUC16c344 и MUC16c114, оказываемый на инвазию матригеля. Как показано на фиг. 4A, экспрессия MUC16c114 и MUC16c344 в клетках A2780 четко способствовала инвазии матригеля. Аналогичным образом, эффект MUC16c114 и MUC16c344, оказываемый на активацию путей ERK и AKT, схож с таковым, наблюдаемым в клетках 3T3, увеличивая базовые уровни как pAKT(S473), так и pERK (T202/Y204) (фиг. 4B). Таким образом, даже в озлокачествленных клеточных линиях яичника повышенная экспрессия карбоксиконцевых элементов MUC16 связана с повышенной инвазией и активацией онкогена. Кроме того, анализировали опухолевый рост MUC16c114- и MUC16c344-трансфицированных линий A2780 in vivo (фиг. 4C). В обеих ситуациях MUC16c114 клеточная линия и MUC16c344 клеточная линия росла более быстро, чем контроли только с вектором. В этой модели раке человека векторные контроли не растут с достаточной скоростью, чтобы в конечном итоге убивать животных.
6.1.3.3 Исследования гликозилирования
[00507] Для того чтобы определять конкретную часть MUC16c114, отвечающую за трансформацию, конструировали два дополнительных фрагмента MUC16: (1) MUC16c80, в котором удаляли 34-аминокислотную последовательность из эктодомена MUC16c114 (от положения 1798 до 1831, как пронумеровано в исходной публикации) (фиг. 1D; SEQ ID № 135) (см. источник 5, как приведено в разделе 6.1.5, далее); и (2) MUC16c86, в которой конструкция MUC16c114 сохраняла весь эктодомен MUC16, но не содержала 28-аминокислотную последовательность из предполагаемого домена эзрина цитоплазматического домена, потенциальные участки фосфорилирования тирозина и SH2 домен (от положения 1857 до 1884) (фиг. 1D; SEQ ID № 134). Эти конструкции вводили в клетки 3T3 и отбирали с помощью FACS по экспрессии на клеточной поверхности остающихся последовательностей MUC16c80 и MUCc86. Эти две дополнительные популяции клеток затем исследовали на MUC16c80- и MUCc86-зависимые изменения. Конструкция MUC16c86 (конструкция с интактным эктодоменом) сохраняла значительно более высокую способность к формированию колоний на мягком агаре, чем конструкция MUC16c80 (конструкция с интактным цитоплазматическим доменом (фиг. 5A)). Также это справедливо для способности к инвазии матригеля (фиг. 5B). MUC16c80 экспрессирующие клетки 3T3 имели скорость инвазии, которая не была статистически отлична от той, что у контрольного вектора phrGFP. В отличие от этого, MUC16c86 экспрессирующие клетки 3T3 сохраняли более инвазивный фенотип, схожий с интактными MUC16c114 и MUC16c344 клетками. Когда исследовали активацию путей AKT и ERK, результаты были в соответствии с исследованием колоний на мягком агаре и инвазии матригеля (фиг. 5C). Экспрессия MUC16c80 фрагмента (без полного интактного эктодомена) не активирует ERK и AKT и схожа с контрольным вектором phrGFP, в отличие от этого MUC16c86 (с интактным эктодоменом) экспрессирующие клетки 3T3 схожи с экспрессирующими полный MUC16c114 клетками 3T3 в активации ERK и AKT. Наконец, значимость интактного эктодомена подтверждали в моделях ксенотрансплантированной опухоли.
[00508] Утрата интактного эктодомена MUC16 (3T3 MUC16c80) вела к утрате MUC16c114-зависимого усиления роста 3T3 по сравнению с MUC16c114 контролем, тогда как MUC16c86-экспрессирующие клетки 3T3 имели умеренную задержку роста, но имели общий эффект, схожий с MUC16c114 экспрессирующими клетками 3T3 (фиг. 5D). Таким образом, внеклеточная часть MUC16c114 фрагмента отвечала за трансформирующие эффекты MUC16 в клетках 3T3. Чтобы дополнительно исследовать роль внеклеточного фрагмента MUC16c114, осуществляли исследования копреципитации с MUC16c114-экспрессирующими клетками 3T3, используя панель MUC16-нацеленных антител (см. источник 14, как приведено в разделе 6.1.5, далее). Не идентифицировали отдельных полос копреципитации с помощью окрашивания серебром, и специфический вестерн-блоттинг для EGFR, интегринов и HER3 был отрицательным. Однако анализ последовательности MUC16c114 подсказывал, что три потенциальных участка N-гликозилирования (Asn1777, Asn1800 и Asn1806 (фиг. 6, SEQ ID № 132 и SEQ ID № 133)) в эктодомене могли играть роль. Анализировали роль этих участков N-гликозилирования. Используя сайт-специфические точечные мутации, все три аспарагина заменяли на аланины. Эту модифицированную MUC16c114 конструкцию, обозначенную MUC16c114-N123, вводили в клетки 3T3, и MUC16c114-N123-экспрессирующие клетки выделяли посредством FACS и антител 4H11 к эктодомену. Как показано на фиг. 7A, эти мутации аспарагина в аланин полностью устраняли MUC16c114-индуцированное усиление инвазии матригеля, которое наблюдали с использованием экспрессирующего родительский MUC16c114 вектора в клетках 3T3. Для того чтобы подтверждать роль N-гликозилирования, клетки 3T3 обрабатывали ингибитором гликозилирования туникамицином (0,1 мкг/мл) и отмечали значимое снижение инвазии матригеля. Два синтетических белковых ингибитора также тестировали для того, чтобы дополнительно исследовать роль внеклеточной последовательности MUC16c114. Внешнюю последовательность MUC16 (от положения 1777 до 1834, как пронумеровано в источнике 5, как приведено в разделе 6.1.5, далее) прикрепляли к pFUSE с Fc остовом человек (MUC16c57-c114 pFUSE), чтобы предоставить «имитирующий» рецептор. Эту конструкцию сравнивали как с MUC16c114 инвазией, так и с контролем вектором pFUSE. Как показано на фиг. 7B, конструкция «имитирующего» рецептора уменьшала общий эффект MUC16c114 экспрессирующего вектора, оказываемый на инвазию матригеля (фиг. 7). Исходя из того, что лектины связаны с эффектом гликозилированного белка MUC16c114, конструировали второй ингибитор из сахарсвязывающего домена LGALS3 (аминокислоты с 117 до 244; фиг. 7 и фиг. 8) (см. источник 23, как приведено в разделе 6.1.5, далее), прикрепленный к тому же остову pFUSE (117-244LGALS3pFUSE). Подобно туникамицину, оба этих белковых ингибитора мешали взаимодействию MUC16c114 с другими белками клеточной поверхности, тогда как отдельно вектор pFUSE не оказывал эффекта (фиг. 7B). Как и в случае с другими вмешательствами, эффект, оказываемый на экспрессию pAKT и pERK, уменьшался параллельно с утратой инвазии матригеля, когда удаляли участки N-гликозилирования, как показано на фиг. 7C. Однако конструкция MUC16c114-N123 имела высокие уровни экспрессии белка MUC16c114-N123, как продемонстрировано с помощью связывания 4H11 (со специфичностью к эктодомену MUC16). Влияние утраты N-гликозилирования аналогичным образом подтверждали при снижении роста в трансфицированных клетках 3T3 у nu/nu мышей, как показано на фиг. 7D.
6.1.3.4 Трансгенные мыши
[00509] Исследовали эффект экспрессии карбоксиконцевых элементов MUC16 у трансгенных мышей и скорость формирования самопроизвольных опухолей. Создавали условных трансгенных мышей, экспрессирующих MUC16c354 (полная последовательность c114 и наиболее проксимальный тандемный повтор, несущий CA125). Ранний энхансер CMV плюс промотор β-актина курицы (CAG) использовали для усиления существенной экспрессии MUC16c354 во всех тканях мышей. Эту стратегию выбирали, поскольку физиология яичника человека сильно отличается от репродуктивной системы мышей, и слабые тканеспецифические промоторы яичников относительно сложно использовать в трансгенных системах. Стратегия для этих мышей представлена на фиг. 9A.
[00510] Условных трансгенных животных отбирали с помощью саузерн-блоттинга, как показано на фиг. 9B, и скрещивали с мышами EIIa-Cre для того, чтобы получать MUC16c354 трансгенных основателей. Как показано на фиг. 9C, отбирали два основателя и создавали колонию MUC16c354 трансгенных мышей. Два основателя сильно экспрессируют MUC16c354 во многих органах, например, головном мозге, ободочной кишке, сердце, почке, печени, легком, яичнике и селезенке. Эти мыши не имели эффекта повсеместной эктопической экспрессии MUC16c354, при нормальных соотношениях самцы:самки в потомстве, нормальных уровнях фертильности и, по-видимому, нормальном времени жизни, превышающем 2 года. Вскрытие двух практически здоровых животных (одного самца и одной самки) из контрольной популяции и MUC16c354 трансгенных мышей с 3-месячными интервалами вплоть до 1 года примечательно только слабой/умеренной гиперплазией эндометрия матки у более старых самок мышей, но заболеваемость и тяжесть значительно не отличались от таковых у контролей дикого типа. Выбранные ткани представлены на фиг. 10. Только одну самопроизвольную опухоль мягких тканей (саркому) наблюдали в колонии из больше чем 100 животных, которых наблюдали в течение 2 лет или больше.
[00511] На основании этого результата предложена гипотеза о том, что потенциально необходим «второй удар». Примечательно, что мышиные модели с мутацией BRCA1 также требуют второго удара, и утрата p53 значительно повышает частоту опухолей. MUC16c354 мышей скрещивали с p53+/- мышами из The Jackson Laboratory. Имел место ограниченный ранний эффект. Однако после приблизительно 6 месяцев MUC16c354 мыши с p53+/- начинали развивать самопроизвольные саркоматозные опухоли мягких тканей и лимфому с частотой, превышающей таковую у нормальных контрольных животных. Выбранные опухоли представлены на врезках на фиг. 9D. Выживаемость Каплана-Мейера для этих мышей представлена на фиг. 9E. MUC16c354:p53+/- мыши демонстрировали значительно более низкую общую выживаемость из-за самопроизвольного развития опухолей (p<0,014). Общее число опухолей, которые наблюдали в каждой группе, составляет: p53 +/- мыши, 20/107 мышей; MUC16c354 и p53 +/- мыши, 34/91 мышей; MUC16c354 мыши, 1/72 мышей; мыши дикого типа, 0/91 мышей. Когда 8 собранных опухолей исследовали в геномном секвенировании p53, все самопроизвольные опухоли имели утрату нормального аллеля p53, что указывает на то, что MUC16 зависимое развитие опухоли также требует утраты функции нормального p53.
6.1.3.5 TCGA для яичников
[00512] На основании фрагментов MUC16 на трансформацию и агрессивности опухолей в экспериментальных моделях исследовали связь между генетическими изменениями в MUC16 и исходами при злокачественных опухолях яичников. Проект по злокачественным опухолям яичников TCGA представляет собой хорошо изученную коллекцию, которая содержит 316 серозных рака яичников с полными данными, включая данные о клиническом исходе. Поскольку экспрессия белка MUC16 является важным драйвером поконтроля раке, анализировали влияние числа копий MUC16 на экспрессию мРНК MUC16. Экспрессия транскрипта MUC16 в целом связана с числом копий гена MUC16, несмотря на то, что имели место широкие вариации в экспрессии транскрипта MUC16 во всех исследованных группах (конечно, за исключением редких гомозиготных делеций MUC16). В большинстве случаев, экспрессия мРНК MUC16 кластеризованы у более высоких чисел транскриптов, чем нормальные образцы фаллопиевых труб, включенные в качестве контролей. Число копий гена представляет собой одну из нескольких переменных, которые потенциально изменяют экспрессию белка MUC16, но ясно, что экспрессия мРНК MUC16 (и белка MUC16, конечно) часто увеличена в серозной раке яичников. Также исследовали комбинированное влияние сверхэкспрессии или мутации MUC16 на клинические исходы в наборе данных TCGA. Когда набор данных TCGA делят на квинтили по экспрессии MUC16, 20% пациентов с наивысшей экспрессией MUC16 имели значительно более низкую выживаемость, чем пациенты с более низкой экспрессией MUC16 (p=0,02969). Эта зависимость дополнительно усиливалась, когда 18 пациентов с мутациями MUC16 включали в группу высокой экспрессии MUC16 (p=0,02117), как показано на фиг. 11A. В совокупности, этот анализ демонстрирует, что экспрессия MUC16 оказывает нежелательное влияние на выживаемость пациентов со злокачественной опухолью яичников и подтверждает негативные биологические эффекты экспрессии MUC16, идентифицированные в доклинических моделях авторов изобретения.
[00513] Злокачественные опухоли яичников часто демонстрируют активацию пути PI3K. Эта активация происходит в первую очередь через амплификацию и сверхэкспрессию вместо событий точечных мутаций, поскольку рак яичников в целом характеризуется изменениями числа копий. На основании активации пути PI3K/AKT в моделях авторов изобретения на клеточных линиях, исследовали зависимость между MUC16 и другими активирующими генетическими изменениями в пути PI3K. Как показано на фиг. 11B, сверхэкспрессия и мутационные события, связанные с MUC16, в целом комплементарны с событиями в другом пути, такими как утрата PTEN, амплификация AKT1, AKT2 или PI3KCA. Механизм это MUC16-движимой активации AKT остается неизвестен. Кроме того, исследовали роль активации ERK, но не идентифицировали связь между экспрессией MUC16 и мутациями ERK пути.
6.1.4 ОБСУЖДЕНИЕ
[00514] MUC16, кодирующий антиген CA125, циркулирует в плазме многих пациентов со злокачественной опухолью яичников (см. источник 1, как приведено в разделе 6.1.5, далее). MUC16 является уникальным среди связанных муцинов благодаря его ограниченной экспрессии за пределами мюллеровых тканей (см. источники 2 и 14, как приведено в разделе 6.1.5, далее). Хотя все более рассматривают в качестве нежелательного прогностического фактора, независимого от массы опухоли, биологический механизм его негативного влияния не вполне понятен (см. источник 18, как приведено в разделе 6.1.5, далее). NH2-часть молекулы содержит несколько тандемных повторов, которые кодируют антиген CA125, и, по-видимому, служит в качестве важных партнеров адгезии к мезотелину и некоторым галектинам (фиг. 1A) (см. источники 5, 17, и 24-26, как приведено в разделе 6.1.5, далее). Хотя предполагают, что эти адгезионные функции критичны для MUC16-связанного неблагоприятного исхода, эти исследования не объясняют все наблюдаемые изменения в поведении клеток раке яичника. Клонирование гликопротеина MUC16 предоставило базовую структурную информацию о продукте гена MUC16 (см. источники 4 и 5, как приведено в разделе 6.1.5, далее). Данные, представленные в этом примере, являются первыми данными, показывающими, что MUC16 может опосредовать передачу сигналов от среды в клетку раке, в частности, данные, представленные в этом примере, идентифицируют гликозилированный эктодомен MUC16 как критичный для MUC16 изменений в поведении клетки раке.
[00515] Этот пример демонстрирует, что 114 аминокислот с карбоксиконца MUC16 достаточно для того, чтобы трансформировать клетки NIH/3T3 (3T3), поддерживая как увеличенный рост на мягком агаре, так и увеличенную способность к инвазии матригеля. Хотя другие идентифицировали большинство мембранной проксимальной C-концевой части MUC16 в качестве критических элементов в MUC16-индуцированном поведении, авторы изобретения связывают это поведение с участками N-гликозилирования в сохраненном эктодомене MUC16. Эти изменения связанны с измененным профилем экспрессии генов и увеличенной экспрессией критических генов инвазии, таких как MMP2, MMP9, CXCL12 и CDH11. Хотя более длинные элементы могут индуцировать более опасное поведение, даже остаточные 114 аминокислот, проксимальные к предполагаемому сайту расщепления, являются достаточными, чтобы в клетках 3T3 индуцировать те же изменения экспрессии генов инвазии. Кроме того, гликозилирование Asn30 в MUC16c114 (соответствующего Asn1806 зрелого MUC16 (SEQ ID № 150) необходимо для онкогенных свойств MUC16c114. Без ограничения какой-либо конкретной теорией, эти находки более всего согласуются с сигнальной трансдукцией «снаружи-внутрь» посредством самых проксимальных частей белка, включая остаточный внеклеточный домен, наряду с трансмембранным доменом и цитоплазматическим хвостом. В отличие от результатов Theriault (Therialt et al. Gynecol Oncol 2011, 121(3):434-443) и Giannakouros (Giannakouros et al. Int. J. Oncol. 2015, 41(1):91-98), утрата внутриклеточного цитоплазматического домена оказала меньше влияние, чем утрата гликозилированного эктодомена. Эти различия могут отражать конкретные выбранные мутации и способ снижения экспрессии. Похоже, сигнал «изнутри-наружу» активирует транскрипцию генетической программы, которая содействует имплантации и росту MUC16 экспрессирующих клеток в мягком агаре и у голых мышей. Когда трансфицированные клетки исследовали на предмет активации обыкновенных онкогенных путей, оба пути AKT и ERK выглядели активированными конститутивной экспрессией MUC16. Механизм, посредством которого MUC16 повышает фосфорилирование AKT/ERK, не ясен и требует дополнительных исследований. Отсутствие копреципитирующих рецепторов подсказывает, что также могут быть вовлечены другие механизмы. Несмотря на то, что последовательности MUC16 очень различны, показано, что другие связанные муцины, включая как MUC1, так и MUC4, действуют в качестве онкогенов, генерирующих сигналы, в клетках 3T3 и фибробластах крысы (см. источники 8 и 9, как приведено в разделе 6.1.5, далее). Вероятно, что муцины на клеточных поверхностях рака играют важные роли через механизмы, которые все еще устанавливают.
[00516] На основании находок в клетках 3T3, результаты эксперимента с MUC16 трансгенными мышами являются очень подходящими. Сама по себе, та же MUC16 проксимальная 354 последовательность может быть легко экспрессирована почти во всех мышиных тканях без нежелательного эффекта у трансгенной мыши. Скорость формирования самопроизвольных опухолей очень низка у этих мышей, а репродуктивная функция выглядит незатронутой. Однако подобно другим моделям рака яичников мышей, утрата функции p53, похоже, играет сильную разрешительную роль при MUC16-зависимом формировании опухоли (см. источник 27, как приведено в разделе 6.1.5, далее). Эти результаты определенно соответствуют равномерной инактивации p53, которая характеризует рак яичников в наборе данных TCGA.
[00517] Эти находки описывают MUC16-связанные изменения в клеточном поведении и транскрипции генов. Модели in vitro и in vivo находятся в соответствии с нежелательными эффектами уровней экспрессии MUC16 в серозной раке яичников и помогают пониманию MUC16 в качестве патогенного фактора, вносящего вклад в поведение раке яичников. Нежелательное влияние возрастающей экспрессии CA125 находится в соответствии с увеличенным опухолевым ростом in vivo и летальностью MUC16 (+) 3T3 трансфектантов (см. источник 18, как приведено в разделе 6.1.5, далее).
6.1.5 ИСТОЧНИКИ, ЦИТИРУЕМЫЕ В ПРИМЕРЕ 1
[00518] 1. Bast RC Jr, Klug TL, St John E, Jenison E, Niloff JM, et al. (1983) A radioimmunoassay using a monoclonal antibody to monitor the course of epithelial ovarian cancer. N Engl J Med 309: 883-887.
[00519] 2. Kabawat SE, Bast RC Jr, Bhan AK, Welch WR, Knapp RC, et al. (1983) Tissue distribution of a coelomic-epithelium-related antigen recognized by the monoclonal antibody OC125. Int J Gynecol Pathol 2: 275-285.
[00520] 3. Bast RC Jr, Badgwell D, Lu Z, Marquez R, Rosen D, et al. (2005) New tumor markers: CA125 and beyond. Int J Gynecol Cancer 15 Suppl 3: 274-281.
[00521] 4. O'Brien TJ, Beard JB, Underwood LJ, Dennis RA, Santin AD, et al. (2001) The CA 125 gene: an extracellular superstructure dominated by repeat sequences. Tumour Biol 22: 348-366.
[00522] 5. Yin BW, Lloyd KO (2001) Molecular cloning of the CA125 ovarian cancer antigen: identification as a new mucin, MUC16. J Biol Chem 276: 27371-27375.
[00523] 6. Yin BW, Dnistrian A, Lloyd KO (2002) Ovarian cancer antigen CA125 is encoded by the MUC16 mucin gene. Int J Cancer 98: 737-740.
[00524] 7. Hollingsworth MA, Swanson BJ (2004) Mucins in cancer: protection and control of the cell surface. Nat Rev Cancer 4: 45-60.
[00525] 8. Li Y, Liu D, Chen D, Kharbanda S, Kufe D (2003) Human DF3/MUC1 carcinoma-associated protein functions as an oncogene. Oncogene 22: 6107-6110.
[00526] 9. Bafna S, Singh AP, Moniaux N, Eudy JD, Meza JL, et al. (2008) MUC4, a multifunctional transmembrane glycoprotein, induces oncogenic transformation of NIH3T3 mouse fibroblast cells. Cancer Res 68: 9231-9238.
[00527] 10. Huang L, Chen D, Liu D, Yin L, Kharbanda S, et al. (2005) MUC1 oncoprotein blocks glycogen synthase kinase 3beta-mediated phosphorylation and degradation of beta-catenin. Cancer Res 65: 10413-10422.
[00528] 11. Li Q, Ren J, Kufe D (2004) Interaction of human MUC1 and beta-catenin is regulated by Lck and ZAP-70 in activated Jurkat T cells. Biochem Biophys Res Commun 315: 471-476.
[00529] 12. Duraisamy S, Ramasamy S, Kharbanda S, Kufe D (2006) Distinct evolution of the human carcinoma-associated transmembrane mucins, MUC1, MUC4 AND MUC16. Gene 373: 28-34.
[00530] 13. Ramsauer VP, Carraway CA, Salas PJ, Carraway KL (2003) Muc4/sialomucin complex, the intramembrane ErbB2 ligand, translocates ErbB2 to the apical surface in polarized epithelial cells. J Biol Chem 278: 30142-30147.
[00531] 14. Dharma Rao T, Park KJ, Smith-Jones P, Iasonos A, Linkov I, et al. (2010) Novel Monoclonal Antibodies Against the Proximal (Carboxy-Terminal) Portions of MUC16. Appl Immunohistochem Mol Morphol 18: 462-72.
[00532] 15. Corrales RM, Galarreta D, Herreras JM, Saez V, Arranz I, et al. (2009) Conjunctival mucin mRNA expression in contact lens wear. Optom Vis Sci 86: 1051-1058.
[00533] 16. Govindarajan B, Gipson IK (2010) Membrane-tethered mucins have multiple functions on the ocular surface. Exp Eye Res 90: 655-663.
[00534] 17. Kaneko O, Gong L, Zhang J, Hansen JK, Hassan R, et al. (2009) A binding domain on mesothelin for CA125/MUC16. J Biol Chem 284: 3739-3749.
[00535] 18. Zorn KK, Tian C, McGuire WP, Hoskins WJ, Markman M, et al. (2009) The prognostic value of pretreatment CA 125 in patients with advanced ovarian carcinoma: a Gynecologic Oncology Group study. Cancer 115: 1028-1035.
[00536] 19. The Cancer Genome Atlas. Available from: http://cancergenome.nih.gov/.
[00537] 20. Cheon DJ, Wang Y, Deng JM, Lu Z, Xiao L, et al. (2009) CA125/MUC16 is dispensable for mouse development and reproduction. PLoS One 4: e4675.
[00538] 21. Mazzoletti M, Broggini M (2010) PI3K/AKT/mTOR Inhibitors In Ovarian Cancer. Curr Med Chem 17: 4433-4447.
[00539] 22. Ventura AP, Radhakrishnan S, Green A, Rajaram SK, Allen AN, et al. (2010) Activation of the MEK-S6 pathway in high-grade ovarian cancers. Appl Immunohistochem Mol Morphol 18: 499-508.
[00540] 23. Strausberg RL, Feingold EA, Grouse LH, Derge JG, Klausner RD, et al. (2002) Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences. Proc Natl Acad Sci USA 99: 16899-16903.
[00541] 24. Seelenmeyer C, Wegehingel S, Lechner J, Nickel W (2003) The cancer antigen CA125 represents a novel counter receptor for galectin-1. J Cell Sci. 116(Pt 7): 1305-1318.
[00542] 25. Lloyd KO, Yin BW (2001) Synthesis and secretion of the ovarian cancer antigen CA 125 by the human cancer cell line NIH:OVCAR-3. Tumour Biol 22: 77-82.
[00543] 26. Liu J, Yang G, Thompson-Lanza JA, Glassman A, Hayes K, et al. (2004) A genetically defined model for human ovarian cancer. Cancer Res 64: 1655-1663.
[00544] 27. Xing D, Orsulic S (2006) A mouse model for the molecular characterization of brca1-associated ovarian carcinoma. Cancer Res 66: 8949-8953.
[00545] 28. Rao TD, Rosales N, Spriggs DR (2011) Dual-fluorescence isogenic high-content screening for MUC16/CA125 selective agents. Mol Cancer Ther 10: 1939-1948.
[00546] 29. Shinoda Y, Ogata N, Higashikawa A, Manabe I, Shindo T, et al. (2008) Kruppel-like factor 5 causes cartilage degradation through transactivation of matrix metalloproteinase 9. J Biol Chem 283: 24682-24689.
[00547] 30. TCGA (2008) Comprehensive genomic characterization defines human glioblastoma genes and core pathways. Nature 455: 1061-1068.
[00548] 31. Taylor BS, Schultz N, Hieronymus H, Gopalan A, Xiao Y, et al. (2010) Integrative genomic profiling of human prostate cancer. Cancer Cell 18: 11-22.
[00549] 32. Heller G, Vendatraman E (1996) Resampling procedures to compare two survival distributions in the presence of right censored data. Biometrics 52: 1204-1213.
6.2 ПРИМЕР 2: АНТИТЕЛА К ГЛИКОЗИЛИРОВАННОМУ MUC16
6.2.1 ВВЕДЕНИЕ
[00550] Антиген CA125, распознаваемый антителом OC125 (см. источник 1, как приведено в разделе 6.2.5, далее), представляет собой сильно гликозилированный антиген, экспрессируемый в доменах тандемных повторов во внеклеточной части гликопротеина MUC16 (см. источники 2 и 3, как приведено в разделе 6.2.5, далее). Этот циркулирующий антиген преимущественно извлекают из доброкачественных или злокачественных мюллеровых тканей, и он одобрен FDA в качестве опухолевого маркера для раке яичников человека, но его функция и роль в канцерогенезе не известны (см. источники 4-6, как приведено в разделе 6.2.5, далее). MUC16 относится к семейству сложных связанных муцинов и состоит из большого сильно гликозилированного внеклеточного домена, небольшого эктодомена между мембраной и предполагаемым сайтом расщепления, гидрофобной трансмембранной области и короткого внутриклеточного хвоста (фиг. 1) (см. источники 7 и 8, как приведено в разделе 6.2.5, далее). Основная часть белка MUC16 высвобождается в окружающее пространство после отщепления, а эктодомен остается на клеточной поверхности. OC125 и большинство других MUC16-реактивных моноклональных антител (mAb) реагируют с антигенами в области тандемных повторов, присутствующих исключительно в отщепляемой части молекулы. Поскольку эти эпитопы вероятно встречаются в циркуляции, существующие mAb нельзя использовать для отслеживания судьбы остального фрагмента белка MUC16, и они могут не точно отражать истинное распределение экспрессии MUC16 (см. источник 9, как приведено в разделе 6.2.5, далее). Другие показали, что гликозилированные поверхностные белки могут регулировать клеточную пролиферацию и дифференцировку через основанные на галектине-3 взаимодействия с участками N-гликозилирования тирозинкиназных рецепторов, например, EGFR, PDGFR и другие (KS Lau Cell 129:123, 2007). Как продемонстрировано в примере 1 (см. раздел 6.1), проксимальные части MUC16 (всего лишь в 114 аминокислот) могут трансформировать иммортализованные клетки 3T3, и этот эффект, по-видимому, устраняется туникамицином.
[00551] Этот пример демонстрирует точные участки гликозилирования, которые опосредуют эти эффекты и обязательную роль галектина 3 в MUC16-зависимой трансформации. Таким образом, разрабатывали антитела, способные связываться с проксимальной пептидной последовательностью (например, MUC16c114) специфично к гликозилированию, чтобы ингибировать ключевые MUC16-опосредованные злокачественные функции, такие как адгезия и инвазия. Моноклональные антитела, направленные на ключевой участок N-гликозилирования в эктодомене MUC16 создавали с использованием определенных синтетических N-гликопептидных антигенов в качестве ключевых имитаторов эпитопов. Эти антитела ингибировали онкогенную биологию MUC16 посредством снижения MUC16-движимой инвазии матригеля, активации онкогена и опухолевого роста, в отличие от других mAb, направленных на не гликозилированный белок, которые не оказывали эффекта. Эти антитела демонстрировали механизм муциновой трансформации и предоставляют эффективный инструмент для диагностического и терапевтического использования в MUC16-положительных опухолях.
6.2.2 МАТЕРИАЛЫ И СПОСОБЫ
6.2.2.1 СИНТЕЗ ГЛИКОПЕПТИДОВ
[00552] Антитела со специфичностью к третьему участку гликозилирования (Asn30, аналогичен Asn1806 в MUC16) 55-аминокислотной последовательности MUC16 (MUC16c55: NFSPLARRVDRVAIYEEFLRMTRNGTQLQNFTLDRSSVLVDGYSPNRNEPLTGNS (SEQ ID № 129) создавали с использованием синтетических гликопептидов в качестве ключевых имитаторов эпитопов, содержащих четко определенную хитобиозу (GlcNAc2) на Asn30 в MUC16c55 (SEQ ID № 129, фиг. 13). Синтез гомогенного N-гликопептида был очень конвергентным и включал образование связи между частично защищенным полноразмерным пептидом (MUC16c55; SEQ ID № 129) и амином хитобиозы в условиях аспартилирования Лансбери (см. источник 11, как приведено в разделе 6.2.5, далее). MUC16c55 (SEQ ID № 129) получали посредством микроволнового Fmoc твердофазного синтеза пептидов (SPPS), после чего следовало N-ацетилирование на смоле (Ac2O, DIEA), деаллирование Asp30 (Pd(PPh3)4, PhSiH3) и последующее отщепление смолы (1-2% TFA/CH2Cl2). Используя процедуру аспартилирования/снятия защитных групп в одной колбе (как описано в источнике 12, как приведено в разделе 6.2.5, далее), свободную боковую цепь карбоновой кислоты в положении Asn30 связывали с амином хитобиозы (см. источник 13, как приведено в разделе 6.2.5, далее), после чего следовала обработка TFA (коктейль R: 90% TFA, 5% тиоанизол, 3% этандитиол, 2% анизол), чтобы предоставлять гликопептид GlcNAc2-55-мер. Присутствие псевдопролиновых мотивов служило для смягчения нежелательного формирования аспартимида во время аспартилирования.
[00553] Кроме того, Man3GlcNAc2-содержащий пептид получали в схожей последовательности в одной колбе.
[00554] Получали более короткие гликопептиды, содержащие Asn30 и Asn24 (аналогичные Asn1800 и Asn1806, соответственно, в MUC16) из MUC16c55 (SEQ ID № 129), (1) 18-мер: CTRNGTQLQNFTLDRSSV (SEQ ID № 130), и (2) 15-мер: CGTQLQNFTLDRSSV (SEQ ID № 131). Гликопептидные 18-мер и 15-мер конъюгировали с гемоцианином морского блюдца (KLH). 15-мер (SEQ ID № 131) содержал хитобиозу в Asn7 (аналогичном Asn1806 в MUC16). Гликопептидные 15-меры синтезировали образом, аналогичным синтезу гликопептидных 55-меров.
[00555] 18-мер (SEQ ID № 130) содержал хитобиозу в Asn4 и Asn10 (аналогичных Asn1800 и Asn1806, соответственно, в MUC16). Аллил-защита в Asn4 и Asn10 в 18-мере (аналогичных Asn1800 и Asn1806, соответственно, в MUC16) вела к значимому формированию аспартимида. Таким образом, пространственно более затрудненный сложный O-2-фенилизопропиловый эфир (O-2-PhiPr, OPp) использовали в SPPS для того, чтобы предоставлять после N-ацетилирования и одновременного отщепления смолы/удаления OPp (1-2% TFA/CH2Cl2) частично защищенный пептид со свободными боковыми цепями Asn4 и Asn10 в 18-мере (аналогичных Asn1800 и Asn1806, соответственно, в MUC16). Осуществляли высоко конвергентную установку двух звеньев хитобиозы через двойное аспартилирование Лансбери, после чего следовало глобальное кислотное снятие защитных групп для того, чтобы создавать бис-гликозилированный пептидный 18-мер (27% после ВЭЖХ очистки).
[00556] Финальное связывание N-концевых остатков цистеина гликопептидных 18-мера и 15-мера с малеимидным производным белка-переносчика предоставляло KLH-конъюгированные конструкции для вакцинации мышей.
6.2.2.2 Протокол иммунизации мышей
[00557] Пять мышей BALB/c и пять мышей Swiss Webster иммунизировали с использованием гликопептиднного 55-мера (см. раздел 6.2.2.1) три раза каждые три недели в присутствии 25 мкл адъюванта Titermax для того, чтобы иммунизировать мышей. Тремя неделями позже мышей иммунизировали смесью KLH-конъюгированных конструкций моногликозилированного 15-мера (SEQ ID № 131) и бис-гликозилированного 18-мера (SEQ ID № 130). Сыворотки анализировали на реактивность к GlcNAc2-гликозилированному 55-меру и более коротким гликопептидам, не конъюгированным с KLH. Не гликозилированные пептидные 55-мер, 15-мер и 18-мер вместе с двумя не родственными MUC16 пептидами, содержащими хитобиозу, использовали в качестве отрицательных контролей для скрининга. Мышей дополнительно иммунизировали KLH-конъюгатами 15-мера и 18-мера еще два раза каждые три недели и ответы анализировали с помощью ELISA после каждой иммунизации.
6.2.2.3 Инвазия
[00558] См. раздел 6.1.2.9. Для экспериментов с shRNA, BD BioCoat™ Matrigel™ Invasion Inserts или Chambers (№ по каталогу 354480 в 24-луночном планшете) и Control Inserts (№ по каталогу 354578 в 24-луночном планшете) приобретали в BD Biosciences, MA. Анализ инвазии матригеля осуществляли в соответствии с протоколом производителя. В кратком изложении, матригелевые камеры в 24-луночных планшетах (хранили при -20°C) и контрольные вставки (хранили при 4°C) оставляли доходить до комнатной температуры. Обе вставки регидратировали в 0,5 мл бессывороточной среды во вставке, а также во внешней лунке 24-луночного планшета, в течение 2 ч при 37°C 5% CO2 во влажном инкубаторе. Культивируемые клетки SKOV3 трипсинизировали и промывали средой для культивирования. Миллион клеток отделяли в другую пробирку для центрифуги и промывали 3 раза бессывороточной средой. Эти клетки затем корректировали, чтобы получить 5000 клеток в 0,5 мл бессывороточной среды. Среду в регидратированных вставках удаляли и вставку переносили в новый 24-луночный планшет, содержащий 0,75 мл среды для культивирования, содержащей 10% эмбриональной телячьей сыворотки (FBS), в лунке, которая служит в качестве хемоаттрактанта. Незамедлительно во вставку добавляли 0,5 мл клеток (5000 клеток) в бессывороточной среде. Надлежащее внимание уделяли, чтобы видеть, что воздушные пузырьки не застревали во вставке и внешней лунке. 24-луночный планшет инкубировали при 37°C 5% CO2 во влажном инкубаторе в течение 48 ч. После инкубации не проникающие клетки удаляли с верхней поверхности мембраны посредством «отскребания», вставляя тампон с хлопком на конце в матригель или контрольную вставку и аккуратно прикладывая давление, при этом перемещая кончик тампона по поверхности мембраны. Отскребание повторяли с использованием второго тампона, увлажненного в среде. Затем вставки окрашивали в новом 24-луночном планшете, содержащем 0,5 мл 0,5% красителя кристаллического фиолетового в дистиллированной воде в течение 30 минут. После окрашивания вставки споласкивали в 3 стаканах дистиллированной воды для того, чтобы удалять избыточный краситель. Вставки сушили на воздухе в новом 24-луночном планшете. Проникшие клетки считали вручную под инвертированным микроскопом при 200× увеличении. Несколько полей мембран в трех повторениях подсчитывали и регистрировали на фиг.
6.2.2.4 Опухолевый рост у бестимусных голых мышей
[00559] См. раздел 6.1.2.11.
6.2.2.5 Анализ связывания биотинилированных гликопептидов
[00560] Аффинность связывания определяли с использованием ForeBio Octet QK. 5 мкг/мл гликопептидного 18-мера, конъюгированного с биотинилированной хитобиозой, загружали на стрептавидиновый биосенсор. После смывания избыточного антигена, антитела мыши тестировали по 10 мкг/мл для стадий ассоциации и диссоциации, соответственно. Параметры связывания вычисляли с использованием модели сайта связывания 1:1, частичная подгонка.
6.2.2.6 Иммуногистохимия тканевой микропанели
[00561] Толстоигольные биопсии уже существующей погруженной в парафин ткани получали из так называемых донорских блоков и затем перемещали в реципиентский парафинизированный «мастер-блок», используя способы Kononen et al. (см., Kononen J, et al. Nat Med 1998;4(7):8447) и впоследствии модифицированные Hedvat et al (см., Hedvat CV et al. Hum Pathol 2002;33(10):968-74). Управляемый вручную Tissue Arrayer MTA-1 из Beecher Instruments Inc. (Sun Prairie, WI) использовали для того, чтобы получать круглые участки (сердцевины) образцов, которые составляли от 0,6 до 1,0 мм в диаметре. Сердцевины располагали на 0,3-0,4 мм друг от друга. Слой контрольных тканей стратегически накладывали около текущих тканевых микропанелей во избежание краевых эффектов. Конкретный состав каждой тканевой микропанели изложен далее. Препараты тканевых микропанелей для раке яичников или контрольной ткани получали, нарезая 4 мкм срезы фиксированной формалином ткани, погруженной в парафин.
[00562] Иммуногистохимию осуществляли на тканевых микропанелях, используя стандартное OC125 (Ventana, Tuscon, AZ), 4H11 (см. Rao et al. Appl. Immunohistochem Mol Morphol, 2010, 18(5):462-72) и 19C11 моноклональное антитело. Срезы тканевых микропанелей резали по 4 мкм, помещали на предметные стекла Superfrost/Plus (марки Fisher) и нагревали в 60° печи в течение по меньшей мере 60 минут. Затем препараты депарафинизировали и гидратировали в дистиллированной воде, вымачивали в цитратном буфере при pH 6,00 в течение 30 минут при 97°C, промывали в проточной воде в течение 2-5 минут, инкубировали в течение 5 минут в 3% пероксиде водорода, разбавленном в дистиллированной воде. Препараты промывали в дистиллированной воде в течение 1 минуты, переносили в ванну с фосфатно-солевым буфером (PBS), pH 7,2, две смены по 5 минут каждая, и помещали в 0,05% BSA, разбавленный в PBS минимум на 1 минуту. После сушки вокруг тканевых срезов нормальную сыворотку применяли в разведении 1:20 в 2% BSA/PBS и инкубировали в течение минимум 10 минут при комнатной температуре во влажной камере. Затем сыворотку отсасывали, не позволяя срезам сохнуть, и приблизительно 150 лямбда нового антитела в разведении 1:1000 помещали на ткань. Препарат инкубировали в течение ночи (приблизительно 15-18 часов) при 4°C во влажной камере. Первичное антитело смывали, используя три смены PBS, в течение 10 минут каждая. Вторичное антитело, биотинилированное α-мышиное из Vector Laboratories (Burlingame, Ca) применяли в разведении 1:500 в 1% BSA/PBS и инкубировали в течение 45-60 минут при комнатной температуре во влажной камере. Антитело смывали, снова используя три смены PBS, как выше. Затем препараты переносили в ванну диаминобензидина (DAB), разведенного в PBS, на 5-15 минут. Затем препараты промывали в водопроводной воде в течение 1 минуты, контрастно окрашивали с использованием модифицированного гематоксилина Харриса (Fisher), обесцвечивали с использованием 1% кислого спирта и синили в аммиачной воде, дегидратировали с использованием 3 смен, каждая из 95% этанола, 100% этанола и ксилола в течение 2 минут каждая и закрывали покровным стеклом с перманентной заливочной средой.
6.2.2.7 Анализ интернализации
[00563] Интернализацию89Zr-19C11 изучали на клетках SKOV3, экспрессирующих MUC16c114. Приблизительно 1×105 клеток высевали в 12-луночный планшет и инкубировали в течение ночи при 37°C 5% CO2 в инкубаторе. Определенный объем радиоактивно меченного белка добавляли в каждую лунку и планшеты инкубировали при 37°C и 4°C в течение 1, 5, 12 и 24 часов. После каждого периода инкубации собирали среду и промывали клетки в 1 мл фосфатно-солевого буфера (PBS). Активность, связанную с поверхностью, собирали посредством промывания клеток в 1 мл 100 мМ уксусной кислоты с 100 мМ глицина (1:1, pH 3,5) при 4°C. Затем прилипшие клетки лизировали с использованием 1 мл 1 M NaOH. Каждый смыв собирали и подсчитывали активность. Соотношение активности финального смыва и общей активности всех смывов использовали для того, чтобы определять % интернализации.
6.2.3 РЕЗУЛЬТАТЫ
6.2.3.1 Патобиология MUC16 зависит от N-гликозилирования C-концевого эктодомена MUC16.
[00564] В примере 1 (см. раздел 6.1) показано, что экспрессия MUC16c114 вела к более агрессивному поведению in vitro/in vivo у фибробластов 3T3 мыши, ведущему к значимому увеличению MUC16c114-движимой инвазии матригеля и более быстрому опухолевому росту in vivo. Таким образом, клеточную линию SKOV-3 (клеточную линия яичника человека, которая не имеет экспрессии MUC16), исследовали на эффект MUC16c114-зависимых свойств. Экспрессия MUC16c114 вела к экспрессии на клеточной поверхности и почти 3-кратному увеличению инвазии матригеля (сравните дорожки 1 и 2 на фиг. 12A). Это увеличение инвазии зависело от N-гликозилирования аспарагина в положениях аминокислот 1 (Asn1), 24 (Asn24) и 30 (Asn 30) в MUC16c114 (соответствующих Asn1777, Asn1800 и Asn1806 зрелого MUC16 (SEQ ID № 150), соответственно; MUC16c114-N123), поскольку мутация Asn30 в аланин (MUC16c114-N3, фиг. 12A, дорожка 3), мутация Asn1 и Asn24 в аланин (MUC16c114-N12, фиг. 12A, дорожка 4) и мутация Asn1, Asn24 и Asn30 в аланин (MUC16c114-N123, фиг. 12A, дорожка 4), устраняли инвазию матригеля. Также см. фиг. 12B. Кроме того, MUC16c114-индуцированная повышенная инвазия матригеля зависела от MGAT5 (первого фермента, участвующего в реакции N-гликозилирования) и/или LGALS3 (фермента, амплифицированного во многих серозных злокачественных опухолях с низкой степенью дифференцировки), поскольку эксперименты с нокдауном shRNA, которые снижали экспрессию MGAT5 или LGALS3, оказывали эффект, схожий с MUC16c114 мутацией в участках N-гликозилирования, и снижали инвазию почти до базовых уровней (фиг. 12A, дорожки 6-10).
[00565] Наиболее однозначным признаком онкогенной трансформации является способность ускорять рост у иммунодефицитных мышей. Для того чтобы измерять эффекты N-гликозилирования MUC16, MGAT5 и LGALS2, оказываемые на скорость роста опухоли, модель опухоли в боку использовали для того, чтобы облегчать регулярные измерения опухоли. Как показано на фиг. 12C, когда клеточные линии 3T3, экспрессирующие вектор (phrGFP), MUC16c114, MUC16c114-N123, MUC16c114 и shRNA против MGAT5 (MUC16c114-shMGAT5) или MUC16c114 и shRNA против LGALS3 (MUC16c114-shLGALS3), имплантировали в бока бестимусных голых мышей, только MUC16c114 клетки 3T3 формировали более крупные опухоли по сравнению с контролями только с вектором на 24 сутки. Эти данные подтверждают анализы in vitro, которые показывают, что для опухолевого роста необходимы N-гликозилирование MUC16, MGAT5 и LGALS3.
6.2.3.2 Синтез гомогенных N-гликопептидов в качестве ключевых имитаторов эпитопов для разработки mAb
[00566] Поскольку определяли, что N-гликозилирование в участке Asn30 в MUC16c114 (соответствующем Asn1806 зрелого MUC16 (SEQ ID № 150); MUC16c114-N3) представляет собой центральное требование для онкогенного действия MUC16, осуществляли гликановое профилирование MUC16c114-N12, экспрессированного в клетках SKOV3, поскольку MUC16c114-N12 сохраняет способность к N-гликозилированию в Asn30 (соответствующем Asn1806 зрелого MUC16 (SEQ ID № 150)). Анализ гликома демонстрировал очень разнообразный паттерн N-гликозилирования для этого C-концевого фрагмента MUC16, с критическим стеблем хитобиозы (GlcNAc2) в качестве минимального повторяющегося звена, к которому прикрепляют различные маннозные фрагменты (фиг. 13A).
[00567] Таким образом, создавали mAb, направленные на гликозилирование, с целью ингибирования зависящих от гликозилирования эффектов MUC16, оказываемых на метастазы и инвазию. Эти антитела разрабатывали для нацеленного воздействия на эпитопы N-гликопептида, содержащие ключевой третий участок гликозилирования (Asn30 в MUC16c114) на более короткой 55-аминокислотной последовательности в эктодомене MUC16 (MUC16c55; SEQ ID № 129). Описание синтеза гликопептидов, используемых в качестве иммуногенов, см. в разделе 6.2.2.1 и на фиг. 13B, фиг. 13C и фиг. 13D. Описание процесса иммунизации см в разделе 6.2.2.2.
[00568] Антитела создавали через иммунизацию короткими гликопептидами MUC16 (55-мер, 18-мер, и 15-мер), содержащими хитобиозу на аминокислотных остатках, соответствующих Asn24 и/или Asn30 в MUC16c114 (соответствующих Asn1800 и Asn1806, соответственно, зрелого MUC16 (SEQ ID № 150)). В дополнение к тому, что хитобиоза является самым маленьким мотивом, общим для более крупных N-гликанов, она также делает возможной более хорошую экспозицию подлежащего пептида, происходящего из MUC16, для индукции антител, которые не только демонстрируют зависимость от гликана, но также пептидную специфичность. Это гипогликозилирование является частым, отличительным признаком у муциновых гликопротеинов на поверхности опухолевых клеток в сравнении с нормальными клетками.
6.2.3.3 Вакцинация мышей синтетическими гликопептидами/гликоконъюгатами и серологический анализ
[00569] Вакцинацию мышей и сбор сыворотки осуществляли в соответствии с протоколом, описанным в разделе 6.2.2.2. После трех иммунизаций с использованием GlcNAc2-55-мера (фиг. 13B), мышей дополнительно иммунизировали смесью KLH-конъюгированных конструкций (моногликозилированный 15-мер (SEQ ID № 131; фиг. 13C) и бис-гликозилированный 18-мер (SEQ ID № 130; фиг. 13D)), две из десяти мышей демонстрировали положительные ELISA сигналы для обоих 55-меров (с и без GlcNAc2), но ответ был в целом слабым, что подсказывает, что мыши не полностью сенсибилизировались при иммунизациях 55-мером. Две дополнительные иммунизации с использованием KLH конъюгатов (GlcNAc2-15-мер (фиг. 13C) и (GlcNAc2)2-18-мер (фиг. 13D)) вели к усиленным IgG иммунным ответам на более короткие гликопептидные 15-мер и 18-мер, в частности, у двух мышей (мышь 7 и мышь 8). Однако эти антитела не демонстрируют какой-либо поддающейся обнаружению реактивности посредством ELISA при использовании гликопептидных 55-меров, что подсказывает, что в этом конкретном анализе эпитоп в этом большом фрагменте или недоступен или конформационно отличен. Мышь 5, которая отвечала на оба 55-мера (содержащий хитобиозу и/или не гликозилированный пептид) была отрицательной к Man3GlcNAc2-производному 55-мера. Не удивительно, что mAb 4H11 (Rao et al. Appl. Immunohistochem Mol Morphol, 2010, 18(5):462-72), которое направлено на не гликозилированный пептидный остов, не демонстрировало связывания с не конъюгированными гликопептидными 15/18-мерами, что указывает на то, что могут иметь место некоторые различия в доступных эпитопах. См. фиг. 14.
6.2.3.4 Разработка зависящего от гликозилирования моноклонального антитела и биологические анализы in vitro - MUC16-движимая инвазия матригеля
[00570] Отбирали одну из десяти мышей (мышь 7), сыворотка которой демонстрировала наивысшее соотношение реактивностей для коротких гликопептидов против не гликозилированных и, следовательно, демонстрировала некоторое предпочтение к присутствию сахара. Получали селезенку мыши 7 и стандартной технологией гибридомных культур предоставляли IgG-продуцирующие гибридомные клеточные линии. Спленоциты сливали с гибридомным партнером слияния, что давало чрезвычайно высокую эффективность слияния (>5,5 колонии/лунка в среднем, при > 30000 гибридом). Отбирали супернатанты и осуществляли их скрининг по реактивности с помощью ELISA против индивидуальных гликопептидов. Предварительный ELISA анализ для тестового планшета слияния против пептида 15-мер-хитобиоза и пептида 18-мер-хитобиоза (объединенных в одной и той же лунке) показывал некоторые положительные сигналы, что указывает на присутствие антител против пептидов, хотя их зависимость от гликозилирования не может быть полностью оценена в этой точке. См. фиг. 14. Тем не менее более высокую долю антител с благоприятной положительностью и, следовательно, более специфичных к гликозилированным хитобиозой антигенам, наблюдали в сравнении с не гликозилированными антигенами. При разбавлении культуры получали по одному клону, растущему в каждой лунке (соотношение 1:1 выше), и первичный скрининг выявлял, что антитела, продуцируемые этими гибридомами, не распознают эпитоп 4H11, который лежит близко к не гликозилированному 15-/18-меру. См. фиг. 14. После завершения скрининга моноклональных антител в более высоком разведении получали антитела, демонстрирующие предпочтение к гликопептидному эпитопу. Таким образом, этот процесс давал 36 первичных mAb, зависящих от хитобиозы, которые тестировали на реактивность к MUC16. Из них 15 mAb оценивали (параллельно с 4H11) по их эффекту, оказываемому на инвазию посредством матригелевого анализа с SKOV3-MUC16c114 трансфектантом (фиг. 15A). Антитела к гликозилированному MUC16 1B5, 10C6, 13A7, 18C6, 19C11, 16C5, 6H10, 21F8, 7B12 демонстрировали ингибирование инвазии матригеля, тогда как 4H11 не оказывало эффекта на это свойство, что указывает на то, что антитела, направленные на Asn30 в MUC16c114 (соответствующий Asn1806 зрелого MUC16 (SEQ ID № 150)) ингибируют биологию MUC16. Впоследствии антитела к гликозилированному MUC16 субклонировали и очищали. Определяли параметры связывания для определенных антител к гликозилированному MUC16 (см. таблицу 9).
[00571] Таблица 9. Параметры связывания антител к гликозилированному MUC16
*= низкая достоверность вычисления; без подгонки для скорости диссоциации;
**= ka слишком низка для определения скорости ассоциации.
[00572] Наконец, иммуногистохимия образцов тканей яичника человека, которую проводили с использованием антитела к гликозилированному MUC16 10C6, показывала усовершенствованное обнаружение MUC16 по сравнению с иммуногистохимией, которую проводили с использованием 4H11 или OC125 (фиг. 16E).
6.2.3.5 Антитела к гликозилированному MUC16 специфичны для гликозилирования MUC16.
[00573] Чтобы исследовать специфичность антител к гликозилированному MUC16, анализ FACs осуществляли на (i) клетках, экспрессирующих нативный (зрелый) MUC16 (клетки OVCA-433), (ii) клетках SKOV3, у которых отсутствует экспрессия MUC16, которые экспрессируют контрольный вектор (клетки SKOV3 phrGFP), (iii) клетках SKOV3, экспрессирующих MUC16c114 (SKOV3 MUC16c114), (iv) клетках SKOV3, экспрессирующих MUC16c114-N1 (SKOV3 MUC16c114-N1), (v) клетках SKOV3, экспрессирующих MUC16c114-N3 SKOV3 MUC16c114-N3), или (vi) клетках SKOV3, экспрессирующих SKOV3 MUC16c114-N123 (SKOV3 MUC16c114-N123), в присутствии или отсутствии антитела к гликозилированному MUC16 (18C6, 19C11, 10C6, 1B5 или 13A7) или моноклонального антитела против MUC16, 4H11 (таблица 10). Антитела 4H11, 18C6, 19C11, 10C6, 1B5 и 13A7 демонстрировали связывание с клетками OVCA-433 (таблица 10; сравните ID №№ 3-8 с отрицательными контролями, ID №№ 1 и 2). В отличие от этого, как ожидали, исходя из постановки исследований и создания антител, ни одно из антител 4H11, 18C6, 19C11, 10C6, 1B5 и 13A7 не связывало клетки SKOV3 phrGFP (таблица 10, ID №№ 11-16 в сравнении с отрицательными контролями, ID №№ 9 и 10). Антитела 4H11, 18C6, 19C11, 10C6, 1B5 и 13A7 связывали SKOV3 MUC16c114 (таблица 10, ID №№ 19-24 в сравнении с отрицательными контролями, ID №№ 17 и 18). Мутация Asn1 в MUC16c114 (соответствующем Asn1777 зрелого MUC16 (SEQ ID № 150)) не ингибировала связывание антитела с клетками SKOV3 MUC16c114-N1 (таблица 10, ID №№ 27-32 в сравнении с отрицательными контролями, ID №№ 25 и 26). Однако, мутация Asn30 в MUC16c114 (соответствующем Asn1806 зрелого MUC16 (SEQ ID № 150)) устраняла связывание антител к гликозилированному MUC16 18C6, 19C11, 10C6, 1B5 и 13A7 (таблица 10, ID №№ 36-40, в сравнении с отрицательными контролями, ID №№ 33 и 34). Кроме того, мутация Asn30 в MUC16c114 (соответствующем Asn1806 зрелого MUC16 (SEQ ID № 150)) не устраняла связывание антитела 4H11, которое не является антителом к гликозилированному MUC16 (таблица 10, ID № 35, в сравнении с отрицательными контролями, ID №№ 33 и 34). Кроме того, мутации аспарагина в аланин в Asn1, Asn24 и Asn30 (соответствующих Asn1777, Asn1800 и Asn1806, соответственно, зрелого MUC16 (SEQ ID № 150)) устраняли связывание антител к гликозилированному MUC16 18C6, 19C11, 10C6 и 1B5 (таблица 10, ID №№ 44-47, в сравнении с отрицательными контролями, ID №№ 41 и 42), но при этом не устраняли связывание 4H11. Следует отметить, что 13A7 сохраняло связывание с клетками SKOV3 MUC16c114-N123. Эти данные демонстрируют, что антитела к гликозилированному MUC16 связываются с MUC16c114 зависимым от гликозилирования образом.
[00574] Таблица 10. FACs анализ антител к гликозилированному MUC16 с клетками OVCA-433 или клетками-трансфектантами SKOV3.
* Показывает, что связывание считали не наблюдаемым.
6.2.3.6 Антитела к гликозилированному MUC16 ингибируют инвазию матригеля.
[00575] Учитывая специфичность к гликозилированию у антител к гликозилированному MUC16 (таблица 9), оценивали способность биологически реактивных супернатантов антител к гликозилированному MUC16 ингибировать инвазию матригеля специфично к гликозилированию. Таким образом, анализ инвазии матригеля осуществляли с использованием стабильных клеточных линий раке яичников SKOV3, которые экспрессируют phrGFP (фиг. 15A, дорожка 1) или phr-GFP-MUC16c114 (MUC16c114; фиг. 15A, дорожки 2-18) в присутствии (фиг. 15A, дорожки 3-18) или отсутствии (фиг. 15A, дорожки 1 и 2) биологически реактивных супернатантов антител к гликозилированному MUC16. Моноклональное антитело к MUC16 4H11 (фиг. 15A, дорожка 3) использовали в качестве контроля для биологически реактивных супернатантов антител к гликозилированному MUC16 (фиг. 15A, дорожки 4-18), чтобы оценивать зависимость от гликозилирования при инвазии матригеля. Экспрессия MUC16c114, или отдельно в присутствии 4H11 (фиг. 15A, дорожки 2 и 3, соответственно), вела к увеличению активности инвазии матригеля. В отличие от этого, инкубация с антителами к гликозилированному MUC16 (фиг. 15A, дорожки 4-18) снижала инвазию матригеля MUC16c114-экспрессирующими клетками раке яичника.
[00576] Затем оценивали способность очищенных антител к гликозилированному MUC16 ингибировать инвазию матригеля. С этой целью клетки SKOV3, экспрессирующие MUC16c114, инкубировали в присутствии и отсутствии антитела к MUC16 4H11 или очищенных антител к гликозилированному MUC16 (фиг. 15B). Антитела к гликозилированному MUC16 7B12, 19C11, 18C6 и 10C6 ингибировали MUC16c114-индуцированную инвазию матригеля (фиг. 15B, сравните дорожки 3-6 с отрицательным контролем, дорожка 2). В отличие от этого, моноклональное антитело против MUC16 4H11 не ингибировало MUC16c114-индуцированную инвазию матригеля (фиг. 15B, сравните дорожку 2 с отрицательным контролем, дорожкой 1). Эти данные демонстрируют, что, в отличие от моноклонального антитела 4H11, антитела к гликозилированному MUC16 (например, 7B12, 19C11, 18C6 и 10C6) блокируют инвазию матригеля.
[00577] Способность антител к гликозилированному MUC16 ингибировать инвазию матригеля анализировали в контексте мутантов N-гликозилирования MUC16c114 (фиг. 16A). С этой целью анализ инвазии матригеля осуществляли на клетках SKOV3 phrGFP, клетках SKOV3 MUC16c114, клетках SKOV3 MUC16c114-N1, клетках SKOV3 MUC16c114-N2 или клетках SKOV3 MUC16c114-N3 (фиг. 16A, дорожки 1-5, соответственно), в присутствии (i) контрольного антитела; (ii) антитела 4H11; или (iii) антитела к гликозилированному MUC16 10C6. MUC16c114-индуцированную инвазию матригеля ингибировали в клетках SKOV3 MUC16c114-N3, поскольку Asn30 в MUC16c114 необходим для MUC16c114 инвазии матригеля. Кроме того, инвазию матригеля индуцировали в клетках SKOV3 MUC16c114, клетках SKOV3 MUC16c114-N1 и клетках SKOV3 MUC16c114-N2 в присутствии и отсутствии моноклонального антитела к MUC16 4H11. В отличие от этого, инкубация этих клеток с антителом к гликозилированному MUC16 10C6 устраняла инвазию матригеля (фиг. 16A). Эти данные также подтверждали на фиг. 16B и в клетках 3T3, экспрессирующих мутантов MUC16c344 (фиг. 16C).
[00578] В совокупности, эти данные показывают, что антитела к гликозилированному MUC16, в отличие от моноклонального антитела против MUC16 4H11, способны ингибировать инвазию матригеля зависимым от гликозилирования образом.
6.2.3.7 Интернализация антитела к гликозилированному MUC16 19C11.
[00579] Наконец, оценивали способность антитела к гликозилированному MUC16, направленного на Asn30 в MUC16c114, к интернализации. Клетки SKOV3, экспрессирующие MUC16c114, инкубировали с89Zr-DFO-меченным антителом 19C11 и определяли интернализацию через радиоактивную метку (фиг. 17). Эти данные демонстрируют, что интернализация меченого антитела 19C11 происходила, когда его инкубировали с MUC16c114-экспрессирующими клетками SKOV3 при 37°C, уже через 1 час после обработки антителом. Клеточное поглощение меченого антитела снижалось при 4°C.
6.2.4 ОБСУЖДЕНИЕ
[00580] MUC16/антиген CA125, элемент семейства муцинов с существенной гомологией с MUC1, долго связывали с гинекологическими злокачественными новообразованиями (см. источник 4, как приведено в разделе 6.2.5, далее). Несмотря на то, что оно не является достаточно чувствительным или специфичным в качестве основного инструмента скрининга, измерение CA125 регулярно используют для того, чтобы осуществлять мониторинг пациентов со злокачественными опухолями яичников через способы обнаружения на основе антител. Подавляющее большинство MUC16-реактивных антител, таких как OC125, направлено против зависящих от гликозилирования эпитопов, встречающихся в отщепляемой фракции молекулы, и их нельзя использовать в качестве инструментов скрининга для того, чтобы обнаруживать проксимальную часть MUC16 после отщепления. Как следствие, биологические исследования остающегося фрагмента белка MUC16 недостаточны. Данные в примере 1 (раздел 6.1) демонстрировали, что 114 аминокислотная последовательность проксимальной области MUC16 (MUC16C114) является достаточной для того, чтобы увеличивать инвазию и опухолевый рост в нескольких клеточных линиях рака яичников. В настоящем описании разительное открытие, что N-гликозилирование этого C-концевого эктодомена, в частности в третьем участке Asn (Asn30, соответствующем Asn1806 зрелого MUC16 (SEQ ID № 150)), является ключевым для онкогенных эффектов MUC16, указывает на новые роли MUC16, который после этого можно рассматривать не только как пассивный маркер заболевания, но также как патогенную молекулу. На основании этого предположения разработка моноклональных антител против этих сохраняемых частей MUC16 выглядит как мощный инструмент для исследования патобиологии этого муцина и создания терапевтических средств, нацеленных на MUC16.
[00581] В предыдущих исследованиях идентифицировали mAb против не отщепляемой C-концевой области MUC16, хотя, в отличие от предшествующих антител, они направлены на не гликозилированный пептидный остов вместо сложных гликопротеиновых эпитопов. В частности, 4H11 демонстрировало высокоаффинное связывание с эктодоменом MUC16 и интернализацию клетками раке яичника более эффективно, чем OC125, по причине близкого местоположения эпитопа. Эта находка подсказывает, что проксимальная область гликопротеина обладает биологией, не зависящей от слущиваемой части MUC16, дистальной относительно предполагаемого сайта расщепления. Однако, поскольку 4H11 не распознает ключевые участки гликозилирования в эктодомене, которые необходимы для патогенного действия MUC16, его потенциал в будущих исследованиях нацеленной терапии ограничен.
[00582] Разработана панель зависящих от гликозилирования моноклональных антител, направленных на ключевые гликопептидные эпитопы в эктодомене MUC16, с использованием KLH-конъюгированных, синтетических гликопептидных имитаторов в комбинации с гибридомной технологией. Этот способ предпочтительнее создания поликлональных антител, поскольку на поликлональном этапе гликопептидная специфичность не являлась полной и также обнаруживали некоторое связывание с пептидными фрагментами не гликозилированного MUC16. Для получения антител к гликозилированному MUC16, первичный отбор генерации моноклональных антител проходил по более высокой доле зависимости от гликозилирования в поликлональной культуре, что связывали с некоторой степенью предпочтения к присутствию сахара. Силу новых моноклональных антител и их более высокую специфичность к гликопептидному эпитопу демонстрировали посредством изучения их эффекта, оказываемого на MUC16-движимую инвазию матригеля. Эти антитела к гликозилированному MUC16 способны ингибировать инвазию в матригелевом анализе, тогда как 4H11, не направленное на гликозилирование, не способно. На основании находки, что N-гликозилирование в Asn30 важно для действия MUC16, эти результаты подтверждают, что вновь созданные антитела специфически направлены на ключевой гликопептидный эпитоп эктодомена MUC16, результатом чего является ингибирование патобиологии MUC16. Важно, что антитело к гликозилированному MUC16 10C6 значительно задерживало MUC16-положительный опухолевый рост в модели на бестимусных голых мышах, которым имплантировали MUC16c114-экспрессирующие клетки раке яичника, что демонстрирует потенциал этих моноклональных антител стать перспективным инструментом для их терапевтического использования в оптимизированных клинических применениях.
6.2.5 ЦИТИРУЕМЫЕ ИСТОЧНИКИ
[00583] 1. Bast, R. C. Jr. et al. Reactivity of a monoclonal antibody with human ovarian carcinoma. J. Clin. Invest. 68, 1331-1337 (1981).
[00584] 2. Yin, B. W. & Lloyd, K. O. Molecular cloning of the CA125 ovarian cancer antigen: identification as a new mucin, MUC16. J. Biol. Chem. 276, 27371-27375 (2001).
[00585] 3. O'Brien, T. J. et al. The CA 125 gene: an extracellular superstructure dominated by repeat sequences. Tumor Biol. 22, 348-366 (2001).
[00586] 4. Bast, R. C. Jr., et al. CA125: the past and the future. Int. J. Biol. Markers 13, 179-187 (1998).
[00587] 5. Rustin, G. J. S. Use of CA-125 in clinical trial evaluation of new therapeutic drugs for ovarian cancer. Clin. Cancer Res. 10, 3919-3926 (2004).
[00588] 6. Scholler, N. & Urban, N. CA125 in ovarian cancer. Biomark. Med. 1, 513-523 (2007).
[00589] 7. Yin, B. W., Dnistrian, A. & Lloyd, K. O. Ovarian cancer antigen CA125 is encoded by the MUC16 mucin gene. Int. J. Cancer 2002, 98, 737-740.
[00590] 8. O'Brien, T. J., Beard, J. B., Underwood, L. J. & Shigemasa, K. The CA 125 gene: a newly discovered extension of the glycosylated N-terminal domain doubles the size of this extracellular superstructure. Tumor Biol. 23, 154-169 (2002).
[00591] 9. Nap, M. et al. Immunohistochemical characterization of 22 monoclonal antibodies against the CA125 antigen: 2nd report from the ISOBM TD-1 workshop. Tumor Biol. 17, 325-331 (1996).
[00592] 10. Rao, T. D. et al. Novel monoclonal antibodies against the proximal (carboxy-terminal) portions of MUC16. Appl. Immunohistochem. Mol. Morphol. 18, 462-472 (2010).
[00593] 11. Cohen-Anisfeld, S. T., Lansbury, P. T. A practical, convergent method for glycopeptide synthesis. J. Am. Chem. Soc. 115, 10531-10537 (1993).
[00594] 12. Wang, P., Aussedat, B., Vohra, Y. & Danishefsky, S. J. An advance in the chemical synthesis of homogeneous N-linked glycopolypeptides by convergent aspartylation. Angew. Chem. Int. Ed. 51, 11571-11575 (2012).
[00595] 13. Likhosherstov, L. M., Novikova, O. S., Derevitskaja, V. & Kochetkov, N. K. A new simple synthesis of amino sugar β-d-glycosylamines. Carbohydr. Res. 146, C1-C5 (1986).
[00596] 14. Nakada, H. et al. Epitopic structure of Tn glycophorin A for an anti-Tn antibody (MLS 128). Proc. Natl. Acad. Sci. USA 90, 2495-2499 (1993).
[00597] 15. Osinaga, E. et al. Analysis of the fine specificity of Tn-binding proteins using synthetic glycopeptide epitopes and a biosensor based on surface plasmon resonance spectroscopy. FEBS Lett. 469, 24-28 (2000).
[00598] 16. Mazal, D. et al. Monoclonal antibodies toward different Tn-amino acid backbones display distinct recognition patterns on human cancer cells. Implications for effective immuno-targeting of cancer. Cancer Immunol. Immunother. 62, 1107-1122 (2013).
[00599] 17. Rosen, D.G. et al. Potential markers that complement expression of CA125 in epithelial ovarian cancer. Gynecol Oncol. 99, 267-277 (2005).
[00600] 18. Moore, R.G., Maclaughlan, S. & Bast, R.C. Jr. Current state of biomarker development for clinical application in epithelial ovarian cancer. Gynecol Oncol. 116, 240-245 (2010).
6.3 ПРИМЕР 3: СПОСОБСТВУЮЩИЕ ОПУХОЛИ ЭФФЕКТЫ MUC16 ТРЕБУЮТ ВЗАИМОДЕЙСТВИЯ С ГАЛЕКТИНОМ-3 И РЕЦЕПТОРАМИ КЛЕТОЧНОЙ ПОВЕРХНОСТИ
[00601] В этом примере предоставлены (a) более подробное описание определенных экспериментов, описанных в примере 2 (раздел 6.2); и (b) дополнительные эксперименты по сравнению с примером 2 (раздел 6.2).
6.3.1 ВВЕДЕНИЕ
[00602] Сверхэкспрессия MUC16/CA125 обычна при серозной раке яичников и повышенные уровни CA125 в сыворотке ассоциированы со сниженной выживаемостью. Антиген CA125, распознаваемый антитело OC125, представляет собой сильно гликозилированный антиген, экспрессируемый в доменах тандемных повторов из внеклеточной части гликопротеина MUC16 (см. источники 3 и 22 в разделе 6.3.13, далее). Этот антиген преимущественно экспрессируют доброкачественные или озлокачествленные мюллеровы ткани, но его функция и роль в канцерогенезе в настоящее время не полностью поняты (см. источник 4 в разделе 6.3.13, далее). MUC16 представляет собой очень сложный связанный муцин, который содержит большой, гетерогенно гликозилированный внеклеточный домен, 58-аминокислотный эктодомен между клеточной мембраной и предполагаемым сайтом расщепления, гидрофобную трансмембранную область и короткий внутриклеточный хвост (см. источник 21 в разделе 6.3.13, далее). OC125 и большинство других MUC16-реактивных моноклональных антител (mAb) распознают иммуногенную 156-аминокислотную область тандемных повторов, присутствующую в отщепляемой части молекулы. Более новые специфичные к эктодомену антитела (например, 4H11 и 4A5) распознают пептидный эпитоп в сохраняемой после расщепления части MUC16 (см. источник 6 в разделе 6.3.13, далее). Продемонстрировано, что C-концевая часть MUC16 (MUC16c114) трансформирует иммортализованные клетки 3T3, как измеряют по увеличенному безъякорному росту, активации путей AKT и ERK, повышенной инвазии матригеля и усиленному росту в ксенотрансплантатах голых мышей (см. раздел 6.1 и источник 19 в разделе 6.3.13, далее). Эти эффекты зависели от эктодомена MUC16, тогда как утрата 31-аминокислотного цитоплазматического хвоста оказывала небольшой эффект на эти свойства. Механизмы, посредством которых эктодомен способствует онкогенному поведению, не полностью поняты (см. источник 19 в разделе 6.3.13, далее). Хотя отсутствуют консенсусные белоксвязывающие домены, 58-аминокислотная последовательность эктодомена MUC16 содержит три участка N-гликозилирования, которые представляют потенциальные участки взаимодействия/регуляторные участки для MUC16 с другими молекулами клеточной поверхности.
[00603] Участки N-гликозилирования тирозинкиназных рецепторов, таких как рецептор эпидермального фактора роста (EGFR), рецептор тромбоцитарного фактора роста (PDGFR) и другие, похоже, взаимодействуют с клеточными лектинами, такими как галектин-3, чтобы регулировать пребывание на поверхности, интенсивность передачи сигналов и клеточное поведение (см. источник 12 в разделе 6.3.13, далее). Эффекты N-гликозилирования зависят от числа участков N-гликозилирования на усиливающих рост рецепторах и аффинности галектина-3 к сложным N-гликозилированным соединениям. На компенсирующих ингибирующих сигналах молекул клеточной поверхности, таких как рецепторы трансформирующего фактора роста β (TGF-β), меньше участков N-гликозилирования. Эти рецепторы чувствительны к сильными потоками питательных веществ, связанным с факторами роста, и обеспечивают функцию демпферирования в нормальных условиях. Однако механизмы ассоциированных со злокачественными опухолями гликопротеиновых взаимодействий с классическими рецепторными тирозинкиназами не известны. MUC1, MUC4 и MUC16 представляют собой сильно гликозилированные связанные гликопротеины, которые отличаются присутствием трансмембранных доменов и сверхэкспрессией в эпителиальных злокачественных опухолях (см. источник 10 в разделе 6.3.13, далее).
[00604] В этом примере (раздел 6.3) показано, что гликозилирование MUC16 играет ключевую роль в трансформации, связанной с муцином, опосредуя сложные взаимодействия на клеточной поверхности.
[00605] C-концевая часть MUC16 способствовала активации онкогена, инвазии матригеля и опухолевому росту. Эти эффекты зависели от MGAT5-зависимого гликозилирования двую проксимальных участков N-гликозилирования в остающемся 58-аминокислотном эктодомене MUC16. Ни N-, ни O-участки гликозилирования в более дистальной области тандемных повторов MUC16 не могут функционально заменить эти два участка. Паттерны гликозилирования MUC16 разнообразны, но стебель хитобиозы характеризовал основание всех частиц в N-гликозилировании. Антитела к проксимальным гликопептидам MUC16, содержащим хитобиозу, блокировали опосредованное галектином-3 связывание с сигнальными рецепторами клеточной поверхности и ингибировали способствующие опухоли эффекты MUC16.
[00606] Систематические изменения в гликопептидах MUC16 использовали для непосредственного детального исследования зависимости между структурой гликана и способствующим опухоли эффектам, оказываемым посредством экспрессии MUC16. Эти эффекты, включая совместную локализацию, активацию онкогена, инвазию матригеля и рост опухолевого ксенотрансплантата, проявлялись посредством опосредованного галектином-3 связывания между N-гликозилированной последовательностью на остающейся не циркулирующей части MUC16 и молекулами клеточной поверхности, такими как рецептор эпидермального фактора роста (EGFR) и интегрин β1. Внеклеточное движимое муцином стимулирование опухоли является механизмом, подтверждаемым находками и данными, представленными в настоящем описании, на который можно успешно нацеленно воздействовать с помощью антител, направленных на участок N-гликозилирования.
[00607] Как показано в этом примере: (1) состояние внеклеточного гликозилирования MUC16 управляет поведением серозной раке яичника; (2) инвазия и рост MUC16+ ксенотрансплантата зависели от конкретных участков N-гликозилирования MUC16; (3) MUC16 формировал гетеротримерные комплексы с галектином-3 и EGFR или интегрином β1; и (4) антитела против участков гликозилирования блокировали внеклеточное MUC16 стимулирование опухоли.
6.3.2 МАТЕРИАЛЫ И СПОСОБЫ
6.3.2.1 Синтез ДНК конструкций карбоксиконца MUC16 (MUC16c114), домена MUC16-CA125 (MUC16c344) и гликозилированного слитого белка
[00608] См. в разделах 6.1.2 и 6.2.2 и источнике 19 в разделе 6.3.13, далее, описание C-концевых конструкций MUC16. Вектор pFUSE-human IgG1-Fc2 (pFUSE) приобретали в InvivoGen (San Diego, CA), и конструкции химерных белков MUC16c57-114-pFUSE и117-244LGALS3-pFUSE также описаны в разделах 6.1.2 и 6.2.2 и источнике 19 в разделе 6.3.13, далее.
6.3.2.2 Клеточная культура, трансфекция и определение характеристик клеточной линии
[00609] Клеточные линии SKOV3, CAOV3 и OVCAR3 получали и поддерживали, как описано в разделах 6.1.2 и 6.2.2 и источнике 19 в разделе 6.3.13, далее. Подробности см. в разделе 6.3.6.
6.3.2.3 Синтез гликопептидов
[00610] Описание подробного синтеза гликопептидов MUC16 см. в разделе 6.4.
6.3.2.4 Инвазия матригеля
[00611] Инвазия базальной мембраны определяли в камерах инвазии матригеля (BD Biosciences, Bedford, MA). Стабильные клеточные линии обрабатывали туникамицином 5 мкг/мл (Sigma-Aldrich, St. Louis MO № по каталогу T7765) или слитным белком MUC16c57-c114-pFUSE 5 мкг/мл или117-244LGALS3-pFUSE 5 мкг/мл; затем миграцию в матригеле измеряли после 48 часов трижды в лунках и по сравнению с трансфектантами контрольным вектором phrGFP и MUC16c114. Также см. разделы 6.1.2 и 6.2.2 и источник 19 в разделе 6.3.13, далее.
6.3.2.5 Опухолевый рост у бестимусных голых мышей
[00612] Трансфицированные клеточные линии и подходящие контрольные клеточные линии вводили в бок самкам бестимусных голых мышей и животным предоставляли стандартный уход в Memorial Sloan Kettering Cancer Center Antitumor Assessment Core Facility. Измерения опухолей выполняли два раза в неделю, и опухолевй рост регистрировали до максимального размера 1500 мм3 по руководствам Memorial Sloan Kettering Cancer Center Research Animal Resource Center. Также см. разделы 6.1.2 и 6.2.2 и источник 19 в разделе 6.3.13, далее.
6.3.2.6 Получение моноклональных антител; протокол иммунизации мышей
[00613] Протокол иммунизации начинали с содержащего хитобиозу гликопептидного 55-мера MUC16 (GlcNAc2-55-мер; SEQ ID № 129), который вводили пяти мышам BALB/c и пяти мышам Swiss Webster три раза каждые 3 недели в присутствии адъюванта. Четвертую иммунизацию осуществляли с использованием смеси MUC16 конструкций KLH-конъюгированного моногликозилированного 15-мера (GlcNAc2-15-мер-KLH; SEQ ID № 131) и бис-гликозилированного 18-мера ([GlcNAc2]2-18-мер-KLH; SEQ ID № 130). Сыворотки анализировали на реактивность против гликопептидных GlcNAc2-55-мера (SEQ ID № 129) и не конъюгированного несущего хитобиозу 15/18-мера (SEQ ID № 131 и SEQ ID № 130, соответственно). Кроме того, не гликозилированные пептидные 55-мер (SEQ ID № 129), 15-мер (SEQ ID № 131) и 18-мер (SEQ ID № 130) вместе с двумя не родственными MUC16, содержащими хитобиозу пептидами использовали в качестве отрицательных контролей для скрининга (SEQ ID №№ 168 и 169). Мышей дополнительно иммунизировали более короткими KLH-конъюгатами (SEQ ID № 130 и SEQ ID № 131) еще два раза каждые 3 недели и ответы анализировали с помощью ELISA после каждой иммунизации. Также см. раздел 6.2.2.
6.3.2.7 ELISA
[00614] Сэндвич-ELISA осуществляли для того, чтобы оценивать положительность антител к индивидуальным (гликоль)пептидам, придерживаясь стандартного протокола центр коллективного использования для ELISA анализа. Также см. раздел 6.2.2.
6.3.2.8 Анализ вестерн-блоттинга
[00615] Равные количества белка разделяли посредством электрофореза в SDS-полиакриламидном геле (SDS-PAGE) и переносили на поливинилидендифторидные (PVDF) или нитроцеллюлозные мембраны с использованием аппарата для переноса BioRad при 4°C. Мембраны блокировали 3% бычьим сывороточным альбумином (BSA) или 5% обезжиренным молоком в PBS с 0,1% Tween-20 (PBST) в течение 1 часа при комнатной температуре. Мембраны проявляли с использованием различных первичных антител [Cell Signaling, MA: Akt № по каталогу9272; Phospho-Akt (Ser473)(193H12) № по каталогу 4058; p44/43 MAPK (Erk1/2) № по каталогу 9102; Phospho-p44/43 MAPK (Erk1/2)(Thr202/Tyr204) № по каталогу 9101; Src № по каталогу 2109S; Phospho-Src № по каталогу 2101L; EGFR № по каталогу 2237L; Phospho-EGFR (Y1068)(D7A5) XP(R) № по каталогу 3777S]; (Sigma-Aldrich, Inc., St. Louis, MO: beta-actin № по каталогу A5441); (Southern BioTech, Birmingham, AL: anti-human-Fc-IgG1-HRP № по каталогу 9054-05); (Abgent, San Diego, CA: polyclonal LGALS3 antibody № по каталогу AP11938b); и (Origene, Rockville, MD: mouse monoclonal anti-EGFR v3 clone OTI3H2 № по каталогу TA506224; mouse monoclonal anti-DDK clone 4C5 № по каталогу TA50011-100) при 4°C в течение ночи. Мембраны промывали три раза в PBS-T и проявляли с использованием HRP-конъюгированного антитела против мыши или против кролика (GE Healthcare, UK) (разведение 1:5000) в течение 1 часа при комнатной температуре. Затем мембраны промывали три раза в PBS-T и проявляли реактивом Western Lightning Chemiluminescence (ECL, Perkin Elmer) в течение 1-5 минут при комнатной температуре, и сигналы проявляли на пленке HyBlot CL (Denville Scientific Inc. Metuchen, NJ).
[00616] Описания протоколов анализа вестерн-блоттинга также см. разделы 6.1.2 и 6.2.2 и источник 6 в разделе 6.3.13, далее.
6.3.3 ИММУНОГИСТОХИМИЯ ТКАНЕВОЙ МИКРОПАНЕЛИ (TMA)
[00617] Иммуногистохимию скрининга TMA человека осуществляли, как описано ранее (см. источник 6 в разделе 6.3.13, далее).
6.3.4 ИММУНОФЛУОРЕСЦЕНТНОЕ ОКРАШИВАНИЕ OVCAR3, SKOV3-MUC16C344 И SKOV3-MUC16C114
[00618] 50000 клеток отдельно высевали в чашки Delta TPG 0,17 мм и культивировали в соответствующих им средах при 37°C в 5% CO2 в течение ночи. Прилипшие клетки промывали два раза в PBS, содержащем 1% эмбриональную телячью сыворотку (FCS) и 0,025% азида натрия (FACS буфер). Клетки окрашивали в разведении 1:50 с использованием или EGFR(R-1)-Alexa Fluor 647 нм (Santa Cruz Biotechnology, CA, № по каталогу sc-101 AF647) и 4H11 или Integrin β1(4B7R)-Alexa Fluor 647 нм (Santa Cruz Biotechnology, CA, № по каталогу sc-9970 AF647) и 4H11 в течение 30 минут при 4°C. Клетки промывали в FACS буфере три раза и затем метили IgG2b-PE козы против мыши (Santa Cruz Biotechnology, CA, № по каталогу sc-3766-PE) в течение 30 минут при 4°C. Клетки промывали в FACS буфере три раза и получали изображения на Zeiss Axio Observer Z1 с использованием 20×/0,8NA воздушного и 63×/1,4NA масляного объектива и регистрирующего программного обеспечения ZEN2.
6.3.5 СТАТИСТИЧЕСКИЙ АНАЛИЗ
[00619] Для того чтобы сравнивать группы, оцениваемые в исследованиях роста и инвазии in vitro и in vivo, данные анализировали на статистическую значимость с использованием двустороннего критерия Стьюдента и программного обеспечения GraphPad Prism (San Diego, CA).
6.3.6 КЛЕТОЧНАЯ КУЛЬТУРА, ТРАНСФЕКЦИЯ И ОПРЕДЕЛЕНИЕ ХАРАКТЕРИСТИК КЛЕТОЧНОЙ ЛИНИИ
[00620] См. источник 3 в разделе 6.3.13 в отношении клеточной линии OVCA-433. Тетрациклин-индуцибельную систему pLenti приобретали в Invitrogen, CA (№ по каталогу K4925-00) и использовали для того, чтобы создавать pLenti-SKOV3c114. Нокаут шпилечной shRNA для EGFR-экспрессирующих вирусных плазмид получали с помощью Memorial Sloan Kettering Cancer Center High Throughput Screening (HTS) Core Facility; трансфицировали клетки HEK293 и собирали вирусные супернатанты с клеток HEK293 для того, чтобы инфицировать клеточные линии pLenti-SKOV3c114-shEGFR. MUC16c114 трансфектанты имели на клеточной поверхности экспрессию белка MUC16 от предполагаемого сайта расщепления до карбоксиконца (аминокислоты с 1777 до 1890 из SEQ ID № 150) (см. источник 21 в разделе 6.3.13, далее). Клеточные линии с более длинными фрагментами MUC16 получали схожим образом, включая линии с экспрессией вектора MUC16c344-GFP, которые имеют на клеточной поверхности экспрессию белка MUC16 в виде 344-аминокислотного фрагмента, идущего до карбоксиконца MUC16 (аминокислоты с 1547 до 1890 из SEQ ID № 150) (см. источники 19 и 22 в разделе 6.3.13, далее).
6.3.7 ТРАНСФЕКЦИЯ
[00621] ДНК конструкции вводили в клетки SKOV3 с использованием DOTAP (Roche Diagnostics, Indianapolis Corporation, IN), следуя протоколу производителя. Стабильные трансфектанты отбирали с использованием 800 мкг/мл G418 для клеток SKOV3 в их средах для культивирования. Они проходили сортировку клеток по экспрессии GFP два раза, и отобранные клетки выращивали в виде линий вплоть до 15 переносов. Стандартный мониторинг FACS анализа осуществляли для того, чтобы подтверждать GFP положительность этих линий. Белковые экстракты этих линий анализировали посредством вестерн-блоттинга с использованием моноклональных антител против hrGFP (Stratagene, La Jolla, CA) и против карбоксиконца MUC16 (см. источник 19 в разделе 6.3.13, далее). Как описано в разделе 6.1, конструкции MUC16c57-114-pFUSE-hIgG1-Fc2 и117-244LGALS3-pFUSE-hIgG1-Fc2 were трансфицировали в эмбриональные клетки почки человека (HEK) FreeStyle 293F (Invitrogen, CA), которые экспрессируют и секретируют слитые белки в бессывороточные среды, в соответствии с протоколом производителя (см. раздел 6.1 и источник 19 в разделе 6.3.13, далее). Секретируемые слитые белки очищали и определяли их характеристики посредством анализа вестерн-блоттинга с использованием антитела против IgG1 человека-Fc-HRP (со специфичностью к γ1 цепи) (Southern Biotech Inc., Birmingham, AL) или 4H11-HRP или поликлонального антитела против LGALS3 человека (Abgent, San Diego, CA). Очищенные белки EGFRDDK-HIS (№ по каталогу TP700043), LGALS3Myc-DDK (№ по каталогу TP308785) и Integrin-β1Myc-DDK (№ по каталогу TP303818), экспрессируемые клетками HEK293, приобретали в Origene, Rockville, MD.
6.3.8 ИММУНОФЛУОРЕСЦЕНТНОЕ ОКРАШИВАНИЕ С ПОМОЩЬЮ FACS АНАЛИЗА
[00622] FACS анализ экспрессии MUC16 осуществляли, как описано в разделе 6.1 и источнике 6 в разделе 6.3.13, далее.
6.3.9 КРИВЫЕ РОСТА
[00623] Кривые роста получали, как описано в разделах 6.1 и 6.2 и источниках 18 и 19 в разделе 6.3.13, далее.
6.3.10 НОМЕНКЛАТУРА
[00624] Как используют в примере 3 (раздел 6.3), «N1» относится к аспарагину в положении 1777 из SEQ ID № 150, также обозначаемому как «Asn1777». Как используют в примере 3 (раздел 6.3), «N24» относится к аспарагину в положении 1800 из SEQ ID № 150, также обозначаемому как «Asn1800». Как используют в примере 3 (раздел 6.3), «N30» относится к аспарагину в положении 1806 из SEQ ID № 150, также обозначаемому как «Asn1806».
6.3.11 РЕЗУЛЬТАТЫ
6.3.11.1 Патобиология MUC16 зависит от N-гликозилирования C-концевого эктодомена MUC16
[00625] Экспрессия самых проксимальных 114 аминокислот C-концевого эктодомена MUC16 (MUC16c114) вела к более агрессивному поведению фибробластов 3T3 мыши in vitro/in vivo, включая значимое увеличение MUC16-движимой инвазии матригеля и более быстрый опухолевый рост in vivo (см. раздел 6.1 и источник 19 в разделе 6.3.13, далее). Чтобы исследовать роль эффектов MUC16 и его гликозилирования, оказываемых на клетки яичника человека, MUC16-отрицательную клеточную линия яичника человека SKOV3 исследовали на влияние экспрессии MUC16 (фиг. 18A-18C). Трансфекция клеток SKOV3 стабильным экспрессирующим MUC16c114 вектором вела к высоким уровням экспрессии MUC16 на клеточной поверхности и больше чем двукратному увеличению инвазии матригеля, как показано на фиг. 19A. 24-часовое воздействие ингибитором N-гликозилирования туникамицином на клетки сильно снижало инвазивные свойства клеток SKOV3-MUC16c114, но оказывало небольшой эффект на инвазию матригеля клетками, трансфицированными только вектором SKOV3-phrGFP (фиг. 19A).
[00626] Ранее лектины были вовлечены в опосредование эффектов гликозилирования (см. источник 17 в разделе 6.3.13, далее), и поскольку галектин-3 часто сверхэкспрессирован в злокачественных опухолях яичников человека, лектин-блокирующую конструкцию создавали посредством объединения сахарсвязывающего домена галектина-3 (117-244LGALS3) с усеченной последовательностью pFUSE-human IgG1-Fc2 (pFUSE), не содержащей вариабельный связывающий домен («117-244LGALS3-pFUSE») (см. источник 1 в разделе 6.3.13, далее). Эта химерная молекула связывает лиганды галектина-3, но не обладает способностью формировать пентамеры галектина-3. Как показано на фиг. 19A, когда эту галектин-блокирующую конструкцию вводили в клетки, она оказывала небольшой эффект на инвазию матригеля контрольными клетками SKOV3-phrGFP, но значительно снижала SKOV3-MUC16c114 инвазию. Контрольный вектор pFUSE, не имеющий сахарсвязывающего домена галектина-3, не имел эффекта. Также создавали растворимый MUC16 эктодомен, сконструированный путем связывания того же вектора pFUSE с 58 аминокислотами из эктодомена MUC16 («MUC16c57-114-pFUSE»). Как и в случае галектин-3-pFUSE(117-244LGALS3-pFUSE)-блокирующей конструкции, MUC16c57-114-pFUSE конструкция также значительно снижала инвазию для клеток SKOV3-MUC16c114, но не для клеток SKOV3-phrGFP. MGAT5 представляет собой фермент гликозилирования, который катализирует формирование тетраантенных N-гликанов с наивысшей аффинностью к связыванию галектином-3 (см. источник 9 в разделе 6.3.13, далее). Мыши с нокаутом MGAT5 устойчивы к опухолевому росту (см. источник 8 в разделе 6.3.13, далее). Без ограничения какой-либо конкретной теорией, предложена гипотеза о том, что эффекты MUC16 зависят от экспрессии как галектина-3, так и MGAT5. Как показано на фиг. 19B, shRNA, которые снижают MGAT5 или галектин-3 (LGALS3), заметно снижали SKOV3-MUC16c114 инвазию, тогда как shRNA отрицательного контроля, обеспечивающая нокдаун Lamelli, не оказывала эффекта.
[00627] Введение мутаций в участки N-гликозилирования эктодомена MUC16 (остатки аспарагина в положениях N1, N24 и N30 эктодомена MUC16c114) снижало наблюдаемые изменения, зависящие от гликозилирования MUC16. Как показано на фиг. 19C, мутация аспарагина в аланин в наиболее дистальном аспарагине (N1), смежно с сайтом расщепления, не оказывала негативного эффекта на инвазию. В отличие от этого, мутации аспарагина в аланин в любом из более проксимальных аспарагинов (N24 или N30) отрицательно влияли на инвазию. В частности, сохранение аспарагина, ближайшего к поверхности мембраны (N30), было наиболее критичным для усиления инвазии, и этот эффект существенно не увеличивался за счет дополнительных мутаций аспарагина в аланин в других остатках аспарагина. Также исследовали более крупную конструкцию MUC16 с 344 аминокислотами из C-конца MUC16 (MUC16c344). Когда экспрессирующие векторы, несущие мутации MUC16 в N30 из MUC16c344 или N24 и N30 из MUC16c344, трансфицировали в клеточную линию SKOV3, происходило значительное снижение инвазии матригеля (фиг. 19D). Несмотря на то, что эта более крупная конструкция имеет семь дополнительных участков N-гликозилирования дистально от сайта расщепления, мутации в ключевых проксимальных участках N24 и N30 все еще снижали инвазию матригеля, как показано на фиг. 19D, так же, как те мутации, которые изменяли инвазию при использовании SKOV3-MUC16c114.
[00628] Продемонстрирована активация ниже по каскаду в обоих путях ERK и PI3K/AKT при MUC16c114 трансформации клеток 3T3 (см. раздел 6.1 и источник 19 в разделе 6.3.13, далее). На фиг. 19E можно видеть, что трансфекция клеток SKOV3 с использованием MUC16c114 активировала различные онкогены, включая pERK1/2, pSRC, и фосфорилирование EGFR. Фиг. 19E демонстрирует, что каждое из следующих условий ослабляет MUC16c114-индуцированную активацию онкогена: нокдаун MGAT5 (shMGAT5), нокдаун галектина-3 (shLGALS3) и мутация аспарагина в аланин в N30. Эти данные находятся в соответствии со снижениями, наблюдаемыми при инвазии матригеля, связанной с экспрессией MUC16c114.
[00629] Эффекты нокдауна MGAT5 или LGALS3 или мутаций участков N-гликозилирования эктодомена MUC16c114 исследовали на опухолевом росте ксенотрансплантата у голых мышей. Как показано на фиг. 19F, имело место полное устранение MUC16c114-индуцированного опухолевого роста при использовании какого-либо из этих вмешательств, направленных на N-гликозилирование. Также исследовали эффект MUC16c114, оказываемый на стабильность рецепторов. Присутствие как N-гликозилирования, так и связи с галектиновым каркасом ассоциировали со стабилизацией EGFR на клеточной поверхности (см. источник 11 в разделе 6.3.13, далее). Без ограничения какой-либо конкретной теорией, полагали, что увеличенное присутствие MUC16 стабилизирует галектиновый каркас клеточной поверхности, тем самым стабилизируя EGFR на клеточной поверхности. Как показано на фиг. 20A, присутствие EGFR на клеточной поверхности клеток SKOV3 возрастало, когда стабильные SKOV3-MUC16c114 трансфектанты сравнивали с контролями, содержащими только вектор, используя FACS анализ. Кроме того, экспрессия MUC16c114 почти удваивала EGFR на клеточной поверхности после обработки циклогексимидом (CHX), чтобы ингибировать синтез новых EGFR, по сравнению с контрольным вектором phrGFP. Стабильность эктодомена MUC16c114 (4H11 положительного) не менялась под действием CHX. Общий EGFR с течением времени сравнивали в стабильных клетках SKOV3-MUC16c114 и SKOV3-phrGFP, которые обрабатывали CHX в течение 24 часов, посредством вестерн-блоттинг, и EGFR сравнивали с β-актином. Денситометрические кривые (фиг. 20B) показывали, что присутствие MUC16c114 на клеточной поверхности стабилизировало EGFR в сравнении с контрольным вектором phrGFP. Для того чтобы исключать возможность того, что этот эффект связан с выбором SKOV3-стабильных MUC16c114 клонов, использовали тетрациклин-индуцибельную MUC16c114 систему. Как показано на фиг. 20C, воздействие тетрациклина в течение 24 часов не оказывало эффекта на инвазию матригеля или контрольными клетками SKOV3, трансфицированными пустым вектором phrGFP, или стабильным MUC16c114 экспрессирующим вектором с под управлением CMV. В MUC16c114 тетрациклин-индуцибельной системе воздействие тетрациклина индуцировало MUC16c114-зависимую инвазию матригеля, схожую со стабильными трансфектантами, как контрольными, так и MUC16c114. Требование к EGFR исследовали через стабильную экспрессию конструкции shRNA (shEGFR), вводимой в клетки SKOV3, которая снижала экспрессию EGFR. Оба клона отдельных клеток для shEGFR-трансфицированных клеток демонстрировали заметно сниженную инвазию матригеля. Тетрациклин-индуцированная экспрессия MUC16c114 в этих двую shEGFR клеточных линиях оказывала минимальный эффект на инвазию матригеля по сравнению с SKOV3-MUC16c114 клеточными линиями, подтверждая, что SKOV3-MUC16c114-индуцированная инвазия матригеля была созависимой от экспрессии EGFR. Стабильность EGFR в тетрациклин-индуцированном SKOV3-MUC16c114, обработанном CHX, исследовали посредством вестерн-блоттинга и сравнивали с β-актином. Как показано на фиг. 20D, воздействие CHX в течение 24 часов вело к устойчивому спаду общего белка EGFR в не индуцированных MUC16(-) клетках SKOV3. Когда тот же эксперимент осуществляли после тетрациклиновой индукции SKOV3-MUC16c114(tet) клеток, CHX-индуцированный уровень утраты EGFR был снижен. MUC16 не только стабилизировал содержание EGFR в клетках, он также стабилизировал уровни экспрессии pEGFR в тетрациклин-индуцированных SKOV3-MUC16c114(tet) клетках по сравнению с не индуцированными SKOV3-MUC16c114(tet) клетками (фиг. 21).
6.3.11.2 Синтез гомогенных N-гликопептидов в качестве имитаторов эпитопов для разработки моноклональных антител (mAb)
[00630] Идентифицировав N-гликозилирование в участках N24 и N30 в MUC16c114 в качестве центрального требования для действия MUC16, анализировали гликановый профиль мутированного гликопептида MUC16c114, содержащего мутации аланина в аспарагин в N1 и N24, который очищали от клеточной линии SKOV3-MUC16c114 (фиг. 22). Этот очищенный гликопептид, таким образом, содержал один остаток аспарагина (N30) для N-гликозилирования. Анализ гликома очищенного гликопептида представлен на фиг. 22A. Его характеристики определяли с помощью паттерна разнообразного N-гликозилирования, содержащего главным образом усеченные гликозилированные соединения, которые имели общий проксимальный дисахарид хитобиозу (GlcNAc2) в качестве минимального повторяющегося звена, к которому прикрепляют фукозные и различные маннозные остатки (фиг. 22A).
[00631] Предложена гипотеза о том, что антитела, нацеленные на эпитоп MUC-16-эктодомена, содержащий ключевой участок гликозилирования N30, могут ингибировать взаимодействие MUC16 с галектиновым каркасом, снижая нежелательные эффекты экспрессии MUC16, включая опухолевый рост и инвазию. Таким образом, конструировали синтетические пептидные антигены различной длины (т. е., 55, 18 и 15 аминокислоты в длину; SEQ ID №№ 129, 131 и 130, соответственно) в эктодомене MUC16, гликозилированные хитобиозой по этому участку N30. Помимо того, что она представляет собой минимальный мотив, общий для более крупных, более сложных N-гликанов, дисахарид хитобиоза также должен быть способен к улучненной экспозиции подлежащего пептида для того, индуцировать антитела, направленные на гликан, которые сохраняют пептидную специфичность.
[00632] Синтез N-гликопептидного 55-мера MUC16-эктодомена (GlcNAc2-55-мер; SEQ ID № 129) был очень конвергентным и включал соединение между полноразмерным пептидом (55-мером), защищенным в целях удобства, и амином хитобиозы, после чего следовало кислое глобальное снятие защитных групп с использованием процедуры аспартилирования/снятия защитных групп авторов изобретения в одной колбе (см. разделы 6.2 и 6.4 и источники 7 и 20 в разделе 6.3.13, далее). Придерживаясь схожего подхода, с помощью конвергентного аспартилирования, также получали более сложный Man3GlcNAc2-гликопептидный 55-мер, несущий концевой гликан триманнозу.
[00633] Для того чтобы фокусировать иммунный ответ против эпитопа меньшего размера около релевантного участка гликозилирования, также синтезировали более короткие гликопептидные 15-мер и 18-мер, несущие один (N30) и два хитобиозных гликана (N24 и N30), соответственно (фиг. 22C; SEQ ID №№ 131 и 130, соответственно), последний по аналогии с кластерным представлением антигена Tn (GalNAc-α-O-Ser/Thr), который, как показано, необходим для связывания с некоторыми mAb (см. разделы 6.2 и 6.4 и источники 14-16 в разделе 6.3.13, далее). Эти гликопептиды затем конъюгировали с белком-переносчиком KLH через N-концевой цистеин для того, чтобы генерировать соответствующие иммуногены для вакцинации мышей.
6.3.11.3 Вакцинация мышей синтетическими гликопептидами/гликоконъюгатами и серологический анализ
[00634] Вакцинацию мышей и сбор сывороток осуществляли в соответствии с протоколом, описанным в разделах 6.2 и 6.4. После 3 иммунизаций GlcNAc2-гликопептидным 55-мером (SEQ ID № 129, фиг. 22B), за которыми следовала иммунизация равной смесью несущих хитобиозу, KLH-конъюгированных конструкций (моногликозилированный 15-мер (SEQ ID № 131) и бис-гликозилированный 18-мер (SEQ ID № 130)), только 2 из 10 мышей демонстрировали слабые положительные ELISA сигналы к обоим 55-мерам (с и без GlcNAc2 (SEQ ID № 129)), что подсказывает, что мыши имели ограниченный иммунный ответ на иммунизации 55-мерами. Две дополнительные реиммунизации с использованием обоих KLH-конъюгатов (GlcNAc2-15-мер (SEQ ID № 131) и (GlcNAc2)2-18-мер (SEQ ID № 130)) вели к усиленным иммунным ответам (типа IgG) на более короткие гликопептиды, в частности, у двух мышей (мышь 7 и мышь 8). mAb 4H11, направленное на другую, не гликозилированную часть пептидного остова MUC16, не демонстрировало связывание с гликопептидными 15-мером/18-мером, что указывает на определенный распознаваемый эпитоп отдельно от положительности сывороток мышей.
[00635] Характеристики поликлональной сыворотки от мыши 7 дополнительно определяли с помощью ELISA, и с помощью FACS проводили скрининг нескольких клеточных линий с экспрессией MUC16c114 и без нее. Эти исследования по сортировке клеток подтверждали положительные сигналы как для клеток SKOV3-MUC16c114, так и для клеток OVCAR3, подобно контрольному антителу 4H11 против MUC16 (см. источник 6 в разделе 6.3.13, далее). Контрольные клетки SKOV3-phrGFP, не имеющие MUC16, были отрицательными по связыванию с сывороткой мыши 7.
6.3.11.4 Отбор mAb, направленных на гликозилирование
[00636] Получали селезенку мыши 7 и спленоциты сливали с гибридомным партнером слияния с высокой эффективностью слияния. Супернатанты отбирали и осуществляли их скрининг по реактивности с помощью ELISA против индивидуальных гликопептидов (фиг. 22C). Несмотря на то, что несколько супернатантов реактивны к гликопептидным GlcNAc2-15-меру и (GlcNAc2)2-18-меру, ни один из гибридомных супернатантов, скрининг которых осуществляли, не демонстрировал высокую степень избирательности к гликозилированным относительно не гликозилированных пептидов в ELISA скрининге. Сохранялась специфичность к MUC16 и ни один из положительных супернатантов не был реактивен к нерелевантным пептидам, гликозилированным хитобиозой. Не наблюдали перекрытия с пептидной последовательностью, распознаваемой mAb 4H11.
[00637] После серийного субклонирования, процесс давал несколько первичных mAb, направленных на хитобиозу, которые реактивны с MUC16-гликозилированными эпитопами и гомологичными не гликозилированными последовательностями, но не несущими хитобиозу нерелевантными пептидами, служащими в качестве отрицательного контроля. Из этого пула отбирали четыре антитела с высокой аффинностью, и дополнительно очищали их для определения характеристик.
6.3.11.5 Определение характеристик mAb, нацеленных/направленных против N30-гликозилированного MUC16
[00638] Результаты подтверждающих исследований по определению характеристик для четырех репрезентативных антител представлены с помощью ELISA на фиг. 23A. Связывание кандидатных антител с различными синтетическими пептидами оценивали и сравнивали со связыванием антитела 4H11, которое распознает пептидный остов MUC16-эктодомена. Не родственные пептиды, связанные с хитобиозой, не демонстрировали значимого связывания каким-либо из выбранных антител против гликан-MUC16. Все кандидатные антитела демонстрировали схожие аффинности связывания с обоими 15-мерами, происходящими из MUC16 (т. е. не гликозилированным пептидом и соответствующим хитобиозным гликопептидом). Дополнительные синтетические гликопептиды, несущие фрагменты альтернативных сахаров, в том числе один GlcNAc, концевую триманнозу-хитобиозу (Man3GlcNAc2) и фукозилированную хитобиозу (GlcNAc2Fuc), по существу не изменяли реактивность антител к пептидам MUC16, связанным с хитобиозой, которые использовали для иммунизации.
[00639] Каждое антитело также тестировали на специфичности к гликан-MUC16c114 и гликан-MUC16c344 на расширенной панели клеточных линий, экспрессирующий по-разному гликозилированные пептиды MUC16 (таблица 11). В этих исследованиях SKOV3-phrGFP трансфектанты сравнивали с SKOV3-MUC16c114 (полное N-гликозилирование), мутантами SKOV3-MUC16N24c114 (без участка гликозилирования N24), SKOV3-MUC16N30c114 (без участка гликозилирования N30) и SKOV3-MUC16N1-N24-N30c114 (без участков гликозилирования N1, N24 или N30). SKOV3-MUC16c114 относится к клеткам SKOV3, экспрессирующим усеченную форму MUC16, который способен к N-гликозилированию по N1, N24 и N30. SKOV3-MUC16N24c114 относится к клеткам SKOV3, экспрессирующим усеченную мутантную форму MUC16, в которой положение аминокислоты, соответствующей Asn1800 из SEQ ID № 150, содержит мутацию аспарагина в аланин, и, таким образом, не способной к N-гликозилированию в этом положении. SKOV3-MUC16N30c114 относится к клеткам SKOV3, экспрессирующим усеченную мутантную форму MUC16, в которой положение аминокислоты, соответствующее Asn1806 из SEQ ID № 150, содержит мутацию аспарагина в аланин, и, таким образом, не способной к N-гликозилированию в этом положении. SKOV3-MUC16N1-N24-N30c114 относится к клеткам SKOV3, экспрессирующим усеченную мутантную форму MUC16, в которой положения аминокислот, соответствующие Asn1777, Asn1800 и Asn1806 из SEQ ID № 150, содержат мутации аспарагина в аланин, и, таким образом, не способную к N-гликозилированию в этих положениях. Как и в случае данных ELISA, результаты показывали, что имела место MUC16-специфичная нацеленность.
[00640] Однако, в отличие от данных ELISA, утрата обоих участков гликозилирования N24 и N30 в эктодомене MUC16 снижала реактивность антител, нацеленных на гликозилирование, тогда как реактивность антитела 4H11 сохранялась, тем самым подтверждая присутствие SKOV3-MUC16c114 на клеточной поверхности. Клетки, несущие C-концевую цепь MUC16, продленную до 344 аминокислот (например SKOV3-MUC16c344), также имели схожее требование к гликозилированию N24 или N30 (таблица 11). Кроме того, реактивность антител против эктодомена гликан-MUC16 не уменьшалась за счет понижающей регуляции MGAT5 (таблица 11), что подтверждает, что хитобиоза в участках N24/N30 вносит вклад в связывание антитела с целыми клетками, независимо от более сложного ветвления.
[00641] Таблица 11. В таблице 11 приведено геометрическое среднее флуоресценции фикоэритрина (PE) из 4H11 и четырех моноклональных антител к эктодомену GlcNAc2-MUC16 при SKOV3-MUC16 трансфекции с модификациями участков N-гликозилирования. 4H11 сохраняет связывание со всеми клеточными линиями (за исключением линии SKOV3-phrGFP, которая не экспрессирует MUC16), независимо от модификации гликозилирования, таким образом подтверждая белок MUC16 на клеточной поверхности. При утрате обоих участков гликозилирования N24 и N30 имело место снижение связывания антител к гликан-MUC16 для обоих MUC16c114 и MUC16c344 трансфектантов. Ограниченная утрата реактивности к клеточной линии с MGAT5 нокдауном подтверждала, что хитобиоза важна для каждого антитела к эктодомену GlcNAc2-MUC16, тогда как более обширное ветвление имело ограниченный эффект.
«G против M» относится к антителу козы против мыши. «PE» относится к фикоэритрину.
[00642] Четыре репрезентативных антитела к гликозилированному MUC16 (18C6, 10C6, 19C11, 7B12), характеристики которых определяли, оценивали вместе с 4H11 на аффинность связывания (таблица 12) и их эффект, оказываемый на инвазию посредством матригелевого анализа с SKOV3-MUC16c114 трансфектантами. Как показано на фиг. 23B-23D, новые разработанные антитела демонстрировали обширное ингибирование инвазии матригеля, тогда как 4H11 отличался своей неспособностью блокировать опосредованную SKOV3-MUC16c114 инвазию, что указывает на то, что эти антитела, нацеленный на эпитопы гликозилированного пептида в эктодомене MUC16, ингибировали некоторые из ключевых биологических свойств MUC16 лучше, чем антитела, нацеленные на близко смежные эпитопы. Все антитела к гликозилированному MUC16 были ингибирующими в клетках раке яичника, экспрессирующих нативный полноразмерный MUC16, таких как клетки CAOV3 и OVCA-433. Это подсказывает, что участки гликозилирования N24/N30 критичны для усиленных инвазивных свойств MUC16, тогда как присутствие других участков N- и O-гликозилирования MUC16 было недостаточным для преодоления блокирования антителом к гликозилированному MUC16 этого критичного эпитопа. Без ограничения какой-либо конкретной теорией, можно предсказать, что ингибирование антителом N24/30 связывания галектина-3 с MUC16 также будет ослаблять стабилизацию EGFR на клеточной поверхности. На фиг. 23B-23D показано, что когда одно из этих антител (10C6) вводили в клеточную культуру, преодолевали эффект стабилизации EGFR от тетрациклин-индуцированного SKOV3-MUC16c114(tet), и степень утраты EGFR в обработанных CHX клетках схож с таковым у не индуцированных SKOV3-MUC16c114(tet) клеточных линий без экспрессии MUC16c114. Иммуногистохимическое окрашивание антителами также исследовали в тканевых микропанелях раке яичников. Как показано на фиг. 23E, каждое из антител, направленных на гликан, к эктодомену MUC16 связывалось с клетками серозной раке яичника в фиксированной парафином ткани с ограниченным взаимодействием с другой стромальной тканью, подобно поведению 4H11. Наконец, у мышей с ослабленным иммунитетом тестировали эффект антитела 10C6, оказываемый на рост SKOV3-MUC16344. Клетки SKOV3-MUC16c344 использовали вместо клеток SKOV3-MUC16c114 в качестве более строгого теста эффекта антитела в MUC16-положительных опухолевых клетках с несколькими участками N- и O-гликозилирования. Антитело 10C6 снижало инвазию матригеля MUC16c344 клетками (фиг. 23F) и значительно снижало рост опухолевых клеток SKOV3-MUC16c344 в боку мыши при введении мышам-опухоленосителям два раза в неделю (фиг. 23G).
[00643] Таблица 12.
* низкая достоверность вычисления, без подгонки для скорости диссоциации;
** ka слишком низка для определения скорости ассоциации.
6.3.11.6 Галектин-зависимая совместная локализация MUC16 и других белков клеточной поверхности
[00644] MUC16-стабилизированный EGFR, по-видимому, является важным драйвером инвазии клеток раке яичника, и это взаимодействие зависит от EGFR, надлежащим образом N-гликозилированного эктодомена белка MUC16 и присутствия галектина-3. Это взаимодействие оценивали с использованием очищенных белков для того, чтобы устанавливать необходимое/достаточное трехстороннее взаимодействие между этими тремя белками. С этой целью, использовали очищенный белок MUC16c57-114-pFUSE (полученный в эмбриональных клетках почки человека [HEK] FreeStyle 293F) (в качестве MUC16 стороны взаимодействия), очищенный белок EGFR (полученный с помощью клеток HEK293) и очищенный галектин-3 (LGALS3; полученный с помощью клеток HEK293). Поскольку эти белки получали в клетках человека, ожидали, что они несут типичные нативные гликозилированные соединения. Без ограничения какой-либо конкретной теорией, предложена гипотеза о том, что три белка будут формировать гетеромеры, которые можно идентифицировать посредством иммунокопреципитации. На фиг. 24A проиллюстрированы результаты этой иммунокопреципитации, в которой каждый из трех обнаруженных белков показан в прямом иммуноблоте на трех левых дорожках. Используя гранулы Agarose Protein A/G PLUS, можно видеть, что белок MUC16c57-114-pFUSE связывался с Protein A/G PLUS-конъюгированными гранулами и присутствовал в элюате при разделении на SDS-PAGE геле. EGFR присутствовал только в объединенном элюате с MUC16c57-114-pFUSE, когда галектин-3 (LGALS3) также присутствовал. Антитело 18C6 устраняло взаимодействие EGFR-MUC16 посредством блокирования N-гликозилированного сайта связывания галектина-3 (см. фиг. 24A). Прямую молекулярную двойную иммунофлуоресцентную визуализацию также использовали для того, чтобы подтверждать совместную локализацию EGFR и MUC16 в живых клетках. Как показано на фиг. 24B и фиг. 25A, EGFR и MUC16 тесно совместно локализованы в клеткахOVCAR3, SKOV3-MUC16c344 и SKOV3-MUC16c114 (см. стрелки на фиг. 24B и 25A). Эти исследования убедительно подтверждали, что MUC16 объединяется с галектином-3 для ассоциации с EGFR на поверхности MUC16-положительных клеток раке яичника. Без ограничения какой-либо конкретной теорией, поскольку многие усиливающие рост рецепторы гликозилированы, пришли к выводу, что лектин-зависимые эффекты MUC16 клеточной поверхности могут включать другие N-гликозилированные белки и не ограничиваться EGFR. Белки интегрины часто изменены в злокачественных опухолях и участвуют в передаче сигналов «снаружи-внутрь», которые инициированы стромально-эпителиальными взаимодействиями, запускающими SRC фосфорилирование и другие эффекты ниже по каскаду. На фиг. 24C изображены взаимодействия MUC16 с интегрином β1, компонент интегрина часто связан с развитием и прогрессированием раке. Как в случае EGFR, очищенный MUC16c57-114-pFUSE связывался с интегрином β1 галектин-3-зависимым образом, и это гетеротримерное взаимодействие требовало всех 3 белков. Как и в случае EGFR, взаимодействие полностью блокировалось блокирующим антителом 18C6 против участка гликозилирования MUC16c114. Совместную локализацию MUC16 и интегрина β1 также подтверждали посредством двойной иммунофлуоресценции в нескольких клеточных линиях рака яичников (фиг. 24D и фиг. 25B). Таким образом, N-гликозилирование в ключевых участках на пептидных эпитопах эктодомена MUC16 опосредовало взаимодействие с белковыми рецепторами клеточной поверхности лектин-специфичным образом для того, чтобы создавать характеристики озлокачествленного поконтроля, включая инвазию матригеля, активацию путей PI3K/ERK и SRC, а также усиленный MUC16-положительный опухолевый рост у мышей с ослабленным иммунитетом.
[00645] Без ограничения каким-либо конкретным механизмом, механистическая модель для муцина, связанного со злокачественной опухолью, MUC16, и его эффекта, оказываемого на поведение клеток раке яичника, представлена на фиг. 26. На фиг. 26A MUC16 связывается с EGFR и интегрином β1 через галектин-3 для того, чтобы усиливать стабильность и сигналы «изнутри-наружу», которые содействуют росту и инвазии. Когда мутированы участки N-гликозилирования эктодомена MUC16 или супрессирована активность MGAT5 (фиг. 26B), связывание предотвращено и сигналы EGFR/интегрин ослаблены. Аналогичным образом, если сурпессирована экспрессия белка галектина-3 (фиг. 26C), молекулярная ассоциация утрачена, а сигналы и инвазия ослаблены. Наконец, когда химерные антитела к эктодомену MUC16 или химерные «TRAP» LGALS3 молекулы препятствуют молекулярному взаимодействию, клетка раке испытывает недостаток каких-либо из наблюдаемых свойств MUC16, способствующих опухоли (фиг. 26D).
6.3.12 ОБСУЖДЕНИЕ
[00646] MUC16 и другие связанные муцины, такие как MUC1 и MUC4, могут трансформировать клетки 3T3 и связаны с нежелательными исходами. Механизмы аберрантно экспрессируемых муцинов в раке сложны и разнообразны. Точно описано, что паттерны N-гликозилирования играют важные роли в росте клеток в ответ на локальное окружение. На разнообразие гликопротеиновых паттернов влияет зависящий от окружения поток гексозаминов через гликозилирование, основанное на аппарате Гольджи. Обычные рецепторы факторов роста, такие как EGFR, рецептор инсулиноподобного фактора роста (IGF1R) и PDGFR, предпочтительно сначала подвергаются гликозилированию зависимым от питательных веществ образом, и эти сильно гликозилированные рецепторы предпочтительно доставляются на клеточную поверхность. В отличие от этого, ингибирующие рецепторы, такие как TGF-β, имеют меньше участков N-гликозилирования, и их представление на клеточной поверхности происходит позже, с последующим ингибированием программы роста (см. источник 12 в разделе 6.3.13, далее). В раке яичников экспрессия EGFR связана с инвазивным поведением и передача сигналов EGFR зависит от состояния гликозилирования рецепторов и аффинности N-гликозилированных соединений к лектинам (см. источник 2 в разделе 6.3.13, далее). Фермент MGAT5, по-видимому, является ключевым для синтеза тетраантенных разветвленных N-гликанов, которые обладают наивысшей аффинностью к галектину-3, важному лектину, сверхэкспрессированному в клетках раке (см. источник 17 в разделе 6.3.13, далее).
[00647] В этом примере приведено доказательство того, что поведение, связанное с экспрессией MUC16, опосредовано через эти процессы на конкретных участках N-гликозилирования на наиболее проксимальной области эктодомена MUC16 относительно клеточной поверхности. MGAT5-зависимые паттерны N-гликозилирования необходимы для высокоаффинного взаимодействия с галектином-3 и белками клеточной поверхности, чтобы способствовать инвазии, активации онкогена и повышенному опухолевому росту у мышей с ослабленным иммунитетом. В частности, N-гликозилирование в самых проксимальных участках на остающемся эктодомене MUC16 после отщепления критически важно для этого взаимодействия. Все вмешательства, которые удаляли эти участки N-гликозилирования, блокировали участки с использованием имитационных рецепторов или препятствовали их полному N-гликозилированию, ослабляли трансформирующие эффекты MUC16. Эти трансформирующие эффекты, похоже, зависят не только от одного MUC16, но также от взаимодействия N-гликозилированного MUC16 с галектином-3 и другими белками клеточной поверхности в проксимальных участках N-гликозилирования. Показано, что экспрессия эктодомена MUC16 стабилизировала EGFR, медиатор роста и инвазии, и продлевала его присутствие на поверхностях SKOV3-MUC16c114 клеток, по сравнению с исходными клетками SKOV3phrGFP. Даже в упрощенной модели гликопептида MUC16, сохраняющей только один участок N-гликозилирования, стохастический характер гликозилирования вел к присутствию различных N-гликанов, все из который связаны с белковым остовом MUC16 через общий стебель хитобиозы. Таким образом, получали антитела против связанного с хитобиозой эпитопа гликан-пептида MUC16c114 (в участках N24/N30) эктодомена MUC16. Эти новые антитела (антитела к гликозилированному MUC16) блокировали усиленную MUC16 инвазию, активацию онкогена и опухолевый рост in vivo. Что важно, эти антитела к гликозилированному MUC16 ингибировали связанные с MUC16 свойства в клетках с полноразмерной экспрессией MUC16, а также тестовых усеченных конструкций с экспрессией более короткого C-конца MUC16. Антитела к гликозилированному MUC16 препятствовали стабилизации EGFR клеточной поверхности раке яичников в присутствии CHX и ослабляли рост трансплантата у голых мышей. Кроме того, эффект антител к гликозилированному MUC16 также предотвращал взаимодействие очищенного MUC16 с очищенным EGFR или интегрином β1 в присутствии рекомбинантного галектина-3.
[00648] В этом примере раскрыты идеи о роли сверхэкспрессии муцина в раке. Через формирование лектин-опосредованных низкоаффинных мультимолекулярных комплексов, MUC16 способен усиливать сигнальную трансдукцию «снаружи-внутрь» зависимым от гликозилирования образом. Конкретные участки N-гликозилирования, отвечающие за максимальный эффект, уникальны и близки к клеточной поверхности, тогда как другие, более дистальные участки N-гликозилирования могли быть менее важными. Ингибиторы галектина-3 проходят клинические испытания, но конструкция имитационного рецептора «галектин-3-TRAP» или усеченные «MUC16-TRAP» молекулы имели схожий эффект в моделях in vitro из этого примера. Антитела к гликозилированному MUC16, идентифицированные в этом примере, ингибировали трансформирующие эффекты MUC16.
6.3.13 ИСТОЧНИКИ
[00649] 1. Ahmad, N., Gabius, H. J., Andre, S., Kaltner, H., Sabesan, S., Roy, R., Liu, B., Macaluso, F., and Brewer, C. F. (2004). Galectin-3 precipitates as a pentamer with synthetic multivalent carbohydrates and forms heterogeneous cross-linked complexes. J Biol Chem 279, 10841-10847.
[00650] 2. Alper, O., Bergmann-Leitner, E. S., Bennett, T. A., Hacker, N. F., Stromberg, K., and Stetler-Stevenson, W. G. (2001). Epidermal growth factor receptor signaling and the invasive phenotype of ovarian carcinoma cells. J Natl Cancer Inst 93, 1375-1384.
[00651] 3. Bast, R. C., Jr., Feeney, M., Lazarus, H., Nadler, L. M., Colvin, R. B., and Knapp, R. C. (1981). Reactivity of a monoclonal antibody with human ovarian carcinoma. The Journal of clinical investigation 68, 1331-1337.
[00652] 4. Burton, D. R., and Mascola, J. R. (2015). Antibody responses to envelope glycoproteins in HIV-1 infection. Nat Immunol 16, 571-576.
[00653] 5. Dharma Rao, T., Park, K. J., Smith-Jones, P., Iasonos, A., Linkov, I., Soslow, R. A., and Spriggs, D. R. (2010). Novel monoclonal antibodies against the proximal (carboxy-terminal) portions of MUC16. Appl Immunohistochem Mol Morphol 18, 462-472.
[00654] 6. Fernandez-Tejada, A., Vadola, P. A., and Danishefsky, S. J. (2014). Chemical synthesis of the β-subunit of human luteinizing (hLH) and chorionic gonadotropin (hCG) glycoprotein hormones. J Am Chem Soc 136, 8450-8458.
[00655] 7. Granovsky, M., Fata, J., Pawling, J., Muller, W. J., Khokha, R., and Dennis, J. W. (2000). Suppression of tumor growth and metastasis in Mgat5-deficient mice. Nat Med 6, 306-312.
[00656] 8. Hirabayashi, J., Hashidate, T., Arata, Y., Nishi, N., Nakamura, T., Hirashima, M., Urashima, T., Oka, T., Futai, M., Muller, W. E., et al. (2002). Oligosaccharide specificity of galectins: a search by frontal affinity chromatography. Biochim Biophys Acta 1572, 232-254.
[00657] 9. Hollingsworth, M. A., and Swanson, B. J. (2004). Mucins in cancer: protection and control of the cell surface. Nat Rev Cancer 4, 45-60.
[00658] 10. Lajoie, P., Partridge, E. A., Guay, G., Goetz, J. G., Pawling, J., Lagana, A., Joshi, B., Dennis, J. W., and Nabi, I. R. (2007). Plasma membrane domain organization regulates EGFR signaling in tumor cells. J Cell Biol 179, 341-356.
[00659] 11. Lau, K. S., Partridge, E. A., Grigorian, A., Silvescu, C. I., Reinhold, V. N., Demetriou, M., and Dennis, J. W. (2007). Complex N-glycan number and degree of branching cooperate to regulate cell proliferation and differentiation. Cell 129, 123-134.
[00660] 12. Mascola, J. R., and Haynes, B. F. (2013). HIV-1 neutralizing antibodies: understanding nature's pathways.Immunol Rev 254, 225-244.
[00661] 13. Mazal, D., Lo-Man, R., Bay, S., Pritsch, O., Deriaud, E., Ganneau, C., Medeiros, A., Ubillos, L., Obal, G., Berois, N., et al. (2013). Monoclonal antibodies toward different Tn-amino acid backbones display distinct recognition patterns on human cancer cells. Implications for effective immuno-targeting of cancer. Cancer Immunol Immunother 62, 1107-1122.
[00662] 14. Nakada, H., Inoue, M., Numata, Y., Tanaka, N., Funakoshi, I., Fukui, S., Mellors, A., and Yamashina, I. (1993). Epitopic structure of Tn glycophorin-a for an anti-Tn antibody (Mls-128). Proc Natl Acad Sci USA 90, 2495-2499.
[00663] 15. Osinaga, E., Bay, S., Tello, D., Babino, A., Pritsch, O., Assemat, K., Cantacuzene, D., Nakada, H., and Alzari, P. (2000). Analysis of the fine specificity of Tn-binding proteins using synthetic glycopeptide epitopes and a biosensor based on surface plasmon resonance spectroscopy. FEBS Lett 469, 24-28.
[00664] 16. Partridge, E. A., Le Roy, C., Di Guglielmo, G. M., Pawling, J., Cheung, P., Granovsky, M., Nabi, I. R., Wrana, J. L., and Dennis, J. W. (2004). Regulation of cytokine receptors by Golgi N-glycan processing and endocytosis. Science 306, 120-124.
[00665] 17. Rao, T. D., Rosales, N., and Spriggs, D. R. (2011). Dual-fluorescence isogenic high-content screening for MUC16/CA125 selective agents. Mol Cancer Ther 10, 1939-1948.
[00666] 18. Rao, T. D., Tian, H., Ma, X., Yan, X., Thapi, S., Schultz, N., Rosales, N., Monette, S., Wang, A., Hyman, D. M., et al. (2015). Expression of CARboxy-terminal portion of MUC16/CA125 induces transformation and tumor invasion. PLoS One 10, e0126633.
[00667] 19. Strausberg, R. L., Feingold, E. A., Grouse, L. H., Derge, J. G., Klausner, R. D., Collins, F. S., Wagner, L., Shenmen, C. M., Schuler, G. D., Altschul, S. F., et al. (2002). Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences. Proc Natl Acad Sci USA 99, 16899-16903.
[00668] 20. Wang, P., Aussedat, B., Vohra, Y., and Danishefsky, S. J. (2012). An advance in the chemical synthesis of homogeneous N-linked glycopolypeptides by convergent aspartylation. Angew Chem Int Edit 51, 11571-11575.
[00669] 21. Yin, B. W., Dnistrian, A., and Lloyd, K. O. (2002). Ovarian cancer antigen CA125 is encoded by the MUC16 mucin gene. Int J Cancer 98, 737-740.
[00670] 22. Yin, B. W., and Lloyd, K. O. (2001). Molecular cloning of the CA125 ovarian cancer antigen: identification as a new mucin, MUC16. J Biol Chem 276, 27371-27375.
6.4 ПРИМЕР 4: ДОПОЛНИТЕЛЬНАЯ ХИМИЧЕСКАЯ ИНФОРМАЦИЯ
[00671] В этом примере предоставлены (a) более подробное описание определенных используемых способов и экспериментов, описанных в примерах 2 и 3 (разделы 6.2 и 6.3); и (b) дополнительная информация по сравнению с примерами 2 и 3 (разделы 6.2 и 6.3).
6.4.1 ОСНОВНЫЕ МАТЕРИАЛЫ И СПОСОБЫ
[00672] Все коммерчески доступные материалы (Aldrich, Fluka, Novabiochem) использовали без дополнительной очистки. Аминокислоты с N-α-Fmoc защитой, псевдопролиновые дипептиды, Oxyma Pure и смолу NovaSyn TG Sieber приобретали в Novabiochem. 1-[бис(диметиламино)метилен]-1H-1,2,3-триазолo[4,5-b]пиридиний 3-оксид гексафторфосфат (HATU) приобретали в Genscript. (7-азабензотриазол-1-илокси)трипирролидинофосфоний гексафторфосфат (PyAOP) приобретали в Oakwood Products, Inc. Октаацетат хитобиозы приобретали в Carbosynth Limited. Раствор TCEP (0,5 M, нейтральный pH) и гетеробифункциональныйлинкер sulfo-GMBS приобретали в Pierce, ThermoScientific. Все другие реактивы, включая гемоцианин морского блюдца (KLH) приобретали в Aldrich. Все растворители имели степень чистоты реактива или ВЭЖХ (Fisher Scientific). Безводный тетрагидрофуран, диэтиловый эфир, дихлорметан, толуол и бензол получали из системы для сухих растворителей (пропускали через колонку нейтрального оксида алюминия в атмосфере аргона) и использовали без дополнительной сушки.
[00673] Реакции осуществляли в атмосфере предварительно очищенного сухого аргона. Жидкости и растворы, чувствительные к воздуху и влаге, переносили через шприц. Подходящие углеводные реактивы сушили через азеотропное удаление воды с использованием толуола. Молекулярные сита активировали при 350°C и дробили непосредственно перед использованием, затем сушили в пламени под вакуумом. Органические растворы концентрировали при пониженном давлении посредством роторного испарения ниже 30°C. ЯМР спектры (1H и13C) регистрировали на спектрометре Bruker Advance DRX-600 MHz, и привязывали к TMS или остаточному растворителю. Масс-спектрометрический анализ низкого разрешения осуществляли с использованием масс-спектрометра JOEL JMS-DX-303-HF или масс-спектрометра Waters Micromass ZQ. Аналитическую TLC осуществляли на пластинках E. Merck silica gel 60 F254 и визуализировали под УФ светом (254 нм) или посредством окрашивания молибденатом церия аммония (CAM) или 5% серной кислотой в метаноле. Колоночную флэш-хроматографию на диоксиде кремния осуществляли on E. Merck 230-400 mesh silica gel 60.
6.4.1.1 UPLC/LC-MS анализ и очистка ВЭЖХ с обращенной фазой.
[00674] Все хроматографические разделения с обращенной фазой содержали подвижную фазу, состоящую из 0,05% трифторуксусной кислоты (TFA) (об./об.) в воде и 0,04% TFA в ацетонитриле. Мониторинг прогресса реакции осуществляли посредством UPLC-MS анализа на системе Waters Acquitytm Ultra Preformance Liquid Chromatography с фотодиодным детектором и одноквадрупольным детектором массы, оборудованной колонками Acquity UPLC BEH C18/C8/C4 (1,7 мкм, 2,1×100 мм), при скорости потока 0,3 мл/мин. Аналитические LC-MS анализы осуществляли на Waters 2695 Separations Module, оборудованном Waters 2996 Photodiode Array Detector, используя колонку Varian Microsorb C18 (150×2,0 мм), колонку Varian Microsorb C8/C4 (250×2,0 мм) или колонку Waters X-Bridge C18 (150×2,1 мм), при скорости потока 0,2 мл/мин. Препаративную ВЭЖХ очистку осуществляли на системе доставки растворителей Ranin HPLC, оборудованной детектором Rainin UV-1, используя колонку Agilent Dynamax Reverse Phase HPLC Microsorb C18/C8/C4 (250×21,4 мм) или колонку Waters X-Bridge C18 (150×19,0 мм), при скорости потока 16,0 мл/мин.
6.4.2 ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОЦЕДУРЫ
6.4.2.1 Твердофазный синтез пептидов на основе Fmoc (SPPS)
[00675] Автоматизированный синтез пептидов осуществляли на CEM Liberty Microwave Peptide Synthesizer. Пептиды синтезировали по стандартным Fmoc протоколам на смоле NovaSyn TG Sieber. Деблокирующая смесь состояла из раствора Oxyma Pure (0,1 M) в 20% пиперидине/DMF. Использовали следующие Fmoc аминокислоты из Novabiochem: Fmoc-Ala-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Asn(Dmcp)-OH, Fmoc-Asp(OMpe)-OH, Fmoc-Asp(OPp)-OH, Fmoc-Asp(OAllyl)-OH, Fmoc-Cys(Trt)-OH, Fmoc-Gln(Dmcp)-OH, Fmoc-Glu(OtBu)-OH, Fmoc-Gly-OH, Fmoc-Ile-OH, Fmoc-Leu-OH, Fmoc-Met-OH, Fmoc-Phe-OH, Fmoc-Pro-OH, Fmoc-Ser(OtBu)-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Tyr(OtBu)-OH, Fmoc-Val-OH. Использовали сдедующие Dmb (2,4-диметоксибензил) и псевдопролиновые дипептиды (Novabiochem): Fmoc-Asp(OtBu)-(Dmb)Gly-OH, Fmoc-Gly-Thr(ψMe,MePro)-OH, Fmoc-Phe-Thr(ψMe,MePro)-OH, Fmoc-Ser(tBu)-Ser(ψMe,MePro)-OH.
6.4.2.2 N-концевое ацетилирование пептид-смолы
[00676] По завершению автоматизированного синтеза в масштабе 0,1 ммоль, пептид-смолу смывали с использованием DMF (2 мл) в сосуд для синтеза пептидов и обрабатывали уксусным ангидридом (188 мкл, 2 ммоль) и DIEA (384 мкл, 2,2 ммоль) в DMF (2 мл). Смесь встряхивали посредством мягкого барботирования азота в течение 1 часа и затем промывали с использованием DMF и CH2Cl2, прежде чем подвергнуть деаллилированию.
6.4.2.3 Деаллилирование боковой цепи аспарагиновой кислоты, Asp(OAllyl), на смоле
[00677] N-ацетилированный связанный со смолой пептид (0,1 моль) обрабатывали с использованием Pd(PPh3)4 (7,5 мг, 6,5 мкмоль) и фенилсилана (75 мкл, 0,6 ммоль) в DMF/CH2Cl2 (4 мл, 1:1). После 20 минут мягкого барботирования азота обработку Pd(PPh3)4/фенилсиланом повторяли два раза. Затем пептид-смолу промывали с использованием DMF, CH2Cl2 и метанола и сушили под вакуумом.
6.4.2.4 Отщепление от смолы [и одновременное снятие защитных групп боковой цепи Asp(O-2-PhiPr), где применимо]
[00678] После сушки, на пептид-смолу воздействовали отщепляющим коктейлем (1% TFA/CH2Cl2, 4 мл) 5 циклов×5 мин, и этот процесс process повторяли четыре раза. Дополнительные последовательности отщепления включали обработку с использованием 1,5% TFA/CH2Cl2 (4 мл 5 циклов×5 мин) и 2% TFA/CH2Cl2 (4 мл 5 циклов×5 мин). Соответствующие части отщепленного раствора индивидуально собирали в ледяном Et2O и концентрировали. Соответствующие маслянистые остатки ресуспендировали в минимальном количестве трифторэтанола и преципитировали водой. Получаемые смеси незамедлительно лиофилизировали, чтобы получать неочищенные защищенные пептиды, несущие C-концевой амид.
6.4.2.5 Сочетание частично защищенного полноразмерного пептида (55-мера) с амином гликана через аспартилирование Лансбери, за которым следовало удаление неустойчивых к кислотам защитных групп с использованием коктейля R
[00679] Частично защищенный полноразмерный пептид (1,0 экв.) и амин гликана (хитобиоза: 4,0 экв.; Man3GlcNAc2 1,6 экв.) комбинировали и растворяли в безводном DMSO. В эту смесь добавляли свежий приготовленный раствор PyAOP (4,0 экв.) в DMSO, после чего следовал DIEA (6,0 экв.). Реакционную смесь перемешивали в течение 3 часов и гасили добавлением 1 мл ледяной воды (0,05% TFA). Образованный осадок выделяли посредством центрифугирования, ресуспендировали в воде/CH3CN (1:1, 0,05% TFA) и незамедлительно лиофилизировали.
[00680] Затем защищенный гликопептид подвергали глобальному кислотному снятию защитных групп посредством обработки коктейлем R (90% TFA, 5% тиоанизол, 3% этандитиол, 2% анизол) (1 мл) в течение 2 часов. Остаток осаждали ледяным Et2O (12 мл) и получаемую суспензию центрифугировали для получения белого осадка. Супернатант декантировали и осадок растирали в порошок с ледяным диэтиловым эфиром (12 мл). Этот процесс повторяли всего три раза, и получаемый преципитат растворяли в воде/CH3CN (1:1, 0,05% TFA) и лиофилизировали. Соответствующий неочищенный гликопептид очищали посредством ВЭЖХ с обращенной фазой.
6.4.2.6 Сочетание частично защищенных пептидов малых размеров (15- и 18-меров) с амином хитобиозы через аспартилирование Лансбери/двойное аспартилирование Лансбери, после чего следовало удаление неустойчивых к кислотам защитных групп
[00681] Частично защищенный пептид (1,0 экв.) и амин хитобиозы (3,0 экв./7,0 экв. для двойного аспартилирования Лансбери) объединяли и растворяли в безводном DMSO. В эту смесь добавляли свежий приготовленный раствор PyAOP (4 экв./6 экв. в последнем случае) в DMSO, после чего следовал DIEA (6 экв./8 экв., соответственно). Реакционную смесь перемешивали в течение 2,5 часа и гасили добавлением 1 мл ледяной воды (0,05% TFA). Образованный осадок выделяли центрифугированием, ресуспендировали в воде/CH3CN (1:1, 0,05% TFA) и незамедлительно лиофилизировали.
[00682] Затем защищенный гликопептид подвергали глобальному кислотному снятию защитных групп посредством обработки TFA коктейлем (94% TFA, 2,5% H2O, 2,5% EDT, 1% TIPSH) (1 мл) в течение 2 часов. Остаток преципитировали ледяным Et2O (12 мл) и суспензию центрифугировали, чтобы получать осадок белого цвета. Супернатант декантировали и осадок растирали в порошок с ледяным диэтиловым эфиром (12 мл). Этот процесс повторяли всего три раза и получаемый преципитат растворяли в воде/CH3CN (1:1, 0,05% TFA) и лиофилизировали. Соответствующий неочищенный гликопептид очищали посредством ВЭЖХ с обращенной фазой.
6.4.2.7 KLH-конъюгация с гликопептидными 15/18-мерами
[00683] KLH сначала инкубировали с гетеробифункциональным сшивателем sulfo-GMBS) в забуференном фосфатом физиологическом растворе (PBS) pH 7 в течение 2 часов. Не конъюгированный сшиватель удаляли посредством эксклюзионной хроматографии (прохождение через тонкодисперсную колонку Bio-Gel P-10, соответственно) и затем получали активированный малеимидом KLH. Свежие (глико)пептиды со снятыми защитными группами, несущими, концевую тиоловую функциональность, смешивали с малеимид-содержащим KLH в PBS pH 7 и инкубировали при комнатной температуре в течение 6 часов. По истечении этого времени не вступивший в реакцию (глико)пептид удаляли с использованием центробежного фильтра Amicon Ultra-4 (порог молекулярной массы 50000). Наконец, соответствующие конъюгаты KLH получали в виде раствора в PBS.
6.4.3 СИНТЕЗ ПОЛНОРАЗМЕРНЫХ ГЛИКОПЕПТИДОВ MUC16 (55-МЕРОВ)
6.4.3.1 Синтез полноразмерного гликопептида, несущего хитобиозу
[00684] По завершении автоматизированного синтеза в соответствии со способами в разделе 6.4.2.1, пептид-смолу подвергали N-ацетилированию и деаллилированию (см. раздел 6.4.2.2 и раздел 6.4.2.3, соответственно), чтобы предоставлять после отщепления от смолы (см. раздел 6.4.2.4) частично защищенный пептидный p55-мер[N1-S55], несущий свободную карбоновую кислоту на боковой цепи Asp30. Фракцию этого неочищенного пептида очищали посредством колоночной хроматографии на силикагеле, осуществляя элюирование с использованием 5→12% MeOH/CH2Cl2, чтобы получать пептидный p55-мер[N1-S55] (70 мг) в виде твердого вещества белого цвета после лиофилизации. На фиг. 27A изображен амид N-ацетилированного пептидного 55-мера с защитой боковой цепи. На фиг. 27B изображены кривые ESI-MS и UV из UPLC анализа для гликопептидного p55-мера[N1-S55].
[00685] В соответствии с разделом 6.4.2.6, пептидный p55-мер[N1-S55] (20 мг, 2,0 мкмоль) и аномерный амин хитобиозы (GlcNAc2) (3,5 мг, 8,1 мкмоль) объединяли и растворяли в безводном DMSO (100 мкл). Затем добавляли раствор PyAOP (4,3 мг, 8,1 мкмоль) в DMSO (30 мкл), после чего следовал DIEA (2,0 мкл, 12,2 мкмоль). Смесь золотисто-желтого цвета перемешивали в течение 3 часов, гасили посредством добавления 1 мл ледяной воды (0,05% TFA), замораживали и лиофилизировали.
[00686] Затем на защищенный гликопептид воздействовали коктейлем R (1,0 мл) в течение 2 часов, осаждали ледяным Et2O, центрифугировали, ресуспендировали и лиофилизировали, как описано в разделе 6.4.2.6. Неочищенный пептид растворяли в 25% ацетонитриле/воде (0,05% TFA) (2 мл) и очищали посредством ВЭЖХ на колонке X-Bridge C18, используя линейный градиент 25-35% ацетонитрила в воде (0,05% TFA) в течение 30 минут. Фракции, содержащие желаемый продукт, который элюировали через 20 минут, собирали и лиофилизировали, чтобы предоставлять гликопептидный «55-мер(хитобиоза)[N1-S55]» (GlcNAc2-55-мер) (3,0 мг, 22% выход) в виде твердого вещества белого цвета (фиг. 28A). На фиг. 28B предоставлены кривые ESI-MS и UV из UPLC анализа для гликопептидного «55-мер(хитобиоза)[N1-S55]» (GlcNAc2-55-мер).
6.4.3.2 Синтез полноразмерного гликопептида, несущего пентасахарид
[00687] В соответствии с разделом 6.4.2.6, пептидный p55-мер[N1-S55] (10 мг, 1,0 мкмоль) и аномерный амин пентасахарида Man3GlcNAc2 (1,5 мг, 1,6 мкмоль) объединяли и растворяли в безводном DMSO (30 мкл). Затем добавляли раствор PyAOP (2,1 мг, 4,1 мкмоль) в DMSO (5 мкл), после чего следовал DIEA (1,0 мкл, 6,1 мкмоль). Смесь золотисто-желтого цвета перемешивали в течение 3 часов, гасили добавлением 1 мл ледяной воды (0,05% TFA), замораживали и лиофилизировали.
[00688] Затем на защищенный гликопептид воздействовали коктейлем R (1,0 мл) в течение 2 часов, осаждали ледяным Et2O, центрифугировали, ресуспендировали и лиофилизировали как описано в разделе 6.4.2.6. Неочищенный пептид растворяли в 25% ацетонитриле/воде (0,05% TFA) (2 мл) и очищали посредством ВЭЖХ на колонке X-Bridge C18, используя линейный градиент 25-35% ацетонитрила в воде (0,05% TFA) в течение 30 минут. Фракции, содержащие желаемый продукт, который элюировали через 18 минут, собирали и лиофилизировали, чтобы предоставлять гликопептидный «55-мер(Man3GlcNAc2)[N1-S55]» (Man3GlcNAc2-55-мер) (1,5 мг, 20% выход) в виде твердого вещества белого цвета. На фиг. 29A изображен Man3GlcNAc2-несущий гликопептидный 55-мер: «55-мер(Man3GlcNAc2)[N1-S55]» (Man3GlcNAc2-55-мер). На фиг. 29B изображены кривые ESI-MS и UV из аналитического ВЭЖХ анализа для гликопептида «55-мер(Man3GlcNAc2)[N1-S55]» (Man3GlcNAc2-55-мер).
6.4.4 СИНТЕЗ ГЛИКОПЕПТИДОВ МЕНЬШИХ РАЗМЕРОВ (15-МЕРА И 18-МЕРА)
6.4.4.1 Синтез моногликозилированного хитобиозой 15-мера
[00689] После завершения автоматизированного синтеза в соответствии с разделом 6.4.2.1, пептид-смолу подвергали N-ацетилированию и деаллилированию (см. раздел 6.4.2.2 и раздел 6.4.2.3, соответственно), чтобы предоставлять после отщепления от смолы (см. раздел 6.4.2.4) частично защищенный пептид p15-мер[C-G25-V38], несущий свободную карбоновую кислоту на боковой цепи Asp30 (соответствующем Asn1806 из SEQ ID № 150). Фиг. 30A. Этот пептид использовали на следующей стадии без дополнительной очистки.
[00690] Пептидный p15-мер[C-G25-V38] (10 мг, 3,8 мкмоль) и аномерный амин хитобиозы (GlcNAc2) (4,8 мг, 11,3 мкмоль) объединяли и растворяли в безводном DMSO (80 мкл). Добавляли раствор PyAOP (5,9 мг, 11,3 мкмоль) в DMSO (20 мкл), после чего следовал DIEA (2,6 мкл, 15 мкмоль), и смесь золотисто-желтого цвета перемешивали в течение 2,5 часа, замораживали и лиофилизировали. Затем на защищенный гликопептид воздействовали TFA коктейлем (1 мл) в течение 2 часов, осаждали ледяным диэтиловым эфиром, центрифугировали, ресуспендировали и лиофилизировали в соответствии с разделом 6.4.2.6. Неочищенный пептид растворяли в 15% ацетонитриле/воде (0,05% TFA) (2 мл) и очищали посредством ВЭЖХ на колонке C18, используя линейный градиент 15-35% ацетонитрила в воде (0,05% TFA) в течение 30 минут. Фракции, содержащие желаемый продукт, который элюировали через 17 минут, собирали и лиофилизировали для того, чтобы предоставлять гликопептидный «15-мер(хитобиоза)[C-G25-V38]» (GlcNAc2-15-мер) (2,0 мг, 25% выход) в виде твердого вещества белого цвета. См. На фиг. 30B моногликозилированный хитобиозой гликопептидный 15-мер: 15-мер(хитобиоза)[C-G25-V38] (GlcNAc2-15-мер). На фиг. 3°C изображены кривые ESI-MS и UV из аналитического ВЭЖХ анализа для гликопептидного «15-мер(хитобиоза)[C-G25-V38]» (GlcNAc2-15-мер).
6.4.4.2 Синтез бис-гликозилированного хитобиозой 18-мера
[00691] После завершения автоматизированного синтеза в соответствии с разделом 6.4.2.1, пептид-смолу подвергали N-ацетилированию (см. 6.4.2.2). Затем отщепление от смолы и сопутствующее удаление защитных групп OPp осуществляли, следуя способам, изложенным в разделе 6.4.2.4, чтобы получать частично защищенный пептидный p18-мер[C-T22-V38], несущий свободную карбоновую кислоту на обеих боковых цепях Asp24 и Asp30 (соответствующих Asn1800 и Asn1806, соответственно, из SEQ ID № 150). Этот пептид использовали на следующей стадии без дополнительной очистки. См. фиг. 32A.
[00692] Пептидный p18-мер[C-T22-V38] (30 мг, 9,1 мкмоль) и аномерный амин хитобиозы (GlcNAc2) (27 мг, 63,4 мкмоль) объединяли и растворяли в безводном DMSO (150 мкл). Затем добавляли PyAOP (28,5 мг, 54,6 мкмоль) в DMSO (50 мкл), после чего следовал DIEA (2,6 мкл, 15 мкмоль), и смесь золотисто-желтого цвета перемешивали в течение 2,5 часа, замораживали и лиофилизировали. Затем на защищенный гликопептид воздействовали TFA коктейлем (1 мл) в течение 2 часов, осаждали ледяным диэтиловым эфиром, центрифугировали, ресуспендировали и лиофилизировали в соответствии с разделом 6.4.2.6. Неочищенный пептид растворяли в 15% ацетонитриле/воде (0,05% TFA) (6 мл) и очищали посредством ВЭЖХ на колонке C8, используя линейный градиент 15-27% ацетонитрила в воде (0,05% TFA) в течение 30 минут. Фракции, содержащие желаемый продукт, который элюировали через 15 минут, собирали и лиофилизировали для того, чтобы предоставлять гликопептидный «18-мер(хитобиоза)2[C-T22-V38]» [(GlcNAc2)2-18-мер] (6,5 мг, 25% выход) в виде твердого вещества белого цвета. См. фиг. 32B. На фиг. 32C изображены кривые ESI-MS и UV из аналитического ВЭЖХ анализа для гликопептидного «18-мер(хитобиоза)2[C-T22-V38]» [(GlcNAc2)2-18-мер].
6.5 KLH-КОНЪЮГАЦИЯ ГЛИКОПЕПТИДНЫХ 15-МЕРА И 18-МЕРА MUC16
[00693] Гликопептидные «15-мер(хитобиоза)[C-G25-V38]» и «18-мер(хитобиоза)2[C-T22-V38]» конъюгировали с KLH, придерживаясь процедуры, изложенной в разделе 6.4.2.7, чтобы получать соответствующие конъюгаты KLH, GlcNAc2-15-мер-KLH и (GlcNAc2)2-18-мер-KLH, соответственно. См. фиг. 33A и фиг. 33B.
7. ТАБЛИЦА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[00694] Таблица 13. Таблица последовательностей.
8. ЭКВИВАЛЕНТЫ
[00695] Все публикации, патенты и патентные заявки, цитируемые в этом описании, включены в настоящее описание посредством ссылки, как если бы каждая индивидуальная публикация или патентная заявка была конкретно и индивидуально указана в качестве включенной посредством ссылки. Несмотря на то, что приведенное выше изобретение описано в некоторых подробностях в качестве иллюстрации и примера для целей прозрачности понимания, специалистам в данной области будет легко видно в свете положений данного изобретения, что в нем можно выполнять определенные изменения и модификации, не отступая от сущности и объема приложенной формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MEMORIAL SLOAN-KETTERING CANCER CENTER
<120> АНТИТЕЛА ПРОТИВ MUC16 И ИХ ИСПОЛЬЗОВАНИЕ
<130> 13542-016-228
<150> 62/134,402
<151> 2015-03-17
<160> 175
<170> FastSEQ для Windows версии 4.0
<210> 1
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 VH
<400> 1
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Asn Thr Leu
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Ser Ser Lys Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Asn Val Asp Thr Ala Asp Ile Ala Thr Tyr Tyr
85 90 95
Cys Ser Arg Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 2
<211> 109
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 VL
<400> 2
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Tyr Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Met His Trp Asn Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Arg Leu Leu Ile Tyr Leu Val Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln His Ile Arg
85 90 95
Glu Leu Thr Arg Ser Glu Gly Gly Pro Ser Trp Lys Asn
100 105
<210> 3
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 HCDR1 (KABAT)
<400> 3
Thr Leu Gly Met Gly Val Gly
1 5
<210> 4
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 HCDR2 (KABAT)
<400> 4
His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ala Leu Lys Ser
1 5 10 15
<210> 5
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 HCDR3 (KABAT)
<400> 5
Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
1 5 10
<210> 6
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 LCDR1 (KABAT)
<400> 6
Arg Ala Ser Lys Ser Val Ser Thr Ser Gly Tyr Ser Tyr Met His
1 5 10 15
<210> 7
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 LCDR2 (KABAT)
<400> 7
Leu Val Ser Asn Leu Glu Ser
1 5
<210> 8
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 LCDR3 (KABAT)
<400> 8
Gln His Ile Arg Glu Leu Thr Arg Ser
1 5
<210> 9
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 HCDR1 (CHOTHIA)
<400> 9
Gly Phe Ser Leu Asn Thr Leu Gly Met
1 5
<210> 10
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 HCDR2 (CHOTHIA)
<400> 10
Trp Asp Asp
1
<210> 11
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 HCDR3 (CHOTHIA)
<400> 11
Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp
1 5 10
<210> 12
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 LCDR1 (CHOTHIA)
<400> 12
Ser Lys Ser Val Ser Thr Ser Gly Tyr Ser Tyr
1 5 10
<210> 13
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 LCDR2 (CHOTHIA)
<400> 13
Leu Val Ser
1
<210> 14
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 LCDR3 (CHOTHIA)
<400> 14
Ile Arg Glu Leu Thr Arg
1 5
<210> 15
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 HCDR1 (IMGT)
<400> 15
Gly Phe Ser Leu Asn Thr Leu Gly Met Gly
1 5 10
<210> 16
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 HCDR2 (IMGT)
<400> 16
Ile Trp Trp Asp Asp Asp Lys
1 5
<210> 17
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 HCDR3 (IMGT)
<400> 17
Ser Arg Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
1 5 10
<210> 18
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 LCDR1 (IMGT)
<400> 18
Lys Ser Val Ser Thr Ser Gly Tyr Ser Tyr
1 5 10
<210> 19
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 LCDR2 (IMGT)
<400> 19
Leu Val Ser
1
<210> 20
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6 LCDR3 (IMGT)
<400> 20
Gln His Ile Arg Glu Leu Thr Arg Ser
1 5
<210> 21
<211> 123
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 VH
<400> 21
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Val
20 25 30
Gly Met Gly Val Gly Trp Ser Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Glu Asp Lys Tyr Tyr Asn Pro
50 55 60
Ala Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln
65 70 75 80
Val Phe Leu Lys Ile Ala Asn Val Asp Thr Ala Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Thr Arg Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 22
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 VL
<400> 22
Asp Ile Val Met Thr Gln Ala Ala Pro Ser Val Ser Val Thr Pro Gly
1 5 10 15
Glu Ser Val Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Arg Lys Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Tyr Trp Phe Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Arg Leu Ile Tyr Tyr Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ser
85 90 95
Leu Glu Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Lys Ile Lys
100 105 110
<210> 23
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 HCDR1 (KABAT)
<400> 23
Thr Val Gly Met Gly Val Gly
1 5
<210> 24
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 HCDR2 (KABAT)
<400> 24
His Ile Trp Trp Asp Asp Glu Asp Lys Tyr Tyr Asn Pro Ala Leu Lys
1 5 10 15
Ser
<210> 25
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 HCDR3 (KABAT)
<400> 25
Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
1 5 10
<210> 26
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 LCDR1 (KABAT)
<400> 26
Arg Ser Ser Lys Ser Leu Arg Lys Ser Asn Gly Asn Thr Tyr Leu Tyr
1 5 10 15
<210> 27
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 LCDR2 (KABAT)
<400> 27
Tyr Met Ser Asn Leu Ala Ser
1 5
<210> 28
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 LCDR3 (KABAT)
<400> 28
Met Gln Ser Leu Glu Tyr Pro Leu Thr
1 5
<210> 29
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 HCDR1 (CHOTHIA)
<400> 29
Gly Phe Ser Leu Ser Thr Val Gly Met
1 5
<210> 30
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 HCDR2 (CHOTHIA)
<400> 30
Trp Asp Asp Glu
1
<210> 31
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 HCDR3 (CHOTHIA)
<400> 31
Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp
1 5 10
<210> 32
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 LCDR1 (CHOTHIA)
<400> 32
Ser Lys Ser Leu Arg Lys Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 33
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 LCDR2 (CHOTHIA)
<400> 33
Tyr Met Ser
1
<210> 34
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 LCDR3 (CHOTHIA)
<400> 34
Ser Leu Glu Tyr Pro Leu
1 5
<210> 35
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 HCDR1 (IMGT)
<400> 35
Gly Phe Ser Leu Ser Thr Val Gly Met Gly
1 5 10
<210> 36
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 HCDR2 (IMGT)
<400> 36
Ile Trp Trp Asp Asp Glu Asp Lys
1 5
<210> 37
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 HCDR3 (IMGT)
<400> 37
Thr Arg Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
1 5 10
<210> 38
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 LCDR1 (IMGT)
<400> 38
Lys Ser Leu Arg Lys Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 39
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 LCDR2 (IMGT)
<400> 39
Tyr Met Ser
1
<210> 40
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12 LCDR3 (IMGT)
<400> 40
Met Gln Ser Leu Glu Tyr Pro Leu Thr
1 5
<210> 41
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 VH
<400> 41
Gln Val Asn Leu Lys Glu Ser Gly Pro Gly Lys Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Leu
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Ser Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Arg Ala Thr Ser Lys Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Val Asn Val Gly Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 42
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 VL
<400> 42
Asp Ile Val Met Thr Gln Ala Ala Pro Ser Ile Pro Val Thr Pro Gly
1 5 10 15
Glu Ser Val Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Tyr Trp Phe Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Arg Leu Ile Tyr Tyr Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Gly Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Leu Glu His Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 43
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 HCDR1 (KABAT)
<400> 43
Thr Leu Gly Met Gly Val Gly
1 5
<210> 44
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 HCDR2 (KABAT)
<400> 44
His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ala Leu Lys Ser
1 5 10 15
<210> 45
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 HCDR3 (KABAT)
<400> 45
Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
1 5 10
<210> 46
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 LCDR1 (KABAT)
<400> 46
Arg Ser Ser Lys Ser Leu Leu His Ser Asn Gly Asn Thr Tyr Leu Tyr
1 5 10 15
<210> 47
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 LCDR2 (KABAT)
<400> 47
Tyr Met Ser Asn Leu Ala Ser
1 5
<210> 48
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 LCDR3 (KABAT)
<400> 48
Met Gln Gly Leu Glu His Pro Leu Thr
1 5
<210> 49
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 HCDR1 (CHOTHIA)
<400> 49
Gly Phe Ser Leu Ser Thr Leu Gly Met
1 5
<210> 50
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 HCDR2 (CHOTHIA)
<400> 50
Trp Asp Asp
1
<210> 51
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 HCDR3 (CHOTHIA)
<400> 51
Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp
1 5 10
<210> 52
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 LCDR1 (CHOTHIA)
<400> 52
Ser Lys Ser Leu Leu His Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 53
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 LCDR2 (CHOTHIA)
<400> 53
Tyr Met Ser
1
<210> 54
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 LCDR3 (CHOTHIA)
<400> 54
Gly Leu Glu His Pro Leu
1 5
<210> 55
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 HCDR1 (IMGT)
<400> 55
Gly Phe Ser Leu Ser Thr Leu Gly Met Gly
1 5 10
<210> 56
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 HCDR2 (IMGT)
<400> 56
Ile Trp Trp Asp Asp Asp Lys
1 5
<210> 57
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 HCDR3 (IMGT)
<400> 57
Ala Arg Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
1 5 10
<210> 58
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 LCDR1 (IMGT)
<400> 58
Lys Ser Leu Leu His Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 59
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 LCDR2 (IMGT)
<400> 59
Tyr Met Ser
1
<210> 60
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 19C11 LCDR3 (IMGT)
<400> 60
Met Gln Gly Leu Glu His Pro Leu Thr
1 5
<210> 61
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 VH
<400> 61
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Asn Thr Leu
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Tyr Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Asn Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 62
<211> 109
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 VL
<400> 62
Glu Leu Asp Met Thr Gln Thr Pro Pro Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Arg Ile Arg Cys Leu Ala Ser Glu Asp Ile Tyr Ser Gly
20 25 30
Ile Ser Trp Tyr Gln Gln Lys Pro Gly Lys Pro Pro Thr Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Leu Glu Ser Gly Val Pro Pro Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Gly Gly Val Gln Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Gly Tyr Ser Tyr Ser Ser
85 90 95
Thr Leu Thr Phe Gly Ala Gly Thr Asn Val Glu Ile Lys
100 105
<210> 63
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 HCDR1 (KABAT)
<400> 63
Thr Leu Gly Met Gly Val Gly
1 5
<210> 64
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 HCDR2 (KABAT)
<400> 64
His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Tyr Pro Ala Leu Lys Ser
1 5 10 15
<210> 65
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 HCDR3 (KABAT)
<400> 65
Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
1 5 10
<210> 66
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 LCDR1 (KABAT)
<400> 66
Leu Ala Ser Glu Asp Ile Tyr Ser Gly Ile Ser
1 5 10
<210> 67
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 LCDR2 (KABAT)
<400> 67
Gly Ala Ser Asn Leu Glu Ser
1 5
<210> 68
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 LCDR3 (KABAT)
<400> 68
Leu Gly Gly Tyr Ser Tyr Ser Ser Thr Leu Thr
1 5 10
<210> 69
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 HCDR1 (CHOTHIA)
<400> 69
Gly Phe Ser Leu Asn Thr Leu Gly Met
1 5
<210> 70
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 HCDR2 (CHOTHIA)
<400> 70
Trp Asp Asp
1
<210> 71
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 HCDR3 (CHOTHIA)
<400> 71
Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp
1 5 10
<210> 72
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 LCDR1 (CHOTHIA)
<400> 72
Ser Glu Asp Ile Tyr Ser Gly
1 5
<210> 73
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 LCDR2 (CHOTHIA)
<400> 73
Gly Ala Ser
1
<210> 74
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 LCDR3 (CHOTHIA)
<400> 74
Gly Tyr Ser Tyr Ser Ser Thr Leu
1 5
<210> 75
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 HCDR1 (IMGT)
<400> 75
Gly Phe Ser Leu Asn Thr Leu Gly Met Gly
1 5 10
<210> 76
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 HCDR2 (IMGT)
<400> 76
Ile Trp Trp Asp Asp Asp Lys
1 5
<210> 77
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 HCDR3 (IMGT)
<400> 77
Ala Arg Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
1 5 10
<210> 78
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 LCDR1 (IMGT)
<400> 78
Glu Asp Ile Tyr Ser Gly
1 5
<210> 79
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 LCDR2 (IMGT)
<400> 79
Gly Ala Ser
1
<210> 80
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> 16C5 LCDR3 (IMGT)
<400> 80
Leu Gly Gly Tyr Ser Tyr Ser Ser Thr Leu Thr
1 5 10
<210> 81
<211> 123
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 VH
<400> 81
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Val
20 25 30
Gly Met Gly Val Gly Trp Ser Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Glu Asp Lys Tyr Tyr Asn Pro
50 55 60
Ala Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln
65 70 75 80
Val Phe Leu Lys Ile Ala Asn Val Asp Thr Ala Asp Thr Ala Thr Tyr
85 90 95
Tyr Cys Thr Arg Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 82
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 VL
<400> 82
Asp Ile Val Met Thr Gln Ala Ala Pro Ser Val Pro Val Thr Pro Gly
1 5 10 15
Glu Ser Val Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Tyr Trp Phe Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Arg Leu Ile Tyr Tyr Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ser
85 90 95
Leu Glu Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 83
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 HCDR1 (KABAT)
<400> 83
Thr Val Gly Met Gly Val Gly
1 5
<210> 84
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 HCDR2 (KABAT)
<400> 84
His Ile Trp Trp Asp Asp Glu Asp Lys Tyr Tyr Asn Pro Ala Leu Lys
1 5 10 15
Ser
<210> 85
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 HCDR3 (KABAT)
<400> 85
Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
1 5 10
<210> 86
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 LCDR1 (KABAT)
<400> 86
Arg Ser Ser Lys Ser Leu Leu His Ser Asn Gly Asn Thr Tyr Leu Tyr
1 5 10 15
<210> 87
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 LCDR2 (KABAT)
<400> 87
Tyr Met Ser Asn Leu Ala Ser
1 5
<210> 88
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 LCDR3 (KABAT)
<400> 88
Met Gln Ser Leu Glu Tyr Pro Leu Thr
1 5
<210> 89
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 HCDR1 (CHOTHIA)
<400> 89
Gly Phe Ser Leu Ser Thr Val Gly Met
1 5
<210> 90
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 HCDR2 (CHOTHIA)
<400> 90
Trp Asp Asp Glu
1
<210> 91
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 HCDR3 (CHOTHIA)
<400> 91
Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp
1 5 10
<210> 92
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 LCDR1 (CHOTHIA)
<400> 92
Ser Lys Ser Leu Leu His Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 93
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 LCDR2 (CHOTHIA)
<400> 93
Tyr Met Ser
1
<210> 94
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 LCDR3 (CHOTHIA)
<400> 94
Ser Leu Glu Tyr Pro Leu
1 5
<210> 95
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 HCDR1 (IMGT)
<400> 95
Gly Phe Ser Leu Ser Thr Val Gly Met Gly
1 5 10
<210> 96
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 HCDR2 (IMGT)
<400> 96
Ile Trp Trp Asp Asp Glu Asp Lys
1 5
<210> 97
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 HCDR3 (IMGT)
<400> 97
Thr Arg Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
1 5 10
<210> 98
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 LCDR1 (IMGT)
<400> 98
Lys Ser Leu Leu His Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 99
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 LCDR2 (IMGT)
<400> 99
Tyr Met Ser
1
<210> 100
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18C6 LCDR3 (IMGT)
<400> 100
Met Gln Ser Leu Glu Tyr Pro Leu Thr
1 5
<210> 101
<211> 123
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6-18C6 VH консенсус
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = Thr или Asn
<220>
<221> ВАРИАНТ
<222> 11
<223> Xaa = Ile или Lys
<220>
<221> ВАРИАНТ
<222> 30
<223> Xaa = Asn или Ser
<220>
<221> ВАРИАНТ
<222> 32
<223> Xaa = Val или Leu
<220>
<221> ВАРИАНТ
<222> 39
<223> Xaa = Ser или Ile
<220>
<221> ВАРИАНТ
<222> 42
<223> Xaa = Pro или Ser
<220>
<221> ВАРИАНТ
<222> 58
<223> Xaa = Glu или отсутствует
<220>
<221> ВАРИАНТ
<222> 63
<223> Xaa = Asn или Tyr
<220>
<221> ВАРИАНТ
<222> 74
<223> Xaa = Lys или Arg
<220>
<221> ВАРИАНТ
<222> 75
<223> Xaa = Ala или Asp
<220>
<221> ВАРИАНТ
<222> 76
<223> Xaa = Thr или Ser
<220>
<221> ВАРИАНТ
<222> 86
<223> Xaa = Val или Ala
<220>
<221> ВАРИАНТ
<222> 89
<223> Xaa = Gly или Asp
<220>
<221> ВАРИАНТ
<222> 93
<223> Xaa = Thr, Ile или Ser
<220>
<221> ВАРИАНТ
<222> 99
<223> Xaa = Thr, Ser или Ala
<400> 101
Gln Val Xaa Leu Lys Glu Ser Gly Pro Gly Xaa Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Xaa Thr Xaa
20 25 30
Gly Met Gly Val Gly Trp Xaa Arg Gln Xaa Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Xaa Asp Lys Tyr Tyr Xaa Pro
50 55 60
Ala Leu Lys Ser Arg Leu Thr Ile Ser Xaa Xaa Xaa Ser Lys Asn Gln
65 70 75 80
Val Phe Leu Lys Ile Xaa Asn Val Xaa Thr Ala Asp Xaa Ala Thr Tyr
85 90 95
Tyr Cys Xaa Arg Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 102
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12, 19C11, 18C6 VL консенсус
<220>
<221> ВАРИАНТ
<222> 11
<223> Xaa = Ile или Val
<220>
<221> ВАРИАНТ
<222> 12
<223> Xaa = Pro или Ser
<220>
<221> ВАРИАНТ
<222> 30
<223> Xaa = Arg или Leu
<220>
<221> ВАРИАНТ
<222> 31
<223> Xaa = Lys или His
<220>
<221> ВАРИАНТ
<222> 79
<223> Xaa = Arg или Lys
<220>
<221> ВАРИАНТ
<222> 86
<223> Xaa = Glu или Gly
<220>
<221> ВАРИАНТ
<222> 96
<223> Xaa = Ser или Gly
<220>
<221> ВАРИАНТ
<222> 99
<223> Xaa = Tyr или His
<400> 102
Asp Ile Val Met Thr Gln Ala Ala Pro Ser Xaa Xaa Val Thr Pro Gly
1 5 10 15
Glu Ser Val Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Xaa Xaa Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Tyr Trp Phe Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Arg Leu Ile Tyr Tyr Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Xaa Ile
65 70 75 80
Ser Arg Val Glu Ala Xaa Asp Val Gly Val Tyr Tyr Cys Met Gln Xaa
85 90 95
Leu Glu Xaa Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 103
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR1 KABAT КОНСЕНСУС
<220>
<221> ВАРИАНТ
<222> 2
<223> Xaa = Lue или Val
<400> 103
Thr Xaa Gly Met Gly Val Gly
1 5
<210> 104
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR2 KABAT КОНСЕНСУС
<220>
<221> ВАРИАНТ
<222> 7
<223> Xaa = Glu или Отсутствует
<220>
<221> ВАРИАНТ
<222> 12
<223> Xaa = Tyr или Asn
<400> 104
His Ile Trp Trp Asp Asp Xaa Asp Lys Tyr Tyr Xaa Pro Ala Leu Lys
1 5 10 15
Ser
<210> 105
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR3 KABAT КОНСЕНСУС
<400> 105
Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
1 5 10
<210> 106
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12, 19C11, 18C6 LCDR2 KABAT КОНСЕНСУС
<220>
<221> ВАРИАНТ
<222> 7
<223> Xaa = Arg или Leu
<220>
<221> ВАРИАНТ
<222> 8
<223> Xaa = Lys или His
<400> 106
Arg Ser Ser Lys Ser Leu Xaa Xaa Ser Asn Gly Asn Thr Tyr Leu Tyr
1 5 10 15
<210> 107
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12, 19C11, 18C6 LCDR2 KABAT КОНСЕНСУС
<400> 107
Tyr Met Ser Asn Leu Ala Ser
1 5
<210> 108
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12, 19C11, 18C6 LCDR3 KABAT КОНСЕНСУС
<220>
<221> ВАРИАНТ
<222> 3
<223> Xaa = Gly или Ser
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = His или Tyr
<400> 108
Met Gln Xaa Leu Glu Xaa Pro Leu Thr
1 5
<210> 109
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6-18C6 HCDR1 CHOTHIA КОНСЕНСУС
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = Asn или Ser
<220>
<221> ВАРИАНТ
<222> 7
<223> Xaa = Leu или Val
<400> 109
Gly Phe Ser Leu Xaa Thr Xaa Gly Met
1 5
<210> 110
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6-18C6 HCDR2 CHOTHIA КОНСЕНСУС
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = Glu или Отсутствует
<400> 110
Trp Asp Asp Xaa
1
<210> 111
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6-18C6 HCDR3 CHOTHIA КОНСЕНСУС
<400> 111
Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp
1 5 10
<210> 112
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12, 19C11, 18C6 LCDR1 CHOTHIA КОНСЕНСУС
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = Leu или Arg
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = His или Lys
<400> 112
Ser Lys Ser Leu Xaa Xaa Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 113
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12, 19C11, 18C6 LCDR2 CHOTHIA КОНСЕНСУС
<400> 113
Tyr Met Ser
1
<210> 114
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12, 19C11, 18C6 LCDR3 CHOTHIA КОНСЕНСУС
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = Gly или Ser
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = His или Tyr
<400> 114
Xaa Leu Glu Xaa Pro Leu
1 5
<210> 115
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6-18C6 HCDR1 IMGT КОНСЕНСУС
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = Asn или Ser
<220>
<221> ВАРИАНТ
<222> 7
<223> Xaa = Val или Leu
<400> 115
Gly Phe Ser Leu Xaa Thr Xaa Gly Met Gly
1 5 10
<210> 116
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6-18C6 HCDR2 IMGT КОНСЕНСУС
<220>
<221> ВАРИАНТ
<222> 6
<223> Xaa = Glu или Отсутствует
<400> 116
Ile Trp Trp Asp Asp Xaa Asp Lys
1 5
<210> 117
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> 10C6-18C6 HCDR3 IMGT КОНСЕНСУС
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = Thr, Ala или Ser
<400> 117
Xaa Arg Ile Gly Thr Ala Gln Ala Thr Asp Ala Leu Asp Tyr
1 5 10
<210> 118
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12, 19C11, 18C6 LCDR1 IMGT КОНСЕНСУС
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = Val или Leu
<220>
<221> ВАРИАНТ
<222> 5
<223> Xaa = His или Lys
<400> 118
Lys Ser Leu Xaa Xaa Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 119
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12, 19C11, 18C6 LCDR2 IMGT КОНСЕНСУС
<400> 119
Tyr Met Ser
1
<210> 120
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> 7B12, 19C11, 18C6 LCDR3 IMGT КОНСЕНСУС
<400> 120
Met Gln Ser Leu Glu Tyr Pro Leu Thr
1 5
<210> 121
<211> 42
<212> Белок
<213> Искусственная последовательность
<220>
<223> прямой праймер MUC16c114
<400> 121
Cys Cys Ala Thr Gly Cys Gly Ala Thr Ala Thr Cys Gly Cys Cys Ala
1 5 10 15
Cys Cys Ala Thr Gly Gly Thr Gly Ala Ala Cys Thr Thr Cys Thr Cys
20 25 30
Gly Cys Cys Ala Cys Thr Gly Gly Cys Thr
35 40
<210> 122
<211> 34
<212> Белок
<213> Искусственная последовательность
<220>
<223> обратный праймер MUC16c114
<400> 122
Thr Ala Cys Gly Gly Cys Gly Gly Cys Cys Gly Cys Thr Thr Gly Cys
1 5 10 15
Ala Gly Ala Thr Cys Cys Thr Cys Cys Ala Gly Gly Thr Cys Thr Ala
20 25 30
Gly Gly
<210> 123
<211> 45
<212> Белок
<213> Искусственная последовательность
<220>
<223> прямой праймер MUC16c344
<400> 123
Cys Cys Ala Thr Gly Cys Gly Ala Thr Ala Thr Cys Gly Cys Cys Ala
1 5 10 15
Cys Cys Ala Thr Gly Gly Thr Gly Ala Cys Ala Gly Gly Cys Cys Cys
20 25 30
Thr Gly Gly Gly Cys Thr Gly Gly Ala Cys Ala Gly Ala
35 40 45
<210> 124
<211> 34
<212> Белок
<213> Искусственная последовательность
<220>
<223> обратный праймер MUC16c344
<400> 124
Thr Ala Cys Gly Gly Cys Gly Gly Cys Cys Gly Cys Thr Thr Gly Cys
1 5 10 15
Ala Gly Ala Thr Cys Cys Thr Cys Cys Ala Gly Gly Thr Cys Thr Ala
20 25 30
Gly Gly
<210> 125
<211> 31
<212> Белок
<213> Искусственная последовательность
<220>
<223> прямой праймер MUC16c57-114
<400> 125
Cys Cys Ala Thr Gly Cys Gly Ala Thr Ala Thr Cys Ala Ala Ala Cys
1 5 10 15
Thr Thr Cys Thr Cys Gly Cys Cys Ala Cys Thr Gly Gly Cys Thr
20 25 30
<210> 126
<211> 33
<212> Белок
<213> Искусственная последовательность
<220>
<223> обратный праймер MUC16c57-114
<400> 126
Ala Gly Ala Thr Cys Thr Ala Ala Cys Cys Ala Thr Gly Gly Gly Ala
1 5 10 15
Ala Gly Gly Thr Cys Ala Gly Ala Ala Thr Thr Cys Cys Cys Ala Gly
20 25 30
Thr
<210> 127
<211> 31
<212> Белок
<213> Искусственная последовательность
<220>
<223> прямой праймер 117-244LGALS3
<400> 127
Cys Cys Ala Thr Gly Cys Gly Ala Thr Ala Thr Cys Ala Cys Cys Thr
1 5 10 15
Thr Ala Thr Ala Ala Cys Cys Thr Gly Cys Cys Thr Thr Thr Gly
20 25 30
<210> 128
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> обратный праймер 117-244LGALS3
<400> 128
Ala Gly Ala Thr Cys Thr Ala Ala Cys Cys Ala Thr Gly Gly Thr Ala
1 5 10 15
Thr Ala Thr Gly Ala Ala Gly Cys Ala Cys Thr Gly Gly Thr
20 25 30
<210> 129
<211> 55
<212> Белок
<213> Искусственная последовательность
<220>
<223> иммунизирующий пептидный 55-мер
<400> 129
Asn Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Thr Arg Asn Gly Thr Gln Leu Gln Asn Phe Thr
20 25 30
Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn Arg Asn
35 40 45
Glu Pro Leu Thr Gly Asn Ser
50 55
<210> 130
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> иммунизирующий пептидный 18-мер
<400> 130
Cys Thr Arg Asn Gly Thr Gln Leu Gln Asn Phe Thr Leu Asp Arg Ser
1 5 10 15
Ser Val
<210> 131
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> иммунизирующий пептидный 15-мер
<400> 131
Cys Gly Thr Gln Leu Gln Asn Phe Thr Leu Asp Arg Ser Ser Val
1 5 10 15
<210> 132
<211> 344
<212> Белок
<213> Искусственная последовательность
<220>
<223> MUC16c344
<400> 132
Trp Glu Leu Ser Gln Leu Thr His Gly Val Thr Gln Leu Gly Phe Tyr
1 5 10 15
Val Leu Asp Arg Asp Ser Leu Phe Ile Asn Gly Tyr Ala Pro Gln Asn
20 25 30
Leu Ser Ile Arg Gly Glu Tyr Gln Ile Asn Phe His Ile Val Asn Gln
35 40 45
Asn Leu Ser Asn Pro Asp Pro Thr Ser Ser Glu Tyr Ile Thr Leu Leu
50 55 60
Arg Asp Ile Gln Asp Lys Val Thr Thr Leu Tyr Lys Gly Ser Gln Leu
65 70 75 80
His Asp Thr Phe Arg Phe Cys Leu Val Thr Asn Leu Thr Met Asp Ser
85 90 95
Val Leu Val Thr Val Lys Ala Leu Phe Ser Ser Asn Leu Asp Pro Ser
100 105 110
Leu Val Glu Gln Val Phe Leu Asp Lys Thr Leu Asn Ala Ser Phe His
115 120 125
Gln Leu Gly Ser Thr Tyr Gln Leu Val Asp Ile His Val Thr Glu Met
130 135 140
Glu Ser Ser Val Tyr Gln Pro Thr Ser Ser Ser Ser Thr Gln His Phe
145 150 155 160
Tyr Leu Asn Phe Thr Ile Thr Asn Leu Pro Tyr Ser Gln Asp Lys Ala
165 170 175
Gln Pro Gly Thr Thr Asn Tyr Gln Arg Asn Lys Arg Asn Ile Glu Asp
180 185 190
Ala Leu Asn Gln Leu Phe Arg Asn Ser Ser Ile Lys Ser Tyr Phe Ser
195 200 205
Asp Cys Gln Val Ser Thr Phe Arg Ser Val Pro Asn Arg His His Thr
210 215 220
Gly Val Asp Ser Leu Cys Asn Phe Ser Pro Leu Ala Arg Arg Val Asp
225 230 235 240
Arg Val Ala Ile Tyr Glu Glu Phe Leu Arg Met Thr Arg Asn Gly Thr
245 250 255
Gln Leu Gln Asn Phe Thr Leu Asp Arg Ser Ser Val Leu Val Asp Gly
260 265 270
Tyr Ser Pro Asn Arg Asn Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro
275 280 285
Phe Trp Ala Val Ile Leu Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile
290 295 300
Thr Cys Leu Ile Cys Gly Val Leu Val Thr Thr Arg Arg Arg Lys Lys
305 310 315 320
Glu Gly Glu Tyr Asn Val Gln Gln Gln Cys Pro Gly Tyr Tyr Gln Ser
325 330 335
His Leu Asp Leu Glu Asp Leu Gln
340
<210> 133
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> MUC16c114
<400> 133
Asn Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Thr Arg Asn Gly Thr Gln Leu Gln Asn Phe Thr
20 25 30
Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn Arg Asn
35 40 45
Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro Phe Trp Ala Val Ile Leu
50 55 60
Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile Thr Cys Leu Ile Cys Gly
65 70 75 80
Val Leu Val Thr Thr Arg Arg Arg Lys Lys Glu Gly Glu Tyr Asn Val
85 90 95
Gln Gln Gln Cys Pro Gly Tyr Tyr Gln Ser His Leu Asp Leu Glu Asp
100 105 110
Leu Gln
<210> 134
<211> 80
<212> Белок
<213> Искусственная последовательность
<220>
<223> MUC16c86
<400> 134
Asn Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Asp Leu Pro Phe Trp Ala Val Ile Leu Ile Gly
20 25 30
Leu Ala Gly Leu Leu Gly Leu Ile Thr Cys Leu Ile Cys Gly Val Leu
35 40 45
Val Thr Thr Arg Arg Arg Lys Lys Glu Gly Glu Tyr Asn Val Gln Gln
50 55 60
Gln Cys Pro Gly Tyr Tyr Gln Ser His Leu Asp Leu Glu Asp Leu Gln
65 70 75 80
<210> 135
<211> 86
<212> Белок
<213> Искусственная последовательность
<220>
<223> MUC16c80
<400> 135
Asn Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Thr Arg Asn Gly Thr Gln Leu Gln Asn Phe Thr
20 25 30
Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn Arg Asn
35 40 45
Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro Phe Trp Ala Val Ile Leu
50 55 60
Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile Thr Cys Leu Ile Cys Gly
65 70 75 80
Asp Leu Glu Asp Leu Gln
85
<210> 136
<211> 14507
<212> Белок
<213> Homo sapiens
<220>
<223> Аминокислотная последовательность незрелого MUC16 человека
(NP_078966.2)
<400> 136
Met Leu Lys Pro Ser Gly Leu Pro Gly Ser Ser Ser Pro Thr Arg Ser
1 5 10 15
Leu Met Thr Gly Ser Arg Ser Thr Lys Ala Thr Pro Glu Met Asp Ser
20 25 30
Gly Leu Thr Gly Ala Thr Leu Ser Pro Lys Thr Ser Thr Gly Ala Ile
35 40 45
Val Val Thr Glu His Thr Leu Pro Phe Thr Ser Pro Asp Lys Thr Leu
50 55 60
Ala Ser Pro Thr Ser Ser Val Val Gly Arg Thr Thr Gln Ser Leu Gly
65 70 75 80
Val Met Ser Ser Ala Leu Pro Glu Ser Thr Ser Arg Gly Met Thr His
85 90 95
Ser Glu Gln Arg Thr Ser Pro Ser Leu Ser Pro Gln Val Asn Gly Thr
100 105 110
Pro Ser Arg Asn Tyr Pro Ala Thr Ser Met Val Ser Gly Leu Ser Ser
115 120 125
Pro Arg Thr Arg Thr Ser Ser Thr Glu Gly Asn Phe Thr Lys Glu Ala
130 135 140
Ser Thr Tyr Thr Leu Thr Val Glu Thr Thr Ser Gly Pro Val Thr Glu
145 150 155 160
Lys Tyr Thr Val Pro Thr Glu Thr Ser Thr Thr Glu Gly Asp Ser Thr
165 170 175
Glu Thr Pro Trp Asp Thr Arg Tyr Ile Pro Val Lys Ile Thr Ser Pro
180 185 190
Met Lys Thr Phe Ala Asp Ser Thr Ala Ser Lys Glu Asn Ala Pro Val
195 200 205
Ser Met Thr Pro Ala Glu Thr Thr Val Thr Asp Ser His Thr Pro Gly
210 215 220
Arg Thr Asn Pro Ser Phe Gly Thr Leu Tyr Ser Ser Phe Leu Asp Leu
225 230 235 240
Ser Pro Lys Gly Thr Pro Asn Ser Arg Gly Glu Thr Ser Leu Glu Leu
245 250 255
Ile Leu Ser Thr Thr Gly Tyr Pro Phe Ser Ser Pro Glu Pro Gly Ser
260 265 270
Ala Gly His Ser Arg Ile Ser Thr Ser Ala Pro Leu Ser Ser Ser Ala
275 280 285
Ser Val Leu Asp Asn Lys Ile Ser Glu Thr Ser Ile Phe Ser Gly Gln
290 295 300
Ser Leu Thr Ser Pro Leu Ser Pro Gly Val Pro Glu Ala Arg Ala Ser
305 310 315 320
Thr Met Pro Asn Ser Ala Ile Pro Phe Ser Met Thr Leu Ser Asn Ala
325 330 335
Glu Thr Ser Ala Glu Arg Val Arg Ser Thr Ile Ser Ser Leu Gly Thr
340 345 350
Pro Ser Ile Ser Thr Lys Gln Thr Ala Glu Thr Ile Leu Thr Phe His
355 360 365
Ala Phe Ala Glu Thr Met Asp Ile Pro Ser Thr His Ile Ala Lys Thr
370 375 380
Leu Ala Ser Glu Trp Leu Gly Ser Pro Gly Thr Leu Gly Gly Thr Ser
385 390 395 400
Thr Ser Ala Leu Thr Thr Thr Ser Pro Ser Thr Thr Leu Val Ser Glu
405 410 415
Glu Thr Asn Thr His His Ser Thr Ser Gly Lys Glu Thr Glu Gly Thr
420 425 430
Leu Asn Thr Ser Met Thr Pro Leu Glu Thr Ser Ala Pro Gly Glu Glu
435 440 445
Ser Glu Met Thr Ala Thr Leu Val Pro Thr Leu Gly Phe Thr Thr Leu
450 455 460
Asp Ser Lys Ile Arg Ser Pro Ser Gln Val Ser Ser Ser His Pro Thr
465 470 475 480
Arg Glu Leu Arg Thr Thr Gly Ser Thr Ser Gly Arg Gln Ser Ser Ser
485 490 495
Thr Ala Ala His Gly Ser Ser Asp Ile Leu Arg Ala Thr Thr Ser Ser
500 505 510
Thr Ser Lys Ala Ser Ser Trp Thr Ser Glu Ser Thr Ala Gln Gln Phe
515 520 525
Ser Glu Pro Gln His Thr Gln Trp Val Glu Thr Ser Pro Ser Met Lys
530 535 540
Thr Glu Arg Pro Pro Ala Ser Thr Ser Val Ala Ala Pro Ile Thr Thr
545 550 555 560
Ser Val Pro Ser Val Val Ser Gly Phe Thr Thr Leu Lys Thr Ser Ser
565 570 575
Thr Lys Gly Ile Trp Leu Glu Glu Thr Ser Ala Asp Thr Leu Ile Gly
580 585 590
Glu Ser Thr Ala Gly Pro Thr Thr His Gln Phe Ala Val Pro Thr Gly
595 600 605
Ile Ser Met Thr Gly Gly Ser Ser Thr Arg Gly Ser Gln Gly Thr Thr
610 615 620
His Leu Leu Thr Arg Ala Thr Ala Ser Ser Glu Thr Ser Ala Asp Leu
625 630 635 640
Thr Leu Ala Thr Asn Gly Val Pro Val Ser Val Ser Pro Ala Val Ser
645 650 655
Lys Thr Ala Ala Gly Ser Ser Pro Pro Gly Gly Thr Lys Pro Ser Tyr
660 665 670
Thr Met Val Ser Ser Val Ile Pro Glu Thr Ser Ser Leu Gln Ser Ser
675 680 685
Ala Phe Arg Glu Gly Thr Ser Leu Gly Leu Thr Pro Leu Asn Thr Arg
690 695 700
His Pro Phe Ser Ser Pro Glu Pro Asp Ser Ala Gly His Thr Lys Ile
705 710 715 720
Ser Thr Ser Ile Pro Leu Leu Ser Ser Ala Ser Val Leu Glu Asp Lys
725 730 735
Val Ser Ala Thr Ser Thr Phe Ser His His Lys Ala Thr Ser Ser Ile
740 745 750
Thr Thr Gly Thr Pro Glu Ile Ser Thr Lys Thr Lys Pro Ser Ser Ala
755 760 765
Val Leu Ser Ser Met Thr Leu Ser Asn Ala Ala Thr Ser Pro Glu Arg
770 775 780
Val Arg Asn Ala Thr Ser Pro Leu Thr His Pro Ser Pro Ser Gly Glu
785 790 795 800
Glu Thr Ala Gly Ser Val Leu Thr Leu Ser Thr Ser Ala Glu Thr Thr
805 810 815
Asp Ser Pro Asn Ile His Pro Thr Gly Thr Leu Thr Ser Glu Ser Ser
820 825 830
Glu Ser Pro Ser Thr Leu Ser Leu Pro Ser Val Ser Gly Val Lys Thr
835 840 845
Thr Phe Ser Ser Ser Thr Pro Ser Thr His Leu Phe Thr Ser Gly Glu
850 855 860
Glu Thr Glu Glu Thr Ser Asn Pro Ser Val Ser Gln Pro Glu Thr Ser
865 870 875 880
Val Ser Arg Val Arg Thr Thr Leu Ala Ser Thr Ser Val Pro Thr Pro
885 890 895
Val Phe Pro Thr Met Asp Thr Trp Pro Thr Arg Ser Ala Gln Phe Ser
900 905 910
Ser Ser His Leu Val Ser Glu Leu Arg Ala Thr Ser Ser Thr Ser Val
915 920 925
Thr Asn Ser Thr Gly Ser Ala Leu Pro Lys Ile Ser His Leu Thr Gly
930 935 940
Thr Ala Thr Met Ser Gln Thr Asn Arg Asp Thr Phe Asn Asp Ser Ala
945 950 955 960
Ala Pro Gln Ser Thr Thr Trp Pro Glu Thr Ser Pro Arg Phe Lys Thr
965 970 975
Gly Leu Pro Ser Ala Thr Thr Thr Val Ser Thr Ser Ala Thr Ser Leu
980 985 990
Ser Ala Thr Val Met Val Ser Lys Phe Thr Ser Pro Ala Thr Ser Ser
995 1000 1005
Met Glu Ala Thr Ser Ile Arg Glu Pro Ser Thr Thr Ile Leu Thr
1010 1015 1020
Thr Glu Thr Thr Asn Gly Pro Gly Ser Met Ala Val Ala Ser Thr
1025 1030 1035
Asn Ile Pro Ile Gly Lys Gly Tyr Ile Thr Glu Gly Arg Leu Asp
1040 1045 1050
Thr Ser His Leu Pro Ile Gly Thr Thr Ala Ser Ser Glu Thr Ser
1055 1060 1065
Met Asp Phe Thr Met Ala Lys Glu Ser Val Ser Met Ser Val Ser
1070 1075 1080
Pro Ser Gln Ser Met Asp Ala Ala Gly Ser Ser Thr Pro Gly Arg
1085 1090 1095
Thr Ser Gln Phe Val Asp Thr Phe Ser Asp Asp Val Tyr His Leu
1100 1105 1110
Thr Ser Arg Glu Ile Thr Ile Pro Arg Asp Gly Thr Ser Ser Ala
1115 1120 1125
Leu Thr Pro Gln Met Thr Ala Thr His Pro Pro Ser Pro Asp Pro
1130 1135 1140
Gly Ser Ala Arg Ser Thr Trp Leu Gly Ile Leu Ser Ser Ser Pro
1145 1150 1155
Ser Ser Pro Thr Pro Lys Val Thr Met Ser Ser Thr Phe Ser Thr
1160 1165 1170
Gln Arg Val Thr Thr Ser Met Ile Met Asp Thr Val Glu Thr Ser
1175 1180 1185
Arg Trp Asn Met Pro Asn Leu Pro Ser Thr Thr Ser Leu Thr Pro
1190 1195 1200
Ser Asn Ile Pro Thr Ser Gly Ala Ile Gly Lys Ser Thr Leu Val
1205 1210 1215
Pro Leu Asp Thr Pro Ser Pro Ala Thr Ser Leu Glu Ala Ser Glu
1220 1225 1230
Gly Gly Leu Pro Thr Leu Ser Thr Tyr Pro Glu Ser Thr Asn Thr
1235 1240 1245
Pro Ser Ile His Leu Gly Ala His Ala Ser Ser Glu Ser Pro Ser
1250 1255 1260
Thr Ile Lys Leu Thr Met Ala Ser Val Val Lys Pro Gly Ser Tyr
1265 1270 1275
Thr Pro Leu Thr Phe Pro Ser Ile Glu Thr His Ile His Val Ser
1280 1285 1290
Thr Ala Arg Met Ala Tyr Ser Ser Gly Ser Ser Pro Glu Met Thr
1295 1300 1305
Ala Pro Gly Glu Thr Asn Thr Gly Ser Thr Trp Asp Pro Thr Thr
1310 1315 1320
Tyr Ile Thr Thr Thr Asp Pro Lys Asp Thr Ser Ser Ala Gln Val
1325 1330 1335
Ser Thr Pro His Ser Val Arg Thr Leu Arg Thr Thr Glu Asn His
1340 1345 1350
Pro Lys Thr Glu Ser Ala Thr Pro Ala Ala Tyr Ser Gly Ser Pro
1355 1360 1365
Lys Ile Ser Ser Ser Pro Asn Leu Thr Ser Pro Ala Thr Lys Ala
1370 1375 1380
Trp Thr Ile Thr Asp Thr Thr Glu His Ser Thr Gln Leu His Tyr
1385 1390 1395
Thr Lys Leu Ala Glu Lys Ser Ser Gly Phe Glu Thr Gln Ser Ala
1400 1405 1410
Pro Gly Pro Val Ser Val Val Ile Pro Thr Ser Pro Thr Ile Gly
1415 1420 1425
Ser Ser Thr Leu Glu Leu Thr Ser Asp Val Pro Gly Glu Pro Leu
1430 1435 1440
Val Leu Ala Pro Ser Glu Gln Thr Thr Ile Thr Leu Pro Met Ala
1445 1450 1455
Thr Trp Leu Ser Thr Ser Leu Thr Glu Glu Met Ala Ser Thr Asp
1460 1465 1470
Leu Asp Ile Ser Ser Pro Ser Ser Pro Met Ser Thr Phe Ala Ile
1475 1480 1485
Phe Pro Pro Met Ser Thr Pro Ser His Glu Leu Ser Lys Ser Glu
1490 1495 1500
Ala Asp Thr Ser Ala Ile Arg Asn Thr Asp Ser Thr Thr Leu Asp
1505 1510 1515
Gln His Leu Gly Ile Arg Ser Leu Gly Arg Thr Gly Asp Leu Thr
1520 1525 1530
Thr Val Pro Ile Thr Pro Leu Thr Thr Thr Trp Thr Ser Val Ile
1535 1540 1545
Glu His Ser Thr Gln Ala Gln Asp Thr Leu Ser Ala Thr Met Ser
1550 1555 1560
Pro Thr His Val Thr Gln Ser Leu Lys Asp Gln Thr Ser Ile Pro
1565 1570 1575
Ala Ser Ala Ser Pro Ser His Leu Thr Glu Val Tyr Pro Glu Leu
1580 1585 1590
Gly Thr Gln Gly Arg Ser Ser Ser Glu Ala Thr Thr Phe Trp Lys
1595 1600 1605
Pro Ser Thr Asp Thr Leu Ser Arg Glu Ile Glu Thr Gly Pro Thr
1610 1615 1620
Asn Ile Gln Ser Thr Pro Pro Met Asp Asn Thr Thr Thr Gly Ser
1625 1630 1635
Ser Ser Ser Gly Val Thr Leu Gly Ile Ala His Leu Pro Ile Gly
1640 1645 1650
Thr Ser Ser Pro Ala Glu Thr Ser Thr Asn Met Ala Leu Glu Arg
1655 1660 1665
Arg Ser Ser Thr Ala Thr Val Ser Met Ala Gly Thr Met Gly Leu
1670 1675 1680
Leu Val Thr Ser Ala Pro Gly Arg Ser Ile Ser Gln Ser Leu Gly
1685 1690 1695
Arg Val Ser Ser Val Leu Ser Glu Ser Thr Thr Glu Gly Val Thr
1700 1705 1710
Asp Ser Ser Lys Gly Ser Ser Pro Arg Leu Asn Thr Gln Gly Asn
1715 1720 1725
Thr Ala Leu Ser Ser Ser Leu Glu Pro Ser Tyr Ala Glu Gly Ser
1730 1735 1740
Gln Met Ser Thr Ser Ile Pro Leu Thr Ser Ser Pro Thr Thr Pro
1745 1750 1755
Asp Val Glu Phe Ile Gly Gly Ser Thr Phe Trp Thr Lys Glu Val
1760 1765 1770
Thr Thr Val Met Thr Ser Asp Ile Ser Lys Ser Ser Ala Arg Thr
1775 1780 1785
Glu Ser Ser Ser Ala Thr Leu Met Ser Thr Ala Leu Gly Ser Thr
1790 1795 1800
Glu Asn Thr Gly Lys Glu Lys Leu Arg Thr Ala Ser Met Asp Leu
1805 1810 1815
Pro Ser Pro Thr Pro Ser Met Glu Val Thr Pro Trp Ile Ser Leu
1820 1825 1830
Thr Leu Ser Asn Ala Pro Asn Thr Thr Asp Ser Leu Asp Leu Ser
1835 1840 1845
His Gly Val His Thr Ser Ser Ala Gly Thr Leu Ala Thr Asp Arg
1850 1855 1860
Ser Leu Asn Thr Gly Val Thr Arg Ala Ser Arg Leu Glu Asn Gly
1865 1870 1875
Ser Asp Thr Ser Ser Lys Ser Leu Ser Met Gly Asn Ser Thr His
1880 1885 1890
Thr Ser Met Thr Tyr Thr Glu Lys Ser Glu Val Ser Ser Ser Ile
1895 1900 1905
His Pro Arg Pro Glu Thr Ser Ala Pro Gly Ala Glu Thr Thr Leu
1910 1915 1920
Thr Ser Thr Pro Gly Asn Arg Ala Ile Ser Leu Thr Leu Pro Phe
1925 1930 1935
Ser Ser Ile Pro Val Glu Glu Val Ile Ser Thr Gly Ile Thr Ser
1940 1945 1950
Gly Pro Asp Ile Asn Ser Ala Pro Met Thr His Ser Pro Ile Thr
1955 1960 1965
Pro Pro Thr Ile Val Trp Thr Ser Thr Gly Thr Ile Glu Gln Ser
1970 1975 1980
Thr Gln Pro Leu His Ala Val Ser Ser Glu Lys Val Ser Val Gln
1985 1990 1995
Thr Gln Ser Thr Pro Tyr Val Asn Ser Val Ala Val Ser Ala Ser
2000 2005 2010
Pro Thr His Glu Asn Ser Val Ser Ser Gly Ser Ser Thr Ser Ser
2015 2020 2025
Pro Tyr Ser Ser Ala Ser Leu Glu Ser Leu Asp Ser Thr Ile Ser
2030 2035 2040
Arg Arg Asn Ala Ile Thr Ser Trp Leu Trp Asp Leu Thr Thr Ser
2045 2050 2055
Leu Pro Thr Thr Thr Trp Pro Ser Thr Ser Leu Ser Glu Ala Leu
2060 2065 2070
Ser Ser Gly His Ser Gly Val Ser Asn Pro Ser Ser Thr Thr Thr
2075 2080 2085
Glu Phe Pro Leu Phe Ser Ala Ala Ser Thr Ser Ala Ala Lys Gln
2090 2095 2100
Arg Asn Pro Glu Thr Glu Thr His Gly Pro Gln Asn Thr Ala Ala
2105 2110 2115
Ser Thr Leu Asn Thr Asp Ala Ser Ser Val Thr Gly Leu Ser Glu
2120 2125 2130
Thr Pro Val Gly Ala Ser Ile Ser Ser Glu Val Pro Leu Pro Met
2135 2140 2145
Ala Ile Thr Ser Arg Ser Asp Val Ser Gly Leu Thr Ser Glu Ser
2150 2155 2160
Thr Ala Asn Pro Ser Leu Gly Thr Ala Ser Ser Ala Gly Thr Lys
2165 2170 2175
Leu Thr Arg Thr Ile Ser Leu Pro Thr Ser Glu Ser Leu Val Ser
2180 2185 2190
Phe Arg Met Asn Lys Asp Pro Trp Thr Val Ser Ile Pro Leu Gly
2195 2200 2205
Ser His Pro Thr Thr Asn Thr Glu Thr Ser Ile Pro Val Asn Ser
2210 2215 2220
Ala Gly Pro Pro Gly Leu Ser Thr Val Ala Ser Asp Val Ile Asp
2225 2230 2235
Thr Pro Ser Asp Gly Ala Glu Ser Ile Pro Thr Val Ser Phe Ser
2240 2245 2250
Pro Ser Pro Asp Thr Glu Val Thr Thr Ile Ser His Phe Pro Glu
2255 2260 2265
Lys Thr Thr His Ser Phe Arg Thr Ile Ser Ser Leu Thr His Glu
2270 2275 2280
Leu Thr Ser Arg Val Thr Pro Ile Pro Gly Asp Trp Met Ser Ser
2285 2290 2295
Ala Met Ser Thr Lys Pro Thr Gly Ala Ser Pro Ser Ile Thr Leu
2300 2305 2310
Gly Glu Arg Arg Thr Ile Thr Ser Ala Ala Pro Thr Thr Ser Pro
2315 2320 2325
Ile Val Leu Thr Ala Ser Phe Thr Glu Thr Ser Thr Val Ser Leu
2330 2335 2340
Asp Asn Glu Thr Thr Val Lys Thr Ser Asp Ile Leu Asp Ala Arg
2345 2350 2355
Lys Thr Asn Glu Leu Pro Ser Asp Ser Ser Ser Ser Ser Asp Leu
2360 2365 2370
Ile Asn Thr Ser Ile Ala Ser Ser Thr Met Asp Val Thr Lys Thr
2375 2380 2385
Ala Ser Ile Ser Pro Thr Ser Ile Ser Gly Met Thr Ala Ser Ser
2390 2395 2400
Ser Pro Ser Leu Phe Ser Ser Asp Arg Pro Gln Val Pro Thr Ser
2405 2410 2415
Thr Thr Glu Thr Asn Thr Ala Thr Ser Pro Ser Val Ser Ser Asn
2420 2425 2430
Thr Tyr Ser Leu Asp Gly Gly Ser Asn Val Gly Gly Thr Pro Ser
2435 2440 2445
Thr Leu Pro Pro Phe Thr Ile Thr His Pro Val Glu Thr Ser Ser
2450 2455 2460
Ala Leu Leu Ala Trp Ser Arg Pro Val Arg Thr Phe Ser Thr Met
2465 2470 2475
Val Ser Thr Asp Thr Ala Ser Gly Glu Asn Pro Thr Ser Ser Asn
2480 2485 2490
Ser Val Val Thr Ser Val Pro Ala Pro Gly Thr Trp Thr Ser Val
2495 2500 2505
Gly Ser Thr Thr Asp Leu Pro Ala Met Gly Phe Leu Lys Thr Ser
2510 2515 2520
Pro Ala Gly Glu Ala His Ser Leu Leu Ala Ser Thr Ile Glu Pro
2525 2530 2535
Ala Thr Ala Phe Thr Pro His Leu Ser Ala Ala Val Val Thr Gly
2540 2545 2550
Ser Ser Ala Thr Ser Glu Ala Ser Leu Leu Thr Thr Ser Glu Ser
2555 2560 2565
Lys Ala Ile His Ser Ser Pro Gln Thr Pro Thr Thr Pro Thr Ser
2570 2575 2580
Gly Ala Asn Trp Glu Thr Ser Ala Thr Pro Glu Ser Leu Leu Val
2585 2590 2595
Val Thr Glu Thr Ser Asp Thr Thr Leu Thr Ser Lys Ile Leu Val
2600 2605 2610
Thr Asp Thr Ile Leu Phe Ser Thr Val Ser Thr Pro Pro Ser Lys
2615 2620 2625
Phe Pro Ser Thr Gly Thr Leu Ser Gly Ala Ser Phe Pro Thr Leu
2630 2635 2640
Leu Pro Asp Thr Pro Ala Ile Pro Leu Thr Ala Thr Glu Pro Thr
2645 2650 2655
Ser Ser Leu Ala Thr Ser Phe Asp Ser Thr Pro Leu Val Thr Ile
2660 2665 2670
Ala Ser Asp Ser Leu Gly Thr Val Pro Glu Thr Thr Leu Thr Met
2675 2680 2685
Ser Glu Thr Ser Asn Gly Asp Ala Leu Val Leu Lys Thr Val Ser
2690 2695 2700
Asn Pro Asp Arg Ser Ile Pro Gly Ile Thr Ile Gln Gly Val Thr
2705 2710 2715
Glu Ser Pro Leu His Pro Ser Ser Thr Ser Pro Ser Lys Ile Val
2720 2725 2730
Ala Pro Arg Asn Thr Thr Tyr Glu Gly Ser Ile Thr Val Ala Leu
2735 2740 2745
Ser Thr Leu Pro Ala Gly Thr Thr Gly Ser Leu Val Phe Ser Gln
2750 2755 2760
Ser Ser Glu Asn Ser Glu Thr Thr Ala Leu Val Asp Ser Ser Ala
2765 2770 2775
Gly Leu Glu Arg Ala Ser Val Met Pro Leu Thr Thr Gly Ser Gln
2780 2785 2790
Gly Met Ala Ser Ser Gly Gly Ile Arg Ser Gly Ser Thr His Ser
2795 2800 2805
Thr Gly Thr Lys Thr Phe Ser Ser Leu Pro Leu Thr Met Asn Pro
2810 2815 2820
Gly Glu Val Thr Ala Met Ser Glu Ile Thr Thr Asn Arg Leu Thr
2825 2830 2835
Ala Thr Gln Ser Thr Ala Pro Lys Gly Ile Pro Val Lys Pro Thr
2840 2845 2850
Ser Ala Glu Ser Gly Leu Leu Thr Pro Val Ser Ala Ser Ser Ser
2855 2860 2865
Pro Ser Lys Ala Phe Ala Ser Leu Thr Thr Ala Pro Pro Thr Trp
2870 2875 2880
Gly Ile Pro Gln Ser Thr Leu Thr Phe Glu Phe Ser Glu Val Pro
2885 2890 2895
Ser Leu Asp Thr Lys Ser Ala Ser Leu Pro Thr Pro Gly Gln Ser
2900 2905 2910
Leu Asn Thr Ile Pro Asp Ser Asp Ala Ser Thr Ala Ser Ser Ser
2915 2920 2925
Leu Ser Lys Ser Pro Glu Lys Asn Pro Arg Ala Arg Met Met Thr
2930 2935 2940
Ser Thr Lys Ala Ile Ser Ala Ser Ser Phe Gln Ser Thr Gly Phe
2945 2950 2955
Thr Glu Thr Pro Glu Gly Ser Ala Ser Pro Ser Met Ala Gly His
2960 2965 2970
Glu Pro Arg Val Pro Thr Ser Gly Thr Gly Asp Pro Arg Tyr Ala
2975 2980 2985
Ser Glu Ser Met Ser Tyr Pro Asp Pro Ser Lys Ala Ser Ser Ala
2990 2995 3000
Met Thr Ser Thr Ser Leu Ala Ser Lys Leu Thr Thr Leu Phe Ser
3005 3010 3015
Thr Gly Gln Ala Ala Arg Ser Gly Ser Ser Ser Ser Pro Ile Ser
3020 3025 3030
Leu Ser Thr Glu Lys Glu Thr Ser Phe Leu Ser Pro Thr Ala Ser
3035 3040 3045
Thr Ser Arg Lys Thr Ser Leu Phe Leu Gly Pro Ser Met Ala Arg
3050 3055 3060
Gln Pro Asn Ile Leu Val His Leu Gln Thr Ser Ala Leu Thr Leu
3065 3070 3075
Ser Pro Thr Ser Thr Leu Asn Met Ser Gln Glu Glu Pro Pro Glu
3080 3085 3090
Leu Thr Ser Ser Gln Thr Ile Ala Glu Glu Glu Gly Thr Thr Ala
3095 3100 3105
Glu Thr Gln Thr Leu Thr Phe Thr Pro Ser Glu Thr Pro Thr Ser
3110 3115 3120
Leu Leu Pro Val Ser Ser Pro Thr Glu Pro Thr Ala Arg Arg Lys
3125 3130 3135
Ser Ser Pro Glu Thr Trp Ala Ser Ser Ile Ser Val Pro Ala Lys
3140 3145 3150
Thr Ser Leu Val Glu Thr Thr Asp Gly Thr Leu Val Thr Thr Ile
3155 3160 3165
Lys Met Ser Ser Gln Ala Ala Gln Gly Asn Ser Thr Trp Pro Ala
3170 3175 3180
Pro Ala Glu Glu Thr Gly Ser Ser Pro Ala Gly Thr Ser Pro Gly
3185 3190 3195
Ser Pro Glu Met Ser Thr Thr Leu Lys Ile Met Ser Ser Lys Glu
3200 3205 3210
Pro Ser Ile Ser Pro Glu Ile Arg Ser Thr Val Arg Asn Ser Pro
3215 3220 3225
Trp Lys Thr Pro Glu Thr Thr Val Pro Met Glu Thr Thr Val Glu
3230 3235 3240
Pro Val Thr Leu Gln Ser Thr Ala Leu Gly Ser Gly Ser Thr Ser
3245 3250 3255
Ile Ser His Leu Pro Thr Gly Thr Thr Ser Pro Thr Lys Ser Pro
3260 3265 3270
Thr Glu Asn Met Leu Ala Thr Glu Arg Val Ser Leu Ser Pro Ser
3275 3280 3285
Pro Pro Glu Ala Trp Thr Asn Leu Tyr Ser Gly Thr Pro Gly Gly
3290 3295 3300
Thr Arg Gln Ser Leu Ala Thr Met Ser Ser Val Ser Leu Glu Ser
3305 3310 3315
Pro Thr Ala Arg Ser Ile Thr Gly Thr Gly Gln Gln Ser Ser Pro
3320 3325 3330
Glu Leu Val Ser Lys Thr Thr Gly Met Glu Phe Ser Met Trp His
3335 3340 3345
Gly Ser Thr Gly Gly Thr Thr Gly Asp Thr His Val Ser Leu Ser
3350 3355 3360
Thr Ser Ser Asn Ile Leu Glu Asp Pro Val Thr Ser Pro Asn Ser
3365 3370 3375
Val Ser Ser Leu Thr Asp Lys Ser Lys His Lys Thr Glu Thr Trp
3380 3385 3390
Val Ser Thr Thr Ala Ile Pro Ser Thr Val Leu Asn Asn Lys Ile
3395 3400 3405
Met Ala Ala Glu Gln Gln Thr Ser Arg Ser Val Asp Glu Ala Tyr
3410 3415 3420
Ser Ser Thr Ser Ser Trp Ser Asp Gln Thr Ser Gly Ser Asp Ile
3425 3430 3435
Thr Leu Gly Ala Ser Pro Asp Val Thr Asn Thr Leu Tyr Ile Thr
3440 3445 3450
Ser Thr Ala Gln Thr Thr Ser Leu Val Ser Leu Pro Ser Gly Asp
3455 3460 3465
Gln Gly Ile Thr Ser Leu Thr Asn Pro Ser Gly Gly Lys Thr Ser
3470 3475 3480
Ser Ala Ser Ser Val Thr Ser Pro Ser Ile Gly Leu Glu Thr Leu
3485 3490 3495
Arg Ala Asn Val Ser Ala Val Lys Ser Asp Ile Ala Pro Thr Ala
3500 3505 3510
Gly His Leu Ser Gln Thr Ser Ser Pro Ala Glu Val Ser Ile Leu
3515 3520 3525
Asp Val Thr Thr Ala Pro Thr Pro Gly Ile Ser Thr Thr Ile Thr
3530 3535 3540
Thr Met Gly Thr Asn Ser Ile Ser Thr Thr Thr Pro Asn Pro Glu
3545 3550 3555
Val Gly Met Ser Thr Met Asp Ser Thr Pro Ala Thr Glu Arg Arg
3560 3565 3570
Thr Thr Ser Thr Glu His Pro Ser Thr Trp Ser Ser Thr Ala Ala
3575 3580 3585
Ser Asp Ser Trp Thr Val Thr Asp Met Thr Ser Asn Leu Lys Val
3590 3595 3600
Ala Arg Ser Pro Gly Thr Ile Ser Thr Met His Thr Thr Ser Phe
3605 3610 3615
Leu Ala Ser Ser Thr Glu Leu Asp Ser Met Ser Thr Pro His Gly
3620 3625 3630
Arg Ile Thr Val Ile Gly Thr Ser Leu Val Thr Pro Ser Ser Asp
3635 3640 3645
Ala Ser Ala Val Lys Thr Glu Thr Ser Thr Ser Glu Arg Thr Leu
3650 3655 3660
Ser Pro Ser Asp Thr Thr Ala Ser Thr Pro Ile Ser Thr Phe Ser
3665 3670 3675
Arg Val Gln Arg Met Ser Ile Ser Val Pro Asp Ile Leu Ser Thr
3680 3685 3690
Ser Trp Thr Pro Ser Ser Thr Glu Ala Glu Asp Val Pro Val Ser
3695 3700 3705
Met Val Ser Thr Asp His Ala Ser Thr Lys Thr Asp Pro Asn Thr
3710 3715 3720
Pro Leu Ser Thr Phe Leu Phe Asp Ser Leu Ser Thr Leu Asp Trp
3725 3730 3735
Asp Thr Gly Arg Ser Leu Ser Ser Ala Thr Ala Thr Thr Ser Ala
3740 3745 3750
Pro Gln Gly Ala Thr Thr Pro Gln Glu Leu Thr Leu Glu Thr Met
3755 3760 3765
Ile Ser Pro Ala Thr Ser Gln Leu Pro Phe Ser Ile Gly His Ile
3770 3775 3780
Thr Ser Ala Val Thr Pro Ala Ala Met Ala Arg Ser Ser Gly Val
3785 3790 3795
Thr Phe Ser Arg Pro Asp Pro Thr Ser Lys Lys Ala Glu Gln Thr
3800 3805 3810
Ser Thr Gln Leu Pro Thr Thr Thr Ser Ala His Pro Gly Gln Val
3815 3820 3825
Pro Arg Ser Ala Ala Thr Thr Leu Asp Val Ile Pro His Thr Ala
3830 3835 3840
Lys Thr Pro Asp Ala Thr Phe Gln Arg Gln Gly Gln Thr Ala Leu
3845 3850 3855
Thr Thr Glu Ala Arg Ala Thr Ser Asp Ser Trp Asn Glu Lys Glu
3860 3865 3870
Lys Ser Thr Pro Ser Ala Pro Trp Ile Thr Glu Met Met Asn Ser
3875 3880 3885
Val Ser Glu Asp Thr Ile Lys Glu Val Thr Ser Ser Ser Ser Val
3890 3895 3900
Leu Arg Thr Leu Asn Thr Leu Asp Ile Asn Leu Glu Ser Gly Thr
3905 3910 3915
Thr Ser Ser Pro Ser Trp Lys Ser Ser Pro Tyr Glu Arg Ile Ala
3920 3925 3930
Pro Ser Glu Ser Thr Thr Asp Lys Glu Ala Ile His Pro Ser Thr
3935 3940 3945
Asn Thr Val Glu Thr Thr Gly Trp Val Thr Ser Ser Glu His Ala
3950 3955 3960
Ser His Ser Thr Ile Pro Ala His Ser Ala Ser Ser Lys Leu Thr
3965 3970 3975
Ser Pro Val Val Thr Thr Ser Thr Arg Glu Gln Ala Ile Val Ser
3980 3985 3990
Met Ser Thr Thr Thr Trp Pro Glu Ser Thr Arg Ala Arg Thr Glu
3995 4000 4005
Pro Asn Ser Phe Leu Thr Ile Glu Leu Arg Asp Val Ser Pro Tyr
4010 4015 4020
Met Asp Thr Ser Ser Thr Thr Gln Thr Ser Ile Ile Ser Ser Pro
4025 4030 4035
Gly Ser Thr Ala Ile Thr Lys Gly Pro Arg Thr Glu Ile Thr Ser
4040 4045 4050
Ser Lys Arg Ile Ser Ser Ser Phe Leu Ala Gln Ser Met Arg Ser
4055 4060 4065
Ser Asp Ser Pro Ser Glu Ala Ile Thr Arg Leu Ser Asn Phe Pro
4070 4075 4080
Ala Met Thr Glu Ser Gly Gly Met Ile Leu Ala Met Gln Thr Ser
4085 4090 4095
Pro Pro Gly Ala Thr Ser Leu Ser Ala Pro Thr Leu Asp Thr Ser
4100 4105 4110
Ala Thr Ala Ser Trp Thr Gly Thr Pro Leu Ala Thr Thr Gln Arg
4115 4120 4125
Phe Thr Tyr Ser Glu Lys Thr Thr Leu Phe Ser Lys Gly Pro Glu
4130 4135 4140
Asp Thr Ser Gln Pro Ser Pro Pro Ser Val Glu Glu Thr Ser Ser
4145 4150 4155
Ser Ser Ser Leu Val Pro Ile His Ala Thr Thr Ser Pro Ser Asn
4160 4165 4170
Ile Leu Leu Thr Ser Gln Gly His Ser Pro Ser Ser Thr Pro Pro
4175 4180 4185
Val Thr Ser Val Phe Leu Ser Glu Thr Ser Gly Leu Gly Lys Thr
4190 4195 4200
Thr Asp Met Ser Arg Ile Ser Leu Glu Pro Gly Thr Ser Leu Pro
4205 4210 4215
Pro Asn Leu Ser Ser Thr Ala Gly Glu Ala Leu Ser Thr Tyr Glu
4220 4225 4230
Ala Ser Arg Asp Thr Lys Ala Ile His His Ser Ala Asp Thr Ala
4235 4240 4245
Val Thr Asn Met Glu Ala Thr Ser Ser Glu Tyr Ser Pro Ile Pro
4250 4255 4260
Gly His Thr Lys Pro Ser Lys Ala Thr Ser Pro Leu Val Thr Ser
4265 4270 4275
His Ile Met Gly Asp Ile Thr Ser Ser Thr Ser Val Phe Gly Ser
4280 4285 4290
Ser Glu Thr Thr Glu Ile Glu Thr Val Ser Ser Val Asn Gln Gly
4295 4300 4305
Leu Gln Glu Arg Ser Thr Ser Gln Val Ala Ser Ser Ala Thr Glu
4310 4315 4320
Thr Ser Thr Val Ile Thr His Val Ser Ser Gly Asp Ala Thr Thr
4325 4330 4335
His Val Thr Lys Thr Gln Ala Thr Phe Ser Ser Gly Thr Ser Ile
4340 4345 4350
Ser Ser Pro His Gln Phe Ile Thr Ser Thr Asn Thr Phe Thr Asp
4355 4360 4365
Val Ser Thr Asn Pro Ser Thr Ser Leu Ile Met Thr Glu Ser Ser
4370 4375 4380
Gly Val Thr Ile Thr Thr Gln Thr Gly Pro Thr Gly Ala Ala Thr
4385 4390 4395
Gln Gly Pro Tyr Leu Leu Asp Thr Ser Thr Met Pro Tyr Leu Thr
4400 4405 4410
Glu Thr Pro Leu Ala Val Thr Pro Asp Phe Met Gln Ser Glu Lys
4415 4420 4425
Thr Thr Leu Ile Ser Lys Gly Pro Lys Asp Val Ser Trp Thr Ser
4430 4435 4440
Pro Pro Ser Val Ala Glu Thr Ser Tyr Pro Ser Ser Leu Thr Pro
4445 4450 4455
Phe Leu Val Thr Thr Ile Pro Pro Ala Thr Ser Thr Leu Gln Gly
4460 4465 4470
Gln His Thr Ser Ser Pro Val Ser Ala Thr Ser Val Leu Thr Ser
4475 4480 4485
Gly Leu Val Lys Thr Thr Asp Met Leu Asn Thr Ser Met Glu Pro
4490 4495 4500
Val Thr Asn Ser Pro Gln Asn Leu Asn Asn Pro Ser Asn Glu Ile
4505 4510 4515
Leu Ala Thr Leu Ala Ala Thr Thr Asp Ile Glu Thr Ile His Pro
4520 4525 4530
Ser Ile Asn Lys Ala Val Thr Asn Met Gly Thr Ala Ser Ser Ala
4535 4540 4545
His Val Leu His Ser Thr Leu Pro Val Ser Ser Glu Pro Ser Thr
4550 4555 4560
Ala Thr Ser Pro Met Val Pro Ala Ser Ser Met Gly Asp Ala Leu
4565 4570 4575
Ala Ser Ile Ser Ile Pro Gly Ser Glu Thr Thr Asp Ile Glu Gly
4580 4585 4590
Glu Pro Thr Ser Ser Leu Thr Ala Gly Arg Lys Glu Asn Ser Thr
4595 4600 4605
Leu Gln Glu Met Asn Ser Thr Thr Glu Ser Asn Ile Ile Leu Ser
4610 4615 4620
Asn Val Ser Val Gly Ala Ile Thr Glu Ala Thr Lys Met Glu Val
4625 4630 4635
Pro Ser Phe Asp Ala Thr Phe Ile Pro Thr Pro Ala Gln Ser Thr
4640 4645 4650
Lys Phe Pro Asp Ile Phe Ser Val Ala Ser Ser Arg Leu Ser Asn
4655 4660 4665
Ser Pro Pro Met Thr Ile Ser Thr His Met Thr Thr Thr Gln Thr
4670 4675 4680
Gly Ser Ser Gly Ala Thr Ser Lys Ile Pro Leu Ala Leu Asp Thr
4685 4690 4695
Ser Thr Leu Glu Thr Ser Ala Gly Thr Pro Ser Val Val Thr Glu
4700 4705 4710
Gly Phe Ala His Ser Lys Ile Thr Thr Ala Met Asn Asn Asp Val
4715 4720 4725
Lys Asp Val Ser Gln Thr Asn Pro Pro Phe Gln Asp Glu Ala Ser
4730 4735 4740
Ser Pro Ser Ser Gln Ala Pro Val Leu Val Thr Thr Leu Pro Ser
4745 4750 4755
Ser Val Ala Phe Thr Pro Gln Trp His Ser Thr Ser Ser Pro Val
4760 4765 4770
Ser Met Ser Ser Val Leu Thr Ser Ser Leu Val Lys Thr Ala Gly
4775 4780 4785
Lys Val Asp Thr Ser Leu Glu Thr Val Thr Ser Ser Pro Gln Ser
4790 4795 4800
Met Ser Asn Thr Leu Asp Asp Ile Ser Val Thr Ser Ala Ala Thr
4805 4810 4815
Thr Asp Ile Glu Thr Thr His Pro Ser Ile Asn Thr Val Val Thr
4820 4825 4830
Asn Val Gly Thr Thr Gly Ser Ala Phe Glu Ser His Ser Thr Val
4835 4840 4845
Ser Ala Tyr Pro Glu Pro Ser Lys Val Thr Ser Pro Asn Val Thr
4850 4855 4860
Thr Ser Thr Met Glu Asp Thr Thr Ile Ser Arg Ser Ile Pro Lys
4865 4870 4875
Ser Ser Lys Thr Thr Arg Thr Glu Thr Glu Thr Thr Ser Ser Leu
4880 4885 4890
Thr Pro Lys Leu Arg Glu Thr Ser Ile Ser Gln Glu Ile Thr Ser
4895 4900 4905
Ser Thr Glu Thr Ser Thr Val Pro Tyr Lys Glu Leu Thr Gly Ala
4910 4915 4920
Thr Thr Glu Val Ser Arg Thr Asp Val Thr Ser Ser Ser Ser Thr
4925 4930 4935
Ser Phe Pro Gly Pro Asp Gln Ser Thr Val Ser Leu Asp Ile Ser
4940 4945 4950
Thr Glu Thr Asn Thr Arg Leu Ser Thr Ser Pro Ile Met Thr Glu
4955 4960 4965
Ser Ala Glu Ile Thr Ile Thr Thr Gln Thr Gly Pro His Gly Ala
4970 4975 4980
Thr Ser Gln Asp Thr Phe Thr Met Asp Pro Ser Asn Thr Thr Pro
4985 4990 4995
Gln Ala Gly Ile His Ser Ala Met Thr His Gly Phe Ser Gln Leu
5000 5005 5010
Asp Val Thr Thr Leu Met Ser Arg Ile Pro Gln Asp Val Ser Trp
5015 5020 5025
Thr Ser Pro Pro Ser Val Asp Lys Thr Ser Ser Pro Ser Ser Phe
5030 5035 5040
Leu Ser Ser Pro Ala Met Thr Thr Pro Ser Leu Ile Ser Ser Thr
5045 5050 5055
Leu Pro Glu Asp Lys Leu Ser Ser Pro Met Thr Ser Leu Leu Thr
5060 5065 5070
Ser Gly Leu Val Lys Ile Thr Asp Ile Leu Arg Thr Arg Leu Glu
5075 5080 5085
Pro Val Thr Ser Ser Leu Pro Asn Phe Ser Ser Thr Ser Asp Lys
5090 5095 5100
Ile Leu Ala Thr Ser Lys Asp Ser Lys Asp Thr Lys Glu Ile Phe
5105 5110 5115
Pro Ser Ile Asn Thr Glu Glu Thr Asn Val Lys Ala Asn Asn Ser
5120 5125 5130
Gly His Glu Ser His Ser Pro Ala Leu Ala Asp Ser Glu Thr Pro
5135 5140 5145
Lys Ala Thr Thr Gln Met Val Ile Thr Thr Thr Val Gly Asp Pro
5150 5155 5160
Ala Pro Ser Thr Ser Met Pro Val His Gly Ser Ser Glu Thr Thr
5165 5170 5175
Asn Ile Lys Arg Glu Pro Thr Tyr Phe Leu Thr Pro Arg Leu Arg
5180 5185 5190
Glu Thr Ser Thr Ser Gln Glu Ser Ser Phe Pro Thr Asp Thr Ser
5195 5200 5205
Phe Leu Leu Ser Lys Val Pro Thr Gly Thr Ile Thr Glu Val Ser
5210 5215 5220
Ser Thr Gly Val Asn Ser Ser Ser Lys Ile Ser Thr Pro Asp His
5225 5230 5235
Asp Lys Ser Thr Val Pro Pro Asp Thr Phe Thr Gly Glu Ile Pro
5240 5245 5250
Arg Val Phe Thr Ser Ser Ile Lys Thr Lys Ser Ala Glu Met Thr
5255 5260 5265
Ile Thr Thr Gln Ala Ser Pro Pro Glu Ser Ala Ser His Ser Thr
5270 5275 5280
Leu Pro Leu Asp Thr Ser Thr Thr Leu Ser Gln Gly Gly Thr His
5285 5290 5295
Ser Thr Val Thr Gln Gly Phe Pro Tyr Ser Glu Val Thr Thr Leu
5300 5305 5310
Met Gly Met Gly Pro Gly Asn Val Ser Trp Met Thr Thr Pro Pro
5315 5320 5325
Val Glu Glu Thr Ser Ser Val Ser Ser Leu Met Ser Ser Pro Ala
5330 5335 5340
Met Thr Ser Pro Ser Pro Val Ser Ser Thr Ser Pro Gln Ser Ile
5345 5350 5355
Pro Ser Ser Pro Leu Pro Val Thr Ala Leu Pro Thr Ser Val Leu
5360 5365 5370
Val Thr Thr Thr Asp Val Leu Gly Thr Thr Ser Pro Glu Ser Val
5375 5380 5385
Thr Ser Ser Pro Pro Asn Leu Ser Ser Ile Thr His Glu Arg Pro
5390 5395 5400
Ala Thr Tyr Lys Asp Thr Ala His Thr Glu Ala Ala Met His His
5405 5410 5415
Ser Thr Asn Thr Ala Val Thr Asn Val Gly Thr Ser Gly Ser Gly
5420 5425 5430
His Lys Ser Gln Ser Ser Val Leu Ala Asp Ser Glu Thr Ser Lys
5435 5440 5445
Ala Thr Pro Leu Met Ser Thr Thr Ser Thr Leu Gly Asp Thr Ser
5450 5455 5460
Val Ser Thr Ser Thr Pro Asn Ile Ser Gln Thr Asn Gln Ile Gln
5465 5470 5475
Thr Glu Pro Thr Ala Ser Leu Ser Pro Arg Leu Arg Glu Ser Ser
5480 5485 5490
Thr Ser Glu Lys Thr Ser Ser Thr Thr Glu Thr Asn Thr Ala Phe
5495 5500 5505
Ser Tyr Val Pro Thr Gly Ala Ile Thr Gln Ala Ser Arg Thr Glu
5510 5515 5520
Ile Ser Ser Ser Arg Thr Ser Ile Ser Asp Leu Asp Arg Pro Thr
5525 5530 5535
Ile Ala Pro Asp Ile Ser Thr Gly Met Ile Thr Arg Leu Phe Thr
5540 5545 5550
Ser Pro Ile Met Thr Lys Ser Ala Glu Met Thr Val Thr Thr Gln
5555 5560 5565
Thr Thr Thr Pro Gly Ala Thr Ser Gln Gly Ile Leu Pro Trp Asp
5570 5575 5580
Thr Ser Thr Thr Leu Phe Gln Gly Gly Thr His Ser Thr Val Ser
5585 5590 5595
Gln Gly Phe Pro His Ser Glu Ile Thr Thr Leu Arg Ser Arg Thr
5600 5605 5610
Pro Gly Asp Val Ser Trp Met Thr Thr Pro Pro Val Glu Glu Thr
5615 5620 5625
Ser Ser Gly Phe Ser Leu Met Ser Pro Ser Met Thr Ser Pro Ser
5630 5635 5640
Pro Val Ser Ser Thr Ser Pro Glu Ser Ile Pro Ser Ser Pro Leu
5645 5650 5655
Pro Val Thr Ala Leu Leu Thr Ser Val Leu Val Thr Thr Thr Asn
5660 5665 5670
Val Leu Gly Thr Thr Ser Pro Glu Pro Val Thr Ser Ser Pro Pro
5675 5680 5685
Asn Leu Ser Ser Pro Thr Gln Glu Arg Leu Thr Thr Tyr Lys Asp
5690 5695 5700
Thr Ala His Thr Glu Ala Met His Ala Ser Met His Thr Asn Thr
5705 5710 5715
Ala Val Ala Asn Val Gly Thr Ser Ile Ser Gly His Glu Ser Gln
5720 5725 5730
Ser Ser Val Pro Ala Asp Ser His Thr Ser Lys Ala Thr Ser Pro
5735 5740 5745
Met Gly Ile Thr Phe Ala Met Gly Asp Thr Ser Val Ser Thr Ser
5750 5755 5760
Thr Pro Ala Phe Phe Glu Thr Arg Ile Gln Thr Glu Ser Thr Ser
5765 5770 5775
Ser Leu Ile Pro Gly Leu Arg Asp Thr Arg Thr Ser Glu Glu Ile
5780 5785 5790
Asn Thr Val Thr Glu Thr Ser Thr Val Leu Ser Glu Val Pro Thr
5795 5800 5805
Thr Thr Thr Thr Glu Val Ser Arg Thr Glu Val Ile Thr Ser Ser
5810 5815 5820
Arg Thr Thr Ile Ser Gly Pro Asp His Ser Lys Met Ser Pro Tyr
5825 5830 5835
Ile Ser Thr Glu Thr Ile Thr Arg Leu Ser Thr Phe Pro Phe Val
5840 5845 5850
Thr Gly Ser Thr Glu Met Ala Ile Thr Asn Gln Thr Gly Pro Ile
5855 5860 5865
Gly Thr Ile Ser Gln Ala Thr Leu Thr Leu Asp Thr Ser Ser Thr
5870 5875 5880
Ala Ser Trp Glu Gly Thr His Ser Pro Val Thr Gln Arg Phe Pro
5885 5890 5895
His Ser Glu Glu Thr Thr Thr Met Ser Arg Ser Thr Lys Gly Val
5900 5905 5910
Ser Trp Gln Ser Pro Pro Ser Val Glu Glu Thr Ser Ser Pro Ser
5915 5920 5925
Ser Pro Val Pro Leu Pro Ala Ile Thr Ser His Ser Ser Leu Tyr
5930 5935 5940
Ser Ala Val Ser Gly Ser Ser Pro Thr Ser Ala Leu Pro Val Thr
5945 5950 5955
Ser Leu Leu Thr Ser Gly Arg Arg Lys Thr Ile Asp Met Leu Asp
5960 5965 5970
Thr His Ser Glu Leu Val Thr Ser Ser Leu Pro Ser Ala Ser Ser
5975 5980 5985
Phe Ser Gly Glu Ile Leu Thr Ser Glu Ala Ser Thr Asn Thr Glu
5990 5995 6000
Thr Ile His Phe Ser Glu Asn Thr Ala Glu Thr Asn Met Gly Thr
6005 6010 6015
Thr Asn Ser Met His Lys Leu His Ser Ser Val Ser Ile His Ser
6020 6025 6030
Gln Pro Ser Gly His Thr Pro Pro Lys Val Thr Gly Ser Met Met
6035 6040 6045
Glu Asp Ala Ile Val Ser Thr Ser Thr Pro Gly Ser Pro Glu Thr
6050 6055 6060
Lys Asn Val Asp Arg Asp Ser Thr Ser Pro Leu Thr Pro Glu Leu
6065 6070 6075
Lys Glu Asp Ser Thr Ala Leu Val Met Asn Ser Thr Thr Glu Ser
6080 6085 6090
Asn Thr Val Phe Ser Ser Val Ser Leu Asp Ala Ala Thr Glu Val
6095 6100 6105
Ser Arg Ala Glu Val Thr Tyr Tyr Asp Pro Thr Phe Met Pro Ala
6110 6115 6120
Ser Ala Gln Ser Thr Lys Ser Pro Asp Ile Ser Pro Glu Ala Ser
6125 6130 6135
Ser Ser His Ser Asn Ser Pro Pro Leu Thr Ile Ser Thr His Lys
6140 6145 6150
Thr Ile Ala Thr Gln Thr Gly Pro Ser Gly Val Thr Ser Leu Gly
6155 6160 6165
Gln Leu Thr Leu Asp Thr Ser Thr Ile Ala Thr Ser Ala Gly Thr
6170 6175 6180
Pro Ser Ala Arg Thr Gln Asp Phe Val Asp Ser Glu Thr Thr Ser
6185 6190 6195
Val Met Asn Asn Asp Leu Asn Asp Val Leu Lys Thr Ser Pro Phe
6200 6205 6210
Ser Ala Glu Glu Ala Asn Ser Leu Ser Ser Gln Ala Pro Leu Leu
6215 6220 6225
Val Thr Thr Ser Pro Ser Pro Val Thr Ser Thr Leu Gln Glu His
6230 6235 6240
Ser Thr Ser Ser Leu Val Ser Val Thr Ser Val Pro Thr Pro Thr
6245 6250 6255
Leu Ala Lys Ile Thr Asp Met Asp Thr Asn Leu Glu Pro Val Thr
6260 6265 6270
Arg Ser Pro Gln Asn Leu Arg Asn Thr Leu Ala Thr Ser Glu Ala
6275 6280 6285
Thr Thr Asp Thr His Thr Met His Pro Ser Ile Asn Thr Ala Val
6290 6295 6300
Ala Asn Val Gly Thr Thr Ser Ser Pro Asn Glu Phe Tyr Phe Thr
6305 6310 6315
Val Ser Pro Asp Ser Asp Pro Tyr Lys Ala Thr Ser Ala Val Val
6320 6325 6330
Ile Thr Ser Thr Ser Gly Asp Ser Ile Val Ser Thr Ser Met Pro
6335 6340 6345
Arg Ser Ser Ala Met Lys Lys Ile Glu Ser Glu Thr Thr Phe Ser
6350 6355 6360
Leu Ile Phe Arg Leu Arg Glu Thr Ser Thr Ser Gln Lys Ile Gly
6365 6370 6375
Ser Ser Ser Asp Thr Ser Thr Val Phe Asp Lys Ala Phe Thr Ala
6380 6385 6390
Ala Thr Thr Glu Val Ser Arg Thr Glu Leu Thr Ser Ser Ser Arg
6395 6400 6405
Thr Ser Ile Gln Gly Thr Glu Lys Pro Thr Met Ser Pro Asp Thr
6410 6415 6420
Ser Thr Arg Ser Val Thr Met Leu Ser Thr Phe Ala Gly Leu Thr
6425 6430 6435
Lys Ser Glu Glu Arg Thr Ile Ala Thr Gln Thr Gly Pro His Arg
6440 6445 6450
Ala Thr Ser Gln Gly Thr Leu Thr Trp Asp Thr Ser Ile Thr Thr
6455 6460 6465
Ser Gln Ala Gly Thr His Ser Ala Met Thr His Gly Phe Ser Gln
6470 6475 6480
Leu Asp Leu Ser Thr Leu Thr Ser Arg Val Pro Glu Tyr Ile Ser
6485 6490 6495
Gly Thr Ser Pro Pro Ser Val Glu Lys Thr Ser Ser Ser Ser Ser
6500 6505 6510
Leu Leu Ser Leu Pro Ala Ile Thr Ser Pro Ser Pro Val Pro Thr
6515 6520 6525
Thr Leu Pro Glu Ser Arg Pro Ser Ser Pro Val His Leu Thr Ser
6530 6535 6540
Leu Pro Thr Ser Gly Leu Val Lys Thr Thr Asp Met Leu Ala Ser
6545 6550 6555
Val Ala Ser Leu Pro Pro Asn Leu Gly Ser Thr Ser His Lys Ile
6560 6565 6570
Pro Thr Thr Ser Glu Asp Ile Lys Asp Thr Glu Lys Met Tyr Pro
6575 6580 6585
Ser Thr Asn Ile Ala Val Thr Asn Val Gly Thr Thr Thr Ser Glu
6590 6595 6600
Lys Glu Ser Tyr Ser Ser Val Pro Ala Tyr Ser Glu Pro Pro Lys
6605 6610 6615
Val Thr Ser Pro Met Val Thr Ser Phe Asn Ile Arg Asp Thr Ile
6620 6625 6630
Val Ser Thr Ser Met Pro Gly Ser Ser Glu Ile Thr Arg Ile Glu
6635 6640 6645
Met Glu Ser Thr Phe Ser Leu Ala His Gly Leu Lys Gly Thr Ser
6650 6655 6660
Thr Ser Gln Asp Pro Ile Val Ser Thr Glu Lys Ser Ala Val Leu
6665 6670 6675
His Lys Leu Thr Thr Gly Ala Thr Glu Thr Ser Arg Thr Glu Val
6680 6685 6690
Ala Ser Ser Arg Arg Thr Ser Ile Pro Gly Pro Asp His Ser Thr
6695 6700 6705
Glu Ser Pro Asp Ile Ser Thr Glu Val Ile Pro Ser Leu Pro Ile
6710 6715 6720
Ser Leu Gly Ile Thr Glu Ser Ser Asn Met Thr Ile Ile Thr Arg
6725 6730 6735
Thr Gly Pro Pro Leu Gly Ser Thr Ser Gln Gly Thr Phe Thr Leu
6740 6745 6750
Asp Thr Pro Thr Thr Ser Ser Arg Ala Gly Thr His Ser Met Ala
6755 6760 6765
Thr Gln Glu Phe Pro His Ser Glu Met Thr Thr Val Met Asn Lys
6770 6775 6780
Asp Pro Glu Ile Leu Ser Trp Thr Ile Pro Pro Ser Ile Glu Lys
6785 6790 6795
Thr Ser Phe Ser Ser Ser Leu Met Pro Ser Pro Ala Met Thr Ser
6800 6805 6810
Pro Pro Val Ser Ser Thr Leu Pro Lys Thr Ile His Thr Thr Pro
6815 6820 6825
Ser Pro Met Thr Ser Leu Leu Thr Pro Ser Leu Val Met Thr Thr
6830 6835 6840
Asp Thr Leu Gly Thr Ser Pro Glu Pro Thr Thr Ser Ser Pro Pro
6845 6850 6855
Asn Leu Ser Ser Thr Ser His Glu Ile Leu Thr Thr Asp Glu Asp
6860 6865 6870
Thr Thr Ala Ile Glu Ala Met His Pro Ser Thr Ser Thr Ala Ala
6875 6880 6885
Thr Asn Val Glu Thr Thr Ser Ser Gly His Gly Ser Gln Ser Ser
6890 6895 6900
Val Leu Ala Asp Ser Glu Lys Thr Lys Ala Thr Ala Pro Met Asp
6905 6910 6915
Thr Thr Ser Thr Met Gly His Thr Thr Val Ser Thr Ser Met Ser
6920 6925 6930
Val Ser Ser Glu Thr Thr Lys Ile Lys Arg Glu Ser Thr Tyr Ser
6935 6940 6945
Leu Thr Pro Gly Leu Arg Glu Thr Ser Ile Ser Gln Asn Ala Ser
6950 6955 6960
Phe Ser Thr Asp Thr Ser Ile Val Leu Ser Glu Val Pro Thr Gly
6965 6970 6975
Thr Thr Ala Glu Val Ser Arg Thr Glu Val Thr Ser Ser Gly Arg
6980 6985 6990
Thr Ser Ile Pro Gly Pro Ser Gln Ser Thr Val Leu Pro Glu Ile
6995 7000 7005
Ser Thr Arg Thr Met Thr Arg Leu Phe Ala Ser Pro Thr Met Thr
7010 7015 7020
Glu Ser Ala Glu Met Thr Ile Pro Thr Gln Thr Gly Pro Ser Gly
7025 7030 7035
Ser Thr Ser Gln Asp Thr Leu Thr Leu Asp Thr Ser Thr Thr Lys
7040 7045 7050
Ser Gln Ala Lys Thr His Ser Thr Leu Thr Gln Arg Phe Pro His
7055 7060 7065
Ser Glu Met Thr Thr Leu Met Ser Arg Gly Pro Gly Asp Met Ser
7070 7075 7080
Trp Gln Ser Ser Pro Ser Leu Glu Asn Pro Ser Ser Leu Pro Ser
7085 7090 7095
Leu Leu Ser Leu Pro Ala Thr Thr Ser Pro Pro Pro Ile Ser Ser
7100 7105 7110
Thr Leu Pro Val Thr Ile Ser Ser Ser Pro Leu Pro Val Thr Ser
7115 7120 7125
Leu Leu Thr Ser Ser Pro Val Thr Thr Thr Asp Met Leu His Thr
7130 7135 7140
Ser Pro Glu Leu Val Thr Ser Ser Pro Pro Lys Leu Ser His Thr
7145 7150 7155
Ser Asp Glu Arg Leu Thr Thr Gly Lys Asp Thr Thr Asn Thr Glu
7160 7165 7170
Ala Val His Pro Ser Thr Asn Thr Ala Ala Ser Asn Val Glu Ile
7175 7180 7185
Pro Ser Ser Gly His Glu Ser Pro Ser Ser Ala Leu Ala Asp Ser
7190 7195 7200
Glu Thr Ser Lys Ala Thr Ser Pro Met Phe Ile Thr Ser Thr Gln
7205 7210 7215
Glu Asp Thr Thr Val Ala Ile Ser Thr Pro His Phe Leu Glu Thr
7220 7225 7230
Ser Arg Ile Gln Lys Glu Ser Ile Ser Ser Leu Ser Pro Lys Leu
7235 7240 7245
Arg Glu Thr Gly Ser Ser Val Glu Thr Ser Ser Ala Ile Glu Thr
7250 7255 7260
Ser Ala Val Leu Ser Glu Val Ser Ile Gly Ala Thr Thr Glu Ile
7265 7270 7275
Ser Arg Thr Glu Val Thr Ser Ser Ser Arg Thr Ser Ile Ser Gly
7280 7285 7290
Ser Ala Glu Ser Thr Met Leu Pro Glu Ile Ser Thr Thr Arg Lys
7295 7300 7305
Ile Ile Lys Phe Pro Thr Ser Pro Ile Leu Ala Glu Ser Ser Glu
7310 7315 7320
Met Thr Ile Lys Thr Gln Thr Ser Pro Pro Gly Ser Thr Ser Glu
7325 7330 7335
Ser Thr Phe Thr Leu Asp Thr Ser Thr Thr Pro Ser Leu Val Ile
7340 7345 7350
Thr His Ser Thr Met Thr Gln Arg Leu Pro His Ser Glu Ile Thr
7355 7360 7365
Thr Leu Val Ser Arg Gly Ala Gly Asp Val Pro Arg Pro Ser Ser
7370 7375 7380
Leu Pro Val Glu Glu Thr Ser Pro Pro Ser Ser Gln Leu Ser Leu
7385 7390 7395
Ser Ala Met Ile Ser Pro Ser Pro Val Ser Ser Thr Leu Pro Ala
7400 7405 7410
Ser Ser His Ser Ser Ser Ala Ser Val Thr Ser Leu Leu Thr Pro
7415 7420 7425
Gly Gln Val Lys Thr Thr Glu Val Leu Asp Ala Ser Ala Glu Pro
7430 7435 7440
Glu Thr Ser Ser Pro Pro Ser Leu Ser Ser Thr Ser Val Glu Ile
7445 7450 7455
Leu Ala Thr Ser Glu Val Thr Thr Asp Thr Glu Lys Ile His Pro
7460 7465 7470
Phe Ser Asn Thr Ala Val Thr Lys Val Gly Thr Ser Ser Ser Gly
7475 7480 7485
His Glu Ser Pro Ser Ser Val Leu Pro Asp Ser Glu Thr Thr Lys
7490 7495 7500
Ala Thr Ser Ala Met Gly Thr Ile Ser Ile Met Gly Asp Thr Ser
7505 7510 7515
Val Ser Thr Leu Thr Pro Ala Leu Ser Asn Thr Arg Lys Ile Gln
7520 7525 7530
Ser Glu Pro Ala Ser Ser Leu Thr Thr Arg Leu Arg Glu Thr Ser
7535 7540 7545
Thr Ser Glu Glu Thr Ser Leu Ala Thr Glu Ala Asn Thr Val Leu
7550 7555 7560
Ser Lys Val Ser Thr Gly Ala Thr Thr Glu Val Ser Arg Thr Glu
7565 7570 7575
Ala Ile Ser Phe Ser Arg Thr Ser Met Ser Gly Pro Glu Gln Ser
7580 7585 7590
Thr Met Ser Gln Asp Ile Ser Ile Gly Thr Ile Pro Arg Ile Ser
7595 7600 7605
Ala Ser Ser Val Leu Thr Glu Ser Ala Lys Met Thr Ile Thr Thr
7610 7615 7620
Gln Thr Gly Pro Ser Glu Ser Thr Leu Glu Ser Thr Leu Asn Leu
7625 7630 7635
Asn Thr Ala Thr Thr Pro Ser Trp Val Glu Thr His Ser Ile Val
7640 7645 7650
Ile Gln Gly Phe Pro His Pro Glu Met Thr Thr Ser Met Gly Arg
7655 7660 7665
Gly Pro Gly Gly Val Ser Trp Pro Ser Pro Pro Phe Val Lys Glu
7670 7675 7680
Thr Ser Pro Pro Ser Ser Pro Leu Ser Leu Pro Ala Val Thr Ser
7685 7690 7695
Pro His Pro Val Ser Thr Thr Phe Leu Ala His Ile Pro Pro Ser
7700 7705 7710
Pro Leu Pro Val Thr Ser Leu Leu Thr Ser Gly Pro Ala Thr Thr
7715 7720 7725
Thr Asp Ile Leu Gly Thr Ser Thr Glu Pro Gly Thr Ser Ser Ser
7730 7735 7740
Ser Ser Leu Ser Thr Thr Ser His Glu Arg Leu Thr Thr Tyr Lys
7745 7750 7755
Asp Thr Ala His Thr Glu Ala Val His Pro Ser Thr Asn Thr Gly
7760 7765 7770
Gly Thr Asn Val Ala Thr Thr Ser Ser Gly Tyr Lys Ser Gln Ser
7775 7780 7785
Ser Val Leu Ala Asp Ser Ser Pro Met Cys Thr Thr Ser Thr Met
7790 7795 7800
Gly Asp Thr Ser Val Leu Thr Ser Thr Pro Ala Phe Leu Glu Thr
7805 7810 7815
Arg Arg Ile Gln Thr Glu Leu Ala Ser Ser Leu Thr Pro Gly Leu
7820 7825 7830
Arg Glu Ser Ser Gly Ser Glu Gly Thr Ser Ser Gly Thr Lys Met
7835 7840 7845
Ser Thr Val Leu Ser Lys Val Pro Thr Gly Ala Thr Thr Glu Ile
7850 7855 7860
Ser Lys Glu Asp Val Thr Ser Ile Pro Gly Pro Ala Gln Ser Thr
7865 7870 7875
Ile Ser Pro Asp Ile Ser Thr Arg Thr Val Ser Trp Phe Ser Thr
7880 7885 7890
Ser Pro Val Met Thr Glu Ser Ala Glu Ile Thr Met Asn Thr His
7895 7900 7905
Thr Ser Pro Leu Gly Ala Thr Thr Gln Gly Thr Ser Thr Leu Asp
7910 7915 7920
Thr Ser Ser Thr Thr Ser Leu Thr Met Thr His Ser Thr Ile Ser
7925 7930 7935
Gln Gly Phe Ser His Ser Gln Met Ser Thr Leu Met Arg Arg Gly
7940 7945 7950
Pro Glu Asp Val Ser Trp Met Ser Pro Pro Leu Leu Glu Lys Thr
7955 7960 7965
Arg Pro Ser Phe Ser Leu Met Ser Ser Pro Ala Thr Thr Ser Pro
7970 7975 7980
Ser Pro Val Ser Ser Thr Leu Pro Glu Ser Ile Ser Ser Ser Pro
7985 7990 7995
Leu Pro Val Thr Ser Leu Leu Thr Ser Gly Leu Ala Lys Thr Thr
8000 8005 8010
Asp Met Leu His Lys Ser Ser Glu Pro Val Thr Asn Ser Pro Ala
8015 8020 8025
Asn Leu Ser Ser Thr Ser Val Glu Ile Leu Ala Thr Ser Glu Val
8030 8035 8040
Thr Thr Asp Thr Glu Lys Thr His Pro Ser Ser Asn Arg Thr Val
8045 8050 8055
Thr Asp Val Gly Thr Ser Ser Ser Gly His Glu Ser Thr Ser Phe
8060 8065 8070
Val Leu Ala Asp Ser Gln Thr Ser Lys Val Thr Ser Pro Met Val
8075 8080 8085
Ile Thr Ser Thr Met Glu Asp Thr Ser Val Ser Thr Ser Thr Pro
8090 8095 8100
Gly Phe Phe Glu Thr Ser Arg Ile Gln Thr Glu Pro Thr Ser Ser
8105 8110 8115
Leu Thr Leu Gly Leu Arg Lys Thr Ser Ser Ser Glu Gly Thr Ser
8120 8125 8130
Leu Ala Thr Glu Met Ser Thr Val Leu Ser Gly Val Pro Thr Gly
8135 8140 8145
Ala Thr Ala Glu Val Ser Arg Thr Glu Val Thr Ser Ser Ser Arg
8150 8155 8160
Thr Ser Ile Ser Gly Phe Ala Gln Leu Thr Val Ser Pro Glu Thr
8165 8170 8175
Ser Thr Glu Thr Ile Thr Arg Leu Pro Thr Ser Ser Ile Met Thr
8180 8185 8190
Glu Ser Ala Glu Met Met Ile Lys Thr Gln Thr Asp Pro Pro Gly
8195 8200 8205
Ser Thr Pro Glu Ser Thr His Thr Val Asp Ile Ser Thr Thr Pro
8210 8215 8220
Asn Trp Val Glu Thr His Ser Thr Val Thr Gln Arg Phe Ser His
8225 8230 8235
Ser Glu Met Thr Thr Leu Val Ser Arg Ser Pro Gly Asp Met Leu
8240 8245 8250
Trp Pro Ser Gln Ser Ser Val Glu Glu Thr Ser Ser Ala Ser Ser
8255 8260 8265
Leu Leu Ser Leu Pro Ala Thr Thr Ser Pro Ser Pro Val Ser Ser
8270 8275 8280
Thr Leu Val Glu Asp Phe Pro Ser Ala Ser Leu Pro Val Thr Ser
8285 8290 8295
Leu Leu Asn Pro Gly Leu Val Ile Thr Thr Asp Arg Met Gly Ile
8300 8305 8310
Ser Arg Glu Pro Gly Thr Ser Ser Thr Ser Asn Leu Ser Ser Thr
8315 8320 8325
Ser His Glu Arg Leu Thr Thr Leu Glu Asp Thr Val Asp Thr Glu
8330 8335 8340
Asp Met Gln Pro Ser Thr His Thr Ala Val Thr Asn Val Arg Thr
8345 8350 8355
Ser Ile Ser Gly His Glu Ser Gln Ser Ser Val Leu Ser Asp Ser
8360 8365 8370
Glu Thr Pro Lys Ala Thr Ser Pro Met Gly Thr Thr Tyr Thr Met
8375 8380 8385
Gly Glu Thr Ser Val Ser Ile Ser Thr Ser Asp Phe Phe Glu Thr
8390 8395 8400
Ser Arg Ile Gln Ile Glu Pro Thr Ser Ser Leu Thr Ser Gly Leu
8405 8410 8415
Arg Glu Thr Ser Ser Ser Glu Arg Ile Ser Ser Ala Thr Glu Gly
8420 8425 8430
Ser Thr Val Leu Ser Glu Val Pro Ser Gly Ala Thr Thr Glu Val
8435 8440 8445
Ser Arg Thr Glu Val Ile Ser Ser Arg Gly Thr Ser Met Ser Gly
8450 8455 8460
Pro Asp Gln Phe Thr Ile Ser Pro Asp Ile Ser Thr Glu Ala Ile
8465 8470 8475
Thr Arg Leu Ser Thr Ser Pro Ile Met Thr Glu Ser Ala Glu Ser
8480 8485 8490
Ala Ile Thr Ile Glu Thr Gly Ser Pro Gly Ala Thr Ser Glu Gly
8495 8500 8505
Thr Leu Thr Leu Asp Thr Ser Thr Thr Thr Phe Trp Ser Gly Thr
8510 8515 8520
His Ser Thr Ala Ser Pro Gly Phe Ser His Ser Glu Met Thr Thr
8525 8530 8535
Leu Met Ser Arg Thr Pro Gly Asp Val Pro Trp Pro Ser Leu Pro
8540 8545 8550
Ser Val Glu Glu Ala Ser Ser Val Ser Ser Ser Leu Ser Ser Pro
8555 8560 8565
Ala Met Thr Ser Thr Ser Phe Phe Ser Thr Leu Pro Glu Ser Ile
8570 8575 8580
Ser Ser Ser Pro His Pro Val Thr Ala Leu Leu Thr Leu Gly Pro
8585 8590 8595
Val Lys Thr Thr Asp Met Leu Arg Thr Ser Ser Glu Pro Glu Thr
8600 8605 8610
Ser Ser Pro Pro Asn Leu Ser Ser Thr Ser Ala Glu Ile Leu Ala
8615 8620 8625
Thr Ser Glu Val Thr Lys Asp Arg Glu Lys Ile His Pro Ser Ser
8630 8635 8640
Asn Thr Pro Val Val Asn Val Gly Thr Val Ile Tyr Lys His Leu
8645 8650 8655
Ser Pro Ser Ser Val Leu Ala Asp Leu Val Thr Thr Lys Pro Thr
8660 8665 8670
Ser Pro Met Ala Thr Thr Ser Thr Leu Gly Asn Thr Ser Val Ser
8675 8680 8685
Thr Ser Thr Pro Ala Phe Pro Glu Thr Met Met Thr Gln Pro Thr
8690 8695 8700
Ser Ser Leu Thr Ser Gly Leu Arg Glu Ile Ser Thr Ser Gln Glu
8705 8710 8715
Thr Ser Ser Ala Thr Glu Arg Ser Ala Ser Leu Ser Gly Met Pro
8720 8725 8730
Thr Gly Ala Thr Thr Lys Val Ser Arg Thr Glu Ala Leu Ser Leu
8735 8740 8745
Gly Arg Thr Ser Thr Pro Gly Pro Ala Gln Ser Thr Ile Ser Pro
8750 8755 8760
Glu Ile Ser Thr Glu Thr Ile Thr Arg Ile Ser Thr Pro Leu Thr
8765 8770 8775
Thr Thr Gly Ser Ala Glu Met Thr Ile Thr Pro Lys Thr Gly His
8780 8785 8790
Ser Gly Ala Ser Ser Gln Gly Thr Phe Thr Leu Asp Thr Ser Ser
8795 8800 8805
Arg Ala Ser Trp Pro Gly Thr His Ser Ala Ala Thr His Arg Ser
8810 8815 8820
Pro His Ser Gly Met Thr Thr Pro Met Ser Arg Gly Pro Glu Asp
8825 8830 8835
Val Ser Trp Pro Ser Arg Pro Ser Val Glu Lys Thr Ser Pro Pro
8840 8845 8850
Ser Ser Leu Val Ser Leu Ser Ala Val Thr Ser Pro Ser Pro Leu
8855 8860 8865
Tyr Ser Thr Pro Ser Glu Ser Ser His Ser Ser Pro Leu Arg Val
8870 8875 8880
Thr Ser Leu Phe Thr Pro Val Met Met Lys Thr Thr Asp Met Leu
8885 8890 8895
Asp Thr Ser Leu Glu Pro Val Thr Thr Ser Pro Pro Ser Met Asn
8900 8905 8910
Ile Thr Ser Asp Glu Ser Leu Ala Thr Ser Lys Ala Thr Met Glu
8915 8920 8925
Thr Glu Ala Ile Gln Leu Ser Glu Asn Thr Ala Val Thr Gln Met
8930 8935 8940
Gly Thr Ile Ser Ala Arg Gln Glu Phe Tyr Ser Ser Tyr Pro Gly
8945 8950 8955
Leu Pro Glu Pro Ser Lys Val Thr Ser Pro Val Val Thr Ser Ser
8960 8965 8970
Thr Ile Lys Asp Ile Val Ser Thr Thr Ile Pro Ala Ser Ser Glu
8975 8980 8985
Ile Thr Arg Ile Glu Met Glu Ser Thr Ser Thr Leu Thr Pro Thr
8990 8995 9000
Pro Arg Glu Thr Ser Thr Ser Gln Glu Ile His Ser Ala Thr Lys
9005 9010 9015
Pro Ser Thr Val Pro Tyr Lys Ala Leu Thr Ser Ala Thr Ile Glu
9020 9025 9030
Asp Ser Met Thr Gln Val Met Ser Ser Ser Arg Gly Pro Ser Pro
9035 9040 9045
Asp Gln Ser Thr Met Ser Gln Asp Ile Ser Thr Glu Val Ile Thr
9050 9055 9060
Arg Leu Ser Thr Ser Pro Ile Lys Thr Glu Ser Thr Glu Met Thr
9065 9070 9075
Ile Thr Thr Gln Thr Gly Ser Pro Gly Ala Thr Ser Arg Gly Thr
9080 9085 9090
Leu Thr Leu Asp Thr Ser Thr Thr Phe Met Ser Gly Thr His Ser
9095 9100 9105
Thr Ala Ser Gln Gly Phe Ser His Ser Gln Met Thr Ala Leu Met
9110 9115 9120
Ser Arg Thr Pro Gly Asp Val Pro Trp Leu Ser His Pro Ser Val
9125 9130 9135
Glu Glu Ala Ser Ser Ala Ser Phe Ser Leu Ser Ser Pro Val Met
9140 9145 9150
Thr Ser Ser Ser Pro Val Ser Ser Thr Leu Pro Asp Ser Ile His
9155 9160 9165
Ser Ser Ser Leu Pro Val Thr Ser Leu Leu Thr Ser Gly Leu Val
9170 9175 9180
Lys Thr Thr Glu Leu Leu Gly Thr Ser Ser Glu Pro Glu Thr Ser
9185 9190 9195
Ser Pro Pro Asn Leu Ser Ser Thr Ser Ala Glu Ile Leu Ala Ile
9200 9205 9210
Thr Glu Val Thr Thr Asp Thr Glu Lys Leu Glu Met Thr Asn Val
9215 9220 9225
Val Thr Ser Gly Tyr Thr His Glu Ser Pro Ser Ser Val Leu Ala
9230 9235 9240
Asp Ser Val Thr Thr Lys Ala Thr Ser Ser Met Gly Ile Thr Tyr
9245 9250 9255
Pro Thr Gly Asp Thr Asn Val Leu Thr Ser Thr Pro Ala Phe Ser
9260 9265 9270
Asp Thr Ser Arg Ile Gln Thr Lys Ser Lys Leu Ser Leu Thr Pro
9275 9280 9285
Gly Leu Met Glu Thr Ser Ile Ser Glu Glu Thr Ser Ser Ala Thr
9290 9295 9300
Glu Lys Ser Thr Val Leu Ser Ser Val Pro Thr Gly Ala Thr Thr
9305 9310 9315
Glu Val Ser Arg Thr Glu Ala Ile Ser Ser Ser Arg Thr Ser Ile
9320 9325 9330
Pro Gly Pro Ala Gln Ser Thr Met Ser Ser Asp Thr Ser Met Glu
9335 9340 9345
Thr Ile Thr Arg Ile Ser Thr Pro Leu Thr Arg Lys Glu Ser Thr
9350 9355 9360
Asp Met Ala Ile Thr Pro Lys Thr Gly Pro Ser Gly Ala Thr Ser
9365 9370 9375
Gln Gly Thr Phe Thr Leu Asp Ser Ser Ser Thr Ala Ser Trp Pro
9380 9385 9390
Gly Thr His Ser Ala Thr Thr Gln Arg Phe Pro Gln Ser Val Val
9395 9400 9405
Thr Thr Pro Met Ser Arg Gly Pro Glu Asp Val Ser Trp Pro Ser
9410 9415 9420
Pro Leu Ser Val Glu Lys Asn Ser Pro Pro Ser Ser Leu Val Ser
9425 9430 9435
Ser Ser Ser Val Thr Ser Pro Ser Pro Leu Tyr Ser Thr Pro Ser
9440 9445 9450
Gly Ser Ser His Ser Ser Pro Val Pro Val Thr Ser Leu Phe Thr
9455 9460 9465
Ser Ile Met Met Lys Ala Thr Asp Met Leu Asp Ala Ser Leu Glu
9470 9475 9480
Pro Glu Thr Thr Ser Ala Pro Asn Met Asn Ile Thr Ser Asp Glu
9485 9490 9495
Ser Leu Ala Ala Ser Lys Ala Thr Thr Glu Thr Glu Ala Ile His
9500 9505 9510
Val Phe Glu Asn Thr Ala Ala Ser His Val Glu Thr Thr Ser Ala
9515 9520 9525
Thr Glu Glu Leu Tyr Ser Ser Ser Pro Gly Phe Ser Glu Pro Thr
9530 9535 9540
Lys Val Ile Ser Pro Val Val Thr Ser Ser Ser Ile Arg Asp Asn
9545 9550 9555
Met Val Ser Thr Thr Met Pro Gly Ser Ser Gly Ile Thr Arg Ile
9560 9565 9570
Glu Ile Glu Ser Met Ser Ser Leu Thr Pro Gly Leu Arg Glu Thr
9575 9580 9585
Arg Thr Ser Gln Asp Ile Thr Ser Ser Thr Glu Thr Ser Thr Val
9590 9595 9600
Leu Tyr Lys Met Pro Ser Gly Ala Thr Pro Glu Val Ser Arg Thr
9605 9610 9615
Glu Val Met Pro Ser Ser Arg Thr Ser Ile Pro Gly Pro Ala Gln
9620 9625 9630
Ser Thr Met Ser Leu Asp Ile Ser Asp Glu Val Val Thr Arg Leu
9635 9640 9645
Ser Thr Ser Pro Ile Met Thr Glu Ser Ala Glu Ile Thr Ile Thr
9650 9655 9660
Thr Gln Thr Gly Tyr Ser Leu Ala Thr Ser Gln Val Thr Leu Pro
9665 9670 9675
Leu Gly Thr Ser Met Thr Phe Leu Ser Gly Thr His Ser Thr Met
9680 9685 9690
Ser Gln Gly Leu Ser His Ser Glu Met Thr Asn Leu Met Ser Arg
9695 9700 9705
Gly Pro Glu Ser Leu Ser Trp Thr Ser Pro Arg Phe Val Glu Thr
9710 9715 9720
Thr Arg Ser Ser Ser Ser Leu Thr Ser Leu Pro Leu Thr Thr Ser
9725 9730 9735
Leu Ser Pro Val Ser Ser Thr Leu Leu Asp Ser Ser Pro Ser Ser
9740 9745 9750
Pro Leu Pro Val Thr Ser Leu Ile Leu Pro Gly Leu Val Lys Thr
9755 9760 9765
Thr Glu Val Leu Asp Thr Ser Ser Glu Pro Lys Thr Ser Ser Ser
9770 9775 9780
Pro Asn Leu Ser Ser Thr Ser Val Glu Ile Pro Ala Thr Ser Glu
9785 9790 9795
Ile Met Thr Asp Thr Glu Lys Ile His Pro Ser Ser Asn Thr Ala
9800 9805 9810
Val Ala Lys Val Arg Thr Ser Ser Ser Val His Glu Ser His Ser
9815 9820 9825
Ser Val Leu Ala Asp Ser Glu Thr Thr Ile Thr Ile Pro Ser Met
9830 9835 9840
Gly Ile Thr Ser Ala Val Asp Asp Thr Thr Val Phe Thr Ser Asn
9845 9850 9855
Pro Ala Phe Ser Glu Thr Arg Arg Ile Pro Thr Glu Pro Thr Phe
9860 9865 9870
Ser Leu Thr Pro Gly Phe Arg Glu Thr Ser Thr Ser Glu Glu Thr
9875 9880 9885
Thr Ser Ile Thr Glu Thr Ser Ala Val Leu Tyr Gly Val Pro Thr
9890 9895 9900
Ser Ala Thr Thr Glu Val Ser Met Thr Glu Ile Met Ser Ser Asn
9905 9910 9915
Arg Ile His Ile Pro Asp Ser Asp Gln Ser Thr Met Ser Pro Asp
9920 9925 9930
Ile Ile Thr Glu Val Ile Thr Arg Leu Ser Ser Ser Ser Met Met
9935 9940 9945
Ser Glu Ser Thr Gln Met Thr Ile Thr Thr Gln Lys Ser Ser Pro
9950 9955 9960
Gly Ala Thr Ala Gln Ser Thr Leu Thr Leu Ala Thr Thr Thr Ala
9965 9970 9975
Pro Leu Ala Arg Thr His Ser Thr Val Pro Pro Arg Phe Leu His
9980 9985 9990
Ser Glu Met Thr Thr Leu Met Ser Arg Ser Pro Glu Asn Pro Ser
9995 10000 10005
Trp Lys Ser Ser Leu Phe Val Glu Lys Thr Ser Ser Ser Ser Ser
10010 10015 10020
Leu Leu Ser Leu Pro Val Thr Thr Ser Pro Ser Val Ser Ser Thr
10025 10030 10035
Leu Pro Gln Ser Ile Pro Ser Ser Ser Phe Ser Val Thr Ser Leu
10040 10045 10050
Leu Thr Pro Gly Met Val Lys Thr Thr Asp Thr Ser Thr Glu Pro
10055 10060 10065
Gly Thr Ser Leu Ser Pro Asn Leu Ser Gly Thr Ser Val Glu Ile
10070 10075 10080
Leu Ala Ala Ser Glu Val Thr Thr Asp Thr Glu Lys Ile His Pro
10085 10090 10095
Ser Ser Ser Met Ala Val Thr Asn Val Gly Thr Thr Ser Ser Gly
10100 10105 10110
His Glu Leu Tyr Ser Ser Val Ser Ile His Ser Glu Pro Ser Lys
10115 10120 10125
Ala Thr Tyr Pro Val Gly Thr Pro Ser Ser Met Ala Glu Thr Ser
10130 10135 10140
Ile Ser Thr Ser Met Pro Ala Asn Phe Glu Thr Thr Gly Phe Glu
10145 10150 10155
Ala Glu Pro Phe Ser His Leu Thr Ser Gly Phe Arg Lys Thr Asn
10160 10165 10170
Met Ser Leu Asp Thr Ser Ser Val Thr Pro Thr Asn Thr Pro Ser
10175 10180 10185
Ser Pro Gly Ser Thr His Leu Leu Gln Ser Ser Lys Thr Asp Phe
10190 10195 10200
Thr Ser Ser Ala Lys Thr Ser Ser Pro Asp Trp Pro Pro Ala Ser
10205 10210 10215
Gln Tyr Thr Glu Ile Pro Val Asp Ile Ile Thr Pro Phe Asn Ala
10220 10225 10230
Ser Pro Ser Ile Thr Glu Ser Thr Gly Ile Thr Ser Phe Pro Glu
10235 10240 10245
Ser Arg Phe Thr Met Ser Val Thr Glu Ser Thr His His Leu Ser
10250 10255 10260
Thr Asp Leu Leu Pro Ser Ala Glu Thr Ile Ser Thr Gly Thr Val
10265 10270 10275
Met Pro Ser Leu Ser Glu Ala Met Thr Ser Phe Ala Thr Thr Gly
10280 10285 10290
Val Pro Arg Ala Ile Ser Gly Ser Gly Ser Pro Phe Ser Arg Thr
10295 10300 10305
Glu Ser Gly Pro Gly Asp Ala Thr Leu Ser Thr Ile Ala Glu Ser
10310 10315 10320
Leu Pro Ser Ser Thr Pro Val Pro Phe Ser Ser Ser Thr Phe Thr
10325 10330 10335
Thr Thr Asp Ser Ser Thr Ile Pro Ala Leu His Glu Ile Thr Ser
10340 10345 10350
Ser Ser Ala Thr Pro Tyr Arg Val Asp Thr Ser Leu Gly Thr Glu
10355 10360 10365
Ser Ser Thr Thr Glu Gly Arg Leu Val Met Val Ser Thr Leu Asp
10370 10375 10380
Thr Ser Ser Gln Pro Gly Arg Thr Ser Ser Ser Pro Ile Leu Asp
10385 10390 10395
Thr Arg Met Thr Glu Ser Val Glu Leu Gly Thr Val Thr Ser Ala
10400 10405 10410
Tyr Gln Val Pro Ser Leu Ser Thr Arg Leu Thr Arg Thr Asp Gly
10415 10420 10425
Ile Met Glu His Ile Thr Lys Ile Pro Asn Glu Ala Ala His Arg
10430 10435 10440
Gly Thr Ile Arg Pro Val Lys Gly Pro Gln Thr Ser Thr Ser Pro
10445 10450 10455
Ala Ser Pro Lys Gly Leu His Thr Gly Gly Thr Lys Arg Met Glu
10460 10465 10470
Thr Thr Thr Thr Ala Leu Lys Thr Thr Thr Thr Ala Leu Lys Thr
10475 10480 10485
Thr Ser Arg Ala Thr Leu Thr Thr Ser Val Tyr Thr Pro Thr Leu
10490 10495 10500
Gly Thr Leu Thr Pro Leu Asn Ala Ser Met Gln Met Ala Ser Thr
10505 10510 10515
Ile Pro Thr Glu Met Met Ile Thr Thr Pro Tyr Val Phe Pro Asp
10520 10525 10530
Val Pro Glu Thr Thr Ser Ser Leu Ala Thr Ser Leu Gly Ala Glu
10535 10540 10545
Thr Ser Thr Ala Leu Pro Arg Thr Thr Pro Ser Val Phe Asn Arg
10550 10555 10560
Glu Ser Glu Thr Thr Ala Ser Leu Val Ser Arg Ser Gly Ala Glu
10565 10570 10575
Arg Ser Pro Val Ile Gln Thr Leu Asp Val Ser Ser Ser Glu Pro
10580 10585 10590
Asp Thr Thr Ala Ser Trp Val Ile His Pro Ala Glu Thr Ile Pro
10595 10600 10605
Thr Val Ser Lys Thr Thr Pro Asn Phe Phe His Ser Glu Leu Asp
10610 10615 10620
Thr Val Ser Ser Thr Ala Thr Ser His Gly Ala Asp Val Ser Ser
10625 10630 10635
Ala Ile Pro Thr Asn Ile Ser Pro Ser Glu Leu Asp Ala Leu Thr
10640 10645 10650
Pro Leu Val Thr Ile Ser Gly Thr Asp Thr Ser Thr Thr Phe Pro
10655 10660 10665
Thr Leu Thr Lys Ser Pro His Glu Thr Glu Thr Arg Thr Thr Trp
10670 10675 10680
Leu Thr His Pro Ala Glu Thr Ser Ser Thr Ile Pro Arg Thr Ile
10685 10690 10695
Pro Asn Phe Ser His His Glu Ser Asp Ala Thr Pro Ser Ile Ala
10700 10705 10710
Thr Ser Pro Gly Ala Glu Thr Ser Ser Ala Ile Pro Ile Met Thr
10715 10720 10725
Val Ser Pro Gly Ala Glu Asp Leu Val Thr Ser Gln Val Thr Ser
10730 10735 10740
Ser Gly Thr Asp Arg Asn Met Thr Ile Pro Thr Leu Thr Leu Ser
10745 10750 10755
Pro Gly Glu Pro Lys Thr Ile Ala Ser Leu Val Thr His Pro Glu
10760 10765 10770
Ala Gln Thr Ser Ser Ala Ile Pro Thr Ser Thr Ile Ser Pro Ala
10775 10780 10785
Val Ser Arg Leu Val Thr Ser Met Val Thr Ser Leu Ala Ala Lys
10790 10795 10800
Thr Ser Thr Thr Asn Arg Ala Leu Thr Asn Ser Pro Gly Glu Pro
10805 10810 10815
Ala Thr Thr Val Ser Leu Val Thr His Pro Ala Gln Thr Ser Pro
10820 10825 10830
Thr Val Pro Trp Thr Thr Ser Ile Phe Phe His Ser Lys Ser Asp
10835 10840 10845
Thr Thr Pro Ser Met Thr Thr Ser His Gly Ala Glu Ser Ser Ser
10850 10855 10860
Ala Val Pro Thr Pro Thr Val Ser Thr Glu Val Pro Gly Val Val
10865 10870 10875
Thr Pro Leu Val Thr Ser Ser Arg Ala Val Ile Ser Thr Thr Ile
10880 10885 10890
Pro Ile Leu Thr Leu Ser Pro Gly Glu Pro Glu Thr Thr Pro Ser
10895 10900 10905
Met Ala Thr Ser His Gly Glu Glu Ala Ser Ser Ala Ile Pro Thr
10910 10915 10920
Pro Thr Val Ser Pro Gly Val Pro Gly Val Val Thr Ser Leu Val
10925 10930 10935
Thr Ser Ser Arg Ala Val Thr Ser Thr Thr Ile Pro Ile Leu Thr
10940 10945 10950
Phe Ser Leu Gly Glu Pro Glu Thr Thr Pro Ser Met Ala Thr Ser
10955 10960 10965
His Gly Thr Glu Ala Gly Ser Ala Val Pro Thr Val Leu Pro Glu
10970 10975 10980
Val Pro Gly Met Val Thr Ser Leu Val Ala Ser Ser Arg Ala Val
10985 10990 10995
Thr Ser Thr Thr Leu Pro Thr Leu Thr Leu Ser Pro Gly Glu Pro
11000 11005 11010
Glu Thr Thr Pro Ser Met Ala Thr Ser His Gly Ala Glu Ala Ser
11015 11020 11025
Ser Thr Val Pro Thr Val Ser Pro Glu Val Pro Gly Val Val Thr
11030 11035 11040
Ser Leu Val Thr Ser Ser Ser Gly Val Asn Ser Thr Ser Ile Pro
11045 11050 11055
Thr Leu Ile Leu Ser Pro Gly Glu Leu Glu Thr Thr Pro Ser Met
11060 11065 11070
Ala Thr Ser His Gly Ala Glu Ala Ser Ser Ala Val Pro Thr Pro
11075 11080 11085
Thr Val Ser Pro Gly Val Ser Gly Val Val Thr Pro Leu Val Thr
11090 11095 11100
Ser Ser Arg Ala Val Thr Ser Thr Thr Ile Pro Ile Leu Thr Leu
11105 11110 11115
Ser Ser Ser Glu Pro Glu Thr Thr Pro Ser Met Ala Thr Ser His
11120 11125 11130
Gly Val Glu Ala Ser Ser Ala Val Leu Thr Val Ser Pro Glu Val
11135 11140 11145
Pro Gly Met Val Thr Ser Leu Val Thr Ser Ser Arg Ala Val Thr
11150 11155 11160
Ser Thr Thr Ile Pro Thr Leu Thr Ile Ser Ser Asp Glu Pro Glu
11165 11170 11175
Thr Thr Thr Ser Leu Val Thr His Ser Glu Ala Lys Met Ile Ser
11180 11185 11190
Ala Ile Pro Thr Leu Ala Val Ser Pro Thr Val Gln Gly Leu Val
11195 11200 11205
Thr Ser Leu Val Thr Ser Ser Gly Ser Glu Thr Ser Ala Phe Ser
11210 11215 11220
Asn Leu Thr Val Ala Ser Ser Gln Pro Glu Thr Ile Asp Ser Trp
11225 11230 11235
Val Ala His Pro Gly Thr Glu Ala Ser Ser Val Val Pro Thr Leu
11240 11245 11250
Thr Val Ser Thr Gly Glu Pro Phe Thr Asn Ile Ser Leu Val Thr
11255 11260 11265
His Pro Ala Glu Ser Ser Ser Thr Leu Pro Arg Thr Thr Ser Arg
11270 11275 11280
Phe Ser His Ser Glu Leu Asp Thr Met Pro Ser Thr Val Thr Ser
11285 11290 11295
Pro Glu Ala Glu Ser Ser Ser Ala Ile Ser Thr Thr Ile Ser Pro
11300 11305 11310
Gly Ile Pro Gly Val Leu Thr Ser Leu Val Thr Ser Ser Gly Arg
11315 11320 11325
Asp Ile Ser Ala Thr Phe Pro Thr Val Pro Glu Ser Pro His Glu
11330 11335 11340
Ser Glu Ala Thr Ala Ser Trp Val Thr His Pro Ala Val Thr Ser
11345 11350 11355
Thr Thr Val Pro Arg Thr Thr Pro Asn Tyr Ser His Ser Glu Pro
11360 11365 11370
Asp Thr Thr Pro Ser Ile Ala Thr Ser Pro Gly Ala Glu Ala Thr
11375 11380 11385
Ser Asp Phe Pro Thr Ile Thr Val Ser Pro Asp Val Pro Asp Met
11390 11395 11400
Val Thr Ser Gln Val Thr Ser Ser Gly Thr Asp Thr Ser Ile Thr
11405 11410 11415
Ile Pro Thr Leu Thr Leu Ser Ser Gly Glu Pro Glu Thr Thr Thr
11420 11425 11430
Ser Phe Ile Thr Tyr Ser Glu Thr His Thr Ser Ser Ala Ile Pro
11435 11440 11445
Thr Leu Pro Val Ser Pro Gly Ala Ser Lys Met Leu Thr Ser Leu
11450 11455 11460
Val Ile Ser Ser Gly Thr Asp Ser Thr Thr Thr Phe Pro Thr Leu
11465 11470 11475
Thr Glu Thr Pro Tyr Glu Pro Glu Thr Thr Ala Ile Gln Leu Ile
11480 11485 11490
His Pro Ala Glu Thr Asn Thr Met Val Pro Arg Thr Thr Pro Lys
11495 11500 11505
Phe Ser His Ser Lys Ser Asp Thr Thr Leu Pro Val Ala Ile Thr
11510 11515 11520
Ser Pro Gly Pro Glu Ala Ser Ser Ala Val Ser Thr Thr Thr Ile
11525 11530 11535
Ser Pro Asp Met Ser Asp Leu Val Thr Ser Leu Val Pro Ser Ser
11540 11545 11550
Gly Thr Asp Thr Ser Thr Thr Phe Pro Thr Leu Ser Glu Thr Pro
11555 11560 11565
Tyr Glu Pro Glu Thr Thr Ala Thr Trp Leu Thr His Pro Ala Glu
11570 11575 11580
Thr Ser Thr Thr Val Ser Gly Thr Ile Pro Asn Phe Ser His Arg
11585 11590 11595
Gly Ser Asp Thr Ala Pro Ser Met Val Thr Ser Pro Gly Val Asp
11600 11605 11610
Thr Arg Ser Gly Val Pro Thr Thr Thr Ile Pro Pro Ser Ile Pro
11615 11620 11625
Gly Val Val Thr Ser Gln Val Thr Ser Ser Ala Thr Asp Thr Ser
11630 11635 11640
Thr Ala Ile Pro Thr Leu Thr Pro Ser Pro Gly Glu Pro Glu Thr
11645 11650 11655
Thr Ala Ser Ser Ala Thr His Pro Gly Thr Gln Thr Gly Phe Thr
11660 11665 11670
Val Pro Ile Arg Thr Val Pro Ser Ser Glu Pro Asp Thr Met Ala
11675 11680 11685
Ser Trp Val Thr His Pro Pro Gln Thr Ser Thr Pro Val Ser Arg
11690 11695 11700
Thr Thr Ser Ser Phe Ser His Ser Ser Pro Asp Ala Thr Pro Val
11705 11710 11715
Met Ala Thr Ser Pro Arg Thr Glu Ala Ser Ser Ala Val Leu Thr
11720 11725 11730
Thr Ile Ser Pro Gly Ala Pro Glu Met Val Thr Ser Gln Ile Thr
11735 11740 11745
Ser Ser Gly Ala Ala Thr Ser Thr Thr Val Pro Thr Leu Thr His
11750 11755 11760
Ser Pro Gly Met Pro Glu Thr Thr Ala Leu Leu Ser Thr His Pro
11765 11770 11775
Arg Thr Glu Thr Ser Lys Thr Phe Pro Ala Ser Thr Val Phe Pro
11780 11785 11790
Gln Val Ser Glu Thr Thr Ala Ser Leu Thr Ile Arg Pro Gly Ala
11795 11800 11805
Glu Thr Ser Thr Ala Leu Pro Thr Gln Thr Thr Ser Ser Leu Phe
11810 11815 11820
Thr Leu Leu Val Thr Gly Thr Ser Arg Val Asp Leu Ser Pro Thr
11825 11830 11835
Ala Ser Pro Gly Val Ser Ala Lys Thr Ala Pro Leu Ser Thr His
11840 11845 11850
Pro Gly Thr Glu Thr Ser Thr Met Ile Pro Thr Ser Thr Leu Ser
11855 11860 11865
Leu Gly Leu Leu Glu Thr Thr Gly Leu Leu Ala Thr Ser Ser Ser
11870 11875 11880
Ala Glu Thr Ser Thr Ser Thr Leu Thr Leu Thr Val Ser Pro Ala
11885 11890 11895
Val Ser Gly Leu Ser Ser Ala Ser Ile Thr Thr Asp Lys Pro Gln
11900 11905 11910
Thr Val Thr Ser Trp Asn Thr Glu Thr Ser Pro Ser Val Thr Ser
11915 11920 11925
Val Gly Pro Pro Glu Phe Ser Arg Thr Val Thr Gly Thr Thr Met
11930 11935 11940
Thr Leu Ile Pro Ser Glu Met Pro Thr Pro Pro Lys Thr Ser His
11945 11950 11955
Gly Glu Gly Val Ser Pro Thr Thr Ile Leu Arg Thr Thr Met Val
11960 11965 11970
Glu Ala Thr Asn Leu Ala Thr Thr Gly Ser Ser Pro Thr Val Ala
11975 11980 11985
Lys Thr Thr Thr Thr Phe Asn Thr Leu Ala Gly Ser Leu Phe Thr
11990 11995 12000
Pro Leu Thr Thr Pro Gly Met Ser Thr Leu Ala Ser Glu Ser Val
12005 12010 12015
Thr Ser Arg Thr Ser Tyr Asn His Arg Ser Trp Ile Ser Thr Thr
12020 12025 12030
Ser Ser Tyr Asn Arg Arg Tyr Trp Thr Pro Ala Thr Ser Thr Pro
12035 12040 12045
Val Thr Ser Thr Phe Ser Pro Gly Ile Ser Thr Ser Ser Ile Pro
12050 12055 12060
Ser Ser Thr Ala Ala Thr Val Pro Phe Met Val Pro Phe Thr Leu
12065 12070 12075
Asn Phe Thr Ile Thr Asn Leu Gln Tyr Glu Glu Asp Met Arg His
12080 12085 12090
Pro Gly Ser Arg Lys Phe Asn Ala Thr Glu Arg Glu Leu Gln Gly
12095 12100 12105
Leu Leu Lys Pro Leu Phe Arg Asn Ser Ser Leu Glu Tyr Leu Tyr
12110 12115 12120
Ser Gly Cys Arg Leu Ala Ser Leu Arg Pro Glu Lys Asp Ser Ser
12125 12130 12135
Ala Thr Ala Val Asp Ala Ile Cys Thr His Arg Pro Asp Pro Glu
12140 12145 12150
Asp Leu Gly Leu Asp Arg Glu Arg Leu Tyr Trp Glu Leu Ser Asn
12155 12160 12165
Leu Thr Asn Gly Ile Gln Glu Leu Gly Pro Tyr Thr Leu Asp Arg
12170 12175 12180
Asn Ser Leu Tyr Val Asn Gly Phe Thr His Arg Ser Ser Met Pro
12185 12190 12195
Thr Thr Ser Thr Pro Gly Thr Ser Thr Val Asp Val Gly Thr Ser
12200 12205 12210
Gly Thr Pro Ser Ser Ser Pro Ser Pro Thr Thr Ala Gly Pro Leu
12215 12220 12225
Leu Met Pro Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Gln Tyr
12230 12235 12240
Glu Glu Asp Met Arg Arg Thr Gly Ser Arg Lys Phe Asn Thr Met
12245 12250 12255
Glu Ser Val Leu Gln Gly Leu Leu Lys Pro Leu Phe Lys Asn Thr
12260 12265 12270
Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg
12275 12280 12285
Pro Glu Lys Asp Gly Ala Ala Thr Gly Val Asp Ala Ile Cys Thr
12290 12295 12300
His Arg Leu Asp Pro Lys Ser Pro Gly Leu Asn Arg Glu Gln Leu
12305 12310 12315
Tyr Trp Glu Leu Ser Lys Leu Thr Asn Asp Ile Glu Glu Leu Gly
12320 12325 12330
Pro Tyr Thr Leu Asp Arg Asn Ser Leu Tyr Val Asn Gly Phe Thr
12335 12340 12345
His Gln Ser Ser Val Ser Thr Thr Ser Thr Pro Gly Thr Ser Thr
12350 12355 12360
Val Asp Leu Arg Thr Ser Gly Thr Pro Ser Ser Leu Ser Ser Pro
12365 12370 12375
Thr Ile Met Ala Ala Gly Pro Leu Leu Val Pro Phe Thr Leu Asn
12380 12385 12390
Phe Thr Ile Thr Asn Leu Gln Tyr Gly Glu Asp Met Gly His Pro
12395 12400 12405
Gly Ser Arg Lys Phe Asn Thr Thr Glu Arg Val Leu Gln Gly Leu
12410 12415 12420
Leu Gly Pro Ile Phe Lys Asn Thr Ser Val Gly Pro Leu Tyr Ser
12425 12430 12435
Gly Cys Arg Leu Thr Ser Leu Arg Ser Glu Lys Asp Gly Ala Ala
12440 12445 12450
Thr Gly Val Asp Ala Ile Cys Ile His His Leu Asp Pro Lys Ser
12455 12460 12465
Pro Gly Leu Asn Arg Glu Arg Leu Tyr Trp Glu Leu Ser Gln Leu
12470 12475 12480
Thr Asn Gly Ile Lys Glu Leu Gly Pro Tyr Thr Leu Asp Arg Asn
12485 12490 12495
Ser Leu Tyr Val Asn Gly Phe Thr His Arg Thr Ser Val Pro Thr
12500 12505 12510
Ser Ser Thr Pro Gly Thr Ser Thr Val Asp Leu Gly Thr Ser Gly
12515 12520 12525
Thr Pro Phe Ser Leu Pro Ser Pro Ala Thr Ala Gly Pro Leu Leu
12530 12535 12540
Val Leu Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Lys Tyr Glu
12545 12550 12555
Glu Asp Met His Arg Pro Gly Ser Arg Lys Phe Asn Thr Thr Glu
12560 12565 12570
Arg Val Leu Gln Thr Leu Leu Gly Pro Met Phe Lys Asn Thr Ser
12575 12580 12585
Val Gly Leu Leu Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg Ser
12590 12595 12600
Glu Lys Asp Gly Ala Ala Thr Gly Val Asp Ala Ile Cys Thr His
12605 12610 12615
Arg Leu Asp Pro Lys Ser Pro Gly Val Asp Arg Glu Gln Leu Tyr
12620 12625 12630
Trp Glu Leu Ser Gln Leu Thr Asn Gly Ile Lys Glu Leu Gly Pro
12635 12640 12645
Tyr Thr Leu Asp Arg Asn Ser Leu Tyr Val Asn Gly Phe Thr His
12650 12655 12660
Trp Ile Pro Val Pro Thr Ser Ser Thr Pro Gly Thr Ser Thr Val
12665 12670 12675
Asp Leu Gly Ser Gly Thr Pro Ser Ser Leu Pro Ser Pro Thr Thr
12680 12685 12690
Ala Gly Pro Leu Leu Val Pro Phe Thr Leu Asn Phe Thr Ile Thr
12695 12700 12705
Asn Leu Lys Tyr Glu Glu Asp Met His Cys Pro Gly Ser Arg Lys
12710 12715 12720
Phe Asn Thr Thr Glu Arg Val Leu Gln Ser Leu Leu Gly Pro Met
12725 12730 12735
Phe Lys Asn Thr Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu
12740 12745 12750
Thr Leu Leu Arg Ser Glu Lys Asp Gly Ala Ala Thr Gly Val Asp
12755 12760 12765
Ala Ile Cys Thr His Arg Leu Asp Pro Lys Ser Pro Gly Val Asp
12770 12775 12780
Arg Glu Gln Leu Tyr Trp Glu Leu Ser Gln Leu Thr Asn Gly Ile
12785 12790 12795
Lys Glu Leu Gly Pro Tyr Thr Leu Asp Arg Asn Ser Leu Tyr Val
12800 12805 12810
Asn Gly Phe Thr His Gln Thr Ser Ala Pro Asn Thr Ser Thr Pro
12815 12820 12825
Gly Thr Ser Thr Val Asp Leu Gly Thr Ser Gly Thr Pro Ser Ser
12830 12835 12840
Leu Pro Ser Pro Thr Ser Ala Gly Pro Leu Leu Val Pro Phe Thr
12845 12850 12855
Leu Asn Phe Thr Ile Thr Asn Leu Gln Tyr Glu Glu Asp Met His
12860 12865 12870
His Pro Gly Ser Arg Lys Phe Asn Thr Thr Glu Arg Val Leu Gln
12875 12880 12885
Gly Leu Leu Gly Pro Met Phe Lys Asn Thr Ser Val Gly Leu Leu
12890 12895 12900
Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg Pro Glu Lys Asn Gly
12905 12910 12915
Ala Ala Thr Gly Met Asp Ala Ile Cys Ser His Arg Leu Asp Pro
12920 12925 12930
Lys Ser Pro Gly Leu Asn Arg Glu Gln Leu Tyr Trp Glu Leu Ser
12935 12940 12945
Gln Leu Thr His Gly Ile Lys Glu Leu Gly Pro Tyr Thr Leu Asp
12950 12955 12960
Arg Asn Ser Leu Tyr Val Asn Gly Phe Thr His Arg Ser Ser Val
12965 12970 12975
Ala Pro Thr Ser Thr Pro Gly Thr Ser Thr Val Asp Leu Gly Thr
12980 12985 12990
Ser Gly Thr Pro Ser Ser Leu Pro Ser Pro Thr Thr Ala Val Pro
12995 13000 13005
Leu Leu Val Pro Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Gln
13010 13015 13020
Tyr Gly Glu Asp Met Arg His Pro Gly Ser Arg Lys Phe Asn Thr
13025 13030 13035
Thr Glu Arg Val Leu Gln Gly Leu Leu Gly Pro Leu Phe Lys Asn
13040 13045 13050
Ser Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu Ile Ser Leu
13055 13060 13065
Arg Ser Glu Lys Asp Gly Ala Ala Thr Gly Val Asp Ala Ile Cys
13070 13075 13080
Thr His His Leu Asn Pro Gln Ser Pro Gly Leu Asp Arg Glu Gln
13085 13090 13095
Leu Tyr Trp Gln Leu Ser Gln Met Thr Asn Gly Ile Lys Glu Leu
13100 13105 13110
Gly Pro Tyr Thr Leu Asp Arg Asn Ser Leu Tyr Val Asn Gly Phe
13115 13120 13125
Thr His Arg Ser Ser Gly Leu Thr Thr Ser Thr Pro Trp Thr Ser
13130 13135 13140
Thr Val Asp Leu Gly Thr Ser Gly Thr Pro Ser Pro Val Pro Ser
13145 13150 13155
Pro Thr Thr Thr Gly Pro Leu Leu Val Pro Phe Thr Leu Asn Phe
13160 13165 13170
Thr Ile Thr Asn Leu Gln Tyr Glu Glu Asn Met Gly His Pro Gly
13175 13180 13185
Ser Arg Lys Phe Asn Ile Thr Glu Ser Val Leu Gln Gly Leu Leu
13190 13195 13200
Lys Pro Leu Phe Lys Ser Thr Ser Val Gly Pro Leu Tyr Ser Gly
13205 13210 13215
Cys Arg Leu Thr Leu Leu Arg Pro Glu Lys Asp Gly Val Ala Thr
13220 13225 13230
Arg Val Asp Ala Ile Cys Thr His Arg Pro Asp Pro Lys Ile Pro
13235 13240 13245
Gly Leu Asp Arg Gln Gln Leu Tyr Trp Glu Leu Ser Gln Leu Thr
13250 13255 13260
His Ser Ile Thr Glu Leu Gly Pro Tyr Thr Leu Asp Arg Asp Ser
13265 13270 13275
Leu Tyr Val Asn Gly Phe Thr Gln Arg Ser Ser Val Pro Thr Thr
13280 13285 13290
Ser Thr Pro Gly Thr Phe Thr Val Gln Pro Glu Thr Ser Glu Thr
13295 13300 13305
Pro Ser Ser Leu Pro Gly Pro Thr Ala Thr Gly Pro Val Leu Leu
13310 13315 13320
Pro Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Gln Tyr Glu Glu
13325 13330 13335
Asp Met Arg Arg Pro Gly Ser Arg Lys Phe Asn Thr Thr Glu Arg
13340 13345 13350
Val Leu Gln Gly Leu Leu Met Pro Leu Phe Lys Asn Thr Ser Val
13355 13360 13365
Ser Ser Leu Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg Pro Glu
13370 13375 13380
Lys Asp Gly Ala Ala Thr Arg Val Asp Ala Val Cys Thr His Arg
13385 13390 13395
Pro Asp Pro Lys Ser Pro Gly Leu Asp Arg Glu Arg Leu Tyr Trp
13400 13405 13410
Lys Leu Ser Gln Leu Thr His Gly Ile Thr Glu Leu Gly Pro Tyr
13415 13420 13425
Thr Leu Asp Arg His Ser Leu Tyr Val Asn Gly Phe Thr His Gln
13430 13435 13440
Ser Ser Met Thr Thr Thr Arg Thr Pro Asp Thr Ser Thr Met His
13445 13450 13455
Leu Ala Thr Ser Arg Thr Pro Ala Ser Leu Ser Gly Pro Met Thr
13460 13465 13470
Ala Ser Pro Leu Leu Val Leu Phe Thr Ile Asn Phe Thr Ile Thr
13475 13480 13485
Asn Leu Arg Tyr Glu Glu Asn Met His His Pro Gly Ser Arg Lys
13490 13495 13500
Phe Asn Thr Thr Glu Arg Val Leu Gln Gly Leu Leu Arg Pro Val
13505 13510 13515
Phe Lys Asn Thr Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu
13520 13525 13530
Thr Leu Leu Arg Pro Lys Lys Asp Gly Ala Ala Thr Lys Val Asp
13535 13540 13545
Ala Ile Cys Thr Tyr Arg Pro Asp Pro Lys Ser Pro Gly Leu Asp
13550 13555 13560
Arg Glu Gln Leu Tyr Trp Glu Leu Ser Gln Leu Thr His Ser Ile
13565 13570 13575
Thr Glu Leu Gly Pro Tyr Thr Leu Asp Arg Asp Ser Leu Tyr Val
13580 13585 13590
Asn Gly Phe Thr Gln Arg Ser Ser Val Pro Thr Thr Ser Ile Pro
13595 13600 13605
Gly Thr Pro Thr Val Asp Leu Gly Thr Ser Gly Thr Pro Val Ser
13610 13615 13620
Lys Pro Gly Pro Ser Ala Ala Ser Pro Leu Leu Val Leu Phe Thr
13625 13630 13635
Leu Asn Phe Thr Ile Thr Asn Leu Arg Tyr Glu Glu Asn Met Gln
13640 13645 13650
His Pro Gly Ser Arg Lys Phe Asn Thr Thr Glu Arg Val Leu Gln
13655 13660 13665
Gly Leu Leu Arg Ser Leu Phe Lys Ser Thr Ser Val Gly Pro Leu
13670 13675 13680
Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg Pro Glu Lys Asp Gly
13685 13690 13695
Thr Ala Thr Gly Val Asp Ala Ile Cys Thr His His Pro Asp Pro
13700 13705 13710
Lys Ser Pro Arg Leu Asp Arg Glu Gln Leu Tyr Trp Glu Leu Ser
13715 13720 13725
Gln Leu Thr His Asn Ile Thr Glu Leu Gly Pro Tyr Ala Leu Asp
13730 13735 13740
Asn Asp Ser Leu Phe Val Asn Gly Phe Thr His Arg Ser Ser Val
13745 13750 13755
Ser Thr Thr Ser Thr Pro Gly Thr Pro Thr Val Tyr Leu Gly Ala
13760 13765 13770
Ser Lys Thr Pro Ala Ser Ile Phe Gly Pro Ser Ala Ala Ser His
13775 13780 13785
Leu Leu Ile Leu Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Arg
13790 13795 13800
Tyr Glu Glu Asn Met Trp Pro Gly Ser Arg Lys Phe Asn Thr Thr
13805 13810 13815
Glu Arg Val Leu Gln Gly Leu Leu Arg Pro Leu Phe Lys Asn Thr
13820 13825 13830
Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg
13835 13840 13845
Pro Glu Lys Asp Gly Glu Ala Thr Gly Val Asp Ala Ile Cys Thr
13850 13855 13860
His Arg Pro Asp Pro Thr Gly Pro Gly Leu Asp Arg Glu Gln Leu
13865 13870 13875
Tyr Leu Glu Leu Ser Gln Leu Thr His Ser Ile Thr Glu Leu Gly
13880 13885 13890
Pro Tyr Thr Leu Asp Arg Asp Ser Leu Tyr Val Asn Gly Phe Thr
13895 13900 13905
His Arg Ser Ser Val Pro Thr Thr Ser Thr Gly Val Val Ser Glu
13910 13915 13920
Glu Pro Phe Thr Leu Asn Phe Thr Ile Asn Asn Leu Arg Tyr Met
13925 13930 13935
Ala Asp Met Gly Gln Pro Gly Ser Leu Lys Phe Asn Ile Thr Asp
13940 13945 13950
Asn Val Met Gln His Leu Leu Ser Pro Leu Phe Gln Arg Ser Ser
13955 13960 13965
Leu Gly Ala Arg Tyr Thr Gly Cys Arg Val Ile Ala Leu Arg Ser
13970 13975 13980
Val Lys Asn Gly Ala Glu Thr Arg Val Asp Leu Leu Cys Thr Tyr
13985 13990 13995
Leu Gln Pro Leu Ser Gly Pro Gly Leu Pro Ile Lys Gln Val Phe
14000 14005 14010
His Glu Leu Ser Gln Gln Thr His Gly Ile Thr Arg Leu Gly Pro
14015 14020 14025
Tyr Ser Leu Asp Lys Asp Ser Leu Tyr Leu Asn Gly Tyr Asn Glu
14030 14035 14040
Pro Gly Pro Asp Glu Pro Pro Thr Thr Pro Lys Pro Ala Thr Thr
14045 14050 14055
Phe Leu Pro Pro Leu Ser Glu Ala Thr Thr Ala Met Gly Tyr His
14060 14065 14070
Leu Lys Thr Leu Thr Leu Asn Phe Thr Ile Ser Asn Leu Gln Tyr
14075 14080 14085
Ser Pro Asp Met Gly Lys Gly Ser Ala Thr Phe Asn Ser Thr Glu
14090 14095 14100
Gly Val Leu Gln His Leu Leu Arg Pro Leu Phe Gln Lys Ser Ser
14105 14110 14115
Met Gly Pro Phe Tyr Leu Gly Cys Gln Leu Ile Ser Leu Arg Pro
14120 14125 14130
Glu Lys Asp Gly Ala Ala Thr Gly Val Asp Thr Thr Cys Thr Tyr
14135 14140 14145
His Pro Asp Pro Val Gly Pro Gly Leu Asp Ile Gln Gln Leu Tyr
14150 14155 14160
Trp Glu Leu Ser Gln Leu Thr His Gly Val Thr Gln Leu Gly Phe
14165 14170 14175
Tyr Val Leu Asp Arg Asp Ser Leu Phe Ile Asn Gly Tyr Ala Pro
14180 14185 14190
Gln Asn Leu Ser Ile Arg Gly Glu Tyr Gln Ile Asn Phe His Ile
14195 14200 14205
Val Asn Trp Asn Leu Ser Asn Pro Asp Pro Thr Ser Ser Glu Tyr
14210 14215 14220
Ile Thr Leu Leu Arg Asp Ile Gln Asp Lys Val Thr Thr Leu Tyr
14225 14230 14235
Lys Gly Ser Gln Leu His Asp Thr Phe Arg Phe Cys Leu Val Thr
14240 14245 14250
Asn Leu Thr Met Asp Ser Val Leu Val Thr Val Lys Ala Leu Phe
14255 14260 14265
Ser Ser Asn Leu Asp Pro Ser Leu Val Glu Gln Val Phe Leu Asp
14270 14275 14280
Lys Thr Leu Asn Ala Ser Phe His Trp Leu Gly Ser Thr Tyr Gln
14285 14290 14295
Leu Val Asp Ile His Val Thr Glu Met Glu Ser Ser Val Tyr Gln
14300 14305 14310
Pro Thr Ser Ser Ser Ser Thr Gln His Phe Tyr Leu Asn Phe Thr
14315 14320 14325
Ile Thr Asn Leu Pro Tyr Ser Gln Asp Lys Ala Gln Pro Gly Thr
14330 14335 14340
Thr Asn Tyr Gln Arg Asn Lys Arg Asn Ile Glu Asp Ala Leu Asn
14345 14350 14355
Gln Leu Phe Arg Asn Ser Ser Ile Lys Ser Tyr Phe Ser Asp Cys
14360 14365 14370
Gln Val Ser Thr Phe Arg Ser Val Pro Asn Arg His His Thr Gly
14375 14380 14385
Val Asp Ser Leu Cys Asn Phe Ser Pro Leu Ala Arg Arg Val Asp
14390 14395 14400
Arg Val Ala Ile Tyr Glu Glu Phe Leu Arg Met Thr Arg Asn Gly
14405 14410 14415
Thr Gln Leu Gln Asn Phe Thr Leu Asp Arg Ser Ser Val Leu Val
14420 14425 14430
Asp Gly Tyr Ser Pro Asn Arg Asn Glu Pro Leu Thr Gly Asn Ser
14435 14440 14445
Asp Leu Pro Phe Trp Ala Val Ile Leu Ile Gly Leu Ala Gly Leu
14450 14455 14460
Leu Gly Val Ile Thr Cys Leu Ile Cys Gly Val Leu Val Thr Thr
14465 14470 14475
Arg Arg Arg Lys Lys Glu Gly Glu Tyr Asn Val Gln Gln Gln Cys
14480 14485 14490
Pro Gly Tyr Tyr Gln Ser His Leu Asp Leu Glu Asp Leu Gln
14495 14500 14505
<210> 137
<211> 43815
<212> ДНК
<213> Homo sapiens
<220>
<223> Последовательность нуклеиновой кислоты незрелого MUC16 человека
(NM_024690.2)
<400> 137
agcgttgcac aattccccca acctccatac atacggcagc tcttctagac acaggttttc 60
ccaggtcaaa tgcggggacc ccagccatat ctcccaccct gagaaatttt ggagtttcag 120
ggagctcaga agctctgcag aggccaccct ctctgagggg attcttctta gacctccatc 180
cagaggcaaa tgttgacctg tccatgctga aaccctcagg ccttcctggg tcatcttctc 240
ccacccgctc cttgatgaca gggagcagga gcactaaagc cacaccagaa atggattcag 300
gactgacagg agccaccttg tcacctaaga catctacagg tgcaatcgtg gtgacagaac 360
atactctgcc ctttacttcc ccagataaga ccttggccag tcctacatct tcggttgtgg 420
gaagaaccac ccagtctttg ggggtgatgt cctctgctct ccctgagtca acctctagag 480
gaatgacaca ctccgagcaa agaaccagcc catcgctgag tccccaggtc aatggaactc 540
cctctaggaa ctaccctgct acaagcatgg tttcaggatt gagttcccca aggaccagga 600
ccagttccac agaaggaaat tttaccaaag aagcatctac atacacactc actgtagaga 660
ccacaagtgg cccagtcact gagaagtaca cagtccccac tgagacctca acaactgaag 720
gtgacagcac agagaccccc tgggacacaa gatatattcc tgtaaaaatc acatctccaa 780
tgaaaacatt tgcagattca actgcatcca aggaaaatgc cccagtgtct atgactccag 840
ctgagaccac agttactgac tcacatactc caggaaggac aaacccatca tttgggacac 900
tttattcttc cttccttgac ctatcaccta aagggacccc aaattccaga ggtgaaacaa 960
gcctggaact gattctatca accactggat atcccttctc ctctcctgaa cctggctctg 1020
caggacacag cagaataagt accagtgcgc ctttgtcatc atctgcttca gttctcgata 1080
ataaaatatc agagaccagc atattctcag gccagagtct cacctcccct ctgtctcctg 1140
gggtgcccga ggccagagcc agcacaatgc ccaactcagc tatccctttt tccatgacac 1200
taagcaatgc agaaacaagt gccgaaaggg tcagaagcac aatttcctct ctggggactc 1260
catcaatatc cacaaagcag acagcagaga ctatccttac cttccatgcc ttcgctgaga 1320
ccatggatat acccagcacc cacatagcca agactttggc ttcagaatgg ttgggaagtc 1380
caggtaccct tggtggcacc agcacttcag cgctgacaac cacatctcca tctaccactt 1440
tagtctcaga ggagaccaac acccatcact ccacgagtgg aaaggaaaca gaaggaactt 1500
tgaatacatc tatgactcca cttgagacct ctgctcctgg agaagagtcc gaaatgactg 1560
ccaccttggt ccccactcta ggttttacaa ctcttgacag caagatcaga agtccatctc 1620
aggtctcttc atcccaccca acaagagagc tcagaaccac aggcagcacc tctgggaggc 1680
agagttccag cacagctgcc cacgggagct ctgacatcct gagggcaacc acttccagca 1740
cctcaaaagc atcatcatgg accagtgaaa gcacagctca gcaatttagt gaaccccagc 1800
acacacagtg ggtggagaca agtcctagca tgaaaacaga gagaccccca gcatcaacca 1860
gtgtggcagc ccctatcacc acttctgttc cctcagtggt ctctggcttc accaccctga 1920
agaccagctc cacaaaaggg atttggcttg aagaaacatc tgcagacaca ctcatcggag 1980
aatccacagc tggcccaacc acccatcagt ttgctgttcc cactgggatt tcaatgacag 2040
gaggcagcag caccagggga agccagggca caacccacct actcaccaga gccacagcat 2100
catctgagac atccgcagat ttgactctgg ccacgaacgg tgtcccagtc tccgtgtctc 2160
cagcagtgag caagacggct gctggctcaa gtcctccagg agggacaaag ccatcatata 2220
caatggtttc ttctgtcatc cctgagacat catctctaca gtcctcagct ttcagggaag 2280
gaaccagcct gggactgact ccattaaaca ctagacatcc cttctcttcc cctgaaccag 2340
actctgcagg acacaccaag ataagcacca gcattcctct gttgtcatct gcttcagttc 2400
ttgaggataa agtgtcagcg accagcacat tctcacacca caaagccacc tcatctatta 2460
ccacagggac tcctgaaatc tcaacaaaga caaagcccag ctcagccgtt ctttcctcca 2520
tgaccctaag caatgcagca acaagtcctg aaagagtcag aaatgcaact tcccctctga 2580
ctcatccatc tccatcaggg gaagagacag cagggagtgt cctcactctc agcacctctg 2640
ctgagactac agactcacct aacatccacc caactgggac actgacttca gaatcgtcag 2700
agagtcctag cactctcagc ctcccaagtg tctctggagt caaaaccaca ttttcttcat 2760
ctactccttc cactcatcta tttactagtg gagaagaaac agaggaaact tcgaatccat 2820
ctgtgtctca acctgagact tctgtttcca gagtaaggac caccttggcc agcacctctg 2880
tccctacccc agtattcccc accatggaca cctggcctac acgttcagct cagttctctt 2940
catcccacct agtgagtgag ctcagagcta cgagcagtac ctcagttaca aactcaactg 3000
gttcagctct tcctaaaata tctcacctca ctgggacggc aacaatgtca cagaccaata 3060
gagacacgtt taatgactct gctgcacccc aaagcacaac ttggccagag actagtccca 3120
gattcaagac agggttacct tcagcaacaa ccactgtttc aacctctgcc acttctctct 3180
ctgctactgt aatggtctct aaattcactt ctccagcaac tagttccatg gaagcaactt 3240
ctatcaggga accatcaaca accatcctca caacagagac cacgaatggc ccaggctcta 3300
tggctgtggc ttctaccaac atcccaattg gaaagggcta cattactgaa ggaagattgg 3360
acacaagcca tctgcccatt ggaaccacag cttcctctga gacatctatg gattttacca 3420
tggccaaaga aagtgtctca atgtcagtat ctccatctca gtccatggat gctgctggct 3480
caagcactcc aggaaggaca agccaattcg ttgacacatt ttctgatgat gtctatcatt 3540
taacatccag agaaattaca atacctagag atggaacaag ctcagctctg actccacaaa 3600
tgactgcaac tcaccctcca tctcctgatc ctggctctgc tagaagcacc tggcttggca 3660
tcttgtcctc atctccttct tctcctactc ccaaagtcac aatgagctcc acattttcaa 3720
ctcagagagt caccacaagc atgataatgg acacagttga aactagtcgg tggaacatgc 3780
ccaacttacc ttccacgact tccttgacac caagtaatat tccaacaagt ggtgccatag 3840
gaaaaagcac cctggttccc ttggacactc catctccagc cacatcattg gaggcatcag 3900
aagggggact tccaaccctc agcacctacc ctgaatcaac aaacacaccc agcatccacc 3960
tcggagcaca cgctagttca gaaagtccaa gcaccatcaa acttaccatg gcttcagtag 4020
taaaacctgg ctcttacaca cctctcacct tcccctcaat agagacccac attcatgtat 4080
caacagccag aatggcttac tcttctgggt cttcacctga gatgacagct cctggagaga 4140
ctaacactgg tagtacctgg gaccccacca cctacatcac cactacggat cctaaggata 4200
caagttcagc tcaggtctct acaccccact cagtgaggac actcagaacc acagaaaacc 4260
atccaaagac agagtccgcc accccagctg cttactctgg aagtcctaaa atctcaagtt 4320
cacccaatct caccagtccg gccacaaaag catggaccat cacagacaca actgaacact 4380
ccactcaatt acattacaca aaattggcag aaaaatcatc tggatttgag acacagtcag 4440
ctccaggacc tgtctctgta gtaatcccta cctcccctac cattggaagc agcacattgg 4500
aactaacttc tgatgtccca ggggaacccc tggtccttgc tcccagtgag cagaccacaa 4560
tcactctccc catggcaaca tggctgagta ccagtttgac agaggaaatg gcttcaacag 4620
accttgatat ttcaagtcca agttcaccca tgagtacatt tgctattttt ccacctatgt 4680
ccacaccttc tcatgaactt tcaaagtcag aggcagatac cagtgccatt agaaatacag 4740
attcaacaac gttggatcag cacctaggaa tcaggagttt gggcagaact ggggacttaa 4800
caactgttcc tatcacccca ctgacaacca cgtggaccag tgtgattgaa cactcaacac 4860
aagcacagga caccctttct gcaacgatga gtcctactca cgtgacacag tcactcaaag 4920
atcaaacatc tataccagcc tcagcatccc cttcccatct tactgaagtc taccctgagc 4980
tcgggacaca agggagaagc tcctctgagg caaccacttt ttggaaacca tctacagaca 5040
cactgtccag agagattgag actggcccaa caaacattca atccactcca cccatggaca 5100
acacaacaac agggagcagt agtagtggag tcaccctggg catagcccac cttcccatag 5160
gaacatcctc cccagctgag acatccacaa acatggcact ggaaagaaga agttctacag 5220
ccactgtctc tatggctggg acaatgggac tccttgttac tagtgctcca ggaagaagca 5280
tcagccagtc attaggaaga gtttcctctg tcctttctga gtcaactact gaaggagtca 5340
cagattctag taagggaagc agcccaaggc tgaacacaca gggaaataca gctctctcct 5400
cctctcttga acccagctat gctgaaggaa gccagatgag cacaagcatc cctctaacct 5460
catctcctac aactcctgat gtggaattca tagggggcag cacattttgg accaaggagg 5520
tcaccacagt tatgacctca gacatctcca agtcttcagc aaggacagag tccagctcag 5580
ctacccttat gtccacagct ttgggaagca ctgaaaatac aggaaaagaa aaactcagaa 5640
ctgcctctat ggatcttcca tctccaactc catcaatgga ggtgacacca tggatttctc 5700
tcactctcag taatgccccc aataccacag attcacttga cctcagccat ggggtgcaca 5760
ccagctctgc agggactttg gccactgaca ggtcattgaa tactggtgtc actagagcct 5820
ccagattgga aaacggctct gatacctctt ctaagtccct gtctatggga aacagcactc 5880
acacttccat gacttacaca gagaagagtg aagtgtcttc ttcaatccat ccccgacctg 5940
agacctcagc tcctggagca gagaccactt tgacttccac tcctggaaac agggccataa 6000
gcttaacatt gcctttttca tccattccag tggaagaagt catttctaca ggcataacct 6060
caggaccaga catcaactca gcacccatga cacattctcc catcacccca ccaacaattg 6120
tatggaccag tacaggcaca attgaacagt ccactcaacc actacatgca gtttcttcag 6180
aaaaagtttc tgtgcagaca cagtcaactc catatgtcaa ctctgtggca gtgtctgctt 6240
cccctaccca tgagaattca gtctcttctg gaagcagcac atcctctcca tattcctcag 6300
cctcacttga atccttggat tccacaatca gtaggaggaa tgcaatcact tcctggctat 6360
gggacctcac tacatctctc cccactacaa cttggccaag tactagttta tctgaggcac 6420
tgtcctcagg ccattctggg gtttcaaacc caagttcaac tacgactgaa tttccactct 6480
tttcagctgc atccacatct gctgctaagc aaagaaatcc agaaacagag acccatggtc 6540
cccagaatac agccgcgagt actttgaaca ctgatgcatc ctcggtcaca ggtctttctg 6600
agactcctgt gggggcaagt atcagctctg aagtccctct tccaatggcc ataacttcta 6660
gatcagatgt ttctggcctt acatctgaga gtactgctaa cccgagttta ggcacagcct 6720
cttcagcagg gaccaaatta actaggacaa tatccctgcc cacttcagag tctttggttt 6780
cctttagaat gaacaaggat ccatggacag tgtcaatccc tttggggtcc catccaacta 6840
ctaatacaga aacaagcatc ccagtaaaca gcgcaggtcc acctggcttg tccacagtag 6900
catcagatgt aattgacaca ccttcagatg gggctgagag tattcccact gtctcctttt 6960
ccccctcccc tgatactgaa gtgacaacta tctcacattt cccagaaaag acaactcatt 7020
catttagaac catttcatct ctcactcatg agttgacttc aagagtgaca cctattcctg 7080
gggattggat gagttcagct atgtctacaa agcccacagg agccagtccc tccattacac 7140
tgggagagag aaggacaatc acctctgctg ctccaaccac ttcccccata gttctcactg 7200
ctagtttcac agagaccagc acagtttcac tggataatga aactacagta aaaacctcag 7260
atatccttga cgcacggaaa acaaatgagc tcccctcaga tagcagttct tcttctgatc 7320
tgatcaacac ctccatagct tcttcaacta tggatgtcac taaaacagcc tccatcagtc 7380
ccactagcat ctcaggaatg acagcaagtt cctccccatc tctcttctct tcagatagac 7440
cccaggttcc cacatctaca acagagacaa atacagccac ctctccatct gtttccagta 7500
acacctattc tcttgatggg ggctccaatg tgggtggcac tccatccact ttaccaccct 7560
ttacaatcac ccaccctgtc gagacaagct cggccctatt agcctggtct agaccagtaa 7620
gaactttcag caccatggtc agcactgaca ctgcctccgg agaaaatcct acctctagca 7680
attctgtggt gacttctgtt ccagcaccag gtacatggac cagtgtaggc agtactactg 7740
acttacctgc catgggcttt ctcaagacaa gtcctgcagg agaggcacac tcacttctag 7800
catcaactat tgaaccagcc actgccttca ctccccatct ctcagcagca gtggtcactg 7860
gatccagtgc tacatcagaa gccagtcttc tcactacgag tgaaagcaaa gccattcatt 7920
cttcaccaca gaccccaact acacccacct ctggagcaaa ctgggaaact tcagctactc 7980
ctgagagcct tttggtagtc actgagactt cagacacaac acttacctca aagattttgg 8040
tcacagatac catcttgttt tcaactgtgt ccacgccacc ttctaaattt ccaagtacgg 8100
ggactctgtc tggagcttcc ttccctactt tactcccgga cactccagcc atccctctca 8160
ctgccactga gccaacaagt tcattagcta catcctttga ttccacccca ctggtgacta 8220
tagcttcgga tagtcttggc acagtcccag agactaccct gaccatgtca gagacctcaa 8280
atggtgatgc actggttctt aagacagtaa gtaacccaga taggagcatc cctggaatca 8340
ctatccaagg agtaacagaa agtccactcc atccttcttc cacttccccc tctaagattg 8400
ttgctccacg gaatacaacc tatgaaggtt cgatcacagt ggcactttct actttgcctg 8460
cgggaactac tggttccctt gtattcagtc agagttctga aaactcagag acaacggctt 8520
tggtagactc atcagctggg cttgagaggg catctgtgat gccactaacc acaggaagcc 8580
agggtatggc tagctctgga ggaatcagaa gtgggtccac tcactcaact ggaaccaaaa 8640
cattttcttc tctccctctg accatgaacc caggtgaggt tacagccatg tctgaaatca 8700
ccacgaacag actgacagct actcaatcaa cagcacccaa agggatacct gtgaagccca 8760
ccagtgctga gtcaggcctc ctaacacctg tctctgcctc ctcaagccca tcaaaggcct 8820
ttgcctcact gactacagct cccccaactt gggggatccc acagtctacc ttgacatttg 8880
agttttctga ggtcccaagt ttggatacta agtccgcttc tttaccaact cctggacagt 8940
ccctgaacac cattccagac tcagatgcaa gcacagcatc ttcctcactg tccaagtctc 9000
cagaaaaaaa cccaagggca aggatgatga cttccacaaa ggccataagt gcaagctcat 9060
ttcaatcaac aggttttact gaaacccctg agggatctgc ctccccttct atggcagggc 9120
atgaacccag agtccccact tcaggaacag gggaccctag atatgcctca gagagcatgt 9180
cttatccaga cccaagcaag gcatcatcag ctatgacatc gacctctctt gcatcaaaac 9240
tcacaactct cttcagcaca ggtcaagcag caaggtctgg ttctagttcc tctcccataa 9300
gcctatccac tgagaaagaa acaagcttcc tttcccccac tgcatccacc tccagaaaga 9360
cttcactatt tcttgggcct tccatggcaa ggcagcccaa catattggtg catcttcaga 9420
cttcagctct gacactttct ccaacatcca ctctaaatat gtcccaggag gagcctcctg 9480
agttaacctc aagccagacc attgcagaag aagagggaac aacagctgaa acacagacgt 9540
taaccttcac accatctgag accccaacat ccttgttacc tgtctcttct cccacagaac 9600
ccacagccag aagaaagagt tctccagaaa catgggcaag ctctatttca gttcctgcca 9660
agacctcctt ggttgaaaca actgatggaa cgctagtgac caccataaag atgtcaagcc 9720
aggcagcaca aggaaattcc acgtggcctg ccccagcaga ggagacgggg agcagtccag 9780
caggcacatc cccaggaagc ccagaaatgt ctaccactct caaaatcatg agctccaagg 9840
aacccagcat cagcccagag atcaggtcca ctgtgagaaa ttctccttgg aagactccag 9900
aaacaactgt tcccatggag accacagtgg aaccagtcac ccttcagtcc acagccctag 9960
gaagtggcag caccagcatc tctcacctgc ccacaggaac cacatcacca accaagtcac 10020
caacagaaaa tatgttggct acagaaaggg tctccctctc cccatcccca cctgaggctt 10080
ggaccaacct ttattctgga actccaggag ggaccaggca gtcactggcc acaatgtcct 10140
ctgtctccct agagtcacca actgctagaa gcatcacagg gactggtcag caaagcagtc 10200
cagaactggt ttcaaagaca actggaatgg aattctctat gtggcatggc tctactggag 10260
ggaccacagg ggacacacat gtctctctga gcacatcttc caatatcctt gaagaccctg 10320
taaccagccc aaactctgtg agctcattga cagataaatc caaacataaa accgagacat 10380
gggtaagcac cacagccatt ccctccactg tcctgaataa taagataatg gcagctgaac 10440
aacagacaag tcgatctgtg gatgaggctt attcatcaac tagttcttgg tcagatcaga 10500
catctgggag tgacatcacc cttggtgcat ctcctgatgt cacaaacaca ttatacatca 10560
cctccacagc acaaaccacc tcactagtgt ctctgccctc tggagaccaa ggcattacaa 10620
gcctcaccaa tccctcagga ggaaaaacaa gctctgcgtc atctgtcaca tctccttcaa 10680
tagggcttga gactctgagg gccaatgtaa gtgcagtgaa aagtgacatt gcccctactg 10740
ctgggcatct atctcagact tcatctcctg cggaagtgag catcctggac gtaaccacag 10800
ctcctactcc aggtatctcc accaccatca ccaccatggg aaccaactca atctcaacta 10860
ccacacccaa cccagaagtg ggtatgagta ccatggacag caccccggcc acagagaggc 10920
gcacaacttc tacagaacac ccttccacct ggtcttccac agctgcatca gattcctgga 10980
ctgtcacaga catgacttca aacttgaaag ttgcaagatc tcctggaaca atttccacaa 11040
tgcatacaac ttcattctta gcctcaagca ctgaattaga ctccatgtct actccccatg 11100
gccgtataac tgtcattgga accagcctgg tcactccatc ctctgatgct tcagctgtaa 11160
agacagagac cagtacaagt gaaagaacat tgagtccttc agacacaact gcatctactc 11220
ccatctcaac tttttctcgt gtccagagga tgagcatctc agttcctgac attttaagta 11280
caagttggac tcccagtagt acagaagcag aagatgtgcc tgtttcaatg gtttctacag 11340
atcatgctag tacaaagact gacccaaata cgcccctgtc cacttttctg tttgattctc 11400
tgtccactct tgactgggac actgggagat ctctgtcatc agccacagcc actacctcag 11460
ctcctcaggg ggccacaact ccccaggaac tcactttgga aaccatgatc agcccagcta 11520
cctcacagtt gcccttctct atagggcaca ttacaagtgc agtcacacca gctgcaatgg 11580
caaggagctc tggagttact ttttcaagac cagatcccac aagcaaaaag gcagagcaga 11640
cttccactca gcttcccacc accacttctg cacatccagg gcaggtgccc agatcagcag 11700
caacaactct ggatgtgatc ccacacacag caaaaactcc agatgcaact tttcagagac 11760
aagggcagac agctcttaca acagaggcaa gagctacatc tgactcctgg aatgagaaag 11820
aaaaatcaac cccaagtgca ccttggatca ctgagatgat gaattctgtc tcagaagata 11880
ccatcaagga ggttaccagc tcctccagtg tattaaggac cctgaatacg ctggacataa 11940
acttggaatc tgggacgact tcatccccaa gttggaaaag cagcccatat gagagaattg 12000
ccccttctga gtccaccaca gacaaagagg caattcaccc ttctacaaac acagtagaga 12060
ccacaggctg ggtcacaagt tccgaacatg cttctcattc cactatccca gcccactcag 12120
cgtcatccaa actcacatct ccagtggtta caacctccac cagggaacaa gcaatagttt 12180
ctatgtcaac aaccacatgg ccagagtcta caagggctag aacagagcct aattccttct 12240
tgactattga actgagggac gtcagccctt acatggacac cagctcaacc acacaaacaa 12300
gtattatctc ttccccaggt tccactgcga tcaccaaggg gcctagaaca gaaattacct 12360
cctctaagag aatatccagc tcattccttg cccagtctat gaggtcgtca gacagcccct 12420
cagaagccat caccaggctg tctaactttc ctgccatgac agaatctgga ggaatgatcc 12480
ttgctatgca aacaagtcca cctggcgcta catcactaag tgcacctact ttggatacat 12540
cagccacagc ctcctggaca gggactccac tggctacgac tcagagattt acatactcag 12600
agaagaccac tctctttagc aaaggtcctg aggatacatc acagccaagc cctccctctg 12660
tggaagaaac cagctcttcc tcttccctgg tacctatcca tgctacaacc tcgccttcca 12720
atattttgtt gacatcacaa gggcacagtc cctcctctac tccacctgtg acctcagttt 12780
tcttgtctga gacctctggc ctggggaaga ccacagacat gtcgaggata agcttggaac 12840
ctggcacaag tttacctccc aatttgagca gtacagcagg tgaggcgtta tccacttatg 12900
aagcctccag agatacaaag gcaattcatc attctgcaga cacagcagtg acgaatatgg 12960
aggcaaccag ttctgaatat tctcctatcc caggccatac aaagccatcc aaagccacat 13020
ctccattggt tacctcccac atcatggggg acatcacttc ttccacatca gtatttggct 13080
cctccgagac cacagagatt gagacagtgt cctctgtgaa ccagggactt caggagagaa 13140
gcacatccca ggtggccagc tctgctacag agacaagcac tgtcattacc catgtgtcta 13200
gtggtgatgc tactactcat gtcaccaaga cacaagccac tttctctagc ggaacatcca 13260
tctcaagccc tcatcagttt ataacttcta ccaacacatt tacagatgtg agcaccaacc 13320
cctccacctc tctgataatg acagaatctt caggagtgac catcaccacc caaacaggtc 13380
ctactggagc tgcaacacag ggtccatatc tcttggacac atcaaccatg ccttacttga 13440
cagagactcc attagctgtg actccagatt ttatgcaatc agagaagacc actctcataa 13500
gcaaaggtcc caaggatgtg tcctggacaa gccctccctc tgtggcagaa accagctatc 13560
cctcttccct gacacctttc ttggtcacaa ccatacctcc tgccacttcc acgttacaag 13620
ggcaacatac atcctctcct gtttctgcga cttcagttct tacctctgga ctggtgaaga 13680
ccacagatat gttgaacaca agcatggaac ctgtgaccaa ttcacctcaa aatttgaaca 13740
atccatcaaa tgagatactg gccactttgg cagccaccac agatatagag actattcatc 13800
cttccataaa caaagcagtg accaatatgg ggactgccag ttcagcacat gtactgcatt 13860
ccactctccc agtcagctca gaaccatcta cagccacatc tccaatggtt cctgcctcca 13920
gcatggggga cgctcttgct tctatatcaa tacctggttc tgagaccaca gacattgagg 13980
gagagccaac atcctccctg actgctggac gaaaagagaa cagcaccctc caggagatga 14040
actcaactac agagtcaaac atcatcctct ccaatgtgtc tgtgggggct attactgaag 14100
ccacaaaaat ggaagtcccc tcttttgatg caacattcat accaactcct gctcagtcaa 14160
caaagttccc agatattttc tcagtagcca gcagtagact ttcaaactct cctcccatga 14220
caatatctac ccacatgacc accacccaga cagggtcttc tggagctaca tcaaagattc 14280
cacttgcctt agacacatca accttggaaa cctcagcagg gactccatca gtggtgactg 14340
aggggtttgc ccactcaaaa ataaccactg caatgaacaa tgatgtcaag gacgtgtcac 14400
agacaaaccc tccctttcag gatgaagcca gctctccctc ttctcaagca cctgtccttg 14460
tcacaacctt accttcttct gttgctttca caccgcaatg gcacagtacc tcctctcctg 14520
tttctatgtc ctcagttctt acttcttcac tggtaaagac cgcaggcaag gtggatacaa 14580
gcttagaaac agtgaccagt tcacctcaaa gtatgagcaa cactttggat gacatatcgg 14640
tcacttcagc agccaccaca gatatagaga caacgcatcc ttccataaac acagtagtta 14700
ccaatgtggg gaccaccggt tcagcatttg aatcacattc tactgtctca gcttacccag 14760
agccatctaa agtcacatct ccaaatgtta ccacctccac catggaagac accacaattt 14820
ccagatcaat acctaaatcc tctaagacta caagaactga gactgagaca acttcctccc 14880
tgactcctaa actgagggag accagcatct cccaggagat cacctcgtcc acagagacaa 14940
gcactgttcc ttacaaagag ctcactggtg ccactaccga ggtatccagg acagatgtca 15000
cttcctctag cagtacatcc ttccctggcc ctgatcagtc cacagtgtca ctagacatct 15060
ccacagaaac caacaccagg ctgtctacct ccccaataat gacagaatct gcagaaataa 15120
ccatcaccac ccaaacaggt cctcatgggg ctacatcaca ggatactttt accatggacc 15180
catcaaatac aaccccccag gcagggatcc actcagctat gactcatgga ttttcacaat 15240
tggatgtgac cactcttatg agcagaattc cacaggatgt atcatggaca agtcctccct 15300
ctgtggataa aaccagctcc ccctcttcct ttctgtcctc acctgcaatg accacacctt 15360
ccctgatttc ttctacctta ccagaggata agctctcctc tcctatgact tcacttctca 15420
cctctggcct agtgaagatt acagacatat tacgtacacg cttggaacct gtgaccagct 15480
cacttccaaa tttcagcagc acctcagata agatactggc cacttctaaa gacagtaaag 15540
acacaaagga aatttttcct tctataaaca cagaagagac caatgtgaaa gccaacaact 15600
ctggacatga atcccattcc cctgcactgg ctgactcaga gacacccaaa gccacaactc 15660
aaatggttat caccaccact gtgggagatc cagctccttc cacatcaatg ccagtgcatg 15720
gttcctctga gactacaaac attaagagag agccaacata tttcttgact cctagactga 15780
gagagaccag tacctctcag gagtccagct ttcccacgga cacaagtttt ctactttcca 15840
aagtccccac tggtactatt actgaggtct ccagtacagg ggtcaactct tctagcaaaa 15900
tttccacccc agaccatgat aagtccacag tgccacctga caccttcaca ggagagatcc 15960
ccagggtctt cacctcctct attaagacaa aatctgcaga aatgacgatc accacccaag 16020
caagtcctcc tgagtctgca tcgcacagta cccttccctt ggacacatca accacacttt 16080
cccagggagg gactcattca actgtgactc agggattccc atactcagag gtgaccactc 16140
tcatgggcat gggtcctggg aatgtgtcat ggatgacaac tccccctgtg gaagaaacca 16200
gctctgtgtc ttccctgatg tcttcacctg ccatgacatc cccttctcct gtttcctcca 16260
catcaccaca gagcatcccc tcctctcctc ttcctgtgac tgcacttcct acttctgttc 16320
tggtgacaac cacagatgtg ttgggcacaa caagcccaga gtctgtaacc agttcacctc 16380
caaatttgag cagcatcact catgagagac cggccactta caaagacact gcacacacag 16440
aagccgccat gcatcattcc acaaacaccg cagtgaccaa tgtagggact tccgggtctg 16500
gacataaatc acaatcctct gtcctagctg actcagagac atcgaaagcc acacctctga 16560
tgagtaccac ctccaccctg ggggacacaa gtgtttccac atcaactcct aatatctctc 16620
agactaacca aattcaaaca gagccaacag catccctgag ccctagactg agggagagca 16680
gcacgtctga gaagaccagc tcaacaacag agacaaatac tgccttttct tatgtgccca 16740
caggtgctat tactcaggcc tccagaacag aaatctcctc tagcagaaca tccatctcag 16800
accttgatcg gcccacaata gcacccgaca tctccacagg aatgatcacc aggctcttca 16860
cctcccccat catgacaaaa tctgcagaaa tgaccgtcac cactcaaaca actactcctg 16920
gggctacatc acagggtatc cttccctggg acacatcaac cacacttttc cagggaggga 16980
ctcattcaac cgtgtctcag ggattcccac actcagagat aaccactctt cggagcagaa 17040
cccctggaga tgtgtcatgg atgacaactc cccctgtgga agaaaccagc tctgggtttt 17100
ccctgatgtc accttccatg acatcccctt ctcctgtttc ctccacatca ccagagagca 17160
tcccctcctc tcctctccct gtgactgcac ttcttacttc tgttctggtg acaaccacaa 17220
atgtattggg cacaacaagc ccagagcccg taacgagttc acctccaaat ttaagcagcc 17280
ccacacagga gagactgacc acttacaaag acactgcgca cacagaagcc atgcatgctt 17340
ccatgcatac aaacactgca gtggccaacg tggggacctc catttctgga catgaatcac 17400
aatcttctgt cccagctgat tcacacacat ccaaagccac atctccaatg ggtatcacct 17460
tcgccatggg ggatacaagt gtttctacat caactcctgc cttctttgag actagaattc 17520
agactgaatc aacatcctct ttgattcctg gattaaggga caccaggacg tctgaggaga 17580
tcaacactgt gacagagacc agcactgtcc tttcagaagt gcccactact actactactg 17640
aggtctccag gacagaagtt atcacttcca gcagaacaac catctcaggg cctgatcatt 17700
ccaaaatgtc accctacatc tccacagaaa ccatcaccag gctctccact tttccttttg 17760
taacaggatc cacagaaatg gccatcacca accaaacagg tcctataggg actatctcac 17820
aggctaccct taccctggac acatcaagca cagcttcctg ggaagggact cactcacctg 17880
tgactcagag atttccacac tcagaggaga ccactactat gagcagaagt actaagggcg 17940
tgtcatggca aagccctccc tctgtggaag aaaccagttc tccttcttcc ccagtgcctt 18000
tacctgcaat aacctcacat tcatctcttt attccgcagt atcaggaagt agccccactt 18060
ctgctctccc tgtgacttcc cttctcacct ctggcaggag gaagaccata gacatgttgg 18120
acacacactc agaacttgtg accagctcct taccaagtgc aagtagcttc tcaggtgaga 18180
tactcacttc tgaagcctcc acaaatacag agacaattca cttttcagag aacacagcag 18240
aaaccaatat ggggaccacc aattctatgc ataaactaca ttcctctgtc tcaatccact 18300
cccagccatc cggacacaca cctccaaagg ttactggatc tatgatggag gacgctattg 18360
tttccacatc aacacctggt tctcctgaga ctaaaaatgt tgacagagac tcaacatccc 18420
ctctgactcc tgaactgaaa gaggacagca ccgccctggt gatgaactca actacagagt 18480
caaacactgt tttctccagt gtgtccctgg atgctgctac tgaggtctcc agggcagaag 18540
tcacctacta tgatcctaca ttcatgccag cttctgctca gtcaacaaag tccccagaca 18600
tttcacctga agccagcagc agtcattcta actctcctcc cttgacaata tctacacaca 18660
agaccatcgc cacacaaaca ggtccttctg gggtgacatc tcttggccaa ctgaccctgg 18720
acacatcaac catagccacc tcagcaggaa ctccatcagc cagaactcag gattttgtag 18780
attcagaaac aaccagtgtc atgaacaatg atctcaatga tgtgttgaag acaagccctt 18840
tctctgcaga agaagccaac tctctctctt ctcaggcacc tctccttgtg acaacctcac 18900
cttctcctgt aacttccaca ttgcaagagc acagtacctc ctctcttgtt tctgtgacct 18960
cagtacccac ccctacactg gcgaagatca cagacatgga cacaaactta gaacctgtga 19020
ctcgttcacc tcaaaattta aggaacacct tggccacttc agaagccacc acagatacac 19080
acacaatgca tccttctata aacacagcag tggccaatgt ggggaccacc agttcaccaa 19140
atgaattcta ttttactgtc tcacctgact cagacccata taaagccaca tccgcagtag 19200
ttatcacttc cacctcgggg gactcaatag tttccacatc aatgcctaga tcctctgcga 19260
tgaaaaagat tgagtctgag acaactttct ccctgatatt tagactgagg gagactagca 19320
cctcccagaa aattggctca tcctcagaca caagcacggt ctttgacaaa gcattcactg 19380
ctgctactac tgaggtctcc agaacagaac tcacctcctc tagcagaaca tccatccaag 19440
gcactgaaaa gcccacaatg tcaccggaca cctccacaag atctgtcacc atgctttcta 19500
cttttgctgg cctgacaaaa tccgaagaaa ggaccattgc cacccaaaca ggtcctcata 19560
gggcgacatc acagggtacc cttacctggg acacatcaat cacaacctca caggcaggga 19620
cccactcagc tatgactcat ggattttcac aattagattt gtccactctt acgagtagag 19680
ttcctgagta catatcaggg acaagcccac cctctgtgga aaaaaccagc tcttcctctt 19740
cccttctgtc tttaccagca ataacctcac cgtcccctgt acctactaca ttaccagaaa 19800
gtaggccgtc ttctcctgtt catctgactt cactccccac ctctggccta gtgaagacca 19860
cagatatgct ggcatctgtg gccagtttac ctccaaactt gggcagcacc tcacataaga 19920
taccgactac ttcagaagac attaaagata cagagaaaat gtatccttcc acaaacatag 19980
cagtaaccaa tgtggggacc accacttctg aaaaggaatc ttattcgtct gtcccagcct 20040
actcagaacc acccaaagtc acctctccaa tggttacctc tttcaacata agggacacca 20100
ttgtttccac atccatgcct ggctcctctg agattacaag gattgagatg gagtcaacat 20160
tctccctggc tcatgggctg aagggaacca gcacctccca ggaccccatc gtatccacag 20220
agaaaagtgc tgtccttcac aagttgacca ctggtgctac tgagacctct aggacagaag 20280
ttgcctcttc tagaagaaca tccattccag gccctgatca ttccacagag tcaccagaca 20340
tctccactga agtgatcccc agcctgccta tctcccttgg cattacagaa tcttcaaata 20400
tgaccatcat cactcgaaca ggtcctcctc ttggctctac atcacagggc acatttacct 20460
tggacacacc aactacatcc tccagggcag gaacacactc gatggcgact caggaatttc 20520
cacactcaga aatgaccact gtcatgaaca aggaccctga gattctatca tggacaatcc 20580
ctccttctat agagaaaacc agcttctcct cttccctgat gccttcacca gccatgactt 20640
cacctcctgt ttcctcaaca ttaccaaaga ccattcacac cactccttct cctatgacct 20700
cactgctcac ccctagccta gtgatgacca cagacacatt gggcacaagc ccagaaccta 20760
caaccagttc acctccaaat ttgagcagta cctcacatga gatactgaca acagatgaag 20820
acaccacagc tatagaagcc atgcatcctt ccacaagcac agcagcgact aatgtggaaa 20880
ccaccagttc tggacatggg tcacaatcct ctgtcctagc tgactcagaa aaaaccaagg 20940
ccacagctcc aatggatacc acctccacca tggggcatac aactgtttcc acatcaatgt 21000
ctgtttcctc tgagactaca aaaattaaga gagagtcaac atattccttg actcctggac 21060
tgagagagac cagcatttcc caaaatgcca gcttttccac tgacacaagt attgttcttt 21120
cagaagtccc cactggtact actgctgagg tctccaggac agaagtcacc tcctctggta 21180
gaacatccat ccctggccct tctcagtcca cagttttgcc agaaatatcc acaagaacaa 21240
tgacaaggct ctttgcctcg cccaccatga cagaatcagc agaaatgacc atccccactc 21300
aaacaggtcc ttctgggtct acctcacagg atacccttac cttggacaca tccaccacaa 21360
agtcccaggc aaagactcat tcaactttga ctcagagatt tccacactca gagatgacca 21420
ctctcatgag cagaggtcct ggagatatgt catggcaaag ctctccctct ctggaaaatc 21480
ccagctctct cccttccctg ctgtctttac ctgccacaac ctcacctcct cccatttcct 21540
ccacattacc agtgactatc tcctcctctc ctcttcctgt gacttcactt ctcacctcta 21600
gcccggtaac gaccacagac atgttacaca caagcccaga acttgtaacc agttcacctc 21660
caaagctgag ccacacttca gatgagagac tgaccactgg caaggacacc acaaatacag 21720
aagctgtgca tccttccaca aacacagcag cgtccaatgt ggagattccc agctctggac 21780
atgaatcccc ttcctctgcc ttagctgact cagagacatc caaagccaca tcaccaatgt 21840
ttattacctc cacccaggag gatacaactg ttgccatatc aacccctcac ttcttggaga 21900
ctagcagaat tcagaaagag tcaatttcct ccctgagccc taaattgagg gagacaggca 21960
gttctgtgga gacaagctca gccatagaga caagtgctgt cctttctgaa gtgtccattg 22020
gtgctactac tgagatctcc aggacagaag tcacctcctc tagcagaaca tccatctctg 22080
gttctgctga gtccacaatg ttgccagaaa tatccaccac aagaaaaatc attaagttcc 22140
ctacttcccc catcctggca gaatcatcag aaatgaccat caagacccaa acaagtcctc 22200
ctgggtctac atcagagagt acctttacat tagacacatc aaccactccc tccttggtaa 22260
taacccattc gactatgact cagagattgc cacactcaga gataaccact cttgtgagta 22320
gaggtgctgg ggatgtgcca cggcccagct ctctccctgt ggaagaaaca agccctccat 22380
cttcccagct gtctttatct gccatgatct caccttctcc tgtttcttcc acattaccag 22440
caagtagcca ctcctcttct gcttctgtga cttcacttct cacaccaggc caagtgaaga 22500
ctactgaggt gttggacgca agtgcagaac ctgaaaccag ttcacctcca agtttgagca 22560
gcacctcagt tgaaatactg gccacctctg aagtcaccac agatacggag aaaattcatc 22620
ctttctcaaa cacggcagta accaaagttg gaacttccag ttctggacat gaatcccctt 22680
cctctgtcct acctgactca gagacaacca aagccacatc ggcaatgggt accatctcca 22740
ttatggggga tacaagtgtt tctacattaa ctcctgcctt atctaacact aggaaaattc 22800
agtcagagcc agcttcctca ctgaccacca gattgaggga gaccagcacc tctgaagaga 22860
ccagcttagc cacagaagca aacactgttc tttctaaagt gtccactggt gctactactg 22920
aggtctccag gacagaagcc atctccttta gcagaacatc catgtcaggc cctgagcagt 22980
ccacaatgtc acaagacatc tccataggaa ccatccccag gatttctgcc tcctctgtcc 23040
tgacagaatc tgcaaaaatg accatcacaa cccaaacagg tccttcggag tctacactag 23100
aaagtaccct taatttgaac acagcaacca caccctcttg ggtggaaacc cactctatag 23160
taattcaggg atttccacac ccagagatga ccacttccat gggcagaggt cctggaggtg 23220
tgtcatggcc tagccctccc tttgtgaaag aaaccagccc tccatcctcc ccgctgtctt 23280
tacctgccgt gacctcacct catcctgttt ccaccacatt cctagcacat atccccccct 23340
ctccccttcc tgtgacttca cttctcacct ctggcccggc gacaaccaca gatatcttgg 23400
gtacaagcac agaacctgga accagttcat cttcaagttt gagcaccacc tcccatgaga 23460
gactgaccac ttacaaagac actgcacata cagaagccgt gcatccttcc acaaacacag 23520
gagggaccaa tgtggcaacc accagctctg gatataaatc acagtcctct gtcctagctg 23580
actcatctcc aatgtgtacc acctccacca tgggggatac aagtgttctc acatcaactc 23640
ctgccttcct tgagactagg aggattcaga cagagctagc ttcctccctg acccctggat 23700
tgagggagtc cagcggctct gaagggacca gctcaggcac caagatgagc actgtcctct 23760
ctaaagtgcc cactggtgct actactgaga tctccaagga agacgtcacc tccatcccag 23820
gtcccgctca atccacaata tcaccagaca tctccacaag aaccgtcagc tggttctcta 23880
catcccctgt catgacagaa tcagcagaaa taaccatgaa cacccataca agtcctttag 23940
gggccacaac acaaggcacc agtactttgg acacgtcaag cacaacctct ttgacaatga 24000
cacactcaac tatatctcaa ggattttcac actcacagat gagcactctt atgaggaggg 24060
gtcctgagga tgtatcatgg atgagccctc cccttctgga aaaaactaga ccttcctttt 24120
ctctgatgtc ttcaccagcc acaacttcac cttctcctgt ttcctccaca ttaccagaga 24180
gcatctcttc ctctcctctt cctgtgactt cactcctcac gtctggcttg gcaaaaacta 24240
cagatatgtt gcacaaaagc tcagaacctg taaccaactc acctgcaaat ttgagcagca 24300
cctcagttga aatactggcc acctctgaag tcaccacaga tacagagaaa actcatcctt 24360
cttcaaacag aacagtgacc gatgtgggga cctccagttc tggacatgaa tccacttcct 24420
ttgtcctagc tgactcacag acatccaaag tcacatctcc aatggttatt acctccacca 24480
tggaggatac gagtgtctcc acatcaactc ctggcttttt tgagactagc agaattcaga 24540
cagaaccaac atcctccctg acccttggac tgagaaagac cagcagctct gaggggacca 24600
gcttagccac agagatgagc actgtccttt ctggagtgcc cactggtgcc actgctgaag 24660
tctccaggac agaagtcacc tcctctagca gaacatccat ctcaggcttt gctcagctca 24720
cagtgtcacc agagacttcc acagaaacca tcaccagact ccctacctcc agcataatga 24780
cagaatcagc agaaatgatg atcaagacac aaacagatcc tcctgggtct acaccagaga 24840
gtactcatac tgtggacata tcaacaacac ccaactgggt agaaacccac tcgactgtga 24900
ctcagagatt ttcacactca gagatgacca ctcttgtgag cagaagccct ggtgatatgt 24960
tatggcctag tcaatcctct gtggaagaaa ccagctctgc ctcttccctg ctgtctctgc 25020
ctgccacgac ctcaccttct cctgtttcct ctacattagt agaggatttc ccttccgctt 25080
ctcttcctgt gacttctctt ctcaaccctg gcctggtgat aaccacagac aggatgggca 25140
taagcagaga acctggaacc agttccactt caaatttgag cagcacctcc catgagagac 25200
tgaccacttt ggaagacact gtagatacag aagacatgca gccttccaca cacacagcag 25260
tgaccaacgt gaggacctcc atttctggac atgaatcaca atcttctgtc ctatctgact 25320
cagagacacc caaagccaca tctccaatgg gtaccaccta caccatgggg gaaacgagtg 25380
tttccatatc cacttctgac ttctttgaga ccagcagaat tcagatagaa ccaacatcct 25440
ccctgacttc tggattgagg gagaccagca gctctgagag gatcagctca gccacagagg 25500
gaagcactgt cctttctgaa gtgcccagtg gtgctaccac tgaggtctcc aggacagaag 25560
tgatatcctc taggggaaca tccatgtcag ggcctgatca gttcaccata tcaccagaca 25620
tctctactga agcgatcacc aggctttcta cttcccccat tatgacagaa tcagcagaaa 25680
gtgccatcac tattgagaca ggttctcctg gggctacatc agagggtacc ctcaccttgg 25740
acacctcaac aacaaccttt tggtcaggga cccactcaac tgcatctcca ggattttcac 25800
actcagagat gaccactctt atgagtagaa ctcctggaga tgtgccatgg ccgagccttc 25860
cctctgtgga agaagccagc tctgtctctt cctcactgtc ttcacctgcc atgacctcaa 25920
cttctttttt ctccacatta ccagagagca tctcctcctc tcctcatcct gtgactgcac 25980
ttctcaccct tggcccagtg aagaccacag acatgttgcg cacaagctca gaacctgaaa 26040
ccagttcacc tccaaatttg agcagcacct cagctgaaat attagccacg tctgaagtca 26100
ccaaagatag agagaaaatt catccctcct caaacacacc tgtagtcaat gtagggactg 26160
tgatttataa acatctatcc ccttcctctg ttttggctga cttagtgaca acaaaaccca 26220
catctccaat ggctaccacc tccactctgg ggaatacaag tgtttccaca tcaactcctg 26280
ccttcccaga aactatgatg acacagccaa cttcctccct gacttctgga ttaagggaga 26340
tcagtacctc tcaagagacc agctcagcaa cagagagaag tgcttctctt tctggaatgc 26400
ccactggtgc tactactaag gtctccagaa cagaagccct ctccttaggc agaacatcca 26460
ccccaggtcc tgctcaatcc acaatatcac cagaaatctc cacggaaacc atcactagaa 26520
tttctactcc cctcaccacg acaggatcag cagaaatgac catcaccccc aaaacaggtc 26580
attctggggc atcctcacaa ggtaccttta ccttggacac atcaagcaga gcctcctggc 26640
caggaactca ctcagctgca actcacagat ctccacactc agggatgacc actcctatga 26700
gcagaggtcc tgaggatgtg tcatggccaa gccgcccatc agtggaaaaa actagccctc 26760
catcttccct ggtgtcttta tctgcagtaa cctcaccttc gccactttat tccacaccat 26820
ctgagagtag ccactcatct cctctccggg tgacttctct tttcacccct gtcatgatga 26880
agaccacaga catgttggac acaagcttgg aacctgtgac cacttcacct cccagtatga 26940
atatcacctc agatgagagt ctggccactt ctaaagccac catggagaca gaggcaattc 27000
agctttcaga aaacacagct gtgactcaga tgggcaccat cagcgctaga caagaattct 27060
attcctctta tccaggcctc ccagagccat ccaaagtgac atctccagtg gtcacctctt 27120
ccaccataaa agacattgtt tctacaacca tacctgcttc ctctgagata acaagaattg 27180
agatggagtc aacatccacc ctgaccccca caccaaggga gaccagcacc tcccaggaga 27240
tccactcagc cacaaagcca agcactgttc cttacaaggc actcactagt gccacgattg 27300
aggactccat gacacaagtc atgtcctcta gcagaggacc tagccctgat cagtccacaa 27360
tgtcacaaga catatccact gaagtgatca ccaggctctc tacctccccc atcaagacag 27420
aatctacaga aatgaccatt accacccaaa caggttctcc tggggctaca tcaaggggta 27480
cccttacctt ggacacttca acaactttta tgtcagggac ccactcaact gcatctcaag 27540
gattttcaca ctcacagatg accgctctta tgagtagaac tcctggagat gtgccatggc 27600
taagccatcc ctctgtggaa gaagccagct ctgcctcttt ctcactgtct tcacctgtca 27660
tgacctcatc ttctcccgtt tcttccacat taccagacag catccactct tcttcgcttc 27720
ctgtgacatc acttctcacc tcagggctgg tgaagaccac agagctgttg ggcacaagct 27780
cagaacctga aaccagttca cccccaaatt tgagcagcac ctcagctgaa atactggcca 27840
tcactgaagt cactacagat acagagaaac tggagatgac caatgtggta acctcaggtt 27900
atacacatga atctccttcc tctgtcctag ctgactcagt gacaacaaag gccacatctt 27960
caatgggtat cacctacccc acaggagata caaatgttct cacatcaacc cctgccttct 28020
ctgacaccag taggattcaa acaaagtcaa agctctcact gactcctggg ttgatggaga 28080
ccagcatctc tgaagagacc agctctgcca cagaaaaaag cactgtcctt tctagtgtgc 28140
ccactggtgc tactactgag gtctccagga cagaagccat ctcttctagc agaacatcca 28200
tcccaggccc tgctcaatcc acaatgtcat cagacacctc catggaaacc atcactagaa 28260
tttctacccc cctcacaagg aaagaatcaa cagacatggc catcaccccc aaaacaggtc 28320
cttctggggc tacctcgcag ggtaccttta ccttggactc atcaagcaca gcctcctggc 28380
caggaactca ctcagctaca actcagagat ttccacagtc agtggtgaca actcctatga 28440
gcagaggtcc tgaggatgtg tcatggccaa gcccgctgtc tgtggaaaaa aacagccctc 28500
catcttccct ggtatcttca tcttcagtaa cctcaccttc gccactttat tccacaccat 28560
ctgggagtag ccactcctct cctgtccctg tcacttctct tttcacctct atcatgatga 28620
aggccacaga catgttggat gcaagtttgg aacctgagac cacttcagct cccaatatga 28680
atatcacctc agatgagagt ctggccgctt ctaaagccac cacggagaca gaggcaattc 28740
acgtttttga aaatacagca gcgtcccatg tggaaaccac cagtgctaca gaggaactct 28800
attcctcttc cccaggcttc tcagagccaa caaaagtgat atctccagtg gtcacctctt 28860
cctctataag agacaacatg gtttccacaa caatgcctgg ctcctctggc attacaagga 28920
ttgagataga gtcaatgtca tctctgaccc ctggactgag ggagaccaga acctcccagg 28980
acatcacctc atccacagag acaagcactg tcctttacaa gatgccctct ggtgccactc 29040
ctgaggtctc caggacagaa gttatgccct ctagcagaac atccattcct ggccctgctc 29100
agtccacaat gtcactagac atctccgatg aagttgtcac caggctgtct acctctccca 29160
tcatgacaga atctgcagaa ataaccatca ccacccaaac aggttattct ctggctacat 29220
cccaggttac ccttcccttg ggcacctcaa tgaccttttt gtcagggacc cactcaacta 29280
tgtctcaagg actttcacac tcagagatga ccaatcttat gagcaggggt cctgaaagtc 29340
tgtcatggac gagccctcgc tttgtggaaa caactagatc ttcctcttct ctgacatcat 29400
tacctctcac gacctcactt tctcctgtgt cctccacatt actagacagt agcccctcct 29460
ctcctcttcc tgtgacttca cttatcctcc caggcctggt gaagactaca gaagtgttgg 29520
atacaagctc agagcctaaa accagttcat ctccaaattt gagcagcacc tcagttgaaa 29580
taccggccac ctctgaaatc atgacagata cagagaaaat tcatccttcc tcaaacacag 29640
cggtggccaa agtgaggacc tccagttctg ttcatgaatc tcattcctct gtcctagctg 29700
actcagaaac aaccataacc ataccttcaa tgggtatcac ctccgctgtg gacgatacca 29760
ctgttttcac atcaaatcct gccttctctg agactaggag gattccgaca gagccaacat 29820
tctcattgac tcctggattc agggagacta gcacctctga agagaccacc tcaatcacag 29880
aaacaagtgc agtcctttat ggagtgccca ctagtgctac tactgaagtc tccatgacag 29940
aaatcatgtc ctctaataga atacacatcc ctgactctga tcagtccacg atgtctccag 30000
acatcatcac tgaagtgatc accaggctct cttcctcatc catgatgtca gaatcaacac 30060
aaatgaccat caccacccaa aaaagttctc ctggggctac agcacagagt actcttacct 30120
tggccacaac aacagccccc ttggcaagga cccactcaac tgttcctcct agatttttac 30180
actcagagat gacaactctt atgagtagga gtcctgaaaa tccatcatgg aagagctctc 30240
tctttgtgga aaaaactagc tcttcatctt ctctgttgtc cttacctgtc acgacctcac 30300
cttctgtttc ttccacatta ccgcagagta tcccttcctc ctctttttct gtgacttcac 30360
tcctcacccc aggcatggtg aagactacag acacaagcac agaacctgga accagtttat 30420
ctccaaatct gagtggcacc tcagttgaaa tactggctgc ctctgaagtc accacagata 30480
cagagaaaat tcatccttct tcaagcatgg cagtgaccaa tgtgggaacc accagttctg 30540
gacatgaact atattcctct gtttcaatcc actcggagcc atccaaggct acatacccag 30600
tgggtactcc ctcttccatg gctgaaacct ctatttccac atcaatgcct gctaattttg 30660
agaccacagg atttgaggct gagccatttt ctcatttgac ttctggattt aggaagacaa 30720
acatgtccct ggacaccagc tcagtcacac caacaaatac accttcttct cctgggtcca 30780
ctcacctttt acagagttcc aagactgatt tcacctcttc tgcaaaaaca tcatccccag 30840
actggcctcc agcctcacag tatactgaaa ttccagtgga cataatcacc ccctttaatg 30900
cttctccatc tattacggag tccactggga taacctcctt cccagaatcc aggtttacta 30960
tgtctgtaac agaaagtact catcatctga gtacagattt gctgccttca gctgagacta 31020
tttccactgg cacagtgatg ccttctctat cagaggccat gacttcattt gccaccactg 31080
gagttccacg agccatctca ggttcaggta gtccattctc taggacagag tcaggccctg 31140
gggatgctac tctgtccacc attgcagaga gcctgccttc atccactcct gtgccattct 31200
cctcttcaac cttcactacc actgattctt caaccatccc agccctccat gagataactt 31260
cctcttcagc taccccatat agagtggaca ccagtcttgg gacagagagc agcactactg 31320
aaggacgctt ggttatggtc agtactttgg acacttcaag ccaaccaggc aggacatctt 31380
catcacccat tttggatacc agaatgacag agagcgttga gctgggaaca gtgacaagtg 31440
cttatcaagt tccttcactc tcaacacggt tgacaagaac tgatggcatt atggaacaca 31500
tcacaaaaat acccaatgaa gcagcacaca gaggtaccat aagaccagtc aaaggccctc 31560
agacatccac ttcgcctgcc agtcctaaag gactacacac aggagggaca aaaagaatgg 31620
agaccaccac cacagctctg aagaccacca ccacagctct gaagaccact tccagagcca 31680
ccttgaccac cagtgtctat actcccactt tgggaacact gactcccctc aatgcatcaa 31740
tgcaaatggc cagcacaatc cccacagaaa tgatgatcac aaccccatat gttttccctg 31800
atgttccaga aacgacatcc tcattggcta ccagcctggg agcagaaacc agcacagctc 31860
ttcccaggac aaccccatct gttttcaata gagaatcaga gaccacagcc tcactggtct 31920
ctcgttctgg ggcagagaga agtccggtta ttcaaactct agatgtttct tctagtgagc 31980
cagatacaac agcttcatgg gttatccatc ctgcagagac catcccaact gtttccaaga 32040
caacccccaa ttttttccac agtgaattag acactgtatc ttccacagcc accagtcatg 32100
gggcagacgt cagctcagcc attccaacaa atatctcacc tagtgaacta gatgcactga 32160
ccccactggt cactatttcg gggacagata ctagtacaac attcccaaca ctgactaagt 32220
ccccacatga aacagagaca agaaccacat ggctcactca tcctgcagag accagctcaa 32280
ctattcccag aacaatcccc aatttttctc atcatgaatc agatgccaca ccttcaatag 32340
ccaccagtcc tggggcagaa accagttcag ctattccaat tatgactgtc tcacctggtg 32400
cagaagatct ggtgacctca caggtcacta gttctgggac agacagaaat atgactattc 32460
caactttgac tctttctcct ggtgaaccaa agacgatagc ctcattagtc acccatcctg 32520
aagcacagac aagttcggcc attccaactt caactatctc gcctgctgta tcacggttgg 32580
tgacctcaat ggtcaccagt ttggcggcaa agacaagtac aactaatcga gctctgacaa 32640
actcccctgg tgaaccagct acaacagttt cattggtcac gcatcctgca cagaccagcc 32700
caacagttcc ctggacaact tccatttttt tccatagtaa atcagacacc acaccttcaa 32760
tgaccaccag tcatggggca gaatccagtt cagctgttcc aactccaact gtttcaactg 32820
aggtaccagg agtagtgacc cctttggtca ccagttctag ggcagtgatc agtacaacta 32880
ttccaattct gactctttct cctggtgaac cagagaccac accttcaatg gccaccagtc 32940
atggggaaga agccagttct gctattccaa ctccaactgt ttcacctggg gtaccaggag 33000
tggtgacctc tctggtcact agttctaggg cagtgactag tacaactatt ccaattctga 33060
ctttttctct tggtgaacca gagaccacac cttcaatggc caccagtcat gggacagaag 33120
ctggctcagc tgttccaact gttttacctg aggtaccagg aatggtgacc tctctggttg 33180
ctagttctag ggcagtaacc agtacaactc ttccaactct gactctttct cctggtgaac 33240
cagagaccac accttcaatg gccaccagtc atggggcaga agccagctca actgttccaa 33300
ctgtttcacc tgaggtacca ggagtggtga cctctctggt cactagttct agtggagtaa 33360
acagtacaag tattccaact ctgattcttt ctcctggtga actagaaacc acaccttcaa 33420
tggccaccag tcatggggca gaagccagct cagctgttcc aactccaact gtttcacctg 33480
gggtatcagg agtggtgacc cctctggtca ctagttccag ggcagtgacc agtacaacta 33540
ttccaattct aactctttct tctagtgagc cagagaccac accttcaatg gccaccagtc 33600
atggggtaga agccagctca gctgttctaa ctgtttcacc tgaggtacca ggaatggtga 33660
cctctctggt cactagttct agagcagtaa ccagtacaac tattccaact ctgactattt 33720
cttctgatga accagagacc acaacttcat tggtcaccca ttctgaggca aagatgattt 33780
cagccattcc aactttagct gtctccccta ctgtacaagg gctggtgact tcactggtca 33840
ctagttctgg gtcagagacc agtgcgtttt caaatctaac tgttgcctca agtcaaccag 33900
agaccataga ctcatgggtc gctcatcctg ggacagaagc aagttctgtt gttccaactt 33960
tgactgtctc cactggtgag ccgtttacaa atatctcatt ggtcacccat cctgcagaga 34020
gtagctcaac tcttcccagg acaacctcaa ggttttccca cagtgaatta gacactatgc 34080
cttctacagt caccagtcct gaggcagaat ccagctcagc catttcaaca actatttcac 34140
ctggtatacc aggtgtgctg acatcactgg tcactagctc tgggagagac atcagtgcaa 34200
cttttccaac agtgcctgag tccccacatg aatcagaggc aacagcctca tgggttactc 34260
atcctgcagt caccagcaca acagttccca ggacaacccc taattattct catagtgaac 34320
cagacaccac accatcaata gccaccagtc ctggggcaga agccacttca gattttccaa 34380
caataactgt ctcacctgat gtaccagata tggtaacctc acaggtcact agttctggga 34440
cagacaccag tataactatt ccaactctga ctctttcttc tggtgagcca gagaccacaa 34500
cctcatttat cacctattct gagacacaca caagttcagc cattccaact ctccctgtct 34560
cccctggtgc atcaaagatg ctgacctcac tggtcatcag ttctgggaca gacagcacta 34620
caactttccc aacactgacg gagaccccat atgaaccaga gacaacagcc atacagctca 34680
ttcatcctgc agagaccaac acaatggttc ccaggacaac tcccaagttt tcccatagta 34740
agtcagacac cacactccca gtagccatca ccagtcctgg gccagaagcc agttcagctg 34800
tttcaacgac aactatctca cctgatatgt cagatctggt gacctcactg gtccctagtt 34860
ctgggacaga caccagtaca accttcccaa cattgagtga gaccccatat gaaccagaga 34920
ctacagccac gtggctcact catcctgcag aaaccagcac aacggtttct gggacaattc 34980
ccaacttttc ccatagggga tcagacactg caccctcaat ggtcaccagt cctggagtag 35040
acacgaggtc aggtgttcca actacaacca tcccacccag tataccaggg gtagtgacct 35100
cacaggtcac tagttctgca acagacacta gtacagctat tccaactttg actccttctc 35160
ctggtgaacc agagaccaca gcctcatcag ctacccatcc tgggacacag actggcttca 35220
ctgttccaat tcggactgtt ccctctagtg agccagatac aatggcttcc tgggtcactc 35280
atcctccaca gaccagcaca cctgtttcca gaacaacctc cagtttttcc catagtagtc 35340
cagatgccac acctgtaatg gccaccagtc ctaggacaga agccagttca gctgtactga 35400
caacaatctc acctggtgca ccagagatgg tgacttcaca gatcactagt tctggggcag 35460
caaccagtac aactgttcca actttgactc attctcctgg tatgccagag accacagcct 35520
tattgagcac ccatcccaga acagagacaa gtaaaacatt tcctgcttca actgtgtttc 35580
ctcaagtatc agagaccaca gcctcactca ccattagacc tggtgcagag actagcacag 35640
ctctcccaac tcagacaaca tcctctctct tcaccctact tgtaactgga accagcagag 35700
ttgatctaag tccaactgct tcacctggtg tttctgcaaa aacagcccca ctttccaccc 35760
atccagggac agaaaccagc acaatgattc caacttcaac tctttccctt ggtttactag 35820
agactacagg cttactggcc accagctctt cagcagagac cagcacgagt actctaactc 35880
tgactgtttc ccctgctgtc tctgggcttt ccagtgcctc tataacaact gataagcccc 35940
aaactgtgac ctcctggaac acagaaacct caccatctgt aacttcagtt ggacccccag 36000
aattttccag gactgtcaca ggcaccacta tgaccttgat accatcagag atgccaacac 36060
cacctaaaac cagtcatgga gaaggagtga gtccaaccac tatcttgaga actacaatgg 36120
ttgaagccac taatttagct accacaggtt ccagtcccac tgtggccaag acaacaacca 36180
ccttcaatac actggctgga agcctcttta ctcctctgac cacacctggg atgtccacct 36240
tggcctctga gagtgtgacc tcaagaacaa gttataacca tcggtcctgg atctccacca 36300
ccagcagtta taaccgtcgg tactggaccc ctgccaccag cactccagtg acttctacat 36360
tctccccagg gatttccaca tcctccatcc ccagctccac agcagccaca gtcccattca 36420
tggtgccatt caccctcaac ttcaccatca ccaacctgca gtacgaggag gacatgcggc 36480
accctggttc caggaagttc aacgccacag agagagaact gcagggtctg ctcaaaccct 36540
tgttcaggaa tagcagtctg gaatacctct attcaggctg cagactagcc tcactcaggc 36600
cagagaagga tagctcagcc acggcagtgg atgccatctg cacacatcgc cctgaccctg 36660
aagacctcgg actggacaga gagcgactgt actgggagct gagcaatctg acaaatggca 36720
tccaggagct gggcccctac accctggacc ggaacagtct ctatgtcaat ggtttcaccc 36780
atcgaagctc tatgcccacc accagcactc ctgggacctc cacagtggat gtgggaacct 36840
cagggactcc atcctccagc cccagcccca cgactgctgg ccctctcctg atgccgttca 36900
ccctcaactt caccatcacc aacctgcagt acgaggagga catgcgtcgc actggctcca 36960
ggaagttcaa caccatggag agtgtcctgc agggtctgct caagcccttg ttcaagaaca 37020
ccagtgttgg ccctctgtac tctggctgca gattgacctt gctcaggccc gagaaagatg 37080
gggcagccac tggagtggat gccatctgca cccaccgcct tgaccccaaa agccctggac 37140
tcaacaggga gcagctgtac tgggagctaa gcaaactgac caatgacatt gaagagctgg 37200
gcccctacac cctggacagg aacagtctct atgtcaatgg tttcacccat cagagctctg 37260
tgtccaccac cagcactcct gggacctcca cagtggatct cagaacctca gggactccat 37320
cctccctctc cagccccaca attatggctg ctggccctct cctggtacca ttcaccctca 37380
acttcaccat caccaacctg cagtatgggg aggacatggg tcaccctggc tccaggaagt 37440
tcaacaccac agagagggtc ctgcagggtc tgcttggtcc catattcaag aacaccagtg 37500
ttggccctct gtactctggc tgcagactga cctctctcag gtctgagaag gatggagcag 37560
ccactggagt ggatgccatc tgcatccatc atcttgaccc caaaagccct ggactcaaca 37620
gagagcggct gtactgggag ctgagccaac tgaccaatgg catcaaagag ctgggcccct 37680
acaccctgga caggaacagt ctctatgtca atggtttcac ccatcggacc tctgtgccca 37740
ccagcagcac tcctgggacc tccacagtgg accttggaac ctcagggact ccattctccc 37800
tcccaagccc cgcaactgct ggccctctcc tggtgctgtt caccctcaac ttcaccatca 37860
ccaacctgaa gtatgaggag gacatgcatc gccctggctc caggaagttc aacaccactg 37920
agagggtcct gcagactctg cttggtccta tgttcaagaa caccagtgtt ggccttctgt 37980
actctggctg cagactgacc ttgctcaggt ccgagaagga tggagcagcc actggagtgg 38040
atgccatctg cacccaccgt cttgacccca aaagccctgg agtggacagg gagcagctat 38100
actgggagct gagccagctg accaatggca tcaaagagct gggcccctac accctggaca 38160
ggaacagtct ctatgtcaat ggtttcaccc attggatccc tgtgcccacc agcagcactc 38220
ctgggacctc cacagtggac cttgggtcag ggactccatc ctccctcccc agccccacaa 38280
ctgctggccc tctcctggtg ccgttcaccc tcaacttcac catcaccaac ctgaagtacg 38340
aggaggacat gcattgccct ggctccagga agttcaacac cacagagaga gtcctgcaga 38400
gtctgcttgg tcccatgttc aagaacacca gtgttggccc tctgtactct ggctgcagac 38460
tgaccttgct caggtccgag aaggatggag cagccactgg agtggatgcc atctgcaccc 38520
accgtcttga ccccaaaagc cctggagtgg acagggagca gctatactgg gagctgagcc 38580
agctgaccaa tggcatcaaa gagctgggtc cctacaccct ggacagaaac agtctctatg 38640
tcaatggttt cacccatcag acctctgcgc ccaacaccag cactcctggg acctccacag 38700
tggaccttgg gacctcaggg actccatcct ccctccccag ccctacatct gctggccctc 38760
tcctggtgcc attcaccctc aacttcacca tcaccaacct gcagtacgag gaggacatgc 38820
atcacccagg ctccaggaag ttcaacacca cggagcgggt cctgcagggt ctgcttggtc 38880
ccatgttcaa gaacaccagt gtcggccttc tgtactctgg ctgcagactg accttgctca 38940
ggcctgagaa gaatggggca gccactggaa tggatgccat ctgcagccac cgtcttgacc 39000
ccaaaagccc tggactcaac agagagcagc tgtactggga gctgagccag ctgacccatg 39060
gcatcaaaga gctgggcccc tacaccctgg acaggaacag tctctatgtc aatggtttca 39120
cccatcggag ctctgtggcc cccaccagca ctcctgggac ctccacagtg gaccttggga 39180
cctcagggac tccatcctcc ctccccagcc ccacaacagc tgttcctctc ctggtgccgt 39240
tcaccctcaa ctttaccatc accaatctgc agtatgggga ggacatgcgt caccctggct 39300
ccaggaagtt caacaccaca gagagggtcc tgcagggtct gcttggtccc ttgttcaaga 39360
actccagtgt cggccctctg tactctggct gcagactgat ctctctcagg tctgagaagg 39420
atggggcagc cactggagtg gatgccatct gcacccacca ccttaaccct caaagccctg 39480
gactggacag ggagcagctg tactggcagc tgagccagat gaccaatggc atcaaagagc 39540
tgggccccta caccctggac cggaacagtc tctacgtcaa tggtttcacc catcggagct 39600
ctgggctcac caccagcact ccttggactt ccacagttga ccttggaacc tcagggactc 39660
catcccccgt ccccagcccc acaaccaccg gccctctcct ggtgccattc acactcaact 39720
tcaccatcac taacctacag tatgaggaga acatgggtca ccctggctcc aggaagttca 39780
acatcacgga gagtgttctg cagggtctgc tcaagccctt gttcaagagc accagtgttg 39840
gccctctgta ttctggctgc agactgacct tgctcaggcc tgagaaggat ggagtagcca 39900
ccagagtgga cgccatctgc acccaccgcc ctgaccccaa aatccctggg ctagacagac 39960
agcagctata ctgggagctg agccagctga cccacagcat cactgagctg ggaccctaca 40020
ccctggatag ggacagtctc tatgtcaatg gtttcaccca gcggagctct gtgcccacca 40080
ccagcactcc tgggactttc acagtacagc cggaaacctc tgagactcca tcatccctcc 40140
ctggccccac agccactggc cctgtcctgc tgccattcac cctcaatttt accatcacta 40200
acctgcagta tgaggaggac atgcgtcgcc ctggctccag gaagttcaac accacggaga 40260
gggtccttca gggtctgctt atgcccttgt tcaagaacac cagtgtcagc tctctgtact 40320
ctggttgcag actgaccttg ctcaggcctg agaaggatgg ggcagccacc agagtggatg 40380
ctgtctgcac ccatcgtcct gaccccaaaa gccctggact ggacagagag cggctgtact 40440
ggaagctgag ccagctgacc cacggcatca ctgagctggg cccctacacc ctggacaggc 40500
acagtctcta tgtcaatggt ttcacccatc agagctctat gacgaccacc agaactcctg 40560
atacctccac aatgcacctg gcaacctcga gaactccagc ctccctgtct ggacccatga 40620
ccgccagccc tctcctggtg ctattcacaa ttaacttcac catcactaac ctgcggtatg 40680
aggagaacat gcatcaccct ggctctagaa agtttaacac cacggagaga gtccttcagg 40740
gtctgctcag gcctgtgttc aagaacacca gtgttggccc tctgtactct ggctgcagac 40800
tgaccttgct caggcccaag aaggatgggg cagccaccaa agtggatgcc atctgcacct 40860
accgccctga tcccaaaagc cctggactgg acagagagca gctatactgg gagctgagcc 40920
agctgaccca cagcatcact gagctgggcc cctacaccct ggacagggac agtctctatg 40980
tcaatggttt cacacagcgg agctctgtgc ccaccactag cattcctggg acccccacag 41040
tggacctggg aacatctggg actccagttt ctaaacctgg tccctcggct gccagccctc 41100
tcctggtgct attcactctc aacttcacca tcaccaacct gcggtatgag gagaacatgc 41160
agcaccctgg ctccaggaag ttcaacacca cggagagggt ccttcagggc ctgctcaggt 41220
ccctgttcaa gagcaccagt gttggccctc tgtactctgg ctgcagactg actttgctca 41280
ggcctgaaaa ggatgggaca gccactggag tggatgccat ctgcacccac caccctgacc 41340
ccaaaagccc taggctggac agagagcagc tgtattggga gctgagccag ctgacccaca 41400
atatcactga gctgggcccc tatgccctgg acaacgacag cctctttgtc aatggtttca 41460
ctcatcggag ctctgtgtcc accaccagca ctcctgggac ccccacagtg tatctgggag 41520
catctaagac tccagcctcg atatttggcc cttcagctgc cagccatctc ctgatactat 41580
tcaccctcaa cttcaccatc actaacctgc ggtatgagga gaacatgtgg cctggctcca 41640
ggaagttcaa cactacagag agggtccttc agggcctgct aaggcccttg ttcaagaaca 41700
ccagtgttgg ccctctgtac tctggctgca ggctgacctt gctcaggcca gagaaagatg 41760
gggaagccac cggagtggat gccatctgca cccaccgccc tgaccccaca ggccctgggc 41820
tggacagaga gcagctgtat ttggagctga gccagctgac ccacagcatc actgagctgg 41880
gcccctacac actggacagg gacagtctct atgtcaatgg tttcacccat cggagctctg 41940
tacccaccac cagcaccggg gtggtcagcg aggagccatt cacactgaac ttcaccatca 42000
acaacctgcg ctacatggcg gacatgggcc aacccggctc cctcaagttc aacatcacag 42060
acaacgtcat gcagcacctg ctcagtcctt tgttccagag gagcagcctg ggtgcacggt 42120
acacaggctg cagggtcatc gcactaaggt ctgtgaagaa cggtgctgag acacgggtgg 42180
acctcctctg cacctacctg cagcccctca gcggcccagg tctgcctatc aagcaggtgt 42240
tccatgagct gagccagcag acccatggca tcacccggct gggcccctac tctctggaca 42300
aagacagcct ctaccttaac ggttacaatg aacctggtcc agatgagcct cctacaactc 42360
ccaagccagc caccacattc ctgcctcctc tgtcagaagc cacaacagcc atggggtacc 42420
acctgaagac cctcacactc aacttcacca tctccaatct ccagtattca ccagatatgg 42480
gcaagggctc agctacattc aactccaccg agggggtcct tcagcacctg ctcagaccct 42540
tgttccagaa gagcagcatg ggccccttct acttgggttg ccaactgatc tccctcaggc 42600
ctgagaagga tggggcagcc actggtgtgg acaccacctg cacctaccac cctgaccctg 42660
tgggccccgg gctggacata cagcagcttt actgggagct gagtcagctg acccatggtg 42720
tcacccaact gggcttctat gtcctggaca gggatagcct cttcatcaat ggctatgcac 42780
cccagaattt atcaatccgg ggcgagtacc agataaattt ccacattgtc aactggaacc 42840
tcagtaatcc agaccccaca tcctcagagt acatcaccct gctgagggac atccaggaca 42900
aggtcaccac actctacaaa ggcagtcaac tacatgacac attccgcttc tgcctggtca 42960
ccaacttgac gatggactcc gtgttggtca ctgtcaaggc attgttctcc tccaatttgg 43020
accccagcct ggtggagcaa gtctttctag ataagaccct gaatgcctca ttccattggc 43080
tgggctccac ctaccagttg gtggacatcc atgtgacaga aatggagtca tcagtttatc 43140
aaccaacaag cagctccagc acccagcact tctacctgaa tttcaccatc accaacctac 43200
catattccca ggacaaagcc cagccaggca ccaccaatta ccagaggaac aaaaggaata 43260
ttgaggatgc gctcaaccaa ctcttccgaa acagcagcat caagagttat ttttctgact 43320
gtcaagtttc aacattcagg tctgtcccca acaggcacca caccggggtg gactccctgt 43380
gtaacttctc gccactggct cggagagtag acagagttgc catctatgag gaatttctgc 43440
ggatgacccg gaatggtacc cagctgcaga acttcaccct ggacaggagc agtgtccttg 43500
tggatgggta ttctcccaac agaaatgagc ccttaactgg gaattctgac cttcccttct 43560
gggctgtcat cctcatcggc ttggcaggac tcctgggagt catcacatgc ctgatctgcg 43620
gtgtcctggt gaccacccgc cggcggaaga aggaaggaga atacaacgtc cagcaacagt 43680
gcccaggcta ctaccagtca cacctagacc tggaggatct gcaatgactg gaacttgccg 43740
gtgcctgggg tgcctttccc ccagccaggg tccaaagaag cttggctggg gcagaaataa 43800
accatattgg tcgga 43815
<210> 138
<211> 518
<212> Белок
<213> Искусственная последовательность
<220>
<223> Биспецифическ.
<400> 138
Glu Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val
100 105 110
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
115 120 125
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln
130 135 140
Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val
145 150 155 160
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu
165 170 175
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
180 185 190
Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg
195 200 205
Gly Glu Cys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln
210 215 220
Leu Val Gln Ser Gly Gly Gly Leu Thr Leu Ser Lys Ala Asp Tyr Glu
225 230 235 240
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
245 250 255
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gly Gly Gly Gly Ser
260 265 270
Gly Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val
275 280 285
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr
290 295 300
Thr Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys
305 310 315 320
Cys Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn
325 330 335
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser
340 345 350
Lys Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr
355 360 365
Gly Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp
370 375 380
Tyr Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly
385 390 395 400
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr
405 410 415
Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile
420 425 430
Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln
435 440 445
Thr Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu
450 455 460
Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
465 470 475 480
Tyr Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr
485 490 495
Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Cys Gly Thr
500 505 510
Lys Leu Gln Ile Thr Arg
515
<210> 139
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> MUC16c114-N3
<400> 139
Asn Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Thr Arg Asn Gly Thr Gln Leu Gln Ala Phe Thr
20 25 30
Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn Arg Asn
35 40 45
Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro Phe Trp Ala Val Ile Leu
50 55 60
Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile Thr Cys Leu Ile Cys Gly
65 70 75 80
Val Leu Val Thr Thr Arg Arg Arg Lys Lys Glu Gly Glu Tyr Asn Val
85 90 95
Gln Gln Gln Cys Pro Gly Tyr Tyr Gln Ser His Leu Asp Leu Glu Asp
100 105 110
Leu Gln
<210> 140
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> НУКЛЕИНОВАЯ КИСЛОТА 10C6 VH
<400> 140
caggtaactc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgaac actcttggta tgggtgtagg ctggattcgg 120
cagccttcag ggaagggtct ggagtggctg gcacacattt ggtgggatga tgataagtac 180
tataacccag ccctgaagag tcggctcaca atctccaagg attcctccaa aaaccaggtt 240
ttcctcaaga tcgccaatgt ggacactgca gatattgcca catactactg ttctcgaatc 300
gggacagctc aggctacgga tgctctggac tactggggtc aaggaacctc agtcaccgtc 360
tcctca 366
<210> 141
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> НУКЛЕИНОВАЯ КИСЛОТА 10C6 VL
<400> 141
gacattgtgc tgacacagtc tcctgcttcc ttagctgtat ctctggggca gagggccacc 60
atctcataca gggccagcaa aagtgtcagt acatctggct atagttatat gcactggaac 120
caacagaaac caggacagcc acccagactc ctcatctatc ttgtatccaa cctagaatct 180
ggggtccctg ccaggttcag tggcagtggg tctgggacag acttcaccct caacatccat 240
cctgtggagg aggaggatgc tgcaacctat tactgtcagc acattaggga gcttacacgt 300
tcggaggggg gaccaagctg gaaataaaac 330
<210> 142
<211> 369
<212> ДНК
<213> Искусственная последовательность
<220>
<223> НУКЛЕИНОВАЯ КИСЛОТА 7B12 VH
<400> 142
caggttactc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc actgttggta tgggtgtagg ctggagtcgt 120
cagccctcag ggaagggtct ggagtggctg gcacacatct ggtgggatga tgaagataag 180
tattataatc cagccctgaa gagtcggctc acaatctcca aggatacctc caaaaaccag 240
gtcttcctca agatcgccaa tgtggacact gcagatagtg ccacatacta ctgtactcga 300
atcgggacag ctcaggctac ggatgctttg gactactggg gtcaaggaac ctcagtcacc 360
gtctcctca 369
<210> 143
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> НУКЛЕИНОВАЯ КИСЛОТА 7B12 VL
<400> 143
gatattgtga tgactcaggc tgcaccctct gtatctgtca ctcctggaga gtcagtatcc 60
atctcctgca ggtctagtaa gagtcttcgg aaaagtaatg gcaacactta cttgtattgg 120
ttcctgcaga ggccaggcca gtctcctcag cgcctgatat attatatgtc caaccttgcc 180
tcaggagtcc cagacaggtt cagtggcaga gggtcaggaa ctgatttcac actgagaatc 240
agtagagtgg aggctgaaga tgtgggtgtt tattactgta tgcaaagtct agaatatcct 300
ctcacgttcg gaggggggac taagctaaaa ataaaa 336
<210> 144
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> НУКЛЕИНОВАЯ КИСЛОТА 19C11 VH
<400> 144
caggttaatc tgaaagagtc tggccctggg aaattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc actcttggta tgggtgtagg ttggattcgt 120
cagtcttcag ggaagggtct ggagtggctg gcacacattt ggtgggatga tgataagtac 180
tataacccag ccctgaagag tcggctcaca atctccaggg ctacctccaa aaaccaggtt 240
ttcctcaaga tcgtcaatgt gggcactgca gatactgcca catattactg tgctcgaatc 300
gggacagctc aggctacgga tgctttggac tattggggtc agggaacctc agtcaccgtt 360
tcctca 366
<210> 145
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> НУКЛЕИНОВАЯ КИСЛОТА 19C11 VL
<400> 145
gatattgtga tgactcaggc tgcaccctct atccctgtca ctcctggaga gtcagtatcc 60
atctcctgca ggtctagtaa gagtcttctg catagtaatg gcaacactta tttgtattgg 120
ttcctgcaga ggccaggcca gtctcctcag cgcctgatat attatatgtc caaccttgcc 180
tcaggagtcc cagacaggtt cagtggcaga gggtcaggaa ctgatttcac actgaaaatc 240
agtagagtgg aggctgggga tgtgggtgtt tattactgta tgcagggtct agagcatcct 300
ctcacgttcg gaggggggac caagctggaa ataaaa 336
<210> 146
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> НУКЛЕИНОВАЯ КИСЛОТА 16C5 VH
<400> 146
caggttactc tgaaagagtc tggccctgga atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgaac actcttggta tgggtgtagg ctggattcgt 120
cagccttcag ggaagggtct ggagtggctg gcacacattt ggtgggatga tgataagtac 180
tattacccag ccctgaagag tcggctcaca atctccaggg atacctccaa aaaccaggta 240
ttcctcaaga tcgccaatgt ggacactgca gatactgcca catactactg tgctcgaatc 300
gggacagctc aggctacgga tgctctggac tactggggtc aaggaacctc agtcaccgtc 360
tcctca 366
<210> 147
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<223> НУКЛЕИНОВАЯ КИСЛОТА 16C5 VL
<400> 147
gagctcgata tgacccagac tccaccctcc ctgtctgcat ctgtgggaga aactgtcagg 60
attaggtgcc tggccagtga ggacatttat agtggtatat cctggtatca acagaagcca 120
gggaaacctc ctacactcct gatctatggt gcatccaatt tagaatctgg ggtcccacca 180
cggttcagtg gcagtggatc tgggacagat tacaccctca ccattggcgg cgtgcaggct 240
gaagatgctg ccacctacta ctgtctaggc ggttatagtt atagtagtac cttgactttt 300
ggagctggca ccaatgtgga aatcaaa 327
<210> 148
<211> 369
<212> ДНК
<213> Искусственная последовательность
<220>
<223> НУКЛЕИНОВАЯ КИСЛОТА 18C6 VH
<400> 148
caggttactc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc actgttggta tgggtgtagg ctggagtcgt 120
cagccttcag ggaagggtct ggagtggctg gcacacattt ggtgggatga tgaggataag 180
tattataacc cagccctgaa gagtcggctc acaatctcca aggatacctc caaaaaccag 240
gtattcctca agatcgccaa tgtggacact gcagatactg ccacatacta ctgtactcga 300
atcgggacag ctcaggctac ggatgctttg gactactggg gtcaaggaac ctcagtcacc 360
gtctcctca 369
<210> 149
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> НУКЛЕИНОВАЯ КИСЛОТА 18C6 VL
<400> 149
gatattgtga tgactcaggc tgcaccctct gtacctgtca ctcctggaga gtcagtatcc 60
atctcctgca ggtctagtaa gagtcttctg catagtaatg gcaacactta cttgtattgg 120
ttcctgcaga ggccaggcca gtctcctcag cgcctgatat attatatgtc caaccttgcc 180
tcaggagtcc cagacaggtt cagtggcaga gggtcaggaa ctgatttcac actgagaatc 240
agtagagtgg aggctgagga tgtgggtgtt tattactgta tgcaaagtct agaatatcct 300
ctcacgttcg gaggggggac caagctggaa ataaaa 336
<210> 150
<211> 14447
<212> Белок
<213> Homo sapiens
<220>
<223> Аминокислотная последовательность зрелого MUC16 человека
<400> 150
Asp Lys Thr Leu Ala Ser Pro Thr Ser Ser Val Val Gly Arg Thr Thr
1 5 10 15
Gln Ser Leu Gly Val Met Ser Ser Ala Leu Pro Glu Ser Thr Ser Arg
20 25 30
Gly Met Thr His Ser Glu Gln Arg Thr Ser Pro Ser Leu Ser Pro Gln
35 40 45
Val Asn Gly Thr Pro Ser Arg Asn Tyr Pro Ala Thr Ser Met Val Ser
50 55 60
Gly Leu Ser Ser Pro Arg Thr Arg Thr Ser Ser Thr Glu Gly Asn Phe
65 70 75 80
Thr Lys Glu Ala Ser Thr Tyr Thr Leu Thr Val Glu Thr Thr Ser Gly
85 90 95
Pro Val Thr Glu Lys Tyr Thr Val Pro Thr Glu Thr Ser Thr Thr Glu
100 105 110
Gly Asp Ser Thr Glu Thr Pro Trp Asp Thr Arg Tyr Ile Pro Val Lys
115 120 125
Ile Thr Ser Pro Met Lys Thr Phe Ala Asp Ser Thr Ala Ser Lys Glu
130 135 140
Asn Ala Pro Val Ser Met Thr Pro Ala Glu Thr Thr Val Thr Asp Ser
145 150 155 160
His Thr Pro Gly Arg Thr Asn Pro Ser Phe Gly Thr Leu Tyr Ser Ser
165 170 175
Phe Leu Asp Leu Ser Pro Lys Gly Thr Pro Asn Ser Arg Gly Glu Thr
180 185 190
Ser Leu Glu Leu Ile Leu Ser Thr Thr Gly Tyr Pro Phe Ser Ser Pro
195 200 205
Glu Pro Gly Ser Ala Gly His Ser Arg Ile Ser Thr Ser Ala Pro Leu
210 215 220
Ser Ser Ser Ala Ser Val Leu Asp Asn Lys Ile Ser Glu Thr Ser Ile
225 230 235 240
Phe Ser Gly Gln Ser Leu Thr Ser Pro Leu Ser Pro Gly Val Pro Glu
245 250 255
Ala Arg Ala Ser Thr Met Pro Asn Ser Ala Ile Pro Phe Ser Met Thr
260 265 270
Leu Ser Asn Ala Glu Thr Ser Ala Glu Arg Val Arg Ser Thr Ile Ser
275 280 285
Ser Leu Gly Thr Pro Ser Ile Ser Thr Lys Gln Thr Ala Glu Thr Ile
290 295 300
Leu Thr Phe His Ala Phe Ala Glu Thr Met Asp Ile Pro Ser Thr His
305 310 315 320
Ile Ala Lys Thr Leu Ala Ser Glu Trp Leu Gly Ser Pro Gly Thr Leu
325 330 335
Gly Gly Thr Ser Thr Ser Ala Leu Thr Thr Thr Ser Pro Ser Thr Thr
340 345 350
Leu Val Ser Glu Glu Thr Asn Thr His His Ser Thr Ser Gly Lys Glu
355 360 365
Thr Glu Gly Thr Leu Asn Thr Ser Met Thr Pro Leu Glu Thr Ser Ala
370 375 380
Pro Gly Glu Glu Ser Glu Met Thr Ala Thr Leu Val Pro Thr Leu Gly
385 390 395 400
Phe Thr Thr Leu Asp Ser Lys Ile Arg Ser Pro Ser Gln Val Ser Ser
405 410 415
Ser His Pro Thr Arg Glu Leu Arg Thr Thr Gly Ser Thr Ser Gly Arg
420 425 430
Gln Ser Ser Ser Thr Ala Ala His Gly Ser Ser Asp Ile Leu Arg Ala
435 440 445
Thr Thr Ser Ser Thr Ser Lys Ala Ser Ser Trp Thr Ser Glu Ser Thr
450 455 460
Ala Gln Gln Phe Ser Glu Pro Gln His Thr Gln Trp Val Glu Thr Ser
465 470 475 480
Pro Ser Met Lys Thr Glu Arg Pro Pro Ala Ser Thr Ser Val Ala Ala
485 490 495
Pro Ile Thr Thr Ser Val Pro Ser Val Val Ser Gly Phe Thr Thr Leu
500 505 510
Lys Thr Ser Ser Thr Lys Gly Ile Trp Leu Glu Glu Thr Ser Ala Asp
515 520 525
Thr Leu Ile Gly Glu Ser Thr Ala Gly Pro Thr Thr His Gln Phe Ala
530 535 540
Val Pro Thr Gly Ile Ser Met Thr Gly Gly Ser Ser Thr Arg Gly Ser
545 550 555 560
Gln Gly Thr Thr His Leu Leu Thr Arg Ala Thr Ala Ser Ser Glu Thr
565 570 575
Ser Ala Asp Leu Thr Leu Ala Thr Asn Gly Val Pro Val Ser Val Ser
580 585 590
Pro Ala Val Ser Lys Thr Ala Ala Gly Ser Ser Pro Pro Gly Gly Thr
595 600 605
Lys Pro Ser Tyr Thr Met Val Ser Ser Val Ile Pro Glu Thr Ser Ser
610 615 620
Leu Gln Ser Ser Ala Phe Arg Glu Gly Thr Ser Leu Gly Leu Thr Pro
625 630 635 640
Leu Asn Thr Arg His Pro Phe Ser Ser Pro Glu Pro Asp Ser Ala Gly
645 650 655
His Thr Lys Ile Ser Thr Ser Ile Pro Leu Leu Ser Ser Ala Ser Val
660 665 670
Leu Glu Asp Lys Val Ser Ala Thr Ser Thr Phe Ser His His Lys Ala
675 680 685
Thr Ser Ser Ile Thr Thr Gly Thr Pro Glu Ile Ser Thr Lys Thr Lys
690 695 700
Pro Ser Ser Ala Val Leu Ser Ser Met Thr Leu Ser Asn Ala Ala Thr
705 710 715 720
Ser Pro Glu Arg Val Arg Asn Ala Thr Ser Pro Leu Thr His Pro Ser
725 730 735
Pro Ser Gly Glu Glu Thr Ala Gly Ser Val Leu Thr Leu Ser Thr Ser
740 745 750
Ala Glu Thr Thr Asp Ser Pro Asn Ile His Pro Thr Gly Thr Leu Thr
755 760 765
Ser Glu Ser Ser Glu Ser Pro Ser Thr Leu Ser Leu Pro Ser Val Ser
770 775 780
Gly Val Lys Thr Thr Phe Ser Ser Ser Thr Pro Ser Thr His Leu Phe
785 790 795 800
Thr Ser Gly Glu Glu Thr Glu Glu Thr Ser Asn Pro Ser Val Ser Gln
805 810 815
Pro Glu Thr Ser Val Ser Arg Val Arg Thr Thr Leu Ala Ser Thr Ser
820 825 830
Val Pro Thr Pro Val Phe Pro Thr Met Asp Thr Trp Pro Thr Arg Ser
835 840 845
Ala Gln Phe Ser Ser Ser His Leu Val Ser Glu Leu Arg Ala Thr Ser
850 855 860
Ser Thr Ser Val Thr Asn Ser Thr Gly Ser Ala Leu Pro Lys Ile Ser
865 870 875 880
His Leu Thr Gly Thr Ala Thr Met Ser Gln Thr Asn Arg Asp Thr Phe
885 890 895
Asn Asp Ser Ala Ala Pro Gln Ser Thr Thr Trp Pro Glu Thr Ser Pro
900 905 910
Arg Phe Lys Thr Gly Leu Pro Ser Ala Thr Thr Thr Val Ser Thr Ser
915 920 925
Ala Thr Ser Leu Ser Ala Thr Val Met Val Ser Lys Phe Thr Ser Pro
930 935 940
Ala Thr Ser Ser Met Glu Ala Thr Ser Ile Arg Glu Pro Ser Thr Thr
945 950 955 960
Ile Leu Thr Thr Glu Thr Thr Asn Gly Pro Gly Ser Met Ala Val Ala
965 970 975
Ser Thr Asn Ile Pro Ile Gly Lys Gly Tyr Ile Thr Glu Gly Arg Leu
980 985 990
Asp Thr Ser His Leu Pro Ile Gly Thr Thr Ala Ser Ser Glu Thr Ser
995 1000 1005
Met Asp Phe Thr Met Ala Lys Glu Ser Val Ser Met Ser Val Ser
1010 1015 1020
Pro Ser Gln Ser Met Asp Ala Ala Gly Ser Ser Thr Pro Gly Arg
1025 1030 1035
Thr Ser Gln Phe Val Asp Thr Phe Ser Asp Asp Val Tyr His Leu
1040 1045 1050
Thr Ser Arg Glu Ile Thr Ile Pro Arg Asp Gly Thr Ser Ser Ala
1055 1060 1065
Leu Thr Pro Gln Met Thr Ala Thr His Pro Pro Ser Pro Asp Pro
1070 1075 1080
Gly Ser Ala Arg Ser Thr Trp Leu Gly Ile Leu Ser Ser Ser Pro
1085 1090 1095
Ser Ser Pro Thr Pro Lys Val Thr Met Ser Ser Thr Phe Ser Thr
1100 1105 1110
Gln Arg Val Thr Thr Ser Met Ile Met Asp Thr Val Glu Thr Ser
1115 1120 1125
Arg Trp Asn Met Pro Asn Leu Pro Ser Thr Thr Ser Leu Thr Pro
1130 1135 1140
Ser Asn Ile Pro Thr Ser Gly Ala Ile Gly Lys Ser Thr Leu Val
1145 1150 1155
Pro Leu Asp Thr Pro Ser Pro Ala Thr Ser Leu Glu Ala Ser Glu
1160 1165 1170
Gly Gly Leu Pro Thr Leu Ser Thr Tyr Pro Glu Ser Thr Asn Thr
1175 1180 1185
Pro Ser Ile His Leu Gly Ala His Ala Ser Ser Glu Ser Pro Ser
1190 1195 1200
Thr Ile Lys Leu Thr Met Ala Ser Val Val Lys Pro Gly Ser Tyr
1205 1210 1215
Thr Pro Leu Thr Phe Pro Ser Ile Glu Thr His Ile His Val Ser
1220 1225 1230
Thr Ala Arg Met Ala Tyr Ser Ser Gly Ser Ser Pro Glu Met Thr
1235 1240 1245
Ala Pro Gly Glu Thr Asn Thr Gly Ser Thr Trp Asp Pro Thr Thr
1250 1255 1260
Tyr Ile Thr Thr Thr Asp Pro Lys Asp Thr Ser Ser Ala Gln Val
1265 1270 1275
Ser Thr Pro His Ser Val Arg Thr Leu Arg Thr Thr Glu Asn His
1280 1285 1290
Pro Lys Thr Glu Ser Ala Thr Pro Ala Ala Tyr Ser Gly Ser Pro
1295 1300 1305
Lys Ile Ser Ser Ser Pro Asn Leu Thr Ser Pro Ala Thr Lys Ala
1310 1315 1320
Trp Thr Ile Thr Asp Thr Thr Glu His Ser Thr Gln Leu His Tyr
1325 1330 1335
Thr Lys Leu Ala Glu Lys Ser Ser Gly Phe Glu Thr Gln Ser Ala
1340 1345 1350
Pro Gly Pro Val Ser Val Val Ile Pro Thr Ser Pro Thr Ile Gly
1355 1360 1365
Ser Ser Thr Leu Glu Leu Thr Ser Asp Val Pro Gly Glu Pro Leu
1370 1375 1380
Val Leu Ala Pro Ser Glu Gln Thr Thr Ile Thr Leu Pro Met Ala
1385 1390 1395
Thr Trp Leu Ser Thr Ser Leu Thr Glu Glu Met Ala Ser Thr Asp
1400 1405 1410
Leu Asp Ile Ser Ser Pro Ser Ser Pro Met Ser Thr Phe Ala Ile
1415 1420 1425
Phe Pro Pro Met Ser Thr Pro Ser His Glu Leu Ser Lys Ser Glu
1430 1435 1440
Ala Asp Thr Ser Ala Ile Arg Asn Thr Asp Ser Thr Thr Leu Asp
1445 1450 1455
Gln His Leu Gly Ile Arg Ser Leu Gly Arg Thr Gly Asp Leu Thr
1460 1465 1470
Thr Val Pro Ile Thr Pro Leu Thr Thr Thr Trp Thr Ser Val Ile
1475 1480 1485
Glu His Ser Thr Gln Ala Gln Asp Thr Leu Ser Ala Thr Met Ser
1490 1495 1500
Pro Thr His Val Thr Gln Ser Leu Lys Asp Gln Thr Ser Ile Pro
1505 1510 1515
Ala Ser Ala Ser Pro Ser His Leu Thr Glu Val Tyr Pro Glu Leu
1520 1525 1530
Gly Thr Gln Gly Arg Ser Ser Ser Glu Ala Thr Thr Phe Trp Lys
1535 1540 1545
Pro Ser Thr Asp Thr Leu Ser Arg Glu Ile Glu Thr Gly Pro Thr
1550 1555 1560
Asn Ile Gln Ser Thr Pro Pro Met Asp Asn Thr Thr Thr Gly Ser
1565 1570 1575
Ser Ser Ser Gly Val Thr Leu Gly Ile Ala His Leu Pro Ile Gly
1580 1585 1590
Thr Ser Ser Pro Ala Glu Thr Ser Thr Asn Met Ala Leu Glu Arg
1595 1600 1605
Arg Ser Ser Thr Ala Thr Val Ser Met Ala Gly Thr Met Gly Leu
1610 1615 1620
Leu Val Thr Ser Ala Pro Gly Arg Ser Ile Ser Gln Ser Leu Gly
1625 1630 1635
Arg Val Ser Ser Val Leu Ser Glu Ser Thr Thr Glu Gly Val Thr
1640 1645 1650
Asp Ser Ser Lys Gly Ser Ser Pro Arg Leu Asn Thr Gln Gly Asn
1655 1660 1665
Thr Ala Leu Ser Ser Ser Leu Glu Pro Ser Tyr Ala Glu Gly Ser
1670 1675 1680
Gln Met Ser Thr Ser Ile Pro Leu Thr Ser Ser Pro Thr Thr Pro
1685 1690 1695
Asp Val Glu Phe Ile Gly Gly Ser Thr Phe Trp Thr Lys Glu Val
1700 1705 1710
Thr Thr Val Met Thr Ser Asp Ile Ser Lys Ser Ser Ala Arg Thr
1715 1720 1725
Glu Ser Ser Ser Ala Thr Leu Met Ser Thr Ala Leu Gly Ser Thr
1730 1735 1740
Glu Asn Thr Gly Lys Glu Lys Leu Arg Thr Ala Ser Met Asp Leu
1745 1750 1755
Pro Ser Pro Thr Pro Ser Met Glu Val Thr Pro Trp Ile Ser Leu
1760 1765 1770
Thr Leu Ser Asn Ala Pro Asn Thr Thr Asp Ser Leu Asp Leu Ser
1775 1780 1785
His Gly Val His Thr Ser Ser Ala Gly Thr Leu Ala Thr Asp Arg
1790 1795 1800
Ser Leu Asn Thr Gly Val Thr Arg Ala Ser Arg Leu Glu Asn Gly
1805 1810 1815
Ser Asp Thr Ser Ser Lys Ser Leu Ser Met Gly Asn Ser Thr His
1820 1825 1830
Thr Ser Met Thr Tyr Thr Glu Lys Ser Glu Val Ser Ser Ser Ile
1835 1840 1845
His Pro Arg Pro Glu Thr Ser Ala Pro Gly Ala Glu Thr Thr Leu
1850 1855 1860
Thr Ser Thr Pro Gly Asn Arg Ala Ile Ser Leu Thr Leu Pro Phe
1865 1870 1875
Ser Ser Ile Pro Val Glu Glu Val Ile Ser Thr Gly Ile Thr Ser
1880 1885 1890
Gly Pro Asp Ile Asn Ser Ala Pro Met Thr His Ser Pro Ile Thr
1895 1900 1905
Pro Pro Thr Ile Val Trp Thr Ser Thr Gly Thr Ile Glu Gln Ser
1910 1915 1920
Thr Gln Pro Leu His Ala Val Ser Ser Glu Lys Val Ser Val Gln
1925 1930 1935
Thr Gln Ser Thr Pro Tyr Val Asn Ser Val Ala Val Ser Ala Ser
1940 1945 1950
Pro Thr His Glu Asn Ser Val Ser Ser Gly Ser Ser Thr Ser Ser
1955 1960 1965
Pro Tyr Ser Ser Ala Ser Leu Glu Ser Leu Asp Ser Thr Ile Ser
1970 1975 1980
Arg Arg Asn Ala Ile Thr Ser Trp Leu Trp Asp Leu Thr Thr Ser
1985 1990 1995
Leu Pro Thr Thr Thr Trp Pro Ser Thr Ser Leu Ser Glu Ala Leu
2000 2005 2010
Ser Ser Gly His Ser Gly Val Ser Asn Pro Ser Ser Thr Thr Thr
2015 2020 2025
Glu Phe Pro Leu Phe Ser Ala Ala Ser Thr Ser Ala Ala Lys Gln
2030 2035 2040
Arg Asn Pro Glu Thr Glu Thr His Gly Pro Gln Asn Thr Ala Ala
2045 2050 2055
Ser Thr Leu Asn Thr Asp Ala Ser Ser Val Thr Gly Leu Ser Glu
2060 2065 2070
Thr Pro Val Gly Ala Ser Ile Ser Ser Glu Val Pro Leu Pro Met
2075 2080 2085
Ala Ile Thr Ser Arg Ser Asp Val Ser Gly Leu Thr Ser Glu Ser
2090 2095 2100
Thr Ala Asn Pro Ser Leu Gly Thr Ala Ser Ser Ala Gly Thr Lys
2105 2110 2115
Leu Thr Arg Thr Ile Ser Leu Pro Thr Ser Glu Ser Leu Val Ser
2120 2125 2130
Phe Arg Met Asn Lys Asp Pro Trp Thr Val Ser Ile Pro Leu Gly
2135 2140 2145
Ser His Pro Thr Thr Asn Thr Glu Thr Ser Ile Pro Val Asn Ser
2150 2155 2160
Ala Gly Pro Pro Gly Leu Ser Thr Val Ala Ser Asp Val Ile Asp
2165 2170 2175
Thr Pro Ser Asp Gly Ala Glu Ser Ile Pro Thr Val Ser Phe Ser
2180 2185 2190
Pro Ser Pro Asp Thr Glu Val Thr Thr Ile Ser His Phe Pro Glu
2195 2200 2205
Lys Thr Thr His Ser Phe Arg Thr Ile Ser Ser Leu Thr His Glu
2210 2215 2220
Leu Thr Ser Arg Val Thr Pro Ile Pro Gly Asp Trp Met Ser Ser
2225 2230 2235
Ala Met Ser Thr Lys Pro Thr Gly Ala Ser Pro Ser Ile Thr Leu
2240 2245 2250
Gly Glu Arg Arg Thr Ile Thr Ser Ala Ala Pro Thr Thr Ser Pro
2255 2260 2265
Ile Val Leu Thr Ala Ser Phe Thr Glu Thr Ser Thr Val Ser Leu
2270 2275 2280
Asp Asn Glu Thr Thr Val Lys Thr Ser Asp Ile Leu Asp Ala Arg
2285 2290 2295
Lys Thr Asn Glu Leu Pro Ser Asp Ser Ser Ser Ser Ser Asp Leu
2300 2305 2310
Ile Asn Thr Ser Ile Ala Ser Ser Thr Met Asp Val Thr Lys Thr
2315 2320 2325
Ala Ser Ile Ser Pro Thr Ser Ile Ser Gly Met Thr Ala Ser Ser
2330 2335 2340
Ser Pro Ser Leu Phe Ser Ser Asp Arg Pro Gln Val Pro Thr Ser
2345 2350 2355
Thr Thr Glu Thr Asn Thr Ala Thr Ser Pro Ser Val Ser Ser Asn
2360 2365 2370
Thr Tyr Ser Leu Asp Gly Gly Ser Asn Val Gly Gly Thr Pro Ser
2375 2380 2385
Thr Leu Pro Pro Phe Thr Ile Thr His Pro Val Glu Thr Ser Ser
2390 2395 2400
Ala Leu Leu Ala Trp Ser Arg Pro Val Arg Thr Phe Ser Thr Met
2405 2410 2415
Val Ser Thr Asp Thr Ala Ser Gly Glu Asn Pro Thr Ser Ser Asn
2420 2425 2430
Ser Val Val Thr Ser Val Pro Ala Pro Gly Thr Trp Thr Ser Val
2435 2440 2445
Gly Ser Thr Thr Asp Leu Pro Ala Met Gly Phe Leu Lys Thr Ser
2450 2455 2460
Pro Ala Gly Glu Ala His Ser Leu Leu Ala Ser Thr Ile Glu Pro
2465 2470 2475
Ala Thr Ala Phe Thr Pro His Leu Ser Ala Ala Val Val Thr Gly
2480 2485 2490
Ser Ser Ala Thr Ser Glu Ala Ser Leu Leu Thr Thr Ser Glu Ser
2495 2500 2505
Lys Ala Ile His Ser Ser Pro Gln Thr Pro Thr Thr Pro Thr Ser
2510 2515 2520
Gly Ala Asn Trp Glu Thr Ser Ala Thr Pro Glu Ser Leu Leu Val
2525 2530 2535
Val Thr Glu Thr Ser Asp Thr Thr Leu Thr Ser Lys Ile Leu Val
2540 2545 2550
Thr Asp Thr Ile Leu Phe Ser Thr Val Ser Thr Pro Pro Ser Lys
2555 2560 2565
Phe Pro Ser Thr Gly Thr Leu Ser Gly Ala Ser Phe Pro Thr Leu
2570 2575 2580
Leu Pro Asp Thr Pro Ala Ile Pro Leu Thr Ala Thr Glu Pro Thr
2585 2590 2595
Ser Ser Leu Ala Thr Ser Phe Asp Ser Thr Pro Leu Val Thr Ile
2600 2605 2610
Ala Ser Asp Ser Leu Gly Thr Val Pro Glu Thr Thr Leu Thr Met
2615 2620 2625
Ser Glu Thr Ser Asn Gly Asp Ala Leu Val Leu Lys Thr Val Ser
2630 2635 2640
Asn Pro Asp Arg Ser Ile Pro Gly Ile Thr Ile Gln Gly Val Thr
2645 2650 2655
Glu Ser Pro Leu His Pro Ser Ser Thr Ser Pro Ser Lys Ile Val
2660 2665 2670
Ala Pro Arg Asn Thr Thr Tyr Glu Gly Ser Ile Thr Val Ala Leu
2675 2680 2685
Ser Thr Leu Pro Ala Gly Thr Thr Gly Ser Leu Val Phe Ser Gln
2690 2695 2700
Ser Ser Glu Asn Ser Glu Thr Thr Ala Leu Val Asp Ser Ser Ala
2705 2710 2715
Gly Leu Glu Arg Ala Ser Val Met Pro Leu Thr Thr Gly Ser Gln
2720 2725 2730
Gly Met Ala Ser Ser Gly Gly Ile Arg Ser Gly Ser Thr His Ser
2735 2740 2745
Thr Gly Thr Lys Thr Phe Ser Ser Leu Pro Leu Thr Met Asn Pro
2750 2755 2760
Gly Glu Val Thr Ala Met Ser Glu Ile Thr Thr Asn Arg Leu Thr
2765 2770 2775
Ala Thr Gln Ser Thr Ala Pro Lys Gly Ile Pro Val Lys Pro Thr
2780 2785 2790
Ser Ala Glu Ser Gly Leu Leu Thr Pro Val Ser Ala Ser Ser Ser
2795 2800 2805
Pro Ser Lys Ala Phe Ala Ser Leu Thr Thr Ala Pro Pro Thr Trp
2810 2815 2820
Gly Ile Pro Gln Ser Thr Leu Thr Phe Glu Phe Ser Glu Val Pro
2825 2830 2835
Ser Leu Asp Thr Lys Ser Ala Ser Leu Pro Thr Pro Gly Gln Ser
2840 2845 2850
Leu Asn Thr Ile Pro Asp Ser Asp Ala Ser Thr Ala Ser Ser Ser
2855 2860 2865
Leu Ser Lys Ser Pro Glu Lys Asn Pro Arg Ala Arg Met Met Thr
2870 2875 2880
Ser Thr Lys Ala Ile Ser Ala Ser Ser Phe Gln Ser Thr Gly Phe
2885 2890 2895
Thr Glu Thr Pro Glu Gly Ser Ala Ser Pro Ser Met Ala Gly His
2900 2905 2910
Glu Pro Arg Val Pro Thr Ser Gly Thr Gly Asp Pro Arg Tyr Ala
2915 2920 2925
Ser Glu Ser Met Ser Tyr Pro Asp Pro Ser Lys Ala Ser Ser Ala
2930 2935 2940
Met Thr Ser Thr Ser Leu Ala Ser Lys Leu Thr Thr Leu Phe Ser
2945 2950 2955
Thr Gly Gln Ala Ala Arg Ser Gly Ser Ser Ser Ser Pro Ile Ser
2960 2965 2970
Leu Ser Thr Glu Lys Glu Thr Ser Phe Leu Ser Pro Thr Ala Ser
2975 2980 2985
Thr Ser Arg Lys Thr Ser Leu Phe Leu Gly Pro Ser Met Ala Arg
2990 2995 3000
Gln Pro Asn Ile Leu Val His Leu Gln Thr Ser Ala Leu Thr Leu
3005 3010 3015
Ser Pro Thr Ser Thr Leu Asn Met Ser Gln Glu Glu Pro Pro Glu
3020 3025 3030
Leu Thr Ser Ser Gln Thr Ile Ala Glu Glu Glu Gly Thr Thr Ala
3035 3040 3045
Glu Thr Gln Thr Leu Thr Phe Thr Pro Ser Glu Thr Pro Thr Ser
3050 3055 3060
Leu Leu Pro Val Ser Ser Pro Thr Glu Pro Thr Ala Arg Arg Lys
3065 3070 3075
Ser Ser Pro Glu Thr Trp Ala Ser Ser Ile Ser Val Pro Ala Lys
3080 3085 3090
Thr Ser Leu Val Glu Thr Thr Asp Gly Thr Leu Val Thr Thr Ile
3095 3100 3105
Lys Met Ser Ser Gln Ala Ala Gln Gly Asn Ser Thr Trp Pro Ala
3110 3115 3120
Pro Ala Glu Glu Thr Gly Ser Ser Pro Ala Gly Thr Ser Pro Gly
3125 3130 3135
Ser Pro Glu Met Ser Thr Thr Leu Lys Ile Met Ser Ser Lys Glu
3140 3145 3150
Pro Ser Ile Ser Pro Glu Ile Arg Ser Thr Val Arg Asn Ser Pro
3155 3160 3165
Trp Lys Thr Pro Glu Thr Thr Val Pro Met Glu Thr Thr Val Glu
3170 3175 3180
Pro Val Thr Leu Gln Ser Thr Ala Leu Gly Ser Gly Ser Thr Ser
3185 3190 3195
Ile Ser His Leu Pro Thr Gly Thr Thr Ser Pro Thr Lys Ser Pro
3200 3205 3210
Thr Glu Asn Met Leu Ala Thr Glu Arg Val Ser Leu Ser Pro Ser
3215 3220 3225
Pro Pro Glu Ala Trp Thr Asn Leu Tyr Ser Gly Thr Pro Gly Gly
3230 3235 3240
Thr Arg Gln Ser Leu Ala Thr Met Ser Ser Val Ser Leu Glu Ser
3245 3250 3255
Pro Thr Ala Arg Ser Ile Thr Gly Thr Gly Gln Gln Ser Ser Pro
3260 3265 3270
Glu Leu Val Ser Lys Thr Thr Gly Met Glu Phe Ser Met Trp His
3275 3280 3285
Gly Ser Thr Gly Gly Thr Thr Gly Asp Thr His Val Ser Leu Ser
3290 3295 3300
Thr Ser Ser Asn Ile Leu Glu Asp Pro Val Thr Ser Pro Asn Ser
3305 3310 3315
Val Ser Ser Leu Thr Asp Lys Ser Lys His Lys Thr Glu Thr Trp
3320 3325 3330
Val Ser Thr Thr Ala Ile Pro Ser Thr Val Leu Asn Asn Lys Ile
3335 3340 3345
Met Ala Ala Glu Gln Gln Thr Ser Arg Ser Val Asp Glu Ala Tyr
3350 3355 3360
Ser Ser Thr Ser Ser Trp Ser Asp Gln Thr Ser Gly Ser Asp Ile
3365 3370 3375
Thr Leu Gly Ala Ser Pro Asp Val Thr Asn Thr Leu Tyr Ile Thr
3380 3385 3390
Ser Thr Ala Gln Thr Thr Ser Leu Val Ser Leu Pro Ser Gly Asp
3395 3400 3405
Gln Gly Ile Thr Ser Leu Thr Asn Pro Ser Gly Gly Lys Thr Ser
3410 3415 3420
Ser Ala Ser Ser Val Thr Ser Pro Ser Ile Gly Leu Glu Thr Leu
3425 3430 3435
Arg Ala Asn Val Ser Ala Val Lys Ser Asp Ile Ala Pro Thr Ala
3440 3445 3450
Gly His Leu Ser Gln Thr Ser Ser Pro Ala Glu Val Ser Ile Leu
3455 3460 3465
Asp Val Thr Thr Ala Pro Thr Pro Gly Ile Ser Thr Thr Ile Thr
3470 3475 3480
Thr Met Gly Thr Asn Ser Ile Ser Thr Thr Thr Pro Asn Pro Glu
3485 3490 3495
Val Gly Met Ser Thr Met Asp Ser Thr Pro Ala Thr Glu Arg Arg
3500 3505 3510
Thr Thr Ser Thr Glu His Pro Ser Thr Trp Ser Ser Thr Ala Ala
3515 3520 3525
Ser Asp Ser Trp Thr Val Thr Asp Met Thr Ser Asn Leu Lys Val
3530 3535 3540
Ala Arg Ser Pro Gly Thr Ile Ser Thr Met His Thr Thr Ser Phe
3545 3550 3555
Leu Ala Ser Ser Thr Glu Leu Asp Ser Met Ser Thr Pro His Gly
3560 3565 3570
Arg Ile Thr Val Ile Gly Thr Ser Leu Val Thr Pro Ser Ser Asp
3575 3580 3585
Ala Ser Ala Val Lys Thr Glu Thr Ser Thr Ser Glu Arg Thr Leu
3590 3595 3600
Ser Pro Ser Asp Thr Thr Ala Ser Thr Pro Ile Ser Thr Phe Ser
3605 3610 3615
Arg Val Gln Arg Met Ser Ile Ser Val Pro Asp Ile Leu Ser Thr
3620 3625 3630
Ser Trp Thr Pro Ser Ser Thr Glu Ala Glu Asp Val Pro Val Ser
3635 3640 3645
Met Val Ser Thr Asp His Ala Ser Thr Lys Thr Asp Pro Asn Thr
3650 3655 3660
Pro Leu Ser Thr Phe Leu Phe Asp Ser Leu Ser Thr Leu Asp Trp
3665 3670 3675
Asp Thr Gly Arg Ser Leu Ser Ser Ala Thr Ala Thr Thr Ser Ala
3680 3685 3690
Pro Gln Gly Ala Thr Thr Pro Gln Glu Leu Thr Leu Glu Thr Met
3695 3700 3705
Ile Ser Pro Ala Thr Ser Gln Leu Pro Phe Ser Ile Gly His Ile
3710 3715 3720
Thr Ser Ala Val Thr Pro Ala Ala Met Ala Arg Ser Ser Gly Val
3725 3730 3735
Thr Phe Ser Arg Pro Asp Pro Thr Ser Lys Lys Ala Glu Gln Thr
3740 3745 3750
Ser Thr Gln Leu Pro Thr Thr Thr Ser Ala His Pro Gly Gln Val
3755 3760 3765
Pro Arg Ser Ala Ala Thr Thr Leu Asp Val Ile Pro His Thr Ala
3770 3775 3780
Lys Thr Pro Asp Ala Thr Phe Gln Arg Gln Gly Gln Thr Ala Leu
3785 3790 3795
Thr Thr Glu Ala Arg Ala Thr Ser Asp Ser Trp Asn Glu Lys Glu
3800 3805 3810
Lys Ser Thr Pro Ser Ala Pro Trp Ile Thr Glu Met Met Asn Ser
3815 3820 3825
Val Ser Glu Asp Thr Ile Lys Glu Val Thr Ser Ser Ser Ser Val
3830 3835 3840
Leu Arg Thr Leu Asn Thr Leu Asp Ile Asn Leu Glu Ser Gly Thr
3845 3850 3855
Thr Ser Ser Pro Ser Trp Lys Ser Ser Pro Tyr Glu Arg Ile Ala
3860 3865 3870
Pro Ser Glu Ser Thr Thr Asp Lys Glu Ala Ile His Pro Ser Thr
3875 3880 3885
Asn Thr Val Glu Thr Thr Gly Trp Val Thr Ser Ser Glu His Ala
3890 3895 3900
Ser His Ser Thr Ile Pro Ala His Ser Ala Ser Ser Lys Leu Thr
3905 3910 3915
Ser Pro Val Val Thr Thr Ser Thr Arg Glu Gln Ala Ile Val Ser
3920 3925 3930
Met Ser Thr Thr Thr Trp Pro Glu Ser Thr Arg Ala Arg Thr Glu
3935 3940 3945
Pro Asn Ser Phe Leu Thr Ile Glu Leu Arg Asp Val Ser Pro Tyr
3950 3955 3960
Met Asp Thr Ser Ser Thr Thr Gln Thr Ser Ile Ile Ser Ser Pro
3965 3970 3975
Gly Ser Thr Ala Ile Thr Lys Gly Pro Arg Thr Glu Ile Thr Ser
3980 3985 3990
Ser Lys Arg Ile Ser Ser Ser Phe Leu Ala Gln Ser Met Arg Ser
3995 4000 4005
Ser Asp Ser Pro Ser Glu Ala Ile Thr Arg Leu Ser Asn Phe Pro
4010 4015 4020
Ala Met Thr Glu Ser Gly Gly Met Ile Leu Ala Met Gln Thr Ser
4025 4030 4035
Pro Pro Gly Ala Thr Ser Leu Ser Ala Pro Thr Leu Asp Thr Ser
4040 4045 4050
Ala Thr Ala Ser Trp Thr Gly Thr Pro Leu Ala Thr Thr Gln Arg
4055 4060 4065
Phe Thr Tyr Ser Glu Lys Thr Thr Leu Phe Ser Lys Gly Pro Glu
4070 4075 4080
Asp Thr Ser Gln Pro Ser Pro Pro Ser Val Glu Glu Thr Ser Ser
4085 4090 4095
Ser Ser Ser Leu Val Pro Ile His Ala Thr Thr Ser Pro Ser Asn
4100 4105 4110
Ile Leu Leu Thr Ser Gln Gly His Ser Pro Ser Ser Thr Pro Pro
4115 4120 4125
Val Thr Ser Val Phe Leu Ser Glu Thr Ser Gly Leu Gly Lys Thr
4130 4135 4140
Thr Asp Met Ser Arg Ile Ser Leu Glu Pro Gly Thr Ser Leu Pro
4145 4150 4155
Pro Asn Leu Ser Ser Thr Ala Gly Glu Ala Leu Ser Thr Tyr Glu
4160 4165 4170
Ala Ser Arg Asp Thr Lys Ala Ile His His Ser Ala Asp Thr Ala
4175 4180 4185
Val Thr Asn Met Glu Ala Thr Ser Ser Glu Tyr Ser Pro Ile Pro
4190 4195 4200
Gly His Thr Lys Pro Ser Lys Ala Thr Ser Pro Leu Val Thr Ser
4205 4210 4215
His Ile Met Gly Asp Ile Thr Ser Ser Thr Ser Val Phe Gly Ser
4220 4225 4230
Ser Glu Thr Thr Glu Ile Glu Thr Val Ser Ser Val Asn Gln Gly
4235 4240 4245
Leu Gln Glu Arg Ser Thr Ser Gln Val Ala Ser Ser Ala Thr Glu
4250 4255 4260
Thr Ser Thr Val Ile Thr His Val Ser Ser Gly Asp Ala Thr Thr
4265 4270 4275
His Val Thr Lys Thr Gln Ala Thr Phe Ser Ser Gly Thr Ser Ile
4280 4285 4290
Ser Ser Pro His Gln Phe Ile Thr Ser Thr Asn Thr Phe Thr Asp
4295 4300 4305
Val Ser Thr Asn Pro Ser Thr Ser Leu Ile Met Thr Glu Ser Ser
4310 4315 4320
Gly Val Thr Ile Thr Thr Gln Thr Gly Pro Thr Gly Ala Ala Thr
4325 4330 4335
Gln Gly Pro Tyr Leu Leu Asp Thr Ser Thr Met Pro Tyr Leu Thr
4340 4345 4350
Glu Thr Pro Leu Ala Val Thr Pro Asp Phe Met Gln Ser Glu Lys
4355 4360 4365
Thr Thr Leu Ile Ser Lys Gly Pro Lys Asp Val Ser Trp Thr Ser
4370 4375 4380
Pro Pro Ser Val Ala Glu Thr Ser Tyr Pro Ser Ser Leu Thr Pro
4385 4390 4395
Phe Leu Val Thr Thr Ile Pro Pro Ala Thr Ser Thr Leu Gln Gly
4400 4405 4410
Gln His Thr Ser Ser Pro Val Ser Ala Thr Ser Val Leu Thr Ser
4415 4420 4425
Gly Leu Val Lys Thr Thr Asp Met Leu Asn Thr Ser Met Glu Pro
4430 4435 4440
Val Thr Asn Ser Pro Gln Asn Leu Asn Asn Pro Ser Asn Glu Ile
4445 4450 4455
Leu Ala Thr Leu Ala Ala Thr Thr Asp Ile Glu Thr Ile His Pro
4460 4465 4470
Ser Ile Asn Lys Ala Val Thr Asn Met Gly Thr Ala Ser Ser Ala
4475 4480 4485
His Val Leu His Ser Thr Leu Pro Val Ser Ser Glu Pro Ser Thr
4490 4495 4500
Ala Thr Ser Pro Met Val Pro Ala Ser Ser Met Gly Asp Ala Leu
4505 4510 4515
Ala Ser Ile Ser Ile Pro Gly Ser Glu Thr Thr Asp Ile Glu Gly
4520 4525 4530
Glu Pro Thr Ser Ser Leu Thr Ala Gly Arg Lys Glu Asn Ser Thr
4535 4540 4545
Leu Gln Glu Met Asn Ser Thr Thr Glu Ser Asn Ile Ile Leu Ser
4550 4555 4560
Asn Val Ser Val Gly Ala Ile Thr Glu Ala Thr Lys Met Glu Val
4565 4570 4575
Pro Ser Phe Asp Ala Thr Phe Ile Pro Thr Pro Ala Gln Ser Thr
4580 4585 4590
Lys Phe Pro Asp Ile Phe Ser Val Ala Ser Ser Arg Leu Ser Asn
4595 4600 4605
Ser Pro Pro Met Thr Ile Ser Thr His Met Thr Thr Thr Gln Thr
4610 4615 4620
Gly Ser Ser Gly Ala Thr Ser Lys Ile Pro Leu Ala Leu Asp Thr
4625 4630 4635
Ser Thr Leu Glu Thr Ser Ala Gly Thr Pro Ser Val Val Thr Glu
4640 4645 4650
Gly Phe Ala His Ser Lys Ile Thr Thr Ala Met Asn Asn Asp Val
4655 4660 4665
Lys Asp Val Ser Gln Thr Asn Pro Pro Phe Gln Asp Glu Ala Ser
4670 4675 4680
Ser Pro Ser Ser Gln Ala Pro Val Leu Val Thr Thr Leu Pro Ser
4685 4690 4695
Ser Val Ala Phe Thr Pro Gln Trp His Ser Thr Ser Ser Pro Val
4700 4705 4710
Ser Met Ser Ser Val Leu Thr Ser Ser Leu Val Lys Thr Ala Gly
4715 4720 4725
Lys Val Asp Thr Ser Leu Glu Thr Val Thr Ser Ser Pro Gln Ser
4730 4735 4740
Met Ser Asn Thr Leu Asp Asp Ile Ser Val Thr Ser Ala Ala Thr
4745 4750 4755
Thr Asp Ile Glu Thr Thr His Pro Ser Ile Asn Thr Val Val Thr
4760 4765 4770
Asn Val Gly Thr Thr Gly Ser Ala Phe Glu Ser His Ser Thr Val
4775 4780 4785
Ser Ala Tyr Pro Glu Pro Ser Lys Val Thr Ser Pro Asn Val Thr
4790 4795 4800
Thr Ser Thr Met Glu Asp Thr Thr Ile Ser Arg Ser Ile Pro Lys
4805 4810 4815
Ser Ser Lys Thr Thr Arg Thr Glu Thr Glu Thr Thr Ser Ser Leu
4820 4825 4830
Thr Pro Lys Leu Arg Glu Thr Ser Ile Ser Gln Glu Ile Thr Ser
4835 4840 4845
Ser Thr Glu Thr Ser Thr Val Pro Tyr Lys Glu Leu Thr Gly Ala
4850 4855 4860
Thr Thr Glu Val Ser Arg Thr Asp Val Thr Ser Ser Ser Ser Thr
4865 4870 4875
Ser Phe Pro Gly Pro Asp Gln Ser Thr Val Ser Leu Asp Ile Ser
4880 4885 4890
Thr Glu Thr Asn Thr Arg Leu Ser Thr Ser Pro Ile Met Thr Glu
4895 4900 4905
Ser Ala Glu Ile Thr Ile Thr Thr Gln Thr Gly Pro His Gly Ala
4910 4915 4920
Thr Ser Gln Asp Thr Phe Thr Met Asp Pro Ser Asn Thr Thr Pro
4925 4930 4935
Gln Ala Gly Ile His Ser Ala Met Thr His Gly Phe Ser Gln Leu
4940 4945 4950
Asp Val Thr Thr Leu Met Ser Arg Ile Pro Gln Asp Val Ser Trp
4955 4960 4965
Thr Ser Pro Pro Ser Val Asp Lys Thr Ser Ser Pro Ser Ser Phe
4970 4975 4980
Leu Ser Ser Pro Ala Met Thr Thr Pro Ser Leu Ile Ser Ser Thr
4985 4990 4995
Leu Pro Glu Asp Lys Leu Ser Ser Pro Met Thr Ser Leu Leu Thr
5000 5005 5010
Ser Gly Leu Val Lys Ile Thr Asp Ile Leu Arg Thr Arg Leu Glu
5015 5020 5025
Pro Val Thr Ser Ser Leu Pro Asn Phe Ser Ser Thr Ser Asp Lys
5030 5035 5040
Ile Leu Ala Thr Ser Lys Asp Ser Lys Asp Thr Lys Glu Ile Phe
5045 5050 5055
Pro Ser Ile Asn Thr Glu Glu Thr Asn Val Lys Ala Asn Asn Ser
5060 5065 5070
Gly His Glu Ser His Ser Pro Ala Leu Ala Asp Ser Glu Thr Pro
5075 5080 5085
Lys Ala Thr Thr Gln Met Val Ile Thr Thr Thr Val Gly Asp Pro
5090 5095 5100
Ala Pro Ser Thr Ser Met Pro Val His Gly Ser Ser Glu Thr Thr
5105 5110 5115
Asn Ile Lys Arg Glu Pro Thr Tyr Phe Leu Thr Pro Arg Leu Arg
5120 5125 5130
Glu Thr Ser Thr Ser Gln Glu Ser Ser Phe Pro Thr Asp Thr Ser
5135 5140 5145
Phe Leu Leu Ser Lys Val Pro Thr Gly Thr Ile Thr Glu Val Ser
5150 5155 5160
Ser Thr Gly Val Asn Ser Ser Ser Lys Ile Ser Thr Pro Asp His
5165 5170 5175
Asp Lys Ser Thr Val Pro Pro Asp Thr Phe Thr Gly Glu Ile Pro
5180 5185 5190
Arg Val Phe Thr Ser Ser Ile Lys Thr Lys Ser Ala Glu Met Thr
5195 5200 5205
Ile Thr Thr Gln Ala Ser Pro Pro Glu Ser Ala Ser His Ser Thr
5210 5215 5220
Leu Pro Leu Asp Thr Ser Thr Thr Leu Ser Gln Gly Gly Thr His
5225 5230 5235
Ser Thr Val Thr Gln Gly Phe Pro Tyr Ser Glu Val Thr Thr Leu
5240 5245 5250
Met Gly Met Gly Pro Gly Asn Val Ser Trp Met Thr Thr Pro Pro
5255 5260 5265
Val Glu Glu Thr Ser Ser Val Ser Ser Leu Met Ser Ser Pro Ala
5270 5275 5280
Met Thr Ser Pro Ser Pro Val Ser Ser Thr Ser Pro Gln Ser Ile
5285 5290 5295
Pro Ser Ser Pro Leu Pro Val Thr Ala Leu Pro Thr Ser Val Leu
5300 5305 5310
Val Thr Thr Thr Asp Val Leu Gly Thr Thr Ser Pro Glu Ser Val
5315 5320 5325
Thr Ser Ser Pro Pro Asn Leu Ser Ser Ile Thr His Glu Arg Pro
5330 5335 5340
Ala Thr Tyr Lys Asp Thr Ala His Thr Glu Ala Ala Met His His
5345 5350 5355
Ser Thr Asn Thr Ala Val Thr Asn Val Gly Thr Ser Gly Ser Gly
5360 5365 5370
His Lys Ser Gln Ser Ser Val Leu Ala Asp Ser Glu Thr Ser Lys
5375 5380 5385
Ala Thr Pro Leu Met Ser Thr Thr Ser Thr Leu Gly Asp Thr Ser
5390 5395 5400
Val Ser Thr Ser Thr Pro Asn Ile Ser Gln Thr Asn Gln Ile Gln
5405 5410 5415
Thr Glu Pro Thr Ala Ser Leu Ser Pro Arg Leu Arg Glu Ser Ser
5420 5425 5430
Thr Ser Glu Lys Thr Ser Ser Thr Thr Glu Thr Asn Thr Ala Phe
5435 5440 5445
Ser Tyr Val Pro Thr Gly Ala Ile Thr Gln Ala Ser Arg Thr Glu
5450 5455 5460
Ile Ser Ser Ser Arg Thr Ser Ile Ser Asp Leu Asp Arg Pro Thr
5465 5470 5475
Ile Ala Pro Asp Ile Ser Thr Gly Met Ile Thr Arg Leu Phe Thr
5480 5485 5490
Ser Pro Ile Met Thr Lys Ser Ala Glu Met Thr Val Thr Thr Gln
5495 5500 5505
Thr Thr Thr Pro Gly Ala Thr Ser Gln Gly Ile Leu Pro Trp Asp
5510 5515 5520
Thr Ser Thr Thr Leu Phe Gln Gly Gly Thr His Ser Thr Val Ser
5525 5530 5535
Gln Gly Phe Pro His Ser Glu Ile Thr Thr Leu Arg Ser Arg Thr
5540 5545 5550
Pro Gly Asp Val Ser Trp Met Thr Thr Pro Pro Val Glu Glu Thr
5555 5560 5565
Ser Ser Gly Phe Ser Leu Met Ser Pro Ser Met Thr Ser Pro Ser
5570 5575 5580
Pro Val Ser Ser Thr Ser Pro Glu Ser Ile Pro Ser Ser Pro Leu
5585 5590 5595
Pro Val Thr Ala Leu Leu Thr Ser Val Leu Val Thr Thr Thr Asn
5600 5605 5610
Val Leu Gly Thr Thr Ser Pro Glu Pro Val Thr Ser Ser Pro Pro
5615 5620 5625
Asn Leu Ser Ser Pro Thr Gln Glu Arg Leu Thr Thr Tyr Lys Asp
5630 5635 5640
Thr Ala His Thr Glu Ala Met His Ala Ser Met His Thr Asn Thr
5645 5650 5655
Ala Val Ala Asn Val Gly Thr Ser Ile Ser Gly His Glu Ser Gln
5660 5665 5670
Ser Ser Val Pro Ala Asp Ser His Thr Ser Lys Ala Thr Ser Pro
5675 5680 5685
Met Gly Ile Thr Phe Ala Met Gly Asp Thr Ser Val Ser Thr Ser
5690 5695 5700
Thr Pro Ala Phe Phe Glu Thr Arg Ile Gln Thr Glu Ser Thr Ser
5705 5710 5715
Ser Leu Ile Pro Gly Leu Arg Asp Thr Arg Thr Ser Glu Glu Ile
5720 5725 5730
Asn Thr Val Thr Glu Thr Ser Thr Val Leu Ser Glu Val Pro Thr
5735 5740 5745
Thr Thr Thr Thr Glu Val Ser Arg Thr Glu Val Ile Thr Ser Ser
5750 5755 5760
Arg Thr Thr Ile Ser Gly Pro Asp His Ser Lys Met Ser Pro Tyr
5765 5770 5775
Ile Ser Thr Glu Thr Ile Thr Arg Leu Ser Thr Phe Pro Phe Val
5780 5785 5790
Thr Gly Ser Thr Glu Met Ala Ile Thr Asn Gln Thr Gly Pro Ile
5795 5800 5805
Gly Thr Ile Ser Gln Ala Thr Leu Thr Leu Asp Thr Ser Ser Thr
5810 5815 5820
Ala Ser Trp Glu Gly Thr His Ser Pro Val Thr Gln Arg Phe Pro
5825 5830 5835
His Ser Glu Glu Thr Thr Thr Met Ser Arg Ser Thr Lys Gly Val
5840 5845 5850
Ser Trp Gln Ser Pro Pro Ser Val Glu Glu Thr Ser Ser Pro Ser
5855 5860 5865
Ser Pro Val Pro Leu Pro Ala Ile Thr Ser His Ser Ser Leu Tyr
5870 5875 5880
Ser Ala Val Ser Gly Ser Ser Pro Thr Ser Ala Leu Pro Val Thr
5885 5890 5895
Ser Leu Leu Thr Ser Gly Arg Arg Lys Thr Ile Asp Met Leu Asp
5900 5905 5910
Thr His Ser Glu Leu Val Thr Ser Ser Leu Pro Ser Ala Ser Ser
5915 5920 5925
Phe Ser Gly Glu Ile Leu Thr Ser Glu Ala Ser Thr Asn Thr Glu
5930 5935 5940
Thr Ile His Phe Ser Glu Asn Thr Ala Glu Thr Asn Met Gly Thr
5945 5950 5955
Thr Asn Ser Met His Lys Leu His Ser Ser Val Ser Ile His Ser
5960 5965 5970
Gln Pro Ser Gly His Thr Pro Pro Lys Val Thr Gly Ser Met Met
5975 5980 5985
Glu Asp Ala Ile Val Ser Thr Ser Thr Pro Gly Ser Pro Glu Thr
5990 5995 6000
Lys Asn Val Asp Arg Asp Ser Thr Ser Pro Leu Thr Pro Glu Leu
6005 6010 6015
Lys Glu Asp Ser Thr Ala Leu Val Met Asn Ser Thr Thr Glu Ser
6020 6025 6030
Asn Thr Val Phe Ser Ser Val Ser Leu Asp Ala Ala Thr Glu Val
6035 6040 6045
Ser Arg Ala Glu Val Thr Tyr Tyr Asp Pro Thr Phe Met Pro Ala
6050 6055 6060
Ser Ala Gln Ser Thr Lys Ser Pro Asp Ile Ser Pro Glu Ala Ser
6065 6070 6075
Ser Ser His Ser Asn Ser Pro Pro Leu Thr Ile Ser Thr His Lys
6080 6085 6090
Thr Ile Ala Thr Gln Thr Gly Pro Ser Gly Val Thr Ser Leu Gly
6095 6100 6105
Gln Leu Thr Leu Asp Thr Ser Thr Ile Ala Thr Ser Ala Gly Thr
6110 6115 6120
Pro Ser Ala Arg Thr Gln Asp Phe Val Asp Ser Glu Thr Thr Ser
6125 6130 6135
Val Met Asn Asn Asp Leu Asn Asp Val Leu Lys Thr Ser Pro Phe
6140 6145 6150
Ser Ala Glu Glu Ala Asn Ser Leu Ser Ser Gln Ala Pro Leu Leu
6155 6160 6165
Val Thr Thr Ser Pro Ser Pro Val Thr Ser Thr Leu Gln Glu His
6170 6175 6180
Ser Thr Ser Ser Leu Val Ser Val Thr Ser Val Pro Thr Pro Thr
6185 6190 6195
Leu Ala Lys Ile Thr Asp Met Asp Thr Asn Leu Glu Pro Val Thr
6200 6205 6210
Arg Ser Pro Gln Asn Leu Arg Asn Thr Leu Ala Thr Ser Glu Ala
6215 6220 6225
Thr Thr Asp Thr His Thr Met His Pro Ser Ile Asn Thr Ala Val
6230 6235 6240
Ala Asn Val Gly Thr Thr Ser Ser Pro Asn Glu Phe Tyr Phe Thr
6245 6250 6255
Val Ser Pro Asp Ser Asp Pro Tyr Lys Ala Thr Ser Ala Val Val
6260 6265 6270
Ile Thr Ser Thr Ser Gly Asp Ser Ile Val Ser Thr Ser Met Pro
6275 6280 6285
Arg Ser Ser Ala Met Lys Lys Ile Glu Ser Glu Thr Thr Phe Ser
6290 6295 6300
Leu Ile Phe Arg Leu Arg Glu Thr Ser Thr Ser Gln Lys Ile Gly
6305 6310 6315
Ser Ser Ser Asp Thr Ser Thr Val Phe Asp Lys Ala Phe Thr Ala
6320 6325 6330
Ala Thr Thr Glu Val Ser Arg Thr Glu Leu Thr Ser Ser Ser Arg
6335 6340 6345
Thr Ser Ile Gln Gly Thr Glu Lys Pro Thr Met Ser Pro Asp Thr
6350 6355 6360
Ser Thr Arg Ser Val Thr Met Leu Ser Thr Phe Ala Gly Leu Thr
6365 6370 6375
Lys Ser Glu Glu Arg Thr Ile Ala Thr Gln Thr Gly Pro His Arg
6380 6385 6390
Ala Thr Ser Gln Gly Thr Leu Thr Trp Asp Thr Ser Ile Thr Thr
6395 6400 6405
Ser Gln Ala Gly Thr His Ser Ala Met Thr His Gly Phe Ser Gln
6410 6415 6420
Leu Asp Leu Ser Thr Leu Thr Ser Arg Val Pro Glu Tyr Ile Ser
6425 6430 6435
Gly Thr Ser Pro Pro Ser Val Glu Lys Thr Ser Ser Ser Ser Ser
6440 6445 6450
Leu Leu Ser Leu Pro Ala Ile Thr Ser Pro Ser Pro Val Pro Thr
6455 6460 6465
Thr Leu Pro Glu Ser Arg Pro Ser Ser Pro Val His Leu Thr Ser
6470 6475 6480
Leu Pro Thr Ser Gly Leu Val Lys Thr Thr Asp Met Leu Ala Ser
6485 6490 6495
Val Ala Ser Leu Pro Pro Asn Leu Gly Ser Thr Ser His Lys Ile
6500 6505 6510
Pro Thr Thr Ser Glu Asp Ile Lys Asp Thr Glu Lys Met Tyr Pro
6515 6520 6525
Ser Thr Asn Ile Ala Val Thr Asn Val Gly Thr Thr Thr Ser Glu
6530 6535 6540
Lys Glu Ser Tyr Ser Ser Val Pro Ala Tyr Ser Glu Pro Pro Lys
6545 6550 6555
Val Thr Ser Pro Met Val Thr Ser Phe Asn Ile Arg Asp Thr Ile
6560 6565 6570
Val Ser Thr Ser Met Pro Gly Ser Ser Glu Ile Thr Arg Ile Glu
6575 6580 6585
Met Glu Ser Thr Phe Ser Leu Ala His Gly Leu Lys Gly Thr Ser
6590 6595 6600
Thr Ser Gln Asp Pro Ile Val Ser Thr Glu Lys Ser Ala Val Leu
6605 6610 6615
His Lys Leu Thr Thr Gly Ala Thr Glu Thr Ser Arg Thr Glu Val
6620 6625 6630
Ala Ser Ser Arg Arg Thr Ser Ile Pro Gly Pro Asp His Ser Thr
6635 6640 6645
Glu Ser Pro Asp Ile Ser Thr Glu Val Ile Pro Ser Leu Pro Ile
6650 6655 6660
Ser Leu Gly Ile Thr Glu Ser Ser Asn Met Thr Ile Ile Thr Arg
6665 6670 6675
Thr Gly Pro Pro Leu Gly Ser Thr Ser Gln Gly Thr Phe Thr Leu
6680 6685 6690
Asp Thr Pro Thr Thr Ser Ser Arg Ala Gly Thr His Ser Met Ala
6695 6700 6705
Thr Gln Glu Phe Pro His Ser Glu Met Thr Thr Val Met Asn Lys
6710 6715 6720
Asp Pro Glu Ile Leu Ser Trp Thr Ile Pro Pro Ser Ile Glu Lys
6725 6730 6735
Thr Ser Phe Ser Ser Ser Leu Met Pro Ser Pro Ala Met Thr Ser
6740 6745 6750
Pro Pro Val Ser Ser Thr Leu Pro Lys Thr Ile His Thr Thr Pro
6755 6760 6765
Ser Pro Met Thr Ser Leu Leu Thr Pro Ser Leu Val Met Thr Thr
6770 6775 6780
Asp Thr Leu Gly Thr Ser Pro Glu Pro Thr Thr Ser Ser Pro Pro
6785 6790 6795
Asn Leu Ser Ser Thr Ser His Glu Ile Leu Thr Thr Asp Glu Asp
6800 6805 6810
Thr Thr Ala Ile Glu Ala Met His Pro Ser Thr Ser Thr Ala Ala
6815 6820 6825
Thr Asn Val Glu Thr Thr Ser Ser Gly His Gly Ser Gln Ser Ser
6830 6835 6840
Val Leu Ala Asp Ser Glu Lys Thr Lys Ala Thr Ala Pro Met Asp
6845 6850 6855
Thr Thr Ser Thr Met Gly His Thr Thr Val Ser Thr Ser Met Ser
6860 6865 6870
Val Ser Ser Glu Thr Thr Lys Ile Lys Arg Glu Ser Thr Tyr Ser
6875 6880 6885
Leu Thr Pro Gly Leu Arg Glu Thr Ser Ile Ser Gln Asn Ala Ser
6890 6895 6900
Phe Ser Thr Asp Thr Ser Ile Val Leu Ser Glu Val Pro Thr Gly
6905 6910 6915
Thr Thr Ala Glu Val Ser Arg Thr Glu Val Thr Ser Ser Gly Arg
6920 6925 6930
Thr Ser Ile Pro Gly Pro Ser Gln Ser Thr Val Leu Pro Glu Ile
6935 6940 6945
Ser Thr Arg Thr Met Thr Arg Leu Phe Ala Ser Pro Thr Met Thr
6950 6955 6960
Glu Ser Ala Glu Met Thr Ile Pro Thr Gln Thr Gly Pro Ser Gly
6965 6970 6975
Ser Thr Ser Gln Asp Thr Leu Thr Leu Asp Thr Ser Thr Thr Lys
6980 6985 6990
Ser Gln Ala Lys Thr His Ser Thr Leu Thr Gln Arg Phe Pro His
6995 7000 7005
Ser Glu Met Thr Thr Leu Met Ser Arg Gly Pro Gly Asp Met Ser
7010 7015 7020
Trp Gln Ser Ser Pro Ser Leu Glu Asn Pro Ser Ser Leu Pro Ser
7025 7030 7035
Leu Leu Ser Leu Pro Ala Thr Thr Ser Pro Pro Pro Ile Ser Ser
7040 7045 7050
Thr Leu Pro Val Thr Ile Ser Ser Ser Pro Leu Pro Val Thr Ser
7055 7060 7065
Leu Leu Thr Ser Ser Pro Val Thr Thr Thr Asp Met Leu His Thr
7070 7075 7080
Ser Pro Glu Leu Val Thr Ser Ser Pro Pro Lys Leu Ser His Thr
7085 7090 7095
Ser Asp Glu Arg Leu Thr Thr Gly Lys Asp Thr Thr Asn Thr Glu
7100 7105 7110
Ala Val His Pro Ser Thr Asn Thr Ala Ala Ser Asn Val Glu Ile
7115 7120 7125
Pro Ser Ser Gly His Glu Ser Pro Ser Ser Ala Leu Ala Asp Ser
7130 7135 7140
Glu Thr Ser Lys Ala Thr Ser Pro Met Phe Ile Thr Ser Thr Gln
7145 7150 7155
Glu Asp Thr Thr Val Ala Ile Ser Thr Pro His Phe Leu Glu Thr
7160 7165 7170
Ser Arg Ile Gln Lys Glu Ser Ile Ser Ser Leu Ser Pro Lys Leu
7175 7180 7185
Arg Glu Thr Gly Ser Ser Val Glu Thr Ser Ser Ala Ile Glu Thr
7190 7195 7200
Ser Ala Val Leu Ser Glu Val Ser Ile Gly Ala Thr Thr Glu Ile
7205 7210 7215
Ser Arg Thr Glu Val Thr Ser Ser Ser Arg Thr Ser Ile Ser Gly
7220 7225 7230
Ser Ala Glu Ser Thr Met Leu Pro Glu Ile Ser Thr Thr Arg Lys
7235 7240 7245
Ile Ile Lys Phe Pro Thr Ser Pro Ile Leu Ala Glu Ser Ser Glu
7250 7255 7260
Met Thr Ile Lys Thr Gln Thr Ser Pro Pro Gly Ser Thr Ser Glu
7265 7270 7275
Ser Thr Phe Thr Leu Asp Thr Ser Thr Thr Pro Ser Leu Val Ile
7280 7285 7290
Thr His Ser Thr Met Thr Gln Arg Leu Pro His Ser Glu Ile Thr
7295 7300 7305
Thr Leu Val Ser Arg Gly Ala Gly Asp Val Pro Arg Pro Ser Ser
7310 7315 7320
Leu Pro Val Glu Glu Thr Ser Pro Pro Ser Ser Gln Leu Ser Leu
7325 7330 7335
Ser Ala Met Ile Ser Pro Ser Pro Val Ser Ser Thr Leu Pro Ala
7340 7345 7350
Ser Ser His Ser Ser Ser Ala Ser Val Thr Ser Leu Leu Thr Pro
7355 7360 7365
Gly Gln Val Lys Thr Thr Glu Val Leu Asp Ala Ser Ala Glu Pro
7370 7375 7380
Glu Thr Ser Ser Pro Pro Ser Leu Ser Ser Thr Ser Val Glu Ile
7385 7390 7395
Leu Ala Thr Ser Glu Val Thr Thr Asp Thr Glu Lys Ile His Pro
7400 7405 7410
Phe Ser Asn Thr Ala Val Thr Lys Val Gly Thr Ser Ser Ser Gly
7415 7420 7425
His Glu Ser Pro Ser Ser Val Leu Pro Asp Ser Glu Thr Thr Lys
7430 7435 7440
Ala Thr Ser Ala Met Gly Thr Ile Ser Ile Met Gly Asp Thr Ser
7445 7450 7455
Val Ser Thr Leu Thr Pro Ala Leu Ser Asn Thr Arg Lys Ile Gln
7460 7465 7470
Ser Glu Pro Ala Ser Ser Leu Thr Thr Arg Leu Arg Glu Thr Ser
7475 7480 7485
Thr Ser Glu Glu Thr Ser Leu Ala Thr Glu Ala Asn Thr Val Leu
7490 7495 7500
Ser Lys Val Ser Thr Gly Ala Thr Thr Glu Val Ser Arg Thr Glu
7505 7510 7515
Ala Ile Ser Phe Ser Arg Thr Ser Met Ser Gly Pro Glu Gln Ser
7520 7525 7530
Thr Met Ser Gln Asp Ile Ser Ile Gly Thr Ile Pro Arg Ile Ser
7535 7540 7545
Ala Ser Ser Val Leu Thr Glu Ser Ala Lys Met Thr Ile Thr Thr
7550 7555 7560
Gln Thr Gly Pro Ser Glu Ser Thr Leu Glu Ser Thr Leu Asn Leu
7565 7570 7575
Asn Thr Ala Thr Thr Pro Ser Trp Val Glu Thr His Ser Ile Val
7580 7585 7590
Ile Gln Gly Phe Pro His Pro Glu Met Thr Thr Ser Met Gly Arg
7595 7600 7605
Gly Pro Gly Gly Val Ser Trp Pro Ser Pro Pro Phe Val Lys Glu
7610 7615 7620
Thr Ser Pro Pro Ser Ser Pro Leu Ser Leu Pro Ala Val Thr Ser
7625 7630 7635
Pro His Pro Val Ser Thr Thr Phe Leu Ala His Ile Pro Pro Ser
7640 7645 7650
Pro Leu Pro Val Thr Ser Leu Leu Thr Ser Gly Pro Ala Thr Thr
7655 7660 7665
Thr Asp Ile Leu Gly Thr Ser Thr Glu Pro Gly Thr Ser Ser Ser
7670 7675 7680
Ser Ser Leu Ser Thr Thr Ser His Glu Arg Leu Thr Thr Tyr Lys
7685 7690 7695
Asp Thr Ala His Thr Glu Ala Val His Pro Ser Thr Asn Thr Gly
7700 7705 7710
Gly Thr Asn Val Ala Thr Thr Ser Ser Gly Tyr Lys Ser Gln Ser
7715 7720 7725
Ser Val Leu Ala Asp Ser Ser Pro Met Cys Thr Thr Ser Thr Met
7730 7735 7740
Gly Asp Thr Ser Val Leu Thr Ser Thr Pro Ala Phe Leu Glu Thr
7745 7750 7755
Arg Arg Ile Gln Thr Glu Leu Ala Ser Ser Leu Thr Pro Gly Leu
7760 7765 7770
Arg Glu Ser Ser Gly Ser Glu Gly Thr Ser Ser Gly Thr Lys Met
7775 7780 7785
Ser Thr Val Leu Ser Lys Val Pro Thr Gly Ala Thr Thr Glu Ile
7790 7795 7800
Ser Lys Glu Asp Val Thr Ser Ile Pro Gly Pro Ala Gln Ser Thr
7805 7810 7815
Ile Ser Pro Asp Ile Ser Thr Arg Thr Val Ser Trp Phe Ser Thr
7820 7825 7830
Ser Pro Val Met Thr Glu Ser Ala Glu Ile Thr Met Asn Thr His
7835 7840 7845
Thr Ser Pro Leu Gly Ala Thr Thr Gln Gly Thr Ser Thr Leu Asp
7850 7855 7860
Thr Ser Ser Thr Thr Ser Leu Thr Met Thr His Ser Thr Ile Ser
7865 7870 7875
Gln Gly Phe Ser His Ser Gln Met Ser Thr Leu Met Arg Arg Gly
7880 7885 7890
Pro Glu Asp Val Ser Trp Met Ser Pro Pro Leu Leu Glu Lys Thr
7895 7900 7905
Arg Pro Ser Phe Ser Leu Met Ser Ser Pro Ala Thr Thr Ser Pro
7910 7915 7920
Ser Pro Val Ser Ser Thr Leu Pro Glu Ser Ile Ser Ser Ser Pro
7925 7930 7935
Leu Pro Val Thr Ser Leu Leu Thr Ser Gly Leu Ala Lys Thr Thr
7940 7945 7950
Asp Met Leu His Lys Ser Ser Glu Pro Val Thr Asn Ser Pro Ala
7955 7960 7965
Asn Leu Ser Ser Thr Ser Val Glu Ile Leu Ala Thr Ser Glu Val
7970 7975 7980
Thr Thr Asp Thr Glu Lys Thr His Pro Ser Ser Asn Arg Thr Val
7985 7990 7995
Thr Asp Val Gly Thr Ser Ser Ser Gly His Glu Ser Thr Ser Phe
8000 8005 8010
Val Leu Ala Asp Ser Gln Thr Ser Lys Val Thr Ser Pro Met Val
8015 8020 8025
Ile Thr Ser Thr Met Glu Asp Thr Ser Val Ser Thr Ser Thr Pro
8030 8035 8040
Gly Phe Phe Glu Thr Ser Arg Ile Gln Thr Glu Pro Thr Ser Ser
8045 8050 8055
Leu Thr Leu Gly Leu Arg Lys Thr Ser Ser Ser Glu Gly Thr Ser
8060 8065 8070
Leu Ala Thr Glu Met Ser Thr Val Leu Ser Gly Val Pro Thr Gly
8075 8080 8085
Ala Thr Ala Glu Val Ser Arg Thr Glu Val Thr Ser Ser Ser Arg
8090 8095 8100
Thr Ser Ile Ser Gly Phe Ala Gln Leu Thr Val Ser Pro Glu Thr
8105 8110 8115
Ser Thr Glu Thr Ile Thr Arg Leu Pro Thr Ser Ser Ile Met Thr
8120 8125 8130
Glu Ser Ala Glu Met Met Ile Lys Thr Gln Thr Asp Pro Pro Gly
8135 8140 8145
Ser Thr Pro Glu Ser Thr His Thr Val Asp Ile Ser Thr Thr Pro
8150 8155 8160
Asn Trp Val Glu Thr His Ser Thr Val Thr Gln Arg Phe Ser His
8165 8170 8175
Ser Glu Met Thr Thr Leu Val Ser Arg Ser Pro Gly Asp Met Leu
8180 8185 8190
Trp Pro Ser Gln Ser Ser Val Glu Glu Thr Ser Ser Ala Ser Ser
8195 8200 8205
Leu Leu Ser Leu Pro Ala Thr Thr Ser Pro Ser Pro Val Ser Ser
8210 8215 8220
Thr Leu Val Glu Asp Phe Pro Ser Ala Ser Leu Pro Val Thr Ser
8225 8230 8235
Leu Leu Asn Pro Gly Leu Val Ile Thr Thr Asp Arg Met Gly Ile
8240 8245 8250
Ser Arg Glu Pro Gly Thr Ser Ser Thr Ser Asn Leu Ser Ser Thr
8255 8260 8265
Ser His Glu Arg Leu Thr Thr Leu Glu Asp Thr Val Asp Thr Glu
8270 8275 8280
Asp Met Gln Pro Ser Thr His Thr Ala Val Thr Asn Val Arg Thr
8285 8290 8295
Ser Ile Ser Gly His Glu Ser Gln Ser Ser Val Leu Ser Asp Ser
8300 8305 8310
Glu Thr Pro Lys Ala Thr Ser Pro Met Gly Thr Thr Tyr Thr Met
8315 8320 8325
Gly Glu Thr Ser Val Ser Ile Ser Thr Ser Asp Phe Phe Glu Thr
8330 8335 8340
Ser Arg Ile Gln Ile Glu Pro Thr Ser Ser Leu Thr Ser Gly Leu
8345 8350 8355
Arg Glu Thr Ser Ser Ser Glu Arg Ile Ser Ser Ala Thr Glu Gly
8360 8365 8370
Ser Thr Val Leu Ser Glu Val Pro Ser Gly Ala Thr Thr Glu Val
8375 8380 8385
Ser Arg Thr Glu Val Ile Ser Ser Arg Gly Thr Ser Met Ser Gly
8390 8395 8400
Pro Asp Gln Phe Thr Ile Ser Pro Asp Ile Ser Thr Glu Ala Ile
8405 8410 8415
Thr Arg Leu Ser Thr Ser Pro Ile Met Thr Glu Ser Ala Glu Ser
8420 8425 8430
Ala Ile Thr Ile Glu Thr Gly Ser Pro Gly Ala Thr Ser Glu Gly
8435 8440 8445
Thr Leu Thr Leu Asp Thr Ser Thr Thr Thr Phe Trp Ser Gly Thr
8450 8455 8460
His Ser Thr Ala Ser Pro Gly Phe Ser His Ser Glu Met Thr Thr
8465 8470 8475
Leu Met Ser Arg Thr Pro Gly Asp Val Pro Trp Pro Ser Leu Pro
8480 8485 8490
Ser Val Glu Glu Ala Ser Ser Val Ser Ser Ser Leu Ser Ser Pro
8495 8500 8505
Ala Met Thr Ser Thr Ser Phe Phe Ser Thr Leu Pro Glu Ser Ile
8510 8515 8520
Ser Ser Ser Pro His Pro Val Thr Ala Leu Leu Thr Leu Gly Pro
8525 8530 8535
Val Lys Thr Thr Asp Met Leu Arg Thr Ser Ser Glu Pro Glu Thr
8540 8545 8550
Ser Ser Pro Pro Asn Leu Ser Ser Thr Ser Ala Glu Ile Leu Ala
8555 8560 8565
Thr Ser Glu Val Thr Lys Asp Arg Glu Lys Ile His Pro Ser Ser
8570 8575 8580
Asn Thr Pro Val Val Asn Val Gly Thr Val Ile Tyr Lys His Leu
8585 8590 8595
Ser Pro Ser Ser Val Leu Ala Asp Leu Val Thr Thr Lys Pro Thr
8600 8605 8610
Ser Pro Met Ala Thr Thr Ser Thr Leu Gly Asn Thr Ser Val Ser
8615 8620 8625
Thr Ser Thr Pro Ala Phe Pro Glu Thr Met Met Thr Gln Pro Thr
8630 8635 8640
Ser Ser Leu Thr Ser Gly Leu Arg Glu Ile Ser Thr Ser Gln Glu
8645 8650 8655
Thr Ser Ser Ala Thr Glu Arg Ser Ala Ser Leu Ser Gly Met Pro
8660 8665 8670
Thr Gly Ala Thr Thr Lys Val Ser Arg Thr Glu Ala Leu Ser Leu
8675 8680 8685
Gly Arg Thr Ser Thr Pro Gly Pro Ala Gln Ser Thr Ile Ser Pro
8690 8695 8700
Glu Ile Ser Thr Glu Thr Ile Thr Arg Ile Ser Thr Pro Leu Thr
8705 8710 8715
Thr Thr Gly Ser Ala Glu Met Thr Ile Thr Pro Lys Thr Gly His
8720 8725 8730
Ser Gly Ala Ser Ser Gln Gly Thr Phe Thr Leu Asp Thr Ser Ser
8735 8740 8745
Arg Ala Ser Trp Pro Gly Thr His Ser Ala Ala Thr His Arg Ser
8750 8755 8760
Pro His Ser Gly Met Thr Thr Pro Met Ser Arg Gly Pro Glu Asp
8765 8770 8775
Val Ser Trp Pro Ser Arg Pro Ser Val Glu Lys Thr Ser Pro Pro
8780 8785 8790
Ser Ser Leu Val Ser Leu Ser Ala Val Thr Ser Pro Ser Pro Leu
8795 8800 8805
Tyr Ser Thr Pro Ser Glu Ser Ser His Ser Ser Pro Leu Arg Val
8810 8815 8820
Thr Ser Leu Phe Thr Pro Val Met Met Lys Thr Thr Asp Met Leu
8825 8830 8835
Asp Thr Ser Leu Glu Pro Val Thr Thr Ser Pro Pro Ser Met Asn
8840 8845 8850
Ile Thr Ser Asp Glu Ser Leu Ala Thr Ser Lys Ala Thr Met Glu
8855 8860 8865
Thr Glu Ala Ile Gln Leu Ser Glu Asn Thr Ala Val Thr Gln Met
8870 8875 8880
Gly Thr Ile Ser Ala Arg Gln Glu Phe Tyr Ser Ser Tyr Pro Gly
8885 8890 8895
Leu Pro Glu Pro Ser Lys Val Thr Ser Pro Val Val Thr Ser Ser
8900 8905 8910
Thr Ile Lys Asp Ile Val Ser Thr Thr Ile Pro Ala Ser Ser Glu
8915 8920 8925
Ile Thr Arg Ile Glu Met Glu Ser Thr Ser Thr Leu Thr Pro Thr
8930 8935 8940
Pro Arg Glu Thr Ser Thr Ser Gln Glu Ile His Ser Ala Thr Lys
8945 8950 8955
Pro Ser Thr Val Pro Tyr Lys Ala Leu Thr Ser Ala Thr Ile Glu
8960 8965 8970
Asp Ser Met Thr Gln Val Met Ser Ser Ser Arg Gly Pro Ser Pro
8975 8980 8985
Asp Gln Ser Thr Met Ser Gln Asp Ile Ser Thr Glu Val Ile Thr
8990 8995 9000
Arg Leu Ser Thr Ser Pro Ile Lys Thr Glu Ser Thr Glu Met Thr
9005 9010 9015
Ile Thr Thr Gln Thr Gly Ser Pro Gly Ala Thr Ser Arg Gly Thr
9020 9025 9030
Leu Thr Leu Asp Thr Ser Thr Thr Phe Met Ser Gly Thr His Ser
9035 9040 9045
Thr Ala Ser Gln Gly Phe Ser His Ser Gln Met Thr Ala Leu Met
9050 9055 9060
Ser Arg Thr Pro Gly Asp Val Pro Trp Leu Ser His Pro Ser Val
9065 9070 9075
Glu Glu Ala Ser Ser Ala Ser Phe Ser Leu Ser Ser Pro Val Met
9080 9085 9090
Thr Ser Ser Ser Pro Val Ser Ser Thr Leu Pro Asp Ser Ile His
9095 9100 9105
Ser Ser Ser Leu Pro Val Thr Ser Leu Leu Thr Ser Gly Leu Val
9110 9115 9120
Lys Thr Thr Glu Leu Leu Gly Thr Ser Ser Glu Pro Glu Thr Ser
9125 9130 9135
Ser Pro Pro Asn Leu Ser Ser Thr Ser Ala Glu Ile Leu Ala Ile
9140 9145 9150
Thr Glu Val Thr Thr Asp Thr Glu Lys Leu Glu Met Thr Asn Val
9155 9160 9165
Val Thr Ser Gly Tyr Thr His Glu Ser Pro Ser Ser Val Leu Ala
9170 9175 9180
Asp Ser Val Thr Thr Lys Ala Thr Ser Ser Met Gly Ile Thr Tyr
9185 9190 9195
Pro Thr Gly Asp Thr Asn Val Leu Thr Ser Thr Pro Ala Phe Ser
9200 9205 9210
Asp Thr Ser Arg Ile Gln Thr Lys Ser Lys Leu Ser Leu Thr Pro
9215 9220 9225
Gly Leu Met Glu Thr Ser Ile Ser Glu Glu Thr Ser Ser Ala Thr
9230 9235 9240
Glu Lys Ser Thr Val Leu Ser Ser Val Pro Thr Gly Ala Thr Thr
9245 9250 9255
Glu Val Ser Arg Thr Glu Ala Ile Ser Ser Ser Arg Thr Ser Ile
9260 9265 9270
Pro Gly Pro Ala Gln Ser Thr Met Ser Ser Asp Thr Ser Met Glu
9275 9280 9285
Thr Ile Thr Arg Ile Ser Thr Pro Leu Thr Arg Lys Glu Ser Thr
9290 9295 9300
Asp Met Ala Ile Thr Pro Lys Thr Gly Pro Ser Gly Ala Thr Ser
9305 9310 9315
Gln Gly Thr Phe Thr Leu Asp Ser Ser Ser Thr Ala Ser Trp Pro
9320 9325 9330
Gly Thr His Ser Ala Thr Thr Gln Arg Phe Pro Gln Ser Val Val
9335 9340 9345
Thr Thr Pro Met Ser Arg Gly Pro Glu Asp Val Ser Trp Pro Ser
9350 9355 9360
Pro Leu Ser Val Glu Lys Asn Ser Pro Pro Ser Ser Leu Val Ser
9365 9370 9375
Ser Ser Ser Val Thr Ser Pro Ser Pro Leu Tyr Ser Thr Pro Ser
9380 9385 9390
Gly Ser Ser His Ser Ser Pro Val Pro Val Thr Ser Leu Phe Thr
9395 9400 9405
Ser Ile Met Met Lys Ala Thr Asp Met Leu Asp Ala Ser Leu Glu
9410 9415 9420
Pro Glu Thr Thr Ser Ala Pro Asn Met Asn Ile Thr Ser Asp Glu
9425 9430 9435
Ser Leu Ala Ala Ser Lys Ala Thr Thr Glu Thr Glu Ala Ile His
9440 9445 9450
Val Phe Glu Asn Thr Ala Ala Ser His Val Glu Thr Thr Ser Ala
9455 9460 9465
Thr Glu Glu Leu Tyr Ser Ser Ser Pro Gly Phe Ser Glu Pro Thr
9470 9475 9480
Lys Val Ile Ser Pro Val Val Thr Ser Ser Ser Ile Arg Asp Asn
9485 9490 9495
Met Val Ser Thr Thr Met Pro Gly Ser Ser Gly Ile Thr Arg Ile
9500 9505 9510
Glu Ile Glu Ser Met Ser Ser Leu Thr Pro Gly Leu Arg Glu Thr
9515 9520 9525
Arg Thr Ser Gln Asp Ile Thr Ser Ser Thr Glu Thr Ser Thr Val
9530 9535 9540
Leu Tyr Lys Met Pro Ser Gly Ala Thr Pro Glu Val Ser Arg Thr
9545 9550 9555
Glu Val Met Pro Ser Ser Arg Thr Ser Ile Pro Gly Pro Ala Gln
9560 9565 9570
Ser Thr Met Ser Leu Asp Ile Ser Asp Glu Val Val Thr Arg Leu
9575 9580 9585
Ser Thr Ser Pro Ile Met Thr Glu Ser Ala Glu Ile Thr Ile Thr
9590 9595 9600
Thr Gln Thr Gly Tyr Ser Leu Ala Thr Ser Gln Val Thr Leu Pro
9605 9610 9615
Leu Gly Thr Ser Met Thr Phe Leu Ser Gly Thr His Ser Thr Met
9620 9625 9630
Ser Gln Gly Leu Ser His Ser Glu Met Thr Asn Leu Met Ser Arg
9635 9640 9645
Gly Pro Glu Ser Leu Ser Trp Thr Ser Pro Arg Phe Val Glu Thr
9650 9655 9660
Thr Arg Ser Ser Ser Ser Leu Thr Ser Leu Pro Leu Thr Thr Ser
9665 9670 9675
Leu Ser Pro Val Ser Ser Thr Leu Leu Asp Ser Ser Pro Ser Ser
9680 9685 9690
Pro Leu Pro Val Thr Ser Leu Ile Leu Pro Gly Leu Val Lys Thr
9695 9700 9705
Thr Glu Val Leu Asp Thr Ser Ser Glu Pro Lys Thr Ser Ser Ser
9710 9715 9720
Pro Asn Leu Ser Ser Thr Ser Val Glu Ile Pro Ala Thr Ser Glu
9725 9730 9735
Ile Met Thr Asp Thr Glu Lys Ile His Pro Ser Ser Asn Thr Ala
9740 9745 9750
Val Ala Lys Val Arg Thr Ser Ser Ser Val His Glu Ser His Ser
9755 9760 9765
Ser Val Leu Ala Asp Ser Glu Thr Thr Ile Thr Ile Pro Ser Met
9770 9775 9780
Gly Ile Thr Ser Ala Val Asp Asp Thr Thr Val Phe Thr Ser Asn
9785 9790 9795
Pro Ala Phe Ser Glu Thr Arg Arg Ile Pro Thr Glu Pro Thr Phe
9800 9805 9810
Ser Leu Thr Pro Gly Phe Arg Glu Thr Ser Thr Ser Glu Glu Thr
9815 9820 9825
Thr Ser Ile Thr Glu Thr Ser Ala Val Leu Tyr Gly Val Pro Thr
9830 9835 9840
Ser Ala Thr Thr Glu Val Ser Met Thr Glu Ile Met Ser Ser Asn
9845 9850 9855
Arg Ile His Ile Pro Asp Ser Asp Gln Ser Thr Met Ser Pro Asp
9860 9865 9870
Ile Ile Thr Glu Val Ile Thr Arg Leu Ser Ser Ser Ser Met Met
9875 9880 9885
Ser Glu Ser Thr Gln Met Thr Ile Thr Thr Gln Lys Ser Ser Pro
9890 9895 9900
Gly Ala Thr Ala Gln Ser Thr Leu Thr Leu Ala Thr Thr Thr Ala
9905 9910 9915
Pro Leu Ala Arg Thr His Ser Thr Val Pro Pro Arg Phe Leu His
9920 9925 9930
Ser Glu Met Thr Thr Leu Met Ser Arg Ser Pro Glu Asn Pro Ser
9935 9940 9945
Trp Lys Ser Ser Leu Phe Val Glu Lys Thr Ser Ser Ser Ser Ser
9950 9955 9960
Leu Leu Ser Leu Pro Val Thr Thr Ser Pro Ser Val Ser Ser Thr
9965 9970 9975
Leu Pro Gln Ser Ile Pro Ser Ser Ser Phe Ser Val Thr Ser Leu
9980 9985 9990
Leu Thr Pro Gly Met Val Lys Thr Thr Asp Thr Ser Thr Glu Pro
9995 10000 10005
Gly Thr Ser Leu Ser Pro Asn Leu Ser Gly Thr Ser Val Glu Ile
10010 10015 10020
Leu Ala Ala Ser Glu Val Thr Thr Asp Thr Glu Lys Ile His Pro
10025 10030 10035
Ser Ser Ser Met Ala Val Thr Asn Val Gly Thr Thr Ser Ser Gly
10040 10045 10050
His Glu Leu Tyr Ser Ser Val Ser Ile His Ser Glu Pro Ser Lys
10055 10060 10065
Ala Thr Tyr Pro Val Gly Thr Pro Ser Ser Met Ala Glu Thr Ser
10070 10075 10080
Ile Ser Thr Ser Met Pro Ala Asn Phe Glu Thr Thr Gly Phe Glu
10085 10090 10095
Ala Glu Pro Phe Ser His Leu Thr Ser Gly Phe Arg Lys Thr Asn
10100 10105 10110
Met Ser Leu Asp Thr Ser Ser Val Thr Pro Thr Asn Thr Pro Ser
10115 10120 10125
Ser Pro Gly Ser Thr His Leu Leu Gln Ser Ser Lys Thr Asp Phe
10130 10135 10140
Thr Ser Ser Ala Lys Thr Ser Ser Pro Asp Trp Pro Pro Ala Ser
10145 10150 10155
Gln Tyr Thr Glu Ile Pro Val Asp Ile Ile Thr Pro Phe Asn Ala
10160 10165 10170
Ser Pro Ser Ile Thr Glu Ser Thr Gly Ile Thr Ser Phe Pro Glu
10175 10180 10185
Ser Arg Phe Thr Met Ser Val Thr Glu Ser Thr His His Leu Ser
10190 10195 10200
Thr Asp Leu Leu Pro Ser Ala Glu Thr Ile Ser Thr Gly Thr Val
10205 10210 10215
Met Pro Ser Leu Ser Glu Ala Met Thr Ser Phe Ala Thr Thr Gly
10220 10225 10230
Val Pro Arg Ala Ile Ser Gly Ser Gly Ser Pro Phe Ser Arg Thr
10235 10240 10245
Glu Ser Gly Pro Gly Asp Ala Thr Leu Ser Thr Ile Ala Glu Ser
10250 10255 10260
Leu Pro Ser Ser Thr Pro Val Pro Phe Ser Ser Ser Thr Phe Thr
10265 10270 10275
Thr Thr Asp Ser Ser Thr Ile Pro Ala Leu His Glu Ile Thr Ser
10280 10285 10290
Ser Ser Ala Thr Pro Tyr Arg Val Asp Thr Ser Leu Gly Thr Glu
10295 10300 10305
Ser Ser Thr Thr Glu Gly Arg Leu Val Met Val Ser Thr Leu Asp
10310 10315 10320
Thr Ser Ser Gln Pro Gly Arg Thr Ser Ser Ser Pro Ile Leu Asp
10325 10330 10335
Thr Arg Met Thr Glu Ser Val Glu Leu Gly Thr Val Thr Ser Ala
10340 10345 10350
Tyr Gln Val Pro Ser Leu Ser Thr Arg Leu Thr Arg Thr Asp Gly
10355 10360 10365
Ile Met Glu His Ile Thr Lys Ile Pro Asn Glu Ala Ala His Arg
10370 10375 10380
Gly Thr Ile Arg Pro Val Lys Gly Pro Gln Thr Ser Thr Ser Pro
10385 10390 10395
Ala Ser Pro Lys Gly Leu His Thr Gly Gly Thr Lys Arg Met Glu
10400 10405 10410
Thr Thr Thr Thr Ala Leu Lys Thr Thr Thr Thr Ala Leu Lys Thr
10415 10420 10425
Thr Ser Arg Ala Thr Leu Thr Thr Ser Val Tyr Thr Pro Thr Leu
10430 10435 10440
Gly Thr Leu Thr Pro Leu Asn Ala Ser Met Gln Met Ala Ser Thr
10445 10450 10455
Ile Pro Thr Glu Met Met Ile Thr Thr Pro Tyr Val Phe Pro Asp
10460 10465 10470
Val Pro Glu Thr Thr Ser Ser Leu Ala Thr Ser Leu Gly Ala Glu
10475 10480 10485
Thr Ser Thr Ala Leu Pro Arg Thr Thr Pro Ser Val Phe Asn Arg
10490 10495 10500
Glu Ser Glu Thr Thr Ala Ser Leu Val Ser Arg Ser Gly Ala Glu
10505 10510 10515
Arg Ser Pro Val Ile Gln Thr Leu Asp Val Ser Ser Ser Glu Pro
10520 10525 10530
Asp Thr Thr Ala Ser Trp Val Ile His Pro Ala Glu Thr Ile Pro
10535 10540 10545
Thr Val Ser Lys Thr Thr Pro Asn Phe Phe His Ser Glu Leu Asp
10550 10555 10560
Thr Val Ser Ser Thr Ala Thr Ser His Gly Ala Asp Val Ser Ser
10565 10570 10575
Ala Ile Pro Thr Asn Ile Ser Pro Ser Glu Leu Asp Ala Leu Thr
10580 10585 10590
Pro Leu Val Thr Ile Ser Gly Thr Asp Thr Ser Thr Thr Phe Pro
10595 10600 10605
Thr Leu Thr Lys Ser Pro His Glu Thr Glu Thr Arg Thr Thr Trp
10610 10615 10620
Leu Thr His Pro Ala Glu Thr Ser Ser Thr Ile Pro Arg Thr Ile
10625 10630 10635
Pro Asn Phe Ser His His Glu Ser Asp Ala Thr Pro Ser Ile Ala
10640 10645 10650
Thr Ser Pro Gly Ala Glu Thr Ser Ser Ala Ile Pro Ile Met Thr
10655 10660 10665
Val Ser Pro Gly Ala Glu Asp Leu Val Thr Ser Gln Val Thr Ser
10670 10675 10680
Ser Gly Thr Asp Arg Asn Met Thr Ile Pro Thr Leu Thr Leu Ser
10685 10690 10695
Pro Gly Glu Pro Lys Thr Ile Ala Ser Leu Val Thr His Pro Glu
10700 10705 10710
Ala Gln Thr Ser Ser Ala Ile Pro Thr Ser Thr Ile Ser Pro Ala
10715 10720 10725
Val Ser Arg Leu Val Thr Ser Met Val Thr Ser Leu Ala Ala Lys
10730 10735 10740
Thr Ser Thr Thr Asn Arg Ala Leu Thr Asn Ser Pro Gly Glu Pro
10745 10750 10755
Ala Thr Thr Val Ser Leu Val Thr His Pro Ala Gln Thr Ser Pro
10760 10765 10770
Thr Val Pro Trp Thr Thr Ser Ile Phe Phe His Ser Lys Ser Asp
10775 10780 10785
Thr Thr Pro Ser Met Thr Thr Ser His Gly Ala Glu Ser Ser Ser
10790 10795 10800
Ala Val Pro Thr Pro Thr Val Ser Thr Glu Val Pro Gly Val Val
10805 10810 10815
Thr Pro Leu Val Thr Ser Ser Arg Ala Val Ile Ser Thr Thr Ile
10820 10825 10830
Pro Ile Leu Thr Leu Ser Pro Gly Glu Pro Glu Thr Thr Pro Ser
10835 10840 10845
Met Ala Thr Ser His Gly Glu Glu Ala Ser Ser Ala Ile Pro Thr
10850 10855 10860
Pro Thr Val Ser Pro Gly Val Pro Gly Val Val Thr Ser Leu Val
10865 10870 10875
Thr Ser Ser Arg Ala Val Thr Ser Thr Thr Ile Pro Ile Leu Thr
10880 10885 10890
Phe Ser Leu Gly Glu Pro Glu Thr Thr Pro Ser Met Ala Thr Ser
10895 10900 10905
His Gly Thr Glu Ala Gly Ser Ala Val Pro Thr Val Leu Pro Glu
10910 10915 10920
Val Pro Gly Met Val Thr Ser Leu Val Ala Ser Ser Arg Ala Val
10925 10930 10935
Thr Ser Thr Thr Leu Pro Thr Leu Thr Leu Ser Pro Gly Glu Pro
10940 10945 10950
Glu Thr Thr Pro Ser Met Ala Thr Ser His Gly Ala Glu Ala Ser
10955 10960 10965
Ser Thr Val Pro Thr Val Ser Pro Glu Val Pro Gly Val Val Thr
10970 10975 10980
Ser Leu Val Thr Ser Ser Ser Gly Val Asn Ser Thr Ser Ile Pro
10985 10990 10995
Thr Leu Ile Leu Ser Pro Gly Glu Leu Glu Thr Thr Pro Ser Met
11000 11005 11010
Ala Thr Ser His Gly Ala Glu Ala Ser Ser Ala Val Pro Thr Pro
11015 11020 11025
Thr Val Ser Pro Gly Val Ser Gly Val Val Thr Pro Leu Val Thr
11030 11035 11040
Ser Ser Arg Ala Val Thr Ser Thr Thr Ile Pro Ile Leu Thr Leu
11045 11050 11055
Ser Ser Ser Glu Pro Glu Thr Thr Pro Ser Met Ala Thr Ser His
11060 11065 11070
Gly Val Glu Ala Ser Ser Ala Val Leu Thr Val Ser Pro Glu Val
11075 11080 11085
Pro Gly Met Val Thr Ser Leu Val Thr Ser Ser Arg Ala Val Thr
11090 11095 11100
Ser Thr Thr Ile Pro Thr Leu Thr Ile Ser Ser Asp Glu Pro Glu
11105 11110 11115
Thr Thr Thr Ser Leu Val Thr His Ser Glu Ala Lys Met Ile Ser
11120 11125 11130
Ala Ile Pro Thr Leu Ala Val Ser Pro Thr Val Gln Gly Leu Val
11135 11140 11145
Thr Ser Leu Val Thr Ser Ser Gly Ser Glu Thr Ser Ala Phe Ser
11150 11155 11160
Asn Leu Thr Val Ala Ser Ser Gln Pro Glu Thr Ile Asp Ser Trp
11165 11170 11175
Val Ala His Pro Gly Thr Glu Ala Ser Ser Val Val Pro Thr Leu
11180 11185 11190
Thr Val Ser Thr Gly Glu Pro Phe Thr Asn Ile Ser Leu Val Thr
11195 11200 11205
His Pro Ala Glu Ser Ser Ser Thr Leu Pro Arg Thr Thr Ser Arg
11210 11215 11220
Phe Ser His Ser Glu Leu Asp Thr Met Pro Ser Thr Val Thr Ser
11225 11230 11235
Pro Glu Ala Glu Ser Ser Ser Ala Ile Ser Thr Thr Ile Ser Pro
11240 11245 11250
Gly Ile Pro Gly Val Leu Thr Ser Leu Val Thr Ser Ser Gly Arg
11255 11260 11265
Asp Ile Ser Ala Thr Phe Pro Thr Val Pro Glu Ser Pro His Glu
11270 11275 11280
Ser Glu Ala Thr Ala Ser Trp Val Thr His Pro Ala Val Thr Ser
11285 11290 11295
Thr Thr Val Pro Arg Thr Thr Pro Asn Tyr Ser His Ser Glu Pro
11300 11305 11310
Asp Thr Thr Pro Ser Ile Ala Thr Ser Pro Gly Ala Glu Ala Thr
11315 11320 11325
Ser Asp Phe Pro Thr Ile Thr Val Ser Pro Asp Val Pro Asp Met
11330 11335 11340
Val Thr Ser Gln Val Thr Ser Ser Gly Thr Asp Thr Ser Ile Thr
11345 11350 11355
Ile Pro Thr Leu Thr Leu Ser Ser Gly Glu Pro Glu Thr Thr Thr
11360 11365 11370
Ser Phe Ile Thr Tyr Ser Glu Thr His Thr Ser Ser Ala Ile Pro
11375 11380 11385
Thr Leu Pro Val Ser Pro Gly Ala Ser Lys Met Leu Thr Ser Leu
11390 11395 11400
Val Ile Ser Ser Gly Thr Asp Ser Thr Thr Thr Phe Pro Thr Leu
11405 11410 11415
Thr Glu Thr Pro Tyr Glu Pro Glu Thr Thr Ala Ile Gln Leu Ile
11420 11425 11430
His Pro Ala Glu Thr Asn Thr Met Val Pro Arg Thr Thr Pro Lys
11435 11440 11445
Phe Ser His Ser Lys Ser Asp Thr Thr Leu Pro Val Ala Ile Thr
11450 11455 11460
Ser Pro Gly Pro Glu Ala Ser Ser Ala Val Ser Thr Thr Thr Ile
11465 11470 11475
Ser Pro Asp Met Ser Asp Leu Val Thr Ser Leu Val Pro Ser Ser
11480 11485 11490
Gly Thr Asp Thr Ser Thr Thr Phe Pro Thr Leu Ser Glu Thr Pro
11495 11500 11505
Tyr Glu Pro Glu Thr Thr Ala Thr Trp Leu Thr His Pro Ala Glu
11510 11515 11520
Thr Ser Thr Thr Val Ser Gly Thr Ile Pro Asn Phe Ser His Arg
11525 11530 11535
Gly Ser Asp Thr Ala Pro Ser Met Val Thr Ser Pro Gly Val Asp
11540 11545 11550
Thr Arg Ser Gly Val Pro Thr Thr Thr Ile Pro Pro Ser Ile Pro
11555 11560 11565
Gly Val Val Thr Ser Gln Val Thr Ser Ser Ala Thr Asp Thr Ser
11570 11575 11580
Thr Ala Ile Pro Thr Leu Thr Pro Ser Pro Gly Glu Pro Glu Thr
11585 11590 11595
Thr Ala Ser Ser Ala Thr His Pro Gly Thr Gln Thr Gly Phe Thr
11600 11605 11610
Val Pro Ile Arg Thr Val Pro Ser Ser Glu Pro Asp Thr Met Ala
11615 11620 11625
Ser Trp Val Thr His Pro Pro Gln Thr Ser Thr Pro Val Ser Arg
11630 11635 11640
Thr Thr Ser Ser Phe Ser His Ser Ser Pro Asp Ala Thr Pro Val
11645 11650 11655
Met Ala Thr Ser Pro Arg Thr Glu Ala Ser Ser Ala Val Leu Thr
11660 11665 11670
Thr Ile Ser Pro Gly Ala Pro Glu Met Val Thr Ser Gln Ile Thr
11675 11680 11685
Ser Ser Gly Ala Ala Thr Ser Thr Thr Val Pro Thr Leu Thr His
11690 11695 11700
Ser Pro Gly Met Pro Glu Thr Thr Ala Leu Leu Ser Thr His Pro
11705 11710 11715
Arg Thr Glu Thr Ser Lys Thr Phe Pro Ala Ser Thr Val Phe Pro
11720 11725 11730
Gln Val Ser Glu Thr Thr Ala Ser Leu Thr Ile Arg Pro Gly Ala
11735 11740 11745
Glu Thr Ser Thr Ala Leu Pro Thr Gln Thr Thr Ser Ser Leu Phe
11750 11755 11760
Thr Leu Leu Val Thr Gly Thr Ser Arg Val Asp Leu Ser Pro Thr
11765 11770 11775
Ala Ser Pro Gly Val Ser Ala Lys Thr Ala Pro Leu Ser Thr His
11780 11785 11790
Pro Gly Thr Glu Thr Ser Thr Met Ile Pro Thr Ser Thr Leu Ser
11795 11800 11805
Leu Gly Leu Leu Glu Thr Thr Gly Leu Leu Ala Thr Ser Ser Ser
11810 11815 11820
Ala Glu Thr Ser Thr Ser Thr Leu Thr Leu Thr Val Ser Pro Ala
11825 11830 11835
Val Ser Gly Leu Ser Ser Ala Ser Ile Thr Thr Asp Lys Pro Gln
11840 11845 11850
Thr Val Thr Ser Trp Asn Thr Glu Thr Ser Pro Ser Val Thr Ser
11855 11860 11865
Val Gly Pro Pro Glu Phe Ser Arg Thr Val Thr Gly Thr Thr Met
11870 11875 11880
Thr Leu Ile Pro Ser Glu Met Pro Thr Pro Pro Lys Thr Ser His
11885 11890 11895
Gly Glu Gly Val Ser Pro Thr Thr Ile Leu Arg Thr Thr Met Val
11900 11905 11910
Glu Ala Thr Asn Leu Ala Thr Thr Gly Ser Ser Pro Thr Val Ala
11915 11920 11925
Lys Thr Thr Thr Thr Phe Asn Thr Leu Ala Gly Ser Leu Phe Thr
11930 11935 11940
Pro Leu Thr Thr Pro Gly Met Ser Thr Leu Ala Ser Glu Ser Val
11945 11950 11955
Thr Ser Arg Thr Ser Tyr Asn His Arg Ser Trp Ile Ser Thr Thr
11960 11965 11970
Ser Ser Tyr Asn Arg Arg Tyr Trp Thr Pro Ala Thr Ser Thr Pro
11975 11980 11985
Val Thr Ser Thr Phe Ser Pro Gly Ile Ser Thr Ser Ser Ile Pro
11990 11995 12000
Ser Ser Thr Ala Ala Thr Val Pro Phe Met Val Pro Phe Thr Leu
12005 12010 12015
Asn Phe Thr Ile Thr Asn Leu Gln Tyr Glu Glu Asp Met Arg His
12020 12025 12030
Pro Gly Ser Arg Lys Phe Asn Ala Thr Glu Arg Glu Leu Gln Gly
12035 12040 12045
Leu Leu Lys Pro Leu Phe Arg Asn Ser Ser Leu Glu Tyr Leu Tyr
12050 12055 12060
Ser Gly Cys Arg Leu Ala Ser Leu Arg Pro Glu Lys Asp Ser Ser
12065 12070 12075
Ala Thr Ala Val Asp Ala Ile Cys Thr His Arg Pro Asp Pro Glu
12080 12085 12090
Asp Leu Gly Leu Asp Arg Glu Arg Leu Tyr Trp Glu Leu Ser Asn
12095 12100 12105
Leu Thr Asn Gly Ile Gln Glu Leu Gly Pro Tyr Thr Leu Asp Arg
12110 12115 12120
Asn Ser Leu Tyr Val Asn Gly Phe Thr His Arg Ser Ser Met Pro
12125 12130 12135
Thr Thr Ser Thr Pro Gly Thr Ser Thr Val Asp Val Gly Thr Ser
12140 12145 12150
Gly Thr Pro Ser Ser Ser Pro Ser Pro Thr Thr Ala Gly Pro Leu
12155 12160 12165
Leu Met Pro Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Gln Tyr
12170 12175 12180
Glu Glu Asp Met Arg Arg Thr Gly Ser Arg Lys Phe Asn Thr Met
12185 12190 12195
Glu Ser Val Leu Gln Gly Leu Leu Lys Pro Leu Phe Lys Asn Thr
12200 12205 12210
Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg
12215 12220 12225
Pro Glu Lys Asp Gly Ala Ala Thr Gly Val Asp Ala Ile Cys Thr
12230 12235 12240
His Arg Leu Asp Pro Lys Ser Pro Gly Leu Asn Arg Glu Gln Leu
12245 12250 12255
Tyr Trp Glu Leu Ser Lys Leu Thr Asn Asp Ile Glu Glu Leu Gly
12260 12265 12270
Pro Tyr Thr Leu Asp Arg Asn Ser Leu Tyr Val Asn Gly Phe Thr
12275 12280 12285
His Gln Ser Ser Val Ser Thr Thr Ser Thr Pro Gly Thr Ser Thr
12290 12295 12300
Val Asp Leu Arg Thr Ser Gly Thr Pro Ser Ser Leu Ser Ser Pro
12305 12310 12315
Thr Ile Met Ala Ala Gly Pro Leu Leu Val Pro Phe Thr Leu Asn
12320 12325 12330
Phe Thr Ile Thr Asn Leu Gln Tyr Gly Glu Asp Met Gly His Pro
12335 12340 12345
Gly Ser Arg Lys Phe Asn Thr Thr Glu Arg Val Leu Gln Gly Leu
12350 12355 12360
Leu Gly Pro Ile Phe Lys Asn Thr Ser Val Gly Pro Leu Tyr Ser
12365 12370 12375
Gly Cys Arg Leu Thr Ser Leu Arg Ser Glu Lys Asp Gly Ala Ala
12380 12385 12390
Thr Gly Val Asp Ala Ile Cys Ile His His Leu Asp Pro Lys Ser
12395 12400 12405
Pro Gly Leu Asn Arg Glu Arg Leu Tyr Trp Glu Leu Ser Gln Leu
12410 12415 12420
Thr Asn Gly Ile Lys Glu Leu Gly Pro Tyr Thr Leu Asp Arg Asn
12425 12430 12435
Ser Leu Tyr Val Asn Gly Phe Thr His Arg Thr Ser Val Pro Thr
12440 12445 12450
Ser Ser Thr Pro Gly Thr Ser Thr Val Asp Leu Gly Thr Ser Gly
12455 12460 12465
Thr Pro Phe Ser Leu Pro Ser Pro Ala Thr Ala Gly Pro Leu Leu
12470 12475 12480
Val Leu Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Lys Tyr Glu
12485 12490 12495
Glu Asp Met His Arg Pro Gly Ser Arg Lys Phe Asn Thr Thr Glu
12500 12505 12510
Arg Val Leu Gln Thr Leu Leu Gly Pro Met Phe Lys Asn Thr Ser
12515 12520 12525
Val Gly Leu Leu Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg Ser
12530 12535 12540
Glu Lys Asp Gly Ala Ala Thr Gly Val Asp Ala Ile Cys Thr His
12545 12550 12555
Arg Leu Asp Pro Lys Ser Pro Gly Val Asp Arg Glu Gln Leu Tyr
12560 12565 12570
Trp Glu Leu Ser Gln Leu Thr Asn Gly Ile Lys Glu Leu Gly Pro
12575 12580 12585
Tyr Thr Leu Asp Arg Asn Ser Leu Tyr Val Asn Gly Phe Thr His
12590 12595 12600
Trp Ile Pro Val Pro Thr Ser Ser Thr Pro Gly Thr Ser Thr Val
12605 12610 12615
Asp Leu Gly Ser Gly Thr Pro Ser Ser Leu Pro Ser Pro Thr Thr
12620 12625 12630
Ala Gly Pro Leu Leu Val Pro Phe Thr Leu Asn Phe Thr Ile Thr
12635 12640 12645
Asn Leu Lys Tyr Glu Glu Asp Met His Cys Pro Gly Ser Arg Lys
12650 12655 12660
Phe Asn Thr Thr Glu Arg Val Leu Gln Ser Leu Leu Gly Pro Met
12665 12670 12675
Phe Lys Asn Thr Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu
12680 12685 12690
Thr Leu Leu Arg Ser Glu Lys Asp Gly Ala Ala Thr Gly Val Asp
12695 12700 12705
Ala Ile Cys Thr His Arg Leu Asp Pro Lys Ser Pro Gly Val Asp
12710 12715 12720
Arg Glu Gln Leu Tyr Trp Glu Leu Ser Gln Leu Thr Asn Gly Ile
12725 12730 12735
Lys Glu Leu Gly Pro Tyr Thr Leu Asp Arg Asn Ser Leu Tyr Val
12740 12745 12750
Asn Gly Phe Thr His Gln Thr Ser Ala Pro Asn Thr Ser Thr Pro
12755 12760 12765
Gly Thr Ser Thr Val Asp Leu Gly Thr Ser Gly Thr Pro Ser Ser
12770 12775 12780
Leu Pro Ser Pro Thr Ser Ala Gly Pro Leu Leu Val Pro Phe Thr
12785 12790 12795
Leu Asn Phe Thr Ile Thr Asn Leu Gln Tyr Glu Glu Asp Met His
12800 12805 12810
His Pro Gly Ser Arg Lys Phe Asn Thr Thr Glu Arg Val Leu Gln
12815 12820 12825
Gly Leu Leu Gly Pro Met Phe Lys Asn Thr Ser Val Gly Leu Leu
12830 12835 12840
Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg Pro Glu Lys Asn Gly
12845 12850 12855
Ala Ala Thr Gly Met Asp Ala Ile Cys Ser His Arg Leu Asp Pro
12860 12865 12870
Lys Ser Pro Gly Leu Asn Arg Glu Gln Leu Tyr Trp Glu Leu Ser
12875 12880 12885
Gln Leu Thr His Gly Ile Lys Glu Leu Gly Pro Tyr Thr Leu Asp
12890 12895 12900
Arg Asn Ser Leu Tyr Val Asn Gly Phe Thr His Arg Ser Ser Val
12905 12910 12915
Ala Pro Thr Ser Thr Pro Gly Thr Ser Thr Val Asp Leu Gly Thr
12920 12925 12930
Ser Gly Thr Pro Ser Ser Leu Pro Ser Pro Thr Thr Ala Val Pro
12935 12940 12945
Leu Leu Val Pro Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Gln
12950 12955 12960
Tyr Gly Glu Asp Met Arg His Pro Gly Ser Arg Lys Phe Asn Thr
12965 12970 12975
Thr Glu Arg Val Leu Gln Gly Leu Leu Gly Pro Leu Phe Lys Asn
12980 12985 12990
Ser Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu Ile Ser Leu
12995 13000 13005
Arg Ser Glu Lys Asp Gly Ala Ala Thr Gly Val Asp Ala Ile Cys
13010 13015 13020
Thr His His Leu Asn Pro Gln Ser Pro Gly Leu Asp Arg Glu Gln
13025 13030 13035
Leu Tyr Trp Gln Leu Ser Gln Met Thr Asn Gly Ile Lys Glu Leu
13040 13045 13050
Gly Pro Tyr Thr Leu Asp Arg Asn Ser Leu Tyr Val Asn Gly Phe
13055 13060 13065
Thr His Arg Ser Ser Gly Leu Thr Thr Ser Thr Pro Trp Thr Ser
13070 13075 13080
Thr Val Asp Leu Gly Thr Ser Gly Thr Pro Ser Pro Val Pro Ser
13085 13090 13095
Pro Thr Thr Thr Gly Pro Leu Leu Val Pro Phe Thr Leu Asn Phe
13100 13105 13110
Thr Ile Thr Asn Leu Gln Tyr Glu Glu Asn Met Gly His Pro Gly
13115 13120 13125
Ser Arg Lys Phe Asn Ile Thr Glu Ser Val Leu Gln Gly Leu Leu
13130 13135 13140
Lys Pro Leu Phe Lys Ser Thr Ser Val Gly Pro Leu Tyr Ser Gly
13145 13150 13155
Cys Arg Leu Thr Leu Leu Arg Pro Glu Lys Asp Gly Val Ala Thr
13160 13165 13170
Arg Val Asp Ala Ile Cys Thr His Arg Pro Asp Pro Lys Ile Pro
13175 13180 13185
Gly Leu Asp Arg Gln Gln Leu Tyr Trp Glu Leu Ser Gln Leu Thr
13190 13195 13200
His Ser Ile Thr Glu Leu Gly Pro Tyr Thr Leu Asp Arg Asp Ser
13205 13210 13215
Leu Tyr Val Asn Gly Phe Thr Gln Arg Ser Ser Val Pro Thr Thr
13220 13225 13230
Ser Thr Pro Gly Thr Phe Thr Val Gln Pro Glu Thr Ser Glu Thr
13235 13240 13245
Pro Ser Ser Leu Pro Gly Pro Thr Ala Thr Gly Pro Val Leu Leu
13250 13255 13260
Pro Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Gln Tyr Glu Glu
13265 13270 13275
Asp Met Arg Arg Pro Gly Ser Arg Lys Phe Asn Thr Thr Glu Arg
13280 13285 13290
Val Leu Gln Gly Leu Leu Met Pro Leu Phe Lys Asn Thr Ser Val
13295 13300 13305
Ser Ser Leu Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg Pro Glu
13310 13315 13320
Lys Asp Gly Ala Ala Thr Arg Val Asp Ala Val Cys Thr His Arg
13325 13330 13335
Pro Asp Pro Lys Ser Pro Gly Leu Asp Arg Glu Arg Leu Tyr Trp
13340 13345 13350
Lys Leu Ser Gln Leu Thr His Gly Ile Thr Glu Leu Gly Pro Tyr
13355 13360 13365
Thr Leu Asp Arg His Ser Leu Tyr Val Asn Gly Phe Thr His Gln
13370 13375 13380
Ser Ser Met Thr Thr Thr Arg Thr Pro Asp Thr Ser Thr Met His
13385 13390 13395
Leu Ala Thr Ser Arg Thr Pro Ala Ser Leu Ser Gly Pro Met Thr
13400 13405 13410
Ala Ser Pro Leu Leu Val Leu Phe Thr Ile Asn Phe Thr Ile Thr
13415 13420 13425
Asn Leu Arg Tyr Glu Glu Asn Met His His Pro Gly Ser Arg Lys
13430 13435 13440
Phe Asn Thr Thr Glu Arg Val Leu Gln Gly Leu Leu Arg Pro Val
13445 13450 13455
Phe Lys Asn Thr Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu
13460 13465 13470
Thr Leu Leu Arg Pro Lys Lys Asp Gly Ala Ala Thr Lys Val Asp
13475 13480 13485
Ala Ile Cys Thr Tyr Arg Pro Asp Pro Lys Ser Pro Gly Leu Asp
13490 13495 13500
Arg Glu Gln Leu Tyr Trp Glu Leu Ser Gln Leu Thr His Ser Ile
13505 13510 13515
Thr Glu Leu Gly Pro Tyr Thr Leu Asp Arg Asp Ser Leu Tyr Val
13520 13525 13530
Asn Gly Phe Thr Gln Arg Ser Ser Val Pro Thr Thr Ser Ile Pro
13535 13540 13545
Gly Thr Pro Thr Val Asp Leu Gly Thr Ser Gly Thr Pro Val Ser
13550 13555 13560
Lys Pro Gly Pro Ser Ala Ala Ser Pro Leu Leu Val Leu Phe Thr
13565 13570 13575
Leu Asn Phe Thr Ile Thr Asn Leu Arg Tyr Glu Glu Asn Met Gln
13580 13585 13590
His Pro Gly Ser Arg Lys Phe Asn Thr Thr Glu Arg Val Leu Gln
13595 13600 13605
Gly Leu Leu Arg Ser Leu Phe Lys Ser Thr Ser Val Gly Pro Leu
13610 13615 13620
Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg Pro Glu Lys Asp Gly
13625 13630 13635
Thr Ala Thr Gly Val Asp Ala Ile Cys Thr His His Pro Asp Pro
13640 13645 13650
Lys Ser Pro Arg Leu Asp Arg Glu Gln Leu Tyr Trp Glu Leu Ser
13655 13660 13665
Gln Leu Thr His Asn Ile Thr Glu Leu Gly Pro Tyr Ala Leu Asp
13670 13675 13680
Asn Asp Ser Leu Phe Val Asn Gly Phe Thr His Arg Ser Ser Val
13685 13690 13695
Ser Thr Thr Ser Thr Pro Gly Thr Pro Thr Val Tyr Leu Gly Ala
13700 13705 13710
Ser Lys Thr Pro Ala Ser Ile Phe Gly Pro Ser Ala Ala Ser His
13715 13720 13725
Leu Leu Ile Leu Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Arg
13730 13735 13740
Tyr Glu Glu Asn Met Trp Pro Gly Ser Arg Lys Phe Asn Thr Thr
13745 13750 13755
Glu Arg Val Leu Gln Gly Leu Leu Arg Pro Leu Phe Lys Asn Thr
13760 13765 13770
Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg
13775 13780 13785
Pro Glu Lys Asp Gly Glu Ala Thr Gly Val Asp Ala Ile Cys Thr
13790 13795 13800
His Arg Pro Asp Pro Thr Gly Pro Gly Leu Asp Arg Glu Gln Leu
13805 13810 13815
Tyr Leu Glu Leu Ser Gln Leu Thr His Ser Ile Thr Glu Leu Gly
13820 13825 13830
Pro Tyr Thr Leu Asp Arg Asp Ser Leu Tyr Val Asn Gly Phe Thr
13835 13840 13845
His Arg Ser Ser Val Pro Thr Thr Ser Thr Gly Val Val Ser Glu
13850 13855 13860
Glu Pro Phe Thr Leu Asn Phe Thr Ile Asn Asn Leu Arg Tyr Met
13865 13870 13875
Ala Asp Met Gly Gln Pro Gly Ser Leu Lys Phe Asn Ile Thr Asp
13880 13885 13890
Asn Val Met Gln His Leu Leu Ser Pro Leu Phe Gln Arg Ser Ser
13895 13900 13905
Leu Gly Ala Arg Tyr Thr Gly Cys Arg Val Ile Ala Leu Arg Ser
13910 13915 13920
Val Lys Asn Gly Ala Glu Thr Arg Val Asp Leu Leu Cys Thr Tyr
13925 13930 13935
Leu Gln Pro Leu Ser Gly Pro Gly Leu Pro Ile Lys Gln Val Phe
13940 13945 13950
His Glu Leu Ser Gln Gln Thr His Gly Ile Thr Arg Leu Gly Pro
13955 13960 13965
Tyr Ser Leu Asp Lys Asp Ser Leu Tyr Leu Asn Gly Tyr Asn Glu
13970 13975 13980
Pro Gly Pro Asp Glu Pro Pro Thr Thr Pro Lys Pro Ala Thr Thr
13985 13990 13995
Phe Leu Pro Pro Leu Ser Glu Ala Thr Thr Ala Met Gly Tyr His
14000 14005 14010
Leu Lys Thr Leu Thr Leu Asn Phe Thr Ile Ser Asn Leu Gln Tyr
14015 14020 14025
Ser Pro Asp Met Gly Lys Gly Ser Ala Thr Phe Asn Ser Thr Glu
14030 14035 14040
Gly Val Leu Gln His Leu Leu Arg Pro Leu Phe Gln Lys Ser Ser
14045 14050 14055
Met Gly Pro Phe Tyr Leu Gly Cys Gln Leu Ile Ser Leu Arg Pro
14060 14065 14070
Glu Lys Asp Gly Ala Ala Thr Gly Val Asp Thr Thr Cys Thr Tyr
14075 14080 14085
His Pro Asp Pro Val Gly Pro Gly Leu Asp Ile Gln Gln Leu Tyr
14090 14095 14100
Trp Glu Leu Ser Gln Leu Thr His Gly Val Thr Gln Leu Gly Phe
14105 14110 14115
Tyr Val Leu Asp Arg Asp Ser Leu Phe Ile Asn Gly Tyr Ala Pro
14120 14125 14130
Gln Asn Leu Ser Ile Arg Gly Glu Tyr Gln Ile Asn Phe His Ile
14135 14140 14145
Val Asn Trp Asn Leu Ser Asn Pro Asp Pro Thr Ser Ser Glu Tyr
14150 14155 14160
Ile Thr Leu Leu Arg Asp Ile Gln Asp Lys Val Thr Thr Leu Tyr
14165 14170 14175
Lys Gly Ser Gln Leu His Asp Thr Phe Arg Phe Cys Leu Val Thr
14180 14185 14190
Asn Leu Thr Met Asp Ser Val Leu Val Thr Val Lys Ala Leu Phe
14195 14200 14205
Ser Ser Asn Leu Asp Pro Ser Leu Val Glu Gln Val Phe Leu Asp
14210 14215 14220
Lys Thr Leu Asn Ala Ser Phe His Trp Leu Gly Ser Thr Tyr Gln
14225 14230 14235
Leu Val Asp Ile His Val Thr Glu Met Glu Ser Ser Val Tyr Gln
14240 14245 14250
Pro Thr Ser Ser Ser Ser Thr Gln His Phe Tyr Leu Asn Phe Thr
14255 14260 14265
Ile Thr Asn Leu Pro Tyr Ser Gln Asp Lys Ala Gln Pro Gly Thr
14270 14275 14280
Thr Asn Tyr Gln Arg Asn Lys Arg Asn Ile Glu Asp Ala Leu Asn
14285 14290 14295
Gln Leu Phe Arg Asn Ser Ser Ile Lys Ser Tyr Phe Ser Asp Cys
14300 14305 14310
Gln Val Ser Thr Phe Arg Ser Val Pro Asn Arg His His Thr Gly
14315 14320 14325
Val Asp Ser Leu Cys Asn Phe Ser Pro Leu Ala Arg Arg Val Asp
14330 14335 14340
Arg Val Ala Ile Tyr Glu Glu Phe Leu Arg Met Thr Arg Asn Gly
14345 14350 14355
Thr Gln Leu Gln Asn Phe Thr Leu Asp Arg Ser Ser Val Leu Val
14360 14365 14370
Asp Gly Tyr Ser Pro Asn Arg Asn Glu Pro Leu Thr Gly Asn Ser
14375 14380 14385
Asp Leu Pro Phe Trp Ala Val Ile Leu Ile Gly Leu Ala Gly Leu
14390 14395 14400
Leu Gly Val Ile Thr Cys Leu Ile Cys Gly Val Leu Val Thr Thr
14405 14410 14415
Arg Arg Arg Lys Lys Glu Gly Glu Tyr Asn Val Gln Gln Gln Cys
14420 14425 14430
Pro Gly Tyr Tyr Gln Ser His Leu Asp Leu Glu Asp Leu Gln
14435 14440 14445
<210> 151
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> MUC16c114-N1
<400> 151
Ala Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Thr Arg Asn Gly Thr Gln Leu Gln Asn Phe Thr
20 25 30
Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn Arg Asn
35 40 45
Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro Phe Trp Ala Val Ile Leu
50 55 60
Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile Thr Cys Leu Ile Cys Gly
65 70 75 80
Val Leu Val Thr Thr Arg Arg Arg Lys Lys Glu Gly Glu Tyr Asn Val
85 90 95
Gln Gln Gln Cys Pro Gly Tyr Tyr Gln Ser His Leu Asp Leu Glu Asp
100 105 110
Leu Gln
<210> 152
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> MUC16c114-N2
<400> 152
Asn Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Thr Arg Ala Gly Thr Gln Leu Gln Asn Phe Thr
20 25 30
Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn Arg Asn
35 40 45
Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro Phe Trp Ala Val Ile Leu
50 55 60
Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile Thr Cys Leu Ile Cys Gly
65 70 75 80
Val Leu Val Thr Thr Arg Arg Arg Lys Lys Glu Gly Glu Tyr Asn Val
85 90 95
Gln Gln Gln Cys Pro Gly Tyr Tyr Gln Ser His Leu Asp Leu Glu Asp
100 105 110
Leu Gln
<210> 153
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> MUC16c114-N12
<400> 153
Ala Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Thr Arg Ala Gly Thr Gln Leu Gln Asn Phe Thr
20 25 30
Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn Arg Asn
35 40 45
Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro Phe Trp Ala Val Ile Leu
50 55 60
Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile Thr Cys Leu Ile Cys Gly
65 70 75 80
Val Leu Val Thr Thr Arg Arg Arg Lys Lys Glu Gly Glu Tyr Asn Val
85 90 95
Gln Gln Gln Cys Pro Gly Tyr Tyr Gln Ser His Leu Asp Leu Glu Asp
100 105 110
Leu Gln
<210> 154
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> MUC16c114-N123
<400> 154
Ala Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Thr Arg Ala Gly Thr Gln Leu Gln Ala Phe Thr
20 25 30
Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn Arg Asn
35 40 45
Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro Phe Trp Ala Val Ile Leu
50 55 60
Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile Thr Cys Leu Ile Cys Gly
65 70 75 80
Val Leu Val Thr Thr Arg Arg Arg Lys Lys Glu Gly Glu Tyr Asn Val
85 90 95
Gln Gln Gln Cys Pro Gly Tyr Tyr Gln Ser His Leu Asp Leu Glu Asp
100 105 110
Leu Gln
<210> 155
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> N-конец первого тандемного повтора MUC16c344
<400> 155
Trp Glu Leu Ser Gln Leu
1 5
<210> 156
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> C-конец первого тандемного повтора MUC16c344
<400> 156
Thr Gly Val Asp Ser Leu Cys
1 5
<210> 157
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> N-конец эктодомена MUC16c344
<400> 157
Asn Phe Ser Pro Leu Ala Arg
1 5
<210> 158
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> C-конец эктодомена MUC16c344
<400> 158
Thr Gly Asn Ser Asp Leu Pro
1 5
<210> 159
<211> 25
<212> Белок
<213> Искусственная последовательность
<220>
<223> Трансмембранн.
<400> 159
Phe Trp Ala Val Ile Leu Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile
1 5 10 15
Thr Cys Leu Ile Cys Gly Val Leu Val
20 25
<210> 160
<211> 31
<212> Белок
<213> Искусственная последовательность
<220>
<223> Цитоплазматический хвост
<400> 160
Thr Thr Arg Arg Arg Lys Lys Glu Gly Glu Tyr Asn Val Gln Gln Gln
1 5 10 15
Cys Pro Gly Tyr Tyr Gln Ser His Leu Asp Leu Glu Asp Leu Gln
20 25 30
<210> 161
<211> 58
<212> Белок
<213> Искусственная последовательность
<220>
<223> эктодомен MUC16c114
<400> 161
Asn Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Thr Arg Asn Gly Thr Gln Leu Gln Asn Phe Thr
20 25 30
Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn Arg Asn
35 40 45
Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro
50 55
<210> 162
<211> 24
<212> Белок
<213> Искусственная последовательность
<220>
<223> эктодомен MUC16c80
<400> 162
Asn Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Asp Leu Pro
20
<210> 163
<211> 58
<212> Белок
<213> Искусственная последовательность
<220>
<223> эктодомен MUC16c86
<400> 163
Asn Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Thr Arg Asn Gly Thr Gln Leu Gln Asn Phe Thr
20 25 30
Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn Arg Asn
35 40 45
Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro
50 55
<210> 164
<211> 22
<212> Белок
<213> Искусственная последовательность
<220>
<223> трансмембранн. MUC16c86
<400> 164
Phe Trp Ala Val Ile Leu Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile
1 5 10 15
Thr Cys Leu Ile Cys Gly
20
<210> 165
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> цитоплазматическ. MUC16c86
<400> 165
Asp Leu Glu Asp Leu Gln
1 5
<210> 166
<211> 58
<212> Белок
<213> Искусственная последовательность
<220>
<223> эктодомен MUC16 3(N в A)c114
<400> 166
Ala Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Thr Arg Ala Gly Thr Gln Leu Gln Ala Phe Thr
20 25 30
Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn Arg Asn
35 40 45
Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro
50 55
<210> 167
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<223> сахарсвязывающий домен LGALS3
<400> 167
Pro Tyr Asn Leu Pro Leu Pro Gly Gly Val Val Pro Arg Met Leu Ile
1 5 10 15
Thr Ile Leu Gly Thr Val Lys Pro Asn Ala Asn Arg Ile Ala Leu Asp
20 25 30
Phe Gln Arg Gly Asn Asp Val Ala Phe His Phe Asn Pro Arg Phe Asn
35 40 45
Glu Asn Asn Arg Arg Val Ile Val Cys Asn Thr Lys Leu Asp Asn Asn
50 55 60
Trp Gly Arg Glu Glu Arg Gln Ser Val Phe Pro Phe Glu Ser Gly Lys
65 70 75 80
Pro Phe Lys Ile Gln Val Leu Val Glu Pro Asp His Phe Lys Val Ala
85 90 95
Val Asn Asp Ala His Leu Leu Gln Tyr Asn His Arg Val Lys Lys Leu
100 105 110
Asn Glu Ile Ser Lys Leu Gly Ile Ser Gly Asp Ile Asp Leu Thr Ser
115 120 125
<210> 168
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> не гликозилированный пептид 2 MUC16
<400> 168
Cys Thr Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn
1 5 10 15
Arg Asn Glu
<210> 169
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> не родственный MUC16 пептидный 18-мер
<400> 169
Gly Ala Val Pro Arg Ser Ala Thr Ile Asn Val Ser Arg Ile Ala Thr
1 5 10 15
Gly Pro
<210> 170
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> 18-мер (no C)
<400> 170
Thr Arg Asn Gly Thr Gln Leu Gln Asn Phe Thr Leu Asp Arg Ser Ser
1 5 10 15
Val
<210> 171
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> 15-мер (без C)
<400> 171
Gly Thr Gln Leu Gln Asn Phe Thr Leu Asp Arg Ser Ser Val
1 5 10
<210> 172
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> MUC16c114-N23
<400> 172
Asn Phe Ser Pro Leu Ala Arg Arg Val Asp Arg Val Ala Ile Tyr Glu
1 5 10 15
Glu Phe Leu Arg Met Thr Arg Ala Gly Thr Gln Leu Gln Ala Phe Thr
20 25 30
Leu Asp Arg Ser Ser Val Leu Val Asp Gly Tyr Ser Pro Asn Arg Asn
35 40 45
Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro Phe Trp Ala Val Ile Leu
50 55 60
Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile Thr Cys Leu Ile Cys Gly
65 70 75 80
Val Leu Val Thr Thr Arg Arg Arg Lys Lys Glu Gly Glu Tyr Asn Val
85 90 95
Gln Gln Gln Cys Pro Gly Tyr Tyr Gln Ser His Leu Asp Leu Glu Asp
100 105 110
Leu Gln
<210> 173
<211> 344
<212> Белок
<213> Искусственная последовательность
<220>
<223> N24 mut c344
<400> 173
Trp Glu Leu Ser Gln Leu Thr His Gly Val Thr Gln Leu Gly Phe Tyr
1 5 10 15
Val Leu Asp Arg Asp Ser Leu Phe Ile Asn Gly Tyr Ala Pro Gln Asn
20 25 30
Leu Ser Ile Arg Gly Glu Tyr Gln Ile Asn Phe His Ile Val Asn Gln
35 40 45
Asn Leu Ser Asn Pro Asp Pro Thr Ser Ser Glu Tyr Ile Thr Leu Leu
50 55 60
Arg Asp Ile Gln Asp Lys Val Thr Thr Leu Tyr Lys Gly Ser Gln Leu
65 70 75 80
His Asp Thr Phe Arg Phe Cys Leu Val Thr Asn Leu Thr Met Asp Ser
85 90 95
Val Leu Val Thr Val Lys Ala Leu Phe Ser Ser Asn Leu Asp Pro Ser
100 105 110
Leu Val Glu Gln Val Phe Leu Asp Lys Thr Leu Asn Ala Ser Phe His
115 120 125
Gln Leu Gly Ser Thr Tyr Gln Leu Val Asp Ile His Val Thr Glu Met
130 135 140
Glu Ser Ser Val Tyr Gln Pro Thr Ser Ser Ser Ser Thr Gln His Phe
145 150 155 160
Tyr Leu Asn Phe Thr Ile Thr Asn Leu Pro Tyr Ser Gln Asp Lys Ala
165 170 175
Gln Pro Gly Thr Thr Asn Tyr Gln Arg Asn Lys Arg Asn Ile Glu Asp
180 185 190
Ala Leu Asn Gln Leu Phe Arg Asn Ser Ser Ile Lys Ser Tyr Phe Ser
195 200 205
Asp Cys Gln Val Ser Thr Phe Arg Ser Val Pro Asn Arg His His Thr
210 215 220
Gly Val Asp Ser Leu Cys Asn Phe Ser Pro Leu Ala Arg Arg Val Asp
225 230 235 240
Arg Val Ala Ile Tyr Glu Glu Phe Leu Arg Met Thr Arg Ala Gly Thr
245 250 255
Gln Leu Gln Asn Phe Thr Leu Asp Arg Ser Ser Val Leu Val Asp Gly
260 265 270
Tyr Ser Pro Asn Arg Asn Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro
275 280 285
Phe Trp Ala Val Ile Leu Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile
290 295 300
Thr Cys Leu Ile Cys Gly Val Leu Val Thr Thr Arg Arg Arg Lys Lys
305 310 315 320
Glu Gly Glu Tyr Asn Val Gln Gln Gln Cys Pro Gly Tyr Tyr Gln Ser
325 330 335
His Leu Asp Leu Glu Asp Leu Gln
340
<210> 174
<211> 344
<212> Белок
<213> Искусственная последовательность
<220>
<223> N30 mut c344
<400> 174
Trp Glu Leu Ser Gln Leu Thr His Gly Val Thr Gln Leu Gly Phe Tyr
1 5 10 15
Val Leu Asp Arg Asp Ser Leu Phe Ile Asn Gly Tyr Ala Pro Gln Asn
20 25 30
Leu Ser Ile Arg Gly Glu Tyr Gln Ile Asn Phe His Ile Val Asn Gln
35 40 45
Asn Leu Ser Asn Pro Asp Pro Thr Ser Ser Glu Tyr Ile Thr Leu Leu
50 55 60
Arg Asp Ile Gln Asp Lys Val Thr Thr Leu Tyr Lys Gly Ser Gln Leu
65 70 75 80
His Asp Thr Phe Arg Phe Cys Leu Val Thr Asn Leu Thr Met Asp Ser
85 90 95
Val Leu Val Thr Val Lys Ala Leu Phe Ser Ser Asn Leu Asp Pro Ser
100 105 110
Leu Val Glu Gln Val Phe Leu Asp Lys Thr Leu Asn Ala Ser Phe His
115 120 125
Gln Leu Gly Ser Thr Tyr Gln Leu Val Asp Ile His Val Thr Glu Met
130 135 140
Glu Ser Ser Val Tyr Gln Pro Thr Ser Ser Ser Ser Thr Gln His Phe
145 150 155 160
Tyr Leu Asn Phe Thr Ile Thr Asn Leu Pro Tyr Ser Gln Asp Lys Ala
165 170 175
Gln Pro Gly Thr Thr Asn Tyr Gln Arg Asn Lys Arg Asn Ile Glu Asp
180 185 190
Ala Leu Asn Gln Leu Phe Arg Asn Ser Ser Ile Lys Ser Tyr Phe Ser
195 200 205
Asp Cys Gln Val Ser Thr Phe Arg Ser Val Pro Asn Arg His His Thr
210 215 220
Gly Val Asp Ser Leu Cys Asn Phe Ser Pro Leu Ala Arg Arg Val Asp
225 230 235 240
Arg Val Ala Ile Tyr Glu Glu Phe Leu Arg Met Thr Arg Asn Gly Thr
245 250 255
Gln Leu Gln Ala Phe Thr Leu Asp Arg Ser Ser Val Leu Val Asp Gly
260 265 270
Tyr Ser Pro Asn Arg Asn Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro
275 280 285
Phe Trp Ala Val Ile Leu Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile
290 295 300
Thr Cys Leu Ile Cys Gly Val Leu Val Thr Thr Arg Arg Arg Lys Lys
305 310 315 320
Glu Gly Glu Tyr Asn Val Gln Gln Gln Cys Pro Gly Tyr Tyr Gln Ser
325 330 335
His Leu Asp Leu Glu Asp Leu Gln
340
<210> 175
<211> 344
<212> Белок
<213> Искусственная последовательность
<220>
<223> N24-N30 mut c344
<400> 175
Trp Glu Leu Ser Gln Leu Thr His Gly Val Thr Gln Leu Gly Phe Tyr
1 5 10 15
Val Leu Asp Arg Asp Ser Leu Phe Ile Asn Gly Tyr Ala Pro Gln Asn
20 25 30
Leu Ser Ile Arg Gly Glu Tyr Gln Ile Asn Phe His Ile Val Asn Gln
35 40 45
Asn Leu Ser Asn Pro Asp Pro Thr Ser Ser Glu Tyr Ile Thr Leu Leu
50 55 60
Arg Asp Ile Gln Asp Lys Val Thr Thr Leu Tyr Lys Gly Ser Gln Leu
65 70 75 80
His Asp Thr Phe Arg Phe Cys Leu Val Thr Asn Leu Thr Met Asp Ser
85 90 95
Val Leu Val Thr Val Lys Ala Leu Phe Ser Ser Asn Leu Asp Pro Ser
100 105 110
Leu Val Glu Gln Val Phe Leu Asp Lys Thr Leu Asn Ala Ser Phe His
115 120 125
Gln Leu Gly Ser Thr Tyr Gln Leu Val Asp Ile His Val Thr Glu Met
130 135 140
Glu Ser Ser Val Tyr Gln Pro Thr Ser Ser Ser Ser Thr Gln His Phe
145 150 155 160
Tyr Leu Asn Phe Thr Ile Thr Asn Leu Pro Tyr Ser Gln Asp Lys Ala
165 170 175
Gln Pro Gly Thr Thr Asn Tyr Gln Arg Asn Lys Arg Asn Ile Glu Asp
180 185 190
Ala Leu Asn Gln Leu Phe Arg Asn Ser Ser Ile Lys Ser Tyr Phe Ser
195 200 205
Asp Cys Gln Val Ser Thr Phe Arg Ser Val Pro Asn Arg His His Thr
210 215 220
Gly Val Asp Ser Leu Cys Asn Phe Ser Pro Leu Ala Arg Arg Val Asp
225 230 235 240
Arg Val Ala Ile Tyr Glu Glu Phe Leu Arg Met Thr Arg Ala Gly Thr
245 250 255
Gln Leu Gln Ala Phe Thr Leu Asp Arg Ser Ser Val Leu Val Asp Gly
260 265 270
Tyr Ser Pro Asn Arg Asn Glu Pro Leu Thr Gly Asn Ser Asp Leu Pro
275 280 285
Phe Trp Ala Val Ile Leu Ile Gly Leu Ala Gly Leu Leu Gly Leu Ile
290 295 300
Thr Cys Leu Ile Cys Gly Val Leu Val Thr Thr Arg Arg Arg Lys Lys
305 310 315 320
Glu Gly Glu Tyr Asn Val Gln Gln Gln Cys Pro Gly Tyr Tyr Gln Ser
325 330 335
His Leu Asp Leu Glu Asp Leu Gln
340
<---
Реферат
Настоящее изобретение относится к области иммунологии. Предложены антитела или их антигенсвязывающие фрагменты, которые иммуноспецифически связываются с MUC16, конъюгаты, химерный антигенный рецептор, Т-клетка, полинуклеотиды. Кроме того, рассмотрен вектор, клетки, фармацевтическая композиция, способ лечения MUC16-положительного рака. Данное изобретение может найти дальнейшее применение в терапии MUC16-положительного рака. 22 н. и 18 з.п. ф-лы, 109 ил., 13 табл., 4 пр.
Формула
Документы, цитированные в отчёте о поиске
Антитела, сконструированные на основе цистеинов, и их конъюгаты
Патенты аналоги
Антитела, сконструированные на основе цистеинов, и их конъюгаты

Комментарии