Металлоорганическая структура и способ ее производства - RU2686901C1
Код документа: RU2686901C1
Чертежи









Описание
УРОВЕНЬ ТЕХНИКИ
1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение раскрывает металлоорганическую структуру и способ ее производства.
2. ОПИСАНИЕ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
[0002] Металлоорганическая структура (в дальнейшем также упоминаемая как «MOF»), которая является пористым соединением, была исследована и разработана как материал, имеющий такую функцию, как хранение газов или разделение газов.
[0003] В качестве методики, относящейся к MOF, например, публикация H. Furukawa et al. «Water adsorption in porous metal-organic frameworks and related materials» J. Am. Chem. Soc. 2014, 136, 4369-4381 раскрывает MOF (MOF-808), включающую в себя Zr4+ в качестве иона металла, ион тримезата в качестве мультидентатного лиганда и ион формиата в качестве монодентатного лиганда. Публикация W. Liang et al. «Turning pore size in a zirconium-tricarboxylate metal-organic framework», Cryst. Eng. Comm. 2014, 16, 6530-6533, раскрывает MOF, включающую в себя Zr4+ в качестве иона металла, ион тримезата в качестве мультидентатного лиганда, а также ион формиата, ион ацетата или ион пропаноата в качестве монодентатного лиганда.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0004] MOF, раскрытые в публикации H. Furukawa et al. «Water adsorption in porous metal-organic frameworks and related materials» J. Am. Chem. Soc. 2014, 136, 4369-4381, а также в публикации W. Liang et al. «Turning pore size in a zirconium-tricarboxylate metal-organic framework», Cryst. Eng. Comm. 2014, 16, 6530-6533, показывают характеристики адсорбирования и десорбирования водяного пара в соответствии с изменением относительной влажности, но оставляют пространство для увеличения количества адсорбируемого и десорбируемого водяного пара. В дополнение к этому в MOF, раскрытых в публикации H. Furukawa et al. «Water adsorption in porous metal-organic frameworks and related materials» J. Am. Chem. Soc. 2014, 136, 4369-4381, а также в публикации W. Liang et al. «Turning pore size in a zirconium-tricarboxylate metal-organic framework», Cryst. Eng. Comm. 2014, 16, 6530-6533, в том случае, когда водяной пар адсорбируется и десорбируется при условиях, в которых изменение относительной влажности является относительно малым, существует проблема того, что десорбция не развивается в достаточной степени, и адсорбированный водяной пар не может быть полностью использован. Например, публикация H. Furukawa et al. «Water adsorption in porous metal-organic frameworks and related materials» J. Am. Chem. Soc. 2014, 136, 4369-4381 описывает следующее. В том случае, когда относительная влажность увеличивается от 20% до 40% во время адсорбции водяного пара и измерения количества десорбции с использованием MOF-808, количество адсорбции водяного пара составляет приблизительно 600 мл/г (при стандартных температуре и давлении). С другой стороны, даже в том случае, когда относительная влажность уменьшается с 40% до 20%, количество десорбируемого водяного пара составляет всего около 400 мл/г (при стандартных температуре и давлении).
[0005] Настоящее раскрытие предлагает металлоорганическую структуру, в которой адсорбируемое и десорбируемое количества водяного пара являются дополнительно улучшенными, а также способ ее производства.
[0006] Первый аспект настоящего изобретения относится к металлоорганической структуре, включающей в себя: ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента в качестве иона металла; а также ион первой органической молекулы, имеющей скелет тримезиновой кислоты, или ион второй органической молекулы, имеющей скелет изофталевой кислоты, в качестве мультидентатных лигандов.
[0007] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения ион металла может быть по меньшей мере одним ионом, выбираемым из группы, состоящей из Zr4+, Hf4+ и Ce4+.
[0008] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения ион металла может представлять собой Zr4+.
[0009] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения ион первой органической молекулы, имеющей скелет тримезиновой кислоты, может быть ионом тримезата.
[0010] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения полный электрический заряд иона второй органической молекулы, имеющей скелет изофталевой кислоты, может быть равен -2 или больше.
[0011] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения ион второй органической молекулы, имеющей скелет изофталевой кислоты, может быть по меньшей мере одним ионом, выбираемым из группы, состоящей из иона изофталата, иона 5-гидроксиизофталата, иона 5-нитроизофталата, иона 5-трет-бутилизофталата, иона 5-хлоризофталата, иона 4-бромизофталата и иона 4,6-диметилизофталата.
[0012] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения ион второй органической молекулы, имеющей скелет изофталевой кислоты, может быть ионом изофталата.
[0013] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения доля иона второй органической молекулы, имеющей скелет изофталевой кислоты, может быть меньше чем 8,4 мол.% относительно всех мультидентатных лигандов.
[0014] Металлоорганическая структура в соответствии с первым аспектом настоящего изобретения может дополнительно включать в себя ион одновалентного линейного насыщенного алифатического карбоксилата, имеющий от 1 до 3 атомов углерода, в качестве монодентатного лиганда.
[0015] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения монодентатный лиганд может быть по меньшей мере любым из иона формиата или иона ацетата.
[0016] Второй аспект настоящего изобретения относится к способу производства металлоорганической структуры, включающему в себя нагревание раствора, включающего в себя источник иона металла, который включает в себя ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента, первую органическую молекулу, имеющую скелет тримезиновой кислоты или ее соли, вторую органическую молекулу, имеющую скелет изофталевой кислоты или ее соли, и растворитель.
[0017] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения источник иона металла может быть соединением циркония.
[0018] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения соединение циркония может быть по меньшей мере либо оксихлоридом октогидрата циркония, либо хлоридом циркония.
[0019] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения первая органическая молекула, имеющая скелет тримезиновой кислоты, может быть тримезиновой кислотой.
[0020] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения вторая органическая молекула, имеющая скелет изофталевой кислоты, может не иметь функциональной группы, имеющей более низкое значение pKa, чем карбоксильная группа изофталевой кислоты.
[0021] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения вторая органическая молекула, имеющая скелет изофталевой кислоты, может быть по меньшей мере одним веществом, выбираемым из группы, состоящей из изофталевой кислоты, 5-гидроксиизофталевой кислоты, 5-нитроизофталевой кислоты, 5-трет-бутилизофталевой кислоты, 5-хлоризофталевой кислоты, 4-бромизофталевой кислоты и 4,6-диметилизофталевой кислоты.
[0022] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения вторая органическая молекула, имеющая скелет изофталевой кислоты, может быть изофталевой кислотой.
[0023] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения доля второй органической молекулы, имеющей скелет изофталевой кислоты, может быть меньше, чем 40 мол.% относительно общей суммы первой органической молекулы, имеющей скелет тримезиновой кислоты, и второй органической молекулы, имеющей скелет изофталевой кислоты.
[0024] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения в качестве растворителя могут использоваться амид и карбоновая кислота.
[0025] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения амид может быть по меньшей мере N,N-диметилформамидом или N,N-диэтилформамидом.
[0026] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения карбоновая кислота может быть одновалентной линейной насыщенной алифатической карбоновой кислотой, имеющей 1-3 атома углерода.
[0027] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения карбоновая кислота может быть по меньшей мере муравьиной кислотой или уксусной кислотой.
[0028] Настоящее изобретение может обеспечить металлоорганическую структуру, в которой адсорбируемое и десорбируемое количества водяного пара являются дополнительно улучшенными, а также способ ее производства.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0029] Особенности, преимущества, а также техническое и промышленное значение примерных вариантов осуществления настоящего изобретения будут описаны ниже со ссылками на сопроводительные чертежи, в которых одинаковые ссылочные цифры обозначают одинаковые элементы, и в которых:
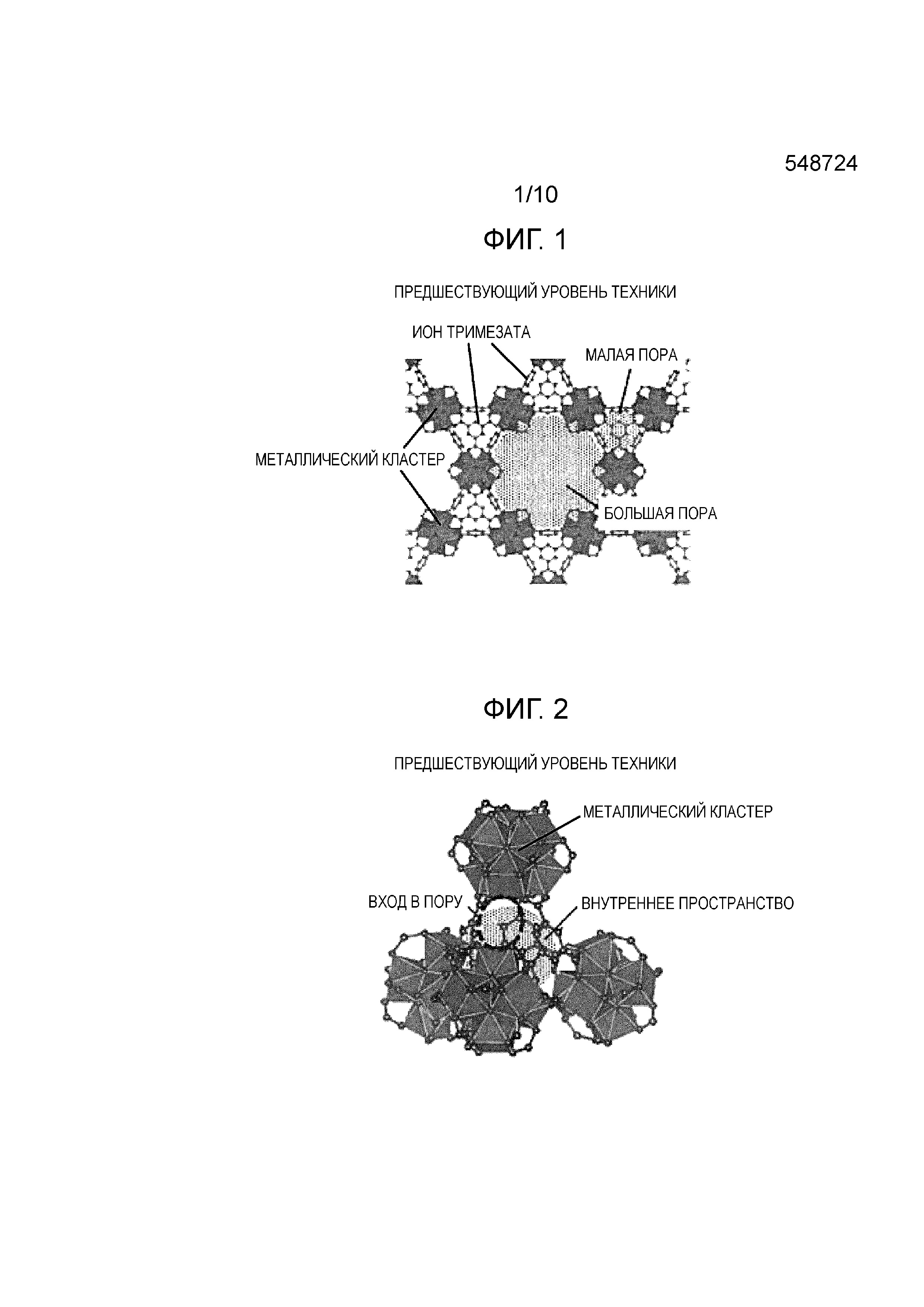
Фиг. 1 представляет собой диаграмму, показывающую кристаллическую структуру MOF (MOF-808) в соответствии с предшествующим уровнем техники;
Фиг. 2 представляет собой диаграмму, показывающую незаполненное пространство кристаллической структуры (клетку), которое формирует малую пору в кристаллической структуре MOF в соответствии с предшествующим уровнем техники;
Фиг. 3 представляет собой диаграмму, схематично показывающую позиционное соотношение между большими порами и малыми порами в MOF в соответствии с предшествующим уровнем техники, а также схематично показывающую состояние внутренней части пор во время адсорбции и десорбции водяного пара;
Фиг. 4 представляет собой диаграмму, соответствующую Фиг. 1, показывающую примерную кристаллическую структуру MOF в соответствии с настоящим изобретением;
Фиг. 5 представляет собой диаграмму, соответствующую Фиг. 2, показывающую клетку, в которую введен дефект в примерной кристаллической структуре MOF в соответствии с настоящим изобретением;
Фиг. 6 представляет собой диаграмму, соответствующую Фиг. 3, схематично показывающую позиционное соотношение между большими порами и малыми порами в MOF в соответствии с настоящим изобретением, а также схематично показывающую состояние внутренней части пор во время адсорбции и десорбции водяного пара;
Фиг. 7 представляет собой блок-схему, показывающую один пример способа производства MOF в соответствии с настоящим изобретением;
Фиг. 8 представляет собой блок-схему, показывающую способ производства MOF в соответствии с Примером 1;
Фиг. 9 представляет собой график, показывающий рентгеновскую дифракцию для MOF в соответствии с Примерами 1-3 и Сравнительными примерами 1-3;
Фиг. 10 представляет собой график, показывающий рентгеновскую дифракцию для MOF в соответствии с Примерами 4-9;
Фиг. 11 представляет собой график, показывающий рентгеновскую дифракцию для MOF в соответствии со Сравнительными примерами 4-9;
Фиг. 12 представляет собой график, показывающий рентгеновскую дифракцию для MOF в соответствии с Примерами 10-12 и Сравнительными примерами 10-12;
Фиг. 13 представляет собой график, показывающий изотермы адсорбции азота для MOF в соответствии с Примером 1 и Сравнительным примером 1;
Фиг. 14 представляет собой график, показывающий величины адсорбции азота для MOF в соответствии с Примерами 1-3 и Сравнительными примерами 1-3;
Фиг. 15 представляет собой график, показывающий величины адсорбции азота для MOF в соответствии с Примерами 4-9;
Фиг. 16 представляет собой график, показывающий величины адсорбции азота для MOF в соответствии со Сравнительными примерами 4-9;
Фиг. 17 представляет собой график, показывающий величины адсорбции азота для MOF в соответствии с Примерами 10-12 и Сравнительными примерами 10-12;
Фиг. 18 представляет собой график, показывающий изотермы адсорбции и десорбции водяного пара для MOF в соответствии с Примером 1 и Сравнительным примером 1; и
Фиг. 19 представляет собой график, показывающий величины адсорбции и десорбции водяного пара для MOF в соответствии с Примерами 1-12 и Сравнительным примером 1.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0030] Далее настоящее изобретение будет описано со ссылкой на чертежи. Следующий вариант осуществления представляет собой один пример настоящего изобретения и не ограничивает настоящее изобретение.
1. Металлоорганическая структура (MOF)
[0031] Первый вариант осуществления настоящего изобретения относится к металлоорганической структуре (MOF), включающей в себя: ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента в качестве иона металла; а также ион органической молекулы, имеющей скелет тримезиновой кислоты, или ион органической молекулы, имеющей скелет изофталевой кислоты, в качестве мультидентатных лигандов.
[0032] При использовании MOF в соответствии с настоящим изобретением величины адсорбции и десорбции водяного пара могут быть улучшены по сравнению с MOF предшествующего уровня техники. MOF в соответствии с настоящим изобретением может в достаточной степени выполнять десорбцию при условиях, в которых изменение относительной влажности является относительно малым. Предполагаемая причина этого будет описана со ссылкой на Фиг. 1-6. Фиг. 1-3 представляют собой диаграммы, показывающие кристаллическую структуру MOF-808 в соответствии с предшествующим уровнем техники, а Фиг. 4-6 представляют собой диаграммы, показывающие примерную кристаллическую структуру MOF в соответствии с настоящим изобретением. Фиг. 1-3 соответствуют Фиг. 4-6, соответственно.
[0033] Фиг. 1 представляет собой диаграмму, показывающую кристаллическую структуру MOF (MOF-808) в соответствии с предшествующим уровнем техники; Как показано на Фиг. 1, MOF в соответствии с предшествующим уровнем техники имеет трехмерную структуру, в которой кластеры металла (в примере, показанном на Фиг. 1 и 2, Zr6O4(OH)4(-CO2)6), включающие в себя Zr4+, которые являются вторичными строительными блоками (SBU), связаны друг с другом через ион органической молекулы, имеющей скелет тримезиновой кислоты (тридентатный лиганд; в примере, показанном на Фиг. 1 и 2, ион тримезата), который является органическим связывающим агентом, и включает в себя два вида пор (большие поры и малые поры), имеющие различные размеры. Фиг. 2 представляет собой диаграмму, показывающую незаполненное пространство кристаллической структуры (клетку), которое формирует малую пору в кристаллической структуре MOF в соответствии с предшествующим уровнем техники. Как показано на Фиг. 2, малая пора формируется в тетраэдрической клетке, которая формируется путем связывания четырех кластеров металла друг с другом через ион тримезата, располагающийся в вершине тетраэдра. Как показано на Фиг. 2, используется структура (так называемая структура пузырька для чернил), в которой вход в малую пору является более узким, чем внутреннее пространство. Фиг. 3 представляет собой диаграмму, схематично показывающую позиционное соотношение между большими порами и малыми порами, а также схематично показывающую состояние внутренней части пор во время адсорбции и десорбции водяного пара. Как показано на Фиг. 3, большие поры и малые поры имеют некоторое позиционное соотношение, в котором малая пора присутствует на задней стороне положения, в котором связаны большие поры, и малая пора имеет описанную выше структуру пузырька для чернил. Поскольку MOF в соответствии с предшествующим уровнем техники имеет эту структуру, предполагается следующее. Водяной пар может адсорбироваться как большими порами, так и малыми порами во время адсорбции, но во время десорбции трудно десорбировать водяной пар, адсорбированный в малых порах. В частности, адсорбция и десорбция повторяются при условиях, когда изменение относительной влажности является относительно малым (например, относительное давление меняется от 0,2 до 0,4), десорбция водяного пара, адсорбированного в малых порах, происходит в недостаточной степени, и водяной пар, адсорбированный в малых порах, не может быть полностью использован.
[0034] С другой стороны, в MOF в соответствии с настоящим изобретением предполагается следующее. Некоторые ионы органической молекулы, имеющей скелет тримезиновой кислоты (тридентатные лиганды; в примере, показанном на Фиг. 4 и 5, ионы тримезата), обмениваются с ионами органической молекулы, имеющей скелет изофталевой кислоты (бидентатные лиганды; в примере, показанном на Фиг. 4 и 5, ионы изофталата). В результате функциональные групп, координированных с ионами металла, и отрицательных электрических зарядов становится недостаточно, и, как показано на Фиг. 4 и 6, дефекты вводятся в структуру MOF для компенсации заряда. Таким образом предполагается, что увеличивается новое пространство, способное к адсорбции, и вес уменьшается благодаря уменьшению плотности скелета, так что величины адсорбции и десорбции водяного пара увеличиваются. В дополнение к этому, как показано на Фиг. 4 и 6, предполагается, что входы малых пор увеличиваются в размерах благодаря введение дефектов, и структура пузырька для чернил деформируется. В результате предполагается, что водяной пар, адсорбированный в малых порах, вероятно будет десорбирован при условиях, когда изменение относительной влажности является относительно малым. Далее каждый из компонентов, составляющих MOF в соответствии с настоящим изобретением, будет описан по порядку.
1.1. Ион металла
[0035] MOF в соответствии с настоящим изобретением включает в себя ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента в качестве иона металла. Для того, чтобы получить кристаллическую структуру MOF в соответствии с настоящим изобретением, ион металла должен быть четырехвалентным. Примеры иона четырехвалентного элемента Группы 4 включают в себя Ti4+, Zr4+ и Hf4+. Примеры иона четырехвалентного редкоземельного элемента включают в себя Ce4+, Pr4+, Tb4+ и Dy4+. MOF в соответствии с настоящим изобретением включает в себя множество видов ионов металла, выбираемых из примеров иона четырехвалентного элемента Группы 4 и примеров иона четырехвалентного редкоземельного элемента. Ион металла особенно не ограничивается, но должен быть восьмикоординирован с оксидным ионом (O2-) для формирования металлического кластера, который является вторичным строительным блоком (SBU) для MOF. Следовательно, ион металла, имеющий относительно большой ионный радиус, является подходящим. С учетом доступности и стабильности четырехвалентного иона, предпочтительным является по меньшей мере один вид иона, выбираемый из группы, состоящей из Zr4+, Hf4+ и Ce4+, и Zr4+ является более предпочтительным.
1.2. Мультидентатный лиганд
[0036] MOF в соответствии с настоящим изобретением включает в себя ион органической молекулы, имеющей скелет тримезиновой кислоты, и ион органической молекулы, имеющей скелет изофталевой кислоты, в качестве мультидентатных лигандов.
1.2.1. Ион органической молекулы, имеющей скелет тримезиновой кислоты
[0037] Ион органической молекулы, имеющей скелет тримезиновой кислоты, относится, например, к иону, имеющему структуру, представленную следующей Формулой (1).
[0038] В Формуле (1) R представляет собой заместитель, а n - натуральное число от 1 до 3. Заместитель R особенно не ограничивается, при условии, что он может образовывать MOF в соответствии с настоящим изобретением, и его примеры включают в себя гидроксильную группу, нитрогруппу, фторную группу, хлорную группу, бромную группу, йодную группу, метиловую группу, этиловую группу и группу трет-бутила.
[0039] Конкретные примеры иона органической молекулы, имеющей скелет тримезиновой кислоты, который имеет эту структуру и может формировать MOF в соответствии с настоящим изобретением, включают в себя по меньшей мере один ион, выбираемый из группы, состоящей из иона тримезата (BTC3-), иона 2-гидрокси-1,3,5-бензолтрикарбоксилата, иона 2-нитро-1,3,5-бензолтрикарбоксилата, иона 2-хлор-1,3,5-бензолтрикарбоксилата, иона 2-бром-1,3,5-бензолтрикарбоксилата и иона 2-метил-1,3,5-бензолтрикарбоксилата. В частности, ион органической молекулы, имеющей скелет тримезиновой кислоты, особенно не ограничивается и предпочтительно является ионом тримезата (BTC3-).
1.2.2. Ион органической молекулы, имеющей скелет изофталевой кислоты
[0040] Ион органической молекулы, имеющей скелет изофталевой кислоты, относится, например, к иону, имеющему структуру, представленную следующей Формулой (2).
[0041] В Формуле (2) R представляет собой заместитель, а n - натуральное число от 1 до 4. Заместитель R особенно не ограничивается, при условии, что он может позволять иону органической молекулы функционировать в качестве органического связывающего агента и может образовывать MOF в соответствии с настоящим изобретением, и его примеры включают в себя гидроксильную группу, нитрогруппу, фторную группу, хлорную группу, бромную группу, йодную группу, метиловую группу, этиловую группу и группу трет-бутила.
[0042] Полный электрический заряд иона органической молекулы, имеющей скелет изофталевой кислоты, должен составлять -2 или больше. Предполагается, что в том случае, когда полный электрический заряд иона органической молекулы, имеющей скелет изофталевой кислоты, составляет -3 или меньше, полный электрический заряд обмениваемого иона органической молекулы, имеющей скелет тримезиновой кислоты, составляет -3, и таким образом компенсация не нужна, и введение дефектов (дефектов положительно заряженных ионов металла) не происходит. В том случае, когда полный электрический заряд иона составляет -1, ион органической молекулы, имеющей скелет изофталевой кислоты, является, например, положительно заряженным заместителем, таким как группа триметиламмония [N(CH3)3+] или группа триэтиламмония [N(C2H5)3+].
[0043] Конкретные примеры иона органической молекулы, имеющей скелет изофталевой кислоты, который имеет структуру и может формировать MOF в соответствии с настоящим изобретением, включают в себя по меньшей мере один ион, выбираемый из группы, состоящей из иона изофталата (м-BDC2-), иона 5-гидроксиизофталата (5-OH-м-BDC2-), иона 5-нитроизофталата (5-NO2-м-BDC2-), иона 5-трет-бутилизофталата (5-трет-Bu-м-BDC2-), иона 5-хлоризофталата (5-Cl-м-BDC2-), иона 4-бромизофталата (4-Br-м-BDC2-) и иона 4,6-диметилизофталата (4,6-2CH3-м-BDC2-). В частности, ион органической молекулы, имеющей скелет тримезиновой кислоты, особенно не ограничивается и предпочтительно является ионом изофталата (м-BDC2-).
[0044] В MOF в соответствии с настоящим изобретением предпочтительно, чтобы доля иона органической молекулы, имеющей скелет изофталевой кислоты, была меньше, чем 8,4 мол.% относительно всех мультидентатных лигандов. В том случае, когда доля иона органической молекулы, имеющей скелет изофталевой кислоты, составляет 8,4 мол.% или больше относительно всех мультидентатных лигандов, количество дефектов увеличивается, и кристаллическая структура MOF вряд ли будет поддерживаться.
1.3. Монодентатный лиганд
[0045] MOF в соответствии с настоящим изобретением может включать в себя монодентатный лиганд. Например, в одном предпочтительном варианте осуществления способа производства металлоорганической структуры согласно описанному ниже второму варианту осуществления настоящего изобретения монодентатный лиганд используется для ограничения количества мультидентатных лигандов, скоординированных с металлическим кластером, и легкого формирования кристаллической структуры MOF в соответствии с настоящим изобретением, и координируется с металлическим кластером для формирования части MOF в соответствии с настоящим изобретением. Примеры монодентатного лиганда включают в себя ион одновалентного линейного насыщенного алифатического карбоксилата, имеющий от 1 до 3 атомов углерода. Монодентатный лиганд предпочтительно представляет собой по меньшей мере один ион, выбираемый из группы, состоящей из иона формиата, иона ацетата и иона пропаноата, и более предпочтительно представляет собой по меньшей мере один ион из иона формиата или иона ацетата. Металлоорганическая структура в соответствии с настоящим изобретением может быть произведена, например, с использованием способа производства металлоорганической структуры согласно второму варианту осуществления настоящего изобретения.
2. Способ производства металлоорганической структуры (MOF)
[0046] Второй вариант осуществления настоящего изобретения относится к способу производства металлоорганической структуры (MOF), включающему в себя стадию нагревания раствора, включающего в себя источник иона металла, который включает в себя ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента, органическую молекулу, имеющую скелет тримезиновой кислоты или ее соли, органическую молекулу, имеющую скелет изофталевой кислоты или ее соли, и растворитель.
[0047] Фиг. 7 представляет собой диаграмму, схематично показывающую один пример способа производства в соответствии с настоящим изобретением. В способе производства, показанном на Фиг. 7, MOF производится посредством стадии (стадии нагрева (S1)) добавления в контейнер источника ионов металла, органической молекулы, имеющей скелет тримезиновой кислоты, или ее соли, органической молекулы, имеющей скелет изофталевой кислоты, или ее соли, а также растворителя для получения раствора, и нагревания полученного раствора.
2.1. Источник ионов металла
[0048] Источник ионов металла, используемый в способе производства в соответствии с настоящим изобретением, особенно не ограничивается, при условии, что он может обеспечивать ион металла, образующий MOF в соответствии с настоящим изобретением. Например, в том случае, когда ион металла представляет собой по меньшей мере один ион, выбираемый из группы, состоящей из Zr4+, Hf4+ и Ce4+, в качестве источника ионов металла может использоваться по меньшей мере одно соединение, выбираемое из группы, состоящей из известного соединения циркония, известного соединения гафния и известного соединения церия. В частности, источник иона металла особенно не ограничивается и предпочтительно является соединением циркония с точки зрения доступности и т.п. Примеры соединения циркония включают в себя по меньшей мере одно из оксихлорида октогидрата циркония (ZrOCl2⋅8H2O) или хлорида циркония (ZrCl4).
2.2. Органическая молекула, имеющая скелет тримезиновой кислоты
[0049] Органическая молекула, имеющая скелет тримезиновой кислоты, относится, например, к органической молекуле, имеющей структуру, представленную следующей Формулой (3).
[0050] В Формуле (3) R представляет собой заместитель, а n - натуральное число от 1 до 3. Заместитель R особенно не ограничивается, при условии, что он может позволять иону органической молекулы функционировать в качестве органического связывающего агента и может образовывать MOF в соответствии с настоящим изобретением, и его примеры включают в себя гидроксильную группу, нитрогруппу, фторную группу, хлорную группу, бромную группу, йодную группу, метиловую группу и этиловую группу.
[0051] Конкретные примеры органической молекулы, имеющей скелет тримезиновой кислоты, которая имеет структуру и может использоваться в способе производства MOF в соответствии с настоящим изобретением, включают в себя по меньшей мере одну кислоту, выбираемую из группы, состоящей из тримезиновой кислоты (H3BTC), 2-гидрокси-1,3,5-бензолтрикарбоновой кислоты, 2-нитро-1,3,5-бензолтрикарбоновой кислоты, 2-хлор-1,3,5-бензолтрикарбоновой кислоты, 2-бром-1,3,5-бензолтрикарбоновой кислоты и 2-метил-1,3,5-бензолтрикарбоновой кислоты. В частности, органическая молекула, имеющая скелет тримезиновой кислоты, особенно не ограничивается и предпочтительно является тримезиновой кислотой (H3BTC).
[0052] Примеры соли органической молекулы, имеющей скелет тримезиновой кислоты, включают в себя калийную соль, натриевую соль, литиевую соль, соль аммония или ангидрид примеров органической молекулы, имеющей скелет тримезиновой кислоты.
2.3. Органическая молекула, имеющая скелет изофталевой кислоты
[0053] Органическая молекула, имеющая скелет изофталевой кислоты, относится, например, к органической молекуле, имеющей структуру, представленную следующей Формулой (4).
[0054] В Формуле (4) R представляет собой заместитель, а n - натуральное число от 1 до 4. Заместитель R особенно не ограничивается, при условии, что он может позволять иону органической молекулы функционировать в качестве органического связывающего агента и может образовывать MOF в соответствии с настоящим изобретением, и его примеры включают в себя гидроксильную группу, нитрогруппу, фторную группу, хлорную группу, бромную группу, йодную группу, метиловую группу, этиловую группу и группу трет-бутила.
[0055] Предпочтительно, чтобы органическая молекула, имеющая скелет изофталевой кислоты, не имела функциональной группы, имеющей более низкое значение pKa (константы диссоциации кислоты), чем карбоксильная группа изофталевой кислоты (м-H2BDC). Предполагается, что в том случае, когда органическая молекула, имеющая скелет изофталевой кислоты, имеет функциональную группу, имеющую более низкое значение pKa, чем карбоксильная группа изофталевой кислоты (м-H2BDC), ион имеет электрический заряд -3 или меньше, и таким образом компенсация заряда не нужна, и введение дефектов не происходит, как было описано выше. Примеры функциональной группы, имеющей более низкое значение pKa (константы диссоциации кислоты), чем карбоксильная группа изофталевой кислоты (м-H2BDC), включают в себя сульфогруппу, сульфеновую группу, фосфиновую группу и фосфоновую группу.
[0056] Конкретные примеры органической молекулы, имеющей скелет изофталевой кислоты, которая имеет структуру и может использоваться в способе производства MOF в соответствии с настоящим изобретением, включают в себя по меньшей мере одну кислоту, выбираемую из группы, состоящей из изофталевой кислоты (м-H2BDC), 5-гидроксиизофталевой кислоты (5-OH-м-H2BDC), 5-нитроизофталевой кислоты (5-NO2-м-H2BDC), 5-трет-бутилизофталевой кислоты (5-трет-Bu-м-H2BDC), 5-хлоризофталевой кислоты (5-Cl-м-H2BDC), 4-бромизофталевой кислоты (4-Br-м-H2BDC) и 4,6-диметилизофталевой кислоты (4,6-(CH3)2-м-H2BDC). В частности, органическая молекула, имеющая скелет изофталевой кислоты, особенно не ограничивается и предпочтительно является изофталевой кислотой (м-H2BDC).
[0057] Примеры соли органической молекулы, имеющей скелет изофталевой кислоты, включают в себя калийную соль, натриевую соль, литиевую соль, соль аммония или ангидрид примеров органической молекулы, имеющей скелет изофталевой кислоты.
[0058] Ион органической молекулы, имеющей скелет фталевой кислоты (например, фталевая кислота (o-H2BDC)), или ион органической молекулы, имеющей скелет терефталевой кислоты (например, терефталевая кислота (п-H2BDC)), в котором карбоксильная группа присутствует в орто-положении или пара-положении в Формуле (4), также является бидентатным лигандом, в котором две карбоксильные группы связаны с бензольным кольцом, как и в ионе органической молекулы, имеющей скелет изофталевой кислоты. Однако предполагается, что ион органической молекулы, имеющей скелет фталевой кислоты, в котором угол между двумя карбоксильными группами составляет 60°, или ион органической молекулы, имеющей скелет терефталевой кислоты, в котором угол между двумя карбоксильными группами составляет 180°, не может быть обменен с ионом органической молекулы, имеющей скелет тримезиновой кислоты, в котором угол между тремя карбоксильными группами составляет 120°, и таким образом кристаллическая структура разрушается.
2.4. Растворитель
[0059] Растворитель, используемый в способе производства в соответствии с настоящим изобретением, особенно не ограничивается, при условии, что источник иона металла, органическая молекула, имеющая скелет изофталевой кислоты, или ее соль и органическая молекула, имеющая скелет тримезиновой кислоты, или ее соль, описанные выше, могут быть диспергированы в нем, и MOF может быть синтезирована на стадии нагревания, описываемой ниже. С точки зрения ускорения синтеза MOF предпочтительно, чтобы использовался амид или карбоновая кислота.
2.4.1. Амид
[0060] Примеры амида, используемого в способе производства в соответствии с настоящим изобретением, включают в себя по меньшей мере одно из N,N-диметилформамида (DMF) или N,N-диэтилформамида (DEF).
2.4.2. Карбоновая кислота
[0061] В способе производства в соответствии с настоящим изобретением при использовании карбоновой кислоты в качестве растворителя ион карбоновой кислоты функционирует как монодентатный лиганд, так что количество мультидентатных лигандов, скоординированных с металлическим кластером, может быть ограничено, и может быть легко сформирована кристаллическая структура MOF в соответствии с настоящим изобретением. Карбоновая кислота, используемая в способе производства в соответствии с настоящим изобретением, особенно не ограничивается, при условии, что она может обеспечивать ион карбоновой кислоты, который функционирует как монодентатный лиганд MOF в соответствии с настоящим изобретением. Примеры карбоновой кислоты включают в себя одновалентную линейную насыщенную алифатическую карбоновую кислоту, имеющую от 1 до 3 атомов углерода. В частности, карбоновая кислота особенно не ограничивается и предпочтительно является по меньшей мере одной кислотой, выбираемой из группы, состоящей из муравьиной кислоты, уксусной кислоты и пропановой кислоты, и более предпочтительно по меньшей мере одной из муравьиной кислоты или уксусной кислоты.
2.5. Стадия нагревания (S1)
[0062] Стадия нагревания (S1) является стадией нагревания раствора, включающего в себя источник иона металла, органическую молекулу, имеющую скелет тримезиновой кислоты, или соль органической молекулы, имеющей скелет тримезиновой кислоты, органическую молекулу, имеющую скелет изофталевой кислоты, или ее соль, а также растворитель.
[0063] Температура нагрева на стадии нагревания (S1) особенно не ограничивается, при условии, что она является температурой, при которой MOF может быть произведена, и предпочтительно составляет 100-150°C. В том случае, когда температура нагрева является более низкой, чем 100°C, реакционная способность является низкой, и MOF навряд ли будет произведена. В том случае, когда температура нагрева является более высокой, чем 150°C, давление пара является высоким, и может произойти утечка пара. Предпочтительно, чтобы время нагрева на стадии нагрева (S1) составляло 6 час или больше. В том случае, когда время нагрева составляет менее 6 час, сырье может не успеть прореагировать друг с другом полностью.
Синтез металлоорганической структуры (MOF)
[0064] С использованием следующих реагентов были синтезированы металлоорганические структуры (MOF) в соответствии с Примерами 1-12 и Сравнительными примерами 1-12.
Реагент
- Оксихлорид октогидрата циркония (ZrOCl2⋅8H2O; производства компании Sigma-Aldrich Corporation)
- Хлорид циркония (ZrCl4, производства компании Sigma-Aldrich Corporation)
- Тримезиновая кислота (H3BTC, производства компании Sigma-Aldrich Corporation)
- Изофталевая кислота (м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 5-гидроксиизофталевая кислота (5-OH-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 5-нитроизофталевая кислота (5-NO2-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 5-трет-бутилизофталевая кислота (5-трет-Bu-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 5-метилизофталевая кислота (5-CH3-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 4,6-диметилизофталевая кислота (4,6-(CH3)2-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 4-бромизофталевая кислота (4-Br-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- Терефталевая кислота (п-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 5-сульфоизофталат натрия (5-SO3Na-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- Уксусная кислота (производства компании Wako Pure Chemical Industries Ltd.)
- Муравьиная кислота (производства компании Wako Pure Chemical Industries Ltd.)
- N,N-диметилформамид (DMF, производства компании Wako Pure Chemical Industries Ltd.)
- N,N-диэтилформамид (DEF, производства компании Tokyo Chemical Industry Co., Ltd.)
Пример 1
[0065] (1) 387 мг (120 ммоль) оксихлорида октогидрата циркония (ZrOCl2⋅8H2O), 76 мг (36 ммоль) тримезиновой кислоты (H3BTC), 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC), 20 мл уксусной кислоты и 20 мл N,N-диметилформамида (DMF) было добавлено в контейнер из политетрафторэтилена емкостью 100 мл (HUT-100, производства компании SAN-AI Kagaku Co., Ltd.).
(2) Контейнер из политетрафторэтилена был помещен во внешний цилиндр высокого давления из нержавеющей стали (HUS-100, производства компании SAN-AI Kagaku Co., Ltd.), и нагревался при 130°C в течение 48 час.
(3) Продукт был отфильтрован, промыт с помощью 10 мл DMF три раза, промыт с помощью 10 мл ацетона (производства компании Wako Pure Chemical Industries Ltd.) три раза, и был нагрет и высушен при 60°C в течение ночи при уменьшении давления до 10-1 Па или ниже. В результате было получено 280 мг продукта (MOF согласно Примеру 1). Фиг. 8 показывает блок-схему способа производства в соответствии с Примером 1.
Пример 2
[0066] (1) MOF согласно Примеру 2 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 67 мг (32 ммоль), а количество изофталевой кислоты (м-H2BDC) было изменено на 13 мг (8 ммоль).
Пример 3
[0067] (1) MOF согласно Примеру 3 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 59 мг (28 ммоль), а количество изофталевой кислоты (м-H2BDC) было изменено на 20 мг (12 ммоль).
Пример 4
[0068] (1) MOF согласно Примеру 4 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 7 мг (4 ммоль) 5-гидроксиизофталевой кислоты (5-OH-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Пример 5
[0069] (1) MOF согласно Примеру 5 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 8 мг (4 ммоль) 5-нитроизофталевой кислоты (5-NO2-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Пример 6
[0070] (1) MOF согласно Примеру 6 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 9 мг (4 ммоль) 5-трет-бутилизофталевой кислоты (5-трет-Bu-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Пример 7
[0071] (1) MOF согласно Примеру 7 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 7 мг (4 ммоль) 5-метилизофталевой кислоты (5-CH3-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Пример 8
[0072] (1) MOF согласно Примеру 8 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 8 мг (4 ммоль) 4,6-диметилизофталевой кислоты (4,6-CH3-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Пример 9
[0073] (1) MOF согласно Примеру 9 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 10 мг (4 ммоль) 4-бромизофталевой кислоты (4-Br-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Пример 10
[0074] (1) MOF согласно Примеру 10 была получена с использованием того же самого способа, что и в Примере 3, за исключением того, что 280 мг (120 ммоль) хлорида циркония (ZrCl4) использовалось вместо 387 мг (120 ммоль) оксихлорида октогидрата циркония (ZrOCl2⋅8H2O).
Пример 11
[0075] (1) MOF согласно Примеру 11 была получена с использованием того же самого способа, что и в Примере 3, за исключением того, что 20 мл муравьиной кислоты использовалось вместо 20 мл уксусной кислоты.
Пример 12
[0076] (1) MOF согласно Примеру 12 была получена с использованием того же самого способа, что и в Примере 3, за исключением того, что 20 мл N,N-диэтилформамида (DEF) использовалось вместо 20 мл N,N-диметилформамида (DMF).
Сравнительный пример 1
[0077] (1) MOF согласно Сравнительному примеру 1 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 84 мг (40 ммоль), а количество изофталевой кислоты (м-H2BDC) было изменено на 0 мг (0 ммоль).
Сравнительный пример 2
[0078] (1) MOF согласно Сравнительному примеру 2 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 50 мг (24 ммоль), а количество изофталевой кислоты (м-H2BDC) было изменено на 27 мг (16 ммоль).
Сравнительный пример 3
[0079] (1) MOF согласно Сравнительному примеру 3 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 42 мг (20 ммоль), а количество изофталевой кислоты (м-H2BDC) было изменено на 33 мг (20 ммоль).
Сравнительный пример 4
[0080] (1) MOF согласно Сравнительному примеру 4 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 11 мг (4 ммоль) 5-сульфоизофталата натрия (5-SO3Na-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Сравнительный пример 5
[0081] (1) MOF согласно Сравнительному примеру 5 была получена с использованием того же самого способа, что и в Сравнительном примере 4, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 67 мг (32 ммоль), а количество 5-сульфоизофталата натрия (5-SO3Na-м-H2BDC) было изменено на 21 мг (8 ммоль).
Сравнительный пример 6
[0082] (1) MOF согласно Сравнительному примеру 6 была получена с использованием того же самого способа, что и в Сравнительном примере 4, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 59 мг (28 ммоль), а количество 5-сульфоизофталата натрия (5-SO3Na-м-H2BDC) было изменено на 32 мг (12 ммоль).
Сравнительный пример 7
[0083] (1) MOF согласно Сравнительному примеру 7 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 7 мг (4 ммоль) терефталевой кислоты (п-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Сравнительный пример 8
[0084] (1) MOF согласно Сравнительному примеру 8 была получена с использованием того же самого способа, что и в Сравнительном примере 7, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 67 мг (32 ммоль), а количество терефталевой кислоты (п-H2BDC) было изменено на 13 мг (8 ммоль).
Сравнительный пример 9
[0085] (1) MOF согласно Сравнительному примеру 9 была получена с использованием того же самого способа, что и в Сравнительном примере 7, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 59 мг (28 ммоль), а количество терефталевой кислоты (п-H2BDC) было изменено на 20 мг (12 ммоль).
Сравнительный пример 10
[0086] (1) MOF согласно Сравнительному примеру 10 была получена с использованием того же самого способа, что и в Сравнительном примере 1, за исключением того, что 280 мг (120 ммоль) хлорида циркония (ZrCl4) использовалось вместо 387 мг (120 ммоль) оксихлорида октогидрата циркония (ZrOCl2⋅8H2O).
Сравнительный пример 11
[0087] (1) MOF согласно Сравнительному примеру 11 была получена с использованием того же самого способа, что и в Сравнительном примере 1, за исключением того, что 20 мл муравьиной кислоты использовалось вместо 20 мл уксусной кислоты.
Сравнительный пример 12
[0088] (1) MOF согласно Сравнительному примеру 12 была получена с использованием того же самого способа, что и в Сравнительном примере 1, за исключением того, что 20 мл N,N-диэтилформамида (DEF) использовалось вместо 20 мл N,N-диметилформамида (DMF).
Измерения
(1) Рентгеновское дифракционное измерение (проверка кристаллической структуры)
[0089] Для каждой из MOF согласно Примерам 1-12 и Сравнительным примерам 1-12 было выполнено рентгеновское дифракционное измерение. Измерительный прибор и условия измерения были следующими.
- Измерительный прибор: RINTRAPID II (производства компании Rigaku Corporation)
- Условия измерения: напряжение=50 В, ток=100 мА, диаметр коллиматора ϕ=0,3, наклон образца ω=15°
Фиг. 9 показывает результаты измерений Примеров 1-3 и Сравнительных примеров 1-3, Фиг. 10 показывает результаты измерений Примеров 4-9, Фиг. 11 показывает результаты измерений Сравнительных примеров 4-9, и Фиг. 12 показывает результаты измерений Примеров 10-12 и Сравнительных примеров 10-12.
(2) Измерение величины адсорбции азота (Проверка объема порового пространства)
[0090] Для каждой из MOF согласно Примерам 1-12 и Сравнительным примерам 1-12 была измерена изотерма адсорбции азота после предварительной обработки, и была получена величина адсорбции азота при относительном давлении 0-0,5. Устройство предварительной обработки, условия предварительной обработки, измерительный прибор и условия измерения были следующими.
- Устройство предварительной обработки: BELPREP-vac II (производства компании MicrotracBEL Corporation)
- Условия предварительной обработки: степень вакуума < 10-2 кПа, нагрев при 130°C в течение 6 час
- Измерительный прибор: BELSORP-max (производства компании MicrotracBEL Corporation)
- Условия измерения: температура: 77 K, адсорбция азота измерялась при относительном давлении 0-0,99
Фиг. 13 показывает изотермы адсорбции азота для MOF согласно Примеру 1 и Сравнительному примеру 1. Фиг. 14 показывает величины адсорбции азота для MOF согласно Примерам 1-3 и Сравнительным примерам 1-3, Фиг. 15 показывает величины адсорбции азота для MOF согласно Примерам 4-9, Фиг. 16 показывает величины адсорбции азота для MOF согласно Сравнительным примерам 4-9, и Фиг. 17 показывает величины адсорбции азота для MOF согласно Примерам 10-12 и Сравнительным примерам 10-12.
(3) Измерение1H-ЯМР (анализ состава MOF)
[0091] Для каждого из продуктов (MOF согласно Примерам 1-12 и Сравнительным примерам 1-3) был измерен1H-ЯМР спектр раствора после разложения, и пропорция лигандов в MOF была получена на основе соотношения интегралов. Условия разложения, измерительный прибор и условия измерения были следующими.
- Условия разложения: приблизительно 10 мг продукта (MOF) были разложены с использованием 1 мл дейтеросерной кислоты (D2SO4)
- Измерительный прибор: JNM-AL400 (производства компании JEOL Ltd.)
- Условия измерения:1H-ЯМР спектр раствора измерялся с использованием тетраметилсилана (TMS) в качестве внутреннего стандарта
Таблица 1 показывает виды и соотношения лигандов в MOF согласно Примерам 1-12 и Сравнительным примерам 1-3.
(4) Измерение адсорбции и десорбции водяного пара (оценка характеристик адсорбции и десорбции водяного пара)
[0092] Для каждого из продуктов (MOF согласно Примерам 1-12 и Сравнительным примерам 1), были измерены изотермы адсорбции и десорбции водяного пара после предварительной обработки, и были получены величина адсорбции водяного пара при относительном давлении 0,2-0,4 и величина десорбции водяного пара при относительном давлении 0,4-0,2. Устройство предварительной обработки, условия предварительной обработки, измерительный прибор и условия измерения были следующими.
- Устройство предварительной обработки: BELPREP-vac II (производства компании MicrotracBEL Corporation)
- Условия предварительной обработки: степень вакуума < 10-2 Па, нагрев при 130°C в течение 6 час
- Измерительный прибор: BELSORP-max (производства компании MicrotracBEL Corporation)
- Условия измерения: величина адсорбции водяного пара при относительном давлении 0-0,85 и величина десорбции водяного пара при относительном давлении 0,85-0,05 были измерены при температуре 20°C
Фиг. 18 показывает кривые адсорбции и десорбции водяного пара Примера 1 и Сравнительного примера 1 при 20°C. Фиг. 19 показывает результаты измерения величин адсорбции и десорбции водяного пара Примеров 1-12 и Сравнительного примера 1.
Таблица 1
Результаты
(1) Рентгеновское дифракционное измерение
[0093] Как показано на Фиг. 9, в Примерах 1-3 был получен тот же самый график рентгеновской дифракции, что и в Сравнительном примере 1. С другой стороны, в Сравнительных примерах 2 и 3 кристалличность явно ухудшилась по сравнению со Сравнительным примером 1. Причиной этого предположительно является то, что в том случае, когда количество добавляемой изофталевой кислоты (м-H2BDC) является более высоким, чем 40 мол.%, количество дефектов увеличивается, и становится трудно поддерживать кристаллическую структуру. Как показано на Фиг. 10, в Примерах 4-9 был получен тот же самый график рентгеновской дифракции, что и в Сравнительном примере 1. Из этого результата было найдено, что любая органическая молекула, имеющая скелет изофталевой кислоты, показывает тот же самый эффект, что и изофталевая кислота (м-H2BDC), независимо от вида, положения и количества функциональных групп. Как показано на Фиг. 11, в Сравнительных примерах 4-6 был получен тот же самый график рентгеновской дифракции, что и в Сравнительном примере 1. Причиной этого предположительно является то, что поскольку в качестве соли органической молекулы, имеющей скелет изофталевой кислоты, добавлялся 5-сульфоизофталат натрия (5-SO3Na-м-H2BDC), был показан тот же самый эффект, что и при добавлении изофталевой кислоты (м-H2BDC). С другой стороны, в Сравнительных примерах 7-9 по мере того, как добавляемое количество терефталевой кислоты (п-H2BDC) увеличивалось, кристалличность ухудшалась. Причина этого предполагается следующей. Терефталевая кислота (п-H2BDC) является также бидентатным лигандом, в котором две карбоксильные группы связаны с бензольным кольцом, как в случае изофталевой кислоты (м-H2BDC). Однако терефталевая кислота (п-H2BDC), в которой угол между двумя карбоксильными группами составляет 180°, не могла быть обмененной с тримезиновой кислотой (H3BTC), в которой угол между тремя карбоксильными группами составляет 120°, и таким образом кристаллическая структура разрушалась. Как показано на Фиг. 12, в Примерах 10-12 и Сравнительных примерах 10-12 был получен тот же самый график рентгеновской дифракции, что и в Сравнительном примере 1. В результате было найдено, что та же самая кристаллическая структура была произведена независимо от вида источника ионов металла или растворителя.
(2) Измерение величины адсорбции азота
[0094] Как показано на Фиг. 13, в Примере 1 количество адсорбируемого азота увеличилось по сравнению со Сравнительным примером 1. Причина этого предполагается следующей. При обмене иона тримезата (BTC3-, тридентатный лиганд) с ионом изофталата (м-BDC2-, бидентатный лиганд) функциональные группы координировались с ионами металла, и отрицательных электрических зарядов было недостаточно, и дефекты вводились в структуру для компенсации заряда. В результате вес уменьшился благодаря уменьшению плотности скелета, и увеличилось новое пространство, способное к адсорбции.
Как показано на Фиг. 14, в Примерах 1-3 количество адсорбируемого азота увеличилось по сравнению со Сравнительным примером 1. С другой стороны, в Сравнительных примерах 2 и 3 количество адсорбируемого азота было меньше, чем в Сравнительном примере 1. Причиной этого предположительно является то, что в том случае, когда количество добавляемой изофталевой кислоты (м-H2BDC) является более высоким, чем 40 мол.%, количество дефектов увеличивается, и становится трудно поддерживать кристаллическую структуру.
Как показано на Фиг. 15, в Примерах 4-9, как и в Примерах 1-3, количество адсорбируемого азота увеличилось по сравнению со Сравнительным примером 1. Причиной этого предположительно является то, что любая органическая молекула, имеющая скелет изофталевой кислоты, показывает тот же самый эффект, что и изофталевая кислота (м-H2BDC), независимо от вида, положения и количества функциональных групп.
Как показано на Фиг. 16, в Сравнительных примерах 4-6 количество адсорбируемого азота не увеличилось по сравнению со Сравнительным примером 1. Причина этого предполагается следующей. Благодаря группе SO3-, образующейся при электролитической диссоциации иона Na+ из группы SO3Na в пятом положении 5-сульфоизофталата натрия (5-SO3Na-м-H2BDC), ион 5-сульфоизофталата (5-SO3-м-BTC3-) функционировал как отрицательный трехвалентный ион, и его валентность была той же самой, что и у обмениваемого иона тримезата (BTC3-). Следовательно, компенсация заряда не требовалась, и введения дефектов (дефектов положительно заряженных ионов металла) не происходило. В Сравнительных примерах 7-9 количество адсорбируемого азота уменьшилось по сравнению со Сравнительным примером 1, и по мере того, как количество добавляемой терефталевой кислоты (п-H2BDC) увеличивалось, количество адсорбируемого азота уменьшалось. Как было описано выше со ссылкой на Фиг. 11, причиной этого предположительно является то, что терефталевая кислота (п-H2BDC) не могла быть обменена с тримезиновой кислотой (H3BTC) в неизменном виде, и таким образом кристаллическая структура разрушалась.
Как показано на Фиг. 17, в Примерах 10-12 количество адсорбируемого азота увеличилось по сравнению со Сравнительными примерами 10-12. В результате было найдено, что та же самая кристаллическая структура была произведена независимо от вида источника ионов металла или растворителя.
(3) Измерение1H-ЯМР
[0095] Как показано в Таблице 1, было найдено, что в Примерах 1-12 ион тримезата (тридентатный лиганд) обменивался с ионом, имеющим скелет изофталевой кислоты (бидентатным лигандом). В Сравнительных примерах 2 и 3 предполагается, что количество, обмененное на ион изофталата (м-BDC2-), было большим, и в том случае, когда это количество составляло 8,4 мол.% или выше, кристаллическая структура не могла поддерживаться.
(4) Измерение адсорбции и десорбции водяного пара
[0096] Как показано на Фиг. 18, в Примере 1 количество адсорбируемого водяного пара увеличилось по сравнению со Сравнительным примером 1. Как описано выше со ссылкой на Фиг. 16, причина этого предполагается следующей. При обмене иона тримезата (BTC3-, тридентатный лиганд) с ионом изофталата (м-BDC2-, бидентатный лиганд) функциональные группы координировались с ионами металла, и отрицательных электрических зарядов было недостаточно, и дефекты вводились в структуру для компенсации заряда. В результате вес уменьшился благодаря уменьшению плотности скелета, и увеличилось новое пространство, способное к адсорбции. В Примере 1 количество десорбируемого водяного пара увеличилось по сравнению со Сравнительным примером 1. Причина этого предполагается следующей. Благодаря введению дефектов входы малых пор увеличились, и структура пузырька для чернил была деформирована. В результате водяной пар, адсорбированный в малых порах, легко десорбировался. Как показано на Фиг. 19, в Примерах 1-12 количество адсорбируемого водяного пара и количество десорбируемого водяного пара были улучшены по сравнению со Сравнительным примером 1.
Реферат
Изобретение относится к металлоорганическим структурам и способу их производства. Описана металлоорганическая структура для адсорбции водяного пара, содержащая: ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента в качестве иона металла; и ион первой органической молекулы, имеющей скелет тримезиновой кислоты, и ион второй органической молекулы, имеющей скелет изофталевой кислоты, в качестве мультидентатных лигандов. Также описан способ производства металлоорганической структуры. Технический результат: улучшенная способность при адсорбции и десорбции водяного пара, обеспечивающаяся с использованием металлоорганической структуры. 2 н. и 19 з.п. ф-лы, 1 табл., 19 ил., 12 пр.
Формула
Документы, цитированные в отчёте о поиске
Металлоорганические каркасные структуры, полученные из карбенофильных металлов и способ их получения

Комментарии