Применение размноженных популяций гематопоэтических стволовых клеток/клеток-предшественников - RU2747728C2
Код документа: RU2747728C2
Чертежи

















Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННУЮ ЗАЯВКУ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США № 62/263470, поданной 4 декабря 2015 года, и предварительной патентной заявки США № 62/263573, поданной 4 декабря 2015 года, которые в полном объеме включены в настоящий документ в качестве ссылки.
ЗАЯВЛЕНИЕ О ПРАВИТЕЛЬСТВЕННОЙ ПОДДЕРЖКЕ
Это изобретение было сделано при государственной поддержке в рамках RC2HL101844, присужденного Национальным институттом здоровья, и HHS0100200800064C, присужденного Министерством здравоохранения и социального обеспечения. Правительство имеет определенные права на это изобретение.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Описаны применения размноженных гематопоэтических стволовых клеток/клеток-предшественников (HSPC) из пуповинной крови. Примеры включают снижение отторжения трансплантата, индуцирование иммунологической толерантности, уменьшение полного парентерального питания (TPN), применения опиатов, и госпитализации после медицинской процедуры, уменьшение мукозита, и уменьшение реакции «трансплантат против хозяина» (РТПХ) после аллогенной трансплантации.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
US 2013/0095079 описывает разработку новаторского клинического продукта, включающего обогащенные по CD34+ и размноженные стволовые клетки пуповинной крови человека (Exp-CBSC), который можно безопасно вводить любому пациенту без какой-либо степени иммунологического соответствия между пациентом и клиническим продуктом. Было показано, что для пациентов с иммуносупрессией Exp-CBSC уменьшает время восстановления иммунной функции. Например, Exp-CBSC помог пациентам с химиотерапией восстановить иммунную функцию быстрее, чем это произошло бы без Exp-CBSC. Тот же эффект наблюдался у пациентов, с тяжелым нарушением иммунитета после подготовки к трансплантации для получения трансплантата пуповинной крови в качестве лечения острого миелогенного лейкоза (ОМЛ) и острого лимфобластного лейкоза (ОЛЛ). Exp-CBSC аналогичным образом помог этим пациентам-реципиентам с трансплантатом пуповинной крови восстановить иммунную функцию быстрее, чем это произошло бы без Exp-CBSC. Exp-CBSC значительно улучшил результаты лечения пациентов, уменьшая инфекцию, рецидивы заболевания и другие часто фатальные осложнения лечения из-за снижения или отсутствия иммунной функции.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к тому, что обогащенные по CD34+ и размноженные стволовые клетки пуповинной крови человека (Exp-CBSC), описанные в US 2013/0095079, имеют дополнительные неожиданные клинические преимущества в различных популяциях пациентов. Например, Exp-CBSC уменьшает отторжение трансплантата, уменьшает полное парентеральное питание, употребление опиатов, и госпитализацию после медицинской процедуры, уменьшает мукозит, и уменьшает реакцию «трансплантат против хозяина» после аллогенной трансплантации. Эти дополнительные неожиданные клинические преимущества Exp-CBSC также значительно улучшают результаты лечения пациентов. Снижение отторжения трансплантата, мукозита и реакции «трансплантат против хозяина» повышает выживаемость и качество жизни после трансплантации. Уменьшение полного парентерального кормления позволяет избежать многочисленных осложнений, которые могут возникнуть из-за такого искусственного кормления. Снижение воздействия на пациента при использовании опиатов может помочь в борьбе с продолжающейся эпидемией злоупотребления болеутоляющими средствами. Наконец, сокращение госпитализации после медицинской процедуры снижает затраты, связанные с медицинским обслуживанием, и аналогичным образом уменьшает потери по упущенным доходам, которые испытывают пациенты во время госпитализации. Каждое из этих применений и преимуществ описано более полно в следующем подробном описании. По отдельности и совместно они дают дополнительные доказательства огромных клинических преимуществ, предлагаемых Exp-CBSC, описанных в US 2013/0095079, в различных популяциях пациентов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ. 1. Блок-схема, демонстрирующая примерную процедуру для обогащения популяции CD34+ клеток и размножения обогащенной популяции.
ФИГ. 2. Фенотипы клеток после наращивания при помощи способов, описываемых в настоящем документе, и в US 2013/0095079.
ФИГ. 3. Абсолютное число и кратность клеток до и после наращивания после культивирования способами, описываемыми в настоящем документе, и в US 2013/0095079.
ФИГ. 4. Количества в начале и в конце наращивания и кратность количества для общего числа ядросодержащих клеток и CD34+ клеток после наращивания для 19 полномасштабных наращиваний при помощи способов, описываемых в настоящем документе, и в US 2013/0095079.
ФИГ. 5. Общее число ядросодержащих клеток (TNC) и CD34+ клеток для каждого из образцов размноженных стволовых клеток пуповинной крови человека и жизнеспособность клеток перед криоконсервацией, и число TNC и CD34+ клеток в каждом замороженном пакете после наращивания при помощи способов, описываемых в настоящем документе, и в US 2013/0095079.
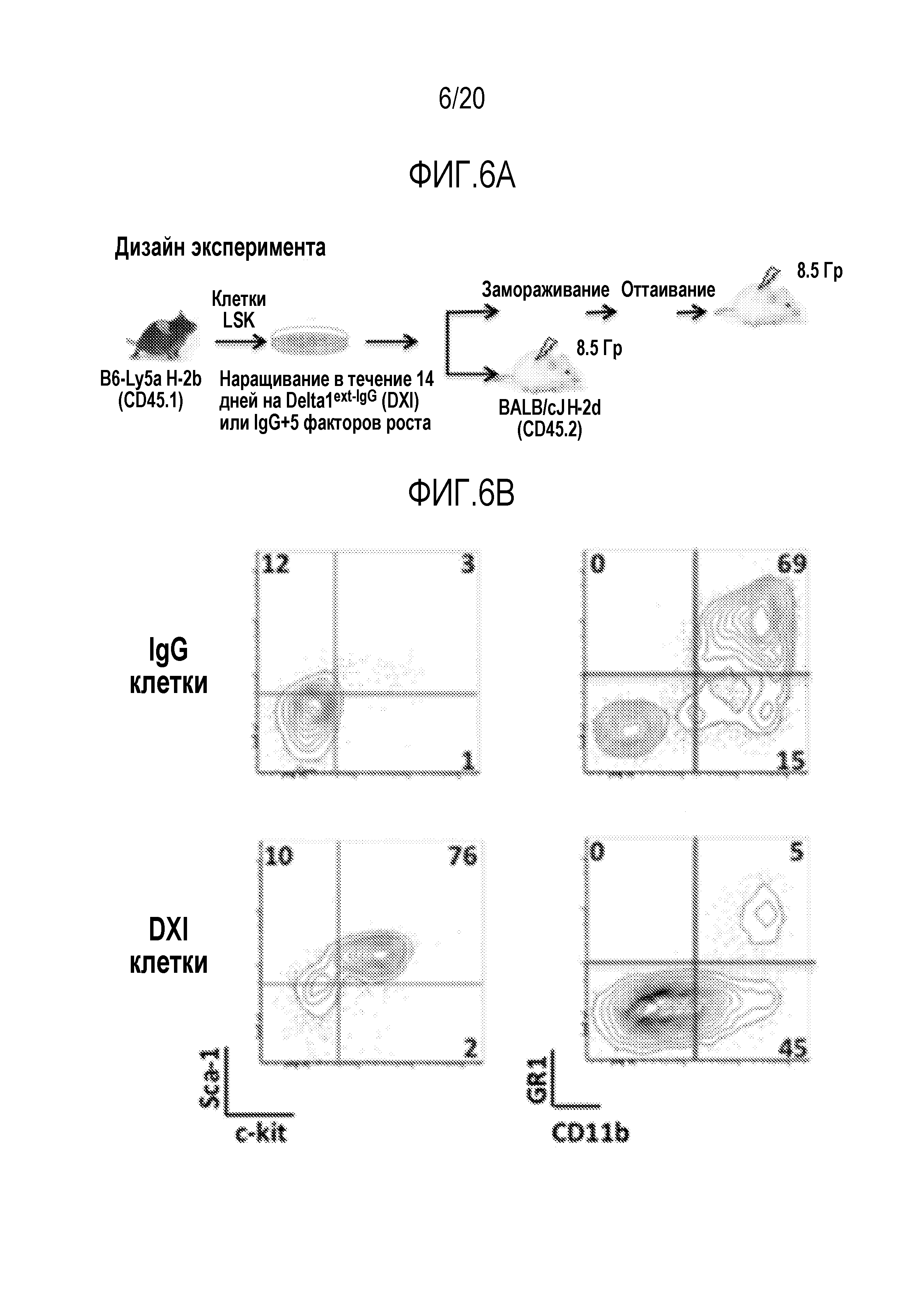
ФИГ. 6A-6C. Вливание Delta1ext-IgG (DXI)-культивированных мышиных клеток восстанавливает реципиентов, несовместимых по главному комплексу гистосовместимости и уменьшает смертность, вызванную облучением всего тела (TBI). Дизайн эксперимента (фиг. 6A). LSK от мышей B6-Ly5a (H-2b, CD45.1) сортировали и культивировали в DXI-(5 мг/мл) или IgG-покрытых флаконах в течение 2 недель. DXI- или IgG-культивируемые клетки, свежие, в конце культивирования, или ранее замороженные трансплантировали внутривенно 6-8-недельным мышам BALB/cJ (H-2d, CD45.2) через 2-4 часа после того как мыши получали летальную дозу облучения всего тела 8,5 Гр (γ-лучи137Cs). (фиг. 6B): Проточный цитометрический анализ IgG- (верхние панели) и DXI-культивированных (нижние панели) клеток в конце 14-суточного культивирования. Процентное содержание донорских клеток (45.1+) в периферической крови (ПК) и костном мозге (КМ) в указанные моменты времени после пересадки 1×106 свежих DXI- или IgG-культивированных клеток (фиг. 6C). Врезка показывает проточный цитометрический анализ донорских (45.1+) клеток (левая панель) и распределение миелоидного и T-лимфоидного рядов (правая панель) донорских клеток в ПК от типичной мыши, которой пересадили аллогенные DXI-культивированные клетки, через 60 суток после трансплантации. Процентное содержание донорских клеток (45.1+)±стандартная ошибка среднего (полосы) в ПК и КМ.
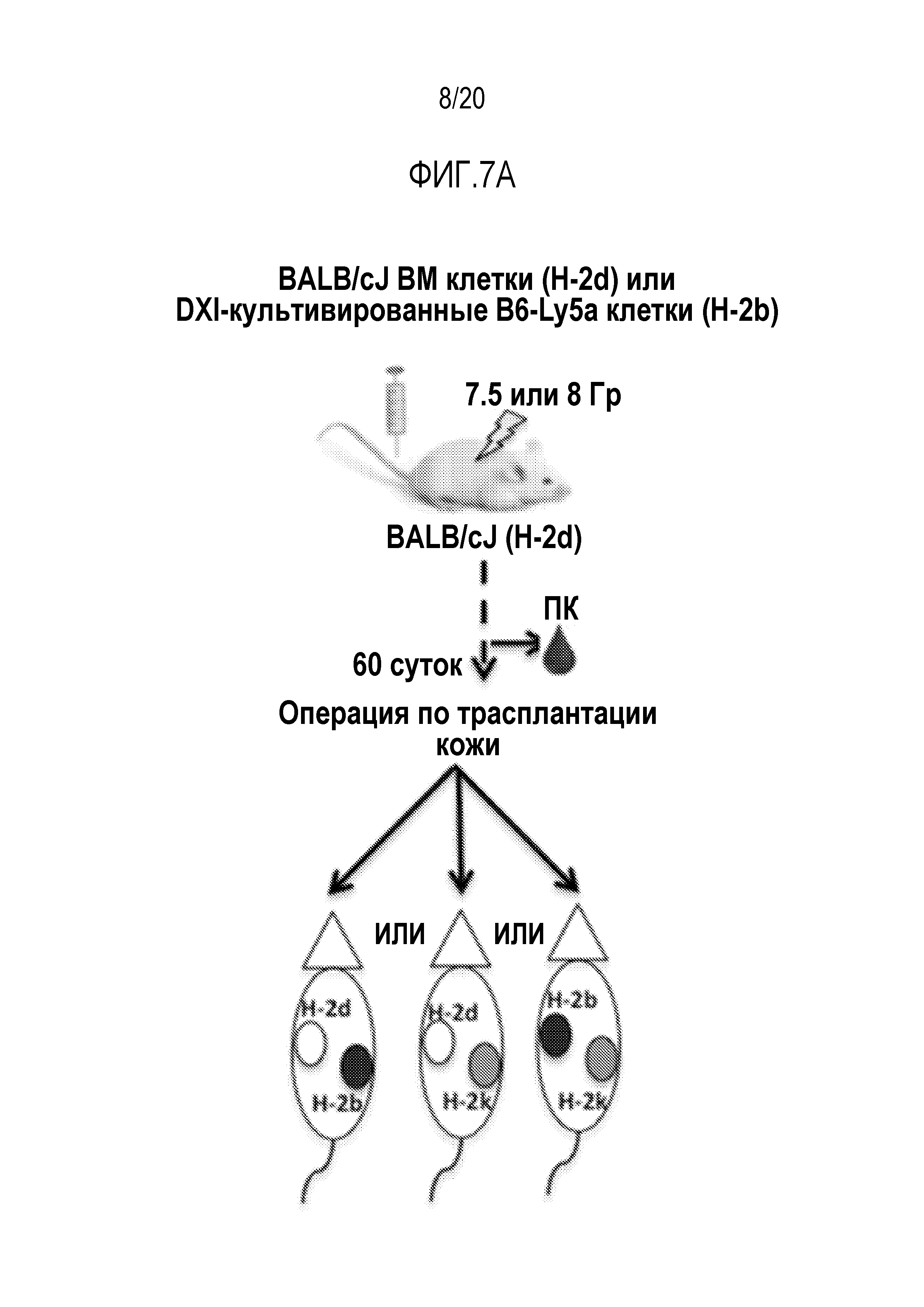
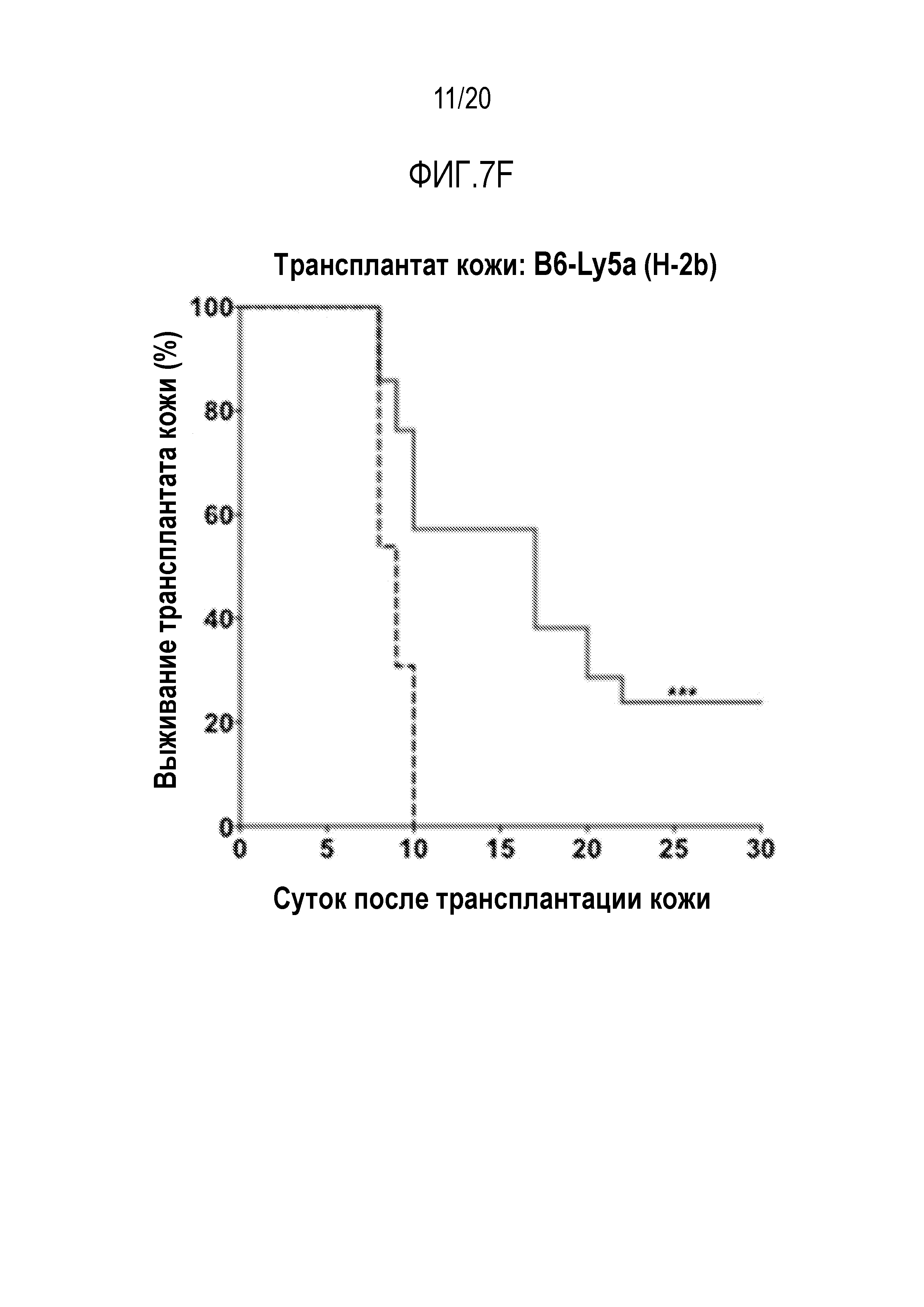
ФИГ. 7A-7G. Вливание замороженных аллогенных DXI-культивированных клеток вызывает донор-специфическую иммунологическую толерантность и улучшает приживаемость кожного трансплантата. (фиг. 7A): Дизайн эксперимента. Мышам BALB/cJ (H-2d) пересаживали 5×106 сингенных клеток КМ BALB/cJ (H-2d) (контрольные мыши, n=20) или замороженных аллогенных DXI-культивированных клеток B6-Ly5a (H-2b) (мыши DXI, n=33), через 2-4 часа после 7,5 или 8,0 Гр TBI. (ФИГ. 7B, 7C): Через 60 суток после пересадки каждая мышь получала два кожных трансплантата. Контрольные мыши получали сингенные H-2d (n=9), аллогенные H-2b (n=13), или сторонние H-2k (n=12) кожные трансплантаты. Мыши DXI получали сингенные H-2d (n=21), аллогенные H-2b (n=21), или сторонние H-2k (n=20) кожные трансплантаты. (фиг. 7B): Типичные кожные трансплантаты у мышей BALB/cJ (H-2d), которым пересадили сингенные клетки КМ, с кожными трансплантатами H-2d и H-2b, или H-2d и H-2k, или H-2b и H-2k. (фиг. 7C): Типичные кожные трансплантаты у мышей BALB/cJ (H-2d), которым пересадили аллогенные DXI-культивируемые клетки, с кожными трансплантатами H-2d и H-2b, или H-2d и H-2k, или H-2b и H-2k. (фиг. 7D): Типичные здоровые H-2b (стрелка внизу левой панели и нижняя стрелка внизу правой панели) и H-2d (верхняя стрелка внизу правой панели) кожные трансплантаты у мышей BALB/cJ, которым пересадили DXI-культивируемые клетки, через 60 суток после операции. (ФИГ. 7E-7G): Коэффициент выживаемости на сутки 30 сингенных (H-2d) (9 у контроля и 21 у мышей DXI) (фиг. 7E), аллогенных (H-2b) (13 у контроля и 21 у мышей DXI) (фиг.7F), и сторонних (H-2k) (12 у контроля и 20 у мышей DXI) (фиг. 7G) кожных трансплантатов. ***, p <0,001.
ФИГ. 8. Средняя длительность начальной госпитализации для педиатрических пациентов, получавших миелоаблативную трансплантацию пуповинной крови с наличием или отсутствием размноженных ex vivo предшественников.
ФИГ. 9. Среднее использования полного парентерального питания (TPN, левая панель) и вливания опиоидов (правая панель) у педиатрических пациентов, получавших миелоаблативную трансплантацию крови пуповины с наличием или отсутствием размноженных ex vivo предшественников.
ФИГ. 10A-10B. Медианы (полосы), интерквартильный диапазон (коробка), и диапазон (усы) количества CD34+ клеток (фиг. 10A) и всех ядросодержащие клетки (фиг. 10B), соответственно, содержащихся в трансплантате пуповинной крови до и после наращивания ex-vivo по сравнению с общим числом в неманипулированной единице/единицах пуповинной крови. Количества ядросодержащих клеток статистически не отличались между размноженными клетками и комбинированными неманипулированными ядросодержащими клетками (p=0,787); однако, количество CD34+ клеток было значимо выше в нарощенной пуповинной крови (p<0,0001). Было значимое повышение ядросодержащих клеток и CD34+ клеток в нарощенной пуповинной крови по сравнению с величинами перед наращиванием (p=0,0006 и p<0,0001, соответственно). Ядросодержащие клетки были размножены до коэффициента медианы 1,9 (диапазон от 0,8 до 6,9) и CD34+ клетки до коэффициента медианы 40,2 (диапазон от 23,8 до 123,1).
ФИГ. 11. Характеристики порций крови и пациентов у реципиентов клеток, размноженных ex vivo, и исторических когорт Центра исследования рака Фреда Хатчинсона (FHCRC) у пациентов, получавших трансплантацию пуповинной крови.
ФИГ. 12A-12C. Выживаемость без признаков заболевания (DFS) за три года (фиг. 12A): Реципиенты клеток, размноженных ex vivo, 86% (95% ДИ: 56-96) по сравнению с контролями 67% (95% ДИ: 52-78). Совокупная смертность не от рецидива по группам (фиг. 12B). Значимо более высокая смертность, связанная с трансплантацией (TRM) среди пациентов в контрольной группе без случаев TRM у реципиентов клеток, размноженных ex vivo: 16% (95% ДИ: 7-27) vs. 0 Совокупная смертность от рецидива по группам (фиг. 12C). Отсутствие значимых отличий между двумя группами: Реципиенты клеток, размноженных ex vivo, 13% (95% ДИ: 2-34) по сравнению с контролями 16% (95% ДИ: 7-28).
ФИГ. 13. Совокупная встречаемость более тяжелой III-IV степени острой реакции ТПХ по группам. Значимое отличие между пациентами, получавшими клетки, размноженные ex vivo, по сравнению с пациентами контрольной группе: Реципиенты клеток, размноженных ex vivo, 0% по сравнению с контролями 26% (95% ДИ: 14-38).
ПОДРОБНОЕ ОПИСАНИЕ
US 2013/0095079 описывает разработку новаторского клинического продукта, включающего обогащенные по CD34+ и размноженные стволовые клетки пуповинной крови человека (Exp-CBSC), который можно безопасно вводить любому пациенту без какой-либо степени иммунологического соответствия между пациентом и клиническим продуктом. Было показано, что для пациентов с иммуносупрессией Exp-CBSC уменьшает время восстановления иммунной функции. Например, Exp-CBSC помогли пациентам с химиотерапией восстановить иммунную функцию быстрее, чем это произошло бы без Exp-CBSC. Тот же эффект наблюдался у пациентов, с тяжелым нарушением иммунитета после подготовки к трансплантации для получения трансплантата пуповинной крови в качестве лечения острого миелогенного лейкоза (ОМЛ) и острого лимфобластного лейкоза (ОЛЛ). Exp-CBSC аналогичным образом помогли этим пациентам-реципиентам с трансплантатом пуповинной крови восстановить иммунную функцию быстрее, чем это произошло бы без Exp-CBSC. Exp-CBSC значительно улучшили результаты лечения пациентов после подавления иммунитета, уменьшая инфекцию, рецидивы заболевания и другие, часто фатальные, осложнения лечения из-за снижения или отсутствия иммунной функции.
Настоящее изобретение относится к тому, что Exp-CBSC, описанные в US 2013/0095079, имеют дополнительные неожиданные клинические преимущества у различных популяций пациентов. Например, Exp-CBSC уменьшает отторжение трансплантата, уменьшает полное парентеральное питание, применение опиоидов, и госпитализацию после медицинской процедуры, уменьшает мукозит, и уменьшает реакцию «трансплантат против хозяина» после аллогенной трансплантации. Эти дополнительные неожиданные клинические преимущества Exp-CBSC у различных популяций пациентов также значительно улучшают результаты лечения пациентов. Снижение отторжения трансплантата, мукозита и реакции «трансплантат против хозяина» повышает выживаемость и качество жизни после пересадки твердой ткани и/или аллогенного трансплантата. Уменьшение полного парентерального питания позволяет избежать многочисленных осложнений, которые могут возникнуть из-за такого искусственного кормления. Снижение воздействия на пациента при использовании опиоидов может помочь в борьбе с продолжающейся эпидемией злоупотребления болеутоляющими средствами. Наконец, сокращение госпитализации после медицинской процедуры снижает затраты, связанные с медицинским обслуживанием, и аналогичным образом уменьшает потери по упущенным возможностям, которые испытывают пациенты во время госпитализации. Каждое из этих применений и преимуществ описано более полно далее. По отдельности и совместно они дают дополнительные доказательства огромных клинических преимуществ, предлагаемых Exp-CBSC, описанных в US 2013/0095079 в различных популяциях пациентов.
Перед описанием новых применений Exp-CBSC для полносты описания предоставляются полезные определения, способы получения Exp-CBSC и их характеристики.
Гематопоэтические стволовые клетки. Гематопоэтическая стволовая клетка является плюрипотенетной и, в конечном итоге, порождает все типы полностью дифференцированных клеток крови. Гматопоэтическая стволовая клетка может самообновляться, или она может дифференцироваться в более коммитированные клетки-предшественники, которые необратимо являются предшественниками только нескольких типов клеток крови. Например, гематопоэтическая стволовая клетка может дифференцироваться в (i) миелоидные клетки-предшественники, которые, в конечном итоге, порождают моноциты и макрофаги, нейтрофилы, базофилы, эозинофилы, эритроциты, мегакариоциты/тромбоциты, дендритные клетки, или в (ii) лимфоидные клетки-предшественники, которые, в конечном итоге, порождают T-клетки, B-клетки, и лимфоцитоподобные клетки, называемые клетки-естественные киллеры (NK-клетки). Как только стволовая клетка дифференцировала в миелоидную клетку-предшественника, ее потомство не может дать клетки лимфоидного ряда, и, аналогично, лимфоидные клетки-предшественники не могут дать клетки миелоидного ряда. Для общего обсуждения гемопоэза и дифференцировки гематопоэтической стволовой клетки, см. Chapter 17, Differentiated Cells and the Maintenance of Tissues, Alberts et al., 1989, Molecular Biology of the Cell, 2nd Ed., Garland Publishing, New York, N.Y.; Chapter 2 of Regenerative Medicine, Department of Health and Human Services, August 2006, и Chapter 5 of Hematopoietic Stem Cells, 2009, Stem Cell Information, Department of Health and Human Services.
Были разработаны анализы in vitro и in vivo для характеристики гематопоэтических стволовых клеток, например, селезеночный колониеобразующий анализ (CFU-S) и анализы восстановления у иммунодефицитных мышей. Дополнительно, для распознавания и выделения гематопоэтических стволовых клеток были использовано наличие или отсутствие белковых маркеров клеточной поверхности, определяемых при помощи распознавания моноклональным антителом. Такие маркеры включают CD34, CD38, CD43, CD45RO, CD45RA, CD59, CD90, CD109, CD117, CD133, CD166, и HLA DR, и их сочетания. См. Chapter 2 of Regenerative Medicine, Department of Health and Human Services, August 2006 и цитируемые в ней ссылки.
Забор пуповинной крови. Кровь пупочного канатика человека и/или плацентарная кровь человека являются источниками стволовых клеток пуповинной крови. Такую кровь можно получать любым известным в данной области способом. Использование пуповинной или плацентарной крови как источника стволовых клеток обеспечивает многочисленные преимущества, включая то, что пуповинную и плацентарную кровь можно получать с легкостью и не травмируя донора. См., например, патент США № 5004681 для обсуждения забора пуповинной и плацентарной крови при рождении человека. В конкретных вариантах осуществления забор пуповинной крови проводят способом, описанным в патенте США № 7147626 B2, выданном Goodman et al. Забор следует проводить в стерильных условиях. Сразу после забора, пуповинную или плацентарную кровь следует смешать с антикоагулянтом. Таким антикоагулянтом может быть любой известный в данной области, в том числе CPD (цитрат-фосфат-декстроза), ACD (кислый цитрат-декстроза), раствор Олсвера (Alsever et al., 1941, N.Y. St. J. Med. 41:126), раствор Де Говина (De Gowin, et al., 1940, J. Am. Med. Ass. 114:850), Edglugate-Mg (Smith, et al., 1959, J. Thorac. Cardiovasc. Surg. 38:573), раствор Рауса-Тернера (Rous и Turner, 1916, J. Exp. Med. 23:219), другие смеси глюкозы, гепарин, этилацетат свинца, и т.д. См., в основном, Hurn, 1968, Storage of Blood, Academic Press, New York, pp. 26-160). В конкретных вариантах осуществления можно использовать ACD.
Пуповинную кровь можно получать путем прямого дренажа из пуповины и/или путем забора иглой из плаценты при родах из корневой и вздутых вен. См., в основном, патент США № 5004681.
В определенных вариантах осуществления на образце собранной крови можно проводить следующие тесты или рутинным образом, или по клиническим показаниям:
(i) Культивирование бактерий: чтобы гарантировать отсутствие микробного загрязнения, можно проводить общепринятые анализы, такие как рутинное культивирование в госпитале на бактерии при аэробных и анаэробных условиях;
(ii) Диагностический скрининг на патогенные микроорганизмы: чтобы гарантировать отсутствие конкретных патогенных микроорганизмов, можно использовать различные диагностические тесты. Диагностический скрининг для любого из многочисленных патогенов, передаваемых через кровь, может быть выполнен стандартными способами. В качестве одного из примеров, собранный образец крови (или образец материнской крови) можно подвергать диагностическому скринингу на присутствие вируса иммунодефицита человека-1 или 2 (ВИЧ-1 или ВИЧ-2). Можно использовать любую из многочисленных систем анализа, основанную на детекции вирионов, вирус-кодирующих белков, ВИЧ-специфических нуклеиновых кислот, антител к ВИЧ-белкам, и т.д. Собранную кровь можно также тестировать на другие инфекционные заболевания, в том числе лимфотропный вирус Т-клеток человека I и II (HTLV-I и HTLV-II), гепатит B, гепатит C, цитомегаловирус, сифилис, лихорадку Западного Нила и другие возбудители инфекции, указанные соответствующими регулирующими органами, такими как Управление по контролю за пищевыми продуктами и лекарственными средствами США.
Предпочтительно, перед забором пуповинной крови определяют историю болезни матери для того чтобы выявить риски, которые клетки пуповинной крови могут представлять для передачи генетических или инфекционных заболеваний, таких как злокачественная опухоль, лейкоз, иммунные нарушения, неврологические нарушения, гепатит или СПИД. Собранные образцы пуповинной крови могут проходить тестирование по одному или нескольким тестам на жизнеспособность клеток, HLA-типирование, типирование ABO/Rh, подсчет CD34+ клеток и подсчет общего числа ядросодержащих клеток.
Обогащение пуповинной крови стволовыми клетками. Как только пуповинная кровь и/или плацентарная кровь собрана от одного человека при родах, кровь обрабатывают для получения обогащенной популяции гематопоэтических стволовых клеток, или обогащенной популяции гематопоэтических стволовых клеток и клеток-предшественников, формируя популяцию стволовых клеток пуповинной крови. Гематопоэтические стволовые клетки, или гематопоэтические стволовые клетки и клетки-предшественники, могут быть положительными по специфическому маркеру, который экспрессируется на повышенных уровнях на гематопоэтических стволовых клетках или гематопоэтических стволовых клетках и клетках-предшественниках, по сравнению с другими типами гематопоэтических клеток. Например, такими маркерами могут быть CD34, CD43, CD45RO, CD45RA, CD59, CD90, CD109, CD117, CD133, CD166, HLA DR, или их сочетание. Гематопоэтические стволовые клетки или гематопоэтические стволовые клетки и клетки-предшественники, также могут быть отрицательными по специфическому маркеру по сравнению с другими типами гематопоэтических клеток. Например, Lin представляет собой комбинацию линиеспецифических антител, которые служат в качестве отрицательных маркеров. CD38 также является примером отрицательного маркера. Предпочтительно, гематопоэтические стволовые клетки, или гематопоэтические стволовые клетки и клетки-предшественники, представляют собой CD34+ клетки. Предпочтительно, популяция стволовых клеток пуповинной крови (ПК) обогащена CD34+ стволовыми клетками или CD34+ стволовыми клетками и клетками-предшественниками (и, таким образом, обеднена T-клетками). Обогащение, таким образом, относится к процессу, где процентное содержание гематопоэтических стволовых клеток, или гематопоэтических стволовых клеток и клеток-предшественников в образце повышено (относительно процентного содержания в образце до процедуры обогащения). Очистка представляет собой один из примеров обогащения. В конкретных вариантах осуществления увеличение числа CD34+ клеток (или других подходящих антиген-положительных клеток) в виде процентного содержания клеток в обогащенном образце по сравнению с образцом до процедуры обогащения, является 5-, 50-, 100-, 200-, 350-кратным или более. В конкретных вариантах осуществления CD34+ клетки обогащены с использованием моноклонального антитела к CD34, которое конъюгировано с магнитным шариком, и прибора для магнитного разделения клеток для отделения CD34+ клеток.
В конкретных вариантах осуществления перед обработкой для обогащения, собранная пуповинная и/или плацентарная кровь является свежей и не была предварительно заморожена.
Для проведения обогащения для гематопоэтических стволовых клеток, или гематопоэтических стволовых клеток и клеток-предшественников можно использовать любой способ, известный в данной области для разделения/отбора клеток. Например, можно использовать способы, которые основаны на различной экспрессии поверхностных клеточных маркеров. Например, для клеток, экспрессирующих поверхностный клеточный маркер CD34, можно проводить положительную селекцию с использованием моноклонального антитела к CD34, таким образом, что клетки, экспрессирующие CD34, сохраняются, а клетки, не экспрессирующие CD34, не сохраняются. Кроме того, используемые способы разделения должны максимально повышать жизнеспособность отбираемых клеток. Конкретный используемый способ будет зависеть от эффективности разделения, цитотоксичности способа, легкости и скорости проведения, и необходимости в сложном оборудовании и/или техническом навыке.
Способы для разделения могут включать магнитное разделение, с использованием магнитных шариков, покрытых антителами, аффинную хроматографию, цитотоксические средства, присоединенные к моноклональному антителу или используемые в сочетании с моноклональным антителом, например, комплемент и цитотоксины, и "пэннинг" с антителом, присоединенным к твердой матрице, например, планшету, или другой подходящий способ. Способы, обеспечивающие точное разделение/отбор включают клеточные сортеры с активацией флуоресценции, которые могут иметь разную степень сложности, например, множество цветовых каналов, детектирующие каналы светорассеяния с малым и тупым углами, импедансные каналы, и т.д.
Антитела можно конъюгировать с маркерами, такими как магнитные шарики, которые обеспечивают прямое разделение, биотином, который может быть удален при помощи авидина или стрептавидина, связанного с подложкой, флуорохромами, которые можно использовать с клеточным сортером с активацией флуоресценции, или т.п., чтобы обеспечить простоту отделения конкретного типа клеток. Можно использовать любой способ, который не является чрезмерно вредным для жизнеспособности выбранных клеток.
В конкретных вариантах осуществления порцию свежей пуповинной крови обрабатывают для отбора по, т.е., для обогащения по, CD34+ клеткам с использованием антител к CD34 напрямую или опосредованно конъюгированных с магнитными частицами с использованием магнитного сепаратора клеток, например, CliniMACS® Cell Separation System (Miltenyi Biotec, Bergisch Gladbach, Germany), который использует суперпарамагнитные частицы наноразмера, состоящие из оксида железа и декстрана, и соединенные со специфическими моноклональными антителами. CliniMACS® Cell Separator представляет собой закрытую стерильную систему, оснащенную одноразовым сменным набором трубок. Сменный набор можно использовать для обработки одной порции собранной пуповинной и/или плацентарной крови для обогащения CD34+ клетками, и выбросить после обработки. Аналогично, можно обогащать CD133+ клетками с использованием антител к CD133. В конкретных вариантах осуществления обогащают CD34+ CD90+ клетками. Аналогично, можно обогащать клетками, экспрессирующим CD43, CD45RO, CD45RA, CD59, CD90, CD109, CD117, CD166, HLA DR, или комбинацию из вышеуказанных, с использованием антител против целевого антигена.
В конкретных вариантах осуществления один или несколько образцов пуповинной крови и/или плацентарной крови можно объединять перед обогащением гематопоэтическими стволовыми клетками, или гематопоэтическими стволовыми клетками и клетками-предшественниками. В конкретных вариантах осуществления отдельные образцы стволовых клеток ПК можно объединять после обогащения гематопоэтическими стволовыми клетками, или гематопоэтическими стволовыми клетками и клетками-предшественниками. В конкретных вариантах осуществления число образцов пуповинной крови и/или плацентарной крови, или образцов стволовых клеток ПК, которые объединяют, составляет 2 или больше (например, 2, 3, 7, 15, 35). В конкретных вариантах осуществления образцы пуповинной крови и/или плацентарной крови или образцы стволовых клеток ПК объединяют безотносительно HLA-типа присутствующих клеток. В конкретных вариантах осуществления безотносительно означает, что не предпринимают никаких шагов для определения совпадения по HLA между образцами в объединении. В определенных вариантах осуществления образцы в объединении получены из пуповинной крови и/или плацентарной крови индивидуумов одинаковой расы, например, от афроамериканцев, европейцев, азиатов, латиноамериканцев, коренных американцев, австралийских аборигенов, инуитов, уроженцев островов Тихого океана, или получены из пуповинной крови и/или плацентарной крови индивидуумов одинаковой этнической принадлежности, например, ирландцев, итальянцев, индийцев, японцев, китайцев, русских, и т.д.
Необязательно, перед обогащением гематопоэтическими стволовыми клетками, или гематопоэтическими стволовыми клетками и клетками-предшественниками, можно разделять эритроциты и лейкоциты пуповинной крови. После проведения разделения эритроцитов и лейкоцитов, фракцию эритроцитов удаляют, а фракцию лейкоцитов обрабатывают на магнитном сепараторе клеток, как описано выше. Разделение фракций красных и белых клеток крови можно проводить любым известным в данной области способом, включая способы центрифугирования. Другие способы разделения, которые можно использовать, включают использование коммерчески доступных продуктов FICOLL™ или FICOLL-PAQUE™ или PERCOLL™ (GE Healthcare, Piscataway, N.J.). FICOLL-PAQUE™ обычно помещают на дно конической пробирки и наслаивают сверху цельную кровь. После центрифугирования в конической пробирке становятся видны следующие слои сверху вниз: плазма и другие составляющие, слой мононуклеарных клеток, называемый лейкоцитарным слоем, который содержит мононуклеарные клетки периферической крови (лейкоциты), FICOLL-PAQUE™, и эритроциты и гранулоциты, которые должны присутствовать в форме осадка. Этот способ разделения позволяет легко собирать мононуклеарные клетки периферической крови.
Необязательно, перед отбором CD34+ клеток аликвоту порции свежей пуповинной крови можно проверить на общее количество ядросодержащих клеток и/или содержание CD34+. В конкретных вариантах осуществления после отбора CD34+ клеток, и фракцию CD34+ клеток ("Стволовые клетки ПК"), и фракцию CD34- клеток восстанавливают. Необязательно, ДНК можно выделять из образца фракции CD34- клеток для начального типирования HLA и будущих исследований на химеризм, даже если не сделан тест на совместимость HLA с пациентом. Фракцию, обогащенную CD34+ стволовыми клетками ("Стволовые клетки ПК") можно затем обрабатывать перед наращиванием, например, стволовые клетки можно суспендировать в подходящей среде для культивирования клеток для перевозки или хранения. В конкретных вариантах осуществления среда для культивирования клеток включает бессывороточную среду для наращивания STEMSPAN™ (StemCell Technologies, Vancouver, British Columbia), дополненную рекомбинантным человеческим интерлейкином-3 (rhIL-3; например, 10 нг/мл или другие концентрации, описываемые в настоящем документе), рекомбинантным человеческим интерлейкином-6 (rhIL-6; например, 50 нг/мл или другие концентрации, описываемые в настоящем документе), рекомбинантным человеческим тромбопоэтином (rhTPO; 50 нг/мл или другие диапазоны, описываемые в настоящем документе), рекомбинантным человеческим лигандом Flt-3 (rhFlt-3L; например, 50 нг/мл или другие концентрации, описываемые в настоящем документе), и рекомбинантным человеческим фактором стволовых клеток (rhSCF; например, 50 нг/мл или другие концентрации, описываемые в настоящем документе).
В конкретных вариантах осуществления образец пуповинной крови и/или плацентарной крови обеднен эритроцитами, и подсчитано число CD34+ клеток во фракции, обедненной эритроцитами. В конкретных вариантах осуществления образцы пуповинной крови и/или плацентарной крови, содержащие более чем 3,5 миллиона CD34+ клеток, можно обогащать при помощи вышеописанных способов обогащения, однако, также можно использовать образцы, содержащие менее чем 3,5 миллиона CD34+ клеток.
Способы наращивания стволовых клеток пуповинной крови. После выделения стволовых клеток ПК из пуповинной крови человека и/или плацентарной крови человека, взятой от одного или нескольких людей при рождении, в соответствии с вышеописанными способами обогащения или другими известными в данной области способами, стволовые клетки ПК размножают для того чтобы увеличить число гематопоэтических стволовых клеток или гематопоэтических стволовых клеток и клеток-предшественников, например, CD34+ клеток. Можно использовать любой известный в данной области способ для наращивания числа стволовых клеток ПК, который приводит к размножению стволовых клеток ПК. Стволовые клетки ПК можно культивировать при условиях роста клеток (например, способствующих митозу), таким образом, что стволовые клетки ПК растут и делятся (пролиферируют) для получения популяции размноженных стволовых клеток ПК. В конкретных вариантах осуществления отдельные популяции стволовых клеток ПК, каждая из которых получена из пуповинной крови и/или плацентарной крови одного человека при рождении, можно объединять, безотносительно типа HLA клеток, до или после способа наращивания. В конкретных вариантах осуществления образец, который размножают, не является совокупностью образцов. В конкретных вариантах осуществления способ, который используют для наращивания, представляет собой способ, для которого было показано, что он (i) приводит в результате к увеличению числа гематопоэтических стволовых клеток, или гематопоэтических стволовых клеток и клеток-предшественников, например, CD34+ клеток, в размноженном образце по сравнению с не размноженным образцом стволовых клеток ПК, и/или (ii) приводит в результате к увеличению числа репопулирующих клеток SCID в размноженном образце, определенном анализом серийных разведений, как показано путем усиленного приживления у мышей NOD/SCID, которым вводили размноженный образец, по сравнению с тем, что наблюдали с не размноженным образцом, где неразмноженный образец и размноженный образец происходят из различных аликвот одного и того же образца, где размноженный образец, но не неразмноженный образец, подвергали процедуре наращивания. В определенных вариантах осуществления способ приводит к 5-, 75-, 100-, 200-, 350-, или 500-кратному или большему увеличению числа гематопоэтических стволовых клеток, или гематопоэтических стволовых клеток и клеток-предшественников в размноженном образце, по сравнению с не размноженным образцом стволовых клеток ПК. Гематопоэтические стволовые клетки или гематопоэтические стволовые клетки и клетки-предшественники могут быть положительными по одному или нескольким из CD34, CD43, CD45RO, CD45RA, CD59, CD90, CD109, CD117, CD133, CD166, и HLA DR и/или отрицательными по Lin и/или CD38. В конкретных вариантах осуществления усиленное приживление можно выявлять, определяя повышенное процентное содержание CD45+ клеток человека в костном мозге мышей, которым вливали аликвоту размноженного образца, по сравнению с мышами, которым вливали аликвоту не размноженного образца, например, через 10 суток, 3 недели или 9 недели после вливания (см. Delaney et al., 2010, Nature Med. 16(2): 232-236).
Такие способы размножения включают способы, описанные в патенте США № 7399633; Delaney et al., 2010, Nature Med. 16(2): 232-236; Zhang et al., 2008, Blood 111:3415-3423; и Himburg et al., 2010, Nature Med. 16, 475-482, а также размножение с использованием антагонистов арилуглеводородных рецепторов, как описано в WO/2013/086436), агонистов LILRB2, как описано в WO/2013/179633, и гидрогелей (например, цвиттерионных гидрогелей), а также способы, описанные ниже.
В конкретных вариантах осуществления стволовые клетки ПК культивируют с факторами роста, и подвергают условиям роста для клеток (например, способствующим митозу), таким образом, что стволовые клетки пролиферируют, для получения размноженной популяции стволовых клеток ПК. В конкретных вариантах осуществления стволовые клетки ПК культивируют с количеством агониста функции Notch, эффективным для ингибирования дифференцировки, и подвергают условиям роста для клеток (например, способствующим митозу), таким образом, что стволовые клетки пролиферируют, для получения размноженной популяции стволовых клеток ПК. В конкретных вариантах осуществления стволовые клетки ПК культивируют с количеством агониста функции Notch, эффективным для ингибирования дифференцировки и в присутствии факторов роста, и подвергают условиям роста для клеток (например, способствующим митозу), таким образом, что стволовые клетки пролиферируют, для получения размноженной популяции стволовых клеток ПК. Размноженную популяцию стволовых клеток ПК, полученную таким образом, можно замораживать и хранить для дальнейшего использования. Необязательно, агонист пути Notch инактивируют или удаляют из размножаемой популяции стволовых клеток ПК перед пересадкой пациенту (например, путем разделения, разведения).
В конкретных вариантах осуществления, стволовые клетки ПК культивируют в течение 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, или 25 суток или больше; или в конкретных вариантах осуществления стволовые клетки ПК культивируют по меньшей мере в течение 10 суток.
Другие примеры условий культивирования для размножения стволовых клеток ПК изложены у Zhang et al., 2008, Blood 111:3415-3423. В конкретных вариантах осуществления стволовые клетки ПК можно культивировать в бессывороточной среде, дополненной гепарином, фактором стволовых клеток, тромбопоэтином, инсулиноподобным фактором роста-2 (IGF-2), фактором роста фибробластов-1 (FGF-1), и Angpt13 или Angpt15. В конкретных вариантах осуществления среда дополнена 10 мкг/мл гепарина, 10 нг/мл фактора стволовых клеток, 20 нг/мл тромбопоэтина, 20 нг/мл IGF-2, 10 нг/мл FGF-1, и 100 нг/мл Angpt13 или Angpt15, и клетки культивируют в течение 19-23 суток. В конкретных вариантах осуществления стволовые клетки ПК можно размножать, культивируя стволовые клетки ПК в бессывороточной среде, дополненной 10 мкг/мл гепарина, 10 нг/мл фактора стволовых клеток, 20 нг/мл тромбопоэтина, 10 нг/мл FGF-1, и 100 нг/мл Angpt15 в течение 11-19 суток. В конкретных вариантах осуществления стволовые клетки ПК можно размножать, культивируя стволовые клетки ПК в бессывороточной среде, дополненной 50 нг/мл фактора стволовых клеток, 10 нг/мл тромбопоэтина, 50 нг/мл лиганда рецептора Flt-3, и 100 нг/мл связывающего белка-2 инсулиноподобного фактора роста (IGFBP2) или 500 нг/мл Angpt15 в течение 10 суток. В конкретных вариантах осуществления стволовые клетки ПК можно размножать, культивируя стволовые клетки ПК в бессывороточной среде, дополненной 10 мкг/мл гепарина, 10 нг/мл фактора стволовых клеток, 20 нг/мл тромбопоэтина, 10 нг/мл FGF-1, 500 нг/мл Angpt15, и 500 нг/мл IGFBP2 в течение 11 суток. См. Zhang et al., 2008, Blood 111:3415-3423.
Примеры условий культивирования для размножения стволовых клеток ПК изложены у Himburg et al., 2010, Nature Med., 16, 475-482. В конкретных вариантах осуществления стволовые клетки ПК можно культивировать в жидкой суспензионной культуре, дополненной тромбопоэтином, фактором стволовых клеток, лигандом рецептора Flt-3, и плейотропином. В конкретных вариантах осуществления жидкая суспензионная культура дополнена 20 нг/мл тромбопоэтина, 125 нг/мл фактора стволовых клеток, 50 нг/мл лиганда рецептора Flt-3, и 10, 100, 500 или 1000 нг/мл плейотропина, и стволовые клетки ПК культивируют в течение 7 суток.
В конкретных вариантах осуществления после размножения стволовых клеток ПК, определяют общее число клеток и жизнеспособные CD34+ клетки для измерения потенциала образца для обеспечения гематопоэтической функции. Многочисленные клинические исследования показали, что общая доза ядросодержащих клеток и доза CD34+ клеток в трансплантатах стволовых клеток высоко коррелируют с приживлением нейтрофилов и тромбоцитов, а также с частотой неудач трансплантации и ранними осложнениями, связанными с трансплантатом (прежде всего, летальными инфекциями), после трансплантации стволовых клеток. Например, на 5-8 сутки после начала культивирования во время размножения, можно брать образец для определения общего числа CD34+ клеток путем мультипараметрической проточной цитометрии, и, таким образом, можно определять процентное содержание CD34+ клеток в образце. Аналогично, перед криоконсервацией или после оттаивания, можно брать аликвоту образца размноженных стволовых клеток ПК для определения общего числа ядросодержащих клеток и процентного содержания жизнеспособных CD34+ клеток для того чтобы рассчитать общее число жизнеспособных CD34+ клеток в образце размноженных стволовых клеток ПК.
В конкретных вариантах осуществления общие количества жизнеспособных CD34+ (или других антиген-положительных) клеток можно считать анализом содержания активного вещества для высвобождения конечного продукта для терапевтического применения. Жизнеспособность можно определять любым известным в данной области способом, например, тест с исключением трипанового синего или с исключением 7-AAD. В конкретных вариантах осуществления общее число ядросодержащих клеток (TNC) и другие данные применяют для расчета активности продукта. Процентное содержание жизнеспособных CD34+ клеток можно оценивать путем проточной цитометрии и использования красителя, который исключается жизнеспособными клетками. Процентное содержание жизнеспособных CD34+ клеток=числу CD34+ клеток, которые исключают 7-AAD (или другой подходящий краситель) в аликвоте образца, деленному на TNC (и жизнеспособных, и нежизнеспособных) в аликвоте. Жизнеспособные CD34+ клетки в образце можно рассчитывать следующим образом: жизнеспособные CD34+ клетки=TNC образца × % жизнеспособных CD34+ клеток в образце. Пропорциональное повышение после обогащения или размножения по жизнеспособным CD34+ клеткам можно рассчитать следующим образом: общее число жизнеспособных CD34+ клеток после культивирования/общее число жизнеспособных CD34+ клеток до культивирования. Как будет очевидно можно использовать антигены, иные чем CD34, или в дополнение к нему.
Агонисты Notch. В конкретных вариантах осуществления стволовые клетки ПК размножают путем культивирования клеток в присутствии агониста функции Notch и одного из множества факторов роста или цитокинов в течение определенного периода времени. Культивирование стволовых клеток ПК можно проводить в любой подходящей среде для культивирования/при условиях, известных в данной области (см., например, Freshney Culture of Animal Cells, Wiley-Liss, Inc., New York, N.Y. (1994)). Время культивирования представляет собой период времени, достаточный для получения популяции размноженных стволовых клеток ПК, как определено в настоящем документе. Например, стволовые клетки ПК можно культивировать в бессывороточной среде в присутствии агониста функции Notch и одного или нескольких факторов роста или цитокинов в течение 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, или 25 суток; или, в конкретных вариантах осуществления в течение по меньшей мере 10 суток. Необязательно, в любой момент во время периода культивирования, среду для культивирования можно заменять свежей средой или можно добавлять свежую среду.
Агонист Notch представляет собой агент, который способствует, т.е., вызывает или усиливает, активацию функции пути Notch. Как применяют в настоящем документе, "функция пути Notch " означает функцию, опосредуемую путем передачи сигнала Notch (сигнальной трансдукцией), включая транслокацию в ядро внутриклеточного домена Notch, транслокацию в ядро RBP-Jκ или его гомолога у дрозофилы Suppressor of Hairless; активация генов bHLH энхансера комплекса Split, например, Mastermind; активация гена HES-1 или гена KBF2 (также называемого CBF1); ингибирование сегрегации нейроблатстов дрозофилы; и связывание Notch с Delta, Jagged/Serrate, Fringe, Deltex или RBP-Jκ/Suppressor of Hairless, или их гомологами или аналогами. См. в основном обзорную статью Kopan et al., 2009, Cell 137:216-233 для обсуждения пути передачи сигнала Notch и его эффектов при активации; см. также Jarriault et al., 1998, Mol. Cell. Biol. 18:7423-7431.
Активацию Notch проводят путем воздействия на клетку агониста Notch. Агонист Notch может быть растворимой молекулой, молекулой, которая рекомбинантно экспрессируется на поверхности клетки, молекулой на клеточном монослое, которым воздействуют на клетки-предшественники, или молекулой, иммобилизованной на твердой фазе. Примеры агонистов Notch представляют собой лиганды внеклеточного связывания Delta и Serrate, которые связываются с внеклеточныым доменом Notch и активируют сигнальную трансдукцию Notch, или фрагмент Delta или Serrate, который связывается с внеклеточныым доменом Notch и активирует сигнальную трансдукцию Notch. Последовательности нуклеиновых кислот и аминокислотные последовательности Delta и Serrate, которые были выделены из нескольких видов, включая человека, известны в данной области, и описаны в международных патентных публикациях №№ WO 93/12141, WO 96/27610, WO 97/01571, Gray et al., 1999, Am. J. Path. 154:785-794. В конкретных вариантах осуществления агонист Notch представляет собой иммобилизованный фрагмент белка Delta или Serrate, включающий внеклеточный домен белка, слитый с эпитопной метой myc (Deltaext-mycили Serrateext-myc, соответственно) или иммобилизованный фрагмент белка Delta или Serrate, включающий внеклеточный домен белка, слитый с Fc-частью IgG (Deltaext-IgG или Serrateext-IgG, соответственно). Агонисты Notch включают белки Notch и их аналоги и производные (включая фрагменты); белки, которые представляют собой другие элементы пути Notch, и их аналоги и производные (включая фрагменты); антитела к ним и фрагменты или другие производные таких антител, содержащие их связывающую область; нуклеиновые кислоты, кодирующие белки и производные или аналоги; а также белки и их производные и аналоги, которые связываются или иным образом взаимодействуют с белками Notch или другими белками пути Notch, таким образом, что это способствует активности пути Notch. Такие агонисты включают белки Notch и их производные, включая внутриклеточный домен, нуклеиновые кислоты Notch, кодирующие вышеуказанные, и белки, включающие домен лигандов Notch, взаимодействующий с Notch (например, внеклеточный домен Delta или Serrate). Другие агонисты включают RBPR/Suppressor of Hairless или Deltex. Fringe можно использовать для усиления активности Notch, например в сочетании с белком Delta. Эти белки, фрагменты и их производные можно рекомбинантно экспрессировать и выделять, или их можно химически синтезировать.
В конкретных вариантах осуществления агонист Notch представляет собой клетку, которая рекомбинантно экспрессирует белок или фрагмент или его производное, которое является агонистом Notch. Клетка экспрессирует агонист Notch таким образом, что он доступен стволовым клеткам ПК, в которых должна быть активирована сигнальная трансдукция Notch, например, он секретируется, экспрессируется на клеточной поверхности и т.д.
В конкретных вариантах осуществления агонист Notch представляет собой пептидомиметик или аналог пептида, или органическую молекулу, которая связывается с участником пути передачи сигнала Notch. Такой агонист можно выявлять при помощи анализов связывания, выбранных из анализов, известных в данной области, например, анализов агрегации клеток, описанных в Rebay et al., 1991, Cell 67:687-699 и в международной патентной публикации No. WO 92/19734.
В конкретных вариантах осуществления агонист представляет собой белок, включающий по меньшей мере фрагмент белка, кодируемого геном, взаимодействующим с Notch, который опосредует связывание с белком Notch или фрагментом Notch, при этом фрагмент Notch содержит область Notch, ответственную за связывание с белком-агонистом, например, повторы 11 и 12 Notch, подобные эпидермальному фактору роста. Гены, взаимодействующие с Notch, как применяют в настоящем документе, означают гены Notch, Delta, Serrate, RBPJκ, Suppressor of Hairless и Deltex, а также другие члены семейства Delta/Serrate или Deltex, которые могут быть идентифицированы в силу гомологии последовательности или генетического взаимодействия и, в более общем смысле, члены "каскада Notch" или гены "группы Notch", которые идентифицируют по молекулярным взаимодействиям (например, связывание in vitro, или генетическим взаимодействиям (как показано фенотипически, например, у Drosophila). Примеры фрагментов Notch-связывающих белков, содержащих область, ответственную за связывание с Notch, описаны в патентах США №№ 5648464, 5849869 и 5856441.
Агонисты Notch можно получать коммерческим путем, при помощи рекомбинантной экспрессии или химического синтеза.
В конкретных вариантах осуществления воздействие на клетки агониста Notch не производят путем инкубации с другими клетками рекомбинантно экспрессирующими лиганд Notch на клеточной поверхности (хотя в других вариантах осуществления этот способ можно использовать), но скорее производят путем воздействия бесклеточного лиганда Notch, например, путем инкубации с бесклеточным лигандом Notch, при этом лиганд иммобилизован на поверхности твердой фазы, например, иммобилизован на поверхности чашки Петри.
В конкретных вариантах осуществления, активности Notch способствует связывание лигандов Notch (например, Delta, Serrate) с внеклеточной частью рецептора Notch. Передача сигнала Notch, по-видимому, запускается путем физического взаимодействия между внеклеточными доменами Notch и его лигандами, которые или связаны с мембранами соседних клеток, или иммобилизованы на твердой поверхности. Полноразмерные лиганды являются агонистами Notch, поскольку их экспрессия на одной клетке запускает активацию пути на соседней клетке, которая экспрессирует рецептор Notch. Растворимые укороченные молекулы Delta или Serrate, в том числе внеклеточные домены белков или их Notch-связывающие части, которые были иммобилизованы на твердой поверхности, такой как планшет для культивирования тканей, являются особенно предпочтительными агонистами пути Notch. Такие растворимые белки можно иммобилизлвать на твердой поверхности при помощи антитела или взаимодействующего белка, например, антитела, нацеленного на эпитопную метку, с которой Delta или Serrate экспрессируются в виде слитого белка (например, эпитопная метка myc, которая распознается антителом 9E10), или белка, который взаимодействует с эпитопной меткой, с которой Delta или Serrate экспрессируются в виде слитого белка (например, иммуноглобулиновая эпитопная метка, которая связывается с белком A).
В конкретных вариантах осуществления и как описано в патенте США № 5780300, выданном Artavanis-Tsakonas et al., агонисты Notch включают реагенты, которые вызывают или активируют клеточные процессы, опосредующие созревание или этапы обработки, необходимые для активации Notch или участника пути передачи сигнала Notch, такого как фуриноподобная конвертаза, необходимая для процессинга Notch, Kuzbanian, дизинтегриновая металлопротеаза (ADAM), которые считаются необходимыми для активации пути Notch выше или параллельно Notch (Schlondorff и Blobel, 1999, J. Cell Sci. 112:3603-3617), или, в более общем смысле, белки клеточной миграции и процессинга, такие как семейство rab ГТФаз, необходимое для движения между отделами клетки (для обзора Rab ГТФаз, см. Olkkonen и Stenmark, 1997, Int. Rev. Cytol. 176:1-85). Агонист может быть любой молекулой, которая повышает активность одного из вышеописанных процессов, такой как нуклеиновая кислота, кодирующая фурин, Kuzbanian или белок rab, или фрагмент или производное или его доминантный активный мутант, или пептидомиметик или аналог пептида или органическая молекула, которая связывается с вышеперечисленными белками и активирует их функцию.
Патент США №5780300 дополнительно описывает классы молекул агонистов Notch (и способы их идентификации), которые можно использовать для активации пути Notch, например, молекулы, которые запускают диссоциацию анкириновых повторов Notch с RBP-Jκ, таким образом, способствуя транслокации RBP-Jκ из цитоплазмы в ядро.
Факторы роста/Цитокины. В конкретных вариантах осуществления стволовые клетки ПК размножают путем культивирования клеток в присутствии агониста функции Notch и одного из множества факторов роста или цитокинов в течение определенного периода времени. Альтернативно, стволовые клетки ПК размножают путем культивирования клеток в присутствии одного из множества факторов роста или цитокинов в течение определенного периода времени. Где необходимо достигнуть размножения стволовых клеток ПК без дифференцировки, стволовые клетки ПК культивируют в присутствии факторов роста, которые поддерживают рост, но не дифференцировку. Фактор роста может быть любым типом молекулы, таким как белок или химическое соединение, который способствует клеточной пролиферации и/или выживанию.
Воздействие на стволовые клетки ПК одного или нескольких факторов роста можно производить до, одновременно, или после воздействия на клетки агониста Notch. В конкретных предпочтительных вариантах осуществления факторы роста, присутствующие в среде для размножения включают один или несколько из следующих факторов роста: фактор стволовых клеток (SCF), также известный как лиганд c-kit или фактор роста тучных клеток, лиганд Flt-3 (Flt-3L), интерлейкин-6 (IL-6), интерлейкин-3 (IL-3), интерлейкин-11 (IL-11) и тромбопоэтин (TPO), гранулоцит-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF), ангиопоэтин-подобные белки (Angptls) (Angptl2, Angptl3, Angptl5, Angptl7, и Mfap4), инсулинопопдобный фактор роста-2 (IFG-2), фактор роста фибробластов-1 (FGF-1). Количество SCF, Flt-3L, IL-6, или TPO может быть в диапазоне 10-1000 нг/мл, в конкретных вариантах осуществления, 50-500 нг/мл, и в конкретных вариантах осуществления, 100-300 нг/мл. В конкретных вариантах осуществления количество SCF, Flt-3L, IL-6, или TPO составляет 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425 или 450 нг/мл. Количество IL-3, IL-11, G-CSF, или GM-CSF может быть в диапазоне 2-100 нг/мл, в конкретных вариантах осуществления, 5-50 нг/мл, и в конкретных вариантах осуществления, 7,5-25 нг/мл, и в конкретных вариантах осуществления, 10-15 нг/мл. В конкретных вариантах осуществления количество IL-3, IL-11, G-CSF, или GM-CSF составляет 5, 6, 7, 8, 9, 10, 12,5, или 15 нг/мл.
В конкретных вариантах осуществления для размножения стволовых клеток ПК, клетки культивируют на чашке Петри, на которой связан белок внеклеточного матрикса. В конкретных вариантах осуществления белок внеклеточного матрикса представляет собой фибронектин (FN), или его фрагмент. Такой фрагмент может быть CH-296 (Dao et al., 1998, Blood 92(12):4612-21) или RetroNectin® (фрагмент рекомбинантного фибронектина человека) (Clontech Laboratories, Inc., Madison, Wis.).
В конкретных вариантах осуществления для размножения стволовых клеток ПК, клетки культивируют на пластиковой чашке Петри, содержащей иммобилизованный лиганд Delta, например, внеклеточный домен Delta, и фибронектин в присутствии 100 нг/мл каждого из SCF и TPO, и 10 нг/мл GM-CSF. В конкретных вариантах осуществления для размножения стволовых клеток ПК, клетки культивируют на пластиковой чашке Петри, содержащей иммобилизованный лиганд Delta и фибронектин в присутствии 100 нг/мл каждого из SCF, Flt-3L, TPO и IL-6 и 10 нг/мл IL-3. В конкретных вариантах осуществления для размножения стволовых клеток, клетки культивируют на пластиковой чашке Петри, содержащей иммобилизованный лиганд Delta и фибронектин в присутствии 100 нг/мл каждого из SCF и Flt-3L и 10 мг/мл каждого из G-CSF и GM-CSF. В конкретных вариантах осуществления для размножения стволовых клеток ПК, клетки культивируют на пластиковой чашке Петри, содержащей иммобилизованный лиганд Delta и фибронектин в присутствии 100 нг/мл каждого из SCF, Flt-3L и TPO и 10 мг/мл GM-CSF. В конкретных вариантах осуществления для размножения стволовых клеток ПК, клетки культивируют на пластиковой чашке Петри, содержащей иммобилизованный лиганд Delta и фибронектин в присутствии 300 нг/мл каждого из SCF и Flt-3L, 100 нг/мл каждого из TPO и IL-6, и 10 мг/мл IL-3. В конкретных вариантах осуществления для размножения стволовых клеток ПК, клетки культивируют на пластиковой чашке Петри, содержащей иммобилизованный лиганд Delta и фибронектин в присутствии 100 нг/мл каждого из SCF, Flt-3L, и TPO и 10 мг/мл каждого из G-CSF и GM-CSF. В конкретных вариантах осуществления фибронектин исключен с чашек Петри или замещен другим белком внеклеточного матрикса. См. также патент США № 7399633 B2, выданный Bernstein et al. для дополнительных примеров условий культивирования для размножения стволовых клеток ПК.
Факторы роста можно получать коммерческим путем, при помощи рекомбинантной экспрессии или химического синтеза. Например, Flt-3L (человеческий), IGF-1 (человеческий), IL-6 (человеческий и мышиный), IL-11 (человеческий), SCF (человеческий), TPO (человеческий и мышиные) можно приобретать у Sigma (St. Louis, Mo.). IL-6 (человеческий и мышиные), IL-7 (человеческий и мышиные), и SCF (человеческий) можно приобретать у Life Technologies, Inc. (Rockville, Md.).
В других вариантах осуществления факторы роста производят путем рекомбинантной экспрессии или путем химического пептидного синтеза (например, при помощи синтезатора пептидов). Последовательности нуклеиновых кислот и пептидов факторов роста, как правило, доступны в GenBank.
В конкретных вариантах осуществления фактор(-ы) роста, применяемые для размножения стволовых клеток ПК в присутствии агониста Notch, получены из тех же самых видов, что и стволовые клетки ПК.
Количество или концентрация факторов роста, подходящих для размножения стволовых клеток ПК будет зависеть от активности препарата фактора роста, и соответствия видов между факторами роста и стволовыми клетками ПК, и т.д. В основном, когда фактор(-ы) роста и стволовые клетки ПК относятся к одному виду, общее количество фактора роста в среде для культивирования находится в диапазоне от 1 нг/мл до 5 мкг/мл, в конкретных вариантах осуществления от 5 нг/мл до 1 мкг/мл, и в конкретных вариантах осуществления от 10 нг/мл до 200 нг/мл. В конкретных вариантах осуществления стволовые клетки ПК размножают, воздействуя на стволовые клетки ПК агонистом Notch и 100 нг/мл SCF. В конкретных вариантах осуществления стволовые клетки ПК размножают, воздействуя на стволовые клетки ПК агонистом Notch и 100 нг/мл каждого из Flt-3L, IL-6 и SCF, и 10 нг/мл IL-11.
Криоконсервация и оттаивание после криоконсервации. Как только популяция размноженных стволовых клеток ПК получена после размножения стволовых клеток из пуповинной крови, популяцию размноженных стволовых клеток ПК можно криоконсервировать. В конкретных вариантах осуществления популяцию размноженных стволовых клеток ПК можно разделить и заморозить в одном или нескольких пакетах (или порциях). В конкретных вариантах осуществления две или более популяции размноженных стволовых клеток ПК можно объединить, разделить на отдельные аликвоты, и заморозить каждую аликвоту. В конкретных вариантах осуществления размноженные стволовые клетки ПК являются свежими, т.е., их не замораживали или криоконсервировали перед размножением. Термины "замороженный/замораживать" и "криоконсервировать/криоконсервированный" используют взаимозаменяемо в настоящей заявке. Криоконсервацию можно производить любым известным в данной области способом, который замораживает клетки в жизнеспособной форме. Замораживание клеток, как правило, является разрушительным. При охлаждении вода в клетке замерзает. Затем происходит травмирование при осмотическом воздействии на клеточную мембрану, дегидратация клетки, концентрирование растворимых веществ и образование льда. Поскольку лед образуется за пределами клетки, доступная вода удаляется из раствора и выводится из клетки, вызывая осмотическую дегидратацию и повышение концентрации растворимых веществ, которое в конечном итоге разрушает клетку. Для обсуждения, см. Mazur, P., 1977, Cryobiology 14:251-272.
Эти повреждающие эффекты можно обойти путем (а) использования криозащитного средства, (б) контроля скорости замораживания, и (с) хранения при достаточно низкой температуре, чтобы свести к минимуму разрушающие реакции.
Криозащитные средства, которые можно использовать, включают диметилсульфоксид (ДМСО) (Lovelock и Bishop, 1959, Nature 183:1394-1395; Ashwood-Smith, 1961, Nature 190:1204-1205), глицерин, поливинилпирролидин (Rinfret, 1960, Ann. N.Y. Acad. Sci. 85:576), полиэтиленгликоль (Sloviter и Ravdin, 1962, Nature 196:548), альбумин, декстран, сахарозу, этиленгликоль, i-эритритол, D-рибитол, D-маннит (Rowe et al., 1962, Fed. Proc. 21:157), D-сорбит, i-инозитол, D-лактозу, холина хлорид (Bender et al., 1960, J. Appl. Physiol. 15:520), аминокислоты (Phan The Tran и Bender, 1960, Exp. Cell Res. 20:651), метанол, ацетамид, глицерина моноацетат (Lovelock, 1954, Biochem. J. 56:265), и неорганические соли (Phan The Tran и Bender, 1960, Proc. Soc. Exp. Biol. Med. 104:388; Phan The Tran и Bender, 1961, in Radiobiology, Proceedings of the Third Australian Conference on Radiobiology, Ilbery ed., Butterworth, London, p. 59). В конкретных вариантах осуществления применяют ДМСО, жидкость, которая не токсична для клеток в низкой концентрации. Будучи низкомолекулярным соединением, ДМСО свободно проникает в клетку и защищает внутриклеточные органеллы, сочетаясь с водой и изменяя ее замораживаемость, и предотвращает повреждение от образования льда. Добавление плазмы (например, в концентрации 20-25%) может усилить защитный эффект ДМСО.
Регулируемая скорость медленного охлаждения может быть существенно важной. Различные криозащитные средства (Rapatz et al., 1968, Cryobiology 5(1):18-25) и различные типы клеток имеют различные оптимальные скорости медленного охлаждения (см. например, Rowe и Rinfret, 1962, Blood 20:636; Rowe, 1966, Cryobiology 3(1):12-18; Lewis, et al., 1967, Transfusion 7(1):17-32; и Mazur, 1970, Science 168:939-949 для воздействия скорости охлаждения на выживание стволовых клеток костного мозга и на их трансплантационный потенциал). Теплота фазы плавления, где вода превращается в лед, должна быть минимальной. Процедуру охлаждения можно проводить с использованием, например, программируемого морозильного устройства или способа метанольной ванны.
Программируемые морозильные аппараты позволяют определять оптимальные скорости охлаждения и облегчают стандартное воспроизводимое охлаждение. Программируемые морозильные камеры с контролируемой скоростью, такие как Cryomed или Planar позволяют настраивать схему замораживания на желаемую кривую скорости охлаждения. Например, для клеток костного мозга в 10% ДМСО и 20% плазме оптимальная скорость составляет от 1° до 3°С/в минуту от 0°С до -80°С. В конкретных вариантах осуществления эту скорость охлаждения можно использовать для неонатальных клеток. Контейнер, для хранения клеток должен быть стабильным при криогенных температурах и обеспечивать быструю теплопроводность для эффективного контроля, как замерзания, так и оттаивания. Герметичные пластиковые флаконы (например, Nunc, Wheaton cryules) или стеклянные ампулы можно использовать для нескольких небольших количеств (1-2 мл), в то время как большие объемы (100-200 мл) можно заморозить в полиолефиновых пакетах (например, Dehned), удерживаемых между металлическими пластинами для лучшей теплопроводности во время охлаждения. Пакеты с клетками костного мозга были успешно заморожены путем помещения их в морозильные камеры -80°C, которые, по счастливой случайности, дают скорость охлаждения 3°C/минуту).
В конкретных вариантах осуществления можно использовать способ охлаждения при помощи метанольной ванны. Способ метанольной ванны хорошо подходит для рутинной криоконсервации множества мелких предметов в больших масштабах. Способ не требует ручного управления скоростью замораживания или устройства для контроля скорости. В конкретных вариантах осуществления клетки, обработанные ДМСО, предварительно охлаждают на льду и переносят в лоток, содержащий охлажденный метанол, который помещают, в свою очередь, в механический холодильник (например, Harris или Revco) при -80°C. Измерения термопары метаноловой ванны и образцов указывают желаемую скорость охлаждения от 1° до 3°C/минуту. После по меньшей мере двух часов, образцы достигают температуры -80°C и могут быть помещены непосредственно в жидкий азот (-196°C) для постоянного хранения.
После тщательного замораживания размноженные стволовые клетки ПК могут быть перенесены в сосуд для длительного криогенного хранения. В конкретных вариантах осуществления образцы можно хранить в криогенном состоянии в жидком азоте (-196°C) или его парах (-165°C). Такое хранение значительно облегчается благодаря наличию высокоэффективных холодильников с жидким азотом, которые напоминают большие контейнеры-термосы с чрезвычайно низким вакуумом и внутренней суперизоляцией, так что потери тепла и потери азота сведены к абсолютному минимуму.
Подходящие стеллажные системы коммерчески доступны и могут использоваться для каталогизации, хранения и поиска отдельных образцов.
Рекомендации и способы для манипуляции, криоконсервации и длительного хранения гематопоэтических стволовых клеток, особенно из костного мозга или периферической крови, в значительной степени применимы к размноженным стволовым клеткам ПК. Такое обсуждение можно найти, например, в следующих ссылках, включенных путем ссылки в настоящий документ: Gorin, 1986, Clinics In Haematology 15(1):19-48; Bone-Marrow Conservation, Culture and Transplantation, Proceedings of a Panel, Moscow, July 22-26, 1968, International Atomic Energy Agency, Vienna, pp. 107-186.
Другие способы криоконсервации жизнеспособных клеток, или их модификации, доступны и предусмотрены для использования (например, способы с холодным металлическим зеркалом; Livesey и Linner, 1987, Nature 327:255; Linner et al., 1986, J. Histochem. Cytochem. 34(9):1123-1135; см. также патент США № 4199022 для Senkan et al., патент США № 3753357 для Schwartz, патент США № 4559298 для Fahy).
Оттаивание. Замороженные клетки предпочтительно быстро оттаивают (например, на водяной бане, поддерживаемой при 37-44°С) и охлаждают сразу же после оттаивания. В конкретных вариантах осуществления флакон с замороженными клетками может быть погружен по горлышко в теплую водяную баню; осторожное вращение обеспечит перемешивание клеточной суспензии, пока она оттаивает, и увеличит теплопроводность от теплой воды к внутренней массе льда. Как только лед полностью растает, флакон можно сразу же положить на лед.
В конкретных вариантах осуществления образец размноженных стволовых клеток ПК после оттаивания или его часть можно вводить для обеспечения гематопоэтической функции у пациента, нуждающегося в этом. Существует несколько процедур, касающихся обработки оттаиваемых клеток, и они могут быть использованы, если они считаются желательными.
Криозащитное средство, если оно токсично для людей, должно быть удалено до терапевтического использования оттаявших размноженных стволовых клеток ПК. В вариантах осуществления, использующих ДМСО в качестве криоконсерванта, предпочтительно пропустить этот шаг во избежание потери клеток, поскольку ДМСО не имеет серьезной токсичности. Однако, когда желательно удаление криозащитного средства, удаление предпочтительно происходит при оттаивании.
Одним из способов удаления криозащитного средства является разбавление до незначительной концентрации. Это может быть достигнуто добавлением среды, за которым следует, при необходимости, один или несколько циклов центрифугирования для осаждения клеток, удаление супернатанта и ресуспендирование клеток. Например, внутриклеточный ДМСО в оттаиваемых клетках можно снизить до уровня (менее 1%), который не будет отрицательно влиять на восстановленные клетки. Это предпочтительно выполнять медленно, чтобы минимизировать потенциально разрушающие осмотические градиенты, возникающие при удалении ДМСО.
После удаления криозащитного средства, могут быть сделаны подсчет клеток (например, с использованием гемоцитометра) и тестирование жизнеспособности (например, путем исключения трипанового синего, Kuchler, 1977, Biochemical Methods in Cell Culture and Virology, Dowden, Hutchinson & Ross, Stroudsburg, Pa., pp. 18-19; 1964, Methods in Medical Research, Eisen et al., eds., Vol. 10, Year Book Medical Publishers, Inc., Chicago, pp. 39-47), для подтверждения выживаемости клеток. Процентное содержание жизнеспособных антиген-положительных (например, CD34) клеток в образце можно определить путем вычисления числа антиген-положительных клеток, которые исключают 7-ААД (или другой подходящий краситель, исключаемый жизнеспособными клетками) в аликвоте образца, деленного на общее число ядросодержащих клеток (TNC) (как жизнеспособных и не-жизнеспособных) в аликвоте образца. Количество жизнеспособных антиген-положительных клеток в образце может быть затем определено путем умножения процентного содержания жизнеспособных антиген-положительных клеток на TNC образца.
Перед криоконсервацией и/или после оттаивания, можно определять общее число ядросодержащих клеток, или в конкретных вариантах осуществления, общее число CD34+ или CD133+ клеток. Например, общее количество ядросодержащих клеток можно определять с использованием гемоцитометра и исключения красителя трипанового синего. Образцы с высоким содержанием клеток могут быть разбавлены до диапазона концентраций, подходящего для ручного подсчета. Конечные количества клеток для продуктов корректируют для любых коэффициентов разбавления. Общее количество ядросодержащих клеток=жизнеспособные ядросодержащие клетки на мл × объем продукта в мл. Количество CD34+или CD133+положительных клеток в образце можно определять, например, с помощью проточной цитометрии с использованием анти-CD34 или анти-CD133 моноклональных антител, конъюгированных с флуорохромом.
В определенных вариантах осуществления идентичность и чистота начальной пуповинной крови и/или плацентарной крови, стволовых клеток ПК, и размноженных стволовых клеток ПК до криоконсервации, или размноженных стволовых клеток ПК после оттаивания могут быть подвергнуты многопараметрическому проточному цитометрическому иммунофенотипированию, которое обеспечивает процентное содержание жизнеспособных антиген-положительных клеток, присутствующих в образце. Каждый образец может быть проверен на один или несколько следующих клеточных фенотипов с использованием панели моноклональных антител, непосредственно конъюгированных с флуорохромами: 1. CD34+ HPC; 2. Т-клетки (CD3+, включая субпопуляции CD4+ и CD8+; 3. B-клетки (CD 19+ или CD20+); 4. NK клетки (CD56+); 5. Моноциты (CD14+); 6. Миеломоноциты (CD 15+) 7. Мегакариоциты (CD41+); 8. Дендритные клетки (линии отрицательные по HLA-DRbright и CD123bright, или отрицательные линии по HLA-DRbright и CD11cbright).
Ниже приведен конкретный примерный протокол, основанный на только что описанных способах. Порция/порции пуповинной крови/плацентарной крови может быть собрана у одного человека при родах. Собранную кровь затем можно смешивать с антикоагулянтом для предотвращения свертывания. Кровь может храниться на карантине при 4°C в контролируемом холодильнике. Полученные порции можно оценивать, и можно определять какая порция/порции будут обработаны для размножения. На порциях может быть указана следующая информация: полученная дата, возраст порции в часах, гестационный возраст донора в неделях, пол донора и объем порции. Кроме того, можно рассчитать общее количество ядросодержащих клеток и можно определять общее количество CD34+ клеток каждой порции, и можно рассчитать процент CD34+ клеток. Когда порция выбрана для размножения, ее можно удалить из карантина и присвоить уникальный идентификатор номера партии, который она может сохранять на всем протяжении производственного процесса.
Перед планируемым началом культивирования для размножения сосуды для тканевых культур могут быть сначала покрыты в течение ночи при 4°C или минимум 2 часа при 37°C Delta1ext-IgGв количестве 2,5 мкг/мл и RetroNectin® (фрагмент рекомбинантного фибронектина человека) (Clontech Laboratories, Inc., Madison, Wis.) в количестве 5 мкг/мл в фосфатно-солевом буфере (PBS). Затем колбы промывают PBS и блокируют при помощи PBS с 2% сывороточным альбумином человека (HSA). Порцию свежей пуповинной крови можно обработать, чтобы отобрать CD34+ клетки с помощью CliniMACS® Plus Cell Separation System. Перед отбором CD34 можно проверить аликвоту порции свежей пуповинной крови на общее количество клеток и содержание CD34. Обе клеточные фракции, CD34+ и CD34-, могут быть восстановлены после обработки. После обогащения согласно этому способу процентное содержание клеток CD34+ в образце, в основном, увеличивается в 88-223 раза относительно процентного содержания клеток CD34+ в образце до обогащения. Обогащенную клеточную фракцию CD34+ можно ресуспендировать в конечной среде для культивирования, которая представляет собой STEMSPAN™ Serum Free Expansion Medium (StemCell Technologies, Vancouver, British Columbia) дополненную rhlL-3 (10 мкг/мл), rhIL-6 (50 мкг/мл), rhTPO (50 мкг/мл), rhFlt-3L (50 мкг/мл), rhSCF (50 мкг/мл).
Обогащенные CD34+ клетки можно добавлять к специально маркированным и приготовленным сосудам для тканевых культур (например, при концентрации≤1,8×104 всех ядросодержащих клеток/см2 площади поверхности сосуда), а затем помещают в индивидуально контролируемые инкубаторы с сигнализацией, предназначенные исключительно для этой партии продукта. Через 2-4 суток культивирования, 50% первоначального объема свежей среды для культивирования (как указано выше) можно добавлять в сосуды. Сосуды с клеточной культурой можно периодически удалять из инкубатора (каждые 1-3 суток), и обследовать инвертированным микроскопом на рост клеток и признаки заражения. На сутки 5-8 сосуд можно осторожно перемешивать для смешивания клеток, и образец в 1 мл можно удалить для тестирования в процессе. Образец клеток может быть посчитан и фенотипирован по экспрессии CD34, CD7, CD14, CD15 и CD56. На всем протяжении периода культивирования клетки можно переносить в дополнительные колбы по мере необходимости, когда плотность клеток увеличивается до≥8×105 клеток/мл. В сутки перед сбором клеток для криоконсервации, можно добавить свежую среду.
На сутки 14-16, популяция размноженных клеток может быть собрана для криоконсервации. Сосуды можно перемешать, и все содержимое переносят в стерильные центрифужные пробирки на 500 мл. Собранные клетки можно центрифугировать, затем промывать один раз посредством центрифугирования в PBS и ресуспендировать в криопротекторном растворе, содержащем HSA, Normosol-R (Hospira, Lake Forrest, Ill.) и диметилсульфоксид (ДМСО). Можно взять образцы для завершающего контроля продукции. Продукт популяции размноженных стволовых клеток ПК можно замораживать в морозильной камере с контролируемой скоростью и переносить на хранение в морозильник с парофазным жидким азотом (LN2).
В конце периода культивирования полученная клеточная популяция должна быть гетерогенной, включая CD34+ клетки-предшественники и более зрелые миелоидные и лимфоидные предшественники, что подтверждает проточный цитометрический анализ на наличие антигенов CD34, CD7, CD14, CD15 и CD56. Типичная характеристика клеток, размноженных этим способом, путем проточной цитометрии в конце периода размножения, представлена на фиг. 2.
Должно быть значительное увеличение количества числа CD34+ и общего количества клеток в течение периода культивирования, в диапазоне от 100- до 387-кратного наращивания CD34+ клеток и от 617- до 3337-кратного увеличения суммарного количества клеток (N=9 отдельных порций пуповинной крови, обработанных для окончательных клинических способов размножения, как описано выше). Должно быть, по существу, полное отсутствие Т-клеток, измеряемое иммунофенотипированием. Функционально, клетки способны к приживлению множества клеточных гематопоэтических линий человека на мышиной модели NOD/SCID.
На фиг.3 показаны данные из десяти полномасштабных размножений ex vivo, выполненных в соответствии с этим протоколом. Среднее кратности размножения для суммарного числа клеток составляло 1723±230 (среднее ± sem), а для клеток CD34+- 179±30 (среднее ± sem). ФИГ. 4 излагаются начальные и конечные количества при наращивании и кратность количества при наращивании для общего количества ядросодержащих клеток и CD34+ клеток после размножения для 19 полномасштабных наращиваний ex vivo. Эти 19 размноженных стволовых клеток пуповинной крови человека были криоконсервированы в один или несколько пакетов. ФИГ. 5 показывает общее количество ядросодержащих клеток (TNC) и CD34+ клеток для каждого образца размноженных стволовых клеток пуповинной крови человека, и жизнеспособность клеток до криоконсервации, и TNC, и CD34+ клетки подсчитывали в каждом замороженном пакете. Кроме того, дополнительные 12 образцов обогащенных CD34+ клеток были размножены с помощью Delta1ext-IgG, и до начала криоконсервации показали среднее 141-кратное наращивание (SEM 17) клеток CD34+.
После вышеуказанного описания будет полезно предоставить следующее определение терминов:
"Стволовые клетки ПК" используется в настоящем документе взаимозаменяемо с "образцом стволовых клеток ПК" и относится к популяции, обогащенной гематопоэтическими стволовыми клетками, или обогащенной гематопоэтическими стволовыми клетками и клетками-предшественниками, полученной из пуповинной крови человека и/или плацентарной крови человека, собранной при родах. Гематопоэтические стволовые клетки, или гематопоэтические стволовые клетки и клетки-предшественники, могут быть положительными по специфическим маркерам, экспрессирующимся на повышенных уровнях на гематопоэтических стволовых клетках или гематопоэтических стволовых клетках и клетках-предшественниках, по сравнению с другими типами гематопоэтических клеток. Например, такими маркерами могут быть CD34, CD43, CD45RO, CD45RA, CD59, CD90, CD109, CD117, CD133, CD166, HLA DR, или их сочетание. Также, гематопоэтические стволовые клетки, или гематопоэтические стволовые клетки и клетки-предшественники, могут быть отрицательными по экспрессируемому маркеру, по сравнению с другими типами гематопоэтических клеток. Например, такими маркерами могут быть Lin, CD38, или их сочетание. В конкретных вариантах осуществления гематопоэтические стволовые клетки, или гематопоэтические стволовые клетки и клетки-предшественники, представляют собой CD34+ клетки.
"Размноженные стволовые клетки ПК" используются в настоящем документе взаимозаменяемо с "образцом размноженных стволовых клеток ПК" и «Ex-CBSC» по отношению к стволовым клеткам ПК, которые подвергались способу для размножения гематопоэтических стволовых клеток, или гематопоэтических стволовых клеток и клеток-предшественников пуповинной крови, при этом было показано, что способ в результате приводит (i) к увеличению числа гематопоэтических стволовых клеток, или гематопоэтических стволовых клеток и клеток-предшественниковв аликвоте образца, размноженного таким образом, и/или (ii) к увеличению числа репопулирующих клеток SCID в размножаемом образце, определенного анализом серийных разведений, как показано путем усиленного приживления у мышей NOD/SCID, которым вводили размноженный образец, по сравнению с тем, что наблюдали с аликвотой образца, который не подвергали процедуре размножения. В конкретных вариантах осуществления усиленное приживление у мышей NOD/SCID можно выявлять, определяя повышенное процентное содержание CD45+ клеток человека в костном мозге мышей, которым вливали аликвоту размноженного образца, по сравнению с мышами, которым вливали аликвоту не размноженного образца, например, через 10 суток, 3 недели или 9 недели после вливания (см. Delaney et al., 2010, Nature Med. 16(2): 232-236). В конкретных вариантах осуществления способ размножения приводит по меньшей мере к 50-, 75-, 100-, 150-, 200-, 250-, 300-, 350-, 400-, 450-, или 500-кратному увеличению числа гематопоэтических стволовых клеток, или гематопоэтических стволовых клеток и клеток-предшественников в аликвоте размноженного образца, и в конкретных вариантах осуществления составляет по меньшей мере 100-кратное увеличение.
Применение Ex-CBSC для уменьшения отторжения трансплантата из твердой ткани. Существует множество заболеваний и состояний, которые в результате приводят к дисфункции или недостаточности органа. В определенных условиях, наилучшим терапевтическим выбором для лечения дисфункции или недостаточности органа является трансплантация органа. Дополнительно, трансплантация органа может быть выгодной или даже жизненно необходимой для индивидуумов, которые перенесли травмирующее или дегенеративное событие. Например, жертвам ожогов и/или аварий могут помочь кожные трансплантаты. Даже пересадка лица входит в клиническую сферу.
Молекулы главного комплекса гистосовместимости (MHC) (лейкоцитарные антигены человека (HLA) у людей) находятся на поверхностях клеток и определенные структуры этих молекул, как правило, уникальны у каждого индивидуума (за исключением идентичных близнецов).
Антигены HLA класса I (HLA-A, HLA-B и HLA-C) представляют собой трансмембранные белки, которые экспрессируются на поверхности практически всех клеток организма (за исключением эритроцитов и клеток центральной нервной системы) и презентируют пептиды на клеточной поверхности, при этом пептиды получены из расщепленных белков, которые разрушаются в протеасомах.
Антигены HLA класса II (HLA-DP, HLA-DM, HLA-DOA, HLA-DOB, HLA-DQ, и HLA-DR) презентируют антигены снаружи клетки T-лимфоцитам. Эти конкретные антигены стимулируют клетки T-хелперы к размножению, и эти клетки T-хелперы затем стимулируют антитело-продуцирующие B-клетки к выработке антител к этому специфическому антигену. Аутоантигены подавляются супрессорными T-клетками.
Антигены HLA класса III кодируют компоненты системы комплемента.
Разнообразие HLA в популяции людей является одним из аспектов защиты от заболеваний, и, как следствие, вероятность того, что два неродственных индивидуума имеют одинаковые молекулы HLA по всем локусам, очень низка. Таким образом, существует необходимость для типирования HLA для определения подходящего совпадения аллелей, чтобы избежать отторжения донорской ткани реципиентом. Большинство типирования тканей (например, для иммунологического соответствия реципиенту) проводят с использованием серологических способов с антителами, специфичными к идентифицированным антигенам HLA. Способы на основе ДНК для выявления полиморфизмов в гене, кодирующем антиген HLA, также используются для типирования аллелей HLA, и быстро становятся предпочтительным методом для типирования HLA. Типирование HLA можно проводить (1) путем определения аллеля HLA, которое выполняется на уровне последовательности ДНК путем определения аллельспецифических последовательностей (типирование с высоким разрешением), и/или (2) путем определения антигена HLA серологически, с помощью антител, специфичных к антигену HLA (типирование с низким разрешением).
Иммунная система каждого индивидуума запрограммирована на атаку чужих или «не своих» MHC- или HLA-несущих тканей. Из-за этого одной из проблем терапевтической трансплантации является разрушительное воздействие иммунной системы реципиента (хозяина) на трансплантат. Если эти разрушительные эффекты не будут устранены, может произойти отторжение трансплантата, которое может быть фатальным, когда, например, отторгается жизненно важный орган. Таким образом, как применяют в настоящем документе, отторжение трансплантата относится к отторжению пересаженного материала из твердой ткани (например, орган, группа клеток (например, островок бета-клеток), кожный трансплантат или волосы) иммунной системой реципиента/хозяина. В конкретных вариантах осуществления отторжение трансплантата означает появление некроза более 80% или 90% клеток или ткани трансплантированного материала в результате иммунного ответа реципиента/хозяина против пересаженного материала. В конкретных вариантах осуществления отторжение трансплантата означает снижение жизнеспособности пересаженного материала, таким образом, что предполагаемая функция пересаженного материала уменьшается на 80% или 90% или более по сравнению с жизнеспособностью пересаженного материала до трансплантации, в результате иммунного ответа реципиента/хозяина против пересаженного материала.
Из-за риска отторжения трансплантата предпринимаются усилия для оптимизации степени совместимости MHC/HLA между донором и реципиентом. Здесь полезно прояснить различие между совместимыми/несовместимыми трансплантатами и «не совпадающими» или «не соответствующими» трансплантатами, поскольку термины применяют в настоящем документе. Иммунологическая совместимость, которое относится к «совместимому» или «несовместимому», относится к степени совместимости. Например, когда протипированы и сопоставлены 6 антигенов HLA, образец может быть указан как совместимый с 4/6, 5/6 или 6/6 антигенами HLA. Аналогичные образцы 4/6 и 5/6 также могут быть «несовместимы» с 2/6 или 1/6 антигенами HLA. В обоих случаях существует высокая степень соответствия между донором и реципиентом (> 50% соответствует). И, наоборот, «без соответствия», «несовпадающий» или «несоответствующий» означает, что степень соответствия между донором и получателем неизвестна, поскольку, например, ни донор, ни реципиент не были типированы по HLA.
В трансплантационной медицине предпочтительна наивысшая степень иммунологической совместимости между донором и реципиентом. Это связано с тем, что высокая степень совместимости, как правило, уменьшает величину ответа отторжения реципиента. Также можно использовать лекарственные препараты для подавления иммунного ответа реципиента/хозяина против трансплантата. Примеры таких иммуносупрессантов («противоотторгающие лекарственные средства») включают преднизон, циклоспорин А и циклофосфамид.
Несмотря на успехи в трансплантации, поддержание трансплантата остается проблемой. Например, иммуносупрессия для предотвращения отторжения трансплантата повышает риск оппортунистических инфекций и злокачественной опухоли. Таким образом, существует необходимость для более эффективных лечебных процедур против отторжения, которые продлевают выживание трансплантата (и, таким образом, пациента) и улучшают качество жизни.
Настоящее изобретение предусматривает, что введение Ex-CBSC уменьшает отторжение трансплантата. Более конкретно, и, как показано в примере 1, введение Ex-CBSC значительно снижает отторжение трансплантата, что продемонстрировано при длительном поддержании кожных трансплантатов. Способность Ex-CBSC уменьшать отторжение аллогенных кожных трансплантатов демонстрирует, что Ex-CBSC также уменьшит отторжение других типов твердых тканей. Это связано с тем, что поддержание кожных трансплантатов особенно затруднено, и таким образом эти типы трансплантатов стали «золотым стандартом» для экспериментальных исследований трансплантации (Anderson & Matzinger, Nat. Med., 2001. (7) 1: 80-87). Преобладающим механизмом, ответственным за отторжение твердой ткани по всем типам тканей, является активация Т-клеток, вызванная «не своими» пептидами, полученными от донора и презентированными молекулами МНС. Субпопуляция Т-клеток, которые отвечают на «не свои» антигены, полученные от донора, становятся Т-клетками памяти, которые затем предотвратят развитие регуляторного иммунного ответа на донорскую ткань. Т-клетки памяти являются важной детерминантой отторжения кожных трансплантатов (Benichou et al. Immunotherapy. 2011. 3(6): 757-770), а также других типов органов, таких как печень (Donckier et al. Tranplantation. 96 (3): 306-15), сердце (Azzawi, J Heart Lung Transplant. 1998. 17:881-887) и почка (Heeger, J Immunol, 1999: 163: 2267-2275). Не ограничиваясь теорией, одна из причин, по которой Ex-CBSC вызывают толерантность к кожным трансплантатам, заключается в том, что они способствуют активности донор-специфических регуляторных Т-клеток, истощая вторичную лимфоидную ткань донор-специфических Т-клеток памяти при размножении Ex-CBSC. Подавление донор-специфических Т-клеток памяти и увеличение регуляторных Т-клеток могут способствовать толерантности ко многим типам органов. Таким образом, Ex-CBSC будут полезны для предотвращения отторжения многих типов твердых органов и тканей.
Кроме того, пример 1 также указывает на то, что снижение отторжения твердой ткани можно отнести к иммунологической толерантности. В этом контексте иммунологическая толерантность относится к снижению интенсивности иммунного ответа хозяина против пересаженного материала. В конкретных вариантах осуществления интенсивность иммунного ответа может быть уменьшена на 5-100%, 25-100% или 75-100% по сравнению со средним иммунным ответом хозяина против материала трансплантата, который не получал Ex-CBSC, как описано в настоящем документе. В конкретных вариантах осуществления интенсивность иммунного ответа можно измерять путем определения момента времени, при котором отторгается пересаженный материал. Например, иммунологическая толерантность может позволить пересаженному материалу выжить и функционировать в течение более длительного периода времени. В конкретных вариантах осуществления иммунологическая толерантность может относиться к состоянию иммунной системы (хозяина), при котором некоторые чужеродные антигены не вызывают иммунный ответ или вызывают сниженный иммунный ответ.
На основании вышеуказанного, Ex-CBSC можно использовать для индукции иммунологической толерантности в разнообразных контекстах и популяциях пациентов. Таким образом, конкретные варианты осуществления, описываемые в настоящем документе, включают введение Ex-CBSC для придания индивидууму иммунной толерантности к трансплантату. Индивидуум, который обладает иммунной толерантностью, не может вызвать иммунный ответ, который значительно отторгает или разрушает трансплантированный материал. В конкретных вариантах осуществления индивидуум, который обладает иммунной толерантностью, не реагирует на антиген путем выработки антител, способных связываться с антигеном, или реагирует на уровне, который снижен в статистически значимой степени и/или по степени клинического значения.
В конкретных вариантах осуществления настоящее изобретение относится к введению Exp-CBSC для уменьшения отторжения трансплантата жировой ткани, кровеносных сосудов, кости, костного мозга, сердечных клеток, хряща, хрящевых клеток, хондральных клеток, улитки внутреннего уха, соединительной ткани, роговицы, монослоев культивированных клеток, зубных тканей, глаза, лица, фасции, фиброзной ткани, ноги, функциональной единицы позвоночника, волос, руки, сердца, сердечных клапанов, кишечника, клеток островка, почки, хрусталика, связок, печени, легкого, мениска, мышечно-сухожильных трансплантатов, мышечной ткани, нервных клеток, нервной ткани, костно-хрящевых клеток, остеогенных клеток, яичника, поджелудочной железы, полусухожильных тканей, кожи, селезенки, стволовых клеток, желудка, сухожилий, яичка, зуба или зубов, и позвоночных дисков.
Как указывалось ранее, положительное воздействие Ex-CBSC в снижении отторжения трансплантата может уменьшить потребность в подавлении иммунитета у пациентов, получающих трансплантаты. Таким образом, после введения Ex-CBSC, пациентам можно вводить меньше иммуносупрессоров. Иллюстративные иммуносупрессоры включают циклоспорин, циклоспорин А, циклофосфамид, преднизон, дексаметазон, метотрексат, азатиоприн, микофенолат мофетил, талидомид, FK-506 (такролимус), сиролимус, системные стероиды, местные стероиды, а также широкий спектр антител, агонисты рецепторов, антагонисты рецепторов, и другие такие сердства, как известно специалисту в данной области. Снижение введения иммуносупрессоров может быть отражено через более низкую дозу, больший промежуток времени между дозами и/или путем прекращения их введения раньше времени.
В конкретных вариантах осуществления можно анализировать экспериментальное отторжение трансплантата путем трансплантации мышам (например, мышам C57BL/6) трансплантированного материала под почечные капсулами и введения Ex-CBSC. Уменьшение отторжения трансплантата можно подтвердить, умерщвляя реципиентов трансплантата и окрашивая на жизнеспособные клетки, или выполняя иммуноцитохимическое окрашивание в месте пересаженного материала (т.е. органа или ткани, присутствующих в месте пересаженного материала) в подходящий момент времени после трансплантации. Момент времени, при котором производят окрашивание (например, гематоксилин и эозин, или иммуноокрашивание) в месте трансплантированного материала, может варьироваться, например, согласно среднему времени выживания, или ожидаемому времени выживания трансплантированного животного.
На различных моделях участок трансплантата можно анализировать, например, путем окрашивания, от 1 суток до 10 лет (т.е., 1, 5, 10, 30, 100 или более суток, 1, 2 и более лет) после трансплантации, в конкретных вариантах осуществления от 10 суток до 1 года после трансплантации, и в более конкретных вариантах осуществления, через 10-100 суток после трансплантации. Например, если трансплантированный материал вводится под почечную капсулу мыши, можно проверять почку трансплантированной мыши. Трансплантированный материал успешно приживается (т.е., не отторгается), если трансплантированный материал все еще обнаруживается и/или, в конкретных вариантах осуществления, пересаженный материал пролиферировал в тканевую массу.
Детекцию трансплантированного материала и пролиферацию пересаженного материала может определять, например, при окрашивании гематоксилином/эозином замороженного среза, полученного из участка трансплантата (например, почки), и обнаружении нового роста, который не производит реципиент трансплантата (например, не производит почка реципиента). В случае ксеногенной трансплантации трансплантированный материал успешно приживается, если специфическое иммуноокрашивание с антисывороткой, специфичной для антигена от видов, из которых получен трансплантированный материал, согласно способам иммуноцитохимической окраски в данной области, идентифицирует положительные клетки. Альтернативно, в вариантах осуществления, где проводят ксеногенную трансплантацию, трансплантированный материал успешно приживается, если молекулы (т.е., белок или антиген), полученные из видов трансплантата (то есть, из вида, из которого происходит пересаженный материал), обнаруживаются в крови реципиента трансплантата.
Сокращение полного парентерального питания. Полное парентеральное питание (TPN) включает удовлетворение потребностей пациента в питании с помощью внутривенных кормлений. TPN, которое иногда также обозначается как внутривенное питание, обеспечивает все углеводы, белки, жиры, воду, электролиты, витамины и минералы, необходимые для нарастания ткани, расходования энергии и других физиологических действий.
TPN возникло как экстренная процедура, которую сначала использовали после операции при тяжелой и массивной травме желудочно-кишечного тракта. Парентеральное питание, будь то полное или дополнительное, в настоящее время применяется при самых разных хронических состояниях, включая последующие медицинские вмешательства, которые делают пациента неспособным или не желающим есть.
Хотя полное парентеральное питание представляет собой жизненно необходимую программу питания для многих пациентов, каждый пациент может страдать от побочных реакций из-за чувствительности к некоторым элементам в питательной смеси и возможности заражения инфекциями через трубку с питанием. Другие осложнения, которые могут развиться, включают сердечную перегрузку, дефицит холина, дегидратацию, электролитный дисбаланс, гипергликемию, механическую травму сердца, метаболический ацидоз, метаболическое заболевание кости, флебит, почечные заболевания и тромбоз полой вены. Таким образом, сокращение количества времени, когда пациент получает TPN, имеет важное клиническое преимущество.
Настоящее изобретение относится к использованию Ex-CBSC для уменьшения TPN у пациентов после медицинской процедуры. Как описано в примере 2, Ex-CBSC, описываемые в настоящем документе, оказали значительный эффект на уменьшение TPN после пересадки пуповинной крови у педиатрических пациентов. Поразительно, что средняя продолжительность TPN снизилась с 30,1 суток до 20,7 суток после введения Ex-CBSC. Это значительное сокращение может помочь облегчить осложнения, связанные с TPN.
Уменьшение использования опиоидов. Опиоиды часто вводятся после медицинских процедур, чтобы уменьшить боль, связанную с процедурой. Однако злоупотребление опиоидами, возросло до эпидемических масштабов в Соединенных Штатах Америки. FDA Consumer Health Information, FDA Acts to Reduce Harm from Opioid Drugs, April 2011. По оценкам FDA в 2007 году более 33 миллионов американцев злоупотребляли опиоидами, по сравнению сс 29 миллионами пять лет назад. Хотя правительство США планирует заниматься эпидемией посредством программ обучения и мониторинга, такие стратегии могут в недостаточной степени отражать суть проблемы, которая относится к природе опиоидных соединений, которая способствует зависимости.
Как применяют в настоящем документе, опиоиды включают соединения, которые стимулируют опиоидные рецепторы. Опиоидные рецепторы представляют собой сопряженные с G-белками рецепторы (GPCR), которые активируются как эндогенными опиоидными пептидами, так и клинически значимыми алкалоидными анальгетическими препаратами, такими как морфин. Существует три основных типа опиоидных рецепторов: δ-опиоидный рецептор, κ-опиоидный рецептор и μ-опиоидный рецептор. Примеры опиоидов включают анилидин, аллилпродин, альфентанил, альфапродин, бензилморфин, бупренорфин, безитрамид, буторфанол, кодеин, клонитазен, циклозацин, дезоцин, дезоморфин, дигидроморфин, декстроморамид, диампромид, дигидрокодеин, диэтилтиамбутен, дименоксадол, димефептанол, диметилтиамбутен, дипипанон, диоксафетил бутират, эптазоцин, этилморфин, этилметилтиамбутен, этонитазин, этогептазин, фентанил, гидрокодон, героин, 6-гидроксиморфон, гидроксипетидин, гидроморфон, изометадон, кетобемидон, леваллорфан, левофенацилморфан, лофентанил, леворфанол, морфин, мирофин, меперидин, мептазинол, метазоцин, метадон, метопон, морфин, нарцеин, налбуфин, налорфин, никоморфин, норлеворфанол, норметадон, норморфин, норпипанон, опиум, оксикодон, оксиморфон, пиритрамид, папаверетум, пентазоцин, фенадоксон, феназоцин, феноперидин, пиминодин, феноморфан, прогептазин, промедол, проперидин, пропирам, пропоксифен, суфентанил, тилидин, трамадол, их стереоизомеры, их метаболиты, их соли, их простые эфиры, их сложные эфиры, и/или их производные, и/или их смеси.
Опиоидные агонисты, которые нацелены на мю-опиоидный рецептор, часто вводятся в комбинации со вторым анальгетиком, таким как жаропонижающее лекарственное средство и/или нестероидное противовоспалительное лекарственное средство (НПВС). В некоторых случаях, полагают, что такие комбинации приводят к аддитивному эффекту, и в некоторых случаях, к синергическому действию при использовании для лечения боли. Примеры одобренных FDA комбинаций включают PERCOCET® (оксикодон/ацетиламинофен) и VICODIN® (гидрокодон/ацетиламинофен). Благодаря улучшенному анальгетическому эффекту такие комбинации могут дозироваться таким образом, чтобы уменьшить количество опиоида, вводимого пациенту («опиоид-сберегающие»). Таким образом, комбинации представляют собой потенциальные способы для уменьшения потенциала злоупотребления опиоидами, вызывающими сильную зависимость. Кроме того, они могут также уменьшать другие побочные эффекты, вызванные опиоидами.
Тем не менее, необходимы дополнительные способы ограничения использования опиоидов, и настоящее изобретение относится к использованию Ex-CBSC для сокращения использования опиоидов у пациентов после медицинской процедуры. Фактически, как описано в примере 2, Ex-CBSC, описываемые в настоящем документе, показали значительное воздействие на снижение употребления опиоидов после пересадки пуповинной крови у педиатрических пациентов. Поразительно, что средняя продолжительность непрерывного приема опиатных препаратов снизилась с 18,1 суток до 9,7 суток после введения Ex-CBSC.
Уменьшение времени госпитализации. Затраты на здравоохранение резко возрастают на всем протяжении США и в других странах, имеющих передовые системы здравоохранения. Любой способ, который уменьшает требуемое время госпитализации, связанное с медицинскими процедурами, поможет смягчить эти растущие издержки. Кроме того, пациенты несут расходы по упущенным возможностям во время прохождения медицинских процедур, требующих расширенной госпитализации. Сокращение необходимого времени госпитализации аналогично помогает пациентам в возвращении к более приятным и/или прибыльным областям деятельности. Таким образом, любой способ для сокращения необходимых сроков госпитализации, связанных с медицинскими процедурами, обеспечит большую социальную и индивидуальную пользу.
Как описано в примере 2, Ex-CBSC, описываемые в настоящем документе, оказали достоверный эффект на дни госпитализации суток после пересадки пуповинной крови у педиатрических пациентов. В среднем пациенты были выписаны на 12 суток ранее (43,2 суток в больнице против 55,6 суток в больнице) после введения Ex-CBSC.
Не будучи связанным теорией, наблюдаемые снижения TPN, использования опиоидов и госпитализации после введения Ex-CBSC могут быть связаны с уменьшенным мукозитом, что также наблюдается после введения Ex-CBSC, о чем свидетельствуют профессиональные медицинские работники у постели больного. Мукозит представляет собой воспалительную реакцию, характеризующуюся поражениями эпителиальной ткани желудочно-кишечного тракта от рта до ануса. Это может быть следствием воздействия ионизирующей радиации или химиотерапевтических средств. Стоматит представляет собой любую воспалительную реакцию, влияющую на пероральную слизистую оболочку полости рта, с наличием или без сопутствующих изъязвлений. Мукозит можно диагностировать, измерять и контролировать с помощью клинически приемлемых стандартов. Таким образом, конкретные варианты осуществления, описываемые в настоящем документе, включают введение Ex-CBSC для уменьшения мукозита у нуждающегося в этом пациента.
Поддержание здоровья выстилки желудочно-кишечного тракта (например, слизистой оболочки кишечника) может привести к некоторым полезным клиническим эффектам, описываемым в настоящем документе, за счет уменьшения или предотвращения бактериальной транслокации. Бактериальная транслокация представляет собой процесс, при котором полостные бактерии мигрируют во внекишечные участки. Модели на животных доступны, известны специалистам в данной области, и, описаны, например, у van Minnen et al J Gastrointest Surg. 2007 May, 11 (5): 682-9.
В конкретных вариантах осуществления Ex-CBSC можно вводить в комбинации с противомикробными соединениями. Примеры противомикробных средств включают противомикробные соединения, антибактериальные средства (например, антибиотики), противогрибковые средства, противоинфекционные средства и противовирусные средства. Как очевидно специалисту в данной области, конкретные соединения могут подпадать более чем под одну из этих классификаций.
Примеры противомикробных соединений включают противомикробные пептиды (AMP), хлоргексидина диацетат, и карбонат серебра.
Примеры антибактериальных средств (например, антибиотиков) включают акларубицин, актиномицин D, актинопланон, адриамицин, производное аэроплизинина, аминогликозиды (например, гентамицин или неомицин), амоксициллин, ампициллин, амрубицин, антрациклин, азиномицин-А, азитромицин, азтреонам, бисукаберин, блеомицина сульфат, бриостатин-1, калихемицин, цефепим, цефиксим, цефтриаксон, цефалоспорин C, цефамандол, цефазолин, хлорамфеникол, хромоксимицин, ципрофлоксацин, клиндамицин, дактиномицин, даунорубицин, дитрисарубицин B, доксорубицин, доксорубицин-фибриноген, доксициклин, элзамицин-A, эпирубицин, эрбстатин, эритромицин, эзорубицин, эсперамицин-Al, эсперамицин-Alb, фостриецин, глидобактин, грегaтин-А, гринкамицин, гербимицин, идарубицин, иллудины, имипенем, казусамицин, кезариродины, меногарил, меропенем, метронидазол, митомицин, неоенактин, нетилмицин, оксализин, оксауномицин, пенициллины (например, оксациллин или мезлоциллин), пепломицин, пилатин, пирарубицин, поротрамицин, пиринданицин А, рифампицин, спектиномицин, стрептомицин, тетрациклин, тигециклин, тобрамицин и триметоприм.
Примеры противогрибковых средств включают полиеновые противогрибковые средства, такие как амфотерицин В, кандицидин, филипин, гамицин, имидаксол, натамицин, нистатин, римоцидин, тиазольные противогрибковые средства и триазол. Имидазольные противогрибковые средства включают бифоназол, блотримазол, бутоконазол, эконазол, фентиконазол, изоконазол, кетоконазол, миконазол, омоконазол, оксиконазол, сертаконазол, сульконазол и тиоконазол. Противогрибковые средства на основе триазола включают альбаконазол, флуконазол, изавуконазол, итраконазол, позаконазол, равуконазол, терконазол и вориконазол. Тиазольные противогрибковые средства включают абафунгин. Примеры аллиламиновых противогрибковых средств включают аморолфин, бутенафин, нафтифин и тербинафин. Эхинокандиновые противогрибковые средства включают анидулафунгин, каспофунгин и микафунгин. Дополнительные противогрибковые средства включают бензойную кислоту, циклопирокс, кристаллический фиолетовый, флюцитозин или 5-фторцитозин, гризеофульвин, галопрогин, полигодиал, толнафтат и ундециленовую кислоту. Эфирные масла, имеющие противогрибковые свойства, включают аллицин, масло цитронеллы, кокосовое масло, лимонный мирт, раствор люголя, масло семян нима, оливковые листья, апельсиновое масло, орегано, масло пальмарозы, пачули, селен и масло чайного дерева.
Примеры противоинфекционных средств включают аналоги пиримидина. Аналог пиримидина, в основном, относится к соединению с пиримидиновой кольцевой структурой (1,3-диазин), замещенной одним или несколькими атомами или химическими группами или окисленной по одному или нескольким атомам углерода в пиримидиновой кольцевой структуре. В конкретных вариантах осуществления аналог пиримидина галогеновый заместитель, такой как F, Cl, Br, или I, у углерода в пиримидиновой кольцевой структуре. Примеры фторпиримидинов включают 5-фторцитозин, 5-фтортимидин, 5-ФУ, 5-FUdR (5-фтор-дезоксиуридин; флоксуридин), капецитабин, фтордезоксиуридин монофосфат (5-dFUMP), фторуридин трифосфат (5-FUTP), трифтортимидин, и трифлюридин. Другие галогенированные аналоги пиримидина включают 5-бромцитозин, 5-бромдезоксиуридин (5-BudR), 5-бромурацил, 5-хлорцитозин, 5-хлордезоксиуридин, 5-хлорурацил, 5-йодцитозин, 5-иоддезоксиуридин (5-IudR), и 5-йодурацил.
Урациловые аналоги пиримидина относятся к соединениям, которые содержать урацильную кольцевую структуру, замещенную одним или несколькими атомами или химическими группами. Урациловый аналог содержит галогеновый заместитель, такой как F, Cl, Br, или I. В определенных вариантах осуществления урациловый аналог содержит заместитель F, и обозначается как фторурациловый аналог. Примеры фторурациловых аналогов включают 5-ФУ, кармофур, доксифлуридин, эмитефур, флоксуридин, и тегафур.
Другие примеры противоинфекционных средств включают хлоргексидин, соединения серебра, ионы серебра, частицы серебра или другие металлические соединения, ионы или частицы (например, золото). Дополнительные противоинфекционные средства включают 2-п-сульфаниламиноэтанол, 4-сульфаниламидосалициловую кислоту, 4,4'-сульфинилдианилин, ацетосульфон, амифлоксацин, амикацин, амоксициллин, амфотерицин В, апалциллин, апициклин, апрамицин, арбекацин, аспоксициллин, азасерин, азидамфеникол, азитромицин, азтреонам, бацитрацин, бамбермицин (-ы), биапенем, бродимоприм, бутирозин, кандицидин (-ы), капреомицин, карбенициллин, карбомицин, карумонам, цефадроксил, цефамандол, цефатризин, цефбуперазон, цефклидин, цефдинир, цефдиторен, цефепим, цефетамет, цефиненоксим, цефиксим, цефминокс, цефодизим, цефоницид, цефоперазон, цефоранид, цефотаксим, цефотетан, цефотиам, цефозопран, цефпимизол, цефпирамид, цефпиром, цефпрозил, цефроксадин, цефтазидим, цефтерам, цефтибутен, цефтриаксон, цефузонам, цефалексин, цефалоглицин, цефалоспорин С, цефрадин, хлорамфеникол, хлоргексидин, хлорфенезин, хлортетрациклин, ципрофлоксацин, ципрофлоксацин, кларитромицин, клинафлоксацин, клиндамицин, кломоциклин, колистин, циклациллин, дапсон, демеклоциклин, дермостатин (-ы), диатимосульфон, дибекацин, дигидрострептомицин, диритромицин, эноксацин, энвиомицин, эпициллин, эритромицин, филипин, флероксацин, фломоксеф, фортимицин (-ы), фунгихромин, гентамицин (-ы), глюкосульфон соласульфон, соединения золота (такие как хлорид золота, ауранофин), ионы золота, частицы золота, грамицидин S, грамицидин (-ы), грепафлоксацин, гуамециклин, гетациллин, имипенем, йод, изепамицин, йозамицин, канамицин (-ы), лейкомицин (-ы), линкомицин, ломефлоксацин, луценсомицин, лимециклин, меклоциклин, мепатрицин, меропенем, метациклин, микрономицин, мидекамицин (-ы), миноциклин, моксалактам, мупироцин, надифлоксацин, натамицин, неомицин, нетилмицин, норфлоксацин, нистатин, офлоксацин, олеандомицин, олигомицин(-ы), окситетрациклин, панипенем, парамомицин, пазуфлоксацин, пефлоксацин, пенициллин N, перимицин А, пипациклин, пипемидиновая кислота, полимиксин, повидон/йод, примицин, п-сульфанилилбензиламин, хинациллин, рибостамицин, рифамид, рифампин, рифамицин SV, рифапентин, рифаксимин, ристоцетин, ритипенем, рокитамицин, ролитетрациклин, розарамицин, розоксацин, рокситромицин, салазосульфадимидин, санциклин, хлорид серебра, соединения серебра (например, ионы серебра, нитрат серебра, оксид серебра), частицы серебра, сисомицин, спарфлоксацин, спектиномицин, спирамицин, стрептомицин, сукцисульфон, сульфахризоидин, сульфалоксисодержащая кислота, сульфамидохризоидин, сульфаниловая кислота, сульфоксон, тейкопланин, темафлоксацин, темоциллин, тетрациклин, тетроксоприм, тиамфеникол, тиазолсульфон, тиострептон, тикарциллин, тигемонам, тобрамицин, тосуфлоксацин, триметоприм, троспектомицин, тровафлоксацин, туберактиномицин, туберцидин и ванкомицин.
Примеры противовирусных средств включают 5-бромуридин, ацикловир, аловудин, амантадин, противовирусные белки, арбидол, бривудин, цидофовир, даклатасвир, докозанол, активированный каспазой олигомеризатор двухцепочечной РНК (дцРНК) (DRACO), фамцикловир, FGI-104, фиалуридин, фомивирсен, фоскарнет, FV-100, ганцикловир, ибацитабин, идоксуридин, имиквимод, инозин, инозин пранобекс, интерферон, марибавир, метизазон, мороксидин, нуклеотидные противовирусные препараты, ораген, пенцикловир, плеконарил, подофиллотоксин, просетта, PSI-6130, рециГен, ресиквимод, рибавирин, ринтатолимод, семапимод, сетробувир, симепревир, софосбувир, соривудин, тарибавирин, тековирамит, телбивудин, тенофовир алафениламид фумарат, теафлавин, тилорон, трифлуридин, тромантадин, валацикловир, валганцикловир, и видарабин.
HSPC и противомикробные препараты также можно вводить в комбинации с антисептиками. Примеры антисептиков включают спирты (например, этанол, 1-пропанол, 2-пропанол), четвертичные аммониевые соли, как quats или QAC's (например, хлорид бензалкония (BAC), цетил триметиламмоний бромид (CTMB), цетилпиридин хлорид (Cetrim, CPC) и хлорид бензетония (BZT)), борная кислота, бриллиантовый зеленый, кальций гипохлорит, хлоргексидин глюконат, пероксид водорода, йод (например, повидон-йод и раствор люголя), меркурохром, октенидин дигидрохлорид, соединения фенола (карболовой кислоты), полигексанид (полигексаметилен бигуанид, PHMB), бикарбонат натрия, хлорид натрия, и натрия гипохлорит.
Уменьшенная реакция «трансплантат против хозяина» после трансплантации аллогенных гематопоэтических клеток. Пересадку гематопоэтических клеток (HCT) можно использовать для продления жизни, или она может быть единственным лечебным средством, доступным для ряда различных гематологических злокачественных опухолей и заболеваний, в том числе острого лимфобластного лейкоза, острого миелолейкоза, хронического миелогенного лейкоза, хронического лимфоцитарного лейкоза, миелодиспластического синдрома (ОЛЛ, ОМЛ, ХМЛ, ХЛЛ, и МДС, соответственно), лимфом, множественной миеломы, тяжелой апластической анемии, иммунодефицита и аутоиммунных нарушений, среди прочих.
Одним из основных препятствий для более широкого распространения и успешного применения HCT и других типов трансплантаций органов является риск реакции трансплантата против хозяина (РТПХ) у реципиента трансплантата. РТПХ характеризуется донорской тканью (импплантатом или трансплантатом), содержащей или продуцирующей клетки иммунной системы, которые атакуют ткань реципиента (хозяина). РТПХ возникает, когда функциональные иммунные клетки в транспланте распознают реципиента как «чужеродное» и наращивают иммунологическую атаку. Многие опасные для жизни осложнения происходят из-за РТПХ, и РТПХ могут быть фатальными, когда иммунные клетки, происходящие из пересаженного материала, нападают и достаточно повреждают органы получателя.
РТПХ может быть острой или хронической. Острая РТПХ характеризуется селективным повреждением печени, кожи, слизистой оболочки, желудочно-кишечного тракта (ЖКТ), самой иммунной системы (гематопоэтическая система, например, костный мозг и тимус), и легких (в форме идиопатического пневмонита). Стадии острой РТПХ определяются следующим образом: общая оценка (кожа-печень-кишка) и стадия для каждого органа устанавливается индивидуально от низкого уровня 1 (I) до максимума 4 (IV). Кожная РТПХ приводит к диффузной макулопапулезной сыпи, иногда похожей на кружево. Печеночную РТПХ можно измерять по уровню билирубина. Кишечник можно оценивать в зависимости от наличия и/или тяжести кишечного воспаления, шелушения слизистой оболочки, диареи, боли в животе, тошноты и рвоты. Стадии кишечной РТПХ можно устанавливать с помощью биопсии кишечника. Функцию почек также можно оценивать путем измерения уровней креатинина и/или BUN. Оценка по описанным I-IV стадиям клинически практикуется и является общепринятой.
Пациенты со стадией IV РТПХ, как правило, имеют неблагоприятный прогноз. Если РТПХ тяжелая, то контроль заболевания может потребовать интенсивной дополнительной иммуносупрессии, включающей стероиды и другие средства, а у пациента могут развиться тяжелые или даже смертельные инфекции в результате иммуносупрессии. Хроническая РТПХ также атакует вышеупомянутые органы, но в процессе своего длительного течения также может нанести ущерб соединительной ткани и железам внешней секреции.
Патофизиология РТПХ включает взаимодействия донорских Т-клеток с антигенпрезентирующими клетками хозяина и последующую выработку провоспалительных цитокинов (цитокиновый шторм), наряду с активацией аллореактивных эффекторных Т-клеток (Т-эффекторов), которые вызывают повреждение органа-мишени. В отличие от этого, полученные от донора зрелые регуляторные foxp3+ Т-клетки (Tregs) могут снижать активность аллореактивности. Таким образом, одна из гипотез заключается в том, что соотношение между донорскими Т-эффекторами и донорскими Tregs играет ключевую роль в тяжести РТПХ. Попытки снизить РТПХ за счет истощения Т-клеток в трансплантированных гематопоэтических клетках, однако, привели к значительному рецидиву злокачественных новообразований при лечении злокачественных опухолей из-за потери терапевтического эффекта трансплантата против лейкоза (ГВЛ), провалу приживления гематопоэтических клеток у пациента (хозяина), и увеличению частоты оппортунистических инфекций.
Аллогенная, или генетически неидентичная и, таким образом, несовместимая, трансплантация гематопоэтических стволовых клетка была выполнена с использованием пуповинной крови, потому что этот тип стволовых клеток легче получить, она несет меньший риск хронической РТПХ для реципиента, безболезненна для донора, и важно, что требуется меньшее совпадение типа ткани HLA между донором и реципиентом, что тем самым расширяет доступ к HCT для пациентов, для которых не могут идентифицировать совместимого родственного или достаточно совместимого неродственного взрослого добровольца-донора. В настоящее время в клинической практике для трансплантатов пуповинной крови HLA-типирование донорской ткани и реципиента касается определения шести антигенов или аллелей HLA, как правило, по два в локусах HLA-A, HLA-B и HLA-DR или по одному в локусах HLA-A, HLA-B и HLA-C и по одному в локусах HAL-DRB1, HLA-DQB1 и HLA-DPB1 (см., например, Kawase et al., 2007, Blood 110: 2235-2241). Несовместимость 4/6 или 5/6 или совместимость 6/6 являются стандартом клинической помощи.
Существенным барьером для использования пуповинной крови как источника клеток для трансплантатов крови человека, тем не менее, было то, что в одной порции пуповинной крови часто недостаточно кровообразующих стволовых клеток/клеток-предшественников для безопасного выполнения трансплантации из-за значительно отсроченного восстановления лейкоцитов и тромбоцитов (гематопоэтическое восстановление), а также повышенного риска отторжения трансплантата. Таким образом, эти пациенты имеют значительный риск смертности, связанной с трансплантацией. Поскольку размер одной порции пуповинной крови (т.е. число кровеобразующих клеток, содержащихся в этом одной донорской порции), часто был недостаточным для трансплантации крови, часто требовались две порции пуповинной крови. Использование двух порций пуповинной крови резко уменьшало риск отторжения/неприживления трансплантата, но время до гематопоэтического восстановления оставалось значительно отсроченным, что приводило к повышенному риску угрожающих жизни инфекций и кровотечений. Кроме того, риск острой РТПХ был также повышен с двумя порциями пуповинной крови, а у реципиентов трансплантата пуповинной крови сохранялся более высокий риск ранней смерти, связанной с трансплантацией.
Учитывая иммунологическую толерантность, наблюдаемую после введения Ex-CBSC в контексте трансплантации плотной ткани, было исследовано может ли такая иммунологическая толерантность вызывать снижение острой РТПХ. Первоначально считалось, что острая РТПХ представляет собой значительный риск, связанный с несовместимым введением Ex-CBSC из-за потенциального значительного несоответствия HLA. Как описано в примере 3, однако, нынешнее изобретение обеспечивает, что несоответствующие Ex-CBSC неожиданно уменьшают возникновение и тяжесть острой РТПХ у пациентов, получающих HLA-совместимые (6/6) или несовместимые (4/6 или 5/6) трансплантации пуповинной крови для лечения острого лейкоза с высокой степенью риска, хронического миелолейкоза и миелодиспластического синдрома. Ни у одного пациента, получающего несоответствующие Ex-CBSC в комбинации с HLA-совместимыми или несовместимыми порциями пуповинной крови, не развиласть III-IV стадия РТПХ, в то время как у 26% пациентов, которые не получали Ex-CBSC в комбинации с порциями пуповинной крови, развилась III-IV стадия РТПХ. Этот результат является значительным, поскольку, как указывалось ранее, пациенты со стадией IV РТПХ, как правило, имеют неблагоприятный прогноз. Снижение возникновения и тяжести РТПХ избавляет от необходимости интенсивной иммуносупрессии, также снижая риск развития смертельных инфекций и/или злокачественной опухоли. Это открытие также подтверждает, что Ex-CBSC индуцирует иммунологическую толерантность в различных трансплантационных контекстах и у различных пациентов.
В этом контексте иммунологическая толерантность относится к уменьшению интенсивности иммунного ответа трансплантационного материала против хозяина. Интенсивность иммунного ответа может быть снижена на 5-100%, 25-100% или 75-100% по сравнению со средним иммунным ответом трансплантата против хозяина по сравнению с реципиентами трансплантата, которые не получали Ex-CBSC, как описано в настоящем документе. В конкретных вариантах осуществления интенсивность иммунного ответа можно измерять путем определения момента времени, в который начинается РТПХ. Например, иммунологическая толерантность может позволить хозяину и органам хозяина выживать и функционировать в течение более длительного периода времени. В конкретных вариантах осуществления иммунологическая толерантность может относиться к состоянию иммунной системы (трансплантата), при котором определенные чужеродные антигены не вызывают иммунного ответа или вызывают сниженный иммунный ответ.
На основе указанного выше, конкретные варианты осуществления, описываемые в настоящем документе, включают введение Ex-CBSC, для того чтобы сделать трансплантат аллогенных гематопоэтических клеток иммуннотолерантным к хозяину. Трансплантат (имплантат) аллогенных гематопоэтических клеток, который является иммуннотолерантным, не может установить значительный иммунный ответ против хозяина, таким образом, у хозяина снижается возникновение и/или тяжесть РТПХ, в конкретных вариантах осуществления, острой РТПХ, и в более конкретных вариантах осуществления, острой стадии III или стадии IV РТПХ. В конкретных вариантах осуществления трансплантат аллогенных гематопоэтических клеток, который является иммуннотолерантным, не реагирует на антиген, продуцируя антитела, способные связываться с антигеном, или реагирует на уровне, который снижен в статистически значимой степени.
Как было указано ранее, положительное воздействие Ex-CBSC может уменьшить потребность в иммуносупрессии у пациентаов, получающих трансплантаты аллогенных гематопоэтических клеток. Таким образом, после введения Ex-CBSC, реципиентам трансплантатов аллогенных гематопоэтических клеток можно вводить меньше иммуносупрессоров. Как указывалось ранее, снижение введения иммуносупрессоров может быть отражено через более низкую дозу, больший период времени между дозами и/или путем прекращения их введения раньше времени.
Стоит отметить, что имеется множество ссылок, описывающих снижение РТПХ после трансплантации пуповинной крови. Эти ссылки преимущественно описывают снижение РТПХ после трансплантации пуповинной крови по сравнению с РТПХ, которая происходит после более стандартных трансплантатов костного мозга. Кроме того, сниженная РТПХ является, в основном, сниженной хронической РТПХ. В настоящем изобретении предусматривается, что введение Ex-CBSC еще больше уменьшает РТПХ, связанную с трансплантацией пуповинной крови. Ex-CBSC дополнительно снижает острую РТПХ, и, более конкретно, самые опасные формы острой РТПХ, стадии III и IV.
Вне клинического контекста эффективность снижения острой РТПХ также может быть подтверждена с использованием моделей на животных. Например, иммунодефицитных мышей NOD.SCIDуc-/- (NSG) (например, из лаборатории Джексона) можно быть облучать дозой 2 Гр до введения всего 2106 мононуклеарных клеток периферической крови (РВМС) от здоровых доноров. Потерю массы и выживаемость инъецированных мышей с течением времени можно оценивать как клинические параметры возникновения и тяжести РТПХ. Потеря массы может быть представлена как процент начальной массы инъецированных мышей в разные моменты времени после инъекции РВМС. Также можно собирать кровь и клетки селезенки и можно определять частоты Т-клеток проточной цитометрией с использованием флуоресцентных mAb, специфичных к человеку.
Выбор порции Exp-CBSC для введения пациенту. На всем протяжении этого изобретения была описана важность иммунологической совместимости (например, HLA-совместимости) пересаженных материалов из твердых тканей и порций пуповинной крови. Напротив, Exp-CBSC не нужно быть иммунологически совместимыми, а вместо этого они предоставляются как готовый продукт, который можно вводить любому пациенту без учета иммунологической совместимости.
В конкретных вариантах осуществления Exp-CBSC вводят без иммунологической совместимости HLA-типа Exp-CBSC с HLA-типом пациента. В конкретных вариантах «без совместимости типа HLA» и «без иммунологической совместимости» означает, что не предпринимаются никакие шаги для того, чтобы какой-либо из антигенов или аллелей HLA соответствовал у пациента и образца. В конкретных вариантах осуществления выбор Exp-CBSC для введения пациенту делается без учета того, будет ли пациент, которому будут вводить Exp-CBSC, совместим или несовместим с Exp-CBSC по любому из антигенов или аллелей HLA. Таким образом, образец Exp-CBSC может иметь тот же тип HLA, что и пациент, или тип HLA Exp-CBSC может отличаться от типа HLA пациента на 1, 2, 3, 4, 5, 6 или более типированных антигенов и/или аллелей HLA. В конкретных вариантах осуществления тип HLA образца Exp-CBSC может отличаться от типа HLA пациента по всем из типированных антигенов и/или аллелей HLA. Во избежание сомнений, однако, материал трансплантата (например, твердая ткань или трансплантация аллогенных гематопоэтических клеток) иммунологически совместим в рамках существующих клинических стандартов ухода. Существующие клинические стандарты ухода могут позволить некоторую степень несоответствия в пределах иммунологической совместимости. В конкретных вариантах осуществления Exp-CBSC может дифференцироваться в клетки миелоидной линии. В конкретных вариантах осуществления Exp-CBSC может дифференцироваться в клетки лимфоидной линии. В конкретных вариантах осуществления Exp-CBSC истощены по Т-клеткам. Истощение по Т-клеткам может быть результатом активного процесса и/или может быть связано с пассивным удалением во время отбора CD34+и культивирования для размножения.
Необязательные параметры для рассмотрения при выборе Exp-CBSC без соответствия могут включать один или несколько из общего количества ядросодержащих клеток, общее количество CD34+(или другого подходящего антигена) клеток, возраст образца, возраст пациента, расу или этническое происхождение донора, массу пациента, тип медицинского состояния, которое предполагается лечить, и его уровень тяжести у конкретного пациента, результат пациента для панели реактивных антител и т.д.
В конкретных вариантах осуществления для получения Exp-CBSC для введения пациенту клетки можно собирать из среды для культивирования, и промывать и концентрировать в носителе в терапевтически-эффективном количестве. Примеры носителей включают солевой раствор, забуференный физиологический раствор, физиологический раствор, воду, раствор Хэнкса, раствор Рингера, Normosol-R (Abbott Labs), Plasma-Lyte A® (Baxter Laboratories, Inc., Morton Grove, IL), глицерин, и их сочетания.
В конкретных вариантах осуществления носители могут быть дополнены сывороточным альбумином человека (САЧ) или другими компонентами сыворотки человека или эмбриональной телячьей сывороткой. В конкретных вариантах осуществления носитель для вливания включает забуференный физиологический раствор с 5% САЧ или декстрозой. Дополнительные средства придания изотоничности включают полигидратные сахарные спирты, включая три- или более гидратные сахарные спирты, такие как глицерин, эритритол, арабит, ксилит, сорбит или маннит.
Носители могут включать буферные средства, такие как цитратные буферы, сукцинатные буферы, футаратные буферы, глюконатные буферы, оксалатные буферы, лактатные буферы, ацетатные буферы, фосфатные буферы, гистидиновые буферы, и/или триметиламиновые соли.
Стабилизаторы относятся к широкой категории эксципиентов, которые могут варьироваться по функции от наполнителя до добавки, которые помогают предотвратить прилипание клеток к стенкам контейнера. Типичные стабилизаторы могут содержать полигидратные сахарные спирты; аминокислоты, такие как аргинин, лизин, глицин, глутамин, аспарагин, гистидин, аланин, орнитин, L-лейцин, 2-фенилаланин, глутаминовая кислота, и треонин; органические сахара или сахарные спирты, такие как лактоза, трегалоза, стахиоза, маннит, сорбит, ксилит, рибитол, миоинизитол, галактитол, глицерин и циклитолы, такие как инозитол; ПЭГ; полимеры аминокислот; сера-содержащие восстановители, такие как мочевина, глутатион, тиоктацид, натрий тиогликолят, тиоглицерин, альфа-монотиоглицерин и тиосульфат натрия; низкомолекулярные полипептиды (т.е., <10 остатков); белки, такие как САЧ, бычий сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; моносахариды, такие как ксилоза, манноза, фруктоза и глюкоза; дисахариды, такие как лактоза, мальтоза и сахароза; трисахариды, такие как рафиноза, и полисахариды, такие как декстран.
Где необходимо или полезно, составы могут включать местный анестетик, такой как лидокаин, чтобы облегчить боль в месте инъекции.
Примеры консервантов включают фенол, бензиловый спирт, метакрезол, метилпарабен, пропилпарабен, октадецилдиметилбензил хлорид аммония, галогениды бензалкония, гексаметоний хлорид, алкилпарабены, такие как метил или пропилпарабен, катехол, резорцинол, циклогексанол и 3-пентанол.
Терапевтически эффективные количества клеток в составах могут быть более чем 102 клеток, более чем 103 клеток, более чем 104 клеток, более чем 105 клеток, более чем 106 клеток, более чем 107 клеток, более чем 108 клеток, более чем 109 клеток, более чем 1010 клеток, или более чем 1011. В конкретных вариантах осуществления составы можно калибровать для того чтобы обеспечить 1 миллион - 20 миллионов HSPC на килограмм при введении индивидууму.
В составах, описываемых в настоящем документе, клетки находятся, в основном, в объеме литра или менее, 500 мл или менее, 250 мл или менее или 100 мл или менее. Таким образом, плотность вводимых клеток составляет, как правило, больше 104 клеток/мл, 107 клеток/мл или 108 клеток/мл или более (например, 109 клеток/мл).
Составы, описываемые в настоящем документе, можно получать для введения, например, путем инъекции, инфузии, перфузии или лаважа. Составы могут быть дополнительно сформулированы для костно-мозговой, внутривенной, интрадермальной, внутриартериальной, внутриузловой, внутрилимфатической, интраперитонеальной, внутриочаговой, внутрь предстательнойй железы, интравагинальной, интраректальной, местной, интратекальной, интратуморальной, внутримышечной, внутрисуставной и/или подкожной инъекции.
Составы Exp-CBSC вводят индивидуумам. Индивидуумы включают людей, ветеринарных животных (собаки, кошки, пресмыкающиеся, птицы и т.д.), домашний скот (лошади, крупный рогатый скот, козы, свиньи, курицы, и т.д.), и животных для исследований (обезьяны, крысы, мыши, рыба, и т.д.). Составы Exp-CBSC вводят индивидуумам в терапевтически эффективных количествах.
Терапевтически эффективные количества включают те, которые обеспечивают эффективные количества, виды профилактического лечения и/или виды терапевтического лечения.
«Эффективное количество» представляет собой количество Exp-CBSC, необходимое для достижения желаемого физиологического изменения у индивидуума. Эффективные количества часто используются для исследовательских целей. В экспериментальных моделях эффективные количества, описываемые в настоящем документе, делают одно или несколько: (i) уменьшают отторжение трансплантата; (ii) снижают TPN; (iii) уменьшают использование опиоидов после физиологической процедуры; (iv) сокращают время до выздоровления в качестве заменителя для времени госпитализации; (v) снижают острую РТПХ; (vi) индуцируют иммунологическую толерантность; и/или (vi) уменьшают мукозит.
«Профилактическое лечение» включает лечение, назначенное индивидууму, у которого нет признаков или симптомов заболевания, так что лечение вводят с целью уменьшения, предотвращения или снижения риска развития заболевания (например, отторжения трансплантата, РТПХ). Таким образом, профилактическое лечение функционирует как профилактическое лечение против, например, отторжения трансплантата и/или стадии III и/или стадии IV РТПХ.
«Терапевтическое лечение» относится к лечению индивидуума, который демонстрирует симптомы или признаки состояния, и вводят индивидууму с целью снижения тяжести или прогрессирования состояния. Терапевтическое лечение может также частично или полностью устранить состояние. В контексте настоящего изобретения состояния включают одно или несколько из отторжения трансплантата, использования TPN, использования опиоидов после медицинской процедуры, госпитализации, РТПХ и мукозита.
Способы для оценки присутствия и/или тяжести указанных состояний предоставляются на всем протяжении этого изобретения, так что терапевтически эффективные количества могут быть легко идентифицированы специалистами в данной области.
Фактическое количество Exp-CBSC, вводимое конкретному субъекту, может быть определено врачом, ветеринаром или исследователем с учетом параметров, таких как физические и физиологические факторы, включая мишень; массу тела; тип состояния; тип трансплантации; тяжесть состояния; предстоящие существенные события, когда они известны; предыдущие или параллельные терапевтические вмешательства; идиопатия индивидуума; и путь введения, например. Кроме того, для определения оптимальных диапазонов доз могут необязательно использоваться анализы in vitro и in vivo.
Терапевтически эффективные количества для введения могут включать более чем 102 клеток, более чем 103 клеток, более чем 104 клеток, более чем 105 клеток, более чем 106 клеток, более чем 107 клеток, более чем 108 клеток, более чем 109 клеток, более чем 1010 клеток, или более чем 1011 клеток. В конкретных вариантах осуществления терапевтически эффективные количества включают 1 миллион - 20 миллионов HSPC на килограмм.
Exp-CBSC можно вводить путем, например, инъекции, инфузии, перфузии или лаважа и более конкретно можно вводить посредством одного или нескольких, в костный мозг, внутривенно, интрадермально, внутриартериально, интранодально, внутрилимфатически, интраперитонеально, внутриочагово, внутрь предстательной железы, интравагинальныо, интраректально, местно, интратекально, интратуморально, внутримышечно, внутрисуставно, и/или путем подкожных инфузий и/или болюсных инъекций.
В конкретных вариантах осуществления количество Exp-CBSC вводят без соответствия с HLA (не предпринимаются шаги для определения степени соответствия между индивидуумом и Exp-CBSC).
Exp-CBSC вводят в пределах клинически значимых временных окон. В конкретных вариантах осуществления у индивидуумов, подвергающихся трансплантации твердой ткани или трансплантации аллогенных гематопоэтических клеток, клинически значимое временное окно может находиться в пределах 12 часов после трансплантации (см., например, WO2006/047569 и WO2007/095594). В конкретных вариантах клинически релевантное окно времени может находиться в пределах 24 часов, 36 часов, 48 часов или 1 недели после медицинской процедуры, такой как трансплантация. Внешние пределы клинически значимых временных окон можно определять экспериментально, увеличив задержку между медицинским вмешательством и введением Exp-CBSC до тех пор, пока Exp-CBSC больше не предоставит соответствующее клиническое преимущество.
Наборы. Наборы могут включать один или несколько контейнеров, содержащих один или несколько составов Exp-CBSC, описываемых в настоящем документе. В конкретных вариантах осуществления наборы могут включать один или несколько контейнеров, содержащих один или несколько составов Exp-CBSC, которые будут использоваться в комбинации с другими клетками, композициями или составами. С таким контейнером (-ами) может быть связано уведомление в форме, предписанной правительственным агентством, регулирующим производство, использование или продажу фармацевтических или биологических продуктов, которое уведомляет об одобрении агентством производства, использования или продажи для введения человеку. В уведомлении может указываться, что предоставленные составы Exp-CBSC можно вводить индивидууму без иммунологического соответствия. Наборы могут включать дополнительные инструкции для использования набора, например, инструкции относительно препарата клеток и/или составов для введения; надлежащего удаления соответствующих отходов; и т.п. Инструкции могут быть в виде отпечатанных инструкций, предоставляемых в пределах набора, или инструкции могут быть напечатаны на части самого набора. Инструкции могут быть в виде листа, публикации, брошюры, компакт-диска или машиночитаемого устройства, или могут предоставлять указания для инструкций в удаленном месте, таком как веб-сайт. В конкретных вариантах осуществления наборы также могут включать некоторые или все из медицинских принадлежностей, необходимых для эффективного использования набора, таких как шприцы, ампулы, трубки, маска для лица, безыгольное устройство для переноса жидкости, колпачок для инъекций, губки, стерильные адгезивные полоски, Хлорапреп, перчатки, и т.п. Могут быть сделаны изменения в содержании любого из наборов, описываемых в настоящем документе. Инструкции набора будут направлять использование Exp-CBSC для осуществления нового клинического применения, описываемого в настоящем документе.
Иллюстративные варианты осуществления:
1. Способ уменьшения отторжения аллогенного кожного трансплантата у нуждающегося в этом индивидуума, включающий:
введение терапевтически эффективного количество обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) нуждающемуся в этом индивидууму в пределах клинически значимого временного окна после получения аллогенного кожного трансплантата, таким образом, уменьшение отторжения аллогенного кожного трансплантата у индивидуума.
2. Способ по варианту осуществления 1, где (i) аллогенный кожный трансплантат и индивидуум иммунологически совместимы и (ii) Exp-CBSC вводят индивидууму без иммунологического соответствия.
3. Способ по варианту осуществления 1 или 2, где Exp-CBSC ранее были криоконсервированы.
4. Способ по любому из вариантов осуществления 1, где Exp-CBSC не включают T-клетки.
5. Способ по любому из вариантов осуществления 1-3, где индивидуум нуждается в этом из-за травмы кожи.
6. Способ по варианту осуществления 5, где травма вызвана огнем, нагреванием, давлением, проколом и/или истиранием.
7. Способ по любому из вариантов осуществления 1-6, где клинически значимое временное окно происходит до получения аллогенного кожного трансплантата.
8. Способ по любому из вариантов осуществления 1-7, где клинически значимое временное окно находится в пределах 36 часов после получения аллогенного кожного трансплантата.
9. Способ по любому из вариантов осуществления 1-7, где клинически значимое временное окно находится в пределах 12 часов после получения аллогенного кожного трансплантата.
10. Способ по любому из вариантов осуществления 1-9, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
11. Способ по любому из вариантов осуществления 1-10, где Exp-CBSC получены из пуповинной крови и/или плацентарной крови одного человека при родах.
12. Способ по любому из вариантов осуществления 1-10, где Exp-CBSC включают совокупность из двух или более различных образцов размноженных стволовых клеток пуповинной крови человека, каждый отдельный образец в совокупности получен из пуповинной крови и/или плацентарной крови отдельного человека при родах.
13. Способ по любому из вариантов осуществления 1-12, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
14. Применение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия для уменьшения отторжения аллогенного кожного трансплантата у нуждающегося в этом индивидуума.
15. Применение по варианту осуществления 14, где применение включает введение терапевтически эффективного количества нуждающемуся в этом индивидууму в пределах клинически значимого временного окна.
16. Применение по варианту осуществления 14 или 15, где Exp-CBSC ранее были криоконсервированы.
17. Применение по любому из вариантов осуществления 14-16, где Exp-CBSC не включают T-клетки.
18. Применение по любому из вариантов осуществления 14-17, где индивидуум нуждается в этом из-за травмы кожи.
19. Применение по варианту осуществления 18, где травма вызвана огнем, нагреванием, давлением, проколом и/или истиранием.
20. Применение по любому из вариантов осуществления 15-19, где клинически значимое временное окно происходит до получения аллогенного кожного трансплантата.
21. Применение по любому из вариантов осуществления 15-20, где клинически значимое временное окно находится в пределах 36 часов после получения аллогенного кожного трансплантата.
22. Применение по любому из вариантов осуществления 15-20, где клинически значимое временное окно находится в пределах 12 часов после получения аллогенного кожного трансплантата.
23. Применение по любому из вариантов осуществления 14-22, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
24. Применение по любому из вариантов осуществления 14-23, где Exp-CBSC получены из пуповинной крови и/или плацентарной крови одного человека при родах.
25. Применение по любому из вариантов осуществления 14-23, где Exp-CBSC включают совокупность из двух или более различных образцов размноженных стволовых клеток пуповинной крови человека, каждый отдельный образец в совокупности получен из пуповинной крови и/или плацентарной крови отдельного человека при родах.
26. Применение по любому из вариантов осуществления 15-25, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
27. Применение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия для индуцирования иммунологической толерантности у реципиента трансплантата.
28. Применение по варианту осуществления 27, где применение включает введение терапевтически эффективного количества нуждающемуся в этом индивидууму в пределах клинически значимого временного окна.
29. Применение по варианту осуществления 27 или 28, где Exp-CBSC ранее были криоконсервированы.
30. Применение по любому из вариантов осуществления 27-29, где Exp-CBSC не включают T-клетки.
31. Применение по любому из вариантов осуществления 27-30, где реципиент трансплантата представляет собой реципиента трансплантата твердой ткани.
32. Способ по варианту осуществления 31, где твердая ткань включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
33. Применение по любому из вариантов осуществления 27-30, где реципиент трансплантата представляет собой реципиента трансплантата гематопоэтических клеток.
34. Применение по любому из вариантов осуществления 27-33, где реципиент трансплантата представляет собой реципиента аллогенного трансплантата.
35. Применение по любому из вариантов осуществления 27-30, где реципиент трансплантата представляет собой реципиента трансплантата аллогенной пуповинной крови.
36. Применение по любому из вариантов осуществления 27-35, где индуцированная иммунологическая толерантность уменьшает введение иммуносупрессорных лекарственных средств индивидууму.
37. Применение по варианту осуществления 36, где иммуносупрессорные лекарственные средства включают один или несколько из циклоспорина, циклоспорина A, циклофосфамида, преднизона, дексаметазона, метотрексата, азатиоприна, микофенолaта, мофетила, талидомида, лития, FK-506, сиролимуса, ATG, инфликсимаба, и системных стероидов.
38. Применение по любому из вариантов осуществления 28-37, где клинически значимое временное окно происходит до получения трансплантата.
39. Применение по любому из вариантов осуществления 28-38, где клинически значимое временное окно находится в пределах 36 часов после получения трансплантата.
40. Применение по любому из вариантов осуществления 28-38, где клинически значимое временное окно находится в пределах 12 часов после получения трансплантата.
41. Применение по любому из вариантов осуществления 27-40, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
42. Применение по любому из вариантов осуществления 27-41, где Exp-CBSC получены из пуповинной крови и/или плацентарной крови одного человека при родах.
43. Применение по любому из вариантов осуществления 27-41, где Exp-CBSC включают совокупность из двух или более различных образцов размноженных стволовых клеток пуповинной крови человека, каждый отдельный образец в совокупности получен из пуповинной крови и/или плацентарной крови отдельного человека при родах.
44. Применение по любому из вариантов осуществления 28-43, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
45. Способ индуцирования иммунологической толерантности к трансплантату твердой ткани у реципиента трансплантата твердой ткани, включающий:
введение терапевтически эффективного количество обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) нуждающемуся в этом индивидууму в пределах клинически значимого временного окна после получения трансплантата твердой ткани, и, таким образом, индуцирование иммунологической толерантности к трансплантату твердой ткани у реципиента трансплантата твердой ткани.
46. Способ по варианту осуществления 45, где (i) трансплантат твердой ткани и индивидуум иммунологически совместимы и (ii) Exp-CBSC вводят индивидууму без иммунологического соответствия.
47. Способ по варианту осуществления 45 или 46, где Exp-CBSC ранее были криоконсервированы.
48. Способ по любому из вариантов осуществления 45-47, где Exp-CBSC не включают T-клетки.
49. Способ по любому из вариантов осуществления 45-48, где иммунологическая толерантность подтверждается улучшенным результатом трансплантации твердой ткани.
50. Способ по варианту осуществления 49, где улучшенный результат трансплантации твердой ткани подтверждается сниженным отторжением трансплантата по сравнению с референсной популяцией, не получавшей Exp-CBSC.
51. Способ по любому из вариантов осуществления 49-50, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
52. Способ по любому из вариантов осуществления 49-51, где улучшенный результат трансплантации твердой ткани подтверждается сниженным введением иммуносупрессорных лекарственных средств по сравнению с референсной популяцией, не получавшей Exp-CBSC.
53. Способ по варианту осуществления 52, где иммуносупрессорные лекарственные средства включают один или несколько из циклоспорина, циклоспорина A, циклофосфамида, преднизона, дексаметазона, метотрексата, азатиоприна, микофенолaта, мофетила, талидомида, лития, FK-506, сиролимуса, ATG, инфликсимаба, и системных стероидов.
54. Способ по любому из вариантов осуществления 45-53, где клинически значимое временное окно происходит до получения трансплантата твердой ткани.
55. Способ по любому из вариантов осуществления 45-54, где клинически значимое временное окно находится в пределах 36 часов после получения трансплантата твердой ткани.
56. Способ по любому из вариантов осуществления 45-54, где клинически значимое временное окно находится в пределах 12 часов после получения трансплантата твердой ткани.
57. Способ по любому из вариантов осуществления 45-56, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
58. Способ по любому из вариантов осуществления 45-57, где Exp-CBSC получены из пуповинной крови и/или плацентарной крови одного человека при родах.
59. Способ по любому из вариантов осуществления 45-57, где Exp-CBSC включают совокупность из двух или более различных образцов размноженных стволовых клеток пуповинной крови человека, каждый отдельный образец в совокупности получен из пуповинной крови и/или плацентарной крови отдельного человека при родах.
60. Способ по любому из вариантов осуществления 45-59, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
61. Применение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия для снижения введения иммуносупрессорных лекарственных средств у нуждающегося в этом индивидуума.
62. Применение по варианту осуществления 61, где применение включает введение терапевтически эффективного количества нуждающемуся в этом индивидууму в пределах клинически значимого временного окна.
63. Применение по варианту осуществления 61 или 62, где Exp-CBSC ранее были криоконсервированы.
64. Применение по любому из вариантов осуществления 61-63, где Exp-CBSC не включают T-клетки.
65. Способ по любому из вариантов осуществления 61-64, где иммуносупрессорные лекарственные средства включают один или несколько из циклоспорина, циклоспорина A, циклофосфамида, преднизона, дексаметазона, метотрексата, азатиоприна, микофенолaта, мофетила, талидомида, лития, FK-506, сиролимуса, ATG, инфликсимаба, и системных стероидов.
66. Применение по любому из вариантов осуществления 61-65, где индивидуум получает иммуносупрессорные лекарственные средства в связи с процедурой трансплантации.
67. Применение по варианту осуществления 66, где процедура трансплантации включает процедуру трансплантации твердой ткани.
68. Применение по варианту осуществления 67, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
69. Применение по любому из вариантов осуществления 66, где процедура трансплантации включает процедуру трансплантации гематопоэтических клеток.
70. Применение по любому из вариантов осуществления 66-69, где процедура трансплантации включает процедуру аллогенной трансплантации.
71. Применение по любому из вариантов осуществления 66, где процедура трансплантации включает процедуру трансплантации аллогенной пуповинной крови.
72. Применение по любому из вариантов осуществления 62-71, где клинически значимое временное окно происходит до процедуры трансплантации.
73. Применение по любому из вариантов осуществления 62-72, где клинически значимое временное окно находится в пределах 36 часов после процедуры трансплантации.
74. Применение по любому из вариантов осуществления 62-72, где клинически значимое временное окно находится в пределах 12 часов после процедуры трансплантации.
75. Применение по любому из вариантов осуществления 61-74, где Exp-CBSC получены из пуповинной крови и/или плацентарной крови одного человека при родах.
76. Применение по любому из вариантов осуществления 61-74, где Exp-CBSC включают совокупность из двух или более различных образцов размноженных стволовых клеток пуповинной крови человека, каждый отдельный образец в совокупности получен из пуповинной крови и/или плацентарной крови отдельного человека при родах.
77. Применение по любому из вариантов осуществления 62-76, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
78. Способ снижения количества иммуносупрессорных лекарственных средств, необходимого реципиенту трансплантата твердой ткани, включающий:
введение терапевтически эффективного количества обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) реципиенту трансплантата в пределах клинически значимого временного окна после получения трансплантата твердой ткани, таким образом, снижение количества иммуносупрессорных лекарственных средств, необходимого реципиенту трансплантата твердой ткани.
79. Способ по варианту осуществления 78, где (i) трансплантат твердой ткани и индивидуум иммунологически совместимы и (ii) Exp-CBSC вводят индивидууму без иммунологического соответствия.
80. Способ по варианту осуществления 78 или 79, где Exp-CBSC ранее были криоконсервированы.
81. Способ по любому из вариантов осуществления 78-80, где Exp-CBSC не включают T-клетки.
82. Способ по любому из вариантов осуществления 78-81, где иммуносупрессорные лекарственные средства включают один или несколько из циклоспорина, циклоспорина A, циклофосфамида, преднизона, дексаметазона, метотрексата, азатиоприна, микофенолaта, мофетила, талидомида, лития, FK-506, сиролимуса, ATG, инфликсимаба и системных стероидов.
83. Способ по любому из вариантов осуществления 78-82, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
84. Способ по любому из вариантов осуществления 78-83, где трансплантат твердой ткани включает аллогенный трансплантат твердой ткани.
85. Способ по любому из вариантов осуществления 78-84, где клинически значимое временное окно находится до трансплантации твердой ткани.
86. Способ по любому из вариантов осуществления 78-85, где клинически значимое временное окно находится в пределах 36 часов после получения трансплантата твердой ткани.
87. Способ по любому из вариантов осуществления 78-85, где клинически значимое временное окно находится в пределах 12 часов после получения трансплантата твердой ткани.
88. Способ по любому из вариантов осуществления 78-87, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
89. Способ по любому из вариантов осуществления 78-88, где Exp-CBSC получены из пуповинной крови и/или плацентарной крови одного человека при родах.
90. Способ по любому из вариантов осуществления 78-88, где Exp-CBSC включают совокупность из двух или более различных образцов размноженных стволовых клеток пуповинной крови человека, каждый отдельный образец в совокупности получен из пуповинной крови и/или плацентарной крови отдельного человека при родах.
91. Способ по любому из вариантов осуществления 78-90, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
92. Применение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия для уменьшения полного парентерального питания (TPN) у нуждающегося в этом индивидуума.
93. Применение по варианту осуществления 92, где применение включает введение терапевтически эффективного количества нуждающемуся в этом индивидууму в пределах клинически значимого временного окна.
94. Применение по варианту осуществления 92 или 93, где Exp-CBSC ранее были криоконсервированы.
95. Применение по любому из вариантов осуществления 92-94, где Exp-CBSC не включают T-клетки.
96. Применение по любому из вариантов осуществления 92-95, где индивидуум получает TPN после медицинской процедуры.
97. Применение по варианту осуществления 96, где медицинская процедура включает трансплантат.
98. Применение по варианту осуществления 97, где трансплантация включает трансплантат твердой ткани.
99. Применение по варианту осуществления 98, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
100. Применение по любому из вариантов осуществления 97, где трансплантация включает процедуру трансплантации гематопоэтических клеток.
101. Применение по любому из вариантов осуществления 97-100, где трансплантация включает процедуру аллогенной трансплантации.
102. Применение по любому из вариантов осуществления 97, где трансплантация включает процедуру трансплантации аллогенной пуповинной крови.
103. Применение по любому из вариантов осуществления 92-102, где индивидуум представляет собой педиатрического пациента.
104. Применение по любому из вариантов осуществления 93-103, где клинически значимое временное окно происходит до медицинской процедуры.
105. Применение по любому из вариантов осуществления 93-104, где клинически значимое временное окно находится в пределах 36 часов после медицинской процедуры.
106. Применение по любому из вариантов осуществления 93-104, где клинически значимое временное окно находится в пределах 12 часов после медицинской процедуры.
107. Применение по любому из вариантов осуществления 92-106, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
108. Применение по любому из вариантов осуществления 92-107, где Exp-CBSC получены из пуповинной крови и/или плацентарной крови одного человека при родах.
109. Применение по любому из вариантов осуществления 92-107, где Exp-CBSC включают совокупность из двух или более различных образцов размноженных стволовых клеток пуповинной крови человека, каждый отдельный образец в совокупности получен из пуповинной крови и/или плацентарной крови отдельного человека при родах.
110. Применение по любому из вариантов осуществления 93-109, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
111. Способ, включающий:
выявление педиатрического пациента, который будет получать полное парентеральное питание (TPN) после получения аллогенного трансплантата;
введение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия педиатрическому пациенту в пределах клинически значимого временного окна после аллогенного трансплантата;
таким образом, уменьшение использования полного парентерального питания (TPN) педиатрическим пациентом после аллогенного трансплантата.
112. Способ по варианту осуществления 111, где (i) аллогенный трансплантат и индивидуум иммунологически совместимы и (ii) Exp-CBSC вводят индивидууму без иммунологического соответствия.
113. Способ по варианту осуществления 111 или 112, где Exp-CBSC ранее были криоконсервированы.
114. Способ по любому из вариантов осуществления 111-113, где Exp-CBSC не включают T-клетки.
115. Способ по любому из вариантов осуществления 111-114, где аллогенный трансплантат включает трансплантат твердой ткани.
116. Способ по варианту осуществления 115, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
117. Способ по любому из вариантов осуществления 111-114, где аллогенный трансплантат включает трансплантат гематопоэтических клеток.
118. Способ по любому из вариантов осуществления 111-114, где аллогенный трансплантат включает процедуру трансплантации пуповинной крови.
119. Способ по любому из вариантов осуществления 111-118, где клинически значимое временное окно происходит до трансплантации.
120. Способ по любому из вариантов осуществления 111-119, где клинически значимое временное окно находится в пределах 36 часов после получения трансплантата.
121. Способ по любому из вариантов осуществления 111-119, где клинически значимое временное окно находится в пределах 12 часов после получения трансплантата.
122. Способ по любому из вариантов осуществления 111-121, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
123. Способ по любому из вариантов осуществления 111-122, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
124. Способ уменьшения использования полного парентерального питания (TPN) индивидуумом после медицинской процедуры, включающий введение терапевтически эффективного количества обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) индивидууму в пределах клинически значимого временного окна после медицинской процедуры, таким образом, уменьшение использования TPN индивидуумом после медицинской процедуры.
125. Способ по варианту осуществления 124, где Exp-CBSC вводят индивидууму без иммунологического соответствия.
126. Способ по варианту осуществления 124 или 125, где Exp-CBSC ранее были криоконсервированы.
127. Способ по любому из вариантов осуществления 124-126, где Exp-CBSC не включают T-клетки.
128. Способ по любому из вариантов осуществления 124-127, где медицинская процедура включает трансплантат.
129. Способ по варианту осуществления 128, где трансплантат включает трансплантат твердой ткани.
130. Способ по варианту осуществления 129, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
131. Способ по любому из вариантов осуществления 128, где трансплантат включает трансплантат гематопоэтических клеток.
132. Способ по любому из вариантов осуществления 128-131, где трансплантат включает аллогенный трансплантат.
133. Способ по любому из вариантов осуществления 128, где трансплантат включает аллогенный трансплантат пуповинной крови.
134. Способ по любому из вариантов осуществления 124-133, где индивидуум представляет собой педиатрического пациента.
135. Способ по любому из вариантов осуществления 124-134, где клинически значимое временное окно происходит до трансплантата.
136. Способ по любому из вариантов осуществления 124-135, где клинически значимое временное окно находится в пределах 36 часов после получения трансплантата.
137. Способ по любому из вариантов осуществления 124-135, где клинически значимое временное окно находится в пределах 12 часов после получения трансплантата.
138. Способ по любому из вариантов осуществления 124-137, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
139. Способ по любому из вариантов осуществления 124-138, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
140. Применение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия для уменьшения использования опиоидов у нуждающегося в этом индивидуума.
141. Применение по варианту осуществления 140, где применение включает введение терапевтически эффективного количества нуждающемуся в этом индивидууму в пределах клинически значимого временного окна.
142. Применение по варианту осуществления 140 или 141, где Exp-CBSC ранее были криоконсервированы.
143. Применение по любому из вариантов осуществления 140-142, где Exp-CBSC не включают T-клетки.
144. Применение по любому из вариантов осуществления 140-143, где опиоид выбран из одного или нескольких из анилидина, аллилпродина, альфентанила, альфапродина, бензилморфина, бупренорфина, безитрамида, буторфанола, кодеина, клонитазена, циклозацина, дезоцина, дезоморфина, дигидроморфина, декстроморамида, диампромида, дигидрокодеина, диэтилтиамбутена, дименоксадола, димефептанола, диметилтиамбутена, дипипанона, диоксафетил бутирата, эптазоцина, этилморфина, этилметилтиамбутена, этонитазина, этогептазина, фентанила, гидрокодона, героина, 6-гидроксиморфона, гидроксипетидина, гидроморфона, изометадона, кетобемидона, леваллорфана, левофенацилморфана, лофентанила, леворфанола, морфина, мирофина, меперидина, мептазинола, метазоцина, метадона, метопона, морфина, нарцеина, налбуфина, налорфина, никоморфина, норлеворфанола, норметадона, норморфина, норпипанона, опиума, оксикодона, оксиморфона, пиритрамида, папаверетума, пентазоцина, фенадоксона, феназоцина, феноперидина, пиминодина, феноморфана, прогептазина, промедола, проперидина, пропирама, пропоксифена, суфентанила, тилидина, трамадола, их стереоизомеров, их метаболитов, их солей, их простых эфиров, их сложных эфиров, и/или их производных, и/или их смесей.
145. Применение по любому из вариантов осуществления 140-144, где опиоид смешивают со вторым активным ингредиентом.
146. Применение по варианту осуществления 145, где опиоид и второй активный ингредиент включают оксикодон и ацетаминофен или гидрокодон и ацетаминофен.
147. Применение по любому из вариантов осуществления 140-146, где индивидуум получает опиоиды после медицинской процедуры.
148. Применение по варианту осуществления 147, где медицинская процедура включает трансплантат.
149. Применение по варианту осуществления 148, где трансплантат включает трансплантат твердой ткани.
150. Применение по варианту осуществления 149, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
151. Применение по любому из вариантов осуществления 148, где трансплантат включает трансплантат гематопоэтических клеток.
152. Применение по любому из вариантов осуществления 148-151, где трансплантат включает аллогенный трансплантат.
153. Применение по любому из вариантов осуществления 148, где трансплантат включает аллогенный трансплантат пуповинной крови.
154. Применение по любому из вариантов осуществления 141-153, где индивидиум представляет собой педиатрического пациента.
155. Применение по любому из вариантов осуществления 142-154, где клинически значимое временное окно происходит до медицинской процедуры.
156. Применение по любому из вариантов осуществления 142-155, где клинически значимое временное окно находится в пределах 36 часов после медицинской процедуры.
157. Применение по любому из вариантов осуществления 142-155, где клинически значимое временное окно находится в пределах 12 часов после медицинской процедуры.
158. Применение по любому из вариантов осуществления 141-157, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
159. Применение по любому из вариантов осуществления 141-158, где Exp-CBSC получены из пуповинной крови и/или плацентарной крови одного человека при родах.
160. Применение по любому из вариантов осуществления 141-158, где Exp-CBSC включают совокупность из двух или более различных образцов размноженных стволовых клеток пуповинной крови человека, каждый отдельный образец в совокупности получен из пуповинной крови и/или плацентарной крови отдельного человека при родах.
161. Применение по любому из вариантов осуществления 142-160, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
162. Способ, включающий:
выявление педиатрического пациента, который будет получать опиоиды после получения аллогенного трансплантата;
введение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия педиатрическому пациенту в пределах клинически значимого временного окна после аллогенного трансплантата;
таким образом, снижение применения опиоида у педиатрического пациента после аллогенного трансплантата.
163. Способ по варианту осуществления 162, где (i) аллогенный трансплантат и индивидуум иммунологически совместимы, и (ii) Exp-CBSC вводят индивидууму без иммунологического соответствия.
164. Способ по варианту осуществления 162 или 163, где Exp-CBSC ранее были криоконсервированы.
165. Способ по любому из вариантов осуществления 162-164, где Exp-CBSC не включают T-клетки.
166. Способ по любому из вариантов осуществления 162-165, где опиоид выбран из одного или нескольких из анилидина, аллилпродина, альфентанила, альфапродина, бензилморфина, бупренорфина, безитрамида, буторфанола, кодеина, клонитазена, циклозацина, дезоцина, дезоморфина, дигидроморфина, декстроморамида, диампромида, дигидрокодеина, диэтилтиамбутена, дименоксадола, димефептанола, диметилтиамбутена, дипипанона, диоксафетил бутирата, эптазоцина, этилморфина, этилметилтиамбутена, этонитазина, этогептазина, фентанила, гидрокодона, героина, 6-гидроксиморфона, гидроксипетидина, гидроморфона, изометадона, кетобемидона, леваллорфана, левофенацилморфана, лофентанила, леворфанола, морфина, мирофина, меперидина, мептазинола, метазоцина, метадона, метопона, морфина, нарцеина, налбуфина, налорфина, никоморфина, норлеворфанола, норметадона, норморфина, норпипанона, опиума, оксикодона, оксиморфона, пиритрамида, папаверетума, пентазоцина, фенадоксона, феназоцина, феноперидина, пиминодина, феноморфана, прогептазина, промедола, проперидина, пропирама, пропоксифена, суфентанила, тилидина, трамадола, их стереоизомеров, их метаболитов, их солей, их простых эфиров, их сложных эфиров, и/или их производных, и/или их смесей.
167. Способ по любому из вариантов осуществления 162-166, где опиоид смешивают со вторым активным ингредиентом.
168. Способ по варианту осуществления 167, где опиоид и второй активный ингредиент включают оксикодон и ацетаминофен или гидрокодон и ацетаминофен.
169. Способ по любому из вариантов осуществления 162-168, где аллогенный трансплантат включает трансплантат твердой ткани.
170. Способ по варианту осуществления 169, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
171. Способ по любому из вариантов осуществления 162-168, где аллогенный трансплантат включает трансплантат гематопоэтических клеток.
172. Способ по любому из вариантов осуществления 162-168, где аллогенный трансплантат включает процедуру трансплантации пуповинной крови.
173. Способ по любому из вариантов осуществления 162-172, где клинически значимое временное окно происходит до трансплантата.
174. Способ по любому из вариантов осуществления 162-173, где клинически значимое временное окно находится в пределах 36 часов после получения трансплантата.
175. Способ по любому из вариантов осуществления 162-173, где клинически значимое временное окно находится в пределах 12 часов после получения трансплантата.
176. Способ по любому из вариантов осуществления 162-175, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
177. Способ по любому из вариантов осуществления 162-176, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
178. Способ снижения применения опиоида индивидуумом после медицинской процедуры, включающий введение терапевтически эффективного количества обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) индивидууму в пределах клинически значимого временного окна после медицинской процедуры, и, таким образом, снижение применения опиоида индивидуумом после медицинской процедуры.
179. Способ по варианту осуществления 178, где Exp-CBSC вводят индивидууму без иммунологического соответствия.
180. Способ по варианту осуществления 178 или 179, где Exp-CBSC ранее были криоконсервированы.
181. Способ по любому из вариантов осуществления 178-180, где Exp-CBSC не включают T-клетки.
182. Способ по любому из вариантов осуществления 178-181, где опиоид выбран из одного или нескольких из анилидина, аллилпродина, альфентанила, альфапродина, бензилморфина, бупренорфина, безитрамида, буторфанола, кодеина, клонитазена, циклозацина, дезоцина, дезоморфина, дигидроморфина, декстроморамида, диампромида, дигидрокодеина, диэтилтиамбутена, дименоксадола, димефептанола, диметилтиамбутена, дипипанона, диоксафетил бутирата, эптазоцина, этилморфина, этилметилтиамбутена, этонитазина, этогептазина, фентанила, гидрокодона, героина, 6-гидроксиморфона, гидроксипетидина, гидроморфона, изометадона, кетобемидона, леваллорфана, левофенацилморфана, лофентанила, леворфанола, морфина, мирофина, меперидина, мептазинола, метазоцина, метадона, метопона, морфина, нарцеина, налбуфина, налорфина, никоморфина, норлеворфанола, норметадона, норморфина, норпипанона, опиума, оксикодона, оксиморфона, пиритрамида, папаверетума, пентазоцина, фенадоксона, феназоцина, феноперидина, пиминодина, феноморфана, прогептазина, промедола, проперидина, пропирама, пропоксифена, суфентанила, тилидина, трамадола, их стереоизомеров, их метаболитов, их солей, их простых эфиров, их сложных эфиров, и/или их производных, и/или их смесей.
183. Способ по любому из вариантов осуществления 178-182, где опиоид смешивают со вторым активным ингредиентом.
184. Способ по варианту осуществления 183, где опиоид и второй активный ингредиент включают оксикодон и ацетаминофен или гидрокодон и ацетаминофен.
185. Способ по любому из вариантов осуществления 178-184, где медицинская процедура включает трансплантат.
186. Способ по варианту осуществления 185, где трансплантат включает трансплантат твердой ткани.
187. Способ по варианту осуществления 186, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
188. Способ по любому из вариантов осуществления 185-184, где трансплантат включает трансплантат гематопоэтических клеток.
189. Способ по любому из вариантов осуществления 185-188, где трансплантат включает аллогенный трансплантат.
190. Способ по любому из вариантов осуществления 185, где трансплантат включает аллогенный трансплантат пуповинной крови.
191. Способ по любому из вариантов осуществления 178-190, где индивидиум представляет собой педиатрического пациента.
192. Способ по любому из вариантов осуществления 178-191,где клинически значимое временное окно происходит до трансплантата.
193. Способ по любому из вариантов осуществления 178-192, где клинически значимое временное окно находится в пределах 36 часов после получения трансплантата.
194. Способ по любому из вариантов осуществления 178-192, где клинически значимое временное окно находится в пределах 12 часов после получения трансплантата.
195. Способ по любому из вариантов осуществления 178-194, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
196. Способ по любому из вариантов осуществления 178-195, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
197. Применение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия для уменьшения госпитализации у нуждающегося в этом индивидуума.
198. Применение по варианту осуществления 197, где применение включает введение терапевтически эффективного количества нуждающемуся в этом индивидууму в пределах клинически значимого временного окна.
199. Применение по варианту осуществления 197 или 198, где Exp-CBSC ранее были криоконсервированы.
200. Применение по любому из вариантов осуществления 197-199, где Exp-CBSC не включают T-клетки.
201. Применение по любому из вариантов осуществления 197-200, где индивидуум госпитализирован в связи с процедурой трансплантации.
202. Применение по варианту осуществления 201, где процедура трансплантации включает трансплантат твердой ткани.
203. Применение по варианту осуществления 202, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
204. Применение по любому из вариантов осуществления 201, где процедура трансплантации включает трансплантат гематопоэтических клеток.
205. Применение по любому из вариантов осуществления 201-204, где процедура трансплантации включает аллогенный трансплантат.
206. Применение по любому из вариантов осуществления 201, где процедура трансплантации включает аллогенный трансплантат пуповинной крови.
207. Применение по любому из вариантов осуществления 197-206, где индивидиум представляет собой педиатрического пациента.
208. Применение по любому из вариантов осуществления 198-207, где клинически значимое временное окно происходит до медицинской процедуры.
209. Применение по любому из вариантов осуществления 198-208, где клинически значимое временное окно находится в пределах 36 часов после медицинской процедуры.
210. Применение по любому из вариантов осуществления 198-208, где клинически значимое временное окно находится в пределах 12 часов после медицинской процедуры.
211. Применение по любому из вариантов осуществления 197-210, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
212. Применение по любому из вариантов осуществления 197-211, где Exp-CBSC получены из пуповинной крови и/или плацентарной крови одного человека при родах.
213. Применение по любому из вариантов осуществления 197-211, где Exp-CBSC включают совокупность из двух или более различных образцов размноженных стволовых клеток пуповинной крови человека, каждый отдельный образец в совокупности получен из пуповинной крови и/или плацентарной крови отдельного человека при родах.
214. Применение по любому из вариантов осуществления 198-213, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
215. Способ, включающий:
выявление педиатрического пациента, который будет госпитализирован после получения аллогенного трансплантата;
введение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия педиатрическому пациенту в пределах клинически значимого временного окна после аллогенного трансплантата;
таким образом, уменьшение времени госпитализации педиатрического пациента после аллогенного трансплантата.
216. Способ по варианту осуществления 215, где (i) аллогенный трансплантат и индивидуум иммунологически совместимы, и (ii) Exp-CBSC вводят индивидууму без иммунологического соответствия.
217. Способ по варианту осуществления 215 или 216, где Exp-CBSC ранее были криоконсервированы.
218. Способ по любому из вариантов осуществления 215-217, где Exp-CBSC не включают T-клетки.
219. Способ по любому из вариантов осуществления 215-218, где аллогенный трансплантат включает трансплантат твердой ткани.
220. Способ по варианту осуществления 219, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
221. Способ по любому из вариантов осуществления 215-218, где аллогенный трансплантат включает трансплантат гематопоэтических клеток.
222. Способ по любому из вариантов осуществления 215-218, где аллогенный трансплантат включает процедуру трансплантации пуповинной крови.
223. Способ по любому из вариантов осуществления 215-222, где клинически значимое временное окно происходит до трансплантата.
224. Способ по любому из вариантов осуществления 215-223, где клинически значимое временное окно находится в пределах 36 часов после получения трансплантата.
225. Способ по любому из вариантов осуществления 215-223, где клинически значимое временное окно находится в пределах 12 часов после получения трансплантата.
226. Способ по любому из вариантов осуществления 215-225, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
227. Способ по любому из вариантов осуществления 215-226, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
228. Способ уменьшения времени госпитализации индивидуума после медицинской процедуры, включающей введение терапевтически эффективного количества обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) индивидууму в пределах клинически значимого временного окна после медицинской процедуры, таким образом, уменьшение времени госпитализации для индивидуума после медицинской процедуры.
229. Способ по варианту осуществления 228, где Exp-CBSC вводят индивидууму без иммунологического соответствия.
230. Способ по варианту осуществления 228 или 229, где Exp-CBSC ранее были криоконсервированы.
231. Способ по любому из вариантов осуществления 228-230, где Exp-CBSC не включают T-клетки.
232. Способ по любому из вариантов осуществления 228-231, где медицинская процедура включает трансплантат.
233. Способ по варианту осуществления 232, где трансплантат включает трансплантат твердой ткани.
234. Способ по варианту осуществления 233, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
235. Способ по любому из вариантов осуществления 232, где трансплантат включает трансплантат гематопоэтических клеток.
236. Способ по любому из вариантов осуществления 232-235, где трансплантат включает аллогенный трансплантат.
237. Способ по любому из вариантов осуществления 228-231, где трансплантат включает аллогенный трансплантат пуповинной крови.
238. Способ по любому из вариантов осуществления 228-237, где индивидиум представляет собой педиатрического пациента.
239. Способ по любому из вариантов осуществления 228-238, где клинически значимое временное окно происходит до трансплантата.
240. Способ по любому из вариантов осуществления 228-239, где клинически значимое временное окно находится в пределах 36 часов после получения трансплантата.
241. Способ по любому из вариантов осуществления 228-239, где клинически значимое временное окно находится в пределах 12 часов после получения трансплантата.
242. Способ по любому из вариантов осуществления 228-241, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
243. Способ по любому из вариантов осуществления 228-242, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
244. Применение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия для уменьшения мукозита у нуждающегося в этом индивидуума.
245. Применение по варианту осуществления 244, где применение включает введение терапевтически эффективного количества нуждающемуся в этом индивидууму в пределах клинически значимого временного окна.
246. Применение по варианту осуществления 244 или 245, где Exp-CBSC ранее были криоконсервированы.
247. Применение по любому из вариантов осуществления 244-246, где Exp-CBSC не включают T-клетки.
248. Применение по любому из вариантов осуществления 244-247, где индивидуум нуждается в этом из-за процедуры трансплантации.
249. Применение по варианту осуществления 248, где процедура трансплантации включает трансплантат твердой ткани.
250. Применение по варианту осуществления 249, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
251. Применение по варианту осуществления 248, где процедура трансплантации включает трансплантат гематопоэтических клеток.
252. Применение по любому из вариантов осуществления 248-251, где процедура трансплантации включает аллогенный трансплантат.
253. Применение по варианту осуществления 248, где процедура трансплантации включает аллогенный трансплантат пуповинной крови.
254. Применение по любому из вариантов осуществления 244-253, где индивидиум представляет собой педиатрического пациента.
255. Применение по любому из вариантов осуществления 245-254, где клинически значимое временное окно происходит до медицинской процедуры.
256. Применение по любому из вариантов осуществления 245-255, где клинически значимое временное окно находится в пределах 36 часов после медицинской процедуры.
257. Применение по любому из вариантов осуществления 245-255, где клинически значимое временное окно находится в пределах 12 часов после медицинской процедуры.
258. Применение по любому из вариантов осуществления 244-257, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
259. Применение по любому из вариантов осуществления 244-258, где Exp-CBSC получены из пуповинной крови и/или плацентарной крови одного человека при родах.
260. Применение по любому из вариантов осуществления 244-258, где Exp-CBSC включают совокупность из двух или более различных образцов размноженных стволовых клеток пуповинной крови человека, каждый отдельный образец в совокупности получен из пуповинной крови и/или плацентарной крови отдельного человека при родах.
261. Применение по любому из вариантов осуществления 245-260, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
262. Способ, включающий:
выявление педиатрического пациента с риском развития мукозита из-за получения аллогенного трансплантата;
введение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия в пределах клинически значимого временного окна после аллогенного трансплантата;
таким образом, уменьшение мукозита у пациента с риском его развития.
263. Способ по варианту осуществления 262, где (i) аллогенный трансплантат и индивидуум иммунологически совместимы, и (ii) Exp-CBSC вводят индивидууму без иммунологического соответствия.
264. Способ по варианту осуществления 262 или 263, где Exp-CBSC ранее были криоконсервированы.
265. Способ по любому из вариантов осуществления 262-264, где Exp-CBSC не включают T-клетки.
266. Способ по любому из вариантов осуществления 262-265, где аллогенный трансплантат включает трансплантат твердой ткани.
267. Способ по варианту осуществления 266, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
268. Способ по любому из вариантов осуществления 262-265, где аллогенный трансплантат включает трансплантат гематопоэтических клеток.
269. Способ по любому из вариантов осуществления 262-265, где аллогенный трансплантат включает процедуру трансплантации пуповинной крови.
270. Способ по любому из вариантов осуществления 262-269, где клинически значимое временное окно происходит до трансплантат.
271. Способ по любому из вариантов осуществления 262-270, где клинически значимое временное окно находится в пределах 36 часов после получения трансплантата.
272. Способ по любому из вариантов осуществления 262-270, где клинически значимое временное окно находится в пределах 12 часов после получения трансплантата.
273. Способ по любому из вариантов осуществления 262-272, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
274. Способ по любому из вариантов осуществления 262-273, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
275. Способ уменьшения мукозита у индивидуума после медицинской процедуры, включающий введение терапевтически эффективного количества обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) индивидууму в пределах клинически значимого временного окна после медицинской процедуры, таким образом, уменьшение мукозита у индивидуума после медицинской процедуры.
276. Способ по варианту осуществления 275, где Exp-CBSC вводят индивидууму без иммунологического соответствия.
277. Способ по варианту осуществления 275 или 276, где Exp-CBSC ранее были криоконсервированы.
278. Способ по любому из вариантов осуществления 275-277, где Exp-CBSC не включают T-клетки.
279. Способ по любому из вариантов осуществления 275-278, где медицинская процедура включает трансплантат.
280. Способ по варианту осуществления 279, где трансплантат включает трансплантат твердой ткани.
281. Способ по варианту осуществления 280, где трансплантат твердой ткани включает жировую ткань, кровеносный сосуд, кость, костный мозг, сердечные клетки, хрящ, хрящевые клетки, хондральные клетки, улитку внутреннего уха, соединительную ткань, роговицу, монослои культивированных клеток, зубную ткань, глаз, лицо, фасцию, фиброзную ткань, ногу, функциональную единицу позвоночника, волосы, руку, сердце, сердечные клапаны, кишечник, инсулярные клетки, почку, хрусталик, связки, печень, легкое, мениск, мышечно-сухожильные трансплантаты, мышечную ткань, нервные клетки, нервную ткань, костно-хрящевые клетки, остеогенные клетки, яичник, поджелудочную железу, полусухожильную ткань, кожу, селезенку, стволовые клетки, желудок, сухожилия, яичко, зуб или позвоночный диск.
282. Способ по любому из вариантов осуществления 279, где трансплантат включает трансплантат гематопоэтических клеток.
283. Способ по любому из вариантов осуществления 279-282, где трансплантат включает аллогенный трансплантат.
284. Способ по любому из вариантов осуществления 279, где трансплантат включает аллогенный трансплантат пуповинной крови.
285. Способ по любому из вариантов осуществления 275-284, где индивидиум представляет собой педиатрического пациента.
286. Способ по любому из вариантов осуществления 275-285, где клинически значимое временное окно происходит до медицинской процедуры.
287. Способ по любому из вариантов осуществления 275-286, где клинически значимое временное окно находится в пределах 36 часов после получения трансплантата.
288. Способ по любому из вариантов осуществления 275-286, где клинически значимое временное окно находится в пределах 12 часов после получения трансплантата.
289. Способ по любому из вариантов осуществления 275-288, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
290. Способ по любому из вариантов осуществления 275-289, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
291. Применение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия для уменьшения острой реакции «трансплантат против хозяина» у нуждающегося в этом индивидуума.
292. Применение по варианту осуществления 291, где применение включает введение терапевтически эффективного количества нуждающемуся в этом индивидууму в пределах клинически значимого временного окна.
293. Применение по варианту осуществления 291 или 292, где Exp-CBSC ранее были криоконсервированы.
294. Применение по любому из вариантов осуществления 291-293, где Exp-CBSC не включают T-клетки.
295. Применение по любому из вариантов осуществления 291-294, где сниженная острая РТПХ включает уменьшение стадии III острой РТПХ.
296. Применение по любому из вариантов осуществления 291-295, где сниженная острая РТПХ включает уменьшение стадии IV острой РТПХ.
297. Применение по любому из вариантов осуществления 291-296, где индивидуум нуждается в этом из-за аллогенного трансплантата гематопоэтических клеток.
298. Применение по варианту осуществления 297, где аллогенный трансплантат гематопоэтических клеток включает трансплантат пуповинной крови.
299. Применение по варианту осуществления 298, где трансплантат пуповинной крови и индивидуум совместимы по 4/6; 5/6; или 6/6 антигенам HLA.
300. Применение по любому из вариантов осуществления 291-299, где индивидиум представляет собой педиатрического пациента.
301. Применение по любому из вариантов осуществления 292-300, где клинически значимое временное окно происходит до медицинской процедуры.
302. Применение по любому из вариантов осуществления 292-301, где клинически значимое временное окно находится в пределах 36 часов после медицинской процедуры.
303. Применение по любому из вариантов осуществления 292-301, где клинически значимое временное окно находится в пределах 12 часов после медицинской процедуры.
304. Применение по любому из вариантов осуществления 291-303, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
305. Применение по любому из вариантов осуществления 291-304, где Exp-CBSC получены из пуповинной крови и/или плацентарной крови одного человека при родах.
306. Применение по любому из вариантов осуществления 291-304, где Exp-CBSC включают совокупность из двух или более различных образцов размноженных стволовых клеток пуповинной крови человека, каждый отдельный образец в совокупности получен из пуповинной крови и/или плацентарной крови отдельного человека при родах.
307. Применение по любому из вариантов осуществления 292-306, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
308. Способ, включающий:
выявление пациента с риском развития острой реакции «трансплантат против хозяина» (РТПХ) из-за получения аллогенного трансплантата;
введение обогащенного CD34+ и размноженного образца пуповинной крови (Exp-CBSC) без соответствия в пределах клинически значимого временного окна после аллогенного трансплантата;
таким образом, уменьшение острой РТПХ у пациента с риском ее развития.
309. Способ по варианту осуществления 308, где (i) аллогенный трансплантат и индивидуум иммунологически совместимы, и (ii) Exp-CBSC вводят индивидууму без иммунологического соответствия.
310. Способ по варианту осуществления 308 или 309, где Exp-CBSC ранее были криоконсервированы.
311. Способ по любому из вариантов осуществления 308-310, где Exp-CBSC не включают T-клетки.
312. Способ по любому из вариантов осуществления 308-311, где сниженная острая РТПХ включает уменьшение стадии III острой РТПХ.
313. Способ по любому из вариантов осуществления 308-312, где сниженная острая РТПХ включает уменьшение стадии IV острой РТПХ.
314. Способ по любому из вариантов осуществления 308-313, где индивидуум нуждается в этом из-за аллогенного трансплантата гематопоэтических клеток.
315. Способ по варианту осуществления 314, где аллогенный трансплантат гематопоэтических клеток включает трансплантат пуповинной крови.
316. Способ по варианту осуществления 315, где трансплантат пуповинной крови и индивидуум совместимы по 4/6; 5/6; или 6/6 антигенам HLA.
317. Способ по любому из вариантов осуществления 308-316, где индивидиум представляет собой педиатрического пациента.
318. Способ по любому из вариантов осуществления 308-317, где клинически значимое временное окно происходит до медицинской процедуры.
319. Способ по любому из вариантов осуществления 308-318, где клинически значимое временное окно находится в пределах 36 часов после медицинской процедуры.
320. Способ по любому из вариантов осуществления 308-318, где клинически значимое временное окно находится в пределах 12 часов после медицинской процедуры.
321. Способ по любому из вариантов осуществления 308-320, где Exp-CBSC включают по меньшей мере 75 миллионов CD34+ клеток.
322. Способ по любому из вариантов осуществления 308-321, где Exp-CBSC получены из пуповинной крови и/или плацентарной крови одного человека при родах.
323. Способ по любому из вариантов осуществления 308-321, где Exp-CBSC включают совокупность из двух или более различных образцов размноженных стволовых клеток пуповинной крови человека, каждый отдельный образец в совокупности получен из пуповинной крови и/или плацентарной крови отдельного человека при родах.
324. Способ по любому из вариантов осуществления 308-323, где терапевтически эффективное количество включает 1 миллион - 20 миллионов CD34+ клеток на килограмм индивидуума.
Пример 1. Сниженное отторжение трансплантата у несовместимых по MHC реципиентов, получавших размноженные с Notch мышиные гематопоэтические стволовые клетки и клетки-предшественники. Вливание размноженных ex vivo мышиных гематопоэтических стволовых клеток и клеток-предшественников (HSPC) реципиентам, полностью несовместимым по главному комплексу гистосовместимости, улучшает выживание кожных трансплантатов, полученных от донора, но не от третьей стороны. Эти данные показывают, что размноженные ex vivo несовместимые HSPC передают донор-специфическую иммунологическую толерантность у мышиной модели h-ARS.
Аллогенные трансплантаты гематопоэтических стволовых клеток (HCT) способствуют донор-специфической иммунологической толерантности и затем снижают риск острого и хронического отторжения трансплантата у реципиентов трасплантатов твердых тканей (Millan et al., 2002, Transplantation; 73:1386-1391; Scandling et al., 2008, N Engl J Med 358:362-368; Granados et al., 2015, Curr Opin Organ Transplant. 20:49-56). Успешную передачу иммунологической толерантности через аллотрансплантат в условиях немиелоаблативной трасплантации гематопоэтических клеток (HCT) с персистирующим смешанным химеризмом и полной отменой иммуносупрессорных лекарственных средств наблюдали у реципиентов почечных трансплантатов (Kawai et al., Am J Transplant 2014, 14: 1599-1611; Scandling et al., Am J Transplant 2015, 15:695-704; Sorof et al., Transplantation 1995, 59:1633-1635). Интересно, что почечная аллотрансплантатная толерантность индуцировалась даже с временным химеризмом у не являющихся человеком приматов и людей (Sorof et al., Transplantation 1995, 59:1633-1635, Kawai and Sachs, Curr Opin Organ Transplant 2013,18:402-407). Kawai предположил, что это явление связано с временным размножением донорских гематопоэтических клеток, таких как незрелые дендритные клетки или T-клетки, что может приводить к удалению из тимуса донор-реактивных Т-клеток реципиента или к индукции донор-специфических регуляторных T-клеток.
В этом примере сообщается, что вливание несовместимых по MHC криоконсервированных размноженных ex vivo мышиных HSPC (Lin-Sca1+cKit+клетки [LSK]) после летальной дозы радиации индуцирует донор-специфическую иммунологическую толерантность, что приводит к более длительной выживаемости донорских кожных аллотрансплантатов. Эти данные подтверждают, что эти клинически значимые, криоконсервированные, универсальные донорские, готовые клеточные продукты могут вызывать донор-специфическую толерантность в органе реципиента трансплантата, снижая отторжение трансплантата.
Способы. Мыши. Самок или самцов мышей B6-Ly5a (H-2b, CD45.1+) разводили и содержали в ветеринарном центре Исследовательского центра рака Фреда Хатчинсона (FHCRC) в особых условиях без патогенов. Самок мышей BALB/cJ (H-2d, CD45.2+) и C3H (H-2k, CD45.2+) приобретали в Лаборатории Джексона (Bar Harbor, ME). Мышей содержали в стандартных условиях, и все эксперименты проводили при одобрении и под руководством Комитета по содержанию и использованию животных FHCRC (IACUC).
Выделение и наращивание мышиных гематопоэтических стволовых клеток и клеток-предшественников. Клетки LSK из костного мозга мыши B6-Ly5a обогащались с помощью клеточного сортера с активацией флуоресценции (FACS) Aria (Becton Dickinson [BD], Franklin Lakes, NJ), как описано ранее (Varnum-Finney, et al., Blood 1998, 91: 4084-4091). После каждой сортировки чистота сортированных популяций была подтверждена и превышала 90%. Необработанные 6-луночные планшеты для культур тканей покрывали сконструированным лигандом Notch (Delta1ext-IgG; DXI) или человеческим IgG при концентрации 5 мг/мл в течение 2 часов при 37°С, затем промывали фосфатно-солевым буфером (PBS) и блокировали по меньшей мере в течение 30 минут с PBS, содержащим 2% бычьего сывороточного альбумина. Сортированные клетки LSK культивировали в присутствии DXI или IgG в модифицированной по методу Исков среде Дульбекко (Thermo Fisher Scientific Life Sciences, Waltham, MA), дополненной 20% эмбриональной телячьей сывороткой (Hyclone FBS, Thermo Fisher Scientific Life Sciences), 1% пенициллином-стрептомицином, и следующими цитокинами: мышиным фактором стволовых клеток, лигандом Flt-3L человека, человеческим IL-6 (100 нг/мл каждого), и человеческим IL-11 (10 нг/мл; все цитокины приобретены у PeproTech, Rocky Hill, NJ) (Varnum- Finney et al., 2003, 101: 1784-1789). Плотность клеток поддерживали на уровне 1×106 клеток/мл во время культивирования в течение 14 суток. В конце 14 суток размноженные клетки LSK собирали, и использовали свежие клетки для экспериментов по трансплантации или криоконсервировали в 90% FBS+10% диметилсульфоксиде. В день трансплантации, восстановление клеток после оттаивания и сохранение фенотипа LSK определяли с использованием исключения красителя трипанового синего и проточной цитометрии, соответственно.
Облучение, трансплантация гематопоэтических стволовых клеток и отслеживание донорского химеризма. Самки мышей BALB/cJ, возрастом 6-8 недель, получали однократную дозу 6,5-8,5 Гр γ-облучения с использованием источника цезия (JL Shepherd & Associates, San Fernando, CA) в размере 81,4 сГр/мин. Четыре-семь часов спустя, мышам инъецировали внутривенно размноженные с IgG или DXI свежие или криоконсервированные клетки LSK (1, 3, 5 и 15×106 клеток, как указано). Чтобы избежать эффекта пола, избежать искажающих факторов и уменьшить размер эксперимента, в качестве реципиентов использовали только самок мышей. Как только было подтверждено, что клетки, размноженные с IgG, не привели к донорскому восстановлению, в последующих экспериментах контрольных мышей инъецировали физиологическим раствором. Мышей наблюдали ежедневно, и умирающих животных, которые соответствовали конкретным критериям, установленным утвержденным IACUC протоколом, подвергали эвтаназии и документировали как экспериментальную смерть из-за радиационно-индуцированной токсичности. Донорский химеризм (% CD45.1+ клеток) и распределение лимфо-миелоидных линий были задокументированы в периферической крови (PB) и костном мозге (КМ) в отдельной когорте мышей, путем проточной цитометрии после облучения.
Проточная цитометрия. Клетки LSK из КМ мышей Ly5a обогащали с использованием FACS, как описано ранее (Varnum-Finney et al., Blood 1998,91: 4084-4091). В кратком изложения, клетки КМ от мышей B6-Ly5a инкубировали с линейным (LIN) коктейлем, приготовленным на месте. Коктейль LIN включает антитело против CD2 (клон RM2-5), CD3 (клон 17A2), CD5 (клон 53-7.3), CD8a (клон 53-6.7), CD11b (клон M1/70), GR1 (клон RB6-8), B220 (клон RA3-6B2) и TER-119 (клон TER-119). Все антитела были от BD Biosciences и индуцированы в крысах. После 10 минут инкубации с коктейлем LIN, образцы отмывали и добавляли гранулы с овечьим анти-крысиным IgG (Dynabeads, Thermo Fisher Scientific Life Sciences). LIN-положительные клетки разделяли с использованием магнитов DynaMag (Thermo Fisher Scientific Life Sciences). LIN-отрицательные клетки, окрашиваемые с помощью Sca1-PE (клон E13-161.7) и c-kit-флуоресцеинизотиоцианатом (FITC) (клон 2B8) и выделяли клетки LSK, с использованием клеточного сортера FACS ARIA II.
Образцы крови собирали с использованием ретро-орбитальной техники, и клетки КМ были собраны путем аспирации из правой или левой бедренной кости под общей анестезией. После лизиса эритроцитов клетки ПК и КМ инкубировали с блокирующим реагентом (PBS с 2% FBS, антитело к CD16/CD32 (2.4G2) и окрашивали следующими противомышиными специфическими антителами (все из BD, за исключением отмеченных особо), CD45.1-PE-Cy7 (клон A20), CD45.2-аллофикоцианин (APC)-Cy7 (клон 104), CD3-FITC (клон 17A2), Gr1-APC (клон RB6-8C5), B220-APC (клон RA3-6B2) Проточный цитометрический анализ проводили с использованием LSRII (BD Biosciences). Все данные проточной цитометрии анализировали с использованием программного обеспечения FlowJo, версия 9.0 (TreeStar, CA).
Процедура трансплантации кожи. В подгруппе мышей, выживших >40 суток, оценивали донор-специфическую толерантность, подвергая этих мышей двусторонней аллогенной и сингенной трансплантации кожи. Двустороннюю аллогенную и сингенную трансплантацию кожи проводили в двух группах мышей BALB/cJ. Первая группа получила кожный трансплантат BALB/cJ с левой стороны, и кожный трансплантат либо B6-Ly5a, либо C3H (H-2k, CD45.2) с правой стороны. Вторая группа BALB/cJ получила на левой стороне кожный трансплантат B6-Ly5a и кожный трансплантат C3H с правой стороны. Этот метод был адаптирован из ранее описанного метода (McFarland и Rosenberg, Curr Protoc Immunol 2009, Chapter 4: Unit 4,4). В кратком изложении, донорские мыши BALB/cJ, B6-Ly5a, и C3H подвергались эвтаназии и собирали вентральные и боковые лоскуты кожи, разрезали на мелкие квадраты и держали в холодном PBS. Контрольных (восстановленных с помощью массы клеток КМ BALB/cJ) и химерных мышей BALB/cJ анестезировали изофлураном, создавали ложе трансплантата размером 7-10 мм с двух сторон на дорсо-латеральной части грудной клетки, помещали трансплантат кожи, обрезали до размера in situ, и закрепляли углы узловыми швами (5,0 покрытый воском плетеный шелк). Трансплантаты были покрыты неприлегающими абсорбирующими марлевыми салфетками, бумажной лентой и ветеринарной повязкой. Через 7 суток, повязки и швы удаляли, и трансплантаты оценивали после этого ежедневно. Устанавливали день отторжения, если >80% трансплантата были некротическими, покрыты корками или смещены с ложа трансплантата.
Статистический анализ. Все статистические анализы проводились с использованием программного обеспечения Prism, версии 6.0f (GraphPad, San Diego, CA), и p значений <.05 считались представляющими собой статистически значимые отличия. Результаты экспериментов представлены как среднее значение±SEM. Данные трансплантации анализировали с помощью стандартизированного теста Стьюдента, а общую выживаемость и выживаемость трансплантата анализировали с помощью анализа кривой выживаемости Каплана-Мейера. Логистическую регрессию применяли для расчета дозы радиации, которая, как ожидается, приведет к смерти до 50% облученной популяции в течение 30 суток и до 70% облученной популяции в течение 30 суток (LD70/30). Данные о выживаемости трансплантата кожи анализировали с использованием стратифицированного теста Уилкоксона (Бреслау) для проверки равенства функций выживания.
Вливание несовместимых размноженных мышиных клеток-предшественников после смертельной дозы облучения приводит к быстрому восстановлению миелоидной линии. Ранее было показано, что мышиные и человеческие HSPC размноженные в культурах, содержащих фрагменты фибронектина и иммобилизованный лиганд Notch, эффективно восстанавливают популяцию у сингенных и ксеногенных реципиентов (Varnum-Finney et al., 2003, 101: 1784-1789; Delaney C et al., Blood 2005, 106: 2693-2699). В этом исследовании было проверено, могут ли размноженные мышиные HSPC аналогично обеспечить быстрое гематопоэтическое восстановление при вливании несовместимым по MHC реципиентам после летального облучения. Для этого были свежие клетки LSK 1×106B6-Ly5a (H-2b, CD45.1), размноженные с IgG или Delta1ext-IgG в течение 14 суток, инъецировали летально облученным (8,5 Гр) 6-8 недельным самкам мышей BALB/cJ (H-2d, CD45.2) (фиг.6A). Как и ожидалось, в конце 14-дневного периода культивирования 76% Delta1ext-IgG -культивируемых клеток были Sca-1+ c-Set+ (фиг.6B, левая нижняя панель), и несколько клеток экспрессировали гранулоцит-ассоциированные антигены (GR-1 и CD11b) (фиг.6В, правая нижняя панель). Напротив, несколько клеток, культивируемых с контрольным IgG, были Sca-1+ c-Set+, и большинство из них были гранулоцитами GR-1+ и CD11b+ гранулоциты, что указывает на дифференцировку (фиг.6B, левая и правая верхние панели).
Уже через 7 суток после вливания свежих DXI-культивированных клеткок высокий уровень приживления наблюдали как в ПК, так и в КМ у MHC-несовместимых мышей (фиг.6C). У этих мышей, донорские клетки продолжали снижаться более чем 8 недель, что привело к низкому уровню донорских клеток в ПК (4,5%±0,6%) через 60 суток после трансплантации. Напротив, приживление доноров на сутки 7 было низким (24%±4%) у мышей, которым вводили с контрольные IgG-культивируемые клетки, и было обнаружено только в КМ. На сутки 14 в этой группе не было обнаружено донорского приживления (фиг.6С). Раннее донорское гематопоэтическое восстановление с DXI-культивируемыми клетками было преимущественно миелоидным (данные не показаны), тогда как через 2 месяца после трансплантации донорский гемопоэзо представлял преимущественно Т-лимфоидные, потомство кратковременно репопулирующих клеток, размноженных ex vivo (фиг.6C, вставка).
Вливание несовместимых DXI-культивируемых клеток стимулирует донор-специфическую толерантность и улучшает выживаемость кожного трансплантата (т.е., уменьшает отторжение трансплантата). Длительное персистирование низких уровней донорских Т-клеток в ПК мышей, трансплантированных DXI-культивированными клетками, без признаков реакции «трансплантат против хозяина» (РТПХ), привело к предположению о наличии донор-специфической трансплантационной толерантности в пределах полноценных барьеров МНС. Чтобы решить, развилась ли у этих мышей донор-специфическая толерантность, им произвели хирургическое размещение сингенных (BALB/cJ, H-2d), донорских (B6-Ly5a, H-2b) или посторонних (C3H, H-2k) кожных трансплантата через 60 суток после трансплантации контрольными сингенными КМ или DXI-культивируемыми клетками. Каждой мыши были имплантированы два кожных трансплантатами, по одному на каждом боку; происхождение трансплантата на каждом боку было сингенным/донорским, сингенным/посторонним или донорским/посторонним (фиг.7А). Шесть и четыре неудачи трансплантации, вызванные техническими проблемами, возникли в группах контроля и DXI, соответственно. Не было отторжения ни одного из сингенных кожных трансплантатов у мышей, предварительно трансплантированных сингенным КМ (фиг.7B, 7E) или аллогенными DXI-культивируемыми клетками (фиг.7C, 7E), тогда как все сторонние кожные трансплантаты были отторгнуты у всех мышей в пределах первых 13 суток после размещения трансплантата, оставив после себя сморщенную рубцовую ткань (фиг.7В, 7С, 7G).
Напротив, 30-дневный коэффициент выживаемости донорнских трансплантатов был значительно увеличен в группе DXI; на сутки 30, 48% (10 из 21) кожных трансплантатов оказались здоровыми и не проявляли признаков отторжения (корки и рубцевания) (фиг.7C, 7F; p <.001). Кроме того, 14% этих трансплантатов показали полное приживление, с подтверждением роста черных волос на фоне белых волос на хирургическом участке (фиг.7D). Длительная выживаемость трансплантата у этих мыши не была обусловлена иммунодефицитом, потому что мыши отторгли все сторонние кожные трансплантаты (фиг.7C, 7G). В разительном контрасте с этим, все донорские трансплантаты были отторгнуты у мышей, трансплантированных сингенными клетками КМ (фиг.7В, 7F). Весьма любопытен тот факт, что уровень персистирующего донорского приживления в ПК во время трансплантации кожи не коррелировал с выживанием трансплантата. Не ограничиваясь теорией, эти результаты подтверждают мнение о том, что улучшение выживаемости кожного трансплантата обусловлено индукцией донорно-специфической иммунологической толерантности путем вливания криоконсервированных аллогенных DXI-культивируемых клеток. Ни у одной из мышей, переживших начальные 30 суток после TBI, не развились какие-либо длительные осложнения воздействия радиации во время эксперимента (90 суток).
Этот пример демонстрирует, что лечение с помощью криоконсервированных размноженных ex vivo с DXI мышиных HSPC у MHC-несовместимых мышиных реципиентов после широкого диапазона смертельных доз TBI привело к быстрому восстановлению миелоидных клеток, полученных от донора, через семь суток после размноженного клеточного продукта, несмотря на значительную несовместимость между клетками и реципиентами. Этот пример также демонстрирует, что устойчивый смешанный донорный химеризм в КМ и ПК возможен в пределах основных барьеров H2-гистосовместимости в полностью несовместимых мышах без каких-либо признаков РТПХ. Важно отметить, что в этом исследовании не использовалась посттрансплантационная иммуносупрессия или антитело в терапии хозяина, которая была признана необходимой в предыдущих исследованиях (Cobbold et al., Nature 1986, 323:164-166; Yamada et al., Am J Transplant 2015,15: 3055-3066; de Vries-van der Zwan et al., Bone Marrow Transplant 1998, 22:91-98).
У летально облученных мышей донорское приживление достигало максимума на сутки 7 с преобладанием миелоидных клеток. После этого уровень донорского приживления снизился, а к суткам 60 приживление доноров стабилизировалось на низком уровне, который был почти исключительно получен из преимущественно CD3+ T-лимфоцитов без каких-либо признаков РТПХ. Т-лимфоцитарный донорский химеризм у этих мышей, трансплантированных MHC-несовместимыми клетками, аналогичен тому, о котором сообщалось ранее насчет мышей, трансплантированных MHC-совместимыми клетками, размноженными с DXI (Varnum-Finney et al., 2003, 101: 1784-1789), и клетки являются потомством кратковременно репопулирующих лимфоидных и миелоидных клеток, полученных ex vivo. Не похоже, что присутствует влияние сигнального пути Notch на развитие потомства Т-клеток, полученного из размноженных репопулирующих клеток, потому что использовали лиганд Notch Delta1, чтобы индуцировать пролиферацию, одновременно подавляя дифференцировку LSK. Не ограничиваясь теорией, индукция иммунологической толерантности через полные барьеры МНС была продемонстрирована значительно более высоким коэффициентом выживаемости кожного трансплантата у мышей, трансплантированных DXI-размноженными клетками. Не было обнаружено никакой корреляции между уровнем химеризма и выживаемостью трансплантата, как сообщалось ранее (Sorof et al., 1995, 59: 1633-1635, Ildstad et al., J Exp Med 1985, 162: 231-244). Низкий уровень Т-клеточного химеризма (3,4%±5%, диапазон, 0,2%-11,2%) был достаточным для передачи донорско-специфической иммунологической толерантности к кожным трансплантатам. Однако коэффициент выживаемости трансплантатов был выше (40%) у мышей, подвергшихся воздействию 8,0-Гр TBI, чем у мышей, подвергшихся воздействию 7,5-Гр TBI, у которых только 1 из 10 кожных трансплантатов не был отторгнут к суткам 30. Это исследование документально подтвердило, что длительное выживание аллотрансплантата кожи у этих мышей было обусловлено, в частности, отсутствием у реципиентов ответа на специфические донорские антигены, показав, что они реагировали на сторонние (C3H) антигены и быстро отторгали сторонние кожные трансплантаты.
Настоящий пример впервые показал индукцию донор-специфической толерантности у реципиентов, получавших криоконсервированные, размноженные ex vivo аллогенные и HLA-несовместимые HSPC.
Пример 2. Применение опиоидов, кормление ТПН и дни госпитализации после медицинской процедуры. Вливание ex vivo размноженных клеток-предшественников пуповинной крови связано с сокращением продолжительности пребывания в больнице и использованием вливания опиоидов и полного парентерального питания у педиатрических пациентов, получающих миелоаблативную трансплантацию пуповиннной крови.
Способы: Педиатрические пациенты (<21 года, n=34), получавшие миелоаблативный режим кондиционирования (FLU/CY/13,2 Gy TBI) с получением или без получения размноженных HSPC ПК (свежих или криоконсервированных), были представлены в этом примере. Продолжительность первоначальной госпитализации, использование опиоидных обезболивающих препаратов (путем непрерывной инфузии или АКП (анальгезии, контролируемой пациентом)), и использование ТПН определяли для каждого пациента. Статистические сравнения между группами проводились с использованием двухсторонних непарных t-тестов.
Результаты: 11 пациентов получали размноженные HSPC ПК в дополнение к 1-2 неманипулированным порциям ПК, тогда как одновременная когорта из 23 пациентов получила такую схему кондиционирования без вливания размноженных клеток. Средняя продолжительность первичной госпитализации после медицинских процедур составила 43,2 против 55,6 суток (p=0,05) (фиг.8), средняя продолжительность для непрерывного приема опиоидных препаратов 9,7 против 18,1 суток (p=0,07), и среднее время получения ТПН составило 20,7 против 30,1 суток (p=0,06) (фиг.9).
Этот пример демонстрирует важные дополнительные преимущества Exp-CBSC. Уменьшение полного парентерального питания позволяет избежать многочисленных осложнений, которые могут возникнуть из-за такого искусственного кормления. Уменьшение воздействия применения опиоидов на пациента может помочь в борьбе с продолжающейся эпидемией злоупотребления болеутоляющими средствами. Наконец, сокращенная госпитализация после медицинской процедуры уменьшает расходы, связанные с медицинской помощью, и аналогично снижает потери от нереализованных возможностей, которые пациенты испытывают во время госпитализации.
Пример 3. Уменьшение острой РТПХ. Проводили проспективное открытое не сравнительное исследование для оценки безопасности, осуществимости и предварительной эффективности у пациентов, проходящих трансплантацию пуповинной крови (ТПК) одной или двойной порцией с последующим вливанием HLA-несовместимого, ранее размноженного ex vivo и криоконсервированного продукта клеток-предшественников пуповинной крови.
Пациенты. Приемлемые пациенты были в возрасте от 6 месяцев до ≤45 лет и имели острый лейкоз высокого риска, хронический миелолейкоз или миелодиспластический синдром. Дополнительные требования к включению включали адекватное общее состояние, адекватную функцию органа и наличие одной или двух порций ПК, совместимых по четырем дополнительным локусам HLA, посредством типирования со средним разрешением для аллелей (A и B) HLA класса I или путем типирования с высоким разрешением для аллеля DRB1 HLA класса II. ТПК одной порцией была разрешена для порций 6/6 с общим количеством ядросодержащих клеток (TNC) ≥2,5×107/кг, для порций 5/6 и 4/6 единиц с TNC ≥4,0×107/кг. Если эти пороговые значения не были соблюдены, проводили ТПК двумя порциями (дТПК), причем каждая порция должен была иметь TNC ≥1,5×107/кг.
Продукты размноженных ex vivo клеток-предшественников: Обработка и производство клеток. В кратком изложении, образцы ПК человека были получены от нормальных доношенных родов с одобрением экспертного институционального совета по этике и оценкой подходящих доноров, определенной в соответствии с 21CFR1271 от банка пуповинной крови центра крови в Пьюджет Саунд. Порции ПК истощали по эритроцитам и подвергали клиническому отбору CD34+ клеток с использованием Miltenyi CliniMACS по инструкциям производителя. Отрицательную фракцию удаляли.
Культуры инициировали очищенными CD34+ клетками и культивировали в течение 14-16 суток в необработанных флаконах для тканевых культур 75-225 см2 (Nunc, Thermo Fisher Scientific, Pittsburg, USA). Флаконы для культивирования были предварительно покрыты лигандом Notch для клинического применения (Delta1ext-IgG, полученным на базе Biologics Production Fred Hutchinson, DMF BB-MF 12366) при 2,5 мкг/мл (плотность, которая ранее была показана как оптимальная для получения NOD/SCID репопулирующих клеток) вместе с 5 нг/мл фрагмент CH-296 фибронектина (Takara Shuzo Co. LTD., Otsu, Japan) в течение 2 часов при 37° или в течение ночи при 4°, промывали PBS. Клетки культивировали в бессывороточной среде (Stemspan SFEM, Stemcell Technologies, Vancouver, BC, Canada) с рекомбинантным человеческим IL-3 (10 нг/мл), IL-6, тромбопоэтином (TPO), лигандом Flt-3L и фактором стволовых клеток (SCF)для клинического применения при 50 мкг/мл) (CellGenix Freiburg, Germany). Клетки были разделены по новым культуральным сосудам для поддержания плотности клеток <1×106 общего количества клеток на миллилитр среды.
На сутки 14-16 культивирования, общий объем клеток собирали и проводили окончательные испытания готовой продукции, включая окончательный подсчет количеств и расчет кратности наращивания для CD34 и TNC, иммунофенотипирование, стерильность по бактериям и грибкам и тест на эндотоксин. На фиг.10А и 10В изображена средняя кратность для наращивания CD34+ клеток (фиг.10А) и средняя кратность общего количества для наращивания ядросодержащих клеток (фиг. 10В) во время сбора размноженного клеточного продукта. Затем продукт был криоконсервирован в морозильной камере с контролируемой скоростью.
Конечный собранный продукт HSPC. Следует отметить, что не было зрелых Т-клеток, вливаемых с размноженным трансплантатом, поскольку продукт состоял из общего потомства, полученного после культивирования CD34+ HSPC, выделенных из одной порции ПК. Т-клетки, содержащиеся в отрицательной фракции, не сохраняли, и не получали или не поддерживали Т-клетки в период культивирования в течение 14 суток. Средняя доза TNC и CD34+ клеток перед заморозкой, полученная из Exp-CBSC, составляла 5,8×107/кг (диапазон от 2,2 до 10,9) и 0,26×106/кг (диапазон от 3,1 до 11,6), соответственно. Средняя доза TNC и CD34+ клеток перед заморозкой, полученная из неманипулированного трансплантата, составила 6,1×107/кг (диапазон от 4,3 до 17,1) и 0,26×106/кг (диапазон от 0,08 до 0,98), соответственно. Пациенты, получавшие Exp-CBSC, имели значительно более высокий уровень TNC в неманипулированных порциях по сравнению с TNC для пациентов в контрольной группе (фиг.11).
Статистический анализ. Вероятность выживаемости без заболевания (DFS) была рассчитана с использованием метода Каплана и Мейера [MacMillan et al., Blood 2009; 113: 2410-15]. Кумулятивная частота рецидива, не связанной с рецидивом смертности (NRM) и острой РТПХ суммировалась с использованием суммарной оценки заболеваемости с рецидивом, рассматриваемым как конкурирующий риск для NRM, NRM как конкурирующий риск для рецидива, и смерть без рецидива для каждой из других конечных точек рассматривалась как конкурирующий риск для каждой, соответственно.
DFS, NRM, острую РТПХ в группе пациентов, получивших Exp-CBSC, сравнивали с результатами 50 пациентов, получивших ТПК без размноженных популяций клеток. Все пациенты получали такую схему кондиционирования и профилактику РТПХ. Частоту рецидива, НРМ и острую РТПХ сравнивали с использованием способа Файн и Грея.
Результаты. Средний период наблюдения за выжившими пациентами составил 4,2 года (диапазон от 2,9 до 4,8 лет). Пациентам было 5-45 лет (медиана 21), и они весили 23-89 кг (медиана 59). Заболевания включали ОМЛ (n=6), ОЛЛ (n=8), МДС (n=1). Шесть пациентов (40%) имели минимальное остаточное заболевание во время трансплантации, определяемое как наличие заболевания, по оценке десятицветной многопараметрической проточной цитометрией на аспиратах костного мозга, полученных в качестве рутинного фона перед ТПК. Все, кроме четырех пациентов (27%), получили две порции ПК для достижения требуемой дозы клеток. По сравнению с контрольной группой не наблюдали различий в отношении пола, возраста, массы, серостатуса по ЦМВ и состояния заболевания при трансплантации.
Исходы трансплантации. Вероятность 3-летней DFS составляла 86% (95% ДИ: 57-97) среди реципиентов Exp-CBSC и 67% (95% CI: 52-78) в контроле (p=0,16) (фиг. 12А). ФИГ.6В и ФИГ. 12C показывают кумулятивную частоту NRM и рецидивов среди реципиентов Exp-CBSC по сравнению с контролями, соответственно. Не наблюдали NRM на всем протяжении исследования, хотя у двух пациентов развился рецидив в дни 53 и 219 после трансплантации, и затем они умерли после дальнейшей терапии. Пациент с рецидивом на сутки 53 имел явный рецидив во время трансплантации.
Острая и хроническая РТПХ. У всех пациентов была диагностирована максимум стадия II острой РТПХ в среднем на 32 сутки (14-86), при этом не наблюдали стадии III-IV острой РТПХ. Напротив, кумулятивная частота стадий III-IV острой РТПХ составила 26% в контроле (р=0,005) (фиг.13). Кожа была наиболее часто поражаемым органом в группе, получавшей Exp-CBSC (n=12). Восемь (53%) пациентов лечили заранее от синдрома приживления со средним временем 6 суток (диапазон 4-9), и у пяти (33%) пациентов была РТПХ через 100 дней. Через 100 дней, из 13 пациентов, подлежащих оценке, 3 (23%) имели поздние признаки острой РТПХ или перекрестный синдром, в то время как ни у кого не было выявлено признаков классической хронической РТПХ. Через 2 года у девяти пациентов (70%) была прекращена иммуносупрессия.
Смертность, связанную с трансплантацией, не наблюдали среди 15 пациентов в этом исследовании; однако, произошло 2 смерти из-за рецидивирующего заболевания, что привело к прекрасной общей выживаемости. Наблюдаемые положительные результаты можно отнести к преодолению задержки приживления, испытываемой пациентами, получавшими ТПК; однако также возможно, что вливание готовых Exp-CBSC привело к увеличению взаимодействия трансплантата против трансплантата и, таким образом, увеличило эффект трансплантата против лейкоза. Хотя небольшое количество пациентов не позволяет делать окончательные выводы, характеристики пациентов (половина из них была с минимальным остаточным заболеванием (MRD+) во время трансплантации), и длительное наблюдение делает эти результаты чрезвычайно обнадеживающими.
Не наблюдали никакой токсичности, связанной с вливаниями, и никаких серьезных побочных эффектов не было связано с готовым продуктом Exp-CBSC. Более удивительно, что ни у одного из пациентов, включенных в исследование, не развилась стадия III-IV острой РТПХ, что предполагает иммуномодулирующие свойства готового продукта. Возможно, что в присутствии готового размноженного продукта, аллореактивные T-клетки из неманипулированной порции будут размножаться in vivo и дифференцироваться в конкретные клеточные субпопуляции, которые способны уменьшить острую РТПХ. Если это подтвердится, это наблюдение может иметь важные клинические последствия. Учитывая, что тяжелые формы острой РТПХ ассоциированы с повышенным риском заболеваемости и смертности, [Brunstein et al., Кровь 2007; 110: 3064-70; MacMillan et al., Blood 2009; 113: 2410-15] использование готового продукта может быть распространено на другие типы трансплантации гематопоэтических клеток (ТГК) с использованием различных источников стволовых клеток с целью смягчения острой РТПХ.
Как понятно специалисту в данной области, каждый вариант осуществления, описываемый в настоящем документе, может содержать, состоять по существу из или включать его конкретный заявленный элемент, шаг, ингредиент или компонент. «Включает» или «включающий» означает «содержит, состоит по существу из или состоит из». Переходный термин «содержит» или «содержат» означает, что он в качестве неограничивающих примеров включает и позволяет включать неуказанные элементы, этапы, ингредиенты, или компонентов, даже в больших количествах. Переходная фраза «состоящий из» исключает любой не указанный элемент, шаг, ингредиент или компонент. Переходная фраза «состоящий по существу из» ограничивает объем варианта осуществления указанными элементами, этапами, ингредиентами или компонентами и теми, которые не оказывают существенного влияния на вариант осуществления. Существенное влияние могло бы привести к статистически значимому и клинически значимому снижению эффективности введения Exp-CBSC для уменьшения (i) отторжения трансплантата, (ii) ТПН, применения опиоидов и госпитализации в течение после медицинской процедуры; (iii) мукозита; или (iv) возникновения и/или тяжести стадии III и стадии IV острой РТПХ после трансплантации пуповинной крови согласно протоколу, описываемому в настоящем документе.
Если не указано иное, все числа, выражающие количества ингредиентов, свойства, такие как молекулярная масса, условия реакций, и т.д., используемые в описании и формуле изобретения, должны пониматься как модифицированные во всех случаях посредством термина «приблизительно». Таким образом, если не указано иное, численные параметры, указанные в описании и прилагаемой формуле изобретения, являются приблизительными, которые могут варьироваться в зависимости от желаемых свойств, которые необходимо было получить по настоящему изобретению. По крайней мере, и не как попытка ограничить применение доктрины эквивалентов к объему формулы изобретения, каждый численный параметр должен быть в принципе интерпретирован в свете количества сообщенных значащих цифр и путем применения обычных методов округления. Когда требуется дополнительная ясность, термин «приблизительно» имеет значение, разумно приписываемое ему специалистом в данной области при использовании в сочетании с указанным численным значением или диапазоном, т.е. обозначая несколько больше или несколько меньше, чем заявленное значение или диапазон, в пределах±20% от заявленного значения; ±19% от заявленной стоимости; ±18% от заявленной стоимости; ±17% от заявленного значения; ±16% от заявленного значения; ±15% от заявленного значения; ±14% от заявленного значения; ±13% от указанной величины; ±12% от заявленного значения; ±11% от заявленной стоимости; ±10% от указанной величины; ±9% от заявленного значения; ±8% от заявленного значения; ±7% от заявленного значения; ±6% от заявленного значения; ±5% от заявленного значения; ±4% от заявленного значения; ±3% от заявленного значения; ±2% от заявленного значения; или±1% от заявленного значения.
Несмотря на то, что числовые диапазоны и параметры, устанавливающие широкий объем изобретения, являются приближениями, численные значения, указанные в конкретных примерах, сообщаются как можно точнее. Любое числовое значение, однако, по своей сути содержит определенные ошибки, неизбежно возникающие в результате стандартного отклонения, найденного в их соответствующих тестовых измерениях.
Термины «a», «an», «the» и подобные ссылки, используемые в отношении описания изобретения (особенно в отношении следующих пунктов), должны толковаться как для единственного числа, так и для множественного, если не указано иначе в настоящем документе или четко противоречит контексту. Перечисление диапазонов значений в настоящем документе просто предназначено для того, чтобы служить сокращенным способом обращения индивидуально к каждому отдельному значению, попадающему в диапазон. Если не указано иначе в настоящем документе, каждое индивидуальное значение включено в описание, как если бы оно было отдельно указано в настоящем документе. Все способы, описываемые в настоящем документе, можно проводить в любом подходящем порядке, если не указано иначе в настоящем документе или иначе явно противоречит контексту. Использование любых примеров, или формулировка для примеров (например, «такой как»), предоставленная в настоящем документе, предназначены просто для лучшего освещения изобретения и не представляют собой ограничение объема изобретения, если не утверждается иное. Никакая формулировка в описании не должна толковаться как указание на любой незаявленный элемент, необходимый для практики по изобретению.
Группировки альтернативных элементов или вариантов осуществления изобретения, описываемого в настоящем документе, не должны толковаться как ограничения. На каждого члена группы можно ссылаться индивидуально и он может быть заявлен индивидуально или в любой комбинации с другими членами группы или другими элементами, найденными в настоящем документе. Предполагается, что один или несколько членов группы могут быть включены в группу или удалены из группы по соображениям удобства и/или патентоспособности. Когда происходит такое включение или удаление, считается, что описание содержит группу как измененную, таким образом выполняя письменное описание всех групп Маркуша, используемых в прилагаемой формуле изобретения.
Конкретные варианты осуществления настоящего изобретения описаны в настоящем документе, в том числе лучший способ, известный авторам изобретения для осуществления изобретения. Разумеется, вариации этих описанных вариантов осуществления станут очевидными специалистам в данной области после прочтения указанного выше описания. Авторы изобретения ожидают, что специалисты в данной области будут использовать такие вариации при необходимости, и авторы изобретения предназначают изобретение для использования иначе, чем конкретно описано в настоящем документе. Таким образом, это изобретение включает все модификации и эквиваленты предмета изобретения, приведенные в прилагаемой к нему формуле изобретения, как это разрешено применимым законодательством. Кроме того, любая комбинация вышеописанных элементов во всех возможных вариантах охватывается изобретением, если не указано иначе в настоящем документе или иное явно противоречит контексту.
Кроме того, было сделано множество ссылок на книги, журнальные статьи, трактаты, патенты, печатные публикации и т.д. (в совокупности «ссылки») на всем протяжении этого описания. Каждая из вышеприведенных ссылок индивидуально включена ссылкой в настоящий документ для их цитируемых принципов.
В заключение, следует понимать, что варианты осуществления, описываемого в настоящем документе изобретения, являются иллюстрацией принципов по настоящему изобретению. Другие модификации, которые могут быть использованы, находятся в пределах объема изобретения. Таким образом, в качестве примеров, но не ограничения, альтернативные конфигурации по настоящему изобретению могут быть использованы в соответствии с принципами в настоящем документе. Таким образом, настоящее изобретение не ограничено тем, что в точности показано и описано.
Представленные в настоящем документе данные приведены в качестве примеров и только для целей иллюстративного обсуждения предпочтительных вариантов осуществления настоящего изобретения и представлены в целях обеспечения того, что считается самым полезным и понятным описанием принципов и концептуальных аспектов различных вариантов осуществления изобретения. В отношении этого не было сделано попыток более подробно показать структурные детали по изобретению, чем это необходимо для фундаментального понимания изобретения; описание, взятое с чертежами и/или примерами, дает понимание специалистам в данной области, как несколько форм по изобретению можно воплотить на практике.
Определения и объяснения, используемые в настоящем изобретении, подразумеваются и предназначены для контроля в любой будущей конструкции, если явно и однозначно не модифицированы в следующих примерах, или когда применение значения делает любую конструкцию бессмысленной или по существу бессмысленной. В тех случаях, когда построение термина сделало бы его бессмысленным или по существу бессмысленным, определение должно быть взято из Словаря Вебстера, 3-го издания или словаря, известного специалистам в данной области, такого как Оксфордский словарь по биохимии и молекулярной биологии (Ed. Anthony Smith, Oxford University Press, Oxford, 2004).
Реферат
Настоящее изобретение относится к области биотехнологии и раскрывает новые способы и применения клинического продукта пуповинной крови, включающего обогащенные по CD34+ и размноженные стволовые клетки. Указанный продукт пуповинной крови используют для индуцирования иммунологической толерантности у реципиента трансплантата, уменьшения острой реакции «трансплантат против хозяина», уменьшения отторжения аллогенной ткани у реципиента трансплантата и для улучшения исхода трансплантации у реципиента трансплантата. Настоящее изобретение позволяет расширить арсенал средств для улучшения исхода трансплантации. 8 н. и 11 з.п. ф-лы, 3 пр., 13 ил.

Комментарии