Композиция - RU2728963C2
Код документа: RU2728963C2
Чертежи














Описание
Область, к которой относится изобретение
Настоящее изобретение относится к композиции, содержащей пептиды, происходящие от рецептора тиреоидстимулирующего гормона (TSHR). Эта композиция или пептиды могут быть использованы для предупреждения и/или подавления продуцирования аутоантител к TSHR, и следовательно, они могут быть использованы для лечения и/или профилактики болезни Грейвса.
Предшествующий уровень техники
Болезнь Грейвса представляет собой аутоиммуное заболевание, поражающее щитовидную железу. Это заболевание характеризуется гиперактивностью щитовидной железы, способствующей продуцированию избыточного количества тиреоидного гормона и увеличению щитовидной железы (зоба). Такое состояние гипертиреоидизма может вызывать нейропсихологические и физические симптомы широкого ряда. Болезнь Грейвса является самой распространенной причиной гипертиреоидизма (60-90% от всех случаев) и обычно развивается у людей среднего возраста, но также может встречаться у детей, подростков и у пожилых людей. Этим заболеванием страдает до 2% женщин, и у женщин, оно встречается в 5-10 раз чаще, чем у мужчин. Детской формой болезни Грейвса страдают приблизительно 6000 детей в Соединенных Штатах (США) и 6000 детей в странах Евросоюза (ЕС). Болезнь Грейвса также является наиболее распространенной причиной тяжелого гипертиреоидизма, который сопровождается более выраженными клиническими признаками и симптомами, а также лабораторно подтвержденными патологиями по сравнению с более легкими формами гипертиреоидизма.
Значительную роль в развитии болезни Грейвса играет наследственный компонент. В последнее время не проводилось какого-либо обследования населения на наличие болезни Грейвса, однако, было проведено несколько квазиэкспериментальных обследований населения на гипертиреоидизм, и все оценки на наличие и встречаемость болезни Грейвса являются приблизительными. Частота встречаемости гипертиреоидизма варьируется от 26:100000 до 93:100000, и по оценкам специалистов, повсевместная распространенность составляет 1,3%, причем, 40% случаев являются подтвержденными, а 60% субклиническими.
Приблизительно 30-50% людей с болезнью Грейвса также страдают офтальмопатией Грейвса (также известной как орбитопатия Грейвса или «тироидное заболевание глаз») (ОГ), то есть, протрузией одного или обоих глаз. Во многих случаях, ОГ протекает в слабой и самокупирующейся форме, однако, в 20% случаев, такое заболевание проявляется в явно выраженной/умеренной или тяжелой форме, причем, по меньшей мере в половине случаев, таким пациентам требуется введение стероидов, а у 3-5% пациентов с ОГ наблюдается опасное для зрения заболевание, сопровождающееся болями в комбинации с дистиреоидной невропатией зрительного нерва. Протрузия глаз может вызывать сильную сухость роговицы, поскольку веки глаз не могут смыкаться на ночь. Повышение давления на зрительный нерв может вызывать дефекты поля зрения и приводить к потере зрения. ОГ может также ассоциироваться с претибиальной микседемой.
Фактически, все симптомы и признаки болезни Грейвса являются результатом прямых и непрямых эффектов гипертиреоидизма, за исключением главных ее симптомов, ОГ, зоба и претибиальной микседемы. Симптомы гипертиреоидизма могут включать бессонницу, тремор рук, гиперактивность, выпадение волос, избыточную потливость, непереносимость жары и потерю массы, несмотря на повышенный аппетит. Другими наиболее распространенными признаками являются диффузное безболезненное увеличение (обычно симметричное) щитовидной железы, несмыкание век, избыточная слезливость, вызываемая ОГ, сердечная аритмия и гипертензия. У пациентов с тиротоксией могут наблюдаться поведенческие и личностные изменения, такие как психоз, возбуждаемость и депрессия. У пациентов с более легкой формой гипертиреоидизма могут наблюдаться менее выраженные манифестации, например, тревожные состояния, беспокойство, раздражительность и эмоциональная неустойчивость.
В настоящее время не существует каких-либо эффективных способов лечения болезни Грейвса, а поэтому обычно применяемое лечение направлено на устранение имеющихся симптомов. Существует три способа лечения болезни Грейвса, то есть, пероральное введение антитиреоидных лекарственных средств (ATD), облучение радиоактивным иодом (RAI) и тиреоидэктомия. Последние два метода повышают время жизни тиреоидных гормонов. RAI-терапия представляет собой наиболее распространенный способ лечения в США, а ATD-терапия представляет собой способ лечения первого ряда в Европе, в Японии и в большинстве других стран во всем мире.
ATD-терапия ассоциируется с некоторыми редкими побочными эффектами и дает ремиссию на 50-60%. В настоящее время становится все более очевидно, что RAI может ускорять развитие OГ или ухудшать состояние при активной OГ, а поэтому, в Соединенных Штатах, число пациентов, подвергаемых ATD-лечению, увеличивается.
Поскольку каждый из выбранных способов лечения не всегда является успешным, то пациенты часто подвергаются более, чем одному способу лечения, если первая попытка оказалась не совсем удачной. Риск возникновения рецидива или последующего гипотиреоидизма является довольно высоким, и общая эффективность имеющихся методов лечения болезни Грейвса оставляет желать лучшего.
Разработка альтернативных методов терапии болезни Грейвса является проблематичной из-за отсутствия релеванитных моделей, а в частности, животных-моделей для оценки потенциальной эффективности предложенной терапии. Известные мыши BALB/c с моделью болезни Грейвса не были протестированы на эффективность лекарственных средств, разрешенных для лечения болезни Грейвса, таких как метимазол и метилпреднизолон.
Таким образом, необходимо разработать альтернативные способы терапии для лечения и профилактики заболевания, ассоциированного с продуцированием аутоантител против TSHR, такого как болезнь Грейвса. Также необходимо разработать альтернативные способы терапии, которые были бы эффективными для лечения болезни Грейвса и снижения или ослабления симптомов такого заболевания. Кроме того, необходимо разработать альтернативные модели для оценки потенциальной эффективности предложенных способов лечения болезни Грейвса.
Краткое описание аспектов изобретения
Авторами настоящего изобретения было обнаружено, что «коктейль» из двух пептидов TSHR является особенно эффективным для подавления или предупреждения продуцирования аутоантител к TSHR in vivo и для лечения болезни Грейвса.
Таким образом, в своем первом аспекте, настоящее изобретение относится к композиции, содержащей следующие пептиды TSHR:
(i) всей или части аминокислотной последовательности KKKKYVSIDVTLQQLESHKKK (SEQ ID NO: 1), или их части, или последовательности, которая по меньшей мере на 60% идентична последовательности SEQ ID NO:1; и
(ii) всей или части аминокислотной последовательности GLKMFPDLTKVYSTD (SEQ ID NO: 2), или их части, или последовательности, которая по меньшей мере на 60% идентична последовательности SEQ ID NO:2.
KKKKYVSIDVTLQQLESHKKK (SEQ ID NO: 1) также обозначается здесь RNB-5D-K1. GLKMFPDLTKVYSTD (SEQ ID NO: 2) также обозначается здесь RNB-9B.
Композиция согласно изобретению может быть использована в терапевтических аспектах описанного здесь изобретения.
Во втором своем аспекте, настоящее изобретение относится к описанному здесь пептиду согласно изобретению, для применения в подавлении или предупреждении продуцирования аутоантител к TSHR in vivo.
В своем третьем аспекте, настоящее изобретение относится к описанному здесь пептиду согласно изобретению, для применения в лечении и/или профилактике болезни Грейвса у индивидуума.
В своем четвертом аспекте, настоящее изобретение относится к применению описанного здесь пептида согласно изобретению в пролучении лекарственного средства для подавления или предупреждения продуцирования аутоантител к TSHR in vivo.
В своем пятом аспекте, настоящее изобретение относится к применению описанного здесь пептида согласно изобретению в получении лекарственного средства для лечения и/или профилактики болезни Грейвса.
В своем шестом аспекте, настоящее изобретение относится к способу подавления или предупреждения продуцирования аутоантител к TSHR у индивидуума, включающему стадию введения индивидууму всего пептида SEQ ID NO:1 или его части, или пептида, последовательность которого по меньшей мере на 60% идентична последовательности пептида SEQ ID NO:1, или его части, и всего пептида SEQ ID NO:2 или его части, или пептида, последовательность которого по меньшей мере на 60% идентична последовательности пептида SEQ ID NO:2, или его части.
В своем седьмом аспекте, настоящее изобретение относится к способу лечения болезни Грейвса у индивидуума, включающему стадию введения индивидууму всего пептида SEQ ID NO:1 или его части, или пептида, последовательность которого по меньшей мере на 60% идентична последовательности пептида SEQ ID NO:1, или его части, и всего пептида SEQ ID NO:2 или его части, или пептида, последовательность которого по меньшей мере на 60% идентична последовательности пептида SEQ ID NO:2, или его части.
В одном из аспектов изобретения, композиция не включает или не содержит следующего пептида:
RNB-4K-GKK: KKGNLPNISRIYVSIDVTGKK
Пептидная композиция согласно изобретению может включать описанные здесь аминокислотные последовательности согласно изобретению. В одном из аспектов изобретения, пептидная композиция включает только описанные здесь аминокислотные последовательности согласно изобретению.
Индивидуум может иметь HLA-DR3. Индивидуум может иметь HLA-DR4.
Описанные здесь пептиды согласно изобретению или композиция согласно изобретению могут быть введены в соответствии со схемой увеличения доз.
В своем восьмом аспекте, настоящее изобретение относится к набору, включающему нижеследующие пептиды TSHR:
(i) всей или части аминокислотной последовательности KKKKYVSIDVTLQQLESHKKK (SEQ ID NO: 1) или ее части, или их части, или последовательности, которая по меньшей мере на 60% идентична последовательности SEQ ID NO:1;
и
(ii) всей или части аминокислотной последовательности GLKMFPDLTKVYSTD (SEQ ID NO: 2), или ее части, или их части, или последовательности, которая по меньшей мере на 60% идентична последовательности SEQ ID NO:2;
для одновремнного, раздельного или последовательного введения.
Набор может быть использован для лечения или предупреждения состояния, связанного с продуцированием аутоантител к TSHR, такого как болезнь Грейвса.
В девятом аспекте изобретения, пептиды или композицию согласно изобретению объединяют с другим терапевтическим средством, которое используется для лечения, профилактики или терапии болезни Грейвса. Так, например, пептиды или композиция могут быть объединены с антитиреоидным лекарственным средством или с β-блокатором.
В своем девятом аспекте, настоящее изобретение относится к животной модели заболевания, ассоциированного с продуцированием анти-TSHR антител, где указанное животное является трансгенным по человеческому HLA-DR3, и где уровни TSHR у этого животного выше, чем у соответствующего контрольного животного. В одном из аспектов изобретения, уровень TSHR увеличивается путем введения вирусного вектора, содержащего молекулу нуклеиновой кислоты, кодирующую пептид TSHR.
Заболеванием, ассоциированным с продуцированием анти-TSHR антител, может быть болезнь Грейвса.
TSHR может представлять собой человеческий TSHR. Так, например, TSHR может представлять собой субъединицу А или внеклеточный домен (ECD) человеческого TSHR.
Вирусным вектором может быть аденовирусный вектор или аденовирусная конструкция.
Аденовирусный вектор или конструкция могут быть введены с интервалами в три недели. Аденовирусный вектор или конструкция могут быть введены путем двух или трех последовательных введений.
Аденовирусный вектор или конструкцию вводят в дозе 109-1011 вирусных частиц. Аденовирусный вектор или конструкция могут быть введены путем внутримышечной инъекции.
Животным может быть мышь. Мышь может представлять собой HLA-BRD1*0301-трансгенную мышь.
Описание чертежей
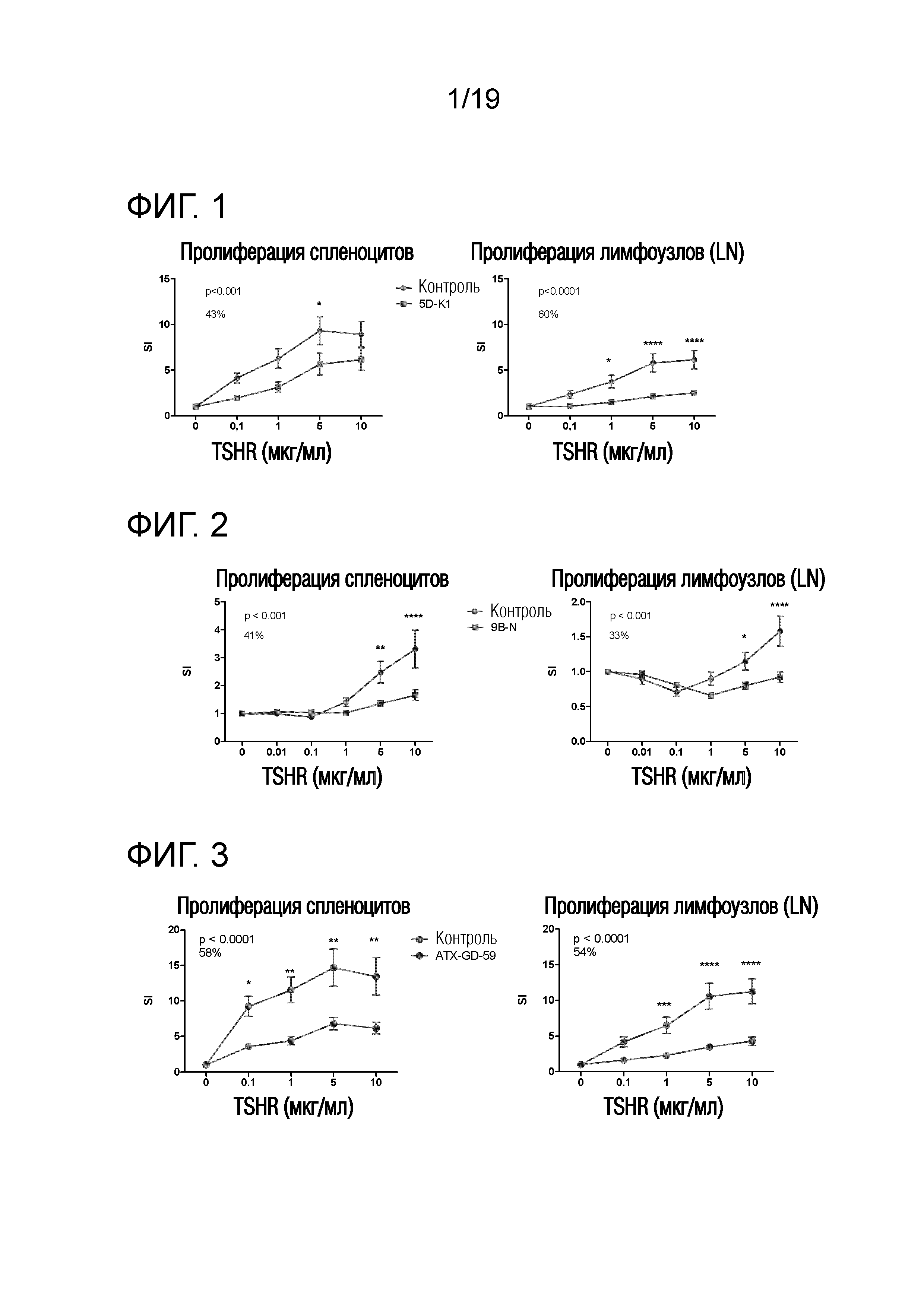
Фигура 1-5D-K1-лечение снижает TSHR-индуцированную пролиферацию у DR3tg-мышей
DR3tg-мыши были предварительно обработаны 5D-K1 (GLS) или контролем (HLA-DR3-связывающим пептидом; GLS) (n=10/группу) в соответствии со схемой увеличения доз до максимальной дозы 100 мкг. Животных иммунизировали 50 мкг 5D (GLS) в ПАФ, и через 10 дней брали лимфоузлы (LN) и селезенку для оценки TSHR-специфической пролиферации. Данные представляют собой среднее ± стандартную ошибку среднего (SEM) величин индекса стимуляции (SI) для мышей, обработанных контролем (красные линии) и мышей, обработанных пептидом (синие линии). Для оценки общих эффектов лечения в отношении пролиферации Т-клеток применяли двухфакторный ANOVA, и p-величины представлены на графиках. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001). Средний процент снижения пролиферации Т-клеток, индуцированного путем обработки пептидом, представлен на графике. SI - индекс стимуляции; LN - лимфоузлы.
Фигура 2-9B-N-обработка снижает TSHR-индуцированную пролиферацию у DR3tg-мышей
DR3tg-мыши были предварительно обработаны 9B-N (PPL) или PBS (n=10/группу) в соответствии со схемой увеличения доз до максимальной дозы 33 мкг. Животных иммунизировали 50 мкг 9B (GLS) в ПАФ, и через 10 дней брали LN и селезенку для оценки TSHR-специфической пролиферации. Данные представляют собой среднее ± стандартную ошибку среднего (SEM) величин индекса стимуляции (SI) для мышей, обработанных контролем (красные линии) и мышей, обработанных пептидом (синие линии). Для оценки общих эффектов лечения в отношении пролиферации Т-клеток применяли двухфакторный ANOVA, и p-величины представлены на графиках. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001). Средний процент снижения пролиферации Т-клеток, индуцированного путем обработки пептидом, представлен на графике. SI - индекс стимуляции; LN - лимфоузлы.
Фигура 3 -ATX-GD-59- обработка снижает TSHR-индуцированную пролиферацию у DR3tg-мышей
DR3tg-мыши были предварительно обработаны ATX-GD-59 (PPL) или контрольным пептидом HIP-15F-GKK (GLS) (n=10/группу) в соответствии со схемой увеличения доз до максимальной дозы 15 нмоль для каждого пептида. Животных иммунизировали 30 нмоль каждого родительского пептида 5D (Severn) и 9B (PPL) в ПАФ, и через 10 дней брали LN и селезенку для оценки TSHR-специфической пролиферации. Данные представляют собой среднее ± стандартную ошибку среднего (SEM) величин индекса стимуляции (SI) для мышей, обработанных контролем (красные линии) и мышей, обработанных пептидом (синие линии). Для оценки общих эффектов лечения в отношении пролиферации Т-клеток применяли двухфакторный ANOVA, и p-величины представлены на графиках. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001). Средний процент снижения пролиферации Т-клеток, индуцированного путем обработки пептидом, представлен на графике. SI - индекс стимуляции; LN - лимфоузлы. Данные являются репрезентативными для 2 независимых экспериментов.
Фигура 4 -ATX-GD-59-обработка снижает TSHR-специфическую пролиферацию спленоцитов у Ad-TSHR-иммунизованных DR3tg-мышей
DR3tg-мышам (n=11/группу) подкожно инъецировали в бок 22,5 пмоль, 225 пмоль и 2250 пмоль ATX-GD-59 или контроля на дни -15, -13 и -11, а затем вводили 3 инъекции 22,5 нмоль/пептид ATX-GD-59 или контроля на дни -8, -6 и -4 (по схеме увеличения доз). Затем мышам 2 раза внутримышечно инъецировали 1010 Ad-TSHR или Ad-LacZ с интервалами в три недели (день 0 и 21). Эксперимент завершали через 5 недель после первой иммунизации и брали селезенку для оценки TSHR-специфической пролиферации. Данные представляют собой среднее ± стандартную ошибку среднего (SEM) абсолютных импульсов в минуту (имп./мин; левый график) или индекса стимуляции (SI; правый график) для мышей, обработанных контролем (красные линии), и мышей, обработанных пептидом (синие линии). Для оценки общих эффектов лечения в отношении пролиферации Т-клеток применяли двухфакторный ANOVA, и p-величины представлены на графиках. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001). Общий средний процент снижения пролиферации Т-клеток, индуцированного путем обработки пептидом, представлен на графике. Данные являются репрезентативными для 2 независимых экспериментов.
Фигура 5 -Профилактическая ATX-GD-59-обработка снижает уровень анти-TSHR антитела
DR3tg-мышам подкожно инъецировали в бок 22,5 пмоль, 225 пмоль и 2250 пмоль ATX-GD-59 (n=11) или контроля (n=11) на дни -15, -13 и -11, а затем вводили 3 инъекции 22,5 нмоль каждого пептида ATX-GD-59 или контроля на дни -8, -6 и -4 (по схеме увеличения доз). Затем мышам 2 раза внутримышечно инъецировали 1010 Ad-TSHR или Ad-LacZ (n=7) с интервалами в три недели (день 0 и 21). Кровь брали до обработки и через 2 и 5 недель после первой иммунизации для оценки общих уровней анти-TSHR IgG с помощью ELISA. Каждая точка означает данные для одной мыши и среднее для групп ± SEM. Для оценки общих различий уровней анти-TSHR IgG применяли однофакторный ANOVA. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001). Данные являются репрезентативными для 2 независимых экспериментов.
Фигура 6 -Профилактическая ATX-GD-59-обработка снижает уровни анти-TSHR антител различных изотипов
DR3tg-мышам подкожно инъецировали в бок 22,5 пмоль, 225 пмоль и 2250 пмоль ATX-GD-59 (n=11) или контроля (n=11) на дни -15, -13 и -11, а затем вводили 3 инъекции 22,5 нмоль каждого пептида ATX-GD-59 или контроля на дни -8, -6 и -4 (по схеме увеличения доз). Затем мышам 2 раза внутримышечно инъецировали 1010 Ad-TSHR или Ad-LacZ (n=7) с интервалами в три недели (день 0 и 3). Кровь брали до обработки и через 2 и 5 недель после первой иммунизации, и на неделю 2 оценивали уровни анти-TSHR IgG определенного изотипа с помощью ELISA. Каждая точка означает данные для одной мыши и среднее для групп ± SEM. Для оценки общих различий уровней анти-TSHR IgG применяли однофакторный ANOVA. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001). Данные являются репрезентативными для 2 независимых экспериментов.
Фигура 7 -Уровни стимулирующих анти-TSHR антител у Ad-TSHR-иммунизованных DR3tg-мышей
DR3tg-мышам подкожно инъецировали в бок 22,5 пмоль, 225 пмоль и 2250 пмоль ATX-GD-59 (n=11) или контроля (n=11) на дни -15, -13 и -11, а затем вводили 3 инъекции 22,5 нмоль каждого пептида ATX-GD-59 или контроля на дни -8, -6 и -4 (по схеме увеличения доз). Затем мышам 2 раза внутримышечно инъецировали 1010 Ad-TSHR или Ad-LacZ (n=7) с интервалами в три недели (день 0 и 3). Сыворотку брали через 5 недель после первой иммунизации и оценивали в анализе клеток CHO. Каждая точка означает данные для одной мыши на неделю 5, и для каждой группы представлено среднее ± SEM. Для оценки различий уровней стимулмирующих анти-TSHR антител применяли критерий Манна-Уитни, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001). Результаты являются репрезентативными для более, чем 3 независимых экспериментов. RLU - относительные единицы излучения (излучение, испускаемое стимулированными клетками/ излучение, испускаемое нестимулированными клетками).
Фигура 8 - Общая схема проведения исследования по комбинированной терапии препаратами MMI и ATX-GD-459
Мышам подкожно инъецировали в бок 15 пмоль, 150 пмоль и 1500 пмоль каждого пептида ATX-GD-459 или контрольного пептида на дни -15, -13 и -11, а затем вводили 3 инъекции 15 пмоль каждого пептида ATX-GD-459 или контрольного пептида на дни -8, -6 и -4 (по схеме увеличения доз). Начиная со дня -15, мышам также вводили носитель или метимазол с помощью подкожно имплантированного осмотического насоса. Затем мышам 2 раза внутримышечно инъецировали 109 частиц Ad-TSHR с интервалами в три недели (недели 0 и 3). Сыворотку брали через 2 недели и непосредственно до обработки, а затем через 2, 4 и 5 недель после первой иммунизации. Эксперимент завершали через 5 недель после первой иммунизации и брали пробы крови и образцы щитовидной железы и селезенки.
Фигура 9 - Общая схема прведения исследования по комбинированной терапии пропранололом и ATX-GD-459
Мышам подкожно инъецировали в бок 15 пмоль, 150 пмоль и 1500 пмоль каждого пептида ATX-GD-459 или контрольного пептида на дни -15, -13 и -11, а затем вводили 3 инъекции 15 пмоль каждого пептида ATX-GD-459 или контрольного пептида на дни -8, -6 и -4 (по схеме увеличения доз). Начиная со дня -15, мышам также вводили носитель или пропранолол путем ежедневных внутрибрюшинных инъекций. Затем мышам 2 раза внутримышечно инъецировали 1010 частиц Ad-TSHR с интервалами в три недели (недели 0 и 3). Кровь брали через 2 недели и непосредственно до обработки, а затем через 2, 4 и 5 недель после первой иммунизации. Эксперимент завершали через 5 недель после первой иммунизации и брали пробы крови и образцы щитовидной железы и селезенки.
Фигура 10 - Пролиферация TSHR-специфических спленоцитов у Ad-TSHR-иммунизованных DR3tg-мышей
DR3tg-мышам (n=7-10/группу) подкожно инъецировали в бок 15 пмоль, 150 пмоль и 1500 пмоль ATX-GD-459 или контроля на дни -15, -13 и -11, а затем вводили 3 инъекции 15 нмоль ATX-GD-459 или контроля на дни -8, -6 и -4 (по схеме увеличения доз). Начиная со дня -15, мышам также вводили носитель (заштрихованные символы) или MMI (незаштрихованные символы) с помощью подкожно имплантированных осмотических насосов. Затем мышам 2 раза внутримышечно инъецировали 109 Ad-TSHR с интервалами в три недели (дни 0 и 3). Эксперимент завершали через 5 недель после первой иммунизации и брали селезенку для оценки TSHR-специфической пролиферации. Данные представляют собой среднее ± стандартную ошибку среднего (SEM) абсолютных импульсов в минуту (имп./мин; левый график), величин индекса стимуляции (SI; средний график) или скорректированных импульсов ((Δимп./мин; правый график). Для оценки общих эффектов лечения в отношении пролиферации Т-клеток применяли двухфакторный ANOVA и критерий post-hoc с поправкой Бонферрони. Значимые различия указаны в тексте.
Фигура 11 - Обработка ATX-GD-459, но не MMI, снижает уровни анти-TSHR антитела IgG
DR3tg-мышам (n=7-10/группу) подкожно инъецировали в бок 15 пмоль, 150 пмоль и 1500 пмоль каждого пептида ATX-GD-459 или контрольного пептида на дни -15, -13 и -11, а затем вводили 3 инъекции 15 нмоль каждого пептида ATX-GD-459 или контрольного пептида на дни -8, -6 и -4 (по схеме увеличения доз). Начиная со дня -15, мышам также вводили носитель или MMI с помощью подкожно имплантированного осмотического насоса. Затем мышам 2 раза внутримышечно инъецировали Ad-TSHR с интервалами в три недели (недели 0 и 3). Эксперимент завершали через 5 недель после первой иммунизации. Кровь брали до обработки и через 2, 4 и 5 недель после первой иммунизации, а затем оценивали уровни анти- TSHR IgG с помощью ELISA. Каждая точка означает данные для одной мыши, и для каждой группы представлено среднее ± SEM. Для оценки общих различий уровней анти-TSHR IgG применяли однофакторный ANOVA. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия, если они имелись, указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001).
Фигура 12 - Обработка ATX-GD-459, но не MMI, снижает уровни анти-TSHR антител IgG2b и IgG2c
DR3tg-мышам (n=7-10/группу) подкожно инъецировали в бок 15 пмоль, 150 пмоль и 1500 пмоль каждого пептида ATX-GD-459 или контрольного пептида на дни -15, -13 и -11, а затем вводили 3 инъекции 15 нмоль каждого пептида ATX-GD-459 или контрольного пептида на дни -8, -6 и -4 (по схеме увеличения доз). Начиная со дня -15, мышам также вводили носитель или MMI с помощью подкожно имплантированного осмотического насоса. Затем мышам 2 раза внутримышечно инъецировали Ad-TSHR с интервалами в три недели (недели 0 и 3). Эксперимент завершали через 5 недель после первой иммунизации. Кровь брали до обработки и через 2, 4 и 5 недель после первой иммунизации, а затем оценивали уровни анти- TSHR IgG с помощью ELISA. Каждая точка означает данные для одной мыши на неделю 2, и для каждой группы представлено среднее ± SEM. Для оценки общих различий уровней анти-TSHR IgG1, IgG2b и IgG2с применяли однофакторный ANOVA. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия, если они имелись, указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001).
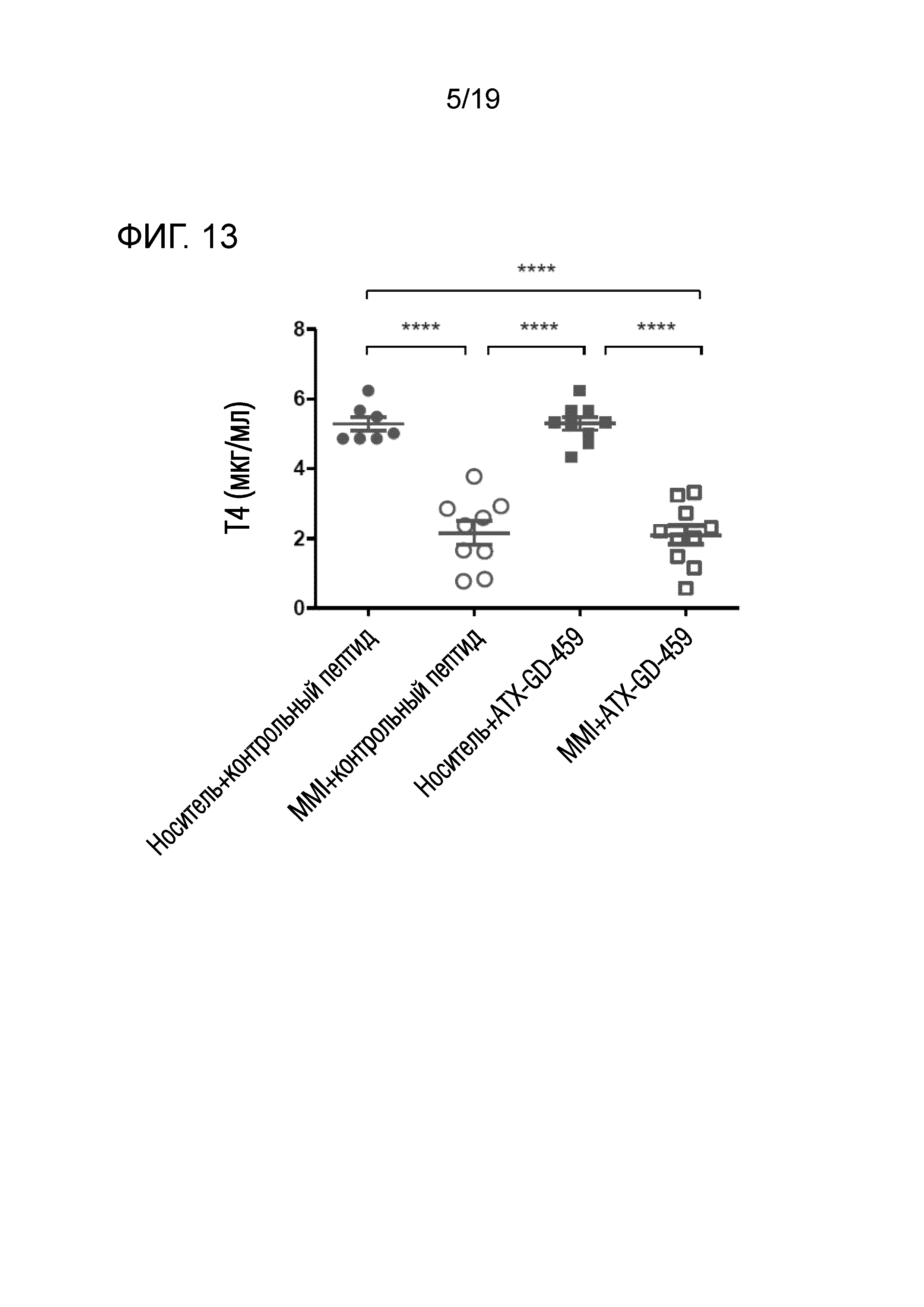
Фигура 13 - MMI-обработка значительно снижает уровни Т4 в сыворотке
DR3tg-мышам (n=7-10/группу) подкожно инъецировали в бок 15 пмоль, 150 пмоль и 1500 пмоль каждого пептида ATX-GD-459 или контрольного пептида на дни -15, -13 и -11, а затем вводили 3 инъекции 15 нмоль каждого пептида ATX-GD-459 или контрольного пептида на дни -8, -6 и -4 (по схеме увеличения доз). Начиная со дня -15, мышам также вводили носитель или MMI с помощью подкожно имплантированного осмотического насоса. Затем мышам 2 раза внутримышечно инъецировали Ad-TSHR с интервалами в три недели (недели 0 и 3). Эксперимент завершали через 5 недель после первой иммунизации. Кровь брали до обработки и через 2, 4 и 5 недель после первой иммунизации, а затем оценивали уровни Т4 с помощью ELISA. Каждая точка означает данные для одной мыши на неделю 2, и для каждой группы представлено среднее ± SEM. Для оценки общих различий уровней Т4 применяли однофакторный ANOVA. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия, если они имелись, указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001).
Фигура 14- Пролиферация TSHR-специфических спленоцитов у Ad-TSHR-иммунизованных DR3tg-мышей
DR3tg-мышам (n=10/группу) подкожно инъецировали в бок 15 пмоль, 150 пмоль и 1500 пмоль ATXGD-459 или контроля на дни -15, -13 и -11, а затем вводили 3 инъекции 15 нмоль/ATX-GD-459 или контроля на дни -8, -6 и -4 (по схеме увеличения доз). Начиная со дня -15, мышам также вводили носитель (заштрихованные символы) или пропранолол (незаштрихованные символы) путем ежедневных внутрибрюшинных инъекций. Затем мышам 2 раза внутримышечно инъецировали 1010 Ad-TSHR с интервалами в три недели (дни 0 и 3). Эксперимент завершали через 5 недель после первой иммунизации и брали селезенку для оценки TSHR-специфической пролиферации. Данные представляют собой среднее ± стандартную ошибку среднего (SEM) абсолютных импульсов в минуту (имп./мин; левый график), величин индекса стимуляции (SI; средний график) или скорректированных импульсов (Δимп./мин; правый график). Для оценки общих эффектов лечения в отношении пролиферации Т-клеток применяли двухфакторный ANOVA и критерий post-hoc с поправкой Бонферрони. Значимые различия указаны в тексте.
Фигура 15 - Обработка ATX-GD-459, но не пропранололом, снижает уровни анти-TSHR антитела IgG
DR3tg-мышам (n=10/группу) подкожно инъецировали в бок 15 пмоль, 150 пмоль и 1500 пмоль ATX-GD-459 или контроля на дни -15, -13 и -11, а затем вводили 3 инъекции 15 нмоль ATX-GD-459 или контроля на дни -8, -6 и -4 (по схеме увеличения доз). Начиная со дня -15, мышам также вводили носитель (заштрихованные символы) или пропранолол (незаштрихованные символы) путем ежедневных внутрибрюшинных инъекций. Затем мышам 2 раза внутримышечно инъецировали 1010 Ad-TSHR с интервалами в три недели (дни 0 и 3). Эксперимент завершали через 5 недель после первой иммунизации. Кровь брали до обработки и через 2, 4 и 5 недель после первой иммунизации, а затем оценивали уровни анти- TSHR IgG с помощью ELISA. Каждая точка означает данные для одной мыши, и для каждой группы представлено среднее ± SEM. Для оценки общих различий уровней анти-TSHR IgG применяли однофакторный ANOVA. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия, если они имелись, указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001).
Фигура 16 - Обработка ATX-GD-459, но не пропранололом, снижает уровни анти-TSHR антител IgG2b и IgG2c
DR3tg-мышам (n=10/группу) подкожно инъецировали в бок 15 пмоль, 150 пмоль и 1500 пмоль ATX-GD-459 или контроля на дни -15, -13 и -11, а затем вводили 3 инъекции 15 нмоль ATX-GD-459 или контроля на дни -8, -6 и -4 (по схеме увеличения доз). Начиная со дня -15, мышам также вводили носитель (заштрихованные символы) или пропранолол (незаштрихованные символы) путем ежедневных внутрибрюшинных инъекций. Затем мышам 2 раза внутримышечно инъецировали 1010 Ad-TSHR с интервалами в три недели (дни 0 и 3). Эксперимент завершали через 5 недель после первой иммунизации. Кровь брали до обработки и через 2, 4 и 5 недель после первой иммунизации, а затем оценивали уровни анти- TSHR IgG с помощью ELISA. Каждая точка означает данные для одной мыши, и для каждой группы представлено среднее ± SEM. Для оценки общих различий уровней анти-TSHR IgG1, IgG2b и IgG2с применяли однофакторный ANOVA. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия, если они имелись, указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001).
Фигура 17 - Введение пропранолола или ATX-GD-459 не влияло на общие уровни T4
DR3tg-мышам (n=10/группу) подкожно инъецировали в бок 15 пмоль, 150 пмоль и 1500 пмоль ATX-GD-459 или контроля на дни -15, -13 и -11, а затем вводили 3 инъекции 15 нмоль ATX-GD-459 или контроля на дни -8, -6 и -4 (по схеме увеличения доз). Начиная со дня -15, мышам также вводили носитель (заштрихованные символы) или пропранолол (незаштрихованные символы) путем ежедневных внутрибрюшинных инъекций. Затем мышам 2 раза внутримышечно инъецировали 1010 Ad-TSHR с интервалами в три недели (дни 0 и 3). Эксперимент завершали через 5 недель после первой иммунизации. Кровь брали до обработки и через 2, 4 и 5 недель после первой иммунизации, а затем оценивали уровни анти- TSHR IgG с помощью ELISA. Каждая точка означает данные для одной мыши на неделю 5, и для каждой группы представлено среднее ± SEM. Для оценки общих различий уровней Т4 применяли однофакторный ANOVA. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия, если они имелись, указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001).
Фигура 18- Уровни пропранолола в плазме подтвердили фармакологическую дозу
Уровень пропранолола в плазме оценивали у контрольных мышей и у мышей, которым вводили пептиды и пропранолол. Плазму анализировали на недели 0 и 5, и результаты регистрировали.
Фигура 19 -Схематический протокол толеризации Т-клеток
Мышам подкожно инъецировали в бок 0,1 мкг, 1 мкг и 10 мкг пептида на дни -15, -13 и -11, а затем вводили 3 инъекции максимальной дозы пептида (одного пептида ATX-GD-459 или коктейля) на дни -8, -6 и -4 (по схеме увеличения доз). Максимальные дозы и соответственно более высокие дозы могут отличаться в различных экспериментах. На день 0, мышей подкожно иммунизировали в основание хвоста пептидом, эмульгированным в полном адъюванте Фрейнда (ПАФ). Эксперимент завершали через 10 дней после иммунизации для оценки пролиферации клеток лимфоузлов (LN) и спленоцитов после повторной стимуляции TSHR или пептидом.
Фигура 20 - ATX-GD-459-обработка эффективно снижает TSHR-индуцированную пролиферацию у HLA-DR3-мышей
(A) HLA-DR4-мышей предварительно обрабатывали RNB-4K-GKK или PBS (n=10/группу) по схеме увеличения доз до максимальной дозы 100 мкг; (B) HLA-DR3-мышей предварительно обрабатывали RNB-5D-K1 или HIP-16E (HLA-DR3-связывающим контрольным пептидом) (n=10/группу) по схеме увеличения доз до максимальной дозы 100 мкг; (C) HLA-DR3-мышей предварительно обрабатывали RNB-9B или PBS (n=10/группу) по схеме увеличения доз до максимальной дозы 33 мкг. Животных иммунизировали родительским пептидом в ПАФ, и через 10 дней брали LN и селезенку для оценки TSHR-специфической пролиферации. Данные представляют собой среднее ± стандартную ошибку среднего (SEM) величин индекса стимуляции (SI) для мышей, обработанных контролем, и мышей, обработанных пептидом. Для оценки общих эффектов лечения в отношении пролиферации Т-клеток применяли двухфакторный ANOVA, и p-величины представлены на графиках. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001). Средний процент снижения пролиферации Т-клеток, индуцированного путем обработки пептидом, представлен на графике. SI - индекс стимуляции; LN - лимфоузлы.
(D) HLA-DR3-мышей предварительно обрабатывали ATX-GD-459 или PBS (n=10/группу) по схеме увеличения доз до максимальной дозы 75 мкг для каждого пептида. Животным иммунизировали 4K/5D/9B, эмульгированным в ПАФ, и через 10 дней брали LN и селезенку для оценки TSHR-специфической пролиферации. Данные представляют собой среднее ± стандартную ошибку среднего (SEM) величин индекса стимуляции (SI) для мышей, обработанных контролем, и мышей, обработанных пептидом. Для оценки общих эффектов лечения в отношении пролиферации Т-клеток применяли двухфакторный ANOVA, и p-величины представлены на графиках. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001). Средний процент снижения пролиферации Т-клеток, индуцированного путем обработки пептидом, представлен на графике. SI - индекс стимуляции; LN - лимфоузлы.
Фигура 21 - Схематическое описание модели аденовирусной болезни Грейвса и ее подтверждение
(A) Мышей внутримышечно иммунизировали аденовирусными векторами, экспрессирующими субъединицу TSHR-A (Ad-TSHR) или β-галактозидазу (Ad-LacZ). 1010 аденовирусных частиц инъецировали два раза с интервалом в 3 недели. Также указаны отклонения от протокола для данного эксперимента. Кровь брали до иммунизации и через 2 и 4 недели после первой иммунизации. Эксперимент завершали через 4 недели послле первой иммунизации и брали кровь, селезенку и щитовидную железу для исследования на наличие симптома, подобного болезни Грейвса. (B) Мышей два раза иммунизировали Ad-TSHR с интервалом в 3 недели (недели 0 и 3). Обработку начинали путем подкожного введения насоса в день первой иммунизации и продолжали в течение 4 недель до окончания эксперимента. Кровь брали до иммунизации и через 2 и 4 недели после первой иммунизации. Мышей подвергали эвтаназии через 4 недели после первой иммунизации и брали пробы крови и образцы селезенки. (C) Мышам подкожно инъецировали в бок 0,1 мкг, 1 мкг и 10 мкг пептида на дни -15, -13 и -11, а затем вводили 3 инъекции 100 мкг пептида на дни -8, -6 и -4 (по схеме увеличения доз). Затем мышам два раза внутримышечно инъецировали Ad-TSHR или Ad-LacZ с интервалом в 3 недели (недели 0 и 3). Кровь брали до иммунизации и через 2 и 5 недель после первой иммунизации. Мышей подвергали эвтаназии через 5 недель после первой иммунизации и брали пробы крови и образцы селезенки.
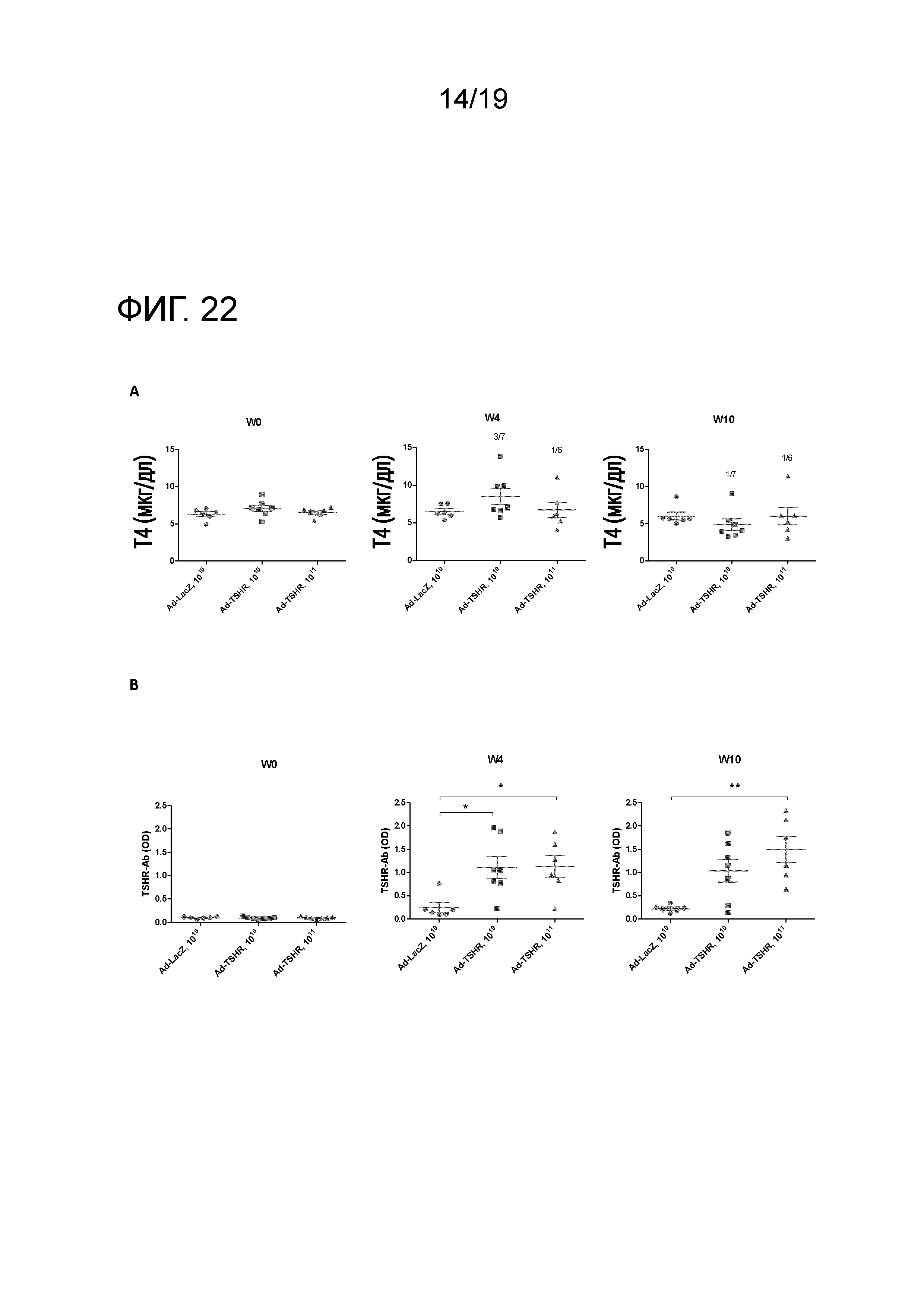
Фигура 22 - Увеличение уровней T4 и анти-TSHR IgG в течение определенного периода времени у мышей BALB/c после Ad-TSHR-иммунизации
Мышей BALB/c (n=6-7/группу) внутримышечно иммунизировали 1010 или 1011 аденовирусных векторов, экспрессирующих субъединицу TSHR-A (Ad-TSHR) или β-галактозидазу (Ad-LacZ). 1010 или 1011 аденовирусных частиц три раза инъецировали с интервалом в 3 недели (недели 0, 3 и 6). Сыворотку брали до иммунизации и через 4 и 10 недель после первой иммунизации. (A) Уровни T4 анализировали с помощью ELISA. Каждая точка означает данные для одной мыши, и для каждой группы представлено среднее ± SEM. Число гипертиреоидных мышей указано на графиках. В соответствии с опубликованными данными, пороговая величина для гипертиреоидизма определена как среднее ± 2 стандартных отклонения от нормальной величины для уровней мышиного Т4 у Ad-LacZ-иммунизованных контрольных мышей. (B) Уровни анти-TSHR IgG анализировали с помощью ELISA. Каждая точка означает данные для одной мыши, и для каждой группы представлено среднее ± SEM. Для оценки общих различий уровней анти-TSHR IgG применяли однофакторный ANOVA. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001).
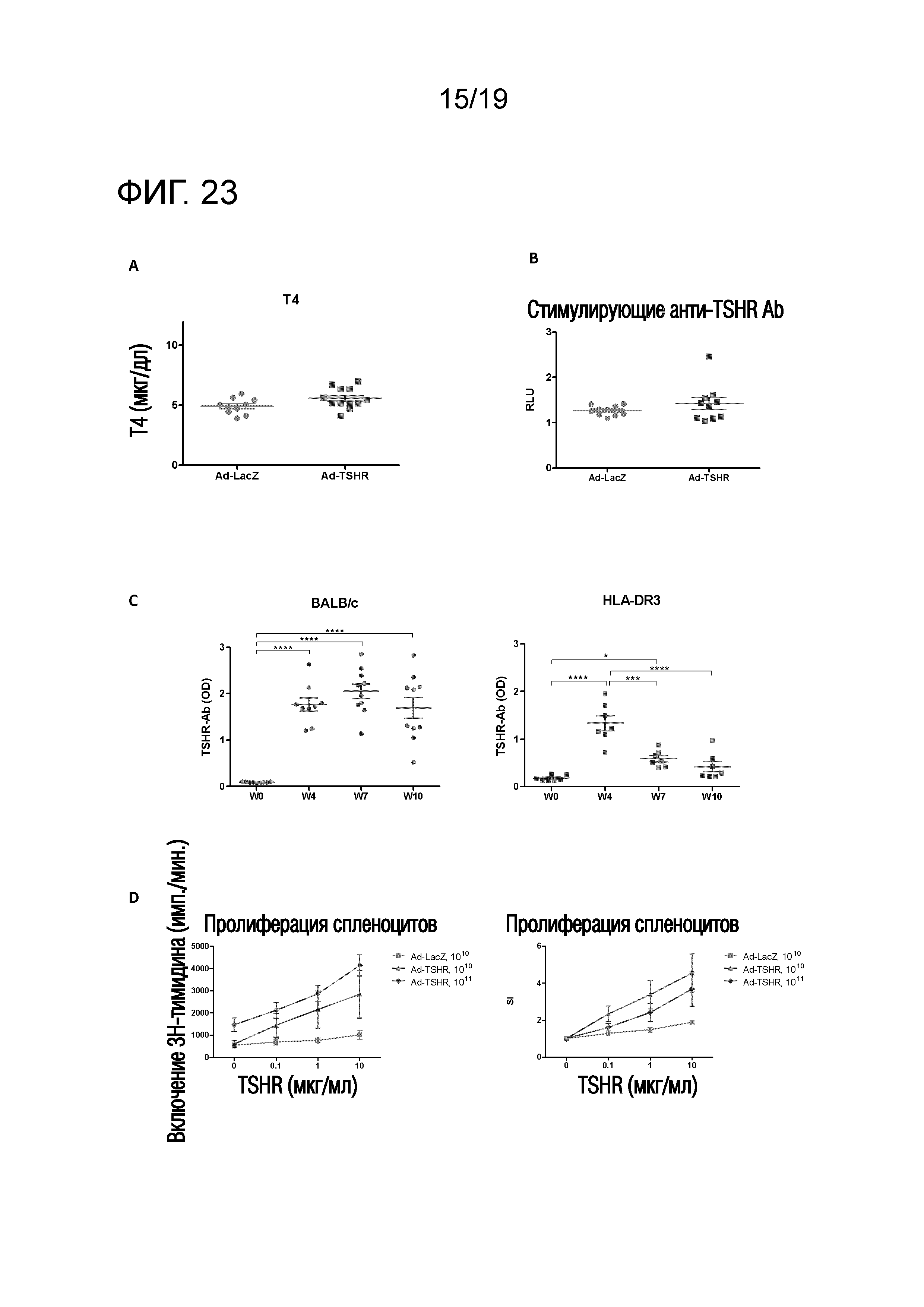
Фигура 23 - Увеличение титров T4, титров стимулирующих анти-TSHR антител и титров анти-TSHR антитела в течение определенного периода времени у DR3tg-мышей после Ad-TSHR-иммунизации
(A) DR3tg-мышей внутримышечно иммунизировали 109 аденовирусных векторов, экспрессирующих субъединицу TSHR-A (Ad-TSHR) (n=10) или β-галактозидазу (Ad-LacZ) (n=12). Аденовирусные частицы 2 раза инъецировали с интервалом в 3 недели (недели 0 и 3). Сыворотку брали до иммунизации и через 2 и 4 недели после первой иммунизации, и уровни Т4 оценивали с помощью ELISA. Каждая точка означает данные для одной мыши на неделю 4 и среднее для групп ± SEM. Для оценки различий уровней Т4 применяли критерий Манна-Уитни, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001). Результаты являются репрезентативными для более, чем 3 независимых экспериментов.
(B) DR3tg-мышей (n=10/группу) внутримышечно иммунизировали 109 аденовирусных векторов, экспрессирующих субъединицу TSHR-A (Ad-TSHR) или β-галактозидазу (Ad-LacZ). Аденовирусные частицы два раза инъецировали с интервалом в 3 недели (недели 0 и 3). Сыворотку брали до иммунизации и через 2 и 4 недели после первой иммунизации, и уровни Т4 оценивали в анализе на репортерный ген люциферазы клеток CHO. Каждая точка означает данные для одной мыши на неделю 4 и среднее для групп ± SEM. Для оценки различий уровней стимулирующих анти-TSHR антител применяли критерий Манна-Уитни, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001). Результаты являются репрезентативными для более, чем 3 независимых экспериментов. RLU - относительные единицы излучения (излучение, испускаемое стимулированными клетками/излучение, испускаемое нестимулированными клетками).
(C) Мышей BALB/c (n=10; левая панель) и DR3tg-мышей (n=7; правая панель) внутримышечно иммунизировали 1010 аденовирусных векторов, экспрессирующих субъединицу TSHR-A (Ad-TSHR). Аденовирусные частицы два раза инъецировали с интервалом в 3 недели (недели 0, 3 и 6). Сыворотку брали до иммунизации и через 4, 7 и 10 недель после первой иммунизации, и уровни анти-TSHR IgG оценивали с помощью ELISA. Каждая точка означает данные для одной мыши и среднее для групп ± SEM. Для оценки общих различий уровней стимулирующих анти-TSHR IgG применяли однофакторный ANOVA, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001).
(D) DR3tg-мышей внутримышечно иммунизировали 1010 или 1011аденовирусных векторов, экспрессирующих субъединицу TSHR-A (Ad-TSHR) или 1010 аденовирусных векторов, экспрессирующих β-галактозидазу (Ad-LacZ). Аденовирусные частицы три раза инъецировали с интервалом в 3 недели (недели 0, 3 и 6). Через 10 недель брали селезенку и оценивали TSHR-индуцированную пролиферацию спленоцитов по включению обработанного тритием тимидина. Результаты представлены как среднее ± SEM на группу. Cpm - число импульсов в минуту; SI - индекс стимуляции.
Фигура 24 - Влияние обработки метимазолом на уровни T4 и анти-TSHR антител у DR3tg-мышей после Ad-TSHR-иммунизации
DR3tg-мышей (n=7-8/группу) иммунизировали Ad-TSHR на неделю 0 и неделю 3. Обработку метимазолом (50 или 500 мкг/мышь/день) или обработку носителем проводили путем встраивания подкожного насоса, начиная со дня первой иммунизации, и продолжали в течение 4 недель до окончания эксперимента. Сыворотку брали до иммунизации и через 2 и 4 недели после первой иммунизации. (A) Уровни T4 анализировали с помощью ELISA. Каждая точка означает данные для одной мыши, и для каждой группы представлено среднее ± SEM. Для оценки общих различий уровней Т4 применяли однофакторный ANOVA. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001). (B) Уровни анти-TSHR IgG анализировали с помощью ELISA. Каждая точка означает данные для одной мыши, и для каждой группы представлено среднее ± SEM. Для оценки общих различий уровней анти-TSHR IgG применяли однофакторный ANOVA. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001).
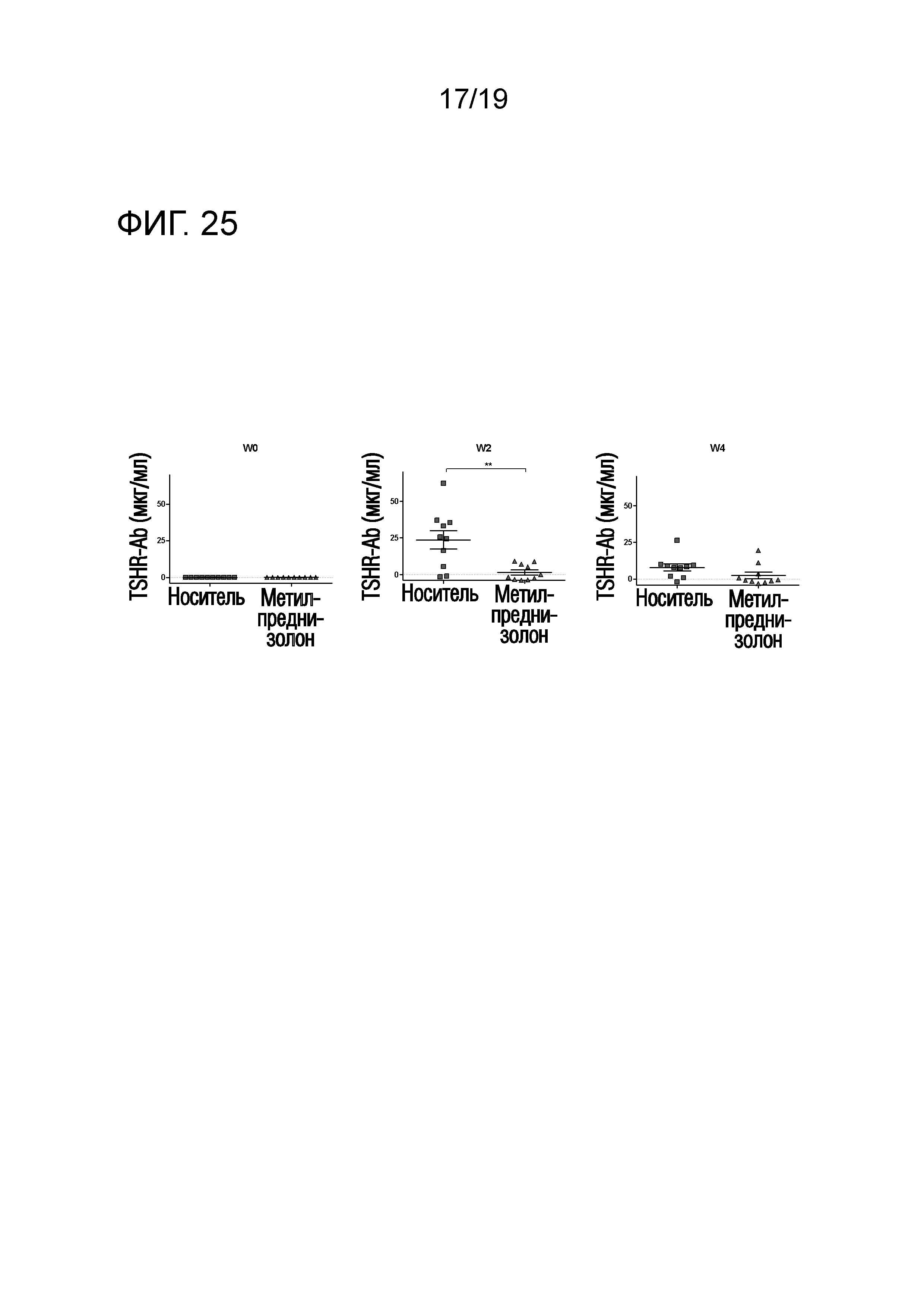
Фигура 25 - Уровни анти-TSHR IgG снижаются после обработки метилпреднизолоном
DR3tg-мышей (n=10/группу) иммунизировали 1010Ad-TSHR на неделю 0 и неделю 3. Обработку метилпреднизолоном (Mpred) (7 мг/кг/день) или обработку носителем проводили путем встраивания подкожного насоса, начиная со дня 3 до первой иммунизации, и продолжали в течение 4 недель до окончания эксперимента. Сыворотку брали до иммунизации и через 2 и 4 недели после первой иммунизации и уровни анти-TSHR IgG оценивали с помощью ELISA. Каждая точка означает данные для одной мыши, и для каждой группы представлено среднее ± SEM. Для оценки различий уровней анти-TSHR IgG применяли критерий Манна-Уитни, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001).
Фигура 26 - ATX-GD-459-обработка снижала уровни анти-TSHR антител
DR3tg-мышам (n=10/группу) подкожно инъецировали в бок 0,1 мкг, 1 мкг и 10 мкг ATX-GD-459 или контроля на дни -15, -13 и -11, а затем вводили 3 инъекции 100 мкг ATX-GD-459 или контроля на дни -8, -6 и -4 (по схеме увеличения доз). Затем мышам 2 раза внутримышечно инъецировали Ad-TSHR или Ad-LacZ с интервалами в три недели (дни 0 и 3). Кровь брали до обработки и через 2 и 5 недель после первой иммунизации для оценки общих уровней анти-TSHR IgG с помощью ELISA. Каждая точка означает данные для одной мыши на неделю 2, и для каждой группы представлено среднее ± SEM. Для оценки общих различий уровней анти-TSHR IgG применяли однофакторный ANOVA. Был применен критерий post-hoc с поправкой Бонферрони, и значимые различия указаны на графиках (*p<0,05; **p<0,01; ***p<0,001: ****p<0,0001)
Фигура 27 - Анализ APIPS показал, что клоны гибридомы отвечают на RNB-5D-K1 и RNB-4K-GKK
5×104 клонов T-клеточной гибридомы, специфичных к RNB-5 (клон 50+35) или RNB-4 (клон 164+455) и TSHR, культивировали в присутствии TSHR и RNB-5D-K1 или RNB-4K-GKK в комбинации с 5×104 человеческих DR3-экспрессирующих антигенпрезентирующих В-клеток (VAVY) (клон 50) или DR4-экспрессирующих антигенпрезентирующих В-клеток (BM14) (клон 35, 164, 455). Антигенпрезентирующие клетки (АПК) были жизнеспособными, или, перед их добавлением в лунки для культивирования, их предварительно фиксировали 0,5% параформальдегидом. После совместного культивирования в течение 48 часов, супернатанты соборали и анализировали с помощью ELISA для оценки уровней секреции IL-2. Результаты представлены для репрезентативных клонов.
Подробное описание изобретения
Настоящее изобретение относится к новому и альтернативному терапевтическому средству для предупреждения или подавления продуцирования аутоантител к TSHR, которое может быть использовано для лечения и/или профилактики болезни Грейвса. Как продемонстрировано в примере 1 настоящего изобретения, комбинация пептидов SEQ ID NN: 1 и 2 обеспечивает толерантность к TSHR у модели с болезнью Грейвса.
Таким образом, в своем первом аспекте, настоящее изобретение относится к композиции, содержащей множество пептидов, происходящих от TSHR, а именно, пептидов согласно изобретению, определенных в настоящей заявке, предпочтительно, пептидов SEQ ID NO:1 и 2.
Рецептор тиреоидстимулирующего гормона
Болезнь Грейвса представляет собой аутоиммунное заболевание, вызываемое аутореактивными T- и B-лимфоцитами, нацеленными на первичный аутоантиген, а именно, рецептор тиреоидстимулирующего гормона (TSHR).
TSHR представляет собой рецептор, сопряженный с G-белком, на тиреоидных фолликулярных клетках в щитовидной железе, которые стимулируют продуцирование тироксина (T4) и трииодотиронина (T3) посредством каскада передачи cAMP-сигнала после его связывания с лигандом, то есть, с тиреоидстимулирующим гормоном (TSH). После интернализации, разложения и презентации TSHR под действием АПК, T-клетки становятся активированными и взаимодействуют с аутореактивными B-клетками, которые, в свою очередь, продуцируют стимулирующие агонистические аутоантитела против TSHR. Тиреоидстимулирующие иммуноглобулины связываются с таким же рецепторным карманом, как и TSH, активируя TSHR-опосредуемую передачу сигнала, что приводит к продуцированию избыточного количества тиреоидного гормона из щитовидной железы и к увеличению щитовидной железы.
TSHR, также известный как рецептор тиротропинa, экспрессируется, в основном, на эпителиальных клетках щитовидной железы.
Холорецептор TSHR имеет 764 остатка и содержит N-концевой внеклеточный домен, с которым связывается TSH; серпентин (или трансмембранный домен) и C-концевой внутриклеточный домен.
TSHR включает крупный внеклеточный домен (418 аминокислот) с выскоконсервативными остатками Cys, которые облегчают образование третичной структуры внеклеточного домена, которая может играть важную роль в связывании с лигандом и в формировании конформации неактивного рецептора. Внеклеточный домен включает более половины длины общего белка и является достаточным для высокоаффинного связывания с лигандом. Молекула рецептора, после ее транспорта на клеточную поверхность, подвергается внутримолекулярному расщеплению, что приводит к удалению последовательности из 50 аминокислот, расположенной между остатками 316 и 366. В результате этого, рецептор содержит две субъединицы, α-субъединицу, включающую внеклеточный лиганд-связывающий домен, и β-субъединицу, включающую трансмембранный домен и короткую С-концевую последовательность, которые, при их связывании друг с другом, образуют дисульфидные связи. В последующих стадиях, α-субъединица удаляется, что приводит к образованию избытка лиганд-связывающего домена, не содержащего β-субъединиц, на клеточной мембране.
После связывания TSH с TSHR в кровотоке, каскад передачи сигнала G-белка активирует аденилил-циклазу, что приводит к повышению уровней межклеточного cAMP. cAMP активирует все функциональные свойства клеток щитовидной железы, включая накачку иодом, синтез тироглобулина, иодирование, эндоцитоз и протеолиз, активность тиреоид-пероксидазы и высвобождение гормонов.
Аминокислотная последовательность зрелого TSHR представлена ниже (SEQ ID No. 3).
1 mrpadllqlv llldlprdlg gmgcssppce chqeedfrvt ckdiqripsl ppstqtlkli
61 ethlrtipsh afsnlpnisr iyvsidvtlq qleshsfynl skvthieirn trnltyidpd
121 alkelpllkf lgifntglkm fpdltkvyst diffileitd npymtsipvn afqglcnetl
181 tlklynngft svqgyafngt kldavylnkn kyltvidkda fggvysgpsl ldvsqtsvta
241 lpskglehlk eliarntwtl kklplslsfl hltradlsyp shccafknqk kirgileslm
301 cnessmqslr qrksvnalns plhqeyeenl gdsivgykek skfqdthnna hyyvffeeqe
361 deiigfgqel knpqeetlqa fdshydytic gdsedmvctp ksdefnpced imgykflriv
421 vwfvsllall gnvfvllill tshyklnvpr flmcnlafad fcmgmyllli asvdlythse
481 yynhaidwqt gpgcntagff tvfaselsvy tltvitlerw yaitfamrld rkirlrhaca
541 imvggwvccf llallplvgi ssyakvsicl pmdtetplal ayivfvltln ivafvivccc
601 yvkiyitvrn pqynpgdkdt kiakrmavli ftdficmapi sfyalsailn kplitvsnsk
661 illvlfypln scanpflyai ftkafqrdvf illskfgick rqaqayrgqr vppknstdiq
721 vqkvthdmrq glhnmedvye lienshltpk kqgqiseeym qtvl
Толерантность
T-клеточные эпитопы играют центральную роль в вырабатывании адаптивного иммунного ответа на любой антиген, независимо от того, является ли он собственным или чужеродным. Центральная роль, которую играют T-клеточные эпитопы в развитии реакций гиперчувствительности (включая аллергию, аутоиммунные заболевания и отторжение трансплантата), была продемонстрирована на экспериментальных моделях. Воспалительные или аллергические реакции могут быть индуцированы путем инъекции синтетических пептидов (полученных на основе структуры Т-клеточных эпитопов) в комбинации с адъювантом.
В противоположность этому, было показано, что иммуногенная толерантность к конкретным антигенам может быть индуцирована путем введения пептидных эпитопов в растворимой форме. Введение растворимого пептида было продемонстрировано как эффективное средство ингибирования заболевания у модели с экспериментальным аутоиммунным энцефаломиелитом (ЭАЭ - модель рассеянного склероза (РС)) (Metzler and Wraith (1993) Int. Immunol. 5:1159-1165; Liu and Wraith (1995) Int. Immunol. 7:1255-1263; Anderton and Wraith (1998) Eur. J. Immunol. 28:1251-1261); и у экспериментальных моделей с артритом, диабетом и увеоретинитом (см. выше Anderton and Wraith (1998)). Это средство было также продемонстрировано как способ лечения заболевания, ассоциированного с ЭАЭ (см. выше Anderton and Wraith (1998)).
Толерантность представляет собой неспособность иммунной системы отвечать на антиген. Толерантность к собственным антигенам является важным признаком иммунной системы; и при ее потере может возникать аутоиммунное заболевание. Адаптивная иммунная система должна поддерживать способность организма отвечать на огромное количество инфекционных агентов, но не должна осуществлять аутоиммуную атаку на собственные антигены, содержащиеся в своих собственных тканях. Это в высокой степени регулируется благодаря чувствительности незрелых Т-лимфоцитов к апоптотической гибели клеток в тимусе (центральная толерантность). Однако, не все собственные антигены могут детектироваться в тимусе, а поэтому происходит гибель не всех аутореактивных тимоцитов. Таким образом, существуют также механизмы, благодаря которым толерантность может приобретаться зрелыми аутореактивными Т-лимфоцитами в периферических тканях (периферическая толерантность). Описание механизмов центральной и периферической толерантности приводится у Anderton et al. (1999) (Immunological Reviews 169:123-137).
В настоящее время известно, что болезнь Грейвса вызывается стимулирующими аутоантителами против TSHR, которые связываются с TSHR и активируют их, что приводит к стимуляции синтеза и секреции тиреоидного гормона и к увеличению щитовидной железы. Композиция согласно изобретению обладает способностью индуцировать толерантность к TSHR, так, чтобы при ее введении индивидууму, она могла восстанавливать толерантность к аутобелку TSHR и снижать патогенный иммунный ответ.
Апитопы
При адаптивном иммунном ответе, Т-лимфоциты обладают способностью распознавать внутренние эпитопы белкового антигена. АПК поглощают белковые антигены и разлагают их на короткие пептидные фрагменты. Пептид может связываться с молекулой главного комплекса гистосовместимости, присутствующей внутри клеток и на клеточной поверхности. При презентации на клеточной поверхности в комбинации с модекулой МНС, пептид может разпознаваться Т-клеткой (посредством T-клеточного рецептора (TCR), и в этом случае, пептидом является Т-клеточный эпитоп.
Таким образом, эпитоп представляет собой пептид, происходящий от антигена, связывающегося с пептид-связывающей бороздкой молекулы МНС и распознаваемого Т-клеткой.
Минимальный эпитоп представляет собой самый короткий фрагмент, происходящий от эпитопа, связывающегося с пептид-связывающей бороздкой молекулы МНС и распознаваемого Т-клеткой. Для данной иммуногенной области обычно получают «гнездовую серию» перекрывающихся пептидов, которые действуют как эпитопы, и все эти эпитопы содержат минимальный эпитоп, но отличаются своими фланкирующими областями.
По тому же самому признаку можно идентифицировать минимальный эпитоп для конкретной комбинации «молекула МНС: Т-клетка» путем оценки ответа на усеченные пептиды. Так, например, если наблюдается ответ на пептид, содержащий остатки 1-15 в перекрывающейся библиотеке, то для идентификации минимального эпитопа могут быть использованы серии, усеченные с обоих концов (то есть, 1-14, 1-13, 1-12 и т.п. и 2-15, 3-15, 4-15 и т.п.).
Авторами настоящего изобретения уже было определено, что существует взаимосвязь между способностью пептида связываться с молекулой МНС и ее презентацией Т-клетке без дополнительного процессинга, и способностью этого пептида индуцировать толерантность in vivo (WO 02/16410). Если пептид является слишком длинным для связывания с пептид-связывающей бороздкой молекулы МНС без дополнительного процессинга (например, усечения), или связывается в несоответствующей конформации, то он не может быть толерогенным in vivo. С другой стороны, если пептид имеет подходящий размер и конформацию для непосредственного связывания с бороздкой, связывающейся с пептидом МНС и презентируется Т-клетке, то такой пептид может быть использован для индуцирования толерантности.
Таким образом, может быть оценена толерогенная способность пептида независимо от его способности связываться с молекулой МНС и презентировать ее Т-клетке без дополнительного процессинга антигена in vitro.
Апитопы TSHR (эпитопы, независимые от процессинга антигена) способны связываться с молекулой MHC и стимулировать ответ TSHR-специфических клеток без какого-либо дополнительного процессинга антигена. Такие апитопы, которые сообщают толерантность к TSHR, могут быть предсказаны методом в соответствии с правилами, описанными в WO 02/16410.
Пептиды, связывающиеся с молекулами МНС класса I, обычно имеют длину 7-13, а чаще всего 8-10 аминокислот. Связывание пептида стабилизируется у двух концов посредством контактов между атомами в главной цепи пептида и в инвариантных сайтах пептид-связывающей бороздки всех молекул МНС класса I. На обоих концах бороздки присутствуют инвариантные сайты, связывающиеся с амино- и карбокси-концом пептида. Изменения длины пептида могут быть осуществлены путем создания петли в пептидном остове, часто в пролиновых или глициновых остатках, обеспечивающих гибкость.
Пептиды, которые связываются с молекулами МНС класса II, обычно имеют длину от 8 до 20 аминокислот, а чаще всего от 10 до 17 аминокислот и более (например, до 40 аминокислот). Эти пептиды имеют удлиненную конформацию по всей бороздке, связывающейся с пептидом MHC II (в отличие от бороздки, связывающейся с пептидом MHC I) и являются «открытыми» с обоих концов. Пептид удерживается в определенном положении, главным образом, за счет контактов атома главной цепи с консервативными остатками, составляющими пептид-связывающую бороздку.
В предпочтительном варианте осуществления изобретения, пептид обладает способностью связываться с молекулой МНС класса II без дополнительного процессинга.
Пептид
Термин «пептид», используемый в общепринятом смысле, означает серию остатков обычно L-аминокислот, соединенных друг с другом пептидными связями, часто расположенными между α-амино- и карбоксильными группами смежных аминокислот. Этот термин включает модифицированные пептиды и синтетические пептидные аналоги.
Пептиды могут быть получены химическими методами (Peptide Chemistry, A practical Textbook. Mikos Bodansky, Springer-Verlag, Berlin). Так, например, пептиды могут быть синтезированы твердофазными методами (Roberge J.Y. et al. (1995) Science 269: 202-204), отщеплены от смолы и очищены с помощью препаративной высокоэффективной жидкостной хроматографии (например, Creighton (1983) Proteins Structures And Molecular Principles, WH Freeman and Co, New York, NY). Автоматический синтез может быть осуществлен, например, на пептидном синтезаторе ABI 431 A (Perkin Elmer) в соответствии с инструкциями производителя.
Альтернативно, пептид может быть получен рекомбинантными методами или путем отщепления от более длинного полипептида. Так, например, пептид может быть получен путем отщепления от белка рецептора тиротропина с последующей модификацией у одного или обоих концов. Состав пептида может быть подтвержден с помощью анализа или секвенирования аминокислот (например, в соответствии с процедурой деградации по Эдману).
В настоящем изобретении используются следующие пептиды:
(i) всей или части аминокислотной последовательности KKKKYVSIDVTLQQLESHKKK (SEQ ID NO: 1) или их части, или последовательности, которая по меньшей мере на 60% идентична последовательности SEQ ID NO:1; и
(ii) всей или части аминокислотной последовательности GLKMFPDLTKVYSTD (SEQ ID NO: 2) или их части, или последовательности, которая по меньшей мере на 60% идентична последовательности SEQ ID NO:2.
Пептид согласно изобретению может включать аминокислотную последовательность или состоять из аминокислотной последовательности, которая по меньшей мере на 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 70%, 81%, 82%, 83%, 84, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична пептиду SEQ ID NN: 1 или 2. В одном из аспектов изобретения, пептид имеет последовательность, которая по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% идентична последовательности SEQ ID NN:1 или 2.
В предпочтительном аспекте изобретения, пептиды содержат SEQ ID NN: 1 и 2. В другом предпочтительном аспекте изобретения, пептиды состоят из SEQ ID NN: 1 и 2.
Идентичность последовательностей может быть оценена любым стандартным методом. Однако, для определения степени идентичности последовательностей существуют подходящие компьютерные программы для сопоставления множества последовательностей, например, Clustal W (Thompson et al., (1994) Nucleic Acids Res., 22: 4673-4680). Для этой цели могут быть применены программы по сравниванию и выравниванию пар последовательностей, такие как ALIGN (Myers ef al., (1988) CABIOS, 4: 1-17), FASTA (Pearson er al., (1988) PNAS, 85:2444-2448; Pearson (1990), Methods Enzymol., 183: 63-98) и BLAST с пробелами (Altschul er al., (1997) Nucleic Acids Res., 25: 3389-3402). Кроме того, в Европейском институте биоинформатики имеется сервер Dali для выравнивания последовательностей белка на основе их структуры (Holm (1993) J. Mol. Biol., 233: 123-38; Holm (1995) Trends Biochem. Sci., 20: 478-480; Holm (1998) Nucleic Acid Res., 26: 316-9).
Выравнивание множества последовательностей и вычисление процента их идентичности может быть осуществлено с использованием стандартных параметров BLAST (с использованием последовательностей, происходящих от всех имеющихся организмов; матрицы Blosum 62, «цены» пробела: наличие 11, удлинение 1).
Альтернативно, могут быть использованы нижеследующая программа и параметры: Программа: Align Plus 4, version 4.10 (Sci Ed Central Clone Manager Professional Suite). Сравнение ДНК: общее сравнение, стандартная линейная оценочная матрица, штраф за несоответствие=2, штраф за пробел=4, штраф за удлинение=1. Сравнение аминокислот: общее сравнение, оценочная матрица BLOSUM 62.
В объем настоящего изобретения входят варианты с указанными или с данными последовательностями при условии, что эти варианты будут сохранять функциональную активность родительской молекулы, то есть, эти варианты являются функционально эквивалентными или, другими словами, имеют или проявляют активность родительского пептида, определенного в настоящей заявке. Такие варианты могут иметь аминокислотные замены, добавления или делеции (включая усечения у одного или обоих концов) родительской последовательности, например, в одну или более аминокислот, например, от 1 до 14 аминокислот.
Также включены функционально эквивалентные производные, в которых одна или более аминокислот являются химически дериватизированными, например, замещены химической группой.
Таким образом, пептиды согласно изобретению могут включать части или фрагменты SEQ ID NN:1-3, при условии, что они будут сохранять требуемую активность. Фрагменты или части SEQ ID NN:1-3 могут, например, иметь длину от 6 до 14 остатков, например, 6, 7, 8, 9, 10, 11, 12 или 13 остатков.
Пептид согласно изобретению может содержать от 8 до 30 аминокислот, например, 8-25 аминокислот, 8-20 аминокислот, 8-15 аминокислот или 8-12 аминокислот. В одном из аспектов изобретения, пептид согласно изобретению может иметь длину 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот.
Пептиды TSHR могут быть получены в форме композиции, а предпочтительно, фармацевтической композиции.
Пептиды TSHR могут представлять собой композицию, полученную в нейтральной или солевой форме. Фармацевтически приемлемыми солями являются кислотно-аддитивные соли (образованные свободными аминогруппами пептида), и такие соли образованы неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или органическими кислотами, такими как уксусная, щавелевая, винная и малеиновая кислоты. Соли, образорванные свободными карбоксильными группами, могут также происходить от неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа, или органических оснований, таких как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин и прокаин.
Комбинация
Авторами настоящего изобретения было неожиданно обнаружено, что пептиды и/или композиция согласно изобретению могут быть введены в комбинации с другими терапевтическими средствами, используемыми для лечения или терапии болезни Грейвса, с сохранением терапевтических эффектов пептидов/композиции согласно изобретению и другого терапевтического средства.
Так, например, в одном из аспектов изобретения, пептиды или композиция согласно изобретению могут быть объединены с другим терапевтическим средством, используемым для лечения или профилактики болезни Грейвса.
Так, например, пептиды или композиция могут быть объединены с антитиреоидным агентом или с β-блокатором.
Как показано в примере 2, введение пептида SEQ ID NO:1 и SEQ ID NO:2 в комбинации с антитиреоидным агентом не влияет на снижение уровня продуцирования анти-TSHR антитела под действием пептидов TSHR и не снижает антитиреоидное действие (определяемое по продуцированию T4), то есть, оба этих терапевтических эффекта сохраняются. Аналогичные результаты также были достигнуты для комбинации композиции согласно изобретению вместе с β-блокатором. Так, например, авторами настоящего изобретения было продемонстрировано, что пептиды согласно изобретению могут быть применены в комбинации с имеющимися средствами для лечения и терапии болезни Грейвса.
Преимущество комбинации согласно изобретению состоит в том, что она облегчает снижение аутоиммуного ответа при болезни Грейвса, то есть, механизма, лежащего в основе этой болезни, а поэтому такая комбинация может быть использована одновременно для лечения или ослабления симптомов болезни Грейвса.
«Антитиреоидный агент» представляет собой антагонист гормона, действующий после тиреоидных гормонов. Антитиреоидные агенты применяются для лечения болезни Грейвса. Антитиреоидные агенты вводят пациентам с болезнью Грейвса для ингибирования синтеза тиреоидных гормонов и, тем самым, для непосредственного снижения уровней тироксина (Т4).
В одном варианте осуществления изобретения, антитиреоидный агент выбран из карбимазола, метимазола (MMI), пропилтиоурацила (PTU) и перхлората калия. В предпочтительном варианте осуществления изобретения, антитиреоидным агентом является метимазол (MMI).
β-блокаторы вводят пациентам с болезнью Грейвса для подавления β-адренергических реакций при гипертиреоидизме (не прибегая к лечению заболевания иммунологическими соединениями).
β-блокаторы принадлежат к классу лекарственных средств, используемых для устранения сердечной аритмии. Бета-блокаторы блокируют действие эндогенных катехоламинов, таких как эпинефрин (адреналин) и норэпинефрин (норадреналин) - а в частности, действие адренергических бета-рецепторов симпатической нервной системы.
β-блокаторами согласно изобретению являются: пропранолол, буциндолол, картеолол, карведиол, лабеталол, надолол, окспренолол, пенбутолол, пиндолол, соталол и тимолол.
В предпочтительном варианте осуществления изобретения, β-блокатором является пропранолол.
Могут быть использованы фармацевтически приемлемые соли β-блокаторов. В предпочтительном варианте осуществления изобретения, β-блокатором является гидрохлорид пропранолола.
Подходящие дозы антитиреоидного агента и β-блокатора могут быть определены специалистом. Так, например, антитиреоидный агент может быть введен в дозе от 10 до 1000 мкг, например, от 20 до 900, от 30 до 800, от 40 до 700, от 50 до 600, от 60 до 500, от 70 до 400, от 80 до 300 или от 90 до 200 мкг. В предпочтительном варианте осуществления изобретения, вводимая доза составляет от 300 до 700 мкг, например, приблизительно 500 мкг, а предпочтительно, 500 мкг.
В предпочтительном варианте осуществления изобретения, антитиреоидный агент вводят ежедневно, например, через каждые 20-28 часов, а предпочтительно, через каждые 24 часа.
Антитиреоидный агент может быть введен любым подходящим способом, известным специалистам. В предпочтительном варианте осуществления изобретения, антитиреоидный агент вводят подкожно.
β-блокатор может быть введен в дозе, например, 1-100 мг/кг, например, 5-90, 10-80, 15-75, 20-70, 25-60, 30-55, 35-50 и 40-45 мг/кг. В предпочтительном варианте осуществления изобретения, β-блокатор вводят в дозе 5-20 мг/кг, предпочтительно, приблизительно 10 мг/кг, а более предпочтительно, 10 мг/кг.
В предпочтительном варианте осуществления изобретения, β-блокатор вводят ежедневно, например, через каждые 20-28 часов, а предпочтительно, через каждые 24 часа.
β-блокатор может быть введен любым подходящим способом, известным специалистам. В предпочтительном варианте осуществления изобретения, β-блокатор вводят внутрибрюшинно.
В одном из вариантов осуществления изобретения, пептиды или композицию согласно изобретению вводят одновременно с антитиреоидным агентом и/или β-блокатором. В альтернативном варианте осуществления изобретения, пептиды или композицию согласно изобретению и антитиреоидный агент и/или β-блокатор вводят в различные периоды времени.
В одном из аспектов изобретения, индивидууму, которому вводят пептиды/композицию (или индивидууму, которому они должны быть введены), уже был введен антитиреоидный агент и/или β-блокатор. Так, например, настоящее изобретение охватывает применение согласно изобретению, где таким индивидуумом является индивидуум, которому вводят или которому ранее вводили антитиреоидный агент и/или β-блокатор.
В другом аспекте изобретения, таким индивидуумом является индивидуум, которому не вводят или которому ранее не вводили каких-либо терапевтических средств для лечения болезни Грейвса.
В одном из обсуждаемых здесь аспектов изобретения, первая стадия включает идентификацию индивидуума, страдающего болезнью Грейвса или имеющего риск развития болезни Грейвса.
Пептиды или композиция согласно изобретению могут быть использованы в профилактических или терапевтических целях.
Пептиды или композиция, при их введении в профилактических целях, могут снижать или предупреждать вырабатывание иммунного ответа на TSHR. Уровень иммунного ответа является более низким, чем ответ в случае, если пациенту не вводили композицию. Термин «снижение» означает частичное снижение иммунного ответа, например, на 50%, 70%, 80% или 90%, чем ответ, который наблюдался бы в случае, если пациенту не вводили композицию (или чем ответ, который наблюдался бы в случае, если пациент, который не проходил лечение в данный период времени). Термин «предупреждение» означает отсутствие какого-либо явного иммунного ответа на TSHR.
Пептиды или композиция, при их введении в профилактических целях, могут подавлять уже имеющийся иммунный ответ на TSHR. Термин «подавление» означает снижение уровня имеющегося иммунного ответа по сравнению с уровнем до лечения пептидом или уровнями, которые наблюдались в тот же самый период времени у пациента, не проходившего лечение.
Лечение пептидами или композицией согласно изобретению может приводить к снижению уровня любых или всех нижеследующих компонентов:
i) аутоантител против TSHR
ii) TSHR-специфичных CD4+-Т-клеток
iii) B-клеток, секретирующих аутоантитела против TSHR.
Детектирование всех этих факторов может быть осуществлено известными методами, такими как ELISA, проточная цитометрия и т.п.
Лечение пептидами или композицией согласно изобретению может также или альтернативно вызывать анергию TSHR-специфичных CD4+-Т-клеток. Анергия может быть детектирована, например, путем последующей стимуляции TSHR in vitro.
Состав
Пептиды или композиция могут быть получены в виде инъецируемого жидкого раствора или суспензии, при этом, может быть также получена твердая форма, которая, перед инъекцией, может быть растворена или суспендирована в жидкости. Препарат может быть также эмульгирован, либо пептиды могут быть инкапсулированы в липосомах. Активные ингредиенты могут быть смешаны с эксципиентами, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом. Подходящими эксципиентами являются, например, вода, физиологический раствор (например, забуференный фосфатом физиологический раствор), декстроза, глицерин, этанол или т.п. и их комбинации.
Кроме того, при необходимости, композиция может содержать небольшие количества вспомогательных веществ, таких как смачивающие или эмульгирующие агенты и/или рН-забуферивающие агенты. Забуферивающими солями являются фосфат, цитрат, ацетат. Для корректировки рН могут быть использованы соляная кислота и/или гидроксид натрия. Для стабилизации могут быть использованы дисахариды, такие как сахароза или трегалоза.
В композиции отношение пептидов (RNB-5D-K1 и RNB-9B) может составлять приблизительно 1:1. Альтернативно, относительное содержание каждого пептида может быть изменено, например, для нацеливания толерогенного ответа на конкретную субсерию аутореактивных Т-клеток, или, если было обнаружено, что один пептид функционирует лучше, чем другие пептиды при конкретных типах HLA.
Пептиды или композиция, после их получения, могут быть введены в стерильный контейнер, который затем герметично закрывают и хранят при низкой температуре, например, при 4°C, либо они могут быть лиофилизованы.
Обычно пептиды или композицию получают в виде лиофилизованного (осушенного вымораживанием) порошка. Лиофилизация позволяет осуществлять длительное хранение в стабилизированной форме. Процедуры лиофилизации хорошо известны специалистам, см., например, http://www.devicelink.com/ivdt/archive/97/01/006.html. Перед лиофилизацией обычно вводят агенты, придающие объем, такие как маннит, декстран или глицин, или сахара, такие как трегалоза.
Пептиды или композиция могут быть введены стандартным способом, например, перорально, внутривенно (если они являются водорастворимыми), внутримышечно, подкожно, подъязычно, интраназально, интрадермально или в виде суппозиториев или имплантатов (например, с использованием молекул пролонгированного высвобождения).
Пептиды или композиция могут быть преимущественно введены интраназально, подкожно или внутрикожно.
Способ, пептиды и композиция согласно изобретению могут быть использованы для лечения человека. Обычно врач определяет фактическую дозу, которая является наиболее подходящией для конкретного индивидуума, и такая доза может варьироваться в зависимости от возраста, массы и ответа конкретного пациента.
Пептиды и композиция согласно изобретению могут быть использованы для лечения человека. Индивидуум может страдать болезнью Грейвса. Этот индивидуум может иметь аутоантитела против TSHR.
Индивидуум может иметь HLA-гаплотип, который ассоциирован с предрасположенностью к продуцированию ингибирующих аутоантител против THSR. У этого индивидуума могут экспрессироваться HLA-DR3 или HLA-DR4. Методы определения HLA-гаплотипа у индивидуума известны специалистам.
В предпочтительном варианте осуществления изобретения может быть осуществлен протокол «увеличения доз», где множество доз вводят пациенту с увеличением их концентраций. Такой способ был применен, например, для введения пептидов фосфолипазы A2 в иммунотерапевтических целях при лечении аллергии на пчелиный яд (Müller et al (1998) J. Allergy Clin Immunol. 101:747-754 and Akdis et al (1998) J. Clin. Invest. 102:98-106).
Набор
Обычно, два пептида TSHR могут быть введены вместе в форме смешанной композиции или коктейля. Однако, в некоторых случаях, предпочтительно, пептиды получают по отдельности в форме набора для одновременного, раздельного, последовательного или комбинированного введения.
Так, например, набор может включать два пептида, содержащиеся в отдельных контейнерах. Содержимое этих контейнеров может быть объединено, а может и не быть объединено до введения.
Набор может также включать средство для смешивания и/или введения (например, паровой ингалятор для интраназального введения; или шприц и иглу для подкожного/интрадермального введения дозы). Набор может также включать инструкции по его применению.
Фармацевтическая композиция или набор согласно изобретению могут быть использованы для лечения и/или профилактики заболевания.
В частности, композиция/набор могут быть использованы для подавления или предупреждения продуцирования аутоантител против TSHR in vivo. Композиция/набор могут быть использованы для лечения и/или профилактики болезни Грейвса у индивидуума.
Животная модель
Существующие в настоящее время животные модели болезни Грейвса имеют ряд недостатков. Так, например, у используемых в настоящее время животных моделей не развиваются симптомы или признаки, присущие болезни Грейвса. Кроме того, подходящие животные модели, например, модели заболевания на базе мышей BALB/c не были протестированы на восприимчивость к апробированной терапии болезни Грейвса.
Поэтому современные модели болезни Грейвса у животных не являются оптимальными для исследования потенциальных методов терапии.
Авторами настоящего изобретения было неожиданно обнаружено, что животное, которое является трансгенным по человеческому HLA-DR3, представляет собой подходящую основу для исследования потенциальных методов терапии. Таким образом, в другом своем аспекте, настоящее изобретение относится к животной модели заболевания, ассоциированного с продуцированием антител к TSHR, где указанное животное является трансгенным по человеческому HLA-DR3 и имеет повышенные уровни HLA-DR3 по сравнению с контрольным животным.
Термин «повышенные уровни TSHR» включает повышенный уровень любой полноразмерной последовательности TSHR, например, пептидов TSHR.
Уровень TSHR был увеличен по сравнению с уровнем у соответствующего контрольного животного (например, животного, которое является трансгенным по человеческому HLA-DR3, но у которого не наблюдались повышенные уровни TSHR). Уровень TSHR может быть увеличен любым подходящим способом, например, путем введения вектора, включающего нуклеиновую кислоту, кодирующую пептид TSHR. В предпочтительном варианте осуществления изобретения, указанным вектором является вирусный вектор.
В другом своем варианте, настоящее изобретение относится к способу получения животной модели заболевания, ассоциированного с продуцированием антител к TSHR, где указанный способ включает повышение уровня TSHR у животного, которое является трансгенным по человеческому HLA-DR3.
В предпочтительном варианте осуществления изобретения, указанный способ включает повышение уровня TSHR путем введения вектора, включающего нуклеиновую кислоту, кодирующую пептид TSHR. В более предпочтительном варианте осуществления изобретения, вектором является вирусный вектор.
Животная модель имеет признаки, присущие заболеванию, ассоциированному с продуцированием антител к TSHR. Так, например, у этой животной модели, уровни антител к TSHR были повышены по сравнению с эквивалентными контрольными животными, у которых уровни TSHR не были повышены. Уровни антител к TSHR могут быть увеличены по меньшей мере в 2, 3, 5, 10, 100 или 1000 раз по сравнению с уровнем у эквивалентного контрольного животного, у которого уровни антител к TSHR не были увеличены.
Уровни антител к TSHR могут быть определены стандартными методами, известными специалистам, например, с помощью анализа ELISA. Уровень антител к TSHR может быть определен в образце in vitro. Так, например, образцом может быть проба сыворотки.
Термин «трансгенный по человеческому HLA-DR3» означает, что на поверхности клеток животного экспрессируется молекула HLA-DR3 человеческого МНС класса II. Такое трансгенное животное может быть получено подходящими методами, хорошо известными специалистам.
Термин «ассоциированный с продуцированием антител к TSHR» означает, что анти-TSHR антитела участвуют в развитии заболевания. Так, например, в случае заболевания, уровни антител к TSHR могут быть повышенными по сравнению с уровнями, наблюдаемыми в отсутствии заболевания. Заболеванием, ассоциированным с антителами к TSHR, может быть болезнь Грейвса.
TSHR может представлять собой человеческий TSHR. Так, например, TSHR может представлять собой субъединицу А человеческого TSHR или ее часть.
Нуклеиновая кислота, кодирующая TSHR, может быть получена методами, хорошо известными специалистам, например, на основе описанной здесь последовательности TSHR.
Нуклеиновая кислота может быть природной, синтетической или рекомбинантной. Она может быть двухцепочечной или одноцепочечной, и может представлять собой ДНК или РНК или их комбинацию. Нуклеиновая кислота может представлять собой, например, кДНК, ПЦР-продукт, геномную последовательность или мРНК.
Нуклеотидная последовательность может быть оптимизирована по кодону для ее продуцирования в выбранном хозяине/клетке-хохяине.
Доставка нуклеотидной последовательности, кодирующей TSHR, может быть осуществлена посредством вирусной инфекции. Подходящие вирусные векторы хорошо известны специалистам. Так, например, вирусным вектором может быть аденовирус, ретровирус или лентивирус.
В частности, вирусным вектором может быть аденовирус.
Получение животного-модели может включать несколько введений вектора.
Вектор, например, аденовирус может быть введен с интервалами в 3 недели. Так, например, вектор может быть введен с интервалом в 18-25, 18-23, 19-23 или 20-22 дня. Вектор может быть введен с интервалом в 20, 21 или 22 дня.
Получение животнй модели может включать введение аденовирусного вектора по меньшей мере два раза. Так, например, аденовирусный вектор может быть введен два или три раза. В частности, получение животной модели может включать введение аденовирусного вектора два раза.
Получение животной модели может включать введение вектора два раза с интервалами в три недели между введениями.
Вектор, например, аденовирус, может быть введен в дозе 108-1011 вирусных частиц на одно введение. В частности, аденовирус может быть введен в дозе 109-1011 вирусных частиц на одно введение. Аденовирус может быть введен в дозе 109 вирусных частиц на одно введение.
Вектор может быть введен любым подходящим способом. Так, например, в случае аденовирусного вектора, этот вектор может быть введен путем внутримышечной инъекции.
Животным может быть млекопитающее. Так, например, животным может быть мышь, крыса, кролик, морская свинка или примат. Предпочтительным животным является мышь.
В одном из вариантов осуществления изобретения, мышь представляет собой HLA-DRA1*01:01- и HLA-DRB1*03:01- трансгенную мышь, полученную на смешанном генетическом фоне. Способ получения такой мыши известен специалистам.
Так, например, мышиная модель, описанная в разделе «Примеры», была получена следующим образом: 6-т.п.о. NdeI-фрагмент HLA-DRA геномного клона в pUC и 24-т.п.о. ClaIxSalI-фрагмент cos 4.1, содержащий ген B, совместно инъецировали в оплодотворенные яйца доноров F1 (C57BL/6xDBA/2), скрещенных с самцами C57BL/6. Затем потомство скрещивали и получали IA-бета-нокаут-мышей C57BL/6 с генетическим фоном (мыши AB0), у которых не экспрессировалась мышиная молекула MHC класса II. У этих DR3tg-мышей экспрессировалась молекула HLA-DR3, но не экспрессировалась мышиная молекула MHC-II. Этот метод не является единственным и существуют известные альтернативные методы получения HLA-DR3-трансгенных мышей, например, мышей с фоном C57BL/10.
Настоящее изобретение более подробно описано в примерах, которые приводятся для лучшего понимания изобретения и не рассматриваются как ограничение объема изобретения.
Примеры
Пример 1 - ATX-GD-59 индуцирует толерантность TSHR-специфических T-клеток и снижает титры анти-TSHR антитела у животных-моделей, то есть, у HLA-DR3-трансгенных мышей
Материалы, методы и процедуры
Мыши
DR3tg-мыши были скрещены в специфических непатогенных условиях в других лабораториях, Charles River, UK или InnoSer, NL. Впервые DR3tg-мыши были созданы Strauβ et al. Вкратце, используемые геномные конструкции представляли собой 6 т.п.о.-Nde I-фрагмент геномного клона HLA-DRA в pUC 13 и 24 т.п.о.-CLa I × Sal I-фрагмент cos 4.1, то есть, космиды (pTCF), содержащей ген B DRB1*0301. Раствор, содержащий 1-2 мкг/мл каждой конструкции, использовали для совместной инъекции в оплодотворенные яйца доноров F1 (C57BL/6xDBA/2), скрещенных с самцами C57BL/6. Затем потомство скрещивали и получали IA-бета-нокаут-мышей C57BL/6 с генетическим фоном (мыши AB0), у которых не экспрессировалась мышиная молекула MHC класса II. У этих DR3tg-мышей экспрессировалась молекула человеческого HLA-DR3 MHC класса II, но не экспрессировалась молекула мышиного MHC класса II. Трансгенные мыши были идентифицированы с помощью Саузерн-блот-анализа «хвоста» ДНК, гидролизованной EcoRI и зондированной 1,35 т.п.о.-Bam HI-фрагментом кДНК DRA и 1,25 т.п.о.-Bam HI-фрагментом кДНК DRB1*0301. В этих экспериментах были использованы DR3tg-мыши, поскольку было высказано предположение, что эта молекула MHC класса II ассоциируется с повышенной восприимчивостью к болезни Грейвса.
Исследования на животных были одобрены «Комитетом по этике проведения экспериментов на животных» в Университете Хасселта и осуществлялись в соответствии со стандартными методами лечения в лаборатории, не содержащей патогенов.
Антигены
Пептиды синтезировали в лаборатории PolyPeptide Laboratories (PPL; Strasbourg, France) и хранили в виде маточного раствора в концентрации 8 мг/мл в PBS при -20°C. Способ получения пептидов основан на твердофазном синтезе пептидов, проводимом путем добавления N-α-Fmoc-защищенных аминокислот в виде структурных элементов, используемых для сборки пептида. C-концевой остаток присоединяли к смоле MBHA как часть Fmoc-lys(Boc)-MPPA-линкера. Другие аминокислоты вводили путем последовательного удаления защитной группы Fmoc и проведения циклов присоединения аминокислот. Если были использованы пептиды PPL, то это указано в надписях на чертеже.
Альтернативно, пептиды синтезировали в лаборатории GL Biochemistry Ltd (GLS; Shanghai, China) или в лаборатории Severn Biotech Ltd (Severn, Kidderminster Worcs., UK) и хранили в виде маточного раствора в концентрации 20 мг/мл в ДМСО (Sigma-Aldrich) при -80°C. Пептиды синтезировали химическим методом присоединения F-moc у N-концевого свободного амина и C-концевого амида. Для каждого эксперимента указаны поставщики различных пептидов.
Пептиды для обработки были использованы в виде одного пептида (9B-N, 5D-K1) или в виде пептидного коктейля ATX-GD-59. ATX-GD-59 представляет собой эквимолярную смесь 9B-N и 5D-K1, а указанные дозы ATX-GD-59 означают содержание отдельного пептида, то есть, общее количество вводимых пептидов в два раза превышает дозу, используемую для обработки.
Рекомбинантный внеклеточный домен человеческого TSHR (TSHR-ECD, AA19-417) был продуцирован в экспрессионной системе личинок Trichoplusia ni с применением технологии Chesapeake PERL technology PERLXpress в Chesapeake PERL (Savage, USA). Качество белка в каждой партии TSHR-ECD оценивали с помощью электрофореза в ДСН-ПААГ и вестерн-блот-анализа.
Аденовирусные векторы закупали у Viraquest (North Liberty, IA, USA). Конструирование и очистка аденовируса, содержащего аминокислотные остатки TSHR 1-289 (Ad-TSHR), были описаны ранее. Вкратце, аденовирусную конструкцию Ad-TSHR и контрольную конструкцию (Ad-LacZ), экспрессирующую β-галактозидазу, размножали в клетках HEK293 и очищали путем центрифугирования в градиенте плотности CsCL. Концентрацию вирусных частц определяли путем измерения оптической плотности на 260 нм.
Эксперимент по толеризации ex vivo
DR3tg-мышам подкожно инъецировали в бок 0,1 мкг, 1 мкг и 10 мкг пептидов на дни -15, -13 и -11, соответственно, а затем вводили 3 инъекции 100 мкг (максимальной дозы/пептид) растворимого пептида (5D-K1 или 9B-N) на дни -8, -6 и -4 (по схеме увеличения доз). ATX-GD-59 представляет собой эквимолярную смесь пептидов 5D-K1 (SEQ ID NO:1) и 9B-N (SEQ ID NO:2) и упомянутая максимальная доза (нмоль) указана для пептидов в коктейле. Поскольку в различных экспериментах используются обе системы, то доза пептида 100 мкг соответствует ~45 нмоль. Пептиды были введены подкожно в PBS. Изменения максимальных доз/пептид и, соответственно, более высокие дозы указаны для каждого эксперимента. На день 0, мышей подкожно иммунизовали в основание хвоста в дозе 50 мкг, соответствующей дозе родительского пептида (немодифицированного 5D и/или 9B), эмульгированного в полном адъюванте Фрейнда (ПАФ; 2 мг/мл Mycobacterium tuberculosis H37RA (Difco Laboratories, Michigan, US) и в неполном адъюванте Фрейнда (Difco)) (50 мкг пептида в 100 мкл ПАФ (100 мкг H37RA)/инъекцию). Через десять дней после иммунизации извлекали LN и селезенку. Клетки LN и спленоциты выделяли и культивировали в среде X-vivo 15, в которую было добавлено 2 мM L-глутамина, 50 ед./мл пенициллина и 50 ед./мл стрептомицина (все от Lonza, Verviers, Belgium) в 96-луночных плоскодонных планшетах. Для исследования индуцированной антигеном пролиферации клеток, 0,5×106 клеток на лунку культивировали (200 мкл/лунку) в течение 72 часов с TSHR-ECD в концентрации 0-25 мкг/мл или с 12,5 мкг/мл очищенного производного белка (PPD; контроля для иммунизации; Statens serum institut, Copenhagen, Denmark). После 72-часового инкубирования при 37°C в инкубаторе с 5% CO2 собирали 60 мкл клеточного супернатанта и замораживали. Затем к клеткам добавляли 20 мкл/лунку обработанного тритием тимидина (PerkinElmer, Zaventem, Belgium) до конечной концентрации 1 мкКи/лунку. Клетки инкубировали при 37°C и 5% CO2, и через 16 часов планшеты замораживали. Оттаянные планшеты собирали и считывали на β-счетчике (на жидкостном сцинтилляционном счетчике Wallac 1450 Microbeta Trilux) для оценки пролиферации клеток.
Животное с аденовирусной моделью БГ
DR3tg-мышам подкожно инъецировали в бок 22,5 пмоль, 225 пмоль и 2250 пмоль ATX-GD-590 или контроль на дни -15, -13 и -11, соответственно, а затем вводили 3 инъекции 22,5 пмоль ATX-GD-59 (максимальной дозы/пептид) или контроля на дни -8, -6 и -4 (по схеме увеличения доз). Изменение максимальных доз, и соответственно, более высокие дозы показаны для каждого эксперимента.
На день 0, мышам внутримышечно инъецировали в бедро Ad-TSHR или Ad-LacZ (1010 вирусных частиц). Все мыши были одновременно иммунизированы одной и той же партией аденовируса на эксперимент. Мышам вводили две инъекции с интервалами в три недели (недели 0 и 3), и брали кровь в различные периоды времени в соответствии с протоколом, представленным на фигуре 2. Через 5 недель после первой иммунимзации, мышей подвергали эвтаназии и брали кровь, клетки селезенки и щитовидную железу. Спленоциты выделяли и культивировали в среде X-vivo 15, в которую было добавлено 2 мM L-глутамина, 50 ед./мл пенициллина и 50 ед./мл стрептомицина (все от Lonza, Verviers, Belgium) в 96-луночных плоскодонных планшетах. Для исследования индуцированной антигеном пролиферации клеток, 0,5×106 клеток на лунку культивировали (200 мкл/лунку) в течение 72 часов с различными концентрациями TSHR-ECD (0-25 мкг/мл). После 72-часового инкубирования при 37°C в инкубаторе с 5% CO2 собирали 60 мкл клеточного супернатанта и замораживали. Затем к клеткам добавляли 20 мкл/лунку обработанного тритием тимидина (PerkinElmer, Zaventem, Belgium) до конечной концентрации 1 мкКи/лунку. Клетки инкубировали при 37°C, и через 16 часов планшеты замораживали. Оттаянные планшеты собирали и считывали на β-счетчике (на жидкостном сцинтилляционном счетчике Wallac 1450 Microbeta Trilux) для оценки пролиферации клеток.
Детектирование анти-TSHR антител
Анти-TSHR антитела (класса IgG) против очищенного рекомбинантного TSHR-ECD (Chesapeake-Perl) оценивали с помощью ELISA. 96-луночные планшеты (половина площади 96-луночного планшета, Fisher Scientific) сенсибилизировали в течение ночи при комнатной температуре (КT) 50 микролитрами/лунку белка TSHR-ECD в PBS (0,5 мкг/мл). После промывки PBS-0,05% твином 20, лунки блокировали 1% BSA (масс/об) в PBS в течение 1 часа при КТ и инкубировали с тестируемой сывороткой (разведения 1:50 или 1:500). Мышиное анти-TSHR антитело (A9, Abcam, Cambridge, UK) использовали в качестве позитивного контроля. Затем связывание антитела детектировали с использованием конъюгированного с пероксидазой хрена (ПХ) козьего антитела против мышиных IgG (Abcam). Для детектирования анти-TSHR антител изотипов IgG1, IgG2a, IgG2b и IgG2c использовали ПХ-конъюгированное крысиное антитело против мышиных IgG1 (Southern Biotech, Alabama, USA), козье антитело против мышиных IgG2a (Southern Biotech), козье антитело против мышиных IgG2b (Abcam) и козье антитело против мышиных IgG2c (Abcam), соответственно. Сигнал проявляли с использованием тетраметилбензидина (TMB). Оптическую плотность (OD) измеряли на планшет-ридере на 450 нм (Tecan Benelux).
Детектирование стимулирующих анти-TSHR антител (TSAb)
Клетки Lulu*, клетки яичника китайского хомячка-К1 (CHO-K1), стабильно трансфецированыые pA3Luc, cAMP-восприимчивой люциферазной конструкцией и pcDNA3-TSHR, а также человеческим TSHR, и обладающие резистентностью к G418, были любезно предоставлены пpоф. M. Ludgate (Cardiff University, UK)9. Клетки выдерживали в среде Хэмса 12 (Lonza), в которую было добавлено 2 мM L-глутамина, 50 ед./мл пенициллина и 50 ед./мл стрептомицина (все от Lonza), 10% фетальной бычьей сыворотки (FBS) (Fisher Scientific, Aalst, Belgium) и 0,2 мг/мл генетицина (Fisher) при 37°C в 5% CO2. Для оценки TSAb, клетки высевали при плотности 2×104 клеток/лунку в 96-луночных планшетах в среде Хэмса 12 с сывороткой, обработанной 10% углем (Sigma-Aldrich, Bornem, Belgium). На следующий день, культуральную среду удаляли, и клетки инкубировали со свежей средой Хэмса, содержащей 5% ПЭГ и 10% тестируемой сыворотки, в течение 4 ч. при 37°C. Затем, клетки лизировали с использованием буфера для лизиса клеточной культуры с люциферазой (Promega, Leiden, The Netherlands). Продуцирование cAMP-восприимчивой люциферазы оценивали в анализе, проводимом с помощью люциферазного репортера (Promega) в соответствии с инструкциями производителей, и измеряли световое излучение на люминометре FLUOstar omega (BMG labtech, Ortenberg, Germany). Результаты выражены в относительных единицах излучения (RLU, излучение, испускаемое стимулированными клетками/излучение, испускаемое нестимулированными клетками).
Детектирование гипертиреоидизма
Общий тироксин (T4) измеряли в неразведенной мышиной сыворотке (10 мкл) с использованием набора CBI для ELISA мышиного/крысиного тироксина (Calbiotech, Spring Valley, CA, USA) в соответствии с инструкциями производителей. Величины T4 вычисляли исходя из стандартов, имеющихся в наборе, и выражали в мкг/дл.
Результаты
Обработка одним пептидом индуцировала TSHR-специфическую толерантность Т-клеток
Для определения толерогенного эффекта отдельных пептидов 5D-K1 и 9B-N, HLA-DR-трансгенных мышей обрабатывали по схеме увеличения доз, начиная с одной дозы одного из пептидов. В первом эксперименте, DR3tg-мышей обрабатывали 5D-K1 или контролем, как описано в разделе «Метод». Предварительная обработка этим модифицированным апитопом приводила к снижению TSHR-индуцированной пролиферации T-клеток на 43% в образцах селезенки и на 60% в образцах LN по сравнению с животными, обработанными контролем (см. фигуры 1 и 2).
Для исследования толерогенной способности пептида 9B-N, DR3tg-мышей обрабатывали 9B-N или PBS. Это исследование показало, что предварительная обработка 9B-N значительно снижала TSHR-индуцированную пролиферацию T-клеток на 41 и 33% в образцах селезенки и LN, соответственно.
Комбинировання обработка пептидами индуцирует TSHR-специфическую толерантность Т-клеток
Обнаружение того факта, что обработка отдельными пептидами 5D-K1 или 9B-N снижает TSHR-специфическую пролиферацию лимфоцитов у мышей, дало основание для проведения исследования, целью которого было определить, может ли комбинированная обработка пептидами в виде коктейля приводить к снижению TSHR-специфического ответа. DR3tg-мышей обрабатывали ATX-GD-59 по схеме увеличения доз и иммунизировали эмульсией, включающей родительские немодифицированные пептиды в ПАФ. Три максимальных дозы (15; 22,5 и 45 нмоль/пептид) ATX-GD-59 были протестированы на их потенциально отличающуюся способность к толеризации, но каких-либо различий между вводимыми дозами не обнаруживалось (данные не приводится). Репрезентативные результаты, представленные на фигуре 3, показали, что ATX-GD-59-обработка индуцировала значительные уровни TSHR-специфической толерантности. TSHR-индуцированная пролиферация была снижена на 58% и 54% в спленоцитах и клетках LN, соответственно.
Комбинированная обработка пептидами снижает уровень продуцирования анти-TSHR антитела у животных с аденовирусной моделью болезни Грейвса
Для иллюстрации терапевтической эффективности ATX-GD-59 было проведено исследование для того, чтобы определить, может ли обработка пептидом ATX-GD-59 приводить к ингибированию параметров болезни Грейвса, таких как TSHR-специфическая пролиферация спленоцитов и вырабатывание анти-TSHR антител. DR3tg-мышам вводили ATX-GD-59 или контроль по схеме увеличения доз, а затем проводили две иммунизации вирусными частицами Ad-LacZ или Ad-TSHR. Сначала исследовали влияние ATX-GD-59-обработки на TSHR-специфическую пролиферацию спленоцитов. Спленоциты Ad-LacZ-иммунизованных мышей не пролиферировались после повторной стимуляции TSHR in vitro (данные не приводятся). Абсолютные величины TSHR-специфической пролиферации спленоцитов у обработанных контролем и у Ad-LacZ-иммунизованных DR3tg-мышей были низкими, но увеличивались в зависимости от дозы. Как показано на фигуре 4, ATX-GD-59-обработка максимальной дозой 22,5 нмол/пептид приводила к значительному снижению TSHR-специфической пролиферации спленоцитов более, чем на 40%. ATX-GD-59-обработка 15 нмоль каждого пептида давала аналогичные результаты (данные не приводятся). Аналогичный толеризующий эффект ATX-GD-59-обработки наблюдался в повторном эксперименте (данные не приводятся), что подтвердило воспроизводимость этих результатов.
Затем оценивали влияние ATX-GD-59-обработки на вырабатывание анти-TSHR антитела. Пробы сыворотки брали для оценки уровней анти-TSHR IgG с помощью ELISA. Анти-TSHR антитела IgG не наблюдались ни до (W-2, данные не приводятся), ни после (W0) предварительной обработки пептидом ATX-GD-59 (фигура 5). В соответствии с данными пролиферации, анти-TSHR антитела не детектировались у контрольных Ad-LacZ-иммунизованных мышей. Высокие уровни анти-TSHR IgG наблюдались у обработанных контрольным пептидом мышей через 2 недели после первой иммунизации Ad-TSHR. ATX-GD-59-обработка приводила к замедлению увеличения уровней анти-TSHR антител, наблюдаемого у обработанных контрольным пептидом мышей после Ad-TSHR-иммунизации на 95% на неделю 2. Кроме того, уровни анти-TSHR IgG снижались на 93% на неделю 5 после обработки пептидом ATX-GD-59.
Для дополнительного исследования снижения уровней анти-TSHR антител оценивали влияние ATX-GD-59-обработки на уровни анти-TSHR антител различных изотипов. Ad-TSHR-иммунизация при плотности вирусных частиц 1010 индуцировала высокие уровни анти-TSHR антител изотипов IgG2b и IgG2c. На фигуре 6 показано, что ATX-GD-59 значительно снижает уровни анти-TSHR антител изотипов IgG1, IgG2b и IgG2c у Ad-TSHR-иммунизованных мышей, что, таким образом коррелирует с паттерном общих уровней антител IgG как поазано на фигуре 5. Обработку дозами пептида 15 нмоль и 22,5 нмоль ATX-GD-59 анализировали два раза в двух независимых экспериментах, в результате чего было обнаружено значительное снижение уровней общих анти-TSHR IgG и IgG различных изотипов (данные для дозы 15 нмоль не приводятся), что указывает на то, что обе эти дозы являются эффективными для модели с аденовирусной БГ.
В целом, полученные результаты показали, что профилактическая ATX-GD-59-обработка является эффективной для индуцирования TSHR-специфической толерантности T-клеток у модели толерантности ex vivo и для снижения уровней анти-TSHR антитела у модели с аденовирусной болезнью Грейвса.
Пример 2 - Комбинированное лечение болезни Грейвса путем введения ATX-GD-459 и лекарственных средств, применяемых в клинической практике для лечения болезни Грейвса
Материалы и методы
Мыши
DR3tg-мыши были скрещены в специфических непатогенных условиях в другой лаборатории, Charles River, UK или InnoSer, NL. Впервые DR3tg-мыши были созданы Strauβ et al. (Strauss et al, 1994, Immunogenetics 3, 104-108). Вкратце, используемые геномные конструкции представляли собой 6 т.п.о.-Nde I-фрагмент геномного клона HLA-DRA в pUC 13 и 24 т.п.о.-CLaI × SalI-фрагмент cos 4.1, то есть, космиды (pTCF), содержащей ген B DRB1*0301. Раствор, содержащий 1-2 мкг/мл каждой конструкции, использовали для совместной инъекции в оплодотворенные яйца доноров F1 (C57BL/6xDBA/2), скрещенных с самцами C57BL/6. Затем потомство скрещивали и получали IA-бета-нокаут-мышей C57BL/6 с генетическим фоном (мыши AB0), у которых не экспрессировалась молекула мышиного MHC класса II. У этих DR3tg-мышей экспрессировалась молекула HLA-DR3, но не экспрессировалась молекула мышиного MHC класса II. Мыши были получены путем возвратного скрещивания с C57BL/6 и с B10.Q. Трансгенные мыши были идентифицированы с помощью Саузерн-блот-анализа «хвоста» ДНК, гидролизованной EcoRI и зондированной 1,35 т.п.о.-BamHI-фрагментом кДНК DRA и 1,25 т.п.о.-BamHI-фрагментом кДНК DRB1*0301. В обоих экспериментах были использованы DR3tg-мыши, поскольку было высказано предположение, что эта молекула MHC класса II ассоциируется с повышенным риском развития у индивидуумов болезни Грейвса.
DR4-мыши были впервые созданы Lars Fugger et al. (PNAS 1994 volume 91: 6151-55), то есть, конструкции HLA-DRA*0101/HLA-DRB1*0401 и mCD3-huCD4c/g были совместно микроинъецированы в эмбрионы потомства F1 (DBA/1xA/CA), и жизнеспособные эмбрионы были перенесены псевдобеременным самкам F1 (BALB/c × 129) для развития беременности. Затем потомство скрещивали и получали IA-бета-нокаут-мышей C57BL/6 с генетическим фоном (мыши AB0), у которых не экспрессировалась молекула мышиного MHC класса II. У этих DR4-мышей экспрессировалась только молекула MHC класса II, а именно, человеческая молекула HLA DR4.
BALB/cJOlaHsd-мыши были получены из лаборатории Harlan (Venray, The Netherlands).
Исследования на животных были одобрены «Комитетом по этике проведения экспериментов на животных» (ECD) в Университете Хасселта и осуществлялись в соответствии со стандартными методами лечения в лаборатории, не содержащей патогенов.
Антигены
Все отдельные пептиды синтезировали в лаборатории GL Biochem Ltd (Shanghai, China) и хранили в виде маточного раствора в концентрации 20 мг/мл в ДМСО (Sigma-Aldrich) при -80°C. Пептиды синтезировали методом присоединения у N-концевого свободного амина и C-концевого амида.
Пептиды ATX-GD-459 (см. Пример 3, где обсуждаются эти пептиды) синтезировали в лаборатории PolyPeptide Laboratories (PPL; Strasbourg, France) и хранили в виде маточного раствора в концентрации 8 мг/мл в PBS при -20°C. Способ получения пептидов основан на твердофазном синтезе пептидов, проводимом путем добавления N-α-Fmoc-защищенных аминокислот в виде структурных элементов, используемых для сборки пептида. C-концевой остаток присоединяли к смоле MBHA как часть Fmoc-lys(Boc)-MPPA-линкера. Другие аминокислоты вводили путем последовательного удаления защитной группы Fmoc и проведения циклов присоединения аминокислот.
Рекомбинантный внеклеточный домен человеческого TSHR (TSHR-ECD, AA19-417) был продуцирован в экспрессионной системе личинок Trichoplusia ni с применением технологии Chesapeake PERL technology PERLXpress в Chesapeake PERL (Savage, USA). Качество белка в каждой партии TSHR-ECD оценивали с помощью электрофореза в ДСН-ПААГ и вестерн-блот-анализа.
Аденовирусные векторы закупали у Viraquest (North Liberty, IA, USA). Конструирование и очистка аденовируса, содержащего аминокислотные остатки TSHR 1-289 (Ad-TSHR), были описаны ранее (Chen et al. 1999 J Clin Endocrinol Metab 84:3182-3186). Вкратце, аденовирусы Ad-TSHR и контрольный аденовирус (Ad-LacZ), экспрессирующие β-галактозидазу, размножали в клетках HEK293 и очищали путем центрифугирования в градиенте плотности CsCL. Концентрацию вирусных частиц определяли путем измерения оптической плотности на 260 нм.
Совместное введение ATX-GD-459 и лекарственных средств, применяемых в клинической практике для лечения болезни Грейвса, животным с аденовирусной моделью БГ
DR3tg-мышам (n=9-10/группу) подкожно инъецировали в бок 15 пмоль, 150 пмоль и 1500 пмоль каждого пептида ATX-GD-459 или контрольного пептида на дни -15, -13 и -11, соответственно, а затем вводили 3 инъекции 15 пмоль каждого пептида ATX-GD-459 (максимальной дозы) или контрольного пептида на дни -8, -6 и -4 (по схеме увеличения доз). Изменение максимальных доз и, соответственно, более высокие дозы показаны для каждого эксперимента. Начиная со дня первой обработки пептидом и до окончания эксперимента, мышей обрабатывали либо MMI, либо пропранололом. MMI (Sigma-Aldrich, Bornem, Belgium) растворяли в стерильной воде в нужной концентрации и вводили мышам в суточной дозе 500 мкг путем подкожного введения посредством осмотических насосов ALZET (модели 1004, 0,11 мкл/час; Charles River, France). Через 4 недели имплантировали новые осмотические насосы. Свежий гидрохлорид пропранолола (Sigma-Aldrich) растворяли в 0,9% физиологическом растворе и вводили ежедневно путем внутрибрюшинных (IP) инъекций в дозе 10 мг/кг/день. На день 0, мышей иммунизировали путем внутримышечной инъекции 109 или 1010 вирусных частиц Ad-TSHR, и через три недели иммунизацию повторяли. Каждую неделю регистрировали массу тела мышей для оценки их состояния. Через 5 недель после первой иммунизации, мышей подвергали эвтаназии и брали пробы крови, образцы щитовидной железы и селезенки. TSHR-индуцированную пролиферацию спленоцитов, секрецию цитокинов и уровни анти-TSHR антитела оценивали как описано ниже.
Детектирование анти-TSHR антител
Анти-TSHR антитела (класса IgG) против очищенного рекомбинантного TSHR-ECD (Chesapeake-Perl) оценивали с помощью ELISA. 96-луночные планшеты (половина площади 96-луночного планшета, Fisher Scientific) сенсибилизировали в течение ночи при комнатной температуре (КT) 50 микролитрами/лунку белка TSHR-ECD в PBS (0,5 мкг/мл). После промывки PBS-0,05% твином 20, лунки блокировали 1% BSA (масс/об) в PBS в течение 1 часа при КТ и инкубировали с тестируемой сывороткой (разведения 1:50 или 1:500). Мышиное анти-TSHR антитело (A9, Abcam, Cambridge, UK) использовали в качестве позитивного контроля. Затем связывание антитела детектировали с использованием конъюгированного с пероксидазой хрена (ПХ) козьего антитела против мышиных IgG (Abcam). Для детектирования анти-TSHR антител изотипов IgG1, IgG2a, IgG2b и IgG2c использовали ПХ-конъюгированное крысиное антитело против мышиных IgG1 (Southern Biotech, Alabama, USA), козье антитело против мышиных IgG2a (Southern Biotech), козье антитело против мышиных IgG2b (Abcam) и козье антитело против мышиных IgG2c (Abcam), соответственно. Сигнал проявляли с использованием тетраметилбензидина. Оптическую плотность (OD) измеряли на планшет-ридере на 450 нм (Tecan Benelux).
Детектирование стимулирующих анти-TSHR антител (TSAb)
Клетки Lulu*, клетки яичника китайского хомячка-К1 (CHO-K1), стабильно трансфецированные pA3Luc, cAMP-восприимчивой люциферазной конструкцией и pcDNA3-TSHR, а также человеческими TSHR, и обладающие резистентностью к G418, были любезно предоставлены пpоф. M. Ludgate (Cardiff University, UK)6. Клетки выдерживали в среде Хэмса 12 (Lonza), в которую было добавлено 2 мM L-глутамина, 50 ед./мл пенициллина и 50 ед./мл стрептомицина (все от Lonza), 10% фетальной бычьей сыворотки (FBS) (Fisher Scientific, Aalst, Belgium) и 0,2 мг/мл генетицина (Fisher) при 37°C в 5% CO2. Для оценки TSAb, клетки высевали при плотности 2×104 клеток/лунку в 96-луночных планшетах в среде Хэмса 12 с сывороткой, обработанной 10% углем (Sigma-Aldrich, Bornem, Belgium). На следующий день, культуральную среду удаляли, и клетки инкубировали со свежей средой Хэмса, содержащей 5% ПЭГ и 10% тестируемой сыворотки, в течение 4 ч. при 37°C. Затем, клетки лизировали с использованием буфера для лизиса клеточной культуры с люциферазой (Promega, Leiden, The Netherlands). Продуцирование cAMP-восприимчивой люциферазы оценивали в анализе, проводимом с помощью люциферазного репортера (Promega) в соответствии с инструкциями производителей, и измеряли световое излучение на люминометре FLUOstar omega (BMG labtech, Ortenberg, Germany). Результаты выражены в относительных единицах излучения (RLU, излучение, испускаемое стимулированными клетками/излучение, испускаемое нестимулированными клетками).
Детектирование гипертиреоидизма
Общий тироксин (T4) измеряли в неразведенной мышиной сыворотке (10 мкл) с использованием набора CBI для ELISA мышиного/крысиного тироксина (Calbiotech, Spring Valley, CA, USA) в соответствии с инструкциями производителей. Величины T4 вычисляли исходя из стандартов, имеющихся в наборе и выражали в мкг/дл.
Анализ на пролиферацию спленоцитов
Спленоциты выделяли и культивировали в среде X-vivo 15, в которую было добавлено 2 мM L-глутамина, 50 ед./мл пенициллина и 50 ед./мл стрептомицина (все от Lonza, Verviers, Belgium) в 96-луночных плоскодонных планшетах. Для исследования индуцированной антигеном пролиферации клеток, 0,5×106 клеток на лунку культивировали (200 мкл/лунку) в течение 72 часов с различными концентрациями TSHR-ECD (0-25 мкг/мл). После 72-часового инкубирования при 37°C в инкубаторе с 5% CO2 собирали 60 мкл клеточного супернатанта и замораживали. Затем к клеткам добавляли 20 мкл/лунку обработанного тритием тимидина (PerkinElmer, Zaventem, Belgium) до конечной концентрации 1 мкКи/лунку. Клетки инкубировали при 37°C и 5% CO2, и через 16 часов планшеты замораживали. Оттаянные планшеты собирали и считывали на β-счетчике (на жидкостном сцинтилляционном счетчике Wallac 1450 Microbeta Trilux) для оценки пролиферации клеток.
Результаты
Комбинированное введение MMI и ATX-GD-459 модели с аденовирусной БГ
Для того, чтобы подтвердить, может ли комбинированная ATX-GD-459-обработка и MMI-обработка применяться для лечения симптомов БГ, был оценен эффект от совместного введения MMI и ATX-GD-459 животному с моделью аденовирусной БГ (дополнительное обсуждение этой модели см. в Примерах 4 и 5). В этом эксперименте, DR3tg-мышей обрабатывали нижеследующими комбинациями MMI и ATX-GD-459: носитель+контрольный пептид, MMI+контрольный пептид, носитель+ATX-GD-459 или MMI+ATXGD-459. Обработка ATX-GD-459 или контрольным пептидом была проведена в первые две недели эксперимента по схеме увеличения доз (фигура 8). Подкожное введение носителя или MMI начинали одновременно, но заканчивали еще до завершения эксперимента. Такая экспериментальная схема позволяет исследовать реципрокное влияние обработки MMI и ATX-GD-459 на параметры заболевания, подобного БГ.
Сначала исследовали влияние MMI- и ATX-GD-459-обработки на TSHR-специфическую пролиферацию спленоцитов. Абсолютные величины TSHR-специфической пролиферации спленоцитов были относительно низкими у мышей, обработанных контролем (фигура 10). Однако, в этом эксперименте, такие величины были гораздо выше, чем у всех других контрольных групп в предыдущих экспериментах (данные не приводятся) или в эксперименте с введением пропранолола. Следовательно, значительное снижение TSHR-специфической пролиферации спленоцитов, обусловленное обработкой MMI или ATX-GD-459, как показано на фигуре 10, должно быть интерпретировано с определенной осторожностью.
После TSHR-специфической пролиферации спленоцитов, у всех мышей определяли уровни анти-TSHR IgG в сыворотке. До начала проведения эксперимента, ни у одной мыши не были детектированы анти-TSHR антитела IgG (данные не приводятся). ATX-GD-459-обработка с увеличением доз не индуцировала какого-либо продуцирования анти-TSHR антител, как было определено на неделю 0 (фигура 11). Ad-TSHR-иммунизация стимулировала продуцирование анти-TSHR антител у мышей, обработанных контрольным пептидом, но не у мышей, обработанных ATX-GD-459. Хотя не наблюдалось какого-либо значимого различия у мышей, обработанных различными дозами контроля, однако, предварительная обработка ATX-GD-459 снижала уровень продуцирования анти-TSHR антител в среднем более, чем на 90%. В противоположность этому, MMI-обработка не влияла на уровни анти-TSHR антитела. Кроме того, MMI-обработка не влияла на антитело-снижающий эффект обработки пептидом ATX-GD-459.
Профиль анти-TSHR антитела был дополнительно проанализирован путем определения изотипов специфического IgG. Как показано на фигуре 12, ни у одной из Ad-TSHR-иммунизованных мышей не продуцировались анти-TSHR антитела изотипа IgG1. Ad-TSHR-иммунизация индуцировала продуцирование анти-TSHR антител IgG2b и IgG2c у мышей, обработанных контрольным пептидом, но не у мышей, обработанных ATX-GD-459. Предварительная ATX-GD-459-обработка снижала уровень продуцирования анти-TSHR антител IgG2b и IgG2c более, чем на 90%. В противоположность этому, MMI-обработка не влияла на уровни анти-TSHR антител изотипов IgG и на антитело-снижающий эффект обработки пептидом ATX-GD-459. Эти данные полностью соответствуют профилю, наблюдаемому для всех анти-TSHR антител IgG.
Помимо определения изотипа была оценена биологическая активность анти-TSHR антител и потенциальный эффект MMI- или ATX-GD-459-обработки. Поскольку порог для стимулирующих антител не был превышен у всех Ad-TSHR-иммунизованных мышей (данные не приводятся), то не было получено каких-либо данных о влиянии MMI- или ATX-GD-459-обработки на вырабатывание стимулирующих антител. Низкий уровень стимулирующих антител соответствует ранее описанным экспериментам (отчет ATX-GD-15-003).
И наконец, было оценено влияние MMI- или ATX-GD-459-обработки на уровни T4. Поскольку в этом эксперименте Ad-LacZ-иммунизация не использовалась в качестве контрольной иммунизации, то заболеваемость гипертиреоидизмом не могла быть определена. Несмотря на отсутствие информации об уровне гипертиреоидизма, полученные результаты четко указывали на то, что MMI-обработка приводила к значительному снижению уровней Т4 (фигура 13). Однако, предварительная ATX-GD-459-обработка не влияла на уровни Т4 в сыворотке. Кроме того, предварительная ATX-GD-459-обработка не влияла на Т4-снижающую эффективность MMI.
В целом, эти данные показали, что комбинированная MMI- или ATX-GD-459-обработка не оказывает негативного влияния на все другие функции и может быть без всяких опасений использована для модели с аденовирусной БГ.
Комбинированное введение пропранолола и ATX-GD-459 модели с аденовирусной БГ
Для устранения адренергических симптомов гипертиреоидизма, пациенты с БГ часто принимают β-блокаторы. Поэтому, в этом эксперименте был исследован эффект комбинированного введения ATX-GD-459 и β-блокатора, а именно, пропранолола, модели с аденовирусной БГ. Сначала была оценена TSHR-специфическая пролиферация спленоцитов. Как показано на фигуре 14, ни обработка пропранололом, ни обработка ATX-GD-459 не оказывали значительного влияния на TSHR-специфическую пролиферацию спленоцитов. Комбинированная обработка пропранололом и ATX-GD-459 также не влияла на пролиферативный ответ.
Затем оценивали влияние обработки пропранололом и ATX-GD-459-обработки на вырабатывание анти-TSHR антитела. Пробы сыворотки брали для оценки уровней анти-TSHR IgG с помощью ELISA. Анти-TSHR антитела IgG не наблюдались ни до (W-2), ни после (W0) предварительной обработки пептидом ATX-GD-459 (фигура 15). Ad-TSHR-иммунизация индуцировала высокий уровень продуцирования анти-TSHR антител у мышей, обработанных контрольным пептидом, и в меньшей степени, у ATX-GD-459-обработанных мышей. Примечательно то, что Ad-TSHR-иммунизация, проводимая с использованием 1010 вирусных частиц в этом эксперименте, приводила к увеличению титров анти-TSHR антител, в отличие от 109 Ad-TSHR-иммунизации, проводимой в предыдущих экспериментах (данные не приводятся). ATX-GD-459-обработка приводила к снижению уровня продуцирования анти-TSHR антител более, чем на 90%, как было определено на W2 и W5 после иммунизации. В противоположность этому, обработка пропранололом не влияла на уровни анти-TSHR антител. Кроме того, обработка пропранололом не влияла на антитело-снижающую эффективность обработки пептидом ATX-GD-459.
Для дополнительного исследования профиля антитела были определены профили анти-TSHR антител изотипа IgG. Хотя уровни этих антител были ниже, чем уровни IgG2b и IgG2c, однако, анти-TSHR антитела IgG явно индуцировались благодаря Ad-TSHR-иммунизации. Эти данные контрастировали с данными, полученными в отсутствии анти-TSHR антител IgG1 в предыдущих экспериментах (данные не приводятся), но это можно объяснить увеличением дозы аденовирусных частиц с 109 до 1010, используемой при иммунизации. Как показано на фигуре 16, ATX-GD-459-обработка значительно снижала уровни анти-TSHR антител IgG2b и IgG2c. Титры анти-TSHR антител IgG1 также снижались после обработки пептидом, но не существенно. В противоположность обработке пептидом, обработка пропранололом не влияла на уровни анти-TSHR антител любых изотипов IgG. Кроме того, обработка пропранололом не влияла на антитело-снижающую эффективность обработки пептидом ATX-GD-459, что полностью соответствовало профилю, наблюдаемому для анти-TSHR антител всех IgG. В целом, ATX-GD-459-обработка значительно снижала титры анти-TSHR антител у этого животного-модели. Однако, какого-либо влияния обработки пропранололом на какие-либо параметры заболевания, подобного БГ, не наблюдалось. Для того, чтобы подтвердить, может ли ежедневное IP-введением индуцировать фармакологические уровни пропранолола в крови мышей, уровни пропранолола в мышиной плазме оценивали с помощью ЖХ-МС-МС (Anacura). Пробы крови брали через 60-90 минут после введения дозы, и уровни пропранолола в плазме индивидуумов сравнивали на W0 и W5. Результаты представлены на фигуре 18.
Пример 3 - Ex vivo толеризация T-клеток посредством ATX-GD-459
Для того, чтобы определить, являются ли пептиды RNB-4K и RNB-5D апитопами, были выбраны гибридомные клоны, специфичные к RNB-4K-GKK и RNB-5D-K1. Были проведены анализы на «презентацию, независимую от процессинга антигена» (APIPS), и было подтверждено, что пептиды RNB-4K-GKK и RNB-5D-K1 являются апитопами (фигура 27).
Была определена способность композиции, содержащей пептиды, представленные в таблице 1 (обозначенные ATX-GD-459), или отдельно вводимых пептидов, индуцировать толерантность к TSHR. Протокол ex vivo толеризации представлен на фигуре 19.
Таблица 1
HLA-DR3-мышей обрабатывали ATX-GD-459 по схеме увеличения доз и иммунизировали комбинацией родительских пептидов 4K/5D/9B в ПАФ. Результаты показали, что ATX-GD-459-обработка индуцировала значительные уровни TSHR-специфической толерантности в клетках селезенки и LN (фигура 20). Толерантность, индуцированная путем ATX-GD-459-обработки, была выше, чем толерантность, индуцированная путем введения отдельных пептидов (фигура 20).
Пример 4 - Создание модели аденовирусной болезни Грейвса
Для подтверждения терапевтического эффекта обработки пептидом ATX-GD-459 сначала создавали модель аденовирусного заболевания у животных, а именно у мышей BALB/c дикого типа. TSHR-индуцированную пролиферацию спленоцитов, уровни анти-TSHR антител IgG, уровни Т4 в сыворотке и патологические изменения в ткани щитовидной железы исследовали как параметры симптомов заболевания. В первом эксперименте, мышей BALB/c иммунизировали 108 вирусных частиц Ad-TSHR. Хотя эта доза вируса была предназначена для индуцирования гипертиреоидизма и продуцирования анти-TSHR антител (Chen et al., 2004, Endocrinology145 (11): 4927-33), однако, только 2 из 10 мышей рассматривались как гипертиреоидные (пограничный симптом), и ни у одной из этих мышей не продуцировались анти-TSHR антитела IgG (данные не приводятся).
Во втором эксперименте, проводимом с использованием увеличенной дозы вирусных частиц, приблизительно у 30% Ad-TSHR-иммунизованных мышей наблюдалось увеличение уровней Т4 в сыворотке, как было определено через 4 недели после первой иммунизации (фигура 22). Однако, на неделе 10, заболеваемость составляла лишь 15%. Такое снижение повышенных уровней T4 у мышей BALB/c дикого типа в течение определенного периода времени после первоначального повышения за недели после иммунизации было описано ранее (McLachlan et al, 2012, Thyroid 8:1-7). Тем не менее, явно выраженный гипертиреоидизм у отдельных мышей четко соответствовал гистопатологическим данным, полученным для ткани щитовидной железы, таким как гипертрофия эпителиальных клеток щитовидной железы или инфильтрация лимфоцитов (данные не приводятся).
Хотя в литературе имеются данные о том, что у мышей с генетическим фоном C57BL/6 или у DR3tg-мышей сохранется резистентность к развитию симптомов, подобных болезни Грейвса, однако, авторами настоящего изобретения был проведен анализ для того, чтобы определить, может ли Ad-TSHR-иммунизация индуцировать развитие симптомов, подобных болезни Грейвса, у DR3tg-мышей со смешанным генетическим фоном C57BL/10, DBA/2, C57BL/6, не относящимся к МНС класса II.
На фигуре 23A указаны уровни T4 в сыворотке у Ad-LacZ- и Ad-TSHR-иммунизованных DR3tg-мышей. Хотя у 4 Ad-TSHR-иммунизованных мышей уровни T4 были выше, чем среднее+2SD у Ad-LacZ-иммунизованных мышей, однако, у них наблюдался лишь пограничный гипертиреоидный синдром, а увеличение уровней Т4 рассматривалось как слишком низкое, чтобы их можно было использовать в качестве параметра заболевания при исследовании эффективности обработки пептидом.
Ad-TSHR-иммунизация индуцировала высокие титры анти-TSHR антител IgG в сыворотке DR3tg-мышей (фигура 11, правая панель). Самые высокие уровни анти-TSHR IgG достигались через 4 недели с последующим их снижением на недели 7 и 10, что контрастировало со стабильными уровнями анти-TSHR IgG, наблюдаемыми у мышей BALB/c (фигура 23C, левая панель). Тот факт, что уровни анти-TSHR IgG у DR3tg-мышей были выше не только через 4 недели, а даже через 2 недели после первой иммунизации (данные не приводятся), привел авторов к решению о прекращении испытания на модели с аденовирусной болезнью Грейвса не через 10 недель, а уже через 4 недели.
Пример 5 - Подтверждение модели с аденовирусной болезнью Грейвса
Для подтверждения DR3tg-модели с аденовирусной болезнью Грейвса было оценено влияние различных имуномодулирующих лекарственных средств на продуцирование анти-TSHR антитела у модели с аденовирусной болезнью Грейвса. Антитиреоидное лекарственное средство метимазол (MMI) в настоящее время применяется для непосредственного снижения уровней тиреоидного гормона у пациентов с болезнью Грейвса. Следовательно, были определены эффекты MMI-обработки у Ad-TSHR-иммунизованных DR3tg-мышей. Исходя из имеющихся в литературе описаний гипертиреоидизм-индуцирующего эффекта MMI у мышей были протестированы две различные дозы MMI (50-500 мкг/мышь/день) (Jeong et al, 2012, Endocrinology 153: 683-9; Mozes et al., 1998, J. Clin Immunology 18 (2): 106-13). Суточная доза 500 мкг MMI значительно снижала уровни T4 на 2 и 4 недели после первой иммунизации, тогда как доза 50 мкг обнаруживала тенденцию к снижению лишь уровней T4 (фигура 24A). Хотя Ad-TSHR-иммунизация не индуцировала гипертиреоидизм в этом эксперименте (данные для Ad-LacZ-иммунизованных мышей не приводятся) и в предыдущих экспериментах, однако, снижение уровней Т4, индуцированное MMI-обработкой, указывало на то, что у DR3tg-мышей, на продуцирование гормонов может влиять щитовидная железа.
MMI, помимо его антитиреоидной функции, также дает иммуномодулирующие эффекты (Mozes et al, 1998, как описано выше; Wang et al, 2003, J. Leukoc. Biol. 73: 57-64). Поэтому, было определено, может ли MMI-обработка снижать уровни продуцирования анти-TSHR IgG у Ad-TSHR-иммунизованных мышей. Хотя MMI-обработка значительно снижала уровни Т4, однако, каких-либо изменений в уровнях анти-TSHR IgG не наблюдалось (фигура 24B).
Пациентам с болезнью Грейвса, а в частности, пациентам с ОГ, часто требуется иммуносуппрессорная терапия глюкокортикоидами. Было протестировано влияние метилпреднизолона, синтетического глюкокортикоидного лекарственного средства на продуцирование анти-TSHR антитела у Ad-TSHR-иммунизованных мышей. Обработка метилпреднизолоном в дозе 7 мг/кг/день приводила к значительному снижению уровней анти-TSHR IgG у Ad-TSHR-иммунизованных DR4tg-мышей, тогда как доза 1 мг/кг/день была недостаточной для снижения титров антитела (данные не приводятся). Обработка Ad-иммунизованных DR3tg-мышей метилпреднизолоном в дозе 7 мг/кг/день приводила к значительному снижению уровней анти-TSHR IgG не через 4 недели, а уже через 2 недели после первой иммунизации, что обусловлено природным снижением уровней анти-TSHR антитела у необработанных мышей за определенный период времени. Обработка метилпреднизолоном также приводила к снижению числа клеток тимуса и селезенки, что указывало на уровень фармакологической дозы, достаточный для введения модели с аденовирусной болезнью Грейвса (фигура 25).
Эти данные продемонстрировали, что эффективность апитопов у DR3tg-мышей с заболеванием может быть определена путем оценки снижения уровня анти-TSHR антител IgG.
Пример 6 - Иллюстрация терапевтической эффективности ATX-GD-459 у модели аденовирусной болезни Грейвса
Для того, чтобы определить, может ли комбинированная обработка пептидами RNB-4K-GKK, RNB-5D-K1 и RNB-9B (ATX-GD-459) подавлять продуцирование анти-TSHR антител, DR3tg-мышей обрабатывали ATX-GD-459 или контролем по схеме увеличения доз, а затем подвергали Ad-LacZ- или Ad-TSHR-иммунизации. Пробы сыворотки брали для оценки уровней анти-TSHR IgG с помощью ELISA. Анти-TSHR антитела IgG не наблюдались ни до (W-2, данные не приводятся), ни после (W0) предварительной обработки пептидом ATX-GD-459 (фигура 25). Высокие уровни анти-TSHR IgG наблюдались у PBS-обработанных мышей через 2 недели после первой Ad-TSHR-иммунизации. ATX-GD-459-обработка приводила к замедлению увеличения уровней анти-TSHR антител IgG после Ad-TSHR-иммунизации на 72% и 65% на неделю 2 и 5, соответственно. Эти результаты показали, что ATX-GD-459 является эффективным для этой модели аденовирусной болезни Грейвса.
Высокие уровни анти-TSHR IgG наблюдались после Ad-TSHR-иммунизации. Следовательно, этот параметр заболевания был применен для исследования эффекта обработки иммуномодулирующими лекарственными средствами или пептидом ATX-GD-459 у модели аденовирусной болезни Грейвса. Было показано, что обработка метилпреднизолоном приводила к успешному снижению уровней анти-TSHR IgG у Ad-TSHR-иммунизованных DR3tg-мышей. Кроме того, обработка пептидом ATX-GD-459 по схеме увеличения доз приводила к снижению увеличения продуцирования анти-TSHR антитела IgG на 70%.
Материалы и методы
Мыши
Мыши были описаны в примере 2.
Антигены
Антигены были описаны в примере 2.
Анализ на систему презентации независимо от процессинга антигена (APIPS)
Антигенспецифические Т-кеточные гибридомы тестировали на их реактивность с пептидами, презентированными фиксированными или нефиксированными клетками VAVY или BM14 (=АПК). 5×104 клеток от отдельных клонов культивировали с 25 мкг/мл пептида и с 5×104 фиксированных или свежих АПК. Для фиксации АПК, клетки инкубировали с 0,5% параформальдегидом (Merck, Darmstadt, Germany) (pH7) в течение 5 минут при комнатной температуре (КТ). Реакцию фиксации прекращали путем добавления 0,4M глицина (Sigma-Aldrich) и промывки клеток в RPMI-10%FCS. Кроме того, реактивность с человеческим белком TSHR-ECD (Chesapeake-PERL, Savage, Maryland, USA) оценивали для идентификации эпитопов. Через 48 часов, индуцированное антигеном продуцирование IL-2 оценивали с помощью ELISA.
Эксперимент по толеризации ex vivo
DR3tg- или DR4tg-мышам подкожно инъецировали в бок 0,1 мкг, 1 мкг и 10 мкг пептидов на дни -15, -13 и -11, соответственно, а затем вводили 3 инъекции 33, 75 или 100 мкг пептида (в зависимости от максимальной дозы, см. надписи на чертеже) на дни -8, -6 и -4 (по схеме увеличения доз). Изменения максимальных доз и, соответственно, более высокие дозы указаны для каждого эксперимента. На день 0, мышей подкожно иммунизировали в основание хвоста 50 мкг антигена (немодифицированного родительского 15-мерного пептида), эмульгированного в ПАФ (пептид/ПАФ). Через десять дней после иммунизации извлекали дренирующие лимфоузлы (LN) и селезенку. Клетки LN и спленоциты выделяли и культивировали в среде X-vivo 15 (в которую было добавлено 2 мM L-глутамина, 50 ед./мл пенициллина и 50 ед./мл стрептомицина; Lonza) в 96-луночных плоскодонных планшетах. Для исследования индуцированной антигеном пролиферации клеток, 0,5×106 клеток на лунку культивировали (200 мкл/лунку) в течение 72 часов с различными концентрациями антигена (0-25 мкг/мл) или с 12,5 мкг/мл очищенного производного белка (PPD; примирующий контроль; Statens serum institut, Copenhagen, Denmark). Через 72-часа собирали 60 мкл клеточного супернатанта и замораживали. Затем к клеткам добавляли 20 мкл/лунку обработанного тритием тимидина (PerkinElmer, Zaventem, Belgium) до конечной концентрации 1 мкКи/лунку. Клетки инкубировали при 37°C, и через 16 часов планшеты замораживали. Оттаянные планшеты собирали и считывали на β-счетчике (на жидкостном сцинтилляционном счетчике Wallac 1450 Microbeta Trilux) для оценки пролиферации клеток.
Животные с моделью аденовирусной болезни Грейвса
Аденовирус, экспрессирующий А-субъединицу человеческого TSHR (аминокислотные остатки 1-289; Ad-TSHR) и контрольный аденовирус (Ad-LacZ), экспрессирующий β-галактозидазу, закупали у Viraquest (North Liberty, IA, USA). 6-недельным самкам мышей BALB/cJOlaHsd (Harlan Laboratories, Venray, The Netherlands) или DR3tg-мышам внутримышечно инъецировали в мышцу бедра Ad-TSHR или Ad-LacZ (109, 1010 или 1011 вирусных частиц). Все мыши были одновременно иммунизированы одной и той же партией аденовируса на эксперимент. Мышам вводили две или три инъекции с интервалами в три недели (неделя 0, 3 и 6), и брали кровь до первой иммунизации и через одну неделю после второй иммунизации. Через 4, 5 или 10 недель после первой иммунимзации, мышей подвергали эвтаназии и брали кровь, клетки селезенки и щитовидную железу. Спленоциты выделяли и культивировали в среде X-vivo 15 (в которую были добавлены глутамин, пенициллин и стрептомицин; Lonza) в 96-луночных плоскодонных планшетах. Для исследования индуцированной антигеном пролиферации клеток, 0,5×106 клеток на лунку культивировали (200 мкл/лунку) в течение 72 часов с различными концентрациями антигена (0-25 мкг/мл). Через 72 часа собирали 60 мкл клеточного супернатанта и замораживали. Затем к клеткам добавляли 20 мкл/лунку обработанного тритием тимидина (PerkinElmer, Zaventem, Belgium) до конечной концентрации 1 мкКи/лунку. Клетки инкубировали при 37°C, и через 16 часов планшеты замораживали. Оттаянные планшеты собирали и считывали на β-счетчике (на жидкостном сцинтилляционном счетчике Wallac 1450 Microbeta Trilux) для оценки пролиферации клеток.
Детектирование анти-TSHR антител
Анти-TSHR антитела (класса IgG) против очищенного белка TSHR-ECD (Chesapeake-Perl) оценивали с помощью ELISA. 96-луночные планшеты (половина площади 96-луночного планшета, Fisher Scientific) сенсибилизировали в течение ночи 50 мкл/лунку белка TSHR-ECD в PBS (0,5 мкг/мл) при КT. После промывки PBS-0,05% твином, лунки блокировали 1% альбумином бычьей сыворотки (BSA) (масс/об) в PBS в течение 1 часа при КТ и инкубировали с тестируемой сывороткой (аликвоты в дубликатах, разведение 1:50). Мышиное анти-TSHR антитело (A9, Abcam, Cambridge, UK) использовали в качестве позитивного контроля. Затем связывание антитела детектировали с использованием конъюгированного с пероксидазой хрена (ПХ) козьего антитела против мышиных IgG (Abcam). Для детектирования анти-TSHR антител изотипов IgG1, IgG2a, IgG2b и IgG2c использовали ПХ-конъюгированное крысиное антитело против мышиных IgG1 (Southern Biotech, Alabama, USA), козье антитело против мышиных IgG2a (Southern Biotech), козье антитело против мышиных IgG2b (Abcam) и козье антитело против мышиных IgG2c (Abcam), соответственно. Сигнал проявляли с использованием тетраметилбензидина (TMB). Оптическую плотность (OD) измеряли на планшет-ридере на 450 нм (Tecan Benelux).
Детектирование стимулирующих анти-TSHR антител (TSAb)
Клетки Lulu*, клетки яичника китайского хомячка-К1 (CHO-K1), стабильно трансфецированыые pA3Luc, cAMP-восприимчивой люциферазной конструкцией и pcDNA3-TSHR, а также человеческими TSHR, и обладающие резистентностью к G418, были любезно предоставлены пpоф. M. Ludgate (Cardiff University, UK). Клетки выдерживали в среде Хэмса 12 (Lonza), в которую было добавлено 2 мM L-глутамина (Lonza), 50 ед./мл пенициллина и 50 ед./мл стрептомицина (Lonza), 10% фетальной бычьей сыворотки (FBS) (Fisher Scientific, Aalst, Belgium) и 0,2 мг/мл генетицина (Fisher) при 37°C в 5% CO2. Для оценки TSAb, клетки высевали при плотности 2×104 клеток/лунку в 96-луночных планшетах в среде Хэмса 12 с сывороткой, обработанной 10% углем (Sigma-Aldrich, Bornem, Belgium). На следующий день, культуральную среду удаляли, и клетки инкубировали со свежей средой Хэмса, содержащей 5% ПЭГ и 10% тестируемой сыворотки, в течение 4 часов при 37°C. Затем, клетки лизировали с использованием буфера для лизиса клеточной культуры с люциферазой (Promega, Leiden, The Netherlands). Продуцирование cAMP-восприимчивой люциферазы оценивали в анализе, проводимом с помощью люциферазного репортера (Promega) в соответствии с инструкциями производителей и измеряли световое излучение на люминометре FLUOstar omega (BMG labtech, Ortenberg, Germany). Результаты выражены в относительных единицах излучения (RLU, излучение, испускаемое стимулированными клетками/излучение, испускаемое нестимулированными клетками).
Детектирование гипертиреоидизма
Общий тироксин (T4) измеряли в неразведенной мышиной сыворотке (10 мкл) с использованием набора CBI для ELISA мышиного/крысиного тироксина (Calbiotech, Spring Valley, CA, USA) в соответствии с инструкциями производителей. Величины T4 вычисляли исходя из стандартов, имеющихся в наборе, и выражали в мкг/дл. Помимо определения уровня Т4 в сыворотке проводили гистологический анализ щитовидной железы для оценки параметра гипертиреоидизма. Щитовидную железу фиксировали в 10% нейтрально забуференного формалина (pH 7,5), приготавляивали срезы и окрашивали гематоксилином и эозином. Срезы исследовали на патологические изменения (гипертрофию, повышенное количество эпителиальных клеток и инфильтрацию лимфоцитов) и оценивали (KWS Biotest, Bristol, UK).
Подтверждение модели болезни Грейвса у животного
DR3tg-мышей два раза внутримышечно иммунизировали Ad-TSHR с интервалами в три недели (день 0 и 21). Начиная со дня первой иммунизации и до окончания эксперимента, мышей обрабатывали либо MMI, либо натриевой солью гемисукцината 6α-метилпреднизолона 21 (метилпреднизолоном). Все соединения вводили подкожно посредством осмотических насосов ALZET (модели 1004, 0,11 мкл/час; Charles River, France). MMI (Sigma) растворяли в стерильной воде в нужной концентрации и вводили мышам в суточной дозе 50 или 500 мкг. Метилпреднизолон (Sigma) растворяли в стерильной воде и вводили мышам в дозе 1 мг/кг/день или 7 мг/кг/день. Каждую неделю регистрировали массу тела мышей для оценки их состояния. Через 4 недели после первой иммунизации, мышей подвергали эвтаназии и брали пробы крови и образцы селезенки. TSHR-специфическую пролиферацию спленоцитов и уровни анти-TSHR антитела оценивали как описано выше.
Животное с профилактической моделью болезни Грейвса
DR3tg-мышам подкожно инъецировали в бок 0,1 мкг, 1 мкг и 10 мкг ATX-GD-459 или контроля на дни -15, -13 и -11, соответственно, а затем вводили 3 инъекции 100 мкг ATX-GD-459 (максимальная доза) или контроля на дни -8, -6 и -4 (по схеме увеличения доз). Изменения максимальных доз и, соответственно, более высокие дозы указаны для каждого эксперимента. На день 0, мышей иммунизировали путем внутримышечной инъекции 109 вирусных частиц Ad-TSHR или Ad-LacZ, и иммунизацию проводили повторно через три недели. Через пять недель после первой иммунизации брали кровь и селезенку. TSHR-специфическую пролиферацию спленоцитов и уровни анти-TSHR антитела оценивали как описано выше.
Различные модификации и изменения будут очевидны для специалиста в данной области и не должны выходить за рамки существа и объема изобретения. Хотя настоящее изобретение описано на конкретных предпочтительных вариантах его осуществления, однако, следует отметить, что заявленное изобретения не должно быть необоснованно ограничено такими конкретными вариантами. Действительно, в описанные способы осуществления изобретения могут быть внесены различные модификации, которые являются очевидными для специалистов в области химии, биологии или в смежных областях и входят в объем настоящего изобретения. Все вышеупомянутые публикации вводятся в настоящее описание посредством ссылки.
Реферат
Изобретение относится к области биотехнологии, конкретно к пептидам TSHR в комбинации с антитиреоидным агентом и/или бета-блокатором, и может быть использовано в медицине для лечения или профилактики болезни Грейвса. Получен комбинированный продукт, включающий эффективное количество пептидов TSHR с KKKKYVSIDVTLQQLESHKKK и GLKMFPDLTKVYSTD и антитиреоидный агент и/или бета-блокатор. Изобретение обеспечивает подавление продуцирования аутоантител к TSHR. 8 н. и 3 з.п. ф-лы, 27 ил., 1 табл., 6 пр.

Комментарии