Способы доставки агента в икринки рыб - RU2741645C2
Код документа: RU2741645C2
Чертежи








Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка претендует на приоритет временной заявки США №62/163511, поданной 19 мая 2015 г., и временной заявки США №62/274958, поданной 5 января 2016 г. Описания таких родственных временных заявок настоящим включены в данный документ в качестве ссылок в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее описание относится к способам доставки агента в икринки и эмбрионы мечущих икру водных животных. Предмет изобретения включает способы, используемые для увеличения проницаемость хориона и введения агентов, например, больших молекул, в икринки и эмбрионы. Настоящее описание также относится к способам скрининга лекарственных средств и биологически активных агентов в анализах безопасности и токсичности для биотехнологической и фармацевтической промышленности, и получению репродуктивно стерильной рыбы для аквакультуры, аквариумного разведения и борьбы с инвазивными видами.
[0003] Описание дополнительно включает способы, используемые для введения морфолинового олигомера (МО) в икринки и эмбрионы мечущих икру водных животных, что приводит к нарушению развития фертильных гонад и к стерильным взрослым рыбам.
УРОВЕНЬ ТЕХНИКИ
[0004] Аквакультура становится все более важной в решении современных и прогнозируемой глобального недостатка водных пищевых продуктов и доступности морепродуктов. С продолжающимся переходом от результатов рыболовного промысла к искусственно разводимым водным видам, возрастает необходимость оптимизации методов аквакультуры для увеличения производства пищевых продуктов и минимизации экологического воздействия, с целью достижения долгосрочной экологической устойчивости наших ресурсов морепродуктов.
[0005] Стерилизация (индуцированное бесплодие) выращиваемой на фермах рыбы и других мечущих икру водных животных увеличивает их темпы роста путем усиления конверсии энергетического содержания пищевых продуктов в мышечный рост, вместо гонадального развития. Кроме того, в случае попадания из процессов аквакультуры в окружающую среду, репродуктивно стерильная выращиваемая на фермах рыба и другие мечущие икру водные животные, включая доместицированные, инородные или генетически модифицированные виды, будет неспособна размножаться или скрещиваться с дикой популяцией. Это будет способствовать биологическому сдерживанию и предотвращать генетическое загрязнение диких популяций и/или акклиматизацию в условиях дикой природы домашних, инородных или генетически модифицированных выращиваемых на фермах рыб и других мечущих икру водных животных.
[0006] Дополнительно, репродуктивная стерилизация рыбы и других мечущих икру водных животных препятствует несанкционированному разведению и торговле защищенными патентами, или иначе защищенными, генетически селекционированными или модифицированными рыбами и другими мечущими икру водными животными.
[0007] Кроме этого, водные животные, такие как данио-рерио (zebrafish), использовались в качестве моделей для оценки лекарственных средств или биологически активных агентов, представляющих интерес. Однако, одной из основных проблем при использовании икринок и эмбрионов таких водных животных является низкая проницаемость хориона или оболочки икринок, которая препятствует проникновению таких агентов через хорион и их попаданию в эмбрион.
[0008] Таким образом, существует потребность в способах увеличения проницаемости хориона икринок водных животных и создании возможности проникновения препаратов-кандидатов, биологически активных агентов и больших молекул через хорион и попадания в эмбрион. Кроме того, существует потребность в способах репродуктивной стерилизации мечущих икру водных животных.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0009] Было обнаружено, что определенные соединения, например, гуанидин, аргинин, и их производные, димеры, тримеры или полимеры, способны эффективно увеличивать проницаемость хориона икринок водных животных, что позволяет агентам, таким как препараты-кандидаты, потенциально биологически активные агенты и/или большие молекулы, проходить через хорион таких икринок мечущих икру водных животных и достигать эмбрионов.
[0010] Один аспект описания относится к способу доставки по меньшей мере одного агента в оплодотворенную или неоплодотворенную икринку (икринки) мечущего икру водного животного, включающему введение к контакт оплодотворенной или неоплодотворенной икринки (икринок) с по меньшей мере одним агентом в присутствии гуанидинсодержащего соединения, которое эффективно увеличивает проницаемость хориона икринки (икринок).
Такие способы могут быть использованы в способах скрининга агентов, представляющих интерес.
[0011] Таким образом, другой аспект описания относится к способу проведения лекарственного скрининга и анализов токсичности соединения с использованием водных животных, включающему введение к контакт икринки (икринок) водного животного с по меньшей мере одним агентом, включающим лекарственное средство, препарат-кандидат, токсичное соединение или токсичное соединение-кандидат в присутствии гуанидинсодержащего соединения, которое эффективно увеличивает проницаемость хориона икринки (икринок), причем способ дополнительно включает реакцию водного животного на агент.
[0012] Дополнительный аспект описания относится к способу увеличения проницаемости хориона икринки (икринок) мечущего икру водного животного, включающему введение в контакт оплодотворенной или неоплодотворенной икринки (икринок) мечущего икру водного животного с гуанидинсодержащим соединением, способным увеличивать проницаемость хориона икринки (икринок).
[0013] Описание дополнительно относится к способам получения популяций стерильных мечущих икру водных животных, причем способы стерилизации включают нарушение миграции и/или развития первичной зародышевой клетки в каждой обработанной особи без вредного влияния на другие характеристики нормального животного.
[0014] Еще один аспект описания относится к способу получения репродуктивно стерильных мечущих икру водных животных, включающему введение в контакт оплодотворенной икринки (икринок) с антисмысловым морфолиновым олигомером, выбранным из олигомерных последовательностей, содержащих 12 оснований, которые эффективно трансфецируют икринку (икринки) и делают полученную из нее особь (особей) репродуктивно стерильной.
[0015] Другой аспект описания относится к способу получения репродуктивно стерильных мечущих икру водных животных, включающему введение в контакт оплодотворенной икринки (икринок) немедленно после оплодотворения с антисмысловым морфолиновым олигомером, который эффективно трансфецирует икринку (икринки) и делает полученную из нее особь (особей) репродуктивно стерильной.
[0016] Другие аспекты, признаки и преимущества изобретения будут лучше понятны из приведенного далее описания и приложенной формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0017] Фиг. 1 представляет собой блок-схему лекарственного скрининга или анализов токсичности агентов, проводимы в соответствии с вариантами реализации описания, использующими гуанидинсодержащее соединение (соединения) (GCCs) для увеличения проницаемости хориона.
[0018] Фиг. 2 представляет собой блок-схему получения репродуктивно стерильной рыбы в соответствии с вариантами реализации описания, использующими гуанидинсодержащее соединение (соединения) (GCCs) для увеличения проницаемости хориона.
[0019] Фиг. 3 представляет собой блок-схему получения репродуктивно стерильной рыбы в соответствии с вариантами реализации описания.
[0020] Фиг. 4 представляет собой флуоресцентную микрофотографию, демонстрирующую эффекты введения рыбным эмбрионам (конъюгата) флуоресцеин-декстран с использованием GCC-аргинина, гуанидина-HCl и гуанидинтиоцианата.
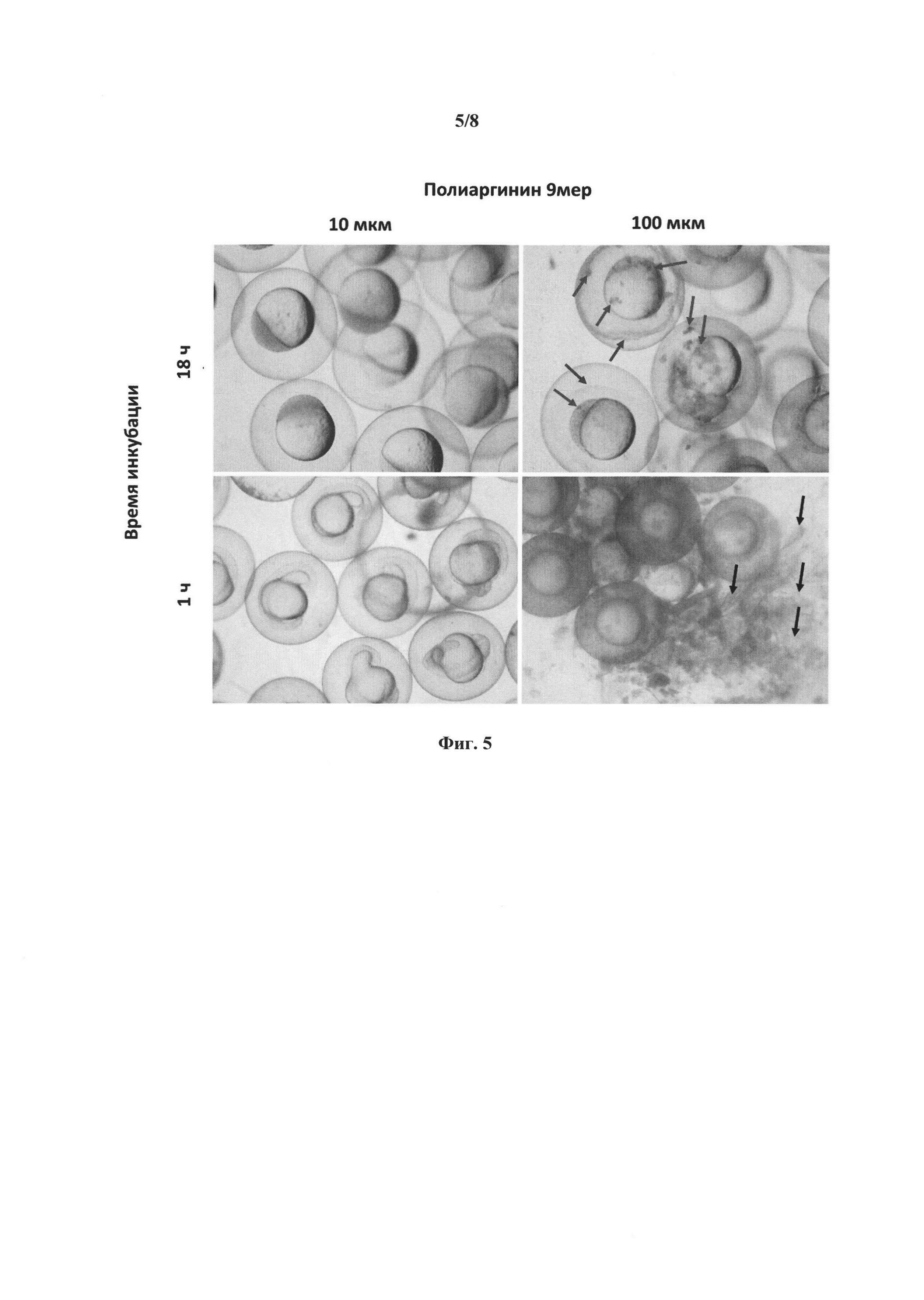
[0021] Фиг. 5 представляет собой микрофотография, демонстрирующие эффекты введения рыбным эмбрионам полиаргинина/9 мера. Фиг. 5 представляет результаты в виде фотографий в светлом поле, показывающие, что высокая концентрация полиаргинина/9 мера (100 мкМ) приводила к образованию неспецифических агрегатов в течение 1 часа инкубации и вызывала лизис хориона после 18 часов инкубации, которые не наблюдались в группе, получившей 10 мкМ полиаргинина/9 мера.
[0022] Фиг. 6A-6D представляют собой микрофотографии, демонстрирующие эффекты введения рыбным эмбрионам (конъюгата) флуоресцеин-декстран, взятого отдельно и в комбинации с полиаргинином. Фиг. 6А представляет результаты в виде фотографий в светлом поле для полиаргинина и (конъюгата) флуоресцеин-декстран; Фиг. 6В представляет результаты в виде фотографий в светлом поле для одного (конъюгата) флуоресцеин-декстран. Фиг. 6С представляет результаты в виде флуоресцентных фотографий для полиаргинина и (конъюгата) флуоресцеин-декстран; Фиг. 6D представляет результаты в виде флуоресцентных фотографий для одного (конъюгата) флуоресцеин-декстран.
[0023] Фиг. 7A-7G представляют собой микрофотографии, показывающие dnd-MO-Vivo индуцированную стерильность лососевых у радужной форели. Исследования гонадальной ткани показывают (Фиг. 7А) хорошо развитые семенники у не получавших препарата самцов рыб; (Фиг. 7В) хорошо развитые яичнику у не получавших препарата самок рыб; (Фиг. 7С) гонады лососевых рыб, получавших dnd-MO-Vivo, развивались в тонкие нитеподобные образования; (Фиг. 7D) микрофотография рассеченных гонад; (Фиг. 7Е) активный сперматогенез семенников не получавших препарата самцов рыб; (Фиг. 7F) хорошо развитый яичник не получавшей препарата контрольной самки с ооцитами на разных стадиях развития; (Фиг. 7G) гистологические исследования гонадальной ткани показывают, что гонады лососевых рыб, получавших dnd-MO-Vivo, выглядят недоразвитыми без развитой гонадальной структуры или зародышевых клеток.
[0024] Фиг. 8A-8D представляют собой микрофотографии, показывающие, что введение лососевым dnd-MO или dnd-MO-Vivo блокировало гонадальное развитие у атлантического лосося. Для атлантического лосося в возрасте 10 месяцев: (Фиг. 8А) развивающиеся семенники не получавшего препарата самца; (Фиг. 8В) развивающийся яичник не получавшей препарата самки; (Фиг. 8С) гонады получавшей dnd-MO-Vivo или получавшей dnd-MO рыбы развивались в тонкие нитеподобные образования; (Фиг. 8D) микрофотографии рассеченных гонад (А), (В) и (С).
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0025] В одном аспекте, описание относится к способу увеличения проницаемости хориона икринки (икринок) мечущего икру водного животного, включающему введение в контакт оплодотворенной или неоплодотворенной икринки (икринок) мечущего икру водного животного с гуанидинсодержащим соединением, способным увеличивать проницаемость хориона икринки (икринок). Такой способ позволяет обеспечить доставку в эмбрион агентов, представляющих интерес, путем увеличения проницаемости хориона в стпени, достаточной для того, чтобы агент получил доступ вовнутрь икринки.
[0026] Доставка агентов в рыбу или других мечущих икру водных животных традиционно осуществлялась с кормом, путем инъекции, или погружением эмбрионов или особей в агент, представляющий интерес. Инъекции в стаде, однако, являются непрактичными в крупномасштабном коммерческом хозяйстве аквакультуры. Кроме того, использование обработки погружением оплодотворенных и активированных водой икринок было ограничено из-за низкой проницаемость хориона икринок, толстого ацеллюлярного многослойного покрытия, также известного как оболочка икринок, состоящего преимущественно из белков и гликопротеинов. Типично, при обработке погружением эмбрионов рыбы или других мечущих икру водных животных, агенты, представляющие интерес, в качестве примера, такие как большие молекулярные соединения, неспособны проходить через хорион и достигать эмбриона.
[0027] После овуляции/икрометания и перед оплодотворением и активацией водой, икринки имеют проницаемый и перфорированный хорион (или внешнюю оболочку), что позволяет воде и веществам проникать в неоплодотворенные икринки через поры или микропиле, маленький канал в хорионе икринки, позволяющий сперме проникать в икринку для оплодотворения. После оплодотворения и активации водой, однако, хорион уплотняется, и икринка становится по существу непроницаемой, препятствуя дальнейшему поглощению веществ или воды из окружающей среды.
[0028] Способы по изобретению предлагают увеличение проницаемости хориона икринки (икринок) мечущего икру водного животного, будь то оплодотворенная или неоплодотворенная икринка, так чтобы можно было осуществлять доставку по меньшей мере одного агента в икринку (икринки) мечущего икру водного животного. Такие способы включают введение в контакт оплодотворенной или неоплодотворенной икринки (икринок) мечущего икру водного животного с по меньшей мере одним агентом в присутствии гуанидинсодержащего соединения (GCC), способного увеличивать проницаемость хориона икринки (икринок).
[0029] Введение в контакт оплодотворенной или неоплодотворенной икринки (икринок) включает хорионическую трансфекцию икринки (икринок).
[0030] Гуанидинсодержащее соединение в аспектах описания могут быть выбраны из гуанидина, производных гуанидина, димеров, тримеров или полимеров гуанидина, например дендримеров, или их солей, или аргинина, производных аргинина, димеров, тримеров или полимеров аргинина, например дендримеров, или их солей, содержащих гуанидиновый фрагмент, и их смесей.
[0031] Гуанидинсодержащие соединения, пригодные для использования в раскрытых способах, представляют собой гуанидинсодержащие соединения, эффективно увеличивающие проницаемость хориона икринки (икринок) водных животных. В используемом в данном документе значении «эффективно увеличивающий проницаемость хориона» означает, что после контакта икринки водного животного с гуанидинсодержащим соединением, хорион такой икринки является более проницаемым, чем хорион икринки такого водного животного, не контактировавшей с гуанидинсодержащим соединением. В качестве примера, проницаемость хориона икринки водного животного после контакта с гуанидинсодержащим соединением в момент времени Т1 будет более проницаемым, чем хорион икринки этого же водного животного, не контактировавшей с гуанидинсодержащим соединением в момент времени Т1. Проницаемость может быть определена способами, известными специалистам в данной области техники; см., например, Hagedorn, М., et al. (1997) «Water distribution and permeability of zebrafish embryos, Brachydanio rerio» J Exp Zool 278, 356-371; и Kais, В., et al., (2013) «DMSO modifies the permeability of the zebrafish (Danio rerio) хорион-implications for the fish embryo test (FET),» Aquat Toxicol, 140-141: p.229-38.
[0032] В используемом в данном документе значении, термин "производные" должен обозначать производные, имеющие такую же самую функциональную структуру, как и соединение, к которому они относятся, и имеющие схожие свойства, например, эффективно увеличивающие проницаемость хориона икринки (икринок) водных животных.
[0033] В используемом в данном документе значении "гуанидин" означает любое соединение, содержащее в своей химической формуле по меньшей мере один атом углерода, имеющий двойную связь с атомом азота и простые связи с двумя другими атомами азота, и включает соли таких соединения.
[0034] Гуанидинсодержащее соединение, в одном аспекте, может быть выбрано из соединений общей формулы (А) ниже:

где:
R1, R2, R3, R4 и R5 обозначают, независимо:
атом водорода, нитро, амино, циано, фенил, циклогексил, бензил, или линейный или разветвленный С1-С4 низший алкильний или С1-С4 алкенильный радикал, необязательно замещенный одним или двумя радикалами, выбраными из: гидроксила, амино, диметиламино, метокси, этокси, карбоксила, карбоксамида, N-метилкарбоксамида или SO3H, или их соли.
[0035] Примеры гуанидинсодержащих соединений включают аргинин, гуанидин-HCl, гуанидин-тиоцианат, гуанидин-ацетат, гуанидин-карбонат, гуанидин-нитрат, гуанидин-сульфат, гуанидин-бикарбонаты и гуанидин-гидробромиды.
[0036] В других аспектах, гуанидинсодержащее соединение представляет собой гуанидинсодержащий димер, тример или полимер. В одном аспекте, гуанидинсодержащее соединение может быть выбрано из соединений общих формул (I) - (IV) ниже:






[0037] Переменная группа «R» может быть выбрана из атома водорода, нитро, амино, циано, фенила, циклогексила, бензила, или линейного или разветвленного С1-С4 низшего алкильного или С1-С4 алкенильного радикала, необязательно замещенного одним или двумя радикалами, выбранными из: гидроксила, амино, диметиламино, метокси, этокси, карбоксила, карбоксамида, N-метилкарбоксамида или SO3H, или их солей. Переменный линкер, связывающий с основной цепью, может быть выбран из аминокислоты, нуклеотида, фосфорамидата, гликоля, полиэтиленгликоля, нитро, амино, циано, фенила, циклогексила, бензила, или линейного или разветвленного С1-С4 низшего алкила. В качестве примера, полиаргинин/9-аргинин представляет собой соединение формулы I с n=9.
[0038] Гуанидинсодержащие соединения могут быть использованы в способах доставки по меньшей мере одного агента в оплодотворенную или неоплодотворенную икринку (икринки) мечущего икру водного животного, причем указанный способ включает введение в контакт оплодотворенной или неоплодотворенной икринки (икринок) с по меньшей мере одним агентом в присутствии гуанидинсодержащего соединения, которое эффективно увеличивает проницаемость хориона икринки (икринок).
[0039] Агент может быть любым соединением, лекарственным средством или препаратом-кандидатом, биологически активным агентом или потенциально биологически активным агентом, лекарственным препаратом, химически активным веществом, терапевтическим средством, или другим тестируемым веществом. Перечисленные материалы включают, без ограничения, такие формы, как незаряженные молекулы, молекулярные комплексы, соли, простые эфиры, сложные эфиры, амиды и т.д.
[0040] В качестве примера, агент или агенты могут быть помещены в среду для погружения, содержащую оплодотворенную или неоплодотворенную икринку (икринки) и гуанидинсодержащее соединение (соединения), так чтобы агент(ы) находились в присутствии гуанидинсодержащего соединения.
[0041] Гуанидинсодержащие соединения в способах по изобретению являются ковалентно связанными или не связанными ковалентно с агентом (агентами). Было обнаружено, что гуанидинсодержащие соединения способны увеличивать проницаемость хориона икринки (икринок) мечущего икру водного животного и обеспечивать возможность доставки агентов в эмбрион даже в тех случаях, когда гуанидинсодержащие соединения не связаны ковалентно с или не конъюгированы с агентом.
[0042] Гуанидинсодержащее соединение в соответствии с некоторыми аспектами описания может быть дендримером, например, октагуанидиновым дендримером, содержащим триазиновое ядро, например, таким как описанный в патенте США №7935816, также известный специалистам в данной области техники как «Vivo». Соответствующая часть описания патента США №7935816 настоящим включена в данный документ в качестве ссылки в полном объеме. В определенных вариантах реализации описания, если гуанидинсодержащее соединение представляет собой октагуанидиновый дендример, содержащий фрагмент триазинового ядра, гуанидинсодержащее соединение не связано ковалентно с, или не конъюгировано с, агентом (агентами), представляющими интерес.
[0043] Среда для погружения в вариантах реализации является водной средой. Среда для погружения может быть любой такой средой, известной квалифицированным специалистам в данной области техники для использования с икринками водных животных. Среда для погружения, например, может быть водной средой, которая может дополнительно содержать пресную воду, солоноватую воду, морскую воду, овариальную жидкость рыб или разбавитель для оплодотворения, содержащий соль, трис (Tris) (рН 7-9), глицин, и/или 0-30% сыворотки и ингибиторы протеазы, такие как апротинин или лейпептин.
[0044] Концентрация гуанидинсодержащего соединения в среде для погружения представляет собой количество, достаточное для увеличения проницаемости хориона икринок в среде для погружения. В качестве примера, концентрация гуанидинсодержащего соединения может иметь значение в диапазоне от примерно 1 до примерно 80000 мкМ, предпочтительно, в диапазоне от примерно 20 до примерно 40000 мкМ, и более предпочтительно, в диапазоне от примерно 40 до примерно 20000 мкМ.
[0045] Обнаружение того, что гуанидинсодержащие соединения в соответствии с описанием способны эффективно увеличивать проницаемость хориона икринок водных животных обеспечивает возможность эффективной доставки агентов в икринки и эмбрионы водных животных. Доставка агентов дополнительно позволяет использовать водных животных в моделях скрининга лекарственных средств или биологически активных агентов или в анализах по оценке токсичности тестируемого агента. В качестве примера, данио-рерио использовались в фенотипических моделях для скрининга лекарственных средств или биологически активных агентов. Соответственно, способы, раскрытые в данном документе, могут быть использованы, например, в методах скрининга лекарственных средств или биологически активных агентов, анализах по оценке безопасности или токсичности лекарственных средств или биологически активных агентов, и способах оценки биологического ответа на тестируемый агент.
[0046] Фиг. 1 иллюстрирует один пример применения гуанидинсодержащих соединений в лекарственном скрининге или анализе токсичности агентав. Как показано, оплодотворенные икринки помещают в ванну с агентом. Одну группу икринок погружают в ванну с агентом без гуанидинсодержащих соединений и одну группу икринок погружают в ванну с агентом в присутствии гуанидинсодержащих соединений. Терапевтическую или токсичную реакцию икринок, погруженных в соединение с GCC, можно контролировать и/или оценивать.
[0047] Аспекты описания, таким образом, охватывают способ скрининга тестируемого агента, такого как лекарственное средство или биологически активный агент, например антитело, белок, пептид, РНК или ДНК, включающий введение в контакт икринки (икринок) мечущего икру водного животного с по меньшей мере одним агентом в присутствии гуанидинсодержащего соединения, которое эффективно увеличивает проницаемость хориона икринки (икринок), и идентификацию ответа, например, физиологической реакции. В качестве примера, метод скрининга может быть использован для оценки тестируемого агента, оценки эффектов тестируемого агента на рыбный эмбрион, оценки токсичности тестируемого агента и т.д.
[0048] Способы в соответствии с описанием дополнительно охватывают использование гуанидинсодержащих соединений в анализах безопасности и токсичности соединений, в которых тестируемый агент вводят в контакт с икринкой (икринками)/эмбрионом (эмбрионами) мечущего икру водного животного в присутствии гуанидинсодержащего соединения, которое эффективно увеличивает проницаемость хориона икринки (икринок)/эмбриона (эмбрионов), и идентифицируют ответ, например, исцеление болезни или физиологическую реакцию (аномалия и смертность) и контролируют и оценивают ответ на тестируемый агент.
[0049] Описание дополнительно предусматривает способы получения репродуктивно стерильных мечущих икру водных животных, включающие введение в контакт икринок в среде для погружения с выбранными агентами, приводящими к получению репродуктивно стерильных особей. Способы стерилизации включают нарушение гонадального развития эмбриона. Настоящее описание также относится к способам предотвращения скрещивания между доместицированной, инородной и генетически модифицированной выращиваемой на фермах рыбой/другими мечущими икру водными животными и их дикими популяциями (stocks), а также акклиматизации таких разводимых в аквакультуре рыб и других мечущих икру водных животных в условиях дикой природы. Кроме того, раскрытые способы могут быть использованы для обеспечения предотвращения генетического загрязнения дикой популяции выращиваемой на фермах рыбой и другими мечущи икру водными животными.
[0050] В используемом в данном документе значении, «стерилизация» мечущих икру водных животных должна пониматься как лишение особей способности к половому размножению. Репродуктивно стерильные мечущие икру водные животные определяются как особи, неспособные достигать половой зрелости или размножаться при достижении возраста половой зрелости.
[0051] Описание, таким образом, предусматривает способ получения репродуктивно стерильных мечущих икру водных животных, включающий введение к контакт икринки (икринок) с агентом, эффективно трансфицирующим икринку (икринки) и делающим полученную из нее особь (особей) репродуктивно стерильной. В некоторых аспектах, агент вводится в контакт с икринками в присутствии гуанидинсодержащего соединения. В некоторых аспектах, агент представляет собой антисмысловой морфолиновый олигомер.
[0052] Способы получения репродуктивно стерильной рыбы и других мечущих икру водных животных включают введение агентов в их икринки для нарушения развития, миграции и колонизации первичной зародышевой клетки (PGC) в гонады эмбриона, что приводит к нарушению развития гонад и/или нарушению полной и надлежащей гонадальной функции на клеточном или тканевом уровне, и в конечном счете к получению стерильной рыбы и других мечущих икру водных животных.
[0053] PGC представляют собой популяцию клеток рыбных эмбрионов, которые являются предшественниками гамет взрослой рыбы и других мечущих икру водных животных. PGC продуцируются на очень ранних стадиях эмбрионального развития. На более поздних стадиях эмбрионального развития, PGC мигрируют в эмбрионе из их первоначального местонахождения в область предшественников гонад. В конце своей миграции PGC проникают в развивающиеся гонады, колонизируют ткань и запускают процесс гаметогенеза, приводящий к зрелым гонадам у взрослой рыбы и других мечущих икру водных животных.
[0054] Способы по изобретению позволяют получать репродуктивно стерильных (бесплодных) мечущих икру водных животных. Стратегия стерилизации будет специфически нарушать развитие гонад в особях без вредного влияния на какие-либо другие характеристики, приводя к получению совершенно нормальных, но репродуктивно стерильных мечущих икру водных животных.
[0055] Таким образом, в различных вариантах реализации, изобретение предусматривает способ эффективного введения агентов в эмбрионы путем введения в контакт икринок с агентами, пригодными для нарушения развития, миграции и/или выживания PGC в большом числе эмбрионов, приводящий к крупномасштабному производству репродуктивно стерильной взрослой рыбы и других мечущих икру водных животных. Способы по изобретению также применимы к отдельным эмбрионам при малых масштабах получения репродуктивно стерильной взрослой рыбы и других мечущих икру водных животных.
[0056] В некоторых аспектах, агент, вводимый в икринки для обеспечения репродуктивной стерильности получаемых из них особей (особи), доставляется в присутствии гуанидинсодержащего соединения в соответствии с данным описанием. Фиг. 2 иллюстрирует пример применения гуанидинсодержащих соединений для получения бесплодной рыбы. Как показано на Фиг. 2, оплодотворенные икринки погружают в ванну с агентом, содержащую гуанидинсодержащее соединение (соединения) или не содержащую каких-либо GCC. Икринки погружают в ванну на 24 часа и затем промывают. Икринки, погруженные в ванну с GCC (одним или несколькими), приводят к получению бесплодной рыбы вследствие нарушения миграции PGC, в то время как икринки, погруженные в ванну без GCC, дают фертильную рыбу.
[0057] Агенты для использования в способах по изобретению могут включать известные агенты, способные нарушать развитие, миграцию и/или выживание PGC, и способные проникать через хорион оплодотворенной или неоплодотворенной икринки, или используются в присутствии соединения, способствующего проникновению в икринки. В одном аспекте, такой агент может быть антисмысловым морфолиновым олигомером, способным нарушать развитие PGC и способным проходить через хорион икринок. Таким образом, в некоторых вариантах реализации, антисмысловой морфолиновый олигомер, пригодный для использования в способах по изобретению, представляет собой антисмысловой морфолиновый олигомер, который эффективно трансфецирует икринку (икринки) и делает полученную из нее особь (особей) репродуктивно стерильной.
[0058] Антисмысловой морфолиновый олигомер используется для транзиентного подавления генной экспрессии путем блокирования трансляции или сплайсинга РНК, которые являются существенными стадиями образования мРНК. Могут быть идентифицированы специфические антисмысловые морфолиновые олигомеры, транзиентно блокирующие или подавляющие экспрессию генов, существенных для развития эмбриональных зародышевых клеток, включая, без ограничений, рецептор dead end (dnd), nanos, vasa, gnrh или fsh, приводящий к нарушению гонадального развития и, в конечном счете, получению стерильной рыбы и других мечущих икру водных животных.
[0059] Таким образом, в одном аспекте описания, предлагается способ получения репродуктивно стерильных мечущих икру водных животных, включающий введение в контакт оплодотворенной или неоплодотворенной икринки (икринок) с антисмысловым морфолиновым олигомером, который эффективно трансфецирует икринку (икринки) и делает полученную из нее особь (особей) репродуктивно стерильной. Введение в контакт может в некоторых аспектах включать присутствие гуанидинсодержащих соединений в соответствии с приведенным в данном документе описанием. Введение в контакт включает хорионическую трансфекцию икринки (икринок). Введение в контакт может происходить во время активации водой.
[0060] В таком аспекте, описание относится к способам получения репродуктивно стерильных мечущих икру водных животных путем введения в икринки эффективных морфолиновых олигомеров для нарушения развития первичных зародышевых клеток (PGC) и миграции к, и колонизации в, гонадах эмбриона, что приводит к нарушению развития гонад и/или полноценного и правильного функционирования гонад на клеточном или тканевом уровне, и в конечном счете, получению стерильной рыбы.
[0061] Dead end (dnd) представляет собой специфический для позвоночных компонент зародышевой плазмы и терминальных гранул, существенный для развития зародышевых клеток. Ген dnd специфически экспрессируется в зародышевой плазме и первичных зародышевых клетках. Поскольку dnd считается существенным для нормальной миграции и выживания PGC, эмбрионы, лишенные этого белка, развиваются в стерильных взрослых особей.
[0062] Раскрытые способы пригодны для получения репродуктивно стерильной рыбы и других мечущих икру водных животных для аквакультуры, аквариумистики, и борьбы с инвазивными видами. В одном аспекте, способы включают нарушение гонадального развития вследствие введения антисмыслового морфолинового олигомера против dead end-мРНК (dnd-MO) или других генов, существенных для гонадального развития, включая, без ограничений, рецептор nanos, vasa, gnrh или fsh, в оплодотворенную икринку (икринки). Действие dnd-MO или другого антисмыслового морфолинового олигомера на гены, существенные для гонадального развития, приводит к нарушению развития фертильных гонад и стерильной взрослой рыбе.
[0063] В вариантах реализации, dnd-MO способен транзиентно подавлять экспрессию белка Dead end, существенного для развития эмбриональной зародышевой клетки.
[0064] Настоящее описание также относится к специфическим морфолиновым олигомерным последовательностям для использования в способах подавления экспрессии гена dead end у рыб.
[0065] Фиг. 3 представляет собой блок-схему получения репродуктивно стерильной рыбы путем введения специфических морфолиновых олигомеров против dead end-мРНК рыбы для нарушения развития первичных зародышевых клеток (PGC), что приводит к нарушению развития гонад, и в конечном счете, получению стерильной рыбы. Если икринки не обрабатывать морфолиновыми олигомерами, они могут дать фертильное маточное стадо.
[0066] Как показано на Фиг. 3, икринки рыб (например, лососевых, мороновых или цихлид) вводят в контакт с морфолиновыми олигомерами против генов dead end соответствующего вида рыб. Фиг. 3 иллюстрирует введение морфолиновых олигомеров против генов dead end во время активации водой и увеличения прочности оболочек в воде. Альтернативно, икринки могут не обрабатываться. Как показано, в тех случаях, когда икринки вводят в контакт с морфолиновыми олигомерами, олигомеры вызывают подавление или блокирование трансляции белка Dead end, приводя к нарушению развития PCG. Взрослые рыбы вследствие этого являются бесплодными из-за отсутствия развития фертильных гонад. Если не мешать нормальному развитию PGC, то у рыб будет происходить нормальное развитие фертильных гонад и рыбы могут быть использованы в качестве маточного стада.
[0067] Таким образом, в вариантах реализации, антисмысловые морфолиновые олигомеры способны эффективно подавлять экспрессию по меньшей мере одного гена dead end, например, по меньшей мере одного гена dead end из гена dead end лососевых, гена dead end мороновых или гена dead end цихлид.
[0068] В другом аспекте, описание относится к специфическим антисмысловым морфолиновым олигомерам, способным транзиентно и эффективно подавлять трансляцию dead end, жизненно важного гена для выживания зародышевых клеток, и специфически нарушать гонадальное развитие, приводя к получению бесплодной рыбы, например, лососевых (лососи и форели), мороновых (окуни) и цихлид (тилапии и декоративные цихлиды).
[0069] В другом аспекте, описание относится к идентификации коротких последовательностей морфолинового олигомера, которые могут легче проникать в икринки для попадания в клетки-мишени. Такие короткие последовательности предпочтительно содержат 12 оснований или 18 оснований вместо 25 оснований, как раскрыто в WO 2015/073819, который включен в данный документ в качестве ссылки. Было обнаружено, что такие морфолиновые олигомерные последовательности более эффективно транзиентно блокируют экспрессию специфических генов, жизненно важных для развития зародышевых клеток в холодноводных видах, таких как атлантический лосось. Считается, что низкая температура вылупления мальков делает короткие морфолиновые олигомеры более устойчивыми к транзиентному блокированию мРНК-мишенью экспрессии специфических генов.
[0070] Описание дополнительно относится к специфическому морфолиновому олигомеру, 5'-ACGCTCCTCCAT-3' (SEQ ID NO: 1) и его вариантам, например, 5'-ACTTGAACGCTCCTCCАТ-3' (SEQ ID NO: 2), которые способны транзиентно и эффективно подавлять экспрессию гена лососевых dead end, что приводит к нарушению развития гонад и/или нарушению полноценного и надлежащего функционирования гонад, и в конечном счете, получению стерильных лососевых. Соответственно, способы по изобретению применимы ко всем лососевым, включая, без ограничений, атлантического лосося, кижуча, чавычи, кеты, нерки, горбуши и масу, радужную, ручьевую и озерную форель, обыкновенного и сибирского хариуса, и арктического гольца, среди прочего.
[0071] Морфолиновые олигомеры могут быть вариантами перечисленных последовательностей. Эти варианты могут включать, без ограничений, другие модифицированные нуклеиновые кислоти и другие морфолиновые олигомеры, которые охватывают полностью или частично вышеперечисленные последовательности. Конкретно включены антисмысловые олигомеры, которые содержат, состоят по существу из, или состоят из, одной или нескольких из SEQ ID NO: l и SEQ ID NO: 2. Также включены варианты этих антисмысловых олигомеров, включая варианты олигомеров, имеющих 80%, 85%, 90%, 95%, 97%, 98%, или 99% (включая все промежуточные целые значения) идентичности последовательностей или гомологии последовательностей с любой из SEQ ID NO:1 и SEQ ID NO: 2., и/или варианты, отличающиеся от этих последовательностей на примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 нуклеотидов, предпочтительно, варианты, являющиеся эффективными для репродуктивной стерилизации рыбы при контакте с рыбной икринкой (икринками).
[0072] Другой аспект изобретения включает антисмысловые морфолиновые олигомеры, состоящие из SEQ ID NO: 1 и ее вариантов. Другой аспект изобретения включает подвергнутые трансфекции икринки мечущего икру водного животного, содержащие антисмысловой морфолиновый олигомер, состоящий из нуклеотидной последовательности SEQ ID NO: 1 или ее варианта.
[0073] Варианты, проявляющие эффективность при репродуктивной стерилизации рыбы после контакта с рыбной икринкой (икринками), при использовании в таком контексте, означают, что использование вариантов в способах, раскрытых в данном документе, будет приводить к репродуктивно стерильной рыбе. В вариантах реализации, варианты будут эффективно подавлять экспрессию гена dead end, представляющего интерес.
[0074] В соответствии с вариантами реализации способов в соответствии с изобретением, оплодотворенная или неоплодотворенная рыбная икринка (икринки) (одну или несколько икринок) погружают в среду для погружения, содержащую антисмысловой морфолиновый олигомер, эффективно подавляющий экспрессию гена dead end у рыбы, представляющей интерес. Такое погружение предпочтительно проводится в начале активации водой икринки (икринок). Концентрация антисмыслового морфолинового олигомера в среде для погружения должна быть достаточной для того, чтобы позволить антисмысловому морфолиновому олигомеру проходить через хорион рыбной икринки (икринок), с эффективной трансфекцией икринки (икринок). В вариантах реализации, такая концентрация типично будет составлять от примерно 1 до примерно 200 мкМ, более предпочтительно, от примерно 10 до примерно 100 мкМ, и еще более предпочтительно, от примерно 20 до примерно 60 мкМ.
[0075] Среда для погружения, в качестве примера, типично является водной средой, которая может дополнительно содержать пресную воду, солоноватую воду, морскую воду, овариальную жидкость рыбы или разбавитель для оплодотворения, содержащий соль, трис (рН 7-9), глицин, и/или 0-30% сыворотки и ингибиторы протеазы, такие как апротинин или лейпептин.
[0076] В соответствии с описанием, среда для погружения может дополнительно содержать гуанидинсодержащее соединение, как описано выше, способное увеличивать проницаемость хориона икринки (икринок).
[0077] Хотя время, необходимое для обеспечения удовлетворительной стерилизации при погружении оплодотворенных икринок рыбы или других мечущих икру водных животных, будет зависеть от вида рыбы и других мечущих икру водных животных, типично рыбные или другие икринки будут погружать в среду для погружения, содержащую морфолиновый олигомер и, необязательно, гуанидинсодержащее соединение, на период времени от примерно 2 до примерно 96 часов, более предпочтительно, от примерно 4 до примерно 72 часов, и еще более предпочтительно, от примерно 5 до примерно 48 часов.
[0078] В одном аспекте, описание относится к способам получения репродуктивно стерильной рыбы и других мечущих икру водных животных путем введения гуанидиновых дендримеров в рыбные икринки или эмбрионы с целью нарушения развития первичных зародышевых клеток (PGC) и миграции к, и колонизации в, гонадах эмбриона, что приводит к нарушению развития гонад и/или нарушению полноценного и надлежащего функционирования гонад на клеточном или тканевом уровне, и в конечном счете, получению стерильной рыбы и других мечущих икру водных животных.
[0079] В одном аспекте, описание относится к гуанидиновому дендримеру, содержащему триазиновое ядро, например, октагуанидиновый дендример с триазиновым ядром, также известному специалистам как «Vivo». Такие соединения описаны в патенте США №7935816. Описание соответствующей части патента США №7935816 настоящим включено в данный документ в качестве ссылки в полном объеме.
[0080] Иллюстративное соединение-транспортер октагуанидинового дендримера с морфолиновым фрагментом в качестве типичного представителя агента представлено в следующем конъюгате:

[0081] Конкретным гуанидиновым дендримером, пригодным для использования с морфолиновыми олигомерами в соответствии с данным описанием, является 2-[(4-нитрофенил)оксикарбонилгексаметиленкарбонилпиперазинил]-4,6-бис{ди[ди-(трифторацетами догексил)аминокарбонилоксиэтил]амино}триазин.
[0082] Описание дополнительно относится к использованию октагуанидинового дендримера с триазиновым ядром. Такой гуанидиновый дендример является эффективным для хорионического транспорта морфолинового олигомера, ковалентно связанного с морфолиновым олигомером или не связанного ковалентно с морфолиновым олигомером.
[0083] В другом аспекте, описание предусматривает способ получения репродуктивно стерильных мечущих икру водных животных, включающий введение в контакт оплодотворенной икринки (икринок) (или эмбрионов) с антисмысловым морфолиновым олигомером и гуанидиновым дендримером, эффективно трансфицирующими икринку (икринки) и делающими полученную из нее особь (особи) репродуктивно стерильной.
[0084] Выбранные морфолиновые олигомеры могут нарушать развитие, миграцию и/или выживание PGC в большом числе эмбрионов, приводя к крупномасштабному производству репродуктивно стерильной взрослой рыбы и других мечущих икру водных животных. Способы по изобретению также применимы к отдельным эмбрионам при малых масштабах получения репродуктивно стерильных взрослых рыб и других мечущих икру водных животных.
[0085] В одном варианте реализации предлагается способ получения репродуктивно стерильных мечущих икру водных животных, включающий погружение оплодотворенной или неоплодотворенной рыбной икринки (икринок) в среду для погружения, содержащую гуанидиновый дендример, например, Vivo, и антисмысловой морфолиновый олигомер, способный эффективно подавлять экспрессию гена dead end или других генов, таких как рецептор nanos, vasa, gnrh или fsh, являющихся существенными для гонадального развития рыбы и других мечущих икру водных животных. Предпочтительно, гуанидиновый дендример представляет собой октагуанидиновый дендример с триазиновым ядром, например, Vivo. Антисмысловой морфолиновый олигомер может, в качестве примера, представлять собой SEQ ID NO: 1 или SEQ ID NO: 2.
[0086] В соответствии с конкретными аспектами способов по изобретению, оплодотворенную или неоплодотворенную икринку (икринки) (одну или несколько) погружают в среду для погружения, содержащую гуанидиновый дендример и антисмысловой морфолиновый олигомер, способный эффективно подавлять экспрессию гена dead end или других генов, существенных для гонадального развития рыбы и других мечущих икру водных животных. Концентрация антисмыслового морфолинового олигомера в среде для погружения должна быть достаточной для того, чтобы позволить антисмысловому морфолиновому олигомеру проходить через хорион икринки (икринок). В вариантах реализации, такая концентрация типично будет составлять от примерно 1 до примерно 200 мкМ, более предпочтительно, от примерно 10 до примерно 100 мкМ, еще более предпочтительно, от примерно 20 до примерно 60 мкМ.
[0087] Все аспекты описания могут включать введение или использование гуанидинсодержащих соединений, эффективно увеличивающих проницаемости хориона икринки водного животного. В таких аспектах, гуанидинсодержащие соединения являются ковалентно связанными или не связанными ковалентно с любым агентом, предназначенным для проведения трансфекции хориона икринки.
[0088] Следует указать, что введение в контакт икринок и/или эмбрионов с агентами и соединениями по настоящему описанию может быть осуществлено любым пригодным способом, например, включая введение в контакт при погружении, или альтернативно путем введения в контакт без погружения, хотя следует указать, что введение в контакт при погружении является действенной и эффективной методикой введения в контакт, пригодной для крупномасштабных операций производства репродуктивно стерильной рыбы и водных животных. Методики введения в контакт без погружения, которые могут быть использованы в общей практике настоящего изобретения, включают, без ограничения, способы введения в контакт путем распыления или нанесения каплями, методы сухого нанесения, в которых икринки вводят в контакт с носителем или поверхностью, покрытой или иначе поддерживающей любые агенты или соединения по настоящему изобретению, эффективные при получении репродуктивно стерильной рыбы, или другие мтодики, с помощью которых икринки и/или эмбрионы вводят в контакт с агентами или соединениями по настоящему изобретению. Введение в контакт предпочтительно включает неинъекционное введение в контакт.
[0089] Настоящее описание относится в одном аспекте к доставке агентов в икринки рыбы или других мечущих икру водных животных путем введения в контакт икринок с агентами во время активации водой и увеличение прочности оболочек оплодотворенных икринок в воде (Фиг. 3). В течение этого периода, икринки активно поглощают воду (в качестве примера, до 14,83±2,05 микролитра на икринку атлантического лосося). Эта активное водопоглощение может быть использовано для введения агентов, например, морфолиновых олигомеров, в икринки.
[0090] Настоящее описание в некоторых аспектах описывает способы эффективной доставки агентов в икринки мечущих икру водных животных путем введения в контакт икринок с агентами, представляющими интерес, в течение окна времени, начинающегося при активации водой и увеличения прочности оболочек в воде. В различных вариантах реализации, введение в контакт включает погружение икринок в среду для погружения, содержащую один или несколько агентов, представляющих интерес. В используемом в данном документе значении, активация водой и увеличение прочности оболочек оплодотворенных икринок в воде начинается при первом контакте только что оплодотворенных икринок с водой (и заканчивается) с завершением увеличения прочности оболочек в воде.
[0091] Соответственно, в различных аспектах, настоящее описание относится к введению в контакт оплодотворенных икринок немедленно после начала активации водой с агентом в среде для погружения. Агент, используемый в среде для погружения, может способствовать стерилизации мечущих икру водных животных, и среда для погружения в конкретных вариантах реализации могут включать дополнительные агенты или другие материалы, полезные для мечущих икру водных животных, вылупляющихся из икринок, введенных в контакт со средой для погружения, например, такие материалы, как ДНК/РНК, гормоны, активаторы роста, защитные антигены, питательные вещества и т.д.
[0092] В соответствии с конкретными аспектами способов по изобретению, оплодотворенную икринку (икринки) (одну или несколько) погружают в водную среду для погружения, тем самым начиная активацию водой, содержащей антисмысловой морфолиновый олигомер или гуанидинсодержащее соединение и антисмысловой морфолиновый олигомер, способный эффективно подавлять экспрессию гена dead end или других генов, существенных для гонадального развития рыбы или других мечущих икру водных животных. Погружение продолжается до тех пор, пока хорион не завершит процесс повышения прочности. Концентрация антисмыслового морфолинового олигомера в ванне должна быть достаточной для того, чтобы позволить антисмысловому морфолиновому олигомеру проходить через хорион икринки (икринок). В вариантах реализации, такая концентрация типично будет составлять от примерно 1 до примерно 200 мкМ, более предпочтительно, от примерно 10 до примерно 100 мкМ, еще более предпочтительно, от примерно 20 до примерно 60 мкМ.
[0093] Способы по изобретению являются применимыми для мечущих икру водных животных. В используемом в данном документе значении, мечущие икру водные животные включают икромечущие виды водных животных, включая все виды рыб и других мечущих икру водных животных, таких как ракообразные и/или моллюски.
[0094] Соответственно, мечущие икру водные животные включают все виды рыб, включая, без ограничений, лосося, атлантического лосося, кижуча, чавычу, кету, нерку, горбушу, масу, форель, радужную форель, ручьевую форель, озерную форель, обыкновенного хариуса, сибирского хариуса, арктического гольца, окуня, гибридного окуня (hybrid bass), полосатого окуня, белого американского окуня, гибридов полосатого и белого американского окуня, каменного окуня yellow bass, окуня (perch), американского лаврака, желтого окуня, европейского окуня (European perch), гибридов окуней (bass-perch hybrids), нильскую тилапию, голубую тилапию, гибридов голубой и нильской тилапии, мозамбикскую тилапию, данио-рерио, карпообразных (carp species), лещей, красных морских карасей, морских карасей (porgies), зубаток и треску.
[0095] Способы по изобретению дополнительно применимы к мечущим икру водным животным, таким как ракообразные и/или моллюски. Такие мечущие икру водные животные могут включать, без ограничений, креветку (shrimp), креветку (prawn), омара, речного рака, крабов, устриц, кальмаров, осьминогов и т.п.
[0096] Преимущества и признаки описания дополнительно проиллюстрированы ссылками на следующие примеры, которые никоим образом не должны истолковываться как ограничивающие объем изобретения, а являются иллюстрациями конкретных вариантов реализации изобретения в конкретных случаях его применения.
[0097] Примеры:
[0098] Данио-рерио были выбраны для первичной иллюстрации способов по изобретению, благодаря их короткому времени жизни поколения и большому числу эмбрионов, образующихся при спаривании, которые могут быть легко получены ежедневно или еженедельно. Дополнительно, эмбрионы данио-рерио являются прозрачными, что позволяет легко проводить визуальные наблюдения, и выносливыми. Нормальное развитие PGC и гонад в эмбрионе представляет собой эволюционно консервативный механизм, присущий всем рыбам. Соответственно, способы по изобретению применимы ко всем видам рыб, включая, без ограничений, данио-рерио, карпообразных, форелевых, лососевых, лещей (включая красных морских карасей и морских карасей), окуней (basses) (включая морских и пресноводных каменных окуней, и гибридных окуней и т.д.), окуней (perches) (желтого окуня, американского лаврака и т.д.), зубаток, треску и другие основные классы, являющиеся кандидатами на культивацию в неволе.
[0099] Как описано в данном документе, способы в общем применимы для выращиваемой на фермах рыбе и водным мечущим икру животным, поскольку является желательным получение стерильных разводимых видов. Соответственно, способы по изобретению применимы к любым разводимым видам рыбы и водных мечущих икру животных, в частности, к коммерчески важным разводимым видам.
[00100] Пример 1
[00101] Изобретение относится к конкретным химическим соединениям, например, гуанидинсодержащим соединениям, которые способны увеличивать проницаемость хориона, что позволяет агентам, таким как большие молекулы, проходить через хорион и попадать в икринку и эмбрион.
[00102] Икринки данио-рерио инкубируют в растворах, содержащих 1 мкМ 10, 20 или 40 кДа (KD) (конъюгата) флуоресцеин-декстран с 0 или 40 мМ аргинина, гуанидина-НСl или гуанидина-тиоцианата в течение 24 часов.
[00103] Результаты флуоресцентной фотографии показывают, что аргинин, гуанидин-HCl и гуанидин-тиоцианат увеличивают поглощение (конъюгата) флуоресцеин-декстран икринками, обработанными 40 мМ аргинина, гуанидина-HCl или гуанидина-тиоцианата (обработанные икринки) по сравнению с поглощением икринок, которые инкубировали в растворах, содержащих только (конъюгат) флуоресцеин-декстран, без гуанидинсодержащих соединений (необработанные икринки). Как показано на Фиг. 4, обработанные икринки поглощают больше (конъюгата) флуоресцеин-декстран, чем необработанные икринки, на что указывает более сильная зеленая флуоресценция, наблюдающаяся для обработанных икринок. Таким образом, аргинин, гуанидин-HCl и гуанидин-тиоцианат увеличивают проницаемость хориона.
[00104] Кроме того, все три разных размера (молекулярные веса 10, 20 и 40 KD)
(конъюгата) флуоресцеин-декстран поглощплись обработанными икринками. Соответственно, способы изобретения применимы для всех мечущих икру водных животных и пригодны для трансфекции икринок молекулами разного размера, включая как малые, так и большие молекулы.
[00105] Пример 2
[00106] Помещают 40 икринок данио-рерио в каждую лунку 48-луночных планшетов, содержащую 300 мкл пресной воды из цистерны. После размещения икринок, воду из системы водоснабжения в каждой лунке заменяют на 300 мкл воды, содержащей 10 или 100 мкМ полиаргинина (9-аргининовый полимер). После 18 часов инкубации икринки анализируют с помощью флуоресцентного микроскопа Axioplan 2 (ZEISS, Thornwood, NY, USA). Микроскоп оснащен цифровой камерой DP70 (Olympus, Center Valley, PA, USA).
[00107] Фиг. 5 показывает микрофотографии, полученные в этих исследованиях. Как видно на фотографиях в светлом поле, высокая концентрация полиаргинина/9 мера (100 мкМ) приводила к образованию, в течение 1 часа инкубации, неспецифических агрегатов, которые не наблюдались в группе, обработанной 10 мкМ полиаргинина/9 мера. После 18 часов инкубация, высокая концентрация полиаргинина/9 мера (100 мкМ) вызывала лизис хориона, что не наблюдалось в группе, обработанной 10 мкМ полиаргинина/9 мера.
[00108] Пример 3
[00109] Помещали 40 икринок данио-рерио в каждую лунку 48-луночных планшетов, содержащую 300 мкл пресной воды из цистерны. После размещения икринок, воду из системы водоснабжения в каждой лунке заменяют на 300 мкл воды, содержащей 0 или 40 мкМ полиаргинина (9-аргининовый полимер) и 1 мкМ 10 кДа (конъюгата) флуоресцеин-декстран. После 4 часов инкубации икринки анализируют с помощью стереомикроскопа MZ12 (Leica, Buffalo Grove, USA), или флуоресцентного микроскопа Axioplan 2 (ZEISS, Thornwood, NY, USA). Оба микроскопа были оснащены цифровой камерой DP70 (Olympus, Center Valley, PA, USA).
[00110] На Фиг. 6A-6D представлены микрофотографии, полученные в этих исследованиях. Как показано, полиаргинин увеличивает проницаемость хориона. Икринки данио-рерио, которые инкубируют в растворах, содержащих 1 мкМ 10 кДа (конъюгата) флуоресцеин-декстран с 0 или 40 мкМ полиаргинина, представлены на Фиг. 6А и 6 В. Фотографии в светлом поле показывают, что полиаргинин (Фиг. 6А) приводит к образованию неспецифических агрегатов, которые не наблюдаются в контроле (Фиг. 6 В).
Фиг.6С и Фиг. 6D показывают флуоресцентные фотографии, на которых видно, что полиаргинин увеличивает поглощение (конъюгата) флуоресцеин-декстран, про что свидетельствует более сильная зеленая флуоресценция, наблюдающаяся для обработанных полиаргинином икринок (Фиг. 6С), по сравнению с контрольными икринками (Фиг. 6D).
[00111] Пример 4
[00112] Дендримерный октагуанидин с триазиновым ядром, также известный как Vivo, конъюгируют с dnd-MO данио-рерио, и используют при погружении эмбрионов данио-рерио в воду. Пригодность способов, раскрытых в данном документе, для индукции стерильности данио-рерио, испытывают путем введения следующих систем:
A: dnd-MO-Vivo 60 мкМ в течение 0,5 часа, 40 мкМ в течение 2 часов, 20 мкМ в течение 3 часов, 10 мкМ в течение 4,5 часов и 5 мкМ в течение 14 часов, введение начинается с момента начала активации водой и увеличения прочности оболочек в воде (немедленно после оплодотворения);
В: раствор, содержащий только воду, в качестве контроля;
С: dnd-MO-Vivo 60 мкМ в течение 0,5 часа, 40 мкМ в течение 2 часов, 20 мкМ в течение 3 часов, 10 мкМ в течение 4,5 часов и 5 мкМ в течение 14 часов, введение начинают через один час после оплодотворения.
[00113] Для данио-рерио, 100% индукция стерильности может быть достигнута только в случае, когда dnd-MO-Vivo вводят немедленно после начала активации водой и увеличения прочности оболочек в воде. Если dnd-MO-Vivo вводят через 1 час после активация водой, то бесплодными были только 44-59% обработанных рыб (Таблица 1).

[00115] Пример 5
[00116] Дендримерный октагуанидин с триазиновым ядром, также известный как Vivo, конъюгируют с dnd-MO лососевых, 5'-CTGACTTGAACGCTCCTCCATTATC-3' (SEQ ID №3), и используют при погружении эмбрионов радужной форели в содержащую его воду, или неоплодотворенных икринок в овариальную жидкость или разбавитель для оплодотворения. Пригодность способов, раскрытых в данном документе, для индукции стерильности радужной форели, испытывают путем введения следующих систем:
I: dnd-MO-Vivo лососевых, 10 мкМ, в течение 48 часов, введение в оплодотворенные икринки с момента начала активации водой (в течение 1 минуты)
II: dnd-MO-Vivo лососевых, 10 мкМ, в течение 48 часов, введение в неоплодотворенные икринки с использованием овариальной жидкости как среды для погружения. Оплодотворение проводят после 48 часов инкубации.
Ill: dnd-MO-Vivo лососевых, 10 мкМ, в течение 48 часов, введение в неоплодотворенные икринки с использованием разбавителя для оплодотворения, содержащего соль, трис (рН 8,0), глицин, и 5% рыбьей сыворотки. Оплодотворение проводят после 48 часов инкубации.
IV: Только вода или среда для погружения без dnd-MO-Vivo лососевых, в качестве контроля.
[00117] Фиг. 7A-7G показывают, что обработка dnd-MO-Vivo лососевых индуцирует бесплодие радужной форели. (Фиг. 7А) - хорошо развитые семенники необработанных контрольных самцов рыб, режим обработки IV; (Фиг. 7В) хорошо развитые яичники необработанных контрольных самок рыб, режим обработки IV; (Фиг. 7С) гонады рыб, обработанных 10 мкМ dnd-MO-Vivo лососевых, режимы обработки I, II и III, развившиеся в тонкие нитеподобные образования; (Фиг. 7D) микрофотография рассеченных гонад; (Фиг. 7Е) активный сперматогенез семенников необработанных контрольных самцов рыб (режим обработки IV); (Фиг. 7F) хорошо развитый яичник не получавшей препарата контрольной самки (режим обработки IV) с ооцитами на разных стадиях развития; (Фиг. 7G) гистологические исследования гонадальной ткани показывают, что гонады лососевых рыб, получавших dnd-MO-Vivo (режимы обработки I, II и III), выглядят недоразвитыми без развитой гонадальной структуры или зародышевых клеток.
[00118] Пример 6
[00119] Для индуцирования стерильности атлантического лосося используют dnd-MO лососевых (см. Пример 5) или дендримерный октагуанидин с триазиновым ядром, также известный как Vivo, конъюгированный с dnd-MO лососевых, с образованием dnd-MO-Vivo лососевых, и испытания проводят путем введения следующих систем:
I: dnd-MO-Vivo лососевых, 10 мкМ, в течение 48 часов, введение в оплодотворенные икринки с начала активации водой (в течение 1 минуты).
II: dnd-MO-Vivo лососевых, 10 мкМ, в течение 48 часов, введение в неоплодотворенные икринки с использованием овариальной жидкости как среды для погружения. Икринки оплодотворяют после 48 часов инкубации.
III: dnd-MO-Vivo лососевых, 10 мкМ, в течение 48 часов, введение в неоплодотворенные икринки с использованием среды для погружения, содержащей соль, трис (рН 8,0), глицин, и 5% рыбьей сыворотки. Оплодотворение проводят после 48 часов инкубации.
IV: dnd-MO лососевых, 20 мкМ, в течение 48 часов, введение в неоплодотворенные икринки с использованием овариальной жидкости как среды для погружения. Икринки оплодотворяют после 48 часов инкубации.
V: dnd-MO лососевых, 20 мкМ, в течение 48 часов, введение в неоплодотворенные икринки с использованием среды для погружения, содержащей соль, трис (рН 8,0), глицин, и 5% рыбьей сыворотки. Икринки оплодотворяют после 48 часов инкубации.
VI: Только вода или среда для погружения, без dnd-MO-Vivo или dnd-MO лососевых, в качестве контроля.
[00120] Фиг. 8A-8D показывают, что обработка dnd-MO или dnd-MO-Vivo лососевых блокирует гонадальное развитие атлантического лосося. Для атлантических лососей в возрасте 10 месяцев: (Фиг. 8А) развивающиеся семенники необработанного самца (режим обработки VI); (Фиг. 8 В) развивающийся яичник необработанной самки (режим обработки VI); (Фиг. 8С) гонады обработанных dnd-MO-Vivo (режимы обработки I, II, III) или обработанных dnd-MO (режимы обработки IV, V) рыб развиваются в тонкие нитеподобные образования; (Фиг. 8D) микрофотографии рассеченных гонад по (Фиг. 8А), (Фиг. 8 В) и (Фиг. 8С).
[00121] Хотя приведенное в данном документе описание касается конкретных аспектов, признаков и типичных вариантов реализации, следует понимать, что применимость изобретения не ограничена этим, а распространяется на и охватывает многочисленные другие варианты, модификации и альтернативные варианты реализации, которые могут быть предложены рядовыми специалистами в области техники, относящейся к настоящему изобретению, на основании приведенного в данном документе описания.
Соответственно, заявляемое в приведенной ниже формуле изобретения, должно толковаться и интерпретироваться в широком смысле, включая все такие варианты, модификации и альтернативные варианты реализации, не выходящие за пределы его сущности и объема.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[00122] Описание предлагает способы доставки агентов в икринки/эмбрионы водных животных с использованием гуанидинсодержащих соединений для увеличения проницаемости хориона икринок. Доставка препаратов-кандидатов или потенциально биологически активных агентов в икринки/эмбрионы водных животных, таких как данио-рерио, обеспечивает возможность скрининга и оценки активности и/или токсичности таких тестируемых агентов.
[00123] Способы и соединения по изобретению дополнительно позволяют получать репродуктивно стерильную рыбу и водных мечущих икру животных. Стерилизация (индуцированное бесплодие) выращиваемой на фермах рыбы и водных мечущих икру животных увеличивает их темпы роста путем увеличения конверсии энергетического содержания пищевых продуктов в мышечный рост, вместо гонадального развития. Кроме того, в случае попадания из систем аквакультуры в окружающую среду, репродуктивно стерильная выращиваемая на фермах рыба и мечущие икру водные животные, включая доместицированные, инородные или генетически модифицированные виды, будут неспособны размножаться или скрещиваться с дикими особями. Это будет способствовать биологическому сдерживанию и предотвращать генетическое загрязнение диких популяций и/или акклиматизацию в дикой среде домашних, инородных или генетически модифицированных выращиваемых на фермах рыб и водных мечущих икру животных.
Реферат
Изобретение относится к способу доставки по меньшей мере одного агента в икринку (икринки) рыбы. Приводят в контакт икринку (икринки) с по меньшей мере одним агентом в присутствии гуанидинсодержащего соединения, эффективно увеличивающего проницаемость хориона икринки (икринок), где гуанидинсодержащее соединение выбрано из аргинина и его солей, гуанидина и его солей и димера, тримера и полимера аргинина. Способы включают нарушение гонадального развития путем введения агентов, приводящих к нарушению развития фертильных гонад и к стерильным взрослым рыбам. Агенты могут быть доставлены в икринки непосредственно перед оплодотворением или после оплодотворения путем введения в контакт с икринкой в среде для погружения, содержащей агент, представляющий интерес. 17 з.п. ф-лы, 6 пр., 1 табл., 8 ил.

Комментарии