Способ получения координационно ненасыщенного металл-органического каркаса и координационно ненасыщенный металл-органический каркас - RU2716125C1
Код документа: RU2716125C1
Чертежи








Описание
ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее описание относится к способу получения координационно ненасыщенного металл-органического каркаса и к координационно ненасыщенному металл-органическому каркасу.
УРОВЕНЬ ТЕХНИКИ
[0002] Металл-органические каркасы (МОК), представляющие собой пористые соединения, являются материалами, которые также называют пористыми координационными полимерами (ПКП). МОК имеют координационную каркасную структуру, имеющую большую площадь поверхности, которая образуется при взаимодействии металла и органического лиганда.
[0003] Поскольку МОК можно использовать в качестве материала для адсорбции или разделения газа, в датчиках и катализаторах, проводятся исследования и разработки в отношении МОК. Кроме того, МОК могут адсорбировать водяной пар, и, таким образом, они были рассмотрены для использования в качестве гигроскопичного материала в химическом тепловом насосе (адсорбционный тепловой насос) или в системе контроля влажности, используемой для транспортных средств, жилых домов и производственных помещений.
[0004] Непатентный документ 1 описывает МОК (MOF-808), содержащий Zr4+ в качестве иона металла, ион тримезиновой кислоты в качестве полидентатного лиганда и ион муравьиной кислоты в качестве монодентатного лиганда.
[0005] Непатентный документ 2 описывает МОК, содержащий сульфат-ион, полученный погружением МОК (MOF-808), который содержит Zr4+ как ион металла, ион тримезиновой кислоты в качестве полидентатного лиганда и ион муравьиной кислоты в качестве монодентатного лиганда, в серную кислоту для замещения иона муравьиной кислоты сульфат-ионом и раскрывается ее каталитическая активность.
[0006] Непатентный документ 3 описывает МОК, содержащий Ti4+ или Hf4+, полученный посредством реакции МОК (UiO-66), который содержит Zr4+ в качестве иона металла и ион терефталевой кислоты в качестве полидентатного лиганда, с TiCpCl2 или HfCl4 для замещения Zr4+ на Ti4+ или Hf4+.
[0007] Непатентный документ 4 описывает МОК, содержащий Zr4+ в качестве иона металла, ион тримезиновой кислоты в качестве полидентатного лиганда и ион муравьиной кислоты, ион уксусной кислоты или ион пропионовой кислоты в качестве монодентатного лиганда.
[СПИСОК ЦИТИРУЕМЫХ МАТЕРИАЛОВ]
[НЕПАТЕНТНЫЙ ДОКУМЕНТ]
[0008]
[NPL 1] X. Фурукава и др., «Адсорбция воды в пористых металл-органических каркасов и связанных с ними материалах», Журнал Американского химического общества, 2014, 136, стр. 4369-4381 (Н. Furukawa et al., "Water Adsorption in Porous Metal-Organic Frameworks and Related Materials", J. Am. Chem. Soc. 2014, 136, pp 4369-4381)
[NPL 2] Дж. Жианг и др., «Сверхкислотность в сульфатном металл-органическом каркасе-808», Журнал Американского химического общества, 2014, 136, стр. 12844-12847 (J. Jiang et al., "Superacidity in Sulfated Metal-Organic Framework-808", J. Am. Chem. Soc. 2014, 136, pp 12844-12847)
[NPL 3] M. Ким и др., «Постсинтетический лиганд и катионный обмен в прочных металл-органических каркасов», Журнал Американского химического общества 2012, 134, стр 18082-18088 (М. Kim et al., "Postsynthetic Ligand and Cation Exchange in Robust Metal-Organic Frameworks", J. Am. Chem. Soc. 2012, 134, pp 18082-18088)
[NPL 4] В. Лианг и др., «Настройка размера пор в металл-органическом каркасе цирконий-трикарбоксилат», CrystEngComm, 2014, 16, стр 6530-6533 (W. Liang et al., "Tuning Pore Size in a Zirconium-Tricarboxylate Metal-Organic Framework", CrystEngComm. 2014, 16, pp 6530-6533)
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[ТЕХНИЧЕСКАЯ ЗАДАЧА]
[0009] МОК, описанные в вышеупомянутой литературе, проявляют свойства адсорбции и десорбции водяного пара в ответ на изменения относительной влажности. Однако эти МОК в условиях низкой относительной влажности имеют низкую гигроскопичность или, в некоторых случаях, не проявляют гигроскопичность. Таким образом, при использовании в качестве гигроскопичного материала для химического теплового насоса тепловая мощность этих МОК может быть недостаточной в некоторых случаях, а при использовании в качестве гигроскопичного материала для системы контроля влажности эффективность осушения этих МОК в некоторых случаях может быть недостаточной.
[0010] Настоящее изобретение обеспечивает способ эффективного получения металл-органического каркаса, который, по меньшей мере, частично решает вышеуказанные проблемы.
[РЕШЕНИЕ ЗАДАЧИ]
[0011] В результате тщательного исследования авторы настоящего изобретения представили настоящее раскрытие, приведенное ниже.
[0012]
<Аспект 1>
Способ получения координационно ненасыщенного металл-органического каркаса, содержащий:
получение прекурсора металл-органического каркаса, содержащего металлический кластер и ион поликарбоновой кислоты и ион монокарбоновой кислоты, которые скоординированы с металлическим кластером, и
обеспечение возможности для прекурсора металл-органического каркаса и соли металла, имеющей кислотность по Льюису, сосуществовать в растворителе для десорбции, по меньшей мере, части иона монокарбоновой кислоты, координированного с металлическим кластером, из металлического кластера.
<Аспект 2>
Способ в соответствии с аспектом 1, в котором
металлический кластер представляет собой металлический кластер типа M6O8-х(ОН)x, при этом
М представляет собой ион элемента группы IV или ион редкоземельного элемента, причем
ион поликарбоновой кислоты и ион монокарбоновой кислоты, скоординированные с металлическим кластером, представляют собой ион поликарбоновой кислоты в качестве полидентатного лиганда и ион монокарбоновой кислоты C1-3 в качестве монодентатного лиганда, соответственно, и при этом
менее шести ионов монокарбоновой кислоты скоординированы с каждым кластером металла.
<Аспект 3>
Способ в соответствии с аспектом 2, в котором М представляет собой, по меньшей мере, одно из группы, состоящей из Zr4+, Hf4+ и Се4+.
<Аспект 4>
Способ в соответствии с любым из аспектов с 1 по 3, в котором ион монокарбоновой кислоты является, по меньшей мере, одним из группы, состоящей из иона муравьиной кислоты, иона уксусной кислоты и иона пропионовой кислоты.
<Аспект 5>
Способ в соответствии с любым из аспектов с 1 по 4, в котором соль металла, имеющая кислотность по Льюису, представляет собой галогенид.
<Аспект 6>
Координационно ненасыщенный металл-органический каркас, содержащий:
металлический кластер типа M6O8-х(ОН)x и ионы карбоновой кислоты, скоординированные с металлическим кластером,
в котором М представляет собой четырехвалентный ион элемента группы IV или ион редкоземельного элемента,
при этом ионы карбоновой кислоты, скоординированные с металлическим кластером, содержат ион поликарбоновой кислоты в качестве полидентатного лиганда и ион монокарбоновой кислоты в качестве монодентатного лиганда,
причем множество металлических кластеров связаны друг с другом благодаря иону поликарбоновой кислоты,
при этом количество ионов монокарбоновых кислот, координированных с металлическим кластером, составляет 80% или менее, когда максимальное количество ионов монокарбоновых кислот, которые могут координироваться с металлическим кластером, составляет 100%, и
причем максимальное количество ионов монокарбоновой кислоты, которые могут координироваться с металлическим кластером, составляет шесть для каждого металлического кластера.
<Аспект 7>
Координационно ненасыщенный металл-органический каркас в соответствии с аспектом 6, в котором количество ионов монокарбоновой кислоты, скоординированных с металлическим кластером, находится в диапазоне от 5% до 80%.
<Аспект 8>
Координационно ненасыщенный металл-органический каркас в соответствии с аспектом 7, в котором М представляет собой, по меньшей мере, одно из группы, состоящей из Zr4+, Hf4+ и Се4+.
<Аспект 9>
Координационно ненасыщенный металл-органический каркас в соответствии с любым из аспектов с 6 по 8, в котором ион монокарбоновой кислоты представляет собой ион монокарбоновой кислоты C1-3.
<Аспект 10>
Координационно ненасыщенный металл-органический каркас в соответствии с любым из аспектов с 6 по 9, в котором ион монокарбоновой кислоты представляет собой, по меньшей мере, одно из группы, состоящей из иона муравьиной кислоты, иона уксусной кислоты и иона пропионовой кислоты.
<Аспект 11>
Координационно ненасыщенный металл-органический каркас в соответствии с любым из аспектов с 6 по 10, дополнительно содержащий ион металла вне кластера.
<Аспект 12>
Координационно ненасыщенный металл-органический каркас в соответствии с аспектом 11, в котором ион металла вне кластера представляет собой, по меньшей мере, один из группы, состоящей из Li+, Mg2+, Al3+, Sc3+, Y3+, Ti4+, Zr4+ и Hf4+.
[ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ]
[0013] В соответствии с настоящим раскрытием предложен способ эффективного получения металл-органического каркаса, который может, по меньшей мере, частично решить проблемы, указанные выше, а также металл-органический каркас, который, по меньшей мере, частично решает проблемы описанные выше.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0014] Фиг. 1 представляет собой вид, показывающий пример способа согласно настоящему изобретению для получения координационно ненасыщенного МОК.
Фиг. 2 представляет собой вид, показывающий пример металлического кластера, который может быть использован в координационно ненасыщенного МОК согласно настоящему изобретению.
Фиг. 3 представляет собой блок-схему способа получения для сравнительного примера А-1.
Фиг. 4 представляет собой блок-схему способа получения для примера А-1.
Фиг. 5 показывает соотношение лигандов, составляющих МОК, для сравнительного примера А-1, примера А-3, примера А-4 и примера А-5.
Фиг. 6 показывает изотермы адсорбции/десорбции водяного пара при 20°С для примера А-3, примера А-4 и примера А-5.
Фиг. 7 представляет собой график, показывающий остаточное количество ионов уксусной кислоты и адсорбционную влажность для сравнительного примера А-1 и примеров с А-1 по А-8.
Фиг. 8 показывает изотермы адсорбции/десорбции водяного пара при 20°С для примера А-2, примера А-13 и примера А-14.
Фиг. 9 показывает изотермы адсорбции/десорбции водяного пара при 20°С для сравнительного примера В-1 и примера В-1.
Фиг. 10 показывает изотермы адсорбции/десорбции водяного пара при 20°С для сравнительного примера С-1 и примера С-1.
Фиг. 11 представляет собой схематический вид теплового насоса, использующего координационно ненасыщенный МОК.
Фиг. 12 представляет собой схематический вид системы регулирования влажности с использованием координационно ненасыщенного МОК.
Фиг. 13 представляет собой график, показывающий остаточное количество ионов уксусной кислоты и адсорбционную влажность в сравнительных примерах А-1 и Х-1 и в примерах с А-1 по А-8 и с Х-1 по Х-4.
Фиг. 14 показывает изотермы адсорбции/десорбции водяного пара при 20°С для примеров Х-2 и Х-4 и сравнительного примера Х-1.
РАСКРЫТИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0015] Настоящее изобретение будет представлено ниже со ссылкой на чертежи. Аспекты, показанные ниже, являются примерами настоящего изобретения. Настоящее изобретение не ограничено аспектами, представленными ниже.
[0016]
<<Способ получения координационно ненасыщенного металл-органического каркаса>>
Способ согласно настоящему изобретению для получения координационно ненасыщенного МОК содержит получение металл-органического каркаса-прекурсора, содержащего металлический кластер и ион поликарбоновой кислоты и ион монокарбоновой кислоты, которые скоординированы с металлическим кластером, и обеспечение для прекурсора металл-органического каркаса и соли металла, имеющей кислотность по Льюису, возможности для сосуществования в растворителе для десорбции, по меньшей мере, части иона монокарбоновой кислоты, который скоординирован с металлическим кластером, из металлического кластера.
[0017] В соответствии со способом по настоящему изобретению может быть получен координационно ненасыщенный МОК.
[0018] На фиг. 1 показан конкретный пример способа согласно настоящему изобретению, в котором за счет наличия соли металла, имеющей кислотность по Льюису, ионы монокарбоновой кислоты удаляются из одного металлического кластера, составляющего МОК, в результате чего МОК находится в координационно ненасыщенном состоянии.
[0019] В прекурсоре МОК, показанном на левой стороне фиг. 1, ион тримезиновой кислоты, который представляет собой тридентатный лиганд поликарбоновой кислоты, и ион уксусной кислоты, который представляет собой монодентатный лиганд монокарбоновой кислоты, скоординированы для Zr6O4(OH)4 как металлический кластер. Поликарбоновая кислота действует как органический линкер между соседними металлическими кластерами и образует сетчатую периодическую структуру.
[0020] В примере, показанном на фиг. 1, YCl3, который является солью металла, имеющей кислотность по Льюису, может воздействовать на ион монокарбоновой кислоты, скоординированный с металлическим кластером, чтобы десорбировать ион монокарбоновой кислоты из металлического кластера. В результате образуются координационно ненасыщенный МОК, имеющий один или множество координационно ненасыщенных центров (участки, обведенные пунктирными линиями), как показано на правой стороне фиг. 1, и формируется комплекс из иона монокарбоновой кислоты и металл из соли металла. Этот комплекс может оставаться в координационно ненасыщенном МОК в некоторых случаях.
[0021] Каждый составляющий элемент способа по настоящему изобретению будет приведен ниже.
[0022]
<Получение прекурсора металл-органического каркаса>
В способе согласно настоящему изобретению получают прекурсор металл-органического каркаса (прекурсор МОК), содержащий металлический кластер и ион поликарбоновой кислоты и ион монокарбоновой кислоты, скоординированный с металлическим кластером.
[0023] Такой прекурсор МОК можно получить известными средствами. Например, прекурсор МОК может быть синтезирован посредством смешивания источника ионов металла, соединения поликарбоновой кислоты и соединения монокарбоновой кислоты, растворения этих компонентов в растворителе, по мере необходимости, и нагревания. Например, прекурсор МОК может быть синтезирован посредством нагревания раствора, содержащего источник ионов металла, соединения поликарбоновой кислоты и соединения монокарбоновой кислоты C1-3.
[0024] Источник ионов металла для синтеза прекурсора МОК конкретно не ограничен, при условии, что металлический кластер, формирующий координационно ненасыщенный МОК, раскрытый выше, может быть сформирован с ним. Соединение, содержащее металл, формирующий металлический кластер, например галогенид металла, или тому подобное, может быть использовано в качестве источника ионов металла. Если металлический кластер содержит атом кислорода, в качестве источника ионов металла можно использовать галогенид металла, соединение окси-металла или оксид металла.
[0025] Источник ионов металла может быть, по меньшей мере, одним из группы, состоящей из соединения циркония, соединения гафния и соединения церия. В этом случае, например, октагидрат оксихлорида циркония (ZrOCl2⋅8H2O) или хлорид циркония (ZrCl4) может быть использован как соединение циркония, так и, например, октагидрат оксихлорида гафния (HfOCl2⋅8H2O) или хлорид гафния (HfCl4) может быть использован в качестве соединения гафния.
[0026] Поликарбоновые кислоты и монокарбоновые кислоты или их соли или ангидриды этих кислот, соответствующие иону поликарбоновой кислоты и иону монокарбоновой кислоты, упомянутые в отношении координационно ненасыщенного МОК, могут использоваться в качестве соединения поликарбоновой кислоты и соединения монокарбоновой кислоты для синтеза прекурсора МОК. Примеры соли поликарбоновой кислоты и соли монокарбоновой кислоты включают в себя соль лития, натриевую соль, калиевую соль или аммиачную соль поликарбоновой кислоты. Как правило, соединения поликарбоновых кислот представляют собой соединения ди-, три- или тетраполикарбоновых кислот.
[0027] Доля ионов поликарбоновой кислоты по отношению к общему молярному числу ионов карбоновых кислот в прекурсоре МОК может составлять 20 мол. % или более, 30 мол. % или более или 40 мол. % или более, и может составлять 95 мол. % или менее, 90% мол. % или менее или 85 мол. % или менее.
[0028] Доля ионов монокарбоновой кислоты по отношению к общему молярному числу ионов карбоновых кислот в прекурсоре МОК может составлять 5 мол. % или более, 10 мол. % или более или 15 мол. % или более, и может составлять 80 мол. % или менее, 70 мол. % или менее или 60 мол. % или менее.
[0029] Смесь источника ионов металлов, соединения поликарбоновой кислоты и соединения монокарбоновой кислоты может дополнительно содержать соединение для получения вышеуказанного полидентатного лиганда, отличного от поликарбоновой кислоты.
[0030] Растворитель для образования прекурсора МОК конкретно не ограничен при условии, что он способен диспергировать или растворять вышеуказанный источник ионов металлов, соединение поликарбоновой кислоты, соединение монокарбоновой кислоты и, при необходимости, соединение для получения описанного полидентатного лиганда больше, чем поликарбоновая кислота, и прекурсор МОК может быть синтезирован в процессе нагревания, который раскрыт ниже.
[0031] С точки зрения стимулирования синтеза прекурсора МОК в качестве растворителя предпочтительно использовать амид. Амиды разлагаются при высоких температурах, постепенно образуя аминное основание. Полученное аминное основание депротонирует карбоксильные группы соединения поликарбоновой кислоты и соединения монокарбоновой кислоты и способствует образованию ионов поликарбоновой кислоты и ионов монокарбоновой кислоты, которые координируются с кластером металла. Примеры амида включают в себя N,N-диметилформамид (ДМФА), N-N-диэтилформамид (ДЭФА), и их комбинации.
[0032] Вышеупомянутое соединение монокарбоновой кислоты может быть использовано в качестве растворителя. В одном варианте осуществления изобретения комбинация соединения амида и монокарбоновой кислоты используется в качестве растворителя.
[0033] Нагревание для синтеза прекурсора МОК может быть проведено при сольватермических условиях.
[0034] Например, прекурсор МОК, содержащий металлический кластер и ион поликарбоновой кислоты и ион монокарбоновой кислоты, скоординированный с металлическим кластером, может быть синтезирован посредством загрузки источника ионов металла, соединения поликарбоновой кислоты, соединения монокарбоновой кислоты и, если необходимо, растворителя, такого как N,N-диметилформамид (ДМФА) или N,N-диэтилформамид (ДЭФА) в сосуд под давлением, например, в автоклав, и нагревания при температуре 100°С или более, или 120°С или более, и 180°С или менее, или 150°С или менее, в течение 6 часов или более, или 24 часов или более, и 100 часов или менее, или 72 часов или менее.
[0035] Прекурсор МОК может быть очищен фильтрацией, промывкой или сушкой, если необходимо, или раствор, содержащий синтезированный прекурсор МОК, может использоваться в неизменном виде в последующих процессах. Промывка может проводиться один или несколько раз с использованием растворителя, например, ДМФА или ацетона. Высушивание можно проводить, оставляя раствор стоять при комнатной температуре или нагревая при нормальном или пониженном давлении.
[0036]
<Десорбция иона монокарбоновой кислоты>
Координационно ненасыщенный МОК можно получить, обеспечив для прекурсора МОК и соли металла, имеющей кислотность по Льюису, возможность сосуществования в растворителе для десорбции, по меньшей мере, части ионов монокарбоновой кислоты, которые координированы с металлическим кластером, из металлического кластера.
[0037]
(Соль металла, имеющая кислотность по Льюису)
Кислоты Льюиса определяются как рецепторы для электронных пар.
[0038] Металлы, включенные в соль металла, имеющую кислотность по Льюису, действуют как кислоты Льюиса для десорбции ионов монокарбоновых кислот, которые являются основаниями Льюиса, из металлического кластера. Поскольку десорбция ионов карбоновых кислот кислотой Льюиса протекает более благоприятно для ионов монокарбоновых кислот, которые являются монодентатными лигандами, чем для ионов поликарбоновых кислот, которые являются полидентатными лигандами, возможно селективно десорбировать ионы монокарбоновых кислот, сохраняя при этом кристаллическую структуру МОК для генерации координационно ненасыщенных центров, по крайней мере, в части металлического кластера.
[0039] В настоящем раскрытии кислота Льюиса предпочтительно является апротонной.
[0040] Соль металла, имеющая кислотность по Льюису, предпочтительно представляет собой галогенид и более предпочтительно представляет собой хлорид или бромид. В некоторых случаях ионы галогенов, полученные из галогенида, могут быть включены в координационно ненасыщенный МОК. Хотя такие ионы галогенов, в частности, ионы хлора и ионы брома, могут координироваться с металлическим кластером, поскольку ионы галогена легко подвергаются замене лиганда молекулами воды и отсоединяются от металлического кластера, они значительно не снижают гигроскопические характеристики координационно ненасыщенного МОК.
[0041] Соль металла, имеющая кислотность по Льюису, предпочтительно содержит металл, в котором число электронов на d-орбите иона металла, имеющего стабильное состояние степени окисления, составляет 0 или 10. Соль металла, содержащая такой металл, действует как кислота Льюиса и может способствовать десорбции иона монокарбоновой кислоты, который является основанием, из металлического кластера.
[0042] Предпочтительно, чтобы соль металла, имеющая кислотность по Льюису, была одна или несколько, выбранная из группы, состоящей из LiCl, MgCl2, AlCl3, ScCl3, YCl3, ZrCl4, HfCl4, MgBr2, и TiCl2Cp2. Cp представляет собой циклопентадиенильный анион или его производное, например, пентаметилциклопентадиенильный анион (Ср*). При использовании этих солей металлов ускоряется десорбция ионов монокарбоновых кислот из металлического кластера, в результате чего может быть получен координационно ненасыщенный МОК, имеющий высокую гигроскопичность.
[0043] Концентрация соли металла, имеющей кислотность по Льюису, в растворителе может составлять, например, 5 ммоль/л или более, 10 ммоль/л или более, 20 ммоль/л или более, 30 ммоль/л или более или 60 ммоль/л или более, и может составлять 600 ммоль/л или менее, 500 ммоль/л или менее, 300 ммоль/л или менее, или 200 ммоль/л или менее.
[0044] Прекурсор МОК и соль металла, имеющая кислотность по Льюису, могут оставаться в состоянии сосуществования в растворителе. Прекурсор МОК может сосуществовать в растворителе с солью металла, имеющей кислотность по Льюису, за счет погружения прекурсора МОК в раствор, содержащий соль металла, имеющую кислотность по Льюису, и растворитель.
[0045] Растворитель конкретно не ограничен при условии, что в нем можно диспергировать или растворить прекурсор МОК и соль металла, имеющую кислотность по Льюису. Например, вода, спирты, такие как метанол, этанол и изопропанол, амиды, такие как N,N-диметилформамид (ДМФА) и N,N-диэтилформамид (ДЭФА), или их комбинации могут быть использованы в качестве растворителя.
[0046] Десорбция ионов монокарбоновой кислоты из металлического кластера может происходить при комнатной температуре или может происходить при нагревании. Например, раствор, содержащий прекурсор МОК, соль металла, имеющую кислотность по Льюису, и растворитель, могут быть нагреты. Температура нагрева может составлять 30°С или более, или 50°С или более, и может составлять 120°С или менее, или 100°С или менее. Кроме того, время нагревания может составлять 6 часов или более, 24 часа или более, или 48 часов или более, и может составлять 100 часов или менее, или 72 часа или менее.
[0047] Координационно ненасыщенный МОК может быть получен посредством десорбции, по меньшей мере, части ионов монокарбоновой кислоты из металлического кластера. Полученный координационно ненасыщенный МОК может быть очищен фильтрацией, промывкой или сушкой, если необходимо. Промывка может проводиться один или несколько раз с использованием растворителя, например, ДМФА или ацетона. Высушивание может быть выполнено, оставляя МОК стоять при комнатной температуре или нагревая при нормальном или пониженном давлении.
[0048]
<<Координационно ненасыщенный металл-органический каркас>>
Координационно ненасыщенный металл-органический каркас (координационно ненасыщенный МОК) согласно настоящему изобретению содержит металлический кластер и ионы карбоновой кислоты, скоординированные с металлическим кластером. По меньшей мере, часть ионов карбоновой кислоты представляют собой ионы поликарбоновых кислот, которые связывают множество металлических кластеров друг с другом, и, по крайней мере, часть металлического кластера содержит координационно ненасыщенные центры. Координационно ненасыщенный МОК, согласно настоящему раскрытию, может быть получен вышеупомянутым способом получения согласно настоящему раскрытию.
[0049] Более конкретно, координационно ненасыщенный металл-органический каркас согласно настоящему изобретению содержит металлический кластер типа M6O8-х(ОН)x и ионы карбоновых кислот, которые координированы с металлическим кластером, в котором
М представляет собой ион элемента группы IV или ион редкоземельного элемента,
в котором ионы карбоновой кислоты, скоординированные с металлическим кластером, представляют собой ион поликарбоновой кислоты в качестве полидентатного лиганда и ион монокарбоновой кислоты в качестве монодентатного лиганда, в котором
множество металлических кластеров связаны друг с другом благодаря иону поликарбоновой кислоты,
в котором количество ионов монокарбоновых кислот, скоординированных с металлическим кластером, составляет 80% или менее, если максимальное количество ионов монокарбоновых кислот, которые могут координироваться с металлическим кластером, составляет 100%, и
максимальное количество ионов монокарбоновой кислоты, которые могут координироваться с металлическим кластером, составляет шесть для каждого металлического кластера.
[0050] Термин «координационно ненасыщенные центры» координационно ненасыщенного МОК согласно настоящему изобретению означает координационные центры, в которых ионы карбоновой кислоты, содержащие ионы монокарбоновых кислот и ионы поликарбоновых кислот, не скоординированы, и другие поливалентные лиганды не скоординированы. Молекулы, например вода (H2O), или диметилформамид (ДМФА) могут быть скоординированы с координационно ненасыщенными центрами, и эти молекулы могут быть получены из растворителя.
[0051] Предполагается, что фрагмент органической группы, который представляет собой гидрофобный фрагмент иона карбоновой кислоты, который скоординирован с металлическим кластером, например метильной группы в ионе уксусной кислоты, снижает гигроскопичность МОК в условиях низкой влажности, поскольку метильная группа ориентирована на поверхности пор МОК и проявляет гидрофобность.
[0052] Полагают, что координационно ненасыщенный МОК согласно настоящему раскрытию может проявлять высокую гигроскопичность даже в условиях низкой влажности, поскольку лиганды, имеющие такие гидрофобные центры, по меньшей мере, частично, удаляются из координационно ненасыщенных центров координационно ненасыщенного МОК согласно настоящему раскрытию. Кроме того, считается, что путем изменения количества координационно ненасыщенных центров в координационно ненасыщенном МОК можно легко регулировать влажность, которая может быть адсорбирована.
[0053] Таким образом, адсорбционная влажность координационно-ненасыщенного МОК согласно настоящему изобретению может составлять 30% или менее, 28% или менее, 26% или менее, 24% или менее, 22% или менее или 20% или менее, и может составлять 10% или более, 12% или более, 16% или более, или 18% или более. Следует отметить, что в настоящем описании адсорбционная влажность означает относительную влажность при адсорбции водяного пара в количестве, равном половине максимального количества адсорбции водяного пара.
[0054] Гигроскопичность координационно ненасыщенного МОК будет раскрыта со ссылкой на фиг. 1, где показан пример способа получения координационно ненасыщенного МОК согласно настоящему раскрытию.
[0055] В МОК, показанном на левой стороне фиг. 1, в качестве примера обычного МОК, ион тримезиновой кислоты, который представляет собой поликарбоновую кислоту тридентатного лиганда, и ион уксусной кислоты, который представляет собой ион монокарбоновой кислоты монодентатного лиганда, координируются с Zr6O4(OH)4 в качестве металлического кластера. Поликарбоновая кислота действует как органический линкер между соседними металлическими кластерами, что позволяет образовать сетчатую периодическую структуру.
[0056] В координационно ненасыщенном МОК, показанном с правой стороны на фиг. 1, в качестве примера координационно ненасыщенного МОК согласно настоящему изобретению, часть металлического кластера содержит один или множество координационно ненасыщенных центров (участки, окруженные пунктирной линией). Поскольку эти координационно ненасыщенные центры вносят вклад в гидрофилизацию поверхности пор координационно ненасыщенного МОК, считается, что адсорбция воды в поры координационно ненасыщенного МОК стимулируется по сравнению с МОК, в которых отсутствуют координационно ненасыщенные центры.
[0057] Поскольку диаметры пор обычных МОК в несколько раз больше такового у молекул воды, и молекулы воды адсорбируются в порах в результате взаимодействия молекул воды с поверхностью пор и взаимодействия между молекулами воды, считается, что гидрофилизация поверхности пор оказывает существенное влияние на улучшение гигроскопичности. Кроме того, также считается, что гигроскопичность можно регулировать, изменяя число координационно ненасыщенных центров в координационно ненасыщенном МОК.
[0058] Координационно ненасыщенный МОК согласно настоящему изобретению может использоваться, в зависимости от применения, в форме порошка или в форме гранул или таблеток. Кроме того, при формировании координационно ненасыщенного МОК согласно настоящему изобретению может использоваться полимерное связующее или подобное вещество.
[0059] Каждый составляющий элемент, входящий в координационно ненасыщенный МОК согласно настоящему раскрытию, будет раскрыт ниже.
[0060]
<Металлический кластер>
В координационно ненасыщенном МОК, согласно настоящему изобретению, металлический кластер определяет форму вершины в периодической структуре координационно ненасыщенного МОК. В качестве металлического кластера можно использовать любой металлический кластер, способный формировать МОК.
[0061] Например, металлический кластер типа M6O8-х(ОН)х может быть использован в качестве металлического кластера координационно ненасыщенного МОК согласно настоящему изобретению.
[0062] Этот металлический кластер имеет структуру, показанную на фиг. 2, где М представляет собой четырехвалентный элемент периодической таблицы группы IV или ион редкоземельного элемента, например, Zr4+, Hf4+, и Се4+, в частности, Zr4+, и его насыщенное координационное число равно 12. Примеры МОК, содержащего этот металлический кластер, включают в себя MOF-808, UiO-66 и MOF-801. Кроме того, примеры лигандов для этого металлического кластера включают в себя тримезиновую кислоту, муравьиную кислоту, терефталевую кислоту и фумаровую кислоту.
[0063] Например, если металлический кластер координационно ненасыщенного МОК согласно настоящему изобретению представляет собой металлический кластер типа M6O8-х(ОН)x, то ионы карбоновой кислоты, скоординированные с металлическим кластером, включают в себя ион поликарбоновой кислоты в качестве полидентатного лиганда и ион C1-3 монокарбоновой кислоты в качестве монодентатного лиганда и менее 6, 5 или менее, или 4 или менее ионов монокарбоновых кислот могут быть скоординированы с металлическим кластером.
[0064] Необходимо отметить, что в случае металлического кластера типа M6O8-х(ОН)х максимальное количество ионов монокарбоновой кислоты, которое может быть скоординировано с металлическим кластером, составляет шесть для каждого металлического кластера.
[0065] Таким образом, в настоящем раскрытии предпочтительно, чтобы количество ионов монокарбоновой кислоты, скоординированных с металлическим кластером, составляло 80% или менее, если максимальное количество ионов монокарбоновой кислоты, которое может быть скоординировано с металлическим кластером типа M6O8-х(ОН)x, равно 100%, причем более предпочтительно в диапазоне от 5 до 80%. Кроме того, количество ионов монокарбоновой кислоты, скоординированных с этим металлическим кластером, может составлять 7% или более, 10% или более, 15% или более, 20% или более, 25% или более, 30% или более, 35% или более, 40% или более, 45% или более, или 50% или более, и могут составлять 95% или менее, 90% или менее, 85% или менее, 80% или менее, 78% или менее, или 75% или менее.
[0066]
<Ион поликарбоновой кислоты>
Ионы поликарбоновой кислоты функционируют как органический линкер, координируя их карбоксилатную группу с металлическим кластером и связывая множество металлических кластеров друг с другом. Это формирует периодическую структуру координационно ненасыщенного МОК. Может быть использована любая произвольная поликарбоновая кислота, с которой может образовываться МОК, и, как правило, ионы поликарбоновой кислоты представляют собой ионы ди-, три- или тетраполикарбоновых кислот.
[0067] Примеры двухвалентных ионов карбоновой кислоты включают в себя замещенные или незамещенные ионы изофталевой кислоты, замещенные или незамещенные ионы терефталевой кислоты, ионы оксалата, ионы фумарата, ионы малоната, ионы транс,транс-муконовой кислоты, ионы цис,цис-муконовой кислоты, ионы 2-6-нафталиндикарбоновой кислоты, ионы 9,10-антрацендикарбоновой кислоты, ионы 2,2'-диамино-4,4'-стильбендикарбоновой кислоты, ионы 2,2'-динитро-4,4'-стильбендикарбоновой кислоты, и ионы 2,3-пиразиндикарбоновой кислоты.
[0068] Замещенные или незамещенные ионы изофталевой кислоты могут быть представлены формулой 1.
[0069]
[Формула 1]

[0070] В формуле 1 каждый R представляет собой независимый заместитель, отличный от карбоксилатной группы, и n представляет собой целое число от 0 до 4. R конкретно не ограничен при условии, что указанные выше ионы могут функционировать в качестве органического линкера с образованием МОК. Их примеры включают гидроксигруппы, нитрогруппы, фторгруппы, хлоргруппы, бромогруппы, йодные группы, цианогруппы, метильные группы, этильные группы, трет-бутильные группы и этинильные группы. Предпочтительно, чтобы у R отсутствовал положительный заряд, который нейтрализует отрицательный заряд карбоксилат-иона. Примеры R, имеющего положительный заряд, включают аммониевые группы, такие как триметиламмониевая группа (-N(CH3)3+) или триэтиламмониевая группа (-N(C2H5)3+).
[0071] Конкретные примеры ионов изофталевой кислоты, представленные формулой 1, включают в себя изофталат-ионы (m-BDC2-), 5-гидроксиизофталата, ионы 5-нитроизофталата, ионы 5-терт-бутилизофталата, ионы 5-этинил изофталата, ионы 5-хлоризофталата, ионы 5-бромизофталата, ионы 5-цианизофталата, и ионы 4,6-диметилизофталата. Замещенный или незамещенный ион изофталевой кислоты, представленный формулой 1, предпочтительно представляет собой ион изофталевой кислоты (m-BDC2-).
[0072] Замещенные или незамещенные ионы терефталевой кислоты могут быть представлены формулой 2.
[0073]
[Формула 2]

[0074] В формуле 2 каждый R представляет собой независимый заместитель, отличный от карбоксилатной группы, и n представляет собой целое число от 0 до 4. R конкретно не ограничен при условии, что указанные выше ионы могут функционировать в качестве органического линкера с образованием МОК. Их примеры включают гидроксигруппы, нитрогруппы, фторгруппы, хлоргруппы, бромогруппы, йодные группы, цианогруппы, метильные группы, этильные группы, трет-бутильные группы и этинильные группы. Предпочтительно, чтобы у R отсутствовал положительный заряд, который нейтрализует отрицательный заряд карбоксилат-иона. Примеры R, имеющего положительный заряд, включают аммониевые группы, такие как триметиламмониевая группа (-N(CH3)3+) или триэтиламмониевая группа (-N(C2H5)3+).
[0075] Конкретные примеры замещенных или незамещенных ионов терефталевой кислоты, представленных формулой 2, включают в себя ионы терефталевой кислоты (p-BDC2-), ионы 2-аминотерефталевой кислоты, ионы 2,5-диаминотерефталевой кислоты, ионы 2-гидрокситерефталевой кислоты, и ионы 2,5-дигидрокситерефталевой кислоты. Замещенные или незамещенные ионы терефталевой кислоты, представленные формулой 2, предпочтительно представляют собой ион терефталевой кислоты (p-BDC2-).
[0076] Примеры трехвалентных ионов карбоновой кислоты включают в себя замещенные или незамещенные ионы тримезиновой кислоты, ионы 1,3,5-трис(4-карбоксифенил) бензола, ионы 1,3,5-трискарбоксифенилэтинилбензола, ионы 4,4',4''-с-триазин-2,4,6-триил-трибензойной кислоты, ионы 1,3,5-трис(4'-карбокси[1,1'-бифенил]-4-ил)бензола, ионы дифенил-3-4'-5-трикарбоновой кислоты, и ионы 4,4',4''-(1,3,5-триазин-2,4,6-триил триимино)трисбензойной кислоты.
[0077] Замещенные или незамещенные ионы тримезиновой кислоты могут быть представлены формулой 3.
[0078]
[Формула 3]
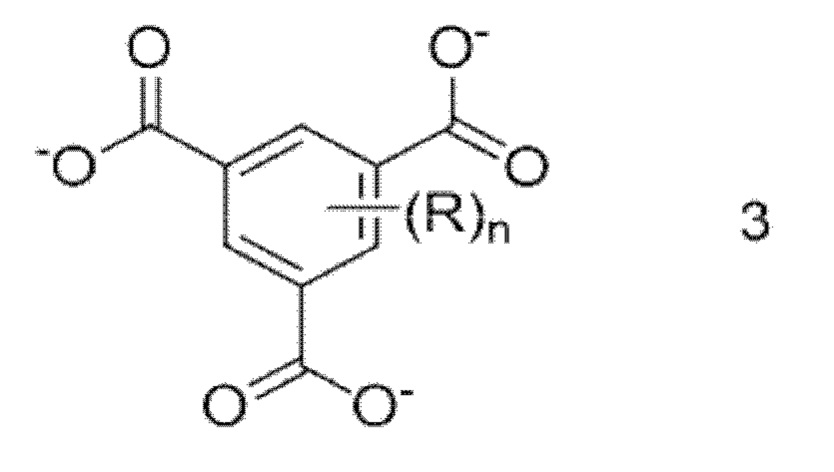
[0079] В формуле 3 каждый R представляет собой независимый заместитель, отличный от карбоксилатной группы, и n представляет собой целое число от 0 до 3. R конкретно не ограничен при условии, что указанные выше ионы могут функционировать в качестве органического линкера с образованием МОК. Их примеры включают гидроксигруппы, нитрогруппы, фторгруппы, хлоргруппы, бромогруппы, йодные группы, цианогруппы, метильные группы, этильные группы, трет-бутильные группы и этинильные группы.
[0080] Конкретные примеры замещенных или незамещенных ионов тримезиновой кислоты, представленных формулой 3, включают в себя ионы тримезиновой кислоты (ВТС3-), ионы 2-гидрокси-1,3,5-бензолтрикарбоновой кислоты, ионы 2-нитро-1,3,5-бензолтрикарбоновой кислоты, ионы 2-хлор-1,3,5-бензолтрикарбоновой кислоты, ионы 2-бром-1,3,5-бензолтрикарбоновой кислоты, и ионы 2-метил-1,3,5-бензолтрикарбоновой кислоты. Замещенные или незамещенные ионы тримезиновой кислоты, представленные формулой 1, предпочтительно представляют собой ион тримезиновой кислоты (ВТС3-).
[0081] Примеры четырехвалентных ионов карбоновой кислоты включают в себя ионы [1,1':4',1'']терфенил-3,3'',5,5''-тетракарбоновой кислоты, ионы 3,3',5,5'-тетракарбоксидифенилметана, ионы 1,2,4,5-тетракис(4-карбоксифенил)бензола, и ионы дифенил-3,3',5,5'-тетракарбоновой кислоты.
[0082] Ион поликарбоновой кислоты предпочтительно представляет собой, по меньшей мере, один из группы, состоящей из замещенных или незамещенных ионов изофталевой кислоты, замещенных или незамещенных ионов терефталевой кислоты и замещенных или незамещенных ионов тримезиновой кислоты. При использовании вышеупомянутого иона поликарбоновой кислоты сетчатая периодическая структура, имеющая поры, подходящие для адсорбции водяного пара, может быть придана координационно ненасыщенному МОК. Ионы поликарбоновой кислоты могут представлять собой комбинацию двухвалентных ионов карбоновой кислоты и трехвалентных ионов карбоновой кислоты.
[0083] Доля ионов поликарбоновой кислоты может составлять 20% мол. или более, 30% мол. или более, или 40% мол. или более, и может составлять 95% мол. или менее, 90% мол. или менее или 85% мол. или менее с использованием общего молярного числа ионов карбоновой кислоты в качестве уровня отсчета.
[0084]
<Ион монокарбоновой кислоты>
Координационно ненасыщенный МОК может включать в себя ион монокарбоновой кислоты, скоординированный с металлическим кластером. Ион монокарбоновой кислоты функционирует как монодентатный лиганд, подавляет координацию полидентатного лиганда, например, иона поликарбоновой кислоты, с металлическим кластером и может использоваться для контроля периодической структуры и кристаллической формы (морфологии) координационно ненасыщенного МОК.
[0085] Ион монокарбоновой кислоты конкретно не ограничен при условии, что с ним может образовываться координационно ненасыщенный МОК. Поскольку ион монокарбоновой кислоты является предпочтительным для формирования периодической структуры координационно ненасыщенного МОК, ион монокарбоновой кислоты предпочтительно представляет собой ион монокарбоновой кислоты С1-3. Монокарбоновая кислота С1-3 предпочтительно представляет собой, по меньшей мере, одну из группы, состоящей из ионов муравьиной кислоты, ионов уксусной кислоты и ионов пропионовой кислоты, и более предпочтительно, по меньшей мере, одну из группы, состоящей из ионов муравьиной кислоты и ионов уксусной кислоты.
[0086] Доля ионов монокарбоновой кислоты может составлять 5% мол. или более, 10% мол. или более или 15% мол. или более, и может составлять 80% мол. или менее, 70% мол. или менее или 60% мол. или менее по отношению к общему молярному числу ионов карбоновой кислоты.
[0087]
<Полидентатные лиганды, отличные от поликарбоновых кислот>
Координационно ненасыщенный МОК может включать полидентатный лиганд, отличный от поликарбоновой кислоты, например, полидентатный лиганд донорный азот. Примеры таких полидентатных лигандов в качестве донорного азота включают в себя ионы имидазола, ионы 2-метилимидазола (mIM), 4,4'-бипиридила, этилендиамина, 1,4-диазабицикло[2.2.2]октана (DABCO), пиразина, 1,2-бис(4-пиридил)этана, и 1,2-бис(4-пиридил)этилена. Подобно ионам поликарбоновых кислот, эти полидентатные лиганды, отличные от лигандов карбоновых кислот, могут функционировать в качестве органического линкера, связывая множество металлических кластеров друг с другом. В настоящем раскрытии лиганд, содержащий как две, так и более карбоксилатные группы и атом азота, имеющий свойство донора, классифицируется как ион поликарбоновой кислоты.
[0088] Доля полидентатного лиганда, отличного от поликарбоновой кислоты, может составлять 40% мол. или менее, 30% мол. или менее или 20% мол. или менее по отношению к общему молярному числу лигандов, скоординированных с металлическим кластером. Кроме того, координационно ненасыщенный МОК может не включать в себя полидентатный лиганд, отличный от поликарбоновой кислоты.
[0089]
<Ион металла, не включенный в металлический кластер (ион металла вне кластера)>
Координационно ненасыщенный МОК согласно настоящему изобретению может включать в себя ион металла, который не включен в металлический кластер. В настоящем раскрытии ион металла, который не включен в металлический кластер, упоминается как «ион металла вне кластера». Как будет раскрыто ниже, координационно ненасыщенный МОК согласно настоящему изобретению может быть получен посредством обеспечения возможности того, чтобы прекурсор металл-органического каркаса и металлический растворитель, имеющий кислотность по Льюису, сосуществовали в растворителе, и обеспечения десорбции ионов монокарбоновой кислоты, которые скоординированы с металлическим кластером. Таким образом, координационно ненасыщенный МОК согласно настоящему изобретению может включать в себя ионы металлов, полученные из соли металла, используемой в качестве ионов металла вне кластера в некоторых случаях.
[0090] Хотя это и не связано какой-либо конкретной теорией, считается, что ионы металла вне кластера образуют комплекс с ионами монокарбоновой кислоты, десорбированными из металлического кластера, и уравновешивают заряд всего координационно ненасыщенного МОК, что является результатом присутствия такого комплекса, например, в порах координационно ненасыщенного МОК.
[0091] Ионы металла вне кластера могут быть, по меньшей мере, одним из группы, состоящей из Li+, Mg2+, Al3+, Sc3+, Y3+, Ti4+, Zr4+ и Hf4+.
[0092]
<<Химический тепловой насос>>
Координационно ненасыщенный металл-органический каркас согласно настоящему изобретению может быть использован, например, в качестве гигроскопичного материала в химическом тепловом насосе. Химический тепловой насос в этом случае содержит хранилище воды для хранения воды, в котором хранится вода в качестве рабочего вещества, блок для хранения гигроскопичного материала и канал для потока водяного пара, который обеспечивает циркуляцию водяного пара между хранилищем воды и блоком для хранения гигроскопичного материала. В таком химическом тепловом насосе хранилище воды может использоваться как в качестве испарителя, так и в качестве конденсатора, или хранилище воды может использоваться в качестве испарителя, и водяной пар может конденсироваться отдельным конденсатором. Такой химический тепловой насос можно использовать для кондиционирования воздуха и отопления транспортных средств, жилых домов и производственных помещений.
[0093] Будет раскрыт аспект, в котором хранилище воды используется как испаритель и конденсатор в таком химическом тепловом насосе. Как показано, например, на левой стороне фиг. 11(a), тепло подводится снаружи к воде (жидкость H2O) в хранилище 10 воды для испарения воды в резервуаре для хранения воды, в результате чего образуется водяной пар (парообразный H2O). Этот этап также называют этапом передачи холода из хранилища воды наружу, посредством испарения воды в хранилище воды с образованием водяного пара. В это время в таком химическом тепловом насосе, как показано на правой стороне фиг. 11(a), водяной пар, генерируемый хранилищем 10 воды, поступает в часть 20 для хранения гигроскопичного материала через канал 30 для потока водяного пара, вступает в реакцию с гигроскопичным материалом и подает тепло адсорбции наружу. Иными словами, в таком тепловом насосе тепло может передаваться со стороны хранилища 10 воды на сторону части 20 для хранения гигроскопичного материала.
[0094] Кроме того, в таком химическом тепловом насосе на этапе регенерации, реакция в котором показана на фиг. 11(a), эта реакция может быть осуществлена снова, как показано на правой стороне фиг. 11(b), тепло подается снаружи в часть 20 для хранения гигроскопичного материала, и вода десорбируется из гигроскопичного материала с образованием водяного пара. Эта стадия может также упоминаться как стадия, на которой холод подается наружу из части 20 для хранения гигроскопичного материала посредством десорбции воды из гигроскопичного материала в части 20 для хранения гигроскопичного материала. В это время в таком химическом тепловом насосе, как показано на левой стороне фиг. 11(b), водяной пар, образующийся в части 20 для хранения гигроскопичного материала, подается в хранилище 10 воды и конденсируется, в результате чего скрытая теплота конденсации подается наружу.
[0095]
<<Система контроля влажности>>
Координационно ненасыщенный металл-органический каркас согласно настоящему изобретению может быть использован, например, в качестве гигроскопичного материала в системе регулирования влажности. Система регулирования влажности в этом случае содержит часть для хранения гигроскопичного материала, канал подачи воздуха для подачи воздуха, содержащего водяной пар, в часть для хранения гигроскопического материала, и канал для выпуска воздуха, подаваемого в часть для хранения гигроскопичного материала из части для хранения гигроскопичного материала. Такая система контроля влажности может использоваться для осушения или контроля влажности транспортных средств, жилых домов и производственных помещений.
[0096] В этой системе регулирования влажности, как показано, например, на фиг. 12(а), воздух, содержащий относительно большое количество водяного пара, подается снаружи в часть 25 для хранения гигроскопичного материала через канал 32 подачи воздуха, и, по меньшей мере, часть водяного пара в воздухе в части 25 для хранения гигроскопичного материала адсорбируется и удаляется гигроскопичным материалом. В это время в части 25 для хранения гигроскопичного материала выделяется тепло адсорбции в результате адсорбции водяного пара гигроскопическим материалом. После этого, по меньшей мере, часть водяного пара в части 25 для хранения гигроскопичного материала удаляется, и воздух, имеющий относительно небольшое количество водяного пара, выпускается из части для хранения гигроскопического материала через канал 34 для выпуска воздуха. «Относительно небольшое количество» и «относительно большое количество» водяного пара имеют относительные значения, и, таким образом, воздух, имеющий относительно небольшое количество водяного пара, означает воздух, имеющий меньше водяного пара по сравнению с воздухом, имеющим относительно большое количество водяного пара.
[0097] Кроме того, в этой системе регулирования влажности на стадии регенерации, на которой снова может быть проведена реакция, показанная на фиг. 12(a), как показано на фиг. 12(b), воздух, содержащий относительно небольшое количество водяного пара, подается снаружи в часть 25 для хранения гигроскопического материала через канал 32 для подачи воздуха, в то время как тепло подается снаружи в часть 25 для хранения гигроскопического материала, и в результате, по меньшей мере, часть водяного пара, которая была адсорбирована гигроскопическим материалом в части 25 для хранения гигроскопического материала, выпускается в воздух. После этого в часть 25 для хранения гигроскопичного материала добавляется водяной пар, и воздух, имеющий относительно высокое содержание водяного пара, выпускается из части для хранения гигроскопичного материала через канал 34 для выпуска воздуха. Эта стадия регенерации может также выполняться, как стадия увлажнения воздуха. Следует отметить, что на этой стадии регенерации также возможно реверсировать поток воздуха, то есть, вводить воздух из канала 34 для выпуска воздуха и выпускать воздух из канала 32 для подачи воздуха. Аналогично вышеупомянутому, «относительно небольшое количество» и «относительно большое количество» водяного пара имеют относительные значения.
ПРИМЕРЫ
[0098]
<<Синтез металл-органического каркаса (МОК)>>
Металл-органические каркасы (МОК) из примеров и сравнительных примеров были синтезированы с использованием реагентов, указанных в таблице 1.
[0099]
[Таблица 1]

[0100]
<Сравнительный пример А-1 (Приготовление Zr-BTC/m-BDC (А))>
Продукт был получен с помощью следующих этапов: с (1) по (3). На фиг. 3 показана блок-схема способа получения для сравнительного примера А-1.
[0101] (1) 387 мг (120 ммоль) октагидрата оксихлорида циркония (ZrOCl2⋅8H2O), 76 мг (36 ммоль) тримезиновой кислоты (Н3ВТС), 7 мг (4 ммоль) изофталевой кислоты (m-H2BDC), 20 мл уксусной кислоты и 20 мл N,N-диметилформамида (ДМФА) были добавлены в контейнер из ПТФЭ объемом 100 мл (HUT-100, производство Sanai-Kagaku Co.).
[0102] (2) Контейнер из ПТФЭ был загружен в устойчивый к давлению внешний цилиндр из нержавеющей стали (HUS-100, производство Sanai-Kagaku Со.) и нагрет в течение 48 часов при температуре 130°С.
[0103] (3) Продукт отфильтровали, три раза промыли, используя 10 мл ДМФА, и три раза промыли, используя 10 мл ацетона, и после этого нагревали до 60°С в течение ночи, пока давление не снизилось до менее, чем 10-1 Па, и высушивали с получением продукта (Zr-BTC/m-BDC (А)) в виде белого порошка. Полученный продукт представляет собой металл-органический каркас, имеющий структуру, в которой ион уксусной кислоты в качестве монодентатного лиганда и ион тримезиновой кислоты и ион изофталевой кислоты в качестве полидентатных лигандов были скоординированы с ионом циркония.
[0104]
<Сравнительный пример Х-1 (Приготовление (Zr-BTC/m-BDC (А); погружение в ДЭФА (30°С))>
Продукт для сравнительного примера Х-1 получают посредством следующих шагов с (1) по (3).
[0105] (1) 187 мг Zr-BTC/m-BDC (А) (приблизительно 0,8 ммоль относительно Zr) как прекурсор МОК, и 40 мл N,N-диметилформамид (ДМФА) в качестве растворителя добавили во флакон объемом 110 мл.
[0106] (2) Флакон объемом 110 мл нагревали в течение 48 часов при температуре 30°С.
[0107] (3) Продукт отфильтровали, три раза промыли в 10 мл ДМФА и три раза промыли в 10 мл ацетона, а затем нагревали при 60°С в течение ночи до тех пор, пока давление не снизилось до 10-1 Па или менее, и высушивали, чтобы получить продукт.
[0108]
<Пример А-1>
Продукт для примера А-1 получали посредством следующих этапов с (1) по (3). Полученный продукт представляет собой координационно ненасыщенный МОК, в котором часть ионов уксусной кислоты в качестве лиганда была десорбирована. На фиг. 4 показана блок-схема способа получения для примера А-1.
[0109] (1) 187 мг Zr-BTC/m-BDC (А) (приблизительно 0,8 ммоль относительно Zr) как прекурсор МОК, 107 мг (0,8 ммоль) хлорида алюминия (AlCl3) и 40 мл N,N-диметилформамида (ДМФА) в качестве растворителя были добавлены во флакон объемом 110 мл.
[0110] (2) Флакон объемом 110 мл нагревали в течение 48 часов при температуре 30°С.
[0111] (3) Продукт отфильтровали, три раза промывали в 10 мл ДМФА и три раза промывали в 10 мл ацетона, а затем нагревали при 60°С в течение ночи до тех пор, пока давление не снизилось до значения менее 10-1 Па, и высушивали, чтобы получить продукт.
[0112]
<Пример А-2>
Продукт получали таким же образом, как в примере А-1, за исключением того, что 121 мг (0,8 ммоль) хлорида скандия (ScCl3) было добавлено вместо хлорида алюминия на этапе (1) примера А-1.
[0113]
<Пример А-3>
Продукт был получен таким же образом, как в примере А-1, за исключением того, что 156 мг (0,8 ммоль) хлорида иттрия (YCl3) было добавлено вместо хлорида алюминия на этапе (1) примера А-1.
[0114]
<Пример А-4>
Продукт был получен таким же образом, как в примере А-1, за исключением того, что 469 мг (2,4 ммоль) хлорида иттрия (YCl3) было добавлено вместо хлорида алюминия на этапе (1) примера А-1.
[0115]
<Пример А-5>
Продукт был получен таким же образом, как в примере А-1, за исключением того, что 1562 мг (8 ммоль) хлорида иттрия (YCl3) было добавлено вместо хлорида алюминия на этапе (1) примера А-1.
[0116]
<Пример А-6>
Продукт был получен таким же образом, как в примере А-2, за исключением того, что температура нагрева на этапе (2) примера А-2, была изменена на 80°С.
[0117]
<Пример А-7>
Продукт был получен таким же образом, как в примере А-3, за исключением того, что температура нагрева на этапе (2) примера А-3 была изменена на 80°С.
[0118]
<Пример А-8>
Продукт был получен таким же образом, как в примере А-4, за исключением того, что температура нагрева на этапе (2) примера А-4, была изменена на 80°С.
[0119]
<Пример А-9>
Продукт был получен таким же образом, как в примере А-2, за исключением того, что растворитель на этапе (1) примера А-2 был изменен с ДМФА на воду.
[0120]
<Пример А-10>
Продукт был получен таким же образом, как в примере А-3, за исключением того, что растворитель на этапе (1) примера А-3 был изменен с ДМФА на воду.
[0121]
<Пример А-11>
Продукт был получен таким же образом, как в примере А-4, за исключением того, что растворитель на этапе (1) примера А-4 был изменен с ДМФА на воду.
[0122]
<Пример А-12>
Продукт был получен таким же образом, как в примере А-1, за исключением того, что 34 мг (0,8 ммоль) хлорида лития (LiCl) было добавлено вместо хлорида алюминия на этапе (1) примера А-1.
[0123]
<Пример А-13>
Продукт был получен таким же образом, как в примере А-1, за исключением того, что 76 мг (0,8 ммоль) хлорида магния (MgCl2) было добавлено вместо хлорида алюминия на этапе (1) примера А-1.
[0124]
<Пример А-14>
Продукт был получен таким же образом, как в примере А-1, за исключением того, что 256 мг (0,8 ммоль) хлорида гафния (HfCl4) было добавлено вместо хлорида алюминия на этапе (1) примера А-1.
[0125]
<Сравнительный пример В-1 (Приготовление Zr-BTC (F)>
Продукт для сравнительного примера В-1 был получен посредством следующих шагов с (1) по (3).
[0126] (1) 387 мг (120 ммоль) октагидрата оксихлорида циркония (ZrOCl2⋅8H2O), 84 мг (40 ммоль) тримезиновой кислоты (Н3ВТС), 20 мл муравьиной кислоты и 20 мл N,N-диметилформамида (ДМФА) было добавлено в контейнер из ПТФЭ объемом 100 мл (HUT-100, производство Sanai-Kagaku Co.).
[0127] (2) Контейнер из ПТФЭ был загружен в устойчивый к давлению внешний цилиндр из нержавеющей стали (HUS-100, производство Sanai-Kagaku Со.) и нагревали в течение 48 часов при температуре 130°С.
[0128] (3) Продукт отфильтровали, три раза промывали, используя 10 мл ДМФА, и три раза промывали, используя 10 мл ацетона, и после этого нагревали до 60°С в течение ночи, пока давление не уменьшилось до значения ниже 10-1 Па, и высушивали для получения продукта Zr-BTC (F) в виде белого порошка.
[0129]
<Пример В-1>
Продукт был получен таким же образом, как в примере А-14, за исключением того, что на этапе (1) примера А-14 было использовано 182 мг (0,8 ммоль относительно Zr) Zr-BTC (F) вместо Zr-BTC/m-BDC(A), количество N,N-диметилформамида (ДМФА) было изменено на 80 мл и количество хлорида гафния (HfCl4) было изменено на 769 мг (2,4 ммоль).
[0130]
<Сравнительный пример С-1 (Приготовление Zr-p-BDC (А))>
Продукт сравнительного примера С-1 был получен посредством следующих этапов с (1) по (3).
[0131] (1) 387 мг (120 ммоль) октагидрата оксихлорида циркония (ZrOCl2⋅8H2O), 199 мг (120 ммоль) терефталевой кислоты (р-Н2ВТС), 10 мл уксусной кислоты и 30 мл N,N-диметилформамида (ДМФА) было добавлено в контейнер из ПТФЭ объемом 100 мл (HUT-100, производство Sanai-Kagaku Co.).
[0132] (2) Контейнер из ПТФЭ был загружен в устойчивый к давлению внешний цилиндр из нержавеющей стали (HUS-100, производство Sanai-Kagaku Со.) и нагревали в течение 48 часов при температуре 130°С.
[0133] (3) Продукт отфильтровали, три раза промывали, используя 10 мл ДМФА, и три раза промывали, используя 10 мл ацетона, и после этого нагревали до 60°С в течение ночи, пока давление не уменьшится до значения ниже 10-1 Па, и высушивали, чтобы получить продукт Zr-p-BDC (А) в виде белого порошка.
[0134]
<Сравнительный пример С-2>
Продукт был получен таким же образом, как в примере А-1, за исключением того, что на этапе (1) примера А-1 было использовано 222 мг (приблизительно 0,8 ммоль относительно Zr) Zr-p-BDC (А) вместо Zr-BTC/m-BDC (А), и хлорид алюминия не использовали.
[0135]
<Пример С-1>
Продукт был получен таким же образом, как в примере А-3, за исключением того, что на этапе (1) примера А-3 было использовано 222 мг (приблизительно 0,8 ммоль относительно Zr) Zr-p-BDC (А) вместо Zr-BTC/m-BDC (А).
[0136]
<Пример Х-1>
Продукт был получен таким же образом, как в примере А-1, за исключением того, что 4,69 г (24,0 ммоль) хлорида иттрия (YCl3) было добавлено вместо хлорида алюминия на этапе (1) примера А-1.
[0137]
<Пример Х-2>
Продукт был получен таким же образом, как в примере А-1, за исключением того, что было добавлено 2,56 г (8,0 ммоль) хлорида гафния (HfCl4) вместо хлорида алюминия на этапе (1) примера А-1.
[0138]
<Пример Х-3>
Продукт был получен таким же образом, как в примере Х-2, за исключением того, что на этапе (1) примера Х-2 был использован N,N-диэтилформамид (ДЭФА) в качестве растворителя вместо N,N-диметилформамида (ДМФА).
[0139]
<Пример Х-4>
Продукт был получен таким же образом, как в примере А-1, за исключением того, что 7,69 г (24,0 ммоль) хлорида гафния (HfCl4) было добавлено вместо хлорида алюминия на этапе (1) примера А-1.
[0140] Условия синтеза полученных МОК приведены в таблице 2.
[Таблица 2-1]

[Таблица 2-2]

[0141]
<Анализ>
(Измерение1H-NMR (Анализ состава МОК))
После разложения продуктов был измерен спектр протонного магнитного резонанса,1H-NMR, раствора для получения соотношения лигандов в МОК на основе общего соотношения. Условия разделения, измерительное устройство и условия измерения указаны ниже.




6=3а+2b
12=3а+2b+с+d
24=6а+4b+2с+d+е+f
[0142] Соотношение лигандов, составляющих Zr-BTC/m-BDC (А) (сравнительный пример А-1) до погружения в раствор (раствор кислоты Льюиса) соли металла, имеющей кислотность по Льюису, и соотношение лигандов, составляющих Zr-BTC/m-BDC (А) (Пример А-3: 20 ммоль⋅л-1; пример А-4: 60 ммоль⋅л-1; и пример А-5: 200 ммоль⋅л-1) после погружения в растворы, имеющие различные концентрации YCl3 (соли металла, имеющей кислотность по Льюису) показано на фиг. 5.
[0143] Из фиг. 5 должно быть понятно, что если концентрация YCl3 увеличивается, то соотношение ионов уксусной кислоты в МОК уменьшается. Кроме того, как показано в таблице 2, из составов МОК, полученных по формулам с 1 по 3, можно понять, что, поскольку содержание ионов тримезиновой кислоты и ионов изофталевой кислоты (а и b) существенно не изменилось, и только содержание (с) количество ионов уксусной кислоты уменьшилось, ионы уксусной кислоты (ионы монокарбоновой кислоты) в МОК были селективно десорбированы в результате погружения в раствор кислоты Льюиса.
[0144]
(Измерения методом атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой ИСП-АЭ (Анализ примесей, полученных из соли металла, имеющего кислотность Льюиса))
После разложения продукты разбавляют сверхчистой водой для количественного анализа металлических элементов, полученных из соли металла, имеющей кислотность по Льюису. Условия разложения и устройство измерения указаны ниже.


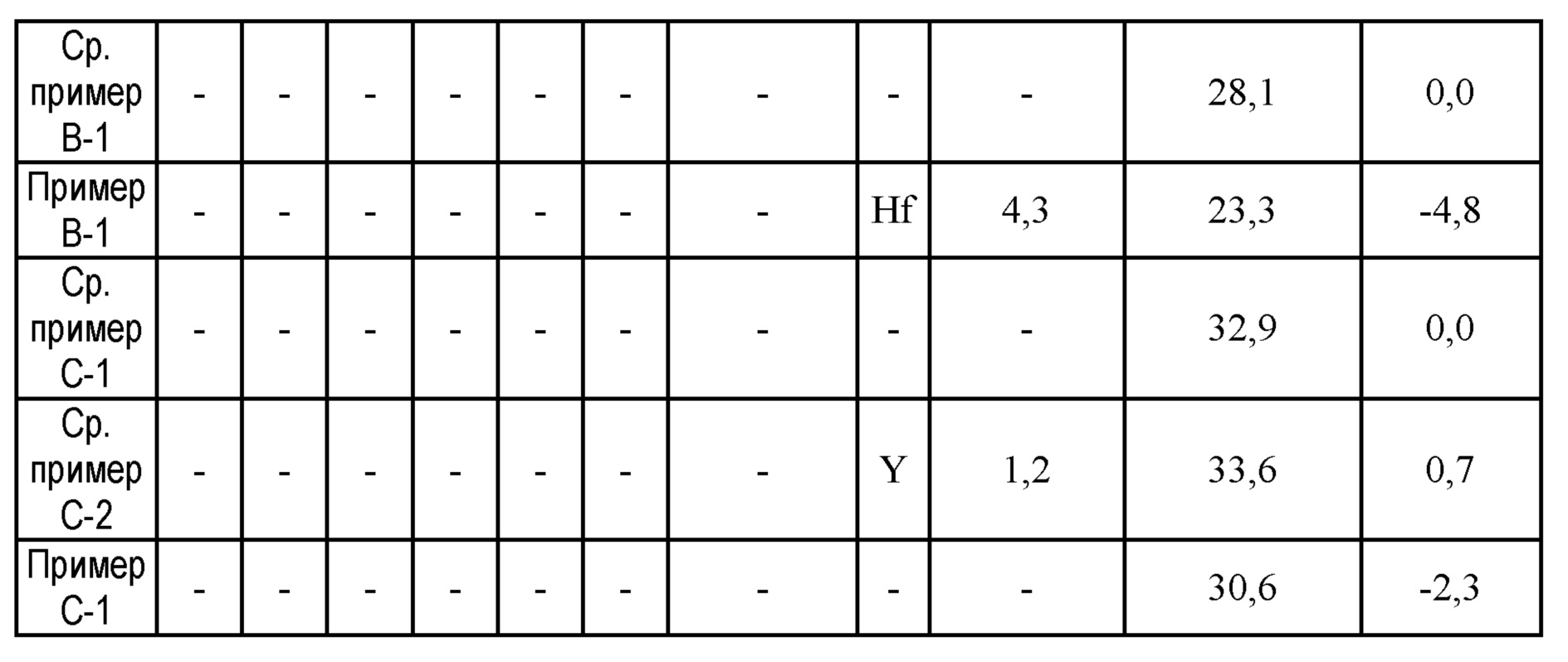
[0145] Типы и содержание примесных металлов, содержащихся в продуктах после погружения в раствор кислоты Льюиса, приведены в таблице 3. Из таблицы 3 можно понять, что, хотя их содержание зависит от стадии промывки, элементы металлов, полученные из соли металла, имеющей кислотность по Льюису, остаются в продукте.
[0146]
(Измерение адсорбции/десорбции водяного пара/ (Оценка характеристик адсорбции/десорбции водяного пара))
После предварительной обработки измеряют изотермы адсорбции/десорбции водяного пара продуктов и определяют величины адсорбции водяных паров при относительной влажности от 0 до 40%. Устройство предварительной обработки, условия предварительной обработки, измерительное устройство и условия измерения указаны ниже.




[0147] Отличия в адсорбционной влажности и отличие в адсорбционной влажности до и после погружения в раствор кислоты Льюиса для примеров и сравнительных примеров показаны в таблице 3. Следует отметить, что отличие в адсорбционной влажности до и после погружения в раствор кислоты Льюиса была получена из отличия в адсорбционной влажности МОК (примеры от А-1 до А-14, В-1, С-1 и от Х-1 до Х-4), а также МОК других сравнительных примеров (сравнительные примеры Х-1 и С-2) после погружения в раствор кислоты Льюиса относительно адсорбционной влажности МОК перед погружением в раствор кислоты Льюиса (адсорбционная влажность для сравнительных примеров А-1, В-1 и С-1), и эти данные представлены в таблице 3 как отличия влажности. Из таблицы 3 можно понять, что после погружения в раствор кислоты Льюиса адсорбционная влажность МОК значительно снизилась (с 2,3% до 14,5%).
[0148]
[Таблица 3-1]

[Таблица 3-2]

[0149] Изотермы адсорбции/десорбции водяного пара при 20°С для сравнительного примера А-1, примера А-3, примера А-4 и примера А-5 показаны на фиг. 6. На кривых адсорбции водяного пара из примера А-3 (остаточное количество ионов уксусной кислоты: 48%), примера А-4 (остаточное количество ионов уксусной кислоты: 37%) и примера А-5 (остаточное количество ионов уксусной кислоты: 29%), фронт нарастания смещен в сторону низкой влажности (левая сторона на фиг. 6) по сравнению со сравнительным примером А-1 (остаточное количество уксусной кислоты ионы: 90%). Кроме того, чем меньше остаточное количество ионов уксусной кислоты, тем больше величина сдвига кривой адсорбции водяного пара.
[0150] Следует обратить внимание, что значение остаточного количества ионов уксусной кислоты (%), показанное в таблице 3, было определено посредством деления значения «с», которое является коэффициентом «(ОАс)» в составе МОК, на шесть с использованием значения для случая, когда шесть ионов монокарбоновой кислоты скоординированы с металлическим кластером, в качестве 100%.
[0151] Относительная влажность при адсорбции водяного пара в количестве, равном половине максимального количества адсорбции водяного пара, была использована в качестве адсорбционной влажности и показана на фиг. 7 вместе с остаточным количеством ионов уксусной кислоты. Понятно, что в примерах от А-1 до А-8 остаточное количество ионов уксусной кислоты было уменьшено по сравнению со сравнительным примером А-1, и адсорбционная влажность соответственно снизилась. Кроме того, существовала сильная корреляция между остаточным количеством ионов уксусной кислоты (%) и адсорбционной влажностью (%).
[0152] Кроме того, влажность, при которой количество адсорбированного водяного пара в сравнительных примерах А-1 и Х-1 и примерах от А-1 до А-8 и от Х-1 до Х-4 достигли половины значения 40% влажности, были приняты за адсорбционную влажность и показаны на фиг. 13 вместе с остаточными количествами ионов уксусной кислоты. Понятно, что в примерах от А-1 до А-8 и от Х-1 до Х-4 остаточное количество ионов уксусной кислоты было уменьшено по сравнению со сравнительными примерами А-1 и Х-1, и адсорбционная влажность соответственно снизилась. Кроме того, существовала сильная корреляция между остаточным количеством ионов уксусной кислоты (%) и адсорбционной влажностью (%).
[0153] Из приведенных выше результатов можно понять, что, за счет регулирования остаточного количества ионов монокарбоновой кислоты (ионов уксусной кислоты) в координационно ненасыщенном МОК, можно регулировать адсорбционную влажность координационно ненасыщенного МОК.
[0154] Изотермы адсорбции/десорбции водяного пара при 20°С для сравнительного примера А-1, примера А-2, примера А-13 и примера А-14 показаны на фиг. 8. В кривых адсорбции водяного пара для примера А-2 (ScCl3), примера А-13 (MgCl2), и примера А-14 (HfCl4), фронт нарастания сместился в сторону низкой относительной влажности (левая сторона на фиг. 8) по сравнению со сравнительным примером А-1 (в котором погружение в раствор кислоты Льюиса не проводилось).
[0155] Изотермы адсорбции/десорбции водяного пара при 20°С для сравнительного примера В-1 и примера В-1 показаны на фиг. 9, и изотермы адсорбции/десорбции водяного пара при 20°С для сравнительного примера С-1 и примера С-1 показаны на фиг. 10. Даже когда МОК был получен из Zr-BTC (F) или Zr-p-BDC (А), с погружением в раствор HfCl4/ДМФА, фронт нарастания кривой адсорбции водяного пара смещен в сторону более низкой влажности (левые стороны фиг. 9 и фиг. 10).
[0156] Изотермы адсорбции/десорбции водяного пара при 20°С для примеров Х-2 и Х-4 и сравнительного примера Х-1 показаны на фиг. 14. На кривых адсорбции водяного пара для примеров Х-2 и Х-4 фронт нарастания смещен в сторону низкой влажности (левая сторона фиг. 14) по сравнению со сравнительным примером Х-1. Следует отметить, что в примере Х-4 можно видеть, что значение адсорбции водяного пара уменьшилось. Предполагается, что это является результатом того факта, что концентрация соли металла, имеющей кислотность по Льюису, была слишком высокой (например, 600 ммоль/л или более), в результате чего ионы поликарбоновой кислоты, которые скоординировались с металлическим кластером, десорбировались.
[0157] Как можно понять из результатов, приведенных выше, согласно настоящему изобретению, можно генерировать координационно ненасыщенные центры с использованием различных видов солей металлов, имеющих кислотность по Льюису в различных МОК, и можно регулировать адсорбционную влажность координационно ненасыщенного МОК на основе силы и количества соли металла, имеющей кислотность по Льюису.
Реферат
Группа изобретений относится к способу получения координационно ненасыщенного металл-органического каркаса и к координационно ненасыщенному металл-органическому каркасу. Способ получения координационно ненасыщенного металл-органического каркаса включает в себя этапы получения прекурсора металл-органического каркаса, содержащего металлический кластер и ион поликарбоновой кислоты и ион монокарбоновой кислоты, скоординированные с металлическим кластером, и обеспечения возможности для прекурсора металл-органического каркаса и соли металла, имеющей кислотность по Льюису, сосуществовать в растворителе для десорбции, по меньшей мере, части ионов монокарбоновой кислоты, которые скоординированы с металлическим кластером, из металлического кластера. Кроме того, представлен координационно ненасыщенный металл-органический каркас, содержащий металлический кластер типа MO(ОН)и ионы карбоновой кислоты, содержащие ион поликарбоновой кислоты в качестве полидентатного лиганда и ион монокарбоновой кислоты Cв качестве монодентатного лиганда, скоординированные с металлическим кластером. Изобретение позволяет получить металл-органический каркас, имеющий высокую гигроскопичность в условиях низкой влажности, и способ изготовления такого металл-органического каркаса. 2 н. и 10 з.п. ф-лы, 14 ил.
Формула
Документы, цитированные в отчёте о поиске
Металлоорганические каркасные структуры, полученные из карбенофильных металлов и способ их получения
Цинкорганические комплексы, способы их получения и применение
Металлорганические скелетные материалы на основе 2,5-фурандикарбоновой или 2,5-тиофендикарбоновой кислоты

Комментарии